Назальная ликворея — что это?
Рассказывает Дмитрий Капитанов, оториноларинголог, отоневролог, профессор, доктор медицинских наук
Назальная ликворея (НЛ) – истечение спинномозговой жидкости в полость носа – довольно редкое, но потенциально летальное заболевание, которое далеко не всегда правильно диагностируется врачами и может долгие годы существовать под маской аллергического или вазомоторного ринита. Ликворная фистула (канал, через который стекает жидкость) возникает из-за дефекта костных структур и мозговых оболочек. Если костный дефект большой, через него могут провалиться оболочки и вещество мозга, создавая грыжевой мешок, который называется менинго(энцефало)целе.
Формы
Подобная фистула может образоваться как следствие черепно-лицевой травмы, предшествующей операции в полости носа и на основании черепа. Или спонтанно, на фоне повышенного внутричерепного давления. Таким образом, различают травматическую и спонтанную назальную ликворею. В свою очередь спонтанная назальная ликворея может быть врожденная, как результат внутриутробного нарушения формирования костных структур основания черепа, так и приобретенная. В последнем случае фистула может сформироваться на фоне разнообразных проблем. Сюда относятся обменные нарушения, повышенный вес, увеличение внутричерепного давления, аномалии развития передних отделов основания черепа и т.д.
В свою очередь спонтанная назальная ликворея может быть врожденная, как результат внутриутробного нарушения формирования костных структур основания черепа, так и приобретенная. В последнем случае фистула может сформироваться на фоне разнообразных проблем. Сюда относятся обменные нарушения, повышенный вес, увеличение внутричерепного давления, аномалии развития передних отделов основания черепа и т.д.
В чем опасность?
Само по себе обильное выделение жидкости из носа достаточно неприятно, поскольку серьезно снижает качество жизни. Но более серьезным осложнением является менингит, т.е. воспаление оболочек и вещества мозга, поскольку есть условия для проникновения инфекции из полости носа в полость черепа при любом простудном заболевании. Другим грозным осложнением является пневмоцефалия, когда воздух внедряется в полость черепа через открытую фистулу. Указанные осложнения требуют экстренной госпитализации пациента.
Симптомы
Симптомы профузной назальной ликвореи:
При наклоне головы из одной половины носа выделяется прозрачная, светлая жидкость.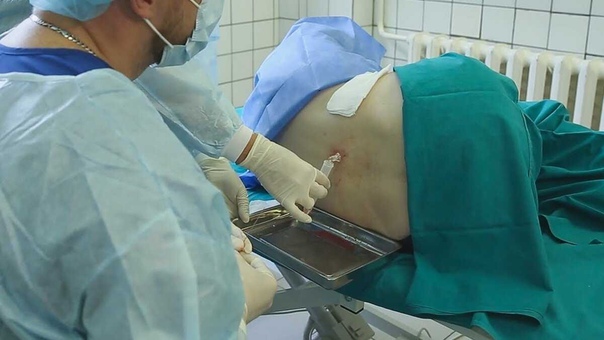
Скрытая, рецидивирующая назальная ликворея диагностируется сложнее и требует применения всего арсенала методик – лабораторных и лучевых. В положении лежа на спине возникает кашель, поскольку стекающий в ротоглотку ликвор может попадать в нижние отделы дыхательных путей, вызывая реактивный ларингит, трахеит и даже пневмонию. Ликворея, осложненная менингитом, проявляется большим спектром неврологических нарушений.
У пациента с назальной ликвореей, как правило, имеется черепно-мозговая травма в анамнезе, либо операция, затрагивающая нос и околоносовые пазухи, в том числе эндоскопическая. При этом спонтанная назальная ликворея может начаться внезапно без явной видимой причины.
Диагностика
В первую очередь врач определяет характер выделений:
-
сторону, с которой идут выделения, -
периодичность, -
специфические положения головы, при которых они появляются, -
зависимость объема выделений от напряжения (проба Вальсальвы).
class=»styled-ul»>
На рисунке показан визуальный осмотр пациента. При наклоне головы вниз из носа начинает выделяться прозрачная жидкость.
Назальную ликворею часто принимают за ринит (аллергический или вазомоторный). Так же пациентам она может напомнить состояние, когда нос орошают жидкими лекарственными средствами.
Профузная назальная ликворея может самостоятельно прекращаться на некоторое время при этом пациенты отмечают головную боль из-за колебаний внутричерепного давления.
О повреждении передних отделов основания черепа могут свидетельствовать:
-
нарушение обоняния (гипосмия или аносмия), -
проблемы со зрением.
class=»styled-ul»>
В стандартное обследование должны входить:
-
Эндоскопическое исследование носа и околоносовых пазух (на рисунке — эндоскопия полости носа прямым эндоскопом; в проекции задней стенки клиновидной пазухи виден небольшой костный дефект, через который поступает ликвор).
-
Риноскопия. -
Обследование слуха на предмет наличия ушной ликвореи, -
Неврологическое обследование, -
Биохимический анализ жидких выделений из носа на уровень глюкозы, определение специфических для ликвора белков (бета-2 фракция трансферина, трейс белок).
Методы лучевой диагностики:
-
Компьютерная томография (КТ) основания черепа и околоносовых пазух (на рисунке определяется большой дефект основания черепа в проекции ситовидной пластинки с формированием менингоцеле (показано стрелкой)). -
КТ-цистернография с эндолюмбальным введением контраста для более точного определения расположения дефекта в основании черепа. Это исследование выполняется в условиях стационара. -
КТ черепа и головного мозга для исключения гидроцефалии, новообразований основания черепа, выявления менингоцеле.
-
Магнитно-резонансная томография (МРТ) – дополнение к КТ для исключения менингоэнцефалоцеле. -
Ликворо-чувствительная МРТ. Неинвазивный метод, не обладает радиационной нагрузкой и занимает немного больше времени, чем обычная МРТ.
Лечение
Лечение назальной ликвореи в основном хирургическое. Долгие годы оно требовало тяжелых, подчас инвалидизирующих вмешательств на основании черепа с использованием транскраниальных доступов. За последние три десятилетия развитие методов эндоназальной эндоскопической хирургии в корне изменило ситуацию, и теперь большинство случаев назальной ликвореи может быть излечено путем щадящих малоинвазивных вмешательств, выполняемых без наружных разрезов через полость носа под эндоскопическим контролем, что позволяет хирургу значительно улучшить обзор операционного поля. Эндоскоп помогает хирургу определить место ликворного свища, аккуратно отделить слизистую оболочку от костного дефекта и точно установить трансплантат на место повреждения.
Способ хирургического вмешательства определяется совместно оториноларингологом-хирургом и нейрохирургом. В ряде случаев требуется именно нейрохирургической вмешательство. Например:
-
Крупные или множественные дефекты кости. -
Черепно-мозговая травма со сдавлением мозга. -
При повышенном внутричерепном давлении, когда нельзя проводить пластику свища, прежде чем гипертензия не будет устранена с помощью операции шунтирования. -
При сложном расположении свища.
Лечение назальной ликвореи в первую очередь направлено на восстановление барьера между полостью носа и интракраниальным пространством, чтобы не развилась внутричерепная инфекция. При этом для пластики небольших дефектов основания черепа можно использовать мягкие ткани, а не костные фрагменты. Но при крупных дефектах кости они должны быть закрыты плотным хрящевым трансплантатом, чтобы не сформировалось энцефалоцеле (мозговой грыжи).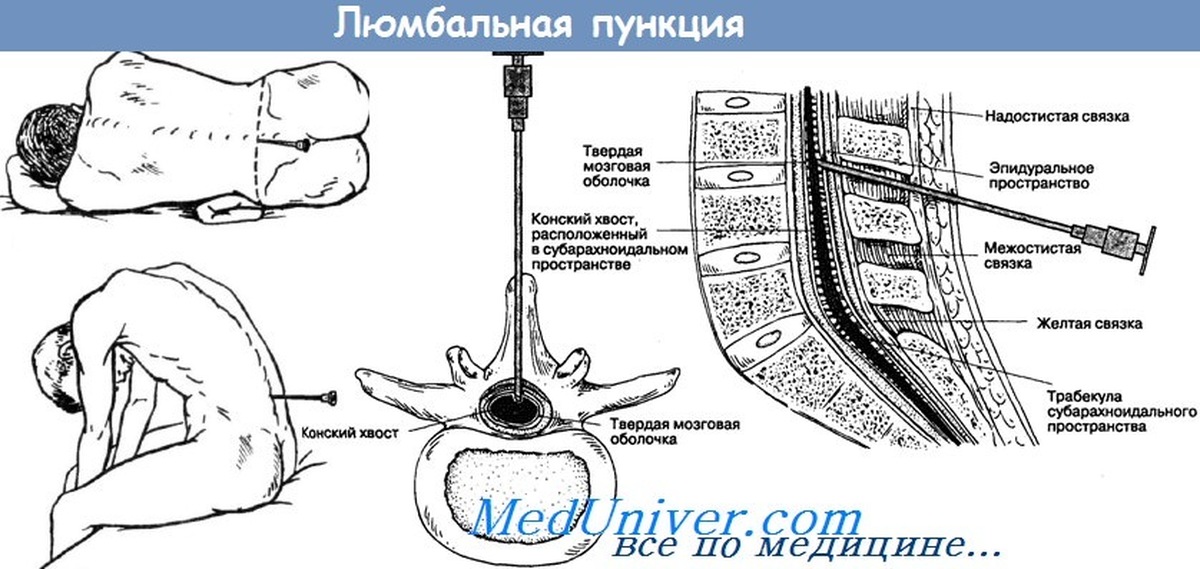
Послеоперационный период
После операции пациентам обычно рекомендует следовать следующим рекомендациям: избегать повышенных физических нагрузок, длительного натуживания, форсированного кашля. Режим должен быть максимально щадящим. По возможности стараться больше находиться в лежачем положении, головной конец кровати приподнять. Если признаки назальной ликвореи полностью пропадут, пациента выписывают с рекомендациями, которые необходимо выполнять в течение как минимум 6 недель.
В течение 3-10 дней после операции часть фрагментов тампонов из полости носа рекомендуется аккуратно удалить. При этом рассасывающиеся материалы, расположенные непосредственно около трансплантата, остаются и удаляются позже. На весь послеоперационный период назначают антибиотики в дозах, предотвращающих развитие синусита.
В позднем послеоперационном периоде при каждом обращении пациента проводится эндоскопическое исследование для исключения рецидива энцефалоцеле, особенно если выполнялась пластика большого дефекта. Важно в последующем проводить дифференциальную диагностику риноликвореи с аллергическими, вазомоторными и вирусными ринитами.
Важно в последующем проводить дифференциальную диагностику риноликвореи с аллергическими, вазомоторными и вирусными ринитами.
Резюме: таким образом, назальная ликворея — редкое, но достаточно опасное заболевание, которое может привести к серьезным осложнениям, включая менингит и пневмоцефалию. Дифференциациальная диагностика с ринитом не всегда проста и однозначна, поэтому вовремя установленный правильный диагноз является залогом адекватного лечения. В виду вышесказанного, осмотр профильного специалиста является первым и необходимым звеном диагностики. В случае подтверждения назальной ликвореи необходима малотравматичная операция по восстановлению целостности основания черепа.
Общие указания по проведению стандартного анализа спинномозговой жидкости. Отчет специальной комиссии ЕФНС по изучению этого вопроса /Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force/
При многих неврологических заболеваниях для подтверждения или установления более точного диагноза требуется проводить анализ спинномозговой жидкости (СМЖ). Цель данной работы — оценить теоретическую базу и сформулировать общие указания для клинического применения при стандартном анализе СМЖ. Этот анализ подразумевает исследование СМЖ на общее содержание белка, альбумина, иммуноглобулинов, глюкозы, лактата, количество клеточных элементов, цитологическое окрашивание и исследование на инфекции. Методы исследования вышеназванных показателей включали системное исследование Medline и обзор соответствующих публикаций одним или несколькими членами комиссии. Оценка симптомов и формирование рекомендаций базировались на обобщенном мнении членов комиссии. Анализ СМЖ рекомендуется проводить сразу же после забора материала. Если существует необходимость ее хранения, 12 мл СМЖ должны быть разделены на 3–4 порции в стерильные пробирки. Определение коэффициента альбумина (Qalb) в СМЖ / сыворотке является более предпочтительным по сравнению с оценкой общего содержания белка. Нормы верхней границы этого показателя должны согласовываться с возрастом пациента.
Цель данной работы — оценить теоретическую базу и сформулировать общие указания для клинического применения при стандартном анализе СМЖ. Этот анализ подразумевает исследование СМЖ на общее содержание белка, альбумина, иммуноглобулинов, глюкозы, лактата, количество клеточных элементов, цитологическое окрашивание и исследование на инфекции. Методы исследования вышеназванных показателей включали системное исследование Medline и обзор соответствующих публикаций одним или несколькими членами комиссии. Оценка симптомов и формирование рекомендаций базировались на обобщенном мнении членов комиссии. Анализ СМЖ рекомендуется проводить сразу же после забора материала. Если существует необходимость ее хранения, 12 мл СМЖ должны быть разделены на 3–4 порции в стерильные пробирки. Определение коэффициента альбумина (Qalb) в СМЖ / сыворотке является более предпочтительным по сравнению с оценкой общего содержания белка. Нормы верхней границы этого показателя должны согласовываться с возрастом пациента. Повышенный Qalb не является специфическим показателем, однако часто наблюдается при бактериальном, криптококковом и туберкулезном менингите, лептоменингеальных метастазах, а также при острой и хронической демиелинизирующей полиневропатии. Патологическое снижение коэффициента содержания глюкозы в СМЖ / сыворотке или повышенная концентрация лактата свидетельствует о бактериальном или грибковом менингите, лептоменингеальных метастазах. Интратекальный синтез иммуноглобулина G лучше всего определяется с помощью изоэлектрофокусировки с последующим специфическим окрашиванием. Клеточная морфология (цитологическое окрашивание) должна оцениваться в случае плеоцитоза, лептоменингеальных метастазов или при подозрении на патологическое кровотечение. Неопределяемое компьютерной томографией интратекальное кровотечение должно исследоваться с помощью выявления билирубина в СМЖ.
Повышенный Qalb не является специфическим показателем, однако часто наблюдается при бактериальном, криптококковом и туберкулезном менингите, лептоменингеальных метастазах, а также при острой и хронической демиелинизирующей полиневропатии. Патологическое снижение коэффициента содержания глюкозы в СМЖ / сыворотке или повышенная концентрация лактата свидетельствует о бактериальном или грибковом менингите, лептоменингеальных метастазах. Интратекальный синтез иммуноглобулина G лучше всего определяется с помощью изоэлектрофокусировки с последующим специфическим окрашиванием. Клеточная морфология (цитологическое окрашивание) должна оцениваться в случае плеоцитоза, лептоменингеальных метастазов или при подозрении на патологическое кровотечение. Неопределяемое компьютерной томографией интратекальное кровотечение должно исследоваться с помощью выявления билирубина в СМЖ.
Введение
Спинномозговая жидкость — это динамическая, метаболически активная субстанция, которая выполняет множество важных функций. Исследование СМЖ оказывает неоценимую диагностическую помощь при оценке воспалений, инфекционных и неинфекционных заболеваний головного и спинного мозга, его мягких оболочек, а также при не выявляемом при компьютерной томографии (КТ) субарахноидальном кровотечении и при лептоменингеальных метастазах. СМЖ на анализ берется сравнительно просто — при помощи люмбальной пункции. Изменения в составе СМЖ при различных заболеваниях могут быть похожими, что усложняет интерпретацию результатов анализа. Комплексная оценка показателей (определение количества белка, альбумина, иммуноглобулинов, глюкозы, лактата и клеточных изменений, а также наличия специфических антигенов и антител к возбудителям инфекций) повышает точность диагноза.
Исследование СМЖ оказывает неоценимую диагностическую помощь при оценке воспалений, инфекционных и неинфекционных заболеваний головного и спинного мозга, его мягких оболочек, а также при не выявляемом при компьютерной томографии (КТ) субарахноидальном кровотечении и при лептоменингеальных метастазах. СМЖ на анализ берется сравнительно просто — при помощи люмбальной пункции. Изменения в составе СМЖ при различных заболеваниях могут быть похожими, что усложняет интерпретацию результатов анализа. Комплексная оценка показателей (определение количества белка, альбумина, иммуноглобулинов, глюкозы, лактата и клеточных изменений, а также наличия специфических антигенов и антител к возбудителям инфекций) повышает точность диагноза.
Целью данного документа является формулировка рекомендаций по применению и толкованию всех этих показателей в различных клинических случаях, а также иллюстрирование того, как различные сочетания этих показателей отображают заболевания нервной системы (табл. 1) [1].
Стратегия исследования
В исследовании Medline используются такие термины, как спинномозговая жидкость, иммуноглобулин G (IgG), иммуноглобулин M (IgM), иммуноглобулин A (IgA) и альбумин. Ключевое слово «спинномозговая жидкость», или «СМЖ», используется в перекрестных ссылках с терминами «глюкоза», «лактат», «цитология», «клетка» в заглавии, исключая слово «ребенок». Поиск информации с упоминанием терминов «спинномозговая жидкость», «диагноз», «электрофорез», «изоэлектрическая фокусировка» осуществлялся в ограниченные сроки: с 1 января 1980 года по 1 января 2005 года — среди материалов с выдержками на английском языке (274 ссылки). Результатом поиска информации с упоминанием терминов «спинномозговая жидкость» и «инфекционный» стали 560 выдержек. По исключении из выборки материалов, которые не касались диагностирования и инфекционных заболеваний центральной нервной системы (например, неинфекционные воспалительные заболевания, вакцинации, общие параметры ЦНС, патофизиология, цитокины и терапия), осталось 60 ссылок. Поиск материалов с упоминанием терминов «спинномозговая жидкость» и «серология» в период с 1 января 1980 года по сегодняшний день дал 35 ссылок за исключением тех, которые не касались темы напрямую. 28 ссылок было найдено при поиске информации с терминами «спинномозговая жидкость» и «бактериальная культура» в период с 1 января 1980 года по сегодняшний день.
Поиск материалов с упоминанием терминов «спинномозговая жидкость» и «серология» в период с 1 января 1980 года по сегодняшний день дал 35 ссылок за исключением тех, которые не касались темы напрямую. 28 ссылок было найдено при поиске информации с терминами «спинномозговая жидкость» и «бактериальная культура» в период с 1 января 1980 года по сегодняшний день.
Материалы отбирались авторами, ответственными за определенные разделы. Также рассматривались учебники и статьи подходящей тематики, упоминаемые в списках литературы найденных работ.
Американская академия неврологии (ААН) не публиковала руководства по проведению анализов, связанных с ЦНС. Члены специальной комиссии самостоятельно подготовили некоторые материалы для различных разделов такого руководства. Все симптомы были разделены на классы от I до IV, а рекомендации — по уровням от A до C в соответствии со схемой, согласованной с рекомендациями ЕФНС [1]. В случае, когда были выявлены симптомы только IV класса и согласие членов комиссии по этому вопросу не достигалось, комиссия формулировала практические советы [1]. Все положения были отредактированы и объединены в один документ, который редактировался до достижения полного согласия членов комиссии.
Все положения были отредактированы и объединены в один документ, который редактировался до достижения полного согласия членов комиссии.
Количественный анализ общего содержания белка и альбумина
Гематоэнцефалический барьер — это физический барьер, состоящий из различных анатомических структур. Этот барьер обеспечивает диффузию и фильтрацию макромолекул из крови в СМЖ. Целостность этого барьера и поток СМЖ определяют количество белка в СМЖ [2, 3]. У новорожденных концентрация белка в СМЖ достаточно высока, но снижается в течение первого года жизни и сохраняется низкой в детском возрасте. У взрослых концентрация белка увеличивается с годами [4, 5] (класс I). Коэффициент концентрации альбумина в СМЖ / сыворотке может также использоваться при определении целостности гематоэнцефалического барьера [6]. На Qalb не влияет интратекальный синтез белка. Этот коэффициент корректируется в зависимости от концентрации альбумина в плазме, а также является неотъемлемой частью формулы интратекального синтеза иммуноглобулина. Независимо от применяемого метода исследования Qalb используется как исходная величина в различных лабораториях [7, 8]. Тем не менее не существует убедительных данных об эффективности показателя Qalb в сравнении с общим содержанием белка при определении функционирования гематоэнцефалического барьера у больших групп пациентов.
Независимо от применяемого метода исследования Qalb используется как исходная величина в различных лабораториях [7, 8]. Тем не менее не существует убедительных данных об эффективности показателя Qalb в сравнении с общим содержанием белка при определении функционирования гематоэнцефалического барьера у больших групп пациентов.
Для общего содержания белка и коэффициента Qalb в разных отделах спинного мозга существуют различные показатели концентрации: самая низкая концентрация наблюдается в ликворе желудочков, самая высокая — в поясничном мешке [3, 9]. Существенное снижение Qalb наблюдалось в первых 0–4 мл и последних 21–24 мл СМЖ, полученной при люмбальной пункции [10] (класс I). На Qalb также влияет масса тела, пол, наличие дегенеративной патологии в нижней части спины, гипертиреоз, потребление алкоголя (класс II) и курение (класс III) [11–14]. Осанка и физическая активность также могут влиять на уровень белка в СМЖ. Так, его концентрация выше у пациентов, ведущих малоактивный сидячий образ жизни [13] (класс III). Повышенная концентрация белка в СМЖ наблюдается у большинства пациентов с бактериальным (0,4–4,4 г/л), криптококковым (0,3–3,1 г/л), туберкулезным (0,2–1,5 г/л) менингитом и нейроборрелиозом [15–18] (класс II). Концентрация, превышающая 1,5 г/л, — это специфический показатель (99 %). Однако он не чувствителен к бактериальному менингиту (55 %) в сравнении со множеством других воспалительных заболеваний [19] (класс I).
Повышенная концентрация белка в СМЖ наблюдается у большинства пациентов с бактериальным (0,4–4,4 г/л), криптококковым (0,3–3,1 г/л), туберкулезным (0,2–1,5 г/л) менингитом и нейроборрелиозом [15–18] (класс II). Концентрация, превышающая 1,5 г/л, — это специфический показатель (99 %). Однако он не чувствителен к бактериальному менингиту (55 %) в сравнении со множеством других воспалительных заболеваний [19] (класс I).
При вирусных нейроинфекциях концентрация белка в СМЖ поднимается не так высоко (обычно < 0,95 г/л) [15] (класс II). Концентрация белка при герпетическом энцефалите не изменяется у половины пациентов в течение первой недели заболевания [20] (класс IV).
Неинфекционными причинами повышения концентрации белка, иногда с повышенным содержанием клеточных элементов, являются субарахноидальное кровоизлияние, васкулит ЦНС и опухоль ЦНС [21] (класс IV). Повышенная концентрация белка при нормальном содержании клеточных элементов в СМЖ (белково-клеточная диссоциация) является показателем острой и хронической воспалительной демиелинизирующей полиневропатии. Однако уровень белка может быть в норме в первую неделю заболевания [22, 23] (класс IV). Общее содержание белка в СМЖ повышается у 80 % пациентов с лептоменингеальными метастазами в среднем до 1 г/л с большим диапазоном колебания [24] (класс III).
Однако уровень белка может быть в норме в первую неделю заболевания [22, 23] (класс IV). Общее содержание белка в СМЖ повышается у 80 % пациентов с лептоменингеальными метастазами в среднем до 1 г/л с большим диапазоном колебания [24] (класс III).
Существуют симптомы I класса, которые подтверждают, что увеличение Qalb и общего содержания белка в СМЖ сопровождают бактериальный, криптококковый и туберкулезный менингит, а также лептоменингеальные метастазы. Так как установление Qalb или уровня белка не является специфическим анализом только для исследования СМЖ, сопоставление этих данных с другими показателями повышает специфичность диагностики, как, например, белково-клеточная диссоциация при синдроме Гийена — Барре.
Количественный интратекальный синтез иммуноглобулина
Интратекальный синтез Ig наблюдается при многих, в основном воспалительных, заболеваниях ЦНС (табл. 2). Между Qalb и коэффициентом содержания IgG в сыворотке и СМЖ существует тесная взаимосвязь, что позволяет вычислить индекс IgG (QIgG / Qalb) [25–27].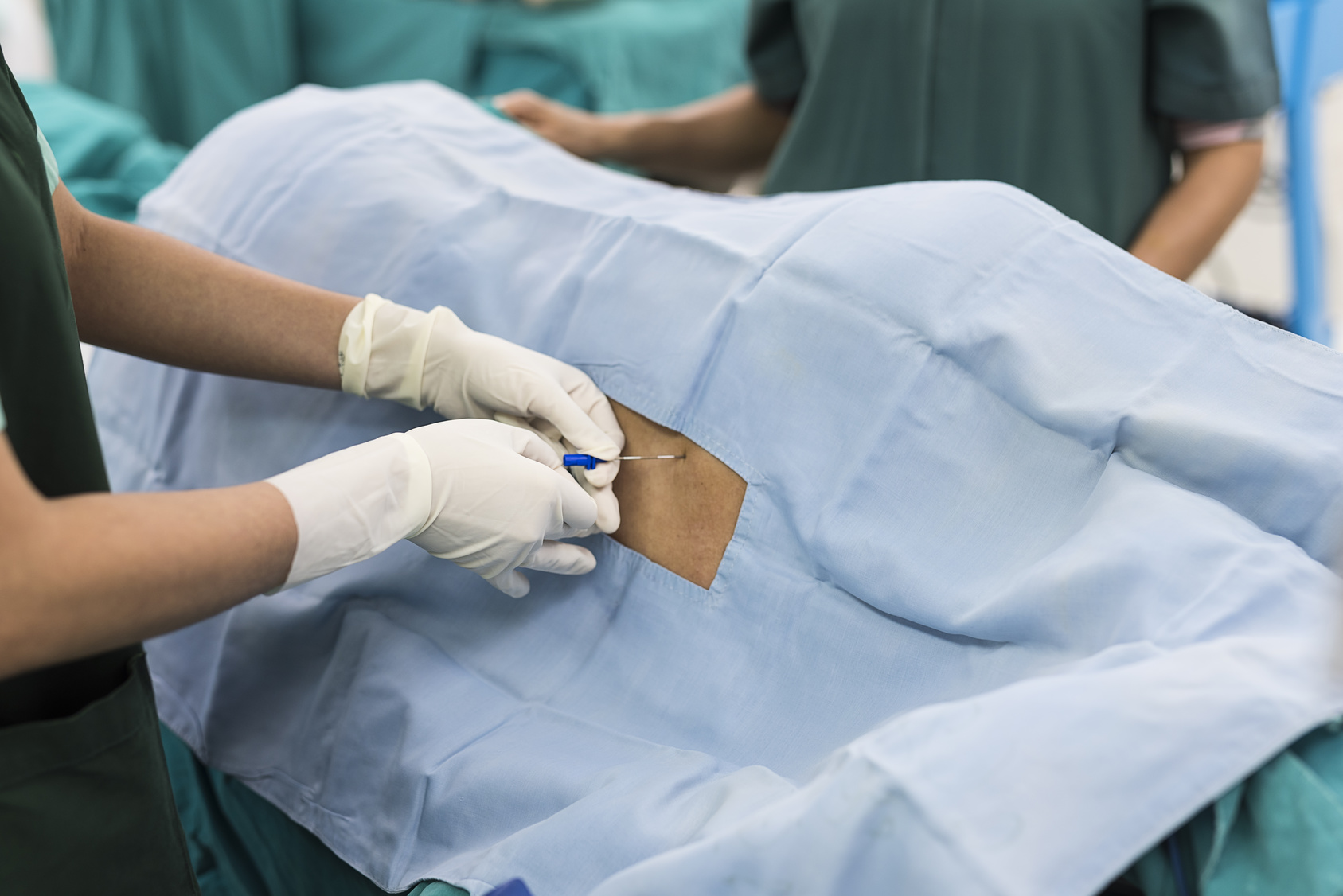 Гиперболическая формула Райбера и расширенные индексы иммуноглобулина Оhman’s базируются на демонстрации нелинейных отношений между коэффициентом Qalb и коэффициентами концентрации IgА, IgG и IgМ в сыворотке ликвора [2, 28, 29]. Для точного выявления интратекального синтеза IgG наиболее показательным является выявление олигоклональных соединений IgG. Такие показатели, как индекс IgG и нелинейные формулы, дают менее точный результат. Однако технически выявление олигоклональных соединений является более сложным анализом, нежели количественные методы. Поэтому рекомендуется не проводить такое исследование у пациентов с подозрением на рассеянный склероз (РС) и с индексом IgG выше 1,1. Опыт показывает, что почти у 100 % таких пациентов интратекально синтезируются олигоклональные соединения IgG (F. Deisenhammer, неопубликованные данные).
Гиперболическая формула Райбера и расширенные индексы иммуноглобулина Оhman’s базируются на демонстрации нелинейных отношений между коэффициентом Qalb и коэффициентами концентрации IgА, IgG и IgМ в сыворотке ликвора [2, 28, 29]. Для точного выявления интратекального синтеза IgG наиболее показательным является выявление олигоклональных соединений IgG. Такие показатели, как индекс IgG и нелинейные формулы, дают менее точный результат. Однако технически выявление олигоклональных соединений является более сложным анализом, нежели количественные методы. Поэтому рекомендуется не проводить такое исследование у пациентов с подозрением на рассеянный склероз (РС) и с индексом IgG выше 1,1. Опыт показывает, что почти у 100 % таких пациентов интратекально синтезируются олигоклональные соединения IgG (F. Deisenhammer, неопубликованные данные).
В исследованиях, в которых проводили анализ СМЖ у пациентов с РС и с другими неврологическими заболеваниями, более точные данные дают нелинейные формулы [30, 31]. Формулы интратекального синтеза IgA, IgG и IgM позволяют определить различные инфекционные заболевания нервной системы [32, 33] (класс III). Однако в одной из работ утверждалось, что повышенные значения в формуле Райбера не всегда свидетельствуют об интратекальном синтезе IgM. Такое повышение наблюдалось и у пациентов с невоспалительными заболеваниями, без наличия олигоклональных соединений IgМ в СМЖ [34] (класс II). В целом не существует убедительных данных, свидетельствующих о преимуществах количественных анализов синтеза интратекального иммуноглобулина для диагностики неврологических заболеваний. Однако в случае подозрения на РС показания индекса IgG могут применяться для определения интратекального синтеза IgG.
Формулы интратекального синтеза IgA, IgG и IgM позволяют определить различные инфекционные заболевания нервной системы [32, 33] (класс III). Однако в одной из работ утверждалось, что повышенные значения в формуле Райбера не всегда свидетельствуют об интратекальном синтезе IgM. Такое повышение наблюдалось и у пациентов с невоспалительными заболеваниями, без наличия олигоклональных соединений IgМ в СМЖ [34] (класс II). В целом не существует убедительных данных, свидетельствующих о преимуществах количественных анализов синтеза интратекального иммуноглобулина для диагностики неврологических заболеваний. Однако в случае подозрения на РС показания индекса IgG могут применяться для определения интратекального синтеза IgG.
Качественный (олигоклональный) интратекальный синтез иммуноглобулина
Определение наличия интратекального олигоклонального IgG в СМЖ важно с диагностической точки зрения, так как это один из лабораторных критериев, помогающий определить клинический диагноз РС [35]. К тому же этот показатель может быть полезным при диагностике таких предполагаемых аутоиммунных заболеваний ЦНС, как паранеопластические процессы и инфекции ЦНС [36–38].
К тому же этот показатель может быть полезным при диагностике таких предполагаемых аутоиммунных заболеваний ЦНС, как паранеопластические процессы и инфекции ЦНС [36–38].
Применение электрофореза позволяет классифицировать гуморальную реакцию по количеству клонов, продуцирующих антитела (т.е. моноклональная, олигоклональная или поликлональная реакция) (рис. 1). На данный момент устаревшие техники заменяются более чувствительными — изоэлектрической фокусировкой (ИЭФ) и иммунофиксацией [6].
При изоэлектрической фокусировке используется градиент pH для разделения популяций IgG по зарядам. Затем эти группы переносятся на нитроцеллюлозу или другие мембраны перед иммунным окрашиванием с применением иммуноглобулинов нечеловеческого происхождения [39]. Некоторые лаборатории продолжают эффективно использовать метод окрашивания по Сливеру для определения олигоклональных соединений [7].
Так как СМЖ по своей природе является ультрафильтратом плазмы, она содержит иммуноглобулины, пассивно переносимые из плазмы, а также иммуноглобулины, которые синтезируются локально. Таким образом, любой системный паттерн продукции иммуноглобулина в плазме или сыворотке находит свое отражение в СМЖ. Поэтому при проведении анализа СМЖ на олигоклональные соединения обязательно проводится парный анализ крови.
Таким образом, любой системный паттерн продукции иммуноглобулина в плазме или сыворотке находит свое отражение в СМЖ. Поэтому при проведении анализа СМЖ на олигоклональные соединения обязательно проводится парный анализ крови.
Антителогенез олигоклонального интратекального IgG не является специфическим. В табл. 3 представлен список заболеваний, связанных с олигоклональными соединениями в пропорциональном соотношении [40]. Таким образом, локальный синтез олигоклональных соединений должен оцениваться только в клиническом контексте. В недавно опубликованных рекомендациях по поводу выявления олигоклональных соединений заключается [41]: «Единственным наиболее информативным анализом является качественная оценка IgG в СМЖ. Этот анализ наиболее эффективно проводится при помощи ИЭФ в сочетании с одной из форм иммунологического анализа (блоттинг или фиксация). Этот качественный анализ должен проводиться с применением неконцентрированной СМЖ и одновременно сопоставляться с истечением сыворотки в том же анализируемом образце на смежном участке. Оптимальным является использование одинакового количества IgG из парной сыворотки и СМЖ. Выявленные позитивные и негативные контрольные показатели должны применяться к каждому набору образцов».
Оптимальным является использование одинакового количества IgG из парной сыворотки и СМЖ. Выявленные позитивные и негативные контрольные показатели должны применяться к каждому набору образцов».
Для подозреваемых неинфекционных воспалительных расстройств ЦНС существует симптом I класса в поддержку применения ИЭФ СМЖ, как для определения предрасположенности, так и для диагностического тестирования при установлении диагноза РС. Симптомы II и III класса свидетельствуют в пользу применения ИЭФ СМЖ в качестве дополнительного диагностического анализа при других неинфекционных воспалительных расстройствах ЦНС (табл. 3).
Концентрация глюкозы в СМЖ, коэффициент соотношения глюкозы в СМЖ и сыворотке и лактат
Глюкоза активно транспортируется через гематоэнцефалический барьер, ее содержание в СМЖ прямо пропорционально содержанию в плазме. Поэтому необходимо проводить замеры в СМЖ и крови одновременно. Концентрация глюкозы в СМЖ в норме составляет 50–60 % от значений в сыворотке [21] (класс IV). Патологическим считается соотношение содержания глюкозы в СМЖ и в сыворотке менее чем 0,4–0,5 [42] (класс IV). Уровень глюкозы в СМЖ приходит в соответствие с плазменным уровнем в течение нескольких часов. Поэтому уровень глюкозы в СМЖ фактически может быть выше, чем в плазме в это время. Рекомендуется проводить исследования сразу же после забора СМЖ, так как при хранении СМЖ глюкоза разрушается.
Патологическим считается соотношение содержания глюкозы в СМЖ и в сыворотке менее чем 0,4–0,5 [42] (класс IV). Уровень глюкозы в СМЖ приходит в соответствие с плазменным уровнем в течение нескольких часов. Поэтому уровень глюкозы в СМЖ фактически может быть выше, чем в плазме в это время. Рекомендуется проводить исследования сразу же после забора СМЖ, так как при хранении СМЖ глюкоза разрушается.
Высокая концентрация глюкозы в СМЖ не имеет какого-либо специфического диагностического значения. И свидетельствует лишь о высоком содержании глюкозы в крови, например, у диабетиков.
Изменение коэффициента соотношения уровня глюкозы в СМЖ и в сыворотке при различных неврологических расстройствах показано в табл. 1.
Важность такого показателя, как уровень лактата в СМЖ, сопоставима с коэффициентом содержания глюкозы в СМЖ и в сыворотке. Содержание лактата в СМЖ никак не зависит от его уровня в крови [43] (класс IV). Нормальным считается уровень < 2,8–3,5 ммоль/л [44] (класс II). Уровень лактата обратно пропорционален коэффициенту содержания глюкозы во всех случаях, кроме заболеваний митохондрий. При этом повышение уровня лактата выявляется раньше, чем снижение концентрации глюкозы.
Уровень лактата обратно пропорционален коэффициенту содержания глюкозы во всех случаях, кроме заболеваний митохондрий. При этом повышение уровня лактата выявляется раньше, чем снижение концентрации глюкозы.
Снижение коэффициента концентрации глюкозы в СМЖ и в сыворотке и повышение уровня лактата в СМЖ свидетельствует о бактериальных и грибковых инфекциях, лептоменингеальных метастазах.
Цитологическое исследование
Цитологическое исследование необходимо проводить не позднее 2 часов после пункции, желательно в течение 30 минут из-за лизиса эритроцитов и лейкоцитов [45] (класс IV).
Количество лейкоцитов в СМЖ обычно рассчитывается в камере Фукса — Розенталя (объем 3,2 мл). Получаемое количество клеток необходимо разделить на 3, чтобы получить количество для 1 мл. Достаточное количество клеток для цитологического исследования можно получить при помощи цитоцентрифуги, седиментационной камеры Сайка или мембранной фильтрации [46]. Для дифференциации клеток широко применяется окрашивание May — Grunwald — Giemsa.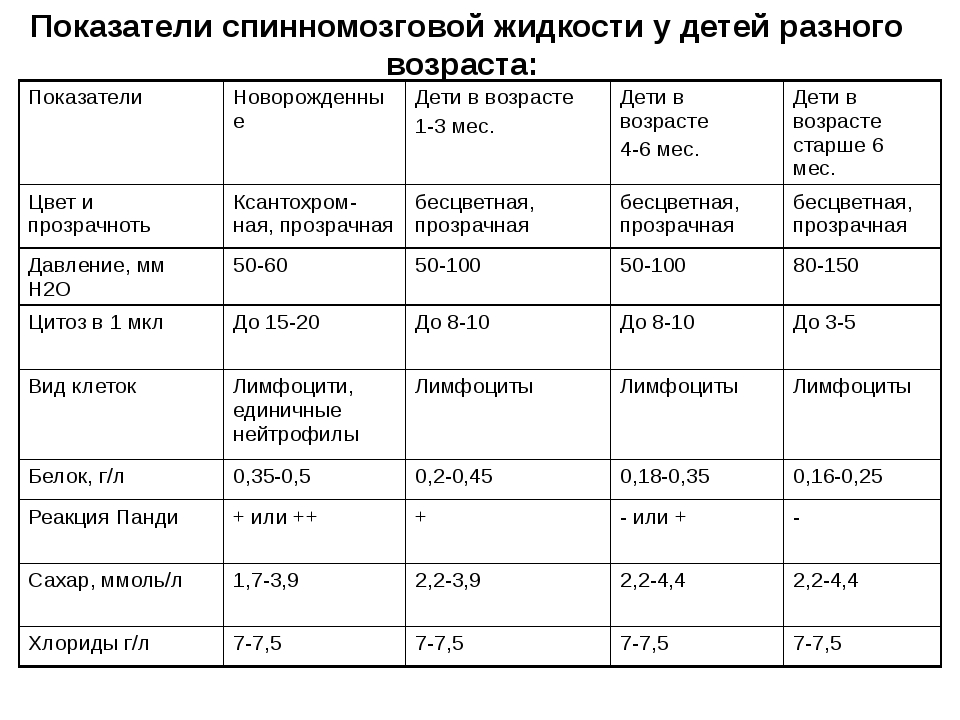 Однако могут также применяться специфические методы, в особенности для выявления злокачественных клеток [47, 48] (класс II).
Однако могут также применяться специфические методы, в особенности для выявления злокачественных клеток [47, 48] (класс II).
В нормальном анализе СМЖ могут обнаруживаться лимфоциты, моноциты и иногда эпендимальные клетки.
Повышенное содержание нейтрофильных гранулоцитов наблюдается при бактериальных и острых вирусных инфекциях ЦНС [48, 49] (класс II). В фазе ремиссии наблюдается мононуклеарная трансформация.
При активации лимфоциты могут увеличиваться или становиться клетками плазмы, что свидетельствует о неспецифической воспалительной реакции [48, 50] (класс IV). Оставшиеся моноциты увеличиваются и проявляют вакуоли при активации. Макрофаги являются наиболее сильно активированными моноцитами. Эти формы клеток наблюдаются при большом количестве различных заболеваний.
Эритрофаги появляются по истечении 12–18 часов после кровотечения. Сидерофаги, содержащие гемосидерин, появляются уже через 1–2 дня после кровотечения и могут сохраняться на протяжении нескольких недель.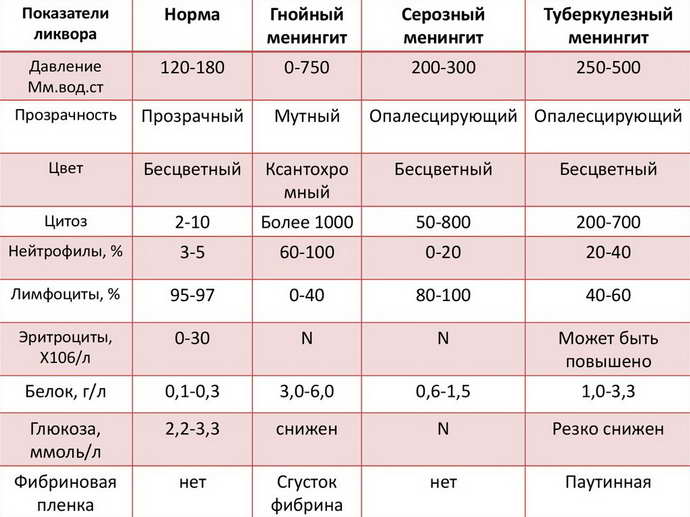 Макрофаги, содержащие гемосидерин (кристаллизованный билирубин), появляются в процессе распада гемоглобина через 2 недели после кровотечения. Они свидетельствуют о субарахноидальном кровоизлиянии [48] (класс IV). Однако спектрофотометрия СМЖ на выявление количества билирубина рекомендуется для подтверждения не выявленного рентгеном подпаутинного (субарахноидального) кровотечения в период до 2 недель после его начала [51].
Макрофаги, содержащие гемосидерин (кристаллизованный билирубин), появляются в процессе распада гемоглобина через 2 недели после кровотечения. Они свидетельствуют о субарахноидальном кровоизлиянии [48] (класс IV). Однако спектрофотометрия СМЖ на выявление количества билирубина рекомендуется для подтверждения не выявленного рентгеном подпаутинного (субарахноидального) кровотечения в период до 2 недель после его начала [51].
Липофаги свидетельствуют о разрушении ткани ЦНС. Наличие макрофагов является неспецифическим показателем, проявляющимся при грыже дисков, злокачественной менингеальной инфильтрации, опухоли спинного мозга, травмах головы, инсультах, МС, васкулите, инфекционном и подпаутинном кровотечении [48] (класс IV).
В нормальном состоянии эозинофилы не присутствуют в СМЖ. Присутствие 10 и более эозинофилов в 1 мл, или эозинофилия 10 % от общего количества лейкоцитов в СМЖ, свидетельствует об ограниченном круге заболеваний. Это паразитические инфекции, кокцидиоидомикоз, злокачественные опухоли, реакция на медикаменты и вентрикулоперитонеальное шунтирование [52].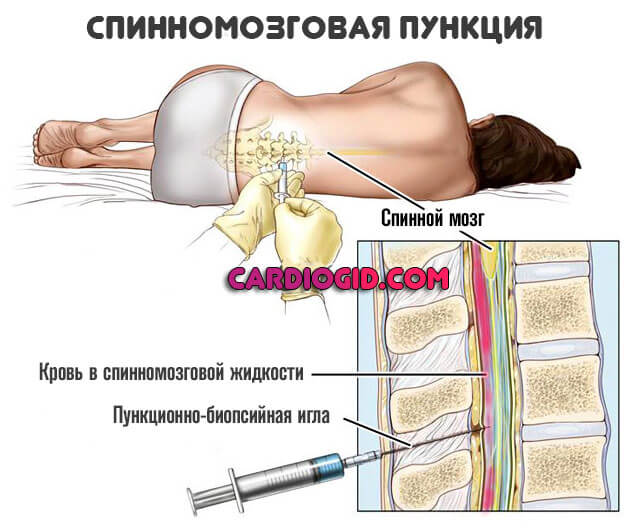 Злокачественные клетки СМЖ свидетельствуют о лептоменингеальных метастазах. Часто получаемые результаты являются ошибочными из-за того, что клетки зоны воспаления принимаются за опухолевые, а также из-за попадания в ликвор для анализа клеток периферической крови [53]. Невыявление злокачественных клеток при цитологическом исследовании СМЖ также случается нередко. Для получения наиболее точных результатов необходимо проводить анализ не менее 10,5 мл жидкости, а также повторить анализ при получении негативного результата. Точность анализа с 50–70 % после первой пункции можно повысить до 85–92 % после повторных анализов [54] (класс III). Последующие пункции не оказывают особого влияния на точность анализа [55, 56] (класс III).
Злокачественные клетки СМЖ свидетельствуют о лептоменингеальных метастазах. Часто получаемые результаты являются ошибочными из-за того, что клетки зоны воспаления принимаются за опухолевые, а также из-за попадания в ликвор для анализа клеток периферической крови [53]. Невыявление злокачественных клеток при цитологическом исследовании СМЖ также случается нередко. Для получения наиболее точных результатов необходимо проводить анализ не менее 10,5 мл жидкости, а также повторить анализ при получении негативного результата. Точность анализа с 50–70 % после первой пункции можно повысить до 85–92 % после повторных анализов [54] (класс III). Последующие пункции не оказывают особого влияния на точность анализа [55, 56] (класс III).
В целом цитологическое исследование является необходимым, так как в большинстве случаев показания для анализа СМЖ включают и возможные заболевания, наличие которых связано с повышенным содержанием различных клеток. Цитологическое окрашивание позволяет выявлять заболевания ЦНС по повышенному содержанию различных клеток.
Исследование СМЖ на инфекции
Существуют малые и средние работы по изучению чувствительности и специфичности тестов на присутствие различных возбудителей инфекций. Однако нет ни одной большой работы, посвященной описанию и оценке эффективности таких анализов в целом. Поэтому нет и надежных данных по таким вопросам, как показания, чувствительность и специфичность микробиологических процедур в целом (например, информации о том, как следует проводить исследования СМЖ при явных инфекциях ЦНС). Существующие положения основываются на клинической практике и теоретическом, правдоподобном описании таких процедур [18, 57, 58].
Существует большое количество методов для выявления антигенов и специфических антител. Выбор метода в основном зависит от типа антигена (табл. 4).
При нейроинфекциях выявление специфических антигенов или антител зависит от клинической картины и результатов анализов СМЖ. Ниже приводится формула расчета относительного интратекального синтеза специфических антител в СМЖ (индекс антител, ИА):
Уровень антител = концентрация антител в СМЖ / концентрация антител в сыворотке.
Уровень IgG = концентрация IgG в СМЖ / концентрация IgG в сыворотке.
ИА = уровень антител / уровень IgG (положительный: > 1,5).
Полимеразная цепная реакция (ПЦР) СМЖ — быстрый и недорогой метод, поэтому он стал неотъемлемым компонентом диагностики. У пациентов с позитивным результатом ПЦР вероятность установления точного диагноза вирусной инфекции ЦНС в 88 раз выше, нежели у пациентов с отрицательным результатом теста. Отрицательный результат ПЦР не позволяет с полной уверенностью установить диагноз (вероятность точного диагноза при вирусной инфекции ЦНС равна 0,1 в таких случаях) [59]. Необходимо отметить, что отрицательный результат этого тестирования может быть неверным, если оно проводится в течение 3 дней после заболевания или в течение 10 дней и более с момента начала симптомов [60, 61].
В целом ПЦР назначается в следующих случаях:
— когда исследование под микроскопом, посев или серология не дали точных результатов;
— когда посев не дает ожидаемого результата, несмотря на клиническую картину инфекционного менингита / менингоэнцефалита;
— пациентам с иммунодефицитом.
Рекомендации и практические советы
Анализ спинномозговой жидкости должен проводиться сразу же после ее забора (в течение часа). При необходимости хранить образцы СМЖ следует при температуре 4–8 °C (краткосрочно) или при –20 °C (длительное время). В образцах СМЖ, которые подверглись хранению, могут быть проанализированы только белковые компоненты и ДНК (при должной подготовке).
Рекомендации уровня B по поводу хранения СМЖ. 12 мл СМЖ должны быть разделены на три стерильных пробирки. Важно, чтобы перед разделением не выпал осадок. Для общих анализов, посева и исследования под микроскопом на наличие бактерий и грибов, тестирования на антитела, ПЦР и выявление антигенов берется 3–4 мл ликвора, который хранится при температуре 4 °C. Больший объем ликвора (10–15 мл) требуется для выявления некоторых патогенов, например Mycobacterium tuberculosis, грибков или паразитов.
Нормы концентрации белка в СМЖ должны соответствовать возрасту пациента (норма выше в неонатальный период и после 60 лет) и месту забора СМЖ (рекомендации уровня B). Точные цифры верхней границы концентрации белка разнятся в зависимости от техники проведения анализа и лаборатории, где он проводится.
Точные цифры верхней границы концентрации белка разнятся в зависимости от техники проведения анализа и лаборатории, где он проводится.
Информативность Qalb выше в сравнении с общим уровнем концентрации белка частично потому, что соотношения более четко определены, а также потому что на этот коэффициент не оказывают влияния изменения содержания других белков в СМЖ (рекомендации уровня B).
Концентрация глюкозы в СМЖ должна соотноситься с ее концентрацией в крови. Поэтому предпочтение отдается коэффициенту соотношения этих параметров. Патологические изменения этого коэффициента или концентрации лактата свидетельствуют о бактериальном или грибковом менингите, лептоменингеальных метастазах (рекомендации уровня B).
Интратекальный синтез IgG может быть измерен с помощью различных количественных методов. Однако для диагностики рассеянного склероза рекомендуется применять один из методов выявления олигоклональных соединений, а не существующие формулы (рекомендации уровня A).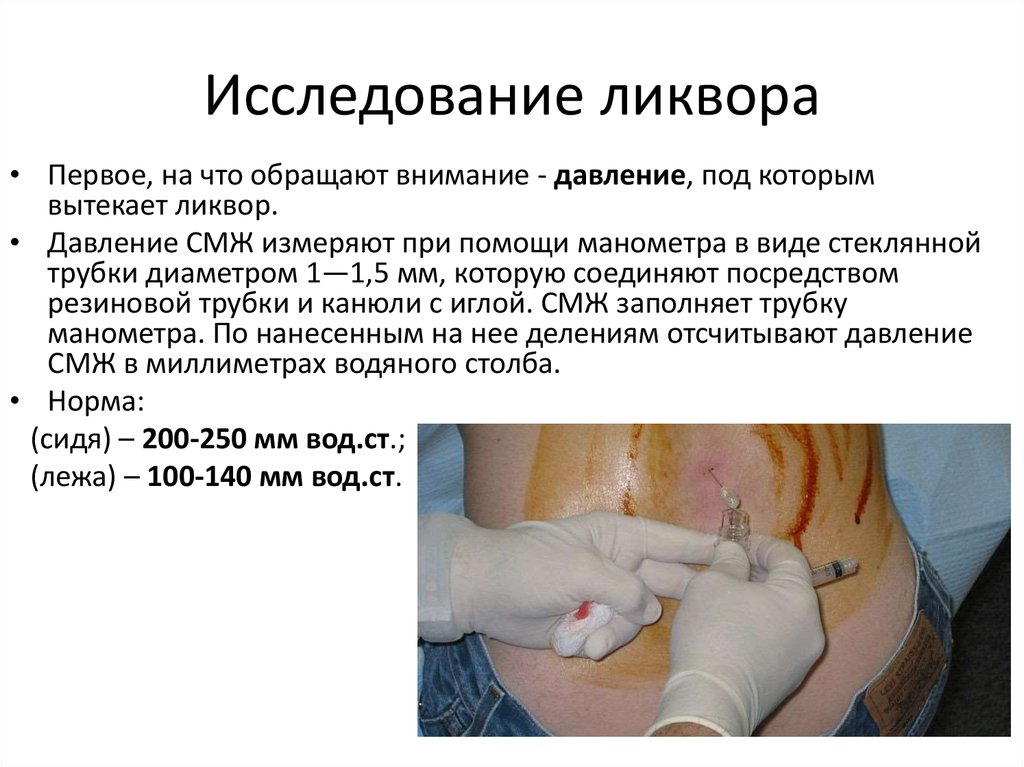 У пациентов с заболеваниями, связанными с интратекальным воспалением (например, инфекции ЦНС), также может наблюдаться интратекальный синтез IgА и IgМ, как показывают нелинейные формулы (гиперболическая формула Райбера или расширенные индексы). Применение этих нелинейных формул более желательно, нежели рассмотрение линейных индексов IgА и IgМ (рекомендации уровня B).
У пациентов с заболеваниями, связанными с интратекальным воспалением (например, инфекции ЦНС), также может наблюдаться интратекальный синтез IgА и IgМ, как показывают нелинейные формулы (гиперболическая формула Райбера или расширенные индексы). Применение этих нелинейных формул более желательно, нежели рассмотрение линейных индексов IgА и IgМ (рекомендации уровня B).
Клеточная морфология (цитологическое окрашивание) должна оцениваться в случае плеоцитоза, лептоменингеальных метастазов или при подозрении на патологическое кровотечение (рекомендация уровня B). В случае получения неубедительных результатов цитологического исследования необходимо провести замер билирубина в течение 2 недель после подозреваемого кровотечения.
Для стандартного микробиологического исследовании рекомендуется осадок 3000 / г за 10 минут (рекомендации уровня B). При исследовании необходимо проводить окраску по Граму или метиленовым синим, аурамином O или по Цилю — Нельсону (Mycobacterium tuberculosis), индийской тушью (Cryptococcus).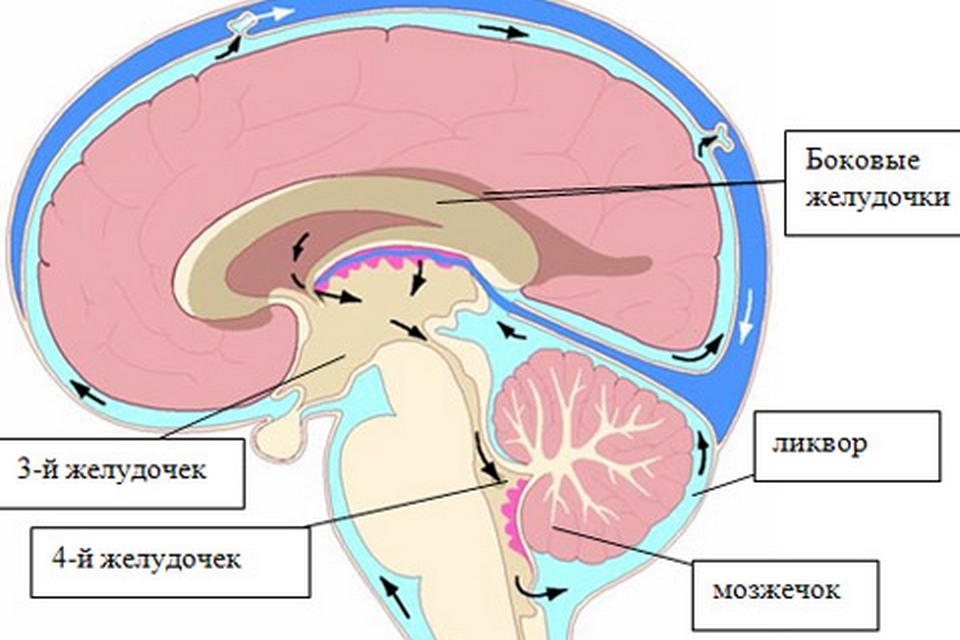 В зависимости от клинической картины может применяться инкубация на ликворе культуры бактерий или грибков. Применять анаэробную культуру рекомендуется в случае подозрения на абсцесс головного мозга. Использование вирусных культур не рекомендуется. Список возбудителей инфекций и их соответствие различным заболеваниям, а также методы их выявления приведены в табл. 4. При интерпретации результатов выявления бактериальных антигенов должны приниматься во внимание исследования под микроскопом и результаты посева. В случае негативных результатов исследования под микроскопом это не рекомендуется. Не рекомендуется ставить диагноз бактериального инфицирования нервной системы, основываясь только на выявлении антигенов (риск заражения).
В зависимости от клинической картины может применяться инкубация на ликворе культуры бактерий или грибков. Применять анаэробную культуру рекомендуется в случае подозрения на абсцесс головного мозга. Использование вирусных культур не рекомендуется. Список возбудителей инфекций и их соответствие различным заболеваниям, а также методы их выявления приведены в табл. 4. При интерпретации результатов выявления бактериальных антигенов должны приниматься во внимание исследования под микроскопом и результаты посева. В случае негативных результатов исследования под микроскопом это не рекомендуется. Не рекомендуется ставить диагноз бактериального инфицирования нервной системы, основываясь только на выявлении антигенов (риск заражения).
Bibliography
1. Brainin M., Barnes M., Baron J.C. et al. Guidance for the preparation of neurological management guidelines by EFNS scientific task forces — revised recommendations 2004 // European Journal of Neurology. — 2004. — 11. — 577-581.
2. Reiber H. Flow rate of cerebrospinal fluid (CSF) — a concept common to normal blood-CSF barrier function and to dysfunction in neurological diseases // Journal of the Neurological Sciences. — 1994. — 122. — 189-203.
3. Thompson E.J. The CSF Proteins: A Biochemical Approach. — Amsterdam: Elsevier, 2005.
4. Eeg-Olofsson O., Link H., Wigertz A. Concentrations of CSF proteins as a measure of blood brain barrier function and synthesis of IgG within the CNS in «normal» subjects from the age of 6 months to 30 years // Acta Paediatrica Scandinavica. — 1981. — 70. — 167-170.
5. Statz A., Felgenhauer K. Development of the blood-CSF barrier // Developmental Medicine and Child Neurology. — 1983. — 25. — 152-161.
6. Andersson M., Alvarez-Cermeno J., Bernardi G. et al. Cerebrospinal fluid in the diagnosis of multiple sclerosis: a consensus report // Journal of Neurology, Neurosurgery and Psychiatry. — 1994. — 57. — 897-902.
— 897-902.
7. Blennow K., Fredman P. Detection of cerebrospinal fluid leakage by isoelectric focusing on polyacrylamide gels with silver staining using the PhastSystem // Acta Neurochirurgica. — 1995. — 136. — 135-139.
8. Reiber H. External quality assessment in clinical neurochemistry: survey of analysis for cerebrospinal fluid (CSF) proteins based on CSF/serum quotients // Clinical Chemistry. — 1995. — 41. — 256-263.
9. Fishman R.A. Cerebrospinal Fluid in Diseases of the Nervous System. — Philadelphia, PA: W.B. Saunders, 1992.
10. Blennow K., Fredman P., Wallin A., Gottfries C.G., Langstrom G., Svennerholm L. Protein analyses in cerebrospinal fluid. I. Influence of concentration gradients for proteins on cerebrospinal fluid / serum albumin ratio // European Neurology. — 1993. — 33. — 126-128.
11. Kornhuber J., Kaiserauer C.H., Kornhuber A.W., Kornhuber M.E. Alcohol consumption and blood-cerebrospinal fluid barrier dysfunction in man // Neuroscience Letters. — 1987. — 79. — 218-222.
— 1987. — 79. — 218-222.
12. Nystrom E., Hamberger A., Lindstedt G., Lundquist C., Wikkelso C. Cerebrospinal fluid proteins in subclinical and overt hypothyroidism // Acta Neurologica Scandinavica. — 1997. — 95. — 311-314.
13. Seyfert S., Kunzmann V., Schwertfeger N., Koch H.C., Faulstich A. Determinants of lumbar CSF protein concentration // Journal of Neurology. — 2002. — 249. — 1021-1026.
14. Skouen J.S., Larsen J.L., Vollset S.E. Cerebrospinal fluid protein concentrations related to clinical findings in patients with sciatica caused by disk herniation // Journal of Spinal Disorders. — 1994. — 7. — 12-18.
15. Negrini B., Kelleher K.J., Wald E.R. Cerebrospinal fluid findings in aseptic versus bacterial meningitis // Pediatrics. — 2000. — 105. — 316-319.
16. Stockstill M.T., Kauffman C.A. Comparison of cryptococcal and tuberculous meningitis // Archives of Neurology. — 1983. — 40. — 81-85.
17. Sabetta J.R., Andriole V.T. Cryptococcal infection of the central nervous system // Medical Clinics of North America. — 1985. — 69. — 333-344.
Sabetta J.R., Andriole V.T. Cryptococcal infection of the central nervous system // Medical Clinics of North America. — 1985. — 69. — 333-344.
18. Kaiser R. Entzundliche und infektiose Erkrankungen. — Stuttgart: George Thieme, 2002.
19. Lindquist L., Linne T., Hansson L.O., Kalin M., Axelsson G. Value of cerebrospinal fluid analysis in the differential diagnosis of meningitis: a study in 710 patients with suspected central nervous system infection // European Journal of Clinical Microbiology and Infectious Diseases. — 1988. — 7. — 374-380.
20. Koskiniemi M., Vaheri A., Taskinen E. Cerebrospinal fluid alterations in herpes simplex virus encephalitis // Reviews of Infectious Diseases. — 1984. — 6. — 608-618.
21. Jerrard D.A., Hanna J.R., Schindelheim G.L. Cerebrospinal fluid // Journal of Emergency Medicine. — 2001. — 21. — 171-178.
22. Segurado O.G., Kruger H., Mertens H.G. Clinical significance of serum and CSF findings in the Guillain —Barre syndrome and related disorders // Journal of Neurology.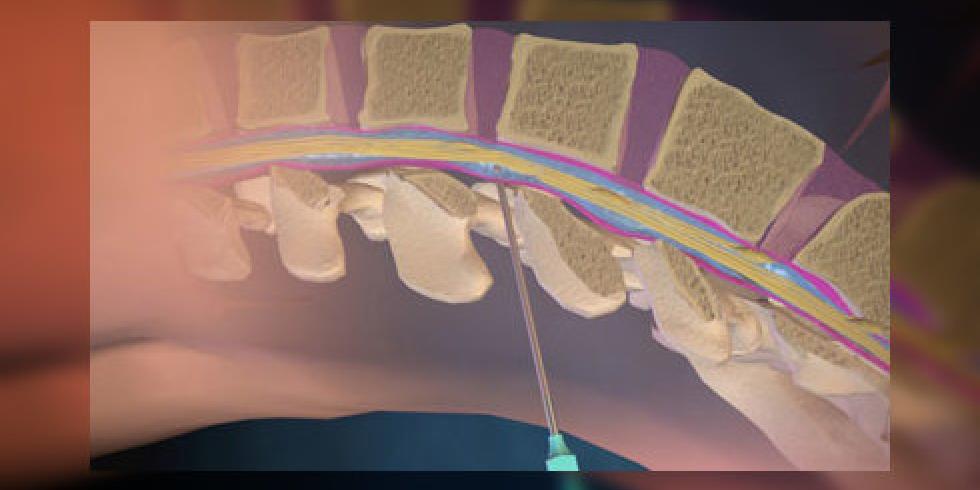 — 1986. — 233. — 202-208.
— 1986. — 233. — 202-208.
23. Seneviratne U. Guillain — Barre syndrome // Postgraduate Medical Journal. — 2000. — 76. — 774-782.
24. Twijnstra A., Ongerboer D.V., van Zanten A.P., Hart A.A., Nooyen W.J. Serial lumbar and ventricular cerebrospinal fluid biochemical marker measurements in patients with leptomeningeal metastases from solid and hematological tumors // Journal of Neuro-Oncology. — 1989. — 7. — 57-63.
25. Delpech B., Lichtblau E. Immunochemical estimation of IgG and albumin in cerebrospinal fluid // Clinica Chimica Acta. — 1972. — 37. — 15-23.
26. Ganrot K., Laurell C.B. Measurement of IgG and albumin content of cerebrospinal fluid, and its interpretation // Clinical Chemistry. — 1974. — 20. — 571-573.
27. Link H., Tibbling G. Principles of albumin and IgG analysis in neurological disorders. The evaluation of IgG synthesis within the CNS in multiple sclerosis // Scandinavian Journal of Clinical Laboratory Investigations. — 1977. — 37. — 385-401.
— 1977. — 37. — 385-401.
28. Ohman S., Ernerudh J., Forsberg P., vаn Schenck H., Vrethem M. Improved formulae for the judgement of intrathecally produced IgA and IgM in the presence of blood CSF barrier damage // Annals of Clinical Biochemistry. — 1993. — 30 (Pt 5). — 454-462.
29. Ohman S., Forsberg P., Nelson N., Vrethem M. An improved formula for the judgement of intrathecally produced IgG in the presence of blood brain barrier damage // Clinica Chimica Acta. — 1989. — 181. — 265-272.
30. Ohman S., Ernerudh J., Forsberg P., Henriksson A., von Schenck H., Vrethem M. Comparison of seven formulae and isoelectrofocusing for determination of intrathecally produced IgG in neurological diseases // Annals of Clinical Biochemistry. — 1992. — 29 (Pt 4). — 405-410.
31. Sellebjerg F., Christiansen M., Rasmussen L.S., Jaliachvili I., Nielsen P.M., Frederiksen J.L. The cerebrospinal fluid in multiple sclerosis. Quantitative assessment of intrathecal synthesis by empirical formulae // European Journal of Neurology. — 1996. — 3. — 548-559.
— 1996. — 3. — 548-559.
32. Felgenhauer K. Differentiation of the humoral immune response in inflammatory diseases of the central nervous system // Journal of Neurology. — 1982. — 228. — 223-237.
33. Felgenhauer K., Schadlich H.J. The compartmental IgM and IgA response within the central nervous system // Journal of the Neurological Sciences. — 1987. — 77. — 125-135.
34. Sharief M.K., Keir G., Thompson E.J. Intrathecal synthesis of IgM in neurological diseases: a comparison between detection of oligoclonal bands and quantitative estimation // Journal of the Neurological Sciences. — 1990. — 96. — 131-142.
35. McDonald W.I., Compston A., Edan G. et al. Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis // Annals of Neurology. — 2001. — 50. — 121-127.
36. Rauer S., Kaiser R. Demonstration of anti-HuD specific oligoclonal bands in the cerebrospinal fluid from patients with paraneoplastic neurological syndromes. Qualitative evidence of anti-HuD specific IgG-synthesis in the central nervous system // Journal of Neuroimmunology. — 2000. — 111. — 241-244.
Qualitative evidence of anti-HuD specific IgG-synthesis in the central nervous system // Journal of Neuroimmunology. — 2000. — 111. — 241-244.
37. Stich O., Graus F., Rasiah C., Rauer S. Qualitative evidence of anti-Yo-specific intrathecal antibody synthesis in patients with paraneoplastic cerebellar degeneration // Journal of Neuroimmunology. — 2003. — 141. — 165-169.
38. Storstein A., Monstad S.E., Honnorat J., Vedeler C.A. Paraneoplastic antibodies detected by isoelectric focusing of cerebrospinal fluid and serum // Journal of Neuroimmunology. — 2004. — 155. — 150-154.
39. Keir G., Luxton R.W., Thompson E.J. Isoelectric focusing of cerebrospinal fluid immunoglobulin G: an annotated update // Annals of Clinical Biochemistry. — 1990. — 27 (Pt 5). — 436-443.
40. McLean B.N., Luxton R.W., Thompson E.J. A study of immunoglobulin G in the cerebrospinal fluid of 1007 patients with suspected neurological disease using isoelectric focusing and the log IgG-Index // Brain./13/13.jpg) — 1990. — 113. — 1269-1289.
— 1990. — 113. — 1269-1289.
41. Freedman M.S., Thompson E.J., Deisenhammer F. et al. Recommended standard of cerebrospinal fluid analysis in the diagnosis of multiple sclerosis: a consensus statement // Archives of Neurology. — 2005. — 62. — 865-870.
42. Feigin R.D., McCracken G.H.Jr., Klein J.O. Diagnosis and management of meningitis // The Pediatric Infectious Disease Journal. — 1992. — 11. — 785–814.
43. Watson M.A., Scott M.G. Clinical utility of biochemical analysis of cerebrospinal fluid // Clinical Chemistry. — 1995. — 41. — 343-360.
44. Jordan G.W., Statland B., Halsted C. CSF lactate in diseases of the CNS // Archives of Internal Medicine. — 1983. — 143. — 85-87.
45. Steele R.W., Marmer D.J., O’Brien M.D., Tyson S.T., Steele C.R. Leukocyte survival in cerebrospinal fluid // Journal of Clinical Microbiology. — 1986. — 23. — 965-966.
46. Lamers K., Wevers R.A. Cerebrospinal fluid diagnostics: biochemical and clinical aspects // Klinicka Biochemie a Metabolismus. — 1995. — 3. — 63-75.
— 1995. — 3. — 63-75.
47. Roma A.A., Garcia A., Avagnina A., Rescia C., Elsner B. Lymphoid and myeloid neoplasms involving cerebrospinal fluid: comparison of morphologic examination and immunophenotyping by flow cytometry // Diagnostic Cytopathology. — 2002. — 27. — 271-275.
48. Adam P., Taborsky L., Sobek O. et al. Cerebrospinal fluid // Advances in Clinical Chemistry. — 2001. — 36. — 1-62.
49. Spanos A., Harrell F.E.Jr., Durack D.T. Differential diagnosis of acute meningitis. An analysis of the predictive value of initial observations // Journal of the American Medical Association. — 1989. — 262. — 2700-2707.
50. Zeman D., Adam P., Kalistova H., Sobek O., Andel J., Andel M. Cerebrospinal fluid cytologic findings in multiple sclerosis. A comparison between patient subgroups // Acta Cytologica. — 2001. — 45. — 51-59.
51. UK National External Quality Assessment Scheme for Immunochemistry Working Group. National guidelines for analysis of cerebrospinal fluid for bilirubin in suspected subarachnoid haemorrhage // Annals of Clinical Biochemistry. — 2003. — 40. — 481-488.
National guidelines for analysis of cerebrospinal fluid for bilirubin in suspected subarachnoid haemorrhage // Annals of Clinical Biochemistry. — 2003. — 40. — 481-488.
52. Lo R.V. III, Gluckman S.J. Eosinophilic meningitis // American Journal of Medicine. — 2003. — 114. — 217-223.
53. Twijnstra A., Ongerboer D.V., van Zanten A.P. Diagnosis of leptomeningeal metastasis Clinical Neurology and Neurosurgery. — 1987. — 89. — 79-85.
54. Glantz M.J., Cole B.F., Glantz L.K. et al. Cerebrospinal fluid cytology in patients with cancer: minimizing false-negative results // Cancer. — 1998. — 82. — 733-739.
55. Kaplan J.G., DeSouza T.G., Farkash A. et al. Leptomeningeal metastases: comparison of clinical features and laboratory data of solid tumors, lymphomas and leukemias // Journal of Neuro-Oncology. — 1990. — 9. — 225-229.
56. Wasserstrom W.R., Glass J.P., Posner J.B. Diagnosis and treatment of leptomeningeal metastases from solid tumors: experience with 90 patients // Cancer. — 1982. — 49. — 759-772.
— 1982. — 49. — 759-772.
57. Kniehl E.R., Dorries H.K., Geiss B. et al. MiQ 17: Qualitatsstandards in der mikrobiologisch-infektiologischen Diagnostik. — Munchen; Jena: Urban & Fischer, 2001.
58. Schlossberg D. Infections of the Nervous System. — Berlin: Springer, 1990.
59. Jeffery K.J., Read S.J., Peto T.E., Mayon-White R.T., Bangham C.R. Diagnosis of viral infections of the central nervous system: clinical interpretation of PCR results // Lancet. — 1997. — 349. — 313-317.
60. Davies N.W., Brown L.J., Gonde J. et al. Factors influencing PCR detection of viruses in cerebrospinal fluid of patients with suspected CNS infections // Journal of Neurology, Neurosurgery and Psychiatry. — 2005. — 76. — 82-87.
61. Kennedy P.G. Viral encephalitis // Journal of Neurology. — 2005. — 252. — 268-272.
62. Schipper H.I., Bardosi A., Jacobi C., Felgenhauer K. Meningeal carcinomatosis: origin of local IgG production in the CSF // Neurology. — 1988. — 38. — 413-416.
— 1988. — 38. — 413-416.
63. Korenke G.C., Reiber H., Hunneman D.H., Hanefeld F. Intrathecal IgA synthesis in X-linked cerebral adrenoleukodystrophy // Journal of Child Neurology. — 1997. — 12. — 314-320.
64. Poser C.M., Paty D.W., Scheinberg L. et al. New diagnostic criteria for multiple sclerosis: guidelines for research protocols // Annals of Neurology. — 1983. — 13. — 227-231.
65. Schumacher G.A., Beebe G., Kebler R.F. et al. Problems of experimental trials of therapy of multiple sclerosis // Annals of the New York Academy of Sciences. — 1965. — 122. — 552-568.
66. Takahashi T., Nakayama T., Tamura M. et al. Nested polymerase chain reaction for assessing the clinical course of tuberculosis meningitis // Neurology. — 2005. — 64. — 1789-1793.
Основной белок миелина в ликворе (цереброспинальной жидкости): исследования в лаборатории KDLmed
Определение концентрации основного белка миелина в ликворе, используемое для диагностики, оценки прогноза и контроля лечения рассеянного склероза.
Синонимы русские
ОБМ в спинномозговой жидкости, в СМЖ.
Синонимы английские
Myelin basic protein (MBP), CSF.
Метод исследования
Иммуноферментный анализ (ИФА).
Единицы измерения
Нг/мл (нанограмм на миллилитр).
Какой биоматериал можно использовать для исследования?
Ликвор.
Как правильно подготовиться к исследованию?
Подготовки не требуется.
Общая информация об исследовании
Основной белок миелина, ОБМ – это один из главных компонентов внутреннего слоя оболочки миелина. При демиелинизации ОБМ и/или его фрагменты поступают в спинномозговую жидкость и поэтому могут быть использованы в качестве клинико-лабораторного маркера разрушения миелина для диагностики, оценки прогноза и контроля лечения рассеянного склероза.
Показано, что повышение уровня ОБМ в ликворе наблюдается примерно в 80 % случаев обострения рассеянного склероза и лишь у немногих пациентов в ремиссии заболевания. Нарастание уровня ОБМ соотносится с прогрессированием изменений по данным МРТ и сохраняется в течение 5-6 недель после начала обострения. На фоне терапии глюкокортикостероидами концентрация ОБМ снижается.
Нарастание уровня ОБМ соотносится с прогрессированием изменений по данным МРТ и сохраняется в течение 5-6 недель после начала обострения. На фоне терапии глюкокортикостероидами концентрация ОБМ снижается.
Если рассеянный склероз проявляется только в виде ретробульбарного неврита, повышения ОБМ в ликворе, как правило, не наблюдается. Это, вероятно, обусловлено тем, что очаг демиелинизации в этом случае расположен на относительно большом расстоянии от четвертого желудочка головного мозга. Другой особенностью ОБМ является то, что при высвобождении из миелина ОБМ может подвергаться фрагментации с образованием множества разных по структуре компонентов, не все из которых могут быть идентифицированы с помощью стандартных тест-систем. Результат исследования в таком случае не всегда соответствует реальной концентрации ОБМ в ликворе.
Повышение ОБМ наблюдается не только при рассеянном склерозе, но и при других заболеваниях ЦНС, например при инсульте, некоторых энцефалопатиях и энцефалитах. Более того, так как ОБМ также обнаруживается в периферических нервах, его концентрация в ликворе может изменяться при наличии демиелинизации нервных волокон за пределами ЦНС. Таким образом, ОБМ – это неспецифический маркер рассеянного склероза.
Более того, так как ОБМ также обнаруживается в периферических нервах, его концентрация в ликворе может изменяться при наличии демиелинизации нервных волокон за пределами ЦНС. Таким образом, ОБМ – это неспецифический маркер рассеянного склероза.
Следует отметить, что на сегодняшний день ОБМ – это дополнительный маркер рассеянного склероза. Как и другие маркеры ликвора (олигоклональные иммуноглобулины G, IgG-индекс), он не входит в основной алгоритм диагностики рассеянного склероза.
Для чего используется исследование?
- Для диагностики, оценки прогноза и контроля лечения рассеянного склероза.
Когда назначается исследование?
- При наличии симптомов рассеянного склероза: нарушение зрения (помутнение, двоение в глазах), слабость, онемение, покалывание в руках и ногах, нарушение равновесия, учащение мочеиспускания, особенно если симптомы носят перемежающийся характер и наблюдаются у молодой женщины;
- при получении неоднозначных результатов магнитно-резонансного исследования головного мозга (МРТ).

Что означают результаты?
Референсные значения: менее 1 нг/мл.
Положительный результат:
- рассеянный склероз и другие демиелинизирующие заболевания ЦНС;
- инсульт;
- энцефалопатии;
- энцефалиты.
Отрицательный результат:
- норма;
- эффективное лечение заболевания.
Что может влиять на результат?
- Фрагментация основного белка миелина при его высвобождении из миелина;
- наличие сопутствующих заболеваний.
Важные замечания
- Основной белок миелина является неспецифичным маркером рассеянного склероза и других демиелинизирующих заболеваний;
- результаты анализы следует интерпретировать с учетом дополнительных клинических, лабораторных и инструментальных данных.
Также рекомендуется
- Диагностика рассеянного склероза (изоэлектрофокусирование олигоклонального IgG в ликворе и сыворотке)
Кто назначает исследование?
Невролог, врач общей практики.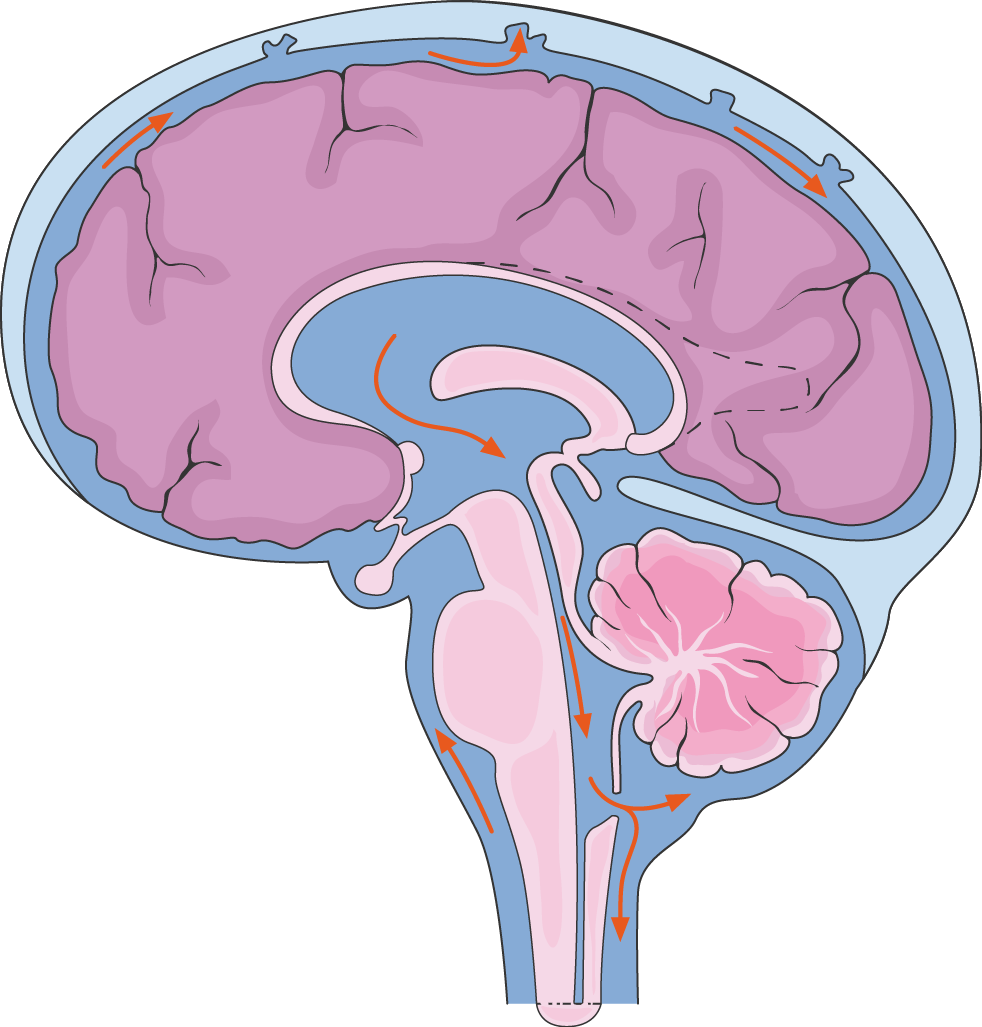
Литература
- Giovannoni G. Multiple sclerosis cerebrospinal fluid biomarkers. Dis Markers. 2006;22(4):187-96. Review.
- Greene DN, Schmidt RL, Wilson AR, Freedman MS, Grenache DG.Cerebrospinal fluid myelin basic protein is frequently ordered but has little value: a test utilization study. Am J Clin Pathol. 2012 Aug;138(2):262-72.
Краниосакральная терапия
Что такое краниосакральная терапия (краниосакральная остеопатия)?
Краниосакральная терапия (сranium (лат.) — «череп», sacrum (лат.) — «крестец») является одной из разновидностей разделов остеопатии, осуществляющей воздействие на весь организм через работу на структурах головы (костях черепа, мозговых оболочках) и крестца. Она очень похожа на легкий массаж для пациента, но сама методика воздействия рук врача абсолютно иная.
Многие считают, что боль в спине можно устранить лишь посредством достаточно сильного и грубого воздействия на кости (вправления), такие процедуры сопровождаются неприятными, а иногда и болезненными ощущениями. Сеанс краниосакральной терапии является полной противоположностью такому методу.
Сеанс краниосакральной терапии является полной противоположностью такому методу.
Краниосакральная остеопатия появилась в начале XX века благодаря исследованиям американского врача-остеопата Сазерленда (Sutherlend), который обнаружил взаимосвязанные колебательные движения костей черепа, передающиеся крестцовой кости через твердую оболочку спинного мозга.
Краниосакральная терапия получила очень большое распространение во всем мире и как самостоятельный метод лечения. Это связано с уникальным сочетанием эффективности, безопасности и удивительной мягкости лечения.
Как проходит сеанс краниосакральной терапии (краниальной остеопатии) ?
Краниосакральная терапия подразумевает использование нескольких техник воздействия. Основная из них – анфолдинг (от англ. «разворачивать»). Врач находит слишком «нагруженные» (спазмированные) ткани и «разворачивает» их в свободном направлении при помощи воздействия руками, расслабляя мышцы и ткани тела пациента. Таким образом, они обретают свою естественную физиологическую подвижность, и ритм сокращений краниосакральной системы восстанавливается.
Таким образом, они обретают свою естественную физиологическую подвижность, и ритм сокращений краниосакральной системы восстанавливается.
Краниосакральная терапия оказывает очень бережное и аккуратное воздействие на всю нервную систему. Грубое воздействие здесь не приемлемо и не допустимо. Мягкие методы, применяемые в краниосакральной терапии, нормализуют кровоснабжение головного и спинного мозга, устраняют нарушения в суставах позвоночника, регулируют натяжение защитных оболочек мозга, нормализуют движение спинномозговой жидкости. Все это приводит к нормализации работы нервной системы человека в целом.
Сеанс терапии занимает от 30 минут до 45 минут. В результате пациент обретает легкость тела, бодрость и чувствует себя «перерожденным». Это первый признак начала выздоровления. Конечно, за один сеанс избавиться от болезней невозможно. Вы будете постепенно замечать у себя всё больше и больше изменений к лучшему.
Такие сеансы будут полезны не только больным, но и здоровым людям. Они являются прекрасной профилактикой, которая повышает сопротивляемость организма болезням, поддерживает его в тонусе, улучшает психоэмоциональный фон и нормализует работу нервной системы.
Они являются прекрасной профилактикой, которая повышает сопротивляемость организма болезням, поддерживает его в тонусе, улучшает психоэмоциональный фон и нормализует работу нервной системы.
Что лечат с помощью краниосакральных техник?
Краниосакральная терапия имеет широкий спектр воздействия на организм человека: улучшается кровообращение головного мозга, устраняется головная боль, восстанавливается подвижность костей таза, крестца и суставов позвоночника, уменьшается напряжение мозговых мембран, нормализуются функции нервной системы.
Особенно краниосакральные техники лечения эффективны при следующих патологических состояниях:
- Головная боли различного генеза, в том числе мигрень
- Хроническая боль в спине
- Синдром хронической усталости
- Последствия родовых травм
- Последствия черепно-мозговых травм
- Вегетативная сосудистая дистония
- Повышенное внутричерепное давление
- Невралгия тройничного нерва
Показания и возможные противопоказания к процедуре краниосакральной терапии определяет врач-специалист индивидуально в каждом конкретном случае.
НАШ СПЕЦИАЛИСТ КРАНИОСАКРАЛЬНЫЙ ТЕРАПЕВТ:
ЛАПИН Антон Владимирович
Врач-невролог, рефлексотерапевт
Записаться на прием можно по телефону: (812) 429 03 33
или телефон диспетчера (812) 429 03 37
или телефон отделения неврологии и мануальной терапии (812) 338 6409
Отделение находится по адресу Петроградская набережная д. 44, 3-этаж
Гидроцефалия
Первичная гидроцефалия и патофизиология
Патофизиология гидроцефалии с нормальным внутричерепным давлением= ГНВД, т.е. рациональное объяснение возникновения сбоев в механизме, которые приводят к образованию гидроцефалии, существует только для определенных форм гидроцефалии. Возникновение таких форм заболевания как, например, хроническая гидроцефалия у взрослых ( или ГНВД) объясняется с помощъю гипотез, которые более или менее находят приятие повсеместно.
Гидроцефалия — это заболевание, при котором происходит увеличение внутренних желудочков мозга (ventriculus cerebri) и , как следствие, скапливание спинномозговой жидкости (= ликвора) внутри черпной коробки. Это скопление ликвора чаще всего диагностицируется с помощью визуальных методов: компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ). Увеличение внутренних желудочков мозга, также известное как вентрикуломегалия, бесспорно является общим элементом всех болезней и причин, приводящих к возникновению гидроцефалии.
К увеличению внутренних желудочков головного мозга могут привести очень многие заболевания. Причина развития гидроцефалии становится понятной, если на снимках КТ и МРТ распознается обструкция путей спинномозговой жидкости. При развитии гидроцефалии с нормальным внутричерепным давлением, при которой препятствия для коммуникации не столь однозначны, причины возникновения болезни до сих пор не ясны. Нарушения пульсации ликвора являются предположительно важным фактором, провоцирующим возникающие механизмы нарушения.
Вторичная гидроцефалия
При вторичной, или приобретенной гидроцефалии речь идет в том случае, если она возникает в следствие другого заболевания, являющегося так называемой основой для развития гидроцефалии. Вне зависимости от этого заболевания, жалобы возникают из-за более или менее повышенного внутричерепого давления и расширения объема внутренних мозговых желудочков. Причиной развития вторичной гидроцефалии являются нарушения циркулирования спинномозговой жидкости внутри или снаружи мозговых желудочков.
Причины нарушения циркуляции спинномозговой жидкости в мозговых желудочках:
- ♦ oпухоли мозга или кисты (например эпендимомы, астроцитомы, медуллобластома)
- ♦ местные кровотечения (например кровотечение в ткани головного мозга и в мозговые желудочки)
- ♦ черепно-мозгoвая травма
Местная закупорка путей спинномозговой жидкости приводят к ее накоплению перед препятствием и как следствие к увеличению внутренних мозговых желудочков.
Причины нарушения циркуляции спинномозговой жидкости вне мозговых желудочков:
- ♦ диффузное кровотечение (кровотечение в субарахноидальном пространстве)
- ♦ менингит (воспаление оболочек головного мозга)
- ♦ диффузные метастазы опухоли в субарахноидальном пространстве
- ♦ кровотечения из аневризмы (деформированные из-из болезненных изменений сосуды
Вне зависимости от причин, спровоцировавших развитие болезни, для лечения гидроцефалии все чаще применяются терапия с использованием шунта и вентрикуло-цистерностомия.
Пресепсин в диагностике нозокомиальной инфекции центральной нервной системы | Абудеев
1. Murthy S.B., Moradiya Y., Shah J., et al. Nosocomial Infections and Outcomes after Intracerebral Hemorrhage: A Population-Based Study. Neurocrit. Care. 2016; 25(2): 178–184. DOI: 10.1007/s12028-016-0282-6.
Neurocrit. Care. 2016; 25(2): 178–184. DOI: 10.1007/s12028-016-0282-6.
2. Hinduja A., Dibu J., Achi E., et al. Nosocomial infections in patients with spontaneous intracerebral hemorrhage. Am. J. Crit. Care. 2015; 24(3): 227–231. DOI: 10.4037/ajcc2015422.
3. Van de Beek D., Drake J.M., Tunkel A.R. Nosocomial bacterial meningitis. N. Engl. J. Med. 2010; 362(2): 146–154. DOI: 10.1056/NEJMra0804573.
4. Lozier A.P., Sciacca R.R., Romagnoli M.F., Connolly E.S. Jr.Ventriculostomyrelated infections: a critical review of the literature. Neurosurgery. 2002; 51(1): 170–181. PMID: 12182415.
5. Beer R., Lackner P., Pfausler B., Schmutzhard E. Nosocomial ventriculitis and meningitis in neurocritical care patients. J. Neurol. 2008; 255(11): 1617-1624. DOI: 10.1007/s00415-008-0059-8.
J. Neurol. 2008; 255(11): 1617-1624. DOI: 10.1007/s00415-008-0059-8.
6. Попугаев К.А., Савин И.А., Ершова О.Н., и др. Факторы риска развития послеоперационного менингита у больных с опухолями хиазмально-селлярной локализации. Анестезиология и реаниматология. 2014; (2): 10–14.
7. Maniker A.H., Vaynman A.Y., Karimi R.J., et al. Hemorrhagic complications of external ventricular drainage. Neurosurgery. 2006; 59(4, Suppl. 2): 419–425. DOI: 10.1227/01.NEU.0000222817.99752.E6.
8. Gozal Y.M., Farley C.W., Hanseman D.J., et al. Ventriculostomy-associated infection A new, standardized reporting definition and institutional experience. Neurocrit Care. 2014; 21: 147–151. PMID: 24343563. DOI: 10.1007/s12028-013-9936-9.
9. Lyke K.E., Obasanjo O.O., Williams M.A., et al. Ventriculitis complicating use of intraventricular catheters in adult neurosurgical patients. Clin. Infect. Dis. 2001; 33(12): 2028–2033. DOI: 10.1086/324492.
Lyke K.E., Obasanjo O.O., Williams M.A., et al. Ventriculitis complicating use of intraventricular catheters in adult neurosurgical patients. Clin. Infect. Dis. 2001; 33(12): 2028–2033. DOI: 10.1086/324492.
10. Park P., Garton H.J., Kocan M.J., Thompson B.G. Risk of infection with prolonged ventricular catheterization. Neurosurgery. 2004; 55(3): 594– 599. PMID: 15335426.
11. Hill M., Baker G., Carter D., et al. A multidisciplinary approach to end external ventricular drain infections in the neurocritical care unit. J. Neurosci. Nurs. 2012; 44(4): 188–193. DOI: 10.1097/JNN.0b013e3182527672.
12. Lemcke J., Depner F., Meier U. The impact of silver nanoparticlecoated and antibiotic-impregnated external ventricular drainage catheters on the risk of infections: a clinical comparison of 95 patients. Acta Neurochir. Suppl. 2012; 114: 347–350. DOI: 10.1007/978-3-7091-0956-4_67.
Acta Neurochir. Suppl. 2012; 114: 347–350. DOI: 10.1007/978-3-7091-0956-4_67.
13. Leonard E.M., van Saene H.K., Shears P., et al. Pathogenesis of colonization and infection in a neonatal surgical unit. Crit. Care Med. 1990; 18(3): 264–269. PMID: 2302949.
14. Reusser P., Zimmerli W., Scheidegger D., et al. Role of gastric colonization in nosocomial infections and endotoxemia: a prospective study in neurosurgical patients on mechanical ventilation. J. Infect. Dis. 1989; 160(3): 414–421. PMID: 2760497.
15. Deutch S., Dahlberg D., Hedegaard J., et al. Diagnosis of ventricular drainage-related bacterial meningitis by broad-range real-time polymerase chain reaction. Neurosurgery. 2007; 61(2): 306–312. DOI: 10.1227/01.NEU.0000255526.34956.E4.
16. Baltas I., Tsoulfa S., Sakellariou P., et al. Posttraumatic meningitis: bacteriology, hydrocephalus, and outcome. Neurosurgery. 1994; 35(3): 422–426. PMID: 7800133.
Baltas I., Tsoulfa S., Sakellariou P., et al. Posttraumatic meningitis: bacteriology, hydrocephalus, and outcome. Neurosurgery. 1994; 35(3): 422–426. PMID: 7800133.
17. Conen A., Walti L.N., Merlo A., et al. Characteristics and treatment outcome of cerebrospinal fluid shunt-associated infections in adults: a retrospective analysis over an 11-year period. Clin. Infect. Dis. 2008; 47(1): 73–82. DOI: 10.1086/588298.
18. Vinchon M., Dhellemmes P. Cerebrospinal fluid shunt infection: risk factors and long-term follow-up. Childs Nerv. Syst. 2006; 22(7): 692– 697. DOI: 10.1007/s00381-005-0037-8.
19. Weisfelt M., Van de Beek D., Spanjaard L., et al. Nosocomial bacterial meningitis in adults: a prospective series of 50 cases. J. Hosp. Infect. 2007; 66(1): 71–78. DOI: 10.1016/j.jhin.2007.02.017.
DOI: 10.1016/j.jhin.2007.02.017.
20. Frontera J.A., Fernandez A., Schmidt J.M. Impact of nosocomial infectious complications after subarachnoid hemorrage. Neurosurgery. 2008; 62: 80–87. PMID: 18300894. DOI: 10.1227/01.NEU.0000311064.18368.EA.
21. Van de Beek D., De Gans J., Spanjaard L., et al. Clinical features and prognostic factors in adults with bacterial meningitis. N Engl J Med. 2004; 351: 1849–1859. PMID: 15509818. DOI: 10.1056/NEJMoa040845.
22. Martínez R., Gaul C., Buchfelder M., et al. Serum procalcitonin monitoring for differential diagnosis of ventriculitis in adult intensive care patients. Intensive Care Med. 2002; 28(2): 208–210. DOI: 10.1007/s00134-001-1176-3.
23. Dubos F., Korczowski B., Aygun D. A., et al. Serum procalcitonin level and other biological markers to distinguish between bacterial and aseptic meningitis in children: a European multicenter case cohort study. Arch. Pediatr. Adolesc. Med. 2008; 162(12): 1157–1163. DOI: 10.1001/archpedi.162.12.1157.
Dubos F., Korczowski B., Aygun D. A., et al. Serum procalcitonin level and other biological markers to distinguish between bacterial and aseptic meningitis in children: a European multicenter case cohort study. Arch. Pediatr. Adolesc. Med. 2008; 162(12): 1157–1163. DOI: 10.1001/archpedi.162.12.1157.
24. Durand M.L., Calderwood S.B., Weber D.J., et al. Acute bacterial meningitis in adults. A review of 493 episodes. N. Engl. J. Med. 1993; 328(1): 21–28. DOI: 10.1056/NEJM199301073280104.
25. Paul R., Koedel U., Pfister H.W. Development of adjunctive therapies for bacterial meningitis and lessons from knockout mice. Neurocrit. Care. 2005; 2(3): 313–324. DOI: 10.1385/NCC:2:3:313.
26. Lorino G., Angeletti S., Gherardi G., et al. Diagnostic value of cytokine assays in cerebrospinal fluid in culture-negative, polymerase chain reaction–positive bacterial meningitis. Eur. J. Clin. Microbiol. Infect. Dis. 2000; 19(5): 388-392. PMID: 10898144
Eur. J. Clin. Microbiol. Infect. Dis. 2000; 19(5): 388-392. PMID: 10898144
27. Bohr V., Rasmussen N., Hansen B., et al. 875 cases of bacterial meningitis: diagnostic procedures and the impact of preadmission antibiotic therapy. J. Infect. 1983; 7(3): 193–202. PMID: 6420474.
28. Bruyn G.A., Kremer H.P., de Marie S., et al. Clinical evaluation of pneumococcal meningitis in adults over a twelve-year period. Eur. J. Clin. Microbiol. Infect. Dis. 1989; 8(8): 695–700. PMID: 2506035.
29. Durand M.L., Calderwood S.B., Weber D.J., et al. Acute bacterial meningitis in adults. A review of 493 episodes. N. Engl. J. Med. 1993; 328(1): 21–28. DOI: 10.1056/NEJM199301073280104.
30. Chakrabarti P. , Das B.K., Kapil A. Application of 16S rDNA based seminested PCR for diagnosis of acute bacterial meningitis. Indian J. Med. Res. 2009; 129(2): 182–188. PMID: 19293446.
, Das B.K., Kapil A. Application of 16S rDNA based seminested PCR for diagnosis of acute bacterial meningitis. Indian J. Med. Res. 2009; 129(2): 182–188. PMID: 19293446.
31. McIntyre P.B., Macintyre C.R., Gilmour R., et al. A population based study of the impact of corticosteroid therapy and delayed diagnosis on the outcome of childhood pneumococcal meningitis. Arch. Dis. Child. 2005; 90(4): 391–396. DOI: 10.1136/adc.2003.037523.
32. Shozushima T., Takahashi G., Matsumoto N., et al. Usefulness of presepsin (sCD14-ST) measurements as a marker for the diagnosis and severity of sepsis that satisfied diagnostic criteria of systemic inflammatory response syndrome. J. Infect. Chemother. 2011; 17(6): 764–769. DOI: 10.1007/s10156-011-0254-x.
33. Endo S., Suzuki Y. , Takahashi G., et al. Usefulness of presepsin in the diagnosis of sepsis in a multicenter prospective study. J. Infect. Chemother. 2012; 18(6): 891–897. DOI: 10.1007/s10156-012-0435-2.
, Takahashi G., et al. Usefulness of presepsin in the diagnosis of sepsis in a multicenter prospective study. J. Infect. Chemother. 2012; 18(6): 891–897. DOI: 10.1007/s10156-012-0435-2.
34. Mussap M., Puxeddu E., Burrai P., et al. Soluble CD14 subtype (sCD14- ST) presepsin in critically ill preterm newborns: preliminary reference ranges. J. Matern. Fetal. Neonatal. Med. 2012; 25(Suppl. 5): 51–53. DOI: 10.3109/14767058.2012.717462.
35. Nockher W.A., Wick M., Pfister H.W. Cerebrospinal fluid levels of soluble CD14 in inflammatory and non-inflammatory diseases of the CNS: upregulation during bacterial infections and viral meningitis. J. Neuroimmunol. 1999; 101(2): 161–169. PMID: 10580799.
36. Thorgersen E.B., Pischke S.E., Barratt-Due A., et al. Systemic CD14 inhibition attenuates organ inflammation in porcine Escherichia coli sepsis. Infect. Immun. 2013; 81(9): 3173–3181. DOI: 10.1128/IAI.00390-13.
Infect. Immun. 2013; 81(9): 3173–3181. DOI: 10.1128/IAI.00390-13.
37. Pugin J., Heumann I.D., Tomasz A., et al. CD14 is a pattern recognition receptor. Immunity. 1994; 1(6): 509–516. PMID: 7534618.
38. Stubljar D., Kopitar A.N, Groselj-Grenc M., et al. Diagnostic Accuracy of Presepsin (sCD14-ST) for Prediction of Bacterial Infection in Cerebrospinal Fluid Samples from Children with Suspected Bacterial Meningitis or Ventriculitis. J. Clin. Microbiol. 2015; 53(4): 1239–1243. DOI: 10.1128/JCM.03052-14.
39. Козлова Е.М. Шунькина Г.Л. Чумак Н.М. и соавт. Уровень пресепсина ликвора у новорожденных детей. Лаборатория. 2014; 2: 31.
40. CDC/NHSN Surveillance Definitions for Specific Types of Infections. 2016. Available: https://www.cdc.gov/nhsn/pdfs/pscmanual/17pscnosinfdef_current.pdf
2016. Available: https://www.cdc.gov/nhsn/pdfs/pscmanual/17pscnosinfdef_current.pdf
41. Cohen S.H., Gerding D.N., Johnson S., et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the Society for Healthcare Epidemiology of America (SHEA) and the Infectious Diseases Society of America (IDSA). Infect. Control. Hosp. Epidemiol. 2010; 31(5): 431–455. DOI: 10.1086/651706.
42. McDonald L.C., Coignard B., Dubberke E., et al. Recommendations for surveillance of Clostridium difficile-associated disease. Infect. Control. Hosp. Epidemiol. 2007; 28(2): 140–145. DOI: 10.1086/511798.
43. Esposito S., De Simone G., Boccia G., et al. Sepsis and septic shock: New definitions, new diagnostic and therapeutic approaches. J. Glob. Antimicrob. Resist. 2017; 10: 204–212. DOI: 10.1016/j.jgar.2017.06.013.
Antimicrob. Resist. 2017; 10: 204–212. DOI: 10.1016/j.jgar.2017.06.013.
44. Varatharaj A., Galea I. The blood-brain barrier in systemic inflammation. Brain Behav. Immun. 2016; 60: 1–12. DOI: 10.1016/j.bbi.2016.03.010.
45. Mazeraud A., Pascal Q., Verdonk F., et al. Neuroanatomy and Physiology of Brain Dysfunction in Sepsis. Clin. Chest. Med. 2016; 37(2): 333–345. DOI: 10.1016/j.ccm.2016.01.013.
46. Shi H., Zheng K., Su Z., et al. Sinomenine enhances microglia M2 polarization and attenuates inflammatory injury in intracerebral hemorrhage. J. Neuroimmunol. 2016; 299: 28–34. DOI: 10.1016/j.jneuroim.2016.08.010.
47. Wang G., Wang S., Zhou Y., et al. Sepsis associated encephalopathy is an independent risk factor for nosocomial coma in patients with supratentorial intracerebral hemorrhage: a retrospective cohort study of 261 patients. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue. 2016; 28(8): 723–728. DOI: 10.3760/cma.j.issn.2095-4352.2016.08.011.
Zhonghua Wei Zhong Bing Ji Jiu Yi Xue. 2016; 28(8): 723–728. DOI: 10.3760/cma.j.issn.2095-4352.2016.08.011.
48. Zhu S.Z., Huang W.P., Huang L.Q., et al. Huperzine A protects sepsis associated encephalopathy by promoting the deficient cholinergic nervous function. Neurosci. Lett. 2016; 631: 70–78. DOI: 10.1016/j.neulet.2016.07.009.
49. Williams S.T. Pathophysiology of encephalopathy and delirium. J. Clin. Neurophysiol. 2013; 30(5): 435–437. DOI: 10.1097/WNP.0b013e3182a73e04.
50. Kobayashi F., Kato H., Suzuki M., et al. A case of posterior reversible leukoencephalopathy syndrome caused by fibromuscular dysplasia. Rinsho Shinkeigaku. 2016; 56(9): 622–626. DOI: 10.5692/clinicalneurol.cn-000912.
51. Nanba T., Kashimura H., Saura H., et al. Subarachnoid hemorrhage due to ruptured intracranial aneurysm following posterior reversible encephalopathy syndrome. J Neurosci. Rural. Pract. 2016; 7(3): 440– 442. DOI: 10.4103/0976-3147.182767.
Nanba T., Kashimura H., Saura H., et al. Subarachnoid hemorrhage due to ruptured intracranial aneurysm following posterior reversible encephalopathy syndrome. J Neurosci. Rural. Pract. 2016; 7(3): 440– 442. DOI: 10.4103/0976-3147.182767.
52. Corrigan F., Mander K.A., Leonard A.V., et al. Neurogenic inflammation after traumatic brain injury and its potentiation of classical inflammation. J. Neuroinflammation. 2016; 13(1): 264. DOI: 10.1186/s12974-016-0738-9.
53. Karthikeyan A., Patnala R., Jadhav S.P., et al. MicroRNAs: Key players in microglia and astrocyte mediated inflammation in CNS pathologies. Curr. Med. Chem. 2016; 23(30): 3528–3546. PMID: 27528056.
54. Atangana E., Schneider U.C., Blecharz K., et al. Intravascular Inflammation Triggers Intracerebral Activated Microglia and Contributes to Secondary Brain Injury After Experimental Subarachnoid Hemorrhage (eSAH).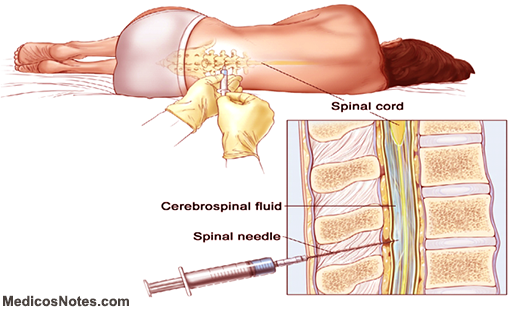 Transl Stroke Res. 2017; 8(2): 144–156. DOI: 10.1007/s12975-016-0485-3.
Transl Stroke Res. 2017; 8(2): 144–156. DOI: 10.1007/s12975-016-0485-3.
55. Sun Y.M., Wang Y.T., Jiang L., et al. The effects of deferoxamine on inhibition for microglia activation and protection of secondary nerveinjury after intracerebral hemorrhage in rats. Pak. J. Pharm. Sci. 2016; 29(3 Suppl): 1087–1093. PMID: 27383488.
56. Ross D., Rosegay H., Pons V. Differentiation of aseptic and bacterial meningitis in postoperative neurosurgical patients. J. Neurosurg. 1988; 69(5): 669–674. DOI: 10.3171/jns.1988.69.5.0669.
57. Morita A. Clinical and Laboratory Diagnosis of Central Nervous System Infections. Brain Nerve. 2015; 67(7): 777–785. DOI: 10.11477/mf.1416200218.
58. Nwachuku E. L., Puccio A.M., Adeboye A., et al. Time course of cerebrospinal fluid inflammatory biomarkers and relationship to 6-month neurologic outcome in adult severe traumatic brain injury. Clin. Neurol. Neurosurg. 2016; 149: 1–5. DOI: 10.1016/j.clineuro.2016.06.009.
L., Puccio A.M., Adeboye A., et al. Time course of cerebrospinal fluid inflammatory biomarkers and relationship to 6-month neurologic outcome in adult severe traumatic brain injury. Clin. Neurol. Neurosurg. 2016; 149: 1–5. DOI: 10.1016/j.clineuro.2016.06.009.
59. Giulieri S., Chapuis-Taillard C., Jaton K., et al. CSF lactate for accurate diagnosis of community-acquired bacterial meningitis. Eur. J. Clin. Microbiol. Infect. Dis. 2015; 34(10): 2049–2055. DOI: 10.1007/s10096-015-2450-6.
60. Xiao X., Zhang Y., Zhang L., et al. The diagnostic value of cerebrospinal fluid lactate for post-neurosurgical bacterial meningitis: a metaanalysis. BMC Infect. Dis. 2016; 16: 483. DOI: 10.1186/s12879-016-1818-2.
Клинический случай хирургического лечения квадригеминального арахноидального дивертикула у собаки
Автор: Албул А. В., ветеринарный врач-невролог Ветеринарной клиники доктора Сотникова (ВКНТИТ), г. Санкт-Петербург.
В., ветеринарный врач-невролог Ветеринарной клиники доктора Сотникова (ВКНТИТ), г. Санкт-Петербург.
Интракраниальный арахноидальный дивертикул (ИАД) – это врожденная или приобретенная патология, при которой спинномозговая жидкость (СМЖ) накапливается внутри полости, образованной расщеплением паутинной оболочки головного мозга. В большинстве случаев у собак ИАД встречается в области цистерны четверохолмия и сопровождается каудовентральным смещением мозжечка, но может также располагаться и в области четвертого желудочка. В ветеринарной литературе ИАД в основном описывается как случайная находка, и, как правило, с этой патологией не связывают какую-либо клиническую симптоматику.
Клинические признаки обычно проявляются при расположении ИАД в области 4-го желудочка. Однако, анализируя литературу по гуманной медицине, можно обнаружить данные о том, что интракраниальные арахноидальные дивертикулы могут приводить к различной симптоматике в зависимости от их размера и расположения.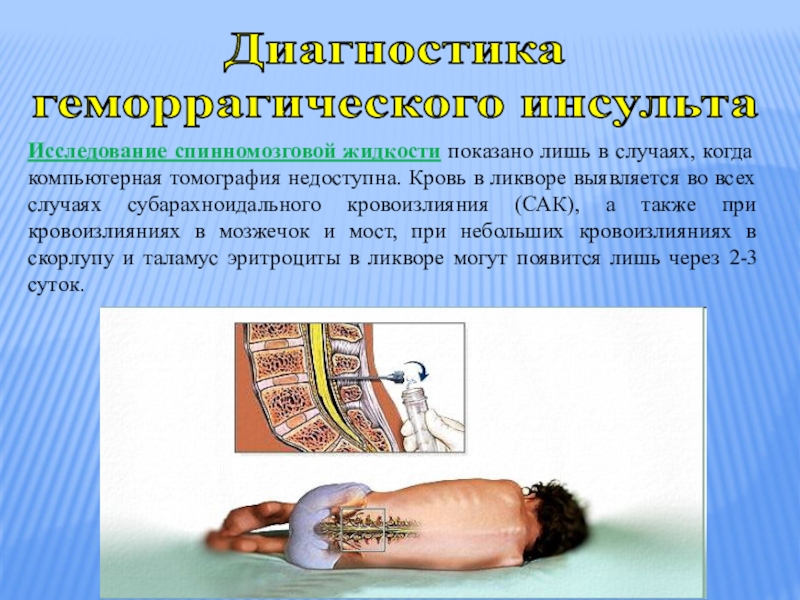 При этом выделяются следующие симптомы: головные боли (в том числе и мигренеподобные), рвота, симптомы, связанные с развитием гидроцефалии, эндокринные расстройства, судороги, симптомы поражения мозжечка и др.
При этом выделяются следующие симптомы: головные боли (в том числе и мигренеподобные), рвота, симптомы, связанные с развитием гидроцефалии, эндокринные расстройства, судороги, симптомы поражения мозжечка и др.
По мнению автора статьи, основной интерес представляет такой симптом, как головная боль, поскольку его трудно диагностировать и интерпретировать у собак. Наша гипотеза заключается в том, что ИАД может вызывать головную боль, провоцирующую изменения в поведении животного, которые проявляются, в частности, в виде низкой активности, сонливости, непереносимости нагрузок и интерпретируются владельцами как особенности характера их питомцев.
Описание клинического случая
В клинику ВКНТИТ поступила собака, причина обращения — зуд в области головы. Дерматологических проблем выявлено не было. Для исключения проблем наружного и среднего уха была проведена отоскопия, которая также не выявила отклонений. Анализы крови (клинический и биохимический) были в пределах нормы. Собака была направлена в неврологическое отделение для исключения возможных причин невропатического зуда. После проведения неврологического осмотра, не выявившего отклонений, пациенту была проведена магнитно-резонансная томография (МРТ) головы с внутривенным контрастированием, по результатам которой был установлен диагноз «квадригеминальный ИАД» (рис. 1).
Собака была направлена в неврологическое отделение для исключения возможных причин невропатического зуда. После проведения неврологического осмотра, не выявившего отклонений, пациенту была проведена магнитно-резонансная томография (МРТ) головы с внутривенным контрастированием, по результатам которой был установлен диагноз «квадригеминальный ИАД» (рис. 1).
Поскольку ИАД был единственной находкой, способной объяснить наличие зуда, было принято решение о хирургическом лечении. Пациенту была проведена операция по фенестрации ИАД. После операции зуд полностью прошел. Кроме этого, владельцами было отмечено, что собака стала намного активнее, у нее пропали ряд особенностей, которые владельцы связывали с характером животного, например сонливость (собаку приходилось будить на прогулку), периодические нарушения аппетита (владельцу приходилось уговаривать питомца поесть), нежелание играть с игрушками (собака отказывалась перетягивать пуллеры).
После операции по фенестрации ИАД животное стало намного активнее и жизнерадостнее. На основании произошедших перемен возникло предположение о том, что ИАД мог приводить не только к зуду, но и к головной боли, обусловленной, возможно, интракраниальной гипертензией либо компрессией структур головного мозга интракраниальным арахноидальным дивертикулом.
На основании произошедших перемен возникло предположение о том, что ИАД мог приводить не только к зуду, но и к головной боли, обусловленной, возможно, интракраниальной гипертензией либо компрессией структур головного мозга интракраниальным арахноидальным дивертикулом.
Видео 1. Поведения собаки до и после хирургического вмешательства.
Обзор литературных данных
Интракраниальные арахноидальные дивертикулы чаще всего являются результатом нарушения развития головного мозга, при которой спинномозговая жидкость может, как считается, накапливаться внутри полости, образовавшейся в результате расщепления мягкой и паутинной оболочек головного мозга в период эмбриогенеза. Нервная трубка в процессе своего формирования окружена рыхлым слоем мезенхимальной ткани, из которой впоследствии развиваются мягкая и паутинная оболочки мозга, при этом в норме спинномозговая жидкость выделяется хориоидным сплетением и, пульсируя, течет через слой мезенхимальной ткани. Считается, что эта пульсация приводит к разделению мозговых оболочек и формированию субарахноидального пространства, а аберрантный ток спинномозговой жидкости может являться причиной расщепления самой паутинной оболочки и способствовать формированию интракраниального арахноидальные дивертикула1-8.
Считается, что эта пульсация приводит к разделению мозговых оболочек и формированию субарахноидального пространства, а аберрантный ток спинномозговой жидкости может являться причиной расщепления самой паутинной оболочки и способствовать формированию интракраниального арахноидальные дивертикула1-8.
Образование ИАД также возможно в результате травмы, воспаления или геморрагии. Обычно в этих случаях при клиническом анализе ликвора удается обнаружить гемосидерин или воспалительные клетки1,5.
Достоверно неизвестно, каким образом спинномозговая жидкость заполняет дивертикул. Существует теория о том, что выстилка дивертикула может обладать способностью к секреции жидкости. Однако количество сторонников у данной теории уменьшается. Это связано с тем, что дивертикул не характеризуется постоянным увеличением и может длительное время не изменять свой размер7,8. Более вероятной считается теория щелевого клапана, суть которой заключается в том, что спинномозговая жидкость может течь только внутрь ИАД. Полученные благодаря МРТ данные подтверждают эту теорию, а эндоскопические исследования в гуманной медицине позволили обнаружить щелевой клапан в области устья дивертикула6-8.
Полученные благодаря МРТ данные подтверждают эту теорию, а эндоскопические исследования в гуманной медицине позволили обнаружить щелевой клапан в области устья дивертикула6-8.
Чаще всего ИАД располагаются в области цистерны четверохолмия (по этой причине их иногда называют квадригеминальными) и могут быть связаны с третьим или четвертым желудочком либо одновременно с третьим и четвертым желудочками3,6-8.
Поскольку ИАД располагаются в области задней черепной ямки, увеличение дивертикула в объеме, как правило, приводит к компрессии и деформации мозжечка и/или затылочных долей головного мозга, однако считается, что компрессия мозжечка протекает бессимптомно3,7.
Распространенность ИАД в популяции собак варьируется от 0,7 до 4%1.
Клинические признаки
Чаще всего ИАД удается обнаружить у собак карликовых и брахицефалических пород, причем заболеванию наиболее подвержены представители породы ши-тцу. Однако в литературных источниках есть упоминания о случаях выявления данной патологии у собак крупных пород, таких как стаффордширский бультерьер, лабрадор-ретривер и курцхаар1,7,8. Возраст проявления клинических симптомов может варьироваться от 2 месяцев до 10 лет7,8. Описаны очень разнообразные симптомы, связанные с наличием ИАД как у животных (собак и кошек), так и у людей, однако считается, что у собак более половины всех обнаруженных ИАД являются случайной находкой7. У людей выраженность неврологических симптомов обычно четко коррелирует с размером, анатомическим расположением ИАД и опосредованным им нарушением нормального тока СМЖ5.
Возраст проявления клинических симптомов может варьироваться от 2 месяцев до 10 лет7,8. Описаны очень разнообразные симптомы, связанные с наличием ИАД как у животных (собак и кошек), так и у людей, однако считается, что у собак более половины всех обнаруженных ИАД являются случайной находкой7. У людей выраженность неврологических симптомов обычно четко коррелирует с размером, анатомическим расположением ИАД и опосредованным им нарушением нормального тока СМЖ5.
В большинстве случаев у собак с ИАД связывают возникновение фокальных или генерализованных приступов, судорог, признаков дисфункции мозжечка и/или вестибулярной системы. Кроме того, описаны такие нарушения, как боль в области шеи, парез, нарушение уровня сознания, парез лицевого нерва 1,2,7,8. Вероятно, клинические признаки напрямую связаны со степенью компрессии нервной ткани ИАД, так, например, компрессия затылочных долей более чем на 14% приводит к проявлению клинических признаков, однако степень компрессии мозжечка не коррелирует с клиническими проявлениями7. Эпилептические приступы и мигренеподобные головные боли – наиболее частые из описанных в литературе симптомы ИАД у людей5,7. Также у людей ИАД может быть причиной нарушения оттока ликвора через водопровод среднего мозга и, как следствие, приводить к развитию гидроцефалии, что, в свою очередь, может являться причиной судорог, умственной отсталости и головных болей5,7. Некоторые исследователи считают, что предрасположенность к вентрикуломегалии у представителей некоторых пород собак может сочетаться с предрасположенностью к формированию ИАД, тем самым предполагая наличие сходных причин в возникновении этих двух патологий7.
Эпилептические приступы и мигренеподобные головные боли – наиболее частые из описанных в литературе симптомы ИАД у людей5,7. Также у людей ИАД может быть причиной нарушения оттока ликвора через водопровод среднего мозга и, как следствие, приводить к развитию гидроцефалии, что, в свою очередь, может являться причиной судорог, умственной отсталости и головных болей5,7. Некоторые исследователи считают, что предрасположенность к вентрикуломегалии у представителей некоторых пород собак может сочетаться с предрасположенностью к формированию ИАД, тем самым предполагая наличие сходных причин в возникновении этих двух патологий7.
Диагностика
Чаще всего ИАД диагностируют с помощью КТ или МРТ, однако возможно визуализировать дивертикул при помощи УЗИ через затылочное отверстие или персистирующие роднички (особенно у молодых собак)1-3,5,7,8. При проведении визуальной диагностики ИАД обычно обнаруживают в области четверохолмия, где он занимает экстрааксиальное положение./031/031.jpg) Жидкость в ИАД по своим характеристикам соответствует спинномозговой жидкости, накопление контраста оболочками дивертикула отсутствует1,2,5,7,8. При проведении МРТ жидкость в дивертикуле является гиперинтенсивной на Т2-ВИ, гипоинтенсивной на Т1- и FLAIR-ВИ2,5,7,8. У некоторых животных описано кровоизлияние в ИАД, которое при проведении МРТ может выглядеть смешанным или гиперинтенсивным на Т1-ВИ, изо- или гипоинтенсивным на Т2-ВИ и гиперинтенсивным на FLAIR. Диагностика кровоизлияния в ИАД может быть затруднена на КТ, поскольку жидкость в дивертикуле обладает сходным сигналом с паренхимой головного мозга 7.
Жидкость в ИАД по своим характеристикам соответствует спинномозговой жидкости, накопление контраста оболочками дивертикула отсутствует1,2,5,7,8. При проведении МРТ жидкость в дивертикуле является гиперинтенсивной на Т2-ВИ, гипоинтенсивной на Т1- и FLAIR-ВИ2,5,7,8. У некоторых животных описано кровоизлияние в ИАД, которое при проведении МРТ может выглядеть смешанным или гиперинтенсивным на Т1-ВИ, изо- или гипоинтенсивным на Т2-ВИ и гиперинтенсивным на FLAIR. Диагностика кровоизлияния в ИАД может быть затруднена на КТ, поскольку жидкость в дивертикуле обладает сходным сигналом с паренхимой головного мозга 7.
Лечение
В связи с тем что ИАД часто представляет собой случайную находку как у собак, так и у людей, необходимо удостовериться, что наблюдаемые клинические проявления не являются следствием иной патологии2,8.
Медикаментозное лечение может включать использование противосудорожных препаратов и/или кортикостероидов.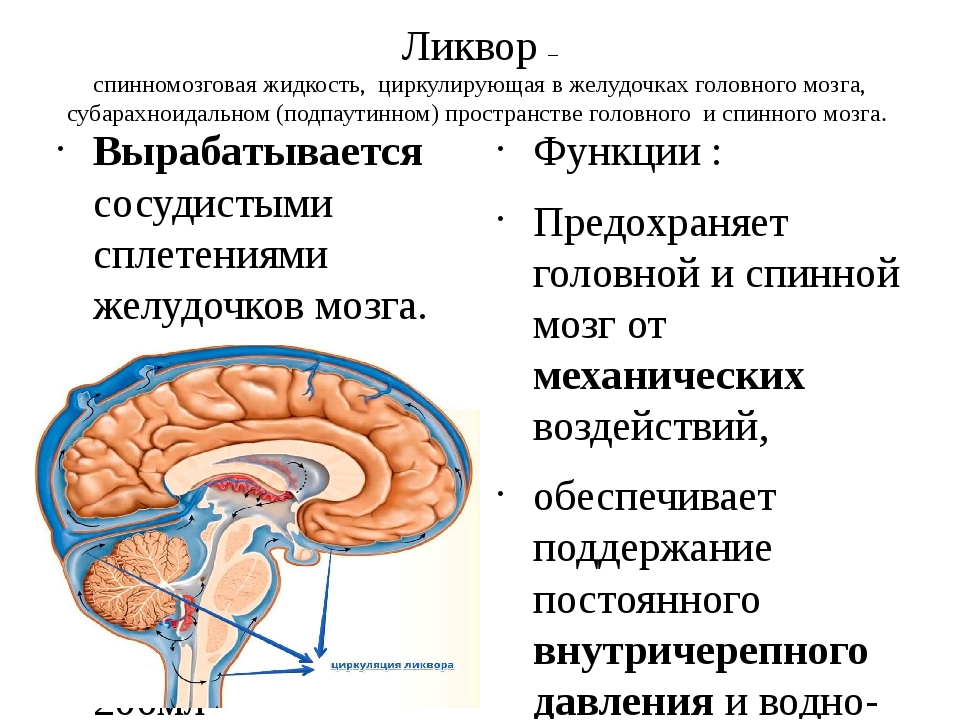 Описано также использование блокаторов протонной помпы, однако их эффективность в последнее время ставится под сомнение 8.
Описано также использование блокаторов протонной помпы, однако их эффективность в последнее время ставится под сомнение 8.
В гуманной медицине для хирургического лечения ИАД используют две техники: фенестрацию дивертикула и цистоперитонеальное шунтирование. Эти же техники описаны и для использования у собак2,5,7,8.
Выводы
На основании данных рассмотренного клинического случая можно предположить, что головная боль может быть недооцененным клиническим признаком у животных с ИАД. В ветеринарной литературе чаще всего говорится о том, что ИАД является случайной находкой или в редких случаях может приводить к параличу лицевого нерва, агрессии, судорогам и боли в области шеи. При этом в медицинской литературе упоминается о том, что одним из основных симптомов ИАД является головная боль. На сегодняшний день диагностика головной боли у собак основывается только на косвенных предположениях, базирующихся на необычном поведении животных. Однако, возможно, проявления некоторых специфических форм поведения, таких как страх у собак карликовых пород перед другими собаками, излишняя агрессия, апатия, могут являться признаками головной боли, которая, в свою очередь, может быть вызвана ИАД.
Список литературы:
- Alves L. S. et al. A retrospective study of quadrigeminal arachnoid cysts diagnosed by Magnetic Resonance Imaging and Computed Tomography in 26 dogs // Pesquisa Veterinária Brasileira. – 2018. – Т. 38. – № 2. – С. 300–308.
- Dewey C. W. et al. Intracranial arachnoid cysts in dogs // Compend Contin Educ Vet. – 2009. – Т. 31. – № 4. – С. 160–168.
- Bazelle J. et al. MRI characteristics of fourth ventricle arachnoid diverticula in five dogs // Veterinary Radiology & Ultrasound. – 2015. – Т. 56. – № 2. – С. 196–203.
- Benedicenti L., Galban E. M. What Is Your Neurologic Diagnosis? // Journal of the American Veterinary Medical Association. – 2015. – Т. 247. – № 11. – С. 1241–1243.
- Cincu R., Agrawal A., Eiras J. Intracranial arachnoid cysts: current concepts and treatment alternatives // Clinical neurology and neurosurgery. – 2007. – Т. 109. – № 10. – С. 837–843.
- Dewey C.
 W. et al. Craniotomy with cystoperitoneal shunting for treatment of intracranial arachnoid cysts in dogs // Veterinary Surgery. – 2007. – Т. 36. – № 5. – С. 416–422.
W. et al. Craniotomy with cystoperitoneal shunting for treatment of intracranial arachnoid cysts in dogs // Veterinary Surgery. – 2007. – Т. 36. – № 5. – С. 416–422. - Platt S., Hicks J., Matiasek L. Intracranial intra-arachnoid diverticula and cyst-like abnormalities of the brain // Veterinary Clinics: Small Animal Practice. – 2016. – Т. 46. – № 2. – С. 253–263.
- Tobias K. M., Johnston S. A. Veterinary surgery: small animal. – 2012. – №. V700 TOBv.
Статическое магнитное поле (SMF) как регулятор судьбы стволовых клеток — новые перспективы в регенеративной медицине, возникающие из недооцененного инструмента
Marycz, K., Mierzejewska, K., mieszek, A., Suszynska, E., Малика И. и др. (2016). Упражнения на выносливость мобилизуют стволовые клетки на ранних стадиях развития в периферическую кровь и увеличивают их количество в костном мозге: последствия для регенерации тканей. Международные стволовые клетки . Исследовательская статья. https://doi.org/10.1155/2016/5756901.
Международные стволовые клетки . Исследовательская статья. https://doi.org/10.1155/2016/5756901.
Артикул
Google ученый
Marędziak, M., mieszek, A., Chrząstek, K., Basinska, K., & Marycz, K. (2015). Физическая активность увеличивает общее количество мезенхимальных стволовых клеток костного мозга, усиливает их остеогенный потенциал и подавляет их адипогенные свойства. Stem Cells International. Исследовательская статья. https://doi.org/10.1155/2015/379093.
Артикул
Google ученый
Suszynska, M., Poniewierska-Baran, A., Gunjal, P., Ratajczak, J., Marycz, K., Kakar, S. S., et al. (2014). Экспрессия рецептора эритропоэтина клетками, происходящими от зародышевой линии, — еще одно подтверждение потенциальной связи между зародышевой линией и кроветворением. Journal of Ovarian Research, 7 , 66. https://doi.org/10.1186/1757-2215-7-66.
Journal of Ovarian Research, 7 , 66. https://doi.org/10.1186/1757-2215-7-66.
CAS
Статья
PubMed
PubMed Central
Google ученый
Марич, К., Жмешек, А., Елень, М., Хшестек, К., Гжесяк, Дж., И Мейснер, Дж. (2015). Влияние биоактивных сфинголипидов S1P и C1P на мультипотентные стромальные клетки — новые возможности в регенеративной медицине. Письма о клеточной и молекулярной биологии, 20 (3), 510–533. https://doi.org/10.1515/cmble-2015-0029.
CAS
Статья
Google ученый
Корницка К., Марыч К., Томашевский К.А., Marędziak, M., & mieszek, A. (2015). Влияние возраста на остеогенный и адипогенный потенциал дифференцировки стромальных стволовых клеток человека (hASC), полученных из жировой ткани, и влияние стрессовых факторов в процессе дифференцировки. Окислительная медицина и долголетие клеток, 2015 (309169). https://doi.org/10.1155/2015/309169.
Окислительная медицина и долголетие клеток, 2015 (309169). https://doi.org/10.1155/2015/309169.
Артикул
Google ученый
Корницка, К., Марыч, К., Марандзяк, М., Томашевский, К. А., и Никпонь, Дж. (2017). Влияние ингибитора ДНК-метилтранфсеразы 5-азацитидина на старение, окислительный стресс и метилирование ДНК стволовых клеток, полученных из жировой ткани. Журнал клеточной и молекулярной медицины, 21 (2), 387–401. https://doi.org/10.1111/jcmm.12972.
CAS
Статья
PubMed
Google ученый
Рахнама, М., Тушинский, Дж. А., Боккон, И., Цифра, М., Сардар, П., и Салари, В.(2011). Эмиссия митохондриальных биофотонов и их влияние на электрическую активность мембраны через микротрубочки. Журнал интегративной неврологии, 10 (1), 65–88. https://doi.org/10.1142/S0219635211002622.
Журнал интегративной неврологии, 10 (1), 65–88. https://doi.org/10.1142/S0219635211002622.
Артикул
PubMed
Google ученый
Левин М. (2003). Биоэлектромагнетизм в морфогенезе. Биоэлектромагнетизм, 24 (5), 295–315. https://doi.org/10.1002/bem.10104.
Артикул
PubMed
Google ученый
Каплан А. И. (1991). Мезенхимальные стволовые клетки. Журнал ортопедических исследований: официальная публикация Общества ортопедических исследований, 9 (5), 641–650. https://doi.org/10.1002/jor.11000
.
CAS
Статья
Google ученый

Cislo-Pakuluk, A., & Marycz, K. (2017). Многообещающий инструмент регенерации сетчатки: современные перспективы и проблемы при использовании мезенхимальных стволовых клеток-предшественников в ветеринарии и офтальмологии человека. Stem Cell Reviews, 13 (5), 598–602. https://doi.org/10.1007/s12015-017-9750-4.
Артикул
PubMed
PubMed Central
Google ученый
Гадери А., и Абтахи С. (2018). Мезенхимальные стволовые клетки: чудесные целители или дремлющие убийцы? Stem Cell Reviews and Reports, 14 (5), 722–733. https://doi.org/10.1007/s12015-018-9824-y.
CAS
Статья
PubMed
Google ученый
Хильшер, Д., Кэбиш, К., Браун, Б. Дж. В., Грей, К., и Тобиаш, Э. (2018). Источники стволовых клеток и трансплантат для тканевой инженерии сосудов. Обзоры и отчеты стволовых клеток, 14 (5), 642–667. https://doi.org/10.1007/s12015-018-9825-x.
(2018). Источники стволовых клеток и трансплантат для тканевой инженерии сосудов. Обзоры и отчеты стволовых клеток, 14 (5), 642–667. https://doi.org/10.1007/s12015-018-9825-x.
CAS
Статья
PubMed
Google ученый
Бауреус Кох, К. Л. М., Соммарин, М., Перссон, Б. Р. Р., Салфорд, Л. Г., и Эберхард, Дж. Л. (2003). Взаимодействие слабых низкочастотных магнитных полей с клеточными мембранами. Биоэлектромагнетизм, 24 (6), 395–402. https://doi.org/10.1002/bem.10136.
Артикул
PubMed
Google ученый
Янь, Дж., Донг, Л., Чжан, Б., и Ци, Н. (2010). Влияние сверхнизкочастотного магнитного поля на рост и дифференцировку мезенхимальных стволовых клеток человека.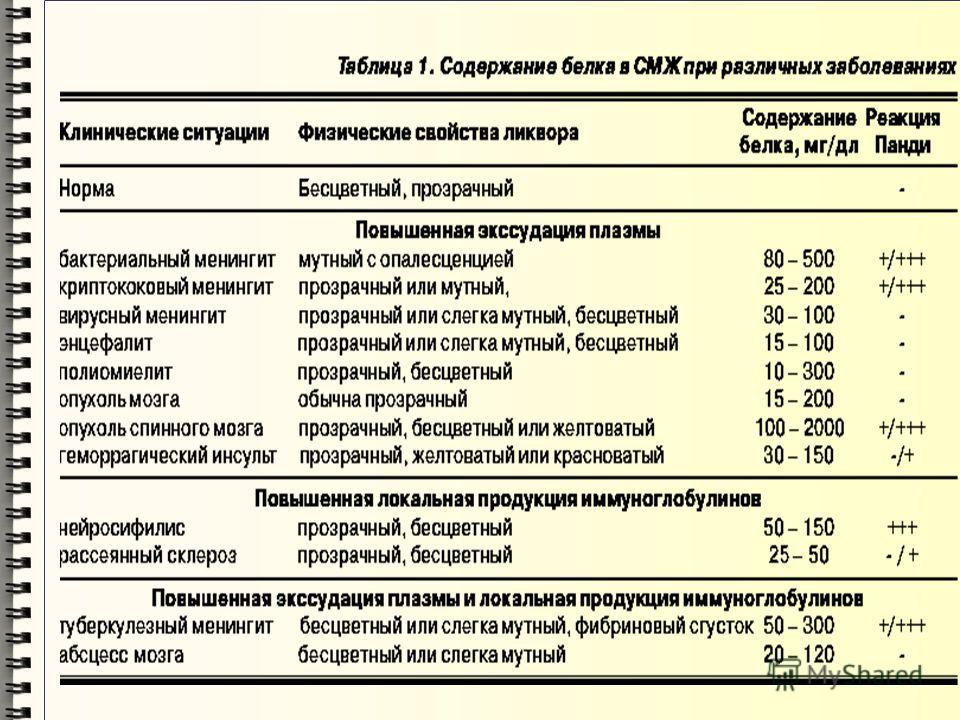 Электромагнитная биология и медицина, 29 (4), 165–176. https://doi.org/10.3109/01676830.2010.505490.
Электромагнитная биология и медицина, 29 (4), 165–176. https://doi.org/10.3109/01676830.2010.505490.
CAS
Статья
PubMed
Google ученый
Теодори, Л., Альбертини, М. К., Угуччони, Ф., Фальсьери, Э., Рокки, М. Б. Л., Баттистелли, М., и др. (2006). Статические магнитные поля влияют на размер, форму, ориентацию и поверхность мембран клеток глиобластомы человека, что продемонстрировано с помощью электронной, оптической и атомно-силовой микроскопии. Цитометрия . Часть A: Журнал Международного общества аналитической цитологии, 69 (2), 75–85. https://doi.org/10.1002/cyto.a.20208.
Артикул
Google ученый
Marędziak, M., mieszek, A., Tomaszewski, K. A. , Lewandowski, D., & Marycz, K. (2016). Влияние слабого статического магнитного поля на остеогенный и адипогенный потенциал дифференцировки стромальных / стволовых клеток жировой ткани человека. Журнал магнетизма и магнитных материалов, 398 , 235–245. https://doi.org/10.1016/j.jmmm.2015.09.004.
, Lewandowski, D., & Marycz, K. (2016). Влияние слабого статического магнитного поля на остеогенный и адипогенный потенциал дифференцировки стромальных / стволовых клеток жировой ткани человека. Журнал магнетизма и магнитных материалов, 398 , 235–245. https://doi.org/10.1016/j.jmmm.2015.09.004.
CAS
Статья
Google ученый
Ли, Ю., Сун, Л.-К., Чен, М.К., Чжан, Ю.-M., Li, J., Feng, X.-Y., et al. (2012). Статическое магнитное поле низкой силы подавляет пролиферацию, миграцию и адгезию гладкомышечных клеток сосудов человека в модели рестеноза через посредство интегринов β1-FAK, сигнальный путь Ca2 +. Анналы биомедицинской инженерии, 40 (12), 2611–2618. https://doi.org/10.1007/s10439-012-0602-8.
Артикул
PubMed
Google ученый
Марендзяк М., Томашевский К., Полинчеуш, П., Левандовски, Д., и Марич, К. (2017). Статическое магнитное поле увеличивает жизнеспособность и скорость пролиферации мезенхимальных стволовых клеток жировой ткани потенциально за счет активации пути фосфоинозитид-3-киназа / Akt (PI3K / Akt). Электромагнитная биология и медицина, 36 (1), 45–54. https://doi.org/10.3109/15368378.2016.1149860.
CAS
Статья
PubMed
Google ученый
Галковски Д., Ратайчак М. З., Коцки Дж. И Дарзинкевич З. (2017). Цитометрии, стволовых клеток и фонтана молодости. Stem Cell Reviews and Reports, 13 (4), 465–481. https://doi.org/10.1007/s12015-017-9733-5.
Артикул
PubMed
Google ученый
Наджар, М., Кромпот, Э., ван Грюнсвен, Л. А., Долле, Л., и Лагно, Л. (2018). Активность альдегиддегидрогеназы в жировой ткани: выделение и профиль экспрессии генов отдельной субпопуляции мезенхимальных стромальных клеток. Stem Cell Reviews and Reports, 14 (4), 599–611. https://doi.org/10.1007/s12015-017-9777-6.
CAS
Статья
PubMed
Google ученый
Менс, М. М. Дж., И Ганбари, М. (2018). Регуляция клеточного цикла стволовых клеток с помощью микроРНК. Обзоры стволовых клеток и отчеты, 14 (3), 309–322. https://doi.org/10.1007/s12015-018-9808-y.
CAS
Статья
PubMed
Google ученый
Лью, В.-З., Хуанг, Ю.-К., Хуанг, К.-Й. , Лин, К.-Т., Цай, М.-Т., и Хуанг, Х.-М. (нет данных). Статические магнитные поля усиливают пролиферацию стволовых клеток пульпы зуба, активируя путь митоген-активируемой протеинкиназы p38 в качестве его предполагаемого механизма. Журнал тканевой инженерии и регенеративной медицины, 12 (1), 19–29. https://doi.org/10.1002/term.2333.
, Лин, К.-Т., Цай, М.-Т., и Хуанг, Х.-М. (нет данных). Статические магнитные поля усиливают пролиферацию стволовых клеток пульпы зуба, активируя путь митоген-активируемой протеинкиназы p38 в качестве его предполагаемого механизма. Журнал тканевой инженерии и регенеративной медицины, 12 (1), 19–29. https://doi.org/10.1002/term.2333.
Артикул
Google ученый
Yu, J. S. L., & Cui, W.(2016). Пролиферация, выживаемость и метаболизм: роль передачи сигналов PI3K / AKT / mTOR в плюрипотентности и определении судьбы клеток. Развитие, 143 (17), 3050–3060. https://doi.org/10.1242/dev.137075.
CAS
Статья
PubMed
Google ученый
Ангульски, А. Б., Каприглионе, Л. Г., Батиста, М., Маркон, Б. Х., Сенегалья, А. К., Стимамиглио, М. А., и Корреа, А. (2017). Содержание белка во внеклеточных везикулах, происходящих из CD133 + , полученных из расширенной пуповинной крови человека, и мезенхимальных стволовых клеток человека, полученных из костного мозга, частично объясняет, почему оба источника являются выгодными для регенеративной медицины. Stem Cell Reviews and Reports, 13 (2), 244–257. https://doi.org/10.1007/s12015-016-9715-z.
Г., Батиста, М., Маркон, Б. Х., Сенегалья, А. К., Стимамиглио, М. А., и Корреа, А. (2017). Содержание белка во внеклеточных везикулах, происходящих из CD133 + , полученных из расширенной пуповинной крови человека, и мезенхимальных стволовых клеток человека, полученных из костного мозга, частично объясняет, почему оба источника являются выгодными для регенеративной медицины. Stem Cell Reviews and Reports, 13 (2), 244–257. https://doi.org/10.1007/s12015-016-9715-z.
CAS
Статья
PubMed
Google ученый
Коллино, Ф., Поматто, М., Бруно, С., Линдосо, Р. С., Таппаро, М., Сиченг, В. и др. (2017). Фракции, обогащенные экзосомами и микровезикулами, выделенные из мезенхимальных стволовых клеток с помощью градиентного разделения, показали разные молекулярные сигнатуры и функции на эпителиальных клетках почечных канальцев.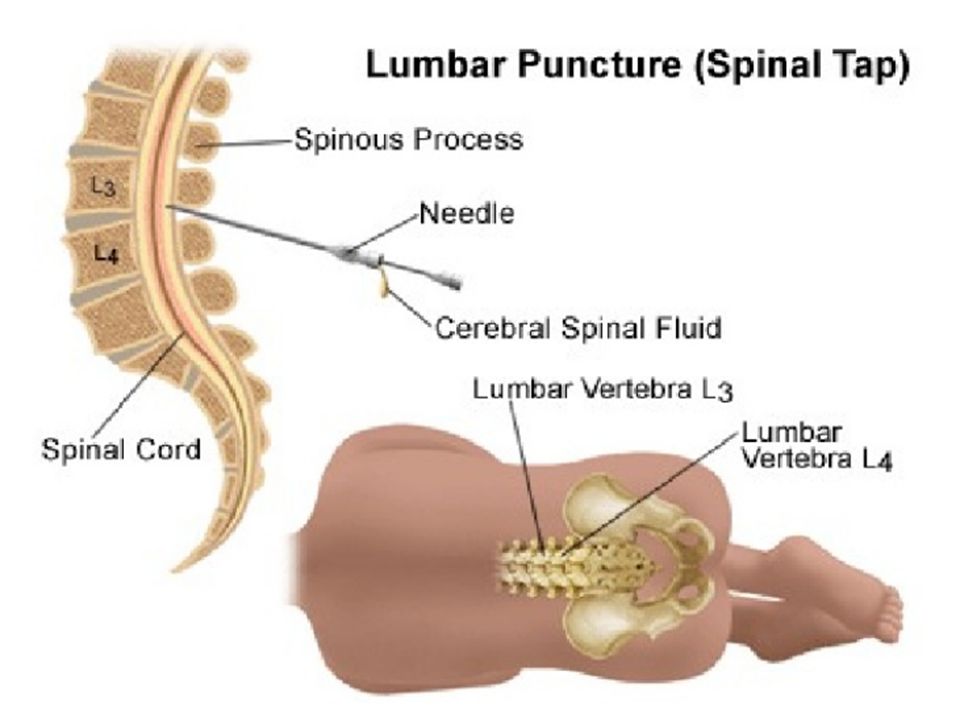 Обзоры стволовых клеток и отчеты, 13 (2), 226–243. https://doi.org/10.1007/s12015-016-9713-1.
Обзоры стволовых клеток и отчеты, 13 (2), 226–243. https://doi.org/10.1007/s12015-016-9713-1.
CAS
Статья
PubMed
Google ученый
Marędziak, M., Marycz, K., Lewandowski, D., Siudzińska, A., & mieszek, A. (2015). Статическое магнитное поле усиливает синтез и секрецию микровезикул (MV), полученных из мембран, богатых VEGF и BMP-2, в стромальных клетках, полученных из жировой ткани лошадей (EqASC) — новый подход в ветеринарной регенеративной медицине. Клеточная биология и биология развития in vitro. Животное, 51 (3), 230–240. https://doi.org/10.1007/s11626-014-9828-0.
CAS
Статья
Google ученый
Марендзяк, М., Марыч, К., Смишек, А., Левандовски, Д.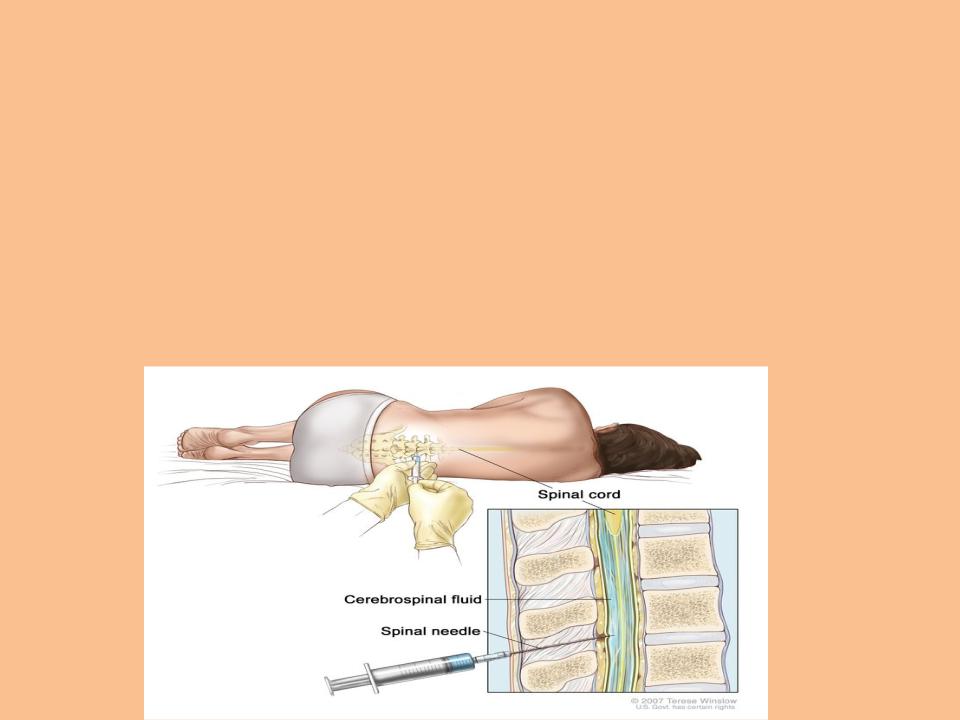 , & Токер, Н. Ю. (2014). Влияние статических магнитных полей на мезенхимальные стволовые клетки собак и лошадей, полученные из жировой ткани. Клеточная биология и биология развития in vitro — животные, 50 (6), 562–571.https://doi.org/10.1007/s11626-013-9730-1.
, & Токер, Н. Ю. (2014). Влияние статических магнитных полей на мезенхимальные стволовые клетки собак и лошадей, полученные из жировой ткани. Клеточная биология и биология развития in vitro — животные, 50 (6), 562–571.https://doi.org/10.1007/s11626-013-9730-1.
Артикул
Google ученый
Стрэттон, Д., Ланге, С., Инал, Дж. М. (2013). Импульсные сверхнизкочастотные магнитные поля стимулируют высвобождение микровезикул из клеток моноцитарного лейкоза человека. Сообщения о биохимических и биофизических исследованиях, 430 (2), 470–475. https://doi.org/10.1016/j.bbrc.2012.12.012.
CAS
Статья
PubMed
Google ученый
Mayer-Wagner, S., Passberger, A., Sievers, B. , Aigner, J., Summer, B., Schiergens, T. S., et al. (2011). Влияние низкочастотных электромагнитных полей на хондрогенную дифференцировку мезенхимальных стволовых клеток человека. Bioelectromagnetics, 32 (4), 283–290. https://doi.org/10.1002/bem.20633.
, Aigner, J., Summer, B., Schiergens, T. S., et al. (2011). Влияние низкочастотных электромагнитных полей на хондрогенную дифференцировку мезенхимальных стволовых клеток человека. Bioelectromagnetics, 32 (4), 283–290. https://doi.org/10.1002/bem.20633.
CAS
Статья
PubMed
Google ученый
Kasten, A., Müller, P., Bulnheim, U., Groll, J., Bruellhoff, K., Бек, У. и др. (2010). Механический стресс интегрина и магнитные силы вызывают биологические реакции в мезенхимальных стволовых клетках, которые зависят от факторов окружающей среды. Журнал клеточной биохимии, 111 (6), 1586–1597. https://doi.org/10.1002/jcb.22890.
CAS
Статья
PubMed
Google ученый
Матье П. С., Лобоа Э. Г. (2012). Цитоскелетная и фокальная адгезия влияет на форму мезенхимальных стволовых клеток, механические свойства и дифференцировку по остеогенным, адипогенным и хондрогенным путям. Тканевая инженерия. Часть B, Обзоры, 18 (6), 436–444. https://doi.org/10.1089/ten.TEB.2012.0014.
CAS
Статья
PubMed
PubMed Central
Google ученый
Марков, М. С. (2007). Расширение использования терапии импульсным электромагнитным полем. Электромагнитная биология и медицина, 26 (3), 257–274. https://doi.org/10.1080/15368370701580806.
Артикул
PubMed
Google ученый
Zwolińska, J., Gąsior, M., nieżek, E., & Kwolek, A. (2016). Использование магнитных полей в лечении больных ревматоидным артритом. Обзор литературы. Reumatologia, 54 (4), 201–206. https://doi.org/10.5114/reum.2016.62475.
Артикул
PubMed
PubMed Central
Google ученый
«Магнитотерапия — натуральная терапия wspomożona osiągnięciami technologii. Wprowadzenie do magetoterapii »Мариуш Послушный.(нет данных). Получено 11 июля 2018 г. из https://w.bibliotece.pl/3407201/Magnetoterapia+-+terapia+naturalna+wspomo%C5%BCona+osi%C4%85gni%C4%99ciami+technologii.+Wprowadzenie+do.
Румбаут Р. Э. и Миркович Д. (2008). Магнитотерапия отека при воспалении: физиологическая оценка. Американский журнал физиологии сердца и физиологии кровообращения, 294 (1), h29 – h30. https://doi.org/10.1152/ajpheart.01342.2007.
CAS
Статья
PubMed
Google ученый
Гмитров Дж., Окубо К. и Окано Х. (2002). Влияние статического магнитного поля 0,25 Тл на микроциркуляцию у кроликов. Биоэлектромагнетика, 23 (3), 224–229.
Артикул
Google ученый
Сюй, С., Окано, Х., & Окубо, К. (2001). Острые эффекты воздействия статических магнитных полей и электромагнитных полей частотой 50 Гц на все тело на микроциркуляцию мышц у мышей, находящихся под наркозом. Bioelectrochemistry (Амстердам, Нидерланды), 53 (1), 127–135.
CAS
Статья
Google ученый
Вергалло, К., Дини, Л., Самошвёльдьи, З., Тенуццо, Б. А., Карата, Э., Панзарини, Э., и Ласло, Дж. Ф. (2013). Анализ in vitro противовоспалительного действия неоднородного статического магнитного поля на макрофаги и лимфоциты человека. PLoS One, 8 (8), e72374. https://doi.org/10.1371/journal.pone.0072374.
CAS
Статья
PubMed
PubMed Central
Google ученый
Мэн, Дж., Сяо, Б., Чжан, Ю., Лю, Дж., Сюэ, Х., Лэй, Дж.,… Сюй, Х. (2013). Суперпарамагнитные чувствительные нановолоконные каркасы в статическом магнитном поле усиливают остеогенез для восстановления костей in vivo. Научные отчеты, 3, 2655. doi: https: //doi.org/10.1038/srep02655.
Dini, L., & Abbro, L. (2005). Биоэффекты статических магнитных полей умеренной интенсивности на клеточные культуры. микрон (Оксфорд, Англия : 1993 ) , 36 (3), 195–217.DOI: https: //doi.org/10.1016/j.micron.2004.12.009.
Артикул
Google ученый
Окано, Х., Онмори, Р., Томита, Н., и Икада, Ю. (2006). Влияние статического магнитного поля умеренной интенсивности на VEGF-A стимулировало образование эндотелиальных капиллярных канальцев in vitro. Биоэлектромагнетизм, 27 (8), 628–640. https://doi.org/10.1002/bem.20246.
CAS
Статья
PubMed
Google ученый
Джабери, Ф. М., Кештгар, С., Тавакколи, А., Пишва, Э., Герамизаде, Б., Таниде, Н., и Джабери, М. М. (2011). Статическое магнитное поле умеренной интенсивности улучшает восстановление повреждений хряща у кроликов. Архив медицинских исследований, 42 (4), 268–273. https://doi.org/10.1016/j.arcmed.2011.06.004.
Артикул
PubMed
Google ученый
Сайфзаде, С., Хоббенаги, Р., Шокухи Сабет Джалали, Ф., и Кабири, Б.(2007). Влияние статического магнитного поля на заживление костей у собак: рентгенографические и гистопатологические исследования. Иранский журнал ветеринарных исследований, Ширазский университет, 8 (1), 8–15.
Google ученый
Cieślińska-wider, J. (2014). Przegląd metod fizykoterapeutycznych stosowanych w reumatoidalnym zapaleniu stawów, 64–69.
Сюй, С., Томита, Н., Икеучи, К., и Икада, Ю. (2007).Восстановление мелких кровеносных сосудов в ишемизированной кости под действием статического магнитного поля. Доказательная дополнительная и альтернативная медицина, 4 (1), 59–63. https://doi.org/10.1093/ecam/nel055.
Артикул
PubMed
Google ученый
Ян, К. К., Томита, Н., Икада, Ю. (1998). Влияние статического магнитного поля на формирование костей бедренных костей крыс. Медицинская инженерия и физика, 20 (6), 397–402.
CAS
Статья
Google ученый
Моррис К. Э. и Скалак Т. К. (2008). Острое воздействие статического магнитного поля умеренной силы снижает образование отеков у крыс. Американский журнал физиологии. Сердце и физиология кровообращения, 294 (1), H50 – H57. https://doi.org/10.1152/ajpheart.00529.2007.
CAS
Статья
PubMed
Google ученый
Котани, Х., Кавагути, Х., Шимоака, Т., Ивасака, М., Уэно, С., Одзава, Х., и др. (2002). Сильное статическое магнитное поле стимулирует формирование костей определенной ориентации in vitro и in vivo. Журнал исследований костей и минералов: Официальный журнал Американского общества исследований костей и минералов, 17 (10), 1814–1821. https://doi.org/10.1359/jbmr.2002.17.10.1814.
Артикул
Google ученый
Шривастава, А.К., и Булт, Дж. У. М. (2014). Наблюдение за работой стволовых клеток in vivo. Обзоры стволовых клеток и отчеты, 10 (1), 127–144. https://doi.org/10.1007/s12015-013-9468-x.
Артикул
PubMed
Google ученый
Мишра, С. К., Хушу, С., Сингх, А. К., и Гангенахалли, Г. (2018). Направление и отслеживание мезенхимальных стволовых клеток, меченных оксидом железа, после инфузии у мышей с черепно-мозговой травмой: продольное исследование МРТ in vivo. Обзоры стволовых клеток и отчеты. https://doi.org/10.1007/s12015-018-9828-7.
Янь, Л., Хань, Й., Хэ, Й., Се, Х., Лю, Дж., Чжао, Л. и др. (2007). Методы отслеживания клеток при трансплантации стволовых клеток. Stem Cell Reviews, 3 (4), 265–269. https://doi.org/10.1007/s12015-007-9004-y.
Артикул
PubMed
Google ученый
Эль-Буббу, К. (2018). Магнитные наночастицы оксида железа в качестве носителей лекарств: получение, конъюгация и доставка. Nanomedicine (Лондон, Англия), 13 (8), 929–952. https://doi.org/10.2217/nnm-2017-0320.
CAS
Статья
Google ученый
Ван П. К. и Шань Л. (2012). Основные элементы, которые следует учитывать при исследованиях МРТ-отслеживания клеток с маркировочными агентами на основе оксида железа. Журнал фундаментальной и клинической медицины, 1 (1), 1–6.
Артикул
Google ученый
Au, K.-W., Liao, S.-Y., Lee, Y.-K., Lai, W.-H., Ng, K.-M., Chan, Y.-C., et al. (2009). Влияние наночастиц оксида железа на сердечную дифференцировку эмбриональных стволовых клеток. Сообщения о биохимических и биофизических исследованиях, 379 (4), 898–903. https://doi.org/10.1016/j.bbrc.2008.12.160.
CAS
Статья
PubMed
Google ученый
Юн, В. С., Чой, Дж. С., Джу, Х. М., Ким, М. Х., Чой, С. Дж., О, Э.S., et al. (2018). Улучшенная техника самонаведения мезенхимальных стволовых клеток с использованием наночастиц оксида железа за счет магнитного притяжения на моделях мышей с обонятельной травмой. Международный журнал молекулярных наук, 19 (5), 1376. https://doi.org/10.3390/ijms1
76.
Артикул
PubMed Central
Google ученый
Хуан Ю., Мао К., Чжан Б. и Чжао Ю. (2017). Суперпарамагнитные наночастицы оксида железа, конъюгированные с фолиевой кислотой для двойной целевой доставки лекарств и МРТ в тераностике рака. Материаловедение и инженерия: C, 70 , 763–771. https://doi.org/10.1016/j.msec.2016.09.052.
CAS
Статья
Google ученый
Али, AAA, Hsu, F.-T., Hsieh, C.-L., Shiau, C.-Y., Chiang, C.-H., Wei, Z.-H., и другие. (2016). Конъюгированные с эрлотинибом наночастицы оксида железа как интеллектуальный тераностический зонд, нацеленный на рак, для МРТ. Scientific Reports, 6 , 36650. https://doi.org/10.1038/srep36650.
CAS
Статья
PubMed
PubMed Central
Google ученый
Leder, A., Raschzok, N., Schmidt, C., Arabacioglu, D., Butter, A., Kolano, S., et al. (2015). Частицы, содержащие оксид железа, размером с микроны для нацеленных на микроРНК манипуляций и отслеживания трансплантированных клеток на основе МРТ. Биоматериалы, 51 , 129–137. https://doi.org/10.1016/j.biomaterials.2015.01.065.
CAS
Статья
PubMed
Google ученый
(PDF) Статическое магнитное поле (SMF) как регулятор судьбы стволовых клеток — новые перспективы в регенеративной медицине, вытекающие из недооцененного инструмента
Путь 3-киназы / Akt (PI3K / Akt).Электромагнитная биология и
Медицина, 36 (1), 45–54. https://doi.org/10.3109/15368378.2016.
1149860.
19. Галковски Д., Ратайчак М. З., Коцки Дж. И Дарзинкевич З.
(2017). Цитометрии, стволовых клеток и фонтана молодости. Стволовая клетка
Обзоры и отчеты, 13 (4), 465–481. https://doi.org/10.1007/
s12015-017-9733-5.
20. Najar, M., Crompot, E., van Grunsven, L.A., Dollé, L., &
Lagneaux, L.(2018). Активность альдегиддегидрогеназы в жировой ткани
: выделение и профиль экспрессии генов отдельной популяции мезенхимальных стромальных клеток под
. Stem Cell Reviews и
Reports, 14 (4), 599–611. https://doi.org/10.1007/s12015-017-
9777-6.
21. Менс, М. М. Дж., И Ганбари, М. (2018). Регуляция клеточного цикла
стволовых клеток с помощью микроРНК. Обзоры стволовых клеток и отчеты, 14 (3),
309–322. https://doi.org/10.1007 / s12015-018-9808-у.
22. Лью, W.-Z., Huang, Y.-C., Huang, K.-Y., Lin, C.-T., Tsai, M.-T., &
Huang, H .-М. (нет данных). Статические магнитные поля усиливают пролиферацию стволовых клеток пульпы
зуба, активируя путь протеинкиназы p38, активируемый митогеном, pro-
, как его предполагаемый механизм. Journal of Tissue
Engineering and Regenerative Medicine, 12 (1), 19–29. https: // doi.
орг / 10.1002 / термин.2333.
23. Yu, J. S. L., & Cui, W.(2016). Пролиферация, выживаемость и метаболизм
: роль передачи сигналов PI3K / AKT / mTOR в плюрипотентности и определении судьбы клеток
. Развитие, 143 (17), 3050–3060. https: //
doi.org/10.1242/dev.137075.
24. Ангульски, А. Б., Каприглионе, Л. Г., Батиста, М., Маркон, Б. Х.,
Сенегалья, А. К., Стимамиглио, М. А., и Корреа, А. (2017). Содержание белка
во внеклеточных везикулах, полученных из расширенных человеческих
CD133 из пуповинной крови человека и
мезенхимальных стволовых клеток костного мозга человека
, полученных из костного мозга, частично объясняет, почему оба источника
полезны для регенеративной медицины. .Ствол
Cell Reviews and Reports, 13 (2), 244–257. https://doi.org/10.
1007 / s12015-016-9715-z.
25. Collino, F., Pomatto, M., Bruno, S., Lindoso, R. S., Tapparo, M.,
Sicheng, W., et al. (2017). Фракции
, обогащенные экзосомами и микровезикулами, выделенные из мезенхимальных стволовых клеток путем градиентного разделения
, показали разные молекулярные сигнатуры и функции на почечных
эпителиальных клетках канальцев. Обзоры и отчеты стволовых клеток, 13 (2), 226–
243.https://doi.org/10.1007/s12015-016-9713-1.
26. Марандзяк, М., Марыч, К., Левандовски, Д., Сюдзиньска, А., &
mieszek, A. (2015). Статическое магнитное поле усиливает синтез и секрецию
микровезикул (MV), полученных из мембран, богатых VEGF
и BMP-2, в стромальных клетках, полученных из жировой ткани лошадей (EqASC) —
новый подход в ветеринарной регенеративной медицине. In vitro
Клеточная биология и биология развития. Животное, 51 (3), 230–240.
https://doi.org/10.1007/s11626-014-9828-0.
27. Marędziak, M., Marycz, K., mieszek, A., Lewandowski, D., &
Toker, N.Y. (2014). Влияние статических магнитных полей на
мезенхимальных стволовых клеток собак и лошадей, полученных из жировой ткани
. In vitro клеточная биология и биология развития — животные, 50 (6),
562–571. https://doi.org/10.1007/s11626-013-9730-1.
28. Страттон, Д., Ланге, С., Инал, Дж. М. (2013).Импульсные магнитные поля сверхнизкой частоты
стимулируют высвобождение микровезикул из клеток моноцитарного лейкоза человека. Биохимические и биофизические
Research Communications, 430 (2), 470–475. https://doi.org/10.
1016 / j.bbrc.2012.12.012.
29. Mayer-Wagner, S., Passberger, A., Sievers, B., Aigner, J., Summer,
,
B., Schiergens, T. S., et al. (2011). Влияние низкочастотных электромагнитных полей
на хондрогенную дифференцировку мезенхимальных стволовых клеток человека
.Биоэлектромагнетизм, 32 (4), 283–290.
https://doi.org/10.1002/bem.20633.
30. Kasten, A., Müller, P., Bulnheim, U., Groll, J., Bruellhoff, K., Beck,
U., et al. (2010). Механический стресс интегрина и магнитные силы
вызывают биологические реакции в мезенхимальных стволовых клетках, которые зависят от факторов окружающей среды. Journal of Cellular
Biochemistry, 111 (6), 1586–1597. https://doi.org/10.1002/jcb.
22890.
31.Матьё П. С. и Лобоа Э. Г. (2012). Цитоскелет и очаговая адипогенность влияет на форму мезенхимальных стволовых клеток, механические свойства
и дифференцировку по остеогенным, адипогенным и
хондрогенным путям. Тканевая инженерия. Часть B, Обзоры,
18 (6), 436–444. https://doi.org/10.1089/ten.TEB.2012.0014.
32. Марков, М. С. (2007). Расширяется использование импульсной электромагнитной терапии поля
. Электромагнитная биология и медицина, 26 (3), 257–
274.Мариуш
Послушный. (нет данных). Получено 11 июля 2018 г. с https: // w.
bibliotece.pl/3407201/Magnetoterapia+-+terapia+naturalna+
wspomo% C5% BCona + osi% C4% 85gni% C4% 99ciami +
технологий. + Wprowadzenie + do.
35. Румбо Р. Э. и Миркович Д. (2008). Магнитотерапия для ede-
ма при воспалении: физиологическая оценка. Американский
Журнал физиологии сердца и физиологии кровообращения, 294 (1),
h29 – h30.https://doi.org/10.1152/ajpheart.01342.2007.
36. Гмитров Дж., Окубо К. и Окано Х. (2002). Влияние статического магнитного поля
0,25 Тл на микроциркуляцию у кроликов. Биоэлектромагнетизм,
23 (3), 224–229.
37. Сюй, С., Окано, Х., & Окубо, К. (2001). Острые эффекты воздействия статических магнитных полей на все тело
и электромагнитных полей с частотой 50 Гц
на микроциркуляцию мышц у наркозависимых мышей.
Биоэлектрохимия (Амстердам, Нидерланды), 53 (1), 127–135.
38. Вергалло, К., Дини, Л., Шамошвёльдьи, З., Тенуццо, Б. А., Карата, Э.,
,
Панзарини, Э., и Ласло, Дж. Ф. (2013). Анализ in vitro анти-
воспалительного действия неоднородного статического магнитного поля
воздействия на макрофаги и лимфоциты человека. PLoS One,
8 (8), e72374. https://doi.org/10.1371/journal.pone.0072374.
39. Мэн, Дж., Сяо, Б., Чжан, Ю., Лю, Дж., Сюэ, Х., Лэй, Дж.,… Сюй, Х.
(2013). Суперпарамагнитно-чувствительные нановолоконные каркасы un-
в статическом магнитном поле усиливают остеогенез для восстановления кости
in vivo.Scientific Reports, 3, 2655. doi: https: //doi.org/10.1038/
srep02655.
40. Дини Л. и Аббро Л. (2005). Биоэффекты статических магнитных полей умеренной интенсивности
на клеточные культуры. Микрон (Оксфорд, Англия: 1993),
36 (3), 195–217. DOI: https: //doi.org/10.1016/j.micron.2004.12.009.
41. Окано, Х., Онмори, Р., Томита, Н., и Икада, Ю. (2006). Воздействие статического магнитного поля средней интенсивности
на VEGF-A стимулировало образование дотелиальных капиллярных канальцев en-
in vitro.Биоэлектромагнетизм,
27 (8), 628–640. https://doi.org/10.1002/bem.20246.
42. Джабери, Ф. М., Кештгар, С., Тавакколи, А., Пишва, Э., Герамизаде,
,
Б., Танидех, Н., и Джабери, М. М. (2011). Статическое магнитное поле умеренной интенсивности
улучшает восстановление повреждений хряща у кроликов.
Архив медицинских исследований, 42 (4), 268–273. https://doi.org/10.
1016 / j.arcmed.2011.06.004.
43. Сайфзаде С., Хоббенаги Р., Шокухи Сабет Джалали Ф., & Кабири,
Б. (2007). Влияние статического магнитного поля на заживление костей у собаки
: рентгенографические и гистопатологические исследования. Иранский журнал
Ветеринарные исследования, Ширазский университет, 8 (1), 8–15.
44. Cieślińska-wider, J. (2014). Przeglądmetod
fizykoterapeutycznych stosowanych w reumatoidalnym zapaleniu
stawów, 64–69.
45. Сюй, С., Томита, Н., Икеучи, К., и Икада, Ю. (2007). Восстановление
мелких кровеносных сосудов в ишемизированной кости в статическом магнитном поле
.Доказательная дополнительная и альтернативная медицина,
4 (1), 59–63. https://doi.org/10.1093/ecam/nel055.
Stem Cell Rev and Rep (2018) 14: 785–792 791
Содержимое предоставлено Springer Nature, применяются условия использования. Права защищены.
Медицинский центр, ориентированный на пациентов | Медицинский фонд Sandhills
Персонал Sandhills Medical Foundation, Inc. (SMF) хотел бы воспользоваться этой возможностью, чтобы поблагодарить вас за то, что вы выбрали нас в качестве своего медицинского дома.Как поставщик медицинских услуг, мы будем рады помочь вам. Мы надеемся, что вместе мы сможем построить отношения, которые обеспечат вам высочайшее качество ухода и обслуживания.
В SMF мы считаем очень важным, чтобы вы знали о преимуществах получения медицинской помощи в медицинском доме, ориентированном на пациента, и рекомендуем вам задавать вопросы одному из наших вежливых сотрудников, если у вас есть какие-либо вопросы.
ЧТО ТАКОЕ МЕДИЦИНСКИЙ ДОМ, ЦЕНТРИРУЕМЫЙ ПАЦИЕНТОМ?
«Медицинский дом, ориентированный на пациента» — это медицинский кабинет, где команда профессионалов здравоохранения работает вместе, чтобы предоставить пациентам новый тип ухода.Медицинский дом — это как старый семейный врач, но с командой профессионалов, использующих современные знания и технологии, чтобы обеспечить вам наилучший уход в своем офисе.
МЕДИЦИНСКИЙ ДОМ, ЦЕНТРИРОВАННЫЙ ДЛЯ ПАЦИЕНТА — О ВАС
Забота о ВАС — самая важная работа в медицинском доме, ориентированном на пациента. Уход в медицинском доме, ориентированном на пациентов SMF, носит индивидуальный характер, и задача команды — убедиться, что вы получаете необходимую медицинскую помощь. Вы можете помочь нам, всегда сообщая своей медицинской бригаде, если вы получаете лечение от других медицинских специалистов, чтобы мы могли помочь скоординировать наилучшее возможное лечение.Эта информация поможет нам лучше обслуживать вас.
ВАША МЕДИЦИНСКАЯ КОМАНДА ПО УХОДУ НА ДОМУ
Персонал Sandhills, ориентированный на пациента, заботится о вашем здоровье.
- • Наша команда профессионалов в области здравоохранения предоставит вам новейшие способы поддержания вашего здоровья с помощью проверенных методов и инструментов самоуправления.
- • У Sandhills будет специальный персонал, который поможет организовать направление к сторонним источникам, таким как специалисты или лаборатории, и обеспечит получение нами ваших отчетов / результатов во время ваших медицинских посещений.
- • В вашу команду могут входить врач, медсестра, а также другие медицинские работники, например фармацевт или терапевт по психическому здоровью.
Эти члены команды помогут вам стать здоровыми, оставаться здоровыми и получать уход и услуги, которые подходят именно вам. Опекуны из вашей семьи также являются частью команды, а ВЫ — самый важный член!
КАЧЕСТВО И БЕЗОПАСНОСТЬ — ПРИЗЫВЫ МЕДИЦИНСКОГО ДОМА, ЦЕНТРИРУЕМОГО ПАЦИЕНТАМИ
- • Sandhills использует инструменты доказательной медицины и поддержки принятия клинических решений для руководства вашим уходом и лечением.
- • Мы разрабатываем и соблюдаем наши научно обоснованные рекомендации по уходу за пациентами для обеспечения качества. Наши рекомендации по уходу за пациентами всегда доступны для ознакомления.
- • Информационные технологии используются для поддержки ухода за пациентами, обучения и улучшения коммуникации.
Все пациенты Sandhill имеют электронную медицинскую карту.
Поскольку ваш медицинский дом ориентирован на пациента, ваша команда по уходу доступна 24/7. Если вам нужна помощь в нерабочее время, вы можете связаться с группой по уходу в нерабочее время по телефону.Чтобы связаться с поставщиком в нерабочее время, позвоните в нашу дежурную службу по телефону (803) 401-5966 или позвоните 911 в экстренных случаях.
Формулярная политика в отношении лекарственных средств на уровне штата
MP 0077/18 — Формулярная политика штата в отношении лекарственных средств (pdf 134KB)
Применимо к: Настоящая Политика применима ко всем поставщикам медицинских услуг, которые предоставляют лекарства населению.Он применяется ко всем лицам, выписывающим лекарства, для обеспечения надлежащего и справедливого доступа к лекарствам и управления лекарственными средствами.
Описание: Целью Общегосударственной политики по лекарственным препаратам (SMF) является оказание помощи в достижении оптимальных результатов для пациентов на справедливой основе с помощью единого списка одобренных лекарств. Обоснование SMF подкреплено Австралийской национальной политикой в области лекарственных средств, которая направлена на улучшение положительных результатов в отношении здоровья с упором на доступ пациентов к лекарствам и их разумное использование.SMF будет поддерживать эффективность в стоимости, использовании и управлении лекарствами, улучшит единообразие и прозрачность, будет способствовать безопасному и качественному использованию лекарств и предоставит возможности для будущих инициатив по повышению качества и безопасности, связанных с лекарствами.
Все отвечающие критериям врачи, работающие в медицинских учреждениях, обязаны назначать лекарства в соответствии с ограничениями и требованиями, установленными SMF.
Обновления:
| Тип поправки | Дата вступления в силу | Описание поправки |
|---|---|---|
| Незначительная поправка | 8 марта 2019 | Была обновлена ссылка на справочную информацию о Фармацевтических справочниках штата Вашингтон. |
Дата вступления в силу: 31 января 2018 г. — 31 декабря 2023 г.
Основы политики
Клиническое руководство, безопасность и качество
Вспомогательная информация
WA Общегосударственные формуляры лекарственных средств
Руководящий документ по рациональному использованию противомикробных препаратов
Правительство Австралии, Министерство здравоохранения и старения: Национальная политика в области лекарственных средств
Совет австралийских терапевтических консультативных групп (CATAG): Переосмысление принятия решений в отношении лекарственных средств: Руководящие принципы качественного использования лекарств, не отпускаемых по прямому назначению
CATAG: Достижение эффективного управления лекарственными средствами: руководящие принципы в отношении ролей и обязанностей комитетов по лекарственным средствам и терапии в государственных больницах Австралии
Кто может выписывать лекарства в Западной Австралии
Аэропорт Сакраменто (SMF) до Medicine Hat
Есть 7 способов добраться из аэропорта Сакраменто (SMF) до Медисин-Хэт на самолете, автобусе, поезде или автомобиле
Выберите вариант ниже, чтобы просмотреть пошаговые инструкции и сравнить цены на билеты и время в пути в планировщике путешествий Rome2rio.
Какой самый дешевый способ добраться из аэропорта Сакраменто (SMF) до Medicine Hat?
Самый дешевый способ добраться из аэропорта Сакраменто (SMF) до Medicine Hat — поездом, автобусом и автомобилем, который стоит от 12000 до 19000 рублей и занимает 41 час 13 минут.
Подробнее
Какой самый быстрый способ добраться из аэропорта Сакраменто (SMF) до Medicine Hat?
Самый быстрый способ добраться из аэропорта Сакраменто (SMF) до Medicine Hat — самолетом, который стоит 10 000–24 000 рублей и занимает 7 часов 49 минут.
Подробнее
Есть ли прямой автобус между аэропортом Сакраменто (SMF) и Medicine Hat?
Нет, прямого автобуса из аэропорта Сакраменто (SMF) до станции Medicine Hat нет.Тем не менее, есть рейсы, отправляющиеся из Терминала A и прибывающие в Medicine Hat, AB — Husky Gas Station, 561 15 st SW через 8Th St & I St, Sacramento, CA, Ванкувер, Британская Колумбия, и Калгари, AB — Westbrook Mall. Путешествие, включая пересадку, занимает примерно 43ч 43мин.
Подробнее
Как далеко аэропорт Сакраменто (SMF) до Medicine Hat?
Расстояние между аэропортом Сакраменто (SMF) и Медисин-Хет составляет 1528 км.Расстояние по автомобильной дороге — 2185,4 км.
Проложить маршрут
Как добраться из аэропорта Сакраменто (SMF) до Medicine Hat без автомобиля?
Добраться из аэропорта Сакраменто (SMF) до Medicine Hat без машины лучше всего на автобусе, который занимает 43 часа 43 минуты и стоит 18000 — 26000 рублей.
Подробнее
Сколько времени нужно, чтобы добраться из аэропорта Сакраменто (SMF) до Medicine Hat?
Путь от аэропорта Сакраменто (SMF) до Medicine Hat, включая трансферы, занимает примерно 7 часов 49 минут.
Подробнее
Где я могу сесть на автобус из аэропорта Сакраменто (SMF) до Medicine Hat?
Аэропорт Сакраменто (SMF) — автобусы компании Medicine Hat, обслуживаемые компанией Greyhound USA, отправляются из Сакраменто, станция Ca.
Подробнее
Автобусом или вылетом из Аэропорт Сакраменто (SMF) в Медисин Хет?
Лучший способ добраться из аэропорта Сакраменто (SMF) до Medicine Hat — перелететь самолетом, который занимает 7 часов 49 минут и стоит 10000 — 24000 рублей.В качестве альтернативы можно доехать на автобусе, который стоит 18000 — 26000 рублей и занимает 43 часа 43 минуты.
Детали режима
Сколько длится перелет из аэропорта Сакраменто (SMF) в Медисин-Хет?
Прямых рейсов из аэропорта Сакраменто в аэропорт Медисин-Хат нет.Самый быстрый перелет занимает 8 ч. 39 м. С двумя пересадками.
Искать рейсы
Куда приезжает автобус из аэропорта Сакраменто (SMF) в Medicine Hat?
Аэропорт Сакраменто (SMF) — автобусы компании Medicine Hat, обслуживаемые Rider Express, прибывают в Medicine Hat, AB — АЗС Husky, 561 15 st SW.
Подробнее
Какие компании обслуживают аэропорт Сакраменто (SMF), США, и Medicine Hat, AB, Канада?
Delta, WestJet и еще семь авиакомпаний летают из аэропорта Сакраменто (SMF) в Медисин-Хет каждый час. Кроме того, вы можете сесть на автобус из аэропорта Сакраменто (SMF) до Medicine Hat через J St.по адресу 4th St., 8Th St & I St, Richards Blvd & Sequoia Pacific Blvd, Sacramento, Ca, Vancouver, Bc, Vancouver, BC, and Calgary, AB — Westbrook Mall примерно в 43 ч 43 м.
Хотите узнать больше о путешествиях по Канаде
Серия путеводителей
Rome2rio предоставляет важную информацию для путешественников со всего мира. Гиды, наполненные полезной и своевременной информацией о поездках, отвечают на все сложные вопросы, такие как «Как мне купить билет?», «Следует ли мне бронировать онлайн перед поездкой?» ‘,’ Сколько мне ожидать платить? ‘,’ Есть ли в поездах и автобусах Wi-Fi? ‘ — чтобы помочь вам получить максимум удовольствия от вашей следующей поездки.
Представитель SMF-Central-Patient Services — открытие работы в области семейной медицины в Сакраменто, Калифорния, в Sutter Health
Обзор должности:
Представитель службы пациентов принимает направления пациентов; планирует встречи и сохраняет данные в компьютеризированной программе планирования; предварительно регистрирует пациента и создает учетные записи для оказания клинических услуг; проверяет и / или получает разрешение на услуги; создает и поддерживает карты пациентов; и гарантирует, что учетная запись пациента готова к выставлению счетов.
Основная ответственность
Принимает направления, проверяет полноту и уместность, общается с источниками направлений для получения дополнительной информации по мере необходимости. Создает и поддерживает карты пациентов. Гарантирует, что диаграммы содержат заказы на направление к врачу, прошлые медицинские записи, документы, необходимые для клинического использования, документы для подписи пациента. Может помочь медицинскому персоналу, работающему с диабетом, загрузив счетчики пациентов. Может компилировать и передавать единицы служебных данных в Финансы для отчетов о производительности.Получает конфиденциальную информацию от пациента или члена семьи, включая демографические, финансовые и медицинские. Предварительно регистрирует пациентов в системе учета пациентов, проверяет страховку, проверяет требования к сооплате и получает / заполняет все необходимые разрешения, сертификаты, уведомления и документацию, требуемую правительством.
Готовит платные билеты на медицинские услуги. В выбранных центрах проверяет каждую карту пациентов на предмет платных услуг и принимает корректирующие меры для обеспечения их точности и полноты.Исследует и устраняет проблемы, выявленные системами учета пациентов, необходимые для обеспечения полного и надлежащего выставления счетов по назначенным претензиям. Может вносить платежи по счетам и сбор денежных / кредитных поступлений на счета пациентов. Может переводить описательный диагноз в коды МКБ-9 и вводить в биллинговую систему.
Записывает пациентов на первичные и последующие визиты и сохраняет данные в компьютеризированной программе планирования.
Квалификация:
МИНИМАЛЬНЫЕ ТРЕБОВАНИЯ К КВАЛИФИКАЦИИ
Образование / включая лицензию / сертификацию / регистрацию
Для младенцев, детей и некоторых настроек требуется текущая базовая СЛР.Сертифицированный биллинговый кодер предпочтительнее. Требуется выпускник средней школы или эквивалент. Предпочтительны сертификация, ассоциированная степень или степень бакалавра в области бизнеса или здравоохранения.
Знание:
Требуется понимание концепций и требований медицинского страхования, включая HMO, PPO, Medicare, Medi-Cal и другие программы федерального правительства и агентства штата. Требуется знание медицинской терминологии и терминологии выставления счетов.
Опыт работы:
Требуется опыт работы в сфере здравоохранения или в сфере страхования, что крайне желательно для регистрации пациентов и / или разрешения на страхование, которое обычно получается примерно за 2 года.Предпочтение отдается сильному опыту работы с клиентами.
Навыки:
Требуется для очень точного сбора разнообразной информации в быстро меняющейся среде при сохранении конфиденциальности пациента. Должен уметь использовать различные сложные инструменты для регистрации и планирования пациентов. Должен обладать высокими навыками устного и письменного общения. Требуются сильные компьютерные навыки. Требуются математические навыки. Требуются навыки обслуживания клиентов. Требует внимания к деталям.Должен иметь способность слышать со вспомогательными устройствами или без них.
Организация: Sutter Medical Foundation — Central
Статус сотрудника: Обычный
Бонус за направление сотруднику: Нет
Льготы: Да
Статус должности: Без освобождения
Профсоюз: Нет
Смена: Переменная
Часы смены: 8-часовая смена
Дней недели по расписанию: Понедельник-пятница
Требования к выходным: Нет
График: Полный рабочий день
Часов за 2 недели 80 Период оплаты
:
Получать оповещения о других SMF-Central-Patient Services Представитель — Семейная медицина вакансий
Информация об интервью для стипендий по медицине сна
Добро пожаловать
Добро пожаловать на собеседование в рамках стипендии UC Davis по медицине сна.Соискатели собеседования найдут основную информацию о дне собеседования на этом сайте. Программа стипендий по медицине сна проводит собеседования 3 раза: 11 сентября, 25 сентября и 9 октября. Соискатели стипендии, получившие приглашение на собеседование, пройдут собеседование в UC Davis Health, расположенном в Сакраменто.
Расписание собеседований стипендии по общей медицине сна
8:00 утра: Введение в программу медицины сна Калифорнийского университета в Дэвисе
9:00 утра: Серия получасовых интервью с преподавателями медицины сна
11:10 утра: Экскурсия по медицинскому центру Калифорнийского университета в Дэвисе Услуги центра
12:30: Обед
13:30: Дидактика сна
15: 00-16: 00: Клуб журнала сна (по желанию)
Информация об аэропорте
Ближайший аэропорт — международный аэропорт Сакраменто (SMF).Медицинский центр Калифорнийского университета в Дэвисе расположен в 15,6 милях от международного аэропорта Сакраменто. Транспорт от аэропорта до медицинского центра Калифорнийского университета в Дэвисе осуществляется на маршрутном такси или на такси. Забронировать Super Shuttle можно онлайн. Стоимость трансфера в одну сторону составляет приблизительно 22 доллара США на человека / 11 долларов США на каждого дополнительного человека. Стоимость проезда на такси из аэропорта составляет от 38 до 50 долларов.
Адрес для собеседования / стоянки / такси / или других услуг
Интервью проводятся в офисах отделения легочной, реанимации и медицины сна.
Здание обслуживания и поддержки пациентов (PSSB)
Улица 4150 В, офис 3400 (Третий этаж)
Сакраменто, Калифорния 95817
Вход в здание обслуживания и поддержки пациентов находится со стороны Colonial Way.
Парковка:
Лучший адрес для GPS / карт — 4300 X Street, Sacramento, CA. Это приведет вас к главному кольцу больницы и к парковке. Убедитесь, что вы взяли билет при входе на парковку. В конце дня мы предоставим парковочные талоны.
UBER / Lyft / Taxi:
Лучший адрес: 4150 V Street, Sacramento, CA. Этот адрес находится в задней части здания обслуживания и поддержки пациентов. Используйте дорожку между стороной здания и дворовым пространством на V и 42-й улице и следуйте по нему к передней части здания.
Карта кампуса
Интервью проводятся в офисах отделения легочной, реанимации и медицины сна.
Здание обслуживания и поддержки пациентов (PSSB)
Улица 4150 В, офис 3400 (Третий этаж)
Сакраменто, Калифорния 95817
Вход в здание обслуживания и поддержки пациентов находится со стороны Colonial Way.
Парковка:
Лучший адрес для GPS / карт — 4300 X Street, Sacramento, CA. Это приведет вас к структуре парковки для посетителей. Убедитесь, что вы взяли билет при входе на парковку. В конце дня мы предоставим парковочные талоны.
UBER / Lyft / Taxi:
Лучший адрес: 4150 V Street, Sacramento, CA. Этот адрес находится в задней части здания обслуживания и поддержки пациентов. Воспользуйтесь переходом между зданием и строительной площадкой на V и 42-й улице к передней части здания.
.





 W. et al. Craniotomy with cystoperitoneal shunting for treatment of intracranial arachnoid cysts in dogs // Veterinary Surgery. – 2007. – Т. 36. – № 5. – С. 416–422.
W. et al. Craniotomy with cystoperitoneal shunting for treatment of intracranial arachnoid cysts in dogs // Veterinary Surgery. – 2007. – Т. 36. – № 5. – С. 416–422.