СТРОМА — РЕГУЛЯТОР ПРОГРЕССИИ ОПУХОЛЕВЫХ КЛЕТОК — Онкология
Успехи в изучении биологии злокачественных опухолей выдвинули на первый план значимость их стромальных клеток, а также факторов, продуцируемых последними, как регуляторов канцерогенеза, особенно опухолевой прогрессии. По сути, утвердилась точка зрения, что фенотип
и биологические особенности каждой опухоли формируются в результате взаимодействия клеток собственно опухоли и ее стромы.
Составляющими стромы опухоли являются соединительно-тканные клеточные элементы, сосуды, нервы, экстрацеллюлярный матрикс (ЭЦМ). Элементы стромы происходят из прилегающей к опухоли соединительной ткани хозяина и из циркулирующей крови. Количественные и качественные характеристики стромы — результат взаимодействия организм — опухолевая клетка и весьма вариабельны в различных опухолях. Например, строма составляет до 90% (или более) массы карцином молочной железы, желудка, поджелудочной железы, в то время как в медуллярном раке молочной железы, а также в лимфомах содержание стромы минимально. Некоторые гистологические типы карцином молочной железы характеризуются обилием эластической ткани с коллагеном, другие (медуллярный рак) — обширными лимфоцитарными инфильтратами. Вариабельность состава стромы может наблюдаться даже в разных участках одной и той же опухоли. Строму лейкозов и асцитных опухолей образуют соответственно составляющие крови и перитонеального экссудата. Клоны лейкозных клеток обычно индуцируют строму, подобную таковой солидных опухолей, в костном мозге и подобную асцитным опухолям в тканях, выстилающих перитонеальную полость.
Некоторые гистологические типы карцином молочной железы характеризуются обилием эластической ткани с коллагеном, другие (медуллярный рак) — обширными лимфоцитарными инфильтратами. Вариабельность состава стромы может наблюдаться даже в разных участках одной и той же опухоли. Строму лейкозов и асцитных опухолей образуют соответственно составляющие крови и перитонеального экссудата. Клоны лейкозных клеток обычно индуцируют строму, подобную таковой солидных опухолей, в костном мозге и подобную асцитным опухолям в тканях, выстилающих перитонеальную полость.
Тем не менее установлено, что в строме нужда-
ются практически все солидные и асцитные опухоли, а также лейкозы. Строма одновременно и обеспечивает жизненно важные коммуникации, необходимые для роста опухоли, и до определенного момента налагает ограничения на распространение опухолевых клеток.
Идентифицированы 3 основных блока связи между опухолью и мультипотентными стромальными клетками (особенно фибробластами): факторы роста, молекулы ЭЦМ и протеиназы.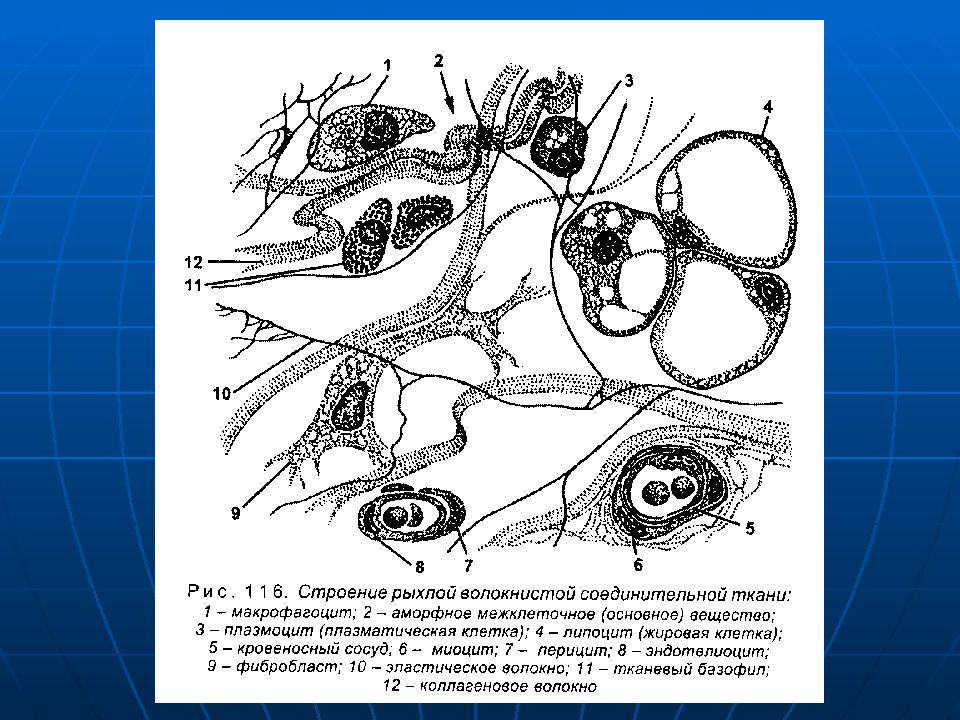
Опухолевые клетки продуцируют ряд ростовых факторов (трансформирующий фактор роста бета (ТGF-β), тромбоцитарный фактор роста (PDGF), щелочной фактор роста фибробластов (bFGF), лиганд рецептора эпидермального фактора роста (L-EGFR), фактор роста эндотелия сосудов (VEGF)), которые воздействуют как на фибробласты, так и на эпителиальные и эндотелиальные клетки. Эндотелиальные клетки продуцируют фактор роста соединительной ткани (ФРСТ), который вместе с ТGF-β и PDGF не только притягивают стромальные клетки в зону опухоли, но и регулируют их функциональную активность, то есть в значительной мере метаболическое окружение опухоли. Экспрессия ФРСТ в тканях, чувствительных к стероидным гормонам (например в строме яичников и эндометрии), зависит от уровня эстрогенов и гестагенов, что вносит существенный вклад в гормонозависимость опухолей. Под влиянием ТGF-β и PDGF стромальные фибробласты развиваются в миофибробласты. Опухольиндуцированный рост стромы сопровождается продукцией этими миофибробластами дополнительных ростовых факторов (в частности инсулиноподобного фактора роста-1, фактора роста гепатоцитов, ФРСТ и VEGF), которые также усиливают рост стромы, а в ряде случаев — и опухолевых клеток.
глоссарий « Институт Стволовых Клеток Человека
The Good Manufacturing Practice (GMP) — Совокупность ряда строительных, санитарных и пожарных норм для производства.
Асимметричное деление — Такое митотическое деление, при котором дочерние клетки не равнозначны по дифференцировочному потенциалу. Считается, что одна дочерняя клетка сохраняет статус, а вторая — под влиянием факторов микроокружения дифференцируется.
Банк клеток — Учреждение, производящее гарантированное, по определенным правилам, хранение клеточных образцов, обеспечивающие их последующие применение.
Банкирование — Процесс длительного хранения криоконсервированных образцов стволовых клеток.
Биодеградация — Процесс разрушения химического соединения под воздействием биологического объекта. То же, что биологическое разрушение химических соединении.
Биосовместимость — Интегральная характеристика естественного или искусственного трансплантата, позволяющая ему приживаться в организме реципиента.
Бипотентный — Способный развиваться [дифференцироваться] только в двух направлениях.
Внутренняя клеточная масса (ВКМ) — У млекопитающих — скопление клеток, расположенное внутри бластоцеля у одного из полюсов. Клетки ВКМ в дальнейшем образуют сам зародыш, а также его провизорные органы — амнион, аллантоис, желточный мешок. ВКМ — основной источник эмбриональных стволовых клеток. Син.: эмбриобласт, зародышевый узелок.
Гемопоэтическая стволовая клетка (ГСК) — Мультипотентная стволовая клетка взрослого организма, способная к дифференцировке во все клетки крови. Син.: гематопоэтическая стволовая клетка, СКК — стволовая кроветворная клетка.
Графт — Тканеинженерный эквивалент любой ткани или органа.
Дедифференцировка [от лат. de-differentia — потеря различий] — Утрата клетками специфических свойств с возвращением их морфофункциональной организации к более примитивному состоянию.
Дифференцировка [от лат. differentia — различие] — Процесс, в ходе которого клетки стойко реализуют закрепленные детерминацией потенции к развитию до дефинитивного морфофункционального состояния. Дифференцировка клеток происходит как в развивающихся, так и в зрелых тканях и характеризуется экспрессией части генома. Основа дифференцировки — синтез цито- и тканеспецифичных белков.
Иммунофлюоресценция — Метод определения количества и/или распределения какого-либо антигена или антитела [иммунного комплекса], при котором антитела маркируются [прямо или косвенно] с помощью флюоресцентного красителя. В случае прямой иммунофлюоресценции [direct immunofluorescence] маркировка антитела производится непосредственно перед его воздействием на ткань. При косвенной иммунофлюоресценции [indirect immunofluorescence] маркировка антитела производится после его соединения с антигеном с помощью флюоресцентно-маркирующей анти-иммуноглобулиновой сыворотки.
Индуктор дифференцировки [от лат. inductio — наведение, побуждение] — Вещество, которое может стимулировать дифференцировку стволовых клеток и клеток-предшественников в определённом направлении.
Индуцированная дифференцировка — Дифференцировка клеток, происходящая в результате воздействия на них определённых факторов биологической или химической природы.
Кластер дифференцировки [cluster differentiation, cluster designation, CD] — Внесенная в специальную номенклатуру группа моноклональных антител, которые имеют совпадающую специфичность и связывают определенную маркерную молекулу. Допустимо применение термина CD по отношению к маркерной молекуле. В настоящий момент насчитывается более 300 CD, внесенных в номенклатуру.
Клетка-предшественник — Клетка, находящаяся на низком уровне дифференцировки, но уже коммитированная к развитию в клетки определённой линии.
Клетки «боковой популяции», SP-клетки, Side- population (SP) — Популяция клеток, которые обладают способностью выкачивать некоторые флуоресцентные красители [Hoechst и др. ] и изначально представляющие собой гемопоэтические клетки.
] и изначально представляющие собой гемопоэтические клетки.
Клеточная трансплантация — Трансплантация [трансфузия] различных типов клеток с целью восстановления повреждённых тканей и органов, либо замещения патологически изменённых собственных клеток реципиента.
Клеточный рост — Процесс деления клеток в организме либо в культуре, не сопровождающийся повышением их уровня дифференцировки.
Клон — Потомство клеток, возникшее от одного общего предшественника.
Клонирование — Искусственное создание генетически идентичных исходным ДНК, клеток, организмов.
Колониеобразующие единицы (КОЕ) — Клетки, способные пролиферировать с образованием колоний в культуре или в органах другого организма.
Костные морфогенетические белки; Bone morphogenetic proteins (BMPs) — Белки, входящие в состав суперсемейства трансформирующих факторов роста. Экспрессируясь в областях организаторов зародыша, они, наряду с другими белками суперсемейства, выполняют разнообразные функции: контролируют клеточную репродукцию, программируемую гибель клеток, миграцию клеток, установление осей зародыша, спецификацию мезодермы, дифференциацию нервной системы и органов чувств, морфогенез кишки.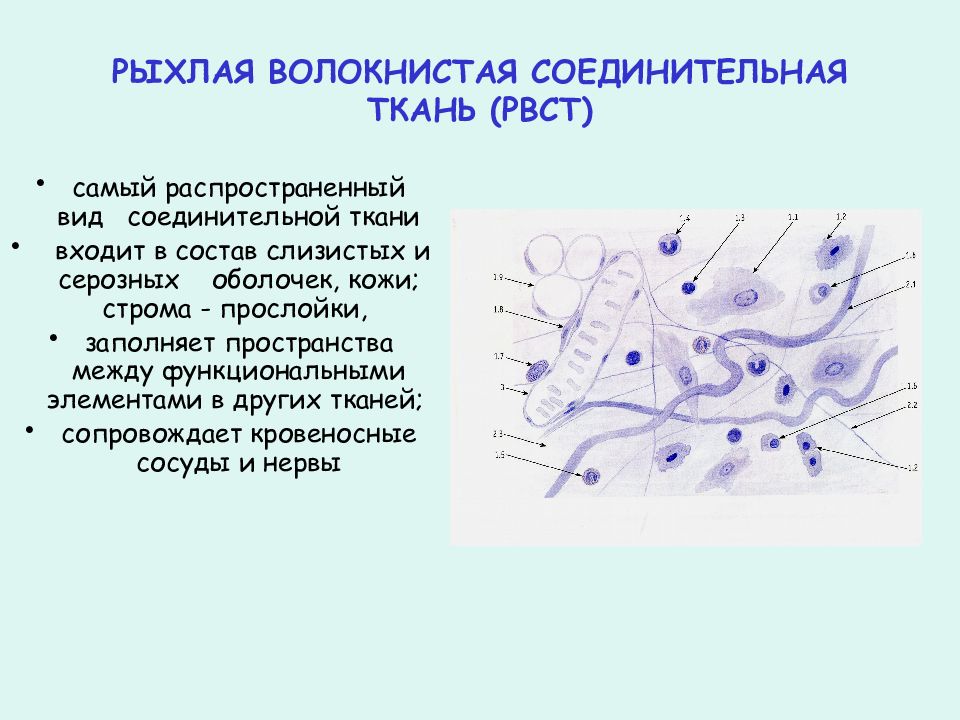 У взрослых особей экспрессируются в основном клетками скелетных тканей и являются молекулярными регуляторами остеогенеза.
У взрослых особей экспрессируются в основном клетками скелетных тканей и являются молекулярными регуляторами остеогенеза.
Криоконсервирование— Метод длительного сохранения клеток, тканей и органов путём их глубокой заморозки в жидком азоте с применением специальных добавок, сохраняющих жизнеспособность клеток или тканей.
Линейные поверхностные антигены, Lineage surface antigen (Lin) — Поверхностные антигены, характеризующие определенную [данную] клеточную линию.
Маркер — Поверхностная или внутриклеточная молекула, характерная для определенной линии клеток на данном этапе дифференцировки в норме либо при патологии.
Миграция — Процесс перемещения любых клеток, обусловленный сложными избирательными взаимодействиями клеточных рецепторов на мембранах мигрирующих клеток и их микроокружения. In vivo данный процесс проявляется перемещением клеток в другие органы.
Мехенхима — Зародышевая соединительная ткань большинства многоклеточных животных, в том числе человека. Из мезенхимы образуются собственно соединительная ткань, кровеносные сосуды, многие мышцы, висцеральный скелет, пигментные клетки и нижний слой соединительнотканной части кожи.
Из мезенхимы образуются собственно соединительная ткань, кровеносные сосуды, многие мышцы, висцеральный скелет, пигментные клетки и нижний слой соединительнотканной части кожи.
Микроокружение — 1. Сложная система, включающая клетки и внеклеточный матрикс, обеспечивающая выживание, рост и дифференцировку стволовых клеток посредством специфических биологически активных молекул — сигнальных факторов и межклеточных взаимодействий. 2. Клеточный состав и тип межклеточного вещества, характерный для данной ткани.
Мононуклеарная фракция клеток [от лат. monos — один и nucleus — ядро] — Клетки, выделенные из костного мозга или периферической крови посредством отделения от эритроцитов, тромбоцитов и гранулоцитов на градиенте плотности.
Мультипотентная клетка — Клетка, способная дифференцироваться в нескольких направлениях в пределах тканевых производных одного зародышевого листка.
Мультипотентные мезенхимальные стромальные клетки (ММСК) — Гетерогенная популяция клеток стромы костного мозга и некоторых иных источников, способная к дифференцировке в клетки, имеющие мезенхимальное происхождение: адипоциты, остеоциты, хондроциты, а также в особых условиях in vitro — в клетки эктодермального и энтодермального фенотипа.
Недифференцированный (недифференцированная клетка) — Клетка, не обладающая характеристиками клеток той или иной тканевой принадлежности и способная претерпевать процесс дифференцировки.
Нейральные стволовые клетки (НСК) — Региональные стволовые клетки, обладающие потенциалом дифференцировки в нейральные и глиальные элементы.
Опухолевая стволовая клетка (Cancer stem cell) — Самоподдерживающаяся клетка, являющаяся источником развития злокачественной клеточной популяции. Считается доказанным наличие таких клеток при лейкозах и некоторых солидных опухолях.
Пассаж — Пересев клеточной культуры.
Перенос ядра соматической клетки — Правильное название так называемого «терапевтического клонирования», отражающее процедуру репрограммирования ядра с целью получения линий эмбриональных стволовых клеток с геномом исходной соматической клетки, позволяющую получать иммунологически совместимый клеточный материал.
Персистенция [от англ. persistence — постоянство, живучесть, выносливость] — Применительно к стволовым клеткам — феномен присутствия и сохранения функционально активных донорских стволовых клеток в организме реципиента.
Пластик-адгезивные клетки — Клетки, способные посредством своих рецепторов прикрепляться к культуральному пластику или стеклу.
Пластичность — Гипотетическая способность стволовых клеток взрослого дифференцироваться в клетки нескольких направлений дифференцировки — производных различных зародышевых листков под воздействием различных стимулов.
Плюрипотентная клетка [от лат. pluro — много; potentia — способность] – способная дифференцироваться по множеству различных направлений в пределах всех зародышевых листков, а также клетки внезародышевых органов.
Приживление — Явление интеграции трансплантата в организм реципиента, не сопровождающееся реакцией отторжения.
Примитивность — Отсутствие у клетки специфических свойств и функций; её потенциальная способность претерпевать процесс дифференцировки с образованием высокоспециализированного потомства.
Пролиферация — [лат. proliferatio, от proles — потомство и ferre — носить, приносить] — Процесс клеточного деления, осуществляющегося путем митоза.
Регенеративная медицина — Область медицины, занимающаяся вопросами восстановления повреждённых или патологически измененных тканей и органов посредством трансплантации стволовых клеток, клеток-предшественников и управления их дифференцировкой.
Регионарные стволовые клетки (РСК) — Стволовые клетки, имеющиеся в дефинитивных тканях и обладающие дифференцировочными потенциями в пределах данной ткани.
Репрограммирование ядра соматической клетки — Изменение генетической программы ядра при его переносе в гетерологическую цитоплазму. Репрограммирование ядра клетки может происходить при её трансдифференцировке без переноса ядер.
Репродуктивное клонирование — Клонирование с целью создания нового организма, генетически идентичного исходному.
Самообновление стволовой клетки — Свойство стволовых клеток, заключающееся в поддержании собственной популяции за счет симметричных или асимметричных делений.
Скаффолд-технология [от англ. scaffold — леса, подмостки] — Культивирование клеток на трёхмерных подложках — носителях естественного или искусственного происхождения с целью пространственного формирования будущего клеточного трансплантата.
Слияние — Объединение цитоплазматического и генетического материала гетерологичных клеток [например донора и реципиента], в результате чего донорские СК приобретают характеристики клеток реципиента. Син.: фьюжн, фузоморфогенез [от англ. fusion — слияние и лат. morphogenesis — придание формы].
Со(ко)культивирование — Совместное культивирование двух или нескольких клеточных линии.
Спонтанная дифференцировка — Самопроизвольная, происходящая в отсутствии воздействия внешних факторов дифференцировка стволовых клеток.
Стволовая клетка — любая недифференцированная или малодифференцированная клетка, которая способна поддерживать собственную популяцию и продуцировать по крайней мере 1 тип коммитированных клеток-предшественников.
Стволовые клетки пуповинной крови — Стволовые клетки, выделенные из сосудов пупочного канатика после рождения ребёнка.
Стволовые клетки взрослых, стволовые клетки дефинитивных тканей; adult stem cells — Стволовые клетки, находящиеся в тканях взрослого организма.
Стволовые клетки костного мозга — Собирательное понятие, под которым понимают как минимум две различные популяции стволовых клеток, находящиеся в костном мозге: стволовые кроветворные клетки [СКК] или гемопоэтические стволовые клетки [ГСК] и мультипотентные мезенхимальные стромальные клетки [ММСК] — общие предшественники мезенхимальных производных.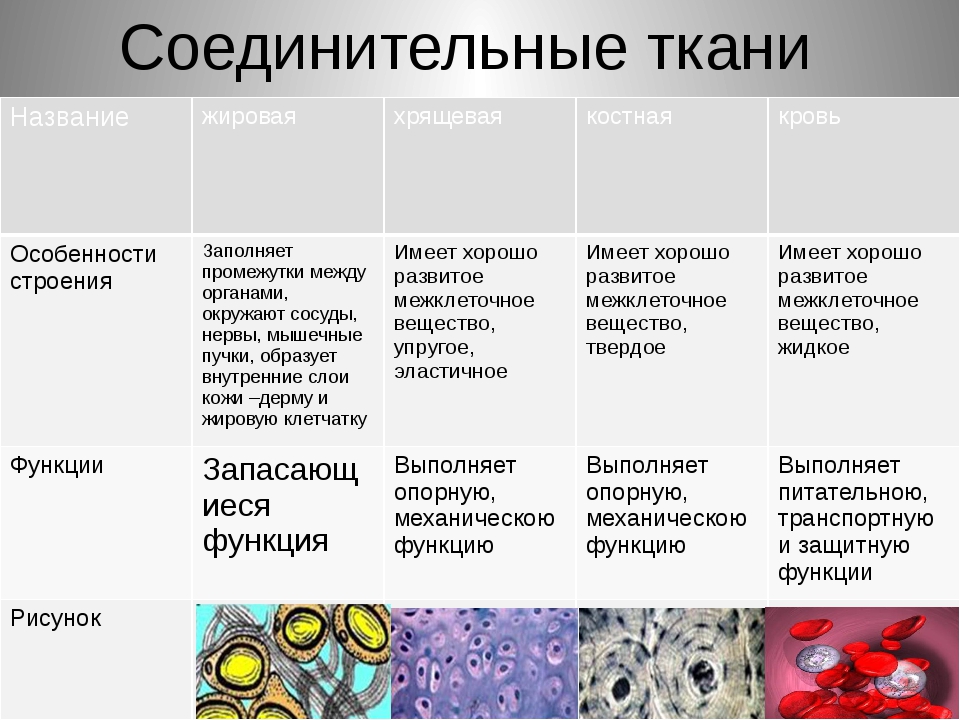
Стромальные клетки — Совокупность клеток преимущественно соединительнотканной природы [ММСК, ретикулярных клеток, адипоцитов, фибробластов и др.] формирующих каркас [основу] кроветворных органов. Исключение — тимус, в котором стромальные клетки имеют эпителиальное происхождение. Также этим термином могут обозначаться собственно соединительнотканные клетки всех остальных паренхиматозных и трубчатых органов, главным образом формирующие их механический каркас.
Терапевтическое клонирование — Некорректное название процедуры переноса ядра соматической клетки с целью получения индивидуальной линии ЭСК.
Тканевая инженерия — Междисциплинарная область знаний, включающая в себя биологию, медицину и технические науки, изучающая создание in vitro эквивалентов тканей и органов, использующая принцип трансплантации клеточной культуры на биосовместимом носителе.
Тканевая ниша стволовой клетки — Отдельная область костного мозга или любой ткани, состоящая из стромальных клеток, обеспечивающая молекулярные сигналы, селективно опосредующие самообновление популяции и дифференцировку СК путём взаимодействий клетка-клетка и близкодействующих [паракринных] молекулярных взаимодействий.
Тотипотентный [от лат. totalis — общий, целый и potentia — способность] — Клетка, способная дифференцироваться не только во все клеточные линии, характерные для данного вида, но и, размножаясь, формировать целостный организм.
Трансдифференцировка [от лат. trans — через и differentia — различие] — Способность стволовой клетки взрослого дифференцироваться в клетки другого зародышевого листка. Син.: пластичность.
Трансплантат [от лат. transplanto — пересаживать] — Совокупность клеток, фрагмент ткани или орган, используемый для пересадки.
Унипотентный [от лат. unos — один и potentia — способность] — Способный дифференцироваться только в одном направлении [в клетки одной линии]. Например: стволовые сперматогенные клетки.
Фетальные стволовые клетки [от лат. fetus — плод] — Стволовые клетки плода, источником которых служит абортивный материал на 9-12 неделях беременности.
Фидер [от англ. feed — кормить] — Слои поддерживающих клеток, необходимых для выживания и функционирования в культуре некоторых типов клеток. Фидер осуществляет метаболические, сигнальные и иммунопротекторные функции.
Хоуминг [от англ. homing — возвращение домой] — Способность клеток мигрировать или «возвращаться» в ткани, из которых они были получены, и интеграция клеток в эти ткани посредством специфических рецепторов хоуминга. Процесс хоуминга включает в себя три этапа: миграцию клеток по кровеносному руслу, их трансмиграцию в ткани через стенки капилляров, и т. н. lodging — удержание клеток в ткани посредством специфических рецепторов.
Эмбриоидные тельца — Структуры, формируемые ЭСК в суспензионнои культуре и имитирующие предимплантационную стадию развития в условиях in vitro.
Энграфтмент — Условное понятие, характеризующее долю трансплантированных клеток, которые избегают гибели в раннем посттрансплантационном периоде, мигрируют в тканевые ниши и осуществляют свойственные им функции.
Ядросодержащие клетки костного мозга — Клетки костного мозга, содержащие цельные, сегментированные или полиморфные ядра.
Статья: Патогенез целлюлита — современный научный взгляд читать
Рыхлая, деформированная, неэластичная кожа в области бедер, ягодиц и живота беспокоит женщин не меньше, чем избыточная масса тела и ожирение. По данным многих авторов, эта проблема встречается у 80-90% женщин в разных странах [11, 24]. Наблюдается определенная закономерность в распространенности целлюлита. Статистика свидетельствует, что женщины азиатского и африканского происхождения менее склонны к развитию целлюлита, чем женщины белой расы. У представительниц стран Средиземноморья и Латинской Америки целлюлит чаще развивается в области ягодиц и бедер, в то время как у жительниц англо-саксонских и северных стран — на животе. Возможно, это связано с национальными традициями в области питания и набором наиболее часто потребляемых продуктов. Многие авторы указывают на то, что наиболее остро проблема целлюлита стоит в тех странах, где употребляют в пищу большое количество насыщенных жиров [12, 23]. В Японии, где заболеваемость целлюлитом минимальна, население потребляет исключительно полиненасыщенные жиры и низкокалорийную пищу. Отмечено, что при изменении образа жизни и переходе на более калорийное питание распространенность целлюлита среди женщин негроидной и монголоидной рас увеличивается. Помимо характера питания существенное значение для формирования целлюлита имеет гиподинамия, которая во многих развитых странах является проблемой, требующей незамедлительного решения. Таким образом, лавинообразный рост заболеваемости целлюлитом обусловлен не только субъективными факторами, такими как растущее внимание к эстетике тела, но и объективными факторами, в частности, изменением характера питания в большинстве стран мира и растущей распространенностью гиподинамии [5, 11, 23].
В Японии, где заболеваемость целлюлитом минимальна, население потребляет исключительно полиненасыщенные жиры и низкокалорийную пищу. Отмечено, что при изменении образа жизни и переходе на более калорийное питание распространенность целлюлита среди женщин негроидной и монголоидной рас увеличивается. Помимо характера питания существенное значение для формирования целлюлита имеет гиподинамия, которая во многих развитых странах является проблемой, требующей незамедлительного решения. Таким образом, лавинообразный рост заболеваемости целлюлитом обусловлен не только субъективными факторами, такими как растущее внимание к эстетике тела, но и объективными факторами, в частности, изменением характера питания в большинстве стран мира и растущей распространенностью гиподинамии [5, 11, 23].
Патогенетические механизмы
Не вызывает сомнений, что с точки зрения патогенеза целлюлит характеризуется триадой признаков: гипертрофией подкожной жировой клетчатки, нарушениями микроциркуляции и уплотнением соединительной ткани.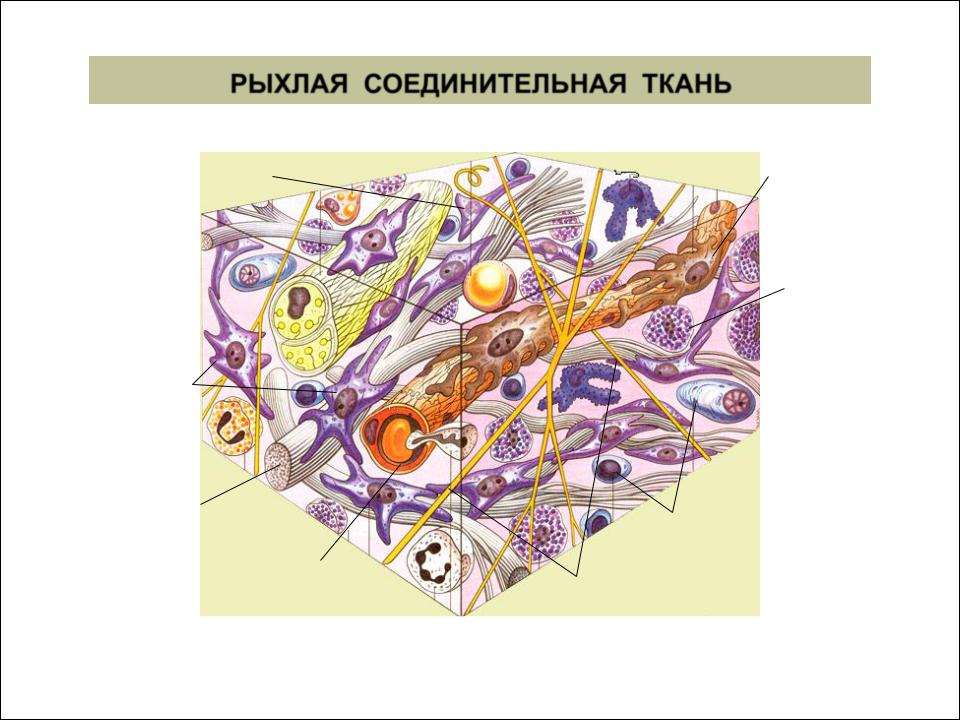 Происходящие при этом изменения на клеточном и функциональном уровнях формируют порочный круг, ведущий к прогрессированию нарушений.
Происходящие при этом изменения на клеточном и функциональном уровнях формируют порочный круг, ведущий к прогрессированию нарушений.
Изменения в жировой ткани
Иногда достаточно сложно разобраться, что же первично при формировании целлюлита: активация липогенеза или дисциркуляторные нарушения, настолько эти процессы взаимосвязаны. Ряд авторов выдвигает на первый план дегенерацию жировых клеток, которая приводит к фиброзу соединительной ткани [2, 14]. Они считают, что первичной при данной патологии является гипертрофия адипоцитов, изменяющая внутриклеточные процессы и нарушающая структуру мембран. Клетки все больше разбухают, соединительнотканные перегородки уплотняются, синтезируется все больше межклеточного вещества — в результате все сильнее затрудняется эвакуация жира из жировой вакуоли.
Жировая ткань как одна из систем организма, участвующих в патогенезе целлюлита, безусловно важна. Основная составляющая жировой ткани у человека — адипоциты, высокоспециализированные клетки, предназначенные для создания запасов энергии и состоящие главным образом из триглицеридов, которые являются наиболее эффективной формой запасания энергии. Вещества, вырабатываемые адипоцитами, обладают разнообразным биологическим действием и могут влиять на активность метаболических процессов в тканях и различных системах организма либо напрямую, либо опосредованно, через нейроэндокринную систему, взаимодействуя с гормонами гипофиза, катехоламинами, инсулином. Жировая ткань вырабатывает множество биологически активных веществ: лептин, фактор некроза опухолей α, интерлейкин-6, свободные жирные кислоты, белок, стимулирующий ацетилирование (ASP), антиактиватора плазминогена 1 (PAI-1), инсулиноподобный фактор роста 1 (IGF-1), ангиотензиноген, эстрогены, простагландины. Увеличение числа или объема адипоцитов происходит вследствие хронического нарушения их метаболизма, то есть нарушения баланса между липолизом и липогенезом. В регуляции липолиза участвуют мембранные рецепторы адипоцитов (α2-,β2- и β3-адренорецепторы), G-белки, гормончувствительная липаза, лептин. Активация α-адренорецепторов стимулирует липогенез, α-адренорецепторов — липолиз. Регуляция липолиза осуществляется через аденилатциклазный механизм: при активации рецепторов происходит превращение АМФ в цАМФ, который, в свою очередь, активирует гормончувствительную липазу, расщепляющую триглицериды. Затем фосфодиэстераза вновь превращает цАМФ в АМФ, блокируя дальнейший липолиз. Норадреналин, обладая высоким сродством к α-адренорецепторам, блокирует липолиз. После того как все α-адренорецепторы оказываются связанными, адреналин связывается с α-адренорецепторами, что приводит к активации аденилатциклазы и стимулирует липолиз. Активность аденилатциклазы повышают также глюкагон, АКТГ, СТГ, гормоны щитовидной железы, вазопрессин. Подавляют липолиз салицилаты и никотиновая кислота. Эстрогены повышают активность ферментов липогенеза, который вызывает гипертрофию адипоцитов, что вместе с фибросклерозом приводит к формированию микро- и макроузлов при целлюлите [17—19, 21, 22].
Исследования показали, что жировая вакуоль адипоцита поверх однослойной фосфолипидной мембраны покрыта особыми белками. Оказалось, что эти белки не только активно участвуют в процессах, связанных с мобилизацией депонированного жира, но и влияют на дифференцировку клеток-предшественников, причем перилипин, белок, окружающий жировую вакуоль зрелого адипоцита, играет в этом очень важную роль. Жировые вакуоли в преадипоцитах окружены другим специальным белком — ADRP (белок, связанный с дифференцировкой адипоцитов, adipose differentiation-related protein). Когда адипоцит созревает, ADRP покидает мембрану вакуоли, и на смену ему приходит перилипин. Именно перилипин препятствует деградации триглицеридов. Если жировые вакуоли продолжают образовываться, они тут же покрываются перилипином. Когда энергия необходима, гормонувствительная липаза гидролизует депонированные триглицериды, но для этого они должны быть ей доступны. Полагают, что с перилипином «договариваются» с помощью фосфорилирования, изменяющего структуру мембраны таким образом,
что триглицериды становятся доступными для гормон-чувствительной липазы [20, 21, 24].
Скорость накопления жира в адипоцитах зависит от интенсивности кровообращения в проблемных зонах. При ускорении кровотока, а точнее при улучшении микроциркуляции, усиливается липолиз, а при ее ухудшении — липогенез. При застойных явлениях в жировой ткани локальная гипертрофия адипоцитов может развиться даже на фоне нормальной массы тела. Если адипоцит теряет связь с микроциркуляторным руслом, жир оказывается запертым в клетках [25].
Вместе с тем имеющиеся на сегодня данные, касающиеся патогенеза целлюлита, позволяют утверждать, что накопление жира в адипоцитах или, точнее, их гипертрофия, не является ведущим патогенетическим моментом. Это подтверждается тем, что признаки целлюлита часто наблюдаются у женщин с нормальной и даже пониженной массой тела. Так, при обследовании нами женщин в возрасте от 19 до 49 лет, предъявляющих жалобы на проявления целлюлита, у 54% был нормальный вес [10]. Наличие целлюлита у женщин, не страдающих ожирением и избыточным весом, свидетельствует о том, что гипертрофия адипоцитов является важным, однако не основным механизмом формирования этой патологии. Кроме того, известно, что при коррекции целлюлита, сопряженного с ожирением, снижение веса за счет уменьшения количества жировой ткани сопровождается визуальным ухудшением течения целлюлита. Только достаточно длительное и упорное лечение позволяет изменить эту картину.
Нарушения микроциркуляции
Состояние микроциркуляторного русла непосредственно связано с состоянием крупных сосудов. Практически все авторы [3, 5, 7, 11, 13] подчеркивают: снижение мышечной активности и сидячий образ жизни ухудшают венозный отток, замедляют циркуляцию лимфы, что и приводит к снижению метаболизма, усилению липогенеза, и, как следствие, развитию целлюлита. Длительная сидячая работа и вождение автомобиля, характерные для многих активно работающих женщин, препятствуют нормальному кровотоку в нижних конечностях, вызывая венозный застой и повреждение капилляров. По нашим данным, заболевания вен и лимфатических сосудов имеются у 56% пациенток с целлюлитом.
Нарушение венозного оттока, застой лимфы ведут к повышению проницаемости сосудистой стенки и выходу плазмы в интерстициальное пространство. Возникающие при этом отек межуточной ткани и гипоксия усугубляют нарушения микроциркуляции, а выделяющиеся при повреждении эндотелия вещества способствуют пролиферации фибробластов и уплотнению соединительнотканных перегородок, которые уже не разграничивают, а сдавливают дольки жировой ткани [2]. От количества крови и лимфы зависит гидростатическое давление в капиллярах, которое в разных органах колеблется от 18 до 40 мм рт. ст. Как правило, оно несколько превосходит онкотическое давление крови (19—21 мм рт. ст.), благодаря чему градиент давления в стенках капилляров направлен в сторону ткани, и фильтрация жидкости преобладает над ее реабсорбцией в плазму. Избыток поступающей в ткань жидкости удаляется через лимфатическую систему. Градиент давления в интерстиции вызывает перемещение жидкости в нем, способствуя доставке в клетки необходимых веществ. Гемодинамические параметры в капиллярах тесно связаны с проницаемостью их стенок, которая зависит от градиента давления и концентрации белков в интерстициальном пространстве и плазме. В свою очередь, физико-химические параметры интерстициального окружения лимфатических капилляров создают условия для лимфообразования и продвижения лимфы.
Лимфатические капилляры, стенки которых образованы эндотелием, выводят из тканей избыток жидкости, белки и продукты обмена. Механизмы перемещения лимфы в капиллярах еще недостаточно ясны, однако доказано, что значительную роль играют сокращения крупных лимфатических сосудов (лимфангионов), имеющих развитую мышечную оболочку. Застой жидкости в просвете сосуда растягивает его стенку, нарушает поступательное продвижение лимфы, а отсутствие сокращений сосудов еще более усугубляет данный патогенетический механизм.
Таким образом, состояние крупных отводящих сосудов, а именно, вен и лимфангионов, непосредственно влияет на микроциркуляцию. Нарушения микроциркуляции наблюдаются у большинства женщин старше 30 лет (особенно рожавших, принимающих гормональные контрацептивы, носящих обувь на высоком каблуке), поэтому возможно, что именно патология венозного кровообращения является ведущим звеном в развитии локальной липодистрофии.
Основные параметры, характеризующие функционирование системы микроциркуляции, определяются состоянием гемодинамики в капиллярах, проницаемостью их стенок, силами, обеспечивающими движение интерстициальной жидкости и лимфы Нарушения микроциркуляции принято делить на сосудистые, внутрисосудистые и внесосудистые. Изменения кровотока, капиллярного давления, функционального состояния сосудистой стенки имеют значение для перфузии тканей. Все нарушения микроциркуляции объединяет одно: в конечном итоге страдает транскапиллярный обмен. Изменения реологических свойств крови играют существенную роль в механизме повреждения тканей и тромбообразовании. На текучесть в системе микроциркуляции влияет и агрегационное состояние тромбоцитов. Ему отводится ведущая роль в тромбообразовании и развитии внутрисосудистой агрегации клеточных элементов.
Изменения в сосудистой стенке обусловлены изменениями местоположения и формы эндотелиальных клеток. Внесосудистые изменения, ведущие к нарушению микроциркуляции, связаны прежде всего с патологическими процессами в периваскулярной ткани. При снижении проницаемости стенок капилляров в первую очередь нарушается перенос биологически активных веществ через базальную мембрану. Изменения в биохимических процессах, водно-солевом обмене и характере окислительно-восстановительных реакций ведут к развитию циркуляторной гипоксии и ухудшению питания органов и тканей. При нарушении проницаемости капилляров существенно страдают пластический обмен и энергетическое обеспечение клеток [3, 4]. Снижение эффективности микроциркуляции проявляется гипоксемией, венозной гипероксией, уменьшением тканевой утилизации кислорода, накоплением молочной и пировиноградной кислот. Микроциркуляторные нарушения приводят к снижению потребления кислорода и аэробной производительности. Все перечисленное в конечном итоге приводит и к нарушениям в системе «липолиз-липогенез». Описаны изменения артериолярных прекапиллярных сфинктеров в области целлюлита, вызывающие рост давления в капиллярах. Рост капиллярного и межуточного давления (вследствие избыточной полимеризации гликозаминогликанов), а также снижение тока плазмы (вследствие сдавления и сжатия сосудов) могут привести к увеличению проницаемости капилляров и венул, а следовательно, к эктазии, отеку дермы и формированию уплотненных перегородок между отдельными адипоцитами и между дольками жировой ткани. Снижение венозного тонуса может происходить параллельно с возрастанием хрупкости капилляров в результате изменений в периваскулярной соединительной ткани, что приводит к разрыву микрососудов и микрокровотечениям [13, 14, 16, 21].
Текучесть крови в сосудах зависит от состава плазмы, характера кровотока в микрососудах (турбулентный или ламинарный), пластичности и деформируемости эритроцитов, склонности клеток к агрегации. Известно, что гиперлипидемия влияет на состояние стенок сосудов, свертываемость крови, микроциркуляцию и перфузию органов [9]. Текучесть крови в микрососудах во многом определяется белковолипидным составом плазмы. При высокой концентрации липопротеинов в плазме кровоток в сосудах малого диаметра становится прерывистым, турбулентным. При гиперлипидемии возрастает содержание холестерина в мембранах эритроцитов, увеличивается их размер, они становятся менее пластичными, ухудшается их способность менять свою форму при прохождении через капилляры, возрастает вязкость крови, увеличивается агрегация эритроцитов [1]. Изучение микроциркуляции у лиц с гиперлипидемией выявило как функциональные нарушения капиллярного кровотока (замедление тока крови, его «зернистость», образование микроагрегатов, застой крови, микротромбозы), так и морфологические изменения самих капилляров (скрученность, неравномерность диаметра, микроаневризмы, запустевание с выключением тока крови).
Гиперлипидемия сопровождается уменьшением артериовенозной разницы по кислороду и свидетельствует об ухудшении утилизации кислорода в периферических тканях. При гиперлипидемии нарушается способность эндотелия вырабатывать эндотелиальный фактор расслабления сосудов — окись азота. Кроме того, гипоксия, которую испытывают клетки эндотелия в условиях гиперлипидемии, ведет к усиленной продукции эндотелина, сильного вазоконстриктора и антагониста окиси азота, что в итоге приводит к нарушению микроциркуляции [9].
Для целлюлита характерны нарушения гемореологии. Нарушения в клеточном звене выражаются в повышенной агрегации тромбоцитов и эритроцитов, снижении деформируемости эритроцитов. Повышение агрегационной способности тромбоцитов приводит к гиперкоагуляции, усиливает пристеночное микротромбообразование и нарушает микроциркуляцию. Это, в свою очередь, препятствует нормальной утилизации кислорода тканями и ведет к нарушениям метаболизма с преобладанием анаэробных процессов гликолиза; с другой стороны, стимулируется выброс тканевого тромбопластина, который увеличивает уровень фибриногена и усиливает коагуляцию.
Компенсаторной реакцией, препятствующей дальнейшему тромбообразованию, является усиление фибринолиза. У пациенток с целлюлитом отмечено повышение вязкости крови на разных скоростях сдвига, увеличение гематокрита. Анализ данных коагулограммы показывает наличие синдрома гиперкоагуляции, так как достоверно снижается время рекальцификации плазмы, повышается уровень фибриногена, снижаются фибринолитическая активность плазмы и толерантность плазмы к гепарину [1, 10]. Исследования микроциркуляции, проводимые с помощью лазерной допплеровской флоуметрии, позволяют оценить функциональную активность микрососудов. Выделяют два типа нарушений: атонический и спастический типы микроциркуляции.
По-видимому, на начальных стадиях развития целлюлита происходят снижение тонуса артериол, значительное повышение внутрисосудистого сопротивления, развивается незначительный венозный застой, застой в капиллярном звене микроциркуляции; пассивные механизмы регуляции микроциркуляции преобладают над активными. Кровенаполнение капилляров на начальных стадиях, с одной стороны, обеспечивает адекватную трофику тканей, а с другой стороны, переполнение капиллярного русла запускает патогенетические механизмы развития целлюлита (расширение капилляров, транссудация плазмы в окружающие ткани, развитие отека, задержка жидкости в тканях, сдавливание окружающих тканей). При прогрессировании целлюлита формируется спастический тип микроциркуляции, характеризующийся повышением тонуса артериол, ростом внутрисосудистого сопротивления, более выраженным венозным застоем, преобладанием активных механизмов регуляции кровотока, существенным снижением базального кровотока, недостаточным кровенаполнением в капиллярном звене. Недостаток кровенаполнения в капиллярном звене может приводить к гипоксии, активации фибробластов и развитию фибросклероза, что характерно для третьей и четвертой стадий целлюлита. Более выраженные явления венозного застоя, чем у пациентов с атоническим типом, свидетельствуют о значительных нарушениях и декомпенсации венулярного звена микроциркуляции.
Окислительный стресс
Рядом авторов изучались изменения параметров окислительных процессов и антиоксидантной защиты и их влияние на микроциркуляцию. Определялось содержание в крови продуктов перекисного окисления липидов: диеновых конъюгатов, малонового диальдегида, а также активность эластазы, уровни α1-антитрипсина, α2-макроглобулина. В результате выявлено усиление процессов свободнорадикального окисления у пациентов с целлюлитом. Отмечалось повышенное содержание диеновых конъюгатов, повышенная активность эластазы при сниженном уровне ее ингибитора (α1-антитрипсина) и повышенном уровне α2-макроглобулина, поступающего из интерстиция в кровь при увеличении сосудистой проницаемости. Все это свидетельствует о большой интенсивности процессов перекисного окисления липидов в крови у пациентов с целлюлитом [10].
Был оценен уровень окислительного стресса при целлюлите по содержанию в тканях продукта перекисного окисления липидов — малонового диальдегида, а также продуктов перекисного окисления белков — карбонильных групп. В качестве показателей состояния антиоксидантной системы были выбраны уровни общего, окисленного и восстановленного глутатиона, церулоплазмина, супероксиддисмутазы, общих антиоксидантов. Обнаружено снижение уровней одних антиоксидантов при повышении уровней других, благодаря чему сохраняется общая активность процессов свободнорадикального окисления, что жизненно важно для структурного гомеостаза. Таким образом, полученные данные свидетельствуют о нарушениях в системе перекисного окисления липидов и развитии окислительного стресса у женщин с целлюлитом [6].
Изменения в соединительной ткани
Третий фактор, участвующий в патогенезе целлюлита, — соединительная ткань. Считается, что активация фибробластов, вызываемая эстрогенами, является причиной избыточной полимеризации гликозаминогликанов в дерме и периваскулярной соединительной ткани, что увеличивает их гидрофильность и межуточное осмотическое давление. Повышение уровня эстрогенов и гормонов щитовидной железы (Т3, Т4) способствует накоплению в тканях гиалуроновой кислоты, которая связывает молекулы воды, а следовательно, способствует усилению отека. Задержка воды (отек) и увеличение вязкости межклеточной жидкости приводят к деформации клеток и сдавлению сосудов, провоцируя тканевую гипоксию. Гипоксия вызывает изменение аэробного метаболизма глюкозы, в результате чего возрастает выработка молочной кислоты. Это активизирует пролингидроксилазу – фермент, который облегчает превращение пролина в гидроксипролин в проколлагене с последующим ростом синтеза коллагена. Накопление в тканях коллагеновых волокон сопровождается уменьшением количества эластина и межуточного вещества, изменениями в соотношении протеогликанов и гликопротеинов, что приводит к уменьшению проницаемости соединительной ткани, торможению репарации, снижению тургора и эластичности кожи. Качественные и количественные изменения коллагена провоцируют фибросклероз в междолевых соединительнотканных перегородках. Таким образом, формируются микроузлы, которые видны на поверхности кожи и определяются на ощупь.
Гормональный дисбаланс
Усугублению микроциркуляторных нарушений способствует гормональный дисбаланс: снижение уровня прогестерона, повышение уровня андрогенов и альдостерона. Альдостерон усиливает реабсорбцию натрия в почечных канальцах, при этом стимулируется выработка вазопрессина, происходит резорбция воды, увеличивается объем циркулирующей плазмы. Остается дискуссионным вопрос о непосредственном участии в патогенезе целлюлита половых гормонов. Большинство авторов указывают на влияние эстрогенов и прогестерона, продуцируемых яичниками. Большое значение имеет внегонадный синтез эстрогенов. В определенный период жизни его роль является определяющей, при этом большинство эстрогенов синтезируется в жировой ткани. Активность ароматазы жировой ткани зависит от топографического расположения жира. В подкожной жировой ткани бедренно-ягодичной области отмечается в 4 раза более высокая активность ароматазы, чем в подкожной жировой ткани живота. Кожа очень чувствительна к воздействию женских половых гормонов благодаря имеющимся в ней специфическим рецепторам. Эстрогены подавляют секреторную активность сальных желез, повышают уровень гиалуроновой кислоты в дерме, что способствует увеличению количества межклеточной жидкости и превращению растворимого коллагена в нерастворимый. Снижение уровня прогестерона при одновременном повышении уровня андрогенов способствует задержке жидкости, снижению скорости синаптической передачи, в частности, через β-адренорецепторы. Вместе с тем данные о влиянии женских половых гормонов на процесс формирования целлюлита носят характер теоретических предположений и пока не получили достаточного научного подтверждения [11, 16—18].
Заключение
Исходя из описанных механизмов формирования целлюлита, любые мероприятия, направленные на его коррекцию, должны учитывать как характер нарушений микроциркуляции, выраженность жировых отложений и изменений в соединительной ткани, так и стадию процесса. Мезотерапия имеет в своем арсенале широкий набор средств, позволяющих воздействовать на патогенетические механизмы формирования целлюлита, и, безусловно, является эффективным методом его коррекции.
Литература
- Болотова Л. Г., Турова Е. А., Кошелева И. В. Комплексное применение физических факторов (кислородно-озоновой терапии и электромиостимуляции) в коррекции отечнофибросклеротической панникулопатии. // Вопросы курортологии, физиотерапии и лечебной физической культуры, 2007, № 1. С. 24—26.
- Блашмезон Ф. Методы оценки целлюлита: индекс удержания воды и Celluscore.// Эстетическая медицина, 2005, № 5. С. 89—94.
- Ерофеев Н. П., Орлов Р. С. Лимфатическая система — необходимый элемент жидкостного гомеостаза организма человека: новый взгляд на старые проблемы. // Вестник Санкт-Петербургского университета, 2008, сер.11, №4 С. 78—86.
- Капилевич Л. В., Ковалев И. В., Баскаков М. Б., Медведев М. А. Внутриклеточные сигнальные системы в эпителий- и эндотелийзависимых процессах расслабления гладких мышц. // Успехи физиологических наук, 2001, № 2. С. 88—98
- Королькова Т. Н. Патогенетические аспекты гиноидной липодистрофии. // Экспериментальная и клиническая дерматокосметология, 2005, № 4. С. 49—60.
- Королькова Т. Н., Полийчук Т. П. Изучение показателей оксидативного стресса при кислородно-озоновой терапии локальных жировых отложений. // Клиническая дерматология и венерология, 2009, № 2. С. 37—42.
- Кошевой Е. Г. Динамика микроциркуляции кожи у пациентов с гиноидной липодистрофией под действием вибровакуумтерапии. // Материалы II Международного конгресса «Восстановительная медицина и реабилита-
ция», 20—21 сентября 2005 г., М., 2005. С. 48. - Крупаткин А. И., Сидоров В. В. Лазерная допплеровская флоуметрия микроциркуляции крови. Руководство для врачей. — М.: Медицина, 2005.
- Липовецкий Б. М. Клиническая липидология. — СПб.: Наука, 2000.
- Минина А. П., Турова Е. А., Болатова Л. Г. и др. Применение лазерной допплеровской флоуметрии для оценки микроциркуляции у пациентов с отечно-фибросклерозирующей панникулопатией. // Ангиология и сосудистая хирургия, 2004, № 3. С. 46—49.
- Михеева С. В. Распространенность и факторы риска формирования целлюлита. // Общественное здоровье и здравоохранение. Сборник научных трудов. СПб., 2000. С. 11—12.
- Михеева С. В. Локализация целлюлита у женщин. // Актуальные проблемы санитарноэпидемиологического благополучия населения Северо-3ападного региона. Материалы научнопрактической конференции. СПб., 2000. С. 173.
- Поленов С. А. Основы микроциркуляции. // Региональное кровообращение и микроциркуляция, 2008, № 1. С.5—19.
- Раннева Е. А., Зубкова С. А., Мовчан В. Н. Современные инструментальные методы диагностики целлюлита. // Экспериментальная и клиническая дерматокосметология, 2007, № 4. С. 48—51.
- Станишевская Т. И. Основные типы микроциркуляции крови и частота их встречаемости у девушек юго-восточного региона Украины. // Ученые записки Таврического национального университета им. В. И. Вернадского. Серия
«Биология, химия», 2005, № 1. С. 131—141. - Турова Е. А., Болатова Л. Г., Минина А. П. Об этиологии и патогенезе целлюлита. // Вестник эстетической медицины, 2008, № 4. С. 23—31.
- Чубриева С. Ю., Глухов Н. В., Зайчик А. Ю. Жировая ткань как эндокринный регулятор (обзор литературы). // Вестник Санкт-Петербургского университета, 2008, сер. 11, вып. 1. С. 32—42.
- Avram M. M. Cellulite: a review of its physiology and treatment. // J Cosmet Laser Ther, 2004, 6. 181—185.
- Bastard J. P., Maachi M., Lagathu C. et al. Recent advances in the relationship between obesity, infl ammation and insulin resistance. // Eur Cytokine Netw, 2006, 17. 4—12.
- Hexsel D. M., Abreu M., Rodrigues T. C. et al. Side-by-side comparison of areas with and without cellulite depressions using magnetic resonance imaging. // Dermatol Surg, 2009, 35. 1471—1477.
- Khan M. H., Victor F., Rao B., Sadick N. S. Treatment of cellulite: Part I. Pathophysiology. // J Am Acad Dermatol, 2010, 62. 361—370.
- Lupi O., Semenovitch I. J., Treu C. et al. Evaluation of the eff ects of caff eine in the microcirculation and edema on thighs and buttocks using the orthogonal polarization spectral imaging and clinical parameters. // J Cosmet Dermatol, 2007, 6.102—107.
- Milani G. B., Natal Filho A., Amado Joao S. M. Correlation between lumbar lordosis angle and degree of gynoid lipodystrophy (cellulite) in asymptomatic women. // Clinics (Sao Paulo), 2008, 63. 503—508.
- Quatresooz P., Xhaufl aire-Uhoda E., Pierard-Franchimont C., Pierard G. E. Cellulite histopathology and related mechanobiology. // Int J Cosmet Sci, 2006, 28. 207—210.
- Smalls L. K., Hicks M., Passeretti D. et al. Eff ect of weight loss on cellulite: gynoid lypodystrophy. // Plast Reconstr Surg, 2006, 118. 510—516.
Гипермобильность суставов при синдроме недифференцированной соединительнотканной дисплазии Текст научной статьи по специальности «Клиническая медицина»
Интегральный показатель (ИП), харак теризующий качество жизни по всем шкалам здоровья у лиц с ДСТ равнялся 2,57±0,05, что входило в интервал нормы (норма Р16_Р84 _ 2,31-2,77). В контрольной группе ИП также соответствовал критериям нормы — 2,52± 0,04. В группе лиц с ДСТ интегральный показатель был понижен и резко понижен у 27,3%, в контрольной группе — у 15,1% (р<0,05), повышен и резко повышен — соответственно у 27,3% и 15,1% (статистически значимых различий между группами не выявлено). У мужчин с ДСТ средний показатель ИП был равен 2,64±0,06, у лиц контрольной группы — 2,67±0,05. В контрольной группе пониженный и резко пониженный ИП имел место у 7,1%, в группе с ДСТ — ни у одного. У женщин с ДСТ средний показатель ИП был равен 2,54±0,01, у лиц контрольной группы — 2,47±0,06, что также входило в интервал нормы. В группе с ДСТ пониженный и резко пониженный ИП был у 37,5% женщин, тогда как в контрольной группе — у 17,9% (р<0,05), повышенный и резко повышенный — соответственно у 25% и 10,3% (статистически значимых различий между группами не выявлено).
ВЫВОДЫ
1. Показатели качества жизни, оцениваемые по всем шкалам здоровья, в основной и контрольной группах находились в интервале нормы.
2. Среди лиц с ДСТ пониженное общее восприятие здоровья встречалось чаще, чем в контрольной группе.
3. Лиц с пониженной социальной активностью и психическим здоровьем в группе женщин с проявлениями ДСТ было больше, чем в противоположной группе.
4. В группе с ДСТ интегральный показатель здоровья был ниже.
5. Лица с ДСТ нуждаются в оптимизации двигательной активности, психологической коррекции и социальной поддержке, несмотря на нормальные показатели качества жизни.
ЛИТЕРАТУРА
1. Земцовский Э.В. Соединительнотканные дисплазии сердца. — СПб, 1998.
2. Клеменов А.В. Недифференцированная дисплазия соединительной ткани: клинические проявления, возможности диагностики и патогенетического лечения. — М., 2005.
3. Яковлев В.М. Кардиореспираторные синдромы при дисплазии соединительной ткани. — Омск, 1994.
УДК 616. 72 — 018. 2 — 007. 17 — 07
ГИПЕРМОБИЛЬНОСТЬ СУСТАВОВ ПРИ СИНДРОМЕ НЕДИФФЕРЕНЦИРОВАННОЙ СОЕДИНИТЕЛЬНОТКАННОЙ
ДИСПЛАЗИИ
Ю.В. Пономаренко
Владивостокский государственный медицинский университет
Поражение костно-мышечной системы является одним из ведущих среди синдромов дисплазии соединительной ткани (ДСТ). В разделе суставно-костно-хряще-вых соединительнотканных дисплазий рассматриваются плоскостопие, «сандале-видная» стопа, Х- и О-образное искривление ног, арахнодактилия, гипермобильность суставов [5]. В течение многих лет врачи не воспринимали гипермобильность суставов (ГМС) всерьёз, считая её проявления курьёзом, ведь все лабораторные показатели у таких больных были нормальными. Лишь биопсия кожи выявляла нарушения на биохимическом уровне и заставила по-другому взглянуть на распространённое в популяции состояние [1]. Широкое ознакомление практических вра-
чей в конце ХХ века с синдромом недифференцированной соединительнотканной дисплазии (НСТД) почти отождествило эти понятия (НСТД = ГМС), так как проявления разболтанности суставов использовались как критерии диагностики. Из проблемы, волновавшей почти исключительно ревматологов (поражение суставного и связочного аппарата), ГМС постепенно превратилась в состояние, требующее постоянного наблюдения со стороны терапевтов и врачей смежных специальностей с целью как дифференциально-диагностической, так и лечебной. При этом, как это присуще синдромам, ГМС может протекать либо вполне самостоятельно (семейная доброкачественная гипермобильность суставов [4]), либо в составе опре-
60
20 10 0
Частота ГМС при ДСТ.
делённых заболеваний/синдромов (НСТД, Марфана, Элерса-Данлоса и др.). Семейная «разболтанность» суставов достаточно распространена в популяции и достигает 2-23,7% от всего населения [1, 2, 4]. При этом синдром чаще встречается в детском и подростковом возрасте, у женщин и лиц определённых профессий (балерины, гимнасты и др.). С возрастом уменьшаются количество вовлечённых суставов, выраженность проявлений ГМС, процент страдающего населения. Начиная с пятого десятилетия частота ГМС резко снижается [2]. Естественно, что указанная зависимость распространённости синдрома от возраста делает важным вопрос: может ли он использоваться в качестве критерия ДСТ? Это побудило провести нас данное исследование.
Всего было осмотрено 263 студента 4-6-х курсов Владивостокского государственного медицинского университета. Среди них было 175 (66,5%)лиц женского пола. Возраст обследованных колебался от 17 до 39 лет (медиана — 21 год; 2025 лет — 5-95 перцентили). В качестве критериев ГМС использована шкала P. Beigh-ton (1983), корректированная А.Г. Беленьким [2], согласно которой к лёгким формам относили сумму баллов от 1 до 3, к умеренным проявлениям разболтанности суставов — от 4 до 6 и к выраженным — от 7 до 9 баллов. Проводились ЭКГ, спирография, эхокардиография, УЗИ органов брюшной полости, почек. Заполнялись карты по специально разработанной схеме, включавшие 43 проявления, которые могли бы быть ассоциированы с НСТД. По результатам обследования здоровыми признаны 24 человека (контрольная группа). У остальных 70 человек обнаружены
проявления пролапса митрального клапана (ПМК) в сочетании с висцеральной патологией (1-я группа), напоминающие MASS-синдром, у 138 — только висцеральные проявления ДСТ без ПМК (2-я), лица с минимальным ПМК и/или МАРС без висцеральных поражений (т.н. изолированная «соединительнотканная дисплазия сердца» [3]).
Синдром гипермобильности суставов был определён у 89 (33,8%) человек. При этом к ГМС относили только случаи умеренных и выраженных его проявлений (4 балла и более), так как лёгкие проявления (1 -3 балла) признаются вариантом нормы. Если же к обследованным добавить лиц, с суммой баллов от 3 и выше (как изначально рекомендовано P. Beigh-ton), то частота встречаемости ГМС возрастёт до 41,4%.
По наличию ГМС преобладали женщины (85,4 против 14,6% у мужчин; р<0, 001). Тест корреляции Спирмена выявил зависимость проявлений разболтанности суставов от пола (г = 0,27; р<0,001). Распределение синдрома в группах представлено на рисунке.
Хорошо видно, что выраженные формы ГМС (7 баллов и более) преобладают в 1 и 2-й группах, уменьшаются в 3-й и отсутствуют в группе сравнения (контроля). Следовательно, лишь выраженные проявления разболтанности суставов могут служить маркером НСТД, хотя их частота невысока — 11,3% (27/239 случаев). Чем больше висцеральных поражений, тем выше вероятность появления ГМС, что логично, так как именно гиперэластичность соединительнотканных элементов приводит к многообразной патологии костно-мышечной ткани.
Лёгкие и умеренные признаки синдрома встречались во всех группах. Причём отмечена интересная закономерность: чем они легче, тем больше вероятность того, что ГМС носит преходящий характер («юве-нильная разболтанность суставов»). Умеренная выраженность синдрома была примерно одинакова во всех группах.
ВЫВОДЫ
1. Гипермобильность суставов в лёгких проявлениях (1-3 балла по шкале Р. Beighton) является вариантом нормы и достаточно часто встречается у здоровых лиц молодого возраста (до 33% в нашем исследовании).
2. Проявления «разболтанности» суставов преобладают у лиц женского пола
(примерно 5,8:1 по отношению к мужчинам).
3. При синдроме недифференцированной дисплазии в качестве критерия могут учитываться случаи выраженной ГМС -от 7 баллов и выше, которые не встречаются в группе контроля.
ЛИТЕРАТУРА
1. Беленький А.Г. // Леч. врач. — 2001. — № 5-6. -С. 78-80.
2. Беленький А.Г., Галушко Е.А. // Тер. арх. — 2002. — № 5. — С. 15-19.
3. Земцовский Э.В. Соединительнотканные дисплазии сердца. Изд. 2-е., доп. — СПб, 2000.
4. Кадурина Т.И. Наследственные коллагенопатии. -СПб, 2000.
5. Яковлев В.М., Карпов Р.С., Бакулина Е.Г. Соединительнотканная дисплазия костной ткани. -Томск, 2004.
УДК 616. 712 — 007. 24 — 018. 2 — 007. 7
ВОРОНКООБРАЗНАЯ ДЕФОРМАЦИЯ ГРУДНОЙ КЛЕТКИ: СОВРЕМЕННОЕ СОСТОЯНИЕ ПРОБЛЕМЫ
Г.И. Нечаева, С.Л. Морозов, Д.В. Черкащенко Омская государственная медицинская академия
Диспластические деформации грудной клетки привлекают внимание многих специалистов: интерес к этой проблеме обусловлен прежде всего существованием многочисленных методов лечения и коррекции. Именно разнообразие подходов к лечению этих больных позволяет утверждать, что оптимальные методы на сегодня отсутствуют [1, 2]. Воронкообразная грудь является наиболее частой деформацией грудной клетки — по данным различных авторов, у 0,6-2,3 % населения. Анатомическое и клиническое описание воронкообразной деформации грудной клетки -ВДГК (грудь сапожника, pectus exca-vatum) было сделано в конце XVI века и опубликовано в виде эссе Sterni cum costis as internia reflexis spirandi difficultatis causa знаменитым анатомом и врачом Bauhinus. Первая операция по поводу ВДГК была произведена в 1911 г. Ludwig Meyer, который резецировал реберные хрящи. В настоящее время известно более 50 методик стернохондропластики и различных её модификаций, что свидетельствует об отсутствии единого мнения о наиболее рациональном виде операции, а также при решении вопроса о показаниях к хирургическому вмешательству.
ВДГК представляет собой различное по форме и глубине искривление грудины и
передних отделов ребер, приводящее к уменьшению объема грудной клетки, сдав-лению и смещению органов средостения, вызывающее функциональные нарушения со стороны сердечно-сосудистой и дыхательной систем, проявляющееся косметическими дефектами различной выраженности [2].
По современным представлениям, ВДГК является локальным проявлением хондродисплазии или переходной стадией синдрома Марфана. Возникновение диспластических изменений хряща связано с патологией ферментов, обеспечивающих катаболизм гликозаминогликанов основного вещества соединительной ткани. Так, в реберных хрящах при ВДГК обнаружено уменьшение содержания хон-дроитин-4- и хондроитин-6-сульфатов, что может быть обусловлено снижением активности фермента хондроитинсульфат-трансферазы либо ферментов синтеза «активного сульфата». Выявлены выраженное перераспределение между содержанием гликозаминогликанов и гликопроте-идов в сторону увеличения последних, изменение типажа коллагена в виде появления III и IV его типов, не встречающихся в полноценном хряще, а также повышение содержания и перераспределение в клеточном матриксе V типа кол-
2. «Казанский мед. ж.», № 5, приложение.
17
Простая киста кости (солитарная или однокамерная киста кости) — заболевание, представленное однокамерной полостью, заполненной прозрачной или кровянистой жидкостью. Основная локализация — проксимальные части (метафизы, вблизи эпифизарной пластинки роста) плечевой (около 50%) и бедренной (около30%) костей, значительно реже поражаются нижние метафизы длинных костей и другие кости. Несколько чаще встречаются у лиц мужского пола. Поражение развивается у больных различных возрастных групп, но в основном в детском и юношеском возрасте. Однокамерная киста кости, по-видимому, образуется в результате временного прекращения формирования кости (в результате внутрикостной гематомы, обструкции лимфатических или венозных сосудов и др.) эпифизарной пластинкой роста. По мере удлинения кости киста смещается от эпифизарной пластинки роста в сторону диафиза.
Клиническая картина. Чаще протекает бессимптомно; патологические переломы в области кисты.
Рентгенологически очаг просветления в костномозговом канале с чёткими границами.
Патоморфология.
Макроскопически стенка кисты представлена фиброзной тканью белесоватого или красновато-коричневого цвета; прилежащая кортикальная кость истончена, напоминает яичную скорлупу, легко режется ножом.
Микроскопия. Соединительнотканная строма, содержащая фибробласты, гистиоциты, ксантомные клетки, отдельные остеокластоподобные клетки, костные трабекулы реактивного характера (ориентированы параллельно поверхности кисты), микрокровоизлияния.
Дифференциальная диагностика. Аневризмальная киста кости.
Лечение. При маленьких кистах – аспирационное лечение; при больших кистах с нарушением структурной целостности кости – кюретаж с замещением костного дефекта.
Исход благоприятный; после кюретажа возможно рецидивирование (15%случаев).
Структурная динамика адгезивных клеток костного мозга при культивировании. Часть 2: первый пассаж.
Исследована морфология и структурная динамика адгезивных клеток костного мозга человека после первого рассева первичной культуры (культивированных в виде адгезированного монослоя на плотном субстрате стеклянного или пластикового дна культурального флакона). Выявлены визуализируемые структурные изменения, которые приобретают клетки в искусственных условиях in vitro, прослежена их динамика при переходе от первичной культуры к клеточной линии. Охарактеризованы адгезивные клетки на разных этапах культивирования: 1) во взвеси перед рассевом, после их открепления от подложки и округления; 2) при прикреплении к дну флакона и распластывании; 3) при образовании монослоя. Наиболее выраженными структурными изменениями являются выпячивания или складчатость клеточной мембраны, образующиеся у культивируемых клеток после открепления от дна культуральных флаконов и помещения в питательную среду во взвешенном состоянии. Наблюдалось значительное обводнение клеточного матрикса. В больших выпячиваниях мембраны клеточный матрикс отсутствовал. Динамика структурных изменений культивируемых клеток оценивалась методом светооптической микроскопии с помощью дифференциального интерференционного контраста по Номарскому и документировалась автоматической цифровой цейтраферной съемкой в условиях культурального инкубатора, интегрированного с инвертированным микроскопом. Для визуализации клеточных структур вне пределов разрешающей способности светового микроскопа использовалась трансмиссионная электронная микроскопия. Выявленное многообразие структурных форм адгезивных клеток на дне культурального флакона может быть связано с присутствием в составе костного мозга разных соединительнотканных дифферонов.
Введение
Адгезивные клетки костного мозга являются объектом внимания многих исследователей на протяжении нескольких десятилетий [1–5]. Автоматическая цейтраферная съемка этих клеток с помощью дифференциального интерференционного контраста (ДИК) по Номарскому позволяет исследовать их морфологическую динамику при культивировании. При исследовании адгезивных клеток костного мозга человека в первичной культуре было выявлено наличие нескольких групп клеток с характерной морфологией, отличающей их друг от друга [6]. Большинство прикрепленных клеток не делилось, хотя их структура все же незначительно изменялась в процессе наблюдения. Митозы наблюдались только у небольшой части адгезивных клеток, имеющих свои морфологические особенности, позволяющие распознать их после распластывания на дне флакона. Представлена светооптическая визуализация детальной динамики этапов их деления. В ходе пролиферации эта небольшая часть клеток постепенно становилась преобладающей и формировала конфлюэнтный (сплошной) монослой. При этом неделящиеся адгезивные клетки сохранялись в составе культуры.
После формирования сплошного монослоя в клетках начинали накапливаться более крупные вакуоли. Очевидно, при этом росла секреторная активность клеток, так как в культуральной среде увеличивалась концентрация коллагена и гликоконъюгатов.
При дальнейшем культивировании количество клеток росло и, соответственно, увеличивалась плотность их расположения на дне флакона. На этом этапе пролиферация клеток замедлялась. Для дальнейшего наращивания клеточной массы и поддержания процесса деления производился пересев (пассаж) выращенной клеточной культуры из одного в несколько культуральных флаконов.
Целью второй части работы являлось исследование структурной динамики адгезивных клеток (собственно соединительнотканных клеток (ССК)) первичной культуры костного мозга человека после субкультивирования и перехода (образования) в клеточную линию.
Материал и методы
В работе использовали вторичные культуры клеток костного мозга человека. Первичная культура, полученная от здоровых доноров, подписавших добровольное информированное согласие, была исследована нами ранее [6]. Мы продолжили исследования этого же клеточного материала при дальнейшем культивировании уже клеточной линии. После диссоциации (открепления) клеток монослоя 0,25% раствором трипсина с солями Хенкса (ПанЭко, Россия) от дна флакона открепленные клетки в виде суспензии пересевались в культуральную посуду с питательной средой для дальнейшего культивирования (среда ДМЕМ с глутамином (ПанЭко, РФ), 10% фетальной телячьей сывороткой крови (HyClone, США), пенициллин-стрептомициновой смесью). Флакон с культуральной средой и внесенными клетками костного мозга помещался на предметный столик инвертированного светооптического микроскопа Nikon Eclipse Ti (Япония), интегрированного с культуральным инкубатором, постоянно поддерживающим температуру 37°С. При исследовании использовался специальный объектив ×10 и модулирующий контраст Хаффмана. Изображение подавалось через фотокамеру на специализированный контроллер и далее на персональный компьютер. Автоматическая цейтраферная съемка с постоянно поддерживаемой автофокусировкой проводилась с помощью программного обеспечения «НИС-Элемент» (NIS-Elements Nikon) с интервалом 5 мин. в течение 2–4 нед. Начиналась съемка через 0–12 ч. после посева и смены культуральной среды. Отдельные периоды культивирования регистрировались в виде цейтраферной съемки с интервалом 20 с. и фокусировкой в ручном режиме. Общее объективное увеличение составляло ×90, на экране контроллера – ×800. Наблюдение производили с помощью ДИК по Номарскому. Условием использования указанного метода является наличие стеклянного дна толщиной 0,17 мм (покровное стекло) и стеклянной верхней части культурального флакона – толщина обычного предметного стекла. В связи с отсутствием в продаже флаконов с вышеуказанными требованиями нами использовались флаконы собственной конструкции. В некоторых флаконах культуры клеток фиксировались и окрашивались по Романовскому – Гимзе. Для ультраструктурного анализа часть полученных клеток на разных этапах культивирования исследовалась с помощью электронной трансмиссионной микроскопии.
Результаты и обсуждение
Открепление клеток полученного ранее монослоя первичной культуры от дна флакона осуществлялось посредством трипсинизации. В ходе этого процесса клетки при отрыве от подложки сокращались, вокруг них появлялся «ореол» из тонких нитей, идущих в виде лучей от тела клетки. Далее клетки приобретали шаровидную или округлую форму, нити постепенно отрывались от дна флакона, сокращались и приобретали вид мелких округлых глыбчатых образований, расположенных на поверхности клеток и на дне флакона. Вероятно, эти нити являлись остатками вещества (возможно белково-гликопротеидной природы), с помощью которого клетки прикреплялись к дну флакона (рис. 1).
Похожий процесс происходил у клеток, готовящихся к делению, но в этом случае они никогда не отрывались от дна флакона полностью, оставаясь фиксированными за счет нескольких отростков. Открепленные и округлившиеся в суспензии клетки клеточной линии после субкультивирования (первого пассажа) были более однородны по морфологии, по сравнению с выделенными из костного мозга клетками первичной культуры. Их эквивалентный диаметр составлял 12–25 мкм.
Перенесенные в новые флаконы со свежей питательной средой клетки некоторое время находились во взвешенном состоянии. На их поверхности можно было наблюдать формирование выраженного рельефа, образованного большим количеством мелких и крупных выпячиваний цитоплазматической мембраны (ЦПМ) округлой формы (пузырьковых псевдоподий), а также многочисленных складок мембраны (рис. 1А). Более крупные выпячивания, или «блеббы» [7], постоянно то увеличивались, то уменьшались в размерах, как бы «пульсировали», порой полностью исчезая в одном месте ЦПМ и появляясь в другом. Очевидно, выпячивания или складки являются своеобразной формой укладки цитоплазматической мембраны после открепления клетки от дна флакона, сокращения и округления (рис. 1А, Б). На ТЭМ видно, что часть выпячиваний небольшого размера заполнена мелкогранулярным материалом средней электронной плотности (рис. 1В). Другие выпячивания, напротив, были свободны от каких-либо структурных элементов клетки, определяемых с помощью контрастирования. В некоторых местах наблюдалось «отслоение» или отделение ЦПМ от структурной части цитоплазмы (внутриклеточного матрикса) (рис. 1В). Общим для всех клеток, находящихся во взвешенном состоянии, являлось наличие в цитоплазме большого количества вакуолей разного размера, внутри которых отсутствовали какие-либо структуры цитоскелета и органеллы. Часть таких вакуолей непосредственно прилежала к ядерной мембране. Отдельные участки цитоплазмы на электроннограммах выглядели структурно разреженными.
В центральной части цитоплазмы кроме вакуолей содержался мелкогранулярный материал средней электронной плотности в виде отдельных гранул, а также их агрегатов – цепочек или конгломератов неопределенной формы (рис. 1В). Встречались овально-округлые структуры с электронноплотным содержимым, размером 0,1–1,0мкм. В цитоплазме было невозможно четко идентифицировать какиелибо органеллы (митохондрии, лизосомы, аппарат Гольджи, ГЭР и др.). В ядрах таких клеток хроматин был представлен в виде отдельных мелких гранул или их небольших скоплений, которые разделялись друг от друга относительно большими свободными пространствами. Хроматин в таких формах отличается от классического ТЭМ-изображения хроматина в ядрах клеток тканей. Он не похож ни на эухроматин (диффузный хроматин), ни на гетерохроматин (конденсированный хроматин).
Прикрепление клеток к дну флакона после пассирования начиналось через 10–15 мин., а через 2–3 ч. почти все клетки были уже прикреплены, уплощены или частично распластаны. Эти процессы взаимодействия с подложкой происходили достаточно быстро, тем не менее, в них можно выделить несколько этапов. Сначала «плавающие» клетки контактировали с дном флакона в нескольких местах посредством выпячиваний цитоплазматической мембраны (рис. 1А). Эти области контакта расширялись, одновременно с появлением по периферии клетки других локусов взаимодействия с дном флакона. Форма клетки при этом становилась более плоской. Постепенно области контактов сливались, образуя общую поверхность контакта с дном флакона, в центре уплощенной клетки.
Выпячивания, расположенные по периферии клетки, после контакта со стеклом приобретали вид своеобразных «ножек» – пузырьковых псевдоподий [7] (рис. 2А), которые в дальнейшем сливались между собой. Уплощенные клетки имели овальную или многоугольную форму с эквивалентным диаметром 60–80 мкм (рис. 2А). В центральной, более высокой части клеток, находилось ядро (менее уплощенная органелла) и эндоплазма. По периферии располагалась эктоплазма, в которой присутствовали лишь единичные вакуоли и тонкие нити (микрофиламенты) цитоскелета. По краям клеток цитоплазматическая мембрана образовывала многочисленные складки. У некоторых клеток сохранялись выпячивания периферической части цитоплазматической мембраны (рис. 2Б). У других – образовывались длинные отростки, оканчивающиеся утолщениями. Далее уплощенные клетки распластывались полностью, включая ядро. В таких клетках четко визуализировались вакуоли, тонкие филаменты цитоскелета, эндоплазма и эктоплазма, а также ядра и ядерная мембрана. Периферические складки клеточных мембран расправлялись (рис. 3). Этот процесс происходил во всех клетках с небольшой временной разницей. Уже через 24–30 ч. начинались первые деления у большинства клеток, полностью повторяющие общую схему этого процесса у пролиферирующих клеток в первичной культуре (рис. 4).
В отличие от первичной культуры, после субкультивирования делилось большинство пересеянных (культивируемых) клеток (рис. 5). В связи с этим, при равной плотности посева, конфлюэнтный монослой в первичной культуре может быть получен значительно раньше (уже через 72 ч.). При большем количестве посеянных клеток, накопление клеточной массы происходило быстрее. В монослое клеточной линии присутствовали также неделящиеся клетки, но их было значительно меньше в соотношении с делящимися, так как количество последних постоянно увеличивалось, а количество неделящихся оставалось таким же, как в первичной культуре. Большинство клеток клеточной линии в монослое имели вытянутую форму и немногочисленные отростки (рис. 6).
Следует отметить, что при последующих пассажах морфология адгезивных клеток костного мозга, составляющих клеточную линию, существенно не изменялась. Размеры открепленных и округлившихся клеток при пересевах во взвешенном состоянии составляли 12–25 мкм в диаметре.
Учитывая, что представленная работа является продолжением ранее опубликованной первой части [1], обсуждение материала будет включать данные, представленные в первой части.
Прикрепление (адгезия) клеток костного мозга из взвешенного состояния к дну флакона после помещения в питательную среду и последующее их распластывание, прежде всего, указывало на наличие в этих клетках соответствующих механизмов адгезии. Несмотря на то, что смысл этих явлений до конца не ясен, сами механизмы прикрепления клеток достаточно подробно описаны в литературе [8, 9]. В клеточную мембрану встроены интегрины и трансмембранные протеогликаны. Их взаимодействию с дном культурального сосуда способствуют гликопротеины, такие как фибронектин, а также фибриллярные белки – коллагены и протеогликаны, которые синтезируются самой клеткой в культуре. Продукты клеточного синтеза оседают на дно флакона и агрегируют (взаимодействуют) с культуральным пластиком или стеклом [10]. Сопоставляя скорость прикрепления и распластывания культивируемых клеток первичной культуры и клеточной линии, можно сделать вывод, что более быстрое прикрепление клеток к подложке (дну флакона) после рассева первичной культуры, вероятно, связано с усилением в процессе культивирования и совершенствованием механизмов клеточной адгезии, способности клеток к взаимодействию с подложкой, а также накоплением в клетках молекул, ответственных за клеточно-субстратное взаимодействие.
Наличие адгезивных веществ между клеточной мембраной и дном флакона подтверждалось появлением радиальных «лучистых» нитей вокруг клетки во время ее сокращения как при откреплении, так и в начале деления. Очевидно, что вышеуказанные нити являлись остатками адгезивных веществ гликопротеидной природы (вероятно фибронектина).
При получении первичной культуры из выделенных мононуклеаров костного мозга человека адгезия и распластывание происходили в диапазоне от 2–3 ч. до 2–3 сут. Очевидно, что эти явления – части одного процесса взаимодействия поверхности клеток с подлежащим стеклом или пластиком дна культурального флакона. Прикрепление клетки сначала происходило локально, а затем количество и площадь контактов увеличивались. Клетки постепенно меняли форму: уплощались и распластывались. Размер распластанной по поверхности дна флакона клетки, очевидно, был ограничен размером (объемом) той сложной трехмерной формы, которую эта клетка имела in vivo в костном мозге. После извлечения из кости (аспирации костного мозга после пункции) и помещения в виде суспензии в жидкую питательную среду для культивирования клетки приобретали шарообразную форму, сходную с ядросодержащими клетками крови, находящимися во взвешенном состоянии.
Очевидно, что адгезия и последующее распластывание связаны с действием физических факторов. На клетку, помещенную в культуральную среду, действовала гравитация, которая неизбежно опускала ее на дно флакона. Таким образом наступал контакт клетки с поверхностью дна культурального флакона. Уже имеющиеся на клеточной мембране адгезивные структуры – интегрины и мембранные протеогликаны, – с помощью которых происходит взаимодействие с элементами внеклеточного матрикса или другими клетками в ткани, дают возможность прикрепляться к поверхности пластика или стекла (дна сосуда).
Многообразие структурных форм адгезивных клеток в первичной культуре, как во взвешенном состоянии, так и при распластывании на дне культурального флакона, могло быть связано с присутствием в составе костного мозга клеток из всех соединительнотканных дифферонов, имеющихся в костном мозге. Фибробластический дифферон в полном объеме представлял собственно соединительнотканные клетки рыхлой волокнистой неоформленной соединительной ткани, формирующей ретикулярную основу (строму) костного мозга. Дифферон включает коммитированные клетки-предшественницы и фибробласты на разных стадиях развития, зрелые фибробласты, стареющие и дефинитивные формы фибробластов. Такое же представительство в костном мозге имеет дифферон жировых клеток. На начальных стадиях развития (дифференцировки) жировые клетки имеют фибробластоподобную морфологию, но в процессе специализации в них постепенно происходит накопление жира в форме мелких капель, сливающихся в более крупные, и, в конечном счете, в одну большую каплю. Конечно, зрелых жировых клеток в первичной культуре не было в связи с их разрушением при получении аспирата и последующей обработки костного мозга для выделения и посева ядросодержащих клеток. Развивающиеся в питательной среде жировые клетки с небольшим содержанием жира в их цитоплазме теряли его при культивировании, принимая вид фибробластов.
Представительство костно-хрящевого дифферона в костном мозге ограничивалось остео-хондрогенными предшественниками [11]. Зрелые клетки – остеоциты и хондроциты – в аспирате костного мозга отсутствовали, так как были «замурованы» в плотный костный или хрящевой матрикс, соответственно. Таким образом, вероятно, пул соединительнотканных адгезивных клеток костного мозга человека представлен совокупностью всех вышеуказанных дифферонов. В литературе этим клеткам приписаны мультипотентные свойства, которые они могут проявлять в виде появления отдельных признаков в культуре при воздействии различных дифференцировочных сигналов и изменении культурального микроокружения [12–14].
В искусственных условиях направленной дифференцировки культивируемых клеток костного мозга только их часть обнаруживает признаки формирования специализированного фенотипа клеток в заданном направлении [15].
Учитывая, что среди адгезивных клеток костного мозга присутствуют клетки всех соединительнотканных дифферонов, можно предположить возможность появления отдельных тканевых признаков у той части культивируемых под действием активирующего сигнала клеток, на который отвечает только популяция клеток отдельного дифферона, соответствующая этому сигналу и воспринимающая его. Поэтому при выявлении мультипотентности в адгезивных клетках костного мозга для чистоты эксперимента необходимо исключить из всего пула соединительнотканных клеток дифферон, чувствительный к соответствующим дифференцировочным сигналам. Это технически сложно осуществить. Поэтому утверждать, что адгезивные клетки костного мозга однозначно мультипотентные – нельзя.
Поддерживаемые в культуре и многократно поделившиеся адгезивные клетки постепенно становятся морфологически более единообразными. Вся совокупность этих клеток состоит из культивируемых адгезивных клеток на разных стадиях зрелости. Эти клетки сохраняли соединительнотканный фенотип, который являлся фактически фенотипом фибробластического дифферона [16].
Еще одним дискуссионным вопросом в литературе является встречающееся определение культивируемой совокупности адгезивных клеток костного мозга, как «мезенхимных стволовых клеток» [1].
С позиции классической гистологии мезенхима – это комплекс неоднородных эмбриональных клеток и межклеточного матрикса, из которого в течении эмбриогенеза образуется соединительная ткань, гемопоэтические органы, гладкомышечные клетки, нейроглия. Во время своего роста мезенхима непрерывно изменяется, и ни на одной стадии своего развития не сходна с предшествующей стадией. Зрелая соединительная ткань также постоянно меняется в процессе онтогенеза, поэтому понятие мезенхимный не следует использовать для характеристики какихлибо ее клеточных форм. Термин «мезенхимный» может лишь указывать на происхождение того или иного типа клеток из мезенхимального зачатка [17].
Постоянная вышеуказанная динамика мезенхимных клеток не позволяет назвать их стволовыми, так как последние должны сохранять и воспроизводить закрепленную генетическую информацию. Культивируемые клетки тем более не могут быть ни мезенхимными, ни стволовыми, так как адгезивные клетки выделены из костного мозга и выращены в искусственных условиях (культуральной среде). В связи с этим, использовать гистологическую терминологию для обозначения культивируемых клеток следует с определенными оговорками. Ткань, в частности соединительная, – это единый клеточно-матриксный комплекс, в который интегрированы сосуды и нервы. Собственно соединительнотканные клетки – это клетки, которые синтезируют компоненты межклеточного матрикса, участвуют в его структурировании, в соответствии с разновидностью соединительной ткани, а также в его постоянном обновлении.
В клеточной культуре – собственно соединительнотканные клетки в искусственной питательной среде не имеют тканевой взаимосвязи друг с другом (структурно и с помощью сигналов), но за счет отдельных компонентов межклеточного матрикса, синтезированных этими клетками, они имеют возможность прикрепляться к пластиковому или стеклянному дну культурального флакона.
Структурная динамика культивируемых адгезивных клеток костного мозга в первичной культуре несколько отличалась в клеточной линии.
Первый этап – нахождение во взвешенном состоянии после трипсинизации клеток конфлюэнтного монослоя первичной культуры – продолжался 10–20 мин. (при получении первичной культуры от 2–3 ч. до 2–3 сут.). Размерный диапазон адгезивных клеток сразу после посева составлял 10–12 мкм. Сразу после пересева уже в клеточной линии размер клеток во взвеси составлял 12–25 мкм. Клеточная мембрана таких клеток имела многочисленные выпячивания разного размера. При ТЭМ исследовании показано, что часть выпячиваний небольшого размера была заполнена цитоплазматическим матриксом; в более крупных выпячиваниях мембраны не было элементов электронноплотного матрикса вообще.
Можно предположить, что происхождение подобных локальных образований связано с отличием физико-химических свойств (эластичности) клеточной мембраны или локальных ослаблений мембранноактиновых связей в местах выпячиваний. Очевидно, при относительно быстром откреплении распластанных в монослое клеток от дна флакона и переходе их во взвеси в округлую или шаровидную форму клеточная мембрана в области выпячиваний, где отсутствует структурированный цитоплазматический матрикс, не проявляет в достаточной степени своих эластических свойств. Вероятно, такие выпячивания происходят под давлением внутриклеточной жидкости, объем которой, возможно, увеличивается за счет поступления извне и перераспределяется при изменении плоской формы клеток в овальную или шарообразную. На это указывают хорошо заметные признаки обводнения цитоплазмы. Таким образом, можно говорить о двух разновидностях выпячиваний являющихся результатом изменения формы клеток. Сам механизм таких изменений требует дальнейшего исследования.
В некоторых работах [18, 19] указывается, что выпячивание цитоплазматической мембраны (блеббинг) наблюдается при апоптозе и является признаком одной из его стадий, предвещая близкую гибель клетки. По другим данным, клетки могут использовать «блеббы» для цитокинеза в отсутствии подложки или слабого прикрепления к ней при культивировании или эмбриогенезе [20, 21] В этих исследованиях не приводится описание структуры «блеббов». В настоящей работе клетки, выделенные из конфлюентного монослоя первичной культуры, имели многочисленные выпячивания мембраны, отличающиеся по своему строению. С помощью этих выпячиваний клетки касались дна культурального флакона. После прикрепления и уплощения часть выпячиваний некоторое время сохранялась, но при полном распластывании исчезала, таким образом, клетки восстанавливали свою структуру, которая у них сформировалась в первичном пассаже. Следовательно, разрушение клеток не происходило. Далее клетки делились. Этот процесс для какой-либо произвольно выбранной группы клеток фиксировался с помощью цейтрафера, что однозначно подтверждало факт продолжения их дальнейшей жизнедеятельности. Следует также обратить внимание на то обстоятельство, что при изменении формы клетки во время подготовки к делению выпячивания цитоплазматической мембраны не возникали. Они появлялись только на стадии телофазы.
Почти все пересеянные клетки клеточной линии начинали делиться после адгезии. Однако проследить количество делений отдельных клеток не представлялось возможным, даже используя цейтраферную съемку. В последующих пассажах размеры клеток не увеличивались. Выпячивания были менее выраженными, в них имелись электронноплотные структуры.
Безусловно, нельзя оставить без внимания ультраструктурную организацию клеток клеточной линии, которые открепляют с помощью трипсинизации от подложки и из конфлюэнтного монослоя. Это особенно важно потому, что подобные клетки наиболее часто используются в клеточных технологиях [22], а при трансплантации клеток в какуюлибо ткань или кровоток они попадают в организм в вышеописанном состоянии после структурной адаптации к условиям культивирования и этапа предварительного наращивания клеточной массы в искусственных условиях. Как изменится ультраструктура таких «обезличенных» в культуре клеток по отношению к существующему в организме дифферону, после переноса их в живую ткань пока недостаточно понятно. К этому следует добавить, что клеточная трансплантация может проводиться на фоне оперативного вмешательства – механической травмы тканей реципиента с последующим неизбежным развитием локального асептического воспаления. Таким образом, трансплантируемые клетки подвергаются многостороннему разнофакторному и многократному стрессу, что, безусловно, негативно скажется на их структурно-функциональной адаптации и последующей жизнедеятельности. Целесообразность в дальнейшем исследовать структурные изменения культивированных клеток после их трансплантации в ткань (in vivo) не вызывает сомнений.
(PDF) A star cell complex as the heart of colonial Kamptozoa
ДОКЛАДЫ АКАДЕМИИ НАУК, 2011, том 441, № 2, с. 278–281
278
Миниатюрные представители беспозвоноч
ных животных, как правило, лишены развитой
сосудистой системы. Тип Kamptozoa включает
мелких (от 0.2 до 8 мм) водных беспозвоночных
животных. Тело Kamptozoa состоит из чашечки,
несущей по краю венчик ресничных щупалец, и
ножки, которая у одиночных форм, принадлежа
щих к отряду Solitaria, прикрепляется к субстрату,
а у колониальных видов из отряда Coloniales отхо
дит от базального диска или от стелющегося по
субстрату столона [2, 4]. Полость тела Kamptozoa
представляет собой гемоцель, специализирован
ной сосудистой системы у них нет. Для обеспече
ния питательными веществами ножки и столона
Coloniales необходим механизм, обеспечиваю
щий циркуляцию жидкости гемоцеля внутри ко
лонии. В течение долгого времени никаких мор
фологических структур, которые могли бы спо
собствовать циркуляции жидкости гемоцеля у
Kamptozoa, не было известно. В 1969 г. Эмшер
манн [3] описал сложное строение звездчатого
комплекса у некоторых видов Kamptozoa и вы
сказал мнение, что он участвует в обеспечении
движения полостной жидкости. В последующие
годы наблюдения Эмшерманна не были под
тверждены другими авторами, и полученные им
данные не входят в современные руководства по
зоологии (см., например, [1]). Таким образом,
требует подтверждения само существование
звездчатого комплекса как органа, обеспечиваю
щего циркуляцию жидкости.
Целью настоящей работы было дать рекон
струкцию тонкого строения звездчатого ком
плекса двух видов колониальных Kamptozoa –
Barentsia discreta (Busk, 1886) и Pedicellina cernua
(Pallas, 1774) – и выяснить механизм работы этого
органа. Колонии B. discreta были собраны в конце
августа 2010 г. в заливе Восток Японского моря
(Находкинский рн Приморского края) с рако
вин моллюска Modiolus difficilis, колонии P. cer
nua – в июле 2010 г. в проливе Великая Салма
Кандалакшского залива Белого моря с раковин
моллюска Mytilus edulis. Особи были помещены в
7.5%ный раствор хлорида магния для расслабле
ния мускулатуры и фиксированы 2.5%ным рас
твором глутаральдегида на 0.1 М фосфатном бу
фере для электронномикроскопических иссле
дований.
Звездчатый комплекс лежит на границе ножки
и чашечки. У обоих исследованных видов он
устроен по общему плану. Кутикула в этом месте
утолщена (у B. discreta – с 3 до 12 мкм, у P. cernua –
с 3 до 8 мкм) и образует неполную кольцевую сеп
ту, которая служит опорой для клеток звездчатого
комплекса. В состав звездчатого комплекса вхо
дят мышечная полусфера, образованная един
ственной клеткой, и ряд лежащих друг под другом
звездчатых мышечных клеток, количество кото
рых колеблется в зависимости от размера особи и
составляет 7–12 клеток у P. cernua
и 6–9 клеток у
B. discreta
(рис. 1). Клетка мышечной полусферы
имеет форму купола, вдающегося в полость ча
шечки. Края этой клетки образуют многочислен
ные выросты, дистальные концы которых расши
рены и смыкаются с дистальными концами со
седних выростов. Между выростами имеются
отверстия, через которые полость тела над клет
кой мышечной полусферы сообщается с поло
стью тела под ней. Клетка мышечной полусферы
одета слоем экстраклеточного матрикса, толщина
которого на выпуклой стороне составляет от 80 до
400 нм, тогда как на вогнутой – около 50–70 нм.
Сократимые филаменты клетки мышечной
полусферы образуют пучки, идущие от центра к
периферии в радиальных направлениях (рис. 2а).
Плазмалемма выпуклой поверхности клетки мы
шечной полусферы образует множественные ин
вагинации, на дне которых располагаются специ
ализированные контакты – гемидесмосомы,
обеспечивающие прикрепление к толстому слою
экстраклеточного матрикса на выпуклой стороне
клетки. С внутренней стороны клетки к гемиде
смосомам крепятся пучки миофиламентов. Ди
стальные концы выростов клетки мышечной по
лусферы прикрепляются специализированными
контактами (гемидесмосомами) к слою плотного
ОБЩАЯ
БИОЛОГИЯ
ЗВЕЗДЧАТЫЙ КОМПЛЕКС –
СЕРДЦЕ КОЛОНИАЛЬНЫХ KAMPTOZOA
© 2011 г. А. О. Борисанова,
член’корреспондент РАН
В. В. Малахов
Поступило 16.05.2011 г.
УДК 591.473.2+592
Московский государственный университет
им. М.В. Ломоносова
Дальневосточный федеральный университет,
Владивосток
SIU SOM Гистология INTRO
КОМПОНЕНТЫ соединительной ткани
Соединительная ткань состоит из клеток, внедренных во внеклеточный матрикс.
Матрица, в свою очередь, состоит из волокон и основного вещества .
Характеристика Типы клеток соединительной ткани включают оба резидентных
ячеек и иммигрантов или блуждающих ячеек.
- Резидентные ячейки :
- Ячейки для иммигрантов включают:
Фибробласты являются наиболее часто встречающимися резидентными клетками в обычной соединительной ткани.
ткань. Фибробласты отвечают за выработку коллагена.
и другие элементы внеклеточного матрикса соединительной
ткань.
На микроскопическом уровне фибробласты лишены очевидных специализированных особенностей.
И фибробласты по всему телу кажутся похожими друг на друга, где бы
они встречаются в обычных соединительных тканях. Таким образом, о
фибробласты, чтобы привлечь внимание наблюдателя. Однако фибробласты
необходимы для нормального развития и ремонта, а также
недавнее исследование ( PLoS
Genetics 2006) показал, что фибробласты
из разных регионов демонстрируют сильно дифференцированные паттерны генов
экспрессия, которая может определять дифференцированные паттерны организации тканей,
например, разные типы кожи и волос на разных участках.Действительно,
одноклеточный тип, называемый «фибробласт», может правильно представлять
множество четко (но незаметно) различных типов клеток, включая мезенхимальные
стволовые клетки », которые сохраняют способность дифференцироваться в другие типы клеток
(см. Science 324: 1666, 26 июня 2009 г.).
Название «фибробласт» является неправильным,
поскольку большинство клеток, в названии которых есть слово «взрыв», являются эмбриональными предшественниками
клетки, которые впоследствии дифференцируются в специализированные типы клеток.Фибробласты
уже являются зрелым дифференцированным типом клеток (хотя некоторые из них могут иметь
способность дифференцироваться в другие типы мезенхимальных клеток).
Отдых
фибробласты обычно имеют так мало цитоплазмы, что обычно появляются клетки,
при световой микроскопии как «голые» ядра.
Ядра фибробластов кажутся плотными (гетерохроматическими) и имеют вид
обычно уплощенная или веретенообразная.Розовый материал на этом миниатюре
изображение внеклеточный коллаген.Фибробласты активны во время роста, но обычно находятся в состоянии покоя
у взрослого. В активном состоянии фибробласты активно секретируют, производя
коллаген и другие компоненты внеклеточного
матрица соединительной ткани. Активные фибробласты кажутся больше, чем
покоящиеся, с большим количеством цитоплазмы и с более эухроматическими ядрами
(менее густо окрашенные).
Образование рубца: Покоящиеся фибробласты сохраняют способность становиться
активны и при необходимости размножаются, как при заживлении после травм. Шрамы
образуются под действием фибробластов во время восстановления тканей. Вещество
рубца — это коллаген, депонированный фибробластами в
заменить поврежденную ткань.
Изображение образования рубца см. В WebPath.
О последних исследованиях участия фибробластов в формировании рубцов см. Science 348: 284 (17 апреля 2015 г.).
Тесно связаны с фибробластами хондробластов , которые продуцируют
матрикс хряща и остеобласты
которые производят костный матрикс.
Терминология: Внешний вид «взрыва»
в имени клетки обычно указывает на эмбриональную клетку, которую трансформирует
в зрелые клетки (например, нейробласты, миобласты). Однако в
случай «фибробласта», «хондробласта» и «остеобласта»,
это обозначение указывает на клетку, которая секретирует волокон, хрящ
или кость.
Адипоциты. Адипоциты — большие клетки соединительной ткани, которые
содержат значительное количество липидов, хранящихся в виде заметных круглых
капли. Адипоциты в первую очередь служат хранилищами резервной энергии.
В массовом порядке , они также помогают в терморегуляции (поддержании тела
температура), а в некоторых местах предлагают некоторую амортизационную способность (например, около
почки, за глазными яблоками).
Поскольку большая часть рыхлой соединительной ткани содержит разбросанные кластеры
адипоцитов термин жировая ткань обычно используется для обозначения больших
массы (явно видимые) этих клеток.
Самым распространенным типом адипоцитов является однокамерный адипоцит и .
или белый жир . Каждая ячейка содержит одну каплю жира (следовательно,
uni locular), окруженный тонким ободком цитоплазмы.
Меньше
Под световым микроскопом адипоцит выглядит как заметный
чистое пространство с очень тонкой каймой. Капля липида, содержащая
основная часть каждого адипоцита не окрашивается обычными водными пятнами, и
могут даже быть удалены растворителями во время подготовки образца. Более того,
Сама цитоплазма адипоцитов незаметно тонка, а ядро любого
конкретный адипоцит вряд ли будет включен в какой-либо данный раздел (см.
Просмотр тканей).На предметных стеклах микроскопа скопления адипоцитов представляют собой
внешний вид чем-то похож на «пену». Отдельные «пузыри»,
каждая из них представляет собой липидную каплю в одной клетке, довольно последовательны
по размеру. Обычно диаметр составляет около 50 микрометров, что сопоставимо.
к волокну скелетных мышц или небольшой (терминальной) артериоле.The
форма капли на срезе ткани на предметном стекле зависит от того, насколько тщательно
образец был подготовлен.В идеале капли гладкие и круглые.
(как на изображении выше), но они также могут быть искажены и иметь форму
кусочки пазла (как на картинке справа).Адипоциты могут встречаться практически в любом образце обычной соединительной ткани.
ткани, где они могут быть найдены в виде отдельных клеток или скоплений. Четный
когда они сгруппированы вместе и очевидно соприкасаются, адипоциты остаются разделенными
тонким слоем матрикса (основного вещества и коллагена), который включает
многочисленные капилляры.Слой жировой ткани в глубоких слоях кожи (в разных
называется гиподерма или подкожная жировая ткань ) может обеспечить значительный
теплоизоляция.
Более специализированный и локализованный тип адипоцитов
называется мультилокулярным адипоцитом или коричневым жиром . Эти
клетки функционируют в процессе термогенерации, по сути сжигая жир для производства тепла.
Физическое лицо
коричневые жировые клетки содержат множество мелких липидных капелек (отсюда и название multi locular)
и многочисленные митохондрии (цитохромы которых придают коричневатый цвет).В
эти клетки, метаболические реакции митохондрий не связаны с
Синтез АТФ, так что произведенная энергия просто выделяется в виде тепла.Младенцы имеют значительное количество бурого жира, особенно
в подушечку между лопатками. Бурого жира мало у взрослых
но может быть обнаружен вокруг надпочечников. Недавние исследования (три
статьи в New England Journal of Medicine 360 [15], 9 апреля 2009 г.)
сообщили о буром жире в области, простирающейся от передней части шеи до грудной клетки;
Активность бурого жира была положительно связана со скоростью метаболизма в покое и
был значительно ниже у людей с избыточным весом или ожирением, чем у худых.
Макрофаги удаляют и переваривают побочные продукты обоих бактериальных
война и нормальный рост и вырождение. Покоящиеся макрофаги
трудно надежно распознать с помощью световой микроскопии, по крайней мере, при обычных препаратах,
потому что им не хватает заметных отличительных характеристик. Они склонны
быть несколько крупнее фибробластов, с большим количеством цитоплазмы. Макрофаги
содержат многочисленные лизосомы, которые используются для расщепления проглоченного материала.Эти лизосомы обычно незаметны при световой микроскопии, но легко
видны под электронной микроскопией.
дюйм
макрофаги, которые были активны и накопили неперевариваемые остатки,
лизосомы могут быть видны при световой микроскопии как коричневые внутриклеточные
гранулы, как на этом изображении макрофагов легких («пылевых клеток»).
Нажмите здесь или на изображение для более широкого поля зрения
просмотрите и дополнительную информацию о макрофагах легких.Исторические сведения: Макрофаги
печени (клетки Купфера) и легких
(пылевые ячейки) были названы до четкого понимания того, что эти ячейки принадлежат
к более широко распространенному типу клеток.Термин ретикулоэндотелиальная система обозначает
к макрофагам печени, селезенки
и лимфатические узлы (т. е. те органы
с продуманными эндотелиальными каналами, поддерживаемыми ретикулярными
соединительная ткань).Название отражает былую путаницу в отношении
различие между эндотелиальными клетками и разбросанной популяцией макрофагов
(моноциты, гистиоциты). Макрофаги можно легко пометить экспериментально
через их фагоцитоз введенных углеродных частиц. Тем не мение,
эндотелиальные клетки также маркируются той же процедурой. Хотя
эндотелиальные клетки не являются резко фагоцитозными, они переносят некоторые
материалы через эндотелиальную выстилку через небольшие эндоцитотические и экзоцитозные
везикулы.
Макрофаги подвижны (амебоидное движение) на короткие расстояния в пределах
локальная область соединительной ткани. Самая обычная соединительная ткань содержит
постоянная популяция резидентных макрофагов. Но когда повреждение или заражение
требует подкрепления, моноциты могут увеличиваться
популяция макрофагов многократно. Моноциты — это циркулирующие клетки
в крови (пример на WebPath)
которые могут дифференцироваться в макрофаги при попадании в соединительную ткань.
Макрофаги относятся к числу наиболее независимых клеток
в организме. Хотя они реагируют на химические сигналы, управляющие
иммунные реакции, отдельные макрофаги способны выползать из
соединительной ткани, пересекающей эпителий тела и удаляющей инородные
материал на открытых поверхностях, таких как альвеолярная выстилка легких и
конъюнктива глаза.Макрофаги могут собираться и сливаться в гигантских клеток
в местах повреждений или посторонних предметов.Для иллюстраций см. WebPath .
пример
1, пример
2, пример
3.
Тучные клетки являются секреторными сигнальными клетками. При малейшем беспокойстве
они испускают химические сигналы, которые распространяются через окружающую землю
вещества и запускают процесс воспаления.
Тучные клетки встречаются в виде небольших отдельных клеток, довольно широко разбросанных в обычных
соединительная ткань.Цитоплазма тучных клеток заполнена секреторными
везикулы, которые могут быть довольно заметны в качественном световом микроскопе
препараты. Гранулы содержат гистамин , гепарин и различные
другие химические медиаторы, высвобождение которых сигнализирует о физиологической защите
ответы.
Аллергия вызвана (частично) ненадлежащей чувствительностью
тучных клеток. Симптомы лечат антигистаминными препаратами ,
химических веществ, которые препятствуют действию гистамина.Историческая справка. Название «тучная клетка».
это неправильное название. Слово «мачта» относится к пище. Когда
впервые описанные секреторные пузырьки тучных клеток были неверно истолкованы
как свидетельство проглатывания путем фагоцитоза. Итак, название предполагает ячейку
который наелся «мачты».
Лимфоциты
представляют собой небольшие клетки с круглыми ядрами и минимальной цитоплазмой (показанный пример
вот из мазка крови).Некоторые лимфоциты циркулируют по всему телу.
тело, свободно перемещаясь от крови к обычной соединительной ткани и обратно.
[Недавний
исследования показывают, что некоторые типы лимфоцитов более разделены на части.]
Лимфоциты служат как разведчиками, так и оружием против вторгающихся микроорганизмов.
(См. Примеры на WebPath,
WebPath
, электронная микрофотография в WebPath.)
Лимфоциты
встречаются в виде незаметных отдельных клеток, разбросанных по самым обычным
соединительной ткани.Они особенно часто встречаются у lamina propria (т. Е.
соединительные ткани слизистых оболочек). Микроскопически заметный
скопления лимфоцитов происходят в разбросанных по телу участках, при этом
особые концентрации в селезенке,
вилочковая железа, лимфа
узлы, пейеровы бляшки подвздошной кишки,
и миндалины. Эти сайты включают
зародышевых центров , в которых пролиферируют активированные лимфоциты.
Лимфоциты вырабатывают антитела, белки, которые обладают способностью
распознают и связываются с посторонними веществами.Антитела могут быть либо
секретируется или связывается с мембраной лимфоцитов. Плазменные клетки являются
дифференцированные лимфоциты, которые специализируются на производстве и секрете
относительно большое количество антител. (Электронная микрофотография
в WebPath.)
[Подробнее о лимфоцитах.]
Другие типы клеток соединительной ткани. Приведенный выше список не является исчерпывающим.
НАЧАЛО СТРАНИЦЫ
ВНЕКЛЕТОЧНЫЙ МАТРИЦА
Внеклеточный матрикс соединительной ткани состоит из земли
вещество и волокна. В обычном соединительном
ткани основное вещество состоит в основном из воды.
Основной тип волокон — коллаген (самый
обилие белка в организме), с эластичными волокнами
как второстепенный элемент. Внеклеточные материалы, которые включают
матрица продуцируется фибробластами.
Подробнее
на сайте Биохимии.
Основное вещество — это фоновый материал, в котором все остальные
соединительнотканные элементы заделаны. В обычной соединительной ткани
Основное вещество состоит в основном из воды, основная роль которой заключается в обеспечении
путь сообщения и транспорта (путем диффузии) между тканями. Этот
вода стабилизирована комплексом гликозаминогликанов ( ГАГ ), протеогликанов ,
и гликопротеинов , все из которых составляют лишь небольшую часть
масса основного вещества.
Эффект ГАГ в воде очень похож на эффект Jello ™ .
Если вы когда-либо готовили Jello ™, вы знаете, что пара столовых ложек
порошка из упаковки Jello ™ может превратить литр воды или более
из текущей жидкости в твердую массу.
Основное вещество может быть сильно модифицировано в специальных
формы соединительной ткани.
- В крови в основном веществе отсутствуют стабилизирующие макромолекулы.Мы называем это сыпучее основное вещество плазмой .
- В скелетной ткани,
Основное вещество может минерализоваться за счет отложения солей кальция.
Мы называем это твердое основное вещество костью . - В хряще,
основное вещество намного тверже, чем в обычной соединительной ткани
но по-прежнему сохраняет большую упругость, чем кость.
внеклеточные волокна соединительной ткани традиционно классифицируются
на три типа:
Коллаген — самый распространенный белок в организме.В качестве важного
структурный элемент внеклеточного матрикса
большинство соединительных тканей, включая кости и хрящи, дает коллаген
ударная вязкость и предел прочности. Сделаны шрамы
коллагена.
Существует более десятка различных разновидностей коллагена.
в теле, обычно обозначается римскими цифрами. Эти разновидности
продуцируются разными генами, имеют несколько разные свойства и
происходят в разных местах.Наиболее распространенные формы перечислены ниже.
Более
на сайте Биохимии.
- Коллаген типа I образует знакомый эозинофильный
коллагеновые волокна обычной волокнистой соединительной ткани (например, дермы, сухожилия,
оболочка органа, фасция). - Коллаген типа II укрепляет хрящи.
- Коллаген типа III образует ретикулярные волокна, а также
встречается в базальных мембранах и
кость. - Коллаген типа IV находится в базальной пластинке вокруг
волокна гладких и скелетных мышц. - Коллаген типа VII — это важный коллаген, связывающий
для формирования базальных мембран.Патология коллагена: Потому что разные типы
коллагена возникают в разных местах, различные нарушения дефекта коллагена
может вызывать разные симптомы в зависимости от того, какой конкретный ген несет
мутация.
The
коллагеновые волокна I типа обычной волокнистой соединительной ткани бесцветны,
поэтому в большинстве случаев их объемный вид белый (например, «белый»
оболочки глаза и других органов, сухожилия, фасции). Результаты белизны
от рассеяния света (по той же причине, что снег белый, хотя
снежинки — прозрачный кристаллический лед). При чрезвычайных обстоятельствах
регулярного расположения волокон и контролируемой внеклеточной жидкости, как в
роговица глаза, объемная
коллаген может быть прозрачным.
Несмотря на то, что коллаген I типа бесцветен, он является эозинофильным и поэтому выглядит розовым в
стандартные образцы тканей, окрашенных H&E.
Такие розовые коллагеновые волокна являются наиболее характерной чертой обычных
соединительная ткань. Способность находить и идентифицировать соединительную ткань
на слайдах — это в значительной степени способность распознавать волокна коллагена.
Коллаген вырабатывается фибробластами.
Коллаген секретируется фибробластами в виде молекул проколлагена,
внеклеточно превращается в тропоколлаген, который самособирается в микроскопически
видимые волокна и совершенно очевидные механические структуры, такие как сухожилия.(Подробнее о биохимии и связанной с ней патологии коллагена см.
Кирзенбаум, Гистология и клеточная биология . )Плотно упакованные волокна коллагена I типа (в плотных
соединительные ткани, такие как дерма и сухожилие) обеспечивают основную силу
с устойчивостью к разрыву и растяжению. Слабо упакованный коллаген
волокна (в рыхлой соединительной ткани, такой как гиподерма
или подслизистая оболочка внутренних органов) допускают свободное движение в определенных пределах.
пределы.
Ретикулярная
волокна ( rete , net), сделанные из коллагена III типа, обеспечивают очень
тонкая сеть (отсюда и название), поддерживающая отдельные клетки в определенных органах
(лимфатические узлы, селезенка,
печень). Ретикулярные волокна не видны.
в стандартных образцах, окрашенных H&E,
но их можно продемонстрировать с помощью солей серебра.
Коллаген, укрепляющий хрящ, кость, основание.
мембраны, базальная пластинка и другие структуры не организованы
в микроскопически видимые волокна.
Эластин
другой волокнистый белок. Как следует из названия, эластин эластичен.
В обычной соединительной ткани эластичные волокна помогают восстановить нормальную форму
после искажения.В достаточно высоких концентрациях эластин придает желтоватый оттенок.
цвет (как в эластичной связке, ligamentum flavum , где flavum
= желтый)
Как и резинки, эластичные волокна могут портиться
возраст и пребывание на солнце. Этот эффект легко продемонстрировать, набрав
два добровольца, молодой и пожилой. Пощипать немного кожи
на тыльной стороне ладони каждого человека, а затем посмотрите, как быстро кожа возвращается
в исходное положение при отпускании.В
эластичные связки, плотная концентрация эластичных волокон придают прочную эластичность
свойств, в то время как меньшая концентрация коллагена служит просто механическим
остановитесь, чтобы предотвратить чрезмерное растяжение при сильном стрессе.В
в дополнение к его появлению в качестве второстепенного компонента в большинстве обычных соединительных
ткани, эластин также характерен для артериальных
стенок (особенно эластических артерий , таких как аорта) и
эластичный хрящ (содержится в
ухо и надгортанник).Эластичные волокна часто плохо окрашиваются H&E,
и поэтому микроскопически видны только на специально окрашенных предметных стеклах.
ВИДЫ соединительной ткани
Как и все остальное, соединительные ткани можно разделить на различные типы.
Стандартная схема классификации основана на составе, то есть
от относительного соотношения различных клеточных и внеклеточных компонентов.Эта схема не совсем удовлетворительна, поскольку каждый компонент может
изменяются по своему собственному континууму.
«Обычная» соединительная ткань , или соединительная ткань «Собственная» ,
представляет собой обобщенную форму соединительной ткани, которая содержит все основные
компоненты соединительной ткани в разумной пропорции, включая клетки
(нескольких типов), внеклеточные волокна и внеклеточные
основное вещество.Вариации относительных пропорций
и расположение клеток, волокон и основного вещества используются для описания / классификации
соединительной ткани.
Соединительная ткань «Особая» . В фоновой текстуре
довольно повсеместно распространенная обычная соединительная ткань, также встречаются
несколько очень сильно дифференцированных и локализованных форм «особых» соединительных
ткань , которые, тем не менее, имеют много общих черт (структурные компоненты,
клеточные клоны) с собственно соединительной тканью.Эти особые формы
включают кость , хрящ ,
лимфоидная ткань (селезенка и лимфатические узлы), и
кровь .
В повседневном использовании термин «соединительная ткань» обычно относится к
к обычной соединительной ткани, в то время как особые формы чаще называют
к по их конкретным названиям (например, кость, хрящ, кровь).
Рыхлый / плотный .Соединительную ткань можно разделить на
сыпучие или плотные , в зависимости от соотношения волокон.
Разница между умеренно рыхлой соединительной тканью и умеренно рыхлой соединительной тканью.
плотную соединительную ткань трудно оценить под микроскопом, так как
сжатие или растяжение может уменьшить или увеличить расстояние между волокнами.
Эту разницу лучше оценить на уровне общей анатомии.
Если свежий образец рыхлой соединительной ткани был поражен
молоток, он «хлюпает». Если образец действительно плотный
при ударе соединительной ткани, например, сухожилия, молоток отскакивал назад.
Нет резкого различия между рыхлой и плотной соединительной тканью;
метки относятся к крайним точкам континуума.
Плотная соединительная ткань названа так из-за
высокая плотность внеклеточных волокон и относительно
меньшие доли основного вещества и клеток.Плотный
коллагеновая соединительная ткань находится везде, где прочность на разрыв
коллагена имеет первостепенное значение. Примеры
включают дермы (слой кожи
из которой получается кожа), сухожилий и связок ,
и оболочек органов (таких как склера, или «белая»,
глаз).Плотная эластичная соединительная ткань везде
эластичность эластина имеет первостепенное значение,
как в ligamentum flavum ( flavum относится к желтой
цвет, обеспечиваемый эластином) и аорты .Рыхлая соединительная ткань имеет
относительно большая доля основного вещества,
клеток или как клеток, так и основного вещества. В
Другими словами, рыхлая соединительная ткань лишена массивного фиброзного армирования.
что характеризует плотную соединительную ткань. Тем не менее, тот же
типы волокон все еще встречаются, хотя их меньше и
более нежный.Рыхлая соединительная ткань легко деформируется, позволяя
ткани с обеих сторон свободно перемещаться относительно друг друга.Тем не мение,
когда рыхлая соединительная ткань сильно деформируется, она тоже становится
прочный и устойчивый к дальнейшей деформации. Внутренняя сила
коллаген одинаков как в рыхлой, так и в плотной соединительной ткани
ткань.Упражнение: Чтобы испытать механический
качество рыхлой соединительной ткани, попробуйте следующее. (1) ущипнуть
кожа одной щеки между большим и указательным пальцами.(2) Удерживайте
слизистая оболочка щеки между зубами. (3) Затем переместите
кожа относительно подкладки. Посмотрите, как далеко могут
перемещаются относительно друг друга. Свобода за счет рыхлости
промежуточной соединительной ткани. Пределы устанавливаются
коллагеновые волокна, которые распрямляются до тех пор, пока
туго.Примеры рыхлой соединительной ткани включают гиподерму ,
собственная пластинка, подслизистая основа,
брыжейка и фасция .( Fascia [L., band] — термин, используемый в макроанатомии для
соединительная ткань, которая слабо связывает различные другие структуры. )
Учебник «идеальный» пример обыкновенной рыхлой связки.
ткань иногда называют ареолярной тканью ( ареолярная
относится к небольшим пространствам, заполненным основным веществом).
Обычное / нерегулярное .Плотная соединительная
ткань может быть далее описана как обычная или нерегулярная ,
в зависимости от ориентации волокон.
В обычной соединительной ткани (пример: сухожилие )
все волокна выровнены в одном направлении,
придавая прочность на разрыв, прежде всего, в этом направлении.В соединительной ткани неправильной формы (пример: дермы )
волокна расположены беспорядочно во всех направлениях.
Фиброколлагеновая
(или всего волокнистых ) тканей содержит значительную часть
коллаген. Основная особенность фиброзной ткани
гибкость в сочетании с большой прочностью на разрыв.
Поскольку коллаген бесцветен и обычно рассеивает свет,
фиброзная соединительная ткань обычно кажется белой.Склера (или «белая») глаза — это
легко видимый пример плотной волокнистой соединительной ткани, включающей
оболочка для органа.Сухожилия и мышечная капсула также могут быть знакомы
из мясной лавки или анатомической лаборатории. Концы мышцы
волокна обычно прикрепляются к плотной волокнистой соединительной ткани
надкостница, сухожилие или связки.Дерма кожи
также волокнистая соединительная ткань (следовательно, кожа в основном состоит из коллагена).
Эластичная ткань — это плотная соединительная ткань, которая содержит преимущественно
эластичные волокна, а не коллаген.Это больше
эластичная (очевидно), чем плотная коллагеновая соединительная ткань.
Примеры включают стенку аорты и эластичный
связка позвоночника (называемая желтая связка [ желтая =
желтый], потому что в достаточном количестве эластин желтоватый).
Жировая
ткань — рыхлая соединительная ткань, в которой преобладает жир
клетки или адипоциты.Поскольку большинство рыхлых
соединительная ткань содержит разбросанные скопления адипоцитов,
термин жировая ткань обычно используется для обозначения больших масс (грубо
видимые) этих ячеек.
Лимфоид
ткань — рыхлая соединительная ткань с большим количеством лимфоцитов
скопившиеся в тканях. Ламина
propria (рыхлая соединительная ткань слизистых оболочек) часто показывает
лимфатические тенденции или даже довольно хорошо развитые лимфатические узлы.В
иммунные клетки в этих местах образуют жизненно важную вторую линию защиты (эпителий
с его сплошной, но довольно легко разрушаемой стеной была первой линией) против
вторжение микроорганизмов.
На отдельной странице описана лимфатическая
система, включая лимфоидные ткани в нескольких специализированных лимфоидных органах
— селезенка, тимус,
лимфатические узлы и миндалины.
Лимфоидные органы также иногда называют ретикулярной тканью из-за:
опорный каркас из ретикулярных волокон (нежный,
ветвящаяся форма коллагена).
Для получения дополнительной информации о лимфоидной ткани посетите сайт «Лимфоидная
Ткани »в Blue
Гистология.
Ареолярная ткань . Идеально обобщенный
форма соединительной ткани с неспециализированными пропорциями различной матрицы
компонентов и клеток, получает собственное название: ареолярной ткани . Брыжейка
обычно приводится в качестве стандартного примера.
Ареолярный
ткань часто вводится с помощью цельного препарата брыжейки .
Термин «ареолярный» относится к множеству небольших пространств (заполненных землей
вещество), видимое в этой ткани.
Кровь традиционно классифицируется как специализированный
форма соединительной ткани, без волокон, очень жидкое основное вещество,
и мобильные соты.Таким образом, кровь отличается от обычной соединительной ткани.
Тем не менее, кровь также можно рассматривать как просто часть
обычная соединительная ткань, которая может свободно перемещаться с места на место
по дифференцированным трассам. (Для более подробной информации перейдите по ссылкам
обсуждение крови.)
Только красные кровяные тельца,
подобно троллейбусам, ограничены магистралями (т. е. кровеносными сосудами). Все
другие типы клеток в крови, а также большинство компонентов плазмы могут циркулировать
довольно свободно от крови к соединительной ткани и обратно.Таким образом,
большинство подвижных клеточных компонентов обычной соединительной ткани — это
взаимозаменяемы с кровью.Имена клеток крови и обычной соединительной ткани могут отличаться.
ткань. Клетки, которые называются макрофагами
в обычной соединительной ткани называются моноцитами
в крови. Клетки крови похожи на ткань туч
клетки называются базофилами .С этой точки зрения термин «белый»
«кровяная клетка» не только очень неспецифична, но также является неправильным термином. «Циркулирующий
соединительнотканная клетка »(пока неспецифическая) лучше соответствует функциональному расположению
этих типов мобильных ячеек.
Кость и хрящ
особые формы соединительной ткани, образованные специализированными остеобластами и
хондробласты с однозначно затвердевшим основным веществом.Эти формы
описаны на отдельной странице, как скелетные
ткань.
ФУНКЦИИ соединительной ткани
Большая часть соединительной ткани выполняет несколько жизненно важных функций одновременно,
в том числе —
После травмы соединительная ткань способствует восстановлению тканей,
особенно при образовании рубцов.
Дополнительные функции, которые можно найти на специализированных сайтах, включают —
Транспорт
Система кровообращения — это знакомый механизм перемещения материалов.
тело.Однако кровеносные сосуды не заходят достаточно далеко. Большинство
клетки расположены не непосредственно напротив капилляров, а скорее несколько десятков
или даже сотни микрометров (несколько диаметров ячейки) от ближайшего
кровеносный сосуд.
Соединительная ткань (точнее, стабилизированная вода
в основном веществе) обеспечивает окончательный путь диффузии питательных веществ,
кислород, отходы и метаболиты в клетки тела и из них.Лекарственные препараты также подкожные и внутримышечные.
в качестве начальной транспортной среды используется соединительная ткань.
Все кровеносные сосуды заключены в соединительной ткани. Единственные клетки
которые получают свою подпитку непосредственно из крови, являются эндотелиальными
клетки, выстилающие сами сосуды. Все остальные ячейки поставляются через
диффузия через промежуточную соединительную ткань.
Транспортные функции крови и соединительной ткани
не могут быть разделены.По сути, кровь
на самом деле просто подвижная фракция соединительной ткани. Сердце и
Система кровообращения просто облегчает движение этой перемещающейся ткани.Всякий раз, когда вы обнаруживаете сложное капиллярное ложе, тесно связанное с
с группой клеток (например, капиллярная сеть, окружающая скелетную
мышечные волокна или окружающие секреторные ацинусы), можно предсказать, что эти
клетки должны иметь исключительно высокий спрос на транспортировку внутрь или наружу,
поскольку покоящаяся клетка может вполне счастливо жить на некотором расстоянии от ближайшего
кровоснабжение.Богатое капиллярное кровоснабжение характерно для мышц и
мозг (снабжает кислородом), легкие (получает кислород), ворсинки кишечника (собирает
питательные вещества), экзокринные железы (доставляющие сырье для секреции) и
эндокринные железы (собирающие гормоны).
Иммунологический надзор и защита
(Подробнее об иммунной системе см. за пределами
ссылки и CRR
Лимфатическая система.)
Соединительная ткань служит транспортным путем не только для
нормальная экономика, но также и для вторгающихся микроорганизмов. Обеспечить защиту
против этой возможности, армия различных типов ячеек развернута повсюду
соединительная ткань.
Соединительная ткань является основным полем битвы за
вторжения: бактерии нелегко размножаются в эпителии — клетке.
мембраны блокируют проникновение в клетки, и внеклеточной пищи мало
для бактерий в эпителии.С другой стороны, соединительная ткань
предлагает потенциальный рай. Обильный внеклеточный материал обеспечивает
все необходимые питательные вещества, а также идеальный теплый, влажный, насыщенный кислородом
среда. Без сильной иммунологической защиты в соединительной ткани
ткани, любой небольшой разрыв в эпителии превратит тело в
отличная бактериальная культура.Воспаление — специфическая функция
соединительной ткани.
Обычная соединительная ткань включает два типа резидентных клеток с иммунологическими
функция, тучные клетки и макрофаги.
( Резидентные ячейки , которые по существу остаются на месте, ожидая
по действию, отличаются от бродячих или иммигрантов клеток
которые мигрируют в ткань и из нее.)
Тучные клетки
секреторные сигнальные клетки.Они очень хрупкие, рвутся при любом
беспокойство. Выпуск их гранул (сохраненный секреторный продукт)
запускает ряд физиологических защитных механизмов, включая воспаление.Макрофаги удаляют и переваривают
побочные продукты как бактериальной войны, так и нормального роста и дегенерации.
Моноциты, которые представляют собой циркулирующие клетки в крови, дифференцируются
в макрофаги, когда они попадают в соединительную ткань.Макрофаги
мобильный (амебоидное движение) на короткие расстояния в пределах локального региона
соединительная ткань. Но когда вторжение требует подкрепления, моноциты
может многократно увеличить популяцию макрофагов.Другие фиксированные клетки (т. Е. Фибробласты
и жировые клетки) в первую очередь структурные, хотя
активность фибробластов (пролиферация клеток и секреция коллагена)
является важным аспектом процесса заживления.
Блуждающие клетки соединительной ткани , также называемые белыми
клетки крови перемещаются в соединительную ткань и выходят из нее. Пять основных
можно рассматривать типы:
- Лимфоциты
циркулируют как через кровь, так и через соединительную ткань. Они обладают в
их секреторный продукт и на их клеточных мембранах способность распознавать
и связываются с посторонними веществами. - нейтрофилов
(собственно нейтрофильные гранулоциты; название происходит от окрашивания
свойства, ни ацидофильные, ни базофильные, специфических для этих клеток
гранулы).Эти фагоцитарные клетки путешествуют по крови, пока не будут вызваны.
в периферические ткани. Воспалительный ответ
(запускается частично тучными клетками) вызывает нейтрофилы
к пораженному участку. Нейтрофилы обладают способностью приближаться, поглощать,
и убивает большинство бактерий. Чтобы просмотреть электронную микрофотографию, см. WebPath. - Эозинофилы, подобные
нейтрофилы названы в соответствии с их характерной окраской; их
цитоплазматические гранулы эозинофильны.Эозинофилы
участвуют в реакции на аллергию и паразитов. - Базофилы, подобные нейтрофилам
и эозинофилы названы в соответствии с их характерной окраской. Их
цитоплазматические гранулы базофильные. Базофилы
представляют собой циркулирующий эквивалент тучных клеток ткани. - Моноциты циркулируют
предшественники макрофагов.[Дополнительные изображения типов WBC, на WebPath.]
Распределение блуждающих иммунных клеток отражает текущие физиологические
и патологические процессы.
- нейтрофилов
обычно ограничиваются циркулирующей кровью, где они остаются готовыми к
защитные реакции. Скопление нейтрофилов (полиморфно-ядерных
нейтрофильные лейкоциты или PMN) вне крови означает острое воспаление,
при повреждении тканей и / или наличии инфекционных микроорганизмов. - Лимфоциты накапливаются позже
и может указывать на хроническое воспаление. В
некоторые регионы (например, миндалины и
in lamina propria вдоль
кишечник), скопления лимфоцитов входят в состав
нормального (непатологического) взаимодействия с антигенами (чужеродными материалами)
которые пересекают эпителий.
Подробнее об иммунной системе см. снаружи.
ссылки и CRR
Лимфатическая система.
Механическая опора
На механическое качество большинства обычных соединительных тканей влияет только
косвенно клетками, находящимися внутри него (в отличие от эпителиального
ткань, которая полностью состоит из клеток).
Исключение составляет жировая ткань,
где большая часть многих адипоцитов может предложить
механическая защита за счет амортизации ударов.
Главный определяющий фактор механических свойств большинства соединительных тканей
внеклеточный матрикс, который секретируется
клетки внутри него (фибробласты в обычном соединительном
ткань, остеобласты и хондробласты
в кости и хряще соответственно).
В обычной соединительной ткани основное вещество
слишком текуч, чтобы обеспечить большую силу. Желеобразное основное вещество
обычной соединительной ткани служит в основном для предотвращения образования внеклеточной воды
от скопления в нижней части вашего тела.Но земля
вещество может быть основной структурной особенностью в особых формах, таких как хрящ
и кость.
В большинстве соединительных тканей образуются внеклеточные волокна.
основные конструктивные элементы.
Коллаген обеспечивает гибкость и высокую прочность на разрыв.
Плотно упакованные коллагеновые волокна обеспечивают прочность и устойчивость к
разрыв и растяжение. Неплотно упакованные волокна коллагена позволяют
движение в определенных пределах.Ретикулярные волокна (действительно, особая форма коллагена)
обеспечивают нежную опорную основу для отдельных ячеек, особенно
когда такие клетки накапливаются в массе, чтобы сформировать большой твердый орган, такой как
селезенка или печень.Эластин, как следует из названия, эластичен, как
резинки, помогающие восстановить нормальную форму после деформации. В эластичном
связки и артерии, плотные эластичные волокна, передают сильные
эластичные свойства, в то время как меньшая концентрация коллагена служит просто
как механический упор для предотвращения чрезмерного растяжения при сильной нагрузке.
Рост и ремонт . Наиболее распространенная фиксированная клетка обыкновенной соединительной
собственно ткань — это фибробласт. Фибробласты
у взрослых обычно спокойны. Во время роста, а также во время ремонта
после повреждения фибробласты являются активными секреторными клетками, которые производят
волокна и основное вещество
соединительная ткань. Они также сохраняют способность размножаться при необходимости,
как во время заживления ран, и, возможно, дифференцироваться в другие мезенхимальные
производные типы клеток (например, эндотелий сосудов
и гладкие мышцы).Миофибробласты напоминают фибробласты, но имеют
дополнительная сократительная способность, полезная, например, для закрытия ран.
Рубец — это коллаген, откладываемый фибробластами во время восстановления. (WebPath
иллюстрирует образование рубца.)
Согласно последним исследованиям ( PLoS
Genetics 2006), генетически дифференцированный
фибробласты также могут нести ответственность за управление локализованными структурами ткани
организация при росте и ремонте.
Экономика энергетики . Соединительная ткань участвует в нескольких взаимосвязанных
способы с накоплением энергии и терморегуляцией.
Бремя резервного хранения энергии почти полностью ложится на адипоциты.
Многие другие клетки, особенно мышечные, имеют кратковременное
запасы энергии в виде внутриклеточного гликогена. Более крупный, но
все еще сравнительно небольшой, запас энергии также обеспечивается гликогеном в
гепатоциты (эпителиальные клетки
печени).Но адипоциты
превышают все другие типы клеток по количеству калорий, хранящихся в одной ячейке.
Накопление подкожно-жировых клеток также обеспечивает
теплоизоляция . И специализированный коричневый
жир (также называемый многокомпонентным жиром) отвечает за выделение тепла
для поддержания температуры тела в условиях, когда изоляции недостаточно.
Эта функция производства тепла особенно важна для младенцев (и
другие мелкие млекопитающие) и могут быть связаны со скоростью метаболизма у взрослых людей.
Гемопоэз . Также падает процесс образования клеток крови
к соединительной ткани. Соединительная ткань костного мозга
специализируется на этой роли. (Слегка пропустите это сейчас.
Вы должны узнать больше на втором курсе.)
изображений костного мозга из WebPath: section,
раздел,
мазок
мазок
мазок.
Соединительная ткань | Предметные стекла для микроскопа
Глава 3. Соединительная ткань
Соединительная ткань обеспечивает поддержку, связывает вместе и защищает ткани и органы тела.
Соединительная ткань состоит из трех основных компонентов: клеток , белковых волокон и аморфного основного вещества . Вместе волокна и основное вещество составляют внеклеточный матрикс . В то время как другие типы тканей (эпителий, мышцы и нервная ткань) в основном состоят из клеток, внеклеточный матрикс является основным компонентом большей части соединительной ткани.
В этой главе рассматриваются основные типы соединительной ткани, а в последующих главах исследуются специализированные соединительные ткани (хрящ, кость,
и кровь).
Соединительнотканные волокна
Три типа волокон соединительной ткани:
- Коллагеновые волокна — большинство из них представляют собой коллаген I типа (самый распространенный белок в организме)
- Предел прочности — сопротивление растяжению
- Эластичные волокна — содержат эластин и фибриллин
- Эластичность — можно растянуть, но при этом вернуть исходную длину
- Ретикулярные волокна — содержат коллаген III типа
- Опора — сеть тонких волокон
Для визуализации волокон каждого типа можно использовать разные пятна.
(коллагеновые и эластичные волокна)
H & E / Azan / Verhoeff
(ретикулярные волокна)
Серебро
(ретикулярные волокна)
Серебро
СОЕДИНИТЕЛЬНАЯ ТКАНЬ
Соединительная ткань классифицируется на основе характеристик ее клеточных и внеклеточных компонентов.Основными критериями являются тип клеток, расположение и тип волокон, а также состав внеклеточного матрикса.
Свободная соединительная ткань
Рыхлая (ареолярная) соединительная ткань имеет редкую, нерегулярную сеть коллагеновых и эластичных волокон, взвешенных в относительно большом количестве основного вещества.
Плотная правильная соединительная ткань
Плотная правильная соединительная ткань состоит из волокон коллагена I типа, ориентированных в одном направлении. Обеспечивает прочность на разрыв в одном направлении.
Плотная соединительная ткань неправильной формы
Плотная соединительная ткань неправильной формы содержит волокна коллагена I типа, сплетенные в нескольких направлениях.Он обеспечивает прочность на разрыв в нескольких направлениях.
Эмбриональная соединительная ткань
Эмбриональная соединительная ткань образуется в процессе развития эмбриона. Мезенхима развивается в различные соединительные ткани тела. Слизистая соединительная ткань представляет собой студенистое вещество, обнаруженное в
пуповина.
СОЕДИНИТЕЛЬНЫЕ ТКАНИ
Клетки соединительной ткани принято делить на два типа:
- Фиксированные клетки (или резидентные клетки) — резидентная популяция клеток, которые развиваются и остаются в соединительной ткани. Фибробласты, адипоциты (жировые клетки), макрофаги и тучные клетки считаются резидентными клетками.
- Временные клетки (или блуждающие клетки) — лейкоциты (белые кровяные тельца), которые мигрируют из кровотока в соединительную ткань в ответ на воспаление или повреждение ткани.
ФИКСИРОВАННЫЕ ЯЧЕЙКИ
Фиксированные клетки — это нормальные компоненты соединительной ткани.
Фибробласты
Фибробласты производят и поддерживают внеклеточный матрикс. Это наиболее распространенный тип клеток соединительной ткани.
Адипоциты
Есть два типа жировой ткани:
- Жир белый — долгосрочное хранение энергии
- Бурый жир — выделение тепла (термогенез)
Белые адипоциты специализируются на синтезе и хранении триглицеридов. Белый жир также служит подушкой для органов и изолирует тело.
Коричневые адипоциты специализируются на выработке тепла. У новорожденных доля бурого жира (5% от массы тела) выше, чем у взрослых, и с возрастом она постепенно уменьшается.
Макрофаги
Макрофаги — это фагоцитарные клетки, которые поглощают и переваривают микробы, клеточный мусор и инородные вещества.Моноциты развиваются в костном мозге, циркулируют в кровотоке и мигрируют в соединительную ткань, где они дифференцируются в макрофаги.
Тучные клетки
Тучные клетки высвобождают молекулы, которые расширяют кровеносные сосуды и привлекают больше иммунных клеток к месту активации тучных клеток. Тучные клетки-предшественники (агранулярные) развиваются в костном мозге, циркулируют в кровотоке и мигрируют в соединительную ткань, где они пролиферируют и дифференцируются в зрелые тучные клетки (гранулярные).
Для идентификации тучных клеток в соединительной ткани требуются специальные красители.
ПЕРЕХОДНЫЕ ЯЧЕЙКИ
Временные клетки — это лейкоциты (белые кровяные тельца), которые циркулируют в кровотоке и мигрируют в соединительную ткань в местах иммунного ответа. К ним относятся нейтрофилы, эозинофилы, базофилы, лимфоциты и моноциты.Эти клетки обсуждаются более подробно в главе, посвященной периферической крови.
Плазменные клетки
Плазматические клетки — это зрелые В-лимфоциты, вырабатывающие большие количества антител. Их много везде, где антигены могут попадать в организм, например, в желудочно-кишечном тракте и дыхательной системе.
Эозинофилы
Эозинофилы участвуют во многих воспалительных процессах, включая паразитарные инфекции, аллергические заболевания и астму.
Соединительная ткань: Руководство по гистологии
Тип соединительной ткани, показанный на этой фотографии, представляет собой тип рыхлой соединительной ткани. Щелкните здесь, чтобы узнать больше о трех различных типах соединительной ткани.
Он содержит коллагеновые волокна, фибробласты и адипоциты (эти клетки выглядят «пустыми», поскольку процесс создания окрашенного участка извлекает липид из этих клеток).
Он также содержит лимфоциты плазматических клеток, макрофаги и тучные клетки. Тучные клетки окрашиваются в довольно темный цвет и выглядят зернистыми, так как в них много секреторных гранул.
Посмотри, сможешь ли ты идентифицировать некоторые из ячеек без этикеток.
Клетки, которые находятся в специализированных формах соединительной ткани:
Специализированная соединительная ткань включает сухожилия и
связки, кости и хрящи, кроветворная ткань, кровь и жир
ткань.Кость содержит остеоциты,
и остеобласты (остео — кости), которые секретируют внеклеточные
матричный материал (ECM), из которого состоит кость. Хрящ содержит
хондроциты и хондробласты (хондро — хрящ), которые
секретируют тип ECM, обнаруженный в хрящах, соответственно. Кровь
сосуды содержат эндотелиальных клеток, простых
плоский эндотелий, выстилающий кровеносную систему, которая
рассматриваются в разделе об эпителии.
Также присутствует, прямо под эпителием кровеносных капилляров,
это клетки, называемые перицитами — (периваскулярные клетки — перициты — греч.
for ‘around), которые могут делиться и обеспечивать источник новых фибробластов,
особенно после травмы тканей.
Наконец, гладкие мышцы обычно встречаются в соединительной
ткань. Например, в областях соединительной ткани, где есть
железы, гладкомышечные клетки, называемые миоэпителиальными
клетки, которые лежат между эпителиальными клетками и основанием
перепонка протоков.
соединительных тканей | Биология для майоров II
Результаты обучения
- Обсудите различные типы соединительной ткани у животных
Соединительные ткани состоят из матрицы, состоящей из живых клеток и неживого вещества, называемого основным веществом.Основное вещество состоит из органического вещества (обычно белка) и неорганического вещества (обычно минерала или воды). Основная клетка соединительной ткани — фибробласт. Эта клетка производит волокна почти во всех соединительных тканях. Фибробласты подвижны, способны выполнять митоз и синтезировать любую соединительную ткань, которая необходима. Макрофаги, лимфоциты и, иногда, лейкоциты могут быть обнаружены в некоторых тканях. В некоторых тканях есть специализированные клетки, которых нет в других.Матрица в соединительной ткани придает ткани ее плотность. Когда соединительная ткань имеет высокую концентрацию клеток или волокон, она имеет пропорционально менее плотный матрикс.
Органическая часть или белковые волокна в соединительных тканях представляют собой коллагеновые, эластичные или ретикулярные волокна. Волокна коллагена придают ткани прочность, предотвращая ее разрыв или отделение от окружающих тканей. Эластичные волокна состоят из протеина эластина; это волокно может растягиваться на половину своей длины и возвращаться к своим первоначальным размеру и форме.Эластичные волокна придают тканям гибкость. Ретикулярные волокна — это третий тип белковых волокон в соединительных тканях. Это волокно состоит из тонких нитей коллагена, которые образуют сеть волокон, поддерживающих ткань и другие органы, с которыми оно связано. Различные типы соединительных тканей, типы клеток и волокон, из которых они состоят, а также расположение образцов тканей приведены в таблице 1.
| Таблица 1. Соединительные ткани | |||
|---|---|---|---|
| Ткань | Ячейки | Волокна | Расположение |
| свободный / ареолярный | фибробласты, макрофаги, некоторые лимфоциты, некоторые нейтрофилы | несколько: коллагеновые, эластичные, ретикулярные | вокруг кровеносных сосудов; якоря эпителия |
| плотная волокнистая соединительная ткань | фибробластов, макрофагов, | в основном коллаген | неровная: кожа нормальная: сухожилия, связки |
| хрящ | хондроцитов, хондробластов | гиалин: мало коллагена, фиброхрящ: большое количество коллагена | скелет акулы, кости плода, человеческие уши, межпозвоночные диски |
| кость | остеобласты, остеоциты, остеокласты | некоторые: коллаген эластичный | скелеты позвоночных |
| жиров | адипоцитов | несколько | жир (жир) |
| кровь | эритроцитов, лейкоцитов | нет | кровь |
Свободная / ареолярная соединительная ткань
Рисунок 1.Рыхлая соединительная ткань состоит из рыхлых коллагеновых и эластичных волокон. Волокна и другие компоненты матрикса соединительной ткани секретируются фибробластами.
Рыхлая соединительная ткань , также называемая ареолярной соединительной тканью, содержит образцы всех компонентов соединительной ткани. Как показано на Рисунке 1, в рыхлой соединительной ткани есть фибробласты; макрофаги тоже присутствуют. Волокна коллагена относительно широкие и имеют светло-розовый цвет, тогда как эластичные волокна тонкие и окрашиваются в темно-синий или черный цвет.Пространство между форменными элементами ткани заполняется матрицей. Материал соединительной ткани придает ей рыхлую консистенцию, похожую на разорванный ватный диск. Рыхлая соединительная ткань находится вокруг каждого кровеносного сосуда и помогает удерживать сосуд на месте. Ткань также находится вокруг большинства органов тела и между ними. Таким образом, ареолярная ткань жесткая, но гибкая и состоит из мембран.
Волокнистая соединительная ткань
Волокнистые соединительные ткани содержат большое количество коллагеновых волокон и мало клеток или матриксного материала.Волокна могут быть расположены нерегулярно или регулярно с параллельными прядями. Неправильно расположенные волокнистые соединительные ткани находятся в областях тела, где напряжение возникает со всех сторон, таких как дерма кожи. Обычная волокнистая соединительная ткань, показанная на рисунке 2, находится в сухожилиях (которые соединяют мышцы с костями) и связках (которые соединяют кости с костями).
Рис. 2. Волокнистая соединительная ткань от сухожилия имеет тяжи коллагеновых волокон, выстроенных параллельно.
Хрящ
Хрящ — это соединительная ткань с большим количеством матрикса и различным количеством волокон. Клетки, называемые хондроцитами , составляют матрикс и волокна ткани. Хондроциты находятся в промежутках внутри ткани, называемых лакунами .
Рис. 3. Гиалиновый хрящ состоит из матрицы, в которую встроены клетки, называемые хондроцитами. Хондроциты существуют в полостях матрикса, называемых лакунами.
Хрящ с небольшим количеством коллагена и эластичных волокон — это гиалиновый хрящ, показанный на рисунке 3.Лакуны беспорядочно разбросаны по ткани, а матрица приобретает молочный или потертый вид с обычными гистологическими окрашиваниями. У акул хрящевой скелет, как и у почти всего человеческого скелета на определенной стадии предродового развития. Остаток этого хряща сохраняется во внешней части человеческого носа. Гиалиновый хрящ также находится на концах длинных костей, уменьшая трение и смягчая суставы этих костей.
Эластичный хрящ имеет большое количество эластичных волокон, придающих ему огромную гибкость.Уши большинства позвоночных животных содержат этот хрящ, как и части гортани или голосовой ящик. Фиброхрящ содержит большое количество коллагеновых волокон, придающих ткани огромную прочность. Фиброхрящи включают межпозвоночные диски у позвоночных животных. Гиалиновый хрящ, обнаруженный в подвижных суставах, таких как колено и плечо, повреждается в результате возраста или травмы. Поврежденный гиалиновый хрящ заменяется волокнистым хрящом, в результате чего суставы становятся «жесткими».
Кость
Кость или костная ткань — это соединительная ткань, которая имеет большое количество двух различных типов матричного материала.Органический матрикс похож на матричный материал, содержащийся в других соединительных тканях, включая некоторое количество коллагена и эластичных волокон. Это придает ткани прочность и гибкость. Неорганический матрикс состоит из минеральных солей, в основном солей кальция, которые придают ткани твердость. Без адекватного органического материала в матрице ткань разрывается; без адекватного неорганического материала в матрице ткань изгибается.
В кости есть три типа клеток: остеобласты, остеоциты и остеокласты.Остеобласты активны в создании костей для роста и ремоделирования. Остеобласты откладывают костный материал в матрицу, и после того, как матрица окружает их, они продолжают жить, но в пониженном метаболическом состоянии в виде остеоцитов. Остеоциты находятся в лакунах кости. Остеокласты активны в разрушении костей для их ремоделирования и обеспечивают доступ к кальцию, хранящемуся в тканях. Остеокласты обычно находятся на поверхности ткани.
Кости можно разделить на два типа: плотные и губчатые.Компактная кость находится в стержне (или диафизе) длинной кости и на поверхности плоских костей, а губчатая кость находится в конце (или эпифизе) длинной кости. Компактная кость организована в субъединицы, называемые остеонов , как показано на рисунке 4. Кровеносный сосуд и нерв находятся в центре структуры внутри гаверсовского канала, с радиально расходящимися кругами лакуны вокруг них, известными как ламели. Волнистые линии между лакунами — это микроканалы, называемые canaliculi ; они соединяют лакуны, чтобы способствовать диффузии между клетками.Губчатая кость состоит из крошечных пластинок, называемых трабекулы , эти пластины служат подпорками для придания прочности губчатой кости. Со временем эти пластины могут сломаться, из-за чего кость станет менее упругой. Костная ткань образует внутренний скелет позвоночных животных, обеспечивая структуру животного и точки прикрепления сухожилий.
Рис. 4. (a) Компактная кость — это плотный матрикс на внешней поверхности кости. Губчатая кость внутри компактной кости пористая с перепончатыми трабекулами.(б) Компактная кость состоит из колец, называемых остеонами. Кровеносные сосуды, нервы и лимфатические сосуды находятся в центральном гаверсовском канале. Кольца из ламелей окружают Гаверсский канал. Между ламелями расположены полости, называемые лакунами. Каналикулы — это микроканалы, соединяющие лакуны вместе. (c) Остеобласты окружают кость снаружи. Остеокласты проделывают туннели в кости, а остеоциты находятся в лакунах.
Жировая ткань
Рис. 5. Жировая ткань — это соединительная ткань, состоящая из клеток, называемых адипоцитами.Адипоциты имеют небольшие ядра, расположенные по краю клетки.
Жировая ткань или жировая ткань считается соединительной тканью, даже если она не имеет фибробластов или настоящего матрикса и имеет только несколько волокон. Жировая ткань состоит из клеток, называемых адипоцитами, которые собирают и хранят жир в форме триглицеридов для энергетического обмена. Жировая ткань дополнительно служит изоляцией, помогая поддерживать температуру тела, позволяя животным быть эндотермической, и действует как амортизатор от повреждений органов тела.Под микроскопом клетки жировой ткани кажутся пустыми из-за экстракции жира во время обработки материала для просмотра, как показано на рисунке 5. Тонкие линии на изображении — это клеточные мембраны, а ядра — маленькие черные точки. по краям ячеек.
Кровь
Кровь считается соединительной тканью, потому что у нее есть матрица, как показано на рисунке 6. Типы живых клеток — это красные кровяные тельца (RBC), также называемые эритроцитами, и белые кровяные тельца (WBC), также называемые лейкоцитами.Жидкая часть цельной крови, ее матрица, обычно называется плазмой.
Рис. 6. Кровь — это соединительная ткань, которая имеет жидкий матрикс, называемый плазмой, и не имеет волокон. Эритроциты (красные кровяные тельца), преобладающий тип клеток, участвуют в переносе кислорода и углекислого газа. Также присутствуют различные лейкоциты (белые кровяные тельца), участвующие в иммунном ответе.
Клетка, которая содержится в крови в наибольшем количестве, — это эритроцит. В образце крови эритроциты исчисляются миллионами: среднее количество эритроцитов у приматов — 4.От 7 до 5,5 миллионов клеток на микролитр. Эритроциты всегда одного и того же размера у разных видов, но различаются по размеру. Например, средний диаметр эритроцитов приматов составляет 7,5 мкл, у собаки — около 7,0 мкл, а диаметр эритроцитов кошки — 5,9 мкл. Эритроциты овцы еще меньше — 4,6 мкл. Эритроциты млекопитающих теряют свои ядра и митохондрии, когда они высвобождаются из костного мозга, в котором они образовались. Эритроциты рыб, земноводных и птиц поддерживают свои ядра и митохондрии на протяжении всей жизни клетки.Основная задача эритроцита — переносить кислород в ткани.
Лейкоциты — это преобладающие лейкоциты периферической крови. Лейкоциты в крови подсчитываются тысячами с измерениями, выраженными в виде диапазонов: количество приматов колеблется от 4800 до 10800 клеток на мкл, собак от 5600 до 19 200 клеток на мкл, кошек от 8000 до 25000 клеток на мкл, крупного рогатого скота от 4000 до 12000 клеток. на мкл, а свиньи от 11000 до 22000 клеток на мкл.
Лимфоциты функционируют в основном в иммунном ответе на чужеродные антигены или материалы.Различные типы лимфоцитов вырабатывают антитела, адаптированные к чужеродным антигенам, и контролируют выработку этих антител. Нейтрофилы — это фагоцитарные клетки, и они участвуют в одной из первых линий защиты от микробных захватчиков, помогая удалять бактерии, попавшие в организм. Другой лейкоцит, обнаруживаемый в периферической крови, — это моноцит. Моноциты дают начало фагоцитарным макрофагам, которые очищают мертвые и поврежденные клетки в организме, независимо от того, являются ли они чужеродными или взятыми из животного-хозяина.Два дополнительных лейкоцита в крови — это эозинофилы и базофилы — оба помогают облегчить воспалительную реакцию.
Слегка зернистый материал среди клеток представляет собой цитоплазматический фрагмент клетки костного мозга. Это называется тромбоцитом или тромбоцитом. Тромбоциты участвуют в стадиях, ведущих к свертыванию крови, чтобы остановить кровотечение через поврежденные кровеносные сосуды. Кровь выполняет ряд функций, но в первую очередь она транспортирует материал по телу, доставляя питательные вещества к клеткам и удаляя из них отходы.
Патологоанатом
Патолог — это врач или ветеринар, специализирующийся на лабораторном обнаружении болезней животных, в том числе человека. Эти специалисты заканчивают медицинское образование, а затем проходят обучение в аспирантуре в медицинском центре. Патолог может наблюдать за клиническими лабораториями для оценки тканей тела и образцов крови для выявления заболеваний или инфекций. Они исследуют образцы тканей под микроскопом, чтобы выявить рак и другие заболевания.Некоторые патологоанатомы проводят вскрытие, чтобы определить причину смерти и прогрессирование болезни.
Внесите свой вклад!
У вас была идея улучшить этот контент? Нам очень понравится ваш вклад.
Улучшить эту страницуПодробнее
Соединительная ткань | Анатомия и физиология
Цели обучения
- Определять и различать типы соединительной ткани: рыхлая, плотная, хрящевая, кость и кровь
- Объясните функции соединительной ткани
Как видно из названия, одна из основных функций соединительной ткани — соединение тканей и органов.В отличие от эпителиальной ткани, которая состоит из клеток, плотно упакованных с небольшим внеклеточным пространством или без него, клетки соединительной ткани диспергированы в матрице . Матрикс обычно включает большое количество внеклеточного материала, продуцируемого клетками соединительной ткани, которые в него встроены. Матрикс играет важную роль в функционировании этой ткани. Двумя основными компонентами матрицы являются , , основное вещество, , и , белковые волокна, .Это основное вещество обычно представляет собой жидкость (воду), но оно также может быть минерализованным и твердым, как в костях. Соединительные ткани бывают самых разнообразных форм, но обычно они имеют три общих характерных компонента: клетки, большое количество основного вещества и белковые волокна. Количество и структура каждого компонента коррелируют с функцией ткани, от твердого основного вещества в костях, поддерживающих тело, до включения специализированных клеток; например, фагоцитарная клетка, которая поглощает патогены, а также очищает ткань от клеточного мусора.
Наиболее распространенной клеткой соединительной ткани является фибробласт . Полисахариды и белки, секретируемые фибробластами, соединяются с внеклеточными жидкостями с образованием вязкого основного вещества, которое со встроенными волокнистыми белками образует внеклеточный матрикс.
Фибробласты секретируют три основных типа волокон: коллагеновые волокна, эластичные волокна и ретикулярные волокна. Коллагеновое волокно состоит из волокнистых белковых субъединиц, связанных вместе, чтобы образовать длинное прямое волокно.Коллагеновые волокна, будучи гибкими, обладают большой прочностью на разрыв, сопротивляются растяжению и придают связкам и сухожилиям характерную упругость и прочность. Эти волокна удерживают соединительные ткани вместе даже во время движения тела.
Эластичное волокно содержит белок эластин вместе с меньшими количествами других белков и гликопротеинов. Основное свойство эластина в том, что после растяжения или сжатия он возвращается к своей первоначальной форме.Эластичные волокна выступают в эластичных тканях кожи и эластичных связках позвоночника.
Ретикулярное волокно также образовано из тех же белковых субъединиц, что и коллагеновые волокна; однако эти волокна остаются узкими и выстраиваются в разветвленную сеть. Они обнаруживаются по всему телу, но наиболее распространены в ретикулярной ткани мягких органов, таких как печень и селезенка, где они закрепляют и обеспечивают структурную поддержку паренхимы (функциональные клетки, кровеносные сосуды и нервы орган).
Все эти типы волокон погружены в основное вещество. Основное вещество, секретируемое фибробластами, состоит из воды, полисахаридов, в частности гиалуроновой кислоты, и белков. Они объединяются, образуя протеогликан с белковой сердцевиной и полисахаридными ветвями. Протеогликан притягивает и улавливает доступную влагу, образуя прозрачную вязкую бесцветную матрицу, которую вы теперь называете основным веществом.
Функции соединительной ткани
Соединительные ткани выполняют множество функций в организме, но, что наиболее важно, они поддерживают и соединяют другие ткани; от соединительнотканной оболочки, окружающей мышечные клетки, до сухожилий, прикрепляющих мышцы к костям, и до скелета, поддерживающего положение тела.Защита — еще одна важная функция соединительной ткани в виде фиброзных капсул и костей, которые защищают нежные органы и, конечно же, скелетную систему. Специализированные клетки соединительной ткани защищают организм от попадающих в него микроорганизмов. Транспортировка жидкости, питательных веществ, отходов и химических веществ обеспечивается специализированными жидкими соединительными тканями, такими как кровь и лимфа. Жировые клетки накапливают излишки энергии в виде жира и способствуют теплоизоляции тела.
Классификация соединительных тканей
Категории соединительной ткани включают следующие:
- Свободная соединительная ткань — большое количество основного вещества и меньше волокон
- Aerolar
- Жир
- Ретикуляр
- Плотная соединительная ткань — большое количество волокон и меньшее количество основного вещества
- Плотный Обычный
- Плотный Нерегулярный
- Эластичный CT
- Хрящ — специализированные клетки, называемые хондроцитами, находятся внутри матрикса (хрящевые клетки)
- Гиалиновый хрящ
- Эластичный хрящ
- Фиброхрящ
- Кость — самая прочная соединительная ткань с небольшим количеством основного вещества, твердым матриксом из кальция и фосфора и специализированными костными клетками, называемыми остеоцитами
- Кровь — жидкая соединительная ткань, без волокон — только основное вещество (плазма) и клетки (красные, белые и тромбоциты)
Свободная соединительная ткань
Рыхлая соединительная ткань находится между многими органами, где она поглощает удары и связывает ткани вместе.Он позволяет воде, солям и различным питательным веществам диффундировать к соседним или внедренным клеткам и тканям.
Жировая ткань состоит в основном из жировых клеток, называемых a дипоцитами , которые хранят липиды в виде капель, заполняющих большую часть цитоплазмы (рисунок 4.6). Большое количество капилляров обеспечивает быстрое хранение и мобилизацию липидных молекул. Жир в основном способствует накоплению липидов, может служить защитой от холода и механических травм, а также защищает внутренние органы, такие как почки и глаза.
Рисунок 4.6. Жировая ткань Это рыхлая соединительная ткань, состоящая из жировых клеток с небольшим количеством внеклеточного матрикса. Он накапливает жир для энергии и обеспечивает изоляцию. LM × 800. (Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012)Ареолярная ткань имеет небольшую специализацию. Он содержит все типы клеток и волокна, описанные ранее, и распределяется случайным образом в виде паутины.Он заполняет промежутки между мышечными волокнами, окружает кровеносные и лимфатические сосуды и поддерживает органы в брюшной полости. Ареолярная ткань лежит в основе большинства эпителия и представляет собой соединительнотканный компонент эпителиальных мембран, которые описаны далее в следующем разделе.
Рисунок 4.7. Ареолярная ткань. Это рыхлая соединительная ткань, широко распространенная по всему телу. Он содержит все три типа волокон (коллагеновые, эластиновые и ретикулярные) с большим количеством основного вещества и фибробластов.
Ретикулярная ткань представляет собой сетчатый поддерживающий каркас для мягких органов, таких как лимфатическая ткань, селезенка и печень (рис. 4.8). Ретикулярные клетки производят ретикулярные волокна, которые образуют сеть, к которой прикрепляются другие клетки. Название происходит от латинского reticulus , что означает «маленькая сеть».
Рисунок 4.8. Ретикулярная ткань Это рыхлая соединительная ткань, состоящая из сети ретикулярных волокон, которая обеспечивает поддерживающую основу для мягких органов.LM × 1600. (Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012)Плотная соединительная ткань
Плотная соединительная ткань содержит больше волокон коллагена, чем рыхлая соединительная ткань. Как следствие, он проявляет большее сопротивление растяжению. Существует три основных категории плотной соединительной ткани: регулярная, нерегулярная и эластичная. Плотные регулярные волокна соединительной ткани параллельны друг другу, увеличивая прочность на разрыв и сопротивление растяжению в направлении ориентации волокон.Связки и сухожилия состоят из плотной регулярной соединительной ткани.
В плотной соединительной ткани неправильной формы направление волокон произвольное. Такое расположение придает ткани большую прочность во всех направлениях и меньшую — в одном конкретном направлении. В некоторых тканях волокна пересекаются и образуют сетку. В других тканях растяжение в нескольких направлениях достигается за счет чередования слоев, в которых волокна проходят с одинаковой ориентацией в каждом слое, а сами слои уложены друг на друга под углом.Дерма кожи представляет собой пример плотной соединительной ткани неправильной формы, богатой коллагеновыми волокнами. Плотные эластичные ткани неправильной формы придают стенкам артерий прочность и способность восстанавливать первоначальную форму после растяжения (рис. 4.9).
Рисунок 4.9. Плотная соединительная ткань (a) Плотная правильная соединительная ткань состоит из коллагеновых волокон, собранных в параллельные пучки. (б) Плотная соединительная ткань неправильной формы состоит из коллагеновых волокон, сплетенных в сетчатую сеть.Сверху, LM × 1000, LM × 200. (Микрофотографии предоставлены Медицинской школой Риджентс Мичиганского университета © 2012)Эластичная соединительная ткань — это модифицированная плотная соединительная ткань, которая помимо коллагеновых волокон содержит множество эластичных волокон, что позволяет ткани возвращаться к своей исходной длине после растяжения (Рис. 4.10). Легкие и артерии имеют слой эластичной соединительной ткани, которая позволяет этим органам растягиваться и отскакивать.
Рисунок 4.10. Эластичная соединительная ткань Эластичная соединительная ткань состоит из коллагеновых волокон с переплетенными эластичными волокнами.Хрящ
Характерный внешний вид хряща обусловлен присутствием полисахаридов, называемых хондроитинсульфатами, которые связываются с белками основного вещества с образованием протеогликанов. В матрицу хряща встроены хондроцитов или хрящевые клетки, и пространство, которое они занимают, называется лакунами (единичное число = лакуна).Слой плотной соединительной ткани неправильной формы, перихондрия, покрывает хрящ. Хрящевая ткань не имеет сосудов, поэтому все питательные вещества должны диффундировать через матрикс, чтобы достичь хондроцитов. Это фактор, способствующий очень медленному заживлению хрящевых тканей.
Три основных типа хрящевой ткани — это гиалиновый хрящ, волокнистый хрящ и эластичный хрящ (рис. 4.11). Гиалин хрящ , наиболее распространенный тип хряща в организме, состоит из коротких и диспергированных коллагеновых волокон и содержит большое количество протеогликанов.Под микроскопом образцы тканей кажутся прозрачными. Поверхность гиалинового хряща гладкая. Сильный и гибкий, он находится в грудной клетке и носу и покрывает кости в местах их соединения, образуя подвижные суставы. Он составляет шаблон эмбрионального скелета до образования кости. Пластина из гиалинового хряща на концах кости позволяет продолжать рост до зрелого возраста. Фиброхрящ жесткий, потому что он имеет толстые пучки коллагеновых волокон, рассредоточенных по его матрице.Коленные и челюстные суставы и межпозвонковые диски являются примерами фиброзного хряща. Эластичный хрящ содержит эластичные волокна, а также коллаген и протеогликаны. Эта ткань обеспечивает жесткую поддержку, а также эластичность. Осторожно потяните за мочки уха и обратите внимание, что они возвращаются к своей первоначальной форме. Наружное ухо содержит эластичный хрящ.
Рисунок 4.11. Типы хрящей Хрящ — это соединительная ткань, состоящая из коллагеновых волокон, заключенных в твердую матрицу сульфатов хондроитина.(а) Гиалиновый хрящ обеспечивает некоторую гибкость. Пример из ткани собаки. (б) Фиброхрящи обеспечивают некоторую сжимаемость и могут поглощать давление. (c) Эластичный хрящ обеспечивает прочную, но эластичную поддержку. Сверху, LM × 300, LM × 1200, LM × 1016. (Микрофотографии предоставлены Медицинской школой Риджентс Мичиганского университета © 2012)Кость
Кость — самая твердая соединительная ткань. Он обеспечивает защиту внутренних органов и поддерживает тело.Жесткий внеклеточный матрикс кости состоит в основном из волокон коллагена, заключенных в минерализованном основном веществе, содержащем гидроксиапатит, форму фосфата кальция. Оба компонента матрицы, органические и неорганические, вносят свой вклад в необычные свойства кости. Без коллагена кости были бы хрупкими и легко разрушались. Без минеральных кристаллов кости сгибались бы и не оказывали особой поддержки. Остеоциты , костные клетки, расположены в лакунах. Гистология поперечной ткани длинной кости показывает типичное расположение остеоцитов в виде концентрических кругов вокруг центрального канала (Рисунок 4.12). Кость — это ткань с высокой васкуляризацией. В отличие от хряща, костная ткань восстанавливается после травм в относительно короткие сроки.
Губчатая кость под микроскопом выглядит как губка и содержит пустоты между трабекулами или собственно дуги кости. Он легче, чем компактная кость, и находится внутри некоторых костей и на концах длинных костей. Компактная кость твердая и имеет большую структурную прочность.
Рисунок 4.12. Костная соединительная ткань Есть два типа костной ткани: плотная и губчатая.Показанное изображение представляет собой компактную костную ткань. Это наиболее распространено и имеет вид матрицы, образующей концентрические кольца вокруг полостей для кровеносных сосудов. Остеоциты (костные клетки) располагаются внутри концентрических колец.Кровь
Кровь — это жидкость соединительной ткани. Кровь состоит из двух компонентов: клеток и жидкого матрикса (рис. 4.13). Эритроциты, красные кровяные тельца, переносят кислород и немного углекислого газа. Лейкоциты, белые кровяные тельца, отвечают за защиту от потенциально вредных микроорганизмов или молекул.Тромбоциты — это фрагменты клеток, участвующие в свертывании крови. Некоторые лейкоциты обладают способностью пересекать эндотелиальный слой, выстилающий кровеносные сосуды, и проникать в соседние ткани. Питательные вещества, соли и отходы растворяются в жидкой матрице, называемой плазмой, и переносятся по телу.
Лимфа содержит жидкий матрикс и лейкоциты. Лимфатические капилляры чрезвычайно проницаемы, позволяя более крупным молекулам и избыточной жидкости из интерстициальных пространств попадать в лимфатические сосуды.Лимфа стекает в кровеносные сосуды, доставляя в кровь молекулы, которые иначе не могли бы напрямую попасть в кровоток. Таким образом, специализированные лимфатические капилляры транспортируют абсорбированные жиры из кишечника и доставляют эти молекулы в кровь.
Рисунок 4.13. Кровь: жидкая соединительная ткань Кровь — это жидкая соединительная ткань, содержащая эритроциты и различные типы лейкоцитов, которые циркулируют в жидком внеклеточном матриксе. LM × 1600.(Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012)Интерактивная ссылка
Перейдите по этой ссылке, чтобы проверить свои знания о соединительной ткани с помощью этой викторины из 10 вопросов. Можете ли вы назвать 10 типов тканей, показанных на слайдах гистологии?
Хотя соединительная ткань имеет более низкую плотность клеток, чем другие ткани, которые вы изучите в этом году, клетки этих тканей чрезвычайно важны.
Фибробласты на сегодняшний день являются наиболее распространенным типом нативных клеток соединительной ткани. Фибробласт синтезирует коллаген и основное вещество внеклеточного матрикса. Эти клетки производят большое количество белка, который они секретируют для создания слоя соединительной ткани. Некоторые фибробласты обладают сократительной функцией; их называют миофибробластами.
Хондроциты и остеоциты образуют внеклеточный матрикс хряща и кости. Более подробную информацию и хондроциты можно будет найти позже в этой лаборатории; Остеоциты будут покрыты в Лаборатории по костям.
Макрофаг — это соединительная ткань, представляющая ретикулоэндотелиальную или мононуклеарную систему фагоцитов. Эта система состоит из ряда тканеспецифичных, подвижных фагоцитарных клеток, которые происходят от моноцитов — к ним относятся клетки Купфера печени, альвеолярные макрофаги легкого, микроглия центральной нервной системы и ретикулярные клетки селезенка. Позже вы встретитесь с каждым из них; А пока убедитесь, что вы понимаете, что все они происходят от моноцитов и что макрофаг — это версия соединительной ткани.Макрофаги неотличимы от фибробластов, но их можно распознать, когда они усваивают большое количество видимых индикаторных веществ, таких как красители или частицы углерода. Макрофаги фагоцитируют чужеродный материал в слое соединительной ткани, а также играют важную роль в качестве антигенпрезентирующих клеток, функция, о которой вы узнаете больше в иммунобиологии.
Тучные клетки — это гранулированные клетки, обычно встречающиеся в соединительной ткани. Эти клетки опосредуют иммунные ответы на инородные частицы.В частности, они высвобождают большое количество гистамина и ферментов в ответ на распознавание антигена. Этот процесс дегрануляции является защитным, когда инородные организмы вторгаются в организм, но также является причиной многих аллергических реакций.
Белые жировые клетки специализируются на хранении триглицеридов и встречаются по отдельности или небольшими группами, разбросанными по рыхлой соединительной ткани. Они особенно распространены на более мелких кровеносных сосудах. Когда жировые клетки накапливаются в таком количестве, что вытесняют или заменяют клеточные и волокнистые элементы, это накопление называется жировой тканью.Эти клетки могут вырасти до 100 микрон и обычно содержат когда-то центрально расположенную липидную вакуоль — цитоплазма образует круговое кольцо вокруг этой вакуоли, а ядро сжимается и смещается в сторону. Функция белого жира — служить источником энергии и теплоизолятором.
Клетки коричневого жира в высшей степени специализированы для регулирования температуры. Этих клеток много у новорожденных и млекопитающих, находящихся в спячке, но редко у взрослых. У них есть многочисленные липидные капли меньшего размера и большое количество митохондрий, цитохромы которых придают ткани коричневый цвет.Цепь переноса электронов в этих митохондриях нарушается разобщающим белком, который вызывает диссипацию митохондриального градиента ионов водорода без производства АТФ. Это генерирует тепло.
4.3 Соединительная ткань поддерживает и защищает — анатомия и физиология
Цели обучения
Опишите структурные характеристики различных соединительных тканей и то, как эти характеристики обеспечивают их функции.
К концу этого раздела вы сможете:
- Определять и различать разные типы соединительной ткани: собственные, поддерживающие и жидкие — и соотносить каждый с их функцией и расположением
- Опишите общие структурные элементы соединительной ткани
- Опишите, как структурные свойства соединительной ткани соотносятся с уникальными функциями ткани.
Функции соединительной ткани
Соединительные ткани выполняют множество функций в организме, самое главное, они поддерживают и соединяют другие ткани: от соединительной оболочки, окружающей мышцу, до сухожилий, прикрепляющих мышцы к костям, и до скелета, поддерживающего положение тела. .Защита — еще одна важная функция соединительной ткани в виде фиброзных капсул и костей, которые защищают нежные органы. Специализированные клетки соединительной ткани защищают организм от попадающих в него микроорганизмов. Транспорт газов, питательных веществ, отходов и химических веществ обеспечивается специальными жидкими соединительными тканями, такими как кровь и лимфа. Жировые клетки накапливают излишки энергии в виде жира и способствуют теплоизоляции тела.
Эмбриональная соединительная ткань
Все соединительные ткани происходят из мезодермального слоя эмбриона (см. Рисунок 4.2.2). Первой соединительной тканью, развивающейся в эмбрионе, является мезенхима , линия стволовых клеток, из которой позже происходят все соединительные ткани. Кластеры мезенхимальных клеток разбросаны по взрослой ткани и поставляют клетки, необходимые для замены и восстановления после повреждения соединительной ткани. В пуповине образуется второй тип эмбриональной соединительной ткани, называемый слизистой соединительной тканью или желе Уортона. Эта ткань больше не присутствует после рождения, оставляя только разбросанные по всему телу мезенхимальные клетки.
Конструктивные элементы соединительной ткани
Соединительные ткани бывают самых разнообразных форм, но обычно они имеют три общих характерных компонента: клетки, большое количество аморфного основного вещества и белковые волокна. В отличие от эпителиальной ткани, которая состоит из плотно упакованных клеток, клетки соединительной ткани более широко рассредоточены во внеклеточном матриксе (ЕСМ). Матрикс играет важную роль в функционировании этой ткани.Основным компонентом матрицы является основное вещество. Это основное вещество обычно представляет собой жидкость, но оно также может быть минерализованным и твердым, как в костях. Количество и структура каждого компонента коррелируют с функцией ткани, от твердого основного вещества в костях, поддерживающих тело, до включения специализированных клеток; например, фагоцитарная клетка, которая поглощает патогены, а также очищает ткань от клеточного мусора.
Типы ячеек
Каждый класс соединительной ткани состоит из основных типов клеток.Клетки могут быть как в активной форме (суффикс — blast ), где они делятся и секретируют компоненты основного вещества, так и в неактивной форме (суффикс — cyte ). Самой многочисленной клеткой в собственно соединительной ткани является фибробласт . Полисахариды и белки, секретируемые фибробластами, соединяются с внеклеточными жидкостями с образованием вязкого основного вещества, которое со встроенными волокнистыми белками и клетками образует внеклеточный матрикс. Хондробласты и , остеобласты представляют собой первичный специализированный тип клеток, расположенный в хряще и кости, соответственно.
Адипоциты — это клетки, которые хранят липиды в виде капель, заполняющих большую часть цитоплазмы. Есть два основных типа адипоцитов: белые и коричневые. Коричневые адипоциты хранят липиды в виде капель и обладают высокой метаболической активностью. Напротив, белые жировые адипоциты хранят липиды в виде одной большой капли и метаболически менее активны. Их эффективность в хранении большого количества жира наблюдается у людей с ожирением. Количество и тип адипоцитов зависит от ткани и местоположения и варьируется среди людей в популяции.
Мезенхимальная клетка — мультипотентная взрослая стволовая клетка. Эти клетки могут дифференцироваться в любой тип клеток соединительной ткани, необходимых для восстановления и заживления поврежденной ткани.
Макрофаг Клетка — это большая клетка, происходящая из моноцита, типа клетки крови, которая проникает в матрицу соединительной ткани из кровеносных сосудов. Клетки макрофагов являются важным компонентом иммунной системы, которая обеспечивает защиту организма от потенциальных патогенов и разрушенных клеток-хозяев.При стимуляции макрофаги выделяют цитокины, небольшие белки, которые действуют как химические посредники. Цитокины привлекают другие клетки иммунной системы к инфицированным участкам и стимулируют их активность. Блуждающие или свободные макрофаги быстро перемещаются за счет амебоидного движения, поглощая инфекционные агенты и клеточный мусор. Напротив, фиксированные макрофаги постоянно проживают в своих тканях.
Тучная клетка , обнаруженная в собственно соединительной ткани, имеет множество цитоплазматических гранул. Эти гранулы содержат химические сигналы гистамина и гепарина.При раздражении или повреждении тучные клетки выделяют гистамин, медиатор воспаления, который вызывает расширение сосудов и усиление кровотока в месте травмы или инфекции, а также зуд, отек и покраснение (у людей со светлой кожей), что распознается как аллергическая реакция. . Тучные клетки происходят из гемопоэтических стволовых клеток и являются частью иммунной системы.
Соединительнотканные волокна и наземное вещество
Фибробласты секретируют три основных типа волокон: коллагеновые волокна, эластичные волокна и ретикулярные волокна. Коллагеновое волокно состоит из волокнистых белковых субъединиц, связанных вместе, образуя длинное прямое волокно. Коллагеновые волокна, будучи гибкими, обладают большой прочностью на разрыв, сопротивляются растяжению и придают связкам и сухожилиям характерную упругость.
Эластичное волокно содержит белок эластин вместе с меньшим количеством других белков и гликопротеинов. Основное свойство эластина в том, что после растяжения или сжатия он возвращается к своей первоначальной форме.Эластичные волокна заметны в эластичных тканях кожи, стенках крупных кровеносных сосудов и в некоторых связках, поддерживающих позвоночник.
Сетчатое волокно образовано из тех же белковых субъединиц, что и коллагеновые волокна, однако эти волокна остаются узкими и расположены в виде разветвленной сети. Они обнаруживаются по всему телу, но наиболее распространены в ретикулярной ткани мягких органов, таких как печень и селезенка, где они закрепляют и обеспечивают структурную поддержку паренхимы (функциональные клетки, кровеносные сосуды и нервы орган).
Все эти типы волокон помещены в основное вещество . Основное вещество, секретируемое фибробластами, состоит из полисахаридов, в частности гиалуроновой кислоты, и белков. Они объединяются, образуя протеогликан с белковой сердцевиной и полисахаридными ветвями. Протеогликан притягивает и улавливает доступную влагу, образуя прозрачное, вязкое, бесцветное основное вещество.
Классификация соединительной ткани
Три широкие категории соединительной ткани классифицируются в соответствии с характеристиками их основного вещества и типами волокон в матрице (Таблица 4.1). Собственно соединительная ткань включает рыхлую соединительную ткань и плотную соединительную ткань . Обе ткани содержат различные типы клеток и белковые волокна, взвешенные в вязком основном веществе. Плотная соединительная ткань усилена пучками волокон, которые обеспечивают прочность на разрыв, эластичность и защиту. В рыхлой соединительной ткани волокна расположены непрочно, оставляя между собой большие промежутки. Поддерживающая соединительная ткань — кость и хрящ — обеспечивают структуру и прочность тела и защищают мягкие ткани.Эти ткани характеризуют несколько различных типов клеток и плотно упакованные волокна в матрице. В кости матрица жесткая и описывается как кальцинированная из-за отложений солей кальция. В жидкой соединительной ткани , лимфе и крови, различные специализированные клетки циркулируют в жидкой жидкости, содержащей соли, питательные вещества и растворенные белки.
| Собственно соединительная ткань | Поддерживающая соединительная ткань | Жидкая соединительная ткань |
Рыхлая соединительная ткань:
| Хрящ:
| Кровь |
Плотная соединительная ткань:
| Кость:
| Лимфа |
Собственная соединительная ткань
Фибробласты присутствуют во всех собственно соединительных тканях (Рисунок 4.3.1). Фиброциты, адипоциты и мезенхимальные клетки — это фиксированные клетки, что означает, что они остаются в соединительной ткани. Другие клетки входят и выходят из соединительной ткани в ответ на химические сигналы. Макрофаги, тучные клетки, лимфоциты, плазматические клетки и фагоцитарные клетки находятся в самой соединительной ткани, но на самом деле являются частью иммунной системы, защищающей организм.
Рисунок 4.3.1 — Собственная соединительная ткань: Фибробласты производят эту фиброзную ткань. Собственно соединительная ткань включает фиксированные клетки фиброцитов, адипоцитов и мезенхимальных клеток (LM × 400).(Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012)
Свободная соединительная ткань
Рыхлая соединительная ткань находится между многими органами, где она поглощает удары и связывает ткани вместе. Он позволяет воде, солям и различным питательным веществам диффундировать к соседним или внедренным клеткам и тканям.
Жировая ткань состоит в основном из жировых клеток с небольшим внеклеточным матриксом (рис. 4.3.2). Большое количество капилляров обеспечивает быстрое хранение и мобилизацию липидных молекул.Белая жировая ткань наиболее обильна. Он может казаться желтым и обязан своим цветом каротину и связанным с ним пигментам из растительной пищи. Белый жир в основном способствует накоплению липидов и может служить защитой от низких температур и механических травм. Белая жировая ткань защищает почки, смягчает заднюю часть глаза, брюшную полость и подкожную клетчатку. Коричневая жировая ткань чаще встречается у младенцев, отсюда и термин «детский жир». У взрослых количество бурого жира меньше, и он находится в основном в шейных и ключичных областях тела.Множество митохондрий в цитоплазме коричневой жировой ткани помогает объяснить ее эффективность в метаболизме накопленного жира. Коричневая жировая ткань является термогенной, что означает, что, расщепляя жиры, она выделяет метаболическое тепло, а не производит аденозинтрифосфат (АТФ), ключевую молекулу, используемую в метаболизме.
Рисунок 4.3.2. Жировая ткань: Это рыхлая соединительная ткань, состоящая из жировых клеток с небольшим внеклеточным матриксом. Он накапливает жир для энергии и обеспечивает изоляцию (LM × 800).(Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012)
Ареолярная ткань показывает относительно небольшую специализацию и является наиболее широко распространенной соединительной тканью в организме. Он содержит все типы клеток и волокна, описанные ранее, и имеет явно случайную структуру, похожую на паутину. Он заполняет промежутки между мышечными волокнами, окружает кровеносные и лимфатические сосуды и поддерживает органы в брюшной полости. Ареолярная ткань лежит в основе большинства эпителия и представляет собой соединительнотканный компонент эпителиальных мембран.
Рисунок 4.3.2a — Ареолярная ткань
Ретикулярная ткань представляет собой сетчатый поддерживающий каркас для мягких органов, таких как лимфатическая ткань, селезенка и печень (рисунок 4.3.3). Ретикулярные волокна образуют сеть, к которой прикрепляются другие клетки. Название происходит от латинского reticulus , что означает «маленькая сеть».
Рисунок 4.3.3 — Ретикулярная ткань: Это рыхлая соединительная ткань, состоящая из сети ретикулярных волокон, которая обеспечивает поддерживающую основу для мягких органов (LM × 1600).(Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012 г.)
Плотная соединительная ткань
Плотная соединительная ткань содержит больше волокон коллагена, чем рыхлая соединительная ткань. Как следствие, он демонстрирует большее сопротивление растяжению и более высокую прочность на разрыв. Существует три основных категории плотной соединительной ткани: регулярная, нерегулярная и эластичная. Плотные регулярные волокна соединительной ткани параллельны друг другу, увеличивая прочность на разрыв и сопротивление растяжению в направлении ориентации волокон.Связки и сухожилия в основном образованы плотной регулярной соединительной тканью.
В плотной соединительной ткани неправильной формы белковые волокна расположены неравномерно и не имеют однородности, характерной для плотной регулярной ткани. Такое расположение придает ткани большую прочность во всех направлениях и меньшую — в одном конкретном направлении. В некоторых тканях волокна пересекаются и образуют сетку. В других тканях растяжение в нескольких направлениях достигается за счет чередования слоев, в которых волокна проходят с одинаковой ориентацией в каждом слое, а сами слои уложены друг на друга под углом.Дерма кожи представляет собой пример плотной соединительной ткани неправильной формы, богатой коллагеновыми волокнами.
Плотная эластичная ткань содержит волокна эластина в дополнение к волокнам коллагена, что позволяет ткани возвращаться к своей исходной длине после растяжения. Плотные эластичные ткани придают стенкам артерий прочность и способность восстанавливать первоначальную форму после растяжения (плотная фигура КТ).
Рисунок 4.3.4 — Плотная соединительная ткань: (a) Плотная регулярная соединительная ткань состоит из коллагеновых волокон, собранных в параллельные пучки.(б) Плотная соединительная ткань неправильной формы состоит из коллагеновых волокон, сплетенных в сетчатую сеть. Сверху, LM × 1000, LM × 200. (Микрофотографии предоставлены Медицинской школой Риджентс Мичиганского университета © 2012)
Рисунок 4.3.4a — Плотная эластичная соединительная ткань : Плотная эластичная соединительная ткань состоит из большого количества эластичных волокон.
Заболевания соединительной ткани: тендинит
Ваш противник стоит наготове, пока вы готовитесь к подаче, но вы уверены, что пробьете мяч мимо соперника.Когда вы подбрасываете мяч высоко в воздух, по вашему запястью пронзает жгучая боль, и вы роняете теннисную ракетку. Та тупая боль в запястье, которую вы игнорировали летом, теперь стала невыносимой болью. Игра пока окончена.
После осмотра вашего опухшего запястья врач в отделении неотложной помощи сообщает, что у вас развился тендинит запястья. Она рекомендует заморозить болезненную область, принимать нестероидные противовоспалительные препараты, чтобы облегчить боль и уменьшить отек, и полностью отдохнуть в течение нескольких недель.Она прерывает ваши протесты, что вы не можете перестать играть. Она строго предупреждает об опасности обострения состояния и возможности операции. Она утешает вас, говоря, что такие известные теннисисты, как Винус и Серена Уильямс и Рафаэль Надаль, также страдали от травм, связанных с тендинитом.
Что такое тендинит и как это произошло? Тендинит — это воспаление сухожилия, толстой полосы волокнистой соединительной ткани, которая прикрепляет мышцу к кости.Состояние вызывает боль и болезненность в области вокруг сустава. Чаще всего это состояние возникает в результате повторяющихся движений во времени, которые напрягают сухожилия, необходимые для выполнения заданий.
Люди, чья работа и увлечения связаны с повторением одних и тех же движений снова и снова, часто подвергаются наибольшему риску развития тендинита. Вы слышали о теннисе и локтях гольфиста, о коленях прыгуна и плечах пловца. Во всех случаях чрезмерное использование сустава вызывает микротравму, которая вызывает воспалительную реакцию.Обычно тендинит диагностируется при клиническом обследовании. В случае сильной боли можно исследовать рентген, чтобы исключить возможность травмы кости. В тяжелых случаях тендинит может даже оторваться сухожилие. Хирургическое лечение сухожилия болезненно. Соединительная ткань в сухожилии не имеет обильного кровоснабжения и медленно заживает.
В то время как пожилые люди подвержены риску развития тендинита, поскольку эластичность ткани сухожилия с возрастом снижается, у активных людей любого возраста тендинит может развиться.Юные спортсмены, танцоры и операторы компьютеров; любой, кто постоянно выполняет одни и те же движения, подвержен риску тендинита. Хотя повторяющиеся движения неизбежны во многих видах деятельности и могут привести к тендиниту, можно принять меры предосторожности, которые могут снизить вероятность развития тендинита. Для активных людей рекомендуется растяжка перед тренировкой и кросс-тренинг или смена упражнений. Для страстного спортсмена, возможно, пора взять несколько уроков, чтобы улучшить технику. Все профилактические меры направлены на повышение прочности сухожилия и уменьшение нагрузки на него.При должном отдыхе и управляемом уходе вы вернетесь на площадку, чтобы отбить эту подачу через сетку.
Внешний веб-сайт
Посмотрите этот анимационный ролик, чтобы узнать больше о тендините, болезненном состоянии, вызванном опухшими или поврежденными сухожилиями.
Поддерживающие соединительные ткани
Две основные формы поддерживающей соединительной ткани, хрящ и кость, позволяют телу сохранять свою осанку и защищать внутренние органы.
Хрящ
Характерный внешний вид хряща обусловлен полисахаридами, называемыми хондроитинсульфатами, которые связываются с белками основного вещества с образованием протеогликанов.В матрицу хряща встроено хондроцитов или хрящевых клеток, и пространство, которое они занимают, называется лакунами (единичное число = лакуна). Слой плотной соединительной ткани неправильной формы, перихондрия, покрывает хрящ. Хрящевая ткань не имеет сосудов, поэтому все питательные вещества должны диффундировать через матрикс, чтобы достичь хондроцитов. Это фактор, способствующий очень медленному заживлению хрящевых тканей.
Три основных типа хрящевой ткани — это гиалиновый хрящ, волокнистый хрящ и эластичный хрящ (Рисунок 4.3.5 — Типы хрящей). Гиалиновый хрящ , самый распространенный тип хряща в организме, состоит из коротких и диспергированных коллагеновых волокон и содержит большое количество протеогликанов. Под микроскопом образцы тканей кажутся прозрачными. Поверхность гиалинового хряща гладкая. Сильный и гибкий, он находится в грудной клетке и носу и покрывает кости в местах их соединения, образуя подвижные суставы. Он формирует шаблон эмбрионального скелета до образования кости. Пластина из гиалинового хряща на концах кости позволяет продолжать рост до зрелого возраста. Фиброхрящ жесткий, потому что он имеет толстые пучки коллагеновых волокон, рассредоточенных по его матрице. Межпозвоночные диски являются примерами фиброзного хряща. Эластичный хрящ содержит эластичные волокна, а также коллаген и протеогликаны. Эта ткань обеспечивает поддержку, а также эластичность. Осторожно потяните за мочки уха и обратите внимание, что они возвращаются к своей первоначальной форме. Наружное ухо содержит эластичный хрящ.
Рисунок 4.3.5. Типы хряща: Хрящ — это соединительная ткань, состоящая из коллагеновых волокон, заключенных в твердую матрицу из хондроитинсульфатов.(а) Гиалиновый хрящ обеспечивает некоторую гибкость. Пример из ткани собаки. (б) Фиброхрящи обеспечивают некоторую сжимаемость и могут поглощать давление. (c) Эластичный хрящ обеспечивает прочную, но эластичную поддержку. Сверху, LM × 300, LM × 1200, LM × 1016. (Микрофотографии предоставлены Медицинской школой Риджентс Мичиганского университета © 2012)
Bone
Кость — самая твердая соединительная ткань. Он обеспечивает защиту внутренних органов и поддерживает тело. Жесткий внеклеточный матрикс кости состоит в основном из волокон коллагена, заключенных в минерализованном основном веществе, содержащем гидроксиапатит, форму фосфата кальция.Оба компонента матрицы, органические и неорганические, вносят свой вклад в необычные свойства кости. Без коллагена кости были бы хрупкими и легко разрушались. Без минеральных кристаллов кости сгибались бы и не оказывали особой поддержки. Остеобласты являются активными костеобразующими клетками, производящими органическую часть внеклеточного матрикса. Зрелые костные клетки, остеоциты, располагаются в лакунах. Кость — это ткань с высокой васкуляризацией. В отличие от хряща, костная ткань восстанавливается после травм в относительно короткие сроки.
Гистология поперечного сечения компактной кости показывает типичное расположение остеоцитов в виде концентрических кругов вокруг центрального канала. Эта структурная единица компактной кости называется остеоном . В губчатой кости или губчатой кости нет такой структурной единицы, которая под микроскопом выглядит как губка и содержит пустоты между трабекулами. Он легче компактной кости и находится внутри костей и на концах длинных костей. Компактная кость твердая и имеет большую структурную прочность.
Жидкая соединительная ткань
Кровь и лимфа — это жидкие соединительные ткани. Клетки циркулируют в жидком внеклеточном матриксе. Все форменные элементы, циркулирующие в крови, происходят из гемопоэтических стволовых клеток, расположенных в костном мозге (Рисунок 4.3.6 — Кровь: жидкая соединительная ткань). Эритроциты, красные кровяные тельца, переносят кислород и углекислый газ. Лейкоциты, белые кровяные тельца, отвечают за защиту от потенциально вредных микроорганизмов или молекул.Тромбоциты — это фрагменты клеток, участвующие в свертывании крови. Некоторые лейкоциты обладают способностью пересекать эндотелиальный слой, выстилающий кровеносные сосуды, и проникать в соседние ткани. Питательные вещества, соли и отходы растворяются в жидкой матрице и переносятся по телу.
Лимфа содержит жидкий матрикс и лейкоциты. Лимфатические капилляры очень проницаемы, что позволяет более крупным молекулам и избыточной жидкости из интерстициальных пространств попадать в лимфатические сосуды. Лимфатические сосуды возвращают в венозную кровь молекулы и жидкость, которые иначе не могли бы напрямую попасть в кровоток.Таким образом, специализированные лимфатические капилляры транспортируют абсорбированные жиры из кишечника и доставляют эти молекулы в кровь.
Рисунок 4.3.6 — Кровь: жидкая соединительная ткань: Кровь — это жидкая соединительная ткань, содержащая эритроциты и различные типы лейкоцитов, которые циркулируют в жидком внеклеточном матриксе (LM × 1600). (Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012)
Внешний веб-сайт
Перейдите по этой ссылке, чтобы проверить свои знания о соединительной ткани с помощью этой викторины из 10 вопросов.Можете ли вы назвать 10 типов тканей, показанных на слайдах гистологии?
Обзор главы
Соединительная ткань — это неоднородная ткань с множеством форм клеток и структурой ткани. Структурно все соединительные ткани содержат клетки, встроенные во внеклеточный матрикс, стабилизированный белками. Химическая природа и физическая структура внеклеточного матрикса и белков сильно различаются между тканями, что отражает разнообразие функций, которые соединительная ткань выполняет в организме.Соединительные ткани отделяют и смягчают органы, защищая их от смещения или травм. Соединительные ткани также обеспечивают поддержку и помощь движению, хранят и транспортируют молекулы энергии, защищают от инфекций и способствуют температурному гомеостазу.
Множество разных клеток способствуют образованию соединительной ткани. Они берут начало в мезодермальном зародышевом листе и дифференцируются от мезенхимы и кроветворной ткани в костном мозге. Фибробласты являются наиболее многочисленными и секретируют много белковых волокон, адипоциты специализируются на хранении жира, гемопоэтические клетки из костного мозга дают начало всем клеткам крови, хондроциты образуют хрящ, а остеоциты образуют кости.Внеклеточный матрикс содержит жидкость, белки, производные полисахаридов и, в случае костей, минеральные кристаллы. Белковые волокна делятся на три основные группы: коллагеновые волокна (толстые, прочные, гибкие и устойчивые к растяжению), ретикулярные волокна (тонкие и образующие поддерживающую сетку) и эластин (тонкие и эластичные волокна).
Основными типами соединительной ткани являются собственно соединительная ткань, поддерживающая ткань и жидкая ткань. Собственно рыхлая соединительная ткань включает жировую ткань, ареолярную ткань и ретикулярную ткань.Они служат для удержания органов и других тканей на месте, а в случае жировой ткани — для изоляции и сохранения запасов энергии. Матрикс является наиболее распространенным элементом рыхлой ткани, хотя жировая ткань не имеет большого количества внеклеточного матрикса. Собственно плотная соединительная ткань богаче волокнами и может быть правильной, с волокнами, ориентированными параллельно, как в связках и сухожилиях, нерегулярной, с волокнами, ориентированными в нескольких направлениях, или эластичной, с большим количеством белка эластина, встроенного в волокна.Капсулы органов (коллагеновый тип) и стенки артерий (эластический тип) содержат плотную соединительную ткань неправильной формы. Хрящ и кость являются поддерживающей тканью. Хрящ содержит хондроциты и довольно гибкий. Гиалиновый хрящ гладкий и чистый, покрывает суставы и находится в растущей части костей. Фиброхрящи прочны из-за дополнительных коллагеновых волокон и, помимо прочего, образуют межпозвоночные диски. Эластичный хрящ может растягиваться и возвращаться к своей первоначальной форме из-за высокого содержания эластичных волокон.Кости состоят из жесткого минерализованного матрикса, содержащего соли кальция, кристаллы и остеоциты, расположенные в лакунах. Костная ткань сильно васкуляризована. Губчатая кость губчатая и менее твердая, чем компактная кость. Жидкая ткань, например кровь и лимфа, характеризуется жидким матриксом и отсутствием поддерживающих волокон.
Вопросы по интерактивной ссылке
Перейдите по этой ссылке, чтобы проверить свои знания о соединительной ткани с помощью этой викторины из 10 вопросов. Можете ли вы назвать 10 типов тканей, показанных на слайдах гистологии?
Щелкните внизу викторины, чтобы получить ответы.
Контрольные вопросы
Вопросы критического мышления
Одна из основных функций соединительной ткани — объединять органы и системы органов в организме. Обсудите, как кровь выполняет эту роль.
Кровь — это жидкая соединительная ткань, множество специализированных клеток, которые циркулируют в водянистой жидкости, содержащей соли, питательные вещества и растворенные белки в жидком внеклеточном матриксе.Кровь содержит форменные элементы, полученные из костного мозга. Эритроциты, или красные кровяные тельца, переносят газы, кислород и углекислый газ. Лейкоциты или белые кровяные тельца несут ответственность за защиту организма от потенциально вредных микроорганизмов или молекул. Тромбоциты — это фрагменты клеток, участвующие в свертывании крови. Некоторые клетки обладают способностью пересекать эндотелиальный слой, выстилающий сосуды, и проникать в соседние ткани. Питательные вещества, соли и отходы растворяются в жидкой матрице и переносятся по телу.
Почему повреждение хряща, особенно гиалинового хряща, заживает намного медленнее, чем перелом кости?
Слой плотной соединительной ткани неправильной формы покрывает хрящ.
