Стерилизация изделий медицинского назначения – выход на новые технологии
Время диктует свои правила. А обстоятельства, которые ввергли весь мир в состояние тотального карантина, заставляют по-новому взглянуть на вещи, которые еще недавно нам казались хорошо знакомыми. Такие обыденные, элементарные действия, как мытье рук перед едой, обрели сегодня новый смысл. Более того, новые реалии современной жизни подняли на пик актуальности два чисто медицинских термина: дезинфекция и стерилизация.
Истории развития методов стерилизации
Эти понятия тесно связаны. Если смотреть исторически, второе плавно вытекало из первого. Стерилизация стала следующим звеном эволюции медицины и одной из опор современной цивилизации. Для начала, внедрение в массы элементарных правил гигиены позволило значительно снизить число смертей от банальной антисанитарии. Достаточно вспомнить средневековье, когда немудрено было проститься с жизнью от простого пореза пальца.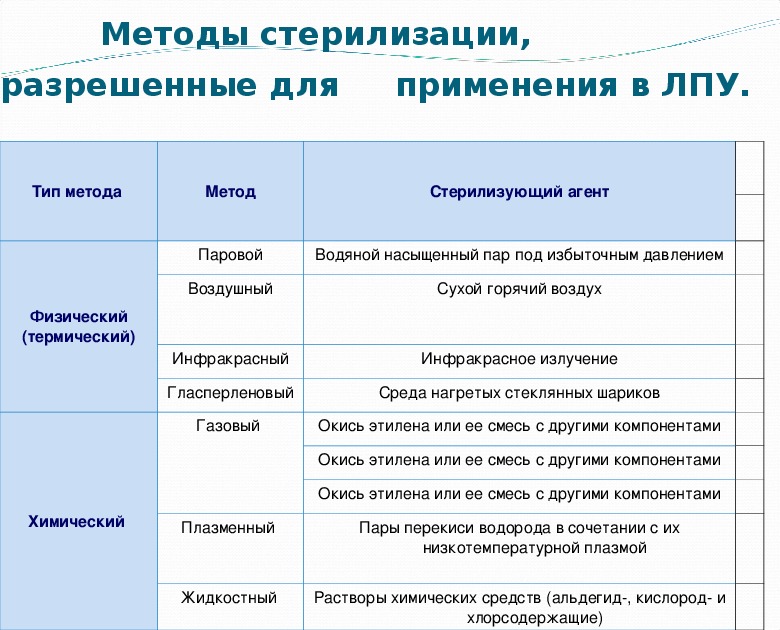 Серьезный подход к дезинфекции вообще и стерилизации изделий медицинского назначения в частности уменьшил риски заражений и смертей от разного рода медицинский манипуляций, например, при хирургических вмешательствах.
Серьезный подход к дезинфекции вообще и стерилизации изделий медицинского назначения в частности уменьшил риски заражений и смертей от разного рода медицинский манипуляций, например, при хирургических вмешательствах.
Ёмкость для стерилизации медицинских инструментов, середина 20 века
Историки и социологи, анализируя статистику прошлых веков, неизменно связывают рост продолжительности жизни населения Земли именно с развитием методик стерилизации разного рода предметов медицинского назначения. Не менее важным стало соблюдение условий общей стерильности во время проведения различных медицинских мероприятий.
Так, поступательное улучшение санитарных условий в медицинских учреждениях на протяжении последних полутора сотен лет позволило, к примеру, успешно бороться со смертностью женщин и младенцев во время родов. Это особенно важно, поскольку со временем показатель младенческой смертности вообще превратился в важный критерий «демографического благополучия» развитых стран, обеспечив там взрывной рост населения. И в вопросе детского здоровья, как считают медики, сегодня мелочей быть не может.
И в вопросе детского здоровья, как считают медики, сегодня мелочей быть не может.
Продвигаясь все дальше и дальше, современная медицина уточняла требования к стерилизации. Стало важным не просто использовать стерильные предметы, но сохранять стерильность изделий медицинского назначения в течении длительного времени. К примеру, на всех этапах их следования от изготовителя до потребителя, от стерильной упаковки изделия на производстве до стерильных условий его использования в какой-нибудь больничной манипуляционной.
Сегодня каждый мало-мальски связанный с медициной специалист хорошо понимает значение и отличие этих двух понятий, которым наша цивилизация обязана своим существованием, – дезинфекция и стерилизация. Обыватель же, хоть и признает их значимость, разницы не видит.
Дезинфекция и стерилизация: разница есть!
Начнем с того, что под дезинфекцией понимается комплекс мероприятий, который направлен на уничтожение возбудителей инфекционных заболеваний и разрушение токсинов на объектах внешней среды. Это всего лишь один из видов обеззараживания, который предотвращает попадание токсинов и микробов на кожу или слизистые. Дезинфекция может и не уничтожить их полностью, но в любом случае уменьшит количество.
Это всего лишь один из видов обеззараживания, который предотвращает попадание токсинов и микробов на кожу или слизистые. Дезинфекция может и не уничтожить их полностью, но в любом случае уменьшит количество.
В качестве действующего вещества дезинфекции – дезинфектанта – используются химические дезинфицирующие средства. Например, такие, как формальдегид или гипохлорит натрия, растворы органических веществ, обладающих дезинфицирующими свойствами: хлоргексидин, четвертичные аммонийные соединения (ЧАСы), надуксусная кислота, полигуанидины (ПГМГ-ГХ).
Дезинфекция бывает профилактическая, которая проводится постоянно, независимо от эпидемической обстановки, и делится в свою очередь на плановую, внеплановую, текущую и итоговую профилактику. Именно к дезинфекции относят мытье рук и окружающих предметов с использованием моющих средств, содержащих бактерицидные добавки.
Пример установки паровой стерилизации. Источник: getinge.com
Специалисты утверждают, что уничтожение инфекционного начала во внешней среде еще не обеспечивает устранение основных источников инфекции. Поэтому дезинфекция важна только в общем комплексе противоэпидемических мероприятий.
Поэтому дезинфекция важна только в общем комплексе противоэпидемических мероприятий.
К слову, медицинские работники даже утилизировать некоторые инструменты одноразового использования (шприцы, иглы для инъекций и т.д.) не могут без предварительной обязательной дезинфекции. И, как вы уже понимаете, она нужна не только в медицине, но и в обычной жизни. Например, обеззараживание помещения или инструмента для маникюра. После этой процедуры количество вредных микроорганизмов сокращается на 70-80%.
Стерилизация же обеспечивает полное освобождение какого-либо предмета или материала от всех видов микроорганизмов (включая бактерии и их споры, грибы, вирусы), либо их уничтожение. То есть абсолютное уничтожение всего живого в любом его проявлении и всех продуктов его жизнедеятельности. Осуществляется термическим, химическим, радиационным, фильтрационным методами.
Процесс стерилизации состоит из трех этапов и включает в себя: дезинфекцию, предстерилизационную обработку и собственно стерилизацию.
Этапы цикла обработки изделий медицинского назначения
Итак, изделия медицинского назначения (ИМН), если они в процессе эксплуатации соприкасаются с раневой поверхностью, контактируют с кровью или со слизистой оболочкой различных органов должны пройти 3 этапа обработки.
Дезинфекция изделий медицинского назначения
Сразу после использования все изделия медицинского назначения подвергают дезинфекции. Этот этап обработки призван сделать их безопасными для медицинского персонала и исключить распространение возбудителей в окружающей среде.
Для проведения дезинфекции изделия погружают в рабочий раствор дезинфекционного средства на время процедуры, установленное в нормативно-методическом документе по применению конкретного средства. После окончания процесса обеззараживания изделие тщательно отмывают от остатков дезинфекционного средства.
Предстерилизационная очистка
Предстерилизационная очистка (ПСО) – этап цикла по обработке ИМН, предусматривающий удаление с изделий белковых, жировых, механических загрязнений и остаточных количеств лекарственных препаратов. При выборе средств для дезинфекции и очистки имеет значение отсутствие у них фиксирующего действия. Так, например, альдегид-содержащие дезинфекционные средства обладают выраженным фиксирующим действием, в результате чего органические загрязнения прочно фиксируются на поверхности обрабатываемых изделий. А это в свою очередь может стать причиной неэффективной дезинфекции и очистки.
При выборе средств для дезинфекции и очистки имеет значение отсутствие у них фиксирующего действия. Так, например, альдегид-содержащие дезинфекционные средства обладают выраженным фиксирующим действием, в результате чего органические загрязнения прочно фиксируются на поверхности обрабатываемых изделий. А это в свою очередь может стать причиной неэффективной дезинфекции и очистки.
Современные композиционные дезинфекционные средства позволяют совместить при использовании раствора одного средства дезинфекцию и ПСО изделий. Для этого используют ферментные средства, обеспечивающие разложение белковых, углеводных и жировых загрязнений, имеющих в составе антимикробные компоненты.
Стерилизация изделий медицинского назначения – финишная прямая
Пример установки газовой-плазменной стерилизации. Источник: meise.com
Стерилизация изделий медицинского назначения является последним этапом обработки. Для ее выполнения, скажем, в лечебно-профилактических учреждениях используются термические, химические методы и их комбинация. К термическим относят паровой, воздушный, инфракрасный, гласперленовый. А к химическим – газовый, плазменный, озоновый и растворами химических средств.
К термическим относят паровой, воздушный, инфракрасный, гласперленовый. А к химическим – газовый, плазменный, озоновый и растворами химических средств.
То, каким именно методом можно воспользоваться для стерилизации конкретных изделий, зависит от самого метода и его особенностей. Специалисты считают, что в момент выбора важно учитывать все достоинства и недостатки разных методик, поскольку ни один из существующих методов стерилизации не является абсолютно идеальным.
Так, самым распространенным методом в лечебно-профилактических учреждениях признаны паровой и воздушный. Но какой бы из методов ни выбрал специалист, он должен будет учесть требования к средствам предстерилизационной очистки и стерилизации медицинских изделий, которые должны иметь:
- высокую активность за возможно короткое время;
- безопасность для персонала, пациентов, окружающей среды;
- хорошую совместимость с материалами изделий, выражающуюся в отсутствии повреждающего действия на материалы;
- возможность контроля процесса;
- простоту и удобство применения;
- приемлемую стоимость и доступность;
- высокую стабильность, способствующую приемлемому сроку хранения химического средства, быструю и полную его растворимость в воде;
- отсутствие раздражающего запаха.

Перспективы развития методов стерилизации медицинских изделий
Специалисты, занимающиеся изучением вопросов методологии дезинфекции и стерилизации изделий медицинского назначения, в один голос утверждают: несмотря на все разнообразие методов, в этой области есть куда развиваться и что совершенствовать.
В частности, процесс стерилизации помогут сделать более эффективным:
- разработка оборудования, позволяющего реализовать новые методы стерилизации с более короткими или более щадящими режимами;
- разработка новых химических средств и оптимальных режимов их применения, обеспечивающих эффект стерилизации в приемлемые сроки;
- увеличение номенклатуры химических средств на основе действующих веществ, пригодных для стерилизации изделий из разнородных материалов;
- разработка химических индикаторов различных классов, позволяющих осуществлять в стерилизаторах разных типов оперативный внешний и внутренний контроль стерилизации.

Таким образом, считается, что некая «идеальная» технология должна обеспечивать обработку изделий различных конструкционных исполнений из любых разнородных материалов в современном автоматизированном оборудовании за возможно короткое время, быть легко контролируемой, а также обоснованно адаптированной к условиям использования как экономически, так и экологически. Причем «идеальная» технология стерилизации, помимо всего прочего, должна позволять обработку изделий в упакованном виде и не требовать удаления остатков стерилизующих средств.
Пример процесса электронно-лучевой стерилизации. Источник: iba-industrial.com
Специалисты также утверждают, что сегодня такой технологии, которая соответствовала бы всем вышеуказанным требованиям, пока не существует. А вот максимально приближенные к идеалу условия и технологии вполне могут быть сосредоточены в одном месте. Особенно если речь идет обо всех циклах фармацевтического производства, таких которые сосредоточены, например, на индустриальной площадке «Экобалтик». Ведь именно здесь, с запуска производства препарата «Мирамистин» в 2014 году начал формироваться новый для региона фармацевтический кластер промышленного производства Калининградской области.
Ведь именно здесь, с запуска производства препарата «Мирамистин» в 2014 году начал формироваться новый для региона фармацевтический кластер промышленного производства Калининградской области.
В планах инвесторов индустриального парка значатся и работы по организации большого фармацевтического склада класса «А» в соответствии со стандартами GDP с блоком электронно-лучевой стерилизации и с системой, которая позволит обеспечить полный контроль этапов поставки и передвижения лекарственных средств от их упаковки на производстве до конечного покупателя.
Обсуждается и возможность строительства на территории индустриального парка «Экобалтик» цеха стерилизации фармупаковки в городе Багратионовске. Проект потребует больших инвестиций, зато цех сможет оказывать такую услугу в Калининградской области для всех предприятий.
К работе над этими проектами управляющая компания площадки «Экобалтик» — ООО «Балтфармацевтика» уже приступила.
Современные средства дезинфекции и стерилизации в стоматологии
Превыше всего в стоматологии-это безопасность, как себя, так и пациента
В день стоматологическая клиника принимает около 50 пациентов,и для того,чтобы обеспечить их безопасность следует тщательно выполнять все требования и правила стерилизации инструментов,а именно:
➖Предварительная дезинфекция и обработка мед изделий
➖Предстерилизационная очистка инструментов
➖Упаковка в крафт пакеты
➖Окончательная стерилизация медицинских инструментов
Начнем с первого этапа — предварительной дезъинфекции и обработки
Дезинфекция изделий медицинского назначения, всех поверхностей и оборудования кабинета с целью уничтожения патогенных и условно-патогенных вирусов,бактерий и грибов.
Cуть метода дезинфекция заключается в полном погружении медицинских инструментов в специальные химические растворы . Полости и каналы изделий должны быть заполнены дезинфицирующим раствором.
Для изделий, не соприкасающихся с пациентом, может быть применен способ протирания салфеткой, смоченной в растворе дезинфектанта.
Сейчас существует множество дезинфицирующих растворов, наиболее часто используемые:
- Деконекс
- Ротасепт
- Актибор
- Венделин
- Централь
- Авансепт
- Трилокс
Все вышеперечисленные растворы направлены на уничтожение патогенных микроорганизмов. Время выдержки и концентрация указана в инструкции каждого дезинфицирующего средства.
Важно! Дезинфекция не эффективна в отношении споровых форм микроорганизмов.
Поэтому после проведения дезинфекции медицинские изделия подвергаются предстерилизационной очистке и стерилизации.
Предстерилизационная обработка
Перед окончательной стерилизацией инструментов проводят их предстерилизационную обработку.
Цель — удаление всех мелких частиц, оставшихся после операции, различных белковых загрязнений.
Для этого каждый инструмент тщательно промывают под проточной водой и очищают в ручную с помощью специальных щёток и ёршиков.
Упаковка в крафт пакеты
Каждый инструмент кладется отдельно от других для того, чтобы избежать повреждения и распространения коррозии. На каждом крафт пакете имеются индикаторы, которые окрашиваются в определенный цвет при различных типах стерилизации.
Стерилизация
Оборудование и инструменты, которые проникают в стерильные ткани организма или сосуды, контактируя с кровью или инъекционными растворами, относятся к «критическим» предметам.
Они должны пройти стерилизацию, чтобы полностью удалились или уничтожились все виды микроорганизмов, включая споры бактерий.
В медицинской практике применяются в основном 3 вида стерилизации:
Первый и самый на данный момент распространённый
Термический метод стерилизации
К нему относится:
➖Паровая стерилизация или автоклавирование
При термической обработке гибнут все живые организмы.
Этот процесс ускоряется при добавлении влаги, но обычного пара недостаточно для стерилизации,необходимо давление, больше атмосферного, что позволит повысить температуру пара для термического разрушения микробной жизни.
Пар под давлением вызывает денатурацию и коагуляцию белка и его ферментов в клетках.
Устройство, в котором происходит стерилизация паром, называется автоклав. Весь цикл стерилизации в автоклаве может занять от 15 до 60 минут, в зависимости от давления, температуры и материала стерилизуемых инструментов.
➖Воздушная стерилизация (сухожаровой шкаф
Сухое тепло в виде горячего воздуха. Гибель микробных организмов происходит за счет окисления и медленного процесса сжигания белка в клетках. При отсутствии влаги в процессе стерилизации требуются более высокие температуры.
Так же существуют и другие способы стерилизации :
Химический метод стерилизации
➖Стерилизация газом
Окись этилена. Основной цикл стерилизации состоит из пяти этапов и занимает около 2,5 часов, за исключением времени аэрации.
➖Плазменная стерилизация
Основной цикл плазменной стерилизация состоит из четырех этапов (создание вакуума, Н2О2 инъекция, диффузия, плазменный разряд).
Процесс занимает от 1 до 3 часов.
➖Стерилизация озоном
Процесс стерилизации происходит посредством окисления, разрушения органических и неорганические веществ.
Время цикла — до 60 минут в зависимости от размера камеры или нагрузки.
Радиационный метод стерилизации
Ионизирующее излучение производит ионы, которые выбивают электроны из атомов,преобразуясь в энергию, которая убивает микроорганизмы
Каждый метод стерилизации имеет свои особенности. При выборе того или иного метода, следует учитывать все возможные побочные эффекты.
На этом все. Посмотрите видео предстерилизационной очистки, обработки инструментов а также упаковки их в крафт пакеты на нашем youtube-канале!
Берегите свои инструменты! От того, как вы будете стерилизовать их, зависит, сколько они вам прослужат.
Методы стерилизации медицинских инструментов
Научно-техническая революция не могла обойти стороной такую отрасль, как медицина. Однако в медицине изменилось не только само оборудование. Для лучшего качества проводимых процедур в медицине начались использоваться новые и современные методы для дезинфекции инструментов, чтобы достигнуть максимальной стерильности. Наряду с новыми методами продолжают использовать старые и проверенные способы дезинфекции, которые доказали свою эффективность столетиями употребления во врачебной практике.
Само понятие стерилизация подразумевает полное уничтожение на инструментах микроорганизмов, вирусов и других возбудителей заболеваний, чтобы врачи, используя инструменты, не смогли занести инфекцию в организм больного. Именно поэтому стерилизация медицинских инструментов — это необходимость с самого возникновения такой науки, как медицина.
Все методы стерилизации можно разделить на термические и холодные. Они отличаются между собой по принципу действия.
Термическая обработка.
К стандартным методам стерилизации, которые имеют большую историческую основу, можно отнести термическую обработку инструментов. Однако даже она потерпела довольно сильные изменения. Раньше в медицине стерилизовать медицинские инструменты можно было только двумя способами: кипячением и обработкой на открытом огне. Оба эти варианта, несмотря на множественные достоинства, имели и некоторые недостатки. Во-первых, не все бактерии и вирусы умирают при температуре кипения воды. Во-вторых, при стерилизации на открытом огне на инструментах образуется копоть. Поэтому для современной стерилизации медицинских инструментов путем термической обработки используются специальные камеры. В них температура намного выше, чем при кипении, а также инструменты стерилизуются без образования побочных налетов на поверхностях.
Современный подход к стерилизации старается достигнуть максимального эффекта. Так как по сравнению с тем же восемнадцатым столетием болезней, которые могут передаваться вместе с медицинскими инструментами, стало намного больше, а вот иммунитет среднестатистического человека значительно снизился. Поэтому в процессе стерилизации нужно применять методы, которые бы максимально обезопасили пациентов от заражения. В разных отраслях медицины, используются разные методы термической стерилизации, в зависимости от того, какой уровень безопасности минимально необходим для пациента.
Так как по сравнению с тем же восемнадцатым столетием болезней, которые могут передаваться вместе с медицинскими инструментами, стало намного больше, а вот иммунитет среднестатистического человека значительно снизился. Поэтому в процессе стерилизации нужно применять методы, которые бы максимально обезопасили пациентов от заражения. В разных отраслях медицины, используются разные методы термической стерилизации, в зависимости от того, какой уровень безопасности минимально необходим для пациента.
Для обработки инструментов в современной медицине используются два метода термической стерилизации — паровой и воздушный. Они тоже немного отличаются между собой. Воздушный способ стерилизации подразумевает нагревание воздуха в камере до температуры, при которой умирают все болезнетворные бактерии. Паровой способ стерилизации подразумевает дополнительную обработку инструментов паром, благодаря чему, кроме того, что бактерии умирают от воздействия высокой температуры, они дополнительно смываются с инструментов потоком пара. Поэтому паровой способ термической обработки применяется там, где необходим очень высокий уровень стерильности.
Поэтому паровой способ термической обработки применяется там, где необходим очень высокий уровень стерильности.
Холодные методы стерилизации.
Если в начале восемнадцатого столетия единственным методом химической стерилизации медицинских инструментов была простая обработка их спиртом, то на сегодняшний день, данная сфера медицины, шагнула значительно дальше. Сейчас наряду с обыкновенным медицинским спиртом используется множество специальных растворов.
Достоинством таких растворов является то, что с их помощью можно быстро стерилизовать инструмент. При этом каждый раствор специально составляется для определенного типа бактерий, если врач работает только с одной группой пациентов. Например, есть специальные растворы, которые быстро убивают вирусы гриппа или же возбудителей кожных заболеваний. Поэтому после одного пациента врач может в самые короткие сроки простерилизовать инструмент и принять другого больного.
Чаще всего такие растворы используют в полевых условиях, когда нет возможности термической обработки инструментов, так как установки для термической обработки требуют наличие питания, кроме того, они достаточно объемны, поэтому постоянно транспортировать их с собой невозможно. А вот специальные химические составы для холодной стерилизации всегда можно иметь даже в походной аптечке.
А вот специальные химические составы для холодной стерилизации всегда можно иметь даже в походной аптечке.
К новым методам стерилизации, которые не имеют аналогов в истории, можно отнести такой способ холодной стерилизации, как обработка инструмента кварцем. В основе данного метода лежит облучение инструментов светом от кварцевой лампы. Несмотря на кажущуюся неэффективность, данный метод стерилизации, позволяет в короткие сроки получить стерильные инструменты. Поэтому он часто используется в медицине как альтернатива термической обработке, хотя к полевым условиям его довольно сложно применить.
К современным методам стерилизации можно также отнести радиационный метод стерилизации. Однако в широкой практике он пока что не применяется, так как оборудование для него объемное, дорогое и требует затрат энергии. Данный метод состоит в том, что инструменты облучаются радиационным излучением, которое убивает все возбудители болезней без исключения. Данный метод часто используют на производстве для того, чтобы стерилизовать инструменты перед упаковкой, так как он дает стопроцентную гарантию стерильности.
Современная медицина значительно прогрессировала за последние несколько столетий. Мы забыли об эпидемиях и в большей части, благодаря тому, что на сегодняшний день все медицинские инструменты являются стерильными. Современные методы термической и холодной стерилизации шагнули далеко вперед, чтобы пациенты и врачи всегда могли оставаться спокойными. Не исключено, что в ближайшем будущем появятся и новые более надежные методы для стерилизации инструментов, которые смогут полностью решить данную проблему.
Вернуться к статьям
Методы и этапы стерилизации и дезинфекции стоматологических инструментов
Стоматологическое лечение относится к тем сферам медицины, где врачу приходится тесно контактировать с пациентами. Каждый осмотр и любая стоматологическая манипуляция подразумевает взаимодействие со слизистыми тканями, зачастую пораженными инфекцией, поэтому соблюдение гигиены, дезинфекция и стерилизация в стоматологии – правило номер один.
Правила стерилизации стоматологических инструментов регулируются МОЗ Украины. Они прописаны с тем посылом, что каждый пациент является потенциальным носителем инфекции. Соответственно, для безопасности других пациентов и медицинского персонала необходимо соблюдать строгие санитарно-гигиенические требования в отношении очистки стоматологического инструмента и принадлежностей, используемых стоматологом.
По какому принципу выбирают методы стерилизации в стоматологии
Обработка стоматологического оборудования и рабочего инструмента стоматолога проводится с целью дезинфекции (обеззараживания) изделий. Выбор метода дезинфекции для каждого инструмента зависит от того, насколько велик риск инфицирования через него.
Например:
- Зубной элеватор, пародонтологические зонды, кюреты для удаления зубного камня, шпатель, боры, наконечники и другой пародонтический инструмент, которые контактируют непосредственно с открытыми ранами ротовой полости, вскрытыми кариозными полостями, относятся к категории высокого риска.
 Они требуют обязательной стерилизации.
Они требуют обязательной стерилизации. - Зуботехническое зеркало и другие материалы, инструменты, которые соприкасаются со слизистой, при условии отсутствия на ней повреждений. В этом случае используется как стерилизация, так и химическая дезинфекция стоматологических инструментов.
- Предметы и материалы, которые контактируют только с кожными покровами пациента, а именно, мебель, стоматологическое кресло, одежда врача – это инструментарий низкого риска передачи инфекции. Для обеззараживания этих предметов подходит наименее интенсивная дезинфекция.
Самые распространенные методы стерилизации стоматологических инструментов
В настоящее время существуют такие виды стерилизации в стоматологии:
- механический;
- биологический;
- физический;
- химический;
- микроволновой;
- ультрафиолетовый.
К механическим способам обработки относятся влажная уборка, стирка медицинской одежды и других тканевых изделий многоразового использования, проветривание стоматологического кабинета. Механическая дезинфекция в стоматологии должна быть ежедневной.
Механическая дезинфекция в стоматологии должна быть ежедневной.
Биологическая дезинфекция – это обработка твердых поверхностей стоматологических инструментов с применением природных противомикробных средств. Подходит не для всех изделий, так как является неэффективной в борьбе с некоторыми штаммами бактерий, например ВИЧ.
Физическая стерилизация инструментов в стоматологии – это не что иное, как обработка и обеззараживание изделий под действием высокой температуры. Термическая обработка считается наиболее надежным и безопасным методом дезинфекции, но она подходит для изделий, изготовленных из термоустойчивых материалов (стальных, твердосплавных).
Термо стерилизация стоматологического инструментария проводится двумя способами:
- сухим;
- паровым.
Химическая дезинфекция – обеззараживание инструментария стоматолога с помощью агрессивных химических средств. Эффективно устраняет все виды вирусов и бактерий, применяется, как правило, для обработки изделий группы высокого риска инфицирования, которые нельзя подвергать действию высоких температур. Холодная стерилизация проводится для обработки пластиковых, резиновых, стеклянных предметов.
Холодная стерилизация проводится для обработки пластиковых, резиновых, стеклянных предметов.
Микроволновая дезинфекция актуальна, когда нужно обработать небольшое количество инструментов низкой и средней категории инфекционного риска. А стерилизация посредством воздействия на предметы ультрафиолетовых лучей предназначена для быстрого обеззараживания поверхностей инструментов, которые не контактируют с раневыми поверхностями.
Основные этапы стерилизации стоматологических инструментов
Полноценный цикл стерилизации состоит из следующих этапов:
- Дезинфекция.
Любые инструменты стоматолога (речь идет об изделиях многоразового использования) должны проходить эту стадию обработки. Процедура для пластиковых, керамических наконечников и, например, полностью металлических инструментов (ножей, элеваторов) будет отличаться только выбором антисептиков.
Дезинфекцию можно выполнять вручную или использовать для этой цели специальное оборудование.
 Принцип работы химического стерилизатора прост: необходимо сложить инструменты в специальный контейнер и опустить его в емкость, заполненную дезинфицирующим раствором. Время пребывания в растворе зависит от его концентрации и типа стоматологического инструмента.
Принцип работы химического стерилизатора прост: необходимо сложить инструменты в специальный контейнер и опустить его в емкость, заполненную дезинфицирующим раствором. Время пребывания в растворе зависит от его концентрации и типа стоматологического инструмента. - Предстерилизация.После обработки химическим антисептиком инструменты необходимо промыть в обычной воде (каждый отдельно) примерно по минуте, потом ополоснуть под проточной водой в течение нескольких минут. Затем инструменты промывают в дистиллированной воде (время обработки – 1 минута). Для предстерилизационной обработки цельнолитых, гладких изделий можно использовать щетки. Предметы с многочисленными насечками, с абразивной поверхностью лучше очищать в ультразвуковом стерилизаторе. УЗ стерилизация стоматологических боров с алмазным напылением – простой и быстрый способ предстерилизационной обработки. Инструментарий помещают в контейнер УЗ аппарата. Затем в аппарат заливают дезраствор и устанавливают время очистки.
 Всю работу оборудование делает за вас в автоматическом режиме. Обработанный инструмент просушивают в сушильном аппарате и упаковывают.
Всю работу оборудование делает за вас в автоматическом режиме. Обработанный инструмент просушивают в сушильном аппарате и упаковывают. - Упаковка.
Этот этап актуален, если планируется паровая стерилизация стоматологических инструментов. Для упаковки потребуются специальные пакеты или упаковочная машина. Инструмент необходимо поместить в пакет, соответствующий ему по размеру и заклеить. Упаковочный аппарат упрощает процесс упаковки. Он комплектуется рулоном упаковочной пленки. При запечатывании инструментов можно регулировать длину и ширину упаковочного материала.
- Стерилизация.
Упакованные инструменты стерилизуют в автоклаве:
- их помещают на специальный поддон;
- пакеты должны лежать бумажным слоем вверх и не перекрывать друг друга;
- затем устанавливают нужную температуру, режим стерилизации;
- далее автоклавирование происходит автоматически.
Простерилизованный стоматологический инструмент хранят в упакованном виде в сухом месте.
Стерилизация и дезинфекция в стоматологии терапевтических инструментов
Все поверхности в стоматологическом кабинете обрабатывают в начале рабочего дня специальными средствами, содержащими поверхностно-активные вещества. В процессе работы врач производит аналогичную дезинфекцию стоматологического кресла и внешних поверхностей стоматологической установки после каждого пациента.
Все инструменты стоматолога – предметы индивидуального использования. В стандартный стоматологический набор входит лоток, гладилка, шпатель, элеватор, зубной зонд и пинцет. Все эти предметы сразу после приема пациента должны пройти полный цикл стерилизации (обеззараживание, предстерилизация и термическая обработка).
Стерилизация эндодонтических инструментов: особенности и последовательность
Большинство эндодонтических инструментов в современной стоматологии относятся к категории изделий одноразового использования.
Правила их применения следующие:
- сразу после использования нужно провести дезинфекцию инструмента;
- после дезинфекции изделие отправляют на утилизацию.

Инструментарий многоразового использования по завершению работы сразу погружают в раствор для дезинфекции, не допуская высыхания. Процедура стерилизации длится полчаса. Если в дальнейшем используется ультразвуковая чистка, то время химической обработки можно сократить в 2 раза.
После предстерилизационной обработки эндодонтический инструмент отправляют на стерилизацию в автоклаве или сухожаровом шкафу (в зависимости от типа инструмента).
Стерильные инструменты важно правильно хранить. В каждой современной клинике имеется для этой цели специальное оборудование.
Стерилизация стоматологических наконечников
Она отличается от дезинфекции других инструментов стоматолога. Наконечники нельзя погружать в агрессивный химический раствор и подвергать действию ультразвука. Дезинфекция стоматологических наконечников осуществляется с помощью специальных антибактериальных салфеток. При обработке изделий важно позаботиться о защите рук от попадания на кожу дезинфицирующего средства.
Порядок стерилизации:
- разборка наконечника;
- протирание поверхностей каждой детали;
- промывание игл, через которые подается физраствор;
- сборка;
- смазка (обязательная процедура перед упаковкой инструмента).
Упакованные наконечники отправляют на хранение в UV-аппарат, в котором ультрафиолетовые лучи обеспечат стерильность инструмента до следующего применения.
Стерилизация в стоматологии ортодонтических инструментов
В стоматологической ортопедии используются не только металлические инструменты, но и множество приспособлений из эластичных материалов:
- Инструментарий из стали, твердых сплавов проходят традиционный процесс стерилизации (от обеззараживания в дезрастворе до термической стерилизации).
- Точно также стерилизуют металлические абразивные диски, коронкосниматери и коронкорезы, металлические ложки.
- Пластиковые ортопедические ложки, каменные диски относятся к изделиям одноразового применения.
 Сразу после использования их необходимо продезинфицировать и отправить на утилизацию.
Сразу после использования их необходимо продезинфицировать и отправить на утилизацию. - Наковальня, ортопедический молоток очищают при помощи салфеток, пропитанных антисептиком. Для эффективности изделия обрабатывают дважды.
- Коронки и мосты, силиконовые или альгинантные файлы первоначально необходимо промыть в воде, а затем погрузить в раствор для быстрой дезинфекции. После химической обработки инструменты нужно тщательно промыть и оставить в емкости с водой на 5 минут.
Самая эффективная стерилизация боров в стоматологии: сухожаровой шкаф или автоклав?
Даже самые сильные дезинфицирующие средства и современные способы стерилизации медицинского инструмента не могут справиться с некоторыми наиболее опасными вирусами – ВИЧ, гепатит и др. Добиться 100% стерильности инструментария стоматолога можно только посредством воздействия на них высоких температур.
В стоматологии практикуют два способа термоочистки инструмента:
- Воздушный – прокаливание металлических и стеклянных стоматологических принадлежностей в сухожаровом шкафу.
 Процедура воздушной стерилизации проходит при температуре 180°С и длится от 30 минут до 2 часов. Прошедшие предстерилизационную обработку предметы выкладывают на поддон без упаковки и помещают в корпус сухожарового шкафа.
Процедура воздушной стерилизации проходит при температуре 180°С и длится от 30 минут до 2 часов. Прошедшие предстерилизационную обработку предметы выкладывают на поддон без упаковки и помещают в корпус сухожарового шкафа. - Паровой – автоклавирование, обработка инструмента горячим паром, который поступает в стерилизационную камеру под большим давлением. Температура в автоклаве 120-130°, и ее вполне достаточно, чтобы уже в течение 5 минут – 1 часа нейтрализовать вредные бактерии.
Оборудование для сухой стерилизации стоит гораздо дешевле, однако стерилизацию в автоклаве стоматология практикует чаще всего.
Причина такого выбора – множество преимуществ, которые дает автоклавирование:
- Деликатное воздействие на материалы, из которых изготовлены инструменты. При сухой обработке боры и другие стоматологические принадлежности сильно накаливаются, что приводит к более быстрому износу изделий. Паровой метод самый безопасный для любых металлов и даже подходит для некоторых видов пластика.

- Экологичность, безопасность для персонала стоматологической клиники и для окружающей среды.
- Непродолжительная экспозиция (длительность сеанса стерилизации в автоклаве самая короткая – от 5 минут для некоторых видов стоматологического инструмента).
- Возможность длительного сохранения изделий стерильными. Медицинские инструменты проходят стерилизацию в автоклаве в упакованном виде. Вакуумная упаковка позволяет транспортировать и хранить стерильные предметы, защищает от загрязнений.
- Функциональность оборудования – наличие нескольких режимов работы.
- Отсутствие потребности в ополаскивании после стерилизации.
- Сушка входит в цикл стерилизации в автоклаве.
- Экономичный расход энергии на обработку инструментария.
Наиболее функциональное и эффективное оборудование для стоматологических кабинетов, клиник – это профессиональные медицинские автоклавы класса B, например автоклав стоматологический Dentsply Sirona DAC Professional, класс В – продукт одного из ведущих производителей стоматологического оборудования в мире.
Автоклавы – дорогостоящая аппаратура, однако качество стерилизации медицинского инструментария – это не та сфера, где можно экономить. Правильный выбор методов дезинфекции, выбор качественного оборудования и соблюдение правил стерилизации в стоматологии гарантирует безопасность и пациентов, и врачей, и всего персонала клиники.
Медицинское оборудование для химической стерилизации
фото с сайта vitasmile.ru
Среди распространенных химических методов стерилизации выделяют жидкостный, газовый и плазменный методы.
С помощью жидкостной стерилизации обрабатывают изделия, выполненные из термочувствительных материалов. Обработка проводится с помощью специальных химических растворов с использованием камер.
Они представляют собой емкость из нержавеющей стали с крышкой и перфорированной полкой.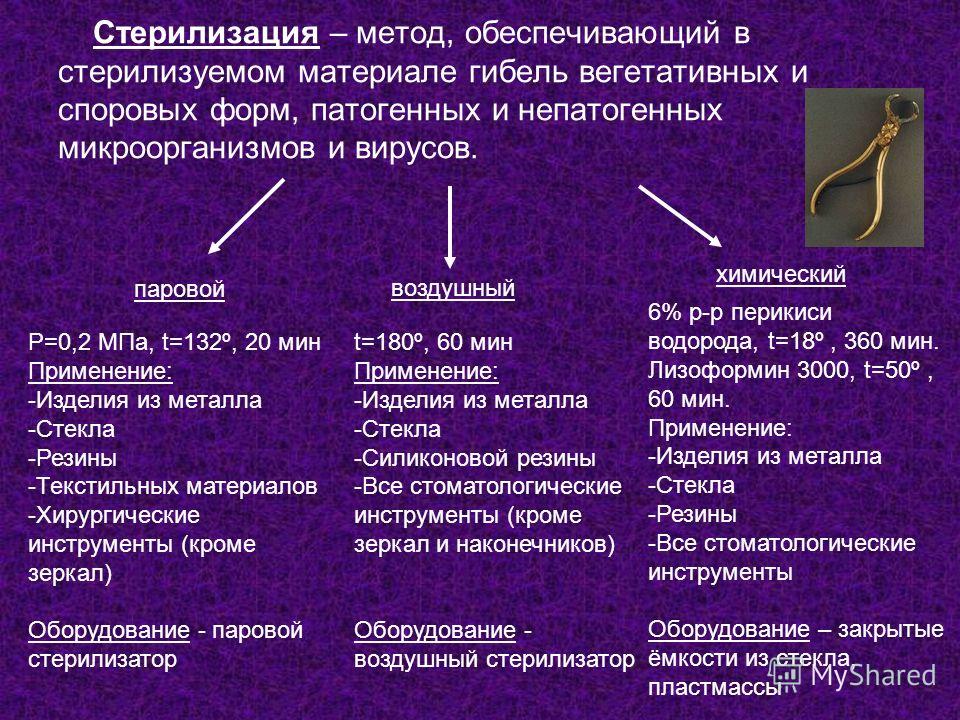 Инструменты обрабатываются под действием специального раствора, который при необходимости может быть подогрет.
Инструменты обрабатываются под действием специального раствора, который при необходимости может быть подогрет.
Такие камеры также могут служить для хранения и транспортировки инструмента.
Газовая стерилизация проводится этиленоксидным и формальдегидным методом. Для нее используются специальные стационарные установки.
Этиленоксидный метод хорошо подходит для обработки пластиковых и полимерных изделий, оптики. Он осуществляется с помощью специальной газовой камеры. Из камеры откачивается воздух, и помещенные в ней предметы подвергаются обработке газом.
Формальдегидный метод больше подходит для дезинфекции, так как формальдегид обладает низкими проникающими характеристиками. Кроме того, температура в камере для обработки должна достигать 80°С.
Главное преимущество газовых методов стерилизации состоит в низкотемпературном режиме процесса, что позволяет обрабатывать инструменты, не допускающие воздействия высокой температуры и влаги.
Газовые стерилизаторы оснащены системой утилизации газа, что делает их безвредными как для человека, так и для окружающей среды. Оборудование оснащено встроенными аэраторами. Стерилизующий агент находится в сменных герметичных картриджах, которые вскрываются только при достижении полной герметичности устройства.
Плазменный метод стерилизации является самым современным и практичным методом, который позволяет обрабатывать любые медицинские изделия и приборы, чувствительные к влаге и температуре. Этот метод основан на создании биоцидной среды с помощью низкотемпературной плазмы и водного раствора перекиси водорода.
При использовании плазменного метода уничтожаются все виды микроорганизмов в любой форме, не образуется токсичных отходов.
Обработка в плазменном стерилизаторе представляет собой сухой процесс, происходит при температуре до 60°С и длится от 35 минут.
Этот метод находит самое широкое применение при обработке оптических систем, изделий из полимерных материалов, электрических инструментов и кабелей, эндоскопов и сопутствующих инструментов, датчиков, имплантатов и других изделий.
Плазменный метод — один из самых актуальных и надежных методов на сегодняшний день.
Оборудование для стерилизации может быть настольным, переносным, стационарным. Реализуется оно обычно во встраиваемой или в автономной форме. В настоящее время распространены камеры объемом от 10 до 100 литров. Выбор объема и стерилизующего агента зависит от конкретных нужд и сферы использования.
Стерилизация. Виды, методы — презентация онлайн
1. Стерилизация. Виды, методы. Преподаватель: Малайчина О.В.
2. Нормативный документ
ОСТ 42-21-2-85
Стерилизация и дезинфекция
изделий медицинского
назначения.
Методы, средства и режимы.
3. Стерилизация
– полное уничтожение всех
видов микроорганизмов и их
спор на поверхности и внутри
различных предметов, а также
в жидкостях и воздухе.
Стерилизации должны подвергаться все
предметы, соприкасающиеся с раневой
поверхностью, контактирующие с кровью
или инъекционными препаратами, а также
отдельные виды диагностической
аппаратуры, которые в процессе
эксплуатации соприкасаются со слизистыми
оболочками и могут вызвать их повреждение.
Стерилизация изделий медицинского
назначения в МО– сложный
многоступенчатый процесс, состоящий
из нескольких этапов, каждый из которых
определяет качество стерилизации:
• предварительная дезинфекция и
обработка изделий на местах
использования (в процедурных,
операционных, перевязочных и пр.)
• предстерилизационная
очистка изделий
ЦСО
• стерилизационная упаковка
• стерилизация
6. Структура централизованного стерилизационного отделения (ЦСО)
Биксы стерильные
В современных МО организованы
централизованные стерилизационные
отделения (ЦСО), в которых проводят:
Предстерилизационную обработку
медицинского инструментария
Стерилизацию:
изделий медицинского назначения
белья и перевязочного материала
10. Задачи ЦСО
• обеспечение лечебных отделений
(МО) стерильными
медицинскими изделиями
• внедрение в практику
современных эффективных
методов предстерилизационной
обработки и стерилизаци
ЦСО должно иметь две зоны:
нестерильную и стерильную.
В нестерильную зону входят «грязная»
и «чистая».
«Грязная» зона включает:
помещения для приема и разборки
медицинских изделий
моечную – помещение предназначено для
проведения ПСО изделий
вспомогательные помещения – гардероб,
комната отдыха и приема пищи персонала,
душевые
«Чистая» зона – это зона, где
производятся:
сушка
контроль качества очистки
разбор, сортировка, составление
наборов
упаковка и подготовка к стерилизации
изделий
13. Стерильная зона
включает в себя:
разгрузочную сторону паровых,
суховоздушных и других
стерилизаторов
склад стерильных материалов
При планировании помещений
целесообразно предусмотреть
организацию двух потоков обработки:
• 1-й поток – обработка и стерилизация
инструментов, резиновых изделий.
• 2-й поток – подготовка и стерилизация
белья и перевязочного материала.
ЦСО оборудуют приточно – вытяжной
вентиляцией и бактерицидными
лампами.
16. Предстерилизационная очистка (ПСО) изделий медицинского назначения Второй этап обработки инструментов
ПСО служит для очистки изделий
медицинского назначения от
белковых, жировых, кровяных,
лекарственных и прочих
загрязнений.
Качество ПСО напрямую влияет на
качество стерилизации.
17. Этапы ПСО (ручной способ):
• Замачивание инструментов медицинского
назначения в моющем растворе 15 минут
• Механическая обработка с помощью ерша,
ватного тампона (каждый по 30 сек.) не
вынимая из раствора, иглы чистить
мандреном
• Промывание под проточной водой при
использовании СМС «Биолот» — 5 мин., другие
7-10 минут («Астра», «Прогресс»)
• Промывание в дистилированной воде 30
секунд
• Высушивание в сухожаровом шкафу (85 0) до
полного исчезновения влаги
• Контроль ПСО
Качество предстерилизационной
очистки проводят пробами:
на остатки крови, дезинфектантов, СМС,
ржавчины
— азопирамовая — универсальная
— фенолфталеиновая – на наличие
остатков СМС
— амидопириновая — на остатки крови
— судан 3 — на наличие жировых и
белковых остатков
19. Оценка результата
Оценка результата
• На контролируемое изделие наносят 2-3 капли реактива и
протирают его тампоном. При положительной азопирамовой пробе
возникает фиолетовое окрашивание, быстро, в течение нескольких
секунд, переходящее в розово- сиреневое и буроватое. Окрашивание,
наступившее позже чем через 1 минуту, не учитывается. Буроватое
окрашивание появляется при наличии ржавчины и
хлорсодержащих окислителей, в остальных случаях окрашивание
розово- сиреневое.
• Фенолфталеиновая проба при наличии неотмытых компонентов
синтетических моющих средств дает розовое окрашивание.
• При положительной амидопириновой пробе возникает синезеленое окрашивание.
• При положительных пробах вся партия контролируемых
изделий подлежит повторной обработке до получения
отрицательных результатов.
• Результаты контроля отражают по форме №366/У, утвержденной
приказом МЗ СССР 04.10.1980г. №1030 «Журнал учета качества
предстерилизационной обработки».
Контролю подлежат: в ЦСО – 1% от
каждого наименования изделий, но не
менее 3-5 единиц.
В случае положительной пробы
(изменение цвета реактива) всю
партию изделий подвергают
повторной очистке. Результаты
контроля фиксируют в журнале.
В качестве стерилизационной
упаковки Минздравом
разрешено использование
определенных видов
материалов.
Задачи упаковки, содержащей медицинское
изделие:
• Обеспечение прохождения
процесса стерилизации
• Защита от физических
воздействий и
механических
повреждений
стерилизуемого объекта
• Сохранение стерильности
до момента использования
Вскрывать упаковку
необходимо с учетом
правил асептики,
антисептики
• стерилизационные коробки
(биксы) без фильтра –внедренные в
практическое здравоохранение еще в начале
прошлого века. Данный тип имеет
небольшой срок сохранения стерильности –
72 часа
• стерилизационные коробки
(биксы) с антибактериальным
фильтром, стерильность в которых
сохраняется до 20 дней
• одноразовые упаковочные пакеты
(КРАФТ- пакеты)– бумажные (плоские
и со складками), комбинированные бумажноламинатные (пленочные).
Крафт — пакет
• Крафт – пакет заклеенный – срок
стерильности 30 суток;
• Крафт – пакет на скрепах – срок
годности 3 суток
Прозрачные рулоны и пакеты разработаны и
производятся как для упаковки отдельных
небольших инструментов и комплектов, так и
для больших тяжелых инструментов,
комплектов белья. Срок стерильности 1 год
Самоклеющаяся комбинированный
бумажно-ламинатный –
срок стерильности — 6 месяцев.
29. Двойная мягкая упаковка из бязи
Срок стерильности 3 суток
• Бумажные и нетканые
оберточные листы
31. Бумажные и нетканые оберточные листы
• Стерилизационные
упаковки из нетканого
материала или бумаги
являются наиболее
подходящими для
больших по объему
лотков с инструментами
для белья. Нетканые
материалы, обладающие
повышенной
прочностью, идеально
подходят для
обертывания тяжелых и
острых изделий.
Импульсный
термосварочный
аппарат
Используют упаковку
комбинированные
бумажно-ламинатные
(пленочные) – срок
стерильности 1 год
35. Импульсный термосварочный аппарат
Импульсный термосварочный аппарат
Выбор адекватного метода
стерилизации зависит от физикохимических и биологических
особенностей стерилизуемого
объекта.
В практике медицинских
организаций наиболее широко
распространены физические
методы стерилизации.
37. Методы стерилизации
Физический
Паровая
Воздушная
Гласперленовая
Инфракрасная
Химический
• Применение
растворов
химических
средств
• Газовая
стерилизация
Холодная
стерилизация
(промышленная)
• Радиационная
• Плазменная
• Озоновая
38. Методы стерилизации, разрешенные для применения в МО
Тип метода
Метод
Стерилизующий агент
Паровой
Водяной насыщенный пар под избыточным давлением
Воздушный
Сухой горячий воздух
Инфракрасный
Инфракрасное излучение
Гласперленовый
Среда нагретых стеклянных шариков
Газовый
Окись этилена или ее смесь с другими компонентами
Окись этилена или ее смесь с другими компонентами
Окись этилена или ее смесь с другими компонентами
Физический
(термический)
Химический
Плазменный
Пары перекиси водорода в сочетании с их
низкотемпературной плазмой
Жидкостный
Растворы химических средств (альдегид-, кислород- и
хлорсодержащие)
39. Физические методы
Физические методы
40. Паровой метод
Компактный
переносной
автоклав
• Для достижения температур выше
точки кипения воды пользуются
автоклавом. Автоклав представляет
собой установку для стерилизации
паром под давлением. Температура
насыщенного пара зависит от
давления.
• Режимы работы автоклава:
132 °C — 2 атмосферы— 20 минут —
основной режим. Стерилизуют все
изделия (стекло, металл, текстиль,
КРОМЕ РЕЗИНОВЫХ).
120 °C — 1,1 атмосфера — 45 минут —
щадящий режим. (стекло, металл,
резиновые изделия, полимерные
изделия — согласно паспорту)
110 °C — 0,5 атмосферы — 180 мин —
особо щадящий режим(нестойкие
препараты, питательные среды)
41. Паровой метод стерилизации
Стерилизующий агент – горячий пар
под
давлением.
Для
этого
метода
используют автоклав.
Упаковки: биксы, крафт-пакеты, бумагаламинат, бязь.
Материалы: полимеры, стекло, латекс,
ткань,
коррозийностойкие
металлы,
текстиль.
Достоинства: высокая проницаемость
пара, большой выбор упаковки, дольше
сохраняется стерильность, дешевый и
простой в использовании метод.
Недостатки:
увлажнение
изделий,
вызывает коррозию металлов.
Паровой метод стерилизации
43. Автоклав стационарный (нового поколения)
44. Воздушный метод Сухой жар —
Воздушный метод
Сухой жар стерилизация осуществляется в специальных
аппаратах — сухо-жаровых шкафахстерилизаторах. Стерилизация в сухожаровом
шкафу происходит при помощи циркуляции
внутри него горячего воздуха.
• Режимы работы автоклава:
180 °C — 60 минут — основной режим.
Стерилизуют все изделия (стекло, металл,
КРОМЕ РЕЗИНОВЫХ).
160 °C — 150 минут — щадящий режим. (стекло,
металл, резиновые изделия, полимерные
изделия — согласно паспорту)
45. Воздушный метод стерилизации
Стерилизующий агент – сухой горячий
воздух (160-200oС).
Упаковки: крафт-пакеты, открытым
способом.
Материалы: металл, стекло, полимер,
резина , латекс.
Достоинства: дешевый, простой метод, не
вызывает коррозии металла, не происходит
увлажнения упаковки и изделий.
Недостатки: ограниченный выбор
упаковки, медленное и неравномерное
прогревание изделий, необходимость
использования более высоких температур,
невозможность использовать материалы из
текстиля.
Воздушный метод стерилизации
46. Воздушный метод
• Примечание:
• Стерилизации подвергают сухие изделия;
• Изделия, простерилизованные в крафт- пакетах, упаковке из
бумаги мешочной влагопрочной, хранят 3-е суток, в 2слойной упаковке из бумаги крепированной для медицинских
целей – до 20 суток;
• Изделия, простерилизованные без упаковки, должны быть
использованы непосредственно после стерилизации в течение
рабочей смены (6 часов) в асептических условиях.
• Во время стерилизации воздушным методом металлических
инструментов без упаковки их располагают так, чтобы они не
соприкасались друг с другом. Разъёмные изделия
стерилизуют в разобранном виде.
47. Воздушный стерилизатор (сухожаровой шкаф)
48. Гласперленовый метод
• Принцип действия глассперленового
стерилизатора основан на приведении
стерилизуемых хирургических инструментов
в контакт с маленькими стеклянными
сферами, имеющими температуру 250С.
• Стерилизация инструмента производится в
течение очень короткого времени — не более
20 секунд. Благодаря такому короткому
периоду и неразрушающему воздействию
стерилизационных (глассперленовых)
шариков на инструмент, негативное влияние
высокой температуры практически
отсутствует.
Всего за 5 секунд стерилизует: щипцы,
клещи, скальпель-держатели, зонды,
шпатели, долота, зубила, алмазы, файлы,
боры, корневые элеваторы, расширители,
угловые наконечники, иглодержатели,
пинцеты, десневые ножницы и т.д.
49. Инфракрасный метод
Малогабаритный
стерилизатор
предназначен для
стерилизации
стоматологических и
микрохирургических
инструментов из металлов
в условиях госпиталей,
поликлиник, больниц и
других лечебных и
косметологических
учреждений.
Стерилизация
осуществляется
инфракрасным мощным
кратковременным
тепловым воздействием.
50. Камера УФО для хранения стерильных инструментов
51. Химические методы
52. Химическая стерилизация
• При данном методе используются химические вещества
в газообразном состоянии или стерилизуемые объекты
погружаются в растворы химических веществ.
Стерилизация растворами – вспомогательный
метод, который применяют при невозможности
использовать другие..
Растворы для стерилизации — стерилянты
Для стерилизации в основном используют
Перекись водорода 6%
Режим стерилизации :
Температура 18 °С — экспозиция 360 мин
Температура 50 °С — экспозиция 180 мин
Раствор используется однократно.
53. Химическая стерилизация
Дезоксон-1
Режим стерилизации :
Температура 18 °С — экспозиция 45 мин
Сайдекс
Температура 21 °С — экспозиция 240 мин
Виркон 2%
Температура 18 °С — экспозиция 10 мин
54. Химическая стерилизация
Стерилизация растворами –
вспомогательный метод, который применяют
при невозможности использовать другие.
Достоинства: доступность, легкость в
исполнении и надежность
Недостатки: изделия стерилизуют без
упаковки, промываются после стерилизации, что
может привести к реконтаминации.
Используется только при децентрализованной
системе.
55. Химическая стерилизация
• Стерилизуемые изделия свободно
раскладывают в емкости с растворами. При
большой длине они укладываются по
спирали, каналы и полости заполняются
раствором.
• После окончания стерилизации изделия
трижды дважды погружают на 5 минут в
стерильную воду, каждый раз меняя ее, затем
стерильным корнцангом их переносят в
стерильную емкость (стерилизационная
коробка), выложенную стерильной
простыней. Срок хранения – 3 суток.
56. Химическая стерилизация
При газовой стерилизации используют смесь ОБ(окись
этилена с бромистым этилом) и его смеси,
формальдегид.
Стерилизуют: Оптика, кардиостимуляторы, изделия из
полимерных материалов, стекла, металлов.
Условия проведения:
Инструментарий упаковывают в два слоя
полиэтиленовой пленкитолщиной 0,06-0,2 мм, бумагу:
упаковочную высокопрочную двухслойную. Срок
сохранения простерилизованных изделий в упаковке из
полиэтиленовой пленки – 5 лет, в пергаменте
57. Химическая стерилизация
Достоинства: В газообразном состоянии
этилен-оксид не вызывает коррозии металлов,
не портит изделий из кожи, шерсти, бумаги,
пластмасс. Он является сильным
бактерицидным, спороцидным и вирулоцидным
средством. Его пары обладают высоким
проникновением. осуществляется при
невысоких температурах (18-80°С) и изделия
стерилизуются в упаковке.
Недостатки: токсичность для персонала и
взрывоопасность при несоблюдении техники
безопасности.
58. Газовая стерилизация
59. Холодный метод стерилизации
Радиационный метод
Стерилизующим агентом являются ионизирующее
гамма- и бета-излучение. Температура объекта при
стерилизации поднимается незначительно, поэтому
этот способ называют холодной стерилизацией.
Для индивидуальной упаковки помимо бумажных,
используют пакеты из полиэтилена. Стерильность в
такой упаковке сохраняется годами. Срок годности
указывается на упаковке. Этот способ широко
применяется на промышленных предприятиях,
изготавливающих медицинские изделия
одноразового использования (системы для
переливания крови, акушерские комплекты).
60. Холодный метод стерилизации
При плазменном методе стерилизации
используют высокочастотную плазму в
отечественных приборах «Пластер», «Ферузо».
Для обработки изделий из термолабильных
материалов (эндоскопы, кардиостимуляторы,
оптические устройства, эндопротезы и т.д.)
используется стерилизатор Стеррад 100-8.
Данный метод применяют для стерилизации
небольших по размерам медицинских изделий
(стоматологические боры, иглы для
иглотерапии и т.д.).
61. Низкотемпературный плазменный стерилизатор СТЕРРАД 100NX
Озоновая стерилизация предназначена для
обработки малогабаритных изделий простой
конфигурации из коррозионностойких сталей и
сплавов.
Озон синтезируется из воздуха в газоразрядном
реакторе стерилизатора.
Время стерилизационной выдержки 50 минут,
время дезактивации озона 10 минут.
Озоновый стерилизатор (СО-01-С или СО-5)
относится к низкотемпературным (температура
40°С), используется для стерилизации сухих
скальпелей, пинцетов, зеркал, зондов, шпателей,
боров стоматологических в неупакованном виде,
размещенных в 1 слой в кювете.
63. Стерилизатор озоновый
65. Химическая стерилизация
Выполняется в закрытых емкостях,
покрытых неповрежденной эмалью, а
также сделанных из стекла или
пластмассы.
Стерилизуемые объекты погружают в
раствор при температуре 18 ± 2°.
Для стерилизации инструменты полностью
погружают в раскрытом (или разобранном)
виде в один из указанных растворов.
При замачивании в спирте и тройном
растворе инструменты считаются
стерильными через 2-3 часа, в перекиси
водорода — через 6 часов.
66. Газовый метод
• При стерилизации пищевых
продуктов, лекарственных препаратов
и разного рода приборов, а также в
лабораторной практике оправдало
себя применение окиси этилена,
которая убивает и вегетативные
клетки, и споры, но действует только в
том случае, если подвергаемые
стерилизации материалы содержат
некоторое количество (5-15%) воды.
Окись этилена применяют в виде
газовой смеси (с N2 или С02), в
которой ее доля составляет от 2 до 50%.
• Этиленоксидный метод обеспечивает
самый щадящий температурный
режим стерилизации.
67. Газовый метод стерилизации
Стерилизующий агент –
формальдегид или этилен-оксид.
Упаковки: бумага-ламинат,
пергамент, крафт-бумага.
Материалы: полимеры, стекло,
металл.
Достоинства: невысокая
температура, использование любых
материалов.
Недостатки: токсичность для
персонала и взрывоопасность при
несоблюдении техники безопасности,
продолжительный
цикл стерилизации.
Газовый метод стерилизации
68. Холодные методы стерилизации
69. Плазменный метод
позволяет создать биоцидную
среду на основе водного
раствора пероксида водорода,
а также низкотемпературной
плазмы (ионизированный
газ, образующийся при
низком давлении).
Это самый современный метод
стерилизации, известный на
сегодняшний день. Он
позволяет стерилизовать
любые медицинские изделия,
от полых инструментов до
кабелей, электроприборов,к
которым в ряде случаев
вообще не удается применить
ни один из известных
методов стерилизации.
70. Плазменные стерилизаторы
71. Радиационный метод
Антимикробная обработка может быть осуществлена с
помощью ионизирующего излучения (у-лучи),
ультрафиолетовых лучей и ультразвука. Наибольшее
применение в наше время получила стерилизация улучами.
Радиационный метод или лучевую стерилизацию γ-лучами,
применяют в специальных установках при промышленной
стерилизации однократного применения- полимерных
шприцев, систем переливания крови, чашек Петри,
пипеток и др.хрупких и термолабильных изделий.
Используются изотопы Со60 и Cs137. Доза проникающей
радиации должна быть весьма значительной — до 20-25
мкГр, что требует соблюдения особо строгих мер
безопасности. В связи с этим лучевая стерилизация
проводится в специальных помещениях и является
заводским методом стерилизации (непосредственно в
стационарах она не производится).
72. Радиационный метод стерилизации
Радиационный метод необходим для стерилизации изделий
из термолабильных материалов.
Стерилизующий агент – ионизирующие γ и β излучения.
Упаковки: помимо бумажных используют пакеты из
полиэтилена.
Достоинства: надолго сохраняется стерильность в
упаковке.
Недостатки: дороговизна метода.
Радиационный
–
основной
метод
промышленной
стерилизации.
Используется
предприятиями,
выпускающими
стерильные
изделия
однократного
применения.
Радиационный метод стерилизации
73. Радиационный метод
Стерилизация инструментов и прочих
материалов проводится в герметичных
упаковках и при целостности последних
сохраняется до 5 лет. Герметичная упаковка
делает удобными хранение и использование
инструментов (необходимо просто вскрыть
упаковку).
74. Озоновая стерилизация
Предназначена для обработки
малогабаритных изделий простой
конфигурации из коррозионностойких
сталей и сплавов
75. Принципы обеспечения стерильности:
• К стерильному предмету прикасайтесь только другим
стерильным предметом, чтобы избежать контаминации.
• Держите стерильные предметы всегда на уровне выше пояса.
• Стерильное поле должно всегда быть в пределах видимости.
• Старайтесь не говорить, не кашлять, не чихать и не
наклоняться над стерильной поверхностью, так как
происходящие при этом потоки воздуха содержат
микроорганизмы.
• Пограничную зону вокруг стерильного поля шириной около
2,5 см считают потенциально заражённой.
• Не допускайте промокания салфеток над стерильной
поверхностью, так как любая жидкость проникает сквозь
ткань, а вместе с ней и микроорганизмы.
• Если стерильный предмет коснулся нестерильного, всё
стерильное поле считают загрязнённым и подготавливают
новое стерильное поле.
• Считайте предмет загрязнённым, если вы не уверенны в его
стерильности.
• Индикаторы представляют собой прямоугольную полоску из
инертного бумажного основания с нанесёнными на одной
стороне двумя цветными метками (Рис.1)-индикаторной 4 и
эталоном сравнения 5, и маркировки. Для приклеивания
индикатора необходимо с его обратной стороны под надписью
«Дата» отделить левую часть защитной бумаги 1 (Рис.1) по
линии насечки 2 приклеить левую часть индикатора до линии
перфорации 3 к упаковке. Правая часть индикатора при этом
не приклеивается.
• Для снятия индикатора с упаковки после стерилизации
необходимо, не отделяя защитную бумагу 1, оторвать
индикатор по линии перфорации от приклеенной левой
части. Приклеенная левая часть индикатора со служебными
надписями не удаляется с упаковки и доходит до
потребителя, что позволяет контролировать кратность
использования бумажного упаковочного материала
СПАСИБО ЗА ВНИМАНИЕ!
Стерилизация в стоматологии
Стерилизация в стоматологии
Для соблюдения должной гигиены, в медицинских учреждениях с изделиями, используемые для операций или манипуляций с инфекционными больными, необходимо регулярно проводить санитарные нормы дезинфекции. Обработке необходимо подвергать все изделия контактирующие непосредственно с больным.
Одним из основных методов дезинфекции, является стерилизация. Этот процесс, включает в себя обработку медицинского инструмента, путем теплового излучения, фильтрации или путем воздействия химическими веществами с целью уничтожения болезнетворных микроорганизмов.
Стоматология предполагает различные вариации стерилизации инструментов, которые использует для своих процедур, самое главное, чтобы гигиена полости рта поддерживалась на должном уровне.
Стерилизация — процесс уничтожения болезнетворных микроорганизмов
Такое понятие, как стерилизация, медикам известно уже очень давно. Согласно медицинским стандартам, стерилизации должны подвергаться все изделия, соприкасающиеся с раненной областью, контактирующие с инфекционными поверхностями или кровью, а также все медицинские инструменты, которые в процессе своей эксплуатации соприкасаются со слизистой оболочкой.
В древности люди применяли серебряные изделия для сохранения пищи, очищения воды от грязи, а так же для профилактики различных заболеваний. Сейчас, наука углубилась уж очень далеко от этих первобытных методов избавления от инфекции. В век генетики и микробиологии, ученые тщательно изучают состояние микроорганизмов их состояние и агрессивное воздействие на окружающую среду.
Стерилизация в стоматологии
Согласно этим исследованиям медики дают рекомендации по обезвреживанию медицинских инструментов путем стерилизации. Хотя полной гарантии избавления от инфекции не существует, но все же стерилизацию оборудования и инструментов для инвазивного вмешательства должна проводиться в обязательном порядке. В медицине, стерилизацию разделяют на три вида: паровой, воздушный и химический методы.
Методы стерилизации оборудования
Паровой метод стерилизации – представляет собой обработку инструментов водяным насыщенным паром под избыточным давлением. Для паровой стерилизации, используют стерилизаторы паровые ГК-10 и ГК-20. Температура воздействия стерилизаторов сто тридцать два градуса, время воздействия от пяти минут, до полного завершения цикла в течение тридцати минут.
Возможна стерилизация термочувствительных изделий. Прекрасно подходит для обработки изделий из метала, стекла, текстиля и резины. Короткий цикл стерилизации – безусловное преимущество метода, высокая стоимость – значительный минус.
Воздушный метод стерилизации это обработка инструментов сухим горячим паром.
Применяются для этого метода стерилизаторы воздушные ГП-80, ГП-40, ГП-20. Температурный режим воздействия составляет от ста шестидесяти до ста восьмидесяти градусов. Минимальное время воздействия – тридцать минут, полный цикл составляет от семидесяти пяти минут до двух часов.
Этот метод имеет ряд недостатков. К ним относятся – длительный цикл обработки инструмента, высокие энергозатраты, воздействие на материалы в одном температурном режиме. Преимуществом можно назвать низкую себестоимость самого оборудования.
Применение химических препаратов подразумевает под собой химический метод стерилизации. Для химического метода применяется перекись водорода, аламинол, пресепт и так далее. Температурный режим при этом методе невысокий и составляет от восемнадцати до пятидесяти градусов. Время воздействия от четырех до пяти часов.
При помощи этого метода можно стерилизовать металл, стекло, полимеры и резину. Недостатком, конечно же, является очень длительный цикл, зато преимуществом бесспорно можно назвать то, что нет необходимости приобретать специальное оборудование.
data-yashareQuickServices=»yaru,vkontakte,facebook,twitter,odnoklassniki,moimir,gplus» data-yashareTheme=»counter»
>
Читайте еще интересное о полезном:
0
0
голос
Рейтинг статьи
Наиболее широко используемый метод стерилизации паром
Ключевые моменты
Три основных условия, по мнению Хармера, должны быть выполнены, прежде чем предмет можно будет считать стерильным:
Среди различных доступных методов пар является самым старым, самым надежным и самым старым. Хармер сказал, что это самый дешевый метод, используемый медицинскими организациями в США. Один из способов стерилизации инструментов паром — разбавление воздуха в настольных стерилизаторах. Такие устройства генерируют собственный пар за счет добавления дистиллированной или деионизированной воды.
Посещения объектов показали, что многие медицинские работники, использующие настольные стерилизаторы, не знают, что сам прибор должен очищаться в соответствии с рекомендациями производителя. Осадок и растворенные твердые частицы могут остаться в резервуаре устройства, если он не был очищен должным образом.
Гравитационное вытеснение и вакуум — это другие типы паровой стерилизации. Установки гравитационного вытеснения основаны на нагнетании тепла и пара под давлением в автоклав; холодный воздух нагнетается вниз и через вентиляционное отверстие в атмосферу.Вакуумные паровые стерилизаторы откачивают весь воздух внутри камеры перед подачей пара. Эти устройства обычно быстрее, чем стерилизаторы с гравитационным вытеснением.
Мгновенное паровое автоклавирование — это метод высокоскоростной стерилизации, который обычно используется, когда не хватает времени для предпочтительных подходов к упаковке. Стерилизация происходит при температуре 270 ° F или выше в течение более коротких периодов времени, необходимых для упакованных инструментов.
«Нет срока годности при хранении с прошивкой», — сказал Хармер. «Его нужно использовать немедленно.»
Дополнительные опции
Стерилизация газообразным оксидом этилена — более старый метод, который медленнее и сложнее, чем новые подходы. Он смертен для спор бактерий, плесени, дрожжей, грибков и вирусов, которые можно убить только с помощью прямой контакт При использовании этого метода эффективная стерилизация зависит от комбинации концентрации газа, относительной влажности, температуры и времени воздействия
Оксид этилена очень токсичен и требует циклов аэрации.По словам Хармера, установки все еще доступны, несмотря на появление новых методов стерилизации, и теперь они разработаны с улучшенными механизмами аэрации. Этиленоксидный газ в основном используется для стерилизации предметов, которые не выдерживают высоких температур, используемых в паровых системах.
Газовая плазменная стерилизация парами перекиси водорода — один из новейших методов. В Соединенных Штатах доступно только одно устройство газовой плазмы, одобренное FDA. Он работает при низкой температуре, не содержит токсинов и не вызывает коррозии и не требует цикла аэрации.Его побочные продукты — кислород и вода — безвредны. Однако устройство не будет работать со всеми размерами просвета. Он не эффективен для металлических или неметаллических инструментов с просветом менее 6 мм или более 310 мм или с просветом из нержавеющей стали менее 3 мм или более 400 мм.
Холодная стерилизация — это альтернативный подход к очистке инструментов. Глутаральдегид является наиболее часто используемым стерилизующим средством в холодных системах, хотя это химическое вещество более широко используется в качестве дезинфицирующего средства высокого уровня.
«Это также можно считать стерилизующим средством, если на самом деле оно используется при комнатной температуре, обычно в течение 10–12 часов», — сказал Хармер. «Вы можете уменьшить это время, если используете автоматизированную систему с повышенными температурами; обычно это занимает около 8 часов.
» Глутаральдегид способен убивать высокорезистентные бактериальные споры, но как только вы его используете, он начинает терять свою эффективность — сказала она. — На нем должен быть указан срок годности, и вам нужно будет проверить его эффективность.»
Глутаралдагид быстро испаряется, имеет сильный запах и может раздражать глаза, нос, носовые ходы, горло и дыхательные пути. При работе с этим химическим веществом сотрудники должны использовать средства защиты глаз, и его необходимо тщательно смыть с инструментов. .Любой остаточный раствор может быть чрезвычайно токсичным для внутриглазных или экстраокулярных тканей. По словам Хармера, это не рекомендуемый метод стерилизации офтальмологических инструментов.
Жидкая химическая стерилизация редко используется в медицинских учреждениях.Исключение составляет перуксусная кислота, химическое вещество с нейтральным pH и дополнительным атомом кислорода; это сильный окислитель с антикоррозийной добавкой. Этот метод низкотемпературной стерилизации подходит для термочувствительных хирургических предметов, которые можно погружать в воду. Эффективность зависит от концентрации активного химического вещества и продолжительности воздействия. Перуксусная кислота не требует аэрации или особого контроля, имеет относительно короткий цикл, не оставляет следов при правильном ополаскивании и не является канцерогенным или мутагенным.
Стерилизация сухим жаром уничтожает организмы путем окисления. Для этого требуются высокие температуры и длительное время воздействия, но вероятность затупления и коррозии инструмента меньше. Однако при сильном нагреве покрытие из нержавеющей стали может быть повреждено.
3 Надежные методы медицинской стерилизации
Одним из наиболее важных процессов в критических средах является стерилизация медицинских инструментов и устройств. Безопасность пациентов во многом зависит от эффективности и надежности стерилизационных устройств.Загрязняющие вещества могут стать очень устойчивыми к дезинфекции, что приводит к необходимости применения высокоэффективных методов стерилизации, обеспечивающих стерильное оборудование. Три основных метода медицинской стерилизации связаны с высокими температурами / давлением и химическими процессами.
1. Плазменный газовый стерилизатор
Плазменная стерилизация
использует низкотемпературную плазму перекиси водорода внутри камеры для уничтожения всех живых микроорганизмов на медицинском и стоматологическом оборудовании, включая бактерии, споры, вирусы и грибки.Когда в камеру добавляется испаренная перекись водорода, оборудование внутри камеры становится стерильным. Когда пар удаляется из камеры, создается низкотемпературная плазма, обеспечивающая полную стерилизацию всех инструментов. Остатками этого процесса являются вода и кислород, что делает работу безопасной как для медицинского персонала, так и для окружающей среды. Хотя плазменная стерилизация является более дорогим методом, она очень эффективна и идеально подходит для чувствительных к влаге медицинских инструментов.
2. Автоклавы
Автоклав — это большой стальной сосуд или камера, в которых циркулирует пар при высокой температуре и давлении для стерилизации различных предметов или как часть промышленного процесса.Промышленные процессы в автоклаве могут включать вулканизацию резины, обработку композитных деталей и склеивание конструкций. Автоклавы — один из самых экономичных методов стерилизации с коротким циклом.
3. Стерилизаторы с парами перекиси водорода
Подобно плазменной стерилизации, стерилизаторы с испарением перекиси водорода (VHP) также используют пары перекиси водорода, но плазменный газ в процессе не используется. Стерилизаторы VHP удаляют влагу из помещения, и пар перекиси водорода быстро впрыскивается генератором для достижения эффективной концентрации для стерилизации оборудования.Эти пары эффективно удаляют микроорганизмы, которые могут присутствовать, стерилизуя корпус. Затем генератор меняет процесс на противоположный, расщепляя пары перекиси водорода на экологически безопасные элементы. Этот метод имеет одно из самых коротких циклов, что дает возможность стерилизовать оборудование большими партиями.
Чтобы быть эффективными, все три метода требуют точного контроля давления на каждом этапе процесса стерилизации. Без контроля уровней давления микроорганизмы все еще могут присутствовать в закрытом помещении, что приводит к нестерильности оборудования.Датчики давления обеспечивают точные измерения давления, обеспечивая высокую эффективность всех трех методов. Поскольку для каждого метода используются уникальные процессы стерилизации, при выборе правильного датчика давления необходимо учитывать множество факторов.
НАЖМИТЕ ЗДЕСЬ, чтобы загрузить нашу техническую документацию по измерению давления в медицинских стерилизаторах.
% PDF-1.6
%
468 0 объект
> / Метаданные 465 0 R / AcroForm 500 0 R / Страницы 424 0 R / Тип / Каталог / PageLabels 421 0 R >>
endobj
465 0 объект
> поток
2009-09-04T15: 55: 45-04: 002009-12-09T14: 03: 22-05: 002009-12-09T14: 03: 22-05: 00 Adobe InDesign CS3 (5.0.4)
AQBIAAAAAQAB / + 4AE0Fkb2JlAGQAAAAAAQUAAs7M / 9sAhAAMCAgICAgMCAgMEAsLCxAUDg0NDhQY
EhMTExIYFBIUFBQUEhQUGx4eHhsUJCcnJyckMjU1NTI7Ozs7Ozs7Ozs7AQ0LCxAOECIYGCIyKCEo
MjsyMjIyOzs7Ozs7Ozs7Ozs7Ozs7OztAQEBAQDtAQEBAQEBAQEBAQEBAQEBAQEBAQED / wAARCAEA
AKsDAREAAhEBAxEB / 8QBQgAAAQUBAQEBAQEAAAAAAAAAAwABAgQFBgcICQoLAQABBQEBAQEBAQAA
AAAAAAABAAIDBAUGBwgJCgsQAAEEAQMCBAIFBwYIBQMMMwEAAhEDBCESMQVBUWETInGBMgYUkaGx
QiMkFVLBYjM0coLRQwclklPw4fFjczUWorKDJkSTVGRFwqN0NhfSVeJl8rOEw9N14 / NGJ5SkhbSV
xNTk9KW1xdXl9VZmdoaWprbG1ub2N0dXZ3eHl6e3x9fn9xEAAgIBAgQEAwQFBgcHBgI7AQACEQMh
MRIEQVFhcSITBTKBkRShsUIjwVLR8DMkYuFygpJDUxVjczTxJQYWorKDByY1wtJEk1SjF2RFVTZ0
ZeLys4TD03Xj80aUpIW0lcTU5PSltcXV5fVWZnaGlqa2xtbm9ic3R1dnd4eXp7fh2 + f3 / 9oADAMB
AAIRAxEAPwDrfqx9WPq3kfVvpN9 / ScG223Bxn2WPxqnOc51TC5znFkkkpKdL / mn9Vf8Aym6f / wCw
tP8A6TSUr / mn9Vf / ACm6f / 7C0 / 8ApNJSv + af1V / 8pun / APsLT / 6TSUr / AJp / VX / ym6f / AOwtP / pN
JSv + af1V / wDKbp // ALC0 / wDpNJSv + af1V / 8AKbp // sLT / wCk0lK / 5p / VX / ym6f8A + wtP / pNJSv8A
mn9Vf / Kbp / 8A7C0 / + k0lK / 5p / VX / AMpun / 8AsLT / AOk0lK / 5p / VX / wApun / + wtP / AKTSUr / mn9Vf
/ Kbp / wD7C0 / + k0lK / wCaf1V / 8pun / wDsLT / 6TSUr / mn9Vf8Aym6f / wCwtP8A6TSUr / mn9Vf / ACm6
f / 7C0 / 8ApNJSv + af1V / 8pun / APsLT / 6TSUr / AJp / VX / ym6f / AOwtP / pNJSv + af1V / wDKbp // ALC0
/ wDpNJSv + af1V / 8AKbp // sLT / wCk0lK / 5p / VX / ym6f8A + wtP / pNJSv8Amn9Vf / Kbp / 8A7C0 / + k0l
PNf83ugft70f2Zh + n + 3PR2fZ69vp / sf1vTjZG31PfH72vKSnpfqn / wCJXo3 / AKb8X / zzWkp1klKS
UpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSU8p / 60X / ANUH / wAY0lOr9U // ABK9
G / 8ATfi / + ea0lOskpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSnlP8A1ov /
AKoP / jGkp1fqn / 4lejf + m / F / 881pKdZJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklK
SUpJSklPKf8ArRf / AFQf / GNJTq / VP / xK9G / 9N + L / AOea0lOskpSSlJKUkpSSlJKUkpSSlJKUkpSS
lJKUkpSSlJKUkpSSlJKUkpSSnlP / AFov / qg / + MaSnV + qf / iV6N / 6b8X / AM81pKdZJSklKSUpJSxI
aC4mANSSkrZyW / WfAc4EVZHoOdsbk + kTUTO3Rw158lJ7RaQ + I4idpV + 9WjpMyaLLrMdjw62mDYwc
t3CWz8UyjTaGSJkYg6hKgvQ35BoNYFVlvqvDJrAOyfznyRDQiBayc + GtCb7Najq9WSCaKLnhmScR
8NB2ubEvPu + hrz + CJhTFDmoz2B + bh / t8m + mthSSmq / qFAputxw7KOO / 07K6AHP3AgFsEjiUeE2xH
PHhJj6q0oNkGQDET2KDKukpSSlJKUkpSSlJKeU / 9aL / 6oP8A4xpKdX6p / wDiV6N / 6b8X / wA81pKd
ZJSklKSUpJTC3b6T9zS5u0y0akiOAkES2LxZvZh2ivoebltvDxt6fbWXRJ1HG0KzV / MPq4PGMYrD
OXF + 4Q3mMso611Y1hzcx + O2zGbucQ55r98SSDDjpPHZM3iOzZAMeYy181WPsaOJ6jqLnUlojByBm
gOtc5z / TOtm + trQ / d5p53 + rWx2YGv3JcW / brpu2hjVY / TuhPrnddl49jy4kySI0ngJt3KTN7cYYc
NdZRKGv / AAX / AKfj / wB8R / 71jj0 / 2zLGd0TN + sIvBZjsptAqZ7t99xd9I8wN3CR4hBdjPL5eavaj
p4lCMlr + p4t9LfQtdnNZaD6jrtpdBFtjjtgj80JV6T5LPcBzRI0PHrvf1P7F76qKOm9dp9wuZkiG
uc8 / ojbXtd7iQZ8eUQSZRROMY4cw68X4WG3m / ZP2hk / tzfs9Gv7BG / bO33bNv5 + 5MjfCOH6tjNwe
7L3tqHDv / K0WJi2Zefi1dWaX2fsxxc15IP8AOWbN3edpCMjQNd2PFjOTLEZd / b / aXb + qz32dBxXW
OLjDxJ1MNe9o / AKPKPWW / wDDZGXLRv8Alq6qY3FJKUkpSSnlP / Wi / wDqg / 8AjGkp1fqn / wCJXo3 /
AKb8X / zzWkp1klKSUpJSklKSUpJSklKSUpJSklKSUgszMarJpw7HxdkbjUyCd2wbnagQNEREkWxy
ywjMRJ1OzHK6hh5dlVWTZsfkO21NguLj / ZB8UhElGTPjxkCR1OzZQZVJKUkpSSlJKUkpSSnlP / Wi
/ wDqg / 8AjGkp1fqn / wCJXo3 / AKb8X / zzWkp1klKSUpJSklKSU4 / 1ltvrow20WvpNuZVW51bi07XB
8hSYgLPk0viMpCMKNXIDRxL7c6np + fktzckvwMw01A2EgtDgPf8AvcqQAEgVuGhOeSOKcuOXolQ1
Sda6rdXflXYmRa1 + Pa2sB1wY0EfSaygD3jzchCF1a7nOZlGUjGRsGt / + 56p89 + U / O60W5V9bcSmq
ylldha0O9MO4 + SEaqOjJmlM5M3qI4QCNfBg / qWT6j325Dmep0X1mjeWj1nAe5okDd8EREfitlzE7
JMt8V / VHmdStGBiMGReMhuD9oJ9b0mknQOc7V1jp / NSjHU + a3NzB9qI4jxcF71 / v + TbqusyOpfV6
+ 47rLKLXOd4k1alCqEmaMzPLgJ3o / km6pS5 / 1l6XFr2bm3Rt2 + 3ayTtlp + l3QgfQV / MwJ5vFr3 / J
zf2jlfZP2l9ts / aP2n0 / sO8bI3x6fp / DuncIuq0a3vz4Pc4zx8VcN + O1Op0 / 7TkfWHqBfk2 + liur
20bprO9jhqD4c6d0yVCAbWDjnzWS5Go1p02dxRugpJSklKSUpJTyn / rRf / VB / wDGNJTq / VP / AMSv
Rv8A034v / nmtJTrJKUkpSSlJKYMvpssfVXY1z6o9RjSC5s8bgOJRorROJJAOoVbRTeGi6ttgY4Pb
vAdDhw4T3SBIVKEZbi0bsLDcx9bqKiy12 + xpY0h7udzhGp80uIrThxkEcI13R2Y3Sr8h9VtWPZkP
aHPY5rHPLAdC4ETEogyAWyx4ZSIIiZfS2b6 + ni412NpF2WIc1wbvtawcEHVwAQ1pMo4uKjVy / H + K
78HCsaxtmPU9tbdjA5jSGtiNrZGghLiKThxkC4hTsHCeGNdj1OFQ21gsaQ0cQ3TQJcRUcOM16Roy
bi4rTW5tNYNALaiGgFgIghmmnySspGKArQabMnUUvtZc + trrK52PIBc3dodp5EpWUmESQSNQw + yY
номер / afRr9b / S7Bv8A86JSs0j2ocXFQvuzZRTXY + 2utrX2x6j2gBzo43EcwlZSIRBJA1LNBcpJSklK
SUpJTyn / AK0X / wBUH / xjSU6v1T / 8SvRv / Tfi / wDnmtJTrJKUkpSSlJKeQzMnPwc / rWdhWtrFD8Y2
McwO37hsAk8cqeIBEQXFzZMuLLmnA7cP1bef1rqBy8qrDL2DDrY4MZSbhY57d5D3AHa2PghGAoWz
Z + cy + 5IR / RA6Xfn2YdW67nUtdkYlrmmmul9lAqBax1sGLnvO6ddA1KGMHdHNc7kiDKJ2A0rv3 / sV
1N1p6tnWVO9N / wCyHP3RMQ4ExqNY4KUPlHmjmTL35kafqmuxmfbd0IV5DW32UWmu0s3bQa + 4LjuM
d0dBxMYGSUsFS9VHX6O70DPvz + kVZmT7rTvDi0RO1xHHyUeSIjKnQ5HPLNgEpbtDC6n1K3Ad1y3I
rNJFrhh7BIFYdtaHgh3726 + SdKIB4Wvh5nLLF7xkK19Pkx6f1fqdl2MbTZbXlVPe8mh2bKnBu5ux
+ 0bm9u6UoRAKOX5rNKUbsiQ / dqkfS + q9Vsf0p + RkC1vUPXa9hra3aaiQ0gtARnCOvgs5bms0ji4p
Xx8XTsgxup9QwcPJcLfUfd1F2M0ljnlhMFz2jc6dOGomIJHkx4 + Zy4oS1u58O38vsTZXWeqUdOzy
HWB + M + r0Miyn03ObYRuBY9gEj4ICETIMmXm80MU9 / TVEit03U8zrmA + ttlpNLKy + 7IopbZ7i50B7
HOlrA3uhERkv5jLzOIizpWpA / Z2d + ixt1NdzHB7bGhzXAQCHCQVERRdGEhKIIZpLlJKUkp5T / wBa
L / 6oP / jGkp1fqn / 4lejf + m / F / wDPNaSnWSUpJSklKSU07ekdOvGSLat32wsOR7nDf6erOHaR5Jwm
RTBLlcUuKx82 / wBFsjo / TMu1t2RQ172gNmSJA4DgCN3zSE5BWTlMOSVyixyehdJy7HXZGO1z3gNc
QXNkDQaNcOI5SGSQRk5LBkNyimPTsJ17sh2YNj6fs7iSSDUddsTCHEaXnl8ZlxVrVfRHR0fp2M + i
ymra7G3 + idzzt9QQ7lx7eKJmSthymKBiQPl2 + qbDw8bAobjYjPTqaSQ2S7kydXElAyJNlfixQxR4
YjRCzovS68h3UzGYLHEknUiXckNJ2ifgjxyqlkeUwxlxCOqsbo / TMOw249AY5wLZkmAeQ3cTt + SR
nIqx8rixm4herpHTqBjCqrb9jLzj + 5x2epq / l2s + aRmTao8rijw0Pl2 + rE9F6W7192O0jJdutBLo
LhruAn2n4JcclfdMPq9Pzbq / YnS / sj8L0B6NhDnt3OlxbxL9278UuOV2j7nh5DCtCyy + kdNzrRfl
UB9gEbpc2QOztpE / NITI2Tl5XFlNyGrba1rWhrQA1ogAcABNZwKXSUpJSklPKf8ArRf / AFQf / GNJ
Tq / VP / xK9G / 9N + L / AOea0lOskpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSS
nlP / AFov / qg / + MaSnV + qf / iV6N / 6b8X / AM81pKdZJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSkl
KSUpJSklKSUpJSklPKf + tF / 9UH / xjSU6v1T / APEr0b / 034v / AJ5rSU6ySlJKUkpSSlJKUkpSSlJK
UkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKeU / 9aL / 6oP8A4xpKdX6p / wDiV6N / 6b8X / wA81pKdZJSk
lKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklPKf + tF / 9UH / AMY0lOr9U / 8AxK9G
/ wDTfi / + ea0lOskpSSlJKUkpSSlJKUkpSSlJKefzOvdcx8q2mjpFl1dby1loLocBw76BSUh / 5yfW
L / yjt + 93 / pNJTv4N92TiVX5FRote2X1Hlp8NYSUnSUpJSklKSUpJSklKSUpJTyn / AK0X / wBUH / xj
SU6v1T / 8SvRv / Tfi / wDnmtJTrJKUkpSSlJKUkpSSlJKec6nhfW + 3Ots6dl114xI9NjiJAgT / AIN3
dJTV / Z318 / 7nVfeP / SSSlfs76 + f9zqvvH / pJJSv2d9fP + 51X3j / 0kkpX7O + vn / c6r7x / 6SSUr9nf
Xz / udV94 / wDSSSnrUlKSUpJSklKSUpJSklPKf + tF / wDVB / 8AGNJTq / VP / wASvRv / AE34v / nmtJTr
JKUkpSSlJKUkpSSnlv8AmJT / ANz8j8ElK / 5iU / 8Ac / I / BJSv + YlP / c / I / BJSv + YlP / c / I / BJSv8A
mJT / ANz8j8ElK / 5iU / 8Ac / I / BJSv + YlP / c / I / BJSv + YlP / c / I / BJT0HTsIdOwqsJr3WioEb3cmST
r96SmykpSSlJKUkpSSnlP / Wi / wDqg / 8AjGkp1fqn / wCJXo3 / AKb8X / zzWkp1klKSUpJSklKSUpJS
klKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSU8p / 60X / ANUH / wAY0lOr9U // ABK9G / 8ATfi / + ea0
lOskpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSnlP8A1ov / AKoP / jGkp1fq
n / 4lejf + m / F / 881pKdZJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklPKf8A
rRf / AFQf / GNJTq / VP / xK9G / 9N + L / AOea0lOskpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKU
kpSSlJKUkpSSnlP / AFov / qg / + MaSnV + qf / iV6N / 6b8X / AM81pKdZJSklKSUpJSklKSUpJSklKSUp
JSklKSUpJSklKSUpJSklKSUpJSklPKf + tF / 9UH / xjSU6v1T / APEr0b / 034v / AJ5rSU6ySlJKUkpS
SlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKeU / 9aL / 6oP8A4xpKdX6p / wDiV6N / 6b8X
/ wA81pKdZJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklPKf + tF / 9UH / AMY0
lOr9U / 8AxK9G / wDTfi / + ea0lOskpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkp
SSnlP / Wi / wDqg / 8AjGkp1fqn / wCJXo3 / AKb8X / zzWkp1klKSUpJSklKSUpJSklKSUpJSklKSUpJS
klKSUpJSklKSUpJSklKSU8p / 60X / ANUH / wAY0lOr9U // ABK9G / 8ATfi / + ea0lOskphda2mp1r + Gi
Skpweh / WnK6v1LP6dkdNdhHBJaHvtDvU2mHEN2NMca68pKZN + tNwvfVb0rL9Nt1lX2ir07Kmsrf6
fq2O9RpYNC6CJjVJTBv1uufZZXX0bqFwY9zBZQ2t7CBq07ja2C5pBjskpn / zpym / T6F1OSRtDa2O
0IJkn1ABxqJSU7tbt7Gv2lu4A7XciexSUySUpJSklKSUpJTkdZ + s / T + jXMw3suy821vqMxMVofZs
nbvducxrWz3c4T2SUt0b609N6ze / DY23Ezam + o / Eym7LQydu8bXOa5s9w4pKdBnUMC2qi + rJpfVl
HbjvbY0ttdDnRW4GHGGk6eCSmOP1TpuZTZkYmXRfTSSLbKrGPYwjUhzmuIEJKSuy8VjWufdW1r2G
xpLgAWNG5zhrwAdSkpVGTjZTd + Nay5o03VuDh97SUlJUlKSU8p / 60X / 1Qf8AxjSU6v1T / wDEr0b /
ANN + L / 55rSU6ySmr1O1tGDbY9r7AAAGVCXuLiGhrRI1JKSngj1Ho7 / rPidczb7W2Gj0MamiSCHm2
wvyIPmYAnjx0CUzzfq + 5 + Tl3Nx + lX78uyz9LVmB + 179xl1P53HYz48JKb3Ren / WLp1t7ekM6PS7I
Ae9jWZbWkM3Bpl / f3idfkkp2MBn10ZfW3Ou6bdRuBucxtot2EmdnDfCJSU7qSl0lKSUpJSklKSU +
f9U6n0bpfWer / typ7cv16bqra6i8uxjUWVuhkHa0h7XOMwfkkpN0rqPRuqdT6Y / pFDjlWXW3XXPq
dX6eMMf03uHqbjtLvTaOJ + 9JSDp3Tsx2H0voF93TbcXpLsh / rV5bjZkBtWTQG + k2qa49b3ncYSUk
6Pg5eDg29MzM7BrwX / ZzS2y + u61uPU2xz2vtrqxvUYXVEN / khySnQsZUMdmNbn4Zbj4 + ZVU43ATV
c1janEEmA3g + UJKdDozG2Z / r7sVjsfGbjPrxrfVc4nY9r7IayPbG3Tukp3UlKSU8p / 60X / 1Qf / GN
JTq / VP8A8SvRv / Tfi / 8AnmtJTrJKYW1VX1uquaHsdo5rhIKSmr + xukzWfslM1R6fsb7dpL29uznE
pKZO6R0pxe52HQTYSXk1t9xcZO7TWSkpiei9ILBWcKjaNQ302gfkSUzp6Z07Ht9ejFprtHFjGNDu
I5A8ElNpJSklKSUpJSklKSU53WPq / wBH68ytnVcZt / ondU8FzLGE87LK3NeJjWCkpl0voXSOiiz9
m4zaXXHdbZq + x + pd7rHlziJJgTokpu7GSTtEnkxykpRrrOha37gkpYVVt + ixo76AcpKU2qphBYxr
SJAIAHOpSUzSUpJTyn / rRf8A1Qf / ABjSU6v1T / 8AEr0b / wBN + L / 55rSU6ySlJKUkpSSlJKUkpSSl
JKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKeU / wDWi / 8Aqg / + MaSn / 9k =
uuid: cc01c10d-2bf0-4653-84ec-d630b21b77c3adobe: docid: indd: 0ec271df-68a2-11de-ab04-f5e7926250aaproof: pdf8b6d611c-8bbf-11dd -3bedec4-dabec8ecd-9fdec8ec-9fc8ec-9fc8ec-8ddddd-8c8ec-9fdec-9fc8ec-9fc8ec-9fc-8ec-9fc-8ec-9fc-8ec-9fc-8ec-8e-9ec-8e-8ec-8e СсылкаStream72.0072.00 Inchesuuid: 811B7F17462E11DA98ABB33C827576F0uuid: 811B7F16462E11DA98ABB33C827576F0
application / pdf Adobe PDF Library 8.0 Ложь
конечный поток
endobj
500 0 объект
> / Кодировка >>>>>
endobj
424 0 объект
>
endobj
421 0 объект
>
endobj
422 0 объект
>
endobj
423 0 объект
>
endobj
425 0 объект
>
endobj
431 0 объект
>
endobj
437 0 объект
>
endobj
443 0 объект
>
endobj
449 0 объект
>
endobj
455 0 объект
>
endobj
456 0 объект
>
endobj
457 0 объект
>
endobj
458 0 объект
>
endobj
459 0 объект
>
endobj
460 0 объект
>
endobj
461 0 объект
>
endobj
462 0 объект
>
endobj
463 0 объект
>
endobj
464 0 объект
>
endobj
352 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
354 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
356 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
358 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
360 0 объект
> / ExtGState >>> / Тип / Страница >>
endobj
362 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
364 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
366 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
368 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
370 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
371 0 объект
> поток
HWYS8 ~ ӖE + 6PTAW
$ 9cxJjZ_ҳ}% JXwN’C # O! ڟ ߕ f2QF \ / CǏIA @ & uOY ~ \ [zUxDGBϱ t2T> fU | 1 Mng ܪ} ĮD] FyINEzbkV] ߡ V] 2, $ CJceST / 5Z2L ֲ Y45lqr3 [mnz6sqr3] (a_5ґ, t, kSb = xvvfcP [pGzIRf6rїS03.UN ~ V / yB = / c0Y} ҄a2 qk 㪲 5w [ZTK = y9fVBL OG5 * L &? UTq:
f, fzk: Bri # E.Too) \ v
VWu | ~] 9F
5 Методы лабораторной стерилизации
Эффективные методы стерилизации необходимы для работы с изолированными клеточными линиями. По очевидным причинам вы не хотите, чтобы в вашей хорошей культуральной среде росли насекомые из окружающей среды, и в равной степени культуры необходимо стерилизовать перед утилизацией. Если вы не используете микробиологические микроскопы для просмотра своих культур, вы можете не знать о каких-либо нежелательных микробах-гостях.Пришло время изучить различные методы стерилизации и то, как они работают, чтобы ваши клетки оставались здоровыми, счастливыми и свободными от насекомых.
ВЛАЖНОЕ ТЕПЛО (автоклавирование)
В большинстве лабораторий предпочтительным методом стерилизации является автоклавирование; использование пара под давлением для нагрева стерилизуемого материала. Это очень эффективный метод, который убивает все микробы, споры и вирусы, хотя для некоторых конкретных ошибок требуются особенно высокие температуры или время инкубации.
Автоклавирование убивает микробы путем гидролиза и коагуляции клеточных белков, что эффективно достигается за счет интенсивного нагрева в присутствии воды.
Сильный жар исходит от пара. Пар под давлением имеет высокую скрытую теплоту; при температуре 100 o C она удерживает в 7 раз больше тепла, чем вода при той же температуре. Это тепло выделяется при контакте с более холодной поверхностью стерилизуемого материала, обеспечивая быструю доставку тепла и хорошее проникновение плотных материалов.
При таких температурах вода отлично гидролизует белки… так что у этих насекомых нет ни единого шанса.
СУХОЙ НАГРЕВ (пламя, выпечка)
Сухой нагрев имеет одно важное отличие от автоклавирования.Вы уже догадались — воды нет, поэтому гидролиз белка не может происходить.
Вместо этого сухой жар убивает микробы за счет окисления клеточных компонентов. Это требует больше энергии, чем гидролиз белка, поэтому для эффективной стерилизации сухим жаром требуются более высокие температуры.
Например, стерилизация обычно может быть достигнута за 15 минут путем автоклавирования при 121 ° C, тогда как для сухого нагрева обычно требуется температура 160 ° C для стерилизации за аналогичный период времени.
ФИЛЬТРАЦИЯ
Фильтрация — отличный способ быстро стерилизовать растворы без нагрева. Фильтры, конечно, работают, пропуская раствор через фильтр с диаметром пор, который слишком мал для микробов.
Фильтры могут быть воронками из рассеянного стекла, сделанными из плавленых при нагревании частиц стекла, или, что чаще встречается в наши дни, мембранными фильтрами, изготовленными из сложных эфиров целлюлозы. Для удаления бактерий обычно используются фильтры со средним диаметром пор 0,2 мкм.
Но помните, что вирусы и фаги могут проходить через эти фильтры, поэтому фильтрация — не лучший вариант, если это вызывает беспокойство.
РАСТВОРИТЕЛИ
Этанол обычно используется в качестве дезинфицирующего средства, хотя, поскольку изопропанол является лучшим растворителем жира, он, вероятно, является лучшим вариантом.
Оба работают, денатурируя белки посредством процесса, для которого требуется вода, поэтому, чтобы они были эффективными, их необходимо разбавить водой до 60-90%.
Опять же, важно помнить, что, хотя этанол и IPA хороши в уничтожении микробных клеток, они не действуют на споры.
ИЗЛУЧЕНИЕ
УФ, рентгеновские лучи и гамма-лучи — это все типы электромагнитного излучения, которые оказывают глубокое разрушающее воздействие на ДНК, поэтому они являются отличными инструментами для стерилизации.
Основное различие между ними с точки зрения их эффективности — их проницаемость.
UV имеет ограниченное проникновение в воздух, поэтому стерилизация происходит только на довольно небольшой площади вокруг лампы. Однако он относительно безопасен и весьма полезен для стерилизации небольших участков, например вытяжек с ламинарным потоком.
Рентгеновские лучи и гамма-лучи гораздо более проникающие, что делает их более опасными, но очень эффективными для крупномасштабной холодной стерилизации пластиковых предметов (например, шприцев) во время производства.
Итак, это некоторые из основных методов стерилизации, которые я могу придумать. Если я что-то пропустил, дайте мне знать в комментариях.
Вам это помогло? Тогда поделитесь с вашей сетью.
Стерилизация в современной стоматологии: сделай правильно!
Все эти моменты имеют решающее значение и требуют четкого рассмотрения, чтобы гарантировать безопасность практикующих врачей, персонала, пациентов и их семей.Целью этой статьи является информирование о рисках использования неподходящих стерилизаторов и циклов, которые увеличивают риск заражения.
Инфекции, связанные со здоровьем (HCAI), также называемые «нозокомиальными инфекциями», относятся к инфекциям, возникающим во время лечения в медицинских учреждениях, включая травмы персонала. По данным ВОЗ, ежегодно во всем мире инфицируются 2 миллиона пациентов, что приводит к длительному пребыванию в больнице, огромным расходам для систем здравоохранения (и пациентов) и значительной смертности, поскольку примерно 100 000 из них умрут.Еще более тревожным является то, что, несмотря на внедрение усиленных гигиенических процедур, постоянно совершенствующееся оборудование, более преданный и лучше обученный персонал; ни одно учреждение или страна еще не решила проблему. Я вижу необходимость как для медицинских работников, так и для всей отрасли уделять больше внимания реализации любых мер, которые могут способствовать улучшению этой ситуации!
Какой метод стерилизации является идеальным?
Это тепло убивает микроорганизмы.Влажное тепло в виде насыщенного пара — наиболее эффективное, экономичное и экологически чистое средство стерилизации. Он также является наиболее безопасным при условии, что цикл стерилизации рассчитан и соответствует обрабатываемым инструментам. Очевидно, что обработка обернутой кассеты для имплантологии требует гораздо более высокого уровня производительности, чем обработка бора или зонда с наконечником без упаковки (сплошной). Стерилизаторы водяного пара обычно предлагают несколько циклов, отличающихся друг от друга уровнем производительности и эффективности.
«Сила» пара на вашу пользу
Пар обладает способностью собирать энергию и, таким образом, распределять высокую убойную силу. По сравнению со стерилизаторами сухого нагрева, которые все еще широко используются, пар выделяет в 300 раз больше энергии на загрузку, что приводит к резкому сокращению плато стерилизации (3 ‘против 60’) и общего времени цикла, хотя и при гораздо более низкой и мягкой температуре ( 134 ° C против 180 ° C). Помимо экономии времени, очень ценным преимуществом для пользователя является то, что все инструменты, включая высокоскоростные и низкоскоростные наконечники, можно многократно обрабатывать, не влияя на их характеристики.
Есть ли ценный справочник по стерилизаторам?
EN 13060 — это европейская эталонная норма для небольших паровых стерилизаторов, которые широко используются в медицинских учреждениях, стоматологических кабинетах и все чаще татуировщиками, пирсерами и ветеринарами. Эта норма, опубликованная в июне 2004 года, повысила уровень производительности настольных стерилизаторов до больничного уровня, что действительно улучшило предотвращение перекрестной инфекции. Очевидно, он определяет, как стерилизаторы должны быть технически сконструированы.Однако для пользователя более актуальным является описание и классификация типов или семейств загрузки, а также категорий цикла B, S и N. Следует отметить, что большинство производителей стерилизаторов, даже за пределами Европы, производят ссылка на EN13060.
Почему циклы могут быть неподходящими?
Каждый инструмент каждого производителя построен по-своему. У каждого свой дизайн и технология.Внутренние части постоянно миниатюрны и сложны, что приводит к возрастающим проблемам в процессах стерилизации. Сложность каждого предмета соответствует определенному сопротивлению проникновению пара. Стандарт Австралии / Новой Зеландии прямо указывает: «Выбор стерилизатора и выбранных циклов стерилизации может не подходить для определенных предметов или типов загрузок». AS / NZ 4815: 2006.
Как упоминалось ранее, пар является идеальным средством для стерилизации при условии, что он контактирует со всеми внутренними и внешними поверхностями инструмента.Что могло помешать проникновению пара во все внутренние полости? Просто воздух. Таким образом, начальная фаза цикла удаления воздуха, также называемая предварительным вакуумом, имеет решающее значение. Уровень остаточного воздуха внутри камеры и нагрузка должны быть снижены почти до 0%, чтобы обеспечить надлежащее проникновение пара в самые сложные предметы, такие как высокоскоростные и низкоскоростные инструменты или пористые продукты. Воздух, попавший в просвет, препятствует проникновению пара и, таким образом, стерилизации соответствующих внутренних поверхностей. Сложность еще больше возрастает, когда предметы складываются или заворачиваются.Вот почему во многих руководствах подчеркивается, что «Неправильный выбор цикла может привести к нестерильным инструментам» .
Чтобы проверить этот момент, был проведен следующий тест:
Двусторонняя открытая стеклянная пипетка 30 см была заполнена жидкостью, а затем обработана циклами типа B и N для сравнения и иллюстрации их соответствующего удаления воздуха, таким образом, паропроницаемости.
Нижний рисунок (тип N) демонстрирует, что пар не может удалить жидкость из центра просвета трубки.Таким образом, часть внутренней поверхности не была бы стерилизована.
Полная классификация нагрузки
В таблице ниже показана классификация нагрузки в соответствии с EN13060. Фактически существует 6 «семейств» загрузок, которые считаются обработанными без упаковки и сохраняются стерильными до момента использования в одинарной или двойной упаковке или в упаковке (хранение и транспортировка). Всего существует 18 типов нагрузки, относящихся к 18 различным задачам. Норма поэтому описывает соответствующие методы испытаний, которые позволяют производителю доказать, что циклы способны выдерживать нагрузку (нагрузки), для которых они были разработаны.Испытания должны быть проведены и задокументированы в виде так называемого «типового испытания» до начала производства любого нового стерилизатора или цикла.
Описание 18 типов нагрузки.
Набор инструментов с узким просветом.
Современные технологии для улучшения очистки и дезинфекции поверхностей окружающей среды в больницах | Устойчивость к противомикробным препаратам и инфекционный контроль
Rutala WA, Вебер DJ. Дезинфицирующие средства, используемые для дезинфекции окружающей среды и новые технологии дезактивации помещений. Am J Infect Control. 2013; 41: S36–41.
PubMed
Статья
Google ученый
Донски CJ. Уменьшает ли улучшение очистки и дезинфекции поверхностей число инфекций, связанных с оказанием медицинской помощи? Am J Infect Control. 2013; 41: S12–9.
PubMed
Статья
Google ученый
Танцовщица SJ. Борьба с внутрибольничной инфекцией: акцент на роли окружающей среды и новых технологиях обеззараживания. Clin Microbiol Rev.2014; 27: 665–90.
CAS
PubMed
PubMed Central
Статья
Google ученый
Han JH, Sullivan N, Leas BF, Pegues DA, Kaczmarek JL, Umscheid CA. Очистка поверхностей больничных палат для предотвращения инфекций, связанных с оказанием медицинской помощи. технический бриф. Ann Intern Med.2015; 163: 598-607.
Carling PC, Bartley JM. Оценка гигиенической чистки в медицинских учреждениях: то, чего вы не знаете, может навредить вашим пациентам. Am J Infect Control. 2010; 38: S41–50.
PubMed
Статья
Google ученый
Бойс Дж. М., Хэвилл Н.Л., Липка А., Хэвилл Х., Ризвани Р. Различия в практике ежедневной уборки в больницах. Инфекционный контроль Hosp Epidemiol. 2010. 31: 99–101.
PubMed
Статья
Google ученый
Sitzlar B, Deshpande A, Fertelli D, Kundrapu S, Sethi AK, Donskey CJ. Одиссея дезинфекции окружающей среды: оценка последовательных вмешательств для улучшения дезинфекции изоляторов Clostridium difficile. Инфекционный контроль Hosp Epidemiol. 2013; 34: 459–65.
PubMed
Статья
Google ученый
Аппельбаум Э., Берг П., Фрост А., Пройс Дж., Аппельбаум Э. Влияние реструктуризации работы на низкооплачиваемых и низкоквалифицированных рабочих в U.С. больницы. В: Бернхадт А., Мурнейн Р., редакторы. Америка с низкой заработной платой: как работодатели меняют возможности на рабочем месте. Нью-Йорк: Фонд Рассела Сейджа; 2003. с. 77–117.
Google ученый
Зубери Д.М., Пташник М.Б. Вредные последствия приватизации и аутсорсинга для вспомогательной работы больниц: опыт нанятых по контракту уборщиков больниц и диетических средств в Ванкувере, Канада. Soc Sci Med. 2011; 72: 907–11.
PubMed
Статья
Google ученый
Zoutman DE, Ford BD, Sopha K. Ресурсы и деятельность по очистке окружающей среды в канадских больницах неотложной помощи. Am J Infect Control. 2014; 42: 490–4.
PubMed
Статья
Google ученый
Думиган Д.Г., Бойс Дж.М., Хэвилл Н.Л., Голебевски М., Балогун О., Ризвани Р. Кто действительно заботится о вашем окружении? Разработка стандартизированных процедур очистки и эффективных методов мониторинга.Am J Infect Control. 2010; 38: 387–92.
PubMed
Статья
Google ученый
Андерсон Р. Э., Янг В., Стюарт М., Робертсон К., Танцовщица С. Дж. Аудит чистоты клинических поверхностей и оборудования: кто что чистит? J Hosp Infect. 2011; 78: 178–81.
CAS
PubMed
Статья
Google ученый
Али С., Мур Дж., Уилсон А.П. Влияние поверхностного покрытия и отделки на очищаемость направляющих лож и распространение Staphylococcus aureus.J Hosp Infect. 2012; 80: 192–8.
CAS
PubMed
Статья
Google ученый
Cadnum JL, Hurless KN, Kundrapu S, Donskey CJ. Перенос спор Clostridium difficile с помощью неспорицидных салфеток и неправильно использованных салфеток из гипохлорита: практика + продукт = совершенство. Инфекционный контроль Hosp Epidemiol. 2013; 34: 441–2.
PubMed
Статья
Google ученый
Сиани Х, Купер С, Майярд Дж. Эффективность «спорицидных» салфеток против Clostridium difficile. Am J Infect Control. 2011; 39: 212–8.
CAS
PubMed
Статья
Google ученый
Engelbrecht K, Ambrose D, Sifuentes L, Gerba C, Weart I, Koenig D. Снижение активности имеющихся в продаже дезинфицирующих средств, содержащих соединения четвертичного аммония, при воздействии на хлопковые полотенца. Am J Infect Control. 2013; 41: 908–11.
CAS
PubMed
Статья
Google ученый
Бойс Дж. М., Салливан Л., Букер А., Бейкер Дж. Проблемы с дезинфицирующим средством на основе четвертичного аммония, возникшие в отделе экологических услуг. Инфекционный контроль Hosp Epidemiol. 2016; 37: 340–2.
PubMed
Статья
Google ученый
Ramm L, Siani H, Wesgate R, Maillard JY. Перенос патогенов и высокая вариабельность удаления патогенов салфетками с моющими средствами.Am J Infect Control. 2015; 43: 724–8.
CAS
PubMed
Статья
Google ученый
Weber DJ, Rutala WA, Sickbert-Bennett E. Вспышки, связанные с зараженными антисептическими и дезинфицирующими средствами. Антимикробные агенты Chemother. 2007; 51: 4217–24.
CAS
PubMed
PubMed Central
Статья
Google ученый
Бойс Дж. М., Хэвилл Н.Л., Тетро Дж., Саттар С.А.Рост бактерий в используемом дезинфицирующем средстве на основе четвертичного аммония больничного класса. Представлено на 21-м ежегодном научном собрании Общества эпидемиологии здравоохранения Америки, 2 апреля 2011 г., Даллас, Техас, abstr 113, 2011 г.
Kampf G, Degenhardt S, Lackner S, Jesse K, von Baum H, Ostermeyer C. Плохо обработанные многоразовые диспенсеры для дезинфекции поверхностей могут быть источником инфекции. BMC Infect Dis. 2014; 14: 37.
PubMed
PubMed Central
Статья
Google ученый
Экштейн BC, Адамс Д.А., Экштейн Е.К., Рао А., Сетхи А.К., Ядавалли Г.К. и др. Снижение загрязнения поверхностей окружающей среды Clostridium difficile и ванкомицином Enterococcus после вмешательства по улучшению методов очистки. BMC Infect Dis. 2007; 7: 61.
PubMed
PubMed Central
Статья
Google ученый
French GL, Otter JA, Shannon KP, Adams NMT, Watling D, Parks MJ.Борьба с загрязнением окружающей среды больницы метициллин-устойчивым стафилококком Staphylococcus (MRSA): сравнение традиционной конечной очистки и обеззараживания паров перекиси водорода. J Hosp Infect. 2004; 57: 31–7.
CAS
PubMed
Статья
Google ученый
Сиглер В., Хенсли С. Стойкость смешанных скоплений стафилококков после дезинфекции поверхностей больничных палат. J Hosp Infect.2013; 83: 253–6.
CAS
PubMed
Статья
Google ученый
Митчелл Б.Г., Дигни В., Медальон П., Танцовщица С.Дж. Контроль метициллин-резистентного золотистого стафилококка (MRSA) в больнице и роль обеззараживания перекисью водорода: анализ прерывистого временного ряда. BMJ Open. 2014; 4: e004522.
PubMed
PubMed Central
Статья
Google ученый
Hayden MK, Bonten MJ, Blom DW, Lyle EA, van de Vijver DA, Weinstein RA. Снижение приобретения устойчивых к ванкомицину Enterococcus после выполнения обычных мер по очистке окружающей среды. Clin Infect Dis. 2006; 42: 1552–60.
PubMed
Статья
Google ученый
Маниан Ф.А., Гриснауэр С., Сенкель Д. Влияние окончательной очистки и дезинфекции на изоляцию комплекса Acinetobacter baumannii с неодушевленных поверхностей больничных палат количественными и качественными методами.Am J Infect Control. 2013; 41: 384–5.
PubMed
Статья
Google ученый
Strassle P, Thom KA, Johnson JK, Leekha S, Lissauer M, Zhu J, et al. Влияние окончательной очистки на уровень загрязнения окружающей среды Acinetobacter baumannii с множественной лекарственной устойчивостью. Am J Infect Control. 2012; 40: 1005–7.
PubMed
Статья
Google ученый
Goodman ER, Platt R, Bass R, Onderdon AB, Yokoe DS, Huang SS.Воздействие мероприятий по очистке окружающей среды на наличие метициллин-резистентных Staphylococcus и ванкомицин-резистентных энтерококков на поверхностях в палатах интенсивной терапии. Инфекционный контроль Hosp Epidemiol. 2008; 29: 593–9.
PubMed
PubMed Central
Статья
Google ученый
Пассаретти К.Л., Оттер Дж. А., Райх Н. Г., Майерс Дж., Шепард Дж., Росс Т. и др. Оценка дезактивации окружающей среды парами перекиси водорода для снижения риска заражения пациента микроорганизмами с множественной лекарственной устойчивостью.Clin Infect Dis. 2013; 56: 27–35.
CAS
PubMed
Статья
Google ученый
Митчелл Б.Г., Танцовщица С.Дж., Андерсон М., Ден Э. Риск заражения организма от предыдущих обитателей комнаты: систематический обзор и метаанализ. J Hosp Infect. 2015; 91: 211–7.
CAS
PubMed
Статья
Google ученый
Carling PC, Briggs JL, Perkins J, Highlander D.Улучшенная уборка комнат пациентов с использованием нового метода наведения. Clin Infect Dis. 2006; 42: 385–8.
PubMed
Статья
Google ученый
Бойс Дж. М., Хэвилл Н. Л., Думиган Д. Г., Голебевски М., Балогун О., Ризвани Р. Мониторинг эффективности методов очистки больниц с использованием анализа биолюминесценции АТФ. Инфекционный контроль Hosp Epidemiol. 2009. 30: 678–84.
PubMed
Статья
Google ученый
Рупп М.Э., Фитцджеральд Т., Шольц Л., Лайден Э., Карлинг П. Сохранение выгоды: программа по устойчивому повышению эффективности очистки окружающей среды. Инфекционный контроль Hosp Epidemiol. 2014; 35: 866–8.
PubMed
Статья
Google ученый
Alfa MJ, Lo E, Wald A, Dueck C, Degagne P, Harding GK. Улучшенное уничтожение спор Clostridium difficile из туалетов госпитализированных пациентов с использованием ускоренной перекиси водорода в качестве чистящего средства.BMC Infect Dis. 2010; 10: 268.
PubMed
PubMed Central
Статья
Google ученый
Rutala WA, Gergen MF, Weber DJ. Эффективность улучшенной перекиси водорода против важных патогенов, связанных со здоровьем. Инфекционный контроль Hosp Epidemiol. 2012; 33: 1159–61.
PubMed
Статья
Google ученый
Boyce JM, Havill NL. Оценка нового дезинфицирующего средства для салфеток с перекисью водорода.Инфекционный контроль Hosp Epidemiol. 2013; 34: 521–3.
PubMed
Статья
Google ученый
Alfa MJ, Lo E, Olson N, MacRae M., Buelow-Smith L. Использование ежедневного дезинфицирующего очистителя вместо ежедневного очистителя снизило уровень внутрибольничных инфекций. Am J Infect Control. 2015; 43: 141–6.
CAS
PubMed
Статья
Google ученый
Rutala WA, Gergen MF, Sickbert-Bennett EE, Williams DA, Weber DJ.Эффективность улучшенной перекиси водорода в обеззараживании штор для конфиденциальности, зараженных патогенами с множественной лекарственной устойчивостью. Am J Infect Control. 2014; 42: 426–8.
CAS
PubMed
Статья
Google ученый
Чиу С., Скура Б., Петрик М., Макинтайр Л., Гэмидж Б., Исаак-Рентон Дж. Эффективность обычных дезинфицирующих / чистящих средств в инактивации норовируса мыши и калицивируса кошек в качестве суррогатных вирусов для норовируса человека.Am J Infect Control. 2015; 43: 1208–12.
CAS
PubMed
Статья
Google ученый
Карлинг П.С., Перкинс Дж., Фергюсон Дж., Томассер А. Оценка новой парадигмы сравнения дезинфекции поверхностей в клинической практике. Инфекционный контроль Hosp Epidemiol. 2014; 35: 1349–55.
PubMed
Статья
Google ученый
Deshpande A, Mana TS, Cadnum JL, Jencson AC, Sitzlar B, Fertelli D, et al.Оценка ежедневного дезинфицирующего средства на основе перуксусной кислоты / перекиси водорода со спороцидным действием. Инфекционный контроль Hosp Epidemiol. 2014; 35: 1414–6.
PubMed
Статья
Google ученый
Микин Н.С., Боуман С., Льюис М.Р., Танцовщица С.Дж. Сравнение эффективности очистки используемого дезинфицирующего средства и электролизованной воды в английском доме престарелых. J Hosp Infect. 2012; 80: 122–7.
CAS
PubMed
Статья
Google ученый
Fertelli D, Cadnum JL, Nerandzic MM, Sitzlar B, Kundrapu S, Donskey CJ. Эффективность электрохимически активированного физиологического раствора для дезинфекции больничного оборудования. Инфекционный контроль Hosp Epidemiol. 2013; 34: 543–4.
PubMed
Статья
Google ученый
Стюарт М., Богуш А., Хантер Дж., Деванни И., Ип Б., Рид Д. и др. Оценка использования нейтральной электролизованной воды для очистки поверхностей, находящихся рядом с пациентом. Инфекционный контроль Hosp Epidemiol.2014; 35: 1505–10.
CAS
PubMed
Статья
Google ученый
Кэхилл О.Дж., Кларо Т., О’Коннор Н., Кафолла А.А., Стивенс Н.Т., Дэниэлс С. и др. Плазма холодного воздуха для обеззараживания неодушевленных поверхностей в больнице. Appl Environ Microbiol. 2014; 80: 2004–10.
PubMed
PubMed Central
Статья
CAS
Google ученый
О’Коннор Н., Кэхилл О., Дэниэлс С., Гэлвин С., Хамфрис Х.Холодная плазма атмосферного давления и дезактивация. Может ли это способствовать профилактике внутрибольничных инфекций? J Hosp Infect. 2014; 88: 59–65.
PubMed
Статья
Google ученый
Кларо Т., Кэхилл О.Дж., О’Коннор Н., Дэниелс С., Хамфрис Х. Плазма атмосферного давления холодного воздуха против спор Clostridium difficile: потенциальная альтернатива для обеззараживания неодушевленных поверхностей в больницах. Инфекционный контроль Hosp Epidemiol.2015; 36: 742–4.
PubMed
Статья
Google ученый
Unal N, Yanik K, Karadag A, Odabasi H, Esen S, Gunaydin M. Оценка эффективности тумана акацида плюс (R) в искоренении возбудителя внутрибольничных инфекций. Int J Clin Exp Med. 2014; 7: 5867–71.
PubMed
PubMed Central
Google ученый
Мур Дж., Гриффит К. Лабораторная оценка обеззараживающих свойств салфеток из микроволокна.J Hosp Infect. 2006. 64: 379–85.
CAS
PubMed
Статья
Google ученый
Rutala WA, Gergen MF, Weber DJ. Микробиологическая оценка швабр из микрофибры для дезинфекции поверхностей. Am J Infect Control. 2007; 35: 569–73.
PubMed
Статья
Google ученый
Мур Г., Холл Т.Дж., Уилсон А.П., Гант В.А. Эффективность неорганического биоцида на основе меди CuWB50 снижается из-за жесткой воды.Lett Appl Microbiol. 2008; 46: 655–60.
CAS
PubMed
Статья
Google ученый
Али С., Мур Дж., Уилсон А.П. Распространение и устойчивость спор Clostridium difficile во время и после очистки спорицидными дезинфицирующими средствами. J Hosp Infect. 2011; 79: 97–8.
CAS
PubMed
Статья
Google ученый
Берген Л.К., Мейер М., Хог М., Рубенхаген Б., Андерсен Л.П.Распространение бактерий на поверхности при очистке салфетками из микрофибры. J Hosp Infect. 2009. 71: 132–7.
CAS
PubMed
Статья
Google ученый
Трайтман А.Н., Маникам К., Альфа М.Дж. Салфетки из микрофибры уменьшают перенос спор Clostridium difficile на поверхности окружающей среды по сравнению с хлопчатобумажными тканями. Am J Infect Control. 2015; 43: 686–9.
PubMed
Статья
Google ученый
Вебер DJ, Рутала, Вашингтон. Самостоятельная дезинфекция поверхностей: обзор текущих методологий и перспектив на будущее. Am J Infect Control. 2013; 41: S31–5.
PubMed
Статья
Google ученый
Хамфрис Х. Самостоятельная дезинфекция и пропитка микробиоцидом поверхностей и тканей: какой потенциал в предотвращении распространения инфекций, связанных с оказанием медицинской помощи? Clin Infect Dis. 2014; 58: 848–53.
PubMed
Статья
CAS
Google ученый
Schmidt MG, Attaway HH, Sharpe PA, John Jr J, Sepkowitz KA, Morgan A, et al. Устойчивое снижение микробной нагрузки на обычные больничные поверхности за счет введения меди. J Clin Microbiol. 2012; 50: 2217–23.
PubMed
PubMed Central
Статья
Google ученый
Schmidt MG, Attaway III HH, Fairey SE, Steed LL, Michels HT, Salgado CD. Медь постоянно ограничивает концентрацию бактерий, обитающих на поручнях кровати в отделении интенсивной терапии.Инфекционный контроль Hosp Epidemiol. 2013; 34: 530–3.
PubMed
Статья
Google ученый
Salgado CD, Sepkowitz KA, John JF, Cantey JR, Attaway HH, Freeman KD, et al. Медные поверхности снижают количество инфекций, приобретенных в отделении интенсивной терапии. Инфекционный контроль Hosp Epidemiol. 2013; 34: 479–86.
PubMed
Статья
Google ученый
Schweizer M, Graham M, Ohl M, Heilmann K, Boyken L, Diekema D. Новые больничные занавески с антимикробными свойствами: рандомизированное контролируемое исследование. Инфекционный контроль Hosp Epidemiol. 2012; 33: 1081–5.
PubMed
Статья
Google ученый
Коцанас Д., Вийесория В. Р., Слоан Т., Стюарт Р. Л., Гиллеспи Е. Серебряная подкладка одноразовых занавесок, вызывающих спорицидность, в отделении интенсивной терапии. Am J Infect Control. 2014; 42: 366–70.
PubMed
Статья
Google ученый
Бакса Д., Шетрон-Рама Л., Голембиески М., Голембиески М., Джайн С., Гордон М. и др. Оценка in vitro нового процесса снижения бактериального загрязнения поверхностей окружающей среды. Am J Infect Control. 2011; 39: 483–7.
CAS
PubMed
Статья
Google ученый
Boyce JM, Havill NL, Guercia KA, Schweon SJ, Moore BA.Оценка двух органосилановых продуктов на предмет устойчивой антимикробной активности на чувствительных поверхностях в палатах пациентов. Am J Infect Control. 2014; 42: 326–8.
CAS
PubMed
Статья
Google ученый
Tamimi AH, Carlino S, Gerba CP. Длительная эффективность самодезинфицирующего покрытия в отделении интенсивной терапии. Am J Infect Control. 2014; 42: 1178–81.
CAS
PubMed
Статья
Google ученый
Hedin G, Rynback J, Lore B. Снижение бактериального загрязнения поверхности в больнице за счет применения нового продукта со стойким эффектом. J Hosp Infect. 2010; 75: 112–5.
CAS
PubMed
Статья
Google ученый
Пейдж К., Уилсон М., Паркин И.П. Противомикробные поверхности и их потенциал в снижении роли неодушевленной среды в возникновении внутрибольничных инфекций. J Mater Chem.2009; 19: 3819–31.
CAS
Статья
Google ученый
Park GW, Cho M, Cates EL, Lee D, Oh BT, Vinje J, et al. Фторированный TiO (2) в качестве вирулицидного покрытия поверхности, активируемого окружающим светом, для борьбы с норовирусом человека. Журнал J Photochem Photobiol B. 2014; 140: 315–20.
CAS
PubMed
Статья
Google ученый
Bogdan J, Zarzynska J, Plawinska-Czarnak J.Сравнение восприимчивости инфекционных агентов к фотокаталитическому воздействию наноразмерных оксидов титана и цинка: практический подход. Nanoscale Res Lett. 2015; 10: 1023.
PubMed
Google ученый
de Jong B, van Zanten ARH. Влияние MVX (диоксида титана) на микробную колонизацию поверхностей в отделении интенсивной терапии. Идентификатор Clinical Trials.gov: NCT02348346, 2015.
Otter JA, Yezli S, Perl TM, Barbut F, French GL.Роль автоматических систем дезинфекции помещений в профилактике инфекций и борьбе с ними. J Hosp Infect. 2013; 83: 1–13.
CAS
PubMed
Статья
Google ученый
Оттава (ON): Канадское агентство по лекарствам и технологиям в области здравоохранения. Не ручные методы дезинфекции помещений в медицинских учреждениях: обзор клинической эффективности и руководящие принципы. 2014.
Андерсен Б.М., Раш М., Хохлин К., Йенсен Ф. Х., Висмар П., Фредриксен Дж.Обеззараживание помещений, медицинского оборудования и машин скорой помощи аэрозолем дезинфицирующего средства перекиси водорода. J Hosp Infect. 2006; 62: 149–55.
CAS
PubMed
Статья
Google ученый
Shapey S, Machin K, Levi K, Boswell TC. Активность системы сухого тумана с перекисью водорода в отношении загрязнения окружающей среды Clostridium difficile в палатах ухода за престарелыми. J Hosp Infect. 2008; 70: 136–41.
CAS
PubMed
Статья
Google ученый
Bartels MD, Kristoffersen K, Slotsbjerg T., Rohde SM, Lundgren B., Westh H. Экологическая дезинфекция Staphylococcus aureus (MRSA), устойчивого к метициллину, с использованием перекиси водорода, образованной сухим туманом. J Hosp Infect. 2008; 70: 35–41.
CAS
PubMed
Статья
Google ученый
Барбут Ф., Менуэт Д., Верахтен М., Гиру Э. Сравнение эффективности системы дезинфекции сухим туманом перекисью водорода и раствора гипохлорита натрия для уничтожения спор Clostridium difficile .Инфекционный контроль Hosp Epidemiol. 2009. 30: 507–14.
CAS
PubMed
Статья
Google ученый
Пискин Н., Селеби Дж., Кулах С., Менгелоглу З., Юмусак М. Активность системы обеззараживания перекисью водорода с помощью сухого тумана против метициллин-резистентного Staphylococcus aureus и Acinetobacter baumannii. Am J Infect Control. 2011; 39: 757–62.
PubMed
Статья
Google ученый
Landelle C, Legrand P, Lesprit P, Cizeau F, Ducellier D, Gouot C и др. Затяжная вспышка Acinetobacter baumannii с множественной лекарственной устойчивостью после межконтинентальной перевозки колонизированных пациентов. Инфекционный контроль Hosp Epidemiol. 2013; 34: 119–24.
PubMed
Статья
Google ученый
Бест Е.Л., Парнелл П., Тиркелл Г., Верити П., Копленд М., Эльсе П. и др. Эффективность глубокой очистки с последующей дезактивацией перекисью водорода при высокой заболеваемости инфекцией Clostridium difficile.J Hosp Infect. 2014; 87: 25–33.
CAS
PubMed
Статья
Google ученый
Фиче Г., Антиога К., Комой Э., Деслис Дж. П., Макдоннелл Г. Инактивация прионов с использованием нового процесса стерилизации газообразным перекисью водорода. J Hosp Infect. 2007. 67: 278–86.
CAS
PubMed
Статья
Google ученый
Heckert RA, Best M, Jordan LT, Dulac GC, Eddington DL, Sterritt WG.Эффективность испаренной перекиси водорода против экзотических вирусов животных. Appl Environ Microbiol. 1997; 63: 3916–8.
CAS
PubMed
PubMed Central
Google ученый
Rogers JV, Sabourin CL, Choi YW, Richter WR, Rudnicki DC, Riggs KB, et al. Оценка дезактивации спор Bacillus anthracis, Bacillus subtilis и Geobacillus stearothermophilus на внутренних поверхностях с использованием газогенератора перекиси водорода. J Appl Microbiol.2005; 99: 739–48.
CAS
PubMed
Статья
Google ученый
Pottage T, Richardson C, Parks S, Walker JT, Bennett AM. Оценка систем газовой дезинфекции перекисью водорода для обеззараживания вирусов. J Hosp Infect. 2010. 74: 55–61.
CAS
PubMed
Статья
Google ученый
Ray A, Perez F, Beltramini AM, Jakubowycz M, Dimick P, Jacobs MR, et al.Использование обеззараживания испаренной перекисью водорода во время вспышки инфекции Acinetobacter baumannii с множественной лекарственной устойчивостью в больнице долгосрочной неотложной помощи. Инфекционный контроль Hosp Epidemiol. 2010; 31: 1236–41.
PubMed
PubMed Central
Статья
Google ученый
Гэлвин С., Бойл М., Рассел Р. Дж., Коулман, округ Колумбия, Кример Е., О’Гара Дж. П. и др. Оценка испарения перекиси водорода, Citrox и pH-нейтрального Ecasol для дезактивации закрытых помещений: пилотное исследование.J Hosp Infect. 2012; 80: 67–70.
CAS
PubMed
Статья
Google ученый
Chmielarczyk A, Higgins PG, Wojkowska-Mach J, Synowiec E, Zander E, Romaniszyn D, et al. Контроль за вспышкой инфекций, вызываемых Acinetobacter baumannii, с помощью испаренной перекиси водорода. J Hosp Infect. 2012; 81: 239–45.
CAS
PubMed
Статья
Google ученый
Бейтс К.Дж., Пирс Р. Использование паров перекиси водорода для контроля окружающей среды во время вспышки болезни Serratia в отделении интенсивной терапии новорожденных. J Hosp Infect. 2005. 61: 364–6.
CAS
PubMed
Статья
Google ученый
Hall L, Otter JA, Chewins J, Wengenack NL. Использование паров перекиси водорода для дезактивации Mycobacterium tuberculosis в шкафу биологической безопасности и комнате. J Clin Microbiol.2007; 45: 810–5.
CAS
PubMed
PubMed Central
Статья
Google ученый
Hall L, Otter JA, Chewins J, Wengenack NL. Деактивация диморфных грибов Histoplasma capsulatum, Blastomyces dermatitidis и Coccidioides immitis с использованием паров перекиси водорода. Med Mycol. 2008. 46: 189–91.
CAS
PubMed
Статья
Google ученый
Boyce JM, Havill NL, Otter JA, McDonald LC, Adams NMT, Cooper T. и др. Воздействие дезактивации паровой комнаты перекиси водорода на загрязнение окружающей среды и передачу Clostridium difficile в медицинских учреждениях. Инфекционный контроль Hosp Epidemiol. 2008; 29: 723–9.
PubMed
Статья
Google ученый
Otter JA, French GL. Выживание внутрибольничных бактерий и спор на поверхностях и инактивация парами перекиси водорода.J Clin Microbiol. 2009. 47: 205–7.
CAS
PubMed
PubMed Central
Статья
Google ученый
Manian FA, Griesenauer S, Senkel D, Setzer JM, Doll SA, Perry AM, et al. Изоляция комплекса Acinetobacter baumannii и метициллин-устойчивого золотистого стафилококка из больничных помещений после окончательной очистки и дезинфекции: можем ли мы сделать лучше? Инфекционный контроль Hosp Epidemiol. 2011; 32: 667–72.
PubMed
Статья
Google ученый
Барбут Ф, Йезли С., Мимун М., Фам Дж., Чауат М., Оттер Дж. А. Уменьшение распространения Acinetobacter baumannii и метициллин-резистентного золотистого стафилококка на ожоговом отделении за счет вмешательства группы инфекционного контроля. Бернс. 2013; 39: 395–403.
PubMed
Статья
Google ученый
Джинс А., Рао Г., Осман М., Меррик П. Искоренение стойкого экологического MRSA. J Hosp Infect. 2005. 61: 85–6.
CAS
PubMed
Статья
Google ученый
Драйден М., Парнаби Р., Дайли С., Льюис Т., Дэвис-Блюз К., Оттер Дж. А. и др. Обеззараживание паров перекиси водорода в борьбе со вспышкой поликлонального метициллин-устойчивого Staphylococcus aureus в хирургическом отделении. J Hosp Infect. 2008; 68: 190–2.
CAS
PubMed
Статья
Google ученый
Оттер Дж. А., Йезли С., Схоутен М. А., ван Зантен А. Р., Хоумес-Зильман Г., Нолманс-Паульссен М.К. Обеззараживание паров перекиси водорода отделения интенсивной терапии для удаления из окружающей среды резервуаров грамотрицательных стержней с множественной лекарственной устойчивостью во время вспышки.Am J Infect Control. 2010. 38: 754–6.
PubMed
Статья
Google ученый
Купер Т., О’Лири М., Йезли С., Оттер Дж. Влияние дезактивации окружающей среды с использованием паров перекиси водорода на частоту инфицирования Clostridium difficile в одном больничном фонде. J Hosp Infect. 2011; 78: 238–40.
CAS
PubMed
Статья
Google ученый
Сниткин Е.С., Желязны А.М., Томас П.Дж., Сток Ф., Хендерсон Д.К., Палмор Т.Н. и др.Отслеживание больничной вспышки устойчивой к карбапенемам Klebsiella pneumoniae с помощью полногеномного секвенирования. Sci Transl Med. 2012; 4: 148ra116.
PubMed
PubMed Central
Статья
Google ученый
Гопинатх Р., Савард П., Кэрролл К.С., Уилсон Л.Э., Ландрам Б.М., Perl TM. Соображения по профилактике инфекций, связанные с металло-бета-лактамазой Enterobacteriaceae Нью-Дели: отчет о болезни. Инфекционный контроль Hosp Epidemiol. 2013; 34: 99–100.
PubMed
Статья
Google ученый
Otter JA, Nowakowski E, Salkeld JA, Duclos M, Passaretti CL, Yezli S, et al. Экономия средств за счет обеззараживания упаковки неиспользованных медицинских принадлежностей с использованием паров перекиси водорода. Инфекционный контроль Hosp Epidemiol. 2013; 34: 472–8.
PubMed
Статья
Google ученый
Otter JA, Barnicoat M, Down J, Smyth D, Yezli S, Jeanes A.Обеззараживание паров перекиси водорода помещения отделения интенсивной терапии, где лечили пациента с лихорадкой Ласса. J Hosp Infect. 2010; 75: 335–7.
CAS
PubMed
Статья
Google ученый
Оттер Дж. А., Мефам С., Атан Б., Мак Д., Смит Р., Джейкобс М. и др. Окончательная дезактивация изолятора высокого уровня Royal Free London после случая болезни, вызванной вирусом Эбола, с использованием паров перекиси водорода. Am J Infect Control.2016; 44: 233–5.
PubMed
Статья
Google ученый
Otter JA, Puchowicz M, Ryan D, Salkeld JAG, Cooper TA, Havill NL, et al. Оценка осуществимости рутинного использования паров перекиси водорода (ВПЧ) для дезинфекции помещений в загруженной больнице США. Инфекционный контроль Hosp Epidemiol. 2009. 30: 574–7.
PubMed
Статья
Google ученый
Berrington AW, Pedler SJ.Исследование газообразного озона для дезактивации MRSA боковых комнат больницы. J Hosp Infect. 1998. 40: 61–5.
CAS
PubMed
Статья
Google ученый
de Boer HEL, van Elzelingen-Dekker CM, van Rheenen-Verberg CMF, Spanjaard L. Использование газообразного озона для уничтожения метициллин-устойчивого Staphylococcus aureus из домашней среды колонизированного сотрудника больницы. Инфекционный контроль Hosp Epidemiol.2006; 27: 1120–2.
PubMed
Статья
Google ученый
Sharma M, Hudson JB. Озон — эффективное и практичное антибактериальное средство. Am J Infect Control. 2008; 36: 559–63.
PubMed
Статья
Google ученый
Дэвис А., Поттедж Т., Беннетт А., Уокер Дж. Технологии очистки воздуха и газов от Clostridium difficile в сфере здравоохранения.J Hosp Infect. 2011; 77: 199–203.
CAS
PubMed
Статья
Google ученый
Гиббс С.Г., Лоу Дж. Дж., Смит П. У., Хьюлетт А.Л. Газообразный диоксид хлора как альтернатива борьбе с клопами. Инфекционный контроль Hosp Epidemiol. 2012; 33: 495–9.
PubMed
Статья
Google ученый
Секстон Дж. Д., Таннер Б. Д., Максвелл С. Л., Герба С. П.. Снижение микробной нагрузки на чувствительные к контакту поверхности в больничных палатах за счет обработки с помощью портативной системы дезинфекции насыщенным паром.Am J Infect Control. 2011; 39: 655–62.
PubMed
Статья
Google ученый
Nernandzic MM, Cadnum JL, Pultz MJ, Donskey CJ. Оценка автоматизированного устройства ультрафиолетового излучения для обеззараживания Clostridium difficile и других патогенов, связанных со здоровьем, в больничных палатах. BMC Infect Dis. 2010; 10: 197.
Артикул
Google ученый
Rutala WA, Gergen MF, Weber DJ. Обеззараживание помещений УФ излучением. Инфекционный контроль Hosp Epidemiol. 2010; 31: 1025–9.
PubMed
Статья
Google ученый
Boyce JM, Havill NL, Moore BA. Терминальная дезактивация палат с использованием автоматизированной мобильной УФ-установки. Инфекционный контроль Hosp Epidemiol. 2011; 32: 737–42.
PubMed
Статья
Google ученый
Rutala WA, Gergen MF, Tande BM, Weber DJ. Быстрая дезактивация больничной палаты с использованием ультрафиолетового (УФ) света с наноструктурированным покрытием стен, отражающим УФ-лучи. Инфекционный контроль Hosp Epidemiol. 2013; 34: 527–9.
PubMed
Статья
Google ученый
Андерсон Д. Д., Герген М. Ф., Сматерс Э., Секстон Д. Д., Чен Л. Ф., Вебер Д. Д. и др. Обеззараживание целевых патогенов в палатах пациентов с помощью автоматизированного устройства, излучающего ультрафиолет.Инфекционный контроль Hosp Epidemiol. 2013; 34: 466–71.
PubMed
PubMed Central
Статья
Google ученый
Махида Н., Воган Н., Босвелл Т. Первая оценка в Великобритании автоматизированного устройства для дезактивации помещений ультрафиолетом-С (Tru-D). J Hosp Infect. 2013; 84: 332–5.
CAS
PubMed
Статья
Google ученый
Nerandzic MM, Fisher CW, Donskey CJ.Сортировка множества вариантов: сравнительная оценка двух систем ультрафиолетовой дезинфекции. PLoS One. 2014; 9: e107444.
PubMed
PubMed Central
Статья
CAS
Google ученый
Rutala WA, Gergen MF, Tande BM, Weber DJ. Обеззараживание помещений аппаратом ультрафиолетового излучения C с коротким временем воздействия ультрафиолета. Инфекционный контроль Hosp Epidemiol. 2014; 35: 1070–2.
PubMed
Статья
Google ученый
Rutala WA, Weber DJ, Gergen MF, Tande BM, Sickbert-Bennett EE. Улучшает ли покрытие всех поверхностей комнаты ультрафиолетовое светоотражающее покрытие C по сравнению с покрытием только стен? Инфекционный контроль Hosp Epidemiol. 2014; 35: 323–5.
PubMed
Статья
Google ученый
Havill NL, Moore BA, Boyce JM. Сравнение микробиологической эффективности паров перекиси водорода и процессов ультрафиолетового излучения для дезактивации помещений.Инфекционный контроль Hosp Epidemiol. 2012; 33: 507–12.
PubMed
Статья
Google ученый
Андерсон Диджей, Секстон Диджей. Эффективность усиленной дезинфекции терминального помещения для предотвращения инфекций, связанных со здоровьем (HAI). Идентификатор Clinical Trials.gov: NCT01579370, 2015.
Stibich M, Stachowiak J, Tanner B, Berkheiser M, Moore L, Raad I., et al. Оценка воздействия импульсного ксенонового ультрафиолетового дезинфекционного устройства для помещений с точки зрения воздействия на больничные операции и снижение микробного загрязнения.Инфекционный контроль Hosp Epidemiol. 2011; 32: 286–8.
PubMed
Статья
Google ученый
Левин Дж., Райли Л.С., Пэрриш С., Инглиш Д., Ан С. Влияние портативного импульсного ксенонового ультрафиолета после окончательной очистки на больничную инфекцию Clostridium difficile в общественной больнице. Am J Infect Control. 2013; 41: 746–8.
PubMed
Статья
Google ученый
Jinadatha C, Quezada R, Huber TW, Williams JB, Zeber JE, Copeland LA. Оценка воздействия импульсного ксенонового ультрафиолетового устройства для дезинфекции помещений на уровни загрязнения метициллин-устойчивым золотистым стафилококком. BMC Infect Dis. 2014; 14: 187.
PubMed
PubMed Central
Статья
CAS
Google ученый
Ghantoji SS, Stibich M, Stachowiak J, Cantu S, Adachi JA, Raad II, et al. Не уступает импульсному ксеноновому ультрафиолетовому излучению по сравнению с отбеливателем для снижения загрязнения окружающей среды Clostridium difficile на высокочувствительных поверхностях в изоляторах инфекций Clostridium difficile.J Med Microbiol. 2015; 64: 191–4.
CAS
PubMed
Статья
Google ученый
Сандер Дж., Ладенштейн М. Надежность дозаторов дезинфицирующих средств в больницах (пер. Автора). Dtsch Med Wochenschr. 1974; 99: 1560–4.
CAS
PubMed
Статья
Google ученый
Nagaraja A, Visintainer P, Haas JP, Menz J, Wormser GP, Montecalvo MA. Инфекции Clostridium difficile до и во время использования ультрафиолетовой дезинфекции.Am J Infect Control. 2015; 43: 940–5.
Артикул
Google ученый
Миллер Р., Симмонс С., Дейл С., Стибич М., Стаховяк Дж. Использование и воздействие системы импульсной ксеноновой ультрафиолетовой дезинфекции комнаты и мультидисциплинарной бригады по уходу на Clostridium difficile в учреждении долгосрочной неотложной помощи . Am J Infect Control. 2015; 43: 1350–3.
PubMed
Статья
Google ученый
МакМаллен К., Вуд Х, Буол В., Джонсон Д., Брэдли А., Вельтье К. и др. Воздействие системы дезинфекции помещения импульсным ксеноновым ультрафиолетовым светом (PX-UV) на нормы Clostridium difficile . Представлено на IDWeek 2015, аннотация 1714, 10 октября 2015 г., Сан-Диего, Калифорния. 2015.
Nerandzic MM, Thota P, Sankar CT, Jencson A, Cadnum JL, Ray AJ, et al. Оценка системы импульсной ксеноновой ультрафиолетовой дезинфекции для снижения количества патогенов, связанных со здоровьем, в больничных палатах.Инфекционный контроль Hosp Epidemiol. 2015; 36: 192–7.
PubMed
Статья
Google ученый
Maclean M, MacGregor SJ, Anderson JG, Woolsey GA, Coia JE, Hamilton K, et al. Обеззараживание окружающей среды изолятора больницы с использованием узкоспектрального света высокой интенсивности. J Hosp Infect. 2010. 76: 247–51.
CAS
PubMed
Статья
Google ученый
Bache SE, Maclean M, MacGregor SJ, Anderson JG, Gettinby G, Coia JE и др. Клинические исследования системы дезактивации окружающей среды с узким спектром света высокой интенсивности (HINS-light EDS) для непрерывной дезинфекции ожогового отделения в стационарных и амбулаторных условиях. Бернс. 2012; 38: 69–76.
PubMed
Статья
Google ученый
Маклин М., Маккензи К., Андерсон Дж. Г., Геттинби Дж., МакГрегор С. Дж.. Световая технология 405 нм для инактивации патогенов и ее потенциальная роль для дезинфекции окружающей среды и борьбы с инфекциями.J Hosp Infect. 2014; 88: 1–11.
CAS
PubMed
Статья
Google ученый
Cram N, Shipman N, Quarles JM. Уменьшение количества переносимых по воздуху микробов в хирургической операционной и других клинических условиях: исследование с использованием системы AiroCide. J Clin Engineering. 2004: 79–88.
Методы стерилизации | Encyclopedia.com
Определение
Методы стерилизации включают в себя все средства, используемые для полного уничтожения или уничтожения живых микроорганизмов на любом объекте, включая инструменты, используемые для тестирования или лечения пациентов.
Цель
Термин «микроорганизм или микроб» относится к любому одноклеточному живому организму, включая бактерий , вирусов и грибов . (Хотя вирусы не являются настоящими одноклеточными организмами, медицинская наука по-прежнему классифицирует их как микроорганизмы.) Микробы могут передаваться при прямом контакте или косвенно через транспортное средство (например, хирургический инструмент) или через воздух, которым дышит пациент. Если у нового хозяина существуют благоприятные условия для роста, микробы размножаются и создают колонии.Многие из этих микроскопических организмов — нормальные обитатели человеческого тела (называемые микрофлорой). Например, разновидности бактерии Staphylococcus являются нормальными обитателями кожи и носовых ходов, а многие различные виды бактерий живут в тонком и толстом кишечнике , помогая в процессе пищеварения.
Однако многие типы микроорганизмов являются патогенными (считаются чужеродными для организма-хозяина) и при попадании в организм вызывают инфекцию , когда они либо напрямую повреждают клетки, либо выделяют токсины, которые в конечном итоге вызывают повреждение.Профилактика болезнетворных микробов в условиях ухода за пациентом обычно осуществляется с помощью асептических или стерильных методов. Цель состоит в том, чтобы создать как можно более свободную от микробов среду, в первую очередь за счет стерилизации и поддержания стерильных / нестерильных барьеров.
Меры предосторожности
Как и продукты питания, продаваемые в продуктовом магазине, стерильные медицинские и хирургические растворы и некоторое другое оборудование имеют срок годности, указывающий, что продукт больше не считается стерильным.Хотя многие больницы считают стерильные предварительно расфасованные одноразовые материалы стерильными на неопределенный срок, если упаковка не повреждена, стерильные товары необходимо тщательно проверять, чтобы убедиться, что целостность упаковки не нарушена или упаковка не промокла. Микробы могут проникать в стерильные товары через разрывы упаковки (стерильный барьер) или через влагу. Если обертка уже повреждена или была влажной, стерильные товары необходимо переупаковать и повторно стерилизовать.
Описание
Пациенты, перенесшие инвазивные медицинские или хирургические процедуры, подвергаются риску заражения в основном из четырех источников:
- Инфекция передается от других людей, включая пациентов и поставщиков медицинских услуг. Такая инфекция называется прямой передачей, которая обычно происходит в результате прямого контакта с кожей или биологическими жидкостями, включая слюну, кашель и плевание.
- Заражение возникает в результате контакта оборудования или других предметов с пациентом.Это называется инфекцией, переносимой транспортными средствами, потому что микроб переносится из другого места на каком-либо объекте или транспортном средстве и вводится через разрыв кожи или слизистых оболочек. Основными примерами являются пищевое отравление , вызванное зараженными продуктами питания, или инфекция, вызванная использованием нестерильного оборудования при инвазивной процедуре, такой как бронхоскопия или флеботомия.
- Инфекция возникает от собственного тела пациента, например, возможное загрязнение операционного поля во время резекции кишечника, если собственный фекальный материал пациента загрязняет содержимое брюшной полости.
- Воздух переносит микробы. Примером воздушно-капельной инфекции является tuberculosis , при которой бактерии передаются с воздушными потоками другим людям через кашель или плевание.
Обеспечение максимально свободной от микробов окружающей среды необходимо для хирургических процедур и даже незначительных медицинских процедур, обычно выполняемых в кабинете врача, таких как наложение швов на рану. Пациентов с состояниями или лечением, которые вызывают нарушение иммунной системы , иногда лечат в искусственно созданной среде, называемой обратной изоляцией.Пациенты с лейкемией, особенно те, кто проходит агрессивную химиотерапию , которым проводят трансплантацию костного мозга, и люди с иммунодефицитными расстройствами (которые могут приводить к незначительной естественной защите от инфекции или ее отсутствию), все являются потенциальными кандидатами на процедуры обратной изоляции. Пациентов с СПИДом (синдром приобретенного иммунодефицита) можно лечить в условиях изоляции, как прямой, так и обратной изоляции для их защиты, а также защиты лиц, осуществляющих уход.Ярким примером обратной изоляции является использование стерильной пластиковой палатки с фильтрованной циркуляцией воздуха, называемой изолятором. ( Недоношенные дети могут быть помещены в специальные стерильные пластиковые люльки, называемые изолетами.)
Техника асептики
Еще со времен Флоренс Найтингейл известно, что чистая среда определенно менее способствует росту микроорганизмов, чем нечистая ед. Создание стерильной среды всегда требует безупречной чистоты.Другой важной мерой является использование дезинфицирующих средств при мытье мебели, стен и полов, а также при замачивании медицинского оборудования или других предметов ухода за пациентами. Дезинфицирующие средства — это агрессивные химические соединения, описываемые как бактерицидные (способные убивать бактерии) или бактериостатические (способные останавливать рост или размножение бактерий). Некоторые из этих дезинфицирующих средств также могут быть противовирусными или противогрибковыми. Дезинфицирующие средства обычно слишком токсичны для тканей, чтобы их можно было использовать непосредственно на теле. Антисептики — это химические соединения, которые также обладают бактерицидным или бактериостатическим действием.Но обычно это более разбавленные растворы, и их можно безопасно использовать при прямом контакте с тканями человека. Обычные антисептики включают йод, перекись водорода и тимеросал.
Невозможно переоценить важность мытья рук до и после ухода за любым пациентом. Это остается самым простым и эффективным средством предотвращения заражения. По оценкам Центра по контролю за заболеваниями (CDC), в американских больницах ежегодно регистрируется два миллиона инфекций, переносимых больницами (известных как внебольничные инфекции), и примерно четверть из них — это инфекции послеоперационных хирургических разрезов.Послеоперационные инфекции возникают в результате перерывов в стерильной технике во время операции или в результате перерывов в асептической методике во время ухода за раной . Кроме того, исследования CDC показали, что среднее соблюдение правил мытья рук медицинскими работниками с 1981 по 1999 год никогда не превышало 50%. Правильная процедура заключается в том, что медицинский персонал должен мыть руки до и сразу после выполнения любой процедуры на пациенте, независимо от того, были ли надеты латексные перчатки или нет. Перчатки, как преграду, можно пробить через отверстия размером с точечные нити.
Как при хирургической операции, так и при обратной изоляции, персонал обычно должен носить предварительно стерилизованные перчатки, сетки для волос, маски и халаты с чистыми бахилами. Введение мочевого катетера, замена хирургического дренажа, очистка трахеотомической трубки или наложение стерильной повязки — все это случаи, когда медицинские работники носят перчатки. Они также создают так называемое стерильное поле или зону, обработанную антисептиками или покрытые непроницаемыми стерильными простынями, чтобы снизить вероятность переноса микроорганизмов.
Перед хирургическими вмешательствами область кожи операционного поля очищается антисептическим раствором, по периферии накладывается стерильная простыня. В случае хирургического вмешательства на кишечнике перед операцией назначают слабительных и клизм , чтобы удалить как можно больше фекалий, тем самым ограничивая количество загрязнения фекалиями. Когда кишечник закрывается, все инструменты, салфетки и губки, которые могли соприкасаться с пациентом, удаляются и заменяются стерильным оборудованием, прежде чем продолжить.Как в хирургических кабинетах, так и в палатах пациентов с обратной изоляцией воздух пропускается через специальную систему вентиляции, которая отфильтровывает микроорганизмы.
Пять средств обычно используются для стерилизации предметов в окружающей среде пациента. К ним относятся:
- Влажное тепло используется путем обработки паром или автоклавирования (обработка паром под высоким давлением). Подобно скороварке, используемой для приготовления еды в домашних условиях и уничтожения бактерий, автоклав обеспечивает циркуляцию пара при температуре 260 ° F (120 ° C) при постоянном давлении 20 фунтов на квадратный дюйм в течение определенных периодов времени.Все оборудование, используемое при проведении медицинских или хирургических процедур, такое как инструменты, трубки (включая катетеры), повязки и постельное белье, используемое для простыней, стерилизуется, как правило, в автоклаве.
- Иногда используется ионизирующее и неионизирующее излучение. Ультрафиолетовый свет — это тип неионизирующего излучения, используемый для предметов, чувствительных к теплу.
- Прохождение жидкости через фильтр, достаточно тонкий, чтобы задерживать микробы.
- Газовая стерилизация, обычно с использованием оксида этилена, препятствует метаболизму и, следовательно, развитию микроорганизмов и подавляет рост спор.Он эффективен при стерилизации термочувствительных предметов и проникает глубоко, но его следует использовать с осторожностью, поскольку он ядовит.
- Сильные дезинфицирующие средства используются в основном для инструментов, таких как термометры и зонды, которые не выдержали автоклавирования. Медицинское оборудование, пропитанное дезинфицирующими средствами для уничтожения микробов, следует промыть перед использованием из-за токсичности многих соединений, используемых для дезинфекции. Некоторые газы, такие как оксид этилена, используемые для стерилизации, чрезвычайно токсичны для человека и должны использоваться с осторожностью.
Подготовка
Как правило, подготовка включает стандартные методы стерилизации пациента, медицинского персонала и окружающей среды. Хирургическим пациентам, которым требуется процедура обратной изоляции, следует рассказать о действиях микроорганизмов, в том числе о том, как они попадают в организм человека, о заболеваниях, которые могут быть вызваны, и о том, как работают методы стерилизации для предотвращения инфекции. Волосы больше не удаляются в обычном порядке с места хирургического разреза перед операцией, поскольку кожа является естественным барьером для инфекции, и при бритье часто возникают небольшие трещины на коже.
Последующий уход
Последующий уход после использования стерилизованного или хирургически чистого оборудования будет включать наблюдение за пациентами на предмет признаков и симптомов инфекции, которые обычно проявляются в течение 48-71 часов. Признаки и симптомы инфекции включают:
- лихорадку
- воспаление или покраснение и припухлость в месте инфекции, часто сопровождающиеся отеком и эритемой
- гнойные или гнойные выделения из ран
- аномально повышенный белый кровь количество
- боль в месте инфекции
Осложнения
Не должно быть никаких осложнений при использовании надлежащих методов стерилизации и асептики.Аллергия на любой из различных антисептиков, используемых для стерилизации кожи перед операцией, может вызвать дерматит или раздражение. Если дезинфицирующее средство, используемое для очистки инструментов, не будет должным образом промыто перед использованием, на поверхностях, на которые попадет раствор, может возникнуть воспалительная реакция, аналогичная ожогу первой степени.
Результаты
Правильные методы стерилизации позволяют предотвратить инфицирование. Методы стерилизации необходимо контролировать и постоянно улучшать.
Роли медицинских бригад
Весь медицинский персонал несет ответственность за основное средство предотвращения инфекции — мытье рук.В первые дни ухода за больными стерилизация оборудования и чистота окружающей среды пациента были основной обязанностью медсестры. Медсестра по-прежнему несет ответственность или подотчетность в этих областях, даже если они могут выполняться другими.
- Специалисты по стерилизации работают либо в операционной в больнице, либо в центральном хозяйстве больницы. Они проходят специальную подготовку и обучение методам стерилизации в медицинском учреждении, в котором они работают.Они несут ответственность за выполнение процедур стерилизации, а также за мониторинг состояния стерильного оборудования и сроков годности. Иногда медсестры или техники операционной несут ответственность за предоставление стерильного оборудования.
- Некоторые дипломированные медсестры (RN) сертифицированы в инфекционном контроле и обязаны хранить статистические данные о заболеваемости и типах инфекций в медицинском учреждении. Эти RN обычно входят в состав комитетов по инфекционному контролю вместе с врачами и клиническими фармацевтами.
- Ученые клинической лаборатории имеют профильную подготовку и должны сдать государственный экзамен. Они берут образцы крови и образцы дренажа из раны, которые назначаются врачом для наблюдения за пациентами на предмет инфекции и для рутинной оценки источников внебольничной инфекции в учреждении.
КЛЮЧЕВЫЕ ТЕРМИНЫ
Бактерии — группа одноклеточных организмов, которые можно увидеть только под микроскопом и которые иногда вызывают болезни у других живых существ.
Грибы — Паразитарные одноклеточные формы жизни, от дрожжей и плесени до грибов. Несколько мелких или микроскопических форм вызывают болезни у других живых существ.
Ионизирующее излучение —излучение, которое заставляет атомы или группы атомов переносить положительный или отрицательный электрический заряд. Жизненно важные процессы жизни зависят от ионов, перемещающихся через клеточные мембраны.
Неионизирующий —излучение, которое не заставляет атомы или группы атомов нести положительный или отрицательный электрический заряд.Жизненно важные процессы жизни зависят от ионов, перемещающихся через клеточные мембраны.
Вирус — субмикроскопический инфекционный агент, рассматриваемый как чрезвычайно простой микроорганизм или чрезвычайно сложная молекула, способная расти и размножаться только в живых клетках.
Ресурсы
КНИГИ
Берков, Роберт и др., Ред. Руководство компании Merck по диагностике и терапии, домашнее издание. New York: Pocket Books, 1999.
Kozier, Barbara, et al. Основы сестринского дела: концепции, процесс и практика. Нью-Джерси: Prentice Hall, Inc., 2000.
Тимби, Барбара К. Фундаментальные навыки и концепции ухода за пациентами, 7-е изд. Филадельфия, Пенсильвания: J.P. Lippincott Co., 2001.
PERIODICALS
Nichols, Ronald Lee. «Предотвращение инфекций хирургического места: взгляд хирурга». CDC 7, № 2 (март-апрель 2001 г.).
Питте, Дидье. «Улучшение соблюдения правил гигиены рук: междисциплинарный подход». CDC 7, № 2 (март-апрель 2001 г.).
ДРУГОЕ
Очистка и дезинфекция. Госпиталь Джона Хопкинса, HEIC,
«Рекомендации по мерам предосторожности при изоляции в больницах». CDC
Срок годности стерильных упаковок. Госпиталь Джона Хопкинса, HEIC,



 Они требуют обязательной стерилизации.
Они требуют обязательной стерилизации. Принцип работы химического стерилизатора прост: необходимо сложить инструменты в специальный контейнер и опустить его в емкость, заполненную дезинфицирующим раствором. Время пребывания в растворе зависит от его концентрации и типа стоматологического инструмента.
Принцип работы химического стерилизатора прост: необходимо сложить инструменты в специальный контейнер и опустить его в емкость, заполненную дезинфицирующим раствором. Время пребывания в растворе зависит от его концентрации и типа стоматологического инструмента. Всю работу оборудование делает за вас в автоматическом режиме. Обработанный инструмент просушивают в сушильном аппарате и упаковывают.
Всю работу оборудование делает за вас в автоматическом режиме. Обработанный инструмент просушивают в сушильном аппарате и упаковывают.
 Сразу после использования их необходимо продезинфицировать и отправить на утилизацию.
Сразу после использования их необходимо продезинфицировать и отправить на утилизацию. Процедура воздушной стерилизации проходит при температуре 180°С и длится от 30 минут до 2 часов. Прошедшие предстерилизационную обработку предметы выкладывают на поддон без упаковки и помещают в корпус сухожарового шкафа.
Процедура воздушной стерилизации проходит при температуре 180°С и длится от 30 минут до 2 часов. Прошедшие предстерилизационную обработку предметы выкладывают на поддон без упаковки и помещают в корпус сухожарового шкафа.
 Оценка результата
Оценка результата Импульсный термосварочный аппарат
Импульсный термосварочный аппарат Физические методы
Физические методы