Обеспечение внутрикостного доступа на до больничном этапе
25/10/2018
Внутрикостная инфузия — современное решение проблемы сосудистого доступа в критических ситуациях
В медицинской практике догоспитального этапа встречаются клинические ситуации, при которых пациент нуждается в сосудистом доступе. От его наличия зависит качество оказываемой медицинской помощи, а зачастую и жизнь человека. Существенные факторы венозного доступа — скорость его обеспечения и скорость введения лекарственных препаратов.
По статистике на установку внутривенного доступа для взрослых пациентов у 5-10% и для детей у 25% уходит более десяти минут. Около 6% случаев таковы, что сосудистый доступ недостижим. Такие ситуации связаны с невозможностью венозного доступа, либо в том случае, когда обеспечить его крайне сложно (например, при движении машины скорой помощи).
Альтернативным вариантом является внутрикостный доступ. Это эффективный, надежный, сравнительно простой способ очень быстрого венозного доступа для введения лекарственных препаратов и жидкостей.
Во многих европейских странах и США протокол оказания экстренной медицинской помощи предусматривает внутрикостную инфузию как второй способ сосудистого доступа, если внутривенный вариант не достигнут с третьей или четвертой попытки или его не удалось осуществить за 90 секунд.
Внутрикостная инфузия позволяет достичь результата в течение первой минуты с первой попытки в 92-96% случаев.
Внутрикостная инфузия часто используется в педиатрии, поскольку внутривенный доступ у новорожденных и маленьких детей даже в комфортных условиях затруднен.
Внутрикостный доступ у взрослых востребован при:
- анафилактическом шоке;
- клинической смерти;
- судорожном состоянии;
- исполнении сердечно-легочной реанимации;
- обширных ожогах;
- выполнении неотложных анестезий;
- транспортировке больных в необорудованных условиях и пр.
История использования внутрикостного доступа
Еще
MEDISON. RU — Допплеросонография периферических сосудов, часть I
RU — Допплеросонография периферических сосудов, часть I
Введение
В современной функциональной диагностике для исследования сосудов все шире применяются ультразвуковые методики. Это связано с ее относительно низкой стоимостью, простотой, неинвазивностью и безопасностью исследования для больного при достаточно высокой информативности по сравнению с традиционными рентген-ангиографическими методиками. Последние модели ультразвуковых сканеров фирмы MEDISON позволяют провести высококачественное обследование сосудов, с успехом диагностировать уровень и протяженность окклюзирующих поражений, выявлять аневризмы, деформации, гипо- и аплазии, шунты, клапанную недостаточность вен и другую патологию сосудов.
Для проведения сосудистых исследований необходим УЗ-сканер, работающий в дуплексном и триплексном режимах, набор датчиков (таблица 1) и пакет программ для сосудистых исследований.
Таблица 1. Датчики, используемые для исследования периферических сосудов.
Датчики, используемые для исследования периферических сосудов.
| Исследуемая область | Тип датчика | Рабочая частота, МГц | Примечание |
|---|---|---|---|
| Сосуды шеи | Линейный (38 мм) | 5,0-7,5 — 10,0 | Наклон луча Коррекция угла |
| Дуга аорты, подключичные сосуды | Секторный (либо небольшой конвексный) | 3,5 | Коррекция угла |
| Плечевые, бедренные сосуды | Линейный | 4,0-5,0 — 7,50 | Наклон луча Коррекция угла |
| Сосуды предплечья | Линейный | 5,0-7,5 — 10,0 | Наклон луча Коррекция угла |
Исследования, приведенные в данном материале, проведены на ультразвуковом сканере SA-8800 «Digital GAIA» (фирма «Medison» Ю. Корея) во время скрининга среди пациентов, направленных на УЗ-обследование других органов.
Корея) во время скрининга среди пациентов, направленных на УЗ-обследование других органов.
Технология УЗИ сосудов
Датчик устанавливают в типичной области прохождения исследуемого сосуда (рис. 1).
Рис. 1. Стандартные доступы при допплеросонографии периферических сосудов. Уровни наложения компрессионных манжет при измерении регионального САД.
1 — дуга аорты;
2, 3 — сосуды шеи: ОСА, ВСА, НСА, ПА, ЯВ;
4 — подключичная артерия;
5 — сосуды плеча: плечевая артерия и вена;
6 — сосуды предплечья;
7 — сосуды бедра: ОБА, ПБА, ГБА, соответствующие вены;
8 — подколенные артерия и вена;
9 — задняя б/берцовая артерия;
10 — тыльная артерия стопы.
МЖ1 — верхняя треть бедра, МЖ2 — нижняя треть бедра, МЖЗ — верхняя треть голени, МЖ4 — нижняя треть голени.
Для уточнения топографии сосудов проводят сканирование в плоскости, перпендикулярной анатомическому ходу сосуда. При поперечном сканировании определяют взаиморасположение сосудов, их диаметр, толщину и плотность стенок, состояние периваскулярных тканей. Воспользовавшись функцией <Area> и обведя внутренний контур сосуда, получают площадь его эффективного поперечного сечения. Далее производят поперечное сканирование вдоль исследуемого сегмента сосуда для поиска участков стенозирования. При выявлении стенозов используют программу <2D % Stenosis> для получения расчетного показателя стеноза. Затем проводят продольное сканирование сосуда, оценивая его ход, диаметр, внутренний контур и плотность стенок, их эластичность, активность пульсации (с использованием М-режима), состояние просвета сосуда. Измеряют толщину комплекса интима-медиа (по дальней стенке). Проводят допплеровское исследование в нескольких участках, перемещая датчик вдоль плоскости сканирования и осматривая возможно больший участок сосуда.
Измеряют толщину комплекса интима-медиа (по дальней стенке). Проводят допплеровское исследование в нескольких участках, перемещая датчик вдоль плоскости сканирования и осматривая возможно больший участок сосуда.
Оптимальной является следующая схема допплеровского исследования сосудов:
- цветное допплеровское картирование на основании анализа направления (ЦДК) или энергии потока (ЦДКЭ) для поиска участков с аномальным кровотоком;
- допплеросонография сосуда в импульсном режиме (D), позволяющая оценивать скорость и направление потока в исследуемом объеме крови;
- допплеросонография сосуда в постоянно волновом режиме для исследования высокоскоростных потоков.
Если УЗ-исследование проводится линейным датчиком, а ось сосуда проходит почти перпендикулярно поверхности, используют функцию наклона допплеровского луча, позволяющую наклонить допплеровский фронт на 15-30 градусов относительно поверхности.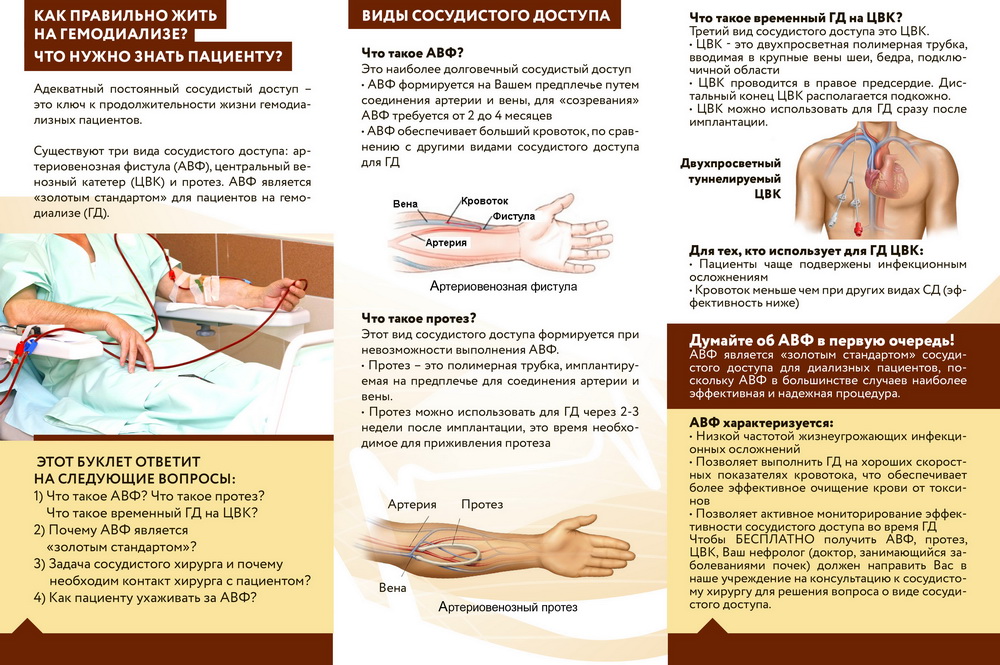 Затем, используя функцию <Angle>, совмещают указатель угла с истинным ходом сосуда, получают устойчивый спектр, устанавливают масштаб изображения (<vel +>, <vel ->) и положение нулевой линии (<Base line +>, <Base line ->). Принято при исследовании артерий основной спектр располагать выше базовой линии, а при исследовании вен — ниже. Ряд авторов рекомендует для всех сосудов, включая вены, располагать вверху антеградный спектр, внизу — ретроградный. Функция <Invers> меняет местами положительную и отрицательную полуоси на оси ординат (скоростей) и таким образом изменяет направление спектра на экране в противоположную сторону. Выбранная скорость временной развертки должна быть достаточной для наблюдения 2-3 комплексов на экране.
Затем, используя функцию <Angle>, совмещают указатель угла с истинным ходом сосуда, получают устойчивый спектр, устанавливают масштаб изображения (<vel +>, <vel ->) и положение нулевой линии (<Base line +>, <Base line ->). Принято при исследовании артерий основной спектр располагать выше базовой линии, а при исследовании вен — ниже. Ряд авторов рекомендует для всех сосудов, включая вены, располагать вверху антеградный спектр, внизу — ретроградный. Функция <Invers> меняет местами положительную и отрицательную полуоси на оси ординат (скоростей) и таким образом изменяет направление спектра на экране в противоположную сторону. Выбранная скорость временной развертки должна быть достаточной для наблюдения 2-3 комплексов на экране.
Расчет скоростных характеристик потоков в режиме импульсной допплерографии возможен при скорости потока не более 1-1,5 м/сек (Nyquist limit). Для получения более точного представления о распределении скоростей необходимо установить контрольный объем не менее 2/3 просвета исследуемого сосуда.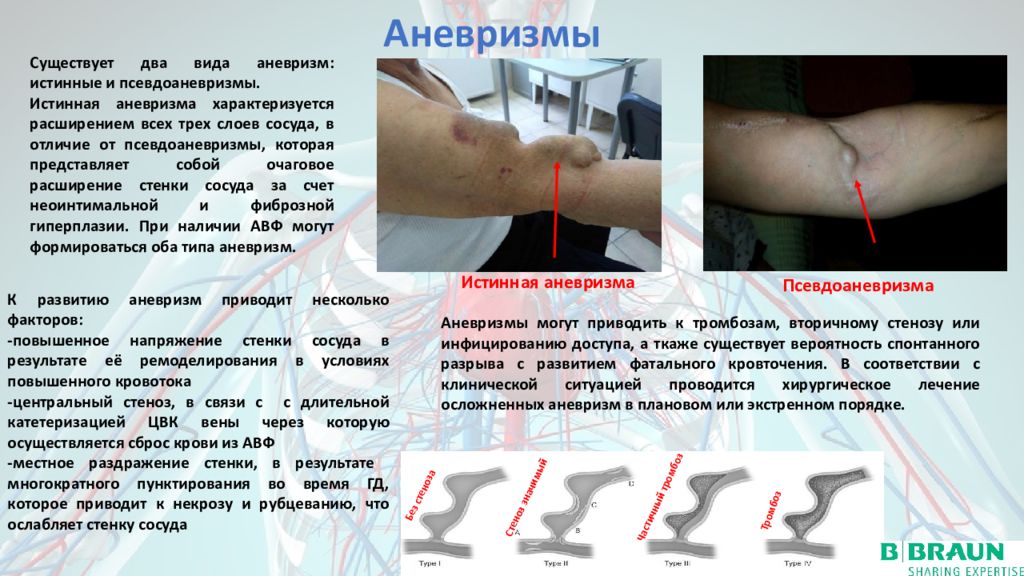 Используются программы <Vascular> при исследовании сосудов конечностей и <Carotid> при исследовании сосудов шеи. Работая в программе, отмечают название соответствующего сосуда, фиксируют значения максимальной систолической и минимальной диастолической скоростей, после чего производят обводку одного комплекса. После проведения всех этих измерений можно получить отчет, включающий значения V max, V min, V mean, PI, RI для всех обследованных сосудов.
Используются программы <Vascular> при исследовании сосудов конечностей и <Carotid> при исследовании сосудов шеи. Работая в программе, отмечают название соответствующего сосуда, фиксируют значения максимальной систолической и минимальной диастолической скоростей, после чего производят обводку одного комплекса. После проведения всех этих измерений можно получить отчет, включающий значения V max, V min, V mean, PI, RI для всех обследованных сосудов.
Количественные допплеросонографические параметры артериального кровотока
2 D% stenosis — %STA = (Stenosis Area/ Blood Vessel Area ) * 100%. Характеризует реальное уменьшение площади гемодинамически эффективного сечения сосуда в результате стенозирования, выраженное в процентах.
V max — максимальная систолическая (или пиковая) скорость — реальная максимальная линейная скорость кровотока вдоль оси сосуда, выраженная в мм/с, см/с или м/с.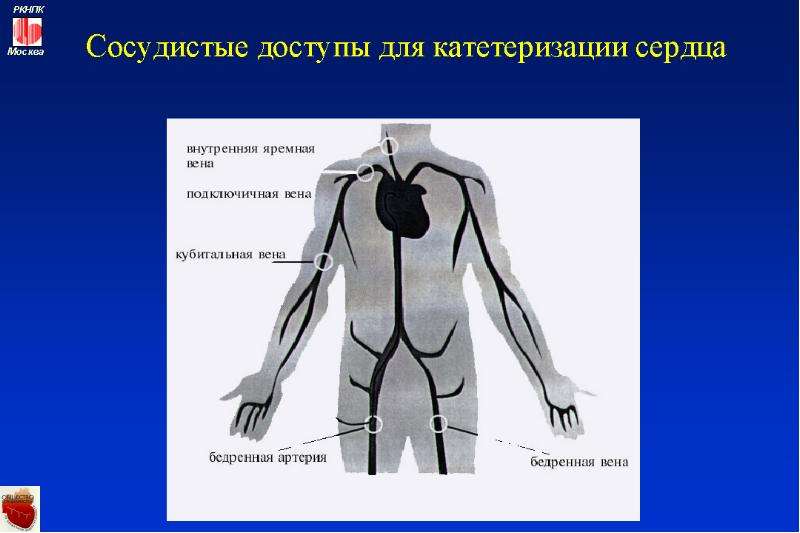
V min — минимальная диастолическая линейная скорость кровотока вдоль сосуда.
V mean — скоростной интеграл под кривой, огибающей спектр кровотока в сосуде.
RI (Resistivity Index, индекс Пурсело) — индекс сосудистого сопротивления. RI = (V systolic — V diastolic)/V systolic. Отражает состояние сопротивления кровотоку дистальнее места измерения.
PI (Pulsatility Index, индекс Гослинга) — индекс пульсации, косвенно отражает состояние сопротивления кровотоку PI = (V systolic — V diastolic)/V mean. Является более чувствительным показателем, чем RI, так как в расчетах используется V mean, которая раньше реагирует на изменение просвета и тонуса сосуда, чем V systolic.
PI, RI важно использовать вместе, т.к. они отражают разные свойства кровотока в артерии. Использование лишь одного из них без учета другого может быть причиной диагностических ошибок.
Качественная оценка допплеровского спектра
Выделяют ламинарный, турбулентный и смешанный типы потока.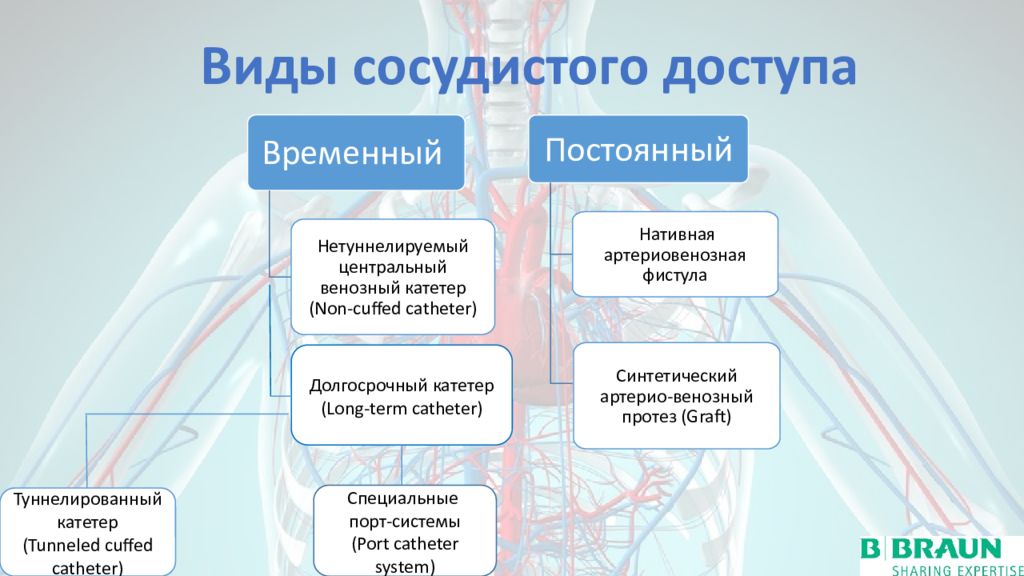
Ламинарный тип — нормальный вариант кровотока в сосудах. Признаком ламинарного кровотока является наличие «спектрального окна» на допплерограмме при оптимальном угле между направлением УЗ-луча и осью потока (рис. 2а). Если этот угол достаточно велик, то «спектральное окно» может «закрыться» даже при ламинарном типе кровотока.
Турбулентный тип кровотока характерен для мест стеноза или неполных окклюзий сосуда и характеризуется отсутствием «спектрального окна» на допплерограмме. При ЦДК выявляется мозаичность окрашивания, в связи с движением частиц в разных направлениях.
Смешанный тип кровотока может в норме определяться в местах физиологических сужений сосуда, бифуркациях артерий. Характеризуется наличием небольших зон турбулентности при ламинарном потоке. При ЦДК выявляется точечная мозаичность потока в области бифуркации или сужения.
В периферических артериях конечностей выделяют также следующие типы кровотока на основании анализа огибающей кривой допплеровского спектра.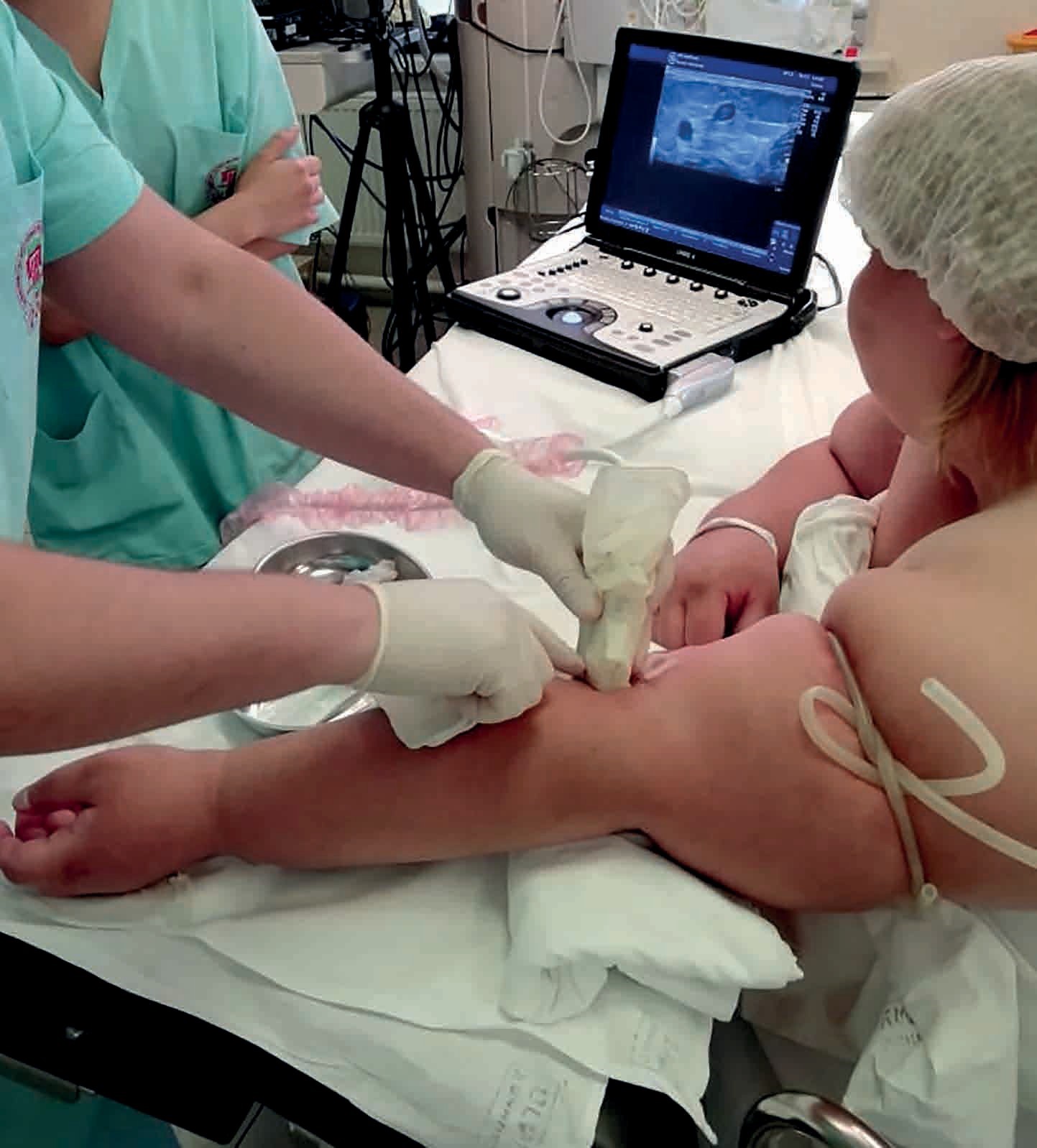
Магистральный тип — нормальный вариант кровотока в магистральных артериях конечностей. Он характеризуется наличием на допплерограмме трехфазной кривой, состоящей из двух антеградных и одного ретроградного пика. Первый пик кривой — систолический антеградный, высокоамплитудный, остроконечный. Второй пик — небольшой ретроградный (ток крови в диастолу до закрытия аортального клапана). Третий пик — небольшой антеградный (отражение крови от створок аортального клапана). Надо отметить, что магистральный тип кровотока может сохраняться и при гемодинамически незначимых стенозах магистральных артерий (рис. 2а, 4).
Магистральный измененный тип кровотока — регистрируется ниже места стеноза или неполной окклюзии. Первый систолический пик изменен, достаточной амплитуды, расширен, более пологий. Ретроградный пик может быть очень слабо выражен. Второй антеградный пик отсутствует (рис. 2б).
Коллатеральный тип кровотока также регистрируется ниже места окклюзии. Он проявляется близкой к монофазной кривой со значительным изменением систолического и отсутствием ретроградного и второго антеградного пиков (рис. 2в).
Он проявляется близкой к монофазной кривой со значительным изменением систолического и отсутствием ретроградного и второго антеградного пиков (рис. 2в).
Рис. 2. Типы кровотока: а — магистральный, б — магистральный измененный, в — коллатеральный.
Отличие допплерограмм сосудов головы и шеи от допплерограмм. конечностей заключается в том, что диастолическая фаза на допплерограммах артерий брахицефальной системы никогда не бывает ниже 0 (т.е. не опускается ниже Base line). Это связано с особенностями кровоснабжения головного мозга. При этом на допплерограммах сосудов системы внутренней сонной артерии диастолическая фаза выше, а системы наружной сонной артерии — ниже (рис. 3).
3).
Рис. 3. Отличие огибающих допплерограмм НСА (а) и ВСА (б).
Рис. 4. Варианты магистрального типа кровотока в артерии. Продольное сканирование. ЦДК. Допплерография в импульсном режиме.
ЦДК. Допплерография в импульсном режиме.
Исследование сосудов шеи
Датчик устанавливают поочередно на каждой стороне шеи в области грудино-ключично-сосцевидной мышцы в проекции общей сонной артерии. При этом визуализируются общие сонные артерии, их бифуркации, внутренние яремные вены. Оценивают контур артерий, их внутренний просвет, измеряют и сравнивают диаметр с обеих сторон на одном уровне. Чтобы отличить внутреннюю сонную артерию (ВСА) от наружной (НСА), используют следующие признаки:
- внутренняя сонная артерия имеет больший диаметр, чем наружная;
- начальный отдел ВСА лежит латеральнее НСА;
- НСА на шее дает ветви, может иметь «рассыпной» тип строения, у ВСА на шее ветвей нет;
- на доппплерограмме НСА определяются острый систолический пик и низко расположенная диастолическая составляющая (рис.
 3а), на допплерограмме, полученной с ВСА, определяются широкий систолический пик и высокая диастолическая составляющая (рис. 3б). Для контроля проводится проба D.Russel. После получения допплеровского спектра с лоцируемой артерии проводится кратковременная компрессия поверхностной височной артерии (непосредственно перед козелком уха) на стороне исследования. При локации НСА на допплерограмме появятся дополнительные пики, при локации ВСА форма кривой не изменится.
3а), на допплерограмме, полученной с ВСА, определяются широкий систолический пик и высокая диастолическая составляющая (рис. 3б). Для контроля проводится проба D.Russel. После получения допплеровского спектра с лоцируемой артерии проводится кратковременная компрессия поверхностной височной артерии (непосредственно перед козелком уха) на стороне исследования. При локации НСА на допплерограмме появятся дополнительные пики, при локации ВСА форма кривой не изменится.
При исследовании позвоночных артерий датчик ставят под углом 90° к горизонтальной оси, либо непосредственно над поперечными отростками в горизонтальной плоскости.
По программе Carotid рассчитывают Vmax (Vpeak), Vmin (Ved), Vmean (TAV), PI, RI. Сравнивают показатели, полученные с противоположных сторон.
Исследование сосудов верхних конечностей
Положение пациента — на спине. Голова несколько откидывается назад, под лопатки подкладывается небольшой валик. Исследование дуги аорты и начальных отделов подключичных артерий проводится при супрастернальном положении датчика (см. рис. 1). Визуализируют дугу аорты, начальные отделы левой подключичной артерии. Из надключичного доступа осматривают подключичные артерии. Сравнивают показатели, полученные слева и справа для выявления асимметрии. При выявлении окклюзий или стенозов подключичной артерии до отхождения позвоночных (1 сегмент) проводят пробу с реактивной гиперемией для выявления синдрома «обкрадывания». Для этого проводят компрессию плечевой артерии пневматической манжеткой в течение 3 минут. В конце компрессии измеряют скорость кровотока в позвоночной артерии и резко спускают воздух из манжетки. Усиление кровотока по позвоночной артерии свидетельствует о поражении в подключичной артерии и ретроградном кровотоке в позвоночной артерии. Если усиления кровотока не происходит, кровоток в позвоночной артерии антеградный и окклюзии подключичной артерии нет. Для исследования подкрыльцовой артерии руку на стороне исследования отводят к наружи и ротируют.
Исследование дуги аорты и начальных отделов подключичных артерий проводится при супрастернальном положении датчика (см. рис. 1). Визуализируют дугу аорты, начальные отделы левой подключичной артерии. Из надключичного доступа осматривают подключичные артерии. Сравнивают показатели, полученные слева и справа для выявления асимметрии. При выявлении окклюзий или стенозов подключичной артерии до отхождения позвоночных (1 сегмент) проводят пробу с реактивной гиперемией для выявления синдрома «обкрадывания». Для этого проводят компрессию плечевой артерии пневматической манжеткой в течение 3 минут. В конце компрессии измеряют скорость кровотока в позвоночной артерии и резко спускают воздух из манжетки. Усиление кровотока по позвоночной артерии свидетельствует о поражении в подключичной артерии и ретроградном кровотоке в позвоночной артерии. Если усиления кровотока не происходит, кровоток в позвоночной артерии антеградный и окклюзии подключичной артерии нет. Для исследования подкрыльцовой артерии руку на стороне исследования отводят к наружи и ротируют. Сканирующая поверхность датчика устанавливается в одкрыльцовую ямку и наклоняется вниз. Сравнивают показатели с обеих сторон. Исследование плечевой артерии проводится при расположении датчика в медиальной борозде плеча (см. рис. 1). Измеряют систолическое АД. Накладывают манжету тонометра на плечо, получают допплеровский спектр с плечевой артерии ниже манжеты. Измеряют АД. Критерий систолического АД — появление допплеровского спектра при допплерографии. Сравнивают показатели, полученные с противоположных сторон.
Сканирующая поверхность датчика устанавливается в одкрыльцовую ямку и наклоняется вниз. Сравнивают показатели с обеих сторон. Исследование плечевой артерии проводится при расположении датчика в медиальной борозде плеча (см. рис. 1). Измеряют систолическое АД. Накладывают манжету тонометра на плечо, получают допплеровский спектр с плечевой артерии ниже манжеты. Измеряют АД. Критерий систолического АД — появление допплеровского спектра при допплерографии. Сравнивают показатели, полученные с противоположных сторон.
Вычисляют показатель несимметричности: ПН = АД сист. dext. — АД сист. sin. [мм. рт. ст.]. В норме -20 < ПН < 20.
Для исследования локтевой и лучевой артерий датчик устанавливают в проекции соответствующей артерии, дальнейшее обследование ведут по вышеописанной схеме.
Исследование вен верхних конечностей проводится обычно одновременно с исследованием одноименных артерий из тех же доступов.
Исследование сосудов нижних конечностей
При описании изменений в бедренных сосудах пользуются следующей терминологией, несколько отличающейся от стандартной анатомической классификации сосудов:
| Анатомическая топография сосуда | Название сосуда |
|---|---|
| Бедренная артерия до ответвления глубокой артерии бедра | Общая бедренная артерия |
| Бедренная артерия после ответвления глубокой артерии бедра | Поверхностная бедренная артерия |
| Бедренная вена от подколенной до впадения глубокой вены бедра | Поверхностная бедренная вена |
Исследование бедренных артерий. Исходное положение датчика — под паховой связкой (поперечное сканирование) (см. рис. 1). После оценки диаметра и просвета сосуда проводят сканирование вдоль общей бедренной, поверхностной бедренной и глубокой бедренной артерий. Записывают допплеровский спектр, сравнивают полученные показатели с обеих сторон.
Исходное положение датчика — под паховой связкой (поперечное сканирование) (см. рис. 1). После оценки диаметра и просвета сосуда проводят сканирование вдоль общей бедренной, поверхностной бедренной и глубокой бедренной артерий. Записывают допплеровский спектр, сравнивают полученные показатели с обеих сторон.
Исследование подколенных артерий. Положение пациента — лежа на животе. Датчик устанавливают в подколенную ямку поперек оси нижней конечности. Проводят поперечное, затем продольное сканирование.
Для уточнения характера кровотока в измененном сосуде измеряют региональное давление. Для этого накладывают манжету тонометра сначала на верхнюю треть бедра и измеряют систолическое АД, затем на нижнюю треть бедра. Критерием систолического АД является появление кровотока при допплерографии подколенной артерии. Вычисляют индекс регионального давления на уровне верхней и нижней трети бедра: РИД = АД сист (бедра) / АД сист (плеча), который в норме должен быть больше 1.
Исследование артерий голени. В положении больного на животе проводится продольное сканирование от места деления подколенной артерии вдоль каждой из ветвей поочередно на обеих голенях. Затем в положении больного на спине сканируют заднюю большеберцовую артерию в области медиальной лодыжки и тыльную артерию стопы в области тыла стопы. Качественная локация артерий в этих точках возможна не всегда. Дополнительным критерием оценки кровотока является региональный индекс давления (РИД). Для вычисления РИД последовательно накладывают манжету вначале на верхнюю треть голени, измеряют систолическое давление, затем манжету накладывают на нижнюю треть голени и повторяют измерения. Во время компрессии проводят сканирование a. tibialis posterior или a. dorsalis pedis. РИД = АД сист (голени) / АД сист (плеча), в норме >= 1. РИД, полученный на уровне 4 манжеты, называют лодыжечным индексом давления (ЛИД).
Исследование вен нижних конечностей. Проводится одновременно с исследованием одноименных артерий либо как самостоятельное исследование.
Исследование бедренной вены проводится в положении больного на спине с несколько разведенными и ротированными кнаружи ногами. Датчик устанавливается в области паховой складки параллельно ей. Получают поперечный срез бедренного пучка, находят бедренную вену, которая располагается медиальнее одноименной артерии. Оценивают контур стенок вены, просвет ее, записывают допплерограмму. Развернув датчик, получают продольный срез вены. Проводят сканирование вдоль вены, оценивают контур стенок, просвет сосуда, наличие клапанов. Записывают допплерограмму. Оценивают форму кривой, ее синхронизацию с дыханием. Проводят дыхательную пробу: глубокий вдох, на задержке дыхания с натуживанием в течение 5 секунд. Определяют функцию клапанного аппарата: наличие расширения вены во время выполнения пробы ниже уровня клапана и ретроградной волны. При выявлении ретроградной волны измеряют ее продолжительность и максимальную скорость. Проводят исследование глубокой вены бедра по аналогичной методике, установив при допплерографии контрольный объем за клапан вены.
Исследование подколенных вен проводится в положении больного на животе. Для усиления самостоятельного кровотока по вене и облегчения получения допплерограммы пациенту предлагают опереться выпрямленными большими пальцами стоп в кушетку. Датчик устанавливают в области подколенной ямки. Проводят поперечное сканирование для определения топографических взаимоотношений сосудов. Записывают допплерограмму и оценивают форму кривой. Если кровоток в вене слабый, проводят компрессию голени, при этом выявляется усиление кровотока по вене. При продольном сканировании сосуда обращают внимание на контур стенок, просвет сосуда, наличие клапанов (обычно можно выявить 1-2 клапана) (рис. 5).
Рис. 5. Исследование кровотока в вене с использованием ЦДК и допплерографии в импульсном режиме.
Проводят пробу с проксимальной компрессией для выявления ретроградной волны. После получения устойчивого спектра сдавливают нижнюю треть бедра на 5 секунд для выявления ретроградного тока. Исследование подкожных вен проводится высокочастотным (7,5-10,0 МГц) датчиком по вышеописанной схеме, предварительно установив датчик в проекции этих вен. Важно проводить сканирование через «гелевую подушку», удерживая датчик над кожей, так как даже небольшого давления на эти вены достаточно для того, чтобы редуцировать в них кровоток.
После получения устойчивого спектра сдавливают нижнюю треть бедра на 5 секунд для выявления ретроградного тока. Исследование подкожных вен проводится высокочастотным (7,5-10,0 МГц) датчиком по вышеописанной схеме, предварительно установив датчик в проекции этих вен. Важно проводить сканирование через «гелевую подушку», удерживая датчик над кожей, так как даже небольшого давления на эти вены достаточно для того, чтобы редуцировать в них кровоток.
Продолжение в следующем номере: Часть II.
Литература
- Зубарев А.Р., Григорян Р.А. Ультразвуковое ангиосканирование. — М.: Медицина, 1991.
- Ларин С.И., Зубарев А.Р., Быков А.В. Сопоставление данных ультразвуковой допплерографии подкожных вен нижних конечностей и клинических проявлений варикозной болезни.
- Аелюк С.Э., Лелюк В.Г. Основные принципы дуплексного сканирования магистральных артерий // Ультразвуковая диагностика.
 — No3.-1995.
— No3.-1995. - Клиническое руководство по ультразвуковой диагностике / Под ред. В.В. Митькова. — М.: «Видар»,1997
- Клиническая ультразвуковая диагностика / Под ред. Н.М. Мухарлямова. — М.: Медицина, 1987.
- Ультразвуковая допплеровская диагностика сосудистых заболеваний / Под редакцией Ю.М. Никитина, А.И. Труханова. — М.: «Видар», 1998.
- НЦССХ им. А.Н.Бакулева. Клиническая допплерография окклюзирующих поражений артерий мозга и конечностей. — М.: 1997.
- Савельев B.C., Затевахин И. И., Степанов Н.В. Острая непроходимость бифуркации аорты и магистральных артерий конечностей. — М.: Медицина, 1987.
- Санников А. Б., Назаренко П.М. Визуализация в клинике, декабрь 1996 г. Частота и гемодинамическая значимость ретроградного кровотока в глубоких венах нижних конечностей у больных варикозной болезнью.
- Ameriso S, et al.
 Pulseless Transcranial Doppler Finding in Takayasu’s Arteritis. J. of Clinical Ultrasound. Sept. 1990.
Pulseless Transcranial Doppler Finding in Takayasu’s Arteritis. J. of Clinical Ultrasound. Sept. 1990. - Bums, Peter N. The Physical principles of Doppler Spectral Analysis. Journal of Clinical Ultrasound, Nov/Dec 1987, Vol. 15, No. 9. ll.facob, Normaan М. et al. Duplex Carotid Sonography: Criteria for Stenosis, Accuracy, and Pitfalls. Radiology, 1985.
- Thomas S. Hatsukami, Jean Primozicb, R. Eugene Zierler & D.Eugene Strandness, ]r. Color doppler characteristics in normal lower extremity arteries. Ultrasound in Medicine & Biology. Vol 18, No. 2, 1992.
Заместительная почечная терапия в ОРИТ
Вопросы для самоконтроля
Какие из следующих утверждений, сравнивающих диализ с фильтрацией, верны:
- диализ зависит от диффузии, а фильтрация – от конвекции
- фильтрация более эффективна чем диализ для удаления небольших молекул
- фильтрация эффективнее диализа для удаления цитокинов
- диализ не так эффективен, как фильтрация для удаления воды
Что из следующих утверждений верно относительно разницы между непрерывной ренальной заместительной терапией (CRRT) и интермиттирующим гемодиализом (IHD):
- CRRT является более экономически эффективным, чем IHD
- IHD предпочтительнее CRRT у пациентов с нестабильной гемодинамикой
- IHD имеет лучшие показатели выживаемости по сравнению с CRRT
- CRRT предпочтительнее IHD у пациентов с сопутствующей острой черепно-мозговой травмой
Следующие заявления, касающиеся заместительной почечной терапии верны:
- плохой сосудистый доступ часто способствует тромбированию фильтра
- ЗПТ играет определенную роль при септическом шоке с нормальной функцией почек
- связанные с белками препараты сложно удалить при помощи CRRT/IHD
- госпитальная смертность пациентов с ОПП на ЗПТ составляет около 60%
Введение
Острая почечная недостаточность, также известная как острое повреждение почек (ОПП), является резким (в течение 48 часов) снижение функции почек. Снижение функции почек при ОПП определяется наличием любого из следующих факторов:
Снижение функции почек при ОПП определяется наличием любого из следующих факторов:
- Абсолютное увеличение креатинина сыворотки ≥ 0,3 мг/дл (≥ 26.4 мкмоль/л)
- Процентное увеличение сывороточного креатинина ≥ 50% (в 1,5 раза от исходного уровня)
- Уменьшение выделения мочи (< 0,5 мл/кг в час, более шести часов).
По оценкам, у трети пациентов в условиях интенсивной терапии имеется ОПП, и примерно 5% из них требуется заместительная почечная терапия (ЗПТ). Госпитальная смертность у пациентов с ОПП, требующей ЗПТ, достигает 60%.
Первоначальное ведение ОПП включает в себя лечение основной причины, прекращение введения нефротоксических препаратов и обеспечение эуволемического статуса с адекватным средним артериальным давлением. Однако, не было показано, что какое-либо специфическое лечение реверсирует ОПП, поэтому ЗПТ является краеугольным камнем дальнейшего ведения пациента.
Показания для ЗПТ
Показаниями для проведения заместительной почечной терапии являются:
- Острое почечное повреждение
- Перегрузка жидкостью (резистентная к диуретикам)
- Гиперкалиемия (K+ > 6.
 5)
5) - Тяжелый метаболический ацидоз (pH < 7,1)
- Быстро повышающийся уровень мочевины/креатинина (или мочевина > 30 ммоль/л)
- Симптоматическая уремия: энцефалопатия, перикардит, кровотечение, тошнота, зуд
- Олигурия/анурия.
Не будет универсально принятых пограничных уровней мочевины, креатинина, калия, или pH, при которых необходимо начать терапию. Приведенные выше цифры являются только приблизительным ориентиром. Начало ЗПТ должно быть вызвано скорее скоростью изменения ренальных параметров и общим состоянием пациентов, чем произвольными уровнями.
Существует некоторое предположение, что раннее начало ЗПТ (определяется в исследовании PICARD как уровень мочевины < 27 ммоль/л) может улучшить выживаемость, однако, точное время ЗПТ все еще не определено.
- Передозировка диализируемых препаратов или токсинов
Некоторые препараты удаляются с помощью ЗПТ, а некоторые нет. Как правило, препараты выводятся ЗПТ, если они растворимы в воде и не связаны с белками.
Выводятся
- препараты лития
- метанол
- этиленгликоль
- салицилаты
- барбитураты
- метформин
- аминогликозиды, метронидазол, карбапенемы, цефалоспорины и большинство пенициллинов
Не выводятся
- дигоксин
- трициклические антидепрессанты
- фенитоин
- гликлазид
- бета-блокаторы (кроме атенолола)
- бензодиазепины
- макролиды, хинолоны
- варфарин
- Тяжелый сепсис
В последнее время наблюдается интерес к возможности использования гемофильтрации для удаления медиаторов воспаления у пациентов с тяжелым сепсисом/септическим шоком. Несколько небольших исследований (с 25 пациентами или менее) предполагали, что высокообъемная гемофильтрация (40-85 мл/кг/час) может уменьшить потребность в вазопрессорах и, возможно, улучшить выживаемость пациентов с септическим шоком, независимо от наличия ОПП. Тем не менее, строгие рекомендации о роли ЗПТ в этой области не могут быть сделаны до тех пор, пока проблема не будет изучена в более крупных исследованиях.
Виды ЗПТ в реаниматологии
ЗПТ включает в себя перитонеальный диализ и трансплантацию почек, но в рамках данной статьи мы сосредоточимся на формах ЗПТ, используемых в условиях интенсивной терапии.
- Интермиттирующий гемодиализ (IHD)
- Непрерывная заместительная почечная терапия (CRRT)
- Непрерывная вено-венозная гемофильтрация (CVVH)
- Непрерывный вено-венозный гемодиализ (CVVHD)
- Непрерывная вено-венозная гемодиафильтрация (CVVHDF)
- Медленная непрерывная ультрафильтрация (SCUF)
- Непрерывная артерио-венозная гемофильтрация (CAVHD)
- Гибридные методы, например, продолжительный низкоэффективный диализ (SLED)
Механизм удаления растворенного вещества: фильтрация (конвекция) по сравнению с диализом (диффузия)
Гемофильтрация заключается в перекачке крови через экстракорпоральный контур, который включает в себя полупроницаемую мембрану. Гидростатическое давление, действующее на мембрану со стороны крови, вызывает перемещение плазмы через фильтр. Этот процесс называется ультрафильтрацией. Молекулы, размер которых достаточно мал для прохода через поры мембраны (<50,000 Дальтон), переносятся через мембрану вместе с водой процессом конвекции. Фильтрованная жидкость (ультрафильтрат) сливается и добавляется замещающая жидкость, регулируемым способом согласно требуемому жидкостному балансу.
Гидростатическое давление, действующее на мембрану со стороны крови, вызывает перемещение плазмы через фильтр. Этот процесс называется ультрафильтрацией. Молекулы, размер которых достаточно мал для прохода через поры мембраны (<50,000 Дальтон), переносятся через мембрану вместе с водой процессом конвекции. Фильтрованная жидкость (ультрафильтрат) сливается и добавляется замещающая жидкость, регулируемым способом согласно требуемому жидкостному балансу.
Гемодиализ заключается в перекачивании крови через экстракорпоральный контур, который включает в себя диализатор. В диализаторе кровь отделяется от кристаллоидного раствора (диализата) полупроницаемой мембраной. Растворенные вещества перемещаются через мембрану по градиенту концентрации, подчиняясь законам диффузии Фика. Например, бикарбонат перемещается из диализата в кровь, тогда как мочевина и калий перемещаются из крови в диализат. Для того чтобы поддерживать градиенты концентраций и соответственно увеличивать эффективность системы, необходима противоточная подача диализата относительно току крови. Когда необходимо удаление воды, увеличивают давление на мембрану со стороны крови, принуждая молекулы воды перемещаться в диализат.
Когда необходимо удаление воды, увеличивают давление на мембрану со стороны крови, принуждая молекулы воды перемещаться в диализат.
Гемодиафильтрация, как следует из названия, представляет собой комбинацию фильтрации и диализа. Она имеет преимущества обоих методов, но в меньшей степени, чем при самостоятельном их использовании. Нет никаких доказательств того, что CVVDF имеет преимущество по выживаемости по сравнению с CVVH, но может быть полезна для увеличения клиренса малых растворенных молекул.
Медленная непрерывная ультрафильтрация используется, когда единственным требованием является удаление воды. Эффективность как у CVVH с низкой скоростью фильтрации. Она может удалить до 6 литров жидкости день, но клиренс растворенных веществ минимален.
Длительность процедуры: интермиттирующая (IHD) и постоянная (CRRT)
Интермиттирующий гемодиализ заключается в диализе с более высокой скоростью потока, чем CRRT за определенные периоды времени.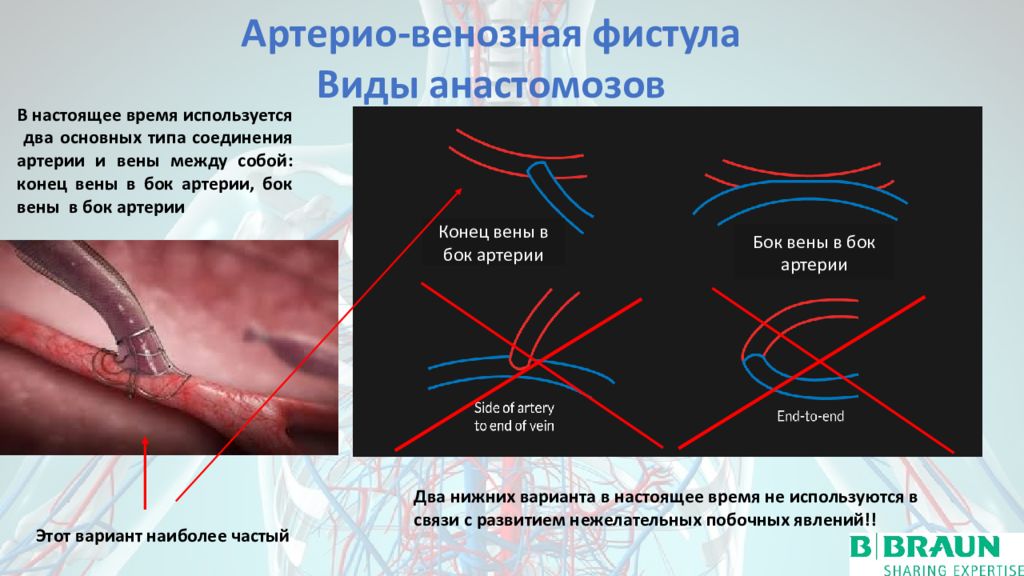 Типичный режим – 3-5 часов диализа 3 раза в неделю. Высокая скорость потока и быстрое снижение осмолярности плазмы подходят только для пациентов со стабильной гемодинамикой. Является основой долгосрочной ЗПТ для хронической почечной недостаточности, в условиях интенсивной терапии используется не часто.
Типичный режим – 3-5 часов диализа 3 раза в неделю. Высокая скорость потока и быстрое снижение осмолярности плазмы подходят только для пациентов со стабильной гемодинамикой. Является основой долгосрочной ЗПТ для хронической почечной недостаточности, в условиях интенсивной терапии используется не часто.
CRRT включает фильтрацию и/или диализ на постоянной основе. Она позволяет лучше управлять водным балансом и создает меньше гемодинамических нарушений, однако это более дорогостоящая методика, чем IHD, и требует постоянной, а не прерывистой антикоагуляции. Есть некоторые данные, позволяющие предположить, что CRRT превосходит IHD у пациентов с сепсисом, сердечно-сосудистой нестабильностью или травмой головы. Тем не менее, большое рандомизированное контролируемое исследование по сравнению IHD с CRRT у пациентов с ОПП и синдромом полиорганной дисфункции не показало разницы в 60-дневной выживаемости.
Длительный низкоэффективный диализ является примером гибридной терапии, целью которой является сочетание логистических и экономических преимуществ IHD с относительной сердечно-сосудистой стабильностью CRRT.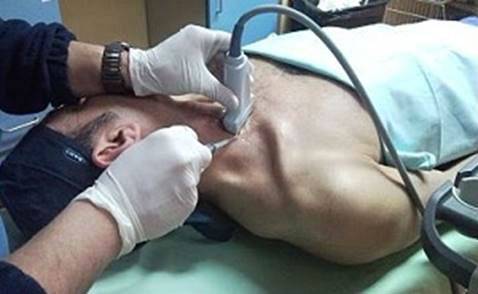 Лечение прерывистое, но обычно ежедневное и с более длительным временем сеанса, чем обычный IHD. Удаление жидкости и растворенных веществ происходит медленнее, чем при IHD, но быстрее, чем при CRRT. Некоторые уверены, что гибридная терапия – это будущее ЗПТ в ОИТ, но в настоящее время нет доказательств в поддержку ее использования. В настоящее время этот метод не используется в Великобритании.
Лечение прерывистое, но обычно ежедневное и с более длительным временем сеанса, чем обычный IHD. Удаление жидкости и растворенных веществ происходит медленнее, чем при IHD, но быстрее, чем при CRRT. Некоторые уверены, что гибридная терапия – это будущее ЗПТ в ОИТ, но в настоящее время нет доказательств в поддержку ее использования. В настоящее время этот метод не используется в Великобритании.
Какой метод ЗПТ нам следует использовать?
Не было доказано, что какой-либо метод ЗПТ в условиях интенсивной терапии дает преимущества по выживаемости по сравнению с другими, поэтому решение о том, какой метод использовать, зависит от следующих показателей.
- Что мы хотим удалить из плазмы
Малые молекулы, электролиты
- менее 500 Дальтон
- мочевина, креатинин, K+, H+, препараты лития
- диализ или фильтрация
Средние молекулы
- 500-5000 Дальтон
- крупные лекарственные молекулы, например, ванкомицин
- фильтрация лучше, чем диализ
Низкомолекулярные белки
- 5000-50000 Дальтон
- цитокины, комплемент
- фильтрация
Вода
- 18 Дальтон
- фильтрация лучше, чем диализ
- Гемодинамический статус пациента
CRRT вызывает менее выраженный водный дисбаланс и является предпочтительным вариантом, если есть какая-либо гемодинамическая нестабильность.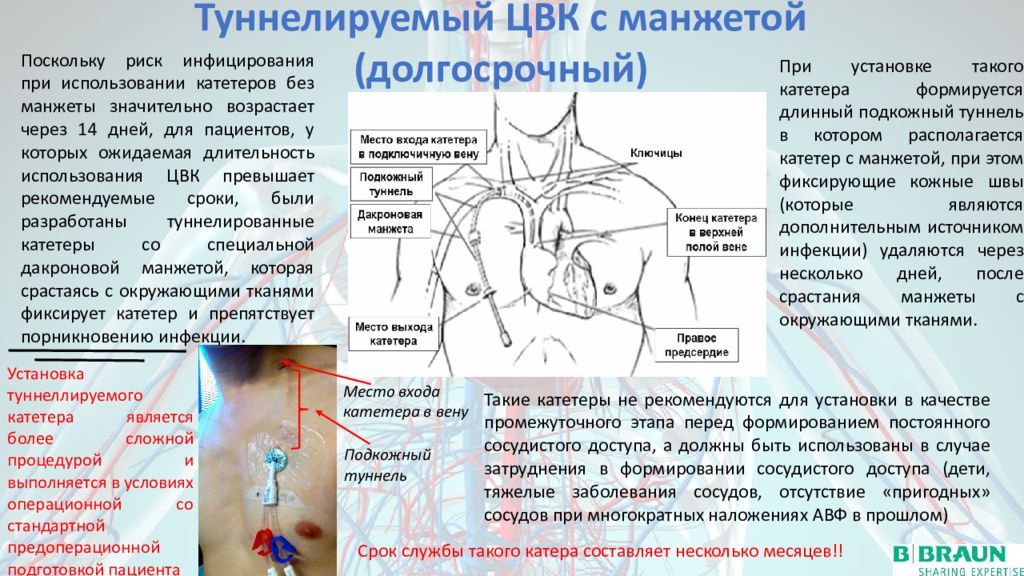
- Наличие материальных ресурсов
- CRRT является более трудоемким и более дорогостоящим, чем IHD
- наличие конкретного оборудования может определять метод ЗПТ.
- Опыт врача
Целесообразно использовать метод ЗПТ, которым владеют все участвующие сотрудники.
- Другие специфические клинические соображения
- Конвективные режимы ЗПТ могут быть полезны, если у пациента септический шок
- CRRT поддерживает режимы питания за счет улучшенного управления жидкостным балансом
- CRRT может быть связана с лучшей церебральной перфузией у пациентов с острой черепно-мозговой травмой или фульминантной печеночной недостаточностью.
Оптимальные скорость потока/доза ЗПТ
При назначении ЗПТ часто просят определить скорость потока. От скорости потока зависит объем произведенного процессом фильтрации ультрафильтрата и объем выходящего диализата. Скорость потока является показателем клиренса растворенного вещества, поэтому он может упрощенно рассматриваться как доза ЗПТ.
Скорость потока является показателем клиренса растворенного вещества, поэтому он может упрощенно рассматриваться как доза ЗПТ.
Недавно закончившиеся 2 рандомизированных контролируемых исследования заключили, что увеличение скорости потока с 20 до 35 мл/кг/час не дает никаких преимуществ:
- Randomised Evaluation of Normal versus Augmented Level по заместительной почечной терапии в отделении реанимации (RENAL) – рандомизированное исследование, включившее 1400 тяжелобольных пациентов с ОПП, не обнаружило разницы в смертности в течение 90 дней в двух группах – интенсивной (35 мл/кг/час) и неинтенсивной (20 мл/кг/час) CRRT.
- Исследование Acute Renal Failure Trial Network (ATN) сравнило интенсивные или менее интенсивные стратегии дозирования у пациентов, перенесших CRRT (35 мл/кг/час против 20 мл/кг/час), IHD (ежедневный) и SLED. Восстановление функции почек и летальность на 60-й день были одинаковыми во всех группах, но в интенсивной группе было больше эпизодов гипотензии.

Как упоминалось ранее в этой статье, гемофильтрация большого объема может быть полезной у пациентов с септическим шоком, поэтому в настоящее время наблюдается тенденция к увеличению скорости потока у пациентов с септическим шоком и ОПП. Это направление практики изучается в исследовании IVOIRE (Impact of High-volume Venovenous Continuous Hemofiltration in the Early Management of Septic Shock Patients With Acute Renal Failure). Это многоцентровое рандомизированное контролируемое исследование, которое в настоящее время набирает пациентов. Пациенты, имеющие септический шок с ОПП рандомизируются на группы – CVVH 70 мл/кг/час или 35 мл/кг/час. Первичная конечная точка – смертность от всех причин на 28 день.
Практические аспекты
Сосудистый доступ
Вено-венозная ЗПТ требует наличия двухпросветного сосудистого катетера, установленного в центральной вене. Кончик должен располагаться в нижней полой вене для бедренных катетеров или верхней полой вене (1-2 см от правого предсердия) для внутренних яремных и подключичных катетеров. Катетеры обычно сделаны из полиуретана или силикона, они должны быть достаточно жесткими, чтобы предотвратить спадение при высоких отрицательных давлениях, но достаточно мягкими для предотвращения перегиба. Хороший поток через внутривенный катетер имеет решающее значение для предотвращения застоя крови в контуре и тромбирования фильтра.
Катетеры обычно сделаны из полиуретана или силикона, они должны быть достаточно жесткими, чтобы предотвратить спадение при высоких отрицательных давлениях, но достаточно мягкими для предотвращения перегиба. Хороший поток через внутривенный катетер имеет решающее значение для предотвращения застоя крови в контуре и тромбирования фильтра.
Есть ряд моментов, которые необходимо учитывать при выборе места для сосудистого доступа.
Внутренняя яремная вена
- Преимущества – самый прямой маршрут (правая сторона) и, в целом, предпочтительный доступ
- Недостатки – колебания внутригрудного давления уменьшает подачу, часто занята другим катетером
Подключичная вена
- Преимущества – самый чистый доступ, самый комфортный для пациента
- Недостатки – Подверженность изменениям внутригрудного давления, стеноз подключичной вены, пневмоторакс
Бедренная вена
- Преимущества – довольно прямой маршрут, обеспечивает хорошие потоки при нахождении наконечника в нижней полой вене
- Недостатки – высокий риск инфекционных осложнений (особенно у пациентов с ожирением)
Существует значительная вероятность возникновения стеноза подключичной вены после введения катетера большого диаметра, что является проблемой, если впоследствии для длительного диализа потребуется артериовенозная фистула. Тем не менее, смертность пациентов на CRRT высока, и те, кто выживает, обычно не нуждаются в диализе.
Тем не менее, смертность пациентов на CRRT высока, и те, кто выживает, обычно не нуждаются в диализе.
Экстракорпоральный контур
Большинство методов CRRT используют приводимую в действие насосом вено-венозную циркуляцию, так как это обеспечивает высокую постоянную скорость потока. Артерио-венозные методы описаны и использовались исторически, однако связаны с катетерными осложнениями и менее надежны.
Антикоагуляция
Все режимы ЗПТ, которые используют экстракорпоральный контур, активируют систему коагуляции, и преждевременное тромбирование фильтра является общей проблемой. Даже небольшое количество образовавшихся сгустков уменьшает производительность фильтра, но если фильтр полностью затромбируется, кровь, содержащаяся в контуре, будет потеряна, а в процессе подготовки нового контура произойдет перерыв в лечении.
Образование тромба в фильтре вызовет сигнал тревоги превышения трансмембранного давления, тогда как тромб в венозном катетере вызовет сигнал тревоги давления доступа. Перегиб катетера или спадение вены также могут быть причиной срабатывания сигнала тревоги давления доступа.
Перегиб катетера или спадение вены также могут быть причиной срабатывания сигнала тревоги давления доступа.
Нефармакологические меры, которые могут быть приняты для уменьшения образования тромба, включают обеспечение адекватного центрального венозного давления у пациента, оптимизацию сосудистого доступа и добавление замещающей жидкости в кровь пациента до того, как она пройдет через гемофильтр (предилюция). Рекомендации, опубликованные в 2009 году Intensive Care Society предполагают, что антикоагулянтная терапия не требуется, когда:
Наличие коагулопатии
- МНО > 2-2.5
- AЧТВ > 60 секунд
- количество тромбоцитов < 60 x 10х3 мм3
Существует высокий риск кровотечения
Пациент получает активированный протеин C
Антикоагуляция должна быть применена во всех остальных ситуациях с целью защиты фильтра, а не пациента. На практике это может быть сложнее, чем кажется. Доступны следующие виды антикоагуляции:
Нефракционированный или низкомолекулярный гепарин
Нефракционированный гепарин (НФГ) (5-30 kDa) – это наиболее часто используемый антикоагулянт в Великобритании, типовой режим включает в себя 40-70 МЕ/кг болюсно, далее инфузия по 5-10 МЕ/кг/час. Он является наиболее экономически эффективным антикоагулянтом и полностью реверсируется протамина сульфатом. Чтобы избежать чрезмерной антикоагуляции, следует контролировать AЧТВ, но нет никаких доказательств того, что подъем AЧТВ продлевает срок службы фильтра.
Низкомолекулярные гепарины (НМГ) (4.5-6 kDa) используются только для ЗПТ в 4% отделений интенсивной терапии в Великобритании. Они выводятся почками, поэтому в данной ситуации их дозирование должно контролироваться уровнями анти-Xa фактора. Период полураспада НМГ более длинный чем НФГ (2-6 ч против 1.5-3 ч) и их влияние можно только частично обратить с помощью протамина. Существует определенное количество данных об использовании НМГ в CRRT, и нет никаких доказательств того, что они превосходят НФГ.
Простагландины
Простагландины (простациклин или простагландин Е2) ингибируют функцию тромбоцитов и могут быть использованы как самостоятельно, так и в сочетании с гепарином, так как они обладают синергетическим эффектом. Простагландины имеют короткий период полураспада (несколько минут), поэтому вводят в виде инфузии (2,5 – 10 нг/кг/мин). Антикоагулянтный эффект прекращается в течение 2 часов после прекращения инфузии, делая простагландины полезной альтернативой гепарину у пациентов с высоким риском кровотечения. Основным побочным эффектом является расширение сосудов, которое может блокировать эффект гипоксической легочной вазоконстрикции и приводить к гипоксемии. Другой недостаток заключается в том, что они дороги и поэтому используются только в качестве терапии второй линии.
Регионарная цитратная антикоагуляция
Регионарная цитратная антикоагуляция – эффективный метод, используемый при увеличенном риске кровотечения. Он часто используется как альтернатива гепарину в США, но редко в Великобритании.
Цитрат натрия вводится в контур перед фильтром, связывает кальций и блокирует образование тромба. Комплекс цитрата кальция свободно фильтруется, после фильтра необходимо введение кальция. Этот вид антикоагуляции ограничивается метаболическими нарушениями, которые она может вызвать: гипокальциемия, гипомагниемия (Mg2+ тоже связывается), гипернатриемия (натриевая нагрузка цитратом натрия), метаболический алкалоз (цитрат метаболизируется в бикарбонат), метаболический ацидоз (вызванный цитратом, особенно если в организме нарушается метаболизм цитрата, например, печеночная недостаточность).
Другие виды
Нет никаких доказательств, чтобы предложить новые альтернативы гепарину, такие как данапароид, гирудин, фондапаринукс или аргатробан.
Фильтры
Свойства фильтра, влияющие на его функцию:
Биосовместимость – степень, в которой мембрана активирует воспалительные и коагуляционные системы пациента. Чем больше биосовместимость мембраны, тем меньше их активация.
Поток – проницаемость фильтра. Мембраны высокого потока (хай-флакс) гидрофобны и могут иметь крупные поры и увеличенное их количество, позволяющие большим количествам воды и растворенных веществ переместиться через мембрану.
Адсорбция – способность более крупных растворенных веществ прилипать к поверхности мембраны. Высоко адсорбционные мембраны обладают потенциальным свойством адсорбировать средние молекулы, в том числе медиаторы воспаления, но только пока мембрана не пропиталась ими (обычно через несколько часов).
Толщина – более тонкие мембраны более проницаемы для диффузии растворенных веществ и также улучшается конвекция.
Площадь поверхности – площадь поверхности мембраны определяет доступную область для диффузии и ультрафильтрации.
Фильтры изготавливают либо на основе целлюлозы, либо синтетические. Синтетические фильтры, такие как полисульфон и полиамид, более биосовместимы и являются мембранами с более высоким потоком, поэтому кажутся более подходящими для CRRT, однако нет убедительных доказательств того, что они улучшают результат. На практике, большинство фильтров, используемых для CRRT – синтетические мембраны хай-флакс с площадью поверхности 0.6–1.2 м2 и размерами пор, пропускающими молекулы до 50.000 Da.
Замещающий раствор
Замещающие растворы имеет немного вариабельный состав, но все они являются сбалансированными кристаллоидными растворами с буфером в виде лактата или гидрокарбоната.
Растворы на основе лактата являются стабильными и, следовательно, это более дешевый и практичный вариант, однако их буферная способность зависит от метаболизма лактата в бикарбонат. При нормальных физиологических условиях организм преобразует лактат в бикарбонат на эквимолярной основе. Это не всегда происходит у пациентов в критическом состоянии, особенно если у них нарушена функция печени или уже есть лактат-ацидоз. В этих ситуациях ЗПТ с использованием замещающего раствора на основе лактата может усугубить ацидоз, поэтому следует использовать раствор на основе бикарбоната. Если это невозможно и уровни лактата сыворотки не чрезмерны, то как альтернативный вариант, продолжать с раствором на основе лактата и начинать внутривенную инфузию гидрокарбоната.
Замещающие растворы на основе бикарбоната имеют более надежную буферную емкость, однако их необходимо готовить непосредственно перед применением. В настоящее время нет никаких доказательств того, что выбор замещающего раствора влияет на выживаемость или восстановление почечной функции.
Замещающий раствор можно вводить перед или после фильтра. Преимущество предилюции в том, что она понижает гематокрит, уменьшая вероятность тромбирования фильтра. Недостатком является то, что предварительное разбавление уменьшает концентрацию растворенного вещества и следует рассмотреть вопрос о компенсационном увеличении скорости потока.
Фармакокинетика во время ЗПТ
Некоторые говорят, что во время проведения пациенту ЗПТ препараты должны быть дозированы по условно принятой СКФ 10-50 мл/мин, но, к сожалению, это не так просто, поскольку существует множество переменных. Самый надежный способ дозирования – измерение плазменной концентрации препаратов, но это невозможно в стандартных клинических условиях, поэтому разумным вариантом будет ориентироваться на рекомендации изготовителя препарата.
Факторы, влияющие на фармакокинетику во время ЗПТ:
Связь с белками
- лекарственные препараты, хорошо связывающиеся с протеинами (например, варфарин, диазепам, пропранолол и фенитоин) выводятся при ЗПТ в малом количестве. Однако, по мере того как уровень протеинов пациента снижается, свободная фракция препарата увеличивается и его клиренс растет.
Размер молекулы препарата и режим ЗПТ
- малые молекулы (<500 Дальтон) выводятся всеми (конвективными и диффузионными) типами ЗПТ, но по мере увеличения размера молекул диффузия становится менее эффективной.
Время процедуры (постоянная или интермиттирующая)
- препараты, полученные между сеансами IHD или SLED, не будут выведены до последующего сеанса.
Доза ЗПТ
- уменьшенные скорости потока / более короткие сеансы уменьшают клиренс препаратов.
Проницаемость мембран
- хай-флакс мембраны гемофильтров, используемых в CRRT, проницаемы для большинства не связанных с белками препаратов.
Остаточная СКФ пациента
- также необходимо учитывать
Прескрипция ЗПТ
Типичная прескрипция для пациента 75 кг, требующего CRRT при ОПП, будет следующей:
Антикоагуляция
- Нефракционированный гепарин: 5000 МЕ болюсно, далее инфузия 500 МЕ/час
- Целью антикоагуляции является фильтр, контроль МНО <2
Водный баланс в течение 24 часов
- стабильный баланс, если пациент эуволемичный
- стремиться к отрицательному балансу, если пациент перегружен жидкостью (<1500 мл/сут)
Тип замещающего раствора / диализата
- используйте раствор без калия при высоком уровне калия сыворотки, по мере нормализации уровня переключайте на калий-содержащий замещающий раствор
- Используйте раствор, основанный на гидрокарбонатном буфере, если имеются сомнения в метаболизме лактата или если лактат сыворотки > 8 ммоль/л (если использован лактат-буфер может потребоваться внутривенная инфузия гидрокарбоната)
Скорость обмена
- 1500 мл/ч (75 кг x 20 мл/кг/час)
Осложнения ЗПТ
Осложнения, общие для IHD, CRRT и гибридной терапии включают:
- осложнения, связанные с сосудистым доступом (катетер-индуцированный сепсис)
- гемодинамические нарушения
- воздушная эмболия
- тромбоцитопения
- кровопотеря
- электролитный дисбаланс
- гипотермия
- эффекты антикоагуляции (кровотечение или специфические побочные эффекты антикоагулянта, например, гепарин-индуцированная тромбоцитопения).
Прогноз пациентов с ОПП на ЗПТ
Bagshaw и др. проанализировали исходы у 240 пациентов с ОПП, нуждающихся в ЗПТ, и показали, что, хотя уровень смертности был высоким (около 60%), большинство выживших (78%) не нуждались в ЗПТ в течение одного года. Из тех, кто нуждался в хронической ЗПТ, 63% имели ранее существовавшие хронические нарушения функции почек с медианой уровня креатинина 232 мкмоль/л.
Резюме
- ОПП является распространенным явлением, 5% пациентов реанимации получают ЗПТ.
- Имеются различные виды ЗПТ, но все они выводят растворенные вещества используя процессы диффузии (диализа) и/или конвекции (фильтрации). ЗПТ можно проводить непрерывно или периодически.
- Ни один из видов ЗПТ не дает преимущества по выживаемости по сравнению с другими, но часто имеются определенные причины, по которым тот или иной метод может быть предпочтительным в данной ситуации.
- Существует ряд доказательств, что высокообъемная гемофильтрация может улучшить выживаемость у пациентов с септическим шоком, но необходимы большие рандомизированные контролируемые исследования в этой области.
- Продолжительность функционирования контура и фильтра зависит от сосудистого доступа хорошего качества и соответствующей антикоагуляции.
- 60% людей, получающих ЗПТ при ОПП, умрут во время лечения, но 80% выживших будут свободны от ЗПТ через год.
Словарь терминов
Полупроницаемая мембрана – барьер из целлюлозы или синтетики, который пропускает воду, электролиты и другие молекулы, задерживающий клеточные компоненты и более крупные молекулы.
Конвекция – транспорт растворенного вещества через мембрану вместе с растворителем (обычно водой) под действием градиента давления.
Дальтон – единица массы, используемая для выражения атомных и молекулярных масс. Это приблизительная масса атома водорода, протона или нейтрона.
Диффузия – перемещение растворенного вещества из компартмента с высокой концентрацией в компартмент с низкой концентрацией.
Закон диффузии Фика – утверждает, что скорость диффузии через мембрану пропорциональна градиенту концентрации.
Гидростатическое давление – давление жидкости при равновесии в данной точке вызванное силой тяжести. В процессе гемофильтрации это давление создается роллерной насосной системой экстракорпорального контура.
Ультрафильтрат –вода плазмы и растворенные в ней вещества, которые проходят через полупроницаемую мембрану.
Ультрафильтрация – транспорт воды через мембрану под действием градиента давления. В гемофильтрации – это процесс, при котором вода плазмы с растворенными веществами отделяется от цельной крови.
Ответы на вопросы
- верно верно неверно верно
- неверно неверно неверно верно
- верно верно неверно верно
Dr Andrew Baker, Anaesthetic ST5,
Dorset County Hospital, Dorchester, UK
Dr Richard Green, Consultant Anaesthetist,
Royal Bournemouth Hospital, Bournemouth, UK
сосудистый доступ | Omnibus rebus
Раздел: Нефрология, May 31st, 2020
В свободном доступе почти год назад были опубликованы рекомендации двух групп по сосудистому доступу – Европейские рекомендации по наилучшей практике в нефрологии выпустили рекомендации для взрослых, а Европейское общество педиатров-нефрологов опубликовало рекомендации для детей. Рекомендации охватывают вопросы созревания артерио-венозной фистулы, хирургические и эндоваскулярные вмешательства при задержке созревания фистулы, оценку состояния сосудистого доступа, техники пункции, своевременность и технику коррегирующих операций в случае тромбоза.
Читать дальше »
Раздел: Нефрология, Mar 7th, 2017
Продолжаю публикацию перечня лекций, которые бесплатно доступны всем желающим на образовательном портале Международного общества нефрологов. В этом посте собраны ссылки на видеозаписи почти ста лекций по широкому кругу вопросов гемодиализа, перитонеального диализа и трансплантации почки.
(more…)
Читать дальше »
Раздел: Нефрология, Mar 9th, 2015
Данная информация важна прежде всего для пациентов с хронической болезнью почек (ХБП), у которых скорость клубочковой фильтрации составляет менее 60 мл/мин/1,73 м2. Однако данные рекомендации следует применять и в целом для пациентов с ХБП или для тех, у кого есть факторы риска ее развития. Напомню, что ХБП выявляется почти у 10% взрослого населения, а факторы риска еще более широко представлены в общей популяции, поэтому все описанное ниже может быть актуально и для обычного «практически здорового» человека.
Взятие крови из вены или внутривенное введение лекарств (в медицинской терминологии прокол вены называется «венепункция» или «пункция вены») относятся к наиболее распространенным медицинским вмешательствам. Для больных с ХБП или высоким риском ее развития важен правильный выбор места пункции вен, о чем многие не знают. Это обусловлено тем, что «традиционная» тактика пункции вен (которая преподается в медицинских училищах и колледжах для медсестер) возникла задолго до появления возможности лечить терминальную стадию ХБП (которую также называют «терминальная почечная недостаточность»). Однако в последнее время в целом ряде стран и отдельных центров в отношении пациентов даже с относительно ранними стадиями ХБП принята тактика венепункции, которую можно назвать «Берегите вены», о причинах возникновения и выполнении которой я расскажу ниже.
(more…)
Читать дальше »
Раздел: Нефрология, Jan 26th, 2015
Национальное агентство по исследованиями и качеству в здравоохранении разместило в бесплатном доступе рекомендации, видеоролики, презентации и обучающие материалы про профилактике развития инфекций у больных на диализе. Они объединены в четыре модуля (на англ.):
Читать дальше »
Раздел: Нефрология, Feb 2nd, 2014
На сайте PCRRT в свободном доступе размещены все презентации конференций по применению продленных методик заместительной почечной терапии в педиатрии 2000-2012 гг., которые не ограничиваются только результатами заместительной почечной терапии, но такие освещают широкий круг вопросов эпидемиологии, патогенеза и отдаленного прогноза заболеваний и синдромов, требующих проведения этих методов лечения. На сайте также представлены протоколы проведения гемофильтрации, гепаринизации, цитратной антикоагуляции, и рекомендуемые локализации и размеры сосудистого доступа в педиатрической практике.
Читать дальше »
Раздел: Нефрология, Jan 12th, 2014
За последнее время в свободном доступе появилось сразу несколько важных материалов по сосудистому доступу, которые хорошо дополняют другие материалы по интервенционной нефрологии.
(more…)
Читать дальше »
Раздел: Нефрология, Dec 19th, 2012
Международное общество нефрологов продолжает пополнять раздел по интервенционной нефрологии на образовательном сайте ISN. Недавно были добавлены видеофильм по техник
Современные немедикаментозные методы лечения стабильной ИБС
Наружная мышечная контрпульсация (усиленная наружная контрпульсация (НКП), EXTERNAL ENHANCED COUNTERPULSATION (EECP) ) — неинвазивный метод лечения ИБС, который облегчает работу сердца и улучшает питание сердечной мышцы за счет усиления кровотока в коронарных сосудах. Существуют ситуации, когда при наличии значимых поражений коронарных артерий и симптомов ишемической болезни сердца (стенокардии), хирургическое вмешательство не может быть выполнено. Обычно это связано с поражением мелких ветвей коронарных артерий, которые нельзя стентировать или шунтировать. Чаще всего такие поражения встречаются у женщин и пациентов, страдающих сахарным диабетом. В этих случаях, помимо общих правил лечения ишемической болезни сердца — коррекции образа жизни и приема лекарственных препаратов, может применяться усиленная наружная контрпульсация. Эта процедура облегчает работу сердца и улучшает питание сердечной мышцы за счет усиления кровотока в коронарных сосудах. Наружная контрпульсация с успехом применяется в качестве подготовки к хирургическому лечению (ангиопластике и аортокоронарному шунтированию), а также в послеоперационном периоде в качестве реабилитации.
Современные аппаратные комплексы для проведения НКП включают в себя: управляемую компьютером пневматическую систему, три пары пневматических манжет, монитор ЭКГ, АД, а также пальцевой плетизмограф. Во время сеанса контрпульсации на икры, нижнюю и верхнюю часть бедер пациента накладываются 3 пары пневматических манжет, последовательно надуваемых сжатым воздухом от периферии к центру. Триггером для надувания и сдувания манжет является зубец R на ЭКГ, который анализируется микропроцессором. Результатом этого является повышение диастолического давления в аорте и увеличение коронарного перфузионного давления, а также разгрузка левого желудочка во время систолы.
Комбинация этих процессов может привести к снижению потребности миокарда в кислороде, увеличению коронарного кровотока и сердечного выброса, что положительно влияет на пациентов с клиническими проявлениями стенокардии.
Проспективные клинические исследования и регистры с участием большого количества пациентов свидетельствуют о значительном снижении симптомов стенокардии и улучшении объективных показателей функции миокарда у больных, прошедших курс НКП. Это послужило основанием для включения наружной контрпульсации, в качестве альтернативного метода лечения рефрактерной стенокардии, в руководство ACC/AHA по лечению пациентов с хронической стабильной стенокардией.
Как проводится наружная контрпульсация?Во время сеанса наружной контрпульсации Вы ложитесь на кушетку; на бедра и голени, в некоторых моделях и на руки, накладываются пневматические манжетки. На грудь накладываются электроды для постоянной записи электрокардиограммы (ЭКГ), которая выводится на экран монитора. На палец надевается датчик для записи кривой пульса, отображающей кровоток в артериях; кроме того, с помощью датчика измеряется насыщение крови кислородом. Во время процедуры манжетки на ногах и руках последовательно надуваются и сдуваются синхронизировано с сердечным ритмом. Во время диастолы, когда сердечная мышца расслаблена и наполняется кровью, а также происходит наполнение коронарных артерий, манжетки последовательно (снизу-вверх) надуваются.
Это приводит к формированию волны крови, направленной к сердцу, что улучшает кровоток в коронарных сосудах. Затем в систолу, когда сердечная мышца сокращается и выбрасывает кровь в аорту, манжетки резко сдуваются. Это облегчает работу сердца и ускоряет кровоток в остальных сосудах.
Курс лечения рассчитан на 35 ч в режиме 1-2 часа ежедневно в течение 4-7 недель.
Кто является кандидатом для наружной контрпульсации?
Возможно, Вам показана наружная контрпульсация, если:
• Вы страдаете хронической ишемической болезнью сердца;
• Вы не получаете облегчения от приема препаратов, в том числе нитратов;
• По каким-либо причинам Вам противопоказана ангиопластика и аортокоронарное шунтирование.
Противопоказания к наружной контрпульсации
• Острая сердечная недостаточность;
• Недостаточность аортального клапана;
• Некоторые нарушения ритма сердца;
• Повышенное артериальное давление, неконтролируемое лекарственными препаратами;
• Тромбоз (закупорка) глубоких вен ног;
• Повышенная кровоточивость;
• Беременность;
• Онкологические заболевания
Возможные осложнения наружной контрпульсации:
Усиленная наружная контрпульсация – процедура неинвазивная, поэтому риск развития каких-либо осложнений крайне невелик. Наиболее частыми проблемами после курса наружной контрпульсации являются повреждения кожи, гематомы на месте накладывания манжет. Некоторые пациенты отмечают боли в ногах после процедуры.
Здесь можно прочитать об опыте использования наружной контрпульсации нашими новосибирскими коллегами.
Сосудистый доступ для гемодиализа | IntechOpen
Постоянный сосудистый доступ обычно требуется пациентам с 4 стадией CKF из-за постоянного лечения HD [6]. Для постоянного доступа к сосудам можно использовать AV-шунт (вне клинической практики), AV-фистулу, трансплантат AF или туннельные или нетуннелированные катетеры для гемодиализа. Во время преддиализной подготовки или образовательной программы перед диализом пациенты должны быть проинформированы о возможных вариантах лечения ESKG, которые включают HD, перитонеальный диализ (PD) и трансплантацию почки.
3.1. Артериовенозный шунт
Внешний AV-шунт принадлежит истории. Он использовался между 1960 и 1965 годами, до того, как был создан первый AV-свищ (Kenneth C. Apple), то есть радиоцефальный (Brescia – Cimino 1966) (рис. 3).
3.2. Артериовенозная фистула
У пациентов, находящихся на хроническом гемодиализе, необходимо своевременно создавать сосудистый доступ. Нативная атриовентрикулярная фистула является золотым стандартом и наиболее часто используемым типом сосудистого доступа у этих пациентов [2].После обследования пациента на стадии 4 СКФ (СКФ 30–15 мл / мин / 1,73 м²) сосудистый хирург оценивает состояние сосудистой системы пациента, чтобы спланировать строительство атриовентрикулярного свища. В случае прогрессирующей почечной недостаточности и / или сахарного диабета необходимо раньше создавать атриовентрикулярный свищ [7]. Перед выбором типа сосудистого доступа следует оценить периферические кровеносные сосуды (артерии и вены) с помощью клинического обследования и ультразвукового исследования. Если диаметр и стенки кровеносных сосудов удовлетворительны, может возникнуть атриовентрикулярная фистула.Обычно это делается на недоминантной руке между лучевой артерией и головной веной как можно дистальнее. AV-фистула — это хирургически созданный подкожный анастомоз между артерией и веной (рис. 4), который созревает за счет расширения вен и артериализации вены.
Рисунок 3.
Quinton-Scribner AV sunt
Рисунок 4.
Типичная артеривенозная фистула (Brescia-Cimino)
AV-анастомоз перенаправляет поток артериальной крови в вену, которая затем расширяется из-за новых гемодинамических условий.Со временем просвет вены расширяется, венозный кровоток увеличивается, и вена становится пригодной для пункции и гемодиализа обычно через три-пять недель [8].
Существует два наиболее распространенных типа анастомозов. Один из них — «бок о бок» (стандартный анастомоз, описанный Brescia), когда артерия и соседняя с ней вена разрезаются в продольном направлении и сшиваются или сшиваются вместе [9]. Этот тип анастомоза может привести к венозной гиперемии руки (рис. 5).
Другой — анастомоз «концевая вена к боковой артерии», при котором головная вена полностью перерезана, ее дистальная часть в направлении руки лигируется, а проксимальная часть пришивается сбоку от соответствующей артерии (Рисунок 6). .
Рисунок 5.
Анастомоз AV фистулы «бок в бок»
Рисунок 6.
Анастомоз «конец в бок» AV фистулы
Если AV свищ не может быть создан на обычном месте, т.е. запястье, оно может быть создано проксимально в средней части предплечья или в локтевой ямке. Свищ также может образовываться между локтевой артерией и базиликовой веной.
3.3. Осложнения АВ свища
3.3.1. Тромбоз
Тромбоз AV фистулы характеризуется полным прекращением кровотока через венозную часть фистулы AF проксимальнее AV анастомоза из-за тромба, который может развиваться в любой части вены (от анастомоза до слияния подключичную вену в верхнюю полую вену).Тромбоз можно диагностировать при стандартном физикальном обследовании. Характерный признак — отсутствие типичного трепета свища при пальпации. В некоторых случаях тромб в вене может быть пальпирован. Можно заметить артериальную пульсацию дистальнее и отсутствие кровотока в пустой вене проксимальнее места тромбоза. Невозможно услышать шум AV-свища с помощью стетоскопа. Результаты могут быть подтверждены ультразвуком, т.е. тромб может быть визуализирован и измерен ультразвуком в режиме B, а отсутствие кровообращения проксимальнее места тромбоза может быть подтверждено допплером [10].
Тромбоз — наиболее серьезное осложнение, приводящее к потере функции свища. Лечится хирургическим путем путем тромбэктомии или эндоваскулярным путем.
3.3.2. Стеноз
Стеноз — наиболее частое осложнение. Это вызвано сужением просвета вены. Хотя он может развиваться в любой части вены, обычно он находится рядом с AV-анастомозом.
Стеноз приводит к нарушению работы атриовентрикулярного свища, характеризующемуся уменьшением кровотока через артериальный сегмент свища в 50% случаев.Сниженный и неадекватный кровоток через AV-фистулу регистрируется насосом крови, что приводит к недостаточным дозам диализа [11]. Стеноз можно заподозрить, если кровоток идет через определенный сегмент вены.
Рис. 7.
Стеноз AV-фистулы, показанный с помощью УЗИ в B-режиме с допплеровской визуализацией недостающего кровотока на месте стеноза.
уменьшено. Часто при аускультации можно услышать пронзительный шум. Диагноз можно подтвердить с помощью УЗИ и флебографии.Приоритет следует отдавать УЗИ в режиме B и допплеровской сонографии, поскольку это неинвазивные методы, позволяющие точно определить место и степень стеноза (рис. 7).
Эти методы могут использоваться для определения длины стеноза и измерения диаметра вены дистальнее и проксимальнее места стеноза. Кроме того, допплерография может определять более высокую скорость кровотока в месте стеноза [12]. В зависимости от результатов, новый анастомоз может быть создан проксимальнее стеноза, или стент может быть установлен на месте стеноза путем чрескожного вмешательства.Если стеноз развивается в крупных венах шеи (обычно подключичной вене), это приводит к отеку всей руки и выраженному коллатеральному венозному кровотоку по подкожным венам. HD осложняется высоким процентом рециркуляции крови, сложным проколом сосуда и высоким венозным сопротивлением. Диагноз подключичного стеноза ставится на основании физикальных и флебографических данных; УЗИ может не дать надежных результатов. Это осложнение купируется путем чрескожной дилатации и стентирования [13].
3.3.3. Аневризма
Аневризма определяется как локализованное расширение вены, обычно проксимальнее места стеноза, когда давление на стенку сосуда увеличивается из-за турбулентности крови и приводит к аневризматическому расширению вены [14]. Турбулентный кровоток при дилатации аневризмы часто приводит к тромбозу атриовентрикулярного свища. Аневризмы диагностируются при осмотре, пальпации и УЗИ (рис. 8).
Рисунок 8.
Аневризматическое увеличение АВ свища.
3.3.4. Псевдоаневризма
В отличие от аневризмы псевдоаневризма не содержит сосудистой стенки. Он распространяется на окружающие мягкие ткани после разрушения стенки сосуда, обычно после неосторожного прокола артерии или трансплантата. Псевдоаневризмы чаще развиваются как осложнения синтетических АВ трансплантатов, чем нативных свищей, и диагностируются с помощью УЗИ.
3.3.5. Гематома
Гематома чаще всего развивается между местом венепункции и кожей из-за неадекватного и непродолжительного сжатия места венепункции после сеанса диализа.Это может вызвать внешнее сжатие сегмента кровеносного сосуда и вызвать стеноз. Гематома диагностируется при осмотре и ультразвуковом исследовании (рисунок 9).
Рисунок 9.
Гематома в местах пункции АВ свища.
3.3.6. Периферическая ишемия
Поскольку кровоток от лучевой артерии к ладонной дуге и пальцам уменьшается после образования AV-фистулы, может развиться «синдром обкрадывания» сосудистого доступа, приводящий к ишемии пальцев.Чаще всего поражаются большой, указательный и средний пальцы, кровоснабжаемые лучевой артерией. Синдром чаще всего развивается у пациентов с сахарным диабетом и изменениями на периферических артериях (гиперплазия интимы, фиброз, кальцифицирующие бляшки, стенозы) из-за диабетической ангиопатии и снижения периферического артериального кровообращения. Следовательно, у пациентов с сахарным диабетом следует избегать антекубитальных атриовентрикулярных свищей [15]. Пациенты часто жалуются на холодные пальцы и боль, у них могут развиться трофические изменения акральных отделов, включая гангрену (рис. 10).
Рисунок 10.
Периферическая ишемия, вызванная «синдромом обкрадывания» вследствие недостаточного кровотока в дистальной части руки после анастомоза AV фистулы.
3.3.7. Сердечные осложнения
У кардиологических пациентов могут развиться дополнительные сердечные осложнения после создания свища ФП, потому что сердечный выброс увеличивается (20–50% сердечного объема проходит через АВ свищ) [16]. Кровоток через атриовентрикулярный свищ в зависимости от расположения составляет 600 — 2000 мл / мин.
3.3.8. Инфекция
Инфекции чаще всего возникают после нестерильной пункции AV свища и характеризуются покраснением и отеком кожи над свищом. Из-за воспалительных изменений кровеносный сосуд может быть ослаблен и разорван, особенно если изменения коснутся аневризмы.
Эти осложнения лечатся медикаментозно с помощью антибиотиков или хирургическим путем в случае неизбежного разрыва (рис. 11) [17].
Рисунок 11.
Инфекция AV свища.На месте пункции присутствует серотическая экстравазация. Образования корок — признак активного воспалительного процесса.
3.4. Артериовенозный трансплантат
Если нативный атриовентрикулярный свищ не может быть создан из-за недостаточности кровеносных сосудов (плохо развитые вены или артериальная недостаточность), между артерией и веной может быть имплантирован синтетический кровеносный сосуд. Такой имплантированный сосуд называется АВ-трансплантатом. Трансплантат изготавливается из биосовместимого материала, такого как полиэфир (дакрон), вспененный политетрафторэтилен (Goretex) или полиуретан (Vectra), чтобы избежать аллергических реакций, тромбоза и инфекции.Он имплантируется подкожно, чтобы быть доступным для пункции, в основном в плечо между плечевой артерией и подмышечной веной и, реже, в предплечье или бедро (рис. 12) [20].
3.4.1. Осложнения
Осложнения с атриовентрикулярным трансплантатом аналогичны описанным для нативных атриовентрикулярных свищей и включают тромбоз, стеноз, псевдоаневризму и инфекции и лечатся аналогичным образом.
Рис. 12.
Схематическое изображение артериовенозного трансплантата
3.5. Туннельные центральные венозные катетеры
У некоторых пожилых пациентов с синдромом хронической сердечной недостаточности и недостаточностью периферических кровеносных сосудов невозможно создать AV-фистулу или имплантировать синтетический AV-трансплантат. Поэтому таким пациентам часто имплантируют постоянный туннельный центральный венозный катетер (ЦВК) с подкожной синтетической манжетой [19]. Соединительная ткань врастает в манжету и фиксирует катетер на месте, в то же время снижая вероятность инфицирования (рис. 13).
Рисунок 13.
Туннельный катетер для гемодиализа, модель Tesio. Два отдельных просвета подходят для лучшего кровотока и меньшей рециркуляции.
Этот подход используется при лечении 10–15% пациентов в программе хронического HD. Пациенты должны быть проинформированы об осложнениях, связанных с туннелированием ЦВК, которые встречаются чаще, чем осложнения, связанные с AV-свищами или AV-трансплантатами (тромбоз, бактериемия, сепсис). Двухпросветные катетеры вводятся через крупные вены (внутреннюю яремную, подключичную или бедренную вены) и соединяются трубкой с насосом для крови, который обеспечивает достаточный кровоток (от 300 до 400 мл / мин) и контролируется с помощью монитора HD.Наиболее желательным местом для установки туннелирования ЦВК является правая внутренняя яремная вена. Альтернативные участки включают внешнюю яремную вену, подключичную вену, бедренную вену и нижнюю полую вену. Если сосудистый доступ временный, его нельзя размещать на той же стороне тела, где планируется создание свища. Подключичную вену следует использовать только в том случае, если яремный доступ невозможен. Катетер вводится по модифицированной методике Сельдингера под контролем ультразвука. Яремный доступ расположен выше и латеральнее грудинного конца ключицы.После успешной установки положение туннелированной ЦВК должно быть подтверждено рентгеном. Есть несколько преимуществ туннелирования CVC. Его можно использовать сразу после установки, он не требует венепункции (меньший риск гепарин-ассоциированного кровотечения), а возможные тромботические осложнения в месте доступа легче контролировать. К недостаткам туннелированного ЦВК относятся более низкий кровоток через диализатор, возможные осложнения при установке катетера, более высокий риск инфекции, стеноз подключичной вены и косметические проблемы [2].
3.5.1. Осложнения
Осложнения, связанные с туннельными катетерами для гемодиализа, могут быть ранними и поздними. Ранние осложнения обычно легкие, такие как гематома в месте пункции, пункция общей сонной артерии, неправильное положение катетера (чаще всего из-за стеноза бахиоцефальной вены), охриплость голоса и парестезия конечности на стороне пункции из-за анестезии. инфильтрация в иннервирующую область возвратного нерва и брахиоцефального нервного сплетения.Более серьезные осложнения включают пневмоторакс, гемоторакс и гемоперикард с неизбежной тампонадой сердца. Поздние осложнения включают тромбоз, инфекцию (обычно в подкожном туннеле), приводящую к бактериемии и, в тяжелых случаях, сепсу (рис. 14) [20].
Рисунок 14.
Инфекция места выхода просвета катетера. Манжета полностью выпячена.
3.5.2. Тромбоз
Тромбоз приводит к недостаточному кровотоку через катетер. Это относительно частое осложнение у диализных пациентов с внутривенными катетерами.Снижение кровотока снижает доставленную дозу диализа. Туннельные катетеры обычно имеют скорость кровотока> 300 мл / мин. Если скорость кровотока ниже, можно заподозрить неполную обструкцию, вызванную отложениями фибрина в просвете. В случае полной непроходимости диализ невозможен; Следовательно, нефункциональный катетер следует заменить новым через новый подкожный туннель [21].
Фибринолитические агенты (урокиназа, тканевой активатор плазминогена — tPA) можно вводить в течение 3-6 часов.При неполной непроходимости рекомендуется закапывание в просвет катетера антитромботических растворов (стандартный гепарин, низкомолекулярный гепарин, цитрат натрия) [22, 23].
Нитрат натрия в последнее время используется чаще, чем стандартный гепарин для профилактики инфекции катетера гемодиализа и тромбоза. Как полисахарид, гепарин привлекает микробы и способствует образованию биопленки на поверхности катетера. Попадание в системный кровоток увеличивает риск кровотечения.Цитрат натрия предотвращает возможное инфицирование, «связывая» кальций, необходимый для роста бактерий, и предотвращает образование тромба, блокируя кальций. Если он попадает в системный кровоток, он не оказывает системного действия, поскольку быстро метаболизируется в печени и мышечной ткани до нейтральных бикарбонатов. Наблюдаемые побочные реакции (возникающие примерно у 10% пациентов) носят временный характер и включают металлический привкус и онемение пальцев рук и ног во время заполнения просвета катетера раствором.Этих реакций можно избежать, уменьшив объем вводимого раствора с шагом 0,1 мл в каждом последующем сеансе диализа до исчезновения симптомов. Используемые концентрации цитрата натрия включают 23%, 30% и 46,7% растворы [24, 25].
3.5.3. Инфекция
Катетер-ассоциированные инфекции являются наиболее частой причиной заболеваний у пациентов с этим типом сосудистого доступа. Диагноз поставить несложно. Он основан на повышенной температуре тела, боли и покраснении вокруг места выхода катетера или подкожного туннеля, часто сопровождающихся выделениями.Диагноз тихой внутрипросветной контаминации поставить сложнее, особенно если отсутствуют внешние признаки воспаления. В этом случае положительная гемокультура или положительная бактериальная культура из внутрипросветного тромба помогают поставить диагноз.
Наиболее распространенные возбудители (80%) включают грамположительные бактерии (Staphylococcus epidermidis, Staphyloccus aureus), тогда как грамотрицательные бактерии и грибы (Enterococcus, Escherichia coli, Pseudomonas, Candida виды) встречаются реже (20%).Специфические маркеры крови (лейкоцитоз, повышенный уровень С-реактивного белка, повышенный уровень прокальцитонина) могут помочь в диагностике катетер-ассоциированной бактериальной инфекции [26].
Лечение известной катетер-ассоциированной инфекции
В случае инфицирования места выхода катетера или туннельной инфекции с отрицательной гемокультурой, необходимо провести туалет выхода или туннеля. Следует взять мазки на выходе для микробиологического анализа и назначить двухнедельную антибактериальную терапию на основе антибиотиков.Поскольку грамположительные бактерии являются возбудителями в 80% случаев, лечение антибиотиками, к которым чувствительны грамположительные бактерии, может быть начато немедленно и продолжено до тех пор, пока не станут доступны микробиологические результаты.
В случае положительного результата гемокультуры без каких-либо клинических признаков инфекции в месте выхода катетера или туннельной инфекции, рекомендуется заменить катетер и ввести профилактику антибиотиками на основании результатов теста на чувствительность к микробам в течение следующих 4 недель.
В случае инфицирования места выхода катетера или туннельной инфекции и положительного результата гемокультуры катетер следует немедленно удалить и в течение следующих 4 недель провести противомикробное лечение, чтобы снизить риск катетер-ассоциированного сепсиса и возможного развития метастатической инфекции. , такие как эндокардит, остеомиелит и позвоночный абсцесс, которые иногда могут развиваться даже после удаления катетера
3.5.4. Профилактика инфекций
Строгие гигиенические меры во время сеансов диализа, использование раствора цитрата натрия для поддержания проходимости катетера между сеансами диализа из-за его антитромботических и антисептических свойств, а также профилактическое нанесение защитной антимикробной мази на кожу вокруг места выхода катетера снизит риск бактериемии [28].
Преимущества и риски внутрикостного сосудистого доступа
Случай
72-летняя женщина с астмой, застойной сердечной недостаточностью и несоблюдением режима приема лекарств обратилась в отделение неотложной помощи с 2-недельным отеком нижних конечностей, утомляемостью и постепенно усиливающейся одышкой. Сообщила об одышке в покое и при физической нагрузке, а также о сухом кашле. При первичном осмотре у нее было свистящее дыхание, заметная эритема правой нижней конечности и двусторонний точечный отек нижних конечностей, больший с правой стороны с мокнущими слезами на коже.Поступила с обострением астмы и целлюлитом нижних конечностей. Она улучшилась с помощью жидкости, небулайзеров с альбутеролом, метилпреднизолона и цефтриаксона / доксициклина. В течение следующих 2 дней госпитализации у нее было ультразвуковое исследование нижних конечностей, которое дало отрицательный результат на тромбоз глубоких вен, а трансторакальная эхокардиограмма была нормальной, за исключением увеличения предсердий.
В полночь второго дня в больнице сын пациентки заметил, что у его матери кружится голова. Четыре часа спустя у пациента внезапно началась брадикардия, частота сердечных сокращений составила 20 ударов в минуту.По дороге в ванную комнату у нее была заметная одышка с сатурацией кислорода 87%. Затем она перестала отвечать. Ее первоначальный ритм был без пульса на электрическую активность. Во время кода старший ординатор поместил внутрикостную (IO) линию в левую большеберцовую кость после нескольких безуспешных попыток получить доступ к периферическим венам. После 10 минут компрессий грудной клетки и усовершенствованного протокола жизнеобеспечения сердечно-сосудистой системы спонтанное кровообращение восстановилось, и пациент был переведен в отделение интенсивной терапии (ОИТ).
Через три часа после установки IO-линии медсестра сообщила основной бригаде, что левая нога была темно-пурпурного цвета, а при осмотре нога была синеватой и сильно отечной с вялыми дистальными импульсами. Сосудистая хирургия диагностировала компартмент-синдром, удалила линию IO и позже этим утром выполнила прикроватную фасциотомию. Раны после фасциотомии заживали медленно и требовали постоянного комплексного ухода. После 2 месяцев в отделении интенсивной терапии и множественных осложнений пациент был выписан.
Сосудистый доступ — краеугольный камень современной медицинской терапии.В кризисной ситуации, особенно когда требуются большие объемы жидкости или вазоактивных лекарств, врачи были обучены доступу к сосудистой системе через крупные вены на шее или в паху. Тем не менее, особенно при низком кровяном давлении или объеме или у детей, внутривенный (IV) доступ может быть затруднен, и многие пациенты умерли за эти годы из-за невозможности получить доступ вовремя.
Установка устройства сосудистого доступа непосредственно в полость костного мозга для лечения началась еще в 1920-х годах.(1) Эти устройства использовались во время Второй мировой войны для лечения шока (2), но позже перестали пользоваться популярностью во многих странах, пока они не были повторно введены в реанимацию детей в США в конце 1980-х годов. Их возрождение во взрослой медицине замедлилось и вновь обрело популярность в последнее десятилетие. (3) Современное развитие быстрых и простых в использовании устройств для внутрикостной (ВКО) установки недавно сделало доступ ИО в пределах досягаемости широкой области продвинутой жизни провайдеры поддержки. (4)
Техника размещения линий ввода-вывода в настоящее время является общепринятым компонентом современных передовых алгоритмов жизнеобеспечения.(3) Внутрикостный доступ требует либо просверливания, либо пробивания коры кости и помещения полой иглы в полость костного мозга, внутри которой находится богатая сеть сосудов костного мозга, которая будет быстро транспортировать жидкости и лекарства в сосудистую систему в целом (рисунок). Как правило, проницаемая костная кора плотно удерживает устройство ввода-вывода, что затрудняет случайное смещение линии (хотя могут происходить смещения).
После установления благоприятного профиля безопасности и эффективности доступ к внутривенным инъекциям одобрен как предпочтительная первая альтернатива неудачному доступу для внутривенных вливаний многочисленными профессиональными организациями, включая Американскую кардиологическую ассоциацию (AHA), Американский колледж врачей неотложной помощи (ACEP), Международный комитет связи по реанимации. (ILCOR) и Национальная ассоциация врачей скорой медицинской помощи (NAEMSP).Установление внутрикостного доступа врачами-нефизиками обычно используется и, как доказано, позволяет сэкономить время в случаях неотложной реанимации, которые часто возникают как в догоспитальных учреждениях, так и в отделениях неотложной помощи (3,5)
.
Оператор должен использовать разумные рекомендации при использовании доступа ввода-вывода. При поиске доступа следует избегать зараженных сайтов. Как правило, если доступ ввода-вывода уже использовался и был прекращен на одном конце, противоположный конец следует использовать для будущих попыток из-за возможности утечки с исходного сайта, если доступ ввода-вывода размещен рядом с ним.Следует соблюдать рекомендации производителя по выбору размера устройства доступа. Пациентам с избыточным количеством ткани может потребоваться игла большего размера, чтобы получить доступ для ввода-вывода и снизить вероятность смещения устройства для ввода-вывода.
Динамика потока при доступе ввода-вывода более сложна, чем при доступе непосредственно в вену. Скорость потока парентеральной жидкости через устройство доступа может варьироваться в зависимости от размера иглы, места доступа и динамики костного мозга (включая возможность того, что костные спикулы препятствуют оттоку из устройства).Например, при настройке низкого потока в большеберцовое пространство оператор может обнаружить, что поворот устройства на несколько градусов может улучшить поток. Пользователи должны быть осторожны при аспирации крови и костного мозга обратно через устройство, например, с целью получения лабораторных исследований, так как это аспирация может вызвать закупорку иглы доступа. Поток жидкости через головку плечевой кости превосходит — до пяти раз больше — по сравнению с тибиальным пространством, приближаясь к потоку в центральную линию доступа (L.Миллер, устное сообщение, октябрь 2013 г.).
При использовании устройств ввода-вывода могут возникнуть многочисленные осложнения. (6) Как и в данном случае, точка проникновения иглы доступа в кору головного мозга может протекать, что позволяет вливать жидкость и лекарства в окружающие ткани, создавая местную экстравазацию и, возможно, создавая синдром купе. Скандинавский обзор 1800 случаев, когда устройство IO использовалось для сосудистого доступа, выявило такие осложнения, как дискомфорт пациента и боль (7.1%), затруднения при проникновении в надкостницу иглой IO (10,3%), проблемы с аспирацией костного мозга (12,3%) и погнутые или сломанные иглы IO (4,0%). Среди других проблем, о которых сообщалось, были трудности с инъекцией жидкости и лекарств после внутривенного введения (7,4%), медленная инфузия (8,8%), смещение после введения (8,5%) и экстравазация (3,7%). Следует отметить, что компартмент-синдром, как в этом случае, встречался относительно редко — 10 случаев (0,6%). Было также 6 случаев (0,4%) остеомиелита. (6) Тщательное внимание к месту, окружающему катетер IO, необходимо для отслеживания осложнений, таких как экстравазация у этого пациента; синдром ее компартмента, вероятно, можно было бы предотвратить, если бы экстравазация была обнаружена раньше.Наконец, после того, как срочность ситуации разрешится, рекомендуется заменить иглу для внутривенного вливания на более длительный доступ для внутривенных вливаний, что еще больше снизит осложнения, связанные с доступом внутривенно.
Несмотря на то, что устройства доступа IO имеют низкий уровень осложнений, они значительно дороже (часто превышают 100 долларов США), чем катетеры IV (несколько долларов США). Эти затраты могут стать существенными для систем аварийного реагирования. Например, в течение 12 месяцев после первоначального развертывания устройства ввода-вывода в районе Далласа (7) системе неотложной медицинской помощи (EMS) пришлось покрыть увеличение расходов, превышающее 40 000 долларов.Следовательно, медицинским директорам скорой медицинской помощи целесообразно установить протокол, требующий некоторого количества начальных попыток периферийного внутривенного введения до реализации использования ввода-вывода.
Должна существовать стандартизированная начальная и непрерывная подготовка в соответствии с требованиями медицинского директора и рекомендациями производителей. ACEP выступает за разработку институциональной политики и обучение использованию доступа ввода-вывода. (8) Кроме того, производители устройств имеют простые учебные материалы, которые могут служить руководством для административного обучающего персонала больниц и служб скорой помощи, которые используют эти устройства.
По нашему опыту, большинство случаев доступа ввода-вывода проходят успешно. Однако когда возникают проблемы, обычно это происходит из-за неправильного выбора места введения ввода-вывода, попытки ввода-вывода при наличии известных противопоказаний или неправильного размещения иглы ввода-вывода (либо слишком глубоко [через заднюю стенку кости у младенцев], либо слишком неглубокий [попытка использования недостаточно длинной иглы у взрослых с ожирением]). Эти осложнения можно смягчить, разработав подробные институциональные руководящие принципы политики использования ввода-вывода, а также путем тщательного обучения всех лиц, которые могут вставлять иглы для ввода-вывода, правильной технике введения.
Очки для сбора
- Внутрикостный сосудистый доступ может спасти жизнь, и системы экстренного реагирования должны иметь одно из этих устройств в наличии, а персонал обучен их использованию.
- Частота осложнений, связанных с внутривенным доступом, невелика и сопоставима с внутривенным доступом.
- Внутривенный сосудистый доступ дороже, чем внутривенные катетеры, поэтому при принятии решения о том, какое из них использовать, необходимо взвесить риски и преимущества различных устройств доступа.
Раймонд Л.Фаулер, доктор медицины, профессор неотложной медицины, хирургии, медицинских профессий и неотложной медицинской помощи, Юго-западный медицинский центр Техасского университета, Даллас, Техас
Мелани Дж. Липпманн, доктор медицины, доцент кафедры неотложной медицины Медицинская школа Уоррена Альперта, Университет Брауна, Провиденс, Род-Айленд
Список литературы
1. Поилка CK, Поилка KR, Lund CC.Циркуляция в костном мозге млекопитающих. Am J Physiol. 1922; 62: 1-92.
2. Моррисон GM. Первичная помощь пострадавшим. Я практикую копать угощение. 1946; 1: 183. [перейти в PubMed]
3. Филлипс Л., Браун Л., Кэмпбелл Т., Миллер Дж., Прель Дж., Янгберг Б. Рекомендации по использованию внутрикостного сосудистого доступа для неотложных и не неотложных ситуаций в различных медицинских учреждениях: документ о консенсусе. Медсестра-критик. 2010; 30: е1-е7. [перейти в PubMed]
4.Удача RP, Haines C, Mull CC. Внутрикостный доступ. J Emerg Med. 2010; 39: 468-475. [перейти в PubMed]
5. Заявление о политике ACEP корпорации Vidacare Corp. поддерживает использование внутрикостного сосудистого доступа в качестве альтернативы внутривенному сосудистому доступу в отделении неотложной помощи. JEMS. 8 ноября 2011 г. [Доступно на]
6. Hallas P, Brabrand M, Folkestad L. Осложнение с внутрикостным доступом: опыт скандинавских пользователей. West J Emerg Med. 2013; 14: 440-443. [перейти в PubMed]
7.Фаулер Р.Л. Электронный перекресток: возможности и проблемы в управлении медицинскими данными. JEMS. 1 октября 2009 г. [Доступно на]
8. Американский колледж врачей скорой помощи. Альтернативные методы сосудистого доступа в отделении неотложной помощи. Ann Emerg Med. 2011; 58: 402. [перейти в PubMed]
Рисунок
Рисунок. Левая нога с внутрикостным устройством в проксимальном отделе большеберцовой кости. (Иллюстрация © 2014 Chris Gralapp.)
Хирургическое отделение — Сосудистый доступ для гемодиализа
Сосудистый доступ — это спасательный круг пациента, находящегося на гемодиализе, поскольку он делает возможным спасающее жизнь лечение гемодиализом.Гемодиализ — это лечение почечной недостаточности, при котором кровь пациента отправляется через фильтр, называемый диализатором, за пределы тела. Доступ — это хирургически созданная вена, используемая для удаления и возврата крови во время гемодиализа. Кровь проходит через иглу, по несколько унций за раз. Затем кровь проходит по трубке, которая попадает в диализатор. Внутри диализатора кровь течет через тонкие волокна, которые отфильтровывают отходы и лишнюю жидкость. Аппарат возвращает отфильтрованную кровь в организм через другую трубку.Сосудистый доступ позволяет большому количеству крови непрерывно течь во время процедур гемодиализа, чтобы фильтровать как можно больше крови за сеанс. Каждую минуту через аппарат проходит около пол-литра крови. Сосудистый доступ должен быть открыт за несколько недель или месяцев до первого сеанса гемодиализа.
Два типа сосудистого доступа, предназначенные для длительного использования, включают артериовенозный (AV) свищ и AV-трансплантат. Третий тип сосудистого доступа — венозный катетер — предназначен для краткосрочного использования.
[Вверх]
Что такое артериовенозная фистула?
Атриовентрикулярный свищ — это соединение артерии с веной, выполненное сосудистым хирургом. Артерии несут кровь от сердца к телу, а вены — от тела обратно к сердцу. Сосудистые хирурги специализируются на хирургии кровеносных сосудов. Хирург обычно помещает атриовентрикулярную фистулу в предплечье или плечо. AV-фистула вызывает дополнительное давление и приток крови в вену, в результате чего она становится большой и сильной.Более крупная вена обеспечивает легкий и надежный доступ к кровеносным сосудам. Без такого доступа регулярные сеансы гемодиализа были бы невозможны. Необработанные вены не могут выдержать повторных вводов иглы, потому что они разрушатся, как соломинка при сильном всасывании.
Поставщики медицинских услуг рекомендуют AV-фистулу по сравнению с другими видами доступа, потому что она
- Обеспечивает хороший кровоток для диализа.
- Длится дольше, чем другие типы доступа.
- Менее вероятность заражения или образования тромбов, чем при других способах доступа.
Перед операцией на атриовентрикулярную фистулу хирург может выполнить тест на картирование сосудов. При картировании сосудов используется допплеровский ультразвук для оценки кровеносных сосудов, которые хирург может использовать для создания AV-фистулы. Ультразвук использует устройство, называемое преобразователем, которое безопасно и безболезненно отражает звуковые волны от органов, чтобы создать изображение их структуры. Специально обученный техник выполняет процедуру в офисе поставщика медицинских услуг, амбулаторном центре или больнице.Радиолог — врач, специализирующийся на медицинской визуализации — интерпретирует изображения. Анестезия для этой процедуры пациенту не требуется. Ультразвуковая допплерография показывает, сколько и как быстро кровь течет по артериям и венам, поэтому хирург может выбрать лучшие кровеносные сосуды для использования.
Хирург выполняет операцию по поводу AV-фистулы в поликлинике или больнице. Процедура сосудистого доступа может потребовать ночевки в больнице; однако многие пациенты после этого уходят домой. Врач использует местную анестезию, чтобы обезболить область, где хирург создает AV-свищ.
AV-фистуле часто требуется от 2 до 3 месяцев для развития или созревания, прежде чем пациент сможет использовать ее для гемодиализа. Если AV фистула не созревает после операции, хирург должен повторить процедуру.
В начале сеанса гемодиализа врач или пациент вставляют две иглы в сосудистый доступ. Одна игла переносит кровь от тела к диализатору. Другой переносит отфильтрованную кровь обратно в тело. Чтобы отличить иглы друг от друга, игла, которая уносит кровь от тела, называется артериальной иглой.Игла, по которой кровь возвращается к телу, называется венозной иглой. Некоторые пациенты предпочитают вставлять собственные иглы в сосудистый доступ, что требует обучения, чтобы узнать, как предотвратить инфекцию и защитить сосудистый доступ. Независимо от того, кто вводит иглы, пациент должен знать, как ухаживать за областью введения иглы, чтобы предотвратить инфицирование.
Если AV фистула не созревает, AV-трансплантат является вторым выбором для длительного сосудистого доступа.
Что такое артериовенозный трансплантат?
АВ-трансплантат — это петлеобразная пластиковая трубка, которая соединяет артерию с веной.Сосудистый хирург выполняет операцию по поводу AV трансплантата, как и операцию по поводу AV фистулы, в амбулаторном центре или больнице. Как и в случае хирургии AV-фистулы, пациенту может потребоваться переночевать в больнице, хотя многие пациенты могут пойти домой после процедуры. Врач использует местную анестезию, чтобы обезболить область, где хирург создает AV-трансплантат.
Пациент обычно может использовать AV-трансплантат через 2–3 недели после операции. AV-трансплантат чаще, чем AV-фистула, имеет проблемы с инфекцией и свертыванием.Повторяющиеся сгустки крови могут блокировать кровоток через трансплантат. Однако ухоженная прививка может прослужить несколько лет.
Подготовьте сосудистый доступ до начала гемодиализа
Пациентам следует подготовить сосудистый доступ задолго до начала гемодиализа, так как AV-фистулам и AV-трансплантатам нужно время, чтобы созреть, прежде чем они будут готовы к использованию. Поставщик медицинских услуг может помочь назначить встречу с сосудистым хирургом задолго до того, как пациент начнет гемодиализ, даже если пациент чувствует себя хорошо.Предоставление сосудистому доступу времени для созревания может помочь предотвратить проблемы с узкими венами, низким кровотоком и тромбами.
Перед процедурой медработники должны использовать тыльную сторону руки пациента для взятия крови, чтобы сохранить кровеносные сосуды в руке. Врач может научить пациента простым упражнениям, которые помогают увеличивать кровеносные сосуды для хирурга. Эти же упражнения способствуют увеличению размера AV-фистулы после процедуры.
[Вверх]
Что такое венозный катетер?
Венозный катетер — это трубка, вводимая в вену на шее, груди или ноге возле паха, обычно только для краткосрочного гемодиализа.После выхода из тела трубка разделяется на две части. Две пробирки имеют колпачки, предназначенные для подключения к линии, по которой кровь поступает в диализатор, и к линии, по которой кровь от диализатора возвращается к телу. При подключении и отключении катетера от трубок человек должен закрыть зажимы на каждой линии.
Если заболевание почек быстро прогрессирует, у пациента может не быть времени на установку AV-фистулы или AV-трансплантата до начала лечения гемодиализом.
Нефролог — врач, специализирующийся на проблемах с почками, — или интервенционный радиолог — врач, который использует медицинское оборудование для визуализации для выполнения операций — выполняет процедуру установки венозного катетера в больнице или амбулаторном центре.Пациенту вводят местную анестезию и седативный эффект, чтобы он оставался спокойным и расслабленным во время процедуры.
Венозные катетеры не подходят для длительного использования. При использовании венозного катетера у пациента может развиться тромб, инфекция или рубцевание вены, что приведет к сужению вены. Однако, если пациенту необходимо сразу начать гемодиализ, венозный катетер будет работать в течение нескольких недель или месяцев, пока хирург не сможет выполнить операцию длительного доступа и AV фистула или AV-трансплантат не успеют созреть.
Если операция по поводу фистулы или трансплантата не увенчалась успехом, пациенту потребуется длительный доступ к венозному катетеру. Когда пациенту требуется венозный катетер на срок более 3 недель, хирург будет «туннелировать» катетер под кожей, а не вводить его непосредственно в вену. Туннельный катетер более удобен и вызывает меньше проблем. Однако даже туннельные катетеры могут инфицироваться.
Какие проблемы может вызвать сосудистый доступ?
Все три типа сосудистого доступа — AV свищ, AV трансплантат и венозный катетер — могут вызывать проблемы, требующие дальнейшего лечения или хирургического вмешательства.Наиболее частые проблемы включают инфекцию доступа и низкий кровоток из-за свертывания крови в доступе.
Инфекция и низкий кровоток при правильно сформированных АВ свищах возникают реже, чем при АВ-трансплантатах и венозных катетерах. Тем не менее наличие AV-фистулы не гарантирует беспроблемный доступ.
AV-трансплантатов чаще развивают низкий кровоток, что свидетельствует о свертывании или сужении доступа. Затем для AV-трансплантата может потребоваться ангиопластика — процедура расширения узкой части.Другой вариант — операция на AV-трансплантате для замены узкой части.
Венозные катетеры чаще всего вызывают инфекцию и проблемы со свертыванием крови. Если эти проблемы развиваются, могут помочь лекарства. Антибиотики — это лекарства, которые борются с бактериями, которые могут вызвать инфекцию. Разжижающие кровь препараты, такие как варфарин, препятствуют свертыванию крови. Если эти методы лечения не дали результатов, нефрологу или интервенционному радиологу потребуется заменить катетер.
[Вверх]
Как пациент ухаживает за сосудистым доступом и защищает его?
Пациент может ухаживать за сосудистым доступом и защищать его по:
- Обеспечение того, чтобы поставщик медицинских услуг проверял доступ на наличие признаков инфекции или проблем с кровотоком перед каждым сеансом гемодиализа, даже если пациент вводит иглы.
- Постоянное поддержание доступа в чистоте.
- Использование сайта доступа только для диализа.
- Будьте осторожны, чтобы не ударить и не повредить доступ.
- Проверяю азарт доступа каждый день. Трепет — это ритмичная вибрация, которую человек может ощущать над сосудистым доступом.
- Наблюдение за признаками инфекции, включая покраснение, болезненность или гной, и сообщение о них.
- Запрещается надевать манжету для измерения кровяного давления на руку доступа.
- Без украшений или тесной одежды на месте доступа.
- Не спит, если рука доступа находится под головой или телом.
- Не поднимать тяжелые предметы и не давить на рычаг доступа.
Еда, диета и питание
Исследователи не обнаружили, что еда, диета и питание играют роль в возникновении или предотвращении проблем с сосудистым доступом.
Дополнительную информацию о правильном питании во время гемодиализа можно найти в разделе о здоровье NIDDK «Правильно питайтесь, чтобы чувствовать себя правильно при гемодиализе».
Что следует помнить
- Сосудистый доступ — это хирургически созданная вена, используемая для удаления и возврата крови во время гемодиализа.
- Артериовенозный (АВ) свищ — это соединение артерии с веной, выполненное сосудистым хирургом.
- Медицинские работники рекомендуют AV-фистулу по сравнению с другими видами доступа, потому что она
- Обеспечивает хороший кровоток для диализа.
- Длится дольше, чем другие типы доступа.
- Менее вероятность заражения или образования тромбов, чем при других способах доступа.
- АВ-трансплантат — это петлеобразная пластиковая трубка, которая соединяет артерию с веной.
- Венозный катетер — это трубка, вводимая в вену на шее, груди или ноге около паха, обычно только для кратковременного использования.
- Венозные катетеры не подходят для длительного гемодиализа. При использовании венозного катетера у пациента может развиться тромб, инфекция или рубцевание вены, что приведет к сужению вены.
- Все три типа сосудистого доступа могут вызвать проблемы, требующие дальнейшего лечения или хирургического вмешательства. Наиболее частые проблемы включают инфекцию доступа и низкий кровоток из-за свертывания крови в доступе.
Этот контент предоставляется Национальным институтом диабета, болезней органов пищеварения и почек (NIDDK), входящим в состав Национальных институтов здравоохранения. NIDDK переводит и распространяет результаты исследований через свои информационные центры и образовательные программы, чтобы повысить уровень знаний и понимания о здоровье и болезнях среди пациентов, медицинских работников и общественности. Контент, создаваемый NIDDK, тщательно проверяется учеными NIDDK и другими экспертами.
NIDDK благодарит:
Майкла Аллона, доктора медицины, Университет Алабамы в Бирмингеме
Эта информация не защищена авторским правом. NIDDK призывает людей свободно делиться этим контентом.
Июль 2014 г.
Страница не найдена — Boston Scientific
Перейти к основному содержанию
Перейти к поиску
Перейти к навигации по продукту
- Новости
- Карьера
- Инвесторам
США
- Профессионалов
Медицинские специальности
- Электрофизиология
- Медицина женского таза
- Гастроэнтерология
- Хирургия желудочно-кишечного тракта
- Гинекология
- Сердечная недостаточность
- Интервенционная кардиология
Лучшие сосудистые специалисты Джорджии | Институт сосудов Саванны
Прежде всего, мы искренне надеемся, что вы, ваша семья и друзья здоровы и останетесь здоровыми в эти тяжелые времена.
Мы хотим вас заверить, мы делаем все возможное, чтобы избежать перебоев в оказании вам помощи, поскольку COVID-19 (коронавирус) влияет на наше сообщество. Как специалисты в области здравоохранения, мы будем оставаться открытыми, внимательно отслеживая ситуацию и следуя указаниям наших должностных лиц в области общественного здравоохранения, государственных органов и местных государственных служащих.
В качестве основного бизнеса Саваннский институт сосудов и Центр доступа остаются ОТКРЫТЫМИ для посещений офисов, виртуальных / телемедицинских визитов и процедур.Для получения дополнительной информации о наших виртуальных / телемедицинских визитах звоните по телефону 912-629-7800.
Если вы плохо себя чувствуете, у вас жар, кашель, вы выезжали за пределы США в течение последних 30 дней или были в тесном контакте с любым подтвержденным пациентом с COVID-19, пожалуйста, свяжитесь с нами по телефону 912-629-7800 до прибытие на прием. Мы перенесем вашу встречу на будущее.
Чистота наших офисов и медицинских помещений остается главным приоритетом.Мы принимаем все возможные меры для защиты здоровья наших пациентов и персонала. Особое внимание уделяется мытью рук за счет увеличения количества станций санитарии для рук и дезинфекции мест общего пользования.
Чтобы свести к минимуму риск заражения наших пациентов и персонала, в наших офисах требуется постоянно носить маски или защитные маски для лица, и до дальнейшего уведомления мы не допускаем посетителей в наши офисы. Мы понимаем, что некоторым пациентам требуется помощь с поездкой и транспортом, но мы просим ваших гостей ждать вас за пределами нашего офиса, за исключением законных медицинских доверенных лиц.Кроме того, перед регистрацией вас попросят заполнить небольшую анкету для проверки здоровья и измерить температуру у сотрудника.
Будьте в курсе местной ситуации с COVID-19. Знайте, где можно найти надежную и актуальную информацию в вашем районе. Следите за последней информацией на веб-сайте CDC COVID-19, а также на веб-сайте вашего государственного и местного департамента здравоохранения. Центры по контролю и профилактике заболеваний выпустили руководство по предотвращению распространения COVID-19 в сообществах, включая руководство для предприятий и работодателей, а также рекомендации по очистке и дезинфекции.Руководство будет обновляться по мере поступления информации.
По всем вопросам обращайтесь к нам, 912-629-7800
С уважением,
Сосудистый институт Саванны
Дом — Сосудистое общество Малайзии.
Добро пожаловать на сайт Общества сосудов Малайзии.
Сосудистому обществу Малайзии почти два десятилетия, и в течение этого периода наблюдалась быстрая эволюция помощи пациентам с сосудистыми заболеваниями.Современные сосудистые хирурги участвуют во всех аспектах ухода за пациентами — от профилактики до лечения и реабилитации. За последние два десятилетия сосудистые хирурги стали широко использовать эндоваскулярную терапию, и это значительно расширило наш арсенал. Термин сосудистый хирург теперь является синонимом эндоваскулярного хирурга, так как он / она сможет предоставить весь спектр терапии, включая медицинскую, хирургическую, а также эндоваскулярную терапию.
Сосудистое общество Малайзии будет сотрудничать с другими братствами, которые занимаются лечением сосудистых пациентов, побуждая нефрологов, интервенционных радиологов, кардиоторакальных хирургов и кардиологов к совместным усилиям по улучшению ухода за пациентами
пациенты.
В настоящее время мы сталкиваемся с беспрецедентной пандемией, которой не было в нашей жизни. Это изменило то, как мы работаем, поскольку теперь мы ищем новые способы удаленного ведения общественной деятельности. Сюда входят вебинары, онлайн-обсуждения и даже онлайн
конференции. Таким образом, в ближайшие месяцы Сосудистое общество Малайзии изменит привычный метод нашей деятельности.
Веб-сайты, в которых используются масштабные средства массовой информации, оказались ценным инструментом для распространения информации не только среди медицинского сообщества, но и среди широкой общественности.Сосудистое общество Малайзии обновит веб-сайт, чтобы пользователи могли получать ценную информацию о сосудистых заболеваниях. Это также позволит некоторым нашим действующим корпоративным членам предоставлять ссылки на свои последние продукты и инновации.
Наконец, потратьте некоторое время на изучение различных образовательных материалов на этом веб-сайте, которые будут периодически обновляться. Кроме того, обратите внимание на различные мероприятия, которые запланированы на месте или в Интернете.
Оставайтесь в безопасности.
Доктор.Нареш Говиндараджантран
Президент
Сосудистое общество Малайзии
.

 RU — Допплеросонография периферических сосудов, часть I
RU — Допплеросонография периферических сосудов, часть I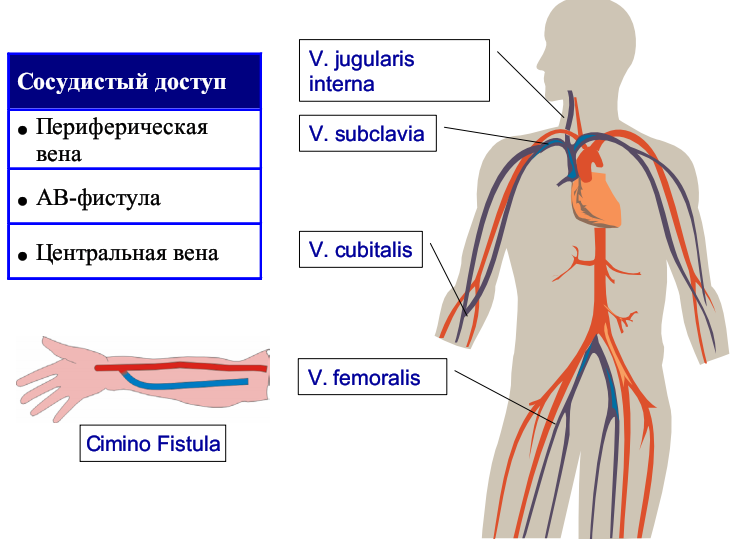 3а), на допплерограмме, полученной с ВСА, определяются широкий систолический пик и высокая диастолическая составляющая (рис. 3б). Для контроля проводится проба D.Russel. После получения допплеровского спектра с лоцируемой артерии проводится кратковременная компрессия поверхностной височной артерии (непосредственно перед козелком уха) на стороне исследования. При локации НСА на допплерограмме появятся дополнительные пики, при локации ВСА форма кривой не изменится.
3а), на допплерограмме, полученной с ВСА, определяются широкий систолический пик и высокая диастолическая составляющая (рис. 3б). Для контроля проводится проба D.Russel. После получения допплеровского спектра с лоцируемой артерии проводится кратковременная компрессия поверхностной височной артерии (непосредственно перед козелком уха) на стороне исследования. При локации НСА на допплерограмме появятся дополнительные пики, при локации ВСА форма кривой не изменится. — No3.-1995.
— No3.-1995. Pulseless Transcranial Doppler Finding in Takayasu’s Arteritis. J. of Clinical Ultrasound. Sept. 1990.
Pulseless Transcranial Doppler Finding in Takayasu’s Arteritis. J. of Clinical Ultrasound. Sept. 1990. 5)
5)