25.12.2020 С Новым Годом и Рождеством! | ||
| ||
| Подробнее | ||
22.09.2020 Операция по устранению нестабильности правого плечевого сустава | ||
| ||
| Подробнее | ||
17.07.2020 Приглашаем 21 июля 2020 в 15.00 на онлайн-конференцию «Предоперационное планирование — золотой стандарт в ортопедии» | ||
| ||
| Подробнее | ||
19. 06.2020 06.2020 День медицинского работника | ||
| ||
| Подробнее | ||
10.03.2020 Поздравляем с 8 Марта! | ||
| ||
| Подробнее | ||
| Страницы: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 |
Способы стерилизация собак и кошек – статья о лечении животных ИВЦ МВА
Автор статьи: Собакина Светлана Константиновна, ветеринарный врач-хирург, руководитель отделения хирургии.
Стерилизация – это операция, направленная на удаление репродуктивных органов самок, заключается в удалении матки и яичников. Во-время проведенная стерилизация снижает риски возникновения рака молочных желез и репродуктивных органов, гнойного воспаления матки (пиометра), а также меняет нрав животного в лучшую сторону.
Принимая решение о необходимости стерилизовать свое животное многие задаются вопросом: какой способ стерилизации выбрать для своего питомца?
Существуют три возможных хирургических способа стерилизации:
- Лапаротомия по белой линии живота
- Лапароскопическая стерилизация
- Стерилизация через боковой доступ
Лапаротомия по белой линии живота является наиболее распространенным методом стерилизации. Выполняется разрез в несколько сантиметров в месте соединения мышц брюшной стенки (белая линия). В результате чего можно хорошо визуализировать всю репродуктивную систему и проводить операцию.
Лапароскопическая стерилизация – это минимально инвазивный способ стерилизации кошек и собак. Операция выполняется через 2 маленьких прокола на животе размером около 0.5 – 1 см в зависимости от размера животного, избегая одного большого разреза, как при полостной операции. В данные проколы устанавливаются специальные порты, через которые вводятся камера и инструменты. Камера позволяет хирургу увеличивать изображение, что способствует лучшей визуализации и точности движений инструментов. Данная методика позволяет снизить уровень боли и ускорить послеоперационное восстановление.
Стерилизация через боковой доступ – доступ в брюшную полость проводится вдоль мышечных волокон боковой брюшной стенки. У данного способа есть строгие показания, противопоказания и риски возможных послеоперационных осложнений.
Лапароскопическая стерилизация кошки
Единственными показаниями к стерилизации через боковой доступ считаются наличие гиперплазии (увеличение) молочных желез, когда они увеличиваются до такой степени, что при стандартном доступе по белой линии невозможность избежать их повреждения, а также стерилизация диких или бездомных животных, связано это с тем, что, выполнив боковой доступ, значительно проще визуально отслеживать состояние послеоперационной раны на расстоянии.
Противопоказаниями данного метода являются:
— беременность
— пиометра
— ожирение
— возраст моложе 12 недель
В связи с особенностями доступа у него существует ряд недостатков и возможных осложнений, вероятность которых выше в сравнении с другими способами стерилизации:
— вероятность заметных рубцов на теле после операции, что, к примеру, недопустимо для выставочных животных
— недостаточная визуализация внутренних органов, в т.ч. матки и яичников, что может привести к нарушению техники операции
— повышенный риск кровотечения
— повышенный риск возникновения реминантного яичника (оставление клеток или тканей яичника в брюшной полости)
— более длительное заживление операционной раны, чаще встречаются отеки и гематомы
Исходя из всего вышеперечисленного, можно прийти к выводу, что методом выбора для домашней кошки или собаки является стерилизация по белой линии живота или лапароскопическая стерилизация.
Берегите здоровье своих питомцев!
Вернуться к списку
СОВРЕМЕННЫЕ СПОСОБЫ ОБРАБОТКИ И СТЕРИЛИЗАЦИИ АЛЛОГЕННЫХ КОСТНЫХ ТКАНЕЙ (обзор литературы). | Воробьев
1. Haeseker B. Mr. Job van Meekeren (1611-1666) and surgery of the hand. Plast Reconstr Surg. 1988;82(3):539-546.
2. Henkel J., Woodruff M.A., Epari D.R., Steck R., Glatt V., Dickinson I.C., Choong P.F., Schuetz M.A., Hutmacher D.W. Bone Regeneration Based on Tissue Engineering Conceptions — A 21st Century Perspective. Bone Res. 2013;1(3):216-248. DOI: 10.4248/BR201303002.
3. Lomas R., Chandrasekar A., Board T.N. Bone allograft in the UK: perceptions and realities. Hip Int. 2013;23(5): 427-433. DOI: 10.5301/hipint.5000018.
Hip Int. 2013;23(5): 427-433. DOI: 10.5301/hipint.5000018.
4. Тихилов Р.М., Шубняков И.И., Коваленко А.Н., Черный А.Ж., Муравьева Ю.В., Гончаров М.Ю. Данные регистра эндопротезирования тазобедренного сустава РНИИТО им. Р.Р. Вредена за 2007–2012 годы. Травматология и ортопедия России. 2013;(3):167-190. Tikhilov R.M., Shubnyakov I.I., Kovalenko A.N., Cherniy A.Zh., Muravyeva Yu.V., Goncharov M.Yu. [Data of hip arthroplasty registry of Vreden Russian Research Institute for Traumatology and Orthopedics for the period 2007–2012 years]. Travmatologiya i Ortopediya Rossii [Traumatology and Orthopedics of Russia]. 2013;(3):167-190. (in Russian).
5. Корнилов Н.Н., Куляба Т.А., Филь А.С., Муравьёва Ю.В. Данные регистра эндопротезирования коленного сустава РНИИТО им. Р.Р. Вредена за 2011–2013 годы. Травматология и ортопедия России. 2015;(1):136-151. DOI: 10.21823/2311-2905-2015-0-1-136-151. Kornilov N.N., Kulyaba T.A., Fil A.S., Muravyeva Yu.V. [Data of knee arthroplasty register of Vreden Russian Research Institute of Traumatology and orthopedics for period 2011–2013]. Travmatologiya i ortopediya Rossii [Traumatology and orthopedics of russia]. 2015;(1): 136-151. (in Russian). DOI: 10.21823/2311-2905-2015-0-1-136-151
DOI: 10.21823/2311-2905-2015-0-1-136-151. Kornilov N.N., Kulyaba T.A., Fil A.S., Muravyeva Yu.V. [Data of knee arthroplasty register of Vreden Russian Research Institute of Traumatology and orthopedics for period 2011–2013]. Travmatologiya i ortopediya Rossii [Traumatology and orthopedics of russia]. 2015;(1): 136-151. (in Russian). DOI: 10.21823/2311-2905-2015-0-1-136-151
6. Мухаметов У.Ф., Мухаметов Ф.Ф., Сулейманов Я.Н., Нагаев Р.Я., Нигматуллин Р.Т., Шангина О.Р. Некоторые аспекты ревизионного эндопротезирования тазобедренного сустава. Пластика костных дефектов губчатыми аллоплантами. Гений ортопедии. 2016;(4):29-35. DOI 10.18019/1028-4427-2016-4-29-35. Mukhametov U.F., Mukhametov F.F., Suleimanov I.N., Nagaev R.I., Nigmatullin R.T., Shangina O.R. [Some aspects of the hip arthroplasty revision. Bone defect plasty with sponge allografts]. Genij Ortopedii [Orthopedic Genius]. 2016;(4):29-35. (in Russian). DOI: 10.18019/1028-4427-2016-4-29-35.
DOI: 10.18019/1028-4427-2016-4-29-35.
7. Hernigou P., Pariat J., Queinnec S., Homma Y., Flouzat Lachaniette C.H., Chevallier N., Rouard H. Supercharging irradiated allografts with mesenchymal stem cells improves acetabular bone grafting in revision arthroplasty. Int Orthop. 2014;38(9):1913-1921. DOI: 10.1007/s00264-014-2285-2.
8. Oryan A., Alidadi S., Moshiri A., Maffulli N. Bone regenerative medicine: classic options, novel strategies, and future directions. J Orthop Surg Res. 2014;9(1):18. DOI: 10.1186/1749-799X-9-18.
9. Brydone A.S., Meek D, Maclaine S. Bone grafting, orthopaedic biomaterials, and the clinical need for bone engineering. Proc Inst Mech Eng H. 2010;224(12):1329-1343.
10. Costain D.J., Crawford R.W. Fresh-frozen vs. irradiated allograft bone in orthopaedic reconstructive surgery. Injury. 2009;40(12):1260-1264. DOI: 10.1016/j.injury.2009.01.116.
Costain D.J., Crawford R.W. Fresh-frozen vs. irradiated allograft bone in orthopaedic reconstructive surgery. Injury. 2009;40(12):1260-1264. DOI: 10.1016/j.injury.2009.01.116.
11. Кирилова И.А., Садовой М.А., Подорожная В.Т. Сравнительная характеристика материалов для костной пластики: состав и свойства. Хирургия позвоночника. 2012;(3):72-83. Kirilova I.A., Sadovoy M.A., Podorozhnaja V.T. [Comparative Characteristics of Materials for Bone Grafting: Composition and Properties]. Khirurgiya pozvonochnika [Spine surgery]. 2012;(3):72-83. (in Russian).
12. Bauer T.W., Muschler G.F. Bone grafts materials. An overview of the basic science. Clin Orthop Relat Res. 2000;(371):10-27.
13. Hench L.L. Biomaterials: a forecast for the future. Biomaterials. 1998;19(16):1419-1423.
14. Nandi S.K., Roy S., Mukherjee P., Kundu B., De D.K., Basu D. Orthopedic applications of bone graft and graft substitutes: a review. Indian J Med Res. 2010;132:15-30.
15. Urist M.R., Silverman B.F., Büring K., Dubuc F.L., Rosenberg J.M. The bone induction principle. Clin Orthop Relat Res. 1967;53:243-83.
16. Giannoudis P.V., Einhorn T.A., Marsh D. Fracture healing: the diamond concept. Injury. 2007;38(4):3-6.
17. Лекишвили М.В., Склянчук Е.Д., Акатов В.С., Очкуренко А.А., Гурьев В.В., Рагинов И.С., Бугров С.Н., Рябов А.Ю., Фадеева И.С., Юрасова Ю.Б., Чеканов А.С. Костнопластические остеоиндуктивные материалы в травматологии и ортопедии. Гений ортопедии. 2015;(4):61-67. DOI: 10.18019/1028-4427-2015-4-61-67. Lekishvili M.V., Sklianchuk E.D., Akatov V.S., Ochkurenko A.A., Gur’ev V.V., Raginov I.S., Bugrov S.N., Riabov A.Iu., Fadeeva I.S., Iurasova Ju.B., Chekanov A.S. [Osteoplastic osteoinductive materials in traumatology and orthopaedics]. Genij Ortopedii [Orthopedic Genius]. 2015;(4):61-67. (in Russian). DOI: 10.18019/1028-4427-2015-4-61-67.
DOI: 10.18019/1028-4427-2015-4-61-67. Lekishvili M.V., Sklianchuk E.D., Akatov V.S., Ochkurenko A.A., Gur’ev V.V., Raginov I.S., Bugrov S.N., Riabov A.Iu., Fadeeva I.S., Iurasova Ju.B., Chekanov A.S. [Osteoplastic osteoinductive materials in traumatology and orthopaedics]. Genij Ortopedii [Orthopedic Genius]. 2015;(4):61-67. (in Russian). DOI: 10.18019/1028-4427-2015-4-61-67.
18. Smith C.A., Richardson S.M., Eagle M.J., Rooney P., Board T., Hoyland J.A. The use of a novel bone allograft wash process to generate a biocompatible, mechanically stable and osteoinductive biological scaffold for use in bone tissue engineering. J Tissue Eng Regen Med. 2015;9(5): 595-604. DOI: 10.1002/term.1934.
19. Islam A., Chapin K., Moore E., Ford J., Rimnac C., Akkus O. Gamma Radiation Sterilization Reduces the High-cycle Fatigue Life of Allograft Bone. Clin Orthop Relat Res. 2016;474(3):827-835. DOI: 10.1007/s11999-015-4589-y.
Clin Orthop Relat Res. 2016;474(3):827-835. DOI: 10.1007/s11999-015-4589-y.
20. Elsalanty M.E., Genecov D.G. Bone grafts in craniofacial surgery. Craniomaxillofac Trauma Reconstr. 2009;2(3): 125-134. DOI: 10.1055/s-0029-1215875.
21. Woodruff M.A., Lange C., Reichert J., Berner A., Chen F., Fratzl P., Schantz J.T., Hutmacher D.W. Bone tissue engineering: from bench to bedside. Materials Today. 2012;15(10):430-434. DOI: 10.1016/S1369-7021(12)70194-3.
22. Man W.Y., Monni T., Jenkins R., Roberts P. Post-operative infection with fresh frozen allograft: reported outcomes of a hospital-based bone bank over 14 years. Cell Tissue Bank. 2016;17(2):269-275. DOI:10.1007/s10561-016-9547-8.
23. Delloye C., Simon P., Nyssen-Behets C., Banse X., Bresler F., Schmitt D. Perforations of cortical bone allografts improve their incorporation. Clin Orthop Relat Res. 2002;(396): 240-247.
Delloye C., Simon P., Nyssen-Behets C., Banse X., Bresler F., Schmitt D. Perforations of cortical bone allografts improve their incorporation. Clin Orthop Relat Res. 2002;(396): 240-247.
24. Lomas R., Drummond O., Kearney J.N. Processing of whole femoral head allografts: A method for improving clinical efficacy and safety. Cell Tissue Bank. 2000;1(3):193-200. DOI: 10.1023/A:1026512312385.
25. Fölsch C., Mittelmeier W., Bilderbeek U., Timmesfeld N., von Garrel T., Peter Matter H. Effect of Storage Temperature on Allograft Bone. Transfus Med Hemother. 2012;39(1):36-40. DOI: 10.1159/000335647.
26. Parkes A.S. Factors affecting the viability of frozen ovarian tissue. J Endocrinol. 1958;17(4):337-343.
27. Taylor A.C. The physical state of transition in the freezing of living cells. Ann N Y Acad Sci. 1960;85:595-609.
Taylor A.C. The physical state of transition in the freezing of living cells. Ann N Y Acad Sci. 1960;85:595-609.
28. Vastel L., Masse C., Mesnil P., Crozier E., Padilla F., Laugier P., Mitton D., Courpied J.P. Comparative ultrasound evaluation of human trabecular bone graft properties after treatment with different sterilization procedures J Biomed Mater Res B Appl Biomater. 2009;90(1):430-437. DOI: 10.1002/jbm.b.31302.
29. DePaula C.A., Truncale K.G., Gertzman A.A., Sunwoo M.H., Dunn M.G. Effects of hydrogen peroxide cleaning procedures on bone graft osteoinductivity and mechanical properties. Cell Tissue Bank. 2005;6(4):287-298. DOI: 10.1007/s10561-005-3148-2.
30. Eagle M.J., Man J., Rooney P., Hogg P., Kearney J.N. Assessment of an improved bone washing protocol for deceased donor human bone. Cell Tissue Bank. 2015;16(1):83-90. DOI: 10.1007/s10561-014-9443-z.
Cell Tissue Bank. 2015;16(1):83-90. DOI: 10.1007/s10561-014-9443-z.
31. Rauh J., Despang F., Baas J., Liebers C., Pruss A., Gelinsky M., Günther K.P., Stiehler M. Comparative biomechanical and microstructural analysis of native versusperacetic acid-ethanol treated cancellous bone graft. Biomed Res Int. 2014;2014:784702. DOI: 10.1155/2014/784702.
32. Russell N., Rives A., Pelletier M.H., Wang T., Walsh W.R. The effect of supercritical carbon dioxide sterilization on the anisotropy of bovine cortical bone. Cell Tissue Bank. 2015;16(1):109-121. DOI: 10.1007/s10561-014-9447-8.
33. Ruphuy G., Souto-Lopes M., Paiva D., Costa P., Rodrigues A.E., Monteiro F.J., Salgado C.L., Fernandes M.H., Lopes J.C., Dias M.M., Barreiro M.F. Supercritical CO2 assisted process for the production of high-purity and sterile nano-hydroxyapatite/chitosan hybrid scaffolds. J Biomed Mater Res B Appl Biomater. 2017 May 4 [Epub ahead of print]. DOI: 10.1002/jbm.b.33903.
J Biomed Mater Res B Appl Biomater. 2017 May 4 [Epub ahead of print]. DOI: 10.1002/jbm.b.33903.
34. Mohr J., Germain M., Winters M., Fraser S., Duong A., Garibaldi A., Simunovic N., Alsop D., Dao D., Bessemer R., Ayeni O.R. Bioburden Steering Committee and Musculoskeletal Tissue Working group. Disinfection of human musculoskeletal allografts in tissue banking: a systematic review. Cell Tissue Bank. 2016;17(4):573-584. DOI: 10.1007/s10561-016-9584-3.
35. Singh R., Singh D., Singh A. Radiation sterilization of tissue allografts: A review. World J Radiol. 2016;8(4): 355-369. DOI: 10.4329/wjr.v8.i4.355.
36. Wassilew G.I., Janz V., Renner L., Perka C., Pruss A. Reduced rates of non-union with modified periacetabular osteotomy using peracetic-acid sterilized cancellous allografts. Cell Tissue Bank. 2016;17(4):713-720. DOI: 10.1007/s10561-016-9587-0.
Cell Tissue Bank. 2016;17(4):713-720. DOI: 10.1007/s10561-016-9587-0.
37. Indelicato P.A., Ciccotti M.G., Boyd J., Higgins L.D., Shaffer B.S., Vangsness C.T. Jr. Aseptically processed and chemically sterilized BTB allografts for anterior cruciate ligament reconstruction: a prospective randomized study. Knee Surg Sports Traumatol Arthrosc. 2013;21(9): 2107-2112. DOI: 10.1007/s00167-012-2309-7.
38. Dunsmuir R.A., Gallacher G. Microwave sterilization of femoral head allograft. J Clin Microbiol. 2003;41(10):4755-4757.
39. Singh R., Singh D. Sterilization of bone allografts by microwave and gamma radiation. Int J Radiat Biol. 2012;88(9):661-666. DOI: 10.3109/09553002.2012.700166.
40. Матвейчук И.В., Розанов В.В., Пантелеев В.И., Агалакова Л.М., Кирилова И.А. Инновационные подходы к совершенствованию процесса стерилизации для решения задач биоимплантологии. Вопросы биологической, медицинской и фармацевтической химии. 2013;11(11):92-97. Matveychuk I.V., Rozanov V.V., Panteleev V.I., Agalakova L.M., Kirilova I.A. [Innovative approaches to improvement of process of sterilization for the solution of problems of bioimplantology]. Voprosy biologicheskoi, meditsinskoi i farmatsevticheskoi khimii [Problems of Biological, Medical and Pharmaceutical Chemistry]. 2013;11(11):92-97.
Матвейчук И.В., Розанов В.В., Пантелеев В.И., Агалакова Л.М., Кирилова И.А. Инновационные подходы к совершенствованию процесса стерилизации для решения задач биоимплантологии. Вопросы биологической, медицинской и фармацевтической химии. 2013;11(11):92-97. Matveychuk I.V., Rozanov V.V., Panteleev V.I., Agalakova L.M., Kirilova I.A. [Innovative approaches to improvement of process of sterilization for the solution of problems of bioimplantology]. Voprosy biologicheskoi, meditsinskoi i farmatsevticheskoi khimii [Problems of Biological, Medical and Pharmaceutical Chemistry]. 2013;11(11):92-97.
41. Rediguieri C.F., Pinto Tde. J., Bou-Chacra N.A., Galante R., de Araújo G.L., Pedrosa Tdo N., Maria-Engler S.S., De Bank P.A. Ozone Gas as a Benign Sterilization Treatment for PLGA Nanofiber Scaffolds. Tissue Eng Part C Methods. 2016;22(4):338-347. DOI: 10.1089/ten.TEC.2015.0298.
42. Shintani H. Ethylene Oxide Gas Sterilization of Medical Devices. Biocontrol Sci. 2017;22(1):1-16. DOI: 10.4265/bio.22.1.
Shintani H. Ethylene Oxide Gas Sterilization of Medical Devices. Biocontrol Sci. 2017;22(1):1-16. DOI: 10.4265/bio.22.1.
43. Калашников В.В., Гордеев А.В., Павлов Е.П., Бушманов Ю.А. Разработка и применение метода радиационной стерилизации в Федеральном медицинском биофизическом центре им. А. И. Бурназяна (обзор). Саратовский научно-медицинский журнал. 2014;10(4):844-849. Kalashnikov V.V., Gordeev A.V., Pavlov E.P., Bushmanov U.A. [Development and application of radiation sterilization method in Federal Medical and Biophysical centre n.a. A.I. Burnazyan (review)]. Saratovskiy nauchnomeditsinskiy zhurnal [Saratov Journal of Medical Scientic Research]. 2014;10(4):844-849.
44. Moore T.M., Gendler E., Gendler E.. Viruses adsorbed on musculoskeletal allografts are inactivated by terminal ethylene oxide disinfection. J Orthop Res. 2004;22(6): 1358-1361. DOI: 10.1016/j.orthres.2004.05.002.
DOI: 10.1016/j.orthres.2004.05.002.
45. Trump J.G., Van De Graaff R.J. Irradiation of biological materials by high energy roentgen rays and cathode rays. J Applied Physics. 1948;19:599-604. DOI: 10.1063/1.1698178.
46. Nguyen H, Morgan DA, Forwood MR. Sterilization of allograft bone: effects of gamma irradiation on allograft biology and biomechanics. Cell Tissue Bank. 2007;8(2): 93-105. DOI: 10.1007/s10561-006-9020-1.
47. Nguyen H., Morgan D.A., Forwood M.R. Sterilization of allograft bone: is 25 kGy the gold standard for gamma irradiation? Cell Tissue Bank. 2007;8(2):81-91. DOI: 10.1007/s10561-006-9019-7.
48. Tallentire A. The Spectrum of Microbial Radiation Sensitivity. Radiat Phys Chem. 1980;15:83-89. DOI: 10.1016/0146-5724(80)9 0101-6.
1980;15:83-89. DOI: 10.1016/0146-5724(80)9 0101-6.
49. Dziedzic-Goclawska A., Kaminski A., UhrynowskaTyszkiewicz I., Stachowicz W. Irradiation as a safety procedure in tissue banking. Cell Tissue Bank. 2005;6(3):201-219. DOI: 10.1007/s10561-005-0338-x.
50. Conway B., Tomford W., Mankin H.J., Hirsch M.S., Schooley R.T. Radiosensitivity of HIV-1-potential application to sterilization of bone allografts. AIDS. 1991;5(5):608-609.
51. Шангина О.Р., Нигматуллин Р.Т. Влияние радиационной стерилизации на структуру и свойства биоматериалов. Морфология. 2006;129(3):44-47. Shangina O.R., Nigmatullin R.T. [Effect of radiation sterilization on biomaterial structure and properties]. Morfologiya [Morphology]. 2006;129(3):44-47.
52. Шангина О.Р., Хасанов Р.А. Организационная структура и технологическая схема тканевого банка «ALLOPLANT®». Технологии живых систем. 2015;12(4):66-67. Shangina O.R., Khasanov R.A. [Organizational structure and technological scheme of “Alloplant®” tissue bank]. Tekhnologii zhivykh sistem [Technologies of Living Systems]. 2015;12(4):66-67.
Шангина О.Р., Хасанов Р.А. Организационная структура и технологическая схема тканевого банка «ALLOPLANT®». Технологии живых систем. 2015;12(4):66-67. Shangina O.R., Khasanov R.A. [Organizational structure and technological scheme of “Alloplant®” tissue bank]. Tekhnologii zhivykh sistem [Technologies of Living Systems]. 2015;12(4):66-67.
53. Hoburg A., Keshlaf S., Schmidt T., Smith M., Gohs U., Perka C., Pruss A., Scheffler S. High-dose electron beam sterilization of soft-tissue grafts maintains significantly improved biomechanical properties compared to standard gamma treatment. Cell Tissue Bank. 2015;16(2):219-226. DOI: 10.1007/s10561-014-9461-x.
54. Burton B., Gaspar A., Josey D., Tupy J., Grynpas M.D., Willett T.L. Bone embrittlement and collagen modifications due to high-dose gamma-irradiation sterilization. Bone. 2014;61:71-81. DOI: 10.1016/j.bone.2014.01.006.
DOI: 10.1016/j.bone.2014.01.006.
55. Loty B., Courpied J.P., Tomeno B., Postel M., Forest M., Abelanet R.. Bone allografts sterilised by irradiation. Biological properties, procurement and results of 150 massive allografts. Int Orthop. 1990;14(3):237-242.
56. Wientroub S., Reddi A.H. Influence of irradiation on the osteoindictive potential of demineralized bone matrix. Calcif Tissue Int. 1988;42(4):255-260.
57. Balsly C.R., Cotter A.T., Williams L.A., Gaskins B.D., Moore M.A., Wolfinbarger L. Jr. Effect of low dose and moderate dose gamma irradiation on the mechanical properties of bone and soft tissue allografts. Cell Tissue Bank. 2008;9(4):289-298. DOI: 10.1007/s10561-008-9069-0.
58. Seto A., Gatt C.J. Jr, Dunn M.G. Radioprotection of tendon tissue via crosslinking and free radical scavenging. Clin Orthop Relat Res. 2008;466(8):1788-1795. DOI: 10.1007/s11999-008-0301-9.
Seto A., Gatt C.J. Jr, Dunn M.G. Radioprotection of tendon tissue via crosslinking and free radical scavenging. Clin Orthop Relat Res. 2008;466(8):1788-1795. DOI: 10.1007/s11999-008-0301-9.
59. Reid J., Sikka R., Tsoi W., Narvy S.J., Hedman T., Lee T.Q., Vangsness C.T. Jr. Sterilization effects on the mechanical properties of human bone-patellar tendon-bone allografts. Orthopedics. 2010;33(4). DOI: 10.3928/01477447-20100225-06.
60. Burgess H.W., Mackrell J., Toms D., Karunanidhi A., Vaidya S., Hollinger J.O., Grieb T.A., Bertenshaw G.P. Response of bone subjected to optimized high dose irradiation. J Biomater Appl. 2010;24(5):387-400. DOI: 10.1177/0885328208097088.
61. Alanay A., Wang J.C., Shamie A.N., Napoli A., Chen C., Tsou P. A novel application of high dose rate (50kGy) gamma irradiation for demineralized bone matrix: effects on fusion rate in a rat spinal fusion model. Spine J. 2008;8(5): 789-795. DOI: 10.1016/j.spinee.2007.06.009.
Spine J. 2008;8(5): 789-795. DOI: 10.1016/j.spinee.2007.06.009.
62. Attia T., Woodside M., Minhas G., Lu X.Z., Josey D.S., Burrow T., Grynpas M., Willett T.L. Development of a novel method for the strengthening and toughening of irradiation-sterilized bone allografts. Cell Tissue Bank. 2017 May 30 [Epub ahead of print]. DOI: 10.1007/s10561-017-9634-5.
63. Pruss A., Kao M., von Garrel T., Frommelt L., Gürtler L., Benedix F., Pauli G. Virus inactivation in bone tissue transplants (femoral heads) by moist heat with the ‘Marburg bone bank system’. Biologicals. 2003;31(1):75-82.
64. Shin S., Yano H., Fukunaga T., Ikebe S., Shimizu K., Kaku N., Nagatomi H., Masumi S. Masumi Biomechanical properties of heat-treated bone grafts. Arch Orthop Trauma Surg. 2005;125(1):1-5. DOI: 10.1007/s00402-004-0746-6.
DOI: 10.1007/s00402-004-0746-6.
65. Vangsness C.T. Jr, Mitchell W. 3rd, Nimni M., Erlich M., Saadat V., Schmotzer H. Collagen shortening. An experimental approach with heat. Clin Orthop Relat Res. 1997;(337):267-271.
66. Pruss A., Seibold M., Benedix F., Frommelt L., von Garrel T., Gürtler L., Dörffel Y., Pauli G, Göbel UB. Validation of the ‘Marburg bone bank system’ for thermodisinfection of allogenic femoral head transplants using selected bacteria, fungi, and spores. Biologicals. 2003;31(4):287-294.
Современное состояние и перспективные инновационные направления развития способов стерилизации биоимплантатов | Розанов
1. Nemzek JA, Arnoczky SP, Swenson CL. Retroviral transmission in bone allotransplantation. The effects of tissue processing. Clin Orthop Relat Res. 1996;(324):275–82.
The effects of tissue processing. Clin Orthop Relat Res. 1996;(324):275–82.
2. Marthy S, Richter M. Human immunodeficiency virus activity in rib allografts. J Oral Maxillofac Surg. 1998;56(4):474–6. doi: 10.1016/s0278-2391(98)90716-9.
3. Martinez OV, Buck BE, Hernandez M, Malinin T. Blood and marrow cultures as indicators of bone contamination in cadaver donors. Clin Orthop Relat Res. 2003;(409):317–24. doi: 10.1097/01.blo.0000053343.97749.21.
4. Singh R, Singh D, Singh A. Radiation sterilization of tissue allografts: A review. World J Radiol. 2016;8(4):355–69. doi: 10.4329/wjr.v8.i4.355.
5. Пантелеев ВИ, Розанов ВВ, Матвейчук ИВ, Лекишвили МВ, Сысоев НН, Шутеев СА, Альков СВ, Андреева ТМ. Медицинские озоновые технологии. Новые задачи, возможности, оборудование. Биомедицинская радиоэлектроника. 2013;(2):3–11.
Медицинские озоновые технологии. Новые задачи, возможности, оборудование. Биомедицинская радиоэлектроника. 2013;(2):3–11.
6. Матвейчук ИВ, Розанов ВВ, Пантелеев ВИ, Агалакова ЛМ, Кирилова ИА. Инновационные подходы к совершенствованию процесса стерилизации для решения задач биоимплантологии. Вопросы биологической, медицинской и фармацевтической химии. 2013;(11):92–8.
7. Алимов АС, Близнюк УА, Борщеговская ПЮ, Варзарь СМ, Еланский СН, Ишханов БС, Литвинов ЮЮ, Матвейчук ИВ, Николаева АА, Розанов ВВ, Студеникин ФР, Черняев АП, Шведунов ВИ, Юров ДС. Применение пучков ускоренных электронов для радиационной обработки продуктов питания и биоматериалов. Известия Российской академии наук. Серия физическая. 2017;81(6):819–23.
8. Розанов ВВ, Матвейчук ИВ, Лекишвили МВ, Литвинов ЮЮ, Андреева ТМ, Николаева АА. Инновационные подходы к стерилизации костных имплантатов. Технологии живых систем. 2015;12(4):74–6.
Инновационные подходы к стерилизации костных имплантатов. Технологии живых систем. 2015;12(4):74–6.
9. Aho AJ, Hirn M, Aro HT, Heikkilä JT, Meurman O. Bone bank service in Finland. Experience of bacteriologic, serologic and clinical results of the Turku Bone Bank 1972-1995. Acta Orthop Scand. 1998;69(6):559–65. doi: 10.3109/17453679808999255.
10. Czapliński J. Sterilisation with ethylene oxide – economics and safety. Forum Zakażeń. 2014;5(4):235–7. doi: dx.doi.org/10.15374/FZ2014041.
11. Kearney JN, Bojar R, Holland KT. Ethylene oxide sterilisation of allogenic bone implants. Clin Mater. 1993;12(3):129–35. doi 10.1016/0267-6605(93)90063-d.
12. Kakiuchi M, Ono K. Preparation of bank bone using defatting, freeze-drying and sterilisation with ethylene oxide gas. Part 2. Clinical evaluation of its efficacy and safety. Int Orthop. 1996;20(3):147–52. doi: 10.1007/s002640050052.
Part 2. Clinical evaluation of its efficacy and safety. Int Orthop. 1996;20(3):147–52. doi: 10.1007/s002640050052.
13. Kakiuchi M, Ono K, Nishimura A, Shiokawa H. Preparation of bank bone using defatting, freeze-drying and sterilisation with ethylene oxide gas. Part 1. Experimental evaluation of its efficacy and safety. Int Orthop. 1996;20(3): 142–6. doi: 10.1007/s002640050051.
14. Arizono T, Iwamoto Y, Okuyama K, Sugioka Y. Ethylene oxide sterilization of bone grafts. Residual gas concentration and fibroblast toxicity. Acta Orthop Scand. 1994;65(6):640–2. doi: 10.3109/17453679408994621.
15. Muscarella LF. Use of ethylene-oxide gas sterilisation to terminate multidrug-resistant bacterial outbreaks linked to duodenoscopes. BMJ Open Gastroenterol. 2019;6(1):e000282. doi: 10.1136/bmjgast-2019-000282.
doi: 10.1136/bmjgast-2019-000282.
16. Tshamala M, Cox E, De Cock H, Goddeeris BM, Mattheeuws D. Antigenicity of cortical bone allografts in dogs and effect of ethylene oxide-sterilization. Vet Immunol Immunopathol. 1999;69(1):47–59. doi: 10.1016/s0165-2427(99)00042-2.
17. Russell JL, Block JE. Clinical utility of demineralized bone matrix for osseous defects, arthrodesis, and reconstruction: impact of processing techniques and study methodology. Orthopedics. 1999;22(5):524–31.
18. Dziedzic-Goclawska A. The effect of radiation sterilization on connective tissue allografts. Proceedings of 2nd World Congress on Tissue Banking “Allograft against disability”. Warsaw; 1999. p. 48.
19. Tallentire A. The spectrum of microbial radiation sensitivity. Radiation Physics and Chemistry. 1977;15(1):83–9. doi: 10.1016/0146-5724(80)90101-6.
Tallentire A. The spectrum of microbial radiation sensitivity. Radiation Physics and Chemistry. 1977;15(1):83–9. doi: 10.1016/0146-5724(80)90101-6.
20. Schmidt T, Hoburg A, Broziat C, Smith MD, Gohs U, Pruss A, Scheffler S. Sterilization with electron beam irradiation influences the biomechanical properties and the early remodeling of tendon allografts for reconstruction of the anterior cruciate ligament (ACL). Cell Tissue Bank. 2012;13(3):387–400. doi: 10.1007/s10561-011-9289-6.
21. Розанов ВВ, Матвейчук ИВ, Черняев АП, Николаева НА. Изменения морфомеханических характеристик костных имплантатов при радиационной стерилизации. Известия Российской академии наук. Серия физическая. 2019;83(10):1435–40. doi: 10.1134/S0367676519040203.
22. Осипенкова-Вичтомова ТК. Судебно-медицинская экспертиза костей. М.: Бином; 2017. 272 с.
Судебно-медицинская экспертиза костей. М.: Бином; 2017. 272 с.
23. Шангина ОР, Нигматуллин РТ. Влияние радиационной стерилизации на структуру и свойства биоматериалов. Морфология. 2006;129(3):44–7.
24. Nguyen H, Cassady AI, Bennett MB, Gineyts E, Wu A, Morgan DA, Forwood MR. Reducing the radiation sterilization dose improves mechanical and biological quality while retaining sterility assurance levels of bone allografts. Bone. 2013;57(1):194–200. doi: 10.1016/j.bone.2013.07.036.
25. Akkus O, Belaney RM. Sterilization by gamma radiation impairs the tensile fatigue life of cortical bone by two orders of magnitude. J Orthop Res. 2005;23(5):1054–8. doi: 10.1016/j.orthres.2005.03.003.
26. Nguyen H, Morgan DA, Forwood MR. Validation of 11 kGy as a radiation sterilization dose for frozen bone allografts. J Arthroplasty. 2011;26(2):303–8. doi: 10.1016/j.arth.2010.03.032.
Nguyen H, Morgan DA, Forwood MR. Validation of 11 kGy as a radiation sterilization dose for frozen bone allografts. J Arthroplasty. 2011;26(2):303–8. doi: 10.1016/j.arth.2010.03.032.
27. Draenert GF, Delius M. The mechanically stable steam sterilization of bone grafts. Biomaterials. 2007;28(8):1531–8. doi: 10.1016/j.biomaterials.2006.11.029.
28. Le Huec JC. Experimental study of the thermic effect on bone at 60 degrees C, as applied to bone allograft. Chirurgie. 1992;118(6–7):397– 404. French.
29. Kühne JH, Refior HJ, Jansson V, DeToma G, Liepold KP, Verpoorten U. Initial clinical results with heat-treated homologous bone transplants. Z Orthop Ihre Grenzgeb. 1994;132(2): 102–11. German. doi: 10.1055/s-2008-1039827.
30. Rauh J, Despang F, Baas J, Liebers C, Pruss A, Gelinsky M, Günther KP, Stiehler M. Comparative biomechanical and microstructural analysis of native versus peracetic acid-ethanol treated cancellous bone graft. Biomed Res Int. 2014;2014:784702. doi: 10.1155/2014/784702.
Rauh J, Despang F, Baas J, Liebers C, Pruss A, Gelinsky M, Günther KP, Stiehler M. Comparative biomechanical and microstructural analysis of native versus peracetic acid-ethanol treated cancellous bone graft. Biomed Res Int. 2014;2014:784702. doi: 10.1155/2014/784702.
31. Сибельдина ЛА. Стерилизация озоном. Медицина и здоровье. 2007;11(19):24–5.
32. Сибельдина ЛА. Дезинфектанты: защита или угроза? Медицина и здоровье. 2009;9(41): 28–9.
33. Быков ВА, Розанов ВВ, Матвейчук ИВ, Пантелеев ВИ, Шутеев СА, Литвинов ЮЮ, Воротников АИ, авторы; ГНУ ВИЛАР Россельхозакадемии, патентообладатель. Способ изготовления костных имплантов. Пат. 2526429 Рос. Федерация. Опубл. 20.08.2014.
34. Пантелеев ИВ, Розанов ВВ, Матвейчук ИВ, Бахтин НА, Журнаков ЕА, Сидельников НИ, авторы; ФГБНУ ВИЛАР, патентообладатель. Установка для стерилизации биоматериалов. Пат. 180532 Рос. Федерация. Опубл. 15.06.2018.
Пантелеев ИВ, Розанов ВВ, Матвейчук ИВ, Бахтин НА, Журнаков ЕА, Сидельников НИ, авторы; ФГБНУ ВИЛАР, патентообладатель. Установка для стерилизации биоматериалов. Пат. 180532 Рос. Федерация. Опубл. 15.06.2018.
35. Nather A, Chew JLL, Aziz Z. Types of Terminal Sterilization of Tissue Grafts. In: Nather A, Yusof N, Hilmy N. Radiation in Tissue Banking. World Scientific; 2007. p. 3–9. doi: 10.1142/9789812708649_0001.
36. Dalmasso JP, Mielnik TJ, inventors; Steris Corp, assignee. Method of sterilization of bone tissue. United States patent 5788941A. 1998 Apr 8.
37. Савельев ВИ, Булатов АА, Рыков ЮА, авторы; ФГУ «РНИИТО им. Р.Р. Вредена Росмедтехнологи», патентообладатель. Комбинированный способ стерилизации костных трансплантатов. Пат. 2356224 Рос. Федерация. Опубл. 27.05.2009.
Опубл. 27.05.2009.
38. Эйдус ЛХ. Мембранный механизм биологического действия малых доз. М.; 2001.
39. Матвейчук ИВ, Розанов ВВ, Гордонова ИК, Никитина ЗК, Сидельников НИ, Литвинов ЮЮ, Николаева АА, Черняев АП, Пантелеев ИВ, авторы; ФГБНУ ВИЛАР, патентообладатель. Комбинированный способ стерилизации костных имплантатов. Пат. 2630464 Рос. Федерация. Опубл. 08.09.2017.
плюсы и минусы, уход после стерилизации – Dr.Hug
В чем разница между стерилизацией кошек и кастрацией?
Ввиду частой путаницы и подмены понятий, стоит пояснить, что при кастрации кошки удаляются все репродуктивные органы. Стерилизация же представляет собой ограниченные манипуляции для исключения репродуктивных функций кошки. В данной статье речь пойдет о том, что такое стерилизация кошки в общем смысле.
Существует 3 метода стерилизации кошек:
- хирургический;
- химический;
- введение имплантата.
Стерилизация кошек хирургическим методом
Хирургический метод стерилизации представляет собой операцию, в ходе которой удаляются яичники (у нерожавших особей) или удаляются яичники и матка (у рожавших кошек или для профилактики различных заболеваний).
Оптимальный возраст для стерилизации кошек 5-7 месяцев. Зависит от породы животного и индивидуальных особенностей. Ваш ветеринарный врач определит лучшее время для проведения операции кошке.
Кастрация или стерилизация кошки, что выбрать?
Существует 3 варианта проведения операции:
- Классический метод – рассечение по белой линии живота, которая находится ниже пупка. Через надрез длиной 3 см можно удалить яичники и матку прямым доступом к органам животного. Шов после стерилизации кошки таким методом заживает в течение 10 дней, в этот период кошка должна находиться в специальной одежде – попоне.

- Через боковой разрез. Сбоку от срединной линии рассекается брюшная полость примерно на 1 см. Этот тип операции подходит для перевязки маточных труб, либо при невозможности проведения операции классическим способом. Кошка после стерилизации таким методом гораздо быстрее восстанавливается, снижается риск осложнений после операции.
- Лапароскопия. При этом способе достаточно маленького прокола в брюшной стенке для удаления матки и яичника. Для этого способа требуется специальное оборудование, с помощью которого проводится операция и фиксируется каждое действие врача в реальном времени. Стерилизация кошек лапароскопическим путем наименее травматична, поэтому полное выздоровление питомца происходит через несколько дней.
Все вышеперечисленные методы проводятся под наркозом. Кошка после наркоза после стерилизации несколько часов находится под наблюдением врача, после чего отправляется домой.
Химический метод стерилизации кошек
Под этим методом понимается употребление гормональных препаратов для подавления полового инстинкта. Это могут быть таблетки или капли. В зависимости от состава препарата подавление влечения у кошек может длиться от 1 месяца до полугода. Ветеринарный врач в исключительных случаях может назначить однократное применение таких препаратов и никогда не порекомендует использовать их на постоянной основе. Причина тому проста: регулярное употребление гормональных средств у кошек может вызвать пищеварительные, эндокринные и неврологические нарушения, а самое страшное – онкологические патологии.
Это могут быть таблетки или капли. В зависимости от состава препарата подавление влечения у кошек может длиться от 1 месяца до полугода. Ветеринарный врач в исключительных случаях может назначить однократное применение таких препаратов и никогда не порекомендует использовать их на постоянной основе. Причина тому проста: регулярное употребление гормональных средств у кошек может вызвать пищеварительные, эндокринные и неврологические нарушения, а самое страшное – онкологические патологии.
Использование имплантата
Биосовместимый имплантат – лекарство, которое вводится в подкожный слой и медленно высвобождается в течение полугода. Это средство для временной стерилизации, иногда используется в качестве альтернативы кастрации, чаще перед медицинской кастрацией. Наиболее распространенный препарат для такой стерилизации кошек в Москве – супрелорин.
Положительные и отрицательные стороны стерилизации кошек. Зачем стерилизовать кошку?
Ветеринарные врачи едины во мнении, что стерилизация кошек необходима всем кошкам, за исключение племенных особей. Весомыми аргументами в пользу операции являются следующие факты:
Весомыми аргументами в пользу операции являются следующие факты:
- Кошка становится более покладистой и спокойной.
- Увеличивается продолжительность жизни животного.
- Снижается риск развития онкологических заболеваний репродуктивной системы.
Однако, есть и противопоказания к проведению операции. Например, животным с патологиями сердца или при нарушении почечной функции. Кроме того, при проведении любых операций есть риск осложнений во время реабилитации.
Подготовка к стерилизации кошки
Как и любая операция, стерилизация кошек требует предварительной подготовки. В первую очередь нужно знать, что к операции допускаются абсолютно здоровые кошки после противопаразитарной обработки (не меньше чем за 14 дней до операции) при наличии всех прививок, необходимых в этом возрасте. Кроме этого, кошке нужно сделать ряд анализов:
- анализ крови;
- УЗИ репродуктивной системы;
- ЭКГ.
В некоторых случаях может потребоваться исследование органов дыханиях или рентген. Операция проводится натощак, попоить животное можно не позднее чем за 3 часа перед операцией.
Операция проводится натощак, попоить животное можно не позднее чем за 3 часа перед операцией.
Уход за кошкой после стерилизации
Чтобы снизить риск развития осложнений важно соблюдать все рекомендации ветеринарного врача в первые дни после стерилизации кошки. От этого зависит здоровье животного в будущем. Если кошке назначены антибиотики или другие препараты важно соблюдать график приема.
Особое внимание нужно уделить питанию питомца в это время. Первое кормление допускается через 8 часов после операции. Корм используется привычный для кошки, но порции нужно немного уменьшить. Иногда после операции кошку может вырвать. Однократная рвота является вариантом нормы, при повторных случаях лучше обратиться к врачу. Поводом для посещения ветеринарного врача является также отказ кошки от пищи и воды больше чем один день.
После стерилизации кошек шов должен быть защищен от попадания бактерий, для этого важно надеть на кошку попону, вовремя и правильно обрабатывать рану. Даже при незначительном ухудшении состояния здоровья нужно обращаться к лечащему ветеринарному врачу.
Даже при незначительном ухудшении состояния здоровья нужно обращаться к лечащему ветеринарному врачу.
В большинстве случаев при правильном уходе кошки уже через 10-14 дней возвращаются к обычной размеренной жизни, позабыв об операции. В пользу стерилизации кошек говорит не только статистика врачей, но и отзывы владельцев.
Экстренная стерилизация кошек
Стерилизация кошек, несмотря на рекомендации ветеринарного врача, является добровольным делом владельца животного. Но в ряде случаев для спасения жизни животного, кошке проводят экстренную операцию. К ним относятся:
- Разрыв матки при родах.
- Выявление новообразования репродуктивных органов, в том числе во время беременности кошки.
- Угроза или наличие сильных кровотечений после окота.
Когда нельзя проводить операцию?
Наряду с рекомендациями по срокам проведения операции есть и ограничения. Так, стерилизация кошек не проводится:
- Во время течки.
 В этот период изменяется гормональный фон и операция может вызвать ряд заболеваний. Кроме того, иммунитет животного в это время ослаблен и время выздоровления может значительно увеличиться. Лучше всего проводить операцию через 2-3 недели после окончания течки.
В этот период изменяется гормональный фон и операция может вызвать ряд заболеваний. Кроме того, иммунитет животного в это время ослаблен и время выздоровления может значительно увеличиться. Лучше всего проводить операцию через 2-3 недели после окончания течки. - Во время беременности. В этот период допускается только экстренная стерилизация обусловленная неспособностью выносить котят или обнаружением серьезного заболевания у кошки.
- После окота. Если кошка не кормит потомство, то стерилизацию можно проводить через месяц после родов, в противном случае не раньше чем через 60 дней. Исключение составляют поводы для экстренной стерилизации.
Сколько стоит стерилизация кошки?
Стоимость стерилизации кошки зависит от многих факторов:
- метод стерилизации;
- сложность операции;
- наличие осложнений;
- использование дополнительных препаратов и т.д.
После консультации ветеринарного врача, определив метод стерилизации и где будет проходить период реабилитации (уход в ветклинике или в домашних условиях), вам будет названа точная цена стерилизации кошки.
В некоторых клиниках проводится бесплатная стерилизация кошек из приютов и бездомных кошек, в целях гуманного регулирования численности животных.
h3O2 Sterilization process | Validation
При валидации процесса Н2О2 стерилизации необходимо составить карту температур камеры и контролировать различные физические параметры, участвующие в цикле. В частности, мониторинг температуры и давления имеет важное значение для оценки эффективности работы цикла Н2О2 стерилизации. Требуется тестирование пустой и загруженной камеры. Рекомендуется, чтобы критерии приемлемости были сформулированы с точки зрения наихудшего развития событий. В зависимости от размера камеры, выбирается соответствующее число датчиков температуры и только один датчик давления / вакуума. Расположение датчиков должно давать полное представление о расположении камеры. Создание тепловой карты пустой камеры обеспечивает определение расположения наиболее критических точек, которые должны контролироваться в ходе процесса (горячие и холодные точки). При необходимости получения данных в режиме реального времени вместе с оборудованием TrackSense® Pro используется модуль SKY, который обеспечивает отображение данных в ПО ValSuite™.
При необходимости получения данных в режиме реального времени вместе с оборудованием TrackSense® Pro используется модуль SKY, который обеспечивает отображение данных в ПО ValSuite™.
Создание и документирование расположений датчиков является важной частью документации. С помощью инструментов устройства и дополнительных изображений, доступных в ПО ValSuite™ Pro, можно создать документированную карту расположения датчиков, которая будет полезна для повторных и сравнительных исследований.
После того, как положение датчиков в емкости документально подтверждено, необходимо определить расположение датчиков внутри продукта. ПО ValSuite ™ облегчает документирование размещения различных датчиков, позволяя пользователям включать описательные изображения для каждого используемого канала.
После сбора всех данных, пользователь должен определить характеристики процесса. При анализе температуры, как правило, требуется, чтобы разница в измерениях температуры загрузки не превышала 2°С. Разница в температуре стенок не должна быть больше 5°С.
Разница в температуре стенок не должна быть больше 5°С.
ValSuite™ предоставляет инструменты для анализа производительности h3O2 стерилизатора на всех этапах процесса. Использование временных маркеров помогает определять графические и аналитические опорные точки в собранных данных. Статистические расчеты, такие как мин., макс. и дельта, а также оценка рассчитанных статистических данных также доступна в программном обеспечении. Предельный отчет предлагает быструю оценку эффективности времени процесса, проходившего в пределах установленных критериев.
ПО ValSuite ™ Pro включает все вычисления в самогенерируемый отчет без необходимости экспорта данных в другое программное обеспечение. Отчеты также могут включать в себя сведения о положении логгеров внутри емкости и описательные изображения расположения датчика. Пожалуйста, ознакомьтесь с примером PDF документа. Создание отчетов ValSuite обеспечивает высочайший уровень безопасности результатов исследования в соответствии с требованиями FDA 21 CFR Часть 11.
Одним из важнейших факторов при валидации любого стерилизатора является калибровка датчиков для демонстрации того, что они находятся в пределах приемлемой точности. Используя встроенный функционал калибровки, пользователи могут выполнить калибровку датчиков Ellab через заданные промежутки времени. ПО ValSuite™ Pro создает легко читаемый отчет калибровки, который включает в себя все измерения и допустимые пределы, которые определяются пользователем. Как минимум раз в год рекомендуется отправлять датчики Ellab для заводской калибровки (которая включает в себя поверенный сертификат калибровки).
Отлов, стерилизация, вакцинация и возврат бездомных животных – самый оптимальный способ регулирования их численности
Регулирование численности бездомных животных путем умерщвления является не только противозаконным и антигуманным, но и просто невыгодным. Для того чтобы популяция уменьшалась, необходима системная работа: отлов – стерилизация – вакцинация – возврат (ОСВВ) и просвещение населения. Это гуманно по отношению к животному и более целесообразно в части расходов бюджетов муниципалитетов и субъектов РФ, заявила зоозащитник, директор Ассоциации организаций и граждан по гуманному отношению к животным «Благополучие животных», эксперт ОНФ Мария Лежнева.
Это гуманно по отношению к животному и более целесообразно в части расходов бюджетов муниципалитетов и субъектов РФ, заявила зоозащитник, директор Ассоциации организаций и граждан по гуманному отношению к животным «Благополучие животных», эксперт ОНФ Мария Лежнева.
На днях СМИ сообщили, что в приюте для бездомных животных, расположенном в деревне Карлук Иркутской области, волонтеры обнаружили множество трупов животных. Зоозащитники обратились с заявлением в правоохранительные органы. Также стало известно, что компания – владелец приюта выиграла тендер на регулирование численности бездомных кошек и собак в Иркутской области.
Мария Лежнева назвала произошедшее отвратительным. Между тем люди, которые давно занимаются проблемой безнадзорных животных, знают десятки таких примеров, и это системная проблема организации госзакупок по контролю численности бездомных животных, отметила она.
«Наша Ассоциация занимается контролем закупок по регулированию численности животных. В каждой третьей встречаются отлов и эвтаназия, то есть другие услуги не предусматриваются. А каждый пятый муниципальный заказчик либо не слышал о профильном федеральном законе 498-ФЗ «Об ответственном обращении с животными», либо не понимает его норм. Мы, конечно, все это исправляем и пресекаем – после нашей проверки закупки приводят в соответствие с законодательством», – пояснила Лежнева.
В каждой третьей встречаются отлов и эвтаназия, то есть другие услуги не предусматриваются. А каждый пятый муниципальный заказчик либо не слышал о профильном федеральном законе 498-ФЗ «Об ответственном обращении с животными», либо не понимает его норм. Мы, конечно, все это исправляем и пресекаем – после нашей проверки закупки приводят в соответствие с законодательством», – пояснила Лежнева.
Она подчеркнула: «Такой метод регулирования численности, как умерщвление, является не только противозаконным и антигуманным, но и просто невыгодным – сумма на услуги специализированных организаций не уменьшается со временем, так как количество животных не уменьшается. Для того чтобы популяция уменьшалась, необходима системная работа: отлов – стерилизация – вакцинация – возврат (ОСВВ) и просвещение населения. Именно то, что прописано в законе».
Так что система ОСВВ является не только гуманной по отношению к животному. Она более цивилизована в части расходов бюджетов муниципалитетов и субъектов Российской Федерации на регулирование численности бездомных кошек и собак, резюмировала Лежнева.
Стерилизация оксидом этилена для медицинских устройств
Обновление пилотной программы мастер-файлов стерилизации оксидом этилена
20 марта 2020 г., в рамках наших постоянных усилий по ускорению утверждения определенных изменений в процессах и средствах стерилизации оксидом этилена, FDA объявило о своем первом принятии мастер-файла в пилотную программу FDA по стерилизации с помощью оксида этилена.Узнайте больше о пилотной программе стерилизации мастер-файлов оксидом этилена.
Это признание происходит в особенно критический момент для FDA, чтобы продолжить нашу важную работу по сокращению нехватки стерилизованных оксидом этилена устройств.
FDA считает, что пилотная программа стерилизации эталонного файла оксидом этилена должна привести к тому, что в стерилизационных помещениях будет использоваться значительно меньшее количество оксида этилена, но при этом обеспечивается надежная защита пациентов.
FDA продолжит свои усилия по снижению чрезмерной зависимости от оксида этилена при стерилизации медицинских изделий и предоставит обновленную информацию о будущих приемах мастер-файлов.
На этой странице:
Связанные страницы:
Почему оксид этилена используется для стерилизации медицинских изделий?
Медицинские изделия стерилизуют различными способами, включая использование влажного тепла (пара), сухого тепла, излучения, газообразного этиленоксида, испаренного пероксида водорода и других методов стерилизации (например, газообразным диоксидом хлора, испаренной надуксусной кислотой и диоксидом азота. ). Стерилизация оксидом этилена — важный метод стерилизации, который производители широко используют для обеспечения безопасности медицинских устройств.Дополнительные сведения о методах стерилизации см. В разделе «Подача и проверка информации о стерильности в предпродажном уведомлении» (510 (k)) для устройств, помеченных как руководство по стерильности (PDF — 386 КБ).
Для многих медицинских устройств стерилизация оксидом этилена может быть единственным методом, который эффективно стерилизует и не повреждает устройство во время процесса стерилизации. Медицинские устройства, изготовленные из определенных полимеров (пластмассы или смолы), металлов или стекла, или имеющие несколько слоев упаковки или труднодоступные места (например, катетеры), вероятно, будут стерилизованы оксидом этилена.
Какие устройства стерилизуются оксидом этилена?
Литература показывает, что около пятидесяти процентов 1,2,3 всех стерильных медицинских устройств в США стерилизованы оксидом этилена. Типы устройств, которые стерилизуются оксидом этилена, варьируются от устройств, используемых в общей медицинской практике (например, перевязки ран), до более специализированных устройств, используемых для лечения определенных участков тела (например, стентов).
Как FDA помогает гарантировать безопасность медицинских изделий, стерилизованных оксидом этилена?
Перед тем, как большинство стерильных медицинских изделий появятся на рынке, FDA рассматривает предмаркетинговые заявки, чтобы определить, есть ли информация о стерильности (например, метод, который производитель выбирает для стерилизации своего изделия, и действия по валидации, используемые для демонстрации того, что изделие может быть эффективно стерилизовано) соответствует международно согласованным добровольным консенсусным стандартам, признанным FDA. Важным элементом нашей нормативной базы является надежная программа стандартов. FDA поощряет спонсоров медицинских устройств использовать признанные FDA добровольные консенсусные стандарты в своих представлениях, поскольку соответствие соответствующим стандартам упрощает нормативный контроль и способствует повышению качества. Узнайте больше о программе признанных стандартов FDA.
Важным элементом нашей нормативной базы является надежная программа стандартов. FDA поощряет спонсоров медицинских устройств использовать признанные FDA добровольные консенсусные стандарты в своих представлениях, поскольку соответствие соответствующим стандартам упрощает нормативный контроль и способствует повышению качества. Узнайте больше о программе признанных стандартов FDA.
Для стерилизации оксидом этилена два добровольно согласованных стандарта (ANSI AAMI ISO 11135: 2014 и ANSI AAMI ISO 10993-7: 2008 (R) 2012) описывают, как разрабатывать, проверять и контролировать процессы стерилизации оксидом этилена для медицинских устройств, а также приемлемые уровни остаточного этиленоксида и этиленхлоргидрина, оставшегося на устройстве после того, как оно прошло стерилизацию этиленоксидом.Эти стандарты помогают гарантировать, что уровни оксида этилена на медицинских устройствах находятся в безопасных пределах, поскольку длительное и профессиональное воздействие оксида этилена связано с раком. Узнайте больше о рисках, связанных с оксидом этилена, на веб-странице Национального института здравоохранения, посвященной оксиду этилена.
Узнайте больше о рисках, связанных с оксидом этилена, на веб-странице Национального института здравоохранения, посвященной оксиду этилена.
Если производитель медицинского изделия изменяет метод, процесс или средство, указанные в его первоначальном представлении PMA для стерилизации своих изделий, производитель обычно должен подать приложение PMA, чтобы агентство могло рассмотреть эти изменения и определить, соответствуют ли они также на международном уровне. согласованные добровольные стандарты, признанные FDA.Для производителей, которые являются держателями 510 (k), метод стерилизации, изменения процесса или места могут быть оценены с помощью руководящего документа FDA: «Решение, когда подавать 510 (k) на изменение существующего устройства» для определения того, была ли стерилизация изменения вызовут необходимость повторной подачи.
FDA также проверяет промышленные предприятия, которые стерилизуют медицинские изделия, и предприятия по их производству, чтобы убедиться, что они прошли валидацию процессов стерилизации, которые соответствуют признанным стандартам FDA.
Государственные департаменты здравоохранения проверяют медицинские учреждения, которые используют оксид этилена для стерилизации медицинских изделий. Узнайте больше о правилах стерилизации в медицинских учреждениях на веб-странице Центров по контролю и профилактике заболеваний.
Роль EPA в стерилизации оксидом этилена
Агентство по охране окружающей среды США (EPA) проверяет и обеспечивает выполнение положений Закона о чистом воздухе для стерилизационных помещений, выделяющих оксид этилена, чтобы гарантировать, что они защищают население от значительного риска.Узнайте больше о правилах EPA для оксида этилена на веб-сайте EPA.
Действия FDA по продвижению стерилизации медицинских изделий
FDA активно работает с экспертами по стерилизации, производителями медицинского оборудования и другими государственными учреждениями, чтобы продвигать инновационные способы стерилизации медицинских устройств с более низким уровнем используемых в настоящее время агентов, а также использовать новые агенты или альтернативы, сохраняя при этом безопасность и эффективность устройств.
Заседания Консультативного комитета по практике инфекционного контроля (HICPAC)
В мае и ноябре 2019 года FDA привлекло сообщество по контролю за инфекциями на заседании Консультативного комитета по практике инфекционного контроля в здравоохранении (HICPAC), чтобы проинформировать общественность о работе FDA и взаимодействии с промышленностью по методам стерилизации устройств, которые обычно стерилизуются с использованием оксида этилена. .
Вызовы инноваций FDA
15 июля 2019 г. FDA объявило о двух государственных инновационных задачах, направленных на поощрение разработки новых методов стерилизации, которые могут включать новые устройства или новые методы, безопасные и эффективные для стерилизации медицинских устройств:
25 ноября 2019 года FDA объявило, что было получено 46 заявок и отобрано 12 участников для испытаний. Подробную информацию о выбранных участниках и дальнейших действиях см. На странице каждой задачи.
Больница общего профиля и приборы для личного пользования Консультативного комитета по медицинскому оборудованию
6-7 ноября 2019 года FDA провело собрание Группы по больницам общего профиля и устройствам личного пользования Консультативного комитета по медицинским устройствам, чтобы обсудить, как лучше всего продвигать инновации в стерилизации медицинских устройств. Материалы встречи доступны на странице объявлений о заседании Консультативного комитета.
Материалы встречи доступны на странице объявлений о заседании Консультативного комитета.
Одна из рекомендаций совещания консультативного комитета — производителям устройств как можно скорее начать сокращать количество бумаги (например, для этикеток и инструкций по использованию), которые включаются в упаковку стерильного устройства.Медицинское изделие, стерилизованное оксидом этилена, должно быть запечатано в тщательно разработанную газопроницаемую упаковку, которая позволяет проникать газу оксида этилена. Когда стерилизационная загрузка (включающая все материалы, вставленные в камеру стерилизатора с устройством) включает в себя большое количество бумаги с устройством, это препятствует попаданию оксида этилена в устройство и, как правило, означает, что требуется больше оксида этилена. Из-за этого FDA поощряет производителей устройств переходить на электронные материалы, где это возможно и безопасно для пользователей устройств.Мы стремимся работать с отраслью, чтобы внести это изменение.
Пилотная программа мастер-файла стерилизации оксидом этилена
25 ноября 2019 года FDA объявило о своей пилотной программе стерилизации мастер-файлов оксидом этилена (EtO Pilot Program). Эта добровольная программа предназначена для того, чтобы позволить компаниям (поставщикам стерилизации), которые стерилизуют одноразовые медицинские устройства с использованием оксида этилена с фиксированной камерой (EtO), предоставить мастер-файл при внесении определенных изменений между участками стерилизации или при внесении определенных изменений в процессы стерилизации, которые используют сокращенные Концентрации EtO.
В рамках этой добровольной программы производители (держатели PMA) устройств класса III, подлежащих предварительному одобрению, которые затронуты такими изменениями, могут ссылаться на основной файл, представленный их поставщиком стерилизации, в отчете после утверждения вместо подачи приложения PMA.
Эта пилотная программа направлена на обеспечение доступа пациентов к безопасным медицинским устройствам, одновременно поощряя новые инновационные способы стерилизации медицинских устройств, которые снижают потенциальное влияние EtO на окружающую среду и здоровье населения.
Пилотная программа EtO Master File началась 25 ноября 2019 года. На сегодняшний день FDA приняло мастер-файлы от участников, перечисленных ниже:
| Компания | Дата приемки |
|---|---|
| Boston Scientific | 18 марта 2020 |
| Becton, Dickinson & Company (BD) | 11 сентября 2020 |
Сообщить об изменениях в месте стерилизации в FDA
Если остановка операций в стерилизационном центре повлияла на вашу продукцию, и вы планируете использовать альтернативную установку для стерилизации своих продуктов:
Сообщить о проблеме или нехватке медицинских изделий
Проблемы с поставками могут привести к нехватке медицинских устройств и могут представлять угрозу для здоровья населения из-за отсрочки или прекращения оказания неотложной помощи пациентам.FDA уделяет большое внимание устранению проблем с поставками продукции и предотвращению причинения вреда пациентам из-за нехватки устройств.
Планирование и предотвращение нехватки оборудования — важная обязанность. FDA может помочь предвидеть, предотвратить или уменьшить дефицит в будущем, работая с производителями устройств, которые добровольно предоставляют нам информацию о потенциальных проблемах с поставками продукции. Узнайте больше о том, как сообщить о нехватке медицинских изделий или проблемах с поставками.
Свяжитесь с нами
Чтобы сообщить о нехватке медицинских устройств или проблемах с поставками, напишите на Deviceshortages @ fda.hhs.gov или по телефону 1-800-638-2041 или 301-796-7100.
1 (31 августа 2017 г.). Сравнение технологий гамма-, электронно-лучевого, рентгеновского и этиленоксида для промышленной стерилизации медицинских устройств и товаров медицинского назначения. Получено 13 марта 2019 г. с http://iiaglobal.com/wp-content/uploads/2018/01/White-Paper-Comparison-Gamma-Eb-Xray-and-EO-for-Sterilisation.pdf
.
2 Бласс, К. (2001). Роль поли (винилхлорида) в здравоохранении .Шобери, Великобритания: Rapra Technology Limited. Извлечь из оксида https://books.google.com/books?id=vNp3bFNOU_AC&pg=PA47&lpg=PA47&dq=Ethylene стерилизации, медицинские приборы, долю рынка и источник = бл & отс = oQzply-FBQ & сиг = ACfU3U0bKGYVubW_3UEj0Kq7G3CpF6SbuQ & гл = еп & са = Х & вед =
Роль поли (винилхлорида) в здравоохранении .Шобери, Великобритания: Rapra Technology Limited. Извлечь из оксида https://books.google.com/books?id=vNp3bFNOU_AC&pg=PA47&lpg=PA47&dq=Ethylene стерилизации, медицинские приборы, долю рынка и источник = бл & отс = oQzply-FBQ & сиг = ACfU3U0bKGYVubW_3UEj0Kq7G3CpF6SbuQ & гл = еп & са = Х & вед =
2ahUKEwiKso3BnuzgAhWFk1kKHeiIC8Q4KBDoATAHegQIARAB # v = OnePage & д = Стерилизация оксидом этилена,
медицинских изделий, доля рынка & f = false
3 Нормативный обзор стандарта этиленоксида Управления по охране труда, 29 C.F.R § (2005) 1910.1047 https://www.osha.gov/dea/lookback/ethylene_oxide_lookback.pdf.
Стерилизация для женщин и мужчин
Вспомогательные репродуктивные технологии (ВРТ): Лечебные процедуры или процедуры, проводимые для начала беременности. Это может включать работу с яйцами, спермой или эмбрионами.
Это может включать работу с яйцами, спермой или эмбрионами.
Внематочная беременность: Беременность в месте, отличном от матки, обычно в одной из маточных труб.
Яйцо: Репродуктивная клетка самки, произведенная в яичниках и высвобождающаяся из них. Также называется яйцеклеткой.
Фаллопиевы трубы: Трубы, по которым яйцеклетка перемещается от яичника к матке.
Вирус иммунодефицита человека (ВИЧ): Вирус, поражающий определенные клетки иммунной системы организма. Если не лечить, ВИЧ может вызвать синдром приобретенного иммунодефицита (СПИД).
Лапароскоп: Тонкий телескоп с подсветкой, который вводится через небольшой разрез (разрез) в брюшной полости для осмотра внутренних органов или для проведения операции.
Лапароскопия: Хирургическая процедура, при которой тонкий телескоп с подсветкой, называемый лапароскопом, вводится через небольшой разрез (разрез) в брюшной полости. Лапароскоп используется для просмотра органов малого таза. С ним можно использовать другие инструменты для проведения хирургических операций.
Лапароскоп используется для просмотра органов малого таза. С ним можно использовать другие инструменты для проведения хирургических операций.
Местная анестезия: Лекарства, снимающие боль в какой-либо части тела.
Минилапаротомия : Небольшой разрез на брюшной полости, используемый для хирургического вмешательства, при котором закрывают маточные трубы в качестве постоянного противозачаточного средства.
Послеродовая стерилизация: Постоянная процедура, предотвращающая беременность женщины, проводится вскоре после рождения ребенка.
Мошонка: Наружный генитальный мешок у мужчин, содержащий яички.
Сперма : жидкость, вырабатываемая мужскими половыми железами и содержащая сперму.
Половой акт: Действие полового члена мужчины, входящего во влагалище женщины.Также называется «заниматься сексом» или «заниматься любовью».
Инфекции, передаваемые половым путем (ИППП): Инфекции, передающиеся половым путем. Инфекции включают хламидиоз, гонорею, вирус папилломы человека (ВПЧ), герпес, сифилис и вирус иммунодефицита человека (ВИЧ, причина синдрома приобретенного иммунодефицита [СПИД]).
Сперма : Клетка, вырабатываемая в мужских семенниках, которая может оплодотворять женскую яйцеклетку.
Стерилизация: Постоянный метод контроля рождаемости.
Яички: Парные мужские органы, вырабатывающие сперму и мужской половой гормон тестостерон. Также называется семенниками.
Перевязка маточных труб: Блокирование маточных труб.
Vas Deferens : Одна из двух небольших трубок, по которым сперма от каждого мужского яичка передается в предстательную железу.
Вазэктомия : постоянный метод контрацепции для мужчин. В этой процедуре удаляется часть трубки, по которой идет сперма.
методов стерилизации | Зевс
Стерилизация
Стерилизация обычно относится к удалению или уничтожению всех живых микроорганизмов, таких как бактерии, плесень, грибки или вирусы, из области или объекта. Цель стерилизации — предотвратить попадание в организм патогенов — болезнетворных микроорганизмов. Стерилизация является обязательной для инструментов и устройств, используемых в контакте с телом, например, в медицинских и стоматологических целях, а также в условиях биомедицинских исследований.
Дезинфекция
Дезинфекция — это более низкая степень стерилизации, включающая только уничтожение микроорганизмов в их вегетативном (или неспоровом) состоянии. Дезинфекция не предполагает уничтожения спор бактерий. Стерилизация — единственный приемлемый стандарт для хирургических целей, хотя для некоторых целей может быть пригодна дезинфекция.
Стерилизация у Зевса
Zeus специализируется на производстве продуктов, где требуются сверхчистые продукты и которые используются в стерильных условиях.Мы преуспеваем в создании продуктов, которые могут выдерживать различные протоколы стерилизации от автоклавирования, гамма-облучения до стерилизации оксидом этилена (ETO).
Качество, чистота и сертификация USP Class VI означают, что они идеально подходят для имплантационных устройств. Наша продукция проверяется и упаковывается в чистых помещениях класса 7.
Свяжитесь с нами или позвоните по телефону 1-800-526-3842, чтобы узнать больше о методах стерилизации.
В таблице ниже приведены несколько методов стерилизации и материалы, для которых они лучше всего подходят.
| Смола | ETO | Автоклав | Гамма |
| ПТФЭ | Отлично | Среднее значение | Плохо |
| FEP | Отлично | Отлично | Хорошо |
| PFA | Отлично | Отлично | Плохо |
| ЭТФЭ | Отлично | Отлично | Хорошо |
| ПВДФ | Отлично | Отлично | Хорошо |
| PEEK | Отлично | Отлично | Отлично |
| Полиэтилен | Отлично | Отлично | Хорошо * |
* Сорта с высокой плотностью не так стабильны, как средние и низкие
Стерилизация — постоянный метод
ПОДРОБНЕЕ
У женщин
Наиболее распространенными формами женской стерилизации являются хирургические и безоперационные методы. Оба метода полностью исключают возможность встречи сперматозоидов с яйцеклеткой в утробе матери, но способы, которыми они это делают, немного отличаются. Один из способов — связать и разрезать трубы, и это называется перевязкой маточных труб. Фаллопиевы трубы также можно запечатать с помощью инструмента с электрическим током или закрыть зажимами, зажимами или кольцами, чтобы сперматозоиды не могли встретиться с яйцеклеткой. Медицинский прибор вводится в маточную трубу через влагалище с помощью специального катетера. Иногда удаляется даже небольшой кусочек трубки.
Оба метода полностью исключают возможность встречи сперматозоидов с яйцеклеткой в утробе матери, но способы, которыми они это делают, немного отличаются. Один из способов — связать и разрезать трубы, и это называется перевязкой маточных труб. Фаллопиевы трубы также можно запечатать с помощью инструмента с электрическим током или закрыть зажимами, зажимами или кольцами, чтобы сперматозоиды не могли встретиться с яйцеклеткой. Медицинский прибор вводится в маточную трубу через влагалище с помощью специального катетера. Иногда удаляется даже небольшой кусочек трубки.
В то время как безоперационная стерилизация блокирует пробирки, поэтому ничего не попадает внутрь и не выходит. Небольшая гибкая металлическая вставка вводится в маточные трубы через влагалище с помощью специального катетера. Устройство работает за счет образования рубцовой ткани вокруг катушки. Это блокирует фаллопиевы трубы и не дает вам забеременеть. Вам необходимо использовать другой метод контрацепции в течение первых 3 месяцев, но после этого он будет постоянным.
Стерилизация проводится в условиях стационара в основном под общим наркозом.Хирургическая стерилизация требует значительно более длительного периода восстановления из-за инвазивного способа проведения процедуры. Операция влияет только на плодородный потенциал женщины и не влияет на ее либидо или способность вступать в половую связь. Важно сначала поговорить со своим лечащим врачом, чтобы получить консультацию о преимуществах и рисках. Также важно, чтобы вы знали об альтернативных обратимых методах контрацепции длительного действия, таких как ВМС, ВМС или имплантат, которые имеют одинаковую низкую частоту неудач.
У мужчин
Стерилизация мужчин часто называется вазэктомией и представляет собой хирургическую процедуру, при которой разрезают протоки, несущие сперму, и операцию можно проводить под местной анестезией. После процедуры мужчина все еще может эякулировать, но сперматозоиды отсутствуют. Это влияет на потенциал фертильности мужчины, но не влияет на его либидо или способность вступать в половую связь. Важно сначала поговорить со своим лечащим врачом, чтобы получить консультацию о преимуществах и рисках.
Важно сначала поговорить со своим лечащим врачом, чтобы получить консультацию о преимуществах и рисках.
Иногда есть возможность отменить операцию, но нет никаких гарантий. Реверсирование требует сложной операции, которая может не сработать.
Эффективность методов стерилизации и их влияние на электрохимическое поведение простой углеродистой стали
Сведение к минимуму загрязнения контрольных обработок в исследованиях микробиологической коррозии (MIC) имеет решающее значение. Процедуры стерилизации металла не должны изменять поверхность или влиять на внутреннюю восприимчивость металла к коррозии, в то же время адекватно дезактивируя биологическую активность.Однако в литературе нет единого мнения относительно таких процедур, отчасти из-за отсутствия общепринятой методологии. В этом исследовании оцениваются различные методы стерилизации углеродистой стали с точки зрения практичности, эффективности и влияния на электрохимический отклик металла. Были оценены три процедуры стерилизации с использованием i) сухого тепла, ii) этанола или iii) глутарового альдегида в качестве стерилизующих агентов. Несмотря на то, что все подходы к стерилизации были одинаково эффективны в удалении микроорганизмов и спор с поверхности металла, сухой нагрев при 170 ° C в инертной атмосфере был определен как наиболее удобный метод стерилизации с точки зрения практичности и постоянства электрохимической реакции металла.Стерилизация углеродистой стали в 75 об.% Этанола и глутарового альдегида, а также в спирте с последующим пламенем не рекомендуется из-за большого разброса реакции коррозии, вызванной воздействием стерилизационной среды.
Были оценены три процедуры стерилизации с использованием i) сухого тепла, ii) этанола или iii) глутарового альдегида в качестве стерилизующих агентов. Несмотря на то, что все подходы к стерилизации были одинаково эффективны в удалении микроорганизмов и спор с поверхности металла, сухой нагрев при 170 ° C в инертной атмосфере был определен как наиболее удобный метод стерилизации с точки зрения практичности и постоянства электрохимической реакции металла.Стерилизация углеродистой стали в 75 об.% Этанола и глутарового альдегида, а также в спирте с последующим пламенем не рекомендуется из-за большого разброса реакции коррозии, вызванной воздействием стерилизационной среды.
Исследования коррозии под воздействием микробиологов (MIC) посвящены роли микроорганизмов в электрохимических процессах, ведущих к коррозии. 1–3 Поскольку бактерии и грибки взаимодействуют с поверхностью металла и окружающей средой, они могут «инициировать, облегчать или ускорять реакцию коррозии, не изменяя ее электрохимической природы. « 4 Повсеместная природа некоторых микроорганизмов может стать проблемой для исследований МПК, где заражение видами с различными метаболическими способностями может изменить результат экспериментов. Следовательно, минимизация заражения чужеродными микроорганизмами для поддержания микробного сообщества, которое должным образом отражает желаемый микробный состав (т.е. это образец окружающей среды или конкретно определенное сообщество) имеет решающее значение для исследований MIC.
« 4 Повсеместная природа некоторых микроорганизмов может стать проблемой для исследований МПК, где заражение видами с различными метаболическими способностями может изменить результат экспериментов. Следовательно, минимизация заражения чужеродными микроорганизмами для поддержания микробного сообщества, которое должным образом отражает желаемый микробный состав (т.е. это образец окружающей среды или конкретно определенное сообщество) имеет решающее значение для исследований MIC.
Большинство компонентов, используемых в исследовании MIC (т.е. посуда, реакторы или электрохимические ячейки и растворы) можно стерилизовать в соответствии со стандартными процедурами стерилизации 5 , используемыми микробиологами; однако в литературе нет единого мнения относительно процедур стерилизации металлических образцов. В идеальной ситуации метод стерилизации должен убивать все микроорганизмы и споры на металле, но он не должен изменять его поверхность или влиять на внутреннюю восприимчивость металла к коррозии.
В обзоре литературы, посвященном более чем 200 статьям, посвященным MIC углеродистых и низколегированных сталей, было выявлено более 20 различных процедур стерилизации металлических образцов, Таблица I.Некоторые из методов, описанных в литературе, варьируются от автоклавирования стальных заглушек внутри водонепроницаемых контейнеров, погружения заглушек в 70 об.% Этилового спирта и их сжигания перед инокуляцией, 6 до погружения в раствор хлора с концентрацией 2000 ч. / Млн (т.е. примерно в 4000 раз больше уровень остаточного хлора, необходимый для обработки природной морской воды) 7–9 в течение 30 минут с последующей обработкой глутаральдегидом в течение ночи. 10 Другие использовали тонкодисперсные суспензии Mg (OH) 2 и ацетон высокой чистоты; 11 погружение на ночь в 70 об.% Этанола с последующей асептической сушкой на воздухе; 12 9 часов термообработки при 130 ° C в стеклянных стаканах, покрытых алюминиевой фольгой; 13 или использование ультрафиолета. 14
14
Таблица I. Краткое изложение методологий стерилизации в исследованиях MIC для простых углеродистых сталей. Методы описаны так, как они появляются в литературе. Было изучено более 200 работ, посвященных МПК в углеродистой стали. В этот список входят только документы, описывающие процедуры стерилизации достаточно подробно, чтобы их можно было воспроизвести в других лабораториях.
| Авторы (год) | Сплав | Процедуры стерилизации / подготовки металла (после полировки, если применимо) |
|---|---|---|
| Бук и Гайлард (1991) 6 | BS970 (MS-II), SAE1020 (MS-I), BS316 (SS-II), AISI304L (SS-I) | Заготовки автоклавированы в водонепроницаемых контейнерах; Перед воздействием бактериальных культур стали погружали в спирт 70 об. %, прокаливали, помещали в стерильные универсальные флаконы и давали остыть. %, прокаливали, помещали в стерильные универсальные флаконы и давали остыть. |
| Кастаньеда и Бенеттон (2008) 21 | SAE-1018 (UNS G10180). | Купоны стерилизовали в 70 об.% Растворе этанола в течение 30 мин и выдерживали в стерильном ламинарном потоке воздуха перед погружением в электрохимические ячейки до использования. |
| de França и другие (1996) 68 | Нержавеющая сталь AISI 304 (UNS S30400). | Купоны, помещенные в полевые условия, не стерилизовались; однако, чтобы проверить прямое влияние морской воды, металлические купоны помещали в колбы, содержащие 100 мл морской воды, и стерилизовали при 120 ° C в течение 20 минут. |
| Дорси и другие (2005) 10 | Многоэлектродные датчики и контрольные купоны UNS G10180 в контуре потока | Проточная петля была «стерилизована» циркуляцией раствора хлора с концентрацией 2000 ч. / Млн в течение 30 минут с последующей обработкой неокисляющим биоцидом (глутаральдегидом) в течение ночи. После стерилизации в воду также добавляли небольшое количество глутаральдегида, чтобы обеспечить дополнительную защиту от загрязнения в течение первых дней тестирования. / Млн в течение 30 минут с последующей обработкой неокисляющим биоцидом (глутаральдегидом) в течение ночи. После стерилизации в воду также добавляли небольшое количество глутаральдегида, чтобы обеспечить дополнительную защиту от загрязнения в течение первых дней тестирования. |
| Eckert и другие (2006) 69 | Купоны изготовлены из трубной стали марки | Купоны очищали ультразвуком в абсолютном этаноле и, наконец, промывали ацетоном. После очистки купоны были упакованы в индивидуальные полиэтиленовые пакеты в среде сухого азота для предотвращения контакта с влагой. Купоны не подвергались воздействию воздуха непосредственно перед их установкой в тестовую систему. |
| Edyvean и другие (1992) 70 | Нержавеющая сталь AISI 316 (UNS S31600) как часть модифицированных устройств Роббинса (MRD) | MRD были стерилизованы путем заполнения их 2. 5 об.% Хлорноватистой кислоты (коммерческий отбеливатель) и выдерживают 2 часа; затем их промывали стерильной деионизированной водой. 5 об.% Хлорноватистой кислоты (коммерческий отбеливатель) и выдерживают 2 часа; затем их промывали стерильной деионизированной водой. |
| Гонсалес-Родригес и другие (2008) 22 | Низкоуглеродистая сталь AISI 1018 (UNS G10180) купоны | Очищенные купоны стерилизовали этанолом перед воздействием экспериментальной среды. |
| Гу и др. (1998) 23 | Купон из нержавеющей стали AISI 316 (UNS S31600) в составе ячеек EIS | Внутренняя и внешняя поверхности клеток EIS стерилизовали 70 об.% Этанолом и сушили при комнатной температуре в стерильном вытяжном шкафу с ламинарным потоком. |
| Li и другие (2001) 24 | SAE 1018 (UNS G10180) | Купоны были обезжирены спиртом, а затем промыты стерилизованной деионизированной водой.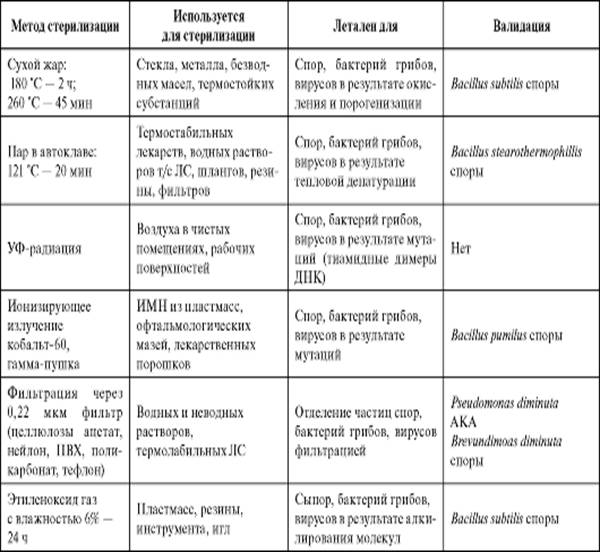 Электроды стерилизовали 70 об.% Спирта в течение 2 часов, а затем хранили на чистом столе до использования. Электроды стерилизовали 70 об.% Спирта в течение 2 часов, а затем хранили на чистом столе до использования. |
| Лугаускас и др. (2009) 11 | Сталь низкоуглеродистая, состав (мас.%): 0,05–0,12 С, 0,003–0,10 Cu, <0,07 Р | Купоны обрабатывали тонкой суспензией Mg (OH) 2 и ацетоном высокой чистоты, чтобы минимизировать начальное загрязнение поверхности питательными веществами из окружающей среды. |
| Миянага и другие (2007) 14 | Состав образцов углеродистой стали (мас.%): 99,71 Fe, 0,03 C, 0,01 Si, 0,19 Mn, 0,013 P, 0,0017 N, 0,026 Al | Поверхность купона продезинфицировали трансиллюминатором в течение 5 мин. |
| Пэн и Парк (1994) 71 | Состав стали купонов (мас. %): Si 0,01, P 0,01, Mn 0,19, S 0,01, Fe 99,78 %): Si 0,01, P 0,01, Mn 0,19, S 0,01, Fe 99,78 | Купоны обезжиривали 100 об.% Этанолом, промывали ацетоном и дистиллированной водой, сушили с помощью воздуходувки N 2 и хранили в эксикаторе перед использованием; Для инактивации микроорганизмов в неинокулированный раствор добавляли глутаральдегид. |
| Роден и др. (2000) 72 | Низкоуглеродистая сталь | Чистые купоны помещали в пробирки, которые стерилизовали при 170 ° C в течение 3 часов. |
| Ройер и Унц (2002) 73 | Стальная проволока из качественной музыкальной пружины (диаметр 0,216 мм, ASTM A228 / A228M) | Проволоки погружали в ванны с ацетоном и 1,5 н. HCl на 15 мин. Очищенные проволоки пропускали через пробки из бутилкаучука, а выступающие области с обеих сторон покрывали антикоррозийным лаком. Затем систему пробка / проволока прикрепляли к бутылям с сывороткой со стерильной средой и продували N 2 . Затем систему пробка / проволока прикрепляли к бутылям с сывороткой со стерильной средой и продували N 2 . |
| Stadler и другие (2008) 13 | Чистое железо (Armco), углеродистая сталь ST37, нержавеющая сталь AISI 304 (UNS S30400) | Купоны в тефлоновых держателях помещали в стеклянный стакан, покрывали алюминиевой фольгой и стерилизовали термической обработкой в течение 9 часов при 130 ° C. Дальнейшие работы, требующие стерильных условий, выполнялись на чистом столе. |
| Незнакомец-Йоханнесен (1987) 74 | Листы стальные окрашенные | Планшеты стерилизовали погружением в 0.1 об.% Перекиси водорода перед инокуляцией |
| Танджи и другие (2002) 75 | Состав купонов из углеродистой стали (мас. %): 99,71 Fe, 0,03 C, 0,19 Mn, 0,017 S, 0,013 P и 0,01 Si, закрепленные в эпоксидной смоле %): 99,71 Fe, 0,03 C, 0,19 Mn, 0,017 S, 0,013 P и 0,01 Si, закрепленные в эпоксидной смоле | Перед прикреплением к эпоксидной смоле полированные купоны очищали ультразвуком в ацетоне в течение 15 минут, сушили на воздухе и хранили в эксикаторе. |
| Валенсия-Кантеро и другие (2003 г.) 76 | Высокоуглеродистая сталь (1 мас.% C) и обычная углеродистая сталь (0.015–0,020 мас.% C) | Купоны из высокоуглеродистой стали очищали путем замачивания в ацетоне в течение 30 минут, а затем чистили зубной щеткой, используя модификацию метода Haruta et al. (1991). Купоны из углеродистой стали очищали с использованием небольшой модификации метода Bryant et al. (1991), подвергали обработке ультразвуком в лимонной кислоте (5 мас. / Об.%) В течение 5 мин, а затем промывали в дистиллированной воде в течение 1 мин. Купоны обжигали и взвешивали, затем помещали в закрытые культуральные пробирки, содержащие богатую солью культуральную среду V9. |
| Вен и другие (2006) 77 | C1018 (UNS G10180) цилиндрический купон, используемый в качестве рабочего электрода в биореакторе | Биореактор автоклавировали перед каждым запуском. |
| Юань и Пехконен (2007) 12 | Нержавеющая сталь AISI 304 (UNS S30400) | Купоны промывали трижды деионизированной водой с последующим обезжириванием ацетоном, затем стерилизовали погружением в 70 об.% Этанола на 8 часов и асептически сушили на воздухе.Вновь приготовленные образцы немедленно подвергали воздействию тестовой среды. |
Важно отметить, что методы, перечисленные в Таблице I, примерно соответствуют тому же количеству статей, явно описывающих процедуры стерилизации в разделе «Методология» рукописи. Действительно, большинство рассмотренных документов не описывают процедуры стерилизации достаточно подробно, чтобы их можно было воспроизвести в других лабораториях. Вероятно, что увеличение количества исследованных статей приведет к увеличению этих показателей.Более того, до настоящего времени не проводилось систематических исследований воздействия метода стерилизации на поверхность металла и соответствующей реакции на коррозию.
Вероятно, что увеличение количества исследованных статей приведет к увеличению этих показателей.Более того, до настоящего времени не проводилось систематических исследований воздействия метода стерилизации на поверхность металла и соответствующей реакции на коррозию.
Основная цель этой работы состояла в том, чтобы определить наиболее удобный метод стерилизации простой углеродистой стали с точки зрения практичности в типичных лабораторных условиях, эффективности и влияния, которое такие процедуры могут иметь на электрохимический отклик металла. Учитывая, что электрохимический и коррозионный отклик в данной среде зависит от состояния поверхности образца, электрохимический отклик был изучен с использованием одной и той же среды до и после стерилизации.Следовательно, различия могут быть напрямую связаны с изменениями состояния поверхности, вызванными стерилизационной обработкой.
Подготовка металлических образцов
Электрохимические испытания были проведены на цилиндрических образцах из гладкой низкоуглеродистой стали UNS G10180 (AISI 1018) в холоднокатаном и отожженном состоянии с приблизительной площадью 5 см. 2 . Перед стерилизацией образцы подвергали мокрой шлифовке до зернистости 600 с использованием бумаги SiC, очищали ультразвуком в этиловом спирте с крепостью 200, промывали ацетоном и деионизированной водой и, наконец, сушили с использованием сжатого аргона.Образцы временно хранили в эксикаторе и использовали в течение 24 часов.
2 . Перед стерилизацией образцы подвергали мокрой шлифовке до зернистости 600 с использованием бумаги SiC, очищали ультразвуком в этиловом спирте с крепостью 200, промывали ацетоном и деионизированной водой и, наконец, сушили с использованием сжатого аргона.Образцы временно хранили в эксикаторе и использовали в течение 24 часов.
Купоны, используемые для определения эффективности процедур стерилизации, были приготовлены в соответствии с теми же шагами; однако для этой задачи использовались плоские стальные купоны UNS G10100 (AISI 1010) с приблизительной открытой площадью 7 см. 2 . Существуют минимальные различия в содержании углерода и микроструктуре между UNS G10100 и UNS G10180 (Таблица II), незначительные для целей настоящего исследования. 15,16
Таблица II. Номинальный состав сплава (мас.%).
 050
050Методы стерилизации
Методы стерилизации, использованные в этом исследовании, обобщены в таблице III. Эти методы были выбраны из-за (а) их широкого использования в микробиологических лабораториях и / или медицинских учреждениях, (б) их практичности или удобства для применения в стандартных лабораторных условиях, включая возможность относительно длительного хранения стерилизованных купонов ( я.е. более 24 часов) вместо немедленного использования, (c) их a priori эффективность и (d) их потенциальное вредное воздействие — или его отсутствие — на металлы. Например, паровая стерилизация (то есть в автоклаве) не была выбрана из-за известного разрушающего воздействия влажного тепла на углеродистую сталь, 17 , а также из-за того, что изоляция купона на герметичном контейнере перед автоклавированием может снизить эффективность метода за счет ограничения пара. -контакт с микроорганизмами, который необходим для оптимальной стерилизации в автоклаве. 18 Аналогичным образом, по аналогичным причинам избегали использования окислителей, таких как соединения хлора (например, растворы гипохлорита натрия) или растворы перекиси водорода. 7,9
-контакт с микроорганизмами, который необходим для оптимальной стерилизации в автоклаве. 18 Аналогичным образом, по аналогичным причинам избегали использования окислителей, таких как соединения хлора (например, растворы гипохлорита натрия) или растворы перекиси водорода. 7,9
Таблица III. Методы стерилизации.
| Сухое тепло | Контейнер герметичный, воздушный |
| Герметичный контейнер, аргон | |
| спирт этиловый 75 об.% | Быстрое погружение с последующим пламенем |
| Ночное погружение, 15 часов | |
| Ночное погружение, 18 часов | |
Глутаральдегид 2 об. % % | Ночное погружение, 15 часов |
Как показано в таблице III, один из выбранных методов включал использование сухого тепла (т.е.е. сушильная печь). Несмотря на то, что основными недостатками сухого тепла для целей стерилизации являются медленное проникновение тепла и скорость уничтожения микробов, это надежный метод стерилизации, обычно используемый в медицинских учреждениях. 19,20 Наиболее часто используемые соотношения времени и температуры: 170 ° C в течение 60 минут, 160 ° C в течение 120 минут и 150 ° C в течение 150 минут; Время разогрева и охлаждения следует прибавить к общему времени. 20 Для этого исследования образцы обрабатывали при 170 ° C в течение 3 часов (т.е.е. включая время нагрева и охлаждения) в зависимости от температурного профиля духового шкафа. Хотя газовый состав атмосферы, в которой экспонируется образец, не влияет на убивающую способность метода, 20 он может повлиять на свойства поверхности образца при нагревании, возможно, влияя на коррозионную реакцию образца. Более того, само тепло может способствовать образованию поверхностных оксидов. Поэтому образцы для электрохимических испытаний нагревали в сухом виде в двух различных атмосферных условиях: i) фильтрованный воздух и ii) инертная атмосфера аргона.
Более того, само тепло может способствовать образованию поверхностных оксидов. Поэтому образцы для электрохимических испытаний нагревали в сухом виде в двух различных атмосферных условиях: i) фильтрованный воздух и ii) инертная атмосфера аргона.
Для проведения стерилизации сухим жаром 100 мл термостойкие стеклянные колбы, содержащие полированные чистые купоны, промывали в течение примерно одного часа. Промывка осуществлялась через отверстие в термостойкой резьбовой крышке колб, которая имела перегородки из политетрафторэтилена и силикона, которые были термостойкими до 180 ° C. Температурный профиль печи был установлен перед стерилизацией. Температурный профиль был получен с использованием термопар, помещенных внутри колб, расположенных в центре пробирки.Во время стерилизации сухим жаром образцы располагались в пределах плато печи. После стерилизации колбы оставались закрытыми до тестирования.
Другой метод стерилизации заключался в использовании раствора этилового спирта в воде в качестве химического дезинфицирующего средства. В медицинских учреждениях растворы этилового спирта в воде (60–90 об.%) Обладают быстрым бактерицидным, туберкулоцидным, фунгицидным и вирулицидным действием. 19 Было обнаружено, что водные растворы более эффективны для денатурирования белков, чем этиловый спирт с концентрацией 200, хотя они могут не обладать спорицидным действием и не могут проникать в богатые белками материалы. 19 Следуя методикам, описанным в литературе, например, 6,12,21–24 и личному общению с другими исследователями MIC в Университете Акрона, было выбрано 25 три времени воздействия. Первые два заключались в погружении истертых, чистых купонов в 75 об.% Раствор этанола на 15 или 18 часов, пытаясь воспроизвести то, что в литературе называется выдержкой «в течение ночи». Более короткое время погружения привело к проблемам с загрязнением в прошлых экспериментах с MIC. 25 Третий метод, т.е. погружение в 75% -ный раствор этилового спирта с последующим обжигом, представляет собой обычный метод стерилизации металлического оборудования, такого как петли и пинцеты, в микробиологических лабораториях. В обоих случаях после длительного или быстрого погружения купоны необходимо было немедленно использовать для электрохимических испытаний.
Третий и последний метод стерилизации заключался в использовании раствора глутарового альдегида. По словам Рутала и других, 19 активированных водных растворов глутарового альдегида (т.е., щелочные растворы) получили признание в качестве дезинфицирующего и химического стерилизующего средства в медицинских учреждениях из-за их микробицидных свойств и некоррозионного действия на оборудование. Обычно 2 об.% Растворы глутаральдегида, забуференные до pH 7,5–8,0, эффективны для уничтожения микроорганизмов; однако требуется длительное время выдержки. 19 Кроме того, рекомендуются особые меры безопасности в связи с известными опасностями для здоровья, связанными с воздействием глутарового альдегида. 19 Таким образом, для этого метода купоны погружали в 2 об.% Водный раствор глутарового альдегида (пентан-1,5-диал), pH 8.0, на 15 часов. После погружения купоны нужно было сразу использовать для электрохимических испытаний. Как и в случае с этиловым спиртом, время воздействия было выбрано так, чтобы повторить воздействие «в течение ночи». 10
Эффективность методов стерилизации
Эффективность всех процедур стерилизации определялась на основании способности культивировать микроорганизмы после обработки купонов следующим образом. В прямом методе стерилизованные образцы инкубировали в течение 3–5 дней в кислородных условиях при комнатной температуре в стерильной богатой среде (Luria-Bertani, далее LB, бульон, содержащий -на литр-5.0 г дрожжевого экстракта (YE), 10,0 г триптона и 10,0 г NaCl, pH 7,4), который стерилизовали отдельными партиями путем автоклавирования. 19 Перенос купона на стерилизованную среду проводили в стерильных условиях. Контроли включали колбы, содержащие (i) стерилизованную среду и без купонов (контроль 1) и (ii) стерилизованную среду и нестерилизованные купоны (контроль 2). Стеклянную посуду, а также все другие инструменты перед использованием стерилизовали автоклавированием и погружением в этанол с последующим обжигом непосредственно перед использованием. 19
После инкубации рост микробов определяли с использованием двух независимых методов: i) спектрофотометрии и ii) флуоресцентной микроскопии. Для спектрофотометрии оптическую плотность определяли при длине волны 600 нм для всех видов стерилизации и контроля. Кроме того, проходящий свет использовали в сочетании с окрашиванием DAPI (4 ‘, 6-диамидино-2-фенилиндол) на инкубированных средах после каждой обработки и контролях для наблюдения за клетками под флуоресцентным микроскопом.Это синее флуоресцентное пятно (максимум возбуждения при 358 нм и максимум испускания при 461 нм), широко используемое в флуоресцентной микроскопии, специфично окрашивает ДНК. 26 Более подробную информацию об этих двух методологиях можно найти в другом месте. 27
Для второго независимого подтверждения эффективности стерилизации был использован подход непрямой обратной стерилизации. Преднамеренно загрязненные чистые, еще не отполированные купоны стерилизовали теми же методами, которые описаны выше.Перед стерилизацией купоны погружали в культуру Escherichia coli ATCC25404, выращенную в течение ночи в аэробных условиях в бульоне LB. После стерилизации купоны инкубировали и тестировали на рост бактерий в соответствии с процедурой прямого метода. Для этого подхода контроли включали колбы, содержащие (i) стерилизованную среду и без купонов (контроль 3) и (ii) стерилизованную среду и намеренно загрязненные купоны (контроль 4).
Электрохимические методы
Растворы для электрохимических испытаний
Синтетическая среда, используемая для испытания коррозионной реакции металла после процедур стерилизации, имела химический состав, аналогичный растворам, используемым для роста обычных бактерий, вызывающих обрастание, 28 , за исключением Были включены исходники C.YE не добавляли к электролитам, используемым в электрохимических испытаниях, поскольку было показано, что YE влияет на измерения коррозии. 29 Состав раствора (на литр): 3,0 г NaNO 3 , 0,7 г KH 2 PO 4 , 0,3 г MgSO 4 . 7H 2 0, 0,01 г CaCl 2 .2H 2 O, 0,02 г FeSO 4 .7H 2 0, 0,5 г NaCl, 0,01 г MnCl 2 .4H 2 O и 2 мл следов элементное решение.Состав раствора микроэлементов был (на литр): 0,75 г MnSO 4 .H 2 O, 0,75 г ZnSO 4 .7H 2 0, 0,15 H 3 BO 3 , 0,08 г FeCl 3 .6H 2 O, 0,08 г CoCl 2 .6H 2 O, 0,075 CuSO 4 .5H 2 O и 0,05 г Na 2 MoO 4 .2H 2 O. Во время тестирования pH раствора оставался в пределах 4,50–4,70.
Отдельный набор образцов был протестирован в 0.1 M NaCl pH 4,50, чтобы сравнить коррозионную активность синтетической среды и электролита, обычно используемого при исследованиях коррозии.
Электрохимические испытания
Электрохимические измерения проводились с использованием стандартной 3-электродной матрицы. Платиновая сетка использовалась в качестве противоэлектрода, а насыщенный каломельный электрод (SCE) использовался в качестве электрода сравнения. Электрод сравнения был подключен к раствору через капилляр Луггина диаметром 1 мм, расположенный на расстоянии 2–3 мм от образца.Все тесты проводились с использованием обычного потенциостата. Для каждого метода стерилизации использовали минимум четыре образца, а четыре дополнительных купона использовали в качестве нестерилизованных контролей (контроль 5). Косвенная оценка изменений состояния поверхности, вызванных каждой стерилизационной обработкой, была получена путем сравнения реакции коррозии стерилизованных и нестерилизованных образцов.
Электрохимические испытания включали:
Испытания потенциодинамической поляризации — наклоны Тафеля
Испытания потенциодинамической поляризации были выполнены для определения значений наклона Тафеля, необходимых для скорости коррозии (C.Р.) расчеты. 30–34 Испытания проводились после достижения стабильного, т. Е. ± 10 мВ, потенциала холостого хода (E OC ), который обычно возникал после 1 часа воздействия, при скорости сканирования 0,167 мВ / с. Потенциал сканировали от -200 мВ до +200 мВ относительно E OC .
Измерения потенциодинамического поляризационного сопротивления
Измерения потенциодинамического поляризационного сопротивления были выполнены в соответствии со спецификацией ASTM f G59 со следующими изменениями. 35 Испытания проводились после стабилизации потенциала свободной коррозии, что обычно длилось 60 минут. Измерения потенциодинамического поляризационного сопротивления проводили при скорости сканирования 0,167 мВ / с. 36 В этом отношении рекомендованная стандартом скорость сканирования 0,167 мВ / с была достаточно низкой, чтобы минимизировать гистерезис, 37,38 и намного ниже максимальной скорости сканирования, предложенной Мансфельдом, Кендигом и Таунли. 36,39 Диапазон потенциалов +/- 25 мВ по сравнению сЕ ОС . Значения поляризационного сопротивления (R P ) были получены как наклон графика зависимости потенциала от плотности тока при i = 0. Затем значения 35,39,40 R P были использованы для расчета скорости коррозии с помощью прибора Штерна. -Уравнение Гири. 35,40 Тафелевые склоны использовались в качестве исходных данных для этого расчета; более подробная информация об этих расчетах представлена в разделе «Результаты». 39–41
Неэлектрохимические методы
Зонды электрического сопротивления (ER)
Прибор ER был использован для оценки скорости коррозии углеродистой стали в растворах этанола и глутаральдегида.Исследования проводились с использованием зонда из углеродистой стали UNS G10100 (AISI 1010) с геометрией проволочная петля. Зонды экспонировались 20 дней. Ожидаемое время отклика, то есть минимальное время, в течение которого происходит надежное, измеримое изменение, зонда составляло от 2 до 6 дней, в зависимости от ожидаемой скорости коррозии. 42,43 Изменения электрического сопротивления были пересчитаны в значения скорости коррозии с использованием рекомендаций производителя.
Измерение изменения массы во время изотермической термообработки
Изотермическая термообработка была проведена для определения кинетики окисления материала.Были использованы прямоугольные образцы из углеродистой стали UNS G10100 (AISI 1010) с приблизительной площадью 8 см 2 . Оценивались пять различных температур: 180, 300, 400, 500 и 600 ° C. Все тесты проводились в двух экземплярах. Образцы помещали в печь при комнатной температуре. Затем печь нагревали до желаемой температуры и поддерживали ее в течение 2 часов. Затем печь выключали, и образцы оставляли охлаждаться в печи. Образцы взвешивали на аналитических весах с точностью до 0.1 мг для определения потери или набора веса из-за различных термических обработок.
Воспроизводимость и статистический анализ
Тесты для оценки эффективности различных методов стерилизации были проведены в трех экземплярах (прямой подход) и в двух экземплярах (непрямой подход).
Все электрохимические измерения повторяли как минимум в четырех повторностях. Дополнительное испытание было проведено, когда наблюдался большой разброс значений скорости коррозии (например, этанол).
Учитывая, что измерения потенциодинамического поляризационного сопротивления могут либо недооценивать, либо переоценивать поляризационное сопротивление в зависимости от направления поляризации, 44–46 каждое измерение потенциодинамического поляризационного сопротивления повторялось 6 раз для каждого образца, 3 раза в прямом направлении и 3 раза. в обратном направлении, проверяя минимальный гистерезис между сканированиями.Для каждого образца указанные значения R P представляют собой среднее значение этих 6 измерений. Термические обработки для определения кинетики окисления простой углеродистой стали проводили в двух экземплярах.
Диапазон использовался для оценки изменчивости результатов, учитывая, что количество повторяющихся независимых значений, n , было небольшим, то есть n <12. Диапазон, w , определяется как разница между максимальные и минимальные значения в наборе значений реплицируемых данных. 47 Как объяснено в ASTM G16, w не делает никаких предположений о распределении ошибок, учитывая его непараметрический характер. Поскольку во всех случаях n <12 и предполагая стандартное распределение, стандартное отклонение S было приблизительно равно: 47
Таблица IV обобщает все контрольные случаи, описанные в этом исследовании. Контроли 1–4 — это контрольные условия, используемые для оценки эффективности различных процедур стерилизации. Контроль 5 представляет собой контрольные условия для всех электрохимических испытаний.
Таблица IV. Сводка контрольных испытаний.
| Контроль 1 | Среда стерилизованная, без купонов; прямой подход к стерилизации. |
| Контроль 2 | Купоны нестерилизованные; прямой подход к стерилизации. |
| Контроль 3 | Среда стерилизованная, без купонов; обратная стерилизация. |
| Контроль 4 | Загрязненные купоны, без дальнейшей стерилизации; обратная стерилизация. |
| Контроль 5 | Как полированные купоны, используемые при электрохимических испытаниях; стерилизация не применяется. Синтетическая среда. |
Результаты процедуры прямой стерилизации показаны на рисунке 1. На рисунке 1a показаны средние значения оптической плотности, измеренные при 600 нм для образцов, стерилизованных в соответствии с подходом прямой стерилизации, тогда как на рисунке 1b показаны эти значения для метода обратной стерилизации. В обоих случаях образцы были сгруппированы по методу стерилизации.
Приблизить
Уменьшить
Сбросить размер изображения
Рис. 1. Средние значения абсорбции, измеренные при 600 нм для образцов, использованных в (а) для подтверждения эффективности прямой и (б) обратной стерилизации. Планки погрешностей соответствуют значениям стандартного отклонения. Отклонение меньше, чем символы для точек, не имеющих полос погрешностей. Стрелка указывает на лечение, при котором после инкубации наблюдался рост бактерий. Результаты сгруппированы по методу стерилизации.
На рис. 2 сравниваются диаграммы потенциодинамического поляризационного сопротивления, снятые в прямом направлении для основных процедур стерилизации с контролем (контроль 5). Среднее сопротивление поляризации шести последовательных измерений, трех в прямом направлении и трех в обратном направлении, также включено в каждый рисунок для сравнения.
Приблизить
Уменьшить
Сбросить размер изображения
Рисунок 2. Типичные кривые потенциодинамического поляризационного сопротивления UNS G10180 для основных процедур стерилизации, снятые в прямом направлении: (а) контрольная 5 — пунктирная линия — и сухой жар (Ar) и (б) этанол (18 ч), этанол (пламя) и глутаральдегид . Значения R P , показанные на фигурах, представляют собой среднее значение шести последовательных сканирований, трех в прямом направлении и трех в обратном направлении. Все тесты проводились в синтетической среде.
Значения сопротивления поляризации в Ом.см 2 были получены с использованием стандартного программного обеспечения для анализа коррозии, как:
, где ɛ — E-E OC в вольтах 46,48,49 .
На рис. 3 сравниваются кривые анодной и катодной поляризации для основных процедур стерилизации с контролем 5. Для каждого повтора наклоны Тафеля оценивались с использованием стандартного программного обеспечения для анализа коррозии. Наклоны анодного тафеля были определены на расстоянии не менее 50 мВ от E OC , что дало максимальную ошибку 2
примерно 7%. 50 Значения наклона анодного тафеля соответствовали значениям, указанным в отчете Stern и Weisert. 51 Поскольку катодные кривые во всех случаях находились под контролем массопереноса (рис. 3), катодные тафелевские наклоны аппроксимировались как β c → ∞ . Учитывая, что коэффициент Штерна-Гири, B:
преобладает меньший из двух тафелевских наклонов, B уменьшается до B = a / 2,303 при катодном контроле массопереноса. 40,52
Приблизить
Уменьшить
Сбросить размер изображения
Рисунок 3. Типичные графики анодной и катодной потенциодинамической поляризации UNS G10180 для основных процедур стерилизации: (a) контроль 5, сухой жар (Ar) и глутаральдегид и (b) контроль 5, этанол (18 ч) и этанол (пламя). Все тесты проводились в синтетической среде.
Плотность тока коррозии i Corr в мкА / см 2 впоследствии была определена как:
и преобразовать в скорости коррозии в мм / год с использованием: 53
, где EW — эквивалентный вес корродирующего вещества в граммах на эквивалент, а ρ — плотность сплава в г / см 3 .EW и ρ были приблизительно равны 27,97 г / экв и 7,87 г / см 3 соответственно. 54
Сопротивление раствора R S измеряли на отдельном наборе образцов, подвергнутых воздействию синтетической питательной среды или 0,1 М NaCl, pH = 4,50, с использованием спектроскопии электрохимического импеданса (EIS). Результаты EIS показали, что среднее значение R S составило 8,4 ± 1,8 Ом. В наиболее консервативном случае, то есть наивысший R S и самый низкий R P , R S составлял менее 3% от общего удельного сопротивления (R T ), при среднем значении менее 1.5%. Таким образом, вклад R S в i corr не учитывался, т.е.R P >> R S .
Скорости коррозии для всех повторений каждого метода стерилизации, оцененные с помощью потенциодинамического поляризационного сопротивления, показаны на рисунке 4. Средние скорости коррозии, установившееся состояние E OC , E OC стандартное отклонение, анодные и катодные тафелевские наклоны, а также минимальные и максимальные значения, диапазон и стандартное отклонение показаны в таблице V.Также для сравнения включены скорости коррозии образцов UNS G10180 (AISI 1018) в 0,1 NaCl при pH 4,50 и контрольные значения скорости коррозии углеродистой стали в свежей газированной воде 55,56 и морской воде 57,58 . Во всех случаях результаты были сгруппированы по методу стерилизации.
Приблизить
Уменьшить
Сбросить размер изображения
Рис. 4. Значения скорости коррозии, определенные методом потенциодинамического поляризационного сопротивления.Результаты сгруппированы по методу стерилизации. Скорости коррозии в пресной воде 55,56 и морской воде 57,58 добавлены для справки. Короткие горизонтальные линии указывают среднюю скорость коррозии.
Таблица V. Измерения скорости коррозии, полученные с помощью метода потенциодинамического поляризационного сопротивления.
| Лечение | AVG OCP (V SCE , SCE) | STD E OC (мВ SCE ) | AVG Анодный тафелевый наклон, β a (В / декада) | AVG Катодный тафелевский наклон, β c (В / декада) | Среднее значение C.Р. (мм / г) | Макс. C.R. (мм / год) | Мин. C.R. (мм / год) | C.R. Range, w (мм / год) | C.R. STD, S (мм / год) |
|---|---|---|---|---|---|---|---|---|---|
| Контроль 5 | -0,693 | 8,1 | 0,093 | ∞ | 0,797 | 0,847 | 0,715 | 0,132 | 0,0660 |
| Сухое тепло (Ar) | -0,678 | 3,3 | 0,092 | ∞ | 0.692 | 0,751 | 0,586 | 0,165 | 0,0825 |
| Сухое тепло (воздух) | -0,674 | 7,4 | 0,083 | ∞ | 0,578 | 0,762 | 0,403 | 0,360 | 0,1800 |
| 75 об.% Этанола, 15 часов | -0,687 | 10,7 | 0,107 | ∞ | 0,644 | 0,822 | 0.495 | 0,327 | 0,1635 |
| 75 об.% Этанола, 18 часов | -0,677 | 70,64 | 0,111 | ∞ | 0,461 | 0,879 | 0,030 | 0,849 | 0,379 |
| 75 об.% Этанол, пламя | -0,679 | 56,7 | 0,108 | ∞ | 0,323 | 0,631 | 0,106 | 0.524 | 0,234 |
| 2 об.% Глутарового альдегида | -0,664 | 4,4 | 0,099 | ∞ | 0,449 | 0,593 | 0,208 | 0,385 | 0,1925 |
| 0,1 М NaCl pH 4,50 | -0,548 | 13,6 | 0,057 | ∞ | 0,234 | 0,284 | 0,136 | 0,148 | 0,074 |
Скорость коррозии UNS G10100 (AISI 1010) в 75 об.% Этанола и 2 об.% Глутарового альдегида, измеренная с помощью зонда ER с проволочной петлей, показана на рисунке 5.На рисунке 5 вертикальная пунктирная линия указывает время отклика датчика. Поскольку время отклика датчика ER зависит от ожидаемой скорости коррозии, 43 было рассчитано консервативное время отклика, предполагая, что средняя скорость коррозии составляет 0,05 мм / год. Точки данных, взятые ниже времени отклика датчика, обозначены пунктирными символами. Наконец, на рис. 6 показано изменение веса в зависимости от температуры.
Приблизить
Уменьшить
Сбросить размер изображения
Рисунок 5. Скорость коррозии UNS G10100 в 75 об.% Этанола или 2 об.% Глутарового альдегида, как указано. Измерения коррозии проводились с использованием серийного ER-зонда с проволочной петлей.
Приблизить
Уменьшить
Сбросить размер изображения
Рис. 6. Увеличение веса UNS G10100 при воздействии воздуха печи в зависимости от температуры.
Эффективность стерилизации
Все методы стерилизации дезактивировали микроорганизмы на поверхности металла.Растворы после обработок прямой стерилизацией не показали разницы в оптической плотности (OD) по сравнению со стерилизованной средой, не содержащей купонов (контроль 1, рисунок 1a). Более того, микроорганизмы не были обнаружены под микроскопом. Только растворы из нестерилизованных контролей (контроль 2, рис. 1а) показали повышенную оптическую плотность; Позже присутствие микроорганизмов было подтверждено визуально под микроскопом.
Испытания обратной стерилизации, в которых микроорганизмы намеренно росли на поверхности, предоставили дополнительные доказательства эффективности различных обработок, использованных в этом исследовании.Никакой разницы в оптической плотности питательной среды не наблюдалось почти во всех методах стерилизации по сравнению с колбами, содержащими исключительно стерилизованную среду (контроль 3, рисунок 1b). Позже отсутствие микроорганизмов было подтверждено под оптическим микроскопом. Единственной обработкой, которая показала небольшое увеличение оптической плотности, было сухое тепло. Микроорганизмы не были обнаружены с помощью микроскопии, а скорее присутствовали остатки высушенной в печи биопленки, которые образовались во время преднамеренного загрязнения, которое привело к немного более высокой OD в среде LB.
Как и ожидалось, загрязненные контроли (контроль 4, рис. 1b) имели повышенную оптическую плотность, связанную с микробным заражением, что позже было подтверждено оптической микроскопией.
Поскольку при методе прямой стерилизации образцы были погружены в богатую питательную среду, вполне вероятно, что микроорганизмы, которые нельзя культивировать в этом обычно используемом бульоне, могли выжить в процессе стерилизации. В этом случае прямой подход не обнаружил бы присутствие таких микроорганизмов.Однако эффективность методов стерилизации также оценивалась с помощью обратной процедуры, определяя их эффективность в уничтожении живых бактерий (например, E. coli, ATCC25404). Представленные здесь результаты позволяют предположить, что все методы стерилизации удаляли живые бактерии с поверхности металла, когда намеренно загрязнен. Кроме того, контаминация действительно имела место в необработанном контрольном случае, но не в стерилизованных образцах, что означает, что все методы стерилизации были способны уничтожить не только живые микроорганизмы, но и, как минимум, все те, которые можно культивировать в LB бульон.Использование различных питательных сред и дополнительных методов обнаружения, таких как независимые от культуры подходы к обнаружению активности, может дать дополнительную информацию об эффективности стерилизации, которая выходит за рамки данной работы.
Электрохимические испытания
Понимание влияния стерилизационной обработки на коррозионное поведение сплава имеет решающее значение для исследований MIC. Идеальная стерилизационная обработка эффективно убивает все живые микроорганизмы и споры на поверхности без изменения состояния поверхности образца, оцениваемого здесь по электрохимической реакции материала.Следовательно, скорости коррозии должны быть в среднем одинаковыми, с разбросом (оцениваемым с использованием диапазона) в пределах вариабельности необработанного контроля. В этом отношении большой разброс скорости коррозии добавляет источник ошибок и может привести к неверной интерпретации данных.
Все процедуры стерилизации в некоторой степени повлияли на электрохимический отклик материала (рис. 4). Влияние процедуры стерилизации на скорость коррозии было более выраженным, чем на E OC , Таблица V.Тем не менее, E OC в этаноле (18 часов) и этаноле с последующим пламенем дает наибольший разброс. Воздействие 75% этанола в течение 18 часов и этанола с последующим пламенем привело к стандартным отклонениям, которые были, соответственно, в 8,7 и 7,0 раз выше, чем у контрольного образца 5.
Скорость коррозии образцов, обработанных сухим жаром в атмосфере инертного аргона, имела среднее значение. скорость коррозии, а также диапазон и стандартное отклонение, аналогичные значениям w и S для контроля (т.е.е. w = 0,165 против 0,132 мм / год и S = 0,0825 против 0,0660, соответственно, или на 25% выше, чем в контроле), контроль 5. Образцы, обработанные сухим жаром на воздухе, напротив, показали небольшое снижение средней скорости коррозии; однако диапазон 0,360 мм / год и стандартное отклонение 0,18 мм / год были в 2,7 раза выше, чем у контроля 5.
Стерилизация 75 об.% этанола оказала заметное влияние на коррозию, которая зависела от времени стерилизации. Средняя скорость коррозии через 15 часов была ниже, чем в контроле (контроль 5), с диапазоном и стандартным отклонением, аналогичным показателям сухого нагрева на воздухе.Стерилизация купонов в этаноле в течение 18 часов, однако, привела к наибольшей изменчивости данных с разницей между максимальной и минимальной скоростью коррозии почти на порядок. Стерилизация пламенем дала наибольшее снижение средней скорости коррозии со значением w 0,524 мм / год и S 0,262 мм / год, что в 4 раза выше, чем в контроле (контроль 5). Наконец, образцы, стерилизованные в 2 об.% Глутарового альдегида, показали среднюю скорость коррозии, аналогичную скорости 18-часовой стерилизации в 75 об.% Этаноле, и значительную изменчивость при w = 0.385 мм / год и S = 0,1925 мм / год.
Большой разброс, вызванный стерилизацией в 75 об.% Этанола и 2 об.% Глутарового альдегида, частично можно объяснить коррозионной активностью среды по отношению к углеродистой стали. В большинстве случаев воздействие 75 об.% Этанола и 2 об.% Глутарового альдегида приводило к появлению видимых пятен ржавчины и обесцвечиванию электролита через 15 часов. Оценка скорости коррозии с использованием зондов ER в 75 об.% Этанола и 2 об.% Глутарового альдегида была проведена, чтобы попытаться объяснить эти наблюдения.
Хотя консервативное время отклика датчика, рассчитанное здесь, было больше, чем фактический период стерилизации, скорость коррозии использовалась как индикатор коррозионной активности окружающей среды.В связи с этим скорость коррозии, оцененная с помощью измерений датчика ER, проведенных после периода начальной стабилизации датчика (рис. 5), находилась в диапазоне от 0,025 до 0,075 мм / год (от 0,985 до 2,955 миль в год). Эти незначительные скорости коррозии составляют 20% и 60% от принятой скорости коррозии углеродистой стали в газированной, тихой (т.е. движущейся со скоростью менее 0,6 м / с) морской воде 57,58 .
Влияние состава электролита
В дополнение к эффекту стерилизационной обработки необходимо учитывать влияние электролита, используемого для испытаний на коррозию.Исследования МПК обычно проводятся с использованием сложных электролитов, в которые добавляется значительное количество компонентов, необходимых для развития микробов. Как обсуждали Webster и Newman, 59 , коррозионная активность этих богатых питательными веществами синтетических сред может сильно отличаться от коррозионной активности реальной рабочей среды, например пресная и морская вода.
Рисунок 4 показывает, что скорость коррозии углеродистой стали (контроль 5) в комплексном растворе, используемом здесь, была в среднем в 3,4 раза выше, чем в 0.1 М раствор NaCl тестировали при том же значении pH, равном 4,50. Хотя краткосрочные лабораторные эксперименты в смоделированных средах не могут быть использованы для прогнозирования долгосрочных скоростей коррозии в естественных средах, показательно сравнить краткосрочное поведение углеродистой стали в синтетическом электролите, используемом в этом исследовании, с долгосрочным поведением. в пресной и морской воде. 37,60 Скорость коррозии в стерильной синтетической среде была в 8 раз выше, чем заявленные средние скорости коррозии углеродистой стали в пресной воде 55,56 и 6.В 35 раз быстрее, чем заявленные значения для углеродистой стали в естественной морской воде. 57,58 Сравнение скорости коррозии по результатам расследования MIC с типичной скоростью коррозии при эксплуатации может ввести в заблуждение. Отрицательный контроль, то есть контроль без микроорганизмов, в реальной стерильной синтетической среде необходим, чтобы отделить действие микроорганизмов от воздействия неорганических и органических веществ, добавленных в электролит. В связи с этим некоторые соединения могут либо усиливать коррозию (например, Fe 3+ и NO 3 —), действуя как добавленные окислители, либо замедлять / ингибировать кинетику растворения за счет образования поверхностных защитных пленок (например,грамм. фосфаты). 61,62 Добавки YE также влияют на результаты коррозии. 29
Кинетика окисления
Данные, представленные выше, позволяют предположить, что сухой жар был наиболее удобной процедурой стерилизации углеродистой стали. Однако продолжительный нагрев при умеренно повышенных температурах потенциально может изменить свойства поверхности и микроструктуру стали. Дополнительные испытания были проведены для определения максимально допустимой температуры для стерилизации сухим жаром.
Как видно на рис. 6, даже при воздействии воздуха образование оксидов было минимальным во время стерилизации сухим жаром, учитывая относительно низкие температуры процедуры. Точно так же на рис. 6 показано, что прибавку в весе из-за окисления можно было измерить с помощью аналитических весов только при температурах выше 400 ° C. Увеличение веса при окислении углеродистой стали и железа зависит от количества холодной обработки и методов подготовки образцов, таких как электрополировка или механическое шлифование. 63 Несмотря на это, увеличение веса образцов, подвергшихся воздействию температур выше 400 ° C, было в разумном соответствии со значением, ожидаемым с использованием закона параболического роста с коэффициентами, указанными в литературе. 64–66 Для образцов, подвергшихся воздействию температуры 400 ° C или выше, скорость коррозии в испытательном растворе резко снизилась (не показано), вероятно, из-за образования защитных оксидов. Рост оксидов не должен быть проблемой априори при стерилизации углеродистой стали при температуре 150–180 ° C.
Использование стерилизации сухим жаром для других сплавов
Основываясь на результатах, представленных здесь, может возникнуть соблазн предположить, что стерилизация сухим жаром в инертной атмосфере может быть использована для других сплавов.Несмотря на то, что на основании кинетики системы Fe-C-Mn не ожидается никаких микроструктурных изменений углеродистой стали из-за стерилизационной обработки при температуре от 150 до 180 ° C, хорошо известно, что продолжительный нагрев при умеренно повышенной температуре может вызвать рост зерна и старение. дисперсионно-твердеющих сплавов, таких как деформируемые алюминиевые сплавы. 67 Хотя стерилизация сухим жаром в инертной атмосфере должна одинаково хорошо работать как с углеродистыми и низколегированными сталями, так и с большинством нержавеющих сталей и сплавов на основе никеля, нагрев в диапазоне 150–180 ° C может привести к дисперсионному упрочнению, например.g., большинство деформируемых алюминиевых сплавов, используемых в аэрокосмической промышленности. 67 Влияние возможных микроструктурных изменений из-за процедуры стерилизации необходимо учитывать при исследовании MIC.
На основании представленных здесь доказательств были сделаны следующие выводы:
- Все методы стерилизации были одинаково эффективны в удалении микроорганизмов и спор с поверхности металла, что было определено напрямую, путем культивирования в бульоне LB, и косвенно, путем определения эффективности уничтожения живых микроорганизмов на преднамеренно загрязненных поверхностях.
- Все методы стерилизации представляют собой источник ошибок, определяемых измерениями линейной поляризации. В этой публикации представлена методология, которой могут следовать другие лаборатории для оценки эффекта альтернативных методов стерилизации в конкретных лабораторных условиях.
- Сухое нагревание при 170 ° C в течение 60 минут (плюс время нагрева и охлаждения) в инертной атмосфере было наиболее удобным методом стерилизации углеродистых сталей с точки зрения практичности и стабильности реакции металла на его применение.
- Хотя стерилизация сухим жаром в инертной атмосфере должна быть одинаково подходящей для всех углеродистых, низколегированных и большинства нержавеющих сталей, а также сплавов на основе никеля, продолжительный нагрев при 150–180 ° C может привести к микроструктурным изменениям некоторых стареющих сталей. сплавы.
- Стерилизация углеродистой стали в 75 об.% Этанола и 2 об.% Глутарового альдегида, а также в спирте с последующим пламенем не рекомендуется из-за большого разброса электрохимической реакции, вызванного воздействием стерилизационной среды.
Авторы благодарят профессора Лу-Кванг Джу, профессора Рикардо М. Карранса, Роберта Миллера II, Хуа Ванга и Альваро Родригеса за их советы и техническую помощь в проекте.
Эта работа связана с Национальным центром образования и исследований по коррозии и характеристикам материалов (NCERCAMP) в Университете Акрона и Министерством обороны США по техническому сотрудничеству в области коррозии при поддержке Министерства обороны США по политике и надзору в области коррозии через инженерные исследования и разработки. Центр / Исследовательская лаборатория строительства армии США, грант W9132T-11-0002, и через Академию ВВС США по соглашению номер FA7000-10-2-0013.
Стерилизация как метод планирования семьи
Стерилизация — это постоянный метод контрацепции и наиболее часто используемая форма планирования семьи среди пар как в Соединенных Штатах, так и во всем мире. Для мужчин и женщин, которые больше не хотят иметь детей, стерилизация предлагает постоянный, безопасный, экономичный и эффективный способ предотвратить нежелательную беременность. Мужская стерилизация встречается реже, чем женская, но обе почти на 100% эффективны для предотвращения беременности.Бесплатное покрытие стерилизации согласно Закону о доступном медицинском обслуживании повысило доступность этой процедуры для женщин, но до сих пор неясно, как это повлияет на показатели использования в будущем. Недавние изменения в политике страхового покрытия, более широкая доступность противозачаточных средств длительного действия, а также изменения в системе оказания медицинской помощи могут изменить выбор, который делают мужчины и женщины в отношении использования стерилизации в качестве метода контрацепции. Этот информационный бюллетень объясняет типы процедур стерилизации, доступные для женщин и мужчин, рассматривает частное страхование и политику покрытия Medicaid, а также обсуждает вопросы, влияющие на доступность в U.С.
Женская стерилизация
Женская стерилизация — это амбулаторная хирургическая процедура. Процедура блокирует маточные трубы, предотвращая попадание яйцеклеток по трубам в матку и препятствуя оплодотворению яйцеклетки сперматозоидами. Данные Центров по контролю и профилактике заболеваний (CDC) показывают, что среди женщин в возрасте от 15 до 44 лет, которые используют метод контрацепции, каждая пятая использует перевязку маточных труб в качестве метода контрацепции. Самый высокий уровень стерилизации наблюдается у женщин в возрасте от 35 до 44 лет, бывших замужних женщин и женщин, родивших трех и более детей.Уровень стерилизации также выше среди чернокожих и латиноамериканских женщин, а также женщин с более низким уровнем дохода (, рисунок 1, ).
Диаграмма 1: Распространенность стерилизации среди женщин от 15 до 44 лет, сообщающих об использовании обратимого или постоянного метода контрацепции, 2013–2015 годы, по отдельным характеристикам
Хотя стерилизация очень эффективна для предотвращения беременности, она не защищает от инфекций, передаваемых половым путем (ИППП). Стерилизацию следует считать постоянной и ее должны проводить только лица, которые не хотят иметь детей в будущем.Хотя процедура может быть отменена, процесс инвазивный, обычно не покрывается страховкой, довольно дорогостоящий и не гарантированно работает.
Перевязка маточных труб
Процедура | Эффективность | Сроки | |
Женская стерилизация | Мини-лапаротомия | Действует немедленно | послеродовой; после аборта; Вне послеродового периода (6 недель + послеродовой период) |
Лапароскопия | Частота неудач беременностей у 5 из 1000 женщин | Только вне послеродового периода | |
Мужская стерилизация | Традиционная вазэктомия | Действует примерно через 3 месяца; Частота неудач при 1 беременности на 1000 женщин | НЕТ |
Вазэктомия без скальпеля (NSV) | НЕТ | ||
| Pro-Vas | Действует примерно через 3 месяца; неубедительные данные о частоте отказов | НЕТ |
Существует два основных метода хирургической перевязки маточных труб: мини-лапаротомия и лапароскопическая стерилизация.Мини-лапаротомия (также называемая минилапом) чаще всего выполняется сразу после родов, сразу после родов под общей или регионарной анестезией. В брюшной полости делается небольшой разрез, и часть фаллопиевой трубы удаляется или блокируется ( Таблица 1 ). С другой стороны, лапароскопическая стерилизация не рекомендуется для послеродового использования. Пока пациент находится под общей анестезией, в брюшной полости делается небольшой разрез и вставляется небольшая тонкая камера для наблюдения за фаллопиевыми трубами, которые затем закрываются.Время восстановления меньше при лапароскопической стерилизации, чем при мини-лапаротомии. Эти методы эффективны немедленно: на каждые 1000 женщин приходится пять беременностей. Однако частота неудач увеличивается со временем, в зависимости от используемой процедуры, и может увеличиваться до 18–37 беременностей на каждые 1000 женщин через десять лет после завершения процедуры. Осложнения возникают редко, но могут включать кровотечение, инфекцию и внематочную беременность.
До недавнего времени существовал один нехирургический метод женской стерилизации, но в США он постепенно отменяется.Утвержденное FDA в 2002 году, Essure представляет собой устройство, состоящее из двух гибких спиралей, которые вводятся в каждую из маточных труб через шейку матки. Со временем вокруг этих спиралей образуется рубцовая ткань, которая блокирует трубки. Этот процесс займет около трех месяцев. Хотя с 2002 года Essure получили более 750 000 женщин, количество сообщений о побочных эффектах растет. В связи с этими сообщениями производитель Bayer решил прекратить продажи Essure в США до 31 декабря st , 2018.
Мужская стерилизация
Мужская стерилизация, также называемая вазэктомией, проводится амбулаторно. При традиционной процедуре врач делает два небольших разреза с каждой стороны мошонки, чтобы перерезать, перерезать и связать или прижечь семявыносящий проток, который соединяет яички с другими железами. Существует также более новая техника «без скальпеля», при которой требуется лишь небольшой прокол в мошонке, чтобы добраться до семявыносящего протока, что сокращает количество осложнений и время восстановления. Несмотря на меньшую частоту использования, вазэктомия безопаснее, дешевле и эффективнее женской стерилизации.Только одна из 1000 женщин забеременеет при использовании этого метода контрацепции; однако вазэктомия не дает немедленного эффекта. Обычно для реабсорбции или эякуляции сперматозоидов, оставшихся в трубках, требуется три месяца. А до тех пор следует использовать альтернативную форму контрацепции. Мужская стерилизация также не защищает от ИППП. Безоперационные альтернативы, такие как пружинные зажимы, были доступны в прошлом, но подавляющее большинство мужчин используют хирургические методы вазэктомии.
Примерно 5% мужчин в Соединенных Штатах подверглись вазэктомии. Использование более распространено среди женатых белых мужчин старше 35 лет. В отличие от женщин, перенесших перевязку маточных труб, распространенность мужской стерилизации увеличивается с ростом дохода и образования (, рис. 2, ).
Рисунок 2: Доля мужчин в возрасте 15-44 лет, сообщивших о вазэктомии, 2013-2015 гг.
Страховая защита
Стерилизация — очень экономичный метод контрацепции. Несмотря на высокие начальные затраты, он обычно не требует последующего ухода и, следовательно, в долгосрочной перспективе может быть дешевле, чем другие методы.В зависимости от места и типа процедуры, среди прочих факторов, стоимость процедуры женской стерилизации составляет от 1500 до 6000 долларов, тогда как вазэктомия может стоить от 350 до 1000 долларов.
Закон о частном страховании и доступном медицинском обслуживании
Закон о доступном медицинском обслуживании (ACA) включает требование о том, чтобы новые планы частного медицинского страхования покрывали по крайней мере одну форму из всех 18 утвержденных FDA методов контрацепции для женщин, как предписано, без разделения затрат. Это означает, что процедуры женской стерилизации должны полностью покрываться планами частного медицинского страхования.Эта федеральная политика не включает мужскую стерилизацию; однако в пяти штатах Иллинойс, Мэриленд, Вермонт, Орегон и Вашингтон были приняты законы, требующие, чтобы регулируемые штатом планы медицинского страхования также покрывали вазэктомию без дополнительных затрат для пациента.
Medicaid
Medicaid, национальная программа медицинского страхования для лиц с низкими доходами, финансируется и осуществляется совместно федеральным правительством и правительством штата. Покрытие планирования семьи является обязательным в рамках Medicaid, что означает, что все штаты должны покрывать эту категорию пособий, но исторически штаты имели право решать, какие конкретные услуги покрываются, включая стерилизацию.Государства, которые не расширили Medicaid, сохранили право определять требования к покрытию стерилизации как для мужчин, так и для женщин. Однако в штатах, которые начали полномасштабное расширение Medicaid, требование ACA о полном охвате всех 18 методов для женщин распространяется на новых получателей Medicaid, которые соответствуют требованиям в результате расширения ACA, что означает, что все методы стерилизации для женщин в этой группе должны быть покрыты. Это требование, однако, не распространяется на вазэктомию, но большинство штатов сообщают, что они покрывают процедуру для мужчин, включенных в их полномасштабную программу.Учитывая, что расширение Medicaid открыло путь для охвата большего количества мужчин, вполне вероятно, что больше мужчин с низким доходом теперь имеют покрытие для вазэктомии, особенно в штатах, которые расширили Medicaid в рамках ACA.
Постановление
запрещает использование федеральных средств для стерилизации женщин моложе 21 года. Они также требуют, чтобы форма информированного согласия была подписана женщиной, желающей пройти стерилизацию, по крайней мере, за 30 дней до процедуры. В случае преждевременных родов согласие должно быть получено не менее чем за 30 дней до предполагаемой даты родов.В случае экстренной абдоминальной операции между получением согласия и процедурой должно пройти не менее 72 часов. Это положение было введено для защиты от принудительной практики и злоупотреблений, которые исторически были направлены на женщин с низким доходом, женщин с ограниченными возможностями, цветных женщин и заключенных. Однако некоторые защитники утверждают, что это требование ложится бременем на бедных женщин, обращающихся за услугами по стерилизации, с которыми женщины с частной страховкой не сталкиваются. Исследование, проведенное в ноябре 2010 года, показало, что 47% женщин, участвующих в программе Medicaid, которые обратились за стерилизацией, но получили отказ из-за проблемы с формой информированного согласия или периода ожидания, снова забеременели в следующем году.
Незастрахованный
Некоторые штаты расширили доступ к услугам планирования семьи для незастрахованного населения за счет использования программы расширения планирования семьи Medicaid, которая обеспечивает покрытие Medicaid исключительно услугами планирования семьи для женщин и мужчин, которые не имеют права на получение всех льгот Medicaid. Эти программы, доступные в 25 штатах, не обязаны охватывать процедуры стерилизации, но большинство сообщают, что они охватывают перевязку маточных труб и вазэктомию. Кроме того, в то время как большая часть государственного финансирования стерилизации поступает из программы Medicaid, часть средств предоставляется федеральной программой планирования семьи Title X и блочными грантами по охране здоровья матери и ребенка и социальным услугам.К этим фондам также применяются федеральные правила, такие как 30-дневный период ожидания.
Поставщики религиозных услуг
В настоящее время существуют федеральные законы и законы штата, которые позволяют поставщикам услуг с религиозными возражениями отказывать пациентам в услугах по стерилизации. Поправка церкви, принятая после Roe v. Wade , запрещает федеральному правительству требовать от поставщика услуг по оказанию помощи в проведении абортов или стерилизации, которые нарушают их религиозные убеждения. Кроме того, в 18 штатах действуют законы, позволяющие отдельным поставщикам или учреждениям отказываться от этих услуг по религиозным причинам.Четыре государства ограничивают это право отказа частными учреждениями ( Рисунок 3 ). В районах с ограниченным выбором поставщиков медицинских услуг нехватка этих услуг может быть особенно сложной для женщин.
Рисунок 3: Государства с политиками, позволяющими поставщикам отказываться от услуг по стерилизации
Еще одна проблема, затрудняющая доступность услуг по стерилизации, — это рост числа больниц неотложной помощи, связанных с католической церковью. Эти больницы должны соблюдать религиозные ограничения, требуемые U.С. Конференция католических епископов, запрещающих стерилизацию. Эти директивы также запрещают направление к специалистам по контрацепции, абортам и стерилизации. В настоящее время 10 из 25 крупнейших систем здравоохранения по всей стране принадлежат к католикам. Есть опасения, что растущее доминирование католических больниц в некоторых областях может ограничить доступ к перевязке маточных труб и послеродовой стерилизации в соответствии с рекомендациями профессиональных медицинских работников. По данным Католической ассоциации здравоохранения, в 2016 году в католических больницах родилось более 529 000 человек.Отсутствие возможности послеродовой стерилизации может создать особую проблему для рожениц в общинах, где единственная больница является частью католической системы здравоохранения (, рисунок 4, ). Больницы, принадлежащие католикам, получают почти половину своих доходов из государственных источников, таких как Medicaid и Medicare, и обслуживают различные группы населения, которые могут не знать об ограничениях, наложенных на их лечение, и не следовать религиозным принципам больницы.
Диаграмма 4: Доля больниц неотложной помощи, связанных с католиками, по штатам, 2016 г.
Заключение
Стерилизация, безопасный, экономичный и постоянный способ контрацепции, более распространена среди женщин, чем среди мужчин, и за последнее десятилетие показатели несколько снизились.В соответствии с ACA, большинство планов частного страхования, а также программы расширения Medicaid теперь покрывают процедуры стерилизации без разделения затрат для женщин, но мужчины не имеют такого же уровня гарантированного покрытия для вазэктомии. Хотя расширенный охват может способствовать более широкому использованию стерилизации в качестве метода контрацепции среди женщин, еще предстоит увидеть, компенсирует ли это растущая доступность LARC, поскольку ВМС и имплантаты служат в качестве возможной замены. Как и в случае с другими противозачаточными средствами, подходы к расширению доступа к стерилизации, такие как сокращение или отмена периода ожидания для женщин по программе Medicaid, повышение уровня образования пациентов, обязательное покрытие для вазэктомии и поддержание наличия врачей, нанятых больницами, которые могут предоставлять эти услуги, скорее всего, будут быть предметом дискуссий в ближайшие годы.
Химическая стерилизация — Pacific BioLabs
Хотя оксид этилена является наиболее часто используемым химическим веществом для стерилизации устройств, используются и другие химические вещества, и разрабатываются новые методологии.
Когда уместна химическая стерилизация?
Химическая стерилизация обычно используется для устройств, чувствительных к высокой температуре, используемой при стерилизации паром, а также для устройств, которые могут быть повреждены облучением (каучуки и пластмассы могут стать более хрупкими после облучения.)
Часто химические стерилизаторы работают за счет использования низкотемпературных высокореактивных газов, которые вступают в прямой контакт с исследуемым предметом (часто через полупористую мембрану или упаковку). Жидкости, например отбеливатель, также используются для стерилизации.
Рекомендации по химической стерилизации
Первоочередной задачей при использовании химической стерилизации является обеспечение совместимости стерилизуемого предмета со стерилизующим средством. Некоторые стерилизаторы могут химически разрушать определенные материалы; вы можете проконсультироваться с производителем материалов для получения дополнительной информации.
Другие проблемы, связанные с химической стерилизацией, включают потенциальный вред людям, подвергающимся воздействию стерилизационных химикатов или остатков процесса стерилизации. Следует контролировать процесс стерилизации, чтобы гарантировать безопасность работников, выполняющих стерилизацию.
Использование химикатов в дезинфекции
Для устройств многоразового использования (например, используемых в больницах) химические вещества часто используются для повторной дезинфекции после каждого использования (дезинфекция — это процесс, отличный от стерилизации).Используемые химические вещества и процедура должны быть утверждены. В этом случае важно выполнить проверку очистки и дезинфекции многоразового устройства.
Химические вещества, используемые для стерилизации или дезинфекции
- Оксид этилена
- Озон
- Блич
- Глутаральдегид и формальдегид
- Фталальдегид
- Перекись водорода
- надуксусная кислота
- Серебро
.


 В этот период изменяется гормональный фон и операция может вызвать ряд заболеваний. Кроме того, иммунитет животного в это время ослаблен и время выздоровления может значительно увеличиться. Лучше всего проводить операцию через 2-3 недели после окончания течки.
В этот период изменяется гормональный фон и операция может вызвать ряд заболеваний. Кроме того, иммунитет животного в это время ослаблен и время выздоровления может значительно увеличиться. Лучше всего проводить операцию через 2-3 недели после окончания течки.