2.11. Стерилизация. Методы, средства и режимы стерилизации
Третьим и последним этапом
обработки изделий медицинского назначения
согласно ОСТ 42-21-2-85 является стерилизация.
Она проводится после дезинфекции и
предстерилизационной очистки.
Стерилизация обеспечивает
гибель на стерилизуемых изделиях
вегетативных и споровых форм патогенных
и непатогенных микроорганизмов.
Стерилизации должны
подвергаться все изделия, соприкасающиеся
с раненой поверхностью, контактирующие
с кровью или инъекционными препаратами,
а также медицинские инструменты, которые
в процессе эксплуатации соприкасаются
со слизистой оболочкой и могут вызвать
ее повреждение!
Методы и средства
стерилизации:
1. Термический метод
(паровые, воздушные стерилизаторы).
2. Химический метод
(растворы химических средств).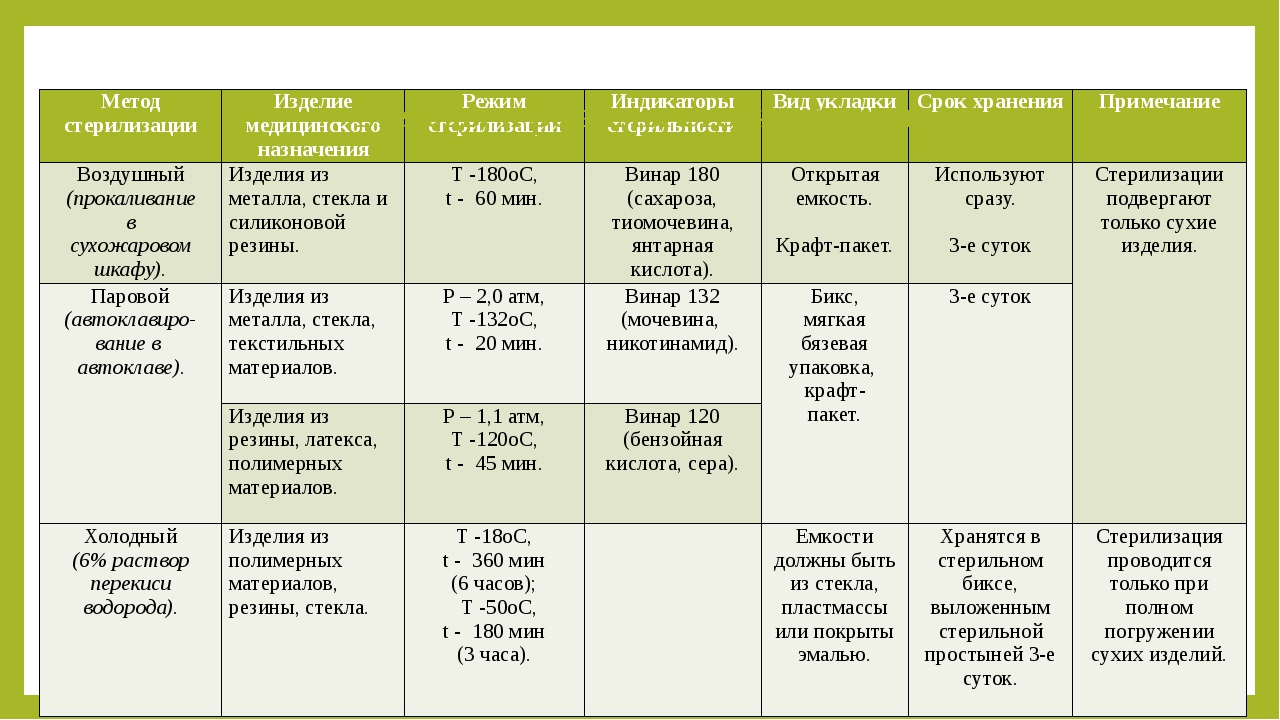
3. Радиационный метод
(установки с радиоактивным источником
излучения).
Выбор метода стерилизации
зависит от многих факторов:
материалы,
из которых состоит изделие;конструктивное
исполнение изделий;необходимость
длительного сохранения стерильности;оперативность
использования и т. д.
1. Термический метод
В практике работы лечебных
учреждений наиболее широкое распространение
получил термический
метод стерилизации
с использованием насыщенного пара и
сухого горячего воздуха (паровой и
воздушный стерилизаторы).
Преимуществами термического
метода стерилизации являются надежность,
удобство и оперативность работы
персонала, возможность использования
разных видов упаковок с целью удлинения
сроков сохранения стерильности изделий,
отсутствие необходимости удаления
остатков химических средств с изделий
и т. д.
д.
При паровом методе
стерилизации стерилизующим средством
является водяной насыщенный пар под
избыточным давлением в паровых
стерилизаторах (автоклавах).
Изделия (ватные шарики,
шприцы, иглы, пеленки, пинцеты, катетеры,
зонды, перчатки и т. д.) размещают в
стерилизационных коробках (биксах): в
крафт-пакетах, в 2-х слойной мягкой
бязевой упаковке.
Режим стерилизации
1. обычный режим — t
= 132 0С,
давление – 2 атм., время – 20 минут.
2. щадящий режим — t
= 120 0С,
давление – 1,1 атм., время – 45 минут.
Эти режимы стерилизации
используются для обработки изделий
медицинского назначения
(см. таблицу № 4).
При воздушном методе
стерилизации стерилизующим средством
является сухой горячий воз дух,
стерилизацию осуществляют в воздушных
стерилизаторах.
Изделия (хирургические,
стоматологические, гинекологические
инструменты, детали приборов и аппаратов,
в том числе изготовленные из
коррозионно-нестойких материалов,
шприцы с пометкой 200, инъекционные иглы,
изделия из силиконовой резины) размещают
в лотках (открытая емкость), крафт-бумаге.
Эффект стерилизации
достигается лишь при равномерном
распределении горячего воздуха. Поэтому
беспорядочная загрузка стерилизатора
не допускается.
Режим стерилизации
1. обычный режим — t
= 180 0С,
время -60 минут.
2. щадящий режим — t
= 160 0С,
время – 150 минут.
Эти режимы стерилизации
используются для обработки изделий
медицинского назначения (см. таблицу №
4).
Таблица 4
14.Стерилизация: понятие,методы,режимы. | gabiya.ru
Стерилизация — (лат. sterilis — обеспложивание) или полное уничтожение микроорганизмов и их спор путем воздействия как физических факторов, так и химических препаратов.
В настоящее время действует отраслевой стандарт (ОСТ 42-21-2-85), определяющий методы, средства и режимы стерилизации и дезинфекции изделий медицинского назначения, который дополнен приказом № 408 и «Методическими указаниями по дезинфекции, предстерилизационной очистке и стерилизации предметов медицинского назначения», утвержденными М3 России 30 декабря 1998 г.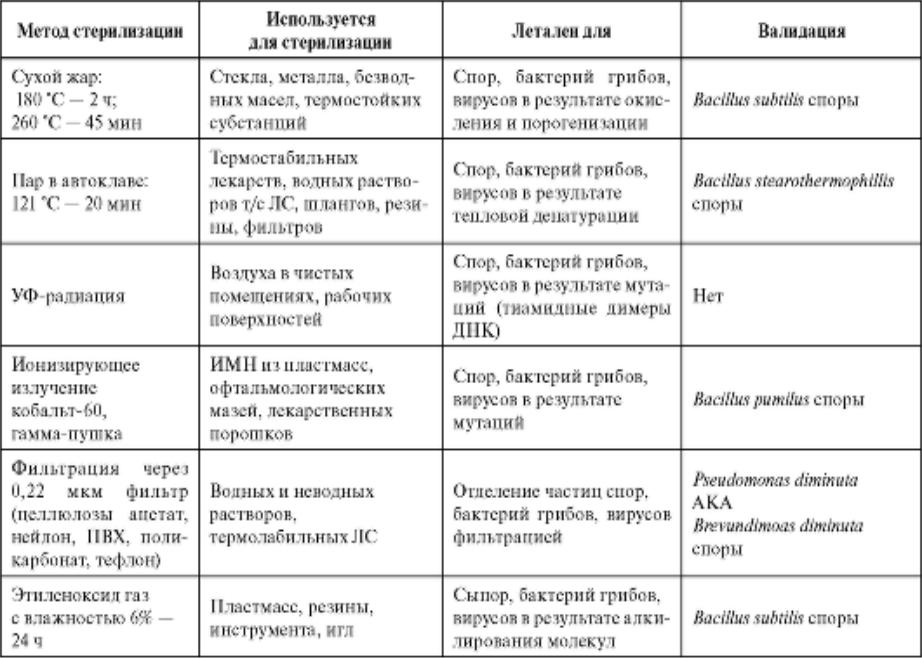 № М У-287-113.
№ М У-287-113.
Стерилизации подвергаются все изделия, соприкасающиеся с раневой поверхностью, контактирующие с кровью или инъекционными препаратами, и отдельные виды медицинских инструментов, которые в процессе эксплуатации соприкасаются со слизистыми оболочками и могут вызвать их повреждения.
Методы стерилизации
Различают термические методы — физический: паровой, воздушный, гласперленовый (в среде нагретых шариков), а также ультрафиолетовое облучение воздуха помещений: перевязочных, процедурных, операционных. . В клинической практике чаще всего применяются термические методы стерилизации, которые заключаются в воздействии пара под избыточным давлением и температуры стерилиации (автоклавирование) и воздействии сухого горячего воздуха, достигающего температуры стерилизации (используются сухожаровые шкафы разной модификации).
Химические методы стерилизации осуществляются растворами дезинфицирующих средств или газами изделий из полиэтилена, аппаратуры для искусственной вентиляции легких (ИВЛ), различных эндоскопов с волоконной оптикой. К химическому методу относится газовая стерилизация оксидом этилена, окисью пропилена, бромистым метилом и их смесью, а также пароформальдегидный метод.
К химическому методу относится газовая стерилизация оксидом этилена, окисью пропилена, бромистым метилом и их смесью, а также пароформальдегидный метод.
Ультразвуковой метод стерилизации. Стерилизация инфракрасным излучением. Радиационный метод в (установке с источником излучения для промышленной стерилизации изделий однократного применения). Выбор метода зависит от многих факторов, основными из которых являются:
1. Материал, из которого состоит изделие.
2. Конструкция изделия.
3. Сроки стерильности изделия.
4. Оперативность метода
Автоклав (от греч. ауто — сам и лат. клавис — ключ) — означает «самозапирание». Автоклавирование, или стерилизация в паровом стерилизаторе, применяется для процесса стерилизации инструмента, любых ИМН из металла, стекла, резины и текстиля, растворов, лигатурного шовного материала.
Режимы стерилизации
1-й режим — температура 132 °С, давление 2 атм., время 20 мин. Первый режим (основной) предназначен для стерилизации изделий из бязи, марли (перевязочного материала, белья и т. д.), стекла, включая шприцы с пометкой «200 ‘С», изделий из коррозийностойкого металла.
д.), стекла, включая шприцы с пометкой «200 ‘С», изделий из коррозийностойкого металла.
2-й режим — температура 120 °С, давление 1,1 атм., время 45 мин. Второй режим (щадящий) рекомендуется для изделий из тонкой резины, латекса (хирургические перчатки и т.д.) и отдельных видов полимеров (полиэтилен высокой плотности).
3-й режим — температура 134 °С — 5 мин, 2 атм.
Воздушный метод стерилизации
Проводится в воздушном стерилизаторе сухим горячим воздухом. Рекомендуется для стерилизации любых ИМН из металла, стекла, силиконовой резины.
Режимы стерилизации
1-й режим — температура 180 °С, время 60 мин. Первый режим (основной) предназначен для стерилизации изделий из стекла, включая шприцы с пометкой «200 °С», изделий из металла: хирургические, стоматоло-гические, гинекологические инструменты, в том числе коррозийнонестойких металлов.
2-й режим — температура 160 °С, время 150 мин. Второй режим (щадящий) предназначен для стерилизации изделий из силиконовой резины, а также деталей некоторых аппаратов и приборов.
Стерилизация растворами химических веществ Перекись водорода обладает выраженным обеззаражи-вающим свойством. Для стерилизации используется 6% раствор перекиси водорода — экспозиция 180 мин, температура 50 °С; при полном погружении для стерилизации изделий из полимеров, резины, стекла и коррозийнонестойких металлов экспозиция — 360 мин при темпера туре 18 “С. (срок стерильности — трое суток)
Стерилизация газами Стерилизация производится в стационарном газовом стерилизаторе. ОСТ рекомендует выполнять газовую стерилизацию ряда медицинских изделий окисью этилена или смесью ОБ. Стерилизации подвергают оптику, кардиостимуляторы, изделия из полимерных материалов, резины, стекла, металла, пластмассовых частей различных аппаратов. Практическое осуществление этого метода встречает значительные трудности, поэтому газовая стерилизация не получила еще того распространения, которого она заслуживает по своим возможностям.
Стерилизация. Виды, методы — презентация онлайн
1.
 Стерилизация. Виды, методы. Преподаватель: Малайчина О.В.
Стерилизация. Виды, методы. Преподаватель: Малайчина О.В.
2. Нормативный документ
ОСТ 42-21-2-85
Стерилизация и дезинфекция
изделий медицинского
назначения.
Методы, средства и режимы.
3. Стерилизация
– полное уничтожение всех
видов микроорганизмов и их
спор на поверхности и внутри
различных предметов, а также
в жидкостях и воздухе.
Стерилизации должны подвергаться все
предметы, соприкасающиеся с раневой
поверхностью, контактирующие с кровью
или инъекционными препаратами, а также
отдельные виды диагностической
аппаратуры, которые в процессе
эксплуатации соприкасаются со слизистыми
оболочками и могут вызвать их повреждение.
Стерилизация изделий медицинского
назначения в МО– сложный
многоступенчатый процесс, состоящий
из нескольких этапов, каждый из которых
определяет качество стерилизации:
• предварительная дезинфекция и
обработка изделий на местах
использования (в процедурных,
операционных, перевязочных и пр. )
)
• предстерилизационная
очистка изделий
ЦСО
• стерилизационная упаковка
• стерилизация
6. Структура централизованного стерилизационного отделения (ЦСО)
Биксы стерильные
В современных МО организованы
централизованные стерилизационные
отделения (ЦСО), в которых проводят:
Предстерилизационную обработку
медицинского инструментария
Стерилизацию:
изделий медицинского назначения
белья и перевязочного материала
10. Задачи ЦСО
• обеспечение лечебных отделений
(МО) стерильными
медицинскими изделиями
• внедрение в практику
современных эффективных
методов предстерилизационной
обработки и стерилизаци
ЦСО должно иметь две зоны:
нестерильную и стерильную.
В нестерильную зону входят «грязная»
и «чистая».
«Грязная» зона включает:
помещения для приема и разборки
медицинских изделий
моечную – помещение предназначено для
проведения ПСО изделий
вспомогательные помещения – гардероб,
комната отдыха и приема пищи персонала,
душевые
«Чистая» зона – это зона, где
производятся:
сушка
контроль качества очистки
разбор, сортировка, составление
наборов
упаковка и подготовка к стерилизации
изделий
13.
 Стерильная зона
Стерильная зона
включает в себя:
разгрузочную сторону паровых,
суховоздушных и других
стерилизаторов
склад стерильных материалов
При планировании помещений
целесообразно предусмотреть
организацию двух потоков обработки:
• 1-й поток – обработка и стерилизация
инструментов, резиновых изделий.
• 2-й поток – подготовка и стерилизация
белья и перевязочного материала.
ЦСО оборудуют приточно – вытяжной
вентиляцией и бактерицидными
лампами.
16. Предстерилизационная очистка (ПСО) изделий медицинского назначения Второй этап обработки инструментов
ПСО служит для очистки изделий
медицинского назначения от
белковых, жировых, кровяных,
лекарственных и прочих
загрязнений.
Качество ПСО напрямую влияет на
качество стерилизации.
17. Этапы ПСО (ручной способ):
• Замачивание инструментов медицинского
назначения в моющем растворе 15 минут
• Механическая обработка с помощью ерша,
ватного тампона (каждый по 30 сек. ) не
) не
вынимая из раствора, иглы чистить
мандреном
• Промывание под проточной водой при
использовании СМС «Биолот» — 5 мин., другие
7-10 минут («Астра», «Прогресс»)
• Промывание в дистилированной воде 30
секунд
• Высушивание в сухожаровом шкафу (85 0) до
полного исчезновения влаги
• Контроль ПСО
Качество предстерилизационной
очистки проводят пробами:
на остатки крови, дезинфектантов, СМС,
ржавчины
— азопирамовая — универсальная
— фенолфталеиновая – на наличие
остатков СМС
— амидопириновая — на остатки крови
— судан 3 — на наличие жировых и
белковых остатков
19. Оценка результата
• На контролируемое изделие наносят 2-3 капли реактива и
протирают его тампоном. При положительной азопирамовой пробе
возникает фиолетовое окрашивание, быстро, в течение нескольких
секунд, переходящее в розово- сиреневое и буроватое. Окрашивание,
наступившее позже чем через 1 минуту, не учитывается. Буроватое
Буроватое
окрашивание появляется при наличии ржавчины и
хлорсодержащих окислителей, в остальных случаях окрашивание
розово- сиреневое.
• Фенолфталеиновая проба при наличии неотмытых компонентов
синтетических моющих средств дает розовое окрашивание.
• При положительной амидопириновой пробе возникает синезеленое окрашивание.
• При положительных пробах вся партия контролируемых
изделий подлежит повторной обработке до получения
отрицательных результатов.
• Результаты контроля отражают по форме №366/У, утвержденной
приказом МЗ СССР 04.10.1980г. №1030 «Журнал учета качества
предстерилизационной обработки».
Контролю подлежат: в ЦСО – 1% от
каждого наименования изделий, но не
менее 3-5 единиц.
В случае положительной пробы
(изменение цвета реактива) всю
партию изделий подвергают
повторной очистке. Результаты
контроля фиксируют в журнале.
В качестве стерилизационной
упаковки Минздравом
разрешено использование
определенных видов
материалов.
Задачи упаковки, содержащей медицинское
изделие:
• Обеспечение прохождения
процесса стерилизации
• Защита от физических
воздействий и
механических
повреждений
стерилизуемого объекта
• Сохранение стерильности
до момента использования
Вскрывать упаковку
необходимо с учетом
правил асептики,
антисептики
• стерилизационные коробки
(биксы) без фильтра –внедренные в
практическое здравоохранение еще в начале
прошлого века. Данный тип имеет
небольшой срок сохранения стерильности –
72 часа
• стерилизационные коробки
(биксы) с антибактериальным
фильтром, стерильность в которых
сохраняется до 20 дней
• одноразовые упаковочные пакеты
(КРАФТ- пакеты)– бумажные (плоские
и со складками), комбинированные бумажноламинатные (пленочные).
Крафт — пакет
• Крафт – пакет заклеенный – срок
стерильности 30 суток;
• Крафт – пакет на скрепах – срок
годности 3 суток
Прозрачные рулоны и пакеты разработаны и
производятся как для упаковки отдельных
небольших инструментов и комплектов, так и
для больших тяжелых инструментов,
комплектов белья. Срок стерильности 1 год
Срок стерильности 1 год
Самоклеющаяся комбинированный
бумажно-ламинатный –
срок стерильности — 6 месяцев.
29. Двойная мягкая упаковка из бязи
Срок стерильности 3 суток
• Бумажные и нетканые
оберточные листы
31. Бумажные и нетканые оберточные листы
• Стерилизационные
упаковки из нетканого
материала или бумаги
являются наиболее
подходящими для
больших по объему
лотков с инструментами
для белья. Нетканые
материалы, обладающие
повышенной
прочностью, идеально
подходят для
обертывания тяжелых и
острых изделий.
Импульсный
термосварочный
аппарат
Используют упаковку
комбинированные
бумажно-ламинатные
(пленочные) – срок
стерильности 1 год
35. Импульсный термосварочный аппарат
Выбор адекватного метода
стерилизации зависит от физикохимических и биологических
особенностей стерилизуемого
объекта.
В практике медицинских
организаций наиболее широко
распространены физические
методы стерилизации.
37. Методы стерилизации
Физический
Паровая
Воздушная
Гласперленовая
Инфракрасная
Химический
• Применение
растворов
химических
средств
• Газовая
стерилизация
Холодная
стерилизация
(промышленная)
• Радиационная
• Плазменная
• Озоновая
38. Методы стерилизации, разрешенные для применения в МО
Тип метода
Метод
Стерилизующий агент
Паровой
Водяной насыщенный пар под избыточным давлением
Воздушный
Сухой горячий воздух
Инфракрасный
Инфракрасное излучение
Гласперленовый
Среда нагретых стеклянных шариков
Газовый
Окись этилена или ее смесь с другими компонентами
Окись этилена или ее смесь с другими компонентами
Окись этилена или ее смесь с другими компонентами
Физический
(термический)
Химический
Плазменный
Пары перекиси водорода в сочетании с их
низкотемпературной плазмой
Жидкостный
Растворы химических средств (альдегид-, кислород- и
хлорсодержащие)
39.
 Физические методы
Физические методы
40. Паровой метод
Компактный
переносной
автоклав
• Для достижения температур выше
точки кипения воды пользуются
автоклавом. Автоклав представляет
собой установку для стерилизации
паром под давлением. Температура
насыщенного пара зависит от
давления.
• Режимы работы автоклава:
132 °C — 2 атмосферы— 20 минут —
основной режим. Стерилизуют все
изделия (стекло, металл, текстиль,
КРОМЕ РЕЗИНОВЫХ).
120 °C — 1,1 атмосфера — 45 минут —
щадящий режим. (стекло, металл,
резиновые изделия, полимерные
изделия — согласно паспорту)
110 °C — 0,5 атмосферы — 180 мин —
особо щадящий режим(нестойкие
препараты, питательные среды)
41. Паровой метод стерилизации
Стерилизующий агент – горячий пар
под
давлением.
Для
этого
метода
используют автоклав.
Упаковки: биксы, крафт-пакеты, бумагаламинат, бязь.
Материалы: полимеры, стекло, латекс,
ткань,
коррозийностойкие
металлы,
текстиль.
Достоинства: высокая проницаемость
пара, большой выбор упаковки, дольше
сохраняется стерильность, дешевый и
простой в использовании метод.
Недостатки:
увлажнение
изделий,
вызывает коррозию металлов.
Паровой метод стерилизации
43. Автоклав стационарный (нового поколения)
44. Воздушный метод Сухой жар —
Воздушный метод
Сухой жар стерилизация осуществляется в специальных
аппаратах — сухо-жаровых шкафахстерилизаторах. Стерилизация в сухожаровом
шкафу происходит при помощи циркуляции
внутри него горячего воздуха.
• Режимы работы автоклава:
180 °C — 60 минут — основной режим.
Стерилизуют все изделия (стекло, металл,
КРОМЕ РЕЗИНОВЫХ).
160 °C — 150 минут — щадящий режим. (стекло,
металл, резиновые изделия, полимерные
изделия — согласно паспорту)
45. Воздушный метод стерилизации
Стерилизующий агент – сухой горячий
воздух (160-200oС).
Упаковки: крафт-пакеты, открытым
способом.
Материалы: металл, стекло, полимер,
резина , латекс.
Достоинства: дешевый, простой метод, не
вызывает коррозии металла, не происходит
увлажнения упаковки и изделий.
Недостатки: ограниченный выбор
упаковки, медленное и неравномерное
прогревание изделий, необходимость
использования более высоких температур,
невозможность использовать материалы из
текстиля.
Воздушный метод стерилизации
46. Воздушный метод
• Примечание:
• Стерилизации подвергают сухие изделия;
• Изделия, простерилизованные в крафт- пакетах, упаковке из
бумаги мешочной влагопрочной, хранят 3-е суток, в 2слойной упаковке из бумаги крепированной для медицинских
целей – до 20 суток;
• Изделия, простерилизованные без упаковки, должны быть
использованы непосредственно после стерилизации в течение
рабочей смены (6 часов) в асептических условиях.
• Во время стерилизации воздушным методом металлических
инструментов без упаковки их располагают так, чтобы они не
соприкасались друг с другом. Разъёмные изделия
Разъёмные изделия
стерилизуют в разобранном виде.
47. Воздушный стерилизатор (сухожаровой шкаф)
48. Гласперленовый метод
• Принцип действия глассперленового
стерилизатора основан на приведении
стерилизуемых хирургических инструментов
в контакт с маленькими стеклянными
сферами, имеющими температуру 250С.
• Стерилизация инструмента производится в
течение очень короткого времени — не более
20 секунд. Благодаря такому короткому
периоду и неразрушающему воздействию
стерилизационных (глассперленовых)
шариков на инструмент, негативное влияние
высокой температуры практически
отсутствует.
Всего за 5 секунд стерилизует: щипцы,
клещи, скальпель-держатели, зонды,
шпатели, долота, зубила, алмазы, файлы,
боры, корневые элеваторы, расширители,
угловые наконечники, иглодержатели,
пинцеты, десневые ножницы и т.д.
49. Инфракрасный метод
Малогабаритный
стерилизатор
предназначен для
стерилизации
стоматологических и
микрохирургических
инструментов из металлов
в условиях госпиталей,
поликлиник, больниц и
других лечебных и
косметологических
учреждений.
Стерилизация
осуществляется
инфракрасным мощным
кратковременным
тепловым воздействием.
50. Камера УФО для хранения стерильных инструментов
51. Химические методы
52. Химическая стерилизация
• При данном методе используются химические вещества
в газообразном состоянии или стерилизуемые объекты
погружаются в растворы химических веществ.
Стерилизация растворами – вспомогательный
метод, который применяют при невозможности
использовать другие..
Растворы для стерилизации — стерилянты
Для стерилизации в основном используют
Перекись водорода 6%
Режим стерилизации :
Температура 18 °С — экспозиция 360 мин
Температура 50 °С — экспозиция 180 мин
Раствор используется однократно.
53. Химическая стерилизация
Дезоксон-1
Режим стерилизации :
Температура 18 °С — экспозиция 45 мин
Сайдекс
Температура 21 °С — экспозиция 240 мин
Виркон 2%
Температура 18 °С — экспозиция 10 мин
54.
 Химическая стерилизация
Химическая стерилизация
Стерилизация растворами –
вспомогательный метод, который применяют
при невозможности использовать другие.
Достоинства: доступность, легкость в
исполнении и надежность
Недостатки: изделия стерилизуют без
упаковки, промываются после стерилизации, что
может привести к реконтаминации.
Используется только при децентрализованной
системе.
55. Химическая стерилизация
• Стерилизуемые изделия свободно
раскладывают в емкости с растворами. При
большой длине они укладываются по
спирали, каналы и полости заполняются
раствором.
• После окончания стерилизации изделия
трижды дважды погружают на 5 минут в
стерильную воду, каждый раз меняя ее, затем
стерильным корнцангом их переносят в
стерильную емкость (стерилизационная
коробка), выложенную стерильной
простыней. Срок хранения – 3 суток.
56. Химическая стерилизация
При газовой стерилизации используют смесь ОБ(окись
этилена с бромистым этилом) и его смеси,
формальдегид.
Стерилизуют: Оптика, кардиостимуляторы, изделия из
полимерных материалов, стекла, металлов.
Условия проведения:
Инструментарий упаковывают в два слоя
полиэтиленовой пленкитолщиной 0,06-0,2 мм, бумагу:
упаковочную высокопрочную двухслойную. Срок
сохранения простерилизованных изделий в упаковке из
полиэтиленовой пленки – 5 лет, в пергаменте
57. Химическая стерилизация
Достоинства: В газообразном состоянии
этилен-оксид не вызывает коррозии металлов,
не портит изделий из кожи, шерсти, бумаги,
пластмасс. Он является сильным
бактерицидным, спороцидным и вирулоцидным
средством. Его пары обладают высоким
проникновением. осуществляется при
невысоких температурах (18-80°С) и изделия
стерилизуются в упаковке.
Недостатки: токсичность для персонала и
взрывоопасность при несоблюдении техники
безопасности.
58. Газовая стерилизация
59. Холодный метод стерилизации
Радиационный метод
Стерилизующим агентом являются ионизирующее
гамма- и бета-излучение. Температура объекта при
Температура объекта при
стерилизации поднимается незначительно, поэтому
этот способ называют холодной стерилизацией.
Для индивидуальной упаковки помимо бумажных,
используют пакеты из полиэтилена. Стерильность в
такой упаковке сохраняется годами. Срок годности
указывается на упаковке. Этот способ широко
применяется на промышленных предприятиях,
изготавливающих медицинские изделия
одноразового использования (системы для
переливания крови, акушерские комплекты).
60. Холодный метод стерилизации
При плазменном методе стерилизации
используют высокочастотную плазму в
отечественных приборах «Пластер», «Ферузо».
Для обработки изделий из термолабильных
материалов (эндоскопы, кардиостимуляторы,
оптические устройства, эндопротезы и т.д.)
используется стерилизатор Стеррад 100-8.
Данный метод применяют для стерилизации
небольших по размерам медицинских изделий
(стоматологические боры, иглы для
иглотерапии и т. д.).
д.).
61. Низкотемпературный плазменный стерилизатор СТЕРРАД 100NX
Озоновая стерилизация предназначена для
обработки малогабаритных изделий простой
конфигурации из коррозионностойких сталей и
сплавов.
Озон синтезируется из воздуха в газоразрядном
реакторе стерилизатора.
Время стерилизационной выдержки 50 минут,
время дезактивации озона 10 минут.
Озоновый стерилизатор (СО-01-С или СО-5)
относится к низкотемпературным (температура
40°С), используется для стерилизации сухих
скальпелей, пинцетов, зеркал, зондов, шпателей,
боров стоматологических в неупакованном виде,
размещенных в 1 слой в кювете.
63. Стерилизатор озоновый
65. Химическая стерилизация
Выполняется в закрытых емкостях,
покрытых неповрежденной эмалью, а
также сделанных из стекла или
пластмассы.
Стерилизуемые объекты погружают в
раствор при температуре 18 ± 2°.
Для стерилизации инструменты полностью
погружают в раскрытом (или разобранном)
виде в один из указанных растворов.
При замачивании в спирте и тройном
растворе инструменты считаются
стерильными через 2-3 часа, в перекиси
водорода — через 6 часов.
66. Газовый метод
• При стерилизации пищевых
продуктов, лекарственных препаратов
и разного рода приборов, а также в
лабораторной практике оправдало
себя применение окиси этилена,
которая убивает и вегетативные
клетки, и споры, но действует только в
том случае, если подвергаемые
стерилизации материалы содержат
некоторое количество (5-15%) воды.
Окись этилена применяют в виде
газовой смеси (с N2 или С02), в
которой ее доля составляет от 2 до 50%.
• Этиленоксидный метод обеспечивает
самый щадящий температурный
режим стерилизации.
67. Газовый метод стерилизации
Стерилизующий агент –
формальдегид или этилен-оксид.
Упаковки: бумага-ламинат,
пергамент, крафт-бумага.
Материалы: полимеры, стекло,
металл.
Достоинства: невысокая
температура, использование любых
материалов.
Недостатки: токсичность для
персонала и взрывоопасность при
несоблюдении техники безопасности,
продолжительный
цикл стерилизации.
Газовый метод стерилизации
68. Холодные методы стерилизации
69. Плазменный метод
позволяет создать биоцидную
среду на основе водного
раствора пероксида водорода,
а также низкотемпературной
плазмы (ионизированный
газ, образующийся при
низком давлении).
Это самый современный метод
стерилизации, известный на
сегодняшний день. Он
позволяет стерилизовать
любые медицинские изделия,
от полых инструментов до
кабелей, электроприборов,к
которым в ряде случаев
вообще не удается применить
ни один из известных
методов стерилизации.
70. Плазменные стерилизаторы
71. Радиационный метод
Антимикробная обработка может быть осуществлена с
помощью ионизирующего излучения (у-лучи),
ультрафиолетовых лучей и ультразвука. Наибольшее
Наибольшее
применение в наше время получила стерилизация улучами.
Радиационный метод или лучевую стерилизацию γ-лучами,
применяют в специальных установках при промышленной
стерилизации однократного применения- полимерных
шприцев, систем переливания крови, чашек Петри,
пипеток и др.хрупких и термолабильных изделий.
Используются изотопы Со60 и Cs137. Доза проникающей
радиации должна быть весьма значительной — до 20-25
мкГр, что требует соблюдения особо строгих мер
безопасности. В связи с этим лучевая стерилизация
проводится в специальных помещениях и является
заводским методом стерилизации (непосредственно в
стационарах она не производится).
72. Радиационный метод стерилизации
Радиационный метод необходим для стерилизации изделий
из термолабильных материалов.
Стерилизующий агент – ионизирующие γ и β излучения.
Упаковки: помимо бумажных используют пакеты из
полиэтилена.
Достоинства: надолго сохраняется стерильность в
упаковке.
Недостатки: дороговизна метода.
Радиационный
–
основной
метод
промышленной
стерилизации.
Используется
предприятиями,
выпускающими
стерильные
изделия
однократного
применения.
Радиационный метод стерилизации
73. Радиационный метод
Стерилизация инструментов и прочих
материалов проводится в герметичных
упаковках и при целостности последних
сохраняется до 5 лет. Герметичная упаковка
делает удобными хранение и использование
инструментов (необходимо просто вскрыть
упаковку).
74. Озоновая стерилизация
Предназначена для обработки
малогабаритных изделий простой
конфигурации из коррозионностойких
сталей и сплавов
75. Принципы обеспечения стерильности:
• К стерильному предмету прикасайтесь только другим
стерильным предметом, чтобы избежать контаминации.
• Держите стерильные предметы всегда на уровне выше пояса.
• Стерильное поле должно всегда быть в пределах видимости.
• Старайтесь не говорить, не кашлять, не чихать и не
наклоняться над стерильной поверхностью, так как
происходящие при этом потоки воздуха содержат
микроорганизмы.
• Пограничную зону вокруг стерильного поля шириной около
2,5 см считают потенциально заражённой.
• Не допускайте промокания салфеток над стерильной
поверхностью, так как любая жидкость проникает сквозь
ткань, а вместе с ней и микроорганизмы.
• Если стерильный предмет коснулся нестерильного, всё
стерильное поле считают загрязнённым и подготавливают
новое стерильное поле.
• Считайте предмет загрязнённым, если вы не уверенны в его
стерильности.
• Индикаторы представляют собой прямоугольную полоску из
инертного бумажного основания с нанесёнными на одной
стороне двумя цветными метками (Рис.1)-индикаторной 4 и
эталоном сравнения 5, и маркировки. Для приклеивания
индикатора необходимо с его обратной стороны под надписью
«Дата» отделить левую часть защитной бумаги 1 (Рис. 1) по
1) по
линии насечки 2 приклеить левую часть индикатора до линии
перфорации 3 к упаковке. Правая часть индикатора при этом
не приклеивается.
• Для снятия индикатора с упаковки после стерилизации
необходимо, не отделяя защитную бумагу 1, оторвать
индикатор по линии перфорации от приклеенной левой
части. Приклеенная левая часть индикатора со служебными
надписями не удаляется с упаковки и доходит до
потребителя, что позволяет контролировать кратность
использования бумажного упаковочного материала
СПАСИБО ЗА ВНИМАНИЕ!
Химическая стерилизация. Химические методы стерилизации
Химические, низкотемпературные (при t<100оС) методы стерилизации (газовый, плазменный и с применением растворов средств), применяемые для стерилизации изделий из термолабильных материалов, требуют наличия соответствующих химических агентов.
Перечень химических средств, которые, согласно утвержденным официальным методическим указаниям, могут применяться для химической стерилизации, на сегодня значительно шире, по сравнению с перечнем, указанным в ОСТ 42-21-2-85. Однако с учетом современных представлений о биоцидных свойствах ряда активно действующих веществ, применяемых в средствах, а также использованных методик и тест-микроорганизмов для изучения стерилизующих свойств включение некоторых средств в число стерилянтов выглядит недостаточно обоснованным.
Однако с учетом современных представлений о биоцидных свойствах ряда активно действующих веществ, применяемых в средствах, а также использованных методик и тест-микроорганизмов для изучения стерилизующих свойств включение некоторых средств в число стерилянтов выглядит недостаточно обоснованным.
Например, это относится к средствам из группы четвертичных аммониевых соединений, полигуанидинов и третичных алкиламинов, а также их композиций (Пантелеева Л.Г.).
Стерилизация с применением растворов химических средств — вспомогательный метод
Необходимо также подчеркнуть, что стерилизация изделий растворами химических средств является вспомогательным методом, поскольку изделия нельзя простерилизовать в упаковке, а по окончании стерилизации их необходимо промыть стерильной жидкостью (питьевая вода или 0,9% раствор натрия хлорида), что при нарушении правил асептики может привести к вторичному обсеменению простерилизованных изделий микроорганизмами.
Данный метод применяется для стерилизации изделий, в конструкции которых использованы термолабильные материалы и когда особенности материалов изделий не позволяют использовать другие официально рекомендуемые методы стерилизации. Конструкция изделия должна позволять стерилизовать его растворами химических средств. При этом необходимо обеспечить хороший доступ стерилизующего средства и промывной жидкости ко всем стерилизуемым поверхностям изделия. На данное время не существует международных стандартов на осуществление процедуры контроля качества стерилизации растворами химических средств.
Конструкция изделия должна позволять стерилизовать его растворами химических средств. При этом необходимо обеспечить хороший доступ стерилизующего средства и промывной жидкости ко всем стерилизуемым поверхностям изделия. На данное время не существует международных стандартов на осуществление процедуры контроля качества стерилизации растворами химических средств.
Все изделия, простерилизованные в неупакованном виде, следует сразу использовать по назначению без переноса их из кабинета в кабинет.
Дезинфицирующее средство высокого уровня для химической стерилизации изделий медицинского назначения и аппаратуры
Для химической стерилизации изделий медицинского назначения и аппаратуры, изготовленных из термолабильных материалов, компания Интердез предлагает препарат«Солиокс» — дезинфицирующее средство высокого уровня.
Препаративная форма СОЛИОКСА
Препаративная форма средства – порошок. Активно действующим веществом в растворе средства является надуксусная кислота, относящаяся к окислителям и являющаяся одним из самых мощных биоцидов.
Самоактивация раствора происходит в течение 15 минут после растворения средства в воде. В течение этого времени в растворе синтезируется надуксусная кислота в количестве, необходимом для выполнения стерилизации и дезинфекции высокого уровня. Содержание надуксусной кислоты в растворе в концентрации 1,75% по препарату (это концентрация, которая используется для стерилизации) – не меньше 0,3%, а рН составляет 8,0±1,0 единиц рН, т.е. реакция растворов находится в диапазоне от нейтральной до слабощелочной.
Средство содержит моющие, антикоррозионные и стабилизирующие содержание надуксусной кислоты компоненты.
Широкий спектр антимикробного действия Солиокса:
- высокоэффективныйбактерицид (в т.ч. против Pseudomonas aeruginosa)
- туберкулоцид (в т.ч. против Мycobacterium tuberculosis і Мycobacterium terrae)
- вирулицид (в т.ч. против возбудителей гепатитов А, В, С, ВИЧ, гриппа всех типов, парагриппа, птичьего гриппа, SARS, аденовирусной, энтеровирусной (в т.
 ч. полиомиелит), коронавирусной, респираторно-синтициальной, риновирусной, ротавирусной инфекции и др.)
ч. полиомиелит), коронавирусной, респираторно-синтициальной, риновирусной, ротавирусной инфекции и др.) - фунгицид (в т.ч. против грибов рода Candida, вобудителей дерматомикозов, плесневых грибов A.niger)
- спороцид (в т.ч. против спор Bacillus subtilis, Bacillus сereus и Aspergillus niger)
- не формируются резистентные штаммы микрооорганизмов
Высокоэффективный стерилянт при экспозиции всего 15 минут!
Растворы средства имеют моющее действие, умеренное коррозионное действие в отношении низкоуглеродистых сталей, в т.ч. с гальваническим покрытием, не повреждают нержавеющую сталь, медь и ее сплавы, алюминий и его сплавы, резину, пластмассы (полиэтилен, полипропилен, поливинилхлорид, органол и др.), стекло, фаянс, фарфор, керамику, древесину, лакокрасочные покрытия и т.д.; обладают отбеливающим действием на текстильные материалы без снижения их прочности, удаляют пятна. После высыхания растворы не оставляют на обработанных поверхностях пятен и потеков, легко смываются водой.
Назначение дезинфицирующего средства Солиокс:
- стерилизация жестких и гибких эндоскопов и медицинских инструментов к ним, а также других изделий, которые подлежат стерилизации растворами стерилизующих средств;
- дезинфекция высокого уровня жестких и гибких эндоскопов и медицинских инструментов к ним, а также других изделий, подлежащих дезинфекции высокого уровня;
- обеззараживание ИМН, медицинской аппаратуры и оборудования, (в т.ч. аппаратов искусственной вентиляции легких, наркозно-дыхательной аппаратуры, кувезов, столовой и лабораторной посуды, поверхностей в помещениях и т.д.;
- текущая, заключительная, профилактическая дезинфекция;
- профилактика появления и борьба с плесенью, в т.ч. в споровой форме.
Термин | Определение |
1. Деконтаминация изделий | Снижение количества микроорганизмов на изделиях медицинского назначения |
2. Устойчивость изделий медицинского назначения к деконтаминации Устойчивость изделий к деконтаминации | Способность изделий медицинского назначения сохранять свои функциональные характеристики после дезинфекции, предстерилизационной очистки и стерилизации |
3. Стерилизация изделий медицинского назначения Стерилизация изделий | Умерщвление на изделиях или в изделиях медицинского назначения микроорганизмов всех видов, находящихся на всех стадиях развития |
4. Дезинфекция изделий медицинского назначения Дезинфекция изделий | Умерщвление на изделиях или удаление с изделий медицинского назначения патогенных микроорганизмов |
5. Стерильное изделие | Изделие медицинского назначения, не содержащее микроорганизмов, способных к размножению |
6. Нестерильное изделие медицинского назначения Нестерильное изделие | Изделие медицинского назначения, содержащее микроорганизмы, способные к размножению |
7. Простерилизованное изделие медицинского назначения Простерилизованное изделие | Изделие медицинского назначения, ставшее стерильным в результате проведения стерилизации |
8. Стерилизующий (дезинфицирующий) агент | Действующее начало, обеспечивающее стерилизацию (дезинфекцию) |
9. Стерилизующее (дезинфицирующее) средство | Физическое или химическое средство, включающее в себя стерилизующий (дезинфицирующий) агент |
10. | — |
11. Химическое стерилизующее (дезинфицирующее) средство | — |
12. Серия стерилизуемых изделий медицинского назначения Серия стерилизуемых изделий | Число изделий медицинского назначения, стерилизуемых за один цикл в одном стерилизаторе на промышленном предприятии |
13. Партия стерилизуемых изделий медицинского назначения Партия стерилизуемых изделий | Число изделий медицинского назначения, стерилизуемых за сутки на промышленном предприятии |
14. Предстерилизационная очистка изделий медицинского назначения Предстерилизационная очистка | Удаление загрязнений с изделий медицинского назначения, подлежащих стерилизации |
15. Ручной способ предстерилизационной очистки изделий медицинского назначения Ручной способ предстерилизационной очистки | — |
16. Механизированный способ предстерилизационной очистки | — |
17. Метод стерилизации (дезинфекции) | Совокупность приемов и операций, обеспечивающих стерилизацию (дезинфекцию) при установленных условиях |
18. Химический метод стерилизации (дезинфекции) | Метод стерилизации (дезинфекции), осуществляемый химическим стерилизующим (дезинфицирующим) средством |
19. Физический метод стерилизации (дезинфекции) | Метод стерилизации (дезинфекции), осуществляемый физическим стерилизующим (дезинфицирующим) средством |
20. Комбинированный метод стерилизации (дезинфекции) | Метод стерилизации (дезинфекции), осуществляемый двумя и более стерилизующими (дезинфицирующими) средствами |
21. | Метод стерилизации, осуществляемый при температуре свыше 100 °С |
22. Паровой метод стерилизации | Термический метод стерилизации, осуществляемый водяным насыщенным паром при избыточном давлении |
23. Воздушный метод стерилизации | Термический метод стерилизации, осуществляемый сухим горячим воздухом |
24. Стерилизация инфракрасным излучением | Термический метод стерилизации, осуществляемый инфракрасным излучением |
25. Холодный метод стерилизации | Метод стерилизации, осуществляемый при температуре не свыше 100 °С |
26. Радиационный метод стерилизации | Холодный метод стерилизации, осуществляемый ионизирующим излучением |
27. Газовый метод стерилизации | Холодный метод стерилизации, осуществляемый спороцидным средством в газообразном состоянии |
28. Стерилизация растворами | Холодный метод стерилизации, осуществляемый растворами спороцидных средств |
29. Параметры стерилизации (дезинфекции) | Количественные показатели физических, химических и временных факторов, обеспечивающих стерилизацию (дезинфекцию) |
30. Режим стерилизации (дезинфекции) | Совокупность параметров стерилизации (дезинфекции) |
31. Время стерилизационной выдержки | Интервал времени, необходимый для стерилизации в установленном режиме |
32. Цикл стерилизации | Минимальный интервал времени для загрузки, стерилизации и выгрузки при стерилизации в паровом, воздушном и газовом стерилизаторе или емкости |
33. Температура стерилизации (дезинфекции) | Температура, при которой обеспечивается стерилизация (дезинфекция) в установленном режиме |
34. Стерилизующая доза газа | Доза газа, обеспечивающая стерилизацию в установленном режиме |
35. Стерилизующая доза ионизирующего излучения | — |
36. Стерилизующий (дезинфицирующий) раствор | Раствор химического стерилизующего (дезинфицирующего) средства, обеспечивающий стерилизацию (дезинфекцию) в установленном режиме |
37. Стерилизующая (дезинфицирующая) концентрация раствора | Концентрация действующего вещества в растворе, обеспечивающая стерилизацию (дезинфекцию) в установленном режиме |
38. Дезинфицированное изделие медицинского назначения Дезинфицированное изделие | Изделие медицинского назначения, на котором умерщвлены или с которого удалены патогенные микроорганизмы |
39. Недезинфицированное изделие медицинского назначения Недезинфицированное изделие | — |
40. Незараженное изделие медицинского назначения Незараженное изделие | — |
41. Серия дезинфицируемых изделий медицинского назначения Серия дезинфицируемых изделий | Число изделий медицинского назначения, дезинфицируемых паровым, воздушным или газовым методом за один цикл в одной дезинфекционной камере на промышленном предприятии |
42. Партия дезинфицируемых изделий медицинского назначения Партия дезинфицируемых изделий | Число изделий медицинского назначения, дезинфицируемых в единицу времени на промышленном предприятии |
43. Термический метод дезинфекции | Метод дезинфекции, осуществляемый при температуре свыше 50 °С |
44. Газовый метод дезинфекции | Химический метод дезинфекции, осуществляемый дезинфицирующим средством в газообразном состоянии |
45. Влажный метод дезинфекции | Химический метод дезинфекции, осуществляемый растворами дезинфицирующих средств |
46. Радиационный метод дезинфекции | Физический метод дезинфекции, осуществляемый ионизирующим излучением |
47. Воздушный метод дезинфекции | Физический метод дезинфекции, осуществляемый сухим горячим воздухом |
48. Паровой метод дезинфекции | Физический метод дезинфекции, осуществляемый насыщенным водяным паром |
49. Паровоздушный метод дезинфекции | Физический метод дезинфекции, осуществляемый увлажненным горячим воздухом |
50. Пароформалиновый метод дезинфекции | Комбинированный метод дезинфекции, осуществляемый смесью увлажненного воздуха или водяного пара с формальдегидом при температуре дезинфекции |
51. Цикл дезинфекции | Минимальный интервал времени для загрузки, дезинфекции и выгрузки при дезинфекции изделий медицинского назначения в дезинфекционной камере, кипятильнике, в паровом, воздушном и газовом стерилизаторе или емкости |
52. Расход дезинфицирующего средства | Доза дезинфицирующего средства, обеспечивающая дезинфекцию в установленном режиме |
53. Время воздействия дезинфицирующего агента | Интервал времени, необходимый для дезинфекции в установленном режиме |
54. Тест-микроорганизмы | Культура микроорганизмов с определенными параметрами устойчивости, используемая для бактериологического контроля стерилизации или дезинфекции |
55. Контроль стерильности | Определение наличия микроорганизмов, способных к размножению, на изделиях, подвергнутых стерилизации |
56. Контроль стерилизации | Определение эффективности стерилизации, осуществляемое бактериологическим контролем стерилизации, и определение параметров стерилизации, осуществляемое физическим или химическим контролем стерилизации |
57. Контроль дезинфекции | Определение эффективности дезинфекции, осуществляемое бактериологическим или биологическим контролем дезинфекции, и определение параметров дезинфекции, осуществляемое физическим или химическим контролем дезинфекции |
58. Биотест стерилизации (дезинфекции) | Объект из установленного материала, обсемененный тест-микроорганизмами, предназначенными для контроля стерилизации (дезинфекции) |
59. Бактериологический контроль стерилизации | Контроль стерилизации, осуществляемый биотестом стерилизации |
60. Бактериологический контроль дезинфекции | Контроль дезинфекции путем обнаружения микроорганизмов, способных к размножению после дезинфекции |
61. Биологический контроль дезинфекции | Контроль дезинфекции путем обнаружения патогенных микроорганизмов при заражении животных |
62. Естественный биотест стерилизации | Биотест стерилизации, естественно обсемененный микроорганизмами различных видов |
63. Земля-биотест стерилизации | Естественный биотест стерилизации, состоящий из высушенной и просеянной почвы |
64. Искусственный биотест стерилизации | Биотест стерилизации, искусственно обсемененный микроорганизмами определенного вида |
65. Устойчивость тест-микроорганизмов | Способность тест-микроорганизмов сохранять жизнеспособность при воздействии физических и химических дезинфицирующих и стерилизующих агентов при определенных параметрах, но погибать при режиме стерилизации |
66. Физический контроль стерилизации (дезинфекции) | Контроль параметров стерилизации (дезинфекции), проводимый с помощью соответствующих средств измерения |
67. Термический контроль стерилизации (дезинфекции) | Физический контроль стерилизации (дезинфекции), проводимый с помощью средств измерения температуры |
68. Химический контроль стерилизации (дезинфекции) | Контроль параметров стерилизации (дезинфекции), проводимый с помощью химических тестов стерилизации (дезинфекции) или путем определения количества стерилизующего (дезинфицирующего) агента |
69. Химический тест стерилизации (дезинфекции) | Химическое вещество, изменяющее свой цвет или физическое состояние при температуре стерилизации (дезинфекции), стерилизующей дозе газа или стерилизующей дозе ионизирующего излучения, служащее для контроля параметров стерилизации (дезинфекции) |
Дезинфекция, предстерилизационная очистка, стерилизация изделий медицинского назначения
Дезинфекция и стерилизация изделий
медицинского назначения проводится для обезвреживания либо уничтожения различных
микроорганизмов. Но некоторые руководители лечебных учреждений, стремясь
сэкономить, относятся к этим мероприятиям недостаточно ответственно. В
результате значительно возрастает риск развития различных инфекционных
заболеваний, в том числе и гнойно-септических, как среди больных, так и
сотрудников ЛПУ. Поэтому очень важно правильно
обеззараживать медицинские изделия. Качество дезинфекции можно оценить с помощью смывов на определение
золотистого стафилококка, синегнойной палочки и бактерий группы кишечной
палочки. Контролируют 1 % одновременно обработанных изделий, но не менее трех
инструментов. Дезинфекция считается эффективной при отсутствии роста
микроорганизмов.
Обработка
медицинских инструментов включает в себя дезинфекцию, предстерилизационную
очистку и собственно стерилизацию. Общие правила организации указанных
процессов установлены «Методическими указаниями по дезинфекции,
предстерилизационной очистке и стерилизации изделий медицинского назначения»
(МУ-287-113). Их утвердил Департамент
Госсанэпиднадзора Минздрава РФ 30.12.1998 г. Кроме того,
применяются утвержденные НИИ дезинфектологии Роспотребнадзора
методические пособия по применению конкретных дезинфицирующих средств.
Познакомимся сначала с
дезинфекцией, которая является достаточно сложной, объемной и универсальной для
различных ЛПУ.
Что такое дезинфекция
Этот термин обозначает
уничтожение патогенных и условно-патогенных микроорганизмов на всех
поверхностях в помещениях, в том числе на полу, стенах, ручках дверей,
выключателях, подоконниках, а также на жесткой мебели, поверхностях врачебного
оборудования, в воздухе помещений, на посуде, белье, изделиях медицинского
назначения и предметах ухода за больными, санитарно-техническом оборудовании,
биологических жидкостях. Словом, дезинфекцию должны проходить все инструменты и
расходные материалы, которые используются в работе любого ЛПУ.
Задачей дезинфекции является
предупреждение или ликвидация накопления, размножения и распространения возбудителей заболеваний. И в первую очередь,
если мы говорим о больницах,
внутрибольничных инфекций. Дезинфекция может быть профилактической и
очаговой.
Профилактическая дезинфекция
проводится для защиты людей от возможного заражения. В лечебных учреждениях она
выполняется в виде текущей ежедневной влажной уборки и генеральной уборки эпидзначимых
кабинетов (операционных,
перевязочных) один раз в неделю. Очаговая дезинфекция проводится в случае
возникновения или подозрения на возникновение инфекционного
заболевания.
Препарат для проведения
дезинфекции и его концентрация выбираются исходя из конкретного инфекционного
заболевания. В зависимости от вида медицинского изделия проводят дезинфекцию
высокого (ДВУ), промежуточного (ДПУ) и низкого уровней (ДНУ).
А теперь условно разделим
обрабатываемые предметы на несколько видов. «Некритические» контактируют с неповрежденной
кожей. «Полукритические» контактируют со слизистыми оболочками или поврежденной
кожей. «Критические» проникают в стерильные ткани организма или сосуды,
контактируют с кровью или инъекционными растворами.
ДВУ используется для обработки
«критических» предметов. При этом методе обработки погибают все микроорганизмы,
кроме спор бактерий. Для ДВУ применяют глутаровый альдегид, диоксид хлора, 6 %
раствор перекиси водорода и средства на основе надуксусной кислоты. Эти
химические средства можно использовать и для стерилизации. Однако при
стерилизации данными веществами время обработки значительно увеличивается.
ДПУ используется для обработки «полукритических
предметов. При проведении ДПУ погибают вегетативные формы бактерий, в том числе
микобактерии, большинство вирусов и грибов. Однако споры бактерий в этих
условиях выживают. Мелкие нелипидные вирусы, например энтеровирусы, риновирусы,
более устойчивы к бактерицидным средствам. Крупные же липидные вирусы, такие
как аденовирусы, вирус гепатита В и ВИЧ, обычно погибают при обработке
дезинфектантами промежуточного уровня. К дезинфекционным средствам,
используемым для ДПУ, относятся практически все препараты, концентрация которых
готовится по режиму уничтожения бактерий и в соответствии с методическими
указаниями к каждому используемому препарату.
ДНУ используется для обработки «некритических»
и некоторых «полукритических» предметов. Например, для обработки ванн, которые
применяют при гидротерапии пациентов с поврежденной кожей. После ДНУ погибают
вегетативные формы большинства видов бактерий, вирусы и грибы. Не реагируют на
этот метод обработки споры бактерий, микобактерии и мелкие нелипидные вирусы. К
средствам ДНУ относятся соединения на основе 70 % и 90 % этилового или
изопропилового спирта, хлорсодержащие препараты, некоторые фенолсодержащие
средства и йодофоры. Среди дезинфектантов низкого уровня также можно назвать
препараты на основе четвертичных аммониевых соединений.
Применяются 4 основных метода
дезинфекции:
Механический
метод – это проветривание,
вентиляция помещений, стирка белья, обработка поверхностей пылесосом,
протирание их влажной ветошью.
Физический
метод заключается
в высокотемпературной обработке Используются кипячение в дистиллированной воде
или воде с добавлением натрия двууглекислого (питьевая сода), паровой метод в
стерилизаторе (автоклаве), воздушный метод в суховоздушном шкафу. Этот метод надежен,
экологически чист и безопасен для персонала.
Химический
метод позволяет
обрабатывать медицинские предметы различными химическими веществами в жидком,
газообразном состоянии. Изделия погружают в дезраствор, налитый в
пластмассовые, стеклянные или покрытые эмалью без повреждений емкости. Для
проведения такой дезинфекции рекомендуется применять специальные контейнеры, в
которых изделия размещаются на перфорированных решетках. Это снижает риск инфицирования
и травматизации персонала. Емкости с растворами дезинфицирующих средств должны
быть снабжены крышками, иметь надписи с указанием названия средства, его
концентрации, срока приготовления и использования.
Биологический
метод основан на
использовании антагонизма различных видов микроорганизмов. Так, при
использовании бактериофагов, то есть вирусов бактерий, уничтожаются
стафилококки, синегнойная палочка, брюшнотифозные бактерии и т. д.
К
сведению. Бактериофаги узко специфичны. Например,
стафилококковый бактериофаг, проникая в микробную клетку стафилококка,
уничтожает только ее. Для обработки медицинских изделий их не применяют, но
зато их можно достаточно эффективно использовать для лечения людей и для
обеззараживания поверхностей, особенно там, где сформировался госпитальный
штамм (например, роддома). Также бактериофаги хорошо знакомы работникам
предприятий коммунальной сферы. Их используют для обеззараживания сточных вод
на полях фильтрации.
Средства химической дезинфекции
Средства
химической дезинфекции наиболее часто используется в ЛПУ. Большинство таких средств
по химическому составу можно разделить на 7 групп.
В состав галогенсодержащих веществ входят в качестве активного действующего
вещества хлор, бром, йод. Препаратами из этой группы являются, в частности,
Хлорамин Б, Хлорэффект, гипохлорид натрия, Де-хлор, нейтральный анолит,
Сульфохлорантин, Пресепт, хлоргексидин глюконат и т.д.
В
кислородсодержащей
группе препаратов действующим веществом является кислород, выделяющийся из
перекиси водорода, перекисных соединений, надкислот. Препаратами этой группы
являются, например, перекись водорода, Оксидезин, Пероксимед, Окадез,
Клиндезин Окси, Виркон.
Средства
на основе катионных поверхностно-активных веществ (ПАВы) представляются весьма
перспективными, так как позволют совмещать дезинфекцию и предстерилизационную
обработку. ПАВы не вызывают коррозию медицинских инструментов. К препаратам из
этой группы относятся АХД 2000 специаль, Аламинол и Аламинол плюс, Бриллиант,
Велтолен, Ника-дез, Премьер, Самаровка, Септодор форте, Вегосепт.
Гуанидсодержащие
средства созданы
на основе сложных органических соединений. Они активны в отношении широкого
спектра микроорганизмов. Препаратами этой группы являются Лизоформин специаль,
Лизетол АФ (при его использовании металлические инструменты полностью
очищаются, причем без коррозии), Пливасепт 5%, хлоргексидин биглюконат
(Гибитан), Фогуцид, который на обработанной поверхности образует защитную пленку,
действующую от 3 до 7 суток.
В состав альдегидсодержащих средств входят глутаровый или янтарный альдегид.
Препараты этой группы обладают выраженным бактерицидным, вирулоцидным,
фунгицидным, спороцидным действием. Вместе с тем они отрицательно действуют на
макроорганизмы. Часть этих дезсредств может использоваться не только для
дезинфекции, но и для стерилизации инструментария, а также для проведения
дезинфекции эндоскопического оборудования по
режиму ДВУ. Из этой группы чаще всего используются Гигасепт ФФ, Сайдекс,
Лизоформин 3000, Секусепт Форте.
Спирты. Это группа препаратов на основе
этанола, пропанола, изопропанола. Такие средства как Бациллол плюс, Деконекс
Соларсепт используют для дезинфекции поверхностей и оборудования. 70 % этиловый
спирт используется как кожный асептик.
Среди
фенолсодержащих препаратов
можно рекомендовать Амоцид и Амоцид 2000, которые эффективны для проведения
текущей и заключительной дезинфекции в очагах туберкулеза для обеззараживания
биоматериала от больных.
Как проводят дезинфекцию
Медицинские
изделия погружают в дезраствор сразу же после их использования. При этом
дезраствор должен полностью покрывать инструменты не менее 1 см над их поверхностью.
Изделия сложной конфигурации дезинфицируют в разобранном виде. Каналы и полости
изделий заполняют дезинфицирующим раствором так, чтобы в них не оставалось
пузырьков воздуха. Сильно загрязненные инструменты нужно подвергать двукратной
обработке.
Хлорсодержащие средства,
например, Хлорамин Б, Клорсепт, применяют в основном для дезинфекции изделий
медицинского назначения из стекла, пластмассы, резины, коррозионно-стойкого
материала или отработанного перевязочного материала и одноразовых инструментов.
Очистка с помощью ерша резиновых изделий не допускается!
Для дезинфекции многоразового
металлического инструментария рекомендуется использовать препараты, которые не
вызывают коррозии. Правда, эти дезсредства стоят дороже. Но экономить не стоит.
Ведь стоимость металлических многоразовых инструментов намного выше.
По окончании дезинфекционной
выдержки изделия промывают. Оставшиеся загрязнения оттирают с помощью ершей,
щеток, салфеток под проточной питьевой водой либо в специальных моющих
аппаратах.
Обратите
внимание. Поскольку альдегидосодержащие дезсредства достаточно токсичны, при работе
с ними персоналу следует соблюдать особые меры предосторожности:
* рабочие растворы из концентратов готовьте в отдельных хорошо
вентилируемых помещениях с достаточной кубатурой;
* во время приготовления рабочих растворов и при работе с ними защищайте
органы дыхания респираторами, кожу рук перчатками, а глаза очками;
* рабочие растворы должны находиться только в емкостях с плотно закрытыми
крышками! Используйте специальные ванночки — стерилизаторы из полиэтилена.
Емкость следует открывать только при необходимости, защищая органы дыхания;
* нельзя разводить исходный концентрат теплой и тем более горячей водой.
Это усиливает вредные испарения с
поверхности раствора;
* промывка изделий под проточной водой до дезинфекции не допускается.
Ведь аэрозоль, образующийся в процессе мытья, может инфицировать персонал,
проводящий обработку, а также поверхности помещений. Подчеркнем, однако, что
при применении многих альдегидосодержащих дезинфектантов очистка медицинских
изделий от загрязнения все же
необходима. Дело в том, что такие дезинфектанты фиксируют белковые загрязнения.
Это затрудняет процесс дезинфекции. Поэтому предварительная очистка в данном
случае должна проводиться с соблюдением противоэпидемических принципов.
Используются специальные емкости. Промывные воды, салфетки, использованные для
очистки, обеззараживаются одним из хлорсодержащих дезинфектантов.
Практическими вопросами
проведения дезинфекции в любом ЛПУ занимаются в основном медицинские сестры. А
вот задача администрации медучреждения — обеспечить приобретение эффективных
дезпрепаратов, замену их с периодичностью не реже 8-12 месяцев, чтобы
предотвратить формирование антибиотикоустойчивых микроорганизмов. На сегодня
поставщики предлагают ЛПУ десятки различных дезинфектантов. Реклама у продавцов
напористая, сделать правильный выбор не так-то легко.
В письме от 25.01.2006 №
0100/626-06-32 Роспотребнадзор предписал при выборе реагентов для дезинфекции
руководствоваться государственным реестром зарегистрированных дезсредств. Найти
этот реестр можно, в частности, на информационных ресурсах Роспотребнадзора в
сети Интернет.
Перечни некоторых
зарегистрированных в нашей стране дезинфицирующих средств доводятся и специальными письмами Роспотребнадзора. Например,
перечень дезсредств, обладающих вирулицидной активностью, отечественного и
зарубежного производства приведен в письме Роспотребнадзора от 07.03.2006 №
0100/2490-06-32.
Предстерилизационная обработка
Для
инструментария, который соприкасается со слизистыми оболочками и ранами, в том
числе операционными, одной дезинфекции недостаточно. Требуется стерилизация. Но
перед этим проводят предстерилизационную обработку. Цель — удаление всех мелких
частиц, оставшихся после операции, различных белковых загрязнений.
При предстерилизационной
обработке используют специально приготовленные растворы, в которые входят вода,
перекись водорода и моющие средства «Астра», «Лотос», «Айна», «Прогресс». Можно
также применять дезинфектанты, специально предусмотренные для совмещения
дезинфекции с предстерилизационной обработкой. Такие препараты очень удобны в
работе, позволяют экономить рабочее время персонала, тем самым сокращая затраты
ЛПУ. В настоящее время выбор комбинированных препаратов достаточно широк.
При предстерилизационной очистке
разъемные медицинские изделия замачиваются в разобранном виде. Все предметы
полностью погружаются в раствор с заполнением всех полостей. О качестве же дезинфекции
и предстерилизационной подготовки медицинского инструментария судят по
результатам биологических и химических анализов.
Важно. Контроль качества предстерилизационной
очистки проводят в ЛПУ ежедневно, под
руководством старшей медицинской сестры. Проверке подлежит 1 % изделий от
партии, но не менее трех единиц. Качество очистки оценивают путем постановки
азопирамовой пробы на наличие остаточных количеств крови, а также путем
постановки фенолфталеиновой пробы на наличие остаточных количеств щелочных
компонентов моющих средств. При положительной азопирамовой пробе не позднее чем
через 1 минуту после нанесения реактива появляется фиолетовое окрашивание,
которое вскоре переходит в розово-сиреневое или буроватое.
При положительной
фенолфталеиновой пробе о наличии на изделиях остаточных количеств щелочных
компонентов моющего средства свидетельствует появление розового окрашивания
реактива. Если пробы на кровь или на остатки щелочных компонентов моющих
средств, оказываются положительными, всю партию изделий повторно очищают до
получения отрицательных результатов.
Стерилизация
Как мы уже говорили, оборудование
и инструменты, которые проникают в стерильные ткани организма или сосуды,
контактируя с кровью или инъекционными растворами, относятся к «критическим»
предметам. Они должны пройти стерилизацию, чтобы полностью удалились или
уничтожились всех виды микроорганизмов, включая споры бактерий. Стерилизация не
может быть относительной, она всегда абсолютна! В медицинской практике
применяются в основном три вида стерилизации.
Таблица
1. Виды стериализации.
|
Виды стерилизации |
Методы стерилизации |
Действующий агент |
|
физический |
паровой
воздушный
гласперленовый
инфракрасный |
пар под избыточным давлением
(120 °С, давление 1,1 атм)
(132 °С, давление 2,0 атм)
сухой воздух при 180 °С
нагретые стеклянные шарики при
инфракрасное излучение при
|
|
химический |
жидкостной
плазменный |
растворы химических соединений
(альдегид-, кислород-,
пары 20 % пероксида водорода |
|
газовый |
— |
окись этилена в смеси с
|
Поясняем. При стерилизации горячим воздухом возбудители болезней уничтожаются
высокой температурой 180°С в суховоздушном стерилизаторе. В случае подобной стерилизации
в автоклаве эффект достигается уже при 120 °С. Инструменты в него укладывают
так, чтобы они не касались друг друга. Для контроля стерилизации используют
химические тесты, которые укладывают на каждую полку суховоздушного
стерилизатора в виде конверта в 5 точках по четырем краям и в середине. Если
хотя бы один химический тест не изменил цвет, стерилизацию всей партии
инструментов проводят заново. Обратите внимание, что сроки хранения стерильного
материала после этой процедуры незначительные – до 1 суток.
Об успешном проведении
стерилизации можно говорить при соблюдении следующих параметров обработки:
температурный режим, давление пара, время воздействия (экспозиция).
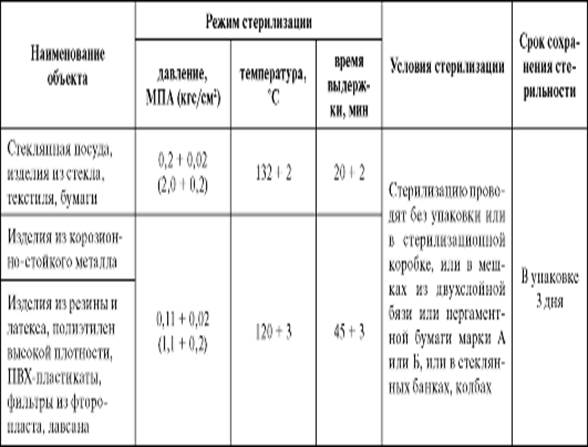
Таблица 2. Режимы стерилизации некоторых
медицинских инструментов
|
Способ стерилизации |
Температура,
°С |
Давление,
кгс/кв.см |
Экспозиция,
мин. |
Материал обрабатываемых изделий |
|
Сухим горячим воздухом
|
180 |
60 |
металл, стекло | |
|
Водяным насыщенным паром под
|
132 |
2,0 |
20 |
металл, стекло, текстильные
|
|
120 |
1,1 |
45 |
резина, латекс, отдельные
|
Стерилизация горячим паром широко
распространена в ежедневной медицинской практике. Ее достоинства – это короткий
полный производственный цикл и невысокие температуры. Автоклавная техника а
последние годы усовершенствовалась и позволяет при доступном для ЛПУ уровне
затрат обеспечивать жесткие требования клинических стандартов.
Одним из основных условий
проведения качественной стерилизации является загрузка автоклава в точном соответствии
с рекомендациями производителя. Это означает правильное расположение и
количество загружаемых предметов. Водяной пар должен свободно циркулировать, а
конденсат своевременно выводиться. При загрузке автоклава обратите внимание на
то, чтобы тяжелые инструменты располагались на нижних поддонах, а легкие — на
верхних.
Изделия загружают в таком
количестве, которое допускает свободную подачу воздуха к стерилизуемым
изделиям. Не допускается перекрывать продувочные окна и решетки вентиляции.
Загрузку и выгрузку изделий проводят при температуре не выше 40-50°С.
Для контроля стерилизации в
каждый бикс закладывают специальные термоиндикаторы. Они должны располагаться
на трех разных уровнях — нижнем, среднем, верхнем — и позволяют осуществлять как
внешний (в камере стерилизатора) и внутренний (в упаковке с изделиями)
контроль. После окончания стерилизации и обязательно до использования
стерильного материала проверяют тесты. Они должны изменить цвет. Если хотя бы
одна полоска не изменила цвет, весь материал повторно стерилизуют.
Срок хранения простерилизованных
изделий: в биксах без фильтра, в двойной мягкой упаковке – 3 суток; в
пергаменте, бумаге мешочной непропитанной, мешочной влагопрочной, бумаге
упаковочной высокопрочной, бумаге крепированной, стерилизационной коробке с
фильтром – 20 суток.
Виды стерилизаторов. Плюсы и минусы
Существуют
стерилизаторы, в которых используется метод, основанный на применении
кратковременного импульсного инфракрасного излучения, создающего в рабочей
камере температуру 200+3°С. Время инфракрасной стерилизации инструментария в
неупакованном виде составляет от 10 до 25 минут, включая этапы выхода на режим
и охлаждения. Однако недостатками такой стерилизации являются отсутствие
упаковки инструментов, повреждающее воздействие на полимерные материалы и
резину, наконец, отсутствие контролирующих индикаторов.
В настоящее время появляется
различная аппаратура для стерилизации мелких инструментов. В качестве примера
можно привести гласперленовый стерилизатор. Он представляет собой камеру,
наполненную стеклянными шариками, которые нагреваются до температуры 190-240°С.
Такой метод стерилизации используется в стоматологии. Однако и он имеет
недостатки: можно применять лишь для мелких цельнометаллических инструментов
без упаковки. Они стерилизуются в течение 5-15 секунд. У более крупных
инструментов для такой обработки доступна только рабочая часть. А полная их
стерилизация даже при увеличении экспозиции не удается. Проблемы возникают и со
средствами контроля работы этих стерилизаторов.
Недостатком стерилизации жидкими
химическими средствами является возможное наличие на очищенном инструментарии
следов очистки — остатков токсичных бактерицидных средств. Кроме этого
необходимо наличие стерильных емкостей, причем не менее двух, со стерильной
дистиллированной водой для отмывания стерилизующего агента. При химической
стерилизации может наступать загрязнение микроорганизмами простерилизованных
инструментов.
Стерилизация газовым методом
более надежна, но технически она весьма сложна. Для нее необходимы особые
помещения, аппаратура, согласование с органами санитарного надзора. Тем не
менее иногда этому методу нет альтернативы. Ведь не всякая медицинская техника
выдержит температурную и жидкостную стерилизацию. К примеру, оптические инструменты,
электрооборудование. Но стерилизация газовым методом с применением окиси
этилена и формальдегида в России широко не применяется, так как пока разработки
отечественной аппаратуры находятся на начальной стадии. В некоторых ЛПУ используют
зарубежные газовые стерилизаторы. Заметим, что это оборудование достаточно дорогое.
Плюсом стерилизации газовым методом является возможность использования упаковки
материалов, которые могут храниться годами. Минусом, помимо его дороговизны, считается
существенное время экспозиции (несколько часов), необходимость дегазации при
помощи специальной аппаратуры, что дополнительно увеличивает длительность цикла
стерилизации.
Существует современный,
эффективный, но весьма дорогой метод стерилизации – плазменная очистка в
низкотемпературных плазменных стерилизаторах SPS. Принцип работы этой
аппаратуры основан
на генерации плазмы непосредственно вокруг стерилизуемого материала.
Стерилизующим агентом является 20 %-ный пероксид водорода. Процесс происходит в
любой части камеры. Контроль температуры осуществляется инфракрасными датчиками.
Стерилизация в этом случае представляет собой сухой процесс при температуре от
+35 до +50 °С, что гарантирует сохранность инструментов и оборудования,
чувствительного к повышенной температуре и влажности. Время стерилизации — от
90 до 120 минут.
Особенности очистки отдельных видов
инструментов
Выше
мы отнесли к «полукритическим» предметы, контактирующие со слизистыми
оболочками или поврежденной кожей, например, ингаляторы и некоторые виды
эндоскопов. «Полукритические» инструменты должны подвергаться ДВУ. Но некоторые
эндоскопические инструменты относятся к «критическим» и подлежат стерилизации.
Обработка эндоскопов производится
непосредственно после их использования и имеет свои особенности, отраженные в табл.
3.
Таблица
3. Порядок очистки эндоскопов
|
Эндоскопы, используемые для
|
Эндоскопы, используемые для стерильных
|
|
1)
2)
3)
|
1)
2)
3)
|
Особенности очистки, дезинфекции,
стерилизации эндоскопов и инструментов к ним содержатся в Методических
указаниях МУ 3.5.1937-04, утвержденных Главным государственным санитарным
врачом РФ 04.03.2004.
Особые хлопоты ЛПУ доставляет
стерилизация термолабильных инструментов. К ним, в частности, относятся
лапароскопы. Стерилизация газом окиси этилена или жидкими химическими
средствами требует наличие специальной дорогостоящей техники (газовый метод), а
также продолжительного времени. Поэтому чтобы не испортить инструмент, во
многих стационарах используют дезинфекцию высокого уровня. Однако в отличие от
стерилизации ДВУ не уничтожает полностью споры бактерий. Поэтому увеличивается
риск инфицирования пациентов. И напомним, что эти изделия после очистки надо хранить в условиях, исключающих вторичное заражение
микроорганизмами.
В заключение хочется подчеркнуть, что последовательное и четкое
проведение в лечебных учреждениях всех мероприятий по проведению дезинфекции и
стерилизации позволит значительно снизить уровень внутрибольничного
инфицирования.
Г.А. КУШНАРЕВА, госпитальный эпидемиолог
Стерилизация изделий медицинского назначения – выход на новые технологии
Время диктует свои правила. А обстоятельства, которые ввергли весь мир в состояние тотального карантина, заставляют по-новому взглянуть на вещи, которые еще недавно нам казались хорошо знакомыми. Такие обыденные, элементарные действия, как мытье рук перед едой, обрели сегодня новый смысл. Более того, новые реалии современной жизни подняли на пик актуальности два чисто медицинских термина: дезинфекция и стерилизация.
Истории развития методов стерилизации
Эти понятия тесно связаны. Если смотреть исторически, второе плавно вытекало из первого. Стерилизация стала следующим звеном эволюции медицины и одной из опор современной цивилизации. Для начала, внедрение в массы элементарных правил гигиены позволило значительно снизить число смертей от банальной антисанитарии. Достаточно вспомнить средневековье, когда немудрено было проститься с жизнью от простого пореза пальца. Серьезный подход к дезинфекции вообще и стерилизации изделий медицинского назначения в частности уменьшил риски заражений и смертей от разного рода медицинский манипуляций, например, при хирургических вмешательствах.
Ёмкость для стерилизации медицинских инструментов, середина 20 века
Историки и социологи, анализируя статистику прошлых веков, неизменно связывают рост продолжительности жизни населения Земли именно с развитием методик стерилизации разного рода предметов медицинского назначения. Не менее важным стало соблюдение условий общей стерильности во время проведения различных медицинских мероприятий.
Так, поступательное улучшение санитарных условий в медицинских учреждениях на протяжении последних полутора сотен лет позволило, к примеру, успешно бороться со смертностью женщин и младенцев во время родов. Это особенно важно, поскольку со временем показатель младенческой смертности вообще превратился в важный критерий «демографического благополучия» развитых стран, обеспечив там взрывной рост населения. И в вопросе детского здоровья, как считают медики, сегодня мелочей быть не может.
Продвигаясь все дальше и дальше, современная медицина уточняла требования к стерилизации. Стало важным не просто использовать стерильные предметы, но сохранять стерильность изделий медицинского назначения в течении длительного времени. К примеру, на всех этапах их следования от изготовителя до потребителя, от стерильной упаковки изделия на производстве до стерильных условий его использования в какой-нибудь больничной манипуляционной.
Сегодня каждый мало-мальски связанный с медициной специалист хорошо понимает значение и отличие этих двух понятий, которым наша цивилизация обязана своим существованием, – дезинфекция и стерилизация. Обыватель же, хоть и признает их значимость, разницы не видит.
Дезинфекция и стерилизация: разница есть!
Начнем с того, что под дезинфекцией понимается комплекс мероприятий, который направлен на уничтожение возбудителей инфекционных заболеваний и разрушение токсинов на объектах внешней среды. Это всего лишь один из видов обеззараживания, который предотвращает попадание токсинов и микробов на кожу или слизистые. Дезинфекция может и не уничтожить их полностью, но в любом случае уменьшит количество.
В качестве действующего вещества дезинфекции – дезинфектанта – используются химические дезинфицирующие средства. Например, такие, как формальдегид или гипохлорит натрия, растворы органических веществ, обладающих дезинфицирующими свойствами: хлоргексидин, четвертичные аммонийные соединения (ЧАСы), надуксусная кислота, полигуанидины (ПГМГ-ГХ).
Дезинфекция бывает профилактическая, которая проводится постоянно, независимо от эпидемической обстановки, и делится в свою очередь на плановую, внеплановую, текущую и итоговую профилактику. Именно к дезинфекции относят мытье рук и окружающих предметов с использованием моющих средств, содержащих бактерицидные добавки.
Пример установки паровой стерилизации. Источник: getinge.com
Специалисты утверждают, что уничтожение инфекционного начала во внешней среде еще не обеспечивает устранение основных источников инфекции. Поэтому дезинфекция важна только в общем комплексе противоэпидемических мероприятий.
К слову, медицинские работники даже утилизировать некоторые инструменты одноразового использования (шприцы, иглы для инъекций и т.д.) не могут без предварительной обязательной дезинфекции. И, как вы уже понимаете, она нужна не только в медицине, но и в обычной жизни. Например, обеззараживание помещения или инструмента для маникюра. После этой процедуры количество вредных микроорганизмов сокращается на 70-80%.
Стерилизация же обеспечивает полное освобождение какого-либо предмета или материала от всех видов микроорганизмов (включая бактерии и их споры, грибы, вирусы), либо их уничтожение. То есть абсолютное уничтожение всего живого в любом его проявлении и всех продуктов его жизнедеятельности. Осуществляется термическим, химическим, радиационным, фильтрационным методами.
Процесс стерилизации состоит из трех этапов и включает в себя: дезинфекцию, предстерилизационную обработку и собственно стерилизацию.
Этапы цикла обработки изделий медицинского назначения
Итак, изделия медицинского назначения (ИМН), если они в процессе эксплуатации соприкасаются с раневой поверхностью, контактируют с кровью или со слизистой оболочкой различных органов должны пройти 3 этапа обработки.
Дезинфекция изделий медицинского назначения
Сразу после использования все изделия медицинского назначения подвергают дезинфекции. Этот этап обработки призван сделать их безопасными для медицинского персонала и исключить распространение возбудителей в окружающей среде.
Для проведения дезинфекции изделия погружают в рабочий раствор дезинфекционного средства на время процедуры, установленное в нормативно-методическом документе по применению конкретного средства. После окончания процесса обеззараживания изделие тщательно отмывают от остатков дезинфекционного средства.
Предстерилизационная очистка
Предстерилизационная очистка (ПСО) – этап цикла по обработке ИМН, предусматривающий удаление с изделий белковых, жировых, механических загрязнений и остаточных количеств лекарственных препаратов. При выборе средств для дезинфекции и очистки имеет значение отсутствие у них фиксирующего действия. Так, например, альдегид-содержащие дезинфекционные средства обладают выраженным фиксирующим действием, в результате чего органические загрязнения прочно фиксируются на поверхности обрабатываемых изделий. А это в свою очередь может стать причиной неэффективной дезинфекции и очистки.
Современные композиционные дезинфекционные средства позволяют совместить при использовании раствора одного средства дезинфекцию и ПСО изделий. Для этого используют ферментные средства, обеспечивающие разложение белковых, углеводных и жировых загрязнений, имеющих в составе антимикробные компоненты.
Стерилизация изделий медицинского назначения – финишная прямая
Пример установки газовой-плазменной стерилизации. Источник: meise.com
Стерилизация изделий медицинского назначения является последним этапом обработки. Для ее выполнения, скажем, в лечебно-профилактических учреждениях используются термические, химические методы и их комбинация. К термическим относят паровой, воздушный, инфракрасный, гласперленовый. А к химическим – газовый, плазменный, озоновый и растворами химических средств.
То, каким именно методом можно воспользоваться для стерилизации конкретных изделий, зависит от самого метода и его особенностей. Специалисты считают, что в момент выбора важно учитывать все достоинства и недостатки разных методик, поскольку ни один из существующих методов стерилизации не является абсолютно идеальным.
Так, самым распространенным методом в лечебно-профилактических учреждениях признаны паровой и воздушный. Но какой бы из методов ни выбрал специалист, он должен будет учесть требования к средствам предстерилизационной очистки и стерилизации медицинских изделий, которые должны иметь:
- высокую активность за возможно короткое время;
- безопасность для персонала, пациентов, окружающей среды;
- хорошую совместимость с материалами изделий, выражающуюся в отсутствии повреждающего действия на материалы;
- возможность контроля процесса;
- простоту и удобство применения;
- приемлемую стоимость и доступность;
- высокую стабильность, способствующую приемлемому сроку хранения химического средства, быструю и полную его растворимость в воде;
- отсутствие раздражающего запаха.
Перспективы развития методов стерилизации медицинских изделий
Специалисты, занимающиеся изучением вопросов методологии дезинфекции и стерилизации изделий медицинского назначения, в один голос утверждают: несмотря на все разнообразие методов, в этой области есть куда развиваться и что совершенствовать.
В частности, процесс стерилизации помогут сделать более эффективным:
- разработка оборудования, позволяющего реализовать новые методы стерилизации с более короткими или более щадящими режимами;
- разработка новых химических средств и оптимальных режимов их применения, обеспечивающих эффект стерилизации в приемлемые сроки;
- увеличение номенклатуры химических средств на основе действующих веществ, пригодных для стерилизации изделий из разнородных материалов;
- разработка химических индикаторов различных классов, позволяющих осуществлять в стерилизаторах разных типов оперативный внешний и внутренний контроль стерилизации.
Таким образом, считается, что некая «идеальная» технология должна обеспечивать обработку изделий различных конструкционных исполнений из любых разнородных материалов в современном автоматизированном оборудовании за возможно короткое время, быть легко контролируемой, а также обоснованно адаптированной к условиям использования как экономически, так и экологически. Причем «идеальная» технология стерилизации, помимо всего прочего, должна позволять обработку изделий в упакованном виде и не требовать удаления остатков стерилизующих средств.
Пример процесса электронно-лучевой стерилизации. Источник: iba-industrial.com
Специалисты также утверждают, что сегодня такой технологии, которая соответствовала бы всем вышеуказанным требованиям, пока не существует. А вот максимально приближенные к идеалу условия и технологии вполне могут быть сосредоточены в одном месте. Особенно если речь идет обо всех циклах фармацевтического производства, таких которые сосредоточены, например, на индустриальной площадке «Экобалтик». Ведь именно здесь, с запуска производства препарата «Мирамистин» в 2014 году начал формироваться новый для региона фармацевтический кластер промышленного производства Калининградской области.
В планах инвесторов индустриального парка значатся и работы по организации большого фармацевтического склада класса «А» в соответствии со стандартами GDP с блоком электронно-лучевой стерилизации и с системой, которая позволит обеспечить полный контроль этапов поставки и передвижения лекарственных средств от их упаковки на производстве до конечного покупателя.
Обсуждается и возможность строительства на территории индустриального парка «Экобалтик» цеха стерилизации фармупаковки в городе Багратионовске. Проект потребует больших инвестиций, зато цех сможет оказывать такую услугу в Калининградской области для всех предприятий.
К работе над этими проектами управляющая компания площадки «Экобалтик» — ООО «Балтфармацевтика» уже приступила.
Стерилизация и дезинфекция — обзор
9.4.1 Стандарты для нетканых перевязочных материалов (ISO, BP, ASTM и BS)
В ASTM есть несколько стандартных методов тестирования медицинских устройств, которые относятся к перевязочным материалам для ран, которые включают общую практику для медицинских изделий, 20 , 21 анализ медицинских материалов, 22–26 методы для медицинских упаковок, 27–29 проникновение жидкости, 30 стерилизация и дезинфекция. 31 , 32 В последние годы ASTM и BS ввели различные стандарты для перевязочных материалов для ран. В BP 33 определен ряд методов испытаний хирургических повязок. Эти методы включают в себя: идентификацию волокна, номер пряжи, количество нитей на заданную длину (нерастянутые, полностью растянутые), вес на единицу площади (неклейкие повязки, липкие повязки, вес клеящей массы), минимальную разрывную нагрузку, эластичность, растяжимость, адгезию, паропроницаемость (ленты, поролоновые повязки), водонепроницаемость, впитываемость (время погружения, водоудерживающая способность), водорастворимые вещества, эфирорастворимые вещества, стойкость окраски, содержание антисептиков, содержание оксида цинка в клеевой массе, X -прозрачность, сульфатная зола хирургических повязок и водоудерживающая способность.Также доступны другие стандарты, относящиеся к перевязочным материалам для ран, такие как тест на стерильность, 34 тест на микробное загрязнение, 35 эффективность антибактериального консервирования 36 и методы стерилизации 37 .
Ряд стандартных методов испытаний перевязочных материалов для ран был введен в британских и европейских стандартах BS EN 13726. Эти методы включают аспекты впитывающей способности, 38 скорости передачи паров влаги проницаемых пленочных повязок, 39 водонепроницаемости, 40 совместимости , 41 и бактериальные барьерные свойства. 42 Другие стандарты, относящиеся к медицинским тканям, включают спецификацию для тканевых опор для позвоночника и живота 43 и спецификацию эластичных свойств тканевых повязок. 44 Стандарты методов испытаний медицинских нетканых компрессов 45 , 46 были недавно введены в Британские стандарты.
Методы тестирования хирургических повязок и хирургических перевязочных материалов были определены в AS2836.0 ~ AS2836.11-1998 следующим образом: общее введение и список методов, 47 методы определения потери массы при сушке, 48 идентификация хлопковых и вискозных волокон, 49 определение массы на единицу площади , 50 определение размера, 51 метод определения времени погружения, 52 определение скорости поглощения и водоудерживающей способности, 53 определение уровня поверхностно-активных веществ, 54 определение количества водорастворимые вещества, 55 определение наличия крахмала и декстринов, 56 определение наличия флуоресцентных веществ 57 и определение содержания сульфатной золы. 58 Также установлены стандарты испытаний медицинских изделий тканевой инженерии. 59–61 Стандарты испытаний, относящиеся к нетканым материалам для медицинского применения, включают стандарты, используемые при производстве компрессов, 62 готовых компрессов, 63 нетканый материал без покрытия, используемый для медицинской упаковки, 64 нетканый материал с клеевым покрытием, используемый для медицинской упаковки 65 и упаковка для окончательно стерилизованных медицинских изделий. 66
Цикл стерилизации — обзор
Разработка процессов непрерывной стерилизации
К проектированию циклов непрерывной стерилизации можно подходить точно так же, как и к системам периодической стерилизации.Непрерывная система включает период времени, в течение которого среда нагревается до температуры стерилизации, время выдержки при желаемой температуре и период охлаждения для восстановления среды до температуры ферментации. Температура среды повышается в теплообменнике непрерывного действия, а затем поддерживается в изолированном змеевидном змеевике выдержки в течение периода выдержки. Продолжительность периода выдержки определяется длиной змеевика и расходом среды. Затем горячая среда охлаждается до температуры ферментации с помощью двух последовательных теплообменников: первый использует поступающую среду в качестве источника охлаждения (таким образом сохраняя тепло за счет нагрева поступающей среды), а второй — охлаждающей воды.Как обсуждалось ранее, основным преимуществом непрерывного процесса является то, что можно использовать гораздо более высокую температуру, таким образом сокращая время выдержки и снижая степень разложения питательных веществ. Требуемый коэффициент Del может быть достигнут сочетанием температуры и времени выдержки, что дает приемлемо небольшую степень разложения питательных веществ. Ричардс (1968) привел следующий пример, чтобы проиллюстрировать диапазон температурно-временных режимов, которые могут использоваться для достижения такой же вероятности достижения стерильности.Коэффициент Del, использованный Ричардсом для стерилизации, составлял 45,7, и следующие температурные режимы времени были рассчитаны таким образом, что все они дали одно и то же значение фактора Del 45,7:
| Температура (° C) | Время выдержки |
|---|---|
| 130 | 2,44 мин |
| 135 | 51,9 с |
| 140 | 18,9 с |
| 150 | 2,7 с |
процесс включает в себя небольшие приращения, т.к. средней, периоды нагрева и охлаждения очень малы по сравнению с периодической системой.Существует два типа стерилизаторов непрерывного действия, которые могут использоваться для обработки ферментационных сред: косвенный теплообменник и прямой теплообменник (паровой инжектор).
Наиболее подходящими теплообменниками непрямого действия являются теплообменники с двойной спиралью, которые состоят из двух листов высококачественной нержавеющей стали, которые изогнуты вокруг центральной оси, образуя двойную спираль, как показано на рис. 5.11. Концы спирали закрываются крышками. Натурный пример показан на рис.5.12. Для достижения температуры стерилизации пар проходит по одной спирали от центра теплообменника, а среда — по другой спирали от внешнего края теплообменника в противоточных потоках. Спиральные теплообменники также используются для охлаждения среды после прохождения через удерживающий змеевик. Поступающая нестерильная среда используется в качестве охлаждающего агента в первом охладителе, так что поступающая среда частично нагревается до того, как достигнет стерилизатора, и, таким образом, сохраняется тепло.
Рисунок 5.11. Схематическое изображение спирального теплообменника
Alfa-Laval Engineering Ltd, Camberley, Surrey, UK
Рисунок 5.12. Спиральный теплообменник промышленного масштаба
Alfa-Laval Engineering Ltd., Камберли, Суррей, Великобритания
Основными преимуществами спирального теплообменника являются:
- 1.
Два потока среды и охлаждающей жидкости или среды и пара , разделены сплошным барьером из нержавеющей стали с уплотнительными прокладками, ограниченными стыками с концевыми пластинами.Это делает маловероятным перекрестное загрязнение между двумя потоками.
- 2.
Спиральный путь, по которому проходит среда, позволяет создать достаточные зазоры, чтобы система могла справиться с взвешенными твердыми частицами. Теплообменник имеет тенденцию к самоочистке, что снижает риск образования отложений, загрязнения и «пригорания».
Непрямые пластинчатые теплообменники состоят из чередующихся пластин, через которые циркулируют противоточные потоки. Прокладки разделяют пластины, и выход из строя этих прокладок может вызвать перекрестное загрязнение между двумя потоками.Кроме того, зазоры между пластинами таковы, что взвешенные твердые частицы в среде могут блокировать теплообменник, и, таким образом, система пригодна только для стерилизации полностью растворимой среды. Однако пластинчатый теплообменник более адаптируем, чем спиральная система, в том смысле, что для увеличения его емкости могут быть добавлены дополнительные пластины.
Непрерывный паровой инжектор впрыскивает пар непосредственно в нестерильный бульон. Преимущества и недостатки системы обобщены Бэнксом (1979):
- 1.
Очень короткое (почти мгновенное) время нагрева.
- 2.
Может использоваться для сред, содержащих взвешенные твердые частицы.
- 3.
Низкие капитальные затраты.
- 4.
Простота очистки и обслуживания.
- 5.
Высокая эффективность использования пара.
Однако есть недостатки:
- 1.
При нагревании может возникнуть пенообразование.
- 2.
Для прямого контакта среды с паром необходимо учитывать разбавление конденсата и «чистый» пар, не содержащий антикоррозионных присадок.
В некоторых случаях система впрыска сочетается с мгновенным охлаждением, когда стерилизованная среда охлаждается, пропуская ее через расширительный клапан в вакуумную камеру. Тогда охлаждение происходит практически мгновенно. Блок-схема системы непрерывной стерилизации с использованием прямого впрыска пара показана на рис.5.13. В некоторых случаях может использоваться комбинация прямого и косвенного теплообменников (Svensson, 1988). Это особенно верно для бульонов, содержащих крахмал, когда на стадии предварительного нагрева используется нагнетание пара. При практически мгновенном повышении температуры критическая температура клейстеризации крахмала достигается очень быстро, и увеличение вязкости, обычно связанное с нагретыми коллоидами крахмала, может быть уменьшено.
Рисунок 5.13. Блок-схема типичного стерилизатора непрерывного действия с инжектором и мгновенным охладителем
Наиболее широко используемая система непрерывной стерилизации основана на спиральных теплообменниках, типичная компоновка которых показана на рис.5.14. Юнкер и др. (2006) описали замену процесса прямого впрыска пара в пилотной установке на процесс, основанный на непрямых спиральных теплообменниках, что позволило избежать проблем, связанных с влиянием на качество среды колебаний качества пара в установке, в частности, присутствием паровых антикоррозионных присадок. . Ключевыми характеристиками этого завода были:
Рисунок 5.14. Блок-схема типичной системы непрерывной стерилизации со спиральными теплообменниками
Alfa-Laval Engineering Ltd., Камберли, Суррей, Великобритания.
- 1.
Ряд резервуаров для корма от 2 000 до 19 000 дм 3 , которые позволяли обрабатывать как ряд объемов среды, так и различные ингредиенты среды стерилизовать последовательно и раздельно.
- 2.
Рециркуляционный резервуар (также называемый циркуляционным или уравнительным резервуаром) и устройство для рециркуляции, чтобы вода могла циркулировать через систему во время очистки и стерилизации установки.
- 3.
Спиральный теплообменник для повышения температуры среды до температуры стерилизации.
- 4.
«Удерживающая петля» для удержания среды при температуре стерилизации в течение необходимого времени.
- 5.
Спиральный теплообменник «рекуператор» для охлаждения стерилизованной среды, выходящей из удерживающего контура, от поступающей холодной нестерильной среды, что сводит к минимуму потери тепла.
- 6.
Охлаждающий спиральный теплообменник, в который подается охлажденная вода для охлаждения стерилизованной среды, выходящей из теплообменника рекуператора, до рабочей температуры.
- 7.
Дополнительный охлаждающий спиральный теплообменник, используемый, когда система использовалась для производства стерильной воды.
- 8.
Коммутационная станция для направления потока продукта из конечных охладителей:
- a.
в систему распределения в ферментеры (если среда стерильная),
- b.
в рециркуляционный бак для рециркуляции через систему во время стерилизации системы, и
- c.
в канализацию на время очистки системы или в случае неисправности.
Коэффициент Del, который должен быть достигнут в процессе непрерывной стерилизации, должен увеличиваться с увеличением масштаба, и он рассчитывается точно так, как описано при рассмотрении масштабирования периодических режимов. Таким образом, если стерилизуемый объем увеличивается с 1000 до 10 000 дм 3 , а риск неудачи остается на уровне 1 к 1000, то коэффициент Del необходимо увеличить с 34.5 до 36,8. Однако преимущество непрерывного процесса состоит в том, что температура может использоваться в качестве переменной при увеличении масштаба непрерывного процесса, так что повышенный коэффициент может быть достигнут при сохранении постоянного качества питательных веществ. Еще одно преимущество непрерывного процесса состоит в том, что распределительную систему можно разработать так, чтобы поток стерильной среды можно было направить для использования в небольших масштабах. Таким образом, лабораторные модели процесса или модели небольшого ферментера можно проводить с использованием среды, которая подвергалась точно такому же режиму стерилизации, что и производственные масштабы.
Deindoerfer и Humphrey (1961) обсудили применение своего критерия качества питательных веществ ( Q ) для непрерывного увеличения масштабов стерилизации. Следует напомнить из нашего предыдущего обсуждения стерилизации партии, что:
Q = A⋅t⋅e− (E / RT).
Следовательно, что касается уравнения фактора Del, путем натурального логарифма и преобразования получается следующее уравнение:
(5.12) lnt = ERT + lnQA.
Таким образом, график натуральных логарифмов времени, необходимого для достижения определенного значения Q , в зависимости от величины, обратной абсолютной температуре, даст прямую линию, наклон которой зависит от энергии активации; то есть график, очень похожий на рис.5.5 для отношения фактор Дел. Если оба графика были наложены на один и тот же рисунок, то получается диаграмма непрерывной стерилизации. Пример, предложенный Deindoerfer и Humphrey (1961), показан на рис. 5.15. Таким образом, на рис. 5.15 каждая линия постоянного фактора Del определяет температурно-временные режимы, дающие одинаковое фракционное уменьшение количества спор, а каждая строка критерия постоянного качества питательных веществ определяет температурно-временные режимы, дающие одинаковое разрушение питательных веществ.Рассматривая влияние разрушения питательных веществ на выход продукта, на рис. 5.15 могут быть наложены ограничения, указывающие критерий качества питательных веществ, ниже которого не достигается дальнейшее увеличение урожая (т. Е. Количество питательных веществ в избытке), и критерий качества питательных веществ, при котором выход продукта самый низкий (т. е. не остается никаких питательных веществ). Таким образом, из такого графика может быть выбран температурно-временной режим, который дает требуемый фактор Del и не влияет отрицательно на выход процесса.
Рисунок 5.15. Диаграмма эффективности непрерывной стерилизации (Deindoerfer & amp; Humphrey, 1961)
Точное принятие подхода Deindoerfer и Humphrey возможно только в том случае, если определено лимитирующее термолабильное питательное вещество и экспериментально определена энергия активации для его термического разрушения. Как указал Бэнкс (1979), эта информация может быть недоступна для сложной ферментационной среды. Однако компромиссы, предложенные Singh et al. (1989) и Boeck et al.(1989) может позволить применить этот подход. Как обсуждалось ранее, коэффициент Del зависит от масштаба, и поэтому по мере увеличения объема, подлежащего стерилизации, следует увеличивать коэффициент Del, если вероятность достижения стерильности остается прежней. Однако критерий качества питательных веществ не зависит от масштаба, так что изменение температурно-временного режима для обеспечения стерильности может отрицательно сказаться на качестве питательных веществ. Изучение рис. 5.15 показывает, что единственный способ, которым может быть увеличен фактор Del без каких-либо изменений в критерии качества питательных веществ, — это повышение температуры и уменьшение времени выдержки.
При разработке процесса непрерывной стерилизации на основе спиральных теплообменников важно учитывать влияние взвешенных твердых частиц на процесс стерилизации. Микроорганизмы, содержащиеся в твердых частицах, получают значительную защиту от стерилизационной обработки. Если время пребывания в стерилизаторе недостаточно для проникновения тепла в частицу, ферментационная среда не может быть стерильной. Обычным решением этой проблемы является «чрезмерное проектирование» процесса и воздействие на среду гораздо более жесткого режима, чем это может быть необходимо.Арменанте и Ли (1993) подробно обсудили эту проблему и создали модель для предсказания поведения непрерывной системы. Их анализ показал, что температура ядер частиц значительно ниже, чем у основной жидкости. Кроме того, существует значительная временная задержка в тепле, проникающем в ядра частиц, что приводит к очень разному профилю время-температура для частиц по сравнению с жидкой средой. Таким образом, температура частиц может не достигнуть критической точки до того, как они покинут стерилизатор, и проникновение тепла в частицы будет продолжаться после стерилизатора.Арменанте и Ли пришли к выводу, что необходимо «переконструировать» стерилизатор и / или первый охлаждающий теплообменник, а не длину выдерживающего змеевика. Помните, что первый охлаждающий теплообменник передает значительное количество тепла от стерильной среды к поступающей среде, и увеличение его площади поверхности даст больше возможностей для проникновения тепла в частицы. Это, в сочетании с повышением температуры или времени пребывания в стерилизаторе, должно гарантировать, что ядра частиц будут нагреты до температуры до того, как будет достигнут удерживающий змеевик.Кроме того, эта работа предполагает, что неразумно использовать метод прямого впрыска пара для нагрева среды из твердых частиц, потому что, опять же, не будет достаточно времени для проникновения тепла в частицы.
Пример расширения режимов стерилизации дается в работе Jain and Buckland (1988) по производству эфротомицина с помощью Nocardia lactamdurans. В этом случае оказалось, что между источником азота белка и глюкозой во время стерилизации происходит благоприятное взаимодействие, что делает белок менее доступным, но приводит к более контролируемой ферментации.Когда глюкозу стерилизовали отдельно, потребность в кислороде для последующей ферментации была чрезмерной, и ферментация преждевременно прекращалась с очень плохим образованием продукта. При увеличении масштабов ферментации было очень трудно достичь правильных условий стерилизации с использованием периодического режима. Однако непрерывная стерилизация с использованием прямого впрыска пара позволила разработать точный процесс получения стерильной среды с необходимой степенью взаимодействия между ингредиентами. Выявление этого явления зависело от тщательного мониторинга мелкомасштабной ферментации и рассмотрения стерилизации как важного фактора увеличения масштабов.
При увеличении масштабов ферментации важно понимать, что процесс создания инокулята также увеличивается в масштабе (см. Главу 6), и может потребоваться более крупный ферментер семян для получения достаточного количества инокулята для запуска масштабов производства. Таким образом, режим стерилизации семенного ферментера (и его среды) также должен быть увеличен. Следовательно, эффективность ферментации семян следует тщательно оценивать, чтобы гарантировать, что качество посевного материала сохраняется в более крупном масштабе, и что на него не повлияло неблагоприятное воздействие какого-либо увеличения строгости режима стерилизации.
Объяснение трех распространенных методов стерилизации инкубатора | Блог
Информация в этой статье любезно предоставлена Александром Крэнстоном из Sheldon Manufacturing.
Производители предлагают множество методов для облегчения самодезактивации инкубатора. Три наиболее распространенных метода:
- УФ-стерилизация
- Стерилизация влажным теплом
- Стерилизация сухим жаром
В этой статье мы подробно рассмотрим эти три типа стерилизации.
1. УФ-стерилизация
нуклеотидов ДНК содержат конъюгированные связи, которые поглощают УФ-свет. УФ-стерилизация создает противомикробный эффект за счет повреждения ДНК микроорганизма, когда ароматические нуклеотиды поглощают фотоны высокой энергии. Это может сделать УФ-стерилизацию эффективным решением для уменьшения загрязнения камеры инкубатора.
Однако есть существенные недостатки. Ваш источник света должен иметь неограниченный доступ ко всем поверхностям камеры инкубатора, полок и оборудования для монтажа полок.Затененные области не будут обеззаражены ультрафиолетовым светом. Кроме того, распространенный метод выживания микроорганизмов под воздействием ультрафиолета — это усиление механизмов восстановления ДНК. В этом случае люди, пережившие УФ-цикл, с большей вероятностью переживут повторные сеансы лечения.
Плюс, УФ-свет обычно неэффективен для уничтожения эндоспор. Микроорганизмы, пережившие процесс УФ-дезактивации, потенциально будут иметь возможность формировать монокультуры и повышать их вероятность достижения кворума.Это возможно, если УФ-стерилизация не сочетается с другими методами обеззараживания инкубатора, такими как разборка и мытье всех поверхностей, дисперсная химическая обработка или эффективный цикл высокой температуры.
2. Стерилизация влажным теплом
Обеззараживание влажным жаром часто применяется в инкубаторах, которые не предназначены для безопасного достижения высоких температур, необходимых для эффективного режима стерилизации сухим жаром. Это может быть связано с риском повреждения внутренних компонентов или с риском перегрева внешнего корпуса инкубатора.
Традиционные автоклавы работают за счет нагрева до ~ 121 ° C и применения повышенного давления пара для увеличения скорости передачи тепла целевым организмам-загрязнителям. Цикл обеззараживания влажным теплом, выполняемый выше, но близкий к 100 ° C и при атмосферном давлении, гарантированно будет менее эффективным, чем автоклав, и не соответствует никаким медицинским организационным критериям стерилизации SAL6. SAL6 представляет собой уровень гарантии стерильности 10-6, что означает снижение количества микроорганизмов на Log6.
Интересно, что археи Geogemma barossii, более известные как «штамм 121», представляют собой вид микроорганизмов, которые, как было доказано, успешно растут и размножаются в автоклаве под давлением при 121 ° C.
3. Стерилизация сухим жаром
Стерилизация сухим жаром при 160–180 ° C в течение нескольких часов удовлетворяет нескольким международным рекомендациям по стерилизации SAL6. Высокотемпературный сухой жар вызывает гибель клеток из-за денатурации всех белков, разрушения нуклеиновых кислот и высыхания.180 ° C в течение 4 часов убьет все известные микроорганизмы, включая закаленные эндоспоры таких бактерий, как сибирская язва.
Инкубатор, представленный ниже, имеет цикл обеззараживания сухим жаром, который поддерживает температуру 180 ° C в течение двух часов.
A SHEL LAB SCO6AD Инкубатор для дезактивации CO2.
Инкубатор, предназначенный для стерилизации сухим жаром, похож на духовку с циклом самоочистки. Оба устройства рассчитаны на работу с гораздо более высокими тепловыми нагрузками, чем в обычных условиях эксплуатации, без повреждений или опасностей, поэтому они изготовлены более жесткими и соответствуют более высоким стандартам качества, чем агрегаты без высоких температур.
Сухая стерилизация при высокой температуре убивает бактерии в камере, которые могут располагаться в затемненных щелях, таких как нижняя сторона полок и внутри крепежных приспособлений для полок, и может заменить необходимость снятия всех полок для их автоклавирования.
Эти методы дополняют (а не заменяют) надлежащие лабораторные процедуры
Отсутствие процедуры самодезактивации — это настоящая замена соблюдению надлежащих лабораторных процедур, включая регулярную очистку камеры инкубатора и соблюдение гигиенических норм.Всегда стоит помнить об этих двух вещах:
- Если в ваших чашках Петри наблюдается загрязнение, и вы снимаете их, чтобы продезинфицировать камеру, а затем снова вставляете их обратно, то вы просто повторно ввели загрязнение в свою камеру.
- Самым большим источником заражения вашего инкубатора является «вы», поскольку вы с ног до головы покрыты сложной микробиотой кожи. Изрядное количество пыли в вашем доме на самом деле представляет собой омертвевшую кожу, а омертвевшая кожа и пыль, которые падают с ваших рук / рук / головы, когда вы попадаете внутрь камеры, весьма эффективны для заражения инкубатора.
Заключение
Тип метода стерилизации, который лучше всего подходит для вашего инкубатора, будет зависеть от конструкции и технических характеристик вашей машины. Однако, чтобы свести к минимуму загрязнение, вы также должны четко осознавать, как неправильная лабораторная практика может привести к ненужному заражению вашего инкубатора.
Об авторе
Эйми разбирает сложные научные и технологические темы, чтобы помочь читателям усвоить концепции и устранить проблемы.Она имеет более чем десятилетний опыт работы в лабораторных условиях, получив степень в области медицинской химии и работая химиком в многонациональной косметической компании, прежде чем продолжить свою страсть к писательской деятельности.
Последние изменения — Международный ресурсный центр по правосудию
Комиссия по положению женщин, Нью-Йорк,
В последние годы международная правозащитная деятельность способствовала повышению осведомленности о принудительной стерилизации как нарушении прав человека, в том числе в результате нашей работы в Международном центре ресурсов правосудия (IJRC).Во всем мире медицинские работники и другие лица продолжают стерилизовать людей без их осознанного согласия, чаще всего нацеливаясь на лиц из числа коренного населения, живущих с ВИЧ, лиц с ограниченными возможностями или лиц, подвергающихся дискриминации по другим признакам. Буквально в этом месяце IJRC продвинула пропаганду наших партнеров по этому вопросу на 63 -й -й сессии Комиссии Организации Объединенных Наций по положению женщин (CSW), а Human Rights Watch опубликовала отчет о недобровольной стерилизации трансгендеров в Японии.За последние три года также были приняты решения региональных судов по правам человека о принудительной стерилизации и важные заявления других органов. В этом посте подробно описываются результаты информационно-пропагандистской деятельности перед региональными органами и органами ООН по правам человека, обобщается растущий объем рекомендаций, заявлений и суждений, которые более полно определяют принудительную стерилизацию как нарушение прав человека и направляют правительства в борьбе с этой вредной практикой.
IJRC в CSW
На прошлой неделе в CSW IJRC провела параллельное мероприятие по предотвращению и устранению принудительной стерилизации, на котором были представлены мнения сторонников, работающих над этими проблемами как в Канаде, так и в Кении.Посмотрите, как Нерима Вир из KELIN объясняет, как организация защищает интересы женщин, живущих с ВИЧ, в Кении, которые были стерилизованы без их ведома или с помощью принуждения. В дополнение к параллельному мероприятию IJRC также сделал письменное заявление, в котором резюмировал соответствующие стандарты в области прав человека и дал рекомендации в отношении действий государства по предотвращению и устранению принудительной стерилизации.
Участие IJRC в CSW является частью нашей постоянной поддержки в области принудительной стерилизации, в первую очередь помощи адвокатам по правам коренных народов в привлечении международного внимания к принудительной стерилизации женщин из числа коренных народов в Канаде.С ноября 2017 года IJRC помогает нашим партнерам в обеспечении многочисленных возможностей для защиты интересов в международных организациях, в том числе в Комитете ООН против пыток (CAT) и Межамериканской комиссии по правам человека (IACHR), помогая формировать международные стандарты и вести общенациональный диалог по этому вопросу. Эта тема. Важно отметить, что эти меры привели к убедительным заключительным наблюдениям Комитета против пыток, который призвал Канаду принять конкретные меры по предотвращению, расследованию и криминализации принудительной стерилизации, а также к подробному и конкретному набору рекомендаций в заявлении МАКПЧ в январе 2019 года.Узнайте больше об этой работе на нашей веб-странице о принудительной стерилизации женщин из числа коренного населения в Канаде.
Эта пропаганда способствовала широкому вниманию средств массовой информации к принудительной стерилизации женщин из числа коренного населения в Канаде и вызвала отклик со стороны канадских официальных лиц. В конце января 2019 года Комитет здравоохранения Палаты общин Канады согласился провести двухдневное исследование распространенности принудительной стерилизации в Канаде. [Globe & Mail] Кроме того, Министерство здравоохранения Канады и Службы коренных народов готовят в этом месяце рабочую группу по этому вопросу, которая призвана объединить представителей канадских территорий и медицинского сообщества.[Globe & Mail] Однако участие является добровольным, и некоторые провинции Канады уже отклонили приглашение к участию. [Globe & Mail] Еще предстоит проделать большую работу по обеспечению выполнения рекомендаций органов по правам человека, включая расследование и устранение заявленных случаев принудительной стерилизации.
Последние международные достижения в области принудительной стерилизации
Стерилизация, проводимая без осознанного согласия, нарушает права человека на достоинство, гуманное обращение, здоровье, семью, информацию, неприкосновенность частной жизни и, в частности, на свободное определение количества детей и интервалов между их рождениями.Принудительная стерилизация лишает человека способности к воспроизводству, как правило, навсегда и необратимо. В некоторых случаях правительства разрешают эти процедуры, например, когда национальное законодательство требует от трансгендеров пройти стерилизацию в обмен на официальное признание их гендерной идентичности. В других случаях правительствам не удается предотвратить принудительную стерилизацию посредством надлежащего надзора и регулирования; и во многих местах правительства продолжают отказывать в возмещении оставшимся в живых, в том числе стерилизованным в соответствии с предшествующей политикой евгеники и контроля над населением.
За последние три года региональные и универсальные суды по правам человека и контролирующие органы все чаще рассматривали принудительную стерилизацию как нарушение прав человека и подчеркивали, как принудительная стерилизация влияет на уязвимые или маргинализованные группы. См. IJRC, Развитие международного права прав человека.
В 2016 году Межамериканский суд по правам человека в деле И.В. против Боливии , постановил, что стерилизация заявительницы Боливией сразу после ее родов без предварительного получения ее предварительного информированного согласия представляет собой нарушение прав заявителя, в том числе на свободу от бесчеловечного обращения, свободу, надлежащую правовую процедуру, честь и достоинство, частную и семейная жизнь, свобода выражения мнения, судебная защита, свобода от гендерного насилия и доступ к средствам правовой защиты. См. I / A Court H.R., I.V. против Боливии . Предварительные возражения, существо дела, возмещение ущерба и затраты. Решение от 30 ноября 2016 года. Серия C № 329. IJRC вмешалась в это дело в деле amicus curiae , представленном совместно с Международной клиникой по правам человека при университете Санта-Клары. [IJRC]
В своем решении от 2017 года по делу AP, Гарсон и Нико против Франции Европейский суд по правам человека постановил, что французское требование о том, чтобы трансгендеры прошли процедуру стерилизации или другое медицинское лечение перед изменением гендерной идентичности в их свидетельствах о рождении, нарушает их право на уважение частной жизни. См. ЕСПЧ, A.P., Гарсон и Нико против Франции , н. 79885/12 52471/13 52596/13, Решение от 6 апреля 2017 года. Европейский комитет по социальным правам обнаружил, что аналогичное требование в Чешской Республике нарушает Европейскую социальную хартию. См. ECSR, Transgender Europe and ILGA-Europe v. Czech Republic , жалоба № 117/2015, Решение по существу, 15 мая 2018 г.
Кроме того, в 2017 году Африканская комиссия по правам человека и народов в своем Замечании общего порядка №4 подтвердили, что принудительная стерилизация — это акт сексуального или гендерного насилия, который может быть приравнен к пыткам или бесчеловечному обращению. См. ACommHPR, Замечание общего порядка № 4 об Африканской хартии прав человека и народов: право на возмещение ущерба для жертв пыток и других жестоких, бесчеловечных или унижающих достоинство видов наказания или обращения (статья 5) (2017), п. . 58.
На универсальном уровне в последние годы несколько договорных органов по правам человека рассмотрели вопрос о принудительной стерилизации.Комитет ООН по экономическим, социальным и культурным правам в своем Замечании общего порядка № 22 от 2016 года назвал законы, требующие стерилизации для юридического признания гендерной идентичности, нарушением обязательства государств уважать право на сексуальное и репродуктивное здоровье. См. CESCR, Замечание общего порядка № 22 о праве на сексуальное и репродуктивное здоровье (статья 12 Международного пакта об экономических, социальных и культурных правах) (2016), п. 30. И Комитет ООН по правам инвалидов, и Специальный докладчик по вопросу о пытках подтвердили, что практика насильственной стерилизации может представлять собой жестокое, бесчеловечное или унижающее достоинство обращение. См. КПИ, Замечание общего порядка № 3 о женщинах и девочках-инвалидах (2016), п. 32; Отчет Специального докладчика по вопросу о пытках и других жестоких, бесчеловечных или унижающих достоинство видах обращения и наказания , 5 января 2016 г., UN Doc. A / HRC / 31/57, пункт. 45.
Кроме того, Независимый эксперт по вопросам сексуальной ориентации и гендерной идентичности в отчете за 2018 год обратил внимание на насилие в отношении трансгендеров в медицинских учреждениях и призвал государства запретить «стерилизацию и другие принудительные медицинские процедуры, применяемые к лесбиянкам, геям, бисексуалам, транс и гендерно неконформные люди. См. Отчет независимого эксперта по защите от насилия и дискриминации на основе сексуальной ориентации и гендерной идентичности , 11 мая 2018 г., UN Doc. A / HRC / 38/43, п. 100.
Кроме того, в 2018 году Специальный докладчик по вопросу о правах инвалидов сослался на доказательства того, что «стерилизация женщин и девочек с умственными и психосоциальными расстройствами продолжает иметь место», и призвал государства «гарантировать, что здоровье — услуги и программы по уходу включают правозащитный подход к инвалидности, являются недискриминационными, требуют информированного согласия перед любым лечением, уважают частную жизнь и свободны от пыток или других жестоких, бесчеловечных или унижающих достоинство видов обращения. См. Доклад Специального докладчика по правам инвалидов , 16 июля 2018 г., UN Doc. A / 73/161, пункты. 40, 74 (3).
Дополнительная информация
Комиссия CSW по положению женщин, которая собирается каждый март в Нью-Йорке, является директивным органом, состоящим из 45 государств-членов ООН. Ежегодно Комиссия делает согласованные выводы по приоритетным темам, которые включают конкретные рекомендации, которые должны выполняться правительствами, межправительственными органами и всеми другими соответствующими заинтересованными сторонами.Организации гражданского общества с консультативным статусом ЭКОСОС могут подавать письменные заявления перед сессией CSW и делать устные заявления во время сессии. См. CSW, Возможности НПО обратиться в Комиссию. Комиссия посредством своей Процедуры коммуникации также принимает жалобы, касающиеся предполагаемых нарушений прав человека, которые она рассматривает и использует, чтобы помочь «выявить новые тенденции и модели несправедливости».
Для получения дополнительной информации о правах женщин в соответствии с международным правом, принудительной стерилизации или принудительной стерилизации женщин из числа коренных народов в Канаде посетите сайт Интернет-ресурсов IJRC.Чтобы быть в курсе новостей международного права в области прав человека, посетите раздел новостей IJRC или подпишитесь на IJRC Daily .
Дела Мексики и Бразилии в JSTOR
Abstract
Двумя наиболее яркими характеристиками противозачаточной практики в современном мире являются широкий разброс в схемах использования в разных странах и тенденция к сохранению или сужению распределения использования по методам, даже по мере появления новых методов. Аргумент, выдвинутый в этой статье, состоит в том, что склонность к использованию ограниченного набора методов является результатом положительной обратной связи в процессе выбора контрацепции и следует логике зависимости от пути.Положительная обратная связь в значительной степени обусловлена социальным взаимодействием между поставщиками и пользователями методов контрацепции. Сохранение устаревших режимов контрацепции иллюстрируется опытом Мексики и Бразилии. В каждом случае утверждается, что условия, события и политика на ранней стадии процесса усыновления оказали определяющее влияние на противозачаточную практику, преобладающую в конце 1990-х годов.
Journal Information
Основанный в 1975 году, журнал Population and Development Review направлен на углубление знаний о взаимосвязи между народонаселением и социально-экономическим развитием и предоставляет форум для обсуждения связанных вопросов государственной политики.Сочетая удобочитаемость со стипендией, журнал опирается на высокий уровень знаний в области социальных наук — в области экономики, антропологии, социологии и политологии — чтобы предлагать сложные идеи, провокационный анализ и критические идеи. Каждый выпуск включает в себя живую коллекцию рецензий на книги и раздел архивов, в котором освещаются исторические сочинения, находящие отклик в современных демографических дискуссиях.
Также доступны приложения к журналу.
Информация для издателя
Совет по народонаселению проводит исследования для решения важнейших вопросов здоровья и развития.Наша работа позволяет парам планировать свою семью и намечать свое будущее. Мы помогаем людям избежать заражения ВИЧ и получить доступ к жизненно важным услугам в связи с ВИЧ. И мы даем девочкам возможность защитить себя и сказать свое слово в своей жизни.
Принудительная стерилизация в 50 штатах Америки
Евгеника: обязательная стерилизация в 50 штатах Америки
Лутц Кельбер, доцент социологии, Вермонтский университет
Презентация о «евгенической стерилизации» в сравнительной перспективе на Ассоциации истории социальных наук 2012: 1, 2.
Американская евгеника
относится, в частности, к
законы об обязательной стерилизации
принят более чем в 30 штатах, что привело к более чем 60 000 стерилизаций
из
инвалиды. Многие из этих людей были стерилизованы
так как
из
инвалидность: они были умственно
инвалид или больной, или принадлежал
социально
обездоленные группы, живущие на обочине общества.
Американские евгенические законы
а также
практики, внедренные в первые десятилетия двадцатого века
под влиянием
гораздо более масштабная национал-социалистическая программа принудительной стерилизации,
который
между 1934 и 1945 гг. привело к примерно 350 000 обязательных
стерилизация
и был ступенькой к Холокосту.Даже после подробностей
нацистский
программа стерилизации (а также ее роль в качестве предшественника
Убийства «эвтаназии») стали более широко
известен после Второй мировой войны (и который New
York Times подробно и подробно рассказал о
четный
до его внедрения в 1934 г.), стерилизации
в некоторых
Американские штаты не остановились. Некоторые штаты продолжали стерилизовать
жители в
1970-е годы.
В то время как Германия приняла важные
шаги в ознаменование
ужасы своего прошлого, включая принудительную стерилизацию (однако
с опозданием), в Соединенных Штатах, когда дело доходит до
к
евгеника.По некоторым штатам достоверных исследований по-прежнему не хватает.
что
показать, как и где произошла стерилизация. Больницы, приюты и
Другие
места, где проводилась стерилизация, до сих пор обычно выбирались
не документировать
что
аспект их истории. Более того, до сих пор ни разу не было
веб-сайт с легко доступным обзором американских
евгеника для всех
Американец
состояния.
Этот сайт предоставляет такой обзор.
Для каждого штата для
какая информация доступна (см. ниже), есть короткий счет
от числа жертв
(по разным данным
источники),
известный период, в течение которого
стерилизация
произошла временная картина
стерилизации и скорости
стерилизация,
принятие закона (ов), группы, указанные в законе,
предписанный
процесс
закон, провоцирующие факторы
и процессы, которые привели к
программа стерилизации,
группы, подвергшиеся преследованию и жертвы,
другие ограничения на
те
установленным законом или инвалидами в целом, крупными
сторонники государства
евгенический
стерилизация, «кормушка»
учреждения »и учреждения, где
была проведена стерилизация, и
оппозиция
стерилизации.Краткая библиография
также предоставляется.
Пока этот исследовательский проект был
изначально предназначался для краткой отчетности по каждому штату, он
быстро вышла за рамки этой цели. Для тех штатов, для которых подробно
доступны монографические исследования, они просто обобщают существующие
стипендия, но для других государств, для которых такая информация не
легкодоступный, он устанавливает основные параметры, в пределах которых
проводились государственные евгенические стерилизации. В рамках этого
изучить текущее состояние помещений, в которых проводится стерилизация.
произошло или то, что служило питающим учреждением, адресовано.
Это исследование привело к
облегчить один конкретный кусок
информация, которая может
не быть
известно даже специалистам в данной области. В нацистской Германии во время
пик
годы
стерилизации между 1934 и 1939 годами, примерно 75-80
стерилизация
происходит в год на 100 000 жителей. В Делавэре во время пика
период стерилизации (поздний
С 1920-х до конца 1930-х годов), показатель составлял 18, примерно от четверти до одной пятой
Германии в пиковый период, или половина
Баварии в 1936 году. [1] Хотя
в
разница в
уровень стерилизации для тоталитарного режима с федеральным
закон о стерилизации в ближайшее время для совершения массового убийства на исторически сложившейся
беспрецедентный масштаб и
демократически управляемое государство в демократической нации остается
значительный, [2]
Это
намного меньше, чем можно было бы ожидать.
Взносы в этот проект были
сделанный второкурсником
награждает студентов
Университет Вермонта в рамках курса с отличием по
Инвалидность
как отклонение. Эти студенты составили первичные счета, которые были
затем отредактировал и исправил Лутц
Кельбер, юрист
Профессор
Социология, Университет Вермонта, который несет полную ответственность за
его содержание и любые ошибки или
упущения. Исследования, которые
вошел в этот проект был
частично поддерживается грантами Колледжа искусств и наук
Кабинет декана
и Центр преподавания и обучения, а также на средства
Колледж с отличием Университета Вермонта.
Обновление 2011 г .:
Новая группа
студенты
в колледже с отличием Университета Вермонта вместе с
студенты старшего курса социологии взяли на себя проект
пересмотр и обновление веб-страниц всех существующих штатов. Этот проект был
началось осенью 2010 г. и завершилось весной 2011 г.
рассматриваемая литература была расширена за счет включения многих
бакалаврские, магистерские и докторские диссертации в различных учреждениях,
а также новейшую доступную научную литературу и
журналистские репортажи.Информация в Интернете также была обновлена.
Примечание: здесь не рассматривается
спорная тема стерилизации
коренных американцев
в 1970-х годах, что, по некоторым данным, привело к увеличению стерилизации.
среди женщин детородного возраста более 25%. Студент в моем независимом
Изучение
Конечно, написал статью по этой теме (здесь).
Комментарии или вопросы? Электронная почта:
Ссылка на преступления «евгеника» и нацистская «эвтаназия»
страница шлюза.
Рассказы об этом сайте и проекте: УВМ Сегодня, 04.03.2009; Honors College Newletter, 24.03.2009
____________________________________________
[1]
Расчеты на основе имеющихся данных о населении.Для Баварии
номер
о стерилизации см. Макс Шпиндлер, Дитер Альбрехт и Алоис Шмид,
ред. 2003. Handbuch der
bayerischen Geschichte.
Мюнхен: Бек, стр. 551-2. Для дополнительного сравнения: канадский
в провинции Альберта в пиковый период
евгенической стерилизации между 1929 и 1939 годами (Грекул, Яна, Харви
Krahn и Дэйв Одинак. 2004. «Стерилизация слабоумных»:
Евгеника в Альберте, 1929-1972 гг. »Журнал
исторической социологии 17, 4, с. 377).
[2] Отдельно
из-за своей связи с генодической политикой нацистская политика стерилизации остается
уникальный постольку, поскольку «только здесь принуждение применялось так последовательно;
нигде больше не существовало бюрократии, которая была бы столь всеобъемлющей и
эффективен в своей расовой гигиене; и только здесь евгеника была
теоретически и практически интегрированы в централизованную и
институционализированная расовая политика »(Майкл Шварц.2008. »
Eugenik und ‘Euthanasie’: Die
internationale Debatte und Praxis bis 1933/45 «.
В Тдличе
Medizin im Nationalsozialismus: Von der Rassenhygiene zum Massenmord,
изд. Клаус-Дитмар Хенке. Кельн: Bhlau, p. 90).
Биологическое состояние: нацистская расовая гигиена, 1933–1939
Нацизм был «прикладной биологией», — заявил депутат Гитлера Рудольф Гесс. Во времена Третьего рейха политически крайняя, антисемитская разновидность евгеники определила курс государственной политики.Режим Гитлера рекламировал «нордическую расу» как свой евгенический идеал и пытался превратить Германию в сплоченное национальное сообщество, исключающее всех, кого считали наследственно «менее ценными» или «расово иностранными».
Меры общественного здравоохранения по контролю над воспроизводством и браком, направленные на укрепление «национального тела» путем устранения у населения биологически опасных генов. Многие немецкие врачи и ученые, которые поддерживали идеи расовой гигиены до 1933 года, восприняли акцент нового режима на биологии и наследственности, новые возможности карьерного роста и дополнительное финансирование исследований.
Диктатура Гитлера, подкрепленная широкими полномочиями полиции, заставила замолчать критиков нацистской евгеники и сторонников прав личности. После того, как все образовательные и культурные учреждения и средства массовой информации попали под контроль нацистов, расовая евгеника проникла в немецкое общество и институты. Евреи, которых считали «чужими», были изгнаны из университетов, научно-исследовательских институтов, больниц и органов здравоохранения. Та же участь постигла и высокопоставленных лиц, считавшихся политически «ненадежными».
Битва за рождений
Вторя непрекращающимся евгеническим страхам, нацисты трубили о предупреждениях демографических экспертов о «национальной смерти» и стремились обратить вспять тенденцию к падению рождаемости. Закон о семейном здоровье от октября 1935 г. запрещал союзы между «наследственно здоровыми» и лицами, признанными генетически непригодными. Вступление в брак и рождение детей стало национальным долгом для «расово подходящих». В речи 8 сентября 1934 года Гитлер заявил: «В моем государстве мать — самая важная гражданка.”
Евгеники выразили обеспокоенность по поводу воздействия алкоголя, табака и сифилиса. Нацистский режим спонсировал исследования, проводил кампании по просвещению населения и принимал законы, которые в совокупности были направлены на устранение «генетических ядов», связанных с врожденными дефектами и генетическим повреждением для последующих поколений. В 1936 году было создано Центральное управление Рейха по борьбе с гомосексуализмом и абортами, чтобы активизировать усилия по предотвращению действий, препятствующих воспроизводству. В речи 1937 года, связывающей гомосексуальность с падением рождаемости, шеф полиции Германии Генрих Гиммлер заявил: «Люди хорошей расы, у которых слишком мало детей, имеют билет в один конец в могилу.”
Программа массовой стерилизации
14 июля 1933 года нацистская диктатура осуществила давние мечты сторонников евгеники, приняв Закон о предотвращении генетических заболеваний потомства, основанный на законе о добровольной стерилизации, разработанном прусскими чиновниками здравоохранения в 1932 году. Новый нацистский закон был в соавторстве с Фальком Руттке, юристом, Артуром Гюттом, врачом и директором по вопросам общественного здравоохранения, и Эрнстом Рюдином, психиатром и одним из первых лидеров немецкого движения за расовую гигиену.Лицами, подпадающими под действие закона, были те мужчины и женщины, которые «страдали» от любого из девяти состояний, которые считались наследственными: слабоумие, шизофрения, маниакально-депрессивное расстройство, генетическая эпилепсия, хорея Хантингтона (смертельная форма деменции), генетическая слепота. , генетическая глухота, тяжелые физические уродства и хронический алкоголизм.
Специальные суды по наследственным вопросам здоровья придавали стерилизацию ауру надлежащей правовой процедуры, но решение о стерилизации в целом было обычным делом.Почти все известные генетики, психиатры и антропологи в то или иное время заседали в таких судах, требуя стерилизации примерно 400 000 немцев. Вазэктомия была обычным методом стерилизации для мужчин, а для женщин — перевязкой маточных труб — инвазивной процедурой, в результате которой погибли сотни женщин.
Просмотры из-за границы
Международная реакция на нацистский закон о стерилизации была разной. В США некоторые редакторы газет отмечали массовость этой политики и опасались, что «гитлеровцы» применит закон к евреям и политическим оппонентам.Напротив, американские евгеники рассматривали закон как логическое развитие более раннего мышления «лучших специалистов» Германии, а не как «поспешную импровизацию гитлеровского режима».
В 1930-х годах ведущие американские и британские генетики все чаще критиковали устоявшиеся евгенические организации за свободное смешение предрассудков с устаревшим и упрощенным пониманием человеческой наследственности. В то же время стерилизация получила поддержку не только в евгенических кругах, но и как средство снижения затрат на лечение в учреждениях и помощь бедным.Уровень стерилизации вырос в некоторых американских штатах во время Великой депрессии, и в тот же период в Финляндии, Норвегии и Швеции были приняты новые законы. В Великобритании католическая оппозиция заблокировала предложенный закон. Нигде количество стерилизованных не приблизилось к массовым масштабам нацистской программы.
Сегрегация евреев
Стерилизация этнических меньшинств, определенных как «расово чуждые», не предусмотрена законом 1933 года. Вместо этого «Закон о защите крови», объявленный в Нюрнберге 15 сентября 1935 года, криминализировал брак или сексуальные отношения между евреями и немцами-неевреями.Вскоре после этого нацистские лидеры сделали шаг вперед в биологической сегрегации, в частном порядке обсуждая «полную эмиграцию» всех евреев как цель. После присоединения Австрии в марте 1938 года (аншлюс) , офицер СС Адольф Эйхман координировал вынужденную эмиграцию десятков тысяч австрийских евреев. Организованные нацистами нападения на немецких и австрийских евреев и еврейскую собственность 9–10 ноября 1938 года — Хрустальная ночь — убедили многих евреев, оставшихся в Рейхе, в том, что уезжать из страны — это единственный способ выжить.
Авторы):
Мемориальный музей Холокоста США, Вашингтон, округ Колумбия
.

 ч. полиомиелит), коронавирусной, респираторно-синтициальной, риновирусной, ротавирусной инфекции и др.)
ч. полиомиелит), коронавирусной, респираторно-синтициальной, риновирусной, ротавирусной инфекции и др.) Деконтаминация изделий
Деконтаминация изделий  Стерильное изделие медицинского назначения
Стерильное изделие медицинского назначения Физическое стерилизующее (дезинфицирующее) средство
Физическое стерилизующее (дезинфицирующее) средство Механизированный способ предстерилизационной очистки изделий медицинского назначения
Механизированный способ предстерилизационной очистки изделий медицинского назначения Термический метод стерилизации
Термический метод стерилизации