Стерилизация (микробиология)
Стерилиза́ция — полное освобождение какого-либо предмета от всех видов микроорганизмов, включая бактерии и их споры, грибы, вирионы, а также от прионного белка, находящихся на поверхностях, оборудовании, в пищевых продуктах и лекарствах. Осуществляется термическим, химическим, радиационным, фильтрационным методами.
Применение
Пищевые продукты
С давних времен частичная стерилизация пищи обеспечивалась за счет тщательной тепловой обработки во время приготовления. Нагревание пищи и воды позволяло снизить число случаев инфекционных заболеваний, увеличивая продолжительность жизни и трудоспособного возраста. Консервирование продуктов в герметичной упаковке стало логическим продолжением этого подхода к сохранению пищи.
Медицина
В медицине под стерилизацией понимается микробная деконтаминация неживых объектов. Принцип асептики предполагает исключение контакта пациента с поверхностями контаминированными условно-патогенной или даже патогенной микрофлорой. С этой целью стерилизовались скальпели, иглы и другой хирургический инструмент. Также стерилизация играет важную роль в производстве парентеральных препаратов.
С этой целью стерилизовались скальпели, иглы и другой хирургический инструмент. Также стерилизация играет важную роль в производстве парентеральных препаратов.
Нагревание медицинских инструментов было известно ещё в Древнем Риме, но было забыто в Средние века, что привело к резкому росту числа осложнений и летальности после хирургических операций.
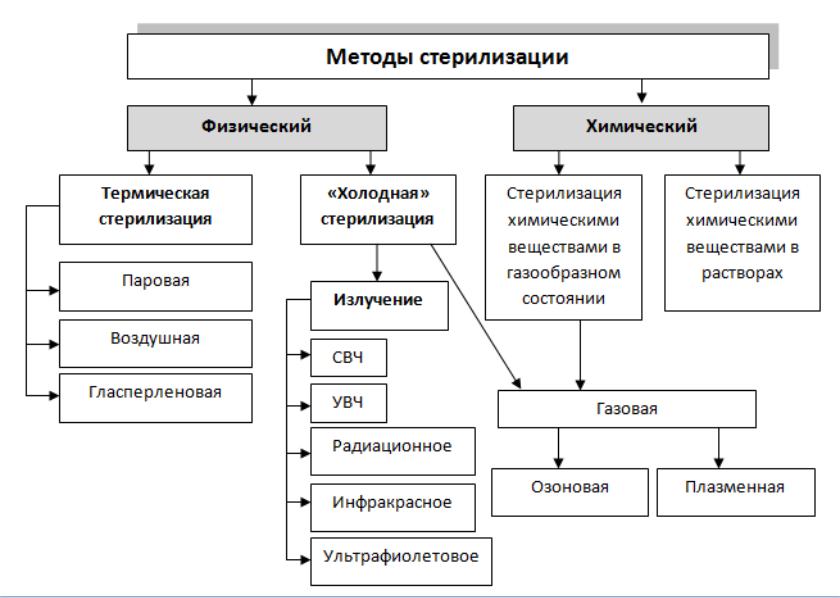
Методы стерилизации
- Термическая: паровая и воздушная (сухожаровая).
- Химическая: газовая или химическими растворами (стерилянтами)
- Радиационная стерилизация — применяется в промышленном варианте
- Метод мембранных фильтров — применяется для получения небольшого количества стерильных растворов, качество которых может резко ухудшиться при действии других методов стерилизации(бактериофаг, селективные питательные среды, антибиотики)
Термические методы стерилизации
Преимущества термических методов стерилизации:
- Надёжность
- Отсутствие необходимости удаления стерилянтов с предметов медицинского назначения
- Удобство работы персонала
- Стерилизация проводится в упаковках, что позволяет сохранить стерильность некоторый период времени.

Паровая стерилизация
Осуществляется подачей насыщенного водяного пара под давлением в паровых стерилизаторах (автоклавах).
Паровая стерилизация под давлением считается наиболее эффективным методом, так как чем выше давление, тем выше температура пара, стерилизующего материал; бактерицидные свойства пара выше, чем воздуха, поэтому для стерилизации применяют пересыщенный пар.
Паровой стерилизации подвергают изделия из текстиля (бельё, вату, бинты, шовный материал), из резины, стекла, некоторых полимерных материалов, питательные среды, лекарственные препараты.
Режимы паровой стерилизации
132 °C — 2 атмосферы(2 кгс/см2) — 20 минут — основной режим. Стерилизуют все изделия (стекло, металл, текстиль, кроме резиновых).
120 °C — 1,1 атмосфера(1,1 кгс/см2) — 45 минут — щадящий режим (стекло, металл, резиновые изделия, полимерные изделия — согласно паспорту, текстиль)
110 °C — 0,5 атмосферы(0,5 кгс/см2) — 180 мин — особо щадящий режим (нестойкие препараты, питательные среды)
Упаковочные материалы при паровой стерилизации:
- Стерилизационная коробка (бикс) простая.
 Срок хранения 3 суток после стерилизации.
Срок хранения 3 суток после стерилизации. - Стерилизационная коробка (бикс) с фильтром. Срок хранения 20 суток после стерилизации.
- Крафт-пакеты со скрепками. Срок хранения — трое суток после стерилизации.
- Крафт-пакеты заклеивающиеся. Срок хранения — 20 суток после стерилизации.
- Ткань (бязь — КРОМЕ МАРЛИ). Срок хранения — трое суток после стерилизации.
- Комбинированные упаковки (прозрачная синтетическая плёнка + бумага) (дгм стеригард). Срок хранения от 180 суток до 720 суток.
Тиндализация — способ стерилизации, предложенный Дж. Тиндалем.
Заключается в дробной обработке жидкостей и пищевых продуктов в текучем паре при 100°С или при трёх — четырёхкратном нагревании их до 100—120°С с промежутками в 24 ч.
За это время споры бактерий, выжившие при 100°С, прорастают, и вышедшие из них вегетативные клетки бактерий погибают при последующем нагревании.
Применение:
Стерилизация лекарственных препаратов, а также для так называемого горячего консервирования пищевых продуктов в специальных аппаратах с терморегуляторами.
Химические методы стерилизации
Используются при обработке приборов, аппаратов, сложных оптических систем, крупногабаритных изделий или изделий из титана, полимерных смол, резин.
Для газовой (холодной) стерилизации используют герметичные контейнеры с парами окиси этилена, формальдегида или специализированными многокомпонентными системами.
Для химической стерилизации растворами применяются основных четыре группы веществ:
- Кислота+окислитель (например «Первомур»)
- Альдегид (например формалин)
- Детергент (например хлоргексидина биглюконат)
- Галоид (например Повидон-йод)
Концентрации и время стерилизации зависит от используемого антисептика или дезинфектанта.
Стерилизация ионизирующим излучением
- радиационный метод или лучевую стерилизацию γ-лучами применяют в специальных установках при промышленной стерилизации однократного применения — полимерных шприцев, систем переливания крови, чашек Петри, пипеток и других хрупких и термолабильных изделий.

- Ряд лет в фармтехнологии для стерилизации используется ультрафиолетовое (УФ) (длина волны 253,7 нм). Источники УФ-излучения — ртутные кварцевые лампы. Их мощное бактериостатическое действие основано на совпадении спектра испускания лампы и спектра поглощения ДНК микроорганизмов, что может является причиной их гибели при длительной обработке излучением кварцевых ламп. При недостаточно мощном действии УФ в прокариотической клетке активизируются процессы световой и темновой репарации и клетка может восстановиться. Метод применяется для стерилизации воздуха приточно-вытяжной вентиляции, оборудования в биксах, также для стерилизации дистиллированной воды.
Источник wikipedia. org
| < Предыдущая | Следующая > |
|---|
Стерилизация: понятие, методы, режимы, виды стерилизаторов. Документы, регламентирующие способы стерилизации.
Технологическая карта практического занятия
ПМ. 04 Выполнение работ по должности «Младшая медсестра по уходу за больными»
04 Выполнение работ по должности «Младшая медсестра по уходу за больными»
МДК 04.02. Безопасная среда для пациента и персонала
Специальность: 34.02.01 «Сестринское дело»
Курс: 2 Семестр: 3
Тема: Стерилизация: понятие, методы, режимы, виды стерилизаторов. Документы, регламентирующие способы стерилизации.
Преподаватель _________________________ Продолжительность 270 минут
Цели учебного занятия:
Образовательная: сформировать знания по вопросам проведения стерилизации объектов термическими методами; обучить правилам работы и режимам стерилизации на паровом и воздушном стерилизаторах
Развивающая: способствовать развитию у студентов мышления, познавательной самостоятельности
Воспитательная: воспитывать ответственность за безопасную среду для пациента и персонала
По итогам занятия студент должен:
знать: содержание нормативной документации по проведению стерилизации; правила проведения стерилизации инструментария многоразового использования в автоклавах и сухожаровых шкафах
уметь: подготовить медицинский инструментарий и перевязочный материал для дальнейшей стерилизации
иметь практический опыт: обеспечения санитарных условий в учреждениях здравоохранения; соблюдения требований техники безопасности при работе с химическими средствами
Оснащение: технические средства обучения: устройства для прослушивания и визуализации учебного материала, перчатки, 6% раствор перекиси водорода, биксы, инструменты, салфетки, выписки из приказов № 720, №408, СанПиН от2010г. Электронно-учебный модуль по теме: «Стерилизация». Схемы, таблицы.
Электронно-учебный модуль по теме: «Стерилизация». Схемы, таблицы.
Образовательные технологии: технология модульного обучения, проблемного обучения, технология практико-ориентированного обучения.
Методы и приемы обучения: самостоятельная работа, объяснение, практическая работа, беседа, сравнение, демонстрация (слайдов, таблиц, плакатов, моделей и макетов).
Средства обучения:
Учебно-наглядные и натуральные пособия, раздаточный материал: таблицы, плакаты, методические указания.
Технические средства обучения: устройства для прослушивания и визуализации учебного материала, перчатки, 6% раствор перекиси водорода, биксы, инструменты, салфетки, выписки из приказов № 720, №408, СанПиН от 2010г, электронно-учебный модуль по данной теме.
Литература:
Основные источники:
Обуховец Т.
 П. Сестринское дело и сестринский уход: учебное пособие/Т.П.Обуховец.-М.; КНОРУС, 2017.-680с.
П. Сестринское дело и сестринский уход: учебное пособие/Т.П.Обуховец.-М.; КНОРУС, 2017.-680с.Обуховец Т.П. Основы сестринского дела: практикум: учебное пособие /Т.П.Обуховец – Ростов-на-Дону.: Феникс, 2016.-685с.
Дополнительные источники:
Манипуляции в сестринском деле: учебное пособие/ Под общей ред. А.Г.Чижа. – Изд. 5-е – Ростов н/Д. «Феникс», 2013. – 318с.
Морозова Г.И. Основы сестринского дела: Ситуационные задачи: учебное пособие/ Г.И.Морозова.- М.:ГЭОТАР-Медиа.2013.-240с.
Мухина С.А., Тарновская И.И. Практическое руководство к предмету «Основы сестринского дела»: учебное пособие/ Мухина С.А., Тарновская И.И. – 2-е изд. испр. и доп.- М.:ГЭОТАР-Медиа.2013.- 512с.
Основы сестринского дела: Алгоритмы манипуляций: учебное пособие/ Н.В.Широкова и др — М.:ГЭОТАР-Медиа.2012.-160с.
Яромич И.
 В. Сестринское дело и манипуляционная техника: учебно-практическое пособие/ И.В.Яромич. Ростов н/Д. «Феникс»; Минск: Высшая школа,2012.- 568с.
В. Сестринское дело и манипуляционная техника: учебно-практическое пособие/ И.В.Яромич. Ростов н/Д. «Феникс»; Минск: Высшая школа,2012.- 568с.
Межпредметные и внутрипредметные связи: основы латинского языка с медицинской терминологией, гигиена и экология человека, здоровый человек и его окружение, анатомия и физиология человека.
Хронологическая карта занятия
№ | Этапы учебного занятия | Время (минуты) |
1. | Организационный момент. | 3 |
2. | Постановка целей, начальная мотивация и актуализация. | 5 |
3. | Определение исходного уровня знаний. | 30 |
4. | Вводный инструктаж. | 20 |
5. | Самостоятельная работа. | 170 |
6. | Заключительный инструктаж. | 10 |
7. | Заполнение дневников и др. | 20 |
8. | Подведение итогов. | 5 |
9. | Задания для самостоятельной работы студентов. | 2 |
10. | Уборка рабочего места. | 5 |
Контроль исходного уровня знаний:
Назовите этапы обработки медицинского инструментария.
С какой целью проводится дезинфекция, основные методы?
Как осуществляется предстерилизационной очистка медицинского инструментария многоразового использования?
Назовите правила проведения азопирамовой пробы.
Что такое «стерилизация», цель ее проведения?
Какие методы стерилизации существуют?
Назовите документы, регламентирующие способы стерилизации.
Самостоятельная работа на занятии:
Изучение цели и методов стерилизации.
Изучение воздушного метода стерилизации: режимы, правила загрузки инструментария, сроки стерильности.

Изучение парового метода стерилизации: режимы, способы укладки в биксы, сроки стерильности биксов.
Изучение химического метода стерилизации: растворы, экспозиция, сроки стерильности.
Изучение газового и радиационного методов стерилизации: преимущества и недостатки.
Зачетная манипуляция:
__________________________________________________________________________
Заполнение дневников:
Составление схемы «Методы стерилизации».
Домашнее задание:
Тема: «Стерилизация».
Тесты по теме «Стерилизация».
Вариант 1.
Метод контроля стерильности:
а) визуальный
б)бактериологический
в)физический
г)фармакологический
Аппарат, применяемый для стерилизации перевязочного материала:
а) термостат
б)автоклав
в)сухожаровой шкаф
г)стерилизатор
Для контроля стерильности в паровом стерилизаторе применяют:
а)сахарозу, ИС-160
б)бензойную кислоту, ИС-120
в)янтарную кислоту,ИС-180
г)винную кислоту, ИС-160
При стерилизации горячим воздухом используется температура:
а) 120
б) 180
в) 132
г) 100
Хранить изделия медицинского назначения после стерилизации 6% р-ром перекиси водорода необходимо в:
а)плотно закрытой стерильной емкости
б)фурацилине
в)спирте
г)хлорамине
Длительность использования накрытого стерильного стола (в часах):
а) 24
б) 8
в)12
г) 6
ЦСО – это:
а)центральное специализированное отделение
б)централизованное стерилизационное отделение
в)централизованное специализированное отделение
г)централизованное стерильное отделение
Экспозиция при стерилизации белья в автоклаве (в мин.
 )
)
а) 40
б)30
в)20
г)45
Для стерилизации одноразовых изделий медицинского назначения в промышленности используется:
а) УФ-излучение
б)стерилизацию текучим паром
в) гамма-излучение
г)термические методы стерилизации
В биксе с фильтром содержимое считается стерильным в течение (в сутках)
а)20
б)3
в)1
г)7
Полное уничтожение микроорганизмов и их спор называется:
а) дезинсекцией
б) стерилизации
в) дезинфекцией
г)дератизацией.
Режим стерилизации инструментов в автоклаве:
а) Т=100 С, давление 1,1 атм, время 120 минут.
б)Т=180 С, давление 2 атм, время 60 минут.
в)Т=140 С, давление 1 атм, время 45 минут.
г)Т=132 С, давление 2 атм, время 20 минут.
Стерилизация стеклянной лабораторной посуды обычно проводится
а) в стерилизаторе
б) в термостате
в) в сухожаровом шкафу
г) в 6% растворе перекиси водорода
Вариант 2.
Наиболее надежный метод контроля стерилизации:
а) визуальный
б) химический
в)физический
г) биологический
При стерилизации водяным паром перевязочного материала используется давление (в атм):
а) 4
б) 3
в) 2
г) 1
Длительность сохранения стерильности в биксе без фильтра( в часах):
а) 72
б) 48
в) 24
г) 12
При паровой стерилизации в качестве упаковочного материала применяется:
а) бумага обычная
б) шелковая ткань
в) марля
г) бязь
Режим стерилизации перчаток в автоклаве:
а) Т=132, давление 2 атм, 45 мин.
б)Т=132 С, давление 2 атм, время 10 минут.
в)Т=120 С, давление 1,1 атм, время 45 минут.
г)Т=120 С, давление 0,5 атм, время 20 минут.
Для контроля температуры в воздушном стерилизаторе применяют:
а) серу, ИС-120
б) бензойную кислоту, ИС-120
в) янтарную кислоту, ИС-180
г) никотинамид, ИС-132
Для стерилизации инструментов применяется перекись водорода
а) 6%
б) 3%
в) 1%
г)33%
Стерилизация шприцев многоразового использования обычно проводится в:
а) термостате
б) стерилизаторе
в) сухожаровом шкафу
г) в растворе 6% перекиси водорода
Для контроля качества стерилизации в воздушном стерилизаторе применяют:
а) термические индикаторы
б) химические индикаторы
в) термовременные индикаторы
г) физические индикаторы
Наиболее широко применяемый метод стерилизации:
а) радиационный
б) физический
в) химический
г) газовый
В целевую укладку не входит:
а) халат
б) маска
в) бахилы
12. Экспозиция при стерилизации инструментов в 6% р-ре перекиси водорода комнатной температуры (в мин):
Экспозиция при стерилизации инструментов в 6% р-ре перекиси водорода комнатной температуры (в мин):
а) 360
б) 180
в) 90
г) 60
13. На крафт – пакете указывают:
а) дату стерилизации, отделение
б)вместимость, отделение
в)дату стерилизации, вместимость
г)дату стерилизации.
Установите соответствие
Вариант 1
Давление пара Температура стерилизации
2,2 атм А. 180 С
1,1 атм Б. 110 С
0,5 атм В. 132 С
Г. 120 С
Вариант 2
Изделия Вид стерилизации
Инструментарий А. паровой
Перевязочный материал Б. воздушный
Перчатки
Белье
Вариант 3
Стерилизация Режим
Воздушная А.
 180 С – 60 мин
180 С – 60 минпаровая (щадящий режим) Б. 160 С – 60 мин
паровая (основной режим) В. 160 С – 150 мин
Г. 1,1 атм – 132 С – 20 мин
Д. 2,0 атм – 132 С – 20 мин
Е. 1,1 атм – 120 С – 45 мин
Ситуационные задачи
Задача № 1
Вы медицинская сестра ЦСО. При проведении контроля качества предстерилизационной очистки с помощью азопирамовой пробы появилось
окрашивание реактива в фиолетовый цвет, переходящий в бурый, в течение 1 минуты.
Задание:
1.Оцените ситуацию.
2.Определите объём сестринских вмешательств.
Задача № 2
Вы медицинская сестра процедурного кабинета. При вскрытии стерилизационный коробки с универсальной укладкой обнаружили, что индикаторная лента ИС -132 не изменила свой цвет.
Задание:
1.Оцените ситуацию.
2.Определите объём сестринских вмешательств.
Задача № 3
Вы медицинская сестра операционного блока. При снятии печаток вы коснулись незащищёнными пальцами рабочей поверхности отработанной перчатки.
Задание:
1.Ваши действия
ТОГБУЗ «ГКБ им. Арх. Луки г. Тамбова»
28 ноября 2019 года операционным блоком ТОГБУЗ «ГКБ им. Арх Луки г. Тамбова» было проведено очередное занятие школы практического мастерства.
Деконтаминация – процесс удаления и уничтожения микроорганизмов с целью обезвреживания и защиты, включающий в себя очистку, дезинфекцию и стерилизацию.
Очистка – процесс, в результате которого инородные тела (микроорганизмы) удаляются с поверхности объекта. Дезинфекция – процесс, уменьшающий количество патогенных микроорганизмов, кроме бактериальных спор. Стерилизация – процесс уничтожения всех микроорганизмов, включая бактериальные споры.
Деконтаминация изделий медицинского назначения – снижение количества микроорганизмов на изделиях медицинского назначения. Поэтому очень важно правильно обеззараживать медицинские изделия. Качество дезинфекции можно оценить с помощью смывов на определение золотистого стафилококка, синегнойной палочки и бактерий группы кишечной палочки. Дезинфекция считается эффективной при отсутствии роста микроорганизмов.
Поэтому очень важно правильно обеззараживать медицинские изделия. Качество дезинфекции можно оценить с помощью смывов на определение золотистого стафилококка, синегнойной палочки и бактерий группы кишечной палочки. Дезинфекция считается эффективной при отсутствии роста микроорганизмов.
Методы очистки:
1. Механическая очистка.
2. Ручная очистка.
3. Ультразвуковая очистка.
4. Применение порошков и специальных дез. средств.
Уровни дезинфекции:
1. Высокий – уничтожение всех микроорганизмов, кроме спор бактерий.
2. Средний – уничтожение бактерий, вирусов, грибов, микобактерий туберкулеза.
3. Низкий – уничтожение большинства бактерий, отдельных видов вирусов и грибов.
Обработка медицинских инструментов включает в себя дезинфекцию, предстерилизационную очистку и собственно стерилизацию.
Средства химической дезинфекции наиболее часто используется в ЛПУ. Большинство таких средств по химическому составу можно разделить на 7 групп:
Большинство таких средств по химическому составу можно разделить на 7 групп:
– В состав галогенсодержащих веществ входят в качестве активного действующего вещества хлор, бром, йод.
– В кислородсодержащей группе препаратов действующим веществом является кислород, выделяющийся из перекиси водорода, перекисных соединений, надкислот.
– Средства на основе катионных поверхностно-активных веществ (ПАВы) представляются весьма перспективными, так как позволют совмещать дезинфекцию и предстерилизационную обработку. ПАВы не вызывают коррозию медицинских инструментов.
– Гуанидсодержащие средства созданы на основе сложных органических соединений. Они активны в отношении широкого спектра микроорганизмов.
– В состав альдегидсодержащих средств входят глутаровый или янтарный альдегид. Препараты этой группы обладают выраженным бактерицидным, вирулоцидным, фунгицидным, спороцидным действием. Вместе с тем они отрицательно действуют на макроорганизмы. Часть этих дез. средств может использоваться не только для дезинфекции, но и для стерилизации инструментария, а также для проведения дезинфекции эндоскопического оборудования по режиму ДВУ.
– Спирты. Это группа препаратов на основе этанола, пропанола, изопропанола.
– Фенолсодержащие препараты эффективны для проведения текущей и заключительной дезинфекции в очагах туберкулеза для обеззараживания биоматериала от больных.
Стерилизация. Методы стерилизации инструментов и медицинских изделий
Стерилиза́ция (иногда деконтаминация) – освобождение какого-либо предмета или материала от всех видов микроорганизмов (включая бактерии и их споры, грибы, вирусы и прионы), либо их уничтожение.
Этапы стерилизации:
1. Дезинфекция.
2. Предстерилизационная очистка.
3. Сборка, группировка,размещение.
4. Стерилизация.
5. Постстерилизационная обработка.
6. Контроль стерилизации.
7. Транспортировка и хранение.
Как проводят дезинфекцию изделий:
– Медицинские изделия погружают в дезраствор сразу же после их использования. При этом дезраствор должен полностью покрывать инструменты не менее 1 см над их поверхностью. Изделия сложной конфигурации дезинфицируют в разобранном виде. Каналы и полости изделий заполняют дезинфицирующим раствором так, чтобы в них не оставалось пузырьков воздуха.
При этом дезраствор должен полностью покрывать инструменты не менее 1 см над их поверхностью. Изделия сложной конфигурации дезинфицируют в разобранном виде. Каналы и полости изделий заполняют дезинфицирующим раствором так, чтобы в них не оставалось пузырьков воздуха.
– Хлорсодержащие средства, например, Де-Хлор, Хлорсепт, применяют в основном для дезинфекции изделий медицинского назначения из стекла, пластмассы, резины, коррозионно-стойкого материала.
– Для дезинфекции многоразового металлического инструментария рекомендуется использовать препараты, которые не вызывают коррозии.
– По окончании дезинфекционной выдержки изделия промывают.
Предстерилизационная обработка:
О качестве же дезинфекции и предстерилизационной подготовки медицинского инструментария судят по результатам постановки азопирамовой пробы. Проверке подлежит 1% изделий от партии, но не менее трех единиц.
Методы стерилизации:
– Термическая: паровая и воздушная (сухожаровая).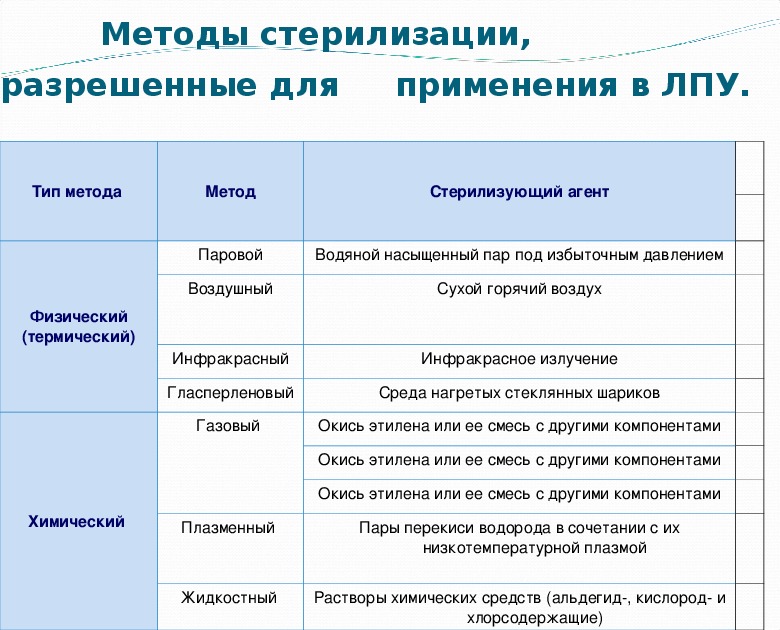
– Химическая: газовая или химическими растворами (стерилянтами).
– Плазменная и озоновая (плазмой перекиси водорода).
– Радиационная стерилизация — применяется в промышленном варианте.
– Метод мембранных фильтров — применяется для получения небольшого количества стерильных растворов, качество которых может резко ухудшиться при действии других методов стерилизации (бактериофаг, селективные питательные среды, антибиотики).
Деконтаминация включает в себя все виды уборок.
Выделяют пять видов уборки:
Предварительная уборка – ежедневно утром перед началом работы. Главной её целью является удаление осевшей за ночь пыли на горизонтальных поверхностях предметов и самой операционной. При этом сначала протирают чистой сухой ветошью полированные и никелированные поверхности мебели и оборудования. Затем влажной ветошью протирают операционные столы и завершают уборку подтиранием пола.
Текущая уборка – выполняют во время операции. Несмотря на то, что около операционного стола ставят тазик для использованного материала, на пол могут упасть салфетки, инструменты и использованное операционное бельё, их тотчас убирают в специальные ёмкости. При выполнении операции на органах живота на пол попадает содержимое брюшной полости, которое убирают чистой ветошью. После этого пол протирают дезраствором.
Несмотря на то, что около операционного стола ставят тазик для использованного материала, на пол могут упасть салфетки, инструменты и использованное операционное бельё, их тотчас убирают в специальные ёмкости. При выполнении операции на органах живота на пол попадает содержимое брюшной полости, которое убирают чистой ветошью. После этого пол протирают дезраствором.
Послеоперационная уборка – по завершении оперативного вмешательства. Она состоит в удалении из операционной всего, что использовали во время операции и не потребуется в дальнейшей работе. Меняют бельё на операционном столе, приводят в порядок состояние не стерильных столов, пополняют запасы растворов. В заключение протирают пол влажной ветошью, подготавливая таким образом помещение к следующей операции.
Заключительная уборка – ежедневно в конце рабочего дня., во время которой помимо удаления использованного материала, белья, инструментов проверяют готовность аппаратуры и различных устройств, протирают их влажной или сухой чистой ветошью. Рамы, стёкла и подоконники, светильники, мебель и калориферы центрального отопления протирают влажной ветошью. По окончании уборки операционный стол, наркозный аппарат и другую аппаратуру покрывают чистой простынёй.
Рамы, стёкла и подоконники, светильники, мебель и калориферы центрального отопления протирают влажной ветошью. По окончании уборки операционный стол, наркозный аппарат и другую аппаратуру покрывают чистой простынёй.
Плановая дезинфекция (генеральная уборка) – в конце рабочей недели в операционной и в конце месяца во всём операционном блоке.
Генеральная уборка (плановая дезинфекция), проводится в соответствии с графиком, один раз в неделю, о чем делается отметка в журнале проведения генеральных уборок. После дезинфекции помещения операционного блока и перевязочных облучают ультрафиолетовым излучением (прямым или отраженным), включая настенные или потолочные бактерицидные облучатели.
Антисептика кожи рук предусматривает применение химических веществ, обладающих антимикробным действием, предназначенных для деконтаминации микрофлоры рук. В зависимости от поставленной цели к требуемой степени деконтаминации различают: гигиеническую и хирургическую антисептику рук.
Правила обработки рук медицинского персонала и кожных покровов пациентов:
1. В целях профилактики ИСМП обеззараживанию подлежат руки медицинских работников (гигиеническая обработка рук, обработка рук хирургов) и кожные покровы пациентов (обработка операционного и инъекционного полей, локтевых сгибов доноров, санитарная обработка кожных покровов).
2. Для достижения эффективного мытья и обеззараживания рук необходимо соблюдать следующие условия: коротко подстриженные ногти, отсутствие лака на ногтях, отсутствие искусственных ногтей, отсутствие на руках колец, перстней и других ювелирных украшений. Перед обработкой рук хирургов необходимо снять также часы, браслеты и пр. Для высушивания рук применяют чистые тканевые полотенца или бумажные салфетки однократного использования, при обработке рук хирургов — только стерильные тканевые.
Стерилизация методы стерилизации | Vetera
Кошка в доме – это не только радость, но и дополнительная ответственность, ведь рано или поздно перед любым хозяином встает вопрос, будет ли пушистый член семьи размножаться или нет. Чтобы принять правильное решение, нужно предварительно взвесить все плюсы и минусы обоих вариантов, поэтому в данной статье мы собрали для вас максимум информации о том, что же такое стерилизация, достоинствах и недостатках этой процедуры и о том, когда и как ее нужно делать, если Вы приняли положительное решение.
Чтобы принять правильное решение, нужно предварительно взвесить все плюсы и минусы обоих вариантов, поэтому в данной статье мы собрали для вас максимум информации о том, что же такое стерилизация, достоинствах и недостатках этой процедуры и о том, когда и как ее нужно делать, если Вы приняли положительное решение.
Что такое стерилизация
Стерилизацией кошек называют несложную хирургическую операцию, проводимую в условиях ветеринарной клиники, при которой у животного удаляются репродуктивные органы, за счет чего детородные функции организма прекращаются и у животного исчезает полностью половое влечение к противоположному полу.
Зачем нужна эта операция, поймет, пожалуй, любой владелец кошки, который столкнулся с ее поведением после наступления половой зрелости, т. е. в 7-8-месячном возрасте. Спокойный пушистик вдруг превращается в очень шумное существо (причем зачастую еще и агрессивное), способное любого члена семьи, даже самого любящего, вывести из себя своими бесконечными концертами по ночам и мурканием. Длительность такого периода составляет от нескольких дней до 1-2 недель, в зависимости от темперамента животного. Поведение это обусловлено обычными инстинктами: таким образом кошка сообщает всем своим сородичам, что уже готова к вязке.
Длительность такого периода составляет от нескольких дней до 1-2 недель, в зависимости от темперамента животного. Поведение это обусловлено обычными инстинктами: таким образом кошка сообщает всем своим сородичам, что уже готова к вязке.
Если хозяин не имеет возможности или желания найти потенциального партнера для питомца и потом заняться пристраиванием котят, и терпеть такое поведение не хочет, зачастую и встает вопрос о стерилизации. После проведения операции в течение месяца у кошечки прекращается выработка ее женских половых гормонов, и она вновь превращается в спокойного домашнего питомца.
Альтернативой стерилизации являются таблетки, капельки либо гормональные уколы, которые временно подавляют возникновение полового возбуждения. Недостатком этого варианта является то, что это биологический стресс для животного, который рано или поздно сказывается на его здоровье, причем иногда уже в первые годы жизни. В результате появляются такие заболевания как эндометриты, пиометриты, кисты яичников, а иногда возникают и злокачественные образования. Именно из-за этого многие ветеринары рекомендуют все же произвести стерилизацию животного, а не использовать временные меры, если, конечно, вы не планируете получать потомство.
Именно из-за этого многие ветеринары рекомендуют все же произвести стерилизацию животного, а не использовать временные меры, если, конечно, вы не планируете получать потомство.
Плюсы стерилизации
Основное достоинство стерилизации очевидно – данная операция позволяет стопроцентно предотвратить появление нежелательного потомства. Проблема пристраивания котят, особенно в условиях мегаполиса, способна вывести из душевного равновесия самого спокойного человека. Избавляться от них – жестоко и негуманно, а оставлять у себя, с учетом, что кошка способна окотиться до 4 раз в год, абсолютно нереально.
Кроме того, стерилизация имеет и ряд других достоинств:
- Она позволяет избавить животное от мучений в период течки. Если квартирная кошка не имеет возможности выходить на улицу, чтобы найти себе потенциального партнера, она, как уже говорилось выше, сильно мучается. В такой период животное начинает громко мяукать, в том числе по ночам, у него пропадает аппетит, портится характер, может начать выпадать шерсть.
 При этом кошка еще и метит территорию и постоянно стремится убежать из квартиры. После операции, уже в течение месяца, такое поведение пропадает.
При этом кошка еще и метит территорию и постоянно стремится убежать из квартиры. После операции, уже в течение месяца, такое поведение пропадает. - Минимизирует риск заразиться опасными инфекциями. Это относится к тем кошкам, которые могут выходить на улицу и самостоятельно искать себе партнера, причем зачастую им становится бродячий кот. К таким заболеваниям относится вирусные лейкоз, иммунодефицит.
- Увеличение продолжительности жизни животного. По статистике, стерилизованная кошка живет примерно на 2-4 года дольше, чем животные, избежавшие подобной операции. Объясняется это тем, что таблетки, капли и уколы, даваемые кошечке во время течки, отнюдь не безопасны для нее. В то же время и постоянные вязки и сопутствующие гормональные перепады также являются стрессом для организма и увеличивают риск появления раковых заболеваний, поликистоза и т. д. Да и роды, как бы то ни было, сильно изнашивают организм.
- Уменьшение жажды странствий и поиска приключений у кошек. Стерилизованные животные обычно более спокойные, домашние, реже вступают в контакты с сородичами.

- С точки зрения всей популяции кошек, стерилизация – самый гуманный метод ее регуляции. Разумнее провести данную операцию, чем пополнять ряды несчастных бездомных животных, которые потом погибают под колесами или попадают в руки живодерам.Для хозяев плюсы тоже очевидны – отсутствие ночных концертов, снижение уровня агрессии у животного, а также банальная экономия – метаболизм у стерилизованных кошек меняется, им требуется меньше корма.
Минусы стерилизации
Стерилизация, как и любое серьезное вмешательство в организм, не может иметь одни преимущества, поэтому у нее есть и минусы:
— В редких случаях возрастает риск ожирения, которое, в свою очередь, может привести к проблемам с работой сердца, диабету, мочекаменной болезни, аллергии. Правда, разработаны методы профилактики появления проблем, достаточно упорядочить питание и кормить животное специализированным кормом, а не пищей с собственного стола. Также нужно следить за питьевым режимом, так как регулярное мочеиспускание необходимо для профилактики появления камней в почках;
— Возможность осложнений, например, воспаление послеоперационного шва. Однако вероятность возникновения проблем практически сводится к минимуму, если проводить операцию в условиях хорошей клиники и потом соблюдать все рекомендации ветеринара по уходу.
Однако вероятность возникновения проблем практически сводится к минимуму, если проводить операцию в условиях хорошей клиники и потом соблюдать все рекомендации ветеринара по уходу.
— Необходимость использования наркоза при проведении операции, который все же несет в себе определенный риск, особенно для пожилых животных. При этом, как правило, молодые кошечки хорошо переносят наркоз, хотя выделяют ряд пород, для которых использование такого обезболивания достаточно опасно и может привести к гипертрофической кардиомиопатии, тромбоэмболии, а в тяжелых случаях и к смертельному исходу. Это мейн-куны, шотландские, британские вислоухие кошки. Если вы планируете стерилизацию для них, необходимо тщательное предварительное обследование и консультация кардиолога.
Подходящий возраст
Наиболее разумно провести стерилизацию в возрасте 6-8 месяцев, то есть сразу после наступления половой зрелости. До этого смысла делать операцию нет, так как организм еще формируется, риск возникновения осложнений выше. Кроме того, при более ранней стерилизации могут отмечаться случаи отставания в росте, развитии у кошек. Для крупных кошек минимальный возраст – 6 месяцев, при условии, что вес достиг 2-3 кг.
Кроме того, при более ранней стерилизации могут отмечаться случаи отставания в росте, развитии у кошек. Для крупных кошек минимальный возраст – 6 месяцев, при условии, что вес достиг 2-3 кг.
Некоторые хозяева почему-то уверены, что кошка должна перед стерилизацией хоть раз привести потомство, мол, это залог ее здоровья и душевного равновесия в будущем. Однако большинство ветеринарных врачей не поддерживают эту точку зрения и настаивают на ранней стерилизации, до того как у животного появились первые признаки течки.
Как подготовить своего питомца к стерилизации?
Подробнее об этом читайте в статье «Подготовка к операции»
Виды стерилизации
Выделяют несколько вариантов стерилизации, наиболее часто применяют следующие:
- Классический метод, при котором по центру живота делается разрез кожи длиной 1-3 см, далее рассекается по белой линии брюшная стенка и достается матка. На сосуды хирург накладывает лигатуру, затем удаляет матку вместе с обоими яичниками и накладывает съемный или несъемный шов.

- Через боковой разрез, в этом случае разрез делают на боку, разъединяя мышцы тупым способом. Это менее травматичный вариант, однако в этом случае не всегда удается удалить матку полностью. Чаще этот вариант используется для бездомных кошек, так как в будущем нет необходимости ухаживать за швами – животное можно сразу отпустить на волю.
- Стерилизация с использованием хирургического крючка. Для проведения операции достаточно разреза менее сантиметра, туда хирург опускает стерильный крючок и аккуратно извлекает яичник. После наложения врачом лигатур яичник удаляется, а при благоприятном течении получается удалить и матку.
- Лапароскопия. Хирург делает несколько проколов кожи и самой брюшной стенки и осуществляет полноценное удаление яичников, матки. Это наиболее дорогостоящий и сложный вариант операции, поэтому в нашей стране используется редко.
Любой метод хорош, если операцию проводит квалифицированный специалист в условиях клиники.
Противопоказания
В целом, в молодом возрасте практически не существует противопоказаний к проведению стерилизации, кроме наличия гнойных воспалений репродуктивных органов. Если же хозяин решил провести операцию кошке, возраст которой больше 10 лет, врач может посчитать операцию недопустимой на основании результатов предварительных обследований и анализов.
Если же хозяин решил провести операцию кошке, возраст которой больше 10 лет, врач может посчитать операцию недопустимой на основании результатов предварительных обследований и анализов.
Лекция 5 ДЕЗИНФЕКЦИЯ И СТЕРИЛИЗАЦИЯ 1. Определение дезинфекции. Виды дезинфекции. 2. Методы дезинфекции. 3. Стерилизация. Методы стерилизации.
Стерилизация Принципы работы ЦСО
ГБПОУ «Тольяттинский медколледж» МДК «Безопасная больничная среда для пациента и персонала» Стерилизация Принципы работы ЦСО Преподаватель Зуева Е.В. Что такое стерилизация? Стерилизация (от лат. sterilis-
Подробнее
5 ДЕЗИНФЕКЦИЯ И СТЕРИЛИЗАЦИЯ
1 Лекция 5 ДЕЗИНФЕКЦИЯ И СТЕРИЛИЗАЦИЯ 1. Определение дезинфекции. 2. Физические методы дезинфекции. 3. Классификация химических соединений, применяемых для дезинфекции. 4. Аппаратная дезинфекция. 5. Классификация
Определение дезинфекции. 2. Физические методы дезинфекции. 3. Классификация химических соединений, применяемых для дезинфекции. 4. Аппаратная дезинфекция. 5. Классификация
Подробнее
3.1. Профилактика инфекционных заболеваний
Постановление Главного государственного санитарного врача РФ от 3 апреля 2003 г. N 30 «О введении в действие санитарно-эпидемиологических правил СП 3.1.1275-03» На основании Федерального закона «О санитарно-эпидемиологическом
Подробнее
Организация работы процедурно кабинета.
Организация работы процедурно кабинета. Наличие графика работы: Время текущих, генеральных уборок; Время работы бактерицидных ламп; Время отпуска процедур в кабинете; График вывешен на входной двери кабинета.
Подробнее
Дневник преддипломной практики
Краевое государственное бюджетное профессиональное образовательное учреждение «Барнаульский базовый медицинский колледж» Дневник преддипломной практики СТУДЕНТКИ (А) ГРУППЫ СПЕЦИАЛЬНОСТЬ ЛАБОРАТОРНАЯ ДИАГНОСТИКА
Подробнее
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ Стерилизация ОФС. 1.1.0016.15 Взамен ст. ГФ XI, вып.2 Настоящая общая фармакопейная статья устанавливает методы и условия стерилизации,
1.1.0016.15 Взамен ст. ГФ XI, вып.2 Настоящая общая фармакопейная статья устанавливает методы и условия стерилизации,
Подробнее
Пояснительная записка
Пояснительная записка Элективный курс по химии в 8 классе имеет особое значение. Именно в этом классе складывается отношение к новому предмету. Целью курса является формирование глубокого и устойчивого
Подробнее
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ Температура плавления ОФС.1.2.1.0011.15 Взамен ГФ XII, ч.1, ОФС 42-0034-07 Температурой плавления называют температуру, при
Подробнее
СанПиН МЗ и СЗ ПМР
«УТВЕРЖДЕНО» Приказом Министра здравоохранения и социальной защиты Приднестровской Молдавской Республики от 1 июня 2010 г. N 241 Регистрационный N 5290 от 16 июня 2010 г.( САЗ 10-24) САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКИЕ
N 241 Регистрационный N 5290 от 16 июня 2010 г.( САЗ 10-24) САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКИЕ
Подробнее
ИНСТРУКЦИЯ ПРОБА-ЦТАБ
ИНСТРУКЦИЯ по применению комплекта реагентов для выделения ДНК ПРОБА-ЦТАБ Выполнено в соответствии с методическими указаниями МУК 4.2.1913-04 ВНИМАНИЕ! Изучите инструкцию перед началом работы 2 1. НАЗНАЧЕНИЕ
Подробнее
Имя Рабочее место Район Шифр Итого:
Фамилия Шифр Имя Рабочее место Район Шифр Итого: Задания практического тура регионального этапа XXXII Всероссийской. БИОХИМИЯ. ИДЕНТИФИКАЦИЯ ЭКСТРАКТОВ Оборудование: Пробирки (3 пробирки с экстрактами
Подробнее
СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Г О С У Д А Р С Т В Е Н Н Ы Й С Т А Н Д А Р Т С О Ю З А С С Р СИСТЕМА СТАНДАРТОВ БЕЗОПАСНОСТИ ТРУДА СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ МЕТОД ОПРЕДЕЛЕНИЯ ПРОНИЦАЕМОСТИ МИКРООРГАНИЗМАМИ ГОСТ 12. 4.136-84 Издание
4.136-84 Издание
Подробнее
ИНСТРУКЦИЯ. Москва, 2009 г.
ИНСТРУКЦИЯ по применению фильтра Фильтраниос ПС 1000 производства «Лаборатории АНИОС» (Франция) для получения микробиологически чистой воды в лечебно-профилактических учреждениях Москва, 2009 г. ИНСТРУКЦИЯ
Подробнее
КАФЕДРА ОБЩЕЙ ХИРУРГИИ
КАФЕДРА ОБЩЕЙ ХИРУРГИИ Асептика в хирургии Цель формирование формирование представлений о значении системы профилактики инфекции в хирургии. Мотивация. 1. Инфекционные осложнения 6-8% операционных ран.
Подробнее
Register your product and get support at www.philips.com/welcome SCF283, SCF282, SCF281 1 Русский 53 Введение Поздравляем с покупкой продукции Philips! Для получения полной поддержки, оказываемой компанией
Подробнее
специальность Лабораторная диагностика
1 Перечень практических навыков для оценки в симулированных условиях при проведении второго этапа первичной аккредитации лиц, завершивших освоение основных образовательных программ среднего профессионального
Подробнее
9 КЛАСС Задание: Вам выданы 7 пробирок, в которых находятся растворы индивидуальных веществ: HCl, NaOH, Pb(NO 3 ) 2, NH 4 Cl, MgSO 4, ZnSO 4, BaCl 2.

9 КЛАСС Задание: Вам выданы 7 пробирок, в которых находятся растворы индивидуальных веществ: HCl, NaOH, Pb(NO 3 ) 2, NH 4 Cl, MgSO 4, ZnSO 4, BaCl 2. Используя эти растворы и универсальную индикаторную
Подробнее
Стерилизация собак — основные методы, все за и против операции
Нередко владельцы испытывают сомнения, нужно ли столь радикальное вмешательство как стерилизация собак? Это связано с отсутствием в обществе объективной информации и ошибочным расцениванием стерилизации, как прихоти человека без учета интересов животного.
Действительно, такое решение — нужна ли стерилизация собак, требует обоснованного подхода. Во внимание принимаются пол, возраст, порода, условия содержания и медицинские показания. На основании обследования собаки, взвешивания эффекта стерилизации и возможных рисков предпринимаются дальнейшие действия.
Общее понятие «стерилизация собак» подразумевает временное или необратимое предотвращение размножения суки и кобеля.
Способы стерилизации собак
Временная обратимая стерилизация собак осуществляется инъекцией гормональных и химических препаратов. Также это может быть подкожная фиксация импланта-контрацептива для постепенного поступления вещества в кровь. Это вещество обеспечивает угнетение репродуктивной функции.
В пользу временной стерилизации собак можно привести неоспоримые аргументы. Во-первых это возможность через некоторое время иметь потомство. Во-вторых это отсутствие наркоза и послеоперационного восстановительного периода. Однако не стоит исключать и частые риски для здоровья животного. Например гиперплазию и опухоль молочных желез. Диабет и функциональное угнетение надпочечников. Кистозную гиперплазию эндометрия и увеличение выработки гормона роста.
Необратимая стерилизация собак возможна как безоперационным методом, так и с помощью хирургического вмешательства у обоих полов.
Безоперационная стерилизация сук происходит путем разрушения соединения матки и яичников. Вследствие этого абсолютно исключается возможность беременности. Серьезным недостатком этого метода является изолированность половых органов. Позже это может привести к серьезным патологиям — опухоли или абсцессу яичников. Для их устранения приходится полностью удалять матку и яичники. Этот факт заставляет задуматься о целесообразности безоперационной стерилизации.
Вследствие этого абсолютно исключается возможность беременности. Серьезным недостатком этого метода является изолированность половых органов. Позже это может привести к серьезным патологиям — опухоли или абсцессу яичников. Для их устранения приходится полностью удалять матку и яичники. Этот факт заставляет задуматься о целесообразности безоперационной стерилизации.
Лапароскопическая стерилизация собак
Операционная стерилизация или кастрация собак — это удаление семенников у кобелей, матки и яичников — у сук. Сейчас проводится стерилизация лапароскопическим методом. Он имеет гораздо меньше последствий для здоровья собаки.
Для проведения данной операции имеют значение субъективные и объективные причины. Например:
- Нежелание владельцев иметь потомство от данной собаки
- Проблемы, сопровождающие течку у суки
- Явная агрессивность и другие негативные поведенческие факторы у кобеля половозрелого возраста
- Необходимость корректирования поведения собаки, склонной к побегам и поиску полового партнёра
- Желание продлить жизнь питомцу
- Медицинские показания (гормональные и воспалительные патологии матки, кисты и опухоли яичников гормонального происхождения, гиперплазии молочных желез, ложные щенности, кровянистые течки, тяжёлые роды)
Если присутствует хотя бы один из этих факторов, владелец должен обдумать вариант хирургической стерилизации собаки. Нужно учесть, что эта операция подходит не всем животным. Некоторые собаки могут не перенести оперативное вмешательство. Это собаки с серьёзными патологиями сердечно-сосудистой системы или почечной недостаточностью. Также есть риск для собак старше 10 лет.
Нужно учесть, что эта операция подходит не всем животным. Некоторые собаки могут не перенести оперативное вмешательство. Это собаки с серьёзными патологиями сердечно-сосудистой системы или почечной недостаточностью. Также есть риск для собак старше 10 лет.
Решение об операции принимается только после медицинского обследования собаки.
Стерилизация собак — за и против
Плюсы стерилизации кобелей:
- Полное устранение риска приобретения рака яичника
- Снижение риска появления анального фурункулеза
- Снижение риска развития заболеваний простаты нераковой этиологии
Плюсы стерилизации сук:
- Полное избавление от риска развития раковых заболеваний матки, шейки и яичников, гнойного эндометрита
- Снижение риска возникновения опухолей молочной железы, а также параанальных желёз
Минусы стерилизации для обоих полов:
- Увеличение риска гормонозависимого ожирения (нужна коррекция питания, увеличение физической нагрузки)
- Редко гормонозависимое недержание мочи
- Редко развитие гипотиреоза (недостатка гормонов щитовидной железы)
- Возрастание риска ортопедических нарушений
В каком возрасте нужна стерилизация собак?
Вопрос, когда стерилизовать собаку, подразумевает самый безопасный для операции возраст. Проводить её ранее 8-месячного возраста не рекомендуется. Это может привести к задержке роста и развития организма. Стерилизация собак эффективна в период от 8 месяцев до 1 года. Тогда она сводит к минимуму все негативные последствия.
Проводить её ранее 8-месячного возраста не рекомендуется. Это может привести к задержке роста и развития организма. Стерилизация собак эффективна в период от 8 месяцев до 1 года. Тогда она сводит к минимуму все негативные последствия.
Из всех методов, лапароскопическая стерилизация собак считается достаточно простой операцией. Она очень хорошо переносится животными.
Большое значение имеет послеоперационный уход. Он включает обработку швов, медикаментозную терапию, щадящую диету.
Стерилизация собак — это решение, которое принимает её владелец. Важно, чтобы оно учитывало сохранение здоровья и увеличение продолжительности жизни питомца.
Преимущества и недостатки различных методов стерилизации
| Метод | Преимущества | Недостатки |
| Паровая стерилизация | Наиболее распространенный метод стерилизации в стационарах. Безопасен для окружающей среды и персонала. Безопасен для окружающей среды и персонала.Короткая экспозиция. Не обладает токсичностью Низкая стоимость Не требует аэрации | Качество стерилизации может быть нарушено при неполном удалении воздуха, повышенной влажности материалов и плохом качестве пара. Могут повреждаться изделия, чувствительные к действию температуры и влажности. |
| Воздушная стерилизация | Низкие коррозийные свойства. Глубокое проникновение в материал Безопасен для окружающей среды Не требует аэрации | Длительная экспозиция. Очень высокая энергопотребляемость. Могут повреждаться термочувствительные изделия |
| Стерилизация окисью этилена | Проникновение в упаковочные материалы и пластиковые пакеты. Можно использовать для стерилизации большинства медицинских изделий. Прост в обращении и контроле | Требуется время для аэрации. Маленький размер стерилизационной камеры. Окись этилена токсична, является вероятным канцерогеном, легко воспламеняется |
| Стерилизация плазмой перекиси водорода | Низкотемпературный режим Не требует аэрации.  Безопасен для окружающей среды и персонала. Конечные продукты нетоксичны. Прост в обращении, работе и контроле | Нельзя стерилизовать бумажные изделия, белье и растворы. Маленький размер стерилизационной камеры. Нельзя стерилизовать изделия с длинными или узкими внутренними каналами. Требуется синтетическая упаковка |
| Стерилизация парами раствора формальдегида | Пожаро- и взрывобезопасен. Можно использовать для стерилизации большинства медицинских изделий. | Необходимость отмывания поверхности от остатков формальдегида. Обладает токсичностью и аллергенностью. Длительная экспозиция. Длительная процедура удаления формальдегида после стерилизации |
Все активнее на рынке используются низкотемпературные методы стерилизации. В мировой практике встречаются 3 основных метода низкотемпературной стерилизации: газовый этиленоксидный, газовый формальдегидный и плазменный.
- Газовая стерилизация при помощи оксида этилена.

Наиболее широко в мире применяется стерилизация с помощью этиленоксида. Для сравнения, в 1999г. в США 52,2% всех одноразовых медицинских изделий было простерилизовано с помощью этиленоксида, 45,5% — гамма-радиацией, 1,8% — паром и только 0,5% — другими методами. Этиленоксидная стерилизация прекрасно зарекомендовала себя в большинстве стран мира, оборудование для ее проведения выпускается большим количеством производителей в различных странах Европы и Америки.
Этиленоксидный метод обеспечивает самый щадящий температурный режим стерилизации. - Газовая стерилизация при помощи формальдегида.
Формальдегид нашел широкое применение в качестве средства для дезинфекции высокого уровня с использованием специальных камер. Для стерилизации же он не является самым удачным выбором. Низкая проникающая способность формальдегида приводит к тому, что данный метод требует применения рабочей температуры в пределах 65 – 80°С, и многие специалисты вообще не считают этот метод низкотемпературным. Для формальдегида имеются существенные ограничения в отношении стерилизации полых изделий, изделий с отверстиями и каналами. Весьма существенно, что для формальдегида не разработано нейтрализаторов и полного мониторинга процесса стерилизации.
Для формальдегида имеются существенные ограничения в отношении стерилизации полых изделий, изделий с отверстиями и каналами. Весьма существенно, что для формальдегида не разработано нейтрализаторов и полного мониторинга процесса стерилизации. - Плазменный метод.
Этот метод основан на действии плазмы перекиси водорода (Н2О2). Плазма — четвертое состояние вещества (в отличие от твердого, жидкого и газообразного). Она состоит из ионов, электронов, нейтральных атомов и молекул и образуется под действием внешних источников энергии, таких как температура, радиационное излучение, электрическое поле и др. При этом методе после впрыскивания раствора перекиси водорода в стерилизационную камеру включается источник электромагнитного излучения частотой 13,56 Мгц, под воздействием которого одновременно происходит деление одной части молекул Н2О2 на две группы (ОН-), а другой части — на одну гидропероксильную группу (ООН-) и один атом водорода, сопровождающееся выделением видимого и ультрафиолетового излучения. В результате создается биоцидная среда, состоящая из молекул перекиси водорода, свободных радикалов и ультрафиолетового излучения. При отключении электромагнитного поля свободные радикалы преобразуются в молекулы воды и кислорода, не оставляя никаких токсичных отходов.
В результате создается биоцидная среда, состоящая из молекул перекиси водорода, свободных радикалов и ультрафиолетового излучения. При отключении электромагнитного поля свободные радикалы преобразуются в молекулы воды и кислорода, не оставляя никаких токсичных отходов.
Типы методов стерилизации, используемых в микробиологии
Стерилизация широко применяется для уничтожения всех форм живых микроорганизмов в веществе. Метод стерилизации направлен на сохранение вещества в течение длительного времени. Он включает в себя воздействие тепла / химикатов на такие вещества, как лекарства, продукты питания, хирургическое оборудование, нутрицевтики и т. Д., Если пищевые материалы не подвергаются стерилизации, есть вероятность, что они содержат опасные бактерии, которые могут вызвать серьезную инфекцию при употреблении.Бактерии, вызывающие заболевания, обычно не видны невооруженным глазом, поэтому в микробиологии используются различные методы стерилизации.
Виды стерилизации
Несмотря на то, что существует множество доступных методов стерилизации, термические и химические методы широко используются для стерильных металлов и пищевых продуктов. Кроме того, существует множество техник. В этой статье вы можете ознакомиться с наиболее часто используемыми методами стерилизации.
Кроме того, существует множество техник. В этой статье вы можете ознакомиться с наиболее часто используемыми методами стерилизации.
Метод газовой стерилизации
Несмотря на то, что тепловая стерилизация нестабильна для термолабильного оборудования, такого как деликатные, пластиковые и резиновые изделия, она стала популярной из-за своих капитальных затрат. Этот метод использует химическое вещество в газообразном состоянии для уничтожения микробактерий. Окись этилена широко используется в этом методе в медицине и фармацевтике.
Консервация включает нанесение соли на различные вещества, такие как рыба, крупы.Металлы и другие пищевые материалы. Сушка — важная техника, требующая сохранения. С помощью этого удивительного метода можно сохранить большую часть еды на нашей кухне. Когда пищевое вещество солится, оно подвергается диффузии, что увеличивает концентрацию соли и уменьшает количество молекул воды, затем оно подвергается процессу осмоса, при котором микробы в нем сморщиваются и умирают. Тот же метод используется в продуктах с высоким содержанием сахара, таких как джемы, желе, сиропы и т. Д.
Тот же метод используется в продуктах с высоким содержанием сахара, таких как джемы, желе, сиропы и т. Д.
Фильтрация включает удаление микробов из раствора с помощью фильтра.Когда жидкость проходит через механический фильтр, микроорганизмы захватываются небольшими порами этого фильтра. Жидкость, которую получает контейнер, не содержит бактерий, поскольку она стерилизована. Да, жидкость обеззараживается, просто используя фильтр. Поскольку метод фильтрации удобен для пользователя, он широко используется в напитках, бактериологических средах, фармацевтических препаратах и т. Д. Для этого метода доступно несколько типов механических фильтров, таких как фильтры Чемберленда, фильтры Беркфельда, фильтры Мандлера, фильтры из фриттованного стекла, Асбестовые фильтры, Фильтр Дженкинса, Ультрафильтр, Мембранный фильтр, Чистящие фильтры
Ультрафиолетовый свет эффективен для борьбы с микробами в пищевых продуктах.Он имеет более высокую длину волны от 100 до 400 нм. Энергия составляет около 265 нм, что достаточно для уничтожения микробов. Когда микробы подвергаются облучению, ультрафиолетовое излучение проникает в ядро ДНК и молекулы тимина. В процессе фотосинтеза связанные молекулы тимина не могли выровнять аденин молекул РНК, в результате изменилась молекулярная структура. Кроме того, нарушается репликация хромосом. Поскольку этот микроорганизм поврежден, он не может продуцировать белки и вскоре умирает.
Когда микробы подвергаются облучению, ультрафиолетовое излучение проникает в ядро ДНК и молекулы тимина. В процессе фотосинтеза связанные молекулы тимина не могли выровнять аденин молекул РНК, в результате изменилась молекулярная структура. Кроме того, нарушается репликация хромосом. Поскольку этот микроорганизм поврежден, он не может продуцировать белки и вскоре умирает.
Неудивительно, что ультрафиолетовые лучи солнца играют жизненно важную роль в борьбе с микроорганизмами в слое воздуха и почвы. Таким же образом ультрафиолет используется для уменьшения популяции микробов. Он также используется для уменьшения поверхностного загрязнения в морге, туалете, аптеке, больничной палате, комнате питания и т. Д.
Когда вещество подвергается воздействию инфракрасного излучения от 0,3 до 0,4 Мрад, оно может вызвать десятикратное уменьшение эндоспор микробов. Ионизирующее излучение широко используется для стерилизации веществ.В основном пластические вещества, содержащие микробы, подвергаются стерилизации с помощью гамма-излучения. Большинство процедур стерилизации связано с воздействием излучения цезия-137. Когда микроорганизмы подвергаются стерилизации путем воздействия на них инфракрасного или микроволнового излучения с более высокой температурой, микробы могут быть убиты косвенно. Однако микроволны не убивают микробы напрямую, поэтому продукты, запеченные в микропечати, не могут убить эти микробы.
Большинство процедур стерилизации связано с воздействием излучения цезия-137. Когда микроорганизмы подвергаются стерилизации путем воздействия на них инфракрасного или микроволнового излучения с более высокой температурой, микробы могут быть убиты косвенно. Однако микроволны не убивают микробы напрямую, поэтому продукты, запеченные в микропечати, не могут убить эти микробы.
Ультразвуковые частоты не слышны человеческому уху.Ультразвуковые колебания используются для исследования и изучения частей тканей. Стоматолог использует аппарат Cavitron для чистки зубов и уничтожения бактерий. Ультразвуковые аппараты используются для чистки зубных бляшек, монет, металлов, ювелирных изделий и т. Д.
Тепловой метод — наиболее распространенный метод стерилизации, который напрямую убивает микробы. Эффект стерилизации зависит от продолжительности нагрева и температуры нагрева. Когда вещество подвергается длительному воздействию прямого пламени, молекулы микробов сжимаются и умирают.Два типа методов нагрева — это методы сухого тепла и методы влажного тепла. Тепловой метод — самый простой способ убить вредные бактерии, которые выживают на частицах пищи.
Тепловой метод — самый простой способ убить вредные бактерии, которые выживают на частицах пищи.
Здесь вещество подвергается стерилизации путем непосредственного воздействия теплового пламени. Некоторые из наиболее распространенных методов влажного тепла — это кипячение, пастеризация и автоклавирование.
- Кипячение широко используется для стерилизации металлических предметов, таких как скальпели, хирургические ножницы, иглы и т. Д.Эти вещества кипятят при высоких температурах, чтобы убить болезнетворные бактерии.
- Пастеризация — Это простой процесс нагрева молока при высоких температурах. После того, как молоко закипело, его снова подвергают охлаждению. Таким образом, микробы в молоке автоматически погибают.
- Автоклавирование — Это тип стерилизации, при котором используется оборудование для паровой стерилизации. Здесь любое вещество в течение часа подвергается воздействию температуры 115 градусов.
 Это мощный метод уничтожения спор бактерий.
Это мощный метод уничтожения спор бактерий.
Метод сухого нагрева
Метод сухого нагрева включает в себя методы обжига, сжигания и печи с горячим воздухом.
- Flaming- Здесь вещество подвергается воздействию пламени всего на несколько минут. Пламя сожжет микробы напрямую.
- Сжигание — Это эффективный метод стерилизации микробных культур.Конец микробной петли подвергается воздействию раскаленного докрасна пламени, таким образом, он убивает микроорганизмы. Это самый простой способ уничтожить микробы в металлах.
- Духовка с горячим воздухом — Сушилка с горячим воздухом применяется для сухих материалов, таких как стеклянная посуда, тяжелые металлы, термостойкие материалы и т. Д. Здесь горячий воздух может циркулировать при определенном времени и температуре. Так работает духовой шкаф с горячим воздухом.
% PDF-1. 6
6
%
468 0 объект
> / Метаданные 465 0 R / AcroForm 500 0 R / Страницы 424 0 R / Тип / Каталог / PageLabels 421 0 R >>
endobj
465 0 объект
> поток
2009-09-04T15: 55: 45-04: 002009-12-09T14: 03: 22-05: 002009-12-09T14: 03: 22-05: 00 Adobe InDesign CS3 (5.0.4)
AQBIAAAAAQAB / + 4AE0Fkb2JlAGQAAAAAAQUAAs7M / 9sAhAAMCAgICAgMCAgMEAsLCxAUDg0NDhQY
EhMTExIYFBIUFBQUEhQUGx4eHhsUJCcnJyckMjU1NTI7Ozs7Ozs7Ozs7AQ0LCxAOECIYGCIyKCEo
MjsyMjIyOzs7Ozs7Ozs7Ozs7Ozs7OztAQEBAQDtAQEBAQEBAQEBAQEBAQEBAQEBAQED / wAARCAEA
AKsDAREAAhEBAxEB / 8QBQgAAAQUBAQEBAQEAAAAAAAAAAwABAgQFBgcICQoLAQABBQEBAQEBAQAA
AAAAAAABAAIDBAUGBwgJCgsQAAEEAQMCBAIFBwYIBQMMMwEAAhEDBCESMQVBUWETInGBMgYUkaGx
QiMkFVLBYjM0coLRQwclklPw4fFjczUWorKDJkSTVGRFwqN0NhfSVeJl8rOEw9N14 / NGJ5SkhbSV
xNTk9KW1xdXl9VZmdoaWprbG1ub2N0dXZ3eHl6e3x9fn9xEAAgIBAgQEAwQFBgcHBgI7AQACEQMh
MRIEQVFhcSITBTKBkRShsUIjwVLR8DMkYuFygpJDUxVjczTxJQYWorKDByY1wtJEk1SjF2RFVTZ0
ZeLys4TD03Xj80aUpIW0lcTU5PSltcXV5fVWZnaGlqa2xtbm9ic3R1dnd4eXp7fh2 + f3 / 9oADAMB
AAIRAxEAPwDrfqx9WPq3kfVvpN9 / ScG223Bxn2WPxqnOc51TC5znFkkkpKdL / mn9Vf8Aym6f / wCw
tP8A6TSUr / mn9Vf / ACm6f / 7C0 / 8ApNJSv + af1V / 8pun / APsLT / 6TSUr / AJp / VX / ym6f / AOwtP / pN
JSv + af1V / wDKbp // ALC0 / wDpNJSv + af1V / 8AKbp // sLT / wCk0lK / 5p / VX / ym6f8A + wtP / pNJSv8A
mn9Vf / Kbp / 8A7C0 / + k0lK / 5p / VX / AMpun / 8AsLT / AOk0lK / 5p / VX / wApun / + wtP / AKTSUr / mn9Vf
/ Kbp / wD7C0 / + k0lK / wCaf1V / 8pun / wDsLT / 6TSUr / mn9Vf8Aym6f / wCwtP8A6TSUr / mn9Vf / ACm6
f / 7C0 / 8ApNJSv + af1V / 8pun / APsLT / 6TSUr / AJp / VX / ym6f / AOwtP / pNJSv + af1V / wDKbp // ALC0
/ wDpNJSv + af1V / 8AKbp // sLT / wCk0lK / 5p / VX / ym6f8A + wtP / pNJSv8Amn9Vf / Kbp / 8A7C0 / + k0l
PNf83ugft70f2Zh + n + 3PR2fZ69vp / sf1vTjZG31PfH72vKSnpfqn / wCJXo3 / AKb8X / zzWkp1klKS
UpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSU8p / 60X / ANUH / wAY0lOr9U // ABK9
G / 8ATfi / + ea0lOskpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSnlP8A1ov /
AKoP / jGkp1fqn / 4lejf + m / F / 881pKdZJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklK
SUpJSklPKf8ArRf / AFQf / GNJTq / VP / xK9G / 9N + L / AOea0lOskpSSlJKUkpSSlJKUkpSSlJKUkpSS
lJKUkpSSlJKUkpSSlJKUkpSSnlP / AFov / qg / + MaSnV + qf / iV6N / 6b8X / AM81pKdZJSklKSUpJSxI
aC4mANSSkrZyW / WfAc4EVZHoOdsbk + kTUTO3Rw158lJ7RaQ + I4idpV + 9WjpMyaLLrMdjw62mDYwc
t3CWz8UyjTaGSJkYg6hKgvQ35BoNYFVlvqvDJrAOyfznyRDQiBayc + GtCb7Najq9WSCaKLnhmScR
8NB2ubEvPu + hrz + CJhTFDmoz2B + bh / t8m + mthSSmq / qFAputxw7KOO / 07K6AHP3AgFsEjiUeE2xH
PHhJj6q0oNkGQDET2KDKukpSSlJKUkpSSlJKeU / 9aL / 6oP8A4xpKdX6p / wDiV6N / 6b8X / wA81pKd
ZJSklKSUpJTC3b6T9zS5u0y0akiOAkES2LxZvZh2ivoebltvDxt6fbWXRJ1HG0KzV / MPq4PGMYrD
OXF + 4Q3mMso611Y1hzcx + O2zGbucQ55r98SSDDjpPHZM3iOzZAMeYy181WPsaOJ6jqLnUlojByBm
gOtc5z / TOtm + trQ / d5p53 + rWx2YGv3JcW / brpu2hjVY / TuhPrnddl49jy4kySI0ngJt3KTN7cYYc
NdZRKGv / AAX / AKfj / wB8R / 71jj0 / 2zLGd0TN + sIvBZjsptAqZ7t99xd9I8wN3CR4hBdjPL5eavaj
p4lCMlr + p4t9LfQtdnNZaD6jrtpdBFtjjtgj80JV6T5LPcBzRI0PHrvf1P7F76qKOm9dp9wuZkiG
uc8 / ojbXtd7iQZ8eUQSZRROMY4cw68X4WG3m / ZP2hk / tzfs9Gv7BG / bO33bNv5 + 5MjfCOH6tjNwe
7L3tqHDv / K0WJi2Zefi1dWaX2fsxxc15IP8AOWbN3edpCMjQNd2PFjOTLEZd / b / aXb + qz32dBxXW
OLjDxJ1MNe9o / AKPKPWW / wDDZGXLRv8Alq6qY3FJKUkpSSnlP / Wi / wDqg / 8AjGkp1fqn / wCJXo3 /
AKb8X / zzWkp1klKSUpJSklKSUpJSklKSUpJSklKSUgszMarJpw7HxdkbjUyCd2wbnagQNEREkWxy
ywjMRJ1OzHK6hh5dlVWTZsfkO21NguLj / ZB8UhElGTPjxkCR1OzZQZVJKUkpSSlJKUkpSSnlP / Wi
/ wDqg / 8AjGkp1fqn / wCJXo3 / AKb8X / zzWkp1klKSUpJSklKSU4 / 1ltvrow20WvpNuZVW51bi07XB
8hSYgLPk0viMpCMKNXIDRxL7c6np + fktzckvwMw01A2EgtDgPf8AvcqQAEgVuGhOeSOKcuOXolQ1
Sda6rdXflXYmRa1 + Pa2sB1wY0EfSaygD3jzchCF1a7nOZlGUjGRsGt / + 56p89 + U / O60W5V9bcSmq
ylldha0O9MO4 + SEaqOjJmlM5M3qI4QCNfBg / qWT6j325Dmep0X1mjeWj1nAe5okDd8EREfitlzE7
JMt8V / VHmdStGBiMGReMhuD9oJ9b0mknQOc7V1jp / NSjHU + a3NzB9qI4jxcF71 / v + TbqusyOpfV6
+ 47rLKLXOd4k1alCqEmaMzPLgJ3o / km6pS5 / 1l6XFr2bm3Rt2 + 3ayTtlp + l3QgfQV / MwJ5vFr3 / J
zf2jlfZP2l9ts / aP2n0 / sO8bI3x6fp / DuncIuq0a3vz4Pc4zx8VcN + O1Op0 / 7TkfWHqBfk2 + liur
20bprO9jhqD4c6d0yVCAbWDjnzWS5Go1p02dxRugpJSklKSUpJTyn / rRf / VB / wDGNJTq / VP / AMSv
Rv8A034v / nmtJTrJKUkpSSlJKYMvpssfVXY1z6o9RjSC5s8bgOJRorROJJAOoVbRTeGi6ttgY4Pb
vAdDhw4T3SBIVKEZbi0bsLDcx9bqKiy12 + xpY0h7udzhGp80uIrThxkEcI13R2Y3Sr8h9VtWPZkP
aHPY5rHPLAdC4ETEogyAWyx4ZSIIiZfS2b6 + ni412NpF2WIc1wbvtawcEHVwAQ1pMo4uKjVy / H + K
78HCsaxtmPU9tbdjA5jSGtiNrZGghLiKThxkC4hTsHCeGNdj1OFQ21gsaQ0cQ3TQJcRUcOM16Roy
bi4rTW5tNYNALaiGgFgIghmmnySspGKArQabMnUUvtZc + trrK52PIBc3dodp5EpWUmESQSNQw + yY
номер / afRr9b / S7Bv8A86JSs0j2ocXFQvuzZRTXY + 2utrX2x6j2gBzo43EcwlZSIRBJA1LNBcpJSklK
SUpJTyn / AK0X / wBUH / xjSU6v1T / 8SvRv / Tfi / wDnmtJTrJKUkpSSlJKeQzMnPwc / rWdhWtrFD8Y2
McwO37hsAk8cqeIBEQXFzZMuLLmnA7cP1bef1rqBy8qrDL2DDrY4MZSbhY57d5D3AHa2PghGAoWz
Z + cy + 5IR / RA6Xfn2YdW67nUtdkYlrmmmul9lAqBax1sGLnvO6ddA1KGMHdHNc7kiDKJ2A0rv3 / sV
1N1p6tnWVO9N / wCyHP3RMQ4ExqNY4KUPlHmjmTL35kafqmuxmfbd0IV5DW32UWmu0s3bQa + 4LjuM
d0dBxMYGSUsFS9VHX6O70DPvz + kVZmT7rTvDi0RO1xHHyUeSIjKnQ5HPLNgEpbtDC6n1K3Ad1y3I
rNJFrhh7BIFYdtaHgh3726 + SdKIB4Wvh5nLLF7xkK19Pkx6f1fqdl2MbTZbXlVPe8mh2bKnBu5ux
+ 0bm9u6UoRAKOX5rNKUbsiQ / dqkfS + q9Vsf0p + RkC1vUPXa9hra3aaiQ0gtARnCOvgs5bms0ji4p
Xx8XTsgxup9QwcPJcLfUfd1F2M0ljnlhMFz2jc6dOGomIJHkx4 + Zy4oS1u58O38vsTZXWeqUdOzy
HWB + M + r0Miyn03ObYRuBY9gEj4ICETIMmXm80MU9 / TVEit03U8zrmA + ttlpNLKy + 7IopbZ7i50B7
HOlrA3uhERkv5jLzOIizpWpA / Z2d + ixt1NdzHB7bGhzXAQCHCQVERRdGEhKIIZpLlJKUkp5T / wBa
L / 6oP / jGkp1fqn / 4lejf + m / F / wDPNaSnWSUpJSklKSU07ekdOvGSLat32wsOR7nDf6erOHaR5Jwm
RTBLlcUuKx82 / wBFsjo / TMu1t2RQ172gNmSJA4DgCN3zSE5BWTlMOSVyixyehdJy7HXZGO1z3gNc
QXNkDQaNcOI5SGSQRk5LBkNyimPTsJ17sh2YNj6fs7iSSDUddsTCHEaXnl8ZlxVrVfRHR0fp2M + i
ymra7G3 + idzzt9QQ7lx7eKJmSthymKBiQPl2 + qbDw8bAobjYjPTqaSQ2S7kydXElAyJNlfixQxR4
YjRCzovS68h3UzGYLHEknUiXckNJ2ifgjxyqlkeUwxlxCOqsbo / TMOw249AY5wLZkmAeQ3cTt + SR
nIqx8rixm4herpHTqBjCqrb9jLzj + 5x2epq / l2s + aRmTao8rijw0Pl2 + rE9F6W7192O0jJdutBLo
LhruAn2n4JcclfdMPq9Pzbq / YnS / sj8L0B6NhDnt3OlxbxL9278UuOV2j7nh5DCtCyy + kdNzrRfl
UB9gEbpc2QOztpE / NITI2Tl5XFlNyGrba1rWhrQA1ogAcABNZwKXSUpJSklPKf8ArRf / AFQf / GNJ
Tq / VP / xK9G / 9N + L / AOea0lOskpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSS
nlP / AFov / qg / + MaSnV + qf / iV6N / 6b8X / AM81pKdZJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSkl
KSUpJSklKSUpJSklPKf + tF / 9UH / xjSU6v1T / APEr0b / 034v / AJ5rSU6ySlJKUkpSSlJKUkpSSlJK
UkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKeU / 9aL / 6oP8A4xpKdX6p / wDiV6N / 6b8X / wA81pKdZJSk
lKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklPKf + tF / 9UH / AMY0lOr9U / 8AxK9G
/ wDTfi / + ea0lOskpSSlJKUkpSSlJKUkpSSlJKefzOvdcx8q2mjpFl1dby1loLocBw76BSUh / 5yfW
L / yjt + 93 / pNJTv4N92TiVX5FRote2X1Hlp8NYSUnSUpJSklKSUpJSklKSUpJTyn / AK0X / wBUH / xj
SU6v1T / 8SvRv / Tfi / wDnmtJTrJKUkpSSlJKUkpSSlJKec6nhfW + 3Ots6dl114xI9NjiJAgT / AIN3
dJTV / Z318 / 7nVfeP / SSSlfs76 + f9zqvvH / pJJSv2d9fP + 51X3j / 0kkpX7O + vn / c6r7x / 6SSUr9nf
Xz / udV94 / wDSSSnrUlKSUpJSklKSUpJSklPKf + tF / wDVB / 8AGNJTq / VP / wASvRv / AE34v / nmtJTr
JKUkpSSlJKUkpSSnlv8AmJT / ANz8j8ElK / 5iU / 8Ac / I / BJSv + YlP / c / I / BJSv + YlP / c / I / BJSv8A
mJT / ANz8j8ElK / 5iU / 8Ac / I / BJSv + YlP / c / I / BJSv + YlP / c / I / BJT0HTsIdOwqsJr3WioEb3cmST
r96SmykpSSlJKUkpSSnlP / Wi / wDqg / 8AjGkp1fqn / wCJXo3 / AKb8X / zzWkp1klKSUpJSklKSUpJS
klKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSU8p / 60X / ANUH / wAY0lOr9U // ABK9G / 8ATfi / + ea0
lOskpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSnlP8A1ov / AKoP / jGkp1fq
n / 4lejf + m / F / 881pKdZJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklPKf8A
rRf / AFQf / GNJTq / VP / xK9G / 9N + L / AOea0lOskpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKU
kpSSlJKUkpSSnlP / AFov / qg / + MaSnV + qf / iV6N / 6b8X / AM81pKdZJSklKSUpJSklKSUpJSklKSUp
JSklKSUpJSklKSUpJSklKSUpJSklPKf + tF / 9UH / xjSU6v1T / APEr0b / 034v / AJ5rSU6ySlJKUkpS
SlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKeU / 9aL / 6oP8A4xpKdX6p / wDiV6N / 6b8X
/ wA81pKdZJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklKSUpJSklPKf + tF / 9UH / AMY0
lOr9U / 8AxK9G / wDTfi / + ea0lOskpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKUkp
SSnlP / Wi / wDqg / 8AjGkp1fqn / wCJXo3 / AKb8X / zzWkp1klKSUpJSklKSUpJSklKSUpJSklKSUpJS
klKSUpJSklKSUpJSklKSU8p / 60X / ANUH / wAY0lOr9U // ABK9G / 8ATfi / + ea0lOskphda2mp1r + Gi
Skpweh / WnK6v1LP6dkdNdhHBJaHvtDvU2mHEN2NMca68pKZN + tNwvfVb0rL9Nt1lX2ir07Kmsrf6
fq2O9RpYNC6CJjVJTBv1uufZZXX0bqFwY9zBZQ2t7CBq07ja2C5pBjskpn / zpym / T6F1OSRtDa2O
0IJkn1ABxqJSU7tbt7Gv2lu4A7XciexSUySUpJSklKSUpJTkdZ + s / T + jXMw3suy821vqMxMVofZs
nbvducxrWz3c4T2SUt0b609N6ze / DY23Ezam + o / Eym7LQydu8bXOa5s9w4pKdBnUMC2qi + rJpfVl
HbjvbY0ttdDnRW4GHGGk6eCSmOP1TpuZTZkYmXRfTSSLbKrGPYwjUhzmuIEJKSuy8VjWufdW1r2G
xpLgAWNG5zhrwAdSkpVGTjZTd + Nay5o03VuDh97SUlJUlKSU8p / 60X / 1Qf8AxjSU6v1T / wDEr0b /
ANN + L / 55rSU6ySmr1O1tGDbY9r7AAAGVCXuLiGhrRI1JKSngj1Ho7 / rPidczb7W2Gj0MamiSCHm2
wvyIPmYAnjx0CUzzfq + 5 + Tl3Nx + lX78uyz9LVmB + 179xl1P53HYz48JKb3Ren / WLp1t7ekM6PS7I
Ae9jWZbWkM3Bpl / f3idfkkp2MBn10ZfW3Ou6bdRuBucxtot2EmdnDfCJSU7qSl0lKSUpJSklKSU +
f9U6n0bpfWer / typ7cv16bqra6i8uxjUWVuhkHa0h7XOMwfkkpN0rqPRuqdT6Y / pFDjlWXW3XXPq
dX6eMMf03uHqbjtLvTaOJ + 9JSDp3Tsx2H0voF93TbcXpLsh / rV5bjZkBtWTQG + k2qa49b3ncYSUk
6Pg5eDg29MzM7BrwX / ZzS2y + u61uPU2xz2vtrqxvUYXVEN / khySnQsZUMdmNbn4Zbj4 + ZVU43ATV
c1janEEmA3g + UJKdDozG2Z / r7sVjsfGbjPrxrfVc4nY9r7IayPbG3Tukp3UlKSU8p / 60X / 1Qf / GN
JTq / VP8A8SvRv / Tfi / 8AnmtJTrJKYW1VX1uquaHsdo5rhIKSmr + xukzWfslM1R6fsb7dpL29uznE
pKZO6R0pxe52HQTYSXk1t9xcZO7TWSkpiei9ILBWcKjaNQ302gfkSUzp6Z07Ht9ejFprtHFjGNDu
I5A8ElNpJSklKSUpJSklKSU53WPq / wBH68ytnVcZt / ondU8FzLGE87LK3NeJjWCkpl0voXSOiiz9
m4zaXXHdbZq + x + pd7rHlziJJgTokpu7GSTtEnkxykpRrrOha37gkpYVVt + ixo76AcpKU2qphBYxr
SJAIAHOpSUzSUpJTyn / rRf8A1Qf / ABjSU6v1T / 8AEr0b / wBN + L / 55rSU6ySlJKUkpSSlJKUkpSSl
JKUkpSSlJKUkpSSlJKUkpSSlJKUkpSSlJKeU / wDWi / 8Aqg / + MaSn / 9k =
uuid: cc01c10d-2bf0-4653-84ec-d630b21b77c3adobe: docid: indd: 0ec271df-68a2-11de-ab04-f5e7926250aaproof: pdf8b6d611c-8bbf-11dd-3bedec4-dabec8ec-8bfdd-3bedc8ec8ec-9fc8ec-9fc8ec-9fdec-9fdc8ec-9fc8ec-9fc-8ec-9fc8ec-9fc8ec-9fc8ec-9fdec-8ec-8e-8e-8ec-9fc8ec8 СсылкаStream72. 0072.00 Inchesuuid: 811B7F17462E11DA98ABB33C827576F0uuid: 811B7F16462E11DA98ABB33C827576F0
0072.00 Inchesuuid: 811B7F17462E11DA98ABB33C827576F0uuid: 811B7F16462E11DA98ABB33C827576F0
application / pdf Adobe PDF Library 8. 0 Ложь
0 Ложь
конечный поток
endobj
500 0 объект
> / Кодировка >>>>>
endobj
424 0 объект
>
endobj
421 0 объект
>
endobj
422 0 объект
>
endobj
423 0 объект
>
endobj
425 0 объект
>
endobj
431 0 объект
>
endobj
437 0 объект
>
endobj
443 0 объект
>
endobj
449 0 объект
>
endobj
455 0 объект
>
endobj
456 0 объект
>
endobj
457 0 объект
>
endobj
458 0 объект
>
endobj
459 0 объект
>
endobj
460 0 объект
>
endobj
461 0 объект
>
endobj
462 0 объект
>
endobj
463 0 объект
>
endobj
464 0 объект
>
endobj
352 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
354 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
356 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
358 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
360 0 объект
> / ExtGState >>> / Тип / Страница >>
endobj
362 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
364 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
366 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
368 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
370 0 объект
> / Font> / ProcSet [/ PDF / Text] / ExtGState >>> / Type / Page >>
endobj
371 0 объект
> поток
HWYS8 ~ ӖE + 6PTAW
$ 9cxJjZ_ҳ}% JXwN’C # O! ڟ ߕ f2QF \ / CǏIA @ & uOY ~ \ [zUxDGBϱ t2T> fU | 1 Mng ܪ} ĮD] FyINEzbkV] ߡ V] 2, $ CJceST / 5Z2L ֲ Y45lqr3 [mnz6sqr3] (a_5ґ, t, kSb = xvvfcP [pGzIRf6rїS03. UN ~ V / yB = / c0Y} ҄a2 qk 㪲 5w [ZTK = y9fVBL OG5 * L &? UTq:
UN ~ V / yB = / c0Y} ҄a2 qk 㪲 5w [ZTK = y9fVBL OG5 * L &? UTq:
f, fzk: Bri # E.Too) \ v
VWu | ~] 9F
Методы стерилизации выдерживают испытание временем
| Карл Дж. Хеммерих — руководитель производственного отдела компании STERIS Isomedix (Сэнди, Юта), а Джон Мейсфилд — исполнительный советник STERIS. Джерри Р.Нельсон, доктор философии, является директором Nelson Laboratories Inc. (Солт-Лейк-Сити). |
За последние 25 лет промышленность медицинского оборудования претерпела значительные изменения. Стерилизация также развивалась, иногда реагируя на требования отрасли, а иногда являясь лидером в новых методах, стандартах и процессах. В глазах тех, кто смотрит в будущее с 1979 года, многие медицинские устройства сегодня очень сложны по своей природе и конструкции, в то время как другие практически не изменились. Технологии стерилизации, оставшиеся неизменными в физике и химии микробной инактивации, претерпели метаморфозы иного рода, чем медицинские продукты, которые они поддерживают.
Технологии стерилизации, оставшиеся неизменными в физике и химии микробной инактивации, претерпели метаморфозы иного рода, чем медицинские продукты, которые они поддерживают.
В 1980 году основными методами стерилизации медицинских изделий были этиленоксид (EtO), гамма, электронный луч (E-луч), влажное тепло, сухое тепло, жидкие химические бактерицидные средства и другие газовые методы. Спустя более 20 лет методы первичной стерилизации остаются прежними. Итак, ничего не изменилось?
Каждый метод стерилизации эффективно убивает организмы, и обычно один метод более эффективен или более эффективен для данного продукта, чем другой.Однако изменения в самих методах, стандартах и разработке биологических индикаторов (BI) и параметрического выпуска привели к изменениям в процессах и сдвигам в предпочтениях отрасли. В этой статье рассматриваются эти изменения и их влияние на рынок стерилизации медицинских изделий за последние 25 лет.
Стерилизация медицинских изделий
В 1980 году EtO использовался почти для 90% всех стерилизованных устройств.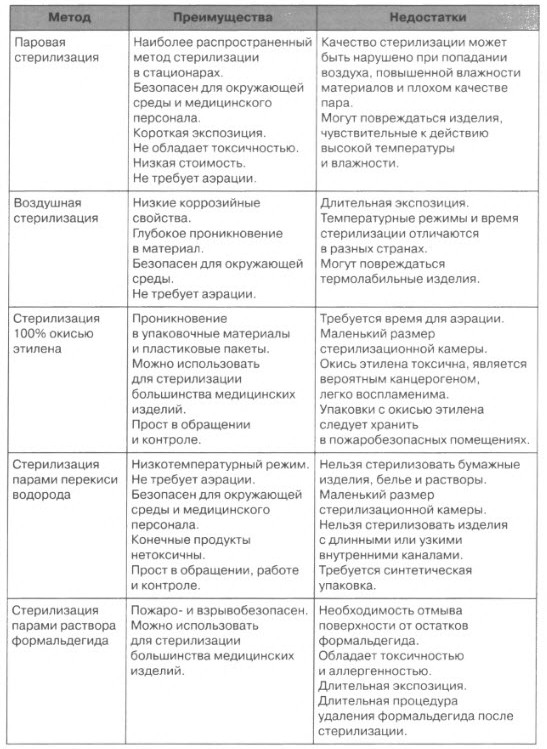 В то время только крупнейшие производители использовали стерилизацию либо гамма-, либо электронным пучком.Подрядчики по облучению только появлялись с ограниченным количеством объектов. Фактически, два крупнейших контрактных облучателя, STERIS Isomedix и Sterigenics, были основаны только в 1970-х годах. На рис. 1 показана разбивка использования EtO, гамма- и электронного пучка, а также для внутренней и контрактной стерилизации с 1980 по 2003 год.
В то время только крупнейшие производители использовали стерилизацию либо гамма-, либо электронным пучком.Подрядчики по облучению только появлялись с ограниченным количеством объектов. Фактически, два крупнейших контрактных облучателя, STERIS Isomedix и Sterigenics, были основаны только в 1970-х годах. На рис. 1 показана разбивка использования EtO, гамма- и электронного пучка, а также для внутренней и контрактной стерилизации с 1980 по 2003 год.
Один из аспектов индустрии медицинского оборудования, который скрыт в данных, заключается в том, что постоянно растущая часть производства медицинского оборудования в США и Канаде перемещается за границу.Однако многие из этих продуктов иностранного производства возвращаются в Северную Америку для окончательной стерилизации.
Причина такой модели связана как с корпоративной структурой, так и с разницей в капитальных вложениях, необходимых для производственных операций, по сравнению со стерилизацией. Производство часто требует минимальных затрат как на рабочую силу, так и на основное оборудование, в то время как стерилизационные помещения требуют значительных капиталовложений в оборудование.
Роль стандартов. Разработка стандартов и руководств сыграла решающую роль в успехах стерилизации.И Ассоциация по развитию медицинского оборудования (AAMI), и Международная организация по стандартизации (ISO) разработали жизнеспособные руководства по валидации, которые относительно легко выполнить.
Эти стандарты часто возникали в ответ на требования FDA и международных регулирующих органов, касающиеся надлежащей производственной практики и обеспечения качества. За поправками к медицинским изделиям 1976 года последовали руководящие документы FDA «Планирование обеспечения качества воспроизводства» в 1981 и 1988 годах и его «Руководство по общим принципам валидации процессов» в 1983 и 1987 годах, которые изменили способ рассмотрения и проверки стерильности.Они были дополнены поправками 1990 года.
Сегодня директивы AAMI и ISO позволяют компаниям реализовать программу стерилизации без необходимости в большом и обременительном отделе стерилизационных технологий. Эти добровольные консенсусные стандарты также предоставили регулирующим органам, таким как FDA, ссылку, на которой основывается их определение стерильности продукта. В таблице I представлен список действующих стандартов стерилизации AAMI и ISO.
В таблице I представлен список действующих стандартов стерилизации AAMI и ISO.
Контрактная стерилизация. В ответ на требования рынка услуги по стерилизации по контракту значительно расширились.Рост объема контрактных услуг по стерилизации стал результатом стремления производителей медицинского оборудования снизить затраты.
Доступность контрактных услуг сыграла важную роль в разработке сложных медицинских изделий. Без необходимости инвестировать в необходимое оборудование или рабочую силу, компании имеют доступ к современным средствам стерилизации, необходимым для таких продуктов.
Совпадение этих событий способствовало прогрессу стерилизации за последние 25 лет.Сокращение времени выполнения работ часто является требованием для выживания. Были разработаны методы, системы и руководящие принципы для выполнения широко используемых сегодня методов производства «точно в срок». Параметрический выпуск и мгновенные BI — это лишь две революционные концепции, разработанные для сокращения времени выполнения работ и повышения надежности стерилизации для производителей.
Стерилизация EtO
Стерилизация EtO имеет решающее значение для стерилизации одноразовых медицинских устройств с момента ее открытия Филлипсом и Кей в 1944 году.Они наткнулись на него во время проведения работ по биологической дезактивации в Форт-Детрике, штат Мэриленд, для армии США. В 1980-х годах EtO потерял некоторую долю рынка из-за стерилизации облучением в результате экологических законов (например, Монреальского протокола [1987], Калифорнийского закона 65, Калифорнийского округа управления качеством воздуха и других нормативных актов Агентства по охране окружающей среды), которые были разработаны, чтобы ограничить разрушение. озонового слоя Земли фторированными газами.
В то время многие думали, что использование EtO будет прекращено; однако сокращение использования оказалось лишь временной неудачей, поскольку компании внесли необходимые изменения для перехода с смеси 12/88-EtO / хлорфторуглерод-газ на газ 100% EtO.С тех пор стерилизация EtO неуклонно росла, поскольку она опиралась на директивы ANSI / AAMI / ISO ST27 / 11135-1994, существующие капитальные вложения, минимальные затраты на модернизацию и доступность подрядчиков.
Основные достижения в области стерилизации EtO включают улучшенные BI, параметрический выпуск, более низкие концентрации газа и улучшенные методы дегазации. БИ превратились из почвенных или песчаных бактерий в первые годы существования EtO в белковые альтернативы с еще более быстрым временем отклика. Фактически, процесс параметрического выпуска сократился с 10–14 дней, которые были обычными для выпуска BI в конце 1970-х годов, до нынешних 2 дней.Даже боязнь иметь дело с остатками EtO уменьшилась благодаря использованию продувки азотом, циклической термической промывки и других методов обработки.
Параметрическая разблокировка, которая была реализована на нескольких внутренних стерилизационных установках 12/88 EtO 20 лет назад, теперь используется на многих внутренних и контрактных объектах. Появление искробезопасных инфракрасных спектрофотометров, а также систем с компьютерным управлением сделало возможным параметрическое высвобождение в процессах 100% EtO. Расширенные исследования по сокращению времени инкубации BI, более низкие остаточные количества и параметрический выпуск в конечном итоге привели к более безопасным продуктам и более коротким временам хранения продуктов.
Гамма-стерилизация
| Таблица I. Обзор мировых стандартов стерилизации и связанных с ней стандартов (щелкните, чтобы увеличить). |
Гамма-стерилизация была технологией после Второй мировой войны. В начале 1960-х он первоначально использовался для уничтожения сибирской язвы на шерсти и ковре.
производство в Австралии. Однако гамма не использовалась для стерилизации медицинских изделий в Северной Америке до 1964 года.Управление по атомной энергии Канады (позднее MDS Nordion; Оттава, Онтарио) ввело в эксплуатацию первую промышленную установку для стерилизации кобальтом-60 для стерилизации хирургических швов для подразделения Ethicon компании Johnson & Johnson.
В 1972 году Isomedix (позже STERIS Isomedix) открыла свою первую контрактную облучательную установку в Нью-Джерси. Sterigenics открыла свое первое гамма-предприятие в 1979 году. Примерно в то же время несколько крупных производителей медицинского оборудования инвестировали в эту новую технологию.
Разработка радиационно-стойких полимеров с улучшенными характеристиками была ключом к успеху гамма-стерилизации.Сегодня составы из ПВХ и поликарбоната исключают коричнево-желтый цвет, характерный для предшествующих продуктов.
Радиационно-стойкий полипропилен был разработан для предотвращения хрупкости, которая ранее ограничивала использование полимера в изделиях, которые подлежат стерилизации облучением. Отчет 17 с технической информацией AAMI был опубликован в 1997 году для определения стабильности материалов, эффектов обработки и надлежащих методов аттестации испытаний (включая ускоренное старение).
Методы проверки также улучшились.Руководящие принципы прошли путь от «просто использовать 2,5 миллиардера» до метода Килмера, до ANSI / AAMI ST32 (1980/1990), до AAMI / ISO 11137 (1994) и AAMI / ISO 13409 (1996), и, наконец, до нынешних МДП 27 VDмакс. В 1974 г. под эгидой AAMI был сформирован комитет для разработки руководящих принципов рационального управления процессом стерилизации медицинских изделий.
Разработанные руководящие принципы валидации включали разработку рациональных методов установки дозы, учитывающих фактическую бионагрузку продукта, ее распределение на продукте, его радиационную стойкость и, в ограниченной степени, конечное использование продукта.К 1994 году, после большой работы и серии национальных и международных встреч, методы установления дозы AAMI получили всемирное признание, когда были включены, с небольшими изменениями, в ISO 11137.
Использование этих рациональных методов установки дозы часто приводило к стерилизации доз. намного ниже, чем у традиционных 2,5 миллиардера, что еще больше расширило диапазон обычных медицинских пластмасс, которые можно стерилизовать без получения неприемлемого цвета, твердости или хрупкости. Важно отметить, что единица измерения дозы облучения была изменена с мегарад (Mrd) на килограммы (кГр), чтобы соответствовать конвенциям System International.
К середине 1990-х годов все большее количество контрактных установок для гамма-облучения предоставляли услуги по стерилизации производителям медицинских изделий, что делало радиационную стерилизацию более конкурентоспособной.
Национальная сеть крупномасштабных контрактных облучательных предприятий означает, что компаниям здравоохранения больше не нужно строить собственные облучатели. Многие производители устройств сняли с эксплуатации свои собственные облучательные установки в пользу использования контрактных облучательных установок.
Математическое моделирование. Производители все больше интересуются математическим моделированием распределения дозы в облученных продуктах. Такое моделирование может помочь улучшить процесс проектирования, оценки и контроля. Производители надеются лучше понять распределение поглощенной дозы в продуктах с неоднородной плотностью, когда продукты подвергаются воздействию ионизирующего излучения в промышленном облучателе. Они также надеются свести к минимуму количество требуемых физических дозиметров.
Использование дозиметрии для измерения фактической дозы, применяемой во время обработки, также претерпело изменения.Использование большого количества тонких пленок и дозиметров из окрашенного пластика привело к тому, что в производственных циклах облучения реже используются более точные эталонные дозиметры аланина. Были разработаны прогнозные математические модели для установок гамма-, высокоэнергетического электронного и рентгеновского облучения. Как определено математическим моделированием, дозиметры размещаются в зонах минимальной и максимальной дозы в облучаемых продуктах. Другие разработки в области дозиметрии включают калибровку дозиметров через Интернет и мониторинг поглощенной дозы в реальном времени.
Были разработаны прогнозные математические модели для установок гамма-, высокоэнергетического электронного и рентгеновского облучения. Как определено математическим моделированием, дозиметры размещаются в зонах минимальной и максимальной дозы в облучаемых продуктах. Другие разработки в области дозиметрии включают калибровку дозиметров через Интернет и мониторинг поглощенной дозы в реальном времени.
Стерилизация электронным пучком и рентгеновскими лучами
| Рис. 1. Столбики для каждого года показывают долю рынка для EtO, гамма-излучения и электронного пучка / Методы рентгеновской стерилизации для репрезентативных лет с 1980 по 2003. Наложенные линии показывают использование промышленностью собственных и контрактных стерилизационных помещений в тот же период (щелкните, чтобы увеличить). |
Самым большим изменением на рынке электронно-лучевой системы стало повышение надежности систем доставки. Компания IBA Inc. произвела революцию на рынке электронного пучка, выпустив ускоритель Rhodotron, в то время как Titan Scan Systems повысила надежность конструкции линейного ускорителя. Помимо самих ускорителей, системы обработки материалов совершили качественный скачок, чтобы лучше представить продукт лучу согласованно и точно.
Компания IBA Inc. произвела революцию на рынке электронного пучка, выпустив ускоритель Rhodotron, в то время как Titan Scan Systems повысила надежность конструкции линейного ускорителя. Помимо самих ускорителей, системы обработки материалов совершили качественный скачок, чтобы лучше представить продукт лучу согласованно и точно.
Рентген только недавно начали использовать для промышленной стерилизации. Однако на самом деле это была первая радиационная технология стерилизации медицинских изделий в конце 1800-х годов. Электронный пучок нашел свою первую медицинскую нишу в 1956 году как метод стерилизации, когда компания Johnson & Johnson использовала его для наложения швов.
Недавние разработки привели к поиску возможности использования рентгеновских лучей в мощных ускорителях электронов на 5–10 миллионов электрон-вольт (МэВ) с целью обеспечения стерилизации медицинских изделий с высокой плотностью и окончательной стерилизации термочувствительных, медицинские изделия низкой плотности.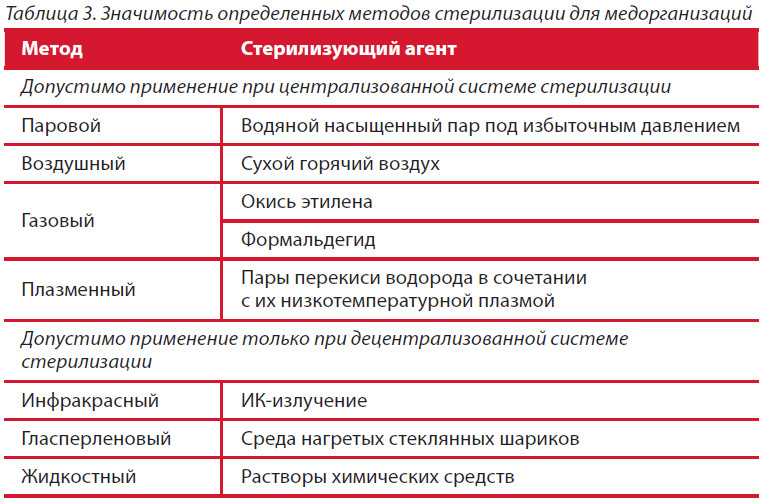
Достигнут прогресс в разработке модульных герметичных электронно-лучевых трубок, работающих при напряжении около 100 кВ. Трубки перспективны для использования с низким энергопотреблением, особенно при стерилизации поверхности медицинских устройств и фармацевтических упаковочных материалов, используемых в процессе асептического розлива.
Испаренная перекись водорода
Стерилизация испарением перекиси водорода (VHP) все чаще используется для промышленной стерилизации медицинских устройств. В качестве низкотемпературного газового метода стерилизации он является альтернативой EtO для некоторых продуктов. Он не проникает так сильно, как оксид этилена; тем не менее, он предлагает некоторые преимущества, включая превосходную совместимость материалов и короткое время цикла. А поскольку перекись разлагается на воду и кислород, время аэрации практически отсутствует.VHP также является спороцидным в очень низких концентрациях (обычно 1-2 мг / л при 25 ° C).
Как и все методы стерилизации, VHP имеет ограничения. Поскольку ему не хватает проникновения, доступного для EtO, должен быть открыт путь для газа, и некоторые материалы (например, целлюлоза) не могут быть обработаны.
Поскольку ему не хватает проникновения, доступного для EtO, должен быть открыт путь для газа, и некоторые материалы (например, целлюлоза) не могут быть обработаны.
Проверка для VHP аналогична проверке для EtO. Поскольку стерилизация VHP не имеет единого стандарта, концепции, изложенные в ANSI / AAMI / ISO 14937 для общих требований к стерилизующему агенту, могут быть использованы для разработки соответствующей стратегии валидации.Также можно использовать другие опубликованные стандарты EtO. Несколько компаний недавно получили разрешение 510 (k) на использование VHP для окончательной стерилизации своих медицинских устройств.
Стерилизация паром
Медицинские изделия, изготовленные из термостойких материалов, можно обрабатывать паром. Использование пара увеличивается из-за присущих ему низких производственных и капитальных затрат, прямого внутреннего контроля и параметрического выпуска; однако он остается небольшим процентом от общего рынка.
Некоторые подрядчики по стерилизации теперь предоставляют услуги по стерилизации паром. Кроме того, доступны различные упаковочные материалы, которые могут быть
Кроме того, доступны различные упаковочные материалы, которые могут быть
подтверждено.
Стерилизация сухим жаром
AAMI недавно выпустил новый стандарт для проверки стерилизации сухим жаром. Традиционно считается, что сухой жар составляет 170–180 ° C в течение часа; тем не менее, более длительное время работы при значительно более низких температурах также может быть подтверждено. Все большее количество медицинских устройств обрабатывается сухим теплом (160 C), хотя его долю на рынке определить нелегко, поскольку большая часть обработки сухим теплом не передается на аутсорсинг.Также теперь доступны упаковочные материалы, которые могут выдерживать суровые условия сухого тепла.
Будущее стерилизации
За последние 25 лет стерилизация эволюционировала, чтобы идти в ногу с индустрией медицинского оборудования. Хотя сами технологии стерилизации остались неизменными по своей физике и химии, некоторые значительные разработки позволили усовершенствовать методы и процессы. Будущее обещает предложить еще более существенные разработки. Ключевые изменения на рынке стерилизации в целом должны включать:
Будущее обещает предложить еще более существенные разработки. Ключевые изменения на рынке стерилизации в целом должны включать:
• Изменения требований к уровню обеспечения стерильности (SAL) для различных групп устройств.На международном уровне требование о маркировке устройства «стерильным» заявлением требует SAL 10–6. В будущем это требование может быть пересмотрено, чтобы разрешить продукты с альтернативными SAL (т. Е. 10–3, 10–4 и т. Д.) В зависимости от необходимости в таких повышенных SAL и использования продукта.
• Альтернативные методы газовой стерилизации, такие как перекись водорода в паровой фазе и перекись водорода в паровой фазе плазмы, предлагаются на контрактной основе.
• Массовый исход стерилизации за границу, аналогичный исходу производства устройств.
• Методы, которые менее зависимы от энергии (т. Е. Более рентабельны) для борьбы с растущими ценами на энергию.
• Улучшенный производственный контроль, уменьшающий проблемы с выбросами бионагрузки.
• Документы групп по разработке стандартов, описывающие, как бороться с выбросами бионагрузки.
• Методы быстрого экологического мониторинга на производстве.
• Дальнейшая гармонизация международных методов.
Основные достижения в области стерилизации и обработки EtO включают:
• BI, которые предлагают практически мгновенное время отклика.
• Дальнейшие разработки в области параметрического выпуска для стерилизации EtO.
• Развитие отраслевых рекомендаций по валидации.
Разработки в области гамма-стерилизации, вероятно, будут включать:
• Окончательная разработка и внедрение рекомендаций VDmax для доз, отличных от 25 кГр, с проверкой с использованием этого метода от 15 до 35 кГр.
• Развитие отраслевых рекомендаций по валидации. В 2004 году должна быть выпущена следующая редакция стандартов AAMI 11137: проект стандарта AAMI 11137-1 «Требования к процессу радиационной стерилизации»; Проект стандарта AAMI 11137-2, «Методы валидации радиационной стерилизации»; и проект стандарта AAMI 11137-3 «Дозиметрия для радиационной стерилизации. ”
”
• Отсутствие требования к валидации стерилизующей дозы для устройств с доказанной очень низкой бионагрузкой.
• Прогностическая дозиметрия с использованием математического моделирования, основанного на применении имеющихся в настоящее время знаний и компьютерных возможностей.
• Параметрический выпуск для лучевой обработки. Давление на конкуренцию с точки зрения затрат и более совершенная наука (основанная на улучшенном компьютерном управлении и системах измерения доз в реальном времени) могут продвигать эту осуществимую методологию вперед.
• Альтернативные стратегии установки дозы, позволяющие дополнительно расширить возможности стерилизационного микробиолога.
Лабораторные усовершенствования должны включать:
• Быстрые микробиологические методы, которые сокращают время, необходимое для оценки бионагрузки, примерно с недели до дня. Технологии уже существуют, но они получат широкое распространение по мере того, как станут более известными нормативное признание, осведомленность и их полезность.
• Методы генетической идентификации микробов как стандарт для идентификации экологических изолятов, отслеживания бионагрузки и расследования отказов.
• Технологические усовершенствования, такие как изоляторы, респираторы с HEPA-фильтром для чистых помещений и улучшенные защитные халаты и материалы халатов, которые повышают надежность существующих методов испытаний на стерильность.
• Новые быстрые микробиологические методы, заменяющие существующую процедуру тестирования на стерильность.
Благодаря этим разработкам стерилизация останется неотъемлемой частью индустрии медицинских изделий. Как и в последние 25 лет, мы уверены, что MD&DI будет предлагать вам обновления и разработки, которые будут происходить в следующие 25 лет.
Авторские права © 2004 Медицинское оборудование и диагностическая промышленность
6.14A: тепло — биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Стерилизация влажным теплом
- Стерилизация сухим теплом
- Ключевые моменты
- Ключевые термины
Цели обучения
- Оценить тепло как средство микробиологического контроля
Нагревание бактериальных сред и посуды в исследованиях и медицине, а также для стерилизации пищевых продуктов является одним из наиболее распространенных методов контроля роста бактерий. Для стерилизации используются разные методы и инструменты.
Для стерилизации используются разные методы и инструменты.
Стерилизация влажным теплом
Влажное тепло вызывает разрушение микроорганизмов путем денатурации макромолекул, в первую очередь белков. Автоклавирование (приготовление под давлением) — очень распространенный метод влажной стерилизации. Он эффективен в уничтожении грибков, бактерий, спор и вирусов, но не обязательно устраняет прионы. При такой стерилизации образцы помещаются в паровую камеру. Камера закрывается и нагревается, так что пар вытесняет воздух из вентиляционных отверстий или выхлопов.Затем прикладывают давление, чтобы внутренняя температура достигла 121 ° C. Эта температура поддерживается от 15 до 30 минут. Этой повышенной температуры и давления достаточно для стерилизации образцов от любых обычно встречающихся микробов или спор. Затем камере дают возможность медленно остыть или путем пассивного рассеивания тепла.
Стерилизация под давлением является преобладающим методом медицинской стерилизации термостойких инструментов. Он также используется для стерилизации материалов для микробиологии и других областей, требующих асептической техники.Для облегчения эффективной стерилизации паром и давлением используется несколько методов проверки и индикации; к ним относятся меняющие цвет индикаторные ленты и биологические индикаторы. Для любого метода стерилизации влажным теплом обычно используются биологические индикаторы в качестве средства проверки и подтверждения. При использовании биологических индикаторов образцы, содержащие споры термостойких микробов, таких как Geobacillus stearothermophilis , стерилизуются вместе со стандартной загрузкой, а затем инкубируются в стерильных средах (часто содержащихся в образце в стеклянной ампуле, которую необходимо разбить после стерилизации).Изменение цвета среды (указывающее на продукцию кислоты бактериями; требуется, чтобы среда была составлена для этой цели) или появление помутнения (помутнение, указывающее на рассеяние света бактериальными клетками) указывает на то, что стерилизация не была достигнута и цикл стерилизации может нуждаться в пересмотре.
Он также используется для стерилизации материалов для микробиологии и других областей, требующих асептической техники.Для облегчения эффективной стерилизации паром и давлением используется несколько методов проверки и индикации; к ним относятся меняющие цвет индикаторные ленты и биологические индикаторы. Для любого метода стерилизации влажным теплом обычно используются биологические индикаторы в качестве средства проверки и подтверждения. При использовании биологических индикаторов образцы, содержащие споры термостойких микробов, таких как Geobacillus stearothermophilis , стерилизуются вместе со стандартной загрузкой, а затем инкубируются в стерильных средах (часто содержащихся в образце в стеклянной ампуле, которую необходимо разбить после стерилизации).Изменение цвета среды (указывающее на продукцию кислоты бактериями; требуется, чтобы среда была составлена для этой цели) или появление помутнения (помутнение, указывающее на рассеяние света бактериальными клетками) указывает на то, что стерилизация не была достигнута и цикл стерилизации может нуждаться в пересмотре. или улучшение. Другими влажными методами являются кипячение образцов в течение определенного периода времени и тиндаллизация. Кипячение не помогает избавиться от спор. Тиндаллизация также инактивирует споры, но это более длительный процесс.
или улучшение. Другими влажными методами являются кипячение образцов в течение определенного периода времени и тиндаллизация. Кипячение не помогает избавиться от спор. Тиндаллизация также инактивирует споры, но это более длительный процесс.
Рисунок: Автоклав : Большой автоклав, используемый для влажной стерилизации сред и оборудования
Стерилизация сухим жаром
Сухой жар уничтожает микроорганизмы, вызывая коагуляцию белков. Процесс стерилизации сухим жаром осуществляется кондуктивным способом; именно здесь тепло поглощается внешней поверхностью предмета и затем передается внутрь следующему слою. В конце концов, весь предмет достигает нужной температуры, необходимой для стерилизации.Время и температура стерилизации сухим жаром составляет 160 ° C в течение 2 часов или 170 ° C в течение 1 часа. Инструменты должны быть высушены перед стерилизацией, так как вода будет мешать процессу. Другие методы тепловой стерилизации включают в себя пламя и сжигание. Пламя обычно используется для стерилизации небольшого оборудования, используемого для асептической обработки бактерий. Если оставить контуры переноса в пламени горелки Бунзена или спиртовой лампы до тех пор, пока они не загорятся красным, то любой инфекционный агент будет инактивирован. Обычно это используется для небольших металлических или стеклянных предметов, но не для больших предметов (см. Сжигание ниже).Однако во время первоначального нагрева инфекционный материал может «разбрызгиваться» с поверхности провода до того, как он погибнет, загрязняя близлежащие поверхности и предметы. Поэтому были разработаны специальные нагреватели, которые окружают инокуляционный контур нагретой клеткой, гарантируя, что такой распыляемый материал не будет дополнительно загрязнять зону. Другая проблема заключается в том, что газовое пламя может оставлять на объекте загрязнения, например углерод, если объект недостаточно нагревается. Вариант пламени — окунуть объект в 70% этанол (или более высокую концентрацию) и просто прикоснуться к нему на короткое время к пламени горелки Бунзена, но не удерживать его в газовом пламени.
Пламя обычно используется для стерилизации небольшого оборудования, используемого для асептической обработки бактерий. Если оставить контуры переноса в пламени горелки Бунзена или спиртовой лампы до тех пор, пока они не загорятся красным, то любой инфекционный агент будет инактивирован. Обычно это используется для небольших металлических или стеклянных предметов, но не для больших предметов (см. Сжигание ниже).Однако во время первоначального нагрева инфекционный материал может «разбрызгиваться» с поверхности провода до того, как он погибнет, загрязняя близлежащие поверхности и предметы. Поэтому были разработаны специальные нагреватели, которые окружают инокуляционный контур нагретой клеткой, гарантируя, что такой распыляемый материал не будет дополнительно загрязнять зону. Другая проблема заключается в том, что газовое пламя может оставлять на объекте загрязнения, например углерод, если объект недостаточно нагревается. Вариант пламени — окунуть объект в 70% этанол (или более высокую концентрацию) и просто прикоснуться к нему на короткое время к пламени горелки Бунзена, но не удерживать его в газовом пламени. Этанол загорится и выгорит через несколько секунд. 70% этанол убивает многие, но не все, бактерии и вирусы. Его преимущество в том, что он оставляет меньше остатков, чем газовое пламя. Этот метод хорошо подходит для стеклянных разносчиков бактерий в форме «хоккейной клюшки». Сжигание также сожжет любой организм дотла. Он используется для дезинфекции медицинских и других биологически опасных отходов перед их утилизацией вместе с неопасными отходами.
Этанол загорится и выгорит через несколько секунд. 70% этанол убивает многие, но не все, бактерии и вирусы. Его преимущество в том, что он оставляет меньше остатков, чем газовое пламя. Этот метод хорошо подходит для стеклянных разносчиков бактерий в форме «хоккейной клюшки». Сжигание также сожжет любой организм дотла. Он используется для дезинфекции медицинских и других биологически опасных отходов перед их утилизацией вместе с неопасными отходами.
Ключевые моменты
- Для стерилизации используются разные методы.Одним из наиболее распространенных является применение влажного тепла, которое включает автоклавирование (приготовление под давлением), кипячение и тиндаллизацию.
- Стерилизация сухим жаром осуществляется методом кондукции и широко используется для инструментов.
- Другие методы нагрева включают пламя и сжигание. Пламя обычно используется для стерилизации небольшого оборудования, используемого для асептической обработки бактерий.

Ключевые термины
- стерилизация : Любой процесс, который устраняет или уничтожает все формы микробной жизни, присутствующие на поверхности, растворе или твердом соединении.
- Тиндаллизация : Тиндаллизация — это процесс трех последовательных паровых обработок для достижения стерилизации в течение трех дней. Это работает, убивая вегетативные клетки, позволяя прорастать выжившим спорам и убивая образовавшиеся вегетативные клетки до того, как они успеют образовать новые споры.
(PDF) СТЕРИЛИЗАЦИЯ И ДЕЗИНФЕКЦИЯ
55
Стерилизация и дезинфекция
МИКРОБИОЛОГИЯ
МОДУЛЬ
Микробиология
Примечания
Недостатки: пары плохо проникают, не проникают в листья
, не проникают
листьев -летучий остаток, активность снижается в присутствии
белка.Глютеральдегид требует щелочного pH, и только те изделия, которые смачиваются
, можно стерилизовать.
Фенол
Механизм действия: действует путем разрушения мембран, осаждения белков и
инактивации ферментов.
Примеры: 5% фенол, 1-5% крезол, 5% лизол (омыленный крезол),
гексахлорофен, хлоргексидин, хлороксиленол (Деттол)
Применение: Джозеф Листер использовал его для предотвращения инфицирования хирургических ран.
Фенолы — производные каменноугольной смолы.Они действуют как дезинфицирующие средства при высокой концентрации
и как антисептики при низкой концентрации. Они являются бактерицидными, фунгицидными,
микобактерицидными, но неактивны в отношении спор и большинства вирусов. Они не инактивируются органическими веществами
. Коррозионные фенольные смолы используются для дезинфекции полов палат
, для утилизации банок в лабораториях и дезинфекции
тазов. Хлоргексидин можно использовать в виде раствора изопропанола для дезинфекции кожи
или в виде водного раствора для орошения ран. Часто используется как антисептик для мытья рук
Часто используется как антисептик для мытья рук
. 20% раствор хлоргексидина глюконата используется для предварительной подготовки рук и кожи до
, а также для общей дезинфекции кожи.
Глюконат хлоргексидина также смешивают с соединениями четвертичного аммония
, такими как цетримид, для усиления и расширения антимикробного эффекта (например, Savlon).
Хлороксиленолы обладают меньшим раздражающим действием, их можно использовать для местного применения и более
эффективнее против грамположительных бактерий, чем грамотрицательных бактерий.
Гексахлорофен представляет собой хлорированный дифенил и вызывает гораздо меньшее раздражение. Он имеет заметный эффект
на грамположительные бактерии, но слабый эффект на грамотрицательные бактерии,
микобактерии, грибы и вирусы. Триклозан представляет собой органический фениловый эфир с хорошей активностью
против грамположительных бактерий и до некоторой степени эффективен против многих
грамотрицательных бактерий, включая Pseudomonas. Он также имеет удовлетворительную активность в отношении грибов
Он также имеет удовлетворительную активность в отношении грибов
и вирусов.
Недостатки: токсичен, вызывает коррозию и раздражает кожу.Хлоргексидин
инактивирован анионным мылом. Хлороксиленол инактивируется жесткой водой.
Галогены
Механизм действия: Они являются окислителями и вызывают повреждение в результате окисления
основных сульфидрильных групп ферментов. Хлор реагирует с водой с образованием хлорноватистой кислоты
, которая обладает бактерицидным действием.
Примеры: соединения хлора (хлор, отбеливатель, гипохлорит) и йод
соединения (настойка йода, йодофоры)
Лучшие 5 методов, используемых для стерилизации
Процесс, который эффективно убивает или устраняет инфекционные агенты (такие как грибы, бактерии, вирусы, формы спор и т. Д.)) с поверхности оборудования, изделия, продукта питания, лекарства или биологической питательной среды называется стерилизацией. Стерилизация осуществляется методами согласно требованиям. Это следующие методы: 1. Стерилизация влажным жаром 2. Стерилизация сухим жаром 3. Стерилизация газом и другие.
Это следующие методы: 1. Стерилизация влажным жаром 2. Стерилизация сухим жаром 3. Стерилизация газом и другие.
Метод № 1. Стерилизация влажным теплом :
При стерилизации паром используется умеренное давление. Пар используется под давлением как средство достижения повышенной температуры.Важно обеспечить использование пара правильного качества, чтобы избежать следующих проблем, таких как перегрев пара, нарушение проникновения пара в пористые нагрузки, неправильный отвод воздуха и т. Д.
Для водных препаратов и хирургических повязок проводят нагрев в насыщенном паре под давлением. Было предложено несколько комбинаций времени и температуры.
Британская и Европейская фармакопеи (2001) рекомендовали температуру 121 ° C и температуру 15 фунтов / дюйм 2 , поддерживаемую на протяжении всей загрузки в течение 15 минут, как предпочтительную комбинацию для этого метода окончательной стерилизации.Он используется для стерилизации водных парентеральных растворов и суспензий, хирургической повязки и тканей, пластиковых и резиновых крышек, металлических инструментов, стеклянных аппаратов и т. Д.
Метод № 2. Стерилизация сухим жаром :
Стерилизация сухим жаром используется для термостойких неводных препаратов, порошков и некоторых пропитанных повязок. Его также можно использовать для стерилизации некоторых типов контейнеров. Стерилизация сухим жаром обычно проводится в сушильном шкафу с горячим воздухом.Тепло передается от источника к нагрузке за счет излучения, условно и в небольшой степени за счет теплопроводности.
Температурно-временное воздействие, необходимое для уничтожения патогена с помощью сухого тепла, показывает, что период в 90 минут при 100 ° C уничтожает все вегетативные бактерии, а период в 3 часа при 140 ″ C убивает споры.
Споры плесени обладают средней устойчивостью и погибают за 90 минут при 115 ° C. Большинство вирусов обладают устойчивостью, аналогичной вегетативным бактериям, но некоторые вирусы столь же устойчивы, как и споры бактерий.грамм. вирус, вызывающий гомологичную сывороточную желтуху.
Британская фармакопея (2001) устанавливает минимальную температуру 160 ° C в течение не менее 2 часов для стерилизации сухим жаром. Допускаются другие комбинации температуры и времени при условии, что сначала будет продемонстрирован воспроизводимый уровень летальности при повседневной эксплуатации. Сухая термообработка при температуре выше 220 ° C представляет собой полезный метод стерилизации и дегидрирования стеклянной посуды в конкретном контейнере, предназначенном для парентерального введения большого объема.
Этот процесс позволяет удалить термостойкий эндотоксин. В каждом цикле важно следить за тем, чтобы все содержимое каждого контейнера сохранялось для эффективного сочетания времени и температуры, особенно для того, чтобы допускать колебания температуры в духовках с горячим воздухом, которые могут быть значительными. Сухое тепло используется для стерилизации стеклянной посуды, фарфорового и металлического оборудования, масел, жиров и порошков, например талька и т. Д.
Метод № 3. Стерилизация газом :
Газообразные стерилизующие агенты бывают двух основных типов: окислители и алкилирующие агенты.Пероксид водорода в паровой фазе является примером первого. Окись этилена и формальдегид являются примерами алкилирующих агентов. Однако BP заявляет, что газовая стерилизация используется, когда нет подходящей альтернативы. Основное преимущество окиси этилена состоит в том, что многие типы материалов, включая термолабильные, можно стерилизовать без повреждений.
Газ может диффундировать через упаковочные материалы и резину и диффундировать после стерилизации. У него есть недостатки: он токсичен и горючий, а также требует правильной влажности.На практике относительная влажность в атмосфере камеры обычно составляет от 40 до 50% при температуре до 6 ° C.
Низкотемпературный пар с формальдегидом использовался в качестве опции для стерилизации термолабильных веществ. Как оксид этилена, так и формальдегид представляют опасность для здоровья, и требуется строгий контроль персонала, подвергающегося воздействию газов, для обеспечения защиты от вредных воздействий.
Метод № 4. Стерилизация радиацией :
Излучения можно разделить на две группы: электромагнитные волны и потоки твердых частиц.Первая группа включает инфракрасное излучение, ультрафиолетовый свет, рентгеновские лучи и гамма-лучи. В последнюю группу входят альфа- и бета-излучения. Чаще всего для стерилизации используются инфракрасное излучение, ультрафиолетовый свет, гамма-излучение и высокоскоростные электроны.
(i) Ультрафиолетовый свет:
Узкий диапазон длин волн УФ-излучения (220-280 нм) эффективен для уничтожения микроорганизмов. Длина волны, близкая к 265 нм, и соседние длины волн сильно поглощаются нуклеопротеидами.Самым серьезным недостатком УФ-излучения как стерилизующего агента является его низкая проникающая способность. Это результат сильного всасывания многих веществ. Применение УФ-излучения ограничено.
(ii) Ионизирующие излучения:
Ионизирующие излучения подходят для промышленных процессов стерилизации. Он должен обладать хорошей проникающей способностью, высокой стерилизационной эффективностью, небольшим или отсутствующим повреждением облучаемых материалов и способностью эффективно производиться.Излучения, которые соответствуют этим четырем критериям, — это лучшие высокоскоростные электроны от машин и гамма-лучи от радиоактивных изотопов.
Стерилизация гамма-лучами проводится с использованием радиоактивного изотопа [CO-60]. Изделия для стерилизации излучением упаковываются в коробки стандартного размера, которые стерилизуются серией медленных проходов вокруг источника гамма-излучения. Поглощенная доза при стерилизации — 25 кГр.
Пластиковые шприцы и катетеры, иглы для подкожных инъекций и лезвия со скальпами, липкие повязки, капсулы для одноразового применения глазной мази, емкости из полиэтилена и упаковочные материалы с использованием алюминиевой фольги и пластиковых пленок стерилизуются гамма-излучением.
Метод № 5. Стерилизация фильтрацией :
Мембранные фильтры изготовлены из производных целлюлозы или других полимеров. В мембранных фильтрах нет свободных волокон или частиц. Они задерживают на поверхности фильтра частицы, размер которых превышает размер пор. Такие фильтры особенно полезны при обнаружении небольшого количества бактерий.
Стерилизация фильтрацией — это метод, разрешенный Британской фармакопеей (2001) для термочувствительных растворов или жидкостей, которые недостаточно стабильны, чтобы выдерживать процесс нагрева в автоклаве.
Прохождение через фильтр с подходящим размером пор (например, 0,22 мкм) может удалить бактерии и плесень. Вирусы и микоплазма не могут быть сохранены. После фильтрации жидкость в асептических условиях распределяется по ранее стерилизованным контейнерам, которые затем герметично закрываются. Этот метод имеет недостатки, заключающиеся в том, что требуется специализированное оборудование и квалифицированный персонал.
Окончательные препараты не могут быть выпущены до тех пор, пока производственная партия не пройдет соответствующий тест на стерильность.Валидация автоклава подробно описана в «Практической микробиологии» Дубей и Махешвари (2007).
Стерилизация | Здоровье и безопасность окружающей среды
Лабораторная практика
Стерилизация
Некоторые дезинфицирующие средства коагулируют или денатурируют белок, делая клетку нефункциональной. Они могут повредить клеточную мембрану, изменяя нормальную избирательную проницаемость, позволяя улетучиваться метаболически важным компонентам или препятствуя проникновению пищи.Кроме того, они могут реагировать с определенным ферментом, чтобы предотвратить его реакцию с его естественным субстратом.
Существует широкий диапазон реакций от микроорганизмов до инактивирующих агентов. Большинство вегетативных бактерий, грибов и липидосодержащих вирусов относительно восприимчивы к химическому обеззараживанию. Нелипидсодержащие вирусы и бактерии с восковым налетом имеют средний уровень устойчивости. Споровые формы наиболее устойчивы.
Методы стерилизации Паровая стерилизация
Автоклавирование обеспечивает тепло и влагу как факторы повреждения для уничтожения организмов.Большинство организмов можно уничтожить в присутствии пара под давлением 121 ° C в течение минимум 15 минут. Время измеряется после того, как температура стерилизуемого материала достигает 121 o C. Основной проблемой для обеспечения надежности этого метода, кроме времени и температуры, является предотвращение захвата воздуха. Воздух должен быть заменен паром и выдерживать соответствующее время в зависимости от нагрузки почвы на загрязненные предметы.
Автоклавы некоторых типов имеют смещение вниз или под действием силы тяжести, в котором используется разница в плотности воздуха по сравнению с паром.Вытесненный воздух выводится через дренажную линию, расположенную в нижней части передней части камеры. Клапан в сливной линии остается открытым до достижения определенной заданной температуры. При достижении этой температуры клапан закрывается, и пар продолжает поступать, пока не будет достигнуто заданное давление или температура. Проблема с автоклавом этого типа заключается в том, что воздух, захваченный в закрытых или вертикальных контейнерах, помещенных в камеру, или уменьшенные нагрузки в камере не перемещаются полностью. Если воздух не вытесняется, температура в этой области будет оставаться низкой на протяжении всего процесса стерилизации, что неэффективно.Поэтому автоклавы этого типа не должны быть перегружены; плотно упакованные и открытые емкости следует перевернуть на бок.
Автоклавы высокого вакуума создают разрежение в камере до входа пара. Если разрежение превышает 27 дюймов рт. Ст., Проблема удаления воздуха уменьшается.
Основными преимуществами стерилизаторов высокого вакуума являются их короткое время цикла и тот факт, что за день можно обрабатывать гораздо больший объем материала, чем при перемещении вниз.Еще одно преимущество — минимальное повреждение материалов из-за сокращенного общего теплового воздействия. Сильно загрязненные предметы, особенно если почва имеет белковую природу, следует автоклавировать дольше, потому что почва может защитить микроорганизмы от смертельного воздействия влажного тепла.
Другие методы, повышающие эффективность автоклавирования, включают ежедневное удаление и очистку заглушки или сетчатого фильтра оборудования, чтобы убедиться, что на нем нет грязи, пыли или отложений; очистка внутренних поверхностей от остатков пара или стерилизуемых материалов.Полоски со спорами или другие материалы для удовлетворительных испытаний можно разместить в различных местах автоклава как индикаторы стерильности.
ПРИМЕЧАНИЕ: Лента для автоклава не гарантирует стерильности; лента указывает только на то, что правильная температура была достигнута и не зависит от времени.
Преимущества
- Уничтожение наиболее устойчивых спор бактерий при относительно коротком воздействии.
- Простой контроль летальности для различных материалов и материалов.
- Нетоксичный остаток и материалы после процесса стерилизации
- Самый экономичный метод.
Недостатки
- Неполное удаление воздуха из стерилизатора снижает температуру и препятствует стерилизации. Воздух — стойкий противник распространения и расширения пара.
- Возможен перегретый пар с пониженной микробной силой при неправильном использовании стерилизатора.
- Непригодный способ стерилизации безводных масел, жиров и порошков.
Сухой жар
Сухой жар используется для стерилизации безводных масел, жиров, порошков и т. Д., Которые не могут легко проникать паром. Сухой жар менее эффективен, чем стерилизация влажным жаром, и требует более длительного времени или более высоких температур; Для каждого типа стерилизуемого материала необходимо определить конкретное время и температуру.
Стерилизацию обычно можно проводить при 160-170 ° C в течение 2-4 часов. Для термостойких материалов могут использоваться более высокие температуры и более короткое время.Свойства теплопередачи и расположение предметов в загрузке имеют решающее значение для обеспечения эффективной стерилизации.
Газовая стерилизация
Бактерицидными свойствами обладают различные газы и пары. Наиболее полезны формальдегид и окись этилена. Стерилизация может быть достигнута, когда они используются в закрытых системах и в контролируемых условиях температуры и влажности.
Газообразный оксид этилена смертельно опасен для микроорганизмов, включая споры, вирусы, грибки и термофильные бактерии с высокой устойчивостью.Влияние времени, температуры, концентрации и влажности на скорость стерилизации оксида этилена напрямую связано. Удвоение концентрации позволит добиться стерилизации примерно в два раза быстрее. Влияние температуры состоит в том, что с каждым повышением температуры на 10 oC стерилизационная активность удваивается. При относительной влажности (RH) 30% стерилизация происходит наиболее быстро, постепенно замедляясь по мере увеличения относительной влажности до 100%.
Все материалы, стерилизованные оксидом этилена, необходимо проветрить по крайней мере за 24 часа до контакта с кожей.Смеси 3-10% окиси этилена в воздухе взрывоопасны. Имеющиеся в продаже смеси этиленоксида с фреоном или CO 2 не взрывоопасны и могут безопасно использоваться.
Преимущества
- Не вредно для термолабильных материалов.
- Терминальная стерилизация упакованных предметов.
- Выход газообразных остатков.
- Проницаемость.
- Трудно инактивируется органическими веществами.
- Можно использовать простое оборудование.
Недостатки
- Особое обращение из-за воспламеняемости, токсичности.
- Длительное время стерилизации и обеззараживания.
- Потенциальная опасность для здоровья; пары необходимо контролировать.
- Снижена эффективность при неправильной обработке.
- Дороже тепла.
Прочие факторы, связанные со стерилизацией
Другие факторы, связанные со стерилизацией: 1) количество организмов на материале и их устойчивость к стерилизующему агенту; 2) Защита организмов от посторонних веществ — прямой пар должен обеспечивать прямой контакт со всеми поверхностями; 3) Экспоненциальная смертность.Число организмов, умирающих в единицу времени, пропорционально числам, присутствующим в начале временного интервала; 4) Функциональная эффективность стерилизатора и надежность механических компонентов; 5) Человеческий фактор при эксплуатации оборудования.
Стандартизация стерилизации (интегрированные факторы)
Интегрированными факторами стандартизации стерилизации являются: 1) надлежащая предварительная очистка, сборка и упаковка принадлежностей для обеспечения прямого контакта с паром; 2) Правильная загрузка стерилизатора; 3) одобренный стерилизатор с подтвержденной надежностью; 4) Адекватный период воздействия, который обеспечит полное проникновение нагрузки с большой погрешностью.
Контроль стерилизации
Все стерилизаторы должны иметь регистраторы времени и температуры для подтверждения адекватной экспозиции для каждой загрузки. Однако свидетельство того, что температура стерилизации поддерживается в течение достаточного времени, не гарантирует стерилизации. Это связано с тем, что температура измеряется на выпускном клапане. Следовательно, это не указывает на то, произошла ли адекватная стерилизация в плотных объемах жидкости или в больших плотных упаковках, обернутых тканью. Остаточный воздух или перегрев также могут привести к неполной стерилизации.Использование химических мониторов, то есть тестовых лент, в автоклаве дает только указание на то, что температура стерилизации могла быть достигнута. Однако такие мониторы не показывают, было ли адекватное воздействие. Лучшим средством обеспечения стерильности является использование биологического монитора спор.
Микроорганизмы, выбранные для полосок со спорами, более устойчивы к стерилизации, чем большинство естественных загрязнителей. Тестовые организмы находятся в высоких концентрациях, чтобы обеспечить запас прочности.Споры будут либо на пропитанных полосах фильтровальной бумаги, либо в растворе в стеклянных ампулах. Для стерилизации паром и горячим воздухом используется термофил Bacillus sterathermophilus. Bacillis globigii используется для получения окиси этилена.
Большинство препаратов полосок со спорами выпускаются в конвертах, содержащих одну или две полосы и контрольную полосу. Тест-полоски упакованы в отдельные конверты, которые удаляются и стерилизуются во время обработки другого материала. Затем тест-полоски и контрольные полоски культивируют, помещая полоски в пробирку с казеиново-соевым бульоном, расщепленным трипсином.Их инкубируют при 37 ° C для газовой стерилизации и 56 ° C для стерилизации паром. В продаже имеются другие типы препаратов спор. Следует строго соблюдать указания производителя.
Паровые стерилизаторы и стерилизаторы горячего воздуха следует проверять один раз в неделю. Каждая загрузка материала, стерилизованного оксидом этилена, которая должна контактировать с глубокими тканями, должна быть проверена.
Поместите тест-полоски в центр исследуемого образца. Никогда не кладите полоски на открытую полку автоклава.Поместите ампулу с раствором спор в самый большой сосуд для проверки стерилизации жидкости.
Работа с полосками со спорами в лаборатории требует особой осторожности, чтобы предотвратить вторичное заражение. Сделайте перенос стерильными щипцами и ножницами. Следите за тем, чтобы стерилизованные полоски со спорами не попали на контрольную полоску.
Выполните окрашивание по Граму и субкультивирование для предотвращения ложноположительных результатов, которые могут возникнуть в результате вторичного заражения этих культур.
При получении положительных результатов немедленно повторно протестируйте стерилизаторы, внимательно изучив показания термометра и манометра, а также изучив последние записи времени и температуры.


 Срок хранения 3 суток после стерилизации.
Срок хранения 3 суток после стерилизации.
 П. Сестринское дело и сестринский уход: учебное пособие/Т.П.Обуховец.-М.; КНОРУС, 2017.-680с.
П. Сестринское дело и сестринский уход: учебное пособие/Т.П.Обуховец.-М.; КНОРУС, 2017.-680с. В. Сестринское дело и манипуляционная техника: учебно-практическое пособие/ И.В.Яромич. Ростов н/Д. «Феникс»; Минск: Высшая школа,2012.- 568с.
В. Сестринское дело и манипуляционная техника: учебно-практическое пособие/ И.В.Яромич. Ростов н/Д. «Феникс»; Минск: Высшая школа,2012.- 568с.


 )
) 180 С – 60 мин
180 С – 60 мин При этом кошка еще и метит территорию и постоянно стремится убежать из квартиры. После операции, уже в течение месяца, такое поведение пропадает.
При этом кошка еще и метит территорию и постоянно стремится убежать из квартиры. После операции, уже в течение месяца, такое поведение пропадает.


 Для формальдегида имеются существенные ограничения в отношении стерилизации полых изделий, изделий с отверстиями и каналами. Весьма существенно, что для формальдегида не разработано нейтрализаторов и полного мониторинга процесса стерилизации.
Для формальдегида имеются существенные ограничения в отношении стерилизации полых изделий, изделий с отверстиями и каналами. Весьма существенно, что для формальдегида не разработано нейтрализаторов и полного мониторинга процесса стерилизации.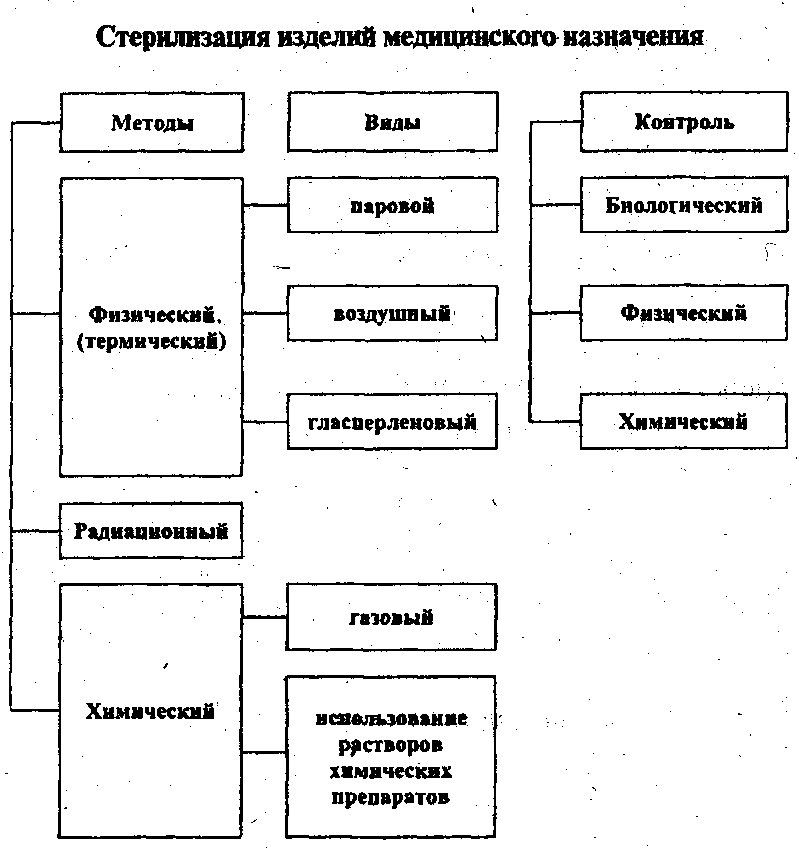 В результате создается биоцидная среда, состоящая из молекул перекиси водорода, свободных радикалов и ультрафиолетового излучения. При отключении электромагнитного поля свободные радикалы преобразуются в молекулы воды и кислорода, не оставляя никаких токсичных отходов.
В результате создается биоцидная среда, состоящая из молекул перекиси водорода, свободных радикалов и ультрафиолетового излучения. При отключении электромагнитного поля свободные радикалы преобразуются в молекулы воды и кислорода, не оставляя никаких токсичных отходов. Это мощный метод уничтожения спор бактерий.
Это мощный метод уничтожения спор бактерий. 