Стероидогенез в коре надпочечников и секреция надпочечниковых андрогенов при болезни и синдроме Иценко–Кушинга | Гончаров
За последние несколько лет значительно возрос интерес к надпочечниковым андрогенам, в частности к дегидроэпиандростерону (ДЭА). Этот стероид не только является прямым предшественником биологически активных андрогенов, но и сам выполняет важные функции в организме человека. ДЭА снижает уровень холестерина в составе липопротеинов крови, улучшает обмен жиров и нормализует содержание жира в мышцах, препятствует развитию остеопороза и стимулирует иммунную систему. ДЭА является также антагонистом кортизола [2].
При гиперпластических и опухолевых процессах в коре надпочечников возрастает количество секретируемых в кровь кортикостероидов, прежде всего основного глюкокортикоида — кортизола. При этом у больных кортизолпродуцирующей аденомой коры надпочечников и АКТГ-зависимой болезнью Иценко—Кушинга (БИК) наблюдаются одни и те же клинические симптомы, обусловленные прежде всего избыточной продукцией кортизола. В то же время крайне мало известно о характере продукции андрогенов пучковой зоной коры надпочечников, хотя в последние годы интерес к изучению их секреции повысился [4, 6, 12].
В то же время крайне мало известно о характере продукции андрогенов пучковой зоной коры надпочечников, хотя в последние годы интерес к изучению их секреции повысился [4, 6, 12].
Основными андрогенами, синтезируемыми в клетках пучковой зоны, являются ДЭА, ДЭА-суль- фат (ДЭАС) и андростендион. В небольших количествах синтезируется и тестостерон. У здоровых людей содержание ДЭА и ДЭАС в крови начинает возрастать с началом пубертата, достигает максимальной концентрации к 30—40 годам, а затем снижается [8]. При БИК уровень ДЭАС в крови либо повышен, либо находится в пределах нормы, тогда как при опухолевом процессе в надпочечниках обнаружено снижение концентрации андрогенов в крови [1, 3, 9, 10].
Цель нашей работы — изучить характер стероидогенеза в коре надпочечников у больных БИК и аденомой коры надпочечников, а также оценить суточный ритм секреции надпочечниковых андрогенов и кортизола и их предшественников (17а- гидроксипрегненолона — 17-PR, 17а-гидроксипро- гестерона — 17-Р и 11-дезоксикортизола—SR) у больных с различными формами гиперкортицизма.
Материалы и методы
Обследовано 2 группы больных с гиперкорти- цизмом: 1-я группа — 18 пациентов (3 мужчин и 15 женщин, средний возраст 35,3 ± 2,6 года) с АКТГ- зависимой БИК; 2-я группа — 15 пациентов (2 мужчин и 13 женщин, средний возраст 35,1 ± 2,7 года) с доброкачественной аденомой коры надпочечников (синдром Кушинга — СК). Диагноз был подтвержден морфологически, масса опухолевой ткани составляла в среднем 13,7 ± 1,3 г.
Таблица 1
Среднесуточное содержание стероидов в периферической крови при БИК, СК и у здоровых доноров (М ± т)
Показатель | БИК | СК | Здоровь | ie | доноры | |||
Кортизол, нмоль/л | 731 | + | 164 | 987 ± | 127 | 229 | + | 15 |
17-Р, нмоль/л | 3,9 | + | 0,4 | 3,8 ± | 1,5 | 3,5 | + | 0,9 |
17-PR, нмоль/л | 39,0 | + | 7,6 | 9,5 ± | 1,2 | 10,8 | ± | 1,0 |
SR, нмоль/л | 3,1 | + | 0,6 | 5,1 ± | 1,3 | 4,7 | + | 0,4 |
ДЭА, нмоль/л | 11,8 | + | 1,8 | 17,2 ± | 4,5 | 40,2 | + | 3,4 |
ДЭАС, нмоль/л | 8923 | + | 520 | 430 ± | 172 | 2314 | + | 350 |
АКТГ, пг/мл | 105,5 | + | 21,3 | 12,3 ± | 2,4 | 39,0 | + | 4,6 |
В контрольную группу были включены 11 практически здоровых добровольцев (4 мужчин и 7 женщин, средний возраст 20,5 ± 1,5 года). За 18—24 ч до начала обследования они были госпитализированы в клинику Эндокринологического научного центра РАМН.
За 18—24 ч до начала обследования они были госпитализированы в клинику Эндокринологического научного центра РАМН.
Пробы крови для гормонального анализа брали из локтевой вены в 8, 16 и 23 ч. Сыворотку и плазму крови получали стандартным методом и до определения гормонов хранили при —20°С. Концентрации кортизола, ДЭА, ДЭАС, 17-Р, 17-PR и SR в плазме определяли радиоиммунологическим методом с использованием высокоспецифичных антисывороток [7]. Концентрацию АКТГ определяли с помощью коммерческих наборов фирмы «CIS-bio International» (Франция). Для каждого гормона вычисляли среднесуточную концентрацию (арифметическое среднее их значений в течение суток).
Обработку результатов проводили с помощью компьютерной nporpaMMbf’Statistica (StatSoft Inc. 1999)» и методом вариационной статистики с использованием /-критерия Стьюдента.
Результаты
Из 18 больных БИК у 4 (23,5%) суточный ритм изменения концентраций всех исследованных гормонов был хорошо выражен: максимальный выброс в кровь наблюдался утром, а минимальный — вечером. У остальных больных уровни гормонов практически не менялись в течение суток. Следовательно, у большинства больных БИК были нарушены взаимоотношения звеньев гипоталамус—гипофиз—кора надпочечников (табл. 1. рис. 1/.
У остальных больных уровни гормонов практически не менялись в течение суток. Следовательно, у большинства больных БИК были нарушены взаимоотношения звеньев гипоталамус—гипофиз—кора надпочечников (табл. 1. рис. 1/.
У всех больных БИК имели место одни и те же закономерности нарушения секреции гормонов (рис. 2): резко возрастала суточная секреция кортизола, а также среднесуточные концентрации 17-PR, ДЭАС и АКТГ. Содержание SR и ДЭА было значительно снижено в течение всех суток, а уровень 17-Р практически не отличался от нормы.
У больных с СК суточная динамика всех исследованных стероидов практически отсутствовала. Среднесуточная концентрация кортизола, как и следовало ожидать, была значительно выше нормы, а содержание ДЭА и ДЭАС существенно снижалось по сравнению с нормой. Была снижена и концентрация АКТГ (см. табл. 1 и рис. 2).
Если принять среднесуточное содержание гормонов у здоровых людей за 1 (рис. 3), то становится очевидным, что при БИК секреция кортизола, 17- PR и ДЭАС возрастает в 3—4 раза. Секреция непосредственных предшественника кортизола SR и свободного ДЭА, наоборот, снижается в 2—3 раза.
Секреция непосредственных предшественника кортизола SR и свободного ДЭА, наоборот, снижается в 2—3 раза.
У больных с СК наблюдается тенденция к некоторому повышению содержания SR (на 10—20%). При этом достоверно снижены содержание АКТГ (в 4—5 раз) и уровни андрогенов надпочечникового происхождения (в 3—5 раз). Необходимо отметить, что повышение секреции кортизола при СК было более выражено, чем при БИК.
Активность ферментных систем стероидогенеза, оцениваемая по соотношению концентраций предшественника и конечного продукта реакции, представлена нами в табл. 2.
У всех больных БИК соотношение 17-P/17-PR (активность Зр-ол-стероиддегидрогеназы) снижается в 3—4 раза по сравнению со здоровыми донорами, а соотношение SR/17-P (активность 21-гидроксилазы) не изменяется. Соотношение кортизол/SR (активность llp-гидроксилазы) возрастает в 4—5 раз, а соотношение ДЭАС/ДЭА (активность сульфатазы) — даже в 7—12 раз, по-видимому, за счет более быстрого превращения SR и ДЭА соответственно в кортизол и ДЭАС.
При СК наблюдали повышение соотношения кортизол/SR в 4—5 раз (активность 11р-гидрокси- лазы) и снижение в 2 раза соотношения ДЭА/17- PR (активность 17,20-десмолазы). Активность сульфатазы (соотношение ДЭАС/ДЭА) не изменялась, что и приводит к повышению секреции кортизола и снижению уровня андрогенов надпочечникового происхождения. Обнаружено небольшое (на 10%) повышение соотношения 17-P/17-PR за счет некоторого снижения среднесуточного содержания 17-PR.
Обсуждение
Сравнение гиперпластических и опухолевых процессов в коре надпочечников показало, что, несмотря на некоторые общие биохимические признаки (повышение концентрации кортизола), при СК характер синтеза надпочечниковых андрогенов, как предшественников гормонов, так и конечных продуктов стероидогенеза, значительно различается.
При оценке основного направления биосинтеза главного кортикостероида — кортизола важнее всего определить соотношение среднесуточных концентраций 17-Р и 17-PR, характеризующее активность Зр-ол-стероиддегидрогеназы. Гиперплазия коры надпочечников при БИК со-
Гиперплазия коры надпочечников при БИК со-
Таблица 2
Изменение соотношения среднесуточного содержания стероидов (в % к норме) в крови при БИК и СК
Соотношение уровней гормонов | БИК | СК |
Кортизол/SR | 344* | 406* |
17-P/17-PR | -360* | 111 |
SR/17-P | -190 | -144 |
ДЭА/17-PR | -770* | -194* |
ДЭАС/ДЭА | 948* | 103 |
Примечание. * — р < 0,01 по сравнению с нормой.
провождается выраженным сдвигом биосинтеза кортизола в сторону преимущественного образования 17-PR по сравнению с 17-Р. Направление пути стероидогенеза в коре надпочечников определяется и активностью 17а-гидроксилазы/ 17,20-десмолазы, которая катализирует превращение прегненолона в 17-PR или 17-гидрокси- лированных стероидов в ДЭА.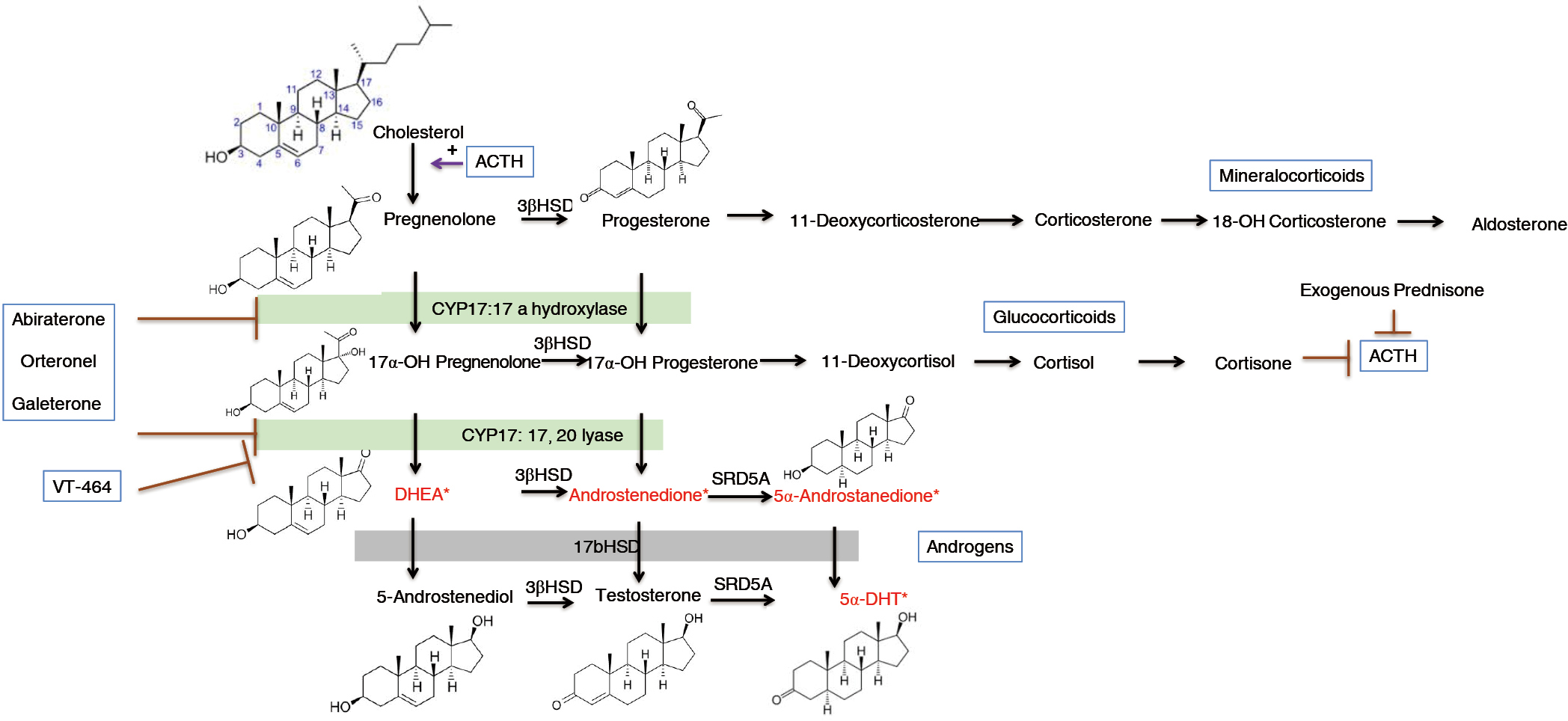 У больных БИК соотношение ДЭА/17-PR, свидетельствующее об активности этого фермента, также снижалось. Это происходило за счет одновременного уменьшения секреции ДЭА и увеличения секреции 17- PR. Следовательно, у больных БИК имеет место явный сдвиг соотношения направлений стероидогенеза в сторону Д5-пути.
У больных БИК соотношение ДЭА/17-PR, свидетельствующее об активности этого фермента, также снижалось. Это происходило за счет одновременного уменьшения секреции ДЭА и увеличения секреции 17- PR. Следовательно, у больных БИК имеет место явный сдвиг соотношения направлений стероидогенеза в сторону Д5-пути.
Одновременно обнаружено значительное увеличение соотношения кортизол/SR и ДЭАС/ДЭА. При БИК среднесуточные концентрации продуктов вышеперечисленных реакций резко повышены, а содержание предшественников значительно снижено. Установленный факт однозначно доказывает увеличение активности ферментов, таких как 110-гидроксилаза и сульфатаза, при данной патологии, что согласуется с данными литературы [11]. Активность 21-гидроксилазы при БИК практически не изменяется, поскольку соотношение SR/17-P достоверно не отличалось от нормы, хотя и имеется некоторая тенденция к снижению данного показателя.
При СК обнаружено значительное повышение среднесуточной концентрации кортизола и резкое снижение этого показателя для надпочечниковых андрогенов (ДЭА и ДЭАС). Наблюдалось повышение соотношения кортизол/SR и 17-P/17-PR, а также снижение соотношения ДЭА/17-PR, что указывает на небольшую активацию Зр-ол-стероиддегидрогеназы, заметную активацию lip-гидроксилазы и снижение активности 17,20-десмолазы. Это и приводит к повышению секреции кортизола и снижению продукции надпочечниковых андрогенов. Мы не обнаружили достоверных изменений в активности 21-гидроксилазы или 17а-гидроксилазы, которая может усиливаться в опухолевой ткани надпочечников [5, 13].
Наблюдалось повышение соотношения кортизол/SR и 17-P/17-PR, а также снижение соотношения ДЭА/17-PR, что указывает на небольшую активацию Зр-ол-стероиддегидрогеназы, заметную активацию lip-гидроксилазы и снижение активности 17,20-десмолазы. Это и приводит к повышению секреции кортизола и снижению продукции надпочечниковых андрогенов. Мы не обнаружили достоверных изменений в активности 21-гидроксилазы или 17а-гидроксилазы, которая может усиливаться в опухолевой ткани надпочечников [5, 13].
Таким образом, некоторое снижение активности 17,20-десмолазы при СК позволяет утверждать, что синтез кортизола происходит в основном по Д4— пути, тогда как образование стероидов, в том числе и надпочечниковых андрогенов, но Д5-пути минимально.
Выводы
- Для гиперплазии коры надпочечников, обусловленной повышенной секрецией АКТГ (АКТГ- зависимая БИК) характерно повышение активности ферментных систем коры надпочечников на конечных этапах биосинтеза кортикостероидов (lip-гидроксилазы и сульфатазы) и уменьшение активности Зр-ол-стероиддегидрогеназы и 17,20- десмолазы.
 Преимущественное образование кортикостероидов осуществляется через Д5-путь, что проявляется повышением концентрации в периферической крови Д5-стероидов (17-PR и ДЭАС) при одновременном снижении концентрации SR и свободного ДЭА.
Преимущественное образование кортикостероидов осуществляется через Д5-путь, что проявляется повышением концентрации в периферической крови Д5-стероидов (17-PR и ДЭАС) при одновременном снижении концентрации SR и свободного ДЭА. - Для больных с СК при неконтролируемом АКТГ биосинтезе стероидов характерно усиление шунта стероидогенеза с преобладанием Д4-пути, тогда как синтез стероидов по Д5-пути минимален. В результате этого образование кортизола осуществляется преимущественно через 17-Р. Для данной патологии характерно значительное повышение активности lip-гидроксилазы и заметное снижение активности 17,20-десмолазы.
1. Гончаров Н. П., Колесникова Г. С. // Кортикостероиды: метаболизм, механизм действия и клиническое применение. — М., 2002.
2. Гончаров Н. П., Кация Г. В., Нижник А. Н. // Формула жизни. Дегидроэпиандростерон: свойства, метаболизм, биологическое значение. — М., 2004.
Гончаров Н. П., Кация Г. В., Нижник А. Н. // Формула жизни. Дегидроэпиандростерон: свойства, метаболизм, биологическое значение. — М., 2004.
3. Barbetta L., Dall’Asta С., Re Т. et al. //Horm. Metab. Res. — 2001. — Vol. 33, N 10. — P. 596-601.
4. Cunningham S. K., McKenna T. J. // Clin. Endocrinol. (Oxford). — 1994. — Vol. 41, N 6. — P. 795-800.
5. D ‘Agata R., Malozowski S., Barkan A. et al. // Horm. Metab. Res. — 1987. — Vol. 19. — P. 386-388.
6. Feek С.M., Maraute D. J., Edwards C. R. W. // Clin. Endocrinol. Metab. — 1983. — Vol. 12, N 3. — P. 597-618.
7. Goncharov N., Kolensikova G., Vorontsov V. et al. // Proceedings of the 5-th Symposium on the Analysis of Steroids. — Smombathely, Hungary, 1993. — P. 407-425.
Goncharov N., Kolensikova G., Vorontsov V. et al. // Proceedings of the 5-th Symposium on the Analysis of Steroids. — Smombathely, Hungary, 1993. — P. 407-425.
8. Goncharov N. P., Katzya G. V. // The Aging Male. — 1998. — Vol. 1. — P. 200-205.
9. Klose M., Jorgensen K., Kristensen L. O. // Clin. Endocrinol. (Oxford). — 2004. — Vol. 61, N 3. — P. 394-399.
10. Lamberton R. P., Jackson I. M. D. // Clin. Endocrinol. Metab. -1983. — Vol. 12, N 3. — P. 509-534.
11. Sasano H., Sato K., Shizawa S. et al. // Mol. Pathol. — 1995. -Vol. 8, N 9. — P. 891-896.
12. Toth M., Racz K., Varga J. et al. // 10-th International Congress of Endocrinology. — San-Francisco, 1996. — P. 3-618.
Toth M., Racz K., Varga J. et al. // 10-th International Congress of Endocrinology. — San-Francisco, 1996. — P. 3-618.
13. Ueshiba H., Shimizu Y., Hiroi N. et al. // Eur. J. Endocrinol. -2002. — Vol. 46, N 3. — P. 375-380.
Стероидогенез — Справочник химика 21
Дальнейшие стадии стероидогенеза также катализируются сложной системой гидроксилирования, которая открыта в митохондриях клеток коры надпочечников последовательность всех этих реакций синтеза стероидных гормонов обобщена в общую схему по H.A. Юдаеву и С.А. Афиногеновой . [c.277]
Синтез стероидных гормонов стимулируется в Коре надпочечников кортикотропином, а в половых железах — лютропином. Эти тропные гормоны аденогипофиза регулируют транспорт эфиров холестерина в клетку активность холестеролэстеразы митохондриальные ферменты превращения холестерина в прегненолон процессы катаболизма углеводов и липидов, обеспечивающие стероидогенез энергией и пластическим материалом. [c.394]
[c.394]
Эти гормоны обеспечивают гаметогенез и стероидогенез в половых железах. Все они являются гликопротеинами с мол. массой около 25 ООО. [c.178]
Обезболивание влияние на поведение (питание, эмоции, обучение) регуляция температуры тела и кровяного давления стимуляция сокращений мышц полового тракта Усиление действия АКТГ на стероидогенез [c.181]
Регуляция биосинтеза. Образование кортикостероидов имеет многоуровневый характер. Прежде всего следует отметить регуляцию, связанную с сигналами, поступающими из гипоталамуса и гипофиза. Далее существенное влияние на этот процесс оказывает содержание холестерола и его транспорт в митохондрии. И наконец, регуляция образования кортикостероидов определяется активностью ферментов гидроксилирования холестерина. Образование прегненолона является лимитирующей стадией всего процесса стероидогене-за. Был обнаружен специальный белок, способствующий взаимодействию холестерина с цитохромом Р-450 и, таким образом, оказывающий существенное влияние на стероидогенез. [c.159]
[c.159]
Регуляция синтеза мужских половых гормонов и мужских половых клеток. Лютропин стимулирует стероидогенез и продукцию тестостерона после связывания с рецепторами на плазматической мембране клеток Лейдига (аналогичные рецепторы найдены в яичниках на клетках желтого тела) по аденилатциклазному механизму. При этом стимулируется ферментативное расщепление боковой цепи холестерина (С2у С21). Аналогично действует кортикотропин в коре надпочечников. Тестостерон по механизмам обратной связи тормозит продукцию и освобождение гонадолиберинов. Регуляция сперматогенеза фоллитропин связывается с клетками Сертоли и усиливает синтез андрогенсвязывающего белка (это гликопротеин. [c.405]
Б. Лютеинизирующий гормон (ЛГ, лютропин). ЛГ связывается со специфическими рецепторами плазматических мембран и стимулирует образование прогестерона клетками желтых тел и тестостерона клетками Лейдига. Роль внутриклеточного сигнала действия ЛГ играет сАМР. Этот нуклеотид имитирует действие Л Г, которое заключается в усилении превращения ацетата в сквален (предшественник в синтезе холестерола) и в повышении образования 2а-гидроксихолестерола из холестерола, представляющего собой необходимый этап биосинтеза прогестерона и тестостерона. Отмечается тесное сопряжение между связыванием ЛГ и продукцией сАМР, однако стероидогенез происходит и при очень небольшом увеличении концентрации сАМР. Следовательно, в этой реакции участвуют резервные рецепторы (см. рис. 43.3). Длительное воздействие ЛГ приводит к десенситизации, обусловленной, вероятно, понижающей регуляцией рецепторов ЛГ. [c.178]
Отмечается тесное сопряжение между связыванием ЛГ и продукцией сАМР, однако стероидогенез происходит и при очень небольшом увеличении концентрации сАМР. Следовательно, в этой реакции участвуют резервные рецепторы (см. рис. 43.3). Длительное воздействие ЛГ приводит к десенситизации, обусловленной, вероятно, понижающей регуляцией рецепторов ЛГ. [c.178]
Механизм действия окситоцина неизвестен. Он вызывает сокращение гладких мышц матки и поэтому используется в фармакологических дозах для стимуляции родовой деятельности у женщин. Интересно, что у беременных животных с поврежденной гипоталамо-гипофизарной системой вовсе не обязательно возникают нарушения родовой деятельности. Наиболее вероятная физиологическая функция окситоцина заключается в стимуляции сокращений миоэпителиальных клеток, окружащих альвеолы молочной железы. Это вызывает перемещение молока в систему альвеолярных протоков и приводит к его выбросу. Мембранные рецепторы для окситоцина найдены в тканях матки и молочной железы. Их количество возрастает под действием эстрогенов и снижается под влиянием прогестерона. Наступление лактации до родов можно, очевидно, объяснить одновременным повышением количества эстрогенов и падением уровня прогестерона непосредственно перед родами. Производные прогестерона часто используются для подавления послеродовой лактации у женщин. Окситоцин и нейрофизин I. по-видимому, образуются и в яичниках, где окситоцин может ингибировать стероидогенез. [c.184]
Их количество возрастает под действием эстрогенов и снижается под влиянием прогестерона. Наступление лактации до родов можно, очевидно, объяснить одновременным повышением количества эстрогенов и падением уровня прогестерона непосредственно перед родами. Производные прогестерона часто используются для подавления послеродовой лактации у женщин. Окситоцин и нейрофизин I. по-видимому, образуются и в яичниках, где окситоцин может ингибировать стероидогенез. [c.184]
У млекопитающих все стероидные гормоны синтезируются из холестерола через промежуточное образование прегненолона в ходе последовательных реакций, которые протекают в митохондриях либо эндоплазматическом ретикулуме клеток надпочечников. Важную роль в стероидогенезе играют гид-роксилазы, катализирующие реакции с участием молекулярного кислорода и NADPH в определенных этапах процесса участвуют дегидрогеназы, изомераза и лиаза. В отношении стероидогенеза клетки проявляют определенную специфичность. Так, 18-гидроксилаза и 18-гидроксистероид-дегидрогена-за — ферменты, необходимые для синтеза альдостерона,— присутствуют только в клетках клубочковой зоны и потому только они продуцируют этот минералокортикоид. На рис. 48.3 схематически изображены пути синтеза трех основных классов стероидов надпочечников. Названия ферментов заключены в рамочки, превращения на каждом из этапов выделены цветом. [c.207]
На рис. 48.3 схематически изображены пути синтеза трех основных классов стероидов надпочечников. Названия ферментов заключены в рамочки, превращения на каждом из этапов выделены цветом. [c.207]
В. АКТГ. У человека быстрое, краткосрочное снижение уровня АКТГ (например, в результате ги-пофизэктомии или подавления секреции глюкокор-тикоидами) мало сказывается на продукции альдостерона, но хроническая недостаточность АКТГ может ослаблять действие других регуляторов (ангиотензина II, Ыа+, К+) на содержание альдостерона в крови. У других видов (например, у крыс) АКТГ играет более важную роль в выработке альдостерона на изолированных клетках клубочковой зоны показано, что он стимулирует синтез сАМР и начальные этапы стероидогенеза. [c.213]
Недостаточность стероидогенных ферментов приводит к недостаточности конечных продуктов и накоплению промеждуточных продуктов стероидогенеза, а также активации альтернативных путей синтеза стероидов. Общая характеристика большинства из этих синдромов, развивающихся в эмбриональном периоде,— это недостаточность продукции кортизола на фоне гиперпродукции АКТГ и гиперплазия надпочечников отсюда и название этих синдромов — врожденная гиперплазия надпочечников. Вюрая общая характеристика—гиперпродукция андрогенов. Избыток андрогенов ведет к усилению роста тела, вирилизации, нарушению формирования наружных половых органов отсюда другое название этих состояний — адреногенитальный синдром . Причина вирилизации, возникающей при врожден- [c.219]
Вюрая общая характеристика—гиперпродукция андрогенов. Избыток андрогенов ведет к усилению роста тела, вирилизации, нарушению формирования наружных половых органов отсюда другое название этих состояний — адреногенитальный синдром . Причина вирилизации, возникающей при врожден- [c.219]
Функция семенников регулируется ЛГ и ФСГ (рис. 50.3). ЛГ стимулирует стероидогенез и образование тестостерона, связываясь с рецепторами на плазматической мембране клеток Лейдига (аналогичные рецепторы ЛГ найдены на поверхности клеток желтого тела) и активируя аденилатциклазу, что приводит к увеличению внутриклеточной концентрации сАМР. В результате ускоряется процесс отщепления боковой цепи холестерола. Обусловлено ли это активацией или индукцией фермента или же усилением транспорта холестерола к ферменту, пока не установлено. Весьма возможно, что в данном случае имеет место индукция какого-то белка, ускоряющего этот процесс. Сходство между рассматриваемым эффектом ЛГ и действием АКТГ на надпочечники очевидно. Хотя Л Г (или ХГЧ) по имеющимся данным индуцирует ферменты стероидогенеза, включая ЗР-ОН-СД, С,7 2о-лиазу и 5а-редуктазу, первичный эффект проявляется, по-видимому, на каком-то этапе превращения холестерола в прегненолон. [c.231]
Хотя Л Г (или ХГЧ) по имеющимся данным индуцирует ферменты стероидогенеза, включая ЗР-ОН-СД, С,7 2о-лиазу и 5а-редуктазу, первичный эффект проявляется, по-видимому, на каком-то этапе превращения холестерола в прегненолон. [c.231]
Синтез тестостерона—процесс, непосредственно предшествующий маскулинизации плода. У мужских эмбрионов кролика синтез тестостерона начинается в возрасте 17—17,5 дней он ассоциируется с резким повышением уровня фермента, отщепляющего боковую цепь холестерола, а также ферментного комплекса 3 Р-гидроксистероид-дегидрогеназа/А -изо-мераза (ключевых ферментов биосинтеза тестостерона). Другие ферменты стероидогенеза всегда имеются в первичных гонадах. Синтез эстрогенов в яичниках начинается в то же самое время, что и синтез тестостерона. Такое совпадение, по-видимому, свидетельствует о том, что дифференцировка по женскому типу—не совсем пассивный процесс, поскольку синтез эстрогенов незрелыми гонадами мог бы играть роль в стимуляции деления первичных зародышевых клеток или их дифференцировки в оогонии. Сигнал, включающий стероидогенез, не установлен. Не известно также, регулируется ли этот процесс на ранних стадиях другими гормонами. На более поздних стадиях эмбриогенеза, как и в постнатальной жизни, стероидогенез регулируется ЛГ, который влияет на скорость отщепления боковой цепи холестерола. [c.245]
Сигнал, включающий стероидогенез, не установлен. Не известно также, регулируется ли этот процесс на ранних стадиях другими гормонами. На более поздних стадиях эмбриогенеза, как и в постнатальной жизни, стероидогенез регулируется ЛГ, который влияет на скорость отщепления боковой цепи холестерола. [c.245]
Нарушение ферментативной активности характеризовалось семикратным снижением и измененной эффективностью связывания с цАМФ мутантного фермента по сравнению с ферментом исходной линии. Протеинкиназный мутант дает скудный стероидогенный ответ на АКТГ и цАМФ. Блокады роста и морфологических изменений, вызываемых этими агентами, в исходной линии клеток не происходит. Эти результаты наводят на мысль, что цАМФ-зависимая протеинкиназа важна для регуляции стероидогенеза в надпочечниках, морфологии и роста под влиянием адренокортикотропного гормона (Gutman et al., 1978). [c.238]
Нельзя не отметить и уникальной роли гипофиза в нейрогуморальной регуляции. Тропины, образующиеся в гипофизе, не только регулируют подчиненные железы, но и. имеют самостоятельные эндокринные эффекты. Так, например, помимо регуляции образования молока, пролактин тормозит процессы дифференцировки клеток, повышает чувствительность половых желез к гонадотропинам, стимулирует родительский инстинкт. АКТГ — не только стимулятор стероидогенеза, но и важный регулятор липолиза в жировой ткани, а также предшественник а-меланоцитстимулирующего гормоиа и пептида (фрагмент 4—10), участвующего в консолидации памяти (превращение кратковременной памяти в долговременную). Гормон роста может регулировать активность иммунной системы, обмен липидов, сахаров и т. д. [c.72]
Тропины, образующиеся в гипофизе, не только регулируют подчиненные железы, но и. имеют самостоятельные эндокринные эффекты. Так, например, помимо регуляции образования молока, пролактин тормозит процессы дифференцировки клеток, повышает чувствительность половых желез к гонадотропинам, стимулирует родительский инстинкт. АКТГ — не только стимулятор стероидогенеза, но и важный регулятор липолиза в жировой ткани, а также предшественник а-меланоцитстимулирующего гормоиа и пептида (фрагмент 4—10), участвующего в консолидации памяти (превращение кратковременной памяти в долговременную). Гормон роста может регулировать активность иммунной системы, обмен липидов, сахаров и т. д. [c.72]
В семенниках и яичниках, где синтез простагландинов наиболее интенсивен, используется арахидоновая кислота, отщепляемая не только от фосфолипидов, но и от этерифицированного холестерина. В этих тканях лютеинизирующий гормон путем повышения концент-. рации цАМФ стимулирует холестерин-эстеразу и холе-стерин-ацетилтрансферазу, в результате чего образуется свободный холестерин, вступающий в стероидогенез (см.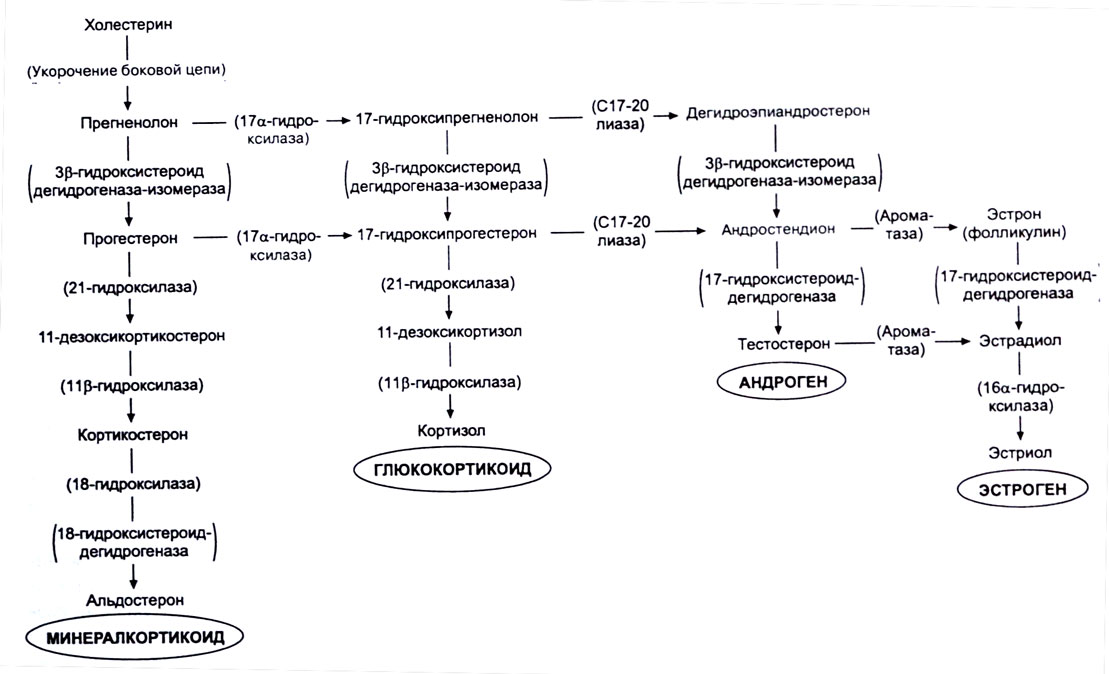
1 2? 07
I
т
РОССИЙСКАЯ АКАДЕМИЯ МЕДИЦИНСКИХ НАУК ЭНДОКРИНОЛОГИЧЕСКИЙ НАУЧНЫЙ ЦЕНТР
На правах рукописи УДК 616.45-089.87]-07:[616.154:577.175.53+616.154:577.175.62
КОЛЕСНИКОВА ГАЛИНА СЕРГЕЕВНА
БИОХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА СТЕРОИДОГЕНЕЗА У БОЛЬНЫХ ПРИ РАЗЛИЧНЫХ НАРУШЕНИЯХ ГОРМОНАЛЬНОЙ ФУНКЦИИ КОРЬ! НАДПОЧЕЧНИКОВ
(специальность 14.00.03 — эндокринология)
АВТОРЕФЕРАТ
диссертации на соискание ученой степени доктора биологических наук
Москва — 1997
Работа выполнена в Эндокринологическом Научном Центре Российской Академии Медицинских Наук
(директор — академик РАМН, доктор медицинских наук, профессор И.И.Дедов)
НАУЧНЫЙ КОНСУЛЬТАНТ
доктор медицинских наук, профессор Н.П.Гончаров
ОФИЦИАЛЬНЫЕ ОППОНЕНТЫ
доктор медицинских наук, профессор В.П.Федотов
доктор биологических наук, профессор Н.Д.Фанченко
доктор медицинских наук, член-корреспондент РАМН А. П.Калинин
П.Калинин
ВЕДУЩЕЕ УЧРЕЖДЕНИЕ
Московская Медицинская Академия им. И.М.Сеченова
Защита состоится………….199 .. г. в…..на заседании
Специализированного Ученого Совета Д 001.13.01 в Эндокринологическом Научном Центре РАМН (117036, Москва, ул.Дм.Ульянова., д.11)
С диссертацией можно ознакомиться в библиотеке ЭНЦ РАМН.
Автореферат разослан «…………» 1997 г.
Ученый секретарь Специализированного Совета доктор медицинских наук
В.Я.Игнапсов
Актуальность темы. Система гипоталамус-гипофиз-кора надпочечников, которая является важным связующим звеном между нервной и гуморальными системами, играет значительную роль в обеспечении функционирования организма как единого целого. Кора надпочечников, секретирующая жизненно необходимые стероидные гормоны оказывает существенное, а порой и решающее влияние на все фундаментальные жизненные процессы, такие как дифференциальная активность генов, скорость и качество процессов транскрипции, регуляция белкового, жирового и водно-солевого обмена, пролиферация клеток, поддержание метаболического гомеостаза, состояние иммунной системы, поведенческие характеристики и т.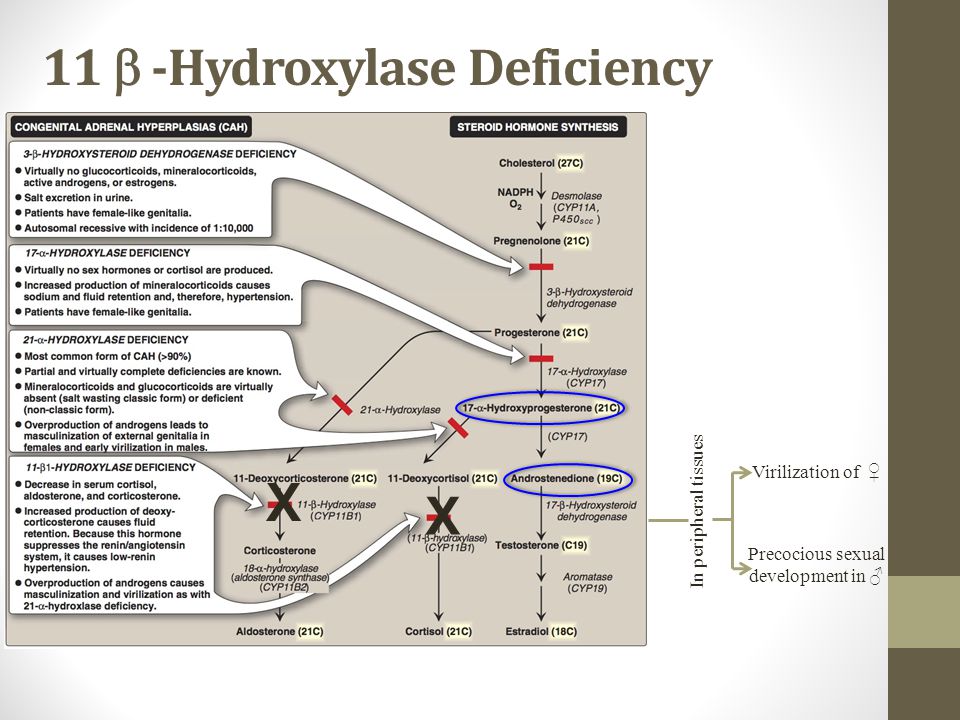 д. Гормонам коркового слоя коры надпочечников, наряду с нервной системой, принадлежит и особая роль в координации защитно-приспособленческих реакций организма, так как одним из главных свойств, присущих всем живым существам, является способность к адаптации и эволюции, то есть обеспечение самосохранения и самоподдержания в условиях изменчивой внешней среды.
д. Гормонам коркового слоя коры надпочечников, наряду с нервной системой, принадлежит и особая роль в координации защитно-приспособленческих реакций организма, так как одним из главных свойств, присущих всем живым существам, является способность к адаптации и эволюции, то есть обеспечение самосохранения и самоподдержания в условиях изменчивой внешней среды.
Именно поэтому нарушения функциональной деятельности системы гипоталамус-гипофиз-кора надпочечников приводят к серьезным повреждениям, которые затрагивают практически все стороны жизнедеятельности организма и без соответствующей терапевтической и/или хирургической коррекции могут заканчиваться летальным исходом.
В настоящее время стало возможным определять концентрацию гормонов в малых объемах биологических жидкостях, благодаря созданию н быстрому внедрению в практику новых высокочувствительных методов гормонального анализа, основанных на иммунологических принципах исследования.Последнее значительно расширяло возможности исследователей и позволило изучать содержание стероидных гормонов, их предшественников и метаболитов в условиях in vivo в любых временных интервалах.
Известно, что изучение стероидогенеза в условиях in vivo связано с серьезными трудностями, которые обусловлены двумя основными причинами. Во-первых, исследования проводятся главным образом в двух наиболее доступных биологических жидкостях — моче и крови, и, во-вторых, при оценке полученных результатов всегда необходимо учитывать как влияние на показатели стероидогенеза регуляторных факторов со стороны систем головного мозга (гипоталамуса, гипофиза или ЦНС), так и биохимические превращения стероидов в печени, почках и/или тканях-мишенях.
Присутствие в стероидпродуцирующих железах комплекса специализированных ферментов обуславливает возможность синтеза конечных продуктов стероидогенеза различными путями. В норме у чело-
века доминирует один путь стероидогенеза, а остальные возможные пути не используются. При изменении условий внешней и внутренней среды или нарушений в самой железе альтернативные пути стероидогенеза могут включаться, а в ряде случаев даже становиться доминирующими. В этих условиях происходит синтез соединений, которые в норме не обнаруживаются или продуцируются в минимальных количествах (например, 21-дезоксикортизол при врожденной дисфункции коры надпочечников или 18-гидроксикортикостерон при синдроме Конна).
В этих условиях происходит синтез соединений, которые в норме не обнаруживаются или продуцируются в минимальных количествах (например, 21-дезоксикортизол при врожденной дисфункции коры надпочечников или 18-гидроксикортикостерон при синдроме Конна).
Развитие тех или иных эндокринных заболевашш определяется, с одной стороны, изменениями в качественном и/или количественном составе стероидных гормонов, секретируемых корой надпочечников, и, с другой стороны, нарушениями взаимоотношений между звеньями гипоталамо-гипофизарно-адреналовой системы. Такого рода нарушения, как правило, ведут к изменению нормального суточного ритма секреции кортикостероидов корой надпочечников. Выявление закономерных изменений стероидогенеза при различных эндокринных заболеваниях является чрезвычайно важной проблемой в изучении их патогенеза и служит практически единственным подходом для поиска адекватных гормональных маркеров с целью более ранней диагностики, проведения патогенетической терапии и оценки ее эффективности при этих заболеваниях.
Цель работы. Основной целью настоящего исследования являлось выявление закономерностей биосинтеза кортикостероидов, их качественного состава и характера суточных колебаний секреции при эндокринных заболеваниях, обусловленных гиперфункцией коры надпочечников.
Для решения поставленной цели было необходимо осуществить системное изучение стероидогенеза в коре надпочечников, то есть определить максимально широкий спектр синтезируемых стероидных гормонов, охватывающий все этапы и пути их синтеза, с учетом суточной динамики их секреции.
Исходя из этого, основные задачи исследования были определены следующим образом: Основные задачи исследования
• изучить характер суточной динамики выброса кортикостероидов разных классов (гшококортикоидов, минералкортикоидов, надпо-чечниковых андрогенов и их предшественников) у больных при патологиях, обусловленных гиперфункцией коры надпочечников и яичников
• установить величины среднесуточных концентраций основных С19-и С21-стероидов в периферической крови в зависимости от характера гиперпластического процесса в коре надпочечников
• оценить состояние биосинтеза адреналовых С21-стероидов в условиях гиперандрогении различного генеза
• определить активность ферментных систем коры надпочечников по соотношению среднесуточных концентраций кортикостероидов в крови и установить особенности изменений стероидогенеза при различных формах гиперфункции коры надпочечников
• провести поиск наиболее информативных диагностических маркеров нарушений сщэоидогенеза п коре надпочечников при различных эндокринных патологиях
• выявить и охарактеризовать диагностическую ценность базальных и среднесуточных показателей содержания исследованных стероидов в периферической крови для оценки характера адреналового стероидогенеза у больных людей
Для решения этих задач нами были выбраны два основных заболевания: болезнь Иценко-Кушинга (БИК) и неклассическая форма врожденной дисфункции коры надпочечников (ВДКН). Эти эндокринные заболевания объединяют прежде всего поражения, выражающиеся в гиперплазии клеток коры надпочечников, которая развивается у обеих групп больных под влиянием повышенной концентрации АКТГ в крови.
Эти эндокринные заболевания объединяют прежде всего поражения, выражающиеся в гиперплазии клеток коры надпочечников, которая развивается у обеих групп больных под влиянием повышенной концентрации АКТГ в крови.
Однако, если в случае БИК повреждение локализовано на уровне гипоталамуса и/или гипофиза, то в случае ВДКН повреждение локализовано на уровне самого надпочечника. В последнем случае постоянный дефицит кортизола приводит к стимуляции выброса АКТГ и, как следствие этого, к компенсаторной гиперплазии коры надпочечников.
Высокая частота встречаемости у больных БИК таких симптомов, как ожирение и гипертензия, обусловило сравнительное изучение особенностей надиочечникового стероидогенеза и у больных ожирением и больных с аденомой коры надпочечников [глюкостеромой (ГС) или альдостеромой (АС)].
Кроме того, как БИК, так и неклассическая форма ВДКН развиваются преимущественно у женщин и девушек в период после пубертата. У этих больных совпадают и некоторые клинические симптомы (например, нарушение менструальной функции вплоть до аменореи и/или проявления гиперандрогении). Нарушение репродуктивной функции и клинические симптомы гиперандрогении могут быть обусловлены и патологическими процессами в других стероидсекретирую-щих железах. Наличие общих предшественников в системе конечных продуктов стероидогенеза, а также возможность синтеза С19-сте-роидов и в яичниках, и в надпочечниках явилось для нас основанием для изучения адреналового стероидогенеза не только при заболеваниях надпочечников, но и при заболеваниях яичников.
Нарушение репродуктивной функции и клинические симптомы гиперандрогении могут быть обусловлены и патологическими процессами в других стероидсекретирую-щих железах. Наличие общих предшественников в системе конечных продуктов стероидогенеза, а также возможность синтеза С19-сте-роидов и в яичниках, и в надпочечниках явилось для нас основанием для изучения адреналового стероидогенеза не только при заболеваниях надпочечников, но и при заболеваниях яичников.
Таким образом, некоторые сходные клинические симптомы и общие черты стероидогенеза в коре надпочечников и яичников определили наш выбор следующих эндокринных заболеваниях: БИК, неклассическая форма ВДКН, опухоли коры надпочечников и яичников, стромальный текоматоз — для сравнительного изучения характера адре-налового стероидогенеза.
Научная новизна работы заключается прежде всего в том, что она является по существу первым в отечественной биохимической эндокринологии фундаментальным исследованием, проведенным в условиях in vivo, характера и путей стероидогенеза в коре надпочечников больных людей.
Детально охарактеризован спектр секретирующихся в кровь гормонов (глюкокортикоидов, минералкортикоидов и надпочечнико-вых андрогенов) и их предшественников в зависимости от исследуемого заболевания.
Впервые в условиях in vivo с помощью вычисления среднесуточных концентраций стероидов в крови выявлены отклонения в направленности путей стероидогенеза как следствие изменения активности специфических ферментов коры надпочечников.
Получены приоритетные данные о характере динамики секреции кортикостероидов в кровь на протяжении суток в зависимости от патологии и от отягощающих основное заболевание симптомов (ожирение и гипертензия).
Доказано, что при различных патологиях, связанных с гиперсекрецией кортикостероидов, преимущественное направление путей стероидогенеза через образование стероидов Д5- или Д4-ряда приводит к строго закономерному изменению уровня секреции определенных гормонов.
Использование метода селективной катетеризации надпочечни-ковых и яичниковых вен позволило впервые получить оригинальные данные о характере секреции стероидов двумя стероидпродуцирую-щими железами женского организма: яичниками и корой надпочечников. На основании этих же исследований впервые был сформулирован вывод о вкладе каждой железы в развитие гиперандрогении у больных женщин.
На основании этих же исследований впервые был сформулирован вывод о вкладе каждой железы в развитие гиперандрогении у больных женщин.
Теоретическое и практическое значение работы. Результаты исследования вносят существенный вклад в развитие современных представлений о биосинтезе стероидов в коре надпочечников человека. Выяснение характера суточного ритма секреции и среднесуточного содержания кортикостероидов в крови больных позволило четко охарактеризовать направленность путей стероидогенеза в коре надпочечников при различных патологиях.
Впервые был осуществлен фундаментальный, системный подход к изучению стероидогенеза в условиях in vivo с использованием комплекса одних и тех же методов, проведенных в одних и тех же лабораторных условиях, и мониторинга содержания гормонов в течение полных суток.
Впервые выявлены гормональные маркеры, совокупность которых с высокой степенью достоверности определяет специфику различных патологических состояшш. Доказано, что повышение концентрации в крови одних стероидов при одновременном снижении других отражает специфические, свойственные только данной патологии, процессы биосинтеза гормонов коры надпочечников.
Проведена адаптация радиоиммунных методов для определения стероидов в крови больных люден, применение этих методов позволило повысить специфичность и чувствительность определения всех классов стероидов в малых объемах крови. В практику Эндокринолог ического Центра РАМН впервые внедрены разработанные нами радиоиммунные методы определения 17а-гидроксипрегненолона, свободного дегидро-эпиандростерона и его сульфатной формы, кортикостерона и 11-дезоксикортизола.
Определены диапазоны содержания стероидов в сыворотке крови здоровых доноров в зависимости от их пола и времени взятия образца крови, что позволило получить стандартный физиологический показатель нормы и относительно него адекватно оценивать изменения в обмене стероидов у больных людей.
Уникальность данной работы заключается в том, что все исследования проведены в условиях in vivo и полученные результаты реально отражают процессы нормальной и патологической физиологии коры надпочечников человека.
Апробация работы Материалы диссертации докладывались на П-м Всесоюзном съезде эндокринологов (Ленинград, 1981), 1-м Всероссийском съезде общества эндокринологов (Уфа, 1984 год), Европейском симпозиуме клинической эндокринологии (Jena, 1989), III-м Всесоюзном съезде эндокринологов (Ташкент, 1989), симпозиуме «Физиология гипофизарно-адренокортикалыюй системы» (Ленинград, 1990), П-м Всероссийском съезде эндокринологов (Челябинск, 1991), 1-м Всероссийском симпозиуме «Хирургия надпочечников» (Санкт-Петербург, 1992), 1Х-м Международном конгрессе эндокринологов (Ницца, 1992), научно-практической конференции, посвященной памяти проф. Шуры-гина «Актуальные вопросы эндокринологии» (Санкт-Петербург, 1993), симпозиуме «Патогенез, клиника и фармакотерапия эндокринопатий» (Харьков, 1994), IX-м Международном конгрессе «Стероидные гормоны» (Dallas, 1994), III-м Всероссийском симпозиуме по хирургической
Шуры-гина «Актуальные вопросы эндокринологии» (Санкт-Петербург, 1993), симпозиуме «Патогенез, клиника и фармакотерапия эндокринопатий» (Харьков, 1994), IX-м Международном конгрессе «Стероидные гормоны» (Dallas, 1994), III-м Всероссийском симпозиуме по хирургической
эндокринологии «Современные аспекты эндокринологии», (Самара, 1994), У-м Международном конгрессе «Гормоны и рак» (С)иеЬеск, 1995), Ш-м Всероссийском съезде эндокринологов (Москва, 1996), симпозиуме «Лабораторная медицина: тенденции и перспективы» (Москва, 1997), У1-м Всероссийском симпозиуме по хирургической эндокринологии (Саранск, 1997).
По материалам диссертации опубликовано 20 работ.
Диссертация апробирована на межотделенческой научной конференции ЭНЦ РАМН (Москва, 1997 год).
Структура диссертации Диссертация изложена на 227 страницах машинописи, состоит из введения, обзора литературы, описания материалов и методов исследования, описания собственных результатов, общего заключения, выводов и списка использованной литературы (32 источника на русском языке и 372 на иностранных языках). Работа иллюстрирована 28 таблицами и 41 рисунком.
Работа иллюстрирована 28 таблицами и 41 рисунком.
МАТЕРИАЛ И МЕТОДЫ
В настоящей работе были изучены образцы крови от 397 больных различными эндокринными заболеваниями в возрасте от 18 до 48 лет, находившихся на лечении в клинических отделениях ЭНЦ РАМН. Из них: 206 больных БИК, 9 больных ВДКН [неклассическая форма], 41 человек с опухолью коры надпочечника различной этиологии [гшо-костерома — ГС ( 15 человек), альдостерома — АС (16 человек) и вирили-зирующая опухоль -ВО ( 10 человек)], 25 больных вирильным синдромом вненадпочечникового происхождения [стромальный текоматоз -СТ (13 человек) и вирилизирующая опухоль яичника — ОЯ (12 человек)], 116 больных без патологий надпочечников или яичников и 11 здоровых доноров (ЗД). Размер опухолей надпочечников и яичников колебался от 5,0 до 20,0 г. Больные ожирением (17 человек) имели индекс массы тела от 31 до 42 кг/м2. Больные с гипертензией имели кровяное давление от 150/95 до 240/130 шш Щ.
Морфологические исследования всех послеоперационных биоп-татов ткани надпочечников и яичников проводились в лаборатории патанатомии ЭНЦ РАМН канд. биол.наук Бронштейн М.И.
биол.наук Бронштейн М.И.
Больным женщинам с вирильным синдромом разной этиологии проводилась селективная катетеризация вен надпочечников и яичников без общей анестезии общепринятым методом ангиографии. Контроль за положением катетера осуществлялся с помощью ретроградной вено-графии.
Взятие образцов крови для последущего определения содержания в них гормонов проводилось из локтевой вены. При исследовании суточного ритма забор крови осуществлялся с помощью катетера, установленного в локтевой вене для того, чтобы снизить до минимума
возможный стресс-индуцированный выброс гормонов в ответ на процедуру взятия крови.
Анализ содержания АКТГ в крови проводили с помощью коммерческих наборов фирмы «CIS BIO International» (Франция).
Изучение концентраций 17а-гидроксипрогесгерона (17Р), 17а-гидроксипрегненолона (17PR), 11 дезоксикортизола (Sr), кортизола (F), кортикостерона (В), альдостерона (Aid), дегидроэпиандростерона (DHA), дегидроэпиандростерон-сульфата (DHAS) и тестостерона (Т) осуществляли радиоиммунологическими методами, модифицированными в лаборатории гормонального анализа ЭНЦ РАМН. Для радиоиммунологических реакций нами использовались антисыворотки к стероидных гормонам, полученные в лаборатории эндокринологии ИЭПиТ АМН СССР (г.Сухуми) и в лаборатории биохимической эндокринологии и гормонального анализа ЭНЦ РАМН. Для приготовления стандартных кривых нами были использованы стандарты стероидов, полученные от фирмы «Steroloids»(BemiKo6pnTaHim). В иммуннологической реакции использовались меченые по тритию стероиды ({игр мы «Amersham» (Великобритания) после их предварительной очистки на колонке Sephadex LH-20.
Для радиоиммунологических реакций нами использовались антисыворотки к стероидных гормонам, полученные в лаборатории эндокринологии ИЭПиТ АМН СССР (г.Сухуми) и в лаборатории биохимической эндокринологии и гормонального анализа ЭНЦ РАМН. Для приготовления стандартных кривых нами были использованы стандарты стероидов, полученные от фирмы «Steroloids»(BemiKo6pnTaHim). В иммуннологической реакции использовались меченые по тритию стероиды ({игр мы «Amersham» (Великобритания) после их предварительной очистки на колонке Sephadex LH-20.
Статистическая обработка результатов проводилась с помощью компьютерной программы «StatgraP’ и методом вариационной статистики с использованием критерия Student’a (M+m).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Характеристика секреции гормонов коры надпочечников у здоровых
людей.
Первым этапом нашей работы явилось изучение суточной динамики стероидных гормонов, секретируемых корой надпочечников у здоровых доноров.
Детальный анализ полученных результатов показал, что имелись лишь некоторые недостоверные половые отличия в характере секреции кортикостероидов. Так, у женщин, в отличие от мужчин, наблюдалось более ранний и более выраженный подъем утренней концентрации F, Sr и В. Уровень 17Р в любое время суток был несколько выше у мужчин, чем у женщин, а концентрации 17PR и DHAS были одинаковыми. Более выраженный суточный ритм содержания свободного DHA отмечался у жетцин: утренняя концентрация этого гормона у них была тчкая же, а дневная — ниже, чем у мужчин.
Именно поэтому в дальнейшем для оценки функционального состояния коры надпочечников были использованы суммарные значения содержания гормонов в крови (за исключением Т), полученные при обследовании как мужчин, так и женщин (табл.1).
Из табл. I видно, что у ЗД наблюдается характерная для коры надпочечников динамика секреции всех кортикостероидов. Регрессионный анализ показал высокую степень корреляции суточного ритма F не только с предшественниками этого гормона (17PR, 17Р, Sr), но и с другими кортикостероидами (минералкортикоидами и андрогенами). Отмечена также высокая степень корреляции между секрецией F и концентрацией АКТГ. Коэффициент корреляции во всех случаях варьировал от 0,61 до 0,89 (р<0,001).
Отмечена также высокая степень корреляции между секрецией F и концентрацией АКТГ. Коэффициент корреляции во всех случаях варьировал от 0,61 до 0,89 (р<0,001).
Предшественники F и В (17Р, 17PR и Sr ), а также DHA имели резко выраженный суточный ритм с перепадом утренних и вечерних концентраций до 80%. Вместе с тем было найдено, что утренний подъем содержания DHAS и Aid был выражен не так резко, как для F, Для этих был гормонов характерен был более сглаженный суточный ритм с изменением их содержания в крови между утром и вечером лишь на 3040%.
Для характеристики ферментных стероидогенных систем in vivo были использованы данные о соотношении среднесуточных концентраций предшественника и конечного продукта ферментативной реакции, что фактически отражает активность ферментных систем в организме.
Анализ соотношения среднесуточных концентраций стер о идо и в крови, выявил лини, минимальные и недостоверные половые различия. Так, у мужчин активности 21-гидроксилазы (соотношение Sr/17P) и сульфатазы (соотношение DHAS/DHA) были меньше, а активность 11 p-гидроксилазы (отношение концентраций F/Sr) выше, чем у женщин.
Активность Зр-олстероиддегидрогеназы (соотношение 17P/17PR), основного фермента, реализующего А4- или Д5-путь биосинтеза надпочечниковых стероидов, для обеих исследованных групп оказалась практически одинаковой.
Таким образом, полученные данные свидетельствуют, что направленность путей стероидогенеза у мужчин и женщин практически не отличается и биосинтез кортнкостероидов у людей, независимо от пола, подчиняется одним и тем же закономерностям.
Характеристика секреции гормонов коры надпочечников у больных
БИК
Следующий этап работы заключался в изучении суточной динамики секреции стероидных гормонов и АКТГ при БИК. Было показано, что примерно у 25% больных БИК секреция F подчиняется нормальному суточному ритму с максимальным выбросом гормона в кровь утром и минимальным — вечером. Следовательно, взаимоотношение звеньев гипоталамус-гипофиз-кора надпочечников у таких больных не нарушено в отличие от значительного большинства больных БИК, у ко-
Табл. 1. Показатели содержания стероидов и АКТГ в периферической крови здоровых доноров и больных ожирением [М±ш] (* — достоверность различий между больными и ЗД).
гормон | ед.изм 18-00 12-00 116-00 120-00 124-00 |4-00 ср.сут.
здоровые доноры (п=11)
И нмоль/л 444±35 172±15 242+37 77±10 69+16 147±24 229±15
БЯ нмоль/л 6,5±0,9 3,9±0.3 4,4±0,3 3,2±0,3 2;9±0,4 5,4±0,7 4,7±0,4
В нмоль/л 44,2±5,1 17,б±2,1 17,6±2,1 11,1±1,6 12.5+1,9 22,2±3,1 22,6±1,4
17Р нмоль/л 4,8±0,3 3,9+0,9 3,0±0,3 2,7±0,3 3,0+0,4 3,3±0,7 3,9±0,4
17РЯ нмоль/л 17,1±1,9 7,8+1,5 8,4±1,1 . 5,7±1,3 7,5±4,1 11,1±1,9 10,8±1,0
ОНА нмоль/л 57,5±7,0 38,4±4,8 36,7+10,4 [34,3+3,8 35,0±4,1 38,8±4,4 40,2±3,4
ОНАБ мкмоль/л 2,8±0,4 2,4±0,3 2,5±0,4 2,3±0,3 1,9±0,4 2,1±0.3 2,3±0,3
АЮ пмоль/л 372±41 201±27 228±33 243+47 243±42 289±34 272±35
АКТГ пг/мл 60,4±8,2 29,4±4,3 25,4±6,5 32,7±7,5 39,0±4,6
больные ожирением сгипертензией (п=8)
И нмоль/л 381±49 212±33 163±13* 95±90 204±53* 180±4I 232±18
БЯ нмоль/л 3,8±0,5* 3,3±0,5 2,6±0,3* 2,7±0,2 2,7±1,0 3,8±0,3* 3,2±0,4*
В нмоль/л 53,4±7,8 47,8±10,4 37,6±6,9* 23,3±5,1* ?2,1±7,5* 44,7±14,3* 37,8±5,6*
17Р нмоль/л 7,5±1,б 5,5±1,3 4,4±1,1 3,7±1,1 3,5±1,3 4,5±1,2 4,6±1,0
17РК нмоль/л 10,8±1,7* 4,9±1,7 2,0±1,0* 4,0±0,8 2,1±0,9* 8,5±3,9 5,5±1,0*
БНА нмоль/л 20,8±2,6* 25,7±3,5* 18,5±1,7* 13,4±0,6* 19,2±2,9* 19,0±1,6* 20,6±3,0*
БНАБ мкмоль/л 1 ,5±0,2* 1,7±0,2 1,4+0,2* 1,3±0,3 1,1+0,1 1,2±0,2* 1,4±0,2*
АИ пмоль/л 574±50* 811±121* 708±108* 660+181* 842±146* 863±143* 717±98*
больные ожирением без гипертензии (п=9)
Б нмоль/л 413+47 284±42 2I0±33 140+93 181±33* 207±36 242±17
БЯ нмоль/л 2,9±0,4* 2,5±0,8 2,3+0,3* 2,0±0,5 1,8±0,2* 2,5±0,3* 2,3±0,2*
В нмоль/л 53,1 ±7,8 23,8±6,6 33,6±6,6* 22,6+6,4* 24,5+5,2* 28,0±5.2 35,6+5,0*
17Р нмоль/л 3,9±0,б 4,2±1,8 3,9+0,6 4,2±1,3 3,9±0,7 3,5±0,9 3,8±0,7
17РК нмоль/л 10,4±3,9* 3,9+1,8* 6,3±2,5 5,9±2,9 4,9±1,6 8,1 ±3,2 7,6±1,9
БНА нмоль/л 2б,5±4,0* 19,7±7,8* 23,5+3,8 19,5±3,7* 18,4±2,4* 19,0±2,1* 22,6±2,3*
БНАБ мкмоль/л 1,9±0,3* 1,5±0,1 * 1,9±0,3 1,8+0,4 2,1 ±0,4 !,9±0,4 2,0±0,2
АЫ пмоль/л 554+75* 569±76* 451±45* 451+101* 454+46* 487±95* 491±46*
торых суточная динамика содержания И отсутствовала.
Произвольно выбранные больные БИК (18 человек) были разделены нами (табл.2) на 2 подгруппы: 1).с нормальным суточным ритмом Б, 2).без выраженной суточной динамики содержания Р.
Для больных первой подгруппы выявлено наличие нормального суточного ритма для АКТГ и всех кортикостероидов с максимальным выбросом их в кровь утром и минимальным вечером. У больных второй подгруппы уровни гормонов практически не менялись в течение суток.
Примененный нами анализ суточной динамики с помощью метода Собьпог позволил выявить существенные отличия характера секреции гормонов у больных БИК с сохраненной суточной динамикой секреции кортикостероидов по сравнению с контрольной группой ЗД (рис.1). Было обнаружено: 1. амплитуда колебаний содержания гормонов у больных была существенно ниже, чем в норме (соотношение стероидов в вечерние и утренние часы понижалось только в 2 раза, тогда как у ЗД отмечалось 5-6-кратное изменение данного показателя), 2.точка надира у больных БИК приходилась на более ранние часы, чем в норме (минимальная концентрация гормонов в крови была обнаружена днем, а не вечером или ночью). Вместе с тем акрофаза наблюдалась в то же время, что и в контрольной группе.
В контрольной группе и у больных БИК с сохраненным суточным ритмом утреннее содержание гормонов во всех случаях превышало как их среднесуточные уровни, так и утреннюю концентрацию соответствующих гормонов у второй подгруппы больных (рис.2). При отсутствии суточной динамики у больных БИК эти два показателя практически не отличались друг от друга. Однако, у всех больных БИК наблюдалось состояние гиперфункции коры надпочечников и имели место одни и те же закономерности нарушения секреции исследованных нами гормонов.
По нашим данным, среднесуточная концентрация Р у всех больных БИК увеличена в среднем в 4 раза по сравнению с группой ЗД, что и определяет развитие всех основных симптомов этого заболевания.
Среднесуточная концентрация 17Р у больных БИК практически не отличается от таковой у ЗД, а концентрация более раннего предшественника И в системе синтеза стероидов — ПРИ. — возрастает в 3-4 раза по сравнению с нормой.
Табл.2. Показатели[М±ш] содержания стероидов и АК’ГГ d периферической кропи больных БИК (£ — среднесуточное содержание гормона) __
гормон ед.изм. 8-00 16-00 23-00 £ 1
1. при наличии суточного ритма (п=4)
F нмоль/л 1027+168* 496+78* 568184* 687+84*
SR пмоль/л 44,010,8* 2,410,4* 2,510,4* 2,910,5*
I! пмоль/л 17,0±5,5* 8,814,8 6,614,4 10,814,7*
17 Р пмоль/л 7,8+1,5* 3,910,4 5,5+1,8 5,911,2
17 PR пмоль/л 66,1+5,9* 25,515,9* 11,6+4,2* 33,0114,5*
DMA пмоль/л 42,3+1,8* 10,811,5* 10,8+1,8* 14,2+1,8*
DBAS мкмоль/л 10,9±0,9* 8,510,9* 7,1±0,2* 8,9+0,5*
Aid пмоль/л 626±180 5451140* 400+280 550+143*
АКТГ пг/мл 126±37* 57124* 43+11* 94134*
2. без суточного ритма ( п=Н)
F пмоль/л 884+137* 7891189* 924+134* 8041135*
SR пмоль/л 3,3+0,7* 3,210,7 2,910,5 3,110.6*
Б пмоль/л 13,7+2,0* 14,312,5 10,511,3 12,811,7*
17Р пмоль/л 4,8+1,5 3,610,9 2,710,7 3,510,9
I7PR пмоль/л 34,2+8,1* 39,5+10,1* 38,6+8,4* 39,017,6*
DUA нмоль/л 13,6+3,1* 13,013,7* 10,210,9* 11,811,8*
DHAS мкмоль/л 5,9+1,1* 7,3+1,2* 6,711,2* 7,2±|,|*
Aid пмоль/л 534+110* 5731135* 8081221* 662+131*
АКТГ пг/мл 12+31 101128 90+22 105+21
3. с гипертензнен (п=У)
F ПМОЛЬ/jl 9651130* 7871124* 8641133* 8НН98*
SR ПМОЛ1./Л 4,1+0,9* 3,310,8 2,910,5 3,310,6*
В ПМОЛЬ/Л 16,6+3,3* 15,813,5 ‘ 10,711,9 12,213,1*
I7P пмоль/л 7,5+1,8 4,811,2 3,310,9 4,8+0,9
I7PR пмоль/л 36,0+10,8* 45,3112,5* 32,1+7,2* 38,7110,2*
DHA НМОЛ1./Л 22,514,8* 19,015,9 12,511,4* 18,713,1*
DHAS мкмоль/л 7,8+1,4* 8,511,5* 7,911,2* 7,4+1,5*
Aid пмоль/л 511147 6311147* 1082+249* 758+138*
АКТГ пг/мл 125147* 119139* 88133* 115137*
акт. ренина пг/мл.час 3,910,7 2.910,5 2,810,5 3,310,6
4. без гниертензии (п=9)
F нмоль/л 856+187* 7351197* 7851139* 731+164*
SR пмоль/л 3,310,8* 2,810,9 3,110,9 3.010,8*
В нмоль/л 12,8+2,8* 8,812,8* 7,9±2,8 10,312,4*
I7P пмоль/л 4,8+1,8 3,010,6 4,211,5 4,811,2
17PR нмоль/л 54,3123,7* 24,6+8,4* 19,5110,2* 31,2110,2*
DMA нмоль/л 16,3+1,4* 10,411,4* 11,1 + 1,4* 12,5 + 1,7*
DHAS мкмоль/л 7,411,4* 9,8+1,9* 8,611,8* 8,611,5*
Aid пмоль/л 6231146* 4671142* 2821142 4571107*
АК’ГГ пг/мл 70117 43+12 62110* 52114
акт. репина пг/мл.час 5,4+1,0 7,010,5 3,910,7 5,411,0
(* — достоверность различим между показателями у больных и здоровых: р<(),01)
я м н л a « «я ив «ж nil ттт тяянт ттт
ят мл пят я» мп ян ш я m я яп я яи н и m m я »
«QnV •■V’ ‘VI Л Л V, «vA .Т»!
оо м
Cî .. CJEïVIE-OX
Чл.—; h.
\ 4
——1 _ 12: i——
«»4¡¡¡F»»»
Piic.оперност1, различий между утренним и среднесуточным содержанием стерондсз
У всех больных БИК нами обнаружено значительное увеличение содержания в крови DHAS в течение суток. По сравнению с группой ЗД, содержание непосредственных предшественников основных надпочечниковых гормонов, таких как Sr для F, DHA для DHAS и В для Aid — резко снижено.
Обнаружено, что суточные изменения концентрации Aid в крови зависили от наличия или отсутствия у таких больных гипертензии (табл.2). Хотя уровень Aid был повышен у больных БИК без гипертензии, нормальный суточный ритм секреции его в кровь сохранялся. Для больных БИК с гипертензией суточная динамика этого гормона имела противоположный характер. В утренние часы, как и у больных БИК без гипертензии, уровень Aid в крови был повышен, но в вечернее время его концентрация не снижалась, а резко возрастала.
На основании этих наблюдений в дальнейшем больные БИК были разделены нами на две подгруппы в зависимости от наличия или отсутствия у них гипертензии среди симптомов заболевания (табл. 2).
У больных БИК с гипертензией среднесуточная концентрация Aid возрастает в 4 раза, а у аналогичных больных, но без гипертензии, лишь в 2 раза. У больных БИК с гипертензией прослеживается обратная корреляция содержания Aid с уровнем В. Возможно, у данных больных В (непосредственный предшественник Aid) более интенсивно, чем в норме, превращается в Aid.
Активность ренина в обеих подгруппах больных БИК не коррелировала с содержанием Aid и его суточной динамикой. Последнее может свидетельствовать о незначительном влиянии ренин-ангиотензиновой системы на регуляцию синтеза и секреции Aid при данной патологии.
Вместе с тем содержание других кортикостероидов в крови остается практически идентичным у больных этих двух подгрупп.
Оказалось, что группа больных с гипертензией состоит в основном из людей со средним возрастом 36,3±1,2 лет и с длительностью заболевания более 5 лет, тогда как в группе без гипертензии средний возраст больных составил 19,8±2,1 лет при длительности заболевания до 3 лет. Обнаруженный факт указывает на то, что развитие гипертензии у больных БИК можно рассматривать в качестве клинического симптома заболевания, характеризующего более тяжелую форму БИК и имеющего более длительный период течения.
Таким образом, полученные результаты однозначно доказывают, что при АКТГ-зависимой БИК имеют место нарушения функции всех трех зон коры надпочечников: изменения функциональной активности клеток клубочковой зоны приводят к повышению продукции
Aid, пучковой — к гиперсекреции F и сетчатой — к усилению синтеза DHAS.
Характер секреции кортикостероидов при ожирении
Начальные стадии БИК клинически трудно отличимы от некоторых форм гипоталамического ожирения. Для обеих групп больных характерно наличие незначительного гирсутизма и ярко выраженное ожирение, у них часто встречается пшертензия и нарушения жирового и углеводного обмена [McKenna TJ.,1996], Именно поэтому в качестве дополнительной группы сравнения нами были обследованы женщины, больные ожирением, осложненным пшертензией или без нее (табл.1).
Для больных ожирением было характерно наличие нормального суточного ритма выброса F. Его абсолютное содержание в крови также соответствует аналогичным показателям у ЗД. Единственным отличием суточной динамики содержания F от таковой у ЗД является некоторое повышение концентрации F ночыо, что может быть связано с изменением обмена стероидов и удлинением их периода полужизни у таких больных.
У больных ожирением найдено значительное увеличение концентрации В и Aid во всех исследованных временных интервалах. При этом у них сохранялась нормальная суточная динамика выброса В в кровь, независимо от наличия или отсутствия гипертензии, тогда как характер суточной динамики Aid непосредствешю зависил от величины кровяного давления. У больных ожирением, осложненным гипертензи-ей, как и у больных БИК, отмечено повышение концентрации Aid в крови в вечернее и ночное время, при этом среднесуточная концентрация его при ожирении сравнима с таковой у больных БИК. У больных ожирением без гипертензии суточная динамика Aid была аналогична таковой у ЗД, но абсолютный уровень его в крови выше нормальных значений и сравним с показателями при БИК.
При сохранении нормального суточного ритма выброса в кровь Sr, 17PR, DHA и DHAS у больных ожирением обнаружено недостоверное снижение абсолютной концентрации данных стероидов (табл.1).
Характер секреции кортикостероидов при гормонально-активных опухолях коры надпочечников.
Изучение секреции кортикостероидов, гиперпродукция которых обусловлена наличием функционально-активных опухолей коры надпочечников, развивающихся в ее клубочковой (АС) или пучковой (ГС) зонах (табл.3), явилось следующим этапом настоящей работы.
Для ГС характерна гиперсекреция F, благодаря чему клинические симптомы этой патологии аналогичны таковым при БИК. Для АС
характерно повышение продукции Aid и основным, а иногда и единственным, клиническим признаком является гипертония.Именно поэто-
Табл.З. Показатели [М±ш] содержания стероидов и АКТГ в периферической крови больных с гтокостеромой и альдостеромой (£ -среднесуточное содсржашге гормонов) __
гормон ед.изм. 8-00 23-00 Е
гшокосте F рома (п=15) нмоль/л 1009±142* 888±124* 984±127* 1
SR нмоль/л 5,5±0,4 4,7±2,5 5,1±1,3
В нмоль/л 31,5±13,7 29,6±11,8 28,7±11,1
17PR нмоль/л 12,9±4,5 5,9±2,0 9.5±1,2
DHA нмоль/л 20,6±4,6* 14,8±3,6* 17,2±4,5*
DHAS мкмоль/л 0,75±0,22* 0,36±0,16* 0,43±0,17*
Aid пм оль/л 434±100 419±52 426±47
АКТГ пг/мл 16,8±4,7* 10,9+3,0* 12,3±2,4*
альдосте рома (п= 16)
F нмоль/л 324±46 241±66 346±75
SR нмоль/л 3,5+0,7* 1,0±0,6* 2,9+1,1 *
В нмоль/л 35,2±6,6 23,2±7,9 24,8±14,6
17Р нмоль/л 5,6±0,8 4,1±1,0 4,8±0,9
17PR нмоль/л 13,8±1,0 9,7±2,3 12,9+1,5
DHA нмоль/л 51,5±5,1
DHAS мкмоль/л 2,73±0,25 1,45±0,28 1,83±0,35
Aid пм оль/л 1196±203* 1238±335* 1263+247*
АКТГ пг/мл 49,6±5,8
* — достоверность различий между больными и ЗД: р<0,01
му данные патологии были использованы в качестве альтернативных моделей при изучении стероидогенеза при БИК. Больные с ГС являлись группой сравнения для больных БИК без гипертензии, а больные с АС -для больных БИК с гипертензией.
Было обнаружено, что концентрация F у больных с ГС была значительно выше нормы, содержание DHA и DHAS достоверно снижалось по сравнению с нормой. Концентрация Aid не отличалась от таковой у ЗД, а при наличии опухолевого процесса наблюдалось снижение концентрации АКТГ.
При наличии у больных АС концентрация Sr была значительно ниже нормы. При этом, хотя и наблюдалась тенденция к снижению по сравнению с нормой содержания В , но в меньшей степени, чем при БИК
сравнению с нормой содержания В , но в меньшей степени, чем при БИК с гипертензией. Уровни F, 17Р, 17PR и АКТГ практически не отличались от нормы, а концентрация надпочечниковых андрогенов — DHA и DHAS — при данной опухоли была в пределах нормальных значений. И, наконец, концентрация Aid у таких больных значительно превышала уровень его и в норме, и при БИК с гипертензией.
Таким образом, несмотря на некоторые общие биохимические признаки: повышение концентрации Aid при АС и концентрации F при ГС — характер синтеза стероидов и его регуляция различны при гиперпластических и опухолевых процессах в коре надпочечников. Нарушения стероидогенеза при ГС проявляются через усиление синтеза F, не зависящего от функциональной активности гипофиза, тогда как при АС происходит резкая активация продукции опухолевыми клетками только одного Aid.
Характеристика секреции гормонов коры надпочечников после двусторонней адреналэктомии у больных БИК.
Основным радикальным методом лечения больных болезнью и синдромом Ицепко-Кушинга является односторонняя или двусторонняя тотальная адреналэктомия (АЭ). Последняя, как известно, ведет к хронической надпочечниковой недостаточности и требует пожизненной заместительной терапии стероидными препаратами. Однако, дозы стероидов, компенсирующих отсутствие глюкокортикоидной и минерал-кортикоидных функций, могут значительно варьировать у разных пациентов, особенно в отдаленные сроки после двусторонней АЭ. Эти индивидуальные различия у таких пациентов можно объяснить двумя ос-новными причинами. Во-первых, наличием сохраненной или восстановившейся после операции ткани надпочечников, способной активно функционировать и синтезировать стероиды, и, во-вторых, индивидуальными отличиями в метаболическом клиренсе, фармакокинетике и фармакодинамике экзогенно вводимых стероидов.
В данном разделе работы нами было проведено изучение содержания основных эндогенных гшококортикоидов и надпочечшгковых андрогенов в периферической крови больных БИК в отдаленные сроки после тотальной АЭ (табл.4).
Прежде всего у больных БИК с двусторонней АЭ для оценки адекватности применяемой гормональной терапии определялось содержание АКТГ в периферической крови. Оказалось, что на фоне заместительной терапии лишь у 25% больных наступала его полная нормализация, у 60% — содержание АКТГ оставалось на повышенном уровне, а у 15% — уровень АКТГ был снижен.
Содержание F у всех больных данной группы поддерживалось на нормальном уровне. При этом концентрация естественных предше-
вешшков И (за исключением 17Р, заметные количества которого образуются в гонадах) и андрогенов надпочечникового происхождения была значительно снижена. Степень снижения содержания этих стероидов не зависила от уровня АКТГ, достигаемого в результате заместительной терапии.
Табл.4. Показатели [М±ш] содержания стероидов у больных БИК после двусторонней адреналэктомии.
гормон ед.изм. 8-00 16-00 23-00 |
1. на фоне заместительной терапии (п=23
Р нмоль/л 364±150 333±125 534±187
8Я нмоль/л 1,2±0,8 0,9±0,5 1,1±0,8
В нмоль/л 6,5+2,2 3,5±1,7 4,9±2,6
17Р нмоль/л 2,1 ±0,5 3,5±1,7 4,9±2,6
17РЯ нмоль/л 12,3±5,1 17,1 ±3,3 16,5±4,5
БНА нмоль/л 1,7±0,6 0,2±0,1 0,3±0,2
БНАБ мкмоль/л 0,35±0,14 0,29±0,19 0,24±0,14
А1с1 пмоль/л 200±136 252+146 144±58
2. через 3 года после операции (с отменой заместительной терапии,
Б нмоль/л 54+14 50±22
В нмоль/л 2,2±1,0 3,6±1,2
ЭНА нмоль/л 5,2±1,6 3,6±0,8
БНАБ мкмоль/л 1,16±0,88 1,60±0,96
3. через 10 лет после операции (с отменой заместительной терапии, п— 16)__
Б нмоль/л 44±18 48±24
В нмоль/л 1,0+0,8 М±0,3
ОНА нмоль/л 4,2±2,0 3,0±0,6
БНАБ мкмоль/л 0,44+0,20 0,32+0,16
У группы больных, которым заместительная терапия гормональными препаратами была отменена до исследования на максимальной возможный срок, проводилось изучение величины «остаточной» или «восстановленной» секреции гормонов у больных после двусторонней АЭ. У таких больных в периферической крови оценивалось содержание двух глюкокортикоидов (И и В) и двух андрогенов (ОНА и БНА5).
Было показано, что при отмене заместительной терапии у больных независимо от срока после удаления обоих надпочечников уровень F как утром, так и вечером не превышал 60 нмоль/л, что в несколько раз меньше нижней границы нормы. Суточный ритм выброса F в кровь у этих больных отсутствовал.
Базальные концентрации В, предшественника Aid, у всех обследованных пациентов с двусторонней АЭ были значительно снижены и колебались от 1,0 до 5,0 нмоль/л, что в 4-12 раз ниже нижней границы нормы. Наиболее существенное снижение данного показателя отмечалось у больных с более длительным сроком, прошедшим после операции. Наблюдалось некоторое повышение содержания В в крови в вечернее время.
Концентрация DHA у всех больных после АЭ также была существенно снижена (в 3 раза по сравнению с нижней границы нормы), а уровень DHAS сохранялся на достаточно высоком уровне, но только у более молодых больных с 3-х летним периодом после удаления надпочечников. Следует отметить, что базальные показатели содержания DHAS у данной группы больных не достигали нормальных величин (утром 1162±882 нмоль/л и вечером 1607±958 нмоль/л) и значительно превышали аналогичные показатели у больных с 10-летним периодом после удаления надпочечников. Суточной динамики DHAS у всех больных обнаружено не было.
Для того, чтобы исключить возможность методической ошибки или артефакта, связанных с определением содержания гормонов в крови радиоиммунным методом в образцах, где присутствует значительное количество стероидов (суммарная экстрация из сыворотки по общепринятой методике), нами было проведено сравнительное исследование концентрации этих стероидов в аналогичных образцах, но после предварительного разделения их на хроматографической колонке Sephadex LH-20. Определение содержания F и В с помощью двух различных подходов не выявило достоверных различий в исследуемых показателях, что однозначно доказывает адекватность используемых нами в работе методов выделения и определения содержания этих гормонов.
Характеристика суточной секреции гормонов при ВДКН.
В качестве альтернативной формы гиперплазии коры надпочечников нами были подобраны и обследованы больные с иекласси-ческой формой ВДКН.
У всех обследованных больных наблюдается четко выраженный суточный ритм всех исследованных нами гормонов (табл.5). Этот ритм характерен для нормальной функции коры надпочечников и повторяет динамику секреции основного глюкокортикоида — F, что свидетельству-
ет о сохранности у больных с ВДКН механизма регуляции функции коры надпочечников по принципу отрицательной обратной связи.
Содержание В у больных ВДКН имело тенденцию к снижению в утренние часы по сравнению с контрольным уровнем. Среднесуточная концентрация Р, Бя и В достоверно не отличалась от таковой у ЗД. Концентрации ОНА и БНАЗ были повышены в 2-3 раза по сравнению с контролем, а уровень Т возрастал более, чем в 5 раз. Превышение среднесуточной концентрации 17Р11 и 17Р над контрольным уровнем достигало 30-40 раз для 17Р и 5-8 раз для 17РЯ.
Мы предположили, что высокие показатели уровня Р в крови у больных ВДКН, не отражают реального содержания этого гормона в крови и могут быть результатом методической ошибки при постановке иммунологической реакции. Известно, что у больных ВДКН из-за дефицита 21-гидроксилазной активности в клетках коры надпочечников значительно повышен синтез 21-дезоксиР, который может конкурировать с Б в радиоиммунологической реакции. В молекулах 21-дезоксиР и Р имеются подобные активные функциональные группы, а именно, гидроксилы в 11р- и 17а-положении, которые играют основную роль в распозновании стероидов антисывороткой к Р, используемой в радиоиммунологических методах. В результате этого величина абсолютного показателя Р будет существенно возрастать, и получаемые результаты в отношении каждого из стероидов будут не верны.
Приведенные нами исследования с очисткой экстрактов стероидов на колонке 8ерЬас1ех ЬН-20 и добавлением 21-дезоксиР к исследуемой плазме показали, что величины концентраций Р, определенные прямым методом, значительно превышают соответствующие показатели, полученные после хроматографии экстракта Р. Процент открытия добавленного стандарта 21-дезоксиР составлял 114,4±10,6%. Следовательно, 21-дезоксиР действительно имеет высокое сродство к используемой антисыворотке к Р, и его уровень в крови больных ВДКН может значительно превышать уровень К
Характеристика секреции стероидов при различных формах вирильного синдрома.
Основным симптомом неклассической формы ВДКН является вирильный синдром. Дифференциальная диагностика заболеваний, при которых основные жалобы касаются вирилизации и отсутствия менструального цикла, зачастую представляет собой значительные трудности. К таким заболеваниям относятся СТ, ВО, ОЯ и ВДКН. Поэтому мы провели сравнительное изучение характера стероидогенеза у больных с ВДКН и у больных вирильным синдромом различной этиологии (табл.5).
Табл.5. Показатели [M±m нмоль/л] содержания стероидов в периферической крови больных различными формами иирнлыюго синдрома (I — среднесуточное содержание стероидов).
гормон 8-00 16-00 23-00
I. врожденная дисфункция коры надпочечников (п=9)
F 722+136* 398+59 260144 459159*
SR «1,7+1,1 2,811,1 2,711,0 3,210,7
В 25,7+5,1 9,4 11,615,5 17,414,3
I7P 180,6+9,3* 105,9+34,2* 79,5+33,6* 121,8+36,3*
17PR 97,2+24,0* 36,0+8,7* 32,1 + 10,2* 54,9+12,9*
DHA 129,7±45,3* 63,3112,5* 73,3+16,6* 98,8+30,8*
DHAS 4730+750 42581611 * 26321315* 42151505*
Т 9,7+2,4* 5,6+1,1* 5,611,2* 6,9 + 1,5*
2. стромальныи текоматоз (п=13)
F 710168* 435+54* 247146* 497151*
SR 2,710,6* 1,0+0,2* 1,1+0,2* 1,9+0,5*
В 17,7±2,9* 8,9+1,6* 5,211,2* 10,6+1,6*
17Р 7,2+2,4 3,0+0,6 2,610,3 3,310,3
I7PR 12,3+5,7 7,8+2,1 5,212,1 11,115,4
DHA 109,2123,1* 69,1115,5* 42,8+7,9 78,4+24,9*
DHAS 3354+1336 280011907 21581757 29801114
‘Г 4,5+0,8* 3,310,3* 2,810,7* 3,7+0,6*
3. пнрилизирующая опухоль надпочечника (п=10)
F 459164 402+100* 3451123* 408+220*
SR 3,4+1,4* 5,111,0 6,8+2,2 5,011,0
В 21,2+7,9 22,415,1 26,013,3* 25,2113,4
I7P 18,319,4* 40,0+6,2* 19,5+4,1* 36,0114,2*
17PR 30,3+10,2* 20,0+6,3* 25,0+4,8* 22,2+4,8*
DHA 88,6141,8 132,1132,2* 109,1+25,7* 102,1+40,9*
D1IAS 466911025 6000+455* 4938+750* 5630+200*
Т 17,5+1 1,8* 18,0+5,2* 18,514,6* 18,8112,3*
4. иирилизпругощая опухоль яичника (п=12)
F 5951147 304147 176131* 390+71
SR 1,7+0,3* 1,310,3* 0,910,2* 1,310,3*
В 15,714,6* 3,512,4* 2,6+1,1* 7,513,0*
I7P 16,515,4 8,413,0* 9,013,6* 10,3+3,3*
17PR 13,2+3,6 7,8+3,3 9,9+3,6 10,2+4,8
DHA 42,1115,2 33,8+10,0 29,718,3 35,7+12,8
DHAS 166411392 10801210* 6761325* 1231+496*
Т 17,2+4,4* 15,3+6,4* 16,115,5* 16,615,9*
Суточная динамика секреции всех исследованных стероидов у больных СТ не отличалась от таковой у ЗД. У этих больных отмечался хорошо выраженный ритм Р, Бя, В, 17Р, 17РЯ, ОНА и ОНАЭ. Снижение концентрации этих стероидов к вечеру по сравненгао с утренним уровнем в крови достигало 2-3 раз. Однако, абсолютное количество секретируемых гормонов значительно отличалось от контроля. Среднесуточное количество Р, ОНА и Т существенно (в 2-4 раза) превышало норму, уровни Бя и В были снижены (в 2-3 раза), а концентрации 17Р, ПРИ. и ОНАБ не отличались от контрольного уровня у ЗД.
У больных с ВО практически отсутствовала нормальная суточная динамика секреции всех исследованных стероидов, что характерно для функционирования любых опухолевых клеток. Мы не наблюдали утреннего повышения и вечернего снижения содержания гормонов и их предшественников. Абсолютный среднесуточный уровень для большинства стероидов (Р, Т, 17Р и 17РИ., ОНА и ОНАБ) был значительно увеличен по сравнению с контролем. Степень его увеличения была различна для разных стероидов. Так, концентрация Ии 17РЯ возрастала в 1,5-2 раза, ОНА и ОНАБ — в 2-3 раза, а 17Р и Т — почти в 10 раз. Среднесуточное содержание Б к и В оставалось в пределах нормы.
Суточная динамика секреции всех исследованных стероидов у больных с О Я не отличалась от нормы. Среднесуточная концентрация И возрастала лишь в 1,5 раза, а концентрация 17Р — в 2-3 раза. Аналогичные показатели для Бя, В и ОНАБ были снижены в 2-4 раза по сравнению с контрольной группой. Одновременно наблюдалось значительное (почти в 10 раз) увеличение среднесуточной концентрации Т.
Таким образом, повышение уровня И в крови наблюдалось при всех патологиях, связанных с вирилизацией. Наиболее значительное увеличение данного показателя характерно для ВО, а наименее выраженное — для ОЯ. Вероятно, как считают некоторые авторы [УегтевЬ М. сГа1. 1988, Агпъ Я. е1 а1. 1991], высокий уровень Т в крови при различных формах вирильного синдрома подавляет активность 21-гид-роксилазы надпочечников. Из-за снижения активности данного фермента может синтезироваться и определенное количество 21-дезоксиР, который интерферирует с Р при его определении в крови.
Следовательно, характер стероидогенеза имел определенные различия при всех патологиях, изученных в данном разделе работы. Общим признаком для них было лишь повышение в разной степени концентраций Т в системе общей циркуляции крови. В связи с этим возникает вопрос о природе и источниках андрогенизации организма, то есть о функциональном состоянии яичников и надпочечников и их вкладе в формировании общего пула андрогенов у вирильных женщин.
Характер секреции стероидов корой надпочечников и яичниками у женщин с различными формами вирильного синдрома Применение селективной катетеризации кровеносных сосудов с последующим определением стероидов в оттекающей от надпочечников или яичников крови, позволило дать однозначный ответ на вопрос об источнике, уровне и характере секреции стероидных гормонов в данных органах.
Ранее Spark R.F. с соавторами [1974] показали, что F секретиру-ется и правым, и левым надпочечниками с одинаковой скоростью. Основываясь на этих данных, мы ограничились определением стероидов только в левой надпочечниковой вене, поскольку доступ к аналогичной надпочечниковой вене справа существенно ограничен, определение стероидов в крови, оттекающей от яичников, проводилось в венозной крови и правого, н левого яичника.
Так как мы не имели возможности получить собственных данных о содержании стероидов в надпочечниковых и яичниковых венах у З.Д, то сравните результатов было проведено между различными группами больных (табл.6), то есть показатели уровня стероидов при каждой из патологий служили как бы своеобразным контролем для других заболеваний.
При ВДКН F, Sr и В секретировались исключительно надпочечниками. Некоторое повышение концентраций F в крови, оттекающей от яичника, по сравнению с его периферическим уровнем было статистически недостоверным. Как предшественники ггаококортикои-дов и надпочечниковых андрогенов: 17Р и 17PR, так и андрогены: DHA, DHAS и Т — секретировались в значительных количествах исключительно надпочечниками. Яичники больных ВДКН практически не продуцировали ни Т, ни DHA или его сульфат. Эти результаты данные убедительно доказывают, что основным источником гиперандро-генизации при ВДКН являются надпочечники.
Секреция F в коре надпочечников у больных с СТ была аналогичной таковой у больных ВДКН. Концентрация В в надпочечниковой вене была существенно выше, чем аналогичный показатель у больных ВДКН. Уровень секреции Sr надпочечниками практически не отличался у больных ВДКН и СТ. 17PR у больных СТ, как и у больных ВДКН, секретировался исключительно корой надпочечников. Некоторое повышение уровня 17PR наблюдалось нами и в крови, оттекающей от яичников, но это увеличение было статистически недостоверно. Существенная часть общего пула 17Р, циркулирующего в периферической крови, секретировалась надпочечниками. Однако, заметные количества 17Р у больных СТ синтезировались и яичниками. DHA и DHAS продуцировались надпочечниками больных СТ в более низких количествах по сравнению с ВДКН. Содержание DHA в адреналовой вене в 2,5
Табл.6. Концентрация гормонов [М±т нмоль/л] d периферической крови (П), крови, оттекающей от левого надпочечника (И), от левого (ЛЯ) и правого (ПЯ) яичника, у
больных с различными формами вирилыюго синдрома._
| гормон | П I Н | ЛЯ |
1. врожденная дисфункция коры надпочечников (п=4)
F 425±I43 45001152″ 643±214
SR 4,3±!,5 38,8±5,0* 4,2±1,3
13 18,0+3,2 175,0+62,0* 12,8±3,5
17Р 254,4+22,8 1417,1 + 114,3* 182,8+68,5
17PR 61,7+20,5 493,7+246,7* 82,3±22,4
DHA 185,7+35,5 1156,4+302,0* 222,8±57,3
Dil AS 4715±1925 47321+12536* 5711+1348
‘Г 5,7+2,1 32,1±12,8* 5,7±3,2
2. стромальныи текоматоз (н=6)
F 550±38 38811608* 630157
SR 4,310,9 45,6±15,5* 4,810,6
Б 24,7+3,1 416,41177,8* 27,2+3,1
17Р 7,8+3,0 355,3+147,7* 48,9+5,3*
17PR 23,1+7,5 1526,41987,3* 53,7±13,8
D1IA 56,0116,9 418,1+225,0* 153,9144,4
D1IAS 865 7483* 952
Т 4,2±0,9 9,6+1,6* 59,3116,2*
3. внрилнзирующая опухоль левого надпочечника (п=3)
F 516 2856* 626
SR 4,7 37,0* 4,6
Б 54,9 300,4* 39,1
17Р 12,0 87,9* 1 1,1
I7PR 44,1 64,2* 14,7
DHA 91,5 93,6 . 93,9
DHAS 3352 41325* 623
Т 8,5 19,3* 8,5
4. вирилизуюшая опухоль яичника (п=10)
гормон П II опухоль справа(п=7) ЛЯ IIЯ опухоль слева (п=3) ЛЯ ПЯ
F 441+57 532311309* 517152 581+92
SR 2,410,4 30,9+12,1* 3,0±0,6 4,0 + 1,0
В 38,6±9,4 506,3+272,8* 42,2+6,6 33,0 + 11,5
17Р 21,4+15,1 106,9+67,1* 23,8 118,6+63,8* 59,8* 6,0+1,8
17PR 17,1 ±6,3 205,9148,7* 14,7 65,1 ±21,9* 21,0 21,6112,0
DHA 65,8113,8 646,21232,2* 36,7 3851109* 49,5 33,719,3
D11AS 16281733 5923+2215* 1423 2556 2781 980
Т 19,716,6 27,8112,9 36,5 101,9138,3* 172,0+23,1 * 26,0+15,4
-достоверность различий по сравнению с содержанием в периферической крови: р<0,01
раза, а ОНАЭ — в 6-7 раз меньше аналогичных показателей при ВДКН. В отличие от сульфатной формы, уровень которой в оттекающей от яичников крови не превышал такового в общем кровотоке, уровень выброса свободного ОНА из яичника была в 3 раза выше по сравнению с его уровнем в локтевой вене. При СТ яичниками продуцируются значительные количества Т.
Следовательно, основным источником гиперандрогенизации при СТ являются яичники, хотя небольшие количества Т продуцируются и надпочечниками.
При ВО основным источником предшественников Р: 17Р, 17РЯ и Бя, а также Р, В и андрогенов оказались надпочечники. У больных этой группы яичники практически не принимали участия в формировании общего пула стероидных гормонов в периферической крови. Секреция гшококортикоидов при ВО была подобна таковой при ВДКН. Но, в отличие от ВДКН, когда повышение продукции всех андрогенов происходит примерно в равной степени, при ВО нарастает прежде всего синтез ОНАБ. Полученный факт однозначно демонстрирует различия в характере стероидогенеза при этих двух патологиях коры надпочечника.
У больных с ОЯ было найдено, что основные глюкокортикоиды (Р, Бя и В) секретировались только надпочечниками. Наблюдалось некоторое превышение синтеза В корой надпочечника при данной патологии по сравнению с аналогичным показателем при ВДКН. Главным источником ОНАБ, ОНА и 17РЯ при ОЯ также являлись надпочечники. Вместе с тем, тот яичник, в котором была локализована опухоль, также секретировал эти стероиды в значительных количествах. 17Р синтезировался в равной степени и в надпочечниках, и в патологическом яичнике, в отличие от синтеза этого гормона при ВДКН. Единственным местом синтеза и секреции Т в организме больных женщин данной группы являлся тот яичник, где была локализована опухоль.
Анализ активности Ферментных систем коры надпочечников.
Одной из основных проблем, которые предстояло нам решить в настоящей работе, являлось исследование количественных и качественных особенностей стероидогенеза в коре надпочечников человека в норме и при ряде эндокринных заболеваний, сопровождающихся избыточной продукции тех или иных сгер о идо п.
Известно, что абсолютный уровень стероидов, щцжулирующих в крови, является результатом циклической секреции этих гормонов эндокринными железами, распределения их в различных пулах и скорости клиренса из существующих пулов. Мы исследовали не только уровень продукции соответствующих стеридов, но и их среднесуточное
содержание в крови путем многократного определешш концентрации гормонов в течение суток и вычисления среднеарифметического показателя их содержания в крови. Изучение именно среднесуточной концентрации, по нашему мнению, является наиболее информативным (интегральным) показателем активности коры надпочечников и метаболических процессов в организме. Он достоверно отражает способность коры надпочечников продуцировать и секретировать те или иные стероиды (табл.7), а с помощью соотношения этих показателей для разных гормонов можно прогнозировать не только функциональную активность данного органа, но и направление путей биосинтеза соответствующих гормонов (табл.8 и рис.3) при различных эндокринных патологиях.
Болезнь Иценко-Кушинга. Характерными биохимическими признаками БИК является резкое повышение среднесуточной концентрации не только F, но и 17PR и DHAS. Выявлено заметное снижение уровня Sr, В и DHA. Обнаружено также значительное возрастание среднесуточной концентрации Aid,
свойственное прежде всего группе больных БИК с гипертензией, то есть тем больным, у которых длительность заболевания дольше и биохимические нарушения обмена выражены сильнее.
При выявлешш основного направления биосинтеза главного кортикостероида — F — определяющим является оценка величины отношения среднесуточных концентраций 17Р и 17PR, характеризующего активность Зрол-стеро-иддегидрогеназы. При гиперплазии коры надпочечников, вызванной БИК, наблюдается выраженный сдвиг биосинтеза Fb сторону преимущественного образовашы 17PR по сравненшо с 17Р, так как соотношение этих двух предшественников F уменьшается в 3,5-4,0 раза.
Важным звеном в выборе направления пути стероидогенеза в коре надпочечников, является и активность 17а-гидроксилазы/17,20-десмолазы, которая катализирует превращение прегненолона в 17PR или 17-гидроксилированных стероидов в DHA. Отношение DHA/17PR, свидетельствующее об активности этого фермента, также снижалось в 7-9 раз по сравненшо с нормой. Это происходило за счет одновременного уменьшения секреции DHA и увеличения секреции 17PR. Следовательно, у больных БИК имеет место явный сдвиг соотношения направлений стероидогенеза в сторону Д5-пути.
Одновременно было обнаружено, что значительно увеличиваются соотношения: F/Sr в 3,5-4 раза, А/В в 3,5-4 раза и DHAS/DHA в 7-12 раз. Было продемонстрировано, что при БИК среднесуточные концентрации продуктов вышеперечисленных реакций резко повышены, а содержание предшественников значительно снижены. Устано-
Табл.7. Характер изменений среднесуточного уровня стеридов по сравнению с аналогичным показателем у ЗД.
гормон БИК ожире- глюко- альдо- вдкн стр.те- пир.011. вир.оп.
ние стерома стерома тематоз иадпоч. яичник.
р Т N т N т т т т
5Я 4 N 4 N 4 N 4
В 4 т N N N 4 N 4
17Р N N N N П N Т Т
17РЯ Т N N Т N Т N
ОНА 4- г 4 N Т 1 т N
ИПАЭ Т 1 4 N т N т 4
А1<3 Т т N 1- — — — -
‘Г N N N N Т Т п П
N достоверных отличий от нормы нет
4 — снижение уровня по сравнению с нормой
Т — повышение уровня но сравнению с нормой в 2-5 раз
1″Г — повышение уровня по сравнению с нормой более, чем в Ю раз
Табл.8. Относительное изменение отношения среднесуточного содержания стероидов (в % по сравнению с нормой) в периферической крови у больных при различных эндокринных патологиях.
БИК ожире- глюко- альдо- ВДКН ст.теко вир.оп. вир.оп.
ние стерома стерома матоз надиоч. яичн.
344* 186 406* 135 211* 301* 120 291*
АШ/В 500* 129 125 416* — — — -
17Р/17РК -360* 165 111 103 611* -124 455* 277*
8К/17Р -190 -176 -144 -200 -4000* -210 -923* 1000*
ОЫА/17РК -770* -112 -194* 100 -205* 189* 124 -105
ОНАБ/ОНА 948* 137 103 -109 -132 -150 -219 -167
* — достоверность различий между показателями у больных и здоровых людей: р<0,0!
Рис.3. Изменение отношений среднесуточных концентраций стероидов в периферической крови больных различными эндокринными патологиями (показатель у ЗД принят за 1).
ожирение
ГС
» АС
* — достоверность различий по сравнению с контролем: р<0,01 И Р/ЭН ет БИЛ 7Р
ШИШ АМ/В ИРМ О НА/17РГ1
УШЛ 17Р/17РИ
□ НАБ/ОНА
вленный факт однозначно доказывает увеличите активности ферментов, таких как 1 ip-гидроксилаза, 18-гидроксилаза и сульфатаза при данной патологии.
Активность 21-гидроксилазы при БИК практически не изменяется, поскольку отношение Sr/17P достоверно не отличалось от нормы, хотя и имеется некоторая тенденция к сниженшо данного показателя.
Таким образом, характерным признаком ферментных стероидо-генных систем в гиперплазированной коре надпочечников при БИК являегся, с одной стороны, увеличение активности ферментов на конечных этапах биосинтеза кортгасостероидов и надпочечниковых андроге-нов и, с другой стороны, уменьшение активности Зр-олстероиддегид-рогеназы и 17,20-лиазы. Стероидогенез в коре надпочечников при данной патологии характеризуется избыточным образованием Д5-сте-роидов (17PR и DHAS) и синтезом F преимущественно по Д5-пути.
Ожирение. Характер биосинтеза стероидов у больных ожирением имеет свои особенности, отличающие его от такового у ЗД и у больных БИК. Выявлено, что отклонения от контроля среднесуточного содержания Sr, DHA и Aid при БИК и ожирении однонаправленны, тогда как изменения концентрации В, DHAS и 17PR у больных обеих групп разнонаправленны.
Снижение среднесуточной концентрации стероидов, предшествующих в процессе биосинтеза конечным продуктам стероидогенеза в коре надпочечников, свидетельствует о некоторой активации стерои-догенных ферментов при ожирении. Однако, степень повышения функциональной активности коры надпочечников при ожирении не так велика, как при БИК, и скорее всего является вариантом нормы, а не патологией собственно надпочечников.
Действительно, сотношения концентраций стероидов, отражающие активность ферментных систем при ожирении свидетельствуют лишь о некоторой тенденции к повышению активности 11 Р-гид-роксилазы. Обнаруженные отличия от соответствующих показателей у ЗД не достоверны и отражают не принципиальные изменения стероидогенеза в надпочечниках у больных ожирением.
Следует помнить, что при ожирении в организме изменяются скорости обменных процессов, что может приводить к изменению активности ферментных систем коры надпочечников и, как следствие этого, к уменьшению или повышению абсолютных концентраций стероидов в крови.а1а Я. й а1. [1987], усиливаются в опухолевой ткани надпочечников.
Таким образом, при ГС синтез Р происходит в основном по Д»-пути, тогда как образование стероидов, в том числе и надпочечниковых андрогенов, по Д5 -пути минимально.
У больных с АС выявлено достоверное увеличение (в 4 раза) только соотношения В/АИ и тенденция к снижению (в 2 раза) соотношения Бя/17Р. Следовательно, при АС возрастает активность 18-гидроксилазы (альдостерон-синтетазы) и несколько снижается активность 21 -гидроксилазы. Мы не обнаружили изменение в активности Зр-олстероиддегидрогеназы у больных АС, так как соотношение 17Р/17РЙ оставалось при данной патологии в пределах нормы. Общее направление стероидогенеза и соотношение его путей у больных с АС практически не отличалось от нормального.
Врожденная дисфункция коры надпочечников.Избыточная продукция андрогенов у больных ВДКН неизбежно должна приводить к изменению активности ферментов коры надпочечников. Известно, что эндогенно образованные андрогены обладают способностью тормозить активность 11 р-гидроксилазы, Зр-олстероиддегидрогеназы, сульфатазы и повышать активность 17а-гидроксилазы/17,20-десмо-лазы.
Однако, полученные в исследовании данные о соотношении стероидов, отражающие активность тех или иных ферментов, свидетельствуют о том, что с достаточной степенью достоверности можно говорить о снижении активности только 21 -гидроксилазы (снижение соотношения Бк/ПР в 40 раз) и 17,20-десмолазы (снижение соотношения ОНА/17РЯ в 2 раза). Хотя повышение в 2 раза соотношения Р/Бк и указывает на возможное увеличение активности 11 Р-гидроксилазы, но этот показатель не отражает реальной ситуации из-за возможной неверной оценки концентрации Р при радиоиммунологическом анализе.
Возрастание в 10 раз соотношения 17Р/17РЯ обусловлено при ВДКН непропорциональным повышением уровня этих стероидов в крови: 17Р в 30-40 раз, а 17РИ. — лишь в 5 раз.
Полученные результаты однозначно доказали, что кора надпочечников у женщин с неклассической формой ВДКН является основным местом синтеза 17а-гидроксилированных предшественников кортикос-тероидов и надпочечниковых андрогенов. Образовавшийся в коре над’ почечников 17PR частично преобразуется в 17Р, дальнейшее превращение которого по Д4-пути затруднено благодаря дефициту 21-гидро-ксилазы; превращение 17PR по Д5-пути протекает без больших затруднений, приводя к повышенному синтезу надпочечниковых андрогенов.
Вирильный синдром. Количественные параметры секреции ис-следовашплх нами стероидов при различных формах вирильного синдрома отличались не только от такового у ЗД, но и друг от друга. Оказалось, что при всех этих заболеваниях имеет место повышение концентрации F. Этот факт может быть обусловлен как увеличением непосредственно его синтеза, так и интерферирующим влиянием 21-дезоксиР, продукция которого возрастает благодаря подавлению ан-дрогенами активности 21-гидроксилазы. Однако, снижение активности 21-гидроксилазы у больных с изученными формами вирильного синдрома выражено в меньшей степени, чем у больных с ВДКН.
Примечательным является тот факт, что изменение среднесуточных концентраций DHA и его сульфата у больных с вирильным синдромом яичникового происхождения было разнонаправленным. При СТ уровень DHA был повышен, а уровень DHAS оставался в норме. При ОЯ, наоборот, содержание DHA было в пределах нормы, а уровень DHAS достоверно снижался. Следовательно, непропорциональное измените среднесуточного уровня этих гормонов, а также снижение соотношения их, характеризующее активность сульфатазы, подтверждают мнение Song C.S. с соавторами [1996] о способности Т периферической кровн снижать активность сульфатазы в коре надпочечников.
Оценка соотношения концентраций стероидов в периферической крови продемонстрировала, что при исследованных заболеваниях функциональные характеристики ферментных систем также различны. В то же время к интерпретации этих результатов следует подходить с осторожностью, поскольку по концентрации стероидов, определенной в периферической крови, практически невозможно судить об изменении активности ферментных систем стероидпродуцирующих желез и вкладе коры надпочечников и/или яичников в формирование общего пула стероидов.
Однозначный ответ об месте основного синтеза стероидов при вирильном синдроме дают наши данные по определению стероидов в
крови, оттекающей ог яичников и надпочечников, при селективной катетеризации соответствующих сосудов.
Так, соотношения концентраций стероидов в периферической крови при ВДКН и ВО не значительно отличаются от соответствующих показателей в крови, оттекающей от надпочечника, и этот факт доказывает, что основным местом синтеза гшококортикоидов, надпочечни-ковых андрогенов и их предшественников у больных с ВО является именно патологический надпочечник или оба надпочечника у больных с неклассической формой ВДКН. Последнее дает основание утверждать с большой степенью достоверности, что при патологии надпочечников отношения концентрации любых исследуемых стероидов в периферической крови отражают характер их биосинтеза в коре надпочечников.
Например, соотношение Бк /17Р, свидетельствующиее об активности 21-гидроксилазы, естественно, снижено наиболее заметно (в 40 раз) у больных с неклассической формой ВДКН и в меньшей степени (в 8-10 раз) у больных с ВО. Соотношение И/Б к, отражающее функциональную активность 11р-гидроксилазы, находится в пределах нормы при ВО. Однако, тенденция к некоторому повышению концентрацшш особенно заметному в вечерние часы, у больных с опухолью надпочечника подтверждает мнение БЬагта О.С. с соавторами [1963] и Богаппо Э. с соавторами [1995] о снижении активности этого фермента при андрогенпродуцирующих опухолях коры надпочечников.
Соотношение 17Р/17Р11, характеризующее активность Зр-олстероиддегидрогеназы, при ВО повышено, что позволяет сделать вывод о сдвиге основного направления стерондогенеза в сторону Д4-пути. При этом заболевании синтез андрогенов надпочечников происходит в основном чq)eз образование 17Р.
При СТ и ОЯ соотношение содержания И и вк в периферической крови отражает функциональную активность коры надпочечников, так как эти стероиды синтезируются исключительно надпочечниками. Их соотношение было повышено в 3 раза по сравнению с нормой. Учитывая тот факт, что концентрация Бк при данных заболеваниях существенно снижена, можно говорить о некотором повышении активности 11р-гидроксилазы.
Таким образом, результаты, полученные в настоящем исследовании, однозначно доказывают, что снижение или повышение активности ферментных систем коры надпочечников имеют решающее значение в развитии эндокринных патологий, сопровождающихся гиичэ-секрецией кортикостероидов или андрогенов. Именно эти изменения определяют характерные для каждой отдельной патологии количественные и качественные показатели спектра синтезируемых глюкосте-роидов, надпочечниковых андрогенов и их предшественников.
выводы
1. Изменения функциональной деятельности различных зон коры надпочечников, сопровождающиеся нарушением активности специфичного для каждой патологии набора ферментативных систем, являются основополагающими в патогенезе эндокринных заболеваний, обусловленных гиперпродукцией гормонов коры надпочечншсов (БИК, ВДКН, опухоли коры надпочечников). При этом меняется и нормальное соотношение путей биосинтеза стероидов Д4- и Д5-ряда, что ведет к избыточной или недостаточной секреции тех или иных кортикостеро-идов по сравнению со здоровыми людьми.
2. В условиях целостного организма наиболее объективным критерием оценки активности ферментных систем стероидогенеза в коре надпочечников является среднесуточная, а не утренняя концентрация стероидов в периферической крови.
3. Для гиперплазии коры надпочечников, обусловленной повышенной секрецией АКТГ ( АКТГ зависимая болезнь Иценко-Ку-шннга) характерно повышение активности ферментных систем коры надпочечншсов на конечных этапах биосинтеза кортикостероидов (11(3-гидроксилазы, 18-гидроксилазы=альдостерон-синтетазы и сульфатазы) и уменьшение активности Зр-олстероид-дегидрогеназы и 17,20-десмо-лазы. Преимущественное образование кортикостероидов осуществляется через Д5 -путь, что проявляется повышением концентрации в периферической крови Д5 -стероидов (17а-гидроксипрегненолот» и дегидро-эпиандростерон-сульфата) и альдостерона при одновременном снижении концентрации кортикостерона, 11-дезоксикортизола и дегидро-эпиандростерона.
4. У значительного большинства больных БИК (75%) отсутствует суточный ритм секреции кортикостероидов в кровь, характерный для здоровых людей. У остальных больных БИК сохраняется суточная динамика секреции стероидных гормонов, близкая к нормальной, хотя абсолютный уровень секреции резко повышен. Содержание гормонов, в частности кортизола, в утренней порции крови у таких больных превышает аналогичный показатель вечером в 1,5-2,0 раза вместо 5,0-8,0 раз у здоровых людей.
5. После двухсторонней адреналэктомии у больных БИК сохраняется синтез и гтококортикоидов, и надпочечниковых андрогенов, однако их уровень снижен в 7-10 раз по сравнению с таковым у здоровых людей.
6. Соотношение путей биосинтеза у больных ожирением не отличается от нормального, а выявляемые различия в абсолютном уровне содержания стероидов в периферической крови (прежде всего, повышение концентрации кортикостерона) обусловлены другими факторами,
не связанными с деятельностью коры надпочечников. Скорее всего, эти изменения являются следствием нарушений процессов инактивации стероидов в печени и/или жировой ткани.
7. У больных БИК и ожирением при наличии гипертензии выявлена специфическая суточная динамика секреции альдостерона со значительным повышением концентрации его в периферической крови вечером, что может свидетельствовать о существовании общих механизмов развития гипертензии при этих эндокринных патологиях.
8. Для больных с гшокостеромой при неконтролируемом АКТГ биосинтезе стероидов характерно усиление шунта стероидогенеза с преобладанием Д4-пути, тогда как синтез стероидов по А5-пути минимален. В результате этого образование кортизола осуществляется преимущественно через 17а-гидроксипрогестерон. Для данной патологии характерным является значительное повышение активности 11 р-гид-роксилазы и заметное снижение активности 17,20-десмолазы.
9. У больных с альдостеромой общее направление стероидогенеза и соотношение обоих путей (Д4 и Д5) в коре надпочечников практически не отличается от нормы. Значительное повышение активности 18-гидроксилазы (альдостерон-синтетазы) приводит к заметному повышению секреции альдостерона, абсолютный уровень которого в периферической крови превышал таковой у больных БИК в 2-3 раза.
10. У больных неклассической формой ВДКН преобразование 17а-гидроксипрогестерона значительно замедляется благодаря резкому снижению активности 21-гидроксилазы, поэтому биосинтез гшокосте-роидов в коре надпочечников по Д4-пути приводит к заметному, превышающему норму в десятки раз, накоплению этого стероида. В результате основное количество синтезированных предшественников метаболизируется далее по Д5 -пути, способствуя увеличению секреции надпочечниковых андрогенов.
11. Для больных с вирилизирующей опухолью коры надпочечников характерно повышение активности ЗР-олстероиддегидрогеназы и уменьшение активное™ 21-гидроксилазы, что приводило к сдвигу общего направления стероидогенеза преимущественно по Д4-пути. Таким образом, биосинтез как глюкостероидов, так и надпочечниковых андрогенов происходит при данной патологии в основном при участии 17а-гидроксипрогестерона. Яичники при данном заболевании оставались интактными.
12. Длительная гиперпродукция андрогенов вненадпочечнико-вого происхождения (стромальный текоматоз и вирилизирующая опухоль яичников) вызывает повышение активности 11 р-гидроксилазы в коре надпочечников, что в конечном итоге приводит к возрастанию концентрации кортизола в периферической крови.
13. Выявленная специфика функциональных патогенетических характеристик стероидогенеза в коре надпочечников при исследованных заболеваниях позволяют разработать новые подходы к гормональной диагностике данных заболеваний. Закономерности биосинтеза кортикостероидов свидетельствуют о том, что в качестве достоверных маркеров, кроме широко известных, следует использовать:
при БИК — повышение концентраций 17а-гидроксипрег-ненолона и дегидроэпиандростерон-сульфата и одновременное снижение содержания 11-дезоксикортизола, кортикостерона и дегидроэпиан-дростерона,
при ВДКН — повышение 17а-гидроксипрегненолона, свободного дегидроэпиандростерона и его сульфата,
при глюкостероме — снижение уровня надпочечниковых андро-
генов,
при альдостероме — снижение уровня 11-дезоксикортизола, при вирилизиругощей опухоли надпочечника — повышение концентрации 17а-гидроксилированных производных прогестерона и пре-гненолона, а также дегидроэпиандростерона и его сульфата.
СПИСОК ИСПОЛЬЗУЕМЫХ СОКРАЩЕНИЙ
АКТГ — адренокортикотропный гормон 17Р- 17а-гидроксипрогестерон 17PR- 17а-гидроксипрегненолон Sr — 11-дезоксикортизол F — кортизол
DHA — дегидроэпиандростерон
DHAS — дегидроэпиандростерон-сульфат
Т — тестостерон
В — кортикостерон
Aid — альдостерон
БИК — АКТГ-зависимая болезнь Иценко-Куппшга ВДКН — неклассическая форма врожденной дисфункции
коры надпочечников ГС — гшокостерома АС — альдостерома
ВО — вирилизирующая опухоль коры надпочечников ОЯ — вирилизирующая опухоль яичника СТ — стромальный текоматоз АЭ — адреналэктомия ЗД — здоровые доноры
СПИСОК ОСНОВНЫХ РАБОТ И СООБЩЕНИЙ. ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ:
1. Применение глюкокортикоидных препаратов при врожденной дисфункции коры надпочечников. / Зеленецкая B.C., Колесникова Г.С., Ромазанович И.Г., Кузнецова Э.С. // Пробл.эндокрнн. — 1982. — №1.
— стр.38-42.
2. Критерии диагностики и методов лечения гормонально-активных опухолей гипофиза. / Марова Е.И., Колесникова Г.С., До-брачева А.Д. // «Раннее распознование эндокринных заболеваний и новые методы лечения. Вопросы экспериментальной эндокринологии.» Материалы 1-ого Всероссийского съезда общ-ва эндокринологов, Уфа, 1984 год, стр.9-10.
3. 17-оксипрогестерон как критерий ранней диагностики и терапии при врожденной дисфункции коры надпочечников. / Колесникова Г.С., Кузнецова Э.С. // Там же, стр.36-37.
4. Диагностическая значимость показателей радиоиммуного определения гшококортикоидиых, гонадотропных и половых гормонов. / Зеленецкая B.C., Колесникова Г.С., Добрачева А.Д. // Лаб.дело. — 1985.
— №12. — стр.726-729.
5. Принципы выбора методов лечения болезни Иценко-Кушинга./ Базаджиева Э.К., Андреева М.А., Карагиозов Л. и др. // Пробл.эндокрнн. — 1986. — №3. — стр.34-38.
6. Диагностика гормонально-активных опухолей гипофиза (обзор литературы и собственные данные)/Марова Е.И., Бухман А.И., Кирпатовская JI.E. и др. // Пробллндокрин. — 1986. — №6. — стр.66-72.
7. Чувствительность гипоталамо-гипофизарной системы к дек-саметазону, введенному в различное время суток, при ожирении. / Бугрова С.А., Колесникова Г.С. // Пробл.эндокрнн. — 1987. — №3. — стр.32-34.
8. Результаты лечения болезни Иценко-Кушинга протоновым пучком. / Марова Е.И., Старкова Н.Т., Кирпатовская Л.Е. и др.// Мед.радиол. — 1987. — №8. — стр.42-49.
9. Лабораторные критерии адекватной диагностики заболеваний коры надпочечников./ Колесникова Г.С., Панкова С.С., Атаманова Т.М. // Материалы Ш-го Всесоюзного съезда эндокринологов, Ташкент, 1989, стр.478.
10. Функциональное состояние гипофизарно-надпочечниковой системы при ожирении. / Колесникова Г.С., Бутрова С.А. // Maтqшaлы симпозиума «Физиология гипофизарно-адренокортикальной системы», Ленинград, 1990, стр. 173-174.
11. Современные методы выяснения источника гиперандрогене-мии у женщин с вирильным синдромом. / Пищулин A.A., Знаменский A.A., Колесникова Г.С. и др. // Материалы 11-го Всероссийского съезда эндокринологов, Челябинск, 1991, стр.311.
12. Ускоренное адренархе — возможный вариант неклассической формы ВДКН. / Семичева Т.В., Колесникова Г.С., Соколов В.В. и др.// Там же, стр.336.
13. Nonclassical congenital adrenal hyperplasia as a possible cause of premoture adrenarche. / Semicheva Т., Kolesnikova G., Buraja Т., Peterkova V. //Adolesc. Pediat.Gynecol. — 1992. — Vol.2. — P. 106-108
14. Системный подход в изучении гипофизарно-адреналовой системы и стероидогенеза у больных болезнью Иценко-Кушинга. / Гончаров Н.П., Колесникова Г.С., Воронцов В.И. и др. // Материалы 1-го Всероссийского симпозиума «Хирургия надпочечников», Санкт-Петербург, 1992, стр.94
15. Pituitary-adrenal function in obese women. / Kolesnikova G., Butrova S., Goncharov N. II 9 Internat.Congress of Endocrinology, Nizza,
1992, 11.03.135.
16. The selective ovarian and adrenal venous catheterization approach for characteristic of steroidogenesis disorders in patients with virilization. / Goncharov N., Znamensky A., Kolesnikova G. et al. // Ibid. 14.04.002.
17. Steroidogenesis in patients with different adrenal and gonadal disfunctions: use of immunoassay methods. / Goncharov N., Kolesnikova
G., Vorontsov V. et al. // Proc. 5th Symp. on the Analysis of steroids. Smombathely, Hungary, 1993, P.407-425.
18. Уровень надпочечниковых С19- и С21-стероидов в отдаленные сроки после оперативного устранения эндогешюго гиперкорти-цизма. / Гончаров Н.П., Трофимов В.М., Вавилов А.Г. и др. // «Актуальные вопросы эндокринологии», Научно-практическая конференция, посвященная памяти проф.Шурыгина Д.Я.. Санкт-Петербург,
1993, стр.47-48.
19. Сравнительная характеристика стероидогенеза и его биоритма в коре надпочечников в условиях их гиперфункции. / Колесникова Г.С., Гончаров Н.П., Воронцов В.И. и др. // Вест.РАМН. — 1994. -№12.-стр.39-44.
20. Состояние стероидогенеза у больных с неклассической формой врожденной дисфункции коры надпочечников. / Гончаров Н.П., Колесникова Г.С., Воронцов В.И., Яровая И.С. // Симпозиум «Патогенез, клиника и фармакотерапия эндокринопатий», Харьков,
1994, стр.104.
21. Характеристика надпочечникового стероидогенеза у женщин, больных стромальным текоматозом. / Колесникова Г.С., Гончаров
H.П., Воронцов В.И., Яровая И.С. // Там же, стр.109.
22.The production of the C-21 and C-19 steroids in women with the different types of hyperandrogenism. / Kolesnikova G., Goncharov N.,
Vorontsov V. // IX Intern. Congress on Hormonal Steroids, Dallas, 1994, C147.
23. Диагностическое значение определения 17-гидроксипрег-ненолона и 17-гидроксипрогестерона при различных дисфункциях сте-роидпродуццрующих желез. / Колесникова Г.С., Гончаров Н.П., Воронцов Н.П., Тодуа Е.Р. // Материалы Ш-го Всероссийского симпозиума по хирургической эндокринологии «Современные аспекты эндокринологии», Самара, 1994, стр.40-44.
24. Уровень глюкокортикоидов и надпочечниковых андрогенов в отдаленные сроки после адреналэктомии. / Гончаров Н.П., Трофимов В.М., Вавилов А.Г. и др. // Пробл.эндокрин. — 1995. — №6. — стр.24-27.
25. Стероидогенез у больных с различными гиперфункциями надпочечников и половых желез. / Гончаров Н.П., Колесникова Г.С., Воронцов В.И. и др. // Вест.РАМН. — 1995. — №6. стр.30-37.
26. Steroid endocrine status in patients with hormone-secreting adrenal tumor. / Kolesnikova G., Goncharov N., Atamano\a T. et al. // Y Intern. Congress «Hormone and Cancer», Quebeck, 1995, P. 108.
27. Use of radioimmunoassay methods in the characterization of steroidogenesis in hormone-producing adrenal cortex tumors./ Kolesnikova G., Goncharov N., Todua T. et al. // Proc. 6th Symp. on the analysis of steroids., Szeged, Hungary, 1996
28. Сравнительная характеристика стероидогенеза при различных формах гиперсекреции гормонов коры надпочечников. / Материалы III съезда эндокринологов России, Москва, 1996, стр.215.
Ферменты стероидогенеза (обзор литературы) Текст научной статьи по специальности «Фундаментальная медицина»
УДК 577.175.63/.64:577.152.1
И.В.Довжикова
ФЕРМЕНТЫ СТЕРОИДОГЕНЕЗА (ОБЗОР ЛИТЕРАТУРЫ)
Дальневосточный научный центр физиологии и патологии дыхания Сибирского отделения РАМН,
Благовещенск
РЕЗЮМЕ
В обзоре представлено описание ферментов, участвующих в биосинтезе половых стероидных гормонов (прогестерона и эстрогенов) из холестерина. Акцент сделан на процессе стероидогенеза в фетоплацентарном комплексе.
Ключевые слова: ферменты стероидогенеза, половые стероидные гормоны.
SUMMARY
I.V.Dovzhikova
STEROIDOGENESIS ENZYMES (REVIEW)
The description of enzymes involved in sexual steroid hormone biosyntheses (progesterone and estrogens) from cholesterol is given in the review. The emphasis is made on the steroidogenesis process in fetoplacental complex.
Key words: steroidogenesis enzymes, sexual steroid hormones.
Стероидные гормоны занимают важное место в жизни человека. При беременности они поддерживают нормальное течение гравидарного процесса: регулируют выполнение жизненно важных функций организма женщины, рост и формирование плода, развитие родовой деятельности. Образование их происходит посредством целого ряда ферментов. Еще в 60-х годах прошлого века в плаценте гистохимически была обнаружена активность 3а, 3p, lip, 16p и 17р-гидроксистероиддегидрогеназ в трофобласте плацентарных ворсин [23, 30, 34]. В последние годы знания в этой области существенно продвинулись вперед, накопилось множество новых фактов. Происходит поиск и описание энзимных изомеров: выделение, очистка, клонирование, определение аминокислотной последовательности и структуры. В отечественной литературе эти данные представлены мало. Целью нашей работы — подробно описать новые сведения о ферментах, участвующих в обмене половых стероидных гормонов с акцентом на процессах стероидоге-неза, протекающих в фетоплацентарном комплексе.
Биосинтез стероидных гормонов происходит главным образом на микросомах и сводится к реакциям гидроксилирования их стероидных предшественников, приводящим к отщеплению алифатических радикалов и образованию полярных продуктов, а также к дегидрогеназным реакциям, обеспечивающим превращения гидроксильных и кетогрупп.
В последние годы накопилось значительное количество знаний в области ферментов стероидогене-
за. Энзимы, участвующие в синтезе стероидных гормонов относятся к двум семействам: цитохром Р450-ферменты и гидроксистероддегидрогеназы. Одно из главных отличий между Р450-ферментами и гидро-ксистероддегидрогеназами — то, что каждый из Р450-
ферментов является продуктом одного отдельного гена, тогда как для гидроксистероддегидрогеназ ситуация совершенно иная. Существует несколько изоформ гидроксистероиддегидрогеназ, каждая из них кодируется свои собственным отдельным геном. Разновидности (изоформы) различаются по распределению в тканях, активности катализатора (то есть, функционируют ли они преимущественно как дегидрогеназы, или как редуктазы), субстратной специфичности, специфичности к кофактору и внутриклеточной локализации [43, 45].
Цитохром Р450-ферменты являются мебраносвя-занными белками, расположенными либо в митохондриальной мембране (к ним относятся CYP11A, CYP11B1, CYP11B2 — названия даны в соответствии с кодирующим их геном), или в эндоплазматическом ретикулуме (микросомальные — CYP17, CYP19, CYP21). В биосинтезе они катализируют гидрокси-лирование и расщепление стероидного субстрата. Эти энзимы функционируют как монооксигеназы, использующие НАДФН в качестве донора электронов [43]. Цитохром Р-450 является местом связывания стероидного субстрата в гидроксилирующей цепи. Во всех реакциях участвует локализованная на внутренней, обращенной в матриксе, мембране многокомпонентная система, содержащая кроме цитохрома Р-450 флавопротеид и ферредоксин [3].
К классу цитохром Р450-ферментов, участвующих в стероидогенезе половых гормонов, относится P450scc (CYP11A). Этот энзим катализирует первую реакцию на пути синтеза всех стероидных гормонов, являющуюся также скорость-лимитирующей. То есть, регуляция стероидогенеза происходит в основном на данной стадии. В реакции участвуют три молекулы НАДФН, три молекулы кислорода и митохондриальная система переноса электронов. Фермент P450scc (от английского — side chain cleavage enzyme — фермент, отщепляющий боковую цепь) является продуктом одного отдельного гена, он катализирует три последовательных реакции гидроксилирования по 20 и 22 углеродным атомам и отщепление боковой углеродной цепи. Этот энзим наиболее выражен в коре надпочечников, яичнике, яичке и плаценте, кроме этого он обнаружен в сердце, центральной и периферической нервной системе. В плаценте фермент локализуется в синцитиотрофобласте [27, 43].
Вне беременности активность энзима регулируется двумя механизмами. Быстрая регуляция в ответ на стимул (процесс стимулируется адренокортикотроп-ным гормоном) осуществляется путем синтеза специального белка StAR (steroidogenic acute regulator), функцией которого является доставка холестерина к месту его преобразования. Процесс опосредуется системой цАМФ — протеинкиназа А. Еще одним регулятором, воздействующим на синтез стероидных гормонов, является отрицательная обратная регуля-
ция активности фермента ГМГ-КоА-редуктазы холестерином [2].
Следующим ферментом этого класса является Р450с17 (CYP17), который также является продуктом одного гена. Он катализирует две оксидоредуктазные реакции при посредстве цитохром Р450, НАДФН, кислорода и микросомальной системы переноса электронов, в результате чего образуются промежуточные соединения, которые в свою очередь преобразуются в С19 стероиды: дегидроэпиандростерон или андростендион. Первоначально считалось, что каждая реакция проводится разными ферментами [1], однако более поздние исследования [40, 41] показало, что один единственный белок катализирует и гидроксилирование и лиазную реакцию, в последующем это было подтверждено [43]. Энзим хорошо выражен во всех классических стероидогенных тканях, кроме плаценты человека, хотя в плацентах некоторых других видов млекопитающих он обнаружен [43]. Данный фермент у человека присутствует в надпочечниках плода, где он и осуществляет свои реакции, в связи, с чем и появилось понятие о фетоплацентарной системе [14, 15, 17].
Следующий фермент этого класса -Р450ароматаза (CYP19), являющаяся также продуктом одного отдельного гена. Данный энзим катализирует превращение С19 стероидов — андростендиона и тестостерона в С18 стероиды — эстрон и эстрадиол, соответственно. Реакция включает микросомальную систему переноса электронов, цитохром Р450 редук-тазу, три молекулы НАДФН и три молекулы кислорода. Р450ароматаза широко распространена в тканях и очень хорошо выражена в плаценте человека [4, 27, 43].
Регуляция деятельности цитохром Р450-ферментов в плаценте отличается от регуляции этих энзимов в других органах [4, 43]. Поиск и идентификация факторов, отвечающих за их активность, велись долго и продолжаются до сих пор на геномном уровне, на посттранскрипционном и каталитическом уровнях [4, 10, 47]. Существует мнение о том, что плацентарный ядерный белок SCC1, через активацию белка АР-2, осуществляет регуляцию активности фермента цитохром P450scc в плаценте человека [6, 43]. Работа фермента цитохром Р450 ароматазы находится под контролем специфического плацентарного exon 1 [22]. Выявлено, что адреноксин является ингибитором для цитохром P450scc [52].
Гидроксистероиддегидрогеназы, участвующие в стероидогенезе принадлежат к семейству алкоголь-дегидрогеназ. Они являются мембраносвязанными (митохондриальными или микросомальными) ферментами, использующими НАД/НАДФ в качестве акцепторов.
Одним из важных энзимов, участвующих в образовании всех активных стероидных гормонов, считается 3в-гидроксистероиддегидрогеназа [45, 53]. В течение последнего времени было выделено и охарактеризовано несколько ее изоформ. На сегодняшний день их известно шесть, каждая из них является продуктом одного отдельного гена [43]. Свои номера они получали в порядке их обнаружения. Фермент широко распространен в стероидогенных тканях и
хорошо выражен в плаценте человека. Регуляция его работы в плаценте отличается от таковой в других тканях, исследования в этой области продолжаются до сих пор.
Вначале этот фермент работает как дегидрогеназа и окисляет гидроксил у 3-го углеродного атома до 3-кетогруппы. Затем он работает как изомераза и катализирует перенос двойной связи из 5-6-го положения в 4-5-е положение, который сопровождается внутри-или межмолекулярным переносом водорода от С4 к С6. Ранее считалось, что в данной ситуации работают два фермента [1, 39]. Но позднее было установлено, что обе реакции осуществляются 3р-гидроксистероиддегидрогеназой [43, 50, 51].
У человека 17р-гидроксистероиддегидрогеназа катализирует превращения эстрона, 17 р-эстрадиола, андростендиона, тестостерона, а также дегидроэпи-андростерона и андрост-5-ен-3 р, 17 р-диола. Таким образом, данный фермент играет важную роль в формировании андрогенов и эстрогенов. Долгое время были известны две изоформы, катализирующие взаимопревращение между высокоактивными 17 р-гидроксистероидами и их 17-кетоформами, тем самым, регулируя биологическую активность половых стероидов. Первым была охарактеризована и клонирована изоформа 1 этого энзима, которая преимущественно катализирует преобразование эстрона в 17 р-эстрадиол (впервые она была выявлена именно при исследовании плаценты), тогда как изоформа 2, наоборот, — конверсию эстрадиола в эстрон. По мере продвижения исследований оказалось, что фермент обнаруживает удивительную мультифункциональность, позволяющую контролировать концентрацию не только стероидов, но и также жирных и желчных кислот [36]. Были выявлены различные типы 17р-гидроксистероиддегидрогеназы, все они играют важную роль в метаболизме эстрогенов и андрогенов [7,
18, 26, 32, 35, 37, 38]. Ключевым лидером в изучении типов 17р-гидроксистероиддегидрогеназы в мировой науке считается V.Luu-The [31-33]. 17р-
гидроксистероиддегидрогеназы различаются по распределению в тканях, каталитическим предпочтениям, субстратной специфичности, субклеточной локализации и механизмам регулирования. Изоформы, катализирующие однонаправленную реакцию восстановления, обозначены цифрами 1, 3, 5 и 7, катализирующие обратную реакцию (окислительную) — 2, 4, 6 и 8. Только три формы этого энзима участвуют в катализе финального шага биосинтеза гормонов — 1, 3 и 7. Недавно введенная номенклатура для них основана на генетическом тождестве и их функциональном значении. Кроме этого, 17р-гидроксистероиддегидрогеназы нумеровались хронологически, в порядке их обнаружения [28, 44]. В 2006 году стало известно о 14-м типе этого энзима [20]. Все выявленные типы фермента активно изучаются.
Тип 5 17р-гидроксистероиддегидрогеназы, отвечает за трансформацию 4 андростендион (4-дион) в тестостерон. Кроме этого, оказалось, что в яичнике он обладает высокой 20а-
гидроксистероиддегидрогеназной активностью. Предполагается, что это необходимо для того, чтобы защитить клетки от высокой концентрации прогесте-
рона. Такая двойная активность этого типа фермента в женских репродуктивных органах, вероятно, необходима для оптимизации гормонального баланса
[19].
Одной из последних была описана изоформа 11, в достаточно сильной степени выраженная в синцитио-трофобласте и катализирующая превращение 5 а-андростан-3а, 17р-диол в андростерон. Этот субстрат привлекается для поддержания нормального течения беременности и модуляции активности рецепторов к у-аминобутиратной кислоте. Пришли к заключению, что он играет свою роль и в стероидогенезе андрогенов и в метаболизме нестероидогенных тканей. Он может действовать метаболизируя компоненты, которые стимулируют стероидный синтез и/или генерируя метаболиты, которые его ингибируют [9].
В 2003 году была выявлена новая 17-гидроксистероиддегидрогеназа, получившая наименование 12 тип 17р-гидроксистероиддегидрогеназы [7, 32, 33]. Обнаружено, что этот тип фермента трансформирует эстрон в эстрадиол. Что интересно, последовательность этого типа сходна с последовательностью 17р-гидроксистероиддегидрогеназы 3 типа и они кодируются одним геном. Однако, несмотря на это, эти типы катализируют разные реакции с разными субстратами (3-й тип 17р-гидроксистероиддегидрогеназы отвечает за преобразование тестостерона в андростендион).
В плаценте идентифицированы 1, 2, 7, 11 типы данного фермента [9, 43]. Считается, что многообразие изоформ 17р-гидроксистероиддегидрогеназы составляет сложную систему, гарантирующую определенную адаптацию в клетках и регулирование уровней половых стероидных гормонов. Широкая и накладывающаяся субстратная специфичность предполагает взаимодействие 17р-
гидроксистероиддегидрогеназ с другими метаболическими путями.
Проводились исследования, касающиеся регуляции работы данного энзима. Среди факторов, оказывающих влияние на 17р-
гидроксистероиддегидрогеназы у человека отмечены факторы транскрипции: плацентарный белок JEG-3 клетки, белки АР2, Зр1, Sp3, GATA-элемент, а также, ретинойная кислота, эпидермальный фактор роста, протеинкиназа А. Было выявлено, что эстрогены ингибируют активность ряда типов 17р-гидроксистероиддегидрогеназы [13], а другие — тип 7, наоборот, активируются ими. Известно сообщение о снижении интенсивности данного фермента под действием цАМФ, запускаемого белковым гормоном [9]. В основном же, в настоящее время проводится изучение регуляции фермента на геномном уровне [12, 24, 25, 31, 33, 42, 46].
При изучении 17р-
гидроксистероиддегидрогеназы тип 7, был сделан вывод, что данный энзим участвует не только в превращении эстрадиола, но и играет другую, возможно более важную роль, действует как 3-кетостероид ре-дуктаза в холестериногенезе [8, 29, 49].
Некоторые исследователи [16], изучая 17р-гидроксистероиддегидрогеназы (изоформа 2) в плаценте пришли к выводу, что этот фермент действует
как барьер, уменьшающий уровень эстрадиола для нормализации его уровня в плодовой циркуляции.
Фермент 20а-гидроксистероддегидрогеназа катализирует превращение прогестерона в его неактивную форму — 20а-дигидропрогестерон [21]. Один из последних выводов, существующий на правах гипотезы, сделанный в результате исследования этого энзима, заключается в том, что в плаценте 20а-гидроксистероддегидрогеназа защищает плод от ци-тотоксического действия высокого содержания прогестерона и, таким образом, поддерживает нормальное развитие плода.
На сегодняшний день ферменту 3 а-гидроксистероддегидрогеназе, вовлеченному в метаболизм всех классов стероидных гормонов уделяется достаточно мало внимания. Он катализирует превращение 5а-андростан-17р-ол-3-ол (дигидротестостерона) в 5а-андростан-3а, 17р-диол (андростанди-ол). Участвует в прогестероновом метаболизме, где преобразует, гидроксильные группы стероида и тем самым регулирует его активность. Для 3 а-гидроксистероддегидрогеназы известно 4 энзимных типа [11, 48].
Проводится несколько исследований, в которых изучаются элементы регуляции работы гидроксисте-роиддегидрогеназ. Одним из факторов, регулирующих работу этих энзимов, считается достаточная концентрация кофактора — НАДФ/НАД [5].
Таким образом, в настоящее время ферменты сте-роидогенеза активно исследуются, происходит накопление знаний об их локализации, регуляции их активности, функциональной роли и так далее. Данных же об изменении интенсивности их работы при различных патологических процессах, в том числе и при обострении инфекционного процесса во время беременности нами не было обнаружено.
ЛИТЕРАТУРА
1. Биохимия гормонов и гормональной регуляции / под ред. Н.А.Юдаева. М.: Наука, 1976. 380 с.
2. Дедов И.И., Мельниченко Г.А., Фадеев В.В. Эндокринология. М.: Медицина, 2000. 632 с.
3. Холестерингидроксилирующий цитохром Р-
450 митохондрий коры надпочечников быка и плаценты человека: иммунохимические свойства и
структурная характеристика / Усанов С.А. [и др.] // Биохимия. 1990. Т.55, №5. С.865-877.
4. Ясинская И.М., Сумбаев В.В. Универсальная и комплексная энзимология ароматазы // Пробл. эн-докринол. 2006. Т.52, №1. С.39-47.
5. Agarwal A. K., Auchus R. J. Minireview: cellular redox state regulates hydroxysteroid dehydrogenase activity and intracellular hormone potency // Endocrinology. 2005. Vol.146, №6. P.2531-2538.
6. Ben-Zimra M., Koler M., Orly J. Transcription of cholesterol side-chain cleavage cytochrome P450 in the placenta: activating protein-2 assumes the role of steroidogenic factor-1 by binding to an overlapping promoter element // Mol. Endocrinol. 2002. Vol.16. P.1864-1880.
7. Blanchard P.-G., Luu-The V. Differential androgen and estrogen substrates specificity in the mouse and primates type 12 17{beta}-hydroxysteroid dehydro-
genase // J. Endocrinology. 2007. Vol.194, №2. P.449-455.
8. 17p-hydroxysteroid dehydrogenase type 7 — an ancient 3-ketosteroid reductase of cholesterogenesis / Breitling R. [et al.] // Mol. Cel. Endc. Breitling. 2001.URL:http://gbb.eldoc.ub.rug.nl/root/2001/MolCelE ndcBreitling1/?pFullItemRecord=ON (дата обращения:
15.04.08).
9. 17fi-Hydroxysteroid dehydrogenase type xi localizes to human steroidogenic cells / Chai Z. [et al.] // Endocrinology. 2003. Vol.144, №5. P.2084-2091.
10. Liver receptor homologue-1 (LRH-1) regulates expression of aromatase in preadipocytes / Clyne C.D. [et al.] // J. Biol. Chem. 2002. Vol.277. P.20591-20597.
11. Cooper W.C., Jin Y., Penning T.M. Elucidation of a complete kinetic mechanism for a mammalian hydrox-ysteroid dehydrogenase (HSD) and identification of all enzyme forms on the reaction coordinate. The example of rat liver 3а-HSD (AKR1c9) // J. Biol. Chem. 2007. Vol.10. P.1074-1084.
12. Biochemical Genetics of 17beta-Hydroxysteroid Dehydrogenases / Deluca D. [et al.] // Curr. ToP. Ster. Res. 2005. Vol.4. P.227-242.
13. Inhibitory effects of fluorine-substituted estrogens on the activity of 17betahydroxysteroid dehydrogenases / D. Deluca [et al.] // Mol. Cell Endocrinol. 2006. Vol.248. P.218-224.
14. Diczflusy E., Pion R., Schwers J. Steroid biogenesis and metabolism in the human foeto-placental unit at midpregnancy // Arch. Anat. Microsc. Et Morphol. Exptl.
1965. Vol.54, №1. P.67-82.
15. Diczflusy E. Steroid metabolism in the human foeto-placental unit // Acta endocrinol. (Copenh.). 1969. Vol.61, №4. P. 649-664.
16. Human type 2 17beta-hydroxysteroid dehydro-
genase mRNA and protein distribution in placental villi at mid and term pregnancy / R. Drolet, M. Simard, J. Plante [et al.] // Reproductive Biology and Endocrinology. 2007. Vol.5, №1. P.5-30. URL: http://
www.rbej.com/content/5/1/30/abstract (дата обращения:
11.05.09).
17. Hirai M., Masubuchi Y., Komoriyama K. Endo-crino-pharmacolgical study of reproduction: role and biosynthesis of steroid hormones in the feto-placental unit // Nippon Yakuriqaku Zasshi. 1981. Vol.77, №3. P.231-244.
18. Characterization of 17{beta}-hydroxysteroid dehydrogenase type 7 in Reproductive Tissues of the Marmoset Monkey / Husen B. [et al.] // Biol. Reprod. 2003. Vol.68, №6. P.2092-2099.
19. A novel polymorphism in the 17 beta-hydroxysteroid dehydrogenase type 5 (aldo-keto reductase 1C3) gene is associated with lower serum testosterone levels in Caucasian men / Jacobsson J. [et al.] // Pharmacogenomics J. 2006. Vol.19. P.169-183.
20. 17B-Hydroxysteroid dehydrogenase 14 affects estradiol levels in breast cancer cells and is a prognostic marker in estrogen receptor-positive breast cancer / A.K. Jansson [et al.] // Cancer Research. 2006. Vol.66. P.11471-11477.
21. Expression and possible role of 20а-hydroxysteroid dehydrogenase in the placenta of the goat
/ Jayasekara W.S.N. [et al.] // J. Reproduction and development. 2005. Vol.51, №2. P.265-272.
22. Mechanisms in tissue-specific regulation of estrogen biosynthesis in humans / Kamat A. [et al.] // Trends Endocrinol. Metab. 2002. Vol.13. P.122-128.
23. Kasuo I., Sueo N. Histochemical demonstration of steroid dehydrogenases in hamster and pig embryos at the preimplantation stage // Fertility and Sterility. 1977. Vol.28, №3. P.350-354.
24. Interspecies comparison of gene structure and computational analysis of gene regulation of 17beta-hydroxysteroid dehydrogenase type I / Keller B. [et al.] // Mol. Cell Endocrinol. 2006. Vol.248. P.168-171.
25. His164 regulates accessibility to the active site in fungal 17beta-hydroxysteroid dehydrogenase / Kristan K. [et al.] // Biochimie. 2007. Vol.89. P.63-71.
26. The key role of 17p-HSDs in sex steroid biology / Labrie F. [et al.] // Steroids. 1997. Vol.62. P.148-158.
27. Expression of 3p-hydroxysteroid dehydrogenase type 1, P450 aromatase, and 17p-hydroxysteroid dehydrogenase types 1, 2, 5 and 7 mRNAs in human early and mid-gestation placentas / Li Y. [et al.] // Placenta. 2004. Vol.26, Is.5. P.387-392.
28. Structural basis of the multispecificity demonstrated by 17beta-hydroxysteroid dehydrogenase types 1 and 5 / Lin S.-X. [et al.] // Mol. Cell Endocrinol. 2006. Vol.248, №1-2. P.38-46.
29. Liu H., Robert A., Luu-The V. Cloning and characterization of human form 2 type 7 17fi-hydroxysteroid dehydrogenase, a primarily 3fi-keto reductase and estrogen activating and androgen inactivating enzyme // J. Steroid Biochem. Mol. Biol. 2005. Vol.94. P.173-179.
30. Lobel B.L., Deane H.W., Romney S.L. Enzymatic histochemistry of the villous portion of the human placenta from six weeks of gestation to term // Am. J. Ob-stet. Gynec. 1962. Vol.83, №3. P.295-299.
31. Luu-The V. Analysis and characteristics of multiple types of human 17p-hydroxysteroid dehydrogenase // The Journal of Steroid Biochemistry and Molecular Biology. 2001. Vol.76, №1. P.143-151.
32. Luu-The V., Tremblay P., Labrie F. Characterization of type 12 17{beta}-hydroxysteroid dehydrogenase, an isoform of type 3 17{beta}-hydroxysteroid dehydrogenase responsible for estradiol formation in women // Mol. Endocrinol. 2006. Vol.20, №2. P.437-443.
33. Characteristics of human types 1, 2 and 3 17p-
hydroxysteroid dehydrogenase activities: oxida-
tion/reduction and inhibition / Luu-The V. [et al.] // J. Steroid Biochem. Mol. Biol. 1995. Vol.55. P.581-587.
34. McKay H.D. The histochemical distribution of hydroxysteroid dehydrogenases in the human foetal membranes at term // Histochemistry and Cell Biology.
1966. Vol.6, №1. P.17-23.
35. Human 17 beta-hydroxysteroid dehydrogenase type 1 and type 2 isoenzymes have opposite activities in cultured cells and characteristic cell- and tissue-specific expression / Miettinen M.M. [et al.] // Am. J. Physiol. Regulatory Integrative Comp. Physiol. 2007. Vol.292, №3. P.R1101-R1109.
36. Mindnich R., Moller G., Adamski J. The role of 17 beta-hydroxysteroid dehydrogenases // Mol. Cell Endocrinol. 2004. Vol.218. P.7-20.
37. Moeller G., Adamski J. Multifunctionality of human 17beta-hydroxysteroid dehydrogenases // Mol. Cell Endocrinol. 2006. Vol.248. P.47-55.
38. Moghrabi N., Andersson S. 17p-Hydroxysteroid dehydrogenases: physiological role in health and disease // Trends in Endocrinology and Metabolism. 1998. Vol.9, №7. P.265-270.
39. Murota S., Fenselau C.C., Talalay P. Partial purification of a beer adrenal delta-5-3-ketosteroid isomerase and studies of its mechanism of action // Steroids. 1971. Vol.17, №1. P.25-37.
40. Nakajin S., Hall P.F. Microsomal cytochrome P-450 from neonatal pig testis. Purification and properties of A C21 steroid side-chain cleavage system (17a-hydroxylase-C17, 20 lyase) // J. Biol. Chem. 1981. Vol.256. P.3871-3876.
41. Microsomal cytochrome P-450 from neonatal pig testis: two enzymatic activities (17a -hydroxylase and c17, 20-lyase) associated with one protein / Nakajin S. [et al.] // Biochemistry. 1981. Vol.20. P.4037-4042.
42. Transcriptional regulation of human and murine 17-beta-hydroxysteroid dehydrogenase type-7 confers its participation in cholesterol biosynthesis / Ohnesorg T. [et al.] // J. Mol. Endocrinol. 2006. Vol.37. P.185-197.
43. Payne A.H., Hales D.B. Overview of steroidogenic enzymes in the pathway from cholesterol to active steroid hormones // Endocr. Rev. 2004. Vol.25, №6. P.947-970.
44. 17p-Hydroxysteroid dehydrogenase (HSD)/17-ketosteroid reductase (KSR) family; nomenclature and main characteristics of the 17HSD/KSR enzymes / Pel-toketo H. [et al.] // J. Molecular Endocr. 1999. Vol.23. P.1-11.
45.Penning T.M. Molecular Endocrinology of Hy-droxysteroid Dehydrogenases // Endocr. Rev. 1997. Vol.18, №3. P.281-305.
46.Localization of Type 8 17B-hydroxysteroid Dehydrogenase mRNA in Mouse Tissues as Studied by
In Situ Hybridization / Pelletier G. [et al.] // J. Histo-chem. and Cytochem. 2005. Vol.53, №10. P. 12571271.
47.Role of CRE-binding protein (CREB) in aroma-tase expression in breast adipose / Sofi M. [et al.] // Breast Cancer Res. Treat. 2003. Vol.79. P.399-407.
48.Human Cytosolic 3{alpha}-Hydroxysteroid dehydrogenases of the aldo-keto reductase superfamily display significant 3{beta}-Hydroxysteroid dehydrogenase Activity: implications for steroid hormone metabolism and action / Steckelbroeck S. [et al.] // J. Biol. Chem. 2004. Vol.279, №11. P.10784-10795.
49.Characterization of estrogenic 17p-hydroxysteroid dehydrogenase (17P-HSD) activity in the human brain / Steckelbroeck S. [et al.] // J. Steroid Boichem. Mol. Biol. 2003. Vol.86, №1. P.79-92.
50.Structure/function relationships responsible for coenzyme specificity and the isomerase activity of human type 1 3fi-hydroxysteroid dehydrogenase/isomerase / Thomas J.L. [et al.] // J. Biol. Chem. 2003. Vol.278. P.35483-35490.
51.The higher affinity of human type 1 3p-hydroxysteroid dehydrogenase (3P-HSD 1) for substrate and inhibitor steroids relative to human 3P-HSD 2 is validatet in MCF-7 tumor cells and related to subunit interactions: 11 Conference on the Adrenal Cortex, New Orleans, La, June 12-15, 2004 / Thomas J.L. [et al.] // Endocr. Res. 2004. Vol.30, №4. P.935-941.
52.Tuckey R. С. McKinley A.J., Headlam M.J. Oxidized adrenoxin acts as a competitive inhibitor of cytochrome P450scc in mitochondria from the human placenta // FEBS Journal. 2001. Vol.268, №8. P.2338-2343.
53.Activity of 3p-hydroxysteroid Dehydrogenase in Human Term Placenta: Effects of Steroids Produced by Feto-Placental Unit / Watanabe H. [et al.]. URL: http://ci.nii.ac.jp/naid/110002122953/en/ (дата обращения: 12.03.09).
Поступила 19.08.2010
Инна Викторовна Довжикова, старший научный сотрудник, 675000, г. Благовещенск, ул. Калинина, 22;
Inna V. Dovzhikova, 22 Kalinin Str., Blagoveschensk, 675000;
E-mail: [email protected]
n П □
стероидогенез — это… Что такое стероидогенез?
- стероидогенез
- n
med. Steroidogenese
Универсальный русско-немецкий словарь.
Академик.ру.
2011.
- стероидный сахарный диабет, сахарный диабет стероидного генеза
- стероидсберегающий
Смотреть что такое «стероидогенез» в других словарях:
Стероиды — Молекула предшественника всех природных стероидов ланостерола. Стероиды вещества животного или реже растительного происхождения, обладающие высок … Википедия
Диспитуитари́зм пуберта́тно-ю́ношеский — (греч. dys + лат. [glandula] pituitaria гипофиз; лат. pubertas, pubertatis возмужалость, половая зрелость; синоним: гипоталамический синдром периода полового созревания, ожирение с розовыми стриями, околопубертатный базофилизм, юношеский… … Медицинская энциклопедия
Дисфункциона́льные ма́точные кровотече́ния — маточные кровотечения в пубертатном, репродуктивном периоде и периоде пременопаузы, обусловленные нарушением функционального состояния системы гипоталамус гипофиз яичники надпочечники. В зависимости от наличия или отсутствия овуляции (см.… … Медицинская энциклопедия
Прегнил — Действующее вещество ›› Гонадотропин хорионический* (Chorionic Gonadotropin*) Латинское название Pregnyl АТХ: ›› G03GA01 Гонадотропин хорионический Фармакологическая группа: Гормоны гипоталамуса, гипофиза, гонадотропины и их антагонисты… … Словарь медицинских препаратов
Половые гормоны — Половые гормоны в узком смысле, гормоны, производимые половыми железами. В наиболее узком смысле под половыми гормонами понимают синоним понятия половые стероиды, в связи с тропностью половых стероидов к вторичным половым признакам и… … Википедия
Хорионический гонадотропин — (ХГ, ХГЧ) гормон, выделяемый плацентой во время беременности. Относится к гонадотропным гормонам наряду с лютеинизирующим и фолликулостимулирующим, но отличается от них по аминокислотной последовательности. Начинает продуцироваться с первых … Википедия
Предменструальный синдром — МКБ 10 N94.394.3 МКБ 9 625.4625.4 DiseasesDB … Википедия
Ароматаза — Обозначения Символы CYP19A1; CYP19 HGNC … Википедия
ХГЧ — Хорионический гонадотропин, или ХГ гонадотропный гормон плаценты, по аминокислотной последовательности отличающийся и от лютеинизирующего гормона, и от фолликулостимулирующего гормона. Хорионический гонадотропин по химическому строению является… … Википедия
11-бета-гидроксилаза — Обозначения Символы CYP11B1; CYP11B, CPN1; DKFZp686B05283; FHI; FLJ36771; P450C11 HGNC … Википедия
11-бета-гидроксистероиддегидрогеназа — 11 бета гидроксистероиддегидрогеназы (11β HSD) два фермента человека, катализирующих преобразование кортизола в кортизон и обратно, тем самым регулируя силу воздействия глюкокортикоидов на стероидные рецепторы. Изоформы У человека в геноме… … Википедия
Витамин D и хронический простатит uMEDp
В обзорной статье на основе результатов современных доказательных клинико-экспериментальных исследований обсуждаются неклассические (внекостные) физиологические эффекты витамина D, обеспечивающие развитие и поддержание нормального анатомо-функционального состояния предстательной железы. В настоящее время витамин D рассматривается как D-гормон, имеющий рецепторный аппарат во многих клетках и тканях. В частности, витамин D обладает целым спектром позитивных физиологических эффектов в отношении предстательной железы (противовоспалительным, стероидогенез-протективным, антибактериальным, антипролиферативным, нейропротективным, антиболевым). Это положительное влияние позволяет противостоять клеточным механизмам формирования и прогрессирования разнонаправленных хронических воспалительных реакций, составляющих суть патогенеза различных форм хронического простатита, включая хронический инфекционный простатит и абактериальный синдром хронической тазовой боли. С учетом высокой частоты дефицита витамина D у больных урологического профиля и важной физиологической роли витамина D предполагается, что управление статусом витамина D у мужчин может рассматриваться как целесообразная диагностическая и эффективная фармакотерапевтическая опция при хронических воспалительных заболеваниях предстательной железы, традиционно характеризующихся неудовлетворительными результатами стандартной комплексной терапии.
Рис. 1. Взаимосвязь между уровнем тестостерона (А) и витамина D (Б) в крупномасштабном популяционном исследовании
Рис. 2. Возможная взаимосвязь между сезонными обострениями хронического простатита и годичными циклами синтеза витамина D и тестостерона у мужчин
Рис. 3. Потенциальные механизмы антибактериального эффекта витамина D в предстательной железе
Рис. 4. Потенциальные механизмы антипролиферативного эффекта витамина D в предстательной железе
Введение
Традиционные представления о важной роли витамина D только в обеспечении кальциево-фосфорного гомеостаза и минеральной плотности костной ткани (совместно с кальцием) в настоящее время устарели [1]. Витамин D не является витамином в классическом понимании. Он образуется de novo в организме из предшественников в биологически неактивной форме (25(ОН)D, или кальцидиол) и только за счет двухступенчатого метаболизма в печени и почках превращается в активную форму (1,25(ОН)2D, или кальцитриол) [1]. Истинные витамины в свою очередь выполняют роль ко-факторов различных клеточных ферментных систем. Кроме того, к активной форме витамина D (1,25(ОН)2D) в клетках различных органов и тканей (головного мозга, предстательной железы, молочной железы, кишечника, мышечной ткани, иммунокомпетентных и половых клетках и т.д.) выявлены специфические рецепторы. Это позволяет рассматривать витамин D не как истинный витамин, а как D-гормон, который генерирует и модулирует медленные геномные и быстрые негеномные молекулярно-клеточные реакции более чем в 40 тканях-мишенях, образуя при этом специфическую D-эндокринную систему, тесно взаимодействующую с другими гормональными сигнальными молекулами [2]. С биохимической точки зрения витамин D представлен целым семейством секостероидных гормонов, из которых для человека наибольшее значение имеют витамин D3 (холекальциферол) животного происхождения и витамин D2 (эргокальциферол) растительного происхождения [1, 2]. Безусловно, следует помнить, что в кератиноцитах кожи человека происходит эндогенный синтез витамина D3 (холекальциферола) под влиянием ультрафиолетового излучения с длиной волны 280–315 нм [1, 2].
Дефицит витамина (гормона) D – новая неинфекционная пандемия XXI в. среди взрослых и детей, проживающих севернее 35-й параллели северной широты (в зоне географической «витаминной зимы»). Подобная ситуация обусловлена резким снижением длительности пребывания на солнце современных людей и недостаточным содержанием этого витамина в продуктах питания.
С дефицитом витамина (гормона) D тесно патогенетически связаны большинство современных заболеваний, с ним ассоциируется повышенный риск общей, онкологической и сердечно-сосудистой смертности (в частности, у мужчин) независимо от возраста [3–5]. Согласно современным данным, D-гормон регулирует от 3 до 10% всего генома человека, включая гены углеводного обмена, стероидогенеза, иммунитета и репродукции, что делает его одним из ключевых полифункциональных гормонов, необходимых человеку в достаточном количестве от внутриутробного развития и далее в течение всей жизни до глубокой старости [6].
Роль витамина D в развитии предстательной железы
В эксперименте в рационе мышей-самок основной группы в течение беременности и лактации отсутствовали источники витамина D, в контрольной группе мыши-самки получали стандартный рацион, содержащий витамин D. Масса предстательной железы детенышей-самцов, появившихся у мышей первой группы, была достоверно выше таковой детенышей-самцов, родившихся у мышей второй группы. В дальнейшем содержание самцов на витамин D-дефицитном рационе продолжалось вплоть до достижения ими среднего возраста. При гистохимических исследованиях ткани предстательных желез у этих самцов обнаружено существенное увеличение количества простатических Ki-67-позитивных эпителиальных клеток – маркеров пролиферации, а также более выраженные явления воспалительной инфильтрации простатического эпителия и стромального фиброза. Кроме того, имевшийся у них дефицит витамина D активировал ядерный фактор NF-κB, мРНК гена интерлейкина 6 и простатический механизм пролиферации STAT3. Интересно, что витамин D-дефицит-индуцированное воспаление ткани предстательной железы и ее гиперплазия частично регрессировали после того, как витамин D-дефицитный рацион был заменен стандартным рационом с нормальным содержанием витамина D. Эти результаты свидетельствуют о том, что у самцов животных дефицит витамина D в молодом возрасте способствует формированию раннего воспаления и гиперплазии предстательной железы в среднем возрасте [7].
Как показало клиническое исследование D.D. Xie и соавт. (2017), уровень в сыворотке 25(OH)D был достоверно ниже у пациентов с раком простаты (n = 60) по сравнению с группой контроля (n = 120). Степень дефицита витамина D достоверно коррелировала с тяжестью заболевания: сывороточный уровень 25(OH)D у пациентов с тяжелой стадией был ниже, чем у пациентов с легкой и умеренной стадией. У всех больных раком предстательной железы уровень в сыворотке таких маркеров воспаления, как C-реактивный белок и интерлейкин 8, был повышен и отрицательно коррелировал с сывороточным уровнем 25(ОН)D. Полученные результаты свидетельствуют о связи не только между раком простаты и дефицитом витамина D, но и дефицитом витамина D и воспалительной передачей сигналов в ткани предстательной железы. При этом хроническое цитокиновое воспаление, опосредованное дефицитом витамина D, может быть важным медиатором прогрессирования заболеваний предстательной железы (в том числе рака) у мужчин с дефицитом витамина D [8].
Физиологические эффекты витамина D в отношении предстательной железы
Противовоспалительный эффект
Противовоспалительный эффект витамина D обусловлен различными механизмами, многие из которых до сих пор активно изучаются. На сегодняшний день установлена важная роль витамина D в регуляции цитокин-опосредованных клеточных и системных реакций в рамках хронического субклинического (асептического) воспаления, а также его иммуномодулирующий эффект в отношении клеточного и гуморального иммунитета. Кроме того, известна роль витамина D в обмене жирных кислот и метаболизме адипоцитов – ключевых продуцентов цитокинов (сигнальных молекул иммунной системы) [9, 10].
В опытах на животных моделях показано, что блокада простатических рецепторов к витамину D приводит к развитию экспериментального аутоиммунного хронического простатита [11, 12]. При этом агонист рецепторов витамина D (элокальцитол) ингибирует активность простатических факторов роста, а также обладает выраженным противовоспалительным эффектом, что было выявлено в экспериментальных исследованиях [13, 14].
Одним из потенциальных механизмов противовоспалительных эффектов витамина D в ткани предстательной железы может рассматриваться его доказанная способность ингибировать систему Rho-киназ (ключевую ферментную систему, способную приводить к развитию локального мышечного спазма не за счет изменения уровня кальция в миоцитах, а путем повышения их чувствительности к кальцию (кальций-независимая мышечная контрактильность)), циклооксигеназу 2, простагландин Е2 и провоспалительный интерлейкин 1 в стромальных клетках предстательной железы [15]. Кроме того, доклинические исследования показали, что гормонально активная форма витамина D (1,25(OH)2D) оказывает антипролиферативное, проапоптотическое, противовоспалительное и иммуномодулирующее действие, а ее тканевые уровни характеризуются активностью специфических гидроксилаз витамина D, экспрессируемых во многих тканях, включая ткань предстательной железы [16].
Стероидогенез-протективный эффект
Многочисленные клинико-экспериментальные исследования выявили способность витамина D регулировать экспрессию генов стероидогенеза, которая в свою очередь регулирует экспрессию генов метаболизма витамина D [17]. По этой причине некоторые авторы полагают, что дефицит тестостерона может гипотетически усиливать неблагоприятные последствия дефицита витамина D, то есть между тестостероном и витамином D существует не односторонняя, а двусторонняя патофизиологическая связь [18].
Улучшение функции клеток Лейдига под влиянием витамина D приводит к реализации целого спектра простатопротективных эффектов тестикулярного тестостерона – одного из ключевых андрогенов-предшественников основного простатического андрогена 5-альфа-дигидротестостерона. Он обеспечивает большинство функций предстательной железы, включая иммуномодулирующую, противовоспалительную и бактерицидную, а также функцию болевой рецепции и перцепции. Эта точка зрения подтверждается результатами крупномасштабного популяционного исследования с участием 3369 мужчин. Было показано, что доля мужчин, имевших адекватный статус витамина D, была самой высокой в группе нормогонадных мужчин (31%) и самой низкой среди мужчин с первичным гипогонадизмом (18%). По данным статистического анализа результатов исследования был сделан вывод, что дефицит/недостаточность витамина D (уровень 25(OH)D в крови
Тесная физиологическая связь витамина D и тестостерона у мужчин проявляется также в практически одинаковом характере сезонных колебаний их уровней в плазме крови в течение года [19]. В настоящее время во многих исследованиях обнаружены сезонные колебания с высоким уровнем витамина (гормона) D в крови летом и осенью и низким уровнем зимой и весной, которые в некотором смысле совпадают с аналогичными годичными циклами колебаний уровня тестостерона у мужчин [19, 20].
Так, E. Wehr и соавт. (2010) провели перекрестное исследование с участием 2299 мужчин, у которых определяли уровни 25(ОН)D, общего тестостерона и глобулина, связывающего половые стероиды, методом иммунного анализа. Кроме того, был рассчитан индекс свободных андрогенов. Согласно полученным данным, мужчины без дефицита/недостаточности витамина D (уровень 25(ОН)D в крови ≥ 30 нг/мл) имели достоверно более высокие уровень общего тестостерона и индекс свободных андрогенов и достоверно более низкий уровень глобулина, связывающего половые стероиды, в крови по сравнению с мужчинами, у кого была недостаточность витамина D (уровень 25(ОН)D в крови 20–29 нг/мл) или его дефицит (уровень 25(ОН)D в крови
Антибактериальный эффект
Исследования последних лет демонстрируют выраженные антибактериальные свойства витамина D [23]. Витамин D через транскрипцию генов активирует синтез собственных антимикробных пептидов (дефензина и кателицидина) иммунными клетками и эпителиалиальными клетками различных органов (рис. 3) [24].
Антипролиферативный эффект
В настоящее время активно изучается влияние витамина D на процессы простатической пролиферации [25–27]. Показано, что полиморфизм гена рецепторов витамина D коррелирует с частотой гиперплазии предстательной железы, осложненной гистологическим простатитом [28–31]. Кроме того, в одном из мультивариационных анализов установлено, что уровни 25(OH)D, альбумина, скорректированного по сывороточному кальцию, глобулина, связывающего половые стероиды, и липопротеинов высокой плотности находятся в достоверной обратной корреляции с объемом предстательной железы, что позволяет рассматривать витамин D как естественный (природный) простатический антипролиферант [32].
Способность витамина D снижать активность простатической 5-альфа-редуктазы (ключевого фермента запуска и прогрессирования простатической пролиферации) и контрактильной системы Rho-киназ, а также его противовоспалительное (антицитокиновое) действие на предстательную железу и нижние мочевые пути подтверждено в ряде исследований. Это позволяет рассматривать дефицит витамина D в качестве предиктора простатической гиперплазии, которая часто сочетается с явлениями хронического воспаления в ткани предстательной железы (рис. 4) [15, 25, 33–35].
Антипролиферативное влияние витамина D на ткань предстательной железы может быть дополнительно опосредовано его способностью ингибировать избыточный инсулиновый клеточный сигнал (уровень инсулина и инсулиноподобного фактора роста 1), ответственный за активацию механизмов пролиферации клеток, в том числе в предстательной железе. Хорошо известно, что инсулин – мощный митогенный гормон, поэтому длительная гиперинсулинемия (инсулинорезистентность) сопровождается повышением риска развития гиперпластических клеточно-тканевых процессов и рассматривается как один из ключевых современных механизмов канцерогенеза [36]. Устранение дефицита витамина D, по мнению некоторых исследователей, благоприятно воздействует на процессы промоции гена инсулина, стимулируя экспрессию инсулиновых рецепторов и тем самым улучшая инсулин-опосредованный внутриклеточный транспорт глюкозы [37].
Кроме того, активный метаболит 1,25(OH)2D обеспечивает активацию транскрипции гена инсулина человека [38, 39]. Витамин D регулирует внеклеточный и внутриклеточный обмен кальция, который необходим для инсулин-опосредованных внутриклеточных процессов в инсулин-зависимых тканях (скелетных мышцах, жировой ткани), а изменения уровня кальция в клетке могут иметь неблагоприятные последствия для секреции инсулина, процесс синтеза которого в свою очередь опосредован кальцием [37, 40]. Поскольку витамин D оказывает модулирующее действие на иммунную систему, то гиповитаминоз D может вызывать системный субклинический воспалительный ответ, который в свою очередь способен индуцировать инсулинорезистентность [41, 42].
В ходе иммуногистохимических исследований установлено, что в уретре рецепторов витамина D экспрессируется гораздо больше, чем в мочевом пузыре или предстательной железе. Кроме того, позитивное влияние витамина D на все указанные структуры нижних отделов урогенитального тракта может осуществляться за счет общих универсальных механизмов, например способности витамина D ингибировать синтез провоспалительных цитокинов (в частности, интерлейкина 8 и фактора некроза опухоли альфа), а также снижать активность циклооксигеназы 2 и выработку интерферона гамма локальными иммунокомпетентными клетками [43]. Поэтому перспективными фармакотерапевтическими мишенями для применения витамина D или агонистов его рецепторов при лечении хронического простатита может стать не только предстательная железа, но и уретра, а также детрузор мочевого пузыря, которые, как известно, в подавляющем большинстве случаев вовлекаются в содружественный патологический процесс [43, 44].
Нейропротективный и антиболевой эффект
В настоящее время накоплены результаты доказательных научных исследований, позволяющие говорить о выраженных нейропротективных и антиболевых эффектах витамина D.
По данным современных исследований, дефицит витамина D (уровень 25(OH)D в крови 45]. После поправки на демографические и клинические переменные среднее увеличение интенсивности боли составило 0,61 ± 0,25 на каждые 25 нмоль/л снижения плазменного уровня 25(OH)D (p = 0,011). Более низкий уровень 25(ОН)D также ассоциировался с большей выраженностью болевых симптомов (r = -0,21, p = 0,008). Полученные результаты свидетельствуют о важной роли низкого уровня витамина D в механизмах повышения центральной чувствительности к боли (гиперсенситизации) [45]. Вместе с тем показано, что заместительная терапия витамином D у пациентов с неспецифической скелетно-мышечной болью позволяет уменьшить выраженность болевого синдрома и депрессивных проявлений, повысить качество жизни, поэтому авторы исследования рекомендуют проводить скрининг на дефицит витамина D среди всех пациентов с этим видом хронической боли [46]. По результатам другого исследования, применение витамина D в дозе 60 000 МЕ/нед в течение восьми недель у пациентов с хронической болью в спине привело к уменьшению интенсивности боли и улучшению функциональных способностей [47].
Сегодня большой практический интерес для врачей различных специальностей, занимающихся проблемами лечения хронических болевых синдромов, представляет хроническая невропатическая боль – один из наиболее плохо диагностируемых и трудно поддающихся стандартной фармакотерапии вариантов хронической неинфекционной боли [48]. В исследовании 2018 г. обнаружено, что невропатическая боль отмечалась у пациентов с дефицитом витамина D (уровень 25(ОН)D в крови
Для урологической практики этот вопрос имеет важное научно-прикладное значение по целому ряду нерешенных аспектов [55].
Во-первых, наблюдается высокая общая частота дефицита/недостаточности витамина D у больных урологического профиля [56, 57]. Так, M.S. Pitman и соавт. (2011) проанализировали результаты обследования 3763 мужчин из урологических баз медицинских данных. Авторы пришли к выводу, что в настоящее время у 68% урологических пациентов неадекватный уровень витамина D, а у 52% из них – нераспознанные дефицит или недостаточность витамина D [57]. Чаще дефицит витамина D выявляется у лиц моложе 50 лет (44,5%), афроамериканцев (53,2%), представителей испанской национальности (41,6%) (р 15 нг/мл [58].
Во-вторых, в настоящее время ни у кого не вызывает сомнений, что в мультифакторный патогенез синдрома хронической тазовой боли (СХТБ)/хронического простатита у мужчин вовлечены механизмы нейропластичности и хронической невропатической боли, часто сочетающиеся с депрессией, что формирует порочный патогенетический круг и существенно утяжеляет клиническое течение указанных нозологий [59–63].
В-третьих, в отечественной литературе недостаточно изучена роль дефицита витамина D в патогенезе невропатического компонента хронической боли при хронических воспалительных заболеваниях предстательной железы. Так, на важность обнаружения и коррекции невропатических механизмов хронической тазовой (простатической) боли указывают М.И. Коган и соавт. (2011). Основываясь на результатах исследований последних пяти – семи лет, они высказали предположение, что если в основе хронической боли при воспалительной форме хронического абактериального простатита лежат тканевые воспалительные факторы, то клинику при невоспалительной форме заболевания, напротив, определяют нейрогенные механизмы [64]. Такие факторы, как невропатия полового нерва с развитием хронического простатита, метаболическая невропатия с поражением нервных сплетений малого таза и предстательной железы по типу тазовых плекситов и нейровегетативные расстройства, могут носить одновременно этиологический и патогенетический характер [65–68].
По данным И.А. Тюзикова и соавт. (2011, 2012), клинические проявления невропатии (независимо от ее этиологии) оказывают негативное влияние практически на все показатели анатомо-функционального состояния предстательной железы и мышц тазового дна [69, 70]. Поэтому эффекты нейропротекции и регуляции болевой рецепции и перцепции, дополнительно опосредованные витамином D, могут оказаться в недалекой перспективе полезной и эффективной фармакотерапевтической опцией при лечении СХТБ/хронического простатита, представляющего, как известно, весьма сложную клиническую междисциплинарную проблему, ухудшающую качество жизни этой группы пациентов [71, 72].
Согласно результатам новейших российских исследований, невропатический компонент СХТБ обнаруживается с помощью валидного опросника для диагностики невропатической боли DN4 практически у каждого третьего больного. Однако адекватная фармакологическая коррекция СХТБ представляет сложную клиническую задачу для врача-уролога [73]. Как установили И.И. Можаев и соавт. (2017), стандартная терапия СХТБ практически не оказывает позитивного влияния на невропатический компонент СХТБ. Более того, в ходе длительной стандартной терапии доля невропатического компонента СХТБ может возрастать. В результате замыкается порочный круг патогенеза хронической боли, что сопровождается усилением явлений вегетативной симпатической гиперактивности, персистенцией хронического болевого синдрома, резистентного к стандартной опиоидной терапии, и существенным ухудшением качества жизни пациентов с хроническим простатитом [73]. При этом роль невропатических механизмов болевого синдрома при хроническом простатите в отечественной рутинной урологической практике явно недооценивается, поэтому невропатический компонент чаще всего остается недиагностированным и, соответственно, некорректированным [74]. Однако с учетом их существенного негативного воздействия на клинические исходы и результаты лечения хронического простатита следует активно искать выход из этой ситуации, поскольку никакие препараты, стандартно применяющиеся для лечения хронического простатита, не способны патогенетически ликвидировать невропатическую боль [75]. В этой связи управление витамин D-статусом мужчин с хроническими воспалительными заболеваниями предстательной железы в условиях высокой частоты дефицита витамина D – полифункционального стероидного гормона у россиян, живущих в зоне географической «витаминной зимы», может быть весьма эффективным дополнением к традиционной фармакотерапии любых клинических вариантов хронического простатита.
В настоящее время на российском фармацевтическом рынке появился Детримакс® Витамин D3 компании ООО «ЮНИФАРМ» – биологически активная добавка для перорального приема со сравнительно высокой для России дозировкой – 25 мкг (1000 МЕ) холекальциферола (витамина D3) в одной таблетке. Детримакс® Витамин D3 хорошо усваивается в желудочно-кишечном тракте за счет образования в среде тонкого кишечника мицеллярных соединений и обладает полноценным спектром всех физиологических эффектов витамина D, необходимых каждому человеку с момента зачатия до глубокой старости. Детримакс® Витамин D3 имеет отличительную особенность – в его составе отсутствуют аллергены, сахароза, ароматизаторы и подсластители, что крайне актуально ввиду высокой распространенности в популяции алиментарной аллергии. Детримакс® Витамин D3 содержит дозу витамина D, равную 1000 МЕ, которая абсолютно безопасна и не требует проведения рутинного лабораторного мониторинга, так как высокая безопасность витамина D в дозировке до 4000 МЕ/сут подтверждена широкомасштабными эпидемиологическими и клиническими международными исследованиями [76, 77]. В декабре 2018 г. был опубликован новый метаанализ, в который было включено 32 клинических рандомизированных исследования [78]. Согласно его результатам, длительный прием высоких доз витамина D (более 2800 МЕ/сут) не увеличивал общее количество нежелательных явлений по сравнению с плацебо у 1731 участника из десяти исследований (ОР 1,05, 95%-ный доверительный интервал (ДИ) 0,88–1,24, р = 0,61), а также камней в почках у 1336 участников из пяти исследований (ОР 1,26, 95% ДИ 0,35–4,58, р = 0,72). Однако отмечалась тенденция к увеличению риска развития гиперкальциемии у 2598 участников в десяти исследованиях (ОР 1,93, 95% ДИ 1,00–3,73, р = 0,05). В то же время его влияние на гиперкальциурию только у 276 участников из трех исследований было недостоверным (ОР 1,93; 95% ДИ 0,83–4,46, р = 0,12) [78]. Эффективность постоянного курсового приема витамина D для лечения и профилактики дефицита/недостаточности витамина D, ассоциированного с целым спектром заболеваний у детей и взрослых, в настоящее время доказана многочисленными международными исследованиями, поэтому витамин D рекомендован к приему ведущими научными сообществами мира и РФ [79, 80].
Заключение
Несмотря на пока явно недостаточное количество доказательных исследований, посвященных патофизиологической роли нарушений статуса витамина D у мужчин с воспалительными заболеваниями предстательной железы, не вызывает сомнения тот факт, что дефицит и недостаточность витамина D сегодня распространенное, но практически не диагностируемое состояние у урологических больных. Современные эпидемиологические исследования однозначно и достоверно свидетельствуют о высокой встречаемости нарушений витамин D-статуса в современной популяции в целом и у мужчин в частности. Однако в отечественной рутинной урологической практике при обследовании и лечении больных хроническим простатитом дефицит или недостаточность витамина D лабораторными методами, как правило, не выявляется и, соответственно, никак не корректируется. Между тем с позиций междисциплинарной и персонифицированной медицины практикующим урологам крайне важно иметь общее представление о биологической роли витамина D в функционировании мужской мочеполовой системы, а также четко представлять патофизиологическую основу и необходимость клинического применения препаратов, содержащих витамин D, для повышения эффективности комплексной фармакотерапии такого распространенного урологического заболевания, как хронический простатит, тем более что в современной России имеются достаточные фармацевтические ресурсы для реализации этих междисциплинарных задач.
Длительное использование синтетических глюкокортикостероидов усиливает воспаление в надпочечниках | Новости
Академическая группа Бристольского университета обнаружила доказательства того, что пролонгированное лечение синтетическими глюкокортикостероидами (ГКС) увеличивает воспаление в надпочечниках в ответ на бактериальную инфекцию. В долгосрочной перспективе это явление может приводить к значительному повреждению надпочечников и функциям этого органа.
Синтетические ГКС – крайне широко применяемые препараты, используемые против многих воспалительных и аутоиммунных заболеваний. Однако прием больших доз за длительное время может приводить к множеству побочных эффектов, в том числе к надпочечниковой недостаточности, которая может перейти в опасную острую форму.
Эндогенные кортикостероиды (например, кортизол) регулируют многие физиологические функции, такие как метаболизм, сердечно-сосудистый тонус, репродуктивные функции, настроение и когнитивный статус, а также работу иммунной системы. Лечение ГКС может приводить к надпочечниковой недостаточности, выражающейся в надпочечниковой атрофии и снижении базальной и стресс-индуцированной секреции кортизола – этот эффект может длиться годы после отмены терапии. Одно из самых грозных последствий надпочечниковой недостаточности – развитие острого надпочечникового криза, возникающего на фоне сниженной секреции кортизола в ответ на воспалительный стресс (инфекция, травма, хирургическое вмешательство).
Предыдущие исследования фокусировались на изучении долгосрочных эффектов стероидного лечения на гипоталамус и гипофиз, но не так внимательно изучали влияние стероидов на надпочечники.
В актуальной работе, опубликованной в журнале Brain, Behavior, and Immunity, исследователи проверили гипотезу о влиянии синтетических ГКС на стероидогенные метаболические пути надпочечников, что может лежать в основе подавления функции этих органов. Было обнаружено, что во время приема синтетических ГКС циркадный ритм секреции нативных стероидов нарушается – и этот эффект наблюдался в том числе длительно после отмены лечения. Также был отмечен парадоксальный провоспалительный эффект синтетических ГКС в надпочечниках, что сопровождалось повреждением эндотелиальных клеток сосудов и апоптозом.
Авторы работы отмечают, что это исследование раскрывает важные физиологические механизмы стероидогенеза и пути их повреждения. Это является прямой предпосылкой для проведения клинических исследований, нацеленных на противовоспалительное лечение и его последствия. Теоретически это можно предотвратить использованием синтетических ГКС с более похожей на эндогенные ГКС струкстурой.
Источник: https://doi.org/10.1016/j.bbi.2020.03.001
Определение стероидогенеза Merriam-Webster
ste · roido · gen · e · sis
| \ stə-ˌrȯi-də-ˈje-nə-səs
; ˌStir-ˌȯi-də- также ˌster- \
Определение
стероидогенеза
Моделирование стероидогенеза: рамочная модель для поддержки генерации гипотез и проверки в эндокринных исследованиях | Примечания к исследованиям BMC
Построение моделей путей стероидогенеза с использованием нотации mEPN
Модель стероидогенеза человека представлена на рис.1, представляющий структуру реакций, которые производят биологически активные стероиды в нормальных условиях. Диаграммы были составлены с использованием модифицированной нотации Эдинбургского пути (mEPN) с использованием программного обеспечения для редактирования сети yED (http://www.yworks.com). Редактируемая версия этой диаграммы доступна в виде файла «.graphml», который можно открыть в yED (дополнительный файл 1). Информация о взаимодействии стероидов и ферментов была получена от Miller et al. [1] и связанные ссылки. Активные проводящие пути в различных тканях (а именно, ретикулярном надпочечнике, клубочках и фасцикулятах, яичках, яичниках, простате и плаценте, дополнительный файл 2) выделены красными прямоугольниками, чтобы легко визуализировать стероидогенные реакции, происходящие в каждой ткани.
Рис. 1
Построение каркасной модели стероидогенеза человека. a Изображение редактируемой рамочной модели стероидогенеза человека. b Расшифровка символов, используемых на схеме. c Добавление URL-адреса Chemspider к стероидному узлу путем редактирования свойств узла в yED
mEPN основан на принципах «диаграмм процессов» и разработан, чтобы быть однозначным, но кратким [3]. Подробный протокол того, как редактировать диаграммы mEPN, был недавно опубликован [4].И биологические объекты (такие как белки или стероиды), и то, как они взаимодействуют друг с другом (например, фосфорилирование или димеризация), представлены как компоненты пути. Небольшие биохимические вещества, такие как стероиды, представлены шестиугольниками, все белки (ферменты) — прямоугольниками с закругленными углами, а все гены — параллелограммами. Черные прямоугольники позволяют параметризовать модели, с помощью которых можно определить начальный ввод токенов на узлах, поступающих в тракт (рис. 1b). Его можно расширить для создания больших, четких и информативных моделей путей [5, 6].
Мы решили маркировать стероиды и их промежуточные соединения на основе названий, широко используемых в биологическом сообществе, но также связали узлы с базой данных Chemspider (http://www.chemspider.com). Это дает ссылку на точную биохимическую структуру, которую представляет молекула, и дает альтернативные названия. Ссылку можно открыть, нажав клавишу F8, когда узел выделен yED (рис. 1c). Существует ряд соглашений об именах биохимических молекул. Полная схема основных стероидогенных путей (рис.1а) содержит узлы, представляющие как ген, так и белок, продуцируемый каждой изоформой фермента, и поэтому каждый узел гена связан с Ensembl (http://www.ensembl.org) [7].
Построение и параметризация динамического потока клеточно-специфической модели стероидогенеза клеток Лейдига крысы с использованием ранее опубликованных экспериментальных данных а тестовое моделирование неизмеримо увеличивает его общую ценность.Мы сконструировали и параметризовали конкретную модель стероидогенеза клеток Лейдига крыс во время постнатального развития и взросления (рис. 2), сосредоточив внимание на конкретных реакциях, которые клетки Лейдига используют для производства своего основного стероидного продукта: андрогенов. Упрощенная версия клеток Лейдига (рис. 2a) использует один белковый узел для представления всех изоформ определенного фермента, поэтому ссылка Ensembl не включена. Редактируемая версия упрощенной схемы также доступна в виде файла «.graphml», который можно открыть в yED (дополнительный файл 3).
Рис. 2
Построение, параматеризация и проверка гипотез с использованием клеточно-специфической модели стероидогенеза клеток Лейдига на крысах. a Изображение редактируемой структуры стероидогенеза клеток Лейдига крысы с деталями параметризации. Черные гистограммы рядом с каждым вводом фермента показывают количество маркеров, добавленных к каждому ферментному узлу на трех стадиях развития клеток-предшественников, незрелых и взрослых клеток Лейдига. Токены вводятся в узел путем редактирования свойств стрелки, ведущей от ввода токена к узлу, и отображаются в виде числовой строки рядом с узлом.Андростендион обозначен зеленым кольцом, тестостерон — синим, а 3α-диол — красным. b Неподвижные кадры из динамических сигнальных выходов сети Петри модели клетки Лейдига на трех стадиях — предшественник, незрелый и взрослый. Каждая из цветных фигур на диаграмме представляет собой стероидный узел в том же положении, что и диаграмма YED выше. Более крупные красные формы указывают на то, что через этот узел проходит больше токенов, меньшие синие формы указывают на меньшее количество, а отсутствие формы указывает на отсутствие токенов. c График, отображающий поток токенов через узлы, представляющие тестостерон (синий) и 3α-диол (красный) в процессе созревания клеток Лейдига.Цветные области вокруг линии указывают на отклонение результата
Параметризация диаграмм путей, построенных в yED для запуска в качестве сигнальных сетей Петри (SPN) в программном обеспечении Graphia Professional, является логическим процессом, и для пользователя не требуется никакого формального обучения математическому моделированию. Подробное описание того, как параметризовать диаграммы YED, чтобы их можно было запускать как SPN в Graphia Professional (Kajeka, Эдинбург, Великобритания, ранее BioLayout Express 3D ) [2], можно найти в Livigni et al.[4]. Представляя сложную сеть в виде сети Петри, метод SPN моделирует поток сигналов как схему накопления токенов в белковых узлах с течением времени.
Параметризация клеточно-специфической диаграммы была достигнута с использованием ранее опубликованных данных об активности ферментов, измеренных на трех различных стадиях созревания клеток Лейдига крыс [8]. В yED маркеры, представляющие активность фермента в пмоль / минуту / миллион клеток, были добавлены к стрелкам, соединяющим черные входные узлы каждого из стероидогенных ферментных узлов, с использованием обозначений a – b, c; d – e, f, где ‘a– b ‘- это первый и последний временные блоки, которые вы хотели бы, чтобы количество токенов «c» было добавлено в модель, а «d – e» — это первый и последний временные блоки, в которых вы хотели бы количество токенов «f» для добавления в модель (и так далее для количества требуемых входных переменных), как показано на рис.2а. Первые 20 временных блоков представляют стадию «предшественников» клеток Лейдига, присутствующих у крысы примерно на постнатальный день (pnd) 21. Временные блоки 21–50 представляют стадию «незрелых» клеток Лейдига, присутствующую около pnd 35, а временные блоки 51–100 представляют зрелые взрослые клетки Лейдига, которые составляют все клетки Лейдига в семеннике, начиная с pnd 90 и далее. Изменение активности фермента на трех стадиях показано черными гистограммами рядом с узлами ввода фермента на рис. 2а. Редактируемая версия параметризованной диаграммы доступна как ‘.graphml ’, который можно открыть в yED (дополнительный файл 4).
Параметризованная диаграмма была запущена как SPN в Graphia Professional в течение 100 временных блоков, 500 прогонов и со стандартным нормальным стохастическим распределением и потребительными переходами [2]. Поток токенов был визуализирован в виде анимации, показанной в Дополнительном файле 5. На рисунке 2b показан снимок экрана с анимированным выводом потока токенов на каждом из трех этапов (снимки экрана, сделанные во временном блоке 20, представляющем прародителя, 50 — незрелого, а 100 — взрослого Стадии клеток Лейдига).Это обеспечивает обзор всех узлов на диаграмме и помогает визуализировать пути потока токенов. Для конкретной визуализации на фиг. 2c были выбраны два узла: тестостерон и 3α-андростандиол («3α-диол»). Если эти результаты принимать как прогноз относительной скорости продукции этих двух стероидов на стадиях незрелых и взрослых клеток Лейдига, мы можем предсказать, что 3α-диол более распространен, чем тестостерон в незрелых клетках Лейдига, и что тестостерон более распространен, чем 3α- диол во взрослых клетках Лейдига.Это предсказание модели согласуется с предыдущими экспериментальными измерениями [8], показывая, что наша модель соответствующим образом резюмирует ситуацию in vivo и, таким образом, полезна для проверки гипотез.
Использование модели для прогнозирования продукции стероидов при дефиците Hsd17b3
Ферменты класса 17-бета-гидроксистероиддегидрогеназы катализируют превращение 17-кето и 17-гидроксистероидов. Различные изоформы фермента экспрессируются в разных стероидогенных тканях.17-бета-гидроксистероиддегидрогеназа типа 3 представляет собой изоформу, экспрессируемую клетками Лейдига у людей ( HSD17B3 ), мышей и крыс ( Hsd17b3 ) [9] и предпочтительно катализирует превращение андростендиона в тестостерон и андростандиона в ДГТ. Мужчины мужского пола с мутациями в HSD17B3 присутствуют с различной степенью физиологической недостаточности, и уровни андростендиона в плазме во время полового созревания обычно в десять раз превышают нормальные уровни [10]. Чтобы продемонстрировать прогностическую силу нашей модели in silico, мы имитировали мутацию потери функции в Hsd17b3 , удалив ввод токена из узла HSD17B модели крысиной клетки Лейдига (рис.3а, б) и перезапустили моделирование. На этот раз токены накапливались в узле андростендиона без выработки тестостерона, что согласуется с профилем циркулирующих андрогенов, наблюдаемым у пациентов с потерей функции HSD17B3 (рис. 3c). При визуализации в виде графика (рис. 3d) показано, что продукция андростендиона увеличивается по мере созревания клеток Лейдига в течение постнатальной жизни, тогда как тестостерон не вырабатывается. Эта простая демонстрация показывает полезность модели для прогнозирования результатов генетических или фармакологических манипуляций до начала какой-либо лабораторной работы или работы in vivo, и ее можно масштабировать с одновременным моделированием нескольких нокаутов.
Рис. 3
Использование модели для прогнозирования исхода нокаута HSD17B в клетках Лейдига. a Мечение узла активности белка HSD17B в модели дикого типа. b Удаление стрелки между входом токена и белковым узлом сбрасывает вход токена на ноль и моделирует нокаут белка. c Стоп-кадр из динамических сигнальных выходов сети Петри нокаутной модели клеток Лейдига HSD17B на взрослой стадии. Каждая из цветных фигур на диаграмме представляет собой стероидный узел в том же положении, что и диаграмма YED выше.Более крупные красные формы указывают на то, что через этот узел проходит больше токенов, меньшие синие формы указывают на меньшее количество, а отсутствие формы указывает на отсутствие токенов. d График, визуализирующий поток токенов через узлы, представляющие тестостерон (синий) и андростендиол (зеленый) в процессе созревания клеток Лейдига. Цветные области вокруг линии указывают на отклонение результата
Стероидные гормоны: синтез, секреция и транспорт
- Filippo Acconcia
- Maria Marino
Живая справочная запись
Первый онлайн:
2
Цитаты- 6.6k
Загрузки
Часть
Эндокринология
Книжная серия (ENDOCR)
Реферат
В системах млекопитающих существует шесть семейств стероидных гормонов, которые можно классифицировать как по химическому, так и по биологическому признаку. Это эстрогены, прогестерон, андрогены, минералокортикоиды, глюкокортикоиды и витамин D. Эти стероидные гормоны играют решающую роль во многих физиологических и патофизиологических процессах и, следовательно, привлекли значительный исследовательский интерес в последнее столетие.Подавляющее большинство циркулирующих стероидов у млекопитающих происходит из-за эндокринной активности гонад и надпочечников, которые метаболизируют липидный холестерин для создания репертуара стероидов. Многочисленные исследования, проводившиеся на протяжении десятилетий, кропотливо выяснили молекулярные ферменты и реакции стероидогенеза, распределенные по митохондриальным и микросомальным компартментам стероидогенных клеток. В этой главе рассматриваются пути биосинтеза, высвобождение и транспорт основных классов стероидных гормонов у млекопитающих.В частности, стероидогенез обсуждается как единый процесс, который повторяется в каждой железе с вариациями, зависящими от типа клеток, по одной теме. Кроме того, также обсуждались гомеостатические механизмы, которые регулируют секрецию или высвобождение стероидных гормонов и гормонов-предшественников с помощью петель обратной связи или биологических ритмов. Наконец, сообщается о роли стероид-специфических белков плазмы и локальной инактивации избытка активных стероидов внутри клеток, чтобы получить четкое представление о том, как регулируются концентрации активных стероидных гормонов.
Ключевые слова
Холестерин Стероидогенные ферменты Стероидные гормоны Стероидсвязывающие белки Стероидогенные железы Нестероидогенные ткани
Это предварительный просмотр содержимого подписки,
войдите в систему
, чтобы проверить доступ.
Ссылки
Auchus RJ, Rainey WE. Адренархе – физиология, биохимия и болезни человека. Клин Эндокринол (Oxf). 2004; 60: 288.
CrossRefGoogle Scholar
Барклай Дж. Л., Цанг А. Х., Остер Х. Взаимодействие центральных и периферических часов в физиологической регуляции.Prog Brain Res. 2012; 199: 163.
CrossRefPubMedGoogle Scholar
Bassett MH, White PC, Rainey WE. Регуляция экспрессии альдостерон-синтазы. Mol Cell Endocrinol. 2004; 217: 67.
CrossRefPubMedGoogle Scholar
Brown MS, Kovanen PT, Goldstein JL. Рецептор-опосредованное поглощение холестерина липопротеинов и его использование для синтеза стероидов в коре надпочечников. Rec Prog Horm Res. 1979; 35: 215.
PubMedGoogle Scholar
Chang TY, Chang CC, Ohgami N, Yamauchi Y.Зондирование холестерина, торговля и этерификация. Annu Rev Cell Dev Biol. 2006; 22: 129.
CrossRefPubMedGoogle Scholar
Chevrier L, Guimiot F, de Roux N. Мутации рецептора GnRH при изолированном гонадотропном дефиците. Mol Cell Endocrinol. 2011; 346: 21.
CrossRefPubMedGoogle Scholar
Clyne CD, Zhang Y, Slutsker L, Mathis JM, White PC, Rainey WE. Ангиотензин II и калий регулируют транскрипцию человеческого CYP11B2 через общие цис-элементы. Мол Эндокринол.1997; 11: 638.
CrossRefPubMedGoogle Scholar
Cooper MS, Stewart PM. 11Бета-гидроксистероиддегидрогеназа типа 1 и ее роль в системе гипоталамус-гипофиз-надпочечники, метаболическом синдроме и воспалении. J Clin Endocrinol Metab. 2009; 94: 4645.
CrossRefPubMedGoogle Scholar
Ehrhart-Bornstein M, Hinson JP, Bornstein SR, Scherbaum WA, Vinson GP. Внутринадпочечниковые взаимодействия в регуляции стероидогенеза надпочечников. Endocr Rev.1998; 19: 101.
CrossRefPubMedGoogle Scholar
Физер Л.Ф., Физер М.Стероиды. Нью-Йорк: Reinhold Publishing Corp; 1959. с. 1–945.
Google Scholar
Gaffey AE, Bergeman CS, Clark LA, Wirth MM. Старение и ось HPA: стресс и устойчивость у пожилых людей. Neurosci Biobehav Rev.2016; 68: 928.
CrossRefPubMedGoogle Scholar
Horton JD, Goldstein JL, Brown MS. SREBP: активаторы полной программы синтеза холестерина и жирных кислот в печени. J Clin Invest. 2002; 109: 1125.
CrossRefPubMedPubMedCentralGoogle Scholar
Khundmiri SJ, Murray RD, Lederer E.ПТГ и витамин D. Compr Physiol. 2016; 6: 561.
CrossRefPubMedGoogle Scholar
Kraemer FB. Утилизация холестерина надпочечниками. Mol Cell Endocrinol. 2007. 42: 265–6.
Google Scholar
Лабри Ф. Все половые стероиды производятся внутриклеточно в периферических тканях с помощью механизмов интракринологии после менопаузы. J Стероид Biochem Mol Biol. 2015; 145: 133.
CrossRefPubMedGoogle Scholar
Lin XW, Blum ID, Storch KF. Часы в главной железе: гипофизарные ритмы и их физиологическое значение.J Biol Rhythms. 2015; 30: 263.
CrossRefPubMedGoogle Scholar
Luu-The V. Оценка стероидогенеза и функций стероидогенных ферментов. J Стероид Biochem Mol Biol. 2013; 137: 176.
CrossRefPubMedGoogle Scholar
Miller WL. Молекулярная биология синтеза стероидных гормонов. Endocr Rev.1988; 9: 295.
CrossRefPubMedGoogle Scholar
Miller WL. Синтез стероидных гормонов в митохондриях. Mol Cell Endocrinol. 2013; 379: 62.
CrossRefPubMedGoogle Scholar
Miller WL, Auchus RJ.Молекулярная биология, биохимия и физиология стероидогенеза человека и его нарушений. Endocr Rev.2011; 32: 81.
CrossRefPubMedGoogle Scholar
Molina PE. Эндокринная физиология. 3-е изд. Нью-Йорк: McGraw-Hill Company; 2010. с. 1–303.
Google Scholar
Norman AW. Солнечный свет, время года, пигментация кожи, витамин D и гидроксивитамин D 25–1100: неотъемлемые компоненты эндокринной системы витамина D. Am J Clin Nutr. 1998; 67: 1108.
PubMedGoogle Scholar
Norman AW, Henry HL.Гормоны. 3-е изд. Лондон: Эльзевьер; 2015. с. 1–413.
CrossRefGoogle Scholar
Normington K, Russell DW. Тканевое распределение и кинетические характеристики ферментов стероид-5-редуктазы крыс. Доказательства различных физиологических функций. J Biol Chem. 1992; 267: 19548.
PubMedGoogle Scholar
Завод TM. Гипоталамический контроль оси гипофиз-гонад у высших приматов: ключевые достижения последних двух десятилетий. J Neuroendocrinol. 2008; 20: 719.
CrossRefPubMedGoogle Scholar
Riegelhaupt JJ, Waase MP, Garbarino J, Cruz DE, Breslow JL.Целенаправленное нарушение стероидогенного острого регуляторного белка D4 приводит к умеренному снижению веса и незначительным изменениям липидного обмена. J Lipid Res. 2010; 51: 1134.
CrossRefPubMedPubMedCentralGoogle Scholar
Russell DW, Wilson JD. Стероид-5-редуктаза: два гена / два фермента. Энн Рев Биохим. 1994; 63: 25.
CrossRefPubMedGoogle Scholar
Stocco DM, Wang X, Jo Y, Manna PR. Множественные сигнальные пути, регулирующие стероидогенез и экспрессию стероидогенного острого регуляторного белка: сложнее, чем мы думали.Мол Эндокринол. 2005; 19: 2647.
CrossRefPubMedGoogle Scholar
Tian Y, Shen W, Lai Z, Shi L, Yang S, Ding T, Wang S, Luo A. Выделение и идентификация тека-интерстициальных клеток яичников и гранулозных клеток незрелых самок мышей. Cell Biol Int. 2015; 39: 584.
CrossRefPubMedGoogle Scholar
Wood CE. Развитие и программирование оси гипоталамус-гипофиз-надпочечники. Clin Obstet Gynecol. 2013; 56: 610.
CrossRefPubMedGoogle Scholar
Дополнительная литература
d’Anglemont de Tassigny X, Colledge WH.Роль передачи сигналов кисспептина в репродукции. Физиология (Bethesda). 2010; 25: 207–17.
CrossRefGoogle Scholar
Miller WL. Нарушения на начальных этапах синтеза стероидных гормонов. J Стероид Biochem Mol Biol. 2017; 165: 18–37. pii: S0960-0760 (16) 30055-3.
CrossRefPubMedGoogle Scholar
Рахмани Б., Гасеми Р., Даргахи Л., Ахмадиани А., Хери А. Нейростероиды; потенциальные поддерживающие роли в поддержании гомеостаза. Gen Comp Endocrinol. 2016; 225: 242–50.
CrossRefPubMedGoogle Scholar
Цанг А.Х., Барклай Дж. Л., Остер Х. Взаимодействие между эндокринной и циркадной системами. J Mol Endocrinol. 2013; 52: R1–16.
CrossRefPubMedGoogle Scholar
Авторы и аффилированные лица
- 1. Департамент науки, Рим, TreRomeItaly, Италия
Стероидогенез яичек подавляется во время экспериментального аутоиммунного энцефаломиелита у крыс
, M.Половые и гендерные вопросы при рассеянном склерозе. Ther. Adv. Neurol. Disord. 6 , 237–248. https://doi.org/10.1177/1756285613488434 (2013).
Артикул
PubMed
PubMed Central
Google Scholar
Whitacre, C. C., Reingold, S. C. & O’Looney, P. A. Гендерный разрыв в аутоиммунитете. Наука 283 , 1277–1278. https://doi.org/10.1126/science.283.5406.1277 (1999).
CAS
Статья
PubMed
Google Scholar
Читнис, Т. Роль тестостерона в риске и течении рассеянного склероза. Мультисклер. (Хаундмиллс, Бейзингсток, Англия) 24 , 36–41. https://doi.org/10.1177/1352458517737395 (2018).
CAS
Статья
Google Scholar
Фостер, С. С., Дэниэлс, К., Бурдетт, Д. Н. и Бебо, Б. Ф. Мл. Нарушение регуляции гипоталамо-гипофизарно-гонадной оси при экспериментальном аутоиммунном энцефаломиелите и рассеянном склерозе. J. Neuroimmunol. 140 , 78–87. https://doi.org/10.1016/s0165-5728(03)00177-2 (2003).
CAS
Статья
PubMed
Google Scholar
Safarinejad, M. R. Оценка эндокринного профиля, оси гипоталамус-гипофиз-яички и качества спермы при рассеянном склерозе. J. Neuroendocrinol. 20 , 1368–1375. https://doi.org/10.1111/j.1365-2826.2008.01791.x (2008).
CAS
Статья
PubMed
Google Scholar
Wei, T. & Lightman, S. L. Нейроэндокринная ось у пациентов с рассеянным склерозом. Мозг 120 (Pt 6), 1067–1076. https://doi.org/10.1093/brain/120.6.1067 (1997).
Артикул
PubMed
Google Scholar
Bove, R. et al. Низкий уровень тестостерона связан с инвалидностью у мужчин с рассеянным склерозом. Мультисклер. (Хаундмиллс, Бейзингсток, Англия) 20 , 1584–1592.https://doi.org/10.1177/1352458514527864 (2014).
CAS
Статья
Google Scholar
Macció, D. R., Calfa, G., Volosín, M. & Roth, G.A. Уровни тестостерона и кортикостерона в сыворотке при остром экспериментальном аутоиммунном энцефаломиелите (EAE) у самцов крыс Wistar. Neuro Endocrinol. Lett. 25 , 196–200 (2004).
PubMed
Google Scholar
Milosevic, A. et al. Половые особенности изменений оси гипоталамус-гипофиз-гонад во время экспериментального аутоиммунного энцефаломиелита. Brain Behav. Иммун. 89 , 233–244. https://doi.org/10.1016/j.bbi.2020.06.025 (2020).
CAS
Статья
PubMed
Google Scholar
Дюфау, М. Л. и Кэтт, К. Дж. Рецепторы гонадотропина и регуляция стероидогенеза в семенниках и яичниках. Vitam. Horm. 36 , 461–592. https://doi.org/10.1016/s0083-6729(08)60989-9 (1978).
CAS
Статья
PubMed
Google Scholar
Коннелли, М. А. и Уильямс, Д. Л. SR-BI и захват холестерина стероидогенными клетками. Trends Endocrinol. Метаб. 14 , 467–472. https://doi.org/10.1016/j.tem.2003.10.002 (2003).
CAS
Статья
PubMed
Google Scholar
Кларк, Б. Дж., Уэллс, Дж., Кинг, С. Р. и Стокко, Д. М. Очистка, клонирование и экспрессия нового индуцированного лютеинизирующим гормоном митохондриального белка в опухолевых клетках Лейдига мыши MA-10. Характеристика стероидогенного белка острой регуляции (StAR). J. Biol. Chem. 269 , 28314–28322 (1994).
CAS
Статья
Google Scholar
Сельварадж В., Стокко Д. М. и Кларк Б.J. Современные знания об острой регуляции стероидогенеза. Biol. Репродукция. 99 , 13–26. https://doi.org/10.1093/biolre/ioy102 (2018).
Артикул
PubMed
PubMed Central
Google Scholar
Пейн, А. Х. и Хейлз, Д. Б. Обзор стероидогенных ферментов на пути от холестерина к активным стероидным гормонам. Endocr. Ред. 25 , 947–970. https://doi.org/10.1210 / er.2003-0030 (2004).
CAS
Статья
PubMed
Google Scholar
Бремер А. А. и Миллер В. Л. В книге Клеточная эндокринология в здоровье и болезнях (редакторы Альфредо, США и Майкл Конн, П.) 207–227 (Academic Press, 2014).
Google Scholar
Collongues, N., Patte-Mensah, C., De Seze, J., Mensah-Nyagan, A.G. & Derfuss, T.Тестостерон и эстроген при рассеянном склерозе: от патофизиологии к терапии. Эксперт Rev. Neurother. 18 , 515–522. https://doi.org/10.1080/14737175.2018.1481390 (2018).
CAS
Статья
PubMed
Google Scholar
Macció, D. R., Calfa, G. & Roth, G. A. Пероральный тестостерон у самцов крыс и развитие экспериментального аутоиммунного энцефаломиелита. НейроиммуноМодуляция 12 , 246–254.https://doi.org/10.1159/000085656 (2005).
CAS
Статья
PubMed
Google Scholar
Габбелс Бапп, М. Р. и Йоргенсен, Т. Н. Андроген-индуцированная иммуносупрессия. Фронт. Иммунол. 9 ,794. https://doi.org/10.3389/fimmu.2018.00794 (2018).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Палашински, К.М., Лоо, К. К., Ашури, Дж. Ф., Лю, Х. Б. и Воскул, Р. Р. Андрогены обладают защитным действием при экспериментальном аутоиммунном энцефаломиелите: последствия для рассеянного склероза. J. Neuroimmunol. 146 , 144–152. https://doi.org/10.1016/j.jneuroim.2003.11.004 (2004).
CAS
Статья
PubMed
Google Scholar
Ходжсон, Ю. М. и де Крецер, Д. М. Ответ сывороточного тестостерона на однократную инъекцию ХГЧ овечьего ЛГ и ЛГРГ самцам крыс. Внутр. Дж. Андрол. 5 , 81–91. https://doi.org/10.1111/j.1365-2605.1982.tb00236.x (1982).
CAS
Статья
PubMed
Google Scholar
Tremblay, Y. & Belanger, A. Изменения уровней стероидов в плазме после однократного введения ХГЧ или аналога агониста ЛГРГ собакам и крысам. J. Steroid Biochem. 22 , 315–320. https://doi.org/10.1016/0022-4731(85)-7 (1985).
CAS
Статья
PubMed
Google Scholar
Анакве, О. О., Мерфи, П. Р. и Могер, В. Х. Характеристика участков связывания бета-адренорецепторов на клетках Лейдига грызунов. Biol. Репродукция. 33 , 815–826. https://doi.org/10.1095/biolreprod33.4.815 (1985).
CAS
Статья
PubMed
Google Scholar
Андрич, С. А., Янич, М. М., Стойков, Н. Дж. И Костич, Т. С. Протеинкиназа G-опосредованная стимуляция базального стероидогенеза клеток Лейдига. Am. J. Physiol.-Endocrinol. Метаб. 293 , E1399 – E1408. https://doi.org/10.1152/ajpendo.00482.2007 (2007).
CAS
Статья
PubMed
Google Scholar
Jakovljevic, M. et al. Подавление NTPDase2 и ADP-чувствительных пуриноцепторов P2 коррелирует с тяжестью симптомов экспериментального аутоиммунного энцефаломиелита. Фронт. Клетка. Neurosci. 11 , 333.https://doi.org/10.3389/fncel.2017.00333 (2017).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Херрманн, М., Шолмерих, Дж. И Штрауб, Р. Х. Влияние цитокинов и факторов роста на отдельные стероидогенные ферменты in vitro: сборник коротких табличных данных. Ann. Акад. Sci. 966 , 166–186. https://doi.org/10.1111/j.1749-6632.2002.tb04213.x (2002).
ADS
CAS
Статья
PubMed
Google Scholar
Шарп Р. М., Доначи К. и Купер И. Повторная оценка интратестикулярного уровня тестостерона, необходимого для количественного поддержания сперматогенеза у крыс. J. Endocrinol. 117 , 19–26. https://doi.org/10.1677/joe.0.1170019 (1988).
CAS
Статья
PubMed
Google Scholar
Зиркин, Б. Р., Сантулли, Р., Авони, К. А. и Юинг, Л. Л. Поддержание передовых сперматогенных клеток в семенниках взрослых крыс: количественная зависимость от концентрации тестостерона в семенниках. Эндокринология 124 , 3043–3049. https://doi.org/10.1210/endo-124-6-3043 (1989).
CAS
Статья
PubMed
Google Scholar
Ivell, R., Wade, J. D. & Anand-Ivell, R. INSL3 как биомаркер функциональности клеток Лейдига. Biol. Репродукция. 88 , 147. https://doi.org/10.1095/biolreprod.113.108969 (2013).
Артикул
PubMed
Google Scholar
Bay, K. et al. Уровни инсулиноподобного фактора 3 в сыворотке у 135 нормальных мужчин и 85 мужчин с заболеваниями яичек: связь с осью лютеинизирующий гормон-тестостерон. J. Clin. Эндокринол. Метаб. 90 , 3410–3418. https://doi.org/10.1210/jc.2004-2257 (2005).
CAS
Статья
PubMed
Google Scholar
Catt, K. J. & Dufau, M. L. In Receptors and Hormone Action (eds Lutz, B.И O’Malley, B. W.) 291–339 (Academic Press, 1978).
Google Scholar
Russell, L.D. et al. Структурные изменения в клетках Лейдига крыс после гипофизэктомии: морфометрические и эндокринные исследования. Эндокринология 131 , 498–508. https://doi.org/10.1210/endo.131.1.1612031 (1992).
CAS
Статья
PubMed
Google Scholar
Hanour, F., Sanchez, P., Cathiard, A.M. & Saez, J.M. Регулирование рецептора гонадотропина в гипофизэктомированных клетках Лейдига крыс. Biochem. Биофиз. Res. Commun. 81 , 547–551. https://doi.org/10.1016/0006-291x(78)91569-3 (1978).
CAS
Статья
PubMed
Google Scholar
Кини, Д. С., Мендис-Хандагама, С. М., Зиркин, Б. Р. и Юинг, Л. Л. Влияние длительного лишения лютеинизирующего гормона на объем клеток Лейдига, количество клеток Лейдига и стероидогенную способность семенников крысы. Эндокринология 123 , 2906–2915. https://doi.org/10.1210/endo-123-6-2906 (1988).
CAS
Статья
PubMed
Google Scholar
Stocco, D. M., Teerds, K. J., van Noort, M. & Rommerts, F. F. Влияние гипофизэктомии и хорионического гонадотропина человека на функцию клеток Лейдига у зрелых крыс. J. Endocrinol. 126 , 367–375. https://doi.org/10.1677/joe.0.1260367 (1990).
CAS
Статья
PubMed
Google Scholar
Винг, Т. Ю., Юинг, Л. Л. и Зиркин, Б. Р. Влияние отмены лютеинизирующего гормона на гладкий эндоплазматический ретикулум клеток Лейдига и стероидогенные реакции, которые превращают прегненолон в тестостерон. Эндокринология 115 , 2290–2296. https://doi.org/10.1210/endo-115-6-2290 (1984).
CAS
Статья
PubMed
Google Scholar
Клайнфельтер, Г. Р., Холл, П. Ф. и Юинг, Л. Л. Влияние лишения лютеинизирующего гормона in situ на стероидогенез клеток Лейдига крыс, очищенных с помощью многоступенчатой процедуры. Biol. Репродукция. 36 , 769–783. https://doi.org/10.1095/biolreprod36.3.769 (1987).
CAS
Статья
PubMed
Google Scholar
Payne, AH & Sha, LL. Множественные механизмы регуляции 3 бета-гидроксистероиддегидрогеназы / дельта 5 –– дельта 4-изомеразы, 17 альфа-гидроксилазы / C17-20 лиазы цитохрома P450 и холестериновой боковой цепи расщепление уровней рибонуклеиновой кислоты цитохрома P450 в первичных культурах клеток Лейдига мыши. Эндокринология 129 , 1429–1435. https://doi.org/10.1210/endo-129-3-1429 (1991).
CAS
Статья
PubMed
Google Scholar
Пейн, А. Х. и Янгблад, Г. Л. Регулирование экспрессии стероидогенных ферментов в клетках Лейдига. Biol. Репродукция. 52 , 217–225. https://doi.org/10.1095/biolreprod52.2.217 (1995).
CAS
Статья
PubMed
Google Scholar
Кини, Д. С. и Мейсон, Дж. И. Экспрессия тестикулярной 3 бета-гидроксистероид дегидрогеназы / дельта 5-4-изомеразы: регулирование лютеинизирующим гормоном и форсколином в клетках Лейдига взрослых крыс. Эндокринология 130 , 2007–2015. https://doi.org/10.1210/endo.130.4.1312436 (1992).
CAS
Статья
PubMed
Google Scholar
Hedger, M. P. Макрофаги и иммунная реакция яичка. J. Reprod. Иммунол. 57 , 19–34. https://doi.org/10.1016/s0165-0378(02)00016-5 (2002).
CAS
Статья
PubMed
Google Scholar
Frungieri, M. B. et al. Число, характер распределения и идентификация макрофагов в семенниках бесплодных мужчин. Fertil. Стерил. 78 , 298–306. https://doi.org/10.1016/s0015-0282(02)03206-5 (2002).
Артикул
PubMed
Google Scholar
Rival, C. et al. Функциональные и фенотипические характеристики макрофагов яичек при экспериментальном аутоиммунном орхите. J. Pathol. 215 , 108–117. https://doi.org/10.1002/path.2328 (2008).
CAS
Статья
PubMed
Google Scholar
Gerdprasert, O. et al. Ответ лейкоцитов яичек на воспаление, вызванное липополисахаридами: дополнительные доказательства гетерогенности популяции макрофагов яичек. Cell Tissue Res. 308 , 277–285. https://doi.org/10.1007/s00441-002-0547-6 (2002).
CAS
Статья
PubMed
Google Scholar
Орава, М., Воутилайнен, Р. и Вихко, Р. Интерферон-гамма ингибирует стероидогенез и накопление мРНК стероидогенных ферментов P450scc и P450c17 в культивируемых клетках Лейдига свиней. Mol. Эндокринол. 3 , 887–894. https: // doi.org / 10.1210 / mend-3-6-887 (1989).
CAS
Статья
PubMed
Google Scholar
Гусман, К., Эрнандес-Белло, Р. и Моралес-Монтор, Дж. Регулирование стероидогенеза в репродуктивных, надпочечников и нервных тканях цитокинами. Открытый нейроэндокринол. J. 3 , 2 (2010).
Google Scholar
Тернбулл, А. В. и Ривье, К.Подавление секреции тестостерона, индуцированной гонадотропином, путем интрацеребровентрикулярной инъекции интерлейкина-1 бета самцам крыс. Эндокринология 138 , 1008–1013. https://doi.org/10.1210/endo.138.3.5019 (1997).
CAS
Статья
PubMed
Google Scholar
Ривье, С. Ингибирующее действие нейрогенных и иммунных стрессоров на секрецию тестостерона у крыс. Нейроиммуномодуляция 10 , 17–29.https://doi.org/10.1159/000064411 (2002).
CAS
Статья
PubMed
Google Scholar
O’Bryan, M.K., Schlatt, S., Phillips, D.J., de Kretser, D.M. & Hedger, M.P. Воспаление, вызванное бактериальным липополисахаридом, нарушает функцию яичек на нескольких уровнях in vivo. Эндокринология 141 , 238–246. https://doi.org/10.1210/endo.141.1.7240 (2000).
CAS
Статья
PubMed
Google Scholar
Hodgson, Y. M. & de Kretser, D. M. Ответ тестостерона у крипторхических и гипофизэктомированных крыс на стимуляцию хорионического гонадотропина человека (ХГЧ). Aust. J. Biol. Sci. 38 , 445–455. https://doi.org/10.1071/bi9850445 (1985).
CAS
Статья
PubMed
Google Scholar
Manna, P. R., Wang, X. J. & Stocco, D. M. Участие множественных факторов транскрипции в регуляции экспрессии гена стероидогенного острого регуляторного белка. Стероиды 68 , 1125–1134. https://doi.org/10.1016/j.steroids.2003.07.009 (2003).
CAS
Статья
PubMed
Google Scholar
Лавуа, Х. А. и Кинг, С. Р. Регуляция транскрипции стероидогенных генов: STARD1, CYP11A1 и HSD3B. Exp. Биол. Med. 234 , 880–907. https://doi.org/10.3181/0903-mr-97 (2009).
CAS
Статья
Google Scholar
Хейлз, Д. Б., Ша, Л. и Пейн, А. Х. Тестостерон ингибирует цАМФ-индуцированный синтез цитохрома Р-450 (17 альфа) клеток Лейдига по механизму, опосредованному рецепторами андрогенов. J. Biol. Chem. 262 , 11200–11206 (1987).
CAS
Статья
Google Scholar
Burgos-Trinidad, M. et al. Репрессия цАМФ-индуцированной экспрессии мышиного гена альфа-гидроксилазы P450 17 / лиазы C17-20 (Cyp17) андрогенами. Mol. Эндокринол. 11 , 87–96. https://doi.org/10.1210/mend.11.1.9871 (1997).
CAS
Статья
PubMed
Google Scholar
Landschulz, KT, Pathak, RK, Rigotti, A., Krieger, M. & Hobbs, HH Регулирование рецептора скавенджера, класс B, тип I, рецептор липопротеинов высокой плотности, в печени и стероидогенных тканях крыса. J. Clin. Расследование. 98 , 984–995.https://doi.org/10.1172/jci118883 (1996).
CAS
Статья
PubMed
Google Scholar
Reaven, E., Zhan, L., Nomoto, A., Leers-Sucheta, S. & Azhar, S. Экспрессия и микровиллярная локализация рецепторов скавенджера класса B, типа I (SR-BI) и селективное поглощение сложного холестерилового эфира клетками Лейдига из семенников крысы. J. Lipid Res. 41 , 343–356 (2000).
CAS
Статья
Google Scholar
Metzger-Peter, K. et al. Исследование TOTEM RRMS (лечение тестостероном нейропротекции и восстановление миелина при рецидивирующем ремиттирующем рассеянном склерозе): протокол рандомизированного двойного слепого плацебо-контролируемого исследования. Испытания 21 , 591–591. https://doi.org/10.1186/s13063-020-04517-6 (2020).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Курт, Ф. et al. Нейропротективные эффекты лечения тестостероном у мужчин с рассеянным склерозом. NeuroImage. Clin. 4 , 454–460. https://doi.org/10.1016/j.nicl.2014.03.001 (2014).
Артикул
PubMed
PubMed Central
Google Scholar
Регуляция стероидогенеза, развития и дифференцировки клеток с помощью стероидогенного фактора-1 и гомолога-1 печеночных рецепторов
ВВЕДЕНИЕ
Ядерные рецепторы (NR) относятся к большому суперсемейству факторов транскрипции, которые необходимы для различных физиологических явлений ( Mangelsdorf et al., 1995; Робинсон-Речави и др., 2003). Они активируются липофильным лиганд-зависимым образом в ответ на стимуляцию стероидными гормонами, гормонами щитовидной железы, витаминами и различными липидами. Помимо таких типичных классов, NR включают орфанные рецепторы, лиганды которых не были идентифицированы. Некоторые орфанные NR конститутивно активируются лиганд-независимым образом; стероидогенный фактор-1 (SF-1) и гомолог рецептора печени-1 (LRH-1) являются двумя такими рецепторами и являются членами подсемейства NR5A (SF-1 — это NR5A1, а LRH-1 — это NR5A2) вместе с Drosophila FTZ-F1 (NR5A3) (Fayard et al., 2004; Ли и Мур, 2008; Паркер и Шиммер, 1997; Schimmer and White, 2010) (рис. 1А). Оба фактора транскрипции играют важную роль в контроле эндокринных функций различных тканей. Из них регуляция стероидогенеза является одной из наиболее важных ролей для обоих факторов. В частности, SF-1 был первоначально идентифицирован как фактор транскрипции, который необходим для транскрипции генов стероидогенных ферментов.
Надпочечники и гонады являются основными стероидогенными органами у млекопитающих и других амниот (Miller, 1988; Miller and Auchus, 2011).Органические стероидные гормоны участвуют в различных физиологических явлениях. Стероиды надпочечников (глюкокортикоиды и минералокортикоиды) необходимы для метаболизма глюкозы, реакции на стресс, иммунитета и баланса жидкости / электролитов. Гонадные половые стероиды (андрогены и эстрогены) важны для дифференциации пола и размножения. Прогестерон яичников необходим при овуляции и беременности. Стероидные гормоны синтезируются из холестерина, который доставляется во внутренние компартменты митохондрий стероидогенным острым регуляторным белком (StAR) (Papadopoulos and Miller, 2012; Stocco, 1997, 2000).Холестерин превращается в прегненолон ферментом расщепления боковой цепи P450 (P450scc / CYP11A1 / Cyp11a1), ферментом, ограничивающим скорость синтеза всех стероидных гормонов (Miller, 2008; Papadopoulos and Miller, 2012). После этого тканеспецифичные гидроксилазы P450 и гидроксистероиддегидрогеназы катализируют реакции, которые продуцируют тканеспецифические стероидные гормоны (Miller, 1988, 2008; Miller and Auchus, 2011).
Хорошо известно, что SF-1 и LRH-1 участвуют в транскрипции генов, связанных со стероидогенезом (Fayard et al., 2004; Ли и Мур, 2008; Паркер и Шиммер, 1997; Шиммер и Уайт, 2010; Wang et al., 2001; Ядзава и др., 2014; Yazawa et al., 2011) и что на стероидогенез заметно влияет дефицит любого из факторов (Duggavathi et al., 2008; Jeyasuria et al., 2004; Pelusi et al., 2008; Zhang et al., 2013). Также известно, что SF-1 участвует в развитии стероидогенных органов (Luo et al., 1994; Parker and Schimmer, 1997) и дифференцировке стероидогенных клеток (Yazawa et al., 2014; Yazawa et al., 2009; Ядзава и др., 2006). По этим причинам SF-1 давно известен как главный регулятор стероидогенеза. Совсем недавно ряд групп, включая нашу, показали, что LRH-1 является еще одним главным регулятором стероидогенеза (Bouguen et al., 2015; Yazawa et al., 2009; Yazawa et al., 2011; Zhang et al., 2013). В настоящем обзоре описывается открытие SF-1 и LRH-1, их роли в явлениях, связанных со стероидогенезом, а также их функциональные различия.
Рис. 1.
Схематическая структура SF-1 и LRH-1.DBD, Hinge и LBD представляют собой ДНК-связывающий домен, шарнирную область и лиганд-связывающий домен соответственно. Черные прямоугольники C-конца показывают мотив AF-2. Проценты указывают на уровни идентичности аминокислот между каждой областью белков человека. Яичниковый LRH-1 отличается от печеночной формы только N-концевым доменом (белые прямоугольники).
Таблица 1.
Гены-мишени SF-1 и LRH-1, которые участвуют в стероидогенезе.
Общие характеристики SF-1 и LRH-1
Ранние исследования продемонстрировали, что промоторные области нескольких генов стероидгидроксилазы цитохрома P450 включают AGGTCA-подобный мотив (последовательность Ad4), который необходим для их транскрипции в стероидогенных клетках (Honda et al. al., 1990; Райс и др., 1991). Кейт Паркер и Кен Морохаши независимо идентифицировали фактор транскрипции в надпочечниках мышей и быков, который связывается с этим мотивом (Lala et al., 1992; Morohashi et al., 1992). Поскольку этот фактор транскрипции придает промоторную активность генам стероид-гидроксилазы P450 в нестероидогенных клетках, они соответственно назвали его стероидогенным фактором-1 (SF-1) / адреналиновым 4-связывающим белком (Ad4BP). В соответствии с этой ролью обнаружение SF-1 / Ad4BP у взрослых выявило его экспрессию в трех слоях коры надпочечников (zona reticularis, zona fasciculata и zona glomerulosa), клетках Лейдига и Сертоли яичек, теке яичника, клетках гранулезы (GCs ) и в меньшей степени в желтом теле (Hatano et al., 1994; Икеда и др., 1993; Kawabe et al., 1999). На основании этих результатов Паркер и Морохаши пришли к выводу, что SF-1 / Ad4BP является определяющим фактором для клеточно-специфической экспрессии генов стероид-гидроксилазы цитохрома P450. В соответствии с этой гипотезой SF-1 / Ad4BP регулирует транскрипцию всех генов стероид-гидроксилазы цитохрома P450 (Carlone and Richards, 1997; Guo et al., 2003; Hanley et al., 2001; Hu et al., 2001; Lala et al., 2001; Lala et al. др., 1992; Лин и др., 2001; Линч и др., 1993; Майкл и др., 1995; Морохаши и др., 1993; Шиммер и Паркер, 1992; Wang et al., 2000; Ye et al., 2009; Zhang and Mellon, 1996) (Таблица 1). Кроме того, транскрипция различных генов, связанных со стероидогенезом, регулируется SF-1 / Ad4BP, таких как переносчики холестерина (Cao et al., 1997; Caron et al., 1997; Sugawara et al., 1996), гидроксистероиддегидрогеназа (Leers -Sucheta et al., 1997) и переносчиков электронов (Huang et al., 2005; Imamichi et al., 2013, 2014) (Таблица 1).
LRH-1 был впервые обнаружен в печени мышей как фактор транскрипции, регулирующий транскрипцию α-фетопротеина (Becker-Andre et al., 1993; Galarneau et al., 1996). LRH-1 контролирует гликолиз, а также гомеостаз холестерина и желчных кислот, регулируя транскрипцию различных генов, таких как глюкокиназа (Oosterveer et al., 2012), SR-BI (Schoonjans et al., 2002), CYP7A1 и CYP8B1 (Goodwin et al., 2000; Lu et al., 2000). Помимо печени, LRH-1 высоко экспрессируется в тканях энтодермального происхождения (поджелудочная железа и кишечник) и участвует в метаболизме, воспалении и обновлении стволовых клеток (Benod et al., 2011; Botrugno et al., 2004; Косте и др., 2007; Fayard et al., 2003; Фернандес-Маркос и др., 2011; Lazarus et al., 2012). LRH-1 также экспрессируется в клетках Лейдига семенников и яичниковых ГК и регулирует транскрипцию генов, связанных со стероидогенезом (Peng et al., 2003; Pezzi et al., 2004; Yazawa et al., 2009; Yazawa et al., 2010). В частности, уровни экспрессии LRH-1 более высоки в яичниках, чем в любой другой ткани (Bookout et al., 2006; Kanno et al., 2014). Недавно было показано, что LRH-1 яичника представляет собой уникальную изоформу, которая имеет усеченный N-концевой домен (Kawabe et al., 2013) (рис.1). Хотя функциональные различия между обеими изоформами неясны, их экспрессия контролируется полностью отличительной регуляцией транскрипции (Kawabe et al., 2013; Zhang et al., 2001). LRH-1 может заменять SF-1 в производстве прогестерона желтым телом (CL) для поддержания беременности (Zhang et al., 2013). Он также экспрессируется в эмбриональных стволовых (ES) клетках и регулирует экспрессию центральных факторов самообновления Oct-3/4 и Nanog (Gu et al., 2005; Mullen et al., 2007; Wagner et al., 2010). Интересно, что LRH-1 увеличивает эффективность репрограммирования соматических клеток в индуцированные плюрипотентные стволовые (iPS) клетки (Guo and Smith, 2010; Heng et al., 2010; Wang et al., 2011).
SF-1 / Ad4BP и LRH-1 принадлежат к одному подсемейству NR и имеют много общих структурных и функциональных характеристик. Оба белка содержат структурные домены типичных NR, ДНК-связывающий домен цинкового пальца, промежуточную шарнирную область и предполагаемый лиганд-связывающий домен на карбоксильном конце, хотя в SF-1 отсутствует N-концевой домен, содержащий мотив AF-1 ( Инжир.1). Было высказано предположение, что длинная шарнирная область проявляет AF-1-подобную активационную активность (Hammer et al., 1999; Li et al., 1999). Поскольку их ДНК-связывающие домены особенно похожи (рис.1), SF-1 и LRH-1 эффективно распознают одну и ту же последовательность ДНК, YCAAGGYCR (Y представляет собой пиримидин, а R представляет собой пурин) в регуляторных элементах генов-мишеней ( Fayard et al., 2003). Таким образом, оба фактора обычно регулируют транскрипцию одних и тех же генов. Это явление также применимо к генам, связанным со стероидогенезом, включая стероид-гидроксилазы цитохрома P450 (Kim et al., 2005; Pezzi et al., 2004; Wang et al., 2001; Ядзава и др., 2009; Yazawa et al., 2010; Yazawa et al., 2011), переносчики холестерина (Kim et al., 2004; Schoonjans et al., 2002), гидроксистероиддегидрогеназа (Peng et al., 2003) и переносчик электронов (Imamichi et al., 2013) (Таблица 1 ). Таким образом, в дополнение к SF-1 можно предположить, что LRH-1 также работает как определяющий фактор в клеточно-специфической экспрессии генов, связанных со стероидогенезом. В поддержку этого мнения, SF-1 и LRH-1 имеют общие функции в других явлениях, таких как регуляция транскрипции Oct-3/4 (Barnea and Bergman, 2000; Gu et al., 2005) и генерации iPS-клеток (Guo, Smith, 2010; Heng et al., 2010).
Участие SF-1 и LRH-1 в развитии и стероидогенезе гонад и надпочечников
Потребность в SF-1 в развитии стероидогенных органов была продемонстрирована in vivo с использованием различных генно-ориентированных моделей. SF-1-нокаутные (KO) мыши умирают от дефицита глюкокортикоидов вскоре после рождения и демонстрируют смену пола от мужчины к женщине в наружных гениталиях (Luo et al., 1994; Sadovsky et al., 1995). Эти фенотипы вызваны полной потерей гонад и надпочечников. Хотя развитие гонад и надпочечников инициируется без SF-1, они регрессируют посредством апоптотической гибели клеток во время последующей стадии развития, возможно, из-за нарушения гликолиза и пентозофосфатного пути (Baba et al., 2014). У мышей SF-1-KO, поскольку гонады исчезают до выработки антимюллерова гормона и тестостерона, которые необходимы для индукции мужской половой дифференциации, внутренние и внешние мочеполовые пути относятся к женскому типу, даже в генетическом отношении. самцы.Гетерозиготные мыши KO также обнаруживают уменьшение объема надпочечников, что связано с нарушением выработки кортикостерона в ответ на стресс (Bland et al., 2004; Bland et al., 2000; Fatchiyah et al., 2006). Эти модели мышей KO демонстрируют, что SF-1 функционирует как главный регулятор в развитии стероидогенных органов in vivo. В соответствии с фенотипом мышей KO у пациентов с мутациями в гене SF-1 наблюдаются дефекты гонад и надпочечников (Achermann et al., 1999; Ferraz-de-Souza et al., 2011; Hasegawa et al., 2004; Lourenco et al., 2009). Помимо стероидогенных органов, мутации гена SF-1 и KO приводят к дефектам гонадотрофов гипофиза (Ingraham et al., 1994; Shinoda et al., 1995; Zhao et al., 2001), вентромедиального гипоталамуса (Ikeda et al. , 1995; Shinoda et al., 1995; Zhao et al., 2008) и селезенки (Morohashi et al., 1999; Zangen et al., 2014).
На тканеспецифичных моделях КО было показано, что SF-1 играет важную роль в стероидогенезе и других гомеостатических процессах, следующих за развитием органов.У мышей KO, специфичных для клеток Лейдига, наблюдаются заметные снижения экспрессии тестикулярных звездочек и Cyp11a1, что указывает на дефект продукции тестостерона (Jeyasuria et al., 2004). В соответствии с этой гипотезой, семенники не могут опускаться (андроген-зависимый процесс развития) и гипопластичны. У GC-специфичных мышей KO имеются многочисленные дефекты яичников (Pelusi et al., 2008). У этих мышей яичники гипопластичны, взрослые особи стерильны, а в яичниках наблюдается пониженное количество ооцитов. Вызванная гонадотропином продукция эстрогена и прогестерона также заметно снижена в этой модели.Эти данные показывают, что экспрессия SF-1 важна в стероидогенных органах на протяжении всей жизни.
Полное устранение LRH-1 вызывает серьезное снижение уровней экспрессии Oct-3/4 и эмбриональный летальный фенотип примерно на 6,5-7,5 эмбриональных днях (Gu et al., 2005; Pare et al., 2004). Функции LRH-1 in vivo дополнительно были выявлены путем изучения гетерозиготных и тканеспецифичных моделей KO. У гетерозиготных мышей Lrh-1 KO аномалии гонадного стероидогенеза проявляются как у самцов, так и у самок (Labelle-Dumais et al., 2007; Volle et al., 2007). У мужчин выработка тестостерона в яичках снижается за счет снижения экспрессии генов, связанных со стероидогенезом, таких как Star, Cyp11a1 и Hsd3b (Volle et al., 2007). Соответственно, эпидидимиды и семенные пузырьки у этих мышей имеют меньший вес, чем у мышей дикого типа. У женщин наблюдается снижение выработки прогестерона лютеиновыми клетками, что приводит к субфертильному фенотипу (Labelle-Dumais et al., 2007). Важность LRH-1 в воспроизводстве самок была дополнительно подтверждена Мерфи и его коллегами с использованием моделей GC- и CL-KO (Bertolin et al., 2014; Дуггавати и др., 2008; Zhang et al., 2013). Мыши GC-KO бесплодны из-за ановуляции и нарушения выработки прогестерона из-за неэффективности лютеинизации (Bertolin et al., 2014; Duggavathi et al., 2008). Однако, несмотря на то, что мыши CL-KO овулируют нормально, они бесплодны из-за неудачной имплантации, вызванной дефицитом выработки прогестерона (Zhang et al., 2013). Таким образом, в дополнение к SF-1, LRH-1 также необходим для стероидогенеза в некоторых тканях во время постнатальной жизни.
Дифференциация стволовых клеток в стероидогенные с помощью SF-1 и LRH-1
В поддержку фенотипов генно-целевых моделей мы продемонстрировали, что SF-1 и LRH-1 индуцируют дифференцировку нестероидогенных стволовых клеток в стероидогенные клетки (Miyamoto et al., 2011; Yazawa et al., 2014; Yazawa et al., 2009; Yazawa et al., 2010; Yazawa et al., 2011; Yazawa et al., 2006; Yazawa et al., 2008) (рис.2). Среди различных типов стволовых клеток мы сосредоточились на мезенхимальных стволовых клетках (МСК).МСК — это мультипотентные соматические стволовые клетки, происходящие из мезодермы, как и в случае со стероидогенными органами. Они определяются как прикрепленные к фибробластам клетки, которые могут дифференцироваться в остеобласты, адипоциты и хондроциты (рис. 2), хотя они также могут генерировать клетки всех трех зародышевых листков, по крайней мере, in vitro (Gojo and Umezawa, 2003; Prockop, 1997; Toyoda et al., 2007). МСК были первоначально выделены из костного мозга (BM-MSC) Friedenstein et al. (Friedenstein et al., 1976) и были обнаружены в жире, плаценте, пуповинной крови и других тканях (Hass et al., 2011; Коде и др., 2009). Поскольку они могут быть источником клонов соединительной ткани in vivo, вполне вероятно, что МСК присутствуют в большинстве органов по всему телу.
Рис. 2.
Индукция стероидогенных клеток гонад и надпочечников из мультипотентных МСК. С помощью цАМФ и SF-1, и LRH-1 независимо друг от друга обладают способностью дифференцировать МСК в стероидогенные клетки.
Чтобы изучить возможность дифференцировки в стероидогенные клетки, BM-MSC крысы трансплантировали в незрелые семенники на той же стадии, когда взрослые клетки Лейдига начинают дифференцироваться от стволовых / предшественников мезенхимальных клеток (Yazawa et al., 2006). Через несколько недель трансплантированные МСК колонизировали интерстициальные пространства семенников реципиента и экспрессировали маркеры клеток Лейдига, такие как Cyp11a1, Hsd3b1 и Cyp17a1. Используя метод сортировки промоторов с промотором CYP11A1 человека (последовательности генома, которые регулируют клеточно-специфическую экспрессию гена CYP11A1 в стероидогенных клетках гонад и надпочечников), мы продемонстрировали, что некоторые изолированные BM-MSC мыши спонтанно дифференцируются в клетки, экспрессирующие стероидогенные ферменты (Yazawa и другие., 2006). Эти результаты показывают, что МСК обладают способностью дифференцироваться в стероидогенные клетки как in vivo, так и in vitro. Кроме того, стабильная трансфекция SF-1 и обработка цАМФ индуцируют дифференцировку всех МСК мыши в Cyp11a1-положительные стероидогенные клетки. Эти клетки экспрессируют различные стероидогенные ферменты и вырабатывают прогестерон и тестостерон. С помощью этого метода также можно дифференцировать человеческие BM-MSC в клетки, продуцирующие кортизол, в ответ на стимуляцию адренокортикотропным гормоном, которые аналогичны клеткам фасцикулярной оболочки надпочечников.Кроме того, BM-MSC трансформируются в стероидогенные клетки посредством опосредованной аденовирусом временной экспрессии SF-1 (Mizutani et al., 2010; Tanaka et al., 2007; Wei et al., 2012; Yanase et al., 2006). Эти исследования согласуются с концепцией, что SF-1 является главным регулятором стероидогенеза. Помимо SF-1, введение LRH-1 также эффективно индуцирует дифференцировку BM-MSCs в стероидогенные клетки без SF-1 (Yazawa et al., 2009; Yazawa et al., 2011). В клетках, продуцирующих LRH-1, уровни экспрессии стероидогенных ферментов и продукции стероидных гормонов были сравнимы с таковыми в клетках, введенных SF-1, что позволяет предположить, что LRH-1 может быть еще одним главным регулятором в стероидогенезе.Фактически, такие ситуации, вероятно, возникают в ХЛ и эпителиальных клетках кишечника (IEC). Эти клетки синтезируют прогестерон или глюкокортикоид, и хотя экспрессия SF-1 практически не определяется (Mueller et al., 2007; Peng et al., 2003; Ramayya et al., 1997), LRH-1 экспрессируется высоко (Mueller et al., др., 2007; Peng et al., 2003). Таким образом, можно предположить, что стероидогенез CL и lECs зависит исключительно от LRH-1, гипотеза, которая подтверждается неупорядоченным стероидогенезом этих клеток у условных мышей KO (Coste et al., 2007; Zhang et al., 2013).
Как и в случае с BM-MSC, MSC, полученные из других тканей, можно дифференцировать в стероидогенные клетки с использованием вышеуказанных методов (Gondo et al., 2008; Wei et al., 2012; Yazawa et al., 2014; Yazawa et al., др., 2010). Однако эти методы неприменимы к плюрипотентным стволовым клеткам, таким как ES-клетки, iPS-клетки и клетки эмбриональной карциномы, поскольку SF-1 и LRH-1 цитотоксичны для этих клеток (Yazawa et al., 2011; Yazawa et al. , 2006). В одном из ранних исследований Crawford et al.также сообщили, что, хотя эктопическая экспрессия SF-1 лишь изредка индуцирует экспрессию гена Cyp11a1 в ES-клетках, эти клетки не синтезируют стероидный гормон из-за отсутствия переносчика холестерина (Crawford et al., 1997; Yazawa et al., 2006 г.). Эти явления вероятны из-за свойств LRH-1, которые важны для экспрессии Oct-3/4 в этих клетках (Gu et al., 2005). Уровни экспрессии Oct-3/4 должны быть постоянными, чтобы поддерживать недифференцированный статус плюрипотентных стволовых клеток (Niwa et al., 2000). Избыточная экспрессия LRH-1 (или эктопическая экспрессия SF-1) может заметно влиять на уровни экспрессии Oct-3/4 (Gu et al., 2005; Heng et al., 2010). Таким образом, можно сделать вывод, что эти факторы затрудняют прямую индукцию стероидогенных клеток из плюрипотентных стволовых клеток. Однако мышиные ES-клетки действительно дифференцируются в клетки коры надпочечников, когда они предварительно дифференцируются в МСК путем импульсной обработки ретиноевой кислотой перед экспрессией SF-1 (Yazawa et al., 2011). Эти результаты показывают, что МСК являются очень полезными инструментами для индукции стероидогенных клеток с использованием белков подсемейства NR5A. Наши результаты также предполагают, что плюрипотентные стволовые клетки могут дифференцироваться в стероидогенные клетки с помощью этих факторов после предварительной дифференцировки в мезодермальный клон. В соответствии с этой гипотезой было продемонстрировано Sonoyama et al. что человеческие ES- и IPS-клетки могут дифференцироваться в продуцирующие кортизол клетки путем экспрессии SF-1 только после предварительной дифференцировки в мезодермальные клетки (Sonoyama et al., 2012). Кроме того, Jameson и его коллеги сообщили, что предварительный отбор или образование EB необходимы для дифференциации введенных SF-1 ES клеток мыши в клетки, продуцирующие половые стероиды (Jadhav and Jameson, 2011).
(PDF) Схема путей стероидогенеза человека
Wikiversity Journal of Medicine, 2014, 1 (1)
doi: 10.15347 / wjm / 2014.005
Рисунок Статья
Схема путей человеческого стероидогенеза
Mikael Häggström, 1,2 * Stannered, 3 Hoffmeier, 3 Settersr, 3 и Richfield3
Введение
Стероидогенез — это биологический процесс, с помощью которого
стероидов вырабатываются из холестерина, а
трансформируются в другие стероиды.[1]
Ниже приводится список основных классов стероидных гормонов
и некоторых известных членов с примерами
основных связанных функций:
• Прогестагены
oПрогестерон, который регулирует циклические изменения
эндометрия матки и
поддержание беременности
• Минералокортикоиды
oАльдостерон, который способствует регуляции артериального давления
• Глюкокортикоиды
o Кортизол, функции которого включают повышение уровня сахара в крови
и действие как иммунодепрессант
• Андрогены
o Тестостерон, который способствует развитию
и поддержанию мужского вторичного пола
Характеристики
• Эстрогены
эстроген, который способствует развитию и поддержанию
женский вторичный пол
характеристика
Рисунок | (Март 2007 г.) Предыдущее изображение: Stannered.
Обзор путей, по которым вырабатываются эти стероиды
, можно получить с помощью диаграммы.
Методы
Создание диаграммы стероидогенеза было
, по сути, работой нескольких авторов, которая была сделана
доступной благодаря лицензированию изображений, то есть
GNU Free Documentation License и Creative
Commons. С помощью этих лицензий предыдущие версии
можно было редактировать и улучшать без обращения
за письменным разрешением каждый раз, когда такое редактирование
было сделано.
Справа представлена подборка изображений, которые можно рассматривать как вехи в развитии диаграммы стероидогенеза
. Им даны хронологические номера
, а окончательной версии —
под номером «Рисунок 5» в разделе результатов. Рисунок
4 используется для упрощения создания последующих работ, поскольку
представляет собой векторное изображение, то есть изображение, основанное на нескольких настраиваемых точках
в пространстве, а не на миллионах
пикселей.Следовательно, последующие производные
могут быть легко отредактированы бесплатными редакторами векторной графики, в этом случае
Inkscape. По сравнению с рис. 4, окончательная версия
на рис. 5 имела следующие дополнения:
Группировка по основным классам стероидов. На этом этапе
использовался учебник «Медицинская физиология» by Boron
& Boulpaep [2] в качестве ссылки, а также для
подтверждения существующих молекулярных структур, ферментов
и продуктов.Кроме того, за отсутствие
конверсии кортикостерона
IJMS | Бесплатный полнотекстовый | Стероидогенез в периферических и переходных зонах ткани рака предстательной железы человека
1. Введение
Предстательная железа состоит из периферической, переходной, центральной и фибромышечной зон, каждая из которых составляет 70%, 5%, 25% и 1]. Каждая зона отличается в зависимости от происхождения, функции и гистологии [2]. Периферическая зона (PZ) и переходная зона (TZ) являются двумя основными участками развития рака простаты, где примерно 70% аденокарцином простаты обычно формируются в PZ, а 25% из них образуются в TZ [1,2].Опухоли, развивающиеся в TZ, имеют благоприятный прогноз, в то время как опухоли PZ имеют плохой прогноз [3]. Различные зоны могут влиять на развитие опухолей, приводя к более агрессивным фенотипам в PZ. Опухоли, возникающие из PZ и TZ, по-видимому, имеют генные сигнатуры, которые напоминают зону их возникновения [4]. Профиль экспрессии miRNA в опухолях TZ также обнаруживает значительные различия по сравнению с опухолями PZ, таким образом обеспечивая дополнительные доказательства дифференциального паттерна развития между опухолями PZ и опухолями TZ [5].Андрогены имеют решающее значение для роста и развития рака простаты [6]. Ткани рака простаты также экспрессируют рецепторы андрогенов (AR) и используют циркулирующий тестостерон для роста и развития [7]. Тестостерон перемещается в опухолевые клетки, где он превращается в дигидротестостерон (ДГТ) ферментами 5α-редуктазы, и в конечном итоге ДГТ связывает и активирует AR [8]. Активированный AR перемещается в ядро и активирует гены, связанные с выживанием, ростом и пролиферацией, которые впоследствии способствуют инвазивному и метастатическому поведению при раке простаты [7,9].Было обнаружено, что опухоли, подвергшиеся воздействию более высоких уровней андрогенов, имеют худший прогноз [10]. Андрогенная депривационная терапия (ADT) посредством удаления гонад или гормональной терапии используется для снижения уровня тестостерона и DHT для замедления роста опухоли простаты, где рак все еще ограничивается предстательной железой [11]. Однако впоследствии рак обычно рецидивирует в более летальной форме, известной как устойчивый к кастрации рак простаты (CRPC), с механизмами синтеза тестостерона и DHT, обнаруженными в опухоли простаты [12].Было показано, что при воздействии андрогенов PZ увеличивает уровни AR, а также гены, связанные с выживанием и пролиферацией, тогда как TZ не оказывает никакого эффекта, несмотря на то, что в обеих зонах присутствует AR [13]. Внутриопухолевый стероидогенез является одним из основных механизмов уклонения от противоопухолевого лечения. и для продолжения роста и развития простаты во время CRPC. При использовании циркулирующих предшественников стероидов, таких как дегидроэпиандростерон (ДГЭА), прогестерон или даже холестерин, рецидивирующие опухоли простаты способны синтезировать тестостерон и ДГТ [14,15].Было показано, что ферменты, необходимые для биосинтеза андрогенов, такие как CYP17A1, 5α-редуктаза, AKR1C3 и другие, активируются в опухолях CRPC [16,17,18,19]. Уровни тестостерона и ДГТ также оказались высокими в опухолях простаты, несмотря на кастрированные уровни, присутствующие в сыворотке [18,20]. В отличие от андрогенов, вырабатываемых из яичек, которые регулируются гипофизом и гипоталамусом, андрогены предстательной железы регулируются стероидогенным фактором 1 и не зависят от агонистов и антагонистов гонадотропин-рилизинг-гормона [21].AR присутствует и активен в этих опухолях, которые запускают пути роста, выживания и пролиферации [22]. Внутрипростатический стероидогенез включает как классический путь, включая выработку тестостерона до DHT, так и черный путь, который обходит образование тестостерона для производства DHT с использованием ферментов 5α-редуктазы [23,24]. Стероиды, образующиеся на классическом пути стероидогенеза, включают прегненолон, 17-ОН-прегненолон, ДГЭА, прогестерон, 17-ОН-прогестерон, андростендион и тестостерон, тогда как примерами стероидов, образующихся на пути скрытого стероидогенеза, являются андростерон, 5-прегнан- 3,20-дион, 5-прегнан-3-ол-20-он, 5-прегнан-17-ол-3,20-дион и 5-андростан-3,17-дион [20,25].Предшественники обоих путей могут быть преобразованы в ДГТ, но было продемонстрировано, что ДГТ, образующийся через черный ход, играет критическую роль в управлении CRPC [26]. Поскольку стероидогенез является движущей силой в развитии и прогрессировании рака простаты, он критически важно иметь четкое представление о стероидогенных путях в ткани рака простаты. Для разгадки тонкостей стероидогенеза простаты человека до настоящего времени в основном использовались клеточные линии и модели ксенотрансплантатов животных.Клеточные линии используются чаще, поскольку они хорошо зарекомендовали себя в молекулярных исследованиях рака простаты и могут быть легко приобретены и размножены. Однако в отношении клеточных линий и методов стероидогенеза существует заметное несоответствие между разными исследователями и во время пассажа клеток [16,27]. Уровни ферментов и стероидогенный потенциал в одних и тех же линиях клеток различаются в зависимости от метода культивирования, добавок и условий испытаний [27,28]. Для сравнения, мышиные модели ксенотрансплантатов, разработанные с использованием клеток рака предстательной железы человека, также используются для имитации стероидогенеза ткани предстательной железы человека, но микроокружение опухоли мышей отвечает за существенные различия между ксенотрансплантатами и опухолями предстательной железы человека [20,29].Хотя клеточные линии могут быть моноклональными для определенного типа клеток, образцы тканей представляют собой большую гетерогенную популяцию различных типов клеток [30]. Клеточные линии могут быть проще в использовании, но могут неточно отображать истинную биологию опухолей простаты в организме человека. Таким образом, образцы ткани предстательной железы предназначены для обеспечения более точной модели стероидогенеза, но обычно трудно получить образцы тканей пациента. Из-за неотъемлемых проблем, связанных с получением опухолей предстательной железы человека, информация о стероидогенезе ткани предстательной железы очень скудна.В результате данные о стероидогенном потенциале различных зон простаты (например, PZ, TZ), связанных с развитием рака, ограничены или отсутствуют. Также неизвестно, есть ли разница между внутренними уровнями стероидов в разных зонах простаты. Кроме того, ограниченная работа по стероидогенезу ткани предстательной железы была проведена радиометрическим методом, который не является золотым стандартом биоаналитической работы [31,32]. Целью настоящего исследования было понять метаболизм стероидов в тканях простаты человека.Мы исследовали базальные уровни стероидов в PZ и TZ в тканях рака простаты человека, а также их стероидогенный потенциал при добавлении предшественников андрогенов. Стероиды как классического, так и черного пути анализировали с использованием метода жидкостной хроматографии-масс-спектрометрии (ЖХ / МС).
3. Обсуждение
Стероидогенез при CRPC является одним из основных механизмов резистентности. К сожалению, исследования стероидогенеза сложно выполнить из-за ограничений аналитических методов и вариабельности модели клеточного рака простаты от методов культивирования и условий эксперимента.Это первое исследование, в котором сообщается об исчерпывающей оценке метаболизма стероидов в тканях рака простаты человека с использованием анализа на основе ЖХ / МС. В настоящей работе мы исследовали метаболизм стероидов на тканевой модели рака простаты и сравнили стероидогенную способность PZ и TZ предстательной железы человека. Содержание стероидов в тканях предстательной железы оценивалось для понимания внутренних уровней в тканях PZ и TZ. Стероиды как классического, так и черного пути анализировали с помощью метода ЖХ / МС.Старшие стероиды из обеих ветвей классического пути, а именно прогестерон и 17-ОН-прегненлон, были использованы для стимуляции образования стероидов в тканях рака простаты человека. Все пациенты в текущем исследовании перенесли радикальную простатэктомию в качестве основного лечения рака простаты без какой-либо адъювантной или неоадъювантной терапии.
Анализ на основе ЖХ / МС был использован для измерения тринадцати простатических стероидов, а именно, ДГЭА, андростендиона, 17-ОН-прогестерона, тестостерона, ДГТ, андростерона, прегненолона, прогестерона, 5-прегнан-3,20-диона, 17- ОН-прегненолон, 5-прегнан-3-ол-20-он, 5-прегнан-17-ол-3,20-дион и 5-андростан-3,17-дион.Анализы тканей предстательной железы из PZ- и TZ-происхождения выявили сходные внутренние уровни всех стероидов, изученных в данной работе. В соответствующих тканевых зонах уровни стероидов, по-видимому, выше в ветви прегненолон-ДГЭА классического пути, в то время как прогестерон-тестостерон в ветви классического пути и черного хода имеют сравнительно более низкие уровни стероидов. Интересно отметить, что уровень тестостерона был намного ниже, чем уровень DHT. Содержание DHT было примерно в 200 и 50 раз выше, чем тестостерон в тканях PZ и TZ, соответственно, и представляло самые высокие уровни среди всех проанализированных стероидов.Также можно отметить, что внутренние уровни стероидов секретного пути, таких как 5-прегнан-3,20-дион, 17-ОН-прегненолон, 5-прегнан-3-ол-20-он, 5-прегнан-17-ол -3,20-дион и 5-андростан-3,17-дион относительно ниже, чем стероиды классического пути, такие как DHEA и 17-OH-прегнелолон. Это наблюдение указывает на важность наличия и поддержания уровня ДГТ в простате. Производство стероидов, по-видимому, активно как в тканях PZ, так и в TZ, причем предпочтение отдается классическому пути через прегненолон в руку DHEA.
Инкубация стероидов, 17-ОН-прегнелона и прогестерона из каждой ветви классического пути проводилась с тканями предстательной железы PZ и TZ для расшифровки их метаболизма. В присутствии 17-ОН-прегненолона стероиды черного пути, такие как 5-прегнан-3,20-дион, 5-прегнан-3-ол-20-он, 5-прегнан-17-ол-3,20- образование диона и андростерона было значительно выше в обеих тканях. Напротив, было обнаружено, что уровни тестостерона и DHT уменьшаются при PZ и TZ. Точно так же использование прогестерона в качестве предшественника привело к значительному увеличению образования прегнан-3,20-диона и 5-прегнан-3-ол-20-она, тогда как уровни DHT снизились как в тканях PZ, так и в TZ.Наши результаты подчеркивают, что стероиды черного пути преимущественно образуются после воздействия прогестерона или 17-ОН-прегненолона. Несмотря на идентифицируемое сходство между метаболизмом двух предшественников, существуют незначительные различия в том, как зоны ткани простаты обрабатывают их. Например, уровни тестостерона не изменяются после инкубации с прогестероном, но снижаются при инкубации с 17-ОН-прегненолоном. Классическая рука, по-видимому, имеет более выраженные чистые изменения в тканях PZ, чем в тканях TZ.Кроме того, чистые изменения в образовании стероидов после инкубации были более заметными с 17-ОН-прегненолоном, чем с прогестероном. Хотя один и тот же предшественник демонстрирует сходную картину с любой из тканевых зон, существуют различия в способах маневрирования предшественников тканью простаты. Результаты нашего исследования показывают, что на уровень андрогенов может влиять стероидная среда ткани, и важно понимать патофизиологические факторы, которые могут повлиять на этот процесс.
В нашем исследовании ткани предстательной железы PZ и TZ способны поддерживать уровни андрогенов с экзогенными предшественниками или без них, что согласуется с отчетом о том, что ферменты для биосинтеза стероидов экспрессируются в ткани рака простаты [16]. Есть некоторые свидетельства того, что ткань простаты может адаптировать путь биосинтеза, когда присутствуют экзогенные предшествующие предшественники. Другие лаборатории сообщили, что синтез ДГТ стал возможен за счет преобразования нижележащих бэкдор-предшественников, в первую очередь андростандиола, путем подачи андростендиона или путем преобразования андростендиона в андростандиол, а затем в ДГТ [33,34,35].Наше исследование показало значительное увеличение числа исходных бэкдоров-предшественников, которые в конечном итоге могут быть преобразованы в нижележащие прекурсоры по мере необходимости. Ранее предполагалось, что большой источник DHEA, вырабатываемый надпочечниками, отвечает за поддержание уровней андрогенов в тканях CRPC [36]. Действительно, базальные уровни DHEA и DHT были двумя самыми высокими уровнями стероидов в обеих зонах ткани простаты. Также было обнаружено, что мутации в ферменте HSD3B обеспечивают преимущество в выживании за счет снижения скорости его разложения и, таким образом, активного увеличения превращения DHEA в андростендион и, в конечном итоге, в DHT [37].Стоит отметить, что за исключением некоторых очень ограниченных радиометрических исследований человеческих тканей [31,32,38], наше исследование убедительно оценило гораздо более широкий спектр стероидов (Рисунок 3). Результаты текущего исследования согласуются с нашей ранее опубликованной работой по клеточному стероидогенезу, которая предполагала преобладание бэкдорных путей после инкубации стероидных предшественников с клетками LNCaP и 22Rv1 в течение 48 часов [29] Понимание тканевого стероидогенеза в основных и опосредованных предшественниками условиях подчеркивает как рак простаты может развиваться в различных микросредовых условиях.В базовых условиях DHEA, по-видимому, действует как резервуар для поддержания уровня андрогенов, необходимого для роста рака. Даже после ADT альтернативные источники DHEA могут снабжать систему стероидогенеза простаты предшественниками [36]. Например, образование сульфированной формы ДГЭА, известной как сульфат ДГЭА (ДГЭА), в экстрапростатических участках катализируется ферментом сульфотрансферазой 2А1. Циркулирующий сывороточный ДГЭА доставляется в предстательную железу транспортерами захвата растворенного носителя и превращается в свободный ДГЭА с помощью фермента сульфатазы простаты [25,36].Таким образом, DHEAS может быть основным предшественником во внутриопухолевом биосинтезе андрогенов и играть важную роль в развитии и прогрессировании CRPC. Действительно, целенаправленное ингибирование простатической сульфатазы для блокирования деконъюгации DHEAS было выделено как терапевтическая стратегия при CRPC [25,36]. Другие источники избыточных андрогенов, в том числе продуцируемые надпочечниками или индукция стероидогенеза в клетках рака простаты или стромы, приводящие к секреции в микроокружение опухоли, могут задействовать механизмы обхода [39,40,41,42].Важно понимать, что существует множество способов адаптации этих путей для поддержания уровня андрогенов от накопления в виде ДГЭА до других бэкдор-предшественников [26,37,42,43]. Пока эти механизмы остаются интактными в CRPC, опухолевые клетки могут продолжать уклоняться от лечения и демонстрировать устойчивый рост. Также вероятно, что присутствует сильный механизм обратной связи, который влияет на компенсаторные пути для поддержания соответствующих уровней андрогенов в ткани опухоли простаты. Четкое понимание того, как эти механизмы обратной связи активируются и регулируют стероидогенез, может иметь решающее значение для разработки схемы лечения CRPC.Есть несколько ограничений, которые могли повлиять на интерпретацию наших результатов. Супрафизиологические концентрации предшественников, использованные в экспериментах, могли влиять на стероидогенную ферментативную активность. Однако желательные более низкие концентрации предшественников создают значительные технические проблемы при идентификации и количественной оценке стероидов. Несмотря на использование тройной квадрупольной системы ЖХ / МС, которая в настоящее время является золотым стандартом аналитических методов, более низкие концентрации субстрата не могли образовывать стероиды в присутствии гомогенатов ткани простаты.Кроме того, метаболические пути глюкуронизации, которые активны в простате [44], в этом исследовании не измерялись. Глюкуронизация предшественников стероидов инактивирует и предотвращает их использование для синтеза DHT. Точно так же базальные уровни DHEAS в зонах ткани простаты в настоящем исследовании не измерялись. Необходимо определить роль глюкуронирования и сульфирования в метаболизме стероидов и регуляции андрогенов, а также в адаптации стероидного пути, когда присутствуют избыточные предшественники.
4. Материалы и методы
4.1. Стероидные стандарты и химические вещества
5α-андростан-17β-ол-3-он (DHT), 5-прегнен-3β-ол-20-он (прегненолон), 5-андростен-3β-ол-17-он (DHEA) , 4-андростен-17β-ол-3-он (тестостерон), 4-прегнен-17α-ол-3,20-дион (17-ОН-прогестерон), 5α-андростан-3α-ол-17-он (андростерон ), 4-андростен-3,17-дион (андростендион), 5α-прегнан-3,20-дион (5прегнан-3-20-дион), 5α-прегнан-3α-ол-20-он (5прегнан-3- ол-20-он), 5α-прегнан-17α-ол-3,20-дион (5-прегнан-17-ол-3,20-дион), 5α-андростан-3,17-дион (5-андростан- 3,17-дион) и 5-прегнен-3β, 17-ол-20-он (17-ОН-прегненолон) были от Steraloids Inc.(Ньюпорт, Род-Айленд, США) и 4-прегнен-3,20-он (прогестерон) был от Sigma-Aldrich (Оквилл, Онтарио, Канада). 5α-андростан-17β-ол-3-он-16,16,17-d3 (d3-DHT) и 4-андростен-17β-ол-3-он-16,16,17-d3 (d3T) были из C / D / N Изотопы (Пуэнт-Клер, Квебек, Канада). Гидроксиламин был приобретен у Fluka (Mississauga, ON, Canada). Гексан, метанол, дихлорметан и ацетонитрил были марки Optima ® от Fisher (Оттава, Онтарио, Канада). Этилацетат сорта Chromasolv ® был приобретен у Sigma-Aldrich (Оквилл, ОН, Канада), а муравьиная кислота для ЖХ / МС была получена от Fisher Scientific (Оттава, ОН, Канада).Вода была очищена 18 МОм на собственном предприятии (установка Millipore RO; Биллерика, Массачусетс, США).
4.2. Образцы простаты человека
Образцы ткани простаты, использованные в настоящем исследовании, были получены из банка тканей Ванкуверского центра простаты (Ванкувер, Британская Колумбия, Канада). Компоненты PZ и TZ предстательной железы были идентифицированы патологом и были мгновенно заморожены после операции. Совет по этике клинических исследований Университета Британской Колумбии (Ванкувер, Британская Колумбия, Канада) предоставил этическое одобрение (сертификат № H09-01628).Дополнительная таблица S1 включает снимок клинических характеристик пациентов с раком простаты, перенесших радикальную простатэктомию без какой-либо неоадъювантной терапии.
4.3. Получение гомогенатов предстательной железы человека
PZ и TZ образцов ткани предстательной железы человека гомогенизировали с использованием системы гомогенизатора тканей Precellys (Bertin Technologies, Франция) в соответствии с протоколом производителя. Вкратце ткань взвешивали, поперечно нарезали скальпелями и гомогенизировали в охлажденном 100 мМ фосфате калия плюс 0.25 M сахарозный буфер (pH 7,4) при соотношении ткань: буфер 1: 7 с использованием пробирок Precellys Tissue Homogenizing CKMix (каталожный номер набора 03961-1-009) для 10 циклов 20-секундной гомогенизации при 6000 об / мин. Ткани гомогенизировали либо индивидуально, либо объединяли, если необходимо, для достижения концентрации 45 мг / мл. Гомогенат переносили в охлажденную пробирку Эппендорфа на 1,5 мл и хранили в морозильной камере -80 ° C до готовности для анализов.
4.4. Анализ стероидной биотрансформации с гомогенатами простаты человека
В реакции in vitro гомогенат простаты человека (PZ или TZ) (45 мг / мл) инкубировали со стероидным субстратом 17-OH прегненолоном (2 мкг / мл), прогестероном (2 мкг / мл). мл) или d3-тестостерон (100 нг / мл, в качестве положительного контроля), NADPH-регенерирующая система (растворы A и B) в 100 мМ калий-фосфатном буфере (pH 7.4) в конечном реакционном объеме 150 мкл при 37 ° C в течение 60 мин на водяной бане со встряхиванием. Реакцию инициировали добавлением НАДФН и останавливали добавлением 1,2 мл охлажденной смеси гексан: этилацетат (60:40) и d3T и d3DHT, используемых в качестве внутреннего стандарта (за исключением положительного контроля d3T). Стероиды дважды экстрагировали смесью гексан: этилацетат (60:40). Затем экстракты сушили при 30 ° C с использованием системы центробежного выпаривания CentriVap и дериватизировали 50 мкл 50 мМ гидроксиламина в 50% метаноле. Подлинные стандарты стероидов прошли тот же процесс дериватизации гидроксиламина.Дериватизированные образцы инкубировали при 65 ° C в течение 1 ч и анализировали с помощью ЖХ / МС. Уровни назначенных стероидов сравнивали с уровнями в аналогах T = 0. В каждый анализ включали другие подходящие контроли, микросомы печени человека, только гомогенат без стероидного субстрата и только стероидный субстрат без гомогената.
4.5. Анализ стероидов с помощью ЖХ / МС
Анализ выполняли на жидкостной хроматографии сверхвысокого качества (UPLC) Waters Acquity, соединенной с Quattro Premier XE с использованием 2.1 × 100 мм BEH 1,7 мкМ колонка C 18 , как описано ранее [29]. MassLynxTM 4.1 (Waters Corporation, Милфорд, Массачусетс, США) использовали для управления прибором. Разделение проводили на колонке 2,1 × 100 мм BEH 1,7 мкМ C 18 , подвижная фаза воды (A) и 0,1% муравьиной кислоты в ацетонитриле (B) (градиент: 0,2 мин, 25% B; 8 мин, 70% B). ; 9 мин, 100% B; 12 мин. 100% B; 12,2 мин, 20% B; продолжительность цикла 14 минут). Температура колонки составляла 40 ° C, а объем инъекции составлял 15 мкл. Для повышения чувствительности МС было установлено несколько ниже единичного разрешения, капиллярность — 3.0 кВ, температуры источника и десольватации составляли 120 ° C и 350 ° C соответственно, потоки газа десольватации и конуса составляли 1000 л / ч и 50 л / ч, давление ячейки столкновений поддерживалось на уровне 6,4 × 10 -3 мбар. Все данные были собраны в режиме положительной ионизации электрораспылением (ES +) с использованием мониторинга множественных реакций (MRM) с конусным напряжением и энергиями столкновения, оптимизированными для каждого аналита из сканирования и анализа сканирования фрагментов дериватизированных стандартов. Образованные производные оксима присутствуют в виде структурных изомеров, которые разделяются в различной степени в зависимости от условий стероидной и жидкостной хроматографии.Площадь под кривой (AUC) аналита по сравнению с внутренним стандартом использовали для количественного определения с включением обоих изомеров, где наблюдается разделение.

 Преимущественное образование кортикостероидов осуществляется через Д5-путь, что проявляется повышением концентрации в периферической крови Д5-стероидов (17-PR и ДЭАС) при одновременном снижении концентрации SR и свободного ДЭА.
Преимущественное образование кортикостероидов осуществляется через Д5-путь, что проявляется повышением концентрации в периферической крови Д5-стероидов (17-PR и ДЭАС) при одновременном снижении концентрации SR и свободного ДЭА.