НАСЛЕДСТВЕННЫЙ ДЕФИЦИТ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ V: КЛИНИЧЕСКИЕ НАБЛЮДЕНИЯ | Яковлева
Введение
Фактор свертывания крови V (FV) — проакцелерин — известен как лабильный фактор, обладающий прокоагулянтными и антикоагулянтными свойствами. FV является кофактором протромбиназного комплекса, который катализирует превращение протромбина в тромбин. Антикоагулянтные свойства FV обусловлены его участием в инактивации фактора свертывания крови VIII (FVIII) в комплексе с активированным протеином С (activated protein C — APC) и протеином S (protein S — PS) [1]. FV синтезируется в печени в виде пептида, состоящего из 2196 аминокислотных остатков. В плазме циркулирует около 80 % FV, 20 % обнаруживается в α-гранулах тромбоцитов, где он связан с белком-мультимерином. Содержание FV в α-гранулах, возможно, обусловлено синтезом FV мегакариоцитами и/или эндоцитозом из плазмы [1-4]. FV циркулирует в плазме в виде одноцепочечной молекулы массой 330 кDа, период полужизни составляет 12-30 часов [1, 5]. Структурная организация FV сходна с таковой FVIII. В ней выделяют три А-домена, два гомологичных С-домена и один большой центральный В-домен (А1-А2-В-А3-С1-С2). Активируется FV под действием тромбина и, в меньшей степени, — активированного фактора свертывания крови X (FХа). Тромбин активирует FV, расщепляя его по остаткам Arg в положениях 709, 1018 и 1545. Это расщепление освобождает В-домен, и образуется димерная молекула, состоящая из тяжелой цепи массой 105 кDa (А1- А2) и легкой цепи 71-74 кDa (А3-С1-С2), которые взаимодействуют посредством ионов Са2+ и гидрофобных связей (рис. 1) [6].
Структурная организация FV сходна с таковой FVIII. В ней выделяют три А-домена, два гомологичных С-домена и один большой центральный В-домен (А1-А2-В-А3-С1-С2). Активируется FV под действием тромбина и, в меньшей степени, — активированного фактора свертывания крови X (FХа). Тромбин активирует FV, расщепляя его по остаткам Arg в положениях 709, 1018 и 1545. Это расщепление освобождает В-домен, и образуется димерная молекула, состоящая из тяжелой цепи массой 105 кDa (А1- А2) и легкой цепи 71-74 кDa (А3-С1-С2), которые взаимодействуют посредством ионов Са2+ и гидрофобных связей (рис. 1) [6].
Рисунок 1. Cтруктура FV (А) и FVa (Б) [6]
Figure 1. Structure of FV (А) и FVa (Б)[6]
Активированный FV (FVa) является кофактором протромбиназного комплекса — мультикомпонентного энзимного комплекса, включающего наряду с FVa, FXa, ионы Са2+ и фосфолипиды. Тяжелая цепь FVa обеспечивает контакт с FXa и протромбином, С-домены легкой цепи — взаимодействие с фосфолипидной поверхностью, а А3-домен легкой цепи связывает FXa и фосфолипиды. FVa повышает концентрацию FXa на мембранной поверхности тромбоцитов, активируя рецептор FXa и аллостерически изменяя активные центры FXa, что способствует расщеплению протромбина. Таким образом, FVa выполняет роль кофактора для FXa, многократно увеличивая его способность к активации тромбина (рис. 2) [1, 7, 8].
FVa повышает концентрацию FXa на мембранной поверхности тромбоцитов, активируя рецептор FXa и аллостерически изменяя активные центры FXa, что способствует расщеплению протромбина. Таким образом, FVa выполняет роль кофактора для FXa, многократно увеличивая его способность к активации тромбина (рис. 2) [1, 7, 8].
Рисунок 2. Протромбиназный комплекс [8]
Figure 2. Prothrombinase complex [8]
Инактивация FVa осуществляется АРС при его расщеплении по остаткам Arg в положениях 506, 306, 679 тяжелой цепи. Гидролиз по остаткам Arg 306 и Arg 506 полностью инактивирует FV. Гидролиз только по остатку Arg 506 приводит к образованию FV-антикоагулянта (FVac). Тримолекулярный комплекс: АРС, Р8, и FVac элиминирует активность FVIIIa в теназном комплексе посредством его расщепления по остаткам Arg 336, Arg 562, Arg 734 [1, 2, 9]. Способностью инактивировать FVa обладает и α-тромбин, что было показано в исследованиях in vitro и in vivo. Он расщепляет FVa в положении Arg 643, в результате аффинность между легкой и тяжелой цепями значительно снижается [8]. Также эксперименты in vitro демонстрируют способность плазмина инактивировать бычий FVa [10].
Он расщепляет FVa в положении Arg 643, в результате аффинность между легкой и тяжелой цепями значительно снижается [8]. Также эксперименты in vitro демонстрируют способность плазмина инактивировать бычий FVa [10].
Наследственный дефицит FV относится к редким коагулопатиям, распространенность заболевания составляет 1 : 1 000 000 населения. Однако в регионах, где распространены близкородственные браки, частота заболевания возрастает до 1:70 000 населения [11]. Редкие наследственные коагулопатии составляют около 10 % всех наследственных дефицитов факторов свертывания крови. Эпидемиология редких коагулопатий представлена в таблице 1 [12, 13].
Таблица 1. Сравнительная частота наследственного дефицита FV в группе редких наследственных коагулопатий в ряде стран ( %) [12, 13]
Table 1. Comparing the frequency of congenital factor V deficiency with other rare congenital bleeding disorders in some countries ( %j [12, 13]
Страна Country | Дефициты факторов свертывания крови; % больных в группе редких наследственных коагулопатий Blood clotting factor deficiencies, % of patients in the group of rare congenital bleeding disorders | |||||||
|---|---|---|---|---|---|---|---|---|
I | II | V | V+VIII | VII | X | XI | XIII | |
Италия Italy | 8 | 5 | 10 | 9 | 25 | 8 | 24 | 11 |
Иран Iran | 11 | 2 | 7 | 11 | 39 | 10 | 7 | 13 |
Индия India | 13 | 3 | 8 | 6 | 15 | 16 | 9 | 30 |
Наследственный дефицит FV был описан норвежским врачом Paul A. Owren во время Второй мировой войны у 29-летней женщины, страдавшей спонтанными экхимозами, профузными носовыми кровотечениями, посттравматическими кровотечениями, меноррагиями и потерей зрения. Изначально это состояние он назвал парагемофилией, определив отсутствие в крови ранее неизвестного прокоагулянта. Впервые эти данные были опубликованы в Норвегии в 1944 г., а после окончания Второй мировой войны — в журнале Lancet в 1947 г. [14]. Заболевание имеет аутосомно-рецессивный путь наследования. В литературе описано более 200 случаев наследственного дефицита FV.
Owren во время Второй мировой войны у 29-летней женщины, страдавшей спонтанными экхимозами, профузными носовыми кровотечениями, посттравматическими кровотечениями, меноррагиями и потерей зрения. Изначально это состояние он назвал парагемофилией, определив отсутствие в крови ранее неизвестного прокоагулянта. Впервые эти данные были опубликованы в Норвегии в 1944 г., а после окончания Второй мировой войны — в журнале Lancet в 1947 г. [14]. Заболевание имеет аутосомно-рецессивный путь наследования. В литературе описано более 200 случаев наследственного дефицита FV.
Молекулярные основы заболевания. Полная генетическая структура FV была описана в 1992 г. L.D. Cripe и соавт. [15]. Ген, кодирующий синтез FV, локализуется на хромосоме 1 в локусе 1q24, состоит из 25 экзонов и имеет протяженность 74кb [15, 16]. При дефиците FV идентифицировано более 150 различных мутаций и свыше 700 полиморфизмов, которые не ассоциируются с клиническими проявлениями [1,17]. Среди выявленных мутаций преобладают точечные миссенс- и нонсенс-мутации (65 %), микроделеции (16 %) и мутации сплайсинга (11 %). По данным, приведенным в обзоре R. Asselta и F. Peyvandi [3], из 48 мутаций, вызывающих тяжелую форму заболевания, 21 (44 %) представляли собой микроделеции или микроинсерции, 14 (29 %) — миссенс-мутации, 7 (15 %) — дефекты сплайсинга и 6 (12 %) — нонсенсмутации. Однако вопрос о корреляции между различными мутациями и клиническими проявлениями заболевания остается открытым.
По данным, приведенным в обзоре R. Asselta и F. Peyvandi [3], из 48 мутаций, вызывающих тяжелую форму заболевания, 21 (44 %) представляли собой микроделеции или микроинсерции, 14 (29 %) — миссенс-мутации, 7 (15 %) — дефекты сплайсинга и 6 (12 %) — нонсенсмутации. Однако вопрос о корреляции между различными мутациями и клиническими проявлениями заболевания остается открытым.
Клинические проявления. Спектр клинических проявлений дефицита FV разнообразен и по источнику кровотечения, и по его интенсивности. Превалирующими являются носовые, десневые, посттравматические, постоперационные кровотечения, гематомы, экхимозы. Гемартрозы — нечастое клиническое проявление дефицита FV, в отличие от наследственного дефицита FVIII. Ж.изнеугрожающими состояниями при дефиците FV являются желудочно-кишечные кровотечения (ЖКК), кровоизлияния в центральную нервную систему (ЦНС).
Согласно Американскому регистру редких наследственных коагулопатий [18], спектр клинических проявлений следующий: 44 % всех эпизодов кровоизлияний — кожный геморрагический синдром, носовые кровотечения и кровоточивость десен, 23 % — кровоизлияния в суставы и мышцы, 19 % — мочеполовые кровотечения, 6 % — ЖКК, 8 % — кровоизлияния в ЦНС. Среди 35 больных иранцев 57 % из них страдали носовыми и десневыми кровотечениями, 50 % женщин имели меноррагии, 29 % имели постоперационные и/или послеродовые кровотечения, 29 % — мышечные гематомы, 26 % — гемартрозы, 6 % — ЖКК; 6 % — кровоизлияния в ЦНС [19].
Среди 35 больных иранцев 57 % из них страдали носовыми и десневыми кровотечениями, 50 % женщин имели меноррагии, 29 % имели постоперационные и/или послеродовые кровотечения, 29 % — мышечные гематомы, 26 % — гемартрозы, 6 % — ЖКК; 6 % — кровоизлияния в ЦНС [19].
Корейскими авторами был проведен анализ клинических данных 10 больных. Один из них не имел клинических симптомов заболевания, у 40 % больных отмечены носовые, десневые, постоперационные кровотечения, меноррагии; внутрибрюшное кровотечение констатировано у 2 (20 %) больных, кровоизлияние в ЦНС — у 1 (10 %), ретроперитонеальная гематома — у 1 (10 %) больного и гемартроз также у 1 (10 %) больного. ЖКК, гематурии не зарегистрированы [20]. Индийскими авторами [21] описано 26 больных с наследственным дефицитом FV, из которых 19 (73 %) страдали спонтанным возникновением экхимозов, 5 (19 %) — мышечных гематом, 14 (53 %) — носовых кровотечений, 15 (58 %) — десневых кровотечений. ЖКК имели 10 (38 %) больных, кровотечения из мочеполового тракта — 6 (23 %), кровоизлияния в ЦНС — 6 (23 %) больных. Послеоперационные кровотечения констатированы у 9 (35 %) больных. Подавляющее большинство больных (92 %) отмечали длительные кровотечения после порезов. Все женщины (12 из группы 26 больных) предъявляли жалобы на меноррагии.
Послеоперационные кровотечения констатированы у 9 (35 %) больных. Подавляющее большинство больных (92 %) отмечали длительные кровотечения после порезов. Все женщины (12 из группы 26 больных) предъявляли жалобы на меноррагии.
Лабораторная диагностика. Характерными лабораторными признаками наследственного дефицита FV являются снижение протромбина по Квику или сочетанные изменения: снижение протромбина по Квику и удлинение активированного частичного тромбопластинового времени (АЧТВ). Диагноз достоверен в случае изолированного снижения активности FV менее 70 % и при отсутствии ингибитора к FV. В зависимости от активности FV в плазме выделяют тяжелую форму дефицита FV (FV менее 1 %), среднюю (FV 1-5 %), легкую (FV более 5 %) [1, 20, 22]. Некоторые авторы диагностируют легкую форму заболевания при активности FV более 10 % [11]. Легкие формы дефицита FV могут сопровождаться изменениями только протромбина по Квику, АЧТВ при этом остается в пределах нормальных значений. В Американском регистре редких наследственных коагулопатий используется классификация гомозиготной и гетерозиготной формы заболевания с пороговым значением FV 20 % [18].
Лечение. Гемостатическая терапия больным с наследственным дефицитом FV назначается с целью лечения геморрагического синдрома (спонтанного или вследствие травмы), периоперационной подготовки, ведения беременности и родоразрешения, регуляции менструальных кровопотерь. Заместительной специфической терапии в настоящее время не существует. Гемостатическая терапия может осуществляться несколькими препаратами. Свежезамороженная плазма (СЗП) является доступным средством, содержащим FV. Дозировка варьирует в пределах 5—20 мл/кг массы тела больного, интервал введения — каждые 12—24 ч в зависимости от интенсивности геморрагического синдрома и индивидуального ответа. Недостатками использования СЗП являются возможности перегрузки объемом, риски инфицирования, появления ингибитора к FV, развития аллергической реакции.
Использование рекомбинантного активированного фактора свертывания VII (эптаког альфа активированного) является применением по неутвержденным показаниям (off-label), и подбор дозы препарата представляет собой определенную трудность. Преимущества использования эптаког альфа (активированного) — это отсутствие риска инфицирования и перегрузки объемом.
Преимущества использования эптаког альфа (активированного) — это отсутствие риска инфицирования и перегрузки объемом.
Ингибиторы фибринолиза могут быть использованы как в виде пероральной формы, так и внутривенно и позволяют больным проводить гемостатическую терапию в домашних условиях при малоинтенсивном геморрагическом синдроме (при носовых, десневых кровотечениях, меноррагиях). Меноррагии являются основной проблемой у женщин с дефицитом FV и требуют совместного наблюдения с гинекологом. Неэффективность терапии ингибиторами фибринолиза является поводом для решения вопроса о назначении гормональных препаратов.
Описаны случаи эффективного использования концентрата тромбоцитов у больных с дефицитом FV и тяжелыми кровотечениями, которые не отвечали на трансфузии СЗП. Эффективность трансфузий концентрата тромбоцитов и неэффективность СЗП объясняли наличием ингибитора к FV, поскольку содержащийся в тромбоцитах FV не успевал нейтрализоваться ингибитором при высвобождении из активированных тромбоцитов и потреблялся на образование протромбиназного комплекса [1, 3].
Цель настоящей работы — описание клинических проявлений и выбора тактики лечения у больных с наследственным дефицитом FV.
Клинические наблюдения
В отделе коагулопатий ФГБУ «НМИЦ гематологии» Минздрава России наблюдаются 170 больных редкими наследственными коагулопатиями. Распределение больных наследственными коагулопатиями по нозологиям представлено в таблице 2. С диагнозом «наследственный дефицит FV» состоят под наблюдением 8 больных (5 женщин, 3 мужчин).
Таблица 2. Распределение больных редкими наследственными коагулопатиями, состоящих на учете в отделе коагулопатий НМИЦ гематологии
Table 2. Distribution of patients with rare inherited bleeding disorders in the Department of coagulopathy disorders of the National Research Center for hematology
Дефицит фактора свертывания крови Blood clotting factor deficiency | Число больных, n ( %) Number of patients, n ( %) |
|---|---|
I | 29 (17) |
II | 1 (0,5) |
V | 8 (5) |
V+VIII | 4 (2) |
VII | 82 (48) |
X | 4 (2) |
XI | 25 (15) |
XIII | 10 (6) |
Комбинированные дефициты Combined coagulation factor deficiencies | 7 (4) |
Клиническое наблюдение 1
Больной Л. , 30 лет, впервые обратился в НМИЦ гематологии в 2012 г., когда был доставлен бригадой «скорой медицинской помощи» и госпитализирован в связи с коагулопатией неясного генеза и спонтанной напряженной гематомой левого предплечья. Тяжесть состояния была обусловлена обширной наряженной гематомой в области левого предплечья, локализовавшейся на наружной и внутренней поверхностях предплечья от лучезапястного до локтевого суставов. В связи с многократным удлинением АЧТВ и снижением протромбина по Квику были исключены наиболее распространенные наследственные коагулопатии — гемофилия, болезнь Виллебранда и начата гемостатическая терапия СЗП.
, 30 лет, впервые обратился в НМИЦ гематологии в 2012 г., когда был доставлен бригадой «скорой медицинской помощи» и госпитализирован в связи с коагулопатией неясного генеза и спонтанной напряженной гематомой левого предплечья. Тяжесть состояния была обусловлена обширной наряженной гематомой в области левого предплечья, локализовавшейся на наружной и внутренней поверхностях предплечья от лучезапястного до локтевого суставов. В связи с многократным удлинением АЧТВ и снижением протромбина по Квику были исключены наиболее распространенные наследственные коагулопатии — гемофилия, болезнь Виллебранда и начата гемостатическая терапия СЗП.
Анамнез заболевания. Больной — уроженец Республики Мордовия. Родственный брак родителей отрицает. Семейный анамнез по кровоточивости был не отягощен. В возрасте 1 года получил травму губы, отмечалось выраженное кровотечение, был госпитализирован, с гемостатической целью проводилась электрокоагуляция. В 1993 г., в возрасте 7 лет, был направлен в Измайловскую детскую клиническую городскую больницу (г. Москва), где был установлен диагноз «Болезнь Виллебранда». В клинической картине заболевания отмечал гематомы, экхимозы, дискомфорт в голеностопных суставах. В 1995 г. лечился в реанимационном отделении в связи с ЖКК. В 2008 г. впервые выявлены антитела к вирусу гепатита С. Трансфузионный анамнез: с 1992 г. осуществлялись трансфузии СЗП, криопреципитата, эритроцитной массы по требованию.
Москва), где был установлен диагноз «Болезнь Виллебранда». В клинической картине заболевания отмечал гематомы, экхимозы, дискомфорт в голеностопных суставах. В 1995 г. лечился в реанимационном отделении в связи с ЖКК. В 2008 г. впервые выявлены антитела к вирусу гепатита С. Трансфузионный анамнез: с 1992 г. осуществлялись трансфузии СЗП, криопреципитата, эритроцитной массы по требованию.
При обследовании в НМИЦ гематологии в коагуло- грамме выявлено: АЧТВ 71 с, фибриноген 3,0 г/л, протромбин по Квику 48 %, FV 5 %, FII 98 %, FVII 90 %; FVIII 84 %, FIX 78 %, FX 96 %, FXI 79,9 %, FW 130 %, FXII 101 %, XIIа-зависимый фибринолиз 6 мин, агрегация тромбоцитов с ристомицином 85 %, агрегация тромбоцитов с коллагеном 73 %, агрегация тромбоцитов с адреналином 62 %, агрегация тромбоцитов с АДФ 69 %. Отсутствие ингибитора к FV позволило исключить приобретенный дефицит FV. В общем анализе крови у больного гемоглобин был 132 г/л, эритроциты 4,4 х 1012/л, тромбоциты 174 х 109/л; лейкоциты 6 х 109/л; в биохимическом анализе крови — общий белок 69 г/л, альбумин 40 г/л, аланинаминотрансфераза 42 ед/л, аспартатамино- трансфераза 29 ед/л, креатинин 85 мкмоль/л. Были выявлены антитела к вирусу гепатита С.
Были выявлены антитела к вирусу гепатита С.
Учитывая анамнестические, клинические и лабораторные данные, у больного был диагностирован наследственный дефицит FV. Продолжены трансфузии СЗП в дозе 700 мл/сутки (8 мл/кг массы тела), после стабилизации состояния больного суточная доза СЗП была уменьшена, он был выписан из НМИЦ гематологии спустя 7 суток.
Контрольное обследование больного было проведенное через месяц после окончания гемостатической терапии и позволило установить тяжелую форму заболевания по лабораторным данным: FV 0,4 %, АЧТВ 155 с, протромбин по Квику 12,6 %. По данным тромбоэластографии (ТЭГ), ротационной тромбоэластометрии (РОТЭМ) с оценкой внешнего (EXTEM) и внутреннего (INTEM) путей свертывания крови у больного были выявлены признаки гипокоагуляции (рис. 3). Повторное обращение в НМИЦ гематологии в 2016 г. было вызвано образованием после физического напряжения обширной гематомы на медиальной поверхности бедра справа размерами 10 х 15 см (рис. 4А), а в 2017 г. — в связи с формированием в результате травмы гематомы в области правого локтевого сустава, переходящей на предплечье, размерами 10 х 7 см (рис. 4Б). В 2018 г. поводом для обращения послужили боли и отечность в области левого голеностопного сустава, при обследовании был диагностирован гемартроз. Во всех случаях больному проводилась заместительная гемостатическая терапия СЗП в дозе 7-10 мл/кг с выраженным положительным эфф ектом. В ноябре 2018 г. у больного появились периодические приступообразные боли в поясничной области, купировавшиеся спазмолитиками. По результатам обследования, включавшего ультразвуковое исследование (УЗИ), магнитно-резонансную томографию с внутривенным контрастированием, была диагностирована мочекаменная болезнь, выявлен камень в лоханочно-мочеточниковом сегменте правой почки. Гематурия и очередной приступ почечной колики явились показанием для экстренной госпитализации и решения вопроса о тактике лечения. Рассматривались следующие варианты лечения: дистанционная ударно-волновая литотрипсия, пиелолитотомия, контактная литотрипсия.
— в связи с формированием в результате травмы гематомы в области правого локтевого сустава, переходящей на предплечье, размерами 10 х 7 см (рис. 4Б). В 2018 г. поводом для обращения послужили боли и отечность в области левого голеностопного сустава, при обследовании был диагностирован гемартроз. Во всех случаях больному проводилась заместительная гемостатическая терапия СЗП в дозе 7-10 мл/кг с выраженным положительным эфф ектом. В ноябре 2018 г. у больного появились периодические приступообразные боли в поясничной области, купировавшиеся спазмолитиками. По результатам обследования, включавшего ультразвуковое исследование (УЗИ), магнитно-резонансную томографию с внутривенным контрастированием, была диагностирована мочекаменная болезнь, выявлен камень в лоханочно-мочеточниковом сегменте правой почки. Гематурия и очередной приступ почечной колики явились показанием для экстренной госпитализации и решения вопроса о тактике лечения. Рассматривались следующие варианты лечения: дистанционная ударно-волновая литотрипсия, пиелолитотомия, контактная литотрипсия. Учитывая высокий риск геморрагических периоперационных осложнений, при выборе метода лечения учитывали как урологические, так и гематологические факторы, поэтому 16 ноября 2018 г. больному была выполнена контактная лазерная уретеролитотрипсия справа со стентированием правого мочеточника. В периоперационном периоде в качестве гемостатической терапии проводились ежедневные трансфузии СЗП в объеме 600-700 мл/сут. Благодаря такой терапии перед операцией протромбин по Квику составил 47 %, АЧТВ 52 с. Однако после оперативного вмешательства у больного сохранялись болевой синдром, требовавший повторного введения спазмолитиков и анальгетиков, и гематурия, что расценили как следствие нарушения гемостаза, а не урологических причин. Гемостатическая терапия СЗП была продолжена в прежнем объеме, АЧТВ поддерживалось в пределах 50 с, протромбин по Квику — 45 %. Увеличение объема трансфузии СЗП представлялось опасным из-за возможного развития тампонады мочевого пузыря сгустками крови. Однако болевой синдром и макрогематурия сохранялись.
Учитывая высокий риск геморрагических периоперационных осложнений, при выборе метода лечения учитывали как урологические, так и гематологические факторы, поэтому 16 ноября 2018 г. больному была выполнена контактная лазерная уретеролитотрипсия справа со стентированием правого мочеточника. В периоперационном периоде в качестве гемостатической терапии проводились ежедневные трансфузии СЗП в объеме 600-700 мл/сут. Благодаря такой терапии перед операцией протромбин по Квику составил 47 %, АЧТВ 52 с. Однако после оперативного вмешательства у больного сохранялись болевой синдром, требовавший повторного введения спазмолитиков и анальгетиков, и гематурия, что расценили как следствие нарушения гемостаза, а не урологических причин. Гемостатическая терапия СЗП была продолжена в прежнем объеме, АЧТВ поддерживалось в пределах 50 с, протромбин по Квику — 45 %. Увеличение объема трансфузии СЗП представлялось опасным из-за возможного развития тампонады мочевого пузыря сгустками крови. Однако болевой синдром и макрогематурия сохранялись. В связи с нефункциональным стентом 26.11.2018 выполнена процедура удаления стента правого мочеточника, который оказался частично тромбирован. Гемостатическая терапия была отменена. Состояние больного стабилизировалось, был выписан, приступил к трудовой деятельности.
В связи с нефункциональным стентом 26.11.2018 выполнена процедура удаления стента правого мочеточника, который оказался частично тромбирован. Гемостатическая терапия была отменена. Состояние больного стабилизировалось, был выписан, приступил к трудовой деятельности.
Срок наблюдения за больным составляет 7 лет.
Рисунок 3. Интегральные тесты больного Л. А. Тромбоэластограмма с цельной цитратной кровью. Б. Ротационная тромбоэластометрия (EXTEM, INTEM)
Figure 3. Integral hemostatic tests of patient L. A. Thromboelastogram with whole citrate blood. Б. Rotational thromboelastometry (EXTEM, INTEM)
Рисунок 4. Геморрагический синдром у больного Л. с наследственным дефицитом фактора свертывания крови V. А. Обширная гематома медиальной области бедра справа. Б. Гематома области локтевого сустава с переходом на предплечье
Figure 4. Hemorrhagic syndrome in patient L. with congenital FV deficiency. А. Extensive hematoma of medial area of a hip on the right. Б. Hematoma of the elbow joint with the transition to the forearm
with congenital FV deficiency. А. Extensive hematoma of medial area of a hip on the right. Б. Hematoma of the elbow joint with the transition to the forearm
Клиническое наблюдение 2
Больная Р. в детском возрасте отмечала спонтанное появление синяков на коже туловища и конечностей, носовые кровотечения. Менструации дебютировали в возрасте 15 лет, они были обильные, продолжительные, менструальный цикл — нерегулярный. В 2011 г., в возрасте 20 лет, она пребывала на стационарном лечении в гинекологическом отделении с диагнозом: «Острый двусторонний сальпингоофорит с нарушением менструальной функции. Эктопия шейки матки. Хронический цервицит. Хронический эндометрит. Кистозно-измененные яичники». Проводилась консервативная терапия с положительным эффектом. При обследовании на тот момент АЧТВ составляло 43 с, фибриноген 2,4 г/л, тромбиновое время (ТВ) 19 с, протромбин по Квику колебался от 16,5 до 58 %. Однако, несмотря на выявленные нарушения гемостаза, больная не была консультирована гематологом.
В 2014 г. проведена криодеструкция эрозии шейки матки, геморрагических осложнений не было. В 20142015 гг. с целью регуляции менструальных кровопотерь по рекомендации гинеколога использовала гормональные интравагинальные препараты, принимала гормональные оральные контрацептивы, однако в дальнейшем отказалась от их приема из-за выраженных побочных эффектов, проявлявшихся головными болями, сменами настроения. Семейный анамнез по кровоточивости не отягощен.
В 2015 г., в возрасте 24 лет, в связи с подозрением на болезнь Виллебранда она была направлена для обследования в отдел коагулопатий НМИЦ гематологии. Основной жалобой на момент обращения были скудные кровянистые выделения из половых путей в течение трех месяцев. При обследовании у больной АЧТВ было 35 с, фибриноген 3,5 г/л, протромбин по Квику 53 %, ТВ 15 с, плазменная активность FII 103 %, FV 23 %, FVII 172 %, FX 107 %, FVIII 122 %, FW 180 %, XIIa-зависимый фибринолиз 8 мин, агрегация тромбоцитов с АДФ 83 %, агрегация тромбоцитов с ристомицином 88 %, агрегация тромбоцитов с коллагеном 85 %, агрегация тромбоцитов с адреналином 77 %.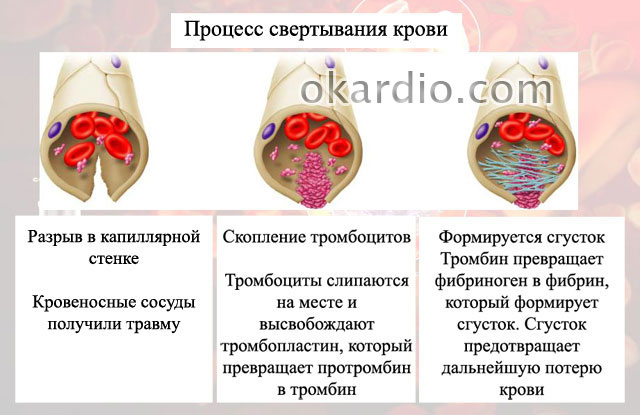 В общем анализе крови концентрация гемоглобина была 115 г/л, эритроцитов 4,4 х 1012/л, тромбоцитов 308 х 109/л, лейкоцитов 8,1 х 109/л. Биохимические показатели крови были в пределах нормальных значений. Таким образом, лабораторные данные позволили исключить диагноз «болезнь Виллебранда» и предположить наличие у больной наследственного дефицита FV.
В общем анализе крови концентрация гемоглобина была 115 г/л, эритроцитов 4,4 х 1012/л, тромбоцитов 308 х 109/л, лейкоцитов 8,1 х 109/л. Биохимические показатели крови были в пределах нормальных значений. Таким образом, лабораторные данные позволили исключить диагноз «болезнь Виллебранда» и предположить наличие у больной наследственного дефицита FV.
С целью генетического подтверждения диагноза в лаборатории генной инженерии НМИЦ гематологии выполнен анализ первичной структуры функционально значимых участков гена FV больной Р. Секвенирование выявило наличие гетерозиготной миссенс-мутации в экзоне 13: CD684 TGT-TAT (Cys684Tyr). Согласно Human Gene Mutation Database (HGMD) [17] данная мутация была описана впервые китайскими авторами в 2008 г. [20].
По данным УЗИ малого таза патологии не было выявлено. На основании осмотра гинекологом диагностированы дисфункция яичников, маточное кровотечение.
Таким образом, на основании лабораторных, клинических и анамнестических данных был диагностирован наследственный дефицит FV, легкая форма.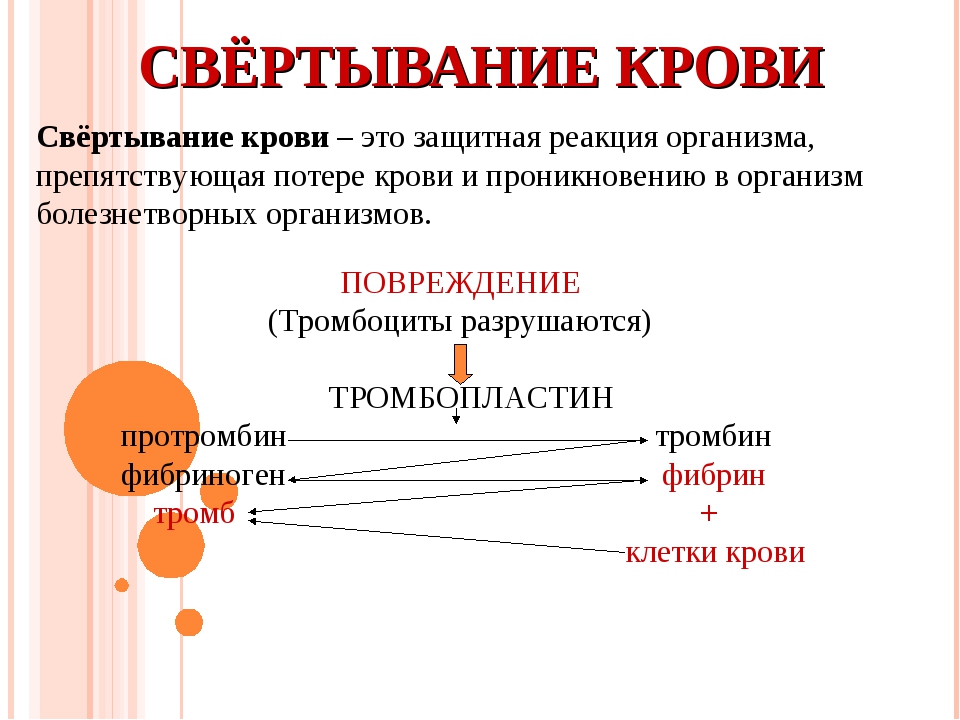 Проведена гемостатическая терапия эптаког альфа (активированным) 3,6 мг в/в (60 мкг/ кг массы тела) без побочных реакций. Назначена антифибринолитическая терапия транексамом 500 мг х 3 раза в день, ангиотропная терапия этамзилатом (дициноном) 250 мг х 4 раза в день. В результате удалось скорректировать менструальный цикл.
Проведена гемостатическая терапия эптаког альфа (активированным) 3,6 мг в/в (60 мкг/ кг массы тела) без побочных реакций. Назначена антифибринолитическая терапия транексамом 500 мг х 3 раза в день, ангиотропная терапия этамзилатом (дициноном) 250 мг х 4 раза в день. В результате удалось скорректировать менструальный цикл.
Через полтора года больная повторно обратилась с жалобами на обильные менструации продолжительностью до 10 дней. Гемостатическую терапию в течение этих полутора лет не проводила. Проведенное обследование не выявило значительных изменений по сравнению с предыдущими результатами. Активность FV в плазме составила 34 %, протромбин по Квику 53 %, АЧТВ 36 с. Концентрация гемоглобина крови повысилась до 125 г/л.
Были выполнены вискоэластичные тесты оценки гемостаза: ТЭГ и РОТЭМ. По данным ТЭГ показатели начального тромбообразования, динамики свертывания крови, плотности тромба и скорости его лизиса были в пределах референсных значений. По данным РОТЭМ тесты внутреннего (INTEM) и внешнего (EXTEM) путей свертывания крови также были в пределах нормальных значений (рис. 5). Больной возобновлена антифибринолитическая и ангиотропная терапия. На этом фоне отмечено уменьшение менструальной кровопотери.
5). Больной возобновлена антифибринолитическая и ангиотропная терапия. На этом фоне отмечено уменьшение менструальной кровопотери.
Рисунок 5. Интегральные гемостатические тесты больной Р. А. Нативная тромбоэластограмма с цельной цитратной кровью. Б. Ротационная тромбоэластометрия (EXTEM, INTEM)
Figure 5. Integral hemostatic tests of patient R. A. Thromboelastogram with whole citrate blood. Б. Rotational thromboelastometry (EXTEM, INTEM)
При обращении в январе 2018 г. жалоб не предъявляла, менструации были умеренные, длились 10 дней. По лабораторным данным: АЧТВ 38 с, протромбин по Квику 65 %, плазменная активность FV 41,6 %. В общем анализе крови: гемоглобин 127 г/л, тромбоциты 268 х 109/л, лейкоциты 6,47 х 109/л.
Срок наблюдения за больной составляет 4 года.
Клиническое наблюдение 3
Больная И. впервые обратилась в отдел коагулопа- тий НМИЦ гематологии в 2018 г. в возрасте 19 лет с жалобами на нарушения менструального цикла, постоянные кровянистые выделения из половых путей, носовые кровотечения, легкое образование синяков. Впервые наследственный дефицит фактора свертывания крови V был диагностирован у нее в 2005 г. в возрасте 7 лет в г. Санкт-Петербурге. Наблюдалась по месту жительства в г. Череповце.
в возрасте 19 лет с жалобами на нарушения менструального цикла, постоянные кровянистые выделения из половых путей, носовые кровотечения, легкое образование синяков. Впервые наследственный дефицит фактора свертывания крови V был диагностирован у нее в 2005 г. в возрасте 7 лет в г. Санкт-Петербурге. Наблюдалась по месту жительства в г. Череповце.
Анамнез по кровоточивости у больной был осложнен. После рождения наблюдалось длительное заживление пупочной ранки. При прорезывании зубов отмечалась кровоточивость. В возрасте 1 года находилась на лечении в реанимационном отделении в связи с ЖКК, осуществлялись трансфузии эритроцитной массы, аминокапроновой кислоты. В возрасте 3 лет после травмы, которую она получила при катании на качелях, кровотечение из раны продолжалось в течение 3 дней, что наряду с проводимой гемостатической терапией (аминокапроновая кислота, гемостатическая губка) потребовало наложения скоб. В возрасте 4 лет была госпитализирована по поводу эрозивного гастрита. В период с 5 до 10 лет отмечались рецидивирующие гематурии, в связи с чем 12 раз была госпитализирована. В результате геморрагического синдрома у больной развилась постгеморрагическая анемия (концентрация гемоглобина крови 38 г/л). Осуществлялись трансфузии СЗП, эритроцитной массы. В возрасте 17 лет развилась обширная гематома голени и стопы после падения, что также потребовало госпитализации и проведения гемостатической терапии СЗП. Трехкратно выполняли удаление зубов, при этом проводилась гемостатическая терапия СЗП, гемостатической губкой.
В результате геморрагического синдрома у больной развилась постгеморрагическая анемия (концентрация гемоглобина крови 38 г/л). Осуществлялись трансфузии СЗП, эритроцитной массы. В возрасте 17 лет развилась обширная гематома голени и стопы после падения, что также потребовало госпитализации и проведения гемостатической терапии СЗП. Трехкратно выполняли удаление зубов, при этом проводилась гемостатическая терапия СЗП, гемостатической губкой.
Гинекологический анамнез. Менструации — с 11 лет, обильные, цикл — нерегулярный. Многократно пребывала в гинекологических стационарах. В возрасте 12 лет ей была назначена заместительная гормональная терапия эстроген-гестагенными препаратами, которую продолжает по настоящее время. В 2011 г. госпитализировалась в Измайловскую детскую клиническую больницу (г. Москва) в связи с маточным кровотечением, где ей выполняли трансфузии СЗП, вводили эптаког альфа (активированный) с некоторым положительным эффектом. С 2016 г. по настоящее время — многократные госпитализации в связи с маточными кровотечениями, проводилась терапия СЗП, эптакогом альфа (активированным). Сопутствующими проблемами проведения гемостатической терапии являлись реакции на введение СЗП, трудности обеспечения венозного доступа. В 2017 г. на фоне массивной гемотрансфузионной терапии развился флебит левой локтевой вены. В свою очередь, постоянные кровопотери приводили к ане- мизации больной и необходимости курсового проведения терапии препаратами железа.
Сопутствующими проблемами проведения гемостатической терапии являлись реакции на введение СЗП, трудности обеспечения венозного доступа. В 2017 г. на фоне массивной гемотрансфузионной терапии развился флебит левой локтевой вены. В свою очередь, постоянные кровопотери приводили к ане- мизации больной и необходимости курсового проведения терапии препаратами железа.
Семейный анамнез по кровоточивости не отягощен; родственный брак родителей отрицает.
В 2019 г. в связи с регулярной необходимостью проведения гемостатической терапии и отсутствием венозного доступа встал вопрос о необходимости установки порт-системы. С этой целью больная была госпитализирована в НМИЦ гематологии. При обследовании: АЧТВ 176 с, фибриноген 3,8 г/л, протромбин по Квику 11 %, МНО 5,19, ТВ 15,6 с, плазменная активность FII 89,1 %, FV 0,4 %, FVII 110 %, FVIII 183 %, FIX 84, 9 %, FX 119 %, FXI 76,6 %, FXII 114 %, FW 120 %, FXIII 65,7 %, ингибитор к FV не выявлен. В общем анализе крови: концентрация гемоглобина 119 г/л, эритроцитов 4,46 х 1012/л, тромбоцитов 247 х 109/л, лейкоцитов 7,9 х 109/л. Биохимические показатели были в пределах нормальных значений. Выполнены тесты РОТЭМ, в которых гипокоагуляция была обнаружена как в тесте EXTEM (EXTEMСT 484 с, норма 38-79, EXTEMcft 201 с, норма 34-159), так и INTEM (INTEMСT 2290 с, норма 38-79), СFT 519 с, норма 34-159), что объясняется участием FV в свертывании как по внешнему пути, отражающемуся в тесте ЕХТЕМ, так и в свертывании по внутреннему пути, что отражается на тесте INTEM (рис. 6 А).
Биохимические показатели были в пределах нормальных значений. Выполнены тесты РОТЭМ, в которых гипокоагуляция была обнаружена как в тесте EXTEM (EXTEMСT 484 с, норма 38-79, EXTEMcft 201 с, норма 34-159), так и INTEM (INTEMСT 2290 с, норма 38-79), СFT 519 с, норма 34-159), что объясняется участием FV в свертывании как по внешнему пути, отражающемуся в тесте ЕХТЕМ, так и в свертывании по внутреннему пути, что отражается на тесте INTEM (рис. 6 А).
Учитывая выраженную гипокоагуляцию, перед операцией больной была осуществлена трансфузия 800 мл СЗП и 4 доз концентрата тромбоцитов, после чего был достигнут гемостаз, произведена катетеризация правой внутренней яремной вены и под кожу на грудной клетке имплантирован резервуар порт-системы. В результате гемостатической терапии к началу операции имплантации порт-системы отмечено сокращение АЧТВ до 42 с, увеличение протромбина по Квику до 47 %, плазменной активности FV до 20 %. Показатель EXTEMСT сократился до 116 с, EXTEMСFT до 55 с, INTEMСT до 268 с, INTEMСFT до 78 с (рис. 6Б). На вторые сутки осуществлена повторная трансфузия концентрата тромбоцитов. Гемостатическая терапия СЗП была продолжена в течение 6 дней. Геморрагических осложнений, признаков гематомы в области установки резервуара порт-системы не отмечалось. Больная была выписана домой в г. Череповец.
6Б). На вторые сутки осуществлена повторная трансфузия концентрата тромбоцитов. Гемостатическая терапия СЗП была продолжена в течение 6 дней. Геморрагических осложнений, признаков гематомы в области установки резервуара порт-системы не отмечалось. Больная была выписана домой в г. Череповец.
Рисунок 6. Интегральные гемостатические тесты больной И. А. Ротационная тромбоэластометрия (EXTEM) до операции Б. Ротационная тромбоэластометрия (EXTEM) через 30 минут после введения СЗП и концентрата тромбоцитов
Figure 6. Integral hemostatic tests of patient I. A. Rotational thromboelastometry (EXTEMj before surgery. Б. Rotational thromboelastometry (EXTEMj 30 minutes after FFP and platelet concentrate administration
Обсуждение
Вопросы диагностики редких наследственных коагулопатий заслуживают особенного внимания. Удлинение АЧТВ и снижение протромбина по Квику могут быть признаками нарушения функции печени, коагулопатии потребления, наследственных дефицитов факторов свертывания крови или наличия ингибиторов к факторам свертывания крови. Дифференциальная диагностика требует расширенного лабораторного исследования параметров внутреннего и внешнего путей свертывания крови.
Дифференциальная диагностика требует расширенного лабораторного исследования параметров внутреннего и внешнего путей свертывания крови.
При заболеваниях печени, сопровождающихся развитием печеночной недостаточности, отмечается уменьшение плазменной концентрации фибриногена, протромбина по Квику, однако плазменная активность FVIII часто повышена.
Коагулопатия потребления — это состояние гиперкоагуляции, развивающееся вследствие различных причин и характеризующееся снижением активности факторов свертывания в плазме крови. Примерами коагулопатий потребления могут быть гестационная коагулопатия, синдром диссеминированного внутри- сосудистого свертывания.
Редкие наследственные коагулопатии характеризуются изолированным снижением активности какого- либо фактора свертывания крови. Степень уменьшения активности фактора свертывания крови может быть различной — от легкой до тяжелой. Это, в свою очередь, по-разному влияет на изменения параметров гемостаза. В первом и третьем клинических наблюдениях плазменная активность FV составляла менее 1 %, протромбин по Квику был снижен до 12 %, АЧТВ составляло более 150 с. Во втором клиническом наблюдении плазменная активность FV составляла 34 %, протромбин по Квику 54 %, а АЧТВ оставалось в пределах нормальных значений. Среди редких наследственных коагулопатий частота сочетанного дефицита факторов V и VIII составляет 3-11 % [12, 13, 24]. Поэтому определение активности FVIII является обязательным для дифференциальной диагностики наследственного дефицита FV. Сочетанный дефицит факторов V и VIII также имеет аутосомно-рецессивный тип наследования. Однако молекулярные основы связаны с наличием мутаций в генах LMANl (Lectin Mannose Binding Protein) или MCFD2 (Multiple Coagulation Factor Deficiency 2), что приводит к дефициту протеинового комплекса, являющегося карго-рецептором транспортировки FV и FVIII от эндоплазматического ретику- лума к комплексу Гольджи [24-26]. Характер клинических проявлений не позволяет идентифицировать эти наследственные коагулопатии, а гемостатическая терапия имеет свои отличия.
Во втором клиническом наблюдении плазменная активность FV составляла 34 %, протромбин по Квику 54 %, а АЧТВ оставалось в пределах нормальных значений. Среди редких наследственных коагулопатий частота сочетанного дефицита факторов V и VIII составляет 3-11 % [12, 13, 24]. Поэтому определение активности FVIII является обязательным для дифференциальной диагностики наследственного дефицита FV. Сочетанный дефицит факторов V и VIII также имеет аутосомно-рецессивный тип наследования. Однако молекулярные основы связаны с наличием мутаций в генах LMANl (Lectin Mannose Binding Protein) или MCFD2 (Multiple Coagulation Factor Deficiency 2), что приводит к дефициту протеинового комплекса, являющегося карго-рецептором транспортировки FV и FVIII от эндоплазматического ретику- лума к комплексу Гольджи [24-26]. Характер клинических проявлений не позволяет идентифицировать эти наследственные коагулопатии, а гемостатическая терапия имеет свои отличия.
Наконец, дифференциальный диагноз следует проводить между наследственным и приобретенным дефицитом FV. В литературе описано около 159 случаев приобретенного дефицита FV [20, 27]. Причины появления ингибитора к FV остаются неизвестными. Обнаружение ингибитора к FV часто ассоциируется с хирургическими процедурами, использованием антибактериальных препаратов, аутоиммунными, онкологическими, инфекционными заболеваниями (туберкулез, ВИЧ). Согласно исследованию Viroj Wiwanitkit [28], из 33 случаев диагностики приобретенного дефицита FV ингибитор к FV был обнаружен у 3 больных с инфекционными заболеваниями, у 3 — с онкологическими заболеваниями, у 2 — с аутоиммунными заболеваниями. У 12 больных предполагается лекарственно-индуцированный генез приобретенного дефицита FV; у 13 — вероятная причина не установлена. Приобретенный дефицит FV чаще диагностируется в зрелом или пожилом возрасте, характеризуется отсутствием семейного геморрагического анамнеза. В отличие от приобретенного дефицита наследственный дефицит FV дебютирует кровотечениями в детском и молодом возрасте, у ряда больных можно выявить семейный характер кровоточивости, родственные браки в генеалогическом древе.
В литературе описано около 159 случаев приобретенного дефицита FV [20, 27]. Причины появления ингибитора к FV остаются неизвестными. Обнаружение ингибитора к FV часто ассоциируется с хирургическими процедурами, использованием антибактериальных препаратов, аутоиммунными, онкологическими, инфекционными заболеваниями (туберкулез, ВИЧ). Согласно исследованию Viroj Wiwanitkit [28], из 33 случаев диагностики приобретенного дефицита FV ингибитор к FV был обнаружен у 3 больных с инфекционными заболеваниями, у 3 — с онкологическими заболеваниями, у 2 — с аутоиммунными заболеваниями. У 12 больных предполагается лекарственно-индуцированный генез приобретенного дефицита FV; у 13 — вероятная причина не установлена. Приобретенный дефицит FV чаще диагностируется в зрелом или пожилом возрасте, характеризуется отсутствием семейного геморрагического анамнеза. В отличие от приобретенного дефицита наследственный дефицит FV дебютирует кровотечениями в детском и молодом возрасте, у ряда больных можно выявить семейный характер кровоточивости, родственные браки в генеалогическом древе. Лабораторным дифференциальным диагностическим критерием является отсутствие нормализации АЧТВ в тестах со смешением исследуемой и нормальной донорской плазм (1:1) и измерением остаточной активности FV в единицах Бетезды [20].
Лабораторным дифференциальным диагностическим критерием является отсутствие нормализации АЧТВ в тестах со смешением исследуемой и нормальной донорской плазм (1:1) и измерением остаточной активности FV в единицах Бетезды [20].
Одним из дискуссионных вопросов является корреляция между активностью FV в плазме и интенсивностью геморрагических проявлений. Приведенные в настоящей работе клинические наблюдения демонстрируют соответствие лабораторных данных клиническим проявлениям. Больные в первом и третьем клинических наблюдениях с тяжелой формой FV имели тяжелые клинические проявления с жизнеугрожающими кровотечениями в анамнезе, больная с легкой формой дефицита FV (клиническое наблюдение 2) — легкие клинические проявления. Однако в различных исследованиях показано, что некоторые больные с тяжелой формой дефицита FV (<1 %) могут быть асимптомны или иметь легкой/средней тяжести клинические проявления, в то время как у больных с легкой формой дефицита FV случаются жизнеугрожающие кровотечения [18, 29]. Описан случай, демонстрирующий различные клинические проявления тяжелого дефицита FV у 2 сиблингов. У одного из них заболевание дебютировало в возрасте 3 недель ЖКК, в дальнейшем клинический фенотип характеризовался редким скудным кожно-слизистым геморрагическим синдромом. У его брата заболевание дебютировало с умбиликального кровотечения при рождении, далее в возрасте 3 месяцев стали возникать спонтанные гемартрозы левого коленного сустава, в 4 месяца — субдуральная гематома слева и фронтальная экстрадуральная гематома нетравматического генеза. Больному проводилась профилактическая заместительная гемостатическая терапия СЗП в течение длительного времени [30].
Описан случай, демонстрирующий различные клинические проявления тяжелого дефицита FV у 2 сиблингов. У одного из них заболевание дебютировало в возрасте 3 недель ЖКК, в дальнейшем клинический фенотип характеризовался редким скудным кожно-слизистым геморрагическим синдромом. У его брата заболевание дебютировало с умбиликального кровотечения при рождении, далее в возрасте 3 месяцев стали возникать спонтанные гемартрозы левого коленного сустава, в 4 месяца — субдуральная гематома слева и фронтальная экстрадуральная гематома нетравматического генеза. Больному проводилась профилактическая заместительная гемостатическая терапия СЗП в течение длительного времени [30].
Другим важным клиническим аспектом являются акушерские проблемы. Клиническая картина дефицита FV имеет гендерные отличия, что обусловлено рисками кровопотери во время менструального цикла и родоразрешения у женщин. Причем кровопо- теря во время родов является ведущим акушерским осложнением [31], в то время как взаимосвязь дефицита FV и невынашивания беременности остается дискутабельной. M. Naderi и соавт. [11] опубликовали данные о заболевании дефицитом FV в двух областях Южного Ирана (Sistance and Baluchestan Province) численностью 2 700 000 человек. В этих двух областях дефицитом FV страдают 40 человек — 19 женщин и 21 мужчина, причем 8 из 19 женщин имели беременности, у 6 из которых случались один или более спонтанные аборты [11]. В другом исследовании, в которое было включено 5 больных женщин, страдавших тяжелой и средней тяжести формой заболевания, у 3 акушерский анамнез был отягощен невынашиванием беременности [32]. Принимая во внимание эти факты, необходимо гематологическое сопровождение на этапах планирования, ведения беременности, родоразрешения и в послеродовом периоде. Учитывая молодой возраст больных женщин в описанных клинических случаях, ожидаемыми являются вопросы, связанные с планированием семьи и возможной беременностью.
M. Naderi и соавт. [11] опубликовали данные о заболевании дефицитом FV в двух областях Южного Ирана (Sistance and Baluchestan Province) численностью 2 700 000 человек. В этих двух областях дефицитом FV страдают 40 человек — 19 женщин и 21 мужчина, причем 8 из 19 женщин имели беременности, у 6 из которых случались один или более спонтанные аборты [11]. В другом исследовании, в которое было включено 5 больных женщин, страдавших тяжелой и средней тяжести формой заболевания, у 3 акушерский анамнез был отягощен невынашиванием беременности [32]. Принимая во внимание эти факты, необходимо гематологическое сопровождение на этапах планирования, ведения беременности, родоразрешения и в послеродовом периоде. Учитывая молодой возраст больных женщин в описанных клинических случаях, ожидаемыми являются вопросы, связанные с планированием семьи и возможной беременностью.
Таким образом, наиболее распространенными наследственными коагулопатиями являются гемофилия и болезнь Виллебранда. Часто редкие наследственные коагулопатии, в том числе наследственный дефицит FV, клинически проявляются маской болезни Виллебранда. Это требует проведения дифференциальной диагностики на основании расширенных параметров коагулограммы. Интегральные гемостатические пробы не являются чувствительными к легкой форме заболевания. Достоверным лабораторным диагностическим критерием является снижение плазменной активности FV. Генетические исследования не являются рутинными, но могут быть использованы для подтверждения диагноза. Несмотря на соответствие клинических проявлений и тяжести заболевания по лабораторным данным в описанных случаях, степень снижения активности FV не всегда является предиктором клинических проявлений. Больные с наследственным дефицитом FV требуют пожизненного наблюдения гематологом с целью контроля спонтанного или индуцированного травмой геморрагического синдрома, планирования гемостатической терапии при необходимости хирургических вмешательств, ведении беременности и родоразрешении.
Это требует проведения дифференциальной диагностики на основании расширенных параметров коагулограммы. Интегральные гемостатические пробы не являются чувствительными к легкой форме заболевания. Достоверным лабораторным диагностическим критерием является снижение плазменной активности FV. Генетические исследования не являются рутинными, но могут быть использованы для подтверждения диагноза. Несмотря на соответствие клинических проявлений и тяжести заболевания по лабораторным данным в описанных случаях, степень снижения активности FV не всегда является предиктором клинических проявлений. Больные с наследственным дефицитом FV требуют пожизненного наблюдения гематологом с целью контроля спонтанного или индуцированного травмой геморрагического синдрома, планирования гемостатической терапии при необходимости хирургических вмешательств, ведении беременности и родоразрешении.
COVID, тромбоз и тромбодинамика
Новый тест нарушения свертывания крови поможет лечить пациентов с COVID-19
Тромбодинамика — тест для ранней диагностики нарушений системы свертывания крови, выявления рисков кровотечений и тромбообразования. Разработчик теста — компания «ГемаКор Лабс» (резидент «Сколково»).
Разработчик теста — компания «ГемаКор Лабс» (резидент «Сколково»).
Еще в самом начале пандемии COVID-19 китайские медики в Ухане заметили нарушение механизма свертывания крови, особенно у тяжелых больных. У пациентов отмечалось активное тромбообразование, то есть формирование в артериях и венах сгустков крови. Тромбоз, как выяснилось,— одно из наиболее распространенных осложнений коронавирусной инфекции, которое часто приводит к гибели больных. Первая скончавшаяся в России пациентка с коронавирусом умерла именно из-за двусторонней тромбоэмболии легочной артерии.
В России первым, кто заинтересовался проблемой тромбозов при коронавирусной инфекции, был член-корреспондент РАН, профессор МГУ им. М. В. Ломоносова Фазли Атауллаханов, который организовал исследование по оценке состояния свертывания крови у пациентов с диагнозом COVID-19 в российских клиниках и привлек в качестве добровольцев несколько десятков молодых врачей, в том числе студентов и сотрудников Сколковского института науки и технологий (Сколтеха). Исследуя свертывание крови различными способами, можно вовремя обнаружить начало процесса гиперкоагуляции и значительного тромбирования сосудов и назначить пациенту антикоагулянты (препараты, уменьшающие свертываемость крови), прежде всего гепарин. Для отслеживания процессов коагуляции профессор Атауллаханов решил воспользоваться инновационным прибором для исследования крови «Регистратор тромбодинамики», разработанным компанией «ГемаКор» и портфельной компанией «Роснано», который позволяет точно определить состояние гиперкоагуляции.
Исследуя свертывание крови различными способами, можно вовремя обнаружить начало процесса гиперкоагуляции и значительного тромбирования сосудов и назначить пациенту антикоагулянты (препараты, уменьшающие свертываемость крови), прежде всего гепарин. Для отслеживания процессов коагуляции профессор Атауллаханов решил воспользоваться инновационным прибором для исследования крови «Регистратор тромбодинамики», разработанным компанией «ГемаКор» и портфельной компанией «Роснано», который позволяет точно определить состояние гиперкоагуляции.
«Наш метод тромбодинамики относится к числу лабораторных тестов, но принципиально от них отличается,— рассказывает гендиректор “ГемаКора” Илья Спиридонов.— В обычных, или рутинных, тестах, которые сейчас применяются в
клинике, кровь или плазма смешиваются в пробирке с различными активаторами свертывания, а затем замеряется время, за которое кровь свернулась. Но ведь в организме кровь начинает сворачиваться там, где есть какое-то повреждение кровеносных сосудов, и тромб растет от места повреждения. То есть в пространственном смысле это очень неоднородный процесс. В нашем тесте используется локализованный активатор свертывания. На него нанесен ровно тот белок, который экспонируется в просвет сосуда в месте повреждения стенки, там, где есть ранка. И от этого места у нас в кювете начинает расти тромб точно так же, как от места повреждения он начинает расти в сосуде. Оценив с помощью видеомикроскопии скорость, с какой растет сгусток, его плотность, максимальный размер и период, в течение которого он начал расти, мы можем предсказать склонность пациента к тромботическим осложнениям».
То есть в пространственном смысле это очень неоднородный процесс. В нашем тесте используется локализованный активатор свертывания. На него нанесен ровно тот белок, который экспонируется в просвет сосуда в месте повреждения стенки, там, где есть ранка. И от этого места у нас в кювете начинает расти тромб точно так же, как от места повреждения он начинает расти в сосуде. Оценив с помощью видеомикроскопии скорость, с какой растет сгусток, его плотность, максимальный размер и период, в течение которого он начал расти, мы можем предсказать склонность пациента к тромботическим осложнениям».
Кроме того, метод тромбодинамики помогает подобрать оптимальную дозу антикоагулянтов. Если в момент, когда действие препарата заканчивается, провести тромбодинамику, можно понять, удалось ли нормализовать коагуляцию. Для тяжелых больных COVID-19 это особенно актуально. «Видимо, сам коронавирус является очень прокоагулянтным по своему действию, потому что воспаляет сосудистую стенку и дает мощную активацию системы свертывания и стандартные дозы антикоагулянтов в некоторых случаях могут быть неадекватны»,— подчеркивает Илья Спиридонов.
«Регистратор тромбодинамики» был зарегистрирован Росздравнадзором еще в конце 2012 года и сегодня используется примерно в 200 клиниках. В 2015-м начались продажи в Европу, в 2019-м — в США, а недавно был подписан дистрибуторский контракт с одной из стран Азии. В прошлом году в Россию и за рубеж было поставлено около 100 тыс. тест-систем.
«Регистратор тромбодинамики» используется для определения гиперкоагуляции при самых разных патологиях, а будет ли он широко применяться в лечении COVID-19, как раз и покажет проводимое профессором Атауллахановым исследование. Недавно закончилась его наблюдательная часть, проходившая на базе десяти больниц с участием тысячи пациентов с коронавирусной инфекцией. Она показала, что метод позволяет выделить группу пациентов, которые подлежат более тщательному наблюдению по поводу тромботических явлений.
Сейчас планируется вторая, интервенционная часть исследования: одна группа больных коронавирусом будет лечиться стандартными дозами гепаринов, а для второй подбор дозы будет осуществляться методом тромбодинамики. Если метод окажется эффективным в подборе и корректировке дозы, его применение, как надеются исследователи, позволит значительно сократить число как тяжелых случаев COVID-19, так и смертельных исходов. Для проведения этого этапа исследования открыт сбор средств на краудфандинговой платформе «Планета».
Если метод окажется эффективным в подборе и корректировке дозы, его применение, как надеются исследователи, позволит значительно сократить число как тяжелых случаев COVID-19, так и смертельных исходов. Для проведения этого этапа исследования открыт сбор средств на краудфандинговой платформе «Планета».
Источник: kommersant.ru
Нарушение свёртываемости крови — Медкор
Свёртывающая система крови (система гемокоагуляции) –
многоступенчатая ферментная система, при активации которой растворенный в плазме крови фибриноген подвергается после отщепления краевых пептидов полимеризации и образует в кровеносных сосудах фибринные тромбы, останавливающие кровотечение.
В физиологических условиях в свёртывающей системе крови уравновешены процессы активации и торможения, в результате сохраняется жидкое состояние крови. Локальная активация свёртывающей системы крови, происходящая в местах повреждения кровеносных сосудов, способствует остановке кровотечения.
Активация свёртывающей системы крови в сочетании с агрегацией клеток крови (тромбоцитов, эритроцитов) играет существенную роль в развитии локального тромбоза при нарушениях гемодинамики и реологических свойств крови, изменениях ее вязкости, воспалительных (например, при васкулитах) и дистрофических изменениях стенок кровеносных сосудов.
Множественный рецидивирующий тромбоз у лиц молодого и среднего возраста может быть связан с врожденными (наследственными) аномалиями свёртывающей системы крови и системы фибринолиза, в первую очередь со снижением активности основных физиологических антикоагулянтов (антитромбина III, белков. С и S и др.), необходимых для поддержания циркулирующей крови в жидком состояния.
Важная физиологическая функция свёртывающей системы крови состоит также в том, что она путем массивного тромбирования микрососудов в зоне воспаления, вокруг очагов инфекционной деструкции тканей, а также асептического некроза отграничивает эти очаги, препятствует диссеминации инфекции, ослабляет поступление в общий кровоток бактериальных токсинов и продуктов распада тканей.
Вместе с тем избыточное и чрезмерно распространенное диссеминированное свертывание крови приводит к развитию тромбогеморрагического синдрома – патологического процесса, являющегося важным компонентом патогенеза большого числа заболеваний, критических и терминальных состояний. В связи с этим распознавание нарушений свертываемости крови и их коррекция имеют большое значение в медицинской практике.
Молекулярно-генетическая диагностика нарушений в системе гемостаза
ЧТО ТАКОЕ ГЕМОСТАЗ?
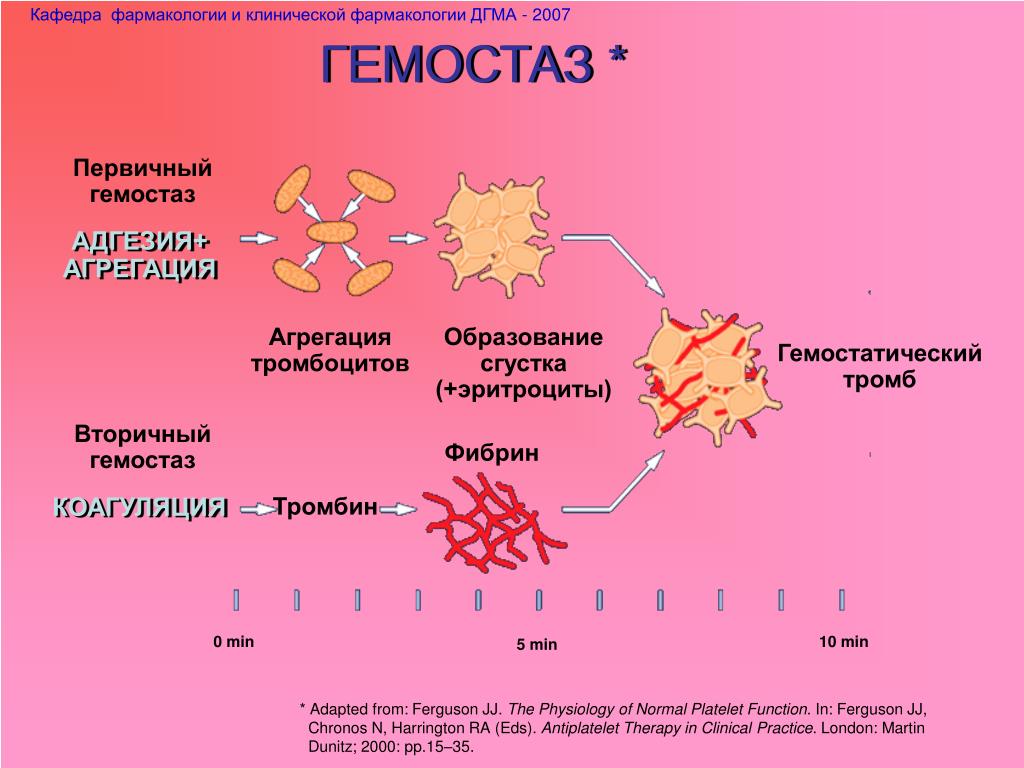
Гемостаз — это сложный процесс, который предотвращает или останавливает истечение крови из просвета сосуда, обеспечивает возникновение свертка фибрина, необходимого для восстановления целостности ткани, и, наконец, удаляет фибрин, когда нужда в нем отпадает.
ЗАЧЕМ НУЖНА СИСТЕМА ГЕМОСТАЗА?
Система гемостаза осуществляет две основные функции:
1.поддержание в жидком состоянии крови, протекающей в кровеносных сосудах,
2. быстрое реагирование на повреждение сосудов (свертывание крови при нарушении целостности сосудистой стенки, образование тромбов для остановки кровотечения и, тем самым, прекращение кровотечения и сохранение объема и состава крови.).
быстрое реагирование на повреждение сосудов (свертывание крови при нарушении целостности сосудистой стенки, образование тромбов для остановки кровотечения и, тем самым, прекращение кровотечения и сохранение объема и состава крови.).
Система гемостаза многокомпонентна. В ней участвуют тромбоциты и другие клетки крови, сосудистая стенка, экстраваскулярная ткань, биологически активные вещества (тромбоцитарно-сосудистый гемостаз), плазменные, тканевые факторы свертывания крови (коагуляционный гемостаз), находящиеся в тесном взаимодействии с противосвертывающей, фибринолитической и калликреин-кининовой системами.
Нарушение любого из этих компонентов ведет к патологии гемостаза:
гипокоагуляция — снижение свертывания крови, проявляется кровоточивостью,
гиперкоагуляция — повышение свертывания крови, проявляется тромбозами,
тромбофилия — склонность к образованию тромбов.
ЧЕМ ОПАСНА ТРОМБОФИЛИЯ?
Тромбофилия — патологическое состояние организма, характеризующееся повышенной склонностью к внутрисосудистому тромбообразованию вследствие врожденного, наследственного или приобретенного нарушения системы гемостаза, приводящего к утрате одной из ее основных функций — поддержания циркулирующей крови в жидком состоянии.
Тромбофилия играет важную роль в патогенезе целого спектра заболеваний и патологических состояний. Причем у многих людей, имеющих склонность к тромбозам, симптомы заболеваний зачастую не проявляются или проходят незамеченными при отсутствии других дополнительных факторов риска.
Если проанализировать структуру осложнений, приводящих к фатальным последствиям, станет очевидным, что одной из главных причин смерти населения являются тромбозы. По оценке экспертов, у каждого десятого человека в течение жизни возникают сердечно-сосудистые заболевания: артериальная гипертензия, атеросклероз сосудов, острый инфаркт миокарда, ишемический инсульт. В развитии этих заболеваний важную роль играют тромботические процессы.
ЧТО ТАКОЕ ТРОМБОЭМБОЛИЯ?
Это состояние, при котором образовавшийся в кровеносном сосуде тромб отрывается от стенки сосуда, переносится с током крови и закупоривает другой сосуд, прекращая кровоток в нем. Чаще всего данный термин применяется в связи с флеботромбозом (образованием тромбов в венах) и эмболией легких (ТЭЛА – тромбоэмболия легочной артерии). У пациентов с сердечно-сосудистыми заболеваниями тромбоэмболия легочной артерии (ТЭЛА) встречается в 15-30% случаев. Смертность от ТЭЛА составляет 1 на 1000 человек в год. Смертность при нелеченной ТЭЛА достигает 30%, однако адекватная антикоагулянтная терапия позволяет снизить ее до 2-8%.
У пациентов с сердечно-сосудистыми заболеваниями тромбоэмболия легочной артерии (ТЭЛА) встречается в 15-30% случаев. Смертность от ТЭЛА составляет 1 на 1000 человек в год. Смертность при нелеченной ТЭЛА достигает 30%, однако адекватная антикоагулянтная терапия позволяет снизить ее до 2-8%.
Послеоперационные венозные тромбозы и эмболии составляют при операциях на брюшной полости 29%, в ортопедии при переломе бедра-53%, в нейрохирургии-29%. при инфаркте миокарда венозные тромбозы наблюдаются в 30-40% случаев, при застойной сердечной недостаточности — в 12%. при инсульте — почти в 75%.
На протяжении многих лет тромбоэмболические осложнения считались непредотвратимыми, так как внезапность и чрезвычайно высокая скорость развития патологического процесса не позволяют в большинстве случаев эффективно предотвращать тяжелые последствия. Однако с внедрением в клиническую практику новых технологий по выявлению генетически обусловленных дефектов гомеостаза (генетических маркеров), нарушающих функционирование врожденных механизмов защиты от тромбозов, появилась возможность своевременной диагностики и профилактики тромболитических осложнений.
ПОЧЕМУ ВОЗНИКАЮТ НАРУШЕНИЯ В СИСТЕМЕ ГЕМОСТАЗА?
К нарушениям гемостаза приводит ряд причин: побочные эффекты лекарственных воздействий, табакокурение, неправильное питание, течение хронических вирусных инфекций, хронические заболевания, течение беременности.
Важнейшая роль в развитии тромбозов принадлежит наследственно обусловленным генетическим мутациям (полиморфизмам) факторов свертывания крови.
КАКИЕ АНАЛИЗЫ НЕОБХОДИМЫ ДЛЯ ОЦЕНКИ СОСТОЯНИЯ СИСТЕМЫ ГЕМОСТАЗА?
Нарушение свертываемости крови при синдроме Хагемана
Анестезиолог-реаниматолог Юлия Егорова о синдроме нарушения свертывания крови, который повышает риск тромбозов и спонтанных выкидышей
Дефицит фактора Хагемана (XII фактор свертывания крови) — это редкое (около 1:1 000 000 населения) и наследственно обусловленное нарушение коагуляционного гемостаза. Наследуется этот дефект преимущественно аутосомно-рецессивно, но в единичных случаях — более тяжелых — выявляется аутосомно-доминантное наследование. В иммунологических исследованиях было показано, что синдром Хагемана характеризуется сниженным синтезом фактора Хагемана, а не образованием его аномальных молекул.
В иммунологических исследованиях было показано, что синдром Хагемана характеризуется сниженным синтезом фактора Хагемана, а не образованием его аномальных молекул.
В 1954 году в Кливленде (США) гематолог Оскар Ратнов наблюдал пациента Джона Хагемана 37 лет со значительно увеличенным временем кровотечения. Обратив внимание на то, что, несмотря на изменения в коагуляции, пациент перенес хирургическую операцию без значительного кровотечения, Ратнов совместно с биохимиком Эрлом Дэйви установил, какого именно белка не хватало в плазме у этого пациента, заподозрив в этом причину нарушения свертываемости крови. Этот сложный белок и был назван фактором Хагемана, а после того как английский гематолог Роберт Макфарлан в 1964 г. сформулировал каскадную теорию гемостаза, занял в ней место как 12‑й фактор свертывания.
Кровотечение — одно из самых опасных для организма состояний, защита организма от него должна быть как надежной, так и саморегулирующейся, чтобы остановка кровотечения не переходила в распространенный тромбоз. Эту роль выполняют сразу несколько систем — клеточная (тромбоцитарный гемостаз) и сложная система белков плазмы, состоящая из многих взаимосвязанных факторов свертывания:
Эту роль выполняют сразу несколько систем — клеточная (тромбоцитарный гемостаз) и сложная система белков плазмы, состоящая из многих взаимосвязанных факторов свертывания:
- I — Фибриноген
- II — Протромбин
- III — Тканевой тромбопластин
- IV — Ионы кальция
- V — Проакцелерин
- VI — Акцелерин — изъят из классификации, так как является
активированным V фактором - VII — Проконвертин
- VIII — Антигемофильный фактор
- IX — Фактор Кристмаса
- X — Фактор Стюарта—Прауэра
- XI — Плазменный предшественник тромбопластина
- XII — Фактор Хагемана
- XIII — Фибринстабилизирующий фактор
- Фактор Флетчера — плазменный прекалликреин
- Фактор Фитцжеральда — высокомолекулярный кининоген
- Фактор Виллебранда — опосредует связывание тромбоцитов с субэндотелием
Фактор Хагемана — сиалогликопротеин — сложное органическое соединение, помимо белковой части включающее в себя олигосахарид и сиаловые кислоты. Сиалогликопротеин синтезируется в печени, далее свободно и «без дела» циркулирует в плазме крови, пока не соприкоснется с отрицательно заряженными поверхностями, например, коллагеном поврежденной ткани или с калликреином, о котором стоит рассказать подробнее.
Сиалогликопротеин синтезируется в печени, далее свободно и «без дела» циркулирует в плазме крови, пока не соприкоснется с отрицательно заряженными поверхностями, например, коллагеном поврежденной ткани или с калликреином, о котором стоит рассказать подробнее.
Калликреин — один из основных функциональных элементов сложной калликреин-кининовой системы, регулирующей процессы воспаления, свертывания крови, микроциркуляции и функции сосудистой стенки.
Фактор Хагемана, активированный повреждением ткани, участвует в запуске калликреин-кининовой системы, превращая прекалликреин в калликреин, а калликреин в свою очередь активирует все новые молекулы фактора Хагемана.
Получается петля для каскадного нарастания процесса. За счет этого небольшое количество поврежденных тканей вызывает реакцию в значительной части плазмы крови.
Кроме того, на 12 фактор (Хагемана) в активной форме действует 13 фактор (фибринстабилизирующий фактор), что запускает каскад биохимических реакций среди молекул, исходно присутствовавших в крови, — внутренний путь коагуляции. В отличие от внутреннего пути, внешний запускается попаданием в кровь тканевого тромбопластина из поврежденных тканей.
В отличие от внутреннего пути, внешний запускается попаданием в кровь тканевого тромбопластина из поврежденных тканей.
Таким образом, фактор Хагемана оказывается связующим звеном между процессами воспаления и свертывания крови; до его открытия связь этих процессов была гипотетической.
Клиническая картина
Клинически дефицит 12 фактора свертывания крови проявляется удлинением времени кровотечения без каких‑либо других симптомов нарушения гемостаза. Выраженность удлинения времени кровотечения зависит от типа наследования генетического дефекта. При доминантном типе дефицит выражен сильнее, при рецессивном — частично компенсируется другими факторами свертывания. Время кровотечения увеличено из‑за замедленной инициации каскадной системы свертывания крови. Склонности к патологическим кровотечениям пациенты не проявляют, поэтому заболевание часто не обнаруживают или обнаруживают случайно при лабораторном обследовании или предоперационном скрининге.
Немного парадоксальным кажется то, что при дефиците фактора свертывания проявляют себя не кровотечения, а тромбозы. Например, Джон Хагеман, по имени которого назван фактор свертывания, впоследствии погиб от тромбоэмболии, которой осложнился перелом костей таза. Современные опубликованные клинические случаи оперативных вмешательств у пациентов с синдромом Хагемана, к счастью, заканчивались благополучно. Тромбофилические нарушения связаны с тем, что XII фактор участвует в разрушении тромбов путем активации калликреин-кининовой системы. Активный калликреин не только запускает генерацию кининов, регулирующих воспаление, сосудистый тонус и болевые реакции, но и превращает неактивный белок плазминоген в активный фермент плазмин (фибринолизин), который и растворяет фибриновую часть тромба. Поэтому с дефицитом фактора Хагемана ассоциированы:
Например, Джон Хагеман, по имени которого назван фактор свертывания, впоследствии погиб от тромбоэмболии, которой осложнился перелом костей таза. Современные опубликованные клинические случаи оперативных вмешательств у пациентов с синдромом Хагемана, к счастью, заканчивались благополучно. Тромбофилические нарушения связаны с тем, что XII фактор участвует в разрушении тромбов путем активации калликреин-кининовой системы. Активный калликреин не только запускает генерацию кининов, регулирующих воспаление, сосудистый тонус и болевые реакции, но и превращает неактивный белок плазминоген в активный фермент плазмин (фибринолизин), который и растворяет фибриновую часть тромба. Поэтому с дефицитом фактора Хагемана ассоциированы:
- тромбозы
- мигрирующие тромбофлебиты
- тромбоэмболии
- инфаркты
- спонтанные аборты
Диагноз и прогноз
Кроме лабораторных исследований установить диагноз помогут анамнестические данные: склонность к длительным кровотечениям и тромботическим осложнениям у пациента и его родственников, а также положительный симптом Румпеля — Лееде (появление мелкоточечных кровоизлияний дистально от наложенного на плечо жгута). Прогноз при дефиците фактора Хагемана в большинстве случаев благоприятный, лечение не требуется. Коррекции это состояние требует только в связи с хирургическими вмешательствами. В качестве подготовки к операции может быть назначено переливание небольших доз свежезамороженной плазмы.
Прогноз при дефиците фактора Хагемана в большинстве случаев благоприятный, лечение не требуется. Коррекции это состояние требует только в связи с хирургическими вмешательствами. В качестве подготовки к операции может быть назначено переливание небольших доз свежезамороженной плазмы.
Период выведения донорского XII фактора — 48–56 ч. Также при наличии этой коагулопатии следует уделять большее внимание профилактике тромботических осложнений: профилактическая компрессия нижних конечностей, УЗИ-контроль состояния вен нижних конечностей и малого таза, особенно при длительном постельном режиме. В послеоперационном периоде для профилактики тромбозов необходимо назначение низкомолекулярных гепаринов, а для терапии кровотечений — отказ от применения ингибиторов фибринолиза, таких как аминокапроновая и транексамовая кислота.
Источники
- Пантелеев М. А., Атауллаханов Ф. И. Свертывание крови: биохимические основы // Клиническая онкогематология. 2008. № 1. URL: http://cyberleninka.
 ru/article/n/svertyvanie-krovi-biohimicheskie-osnovy
ru/article/n/svertyvanie-krovi-biohimicheskie-osnovy - Литвицкий П. Ф. Патология системы гемостаза // Вопросы современной педиатрии. 2014. № 2. URL: http://cyberleninka.ru/article/n/patologiya-sistemy-gemostaza
- Шулутко А. М., Крылов А. Ю., Просолов Н. В., Петровская А. А. Периоперационное ведение пациента с недостаточностью XII фактора (болезнь Хагемана) //Московский хирургический журнал. 2015. № 4 (44). URL: http://www.mossj.ru/journal/MOSSJ_2015/MXG_2015_04.pdf
Исследование системы гемостаза (коагулограмма) в диагностическом центре «МедиСкан» в Домодедово
Значение анализа: коагулограмма (лат. coagulatio свертывание, сгущение + греч, gramma линия, изображение) или гемостазиограмма — сложный комплексный анализ. Врач оценивает не столько каждый конкретный показатель в отдельности, сколько цельную картину свертывания крови.
Забор крови
Не допускается в течение 8 часов (желательно 12) до сдачи анализов прием пищи, в том числе, сок, чай, кофе, алкоголь. Можно пить воду. Забор крови на гемостазиограмму проводится в специальные пробирки с голубой крышкой, содержащие цитрат натрия. Цитрат натрия связывает ионы кальция и предотвращает процесс свертывания крови. Кровь необходимо набирать точно до метки, нанесенной на пробирку. При нарушении соотношения кровь-цитрат интерпретация тестов затруднительна. После забора кровь тщательно и аккуратно перемешивается с цитратом без резкого встряхивания. При сдаче гемостазиограммы на фоне или после приема лекарственных препаратов влияющих на свертывание крови, их необходимо обязательно указывать в направительном бланке.
Можно пить воду. Забор крови на гемостазиограмму проводится в специальные пробирки с голубой крышкой, содержащие цитрат натрия. Цитрат натрия связывает ионы кальция и предотвращает процесс свертывания крови. Кровь необходимо набирать точно до метки, нанесенной на пробирку. При нарушении соотношения кровь-цитрат интерпретация тестов затруднительна. После забора кровь тщательно и аккуратно перемешивается с цитратом без резкого встряхивания. При сдаче гемостазиограммы на фоне или после приема лекарственных препаратов влияющих на свертывание крови, их необходимо обязательно указывать в направительном бланке.
Тесты коагулограммы
АЧТВ
АЧТВ (активированное частичное тромбопластиновое время). Тест на внутренний путь свертывания крови. В свертывании крови по внутреннему пути участвуют 3 витамин К- зависимых фактора (II, IX, X), фактор XII, высокомолекулярный кининоген (ВМК), прекалликреин (ПК), а также антигемофильные глобулины А (фактор VIII:C), В (фактор X) и С (фактор XI). Активация внутреннего пути в организме происходит при повреждении сосудистой стенки, контакте с чужеродной поверхностью, при избытке адреналина, биогенных аминов, циркулирующих иммунных комплексов и др. Снижение активности — при недостаточности факторов, в том числе антгемофильных глобулинов, избытке антикоагулянтов (гепарин, волчаночные антикоагулянты и др.).
Активация внутреннего пути в организме происходит при повреждении сосудистой стенки, контакте с чужеродной поверхностью, при избытке адреналина, биогенных аминов, циркулирующих иммунных комплексов и др. Снижение активности — при недостаточности факторов, в том числе антгемофильных глобулинов, избытке антикоагулянтов (гепарин, волчаночные антикоагулянты и др.).
Показания к исследованию:
- Скрининговый тест состояния свертывающей системы.
- Исследование патологии свертывания крови.
- Контроль гемостаза при лечении гепарином.
- Диагностика гемофилии.
- Диагностика антифосфолипидного синдрома.
Клиническая интерпретация
Укрочение АЧТВ — признак тромбофилии или синдрома ДВС. Удлинение АЧТВ: ДВС, снижение синтеза факторов свертывания при заболеваниях печени, массивные гемотрансфузии, введение гепарина (удлинение АЧТВ в 1,5-2 раза), дефицит факторов внутреннего пути, дефицит витамина К, присутствие ингибиторов свертывания, наличие волчаночного антикоагулянта (ВА), наличие гемофилии.
Протромбиновый тест (ПТ)
ПТ является тестом на внешний (быстрый) механизм гемокоагуляции. В свертывании крови по внешнему пути участвуют витамин К-зависимые факторы VII, Х, фактор V, и тканевой фактор (ТФ) или тканевой тромбопластин, который запускает реакцию свертывания крови. При физиологических условиях ТФ попадает в кровь из поврежденных или разрушенных клеток, в том числе лейкоцитов, макрофагов, клеток опухолей, и активирует процесс свертывания крови. Снижение активности наблюдается при недостатке факторов свертывания крови из-за естественного или индуцированного лекарствами снижения синтеза.
Проторомбиновый тест в коагулограмме выражается двумя показателями:
Активность факторов протромбинового комплекса по Квику в %.
Это принятый в мире способ выражения ПТ. Расчет проводится по калибровочному графику, построенному при разведении донорской (контрольной) плазмы. Не соответствует принятому только в России протромбиновому индексу (ПТИ).

Показания к исследованию:
- Скриниговый тест исследования свертывающей системы крови.
- Исследование патологии свертывания крови.
- Контроль гемостаза при лечении антикоагулянтами непрямого действия.
- Оценка синтеза в печени факторов протромбинового комплекса.
Клиническая интерпретация:
Повышение активности (увеличение %) — склонность к тромбофилии.
Снижение активности (снижение %):
- Наследственный или приобретенный дефицит I, II, V, VII и X факторов.
- Идиопатическая семейная гипопротромбинемия.
- Приобретенная и наследственная гипофибриногенемия.
- Дефицит витамина К в диете (II, VII, IХ и X факторы образуются в гепатоцитах в присутствии витамина К).
- Дефицит витамина К у матери (геморрагический диатез у новорожденного).
- Прием лекарственных средств — антагонистов витамина К (антикоагулянтов непрямого действия — варфарина и др.), и усиливающих их действие препаратов: анаболических стероидов, клофибрата, глюкагона, тироксина, индометацина, неомицина, оксифенбутазона, салицилатов; гепарина, урокиназы и др.
 ).
).
МНО (международное нормализованное отношение).
Используется только при лечении антикоагулянтами непрямого действия (варфарин и др.). Для скринига и оценки функции печени не используется.
Оптимальные пределы МНО, которые должны быть достигнуты в ходе лечения антикоагулянтами непрямого действия, зависят от терапевтических целей и определяются лечащим врачом.
МНО и протромбин по Квику коррелируют отрицательно — снижение протромбина по Квику соответствует повышению МНО.
При применении варфарина рекомендуется выполнять следующие правила:
- Применять варфарин в соответствии со сроком годности.
- При приеме варфарина ограничивать потребление витамина К.
- Отодвигать прием варфарина от приема пищи, т. к. препарат сорбируется пищей.
- Помнить, что ряд лекарственных средств тормозит действие препарата: барбитураты, кортикостероиды, пероральные контрацептивы, мепробамат и др.
Тромбиновое время
Тромбиновое время — это срок, в течение которого происходит превращение фибриногена в фибрин в цитратной плазме после добавления к ней тромбина. Скорость образования фибринового сгустка зависит, главным образом, от количества и функциональной полноценности фибриногена и присутствия в крови антикоагулянтов. Тест на конечный этап свертывания крови.
Скорость образования фибринового сгустка зависит, главным образом, от количества и функциональной полноценности фибриногена и присутствия в крови антикоагулянтов. Тест на конечный этап свертывания крови.
Показания к назначению исследования.
- Скриниговый тест исследования свертывающей системы крови.
- Определение дефицита или дефективности фибриногена.
- Оценка состояния пациента при диссеминированном внутрисосудистом свертывании (ДВС-синдроме).
- Снижение синтетической функции печени.
- Выявление присутствия в крови вторичных антикоагулянтов — продуктов деградации фибрина/фибриногена (ПДФ).
Клиническая интерпретация.
Укорочение — склонность к тромбофилии, риск тромбозов.
Удлинение: гипо- и дисфибриногенемия, наличие физиологических (гепарин) и патологических (ПДФ, моноклональные антитела) ингибиторов тромбина, парапротеинемия, уремия, иногда волчаночные антикоагулянты (ВА).
Фибриноген
Фибриноген — по международной номенклатуре фактор I (первый) свертывающей системы крови.![]() Вырабатывается печенью и поступает в кровь. Под действием тромбина растворимый фибриноген превращается в нерастворимый фибрин, который и составляет основу сгустка. Образование фибрина проходит несколько этапов (образование мономеров фибрина, полимеризация, стабилизация сгустка).
Вырабатывается печенью и поступает в кровь. Под действием тромбина растворимый фибриноген превращается в нерастворимый фибрин, который и составляет основу сгустка. Образование фибрина проходит несколько этапов (образование мономеров фибрина, полимеризация, стабилизация сгустка).
Фибриноген является белком острой фазы воспаления, поэтому повышается при воспалительных и некротических процессах, влияет на величину СОЭ (с повышением концентрации фибриногена скорость оседания эритроцитов увеличивается). Рост концентрации фибриногена в плазме повышает вязкость крови и коррелирует с увеличением риска тромботических осложнений сердечно-сосудистых заболеваний. В ходе беременности происходит физиологическое увеличение содержание фибриногена плазмы крови.
Показания к назначению анализа:
- Патология свертывания крови.
- Предоперационное обследование.
- Обследование при беременности.
- Наличие сердечно-сосудистой патологии.
Клиническая интерпретация.
Увеличение: воспаление, некроз, курение, заболевания почек, коллагенозы, новообразования, атеросклероз, введение эстрогенов (в том числе пероральных контроцептивов), беременность, др.
Снижение: врожденный дефицит, ДВС, печеночно-клеточная недостаточность, острый фибринолиз, лейкозы, инфекционный мононуклеоз, токсикоз беременности, змеиные яды, введение некоторых лекарственных препаратов (рептилаза, фибраты, фенобарбитал, анаболические гормоны, андрогены, вальпроевая кислота и др.) и фибринолитиков (стрептокиназа, урокиназа, актилизе и др.).
Антитромбин III (АТ III)
Антитромбин III — основной фермент противосвертывающей системы крови, на долю которого приходится до 75% антикоагулянтной активности. Это гликопротеин, который синтезируется в клетках печени. Без гепарина инактивация тромбина антитромбином III протекает медленно. При наличии гепарина процесс инактивации развертывается очень быстро. Поэтому АТ III называют плазменным кофактором гепарина. В случае значительного снижения уровня АТ III гепарин почти не оказывает своего антикоагулянтного действия. При уровне АТ III в плазме ниже 60% резко возрастает риск тромбозов.
В случае значительного снижения уровня АТ III гепарин почти не оказывает своего антикоагулянтного действия. При уровне АТ III в плазме ниже 60% резко возрастает риск тромбозов.
Показания к применению.
- Наследственный дефицит АТ III.
- Лечение гепарином профилактическое и при ДВС-синдроме.
- Хирургические вмешательства.
- Беременность и роды.
Клиническая интерпретация.
Повышение уровня: воспалительные процессы; острый гепатит; холестаз; дефицит витамина К; прием варфарина, острый панкреатит; менструация; прием анаболических стероидов.
Снижение уровня: нарушение синтеза в печени, быстрое потребление при введении гепарина в больших дозах, массивное образование тромбина (ДВС-синдром), врожденный дефицит, лечение L-аспарагиназой поздних гестозов, прием пероральных контроцептивов, 3 триместр беременности.
Фибринолитическая активность (ХЗФ)
Фибринолитическая активность — это скорость растворения фибринового сгустка плазмином и другими фибринолитиками, содержащимися в плазме крови. При определение фибринолиза традиционным эуглобулиновым методом тест у здорового человека длится 3-5 часов, что несовместимо с современными требованиями к лабораторным исследованиям. Поэтому в качестве теста для оценки скорости растворения фибрина отечественными производителями был предложен так называемый XIIа-зависимый или Хагеман-зависимый фибринолиз (фактор XII — это фактор Хагемана). Он проходит при активации контактной фазы каолином и у здорового человека длится всего 4-12 мин. Метод является базовым, так как чувствителен к различной патологии в плазменных протеолитических системах. При ДВС-синдроме начинается закономерное угнетение данного вида фибринолиза уже на 1 стадии. Тест также может применяться для оценки эффективности тромболитической терапии.
При определение фибринолиза традиционным эуглобулиновым методом тест у здорового человека длится 3-5 часов, что несовместимо с современными требованиями к лабораторным исследованиям. Поэтому в качестве теста для оценки скорости растворения фибрина отечественными производителями был предложен так называемый XIIа-зависимый или Хагеман-зависимый фибринолиз (фактор XII — это фактор Хагемана). Он проходит при активации контактной фазы каолином и у здорового человека длится всего 4-12 мин. Метод является базовым, так как чувствителен к различной патологии в плазменных протеолитических системах. При ДВС-синдроме начинается закономерное угнетение данного вида фибринолиза уже на 1 стадии. Тест также может применяться для оценки эффективности тромболитической терапии.
Клиническая интерпретация.
Активация фибринолиза (укорочение времени растворения сгустка) встречается достаточно редко и связано, как правило, со снижением уровня фибриногена или увеличением содержания плазминогена и его активаторов (панкреатит, онкологические заболевания, шок, цирроз печени, патология беременности, терминальные состояния и др. ).
).
Угнетение фибринолиза (удлинение времени растворения сгустка) отмечается при гиперфибриногенемии, врожденном снижении и дефекте плазминогена, гепаринотерапии, дефиците плазминогена и его факторов (рецидивирующие венозные тромбозы, системные васкулиты, сепсис, нефротический синдром, снижение синтеза плазминогена в печени), при нарушении активности плазменной калликреин-кининовой системы.
Оценка уровня тромбинемии (активации внутрисосоудистой системы свертывания крови)
У здорового человека в крови присутствует преимущественно фибриноген. Остальные промежуточные продукты превращения фибриногена в фибрин находятся в минимальном количестве. При ряде форм патологии, характеризующихся внутрисосудистым свертыванием крови (ДВС, тромбозы, тромбофилии) под действием свободного тромбина идет постоянный процесс трансформации фибриногена в фибрин и накопление фибрин-мономерных комплексов.
Активация фибринолиза сопровождается образованием продуктов деградации фибрина/фибриногена (ПДФ), которые взаимодействуют с фибрин-мономерами, увеличивая количество растворимых фибрин-мономерных комплексов (РФМК).
Специфическими продуктами деградации фибрина под действием плазмина и других фибринолитиков являются Д-димеры. Их концентрация в крови пропорциональна активности фибринолиза и количеству лизируемого фибрина.
Используемые лабораторные тесты
РФМК
Тест позволяет оценить количественно уровень растворимого фибрина плазмы, или, другими словами, уровень тромбинемии. Рост количества РФМК наблюдается при тромбозе, тромбофилими, на поздних сроках беременности в соответствии с ростом содержания фибриногена. Тест также может использоваться для оценки эффективности и достаточности антикоагулянтной терапии по конечному ее результату — ликвидации тромбинемии (полученные величины в пределах референтных значений).
Этаноловый тест
При повышении уровня тромбинемии и наличии в исследуемой плазме комплексов фибрин-мономеров с продуктами фибринолиза и фибриногеном под влиянием этанола образуется желеобразный сгусток (положительный результат, 1). Коррелирует с РФМК.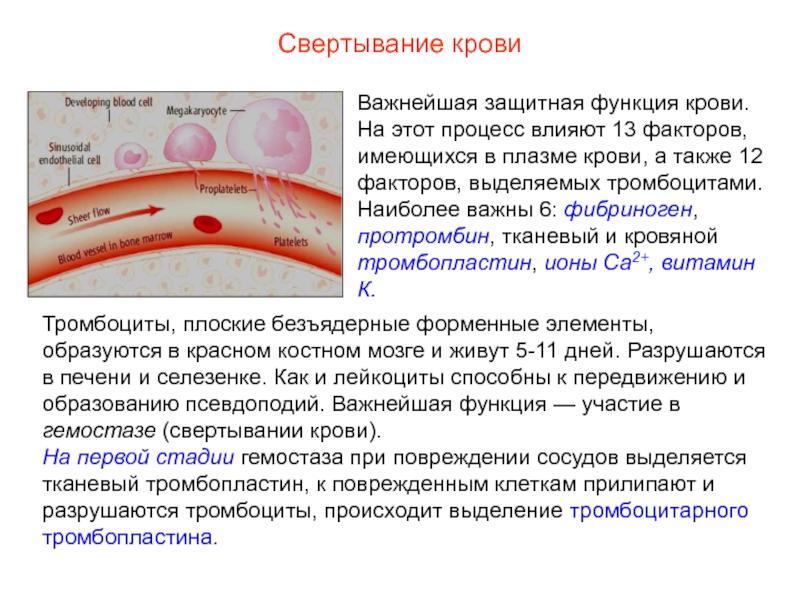 У здорового человека сгустка не образуется (тест отрицательный, 0).
У здорового человека сгустка не образуется (тест отрицательный, 0).
Д-димеры
Повышенный уровень D-димера обнаруживается при многочисленных состояниях, связанных с активацией коагуляции (синдром диссеминированного внутрисосудистого свертывания крови, тромбоз глубоких вен, тромбоэмболия легочной артерии, массивные повреждения тканей или хирургические операции, сердечная недостаточность, инфекции, воспаления, неопластические состояния).
Несмотря на ограниченную специфичность теста (около 50%), определение D-димера имеет преимущества по сравнению с измерением других маркеров коагуляции и фибринолиза, так как D-димер образуется только из конечного продукта превращения фибриногена в фибрин — нерастворимого фибрина, то есть он является продуктом лизиса тромба. При первичном фибринолизе и дисфибриногенемиях уровень D-димера не меняется.
На концентрацию D-димера в крови влияют такие факторы как величина тромба, время от начала клинических проявлений до назначения антикоагулянтной терапии и др.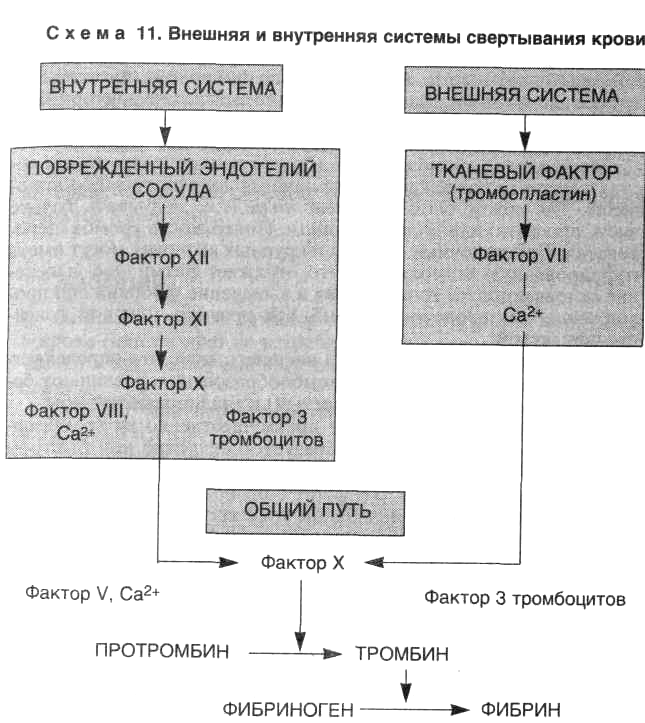 На фоне приема антикоагулянтов уровень D-димера постепенно снижается, а тромболитическая терапия вызывает повышение уровня D-димера.
На фоне приема антикоагулянтов уровень D-димера постепенно снижается, а тромболитическая терапия вызывает повышение уровня D-димера.
Для теста наиболее характерна отрицательная диагностическая значимость (около 100%), т. е. отрицательный результат с высокой долей вероятности позволяет исключить диагноз тромбоза.
У беременных женщин, начиная с ранних сроков беременности, уровень D-димера в крови постепенно повышается. К концу срока беременности значения его могут быть в 3-4 раза выше исходного уровня. Значительно более высокие показатели D-димера отмечаются у женщин с осложненным течением беременности (с гестозом, преэклампсией), а также у беременных, больных диабетом, заболеваниями почек.
Повышение уровня D-димера установлено у лиц старше 80 лет.
Показания к назначению анализа.
- Диагностика тромботических состояний. Тромбоз глубоких вен (тест исключения). Тромбэмболия легочной артерии (ТЭЛА).
- Синдром диссеминированного внутрисосудистого свертывания крови (ДВС).

- Осложненное течение беременности.
- Мониторинг тромболитической терапии.
Повышение уровня.
- Артериальные и венозные тромбы (в т. ч. тромбоз глубоких вен, тромбоэмболия легочной артерии).
- ДВС-синдром.
- Инфекции, сепсис.
- Воспаление (небольшое повышение).
- Болезни печени.
- Обширные гематомы.
- Наличие ревматоидного фактора.
- Беременность.
- Хирургические вмешательства.
- Возраст старше 80 лет.
- Онкологические заболевания.
- Тромболитическая терапия.
Суммарный средний индекс тромбогенности
Суммарный средний индекс тромбогенности (ССИТ) — это расчетный показатель, который позволяет оценить направление сдвига в системе гемостаза пациента, результат взаимодействия всех систем гемостаза: свертывающей, противосвертывающей, фибринолитической, антифибринолитической. При превышении референтных пределов (ССИТ > 1,1) пациент склонен к гиперкоагуляции, при снижении (ССИТ < 0,8) — к гипокоагуляции. Оценка результатов конкретных тестов позволяет определить, за счет каких механизмов гемостаза нарушилось равновесие и какие меры необходимо предпринять для его восстановления.
Оценка результатов конкретных тестов позволяет определить, за счет каких механизмов гемостаза нарушилось равновесие и какие меры необходимо предпринять для его восстановления.
любовь или ненависть – Наука – Коммерсантъ
Реакция нашего организма на появившуюся в кровотоке бактериальную инфекцию — комплексный ответ, в котором участвуют клетки и компоненты иммунной системы, системы свертывания крови, обязательно подключаются клетки эндотелия, выстилающие кровеносные сосуды, и все это дополняется ответами печени и эндокринной системы.
Даже реакция одной из перечисленных систем — системы свертывания крови — многосторонняя. Система свертывания крови традиционно делится на два взаимосвязанных звена — тромбоцитарное и плазменное. Тромбоцитарное свертывание — это активация, адгезия (прилипание) к поверхности и агрегация (слипание друг с другом) клеток — тромбоцитов. Плазменное свертывание — это последовательная активация белков-протеаз (ферменты, расщепляющие другие белки), приводящая к полимеризации белка плазмы крови фибриногена в длинные разветвленные нити фибрина и образованию сгустка (этот процесс напоминает образование желе).
На бактериальную инфекцию реагирует оба звена свертывания крови. Тромбоциты образуют агрегаты вокруг бактерий и могут их поглощать (фагоцитоз). Также тромбоциты «узнают» бактериальные паттерны и выпускают тромбоцитарные антимикробные вещества. Во всех перечисленных случаях тромбоциты запускают активацию иммунной системы организма. В свою очередь, бактерии образуют колонии на тромбоцитах и тромбах, таким образом закрепляясь в кровотоке. Свертывание плазмы не менее сложно взаимодействует с бактериальной инфекцией: кроме запуска от чужеродной поверхности — бактериальной стенки, образование фибринового сгустка запускается специфическими бактериальными протеазами, также подавляющими фибринолиз — физиологический процесс деградации тромбов. Причем все перечисленные ответы на молекулярном уровне специфичны для рода, а то и вида патогенных бактерий.
Наша команда, базирующаяся в Национальном медицинском исследовательском центре детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева, исследует все аспекты активации системы свертывания крови как при физиологических процессах, так и при патологии. Один из проектов, который мы вели несколько лет, был посвящен вопросам ответа системы свертывания крови на липополисахариды (ЛПС) — компоненты клеточной стенки грамотрицательных бактерий (например, кишечной палочки). Уровень этого ответа оказывается жизненно важным при острых бактериальных инфекциях, вызывающих спонтанную коагуляцию крови — диссеминированное внутрисосудистое свертывание (ДВС), когда слишком бурная реакция системы приводит к резкому снижению концентрации белков и тромбоцитов и, как следствие, геморрагии в сочетании с нарушением микроциркуляции в органах. В настоящее время в клинической практике лечение ДВС в зависимости от фазы проводится антиагрегантами (такими как аспирин), антикоагулянтами (производные гепарина), компонентами плазмы и тромбоконцентратами, то есть лечение не нормализует свертывание, а сдвигает баланс в сторону его ослабления или усиления (подробнее — «Практическая коагулология», ред. А. И. Воробьев, Москва, 2012). Понимание молекулярных механизмов реакции системы свертывания крови на бактерии позволит существенно улучшить современные подходы к терапии ДВС.
Один из проектов, который мы вели несколько лет, был посвящен вопросам ответа системы свертывания крови на липополисахариды (ЛПС) — компоненты клеточной стенки грамотрицательных бактерий (например, кишечной палочки). Уровень этого ответа оказывается жизненно важным при острых бактериальных инфекциях, вызывающих спонтанную коагуляцию крови — диссеминированное внутрисосудистое свертывание (ДВС), когда слишком бурная реакция системы приводит к резкому снижению концентрации белков и тромбоцитов и, как следствие, геморрагии в сочетании с нарушением микроциркуляции в органах. В настоящее время в клинической практике лечение ДВС в зависимости от фазы проводится антиагрегантами (такими как аспирин), антикоагулянтами (производные гепарина), компонентами плазмы и тромбоконцентратами, то есть лечение не нормализует свертывание, а сдвигает баланс в сторону его ослабления или усиления (подробнее — «Практическая коагулология», ред. А. И. Воробьев, Москва, 2012). Понимание молекулярных механизмов реакции системы свертывания крови на бактерии позволит существенно улучшить современные подходы к терапии ДВС.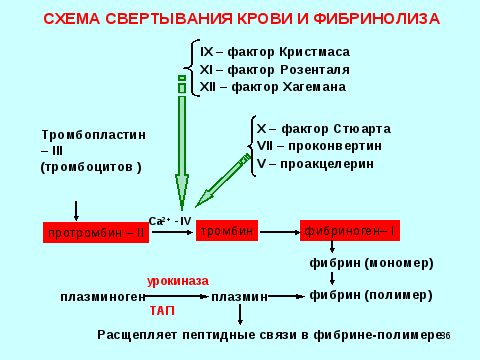
В этом проекте мы стартовали с взаимодействия плазменного звена свертывания крови с ЛПС. После нескольких серий экспериментов мы пришли к выводу, что воздействие ЛПС является достаточно слабым и сильно зависит от донора. При анализе данных с помощью компьютерного моделирования был сделан вывод, что свертывание крови может «стартовать» с образованных (в результате работы иммунной системы) агрегатов ЛПС, однако одиночные молекулы ЛПС, связываясь с белками-протеазами, скорее подавляют свертывание крови.
Отдельно рассматривались механизмы активации свертывания крови в результате вызванного бактериями воспаления, когда либо сами клетки эндотелия, либо клетки иммунной системы на своей поверхности выставляют белок — тканевый фактор, запускающий всю систему свертывания крови. С помощью компьютерного моделирования мы показали, что при гибели таких клеток, когда образуется множество мембранных везикул — «пузырьков» размером 10–100 нм, свертывание плазмы крови запускается наиболее интенсивно из-за повышенной аффинности («любви») протеаз свертывания к искривленной поверхности.
Клетки крови, тромбоциты, могут взаимодействовать с ЛПС через специальные белки-рецепторы на своей поверхности, так называемые Toll-подобные рецепторы. Кстати, такие же рецепторы отвечают за активацию ЛПС клеток иммунной системы и приводят к развитию воспаления. Однако, к нашему удивлению, для тромбоцитов прямой активации ЛПС мы не смогли идентифицировать, несмотря на наличие функциональных Toll-подобных рецепторов. После множества экспериментов в коллаборации с группой профессора С. П. Гамбаряна из Института эволюционной физиологии и биохимии им. И. М. Сеченова (Санкт-Петербург) мы показали, что ЛПС даже вызывают небольшое подавление активации тромбоцитов.
Таким образом, мы получили, что компоненты бактериальной клеточной стенки, липополисахариды, сами по себе либо не воздействуют на систему свертывания крови, либо вызывают подавление активации свертывания. Такое поведение — подавление свертывания крови — характерно для многих бактерий, ведь образование тромба вокруг бактерии может помешать ее распространению в организме. Описанная выше острая реакция на бактериальную инфекцию для случая кишечной палочки, скорее всего, связана с активацией системы свертывания в результате общего процесса воспаления, запущенного бактериями в организме. В настоящее время мы продолжаем изучение активации системы свертывания крови при воспалении и при других взаимодействиях с иммунной системой, по проектам, поддержанным РФФИ и РНФ, а также фонда «Врачи, инновации, наука — детям».
Описанная выше острая реакция на бактериальную инфекцию для случая кишечной палочки, скорее всего, связана с активацией системы свертывания в результате общего процесса воспаления, запущенного бактериями в организме. В настоящее время мы продолжаем изучение активации системы свертывания крови при воспалении и при других взаимодействиях с иммунной системой, по проектам, поддержанным РФФИ и РНФ, а также фонда «Врачи, инновации, наука — детям».
Результаты получены в рамках проекта «Выявление мишеней для фармакологического воздействия на свертывание крови при бактериальной инфекции», поддержанного совместно РФФИ и правительством Москвы.
Анастасия Свешникова, руководитель проекта, д.ф.-м.н., в.н.с. лаборатории клеточного гемостаза и тромбоза НМИЦ ДГОИ
Нарушения свертывания крови (состояния гиперкоагуляции)
Обзор
Доктор Джон Бартоломью обсуждает фактор V Лейдена, нарушение свертывания крови.
Образование сгустка крови
Когда вы порезаетесь или получаете травму, ваше тело останавливает кровотечение, образуя сгусток крови.Белки и частицы в крови, называемые тромбоцитами, слипаются, образуя сгусток крови. Процесс образования сгустка называется коагуляцией. Нормальная коагуляция важна во время травмы, поскольку она помогает остановить кровотечение из пореза и запустить процесс заживления.
Однако кровь не должна свертываться, когда она просто движется по телу. Если кровь имеет тенденцию к слишком сильному свертыванию, это называется состоянием гиперкоагуляции или тромбофилией.
Опасны ли состояния гиперкоагуляции?
Состояния гиперкоагуляции могут быть опасными, особенно если эти состояния не идентифицированы и не лечатся должным образом.Люди с гиперкоагуляцией имеют повышенный риск образования тромбов в артериях (кровеносных сосудах, которые отводят кровь от сердца) и венах (кровеносных сосудах, несущих кровь к сердцу). Сгусток внутри кровеносного сосуда также называется тромбом или эмболом.
Сгустки крови в венах или венозной системе могут перемещаться по кровотоку и вызывать тромбоз глубоких вен (сгусток крови в венах таза, ног, рук, печени, кишечника или почек) или легочную эмболию (сгусток крови в легких). ).
Сгустки крови в артериях могут увеличить риск инсульта, сердечного приступа, сильной боли в ногах, затруднений при ходьбе или даже потери конечности.
Симптомы и причины
Что вызывает состояния гиперкоагуляции?
Состояния гиперкоагуляции обычно являются генетическими (наследственными) или приобретенными состояниями.Генетическая форма этого расстройства означает, что человек рождается со склонностью к образованию тромбов. Приобретенные состояния обычно являются результатом хирургического вмешательства, травмы, приема лекарств или заболевания, которое увеличивает риск состояний гиперкоагуляции.
Унаследовано Условия гиперкоагуляции включают:
- Фактор V Лейден (самый распространенный)
- Мутация гена протромбина
- Дефицит природных белков, препятствующих свертыванию (таких как антитромбин, протеин C и протеин S)
- Повышенный уровень гомоцистеина
- Повышенный уровень фибриногена или дисфункционального фибриногена (дисфибриногенемия)
- Повышенный уровень фактора VIII (все еще исследуемый как наследственное заболевание) и других факторов, включая фактор IX и XI
- Аномальная фибринолитическая система, включая гипоплазминогенемию, дисплазминогенемию и повышение уровней ингибитора активатора плазминогена (PAI-1)
Приобретенные состояния гиперкоагуляции включают:
- Рак
- Некоторые лекарства, используемые для лечения рака, такие как тамоксифен, бевацизумаб, талидомид и леналидомид
- Недавняя травма или операция
- Установка центрального венозного катетера
- Ожирение
- Беременность
- Дополнительное употребление эстрогенов, включая оральные контрацептивы (противозачаточные таблетки)
- Заместительная гормональная терапия
- Длительный постельный режим или неподвижность
- Сердечный приступ, застойная сердечная недостаточность, инсульт и другие заболевания, приводящие к снижению активности
- Гепарин-индуцированная тромбоцитопения (снижение количества тромбоцитов в крови из-за гепарина или препаратов низкомолекулярного гепарина)
- Продолжительное путешествие на самолете, также известное как «синдром эконом-класса».

- Синдром антифосфолипидных антител
- Предыдущий анамнез тромбоза глубоких вен или тромбоэмболии легочной артерии
- Миелопролиферативные заболевания, такие как истинная полицитемия или эссенциальный тромбоцитоз
- Пароксизмальная ночная гемоглобинурия
- Синдром воспалительного кишечника
- ВИЧ / СПИД
- Нефротический синдром (слишком много белка в моче)
Диагностика и тесты
Как диагностируется состояние гиперкоагуляции?
Тщательный медицинский анамнез
Определенные условия повышают риск развития тромбов у человека, но не обязательно указывают на генетическое состояние гиперкоагуляции.Следовательно, необходима тщательная оценка личной и семейной истории болезни пациента.
Пациенты могут быть кандидатами на обследование на гиперкоагуляцию, если у них есть:
- Семейный анамнез аномального свертывания крови
- Аномальная свертываемость крови в молодом возрасте (до 50 лет)
- Тромбоз необычных участков или участков, таких как вены рук, печень (портал), кишечник (брыжеечный), почки (почечные) или головной мозг (церебральный)
- Сгустки крови без ясной причины (идиопатические)
- Повторяющиеся тромбы
- В анамнезе частые выкидыши
- Инсульт в молодом возрасте
Лабораторные испытания
Если у вас есть одно из перечисленных выше состояний, ваш врач может порекомендовать анализы крови для дальнейшей оценки вашего состояния.
Эти тесты должны выполняться в специализированной лаборатории свертывания крови и интерпретироваться патологом или клиницистом, имеющим опыт в области коагуляции, сосудистой медицины или гематологии.
В идеале анализы следует делать, когда у вас нет острого события свертывания крови.
Наиболее распространенные лабораторные тесты включают:
- PT-INR : Тест на протромбиновое время (PT или protime) используется для расчета вашего международного нормализованного отношения (INR). Эта информация используется для отслеживания вашего состояния, если вы принимаете варфарин (кумадин).Ваш INR поможет вашему лечащему врачу определить, насколько быстро ваша кровь свертывается и нужно ли изменить дозу варфарина (кумадина).
- Активированное частичное тромбопластиновое время (АЧТВ) : Измеряет время, необходимое для свертывания крови. Этот тест используется для контроля вашего состояния, если вы принимаете гепарин.
- Уровень фибриногена
- Общий анализ крови
Некоторые тесты помогают выявить синдром антифосфолипидных антител или дисфибриногенемии — состояния, которые могут быть связаны с состояниями гиперкоагуляции.
Тесты, используемые для диагностики наследственных состояний гиперкоагуляции, включают:
- Генетические тесты, включая фактор V Лейден (устойчивость к активированному протеину C) и мутацию гена протромбина (G20210A) *
- Активность антитромбина
- Активность протеина С
- Активность протеина S **
- Уровни гомоцистеина в плазме натощак
* Фактор V Лейден и мутация гена протромбина (G20210A) являются наиболее часто выявляемыми генетическими дефектами, повышающими риск свертывания крови у человека.
** Дополнительные лабораторные тесты, такие как измерение уровней свободного (активного) и общего антигена протеина S, могут потребоваться для подтверждения результатов анализа активности протеина S.
Другие тесты, используемые для диагностики приобретенных состояний гиперкоагуляции, включают тесты на:
- Антикардиолипиновые антитела (АСА) или бета-2 гликопротеины, которые являются частью синдрома антифосфолипидных антител *
- Волчаночные антикоагулянты (LA), часть синдрома антифосфолипидных антител *
- Антитела к гепарину (у пациентов, у которых снижается количество тромбоцитов при воздействии гепарина)
* Наличие антифосфолипидных антител (ACA) и волчаночного антикоагулянта (LA) важно при обследовании человека, у которого были повторные выкидыши и венозный или артериальный тромбоз.
Тестирование помогает определить, есть ли у пациента риск дальнейшего свертывания крови, и помогает определить соответствующий курс и продолжительность лечения, чтобы предотвратить образование тромбов в будущем. Тестирование также может помочь выявить родственников, у которых в настоящее время нет симптомов, но которые могут находиться в группе риска.
Ведение и лечение
Как лечат состояния гиперкоагуляции?
Антикоагулянтные препараты
В большинстве случаев лечение необходимо только тогда, когда тромб образуется в вене или артерии.Антикоагулянты снижают способность крови к свертыванию и предотвращают образование дополнительных сгустков.
Антикоагулянтные препараты включают:
- Варфарин (кумадин) выпускается в форме таблеток и принимается перорально (внутрь).

- Гепарин — это жидкое лекарство, которое вводится либо через внутривенную (IV) линию, по которой лекарство доставляется непосредственно в вену, либо путем подкожных (под кожей) инъекций, вводимых в больнице.
- Низкомолекулярный гепарин вводится подкожно один или два раза в день и может приниматься дома.
- Фондапаринукс (Арикстра) вводится подкожно.
Вы и ваша семья будете проинструктированы о том, как принимать прописанные антикоагулянты.
Ваш врач расскажет вам о преимуществах и рисках этих лекарств. Эта информация, наряду с вашим диагнозом, поможет определить тип антикоагулянта, который вы будете принимать, как долго вам нужно будет его принимать, а также тип необходимого последующего наблюдения.
Как и в случае с любым другим лекарством, важно знать, как и когда принимать антикоагулянт в соответствии с рекомендациями врача, а также часто сдавать анализы крови по назначению врача.
Если вам прописали варфарин (кумадин):
- Вам необходимо будет часто сдавать анализ крови, называемый PT-INR, чтобы оценить, насколько хорошо работает лекарство.
 Пожалуйста, соблюдайте все запланированные посещения лаборатории, чтобы можно было отслеживать вашу реакцию на лекарство. Ваши лекарства могут быть изменены или скорректированы в зависимости от результатов этого теста.
Пожалуйста, соблюдайте все запланированные посещения лаборатории, чтобы можно было отслеживать вашу реакцию на лекарство. Ваши лекарства могут быть изменены или скорректированы в зависимости от результатов этого теста. - Вам следует заказать и носить медицинский идентификационный браслет, чтобы вы могли получить надлежащую медицинскую помощь в случае возникновения чрезвычайной ситуации.
- При травме может возникнуть кровотечение или синяк. Позвоните своему врачу, если у вас сильное или необычное кровотечение или синяк.
- Некоторые лекарства, отпускаемые без рецепта (без рецепта), влияют на работу антикоагулянтов. Не принимайте никаких других лекарств, не посоветовавшись предварительно с врачом.
- Спросите своего врача о конкретных рекомендациях по питанию, которые вам необходимо соблюдать при приеме варфарина. Определенные продукты, например продукты с высоким содержанием витамина К (содержатся в брюссельской капусте, шпинате и брокколи), могут изменить действие лекарства.

- Не следует принимать варфарин (кумадин), если вы беременны или планируете забеременеть. Если да, спросите своего врача о переходе на другой тип антикоагулянтов. Доктора различаются по квалификации из-за разницы в обучении и опыте; больницы различаются по количеству доступных услуг. Чем сложнее ваша медицинская проблема, тем больше эти различия в качестве и тем больше они имеют значение.
Ресурсы
Лечащие врачи
Доктора различаются по квалификации из-за разной подготовки и опыта; больницы различаются по количеству доступных услуг.Чем сложнее ваша медицинская проблема, тем больше эти различия в качестве и тем больше они имеют значение.
Очевидно, что врач и больница, которые вы выберете для получения комплексной специализированной медицинской помощи, будут иметь прямое влияние на то, насколько хорошо вы себя чувствуете. Чтобы помочь вам сделать этот выбор, ознакомьтесь с результатами нашего Института сердца, сосудов и торакальной системы семьи Миллер.
Чтобы помочь вам сделать этот выбор, ознакомьтесь с результатами нашего Института сердца, сосудов и торакальной системы семьи Миллер.
Cleveland Clinic Heart, Vascular & Thoracic Institute Специалисты и хирурги сосудистой медицины
Выбор врача для лечения сосудистого заболевания зависит от того, на каком этапе диагностики и лечения вы находитесь.Следующие секции и отделения Института сердца, сосудов и торакальной хирургии лечат пациентов со всеми типами сосудистых заболеваний, включая нарушения свертывания крови:
Секция сосудистой медицины: для оценки, медицинского обслуживания или интервенционных процедур для лечения сосудистых заболеваний. Кроме того, неинвазивная лаборатория включает в себя современное оборудование для компьютерной визуализации, которое помогает диагностировать сосудистые заболевания без дополнительного дискомфорта для пациента. Позвоните на прием в сосудистую медицину по бесплатному телефону 800-223-2273, добавочный 44420 или запишитесь на прием через Интернет.
Отделение сосудистой хирургии: хирургическая оценка хирургического лечения сосудистых заболеваний, в том числе заболеваний аорты, периферических артерий и вен. Позвоните на прием в сосудистую хирургию по бесплатному телефону 800-223-2273, добавочный 44508 или запишитесь на прием через Интернет.
Вы также можете воспользоваться нашей консультацией MyConsult о втором мнении через Интернет. Институт сердца, сосудов и грудной клетки также имеет специализированные центры и клиники для лечения определенных групп пациентов:
Узнайте больше об экспертах, специализирующихся на диагностике и лечении сосудистых и артериальных заболеваний.
Контакт
Если вам нужна дополнительная информация, нажмите здесь, чтобы связаться с нами, пообщаться в чате с медсестрой или позвонить в Ресурсную и информационную медсестру Института сердечно-сосудистых заболеваний и торакальной хирургии семьи Миллер по телефону 216.445.9288 или по бесплатному телефону 866.289.6911. Будем рады вам помочь.
Будем рады вам помочь.
Стать пациентом
Варианты лечения
Дополнительную информацию о вариантах лечения сосудов можно найти по телефону:
Руководства по лечению
Диагностические тесты
Диагностические тесты используются для диагностики ишемической болезни сердца и наиболее эффективного метода лечения.
Веб-чаты
Наши веб-чаты и видеочаты дают пациентам и посетителям еще одну возможность задать вопросы и пообщаться с нашими врачами.
Видео
Интерактивные инструменты
Дополнительная информация и ресурсы
* В новом окне браузера откроется эта ссылка. Включение ссылок на другие веб-сайты не означает одобрения материалов на этих веб-сайтах или какой-либо связи с их операторами.
Почему стоит выбрать клинику Кливленда для лечения?
Наши результаты говорят сами за себя.Пожалуйста, ознакомьтесь с нашими фактами и цифрами, и если у вас есть какие-либо вопросы, не стесняйтесь их задавать.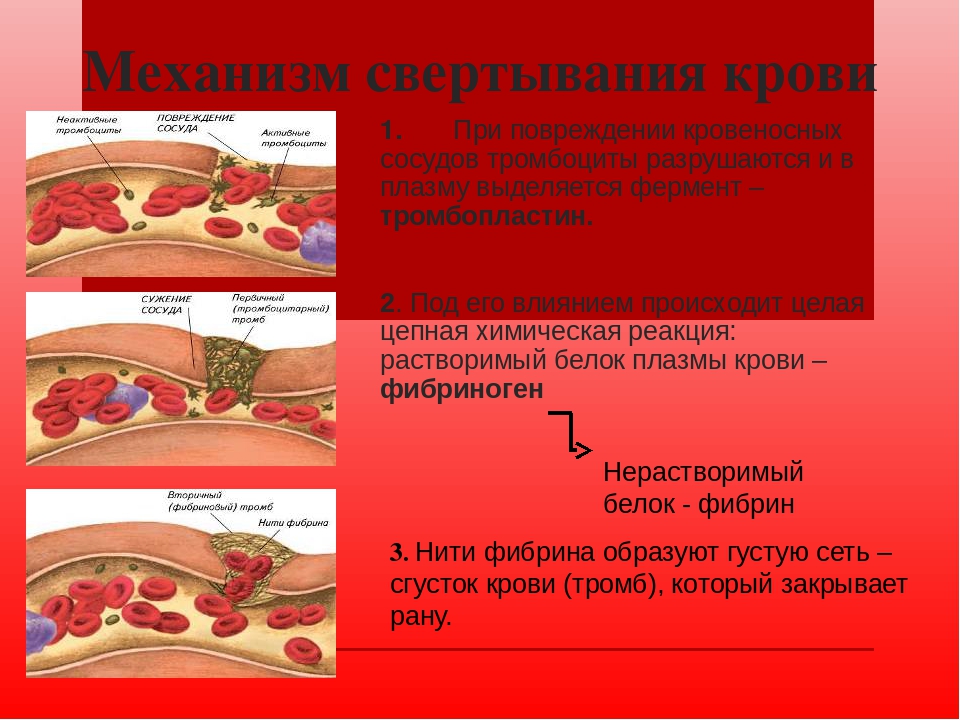
Нарушения свертывания крови (состояния гиперкоагуляции)
Обзор
Доктор Джон Бартоломью обсуждает фактор V Лейдена, нарушение свертывания крови.
Образование сгустка крови
Когда вы порезаетесь или получаете травму, ваше тело останавливает кровотечение, образуя сгусток крови. Белки и частицы в крови, называемые тромбоцитами, слипаются, образуя сгусток крови. Процесс образования сгустка называется коагуляцией. Нормальная коагуляция важна во время травмы, поскольку она помогает остановить кровотечение из пореза и запустить процесс заживления.
Однако кровь не должна свертываться, когда она просто движется по телу. Если кровь имеет тенденцию к слишком сильному свертыванию, это называется состоянием гиперкоагуляции или тромбофилией.
Опасны ли состояния гиперкоагуляции?
Состояния гиперкоагуляции могут быть опасными, особенно если эти состояния не идентифицированы и не лечатся должным образом. Люди с гиперкоагуляцией имеют повышенный риск образования тромбов в артериях (кровеносных сосудах, которые отводят кровь от сердца) и венах (кровеносных сосудах, несущих кровь к сердцу). Сгусток внутри кровеносного сосуда также называется тромбом или эмболом.
Сгустки крови в венах или венозной системе могут перемещаться по кровотоку и вызывать тромбоз глубоких вен (сгусток крови в венах таза, ног, рук, печени, кишечника или почек) или легочную эмболию (сгусток крови в легких). ).
Сгустки крови в артериях могут увеличить риск инсульта, сердечного приступа, сильной боли в ногах, затруднений при ходьбе или даже потери конечности.
Симптомы и причины
Что вызывает состояния гиперкоагуляции?
Состояния гиперкоагуляции обычно являются генетическими (наследственными) или приобретенными состояниями.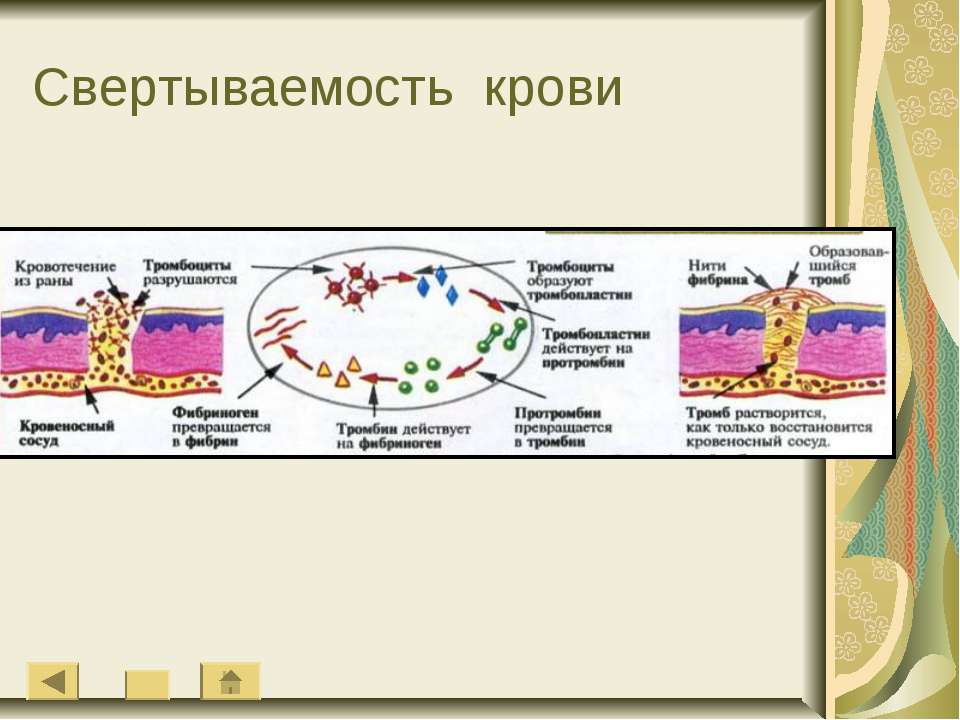 Генетическая форма этого расстройства означает, что человек рождается со склонностью к образованию тромбов. Приобретенные состояния обычно являются результатом хирургического вмешательства, травмы, приема лекарств или заболевания, которое увеличивает риск состояний гиперкоагуляции.
Генетическая форма этого расстройства означает, что человек рождается со склонностью к образованию тромбов. Приобретенные состояния обычно являются результатом хирургического вмешательства, травмы, приема лекарств или заболевания, которое увеличивает риск состояний гиперкоагуляции.
Унаследовано Условия гиперкоагуляции включают:
- Фактор V Лейден (самый распространенный)
- Мутация гена протромбина
- Дефицит природных белков, препятствующих свертыванию (таких как антитромбин, протеин C и протеин S)
- Повышенный уровень гомоцистеина
- Повышенный уровень фибриногена или дисфункционального фибриногена (дисфибриногенемия)
- Повышенный уровень фактора VIII (все еще исследуемый как наследственное заболевание) и других факторов, включая фактор IX и XI
- Аномальная фибринолитическая система, включая гипоплазминогенемию, дисплазминогенемию и повышение уровней ингибитора активатора плазминогена (PAI-1)
Приобретенные состояния гиперкоагуляции включают:
- Рак
- Некоторые лекарства, используемые для лечения рака, такие как тамоксифен, бевацизумаб, талидомид и леналидомид
- Недавняя травма или операция
- Установка центрального венозного катетера
- Ожирение
- Беременность
- Дополнительное употребление эстрогенов, включая оральные контрацептивы (противозачаточные таблетки)
- Заместительная гормональная терапия
- Длительный постельный режим или неподвижность
- Сердечный приступ, застойная сердечная недостаточность, инсульт и другие заболевания, приводящие к снижению активности
- Гепарин-индуцированная тромбоцитопения (снижение количества тромбоцитов в крови из-за гепарина или препаратов низкомолекулярного гепарина)
- Продолжительное путешествие на самолете, также известное как «синдром эконом-класса».

- Синдром антифосфолипидных антител
- Предыдущий анамнез тромбоза глубоких вен или тромбоэмболии легочной артерии
- Миелопролиферативные заболевания, такие как истинная полицитемия или эссенциальный тромбоцитоз
- Пароксизмальная ночная гемоглобинурия
- Синдром воспалительного кишечника
- ВИЧ / СПИД
- Нефротический синдром (слишком много белка в моче)
Диагностика и тесты
Как диагностируется состояние гиперкоагуляции?
Тщательный медицинский анамнез
Определенные условия повышают риск развития тромбов у человека, но не обязательно указывают на генетическое состояние гиперкоагуляции.Следовательно, необходима тщательная оценка личной и семейной истории болезни пациента.
Пациенты могут быть кандидатами на обследование на гиперкоагуляцию, если у них есть:
- Семейный анамнез аномального свертывания крови
- Аномальная свертываемость крови в молодом возрасте (до 50 лет)
- Тромбоз необычных участков или участков, таких как вены рук, печень (портал), кишечник (брыжеечный), почки (почечные) или головной мозг (церебральный)
- Сгустки крови без ясной причины (идиопатические)
- Повторяющиеся тромбы
- В анамнезе частые выкидыши
- Инсульт в молодом возрасте
Лабораторные испытания
Если у вас есть одно из перечисленных выше состояний, ваш врач может порекомендовать анализы крови для дальнейшей оценки вашего состояния.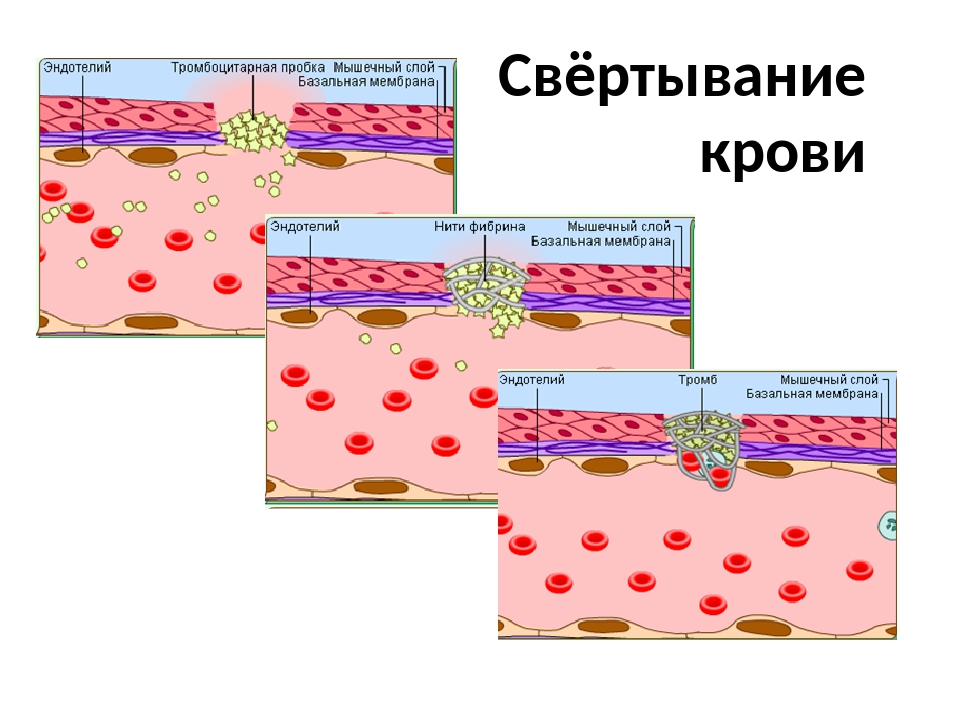
Эти тесты должны выполняться в специализированной лаборатории свертывания крови и интерпретироваться патологом или клиницистом, имеющим опыт в области коагуляции, сосудистой медицины или гематологии.
В идеале анализы следует делать, когда у вас нет острого события свертывания крови.
Наиболее распространенные лабораторные тесты включают:
- PT-INR : Тест на протромбиновое время (PT или protime) используется для расчета вашего международного нормализованного отношения (INR). Эта информация используется для отслеживания вашего состояния, если вы принимаете варфарин (кумадин).Ваш INR поможет вашему лечащему врачу определить, насколько быстро ваша кровь свертывается и нужно ли изменить дозу варфарина (кумадина).
- Активированное частичное тромбопластиновое время (АЧТВ) : Измеряет время, необходимое для свертывания крови. Этот тест используется для контроля вашего состояния, если вы принимаете гепарин.
- Уровень фибриногена
- Общий анализ крови
Некоторые тесты помогают выявить синдром антифосфолипидных антител или дисфибриногенемии — состояния, которые могут быть связаны с состояниями гиперкоагуляции.
Тесты, используемые для диагностики наследственных состояний гиперкоагуляции, включают:
- Генетические тесты, включая фактор V Лейден (устойчивость к активированному протеину C) и мутацию гена протромбина (G20210A) *
- Активность антитромбина
- Активность протеина С
- Активность протеина S **
- Уровни гомоцистеина в плазме натощак
* Фактор V Лейден и мутация гена протромбина (G20210A) являются наиболее часто выявляемыми генетическими дефектами, повышающими риск свертывания крови у человека.
** Дополнительные лабораторные тесты, такие как измерение уровней свободного (активного) и общего антигена протеина S, могут потребоваться для подтверждения результатов анализа активности протеина S.
Другие тесты, используемые для диагностики приобретенных состояний гиперкоагуляции, включают тесты на:
- Антикардиолипиновые антитела (АСА) или бета-2 гликопротеины, которые являются частью синдрома антифосфолипидных антител *
- Волчаночные антикоагулянты (LA), часть синдрома антифосфолипидных антител *
- Антитела к гепарину (у пациентов, у которых снижается количество тромбоцитов при воздействии гепарина)
* Наличие антифосфолипидных антител (ACA) и волчаночного антикоагулянта (LA) важно при обследовании человека, у которого были повторные выкидыши и венозный или артериальный тромбоз.
Тестирование помогает определить, есть ли у пациента риск дальнейшего свертывания крови, и помогает определить соответствующий курс и продолжительность лечения, чтобы предотвратить образование тромбов в будущем. Тестирование также может помочь выявить родственников, у которых в настоящее время нет симптомов, но которые могут находиться в группе риска.
Ведение и лечение
Как лечат состояния гиперкоагуляции?
Антикоагулянтные препараты
В большинстве случаев лечение необходимо только тогда, когда тромб образуется в вене или артерии.Антикоагулянты снижают способность крови к свертыванию и предотвращают образование дополнительных сгустков.
Антикоагулянтные препараты включают:
- Варфарин (кумадин) выпускается в форме таблеток и принимается перорально (внутрь).

- Гепарин — это жидкое лекарство, которое вводится либо через внутривенную (IV) линию, по которой лекарство доставляется непосредственно в вену, либо путем подкожных (под кожей) инъекций, вводимых в больнице.
- Низкомолекулярный гепарин вводится подкожно один или два раза в день и может приниматься дома.
- Фондапаринукс (Арикстра) вводится подкожно.
Вы и ваша семья будете проинструктированы о том, как принимать прописанные антикоагулянты.
Ваш врач расскажет вам о преимуществах и рисках этих лекарств. Эта информация, наряду с вашим диагнозом, поможет определить тип антикоагулянта, который вы будете принимать, как долго вам нужно будет его принимать, а также тип необходимого последующего наблюдения.
Как и в случае с любым другим лекарством, важно знать, как и когда принимать антикоагулянт в соответствии с рекомендациями врача, а также часто сдавать анализы крови по назначению врача.
Если вам прописали варфарин (кумадин):
- Вам необходимо будет часто сдавать анализ крови, называемый PT-INR, чтобы оценить, насколько хорошо работает лекарство.
 Пожалуйста, соблюдайте все запланированные посещения лаборатории, чтобы можно было отслеживать вашу реакцию на лекарство. Ваши лекарства могут быть изменены или скорректированы в зависимости от результатов этого теста.
Пожалуйста, соблюдайте все запланированные посещения лаборатории, чтобы можно было отслеживать вашу реакцию на лекарство. Ваши лекарства могут быть изменены или скорректированы в зависимости от результатов этого теста. - Вам следует заказать и носить медицинский идентификационный браслет, чтобы вы могли получить надлежащую медицинскую помощь в случае возникновения чрезвычайной ситуации.
- При травме может возникнуть кровотечение или синяк. Позвоните своему врачу, если у вас сильное или необычное кровотечение или синяк.
- Некоторые лекарства, отпускаемые без рецепта (без рецепта), влияют на работу антикоагулянтов. Не принимайте никаких других лекарств, не посоветовавшись предварительно с врачом.
- Спросите своего врача о конкретных рекомендациях по питанию, которые вам необходимо соблюдать при приеме варфарина. Определенные продукты, например продукты с высоким содержанием витамина К (содержатся в брюссельской капусте, шпинате и брокколи), могут изменить действие лекарства.

- Не следует принимать варфарин (кумадин), если вы беременны или планируете забеременеть. Если да, спросите своего врача о переходе на другой тип антикоагулянтов. Доктора различаются по квалификации из-за разницы в обучении и опыте; больницы различаются по количеству доступных услуг. Чем сложнее ваша медицинская проблема, тем больше эти различия в качестве и тем больше они имеют значение.
Ресурсы
Лечащие врачи
Доктора различаются по квалификации из-за разной подготовки и опыта; больницы различаются по количеству доступных услуг.Чем сложнее ваша медицинская проблема, тем больше эти различия в качестве и тем больше они имеют значение.
Очевидно, что врач и больница, которые вы выберете для получения комплексной специализированной медицинской помощи, будут иметь прямое влияние на то, насколько хорошо вы себя чувствуете. Чтобы помочь вам сделать этот выбор, ознакомьтесь с результатами нашего Института сердца, сосудов и торакальной системы семьи Миллер.
Чтобы помочь вам сделать этот выбор, ознакомьтесь с результатами нашего Института сердца, сосудов и торакальной системы семьи Миллер.
Cleveland Clinic Heart, Vascular & Thoracic Institute Специалисты и хирурги сосудистой медицины
Выбор врача для лечения сосудистого заболевания зависит от того, на каком этапе диагностики и лечения вы находитесь.Следующие секции и отделения Института сердца, сосудов и торакальной хирургии лечат пациентов со всеми типами сосудистых заболеваний, включая нарушения свертывания крови:
Секция сосудистой медицины: для оценки, медицинского обслуживания или интервенционных процедур для лечения сосудистых заболеваний. Кроме того, неинвазивная лаборатория включает в себя современное оборудование для компьютерной визуализации, которое помогает диагностировать сосудистые заболевания без дополнительного дискомфорта для пациента. Позвоните на прием в сосудистую медицину по бесплатному телефону 800-223-2273, добавочный 44420 или запишитесь на прием через Интернет.
Отделение сосудистой хирургии: хирургическая оценка хирургического лечения сосудистых заболеваний, в том числе заболеваний аорты, периферических артерий и вен. Позвоните на прием в сосудистую хирургию по бесплатному телефону 800-223-2273, добавочный 44508 или запишитесь на прием через Интернет.
Вы также можете воспользоваться нашей консультацией MyConsult о втором мнении через Интернет. Институт сердца, сосудов и грудной клетки также имеет специализированные центры и клиники для лечения определенных групп пациентов:
Узнайте больше об экспертах, специализирующихся на диагностике и лечении сосудистых и артериальных заболеваний.
Контакт
Если вам нужна дополнительная информация, нажмите здесь, чтобы связаться с нами, пообщаться в чате с медсестрой или позвонить в Ресурсную и информационную медсестру Института сердечно-сосудистых заболеваний и торакальной хирургии семьи Миллер по телефону 216.445.9288 или по бесплатному телефону 866.289.6911. Будем рады вам помочь.
Будем рады вам помочь.
Стать пациентом
Варианты лечения
Дополнительную информацию о вариантах лечения сосудов можно найти по телефону:
Руководства по лечению
Диагностические тесты
Диагностические тесты используются для диагностики ишемической болезни сердца и наиболее эффективного метода лечения.
Веб-чаты
Наши веб-чаты и видеочаты дают пациентам и посетителям еще одну возможность задать вопросы и пообщаться с нашими врачами.
Видео
Интерактивные инструменты
Дополнительная информация и ресурсы
* В новом окне браузера откроется эта ссылка. Включение ссылок на другие веб-сайты не означает одобрения материалов на этих веб-сайтах или какой-либо связи с их операторами.
Почему стоит выбрать клинику Кливленда для лечения?
Наши результаты говорят сами за себя.Пожалуйста, ознакомьтесь с нашими фактами и цифрами, и если у вас есть какие-либо вопросы, не стесняйтесь их задавать.
Нарушения свертывания крови (состояния гиперкоагуляции)
Обзор
Доктор Джон Бартоломью обсуждает фактор V Лейдена, нарушение свертывания крови.
Образование сгустка крови
Когда вы порезаетесь или получаете травму, ваше тело останавливает кровотечение, образуя сгусток крови. Белки и частицы в крови, называемые тромбоцитами, слипаются, образуя сгусток крови. Процесс образования сгустка называется коагуляцией. Нормальная коагуляция важна во время травмы, поскольку она помогает остановить кровотечение из пореза и запустить процесс заживления.
Однако кровь не должна свертываться, когда она просто движется по телу. Если кровь имеет тенденцию к слишком сильному свертыванию, это называется состоянием гиперкоагуляции или тромбофилией.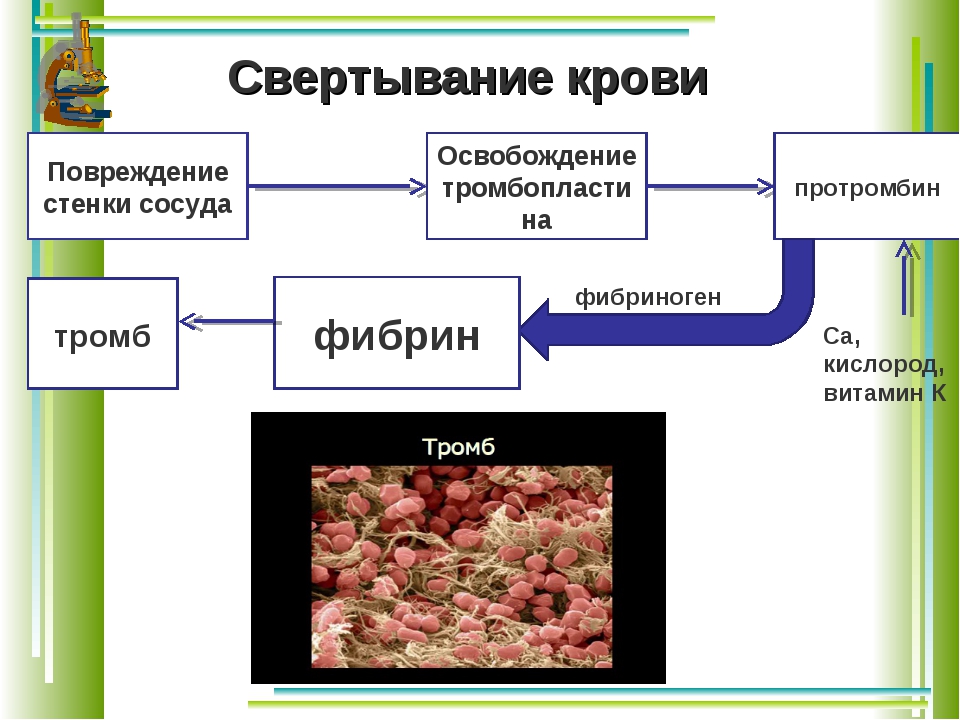
Опасны ли состояния гиперкоагуляции?
Состояния гиперкоагуляции могут быть опасными, особенно если эти состояния не идентифицированы и не лечатся должным образом. Люди с гиперкоагуляцией имеют повышенный риск образования тромбов в артериях (кровеносных сосудах, которые отводят кровь от сердца) и венах (кровеносных сосудах, несущих кровь к сердцу). Сгусток внутри кровеносного сосуда также называется тромбом или эмболом.
Сгустки крови в венах или венозной системе могут перемещаться по кровотоку и вызывать тромбоз глубоких вен (сгусток крови в венах таза, ног, рук, печени, кишечника или почек) или легочную эмболию (сгусток крови в легких). ).
Сгустки крови в артериях могут увеличить риск инсульта, сердечного приступа, сильной боли в ногах, затруднений при ходьбе или даже потери конечности.
Симптомы и причины
Что вызывает состояния гиперкоагуляции?
Состояния гиперкоагуляции обычно являются генетическими (наследственными) или приобретенными состояниями. Генетическая форма этого расстройства означает, что человек рождается со склонностью к образованию тромбов. Приобретенные состояния обычно являются результатом хирургического вмешательства, травмы, приема лекарств или заболевания, которое увеличивает риск состояний гиперкоагуляции.
Генетическая форма этого расстройства означает, что человек рождается со склонностью к образованию тромбов. Приобретенные состояния обычно являются результатом хирургического вмешательства, травмы, приема лекарств или заболевания, которое увеличивает риск состояний гиперкоагуляции.
Унаследовано Условия гиперкоагуляции включают:
- Фактор V Лейден (самый распространенный)
- Мутация гена протромбина
- Дефицит природных белков, препятствующих свертыванию (таких как антитромбин, протеин C и протеин S)
- Повышенный уровень гомоцистеина
- Повышенный уровень фибриногена или дисфункционального фибриногена (дисфибриногенемия)
- Повышенный уровень фактора VIII (все еще исследуемый как наследственное заболевание) и других факторов, включая фактор IX и XI
- Аномальная фибринолитическая система, включая гипоплазминогенемию, дисплазминогенемию и повышение уровней ингибитора активатора плазминогена (PAI-1)
Приобретенные состояния гиперкоагуляции включают:
- Рак
- Некоторые лекарства, используемые для лечения рака, такие как тамоксифен, бевацизумаб, талидомид и леналидомид
- Недавняя травма или операция
- Установка центрального венозного катетера
- Ожирение
- Беременность
- Дополнительное употребление эстрогенов, включая оральные контрацептивы (противозачаточные таблетки)
- Заместительная гормональная терапия
- Длительный постельный режим или неподвижность
- Сердечный приступ, застойная сердечная недостаточность, инсульт и другие заболевания, приводящие к снижению активности
- Гепарин-индуцированная тромбоцитопения (снижение количества тромбоцитов в крови из-за гепарина или препаратов низкомолекулярного гепарина)
- Продолжительное путешествие на самолете, также известное как «синдром эконом-класса».

- Синдром антифосфолипидных антител
- Предыдущий анамнез тромбоза глубоких вен или тромбоэмболии легочной артерии
- Миелопролиферативные заболевания, такие как истинная полицитемия или эссенциальный тромбоцитоз
- Пароксизмальная ночная гемоглобинурия
- Синдром воспалительного кишечника
- ВИЧ / СПИД
- Нефротический синдром (слишком много белка в моче)
Диагностика и тесты
Как диагностируется состояние гиперкоагуляции?
Тщательный медицинский анамнез
Определенные условия повышают риск развития тромбов у человека, но не обязательно указывают на генетическое состояние гиперкоагуляции.Следовательно, необходима тщательная оценка личной и семейной истории болезни пациента.
Пациенты могут быть кандидатами на обследование на гиперкоагуляцию, если у них есть:
- Семейный анамнез аномального свертывания крови
- Аномальная свертываемость крови в молодом возрасте (до 50 лет)
- Тромбоз необычных участков или участков, таких как вены рук, печень (портал), кишечник (брыжеечный), почки (почечные) или головной мозг (церебральный)
- Сгустки крови без ясной причины (идиопатические)
- Повторяющиеся тромбы
- В анамнезе частые выкидыши
- Инсульт в молодом возрасте
Лабораторные испытания
Если у вас есть одно из перечисленных выше состояний, ваш врач может порекомендовать анализы крови для дальнейшей оценки вашего состояния.
Эти тесты должны выполняться в специализированной лаборатории свертывания крови и интерпретироваться патологом или клиницистом, имеющим опыт в области коагуляции, сосудистой медицины или гематологии.
В идеале анализы следует делать, когда у вас нет острого события свертывания крови.
Наиболее распространенные лабораторные тесты включают:
- PT-INR : Тест на протромбиновое время (PT или protime) используется для расчета вашего международного нормализованного отношения (INR). Эта информация используется для отслеживания вашего состояния, если вы принимаете варфарин (кумадин).Ваш INR поможет вашему лечащему врачу определить, насколько быстро ваша кровь свертывается и нужно ли изменить дозу варфарина (кумадина).
- Активированное частичное тромбопластиновое время (АЧТВ) : Измеряет время, необходимое для свертывания крови. Этот тест используется для контроля вашего состояния, если вы принимаете гепарин.
- Уровень фибриногена
- Общий анализ крови
Некоторые тесты помогают выявить синдром антифосфолипидных антител или дисфибриногенемии — состояния, которые могут быть связаны с состояниями гиперкоагуляции.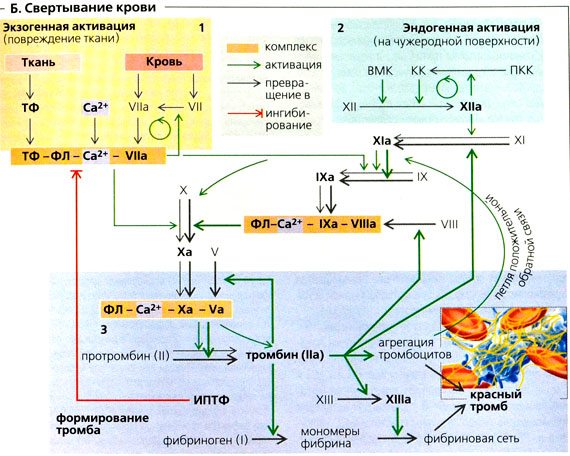
Тесты, используемые для диагностики наследственных состояний гиперкоагуляции, включают:
- Генетические тесты, включая фактор V Лейден (устойчивость к активированному протеину C) и мутацию гена протромбина (G20210A) *
- Активность антитромбина
- Активность протеина С
- Активность протеина S **
- Уровни гомоцистеина в плазме натощак
* Фактор V Лейден и мутация гена протромбина (G20210A) являются наиболее часто выявляемыми генетическими дефектами, повышающими риск свертывания крови у человека.
** Дополнительные лабораторные тесты, такие как измерение уровней свободного (активного) и общего антигена протеина S, могут потребоваться для подтверждения результатов анализа активности протеина S.
Другие тесты, используемые для диагностики приобретенных состояний гиперкоагуляции, включают тесты на:
- Антикардиолипиновые антитела (АСА) или бета-2 гликопротеины, которые являются частью синдрома антифосфолипидных антител *
- Волчаночные антикоагулянты (LA), часть синдрома антифосфолипидных антител *
- Антитела к гепарину (у пациентов, у которых снижается количество тромбоцитов при воздействии гепарина)
* Наличие антифосфолипидных антител (ACA) и волчаночного антикоагулянта (LA) важно при обследовании человека, у которого были повторные выкидыши и венозный или артериальный тромбоз.
Тестирование помогает определить, есть ли у пациента риск дальнейшего свертывания крови, и помогает определить соответствующий курс и продолжительность лечения, чтобы предотвратить образование тромбов в будущем. Тестирование также может помочь выявить родственников, у которых в настоящее время нет симптомов, но которые могут находиться в группе риска.
Ведение и лечение
Как лечат состояния гиперкоагуляции?
Антикоагулянтные препараты
В большинстве случаев лечение необходимо только тогда, когда тромб образуется в вене или артерии.Антикоагулянты снижают способность крови к свертыванию и предотвращают образование дополнительных сгустков.
Антикоагулянтные препараты включают:
- Варфарин (кумадин) выпускается в форме таблеток и принимается перорально (внутрь).

- Гепарин — это жидкое лекарство, которое вводится либо через внутривенную (IV) линию, по которой лекарство доставляется непосредственно в вену, либо путем подкожных (под кожей) инъекций, вводимых в больнице.
- Низкомолекулярный гепарин вводится подкожно один или два раза в день и может приниматься дома.
- Фондапаринукс (Арикстра) вводится подкожно.
Вы и ваша семья будете проинструктированы о том, как принимать прописанные антикоагулянты.
Ваш врач расскажет вам о преимуществах и рисках этих лекарств. Эта информация, наряду с вашим диагнозом, поможет определить тип антикоагулянта, который вы будете принимать, как долго вам нужно будет его принимать, а также тип необходимого последующего наблюдения.
Как и в случае с любым другим лекарством, важно знать, как и когда принимать антикоагулянт в соответствии с рекомендациями врача, а также часто сдавать анализы крови по назначению врача.
Если вам прописали варфарин (кумадин):
- Вам необходимо будет часто сдавать анализ крови, называемый PT-INR, чтобы оценить, насколько хорошо работает лекарство.
 Пожалуйста, соблюдайте все запланированные посещения лаборатории, чтобы можно было отслеживать вашу реакцию на лекарство. Ваши лекарства могут быть изменены или скорректированы в зависимости от результатов этого теста.
Пожалуйста, соблюдайте все запланированные посещения лаборатории, чтобы можно было отслеживать вашу реакцию на лекарство. Ваши лекарства могут быть изменены или скорректированы в зависимости от результатов этого теста. - Вам следует заказать и носить медицинский идентификационный браслет, чтобы вы могли получить надлежащую медицинскую помощь в случае возникновения чрезвычайной ситуации.
- При травме может возникнуть кровотечение или синяк. Позвоните своему врачу, если у вас сильное или необычное кровотечение или синяк.
- Некоторые лекарства, отпускаемые без рецепта (без рецепта), влияют на работу антикоагулянтов. Не принимайте никаких других лекарств, не посоветовавшись предварительно с врачом.
- Спросите своего врача о конкретных рекомендациях по питанию, которые вам необходимо соблюдать при приеме варфарина. Определенные продукты, например продукты с высоким содержанием витамина К (содержатся в брюссельской капусте, шпинате и брокколи), могут изменить действие лекарства.

- Не следует принимать варфарин (кумадин), если вы беременны или планируете забеременеть. Если да, спросите своего врача о переходе на другой тип антикоагулянтов. Доктора различаются по квалификации из-за разницы в обучении и опыте; больницы различаются по количеству доступных услуг. Чем сложнее ваша медицинская проблема, тем больше эти различия в качестве и тем больше они имеют значение.
Ресурсы
Лечащие врачи
Доктора различаются по квалификации из-за разной подготовки и опыта; больницы различаются по количеству доступных услуг.Чем сложнее ваша медицинская проблема, тем больше эти различия в качестве и тем больше они имеют значение.
Очевидно, что врач и больница, которые вы выберете для получения комплексной специализированной медицинской помощи, будут иметь прямое влияние на то, насколько хорошо вы себя чувствуете. Чтобы помочь вам сделать этот выбор, ознакомьтесь с результатами нашего Института сердца, сосудов и торакальной системы семьи Миллер.
Чтобы помочь вам сделать этот выбор, ознакомьтесь с результатами нашего Института сердца, сосудов и торакальной системы семьи Миллер.
Cleveland Clinic Heart, Vascular & Thoracic Institute Специалисты и хирурги сосудистой медицины
Выбор врача для лечения сосудистого заболевания зависит от того, на каком этапе диагностики и лечения вы находитесь.Следующие секции и отделения Института сердца, сосудов и торакальной хирургии лечат пациентов со всеми типами сосудистых заболеваний, включая нарушения свертывания крови:
Секция сосудистой медицины: для оценки, медицинского обслуживания или интервенционных процедур для лечения сосудистых заболеваний. Кроме того, неинвазивная лаборатория включает в себя современное оборудование для компьютерной визуализации, которое помогает диагностировать сосудистые заболевания без дополнительного дискомфорта для пациента. Позвоните на прием в сосудистую медицину по бесплатному телефону 800-223-2273, добавочный 44420 или запишитесь на прием через Интернет.
Отделение сосудистой хирургии: хирургическая оценка хирургического лечения сосудистых заболеваний, в том числе заболеваний аорты, периферических артерий и вен. Позвоните на прием в сосудистую хирургию по бесплатному телефону 800-223-2273, добавочный 44508 или запишитесь на прием через Интернет.
Вы также можете воспользоваться нашей консультацией MyConsult о втором мнении через Интернет. Институт сердца, сосудов и грудной клетки также имеет специализированные центры и клиники для лечения определенных групп пациентов:
Узнайте больше об экспертах, специализирующихся на диагностике и лечении сосудистых и артериальных заболеваний.
Контакт
Если вам нужна дополнительная информация, нажмите здесь, чтобы связаться с нами, пообщаться в чате с медсестрой или позвонить в Ресурсную и информационную медсестру Института сердечно-сосудистых заболеваний и торакальной хирургии семьи Миллер по телефону 216.445.9288 или по бесплатному телефону 866.289.6911.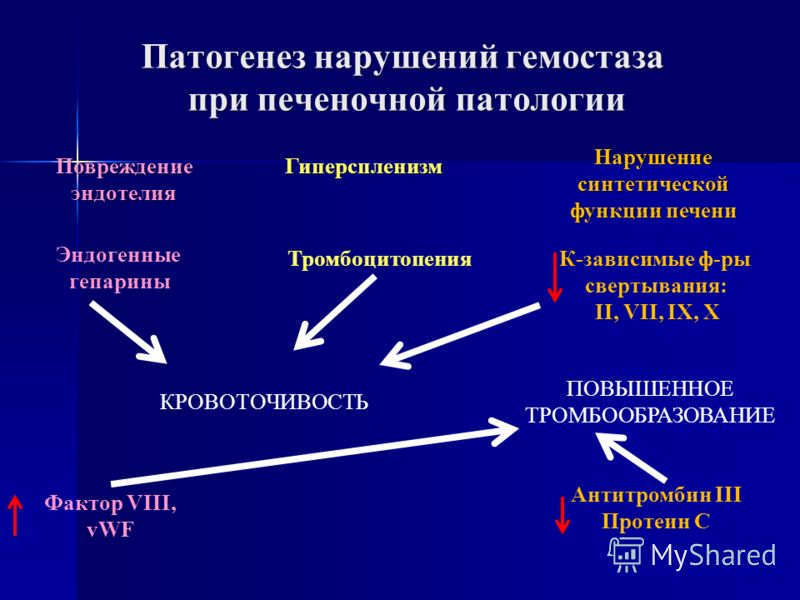 Будем рады вам помочь.
Будем рады вам помочь.
Стать пациентом
Варианты лечения
Дополнительную информацию о вариантах лечения сосудов можно найти по телефону:
Руководства по лечению
Диагностические тесты
Диагностические тесты используются для диагностики ишемической болезни сердца и наиболее эффективного метода лечения.
Веб-чаты
Наши веб-чаты и видеочаты дают пациентам и посетителям еще одну возможность задать вопросы и пообщаться с нашими врачами.
Видео
Интерактивные инструменты
Дополнительная информация и ресурсы
* В новом окне браузера откроется эта ссылка. Включение ссылок на другие веб-сайты не означает одобрения материалов на этих веб-сайтах или какой-либо связи с их операторами.
Почему стоит выбрать клинику Кливленда для лечения?
Наши результаты говорят сами за себя.Пожалуйста, ознакомьтесь с нашими фактами и цифрами, и если у вас есть какие-либо вопросы, не стесняйтесь их задавать.
Проблемы с кровотечением | Cancer.Net
Когда у человека нарушение свертываемости крови, его кровь не свертывается достаточно быстро. Это приводит к слишком сильному кровотечению или кровотечению, которое длится долгое время.
Нормальное свертывание крови называется коагуляцией. В этом сложном процессе задействованы тромбоциты и факторы свертывания или свертывания крови. Тромбоциты — это особые клетки крови.Факторы свертывания или свертывания — это типы белков, которые содержатся в крови.
Тромбоциты и факторы свертывания крови объединяются для заживления сломанных кровеносных сосудов. Это помогает контролировать кровотечение. Человеку необходим правильный баланс факторов свертывания крови для здорового кровотечения и свертывания крови.
Нарушения свертывания крови возникают при:
Факторы свертывания отсутствуют или повреждены.
В крови слишком мало тромбоцитов.
Тромбоциты работают неправильно.
Симптомы кровотечения
Люди с нарушениями свертываемости крови могут иметь следующие симптомы:
Порезы, которые слишком сильно кровоточат
Неожиданный или внезапный синяк
Маленькие пурпурные или красные пятна под кожей, называемые петехиями
Кровь в рвоте, часто напоминающая кофейную гущу.
Черный или кровавый стул
Красная или розовая моча
Головокружение, головные боли или изменения зрения
Боль в суставах
Кровотечение из десны или носа
Менструальный цикл у женщин обильнее или дольше обычного
Обсудите со своим лечащим врачом любые симптомы, которые у вас есть.В частности, расскажите им о новых симптомах или изменении симптомов.
Причины проблем с кровотечением
Иногда человек наследует нарушение свертываемости крови. Это означает, что он генетический и передается в семье. У человека также могут быть проблемы с кровотечением, вызванные болезнью или лечением определенными препаратами.
Проблемы с кровотечением могут быть вызваны:
Наследственные заболевания. Гемофилия и болезнь фон Виллебранда бывают двух типов. При гемофилии кровь не свертывается нормально.При болезни фон Виллебранда факторы свертывания отсутствуют или работают плохо.
Дефицит витамина К
Рак, который начинается или распространяется на печень
Другие болезни печени, включая гепатит и цирроз. Гепатит — это инфекция печени. Цирроз — это рубцевание печени.
Длительный прием сильнодействующих антибиотиков или антикоагулянтов. Антикоагулянты — это лекарства, разжижающие кровь.
Препараты, называемые ингибиторами ангиогенеза. Это предотвращает рост и развитие новых кровеносных сосудов.
Тромбоцитопения, необычно низкий уровень тромбоцитов
Анемия, то есть необычно низкий уровень эритроцитов
Другие заболевания, не связанные с раком
Диагностика проблем с кровотечением
Ваша медицинская бригада изучит вашу историю болезни, проведет медицинский осмотр и возьмет кровь.Кровь может использоваться для нескольких анализов крови, в том числе:
Лечение кровотечений
Устранение побочных эффектов — важная часть лечения и лечения рака. Это называется паллиативной или поддерживающей терапией. Это помогает удовлетворить физические, эмоциональные и социальные потребности человека, больного раком.
По возможности, медицинская бригада занимается лечением основной причины нарушения свертываемости крови, например рака или заболевания печени. Дополнительные процедуры могут включать:
Витамин К для инъекций
Препараты, способствующие свертыванию крови
Переливания плазмы крови или тромбоцитов
Другие лекарства для лечения проблем с тромбоцитами.К ним относятся гидроксимочевина (Droxia, Hydrea) и опрелвекин (Neumega).
Связанные ресурсы
Информационный бюллетень ASCO Answers: общие сведения об анализах крови (PDF)
Когда обращаться к врачу во время лечения рака
Проблемы со свертыванием | Cancer.Net
Сгусток крови — серьезное заболевание, которое требует немедленного лечения. Люди, больные раком, и те, кто получает лечение от рака, имеют повышенный риск образования тромбов.
Нормальное свертывание крови, называемое коагуляцией, представляет собой сложный процесс.Он включает в себя специализированные клетки крови, называемые тромбоцитами, и различные белки крови, называемые факторами свертывания или свертывания. Эти тромбоциты и факторы свертывания крови объединяются, чтобы залечить сломанные кровеносные сосуды и остановить кровотечение. Факторы свертывания, способствующие кровотечению, и факторы, способствующие свертыванию, должны быть сбалансированы.
Нарушения свертывания крови возникают, когда некоторые факторы свертывания отсутствуют или повреждены. Это вызывает образование сгустков внутри тела, которые блокируют нормальный кровоток и вызывают серьезные проблемы.
Сгустки крови могут образовываться и перемещаться в разные части тела, в том числе:
Вены, называемые венозной тромбоэмболией (ВТЭ). Если вена находится в ноге, бедре или тазу, это называется тромбозом глубоких вен (ТГВ).
Легкие, называемые тромбоэмболией легочной артерии (ТЭЛА).
Артерия. Это реже, но тоже очень серьезно.
Признаки и симптомы проблем со свертыванием крови
Люди с проблемами свертывания крови могут испытывать:
Отек руки или ноги с одной стороны тела
Боль в руке или ноге в месте нахождения тромба
Проблемы с дыханием или боль в груди при дыхании
Учащенное сердцебиение
Низкий уровень кислорода
Снятие побочных эффектов — важная часть лечения и лечения рака.Это называется паллиативной или поддерживающей терапией. Немедленно сообщите своему лечащему врачу о любом из этих симптомов. Даже у людей с низким уровнем тромбоцитов может образоваться тромб. Иногда люди не знают, что у них есть тромб, пока он не будет диагностирован во время анализа.
Причины проблем со свертыванием
Люди, больные раком, имеют более высокий риск образования тромбов и нарушений свертываемости. Это может быть вызвано раком или его лечением. К таким факторам риска относятся:
Рак легких, почек, мозга, пищеварительной системы, женской репродуктивной системы, например рак матки, и крови, например лейкоз и лимфома
Метастатический рак, то есть рак, распространившийся на другие части тела, откуда он начался
Лечение рака, включая операции продолжительностью более 1 часа, химиотерапию, лучевую терапию и гормональную терапию.Лекарства, называемые антиангиогенными препаратами, которые блокируют образование новых кровеносных сосудов, такие как талидомид (Синовир, Таломид) и леналидомид (Ревлимид), также могут повышать риск образования тромбов.
Лечение препаратами, стимулирующими эритропоэз, которые помогают организму вырабатывать больше красных кровяных телец, такими как эпоэтин (Epogen, Eprex, Procrit) и дарбэпоэтин (Aranesp)
Долгосрочное использование внутривенного катетера или порта
Сгустки крови также могут быть вызваны причинами, отличными от рака и его лечения, например:
Длительные периоды бездействия, например долгая поездка в самолете или автомобиле.Это также может включать пребывание в больнице, потому что большинство людей в больнице не могут быть физически активными и должны оставаться в постели или не могут встать с постели.
Наличие других заболеваний или состояний, помимо рака, таких как ожирение, инфекция, заболевание почек, заболевание легких или сгусток крови в кровеносном сосуде, называемом артерией, которая уносит кровь от сердца.
Пожилой возраст.
Раса / этническая принадлежность. Риск выше для чернокожих и ниже для белых и азиатских людей.
Состояние, которое наследуется, то есть передается от родителя к ребенку в семье. Это включает лейденскую мутацию фактора V, которая вызывает слишком сильное свертывание крови.
Диагностика проблем со свертыванием крови
Ваш врач может использовать один или несколько способов найти тромб, в том числе:
Допплерография. Ультразвук использует звуковые волны, чтобы посмотреть на кровоток в венах рук или ног.Он может обнаружить снижение кровотока из тромба.
Компьютерная томография (КТ) . Компьютерная томография делает снимки внутренней части тела с использованием рентгеновских лучей, сделанных под разными углами. Специальный краситель, называемый контрастным веществом, вводится пациенту в вену или вводится в виде таблетки или жидкости для проглатывания перед сканированием, чтобы улучшить детализацию изображения. Врачи обычно используют компьютерную томографию для диагностики тромба в легких или ТЭЛА.
Вентиляция / перфузия легких (VQ). Этот тест, который может диагностировать PE, состоит из 2 разных частей:
Ангиограмма. Этот тест может обнаружить сгусток крови в артерии. Во время ангиограммы в артерию вводят краситель. Затем артерию исследуют с помощью специального рентгеновского аппарата — флюороскопа.
Профилактика и лечение проблем со свертыванием крови
Тромбы можно предотвратить и вылечить с помощью лекарств. Антикоагулянты — это препараты, которые предотвращают образование тромбов или препятствуют ухудшению существующих сгустков.Эти препараты могут увеличить риск кровотечения, но для большинства людей они безопасны. Типичные антикоагулянты включают:
Некоторые из этих препаратов принимают внутрь. Другие вводятся в виде инъекции под кожу, называемой подкожной инъекцией.
Американское общество клинической онкологии (ASCO) рекомендует следующее для предотвращения образования тромбов у онкологических больных:
Некоторым пациентам, находящимся в больнице, возможно, потребуется принимать лекарства от тромбов.Этот вид лекарства называется антикоагулянтом. Необходимость приема антикоагулянта может зависеть от того, как долго он находится в больнице, и от высокого риска образования тромбов.
Людям с множественной миеломой, которые принимают антиангиогенные средства вместе с химиотерапией и / или дексаметазоном (несколько торговых марок), следует принимать гепарин или низкие дозы аспирина.
Люди, которым предстоит серьезная операция по поводу рака, должны пройти курс лечения для предотвращения образования тромбов после операции.Лечение должно продолжаться от 7 до 10 дней или до 4 недель, в зависимости от типа операции и риска образования тромбов.
Люди с высоким риском образования тромбов, которые не находятся в больнице, могут получать апиксабан, ривароксабан или некоторые формы гепарина
Ваш врач может также порекомендовать следующие методы помимо приема лекарств для предотвращения образования тромбов:
Чулки с градуированной компрессией, которые являются разновидностью поддерживающего шланга
Прерывистое пневматическое сжатие, при котором ноги сжимаются через втулку, соединенную с машиной
Механические ножные насосы
Узнайте больше об этих рекомендациях на отдельном веб-сайте ASCO.
Человеку с тромбом необходимо лечение немедленно. Наиболее распространенное лечение — это антикоагулянт, который можно вводить под кожу или в вену. Но некоторые люди могут принять проглоченную таблетку. Если кровь считается достаточно жидкой, риск свертывания снижается.
Люди, принимающие антикоагулянты, должны регулярно проверяться на предмет повышенного кровотечения. Некоторые люди не могут принимать препараты для разжижения крови из-за низкого уровня тромбоцитов или высокого риска кровотечения.Для этих людей в тело можно поместить специальный фильтр, чтобы предотвратить попадание тромба в легкие, что может быть очень опасным.
Вопросы, которые следует задать бригаде здравоохранения
Поговорите со своим лечащим врачом, чтобы узнать больше о риске образования тромба, о том, как профилактика образования тромбов будет включена в ваш общий план лечения и какие методы лечения доступны в случае образования тромба.
Вы можете задать следующие вопросы:
Есть ли у меня повышенный риск образования тромба?
Что можно сделать, чтобы предотвратить образование тромба до его образования?
Каковы признаки и симптомы сгустка крови?
Если у меня есть тромбы или они были раньше, какое лечение вы порекомендуете?
Как долго мне понадобится это лечение?
Каков мой риск кровотечения при таком лечении? Есть ли другие побочные эффекты?
Какие состояния здоровья или лекарства могут помешать лечению тромбов?
Кому мне позвонить, если у меня возникнут опасения по поводу симптома?
Связанные ресурсы
Когда обращаться к врачу во время лечения рака
Путешествие с раком
Что такое чрезмерная свертываемость крови (гиперкоагуляция)?
Когда вы получаете порез или рану, ваше тело образует сгустки крови, утолщенную массу ткани крови, чтобы остановить кровотечение.Белки в вашей крови, называемые фибринами, работают с небольшими фрагментами клеток крови, называемыми тромбоцитами, с образованием сгустка. Это называется коагуляцией — процессом, который помогает организму при травме, поскольку замедляет кровопотерю.
После остановки кровотечения и заживления организм должен разрушиться и удалить сгустки. Но иногда сгустки крови образуются слишком легко или не растворяются должным образом и перемещаются по телу, ограничивая или блокируя кровоток.
Это называется чрезмерным свертыванием крови или гиперкоагуляцией и может быть очень опасным.В случае чрезмерного свертывания крови эти сгустки могут образовываться в артериях или венах головного мозга, сердца, почек, легких и конечностей или перемещаться в них, что, в свою очередь, может вызвать сердечный приступ, инсульт, повреждение органов тела или даже смерть.
Многие факторы могут вызвать чрезмерное свертывание крови, включая определенные заболевания и состояния, генетические мутации и лекарства. Эти причины делятся на две категории: приобретенных и генетических .
- Приобретенный означает, что чрезмерное свертывание крови было вызвано другим заболеванием или состоянием.Курение, избыточный вес и ожирение, беременность, прием противозачаточных таблеток или заместительная гормональная терапия, рак, длительный постельный режим или поездки на автомобиле или самолете — вот лишь несколько примеров.
- Генетический , или унаследованный, источник чрезмерного свертывания крови встречается реже и обычно связан с генетическими дефектами. Эти дефекты обычно возникают в белках, необходимых для свертывания крови, а также могут возникать с веществами, задерживающими или растворяющими сгустки крови.
Приобретенные и генетические источники чрезмерной свертываемости крови не связаны, но у человека могут быть оба.
Некоторые другие названия чрезмерной свертываемости крови:
- Расстройства или состояния гиперкоагуляции
- Гиперкоагуляция
- Тромбоэмболические состояния
- Тромбофилия (название, используемое в основном для обозначения генетических заболеваний)
- Тромботические расстройства
Почему имеет значение чрезмерная свертываемость крови
Перспективы и лечение чрезмерного свертывания крови зависят от причины образования тромбов, их тяжести и того, насколько хорошо их можно контролировать.
Некоторые возможные эффекты сгустков крови включают:
- Инсульт — Инсульт может произойти, если сгусток крови приведет к ограничению притока крови к мозгу. Если кровоток прерывается более чем на несколько минут, клетки вашего мозга начинают умирать. Это повреждает те части тела, которые контролируются клетками мозга. Инсульт может вызвать длительное повреждение головного мозга, длительную инвалидность, паралич (неспособность двигаться) или смерть.
- Heart Attack — Сгусток крови в коронарной артерии может привести к сердечному приступу.Сердечный приступ происходит, если блокируется приток крови к участку сердечной мышцы. Если кровоток быстро не восстанавливается, участок сердечной мышцы повреждается из-за недостатка кислорода и начинает умирать. Это повреждение сердца может быть неочевидным или может вызвать серьезные или длительные проблемы, такие как сердечная недостаточность или аритмии.
- Почечная недостаточность — Сгусток крови в почках может привести к почечной недостаточности, когда почки больше не могут выводить жидкости и отходы из организма.
- Легочная эмболия — Если сгусток крови перемещается из глубокой вены тела в легкие, это называется тромбоэмболией легочной артерии (ТЭЛА).ПЭ — серьезное заболевание, которое может повредить ваши легкие и другие органы и вызвать низкий уровень кислорода в крови.
- Тромбоз глубоких вен — Сгусток крови в вене глубоко в руке или ноге может вызвать боль, отек, покраснение или повышенное тепло в пораженной конечности, что может вызвать тромбоз глубоких вен (ТГВ). Сгустки ТГВ могут оторваться, попасть в легкие и вызвать ТЭЛА.
- Венозная тромбоэмболия (ВТЭ) — Вместе ТЭЛА и ТГВ составляют венозную тромбоэмболию.
- Заболевание периферических артерий (ЗПА) — ЗПА представляет собой сужение периферических артерий, чаще всего в артериях таза и ног.
- Проблемы, связанные с беременностью — Сгустки крови могут вызвать выкидыш, мертворождение и другие проблемы, связанные с беременностью, например, преэклампсию, повышенное кровяное давление во время беременности.
С помощью лекарств и постоянного ухода многие люди с чрезмерным свертыванием крови могут успешно справиться с этим.
Нарушения свертывания крови | BCDI в Пеории, Иллинойс,
Нарушения свертывания крови — это термин, используемый для описания группы состояний, при которых наблюдается повышенная тенденция к чрезмерному свертыванию. Эти расстройства включают наследственные состояния, такие как:
- Протромбин 20210A мутации
- Анти-тромбиновая недостаточность
- Фактор V Лейден
- Дефицит протеина С
- Дефицит белка S
- Антифосфолипидный синдром
- Гипергомоцистеинемия
Для получения более подробной информации о ваших конкретных нарушениях свертываемости крови или свертывания крови обратитесь в медицинскую группу BCDI.
Что такое тромбоз?
Развитие тромба называется тромбозом. Сосудистая система включает в себя как венозную систему (вены, по которым кровь от тканей к сердцу), так и артериальную систему (систему, которая доставляет кровь от сердца к тканям). Приступы тромбоза могут возникать в любой системе. Симптомы связаны с той частью сосудистой системы, в которой они возникают, размером сгустка и тем, отламывается ли сгусток и перемещается ли он в другую часть тела (эмболия).
Существуют различные термины, используемые для дальнейшего определения этих тромботических эпизодов, таких как тромбоз глубоких вен (ТГВ) или заболевание периферических сосудов. Для некоторых пациентов теперь мы можем определить основную причину повышенного риска чрезмерного кровообращения.
свертывание. Мы по-прежнему не можем принять это решение во всех случаях. Это означает, что еще предстоит понять, почему у некоторых людей и семей тромбофилия.
Тромбоз — очень распространенная проблема со здоровьем.По оценкам, около двух миллионов человек ежегодно страдают от ТГВ в Соединенных Штатах. Кроме того, почти половина пациентов со сгустками глубоких вен испытывают долгосрочные последствия для здоровья, которые отрицательно сказываются на качестве их жизни и требуют лечения на миллионы долларов.
Загрузите информационный бюллетень здесь
Что такое тромбофилия?
Тромбофилия — это повышенная склонность к тромбозам или образованию тромбов. В то время как люди с гемофилией имеют повышенную склонность к кровотечениям, люди с тромбофилией имеют повышенную тенденцию к образованию тромбов.Так же, как гемофилия вызвана аномалией фактора свертывания крови, некоторые формы тромбофилии также вызваны аномалией или дефицитом фактора свертывания крови.
Тромбофилия — не новое заболевание, но оно стало более узнаваемым и более обсуждаемым из-за возросшей способности тестировать и идентифицировать некоторые из основных вызывающих аномалий. Люди, у которых наблюдаются эпизоды тромбоза либо как единичное, либо как повторяющееся событие, могут быть поражены тромбофилическим расстройством.Есть люди, унаследовавшие этот ген, которые имеют повышенную склонность к тромбозам, но могут никогда лично не испытать тромб. Многие люди могут иметь известное тромбофилическое состояние и никогда не испытывать тромбоза.
И дети, и взрослые могут иметь тромбофилию. Однако его чаще диагностируют у подростков и взрослых из-за нормальных изменений гемостатического баланса, которые происходят с ростом и старением. Несмотря на то, что у мужчин и женщин могут быть нарушения свертывания крови, эти состояния создают дополнительные трудности для женщин из-за их отношения к репродуктивным проблемам.У женщин с этими заболеваниями во время беременности могут развиться серьезные осложнения, ведущие к выкидышу. Беременность, оральные контрацептивы и заместительная гормональная терапия в постменопаузе — все это потенциальные триггеры ТГВ у женщин с тромбофилией.
Тромбофилия поражает большое количество людей во всем мире. Недавние исследования показывают, что эти расстройства вносят значительный вклад в заболеваемость и смертность в Соединенных Штатах. Каждый год более 600 000 американцев умирают от аномальных тромбов.
Лечение тромбофилии
Люди с тромбофилией могут получать лекарства, влияющие на систему свертывания крови. Некоторым людям с тромбофилией могут быть прописаны продукты для лечения тромбофилии на длительной или периодической основе, в зависимости от основной причины их тромбофилии.
- Некоторых людей с тромбофилией лечат лекарствами, которые классифицируются как разжижители крови, которые снижают способность человека образовывать сгусток.Примеры этих лекарств включают аспирин, гепарин, низкомолекулярный гепарин и кумадин. Существуют также некоторые специфические лекарства (тромболитические средства), которые при определенных обстоятельствах назначаются для растворения сгустков
- Люди с тромбофилией могут получать лекарства только во время повышенного риска тромбоза или в течение длительного периода времени (даже на всю жизнь), в зависимости от их конкретного диагноза и клинических обстоятельств.
Растет потребность в том, чтобы пациенты с тромбофилией осматривала бригада медицинских специалистов в одном учреждении.Подобно услугам по лечению и профилактике гемофилии, предоставляемым через HTC, интегрированный уход может снизить заболеваемость и смертность, связанные с тромбофилией.

 ru/article/n/svertyvanie-krovi-biohimicheskie-osnovy
ru/article/n/svertyvanie-krovi-biohimicheskie-osnovy
 ).
).

 Пожалуйста, соблюдайте все запланированные посещения лаборатории, чтобы можно было отслеживать вашу реакцию на лекарство. Ваши лекарства могут быть изменены или скорректированы в зависимости от результатов этого теста.
Пожалуйста, соблюдайте все запланированные посещения лаборатории, чтобы можно было отслеживать вашу реакцию на лекарство. Ваши лекарства могут быть изменены или скорректированы в зависимости от результатов этого теста.
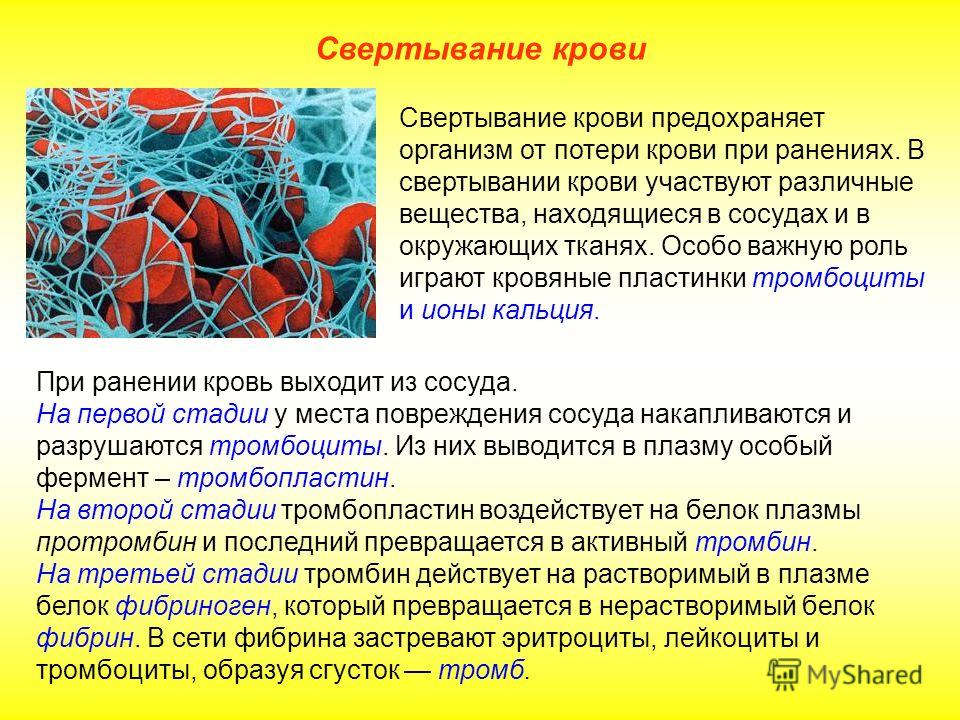

 Пожалуйста, соблюдайте все запланированные посещения лаборатории, чтобы можно было отслеживать вашу реакцию на лекарство. Ваши лекарства могут быть изменены или скорректированы в зависимости от результатов этого теста.
Пожалуйста, соблюдайте все запланированные посещения лаборатории, чтобы можно было отслеживать вашу реакцию на лекарство. Ваши лекарства могут быть изменены или скорректированы в зависимости от результатов этого теста.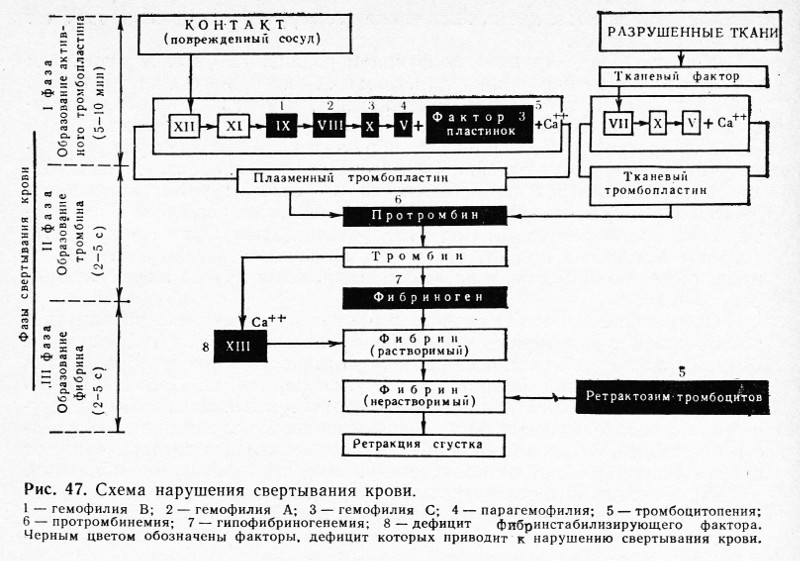

 Пожалуйста, соблюдайте все запланированные посещения лаборатории, чтобы можно было отслеживать вашу реакцию на лекарство. Ваши лекарства могут быть изменены или скорректированы в зависимости от результатов этого теста.
Пожалуйста, соблюдайте все запланированные посещения лаборатории, чтобы можно было отслеживать вашу реакцию на лекарство. Ваши лекарства могут быть изменены или скорректированы в зависимости от результатов этого теста.