Вакцинация против туберкулеза | Министерство здравоохранения Чувашской Республики
Следующая по очереди – вакцинация против туберкулеза. Её выполняют при выписке из роддома на 3-7 день жизни.
Туберкулез – инфекция, вызываемая микобактерией туберкулёза человека. Поражаются лёгкие, другие внутренние органы, кожа, кости, позвоночник. Наиболее тяжёлой формой заболевания является туберкулёзный менингит (воспаление мозговых оболочек). На заболеваемость туберкулёзом влияет ряд социальных факторов: недостаточное питание, скученность в помещениях, где живёт ребёнок и контакты с больными туберкулёзом взрослыми. Но болеют и социально благополучные люди, нередко туберкулёз выявляют у пожилых людей. Вакцинация новорожденных вакциной БЦЖ спасает от наиболее тяжёлых форм туберкулёза (туберкулёзного менингита, диссеминированных форм). От инфицирования самой туберкулёзной палочкой она не защищает, но защищает от смертельных и инвалидизирующих форм туберкулёза.
Вакцина БЦЖ существует на протяжении 80 лет и является одной из наиболее широко используемых в мире. ВОЗ рекомендует начинать вакцинацию БЦЖ сразу после рождения ребенка. В странах, где заболеваемость туберкулёзом очень низкая (США, Германия, Швеция, Израиль и другие), прививку БЦЖ проводят только в группах риска (людям, приехавшим из стран, где распространен туберкулёз).
Россия относится к странам с очень высокой заболеваемостью туберкулёзом, в том числе лекарственноустойчивым. В России прививка против туберкулёза жизненно необходима новорожденному.
Вакцина БЦЖ содержит как живые, так и неживые микробные клетки.
В вакцине БЦЖ-М доля живых клеток выше, а доза в 2 раза меньше, что позволяет меньшей дозой получить удовлетворительный результат и снизить частоту нежелательных реакций.
Обе вакцины из субштамма М. bovis (коровий) — БЦЖ (BCG-1 Russia) и оба препарата отвечают требованию ВОЗ.
В календарь данная вакцинация введена в 1953 году.
Вакцинация проводится практически здоровым новорожденным вакциной БЦЖ-М в возрасте 3-7 дней внутрикожно в верхнюю треть плеча. Вакцина БЦЖ используется у новорожденных в субъектах РФ с показателями заболеваемости выше 80 на 100 тыс. населения, а также при наличии в окружении больных туберкулёзом.
Вакцина БЦЖ используется у новорожденных в субъектах РФ с показателями заболеваемости выше 80 на 100 тыс. населения, а также при наличии в окружении больных туберкулёзом.
Ревакцинация проводится туберкулиноотрицательным детям в возрасте 7лет.
Скворцова допустила влияние вакцины от туберкулеза на течение COVID-19 :: Общество :: РБК
Вероника Скворцова
(Фото: Евгений Филипов / Global Look Press)
Вакцинация от туберкулеза (БЦЖ) может иметь определенную взаимосвязь с уровнем заболеваемости и смертности от коронавирусной инфекции, заявила глава Федерального медико-биологического агентства Вероника Скворцова в эфире телеканала «Россия 24».
Скворцова подтвердила, что в международных обзорах сейчас обсуждается взаимосвязь между скоростью распространения и уровнем смертности от коронавируса в разных странах с тем, применяется ли в них вакцина БЦЖ. Так, есть мнение, что вакцинация БЦЖ уменьшает число случаев заражения COVID-19.
Скворцова заявила об оставшихся 10–14 днях до «плато» коронавируса
По словам Скворцовой, сейчас существует много домыслов на счет связи вакцинации БЦЖ и распространения коронавируса. «Но то, что это может иметь определенное значение, наверное, может. Но я думаю, что сейчас механизмы перестройки иммунной обсуждать мы точно не будем, но какую-то роль это играет», — сказала она.
Коронавирус
Россия Москва Мир
0 (за сутки)
Выздоровели
0
0 (за сутки)
Заразились
0
0 (за сутки)
Умерли
0 (за сутки)
Выздоровели
0
0 (за сутки)
Заразились
0
0 (за сутки)
Умерли
0 (за сутки)
Выздоровели
0
0 (за сутки)
Заразились
0
0 (за сутки)
Умерли
Источник: JHU,
федеральный и региональные
оперштабы по борьбе с вирусом
Источник: JHU, федеральный и региональные оперштабы по борьбе с вирусом
Развитие вакцинопрофилактики | ГОБУЗ «Кольская ЦРБ»
24 марта 1882 года, когда Роберт Кох объявил о том, что сумел выделить бактерию, вызывающую туберкулёз, ученый достиг величайшего за всю свою жизнь триумфа.
Почему все же именно открытие возбудителя туберкулеза называют научным подвигом?
Дело в том, что возбудители болезни туберкулеза – чрезвычайно трудный объект для исследования. В первых препаратах для микроскопии, сделанных Кохом из легочной ткани молодого рабочего, умершего от скоротечной чахотки, ни одного микроба обнаружить не удалось. Не теряя надежды, ученый провел окраску препаратов по собственной методике и впервые под микроскопом увидел неуловимого возбудителя туберкулеза.
В первых препаратах для микроскопии, сделанных Кохом из легочной ткани молодого рабочего, умершего от скоротечной чахотки, ни одного микроба обнаружить не удалось. Не теряя надежды, ученый провел окраску препаратов по собственной методике и впервые под микроскопом увидел неуловимого возбудителя туберкулеза.
На следующем этапе необходимо было получить пресловутые микробактерии в чистой культуре. Еще несколько лет назад Кох нашел способ культивирования микробов не только на подопытных животных, но и в искусственной среде, например, на разрезе сваренного картофеля или в мясном бульоне. Он попытался таким же способом культивировать и бактерии туберкулеза, но они не развивались. Однако когда Кох впрыснул содержимое раздавленного узелка под кожу морской свинки, та погибла в течение нескольких недель, а в ее органах ученый нашел огромное количество палочек. Кох пришел к выводу, что бактерии туберкулеза могут развиваться только в живом организме.
Желая создать питательную среду, подобную живым тканям, Кох решил применить сыворотку животной крови, которую ему удалось раздобыть на бойне. И действительно, в этой среде бактерии быстро размножались. Полученными таким образом чистыми культурами бактерий Кох заразил несколько сотен подопытных животных разных видов, и все они заболели туберкулезом. Ученому было ясно, что возбудитель заболевания найден. В это время мир был возбужден открытым Пастером методом предупреждения заразных болезней с помощью прививок ослабленных культур бактерий, вызывающих данную болезнь. Поэтому Кох считал, что ему удастся тем же способом спасти человечество от туберкулеза.
И действительно, в этой среде бактерии быстро размножались. Полученными таким образом чистыми культурами бактерий Кох заразил несколько сотен подопытных животных разных видов, и все они заболели туберкулезом. Ученому было ясно, что возбудитель заболевания найден. В это время мир был возбужден открытым Пастером методом предупреждения заразных болезней с помощью прививок ослабленных культур бактерий, вызывающих данную болезнь. Поэтому Кох считал, что ему удастся тем же способом спасти человечество от туберкулеза.
Он приготовил вакцину из ослабленных бактерий туберкулеза, но предупредить заболевание с помощью этой вакцины ему не удалось. Вакцина эта под названием «туберкулина» до сих пор применяется как вспомогательное средство при диагностике туберкулеза. Кроме этого, Кох открыл бациллу сибирской язвы, холерный вибрион. В 1905 году за «исследования и открытия, касающиеся лечения туберкулеза» ученый был удостоен Нобелевской премии по физиологии и медицине.
26 декабря 1891 года Эмиль фон Беринг спас жизнь больному ребенку, сделав ему первую прививку от дифтерии.
До начала XX века дифтерия ежегодно уносила тысячи детских жизней, а медицина была бессильна облегчить их страдания и спасти от тяжелой агонии.
Немецкий бактериолог Фридрих Лёффлер в 1884 году сумел открыть бактерии, вызывающие дифтерию — палочки Corynebacterium diphtheriae. А ученик Пастера Пьер Эмиль Ру показал, как действуют палочки дифтерии и доказал, что все общие явления дифтерии — упадок сердечной деятельности, параличи и прочие смертельные последствия – вызваны не самой бактерией, а вырабатываемым ею ядовитым веществом (токсином), и что вещество это, введенное в организм, вызывает эти явления само по себе, при полном отсутствии в организме дифтерийных микробов.
Но Ру не умел обезвредить яд и не мог найти способ спасения больных детей. В этом ему помог ассистент Коха Беринг. В поисках средства, которое убивало бы бактерии дифтерии, Беринг делал прививки зараженным животным из разных веществ, но животные погибали. Однажды для прививки он использовал трихлорид йода. Правда, и на этот раз морские свинки тяжело заболели, но ни одна из них не погибла.
Правда, и на этот раз морские свинки тяжело заболели, но ни одна из них не погибла.
Воодушевленный первой удачей, Беринг, дождавшись выздоровления подопытных свинок, сделал им прививку, содержавшую дифтерийный токсин. Животные превосходно выдержали прививку, несмотря на то, что получили огромную дозу токсина. Затем ученый выяснил, что если сыворотку крови перенесших дифтерию и выздоровевших морских свинок ввести заболевшим животным, те выздоравливают. Значит, в крови переболевших появляется какой-то антитоксин, который нейтрализует токсин дифтерийной палочки.
В конце 1891 года в клинике детских болезней в Берлине, переполненной детьми, умирающими от дифтерии, была сделана прививка с антитоксином – и ребенок выздоровел. Эффект опыта был впечатляющим, многие дети были спасены, но все же успех был лишь частичным, и сыворотка Беринга не стала надежным средством, спасавшим всех детей. И тут Берингу помог его коллега и друг Пауль Эрлих – будущий изобретатель «препарата 606» (сальварсана) и победитель сифилиса. А тогда он сумел наладить масштабное производство сыворотки, рассчитать правильные дозировки антитоксина и повысить эффективность вакцины.
А тогда он сумел наладить масштабное производство сыворотки, рассчитать правильные дозировки антитоксина и повысить эффективность вакцины.
В 1894 году усовершенствованная сыворотка была успешно опробована на 220 больных детях. За спасение детей Берингу в 1901 году была присуждена первая Нобелевская премия по физиологии и медицине «за работу по сывороточной терапии, главным образом, за её применение при лечении дифтерии, что открыло новые пути в медицинской науке и дало в руки врачам победоносное оружие против болезни и смерти».
Уже позже, в 1913 году, Беринг предложил введение смеси токсина и антитоксина для выработки у детей активного иммунитета. И это оказалось наиболее действенным средством защиты (пассивный иммунитет, возникающий после введения одного только антитоксина, недолговечен). Профилактическая сыворотка, которая употребляется теперь против дифтерии, была найдена доктором Гастоном Рамоном, работником Пастеровского института в Париже, много лет спустя после открытия Лефлера, Ру и Беринга.
В конце XIX в. немецкий ученый Пауль Эрлих (1854-1915) положил начало учению об антителах как факторах гуморального иммунитета. Бурная полемика и многочисленные исследования, предпринятые после этого открытия, привели к весьма плодотворным результатам: было установлено, что иммунитет определяется как клеточными, так и гуморальными факторами. Таким образом, было создано учение об иммунитете. П. Эрлих в 1908 г. был удостоен Нобелевской премии по физиологии за создание клеточной теории иммунитета, которую он разделил с Ильей Ильичом Мечниковым.
1892 год считается годом открытия новых организмов — вирусов.
Впервые существование вируса (как нового типа возбудителя болезней) доказал русский учёный Дмитрий Иосифович Ивановский. Дмитрий Иосифович обнаружил вирусы в результате изучения заболевания табачных растений.
Пытаясь найти возбудителя опасной болезни – табачной мозаики (проявляется на многих, особенно тепличных растениях в виде скручивающихся трубочкой, желтеющих и опадающих листьев, в некрозе плодов, нарастающих боковых почек), Ивановский несколько лет занимался исследованиями в Никитском ботаническом саду под Ялтой и в ботанической лаборатории АН.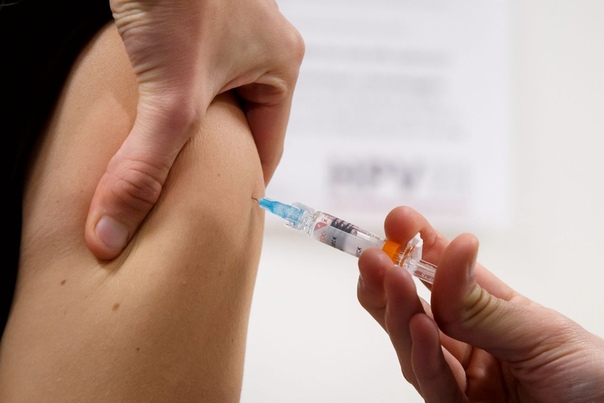
Зная из работ голландского ботаника А.Д. Майера о том, что мозаичную болезнь табака можно вызвать переносом сока больных растений здоровым, ученый растирал листья больных растений, процеживал сок через полотняный фильтр и впрыскивал его в жилки здоровых листьев табака. Как правило, инфицированные растения перенимали болезнь.
Ботаник тщательно изучал под микроскопом больные листья, но не обнаружил ни бактерий, ни еще каких-либо микроорганизмов, что неудивительно, так как вирусы размером от 20 до 300 нм (1 нм = 109 м) на два порядка меньше бактерий, и их в оптический микроскоп увидеть нельзя. Считая, что в инфицировании виноваты все-таки бактерии, ботаник стал пропускать сок через специальный фарфоровый фильтр Э. Шамберлана, но, вопреки ожиданиям, инфекционные свойства отфильтрованного сока сохранялись, то есть, фильтр не улавливал бактерии.
Попытка вырастить возбудителя мозаики на обычных питательных средах, как это делается с теми же бактериями, не увенчалась успехом. Обнаружив в клетках инфицированных растений кристаллические включения (кристаллы «И»), ученый пришел к выводу, что возбудителем мозаичной болезни является твердое инфекционное начало – либо фильтрующиеся бактерии, не способные расти на искусственных субстратах, либо неведомые и невидимые микроорганизмы, выделяющие токсины.
Обнаружив в клетках инфицированных растений кристаллические включения (кристаллы «И»), ученый пришел к выводу, что возбудителем мозаичной болезни является твердое инфекционное начало – либо фильтрующиеся бактерии, не способные расти на искусственных субстратах, либо неведомые и невидимые микроорганизмы, выделяющие токсины.
О своих наблюдениях Ивановский доложил в 1892 г. на заседании Императорской АН. Исследования Ивановского подхватили ученые во всем мире. Использовав метод фильтрации русского ученого, немецкие врачи Ф. Лефлер и П. Фрош в 1897 г. обнаружили возбудителя ящура крупного рогатого скота. Затем последовал бум открытий вирусов – желтой лихорадки, чумы, бешенства, натуральной оспы, полиомиелита и т. д. В 1917 году были открыты бактериофаги – вирусы, разрушающие бактерии. Естественно, каждое открытие не было задачей «чистой» науки, за ним тут же следовало приготовление противоядия – вакцины, лечение и профилактика заболевания.
1921 год ознаменовался изобретением живой бактериальной вакцины против туберкулеза (БЦЖ).
Туберкулез перестал считаться смертельно опасным заболеванием, когда микробиолог Альбер Кальметт и ветеринар Камиль Герен разработали во Франции в 1908-1921 годах первую вакцину для человека на основе штамма ослабленной живой коровьей туберкулезной бациллы.
В 1908 году они работали в Институте Пастера в Лилле. Их деятельность охватывала получение культур туберкулёзной палочки и исследования различных питательных сред. При этом ученые выяснили, что на питательной среде на основе глицерина, жёлчи и картофеля вырастают туберкулёзные палочки наименьшей вирулентности (от лат. virulentus— ядовитый, сумма свойств микроба, определяющая его болезнетворное действие).
С этого момента они изменили ход исследования, чтобы выяснить, нельзя ли посредством повторяющегося культивирования вырастить ослабленный штамм для производства вакцины. Исследования продлились до 1919 года, когда вакцина с невирулентными (ослабленными) бактериями не вызвала туберкулёз у подопытных животных. В 1921 году ученые создали вакцину БЦЖ (BCG – Bacille bilie’ Calmette-Gue’rin) для применения на людях.
Исследования продлились до 1919 года, когда вакцина с невирулентными (ослабленными) бактериями не вызвала туберкулёз у подопытных животных. В 1921 году ученые создали вакцину БЦЖ (BCG – Bacille bilie’ Calmette-Gue’rin) для применения на людях.
Общественное признание вакцины проходило с трудом, в частности, из-за случавшихся трагедий. В Любеке 240 новорождённых были привиты в 10-дневном возрасте. Все они заболели туберкулёзом, 77 из них умерли. Расследование показало, что вакцина была заражена вирулентным (неослабленным) штаммом, который хранился в том же инкубаторе. Вина была возложена на директора больницы, которого приговорили к 2 годам лишения свободы за халатность, повлёкшую смерть.
Многие страны, получившие от Кальметта и Герена штамм БЦЖ (1924-1925 гг.), подтвердили его эффективность и вскоре перешли к ограниченной, а затем и к массовой вакцинации против туберкулеза. В СССР штамм БЦЖ был привезен Л.А. Тарасевичем в 1925 году и обозначен BCG-I.
Вакцина БЦЖ выдержала испытание временем, ее эффективность проверена и доказана практикой. В наши дни вакцина БЦЖ является основным препаратом для специфической профилактики туберкулеза, признанным и используемым во всем мире. Попытки приготовления противотуберкулезной вакцины из других ослабленных штаммов или отдельных фракций микробных клеток пока не дали значимых практических результатов.
В 1923 году французский иммунолог Г. Рамон получил столбнячный анатоксин, который стал применяться для профилактики заболевания. Научное изучение столбняка началось во второй половине XIX века. Возбудитель столбняка был открыт почти одновременно русским хирургом Н. Д. Монастырским (в 1883 году) и немецким ученым А. Николайером (в 1884 году). Чистую культуру микроорганизма выделил в 1887 г. японский микробиолог С. Китазато, он же в 1890 г. получил столбнячный токсин и (совместно с немецким бактериологом Э. Берингом) создал противостолбнячную сыворотку.
Берингом) создал противостолбнячную сыворотку.
12 апреля 1955 г. в США успешно завершилось крупномасштабное исследование, подтвердившее эффективность вакцины Джонаса Солка – первой вакцины против полиомиелита. Эксперименты по созданию противополиомиелитной вакцины Солк начал в 1947 году. Вакцина из предварительно умерщвленных формалином полиовирусов была испытана Американским национальным фондом по борьбе с полиомиелитом. Впервые вакцина, созданная из предварительно умерщвленных формалином полиовирусов, прошла испытание в 1953-54 гг. (тогда ее тестировали добровольцы), а с 1955 года она получила уже широкое применение.
В исследовании приняло участие около 1 млн детей в возрасте 6-9 лет, из которых 440 тыс. получили вакцину Солка. По свидетельству очевидцев, родители с воодушевлением делали пожертвования на исследование и охотно записывали своих детей в ряды его участников. Сейчас это трудно представить, но в то время полиомиелит был самой грозной детской инфекцией, и родители со страхом ожидали прихода лета, когда регистрировался сезонный пик инфекции.
Результаты пятилетнего, с 1956 по 1961 год, массового применения вакцины превзошли все ожидания: среди детей в возрастных группах, особенно подверженных инфекции, заболеваемость снизилась на 96%.
В 1954 г. в США было зарегистрировано более 38 тыс. случаев полиомиелита, а спустя 10-летие применения вакцины Солка, в 1965 г., количество случаев полиомиелита в этой стране составило всего 61.
В 1991 году Всемирная организация здравоохранения объявила, что в Западном полушарии полиомиелит побежден. В странах Азии и Африки, благодаря массовым вакцинациям, заболеваемость также резко снизилась. Позже вакцина Солка была заменена на более совершенную, разработанную Альбертом Сэйбином. Однако вклад Джонаса Солка в борьбу с полиомиелитом это ничуть не приуменьшило: в этой области он по сей день считается первопроходцем.
В 1981-82 гг. стала доступной первая вакцина против гепатита В. Тогда в Китае приступили к использованию вакцины, приготовленной из плазмы крови, полученной от доноров из числа больных, которые имели продолжительную инфекцию вирусного гепатита В. В том же году она стала доступна и в США. Пик её применения пришёлся на 1982-88 гг. Вакцинацию проводили в виде курса из трёх прививок с временным интервалом. При постмаркетинговом наблюдении после введения такой вакцины отметили возникновение нескольких случаев побочных заболеваний центральной и периферической нервной системы. В исследовании привитых вакциной лиц, проведённом через 15 лет, подтверждена высокая иммуногенность вакцины, приготовленной из плазмы крови.
В том же году она стала доступна и в США. Пик её применения пришёлся на 1982-88 гг. Вакцинацию проводили в виде курса из трёх прививок с временным интервалом. При постмаркетинговом наблюдении после введения такой вакцины отметили возникновение нескольких случаев побочных заболеваний центральной и периферической нервной системы. В исследовании привитых вакциной лиц, проведённом через 15 лет, подтверждена высокая иммуногенность вакцины, приготовленной из плазмы крови.
С 1987 г. на смену плазменной вакцине пришло следующее поколение вакцины против вируса гепатита В, в которой использована технология генной модификации рекомбинантной ДНК в клетках дрожжевого микроорганизма. Её иногда называют генно-инженерной вакциной. Синтезированный таким способом HBsAg выделяли из разрушаемых дрожжевых клеток. Ни один способ очистки не позволял избавляться от следов дрожжевых белков. Новая технология отличалась высокой производительностью, позволила удешевить производство и уменьшить риск, происходящий из плазменной вакцины.
В 1983 году Харальд цур Хаузен ему обнаружил ДНК папилломавируса в биопсии рака шейки матки, и это событие можно считать открытием онкогенного вируса ВПЧ-16.
Еще в 1976 году была выдвинута гипотеза о взаимосвязи вирусов папилломы человека (ВПЧ) с раком шейки матки. Некоторые разновидности ВПЧ безвредны, некоторые вызывают образование бородавок на коже, некоторые поражают половые органы (передаваясь половым путем). В середине семидесятых Харальд цур Хаузен обнаружил, что женщины, страдающие раком шейки матки, неизменно заражены ВПЧ.
В то время многие специалисты полагали, что рак шейки матки вызывается вирусом простого герпеса, но цур Хаузен нашел в раковых клетках не вирусы герпеса, а вирусы папилломы и предположил, что развитие рака происходит в результате заражения именно вирусом папилломы. Впоследствии ему и его коллегам удалось подтвердить эту гипотезу и установить, что большинство случаев рака шейки матки вызваны одним из двух типов этих вирусов: ВПЧ-16 и ВПЧ-18. Эти типы вируса обнаруживаются примерно в 70% случаях рака шейки матки. Зараженные такими вирусами клетки с довольно большой вероятностью рано или поздно становятся раковыми, и из них развивается злокачественная опухоль.
Эти типы вируса обнаруживаются примерно в 70% случаях рака шейки матки. Зараженные такими вирусами клетки с довольно большой вероятностью рано или поздно становятся раковыми, и из них развивается злокачественная опухоль.
Исследования Харальда цур Хаузена в области ВПЧ-инфекции легли в основу понимания механизмов канцерогенеза, индуцированного вирусом папилломы. Впоследствии были разработаны вакцины, которые позволяют предотвратить инфекцию вирусами ВПЧ-16 и ВПЧ-18. Это лечение позволяет сократить объем хирургического вмешательства и в целом снизить угрозу, представляемую раком шейки матки.
В 2008 году Нобелевский комитет присудил Нобелевскую премию в области физиологии и медицины Харальду цур Хаузену за открытие того, что вирус папилломы может вызывать рак шейки матки.
Вакцинопрофилактика туберкулеза в мегаполисе: ее эффективность и возникающие проблемы | Севостьянова
1. European Centre for Disease Prevention and Control/WHO Regional Office for Europe. Tuberculosis surveillance and monitoring in Europe 2013. Stockholm, European Centre for Disease Prevention and Control. 2013.
European Centre for Disease Prevention and Control/WHO Regional Office for Europe. Tuberculosis surveillance and monitoring in Europe 2013. Stockholm, European Centre for Disease Prevention and Control. 2013.
2. Blasi F., Reichman L.B, Migliori G.B. Presenting the European Forum for TB Innovation: innovative thinking in progressing towards TB elimination in Europe. Eur Respir. J. 2012; 40: 806 — 808.
3. Veen J., Migliori G.B., Raviglione M., Rieder H.L., Dara M., Falzon D. et al. Harmonisation of TB control in the WHO European region: the history of the Wolfheze Workshops. Eur. Respir. J. 2011; 37: 950 — 959.
4. Аксенова В.А. Современные подходы к проблеме применения противотуберкулезной вакцинации. Эпидемиология и Вакцинопрофилактика. 2004; 4: 13 — 16.
5. Севостьянова Т.А., Аксенова В.А., Леви Д.Т. Проблемы современной вакцинопрофилактики туберкулеза в России. Материалы 1 конгресса национальной ассоциации фтизиатров. Сакт-Петербург. 2012: 197 — 199.
6. Васильева Е.Б., Мосина А.В., Клиническая и эпидемиологическая характеристика туберкулеза у детей раннего возраста. Пробл. туб. 2008;. 11: 24 — 27.
7. Леви Д.Т., Александрова Н.В., Рухамина М.Л., Подлипаева И.В. Осложнения вакцинации БЦЖ. Всероссийская научно-практическая конференция «Вакцинология 2010. Совершенствование иммунобиологических средств профилактики, диагностики и лечения инфекционных болезней», Москва. 2010: 67 — 68.
8. Raviglione M., Marais B., Floyd K., Lonnroth K. , Getahun H., Migliori G.B. et al. Scaling up interventions to achieve global tuberculosis control: progress and new developments. Lancet 2012; 379: 1902 — 1913.
, Getahun H., Migliori G.B. et al. Scaling up interventions to achieve global tuberculosis control: progress and new developments. Lancet 2012; 379: 1902 — 1913.
9. Аксенова В.А., Леви Д.Т. Туберкулезные вакцины. Вакцины и вакцинация. Национальное руководство. 2011; 18: 371 — 412.
10. Trunz B.B., Fine Fi, Dye C. Effect of BCG vaccination on childhood tuberculous meningitis and miliary tuberculosis worldwide: a meta-analysis and assessment of cost-effectiveness. Lancet. 2006; 367: 1173 — 1180.
11. World Health Organization. BCG (Tuberculosis). Доступно на: www.who.int/biologicals/areas/vaccines/bcg/Tuberculosis/en/ Date last accessed: June 7, 2013. Date last updated: June 28, 2012.
12. Dara M., Acosta C.D., Rusovich V., Zellweger J.P., Centis R., Migliori G.B. WHO EURO Childhood Task Force Memb (2014). Bacille Calmette-Guerin vaccination: the current situation in Europe. European Respiratory Journal, 43 (1), 24 — 35.
Dara M., Acosta C.D., Rusovich V., Zellweger J.P., Centis R., Migliori G.B. WHO EURO Childhood Task Force Memb (2014). Bacille Calmette-Guerin vaccination: the current situation in Europe. European Respiratory Journal, 43 (1), 24 — 35.
13. Противотуберкулезная работа в городе Москве. Аналитический обзор статистических показателей по туберкулезу, 2013 г. Е.М. Богородская, В.И. Литвинов ред. Москва. 2014: 15.
14. Приказ Минздрава РФ от 21 марта 2014 г. № 125н г. «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям».
15. Шамуратова Л.Ф., Влацкая Ю.Ф., Сенчихина О.Ю., Синицын М.В. Отдельные аспекты вакцинопрофилактики туберкулеза у детей из перинатального контакта по ВИЧ-инфекции и их влияние на течение туберкулеза. Туберкулез и социально значимые заболевания. 2014; 5: 50 — 57.
Туберкулез и социально значимые заболевания. 2014; 5: 50 — 57.
16. Nuttall J.J.C, Eley B.S. BCG Vaccination in HIV-Infected Children. Tuberc. Res. Treat. 2011: 712 — 736.
17. Cuello-Garca C.A, Perez-Gaxiola G, Jimenez Gutierrez C. Treating BCG-induced disease in children. Cochrane Database Syst. Rev. 2013; 1: CD008300.
Вакцинопрофилактика туберкулеза | Леви | БИОпрепараты. Профилактика, диагностика, лечение
1. Calmette A., Guérin C., Weill-Hallé B. Essais d’immunization contre l’infection tuberculouse. Rev. Tuberc. 1924; 5: 481-91.
2. Hokey D.A., Misra A. Aerosol vaccines for tuberculosis: a fine line between protection and pathology. Tuberculosis (Edinb) 2011; 91: 82-5.
Tuberculosis (Edinb) 2011; 91: 82-5.
3. Wang Z., Pan Y., Wu J., Zhu B. Complete genome sequence and sequence analysis of BCG Tice. Wei Sheng Wu Bao 2012; 52: 1219-27 (in Chinese) [PubMed].
4. Gomes L.H., Otto T.D., Vasconcellos E.A. et al. Genome sequence of Mycobacterium tuberculosis BCG Moreau, the Brasilian Vaccine strain against tuberculosis. Bacteriol. 2011; 193: 5600-01 [PubMed].
5. Митинская Л.А., ред. Туберкулез у детей. М.: Кудесники; 2004.
6. Аксенова В.А., Севостьянова Т.А., Барышникова Л.А., Клевно Н.И. Туберкулез у детей в России и задачи фтизиатрической и общей педиатрической службы по профилактике и раннему выявлению заболевания. Туберкулез и болезни легких 2014; 3: 40-6.
7. Аксенова В.А., Клевно Н.И., Севостьянова Т.А. Эпидемиологическая ситуация по туберкулезу у детей и подростков в России. Туберкулез и болезни легких 2011; 4: 22.
8. Trunz B.B., Fine P., Dye C. Effect of BCG vaccination on childhood tuberculous meningitis and miliary tuberculosis worldwide: a metaanalysis and assessment of cost-effectiveness. Lancet 2006; 367(9517): 117-80.
9. Блум Б.Р., Файн П.Е.М. Опыт вакцинации БЦЖ: будущее вакцины против туберкулеза. В кн. Карачунский М.А., ред. Туберкулез, патогенез, защита, контроль. М.; 2002. С. 575-605.
10. Barreto M.L., Cunha S.S., Pereira S.M., Genser B., Hijjar M.A., Ichihara M.Y. et. al. Neonatal BCG protection against tuberculosis lasts for 20 years in Brazil. Tuber. Lung Dis. 2005; 9(10): 1171-3.
Tuber. Lung Dis. 2005; 9(10): 1171-3.
11. Митинская Л.А., Ефимова А.А., Лицева О.А. Эффективность вакцинации новорожденных вакциной БЦЖ и БЦЖ-М. Проблемы туберкулеза 1990; 12: 3-8.
12. Поддубная Л.В., Шилова Е.П., Егошина И.Ю., Шакуро Ж.В. Диагностика активности туберкулезного процесса у детей. Туберкулез и болезни легких 2013; 9: 16-19.
13. Смит П.Ж., Мосс А.Р. Эпидемиология туберкулеза. В кн. Карачунский М.А., ред. Туберкулез, патогенез, защита, контроль. М.; 2002. С. 49-62.
14. Черноусова Л.Н., Андреевская С.Н., Смирнова Т.Г., Земскова З.С., Ларионова Е.Е. Биологические свойства штаммов M. tuberculosis кластера W. Проблемы туберкулеза 2008; 10: 45-50.
15. Barreto M.L., Pereira S.M., Ferreira A.A. BCG vaccine: efficacy and indications for vaccination and revaccination. Pediatr. 2006; 82(3, Suppl): 45-54.
Barreto M.L., Pereira S.M., Ferreira A.A. BCG vaccine: efficacy and indications for vaccination and revaccination. Pediatr. 2006; 82(3, Suppl): 45-54.
16. Ho M.M., Markey K., Rigsby P., Hockley J., Corbel M.J. Report on international collaborative study to establish the first WHO reference reagent for three different substrains. Vaccine 2011; 29: 512-8.
17. Berh M.,A. BCG-different strains, different vaccines? Lancet Infect.Dis. 2002; 2: 86-92.
18. WHO Expert committee on Biological Standardization. Requirements for BCG vaccine. WHO Technical Rep Ser № 979, 2013.
19. Vanicek H. Complications after initial BCG vaccination in a 5-yeare period in East Bohemia region. Cesk. Pediatr. 1988; 43: 23-26.
1988; 43: 23-26.
20. Lotte A., Wasz-Hocket O., Poisson N., Dumitrescu N., Verron M., Couvet E. BCG complications. Adv. Tuberc. Res. 1988; 21: 107-93.
21. Закирова Н.Р. Осложнения после вакцинации и ревакцинации БЦЖ у детей на территории России. Автореф. дис.. канд. мед. наук. М.; 1998.
22. Таточенко В.К., Озерецковский Н.А., Федоров А.М. Диагностика и лечение поствакцинальных осложнений. В кн.: Иммунопрофилактика. М.; 2014. С. 163-88.
23. Milstein J.B., Gibson J.J. Quality control of BCG vaccine by WHO; А review of factors that may affect vaccine effectiveness and safety. Bull. World Health Org. 1990; 88: 93-106.
24. Hess J., Miko D., Catic A., Lehmensiek V., Russell D.G., Kaufmann SHE. Mycobacterium bovis Bacille Calmette-Guerin strains secreting listeriolysis of Listeria monocylogenes. Proc. Natl Acad. Sci. USA 1998; 95: 5299-304.
Hess J., Miko D., Catic A., Lehmensiek V., Russell D.G., Kaufmann SHE. Mycobacterium bovis Bacille Calmette-Guerin strains secreting listeriolysis of Listeria monocylogenes. Proc. Natl Acad. Sci. USA 1998; 95: 5299-304.
25. Paterson R. Human trials start for new tuberculosis vaccine. Lancet. Infect. Dis. 200; 1: 291-6.
26. Bao L., Chen W., Zhang H., Wang X. Virulens, Immunogenicity and protective efficacy of two recombinant Mycobacterium bovis BCG strains expressing the antigen ESAT-6 from Mycobacterium tuberculosis. Infect. Immun. 2003; 71: 1656-61.
27. Mahairas G.G., Sabo P.J., Hickey M.J., Singh D.S. Molecular analysis of genetic differences between Mycobacterium bovis BCG and virulent M. bovis. Bacteriol. 1996; 178 (5): 1274-82.
28. Behr M.A. and Small P.M. A historical and molecular phylogeny of BCG strains. Vaccine 1999; 17(7-8): 915-22.
Behr M.A. and Small P.M. A historical and molecular phylogeny of BCG strains. Vaccine 1999; 17(7-8): 915-22.
29. Seki M., Honda I., Fujita I., Yano I., Yamamoto S., Koyama A. Whole genome sequence analysis of Mycobacterium bovis BCG Tokio 172: A comparative study of BCG vaccine substraines. Vaccine 2009; 27: 1710-6.
30. Kamath A.T., Fruth U., Brennan M.J., Dobbelaer R., Hubrechts P., Ho M.M. et al. New live mycobacterial vaccines: The Geneva consensus on essential steps towards clinical development. Vaccine 2005: 23: 3753-61.
31. Garsia Contreras L., Awashthi S., Hanif S.N.M., Hickey A.J. Inhaled Vaccines for the Prevention of tuberculosis. Micobac Dis. 2012; S: 1-002: 1-13.
32. БИОПРЕПАРАТЫ
БИОПРЕПАРАТЫ
33. Kaufmann S.Y. Fact and fiction in tuberculosis vaccine research: 10 years later. Lancet Infect Dis. 2011; 11: 633-40.
34. Sun Ronggai, Skeiky Easir A.W., Dheenadhayalan V., Imam Z., Penn E. et al. Novel BCG expressing perfringolysin O and the over-expression of key immunodominant antigens; pre-clinical characterization, safety and protection against challenge with Mycobacterium tuberculosis. Vaccine 2009; 27: 4412-23.
35. Desel C., Dorhoi A., Bandermann S., Grode L., Eisele B. et al. Recombinant BCG AureC hly+ induces superior protection over parental BCG by stimulating balans combination of type 1 and type 17 cytokine responses. Infect Dis. 2011; 204: 1573-84.
36. Sampson S.L., Mansfielf K.G., Carville A., Magee D.M., Quitugua T. et al. Extended safety and efficacy studies of a live attenuated double leucine candidate. Vaccine 2011; 29: 4839-47.
Sampson S.L., Mansfielf K.G., Carville A., Magee D.M., Quitugua T. et al. Extended safety and efficacy studies of a live attenuated double leucine candidate. Vaccine 2011; 29: 4839-47.
37. Ibanga H.B., Brookes R.H., Hill P.C., Owiafe P.K., Fletcher H.A., Lienhardt C. et al. Early clinical trials with a new tuberculosis vaccine, MVA85A, in tuberculosis endemic countries: Issues in study design. Lancet Dis. 2006; 6: 522-8.
38. Tameris M.D., Hatherill M., Landry B.S. et al. Safety and efficacy of MVA85A, a new tuberculosis vaccine, infants previously vaccinated with BCG: a randomized, placebo-controlled phase 2b trial; Lancet 2013; 381: 1021-8.
Оценка эффективности противотуберкулезной вакцинации у детей, родившихся у женщин с ВИЧ-инфекцией | Клевно
1. Аксенова В.А., Леви Д.Т. Туберкулезные вакцины. Вакцины и вакцинация. Национальное руководство. М, 2011; 18: 371–412. (Aksenova V.A., Levi D.T. TB vaccine. Vaccines and vaccination. National leadership. Moscow, 2011; 18: 371–412. (in Russ))
Аксенова В.А., Леви Д.Т. Туберкулезные вакцины. Вакцины и вакцинация. Национальное руководство. М, 2011; 18: 371–412. (Aksenova V.A., Levi D.T. TB vaccine. Vaccines and vaccination. National leadership. Moscow, 2011; 18: 371–412. (in Russ))
2. Шугаева С.Н., Петрова А.Г., Киклевич В.Т. и др. Вакцинопрофилактика туберкулеза у детей, рожденных от ВИЧ- инфицированных матерей. Мат. 1 Всерос. ежегодного конгресса по инфекцион. болезням. Инфекционные болезни 2009; 7: 239. (Shugaeva S.N. Petrova А.G., Kiklevich V.T. et al. Vaccine tuberculosis in children born to HIV-infected mothers. Annual congress on infectious diseases. Infektsionnye bolezni 2009; 7: 239. (in Russ))
3. Митинская Л.А. Вакцинация БЦЖ (настоящее и будущее). Проблемы туберкулеза 1995; 3: 54–58. (Mitinskaya L.A. BCG vaccination (present and future). Problemy tuberkuleza 1995; 3: 54–58. (in Russ))
4. Hesseling A.C., Rabie H., Marais B.J. et al. Bacilli Calmette-Guerin vaccine-induced disease in HIV-infected and HIVuninfected children. Clin Infect Dis. 2006: 42: 548–558.
5. Нечаева О.Б., Скачкова Е.И., Подымова А.С. и др. Эффективность прививок БЦЖ у детей, рожденных от ВИЧ-инфицированных матерей. Социальные аспекты здоровья населения [Электронный ресурс]: информационно-аналитический вестник. М, 2011; 1: 17: http:// vestnikmednet.ru/content/view/272/30/ (Nechayeva O.B., Skachkova E.I., Podymova A.S. et al. The effectiveness of BCG vaccination in children born to HIV-infected mothers. The social dimension of health [electronic resource]: information-analytical bulletin. Moscow, 2011; 1: 17: http:// vestnikmednet.ru/content/view/272/30/ (in Russ))
6. Global Advisory Committee on Vaccine Safety, World Health Organization. Revised BCG vaccination guidelines for infants at risk for HIV infection. Wkly Epidemiologic Rec 2007; 82: 193–196.
7. Mak T.K., Tippi K., Hesseling A.C. et al. Mantoux Making BCG vaccination programmes safer in the HIV era. Lancet 2008; 372: 786–787.
8. Reichman L.B. Why hasn’t BCG proved dangerous in HIV-infected patients? JAMA 1998; 261: 3246.
9. Starke J.R. Diagnosis of tuberculosis in children. Pediatr Infect Dis J 2000; 19: 1095–1096.
10. Mak T.K., Hesseling A.C., Hussey G.D., Cotton M.F. Making BCG vaccination programmes safer in the HIV era. Lancet 2008; 372: 786–787.
11. Tastan Y., Arvas A., Demir G. et al. Influence of bacillus Calmette-Guerin vaccination at birth and 2 months old age on the peripheral blood T-cell subpopulations [gamma/delta and alpha-beta T-cell]. Pediatr Allerg Immunol 2005; 16: 624–629.
12. Revised BCG vaccination guidelines for infants at risk for HIV infection. Wkly Epidemiol Rec 2007; 82: 21: 193–196.
границ | Вакцинация против туберкулеза: модернизация БЦЖ с помощью молекулярной генетики и иммунологии
«Обязательство по продвижению исследований в области фундаментальной науки , исследований в области общественного здравоохранения и разработке инновационных продуктов и подходов , … , , без которых прекращение эпидемии туберкулеза будет невозможно. , в том числе для обеспечения , as как можно скорее , новые , безопасные , эффективные , справедливые , доступные , доступные вакцины , … » Резолюция, принятая Генеральной Ассамблеей Организации Объединенных Наций на заседании высокого уровня по борьба с туберкулезом, 2018 (1).
Введение
Единственная вакцина против туберкулеза (ТБ), используемая до сих пор, Bacille Calmette Guérin (BCG), была представлена в 1921 году после интенсивных исследований и разработок (НИОКР) в течение более десяти лет (2). Это не первая попытка иммунизации против туберкулеза. Самая первая попытка была предпринята Робертом Кохом, который использовал композицию субъединица-адъювант (3). Впоследствии было протестировано несколько других подходов, включая вакцины убитых микобактерий и живые нетуберкулезные штаммы микобактерий.Тем не менее, все они потерпели неудачу, и на сегодняшний день единственной вакциной с доказанной безопасностью и эффективностью остается БЦЖ. Фактически, сегодня БЦЖ — наиболее широко используемая вакцина, которую вводили более 4 миллиардов раз. БЦЖ была разработана для защиты новорожденных с высоким риском туберкулеза (2). Эта задача была выполнена, по крайней мере, частично, поскольку было доказано, что БЦЖ защищает от тяжелого внелегочного туберкулеза, но меньше — от легочного туберкулеза у младенцев (4–6). Тем не менее, даже сегодня детский ТБ вызывает тревогу в эндемичных по ТБ странах с высоким уровнем охвата иммунизацией БЦЖ (7–9).Позже БЦЖ также была протестирована в качестве вакцины против легочного туберкулеза у подростков и взрослых, но эта амбициозная цель не была достигнута, и ни одна вакцина так и не смогла надежно защитить от легочного туберкулеза, наиболее распространенной формы болезни, в любой возрастной группе. Срочно необходима более совершенная вакцина, поскольку Mycobacterium tuberculosis ( Mtb ), вызывающая туберкулез, остается на вершине печально известного списка смертельных инфекционных агентов (10). В 2018 году этим заболеванием заболели 10 млн человек и 1.5 миллионов умерли (11) (рисунок 1). В начале 21 века наблюдается рост усилий в области НИОКР по созданию новых противотуберкулезных вакцин (12–19). К ним относятся составы субъединицы-адъювант, содержащие слитые белки Mtb , вакцины с вирусным вектором, экспрессирующие один или несколько антигенов Mtb , убитые микобактериальные вакцины и жизнеспособные аттенуированные микобактериальные вакцины.
Рисунок 1. Эпидемиологические данные по туберкулезу (ТБ).
Иммунопатология туберкулеза
Туберкулез — хроническое инфекционное заболевание, вызываемое внутриклеточным возбудителем Mtb (20).Эти кислотоустойчивые бациллы защищены уникальной богатой липоидами клеточной стенкой, содержащей различные воскоподобные вещества и гликолипиды, которые способствуют сопротивлению иммунной атаке. Mtb обычно передается аэрозолями, попадая в альвеолы в нижних долях легких. Как только патоген попадает в альвеолярные фагоциты, он попадает в фагосому, где поддерживает нейтральный локальный pH (21). Более того, Mtb способен выходить в цитозоль (22). Эти и другие механизмы способствуют устойчивости Mtb к профессиональным фагоцитам, включая полиморфноядерные нейтрофильные гранулоциты (короткие нейтрофилы) и мононуклеарные фагоциты (тканевые макрофаги и моноциты) (23–27).Макрофаги покоящейся ткани обычно не могут устранить Mtb и служат его отступлением из-за своей долгой жизни. Моноциты крови немного более агрессивны, но не могут достичь стерильного удаления Mtb . Нейтрофилы — это очень агрессивные фагоциты, потенциально способные нанести вред Mtb . Из-за их короткого срока службы им, как правило, не удается полностью уничтожить Mtb , и они не служат гаванью, в которой может сохраняться Mtb .После активации цитокинами, особенно интерфероном-γ (IFN-γ), мононуклеарные фагоциты увеличивают свою антибактериальную способность и представляют более серьезную угрозу для Mtb , хотя обычно они не могут полностью его искоренить. Врожденный иммунный ответ, опосредованный профессиональными фагоцитами, служит первым барьером для Mtb . Недавние данные свидетельствуют о том, что эпигенетические изменения, вызванные Mtb в профессиональных фагоцитах, приводят к тренированному иммунитету. Такой тренированный иммунитет может сыграть роль в ранней защите от повторных инфекций Mtb (28, 29).Однако убедительных доказательств в пользу этого предположения пока нет.
Кроме того, подтипы дендритных клеток (ДК) могут охватывать Mtb (30, 31). Вероятно, они перемещают Mtb в паренхиму легких, где начинается формирование гранулемы.
Формирование гранулемы строго регулируется Т-лимфоцитами, первоначально стимулированными в дренирующих лимфатических узлах, к которым перемещаются DC, содержащие Mtb (25, 32). Т-лимфоциты организуют образование твердых гранулем, которые в основном состоят из макрофагов, ДК и Т- и В-лимфоцитов.В этих гранулемах содержится Mtb , и инфицированный человек остается здоровым и у него развивается латентная туберкулезная инфекция (ЛТИ) (24, 33, 34). Было доказано, что Т-клетки CD4 играют центральную роль в приобретении устойчивости к Mtb и сдерживают их (19, 25). По цитокинам эти CD4 Т-клетки секретируют, их можно разделить на клетки Th2, Th3 и Th27. Клетки Th2 предпочтительно стимулируются во время инфицирования Mtb и имеют большое значение для защиты. Они продуцируют цитокины, такие как IFN-γ, интерлейкин-2 (IL-2) и α некроза опухоли (TNF-α).Клетки Th3 индуцируются слабо. Их часто считают вредными при туберкулезе, поскольку они вызывают несоответствующие эффекторные механизмы. Их основные цитокины — это ИЛ-4, ИЛ-5, ИЛ-10 и ИЛ-13. Однако были представлены доказательства того, что цитокины Th3, по крайней мере частично, могут способствовать заживлению тканей. Клетки Th27 вызывают быстрые провоспалительные реакции, секретируя ИЛ-17. Они стимулируются во время заражения Mtb , и были опубликованы доказательства того, что они участвуют в защите от туберкулеза, особенно на ранних стадиях заражения.Роль CD8 Т-клеток в защите и сдерживании — хотя и менее значительная — также широко признана. CD8 Т-клетки часто продуцируют цитокины типа Th2 и, кроме того, проявляют цитолитическую активность (19, 25, 26). Был продемонстрирован вклад цитолитических механизмов в убийство Mtb (35). Роль других лимфоидных клеток, включая врожденные лимфоидные клетки (iLC), NK T-клетки, иммунные T-клетки слизистой оболочки (MAIT), γδ T-лимфоциты и B-лимфоциты, является предметом постоянных дискуссий (32, 36–45).В-лимфоциты могут участвовать в иммунитете против ТБ посредством двух механизмов: во-первых, как регуляторные В-лимфоциты, а во-вторых, как плазматические клетки, продуцирующие антитела. Доказательств наличия регуляторных В-лимфоцитов в иммунитете против ТБ немного (46, 47). Выявлена роль различных изотипов антител в защите от туберкулеза (36, 42, 45). Возможно, эти антитела модулируют профессиональные фагоциты за счет их связывания с различными рецепторами Fc. Получены убедительные доказательства того, что γδ Т-клетки вносят вклад в раннюю иммунную защиту, секретируя IL-17 (38).ILC можно разделить на iLC-1, iLC-2 и iLC-3 в соответствии с их паттерном секреции цитокинов (40). Цитокины, продуцируемые iLC-1, относятся к типу Th2, цитокины iLC-2 относятся к Th3, а цитокины iLC-3 относятся к типу Th27. ILC-1 и iLC-3, вероятно, способствуют устойчивости к Mtb и iLC-2 к заживлению поражений (37). Во время хронической инфекции канонические Т-лимфоциты CD4 и CD8 развиваются в Т-клетки памяти, которые можно сгруппировать в эффекторные Т-клетки памяти (T EM ), центральные Т-клетки памяти (T CM ) и резидентные Т-клетки памяти (T РМ ) (48).Хотя роль различных Т-клеток памяти в защите от Mtb до конца не изучена, были представлены доказательства особой роли T RM и T CM в защите от Mtb (49, 50). Вероятно, что разные типы Т-клеток памяти участвуют в защитном иммунитете на разных стадиях инфекции.
Во время LTBI Mtb содержится в твердых грануоломах (24, 33, 51). ЛТБИ переходит в активный туберкулез, когда гранулемы становятся некротическими, а затем казеозными.Это происходит примерно у 5% людей с ЛТИ в течение первых 2 лет и еще у 5% в более поздние сроки. Таким образом, только ок. У 10% из 1,7 миллиарда людей с ЛТИ развивается активная форма туберкулеза (52). Развитие болезни в активную фазу происходит из-за ослабления иммунного ответа с помощью нескольких не до конца изученных механизмов. Вероятно, что подавляющие клетки миелоидного происхождения и регуляторные Т-лимфоциты участвуют в ослаблении защитного иммунитета (53, 54). Эти клетки продуцируют ингибирующие цитокины, включая IL-4, IL-10 и трансформирующий фактор роста-β (TGF-β).Более того, вероятно, задействован чрезмерный контроль контрольных точек посредством ингибирующих поверхностных молекул, включая взаимодействия корецепторов PD-1 / PDL-1 и CTLA-4 / B7 (55, 56).
Примечательно, что прогрессирование ЛТИ до активной формы туберкулеза следует рассматривать как непрерывный процесс, а не как отдельный шаг от одной стадии к другой (33, 57, 58). Mtb передается от больного туберкулезом здоровому человеку в метаболически активной и репликативной стадии. Следовательно, хост сначала встречает высокоактивную Mtb (24).Во время LTBI Mtb переходит из метаболически активной и репликативной стадии в стадию покоя, в которой его активность заметно снижается. После перехода в активный туберкулез Mtb просыпается и снова становится активным.
На ранней стадии инфекции возможно быстрое уничтожение Mtb до того, как разовьется стабильный ЛТИ, но доля лиц, которые становятся временно инфицированными, иногда сопровождающимися короткими эпизодами клинических симптомов, остается неясной (51, 57, 59 ).Недавние данные свидетельствуют о том, что на смену LTBI приходит зарождающийся туберкулез, при котором хозяин остается здоровым, но становится тревожным, а Mtb восстанавливает свою метаболическую и репликативную активность (59–62). Впоследствии развивается субклинический туберкулез, при котором появляются первые признаки патологии, хотя клинически пациент выглядит здоровым. Признаки бдительности хозяина и патологии могут быть обнаружены по чувствительной экспрессии генов и метаболическому профилированию (26, 60–62). Учитывая, что большинство, если не все, случаи субклинического ТБ прогрессируют до активной формы ТБ, которую можно диагностировать клинически, можно предсказать заболевание с помощью чувствительного профилирования с помощью транскриптомики и метаболомики (60–63).Обратите внимание, что разные стадии не являются дискретными и что у одного пациента области, отражающие ЛТИ (твердые гранулемы, содержащие Mtb в спящем состоянии), зарождающийся ТБ (твердые или некротические гранулемы, в которых Mtb восстанавливают свою метаболическую и репликативную активность), субклинический ТБ ( дальнейшее усиление патологии из-за перехода некоторых твердых гранулем в некротические и, в конечном итоге, первых признаков казеоза) и активный ТБ (присутствуют все три формы гранулем с преобладанием казеоза и кавитации).Соответственно, сосуществуют разные стадии гранулем, от твердой формы до казеации и кавитации (58). Очевидно, что сосуществование различных патологий и различных активностей Mtb делает иммунопатологию ТБ очень сложной.
ВСТАВКА 1. Основные вакцины-кандидаты в клинических испытаниях.
Различные типы противотуберкулезных вакцин поступили в клинические испытания. Это: вирусные векторные антигены белка Mtb , антигены гибридного белка Mtb в адъювантах, вакцины на убитых целых микобактериальных клетках и рекомбинантные жизнеспособные микобактериальные вакцины.Вакцины с вирусным вектором и адъювантные белковые вакцины представляют собой субъединичные вакцины, которые, как принято считать, усиливают первичную вакцинацию БЦЖ. Жизнеспособные противотуберкулезные вакцины рассматриваются для замены БЦЖ или для усиления предыдущей первичной вакцинации БЦЖ. Убитые цельноклеточные вакцины иногда рассматриваются для ревакцинации и, чаще, для лечения туберкулеза в дополнение к химиотерапии.
• Вакцины с вирусным вектором включают MVA85A, модифицированную вакцину против осповакцины Анкары (MVA), экспрессирующую антиген Ag85A размером Mtb. Первые испытания эффективности этой вакцины фазы IIb у новорожденных и взрослых не дали защиты (102, 103). Совсем недавно вакцина была протестирована на безопасность и иммуногенность после нанесения аэрозоля (104, 105). Другие вакцины с вирусным вектором включают аденовирусные векторы с дефицитом репликации, экспрессирующие антиген Ag85A, и вектор вируса гриппа h2N1 с дефицитом репликации, экспрессирующий антиген Ag85A и ESAT-6. Также тестируются новые схемы прайм-буста, включая аденовирусные векторы для прайм-буста и вектор MVA для буст-экспрессии антигена Ag85A.
Основные кандидаты с вирусным вектором, проходящие клинические испытания:
Ad5Ag85A (фаза I), вектор аденовируса (Ad) 5 с дефицитом репликации, экспрессирующий антиген 85A (106, 107).
ChAdOx1.85A + MVA85A (фаза I), режим прайма / бустера, включающий прайм с аденовирусом шимпанзе (ChAd), экспрессирующим антиген 85A (ChAdOx1.85A), с последующей имитацией модифицированным вирусом осповакцины Анкары (MVA), экспрессирующим антиген 85A (108).
TB-FLU-04L (фаза IIa), штамм вируса гриппа h2N1 с дефицитом репликации, экспрессирующий антиген 85A и ESAT-6 (109).
• Составы белковых адъювантов, проходящие клинические испытания, включают:
Гибрид 1 ( h2 , фаза I завершена), содержащий либо IC31 , либо CAF01 в качестве адъюванта и слитый белок Antigen 85B и ESAT-6 в качестве антигена (110, 111).
h5 (завершена фаза II) и H56 (фаза IIb) в составе IC31 в качестве адъюванта и слитых белков антигена 85B и TB10.4 (h5) или антигена 85B, ESAT-6 и Rv2660c (H56) ( 73, 112–114).
ID93 (фаза IIa), состоящая из GLA-SE в качестве адъюванта и слитого белка 4 антигенов, а именно Rv2608, Rv3619, Rv3620 и Rv1813 (115, 116).
M72 (завершена фаза IIb), состоящая из AS01 E в качестве адъюванта и слитого белка 2 антигенов, Rv1196 и Rv0125. M72 завершил исследование фазы IIb, показав его частичную защитную эффективность (более подробную информацию см. В тексте) (65, 66, 117).
• Составы адъювантов:
IC31 , катионные пептиды плюс агонист TLR-9;
CAF01 , катионный липосомный носитель плюс иммуномодулирующий гликолипид;
GLA-SE , эмульсия сквалена «масло в воде» плюс агонист TLR-4;
AS01 E , липосомы с монофосфориллипидом А плюс сапонин QS21.
• Жизнеспособные вакцины, проходящие клинические испытания:
MTBVAC (завершена фаза IIa), генетически аттенуированная вакцина Mtb (118, 119).
VPM1002 (несколько испытаний фазы III), вакцина rBCG (подробности см. В тексте) (84, 85).
• К убитым цельноклеточным вакцинам относятся:
DAR-901 (убит M. obuense ), который уже завершил испытание фазы III под другим названием (120–123) и в настоящее время проходит повторную оценку (испытание фазы I завершено) (124).
MIP (фаза III) на основе убитых организмов M. indicus pranii (125–127).
M. vaccae (фаза III) на основе убитых M. vaccae (128–132).
RUTI (фаза IIa) очищенная убитая вакцина из фрагментов Mtb (133–135).
• Терапевтические вакцины: вышеупомянутые испытания вакцин оценивают результаты профилактической вакцинации. Несколько кандидатов также тестируются в качестве терапевтических вакцин либо для лечения туберкулеза в дополнение к канонической химиотерапии, либо для лечения туберкулеза у больных туберкулезом, которые были излечены от туберкулеза с помощью канонической химиотерапии, но могут иметь рецидив (136).
Терапевтические вакцины, проходящие клинические испытания, включают:
H56: IC31 (фаза I), состав субъединицы белка;
ID93: GLA-SE (фаза I), состав субъединичного белка;
RUTI (фаза IIa), очищенная убитая вакцина из фрагментов Mtb ;
TB-FLU-04L (фаза IIa), вакцина с вирусным вектором;
MIP (завершена фаза III), убитый препарат M. indicus pranii ;
М.vaccae (завершена фаза III), убитый препарат M. vaccae ;
VPM1002 (фаза III), живая вакцина rBCG.
Текущее состояние эпидемиологии туберкулеза и поставок противотуберкулезных вакцин
Согласно последнему отчету Всемирной организации здравоохранения (ВОЗ) о туберкулезе, в 2018 г. 10 миллионов человек заболели активной формой туберкулеза и 1,5 миллиона умерли от туберкулеза (11). Во всем мире 1,7 миллиона человек инфицированы Mtb (ЛТИ, туберкулез в начальной стадии, субклинический туберкулез) (52).Таким образом, цель ВОЗ по ликвидации туберкулеза в ближайшие десятилетия требует гораздо более эффективных мер вмешательства и, в частности, высокоэффективной вакцины (10). БЦЖ не защищает от легочного туберкулеза, который является не только наиболее распространенной формой заболевания, но и основным источником передачи. Это привело к нескольким попыткам разработать новые схемы вакцинации (18). Многочисленные вакцины-кандидаты прошли клинические испытания, и были получены первые многообещающие результаты (см. Ниже). Текущие вакцины-кандидаты, проходящие клинические испытания, представляют собой вакцины с вирусным вектором, экспрессирующие несколько антигенов Mtb , адъювантные субъединичные вакцины, обычно содержащие слитые белки, представляющие от двух до четырех антигенов Mtb , убитые цельноклеточные вакцины и жизнеспособные цельноклеточные вакцины.Более подробную информацию можно найти во вставке 1. Вакцины-кандидаты тестируются в различных клинических ситуациях. Это:
(i) Профилактика инфекции (PoI): эта клиническая конечная точка может применяться для предконтактной вакцинации, то есть вакцинации лиц, которые еще не встречались с Mtb . Самая важная целевая группа для PoI — новорожденные. ВОЗ отдает приоритет вакцине, чтобы снизить риск заражения Mtb (11).
(ii) Профилактика заболеваний (PoD): очевидно, что PoI приведет к PoD.Однако основная целевая группа для PoD — это люди с ЛТИ. Снижение риска заболевания ТБ у лиц с ЛТИ также является приоритетом ВОЗ (11).
(iii) Профилактика рецидивов (PoR): В высокоэндемичных районах ок. У 10% больных туберкулезом, вылеченных каноническим медикаментозным лечением, возникают рецидивы либо из-за повторного инфицирования, либо из-за рецидива (64).
(iv) Терапевтическая вакцинация в дополнение к каноническому лекарственному лечению: такая схема вакцинации приобретает все большее значение для пациентов с туберкулезом с множественной или широкой лекарственной устойчивостью (МЛУ / ШЛУ-ТБ) (16).По оценкам, полмиллиона больных активным ТБ страдают от МЛУ-ТБ и от 50 000 до 100 000 человек — от ШЛУ-ТБ (1). Вакцины против PoR также иногда рассматриваются как терапевтические вакцины.
Этот обзор будет посвящен вакцинам, предотвращающим активный туберкулез посредством PoI, PoD или PoR.
Профилактика заболеваний субъединичной вакциной M72 в клинических испытаниях фазы IIb
Вакцина-кандидат M72, разработанная GlaxoSmithKline, успешно завершила клинические испытания фазы IIb (65, 66).Участниками этого исследования были ВИЧ-– взрослых с ЛТИ, которые были иммунизированы БЦЖ в младенчестве. Следовательно, исследование представляло собой постконтактную бустерную иммунизацию субъединичной вакциной с PoD в качестве клинической конечной точки. Клиническая конечная точка была определена через 2 года наблюдения как туберкулез легких при отсутствии ВИЧ-инфекции (66). Исследование показало, что ок. 50% защита по сравнению с контролем плацебо. Последующее исследование подтвердило эффективность после третьего года (65). Это первое испытание вакцины, которое предоставило доказательства наличия PoD при туберкулезе у людей.Положительный контроль с БЦЖ не был включен в это исследование. Есть надежда, что глобальное профилирование экспрессии генов и иммунологические данные предоставят информацию о потенциальных механизмах, лежащих в основе PoD, вызванного этой вакциной. Вакцина содержит два антигена ТБ, приготовленные в мощном адъюванте, AS 01E (см. Вставку 1). Этот адъювант был разработан как часть серии адъювантных систем (AS) и также используется в вакцинах против опоясывающего лишая, Shingrix, и вакцине против малярии, Mosquirix (67). Доступность AS 01E ограничена, а стоимость производства высока.Необходимо выяснить, повлияют ли и как эти ограничения на поставку этой вакцины для широкомасштабных программ иммунизации. Достаточное количество вакцин от болезней, связанных с бедностью, включая туберкулез и малярию, во многом зависит от доступной цены (68).
Данные о многообещающей профилактике заболеваний у нечеловеческих приматов (NHP) с помощью вакцины против туберкулеза с вирусным вектором
Вакцины на основе цитомегаловируса (CMV) были изучены при ряде инфекционных заболеваний (69). Примечательно, что на модели обезьяньего вируса иммунодефицита (SIV) макак-резус вакцины с вектором CMV, экспрессирующие антигены SIV, показали глубокую защиту, опосредованную Т-лимфоцитами CD4 и CD8 (69).Эти Т-клетки были охарактеризованы как эффекторные Т- ЕМ -клетки и переходные эффекторные Т-клетки памяти. На основе этих результатов была разработана кандидатная противотуберкулезная вакцина, основанная на векторе CMV, экспрессирующем 6 или 9 антигенов Mtb (70). Этот вектор был протестирован на PoD на макаках-резусах, и было показано, что он вызывает сильную защиту от туберкулеза (70). Важно отметить, что у части животных были получены доказательства стерильной эрадикации Mtb этой вакциной против туберкулеза с вектором CMV.Как и ожидалось, вакцина вызывала выраженные Т-клеточные ответы CD4 и CD8, а также выраженную секрецию IFN-γ и TNF. В отличие от этого, ответы антител не индуцировались в значительной степени. Популяция защитных Т-клеток CD8 ограничивалась не только MHC I, но также MHC-E или MHC II. БЦЖ, вводимая внутрикожно, также индуцировала защиту, хотя и более слабую. Интересно, что первичная вакцинация БЦЖ и бустерная вакцинация против туберкулеза на основе ЦМВ вернули сильный защитный эффект вакцины против ЦМВ до уровней защиты, индуцированных БЦЖ.Профили экспрессии генов вакцинированных животных показали роль нейтрофилов в защите, индуцированной вакциной против туберкулеза с вектором CMV. В заключение, несмотря на определенные недостатки вакцин с вектором ЦМВ в целом, вакцина против туберкулеза на основе ЦМВ представляет собой многообещающий кандидат, который заслуживает дальнейшего изучения. Очевидно, что аннулирующий эффект прайм-вакцины БЦЖ на защитную эффективность, индуцированную бустер-вакциной против ЦМВ, требует особого внимания. Иммунизация новорожденных БЦЖ обычно проводится в районах с высокой эндемичностью туберкулеза в рамках рекомендованной ВОЗ расширенной программы иммунизации (РПИ).Следовательно, новая вакцина, не обеспечивающая добавленной стоимости для лиц, иммунизированных БЦЖ, столкнется с серьезными проблемами, прежде чем сможет получить дальнейшее развитие. Аналогичным образом, недавнее исследование показало, что при NHP-бустинге БЦЖ вакцинами M72 или H56 (см. Вставку 1) не удалось усилить защиту, индуцированную БЦЖ (71).
Последние результаты исследования канонической бацилловой вакцины Кальметта-Герина
Два недавних исследования иммунизации БЦЖ выявили заметное влияние схемы вакцинации (72, 73). В первом исследовании NHP иммунизировали БЦЖ внутривенно (72).Более ранние исследования 1970-х годов уже предоставили убедительные доказательства того, что внутривенная иммунизация живой БЦЖ индуцирует лучшую защиту от ТБ по сравнению с другими путями введения в NHP с доказательствами стерильной эрадикации Mtb (74, 75). Таким образом, в одном исследовании 3/3 животных были заметно защищены от туберкулеза, что определялось гематогенным распространением, лимфаденопатией и поражением легких (74). С другой стороны, после внутривенного введения живой БЦЖ сообщалось о глубокой спленомегалии.Вероятно, это серьезное нежелательное явление было основной причиной того, что такие исследования не были продолжены. Лишь совсем недавно этот подход был исследован более глубоко. Было показано, что внутривенная иммунизация NHP с помощью БЦЖ индуцировала более глубокую защиту, чем внутрикожная или аэрогенная вакцинация (72). Действительно, у части животных, получавших БЦЖ внутривенно, не удалось извлечь Mtb . Это исследование также включало серию сложных иммунологических и патологических анализов.Было обнаружено, что антигенные ответы CD4 и CD8 Т-лимфоцитов были вызваны в основном внутривенной иммунизацией перед контрольным заражением Mtb , тогда как γ / δ Т-клетки и MAIT-клетки были, аналогично, активированы, как и в группах, получавших другие пути иммунизации. Ответ Т-клеток был в основном типом Th2 с некоторым вкладом типа Th27. С отрицательной стороны, спленомегалия наблюдалась после внутривенной иммунизации ок. увеличение селезенки вдвое по сравнению с контролем. Однако спленомегалия была преходящей, и через 6 месяцев после иммунизации БЦЖ не наблюдалось различий в размере селезенки в разных экспериментальных группах, включая внутривенное введение.Через шесть месяцев после иммунизации животных заражали низкой дозой Mtb . Позитронно-эмиссионная томография — сканирование с помощью компьютерной томографии (ПЭТ / КТ) выявило меньше гранулем у животных, иммунизированных внутривенно, по сравнению с контрольной группой. Эти результаты подтверждают концепцию того, что иммунизация БЦЖ может вызывать глубокую, в некоторых случаях бесплодную, защиту при NHP. Необходимо увидеть, насколько наблюдаемая спленомегалия будет недопустимой для клинических исследований на людях.
Второе недавнее исследование проверило результат бустерной вакцинации БЦЖ у Mtb взрослых, не подвергавшихся воздействию (73).Ревакцинация БЦЖ проводилась ранее, хотя обычно она не одобрялась из-за потенциального риска побочных эффектов. Это предположение было в значительной степени основано на неофициальных отчетах, описывающих случайные побочные эффекты после повторной иммунизации БЦЖ у лиц с ЛТИ и частые тяжелые события у пациентов с ТБ. В принципе, ревакцинация БЦЖ у неинфицированных Mtb индивидуумов не вызывает серьезных побочных эффектов, и в недавнем официальном клиническом исследовании ревакцинация БЦЖ Mtb не подвергавшихся воздействию людей продемонстрировала частичную профилактику стабильной инфекции Mtb (73).Точнее, воздействие определяли косвенно с помощью анализа высвобождения IFN-γ (IGRA), который определяет секрецию IFN-γ каноническими Т-клетками после рестимуляции in vitro специфическими антигенами Mtb (76–78). Этот анализ в основном основан на ответах Т-лимфоцитов CD4 с некоторым вкладом Т-лимфоцитов CD8. В то время как исходная конверсия IGRA не различалась между иммунизированными БЦЖ и необработанными участниками исследования, устойчивая конверсия IGRA была значительно снижена на прибл. 45% участников исследования, иммунизированных БЦЖ, по сравнению с контрольной группой (73).Эти результаты можно интерпретировать как означающие, что стабильная инфекция Mtb предотвращается ревакцинацией БЦЖ, хотя на самом деле она основана на снижении Т-клеточных ответов, измеренных с помощью IGRA. Остается установить более точно, трансформируется ли предотвращение устойчивого преобразования IGRA напрямую в долгосрочную PoI и, следовательно, PoD. Предыдущие обсервационные исследования оценивали PoD при ревакцинации БЦЖ на основании эпидемиологических данных. Как правило, они не обнаружили значительных различий между контрольной группой и лицами, повторно вакцинированными БЦЖ (79–81).
Эти два исследования предоставляют убедительные доказательства того, что результат вакцинации БЦЖ существенно зависит от типа введения, особенно от способа иммунизации (внутривенная) и типа схемы вакцинации (предконтактная ревакцинация). В заключение, вакцина БЦЖ по-прежнему требует улучшений.
ВПМ1002
Одна из самых современных противотуберкулезных вакцин, VPM1002, была улучшена путем генетической модификации (82). VPM1002 — это рекомбинантная БЦЖ (рБЦЖ), которая экспрессирует листериолизин из Listeria monocytogenes и лишена уреазы C (83).Разработка этой вакцины началась в 1990-х годах с целью улучшить БЦЖ, наделив ее способностью стимулировать более широкий и эффективный Т-клеточный ответ.
VPM1002 успешно завершил клинические испытания фазы I и фазы IIa, доказав его безопасность и иммуногенность у взрослых и новорожденных (84, 85). Завершено клиническое испытание фазы II у новорожденных, подвергшихся воздействию ВИЧ, и новорожденных, не подвергавшихся воздействию ВИЧ, и ожидается его раскрытие (NCT 023). Готовится клиническое испытание фазы III на новорожденных, инфицированных и не подвергавшихся воздействию ВИЧ, и ожидается, что оно начнется в 2020 году.Это исследование было разработано как предварительная замена БЦЖ для младенцев с PoI в качестве клинической конечной точки. В этом клиническом испытании, получившем название priMe , новорожденные будут иммунизированы VPM1002 или БЦЖ в качестве компаратора в нескольких центрах в Африке к югу от Сахары. В настоящее время в Индии продолжается клиническое испытание фазы III с использованием VPM1002 для оценки PoR (NCT 03152903). Для этого испытания набираются пациенты с туберкулезом, вылеченные с помощью медикаментозного лечения. По оценкам, у 10% этих лиц разовьется активная форма туберкулеза в результате повторного инфицирования или рецидива в течение 1 года после завершения лечения лекарственными препаратами.Таким образом, клиническое испытание покажет, может ли вакцинация VPM1002, проведенная через 3 месяца после завершения лекарственного лечения, предотвратить рецидив. Индийским советом по медицинским исследованиям (ICMR) в июле 2019 г. было начато испытание фазы III домашних контактов, в ходе которого VPM1002 и другая вакцина-кандидат (MIP, см. Вставку 1) будут оцениваться на предмет PoD в домашних контактах с пациентами с активной легочной болезнью. Заболевание туберкулезом. Кроме того, VPM1002 также оценивается как терапевтическое средство против немышечно-инвазивного рака мочевого пузыря в качестве заменителя БЦЖ (NCT 02371447).Каноническая противотуберкулезная вакцина БЦЖ является предпочтительным иммуномодулирующим средством для лечения рака мочевого пузыря, и текущее клиническое испытание оценивает, является ли VPM1002 более безопасным и, по крайней мере, столь же эффективным, как БЦЖ, против рецидива рака мочевого пузыря. В заключение, спустя столетие после внедрения оригинальной вакцины БЦЖ есть надежда на возрождение усовершенствованной противотуберкулезной вакцины на основе БЦЖ. Рационально обновленная БЦЖ могла бы способствовать разрешению кризиса с туберкулезом.
Чем отличается внутриклеточное поведение между VPM1002, Bacille Calmette-Guérin и
Mtb ?
И БЦЖ, и Mtb находятся в фагосомах, которые блокируются на ранней стадии за счет нейтрализации pH фагосомы для предотвращения его закисления (21).Следовательно, слияние фаголизосом уменьшается. Тем не менее, БЦЖ разрушается в фагосоме, тогда как Mtb выживает в фагоцитах в течение длительных периодов времени. Только недавно были выяснены механизмы вирулентности Mtb , отсутствующие в БЦЖ. Хотя существует несколько субштаммов БЦЖ, теперь ясно, что критическим этапом, который произошел во время аттенуации родительского штамма Mycobacterium bovis , была потеря области различия (RD) 1, которая кодирует ряд продуктов гена, опосредованная через системы секреции ESX / типа VII и способны нарушать фагосомную мембрану (86).Нарушение мембраны продуктами гена RD-1 Mtb приводит к активации инфламмасом, апоптозу и аутофагии (рис. 2). Сигнальные каскады включают nod-подобный рецепторный белок 3 (NLRP-3) и отсутствующий в меланоме 2 (AIM-2), ответственный за процессинг IL-1 и IL-18 из соответствующих молекул-предшественников воспалением, а также STING, отвечающий за аутофагия и IFN-зависимые ответы типа I (87). STING распознает циклический гуанозинмонофосфат-аденозинмонофосфат (cGAMP), полученный из двухцепочечной ДНК Mtb через фермент циклическую гуанозинмонофосфат-аденозинмонофосфатсинтазу (cGAS).Все эти последствия вызваны Mtb , но не или в меньшей степени BCG.
Рисунок 2. Основные механизмы, лежащие в основе индукции иммунного ответа хозяина с помощью VPM1002 и M. tuberculosis ( Mtb ) (более подробную информацию см. В тексте). (А) VPM1002. VPM1002 (rBCGΔureC :: Hly) экспрессирует листериолизин и не обладает активностью уреазы C. После фагоцитоза VPM1002 попадает в фагосому. В основном фагосомы становятся кислыми после поглощения частиц, но BCG и Mtb активно поддерживают нейтральный pH фагосомы.Из-за отсутствия уреазы C в VPM1002 происходит подкисление. Это способствует возмущению фагосомной мембраны биологически активным листериолизином. (1) Нарушение мембраны позволяет антигенам выходить в цитозоль для обработки через путь MHC класса I. (2) Возмущение может привести к апоптозу. (3) Двухцепочечная ДНК, высвобожденная в цитозоль, определяется отсутствием в меланоме 2 (AIM2). (4) AIM2 активирует инфламмасому с образованием IL-1β и IL-18. (5) Образуется циклическая GMP-AMP-синтаза (cGAS), которая затем превращается в циклический гуанозинмонофосфат-аденозинмонофосфат (cGAMP).(6) Последняя молекула воспринимается стимулятором генов IFN (STING), который вызывает аутофагию и ответы IFN типа I. (7) Выход антигена в цитозоль позволяет стимулировать Т-клетки CD8 в дополнение к Т-клеткам CD4. (8) Апоптоз способствует перекрестному праймингу. (9) Аутофагия ускоряет выведение VPM1002 и улучшает презентацию антигена и стимуляцию Т-клеток. (10) IL-1β и IL-18 вызывают воспалительную реакцию. Посредством этих механизмов VPM1002 вызывает иммунный ответ с большей глубиной и широтой, чем родительская BCG (B) Mtb .Геном Mtb включает область различия 1 (RD-1), которая кодирует многочисленные факторы вирулентности, отсутствующие в BCG. Примечательно, что гены Esx-зависимых механизмов вызывают возмущение фагосомных мембран, что очень похоже на VPM1002. Для получения дополнительной информации см. (A) . Поскольку продукты гена, кодируемые RD-1, не разрушаются после выхода в цитозоль, преобладают патологические последствия. Более того, генные продукты, кодируемые RD-1, не контролируются pH. Следовательно, встроенные механизмы безопасности VPM1002 отсутствуют в Mtb (см. Также рисунок 3).
Для создания VPM1002 БЦЖ была снабжена листериолизином из L. monocytogenes , который способствует возмущению фагосомной мембраны, вызывая тем самым более сильные ответы Т-клеток (83). Листериолизин представляет собой перфорин, активируемый тиолами, который проникает сквозь холестеринсодержащие мембраны при кислом pH (88–90). Это ограничение pH обычно предотвращает активность листериолизина во внеклеточной среде с нейтральным pH, например кровь и межклеточное пространство. Однако это достигается при естественном заражении фагоцитов L.monocytogenes , который обеспечивает секрецию биологически активного листериолизина. Поскольку БЦЖ нейтрализует фагосомный компартмент, закисление не достигается. По этой причине ген, кодирующий уреазу C, был удален в VPM1002 (83). Этот фермент отвечает за выработку аммиака и, таким образом, участвует в нейтрализации фагосомы, в которой находится БЦЖ (21). Соответственно, VPM1002, лишенный уреазы C, способствует закислению фагосом и, таким образом, секреции биологически активного листериолизина (рис. 2).Как только листериолизин достигает цитозоля, он быстро разрушается. Это связано с аминокислотной последовательностью пролин-глутамат-серин-треонин (PEST) в аминокислотной последовательности листериолизина, которая способствует его убиквитинированию (рис. 3) (88–90). Это представляет собой встроенный механизм безопасности, который ограничивает активность листериолизина нарушением мембраны фагосомы, где находится VPM1002, и предотвращает дальнейшее потенциально пагубное воздействие на клеточные мембраны. Закодированная машина RD-1 Mtb не оснащена таким предохранительным механизмом.
Рисунок 3. Механизмы безопасности листериолизина делают VPM1002 менее вирулентным, чем исходная БЦЖ. Листериолизин содержит последовательность, подобную PEST, которая способствует его деградации. (1) Только при кислом pH листериолизин является биологически активным и, следовательно, возмущает фагосомную мембрану. (2) В цитозоле агрегаты мономерного листериолизина. (3) Агрегированный листериолизин разлагается убиквитином, что приводит к образованию неактивных пептидов. (4) Мультимерные комплексы листериолизина образуются на плазматической мембране.(5) Эти комплексы перемещаются в аутофагосомы убиквитином. (6) Эти комплексы листериолизина инактивированы в фагосоме. PEST = пролин (P), гуталат (E), серин (S) и треонин (T). Изменено из (88–90).
Подобно аппарату RD-1 в Mtb , листериолизин-опосредованное возмущение фагосомной мембраны с помощью VPM1002 приводит к активации воспаления посредством AIM-2 (91). Следовательно, IL-1 и IL-18 процессируются из их соответствующих предшественников. Эти провоспалительные цитокины создают среду, благоприятную для активации клеток Th2 и Th27.Листериолизин также способствует аутофагии через AIM-2 и STING, способствуя восприятию двухцепочечной микобактериальной ДНК, полученной из VPM1002, через cGAS и cGAMP после ее выхода в цитозоль (91). Кроме того, нарушение мембраны листериолизином вызывает апоптоз, что приводит к перекрестному праймированию Т-клеток (92). Вместе эти механизмы улучшают эффективность вакцины VPM1002 по сравнению с канонической БЦЖ (82, 93). Более того, в доклинических исследованиях было показано, что VPM1002 безопаснее, чем БЦЖ (83). В экспериментальных моделях была продемонстрирована улучшенная стимуляция как CD4, так и CD8 Т-клеток (92), а также более глубокая активация клеток Th27 в дополнение к клеткам Th2 (94).Кроме того, Т-клетки центральной памяти более сильно стимулировались VPM1002 по сравнению с канонической БЦЖ (50). Наконец, было показано, что VPM1002 стимулирует более высокие уровни специфических антител в сыворотке крови как на животных моделях, так и на людях (50, 84, 85). В заключение, VPM1002 стимулирует иммунный ответ большей глубины и широты и в то же время проявляет более низкую вирулентность по сравнению с БЦЖ (82).
Обучение от людей, устойчивых к стабильной инфекции
Mtb и способных искоренить Mtb после стабильной инфекции
Лица с ЛТИ обычно выявляются с помощью туберкулиновой кожной пробы (ТКП) или IGRA (рис. 4) (76–78).Соответственно, идентификация 1,7 миллиарда людей на этом земном шаре с LTBI основана на измерениях ответов Т-клеток против антигенов Mtb . Эти антигены представляют собой относительно неопределенные смеси белков Mtb (очищенное производное белка, PPD) в случае TST и четко определенных белков и / или пептидов Mtb в случае IGRA.
Рисунок 4. Судьба семейных контактов с больным туберкулезом. Домохозяйства, контактирующие с заболевшим ТБ, либо уже латентно инфицированы ТБ (ЛТИ), либо не демонстрируют доказательств иммунитета против инфекции Mtb .После продолжительного контакта с больным туберкулезом, инфицированным туберкулезом, большинство наивных людей быстро превращается в ЛТИ, поскольку у них развивается иммунный ответ против инфекции Mtb . Большинство из этих ранних преобразователей останутся LTBI и, следовательно, станут устойчивыми преобразователями. Небольшая часть ранних преобразователей становится наивной, то есть лишенной измеримого иммунного ответа на инфекцию Mtb . Некоторые наивные люди останутся постоянными неконвертерами, то есть они не изменят свой статус отсутствия иммунитета, указывающий на отсутствие инфекции Mtb .Наконец, некоторые люди с ЛТИ станут наивными, то есть они теряют обнаруживаемый иммунный ответ на Mtb , что указывает на элиминацию Mtb . Механизмы, лежащие в основе этих преобразований / реверсий, остаются неуловимыми. (A) Обозначает ответ в TST / IGRA, а (B) отображает итоговые выводы о преобразовании / реверсии (более подробную информацию см. В тексте).
Несколько линий доказательств предполагают, что определенная популяция людей остается неинфицированной Mtb , несмотря на их тесный и продолжительный контакт с пациентами с активным легочным туберкулезом, которые постоянно изгоняют Mtb (95–98).Это мнение основано на выводе о том, что такие люди не конвертируются при тестировании TST или IGRA. Если предположить, что отсутствие канонического иммунного ответа, определяемого TST и / или IGRA, отражает отсутствие инфекции Mtb , возникает следующий сценарий (рис. 3): первоначально домашние контакты пациента с активным легочным туберкулезом делятся на две группы; те, кто уже является ЛТБИ из-за предыдущего контакта и, следовательно, имеют TST + / IGRA + , и наивные люди, которые имеют TST — / IGRA — .Из-за интенсивного контакта большинство наивных людей обратятся в TST + / IGRA + , и большинство из них останутся TST + / IGRA + в течение более длительных периодов времени, если не на всю жизнь. Однако небольшая группа может вернуться к TST — / IGRA — , указывая на то, что они способны уничтожить Mtb , прежде чем они станут навсегда инфицированными. Недавнее испытание ревакцинации БЦЖ для ЛПИ (73), описанное выше, не выявило значительных различий между вакцинированными БЦЖ и контрольной группами в раннем переходе на IGRA + .Тем не менее, снижение на 45% устойчивого уровня IGRA + (определенного в более поздние моменты времени) наблюдалось в группе, иммунизированной БЦЖ, по сравнению с контролем без иммунизации БЦЖ. Более того, обсервационные исследования выявили отдельную группу постоянных неконвертеров (TST — / IGRA — ), как правило, порядка 20% (95–98).
Очевидно, описанные эффекты могут быть также вызваны техническими причинами, и группа TST — / IGRA — могла быть инфицирована Mtb , но пропущена TST / IGRA, потому что у этих людей развивается защитный иммунный ответ, который не обнаруживается. компании TST и IGRA.Базовые механизмы могут включать антитела, клетки MAIT, γδ Т-клетки, NK-клетки и NKT-клетки (32, 36–45). Кроме того, остается неясным, действительно ли все люди TST + / IGRA + инфицированы Mtb или, по крайней мере, подгруппе удалось устранить Mtb , но остается TST + / IGRA + из-за сильный ответ Т-клеток памяти, который сохраняется в отсутствие антигенов Mtb . В основном иммунология определяет память как состояние иммунитета при отсутствии номинального антигена (ов).
Другая интересная группа может возникнуть спустя годы после первичного заражения Mtb . В то время как многие люди с ЛТБИ остаются в течение долгого времени TST + / IGRA + , некоторые люди возвращаются к TST — / IGRA — . Вероятно, что у этих людей возврат от TST + / IGRA + к TST — / IGRA — отражает стерильное уничтожение Mtb . Тем не менее, нельзя формально исключить, что эти люди остаются инфицированными Mtb и контролируют инфекцию с помощью неизвестных иммунных механизмов, не обнаруживаемых TST / IGRA, таких как антитела и нетрадиционные Т-клетки.В любом случае, постоянные неконвертеры и поздние ревертеры представляют собой очень интересные исследовательские группы, которые дают возможность получить более глубокое понимание механизмов защиты от Mtb . Вакцины против туберкулеза, которые предотвращают стабильную инфекцию Mtb и тем самым предотвращают ЛТИ и активное заболевание ТБ, были бы весьма желательны. Специфические механизмы, лежащие в основе постоянного непревращения и поздней реверсии, могут быть выяснены путем определения транскриптомных, метаболомных и иммунологических маркеров и сигнатур, которые отличают постоянные неконвертеры и поздние ревертеры от устойчивых и продолжительных ревертеров соответственно (26, 99).
Перспективы и будущее
За последнее десятилетие производство противотуберкулезных вакцин значительно расширилось. Во-первых, ряд вакцин готов для тестирования клинической эффективности на PoI, PoD или PoR (см. Вставку 1). Это означает, что несколько вакцин-кандидатов уже доказали свою безопасность и иммуногенность. Во-вторых, в результате клинических испытаний за последние годы появилось несколько положительных сигналов, включая доказательство концепции о том, что субъединичная вакцина, усиленная сильным адъювантом, может частично защищать от активного ТБ при введении после контакта пациентам с ЛТИ (65, 66).В-третьих, ревакцинация Mtb лиц, не подвергавшихся воздействию БЦЖ, предоставила косвенные доказательства частичной профилактики устойчивой инфекции Mtb (73). Очевидно, что еще предстоит решить основные вопросы. К ним относятся: Во-первых, результат ревакцинации БЦЖ был определен с помощью IGRA, который измеряет канонические Т-клеточные иммунные ответы, а не инфекцию Mtb per se (см. Выше). Это поднимает вопрос, действительно ли БЦЖ предотвратила инфекцию Mtb или же инфекция произошла, но контролировалась альтернативными иммунными механизмами, такими как антитела и / или нетрадиционные Т-клетки.Во-вторых, клиническое испытание M72 не включало вакцинацию БЦЖ в качестве положительного контроля. В-третьих, исследования в NHP показали, что различные субъединичные конструкции вакцины, включая M72, H56 и вакцину против туберкулеза с вектором CMV, не повышают защиту при введении в качестве бустера при первичной вакцинации БЦЖ (70, 71). В общем, есть вполне оправданные надежды на вакцины лучшего качества; но по-прежнему трудно предсказать, когда и в какой степени туберкулез можно будет контролировать с помощью улучшенных стратегий вакцинации.
Нассим Николас Талеб наиболее известен тем, что описал концепцию Черного лебедя, которая в основном включает в себя понятия (100): (i) редкие и невероятные события происходят чаще, чем мы предполагаем; (ii) эти экстремальные явления могут иметь огромные последствия; (iii) эксперты обычно предоставляют объяснения постфактум, которые не были правдоподобными заранее.Эта концепция была удачно проиллюстрирована кризисом финансового фондового рынка в 2008 году, когда многочисленные владельцы акций, которые постепенно накапливали финансовую базу, обанкротились в результате единственного события. Наиболее наглядное описание концепции Черного лебедя — это жизнь индейки в День благодарения, о которой очень хорошо заботятся в течение первых 1000 дней путем кормления ее наиболее питательной пищей. Наблюдатель (включая индейку, если он мог) может сделать вывод, что качество жизни этого животного постоянно повышается.Тем не менее, на 1001 день мясник неожиданно убивает животное, готовясь к Дню благодарения. Очевидно, что это экстремальное событие, которое сильно повлияет на животное. Этот сценарий также можно перевернуть в позитивном направлении, то есть неожиданное и невероятное событие превратится во что-то значительно лучшее (событие, которое, возможно, лучше было бы описать термином «Розовый лебедь»). Что касается дизайна противотуберкулезной вакцины, постоянное финансирование НИОКР (от фундаментальных исследований до доклинических и клинических разработок) расширит наши знания об основных механизмах защиты от ТБ и о том, как эту информацию можно использовать для разработки противотуберкулезной вакцины (Рисунок 5).
Рис. 5. Возможные сценарии разработки противотуберкулезной вакцины при условии адекватного финансового финансирования исследований и разработок (НИОКР). Верхний , одношаговое событие; Нижний , многоступенчатое мероприятие.
В течение долгого времени исследование ползет, но то и дело прыгает. За счет увеличения финансирования можно подготовить плодородную почву для исследований и разработок более совершенных вакцин. Возможно, это приведет к экстремальному событию (одиночный прыжок), в результате чего будет создана новая вакцина, подходящая для всех целей.Скорее всего, произойдет пара небольших, но значимых событий, которые в конечном итоге приведут к созданию противотуберкулезных вакцин для различных целей. Тип вакцины и время, когда она будет готова для клинического лицензирования, остаются неясными, как и ожидалось для Черного / Розового лебедя. Тем не менее, увеличение финансирования НИОКР повысит шансы на успех. Несомненно, это не может быть достигнуто бесплатно; тем не менее, в конечном итоге это позволит сократить расходы за счет сокращения огромных расходов, вызванных эндемическим туберкулезом. В конце концов, ежегодные затраты на лечение активного туберкулеза во всем мире оцениваются в пределах 2 миллиардов долларов США, а общее бремя ТБ для мировой экономики составляет порядка 100 миллиардов долларов США (101).
В заключение стоит процитировать резолюцию, принятую Генеральной Ассамблеей ООН на заседании высокого уровня по борьбе с туберкулезом в 2018 г. (1):
«Обязательство мобилизовать достаточное и устойчивое финансирование , с целью увеличения общих глобальных инвестиций до 2 миллиардов долларов , , чтобы закрыть предполагаемый дефицит в 1,3 миллиарда долларов в ежегодном финансировании исследований туберкулеза , , обеспечивая, страны вносят соответствующий вклад в исследования и разработки….”
Авторские взносы
SK придумал идею и написал рукопись.
Конфликт интересов
SK является соавтором противотуберкулезной вакцины VPM1002 и совладельцем патента, выданного Vakzine Projekt Management GmbH, Ганновер, Германия, и сублицензированного Serum Institute of India Pvt. Ltd., Пуна, Индия. Вакцина в настоящее время проходит клинические испытания.
Благодарности
Автор благодарит Diane Schad за превосходную графику и Souraya Sibaei за отличную помощь в подготовке рукописи.
Список литературы
2. Кальметт А., Герен С., Боке А., Негре Л. Профилактическая вакцинация против туберкулеза по методу BCG. Париж: Masson et Cie (1927).
Google Scholar
3. Кауфманн Ш., Винау Ф. От бактериологии к иммунологии: дуализм специфичности. Nat Immunol. (2005) 6: 1063–66.
Google Scholar
4. Colditz GA, Berkey CS, Mosteller F, Brewer TF, Wilson ME, Burdick E, et al. Эффективность вакцинации против бациллы Кальметта-Герена новорожденных и младенцев в профилактике туберкулеза: метаанализ опубликованной литературы. Педиатрия. (1995) 96 (1 Pt 1): 29–35.
PubMed Аннотация | Google Scholar
5. Кольдиц Г.А., Брюер Т.Ф., Берки С., Уилсон М.Э., Бердик Э., Файнберг Х.В. и др. Эффективность вакцины БЦЖ в профилактике туберкулеза. Мета-анализ опубликованной литературы. JAMA. (1994) 271: 698–702. DOI: 10.1001 / jama.271.9.698
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Рой А., Эйзенхут М., Харрис Р. Дж., Родригес Л.С., Шридхар С., Хаберманн С. и др.Эффект вакцинации БЦЖ против инфекции Mycobacterium tuberculosis у детей: систематический обзор и метаанализ. Br Med J. (2014) 349: g4643. DOI: 10.1136 / bmj.g4643
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Чанг СС, Хан Ф.А., Мильштейн М.Б., Толман А.В., Бенедетти А., Старке Дж. Р. и др. Результаты лечения детского туберкулезного менингита: систематический обзор и метаанализ. Lancet Infect Dis. (2014) 14: 947–57.DOI: 10.1016 / S1473-3099 (14) 70852-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Hesseling AC, Marais BJ, Gie RP, Schaaf HS, Fine PE, Godfrey-Faussett P, et al. Риск диссеминированной бациллы Кальметта-Герена (БЦЖ) у ВИЧ-инфицированных детей. Вакцина. (2007) 25: 14–8.
PubMed Аннотация | Google Scholar
9. Trunz BB, Fine P, Dye C. Влияние вакцинации БЦЖ на детский туберкулезный менингит и милиарный туберкулез во всем мире: метаанализ и оценка экономической эффективности. Ланцет. (2006) 367: 1173–80.
PubMed Аннотация | Google Scholar
10. Абу-Раддад Л.Дж., Сабателли Л., Ахтерберг Д.Т., Сугимото Д.Д., Лондини И.М. мл., Дай С. и др. Эпидемиологические преимущества более эффективных противотуберкулезных вакцин, лекарств и средств диагностики. Proc Natl Acad Sci USA. (2009) 106: 13980–85. DOI: 10.1073 / pnas.00106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Всемирная организация здравоохранения. Глобальный доклад ВОЗ по туберкулезу, 2019 г. Женева: Всемирная организация здравоохранения (2019).
Google Scholar
18. Kaufmann SHE, Dockrell HM, Drager N, Ho MM, McShane H, Neyrolles O, et al. TBVAC2020: продвижение противотуберкулезных вакцин от открытия до клинической разработки. Front Immunol. (2017) 8: 1203. DOI: 10.3389 / fimmu.2017.01203
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. van der Wel N, Hava D, Houben D, Fluitsma D, van Zon M, Pierson J, et al. M. tuberculosis и M. leprae перемещаются из фаголизосомы в цитозоль миелоидных клеток. Ячейка. (2007) 129: 1287–98.
PubMed Аннотация | Google Scholar
25. О’Гарра А., Редфорд П.С., Макнаб Ф.В., Блум С.И., Уилкинсон Р.Дж., Берри М.П. Иммунный ответ при туберкулезе. Annu Rev Immunol. (2013) 31: 475–527. DOI: 10.1146 / аннурев-иммунол-032712-095939
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27.Schorey JS, Schlesinger LS. Врожденные иммунные ответы на туберкулез. Microbiol Spectr. (2016) 4: TBTB2-0010-2016.
Google Scholar
29. Netea MG, Schlitzer A, Placek K, Joosten LAB, Schultze JL. Врожденная и адаптивная иммунная память: эволюционный континуум реакции хозяина на патогены. Клеточный микроб-хозяин. (2019) 25: 13–26. DOI: 10.1016 / j.chom.2018.12.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30.Lozza L, Farinacci M, Fae K, Bechtle M, Staber M, Dorhoi A и др. Перекрестное взаимодействие между субпопуляциями человеческих DC способствует антибактериальной активности и стимуляции CD8 + Т-клеток в ответ на бациллу Кальметта-Герена. Eur J Immunol. (2014) 44: 80–92. DOI: 10.1002 / eji.201343797
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Бехар С.М., Карпентер С.М., Бути М.Г., Барбер Д.Л., Джаяраман П. Организация легочного Т-клеточного иммунитета во время инфекции Mycobacterium tuberculosis : прерывание иммунитета. Semin Immunol. (2014) 26: 559–77. DOI: 10.1016 / j.smim.2014.09.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Барри С.Е. III, Бошофф Х.И., Дартуа В., Дик Т., Эхрт С., Флинн Дж. И др. Спектр латентного туберкулеза: переосмысление биологии и стратегии вмешательства. Nat Rev Microbiol. (2009) 7: 845–55. DOI: 10.1038 / nrmicro2236
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Ульрихс Т., Кауфманн Ш.Новое понимание функции гранулем при туберкулезе человека. J Pathol. (2006) 208: 261–9.
PubMed Аннотация | Google Scholar
35. Стенджер С., Хансон Д.А., Тейтельбаум Р., Деван П., Ниази К.Р., Фроелич К.Дж. и др. Антимикробная активность цитолитических Т-клеток, опосредованная гранулизином. Наука. (1998) 282: 121–5.
PubMed Аннотация | Google Scholar
36. Ачкар JM, Casadevall A. Антител-опосредованный иммунитет против туберкулеза: значение для разработки вакцины. Клеточный микроб-хозяин. (2013) 13: 250–62. DOI: 10.1016 / j.chom.2013.02.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Ардайн А., Доминго-Гонсалес Р., Дас С., Казер С.В., Ховард Н.К., Сингх А. и др. Врожденные лимфоидные клетки 3-й группы обеспечивают ранний защитный иммунитет против туберкулеза. Природа. (2019) 570: 528–32. DOI: 10.1038 / s41586-019-1276-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Колтер Ф., Пэрриш А., Мэннинг Д., Кампманн Б., Менди Дж., Гаранд М. и др.Продукция IL-17 из Т-хелпера 17, инварианта Т, ассоциированного со слизистой оболочкой, и γδ клеток при туберкулезной инфекции и заболевании. Front Immunol. (2017) 8: 1252.
Google Scholar
42. Лу Л.Л., Чанг А.В., Роузброк Т.Р., Гебремайкл М., Ю У.Х., Грейс П.С. и др. Функциональная роль антител при туберкулезе. Ячейка. (2016) 167: 433–43.e14. DOI: 10.1016 / j.cell.2016.08.072
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Лу Л.Л., Смит М.Т., Ю К.К.К., Людеманн С., Сускович Т.Дж., Грейс П.С. и др.IFN-гамма-независимые иммунные маркеры воздействия Mycobacterium tuberculosis . Nat Med. (2019) 25: 977–87. DOI: 10.1038 / s41591-019-0441-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Рой Чоудхури Р., Валлания Ф., Ян К., Лопес Анхель С.Дж., Дарбо Ф., Пенн-Николсон А. и др. Многокогортное исследование иммунных факторов, связанных с исходами инфекции M. tuberculosis . Природа. (2018) 560: 644–8.
Google Scholar
45.Циммерманн Н., Торманн В., Ху Б., Колер А.Б., Имаи-Мацусима А., Лохт С. и др. Ответы человеческих изотип-зависимых ингибирующих антител против Mycobacterium tuberculosis . EMBO Mol Med. (2016) 8: 1325–39. DOI: 10.15252 / emmm.201606330
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Бенард А., Саква И., Скиерло П., Колом А., Мерсье И., Тайлё Л. и др. В-клетки, продуцирующие IFN типа I, модулируют поляризацию макрофагов при туберкулезе. Am J Respir Crit Care Med. (2018) 197: 801–13. DOI: 10.1164 / rccm.201707-1475OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Cerqueira C, Manfroi B, Fillatreau S. Регуляторные B-клетки и плазматические клетки, продуцирующие IL-10: молекулярные механизмы и актуальность болезни. Semin Immunol. (2019) 44: 101323. DOI: 10.1016 / j.smim.2019.101323
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Perdomo C, Zedler U, Kuhl AA, Lozza L, Saikali P, Sander LE и др.Вакцинация БЦЖ слизистой оболочки индуцирует защитные популяции резидентных в легких Т-клеток памяти против туберкулеза. мБио. (2016) 7: e01686-16. DOI: 10.1128 / mBio.01686-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Фогельзанг А., Пердомо С., Зедлер Ю., Кульманн С., Гурвиц Р., Генгенбахер М. и др. CD4 + Т-клетки центральной памяти ответственны за превосходную защиту рекомбинантной вакцины Bacillus Calmette-Guerin Δurec :: hly от туберкулеза. J Infect Dis. (2014) 210: 1928–37.
Google Scholar
51. Simmons JD, Stein CM, Seshadri C, Campo M, Alter G, Fortune S и др. Иммунологические механизмы устойчивости человека к персистирующей инфекции Mycobacterium tuberculosis . Nat Rev Immunol. (2018) 18: 575–89. DOI: 10.1038 / s41577-018-0025-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Houben RM, Dodd PJ. Глобальное бремя латентной инфекции туберкулеза: переоценка с использованием математического моделирования. PLoS Med. (2016) 13: e1002152. DOI: 10.1371 / journal.pmed.1002152
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Барбер Д.Л., Сакаи С., Кудчадкар Р.Р., Флинг С.П., Дэй Т.А., Вергара Дж.А. и др. Туберкулез после блокады PD-1 для иммунотерапии рака. Sci Transl Med. (2019) 11: eaat2702. DOI: 10.1126 / scitranslmed.aat2702
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Lin PL, Ford CB, Coleman MT, Myers A, Gawande R, Ioerger T. и др.Стерилизация гранулем обычна при активном и латентном туберкулезе, несмотря на вариабельность уничтожения бактерий внутри хозяина. Nat Med. (2014) 20: 75–9. DOI: 10,1038 / нм 3412
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Drain PK, Bajema KL, Dowdy D, Dheda K, Naidoo K, Schumacher SG, et al. Начальный и субклинический туберкулез: клинический обзор ранних стадий и прогрессирования инфекции. Clin Microbiol Rev. (2018) 31: e00021-18.DOI: 10.1128 / CMR.00021-18
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Сулиман С., Томпсон Э., Сазерленд Дж., Вайнер Роуд Дж., Ота МОС, Шанкар С. и др. Панафриканская кровная сигнатура с четырьмя генами предсказывает прогрессирование туберкулеза. Am J Respir Crit Care Med. (2018) 197: 1198–208. DOI: 10.1371 / journal.pmed.1002781
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Weiner J III, Maertzdorf J, Sutherland JS, Duffy FJ, Thompson E, Suliman S, et al.Изменения метаболитов в крови предсказывают начало туберкулеза. Nat Commun. (2018) 9: 5208. DOI: 10.1038 / s41467-018-07635-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Зак Д.Е., Пенн-Николсон А., Скриба Т.Дж., Томпсон Э., Сулиман С., Амон Л.М. и др. Сигнатура РНК крови для риска заболевания туберкулезом: проспективное когортное исследование. Ланцет. (2016) 387: 2312–22. DOI: 10.1016 / S0140-6736 (15) 01316-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65.Tait DR, Hatherill M, Van Der Meeren O, Ginsberg AM, Van Brakel E, Salaun B и др. Окончательный анализ испытания вакцины M72 / AS01E для профилактики туберкулеза. N Engl J Med. (2019) 381: 2429–39. DOI: 10.1056 / NEJMoa13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Ван дер Мерен О., Хатерилл М., Ндуба В., Уилкинсон Р., Муйойета М., Ван Бракель Е. и др. Фаза 2b контролируемых испытаний вакцины M72 / AS01E для профилактики туберкулеза. N Engl J Med. (2018) 379: 1621–34.DOI: 10.1056 / NEJMoa1803484
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Del Giudice G, Rappuoli R, Didierlaurent AM. Корреляты адъювантности: обзор адъювантов в лицензированных вакцинах. Semin Immunol. (2018) 39: 14–21. DOI: 10.1016 / j.smim.2018.05.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Кауфманн ОНА. Доступные по цене вакцины имеют решающее значение для наших постоянных усилий по снижению глобальной детской смертности. Hum Vaccin Immunother. (2019) 15: 2660–5. DOI: 10.1080 / 21645515.2019.1605817
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Хансен С.Г., Зак Д.Э., Сюй Дж., Форд Дж. К., Маршалл Е. Э., Малули Д. и др. Профилактика туберкулеза у макак-резусов с помощью вакцины на основе цитомегаловируса. Nat Med. (2018) 24: 130–43. DOI: 10,1038 / нм 4473
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. Darrah PA, DiFazio RM, Maiello P, Gideon HP, Myers AJ, Rodgers MA, et al.Повышение уровня БЦЖ белками или rAD5 не усиливает защиту от туберкулеза у макак-резусов. Вакцины NPJ. (2019) 4:21.
Google Scholar
72. Darrah PA, Zeppa JJ, Hackney JA, Wadsworth IIMH, Hughes TK, Pokkali S, et al. Профилактика туберкулеза у макак после внутривенной иммунизации БЦЖ. Природа. (2020) 577: 95–102. DOI: 10.1038 / s41586-019-1817-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73.Nemes E, Geldenhuys H, Rozot V, Rutkowski KT, Ratangee F, Bilek N, et al. Профилактика инфекции M. tuberculosis с помощью вакцины h5: IC31 или ревакцинации БЦЖ. N Engl J Med. (2018) 379: 138–49. DOI: 10.1056 / NEJMoa1714021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Anacker RL, Brehmer W., Barclay WR, Leif WR, Ribi E, Simmons JH, et al. Превосходство внутривенно вводимых БЦЖ и клеточных стенок БЦЖ в защите макак-резусов ( Macaca Mulatta ) от туберкулеза, передаваемого воздушно-капельным путем. Z Immunitatsforsch Exp Klin Immunol. (1972) 143: 363–76.
Google Scholar
75. Barclay WR, Anacker RL, Brehmer W., Leif W., Ribi E. Туберкулез, вызванный аэрозолем, у нечеловеческих приматов и течение заболевания после внутривенной вакцинации БЦЖ. Infect Immun. (1970) 2: 574–82.
PubMed Аннотация | Google Scholar
76. Эндрюс Дж. Р., Хатерилл М., Магомед Х., Ханеком В. А., Кампо М., Хоун Т. Р. и др. Динамика конверсии и реверсии золота квантиферон-ТБ в пробирке в группе подростков из Южной Африки. Am J Respir Crit Care Med. (2015) 191: 584–91. DOI: 10.1164 / rccm.201409-1704OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Дил Р., Голетти Д., Феррара Дж., Ботамли Дж., Чирилло Д., Кампманн Б. и др. Анализ высвобождения гамма-интерферона для диагностики латентной инфекции Mycobacterium tuberculosis : систематический обзор и метаанализ. Eur Respir J. (2011) 37: 88–99. DOI: 10.1183 / 0
36.00115110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
78.Пай М., Цверлинг А., Мензис Д. Систематический обзор: Анализы на основе Т-клеток для диагностики латентной туберкулезной инфекции: обновленная информация. Ann Intern Med. (2008) 149: 177–84.
PubMed Аннотация | Google Scholar
79. Баррето М.Л., Перейра С.М., Пилгер Д., Круз А.А., Кунья С.С., Сант’Анна С. и др. Доказательства влияния ревакцинации БЦЖ на заболеваемость туберкулезом у детей школьного возраста в Бразилии: второй отчет кластерного рандомизированного исследования BCG-revac. Вакцина. (2011) 29: 4875–77. DOI: 10.1016 / j.vaccine.2011.05.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80. Группа по профилактике заболеваний Каронги. Рандомизированное контролируемое испытание одной вакцины БЦЖ, повторной БЦЖ или комбинированной БЦЖ, убившей вакцины против Mycobacterium leprae для профилактики лепры и туберкулеза в Малави. Ланцет. (1996) 348: 17–24. DOI: 10.1016 / s0140-6736 (96) 02166-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81.Rodrigues LC, Pereira SM, Cunha SS, Genser B, Ichihara MY, de Brito SC и др. Влияние ревакцинации БЦЖ на заболеваемость туберкулезом у детей школьного возраста в Бразилии: кластерное рандомизированное исследование BCG-revac. Ланцет. (2005) 366: 1290–5.
PubMed Аннотация | Google Scholar
82. Nieuwenhuizen NE, Kulkarni PS, Shaligram U, Cotton MF, Rentsch CA, Eisele B, et al. Рекомбинантная вакцина Bacille Calmette-Guerin VPM1002: готова для испытаний на клиническую эффективность. Front Immunol. (2017) 8: 1147. DOI: 10.3389 / fimmu.2017.01147
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Grode L, Seiler P, Baumann S, Hess J, Brinkmann V, Nasser Eddine A, et al. Повышение эффективности вакцины против туберкулеза рекомбинантных мутантов Mycobacterium bovis Bacille Кальметта-Герена, секретирующих листериолизин. J Clin Invest. (2005) 115: 2472–9.
Google Scholar
84. Grode L, Ganoza CA, Brohm C, Weiner IIIJ, Eisele B, Kaufmann SH.Безопасность и иммуногенность рекомбинантной вакцины БЦЖ VPM1002 в открытом рандомизированном клиническом исследовании фазы 1. Вакцина. (2013) 31: 1340–8. DOI: 10.1016 / j.vaccine.2012.12.053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
85. Loxton AG, Knaul JK, Grode L, Gutschmidt A, Meller C, Eisele B, et al. Безопасность и иммуногенность рекомбинантной вакцины Mycobacterium bovis BCG VPM1002 у новорожденных, не подвергавшихся воздействию ВИЧ, в Южной Африке. Clin Vaccine Immunol. (2017) 24: e00439-16. DOI: 10.1128 / CVI.00439-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Вазири Ф., Брош Р. Системы секреции ESX / типа VII — важный выход для микобактериальных белков. Microbiol Spectr. (2019) 7: PSIB-0029-2019. DOI: 10.1128 / microbiolspec.PSIB-0029-2019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Вассерманн Р., Гюлен М.Ф., Сала С., Перин С.Г., Лу Й., Рыбникер Дж. И др. Mycobacterium tuberculosis дифференцированно активирует cGAS- и инфламмасомозависимые внутриклеточные иммунные ответы через ESX-1. Клеточный микроб-хозяин. (2015) 17: 799–810. DOI: 10.1016 / j.chom.2015.05.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Чен С., Нгуен Б.Н., Митчелл Г., Марголис С.Р., Ма Д., Портной Д.А. Последовательность, подобная листериолизину О, кооптирует AP-2-опосредованный эндоцитоз для предотвращения повреждения плазматической мембраны во время инфицирования листериями. Клеточный микроб-хозяин. (2018) 23: 786–95.e5. DOI: 10.1016 / j.chom.2018.05.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89.Декатур А.Л., Портной ДАА. Последовательность, похожая на вредителя, в листериолизине О, необходимая для патогенности Listeria monocytogenes . Наука. (2000) 290: 992–5.
PubMed Аннотация | Google Scholar
91. Сайга Х., Ньивенхейзен Н., Генгенбахер М., Кёлер А.Б., Шуерер С., Моура-Алвес П. и др. Рекомбинантная вакцина BCG Δurec :: hly нацелена на инфламмасому AIM2, вызывая аутофагию и воспаление. J Infect Dis. (2015) 211: 1831–41. DOI: 10.1093 / infdis / jiu675
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92.Фариначчи М, Вебер С, Кауфманн Ш. Рекомбинантная противотуберкулезная вакцина rBCG Δurec :: hly (+) индуцирует апоптотические везикулы для улучшения праймирования CD4 (+) и CD8 (+) Т-клеток. Вакцина. (2012) 30: 7608–14.
Google Scholar
93. Винау Ф., Вебер С., Сад С., де Диего Дж., Хупс С.Л., Брейден Б. и др. Апоптотические везикулы перекрестно проникают в Т-клетки CD8 и защищают от туберкулеза. Иммунитет. (2006) 24: 105–17.
PubMed Аннотация | Google Scholar
94.Дезель С., Дорхой А., Бандерманн С., Гроде Л., Эйзеле Б., Кауфманн Ш. Рекомбинантная БЦЖ Δurec hly + индуцирует лучшую защиту по сравнению с исходной БЦЖ за счет стимуляции сбалансированной комбинации цитокиновых ответов типа 1 и 17. J Infect Dis. (2011) 204: 1573–84.
Google Scholar
96. Дики HA. Туберкулез у студентов-медсестер и студентов-медиков Висконсинского университета. Ann Intern Med. (1950) 33: 941–59.
Google Scholar
97.Хук В.Н., Бейкер Дж. Х., Соренсен К., Кент, округ Колумбия. Эпидемиология туберкулезной инфекции в закрытой среде. Arch Environ Health. (1968) 16: 26–35.
Google Scholar
98. Кайпилявар В., Салгаме П. Устойчивые к инфекциям: цели новых исследований для выявления естественного защитного иммунитета против Mycobacterium tuberculosis . F1000 Исследования. (2019) 8: F1000 Faculty Rev-1698. DOI: 10.12688 / f1000research.19805.1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100.Талеб Н.Н. Черный лебедь. Влияние невероятного. 2-е изд. Нью-Йорк, Нью-Йорк: Penguin Random House LLC (2010).
Google Scholar
101. APPG Цена пандемии. Подсчет стоимости МЛУ-ТБ. Лондон: Всепартийная парламентская группа по глобальному туберкулезу (2015).
Google Scholar
102. Ндиай Б.П., Тиенеманн Ф., Ота М., Ландри Б.С., Камара М., Дайе С. и др. Безопасность, иммуногенность и эффективность кандидатной противотуберкулезной вакцины MVA85a у здоровых взрослых, инфицированных ВИЧ-1: рандомизированное плацебо-контролируемое исследование фазы 2. Ланцет Респир Мед. (2015) 3: 190–200. DOI: 10.1016 / S2213-2600 (15) 00037-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Тамерис, доктор медицины, Хатерилл М., Ландри Б.С., Скриба Т.Дж., Сноуден М.А., Локхарт С. и др. Безопасность и эффективность MVA85A, новой противотуберкулезной вакцины, у младенцев, ранее вакцинированных БЦЖ: рандомизированное плацебо-контролируемое исследование фазы 2b. Ланцет. (2013) 381: 1021–8.
PubMed Аннотация | Google Scholar
104.Манджали Томас З.-Р., Сатти И., Маршалл Д. Л., Харрис С. А., Лопес Рамон Р., Хамиди А. и др. Альтернативная аэрозольная и системная иммунизация рекомбинантным вирусным вектором для туберкулеза, MVA85A: рандомизированное контролируемое исследование фазы I. PLoS Med. (2019) 16: e1002790. DOI: 10.1371 / journal.pmed.1002790
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105. Сатти И., Мейер Дж., Харрис С.А., Манджали Томас З.Р., Гриффитс К., Антробус Р.Д. и др. Безопасность и иммуногенность кандидатной противотуберкулезной вакцины MVA85a, доставляемой в виде аэрозоля здоровым взрослым, вакцинированным БЦЖ: Фаза 1, двойное слепое, рандомизированное контролируемое испытание. Lancet Infect Dis. (2014) 14: 939–46. DOI: 10.1016 / S1473-3099 (14) 70845-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Смаилл Ф., Джеанатан М., Смиежа М., Медина М.Ф., Тантридж-Дон Н., Зганиач А. и др. Вакцина против туберкулеза на основе аденовируса 5 типа человека индуцирует устойчивые Т-клеточные ответы у людей, несмотря на существовавший ранее иммунитет против аденовируса. Sci Transl Med. (2013) 5: 205ra134. DOI: 10.1126 / scitranslmed.3006843
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107.Smaill F, Xing Z. Вакцина против туберкулеза на основе аденовируса человека 5 типа: будущее за респираторным путем? Вакцины Expert Rev. (2014) 13: 927–30. DOI: 10.1586 / 14760584.2014.929947
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108. Стилиану Э., Гриффитс К.Л., Пойнц Х.С., Харрингтон-Кандт Р., Дикс М.Д., Стокдейл Л. и др. Повышение защитной эффективности БЦЖ с помощью нового аденовируса шимпанзе и модифицированного вируса коровьей оспы, экспрессирующих Ag85A. Вакцина. (2015) 33: 6800–8. DOI: 10.1016 / j.vaccine.2015.10.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109. Сергеева М.В., Пулькина А.А., Васильев К.А., Романовская-Романко Е.А., Комиссаров А.А., Кучур О.А. и др. Безопасность и иммуногенность адаптированного к холоду рекомбинантного вектора гриппа, экспрессирующего антигены ESAT-6 и Ag85A M. tuberculosis . Vopr Virusol. (2017) 62: 266–72.
Google Scholar
110. van Dissel JT, Arend SM, Prins C., Bang P, Tingskov PN, Lingnau K, et al.Ag85B-ESAT-6 с адъювантом IC31 способствует сильным и долгоживущим Mycobacterium tuberculosis специфическим Т-клеточным ответам у наивных добровольцев. Вакцина. (2010) 28: 3571–81. DOI: 10.1016 / j.vaccine.2010.02.094
PubMed Аннотация | CrossRef Полный текст | Google Scholar
111. van Dissel JT, Joosten SA, Hoff ST, Soonawala D., Prins C., Hokey DA, et al. Новая липосомная адъювантная система CAF01 способствует долгоживущим Mycobacterium tuberculosis -специфическим Т-клеточным ответам у человека. Вакцина. (2014) 32: 7098–107. DOI: 10.1016 / j.vaccine.2014.10.036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112. Гелденхейс Х., Мирнс Х., Майлз Д. Д., Тамерис М., Хоки Д., Ши З. и др. Вакцина против туберкулеза h5: IC31 безопасна и вызывает стойкий полифункциональный Т-клеточный ответ CD4 у взрослых в Южной Африке: рандомизированное контролируемое исследование. Вакцина. (2015) 33: 3592–9. DOI: 10.1016 / j.vaccine.2015.05.036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113.Луабея А.К., Кагина Б.М., Тамерис М.Д., Гелденхейс Х., Хофф С.Т., Ши З. и др. Первое испытание на людях постконтактной противотуберкулезной вакцины H56: IC31 на Mycobacterium tuberculosis инфицированных и неинфицированных здоровых взрослых. Вакцина. (2015) 33: 4130–40. DOI: 10.1016 / j.vaccine.2015.06.051
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Сулиман С., Луабея АКК, Гелденхейс Х., Тамерис М., Хофф С.Т., Ши З. и др. Оптимизация дозы вакцины H56: IC31 для эндемичных по туберкулезу групп населения.двойное слепое плацебо-контролируемое исследование выбора дозы. Am J Respir Crit Care Med. (2019) 199: 220–31. DOI: 10.1164 / rccm.201802-0366OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
115. Колер Р.Н., Дэй Т.А., Эллис Р., Пьяцца Ф.М., Бекманн А.М., Вергара Дж. И др. Адъювант агониста TLR-4, GLA-SE, улучшает величину и качество иммунных ответов, вызываемых противотуберкулезной вакциной ID93: первое испытание на людях. Вакцины NPJ. (2018) 3:34.DOI: 10.1038 / s41541-018-0057-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
116. Пенн-Николсон А., Тамерис М., Смит Э., Дэй Т.А., Мусвосви М., Джаяшанкар Л. и др. Безопасность и иммуногенность новой противотуберкулезной вакцины ID93 + GLA-SE у здоровых взрослых, вакцинированных БЦЖ, в Южной Африке: рандомизированное двойное слепое плацебо-контролируемое исследование фазы 1. Ланцет Респир Мед. (2018) 6: 287–98. DOI: 10.1016 / S2213-2600 (18) 30077-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117.Leroux-Roels I, Forgus S, De Boever F, Clement F, Demoitie MA, Mettens P и др. Улучшение ответа CD4 (+) Т-клеток на Mycobacterium tuberculosis у PPD-отрицательных взрослых с помощью M72 / AS01 по сравнению с композициями кандидатных вакцин против туберкулеза M72 / AS02 и Mtb72F / AS02: рандомизированное испытание. Вакцина. (2013) 31: 2196–206. DOI: 10.1016 / j.vaccine.2012.05.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118. Спертини Ф., Одран Р., Чакур Р., Каруи О., Штайнер-Монар В., Тьерри А.С. и др.Безопасность иммунизации человека живой аттенуированной вакциной Mycobacterium tuberculosis : рандомизированное двойное слепое контролируемое исследование фазы I. Ланцет Респир Мед. (2015) 3: 953–62. DOI: 10.1016 / S2213-2600 (15) 00435-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119. Тамерис М., Мирнс Х, Пенн-Николсон А., Грегг И., Билек Н., Мабве С. и др. Живая аттенуированная вакцина Mycobacterium tuberculosis MTBVAC по сравнению с БЦЖ у взрослых и новорожденных: рандомизированное контролируемое двойное слепое исследование с увеличением дозы. Ланцет Респир Мед. (2019) 7: 757–70. DOI: 10.1016 / S2213-2600 (19) 30251-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
120. Johnson JL, Kamya RM, Okwera A, Loughlin AM, Nyole S, Hom DL, et al. Рандомизированное контролируемое испытание иммунотерапии Mycobacterium vaccae у взрослых жителей Уганды, инфицированных вирусом иммунодефицита человека, с впервые выявленным туберкулезом легких. сотрудничество в области исследований Западного резервного университета Уганды и Кейс. J Infect Dis (2000) 181: 1304–12.
PubMed Аннотация | Google Scholar
121. Лахи Т., Арбейт Р.Д., Бакари М., Хорсбург С.Р., Мати М., Уодделл Р. и др. Иммуногенность защитной цельноклеточной микобактериальной вакцины у ВИЧ-инфицированных взрослых: исследование III фазы в Танзании. Вакцина. (2010) 28: 7652–8. DOI: 10.1016 / j.vaccine.2010.09.041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
122. von Reyn CF, Mtei L, Arbeit RD, Waddell R, Cole B, Mackenzie T., et al. Профилактика туберкулеза у ВИЧ-инфицированных взрослых, примированных бациллой Кальметта-Герена, усиленных инактивированной цельноклеточной микобактериальной вакциной. СПИД. (2010) 24: 675–85. DOI: 10.1097 / QAD.0b013e3283350f1b
PubMed Аннотация | CrossRef Полный текст | Google Scholar
123. Вуола Дж. М., Ристола М. А., Коул Б., Ярвилуома А., Твароха С., Ронкко Т. и др. Иммуногенность инактивированной микобактериальной вакцины для профилактики ВИЧ-ассоциированного туберкулеза: рандомизированное контролируемое исследование. СПИД. (2003) 17: 2351–5.
PubMed Аннотация | Google Scholar
124. von Reyn CF, Lahey T., Arbeit RD, Landry B., Kailani L, Adams LV, et al.Безопасность и иммуногенность бустерной инактивированной цельноклеточной вакцины против туберкулеза у взрослых, примированных БЦЖ: рандомизированное контролируемое испытание DAR-901. PLoS One. (2017) 12: e0175215. DOI: 10.1371 / journal.pone.0175215
PubMed Аннотация | CrossRef Полный текст | Google Scholar
125. Гупта А., Ахмад Ф. Дж., Ахмад Ф., Гупта Ю. Д., Натараджан М., Каточ В. и др. Эффективность иммунотерапии Mycobacterium indicus pranii в качестве дополнения к химиотерапии туберкулеза и основных иммунных реакций в легких. PLoS One. (2012) 7: e39215. DOI: 10.1371 / journal.pone.0039215
PubMed Аннотация | CrossRef Полный текст | Google Scholar
126. Майози Б.М., Нцехе М., Бош Дж., Панди С., Юнг Х., Гумедзе Ф. и др. Преднизолон и Mycobacterium indicus pranii при туберкулезном перикардите. N Engl J Med. (2014) 371: 1121–30. DOI: 10.1056 / NEJMoa1407380
PubMed Аннотация | CrossRef Полный текст | Google Scholar
127. Шарма С.К., Каточ К., Сарин Р., Баламбал Р., Кумар Джайн Н., Патель Н. и др.Эффективность и безопасность Mycobacterium indicus pranii в качестве дополнительной терапии при туберкулезе легких категории II в рандомизированном исследовании. Научный доклад (2017) 7: 3354. DOI: 10.1038 / s41598-017-03514-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
128. Бутов Д.А., Ефременко Ю.В., Прихода Н.Д., Зайцева С.И., Юрченко Л.В., Соколенко Н.И. и др. Рандомизированное плацебо-контролируемое испытание фазы II уничтоженных нагреванием Mycobacterium vaccae (серия Immodulon) в форме таблеток для перорального применения (V7). Иммунотерапия. (2013) 5: 1047–54. DOI: 10.2217 / imt.13.110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
130. Ефременко Ю.В., Бутов Д.А., Прихода Н.Д., Зайцева С.И., Юрченко Л.В., Соколенко Н.И. и др. Рандомизированное плацебо-контролируемое испытание фазы II уничтоженных нагреванием Mycobacterium vaccae (серия Longcom) в форме таблеток для перорального применения (V7). Hum Vaccin Immunother. (2013) 9: 1852–6. DOI: 10.4161 / hv.25280
PubMed Аннотация | CrossRef Полный текст | Google Scholar
131.Вен Х, Хуан Джи, Мэн Икс, Ли С., Чжан Джи Кью. Дополнительная терапия вакцины Mycobacterium vaccae в лечении туберкулеза с множественной лекарственной устойчивостью: систематический обзор и метаанализ. Biomed Rep. (2016) 4: 595–600. DOI: 10.3892 / br.2016.624
PubMed Аннотация | CrossRef Полный текст | Google Scholar
132. Ян XY, Chen QF, Li YP, Wu SM. Mycobacterium vaccae в качестве адъювантной терапии против противотуберкулезной химиотерапии у никогда не лечившихся больных туберкулезом: метаанализ. PLoS One. (2011) 6: e23826. DOI: 10.1371 / journal.pone.0023826
PubMed Аннотация | CrossRef Полный текст | Google Scholar
133. Cardona PJ. РУТИ: новый шанс сократить лечение латентной туберкулезной инфекции. Туберкулез (Единб). (2006) 86: 273–89.
PubMed Аннотация | Google Scholar
134. Нелл А.С., Д’Лом Э., Буик П., Сабате М., Боссер Р., Пикас Дж. И др. Безопасность, переносимость и иммуногенность новой противотуберкулезной вакцины ruti: рандомизированное плацебо-контролируемое клиническое испытание фазы II у пациентов с латентной туберкулезной инфекцией. PLoS One. (2014) 9: e89612. DOI: 10.1371 / journal.pone.0089612
PubMed Аннотация | CrossRef Полный текст | Google Scholar
135. Вилаплана С., Монтане Е., Пинто С., Барриоканал А.М., Доменек Г., Торрес Ф. и др. Двойное слепое рандомизированное плацебо-контролируемое клиническое испытание фазы I терапевтической противотуберкулезной вакцины RUTI. Вакцина. (2010) 28: 1106–16. DOI: 10.1016 / j.vaccine.2009.09.134
PubMed Аннотация | CrossRef Полный текст | Google Scholar
136.Groschel MI, Prabowo SA, Cardona PJ, Stanford JL, van der Werf TS. Лечебные вакцины от туберкулеза — систематический обзор. Вакцина. (2014) 32: 3162–8. DOI: 10.1016 / j.vaccine.2014.03.047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Можно ли использовать БЦЖ для защиты от COVID-19?
Спустя почти 100 лет с момента первого использования у людей в качестве вакцины от туберкулеза, Bacillus Calmette – Guérin (BCG) был предложен в качестве возможного агента для предотвращения коронавирусной болезни 2019 (COVID-19).Ряд исследований проводится для изучения этой возможности, но — даже если они окажутся эффективными — останется много вопросов.
Продолжающаяся пандемия коронавирусного заболевания 2019 (COVID-19) возобновила академический и клинический интерес к старой вакцине Bacillus Calmette – Guérin (BCG). БЦЖ, аттенуированный штамм Mycobacterium bovis , был первоначально разработан Альбертом Кальметтом и Камилем Гереном в начале 20 века в качестве вакцины против туберкулеза.БЦЖ, впервые примененная для людей в 1921 году, в настоящее время является одной из наиболее широко используемых вакцин для младенцев и новорожденных, у которых ее основное применение заключается в профилактике туберкулезного менингита и диссеминированного туберкулеза 1 . Важно отметить, что БЦЖ также используется в качестве адъювантной иммунотерапии для пациентов с немышечно-инвазивным раком мочевого пузыря 2 .
Было показано, что вакцинация детей БЦЖ помимо ожидаемого эффекта в отношении профилактики тяжелых заболеваний, вызываемых туберкулезом, обладает рядом гетерологичных защитных эффектов.В частности, вакцинация новорожденных БЦЖ может снизить общую детскую смертность, включая смертность, не связанную с туберкулезом 3 , что в основном обусловлено снижением сепсиса и респираторных инфекций в детстве 4 .
Несколько механизмов, с помощью которых БЦЖ обеспечивает неспецифическую защиту от респираторных инфекций, были предметом активного исследования. Во-первых, молекулярное сходство между антигенами БЦЖ и вирусными антигенами может привести после вакцинации БЦЖ к популяции В- и Т-клеток памяти, которые распознают как БЦЖ, так и респираторные патогены.Однако этот механизм вряд ли может объяснить различную защиту, возникающую в результате вакцинации БЦЖ. Во-вторых, БЦЖ может привести к антиген-независимой активации сторонних В- и Т-клеток, механизм, который получил название гетерологичного иммунитета. Наконец, БЦЖ может привести к долгосрочной активации и перепрограммированию клеток врожденного иммунитета. Этот последний механизм, который вызвал большой интерес в последнее десятилетие, получил название тренированного иммунитета 5 .
Тренированный иммунитет возникает за счет эпигенетического перепрограммирования моноцитов в очаге инфекции или иммунизации.Эти моноциты претерпевают гистоновую модификацию на промоторных участках генов, кодирующих воспалительные цитокины, что приводит к долгосрочным изменениям их способности реагировать на новые стимулы и приводит к все более активному иммунному ответу при их реактивации. Имеются данные, подтверждающие наличие тренированного иммунитета в контексте иммунизации БЦЖ: моноциты взрослых, получивших вакцинацию БЦЖ, демонстрируют повышенную экспрессию различных поверхностных маркеров, связанных с активацией, и продуцируют большее количество цитокинов, таких как IL-1β, IL-6. , IFNγ и TNF в ответ на инфекцию различными патогенами по сравнению с моноцитами взрослых, не получивших вакцину БЦЖ.Эта защита охватывает широкий спектр организмов, включая бактерии, такие как Staphylococcus aureus , грибы, такие как Candida albicans , и вирусы, такие как вирус желтой лихорадки 6,7 .
В настоящее время исследователи пытаются проверить гипотезу о том, что гетерологичная защита, создаваемая БЦЖ, может защитить от тяжелого заболевания, вызванного COVID-19. Интересно, что данные из публикации, не прошедшей рецензирование, в некоторой степени подтверждают эту гипотезу. Авторы этой статьи обнаружили, что в некоторых регионах мира, в которых не действует политика всеобщей вакцинации БЦЖ, например в Италии и США, смертность от COVID-19 выше, чем в местах, где давно действует политика всеобщей вакцинации БЦЖ, например как Южная Корея и Япония 8 .Однако эти доказательства являются косвенными, и различия в смертности от COVID-19 в разных местах могут объясняться множеством факторов, помимо политики вакцинации БЦЖ. В настоящее время проводится несколько исследований для определения влияния вакцинации БЦЖ на исходы COVID-19, в том числе в двух группах высокого риска. Во-первых, клинические испытания в Австралии, Нидерландах и США направлены на то, чтобы проверить, может ли вакцинация БЦЖ медицинских работников защитить их от COVID-19 (см. Ссылки по теме). Во-вторых, продолжаются исследования, чтобы проверить влияние вакцинации БЦЖ на профилактику тяжелой инфекции COVID-19 среди пожилых людей.Наконец, в Германии проводится исследование, посвященное проверке того, может ли VPM1002, рекомбинантный вакцинный штамм, полученный из БЦЖ, защитить медицинских работников или пожилых пациентов от COVID-19 (ref. 9 ).
Если эти испытания действительно продемонстрируют защитный эффект вакцинации БЦЖ от COVID-19, многие вопросы останутся. Во-первых, как долго сохраняется гетерологичный иммунитет, вызванный БЦЖ, после вакцинации? Предыдущие исследования показали, что действие БЦЖ на моноциты может длиться несколько месяцев; однако некоторые из этих эффектов, особенно повышенная способность обученных моноцитов секретировать цитокины, впоследствии постепенно ослабевают 7 .Во-вторых, какое оптимальное время для вакцинации? Исследования влияния вакцинации БЦЖ на респираторные инфекции в детстве и смертность демонстрируют преимущество вакцинации в раннем возрасте (до 9 месяцев по сравнению с более поздним возрастом детства) 4 . Однако неизвестно, повлияет ли возраст вакцинации на влияние БЦЖ на COVID-19. Наконец, как использование БЦЖ для предотвращения COVID-19 повлияет на ее использование для лечения рака мочевого пузыря? Будет ли использование БЦЖ для предотвращения COVID-19 усугублять продолжающуюся нехватку БЦЖ для лечения рака мочевого пузыря, особенно в США, где Merck является единственным производителем БЦЖ? И будут ли защищены от COVID-19 пациенты с раком мочевого пузыря, которые прошли курс лечения внутрипузырной БЦЖ?
«Исследования продолжаются, чтобы определить, может ли вакцинация БЦЖ защитить от инфекции COVID-19»
Исследования продолжаются, чтобы определить, может ли вакцинация БЦЖ защитить от инфекции COVID-19.Какими бы ни были результаты этих усилий, то, что вакцина БЦЖ продолжает стимулировать научные исследования, проливают новый свет на наше понимание иммунологических механизмов за 100 лет с момента ее разработки.
Ссылки
- 1.
Colditz, G. A. et al. Эффективность вакцинации против бациллы Кальметта-Герена новорожденных и младенцев в профилактике туберкулеза: метаанализ опубликованной литературы. Педиатрия 96 , 29–35 (1995).
CAS
PubMed
PubMed CentralGoogle Scholar
- 2.
Редельман-Сиди Г., Гликман М. С. и Бохнер Б. Х. Механизм действия БЦЖ-терапии рака мочевого пузыря — актуальная перспектива. Нац. Преподобный Урол. 11 , 153–162 (2014).
CAS
СтатьяGoogle Scholar
- 3.
Хиггинс, Дж. П. и др. Связь вакцины БЦЖ, АКДС и кори, содержащих вакцину, с детской смертностью: систематический обзор. BMJ 355 , i5170 (2016).
Артикул
Google Scholar
- 4.
Hollm-Delgado, M. G., Stuart, E. A. и Black, R. E. Острая инфекция нижних дыхательных путей среди детей, вакцинированных Bacille Calmette-Guerin (BCG). Педиатрия 133 , e73 – e81 (2014).
Артикул
Google Scholar
- 5.
Goodridge, H. S. et al. Использование полезных гетерологичных эффектов вакцинации. Нац. Rev. Immunol. 16 , 392–400 (2016).
CAS
СтатьяGoogle Scholar
- 6.
Arts, R. J. W. et al. Вакцинация БЦЖ защищает людей от экспериментальной вирусной инфекции за счет индукции цитокинов, связанных с тренированным иммунитетом. Cell Host Microbe 23 , 89–100 (2018).
CAS
СтатьяGoogle Scholar
- 7.
Kleinnijenhuis, J. et al. Длительные эффекты вакцинации БЦЖ как на гетерологичные ответы Th2 / T H 17, так и на врожденный тренированный иммунитет. J. Врожденный иммунитет. 6 , 152–158 (2014).
CAS
СтатьяGoogle Scholar
- 8.
Miller, A. et al. Корреляция между универсальной политикой вакцинации БЦЖ и снижением заболеваемости и смертности от COVID-19: эпидемиологическое исследование. Препринт по адресу medRxiv https: // doi.org / 10.1101 / 2020.03.24.20042937 (2020).
Артикул
PubMed
PubMed CentralGoogle Scholar
- 9.
de Vrieze, J. Может ли вакцина против туберкулеза столетней давности укрепить иммунную систему против нового коронавируса? Science https://www.sciencemag.org/news/2020/03/can-century-old-tb-vaccine-steel-immune-system-against-new-coronavirus# (2020).
Скачать ссылки
Информация об авторе
Принадлежность
Отделение инфекционных болезней, Мемориальный онкологический центр Слоуна Кеттеринга, Нью-Йорк, Нью-Йорк, США
Гил Редельман-Сиди
63
для корреспонденции
Гил Редельман-Сиди.
Декларации этики
Конкурирующие интересы
Автор заявляет об отсутствии конкурирующих интересов.
Дополнительная информация
Ссылки по теме
Поиск на ClinicalTrials.gov по БЦЖ и COVID:
https://clinicaltrials.gov/ct2/results?cond=COVID&term=bcg&cntry=&state=&city=&dist=&Search=Search
Об этой статье
Цитируйте эту статью
Redelman-Sidi, G.Можно ли использовать БЦЖ для защиты от COVID-19 ?.
Nat Rev Urol 17, 316–317 (2020). https://doi.org/10.1038/s41585-020-0325-9
Ссылка для скачивания
Дополнительная литература
COVID-19: обзор эволюции, передачи, обнаружения, контроля и профилактики нового коронавирусного заболевания
- Аншика Шарма
- , Исра Ахмад Фарук
- и Сунил Кумар Лал
Вирусов
(2021 год)Вакцинация против бациллы Кальметта-Герена и социально-экономические переменные в сравнении с глобальными характеристиками COVID-19: устранение противоречивой проблемы
- Луиджи Вентура
- , Маттео Витали
- и Винченцо Романо Спика
Аллергия
(2021 год)Возможности вакцинации БЦЖ от COVID-19: аналитический подход
Вакцины и иммунотерапевтические средства для человека
(2021 год)Управление
NMIBC
в течение
BCG
нехватка и
COVID-19
‐19- Мэр Нихила
- , Кристиан Фанкхаузер
- , Виджай Сангар
- и Хью Мостафид
Тенденции в урологии и мужском здоровье
(2021 год)Три десятилетия клинических испытаний иммунотерапии лейшманиозов человека: систематический обзор и метаанализ
- Камила Алвес Мота
- , Джули Ояма
- , Мариана де Соуза Террон Монич
- , Алин Авила Брустолин
- , Жоао Витор Перес де Соуза
- , Летисия Диаси Лоуси
- , Хорхе Хуарес Виейра Тейшейра
- и Тас Гомес Верзиньясси Сильвейра
Лусиана Диасиана Мурасе
Сильва Сантос
Иммунотерапия
(2021 год)
Может ли вакцина против туберкулеза БЦЖ, которой уже 100 лет, защитить от коронавируса?
На этой неделе Фонд Билла и Мелинды Гейтс объявил, что пожертвует 10 миллионов австралийских долларов, чтобы помочь в финансировании австралийских пробных испытаний, можно ли использовать очень старую вакцину БЦЖ против новой угрозы COVID-19.
Так что же такое вакцина БЦЖ и какое место она может занять в борьбе с коронавирусом?
Азбука BCG
Вакцина БЦЖ использовалась почти столетие для защиты от туберкулеза, бактериального заболевания, поражающего легкие. Туберкулез вызывается бактерией под названием Mycobacterium tuberculosis .
BCG — это сокращение от Bacillus Calmette-Guérin, поскольку оно было создано Леоном Шарлем Альбертом Кальметтом и Жан-Мари Камиль Герен в начале 1900-х годов.
Для создания вакцины они использовали Mycobacterium bovis , бактерию, обнаруженную у коров и тесно связанную с Mycobacterium tuberculosis . Они выращивали его на желе, богатом питательными веществами, в лаборатории почти 13 лет. Бактерия адаптировалась к такому комфортному образу жизни, потеряв в своей ДНК элементы, в которых она больше не нуждалась, в том числе элементы, вызывающие болезни.
Этот процесс называется ослаблением и приводит к появлению живого, но ослабленного микроба, который можно вводить людям в качестве вакцины.
Читать далее:
Коронавирус: можно ли контролировать пандемию с помощью существующих вакцин, таких как MMR или BCG?
БЦЖ предлагается младенцам в некоторых частях мира, где все еще высока заболеваемость туберкулезом. Он защищает в 86% случаев от некоторых более редких форм туберкулеза, которые чаще встречаются у детей.
Но он защищает только 50% времени у взрослых.
Ученые и клиницисты в целом считают, что нам нужна более совершенная вакцина от туберкулеза.Однако эпидемиологи заметили, что у детей, получавших БЦЖ, было значительно лучше общее состояние здоровья, с меньшим количеством респираторных инфекций и меньшим количеством смертей.
Иммунологи подозревают, что это вызвано типом иммунного ответа, который называется «тренированный иммунитет».
Тренированный иммунитет отличается от того, как мы традиционно думаем об иммунитете или «иммунной памяти», потому что он задействует разные типы иммунных клеток.
Иммунная память против тренированного иммунитета
В нашей иммунной системе есть два основных типа клеток: врожденные клетки, которые быстро реагируют на микробы, вызывающие болезнь, и адаптивные клетки, которые изначально реагируют довольно медленно.
Адаптивные клетки включают В-клетки, которые вырабатывают антитела, блокирующие инфекцию, и Т-клетки, которые могут убивать инфицированные клетки. Важно отметить, что адаптивные клетки могут запоминать определенные микробы годами или даже десятилетиями после того, как мы впервые с ними столкнемся.
Это явление называется «иммунной памятью».
Когда адаптивные иммунные клетки сталкиваются с одним и тем же микробом второй или последующий раз, они реагируют намного быстрее, и иммунная система может эффективно избавиться от инфекции до того, как она вызовет болезнь.Благодаря иммунной памяти мы часто не заражаемся конкретным микробом, например ветряной оспой, более одного раза.
Большинство наших современных вакцин используют иммунную память, чтобы защитить нас от инфекции.
Читать далее:
Где мы находимся с разработкой вакцины от коронавируса?
На протяжении десятилетий ученые полагали, что врожденным клеткам не хватало способности запоминать предыдущие встречи с микробами. Однако недавно мы узнали, что некоторые врожденные клетки, такие как моноциты, можно «тренировать» во время встречи с микробом.Тренировка может запрограммировать врожденные клетки на более быструю активацию при следующей встрече с микробом — любым микробом.
Некоторые живые аттенуированные вакцины, такие как БЦЖ, могут вызывать выработанный иммунитет, что может усилить контроль над другими инфекциями на раннем этапе. Это поднимает заманчивую возможность того, что БЦЖ может обучить врожденные клетки улучшить ранний контроль над вирусом SARS-CoV-2, уменьшить заболевание COVID-19 или даже предотвратить инфекцию.
И в качестве бонуса БЦЖ потенциально может защитить нас и от других патогенов.
Вакцина БЦЖ нацелена на тренированный иммунитет, тогда как большинство других вакцин нацелены на иммунную память.
Кайли Куинн, автор предоставил
Может ли БЦЖ защитить от COVID-19?
Мы пока не знаем, снизит ли БЦЖ тяжесть COVID-19, но у вакцины есть некоторые интересные особенности.
Во-первых, БЦЖ — мощный стимулятор иммунной системы. В настоящее время его используют наряду с другими методами лечения рака мочевого пузыря и меланомы, поскольку он может стимулировать иммунные клетки к атаке опухоли.
БЦЖ, по-видимому, также улучшает иммунитет легких. Как мы уже упоминали, дети, которым была сделана вакцина, реже болеют респираторными инфекциями.
В Мельбурне проводится исследование, посвященное тому, может ли БЦЖ уменьшить симптомы астмы у детей.
И, наконец, было показано, что БЦЖ ограничивает вирусную инфекцию. В одном исследовании добровольцам давали БЦЖ или плацебо за месяц до заражения вирусом. У добровольцев, получавших БЦЖ, количество вируса, продуцируемого во время инфекции, было незначительным по сравнению с теми, кто получал плацебо.
Читать далее:
Объяснитель: что такое туберкулез и рискую ли я заразиться им в Австралии?
Однако БЦЖ может вызывать побочные эффекты, о которых следует помнить. Обычно это вызывает образование небольшого вздутия на коже в месте вакцинации и может вызвать болезненный отек в окружающих лимфатических узлах.
Важно отметить, что поскольку это живая бактерия, она может распространяться из места вакцинации и вызывать заболевание, называемое диссеминированной БЦЖ, у людей с иммунодефицитом, таких как люди с ВИЧ.Это означает, что БЦЖ нельзя давать всем.
Текущие клинические испытания
Окончательный тест на вакцину БЦЖ в качестве меры профилактики COVID-19 — это проведение рандомизированных клинических испытаний, которые сейчас продолжаются.
Исследователи из Австралии и Нидерландов готовятся назначить БЦЖ людям, у которых, возможно, самый высокий риск заражения COVID-19: медицинским работникам на переднем крае.
Эти испытания III фазы будут собирать данные о том, имеют ли работники, вакцинированные БЦЖ, меньше или менее серьезные инфекции COVID-19.
Если BCG окажется эффективным, мы столкнемся с другими проблемами. Например, поставки вакцины в настоящее время ограничены. Кроме того, существует множество различных штаммов БЦЖ, и не все они могут обеспечивать одинаковую защиту от COVID-19.
Защита скорее всего начнет ослабевать относительно быстро. Когда тренированный иммунитет отслеживался у людей после вакцинации БЦЖ, он начал снижаться через 3–12 месяцев после вакцинации.
Защита также не будет такой сильной, как у многих традиционных вакцин, таких как вакцина MMR, которая защищает от кори 94.В 1% случаев.
Читать далее:
Вот почему ВОЗ утверждает, что до вакцины от коронавируса осталось 18 месяцев
Таким образом, БЦЖ будет наиболее полезной для людей с высоким риском заражения, но она не заменит традиционную вакцину, основанную на иммунной памяти.
Эти исследования важны для того, чтобы дать нам возможность выбора. Нам нужен полный набор инструментов для борьбы с COVID-19, состоящий из противовирусных и противовоспалительных препаратов и вакцин.Но до эффективной вакцины против COVID-19, вероятно, еще много месяцев, а то и лет.
Перепрофилировав старую хорошо охарактеризованную вакцину, мы могли бы восполнить этот пробел и обеспечить некоторую защиту нашим медицинским работникам, когда они борются с COVID-19.
Иммунизация против туберкулеза может уменьшить болезнь Covid-19
Согласно новому израильскому исследованию, вакцинация против туберкулеза, по-видимому, обеспечивает некоторую защиту от Covid-19 для людей в возрасте до 24 лет.
Исследование, проведенное научным сотрудником Др.Надав Раппопорт из Университета Бен-Гуриона в Негеве вместе с коллегами из Еврейского университета в Иерусалиме обнаружили корреляцию между политикой стран в отношении вакцины против туберкулеза бациллы Кальметта-Герена (БЦЖ) и исходами от COVID-19 в этих странах.
Защита оказывается значительной в первую очередь среди тех, кто получил вакцинацию в течение последних 15 лет. Исследователи не обнаружили подобного эффекта у пожилых людей, получивших вакцину БЦЖ более 15 лет назад.
Их данные показали, что вакцинация БЦЖ неизменно входила в два основных показателя эффекта в 55 исследованных странах (в которых проживает почти 63 процента населения мира).
Раппапорт, который является частью отдела разработки программного обеспечения и информационных систем BGU, и его коллеги нормализовали данные так, чтобы страны были выровнены по первой дате, когда каждая страна достигла уровня смертности 0,5 смертей на миллион или выше. Исследователи также контролировали демографические, экономические, связанные с ограничениями пандемии и состояния здоровья переменные, зависящие от страны.Были включены только страны с населением не менее 3 миллионов человек.
В исследовании также сравнивалась вакцинация БЦЖ по всей стране и вакцинация от других болезней, таких как корь и краснуха. Раппапорт и его команда обнаружили, что другие вакцины не имели значительной связи с исходами от Covid-19.
Израильское исследование — не первое, что обнаруживает влияние БЦЖ за рамки туберкулеза. Исследователи из Нидерландов сообщили, что вакцина оказывает общее стимулирующее действие на иммунную систему.В исследовании, проведенном в Нидерландах, БЦЖ не тестировалась специально на исходы Covid-19, но демонстрирует «осторожно положительную картину» с меньшим количеством заболевших в период с марта по май 2020 года среди вакцинированной группы, а также меньшим количеством жалоб на усталость.
Отдельное американское исследование предполагает, что если бы вакцинация БЦЖ была обязательной несколько десятилетий назад, количество смертей от первой волны Covid-19 в США могло бы снизиться на 80%.
БЦЖ — самая распространенная вакцина в мире.Обычно его дают вскоре после рождения или в раннем детстве.
«Мы предполагаем, что охват вакцинацией БЦЖ, особенно среди недавно вакцинированного населения, способствует ослаблению распространения и серьезности пандемии Covid-19», — заключили израильские исследователи. «Наши результаты показывают, что изучение протоколов вакцины БЦЖ в контексте текущей пандемии может оказаться полезным».
Исследование BGU было опубликовано в журнале Vaccines .
BCG Вакцина против туберкулеза: потенциальная защита от COVID-19
В многочисленных исследованиях, сравнивающих влияние коронавирусного заболевания 2019 (COVID-19) во всем мире, результаты показывают более низкие уровни инфицирования и смертности в странах с универсальной политикой вакцинации против туберкулеза бациллой Кальметта-Герена (БЦЖ) новорожденных по сравнению со странами, в которых эта практика отсутствует. 1 В исследовании, опубликованном в июле 2020 года, каждые 10% увеличения индекса БЦЖ (который отражает степень вакцинации БЦЖ в стране) ассоциировались с 10.Снижение смертности от COVID-19 на 4% и более высокие показатели смертности наблюдались в странах, где всеобщая вакцинация БЦЖ была начата позже, а не раньше. 2
Кроме того, эпидемиологические исследования, проведенные до появления COVID-19, «показали, что вакцинация БЦЖ, по-видимому, оказывает благотворное влияние не только на профилактику туберкулеза, но и на общую смертность», по словам Бали Пулендрана, доктора философии, Виолетты Л. Хортон, профессор микробиологии и иммунологии на кафедре вирусологии Стэнфордского университета в Калифорнии. 3
Некоторые результаты также подтверждают широкий защитный эффект вакцины БЦЖ против вирусных патогенов, включая респираторные инфекции. 4 Считается, что БЦЖ может стимулировать «тренированный иммунитет», который был в центре внимания примерно последние 10 лет с тех пор, как ученые «поняли, что врожденная иммунная система действительно имеет некоторую память об инфекции», — объяснил доктор Пулендран. 4 «Он может быть намного короче, чем у адаптивной иммунной системы, но гораздо шире.”
Продолжить чтение
В совокупности такие наблюдения еще больше пробудили интерес исследователей к влиянию вакцинации БЦЖ на инфекцию COVID-19. Есть надежда, что благодаря широкой защите, обеспечиваемой тренированным иммунитетом, вакцина может, по крайней мере, ограничить серьезность инфекции. 2
Однако другие исследования дали противоречивые результаты, в том числе исследование, опубликованное в августе 2020 года в журнале Clinical Infectious Diseases , в котором анализировалось влияние вакцинации БЦЖ на исходы, связанные с COVID-19, у лиц, родившихся в Швеции до и после апреля 1975 года (n = 1,026,304 и n = 1,018,544 соответственно).На тот момент национальная практика вакцинации всех новорожденных была прекращена, что «позволило нам оценить эффект БЦЖ без систематических ошибок, связанных с межстрановыми сравнениями», — пишут авторы. 5
Используя прерывистость регрессии, они «смогли показать, что в этих когортах нет разного количества случаев COVID-19 и госпитализаций на душу населения, с высокой точностью, которую вряд ли можно будет достичь с помощью [рандомизированного контролируемого исследования]».Эти данные показывают, что вакцинация БЦЖ при рождении не защищает от COVID-19 в среднем возрасте.
Необходимы дальнейшие исследования, чтобы выяснить влияние вакцинации БЦЖ на инфекцию COVID-19 в различных группах населения. «Это привлекательная гипотеза, которую следует тщательно проверить в хорошо контролируемых клинических испытаниях с достаточно большим количеством [участников], которые позволят сделать строгие и обоснованные выводы», — сказал д-р Пулендран.
В настоящее время по крайней мере 12 рандомизированных контролируемых испытаний изучают потенциальную пользу вакцинации БЦЖ для этой цели.Например, в двух испытаниях изучается, может ли вакцинация (во взрослом возрасте) защитить от заболеваемости и тяжести COVID-19 у медицинских работников и сократить количество прогулов на рабочем месте среди этой группы населения, в то время как другое испытание сосредоточено на влиянии вакцины на частоту возникновения инфекции. Госпитализация пожилых людей в связи с COVID-19. 3,6
В соответствующей работе доктор Пулендран и его коллеги изучали использование системной вакцинологии для прогнозирования иммунного ответа на вакцинацию, а также использование адъювантов для усиления иммунного ответа на вакцины. 7,8
Чтобы узнать больше о выводах, касающихся потенциальной роли БЦЖ в защите от инфекции COVID-19, мы поговорили с Прамодом Кумаром Гуптой, доктором философии, исследователем отдела иммунологии и иммунологического анализа туберкулеза Центра радиационной медицины при Центре атомных исследований Бхабха в г. Мумбаи, Индия. Доктор Гупта опубликовал статью по этой теме в октябре 2020 года в журнале Cellular Immunology . 9
Какие данные говорят о защитных эффектах вакцинации БЦЖ против COVID-19?
БЦЖ — это вакцина столетней давности с отличным профилем безопасности для всех возрастных групп, включая младенцев, взрослых и пожилых людей.На сегодняшний день несколько клинических исследований показали, что БЦЖ снижает общую младенческую смертность за счет защиты от немикобактериальных заболеваний. Кроме того, БЦЖ обеспечивает защиту от неспецифических респираторных инфекций у взрослых и пожилых людей.
Недавно многие группы сообщили, что смертность от COVID-19 в странах с универсальными программами вакцинации БЦЖ ниже, чем в странах без таких программ. Однако вакцинация БЦЖ — не единственная причина защитного действия вакцины БЦЖ — также задействованы другие переменные, такие как средний возраст населения, этническая принадлежность, инфраструктура здравоохранения, центры тестирования и надлежащие системы мониторинга смертности.
Каковы возможные механизмы, лежащие в основе этих эффектов?
Основным механизмом гетерологической защиты, опосредованной БЦЖ, против коронавируса 2 тяжелого острого респираторного синдрома (SARS-CoV-2) или любого другого патогена является индукция тренированного иммунитета. 9 Тренированный иммунитет определяется как реакция памяти в клетках врожденного иммунитета и регулируется эпигенетической модификацией и метаболическим перепрограммированием в клетках врожденного иммунитета. 9
Какие дополнительные исследования необходимы для дальнейшего изучения БЦЖ как потенциальной вакцины против COVID-19?
Все исследования, в которых сообщается о защитном эффекте вакцинации БЦЖ, носят экологический характер и склонны к ошибочной предвзятости.Реальный потенциал БЦЖ против COVID-19 может быть реализован только после хорошо спланированных клинических испытаний. В настоящее время проводится более 12 клинических испытаний, результаты которых ожидаются в ближайшее время.
Я хотел бы добавить, что «рекомбинантная БЦЖ, экспрессирующая антигены SARS-CoV-2» может иметь потенциальные защитные эффекты против COVID-19, и необходимые разрешения могут быть ускорены из-за профиля безопасности, присущего БЦЖ.
Проводятся ли какие-либо заметные исследования других существующих вакцин с этой целью?
Помимо БЦЖ, другими живыми вакцинами, которые продемонстрировали гетерологичный защитный эффект, являются вакцина MMR [корь-эпидемический паротит-краснуха] и пероральная вакцина против полиомиелита. 4 Оба из них исследуются в клинических испытаниях, чтобы изучить их эффективность против COVID-19.
Список литературы
1. Перейра М., Пайшао Э., Трайман А. и др. Необходимость быстрых, качественных и недорогих исследований роли вакцины БЦЖ в борьбе с COVID-19. Respir Res . 2020; 21 (1): 178.
2. Эскобар Л. Е., Молина-Крус А., Бариллас-Мьюри К. Защита вакцины БЦЖ от тяжелого коронавирусного заболевания 2019 г. (COVID-19). Proc Natl Acad Sci U S A . 2020; 117 (30): 17720-17726.
3. Curtis N, Sparrow A., Ghebreyesus TA, Netea MG. Рассмотрение вакцинации БЦЖ для снижения воздействия COVID-19. Ланцет . 2020; 395 (10236): 1545-1546.
4. Netea MG, Giamarellos-Bourboulis EJ, Domínguez-Andrés J, et al. Тренированный иммунитет: инструмент для снижения восприимчивости и тяжести инфекции SARS-CoV-2. Ячейка . 2020; 181 (5): 969-977.
5. de Chaisemartin C, de Chaisemartin L.Вакцинация БЦЖ в младенчестве не защищает от COVID-19. Данные естественного эксперимента в Швеции Clin Infect Dis . Опубликовано онлайн 23 августа 2020 г. doi: 10.1093 / cid / ciaa1223
6. ten Doesschate T, Moorlag SJCFM, van der Vaart TW, et al; от имени исследовательской группы BCG-CORONA. Два рандомизированных контролируемых испытания вакцинации против Bacillus Calmette-Guérin для сокращения числа прогулов среди медицинских работников и количества госпитализаций пожилых людей во время пандемии COVID-19: структурированное резюме протоколов исследования для двух рандомизированных контролируемых испытаний. Испытания . 2020; 21 (1): 481. DOI: 10.1186 / s13063-020-04389-w
7. Кортезе М., Шерман А.С., Руфаэль Н.Г., Пулендран Б. Системный биологический анализ иммунного ответа на вакцинацию против гриппа. Колд Спринг Харб Перспект Мед . Опубликовано онлайн 9 марта 2020 г. doi: 10.1101 / cshperspect.a038596
8. Ellebedy AH, Nachbagauer R, Jackson KJL и др. Адъювантная вакцина против гриппа H5N1 усиливает как перекрестно-реактивные В-клетки памяти, так и штамм-специфичные наивные В-клеточные ответы у людей. Proc Natl Acad Sci U S. A. 2020; 117 (30): 17957-17964.
9. Гупта ПК. Новая вакцина против новой болезни: является ли рекомбинантная вакцина БЦЖ ответом на COVID-19? Cell Immunol . 2020; 356: 104187. DOI: 10.1016 / j.cellimm.2020.104187
Введение — HSE.ie
Как действует вакцина?
Вакцина БЦЖ содержит штамм Mycobacterium bovis, бактерии, вызывающей туберкулез (ТБ) крупного рогатого скота.Бактерии были изменены так, что они не вызывают туберкулезную инфекцию, но заставляют вашу иммунную систему вырабатывать антитела. Они делают вас невосприимчивыми к болезни.
Где проблема с туберкулезом?
Плохие условия по-прежнему существуют во многих менее развитых странах. Некоторые штаммы бактерий ТБ выработали устойчивость к одному или нескольким противотуберкулезным препаратам, что затрудняет их лечение. Это произошло из-за того, что люди не завершили курс лечения или им было назначено несоответствующее лечение, или из-за недостаточного количества лекарств.Вакцинация БЦЖ эффективна против некоторых тяжелых форм заболевания, таких как туберкулезный менингит у детей, но не эффективна против всех форм туберкулеза. Глобальная эпидемия ВИЧ, начавшаяся в 1980-х годах, привела к соответствующей эпидемии случаев туберкулеза. . Это связано с тем, что ВИЧ ослабляет иммунную систему человека, что повышает вероятность заболевания туберкулезом.
Насколько распространен туберкулез в Ирландии?
В 1952 году в Ирландии было зарегистрировано почти 7000 случаев туберкулеза.Сочетание лучших условий жизни, антибиотиков против туберкулеза и вакцины БЦЖ резко снизило количество случаев туберкулеза в Ирландии. В 2019 году общее количество зарегистрированных случаев заболевания составило 272 человека. Подробные отчеты по эпидемиологии туберкулеза можно найти на веб-сайте Центра эпиднадзора за охраной здоровья.
Где широко распространен туберкулез?
ТБ найдено по всему миру. Известно, что в некоторые части мира с высоким уровнем заболеваемости туберкулезом входят страны Африки к югу от Сахары (все страны к югу от пустыни Сахара) и Азия.Если вы планируете посетить страну с высоким уровнем риска и работать или жить с местным населением более месяца, обычно рекомендуется вакцинация БЦЖ.
Заразен ли туберкулез?
Да. Туберкулез распространяется, когда человек с активной инфекцией туберкулеза в легких кашляет или чихает, а кто-то другой вдыхает каплю зараженной слюны. Однако туберкулез не так заразен, как простуда или грипп. Обычно вам нужно провести длительное время в тесном контакте с инфицированным человеком, прежде чем вы заразитесь туберкулезом.Например, инфекции обычно передаются между членами семьи, живущими в одном доме.
Полезные ссылки
Противотуберкулезная вакцина укрепляет иммунную систему — ScienceDaily
Противотуберкулезная вакцина, разработанная 100 лет назад, также делает вакцинированных людей менее восприимчивыми к другим инфекциям. Хотя этот эффект был признан давно, неизвестно, что его вызывает. Вместе с коллегами из Австралии и Дании исследователи из медицинского центра университета Радбауд, университетов Неймегена и Бонна представили возможный ответ на этот вопрос.Их результаты также интересны на фоне пандемии Covid-19: в настоящее время несколько исследований тестируют использование вакцины для предотвращения тяжелого прогрессирования заболевания среди групп риска, таких как персонал больниц и пожилые люди. Исследование опубликовано в журнале Cell Host & Microbe.
Вакцина БЦЖ (аббревиатура расшифровывается как Bacillus Calmette-Guérin) — единственная вакцина, обеспечивающая эффективную защиту от инфекций, вызываемых бактериями туберкулеза.С момента первого применения в медицине в 1921 году он использовался миллиарды раз. Обнаружился неожиданный побочный эффект: вакцинированные лица гораздо реже заболевали не только туберкулезом, но и другими инфекциями. Один из примеров — Гвинея-Бисау в Западной Африке: там смертность вакцинированных новорожденных была почти на 40 процентов ниже, чем смертность невакцинированных младенцев
Подобный эффект в настоящее время наблюдается и с другими вакцинами, почти исключительно с вакцинами на основе живых патогенов.Эксперты также говорят о «тренированном иммунитете»: способности врожденного иммунного ответа становиться более эффективным независимо от типа повторного заражения. Однако до сих пор в значительной степени неизвестно, почему этот тренировочный эффект может сохраняться в течение многих лет, даже спустя долгое время после того, как иммунные клетки, которые циркулировали в крови во время вакцинации, умерли. Подробные исследования по этой теме отсутствовали, особенно на людях; текущее исследование в определенной степени восполняет этот пробел: «Мы вакцинировали 15 добровольцев вакциной БЦЖ и ввели плацебо еще пяти людям для сравнения», — поясняет проф.Доктор Михай Нетеа из медицинского центра университета Радбауд в Неймегене, Нидерланды. «Три месяца спустя мы взяли у этих людей образцы крови и костного мозга».
Между двумя группами были обнаружены поразительные различия. Например, иммунные клетки в крови вакцинированных людей выпускают значительно больше воспалительных мессенджеров. Эти так называемые цитокины усиливают эффективность иммунной защиты; например, они обращаются за помощью к другим иммунным клеткам и направляют их к месту заражения.Более того, иммунные клетки вакцинированных лиц показали активность совершенно иных генов, чем в группе плацебо, особенно тех, которые необходимы для выработки цитокинов.
Более легкий доступ к генам для защиты от инфекций
В крови много разных типов иммунных клеток. Все они вырабатываются костным мозгом. Здесь растут так называемые гемопоэтические стволовые клетки, «матери» всех иммунных клеток. Вакцинация БЦЖ также вызывает долгосрочные изменения в их генетической программе.«Мы обнаружили, что после вакцинации определенный генетический материал становится более доступным, а это означает, что он может быть прочитан клетками чаще», — объясняет профессор д-р Андреас Шлитцер из института LIMES при Университете Бонна.
Образно говоря, каждая человеческая клетка содержит в своем ядре огромную библиотеку из десятков тысяч книг, генов. Когда клетка хочет произвести определенную молекулу, например цитокин, она ищет инструкции по сборке в соответствующей книге.Но не все книги можно так легко достать: некоторые обычно находятся под замком. Вакцинация БЦЖ делает некоторые из этих книг доступными, вероятно, на многие месяцы или годы. К ним относятся те, которые необходимы для увеличения выработки цитокинов. «Это объясняет, почему вакцинация приводит к усилению иммунного ответа в долгосрочной перспективе», — сказал Нетеа. «Это вполне может быть основой для длительного воздействия тренировочного эффекта».
Интересен и другой аспект: большинство выпущенных книг, т.е.е. гены, которые становятся более доступными после введения вакцины, дополнительно контролируются молекулой, называемой HNF. Этот «ядерный фактор печени» гарантирует, что иммунные клетки разумно используют свою недавно обретенную силу, а это означает, что они выделяют цитокины только тогда, когда действительно существует патоген, который необходимо атаковать. «Возможно, это открытие можно будет использовать в терапевтических целях для специфического воздействия на тренированный иммунитет», — объясняет исследователь LIMES профессор Шлитцер.
Результаты также представляют интерес на фоне нынешней пандемии Covid-19: исследователи надеются, что вакцинация БЦЖ может оказать положительное влияние на болезнь.Хотя обученная иммунная система, вероятно, не может предотвратить заражение вирусом, она может снизить риск тяжелого течения болезни. Это может принести пользу особенно уязвимым медицинским работникам. В настоящее время этот вопрос исследуют несколько крупномасштабных медицинских исследований, в том числе два в медицинском центре университета Радбауд в Неймегене и еще одно в Университете Мельбурна, который также является партнером текущего проекта.
Однако, пока не будут получены результаты, ВОЗ не рекомендует массовую вакцинацию вакциной БЦЖ, также для того, чтобы не поставить под угрозу поставки в туберкулезных регионах.От туберкулеза ежегодно умирает более миллиона человек, что ставит его на первое место в списке самых смертоносных инфекционных заболеваний в мире.
История Источник:
Материалы предоставлены Боннским университетом . Примечание. Содержимое можно редактировать по стилю и длине.
.
