Вариантная анатомия магистральных сосудов системы воротной вены и ее прикладное значение Текст научной статьи по специальности «Клиническая медицина»
УДК 611.149 DOI: 10.21626/vestnik/2018-2/11
ВАРИАНТНАЯ АНАТОМИЯ МАГИСТРАЛЬНЫХ СОСУДОВ СИСТЕМЫ ВОРОТНОЙ ВЕНЫ
И ЕЕ ПРИКЛАДНОЕ ЗНАЧЕНИЕ
© Гайворонский И.В.12, Котив Б.Н.2, Коваленко Н.А.2, Лазаренко В.А.3
1 Кафедра морфологии Санкт-Петербургского государственного университета, Санкт-Петербург; 2 Кафедра нормальной анатомии Военно-медицинской академии имени С.М. Кирова, Санкт-Петербург; 3 Кафедра хирургических болезней ФПО Курского государственного
медицинского университета, Курск
E-mail: [email protected]
Изменения уровня и варианта формирования воротной вены могут вызвать затруднения во время диагностических и хирургических процедур. Изучены и проанализированы поствитальный материал взрослых людей и архивные данные МСКТА живота для определения вариантной анатомии корней и притоков воротной вены, ее морфометриче-ских характеристик, уровня, формирования, прикладного значения в хирургии. Воротная вена преимущественно формировалась на уровне L2 позвонка. В 72,3% случаев нижняя брыжеечная сливалась с селезеночной веной. Вариант впадения нижней брыжеечной вены в верхнюю брыжеечную вену был обнаружен в 22,3% случаев. Конфлюенс трех вен — в 4,7% случаев. Также встретился 1 случай формирования воротной вены за счет верхней брыжеечной, нижней брыжеечной, селезеночной и левой ободочной вен (0,7%). Полученные результаты могут использоваться для выявления и интерпретации топографо-анатомических вариаций на дооперационном этапе и имеют важное прикладное значение в хирургии верхнего этажа полости брюшины.
Ключевые слова: воротная вена, портальная система, брыжеечные вены, хирургическая анатомия сосудов, селезеночная вена, конфлюенс воротной вены, атипичные варианты.
VARIANT ANATOMY OF MAIN VESSELS OF THE PORTAL SYSTEM AND ITS PRACTICAL IMPLICATION
Gajvoronsky I. V.1’2, Kotiv B.N.2, Kovalenko N.A.2, Lazarenko V.A.3
1 Department of Morphology of St. Petersburg State University, St. Petersburg;
2 Department of General Anatomy of S.M. Kirov Military Medical Academy, St. Petersburg;
3 Department of Surgical Diseases of FPE of Kursk State Medical University, Kursk
Changes in the level and variant of portal vein formation can cause difficulties during diagnostic and surgical procedures. The cadaveric material of adults and archival data of the multidetector row spiral CT of the abdomen were studied and analyzed to determine the variant anatomy of the roots and inflows of the portal vein, its morphometric characteristics, level, formation and its application value in surgery. The portal vein was predominantly formed at the level of the L2 vertebra. In 72.3% of cases the inferior mesenteric merged with the splenic vein. The incidence of confluence of inferior mesenteric vein with superior mesenteric vein was found in 22.3% of cases. Confluence of three veins was revealed in 4.7% of cases. Also there was 1 case of forming the portal vein due to the superior mesenteric, inferior mesenteric, splenic and left colic veins (0.7%). The obtained results can be used for revealing and interpreting topographic and anatomical variations at the preoperative stage and are of great practical importance in the surgery of the upper floor of the peritoneal cavity.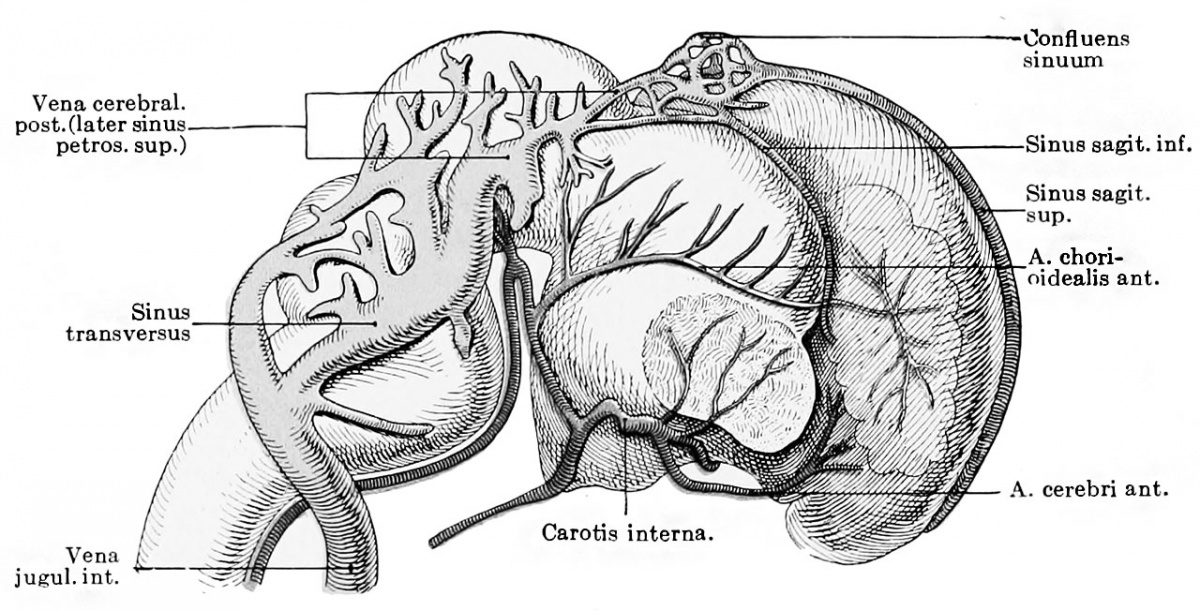
Keywords: portal vein, portal system, mesenteric veins, surgical vascular anatomy, splenic vein, confluence of portal vein, atypical patterns.
Глубокое понимание вариантов формирования воротной вены, знание архитектоники ее корней и притоков может иметь первостепенную роль для хирургов, выполняющих операции на поджелудочной железе, желудке, двенадцатиперстной кишке и печени. Их необходимо учитывать при создании портокавального анастомоза, чрескожных гепатобилиарных вмешательствах и сложных хирургических резекциях, в бариатриче-ской хирургии, а также при выполнении интервенционных радиологических манипуляций и интерпретации полученных изображений, что подчеркивает важность обширных анатомических знаний на дооперационном этапе [3, 18].
Сложные процедуры в абдоминальной хирур-
гии могут быть хорошо спланированы до фактической операции с помощью прекурсорной визуализации. В последние годы развитие многофазной спиральной компьютерно-томографической ангиографии (МСКТА) привело к значительному продвижению в клинической диагностике, а также к использованию в хирургическом и интервенционном лечении абдоминальных заболеваний. Венозные вариации и аномалии обычно обнаруживаются при рутинных исследованиях с использованием неинвазивных методов визуализации. Благодаря совершенствованию МСКТА, а также разработкам в области компьютерных технологий стало возможным создание трехмерных визуализаций с использованием проекции макси-
мальной интенсивности (М1Р), мультипланарной реконструкции (MPR) и объемного рендеринга (УК), позволяющих детально отображать венозные структуры [15].
Классически воротная вена формируется в результате слияния верхней брыжеечной вены (ВБВ), спутника одноименной артерии с вертикальным восходящим направлением, с общим венозным стволом горизонтального направления, образованным соединением селезеночной вены (СВ) с нижней брыжеечной веной (НБВ) [24].
Воротная вена начинается на уровне верхней границы L2 позвонка, иногда на уровне тела L1 позвонка, парамедиально справа от позвоночного столба, кпереди от нижней полой вены и проходит вверх и немного вправо позади шейки поджелудочной железы и верхней части двенадцатиперстной кишки. Ее длина составляет 6-8 см, а диаметр 1-2 см. Притоками ВВ являются левая желудочная, правая желудочная, околопупочная, предпривратниковая и пузырная вены. Она принимает кровь от поддиафрагмальной части пищевода, желудка, поджелудочной железы, селезенки, тонкой и толстой кишки, за исключением нижней части прямой кишки [2, 3, 4].
Атипичные варианты архитектоники ВВ встречаются у 20-35% людей [12]. Большинство этих вариантов формирования ВВ связано с различным впадением НБВ. Классически НБВ впадает в СВ, но также она может впадать в ВБВ, либо в конфлюенс ВВ [23, 24]. Пренебрежение знаниями об этих вариантах может привести к серьезным осложнениям, тогда как их предвидение способствует пониманию периоперационных осложнений, которые могут повлиять на результат лечения пациента.
Учитывая вышеописанные фундаментальное, хирургическое и радиологическое значения вариантной анатомии ВВ возникла необходимость в углубленном изучении ее морфологических и то-пографо-анатомических особенностей.
Целью настоящего исследования явилось изучение вариантов формирования воротной вены и морфометрических характеристик ее корней и ствола.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проведено на 48 небальзамиро-ванных органокомплексах трупов взрослых людей с известным полом (31 мужчина и 17 женщин) с помощью препарирования, морфометрии и рентгенографии.
Предварительно на органокомплексах брюшной полости проводили инъекцию системы воротной вены затвердевающей двухкомпонентной
силиконовой композицией, окрашенной в синий цвет, в объеме 150 мл.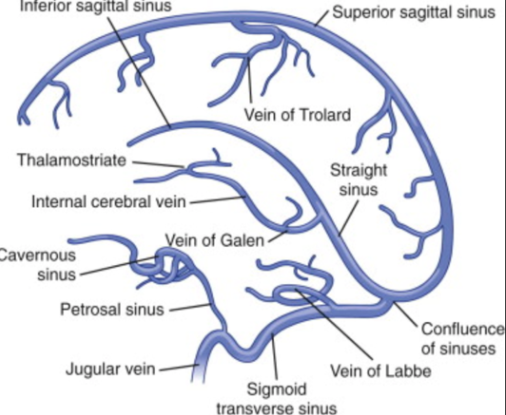 С этой целью выделяли воротную вену, в просвет сосуда ретроградно устанавливали канюлю, вводили раствор для промывания (NaCl 0,9% — 250 мл, гепарин 5000 ЕД/мл 5 мл). На 22 органокомплексах в такую же композицию добавляли рентгенокон-трастное вещество (порошкообразный свинцовый сурик). Рентгеновские снимки выполнялись на портативном микрофокусном рентгеновском аппарате «ПАРДУС-У».
С этой целью выделяли воротную вену, в просвет сосуда ретроградно устанавливали канюлю, вводили раствор для промывания (NaCl 0,9% — 250 мл, гепарин 5000 ЕД/мл 5 мл). На 22 органокомплексах в такую же композицию добавляли рентгенокон-трастное вещество (порошкообразный свинцовый сурик). Рентгеновские снимки выполнялись на портативном микрофокусном рентгеновском аппарате «ПАРДУС-У».
Длину ВВ измеряли с помощью специального штангенциркуля в следующих точках: проксимально — угол, образованный на стыке корней ВВ; дистально — угол, сформированный делением ВВ в воротах печени, а диаметр ВВ — в середине между проксимальной и дистальной точками.
Исследования на поствитальном материале были проведены на учебной базе кафедры нормальной анатомии, ретроспективный анализ за последние 5 лет архивных данных диагностических МСКТА брюшной полости — на кафедре рентгенологии и радиологии (с курсом ультразвуковой диагностики) Военно-медицинской академии им. С.М. Кирова.
Было зарегистрировано 100 исследований пациентов с известным полом в возрасте от 35 до 88 лет. Критерии включения были следующими: качество изображений органов и структур брюшной полости было диагностическим; отсутствие внутри- или внепеченочных поражений, влияющих на визуализацию анатомии ВВ. Исключались исследования пациентов, перенесших процедуру Уиппла, панкреатэктомию, колэктомию, обширную резекцию кишки, спленэктомию или иные операции и патологии, которые нарушали венозный отток.
МСКТА были выполнены на 16-срезовом компьютерном томографе КТ (Aquilion 16, Toshiba, Япония) в портальной венозной фазе через 90 секунд после инъекции 80-120 мл контрастного вещества Ультравист (Ultravist, Bayer Schering Pharma, Германия). Для сканирования использовался следующий протокол: напряжение на трубке было 120 кВ, ток трубки приемника составлял 300 мА. Анализ МСКТА-изображений мезенте-рико-портальной зоны проводили в осевых, коро-нальных, аксиальных, а также трехмерных реконструкциях с использованием постобработки на рабочей станции Radiant (Medixant, Польша).
Анализ МСКТА-изображений мезенте-рико-портальной зоны проводили в осевых, коро-нальных, аксиальных, а также трехмерных реконструкциях с использованием постобработки на рабочей станции Radiant (Medixant, Польша).
При этом оценивали варианты формирования ствола ВВ, его длину и диаметр на уровне середины длины, вариант угла с сагиттальной плоскостью, а также уровень формирования по отношению к поджелудочной железе.
Статистическая обработка цифровых данных производилась с помощью прикладной програм-
мы Microsoft Excel 15.0. Определяли средние значения и средние квадратичные отклонения.
На выполнение исследования получено разрешение независимого этического комитета ФБГВОУ ВО «Военно-медицинская академия имени С.М. Кирова» МО РФ № 199 от 19.12.2017 г.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Выделено 4 варианта формирования ствола ВВ: 1 — слияние ВБВ с общим стволом СВ и НБВ; 2 — слияние СВ с общим стволом ВБВ и НБВ;
3 — слияние ВБВ, СВ и НБВ; 4 — слияние ВБВ, СВ, НБВ и левой ободочной вены (рис. 1). Эти варианты встретились в 72,3%, 22,3%, 4,7%, 0,7% наблюдений соответственно.
Морфометрические характеристики ствола и основных корней ВВ представлены в таблице 1.
Большая часть ствола воротной вены располагалась в составе печеночно-двенадцатиперстной связки позади общего желчного протока, меньший сегмент воротной вены — позади головки поджелудочной железы. В 72,3% наблюдениях конфлюенс находился позади перешейка поджелудочной железы. В 18,9% наблюдениях имело место слияния корней ВВ на уровне верхнего
Рис. 1. Варианты формирования воротной вены по данным трехмерных реконструкций МСКТА: а — слияние ВБВ с общим стволом СВ и НБВ; б — слияние СВ с общим стволом ВБВ и НБВ; в — конфлюенс ВБВ, СВ и НБВ; 4 — слияние ВБВ, СВ, НБВ и левой ободочной вены.
1. Варианты формирования воротной вены по данным трехмерных реконструкций МСКТА: а — слияние ВБВ с общим стволом СВ и НБВ; б — слияние СВ с общим стволом ВБВ и НБВ; в — конфлюенс ВБВ, СВ и НБВ; 4 — слияние ВБВ, СВ, НБВ и левой ободочной вены.
Таблица 1
Морфометрические показатели ствола воротной вены и его корней
Исследуемый сосуд D, мм L, мм Cv
min max M±m min max M±m D L
Ствол ВВ 8 20 12,5±2,4 34,1 84 64,7±11,1 0,13 0,18
СВ 4,4 12 8,3±1,7 78,6 187 117,5±21,4 0,22 0,11
ВБВ 6,4 14,5 9,4±1,7 77,4 136,7 107,4±12,3 0,18 0,11
НБВ 2 8,2 5,4±1,1 97,7 168,7 139,4±19,2 0,21 0,14
края поджелудочной железы и в 8,8% — на уровне нижнего края поджелудочной железы. Во всех наблюдениях конфлюенс воротной вены, образованный слиянием ее корней, располагался в борозде на задней поверхности головки поджелудочной железы и с трех сторон был окружен ее тканью. Глубина борозды достигала 3-4 мм.
Классическое формирование ВВ на уровне нижнего края L1 наблюдалось в 68% наблюдений. В 20% ВВ формировалась на уровне L2, в 10% на уровне межпозвоночного диска между L1 -L2 и в 2% на уровне T12 позвонка.
Также оценивался угол, образованный осью ствола ВВ и срединной сагиттальной плоскостью. В 58% наблюдений этот угол составлял 31-60° с сагиттальной плоскостью, в 2% — 10-30°, то есть ствол ВВ располагался почти вертикально, и в 40% — 61-90°, то есть ствол ВВ располагался почти горизонтально.
Нами были четко визуализированы следующие притоки ВВ: пузырная, верхняя задняя под-желудочно-двенадцатиперстная, левая желудочная, правая желудочная, предпривратниковая и околопупочные вены.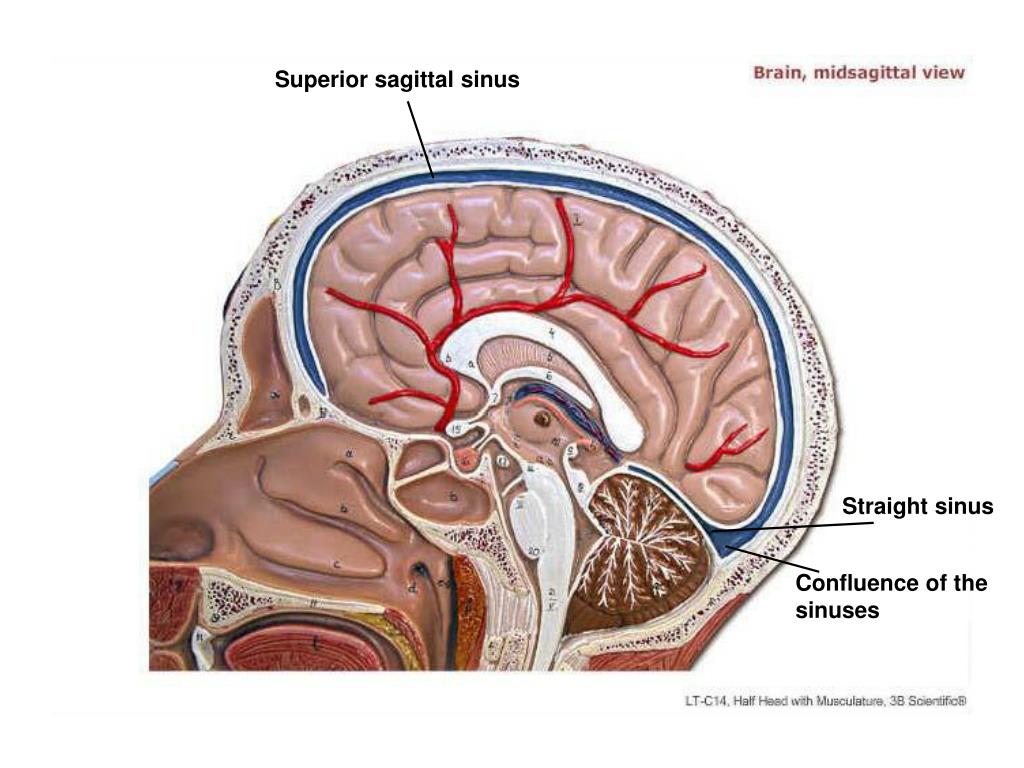 Следует отметить, что притоки ВВ обладают выраженной вариабельностью мест и уровня впадения в ствол ВВ. Учитывая, что данный вопрос заслуживает отдельного глубокого изучения, мы специально не останавливались на оценке их форм и архитектоники в этой статье.
Следует отметить, что притоки ВВ обладают выраженной вариабельностью мест и уровня впадения в ствол ВВ. Учитывая, что данный вопрос заслуживает отдельного глубокого изучения, мы специально не останавливались на оценке их форм и архитектоники в этой статье.
Результаты нашего исследования показали, что формирование ВВ преимущественно происходит на уровне позвонка L1, в отличии от результатов других авторов. В работах H. Kaur et al. [14] и А.А. Шалимова [7] ВВ преимущественно начиналась на уровне позвонка L2. Это
Морфометрические показатели ствола вор
может быть обусловлено использованием прижизненного метода визуализации, а также большей выборкой в нашей работе.
Информация о морфометрических характеристиках ствола ВВ и его корней также сильно различается. В таблице 2 представлены данные D. Sztika et al. [24], H. Kaur et al. [14], N.A. Michels [18], P. Krumm et al. [16], выполненные на большом по обьему материале.
Сравнительный анализ данных литературы и результатов собственного исследования, представленных в таблице 1, свидетельствует о существенных различиях как длины ствола, так и диаметра ВВ и ее корней. Это обусловлено широким диапазоном вариантной анатомии исследуемых сосудов.
Также D. Sztika et al. [24] изучали возможные варианты значений угла, образованного ВВ с вертикальной плоскостью, и выделили три варианта: наклоненный, ВВ образует угол 45° с вертикалью; вертикальный, ВВ образует угол 10-30°, и горизонтальный, ВВ образует угол 75-80°. Преимущественно встречались наклоненный и горизонтальный варианты, что не противоречит результатам в нашей работе.
В таблице 3 продемонстрированы возможные варианты формирования ствола ВВ, по результатам исследований зарубежных авторов, полученных как на поствитальном материале, так и прижизненно. Вариант конфлюенса ВВ, сформированного слиянием трех корней, в литературе встречается чаще, чем в нашем исследовании, что может быть связано с меньшей выборкой у других авторов.
Вариант конфлюенса ВВ, сформированного слиянием трех корней, в литературе встречается чаще, чем в нашем исследовании, что может быть связано с меньшей выборкой у других авторов.
Таблица 2
й вены и его корней по данным литературы
ВВ С В ВБВ НБВ
L, мм D, мм L, мм D, мм D, мм D, мм
Sztika D. et al. 65 22 119 7,4
Kaur H. et al. 62,9 (38-80) 16,8 (8-18)
Michels N.A. 80-100 8-14
Krumm P. et al. 14,8 10,2 12 5
Таблица 3
Варианты формирования ствола воротной вены по данным зарубежных авторов
ВБВ+ (СВ+НБВ) СВ+ (НБВ+ВБВ) СВ+НБВ+ВБВ Другие
Kaur H. et al. 90% 10%
Munguti J. et al. 35,7% 38,1% 26,2%
Papadopoulos N.J. 24%
Purcell H.K. et al. 28% 53% 3% 16 %
Raut R. et al. 30% 22,5% 32,5% 15%
Krumm P. et al. 37,6% 19,2% 28,8% 14,4%
Следует отметить, что в исследовании, проведенном P. Papavasiliou et al. [21], в 5,3% случаев отсутствовал ствол ВБВ. А.Е. Леонович [6] описал случай, когда расширенные СВ и ВБВ сливались в достаточно широкий, но короткий общий ствол, который впадал в нижнюю полую вену, формируя врожденный портокавальный шунт.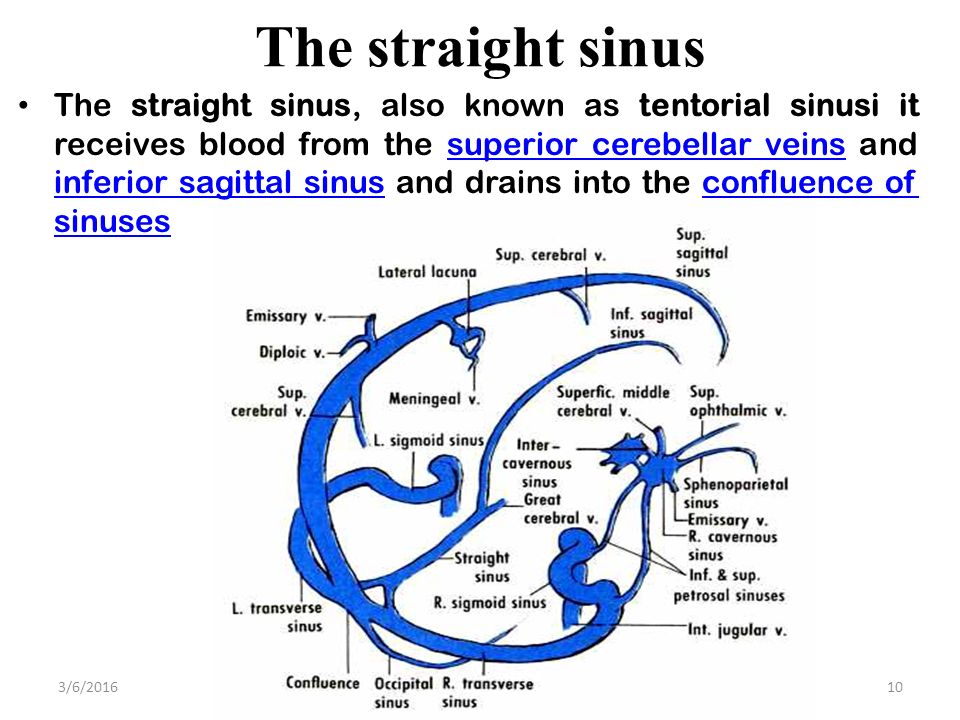 J.S. Zhang et al. [25] описали удвоение ВВ, а также вариант предуоденальной ВВ. Авторы указывают, что данный вариант может приводить к кишечной непроходимости, в результате внешнего сдавле-ния двенадцатиперстной кишки [11]. Существуют и другие атипичные варианты формирования ВВ, обычно существующие бессимптомно, но требующие точной дооперационной диагностики для предупреждения ятрогенных ошибок [10, 13, 16, 18]. Важно подчеркнуть, что в основе большинства вариаций лежат генетические, метаболические и гемодинамические факторы эмбриогенеза [12, 10].
J.S. Zhang et al. [25] описали удвоение ВВ, а также вариант предуоденальной ВВ. Авторы указывают, что данный вариант может приводить к кишечной непроходимости, в результате внешнего сдавле-ния двенадцатиперстной кишки [11]. Существуют и другие атипичные варианты формирования ВВ, обычно существующие бессимптомно, но требующие точной дооперационной диагностики для предупреждения ятрогенных ошибок [10, 13, 16, 18]. Важно подчеркнуть, что в основе большинства вариаций лежат генетические, метаболические и гемодинамические факторы эмбриогенеза [12, 10].
Прикладное клиническое значение вариантной анатомии ВВ включает в себя возможность предоперационного определения архитектоники, топографо-анатомических и морфометрических характеристик, выполнения технически сложных реконструктивных операций, а также выбор потенциальных доноров при трансплантации печени, что позволяет минимизировать вероятность послеоперационных осложнений. В случае атипичного конфлюенса ВВ может быть затруднено выполнение запланированной операции портока-вального или спленоренального шунтирования, а также потребуется использование одного из его корней или притоков — НБВ или левой желудоч-но-сальниковой вены вместо СВ [13].
Врастание опухоли в ВВ и (или) ВБВ перестало быть непреодолимым препятствием для операции с момента появления в хирургической практике метода резекции en bloc, а результаты такого рода вмешательств оказались не хуже стандартных [1, 2]. Резекция одного из этих сосудов является достаточно рутинной, однако поражение зоны конфлюенса вызывает ряд проблем, таких как препятствие для мобилизации опухоли и забрюшинной мягкотканной диссекции. Прямая реконструкция ВВ и ВБВ с перевязкой СВ обычно приводит к развитию левосторонней сегментарной портальной гипертензии с угрозой желудочного кровотечения, при этом сохранение кровотока по селезеночной вене является технически сложным, чревато ее тромбозом и содержит ряд других нерешенных проблем [13].
Послеоперационные осложнения со стороны мезентерико-портальной системы, в частности, острый обширный тромбоз ВВ или ВБВ, могут приводить к системной гипотензии, ишемии кишечника, некрозу и даже к летальному исходу [17]. Однако современные литературные данные о травмах внутренних органов свидетель-
ствуют о том, что лигирование ВБВ, даже в остром состоянии, иногда может быть выполнено без катастрофических результатов [8]. Предоперационное неинвазивное выявление вариантной анатомии ВВ с помощью МСКТА позволяет спланировать оптимальную хирургическую тактику и минимизировать послеоперационные осложнения.
Таким образом, на основании проведенных исследований можно сделать следующие выводы:
1. Самыми распространенными вариантами формирования ствола ВВ являются слияние ВБВ и селезеночно-брыжеечного ствола (72,3%) и образование ствола ВВ путем слияния СВ со стволом ВБВ и НБВ (22,3%). Проведенное исследование свидетельствует о высокой частоте атипичных вариантов формирования ВВ, отличных от классического, что следует учитывать при планировании оперативных вмешательств.
2. Количественные значения длины и диаметра ствола ВВ и ее корней согласно коэффициенту вариации, составляющего менее 33% для всех групп, однородны, что говорит о близости нахождения их к среднему значению. Однако несмотря на уровень однородности, для большинства показателей степень рассеивания данных средняя, а для показателей диаметра СВ (22%) и НБВ (21%) — значительная, т.е. морфометрические характеристики корней и ствола ВВ обладают широким диапазоном вариантной анатомии.
ЛИТЕРАТУРА / REFERENCES
1. Гайворонский И.В., Лазаренко В.А., Суров Д. А., Ничипорук Г.И., Сотников А.С. Экспериментальное обоснование расширенной гастропанкреато-дуоденальной резекции с одновременной коррекцией портального кровотока // Курский научно-практический вестник человек и его здоровье. -2011. — Т. 4. — С. 16-23. [Gaivoronskiy I.V., Lazaren-ko V.A., Surov D.A., Nichiporuk G.I., Sotnikov A.S. Experimental substantiation of gastropancreatoduode-nal excision with simultaneous correction of portal blood flow. Kursk Scientific and Practical Bulletin «Man and His Health». 2011; 4: 16-23 (in Russ.)].
А., Ничипорук Г.И., Сотников А.С. Экспериментальное обоснование расширенной гастропанкреато-дуоденальной резекции с одновременной коррекцией портального кровотока // Курский научно-практический вестник человек и его здоровье. -2011. — Т. 4. — С. 16-23. [Gaivoronskiy I.V., Lazaren-ko V.A., Surov D.A., Nichiporuk G.I., Sotnikov A.S. Experimental substantiation of gastropancreatoduode-nal excision with simultaneous correction of portal blood flow. Kursk Scientific and Practical Bulletin «Man and His Health». 2011; 4: 16-23 (in Russ.)].
2. Гайворонский И.В., Лазаренко В.А., Сотников А.С., Ничипорук Г.И., Суров Д.А. Воротная вена: клиническая анатомия, острая окклюзия и способы хирургической коррекции портального кровотока / под ред. И.В. Гайворонского, В.А. Лазаренко, А.С. Сотникова, Г.И. Ничипорука, Д.А. Сурова -Белгород : Белгор. обл. тип., 2014. — 204 с. [Gayvoronskiy I.V., Lazarenko V.A., Sotnikov A.S., Nichiporuk G.I., Surov D.A. Gate vein: clinical anatomy, acute occlusion and methods of surgical correction of portal blood flow. I.V. Gayvoronskiy, V.A. Lazarenko, A.S. Sotnikov, G.I. Nichiporuk, D.A. Surov, editors — Belgorod : Belgor. obl. tip.; 2014: 204 (in Russ.)].
3. Коваленко Н.А., Гайворонский И.В., Котив Б.Н., Баховадинова Ш.Б., Кантемиров В.В., Новицкая Н.Ю. Клиническое значение вариантной ана-
томии левой желудочной вены // MEDLINE.RU. Российский биомедицинский журнал. — 2018. -Т. 19. — C. 103-116. [Kovalenko N.A., Gaivor-onskiy I.V., Kotiv B.N., Bahovadinova Sh.B., Kantemi-rov V.V., Novickaja NJu. Clinical significance of variant anatomy of the left gastric vein. MEDLINE.RU. Rossiyskiy biomeditsinskiy zhurnal. 2018; 19: 103-116 (in Russ.)].
4. Коваленко Н.А., Гайворонский И.В., Котив Б.Н., Тягун В.С., Новицкая Н.Ю. Вариантная анатомия воротной вены и ее прикладное значение в хирургии // MEDLINE. RU. Российский биомедицинский журнал. — 2018. — Т. 19. — C. 182-208. [Kovalenko N.A., Gaivoronskiy I.V., Kotiv B.N., Tyagun V.S., Novickaja NJu. Variant anatomy of portal vein and its practical implication. MEDLINE.RU. Rossiyskiy biomeditsinskiy zhurnal. 2018; 19: 182-208 (in Russ.)].
RU. Российский биомедицинский журнал. — 2018. — Т. 19. — C. 182-208. [Kovalenko N.A., Gaivoronskiy I.V., Kotiv B.N., Tyagun V.S., Novickaja NJu. Variant anatomy of portal vein and its practical implication. MEDLINE.RU. Rossiyskiy biomeditsinskiy zhurnal. 2018; 19: 182-208 (in Russ.)].
5. Колсанов А.В., Манукян А.А., Зельтер П.М., Чаплыгин С.С., Звонарева З.Н. Вариантная анатомия воротной вены по данным компьютерной томографии // Журнал анатомии и гистопатологии. -2017. — Т. 6, № 4. — С. 31-36. [KolsanovA.V., Manu-kyan A.A., Zel’ter P.M., Chaplygin S.S., Zvonare-va Z.N. Variant anatomy of the portal vein according to computed tomography. Zhurnal anatomii i gistopatologii. 2017; 6(4): 31-36 (in Russ.)].
6. Леонович А.Е., Соколина И.А., Лемешко З.А., Ма-евская М.В. Редкое наблюдение: врожденная аномалия развития воротной вены, сочетающаяся с аберрантными сосудами левой почки и дефектом межжелудочковой перегородки // Медицинская визуализация. — 2005. — № 6. — С. 68-70. [Leonovich A.E., Sokolina I.A., Lemeshko Z.A., MaevskayaM.V. Rare Case Report: Congenital Portal Vein Anomaly Combined with Left Kidney Aberrant Vessels and Ventricular Septal Defect. Meditsinskaya vizualizatsiya. 2005; (6): 68-70 (in Russ.)].
7. Шалимов А.А., Калита Н.Я., Котенко О.Г. Портальная гемодинамика у больных с варикозным расширением вен пищевода и желудка при циррозе печени // Журн. АМН Украни. — 1999. — Т. 5, № 2. — С. 263-273. [Shalimov A.A., Kalita N.Ya., Ko-tenko O.G. Portal hemodynamics in patients with varicose veins of the esophagus and stomach with cirrhosis. Zhurnal AMN Ukraini. 1999; 5(2): 263-273 (in Russ.)].
8. Alexander W.F., Purcell H.K. Variations in the portal system of veins // Anat. Rec. — 1952. — Vol. 109. -P. 261-262.
9. Chevrel J.P. Anatomie clinique: le tronc. — Paris : Springer Verlag, 1995. — 622 p.
Chevrel J.P. Anatomie clinique: le tronc. — Paris : Springer Verlag, 1995. — 622 p.
10. Chitra P.S., Maheshwari K., Anandhi V. Prepancreatic formation of portal vein associated with prepancreatic superior mesenteric artery and splenic vein // International Journal of Anatomical Variations. — 2014. -Vol. 7. — P. 35-36.
11. Choi S.O., Park W.H. Preduodenal portal vein: a cause of prenatally diagnosed duodenal obstruction // J. Pe-diatr. Surg. — 1995. — Vol. 30, N 10. — P. 1521-1522. -DOI: 10.1016/0022-3468(95)90430-1.
12. Covey A.M., Brody L.A., Getrajdman G.I., Sofocleous C.T., Brown K.T. Incidence, patterns, and clinical relevance of variant portal vein anatomy //
AJR Am. J. Roentgenol. — 2004. — Vol. 183, N 4. -P. 1055-1064. — DOI: 10.2214/ajr.183.4.1831055.
13. Evans D.B., Lee J.E., Leach S.D., Fuhrman G.M., Cu-sack J.C.Jr., Rich T.A. Vascular resection and intraoperative radiation therapy during pancreaticoduodenectomy: rationale and technique // Adv. Surg. -1996. — Vol. 29. — P. 235-262.
14. Kaur H., Singh M., Bajaj A.S. A cadaveric study of morphology of portal vein with its clinical importance // Med J DY Patil Univ. — 2016. — Vol. 9, N 3. — P. 336-340. — DOI: 10.4103/09752870.182504.
15. Kog Z., Oguzkurt L., Ulusan S. Portal vein variations: clinical implications and frequencies in routine abdominal multidetector CT // Diagn. Intervent. Radiol. — 2007. — Vol. 13, N 2. — P. 75-80.
16. Krumm P., Schraml C., Bretschneider C., Seeger A., Klumpp B., Kramer U., Claussen C.D., Miller S. Depiction of variants of the portal confluence venous system using multidetector row CT: analysis of 916 cases // Rofo.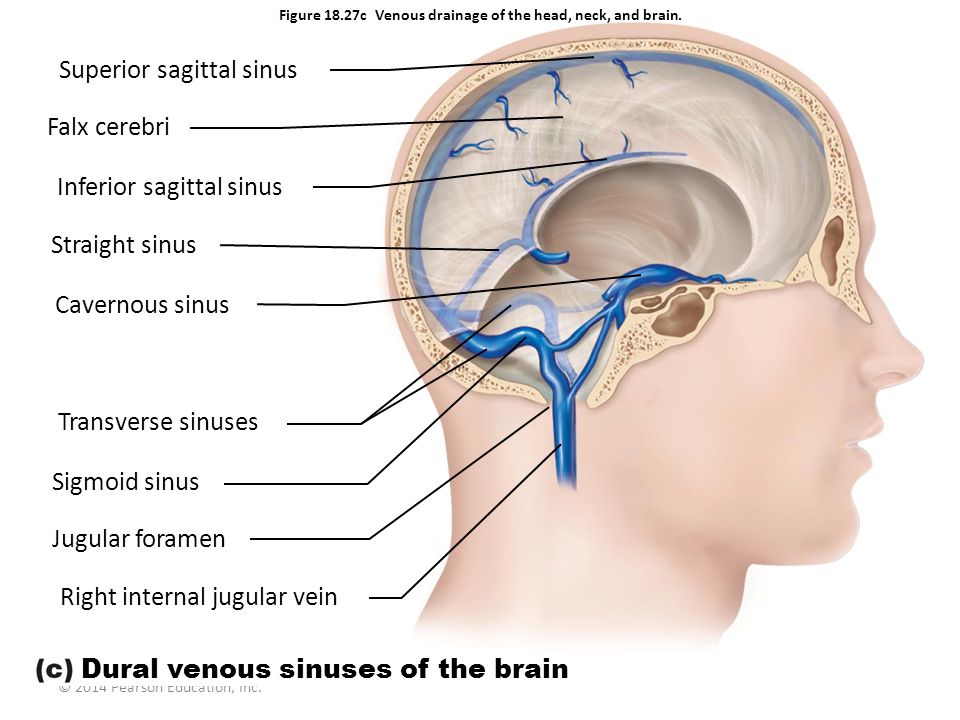 — 2011. — Vol. 183, N 12. — P. 11231129. — DOI: 10.1055/s-0031-1281745.
— 2011. — Vol. 183, N 12. — P. 11231129. — DOI: 10.1055/s-0031-1281745.
17. Kumar S., Sarr M.G., Kamath P.S. Mesenteric venous thrombosis // N. Engl. J. Med. — 2001. -Vol. 345, N 23. — P. 1683-1688. -DOI: 10.1056/NEJMra010076.
18. Michels N.A. Blood supply and anatomy of the upper abdominal organs. In: Observations on blood supply of the liver and the gall bladder. — England : Pitman Medical Publishing Company Limited, 1955. -P. 150-152.
19. Munguti J., Sammy M., Cheruiyot I., Kariuki B., Olabu B. Pattern and position of portal vein formation in a kenyan population // MOJ Anat. & Physiol. -2017. — Vol. 3, N 3. — ID 00093. -DOI: 10.15406/mojap.2017.03.00093.
20. Papadopoulos N.J. Stereotactic patterns of the extra-hepatic portal venous system // Anat. Clin. — 1981. -Vol. 3. — P. 143-148.
21. Papavasiliou P., Arrangoiz R., Zhu F., Chun Y.S., Edwards K., Hoffman J.P. The anatomic course of the first jejunal branch of the superior mesenteric vein in relation to the superior mesenteric artery // Int. J. Surg. Oncol. — 2012. — Vol. 2012. — ID 538769. -DOI: 10.1155/2012/538769.
22. Purcell H.K., Connor J.J., Alexander W.F., Scully N.M. Observations on the major radicles of the ex-trahepatic portal systems // AMA Arch. Surg. -1951. — Vol. 62, N 5. — P. 670-677.
23. Raut R., Bahetee B. Study of variations in the formation of portal vein // Sch. J. App. Med. Sci. -2015. — Vol. 3. — P. 1370-1375.
24. Sztika D., Zahoi D.E., Motoc A., Farca Ureche M., Daescu E. Anatomical variations of the hepatic portal vein associated with incomplete celiac trunk // Rom.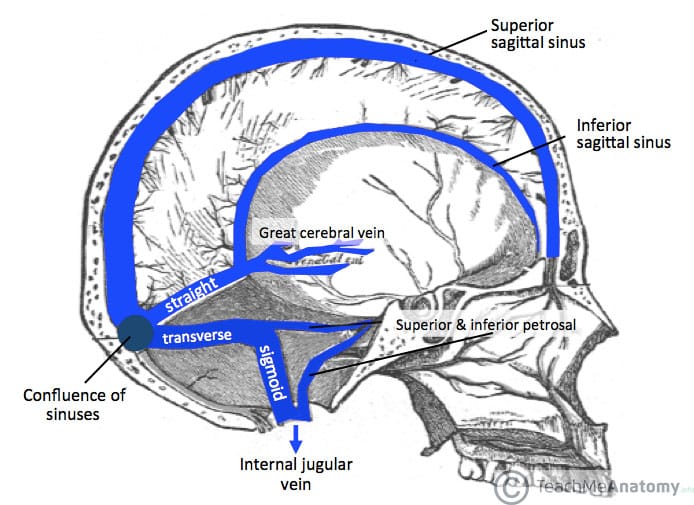 J. Morphol. Embryol. — 2011. — Vol. 52, N 2. -P. 695-698.
J. Morphol. Embryol. — 2011. — Vol. 52, N 2. -P. 695-698.
25. Zhang J.S., Wang Y.P., Wang M.Q., Yang L., Xing C.C., Yu M., Cui Z. Diagnosis of an accessory portal vein and its clinical implications for portosystemic shunts // Cardiovasc. Intervent. Radiol. -1996. — Vol. 19, N 4. — P. 239-241.
Дренаж венозных синусов (королевская техника остеопатии)
Техника дренажа венозных синусов направлена на улучшение оттока венозной крови от головного мозга.
Применение методики показано при следующих состояниях, связанных с нарушением КСР или мембранозными нарушениями ТМО
- Внутричерепная гипертензия, связанная с нарушением венозного оттока
- Цефалгии, связанные с нарушениями венозного оттока
- Мигренеподобные пароксизмы
- Гипертензионно-гидроцефальный синдром
- Вегетативно-сосудистые дистонии по гипертоническому типу
- Патологии ЛОР-сферы
- Патологии области орбиты
- Синдром хронической усталости
- ДЦП
- Задержка психомоторного развития
- Последствия перенесенных интоксикаций и длительных заболеваний
- Энцефалопатии различного генеза
- Часто болеющие дети
- СДВГ
- Астения в любом возрасте
- Депрессивные состояния у взрослых
- Последствия черепно-мозговой травмы
- и др.
Внимание. Перед проведением техники венозных синусов необходимо освободить пути оттока венозной крови от головы:
1. Подзатылочный регион С0-С1-С2
2. Верхняя апертура грудной клетки
3. Грудо-брюшная диафрагма
Этапы выполнения техники дренажа венозных синусов
Этап 1. Слияние синусов (confluence)
- 3 пальцы рук устанавливаются рядом друг с другом в точке инион (самая выступающая точка затылочной кости). Остальные пальцы мягко поддерживают череп не создавая воздействия.
- Направление воздействия 3 пальцев рук производится по направлению к центру головы с мягким латеральным компонентом.

- Удерживая положение пальцев дожидаемся размягчения черепа
Этап 2. Затылочный синус
- Сохраняя такое же положение пальцев рук, перемещать их по направлению к БЗО на расстояние одного пальца.
- Дожидается размягчения черепа в области затылочного синуса
- Перемещая пальцы по направлению к БЗО повторяем технику
Этап 3. Декомпрессия мыщелков затылочной кости
- Установите пальцы в подзатылочную область в проекцию мыщелков затылочной кости
- За счет сведения локтей, разведите пальцы, оказывая латеральную тракцию на мыщелки затылочной кости
- Дождитесь расслабления тканей
Этап 4. Поперечный синус
- Установите 5 пальцы на инион, а остальные пальцы вдоль верхней выйной линии к нижним наружным углам теменных костей.
- Дождитесь расслабления тканей
Этап 5. Прямой синус
- Согните голову – локти оператора находятся на столе. Установите 5 пальцы на инион
- Разместите 1 пальцы друг на друге и установите их на вертекс.
- Создайте легкую компрессию между 1 и 5 пальцами (в проекции прямого синуса). Может возникать ощущение “сжатой пружины”.
- Дожидайтесь “разжатия пружины” или размягчения в проекции прямого синуса
Этап 6. Верхний сагиттальный синус
- Начиная с инион, расположите 1 пальцы рук один впереди другого, контактируя с сагиттальным швом
- Создавайте давление 1 пальцев рук на разъединение сагиттального шва
- Дожидайтесь расслабления тканей в каждой точке.
- Переместите нижний палец вперед верхнего вдоль сагиттального шва.
Этап 7. Метопический шов
- Разместите перекрещенные пальцы рук в проекции метопического шва лобной кости
- Воздействуйте на лобную кость в направлении к центу головы и раздвигая латерально.
- Дождитесь расслабления тканей
Примеры техник остеопатических коррекций
- Дренаж венозных синусов
- Техники декомпресии СБС
- Лифт лобной кости (frontal lift)
- Лифт теменных костей (parietal lift)
- Техника компрессии четвертого желудочка головного мозга (CV4, compression of ventricle four)
- Коррекция лобно-теменного шва
- Коррекция затылочно-теменного шва
- Коррекция теменно-чешуйчатого шва
- Коррекция теменно-сосцевидного шва
- Коррекция височно-затылочных швов
- Коррекция брегмы
- Коррекция височной кости
- Тестирование и коррекция решетчатой кости
- Дисфункции костей таза
Поперечные пазухи — Transverse sinuses
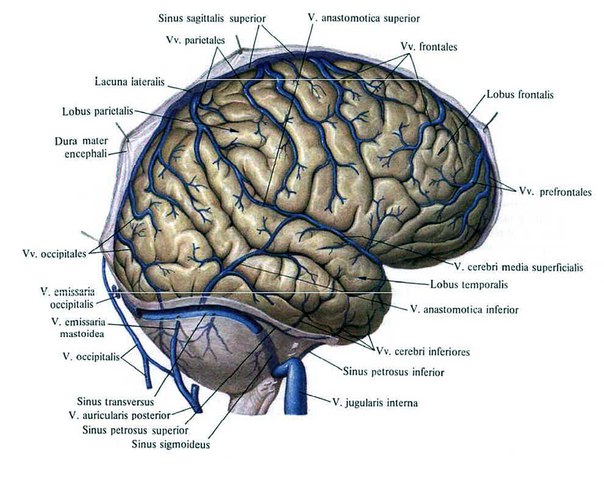
В поперечных синусах (левые и правые боковые синусы), в человеческой голове, две области , под мозгом , которые позволяют крови стекать из задней части головы.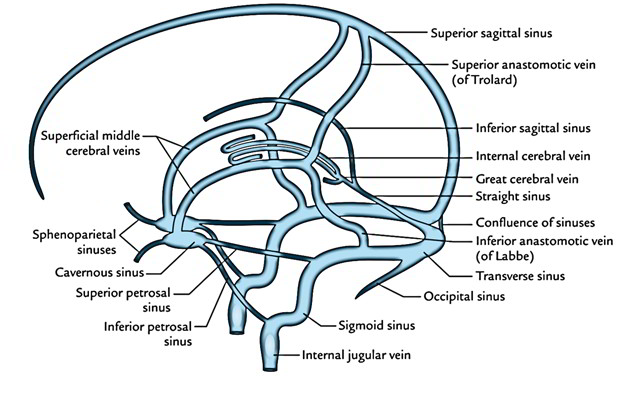 Они проходят латерально в бороздке по внутренней поверхности затылочной кости . Они стекают из места слияния пазух (через внутренний затылочный выступ ) с сигмовидными пазухами , которые в конечном итоге соединяются с внутренней яремной веной . См. Диаграмму (справа) : обозначено под мозгом как « SIN. TRANS. » (Латинское: sinus transversus ).
Они проходят латерально в бороздке по внутренней поверхности затылочной кости . Они стекают из места слияния пазух (через внутренний затылочный выступ ) с сигмовидными пазухами , которые в конечном итоге соединяются с внутренней яремной веной . См. Диаграмму (справа) : обозначено под мозгом как « SIN. TRANS. » (Латинское: sinus transversus ).
Поперечные пазухи имеют большие размеры и начинаются у внутреннего затылочного выступа ; один, как правило, правый, является прямым продолжением верхнего сагиттального синуса , другой — прямого синуса .
Каждая поперечная пазухи проходит боковой и вперед, описывая небольшой кривой с выпуклостью вверх, к основанию височной кости части в височной кости , и лжи, в этой части ее ход, в прикрепленном краю намет мозжечок ; Затем он покидает тенториум и изгибается вниз и кнутри (область, которую иногда называют сигмовидным синусом ), чтобы достичь яремного отверстия , где он заканчивается во внутренней яремной вене .
В его ходе он опирается на чешуи в затылочной , в сосцевидного угла в теменной , в сосцевидного части из височной , и, как раз до его окончания, в яремную процесса в затылочной ; часть, которая занимает бороздку на сосцевидном отростке височной кости, иногда называется сигмовидным синусом .
Поперечные пазухи часто бывают неравного размера, причем синус, образованный верхним сагиттальным синусом , больше; они увеличиваются в размерах по мере продвижения от спины к центру.
На поперечном сечении горизонтальная часть имеет призматическую форму, кривая часть — полуцилиндрическую.
Они получают кровь из верхних каменистых пазух у основания каменистой части височной кости ; они сообщаются с венами перикраниума посредством сосцевидных и кондиллоидных эмиссарных вен ; и они получают некоторые из нижних церебральных и нижних мозжечковых вен и некоторые вены от диплоэ .
Petrosquamous пазухи , когда они присутствуют, проходит в обратном направлении вдоль стыка чешуи и каменистой части височной, и открывается в поперечный синус.
Дополнительные изображения
Левая теменная кость. Внутренняя поверхность.
Твердая мозговая оболочка и ее отростки обнажены путем удаления части правой половины черепа и головного мозга.
Пазухи у основания черепа.
Горизонтальный разрез через левое ухо; верхняя половина секции.
Связь головного мозга и средней менингеальной артерии с поверхностью черепа.
Левая височная кость с поверхностными отметками для барабанной полости (красный), поперечного синуса (синий) и лицевого нерва (желтый).
Поперечные пазухи
Поперечные пазухи
Смотрите также
Ссылки
внешние ссылки
<img src=»https://en.wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
%d0%ba%d0%b0%d1%82%d0%b5%d1%82%d0%b5%d1%80 %d0%b2%d0%bd%d1%83%d1%82%d1%80%d0%b8%d0%b2%d0%b5%d0%bd%d0%bd%d1%8b%d0%b9 %d0%b2%d0%b5%d0%bd%d0%be%d0%b7%d0%bd%d1%8b%d0%b9 %d0%bf%d0%b5%d1%80%d0%b8%d1%84 – Corona Todays
гобелены по эскизам художника бернарда ван орлея
About press copyright contact us creators advertise developers terms privacy policy & safety how works test new features press copyright contact us creators. Watch?v=hqni5evcvry&feature. Search the world’s information, including webpages, images, videos and more. google has many special features to help you find exactly what you’re looking for. Created with aximedia slide show creator. download this app: play.google store apps details?id=com.amem. Content type: message rfc822 return path: received: from vui (111 250 5 48.dynamic ip.hinet [111.250.5.48]) (authenticated bits=0) by lasfragancias (8. 13.8 8.
13.8 8.
лукас кранах старший Lucas Cranach The Elder 1472 1553
=d0=9a=d1=80=d0=b0=d1=82=d0=ba=d0=b8=d0=b5 = =d0=b8=d0=bd=d1=81=d1=82=d1=80=d1=83=d0=ba=d1=86=d0=b8=d0=b8 =d0=ad=d1=82=d0=b0 =d0=bd=d0=b5=d0=b1=d0=be=d0=bb=d1=8c=d1. From: Сохранено microsoft internet explorer 5> subject: =?windows 1251?b?0ux17e7r7upo6a==?= date: tue, 8 dec 2009 10:55:40 0300 mime version: 1.0 content. Message id: [email protected] doc production> subject: exported from confluence mime version: 1.0 content type: multipart.
австрийский художник эпохи рококо иоганн георг платцер
мастер попугая Master Of The Parrot Active Antwerp Ca
Ложь Карины Мишулиной.
m.vk away ?to=https%3a%2f%2f change.org%2fp%2f%25d1%2581%25d0%25bb%25d0%25b5%25d0%25b4%25d1%2581%25d1
Приятного просмотра 🙂 сегодня будет 2 хоррор игры просто игра и просто музыка под ние. Го 5 лаков и я снимаю дальше буду снимать хоррор
Оригинал
Побывал в деревне Литовке
google imgres?imgurl=http%3a%2f%2fandrey eltsov.ru%2fwp content%2fuploads%2f2018%2f10%2f%25d0%25bf%25d0%259f%
google imgres?imgurl=http%3a%2f%2fsvoikrugozor.ru%2fwp content%2fuploads%2f2015%2f12%2f%25d1%2588%25d0%25b0%
Спасибо большое афтору twenty one pilots за его 1 песеню которые были использованы в ролике СПАСИБО!
Спасибо большое жеке за то что порешал мою проблему с аудио его саундлауд
Курьерская доставка почты за пределы Республики Казахстан.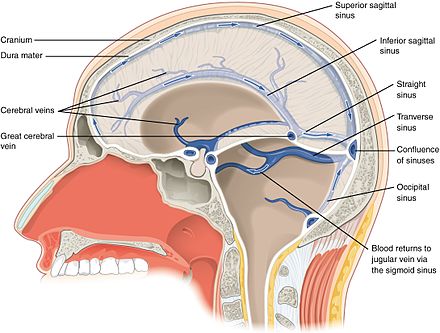 Возможно ли применить статью 395 и не облагать НДС обороты связанные с
Возможно ли применить статью 395 и не облагать НДС обороты связанные с
Влияние церебральной венозной дисциркуляции на развитие заболеваний головного мозга
- Ким О.В., Маджидова Ё.Н.
Ташкентский педиатрический медицинский
институт, Республика Узбекистан, г. Ташкент
Аннотация
Роль венозной системы в развитии заболеваний центральной нервной системы недостаточно изучена. Как известно, венозная система головного мозга чрезвычайно разнообразна, и различные варианты строения не всегда позволяют выявить определенную патологию. Сообщалось о ряде экстракраниальных венозных структурных/морфологических, гемодинамических/функциональных нарушений, которые нарушают кровоток и ведут к развитию временной коллатеральной компенсации. Срыв данных компенсационных механизмов приводят к заболеваниям центральной нервной системы.
Калит сузлар
анатомия венозной системы мозга, венозная дисциркуляция, хроническая ишемия мозга, заболевания головного мозга.
Адабиёт
Бабенков Н.В., Шмырев В.И., Клиника и течение окклюзирующих процессов в поперечных синусах мозга // Мат. VIII Всероссийского съезда неврологов. Казань, 2001. С. 198–199.
Бердичевский М.Я., Музлаев Г.Г., Литвиненко Д.В., Шагал Л.В., Рыжий А. В. Современные аспекты диагностики и лечения нарушений венозного кровообращения головного мозга // Неврологический журнал. 2004. Т.9. №2. С. 11–17.
Манвелов Л.С. Кадыков А.В. Венозная недостаточность мозгового кровообращения (лекция) // Атмтсофера. Нервные болезни. 2007. №2. С. 18-21.
Медведева Л.А., Дутикова Е.Ф., Щербакова Н.Е. и др. Комплексная патогенетическая терапия головных болей, обусловленных дегенеративно-дистрофическими изменениями шейного отдела позвоночника с явлениями венозного застоя // Журнал неврологии и психиатрии им С.С. Корсакова.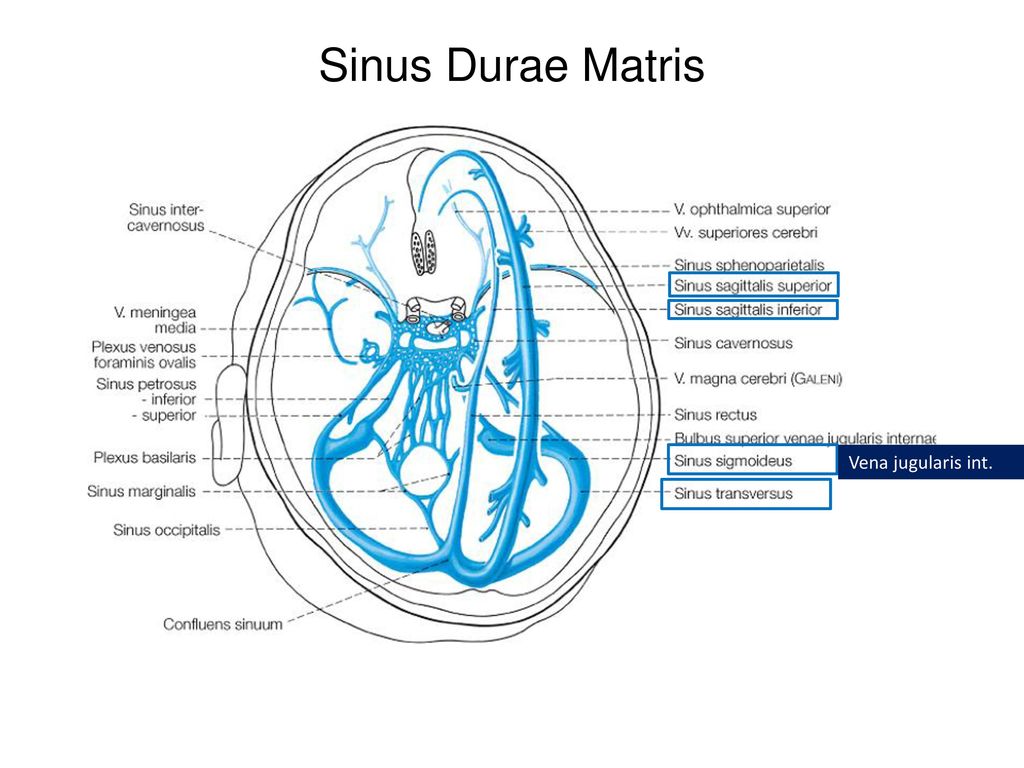 2007. №107(11). С. 36–41.
2007. №107(11). С. 36–41.
Мищенко Т.С., Здесенко И.В., Линская А.В., Мищенко В.Н. Новые мишени терапевтического воздействия у пациентов с хронической ишемией головного мозга // Международный неврологический журнал. 2011. №2(40) С. 7-13.
Семенов С. Е. Диагностика нарушений церебрального венозного кровообращения (обзор) // Сиб. мед. журн. 2001. №1. С. 63–72.
Федин А.И. и соавтр. Венозная энцефалопатия // Невроньюсспецвыпуск 2017
Фурсова Л.А. Тромбозы церебральных вен и синусов // ARSMedicine. 2009. №3(13). С. 106–118.
Шагал Л.В., Барабанова М.А., Музлаев Г.Г., Блуменау И.С., Ухина Е.В. Состояние венозного церебрального кровотока при дисциркуляторной энцефалопатии // Кубанский научный медицинский вестник 2009. №4(109). С. 159-162
Шумилина М.В. Нарушения венозного церебрального кровообращения с сердечно-сосудистой патологией // Клиническая физиология кровообращения. 2013. №3. С. 15-16.
Шумилина М.В., Бузиашвили Ю.И., Яхно Н.Н. и др. Роль венозных церебральных нарушений в развитии церебральной патологии // Современное состояние методов неинвазивной диагностики в медицине. Сочи, 2003. С. 95-96.
Doepp F, Hoffmann O, Schreiber S, Lammert I, Einhaupl KM, Valdueza JM: Venous collateral blood flow assessed by Doppler ultrasound after unilateral radical neck dissection. Ann OtolRhinolLaryngol. 2001, 110: 1055-1058.
Doepp F, Schreiber SJ, von Munster T, Rademacher J, Klingebiel R, Valdueza JM: How does the blood leave the brain? A systematic ultrasound analysis of cerebral venous drainage patterns. Neuroradiology. 2004, 46: 565-570.
Doepp F, Valdueza JM, Schreiber SJ: Incompetence of internal jugular valve in patients with primary exertional headache: a risk factor?.Cephalalgia. 2008, 28: 182-185.
Dolic K, Marr K, Valnarov V, Dwyer MG, Carl E, Hagemeier J, Kennedy C, Brooks C, Kilanowski C, Hunt K, Hojnacki D, Weinstock-Guttman B, Zivadinov R: Sensitivity and specificity for screening of chronic cerebrospinal venous insufficiency using a multimodal non-invasive imaging approach in patients with multiple sclerosis. Funct Neurol. 2011, 26: 205-214.
Funct Neurol. 2011, 26: 205-214.
Dolic K, Siddiqui A, Karmon Y, Marr K, Zivadinov R: The role of noninvasive and invasive diagnostic imaging techniques for detection of extra-cranial venous system anomalies and their development variants. BMC Med. 2013, 11: 155.
Escott EJ, Branstetter BF: It’s not a cervical lymph node, it’s a vein: CT and MR imaging findings in the veins of the head and neck. Radiographics. 2006, 26: 1501-1515.
Hsu HY, Chao AC, Chen YY, Yang FY, Chung CP, Sheng WY, Yen MY, Hu HH: Reflux of jugular and retrobulbar venous flow in transient monocular blindness. Ann Neurol. 2008, 63: 247-253.
McTaggart RA, Fischbein NJ, Elkins CJ, Hsiao A, Cutalo MJ, Rosenberg J, Dake MD, Zaharchuk G: Extracranial venous drainage patterns in patients with multiple sclerosis and healthy controls. AJNR Am J Neuroradiol. 2012, 33: 1615-1620.
Pucheu A, Evans J, Thomas D, Scheuble C, Pucheu M: Doppler ultrasonography of normal neck veins. J Clin Ultrasound. 1994, 22: 367-373.
San Millan Ruiz D, Gailloud P, Rufenacht DA, Delavelle J, Henry F, Fasel JH: The craniocervical venous system in relation to cerebral venous drainage. AJNR Am J Neuroradiol. 2002, 23: 1500-1508.
Schaller B: Physiology of cerebral venous blood flow: from experimental data in animals to normal function in humans. Brain Res Brain Res Rev. 2004, 46: 243-260.
Schmidek HH, Auer LM, Kapp JP: The cerebral venous system. Neurosurgery. 1985, 17: 663-678.
Schreiber SJ, Lurtzing F, Gotze R, Doepp F, Klingebiel R, Valdueza JM: Extrajugular pathways of human cerebral venous blood drainage assessed by duplex ultrasound. J Appl Physiol. 2003, 94: 1802-1805.
Silva MA, Deen KI, Fernando DJ, Sheriffdeen AH: The internal jugular vein valve may have a significant role in the prevention of venous reflux: evidence from live and cadaveric human subjects. ClinPhysiolFunct Imaging. 2002, 22: 202-205.
Suzuki Y, Ikeda H, Shimadu M, Ikeda Y, Matsumoto K: Variations of the basal vein: identification using three-dimensional CT angiography. AJNR Am J Neuroradiol. 2001, 22: 670-676.
AJNR Am J Neuroradiol. 2001, 22: 670-676.
Tanoue S, Kiyosue H, Sagara Y, Hori Y, Okahara M, Kashiwagi J, Mori H: Venous structures at the craniocervical junction: anatomical variations evaluated by multidetector row CT. Br J Radiol. 2010, 83: 831-840.
Valdueza JM, von Munster T, Hoffman O, Schreiber S, Einhaupl KM: Postural dependency of the cerebral venous outflow. Lancet. 2000, 355: 200-201.
Yu W, Rives J, Welch B, White J, Stehel E, Samson D. Hypoplasia or occlusion of the ipsilateral cranial venous drainage is associated with early fatal edema of middle cerebral artery infarction. Stroke. 2009 Dec;40(12):3736–3739.
Zamboni P, Galeotti R, Menegatti E, Malagoni AM, Tacconi G, Dall’Ara S, Bartolomei I, Salvi F: Chronic cerebrospinal venous insufficiency in patients with multiple sclerosis. J NeurolNeurosurg Psychiatry. 2009, 80: 392-399.
Zamboni P, Galeotti R: The chronic cerebrospinal venous insufficiency syndrome. Phlebology. 2010, 25: 269-279.
Zhang W, Ye Y, Chen J, Wang Y, Chen R, Xiong K, Li X, Zhang S: Study on inferior petrosal sinus and its confluence pattern with relevant veins by MSCT. SurgRadiol Anat. 2010, 32: 563-572.
Zivadinov R, Chung CP. Potential involvement of the extracranial venous system in central nervous system disorders and aging. BMC Med. 2013; 11:260.
Работа в интернете — школьникам в Новосибирске
- Работа в Новосибирске
- /
- /
Вакансии в Новосибирске
В интернете — Школьникам
Должность
Заработная плата
Месяц
Смена
Час
Компания
Категория
Только выбранные
Профессия
Только выбранные
Занятость
Формат работы
Тип работы
Районы
Микрорайон
Только выбранные
Метро
По вашему запросу ничего не найдено
Измените параметры фильтрации или посмотрите полный список вакансий
Комплектовщик вахта.»Надежный партнер»
от 40 000 до 57 000 ₽ в месяц
В связи с увеличением спроса на продукцию открыт дополнительный набор Комплектовщиков БЕЗ ОПЫТА на склад спортивных товаров в Екат.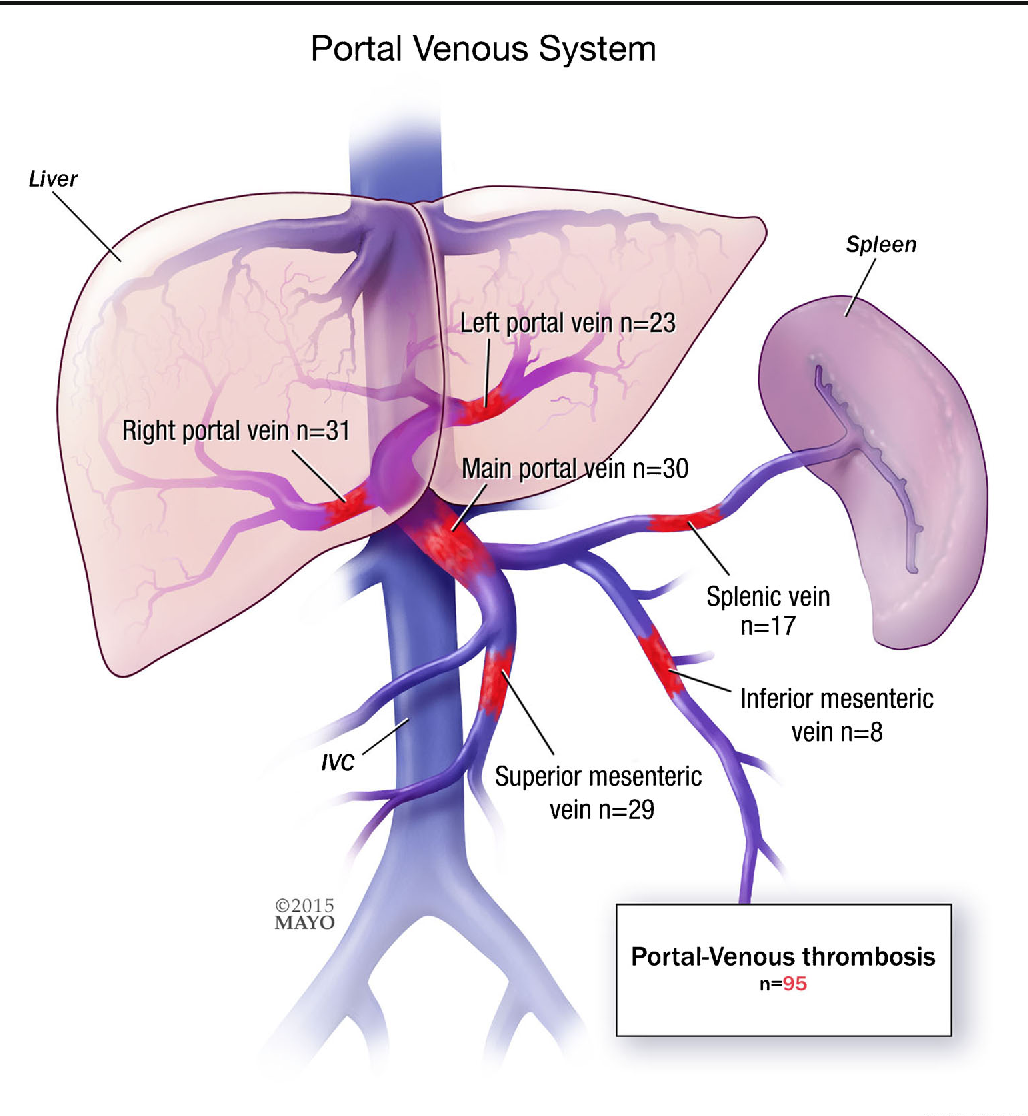 ..
..
Работа на складе спортивных товаров. Комплектовка заказов по накладной.
Дорожный рабочий (в г. Москву)»Надежный партнер»
от 35 000 до 40 000 ₽ в месяц
Официальное трудоустройство. Оплата труда почасовая. Первая вахта 120р. ч/ч, вторая 130р.ч/ч, третья и последующие 140 р.ч/ч
Граф…
Работа на строительном участке дороги: Подготовка дорожного полотна под асфальтирования с нулевого цикла. Укладка гранитного камня…
Слесарь-ремонтник»Надежный партнер»
от 43 000 до 50 000 ₽ в месяц
График работы 5/2 по 8 часов (возможны подработки).
Возможна вахта 60/30.
Выплата заработной платы своевременно, без задержек.
Ин…
— Ремонт станочного парка (токарные, фрезерные станки)
Дорожный рабочий (в г. Москву)»Надежный партнер»
от 35 000 до 40 000 ₽ в месяц
Официальное трудоустройство. Оплата труда почасовая. Оплата труда почасовая. Первая вахта 120р. ч/ч, вторая 130р.ч/ч, третья и пос…
Работа на строительном участке дороги: Подготовка дорожного полотна под асфальтирования с нулевого цикла. Укладка гранитного камня…
Токарь-универсал в г. Пенза»Надежный партнер»
от 48 000 до 50 000 ₽ в месяц
Возможен вахтовый график 60/30 или на постоянной основе.
График работы 5/2 по 8-10 часов.
Возможны подработки по субботам.
прож…
Изготовление деталей на станках
ДИП 300 и ДИП 500. Уверенное чтение чертёжной документации. Самостоятельная наладка станка для об…
Упаковщики в Москву и МО.»Надежный партнер»
Работа с проживанием.
Трудоустройство и заселение в день обращения. Бесплатно.
Проживание в комфортном, благоустроенном общежитии….
Фасовка, маркировка, сборка, упаковка, комплектовка товаров народного потребления.
Дорожный рабочий вахта в г. Москву»Надежный партнер»
от 35 000 до 40 000 ₽ в месяц
Официальное трудоустройство. Оплата труда почасовая. Оплата труда почасовая. Первая вахта 120р. ч/ч, вторая 130р.ч/ч, третья и пос…
Работа на строительном участке дороги: подготовка дорожного полотна под асфальтирования с нулевого цикла.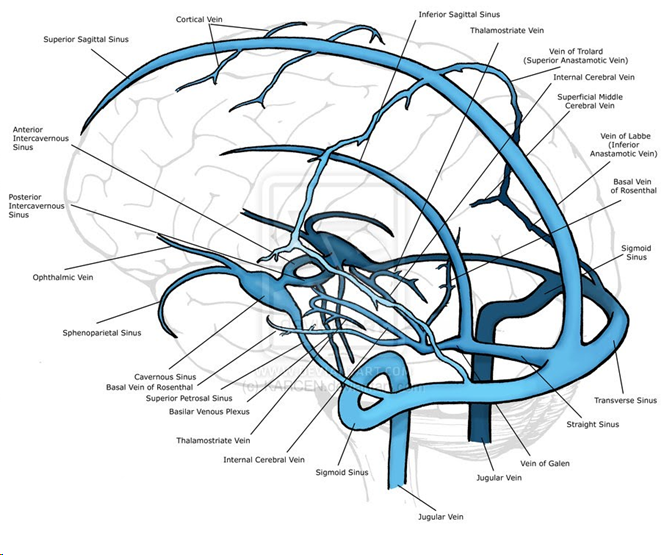 Укладка гранитного камня…
Укладка гранитного камня…
Электромонтажник (Вахта)»Надежный партнер»
от 50 000 до 65 000 ₽ в месяц
-Испытательный срок 1 месяц.
-Трудоустройство официальное, вахтовый график работы 60/14 или 35/7.
-Уровень заработной платы опреде…
-Полный комплекс электромонтажных работ: монтаж слаботочных сетей (телефон, пожарная сигнализация, компьютерная сеть, видео, и т.д…
Старший менеджер по работе с клиентамиЛанта-Банк
-Стабильный, динамично развивающийся банк.
-Трудоустройство в соответствии с ТК РФ.
-Социальный пакет согласно ТК РФ.
-Дружественн…
-Обслуживание юридических лиц:
-открытие счетов клиентам, прием и подготовка платежных документов.
-Обслуживаниефизических лиц:
-о…
Веб-разработчик на python (django)Ван
В нашу команду ищем опытного и ответственного python разработчика, нацеленного на качественную удаленную работу
Чем ты будешь зан…
Продавец-кассир (Новосибирск, Королева, 10/1)Пятерочка
от 25 000 до 28 000 ₽ в месяц
-График работы 5/2, 2/2, возможен неполный рабочий день, неполная рабочая неделя
-Возможность подработки (работа по совместительст…
-Обслуживание покупателей на кассе (наличный и безналичный расчет)
-Выкладка товара в зале
-Отслеживание сроков годности товара
-П…
Senior Software Engineer (PyCharm)JetBrains
PyCharm — это интегрированная среда разработки(IDE) для приложений на языке программирования Python. В последнее время язык Python…
улица Демакова 30Специалист клиентской поддержкиLIME
от 25 000 до 30 000 ₽ в месяц
-Трудоустройство в полном соответствии с ТК РФ;
-График работы: 2/2, рабочий день с 10:00 до 22:00;
-Достойная заработная плата. С…
-Прием обращений, поступающих через дистанционные каналы связи;
-Консультирование клиентов.
Место впадения носовых пазух: Анатомия, притоки, дренаж
Слияние носовых пазух: хотите узнать о нем подробнее?
Наши увлекательные видео, интерактивные викторины, подробные статьи и HD-атлас помогут вам быстрее достичь лучших результатов.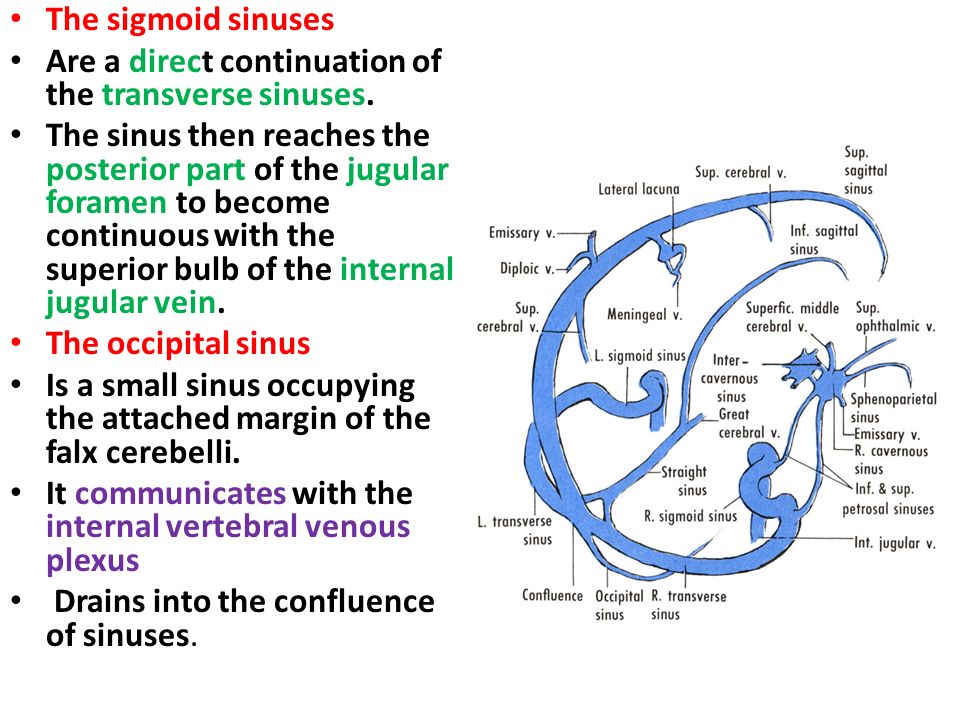
С чем вы предпочитаете учиться?
«Я бы честно сказал, что Kenhub сократил мое учебное время вдвое».
—
Подробнее.
Ким Бенгочеа, Университет Реджиса, Денвер
Автор:
Аарон Бегер, бакалавр наук
•
Рецензент:
Роберто Груичич, доктор медицины
Последний раз отзыв: 29 октября 2020 г.
Время чтения: 2 минуты.
Слияние пазух (confluens sinuum)
Слияние пазух ( торкуляр Герофила или торкула ) представляет собой дуральный венозный синус, который проявляется как расширение на заднем конце верхнего сагиттального синуса.Он расположен на каудальном участке мозга, вокруг внутреннего затылочного выступа затылочной кости.
Функционально этот сосуд представляет собой соединение между верхней сагиттальной, прямой, затылочной и двумя поперечными пазухами; он облегчает отток крови из верхних сагиттальных, прямых и затылочных пазух в двусторонние поперечные пазухи, которые переносят кровь к внутренней яремной вене.
| Слив из | Верхний сагиттальный синус, прямой синус и затылочный синус |
| Слив к | Поперечная пазуха |
| Площадь дренажа | Полушария головного мозга |
В этой статье мы обсудим анатомию и функцию слияния носовых пазух.
Анатомия
Как и другие дуральные венозные синусы, место слияния пазух не имеет клапанов, и не содержит мышечной ткани в своих стенках. Его стенки, выстланные эндотелием, вместо этого состоят из надкостницы и менингеальных слоев, твердой мозговой оболочки, которая является самым внешним слоем мозговых оболочек головного мозга.
Его стенки, выстланные эндотелием, вместо этого состоят из надкостницы и менингеальных слоев, твердой мозговой оболочки, которая является самым внешним слоем мозговых оболочек головного мозга.
Как правило, давление и сила тяжести заставляют кровь вытекать из верхних сагиттальных, прямых и затылочных пазух в слияние пазух, а затем латерально в поперечные пазухи, предназначены для для внутренней яремной вены через сигмовидный синус.Однако, поскольку дуральные венозные синусы бесклапанные, кровь может течь в направлении в любом направлении .
Чтобы узнать больше о дуральных пазухах мозга, ознакомьтесь с нашими статьями, тестами и видео.
Слияние носовых пазух: хотите узнать о нем подробнее?
Наши увлекательные видео, интерактивные викторины, подробные статьи и HD-атлас помогут вам быстрее достичь лучших результатов.
С чем вы предпочитаете учиться?
«Я бы честно сказал, что Kenhub сократил мое учебное время вдвое.”
—
Подробнее.
Ким Бенгочеа, Университет Реджиса, Денвер
Показать ссылки
Список литературы
- Haines, D.E. (2014). Нейроанатомия в клиническом контексте: атлас структур, разделов, систем и синдромов (9-е изд.). Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс.
- Мур, К. Л., Далли, А. Ф., и Агур, А. М. Р. (2014). Клинически ориентированная анатомия (7-е изд.). Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс.
- Неттер, Ф. (2019).Атлас анатомии человека (7-е изд.). Филадельфия, Пенсильвания: Сондерс.
- Стандринг, С. (2016). Анатомия Грея (41-е изд.). Эдинбург: Эльзевьер Черчилль Ливингстон.
- Таббс, Р. С., Шоджа, М. М., Лукас, М., и Бергман, Р. А. (2016). Всесторонняя энциклопедия анатомических изменений человека Бергмана. Хобокен: Уайли Блэквелл.
- Янг П.А., Янг П.Х., Толберт Д.Л. (2015). Основы клинической неврологии (3-е изд.). Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс.

Иллюстраторы
- Слияние синусов (confluens sinuum) — Пол Ким
© Если не указано иное, все содержимое, включая иллюстрации, является исключительной собственностью Kenhub GmbH и защищено немецкими и международными законами об авторских правах. Все права защищены.
Слияние пазух — обзор
Прерывание верхних сагиттальных, прямых, поперечных и затылочных пазух
Прерывание верхних сагиттальных пазух и поперечных пазух является наиболее частым анатомическим вариантом пазух.В большинстве случаев он заканчивается правым поперечным синусом (правое преобладание), но может также заканчиваться левым поперечным синусом (левое преобладание) и слиянием пазух (кодоминантность). Этот образец доминирования зависит от возраста пациента и больше похож на образец для взрослых после 5 лет. Сообщалось, что у детей младше 2 лет паттерн кодоминантности был самым высоким. 97 Это завершение обычно происходит на уровне внутреннего затылочного выступа, но может также возникать и выше этого уровня.В других случаях верхний сагиттальный синус может разветвляться и соединяться с раздвоенным прямым синусом, а затем становится непрерывным с поперечным синусом. В терминальной части синуса также можно увидеть перегородку твердой мозговой оболочки, разделяющую эту часть синуса на неравные каналы. Эта дуральная перегородка может также расширять и разделять место слияния пазух, прямой пазухи или поперечной пазухи. В редких случаях верхний сагиттальный синус может быть разделен на три канала с различными окончаниями.В одном случае это окончание включало поверхностную нитевидную поперечную пазуху, перекрывающую более глубокую поперечную пазуху.
Fukusumi et al. 20 классифицировали схему дренажа верхней сагиттальной пазухи в поперечную пазуху на четыре типа. Тип I: верхний сагиттальный синус достигает центрально расположенного слияния, а затем разделяется на двусторонний поперечный синус. Тип II: верхний сагиттальный синус разделяется на правую и левую конечности, впадая в одну и ту же боковую поперечную пазуху. Тип III (наиболее распространенный): верхний сагиттальный синус дренирует преимущественно правый поперечный синус. Тип IV: верхний сагиттальный синус отводится преимущественно в левую сторону. 20 Такая же классификация была применена Singh et al. на основе оттисков затылочной кости для синусов твердой мозговой оболочки вокруг слияния. Они также добавили, что тип I чаще встречается у женщин, тогда как у мужчин чаще наблюдается прекращение типа III. 21
Тип III (наиболее распространенный): верхний сагиттальный синус дренирует преимущественно правый поперечный синус. Тип IV: верхний сагиттальный синус отводится преимущественно в левую сторону. 20 Такая же классификация была применена Singh et al. на основе оттисков затылочной кости для синусов твердой мозговой оболочки вокруг слияния. Они также добавили, что тип I чаще встречается у женщин, тогда как у мужчин чаще наблюдается прекращение типа III. 21
Точно так же прямая пазуха может достигать центрально расположенного слияния перед разделением на двусторонний поперечный синус (тип I), преждевременно раздваиваться на правый и левый каналы перед соединением с соответствующей поперечной пазухой (тип II), сливаться преимущественно в правую. поперечный синус (тип III) или преимущественно левый поперечный синус (тип VI). 16,20 Чаще всего наблюдаются первые два типа, и дренирование в левую поперечную пазуху больше, чем в правую. 23
В большинстве случаев затылочный синус оканчивается местом слияния синусов, но может также оканчиваться поперечным синусом, верхним сагиттальным синусом или прямым синусом. 27 В последнем состоянии затылочный синус называется косым затылочным синусом и функционирует как главный дренажный канал, когда поперечный синус находится в зачаточном состоянии. 104,105 О более развитой косой затылочной пазухе сообщили Shoja et al. 107 в сочетании с другими вариантами твердой мозговой оболочки. В этом случае синус был обнаружен заднебоковой по отношению к большому затылочному отверстию, проходящий вверх и заднемедиально и соединяющий терминальную часть правого сигмовидного синуса с затылочным и правым поперечными пазухами через одну медиальную и две боковые ветви соответственно. 107 В редких случаях затылочный синус может стекать в верхнюю луковицу внутренней яремной вены в сочетании с нормальным, гипопластическим или отсутствующим поперечным синусом и сигмовидным синусом. 108
108
Основываясь на своих выводах, Kopuz et al. 93 классифицировали окончание венозных синусов в области слияния синусов у новорожденных на шесть типов. При типе I верхний сагиттальный синус продолжался правым поперечным синусом, и два затылочных синуса были открыты до слияния. При типе II верхний сагиттальный синус также продолжался правым поперечным синусом, но было замечено более двух затылочных пазух, открывающихся в слияние.Типы III и IV аналогичны типам I и II соответственно, за исключением того, что верхний сагиттальный синус непрерывен с левым поперечным синусом. При типе V верхний сагиттальный синус впадает в слияние, с которым соединяются поперечный синус и два затылочных синуса. При типе VI верхний сагиттальный синус раздваивается перед соединением с поперечным синусом. 93
Новая паллиативная хирургическая техника для пациентов с высоким риском Тотальное аномальное соединение легочных вен (шунт Сармаста-Такрити) | Journal of Cardiothoracic Surgery
Оценка давления до вмешательства в операционной и после коррекции проиллюстрирована в (Таблица 1.). Сразу после завершения операции (STS) давление ПВХ снизилось до точки, при которой его градиент давления стал нулевым. Оксигенация крови улучшилась до 84% (до операции Sao2 составляла 70% при 100% кислороде), исчезли цианоз, возбуждение, проблемы с кормлением. Через три дня, когда его выписали, сатурация артериальной крови кислородом достигла 91%. Несмотря на хорошие успехи в лечении ТАПВК в последние десятилетия, этот тяжелый порок развития в его различных анатомических формах остается проблематичным в раннем младенчестве.Значительная обструкция оттока легочных вен приводит к отеку легких при нормальных размерах и форме сердца и кардиогенному шоку, который при отсутствии лечения быстро приводит к летальному исходу. У нашего пациента до операции наблюдался значительный градиент между точкой дренажа вертикальной вены к левой брахиоцефальной вене и легочными венами с ускорением потока> 3,0 м / сек (обструкция легочной вены), но при послеоперационной эхокардиографии ускорение среднего потока 0,8 м / сек было обнаружено при сайт канала.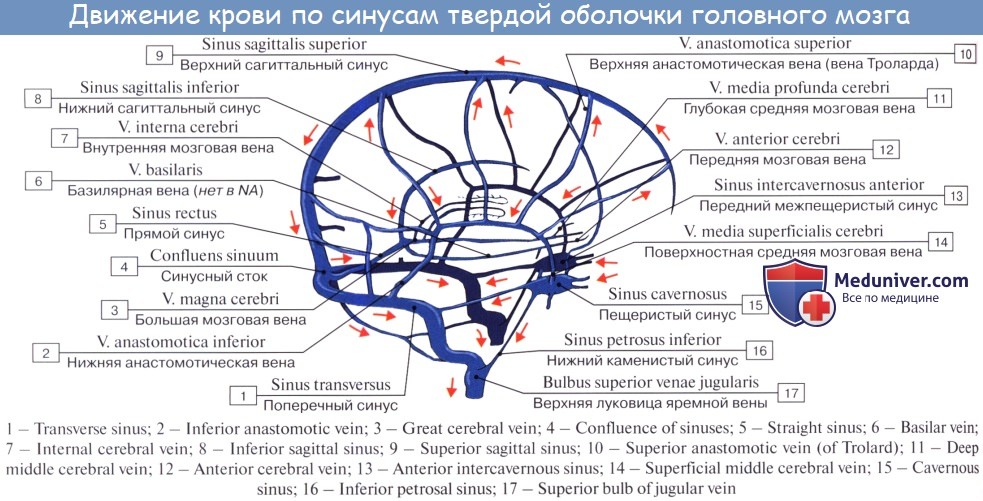 Этот поток и проходимость сохранялись до второй операции, показав идентичное среднее значение Vmax 0,8 м / с. В канале не наблюдалось ни турбулентного, ни непрерывного течения. Почти во всех отчетах сообщалось, что высокая периоперационная летальность связана с PVO, низким весом (W <2,5–3 кг), ранним возрастом (A <2 м), тяжелым предоперационным ацидозом, длительным периодом перекрестного зажима аорты (ACC) и остановкой сердца. Второй рубеж в лечении TAPVC - это послеоперационный PVO. В таких сложных ситуациях, если пациенты выживают после операции, большинству из них потребуются многократные послеоперационные хирургические вмешательства из-за рецидивов ППО со все более неблагоприятным исходом в каждом представлении [7].Медицинские меры минимально эффективны при лечении последующих гемодинамических и метаболических проблем, поэтому их использование ограничивается предоставлением краткосрочной консервативной терапии до тех пор, пока не будет выполнено окончательное хирургическое лечение. ПВО обычно приводит к летальному исходу даже после повторной операции и обширных попыток ревизии или восстановления [8]. Это отсутствие успеха привело к альтернативным методам лечения, таким как баллонная дилатация и стентирование. Операция Рашкинда или баллонная септостомия предсердий (BAS) использовалась с некоторым успехом для декомпрессии легочного венозного давления и улучшения C / O при ограниченном ASD, но они, по-видимому, не приносят дополнительных преимуществ.Более того, в нескольких отчетах предлагалось использовать чрескожную ангиопластику и стентирование закупоренной вены для смягчения шока и улучшения предоперационного метаболического состояния. Исследования показали, что во время среднего поперечного наблюдения, составляющего 3,1 года, оценочная смертность составила 38 +/- 8% через 1 год и 50 +/- 8% через 5 лет после имплантации стента. Необходимость повторного вмешательства (из-за окклюзии стента) составила 58 +/- 7% через 1 год. В 1996 году была описана методика безшивной пластики с использованием аутологичного перикарда in situ при рецидивирующем стенозе легочной вены после основной операции TAPVC [9].
Этот поток и проходимость сохранялись до второй операции, показав идентичное среднее значение Vmax 0,8 м / с. В канале не наблюдалось ни турбулентного, ни непрерывного течения. Почти во всех отчетах сообщалось, что высокая периоперационная летальность связана с PVO, низким весом (W <2,5–3 кг), ранним возрастом (A <2 м), тяжелым предоперационным ацидозом, длительным периодом перекрестного зажима аорты (ACC) и остановкой сердца. Второй рубеж в лечении TAPVC - это послеоперационный PVO. В таких сложных ситуациях, если пациенты выживают после операции, большинству из них потребуются многократные послеоперационные хирургические вмешательства из-за рецидивов ППО со все более неблагоприятным исходом в каждом представлении [7].Медицинские меры минимально эффективны при лечении последующих гемодинамических и метаболических проблем, поэтому их использование ограничивается предоставлением краткосрочной консервативной терапии до тех пор, пока не будет выполнено окончательное хирургическое лечение. ПВО обычно приводит к летальному исходу даже после повторной операции и обширных попыток ревизии или восстановления [8]. Это отсутствие успеха привело к альтернативным методам лечения, таким как баллонная дилатация и стентирование. Операция Рашкинда или баллонная септостомия предсердий (BAS) использовалась с некоторым успехом для декомпрессии легочного венозного давления и улучшения C / O при ограниченном ASD, но они, по-видимому, не приносят дополнительных преимуществ.Более того, в нескольких отчетах предлагалось использовать чрескожную ангиопластику и стентирование закупоренной вены для смягчения шока и улучшения предоперационного метаболического состояния. Исследования показали, что во время среднего поперечного наблюдения, составляющего 3,1 года, оценочная смертность составила 38 +/- 8% через 1 год и 50 +/- 8% через 5 лет после имплантации стента. Необходимость повторного вмешательства (из-за окклюзии стента) составила 58 +/- 7% через 1 год. В 1996 году была описана методика безшивной пластики с использованием аутологичного перикарда in situ при рецидивирующем стенозе легочной вены после основной операции TAPVC [9].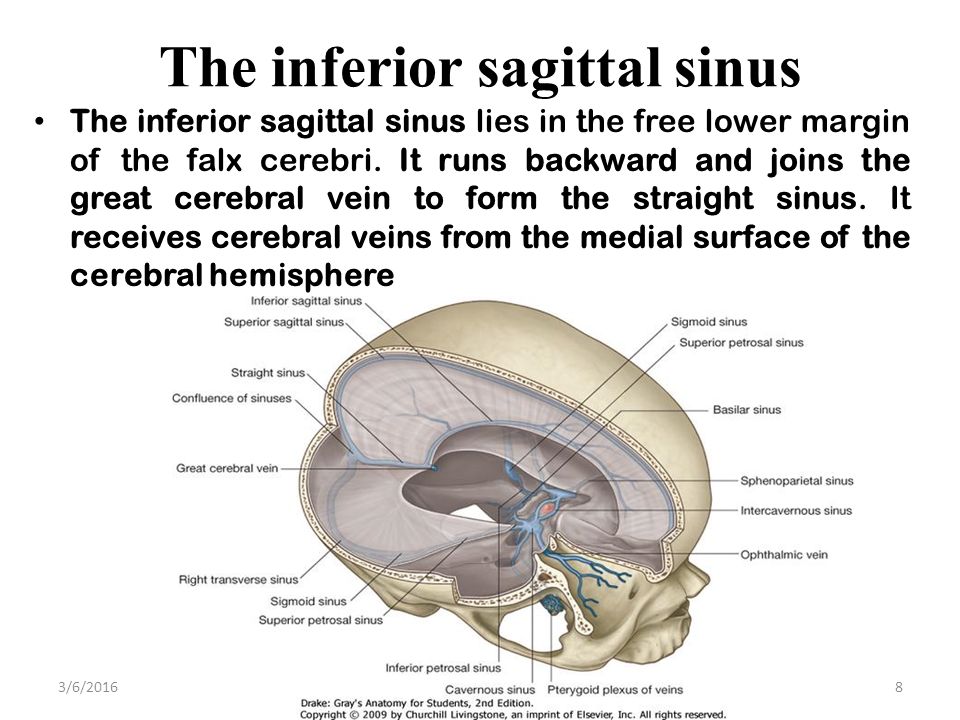 Последующие отчеты подчеркивают полезность этого метода у отдельных пациентов в качестве основной процедуры. Несмотря на интерес к бесшовной технике, существует мало убедительных доказательств того, что она дает преимущество перед традиционными методами, использовавшимися в ретроспективном анализе для сравнения исходов смерти и рестеноза после традиционных и бесшовных методов. По результатам многофакторного анализа статистически значимых различий между традиционными и бесшовными методами не выявлено. Мы столкнулись с пациентом, который почти охватывал все критические факторы риска, которых было достаточно, чтобы сделать оперативный прогноз очень плохим.Стандартные стандартные оперативные процедуры показали уровень смертности до 50% и уровень заболеваемости послеоперационной обструкцией легочных вен (PVO) до 54%, особенно при обструктивном типе TOPVC, а также о том, что почти все они нуждаются во второй операции. У нашего пациента было больше возможностей набрать соответствующий вес, а также камеры сердца и легочные вены. Шунт Сармаст-Такрити (STS) установил адекватную послеоперационную гемодинамику для новорожденных с симптомами и быстро восстановил левую кардиологическую сторону.STS с ограниченным гепарином (100 Ед / кг) проводился без использования CPB с целью снижения заболеваемости, связанной с экстракорпоральным кровообращением. Отказ от CPB существенно снизил стоимость процедуры и избавил пациента от присущих ей осложнений [10]. .После процедуры было подготовлено достаточно времени для сердца, чтобы компенсировать его камеры, особенно правый желудочек и левое предсердие, и обеспечить терпимое состояние для основной операции. Хотя наш опыт был ограничен STS при суперкардиальном типе, мы оптимистичны и надеемся на его выполнимость и полезность при других типах TAPVC.Теперь мы очень довольны тем, что можем помочь такому сложному новорожденному.
Последующие отчеты подчеркивают полезность этого метода у отдельных пациентов в качестве основной процедуры. Несмотря на интерес к бесшовной технике, существует мало убедительных доказательств того, что она дает преимущество перед традиционными методами, использовавшимися в ретроспективном анализе для сравнения исходов смерти и рестеноза после традиционных и бесшовных методов. По результатам многофакторного анализа статистически значимых различий между традиционными и бесшовными методами не выявлено. Мы столкнулись с пациентом, который почти охватывал все критические факторы риска, которых было достаточно, чтобы сделать оперативный прогноз очень плохим.Стандартные стандартные оперативные процедуры показали уровень смертности до 50% и уровень заболеваемости послеоперационной обструкцией легочных вен (PVO) до 54%, особенно при обструктивном типе TOPVC, а также о том, что почти все они нуждаются во второй операции. У нашего пациента было больше возможностей набрать соответствующий вес, а также камеры сердца и легочные вены. Шунт Сармаст-Такрити (STS) установил адекватную послеоперационную гемодинамику для новорожденных с симптомами и быстро восстановил левую кардиологическую сторону.STS с ограниченным гепарином (100 Ед / кг) проводился без использования CPB с целью снижения заболеваемости, связанной с экстракорпоральным кровообращением. Отказ от CPB существенно снизил стоимость процедуры и избавил пациента от присущих ей осложнений [10]. .После процедуры было подготовлено достаточно времени для сердца, чтобы компенсировать его камеры, особенно правый желудочек и левое предсердие, и обеспечить терпимое состояние для основной операции. Хотя наш опыт был ограничен STS при суперкардиальном типе, мы оптимистичны и надеемся на его выполнимость и полезность при других типах TAPVC.Теперь мы очень довольны тем, что можем помочь такому сложному новорожденному.
Таблица 1 Предоперационное и послеоперационное давление сердца у 4-дневного мужчины с полным аномальным соединением легочных вен, сопровождающимся обструкцией легочных вен
Патологии легочных вен | Торакальный ключ
Абсолютно аномальное соединение легочных вен
Заболеваемость и этиология
На рубеже семнадцатого века Уилсон описал «чудовищное образование сердца, в котором верхняя полая вена была соединена стволом, образованным двумя большими венами. выходит из легких.Теперь мы знаем, что различные формы таких полностью аномальных легочных венозных соединений (TAPVC) при отсутствии изомерии придатков предсердий или висцеральной гетеротаксии составляли 1 из каждых 40 пациентов, зарегистрированных в Региональной программе кардиологии новорожденных Новой Англии. Таким образом, эта сущность занимает 12-е место по частоте и встречается один раз на 17 000 живорождений. В исследовании новорожденных, проведенном в Балтиморе и Вашингтоне, порок развития встречался реже, составляя 1,5% всех пациентов с сердечно-сосудистыми пороками и встречаясь один раз на 14 700 живорожденных.TAPVC, как известно, является частью синдромов Холта-Орама, Клиппеля-Фейля, фокомелии и Шахенмана. Установить частоту частично аномального соединения легочной вены труднее, поскольку аномальное соединение единственной вены (рис. 28.1) может быть нераспознано ни при жизни, ни при смерти. О таких аномалиях сообщалось примерно в 1 из 200 рутинных вскрытий. Кроме того, в обширном исследовании, основанном на опыте хирургических вмешательств и аутопсий, было обнаружено, что семь десятых всех случаев аномального соединения легочных вен относятся к частичной разновидности, хотя в этот обзор были включены пациенты с изомерией придатков предсердий.
выходит из легких.Теперь мы знаем, что различные формы таких полностью аномальных легочных венозных соединений (TAPVC) при отсутствии изомерии придатков предсердий или висцеральной гетеротаксии составляли 1 из каждых 40 пациентов, зарегистрированных в Региональной программе кардиологии новорожденных Новой Англии. Таким образом, эта сущность занимает 12-е место по частоте и встречается один раз на 17 000 живорождений. В исследовании новорожденных, проведенном в Балтиморе и Вашингтоне, порок развития встречался реже, составляя 1,5% всех пациентов с сердечно-сосудистыми пороками и встречаясь один раз на 14 700 живорожденных.TAPVC, как известно, является частью синдромов Холта-Орама, Клиппеля-Фейля, фокомелии и Шахенмана. Установить частоту частично аномального соединения легочной вены труднее, поскольку аномальное соединение единственной вены (рис. 28.1) может быть нераспознано ни при жизни, ни при смерти. О таких аномалиях сообщалось примерно в 1 из 200 рутинных вскрытий. Кроме того, в обширном исследовании, основанном на опыте хирургических вмешательств и аутопсий, было обнаружено, что семь десятых всех случаев аномального соединения легочных вен относятся к частичной разновидности, хотя в этот обзор были включены пациенты с изомерией придатков предсердий.
Рис. 28.1
Аномальное соединение правой верхней легочной вены с верхней полой веной (SCV), которое было обнаружено случайно при нормальном вскрытии.
В более ранних сообщениях о TAPVC подчеркивалось преобладание мужчин в условиях инфрадиафрагмального дренажа с равным полем в остальных типах. Однако среди тех, кто был зарегистрирован в Региональной программе кардиологии новорожденных Новой Англии, две трети с супракардиальными и сердечными связями были мужчины, тогда как это был инфрадиафрагмальный вариант, который показал равное соотношение полов.Как и в случае с очень многими поражениями, есть несколько примеров семейной кластеризации, в одном сообщении указывается на аутосомно-доминантное наследование. Некоторые данные, свидетельствующие о воздействии тератогенов на мать в течение первых 3 месяцев беременности, были получены в ходе исследования новорожденных в Балтиморе и Вашингтоне. Повторный анализ этого набора данных в 2004 году показал, что связь с воздействием свинца на мать неубедительна, но выявила связь между полностью аномальной связью и воздействием свинца на отца до зачатия.
Некоторые данные, свидетельствующие о воздействии тератогенов на мать в течение первых 3 месяцев беременности, были получены в ходе исследования новорожденных в Балтиморе и Вашингтоне. Повторный анализ этого набора данных в 2004 году показал, что связь с воздействием свинца на мать неубедительна, но выявила связь между полностью аномальной связью и воздействием свинца на отца до зачатия.
Анатомия
Аномальные легочные соединения принимают различные формы и проявляют несколько важных клинических особенностей.Первым важным признаком является доля оттока легочных вен, который связан с участками, отличными от морфологически левого предсердия. Это может быть одиночная легочная вена, все вены одного легкого или весь легочный венозный дренаж (рис. 28.2). Комбинации также возможны, когда все вены не дренируют аномально, поэтому, хотя и редко, возможно, что весь дренаж из одного легкого и единственная вена из другого легкого связаны с другими участками, кроме морфологически левого предсердия.После того, как было установлено, что легочная вена или легочные вены дренируются аномально, не менее важно определить место дренажа и все ли вены дренируются в одно и то же место. Необходимо искать стенозированные участки или участки на пути аномального дренажа. Также необходимо установить, является ли аномальное соединение легочных вен изолированной аномалией или частью более сложной аномалии, и есть ли связанные структурные аномалии легочной сосудистой сети.
Рис. 28.2
Возможности аномального соединения легочных вен.
Прежде чем обсуждать эти важные анатомические переменные более подробно, следует пояснить использование термина аномальное легочное венозное соединение . Это связано с тем, что при определенных обстоятельствах легочные вены, нормально соединенные с морфологически левым предсердием, могут аномально дренировать в системный участок, например, при митральной атрезии и дефекте межпредсердной перегородки или фенестрации в коронарный синус, или при наличии так называемой левоатриальной кардинальной вены (рис. 28,3).
28,3).
Рис. 28.3
Пример полностью аномального оттока легочной вены при нормально соединенных легочных венах, в данном случае потому, что так называемая лево-предсердная кардинальная вена соединяет левое предсердие с верхней полой веной (SCV) с митральным атрезия и неповрежденная межпредсердная перегородка.
Легочная вена соединена аномально только тогда, когда она прикреплена к месту, отличному от морфологически левого предсердия. В этом отношении также важно различать левое и морфологически левое предсердия.При изомерии отростков правого предсердия все четыре легочные вены часто соединяются с крышей предсердия морфологически правым отростком, который может быть левосторонним. Поскольку в этом случае атриум имеет морфологически правый придаток, этот анатомический рисунок является аномальным. Действительно, легочные вены должны быть соединены аномально в условиях правильной изомерии, независимо от места их оттока. Таким образом, тема легочных венозных соединений в сердце с изомерными придатками представляет собой особую ситуацию, которая подробно обсуждается в главе 26.В этой главе мы в первую очередь касаемся полностью аномальной связи в латерализованных предсердных камерах, другими словами, обычном и зеркальном расположении, но в соответствующих случаях делается ссылка на сердца с изомерными придатками.
Когда все легочные вены соединены аномально, они обычно дренируют в одно и то же место. В некоторых случаях разные легочные вены связаны с отдельными аномальными участками. Это называется смешанный дренаж (Видео 28.1). Места такого дренажа такие же, как и тогда, когда весь возврат легочной вены достигает экстракардиального участка через слияние. Эти участки аномальной связи делятся на надкардиальные, сердечные и инфракардиальные группы. Первые два, вместе взятые, составляют наддиафрагмальный дренаж, тогда как инфракардиальный дренаж одновременно является инфрадиафрагмальным (рис. 28.4).
Рис. 28.4
28.4
Различные участки аномального соединения легочных вен.
Сердечные и внутрисердечные аномальные связи составляют примерно четверть каждой от общей группы. Надсердечное соединение может происходить с левой брахиоцефальной веной, непосредственно с правой верхней полой веной, с непарной системой вен или с левой верхней полой веной, хотя, когда левая вена стекает в коронарный синус, это считается сердечным дренажом. . Чаще всего четыре легочные вены по очереди присоединяются к венозному каналу за левым предсердием.Этот канал традиционно называют слиянием, но отдельные жилы обычно присоединяются к каналу последовательно. От этого горизонтального канала вертикальная вена обычно проходит через левый паравертебральный желоб, чтобы присоединиться к левой брахиоцефальной вене, которая заканчивается правой верхней полой веной (рис. 28.5; видео 28.2). Именно ход вертикальной вены обычно определяет, заблокирован ли путь. Если вена проходит кпереди от левой легочной артерии, это течение не связано с обструкцией.Если вена проходит между левой легочной артерией и левым бронхом, эти две структуры зажимают канал в так называемых бронхолегочных тисках (рис. 28.6). Обструкция аномальной связи по типу «снеговика» также может возникать, хотя и редко, при открытии брахиоцефальной вены в верхнюю полую вену. Надкардиальное соединение также может быть обнаружено, когда вертикальная вена соединяется непосредственно с правой верхней полой веной. Обструкция может возникать либо в этом полом венозном соединении, либо в других тисках, на этот раз между правой легочной артерией и килем.Когда аномальные легочные вены присоединяются к системной венозной системе через неполную вену, горизонтальная вена обычно пересекает слева направо под сердцем, снова принимая отдельные легочные вены последовательным образом. Вертикальная вена поднимается вверх в правом паравертебральном желобе, соединяясь с верхней полой веной через непарную вену (рис. 28.7).
Рис. 28. 5
5
Типичный «снеговик» рисунок суперкардиального полностью аномального соединения легочной вены с верхней полой веной (SCV).Аномальный венозный путь формирует голову снеговика, а масса желудочков составляет тело.
Рис. 28.6
Бронхолегочные тиски, создающие обструкцию надсердечными связями.
Рис. 28.7
Образец от пациента с изомерными придатками правого предсердия, показывающий, что горизонтальная вена, проходящая слева направо и восходящая в правом паравертебральном желобе, дренирует надкардиальным образом через непарную вену.
При обычном или зеркальном расположении предсердий сердечная форма аномального соединения почти всегда обнаруживается, когда легочные вены соединяются с правым предсердием через коронарный синус (рис. 28.8). Можно сомневаться, следует ли рассматривать это как сердечную связь или через постоянную левую верхнюю полую вену. Независимо от таких тонкостей, нет сомнений в том, что место возврата находится в сердце, поэтому сердечная связь является подходящим описанием.Отдельные легочные вены могут поступать в коронарный синус по-разному, но последний общий путь — это синус в пределах левой предсердно-желудочковой борозды, которая обычно увеличивается по сравнению с нормальной ситуацией. Отдельные стенки коронарного синуса и левого предсердия отделяют горизонтальный венозный канал от полости левого предсердия, хотя стенки легко удалить хирургическим путем. Восстановление аномального соединения достигается простым закрытием и устья коронарного синуса, и межпредсердного сообщения, при этом, конечно, соблюдаются предсердно-желудочковые проводящие ткани в треугольнике Коха.Обструкция редко возникает, когда легочные вены проходят через коронарный синус, но она может быть вызвана постоянным фивиевым клапаном или внутри синуса, когда отдельные вены соединяются необычным образом.
Рис. 28.8
Абсолютно аномальное соединение легочных вен через коронарный синус с правым предсердием. Сердце сфотографировано сзади и слева. Если удалить стенки, отделяющие полость пазухи от левого предсердия, аномалию можно исправить, просто закрыв правое предсердное устье коронарного синуса.
Сердце сфотографировано сзади и слева. Если удалить стенки, отделяющие полость пазухи от левого предсердия, аномалию можно исправить, просто закрыв правое предсердное устье коронарного синуса.
Прямое соединение легочных вен с морфологически правым предсердием чрезвычайно редко, за исключением случая изомерии придатков правого предсердия. В этом случае коронарный синус отсутствует, и чаще всего имеется дефект межпредсердной перегородки, часто практически отсутствует. Легочные вены имеют тенденцию сбиваться вместе, открываясь через срединное фиброзное слияние в крыше предсердия (рис. 28.9). Поскольку в месте слияния отсутствуют мускулы, это может стать препятствием. Реже в сердцах с изомерными правыми придатками предсердная перегородка может быть сформирована намного лучше, но все же легочные вены соединяются напрямую с одним из предсердий (рис.28.10). Такое расположение следует ожидать в сердцах с обычным или зеркальным расположением предсердий, но нам еще предстоит идентифицировать такой случай.
Рис. 28.9
Сердце пациента с изомерными придатками предсердий, показывающее, что все легочные вены дренируют через срединное фиброзное слияние.
Рис. 28.10
Сердце пациента с изомерными придатками правого предсердия. Обратите внимание на отсутствие коронарного синуса. Все легочные вены (стрелки) соединяются напрямую, но отдельно с правым предсердием.
Последний участок аномального соединения — и подкардиальный, и поддиафрагмальный. В этом случае легочные вены соединяются вместе, входя в нисходящую вертикальную вену, которая проходит в брюшную полость через пищеводное отверстие диафрагмы. Обычно он стекает в воротную вену или в один из ее притоков (рис. 28.11; видео 28.3). Дренирование нижней полой вены происходит очень редко. Когда инфракардиальное соединение находится с системой воротной вены, обструкция почти всегда присутствует после закрытия венозного протока.Как только этот компонент кровообращения плода закрылся, кровь должна пройти через ткани печени, чтобы достичь системных вен. Дополнительный дискретный стеноз может быть обнаружен, когда вертикальная вена проходит через диафрагму, в то время как канал также может разбиваться на дельту более мелких каналов, которые заканчиваются притоками воротной вены.
Дополнительный дискретный стеноз может быть обнаружен, когда вертикальная вена проходит через диафрагму, в то время как канал также может разбиваться на дельту более мелких каналов, которые заканчиваются притоками воротной вены.
Рис. 28.11
Инфрадиафрагмальная и инфракардиальная полностью аномальные соединения легочных вен. Пройдя в брюшную полость, венозное слияние оканчивается воротной венозной системой.
Во всех проиллюстрированных ситуациях мы показали аномальное соединение легочных вен, дренирующих их с одним и тем же местом в системной системе. Как уже говорилось, также возможно, что разные жилы оканчиваются в разных аномальных участках. Это называется смешанное аномальное соединение . Когда это видно, некоторые из вен могут соединиться друг с другом перед тем, как дренировать в одно из множества мест аномального соединения, но разные части легкого обычно дренируют через отдельные каналы.В очень редких случаях все легочные вены могут присоединиться к общему слиянию, но само слияние отводится через отдельные каналы, например, как в левую вертикальную вену, так и в коронарный синус. При всех этих паттернах смешанной аномальной связи существуют те же возможности для закупорки путей, как когда все легочные вены аномально стекают в одно и то же место, как обсуждалось ранее.
Даже исключая те случаи TAPVC, связанные с изомерными придатками правого предсердия, большая часть пациентов имеет значительные ассоциированные пороки развития.У этих пациентов, например, с аномальными вентрикулоартериальными связями или тетралогией Фалло, ассоциированная аномалия, вероятно, является основным поражением. Даже когда аномальная связь изолирована, почти всегда присутствует межпредсердная связь, так что венозная кровь может достигать левой стороны сердца. Предсердная перегородка может быть целой. Для этого требуется альтернативный путь, по которому кровь может попасть в левую часть сердца (см. Ниже).
У любого пациента с TAPVC размер левого предсердия и левого желудочка является очевидной проблемой для хирурга.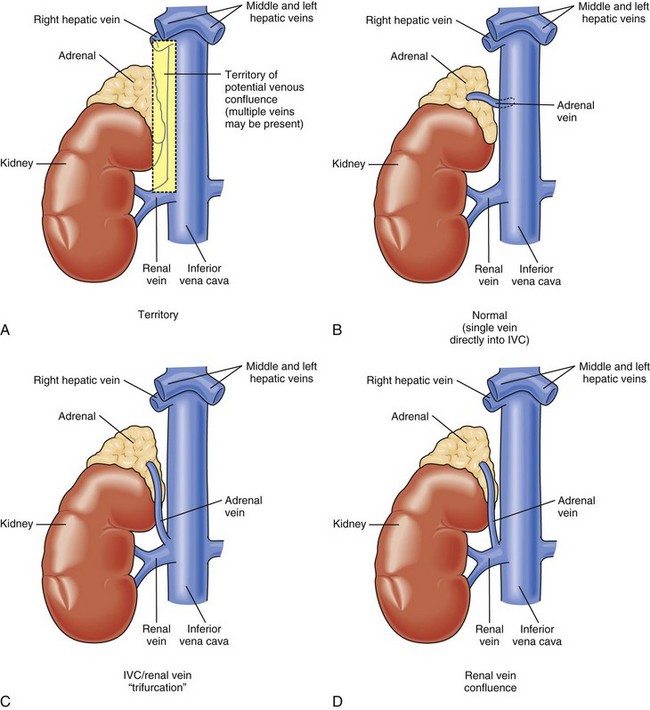 На первый взгляд эти структуры кажутся морфологу маленькими из-за несопоставимой гиперплазии правого предсердия и правого желудочка. Однако измерения показывают, что левосторонние структуры обычно имеют адекватные размеры. Редко бывает, чтобы между местом слияния легочных вен и левым предсердием было большое расстояние (см. Рис. 28.11). Взятые вместе, эти особенности служат для облегчения хирургического вмешательства практически у всех пациентов. Проблемы, если они существуют, скорее всего, будут обнаружены у пациентов со смешанным дренажом или в условиях изомерии морфологически придатков правого предсердия.
На первый взгляд эти структуры кажутся морфологу маленькими из-за несопоставимой гиперплазии правого предсердия и правого желудочка. Однако измерения показывают, что левосторонние структуры обычно имеют адекватные размеры. Редко бывает, чтобы между местом слияния легочных вен и левым предсердием было большое расстояние (см. Рис. 28.11). Взятые вместе, эти особенности служат для облегчения хирургического вмешательства практически у всех пациентов. Проблемы, если они существуют, скорее всего, будут обнаружены у пациентов со смешанным дренажом или в условиях изомерии морфологически придатков правого предсердия.
Дальнейшие проблемы могут возникнуть из-за изменений в легочной сосудистой сети. Вскрытие выявило изменения в венах у всех обследованных пациентов, включая умерших в первый день жизни, что указывает на то, что сами изменения происходят во время жизни плода. Вены приобретают артериальные характеристики, а с возрастом увеличивается мускулистость легочных артерий. Все эти особенности указывают на необходимость немедленного хирургического вмешательства после диагностики аномалии.
Морфогенез
Знание о развитии легочных вен дает хорошее объяснение аномальных легочных венозных соединений. Само развивающееся предсердие изначально связано со средостением через так называемый дорсальный мезокард, даже до образования зачатков легких из трахеи (см. Главу 3). По мере развития легких сплетение внутрилегочных вен соединяется с легочным венозным каналом, который проходит в развивающееся средостение.Вновь сформированная первичная легочная вена использует исходные соединения дорсального мезокарда для доступа к предсердному компоненту развивающейся сердечной трубки. После нормального слияния с развивающимися внутрилегочными венозными сплетениями сами легочные вены «каннибализируются» предсердием с образованием венозных компонентов нормального морфологически левого предсердия. Это происходит относительно поздно в развитии. TAPVC является следствием недостаточности канализации легочного венозного канала в средостение. Первоначально, поскольку сами легочные зачатки происходят из передней кишки, внутрилегочные вены также связаны с системной венозной системой. Если легочный венозный канал не развивается, эти анастомозы между легочной и системной венозными системами сохраняются и расширяются. Анастомоз с передней кардинальной системной венозной системой приводит к надкардиальному аномальному соединению. Анастомоз с системным венозным синусом или левым рогом синуса создает сердечное соединение, тогда как инфрадиафрагмальное соединение является следствием анастомоза с омфаломезентериальной системой.В самом строгом смысле эти анастомозы не являются ни аномальными, ни легочными. Если они сохраняются, они обязательно приводят к аномальному соединению легочных вен. В редких случаях можно найти сердце, в котором легочный венозный канал сформировался, но стал атретическим по ходу между предсердием и внутрилегочными венозными сплетениями. Действительно, иногда легочные вены могут прилегать к левому предсердию, но мускулатура присутствует между двумя компонентами развития. Аномальный канал, аналогичный лево-предсердной кардинальной вене, обеспечивает единственный путь оттока легочной венозной крови.Все эти примеры легко объяснить с помощью гипотезы развития, обсуждавшейся ранее. Следует отметить, что, хотя развитие нормальной анатомии легочных вен хорошо изучено, текущие мысли о развитии аномальных легочных венозных связей являются предположительными, основанными на сочетании морфологических наблюдений и результатов нормального развития. Поэтому это обсуждение следует рассматривать в свете этой оговорки.
Первоначально, поскольку сами легочные зачатки происходят из передней кишки, внутрилегочные вены также связаны с системной венозной системой. Если легочный венозный канал не развивается, эти анастомозы между легочной и системной венозными системами сохраняются и расширяются. Анастомоз с передней кардинальной системной венозной системой приводит к надкардиальному аномальному соединению. Анастомоз с системным венозным синусом или левым рогом синуса создает сердечное соединение, тогда как инфрадиафрагмальное соединение является следствием анастомоза с омфаломезентериальной системой.В самом строгом смысле эти анастомозы не являются ни аномальными, ни легочными. Если они сохраняются, они обязательно приводят к аномальному соединению легочных вен. В редких случаях можно найти сердце, в котором легочный венозный канал сформировался, но стал атретическим по ходу между предсердием и внутрилегочными венозными сплетениями. Действительно, иногда легочные вены могут прилегать к левому предсердию, но мускулатура присутствует между двумя компонентами развития. Аномальный канал, аналогичный лево-предсердной кардинальной вене, обеспечивает единственный путь оттока легочной венозной крови.Все эти примеры легко объяснить с помощью гипотезы развития, обсуждавшейся ранее. Следует отметить, что, хотя развитие нормальной анатомии легочных вен хорошо изучено, текущие мысли о развитии аномальных легочных венозных связей являются предположительными, основанными на сочетании морфологических наблюдений и результатов нормального развития. Поэтому это обсуждение следует рассматривать в свете этой оговорки.
Патофизиология
Шунты
Обязательное шунтирование слева направо, так как возврат из легочной вены осуществляется в системные вены или правое предсердие.Системный выброс может поддерживаться только при наличии шунта справа налево, который почти всегда на уровне предсердий. Как уже говорилось, были описаны исключительные случаи, когда межпредсердная перегородка была интактной. У этих пациентов шунт справа налево происходил либо на уровне желудочков, либо на уровне протоков.
У этих пациентов шунт справа налево происходил либо на уровне желудочков, либо на уровне протоков.
Когда шунт справа налево находится на уровне предсердий, паттерн кровотока у плода имеет тенденцию поддерживаться клапанным механизмом овального отверстия. Таким образом, у большинства пациентов с инфрадиафрагмальным соединением насыщенная кислородом кровь, восходящая по нижней полой вене к правому предсердию, направляется к левому предсердию.Системная сатурация артериальной крови кислородом соответственно выше, чем в легочных артериях. Когда аномальное венозное соединение находится над сердцем, насыщенная кислородом кровь имеет тенденцию направляться вниз по верхней полой вене и через трикуспидальный клапан. Следовательно, у некоторых из этих пациентов легочная артериальная кровь более насыщена кислородом, чем системная артериальная кровь. При наличии открытого артериального протока такая структура кровотока может привести к обратному дифференциальному цианозу с более высоким насыщением кислородом в верхних конечностях, чем в нижних.В остальных смешивание завершено. Аналогичные закономерности обнаруживаются при аномальном соединении с коронарным синусом. Предположительно это связано с тем, что устье коронарного синуса больше направлено к трехстворчатому клапану, чем к овальной ямке.
Обструкция возврата в легочную вену
Обструкция возврата в легочную вену может возникнуть в любом из анатомических участков, задокументированных ранее. Младенцы с признаками пограничной венозной обструкции должны быть повторно обследованы, поскольку сочетание снижения легочного сосудистого сопротивления и повышенного кровотока к легким, обычно наблюдаемого в послеродовой период, может выявить более серьезную обструкцию.Когда имеется определенная обструкция, давление в правом желудочке обычно надсистемное. Есть много младенцев, особенно с возвращением в коронарный синус, у которых систолическое давление в двух желудочках более или менее одинаково, несмотря на отсутствие какой-либо определяемой обструкции.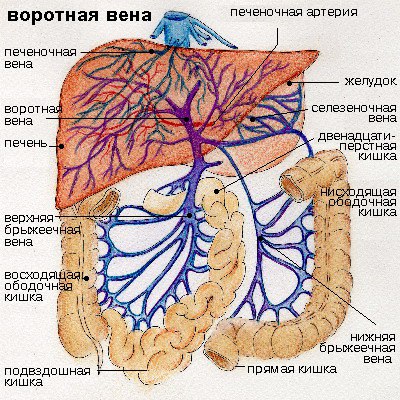 Действительно, в одном исследовании не было обнаружено значительной разницы в систолическом давлении, измеренном ни в правом желудочке, ни в легочных артериях между пациентами с обструкцией и без, а также с надсердными или внутрисердечными связями.Это говорит о том, что основной причиной легочной гипертензии у пациентов без явной обструкции легочных вен является повышение легочного сопротивления, предположительно в результате расширения мышц в периферические артериолы и вены. Если это причина, то почти неизменное восстановление нормального состояния после успешного ремонта указывает на то, что процесс обратим. В качестве альтернативы, по крайней мере, часть проблемы может быть результатом невыявленных анатомических причин обструкции легочных вен.
Действительно, в одном исследовании не было обнаружено значительной разницы в систолическом давлении, измеренном ни в правом желудочке, ни в легочных артериях между пациентами с обструкцией и без, а также с надсердными или внутрисердечными связями.Это говорит о том, что основной причиной легочной гипертензии у пациентов без явной обструкции легочных вен является повышение легочного сопротивления, предположительно в результате расширения мышц в периферические артериолы и вены. Если это причина, то почти неизменное восстановление нормального состояния после успешного ремонта указывает на то, что процесс обратим. В качестве альтернативы, по крайней мере, часть проблемы может быть результатом невыявленных анатомических причин обструкции легочных вен.
Роль овального отверстия в проблеме неоднозначна.Теоретически закупорка этого отверстия приводит к высокому давлению в правом предсердии, которое препятствует легочному венозному оттоку и, таким образом, вызывает легочную гипертензию. Однако Гатман и Надас аргументировали это по трем причинам, что значительная обструкция легочного венозного возврата на уровне предсердий была редкостью. Во-первых, пациенты как группа имели одинаковое давление в правом предсердии, независимо от того, были ли они легочной гипертензией или нет. Во-вторых, около трети пациентов с легочной гипертензией не имели градиента давления на уровне предсердий.Действительно, в некоторых случаях среднее давление в левом предсердии было выше, чем в правом. В-третьих, почти все пациенты с обструкцией легочных сосудов также имели обструкцию легочных вен. Хотя эти аргументы убедительны в отношении незначительной роли овального отверстия в развитии легочной гипертензии, они не исключают возможность того, что небольшое отверстие может ограничивать системный кровоток.
Последствия обструкции легочной вены
При беспрепятственном оттоке легочной вены диастолическое давление правого желудочка низкое, а податливость правого желудочка относительно высокая.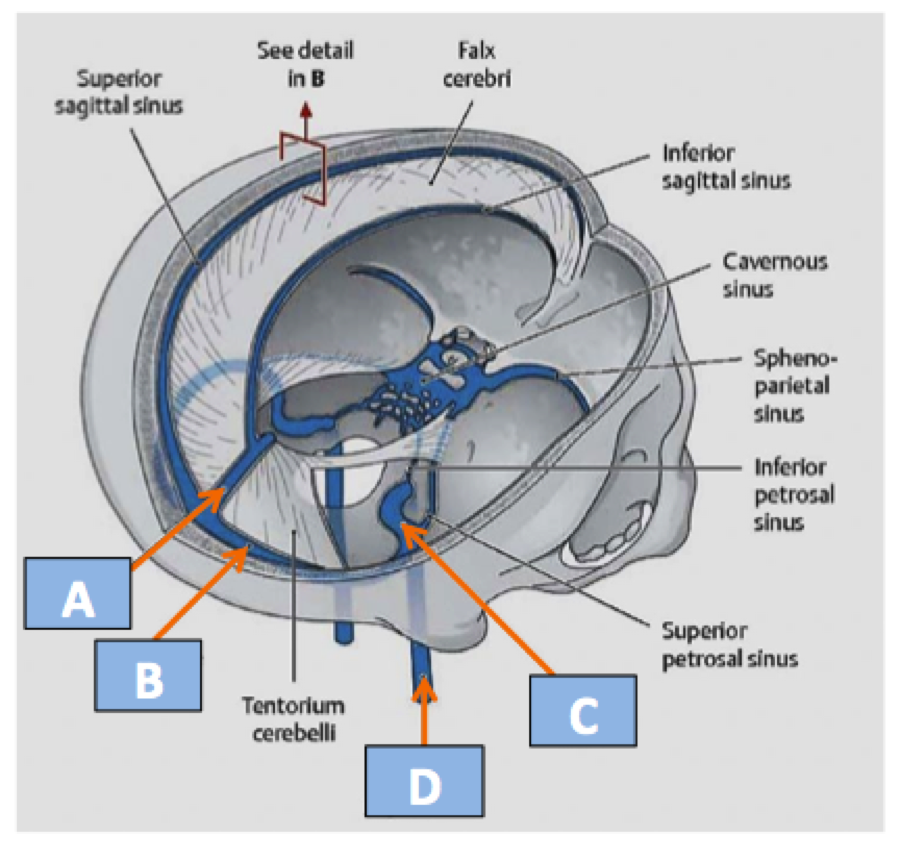 Следовательно, кровь, возвращающаяся в правое предсердие, имеет тенденцию попадать в правый желудочек, а не в левое предсердие. Приток крови к легким имеет тенденцию значительно превышать кровоток в системном контуре. В результате значительно увеличиваются конечный диастолический и ударный объемы правого желудочка. Поскольку смешивание легочной и системной венозной крови является полным, за исключением незначительных степеней перетока, описанных ранее, правопредсердная и, следовательно, системная артериальная кровь хорошо насыщена кислородом, причем уровень насыщения кислородом превышает 90%.
Следовательно, кровь, возвращающаяся в правое предсердие, имеет тенденцию попадать в правый желудочек, а не в левое предсердие. Приток крови к легким имеет тенденцию значительно превышать кровоток в системном контуре. В результате значительно увеличиваются конечный диастолический и ударный объемы правого желудочка. Поскольку смешивание легочной и системной венозной крови является полным, за исключением незначительных степеней перетока, описанных ранее, правопредсердная и, следовательно, системная артериальная кровь хорошо насыщена кислородом, причем уровень насыщения кислородом превышает 90%.
Напротив, при обструкции легочных вен давление в легочных венах повышается. Если давление достаточно сильное, возникает отек легких, хотя бронхолегочные венозные анастомозы могут в некоторой степени снизить давление. В тяжелых случаях давление в легочной артерии повышается даже выше системного давления, и легочный кровоток снижается. Поэтому правый желудочек становится перегруженным давлением, а не объемом. Системная сатурация артериальной крови кислородом может упасть до значений от 20% до 30%.Снижение системной сатурации артериальной крови и, возможно, выброса приводит к гипоксемии тканей и метаболическому ацидозу. Эти эффекты обструкции легочных вен усугубляются уже описанными изменениями в мелких легочных венах и артериях, которые могут еще больше увеличивать сопротивление легочных сосудов.
У случайных пациентов, которые выживают в младенчестве без тяжелой обструкции легочных вен, может развиться поздняя обструктивная болезнь легочных сосудов, как и у пациентов с дефектом межпредсердной перегородки.Эффекты такие же, как и при обструкции легочных вен, за исключением того, что отек легких не возникает.
Представление и симптомы
Очень редко TAPVC может проявляться как внезапная смерть в первые 2 месяца жизни. Еще в 1962 году Hastreiter и его коллеги признали, что основным фактором, определяющим клиническую картину, является наличие обструкции легочных вен. Следовательно, для каждого из следующих разделов, касающихся клинической картины, пациенты будут разделены на пациентов с обструкцией легочных вен и без нее.Некоторые пациенты с незначительной обструкцией попадают между двумя группами и проявляют черты обеих.
Следовательно, для каждого из следующих разделов, касающихся клинической картины, пациенты будут разделены на пациентов с обструкцией легочных вен и без нее.Некоторые пациенты с незначительной обструкцией попадают между двумя группами и проявляют черты обеих.
Пациенты с тяжелой обструкцией легочных вен, поступающие в первые или две недели жизни с явным цианозом и затруднениями с кормлением и дыханием. В отличие от того, что наблюдается при респираторном дистресс-синдроме, хрипящее дыхание очень редко наблюдается при затрудненном венозном оттоке. Признаками респираторного дистресс-синдрома, а не полностью аномальной легочной связи, являются материнский диабет, недоношенность, кесарево сечение и очень раннее начало респираторных заболеваний.Любой из них или все они могут быть обнаружены при аномальном соединении легочных вен. В исследовании реестра Общества экстракорпорального жизнеобеспечения в 1992 году, в котором находилось 4823 пациента, считалось, что у 623 пациентов наблюдается постоянное кровообращение плода. Из них у 10% были выявлены врожденные пороки сердца. Около половины из них имели TAPVC, а 10% имели полную транспозицию. Это подчеркивает, насколько легко без проведения эхокардиографии принять TAPVC за постоянное кровообращение плода. Уникальный способ проявления — гематемезис — был описан у одного пациента с инфрадиафрагмальным возвратом в левую желудочную вену.Другой уникальный режим — тяжелая неконъюгированная гипербилирубинемия на фоне инфрадиафрагмального возврата. Пациент пережил обменное переливание крови и хирургическое вмешательство.
Пациенты без тяжелой обструкции легочных вен, как правило, имеют сердечную недостаточность в возрасте 2–3 месяцев. У них были проблемы с кормлением, а иногда и инфекции дыхательных путей. Цианоз обычно не является симптомом.
Люди с тяжелой обструкцией легочных вен — это больные новорожденные с явным или тяжелым цианозом.Пятна на коже являются частыми, что отражает плохую периферическую перфузию и метаболический ацидоз. Обычно выражено тахипноэ, хотя дыхание спокойное. Гепатомегалия иногда бывает значительной, особенно когда дренаж идет в воротную вену. Периферические импульсы часто несколько слабые. В прекордиуме тихо. При аускультации шумов обычно нет. Если шум действительно существует, он обычно невпечатляет и носит срединный систолический характер. Иногда венозный шум слышен в области, где затруднен возврат легочной вены, например, под левой ключицей в аномальном соединении через левую вертикальную вену.Первый звук сердца является одиночным, а второй тон сердца описывается как «физиологическое» или «фиксированное» расщепление. Усилен легочный компонент, может быть слышен четвертый тон сердца. Редко второй тон сердца кажется одиночным.
Обычно выражено тахипноэ, хотя дыхание спокойное. Гепатомегалия иногда бывает значительной, особенно когда дренаж идет в воротную вену. Периферические импульсы часто несколько слабые. В прекордиуме тихо. При аускультации шумов обычно нет. Если шум действительно существует, он обычно невпечатляет и носит срединный систолический характер. Иногда венозный шум слышен в области, где затруднен возврат легочной вены, например, под левой ключицей в аномальном соединении через левую вертикальную вену.Первый звук сердца является одиночным, а второй тон сердца описывается как «физиологическое» или «фиксированное» расщепление. Усилен легочный компонент, может быть слышен четвертый тон сердца. Редко второй тон сердца кажется одиночным.
Если смотреть с конца кровати, пациенты без тяжелой обструкции легочных вен напоминают пациентов с большим дефектом межжелудочковой перегородки. Они тощие и тахипноэтические, с втяжками. Наличие цианоза, безусловно, можно не заметить, если обследовать младенца при плохом освещении.Даже при хорошем освещении его можно не обнаружить. Обычно наблюдается гепатомегалия, и в легких вполне могут выслушиваться хрипы.
Периферический пульс нормальный или слабый, прекордиум гиперактивен, но без каких-либо ощущений. При аускультации первый тон сердца в норме и обычно наблюдается широкое фиксированное расщепление второго звука. Систолический шум выброса слышен в легочной области из-за чрезмерного кровотока через легочный клапан. Средний диастолический шум обычно слышен у нижней левой границы грудины, что свидетельствует о чрезмерном потоке через трикуспидальный клапан.
Пациенты без легочной венозной обструкции очень редко выживают в младенчестве без выявления сердечных заболеваний. Эти пациенты поступают так же, как и типичный пациент с дефектом межпредсердной перегородки, но с дополнительными признаками легкого цианоза и клубочков.
Исследования
Рентгенография грудной клетки
Новорожденные с тяжелой обструкцией легочных вен имеют характерную рентгенограмму грудной клетки с маленьким или нормальным размером сердца, обрамленным полями легких из матового стекла (рис.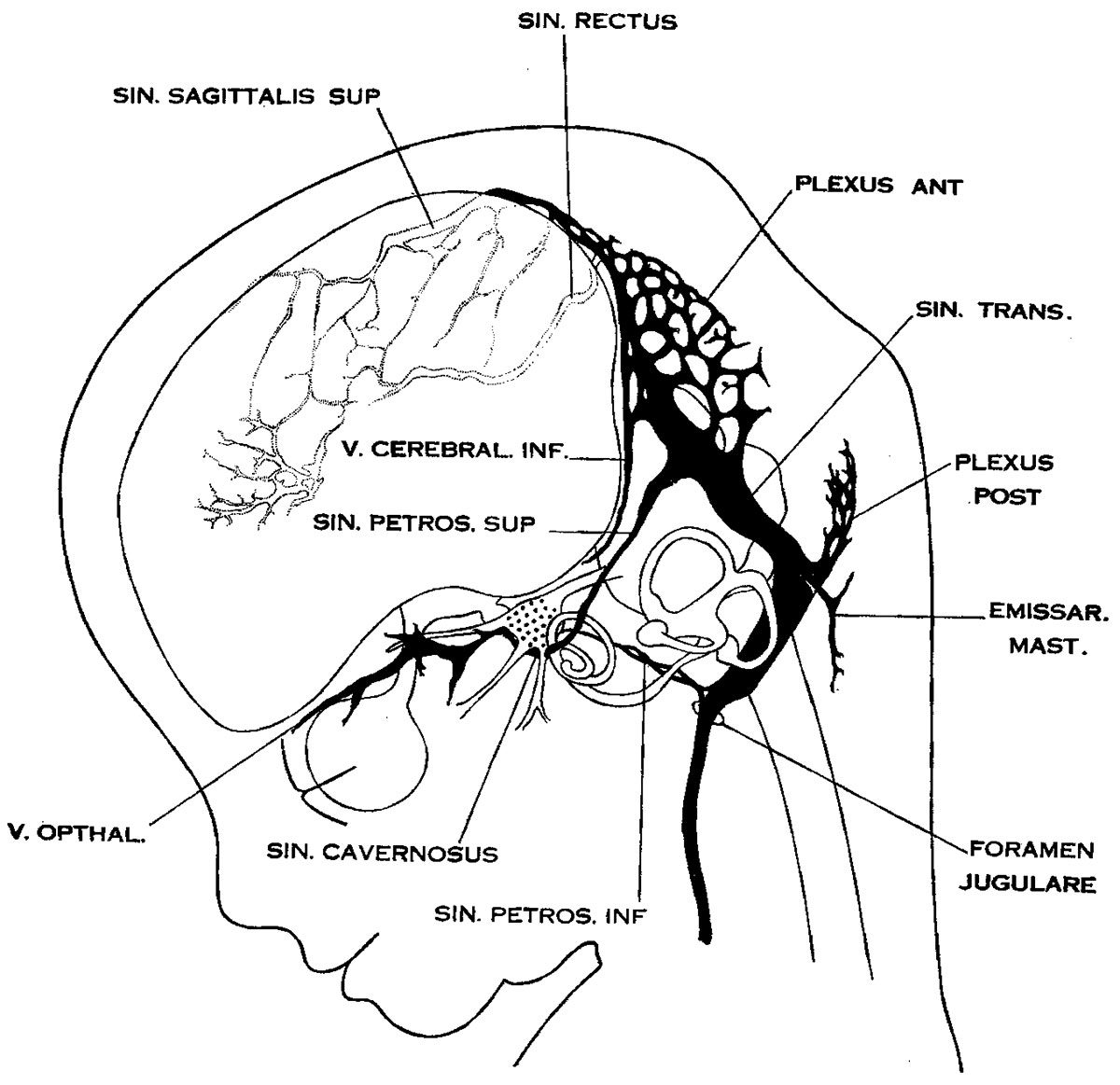 28.12). Иногда можно увидеть линии Керли B. Эти проявления иногда путают с проявлениями респираторного дистресс-синдрома. Однако, в отличие от респираторного дистресс-синдрома, обструкция легочных вен обычно приводит к равномерному распределению изменений в полях легких. Более того, облитерация части или всего сердечного силуэта и появление воздушной бронхограммы очень характерны для респираторного дистресс-синдрома и редко встречаются у пациентов с ТАПВК.
28.12). Иногда можно увидеть линии Керли B. Эти проявления иногда путают с проявлениями респираторного дистресс-синдрома. Однако, в отличие от респираторного дистресс-синдрома, обструкция легочных вен обычно приводит к равномерному распределению изменений в полях легких. Более того, облитерация части или всего сердечного силуэта и появление воздушной бронхограммы очень характерны для респираторного дистресс-синдрома и редко встречаются у пациентов с ТАПВК.
Рис.28.12
Рентгенограмма грудной клетки, типичная для обструкции полностью аномального соединения легочных вен, показывающая вид матового стекла в обоих полях легких и небольшую сердечную тень.
У пациентов без тяжелой обструкции легочных вен сердца увеличены из-за перегрузки объемом правого желудочка вместе с набухшими полями легких. Легочный ствол становится заметным у пожилых пациентов, как и левая вертикальная вена, когда это место аномального венозного соединения.Это приводит к появлению «снеговика», известного почти каждому педиатру и также описываемого как «W.C. Сердце поля «. Сейчас это имеет в основном историческое значение, потому что у пациентов обычно исправляют дефект задолго до того, как успевает появиться снеговик, что раньше было на втором году жизни. Менее одной трети младенцев с надсердечным аномальным соединением демонстрируют снеговика. Однако редко о снеговиках сообщают уже в 3-месячном возрасте.
Электрокардиография
Электрокардиограмма показывает отклонение оси вправо с петлей во фронтальной плоскости по часовой стрелке и гипертрофией правого желудочка.V1 обычно показывает картину rsR ’, хотя qR наблюдается у 80% пациентов. Можно подумать, что последнее указывает на наличие более тяжелой легочной гипертензии, но корреляция между ними плохая. Нарушения проводимости редки. В возрасте до 1 месяца только около 1 из 12 пациентов имеет гипертрофию правого предсердия, тогда как это наблюдается у 75% в период от 1 до 3 месяцев и у 90% в течение 3 месяцев. Пациенты с обструкцией легочных вен в более молодом возрасте гораздо реже имеют гипертрофию правого предсердия, чем пациенты без обструкции легочных вен.
Пациенты с обструкцией легочных вен в более молодом возрасте гораздо реже имеют гипертрофию правого предсердия, чем пациенты без обструкции легочных вен.
Эхокардиография
Эхокардиография — это окончательный неинвазивный метод диагностики. Еще в 1979 году было показано, что возможно визуализировать по крайней мере одну вену, соединенную с левым предсердием, у 94% младенцев в возрасте до 3 месяцев с нормально соединенными легочными венами и по крайней мере две в 77%. Корреляционные анатомические исследования показывают, что подреберный и апикальный доступы визуализируют нормальные левую нижнюю и правую верхние легочные вены, тогда как надгрудинный доступ при хорошем окне может продемонстрировать все четыре.Таким образом, современные методы должны иметь возможность продемонстрировать нормальные легочные венозные связи у всех новорожденных и младенцев. Любой младенец, у которого не могут быть четко видны нормальные легочные венозные связи, должен быть отправлен на дальнейшую визуализацию, будь то дополнительная эхокардиография или другие методы (см. Ниже).
Когда выполняется эхокардиограмма, есть определенные подсказки, которые должны направить к диагностике TAPVC. Исключительное шунтирование справа налево на уровне предсердий (через дефект межпредсердной перегородки или открытое овальное отверстие) является ненормальным в любых условиях и не должно рассматриваться как результат гипертензии правого желудочка (рис.28.13). Следует предполагать, что у любого пациента с этим открытием есть TAPVC, пока не будет доказано обратное. Другие признаки включают небольшое левое предсердие, расширенную верхнюю полую вену (рис. 28.14), непульсирующий каудально направленный поток, видимый ниже уровня сердца при визуализации подреберья, или непульсирующий краниально направленный поток, видимый выше уровня сердца. Каждый из этих открытий должен побудить кого-то задуматься о возможности TAPVC.
Рис. 28.13
Эхокардиографические изображения, показывающие основные результаты, которые должны вызвать подозрение на полностью аномальное соединение легочных вен.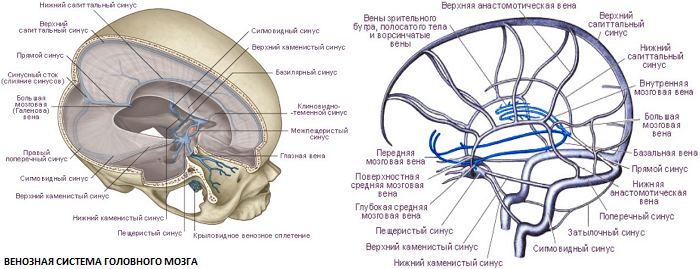 (A) Это изображение, полученное в субкостальной плоскости по короткой оси, показывает исключительно поток справа налево в межпредсердной перегородке. Когда это открытие присутствует, необходимо окончательно идентифицировать наличие или отсутствие легочных венозных соединений с левым предсердием. (B) Это изображение, сделанное в плоскости подреберья по длинной оси, показывает структуру кзади от левого предсердия. Это открытие должно вызвать подозрение на слияние легочных вен, которое можно отличить от легочной артерии с помощью цветного и спектрального допплера.Кроме того, створчатый клапан овального отверстия сдвигается вправо (стрелка) , что соответствует потоку справа налево в межпредсердной перегородке. C, Confluence; ЛА, левое предсердие; RA, правое предсердие.
(A) Это изображение, полученное в субкостальной плоскости по короткой оси, показывает исключительно поток справа налево в межпредсердной перегородке. Когда это открытие присутствует, необходимо окончательно идентифицировать наличие или отсутствие легочных венозных соединений с левым предсердием. (B) Это изображение, сделанное в плоскости подреберья по длинной оси, показывает структуру кзади от левого предсердия. Это открытие должно вызвать подозрение на слияние легочных вен, которое можно отличить от легочной артерии с помощью цветного и спектрального допплера.Кроме того, створчатый клапан овального отверстия сдвигается вправо (стрелка) , что соответствует потоку справа налево в межпредсердной перегородке. C, Confluence; ЛА, левое предсердие; RA, правое предсердие.
Рис. 28.14
Изображение, полученное с продольной оси подреберья под углом назад, демонстрирует сильно расширенную верхнюю полую вену (SCV), впадающую в правое предсердие (RA), что свидетельствует о наличии аномальной легочной вены. связь.Дальнейшее обследование выявило полностью аномальное соединение легочной вены с левой брахиоцефальной веной.
Неспособность продемонстрировать легочную вену, соединенную с левым предсердием, должна привести к тщательному поиску ключевого положительного признака, необходимого для диагностики. Это слияние легочных вен или собирательный венозный канал, который был обнаружен у 21 из 23 пациентов, исследованных Смоллхорном и его коллегами. Как было подчеркнуто, когда легочные вены аномально связаны с коронарным синусом, собирающий венозный канал часто является самим коронарным синусом.С нескольких точек зрения слияние можно увидеть как безэховую непульсирующую область позади левого предсердия и четко отделенную от него (см. Рис. 28.13). Следует проявлять осторожность, чтобы отличить это слияние от легочной артерии. Легочные артерии берут начало от легочного ствола, располагаются кпереди и обычно пульсируют. Субкостальные и парастернальные виды по короткой оси также демонстрируют размер межпредсердной коммуникации. Характерное изображение легочных вен, входящих в слияние, получается в надгрудинной или парастернальной проекции по короткой оси.Вертикальную вену легко идентифицировать из надгрудинного доступа (рис. 28.15). Слияние также может быть более длинным каналом, последовательно собирающим отдельные вены, и, что еще реже, может быть несколько удалено от левого предсердия. После обнаружения слияния необходимо определить его связь с системным венозным кровообращением.
Субкостальные и парастернальные виды по короткой оси также демонстрируют размер межпредсердной коммуникации. Характерное изображение легочных вен, входящих в слияние, получается в надгрудинной или парастернальной проекции по короткой оси.Вертикальную вену легко идентифицировать из надгрудинного доступа (рис. 28.15). Слияние также может быть более длинным каналом, последовательно собирающим отдельные вены, и, что еще реже, может быть несколько удалено от левого предсердия. После обнаружения слияния необходимо определить его связь с системным венозным кровообращением.
Рис. 28.15
Эхокардиографические изображения у пациента с надкардиальной формой полностью аномального соединения легочных вен.(A) Изображение надгрудинной выемки, показывающее дренаж легочной вены до слияния (Со), с дренажом вверх через вертикальную вену (VV) к левой брахиоцефальной вене (не показана). Основная легочная артерия (MPA) расширена, что часто встречается у пациентов с аномальным оттоком легочных вен. (B) Изображение надгрудинной выемки, показывающее расширенную брахиоцефальную вену (BCV) и верхнюю полую вену (SCV). Обратите внимание, что эти вены намного больше, чем аорта нормального размера (АО), что должно вызывать подозрение на суперкардиальное полностью аномальное соединение легочных вен.(C) Импульсно-волновой доплеровский анализ в вертикальной вене, выявляющий фазовый низкоскоростной поток, который является типичной картиной потока при отсутствии препятствий.
Нисходящую вену, обнаруженную в аномальном инфрадиафрагмальном соединении, иногда можно увидеть, спускающуюся от места слияния с надгрудинным доступом. Гораздо чаще нисходящую вену находят, помещая датчик так, чтобы получить субкостальный разрез по короткой оси аорты или нижней полой вены, а затем сканировать слева направо.Нисходящая вена узнается, поскольку она проникает в диафрагму (рис. 28.16). Для оценки направления и пульсации любого сосуда, пересекающего диафрагму, следует использовать спектральный и цветной допплерографию. Он отличается от аорты отсутствием пульсации и отсутствием связи с верхней брыжеечной артерией. Он отличается от нижних полых и печеночных вен направлением кровотока, невозможностью проникновения в то или иное предсердие и тем фактом, что он берет начало за сердцем.Если местом окончания является воротная вена, нисходящая вена часто выглядит как палец, указывающий вперед от пищеводного отверстия в направлении печеночного портала. По нашему опыту, этих отличительных черт достаточно для диагностики.
Он отличается от аорты отсутствием пульсации и отсутствием связи с верхней брыжеечной артерией. Он отличается от нижних полых и печеночных вен направлением кровотока, невозможностью проникновения в то или иное предсердие и тем фактом, что он берет начало за сердцем.Если местом окончания является воротная вена, нисходящая вена часто выглядит как палец, указывающий вперед от пищеводного отверстия в направлении печеночного портала. По нашему опыту, этих отличительных черт достаточно для диагностики.
Рис. 28.16
Эхокардиографические изображения, сделанные у пациента с инфракардиальным полностью аномальным соединением легочной вены с воротной веной. (A) Вид по длинной оси подреберья показывает вертикальную вену (VV), пересекающую диафрагму (стрелка) и соединяющуюся с воротной веной (PV), с турбулентностью по цветному доплеровскому изображению.(B) Вид по короткой оси подреберья показывает расширенную печеночную вену (HV), входящую в правое предсердие (RA). (C) Спектральное доплеровское измерение в вертикальной вене. Обратите внимание на высокую скорость с уменьшенной фазностью по сравнению с рис. 28.15, что соответствует венозной обструкции.
Вертикальная вена, направленная вверх, лучше всего видна из надгрудинного доступа, в котором легко визуализируется ее соединение с брахиоцефальной веной. Вертикальную вену обычно можно проследить от места слияния, особенно потому, что ее первоначальный восходящий ход и слияние часто можно увидеть на подреберных и апикальных разрезах.Для оценки направления и пульсации любого сосуда, соединяющегося с брахиоцефальной веной снизу, следует использовать импульсную и цветную допплерографию. Аналогичные правила применяются, когда вертикальная вена поднимается вверх в правом паравертебральном желобе и заканчивается неположенной веной.
Если ни восходящая, ни нисходящая вена не идентифицирована, аномальное соединение наиболее вероятно либо с коронарным синусом, верхней полой веной, либо непосредственно с правым предсердием. Если речь идет о коронарном синусе, эта структура, которую лучше всего идентифицировать на поперечных срезах в парастернальном разрезе по длинной оси или в апикальном четырехкамерном разрезе, поскольку он лежит в пределах левой предсердно-желудочковой борозды, будет увеличена и будет выпирать переднезаднее в левое предсердие. .Следует проявлять особую осторожность, чтобы различать увеличение коронарного синуса из-за стойкости левой верхней полой вены и паттерн, по которому легочные вены впадают в нее. Цветной допплер может использоваться для идентификации легочных вен, дренирующих в пазуху (рис. 28.17). Изображенный таким образом нижний край коронарного синуса соответствует атриовентрикулярному соединению. Если верхний край лежит более или менее параллельно ему, это предполагает соединение с левой верхней полой веной.Если, однако, верхний край выпячивается вверх, следует подозревать аномальное соединение легочных вен. Это различие можно подтвердить, сделав небольшие наклонные и вращательные движения датчика, которые покажут аномально соединяющиеся легочные вены. Аномальное соединение с правым предсердием или верхней полой веной может быть диагностировано, если нет восходящей или нисходящей вены, коронарный синус нормального размера и легочные вены можно проследить до места их входа в правое предсердие или верхнюю полую вену. ( Рисунок.28.18). Эхокардиографу следует рассмотреть возможность измерения диаметра всех четырех легочных вен между воротами и впадиной, поскольку сумма этих диаметров является надежным и независимым показателем выживаемости после операции. Большинство поздних смертей в этом исследовании были результатом индивидуального стеноза легочных вен (ПВС) на участках, удаленных от хирургического анастомоза в левое предсердие. У пожилых пациентов может быть трудно визуализировать легочные вены из прекордиальной области. В этих обстоятельствах наиболее полезными могут быть чреспищеводная эхокардиография, компьютерная томографическая ангиография (КТА) или магнитно-резонансная томография (МРТ).
Если речь идет о коронарном синусе, эта структура, которую лучше всего идентифицировать на поперечных срезах в парастернальном разрезе по длинной оси или в апикальном четырехкамерном разрезе, поскольку он лежит в пределах левой предсердно-желудочковой борозды, будет увеличена и будет выпирать переднезаднее в левое предсердие. .Следует проявлять особую осторожность, чтобы различать увеличение коронарного синуса из-за стойкости левой верхней полой вены и паттерн, по которому легочные вены впадают в нее. Цветной допплер может использоваться для идентификации легочных вен, дренирующих в пазуху (рис. 28.17). Изображенный таким образом нижний край коронарного синуса соответствует атриовентрикулярному соединению. Если верхний край лежит более или менее параллельно ему, это предполагает соединение с левой верхней полой веной.Если, однако, верхний край выпячивается вверх, следует подозревать аномальное соединение легочных вен. Это различие можно подтвердить, сделав небольшие наклонные и вращательные движения датчика, которые покажут аномально соединяющиеся легочные вены. Аномальное соединение с правым предсердием или верхней полой веной может быть диагностировано, если нет восходящей или нисходящей вены, коронарный синус нормального размера и легочные вены можно проследить до места их входа в правое предсердие или верхнюю полую вену. ( Рисунок.28.18). Эхокардиографу следует рассмотреть возможность измерения диаметра всех четырех легочных вен между воротами и впадиной, поскольку сумма этих диаметров является надежным и независимым показателем выживаемости после операции. Большинство поздних смертей в этом исследовании были результатом индивидуального стеноза легочных вен (ПВС) на участках, удаленных от хирургического анастомоза в левое предсердие. У пожилых пациентов может быть трудно визуализировать легочные вены из прекордиальной области. В этих обстоятельствах наиболее полезными могут быть чреспищеводная эхокардиография, компьютерная томографическая ангиография (КТА) или магнитно-резонансная томография (МРТ).
Рис. 28.17
Вид по длинной оси подреберья у пациента с полностью аномальным соединением легочной вены с коронарным синусом. Зонд прошел ниже левого предсердия, чтобы выявить правые легочные вены (RPV) и левую нижнюю легочную вену (LLPV), дренирующие в расширенный коронарный синус (CS), который впоследствии дренирует в правое предсердие (RA). Левая верхняя легочная вена не видна на этом изображении, но она также впадает в коронарный синус (Видео 28.4 и 28,5).
Рис. 28.18
Эхокардиографические изображения, сделанные у пациента с суперкардиальным полностью аномальным соединением легочной вены с дренажом в верхнюю полую вену. (A) Изображение в субкостальной плоскости по длинной оси показывает большое слияние легочных вен (C) кзади от левого предсердия (LA), с прямым соединением с верхней полой веной (SCV). (B) Изображение в субкостальной плоскости короткой оси также отображает слияние легочных вен (C), которое соединяется непосредственно с задней стенкой SCV ниже правой легочной артерии (RPA) (видео 28.6). RA, Правое предсердие.
Цветной допплер очень важен для диагностики у этих пациентов. Во-первых, становится невозможным спутать левую вертикальную вену, дренирующуюся к брахиоцефальной вене, со стойкой левой верхней полой веной, за исключением крайне маловероятной связи с атрезией коронарного синуса. Различия, продемонстрированные в направлении потока, одинаково применимы к различию между нижней полой веной и нисходящим легочным венозным путем. Во-вторых, если есть сомнения относительно того, является ли полученное изображение подлинной легочной веной или артефактом, демонстрация цвета внутри структуры указывает на то, что она сосудистая.В-третьих, места обструкции легочного венозного пути могут быть продемонстрированы как точки турбулентности (см. Рис. 28.16) или даже отсутствия кровотока как до операции, так и после операции. Как важно при цветной допплеровской визуализации любой венозной структуры, необходимо соблюдать осторожность, чтобы обеспечить соответствующий предел Найквиста для оптимального выявления оттока и обструкции легочных вен.
В областях, где цветной допплер предполагает наличие препятствий, импульсный допплер предлагает объективное измерение. Характерной особенностью является наличие очагового увеличения скорости потока с непрерывным нефазовым потоком в дистальном направлении (см.рис.28.16). Чувствительность 100% и специфичность 85% заявлены для обнаружения обструкции с помощью поперечного сечения и цветного допплера.
В настоящее время стандартом лечения является диагностика и восстановление TAPVC на основе только эхокардиографии. В 1983 году Stark и его коллеги впервые сообщили об успешном восстановлении TAPVC у шести младенцев без предшествующей катетеризации сердца. Последующий опыт подтверждает, что квалифицированное использование поперечной эхокардиографии позволяет избежать необходимости в дополнительных исследованиях у большинства пациентов.Однако смешанный полностью аномальный возврат легочных вен не всегда может быть полностью выявлен с помощью эхокардиографии. Если клинические данные и результаты поперечной эхокардиографии не соответствуют клиническому сценарию, необходимо без колебаний провести дополнительную визуализацию.
Ультразвуковая технология продвинулась до такой степени, что стало возможно диагностировать ТАПВК с помощью эхокардиографии плода, хотя ее часто пропускают при скрининговых ультразвуковых исследованиях из-за отсутствия дополнительных сердечных аномалий. Наличие слияния позади левого предсердия, вертикальной вены, расширенного коронарного синуса или верхней полой вены или расширенного промежутка между нисходящей аортой и задней стенкой левого предсердия являются наиболее последовательными эхокардиографическими подсказками.Как и в случае послеродовой эхокардиографии, цветной и импульсный допплеровский анализ могут значительно помочь в выявлении венозной обструкции.
Катетеризация сердца и традиционная ангиография
Катетеризация сердца и традиционная ангиография редко показаны в эту эпоху. Если это будет выполнено, они задокументируют уже указанную патофизиологию. Анатомию легочных вен почти всегда можно определить без инвазивного исследования.
Компьютерная томографическая ангиография и магнитно-резонансная томография
Технологические достижения в области медицинской визуализации увеличили использование КТА и МРТ при обследовании пациентов с аномальным соединением легочных вен.Учитывая сложность, присущую пониманию трехмерных взаимоотношений у этих пациентов, методы многоплоскостной визуализации, такие как МРТ и КТА, позволяют трехмерное представление сложных анатомических взаимоотношений. Легочные венозные соединения с особенно извилистым течением, как это часто наблюдается при инфракардиальном соединении или дренаже через непарную систему, может быть трудно проследить с помощью эхокардиографии. Эти многоплоскостные режимы позволяют относительно просто проследить даже самые извилистые сосуды.Еще в 1991 г. Masui et al. обнаружили, что МРТ превосходит как эхокардиографию, так и обычную ангиографию у пациентов с TAPVC. С тех пор многие другие авторы подтвердили его полезность у этих пациентов. Помимо визуализации сложных структур, МРТ позволяет получать функциональные данные, включая количественную оценку потока и объемный анализ. Тем не менее, МРТ сердца требует сочетания технических знаний и знаний в области анатомии сердца, которые доступны не во всех центрах, а трудоемкие протоколы сканирования вместе с необходимостью перехода на «безопасное для МРТ» оборудование ограничивают практичность этого метода визуализации в наиболее тяжелобольные младенцы.
КТА высокого разрешения с использованием мультидетекторных сканеров зарекомендовала себя как высокоточная альтернатива в диагностике и характеристике аномальных соединений легочных вен (рис. 28.19). Новые сканеры сократили время сканирования до нескольких секунд или меньше, что позволяет выполнять большинство сканирований без седации. Доступно коммерческое программное обеспечение для трехмерной реконструкции этих наборов данных (наряду с наборами данных магнитно-резонансной ангиографии [MRA]), позволяющее тем, кто обладает достаточными знаниями в области врожденных пороков сердца, манипулировать анатомией таким образом, чтобы это было легко понять.В отличие от МРА, КТА позволяет одновременно выполнять трехмерную реконструкцию дополнительных структур грудной клетки. Эта особенность делает его особенно полезным для пациентов с бронхолегочными тисками, в которых вертикальная вена сжимается между бронхом и легочной артерией. В критически больных патентах КТА может выполняться оперативно, с минимальным временем пребывания вне отделения интенсивной терапии и без необходимости перехода на специализированное оборудование. Это может быть полезно для пациентов, находящихся на экстракорпоральной мембранной оксигенации (ЭКМО).
Рис. 28.19
Трехмерная реконструкция компьютерной томографической ангиограммы с заднего обзора. У этого пациента с сердечной формой полностью аномального соединения легочных вен все легочные вены входят в коронарный синус (CS). Обратите внимание, что левая верхняя и левая нижняя легочные вены (LUPV и LLPV) соединяются, образуя общую левую легочную вену, что часто встречается даже в нормальном сердце. RLPV , Правая нижняя легочная вена; RUPV , правая верхняя легочная вена. F, футов; H, головка; л., л. R, правый.
В отличие от традиционной ангиографии, MRA и CTA отображают контраст одновременно в нескольких структурах. Это особенно полезно для документирования смешанных связей и выяснения пространственных отношений у людей с более сложным анатомическим расположением (рис. 28.20). Вместо использования нескольких инъекций и курсов катетера для поиска каждого соединения легочной вены, все соединения могут быть расположены на одной инъекции контрастного вещества.С другой стороны, традиционная ангиография, вероятно, лучше подходит для выявления оттока легочных вен из областей легкого, где нет легочного кровотока, поскольку эти новые методы не имеют приемлемой замены клиновидной ангиограмме легочной артерии. При визуализации пациентов с подозрением на надкардиальный дренаж может оказаться полезным вводить контраст ниже сердца. Предполагая, что сканирование выполняется с первым прохождением контраста через сердце, как это стандартная процедура, любой контраст в венозной структуре над сердцем может быть четко идентифицирован как легочный венозный по происхождению (рис.28.21). Это особенно полезно, когда кто-то пытается отличить левую верхнюю полую вену от вертикальной вены. Обратное можно применить к инфракардиальному соединению (рис. 28.22).
Рис. 28.20
Трехмерная реконструкция компьютерной томографической ангиограммы выявляет сложные соединения легочных вен у пациента со смешанным полностью аномальным соединением легочных вен. Правая и левая нижние легочные вены (RLPV и LLPV) соединяются с горизонтальным слиянием (C), которое ведет в вертикальную вену (VV).Легочный венозный отток из левого верхнего легкого опорожняется через несколько отдельных вен (желтые стрелки) по мере того, как вертикальная вена поднимается вверх. Вертикальная вена ныряет под левую неполную вену, что приводит к стенозу (красная стрелка) перед присоединением к правой части левой верхней полой вены (LSCV). Правая верхняя легочная вена (RUPV) соединяется с левой стороной правой верхней полой вены (RSCV). Также имеется небольшой стенозирующий сосуд (белая стрелка) , соединяющий правую сторону места слияния с правой непостоянной веной, которая проходит над правой верхней легочной веной и соединяется с правой верхней полой веной.Это изображение подчеркивает полезность компьютерной томографической ангиографии для оценки сложных легочных венозных соединений (видео 28.7). F, футов; H, головка; л., л. R, правый.
Рис. 28.21
Трехмерная реконструкция компьютерной томографической ангиограммы, рассматриваемой с задней точки зрения пациента с суперкардиальной формой полностью аномального соединения легочных вен. Видно, что все четыре легочные вены входят в горизонтальное слияние (C), которое отводится через вертикальную вену (VV) в левую брациоцефальную вену (BCV).Обратите внимание на область стеноза (звездочка) , когда место слияния соединяется с вертикальной веной, что приводит к обструкции. LLPV , Левая нижняя легочная вена; LUPV , левая верхняя легочная вена; RLPV , правая нижняя легочная вена; RUPV , правая верхняя легочная вена; SCV , верхняя полая вена. F, футов; H, головка; л., л. R, правый.
Рис. 28.22
Трехмерная реконструкция компьютерной томографической ангиограммы пациента с инфракардиальной формой полностью аномального соединения легочных вен.Изображения просматриваются с задней (A) и левой (B) перспективы, на которых видны четыре легочные вены, входящие в небольшое слияние (C). Вертикальная вена (VV) отводится снизу через диафрагму, соединяясь с печеночной веной (HV) и воротной веной (PV). Имеется выраженный стеноз вертикальной вены (стрелка) ниже соединения с печеночной веной. ICV , Нижняя полая вена; LLPV , левая нижняя легочная вена; LUPV , левая верхняя легочная вена; RLPV , правая нижняя легочная вена; RUPV , правая верхняя легочная вена. F, футов; H, головка; л., л. R, правый.
Дифференциальная диагностика
Многие основы дифференциальной диагностики уже обсуждались и не будут здесь повторяться. Как мы увидим, атрезия легочных вен также представляет собой полностью аномальную связь с тяжелой обструкцией легочных вен. Однако эти два состояния могут быть неотличимы до операции, если при предоперационной визуализации общая легочная вена не видна.
Беспрепятственное соединение следует отличать от других состояний, вызывающих сердечную недостаточность, легкий цианоз и кардиомегалию с полнокровием легких и гипертрофией правого желудочка. Наиболее важным из них является полная транспозиция с большим дефектом межжелудочковой перегородки, при которой второй тон сердца обычно одиночный. Дефект атриовентрикулярной перегородки с общим предсердием легко распознается с помощью эхокардиографии. Абсолютно аномальное соединение с левой вертикальной веной следует отличать от левоатриальной кардинальной вены, обнаруженной в связи с митральной атрезией и неповрежденной межпредсердной перегородкой (см. Ниже).В обоих случаях кровоток в легочной вене сливается через левую вертикальную вену. В случае лево-предсердной кардинальной вены местом слияния является левое предсердие, при этом легочные вены обычно соединяются.
Течение и прогноз
Только при лечении 75% всех детей с ТАПВК, не осложненным изомерией, умерли или нуждались в хирургическом вмешательстве до своего первого дня рождения. Интересно, что такая низкая выживаемость имела место, несмотря на то, что менее 10% имели инфрадиафрагмальную аномальную связь.В одном исследовании с участием 25 пациентов с обструкцией легочных вен, получавших медикаментозное лечение, только двое пережили свой первый год. В посмертном исследовании, проведенном в Центральной Богемии и относящемся к периоду до кардиохирургического вмешательства, 95,8% смертей произошли на первом году жизни. Для окончательного лечения требуется хирургическое вмешательство.
Менеджмент
Лечение
Медицинский менеджмент состоит из вспомогательных мер при подготовке к окончательному хирургическому вмешательству.При беспрепятственном TAPVC медицинское лечение направлено на оптимизацию правожелудочковой недостаточности и гипоксии. При затрудненном TAPVC лечение направлено на коррекцию гемодинамического нарушения и метаболического ацидоза. Новорожденных обычно вентилируют, и простагландин E1 может временно улучшить системный сердечный выброс, поддерживая шунт справа налево через артериальный проток; однако этот маневр вряд ли обеспечит значительную реанимацию новорожденного с гипоксией и плохой гемодинамикой.
Временные вмешательства
Хотя диагноз ТАПВК является абсолютным показанием к хирургическому вмешательству, из-за клинического спектра физиологических проявлений у детей с ТАПВК существуют временные меры, которые могут быть использованы для перехода ребенка к операции, особенно дети с низкой массой тела при рождении и тяжелыми нарушениями гемодинамики.
Баллонная септостомия предсердий использовалась для устранения рестриктивного межпредсердного дефекта с ограниченным улучшением системной гемодинамики. Сано и его коллеги обнаружили, что септостомия не привела к достаточному клиническому улучшению у пациентов в критическом состоянии, чтобы отсрочить хирургическое вмешательство.
У пациентов с обструкцией легочного венозного возврата гибридный подход с эндоваскулярной установкой стента может рассматриваться как мост к хирургическому вмешательству. Такой подход смягчает кардиогенный шок и позволяет оптимизировать предоперационный статус.В отчетах о случаях заболевания документально подтверждено успешное стентирование закупоренной вертикальной вены, причем чаще всего сообщается об инфракардиальном и надкардиальном типах TAPVC. В отчетах о клинических случаях зарегистрировано первичное стентирование с ангиопластикой при рестенозе внутри стента, ведущее к последующему хирургическому вмешательству, причем самый длинный интервал между стентированием и операцией задокументирован как 15 месяцев. Также имеется документация по установке стента между слиянием легких и левым предсердием для перехода новорожденного к операции.
Для детей с обструкцией ТАПВК и кардиогенным шоком ЭКМО может стать эффективным мостом к хирургическому вмешательству. В отчетах о клинических случаях указывается, что ЭКМО используется для стабилизации перед эндоваскулярной установкой стента и / или операцией. В базе данных Общества торакальных хирургов ЭКМО также используется в послеоперационном периоде примерно у 8% детей, которым требуется восстановление TAPVC, при этом у большинства этих пациентов имеется физиология одного желудочка.
Хирургия
Время операции зависит от клинического статуса представившего ребенка.У новорожденных с обструкцией TAPVC необходимо быстрое хирургическое вмешательство. Для детей с беспрепятственным TAPVC сроки планового ремонта менее ясны. Некоторые центры выбирают раннее плановое неонатальное восстановление, тогда как другие откладывают плановое восстановление до 3-6 месяцев. Поскольку неонатальная хирургия продвинулась вперед, а хирургическая смертность низка, сторонники раннего планового неонатального восстановления считают, что влияние нарушения кровообращения на желудочек и потенциальная повышенная потребность в искусственной вентиляции легких в послеоперационном периоде предполагают, что раннее хирургическое вмешательство является полезным.В других центрах плановое хирургическое вмешательство откладывается на основании бездоказательного предположения, что хирургический риск и исходы развития нервной системы более благоприятны, если не допустить неонатального периода.
TAPVC было первым заболеванием, которое потребовало восстановления открытого сердца, учитывая отсутствие паллиативных вариантов и возможность получения отличных долгосрочных результатов, если может быть достигнута немедленная выживаемость. Результаты ранней хирургической серии демонстрируют высокую смертность младенцев, перенесших операцию. Операции в это время включали операции, при которых был создан анастомоз между слиянием легочных вен и левым предсердием, но межпредсердное сообщение не было закрыто; вертикальная вена, если была закупорена, не лигировалась.Хотя последующее спонтанное закрытие межпредсердной коммуникации было зарегистрировано у некоторых пациентов, этот поэтапный подход в настоящее время используется редко, и хирургические результаты значительно улучшились. В начале 80-х годов прошлого века возраст пациента или место соединения обсуждалось как наиболее важный фактор, определяющий операционную выживаемость, но самые последние исследования не показали, что ни один из них играет важную роль при плановом ремонте. Хирургическая смертность в нынешнюю эпоху может составлять менее 5% у пациентов с изолированным заболеванием, что затрудняет анализ факторов риска периоперационной смертности.
Предоперационные факторы риска смерти включают предоперационную обструкцию легочных вен, функциональную унивентрикулярную физиологию и факторы, связанные с ранним возрастом восстановления. Предоперационные гемодинамические факторы, такие как повышенное систолическое давление в легочной артерии, использование предоперационных инотропных агентов и послеоперационные события, связанные с легочной гипертензией, являются важными факторами риска хирургической смертности. Тип сердечной связи был идентифицирован в некоторых сериях как важный фактор, связанный со смертью, при этом инфракардиальный и смешанный типы были связаны с более высоким риском.Поскольку многие предоперационные детерминанты связаны с нестабильной гемодинамикой в предоперационном периоде, результаты у отдельных групп пациентов, вероятно, улучшатся при пренатальной диагностике и использовании временных мер, таких как эндоваскулярная установка стента и ЭКМО.
Хирургический доступ
Хирургическое вмешательство продиктовано основной анатомией; однако все хирургические доступы имеют общую цель — создать максимально возможное отверстие между местом слияния легочной вены и левым предсердием.
Восстановление сердечной TAPVC обычно включает снятие кровли коронарного синуса, соединенного с вертикальной веной. После остановки кардиоплегии вводится правое предсердие, и общая стенка между коронарным синусом и соединительной веной разрезается до места слияния легочных вен, создавая широкое слияние. Коронарный синус и дефект межпредсердной перегородки закрываются перикардиальным пластырем, который оставляет отток из легочных вен и кровь из коронарного синуса в левое предсердие.В случаях, когда легочные вены прикрепляются к правому предсердию, создается перегородка для направления возвращающейся крови в левое предсердие, подобно дефектам межпредсердной перегородки верхнего венозного синуса с частичным аномальным соединением легочных вен.
При суперкардиальной и инфракардиальной пластике TAPVC доступ к слиянию легочных вен можно получить с правой или с левой стороны. При левостороннем доступе сердце можно отвести вперед и вправо, чтобы обнажить слияние легочных вен.Соответствующие разрезы делаются в месте слияния легочных вен и левого предсердия, и между разделенными структурами строится анастомоз (видео 28.8). Необходимо следить за тем, чтобы втягивание сердца вправо не привело к искажению анастомоза при возвращении сердца в его анатомическое положение. В качестве альтернативы, при правостороннем доступе доступ к слиянию легочных вен осуществляется через правое предсердие, через межпредсердную перегородку и через разрез в задней стенке левого предсердия.Место впадения легочной вены рассекают и анастомозируют с левым предсердием. Разделенная перегородка предсердий часто закрывается перикардиальной заплатой, которая также служит для увеличения общего размера левого предсердия.
Смешанное восстановление TAPVC продиктовано основной анатомией, при этом наиболее распространенная анатомия заключается в том, что одна вена остается подключенной к системному венозному кровообращению, в то время как другие три вены стекают в заднее слияние. При таком расположении слияние анастомозируется с задним левым предсердием, а единственная вена повторно имплантируется или включается в более крупный анастомоз слияния с использованием бесшовной техники (описанной ниже).В некоторых случаях единственная легочная вена может оставаться подключенной к системному венозному кровообращению, что приводит к небольшому остаточному шунту слева направо, который не влияет на общую гемодинамику.
Безшовная техника
Безшовная техника была представлена в 1996 году двумя группами и была разработана для решения проблемы ПВС, возникшей после ремонта ПВС после ремонта. Первоначальные ранние и среднесрочные результаты свидетельствовали об отсутствии рецидивирующего стеноза. Использование техники без наложения швов было расширено в качестве метода первичного восстановления TAPVC и в качестве профилактической стратегии для минимизации послеоперационного PVS; Среднесрочные когорты в одном учреждении продемонстрировали не меньшую эффективность этого метода по сравнению с традиционным лечением.Безшовный метод включает резекцию закупоренных легочных вен и прямое ушивание левого предсердия с перикардом вокруг слияния разделенных легочных вен, избегая прямого наложения швов левого предсердия на легочные вены. Основные теоретические преимущества, полученные от бесшовного метода, включают максимальное увеличение размера слияния, минимизацию деформации, предотвращение связанных с наложением травм рассеченной ткани легочной вены, предотвращение остановки кровообращения и уменьшение геометрической сложности по сравнению с традиционным ремонтом.Обнадеживающие среднесрочные результаты были замечены в небольших группах групп высокого риска, таких как дети с инфракардиальным и смешанным TAPVC, небольшим слиянием или предоперационной обструкцией легочных вен. Крупное ретроспективное исследование показало, что безшовная техника связана с более низкой частотой послеоперационного восстановления ПВС, чем обычная пластика. Хотя данные подтверждают использование бесшовных методов, проспективные испытания не проводились из-за чрезмерных требований к размеру выборки.
Вертикальная вена
Вертикальная вена часто перевязывается во время операции.Некоторые хирурги предпочитают оставлять его открытым в качестве механизма для снижения давления в левом предсердии у пациентов, у которых левое сердце с трудом переносит резкое увеличение легочного венозного возврата после операции. В этом отношении открытая вертикальная вена имеет тот же физиологический эффект, что и дефект межпредсердной перегородки, и это может быть полезно при лечении послеоперационной легочной гипертензии. Считается, что после восстановления кровоток по этому пути с высоким сопротивлением незначителен, хотя последующее исследование этих пациентов показывает, что эта вена часто остается открытой.Во время операции хирург может направлять принятие решения, измеряя левое предсердие и системное артериальное давление после того, как пациента вывели из обходного анастомоза. Если ловушка вертикальной вены достигается без повышения давления в левом предсердии и падения системного давления, выполняется перевязка вены. Отчеты о случаях продемонстрировали отсроченное закрытие вертикальной вены с помощью чрескожных устройств у тех детей, у которых после операции развиваются значительные шунты слева направо.
Результаты хирургии
Поздние результаты хирургического восстановления тотального аномального соединения легочных вен в целом отличные.Функция риска смерти становится аналогичной функции риска для населения в течение примерно 24 месяцев после операции. Тем не менее, поздняя обструкция легочных вен (послеоперационная ПВС) имела место примерно в 10% всех крупных хирургических серий, и эта цифра оставалась относительно постоянной в течение последних 30 лет. Это серьезное осложнение плохо изучено и может возникнуть у пациентов с непроходимостью и без нее до операции.
Факторы, связанные с плохими результатами хирургического вмешательства, включают инфракардиальный или смешанный дренаж, ремонт, сделанный в более молодом возрасте, и сложные врожденные поражения сердца (т.е., физиология одного желудочка). Важно отметить, что послеоперационная ПВС и предоперационная обструкция легочных вен также связаны с повышенным риском смерти. Пациенты с небольшим слиянием легочных вен и остаточными градиентами в легочных венах после восстановления подвержены риску развития ПВС после ремонта.
Постремонтный стеноз легочных вен
Постремонтный ПВС обычно возникает в течение первого года после ремонта, при этом многие случаи появляются в течение 4-6 недель после первоначального ремонта.Клиническая картина может быть скрытой до момента значительного стеноза или может быть обнаружена при рутинной визуализации. Раннее развитие постремонтных ПВС связано с плохими результатами. Считается, что факторы, способствующие развитию ПВС после ремонта, возникают в двух широких категориях. В первую категорию входят дети, у которых развивается стриктура анастомоза из-за технических недостатков, а также дети с неадекватной резекцией или невозможностью создания большого анастомоза, что приводит к остаточным градиентам.В этой группе метод бесшовной пластики может дать наибольшие преимущества, поскольку он нейтрализует сложную геометрию слияния легких, минимизирует анатомическое искажение и максимизирует размер анастомоза с созданием неоатрия. У небольшой группы детей прогрессирование заболевания может привести к отсутствию сопутствующих хирургических факторов риска, и могут быть активны другие факторы, включая аномальное развитие легочных вен или генетические или экологические триггеры, которые могут повлиять на последующее развитие ПВС после ремонта.
Наблюдение за послеоперационным стенозом легочной вены
Поскольку у большинства детей, перенесших операцию TAPVC, послеоперационный стеноз не разовьется; скрининг с помощью эхокардиографии является стандартом и должен проводиться в течение 4-6 недель после восстановления. Диагноз ставится с помощью цветового картирования и допплеровского опроса и обычно демонстрирует небольшой анастомоз (рис. 28.23) и / или непрерывный нефазовый относительно высокоскоростной сигнал Доплера и увеличенный правый желудочек.Если есть эхокардиографические данные, указывающие на повышенное правостороннее давление или измененный кровоток в одной или нескольких легочных венах, следует использовать второй метод для подтверждения и дальнейшего определения анатомии. В случаях одностороннего ПВС перераспределение кровотока в легком (между закупоренными и свободными сегментами) или между легкими может уменьшить кровоток через закупоренные легочные вены с последующим уменьшением градиентов легочных вен и систематической недооценкой тяжести стеноза.Методом подтверждения подозрения на диагноз ПВС после ремонта может быть КТ, МРТ или катетеризационная ангиография сердца. КТ и МРТ могут определить точную анатомию обструкции и являются менее инвазивными методами, чем катетеризация (рис. 28.24). МРТ имеет дополнительное преимущество, так как предоставляет информацию о потоке в легочной сосудистой сети; тем не менее, у детей с сильно повышенным правосторонним давлением необходимо учитывать необходимость седации. Катетеризация сердца позволяет поставить диагноз и возможное вмешательство и может использоваться для тех, кому требуется стабилизация с помощью баллонной ангиопластики или установки стента по поводу правожелудочковой недостаточности из-за быстрого прогрессирования.
Только золотые участники могут продолжить чтение. Войдите или зарегистрируйтесь, чтобы продолжить
Связанные
Венозный дренаж ЦНС — Cerebrum
Центральная нервная система состоит из головного мозга, мозжечка, ствола мозга и спинного мозга. Их венозный отток сложен и, что довольно уникально, не следует за артериальным кровотоком.
Головной мозг, мозжечок и ствол мозга дренируются многочисленными венами, которые впадают в синусы твердой мозговой оболочки . Спинной мозг снабжен передними и задними спинными венами, которые впадают во внутренние и наружные позвоночные сплетения .
В этой статье мы рассмотрим венозный отток центральной нервной системы. Мы обсудим дуральные венозные синусы, вены головного мозга, спинномозговые вены и рассмотрим клиническую значимость описанной анатомии.
Дуральные венозные синусы
Дуральные венозные синусы лежат между периостальным и менингеальным слоями твердой мозговой оболочки. Их лучше всего рассматривать как собирающие лужи крови, истощающие центральную нервную систему, лицо и кожу головы. Все синусы твердой мозговой оболочки в конечном итоге впадают во внутреннюю яремную вену . В отличие от большинства вен тела, венозные синусы твердой мозговой оболочки не имеют клапанов.
Всего одиннадцать венозных синусов.Прямые, верхние и нижние сагиттальные пазухи находятся в falx cerebri твердой мозговой оболочки. Они сходятся в месте слияния носовых пазух (перекрывает внутренний затылочный выступ ). Прямая пазуха является продолжением большой мозговой вены и нижнего сагиттального синуса.
От места слияния поперечный синус продолжается в обе стороны и изгибается в сигмовидный синус , синус, чтобы соответствовать отверстию внутренней яремной вены.
Пещеристая пазуха дренирует офтальмологические вены и может быть обнаружена по обе стороны от турецкого седла. Отсюда кровь возвращается во внутреннюю яремную вену через пазухи верхних или нижних каменистых пазух .
Рис. 1. Сагиттальный разрез, показывающий дуральные венозные синусы и большую мозговую вену [/ caption]
[старт-клиника]
Клиническая значимость — Тромбоз венозного синуса головного мозга
Тромбоз венозного синуса головного мозга (CVST) описывает наличие тромба в одном из синусов твердой мозговой оболочки.
Тромб перекрывает венозный возврат через пазухи и вызывает скопление дезоксигенированной крови в паренхиме головного мозга. Это, в свою очередь, может привести к венозному инфаркту . Ситуация осложняется скоплением спинномозговой жидкости, которая больше не может стекать через тромбированный венозный синус.
Общие клинические признаки — головная боль, тошнота и рвота, а также неврологические нарушения.
Окончательный диагноз обычно ставится с помощью КТ или МРТ с контрастированием, которые демонстрируют обструкцию венозных синусов.Лечение проводится антикоагулянтами.
[окончание клинической]
Вены головного мозга
Вены головного мозга несут ответственность за перенос крови из тканей мозга и отложение ее в венозных синусах твердой мозговой оболочки.
Их можно разделить на поверхностных и глубоких групп, которые ярко расположены вокруг извилин и борозд мозга. При выходе из паренхимы головного мозга вены проходят в субарахноидальное пространство и проникают в мозговые оболочки и попадают в венозные синусы твердой мозговой оболочки.
Поверхностная система
Поверхностная система вен в значительной степени отвечает за дренирование коры головного мозга:
- Верхние вены головного мозга : дренируют верхнюю поверхность, перенося кровь в верхний сагиттальный синус.
- Поверхностная средняя вена головного мозга : дренирует боковую поверхность каждого полушария, перенося кровь в кавернозные или клиновидно-небные синусы.
- Нижние вены головного мозга : Осушает нижнюю часть каждого полушария головного мозга, депонируя кровь в кавернозные и поперечные синусы.
- Верхняя анастамотическая вена (Тролард): соединяет поверхностную среднюю мозговую вену с верхним сагиттальным синусом.
- Нижняя анастамотическая вена (Лаббе): соединяет поверхностную среднюю мозговую вену с поперечным синусом.
Глубокая система
- Субэпендимальные вены — Существуют многочисленные субэпендимальные вены, которые не будут здесь подробно описываться. Они получают кровь из мозговых вен и переносят ее в дуральные венозные синусы.Заслуживает упоминания большая мозговая вена (вена Галена); он образован слиянием двух глубоких вен и впадает в прямую пазуху.
- Медуллярные вены : берут начало на 1-2 см ниже коркового серого вещества и впадают в субэпендимальные вены. Они истощают глубокие области мозга.
Другие структуры центральной нервной системы
Мозжечок
Есть две основные вены, отвечающие за венозный отток мозжечка — верхняя и нижняя вены мозжечка.Они впадают в верхние каменистые, поперечные и прямые дуральные венозные синусы.
Ствол мозга
Венозный дренаж ствола мозга осуществляется многочисленными сосудами, многие из которых выходят за рамки данной статьи. Примеры вен, которые дренируют ствол мозга, включают поперечную мостиковую вену , , переднемедиальную медуллярную вену, а также переднюю и заднюю спинномозговые вены.
Спинной мозг
Спинной мозг снабжается тремя передними и тремя задними спинными венами .Эти вены бесклапанные и образуют анастамотическую сеть вдоль поверхности спинного мозга. Они также получают венозную кровь из корешковых вен.
Спинномозговые вены впадают во внутренние и внешние позвоночные сплетения, которые, в свою очередь, впадают в системные сегментарные вены. Внутреннее позвоночное сплетение также выходит в дуральные венозные синусы сверху.
Рис. 2. Наружное и внутреннее позвоночные сплетения. [/ caption]
Полный аномальный возврат в легочную вену (TAPVR)
Полный аномальный возврат в легочные вены — это врожденное (имеется в виду с рождения) заболевание сердца, поражающее легочные вены.
Артерии отводят кровь от сердца; вены несут его к сердцу. Легочные вены очень важны: они несут «красную» кровь, которая забрала кислород из легких, обратно к сердцу, чтобы перекачать ее в организм. Обычно имеется четыре легочных вены, по две от каждого легкого. Обычно все они подключаются непосредственно к левому предсердию сердца (левой верхней камере).
У ребенка, рожденного с полным аномальным — что означает ненормальное — легочным венозным оттоком (TAPVR), легочные вены соединяются с другими венами и, в конечном итоге, отводят их кровь в правое предсердие.Обычно правое предсердие получает только «голубую» кровь, возвращающуюся из организма без кислорода, которая затем переходит в правый желудочек и перекачивается в легкие. В TAPVR правое предсердие получает как «синюю» кровь от тела, так и «красную» кровь из легких.
В результате правая часть сердца перегружена перекачкой дополнительной крови, которую она получает. Часто происходит закупорка вен, по которым кровь поступает из легочных вен, что вызывает резервное копирование крови в легких.Это нарушает нормальный кровоток между легкими и телом. Кроме того, кровь, покидающая сердце из тела, имеет более низкий уровень кислорода.
У детей с ТАПВР есть и другие пороки сердца. У них есть отверстие в стенке, разделяющей две верхние камеры сердца (дефект межпредсердной перегородки), и может быть открытый артериальный проток, дополнительный кровеносный сосуд между легочными артериями и аортой. Эти пороки сердца действительно могут помочь ребенку с TAPVR выжить, позволяя большему количеству крови попадать из правой части сердца в левую и обратно к телу.Фактически, дети без дефекта межпредсердной перегородки не выживают.
Наши детские кардиологи подробно объяснят анатомию сердца вашего ребенка. Как правило, существует четыре типа TAPVR:
Надсердный TAPVR
Легочные вены отводятся в правое предсердие через верхнюю полую вену. Верхняя полая вена — это большая вена, которая обычно несет только дезоксигенированную или «синюю» кровь в правое предсердие из верхней половины тела.
Инфракардиальный TAPVR
Легочные вены впадают в правое предсердие через печеночные (печеночные) вены и нижнюю полую вену.Нижняя полая вена — это еще одна крупная вена, которая обычно несет только дезоксигенированную кровь в правое предсердие из нижней части тела.
Сердечный TAPVR
Есть два типа. В одном случае легочные вены могут напрямую входить в правую часть сердца, в правое предсердие. Кроме того, легочные вены могут стекать в коронарный синус. Коронарный синус — это вена, которая обычно переносит дезоксигенированную кровь из сердечной мышцы в правое предсердие.Эта вена обычно очень мала, но при таком ненормальном количестве крови становится довольно большой.
Смешанный ТАПВР
Легочные вены разделяются и частично дренируют более чем в один из этих вариантов.
Общие симптомы аномального легочного венозного возврата включают:
- Синий или фиолетовый оттенок губ, кожи и ногтей (цианоз)
- Учащенное дыхание или усиление работы во время дыхания, особенно во время еды
- Шумы в сердце: дополнительный звук сердца, когда врач слушает с помощью стетоскопа
Степень тяжести симптомов TAPVR варьируется.
В некоторых случаях новорожденные с TAPVR испытывают затрудненное дыхание и быстро серьезно заболевают. Это происходит, когда легочные вены слишком узкие или в какой-то момент закупорены, и кровь не может вытекать из легких так быстро, как следовало бы. Это называется TAPVR с легочной обструкцией. Этих детей обычно доставляют в кардиологический центр при CHOP из родильных домов и помещают в отделение интенсивной терапии сердца Табас для стабилизации.
В других случаях TAPVR диагностируется в первые несколько месяцев жизни, когда у ребенка проявляются более легкие симптомы, такие как шум в сердце или цианоз (синий оттенок кожи).
Для диагностики TAPVR могут потребоваться некоторые или все из следующих тестов:
- Эхокардиограмма: звуковые волны создают изображение сердца. Обычно это окончательный тест для постановки диагноза.
- Электрокардиограмма (ЭКГ): запись электрической активности сердца. Обычно это свидетельствует о гипертрофии правых отделов сердца (увеличенный размер правого желудочка).
- Рентген грудной клетки: показывает увеличение правого сердца и усиление кровотока через легочную артерию.Если вены закупорены, возникает отек легких (скопление жидкости в легких).
- Пульсоксиметрия: неинвазивный способ контроля содержания кислорода в крови. Это число будет низким, обычно в диапазоне от среднего до высокого уровня 80-х (нормальное значение составляет от 95 до 100 процентов).
- Катетеризация сердца: тонкая трубка вводится в сердце через вену и / или артерию в ноге или через пупок («пупок»). Иногда это необходимо для помощи в диагностике. Его также используют, чтобы увидеть, не слишком ли мал дефект межпредсердной перегородки.Если это так, его можно увеличить, расширив отверстие с помощью баллона на катетере (баллонное расширение).
- МРТ сердца: трехмерное изображение, показывающее аномалии сердца.
Полный аномальный возврат в легочную вену требует операции на открытом сердце во всех случаях. Новорожденным в критическом состоянии немедленно проводят операцию. Если ребенок не находится в критическом состоянии, врачи могут отложить операцию до двух месяцев, в зависимости от силы ребенка и анатомии сердца.
Чтобы понять операцию, важно знать о TAPVR, что легочные вены, несмотря на их аномальные связи с другими венами, все заканчиваются скоплением (так называемым «слиянием») в задней части левого предсердия. Хирург открывает слияние, чтобы вены могли стекать в левое предсердие. Затем он или она связывает все ненормальные связи между легочными венами и другими венами, так что кровь может идти только по пути к левому предсердию. Хирург также закрывает дефекты перегородки (аномальные отверстия) крошечными заплатками или швами и закрывает открытый артериальный проток.По мере того как ребенок стареет, сердечная подкладка вырастает из швов.
Благодаря огромным успехам в медицине и технологиях сегодня большинство детей, рожденных с полным аномальным оттоком из легочных вен, продолжают вести продуктивную жизнь во взрослом возрасте.
Детям, которые в младенчестве были тяжело больными, может пройти более долгий путь к выздоровлению. Однако в большинстве случаев дети не испытывают долгосрочных эффектов. Им также не придется оставаться на каких-либо лекарствах или ограничивать занятия спортом.
В редких случаях легочные вены закупориваются в более позднем возрасте, и требуется дополнительная операция или процедура катетеризации. У небольшого числа детей также может наблюдаться аритмия (нарушение сердечного ритма), которую можно лечить с помощью лекарств, радиочастотной абляции или кардиостимулятора.
До 18 лет
Дети, родившиеся с TAPVR и получившие лечение, должны продолжать регулярно посещать детского кардиолога.
Во взрослую жизнь
Важно, чтобы дети, родившиеся с полным аномальным оттоком из легочных вен, продолжали посещать кардиолога.Мы поможем пациентам перейти к взрослому специалисту по врожденным порокам сердца.
Филадельфийский центр врожденных пороков сердца для взрослых, совместная программа Детской больницы Филадельфии и Penn Medicine, удовлетворяет уникальные потребности взрослых, родившихся с пороками сердца.
Неравномерность контура венозного слияния в предоперационной компьютерной томографии позволяет прогнозировать гистопатологическую инфильтрацию
Абстрактные
Назначение
Целью настоящего исследования было сравнение КТ-признаков инфильтрации портальной вены с фактической гистопатологической инфильтрацией вены или границы раздела опухоль / вена (TVI) при пограничной резектабельной протоковой аденокарциноме поджелудочной железы (PDAC).
Методы и материалы
Обследовано
101 пациент с ранее не получавшими терапию, первично резецированными PDAC головки поджелудочной железы без поражения артерий. Слияние воротной вены оценивалось на предмет неровности контура (определяемой как инфильтрация) и степени контакта. Рассчитывали чувствительность и специфичность неровности контура в зависимости от контакта опухоли с веной> 180 °, а также комбинацию признаков инфильтрации опухолевыми клетками стенки сосуда или TVI. Общая выживаемость (ОС) сравнивалась между группами.
Результаты
Чувствительность и специфичность неровностей контура для идентификации опухолевой инфильтрации воротной вены или TVI была выше по сравнению с контактом опухоли с сосудом> 180 ° для инфильтрации опухолевыми клетками (96% / 79% против 91% / 38% соответственно, р <0,001). Комбинация признаков повысила специфичность до 92% (чувствительность 88%). Пациенты с неровностями контура / контактом опухоли с веной> 180 ° / обоими признаками имели значительно худшую общую выживаемость (16.2 против 26,5 месяцев / 17,9 против 37,4 месяцев / 18,5 против 26,5 месяцев соответственно, все p <0,05).
Заключение
Неравномерность контура слияния воротной вены является сильным предиктором фактической инфильтрации опухолевыми клетками стенки сосуда или TVI и должна быть отмечена как таковая в радиологических отчетах.
Образец цитирования: Kaissis GA, Lohöfer FK, Ziegelmayer S, Danner J, Jäger C, Schirren R, et al. (2019) Погранично-операбельная аденокарцинома поджелудочной железы: неравномерность контура венозного слияния в предоперационной компьютерной томографии позволяет прогнозировать гистопатологическую инфильтрацию.PLoS ONE 14 (1):
e0208717.
https://doi.org/10.1371/journal.pone.0208717
Редактор: Маттиас Ри, Университетская клиника Гамбурга Эппендорф, ГЕРМАНИЯ
Поступила: 13 сентября 2018 г .; Одобрена: 22 ноября 2018 г .; Опубликован: 2 января 2019 г.
Авторские права: © 2019 Kaissis et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Данные изображений пациентов и гистопатологические отчеты содержат конфиденциальную информацию о пациентах и не могут быть опубликованы из-за этических ограничений, установленных комитетом по этике учреждения (Ethikkommission der Fakultät für Medizin der Technischen Universität München). Данные доступны по обоснованному запросу от соответствующего автора.
Финансирование: Работа выполнена при финансовой поддержке Немецкого исследовательского фонда (DFG, http: // www.dfg.de/en/) в рамках инициативы SFB 824 (центр совместных исследований, http://www.sfb824.de/en/), «Визуализация для выбора, мониторинга и индивидуализации лечения рака» Рикмеру Ф. Брарену ( SFB824, проект C6) и Wilko Weichert (проект Z2). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Аденокарцинома протока поджелудочной железы остается одним из самых смертоносных злокачественных заболеваний, отчасти из-за ее склонности к десмопластической реакции и инфильтрации окружающих тканей, включая периневральную и сосудистую инвазию [1].Самые высокие показатели выживаемости наблюдаются при макроскопическом полном хирургическом удалении опухоли [2], что может быть достигнуто примерно у 84% пациентов, перенесших операцию [3]. В стремлении увеличить число пациентов, подлежащих лечебному лечению, хирургические методы получили дальнейшее развитие: были введены схемы неоадъювантной химиотерапии и в настоящее время проходят испытания в фазе II клинических испытаний (NEONAX, NCT02047513; NEOLAP, NCT02125136). Соответственно, рентгенологические признаки резектабельности были скорректированы, чтобы включать опухоли с сосудистым поражением и возможность резекции и реконструкции сосудов, включая «пограничные резектабельные» (BR) опухоли.[4, 5].
Среди нескольких принятых критериев для определения резектабельности при PDAC, связь опухоли с прилегающей сосудистой сетью при дооперационной визуализации считается фундаментальной. Начиная с первоначальных отчетов Лу и др. [6], которые классифицировали степень контакта с опухолью (артериальной и / или венозной) ≥180 °, и Hough et al. [7], которые классифицировали неровность контура, то есть «каплевидный признак» , как показатель нерезектабельности, соответствующие общества предложили несколько других определений резектабельности артерий и вен.Согласно последним рекомендациям NCCN [8], вышеупомянутое венозное поражение теперь явно включено в BR. Для различных результатов визуализации сообщалось о различиях в результатах, отчасти из-за включения в исследования широкого спектра методов визуализации, клинических стадий, локализации опухолей и типов поражения сосудов (например, артериальных и венозных). Важно отметить, что во многих исследованиях отсутствует корреляция результатов визуализации с наиболее фундаментальным параметром исхода, гистопатологической инфильтрацией границы раздела между опухолью и веной (TVI) и стенкой сосуда.Однако с введением многообещающих планов неоадъювантного лечения требуется специфическая дифференциация стадий опухоли и точное определение границ опухоли. Поскольку пациенты с PDAC все чаще проходят лечение в специализированных центрах опытными клиницистами, радиологические отчеты должны быть нацелены на максимально достижимую точность. Таким образом, цель настоящего исследования состояла в том, чтобы переоценить прогностическую силу КТ-признаков «неправильность контура» и «степень контакта опухоли с веной» [4] для гистопатологически подтвержденной инфильтрации вены или TVI в Когорта пациентов с раком головки поджелудочной железы, ранее не получавших лечения, которым была выполнена резекция опухоли с лечебной целью.
Материалы и методы
Утверждение этических норм
Исследование было одобрено институциональным этическим комитетом (Ethikkommission der Fakultät für Medizin der Technischen Universität München; 180/17 S), отказавшись от требования письменного информированного согласия на ретроспективный анализ данных.
Дизайн исследования
Когорта пациентов.
Всего 312 пациентов, перенесших панкреатодуоденэктомию в период с 07/2007 по 10/2014, были рассмотрены для включения в исследование, из них 101 пациент (54 мужчины и 47 женщин) был включен в исследование и подвергся ретроспективному анализу.
Решение о хирургическом исследовании было принято на междисциплинарной конференции по опухолям. Период времени между получением предоперационной КТ и хирургическим обследованием составлял 2 ± 1 недели.
Критерии исключения.
Пациенты с признаками метастатического распространения при постановке диагноза, предшествующей историей злокачественных заболеваний, доказательствами поражения артерий в предоперационной КТ или ранними послеоперационными осложнениями (Clavien-Dindo-Score ≥3 в течение 2 недель после операции) были исключены, чтобы ограничить любую систематическую ошибку. от ранних хирургических осложнений на ОС.Ни один пациент не получал неоадъювантного лечения. Пациенты, перенесшие эндоскопическое вмешательство по установке стента желчного протока, были исключены из-за возможных артефактов визуализации, возникающих в результате этого вмешательства. Не исключались пациенты, перенесшие эндоскопическое УЗИ или биопсию.
Параметры изображения.
Данные КТ были включены в исследование, если они соответствовали следующим критериям: венозная фаза с усилением контрастирования при задержке дыхания на вдохе с ослаблением воротной вены ≥ 140 единиц Хаунсфилда, толщина среза не более 3 мм, наличие аксиальных, коронарных и сагиттальных мультиплоскостных преобразований. изображение тела от верхушки легкого до проксимального отдела бедренной кости.Данные были получены с помощью КТ-сканеров от 16 до 64 рядов и реконструированы с использованием ядер средней жесткости.
Наблюдатели-радиологи.
Все изображения изначально независимо просматривали 3 радиолога, не знавшие гистопатологического результата (GK, FL, RB с 4, 6 и 10 годами опыта соответственно). Был достигнут консенсус по всем изображениям, причем наиболее опытный радиолог (РБ) выступал в качестве решающего вопроса в случаях разногласий (n = 8 случаев). Изображения были просмотрены в стандартных условиях освещения с использованием той же больничной рабочей станции PACS с SECTRA IDS 7.
Определение КТ-признаков инфильтрации около портальной вены.
Портальная вена, определяемая как сосуд проксимальнее места слияния верхней брыжеечной и селезеночной вен, и верхняя брыжеечная вена до 2 см дистальнее места слияния были оценены во всех 3 мультипланарных реформах. Инфильтрация портального венозного слияния определялась как неровность контура сосуда в соответствии с текущими рекомендациями по радиологической отчетности [4] (рис. 1). Степень контакта между солидной опухолью и слиянием воротной вены была оценена как ≤180 ° по сравнению с> 180 °.
Рис. 1. Неровность венозного контура у двух пациентов.
A-C показывают мягкие ткани, искажающие сосуд (белые стрелки). D-F показывают сужение фокального сосуда (черные стрелки). Опухоль (Т) и воротная вена (*) отмечены соответствующим образом. Все изображения получены при 3-миллиметровой мультипланарной реформации в аксиальной (A / D), корональной (B / E) и сагиттальной (C / F) плоскостях.
https://doi.org/10.1371/journal.pone.0208717.g001
Хирургическая процедура.
Всем пациентам после хирургического обследования была выполнена резекция головки поджелудочной железы с сохранением привратника в одном и том же месте.Решение за или против венозной резекции принималось хирургом на основании интраоперационного впечатления венозной инфильтрации.
Гистопатологический анализ.
Были рассмотрены окончательные отчеты о хирургической патологии, подписанные двумя узкоспециализированными патологоанатомами. Регистрировали максимальный размер опухоли, классификацию pTNM и градацию опухоли (UICC 8 th ed.). Инфильтрация стенки сосуда до уровня адвентиции или глубже, или присутствие опухолевых клеток на или ≤1 мм от границы раздела между опухолью и веной было явно идентифицировано и классифицировано как присутствующее или отсутствующее в отчете.
Статистический анализ.
Все статистические тесты были выполнены с использованием программы GraphPad Software Prism 7 . Определен уровень значимости p <0,05. Чувствительность, специфичность, положительные и отрицательные прогностические значения нерегулярности контура слияния воротной вены и степени контакта между опухолью и слиянием воротной вены> 180 ° для прогнозирования фактической инфильтрации опухолевыми клетками венозной стенки или TVI были рассчитаны с использованием метода Фишера. точный тест.Для кросс-табличного анализа использовался критерий хи-квадрат. Сравнение выживаемости проводилось с использованием лог-рангового критерия Мантела-Кокса после подтверждения того, что допущения модели были выполнены.
Результаты
Средний возраст при постановке диагноза составлял 69,5 ± 11,2 года, размер опухоли составлял от 25 до 40 мм (максимальный размер, указанный в окончательном гистопатологическом отчете). У всех пациентов было локорегиональное распространение лимфатических узлов. 94 пациента получили адъювантную химиотерапию гемцитабином после решения междисциплинарного совета по опухолям (из них 3 пациента дополнительно получили цетуксимаб, эрлотиниб или капецитабин), а 7 пациентов отказались от адъювантной химиотерапии.Классификация опухоли была G1 в 9 случаях, G2 в 46 случаях и G3 в 46 случаях.
Распределение степени опухоли и режима адъювантной химиотерапии для пациентов с и без нарушения венозного контура и с контактом опухоли с веной> 180 ° / ≤180 ° показано в таблицах 1 и 2 соответственно.
Были рассмотрены неравномерность контура слияния воротной вены и степень контакта опухоли с сосудом на предоперационной компьютерной томографии, а также гистопатологические образцы 101 пациента, перенесшего резекцию головки поджелудочной железы по поводу PDAC (рис. 2а).
Рис. 2. Блок-схема, показывающая распределение пациентов по группам с и без нарушения венозного контура (а) и пациентов в группах с контактом опухоли с веной> 180 ° или ≤180 ° (b), а также результаты гистопатологического исследования.
https://doi.org/10.1371/journal.pone.0208717.g002
Из них у 62 пациентов (61,4%) наблюдалась неровность контура впадения воротной вены. Из них 39 пациентам (62,9%) была выполнена венозная резекция, у всех выявлена инфильтрация опухолевыми клетками стенки сосуда при гистопатологическом анализе образца резекции.Из оставшихся 23 пациентов, которым не выполнялась резекция вены, у 13 (56,5%) была выявлена инфильтрация опухолевыми клетками на расстоянии менее 1 мм от TVI. Напротив, из 39 пациентов, у которых не было нарушения контура, 5 (12,8%) подверглись резекции вены, и ни у одного (0%) из них не было выявлено инфильтрации опухолевыми клетками стенки сосуда или ≤1 мм от TVI. Из оставшихся 34 пациентов, у которых не было неровностей контура и не было резекции вен, только у 2 (5,9%) опухолевые клетки были на расстоянии менее 1 мм от TVI.
Для сравнения, контакт опухоли с сосудом> 180 ° был отмечен у 78 (77.2%) из 101 пациента. Из них 37 пациентам (47,4%) была выполнена резекция вен, и у всех (100%) наблюдалась инфильтрация стенок сосудов опухолевыми клетками при гистопатологическом анализе. Из оставшегося 41 пациента только у 12 (29,3%) наблюдалась инфильтрация опухолевыми клетками на расстоянии ≤1 мм от TVI. Кроме того, из 23 пациентов с контактом опухоли и сосуда ≤180 °, в общей сложности у 5 (21,7%) наблюдалась инфильтрация опухолевыми клетками стенки сосуда (n = 4), либо на расстоянии ≤1 мм от TVI (n = 1). (Рис. 2b).
Медиана OS у пациентов с нарушением контура венозного слияния или без него составила 16.2 месяца и 26,5 месяцев соответственно (n = 101, p = 0,001) (рис. 3а).
Рис. 3.
Кривые выживаемости Каплана-Мейера пациентов с неровностями венозного контура и без неровностей венозного контура (а). Кривые выживаемости Каплана-Мейера пациентов с контактом опухоли с веной ≤180 ° и> 180 ° (б).
https://doi.org/10.1371/journal.pone.0208717.g003
Пациенты с контактом опухоли с веной> 180 ° имели среднюю выживаемость 17,9 месяцев по сравнению с 37,4 месяца в группе с контактом опухоли с веной ≤180 ° (n = 101, p = 0.02), хотя кривые выживаемости пересеклись, что указывает на нарушение модели пропорциональных рисков, которую, таким образом, следует интерпретировать с осторожностью (рис. 3b).
Всего подверглось цензуре 13/101 (12,8%) случаев.
Неровность контура по сравнению с контактом опухоли с сосудом> 180 ° показала более высокую чувствительность (96,3% против 90,7%), специфичность (78,7% против 38,3%), а также положительную (83,9% против 62,8%) и отрицательную (94,8%) против 78,2%) прогностическая ценность гистопатологического результата инфильтрации опухолевыми клетками стенки сосуда или TVI (p <0.0001 в обоих случаях, всего n = 101).
Анализ подгруппы пациентов, у которых наблюдались как неровность венозного контура, так и контакт опухоли с сосудом> 180 ° (n = 17, у 13 из которых наблюдались признаки инфильтрации стенки сосуда, у 1 — признаки инфильтрации ТВИ и у 3 — без признаков инфильтрации стенки сосуда или TVI) по сравнению с пациентами, у которых не было ни одного из признаков (n = 37, из которых у 35 не было признаков инфильтрации стенки сосуда или TVI, а у 2 не было признаков инфильтрации TVI но ни одного с фактической инфильтрацией стенки сосуда) дала чувствительность 87.5%, специфичность 92,1%, прогностическая ценность положительного результата 82,4% и прогностическая ценность отрицательного результата 94,6%. (Таблица 3).
Анализ выживаемости по Каплану-Мейеру в комбинированном анализе представлен на рис. 4. Медиана ОС для пациентов с неровностью венозного контура и контактом с веной> 180 ° составила 18,5 месяцев, для пациентов без неровности венозного контура или контакта с веной> 180 ° — 26,5 месяцев (n = 17 против n = 37, p = 0,028).
Обсуждение
Точная предварительная стадия лечения имеет большое значение при PDAC, потому что пациенты стратифицируются по схемам потенциально излечивающей и паллиативной терапии на основе мельчайших различий в распространении опухоли, которые лучше всего выявляются при поперечной визуализации.Среди них венозная инфильтрация является важным открытием, которое требует резекции и замены сосудов для обеспечения полного удаления опухоли у пациентов, ранее не получавших терапию. Настоящее исследование демонстрирует, что неравномерность контура венозного слияния является сильным предиктором гистопатологически идентифицированной инфильтрации опухолевыми клетками TVI или стенки сосуда и худшего общего выживания, а также что неравномерность венозного контура превосходит контакт опухоли с веной> 180 °.
Результаты исследования подчеркивают важность выявления неровностей контура, что является и должно оставаться стандартом отчетности в PDAC.Помимо повышенной чувствительности неровности венозного контура по сравнению с контактом опухоли с веной, комбинация обоих признаков дает повышенную специфичность, поэтому мы рекомендуем отмечать наличие обоих результатов в радиологических отчетах. Необходимость дополнительного просмотра изображений узкоспециализированными радиологами (например, «справочными центрами») в случаях подозреваемого или подтвержденного PDAC подчеркивается зачастую тонким характером этих рентгенографических результатов. Наше исследование включало только данные КТ с доступностью срезов толщиной ≤3 мм и трехуровневыми MPR, полагая, что это минимальное требование для точной диагностики и соответствует текущей литературе [9], хотя мы поддерживаем стремление к максимально достижимой пространственной разрешение за счет использования как можно более тонких наборов изотропных данных для диагностики.С развитием технологий компьютерной томографии ожидается, что более высокая доступность настраиваемых MPR «на лету», а также изогнутых MPR и методов 3D-рендеринга еще больше повысит чувствительность.
Высокая чувствительность неровностей контура слияния воротной вены, наблюдаемая при предоперационной КТ для гистопатологической инфильтрации опухолевыми клетками ТВИ или инфильтрации стенки сосуда, указывает на то, что даже в тех случаях, когда рассечение сосуда от опухоли технически возможно без удаления сосуда, высока вероятность инфильтрации опухоли около вены.Таким образом, обнаружение неровности венозного контура поддерживает усиленный (нео) адъювантный химиотерапевтический подход и должно приниматься во внимание пациентами, которым выполняется первичная резекция. Однако в условиях неоадъювантной терапии необходимо дальнейшее исследование значимости неровностей венозного контура, поскольку даже нежизнеспособный опухолевый матрикс может вызывать стойкие сосудистые нарушения. В некоторых случаях мы могли наблюдать, что в случаях несоответствия между обнаружением радиологом неровности венозного контура и интраоперационным слепком (т.е. хирург подозревает венозную инфильтрацию и резектирует сосуд при отсутствии нарушения контура), отсутствие неправильности контура, по-видимому, является лучшим предиктором гистопатологического результата, хотя это следует интерпретировать с осторожностью в этой очень небольшой подгруппе из 5 случаев.
Диагностическая чувствительность и специфичность в нашем исследовании выше, чем в предыдущем исследовании, включающем часть той же когорты [10]. Тем не менее, это предыдущее исследование включало только 23 пациента, визуализационные исследования включали как КТ, так и МРТ, исключения случаев из-за качества изображения не проводились, и отбор пациентов не был таким ограничительным, как в настоящем исследовании.
В нашей группе пациентов неравномерность венозного контура коррелировала с худшей общей выживаемостью. Это открытие неудивительно для этой исторической когорты без неоадъювантной терапии и согласуется с другими исследованиями [11], которые обнаружили, что инвазия воротной или верхней брыжеечной вены является независимым предиктором худшей общей выживаемости. С постоянным совершенствованием хирургической техники и включением большего числа пациентов в режимы неоадъювантной терапии мы ожидаем, что нынешние когорты пациентов с венозной инфильтрацией покажут улучшенную выживаемость, как показано в текущем корейском исследовании [12].
Мы постарались устранить источники систематической ошибки в отношении клинических характеристик. Поскольку система UICC в отношении Т-стадии PDAC изменилась с версии 7 th на версию 8 th , мы решили отбирать случаи пациентов на основе фактического диаметра опухоли и полностью отказаться от «Т» -классификации. Кроме того, у всех пациентов был узловой статус N1. Распределение адъювантной химиотерапии и классификация опухолей в исследуемых когортах были сбалансированы до такой степени, что мы не ожидаем значительного искажения результатов.Ни один из пациентов, включенных в это исследование, не получал неоадъювантную химиотерапию. Следовательно, полученные результаты необходимо пересмотреть в контексте неоадъювантной химиотерапии, поскольку обнаружение нерегулярности контура венозного слияния может не иметь таких же последствий в таких условиях.
У нашего исследования есть несколько ограничений. В ретроспективном одноцентровом исследовании результаты могут быть искажены из-за хирургической техники и предпочтений, а также радиологических отчетов по отдельным отделениям. Хотя общий размер когорты составлял 101 пациент, гистопатологические данные о венозной инфильтрации были доступны для подвыборки из 44 пациентов.Более того, хотя консенсус был высоким, расчет оценок вариабельности между наблюдателями не производился. В неспециализированных центрах количество сообщений может быть ниже из-за более низкой подверженности радиологов случаям рака поджелудочной железы. Ограничительный отбор образцов пациентов, который мы предприняли для ограничения систематической ошибки, связанной с размером опухоли или вариациями в пространственном соотношении между положением опухоли и сосудов, не позволяет делать существенные выводы относительно любых возможных зон предрасположенности к инфильтрации опухоли вдоль рассматриваемых сосудов, что потребует дальнейшая оценка в будущих исследованиях.
Наше исследование демонстрирует, что неровность контура венозного слияния является чувствительным и специфическим признаком инфильтрации опухолевыми клетками стенки сосуда или близлежащих тканей, превосходя по эффективности опухоль> 180 ° от контакта с веной. Это также показывает, что неравномерность контура является предиктором худшей общей выживаемости в этой когорте, не получавшей предварительного лечения. Это подчеркивает важность получения высококачественных дооперационных изображений, которые должны быть проверены опытными / узкоспециализированными радиологами. Внимание к этому, часто незаметному открытию, и его включение в стандартизованный рентгенологический отчет может привести к улучшению терапии либо за счет включения в схемы неоадъювантной терапии, либо за счет хирургической резекции вены.
Ссылки
- 1.
Сигел Р.Л., Миллер К.Д., Джемал А. (2017) Статистика рака, 2017. CA Cancer J Clin 67: 19–30 pmid: 28055103 - 2.
Кимура К., Амано Р., Наката Б., Ямазо С., Хирата К., Мурата А. и др. (2014) Клинические и патологические особенности пятилетних выживших после панкреатэктомии по поводу аденокарциномы поджелудочной железы. Мир J Surg Oncol 12: 360 pmid: 25429841 - 3.
Katz MH, Wang H, Fleming JB, Sun CC, Hwang RF, Wolff RA et al (2009) Долгосрочная выживаемость после мультидисциплинарного лечения резецированной аденокарциномы поджелудочной железы.Энн Сург Онкол 16: 836–847 pmid: 19194760 - 4.
Аль-Хавари М.М., Фрэнсис И.Р., Чари С.Т., Фишман Е.К., Хаф Д.М., Лу Д.С. и др. (2014) Шаблон отчета о радиологии протоковой аденокарциномы поджелудочной железы: согласованное заявление Общества абдоминальной радиологии и Американской ассоциации поджелудочной железы. Радиология 270: 248–260 pmid: 24354378 - 5.
Isaji S, Mizuno S, Windsor JA, Bassi C, Fernandez-Del Castillio C, Hackert T et al (2018) Международный консенсус по определению и критериям пограничной резектабельной протоковой аденокарциномы поджелудочной железы 2017.Панкреатология 18: 14–11 ч, дневное время: 29191513 - 6.
Лу Д.С., Ребер Х.А., Красный Р.М., Каделл Б.М., Сэйр Дж. (1997) Локальная стадия рака поджелудочной железы: критерии нерезектабельности крупных сосудов, выявленные с помощью панкреатической фазы, тонкой спиральной КТ. AJR Am J Roentgenol 168: 1439–1443 pmid: 9168704 - 7.
Hough TJ, Raptopoulos V, Siewert B, Matthews JB (1999) Верхняя брыжеечная вена Teardrop: признак КТ для неоперабельной карциномы поджелудочной железы. AJR Am J Roentgenol 173: 1509–1512 pmid: 10584793 - 8.Tempero MA, Malafa MP, Al-Hawary M, Asbun H, Bain A, Behrman SW et al (2017) Аденокарцинома поджелудочной железы, Версия 2.2017, Рекомендации NCCN по клинической практике в онкологии. J Natl Compr Canc Netw 15: 1028–1061 pmid: 28784865
- 9.
Заки AM, Вольфганг CL, Weiss MJ, Javed AA, Fishman EK, Zaheer A (2017) Отношения опухоль-сосуд в аденокарциноме поджелудочной железы при многодетекторной компьютерной томографии: различные системы классификации и их влияние на планирование лечения. Рентгенограмма 37: 93–112 pmid: 27885893 - 10.Michalski CW, Kong B, Jager C, Kloe S, Beier B, Braren R et al (2015) Результаты резекций аденокарциномы поджелудочной железы с подозрением на поражение вен: опыт единого центра. BMC Surg 15: 100 pmid: 26296752
- 11.
Mierke F, Hempel S, Distler M, Aust DE, Saeger HD, Weitz J et al (2016) Влияние вовлечения воротной вены из-за рака поджелудочной железы на структуру метастазов после хирургической резекции. Ann Surg Oncol 23: 730–736 pmid: 27554501 - 12.
Kim M, Kang TW, Cha DI, Kim YK, Kim SH, Jang KT et al (2018) Прогнозирование и клинические последствия инвазии воротной вены / верхней брыжеечной вены у пациентов с удаленным раком головки поджелудочной железы: значение параметров предоперационной КТ.Clin Radiol 73: 564–573 pmid: 29519500
.


