Симптомы, диагностика и лечение болезни Верльгофа у детей.
Симптомы, диагностика и лечение болезни Верльгофа у детей. Аутоиммунная идиопатическая тромбоцитопеническая пурпура. Болезнь Верльгофа (аутоиммунная идиопатическая тромбоцитопеническая пурпура) — заболевание, характеризующееся множественными кровоизлияниями в кожу и кровотечениями из слизистых оболочек, обусловленными пониженной концентрацией в крови тромбоцитов.
Наблюдается чаще у женщин в период перестройки нейроэндокринной системы — в 15—20 и 40—50 лет, а также у новорожденных. Известны случаи семейных заболеваний. Сущность заболевания заключается в пониженной выработке тромбоцитов, либо в бесконтрольном приёме антитромбоцитарных препаратов. Медикаментозная тромбоцитопения возникает вскоре после приема медикаментов, продолжается обычно 1 —12 недель, и как правило, заканчивается спонтанным выздоровлением.
Прогноз существенно зависит от своевременности обращения к сосудистому хирургу либо гематологу и начала лечения, а также вторичной профилактики!
Жалобы пациентов
Жалобы на кровоизлияния в кожные покровы и кровотечения из слизистых оболочек, которые развиваются самопроизвольно или под влиянием незначительных травм. Наиболее часто жалобы на кровотечения из носа, десен и из полости рта, иногда — из внутренних органов; у женщин жалобы на маточные кровотечения. Часто синяки возникают после незначительной тупой травмы или спонтанно.
Наиболее часто жалобы на кровотечения из носа, десен и из полости рта, иногда — из внутренних органов; у женщин жалобы на маточные кровотечения. Часто синяки возникают после незначительной тупой травмы или спонтанно.
Диагностика
Диагностика выставляется при объективном осмотре сосудистым хирургом либо гематологом, и устанавливается по видимым изменениям окраски кожных покровов. Диагноз выставляется на основании клинической и гематологической картины.
Прогноз в отношении жизни в большинстве случаев благоприятный, однако, возможен смертельный исход в результате массивных кровотечений и обширных кровоизлияний в жизненно важные органы. Иммунный характер тромбоцитопений устанавливают на основании соответствующих лабораторных тестов (обнаружение антитромбоцитарных антител).
Лечение только консервативное!
Ошибки
Ошибки: болезнь Верльгофа часто путают с неиммунными тромбоцитопениями, с тромбоцитопатией, лейкозом, системной красной волчанкой или ревматоидным артритом.
В соответствии с этиологией и патогенезом, а также клиническим течением различают следующие варианты тромбоцитопенической пурпуры:
- собственно болезнь Верльгофа— хроническая «идиопатическая» пурура;
- изоиммунная пурпура на фоне переливаний крови (тромбоцитарной массы) или частых прерываний беременности;
- пурпура новорожденных, связанная с прошедшими через плаценту материнскими клетками;
- аутоиммунные тромбоцитопении, сочетающиеся с гемолитической аутоиммунной анемией, системной красной волчанкой и др.;
- симптоматические тромбоцитопении, которые могут наблюдаться при В12-дефицитных, гипо- и апластических анемиях, острой и хронической лучевой болезни, радиации, системных поражениях кроветворения (лейкозы — ретикулезы), злокачественных новообразованиях, инфекционных заболеваниях, при приеме некоторых лекарств.
По течению выделяют острую (менее 6 месяцев) и хроническую форму тромбоцитопенической пурпуры. Хроническая форма подразделяется на варианты:
- с редкими рецидивами;
- с частыми рецидивами;
- непрерывно рецидивирующее течение.

Лечение болезни верльгофа — все симптомы, диагностика, врачи
Гематологи Москвы — последние отзывы
Очень внимательный, аккуратный врач и профессионал своего дела. Он собрал все сведения о заболевании, о проблеме обращения и исследовал все предоставленные анализы. Так же доктор вынес заключение и дал рекомендации. Я однозначно порекомендовала бы его и осталась очень довольна!
Ирина,
12 мая 2021
Ольга Алексеевна предоставила мне полную информацию по состоянию, подтвердила диагноз и рассказала о дальнейших действиях. Она не торопилась и всё доступно объяснила. Я не первый год наблюдаюсь у данного специалиста.
Она не торопилась и всё доступно объяснила. Я не первый год наблюдаюсь у данного специалиста.
На модерации,
30 мая 2021
Доктор доброжелательный, вежливый и внимательный. Она выслушала мою проблему, задавала вопросы, просмотрела результаты анализов и выписала направления на сдачу анализов. Так же врач назначила мне фолиевую кислоту и написала рекомендации. Я довольна!
Лариса,
27 мая 2021
Специалист очень хороший, человечный и профессиональный. Она мне всё доступно объяснила, всё расписала и назначила лечение.
Она мне всё доступно объяснила, всё расписала и назначила лечение.
Наталья,
27 мая 2021
Елена Николаевна внимательно выслушала все мои проблемы, осмотрела, проконсультировала и всё объяснила. Мы так же обсудили возможные варианты решения, дала рекомендации и заключение. Она профессиональный и доброжелательный врач. Всё прошло быстро, понятно и по делу.
Виталий,
27 мая 2021
Доктор меня проконсультировала, всё подробно объяснила и дала рекомендации. Она знающий и опытный врач, который производит благожелательные впечатления.
Она знающий и опытный врач, который производит благожелательные впечатления.
Софья,
27 мая 2021
Доктор хороший и доброжелательный. Он сказал что у меня не достаточно данных и направил на анализы.
Анастасия,
27 мая 2021
Доктор внимательный, замечательный и профессиональный. Это настоящий врач. Он все просмотрел, пояснил и направил на обследования.
Это настоящий врач. Он все просмотрел, пояснил и направил на обследования.
Эльвира,
27 мая 2021
Доктор очень приятный. Он хорошо ладит с детьми. Врач изучил анализы, посмотрел, послушал ребёнка, витамины не выписал, потому что режутся зубы и назначил анализ крови.
Лиля,
26 мая 2021
Открытый и легкий в общении доктор. Он мне задал вопросы, послушал, все рассказал, показал и понятно объяснил.
Он мне задал вопросы, послушал, все рассказал, показал и понятно объяснил.
Дарья,
25 мая 2021
Показать 10 отзывов из 1480
Тромбоцитопеническая пурпура
Тромбоцитопеническая пурпура
Тромбоцитопеническая пурпура – это заболевание, которое характеризуется кровоизлияниями под кожу, повышенной кровоточивостью, возникающих в результате тромбоцитопении – снижения количества тромбоцитов в крови. Поскольку тромбоциты отвечают за свертываемость крови, снижение их количества в крови до 150×109/л приводит к ее низкой свертываемости, поэтому возникают обильные кровотечения. Само название болезни Purpura thrombocytopenica в переводе с латинского означает: purpura — пурпурный цвет, thrombocyte – тромбоциты, от греч. penia – бедность. Синоним: болезнь Верльгофа.
penia – бедность. Синоним: болезнь Верльгофа.
Тромбоцитопеническую пурпуру относят к заболеваниям группы геморрагических диатезов. Встречается эта болезнь с частотой 10-80 случаев на миллион жителей в год. Обнаруживается пурпура чаще всего в детском возрасте, обычно у детей 2-7 лет, но встречается даже у грудных детей. В возрасте до 10 лет мальчики и девочки болеют с одинаковой частотой, после 10 лет – девочки болеют в несколько раз чаще. Начинается пурпура, как правило, после вирусной или бактериальной инфекции.
Симптомы
- Кровоизлияния в кожу.
- Бледность кожи.
- Кровотечение из носа.
- Кровоточивость десен.
- Кишечные, желудочные кровотечения.
- У девочек – маточные кровотечения.
- Низкое давление.
- Повышение температуры до 38°С.
- Лимфаденопатия — увеличение лимфатических узлов.
- В 15-20% случаев – увеличение печени и селезенки.
Классификация
В зависимости от причин и механизма развития различают следующие виды заболевания:
- Идиопатическая тромбоцитопеническая пурпура (болезнь Верльгофа).

- Изоиммунная – из-за повторных переливаний крови или тромбоцитной массы, а также беременностей.
- Врожденная иммунная тромбоцитопеническая пурпура – из-за несовместимости крови матери и ребенка, обычно проходит к 4-5 месяцам жизни ребенка.
- Аутоиммунная тромбоцитопеническая пурпура – сочетается с анемией, системной красной волчанкой и др.
- Симптоматическая – наблюдается при дефиците витамина В12, лучевой болезни, некоторых инфекциях, приеме некоторых сильнодействующих лекарственных препаратов.
Сочетание пурпуры с эндокардитом, малярией, лейшманиозом может осложнить протекание этих инфекционных заболеваний.
Причины возникновения
Обычно причиной тромбоцитопенической пурпуры служит вирусная инфекция – в 80% случаев это грипп, ветрянка, корь, краснуха. Случается, что болезнь спровоцировала реакция на прививку при вакцинации. Врожденная форма болезни вызвана несовместимостью материнской крови и ребенка, наследственными заболеваниями крови или обмена веществ. Пурпура может возникнуть при лейкозе и других раковых заболеваниях крови.
Пурпура может возникнуть при лейкозе и других раковых заболеваниях крови.
Диагностика
Диагностика основана на фиксации характерных симптомов – носовых, желудочных, кишечных, маточных кровотечений, бледности кожи, высокой температуре. Проводятся эндотелиальные пробы – их положительный результат свидетельствует о пурпуре. Проведение лабораторных тестов (измерение времени кровотечения, определение степени ретракции сгустка крови и др.) – наиболее надежный способ диагностики тромбоцитопенической пурпуры.
Для дифференциальной диагностики тромбоцитопенической пурпуры от лейкоза, красной волчанки, тромбоцитопатии проводят иммунологические исследования, пункцию красного костного мозга, структурный анализ крови.
Лечение заболевания
Прежде всего, нужно обеспечить ребенку постельный режим. Обычно лечение тромбоцитопенической пурпуры проводят в больнице. При кровотечении десен и слизистой рта пища для ребенка должна быть охлажденной.
Для лечения назначаются глюкокортикоиды и иммунодепрессанты. Рассмотрим их применение поподробнее.
Преднизолон – применяется в течение 2-3 недель в дозировке 2 мг в сутки на каждый килограмм массы тела. Затем идет снижение дозы и отмена препарата. Иногда применяются короткие курсы по 7 дней с дозировкой 3 мг в сутки на каждый килограмм массы тела. Между такими курсами делают перерыв 5-7 дней. В большинстве случаев такая методика помогает, однако у некоторых пациентов после отмены преднизолона может возникнуть рецидив болезни.
Иммуноглобулины – применяются в сочетании с основными препаратами (обычно с глюкокортикоидами). Чаще всего назначается внутривенное введение Ig 0,4 мг/кг в сутки, курс – 5 дней. Если эти препараты не улучшают ситуацию, то применяют цитостатики.
При слабом эффекте глюкокортикоидов и иммуноглобулинов рассматривается целесообразность проведения спленэктомии – операции по удалению селезенки. Как правило, такую операцию проводят детям от 5 лет, помогает она в 70% случаев.
Смертность от тромбоцитопенической пурпуры составляет 1-2% случаев. Основная причина – кровоизлияние в головной мозг. За последние годы в связи с развитием медицины врачам удалось существенно сократить количество летальных исходов заболевания.
Профилактика
Никаких профилактических мер по предупреждению тромбоцитопенической пурпуры не разработано. Профилактика сводится к предотвращению возможных рецидивов. Среди возможных мер профилактики можно выделить особое внимание детям при вакцинации, индивидуальный подход к детям с повышенным риском заболевания. После полного выздоровления от пурпуры пациенты находятся на учете в течение 5 лет, регулярно сдают кровь для анализа количества тромбоцитов. При заболевании другой инфекционной болезнью необходимо проведение тщательного обследования.
Болезнь Верльгофа (иммунопатологическая тромбоцитопеническая пурпура)
Болезнь Верльгофа или иммунопатологическая тромбоцитопеническая пурпура (ИТП) – нарушение свертывания крови, при котором иммунная система уничтожает тромбоциты – клетки необходимые для нормального свертывания крови. У больных данным недугом наблюдается низкое количество тромбоцитов в крови (тромбоцитопения).
У больных данным недугом наблюдается низкое количество тромбоцитов в крови (тромбоцитопения).
Причины
Болезнь Верльгофа возникает, когда определенные клетки иммунной системы вырабатывают антитела против тромбоцитов. Тромбоциты, в свою очередь, отвечают за свертывание крови — помогают крови организма сворачиваться для закрытия небольших отверстий поврежденных кровеносных сосудов.
При данном заболевании антитела, вырабатываемые организмом, атакуют тромбоциты, которые затем уничтожаются в селезенке.
У детей данное заболевание зачастую сопровождается вирусной инфекцией. У взрослых хроническая форма заболевания может возникнуть после вирусной инфекции, приема лекарственных препаратов определенной группы, во время беременности, или в результате расстройства иммунной системы.
ИТП чаще болеют женщины. В детском возрасте болезни в равной мере подвержены дети мужского и женского пола.
Симптомы
- Кровоизлияние на коже, характеризующееся появлением мелких красных точечных высыпаний
- Появление синяков необъяснимого происхождения
- Кровотечение из носа или кровотечение в полости рта
- Аномально обильная менструация
Диагностика
В лабораторных условиях проводятся тесты для проверки свертывания крови и количества тромбоцитов в организме.
- Общий анализ крови обычно выявляет низкое количество тромбоцитов
- Тесты на свертываемость крови могут оказаться аномальными
- Могут обнаруживаться антитела против тромбоцитов
- Наблюдается увеличение времени свертывания крови
Пункция костного омзга является одной из стандартных процедур диагностики и может выявить повышенное количество клеток мегакариоцитов. Данные клетки – ранняя форма тромбоцитов
Лечение
В большинстве случаев у детей заболевание проходит без лечения. Однако в некоторых случаях может потребоваться терапия.
Взрослым назначают стериойдные противовоспалительные средства (преднизолон). В некоторых тяжелых случаях может быть рекомендована хирургическая процедура по удалению селезенки (спленэктомия). Данная процедура обычно помогает примерно половине пациентов восстановить количество тромбоцитов в организме.
Если лечение преднизолоном не помогло, то другие виды терапии могут включить в себя:
- Прием лекарства Данозол
- Инъекции больших доз гамма-глобулина
- Прием препаратов, подавляющие иммунную систему
- Фильтрация антител в крови
- Анти-RhD терапия для людей с определенным типом крови
Людям, страдающим от болезни Верльгофа не стоит принимать аспирин, ибупрофен или варфарин, так как эти медицинские препараты влияют на функцию тромбоцитов и свертывание крови из-за чего могут спровоцировать кровотечение.
Течение болезни
При лечении шанс наступления ремиссии (периода без симптомов болезни) очень высок. В редких случаях болезнь принимает хроническую форму у взрослых и может вновь проявляться даже после периода ремиссии.
Теги:
Болезнь Верльгофа
иммунопатологическая тромбоцитопеническая пурпура
Синонимы:
иммунопатологическая тромбоцитопеническая пурпура
Лечение болезни верльгофа (тромбоцитопеническая пурпура). Список клиник, рейтинг, отзывы, цены
О заболевании
ИТП — это состояние, когда у человека слишком легко появляются синяки и ссадины. У человек также могут легко возникать кровотечения. Это состояние развивается, если у человека низкий уровень тромбоцитов в крови. Тромбоциты ответственны за свертывание крови, что жизненно важно для остановки кровотечения, а также для заживления синяков.
ИТП может развиваться у взрослых и детей. Интересно, что детям намного легче оправиться от этого состояния, а для взрослых это состояние может стать долгосрочным. Кроме того, дети обычно восстанавливаются без лечения. У детей основной причиной идиопатической тромбоцитопенической пурпуры является вирусная инфекция, которая влияет на процесс свертывания крови, а именно на уровни тромбоцитов в крови. У взрослых могут быть легкие и тяжелые случаи идиопатической тромбоцитопенической пурпуры. В легких случаях человек может даже не заметить, что у них низкий уровень тромбоцитов. В тяжелых случаях существует риск развития внутреннего кровоизлияния в результате внутреннего кровотечения, поэтому важно пройти лечение, чтобы избежать такого риска.
Кроме того, дети обычно восстанавливаются без лечения. У детей основной причиной идиопатической тромбоцитопенической пурпуры является вирусная инфекция, которая влияет на процесс свертывания крови, а именно на уровни тромбоцитов в крови. У взрослых могут быть легкие и тяжелые случаи идиопатической тромбоцитопенической пурпуры. В легких случаях человек может даже не заметить, что у них низкий уровень тромбоцитов. В тяжелых случаях существует риск развития внутреннего кровоизлияния в результате внутреннего кровотечения, поэтому важно пройти лечение, чтобы избежать такого риска.
У детей, причинами которые идиопатической тромбоцитопенической пурпуры, являются грипп и эпидемический паротит. У взрослых идиопатическая тромбоцитопеническая пурпура проявляется как аутоиммунное состояние, когда иммунная система начинает бороться против самого себя. Это состояние чаще встречается у женщин.
Симптомы
- Чрезмерные синяки
- Частые кровотечения
- Носовые кровотечения
- Тяжелые менструации у женщин
- Кровь в моче в некоторых случаях
- Кровотечение из десен
- Слабость
- Усталость
Диагностика
- Во время общего обследования врач спрашивает у человека, страдал ли он от аутоиммунного состояния.
 У детей врач спросит, были ли ранее инфекции, такие как свинка и грипп
У детей врач спросит, были ли ранее инфекции, такие как свинка и грипп - Развернутый анализ крови используется для подсчета тромбоцитов в крови
- Иногда используется анализ костного мозга, хотя он чаще используется у взрослых для определения точной причины идиопатической тромбоцитопенической пурпуры
Виды лечения
- Консервативное лечение включает назначение лекарств, которые стимулируют выработку тромбоцитов в крови. В некоторых случаях иммунодепрессанты можно назначать для снижения реакции иммунной системы. Кроме того, врач может использовать инъекции, которые повышают количество клеток крови.
- Операция может быть использована для удаления селезенки, чтобы увеличить количество тромбоцитов.
Автор: Доктор Вадим Жилюк
Что нужно знать о тромбоцитопенической пурпуре
Болезнь Верльгофа
Есть множество заболеваний, ведущим симптомом которых являются геморрагические поражения. К их числу относится тромбоцитопеническая пурпура, или болезнь Верльгофа (она была описана этим немецким врачом в 1735 году). Речь идет о гематологической патологии, сопровождающейся снижением количества тромбоцитов в крови, повышенной кровоточивостью и развитием геморрагического синдрома.
К их числу относится тромбоцитопеническая пурпура, или болезнь Верльгофа (она была описана этим немецким врачом в 1735 году). Речь идет о гематологической патологии, сопровождающейся снижением количества тромбоцитов в крови, повышенной кровоточивостью и развитием геморрагического синдрома.
Обычно заболевание возникает в возрасте до 10 лет и является одной из самых распространенных форм геморрагического диатеза у детей. Среди взрослых чаще болеют молодые женщины. Причины возникновения первичной (идиопатической) формы тромбоцитопенической пурпуры в настоящее время изучены недостаточно, но считается, что большинство случаев связано с аутоиммунной реакцией организма. Часто болезнь развивается после перенесенных заболеваний верхних дыхательных путей вирусного или бактериального генеза, ветряной оспы, кори, краснухи, инфекционного мононуклеоза и других инфекций.
В зависимости от длительности течения различают острые (от 3 до 6 месяцев) и хронические формы заболевания, причем у детей чаще диагностируется острая форма, а у взрослых — хроническая. Ведущими симптомами болезни Верльгофа являются кровоизлияния в кожу и кровотечения из слизистых оболочек, которые возникают либо спонтанно, либо вследствие незначительных травм. Кровоизлияния располагаются на туловище, конечностях, слизистой оболочке полости рта, реже на лице и волосистой части головы. Особенностью кожных геморрагий при тромбоцитопенической пурпуре является их беспорядочность, асимметричность, полиморфность. Наряду с незначительной геморрагической сыпью встречаются кровоподтеки различной величины. Их цвет меняется от багрово-красного до синего, зеленоватого и желтого. К частым симптомам относят кровотечения из слизистых оболочек, в первую очередь это носовые кровотечения, обычно повторные, приводящие к анемии. Нередко кровотечения наблюдаются в ротовой полости, пищеварительном тракте, мочевом пузыре, у девушек — маточные кровотечения. Возможны кровоизлияния в плевру, яичники, почки, склеру и сетчатку глаза. Наиболее опасным осложнением является кровоизлияние в головной мозг, которое имеет самые тяжелые последствия и может привести к летальному исходу.
Ведущими симптомами болезни Верльгофа являются кровоизлияния в кожу и кровотечения из слизистых оболочек, которые возникают либо спонтанно, либо вследствие незначительных травм. Кровоизлияния располагаются на туловище, конечностях, слизистой оболочке полости рта, реже на лице и волосистой части головы. Особенностью кожных геморрагий при тромбоцитопенической пурпуре является их беспорядочность, асимметричность, полиморфность. Наряду с незначительной геморрагической сыпью встречаются кровоподтеки различной величины. Их цвет меняется от багрово-красного до синего, зеленоватого и желтого. К частым симптомам относят кровотечения из слизистых оболочек, в первую очередь это носовые кровотечения, обычно повторные, приводящие к анемии. Нередко кровотечения наблюдаются в ротовой полости, пищеварительном тракте, мочевом пузыре, у девушек — маточные кровотечения. Возможны кровоизлияния в плевру, яичники, почки, склеру и сетчатку глаза. Наиболее опасным осложнением является кровоизлияние в головной мозг, которое имеет самые тяжелые последствия и может привести к летальному исходу.
Для точной постановки диагноза необходим анализ крови с определением скорости свертывания, уровня тромбоцитов и гемоглобина. Лечение направлено на ликвидацию геморрагического синдрома, устранение анемии и предотвращение рецидивов. В случае значительного падения уровня тромбоцитов лечение проводится в условиях стационара из-за высокого риска развития осложнений. В терапии тромбоцитопенической пурпуры применяют препараты, обладающие кровоостанавливающим действием (местным или общим) и снижающие сосудистую проницаемость. При необходимости проводят переливание крови, тромбоцитарной и эритроцитарной массы. Однако в основе терапии — применение глюкокортикостероидов, которые позволяют подавить аутоиммунные процессы и снизить сосудистую проницаемость. При неэффективности консервативного лечения прибегают к спленэктомии — удалению селезенки. В большинстве случаев заболевание заканчивается полным выздоровлением, однако в дальнейшем необходимо постоянное наблюдение у гематолога.
Юрий Кузьменков, врач РНПЦ «Кардиология»
Сфера интересов доктора — терапия, кардиология, эндокринология.
Ждем ваших вопросов, друзья!
Болезнь Верльгофа
Болезнь Верльгофа – заболевание, характеризующееся кровотечениями из слизистых оболочек и множественными кровоизлияниями в кожу.
Тромбоцитопеническая пурпура, тромбоцитопения и болезнь Верльгофа – это разные названия одного и того же заболевания, связанного с уменьшением количества тромбоцитов в крови.
Болезнь Верльгофа у детей является самым распространенным генетическим заболеванием крови. Среди взрослых людей заболевание встречается чаще у женщин.
Причины болезни Верльгофа
Причина заболевания до конца не установлена, но обычно болезнь Верльгофа возникает после перенесенных вирусных, бактериальных и других инфекционных заболеваний. Также спровоцировать болезнь может вакцинация, переохлаждение или перегревание организма и прием лекарственных препаратов.
Механизм тромбоцитопении при болезни Верльгофа заключается в повышенном разрушении тромбоцитов в результате образования антител, нарушении образования тромбоцитов в костном мозге и укорачивании продолжительности их жизни.
Симптомы болезни Верльгофа
Заболевание проявляется кровоизлияниями на коже и слизистых оболочках, а также носовыми, десневыми и желудочно-кишечными кровотечениями. У больного могут возникать судороги, слабость и тошнота. Самое тяжелое осложнение болезни – кровоизлияние в мозг.
Лечение болезни Верльгофа
Диагностика заболевания включает в себя общий и биохимический анализы крови и мочи, пункцию костного мозга. Исследования крови показывают, что уровень эритроцитов и тромбоцитов низкий, а время продолжительности кровотечения повышено.
Методы лечения болезни Верльгофа зависят от стадии заболевания. Лечение заболевания направлено на остановку кровотечений и предупреждение рецидива. Для этого назначают кровоостанавливающие препараты, кортикостероиды и проводят переливание крови или тромбоцитарной массы. Оперативный метод лечения заключается в удалении селезенки, но после операции может исчезнуть лишь кровоточивость, а тромбоцитопения остаться.
Прогноз и профилактика болезни Верльгофа
В большинстве случаев прогноз благоприятный, процент летальных исходов в связи с кровоизлиянием в мозг низкий.
Профилактика болезни Верльгофа заключается в избегании людьми, имеющих наследственную предрасположенность к заболеванию, факторов, которые могут спровоцировать его. К таким факторам относятся инфекционные заболевания, переохлаждения и перегревания организма, а также прием лекарственных препаратов и вакцинация.
Болезнь Верльгофа и беременность
Специалисты долгое время спорили о сохранении беременности пациенток, страдающих болезнью Верльгофа. В настоящее время стало ясно, что при своевременной помощи будущей матери, исход беременности благоприятный, если болезнь протекает спокойно. Но также могут возникнуть и осложнения беременности, такие как выкидыш, кровотечения после родов, отслойка плаценты, гестоз и другие.
Подвержены ли пациенты с болезнью Верльгофа повышенному риску кровотечений во время кардиохирургических операций? | Европейский журнал кардио-торакальной хирургии
Аннотация
Предпосылки : Обычно предполагается, что пациенты с болезнью Верльгофа (ББ) подвергаются повышенному риску кровотечений при проведении кардиохирургических операций с экстракорпоральным кровообращением. Поэтому мы провели это исследование случай-контроль, чтобы оценить реальный риск кровотечений у этих пациентов. Методы : С 05/95 по 07/98 десять пациентов с WD (восемь мужчин, две женщины) перенесли кардиохирургические операции с использованием экстракорпорального кровообращения (группа WD). Пятеро из этих пациентов с количеством тромбоцитов ниже 80 / нл получали до операции иммуноглобулины. Каждый пациент с WD был сопоставлен с пятью пациентами без WD (группа без WD) с использованием диагноза, возраста, пола, фракции выброса, количества дистальных анастомозов и индекса массы тела в качестве критериев соответствия. Результаты : Среднее количество тромбоцитов было значительно ниже в группе WD, чем в группе без WD, несмотря на значительное увеличение количества тромбоцитов после лечения иммуноглобулином (54 / нл↠112 / нл, P = 0.018). Накануне, непосредственно после и в первый день после операции они составляли 141 / нл против 215 / нл ( P = 0,012), 75 / нл против 147 / нл ( P = 0,001) и 93 / нл.
Поэтому мы провели это исследование случай-контроль, чтобы оценить реальный риск кровотечений у этих пациентов. Методы : С 05/95 по 07/98 десять пациентов с WD (восемь мужчин, две женщины) перенесли кардиохирургические операции с использованием экстракорпорального кровообращения (группа WD). Пятеро из этих пациентов с количеством тромбоцитов ниже 80 / нл получали до операции иммуноглобулины. Каждый пациент с WD был сопоставлен с пятью пациентами без WD (группа без WD) с использованием диагноза, возраста, пола, фракции выброса, количества дистальных анастомозов и индекса массы тела в качестве критериев соответствия. Результаты : Среднее количество тромбоцитов было значительно ниже в группе WD, чем в группе без WD, несмотря на значительное увеличение количества тромбоцитов после лечения иммуноглобулином (54 / нл↠112 / нл, P = 0.018). Накануне, непосредственно после и в первый день после операции они составляли 141 / нл против 215 / нл ( P = 0,012), 75 / нл против 147 / нл ( P = 0,001) и 93 / нл. nl против 136 / nl ( P = 0,009). Соответственно, пациенты из группы WD получали значительно больше концентратов тромбоцитов, чем пациенты из группы без WD (среднее количество концентратов тромбоцитов: 2,3 против 0,7, P = 0,007). Полная потеря дренажа через медиастинальные грудные трубки была почти одинаковой (1197 мл в группе без WD и 1140 мл в группе WD).Один пациент в каждой группе страдал кровотечением, требующим повторного обследования. Три пациента из группы без WD (6%) и один пациент из группы WD (10%) скончались после операции, не связанной с WD. Выводы : Пациенты с WD могут подвергаться кардиохирургическому вмешательству без заметно повышенного риска кровотечений, несмотря на более высокую, чем обычно, потребность в переливании крови и значительно более низкое количество тромбоцитов в периоперационном периоде.
nl против 136 / nl ( P = 0,009). Соответственно, пациенты из группы WD получали значительно больше концентратов тромбоцитов, чем пациенты из группы без WD (среднее количество концентратов тромбоцитов: 2,3 против 0,7, P = 0,007). Полная потеря дренажа через медиастинальные грудные трубки была почти одинаковой (1197 мл в группе без WD и 1140 мл в группе WD).Один пациент в каждой группе страдал кровотечением, требующим повторного обследования. Три пациента из группы без WD (6%) и один пациент из группы WD (10%) скончались после операции, не связанной с WD. Выводы : Пациенты с WD могут подвергаться кардиохирургическому вмешательству без заметно повышенного риска кровотечений, несмотря на более высокую, чем обычно, потребность в переливании крови и значительно более низкое количество тромбоцитов в периоперационном периоде.
1 Введение
Принято считать, что пациенты, страдающие болезнью Верльгофа (ББ) и перенесшие хирургические вмешательства, имеют повышенный риск послеоперационных кровотечений. Это особенно актуально для операций на сердце с использованием экстракорпорального кровообращения из-за необходимости полной гепаринизации и деструктивного воздействия экстракорпорального кровообращения на все компоненты крови. Из-за редкого сочетания ББ и ишемической болезни сердца в англо-американской литературе имеется лишь несколько сообщений с небольшим количеством пациентов [1–8], так что реальный риск кровотечений до сих пор остается неясным. Поэтому мы провели это исследование случай-контроль, сравнивая пациентов с WD и без него, чтобы оценить риск кровотечений.
Это особенно актуально для операций на сердце с использованием экстракорпорального кровообращения из-за необходимости полной гепаринизации и деструктивного воздействия экстракорпорального кровообращения на все компоненты крови. Из-за редкого сочетания ББ и ишемической болезни сердца в англо-американской литературе имеется лишь несколько сообщений с небольшим количеством пациентов [1–8], так что реальный риск кровотечений до сих пор остается неясным. Поэтому мы провели это исследование случай-контроль, сравнивая пациентов с WD и без него, чтобы оценить риск кровотечений.
2 Материалы и методы
В период с мая 1995 г. по июль 1998 г. десять пациентов (восемь мужчин, две женщины) с WD (группа WD) были направлены в наше учреждение для кардиохирургии с экстракорпоральным кровообращением (десять из 4533 пациентов, 0,22%). Пять пациентов без WD были сопоставлены с каждым пациентом с WD с использованием диагноза, возраста, пола, фракции выброса, количества дистальных анастомозов и индекса массы тела в качестве критериев соответствия (группа без WD). Для качественных данных требовалось соответствие, для количественных допускались отклонения до 10%.Критерии соответствия представлены в таблице 1.
Для качественных данных требовалось соответствие, для количественных допускались отклонения до 10%.Критерии соответствия представлены в таблице 1.
Таблица 1
Таблица 1
Отмеченные предоперационные параметры включали тяжесть и лечение WD, классификацию NYHA и срочность хирургического вмешательства. Кроме того, оценивались время пережатия, продолжительность экстракорпорального кровообращения и хирургического вмешательства, а также пребывание в отделении интенсивной терапии. Что касается периоперационного риска, мы проанализировали степень кровопотери и потребности в переливании крови, а также смертность и заболеваемость.
Антикоагуляция для экстракорпорального кровообращения проводилась гепарином (400 Ед / кг, время активированной коагуляции ≥400 с) всем пациентам. Эффекты гепарина были отменены снижением дозы протамина (0,3 мл / кг), поскольку хорошо известно, что такое лечение приводит к меньшей кровопотере и увеличению количества тромбоцитов в послеоперационном периоде [9].
Диагноз WD был поставлен при наличии хронической тромбоцитопении с нормальной морфологией костного мозга (у двух пациентов повышенный мегакариоцитопоэз), отсутствии спленомегалии и других причин вторичной тромбоцитопении.У восьми пациентов с WD не было симптомов заболевания, и они не лечились. Двум пациентам перед госпитализацией была выполнена спленэктомия из-за склонности к спонтанному кровотечению, но только у одного пациента она была успешной. Другой пациент получил циклоспорин и кортикостероиды, но это лечение также не помогло. Пять пациентов с числом тромбоцитов ≥80 / нл получали иммуноглобулины (0,4 г / кг в день в течение 4–5 дней) до операции, остальные пять пациентов с числом тромбоцитов ≥80 / нл не получали специального лечения.
Статистический анализ проводился с помощью точного критерия Фишера для качественных данных и критерия Манна – Уитни для количественных данных. Парные сравнения рассчитывались с помощью критерия Вилкоксона. Значение P 0,05 считалось значительным.
3 Результаты
Статистический анализ не выявил различий между обеими группами в отношении критериев соответствия (таблица 1).
Значительные различия были обнаружены в среднем количестве потребностей в переливании эритроцитов и концентратов тромбоцитов, а также в среднем количестве тромбоцитов за день до, сразу после и в первый день после операции.На второй и третий день после операции различия между обеими группами в отношении количества тромбоцитов больше не были значимыми. Требования к переливанию представлены в таблице 2, а периоперационный курс подсчета тромбоцитов — на рисунке 1.
Таблица 2
Таблица 2
Рис. 1
Периоперационный курс подсчета тромбоцитов. При переливании концентратов тромбоцитов и инфузии 60 г иммуноглобулинов одному пациенту в первый послеоперационный день среднее количество тромбоцитов в послеоперационном периоде не опускалось ниже 75 / нл (данные представлены как среднее значение и диапазон). no-WD-группа, — — — -; WD-группа, — # P = 0,012; ○ P = 0,001; * P = 0,009.
no-WD-группа, — — — -; WD-группа, — # P = 0,012; ○ P = 0,001; * P = 0,009.
Рис. 1
Периоперационный курс подсчета тромбоцитов. При переливании концентратов тромбоцитов и инфузии 60 г иммуноглобулинов одному пациенту в первый послеоперационный день среднее количество тромбоцитов в послеоперационном периоде не опускалось ниже 75 / нл (данные представлены как среднее значение и диапазон). no-WD-группа, — — — -; WD-группа, — # P = 0,012; ○ P = 0.001; * P = 0,009.
Всем пациентам планово выполнено аортокоронарное шунтирование. Продолжительность операции и экстракорпоральное кровообращение, а также время пережатия и кровопотеря показаны в таблице 2. У одного пациента из группы WD также был стеноз высокой степени левой внутренней сонной артерии, который привел к длительному обратимый ишемический неврологический дефицит за 2 месяца до операции на сердце. Поэтому ему пришлось пройти эндартерэктомию левой внутренней сонной артерии одновременно с аортокоронарным шунтированием. Кроме того, перед операцией был имплантирован внутриаортальный баллонный насос из-за тяжелой дисфункции левого желудочка. Помпа снята на вторые сутки после операции без осложнений.
Кроме того, перед операцией был имплантирован внутриаортальный баллонный насос из-за тяжелой дисфункции левого желудочка. Помпа снята на вторые сутки после операции без осложнений.
Продолжительность искусственной вентиляции легких и время пребывания в реанимации составили 17,6 ч (9–50 ч) и 4,0 дня (2–7 дней) соответственно в группе WD и 12,0 ч (4–26 ч) и 4,2 часа. (1–23 ч) в группе без ВД.
Одно повторное исследование у пациента из группы без БВ пришлось провести по поводу тампонады перикарда, которая была вызвана тенденцией к диффузному кровотечению.Также в группе WD произошло одно кровотечение: оно было вызвано кровоточащей ветвью левой внутренней грудной артерии. Один пациент в каждой группе скончался из-за трудноизлечимой сердечной аритмии: два других пациента из группы без WD умерли из-за полиорганной недостаточности и пневмонии, вызванной искусственной вентиляцией легких.
Дальнейшие послеоперационные осложнения возникли у девяти пациентов из группы без ВБ. Двум пациентам пришлось повторно интубировать дыхательную недостаточность; через несколько дней их успешно отлучили от ИВЛ.Четырем пациентам потребовалась послеоперационная имплантация внутриаортального баллонного насоса для стабилизации гемодинамики. Все пациенты были успешно отлучены от внутриаортального баллонного насоса, но одному пациенту пришлось перенести фасциотомию из-за компартмент-синдрома. У двух пациентов нарушения заживления ран лечились консервативно, у одного потребовалось оперативное вмешательство.
Двум пациентам пришлось повторно интубировать дыхательную недостаточность; через несколько дней их успешно отлучили от ИВЛ.Четырем пациентам потребовалась послеоперационная имплантация внутриаортального баллонного насоса для стабилизации гемодинамики. Все пациенты были успешно отлучены от внутриаортального баллонного насоса, но одному пациенту пришлось перенести фасциотомию из-за компартмент-синдрома. У двух пациентов нарушения заживления ран лечились консервативно, у одного потребовалось оперативное вмешательство.
4 Комментарий
Наше текущее исследование демонстрирует, что количество тромбоцитов у пациентов с WD значительно ниже в периоперационном периоде (рис.1) несмотря на предоперационное лечение иммуноглобулинами, как описано выше. Поэтому количество переливаемых продуктов крови (таблица 2), особенно концентратов тромбоцитов, превышает обычную потребность.
Согласно предыдущим сообщениям [4,5,8], более низкое количество тромбоцитов, помимо пагубного воздействия экстракорпорального кровообращения на тромбоциты, необходимость полной антикоагуляции и нарушение функции циркулирующих тромбоцитов, были предположительно ответственны за повышенный риск послеоперационных кровотечений. , повторные исследования и переливание продуктов крови.Поскольку консервативная терапия WD, состоящая из кортикостероидов и / или иммуносупрессивного лечения, редко была успешной в отношении нормализации количества тромбоцитов и регресса симптомов, было описано несколько стратегий для снижения риска послеоперационных кровотечений у пациентов с WD:
, повторные исследования и переливание продуктов крови.Поскольку консервативная терапия WD, состоящая из кортикостероидов и / или иммуносупрессивного лечения, редко была успешной в отношении нормализации количества тромбоцитов и регресса симптомов, было описано несколько стратегий для снижения риска послеоперационных кровотечений у пациентов с WD:
Спленэктомия была предлагается как одновременная процедура или перед операцией на сердце [4,5]. Недостатками комбинированной процедуры являются повышенный операционный риск и то, что нормализация количества тромбоцитов занимает несколько дней.Таким образом, пациенту не приносит пользы дополнительная процедура, то есть спленэктомия, в раннем послеоперационном периоде, когда риск кровотечений наиболее высок. Поэтому была введена поэтапная процедура, но это ведение требует дополнительного оперативного вмешательства, которое также несет в себе риск кровотечений и отсрочку кардиохирургического вмешательства.
Предоперационное лечение иммуноглобулинами может быть лучшим терапевтическим методом [6,10,11]. Это приводит к временному увеличению количества тромбоцитов, которое можно легко контролировать с помощью анализа количества тромбоцитов, позволяет оптимизировать время хирургических вмешательств и продолжается в прямом послеоперационном периоде [12,13].В нашем недавнем отчете мы смогли четко продемонстрировать этот эффект лечения иммуноглобулином у пациентов с количеством тромбоцитов ниже 80 / нл: среднее количество тромбоцитов увеличилось с 54 / нл за 5 дней до операции до 112 / нл за день до операции ( P = 0,018). и после операции не опускалась ниже 60 / нл [11]. Пациенты с количеством тромбоцитов выше 80 / нл не получали иммуноглобулины без повышенного риска послеоперационных кровотечений [11]. Точный механизм действия иммуноглобулинов до сих пор неясен; Обсуждается несколько возможностей: нарушение фагоцитоза тромбоцитов ретикулоэндотелиальной системой, нейтрализация аутоантител, ингибирование синтеза аутоантител или нарушение взаимодействия между тромбоцитами и активированными факторами комплемента [12,14].
Это приводит к временному увеличению количества тромбоцитов, которое можно легко контролировать с помощью анализа количества тромбоцитов, позволяет оптимизировать время хирургических вмешательств и продолжается в прямом послеоперационном периоде [12,13].В нашем недавнем отчете мы смогли четко продемонстрировать этот эффект лечения иммуноглобулином у пациентов с количеством тромбоцитов ниже 80 / нл: среднее количество тромбоцитов увеличилось с 54 / нл за 5 дней до операции до 112 / нл за день до операции ( P = 0,018). и после операции не опускалась ниже 60 / нл [11]. Пациенты с количеством тромбоцитов выше 80 / нл не получали иммуноглобулины без повышенного риска послеоперационных кровотечений [11]. Точный механизм действия иммуноглобулинов до сих пор неясен; Обсуждается несколько возможностей: нарушение фагоцитоза тромбоцитов ретикулоэндотелиальной системой, нейтрализация аутоантител, ингибирование синтеза аутоантител или нарушение взаимодействия между тромбоцитами и активированными факторами комплемента [12,14].
Введение продуктов крови, особенно концентратов тромбоцитов у пациентов с WD, представляет собой хорошо известный шаг по увеличению количества тромбоцитов. Ключевой вопрос заключается в том, когда и почему показано переливание продуктов крови пациентам с WD. По данным Salmenperä et al. [15], количество тромбоцитов постепенно снижается во время экстракорпорального кровообращения и остается на уровне половины исходного уровня до четвертого послеоперационного дня. Кроме того, помимо активации тромбоцитов при контакте с инородными поверхностями экстракорпорального кровообращения, часто встречается дисфункция тромбоцитов, которая вызвана изменениями мембраны тромбоцитов из-за напряжения сдвига, поверхностного прилипания и турбулентного потока.Несмотря на активацию тромбоцитов, длительное время кровотечения после кардиохирургического вмешательства из-за дисфункции тромбоцитов хорошо известно и является наиболее вероятной причиной нехирургического кровотечения [15]. Следовательно, соответствующее лечение пациентов с WD с низким количеством тромбоцитов начинается уже до операции. Как описано выше, пациентам с WD с количеством тромбоцитов ниже 80 / мл мы вводим иммуноглобулины для увеличения количества тромбоцитов.
Как описано выше, пациентам с WD с количеством тромбоцитов ниже 80 / мл мы вводим иммуноглобулины для увеличения количества тромбоцитов.
У наших пациентов с WD не было необходимости в интраоперационном введении продуктов крови.В послеоперационном периоде переливание продуктов крови следует обычным рекомендациям в случае обильного кровотечения [15]. Пациентам без явной тенденции к кровотечениям концентраты тромбоцитов переливают эмпирически, если количество тромбоцитов падает ниже 60 / нл. Этот порог подтверждается Simon et al. [16], которые сообщили, что профилактическое введение концентратов тромбоцитов не снижает кровопотери через дренажную трубку и потребность в переливании крови, а также не улучшает клинический исход у пациентов с легкой тромбоцитопенией (количество тромбоцитов 58 / нл).Упакованные эритроциты переливают пожилым пациентам (возраст старше 65 лет), если гемоглобин ниже 10 г / дл; у более молодых стабильных пациентов порог переливания — гемоглобин ниже 8 г / дл [17].
Раннее применение продуктов крови у пациентов с WD (особенно переливание концентратов тромбоцитов пациентам без явной тенденции к кровотечению и количества тромбоцитов ниже 60 / нл) может быть причиной того, что мы не смогли продемонстрировать каких-либо существенных различий в общем дренаже. потеря между обеими группами нашего исследования.Конечно, основным ограничением нашего исследования является небольшое количество пациентов с WD, поэтому мы, возможно, не смогли продемонстрировать ожидаемые различия в кровопотере или повышенный риск послеоперационных кровотечений. Но наше исследование ясно показывает, что количество тромбоцитов в периоперационном периоде значительно ниже, а потребности в переливании крови значительно увеличиваются у пациентов с WD.
5 Заключение
Пациенты с WD могут подвергнуться кардиохирургическому вмешательству без значительного увеличения риска кровотечений, несмотря на более высокую, чем обычно, потребность в переливании крови и значительно более низкое количество тромбоцитов в периоперационном периоде.
Список литературы
[1],,.
Операция на сердце у пациента с рефрактерной идиопатической тромбоцитопенической пурпурой
,
J Thorac Cardiovasc Surg
,
1994
, vol.
107
(стр.
316
—
317
) [2].
Аортокоронарное шунтирование при хронической иммуноопосредованной тромбоцитопенической пурпуре: предоперационное лечение внутривенным иммуноглобулином и кортикостероидами
,
Military Med
,
1995
, vol.
160
(стр.
624
—
625
) [3].
Аортокоронарное шунтирование у двух пациентов с иммунной тромбоцитопенической пурпурой без предоперационной спленэктомии
,
WV Med J
,
1992
, vol.
88
(стр.
510
—
511
) [4],,,,,.
Комбинированная коронарная реваскуляризация и спленэктомия
,
Ann Thorac Surg
,
1989
, vol.
48
(стр.
853
—
854
) [5],,.
Замена митрального клапана и спленэктомия у пациента с хронической идиопатической тромбоцитопенической пурпурой
,
Thorac Cardiovasc Surgeon
,
1982
, vol.
30
(стр.
407
—
408
) [6],,,,.
Аортокоронарное шунтирование при иммунной тромбоцитопенической пурпуре
,
Ann Thorac Surg
,
1997
, vol.
64
(стр.
1059
—
1062
) [7],.
Замена митрального клапана у пациента с идиопатической тромбоцитопенической пурпурой: предоперационное лечение даназолом
,
J Cardiovasc Surg
,
1991
, vol.
32
(стр.
840
—
842
) [8],,,.
Аортокоронарное шунтирование при идиопатической тромбоцитопении без спленэктомии
,
Ann Thorac Surg
,
1989
, vol.
48
(стр.
721
—
722
) [9],,,.
Успешное применение уменьшенной дозы протамина после искусственного кровообращения
,
Anesth Analg
,
1976
, vol.
55
(стр.
110
—
113
) [10],,,,.
Болезнь Верльгофа — фактор риска кардиохирургии?
,
Z Herz- Thorax- Gefäßchir
,
1997
, т.
11
(стр.
198
—
202
) [11],,,,,,.
Предоперационное лечение ИГ у пациентов с болезнью Верльгофа, перенесших операцию на сердце
,
Ann Thorac Surg
,
2000
, vol.
69
(стр.
61
—
64
) [12],.
Аутоантитела к гликопротеинам тромбоцитов при аутоиммунной тромбоцитопенической пурпуре: их клиническое значение и ответ на лечение
,
Кровь
,
1993
, т.
81
(стр.
1246
—
1250
) [14].
Старые и новые взгляды на внутривенную иммуноглобулиновую терапию
,
Schweiz Med Wochenschr
,
1994
, vol.
124
(стр.
5
—
25
) [15],,. .
Гемостаз и искусственное кровообращение
,
Искусственное кровообращение
,
1995
Нью-Йорк
Springer
(стр.
88
—
113
) [16],.
Контролируемое испытание рутинного введения концентратов тромбоцитов при искусственном кровообращении
,
Ann Thorac Surg
,
1984
, vol.
37
(стр.
359
—
364
) [17],. ,,,,.
,,,,.
Геморрагические и тромботические осложнения кардиохирургии
,
Торакальная и сердечно-сосудистая хирургия Гленна, т. 2
,
1995
6-е изд. (Стр.
1793
—
1810
)
© 2000 Elsevier Science B.V. Все права защищены.
Elsevier Science B.V.
Подвержены ли пациенты с болезнью Верльгофа повышенному риску кровотечений во время кардиохирургических операций? | Европейский журнал кардио-торакальной хирургии
Аннотация
Предпосылки : Обычно предполагается, что пациенты с болезнью Верльгофа (ББ) подвергаются повышенному риску кровотечений при проведении кардиохирургических операций с экстракорпоральным кровообращением.Поэтому мы провели это исследование случай-контроль, чтобы оценить реальный риск кровотечений у этих пациентов. Методы : С 05/95 по 07/98 десять пациентов с WD (восемь мужчин, две женщины) перенесли кардиохирургические операции с использованием экстракорпорального кровообращения (группа WD). Пятеро из этих пациентов с количеством тромбоцитов ниже 80 / нл получали до операции иммуноглобулины. Каждый пациент с WD был сопоставлен с пятью пациентами без WD (группа без WD) с использованием диагноза, возраста, пола, фракции выброса, количества дистальных анастомозов и индекса массы тела в качестве критериев соответствия. Результаты : Среднее количество тромбоцитов было значительно ниже в группе WD, чем в группе без WD, несмотря на значительное увеличение количества тромбоцитов после лечения иммуноглобулином (54 / нл↠112 / нл, P = 0,018) . Накануне, непосредственно после и в первый день после операции они составляли 141 / нл против 215 / нл ( P = 0,012), 75 / нл против 147 / нл ( P = 0,001) и 93 / нл. nl против 136 / nl ( P = 0,009). Соответственно, пациенты из группы WD получали значительно больше концентратов тромбоцитов, чем пациенты из группы без WD (среднее количество концентратов тромбоцитов: 2.3 против 0,7, P = 0,007).
Пятеро из этих пациентов с количеством тромбоцитов ниже 80 / нл получали до операции иммуноглобулины. Каждый пациент с WD был сопоставлен с пятью пациентами без WD (группа без WD) с использованием диагноза, возраста, пола, фракции выброса, количества дистальных анастомозов и индекса массы тела в качестве критериев соответствия. Результаты : Среднее количество тромбоцитов было значительно ниже в группе WD, чем в группе без WD, несмотря на значительное увеличение количества тромбоцитов после лечения иммуноглобулином (54 / нл↠112 / нл, P = 0,018) . Накануне, непосредственно после и в первый день после операции они составляли 141 / нл против 215 / нл ( P = 0,012), 75 / нл против 147 / нл ( P = 0,001) и 93 / нл. nl против 136 / nl ( P = 0,009). Соответственно, пациенты из группы WD получали значительно больше концентратов тромбоцитов, чем пациенты из группы без WD (среднее количество концентратов тромбоцитов: 2.3 против 0,7, P = 0,007). Полная потеря дренажа через медиастинальные грудные трубки была почти одинаковой (1197 мл в группе без WD и 1140 мл в группе WD). Один пациент в каждой группе страдал кровотечением, требующим повторного обследования. Три пациента из группы без WD (6%) и один пациент из группы WD (10%) скончались после операции, не связанной с WD. Выводы : Пациенты с WD могут подвергаться кардиохирургическому вмешательству без заметно повышенного риска кровотечений, несмотря на более высокую, чем обычно, потребность в переливании крови и значительно более низкое количество тромбоцитов в периоперационном периоде.
Полная потеря дренажа через медиастинальные грудные трубки была почти одинаковой (1197 мл в группе без WD и 1140 мл в группе WD). Один пациент в каждой группе страдал кровотечением, требующим повторного обследования. Три пациента из группы без WD (6%) и один пациент из группы WD (10%) скончались после операции, не связанной с WD. Выводы : Пациенты с WD могут подвергаться кардиохирургическому вмешательству без заметно повышенного риска кровотечений, несмотря на более высокую, чем обычно, потребность в переливании крови и значительно более низкое количество тромбоцитов в периоперационном периоде.
1 Введение
Принято считать, что пациенты, страдающие болезнью Верльгофа (ББ) и перенесшие хирургические вмешательства, имеют повышенный риск послеоперационных кровотечений. Это особенно актуально для операций на сердце с использованием экстракорпорального кровообращения из-за необходимости полной гепаринизации и деструктивного воздействия экстракорпорального кровообращения на все компоненты крови. Из-за редкого сочетания ББ и ишемической болезни сердца в англо-американской литературе имеется лишь несколько сообщений с небольшим количеством пациентов [1–8], так что реальный риск кровотечений до сих пор остается неясным.Поэтому мы провели это исследование случай-контроль, сравнивая пациентов с WD и без него, чтобы оценить риск кровотечений.
Из-за редкого сочетания ББ и ишемической болезни сердца в англо-американской литературе имеется лишь несколько сообщений с небольшим количеством пациентов [1–8], так что реальный риск кровотечений до сих пор остается неясным.Поэтому мы провели это исследование случай-контроль, сравнивая пациентов с WD и без него, чтобы оценить риск кровотечений.
2 Материалы и методы
В период с мая 1995 г. по июль 1998 г. десять пациентов (восемь мужчин, две женщины) с WD (группа WD) были направлены в наше учреждение для кардиохирургии с экстракорпоральным кровообращением (десять из 4533 пациентов, 0,22%). Пять пациентов без WD были сопоставлены с каждым пациентом с WD с использованием диагноза, возраста, пола, фракции выброса, количества дистальных анастомозов и индекса массы тела в качестве критериев соответствия (группа без WD).Для качественных данных требовалось соответствие, для количественных допускались отклонения до 10%. Критерии соответствия представлены в таблице 1.
Таблица 1
Таблица 1
Отмеченные предоперационные параметры включали тяжесть и лечение WD, классификацию NYHA и срочность хирургического вмешательства. Кроме того, оценивались время пережатия, продолжительность экстракорпорального кровообращения и хирургического вмешательства, а также пребывание в отделении интенсивной терапии.Что касается периоперационного риска, мы проанализировали степень кровопотери и потребности в переливании крови, а также смертность и заболеваемость.
Антикоагуляция для экстракорпорального кровообращения проводилась гепарином (400 Ед / кг, время активированной коагуляции ≥400 с) всем пациентам. Эффекты гепарина были отменены снижением дозы протамина (0,3 мл / кг), поскольку хорошо известно, что такое лечение приводит к меньшей кровопотере и увеличению количества тромбоцитов в послеоперационном периоде [9].
Диагноз WD был поставлен при наличии хронической тромбоцитопении с нормальной морфологией костного мозга (у двух пациентов повышенный мегакариоцитопоэз), отсутствии спленомегалии и других причин вторичной тромбоцитопении.У восьми пациентов с WD не было симптомов заболевания, и они не лечились. Двум пациентам перед госпитализацией была выполнена спленэктомия из-за склонности к спонтанному кровотечению, но только у одного пациента она была успешной. Другой пациент получил циклоспорин и кортикостероиды, но это лечение также не помогло. Пять пациентов с числом тромбоцитов ≥80 / нл получали иммуноглобулины (0,4 г / кг в день в течение 4–5 дней) до операции, остальные пять пациентов с числом тромбоцитов ≥80 / нл не получали специального лечения.
Статистический анализ проводился с помощью точного критерия Фишера для качественных данных и критерия Манна – Уитни для количественных данных. Парные сравнения рассчитывались с помощью критерия Вилкоксона. Значение P 0,05 считалось значительным.
3 Результаты
Статистический анализ не выявил различий между обеими группами в отношении критериев соответствия (таблица 1).
Значительные различия были обнаружены в среднем количестве потребностей в переливании эритроцитов и концентратов тромбоцитов, а также в среднем количестве тромбоцитов за день до, сразу после и в первый день после операции.На второй и третий день после операции различия между обеими группами в отношении количества тромбоцитов больше не были значимыми. Требования к переливанию представлены в таблице 2, а периоперационный курс подсчета тромбоцитов — на рисунке 1.
Таблица 2
Таблица 2
Рис. 1
Периоперационный курс подсчета тромбоцитов. При переливании концентратов тромбоцитов и инфузии 60 г иммуноглобулинов одному пациенту в первый послеоперационный день среднее количество тромбоцитов в послеоперационном периоде не опускалось ниже 75 / нл (данные представлены как среднее значение и диапазон).no-WD-группа, — — — -; WD-группа, — # P = 0,012; ○ P = 0,001; * P = 0,009.
Рис. 1
Периоперационный курс подсчета тромбоцитов. При переливании концентратов тромбоцитов и инфузии 60 г иммуноглобулинов одному пациенту в первый послеоперационный день среднее количество тромбоцитов в послеоперационном периоде не опускалось ниже 75 / нл (данные представлены как среднее значение и диапазон). no-WD-группа, — — — -; WD-группа, — # P = 0,012; ○ P = 0.001; * P = 0,009.
Всем пациентам планово выполнено аортокоронарное шунтирование. Продолжительность операции и экстракорпоральное кровообращение, а также время пережатия и кровопотеря показаны в таблице 2. У одного пациента из группы WD также был стеноз высокой степени левой внутренней сонной артерии, который привел к длительному обратимый ишемический неврологический дефицит за 2 месяца до операции на сердце. Поэтому ему пришлось пройти эндартерэктомию левой внутренней сонной артерии одновременно с аортокоронарным шунтированием.Кроме того, перед операцией был имплантирован внутриаортальный баллонный насос из-за тяжелой дисфункции левого желудочка. Помпа снята на вторые сутки после операции без осложнений.
Продолжительность искусственной вентиляции легких и время пребывания в реанимации составили 17,6 ч (9–50 ч) и 4,0 дня (2–7 дней) соответственно в группе WD и 12,0 ч (4–26 ч) и 4,2 часа. (1–23 ч) в группе без ВД.
Одно повторное исследование у пациента из группы без БВ пришлось провести по поводу тампонады перикарда, которая была вызвана тенденцией к диффузному кровотечению.Также в группе WD произошло одно кровотечение: оно было вызвано кровоточащей ветвью левой внутренней грудной артерии. Один пациент в каждой группе скончался из-за трудноизлечимой сердечной аритмии: два других пациента из группы без WD умерли из-за полиорганной недостаточности и пневмонии, вызванной искусственной вентиляцией легких.
Дальнейшие послеоперационные осложнения возникли у девяти пациентов из группы без ВБ. Двум пациентам пришлось повторно интубировать дыхательную недостаточность; через несколько дней их успешно отлучили от ИВЛ.Четырем пациентам потребовалась послеоперационная имплантация внутриаортального баллонного насоса для стабилизации гемодинамики. Все пациенты были успешно отлучены от внутриаортального баллонного насоса, но одному пациенту пришлось перенести фасциотомию из-за компартмент-синдрома. У двух пациентов нарушения заживления ран лечились консервативно, у одного потребовалось оперативное вмешательство.
4 Комментарий
Наше текущее исследование демонстрирует, что количество тромбоцитов у пациентов с WD значительно ниже в периоперационном периоде (рис.1) несмотря на предоперационное лечение иммуноглобулинами, как описано выше. Поэтому количество переливаемых продуктов крови (таблица 2), особенно концентратов тромбоцитов, превышает обычную потребность.
Согласно предыдущим сообщениям [4,5,8], более низкое количество тромбоцитов, помимо пагубного воздействия экстракорпорального кровообращения на тромбоциты, необходимость полной антикоагуляции и нарушение функции циркулирующих тромбоцитов, были предположительно ответственны за повышенный риск послеоперационных кровотечений. , повторные исследования и переливание продуктов крови.Поскольку консервативная терапия WD, состоящая из кортикостероидов и / или иммуносупрессивного лечения, редко была успешной в отношении нормализации количества тромбоцитов и регресса симптомов, было описано несколько стратегий для снижения риска послеоперационных кровотечений у пациентов с WD:
Спленэктомия была предлагается как одновременная процедура или перед операцией на сердце [4,5]. Недостатками комбинированной процедуры являются повышенный операционный риск и то, что нормализация количества тромбоцитов занимает несколько дней.Таким образом, пациенту не приносит пользы дополнительная процедура, то есть спленэктомия, в раннем послеоперационном периоде, когда риск кровотечений наиболее высок. Поэтому была введена поэтапная процедура, но это ведение требует дополнительного оперативного вмешательства, которое также несет в себе риск кровотечений и отсрочку кардиохирургического вмешательства.
Предоперационное лечение иммуноглобулинами может быть лучшим терапевтическим методом [6,10,11]. Это приводит к временному увеличению количества тромбоцитов, которое можно легко контролировать с помощью анализа количества тромбоцитов, позволяет оптимизировать время хирургических вмешательств и продолжается в прямом послеоперационном периоде [12,13].В нашем недавнем отчете мы смогли четко продемонстрировать этот эффект лечения иммуноглобулином у пациентов с количеством тромбоцитов ниже 80 / нл: среднее количество тромбоцитов увеличилось с 54 / нл за 5 дней до операции до 112 / нл за день до операции ( P = 0,018). и после операции не опускалась ниже 60 / нл [11]. Пациенты с количеством тромбоцитов выше 80 / нл не получали иммуноглобулины без повышенного риска послеоперационных кровотечений [11]. Точный механизм действия иммуноглобулинов до сих пор неясен; Обсуждается несколько возможностей: нарушение фагоцитоза тромбоцитов ретикулоэндотелиальной системой, нейтрализация аутоантител, ингибирование синтеза аутоантител или нарушение взаимодействия между тромбоцитами и активированными факторами комплемента [12,14].
Введение продуктов крови, особенно концентратов тромбоцитов у пациентов с WD, представляет собой хорошо известный шаг по увеличению количества тромбоцитов. Ключевой вопрос заключается в том, когда и почему показано переливание продуктов крови пациентам с WD. По данным Salmenperä et al. [15], количество тромбоцитов постепенно снижается во время экстракорпорального кровообращения и остается на уровне половины исходного уровня до четвертого послеоперационного дня. Кроме того, помимо активации тромбоцитов при контакте с инородными поверхностями экстракорпорального кровообращения, часто встречается дисфункция тромбоцитов, которая вызвана изменениями мембраны тромбоцитов из-за напряжения сдвига, поверхностного прилипания и турбулентного потока.Несмотря на активацию тромбоцитов, длительное время кровотечения после кардиохирургического вмешательства из-за дисфункции тромбоцитов хорошо известно и является наиболее вероятной причиной нехирургического кровотечения [15]. Следовательно, соответствующее лечение пациентов с WD с низким количеством тромбоцитов начинается уже до операции. Как описано выше, пациентам с WD с количеством тромбоцитов ниже 80 / мл мы вводим иммуноглобулины для увеличения количества тромбоцитов.
У наших пациентов с WD не было необходимости в интраоперационном введении продуктов крови.В послеоперационном периоде переливание продуктов крови следует обычным рекомендациям в случае обильного кровотечения [15]. Пациентам без явной тенденции к кровотечениям концентраты тромбоцитов переливают эмпирически, если количество тромбоцитов падает ниже 60 / нл. Этот порог подтверждается Simon et al. [16], которые сообщили, что профилактическое введение концентратов тромбоцитов не снижает кровопотери через дренажную трубку и потребность в переливании крови, а также не улучшает клинический исход у пациентов с легкой тромбоцитопенией (количество тромбоцитов 58 / нл).Упакованные эритроциты переливают пожилым пациентам (возраст старше 65 лет), если гемоглобин ниже 10 г / дл; у более молодых стабильных пациентов порог переливания — гемоглобин ниже 8 г / дл [17].
Раннее применение продуктов крови у пациентов с WD (особенно переливание концентратов тромбоцитов пациентам без явной тенденции к кровотечению и количества тромбоцитов ниже 60 / нл) может быть причиной того, что мы не смогли продемонстрировать каких-либо существенных различий в общем дренаже. потеря между обеими группами нашего исследования.Конечно, основным ограничением нашего исследования является небольшое количество пациентов с WD, поэтому мы, возможно, не смогли продемонстрировать ожидаемые различия в кровопотере или повышенный риск послеоперационных кровотечений. Но наше исследование ясно показывает, что количество тромбоцитов в периоперационном периоде значительно ниже, а потребности в переливании крови значительно увеличиваются у пациентов с WD.
5 Заключение
Пациенты с WD могут подвергнуться кардиохирургическому вмешательству без значительного увеличения риска кровотечений, несмотря на более высокую, чем обычно, потребность в переливании крови и значительно более низкое количество тромбоцитов в периоперационном периоде.
Список литературы
[1],,.
Операция на сердце у пациента с рефрактерной идиопатической тромбоцитопенической пурпурой
,
J Thorac Cardiovasc Surg
,
1994
, vol.
107
(стр.
316
—
317
) [2].
Аортокоронарное шунтирование при хронической иммуноопосредованной тромбоцитопенической пурпуре: предоперационное лечение внутривенным иммуноглобулином и кортикостероидами
,
Military Med
,
1995
, vol.
160
(стр.
624
—
625
) [3].
Аортокоронарное шунтирование у двух пациентов с иммунной тромбоцитопенической пурпурой без предоперационной спленэктомии
,
WV Med J
,
1992
, vol.
88
(стр.
510
—
511
) [4],,,,,.
Комбинированная коронарная реваскуляризация и спленэктомия
,
Ann Thorac Surg
,
1989
, vol.
48
(стр.
853
—
854
) [5],,.
Замена митрального клапана и спленэктомия у пациента с хронической идиопатической тромбоцитопенической пурпурой
,
Thorac Cardiovasc Surgeon
,
1982
, vol.
30
(стр.
407
—
408
) [6],,,,.
Аортокоронарное шунтирование при иммунной тромбоцитопенической пурпуре
,
Ann Thorac Surg
,
1997
, vol.
64
(стр.
1059
—
1062
) [7],.
Замена митрального клапана у пациента с идиопатической тромбоцитопенической пурпурой: предоперационное лечение даназолом
,
J Cardiovasc Surg
,
1991
, vol.
32
(стр.
840
—
842
) [8],,,.
Аортокоронарное шунтирование при идиопатической тромбоцитопении без спленэктомии
,
Ann Thorac Surg
,
1989
, vol.
48
(стр.
721
—
722
) [9],,,.
Успешное применение уменьшенной дозы протамина после искусственного кровообращения
,
Anesth Analg
,
1976
, vol.
55
(стр.
110
—
113
) [10],,,,.
Болезнь Верльгофа — фактор риска кардиохирургии?
,
Z Herz- Thorax- Gefäßchir
,
1997
, т.
11
(стр.
198
—
202
) [11],,,,,,.
Предоперационное лечение ИГ у пациентов с болезнью Верльгофа, перенесших операцию на сердце
,
Ann Thorac Surg
,
2000
, vol.
69
(стр.
61
—
64
) [12],.
Аутоантитела к гликопротеинам тромбоцитов при аутоиммунной тромбоцитопенической пурпуре: их клиническое значение и ответ на лечение
,
Кровь
,
1993
, т.
81
(стр.
1246
—
1250
) [14].
Старые и новые взгляды на внутривенную иммуноглобулиновую терапию
,
Schweiz Med Wochenschr
,
1994
, vol.
124
(стр.
5
—
25
) [15],,. .
Гемостаз и искусственное кровообращение
,
Искусственное кровообращение
,
1995
Нью-Йорк
Springer
(стр.
88
—
113
) [16],.
Контролируемое испытание рутинного введения концентратов тромбоцитов при искусственном кровообращении
,
Ann Thorac Surg
,
1984
, vol.
37
(стр.
359
—
364
) [17],. ,,,,.
Геморрагические и тромботические осложнения кардиохирургии
,
Торакальная и сердечно-сосудистая хирургия Гленна, т. 2
,
1995
6-е изд. (Стр.
1793
—
1810
)
© 2000 Elsevier Science B.V. Все права защищены.
Elsevier Science B.V.
Подвержены ли пациенты с болезнью Верльгофа повышенному риску кровотечений во время кардиохирургических операций? | Европейский журнал кардио-торакальной хирургии
Аннотация
Предпосылки : Обычно предполагается, что пациенты с болезнью Верльгофа (ББ) подвергаются повышенному риску кровотечений при проведении кардиохирургических операций с экстракорпоральным кровообращением.Поэтому мы провели это исследование случай-контроль, чтобы оценить реальный риск кровотечений у этих пациентов. Методы : С 05/95 по 07/98 десять пациентов с WD (восемь мужчин, две женщины) перенесли кардиохирургические операции с использованием экстракорпорального кровообращения (группа WD). Пятеро из этих пациентов с количеством тромбоцитов ниже 80 / нл получали до операции иммуноглобулины. Каждый пациент с WD был сопоставлен с пятью пациентами без WD (группа без WD) с использованием диагноза, возраста, пола, фракции выброса, количества дистальных анастомозов и индекса массы тела в качестве критериев соответствия. Результаты : Среднее количество тромбоцитов было значительно ниже в группе WD, чем в группе без WD, несмотря на значительное увеличение количества тромбоцитов после лечения иммуноглобулином (54 / нл↠112 / нл, P = 0,018) . Накануне, непосредственно после и в первый день после операции они составляли 141 / нл против 215 / нл ( P = 0,012), 75 / нл против 147 / нл ( P = 0,001) и 93 / нл. nl против 136 / nl ( P = 0,009). Соответственно, пациенты из группы WD получали значительно больше концентратов тромбоцитов, чем пациенты из группы без WD (среднее количество концентратов тромбоцитов: 2.3 против 0,7, P = 0,007). Полная потеря дренажа через медиастинальные грудные трубки была почти одинаковой (1197 мл в группе без WD и 1140 мл в группе WD). Один пациент в каждой группе страдал кровотечением, требующим повторного обследования. Три пациента из группы без WD (6%) и один пациент из группы WD (10%) скончались после операции, не связанной с WD. Выводы : Пациенты с WD могут подвергаться кардиохирургическому вмешательству без заметно повышенного риска кровотечений, несмотря на более высокую, чем обычно, потребность в переливании крови и значительно более низкое количество тромбоцитов в периоперационном периоде.
1 Введение
Принято считать, что пациенты, страдающие болезнью Верльгофа (ББ) и перенесшие хирургические вмешательства, имеют повышенный риск послеоперационных кровотечений. Это особенно актуально для операций на сердце с использованием экстракорпорального кровообращения из-за необходимости полной гепаринизации и деструктивного воздействия экстракорпорального кровообращения на все компоненты крови. Из-за редкого сочетания ББ и ишемической болезни сердца в англо-американской литературе имеется лишь несколько сообщений с небольшим количеством пациентов [1–8], так что реальный риск кровотечений до сих пор остается неясным.Поэтому мы провели это исследование случай-контроль, сравнивая пациентов с WD и без него, чтобы оценить риск кровотечений.
2 Материалы и методы
В период с мая 1995 г. по июль 1998 г. десять пациентов (восемь мужчин, две женщины) с WD (группа WD) были направлены в наше учреждение для кардиохирургии с экстракорпоральным кровообращением (десять из 4533 пациентов, 0,22%). Пять пациентов без WD были сопоставлены с каждым пациентом с WD с использованием диагноза, возраста, пола, фракции выброса, количества дистальных анастомозов и индекса массы тела в качестве критериев соответствия (группа без WD).Для качественных данных требовалось соответствие, для количественных допускались отклонения до 10%. Критерии соответствия представлены в таблице 1.
Таблица 1
Таблица 1
Отмеченные предоперационные параметры включали тяжесть и лечение WD, классификацию NYHA и срочность хирургического вмешательства. Кроме того, оценивались время пережатия, продолжительность экстракорпорального кровообращения и хирургического вмешательства, а также пребывание в отделении интенсивной терапии.Что касается периоперационного риска, мы проанализировали степень кровопотери и потребности в переливании крови, а также смертность и заболеваемость.
Антикоагуляция для экстракорпорального кровообращения проводилась гепарином (400 Ед / кг, время активированной коагуляции ≥400 с) всем пациентам. Эффекты гепарина были отменены снижением дозы протамина (0,3 мл / кг), поскольку хорошо известно, что такое лечение приводит к меньшей кровопотере и увеличению количества тромбоцитов в послеоперационном периоде [9].
Диагноз WD был поставлен при наличии хронической тромбоцитопении с нормальной морфологией костного мозга (у двух пациентов повышенный мегакариоцитопоэз), отсутствии спленомегалии и других причин вторичной тромбоцитопении.У восьми пациентов с WD не было симптомов заболевания, и они не лечились. Двум пациентам перед госпитализацией была выполнена спленэктомия из-за склонности к спонтанному кровотечению, но только у одного пациента она была успешной. Другой пациент получил циклоспорин и кортикостероиды, но это лечение также не помогло. Пять пациентов с числом тромбоцитов ≥80 / нл получали иммуноглобулины (0,4 г / кг в день в течение 4–5 дней) до операции, остальные пять пациентов с числом тромбоцитов ≥80 / нл не получали специального лечения.
Статистический анализ проводился с помощью точного критерия Фишера для качественных данных и критерия Манна – Уитни для количественных данных. Парные сравнения рассчитывались с помощью критерия Вилкоксона. Значение P 0,05 считалось значительным.
3 Результаты
Статистический анализ не выявил различий между обеими группами в отношении критериев соответствия (таблица 1).
Значительные различия были обнаружены в среднем количестве потребностей в переливании эритроцитов и концентратов тромбоцитов, а также в среднем количестве тромбоцитов за день до, сразу после и в первый день после операции.На второй и третий день после операции различия между обеими группами в отношении количества тромбоцитов больше не были значимыми. Требования к переливанию представлены в таблице 2, а периоперационный курс подсчета тромбоцитов — на рисунке 1.
Таблица 2
Таблица 2
Рис. 1
Периоперационный курс подсчета тромбоцитов. При переливании концентратов тромбоцитов и инфузии 60 г иммуноглобулинов одному пациенту в первый послеоперационный день среднее количество тромбоцитов в послеоперационном периоде не опускалось ниже 75 / нл (данные представлены как среднее значение и диапазон).no-WD-группа, — — — -; WD-группа, — # P = 0,012; ○ P = 0,001; * P = 0,009.
Рис. 1
Периоперационный курс подсчета тромбоцитов. При переливании концентратов тромбоцитов и инфузии 60 г иммуноглобулинов одному пациенту в первый послеоперационный день среднее количество тромбоцитов в послеоперационном периоде не опускалось ниже 75 / нл (данные представлены как среднее значение и диапазон). no-WD-группа, — — — -; WD-группа, — # P = 0,012; ○ P = 0.001; * P = 0,009.
Всем пациентам планово выполнено аортокоронарное шунтирование. Продолжительность операции и экстракорпоральное кровообращение, а также время пережатия и кровопотеря показаны в таблице 2. У одного пациента из группы WD также был стеноз высокой степени левой внутренней сонной артерии, который привел к длительному обратимый ишемический неврологический дефицит за 2 месяца до операции на сердце. Поэтому ему пришлось пройти эндартерэктомию левой внутренней сонной артерии одновременно с аортокоронарным шунтированием.Кроме того, перед операцией был имплантирован внутриаортальный баллонный насос из-за тяжелой дисфункции левого желудочка. Помпа снята на вторые сутки после операции без осложнений.
Продолжительность искусственной вентиляции легких и время пребывания в реанимации составили 17,6 ч (9–50 ч) и 4,0 дня (2–7 дней) соответственно в группе WD и 12,0 ч (4–26 ч) и 4,2 часа. (1–23 ч) в группе без ВД.
Одно повторное исследование у пациента из группы без БВ пришлось провести по поводу тампонады перикарда, которая была вызвана тенденцией к диффузному кровотечению.Также в группе WD произошло одно кровотечение: оно было вызвано кровоточащей ветвью левой внутренней грудной артерии. Один пациент в каждой группе скончался из-за трудноизлечимой сердечной аритмии: два других пациента из группы без WD умерли из-за полиорганной недостаточности и пневмонии, вызванной искусственной вентиляцией легких.
Дальнейшие послеоперационные осложнения возникли у девяти пациентов из группы без ВБ. Двум пациентам пришлось повторно интубировать дыхательную недостаточность; через несколько дней их успешно отлучили от ИВЛ.Четырем пациентам потребовалась послеоперационная имплантация внутриаортального баллонного насоса для стабилизации гемодинамики. Все пациенты были успешно отлучены от внутриаортального баллонного насоса, но одному пациенту пришлось перенести фасциотомию из-за компартмент-синдрома. У двух пациентов нарушения заживления ран лечились консервативно, у одного потребовалось оперативное вмешательство.
4 Комментарий
Наше текущее исследование демонстрирует, что количество тромбоцитов у пациентов с WD значительно ниже в периоперационном периоде (рис.1) несмотря на предоперационное лечение иммуноглобулинами, как описано выше. Поэтому количество переливаемых продуктов крови (таблица 2), особенно концентратов тромбоцитов, превышает обычную потребность.
Согласно предыдущим сообщениям [4,5,8], более низкое количество тромбоцитов, помимо пагубного воздействия экстракорпорального кровообращения на тромбоциты, необходимость полной антикоагуляции и нарушение функции циркулирующих тромбоцитов, были предположительно ответственны за повышенный риск послеоперационных кровотечений. , повторные исследования и переливание продуктов крови.Поскольку консервативная терапия WD, состоящая из кортикостероидов и / или иммуносупрессивного лечения, редко была успешной в отношении нормализации количества тромбоцитов и регресса симптомов, было описано несколько стратегий для снижения риска послеоперационных кровотечений у пациентов с WD:
Спленэктомия была предлагается как одновременная процедура или перед операцией на сердце [4,5]. Недостатками комбинированной процедуры являются повышенный операционный риск и то, что нормализация количества тромбоцитов занимает несколько дней.Таким образом, пациенту не приносит пользы дополнительная процедура, то есть спленэктомия, в раннем послеоперационном периоде, когда риск кровотечений наиболее высок. Поэтому была введена поэтапная процедура, но это ведение требует дополнительного оперативного вмешательства, которое также несет в себе риск кровотечений и отсрочку кардиохирургического вмешательства.
Предоперационное лечение иммуноглобулинами может быть лучшим терапевтическим методом [6,10,11]. Это приводит к временному увеличению количества тромбоцитов, которое можно легко контролировать с помощью анализа количества тромбоцитов, позволяет оптимизировать время хирургических вмешательств и продолжается в прямом послеоперационном периоде [12,13].В нашем недавнем отчете мы смогли четко продемонстрировать этот эффект лечения иммуноглобулином у пациентов с количеством тромбоцитов ниже 80 / нл: среднее количество тромбоцитов увеличилось с 54 / нл за 5 дней до операции до 112 / нл за день до операции ( P = 0,018). и после операции не опускалась ниже 60 / нл [11]. Пациенты с количеством тромбоцитов выше 80 / нл не получали иммуноглобулины без повышенного риска послеоперационных кровотечений [11]. Точный механизм действия иммуноглобулинов до сих пор неясен; Обсуждается несколько возможностей: нарушение фагоцитоза тромбоцитов ретикулоэндотелиальной системой, нейтрализация аутоантител, ингибирование синтеза аутоантител или нарушение взаимодействия между тромбоцитами и активированными факторами комплемента [12,14].
Введение продуктов крови, особенно концентратов тромбоцитов у пациентов с WD, представляет собой хорошо известный шаг по увеличению количества тромбоцитов. Ключевой вопрос заключается в том, когда и почему показано переливание продуктов крови пациентам с WD. По данным Salmenperä et al. [15], количество тромбоцитов постепенно снижается во время экстракорпорального кровообращения и остается на уровне половины исходного уровня до четвертого послеоперационного дня. Кроме того, помимо активации тромбоцитов при контакте с инородными поверхностями экстракорпорального кровообращения, часто встречается дисфункция тромбоцитов, которая вызвана изменениями мембраны тромбоцитов из-за напряжения сдвига, поверхностного прилипания и турбулентного потока.Несмотря на активацию тромбоцитов, длительное время кровотечения после кардиохирургического вмешательства из-за дисфункции тромбоцитов хорошо известно и является наиболее вероятной причиной нехирургического кровотечения [15]. Следовательно, соответствующее лечение пациентов с WD с низким количеством тромбоцитов начинается уже до операции. Как описано выше, пациентам с WD с количеством тромбоцитов ниже 80 / мл мы вводим иммуноглобулины для увеличения количества тромбоцитов.
У наших пациентов с WD не было необходимости в интраоперационном введении продуктов крови.В послеоперационном периоде переливание продуктов крови следует обычным рекомендациям в случае обильного кровотечения [15]. Пациентам без явной тенденции к кровотечениям концентраты тромбоцитов переливают эмпирически, если количество тромбоцитов падает ниже 60 / нл. Этот порог подтверждается Simon et al. [16], которые сообщили, что профилактическое введение концентратов тромбоцитов не снижает кровопотери через дренажную трубку и потребность в переливании крови, а также не улучшает клинический исход у пациентов с легкой тромбоцитопенией (количество тромбоцитов 58 / нл).Упакованные эритроциты переливают пожилым пациентам (возраст старше 65 лет), если гемоглобин ниже 10 г / дл; у более молодых стабильных пациентов порог переливания — гемоглобин ниже 8 г / дл [17].
Раннее применение продуктов крови у пациентов с WD (особенно переливание концентратов тромбоцитов пациентам без явной тенденции к кровотечению и количества тромбоцитов ниже 60 / нл) может быть причиной того, что мы не смогли продемонстрировать каких-либо существенных различий в общем дренаже. потеря между обеими группами нашего исследования.Конечно, основным ограничением нашего исследования является небольшое количество пациентов с WD, поэтому мы, возможно, не смогли продемонстрировать ожидаемые различия в кровопотере или повышенный риск послеоперационных кровотечений. Но наше исследование ясно показывает, что количество тромбоцитов в периоперационном периоде значительно ниже, а потребности в переливании крови значительно увеличиваются у пациентов с WD.
5 Заключение
Пациенты с WD могут подвергнуться кардиохирургическому вмешательству без значительного увеличения риска кровотечений, несмотря на более высокую, чем обычно, потребность в переливании крови и значительно более низкое количество тромбоцитов в периоперационном периоде.
Список литературы
[1],,.
Операция на сердце у пациента с рефрактерной идиопатической тромбоцитопенической пурпурой
,
J Thorac Cardiovasc Surg
,
1994
, vol.
107
(стр.
316
—
317
) [2].
Аортокоронарное шунтирование при хронической иммуноопосредованной тромбоцитопенической пурпуре: предоперационное лечение внутривенным иммуноглобулином и кортикостероидами
,
Military Med
,
1995
, vol.
160
(стр.
624
—
625
) [3].
Аортокоронарное шунтирование у двух пациентов с иммунной тромбоцитопенической пурпурой без предоперационной спленэктомии
,
WV Med J
,
1992
, vol.
88
(стр.
510
—
511
) [4],,,,,.
Комбинированная коронарная реваскуляризация и спленэктомия
,
Ann Thorac Surg
,
1989
, vol.
48
(стр.
853
—
854
) [5],,.
Замена митрального клапана и спленэктомия у пациента с хронической идиопатической тромбоцитопенической пурпурой
,
Thorac Cardiovasc Surgeon
,
1982
, vol.
30
(стр.
407
—
408
) [6],,,,.
Аортокоронарное шунтирование при иммунной тромбоцитопенической пурпуре
,
Ann Thorac Surg
,
1997
, vol.
64
(стр.
1059
—
1062
) [7],.
Замена митрального клапана у пациента с идиопатической тромбоцитопенической пурпурой: предоперационное лечение даназолом
,
J Cardiovasc Surg
,
1991
, vol.
32
(стр.
840
—
842
) [8],,,.
Аортокоронарное шунтирование при идиопатической тромбоцитопении без спленэктомии
,
Ann Thorac Surg
,
1989
, vol.
48
(стр.
721
—
722
) [9],,,.
Успешное применение уменьшенной дозы протамина после искусственного кровообращения
,
Anesth Analg
,
1976
, vol.
55
(стр.
110
—
113
) [10],,,,.
Болезнь Верльгофа — фактор риска кардиохирургии?
,
Z Herz- Thorax- Gefäßchir
,
1997
, т.
11
(стр.
198
—
202
) [11],,,,,,.
Предоперационное лечение ИГ у пациентов с болезнью Верльгофа, перенесших операцию на сердце
,
Ann Thorac Surg
,
2000
, vol.
69
(стр.
61
—
64
) [12],.
Аутоантитела к гликопротеинам тромбоцитов при аутоиммунной тромбоцитопенической пурпуре: их клиническое значение и ответ на лечение
,
Кровь
,
1993
, т.
81
(стр.
1246
—
1250
) [14].
Старые и новые взгляды на внутривенную иммуноглобулиновую терапию
,
Schweiz Med Wochenschr
,
1994
, vol.
124
(стр.
5
—
25
) [15],,. .
Гемостаз и искусственное кровообращение
,
Искусственное кровообращение
,
1995
Нью-Йорк
Springer
(стр.
88
—
113
) [16],.
Контролируемое испытание рутинного введения концентратов тромбоцитов при искусственном кровообращении
,
Ann Thorac Surg
,
1984
, vol.
37
(стр.
359
—
364
) [17],. ,,,,.
Геморрагические и тромботические осложнения кардиохирургии
,
Торакальная и сердечно-сосудистая хирургия Гленна, т. 2
,
1995
6-е изд. (Стр.
1793
—
1810
)
© 2000 Elsevier Science B.V. Все права защищены.
Elsevier Science B.V.
Подвержены ли пациенты с болезнью Верльгофа повышенному риску кровотечений во время кардиохирургических операций? | Европейский журнал кардио-торакальной хирургии
Аннотация
Предпосылки : Обычно предполагается, что пациенты с болезнью Верльгофа (ББ) подвергаются повышенному риску кровотечений при проведении кардиохирургических операций с экстракорпоральным кровообращением.Поэтому мы провели это исследование случай-контроль, чтобы оценить реальный риск кровотечений у этих пациентов. Методы : С 05/95 по 07/98 десять пациентов с WD (восемь мужчин, две женщины) перенесли кардиохирургические операции с использованием экстракорпорального кровообращения (группа WD). Пятеро из этих пациентов с количеством тромбоцитов ниже 80 / нл получали до операции иммуноглобулины. Каждый пациент с WD был сопоставлен с пятью пациентами без WD (группа без WD) с использованием диагноза, возраста, пола, фракции выброса, количества дистальных анастомозов и индекса массы тела в качестве критериев соответствия. Результаты : Среднее количество тромбоцитов было значительно ниже в группе WD, чем в группе без WD, несмотря на значительное увеличение количества тромбоцитов после лечения иммуноглобулином (54 / нл↠112 / нл, P = 0,018) . Накануне, непосредственно после и в первый день после операции они составляли 141 / нл против 215 / нл ( P = 0,012), 75 / нл против 147 / нл ( P = 0,001) и 93 / нл. nl против 136 / nl ( P = 0,009). Соответственно, пациенты из группы WD получали значительно больше концентратов тромбоцитов, чем пациенты из группы без WD (среднее количество концентратов тромбоцитов: 2.3 против 0,7, P = 0,007). Полная потеря дренажа через медиастинальные грудные трубки была почти одинаковой (1197 мл в группе без WD и 1140 мл в группе WD). Один пациент в каждой группе страдал кровотечением, требующим повторного обследования. Три пациента из группы без WD (6%) и один пациент из группы WD (10%) скончались после операции, не связанной с WD. Выводы : Пациенты с WD могут подвергаться кардиохирургическому вмешательству без заметно повышенного риска кровотечений, несмотря на более высокую, чем обычно, потребность в переливании крови и значительно более низкое количество тромбоцитов в периоперационном периоде.
1 Введение
Принято считать, что пациенты, страдающие болезнью Верльгофа (ББ) и перенесшие хирургические вмешательства, имеют повышенный риск послеоперационных кровотечений. Это особенно актуально для операций на сердце с использованием экстракорпорального кровообращения из-за необходимости полной гепаринизации и деструктивного воздействия экстракорпорального кровообращения на все компоненты крови. Из-за редкого сочетания ББ и ишемической болезни сердца в англо-американской литературе имеется лишь несколько сообщений с небольшим количеством пациентов [1–8], так что реальный риск кровотечений до сих пор остается неясным.Поэтому мы провели это исследование случай-контроль, сравнивая пациентов с WD и без него, чтобы оценить риск кровотечений.
2 Материалы и методы
В период с мая 1995 г. по июль 1998 г. десять пациентов (восемь мужчин, две женщины) с WD (группа WD) были направлены в наше учреждение для кардиохирургии с экстракорпоральным кровообращением (десять из 4533 пациентов, 0,22%). Пять пациентов без WD были сопоставлены с каждым пациентом с WD с использованием диагноза, возраста, пола, фракции выброса, количества дистальных анастомозов и индекса массы тела в качестве критериев соответствия (группа без WD).Для качественных данных требовалось соответствие, для количественных допускались отклонения до 10%. Критерии соответствия представлены в таблице 1.
Таблица 1
Таблица 1
Отмеченные предоперационные параметры включали тяжесть и лечение WD, классификацию NYHA и срочность хирургического вмешательства. Кроме того, оценивались время пережатия, продолжительность экстракорпорального кровообращения и хирургического вмешательства, а также пребывание в отделении интенсивной терапии.Что касается периоперационного риска, мы проанализировали степень кровопотери и потребности в переливании крови, а также смертность и заболеваемость.
Антикоагуляция для экстракорпорального кровообращения проводилась гепарином (400 Ед / кг, время активированной коагуляции ≥400 с) всем пациентам. Эффекты гепарина были отменены снижением дозы протамина (0,3 мл / кг), поскольку хорошо известно, что такое лечение приводит к меньшей кровопотере и увеличению количества тромбоцитов в послеоперационном периоде [9].
Диагноз WD был поставлен при наличии хронической тромбоцитопении с нормальной морфологией костного мозга (у двух пациентов повышенный мегакариоцитопоэз), отсутствии спленомегалии и других причин вторичной тромбоцитопении.У восьми пациентов с WD не было симптомов заболевания, и они не лечились. Двум пациентам перед госпитализацией была выполнена спленэктомия из-за склонности к спонтанному кровотечению, но только у одного пациента она была успешной. Другой пациент получил циклоспорин и кортикостероиды, но это лечение также не помогло. Пять пациентов с числом тромбоцитов ≥80 / нл получали иммуноглобулины (0,4 г / кг в день в течение 4–5 дней) до операции, остальные пять пациентов с числом тромбоцитов ≥80 / нл не получали специального лечения.
Статистический анализ проводился с помощью точного критерия Фишера для качественных данных и критерия Манна – Уитни для количественных данных. Парные сравнения рассчитывались с помощью критерия Вилкоксона. Значение P 0,05 считалось значительным.
3 Результаты
Статистический анализ не выявил различий между обеими группами в отношении критериев соответствия (таблица 1).
Значительные различия были обнаружены в среднем количестве потребностей в переливании эритроцитов и концентратов тромбоцитов, а также в среднем количестве тромбоцитов за день до, сразу после и в первый день после операции.На второй и третий день после операции различия между обеими группами в отношении количества тромбоцитов больше не были значимыми. Требования к переливанию представлены в таблице 2, а периоперационный курс подсчета тромбоцитов — на рисунке 1.
Таблица 2
Таблица 2
Рис. 1
Периоперационный курс подсчета тромбоцитов. При переливании концентратов тромбоцитов и инфузии 60 г иммуноглобулинов одному пациенту в первый послеоперационный день среднее количество тромбоцитов в послеоперационном периоде не опускалось ниже 75 / нл (данные представлены как среднее значение и диапазон).no-WD-группа, — — — -; WD-группа, — # P = 0,012; ○ P = 0,001; * P = 0,009.
Рис. 1
Периоперационный курс подсчета тромбоцитов. При переливании концентратов тромбоцитов и инфузии 60 г иммуноглобулинов одному пациенту в первый послеоперационный день среднее количество тромбоцитов в послеоперационном периоде не опускалось ниже 75 / нл (данные представлены как среднее значение и диапазон). no-WD-группа, — — — -; WD-группа, — # P = 0,012; ○ P = 0.001; * P = 0,009.
Всем пациентам планово выполнено аортокоронарное шунтирование. Продолжительность операции и экстракорпоральное кровообращение, а также время пережатия и кровопотеря показаны в таблице 2. У одного пациента из группы WD также был стеноз высокой степени левой внутренней сонной артерии, который привел к длительному обратимый ишемический неврологический дефицит за 2 месяца до операции на сердце. Поэтому ему пришлось пройти эндартерэктомию левой внутренней сонной артерии одновременно с аортокоронарным шунтированием.Кроме того, перед операцией был имплантирован внутриаортальный баллонный насос из-за тяжелой дисфункции левого желудочка. Помпа снята на вторые сутки после операции без осложнений.
Продолжительность искусственной вентиляции легких и время пребывания в реанимации составили 17,6 ч (9–50 ч) и 4,0 дня (2–7 дней) соответственно в группе WD и 12,0 ч (4–26 ч) и 4,2 часа. (1–23 ч) в группе без ВД.
Одно повторное исследование у пациента из группы без БВ пришлось провести по поводу тампонады перикарда, которая была вызвана тенденцией к диффузному кровотечению.Также в группе WD произошло одно кровотечение: оно было вызвано кровоточащей ветвью левой внутренней грудной артерии. Один пациент в каждой группе скончался из-за трудноизлечимой сердечной аритмии: два других пациента из группы без WD умерли из-за полиорганной недостаточности и пневмонии, вызванной искусственной вентиляцией легких.
Дальнейшие послеоперационные осложнения возникли у девяти пациентов из группы без ВБ. Двум пациентам пришлось повторно интубировать дыхательную недостаточность; через несколько дней их успешно отлучили от ИВЛ.Четырем пациентам потребовалась послеоперационная имплантация внутриаортального баллонного насоса для стабилизации гемодинамики. Все пациенты были успешно отлучены от внутриаортального баллонного насоса, но одному пациенту пришлось перенести фасциотомию из-за компартмент-синдрома. У двух пациентов нарушения заживления ран лечились консервативно, у одного потребовалось оперативное вмешательство.
4 Комментарий
Наше текущее исследование демонстрирует, что количество тромбоцитов у пациентов с WD значительно ниже в периоперационном периоде (рис.1) несмотря на предоперационное лечение иммуноглобулинами, как описано выше. Поэтому количество переливаемых продуктов крови (таблица 2), особенно концентратов тромбоцитов, превышает обычную потребность.
Согласно предыдущим сообщениям [4,5,8], более низкое количество тромбоцитов, помимо пагубного воздействия экстракорпорального кровообращения на тромбоциты, необходимость полной антикоагуляции и нарушение функции циркулирующих тромбоцитов, были предположительно ответственны за повышенный риск послеоперационных кровотечений. , повторные исследования и переливание продуктов крови.Поскольку консервативная терапия WD, состоящая из кортикостероидов и / или иммуносупрессивного лечения, редко была успешной в отношении нормализации количества тромбоцитов и регресса симптомов, было описано несколько стратегий для снижения риска послеоперационных кровотечений у пациентов с WD:
Спленэктомия была предлагается как одновременная процедура или перед операцией на сердце [4,5]. Недостатками комбинированной процедуры являются повышенный операционный риск и то, что нормализация количества тромбоцитов занимает несколько дней.Таким образом, пациенту не приносит пользы дополнительная процедура, то есть спленэктомия, в раннем послеоперационном периоде, когда риск кровотечений наиболее высок. Поэтому была введена поэтапная процедура, но это ведение требует дополнительного оперативного вмешательства, которое также несет в себе риск кровотечений и отсрочку кардиохирургического вмешательства.
Предоперационное лечение иммуноглобулинами может быть лучшим терапевтическим методом [6,10,11]. Это приводит к временному увеличению количества тромбоцитов, которое можно легко контролировать с помощью анализа количества тромбоцитов, позволяет оптимизировать время хирургических вмешательств и продолжается в прямом послеоперационном периоде [12,13].В нашем недавнем отчете мы смогли четко продемонстрировать этот эффект лечения иммуноглобулином у пациентов с количеством тромбоцитов ниже 80 / нл: среднее количество тромбоцитов увеличилось с 54 / нл за 5 дней до операции до 112 / нл за день до операции ( P = 0,018). и после операции не опускалась ниже 60 / нл [11]. Пациенты с количеством тромбоцитов выше 80 / нл не получали иммуноглобулины без повышенного риска послеоперационных кровотечений [11]. Точный механизм действия иммуноглобулинов до сих пор неясен; Обсуждается несколько возможностей: нарушение фагоцитоза тромбоцитов ретикулоэндотелиальной системой, нейтрализация аутоантител, ингибирование синтеза аутоантител или нарушение взаимодействия между тромбоцитами и активированными факторами комплемента [12,14].
Введение продуктов крови, особенно концентратов тромбоцитов у пациентов с WD, представляет собой хорошо известный шаг по увеличению количества тромбоцитов. Ключевой вопрос заключается в том, когда и почему показано переливание продуктов крови пациентам с WD. По данным Salmenperä et al. [15], количество тромбоцитов постепенно снижается во время экстракорпорального кровообращения и остается на уровне половины исходного уровня до четвертого послеоперационного дня. Кроме того, помимо активации тромбоцитов при контакте с инородными поверхностями экстракорпорального кровообращения, часто встречается дисфункция тромбоцитов, которая вызвана изменениями мембраны тромбоцитов из-за напряжения сдвига, поверхностного прилипания и турбулентного потока.Несмотря на активацию тромбоцитов, длительное время кровотечения после кардиохирургического вмешательства из-за дисфункции тромбоцитов хорошо известно и является наиболее вероятной причиной нехирургического кровотечения [15]. Следовательно, соответствующее лечение пациентов с WD с низким количеством тромбоцитов начинается уже до операции. Как описано выше, пациентам с WD с количеством тромбоцитов ниже 80 / мл мы вводим иммуноглобулины для увеличения количества тромбоцитов.
У наших пациентов с WD не было необходимости в интраоперационном введении продуктов крови.В послеоперационном периоде переливание продуктов крови следует обычным рекомендациям в случае обильного кровотечения [15]. Пациентам без явной тенденции к кровотечениям концентраты тромбоцитов переливают эмпирически, если количество тромбоцитов падает ниже 60 / нл. Этот порог подтверждается Simon et al. [16], которые сообщили, что профилактическое введение концентратов тромбоцитов не снижает кровопотери через дренажную трубку и потребность в переливании крови, а также не улучшает клинический исход у пациентов с легкой тромбоцитопенией (количество тромбоцитов 58 / нл).Упакованные эритроциты переливают пожилым пациентам (возраст старше 65 лет), если гемоглобин ниже 10 г / дл; у более молодых стабильных пациентов порог переливания — гемоглобин ниже 8 г / дл [17].
Раннее применение продуктов крови у пациентов с WD (особенно переливание концентратов тромбоцитов пациентам без явной тенденции к кровотечению и количества тромбоцитов ниже 60 / нл) может быть причиной того, что мы не смогли продемонстрировать каких-либо существенных различий в общем дренаже. потеря между обеими группами нашего исследования.Конечно, основным ограничением нашего исследования является небольшое количество пациентов с WD, поэтому мы, возможно, не смогли продемонстрировать ожидаемые различия в кровопотере или повышенный риск послеоперационных кровотечений. Но наше исследование ясно показывает, что количество тромбоцитов в периоперационном периоде значительно ниже, а потребности в переливании крови значительно увеличиваются у пациентов с WD.
5 Заключение
Пациенты с WD могут подвергнуться кардиохирургическому вмешательству без значительного увеличения риска кровотечений, несмотря на более высокую, чем обычно, потребность в переливании крови и значительно более низкое количество тромбоцитов в периоперационном периоде.
Список литературы
[1],,.
Операция на сердце у пациента с рефрактерной идиопатической тромбоцитопенической пурпурой
,
J Thorac Cardiovasc Surg
,
1994
, vol.
107
(стр.
316
—
317
) [2].
Аортокоронарное шунтирование при хронической иммуноопосредованной тромбоцитопенической пурпуре: предоперационное лечение внутривенным иммуноглобулином и кортикостероидами
,
Military Med
,
1995
, vol.
160
(стр.
624
—
625
) [3].
Аортокоронарное шунтирование у двух пациентов с иммунной тромбоцитопенической пурпурой без предоперационной спленэктомии
,
WV Med J
,
1992
, vol.
88
(стр.
510
—
511
) [4],,,,,.
Комбинированная коронарная реваскуляризация и спленэктомия
,
Ann Thorac Surg
,
1989
, vol.
48
(стр.
853
—
854
) [5],,.
Замена митрального клапана и спленэктомия у пациента с хронической идиопатической тромбоцитопенической пурпурой
,
Thorac Cardiovasc Surgeon
,
1982
, vol.
30
(стр.
407
—
408
) [6],,,,.
Аортокоронарное шунтирование при иммунной тромбоцитопенической пурпуре
,
Ann Thorac Surg
,
1997
, vol.
64
(стр.
1059
—
1062
) [7],.
Замена митрального клапана у пациента с идиопатической тромбоцитопенической пурпурой: предоперационное лечение даназолом
,
J Cardiovasc Surg
,
1991
, vol.
32
(стр.
840
—
842
) [8],,,.
Аортокоронарное шунтирование при идиопатической тромбоцитопении без спленэктомии
,
Ann Thorac Surg
,
1989
, vol.
48
(стр.
721
—
722
) [9],,,.
Успешное применение уменьшенной дозы протамина после искусственного кровообращения
,
Anesth Analg
,
1976
, vol.
55
(стр.
110
—
113
) [10],,,,.
Болезнь Верльгофа — фактор риска кардиохирургии?
,
Z Herz- Thorax- Gefäßchir
,
1997
, т.
11
(стр.
198
—
202
) [11],,,,,,.
Предоперационное лечение ИГ у пациентов с болезнью Верльгофа, перенесших операцию на сердце
,
Ann Thorac Surg
,
2000
, vol.
69
(стр.
61
—
64
) [12],.
Аутоантитела к гликопротеинам тромбоцитов при аутоиммунной тромбоцитопенической пурпуре: их клиническое значение и ответ на лечение
,
Кровь
,
1993
, т.
81
(стр.
1246
—
1250
) [14].
Старые и новые взгляды на внутривенную иммуноглобулиновую терапию
,
Schweiz Med Wochenschr
,
1994
, vol.
124
(стр.
5
—
25
) [15],,. .
Гемостаз и искусственное кровообращение
,
Искусственное кровообращение
,
1995
Нью-Йорк
Springer
(стр.
88
—
113
) [16],.
Контролируемое испытание рутинного введения концентратов тромбоцитов при искусственном кровообращении
,
Ann Thorac Surg
,
1984
, vol.
37
(стр.
359
—
364
) [17],. ,,,,.
Геморрагические и тромботические осложнения кардиохирургии
,
Торакальная и сердечно-сосудистая хирургия Гленна, т. 2
,
1995
6-е изд. (Стр.
1793
—
1810
)
© 2000 Elsevier Science B.V. Все права защищены.
Elsevier Science B.V.
Подвержены ли пациенты с болезнью Верльгофа повышенному риску кровотечений во время кардиохирургических операций? | Европейский журнал кардио-торакальной хирургии
Аннотация
Предпосылки : Обычно предполагается, что пациенты с болезнью Верльгофа (ББ) подвергаются повышенному риску кровотечений при проведении кардиохирургических операций с экстракорпоральным кровообращением.Поэтому мы провели это исследование случай-контроль, чтобы оценить реальный риск кровотечений у этих пациентов. Методы : С 05/95 по 07/98 десять пациентов с WD (восемь мужчин, две женщины) перенесли кардиохирургические операции с использованием экстракорпорального кровообращения (группа WD). Пятеро из этих пациентов с количеством тромбоцитов ниже 80 / нл получали до операции иммуноглобулины. Каждый пациент с WD был сопоставлен с пятью пациентами без WD (группа без WD) с использованием диагноза, возраста, пола, фракции выброса, количества дистальных анастомозов и индекса массы тела в качестве критериев соответствия. Результаты : Среднее количество тромбоцитов было значительно ниже в группе WD, чем в группе без WD, несмотря на значительное увеличение количества тромбоцитов после лечения иммуноглобулином (54 / нл↠112 / нл, P = 0,018) . Накануне, непосредственно после и в первый день после операции они составляли 141 / нл против 215 / нл ( P = 0,012), 75 / нл против 147 / нл ( P = 0,001) и 93 / нл. nl против 136 / nl ( P = 0,009). Соответственно, пациенты из группы WD получали значительно больше концентратов тромбоцитов, чем пациенты из группы без WD (среднее количество концентратов тромбоцитов: 2.3 против 0,7, P = 0,007). Полная потеря дренажа через медиастинальные грудные трубки была почти одинаковой (1197 мл в группе без WD и 1140 мл в группе WD). Один пациент в каждой группе страдал кровотечением, требующим повторного обследования. Три пациента из группы без WD (6%) и один пациент из группы WD (10%) скончались после операции, не связанной с WD. Выводы : Пациенты с WD могут подвергаться кардиохирургическому вмешательству без заметно повышенного риска кровотечений, несмотря на более высокую, чем обычно, потребность в переливании крови и значительно более низкое количество тромбоцитов в периоперационном периоде.
1 Введение
Принято считать, что пациенты, страдающие болезнью Верльгофа (ББ) и перенесшие хирургические вмешательства, имеют повышенный риск послеоперационных кровотечений. Это особенно актуально для операций на сердце с использованием экстракорпорального кровообращения из-за необходимости полной гепаринизации и деструктивного воздействия экстракорпорального кровообращения на все компоненты крови. Из-за редкого сочетания ББ и ишемической болезни сердца в англо-американской литературе имеется лишь несколько сообщений с небольшим количеством пациентов [1–8], так что реальный риск кровотечений до сих пор остается неясным.Поэтому мы провели это исследование случай-контроль, сравнивая пациентов с WD и без него, чтобы оценить риск кровотечений.
2 Материалы и методы
В период с мая 1995 г. по июль 1998 г. десять пациентов (восемь мужчин, две женщины) с WD (группа WD) были направлены в наше учреждение для кардиохирургии с экстракорпоральным кровообращением (десять из 4533 пациентов, 0,22%). Пять пациентов без WD были сопоставлены с каждым пациентом с WD с использованием диагноза, возраста, пола, фракции выброса, количества дистальных анастомозов и индекса массы тела в качестве критериев соответствия (группа без WD).Для качественных данных требовалось соответствие, для количественных допускались отклонения до 10%. Критерии соответствия представлены в таблице 1.
Таблица 1
Таблица 1
Отмеченные предоперационные параметры включали тяжесть и лечение WD, классификацию NYHA и срочность хирургического вмешательства. Кроме того, оценивались время пережатия, продолжительность экстракорпорального кровообращения и хирургического вмешательства, а также пребывание в отделении интенсивной терапии.Что касается периоперационного риска, мы проанализировали степень кровопотери и потребности в переливании крови, а также смертность и заболеваемость.
Антикоагуляция для экстракорпорального кровообращения проводилась гепарином (400 Ед / кг, время активированной коагуляции ≥400 с) всем пациентам. Эффекты гепарина были отменены снижением дозы протамина (0,3 мл / кг), поскольку хорошо известно, что такое лечение приводит к меньшей кровопотере и увеличению количества тромбоцитов в послеоперационном периоде [9].
Диагноз WD был поставлен при наличии хронической тромбоцитопении с нормальной морфологией костного мозга (у двух пациентов повышенный мегакариоцитопоэз), отсутствии спленомегалии и других причин вторичной тромбоцитопении.У восьми пациентов с WD не было симптомов заболевания, и они не лечились. Двум пациентам перед госпитализацией была выполнена спленэктомия из-за склонности к спонтанному кровотечению, но только у одного пациента она была успешной. Другой пациент получил циклоспорин и кортикостероиды, но это лечение также не помогло. Пять пациентов с числом тромбоцитов ≥80 / нл получали иммуноглобулины (0,4 г / кг в день в течение 4–5 дней) до операции, остальные пять пациентов с числом тромбоцитов ≥80 / нл не получали специального лечения.
Статистический анализ проводился с помощью точного критерия Фишера для качественных данных и критерия Манна – Уитни для количественных данных. Парные сравнения рассчитывались с помощью критерия Вилкоксона. Значение P 0,05 считалось значительным.
3 Результаты
Статистический анализ не выявил различий между обеими группами в отношении критериев соответствия (таблица 1).
Значительные различия были обнаружены в среднем количестве потребностей в переливании эритроцитов и концентратов тромбоцитов, а также в среднем количестве тромбоцитов за день до, сразу после и в первый день после операции.На второй и третий день после операции различия между обеими группами в отношении количества тромбоцитов больше не были значимыми. Требования к переливанию представлены в таблице 2, а периоперационный курс подсчета тромбоцитов — на рисунке 1.
Таблица 2
Таблица 2
Рис. 1
Периоперационный курс подсчета тромбоцитов. При переливании концентратов тромбоцитов и инфузии 60 г иммуноглобулинов одному пациенту в первый послеоперационный день среднее количество тромбоцитов в послеоперационном периоде не опускалось ниже 75 / нл (данные представлены как среднее значение и диапазон).no-WD-группа, — — — -; WD-группа, — # P = 0,012; ○ P = 0,001; * P = 0,009.
Рис. 1
Периоперационный курс подсчета тромбоцитов. При переливании концентратов тромбоцитов и инфузии 60 г иммуноглобулинов одному пациенту в первый послеоперационный день среднее количество тромбоцитов в послеоперационном периоде не опускалось ниже 75 / нл (данные представлены как среднее значение и диапазон). no-WD-группа, — — — -; WD-группа, — # P = 0,012; ○ P = 0.001; * P = 0,009.
Всем пациентам планово выполнено аортокоронарное шунтирование. Продолжительность операции и экстракорпоральное кровообращение, а также время пережатия и кровопотеря показаны в таблице 2. У одного пациента из группы WD также был стеноз высокой степени левой внутренней сонной артерии, который привел к длительному обратимый ишемический неврологический дефицит за 2 месяца до операции на сердце. Поэтому ему пришлось пройти эндартерэктомию левой внутренней сонной артерии одновременно с аортокоронарным шунтированием.Кроме того, перед операцией был имплантирован внутриаортальный баллонный насос из-за тяжелой дисфункции левого желудочка. Помпа снята на вторые сутки после операции без осложнений.
Продолжительность искусственной вентиляции легких и время пребывания в реанимации составили 17,6 ч (9–50 ч) и 4,0 дня (2–7 дней) соответственно в группе WD и 12,0 ч (4–26 ч) и 4,2 часа. (1–23 ч) в группе без ВД.
Одно повторное исследование у пациента из группы без БВ пришлось провести по поводу тампонады перикарда, которая была вызвана тенденцией к диффузному кровотечению.Также в группе WD произошло одно кровотечение: оно было вызвано кровоточащей ветвью левой внутренней грудной артерии. Один пациент в каждой группе скончался из-за трудноизлечимой сердечной аритмии: два других пациента из группы без WD умерли из-за полиорганной недостаточности и пневмонии, вызванной искусственной вентиляцией легких.
Дальнейшие послеоперационные осложнения возникли у девяти пациентов из группы без ВБ. Двум пациентам пришлось повторно интубировать дыхательную недостаточность; через несколько дней их успешно отлучили от ИВЛ.Четырем пациентам потребовалась послеоперационная имплантация внутриаортального баллонного насоса для стабилизации гемодинамики. Все пациенты были успешно отлучены от внутриаортального баллонного насоса, но одному пациенту пришлось перенести фасциотомию из-за компартмент-синдрома. У двух пациентов нарушения заживления ран лечились консервативно, у одного потребовалось оперативное вмешательство.
4 Комментарий
Наше текущее исследование демонстрирует, что количество тромбоцитов у пациентов с WD значительно ниже в периоперационном периоде (рис.1) несмотря на предоперационное лечение иммуноглобулинами, как описано выше. Поэтому количество переливаемых продуктов крови (таблица 2), особенно концентратов тромбоцитов, превышает обычную потребность.
Согласно предыдущим сообщениям [4,5,8], более низкое количество тромбоцитов, помимо пагубного воздействия экстракорпорального кровообращения на тромбоциты, необходимость полной антикоагуляции и нарушение функции циркулирующих тромбоцитов, были предположительно ответственны за повышенный риск послеоперационных кровотечений. , повторные исследования и переливание продуктов крови.Поскольку консервативная терапия WD, состоящая из кортикостероидов и / или иммуносупрессивного лечения, редко была успешной в отношении нормализации количества тромбоцитов и регресса симптомов, было описано несколько стратегий для снижения риска послеоперационных кровотечений у пациентов с WD:
Спленэктомия была предлагается как одновременная процедура или перед операцией на сердце [4,5]. Недостатками комбинированной процедуры являются повышенный операционный риск и то, что нормализация количества тромбоцитов занимает несколько дней.Таким образом, пациенту не приносит пользы дополнительная процедура, то есть спленэктомия, в раннем послеоперационном периоде, когда риск кровотечений наиболее высок. Поэтому была введена поэтапная процедура, но это ведение требует дополнительного оперативного вмешательства, которое также несет в себе риск кровотечений и отсрочку кардиохирургического вмешательства.
Предоперационное лечение иммуноглобулинами может быть лучшим терапевтическим методом [6,10,11]. Это приводит к временному увеличению количества тромбоцитов, которое можно легко контролировать с помощью анализа количества тромбоцитов, позволяет оптимизировать время хирургических вмешательств и продолжается в прямом послеоперационном периоде [12,13].В нашем недавнем отчете мы смогли четко продемонстрировать этот эффект лечения иммуноглобулином у пациентов с количеством тромбоцитов ниже 80 / нл: среднее количество тромбоцитов увеличилось с 54 / нл за 5 дней до операции до 112 / нл за день до операции ( P = 0,018). и после операции не опускалась ниже 60 / нл [11]. Пациенты с количеством тромбоцитов выше 80 / нл не получали иммуноглобулины без повышенного риска послеоперационных кровотечений [11]. Точный механизм действия иммуноглобулинов до сих пор неясен; Обсуждается несколько возможностей: нарушение фагоцитоза тромбоцитов ретикулоэндотелиальной системой, нейтрализация аутоантител, ингибирование синтеза аутоантител или нарушение взаимодействия между тромбоцитами и активированными факторами комплемента [12,14].
Введение продуктов крови, особенно концентратов тромбоцитов у пациентов с WD, представляет собой хорошо известный шаг по увеличению количества тромбоцитов. Ключевой вопрос заключается в том, когда и почему показано переливание продуктов крови пациентам с WD. По данным Salmenperä et al. [15], количество тромбоцитов постепенно снижается во время экстракорпорального кровообращения и остается на уровне половины исходного уровня до четвертого послеоперационного дня. Кроме того, помимо активации тромбоцитов при контакте с инородными поверхностями экстракорпорального кровообращения, часто встречается дисфункция тромбоцитов, которая вызвана изменениями мембраны тромбоцитов из-за напряжения сдвига, поверхностного прилипания и турбулентного потока.Несмотря на активацию тромбоцитов, длительное время кровотечения после кардиохирургического вмешательства из-за дисфункции тромбоцитов хорошо известно и является наиболее вероятной причиной нехирургического кровотечения [15]. Следовательно, соответствующее лечение пациентов с WD с низким количеством тромбоцитов начинается уже до операции. Как описано выше, пациентам с WD с количеством тромбоцитов ниже 80 / мл мы вводим иммуноглобулины для увеличения количества тромбоцитов.
У наших пациентов с WD не было необходимости в интраоперационном введении продуктов крови.В послеоперационном периоде переливание продуктов крови следует обычным рекомендациям в случае обильного кровотечения [15]. Пациентам без явной тенденции к кровотечениям концентраты тромбоцитов переливают эмпирически, если количество тромбоцитов падает ниже 60 / нл. Этот порог подтверждается Simon et al. [16], которые сообщили, что профилактическое введение концентратов тромбоцитов не снижает кровопотери через дренажную трубку и потребность в переливании крови, а также не улучшает клинический исход у пациентов с легкой тромбоцитопенией (количество тромбоцитов 58 / нл).Упакованные эритроциты переливают пожилым пациентам (возраст старше 65 лет), если гемоглобин ниже 10 г / дл; у более молодых стабильных пациентов порог переливания — гемоглобин ниже 8 г / дл [17].
Раннее применение продуктов крови у пациентов с WD (особенно переливание концентратов тромбоцитов пациентам без явной тенденции к кровотечению и количества тромбоцитов ниже 60 / нл) может быть причиной того, что мы не смогли продемонстрировать каких-либо существенных различий в общем дренаже. потеря между обеими группами нашего исследования.Конечно, основным ограничением нашего исследования является небольшое количество пациентов с WD, поэтому мы, возможно, не смогли продемонстрировать ожидаемые различия в кровопотере или повышенный риск послеоперационных кровотечений. Но наше исследование ясно показывает, что количество тромбоцитов в периоперационном периоде значительно ниже, а потребности в переливании крови значительно увеличиваются у пациентов с WD.
5 Заключение
Пациенты с WD могут подвергнуться кардиохирургическому вмешательству без значительного увеличения риска кровотечений, несмотря на более высокую, чем обычно, потребность в переливании крови и значительно более низкое количество тромбоцитов в периоперационном периоде.
Список литературы
[1],,.
Операция на сердце у пациента с рефрактерной идиопатической тромбоцитопенической пурпурой
,
J Thorac Cardiovasc Surg
,
1994
, vol.
107
(стр.
316
—
317
) [2].
Аортокоронарное шунтирование при хронической иммуноопосредованной тромбоцитопенической пурпуре: предоперационное лечение внутривенным иммуноглобулином и кортикостероидами
,
Military Med
,
1995
, vol.
160
(стр.
624
—
625
) [3].
Аортокоронарное шунтирование у двух пациентов с иммунной тромбоцитопенической пурпурой без предоперационной спленэктомии
,
WV Med J
,
1992
, vol.
88
(стр.
510
—
511
) [4],,,,,.
Комбинированная коронарная реваскуляризация и спленэктомия
,
Ann Thorac Surg
,
1989
, vol.
48
(стр.
853
—
854
) [5],,.
Замена митрального клапана и спленэктомия у пациента с хронической идиопатической тромбоцитопенической пурпурой
,
Thorac Cardiovasc Surgeon
,
1982
, vol.
30
(стр.
407
—
408
) [6],,,,.
Аортокоронарное шунтирование при иммунной тромбоцитопенической пурпуре
,
Ann Thorac Surg
,
1997
, vol.
64
(стр.
1059
—
1062
) [7],.
Замена митрального клапана у пациента с идиопатической тромбоцитопенической пурпурой: предоперационное лечение даназолом
,
J Cardiovasc Surg
,
1991
, vol.
32
(стр.
840
—
842
) [8],,,.
Аортокоронарное шунтирование при идиопатической тромбоцитопении без спленэктомии
,
Ann Thorac Surg
,
1989
, vol.
48
(стр.
721
—
722
) [9],,,.
Успешное применение уменьшенной дозы протамина после искусственного кровообращения
,
Anesth Analg
,
1976
, vol.
55
(стр.
110
—
113
) [10],,,,.
Болезнь Верльгофа — фактор риска кардиохирургии?
,
Z Herz- Thorax- Gefäßchir
,
1997
, т.
11
(стр.
198
—
202
) [11],,,,,,.
Предоперационное лечение ИГ у пациентов с болезнью Верльгофа, перенесших операцию на сердце
,
Ann Thorac Surg
,
2000
, vol.
69
(стр.
61
—
64
) [12],.
Аутоантитела к гликопротеинам тромбоцитов при аутоиммунной тромбоцитопенической пурпуре: их клиническое значение и ответ на лечение
,
Кровь
,
1993
, т.
81
(стр.
1246
—
1250
) [14].
Старые и новые взгляды на внутривенную иммуноглобулиновую терапию
,
Schweiz Med Wochenschr
,
1994
, vol.
124
(стр.
5
—
25
) [15],,. .
Гемостаз и искусственное кровообращение
,
Искусственное кровообращение
,
1995
Нью-Йорк
Springer
(стр.
88
—
113
) [16],.
Контролируемое испытание рутинного введения концентратов тромбоцитов при искусственном кровообращении
,
Ann Thorac Surg
,
1984
, vol.
37
(стр.
359
—
364
) [17],. ,,,,.
Геморрагические и тромботические осложнения кардиохирургии
,
Торакальная и сердечно-сосудистая хирургия Гленна, т. 2
,
1995
6-е изд. (Стр.
1793
—
1810
)
© 2000 Elsevier Science B.V. Все права защищены.
Elsevier Science B.V.
Иммунная тромбоцитопения: MedlinePlus Genetics
Генетическая причина иммунной тромбоцитопении неясна.Это состояние возникает, когда собственная иммунная система организма нарушает работу и атакует ткани и органы организма (аутоиммунитет). Обычно иммунная система вырабатывает белки, называемые антителами, которые прикрепляются к определенным чужеродным частицам и микробам, помечая их для разрушения. При иммунной тромбоцитопении иммунная система ненормально разрушает тромбоциты и производит меньше тромбоцитов, чем обычно. Люди с иммунной тромбоцитопенией вырабатывают антитела, которые атакуют нормальные тромбоциты. Тромбоциты разрушаются и выводятся из организма, что приводит к нехватке этих клеток у пораженных людей.Некоторые из этих антител также влияют на клетки костного мозга, производящие тромбоциты (известные как мегакариоциты), что приводит к снижению выработки тромбоцитов, что еще больше снижает количество тромбоцитов в крови.
У некоторых людей с иммунной тромбоцитопенией аномальные иммунные реакции могут совпадать с инфекцией, вызванной определенными вирусами или бактериями. Воздействие этих чужеродных захватчиков может заставить организм бороться с инфекцией, но иммунная система также ошибочно атакует тромбоциты.
Генетические вариации (полиморфизмы) некоторых генов были обнаружены у некоторых людей с иммунной тромбоцитопенией и могут повышать риск аномальных иммунных реакций. Однако вклад этих генетических изменений в развитие иммунной тромбоцитопении неясен.
Состояние, вызванное целевым разрушением тромбоцитов собственными иммунными клетками организма, называется первичной иммунной тромбоцитопенией. Иммунная тромбоцитопения, возникшая после бактериальной или вирусной инфекции, считается первичной, потому что инфекция запускает специфичную для тромбоцитов иммунную реакцию, обычно без каких-либо других признаков или симптомов.Однако иммунная тромбоцитопения может быть признаком других иммунных нарушений, таких как общий вариабельный иммунный дефицит, который возникает, когда иммунная система имеет пониженную способность защищать организм от инородных захватчиков, или других аутоиммунных заболеваний, таких как системная красная волчанка. Иммунная тромбоцитопения также может возникать при других заболеваниях крови, включая форму рака кроветворной ткани, известную как хронический лимфоцитарный лейкоз, и инфекция вируса иммунодефицита человека (ВИЧ).Когда иммунная тромбоцитопения является признаком других заболеваний, это состояние известно как вторичная иммунная тромбоцитопения.
Болезнь Верльгофа | Illness.com
Болезнь Верльгофа | Illness.com Болезнь Верльгофа | Illness.com
Болезнь Верльгофа широко известна как ИТП. Иммунная тромбоцитопеническая пурпура (ИТП) — это нарушение свертываемости крови, при котором иммунная система разрушает тромбоциты, необходимые для нормального свертывания крови. У людей с этим заболеванием слишком мало тромбоцитов в крови.
У пораженных людей могут появиться красные или пурпурные пятна на коже, вызванные кровотечением непосредственно под поверхностью кожи.Небольшие кровоточащие пятна под кожей называются пурпурой, а более крупные — экхимозами. У людей с иммунной тромбоцитопенией могут быть эпизоды значительных кровотечений, например носовые кровотечения (носовые кровотечения) или кровотечения во влажной слизистой оболочке (слизистых оболочках) рта. В тяжелых случаях у людей может быть желудочно-кишечное кровотечение или кровь в моче или стуле, или обильные и продолжительные менструальные кровотечения (меноррагия). В очень редких случаях может возникнуть кровотечение внутри черепа (внутричерепное кровоизлияние), которое может быть опасным для жизни.Более сильное снижение количества тромбоцитов часто связано с более частыми эпизодами кровотечения и повышенным риском сильного кровотечения.
Хотя иммунную тромбоцитопению можно диагностировать в любом возрасте, существует два периода, когда заболевание может развиться наиболее вероятно: в раннем детстве и в позднем взрослом возрасте. У детей снижение тромбоцитов часто происходит внезапно, но обычно уровень тромбоцитов возвращается к норме в течение нескольких недель или месяцев. Иммунной тромбоцитопении у детей часто предшествует незначительная инфекция, например инфекция верхних дыхательных путей, но связь между инфекцией и иммунной тромбоцитопенией не ясна.У взрослых развитие иммунной тромбоцитопении обычно происходит постепенно, и заболевание имеет тенденцию сохраняться на протяжении всей жизни.
Синоним
ITP; Иммунная тромбоцитопения; Нарушение свертываемости крови — идиопатическая тромбоцитопеническая пурпура; Нарушение свертываемости крови — ИТП; Аутоиммунный — ИТП; Низкое количество тромбоцитов — ITP
ITP возникает, когда определенные клетки иммунной системы вырабатывают антитела против тромбоцитов. Тромбоциты способствуют свертыванию крови, собираясь вместе и закрывая небольшие отверстия в поврежденных кровеносных сосудах.
Антитела прикрепляются к тромбоцитам. Организм разрушает тромбоциты, несущие антитела.
У детей болезнь иногда возникает после вирусной инфекции. У взрослых это чаще является длительным (хроническим) заболеванием и может возникать после вирусной инфекции, при приеме определенных лекарств, во время беременности или как часть иммунного расстройства.
ИТП чаще поражает женщин, чем мужчин. Это чаще встречается у детей, чем у взрослых. У детей заболевание одинаково поражает мальчиков и девочек.
Генетическая причина иммунной тромбоцитопении неясна. Это состояние возникает, когда собственная иммунная система организма нарушает работу и атакует ткани и органы организма (аутоиммунитет). Обычно иммунная система вырабатывает белки, называемые антителами, которые прикрепляются к определенным чужеродным частицам и микробам, помечая их для разрушения. При иммунной тромбоцитопении иммунная система ненормально разрушает тромбоциты и производит меньше тромбоцитов, чем обычно. Люди с иммунной тромбоцитопенией вырабатывают антитела, которые атакуют нормальные тромбоциты.Тромбоциты разрушаются и выводятся из организма, что приводит к нехватке этих клеток у пораженных людей. Некоторые из этих антител также влияют на клетки костного мозга, производящие тромбоциты (известные как мегакариоциты), что приводит к снижению выработки тромбоцитов, что еще больше снижает количество тромбоцитов в крови.
У некоторых людей с иммунной тромбоцитопенией аномальные иммунные реакции могут совпадать с инфицированием определенными вирусами или бактериями. Воздействие этих чужеродных захватчиков может заставить организм бороться с инфекцией, но иммунная система также ошибочно атакует тромбоциты.
Генетические вариации (полиморфизмы) некоторых генов были обнаружены у некоторых людей с иммунной тромбоцитопенией и могут повышать риск аномальных иммунных реакций. Однако вклад этих генетических изменений в развитие иммунной тромбоцитопении неясен.
Состояние, вызванное целевым разрушением тромбоцитов собственными иммунными клетками организма, называется первичной иммунной тромбоцитопенией. Иммунная тромбоцитопения, возникшая после бактериальной или вирусной инфекции, считается первичной, потому что инфекция запускает специфичную для тромбоцитов иммунную реакцию, обычно без каких-либо других признаков или симптомов.Однако иммунная тромбоцитопения может быть признаком других иммунных нарушений, таких как общий вариабельный иммунный дефицит, который возникает, когда иммунная система имеет пониженную способность защищать организм от инородных захватчиков, или других аутоиммунных заболеваний, таких как системная красная волчанка. Иммунная тромбоцитопения также может возникать при других заболеваниях крови, включая форму рака кроветворной ткани, известную как хронический лимфоцитарный лейкоз, и инфекция вируса иммунодефицита человека (ВИЧ).Когда иммунная тромбоцитопения является признаком других заболеваний, это состояние известно как вторичная иммунная тромбоцитопения.
Симптомы ИТП могут включать любые из следующих:
Аномально обильные месячные у женщин
Кровотечение в кожу, часто вокруг голеней, вызывающее кожную сыпь, которая выглядит как точечные красные пятна (петехиальная сыпь)
Легкие синяки
Носовое кровотечение или кровотечение изо рта
Для определения количества тромбоцитов будут сданы анализы крови.
Также может быть сделана аспирация костного мозга или биопсия.
У детей болезнь обычно проходит без лечения. Некоторым детям может потребоваться лечение.
Взрослые обычно начинают принимать стероидные препараты под названием преднизон или дексаметазон. В некоторых случаях рекомендуется операция по удалению селезенки (спленэктомия). Это увеличивает количество тромбоцитов примерно у половины людей. Однако вместо этого обычно рекомендуются другие лекарственные препараты.
Если болезнь не проходит с помощью преднизона, другие методы лечения могут включать:
Инфузии высоких доз гамма-глобулина (иммунный фактор)
Лекарства, подавляющие иммунную систему
Анти -Терапия RhD для людей с определенными группами крови
Лекарства, которые стимулируют костный мозг для производства большего количества тромбоцитов
Людям с ИТП не следует принимать аспирин, ибупрофен или варфарин, потому что эти препараты влияют на функцию тромбоцитов или свертывание крови , и может возникнуть кровотечение.


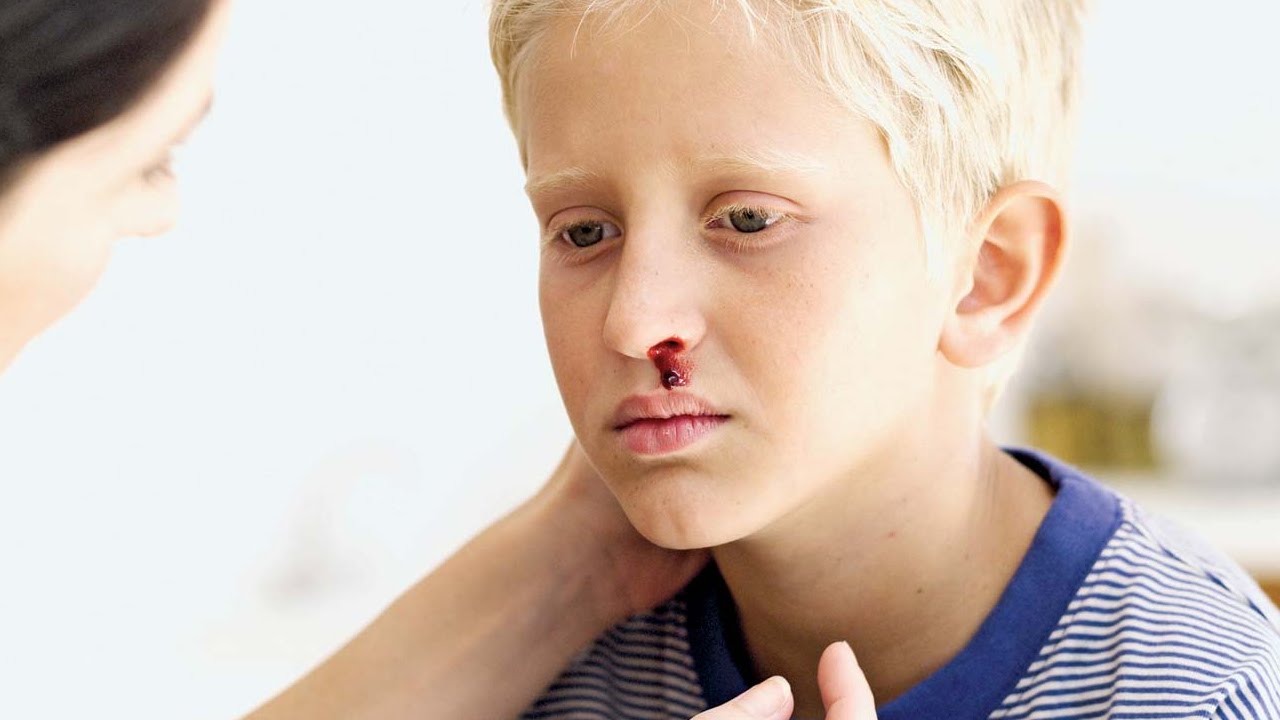
 У детей врач спросит, были ли ранее инфекции, такие как свинка и грипп
У детей врач спросит, были ли ранее инфекции, такие как свинка и грипп