Коронавирус может проникать в головной мозг, нарушать работу нервной системы и вызывать другие осложнения
- Николай Воронин
- Корреспондент по вопросам науки
Автор фото, Getty Images
Заражение Covid-19 не ограничивается инфекцией дыхательных органов. Как показывают практические исследования, у значительного числа пациентов вирус поражает и нервную систему.
Механизм его воздействия на нервные клетки пока не изучен, однако ученые не сомневаются в том, что какая-то связь есть: временная пропажа вкуса или обоняния были признаны специфическими симптомами Covid-19 еще в середине марта.
Кроме того, из носоглотки вирус способен проникать напрямую в головной мозг, а это в свою очередь может спровоцировать целый ряд осложнений, нарушив нормальную работу практически любого органа.
Список возможных сопутствующих заболеваний огромен: от проблем с пищеварением и закупорки сосудов — до сердечной недостаточности и энцефалита.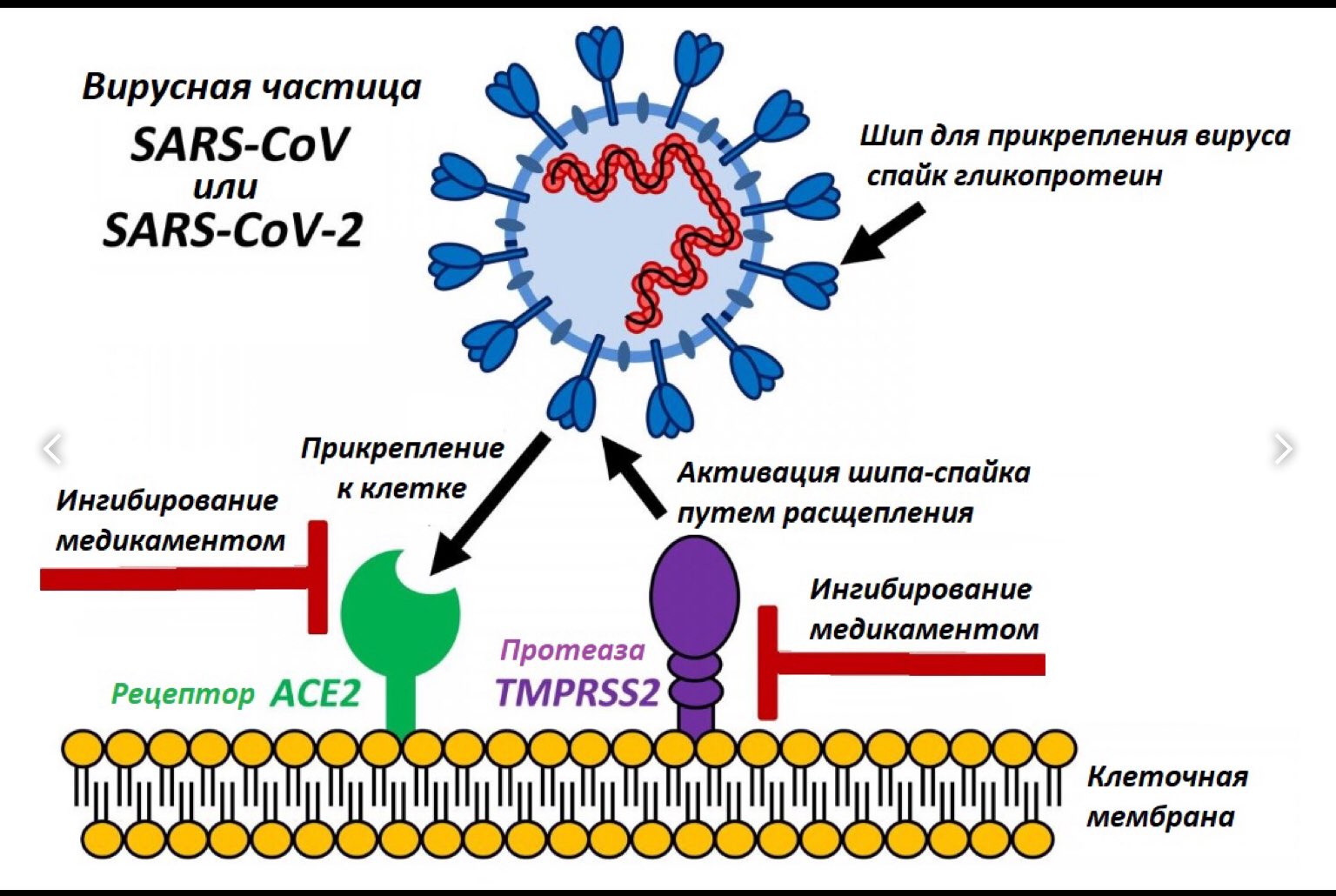
Многоликий вирус
Спустя четыре месяца с начала эпидемии ученым по-прежнему очень мало известно о вызывающем болезнь вирусе SARS-CoV-2 и его действии на организм человека.
Общая картина инфекции складывается по крупицам, из сотен статей в научных журналах, где врачи со всего мира делятся опытом лечения коронавирусных пациентов.
В результате продолжает расширяться список возможных симптомов Covid-19 (их уже больше десятка), а вместе с ним — и наши представления о том, какие еще органы способен поражать вирус и какими осложнениями может обернуться болезнь, помимо пневмонии.
Автор фото, Getty Images
Чаще всего медики описывают нарушения работы нервной системы. Сразу два исследования — во Франции и в Китае — пришли к выводу, что неврологические симптомы в той или иной форме испытывают более трети зараженных.
Однако в целом новая инфекция отличается куда более разносторонним и даже индивидуальным подходом.
Но и нервную систему вирус может поражать очень по-разному — речь далеко не только о временном отказе чувств.
В частности, в качестве побочных проявлений Covid-19 описаны несколько случаев энцефалита (воспаления мозга), а также синдрома Гийена-Барре: иммунная система пациента начинает атаковать собственные нервные клетки, что приводит к мышечной слабости, а в тяжелых случаях — к параличу.
Американские медики встревожены сообщениями о том, что только в Нью-Йорке за две недели у коронавирусных пациентов было зафиксировано пять случаев обширного инсульта — причем у относительно молодых людей (до 50 лет), без других ярко выраженных симптомов Covid-19.
По предварительным данным, в качестве побочного эффекта воспаления коронавирус спровоцировал у них образование тромбов в крупных сосудах — что в итоге и привело к острому нарушению мозгового кровообращения.
Однако в основном неврологические расстройства наблюдаются все-таки у тяжелых больных. В таких случаях эти симптомы иногда остаются даже после выздоровления пациентов от Covid-19.
В таких случаях эти симптомы иногда остаются даже после выздоровления пациентов от Covid-19.
Автор фото, Getty Images
Почему осложнения такие разные?
Нарушить работу нервной системы вирус может как косвенно, путем чрезмерной активизации иммунной системы (так называемый цитокиновый шторм), так и напрямую. Это выяснилось в результате вскрытия тел погибших от Covid-19.
Вирусные частицы у жертв были обнаружены в том числе и в головном мозге. Есть версия, что инфекция попадает туда из дыхательных путей через обонятельные рецепторы в носу.
Это не какая-то уникальная способность нового коронавируса. Аналогичную инфекцию мозга могут вызывать и некоторые другие вирусы, в том числе гриппа и кори — что также иногда приводит к неврологическим заболеваниям, хоть и довольно редко.
Правда, в случае с Covid-19 дело обстоит чуть сложнее. Во-первых, число зараженных уже превысило 3 млн — а значит, даже редких случаев в совокупности оказывается немало. А во-вторых, если вирус все же попал в мозг, дальнейшее заражение почти неизбежно: на поверхности мозговых клеток присутствует тот самый мембранный рецептор ACE2, через который вирус легко проникает внутрь, вызывая воспаление.
А во-вторых, если вирус все же попал в мозг, дальнейшее заражение почти неизбежно: на поверхности мозговых клеток присутствует тот самый мембранный рецептор ACE2, через который вирус легко проникает внутрь, вызывая воспаление.
Этот же рецептор есть и у клеток, выстилающих внутреннюю поверхность кровеносных сосудов — поэтому в тяжелых случаях вирус прорывается из дыхательных органов в общий кровоток. В результате тромботические осложнения возникают почти у каждого третьего больного коронавирусной пневмонией.
С кровью вирус может попасть уже в любые органы, в том числе и в мозг. Однако, по последним данным, почти половина всех инфицированных переносят Covid-19 вообще без всяких симптомов.
Пытаясь понять, почему у одних людей болезнь протекает совершенно незаметно, а у других приводит к столь тяжелым последствиям, в Британии провели исследования нескольких тысяч пар идентичных близнецов.
Согласно предварительным данным, тяжесть инфекции, многие ее симптомы, а возможно, и сама вероятность заражения довольно сильно зависят от генетических факторов, то есть наследственности.
Инфекции головного мозга | Неврология
Все инфекции в разной степени опасны, а тем более – нейроинфекции. Самыми опасными из нейроинфекций считаются те, которые поражают головной мозг. Здесь не может быть «несерьезных» заболеваний. Каждый возбудитель, который может преодолеть гематоэнцефалический барьер представляет огромную опасность для здоровья и жизни человека.
Виды инфекций головного мозга
Все многообразие нейроинфекций, поражающих головной мозг можно разделить на пять групп:
-
бактериальные; -
паразитарные; -
вирусные; -
прионные; -
грибковые.
Бактериальные инфекции
Огромное количество возбудителей относящихся к бактериальным инфекциям могут поражать головной мозг.
Такие заболевания как менингит, энцефалит или абсцесс головного мозга вполне могут вызвать такие «обыденные» возбудители, как пневмококк, стафилококк, энтеробактерии. Но произойти это может, только при:
Но произойти это может, только при:
-
повреждении костей черепа, с нарушением целостности оболочек мозга; -
заносе возбудителей во время нейрохирургической операции; -
наличии гнойного очага в организме и ослабленный иммунитет.
Однако с другими возбудителями дело обстоит иначе.
Менингококковая инфекция – традиционная нейроинфекция, которая поражает головной мозг. Пик заболеваемости отмечается в осенне- зимний период, когда иммунная система из-за частых переохлаждений человека и нехватки витаминов снижена.
Если иммунная система в норме, то вы ограничитесь обычным назофарингитом, в обратном случае – вероятность заполучить менингит или менингоэнцефалит возрастает.
Симптомы менингококковой инфекции
-
лихорадка, -
повышение температуры тела до 39-40° С. -
озноб, -
головная боль -
слабость -
напряжение мышц шеи -
тошнота, -
рвота,
специфические симптомы
-
Выступающая над поверхностью кожи сыпь красно-фиолетового цвета, элементы которой напоминают по форме звезду -
Заболевание начинается очень остро (часто можно указать конкретное время (час), когда человек заболел) -
В течение 24-х часов, пока человек в сознании должно начаться лечение, в противном случае он может впасть в кому.
Микобактерии туберкулеза кроме в всего прочего могут поражать и головной мозг.
Чаще болеют дети, пожилые люди и лица страдающие иммунодефицитом.
Симптоматика начала заболевания ярко не выражена, чаще это общая слабость, недомогание, отсутствие аппетита, головная боль и раздражительность, температура тела носит субфебрильный характер (температура повышается на протяжении длительного времени в пределах 37,1 – 38°C. ). Впоследствии присоединяются «обычные» менингеальные симптомы.
После присоединяются неврологические нарушения – парезы и параличи лицевого нерва, глазодвигательной мускулатуры, головокружения. На фоне неврологических расстройств возникают нарушения психики.
Нейросифилис, сейчас почти не встречается, но до открытия пенициллина составлял основу работы неврологов. Нейросифилис бывает нескольких видов:
-
Асимптомный, протекает без особых признаков, обнаружить заболевание можно только по анализам.
-
Менингит – часто появляется в течение первого года заболевания, проявляется нарушениями работы черепно-мозговых нервов и повышенным внутричерепным давлением (ВЧД). -
Цереброваскулярный – возникает в основном на 2-5 году заболевания и может привести к инсульту или трансформироваться в спинную сухотку или прогрессивный паралич. -
Прогрессивный паралич – заболевание, которое еще называли «параличом помешанных». Возникает через 15-20 лет после инфицирования и сначала проявляется психическими симптомами, затем возникают и прогрессируют параличи мускулатуры, которые в конечном итоге приводят к смерти. -
Врожденный, который, строго говоря, поражает весь организм и характеризуется множественными дефектами развития ребенка. -
Гумма головного мозга – проявляется как объемное образование. Симптомы включают в себя повышение ВЧД и очаговую симптоматику, в зависимости от локализации гуммы.
Неприятной особенностью заболевания является его трудная диагностика.
Вирусные и прионные инфекции
Существует огромное множество вирусов –возбудителей острых энцефалитов (комариный, клещевой, эпидемический), в общем они отличаются переносчиками и географией распространения.
Очаговая симптоматика возникает на фоне «общеинфекционных проявлений», это :
-
парезы -
параличи дыхательной мускулатуры -
параличи конечностей, -
параличи лицевой мускулатуры и пр.
Огромную опасность могут составлять бешенство и медленные инфекции, в связи с чем, им уделяется особое внимание.
Бешенство.
Бешенством могут страдать практически все млекопитающие. Источником появления инфекции обычно служат собаки, волки, лисицы и именно через укус зараженных животных к человеку и передается эта опасная инфекция.
Симптомы:
-
гидро и аэрофобия -
судороги -
приступы агрессивного поведения.
Экстренная вакцинопрофилактика после укуса – это единственный способ выздороветь, поэтому дожидаться развития первых симптомов заболевания запрещено, поскольку это может говорить только о том, что человека уже не спасти.
Медленные инфекции – вирусные нейроинфекции, которые имеют способность длительное время бессимптомно находиться в нервной ткани человека, с последующим развитием заболевания.
Учеными были выведены четыре главных признака, отличающих медленные инфекции:
-
необычно продолжительный (месяцы и годы) инкубационный период; -
медленно прогрессирующий характер течения; -
необычность поражения органов и тканей; -
неизбежность смертельного исхода.
Возбудители вируса — краснуха и корь. По не до конца ясным причинам эти вирусы после перенесенного заболевания могут остаться в клетках головного мозга и через 4 и более лет вызывать заболевание. Оба вируса вызывают панэнцефалит со сходной симптоматикой:
Оба вируса вызывают панэнцефалит со сходной симптоматикой:
· изменение личности с развитием деменции
· постепенный паралич всей поперечнополосатой мускулатуры.
К огромному сожалению, даже при лечении, последствия у этих нейроинфекций всегда одинаковы – летальный исход.
Прионы
Прионы — «белковая инфекционная (частица)» (от англ. proteinaceous infectious (particles).
Прионы определяют как «малую белковую инфекционную частицу, устойчивую к инактивирующим воздействиям, которые модифицируют нуклеиновые кислоты», другими словами прионы — это обычные белки организма, которые по неким причинам (которые пока неизвестны) начинают вести себя «неправильно».
Существует четыре вида прионных нейроинфекций, и только с одной из них понятен механизм передачи. В некоторых племенах Папуа-Новая Гвинея часто отмечались случаи куру-куру из-за ранее распространенного ритуального каннибализма – поедания мозга родственников. Прионы вызывают спонгиформную энцефалопатию, то есть мозг превращается в подобие губки.
Прионы вызывают спонгиформную энцефалопатию, то есть мозг превращается в подобие губки.
Паразитарные инфекции
Токсоплазмоз – паразитарное заболевание, характеризуется возможностью внутриутробного заражения, поражения нервной системы, глаз, скелетной мускулатуры и мышцы сердца, а также увеличением лимфоузлов, печени и селезенки.
Для возбудителя этого заболевания человек – промежуточный хозяин, а основной – кошки. При нормальном состоянии иммунитета заболевание никак не проявляется, но если человек страдает иммунодефицитом, то могут быть такие варианты заболевания:
-
энцефалопатия, с развитием делирия, спутанности сознания вплоть до комы; -
менингоэнцефалит, со всеми своими классическими проявлениями; -
токсоплазменный абсцесс мозга, который проявляется общеинфекционными симптомами, очаговыми нарушениями, в зависимости от расположения, судорогами, нарушением сознания.
Наиболее тяжелые последствия токсоплазмоза – у беременных, так как он вызывает недоразвитие головного мозга плода.
Диагностика
Для того, чтобы диагностировать нейроинфекцию, в том числе головного мозга, используется комплекс мероприятий:
-
общий анализ крови и мочи; -
биохимический анализ крови; -
анализ крови на антитела к вирусным, бактериальным и другим агентам; -
методы визуализации – МРТ;
Лечение
Несмотря на различие возбудителей, некоторые аспекты лечения совпадают во всех случаях.
Больным обязательно назначают постельный режим (при острых инфекциях), противовоспалительные препараты, детоксикационную терапию.
Когда это подострый или хронический процесс, то больным также дают «сосудистые» препараты, способствующие лучшему кровоснабжению головного мозга, ноотропные, противовоспалительные препараты.
Меры предосторожности
Не употреблять в пищу сырое или недостаточно термически обработанное мясо, тщательно мыть руки после контакта с кошками.
Нейровирусная инфекция: как уберечь своё здоровье?
Нейровирусная инфекция — группа инфекционных болезней с локализацией возбудителя в различных отделах центральной нервной системы
Мы знаем, что наша центральная нервная система выполняет
одну из ключевых функций в работе всего организма. Нервные
волокна полностью обволакивают человеческое тело с головы до ног,
где беспрерывно работают нервные импульсы, которые отвечают за
чувствительные факторы, двигательные и смешанные – работа
импульсов из рецептора в центральную нервную систему и наоборот.
Функционал центральной нервной системы может быть нарушен при
возникновении в организме нейровирусной инфекции.
Нейровирусная инфекция в свою очередь представляет собой группу
инфекционных болезней с локализацией возбудителя в различных
отделах центральной нервной системы. Причинами такой инфекции
Причинами такой инфекции
могут стать вирусы, бактерии, грибы, простейшие. В основном это
происходит при воспалении оболочек головного и спинного мозга
(менингит), поражение вещества головного мозга
(энцефалит) и спинного мозга
(миелит). Появление подобных причин, которые
относятся к вышеуказанным воспалениям, происходит из-за широкого
распространения вирусной инфекции нервной системы, высокого
сопротивления организма при появлении бактериальных и вирусных
веществ к химиопрепаратам, а также из-за появления
вирусно-бактериальных, вирусно-вирусных и вирусно-грибковых
носителей. Как отмечают специалисты, существует более 85 вирусов,
способных поражать центральную нервную систему человека.
Обследование пациента
Инфекцию можно считать нейровирусной в случае соответствия
следующим критериям. Если возникает нейроинвазивность – процесс
проникновения конкретного вируса в нервную систему организма;
если проявляется нейротропизм – когда происходит инфицирование
вирусом клеток головного мозга, а конкретно его нейронов; и,
наконец, если врач обнаруживает у пациента нейровирулентность –
заболевание нервной системы, возникающее при вторжении в организм
массовой группы вирусов.
Для того, чтобы своевременно предотвратить возможность
развития нейровирусной инфекции, необходимо обратиться
к ЛОР-специалисту, сделать полное обследование на отсутствие
стоматологических патологий, полностью исключить контакт с уже
инфицированными людьми, носить головной убор при низкой
температуре воздуха и укреплять иммунитет,
употреблять фрукты, овощи и полезные витамины. Казалось бы,
ничего сложного в этом нет, и данные рекомендации легко
соблюдать. Однако, некоторые люди пренебрегают своим здоровьем,
за что потом им же и расплачиваются, когда появляются симптомы
болезни, и вирус в организме дает о себе знать. Уже при
возникновении стадии высокого развития нейроинфекции пациенты
начинают обращаться к специалисту за эффективным и быстрым
лечением. Только в данном случае на выздоровление заболеваний
потребуется масса времени и усилий.
Электроэнцефалография (ЭЭГ) — диагностика головного мозга
Источник — Неврологическая клиника доктора Яценко
В медицинских справочниках нейровирусное заболевание трактуется
как инфекционное, вызванное грибками, вирусами или бактериями,
которое поражает нервную систему, при этом имеет тяжелое течение
с высоким процентом смертности. Нейроинфекция включает в себя
Нейроинфекция включает в себя
достаточно большой список заболеваний, многие из которых
губительны для головного мозга. Все они могут иметь острую форму
течения или переходить в хроническую и протекать достаточно вяло.
Как показывает медицинская практика, эти заболевания могут пройти
в острой форме один раз и больше не беспокоить больного или иметь
частые и яркие рецидивы до конца его дней. У взрослого
человека после перенесенных заболеваний остается головная боль,
постоянные болевые ощущения в спине, которые усиливаются при
изменении погоды. Многие специалисты констатируют тот факт, что у
таких больных после выздоровления ухудшается память, отмечаются
проблемы с запоминанием, может нарушаться слух, зрение.
Встречаются и такие единичные случаи, когда нейроинфекционное
заболевание приводит к полной потере зрения и слуха. К счастью,
это происходит крайне редко.
Методики проведения терапии во многом зависят от того, какая
именно инфекция спровоцировала возникновение патологии, от места
локализации, а также вида самой инфекции. К основным задачам
проведения медикаментозной терапии относятся: нормализация
деятельности нервной системы; восстановление иммунной системы
организма; устранение путей распространения инфекции и его
возбудителя.
Если же пациенту удалось вылечить сложную стадию нейровирусной
инфекции, то всё равно степень осложнения на здоровье организма
остается. Последствия перенесенной нейроинфекции зависят от вида
заболевания и времени начала лечения. У пациентов может остаться
головная или спинная боль, усиливающиеся при изменениях погоды.
Стоит отметить, что на фоне нейровирусной инфекций могут
активироваться и сопутствующие заболевания. Например, при миелите
практически всегда наступает паралич. Самыми серьезными считаются
последствия нейроинфекции головного мозга, перенесенной во
внутриутробном периоде. Они влекут за собой аномалии развития
ребенка, различные пороки внутренних органов и систем.
Запомните, что нейроинфекционные процессы, поражающие нервную
систему, несут серьёзную угрозу для жизни человека, поэтому
крайне важно своевременно обращаться к доктору при наличии
симптомов болезни, а также проводить профилактику своего
здоровья.
Источники:
Инфекции центральной нервной системы — cmd-online.ru
Острые нейроинфекции и их последствия — kb9yar.ru
Нейроинфекция — dobrobut.com
Нейроинфекция. Неврология — omegamc.ua
Источник изображения в тексте и на главной странице —
Неврологическая клиника доктора
Яценко
Влияние новой коронавирусной инфекции на центральную нервную систему
Пандемия новой коронавирусной инфекции бросила вызовы врачам всех специальностей. Неврологи и психиатры тоже не остались в стороне. Несмотря на то, что коронавирус приводит к преимущественному поражению лёгких, у заметного числа пациентов возникают поражения нервной системы. К ним относятся нарушения обоняния (68%) и изменения вкусовой чувствительности (71%). Более редкими симптомами будут головная боль (8%), тошнота и рвота (1%). Также у пациентов с SARS-CoV-2 описано развитие инсультов, атаксия, нейропатическая боль и судорожные припадки. Чем тяжелее состояние пациента относительно дыхательной системы, тем чаще у него возникают и тяжелее протекают неврологические симптомы коронавирусной инфекции.
Важно понять, является ли вирус SARS-CoV-2 тропным к нервной ткани человека или описанные выше симптомы и состояния вызваны общим иммунным ответом организма. Ранее определённые коронавирусы, на которые похож SARS-CoV-2, были признаны нейротропными и обладали способностью проникать через гематоэнцефалический барьер. Учитывая родство нового коронавируса с ними и принимая во внимание некоторые исследования на моделях, мы можем сказать, что новый коронавирус, вероятнее всего, обладает нейротропностью и способен проникать в нервную систему человека. Фермент ACE2, который является мишенью для SARS-CoV-2, обнаруживается и в нервной ткани человека, что объясняет возможность нового коронавируса поражать нейроны и глию, ткань, обеспечивающую «поддержку» работы нейронов.
В качестве ещё одного варианта проникновения вируса в центральную нервную систему называют транссинаптическую передачу. При ней вирус пробирается в мозг по нервным стволам обонятельного нерва. Данная версия подтверждена на трансгенных мышах, имеющих человеческий белок ACE2. При инфицировании мышей SARS-CoV, родственником нового коронавируса, вирус последовательно обнаруживался в обонятельной луковице, таламусе и стволе головного мозга. В последующем это давало для него возможность распространяться по другим отделам мозга, вызывая там воспаление. Ещё одним нервом, который может доставить коронавирус прямо в мозг, может быть блуждающий нерв. По нему коронавирус способен добраться из лёгких и пищеварительного тракта.
Другим фактором, поражающим нервную систему при новой коронавирусной инфекции, стал цитокиновый шторм. Воспалительная реакция на присутствие вируса в организме наносит ему не меньший вред, чем сам вирус. Избыток интерлейкина-6, интерлейкина-10 и фактора некроза опухоли-альфа указываются исследователями как основные участники этого процесса. Одним из опасных проявлений иммунного поражения центральной нервной системы при инфекции SARS-CoV-2 будет острый некротизирующий геморрагический энцефалит. Кроме этого при новой коронавирусной инфекции меняется и свёртываемость крови, что также может влиять на проницаемость гематоэнцефалического барьера и иммунную реакцию на уровне организма и на уровне отдельных органов.
В настоящее время происходит сбор данных о новой коронавирусной инфекции. Об отложенных последствиях пока рано говорить, но уже сейчас мы видим пациентов, которые перенесли инфекцию SARS-CoV-2 и предъявляют жалобы на повышенную утомляемость, снижение умственной работоспособности, одышку, головные боли и боли в теле. Вполне вероятно, что мы имеем дело с последствиями перенесённой инфекции, которая поразила не только лёгкие, но и центральную нервную систему людей.
Виктор Лебедев, врач-психиатр, руководитель проекта «Дело Пинеля»
Источник: Jarrahi, A., Ahluwalia, M., Khodadadi, H. et al. Neurological consequences of COVID-19: what have we learned and where do we go from here?. J Neuroinflammation 17, 286 (2020). https://doi.org/10.1186/s12974-020-01957-4
Полиомиелит
Полиомиелит (или детский спинномозговой паралич) – острое инфекционное заболевание, вызываемое вирусом полиомиелита (poliovirus hominis), который поражает преимущественно центральную нервную систему (серое вещество спинного мозга). Полиовирус относится к виду кишечных вирусов и существует в виде 3 независимых типов. Вирус не разрушается в кислой среде желудка, довольно устойчив во внешней среде, однако, при кипячении и применении хлорсодержащих дезинфицирующих средств быстро погибает. Важно отметить, что вирус полиомиелита нечувствителен к антибиотикам!
Источником инфекции всегда является человек, особенно опасны больные легкими или стертыми формами заболевания. Несмотря на то, что естественная восприимчивость людей высокая, наиболее восприимчивы дети в возрасте до 7 лет. Клинически выраженная инфекция встречается гораздо реже носительства: на один явный случай приходится от 100 до 1000 случаев бессимптомного носительства. Наибольшее выделение вируса происходит в течение первой недели болезни.
Во внешнюю среду вирус полиомиелита попадает вместе с испражнениями больных, он содержится также в слизи носоглотки. Механизм передачи – фекально-оральный, возможна также передача воздушно-капельным путем. Вирус может передаваться с пищей, водой, при бытовом контакте.
Полиомиелит характеризуется разнообразием клинических форм и обычно проявляется развитием потери движения в конечностях вплоть до полного паралича. Первыми симптомами болезни являются лихорадка, усталость, головная боль, рвота и боли в конечностях.
Вирус проникает в организм через слизистую оболочку носоглотки или кишечника. Инкубационный период колеблется от 4 до 30 дней (обычно от 6 до 21 дня). В это время вирус активно размножается в лимфоидной ткани, затем проникает в кровь и достигает нервных клеток. Нервные клетки подвергаются дистрофическим изменениям, распадаются и гибнут.
Выделяют абортивную форму, протекающую без клинических признаков поражения нервной системы («малая болезнь»), и формы полиомиелита, протекающие с поражением центральной нервной системы, которые подразделяют на непаралитическую и паралитическую. Паралитическая форма может протекать с поражением разных отделов нервной системы (спинальная, понтинная, бульбарная). Выделяют также сочетанную форму, когда поражаются сразу несколько отделов мозга.
Абортивная форма болезни начинается остро. Кратковременно повышается температура тела, возникает умеренная интоксикация, головная боль, легкие катаральные явления, боли в животе, жидкий стул. Обычно абортивная форма протекает доброкачественно и завершается выздоровлением.
При непаралитической форме начало так же острое. Температура поднимается до 39—40 °С. Уже в первый день появляется интенсивная головная боль, затем рвота. Могут возникнуть боли в спине, шее, конечностях. Менингеальные симптомы выражены умеренно, могут отсутствовать.
Наиболее неблагоприятной считается паралитическая форма, в которой выделяют 4 периода:
1. Препаралитический — Начинается остро и длится 3—6 дней. Характеризуется лихорадкой, общей интоксикацией, катаральными явлениями (кашель, насморк, боли в горле), диспепсическими расстройствами (боли в животе, жидкий стул) и симптомами поражения центральной нервной системы. Больные вялы, сонливы, дети капризны. Характерна потливость.
2. Паралитический период. Параличи могут возникнуть на 2-6 день болезни, обычно после нормализации температуры.
3. Восстановительный период длиться до 2 недель от момента возникновения параличей.
4. Резидуальный период характеризуется атрофией пораженных мышц, развитием контрактур суставов, остеопорозом, деформацией костей, у детей — отставанием пораженных конечностей в росте, при поражении мышц спины — искривлением позвоночника.
Гибель четверти нервных клеток в утолщениях спинного мозга ведет к парезу конечностей – человек чувствует, что ему не хватает сил двигать руками или ногами. При дальнейшей гибели нервных клеток возникает паралич – полная неспособность двигать конечностями. Чаще всего парализует ноги. Иногда наступает паралич мышц туловища и шеи. Наиболее тяжелыми поражениями являются паралич дыхательных мышц и повреждение продолговатого мозга, которые приводят к тяжелым расстройствам дыхания и кровообращения. Чаще больные погибают от нарушения дыхания.
Из-за устойчивости вируса к антимикробным препаратам полиомиелит не лечится – применяется только поддерживающая терапия. Восстановительный период после болезни может продолжаться от нескольких месяцев до 3 лет. Постинфекционный иммунитет — типоспецифический, пожизненный только к тому типу вируса, который вызвал заболевание, поэтому лица, перенесшие заболевание не освобождаются от профилактических прививок.
Остаточные явления, которые возникают у одного человека из 100 заболевших, характеризуются инвалидизацией — стойкими вялыми параличами, атрофией мышц, деформациями конечностей, туловища. Полиомиелит опасен и другими осложнениями: развитием пневмонии, ателектаза легких; иногда развиваются тяжелые желудочно-кишечные расстройства с кровотечением и язвами.
Учитывая отсутствие прямого этиологического лечения и тяжесть последствий, единственным эффективным методом борьбы с полиомиелитом остается вакцинация. После повсеместного распространения вакцинопрофилактики, полиомиелит был почти полностью побежден. В 1988 году правительства создали Глобальную инициативу по ликвидации полиомиелита (ГИЛП), чтобы навсегда избавить человечество от этой болезни. По оценкам ВОЗ, с 1988 по 2014 год число случаев заболевания полиомиелитом уменьшилось, с 350 000 до 359 случаев заболевания в год. А в 2015 году во всем мире было зарегистрировано всего 73 случая. В настоящий момент неблагоприятными регионами по риску заразиться диким полиовирусом остаются только Афганистан и Пакистан.
Помимо вакцинации важными средствами профилактики остаются:
Соблюдение правил личной и общественной гигиены;
Употребление в пищу только доброкачественных продуктов и воды.
Однако, до тех пор, пока в мире остается хоть один инфицированный человек, риску заражения диким штаммом полиомиелита подвергаются дети во всех странах.
Помните, отказ от вакцинации подвергает серьезному риску здоровье вашего ребенка!
Материал подготовлен на основе информации
из открытых источников.
Подробнее о вакцинопрофилактике полиомиелита читайте далее:
Профилактика полиомиелита
Поражение ЦНС при моно- и микст-инфекции герпеса человека 6-го типа | #11/16
Герпесвирусные инфекции (ГВИ) являются важной медико-социальной проблемой современного здравоохранения. По данным ВОЗ до 90% населения Земли инфицированы вирусами семейства герпеса, среди которых известно 8 антигенных серотипов: вирусы простого герпеса 1-го и 2-го типа (ВПГ 1-го типа и ВПГ 2-го типа), ветряной оспы — опоясывающего герпеса, цитомегаловирус (ЦМВ), вирус Эпштейна–Барр (ЭБВ), вирусы герпеса человека 6-го, 7-го и 8-го типов (ВГЧ 6-го типа, ВГЧ 7-го типа и ВГЧ 8-го типа) [1].
Первичная инфекция, вызванная вирусом герпеса человека 6-го типа, встречается у детей первых 3 лет жизни, более 90% всех случаев приходится на возраст до 2 лет. Пик заболеваемости ВГЧ 6-го типа регистрируется в возрасте от 7 до 13 мес, а ВГЧ 7-го типа — между первым и вторым годами жизни. Около 95% взрослых имеют антитела к ВГЧ 6-го типа [2].
Способность герпесвирусов к персистенции и латенции в инфицированном организме, высокая мутабельность позволяют им избегать иммунного надзора и вызывать хроническую и латентную инфекцию у человека. Серологические исследования ВГЧ 6-го типа показали широкую распространенность случаев инфекции ВГЧ 6-го типа, она обнаруживается во всех странах, где проводились исследования.
Высокий титр IgG у детей при рождении за счет материнских антител снижается к 3–4 мес жизни и достигает 70% к 15 мес жизни. ДНК вируса выявляется у 10% детей до 1 мес жизни, что отражает перинатальную передачу ее от матери ребенку. Для ВГЧ 6-го типа, как и для других герпесвирусов, характерна способность к персистенции и латенции в организме инфицированного человека [3].
ВГЧ 6-го типа был впервые выделен и идентифицирован в 1986 г. у больных с лимфопролиферативными заболеваниями, был назван В-лимфотропным вирусом и первоначально получил название человеческого В-лимфотропного герпесвируса (HBLV — human B-lymphotropic virus) [4].
В последующем было установлено, что существует два вида ВГЧ 6-го типа — ВГЧ 6А и ВГЧ 6В, отличающихся по биологическим, молекулярным и генетическим характеристикам, эпидемиологии и клиническим проявлениям.
Вирион ВГЧ 6-го типа, как и у других герпесвирусов, представляет собой довольно крупную частицу (150–200 нм в диаметре) и состоит из нуклеокапсида и наружной оболочки (суперкапсида). Нуклеокапсид (или сердцевина) организован по типу кубической симметрии и состоит из 162 капсомеров. Суперкапсид пронизывают гликопротеиновые шипы, образованные белками ядерной мембраны, обеспечивающие прикрепление и проникновение вирусов в клетку хозяина. Между нуклеокапсидом и суперкапсидом расположен покровный слой-тегумент, содержащий белки, необходимые для начала воспроизводства новых вирусов. Геном ВГЧ 6-го типа был полностью расшифрован в 1995–1996 гг. Он состоит из 102 генов. Белки, кодируемые геномом ВГЧ 6-го типа, на 65% гомологичны цитомегаловирусным и на 21% — остальным герпесвирусам [5].
Заражение начинается с прикрепления комплекса гликопротеинов ВГЧ 6-го типа к клеточному гликопротеиновому рецептору CD46, экспрессируемому на мембране практически всех клеток человека. ВГЧ 6А эффективно инфицирует клетку, взаимодействуя с рецептором CD46, а ВГЧ 6В, прикрепляясь к клетке, использует не только рецептор CD46, но и дополнительные корецепторы [6].
ВГЧ 6-го типа способен инфицировать эпителиоциты, эндотелиоциты, гепатоциты, эмбриональные астроциты, олигодендроциты, предшественники глиальных клеток, микроглии, фибробласты, стволовые клетки (CD34+), дендритные клетки, мононуклеарные клетки крови, но наиболее эффективно ВГЧ 6-го типа реплицируется (in vitro) в CD4+ T-лимфоцитах, проявляя цитопатическое действие. Вирус проявляет тропизм к широкому спектру клеток хозяина: его обнаруживают в лимфатических узлах, клетках почек, в слюнных железах, мозге [7].
После взаимодействия ВГЧ 6-го типа c CD46 происходит слияние оболочки вируса с плазматической или эндосомальной мембраной. Тегумент и нуклеокапсидные протеины направляют вирусный капсид к ядру клетки. Лишенный оболочки капсид транспортируется при участии цитоскелета клетки через цитоплазму к порам ядерной мембраны, через которые ДНК ВГЧ 6-го типа попадает в ядро клетки и замыкается в кольцо, а капсидная оболочка остается в цитоплазме возле ядерных пор [3, 8].
В ядре клетки макроорганизма происходят транскрипция, репликация вирусной ДНК и сборка капсидов. Отличительной особенностью ВГЧ 6-го типа, как и других герпесвирусов, является большое число кодируемых ими ферментов, вовлеченных в синтез молекулы ДНК. Все вирусные белки синтезируются в цитоплазме, а транскрипция ДНК ВГЧ 6-го типа происходит в ядре.
В последующей сборке вириона различают несколько этапов: 1) сборку пустых В-капсидов, представляющих собой белковый каркас будущего нуклеокапсида и накапливающихся в ядре клетки; 2) упаковывание вирусной ДНК в сформировавшиеся пустые капсиды; 3) приобретение нуклеокапсидом тегументного слоя.
Процесс одевания капсида в оболочку протекает очень быстро. Вирионы накапливаются в эндоплазматическом ретикулуме и покидают клетку путем экзоцитоза. Общее время от инфицирования до появления новых вирионов ВГЧ 6-го типа составляет около 72 часов [9]. Ростовой цикл вируса длится 4–5 дней.
После первичного заражения ребенка ВГЧ 6-го типа типа возможны несколько вариантов развития болезни: от классической Roseola infantum (внезапной экзантемы) до возникновения недифференцируемых заболеваний, сопровождающихся лихорадочным состоянием без видимого очага инфекции, судорожным синдромом и сыпью. По данным ряда авторов от 13% до 33% первых эпизодов фебрильных судорог приходится на манифестацию первичной инфекции ВГЧ 6-го типа. Триггером почти трети всех судорожных приступов, регистрируемых у детей в возрасте до 2 лет, является ВГЧ 6-го типа, что свидетельствует об активном размножении вируса в центральной нервной системе (ЦНС) [10].
Было показано, что ВГЧ 6-го типа обладает тропизмом к линиям глиобластомы и нейробластомы так же, как и к эмбриональной глии, хотя эти клетки поддерживают рост вируса менее эффективно, чем лимфоциты. Это и является объяснением тому, что вирус способен инфицировать ЦНС и вызывать энцефалиты и менингиты во время экзантемы субитум или других серологически подтвержденных острых заболеваний у детей, вызванных ВГЧ 6-го типа. Доказано, что ВГЧ 6-го типа может инвазировать клетки ЦНС во время первичной инфекции, которые в последующем могут служить сайтом латенции для ВГЧ 6-го типа. Активная инфекция ВГЧ 6-го типа вызывает изменения продукции цитокинов [11–13].
В момент острой инфекции возбудитель может быть выделен из крови. После заражения инфекция ВГЧ 6-го типа приобретает латентное течение. Место латентного содержания вируса не изучено, но полагают, что вирус остается латентным некоторое время в моноцитах и макрофагах. Вирус инфицирует слюнные железы и выделяется из них. Обнаружение вируса в крови характерно лишь в периоде фебрильной стадии внезапной экзантемы и при реактивации и генерализации инфекции в условиях иммуносупрессии [14, 15].
Клетки, инфицированные вирусом ВГЧ 6-го типа, могут малигнизироваться и вызывать рост опухоли. Американская ассоциация по исследованию рака в 2010 г. опубликовала сведения о том, что ВГЧ 6-го типа запускает этот процесс с помощью DR7 онкопротеина [16].
С высокой частотой ДНК ВГЧ 6-го типа обнаруживалась в биоптатах из глиом, а также высокие уровни интерлейкина-6 (ИЛ-6), интерлейкина-8 (ИЛ-8), фактора некроза опухоли α и трансформирующего фактора роста β (ТФР-β) в экссудате кистозных образований глиом. Японские ученые утверждают, что данные этих исследований убедительно свидетельствуют об участии инфекции ВГЧ 6-го типа в патогенезе глиомы.
В редких случаях геном ВГЧ 6-го типа может интегрироваться в хромосомы человека, при этом развивается особая форма инфекции, характеризующаяся необычно высокой вирусной нагрузкой в крови.
Проведенные в Японии исследования показали, что распространенность таких форм инфекции ВГЧ 6-го типа составляет 0,2% случаев среди зараженных пациентов, в Великобритании этот показатель достиг соответственно 0,8% и 1,5%. У детей, госпитализированных с судорожным синдромом или энцефалитом, чаще выявлялась инфекция ВГЧ 6-го типа, интегрированная в геном человека, показатель которой достигал 3,3%.
При инфекции ВГЧ 6-го типа патология ЦНС сопровождается нарушением памяти, усталостью и трудностями в познавательной деятельности, судорогами и острым лимбическим энцефалитом [17].
Судороги являются типичным клиническим проявлением этой инфекции, при этом МРТ головного мозга в таких случаях демонстрирует вовлечение медианных отделов височных долей головного мозга. Появились доказательства того, что ВГЧ 6A играет роль в развитии рассеянного склероза (РС), нередко выступая в качестве активатора других вирусов — EBV или эндогенных ретровирусов (HERV-W). В настоящее время большое внимание в развитии РС придается роли ВГЧ 6-го типа, наряду с ЭБВ, Chlamydophilla pneumoniae и человеческих эндогенных ретровирусов (HERVs) [18, 19].
Показано, что определенные структуры, кодирующиеся геномом ВГЧ 6-го типа, идентичны антигенам основного белка миелина. Важно, что и количество T-клеток, и титр антител к этим аминокислотным последовательностям были существенно выше у пациентов с РС. Кроме того, инфицированные в пробирке глиальные клетки продемонстрировали способность ослаблять клеточный иммунный ответ и увеличивали число олигодендроцитных маркеров, что свидетельствует о возможности инфекции ВГЧ 6-го типа влиять на механизмы восстановления нервной ткани [17, 20].
Существуют многочисленные данные о менингитах, энцефалитах, энцефаломиелитах, ассоциированных с герпетической инфекцией 6-го типа [21, 22].
Группа ученых Национального института неврологических нарушений в Бетесде, США (Viral Immunology Section, National Institute of Neurological Disorders and Stroke, NINDS, Bethesda) предприняли попытку выяснить, как вирус герпеса 6-го типа может проникнуть в мозговую ткань. Авторы, проанализировав образцы со слизистой оболочки носа, обнаружили в ней ВГЧ 6-го типа в 50% случаев. В дальнейших экспериментах авторы установили, что глиальные клетки, сопровождающие обонятельный тракт от носовых рецепторов до мозга, чувствительны к этому вирусу и могут служить ему проводниками в проникновении в нейроглиальные клетки: олигодендроциты, микроглию и астроциты — фагоцитирующие макрофагальные клетки ЦНС [23].
Известно, что глиальные клетки выполняют опорную, разграничительную, трофическую функции, участвуют в росте нервной ткани, поддерживают гомеостаз за счет обратного захвата медиаторов и ионов калия, извлечения глутамата и ионов калия из синаптической щели после передачи сигнала между нейронами; гематоэнцефалический барьер; участвуют в генерации кальциевых сигналов в ответ на нейрональную активность, контроль кровотока. Олигодендроциты и астроглия участвуют в миелинизации аксонов ЦНС, изоляции аксона и, как следствие, — миелинизации (возможности быстрого сальтаторного проведения нервных импульсов — по перехватам Ранвье, остающимся между изолированными участками, а также в трофической функции) [24].
Американскими учеными продемонстрировано, каким образом вирус герпеса 6-го типа распространяется по нервной системе и нарушает передачу нервных импульсов (рис. 1).
Митохондрии, являясь внутриклеточными органеллами клеток нейроглии, отвечают за снабжение их энергией, взаимодействие с другими клетками (контакты между аксонами отдельных нейронов) и саморазрушение инфицированной клетки. Их активность и направление движения определяются, в частности, концентрацией кальция во внутриклеточном матриксе. В норме максимум содержания кальция в аксоне наблюдается в момент получения сигнала от другого нейрона. Митохондриальный белок Miro позволяет митохондриям зафиксировать этот момент и переместиться на участок синапса, где наблюдается выброс кальция. Там белок Miro останавливает митохондрии, и они обеспечивают энергией процесс передачи нервного импульса.
При попадании вируса герпеса 6-го типа внутрь нервной клетки возрастает уровень внутриклеточного кальция. Белок Miro останавливает митохондрии, тем самым блокируя передачу нервных импульсов. При этом передвижение митохондрий осуществляется вдоль микротрубочек, пронизывающих матрикс клетки, при помощи моторных белков динеина и кинезина-1. Поскольку при повышенной концентрации кальция митохондрии лишены способности двигаться, кинезин-1 оказывается свободным, при этом вирус герпеса 6-го типа использует его для собственного перемещения внутри нервной клетки.
Этими механизмами достаточно четко объясняется блок потребления кальция и водно-электролитных нарушений в синаптической ткани, следствием чего является судорожный синдром при инфицировании ВГЧ 6-го типа [25].
Врожденные дисплазии и мальформации мозга, гипертермия, подострый энцефалит, метаболические дисфункции и другие причины (разрушающие промежуточные нейроны) способствуют появлению постоянной залповой активности, которая в конечном итоге и приводит к развитию прогрессирующих миоклоний. В развитии когниций у детей в первом десятилетии жизни важную роль играет именно активация функции гиппокампа и уменьшение гипервозбудимости незрелого неокортекса. Мезиальный склероз и атрофия гиппокампа становятся базовыми генераторами эпилептической активности в подавлении памяти [26].
Рассогласование механизма созревания в комбинации с транзиторными воспалительными процессами на фоне перманентной спайк-волновой активности, гипертермии, стресса, преморбидной предрасположенности приводит к развитию разрушительных форм эпилепсии у детей. Но наиболее актуальными сегодня в нейропедиатрии являются фебрильные судороги и фебрильно-провоцируемая эпилепсия [27–29].
При проведении исследований в Японии были обследованы пациенты с повторными (больше трех) приступами фебрильных судорог в анамнезе, у которых в 80% случаев был выявлен ВГЧ 6-го типа в спинномозговой жидкости по сравнению с 14% у больных с изолированным эпиприступом (Kondo, 1993). Недавние исследования, проведенные Nagasawa и соавт. (2006), показали, что ВГЧ 6-го типа может приводить к судорогам во время реактивации инфекции. Предложено называть это состояние «ВГЧ-6-энцефалопатия с судорожными пароксизмами во время реактивации».
Японские ученые впервые показали, что ВГЧ 6B может быть частой причиной височной эпилепсии. При проведении трех из шести резекций средних отделов височной доли ими были выявлены положительные результаты ДНК-диагностики на ВГЧ 6-го типа.
По данным Fotheringham (2007) у 16 пациентов с медианной височной эпилепсией (МВЭ) была выполнена лечебная резекция участков височных долей, из них у 11 определялись высокие уровни ДНК ВГЧ 6-го типа в ткани мозга, в то время как у 7 пациентов группы контроля ДНК этого вируса не было обнаружено. Было установлено, что у 11 из 16 больных имела место нейроинфекция ВГЧ 6B, причем у пациентов контрольной группы положительные результаты диагностики ВГЧ 6-го типа не были получены ни в одном случае. Кроме того, исследователи показали, что вирус концентрируется в височной доле и смежных областях, но не в лобных или затылочных долях [30].
Гиппокамп является частью лимбической системы головного мозга (обонятельного мозга), который участвует в механизмах формирования эмоций, консолидации памяти. Две трети пациентов с медианной височной эпилепсией фактически страдают хронической нейроинфекцией этиологии ВГЧ 6-го типа.
ВГЧ 6-го типа вызывает дисфункцию астроглии, что оказывает проэпилептогенное влияние на чувствительные нейроны в гиппокампе, с последующим развитием эпилепсии.
Интерес к вопросу ассоциации ВГЧ 6B и МВЭ существенно возрос после публикации результатов исследований, проведенных учеными из NINDS с 2003 г., которые диагностировали высокие уровни ДНК ВГЧ 6B в ткани мозга у пациентов с диагнозом МВЭ. Была исследована мозговая ткань пациентов, у которых провели удаление секции мозга в качестве терапии рефрактерной эпилепсии. Явным аспектом патогенеза судорог при герпесвирусной инфекции явилось повреждение ткани гиппокампа. Авторами доказано, что ВГЧ 6-го типа обусловливает дефицит транспортера глутамата и угнетает обратный захват глутаминовой кислоты. Глутаматная транспортная дисфункция заканчивается поражением нейронов в гиппокампе, и это вызывает развитие МВЭ [31, 32].
При травме мозга или его заболеваниях нарушения связывают с повреждением транспортной системы глутамата, с последующим избыточным накоплением внутриклеточно кальция, ингибирующего функцию митохондрий, что может приводить даже к гибели клетки (феномену, получившему название эксайтотоксичности).
Механизмы клеточной смерти, помимо вышеизложенного, включают Glu/Ca2+ опосредованную промоцию факторов транскрипции проапоптотических генов или снижение транскрипции антиапоптотических генов [33].
У ВГЧ 6B и ВГЧ 6A имеются различия в тропизме к человеческим глиальным клеткам, что позволяет полагать о возможности последними вызывать различные формы заболевания. ВГЧ 6А, который чаще вызывает рассеянный склероз, обусловливает инфицирование астроцитов с цитопатическим эффектом и формированием высокой нагрузки вирусной ДНК, в то время как ВГЧ 6B не вызывает морфологических изменений при поражении астроцитов. При этом сохраняются низкие уровни внутриклеточной вирусной ДНК и отсутствует поддающаяся обнаружению ДНК патогена. Meeuwsen и соавт. определили, что воздействие ВГЧ 6В на астроциты приводит к изменению реакции инфицированных клеток на провоспалительные цитокины и другие иммуномодулирующие факторы в период воспаления, что может приводить к эпилептогенезу. Эти результаты дают возможность предположить, что ВГЧ 6B способен сохраняться на низком уровне активности в течение многих лет, что обусловливает дисрегуляцию деятельности астроцитов и усиление глутаматергической эксайтотоксичности, в то время как ВГЧ 6A больше связан с прямой деструкцией ключевых компонентов нервной системы [32].
При нейроинфекции ВГЧ 6-го типа излюбленная локализация поражения такая же, как и в случае HSV-1-энцефалита (преимущественно медиальные отделы височных долей, а также близлежащие структуры), что, по-видимому, определяется механизмом проникновения вируса в головной мозг (через обонятельные нервы), хотя описан лишь гематогенный механизм заражения ЦНС. Таким образом, речь идет о так называемом лимбическом энцефалите (limbic encephalitis), при котором страдает гиппокамп, медиальные отделы височных долей и близлежащие структуры мозга. В последнее время описаны случаи ромбэнцефалита (rhombencephalitis), вызванного ВГЧ 6-го типа, когда поражаются преимущественно ствол мозга и мозжечок и в меньшей степени — большие полушария головного мозга.
Клиника наиболее типичной формы — лимбического энцефалита — определяется функциональной принадлежностью лимбической системы мозга, которая отвечает за память, эмоциональную окраску получаемой информации, а также регуляцию вегетативных функций. Ядро клинической картины обычно составляют шесть симптомов: ажитация; бессонница; спутанность сознания; субфебрилитет; снижение памяти и внимания; обонятельные галлюцинации и судороги. Поначалу развивается температурная реакция, которая варьирует от субфебрилитета до фебрильных цифр, а у больных с тяжелым иммунодефицитом может отсутствовать вовсе. Общемозговая симптоматика часто слабо выражена, что несколько затрудняет диагностику. Нарушение сознания проявляется в виде оглушения и летаргии, реже — сопора и комы, однако в некоторых случаях четкие признаки угнетения сознания могут отсутствовать, а наоборот, преобладают признаки психомоторного возбуждения, бессонницы и ажитации, поэтому такие больные часто ошибочно попадают в психиатрические лечебницы. Остро или подостро развиваются когнитивные нарушения — снижение памяти и внимания, которые у пожилых людей (а это группа риска по энцефалиту, вызванному ВГЧ 6-го типа) [22, 26].
Диагноз острой герпетической инфекции, вызванной ВГЧ 6-го типа, основывается на совокупности клинических данных и комплекса лабораторных методов. Одним из самых распространенных иммунобиологических методов для обнаружения специфических антител является иммуноферментный анализ (ИФА). Его чувствительность 99%, специфичность 95%. Серодиагностика дает ретроспективную информацию о наличии вируса. Недостатками серологических тестов при диагностике оппортунистических инфекций являются: высокая частота носительства у здоровых, наличие антител класса IgG означает лишь ответ на инфекцию, но не свидетельствует об активности инфекционного процесса, отсутствие антител не означает отсутствия возбудителя (иммунодефицит вызывает снижение продукции антител), хроническая инфекция не всегда сопровождается выявлением антител IgM, не позволяют различить ВГЧ 6А и ВГЧ 6В. Если в качестве скринингового метода рекомендуется использовать метод полимеразной цепной реакции (ПЦР), ИФА и реакцию иммунофлюоресценции (РИФ), то в качестве подтверждающего — метод выявления антигенов герпесвируса в клетках крови на чувствительных клеточных культурах.
Таким образом, согласно современным представлениям в генезе развития судорог у детей на фоне вирусных инфекций важное значение имеет не только гипертермический синдром, но и повреждающее влияние инфекции ВГЧ 6-го типа, которая патогенетически может являться пусковым механизмом в возникновении повторных эпизодов судорог, с угрозой развития FIRES-синдрома с признаками разрушительной эпилептической энцефалопатии или формирования прогрессирующего энцефалита (ВГЧ 6-го типа) с выраженными резидуальными расстройствами и нередко опасностью летального исхода [26].
В настоящее время накапливается все больше данных о труднокурабельных формах эпилептической энцефалопатии, ассоциированных с вирусными инфекциями, в том числе и с инфекцией ВГЧ 6-го типа. При этом данные литературы свидетельствуют о течении клинически бессудорожных форм эпилептической энцефалопатии на фоне данной инфекции, которая не поддается противоэпилептической терапии и требует от педиатра и невролога своевременной этиологической герпесвирусной расшифровки и назначения специфической этиотропной терапии в комплексном лечении этой категории больных. Аналогичные подходы в диагностике и лечении необходимы при развитии лимбического энцефалита, в развитии которого важное значение отводится инфекции ВГЧ 6-го типа, о чем свидетельствуют и наши данные наблюдений.
Целью настоящего исследования было изучение этиологии, клинических проявлений и вариантов течения инфекционного заболевания, сопровождающегося поражением нервной системы, с акцентом на герпесвирусные инфекции, в частности, на инфекцию герпеса человека 6-го типа.
Материалы и методы исследования
Под нашим наблюдением в инфекционных и неврологических отделениях клинической базы (в Морозовской детской городской клинической больнице и ДКБ № 9 им. Г. Н. Сперанского) кафедры инфекционных болезней у детей РНИМУ им. Н. И. Пирогова находилось 96 детей (42 девочки и 54 мальчика) в возрасте от 6 месяцев до 16 лет.
В клинической характеристике наблюдавшихся 96 детей регистрировался следующий спектр неврологической патологии: судорожный синдром у 41, из них повторные эпизоды регистрировались у 25 детей; эпилепсия у 22 детей; энцефалит — у 24 и нейропатия — у 9 детей.
Критериями включения в исследование являлись:
- больные с судорожным синдромом, возникшим однократно;
- больные с судорожным синдромом, возникшим повторно;
- дети с эпилепсией;
- с энцефалитом;
- с нейропатией.
Критериями исключения являлись: больные с органическими поражениями ЦНС, генетическими и митохондриальными мутациями (кортикальная мозжечковая атрофия, синдром Драве, энцефалит Расмуссена, гиповитаминоз пиридоксина, подострый склерозирующий панэнцефалит).
Диагнозы устанавливались на основании клинико-анамнестических данных и лабораторных методов исследования.
Клинические анализы крови, мочи, биохимические исследования, ИФА для определения специфических антител, непрямая реакция иммунофлюоресценции (НРИФ) с целью идентификации антигенов герпесвирусов 1-го, 2-го, 4-го, 5-го и 6-го типов в клетках крови, ПЦР в реальном времени на ДНК вирусов семейства герпесов. По показаниям проводились люмбальная пункция, видеомониторинг ЭЭГ, НСГ, КТ, МРТ, определение уровня нейроспецифической енолазы, сывороточных антител против основного белка миелина и антител к NMDA-рецепторам.
Результаты и их обсуждение
Спектр вариантов течения инфекции ВГЧ 6-го типа представлен в табл.
Из них острая форма инфекции ВГЧ 6-го типа зарегистрирована у 84 (87%) детей: у 32 (33%) — в моноварианте, а у 52 (54%) пациентов в микст-варианте. Остальные 12 (13%) детей имели активно текущую персистирующую инфекцию ВГЧ 6-го типа, из них 3 — в сочетании с другими герпесвирусами (табл., рис. 2).
Критериями постановки диагноза острой инфекции являлись: обнаружение антител IgM, ДНК и антигенов вируса в клетках крови.
У 41 (43%) ребенка — 19 девочек и 22 мальчиков (в возрасте от 7 мес до 5 лет), поступавших в стационар, диагностировали судорожный синдром на фоне ОРВИ, у которых зарегистрирована моноинфекция ВГЧ 6-го типа у 19 (20%), а у остальных 22 (23%) детей микст-инфекция в виде различных сочетаний герпесвирусов: у 9 детей инфекция ВГЧ 6-го типа сочеталась с ЭБВ, у 7 — с ЦМВ-инфекцией, у 4 — с ВПГ и у 2 — с ЦМВ + ЭБВ + ВПГ (рис. 3).
В эту подгруппу вошли дети с фебрильными судорогами, возникшими впервые или имевшимися в анамнезе, а также у одного ребенка диагностировали FIERS-синдром на фоне активно персистирующей инфекции ВГЧ 6-го типа в сочетании с персистирующей ВПГ-инфекцией.
В своей практической работе мы руководствовались классификацией S. Livingston, приведенной в работе The diagnosis and treatment of convulsive disorders in children [34]. Автор впервые предложил термин «простые фебрильные судороги», к которым относил те припадки, которые возникают у детей до 6 лет жизни, носят генерализованный характер, кратковременные (до 5 мин), не повторяются в течение лихорадочного периода и не сопровождаются изменениями на ЭЭГ. К сложным фебрильным судорогам S. Livingston относил припадки, которые имеют большую продолжительность, чем простые фебрильные (по современным воззрениям больше 15–20 мин и выше), или повторяются в течение первых суток лихорадочного периода, могут иметь парциальный характер, при которых выявляются изменения на ЭЭГ, и часто возникают на патологически измененном преморбидном неврологическом фоне.
В нашем исследовании судороги отмечались у детей преимущественно в возрасте от 1 года до 3 лет. У 16 детей имел место только один эпизод судорог на фоне острой респираторной вирусной инфекции (ОРВИ), а у 25 — возникли повторные судороги, которые регистрировались на фоне лихорадочного состояния.
Повторные судороги отмечались у 25 (26%) пациентов: из которых моноинфекция ВГЧ 6-го типа была зарегистрирована у 13 (13,5%) детей, у 12 (12,5%) в сочетании с другими герпесвирусами (табл., рис. 4). Острая инфекция ВГЧ 6-го типа выявлена у 23 (24%) пациентов, из них у 13 (13,6%) детей в виде моноинфекции, у 10 (10,4%) и у 2 (2%) — персистирующая микст-ГВИ.
В спектре микст-инфекции ВГЧ 6-го типа у детей с повторными судорогами регистрировались следующие варианты сочетаний герпесвирусов: ВГЧ 6-го типа + ЦМВ + ЭБВ + ВПГ — 1 ребенок; ВГЧ 6-го типа + ЭБВ — 4 детей; ВГЧ 6-го типа + ЦМВ — 2 детей и ВГЧ 6-го типа + ВПГ — 5 детей.
Формирование эпилепсии отмечено у 22 (23%) детей, дебют которой приходился на возраст до 1 года жизни. В маркерном спектре у этих больных чаще имела место смешанная герпесвирусная инфекция и только у одного ребенка моноинфекция ВГЧ 6-го типа (рис. 5).
Острая инфекции ВГЧ 6-го типа регистрировалась у 20 (21%) детей, из них у 4 (4%) — в виде моноинфекции и у 16 (17%) в варианте острой микст-инфекции; хроническая персистирующая микст-инфекция ВГЧ 6-го типа выявлена только у 2 (2%) детей.
Приступы судорог или другие пароксизмальные проявления, развивающиеся во время текущего инфекционного заболевания, свидетельствуют об истинной эпилепсии, поэтому важное значение имеют данные анамнеза, лабораторных и параклинических исследований.
В наших наблюдениях эпизоды судорог в большинстве случаев являлись первыми клиническими симптомами заболевания, их возникновение в остром периоде герпетического энцефалита у детей, особенно в возрасте до 4 лет, явилось в определенной степени патогномоничным симптомом, что должно быть учтено при дифференциальной диагностике энцефалита от других заболеваний.
При острых вирусных энцефалитах характерен полиморфизм ЭЭГ-проявлений, не являющихся нозологически специфическими, но отражающих тяжесть и локальность повреждения мозга. При доброкачественном течении энцефалитов происходит нормализация биоэлектрической активности мозга, а при неблагоприятном течении — ЭЭГ-изменения приобретали эпилептиформный характер с наличием продолженного регионального замедления и очагов спайк-волновой активности.
Значительный риск формирования симптоматической эпилепсии в раннем периоде реконвалесценции после первичных энцефалитов требует клинико-электрофизиологического наблюдения пациентов, а при выявлении эпилептизации головного мозга по данным ЭЭГ без возникновения приступов необходим постоянный контроль с назначением противоэпилептической терапии в соответствии с формой эпилепсии.
В спектре микст-вариантов течения инфекции ВГЧ 6-го типа при эпилепсии выявлялись такие сочетания, как: ВГЧ 6-го типа + ВПГ — 6 детей, ВГЧ 6-го типа + ЦМВ — 3 детей, ВГЧ 6-го типа + ЭБВ — 8 детей и ВГЧ 6-го типа + ЦМВ + ВПГ — 2 детей.
Топика поражения ЦНС у детей с судорожным синдромом на фоне инфекции ВГЧ 6-го типа представлена на рис. 6
В данную группу вошли дети с локализационно-обусловленными, генерализованными формами эпилепсии, а также со специфическими синдромами:
- очаговая эпилепсия у детей с изменениями теменных и височных долей на МРТ, возникшая после перенесенной внезапной экзантемы;
- криптогенная фокальная эпилепсия у детей с фебрильными судорогами после перенесенного энцефалита неустановленной этиологии в анамнезе;
- криптогенная эпилепсия с трансформацией височно-теменных долей у детей с внутриутробным инфицированием, подтвержденным лабораторно при обследовании матерей;
- генерализованная эпилепсия после перенесенной вирусной инфекции, на фоне которой у части пациентов впервые возникал судорожный синдром, перешедший в статусное течение приступов без эпиактивности.
Можно заключить, что на фоне инфекции ВГЧ 6-го типа наиболее часто выявляется криптогенная эпилепсия. Диагноз выставлялся с учетом характера судорог, характерных изменений на ЭЭГ, результатов нейровизуализации, а также отсутствия клиники и лабораторных данных, характерных для нейроинфекции.
Острый энцефалит — диагностировали у 24 (25%) детей, из которых острая инфекция ВГЧ 6-го типа была у 22 (23%) детей; у 7 (7%) в виде моноинфекции ВГЧ 6-го типа и у 15 (16%) — в виде микст-варианта; у 2 (2%) детей энцефалит развился на фоне персистирующей микст-инфекции ВГЧ 6-го типа (рис. 7).
В спектре микст-инфекции ВГЧ 6-го типа у больных с острым энцефалитом определялись следующие сочетания вирусов герпеса: ВГЧ 6-го типа + ВПГ — у 3 детей; ВГЧ 6-го типа + ЭБВ + ЦМВ — у 6 детей; ВГЧ 6-го типа + ВПГ + ЦМВ — у 3 детей и ВГЧ 6-го типа + ЭБВ — у 5 детей.
Нейропатия на фоне инфекции ВГЧ 6-го типа отмечена у 9 (9,4%) детей: у 6 (6,2%) имело место поражение зрительного нерва в виде диплопии, косоглазия, снижения остроты зрения и у 3 детей (3,2%) диагностировали парез нижних конечностей. Острая моноинфекция ВГЧ 6-го типа регистрировалась у 2 (2,1%) детей с поражением зрительного нерва, у 5 (5,2%) — острая микст-инфекция ВГЧ 6-го типа и у остальных 2 (2,1%) имела место хроническая персистирующая моноинфекция ВГЧ 6-го типа в стадии реактивации.
Пациентам, у которых выявлялась герпетическая инфекция, назначалась противовирусная и интерферонотерапия, на фоне которой достигалось купирование острой инфекции ВГЧ 6-го типа или снижение активной персистенции ВГЧ 6-го типа наряду с другими герпесвирусами.
Выводы
Полученные данные свидетельствуют о том, что герпесвирусные инфекции выявляются у 87% детей с неврологической патологией, что указывает на достаточно большую вероятность того, что эти инфекционные агенты, особенно ВГЧ 6-го типа, играют роль в генезе развития фебрильных судорог, эпилепсии и нейропатии.
У детей первого года жизни существует вероятность ложноположительных результатов, что связано с выявлением материнских IgG герпесвирусных инфекций в крови. При обследовании матерей можно исключить диагноз первичного или внутриутробного инфицирования. Выявление у больного ДНК вируса, IgM и антигенов вируса в мононуклеарах исключает ложноположительный результат и свидетельствует о течении острой инфекции.
Существует вероятность получения ложноотрицательного результата у детей раннего возраста, при обследовании которых отсутствовали маркеры инфекции ВГЧ 6-го типа, в то же время у их матерей в крови обнаруживались высокие диагностические титры IgM ВГЧ 6-го типа, что не исключало латентное течение данной инфекции у этих детей.
Таким образом, комплексное обследование пары мать–ребенок полным спектром анализов (ИФА, НРИФ, ПЦР) на выявление маркеров вирусов семейства герпесов важно для постановки верного диагноза.
Диагноз хронической инфекции нелегко доказать при помощи стандартных лабораторных исследований, поэтому пациенты должны быть обследованы полным спектром анализов: ИФА для определения специфических антител, НРИФ с целью идентификации антигенов герпесвирусов 1-го, 2-го, 4-го, 5-го и 6-го типов в клетках крови, ПЦР в реальном времени на ДНК вирусов семейства герпесов. В возрастной группе до 7 лет имеет смысл обследование матери тем же набором исследований для исключения риска внутриутробного инфицирования, ложноположительного результата у детей первого года жизни, имеющих титры IgG, а также для исключения течения латентной инфекции у детей с низким антительным ответом.
Острая инфекция ВГЧ 6-го типа в моноварианте регистрируется у 34% пациентов с вирусными энцефалитами и у детей с атипичными или повторными эпизодами судорог.
Инфекция ВГЧ 6-го типа может сохраняться в мозговой ткани даже после того, как специфические антитела, выработанные во время первичной инфекции, уже не выявляются в плазме крови.
Острая микст-инфекция ВГЧ 6-го типа чаще регистрируется при формировании эпилепсии. У 68% детей с эпилепсией в анамнезе имеет место атипичное течение фебрильных судорог.
Персистирующая моноинфекция ВГЧ 6-го типа, по нашим данным, не встречалась ни в одной из групп. В то время как при инфекции ВГЧ 6-го типа в сочетании с другими герпесвирусами регистрируются поражения нервной системы, что может свидетельствовать о реактивации ВГЧ 6-го типа при микст-инфицировании.
Дети с такими диагнозами, как судорожный синдром, эпилепсия, нейропатия, нуждаются в обследовании полным спектром анализов (ИФА, НРИФ, ПЦР) на выявление маркеров вирусов семейства герпесов, с акцентом на ВГЧ 6-го типа. Пациентам, у которых выявляется герпетическая инфекция, необходимо назначение противовирусной и интерферонотерапии с целью купирования активности ГВИ. Кроме того, такие дети нуждаются в ноотропной терапии, динамическом наблюдении и обследовании до полной ликвидации репликативной активности вируса.
Литература
- Исаков В. А., Рыбалкин С. Б., Романцов М. Г. Герпесвирусная инфекция. Рекомендации для врачей СПб, 2006. С. 8.
- Caserta M. T., Hall C. Bю, Schnabel K. et al. Primary human herpesvirus 7 infection: a comparison of human herpesvirus 7 and human herpesvirus 6 infections in children // J. Pediatriya. 1998; 133: 386–389.
- Long S. S., Pickering L. K., Charles G. Principles and practice of pediatric infectious diseases edited // Prober Churchill Livingstone Inc. 1997. P. 1821.
- Salahuddin S. Z., Ablashi D. V., Markham P. D. et al. Isolation of a new virus, HBLV, in patients with lymphoproliferative disorders // Science. 1986; 234: 596–601.
- Abdel-Haq N. M., Asmar B. I. Human herpesvirus 6 (HHV6) infection // Indian J Pediatr. 2004; 71 (1): 89–96.
- Mori Y. Recent topics related to human herpesvirus 6 cell tropis // Cell Microbiol. 2009, Jul; 11 (7): 1001–1006.
- Mori Y., Seya T., Huang H. L., Akkapaiboon P., Dhepakson P., Yamanishi K. Human herpesvirus 6 variant A but not variant B induces fusion from without in a variety of human cells through a human herpesvirus 6 entry receptor, CD46 // Journal Virol. 2002, Jul; 76 (13): 6750–6761.
- Braun D. K., Dominguez G., Pellett P. E. Human herpesvirus 6 // Clin Microbiol Rev. 1997.
- Абатуров А. Е., Шостакович-Корецкая Л. Р. HHV-6-инфекция у детей // Здоровье ребенка. 2007, 3 (6).
- Yamanishi K., Okuno T., Shiraki K. et al. Indentification of human herpesvirus-6 as a causal agent for exanthem subitum // Lancet. 1988; 1: 1065–1067.
- Josephs S. F., Salahuddin S. Z., Ablashi D. V., Schachter F., Wong Staal F., Gallo R. C. Genomic analysis of the human B-lymphotropic virus (HBLV) // Science. 1986; 234: 601–603.
- Takahashi K., Sonoda, Higashi K., Kondo T., Takahashi H., Takahashi M. et al. Predominant CD4 T-lymphocyte tropism of human herpesvirus 6-related virus // J Virol. 1989; 63: 3161–3163.
- Liberto M. C., Iannello D., Capozza A. B. Altered cytokine production after human herpes virus type 6 infection // New Microbiol. 1999, Oct; 22 (4): 293–300.
- Bressollette-Bodin C., Nguyen T. V., Illiaquer M., Besse B., Peltier C., Chevallier P., Imbert-Marcille B. M. Quantification of two viral transcripts by real time PCR to investigate human herpesvirus type 6 active infection // J Clin Virol. 2014, Feb; 59 (2): 94–99.
- Каражас Н. В., Малышев И. А., Рыбалкина Т. И., Калугина М. Ю., Бошьян Р. Е. и др. Герпесвирусная инфекция. Эпидемиология, клиника, диагностика, профилактика и лечение. Методические рекомендации № 41. М., 2007. С. 118.
- Lacroix A., Collot-Teixeira S., Mardivirin L., Jaccard A., Petit B., Piguet C., Sturtz F., Preux P. M., Bordessoule D., Ranger-Rogez S. Involvement of human herpesvirus-6 variant B in classic Hodgkin’s lymphoma via DR7 oncoprotein // Clin Cancer Res. 2010, Oct 1; 16 (19): 4711–4721.
- Chi J., Gu B., Zhang C., Peng G., Zhou F., Chen Y., Zhang G., Guo Y., Guo D., Qin J., Wang J., Li L., Wang F., Liu G., Xie F., Feng D., Zhou H., Huang X., Lu S., Liu Y., Hu W., Yao K. Human herpesvirus 6 latent infection in patients with glioma // J Infect Dis. 2012, Nov; 206 (9): 1394–1398.
- Challoner P. B., Smith K. T, Parker J. D. et al. Plaque-associated expression of human herpes virus 6 in multiple sclerosis. Proceedings of the National Academy of Sciences of the United States of America. 1995. Vol. 92, p. 7440–77444.
- Soldan S. S., Berti R., Salem N., Voumvourakis K. I., Kitsos D. K., Tsiodras S., Petrikkos G, Stamboulis E. Human herpesvirus 6 infection as a trigger of multiple sclerosis // Mayo Clinic Proceedings. 2010, vol. 85, № 11, p. 1023–1030.
- Birnbaum T., Padovan C. S., Sporer B., Rupprecht T. A., Äußerer H., Jaeger G., Pfister H. W. Severe Meningoencephalitis Caused by Human Herpesvirus 6 Type B in an Immunocompetent Woman Treated with Ganciclovir // Clin Infect Dis. 2005, Mar 15; 40 (6): 887–889.
- Nora-Krukle Z., Chapenko S., Logina I., Millers A., Platkajis A., Murovska M. Human herpesvirus 6 and 7 reactivation and disease activity in multiple sclerosis // Medicina (Kaunas). Литва. 2011; 47 (10): 527–31. J Neurovirol. 2001 Dec; 7 (6): 564–569.
- Казимирчук В. Е., Мальцев Д. В. Диагностика и лечение инфекции, вызванной вирусом герпеса человека 6-го типа // Клиническая иммунология. Аллергология. Инфектология 2011, № 5.
- Harberts E., Yao K., Wohler J. E., Maric D., Ohayon J., Henkin R., Jacobson S. Human herpesvirus-6 entry into the central nervous system through the olfactory pathway // Proceedings of the National Academy of Sciences. 2011, 108 (33): 13734.
- Kamei A., Fujiwara T., Hiraga S., Onuma R., Ichinohe S. Acute disseminated demyelination due to primary human herpesvirus-6 infection // Eur J Pediatr. 1997; 156 (9): 709–712.
- Tal Kramer, Lynn W. Enquist. Alphaherpesvirus Infection Disrupts Mitochondrial Transport in Neurons. 2012, Vol. 11, Issue 5, p. 504–514.
- Евтушенко С. К. Разрушительные и труднокурабельные формы эпилепсии и эпилептические энцефалопатии у детей // Международный неврологический журнал. 2012, 6 (52).
- Epstein L. G., Shinnar S., Hesdorffer D. C., Nordli D. R., Hamidullah A., Benn E. K. T., Pellock J. M., Frank L. M., Lewis D. V., Moshe S. L., Shinnar R. C. Shumei Sun and the FEBSTAT study team. Epilepsia; Human herpesvirus 6 and 7 in febrile status epilepticus: The FEBSTAT study. Published Online: June 14, 2012.
- Ward K. N., Gray J. J. Primary human herpesvirus 6 infection is frequently overlooked as a cause of febrile fits in young children // J Med Virol. 1994; 42: 119–123.
- Kondo K., Nagafuji H., Hata A., Tomomori C., Yamanishi K. Association of human herpesvirus 6 infection of the central nervous system with recurrence of febrile convulsions // J Infect Dis. 1993; 167: 1197–1200.
- Donati D., Akhyani N., Fogdell-Hahn A., Cermelli C., Cassiani-Ingoni R., Vortmeyer A., Heiss J. D., Cogen P., Gaillard W. D., Sato S., Theodore W. H., Jacobson S. Detection of human herpesvirus-6 in mesial temporal lobe epilepsy surgical brain resections // Neurology. 2003, Nov 25; 61 (10): 1405–1411.
- Shigeri Y., Seal R. P., Shimamoto K. «Molecular pharmacology of glutamate transporters, EAATs and VGLUTs // Brain Research Reviews. 2004. 45 (3): 250–265.
- Meeuwsen S. et al. Modulation of the cytokine network in human adult astrocytes by human herpesvirus-6 a // J. Neuroimmunol. 2005. V. 164, № 1. P. 37–47.
- Okubo Y., Sekiya H., Namiki S., Sakamoto H., Iinuma S., Yamasaki M., Watanabe M., Hirose K., Iino M. Imaging extrasynaptic glutamate dynamics in the brain // Proceedings of the National Academy of Sciences. 2010. 107 (14): 6526. DOI: 10.1073/pnas.0913154107.
- Livingston S. The diagnosis and treatment of convulsive disorders in children». Springfield: Charles C. Thomas, 1954.
Ф. С. Харламова*, 1, доктор медицинских наук, профессор
О. В. Шамшева*, доктор медицинских наук, профессор
Е. В. Симонова*
И. М. Дроздова**
* ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
** ГБУЗ Морозовская ДГКБ ДЗМ, Москва
1 Контактная информация: [email protected]
Засел в голове: новый коронавирус может вызвать опухоль мозга | Статьи
Новый коронавирус, согласно предположению зарубежных ученых, способен вызвать опухоль мозга и ускорить развитие уже имеющейся. Он проникает в мозг, где связывается с клетками нервной ткани, участвующими в развитии онкологического заболевания. Российские ученые считают, что SARS-Cov-2 действительно может влиять на процесс появления опухоли мозга. Однако отдаленные последствия COVID-19 только предстоит оценить. Многие другие вирусы проявляют свои онкогенные свойства порой спустя десятилетия после проникновения в организм человека.
Ключ к мозгу
Турецкие ученые из Университета имени Безмалема Вакифа выдвинули гипотезу, что часть молекулы SARS-Cov-2 (S-белок) связывается с глиальными и нейроглиальными клетками нервной ткани. Эти клетки окружают нейроны, обеспечивая условия для генерации и передачи нервных импульсов.
«Роль COVID-19 в опухолеобразовании изучена слабо, а о его роли в патофизиологии глиомы не сообщалось. Известно, что глиальные и нейрональные клетки экспрессируют АПФ2 на своей поверхности, что делает их потенциальной мишенью для инфекции COVID-19», — сообщили авторы работы.
Фото: REUTERS/Luisa Gonzalez
Эта гипотеза возникла в связи с возможностью коронавируса взаимодействовать с клетками мозга. На поверхности SARS-Cov-2 есть спайковый или отростчатый белок (S), похожий на шип. Именно эти шипы образуют так называемую корону, которую видят исследователи при рассмотрении патогена под электронным микроскопом. S-белок позволяет коронавирусу присоединиться к рецептору клетки-хозяина в момент проникновения в клетку. Данный шип часто называют ключом, который вставляется в замок, расположенный на поверхности клетки, где замок — фермент под названием АПФ2. Этот фермент присутствует в большинстве тканей организма, в том числе в нейронах головного мозга, а также во вспомогательных клетках особой ткани, составляющих около 40% объема центральной нервной системы.
«Поэтому мы предполагаем, что COVID-19 может индуцировать онкогенез глиомы через белок S. Это может увеличить риск развития глиомы у людей, инфицированных COVID-19, и может усилить рост опухоли у пациентов, инфицированных COVID-19», — заявили ученые.
Эту возможность ученые доказали с помощью компьютерного моделирования.
Давно известно, что различные вирусы способствуют появлению злокачественных опухолей. В пример можно привести вирусы папиломы человека, вызывающие рак шейки матки, некоторые герпес-вирусы, вирус Эпштейна-Барр, вирусы гепатита В и С, онкогенные ретровирусы. Причем последствия контактирования вируса и организма порой наблюдаются спустя годы и даже десятилетия после инфицирования.
Фото: ИЗВЕСТИЯ/Сергей Коньков
— Отдаленные последствия новой коронавирусной инфекции нам еще предстоит узнать, — сообщила директор Института персонализированной медицины Сеченовского университета (вуз — участник проекта повышения конкурентоспособности образования «5-100») Марина Секачева. — И очень хорошо, что уже сегодня коллеги занимаются прогнозированием, в том числе относительно развития глиомы. Это позволит заранее сосредоточиться на изучении возможных проблем и осложнений, особенно когда речь идет об онкологических заболеваниях. Теоретически вирус может опосредованно или напрямую участвовать в механизмах развития опухоли.
Пока предположение
Однако эксперты считают, что пока рано говорить о доказанном влиянии вируса SARS-Cov-2 на развитие опухоли мозга.
— Любой онкогенный вирус, проникая в клетку, изменяет ее, что в ряде случаев приводит к ее злокачественному перерождению, — отметила заведующая лабораторией вирусного канцерогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России Ксения Смирнова. — Но необходимо отметить, что это довольно длительный процесс, который обязательно требует влияния дополнительных факторов внешней и внутренней среды. Периодически появляются экспериментальные доказательства этиологической роли ряда нейротропных вирусов (например, вируса Эпштейна-Барр) в развитии глиом, но все эти данные касаются ДНК-содержащих вирусов (SARS-Cov-2 представляет собой РНК-вирус. — «Известия»).
ДНК-технологии в отделении молекулярно-биологических исследований
Фото: РИА Новости/Игорь Онучин
Исполняющий обязанности директора Института биомедицинских систем и биотехнологий Санкт-Петербургского политехнического университета Петра Великого Андрей Васин отнесся к теории турецких ученых скептически. По его мнению, описанный в статье механизм является крайне маловероятным.
— Предположение авторов работы подкреплено только результатами компьютерного моделирования связывания S-белка с несколькими рецепторами, никаких экспериментальных данных об онкогенном потенциале коронавируса представлено не было, — заявил эксперт. — Существует целая группа онкогенных вирусов человека, вызывающих развитие различных опухолей. Однако для РНК-содержащих респираторных вирусов человека, к которым относятся SARS-CoV-2 и другие коронавирусы человека, свойство онкогенности, насколько мне известно, описано не было.
Авторы статьи сами подчеркивают, что полученные результаты требуют дальнейшего исследования. Ведь COVID-19 — новое заболевание, изученное пока крайне слабо. Поэтому сейчас любое предположение относительно последствий попадания SARS-Cov-2 в организм носит гипотетический характер. Скорее всего, многие из догадок не сбудутся, однако наличие готовой теории и готовность к различным «эффектам» COVID-19 облегчат и ускорят борьбу с влиянием этой болезни на здоровье.
Справка «Известий»
Глиома — это вид опухоли мозга, которая развивается из глиальных клеток. Самая распространенная среди опухолей мозга, встречается в 60% случаев. Относится к первичным, то есть развивающимся из самой ткани головного мозга (вторичные связаны с метастатическим процессом из других органов, пораженных онкологическим заболеванием).
К глиальным опухолям головного мозга относят:
• астроцитому — доброкачественную опухоль из глиальной ткани с локализацией в полушариях мозга и мозжечке;
• олигодендроглиому — опухоль из глиальной ткани, не склонную к прорастанию в другие ткани с локализацией в полушариях головного мозга;
• эпендимому — доброкачественную опухоль, локализованную в боковых или четвертом желудочке;
• мультиформную глиобластому — данный вид опухоли диагностируют, как правило, у пациентов пожилого возраста;
• медуллобластому — опухоль, поражающую мозжечок, чаще всего ее обнаруживают у детей;
• пинеалому — новообразование, поражающее шишковидную железу.
Что мы знаем о влиянии COVID на нервную систему
Многие симптомы, которые испытывают люди, инфицированные SARS-CoV-2, связаны с нервной системой. Пациенты жалуются на головные боли, боли в мышцах и суставах, усталость и «мозговой туман» или потерю вкуса и запаха — все это может длиться от нескольких недель до месяцев после заражения. В тяжелых случаях COVID-19 также может привести к энцефалиту или инсульту. Вирус имеет неоспоримые неврологические эффекты. Но то, как он на самом деле влияет на нервные клетки, все еще остается загадкой.Может ли одна только активация иммунной системы вызвать симптомы? Или новый коронавирус напрямую атакует нервную систему?
Некоторые исследования, в том числе недавний препринт, посвященный изучению тканей мозга мышей и человека, показывают доказательства того, что SARS-CoV-2 может проникать в нервные клетки и мозг. Остается вопрос, происходит ли это регулярно или только в самых тяжелых случаях. Как только иммунная система начинает работать с перегрузкой, последствия могут быть далеко идущими, даже заставляя иммунные клетки вторгаться в мозг, где они могут нанести ущерб.
Некоторые неврологические симптомы гораздо менее серьезны, но кажутся более запутанными. Один симптом — или набор симптомов — который иллюстрирует эту загадку и привлекает все большее внимание, — это неточный диагноз, называемый «мозговой туман». Даже после того, как основные симптомы исчезли, пациенты с COVID-19 нередко испытывают потерю памяти, спутанность сознания и другую нечеткость ума. Что лежит в основе этих переживаний, до сих пор неясно, хотя они также могут быть связаны с воспалением всего тела, которое может сопровождать COVID-19.Однако у многих людей развивается усталость и мозговой туман, который сохраняется в течение нескольких месяцев даже после легкого случая, который не побуждает иммунную систему выйти из-под контроля.
Другой широко распространенный симптом, называемый аносмией, или потерей обоняния, также может быть результатом изменений, происходящих без инфицирования самих нервов. Обонятельные нейроны, клетки, передающие запахи в мозг, не имеют основного места стыковки или рецептора для SARS-CoV-2, и, похоже, они не заражаются. Исследователи все еще изучают, как потеря обоняния может быть результатом взаимодействия вируса и другого рецептора на обонятельных нейронах или его контакта с ненервными клетками, выстилающими нос.
Эксперты говорят, что вирусу не обязательно проникать внутрь нейронов, чтобы вызвать некоторые загадочные неврологические симптомы, возникающие в настоящее время в результате болезни. Многие эффекты, связанные с болью, могут возникнуть в результате атаки на сенсорные нейроны, нервы, которые проходят от спинного мозга по всему телу для сбора информации из внешней среды или внутренних процессов организма. В настоящее время исследователи делают успехи в понимании того, как SARS-CoV-2 может захватить чувствительные к боли нейроны, называемые ноцицепторами, чтобы вызвать некоторые характерные симптомы COVID-19.
Нейробиолог Теодор Прайс, изучающий боль в Техасском университете в Далласе, обратил внимание на симптомы, описанные в ранней литературе и цитируемые пациентами его жены, практикующей медсестры, которая видит людей с COVID удаленно. Эти симптомы включают боль в горле, головные боли, боль в мышцах всего тела и сильный кашель. (Кашель частично вызывается сенсорными нервными клетками в легких.)
Любопытно, что некоторые пациенты сообщают об утрате определенного ощущения, называемого хеметезом, из-за которого они не могут обнаружить острый перец чили или холодную мяту — восприятие, передаваемое ноцицепторами, а не вкусовыми клетками.Хотя многие из этих эффектов типичны для вирусных инфекций, распространенность и стойкость этих симптомов, связанных с болью, а также их присутствие даже в легких случаях COVID-19, позволяют предположить, что сенсорные нейроны могут быть затронуты помимо обычных воспалительных реакций на инфекцию. Это означает, что эффекты могут быть напрямую связаны с самим вирусом. «Это просто поразительно, — говорит Прайс. Пострадавшие пациенты «все страдают головными болями, а некоторые из них, кажется, имеют проблемы с болью, которые похожи на невропатию», хроническую боль, возникающую из-за повреждения нервов.Это наблюдение заставило его исследовать, может ли новый коронавирус заразить ноцицепторы.
Основным критерием, который ученые используют для определения того, может ли SARS-CoV-2 инфицировать клетки по всему телу, является наличие ангиотензин-превращающего фермента 2 (ACE2), белка, встроенного в поверхность клеток. ACE2 действует как рецептор, который посылает сигналы в клетку для регулирования кровяного давления, а также является точкой входа для SARS-CoV-2. Поэтому Прайс стал искать его в нейронах человека в исследовании, опубликованном в журнале PAIN .
Ноцицепторы — и другие сенсорные нейроны — живут в дискретных кластерах , расположенных сразу за пределами спинного мозга, называемых ганглиями задних корешков (DRG). Прайс и его команда приобрели нервные клетки, пожертвованные после смерти или операций по поводу рака. Исследователи выполнили секвенирование РНК, методику определения того, какие белки собирается производить клетка, и использовали антитела для нацеливания на сам ACE2. Они обнаружили, что подмножество нейронов DRG действительно содержало ACE2, обеспечивая вирусу портал в клетки.
Сенсорные нейроны посылают длинные усики, называемые аксонами, , окончания которых воспринимают определенные стимулы в теле и затем передают их в мозг в виде электрохимических сигналов. Конкретные нейроны DRG, содержащие ACE2, также имели генетические инструкции, мРНК, для сенсорного белка, называемого MRGPRD. Этот белок отмечает клетки как подмножество нейронов, окончания которых сосредоточены на поверхностях тела — коже и внутренних органах, включая легкие, — где они будут готовы подхватить вирус.
Прайс говорит, что нервная инфекция может способствовать как острым, так и длительным симптомам COVID. «Наиболее вероятным сценарием было бы поражение вегетативных и сенсорных нервов вирусом», — говорит он. «Мы знаем, что заражение сенсорных нейронов вирусом может иметь долгосрочные последствия», даже если вирус не остается в клетках.
Но, добавляет Прайс, «не обязательно, чтобы нейроны инфицировались». В другом недавнем исследовании он сравнил данные генетического секвенирования клеток легких пациентов с COVID и здоровых людей из контрольной группы и искал взаимодействия со здоровыми нейронами DRG человека.Прайс говорит, что его команда обнаружила у инфицированных пациентов множество сигнальных молекул иммунной системы, называемых цитокинами, которые могут взаимодействовать с рецепторами нейронов. «По сути, это набор вещей, которые, как мы знаем, связаны с невропатической болью». Это наблюдение предполагает, что нервы могут подвергаться длительному повреждению со стороны иммунных молекул без прямого заражения вирусом.
Энн Луиза Оклендер, невролог из Массачусетской больницы общего профиля, написавшая комментарий к статье Прайса в PAIN, , говорит, что исследование «было исключительно хорошим», отчасти потому, что в нем использовались человеческие клетки.Но, добавляет она, «у нас нет доказательств того, что прямое проникновение вируса в [нервные] клетки является основным механизмом клеточного [нервного] повреждения», хотя новые результаты не исключают эту возможность. По словам Оклендера, «абсолютно возможно», что воспалительные состояния вне нервных клеток могут изменить их активность или даже вызвать необратимые повреждения. Другая перспектива заключается в том, что вирусные частицы, взаимодействующие с нейронами, могут привести к аутоиммунной атаке на нервы.
ACE2 считается основной точкой входа нового коронавируса.Но Раджеш Кханна, нейробиолог и исследователь боли из Университета Аризоны, отмечает, что «ACE2 — не единственная игра в городе, где SARS-CoV-2 проникает в клетки». Другой белок, нейропилин-1 (NRP1), «может быть альтернативным проходом» для проникновения вируса, добавляет он. NRP1 играет важную роль в ангиогенезе (формировании новых кровеносных сосудов) и в росте длинных аксонов нейронов.
Эта идея пришла из исследований на клетках и мышах. Было обнаружено, что NRP1 взаимодействует с печально известным шиповым белком вируса, который он использует для проникновения в клетки.«Мы доказали, что он связывает нейропилин и что рецептор обладает инфекционным потенциалом», — говорит вирусолог Джузеппе Балистрери из Хельсинкского университета, который является соавтором исследования на мышах, которое было опубликовано в журнале Science вместе с отдельным исследованием клеток. Более вероятно, что NRP1 действует как кофактор с ACE2, чем то, что белок сам по себе обеспечивает проникновение вируса в клетки. «Мы знаем, что когда у нас есть два рецептора, мы получаем больше инфекции. Вместе они намного мощнее », — добавляет Балистрери.
Эти открытия вызвали интерес у Кханна, который изучал фактор роста эндотелия сосудов (VEGF), молекулу с давно признанной ролью в передаче сигналов боли, которая также связывается с NRP1. Он задавался вопросом, повлияет ли вирус на передачу сигналов боли через NRP1, поэтому он проверил его на крысах в исследовании, которое также было опубликовано в PAIN . «Мы поместили VEGF в животное [в лапу], и о чудо, мы увидели сильную боль в течение 24 часов», — говорит Кханна. «Затем был проведен действительно крутой эксперимент: мы одновременно добавляли VEGF и спайк, и угадайте, что? Боль ушла.”
Исследование показало, «что происходит с передачей сигналов нейрона, когда вирус пощекотал рецептор NRP1», — говорит Балистрери. «Результаты впечатляющие», демонстрируя, что активность нейронов была изменена «прикосновением к шипу вируса через NRP1».
В эксперименте на крысах с повреждением нерва для моделирования хронической боли введение одного спайкового белка ослабляло болевое поведение животных. Это открытие указывает на то, что препарат, похожий на шип, который связывает NRP1, может иметь потенциал в качестве нового болеутоляющего средства.Такие молекулы уже разрабатываются для использования при раке.
В более провокационной и непроверенной гипотезе, Кханна предполагает, что спайковый белок может действовать на NRP1, чтобы заглушить ноцицепторы у людей, возможно, маскируя симптомы, связанные с болью, на очень ранней стадии инфекции. Идея состоит в том, что белок может оказывать обезболивающее действие, поскольку SARS-CoV-2 начинает инфицировать человека, что может способствовать более легкому распространению вируса. «Я не могу этого исключить», — говорит Балистрери. «Это не невозможно. У вирусов есть целый арсенал инструментов, которые можно скрыть.Это лучшее, что они знают: заставить нашу оборону замолчать ».
Еще предстоит определить, может ли инфекция SARS-CoV-2 вызывать обезболивание у людей. «Они использовали большую дозу кусочка вируса в лабораторной системе и на крысе, а не на человеке», — говорит Балистрери. «Величина наблюдаемых ими эффектов [может быть связана] с большим количеством использованного вирусного белка. Вопрос будет в том, сможет ли сам вирус [притупить боль] у людей ».
Опыт одного пациента — Рэйва Преториуса, 49-летнего мужчины из Южной Африки — показывает, что продолжение этого направления исследований, вероятно, имеет смысл.В результате автомобильной аварии в 2011 году Преториус получил перелом нескольких позвонков на шее и обширное повреждение нервов. Он говорит, что живет с постоянной жгучей болью в ногах, которая просыпается каждую ночь в 3 или 4 часа ночи. «Такое ощущение, что кто-то непрерывно поливает мне ноги горячей водой, — говорит Преториус. Но все резко изменилось, когда он заразился COVID-19 в июле на своей работе в производственной компании. «Мне это показалось очень странным: когда я болел COVID, боль была терпимой. В какой-то момент казалось, что боль ушла.Я просто не мог в это поверить », — говорит он. Преториус смог проспать всю ночь впервые после аварии. «Я прожил лучшую жизнь, когда был болен, потому что боль ушла», несмотря на усталость и изнуряющие головные боли, — говорит он. Теперь, когда Преториус излечился от COVID, его невропатическая боль вернулась.
Хорошо это или плохо, но COVID-19, похоже, влияет на нервную систему. Включают ли они инфекцию нервов, пока неизвестно, как и о SARS-CoV-2.Суть в том, что, хотя вирус в принципе может инфицировать некоторые нейроны, в этом нет необходимости. Это может вызвать множество разрушений извне этих клеток.
Подробнее о вспышке коронавируса от Scientific American читайте здесь. И читайте репортажи из нашей международной сети журналов здесь.
Как COVID-19 может повредить мозг
Женщина видела в своем доме львов и обезьян. Она становилась дезориентированной и агрессивной по отношению к другим и была убеждена, что ее муж был самозванцем.Ей было около 50 лет — на несколько десятков лет старше того возраста, в котором обычно развивается психоз, — и у нее не было психиатрического анамнеза. Однако у нее был COVID-19. Это был один из первых известных случаев психоза после заражения 1 .
В первые месяцы пандемии COVID-19 врачи изо всех сил пытались сохранить дыхание пациентов и сосредоточились в основном на лечении повреждений легких и системы кровообращения. Но даже тогда доказательства неврологических эффектов накапливались.Некоторые люди, госпитализированные с COVID-19, испытывали бред: они были сбиты с толку, дезориентированы и возбуждены 2 . В апреле группа из Японии опубликовала 3 — первый отчет о человеке с COVID-19, у которого наблюдались отек и воспаление в тканях мозга. В другом отчете 4 описан пациент с ухудшением миелина, жирового покрытия, которое защищает нейроны и необратимо повреждается при нейродегенеративных заболеваниях, таких как рассеянный склероз.
«Неврологические симптомы становятся все более и более пугающими», — говорит Алиссон Муотри, нейробиолог из Калифорнийского университета в Сан-Диего, в Ла-Хойя.
Список теперь включает инсульт, кровоизлияние в мозг и потерю памяти. Нередко серьезные заболевания вызывают такие эффекты, но масштабы пандемии COVID-19 означают, что у тысяч или даже десятков тысяч людей уже могут быть эти симптомы, а некоторые могут в результате сталкиваться с проблемами на всю жизнь.
Тем не менее, исследователи изо всех сил пытаются ответить на ключевые вопросы, в том числе на базовые, например, сколько людей страдают этими заболеваниями и кто подвержен риску. Самое главное, они хотят знать, почему проявляются именно эти симптомы.
Хотя вирусы могут проникать в мозг и инфицировать его, неясно, действительно ли SARS-CoV-2 делает это в значительной степени. Вместо этого неврологические симптомы могут быть результатом чрезмерной стимуляции иммунной системы. Это очень важно выяснить, потому что эти два сценария требуют совершенно разных подходов. «Вот почему механизмы болезни так важны», — говорит Бенедикт Майкл, невролог из Ливерпульского университета, Великобритания.
Пораженный мозг
По мере нарастания пандемии Майкл и его коллеги были среди многих ученых, которые начали собирать отчеты о неврологических осложнениях, связанных с COVID-19.
В июньской статье 5 он и его команда проанализировали клинические детали 125 человек в Соединенном Королевстве с COVID-19, у которых были неврологические или психические эффекты. Из них 62% испытали нарушение кровоснабжения мозга, такое как инсульты и кровотечения, а 31% имели измененные психические состояния, такие как спутанность сознания или длительное бессознательное состояние, иногда сопровождающееся энцефалитом, отеком ткани мозга. У десяти человек с измененным психическим состоянием развился психоз.
Не все люди с неврологическими симптомами серьезно болели в отделениях интенсивной терапии.«Мы видели эту группу молодых людей без обычных факторов риска, у которых наблюдается инсульт, а также пациентов с острыми изменениями психического статуса, которые иначе не объяснены», — говорит Майкл.
Неврологические симптомы, сопровождающие COVID-19, включают делирий, психоз и инсульт Фото: Стефан Маэ / Reuters
В аналогичном исследовании 1 , опубликованном в июле, были собраны подробные описания случаев 43 человек с неврологическими осложнениями COVID-19. Некоторые закономерности проясняются, говорит Майкл Занди, невролог из Университетского колледжа Лондона и ведущий автор исследования.Наиболее частыми неврологическими эффектами являются инсульт и энцефалит. Последний может перерасти в тяжелую форму, называемую острым диссеминированным энцефаломиелитом, при котором как головной, так и спинной мозг воспаляются, а нейроны теряют свою миелиновую оболочку, что приводит к симптомам, напоминающим симптомы рассеянного склероза. У некоторых из наиболее пострадавших пациентов наблюдались лишь легкие респираторные симптомы. «Это была их основная болезнь, пораженная мозгом», — говорит Занди.
Менее распространенные осложнения включают повреждение периферических нервов, типичное для синдрома Гийена – Барре, и то, что Занди называет «мешаниной вещей», например тревожность и посттравматическое стрессовое расстройство.Подобные симптомы наблюдались при вспышках тяжелого острого респираторного синдрома (SARS) и ближневосточного респираторного синдрома (MERS), также вызванных коронавирусами. Но во время этих вспышек было инфицировано меньше людей, поэтому доступно меньше данных.
Сколько человек?
Клиницисты не знают, насколько распространены эти неврологические эффекты. Другое исследование 6 , опубликованное в июле, оценило их распространенность с использованием данных других коронавирусов. Симптомы, влияющие на центральную нервную систему, возникли как минимум в 0.04% людей с SARS и у 0,2% людей с MERS. Учитывая, что в настоящее время во всем мире зарегистрировано 28,2 миллиона подтвержденных случаев COVID-19, это может означать, что от 10 000 до 50 000 человек испытали неврологические осложнения.
Но главная проблема при количественной оценке случаев заключается в том, что клинические исследования обычно сосредоточены на госпитализированных людях с COVID-19, часто на тех, кто нуждался в интенсивной терапии. Распространенность неврологических симптомов в этой группе может быть «более 50%», — говорит нейробиолог Фернанда де Феличе из Федерального университета Рио-де-Жанейро в Бразилии.Но гораздо меньше информации о тех, кто имел легкое заболевание или не имел респираторных симптомов.
Этот недостаток данных означает, что трудно понять, почему у некоторых людей есть неврологические симптомы, а у других — нет. Также неясно, сохранятся ли последствия: COVID-19 может иметь другие последствия для здоровья, которые длятся месяцами, а различные коронавирусы оставляли у некоторых людей симптомы на долгие годы.
Инфекция или воспаление?
Однако самый насущный вопрос для многих нейробиологов — почему мозг вообще страдает.По словам Де Феличе, несмотря на то, что картина нарушений довольно последовательна, лежащие в основе механизмы еще не ясны.
Ответ поможет врачам выбрать правильное лечение. «Если это прямая вирусная инфекция центральной нервной системы, это те пациенты, которым мы должны быть нацелены на прием ремдесивира или другого противовирусного препарата», — говорит Майкл. «Если вирус не находится в центральной нервной системе, возможно, вирус не попал в организм, тогда нам нужно лечить с помощью противовоспалительной терапии.
Ошибиться было бы вредно. «Бессмысленно давать кому-то противовирусные препараты, если вирус ушел, и давать противовоспалительные препараты тому, у кого вирус в мозгу, рискованно», — говорит Майкл.
Есть явные доказательства того, что SARS-CoV-2 может инфицировать нейроны. Команда Муотри специализируется на создании «органоидов» — миниатюрных скоплений ткани мозга, созданных путем принуждения плюрипотентных стволовых клеток человека к дифференцировке в нейроны.
В майском препринте 7 команда показала, что SARS-CoV-2 может инфицировать нейроны в этих органоидах, убивая некоторые из них и уменьшая образование синапсов между ними.Согласно препринту, опубликованному 8 сентября 8 , работа иммунолога Акико Ивасаки и ее коллег из Медицинской школы Йельского университета в Нью-Хейвене, штат Коннектикут, похоже, подтверждает это с помощью органоидов человека, мозга мышей и некоторых патологоанатомических исследований. Но остаются вопросы о том, как вирус может попасть в мозг людей.
Поскольку потеря обоняния является обычным симптомом, неврологи задались вопросом, может ли обонятельный нерв обеспечить путь проникновения. «Все были обеспокоены такой возможностью, — говорит Майкл.Но свидетельства говорят против.
Группа под руководством Мэри Фоукс, патолога из Медицинской школы Икана на горе Синай в Нью-Йорке, в конце мая опубликовала препринт 9 , в котором описаны вскрытия 67 человек, умерших от COVID-19. «Мы видели вирус в самом мозге», — говорит Фаукс: электронные микроскопы показали его присутствие. Но уровни вируса были низкими и не всегда обнаруживались. Кроме того, если вирус проникает через обонятельный нерв, соответствующая область мозга должна быть затронута в первую очередь.«Мы просто не видим вирус, вовлеченный в обонятельную луковицу», — говорит Фаукс. По ее словам, инфекции в головном мозге скорее небольшие и имеют тенденцию группироваться вокруг кровеносных сосудов.
Майкл согласен с тем, что вирус трудно найти в мозге по сравнению с другими органами. Тесты с использованием полимеразной цепной реакции (ПЦР) часто не обнаруживают его там, несмотря на их высокую чувствительность, а в нескольких исследованиях не удалось обнаружить какие-либо вирусные частицы в спинномозговой жидкости, окружающей головной и спинной мозг (см., Например, исх.10) 10 . Одна из причин может заключаться в том, что рецептор ACE2, белок в клетках человека, который вирус использует для проникновения, не очень сильно экспрессируется в клетках мозга 10 .
«Кажется, что вирусные инфекции центральной нервной системы невероятно редки», — говорит Майкл. Это означает, что многие из проблем, с которыми сталкиваются врачи, вероятно, являются результатом борьбы иммунной системы организма с вирусом.
Тем не менее, это может быть не во всех случаях, а это означает, что исследователям необходимо будет определить биомаркеры, которые могут надежно отличить вирусную инфекцию мозга от иммунной активности.На данный момент это означает больше клинических исследований, вскрытий и физиологических исследований.
Де Феличе говорит, что она и ее коллеги планируют наблюдать за пациентами, выздоровевшими после интенсивной терапии, и создать биобанк образцов, включая спинномозговую жидкость. Занди говорит, что аналогичные исследования начинаются в Университетском колледже Лондона. Без сомнения, исследователи будут перебирать такие образцы годами. По словам Майкла, хотя вопросы, которые они решают, возникают почти во время каждой вспышки заболевания, COVID-19 представляет новые проблемы и возможности.«Чего у нас не было с 1918 года, так это пандемии такого масштаба».
границ | Неврологический ущерб от коронавирусов: катастрофа в очереди!
Введение
Общая черта между вирусом простого герпеса (HSV), вирусом Западного Нила (WNV), энтеровирусами, такими как полиовирус (PV), вирусом Коксаки (CV), вирусом гриппа (IAV), вирусом кори (MV), и особенно респираторными вирусами человека, такими как коронавирусы. (CoV) заключается в том, что их первичный очаг инфекции не находится в центральной нервной системе (ЦНС) человека, но все они являются «нейропатогенными» и демонстрируют фатальные неврологические отклонения у людей.Эти вирусы поражают миллионы людей во всем мире и вызывают целый спектр неврологических и психических заболеваний (1–3). Если мы рассмотрим другие хронические вирусные инфекции, такие как вирус иммунодефицита человека (ВИЧ), вирус Джона Каннингема (JCV), вирус простого герпеса (ВПГ), вирус герпеса человека 6 (HHV-6) и Т-лимфотропный вирус человека (HTLV). -1) — мы понимаем, что периферические вирусные инфекции и возникновение неврологических осложнений — довольно взаимосвязанное явление (4–6). Поскольку неврологические аномалии являются смертельными или потенциально опасными для качества жизни, они в конечном итоге ограничивают выживание и детородную деятельность хозяина.Согласно этому определению вторжение в нервную систему хозяина кажется менее перспективным эволюционным путем (7). Это еще больше усложняет сценарий вторжения периферических / респираторных вирусов в ЦНС.
Центральная нервная система (ЦНС) строго охраняется гематоэнцефалическим барьером (ГЭБ) и эффективным иммунным надзором. Возникает интригующий вопрос о том, как эти не нейротропные вирусы (большинство из них респираторные вирусы) вызывают соответствующую первичную патологию в дистальной части тела хозяина, в конечном итоге нарушая неприкосновенность ЦНС.Есть ли общий путь для всех этих вирусов проникнуть в ЦНС и вызвать неврологические расстройства, или все они используют уникальный путь для возникновения своей невропатологии?
При обычном течении инфекции вирусы обычно проникают через инфицированную ткань и возвращаются обратно в кровоток и лимфатические узлы, а гематогенным путем они могут получить доступ к ЦНС. Клинические наблюдения показывают, что любой вирус, который контактирует с эпителиальными и эндотелиальными оболочками, обычно поражает ЦНС, потому что почти все эпителиальные оболочки слизистых оболочек человека в значительной степени встроены в периферические сенсорные нервы.Однако в случае ненейротропных вирусных инфекций все это кажется условно-патогенным, потому что эти вирусы сначала проявляют свои первичные симптомы болезни, а затем — вторичный набор патологий, включающий неврологические аберрации.
Опираясь на более чем 100-летние обширные исследования и обширную литературу, мы можем глубже изучить различные вирусные стратегии нарушения ЦНС и провести более широкое сравнение, чтобы найти некоторые наиболее часто используемые пути. В следующем обсуждении мы попытаемся изучить этот вопрос относительно того, является ли их попадание в ЦНС условно-патогенным и случайным, или эти периферические вирусы приспособлены для запуска такого многогранного патогенеза.
Легче ли респираторным вирусам проникать в ЦНС?
Основные маршруты входа в ЦНС можно разделить на две категории. Во-первых, гематогенный путь, который означает проникновение периферических инфицированных клеток крови, таких как моноциты / макрофаги, в качестве «троянского коня» через пересечение ГЭБ (схематическое изображение на рисунке 1). Этот путь может также включать инфицирование эндотелиальных клеток микрососудов головного мозга или параклеточного прохода через разрушение плотных контактов и увеличение проницаемости эндотелия мозга (8–11).Другой важный путь проникновения — это нейрональный или аксональный путь, вовлекающий различные периферические нервные окончания, такие как обонятельные сенсорные нейроны и окончания кишечных нервов. Он называется аксональным транспортным путем, потому что патогены пересекают один нейрон за другим через синаптические нервные окончания (8, 12, 13). Известно, что вирусы используют моторные белки, такие как динеин и кинезин, для ретроградного и антероградного движения во время нейронального транспорта (8, 9). Вирусы могут адаптировать оба этих пути для проникновения в ЦНС, и они были подробно рассмотрены в другом месте (12, 14, 15).Список вирусов представлен в таблице 1, в которой показан их соответствующий путь проникновения в ЦНС.
Рисунок 1. Основные маршруты проникновения вирусов в ЦНС. Схема описывает два основных пути передачи вирусов в ЦНС: гематогенный путь передачи и путь обонятельного нейронального транспорта. Респираторные вирусы могут инфицировать нижние дыхательные пути и эпителий легких, которые находятся в тесном контакте с тонкими кровеносными капиллярами для транспорта кислорода.Вирусы перемещаются к базолатеральной стороне эпителия легких, попадают в кровоток и в конечном итоге инфицируют моноциты / макрофаги в кровеносных капиллярах. В качестве пути «троянского коня» эти инфицированные моноциты могут попасть в ЦНС. В пути передачи обонятельных нейронов вирусы перемещаются от одного нейрона к другому через синаптические окончания, используя моторные белки клетки, чтобы в конечном итоге достичь ЦНС.
Таблица 1. Несколько маршрутов проникновения вирусов в ЦНС.
Нейроны обонятельных рецепторов демонстрируют некоторые ключевые анатомические и функциональные особенности, обычно отсутствующие где-либо еще.Нейроны обонятельных рецепторов находятся преимущественно в верхних дыхательных путях, области, обычно известной как носовая полость и носовая перегородка. Когда какой-либо запах растворяется в слизистой оболочке носовой полости, апикальная часть или дендриты обонятельных нервов воспринимают его и передают этот сигнал в базальную часть тел обонятельных нервов для дальнейшей передачи в мозг (16). Окончания нейронов обонятельных рецепторов напрямую подвергаются воздействию внешних стимулов и способны в огромной степени взаимодействовать со всеми макромолекулами окружающей среды.Это взаимодействие отвечает за нашу надуманную способность ощущать почти один триллион видов запахов, присутствующих во Вселенной (17). Эти обонятельные нервные окончания выполняют функцию хеморецепторов. Это означает, что любые макромолекулы могут быть физически включены в клетки обонятельного нерва и перемещаться по синаптическому пути транс- в ЦНС. Это делает клетки обонятельного нерва чрезвычайно полезным инструментом для респираторных вирусов, чтобы достичь ЦНС, даже не беспокоясь о барьере ГЭБ (18).Сообщается, что респираторные вирусы, такие как грипп и коронавирусы, предпочтительно проходят этот обонятельный путь для проникновения в ЦНС другими путями.
В случае текущей пандемии, вызванной SARS-CoV-2, у пациентов, как широко сообщалось, проявлялись симптомы аносмии / дисгевзии (т.е. изменения, связанные с запахом и вкусом) (19). Американская академия отоларингологии — хирургии головы и шеи (AAO-HNS) также приняла аносмию и дисгевзию как предвестник COVID-19 (20).Точный путь проникновения SARS-CoV-2 в ЦНС экспериментально еще не установлен. Однако, поскольку этот вирус почти на 79% похож на предыдущий SARS-CoV, мы можем ожидать некоторого сходства и в способе проникновения в ЦНС. Присутствие SARS-CoV (причины эпидемий SARS в 2009 и 2013 годах) в ЦНС было хорошо установлено как у людей, так и у экспериментальных животных. Сообщалось, что в случае SARS-CoV область ствола мозга сильно инфицирована (21). Сообщается также, что SARS-CoV распространяется через механорецепторы и хеморецепторы, присутствующие в нижних дыхательных путях, к медуллярному кардиореспираторному центру мозга по синаптическому пути (22).Этим объясняется широко распространенное проявление сосудистых и сердечных аномалий у тяжелых пациентов с эпидемиями SARS-CoV. В нынешней пандемии SARS-CoV-2 пациенты также демонстрируют интенсивные сосудистые и сердечные аномалии, которые становятся основной причиной смерти, однако точные клеточные и молекулярные механизмы все еще нуждаются в экспериментальной проверке (22).
Респираторные вирусы тоже гематогенным путем
Dijkman et al. сообщили, что коронавирусы человека (HCoV) вызывают гораздо меньшее цитопатическое воздействие на первичные респираторные эпителиальные клетки человека (23).Они также показали, что все штаммы HCoV отрастают преимущественно с апикальной стороны эпителиальных клеток, но многие вирусы также высвобождаются с базолатеральной стороны (23). Таким образом они могут проходить через эпителиальный барьер и попадать в кровоток и лимфатические узлы (рис. 1). Это объясняет, как они могут инфицировать лейкоциты и гематогенным путем перемещаться в другие отдаленные органы, такие как ЦНС, почки, кишечник и т. Д. (1). Было показано, что этот путь используется различными другими вирусами, такими как вирус кори (24), вирус Nipah (25) и вирус гриппа B (26, 27).Тем не менее, для инфекции SARS-CoV-2 предпочтительный путь проникновения (гематогенный или обонятельный нервный транспорт) в ЦНС требует дополнительной экспериментальной проверки.
Для ненейротропных вирусов время действительно иллюзия
Согласно классическим определениям, патоген и их патогенез представляют собой типичную причинно-следственную связь, описываемую как «теория микробов». Это был золотой стандарт, установленный Робертом Кохом в 1890 году, также известный как постулаты Коха. Однако кажется, что вирусы легко нарушают постулаты Коха, вызывая неврологические расстройства.В случае вирусных инфекций у нас есть несколько примеров, когда неврологические последствия вирусных инфекций произошли через десятилетия после первичной инфекции, когда все сигнатуры вирусного генома, белков и токсинов давно ушли от хозяина. Это создает серьезную проблему для определения и связывания вирусной инфекции и связанного с ней нейропатогенеза. Известно, что вирусы прямо или косвенно являются первопричиной нескольких неврологических синдромов. Разница между невропатологией, вызванной прямой вирусной инфекцией, и невропатологией, вызванной потенциальными посторонними факторами, все еще является предметом пристального изучения.
Для большей перспективы, если мы вернемся к истории «испанского гриппа» 1918 года, современные врачи и исследователи наблюдали интригующую ассоциацию летаргического энцефалита (изнурительное нервное расстройство в форме нарушения сна, летаргии и т. Д.). и симптомы, подобные симптомам Паркинсона) у больных гриппом после выздоровления. Эти неврологические нарушения могут снижать качество жизни пациента на десятилетия (3, 28). После этого многие эпизоды эпидемии гриппа и их связь с последующими неврологическими расстройствами начали убеждать исследователей в том, что ненейротропные / периферические вирусы, особенно респираторные вирусы, могут влиять на мозг человека с длительными неврологическими расстройствами (2).Те вирусные инфекции, когда сильный иммунный ответ заставляет мозг очищаться от вирусных частиц посредством апоптоза и очистки инфицированных нейронов, представляют собой более сложные сценарии. Например, при инфекции вирусом везикулярного стоматита (VSV), которая поражает серотонинергическую систему мозга, иммунный клиренс приводит к постоянной потере серотониновых нейронов, что приводит к нейрохимическим и поведенческим изменениям (29). Начальная вирусная инфекция вызывает пожизненные неврологические и психиатрические изменения, однако ни один диагноз не может доказать их связь с конкретной вирусной инфекцией, поскольку вирус уже давно элиминирован от хозяина.
Постполиомиелитный синдром представляет собой прекрасный пример того, как некоторые вирусы могут оставаться латентными в мозге и вызывать неврологическую дисфункцию намного позже в жизни. Сообщалось о многих случаях, когда симптомы полиомиелита, такие как слабость пораженных конечностей, возвращались через десятилетия, иногда даже через 30–40 лет (30, 31). Точно так же ветряная оспа, вызванная двухцепочечной ДНК, обволакивающей вирус герпеса, остается латентной внутри нейронов в течение десятилетий (32, 33). Он проявляется в виде опоясывающего лишая, когда активный вирус продуцируется из его скрытого генома, и начинает проявлять симптомы зуда и боли.Он может производить компетентный к репликации вирус, который может перемещаться по аксональной сети и снова заражать нейроны ЦНС (33). В такой ситуации мы сталкиваемся с проблемой, заключающейся в том, что диагностические тесты могут обнаружить вирус только в крови или спинномозговой жидкости, что дает нам ложный диагноз, что у пациента нет вируса, в то время как паренхиматозные ткани все еще могут содержать вирус.
Текущая пандемия COVID-19 / SARS-CoV-2
Информация об общих характеристиках вируса SARS-CoV-2, использовании рецепторов ACE2, их передаче и патологии широко доступна в текущем потоке литературы (34–38).Поэтому мы в основном сосредоточимся на их невропатологических аспектах и других уникальных особенностях.
Первоначальные доказательства повреждения ЦНС, связанного с SARS-CoV-2, появились, когда пациенту, инфицированному SARS-CoV-2, был поставлен диагноз острой некротической геморрагической энцефалопатии наряду с другими обычными симптомами COVID-19. МРТ головного мозга показала геморрагические ободки в различных сегментах головного мозга, таких как двусторонние таламусы, медиальные височные доли и субинсулярные области (39). Однако прямое присутствие вирусных частиц SARS-CoV-2 в головном мозге и спинномозговой жидкости все еще требовало экспериментальной проверки, которая могла бы дополнительно подтвердить их нейротропизм (39).Сильная связь SARS-CoV-2 с неврологическими расстройствами широко обсуждалась в современной литературе. Последние новости о невропатологии при COVID-19 / SARS-CoV-2 можно подробно изучить в следующих ссылках (40–42). Поскольку эта пандемия все еще продолжается и большинство данных о пациентах, собранных до сих пор, относятся только к фазе острого респираторного заболевания, отсутствует какая-либо документация о долгосрочном воздействии SARS-CoV-2 на ЦНС человека. Большинство данных о неврологических повреждениях во время инфекции SARS-CoV-2 до сих пор не подтверждены лабораторными исследованиями; Итак, нам нужно будет посмотреть, как предыдущий эпизод коронавируса повлиял на ЦНС.
Нейроинвазивность коронавирусов
Присутствие РНК коронавируса (шесть ранее известных коронавирусов) было зарегистрировано в образцах вскрытия мозга человека, которые четко установили, что, будучи в первую очередь респираторным вирусом, он естественно нейроинвазивен для человека-хозяина и может успешно реплицироваться в головном мозге (43). Кроме того, во многих лабораториях было установлено, что стойкая инфекция коронавируса происходит в клетках ЦНС человека, таких как олигодендроциты и нейроглиальные клеточные линии (44–46).В модели на мышах РНК HCoV-OC43 обнаруживалась намного дольше после того, как мыши пережили эпизоды острого энцефалита, вызванного коронавирусом. Инфекция HCoV-OC43 на модели мышей предполагала потерю нейронов гиппокампа (47). Эти отчеты предполагают, что коронавирус — это не только вирус гриппа с безвредными последствиями заболевания, но также он способен поддерживать стойкую инфекцию в ЦНС. Коронавирусная инфекция на самом деле может быть фактором или кофактором долгосрочных неврологических аномалий, которые будут обнаружены в более позднем возрасте, которые мы не можем легко связать с предыдущими эпизодами коронавирусной инфекции.
Другие штаммы коронавируса, такие как HCoV-229E, также инфицируют первичные моноциты человека и активируют их (48). Эти инфицированные HCoV-229E моноциты после активации превратятся в макрофаги и могут проникнуть в ЦНС, особенно у пациентов с ослабленным иммунитетом. На моделях мышей было замечено, что HCoV-229E может проникать в ЦНС, используя в своих интересах среду с подавлением иммунитета (49). Сообщалось, что SARS-CoV-1, причинный фактор предыдущей эпидемии SARS, инфицировал моноциты, чтобы активировать их в макрофаги и дендритные клетки (50, 51).Эти отчеты предполагают, что коронавирусы разработали механизм гематогенного пути проникновения в ЦНС, и эти периферические популяции моноцитов-макрофагов могут служить резервуаром для поддержания их репликации в ЦНС. Имеются также сообщения о коронавирусной инфекции в эндотелиальных клетках головного мозга, показанные на моделях клеточных культур (52). Сообщалось, что SARS-CoV-1 инфицирует эндотелиальные клетки головного мозга человека (53). Существует несколько примеров гематогенного пути проникновения в ЦНС, однако также известно, что коронавирусы проходят путь нейрональной передачи.
На пути нейрональной передачи вирус обычно заражает нейроны, расположенные на периферии, и активно транспортирует себя, используя клеточный актин-миозиновый аппарат нейронов, чтобы проникнуть в ЦНС (54). Этот путь был подтвержден и в исследованиях на животных, где коронавирусы, такие как HCoV-OC43 и SARS-CoV-1, вводились мышам с помощью интраназальных инъекций. Сначала вирусы были обнаружены в дыхательных путях, а затем были обнаружены в ЦНС восприимчивых мышей, что подтвердило обонятельный путь, по которому они достигли ЦНС (55–58).Точно так же мышиный коронавирус (Mu-CoV) также попадает по обонятельному нерву в ЦНС (59). Экспериментально показано, что штамм HCoV-OC43 распространяется дальше от обонятельной луковицы в другие нервные области, такие как кора, гиппокамп и даже ствол мозга и спинной мозг (39). Этот обонятельный путь, используемый другими вирусами, такими как вирус гриппа, вирус болезни Борна и вирус простого герпеса, был подробно рассмотрен Мори и его коллегами (18).
Нейропатогенез, опосредованный коронавирусом
Рассуждения о вирусной этиологии распространенных неврологических заболеваний, таких как болезнь Паркинсона (БП), ADEM (острый диссеминированный энцефаломиелит) и рассеянный склероз (РС), в последнее время приобрели большую силу.В частности, с различными коронавирусами, такими как HCoV-229E и HCoV-OC43, обнаруживаемыми при болезни Паркинсона (PD), ADEM (острый диссеминированный энцефаломиелит) и головном мозге пациентов с рассеянным склерозом (MS), это теперь обсуждается как связующее звено между этими нейродегенеративными заболеваниями. заболевания и вирусные инфекции (43, 60). Было обнаружено, что даже мышиные коронавирусы, известные своей демиелинизацией у мышей, способствуют окислительному повреждению тканей при заболевании РС человека (61). Это обеспечило очень интересную, хотя и тревожную корреляцию, согласно которой длительные инфекции коронавирусом в ЦНС человека могут способствовать возникновению поражений, подобных РС.
Во время репликации и пролиферации коронавируса в эпителиальных клетках легких феномен альвеолярного газообмена серьезно затруднен из-за повреждения эпителиальных клеток легких (62). После этого недостаток кислорода во всем организме, включая ЦНС, может вызвать гипоксию. Он может активировать анаэробные метаболические пути и митохондриальные пути в головном мозге (63, 64). Возникающий в результате ацидоз в головном мозге может вызывать множественные дисфункции, такие как расширение сосудов головного мозга, отек мозга, интерстициальный отек, головные боли и застойные явления и т. Д. (65, 66).В тяжелых случаях это может привести к ухудшению функций мозга, сонливости, бульбарному отеку конъюнктивы и, в конечном итоге, к коме (67). Поскольку отчеты пациентов из Китая и Италии неизменно показывают, что у критических пациентов с SARS-CoV-2 часто развивается тяжелая гипоксия, вероятно последующее повреждение головного мозга.
Это может быть верно для стойких инфекций других коронавирусов в ЦНС, однако необходимы дополнительные экспериментальные данные, чтобы установить такую корреляцию для всех недавних коронавирусов, таких как SARS-CoV-1, MERS-CoV и SARS-CoV- 2.
Почему мозг «наиболее восприимчив» к цитокиновому шторму?
Цитокинов когда-то сравнивали с дождем. Поскольку умеренный и своевременный дождь необходим для поддержания жизни на Земле, точно так же базовое количество цитокинов действительно необходимо для множества клеточных и физиологических процессов в течение жизни организма (68, 69). Цитокиновый шторм — это состояние, при котором регуляторы воспалительного иммунного ответа и, следовательно, выработка цитокинов становятся несоразмерными и неуместными.Это приводит к образованию неконтролируемого количества воспалительных молекул. Цитокиновый шторм случается при множественных бактериальных и вирусных инфекциях и септических состояниях, однако термин «цитокиновый шторм» приобрел популярность только после обсуждения в контексте болезни гриппа в 2005 г. (70).
Этот чрезмерно активный врожденный иммунный ответ создает ситуацию «цитокинового шторма», что обычно означает, что уровни провоспалительных и противовоспалительных цитокинов высоки в сыворотке крови пациентов.Эти вспышки цитокинов обычно разрушительны для всех жизненно важных органов, таких как сердце, почки и легкие (рис. 2). Если такой сценарий происходит в головном мозге, это становится чрезвычайно разрушительным и еще больше открывает путь к менингиту, энцефалиту, менингоэнцефалиту и общим нейродегенеративным состояниям (68, 71). Ранее сообщалось, что многие вирусные инфекции ВИЧ-1, денге и других флавивирусов вызывают феномен цитокинового шторма в периферическом теле, который может достигать ЦНС либо через нарушение ГЭБ, либо иногда даже через транс- клеточного пересечения BBB (11, 72).Роль экзосом и других внеклеточных везикул в вирусной геморрагической лихорадке Денге также обсуждалась, чтобы подчеркнуть важность секреции экзосом в феномене цитокинового шторма (59). Даже вирусные белки, такие как ВИЧ-1 Tat, Nef и NS1 денге, циркулируют в кровотоке и запускают выработку и транспортировку цитокинов во многие органы, включая ЦНС (73–77). В конечном итоге все эти притоки периферических воспалительных молекул внутри ЦНС активируют резидентные макрофаги мозга, т.е.е., микроглия, которая становится гиперактивируемой и начинает продуцировать собственный набор воспалительных молекул и вызывает нейровоспаление. Весь этот процесс подготовки микроглии к действию известен как «праймирование микроглии».
Рис. 2. Множественная недостаточность органов из-за «цитокиновой бури». Мультяшное изображение того, как «Цитокиновый шторм», образующийся при респираторных вирусных инфекциях, может повредить не только первичный очаг инфекции (например, легкие), но также нарушить гомеостаз в почках, сердце, кишечнике, церебральной паренхиме и кровеносных сосудах из-за повсеместного распространения наличие рецепторов ACE2.В тяжелых случаях это приводит к полиорганной недостаточности и, в конечном итоге, к смерти пациентов.
«Нанесение микроглиальной грунтовки» может многое объяснить
Примечательно, что большинство хронических нейродегенеративных заболеваний связаны с неразрешенным воспалением, также называемым нейровоспалением. Этими заболеваниями в основном являются болезнь Альцгеймера (AD), рассеянный склероз (MS), болезнь Паркинсона (PD), болезнь Хантингтона (HD), ишемия и инсульты (67, 68). Многие исследователи объяснили феномен «микроглиального прайминга», когда микроглия подвергается размножению с последующей активацией и остается в этом «праймированном» состоянии в течение очень долгого времени (78).Это «праймирование» делает микроглию чрезвычайно восприимчивой к вторичным воспалительным стимулам. Даже небольшой молекулярный триггер может вызвать усиленный воспалительный ответ от примированной микроглии (78, 79). Экспериментально подтверждено, что TNFa и активация микроглии связаны положительной петлей обратной связи (79). Это объясняет, почему мозг так восприимчив к периферическому цитокиновому шторму, создаваемому любым путем, будь то бактериальным, вирусным или любыми другими воспалительными аномалиями, связанными со старением, такими как ревматоидный артрит.Цитокины, продуцируемые «примированной микроглией», представляют гораздо большую угрозу для нарушения гомеостаза ЦНС, чем системные воспалительные молекулы, добавленные из периферических моноцитов (68, 69).
Вторичный стимул, активирующий микроглию, может начаться в ЦНС многими способами, такими как нейровирусные инфекции или бактериальная инвазия. Однако было замечено, что состояния, которые способствуют системному воспалению, такие как диабет, ишемические состояния и артрит, являются основной причиной прайминга микроглии, и это особенно заметно у пожилых людей (80–82).Это подвергает пожилое население гораздо более высокому риску неврологических и когнитивных нарушений при воздействии респираторных и / или других периферических вирусных инфекций.
Помимо микроглии, астроциты и нейроны также могут продуцировать несколько цитокинов при воздействии внешних раздражителей (69, 78). Такие изменения церебрального гомеостаза в основном происходят в синапсах (78, 83–85). Синаптические аномалии ответственны за недостаточное обучение и память и нарушение нормального поведения (83–85).Это соединение системного воспаления с аномалиями ЦНС является сложным взаимодействием, однако в то же время оно дает нам обнадеживающее окно для лечения нейродегенеративных состояний, просто контролируя системное воспаление.
Теперь мы кратко перечислим неврологические аномалии, вызванные следующими вирусными захватчиками.
SARS-CoV
SARS-CoV-1 стал причиной эпидемий SARS в 2003, 2009 и 2012 годах, которые начались в Азии и распространились по всему миру. Этот вирус вызывает характерное респираторное заболевание, которое включает высокую температуру, сухой кашель и затрудненное дыхание, а также тяжелые случаи, проявляющиеся дыхательной недостаточностью и смертью (86).Этот коронавирус SARS возник из резервуара летучих мышей (87). Он заразил циветт пальмы в качестве промежуточного хозяина, а затем перешел на человека-хозяина (87). Всего произошло 8096 случаев инфицирования в 26 странах с высоким уровнем смертности ∼10%, в результате чего в общей сложности погибло 774 человека (88).
Как это произошло 17 лет назад, у исследовательских сообществ было достаточно времени, чтобы изучить непосредственное и долгосрочное воздействие SARS-CoV на ЦНС человека. Было обнаружено, что SARS-CoV вызывает множество неврологических аномалий, таких как энцефалит, ишемический инсульт аорты и полинейропатия (86).Интересно, что в большинстве случаев SARS-CoV при аутопсии наблюдались признаки отека мозга и менингеальной вазодилатации. Внутри мозга присутствие вирусных частиц SARS-CoV и их последовательностей РНК было идентифицировано одновременно с ишемическими изменениями нейронов, демиелинизирующими аномалиями, а также свидетельствами инфильтрации моноцитов и лимфоцитов в головном мозге (89). В таблице 2 представлен сравнительный процент пациентов с неврологическими расстройствами.
Таблица 2. Неврологические проявления респираторных вирусов.
МЕРС-КоВ
MERS-CoV — относительно недавний представитель семейства коронавирусов, выявленный в 2015 году на Аравийском полуострове. Он произошел от летучих мышей и много лет использовал верблюдов в качестве промежуточных хозяев, прежде чем перейти к человеческим хозяевам (90). Он имеет клинические результаты, аналогичные SARS-CoV, с типичными симптомами пневмонии, такими как высокая температура, кашель и одышка, которые часто приводят к острому респираторному дистресс-синдрому (ARDS), совокупно именуемому ближневосточным респираторным синдромом (MERS) (90). .Тяжелые состояния также включали септический шок из-за цитокинового шторма, который привел к полиорганной недостаточности и, в конечном итоге, к смерти (91). Этот вирус считается потенциальным нейроинвазивным вирусом на основании клинических и экспериментальных данных. Исследования показали, что почти у 25,7% пациентов с БВРС развилось безумие, и около 9% пациентов имели приступы судорог после инфекции БВРС-КоВ (92–94). Другое исследование также подтвердило эти тенденции и заявило, что почти у 20% пациентов наблюдались неврологические симптомы при инфекции БВРС-КоВ наряду с их обычным респираторным заболеванием.Эти симптомы включали потерю сознания, ишемические инсульты, синдром Гийена-Барре, паралич и другие инфекционные невропатические проявления.
SARS-CoV-2 / COVID-19
Последнее добавление нового коронавируса, впервые обнаруженного в 2019 году в китайском городе Ухань, было названо SARS-CoV-2 на основе анализа последовательности его генома (95, 96). Этот новый коронавирус имеет 79,5% сходства последовательностей с более ранним SARS-CoV и почти 50% сходства с MERS-CoV. SARS-CoV-2 вызывает симптомы, типичные для легочных респираторных заболеваний, такие как лихорадка различной степени, кашель и пневмония, с высоким риском полиорганной недостаточности с наблюдаемым до сих пор уровнем смертности около 4% (96).
ACE2 является установленным рецептором для многих коронавирусов человека и вируса гриппа (97, 98). Внутри ЦНС связывание SARS-CoV-2 с этим рецептором может вызвать повышение артериального давления и кровоизлияние в мозг. ACE2 также экспрессируется в эндотелии капилляров ЦНС; SARS-CoV-2 может связываться и преодолевать гематоэнцефалический барьер, чтобы проникнуть в ЦНС (99). Поскольку SARS-CoV-2 имеет почти 80% сходства геномной последовательности с предыдущим коронавирусом SARS, мы можем ожидать много сходства в различных белковых структурах и способах их патогенеза.
Неврологические аномалии, вызванные SARS-CoV-2
Поскольку пандемия все еще продолжается, клиницистам еще предстоит наблюдать долгосрочные вторичные эффекты инфекции SARS-CoV-2 на здоровье пациентов. Неврологические аномалии все еще регистрируются на уровне пациентов, а их молекулярные механизмы, исследования на животных моделях и клеточные данные еще предстоит выполнить и проверить. Клинические отчеты показали, что пациенты, инфицированные SARS-CoV-2, проявляют симптомы внутричерепной инфекции, такие как головная боль, потеря сознания, эпилептические припадки и т. Д.Большинство пациентов сообщили о потере обоняния и вкуса, о состоянии, известном как аносмия и дисгевзия (100–102). Интересно, что бессимптомные пациенты, у которых не было явных респираторных заболеваний, также испытывали эти неврологические симптомы (103–105). Многие китайские больницы постоянно сообщают, что новая инфекция SARS-CoV-2 поражает ЦНС пациентов, и у этих пациентов проявляются симптомы вирусного энцефалита (105). Данные секвенирования генома спинномозговой жидкости пациентов, инфицированных SARS-CoV-2, также выявили вирусные последовательности, которые добавили поддержку идее о том, что SARS-CoV-2 может проникать в ЦНС и, вероятно, быть причиной неврологических аномалий, связанных с болезнь (103–105).Однако прямая причинно-следственная связь между SARS-CoV-2 и неврологическими отклонениями еще предстоит установить экспериментально. Вероятно, что многие условно-патогенные микроорганизмы могут проникать через гематоэнцефалический барьер и вызывать вторичные внутричерепные инфекции. Это может быть причиной описанных выше симптомов головной боли, рвоты, извилин конечностей и нарушений сознания, очевидных у пациентов с тяжелой формой COVID-19. COVID-19 — это в первую очередь инфекция легких и вызывает массивный периферический «цитокиновый шторм», что частично объясняет, почему эта инфекция также может вызывать острое цереброваскулярное заболевание (106, 107).Другие отчеты пациентов также предполагают, что тяжелые инфекции SARS-CoV-2 часто связаны с повышенным уровнем D-димеров в крови и значительным снижением тромбоцитов, что снова дает некоторое объяснение того, почему пациенты подвергаются более высокому риску цереброваскулярных событий в их организме.
Коронавирусы человека имеют сильное сходство с нейроинвазивными коронавирусами животных, такими как PHEV (вирус гемагглютинирующего энцефалита свиней) (108), FCoV (коронавирус кошек) (109) и вирус JHM (110) в отношении структуры и способа репликации.Все эти коронавирусы животных могут проникать в ЦНС и вызывать множественные невропатологии. Из восьми зарегистрированных коронавирусов человека четыре из них, [HCoV-229E, HCoV-OC43 (21, 108), SARS-CoV (21, 36) и MERS-CoV (21, 36)], как сообщалось, являются нейроинвазивными. и нейротропный у людей. Это говорит о том, что в будущем мы будем наблюдать тяжелое бремя неврологических отклонений у пациентов с SARS-CoV-2. Пандемия SARS-CoV-2 также вызывает большее беспокойство, поскольку она уже заразила очень большое количество населения во всем мире (∼1
00) и все еще продолжается.
Возможные меры вмешательства и стратегии защиты от SARS-CoV-2 и COVID-19
Поскольку пандемия COVID-19 нанесла ущерб социально-экономической деятельности и человеческому взаимодействию во всем мире, миру необходимы срочные меры по сдерживанию и пресечению передачи вируса, а также получение эффективной вакцины в качестве долгосрочной цели. На основании имеющихся клинических и эпидемиологических данных Всемирная организация здравоохранения (ВОЗ) уже выпустила множество руководств, которые помогли разработать стратегии профилактики для подавления общей передачи вируса и уровня смертности от SARS-CoV-2.Контролируемое перемещение населения, более широкое распространение и быстрое тестирование с последующей изоляцией, а также более широкая доступность медицинских услуг для снижения смертности — вот несколько широко применяемых предложений, которые в значительной степени помогли контролировать это заболевание. Поскольку неврологические нарушения чаще встречались у тяжелобольных и критических пациентов с COVID-19 по сравнению с пациентами легкой степени (104), это предполагает, что ранняя диагностика, снижение вирусной нагрузки и подавление острого воспалительного ответа хозяина имеют первостепенное значение в борьбе с неврологическими заболеваниями. беспорядки.Поскольку неконтролируемый цитокиновый шторм обычно связан с полиорганной недостаточностью и ухудшением неврологических симптомов, основное внимание при оказании медицинской помощи пациентам с COVID-19 в значительной степени сместилось на смягчение воспалительных реакций хозяина (111). Некоторые препараты-кандидаты, такие как барицитиниб, федратиниб и руксолитиниб (противовоспалительные препараты, применяемые при ревматоидном артрите), гидроксихлорохин, азитромицин, ремдесивир (комбинация, используемая в качестве противовирусного лечения), комбинация лопинавира и ритонавира (LPV / r). Кортикостероиды для успокоения цитокиновых бурь, рекомбинантные интерфероны и многие другие популярные противораковые препараты были протестированы и, как сообщается, показали частичное облегчение в борьбе с общей тяжестью заболевания [подробно рассмотрено 111].
Вирус гриппа (IAV)
Вирусы гриппа относятся к семейству Orthomyxoviridae и содержат одноцепочечную РНК с отрицательным смыслом в качестве своего генома (112). На данный момент известно четыре различных типа вирусов гриппа: A, B, C и Thogotovirus. Однако только типы A и B клинически значимы для возникновения заболеваний человека (112). Симптомы характерны для респираторных заболеваний, таких как грипп, и включают озноб, простуду, головную боль, боли в мышцах и горле (113).Грипп вызывает широко распространенные сезонные эпидемии, поражающие 3-5 миллионов человек, из которых 10% могут привести к летальному исходу (114). Обычно он вызывает локализованную инфекцию верхних дыхательных путей, но в некоторых тяжелых случаях может поражать нижний отдел и вызывать симптомы, подобные пневмонии (115–117), и даже влиять на гомеостаз ЦНС (116, 117). Сообщалось, что инфекция гриппа может действовать как фактор, отягчающий болезнь Паркинсона (БП) (118). Экспериментальные исследования на мышах также показали, что вирус гриппа может усиливать ишемическое повреждение головного мозга, инициируя каскад цитокинов, и риск мозгового кровоизлияния через нарушение активатора плазминогена тканевого типа (119).
В случае инфекций гриппа имеется обширный анамнез пациентов, сообщающих о различных расстройствах ЦНС, что в совокупности предполагает, что вирус гриппа является потенциально нейротропным вирусом и способен вызывать долгосрочные неврологические последствия (116). Даже некоторые недавние вспышки и пандемия «свиного гриппа» 2009 г. также дали аналогичные указания на то, что неврологические последствия являются весьма вероятным последствием инфекции гриппа (120, 121). Несмотря на то, что они печально известны исходами респираторных заболеваний, их вторыми наиболее частыми проявлениями заболевания являются энцефалит и другие осложнения со стороны ЦНС, такие как атаксия, миелопатия, судороги и делирий, которые обычно появляются через 1 неделю после респираторных симптомов гриппа (120, 121).Многочисленные исследования подтвердили неврологические последовательности инфекций гриппа, таких как энцефалит, фебрильные судороги, синдром Рейе, острый энцефаломиелит (ADEM) и острая некротическая энцефалопатия у людей (121). Используя мышиные модели, было установлено, что вирус гриппа A проникает в ЦНС через обонятельный нервный путь и нарушает морфологию гиппокампа и уровни экспрессии синаптических регуляторных генов, изменяя познание и поведение хозяина (122). Он также может инфицировать эндотелиальные клетки микрососудов и разрушать ГЭБ, чтобы попасть в ЦНС (123).Однако в случае инфекции гриппа, что интересно, простая способность проникать в ЦНС не означает, что она является нейропатогенной (7). Лучше всего это было проиллюстрировано во время пандемии 2009 года, вызванной гриппом h2N1, который никогда не проникал в ЦНС, но, как было документально подтверждено, имел сильную связь с энцефалитом (124).
Однако этот парадокс можно объяснить с точки зрения нейровоспаления. Периферический «цитокиновый шторм», вызванный вирусными инфекциями, может объяснить, почему нейротропность не является важным критерием неврологических нарушений.Периферические цитокины могут перемещаться в ЦНС и косвенно активировать или запускать резидентную микроглию головного мозга (как объяснено в предыдущих разделах) (125, 126). В случае инфекции не нейротропного штамма h2N1 (A / PR / 8/34), который не мог проникнуть в ЦНС, но вызывал массивный центральный воспалительный ответ, изменял гиппокамп и вызывал последующий когнитивный дефицит у мышей (126) . В этом исследовании они проверили статус гиппокампа всего через 7 дней после заражения, однако остается интригующий вопрос относительно долгосрочных последствий невропатологии, связанной с гриппом.Другое исследование (127) также предоставило убедительные экспериментальные доказательства того, что обычный грипп (не нейротропный штамм) может изменять гиппокамп и влиять на поведение пациентов даже после того, как инфекция была устранена (127).
Вирус Нипах (NiV)
Вирус
Nipah (NiV) является одним из самых недавно появившихся представителей семейства парамиксовирусов и вызывает острые респираторные заболевания у человека-хозяина (128). В критических случаях также сообщается о проявлении некротического альвеолита, кровотечения, пневмонии и отека легких (129).Впервые он возник в Малайзии в 1998–1999 гг. И имеет очень высокий уровень смертности, до 40% (130). Иммуногистологические исследования пациентов со смертельным исходом подтвердили широко распространенное присутствие вирусных частиц и других антигенов NiV из эндотелия и гладкомышечных клеток сосудистой сети (131). Было обнаружено, что паренхимные клетки, такие как мышечные клетки и даже нейроны, обильно инфицированы NiV (131). В частности, эндотелиальные клетки и нейроны крови считаются основным очагом инфекции в ЦНС, а васкулит и тромбоз считаются критическими для патогенеза NiV (131, 132).Исследования на мышах подтвердили, что NiV проходит путь обонятельного нерва от носового эпителия к ЦНС (133). Сообщается, что NiV вызывает множество неврологических патологий, таких как спутанность сознания, двигательный дефицит, снижение сознания, судороги и фебрильный энцефалитный синдром (134).
Вирус кори (MV)
Вирус кори (MV) — это общее название рода Morbillivirus, принадлежащего к подсемейству Paramyxovirinae семейства Paramyxoviridae. MV попадает в категорию вирусов с оболочкой с геномом одноцепочечной РНК с отрицательным смыслом (135).Вирус кори — очень распространенный вирус, вызывающий респираторное заболевание с лихорадкой, простудой и застойными явлениями (135).
Предполагается, что
MV попадают в ЦНС обоими путями: гематогенным и нейрональным путями транспорта. Однако есть свидетельства того, что оба типа пути, по которому вирус MV достигает ЦНС. Нуклеокапсидный белок MV постоянно обнаруживается на пресинаптических мембранах инфицированных нейронов, что указывает на то, что MV может распространяться контактно-зависимым, транс- синаптическим способом.Парадокс их путешествия подробно рассмотрен Young et al. (136, 137). Это в основном самоизлечивающееся заболевание, однако, как сообщается, у многих тяжелых пациентов есть постинфекционный энцефаломиелит (PIE) или острый диссеминированный энцефаломиелит (ADEM) (136). У некоторых пациентов с ослабленным иммунитетом инфекция МК может привести к энцефалиту с тельцами включения (MIBE), который является вторичным осложнением ЦНС (138). Другая форма заболевания ЦНС, подострый склероз панэнцефалита (SSPE), также была связана с некоторыми критическими пациентами с МК.Это заболевание считается медленно прогрессирующим неврологическим заболеванием, которое проявляется только через 6–10 лет после инфицирования МК (135–137).
Заключение, будущие направления и новые идеи
В этой обзорной статье мы обсудили, как респираторные вирусы используют клетки обонятельного нерва, а иногда даже гематогенный путь для достижения ЦНС. Происходит случайное повреждение нескольких органов, таких как мозг, почки и сердце, хотя легкие остаются основным полем битвы. Периферические цитокиновые бури, повышенное повреждение гипоксией и воспалительная активация клеток ЦНС, таких как микроглия, играют ключевую роль в причинении неврологического ущерба пациентам, инфицированным респираторными вирусами.В этой обзорной статье представлена компиляция ранее известных взаимосвязей респираторных вирусов и нарушения гомеостаза ЦНС. В частности, было показано, что все предыдущие члены семейства коронавирусов ухудшают неврологическое здоровье в качестве долгосрочных последствий. SARS-CoV-2 уже заразил более 19 миллионов человек по всему миру и убил более 700000 человек во всем мире. В будущем очень большое количество пациентов с SARS-CoV-2, вероятно, столкнется с множеством неврологических отклонений.
Необходимо приложить глобальные усилия не только к мерам эпидемиологического смягчения, таким как контроль массовых перемещений людей, межконтинентальные путешествия и разработка эффективных вакцин, но и к сбору дополнительных данных о нейротропизме, нарушении биологии глиальных клеток и роли микроглии в усилении цитокинового шторма SARS-CoV-2. В наших предыдущих работах было конкретно выяснено, как вирусная инфекция (ВИЧ-1, DENV, JEV и т. Д.) Или даже вирусные токсичные белки могут преодолевать гематоэнцефалический барьер и усугублять нейровоспалительный ответ в ЦНС.В нашей предыдущей работе мы также подчеркнули, что внеклеточные везикулы, высвобождаемые периферическими иммунными клетками после заражения вирусом денге, обладают способностью запускать феномен цитокинового шторма в ЦНС. Эти недавние работы дают нам больше подсказок о том, как мы можем заблокировать взаимосвязи периферийных клеток и ЦНС. Мы можем продолжить изучение биологии трафика, чтобы контролировать секрецию внеклеточных везикул, которая передает сигналы и активаторы транскрипции между органами. Мы также можем изучить различные временные меры для регулирования проницаемости ГЭБ, чтобы можно было проверить переход SARS-CoV-2 в ЦНС.Следует изучить усилители иммунитета слизистых оболочек, которые могут содержать SARS-CoV-2 на самих эпителиальных поверхностях и не позволять им проникать во все жизненно важные органы хозяина, включая ЦНС.
Это понимание даст нам возможность принять гораздо более целостный подход к управлению неврологическим здоровьем, пока острая фаза SARS-Cov-2 все еще продолжается, чтобы улучшить качество жизни SARS-CoV-2 и другие респираторные пациенты.
Взносы авторов
RM и AB концептуализировали структуру этой обзорной статьи, исправили, прочитали и доработали статью.Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
RM является стипендиатом программы DST-INSPIRE Fellowship – Правительство Индии. AB является почетным ученым в Национальном институте иммунологии и стипендиатом Институционального финансирования NII, DBT и ICMR, Нью-Дели, Индия.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарны за все исследования, проведенные во всем мире для разрешения этого загадочного сценария неврологических патологий, вызванных респираторными вирусами. Мы также приносим извинения за то, что из-за ограниченного пространства мы не смогли добавить их все в эту обзорную статью.
Ссылки
1. Desforges M, le Coupanec A, Brison É, Meessen-Pinard M, Talbot PJ. Респираторные коронавирусы человека: нейроинвазивные, нейротропные и потенциально нейровирулентные патогены. Virologie. (2014) 18: 5–16. DOI: 10.1684 / vir.2014.0544
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Генри Дж., Смэйн Р.Дж., Джанг Х., Миллер Б., Окун М.С. Паркинсонизм и неврологические проявления гриппа на протяжении 20 и 21 веков. Разлад, связанный с паркинсонизмом. (2010) 16: 566–71. DOI: 10.1016 / j.parkreldis.2010.06.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Barbosa-Silva MC, Santos LE, Rangel B.Воздействие ненейротропных штаммов гриппа на мозг: роль микроглиального прайминга? J Neurosci. (2018) 38: 7758–60. DOI: 10.1523 / JNEUROSCI.1368-18.2018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Гордон Дж., Галлия Г.Л., дель Валле Л., Амини С., Халили К. Полиомавирус человека JCV и экспрессия генов миелина. J Neurovirol. (2000) 6 (Дополнение 2): S92–7.
Google Scholar
9. Суонсон П., МакГэверн Д. Порталы проникновения вирусов в центральную нервную систему.В кн .: Редактор К Доровини-Зис. Гематоэнцефалический барьер при здоровье и болезнях. (Том 2), ABoca Raton, FL: CRC Press. (2015). DOI: 10.1201 / b19299-3
CrossRef Полный текст | Google Scholar
10. Ли Ф, Ван И, Ю Л, Цао С., Ван К., Юань Дж. И др. Вирусная инфекция центральной нервной системы и нейровоспаление предшествуют нарушению гематоэнцефалического барьера при инфицировании вирусом японского энцефалита. J Virol. (2015) 89: 5602–14. DOI: 10.1128 / jvi.00143-15
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11.Мишра Р., Сингх СК. ВИЧ-1 Tat C модулирует экспрессию miRNA-101 для подавления VE-кадгерина в эндотелиальных клетках микрососудов головного мозга человека. J Neurosci. (2013) 33: 5992–6000. DOI: 10.1523 / JNEUROSCI.4796-12.2013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Дам Т., Рудольф Х., Шверк С., Шротен Х., Тененбаум Т. Нейроинвазия и воспаление при вирусных инфекциях центральной нервной системы. Медиаторы воспаления. (2016) 2016: 8562805. DOI: 10.1155/2016/8562805
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Люти Л.Н., Эриксон А.К., Йесудхасан П.Р., Икизлер М., Дермоди Т.С., Пфайффер Дж.К. Сравнение трех нейротропных вирусов показывает различия в распространении вируса в центральную нервную систему. Вирусология. (2016) 487: 1–10. DOI: 10.1016 / j.virol.2015.09.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Венцель BM. Обоняние. В: Редактор А. М. Фреда. Психохирургические проблемы. Абингдон: Группа Тейлор и Фрэнсис. (1952) 107–109. DOI: 10.4324 / 9781315008998-14
CrossRef Полный текст | Google Scholar
17. Бушдид К., Магнаско М.О., Фоссхалл Л. Наука. (2014) 343, 1370–72. DOI: 10.1038 / природа.2014.14904
CrossRef Полный текст | Google Scholar
19.Baig AM, Khaleeq A, Ali U, Syeda H. Доказательства воздействия вируса COVID-19 на ЦНС: распределение в тканях, взаимодействие вируса-хозяина и предполагаемые нейротропные механизмы. ACS Chem Neurosci. (2020) 11: 995–8. DOI: 10.1021 / acschemneuro.0c00122
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Кайе Р., Чанг К.В.Д., Казахая К., Бреретон Дж., Деннени Дж. Инструмент отчетности об аносмии COVID-19: первые результаты. Otolaryngol Head Neck Surg. (2020) 163: 132–4.DOI: 10.1177 / 0194599820922992
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. de Wit E, van Doremalen N, Falzarano D, Munster VJ. SARS и MERS: последние сведения о новых коронавирусах. Nat Rev Microbiol. (2016) 14: 523–34. DOI: 10.1038 / nrmicro.2016.81
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Li YC, Bai WZ, Hashikawa T. Нейроинвазивный потенциал SARS-CoV2 может быть, по крайней мере, частично ответственен за дыхательную недостаточность у пациентов с COVID-19. J Med Virol. (2020) 92: 552–5. DOI: 10.1002 / jmv.25728
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Dijkman R, Jebbink MF, Koekkoek SM, Deijs M, Jonsdottir HR, Molenkamp R, et al. Выделение и характеристика существующих штаммов коронавируса человека в первичных культурах эпителиальных клеток человека выявили различия в тропизме клеток-мишеней. J Virol. (2013) 87: 6081–90. DOI: 10.1128 / jvi.03368-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24.Meyding Lamade U, Strank C. Герпесвирусные инфекции центральной нервной системы у пациентов с ослабленным иммунитетом. Ther Adv Neurol Disord. (2012) 5: 279–96. DOI: 10.1177 / 1756285612456234
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Матье К., Поль С., Сечи Дж., Трайкович-Боденнек С., Девергнас С., Рауль Х. и др. Вирус Nipah использует лейкоциты для эффективного распространения в организме хозяина. J Virol. (2011) 85: 7863–71. DOI: 10.1128 / jvi.00549-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26.Чавес А.Дж., Вергара-Алерт Дж., Бускетс Н., Валле Р., Ривас Р., Рамис А. и др. Нейроинвазия высокопатогенного вируса гриппа H7N1 вызвана нарушением гематоэнцефалического барьера на птичьей модели. PLoS One. (2014) 9: e115138. DOI: 10.1371 / journal.pone.0115138
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. van Riel D, Leijten LM, Verdijk RM, GeurtsvanKessel C, van der Vries E, van Rossum AMC, et al. Доказательства инвазии вируса гриппа в ЦНС по обонятельному пути у ребенка с ослабленным иммунитетом. J Infect Dis. (2014) 210: 419–23. DOI: 10.1093 / infdis / jiu097
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Ладлоу М., Кортекаас Дж., Херден С., Хоффманн Б., Таппе Д., Требст С. и др. Нейротропные вирусные инфекции как причина немедленной и отсроченной невропатологии. Acta Neuropathol. (2016) 131: 159–84. DOI: 10.1007 / s00401-015-1511-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Mohammed AKH, Maehlen J, Magnusson O, Fonnum F, Kristensson K.Стойкие изменения в поведении и серотонине в головном мозге при старении у крыс, перенесших инфекцию носовых инфекций у младенцев. Neurobiol Aging. (1992) 13: 83–7. DOI: 10.1016 / 0197-4580 (92)
-N
CrossRef Полный текст | Google Scholar
31. Блондель Б., Колбер-Гарапин Ф., Кудерк Т., Виротиус А., Гивель-Бенхассин Ф. Полиовирус, патогенез полиомиелита и апоптоз. Curr Top Microbiol Immunol. (2005) 289: 25–56. DOI: 10.1007 / 3-540-27320-4_2
CrossRef Полный текст | Google Scholar
33.Штайнер I, Кеннеди П.Г., Пахнер А.Р. Нейротропные вирусы герпеса: простой герпес и ветряная оспа. Lancet Neurol. (2007) 6: 1015–28. DOI: 10.1016 / S1474-4422 (07) 70267-3
CrossRef Полный текст | Google Scholar
34. Ан Д. Г., Шин Х. Дж., Ким М. Х., Ли С., Ким Х. С., Мён Дж и др. Текущее состояние эпидемиологической диагностики, лечения и вакцин от нового коронавирусного заболевания 2019 г. (COVID-19). J Microbiol Biotechnol. (2020) 30: 313–24. DOI: 10.4014 / jmb.2003.03011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Zhai P, Ding Y, Wu X, Long J, Zhong Y, Li Y. Эпидемиология, диагностика и лечение COVID-19. Int J Antimicrob Agents. (2020) 55: 105955. DOI: 10.1016 / j.ijantimicag.2020.105955
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Петросилло Н., Вице-Конте Дж., Эргонул О., Ипполито Дж., Петерсен Э. COVID-19, SARS и MERS: тесно связаны ли они? Clin Microbiol Infect. (2020) 26: 729–34. DOI: 10.1016 / j.cmi.2020.03.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Goh KJ, Choong MC, Cheong EH, Kalimuddin S, Duu Wen S, Phua GC, et al. Быстрое прогрессирование до острого респираторного дистресс-синдрома: обзор современного понимания критического заболевания, вызванного инфекцией COVID-19. Ann Acad Med Singapore. (2020) 49: 108–18.
Google Scholar
38. Борди Л., Никастри Е., Скорцолини Л., ди Каро А., Капобианки М. Р., Кастиллетти С. и др.Дифференциальная диагностика заболеваний у пациентов, находящихся под обследованием на новый коронавирус (SARS-CoV-2), Италия, февраль 2020 г. Еврононадзор. (2020) 25: 2000170. DOI: 10.2807 / 1560-7917.ES.2020.25.8.2000170
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Пойяджи Н., Шахин Г., Нуджаим Д., Стоун М., Патель С., Гриффит Б. Острая геморрагическая некротическая энцефалопатия, связанная с COVID-19: особенности КТ и МРТ. Радиология. (2020) 296: E119–20.DOI: 10.1148 / radiol.2020201187
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Эллул М.А., Бенджамин Л., Сингх Б., Лант С., Майкл Б.Д., Истон А. и др. Неврологические ассоциации COVID-19. Lancet Neurol. (2020) 19: 767–83. DOI: 10.1016 / S1474-4422 (20) 30221-0
CrossRef Полный текст | Google Scholar
41. Wu Y, Xu X, Chen Z, Duan J, Hashimoto K, Yang L, et al. Поражение нервной системы после заражения COVID-19 и другими коронавирусами. Brain Behav Immun. (2020) 87: 18–22. DOI: 10.1016 / j.bbi.2020.03.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Ромоли М., Елчич И., Бернар-Валнет Р., Гарсия Азорин Д., Мансинелли Л., Ахвледиани Т. и др. Систематический обзор неврологических проявлений инфекции SARS-CoV-2: дьявол кроется в деталях. Eur J Neurol. (2020). 27: 1712–26. DOI: 10.1111 / ene.14382
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44.Arbor N, Ekandé S, Côté G, Lachance C, Chagnon F, Tardieu M и др. Стойкая инфекция человеческих олигодендроцитарных и нейроглиальных клеточных линий человеческим коронавирусом 229E. J Virol. (1999) 73: 3326–37. DOI: 10.1128 / jvi.73.4.3326-3337.1999
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Arbor N, Côté, G Lachance, C. Tardieu, M Cashman NR, Talbot PJ. Острая и стойкая инфекция линий нервных клеток человека коронавирусом человека OC43. J Virol. (1999) 73: 3338–50. DOI: 10.1128 / jvi.73.4.3338-3350.1999
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Arbor N, Talbot PJ. Стойкое инфицирование линий нервных клеток коронавирусами человека. Adv Exp Med Biol. (1998) 440: 575–81. DOI: 10.1007 / 978-1-4615-5331-1_75
CrossRef Полный текст | Google Scholar
47. Джакоми Х., Фрагосо Г., Алмазан Г., Мушински В.Е., Талбот П.Дж. Инфекция человеческого коронавируса OC43 вызывает хронический энцефалит, приводящий к инвалидности у мышей BALB / C. Вирусология. (2006) 349: 335–46. DOI: 10.1016 / j.virol.2006.01.049
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Desforges M, Miletti TC, Gagnon M, Talbot PJ. Активация моноцитов человека после заражения коронавирусом человека 229Е. Virus Res. (2007) 130: 228–40. DOI: 10.1016 / j.virusres.2007.06.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Лассниг С., Санчес К.М., Эгербахер М., Вальтер И., Майер С., Кольбе Т. и др.Разработка модели трансгенной мыши, чувствительной к коронавирусу человека 229E. Proc Natl Acad Sci USA. (2005) 102: 8275–80. DOI: 10.1073 / pnas.0408589102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Шпигель М, Шнайдер К., Вебер Ф, Вайдманн М, Хьюферт Ф. Взаимодействие коронавируса, ассоциированного с тяжелым острым респираторным синдромом, с дендритными клетками. J Gen Virol. (2006) 87 (Pt 7): 1953–60. DOI: 10.1099 / vir.0.81624-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52.Кабирак Г.Ф., Мюррей Р.С., Маклафлин Л.Б., Сколник Д.М., Хог Б., Доровини-Зис К. и др. Взаимодействие коронавирусов in vitro с эндотелиальными клетками микрососудов головного мозга приматов и человека. Adv Exp Med Biol. (1995) 380: 79–88. DOI: 10.1007 / 978-1-4615-1899-0_11
CrossRef Полный текст | Google Scholar
53. Dubé, M, le Coupanec A, Wong AHM, Rini JM, Desforges M, Talbot PJ. Аксональный транспорт обеспечивает распространение коронавируса человека OC43 от нейрона к нейрону. J Virol. (2018) 92: e404–18. DOI: 10.1128 / jvi.00404-18
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. McCray PB, Pewe L, Wohlford-Lenane C., Hickey M, Manzel L, Shi L, et al. Смертельная инфекция мышей K18-hACE2, инфицированных коронавирусом тяжелого острого респираторного синдрома. J Virol. (2007) 81: 813–21. DOI: 10.1128 / jvi.02012-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Батлер Н., Пью Л., Трандем К., Перлман С.Мышиный энцефалит, вызванный HCoV-OC43, коронавирусом человека с широкой видовой специфичностью, частично является иммуноопосредованным. Вирусология. (2006) 347: 410–21. DOI: 10.1016 / j.virol.2005.11.044
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Сен-Жан-младший, Жакоми Х., Дефорж М., Вабре А., Фреймут Ф., Талбот П.Дж. Респираторный коронавирус человека OC43: генетическая стабильность и нейроинвазия. J Virol. (2004) 78: 8824–34. DOI: 10.1128 / jvi.78.16.8824-8834.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Нетланд Дж., Мейерхольц Д.К., Мур С., Касселл М., Перлман С. Тяжелая инфекция, вызванная коронавирусом острого респираторного синдрома, вызывает гибель нейронов в отсутствие энцефалита у мышей, трансгенных по человеческому ACE2. J Virol. (2008) 82: 7264–75. DOI: 10.1128 / jvi.00737-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Yeh EA, Collins A, Cohen ME, Duffner PK, Faden H. Обнаружение коронавируса в центральной нервной системе у ребенка с острым диссеминированным энцефаломиелитом. Педиатрия. (2004) 113: e73–6. DOI: 10.1542 / педс.113.1.e73
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Schuh C., Wimmer I., Hametner S, Haider L, van Dam AM, Liblau RS, et al. Окислительное повреждение тканей при рассеянном склерозе лишь частично отражается на экспериментальных моделях болезни. Acta Neuropathol. (2014) 128: 247–66. DOI: 10.1007 / s00401-014-1263-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62.He L, Ding Y, Zhang Q, Che X, He Y, Shen H и др. Экспрессия повышенных уровней провоспалительных цитокинов в клетках ACE2 +, инфицированных SARS-CoV, у пациентов с SARS: связь с острым повреждением легких и патогенезом SARS. J Pathol. (2006) 210: 288–97. DOI: 10.1002 / путь.2067
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Делиа Р.В., Харрисон К., Ойстон П.К., Лукашевски Р.А., Кларк Г.К. Ориентация на «цитокиновый шторм» с терапевтической пользой. Clin Vaccine Immunol. (2013) 20: 319–27. DOI: 10.1128 / CVI.00636-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. Mishra R, Sood V, Banerjea AC. NS5 денге модулирует экспрессию miR-590 для регулирования убиквитин-специфической пептидазы 42 в микроглии человека. FASEB Bioadv. (2019) 1: 265–78. DOI: 10.1096 / fba.2018-00047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Мишра Р., Чхатбар С., Сингх С.К. ВИЧ-1 Tat C-опосредованная регуляция фактора-3, ассоциированного с рецептором фактора некроза опухоли, с помощью микроРНК 32 в микроглии человека. J Neuroinflamm. (2012) 9: 131. DOI: 10.1186 / 1742-2094-9-131
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Ниранджан Р., Мутукумаравел С., Джамбулингам П. Вовлечение нейровоспаления в вирусное заболевание денге: важность врожденного и адаптивного иммунитета. Нейроиммуномодуляция. (2019) 26: 111–8. DOI: 10.1159 / 000501209
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75. Zheng Z, Yang J, Jiang X, Liu Y, Zhang X, Li M, et al.Неструктурный белок NS5 вируса клещевого энцефалита индуцирует экспрессию RANTES в зависимости от активности РНК-зависимой РНК-полимеразы. J Immunol. (2018) 201: 53–68. DOI: 10.4049 / jimmunol.1701507
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Amaral DCG, Rachid MA, Vilela MC, Campos RDL, Ferreira GP, Rodrigues DH, et al. Внутримозговая инфекция вирусом денге-3 вызывает менингоэнцефалит и изменения поведения, которые предшествуют летальному исходу у мышей. J Neuroinflamm. (2011) 8:23. DOI: 10.1186 / 1742-2094-8-23
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. ван Марл Г., Генри С., Тодорук Т., Салливан А., Сильва С., Рурк С.Б. и др. Белок Nef вируса иммунодефицита человека 1 типа опосредует гибель нервных клеток: нейротоксическая роль IP-10. Вирусология. (2004) 329: 302–18. DOI: 10.1016 / j.virol.2004.08.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79.Куно Р., Ван Дж., Каванокучи Дж., Такеучи Х., Мизуно Т., Судзумура А. Аутокринная активация микроглии фактором некроза опухоли-α. J Neuroimmunol. (2005) 162: 89–96. DOI: 10.1016 / j.jneuroim.2005.01.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80. Перри В. Х., Тилинг Дж. Микроглия и макрофаги центральной нервной системы: вклад прайминга микроглии и системного воспаления в хроническую нейродегенерацию. Semin Immunopathol. (2013) 35: 601–12.DOI: 10.1007 / s00281-013-0382-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Каннингем С., Кэмпион С., Ланнон К., Мюррей К.Л., Вудс Дж.Ф.К., Дикон Р.М.Дж. и др. Системное воспаление вызывает острые поведенческие и когнитивные изменения и ускоряет нейродегенеративное заболевание. Biol Psychiatry. (2009) 65: 304–12. DOI: 10.1016 / j.biopsych.2008.07.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82. Импей Б, Каусон А.Е., Агьеманг-Премпе А, Бейли Дж.Л., Вершуур С., Ньюман Т.А.Способствует ли системное воспаление прогрессированию возрастной потери слуха? GLIA. (2013). DOI: 10.1002 / glia.22530
CrossRef Полный текст | Google Scholar
83. Моррис Г.П., Кларк И.А., Зинн Р., Виссел Б. Микроглия: новый рубеж для исследований синаптической пластичности, обучения и памяти, а также нейродегенеративных заболеваний. Neurobiol Learn Mem. (2013) 105: 40–53. DOI: 10.1016 / j.nlm.2013.07.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84.Лю Т., Кларк Р.К., Макдоннелл П.К., Молодой PR, Белый РФ, Барон ФК и др. Экспрессия фактора некроза опухоли-α в ишемизированных нейронах. Инсульт. (1994) 25: 1481–8. DOI: 10.1161 / 01.STR.25.7.1481
CrossRef Полный текст | Google Scholar
86. Tsai LK, Hsieh ST, Chang YC. Неврологические проявления при тяжелом остром респираторном синдроме. Acta Neurol Тайвань. (2005) 14: 113–9. DOI: 10.29819 / ANT.200509.0002
CrossRef Полный текст | Google Scholar
89.Хуан Д.З., Ланг З.В., Вэнь Т., Хэ LX, Се Л., Чжоу Ю.С. Обнаружение РНК коронавируса SARS в тканях легких пациентов с тяжелым острым респираторным синдромом с помощью полимеразной цепной реакции обратной транскрипции in situ. Chin J Microbiol Immunol. (2004) 10: 311–6. DOI: 10.3201 / eid1002.030759
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Саад М., Омрани А.С., Баиг К., Бахлул А., Эльзейн Ф., Матин М.А. и др. Клинические аспекты и исходы у 70 пациентов с коронавирусной инфекцией ближневосточного респираторного синдрома: опыт одного центра в Саудовской Аравии. Int J Infect Dis. (2014) 29: 301–6. DOI: 10.1016 / j.ijid.2014.09.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. Ким Дж. Э., Хео Дж. Х., Ким Хо, Сон Ш., Пак С. С., Пак Т. Х. и др. Неврологические осложнения при лечении ближневосточного респираторного синдрома. J Clin Neurol. (2017) 13: 227–33. DOI: 10.3988 / jcn.2017.13.3.227
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Ву А, Пэн И, Хуанг Б., Дин Х, Ван Х, Ниу П и др.Состав генома и дивергенция нового коронавируса (2019-nCoV), происходящего из Китая. Клеточный микроб-хозяин. (2020) 27: 325–8. DOI: 10.1016 / j.chom.2020.02.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Кумар С., Маурья В.К., Прасад АК, Бхатт MLB, Саксена СК. Структурные, гликозилированные и антигенные вариации между новым коронавирусом 2019 года. (2019-nCoV) и коронавирус SARS (SARS-CoV). Вирусная болезнь. (2020) 31: 13–21. DOI: 10.1007 / s13337-020-00571-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97.Янь Р., Чжан И, Ли И, Ся Л., Го И, Чжоу К. Структурная основа распознавания SARS-CoV-2 полноразмерным человеческим ACE2. Наука. (2020) 367: 1444–8. DOI: 10.1126 / science.abb2762
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. Вход в клетки SARS-CoV-2 зависит от ACE2 и TMPRSS2 и блокируется клинически доказанным ингибитором протеазы. Cell. (2020) 181: 271–80.DOI: 10.1016 / j.cell.2020.02.052
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99. Хэмминг И., Таймс В., Бултуис MLC, Lely AT, Navis GJ, ван Гур Х. Распределение в тканях белка ACE2, функционального рецептора коронавируса SARS. Первый шаг к пониманию патогенеза SARS. J Pathol. (2004) 203: 631–7. DOI: 10.1002 / путь.1570
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Moein ST, Hashemian SMR, Mansourafshar B, Khorram-Tousi A, Tabarsi P, Doty RL.Нарушение обоняния: биомаркер COVID-19. Int Forum Allergy Rhinol. (2020) 10: 944–50. DOI: 10.1002 / alr.22587
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101. Ян С.Х., Фараджи Ф., Праджапати Д.П., Острандер Б.Т., DeConde AS. Самостоятельная потеря обоняния связана с амбулаторным клиническим течением Covid-19. Int Forum Allergy Rhinol. (2020) 10: 821–31. DOI: 10.1002 / alr.22592
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102.Хопкинс С., Кумар Н. Потеря обоняния как маркер инфекции COVID-19. Лондон: Ent Uk. (2020).
Google Scholar
103. Мао Л., Ван М., Чен С., Хе Ц., Чанг Дж., Хун С. и др. Неврологические проявления у госпитализированных пациентов с COVID-19 в Ухане, Китай: ретроспективное исследование серии случаев. ССРН Электрон Ж. (2020). DOI: 10.2139 / ssrn.3544840
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Мао Л., Цзинь Х., Ван М., Ху Й., Чен С., Хе Ц. и др.Неврологические проявления госпитализированных пациентов с коронавирусной болезнью 2019 г. в Ухане, Китай. JAMA Neurol. (2020) 77: 1–9. DOI: 10.1001 / jamaneurol.2020.1127
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Chen C, Zhang XR, Ju ZY, He WF. Достижения в исследовании механизма цитокинового шторма, вызванного коронавирусной болезнью 2019, и соответствующих иммунотерапевтических методов. Чжунхуа Шао Шан За Чжи. (2020) 36: 471–5. DOI: 10,3760 / см.j.cn501120-20200224-00088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107. Мехта П., Маколи Д.Ф., Браун М., Санчес Е., Таттерсолл Р.С., Мэнсон Дж. Дж. COVID-19: рассмотрите синдромы цитокинового шторма и иммуносупрессию. Ланцет. (2020) 395: 1033–4. DOI: 10.1016 / S0140-6736 (20) 30628-0
CrossRef Полный текст | Google Scholar
108. Mora-Díaz JC, Piñeyro PE, Houston E, Zimmerman J, Giménez-Lirola LG. Вирус гемагглютинирующего энцефаломиелита свиней: обзор. Front Vet Sci. (2019) 6:53. DOI: 10.3389 / fvets.2019.00053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109. Foley JE, Rand C, Leutenegger C. Воспаление и изменения уровней цитокинов при неврологическом инфекционном перитоните кошек. J Feline Med Surg. (2003) 5: 313–22. DOI: 10.1016 / S1098-612X (03) 00048-2
CrossRef Полный текст | Google Scholar
110. Ламперт П. В., Симс Дж. К., Князев А. Дж. Механизм демиелинизации при вирусном энцефаломиелите JHM — электронно-микроскопические исследования. Acta Neuropathol. (1973) 24: 76–85. DOI: 10.1007 / BF006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Kuiken T, Riteau B, Fouchier RAM, Rimmelzwaan GF. Патогенез вирусных инфекций гриппа: хорошее, плохое и уродливое. Curr Opin Virol. (2012) 2: 276–86. DOI: 10.1016 / j.coviro.2012.02.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
116. Штудаль М. Вирус гриппа и проявления ЦНС. J Clin Virol. (2003) 28: 225–32. DOI: 10.1016 / S1386-6532 (03) 00119-7
CrossRef Полный текст | Google Scholar
117. Джанг Х., Больц Д., Штурм-Рамирес К., Шепард К.Р., Цзяо Й., Вебстер Р. и др. Высокопатогенный вирус гриппа H5N1 может проникать в центральную нервную систему и вызывать нейровоспаление и нейродегенерацию. Proc Natl Acad Sci USA. (2009) 106: 14063–8. DOI: 10.1073 / pnas.0
6106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119.Мухаммад С., Хаасбах Э., Котчурко М., Стригли А., Кренц А., Риддер Д.А. и др. Инфекция вирусом гриппа усугубляет исход инсульта. Инсульт. (2011) 42: 783–91. DOI: 10.1161 / STROKEAHA.110.596783
PubMed Аннотация | CrossRef Полный текст | Google Scholar
121. Бриттон П.Н., Блит С.К., Макартни К., Дейл Р.К., Ли-Ким-Мой Дж., Кхандакер Г. и др. Спектр и бремя связанных с гриппом неврологических заболеваний у детей: комбинированный дозорный эпиднадзор за энцефалитом и гриппом в Австралии, 2013-2015 гг. Clin Infect Dis. (2017) 65: 653–60. DOI: 10.1093 / cid / cix412
PubMed Аннотация | CrossRef Полный текст | Google Scholar
122. Юргенс Х.А., Аманчерла К., Джонсон Р.В. 146. Влияние инфекции гриппа на активацию микроглии и морфологию нейронов в гиппокампе мышей. Brain Behav Immun. (2011) 25 (Дополнение 2): S221. DOI: 10.1016 / j.bbi.2011.07.149
CrossRef Полный текст | Google Scholar
123. Чан MCW, Чан RWY, Yu WCL, Ho CCC, Chui WH, Lo CK и др.Инфекция вирусом гриппа H5N1 поляризованных клеток альвеолярного эпителия человека и эндотелиальных клеток микрососудов легких. Respir Res. (2009) 10: 102. DOI: 10.1186 / 1465-9921-10-102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
124. Садасиван С., Занин М., О’Брайен К., Шульц-Черри С., Смейн Р.Дж. Индукция активации микроглии после заражения ненейротропным вирусом гриппа A / CA / 04/2009 h2N1. PLoS One. (2015) 10: e0124047. DOI: 10.1371 / journal.pone.0124047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
126. Юргенс Х.А., Аманчерла К., Джонсон Р.В. Инфекция гриппа вызывает нейровоспаление и влияет на структуру и функцию гиппокампа. Proquest Diss Theses. (2012) 32: 3958–68. DOI: 10.1523 / JNEUROSCI.6389-11.2012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
127. Хоссейни С., Вилк Э., Михаэльсен-Преусс К., Герхаузер И., Баумгертнер В., Гефферс Р. и др.Длительное нейровоспаление, вызванное вирусной инфекцией гриппа, и влияние на морфологию и функцию нейронов гиппокампа. J Neurosci. (2018) 38: 3060–80. DOI: 10.1523 / JNEUROSCI.1740-17.2018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
130. Парашар Ю.Д., Сунн Л.М., Онг Ф., Маунтс А.В., Ариф М.Т., Ксиазек Т.Г. и др. Исследование факторов риска инфицирования человека новым зоонозным парамиксовирусом, вирусом нипах, методом случай-контроль во время вспышки тяжелого энцефалита в 1998–1999 гг. В Малайзии. J Infect Dis. (2000) 181: 1755–9. DOI: 10.1086 / 315457
PubMed Аннотация | CrossRef Полный текст | Google Scholar
131. Wong KT, Shieh WJ, Kumar S, Norain K, Abdullah W., Guarner J, et al. Инфекция вирусом Нипах: патология и патогенез зарождающегося парамиксовирусного зооноза. Am J Pathol. (2002) 161: 2153–67. DOI: 10.1016 / s0002-9440 (10) 64493-8
CrossRef Полный текст | Google Scholar
133. Мюнстер В.Дж., Прескотт Дж. Б., Бушмейкер Т., Лонг Д., Розенке Р., Томас Т. и др.Быстрое проникновение вируса Нипах в центральную нервную систему хомяков обонятельным путем. Научный доклад (2012) 2: 736. DOI: 10.1038 / srep00736
PubMed Аннотация | CrossRef Полный текст | Google Scholar
134. Bellini WJ, Harcourt BH, Bowden N, Rota PA. Вирус Нипах: новый парамиксовирус, вызывающий тяжелый энцефалит у людей. J Neurovirol. (2005) 11: 481–7. DOI: 10.1080 / 13550280500187435
PubMed Аннотация | CrossRef Полный текст | Google Scholar
137.Молодой В.А., Ралль Г.Ф. Попадание в синапс: вирус кори распространяется в нейронах и между ними. Curr Top Microbiol Immunol. (2009) 330: 3–30. DOI: 10.1007 / 978-3-540-70617-5_1
CrossRef Полный текст | Google Scholar
138. O’Donnell LA, Rall GF. Нейровирология голубой луны: достоинства изучения редких заболеваний ЦНС вирусного происхождения. J Neuroimmune Pharmacol. (2010) 5: 443–55. DOI: 10.1007 / s11481-010-9200-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Новые и вновь появляющиеся вирусы, поражающие нервную систему | Неврологические исследования и практика
Рост торговли, привычки путешествовать, урбанизация и изменение климата являются одними из факторов, которые способствуют эволюции и распространению новых патогенов.Инфекционные заболевания возникают или возобновляются каждый год. Нейроинфекционные заболевания могут возникать в виде вспышек в небольших локализованных регионах или могут быстро распространяться на большие географические районы. Эпидемия возникает, когда инфекционное заболевание быстро распространяется среди многих людей, например, вспышка вируса Зика. Пандемия — это глобальная вспышка болезни, как видно, например, по ВИЧ / СПИДу. Недавние вспышки, вызванные вирусом чикунгунья, вирусом Западного Нила, энтеровирусной инфекцией и эболавирусом, вызвали серьезные неврологические проявления и быстро распространились по континентам.Эндемические заболевания присутствуют постоянно, обычно в небольшом количестве. Нейроинфекционные заболевания, передаваемые вирусами, могут вызывать широкий спектр неврологических проявлений, таких как менингит, энцефалит, менингоэнцефалит, синдромы Гийана-Барре, а также инсульты. Часто у этих пациентов остаются тяжелые неврологические последствия. В обязательном порядке неврологи знакомы с текущими событиями, включая типичные и атипичные проявления неврологических инфекций у путешественников, а также рекомендации по диагностике и лечению.Чтобы избежать летальных исходов и долгосрочных последствий, специализированная неврологическая интенсивная терапия имеет решающее значение для выживания.
Нейротропные вирусы могут проникать в мозг через ретроградный аксональный транспорт, гематогенное распространение через гематоэнцефалический барьер (ГЭБ) или через распространение инфицированных лейкоцитов через ГЭБ в паренхиму мозга. В патогенезе нейротропных патогенов гематоэнцефалический барьер играет жизненно важную роль, контролируя доступ циркулирующих молекул, иммунных клеток или вирусов в центральную нервную систему.ГЭБ не является непроницаемым, и нейротропные вирусы эволюционировали, чтобы разрушать и ускользать. Но известно, что некоторые из вирусов способны проникать в паренхиму мозга как «троянский конь»: ретроградный аксональный транспорт флавивируса после укуса комара обеспечивает такой нейроинвазивный путь. Семафорины (секретируемые, трансмембранные и связанные с гликозилфосфатидилинозитом белки) действуют как потенциальный рецептор входа. Вирусная инфекция увеличивает уровни металлопротеиназы и фактора некроза опухоли, что облегчает проникновение инфицированных нейтрофилов в ЦНС.Флавивирусы, такие как вирус Западного Нила, вирус денге, вирус японского энцефалита B, могут использовать этот путь для проникновения в ЦНС. Попадание вируса в межклеточную среду включает изменение экспрессии или фосфорилирования белков плотных контактов, нарушение базальной пластинки и нарушение актинового цитоскелета.
Многие вирусы, вызывающие неврологические расстройства, принадлежат к семейству Adenoviridae, арбовирусов (вирус, переносимый членистоногими), , Arenaviridae, Herpesviridae, Picornaviridae, Paramyxoviridae , а также Togaviridae .С последних нескольких лет также обсуждались Bornaviridae (Bornavirus), как возможно связанные с психическими расстройствами. В 2015 году новая линия (борнавирус пестрой белки 1, VSBV-1) была подтверждена как возбудитель энцефалита у людей.
Арбовирусы передаются членистоногими, около 100 из них являются патогенами человека, что представляет серьезную проблему для общественного здравоохранения во многих частях мира. Термин арбовирус включает множество различных генетически неоднородных вирусов, определяемых только передачей через членистоногих.
Арбовирусы размножаются у позвоночных, захватываются членистоногими, например, кровососущими насекомыми или клещами, во время виремии и передаются позвоночным через укус или веревку. Чтобы выжить в плохих климатических условиях, вирусы частично перезимовывают у членистоногих. За некоторыми исключениями люди и домашние животные, такие как кошки и собаки, не являются носителями арбовирусной инфекции [6].
Flavivirus, семейство Flaviviridae , относится к наиболее важным развивающимся вирусам во всем мире и включает более 70 различных типов вирусов.Флавивирусы используют одноцепочечную мРНК и трансформируются в белки-предшественники, которые включают металлопротеиназы, как структурные, так и неструктурные белки.
Флавивирусы используют комаров, таких как Aedes spp. , комары или клещи Culex ( Ixodidae, Argasidae ) в качестве переносчиков. Вирусы, переносимые насекомыми, обычно имеют определенные эндемичные географические районы, где заболеваемость в основном зависит от времени года. Флавивирусы присутствуют на шести разных континентах, и глобальное распространение флавивирусов динамично [17].
Вирус денге (DENV), вирус Зика (ZIKV), вирус чикунгунья, японский энцефалит, клещевой энцефалит, вирус Западного Нила и энцефалит Сент-Луиса являются одними из наиболее распространенных флавивирусных инфекций, в которые вовлечена ЦНС. . Азиатский тигровый комар является важным переносчиком арбовирусов, комара желтой лихорадки ( Aedes aegypti ). Среди более чем 22 типов вирусов, которые могут передаваться через Aedes albopictus , находятся вирусы чикунгуньи, денге, желтой лихорадки и вирусы Западного Нила.На Рисунке 1 показано текущее распределение комаров Aedes. Первоначально комары Aedes были впервые обнаружены в Африке, распространились в Юго-Восточную Азию, а в последние десятилетия — в основном по всему миру.
Рис. 1
Распространение комаров Aedes (создано с помощью mapchart.net 27.10.2018)
Название flavivirus происходит от первого вируса (желтая лихорадка), для которого был обнаружен путь, связанный с насекомыми (flavus, лат. : желтый) [24, 25].
Из-за тесной взаимосвязи, а также совместной циркуляции в одних и тех же географических регионах могут возникать коинфекции с несколькими арбовирусами.Сообщалось о случаях коинфекции вируса чикунгунья (CHIKV) и вируса денге (DENV), а также коинфекции вируса Зика (ZIKV) и CHIKV [14, 23, 27].
Однако неясно, происходит ли коинфекция через один или несколько укусов комаров.
Goertz et al. исследовали потенциал Ae. aegypti для передачи как ZIKV, так и CHIKV за один укус. По их результатам, 12% комаров передают ZIKV и CHIKV за один укус, одновременное пероральное воздействие обоих вирусов не изменило инфекцию и скорость передачи по сравнению с воздействием одного вируса.[10]. Также сообщалось о некоторых случаях тройной инфекции ZIKV, CHIKV и DENV (Wagoner et al .; [4, 26]).
Вирусные инфекции могут вызывать прямое вирусное опосредованное повреждение клеток, а также аутоиммунные расстройства. Другой механизм — это так называемое усиление иммунитета — после первичного заражения одним подтипом вируса Денге и повторного заражения другим подтипом вируса Денге происходит обострение симптомов и тяжелые неврологические проявления [20, 21].
Инфекция нервной системы вирусом денге (DENV)
Таксономия, виды, морфология, геном, размножение, патогенез, вирулентность, передача
Денге является членом семейства Flaviviridae и имеет одноцепочечную положительную РНК, с четырьмя известными серотипами, от DENV-1 до DENV-4.DENV передается Aedes spp. ( Aedes aegypti, Aedes albopictus ), но не все виды Aedes spp. передает каждый серотип из-за их генетических вариаций.
Комары без рецепторного белка R67 / R64 в эпителиальных клетках кишечника не способны передавать DENV 1–4. Через укус инфицированного комара DENV попадает в кровоток и проникает в макрофаги. Макрофаги переносят вирус по лимфатическим каналам в лимфатические узлы, где он размножается.У пациента с виремией содержится от 10 8 до 10 9 инфекционных частиц на мл крови, и виремия длится в среднем от 4 до 5 дней. Эндотелиальные клетки и, возможно, также клетки костного мозга восприимчивы к инфекции. Предыдущая инфекция DENV 1–4 с последующим заражением другим из четырех серотипов DENV может привести к более серьезным заболеваниям, что, возможно, объясняется усилением иммунитета [20].
Сравнивая аминокислотные последовательности их белков E четырех серотипов DENV, они показывают 63–68% гомологии между различными серотипами.Гомология между различными вариантами серотипа DENV составляет более 90%. Частично DENV-специфические антитела перекрестно реагируют с другими серотипами DHF и DSS. Из-за своего низкого сродства они не обладают нейтрализующим действием, но обеспечивают предпочтительное, более эффективное поглощение клетками вирусов, образующих комплекс с АК, посредством взаимодействия с рецепторами Fc на моноцитах и макрофагах (перекрестно реагирующие молекулы IgG увеличивают инфекционное заболевание). Осман и др. провели исследование частоты серотипов инфекции DENV в Брунее-Даруссаламе, Юго-Восточная Азия.Преобладающим серотипом для Брунея является DENV-2, за которым следует DENV-1. [22], пациенты, путешествующие, например, в Малайзию и заразившиеся другим DENV, ожидают более тяжелых заболеваний, вероятнее всего, явления, называемого иммуноусилением [3].
Эпидемиология
В 1992 году лихорадка денге (ЛД) все еще рассматривалась Всемирной организацией здравоохранения (ВОЗ) как одна из забытых болезней. С тех пор произошли кардинальные перемены: теперь это заболевание считается одним из самых серьезных инфекционных заболеваний, имеющих масштабы пандемии.Общая заболеваемость увеличилась более чем в 30 раз за последние 50 лет. Например, в Германии в Институт Роберта Коха (RKI) было зарегистрировано 957 случаев заболевания в 2016 году и 635 случаев в 2017 году. В 2018 году до октября в РКИ поступило 367 дел. Ежегодное количество случаев во всем мире оценивается примерно в 390 миллионов. Денге является эндемическим заболеванием более чем в 100 странах Африки, Америки, Восточного Средиземноморья, Юго-Восточной Азии и Западной части Тихого океана. Наиболее серьезно пострадали регионы Северной и Южной Америки, Юго-Восточной Азии и Западной части Тихого океана.
Клинические проявления
Время инкубации составляет от 3 до 14 дней. Инфекции денге обычно клинически легкие или даже часто бессимптомны. К неврологическим осложнениям относятся менингит и энцефалит. Пациенты сначала жалуются на лихорадку, головную боль, боль в мышцах и суставах и сыпь. Обычно наблюдается резкое повышение температуры. Часто возникают головная боль, сильная боль в мышцах и суставах, брадикардия, гипотензия, лимфаденопатия, называемая ломкой. Может случиться второй пик лихорадки с экзантемой тела, а также петехиями.В целом течение болезни короткое и резкое, но описаны длительные периоды реконвалесценции с сильным истощением, которые могут длиться неделями. Регулярно появляются пациенты с сопутствующим гепатитом с умеренным повышением уровня трансаминаз. Примерно в 10% случаев поражается нервная система. Наиболее частыми неврологическими проявлениями инфекции DENV являются энцефалит, менингит, инсульты и мозжечковое кровотечение, синдром Гийена-Барре, миозит также может быть вызван DENV.
Особенно в этой группе после окончания острого заболевания часто появляется выраженная усталость в течение нескольких недель в виде синдрома истощения.Повышенная проницаемость стенок кровеносных капилляров, а также тромбоцитопения являются причиной геморрагической лихорадки денге (DHF) и шокового синдрома денге (DSS). ДГФ имеет в основном симптомы, сходные с симптомами ДФ, за которыми следует короткая ремиссия. До внезапного обострения, характеризующегося гипотонией и нарушением кровообращения, причиной DHF являются боли в животе, рвота, беспокойство, нарушение сознания или внезапный переход от лихорадки к гипотермии. Петехии на коже и слизистых оболочках возникают вследствие низкого количества тромбоцитов и дисфункциональных тромбоцитов.Могут возникнуть внутричерепное кровотечение, геморрагическая пневмония и желудочно-кишечное кровотечение. DSS следует за неблагоприятным течением DHF с в основном летальным исходом. DHF вызывается факторами хозяина, такими как предыдущая инфекция DENV и возраст <15 лет. DHF и DSS являются типичными вторичными заболеваниями после предыдущей первичной инфекции, посредством которых различные серотипы связывают первоначально нацеленные на денге антитела с поверхностью нового серотипа, не имея возможности нейтрализовать его. Вирус «замаскирован» для другого иммунного ответа, его размножение и пролиферация благоприятствуют, это может привести к серьезному течению заболевания с тенденцией к кровотечению и повреждением сосудов.DENV также был обнаружен в таких органах, как легкие, печень, почки и желудочно-кишечный тракт.
Дифференциальный диагноз
Зика, вирусная лихорадка, лихорадка Западного Нила, а также другие вирусы, передаваемые членистоногими, и малярия или лептоспироз, синдром Гийена-Барре, инсульт [8].
Диагностика
Исследование спинномозговой жидкости имеет решающее значение для диагностики, здесь ИФА является золотым стандартом, также может быть проведена ОТ-ПЦР. Обычно у пациентов наблюдается тромбоцитопения.Возможно повышение трансаминаз и лимфоцитоз. В сомнительных случаях необходимо повторить ЦСЖ, если возможно из-за тромбоцитопении. Триа: сыпь, тромбоцитопения и сильные головные боли, боли в мышцах и суставах являются характеристиками для диагностики лихорадки Денге.
Лечение
Противовирусная терапия недоступна. Инфекция DENV лечится симптоматически. Очень важно раннее распознавание тяжелых осложнений, например, вторичных по отношению к дисфункции тромбоцитов и тромбоцитопении.Рекомендуется лечение в специализированном неврологическом отделении интенсивной терапии, при миелите или менингоэнцефалите реанимация неврологической помощи спасает жизнь.
Прогноз
Пациенты с ДФ в целом имеют хороший прогноз. Пациенты с тяжелой формой DHF часто прогрессируют до DSS с высокой смертностью.
Вакцинация
По рекомендации ВОЗ страны должны рассматривать вакцину против денге только в тех случаях, когда эпидемиология предполагает высокое бремя болезни, для использования у лиц в возрасте 9–45 лет, полные рекомендации можно найти в выпусках ВОЗ.Глобальной вакцинации против DENV не существует, поскольку с апреля 2018 года ВОЗ пересмотрела рекомендации для эндемичных регионов.
Нипах-вирус (NiV)
Таксономия, виды, морфология, геном, репродукция, патогенез, вирулентность, передача
Нипах-вирус — новый вирус, переносимый летучими мышами, относится к парамиксовирусам, группе отрицательного смысла, одиночным вирусы с цепной РНК. Парамиксовирусы традиционно ассоциируются с группой вирусов, которые имеют узкий круг хозяев и обычно вызывают вспышки заболеваний с низким уровнем смертности [15].Плодовые летучие мыши (виды Pteropus) передают Nipah, но количество случаев передачи вируса Nipah от человека к человеку увеличилось, например в Бангладеш [28].
Эпидемиология
Название Nipah происходит от малайского Kampung Sungai, здесь вирус был выделен впервые [5]. Вспышки NiV происходят в регионе Юго-Восточной Азии почти ежегодно с серьезными заболеваниями и высокими показателями смертности.
Первая признанная вспышка NiV произошла в 1998 году в Малайзии, где были инфицированы люди и свиньи, из-за транспортировки инфицированных свиней вирус был также обнаружен в других регионах Малайзии.Передача NiV в это время происходила от свиньи к человеку, и после уничтожения около 900 000 свиней эпидемия была остановлена [1]. Австралия, Бангладеш, Камбоджа, Китай, Индия, Индонезия, Мадагаскар, Тайвань и Таиланд — это страны, о которых сообщается о риске вспышки, основанном на серологических данных или молекулярном обнаружении у крылоногих летучих мышей. Летучие мыши Pteropus являются коренными жителями Бутана, Брунея, Китая, Индонезии, Лаоса, Мадагаскара, Мьянмы, Непала, Филиппин, Сингапура, Тайваня, Таиланда и Вьетнама.
Клинические проявления
Инкубационный период составляет от 3 до 31 дня, в среднем 7 дней.
Большинство пациентов обращаются с острым энцефалитом, лихорадкой, головными болями и изменением сознания. Во время эпидемии в Малайзии пациенты также страдали гриппоподобным синдромом. По данным Всемирной организации здравоохранения (ВОЗ) уровень смертности оценивается в 40–75%, при этом во время вспышек могут возникать колебания в зависимости от местных возможностей клинического ведения. Например, уровень смертности от последней вспышки в Керале, Индия, составил 86%.
Во время эпидемий в Малайзии в среднем через 10 дней наступала смерть.Через несколько недель у некоторых пациентов случился рецидив.
Дифференциальный диагноз
Другие возбудители энцефалита, такие как японский энцефалит, вирус простого герпеса типа 1, энцефалит, вирус денге.
Диагноз
Исследование спинномозговой жидкости имеет решающее значение. Для специфической диагностики могут использоваться выделение вируса, электронная микроскопия, иммуно-электронная микроскопия, иммуногистохимия, серология и ПЦР. Обратите внимание, что для работы с NiV доступны только специальные лаборатории (уровень биобезопасности 4- BSL4).Специфическое обнаружение может быть выполнено с помощью спинномозговой жидкости, сыворотки, крови, а также мазков. Для целей эпиднадзора и диагностики были разработаны три теста, не требующие BSL4: ELISA (иммуноферментный анализ), мультиплексный тест с жидким белком и вирус псевдотипа (были разработаны различные псевдотипы, несущие белки F и G, для обнаружения вирусспецифических антител. ).
Нейрорадиология: магнитно-резонансная томография (МРТ) не позволяет отличить другие вирусные энцефалиты. Нарушения, наблюдаемые при МРТ, представляют собой множественные небольшие асимметричные очаговые поражения в подкорковом и глубоком белом веществе без окружающих отеков.Поражение ствола мозга является обычным явлением.
Лечение
Специального лечения не существует. Специализированная неврологическая интенсивная терапия имеет важное значение для выживания и прогноза. Рибавирин, который ингибирует репликацию вируса Хендра in vitro, использовался эмпирически во время вспышки в Малайзии. Недавние модели на животных показали, что рибавирин подавляет распространение вируса in vitro, но не in vivo. В модели на животных рибавирин отсрочил смерть от вирусного заболевания у NiV-инфицированных животных примерно на 5 дней [9].
Прогноз
Исследования in vivo показали, что рибаварин, возможно, эффективен для снижения смертности. Из пациентов, переживших NiV энцефалит, 20% имеют остаточный неврологический дефицит, включая когнитивные трудности, тетрапарез, мозжечковые симптомы, паралич нервов и клиническую депрессию.
Прививки
Коммерческой вакцины нет.
Вирус японского энцефалита B (JEV)
Таксономия, виды, морфология, геном, размножение, патогенез, вирулентность, передача
JEV принадлежит к Flaviviridae с одноцепочечной РНК.ЯВЭ передается москитами Culex, обычно Culex tritaeniorhynchus , которые размножаются на рисовых полях и в других источниках воды. Обычно это энзоотический цикл, тупиковым хозяином для вируса являются люди. После заражения вирус размножается в лимфоидной ткани. Отсюда происходит виремическое распространение и вторжение в ЦНС. Воспаление возникает при очаговом некрозе нервных клеток, нейроглии и периваскулярных лимфоцитарных инфильтратах.
Эпидемиология
ЯЭ является эндемическим заболеванием в Южной и Юго-Восточной Азии.Менее чем у 1% людей клинические признаки развиваются после инкубации, примерно у 20% пациентов с симптомами развивается энцефалит со смертельным исходом.
Клинические проявления
Инкубационный период составляет около 5–15 дней. Клинически пациенты могут иметь гриппоподобное заболевание. Это может сопровождаться очаговыми неврологическими признаками, острым вялым параличом и, как следствие, тяжелым опасным для жизни энцефалитом. У пациентов, переживших энцефалит или острый вялый паралич, часто наблюдаются значительные неврологические последствия.
Дифференциальный диагноз
Другие болезни, вызванные вирусом членистоногих, с таким же географическим распространением комаров, как лихорадка Чикунгунья [7, 18].
Диагноз
Обследование спинномозговой жидкости необходимо. Доступен экспресс-тест для обнаружения антител IgM, с помощью которого можно тестировать сыворотку и плазму. В дальнейшем можно обнаружить увеличение титров IgG. Нейрорадиологическое обследование может выявить поражение таламуса и базальных ганглиев.
Лечение
Противовирусных препаратов нет.Решающее значение имеют специализированные неврологические препараты для интенсивной терапии.
Прогноз
Примерно 50% тяжелых случаев заканчиваются летальным исходом, 44% случаев легкого или умеренного течения имеют полное выздоровление, 31% имеют стойкие и тяжелые неврологические последствия, включая хронические судороги, двигательную дисфункцию и психоневрологические симптомы.
Вакцинация
Имеется вакцина против ЯЭ, она рекомендована людям, живущим в эндемичных регионах или путешествующим в них. Для Европы инактивированная вакцина i.м. одобрена, первичная иммунизация состоит из двух доз с интервалом 28 дней. Европейское Медицинское Агентство рекомендует ревакцинацию для взрослых, подвергшихся воздействию, в течение первого года.
Инактивированная вакцина, полученная из мозга мышей, теперь заменена вакцинами на основе клеточных культур. Доступны четыре типа вакцин на основе клеточных культур. Живая аттенуированная вакцина (штамм SA 14–14-2), наиболее распространенная в Китае, где первая доза вводится подкожно в 8 месяцев, а затем — бустерная доза в возрасте 2 лет.Инактивированная вакцина с квасцовым адъювантом на основе клеток веро (штамм SA 14–14-2), две внутримышечные дозы с интервалом в 4 недели, ревакцинация рекомендуется через 1 год. Третий — инактивированная вакцина, полученная из клеток веро (штамм Пекин-1), с первичной иммунизацией тремя дозами с интервалом в 4 недели. Живая химерная вакцина (с желтой лихорадкой 17D в качестве основы) рекомендуется только разовая доза, необходимость в ревакцинации еще не определена.
Вирус болезни Борна (BDV)
Таксономия, виды, морфология, геном, размножение, патогенез, вирулентность, передача
BDV является членом семейства Bornaviridae с отрицательной одноцепочечной несегментированной РНК.Наиболее вероятный естественный путь проникновения — это нервные окончания в носовой и глоточной оболочках. Инфекционная доза при естественной инфекции неизвестна, равно как и передача от инфицированных животных человеку. Вертикальная передача подтверждена для животных и людей.
Эпидемиология
В 1700-х годах болезнь борна была впервые описана в европейских ветеринарных учебниках как болезнь сельскохозяйственных лошадей с такими названиями, как горячая болезнь (немецкий: Hitzige Kopfkrankheit) или эпидемический энцефаломиелит (немецкий: Seuchenhafte Gehirn-Rückenmarksentzündzündzündzündzünd).Название болезни Борна было дано после крупных вспышек болезни в 1894–1896 гг. В районе Борна в Саксонии, Германия.
BDV был первым членом нового семейства Bornaviridae в порядке Mononegavirales , в течение первого десятилетия двадцать первого века новый BDV, теперь известный как птичий борнавирус (ABV), был идентифицирован у попугаев с провентрикулярным болезнь дилатации. Как известно в ветеринарии на протяжении многих десятилетий, недавно появившийся вирус был идентифицирован как возбудитель смертельного энцефалита у людей.В период с 2011 по 2013 год у трех заводчиков пестролистных белок ( Scirus variegatoides ) был энцефалит со схожими признаками и симптомами со смертельным исходом через два-четыре месяца после начала заболевания. Филогенетический анализ показал, что вирус образует линию, отдельную от известных видов борнавирусов, предварительно названных борнавирусами пестрой белки 1 (VSBV-1) [13].
Клинические проявления
Для людей, инфицированных вирусом Борна, точное время инкубации не указано. Исследования на животных показали симптомы заболевания через две-три недели.
Неврологические признаки могут быть сложными и разнообразными, разнообразие инфекций ЦНС может привести к сопоставимой клинической картине.
Недавно опубликованные случаи заболевания людей имели аналогичные симптомы. У всех были энцефалит, лихорадка, качественная и количественная потеря сознания с начальными мозжечковыми симптомами, миоклонические подергивания и парез черепных нервов [13].
Дифференциальный диагноз
Необходимо учитывать клещевой энцефалит, бешенство, ботулизм в регионах с флавивирусом, передаваемым членистоногими.
Диагноз
Исследование спинномозговой жидкости имеет решающее значение. Диагноз можно подтвердить с помощью BDV-специфических антител в сыворотке и CSF или BDV-специфических антигенов, обнаружения РНК в крови или CSF. Вестерн-блоттинг, ELISA и непрямой иммунофлуоресцентный анализ (IFA) были признаны серологическими тестами. ИФА считается наиболее надежным методом с высокой чувствительностью и специфичностью.
Лечение
Специального лечения не существует. Для выживания необходима специальная неврологическая интенсивная терапия.
Вакцинация
Вакцинация отсутствует. Поскольку вакцинация животных ненадежна, дальнейшие исследования вакцин для человека в настоящее время не проводятся.
Вирус Западного Нила (WNV)
Таксономия, виды, морфология, геном, размножение, патогенез, вирулентность, передача
WNV принадлежит к роду Flavivirus и передается москитами culex в энзоотическом цикле. WNV содержит ss-РНК, которая кодирует белки капсида (C), оболочки (E), премембраны (prM), а также семь неструктурных белков.Существует несколько генетических линий от WNV, линии 1 и 2 ответственны за основные эпидемии среди людей. Репликация происходит на месте инокуляции, после чего вирус распространяется на лимфатические узлы и кровоток. Проникновение вируса в ЦНС, по-видимому, следует за стимуляцией толл-подобных рецепторов и повышенным уровнем фактора некроза опухоли-α (TNF-α), TNF-α увеличивает проницаемость гематоэнцефалического барьера. WNV напрямую поражает нейроны, особенно в глубоких ядрах и сером веществе ствола и спинного мозга.
Эпидемиология
Первая изоляция WNV произошла в 1937 году в районе Западного Нила в Уганде. Исторически во всем мире случались спорадические вспышки. С 1999 г. было зарегистрировано большое количество вспышек в Северной Америке, Южной и Восточной Европе, где ежегодно случаются более мелкие вспышки.
Клинические проявления
Большинство инфекций ВЗН протекают субклинически и примерно в 80% случаев бессимптомны [5].
Время инкубации составляет 2–14 дней, часто лихорадка Западного Нила проходит самостоятельно.Классическими симптомами лихорадки Западного Нила являются острое начало лихорадки, головная боль, утомляемость, недомогание, мышечные боли и слабость. Редкие случаи — желудочно-кишечные симптомы и преходящая макулярная сыпь на туловище и конечностях. У некоторых пациентов развиваются гепатит, панкреатит, миокардит, рабдомолиз, орхит и глазные проявления. Примерно у <1% развиваются неврологические осложнения, такие как менингит или энцефалит. WNV-инфекция спинномозговых мотонейронов (клеток переднего рога) вызывает острый асимметричный вялый паралич (AFP), аналогичный полиомиелиту.ОВП встречается примерно у 13% пациентов с неврологическими нарушениями [5]. Заболеваемость менингоэнцефалитом выше в старшей возрастной группе.
Дифференциальный диагноз
Другие болезни, вызванные вирусом членистоногих, с таким же географическим распространением комаров, как лихорадка чикунгунья и лихорадка денге.
Диагноз
Исследование спинномозговой жидкости имеет решающее значение. Пациенты с нейроинвазивными заболеваниями обычно имеют лимфоцитарный плеоцитоз в спинномозговой жидкости, нейтрофилы могут преобладать на ранней стадии заболевания.Лабораторная диагностика из спинномозговой жидкости и образцов крови включает ОТ-ПЦР и анализ IgM / IgG.
МРТ часто бывает нормальным, но аномалии сигналов в базальных ганглиях, таламусе и стволе мозга могут наблюдаться у пациентов с энцефалитом, аномалии сигналов в переднем отделе спинного мозга у пациентов с полиомиелитоподобным синдромом.
Лечение
Специфического лечения WNV-инфекции не существует. Специализированная неврологическая интенсивная терапия имеет решающее значение для выживания. Пациентам с тяжелым менингитом часто требуется обезболивание, противорвотная терапия и регидратация при тошноте и рвоте.При тяжелых синдромах энцефалита пациенты должны наблюдаться на предмет развития повышенного внутричерепного давления и судорог. Пациенты с параличом или энцефалитом должны находиться под наблюдением на предмет неспособности защитить дыхательные пути. Может быстро развиться острая нервно-мышечная дыхательная недостаточность, особенно может потребоваться искусственная вентиляция легких.
Сообщалось об отдельных пациентах, у которых рассматривались рибаварин, интерферон-α, WNV-специфический иммуноглобулин и соединения, нацеленные на антисмысловые гены, но клинических исследований не проводилось.
Вакцинация
Вакцинация для людей отсутствует. Используются четыре ветеринарные прививки.
Вирус Зика (ZIKV)
Таксономия, виды, морфология, геном, размножение, патогенез, вирулентность, передача
Вирус Зика относится к флавивирусам, это положительный вирус с одноцепочечной РНК. Геном ZIKV включает две некодирующие области и одну область, кодирующую полипротеин, который расщепляется на десять белков, включая капсид, предшественник мембраны и оболочку, а также семь неструктурных белков.ZIKV проникает в клетки-хозяева за счет эндоцитоза, инициируемого при взаимодействии гликопротеина оболочки вируса с рецепторами клеточной поверхности. Комары Aedes передают ZIKV, в основном Aedes aegypti , он также может передаваться от матери к плоду при половом контакте, переливании крови и продуктов крови и трансплантации органов [2, 11, 16].
Эпидемиология
В 1947 году ZIKV был обнаружен в лесу Зика в Уганде, Африка. Первая крупная вспышка была зарегистрирована в 2007 году на острове Яп в Микронезии, после чего вирус быстро распространился на страны Юго-Восточной Азии (Французская Полинезия в 2013 году, Остров Кука и Остров Пасхи в 2014 году), в период с 2015 по 2017 год наблюдалось резкое увеличение ZIKV. случаев в Южной Америке, о том, что Всемирная организация здравоохранения объявила чрезвычайную ситуацию в области здравоохранения в период с 02/2016 по 11/2016.
Клинические проявления
Расчетное время инкубации составляет от трех до 14 дней. Обычно симптомы легкие, включая лихорадку, сыпь, конъюнктивит, боль в мышцах и суставах, недомогание или головную боль. У большинства инфицированных людей симптомы отсутствуют. Неврологические осложнения, такие как синдром Гийана-Барре, невропатия и миелит, могут возникать как у взрослых, так и у детей.
ЗИКВ может вызывать врожденные синдромы у беременных. Между тем была подтверждена причинная связь между инфекцией ZIKV у беременных женщин и последующими пороками развития, такими как микроцефалия и тяжелое повреждение головного мозга.Вирус проходит через плацентарный барьер, заражая нервные клетки плода, реплицируясь и вызывая тяжелые неврологические осложнения [19].
Дифференциальный диагноз
Большинство флавивирусов из того же географического региона, что и DENV и CHIKV.
Диагностика
Доступно несколько диагностических инструментов, включая анализ ОТ-ПЦР в реальном времени (рОТ-ПЦР) и MAC-ELISA. РНК NAT следует проводить с образцами сыворотки и мочи.
В течение первой недели болезни развиваются ZIKV-специфические IgM и нейтрализующие антитела, уровни IgM изменчивы, но обычно положительные ближе к 4-му дню появления симптомов.
Иммуноферментный анализ с захватом антител IgM (MAC-ELISA) используется для качественного определения антител IgM в сыворотке или спинномозговой жидкости.
Лечение
Поскольку специфической противовирусной терапии нет, лечение носит симптоматический характер.
Вакцинация
Вакцины нет, защита от укусов комаров является ключевой профилактикой.
Вирус чикунгуньи (CHIKV)
Таксономия, виды, морфология, геном, репродукция, патогенез, вирулентность, передача
Вирус чикунгунья также относится к вирусам, передаваемым членистоногими (семейство Togaviridae , род ) Alphaviridae, род эндемические инфекции.CHIKV передается Ae. aegypti и Ae. albopictus , несмотря на это, CHIKV может передаваться от виремической матери ребенку во время родов. Во всем мире известны три филогенетических линии CHIKV с различными антигенными характеристиками, две основные линии циркулируют в Африке, а третья — в Азии. Передающий конкретный вариант африканской линии Ae. albopictus считается высококвалифицированным. В вирусе произошла замена одной аминокислоты с аланина на валин, что приводит к лучшей адаптации вируса в Ae.albopictus [12] .
Эпидемиология
Первая изоляция от людей и комаров произошла во время вспышки в приграничном районе между Мозамбиком и Танзанией в 1952 году. В 2013 году CHIKV был занесен в Южную Америку через Карибский бассейн, с тех пор более 300 000 случаев заражения и более 130 смертей. сообщалось [10].
CHIKV был распространен во Франции в 2010, 2014 и 2017 годах, в Италии с двумя крупными вспышками в 2007 и 2017 годах. Изолированные штаммы CHIKV в Европе принадлежат к африканской линии.К настоящему времени Ae. albopictus инфицировал более 25 европейских стран, наибольшая численность — в Италии. Ранее считалось, что территория к северу от Альп непригодна для установления Ae. albopictus , но даже в этом регионе Ae. albopictus перезимовывает (включая локальное расширение популяции и обнаружение личинок уже весной).
Клиническое проявление
CHIKV проявляется высокой температурой, головной болью, пятнисто-папулезной сыпью и болезненной артралгией с типичным временем инкубации 3–7 дней.Другими симптомами могут быть ретроорбитальная боль. Миокардит и кровотечение, в большинстве случаев пациенты выздоравливают в течение 1-2 недель, но боль в суставах может сохраняться от нескольких месяцев до лет.
Во время вспышки на острове Реюньон в 2005–2006 гг. У 12% пациентов были неврологические признаки, включая количественные и качественные изменения сознания, очаговые неврологические признаки, такие как дефицит черепных нервов, судороги, геми / парапарез и непроизвольные движения [27].
Дифференциальный диагноз
Диагноз
Диагноз устанавливается путем обнаружения РНК CHIKV с помощью ОТ-ПЦР или вирусной серологии в течение первых 5 дней после появления систем с высокой чувствительностью и специфичностью.Отрицательный результат ПЦР инициирует быстрое серологическое тестирование с помощью иммуноферментного анализа (ELISA) или непрямого флуоресцентного антитела (IFA). CHIKV может быть выделен из спинномозговой жидкости, плазмы или обнаружен путем амплификации нуклеиновой кислоты во время начальной лихорадки. IgM может сохраняться месяцами, поэтому может быть полезно обнаружение антител IgM. Для дифференциальной диагностики следует учитывать другие болезни, передаваемые членистоногими, с учетом того же географического распределения.
Лечение
Противовирусного лечения CHIKV нет, лечение симптоматическое, в том числе специализированная неврологическая интенсивная терапия.
Прогноз
Обычно прогноз при инфекции Чикунгунья хороший. Смертность выше у пожилых пациентов и пациентов с ослабленным иммунитетом.
Вакцинация
Вакцинация отсутствует.
Острые неврологические синдромы, вызванные вирусами
Поражение головного мозга — одно из самых серьезных последствий вирусной инфекции. Многие семейства вирусов обладают способностью проникать в ткани мозга и размножаться в них, но, к счастью, серьезные инфекции мозга встречаются редко.Клинически неврологические заболевания, вызываемые вирусами, можно разделить на острые и хронические синдромы. Патология может быть вызвана либо размножением вируса в клетках головного мозга, либо (неверно направленным) иммунным ответом хозяина — постинфекционным энцефаломиелитом.
Вирусы, поражающие мозг, могут достигать центральной нервной системы с током крови или распространяться по периферическим нервам. Бессимптомное инфицирование головного мозга является обычным явлением.
Если вирус поражает мозг напрямую, его обычно можно выделить либо из ткани мозга, либо из спинномозговой жидкости.С постинфекционными синдромами дело обстоит иначе.
Острые неврологические синдромы
Существует четыре основных синдрома:
1. Асептический менингит
2. Острый вялый паралич
3. Энцефалит
4. Постинфекционный энцефаломиелит
1. Асептический менингит
Это самый распространенный вирусный синдром. Состояние самоограничено и имеет хороший прогноз. Инфекция ограничивается мозговыми оболочками. Клинические признаки включают лихорадку, головную боль, ригидность шеи, светобоязнь и рвоту.Результаты CSF включают плеоцитоз, состоящий как из полиморфов, так и из лимфоцитов, но обычно с преобладанием лимфоцитов, нормальным уровнем глюкозы и отсутствием роста бактерий (отсюда и термин «асептический»).
Вирусы — самая частая причина менингита. Инфекции могут возникнуть в любом возрасте, но особенно часто встречаются у детей и молодых людей.
Распространенные вирусные агенты включают: энтеровирусы , и вирус паротита , (реже ВПГ-2 и вирус ветряной оспы).
Иногда может поражаться и нижележащая ткань мозга, вызывая менинго-энцефалит .Прогноз зависит от степени повреждения паренхимы головного мозга.
2. Энцефалит (болезнь серого вещества)
Репликация вируса происходит в самой мозговой ткани , вызывая деструктивные поражения в сером веществе . Основные симптомы включают: лихорадку, сонливость, спутанность сознания, снижение уровня сознания, судороги и очаговые неврологические признаки. Заболеваемость и смертность очень высоки. Вирусы, вызывающие это состояние, включают простого герпеса , бешенства и некоторые из арбовирусов .
Арбовирусы представляют собой разнообразную группу оболочечных вирусов оцРНК, которые инфицируют животных. Они передаются от одного позвоночного хозяина к другому через кровососущих членистоногих. Основные водоемы — дикие птицы и мелкие млекопитающие. Человек может заразиться, если его укусит насекомое-переносчик.
В Южной Африке нет энзоотических арбовирусов , которые конкретно вызывают энцефалит . Однако в редких случаях энцефалит может возникать как часть клинического течения инфекции такими вирусами, как вирус Западного Нила , вирус лихорадки Рифт-Валли и вирус Синбис .Эти вирусы являются энзоотическими в стадах домашнего скота в некоторых частях страны, и иногда могут быть инфицированы сельскохозяйственные рабочие или ветеринары.
Бешенство:
Вирус бешенства представляет собой оболочечный (пулевидный) вирус оцРНК. В первую очередь он поражает теплокровных позвоночных. Он является энзоотическим в большинстве частей мира. Вирус выделяется со слюной инфицированных животных, и люди иногда заражаются, если их укусило инфицированное животное. Поведение зараженного животного изменяется, и оно с большей вероятностью укусит людей или других животных, с которыми вступает в контакт (что обеспечивает выживание вирусов).Наиболее частые источники заражения человека — собаки и летучие мыши.
Патогенез:
Вирус попадает в ткани через укус. Он проникает в периферические нервы и поднимается по аксону в мозг, где воспроизводится. Это вызывает смертельный энцефалит.
Инкубационный период:
Он варьируется от 9 до 90 дней в зависимости от степени тяжести и места укуса. Инкубационный период определяется тем, как долго вирус достигает мозга. (Укусы стопы занимают больше времени, чем укусы лица.)
Заболевание можно предотвратить у человека, подвергшегося воздействию, путем введения постконтактной профилактики в форме антирабической вакцины и антирабического иммуноглобулина .
3. Острый вялый паралич
Этот синдром возникает из-за прямой инфекции моторных нейронов (серого вещества) спинного мозга вирусом. Пациенты поступают с лихорадкой и вялым параличом группы мышц. Признаки менингита, такие как головная боль и скованность шеи, являются частыми сопутствующими признаками.К наиболее распространенным этиологическим агентам относятся полиовирусы 1, 2 и 3 , но с учетом снижения распространенности полиомиелита дикого типа из-за успешной глобальной вакцинации, другие (не полиомиелитные) энтеровирусы являются причиной большинства случаев. (см. информацию о энтеровирусах и полиомиелите)
4 (i) Постинфекционный энцефалит (болезнь белого вещества)
Это необычное осложнение может развиться в фазе выздоровления после ряда распространенных вирусных инфекций, включая корь, эпидемический паротит, краснуху и первичную инфекцию, вызванную вирусом ветряной оспы.Кроме того, он может развиться после контакта с некоторыми вакцинами, такими как: вирус осповакцины и старые нейротканевые вакцины против бешенства. Распространенные демиелинизирующие поражения развиваются с вовлечением белого вещества головного и спинного мозга. Характерные гистологические признаки включают: лимфоцитарную инфильтрацию и периваскулярные манжеты соседних кровеносных сосудов. Возбудитель не может быть выделен из ткани головного мозга или спинномозговой жидкости. Этиология несколько неясна, но считается, что это опосредованный Т-клетками феномен аутоиммунного , вызванный воздействием чужеродных антигенов, которые тесно связаны с белками хозяина, обычно присутствующими в ткани мозга (молекулярная мимикрия).
4 (ii) Синдром Жиллена-Барре
Этот синдром характеризуется полиневритом , который развивается через несколько дней или недель после острой фазы определенных бактериальных или вирусных инфекций. Заболевание связано с демиелинизацией периферических нервов . Пациенты поступают с восходящим параличом, связанным с парестезией. Как и постинфекционный энцефаломиелит, это иммунологический феномен . Пациенты обычно выздоравливают самопроизвольно в течение нескольких недель или месяцев, поскольку пораженные нервы ремиелинизируются.
Энтеровирусы
Вирусология
Энтеровирусы представляют собой большое семейство (на данный момент идентифицировано> 100 типов) небольших оболочечных вирусов оцРНК, которые попадают в организм через желудочно-кишечный тракт. (Отсюда и название энтеро-)
Вирус выделяется с фекалиями и передается фекальным оральным путем.
Инфекция очень распространена. Люди в течение жизни неоднократно заражаются различными энтеровирусами. Большинство инфекций тривиальны. Энтеровирусы вызывают широкий спектр клинических заболеваний у людей, включая лихорадочные заболевания с сыпью, инфекции дыхательных путей, конъюнктивит, миозит, миокардит, перикардит, гепатит (вирус гепатита А является энтеровирусом), менингит, менинго- энцефалит и острый вялый паралич.
Энтеровирусы являются наиболее частой причиной асептического менингита и острого вялого паралича . (См. Примечания о детских инфекциях относительно других проявлений энтеровирусной инфекции)
Полиовирус
3 родственных энтеровируса, полиовирус 1, 2 и 3 ответственны за клиническое заболевание полиомиелит . Это была страшная болезнь до того, как были разработаны эффективные вакцины для борьбы с инфекцией. Глобальное использование вакцины довело болезнь до стадии искоренения.В настоящее время циркуляция полиовируса ограничена некоторыми частями Африки и Индийского субконтинента. Инфекция была ликвидирована Всемирной организацией здравоохранения (ВОЗ).
Патогенез
Вирус попадает в организм через прием внутрь. Он реплицируется в лимфоидных тканях кишечника. У некоторых людей это может сопровождаться виремией и гематогенным распространением на ЦНС. Литическая инфекция мотонейронов в передних рогах спинного мозга приводит к ослаблению нижних мотонейронов в мышцах, снабжаемых пораженными мотонейронами (вялый паралич).
Инкубационный период
7-14 дней
Клинические исходы после инфицирования
1. Бессимптомная инфекция (репликация остается только в кишечнике)
2. Легкая фебрильная болезнь, которая проходит. (возникает виремия, но вирус не проникает в ЦНС)
3. Незначительное лихорадочное заболевание, за которым следует асептический менингит, который проходит.
4. Лихорадочное заболевание с последующим менингитом и острым вялым параличом.
Примечание. Большинство инфекций протекает бессимптомно. Менее 1% инфекций приводит к параличу.
Контроль с помощью эффективной вакцины
В мире широко используются две эффективные вакцины против полиовируса: живая аттенуированная вакцина (Sabin) и инактивированная формалином вакцина (Salk). Оба содержат 3 штамма вируса, вызывающего паралитический полиомиелит, а именно полиовирусы 1, 2 и 3.
Обе вакцины были разработаны в 1950-х годах: живая аттенуированная вакцина была создана путем серийного пассажа вирулентного вируса в культуре клеток для получения штаммов полиовируса, которые сохраняли антигенность, но не могли вызывать заболевание.Инактивированная (убитая) вакцина содержит инактивированные формалином полиовирусы. Обе вакцины очень эффективны для защиты от инфекции:
Характеристики вакцин против полиомиелита
Вакцина, инактивированная формалином (Salk) | Живая аттенуированная вакцина (Сабин) | |
Способ применения | Впрыск | Капли пероральные |
Иммунный ответ | Хорошо, IgG в крови | Хорошо, IgA в кишечнике |
Продолжительность иммунитета | Средний | длинный |
Стоимость | дорого | дешево |
Стабильность вакцины | конюшня | Не стабильно, важна холодовая цепь |
Передача лицам, контактирующим с вакцинами | № | да |
Опасности | Нет | Возврат к вирулентности (очень редко) |
В Южной Африке 6 доз живой аттенуированной полиовакцины обычно вводятся всем младенцам при рождении в возрасте 6, 10 и 14 недель, 18 месяцев и 5 лет.Необходимо вводить несколько доз, поскольку каждый раз может «принимать» только один штамм. (Помните, что вакцина состоит из трех вирусов).
Полиомиелит — болезнь, подлежащая регистрации. Департамент здравоохранения должен быть уведомлен обо всех пациентах с заболеванием, похожим на полиомиелит. У пациентов с острым вялым параличом следует брать два образца стула (в последующие дни). Стул отправляется в Национальный институт инфекционных заболеваний в Йоханнесбурге для тестирования на полиовирус. Последний случай полиомиелита, вызванного полиовирусом дикого типа, произошел в Южной Африке в 1987 году, но периодические вспышки болезни продолжают происходить в других частях Африки.Таким образом, необходимы постоянная бдительность и высокий охват вакцинацией, поскольку вирус может быть повторно занесен в страну.
Многие страны первого мира отказались от живой аттенуированной вакцины и теперь используют убитую вакцину из-за редких случаев паралича, которые могут возникнуть у реципиентов живой вакцины (менее 1 на 10 миллионов доз).
Вирус паротита
Вирус эпидемического паротита представляет собой оболочечный вирус ssRNA, принадлежащий к семейству Paramyxoviridae .Инфекция распространяется воздушно-капельным путем. Он вызывает легкое фебрильное заболевание у детей. Наиболее характерным признаком является болезненное увеличение одной или обеих околоушных желез. Примерно в 5% случаев инфекция может быть осложнена асептическим менингитом .
Орхит развивается примерно у 20% мужчин, которые заражаются паротитом после полового созревания.
заболеваний нервной системы | Определение, обследование, патология и типы
История болезни
Старая поговорка в медицине: «Слушайте пациента; он сообщает вам диагноз », — особенно верно в неврологии.Описание симптомов пациентом — ценный инструмент, который позволяет врачу узнать о природе и локализации возможного неврологического заболевания. Изучая историю болезни пациента, невролог отмечает уровень осведомленности пациента, потерю памяти, осанку и походку, манеру поведения и выражение, речь и, в некоторой степени, личность. Невролог также отмечает такие симптомы, как боль, головная боль, потеря чувствительности, слабость, нарушение координации, истощение определенных групп мышц и аномальные движения.
Способность замечать окружающую среду и реагировать на нее — это не временное явление, а континуум. Из состояния полной бдительности человек может перейти через сонливость в ступор, состояние, при котором осознанность значительно снижается, и наилучшим двигательным ответом на стимуляцию является стон или другая голосовая (но не вербальная) реакция. Более глубокие уровни бессознательности проходят через легкую кому, при которой сильная стимуляция вызывает только неуклюжую двигательную реакцию, до глубокой комы, в которой есть только рефлекторное движение или нет никакой реакции.Такое угнетение сознания возникает при нарушении функций ствола мозга или коры головного мозга. Заболевания ствола мозга могут вызвать кому, если ствол мозга сдавлен другими частями мозга, опухшими из-за болезни, или если он поражен местной болезнью, такой как энцефалит, инсульт или сотрясение мозга. Заболевания коры головного мозга, вызывающие кому, включают отравление седативными препаратами, недостаток глюкозы или кислорода в крови, кровоизлияние в мозг и некоторые редкие инфильтративные расстройства, при которых снижение уровня сознания происходит в течение недель или месяцев.Кратковременные периоды потери сознания, о которых пациент может не знать, возникают при многих формах эпилепсии, нарколепсии, повторяющихся приступах низкого уровня сахара в крови и снижении кровоснабжения головного мозга, особенно ствола мозга.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Головная боль
Когда давление внутри черепа увеличивается, чувствительные к боли структуры в головном мозге и вокруг него деформируются и вызывают боль в плохо локализованной области, но часто идентифицируемой в передней или задней части головы, что называется тракционной головной болью.Тяговые головные боли могут быть вызваны отеком мозга, инфекцией, кровотечением, опухолью, стрессом или затрудненным оттоком спинномозговой жидкости. Кроме того, боль может ощущаться в области головы, хотя заболевание, вызывающее боль, находится в другом месте; Примером может служить лицевая боль, иногда ощущаемая при недостатке крови к сердцу. Местное заболевание таких структур черепа, как челюстные суставы, придаточные пазухи носа и зубы, среднее ухо и сами кости черепа, также может вызывать боль.
Головные боли напряжения вызваны длительным чрезмерным сокращением мышц, которые проходят по черепу спереди назад; эти головные боли часто вызваны стрессом.Обычно описывается постоянная давящая или тянущая боль, часто с пульсирующей составляющей. Мигрень может возникать одновременно с головной болью напряжения и характеризуется пульсирующей болью с болезненностью кожи головы, тошнотой, рвотой и чувствительностью к шуму и свету.
Когнитивные изменения
Плохая концентрация, вызванная озабоченностью, усталостью или депрессией, является наиболее частой причиной потери памяти, но также причинами могут быть широко распространенные заболевания мозга, авитаминоз, эпилепсия и деменция (потеря интеллектуальных способностей).Когда период потери памяти четко определен, основными причинами являются травма головы, судороги, отравление (например, алкоголем) и кратковременные эпизоды недостаточного кровоснабжения мозга. Нарушение понимания, рассуждения, логического мышления и способности планировать наперед также могут быть симптомами неврологического расстройства.
Языковой и речевой дефицит
Пациенты с афазией могут точно знать, что они хотят сказать, но они не могут выразить свои мысли устными (а часто и письменными) словами.Они также могут быть не в состоянии понять значение устной или письменной речи, поэтому нормальная речь звучит как иностранный. Инсульт — самая частая причина афазии, но причиной может быть любое очаговое заболевание головного мозга.
Сходными проблемами языка и понимания речи являются апраксия и агнозия. Апраксия — это неспособность выполнять полезные или умелые действия; Пациенты с апраксией могут назвать такой предмет, как гребень или ключ, но они могут не знать, как им пользоваться. Агнозия — это неспособность понять значение неязыкового стимула; больной агнозом может быть не в состоянии распознать источник звука музыкального инструмента.
Дизартрия, или затруднение артикуляции, обычно вызывается аномалией нервов и мышц во рту и вокруг рта или в их соединениях. Проблемы с воспроизведением речевых звуков, называемые дисфонией, часто указывают на проблему, затрагивающую гортань или нервы и мышцы этой структуры. Поскольку черепные нервы, снабжающие эти области, берут начало в стволе мозга, неврологические заболевания этой области также могут быть причиной.
Вирусная инфекция может вызвать атаку необычных иммунных клеток на нервы при рассеянном склерозе — ScienceDaily
Лейкоциты с рецепторами как для вирусов, так и для нервных белков могут атаковать нервы после борьбы с инфекцией
Вирусная инфекция может побудить организм атаковать собственную нервную ткань, активируя необычные, борющиеся с болезнями клетки с рецепторами как для вирусных, так и для нервных белков.Наблюдение за двумя рецепторами позволяет предположить, что повреждение нервов головного и спинного мозга может быть вызвано у восприимчивых молодых людей, страдающих рассеянным склерозом (РС).
Ученые из отдела иммунологии Вашингтонского университета Цинъюн «Джон» Цзи, Антуан Першелле и Джоан М. Говерман провели исследование, которое было опубликовано 6 июня в журнале « Nature Immunology ».
Считается, что это первое исследование, раскрывающее механизм аутоиммунного заболевания, который зависит от иммунных клеток-разрушителей, экспрессирующих двойные рецепторы для нормального белка, вырабатываемого организмом и патогеном.
Рассеянный склероз — одно из многих аутоиммунных заболеваний, при которых линии защиты организма сбиваются и начинают повреждать нормальные ткани. В случае рассеянного склероза защитная оболочка вокруг основных нервов — миелин — в головном и спинном мозге разрушается. Подобно изношенному электрическому шнуру, нервы больше не передают четкий сигнал.
Люди с рассеянным склерозом могут потерять способность видеть, ходить или пользоваться руками, в зависимости от того, какие нервы поражены.Симптомы могут появляться, исчезать и снова появляться. Заболевание чаще встречается у женщин, чем у мужчин.
У здоровых людей иммунная система контролируется, чтобы переносить обычные белки и клетки в организме, подобно тому, как нетерпеливую сторожевую собаку ставят на поводок и приучают игнорировать друзей и соседей, но при этом защищать семью.
«Считается, что аутоиммунитет возникает в результате случайного нарушения толерантности собственных белков организма. Это нарушение вызвано чем-то в окружающей среде, скорее всего, патогеном», — отметил Говерман, профессор и действующий председатель иммунологии, чьи исследования сосредоточены на истоки аутоиммунного заболевания.Ее лаборатория изучает механизмы, поддерживающие толерантность, а также «срабатывающие» механизмы, которые ее побеждают.
В своем последнем опубликованном исследовании ее исследовательская группа генетически сконструировала мышей, которые чрезмерно продуцируют определенный тип белых кровяных телец из группы, известной как Т-киллеры. Нормальная функция клеток-киллеров — атаковать опухолевые клетки или клетки, инфицированные вирусами или другими патогенами. Эти Т-клетки имеют рецепторы, которые распознают специфические белки, которые зараженные клетки отображают для них, что очень похоже на удерживание цели в окне.
Специфическими Т-киллерами, исследованными в этом исследовании, были CD8 + Т-клетки. Лаборатория Говермана сконструировала мышей так, чтобы они производили избыточное количество клеток CD8 +, которые распознавали основной белок миелина, преобладающий белок в миелиновой оболочке, покрывающей нервы. Главный вопрос, изучаемый в ходе исследования, заключался в том, будут ли мыши, полученные с помощью генной инженерии, проявлять заболевание, напоминающее рассеянный склероз.
Исследователи заразили мышей вирусом, который был сконструирован для производства основного белка миелина.Эта инфекция должна активировать CD8 + Т-клетки, чтобы сначала атаковать инфицированные вирусом клетки, создавая основной белок миелина для уничтожения вируса, а затем убивать другие клетки, которые заставляют основной белок миелина оборачиваться вокруг нервов. Убийство этих клеток разрушило бы миелиновую оболочку.
Как и ожидалось, у мышей развилось заболевание, подобное рассеянному склерозу. Но исследователи были удивлены, когда вирусы, лишенные основного белка миелина, также вызвали болезнь.
Дополнительные эксперименты по скрещиванию показали наличие двух рецепторов на нескольких CD8 + Т-клетках.Эти клетки, специально сконструированные для связывания с основным белком миелина, также создали свои собственные рецепторы для вирусов и могут распознавать оба. При воздействии на клетки, инфицированные вирусами, они связываются и уничтожают их с помощью одного рецептора. Будучи настроенными, как будто они были безумными, некоторые из этих клеток с двойным агентом затем направятся в другое место, чтобы связать свой другой рецептор с клетками, производящими основной белок миелина, и разрушить оболочку нервных клеток.
«Эти результаты, — отметили авторы, — демонстрируют роль клеток с двойным рецептором в аутоиммунитете».«Исследование также указывает на то, почему повсеместная вирусная инфекция может оставить большинство людей без каких-либо длительных эффектов, но вызвать аутоиммунитет у генетически предрасположенных людей.
Полученные данные открывают новый взгляд на предположение о том, что рассеянный склероз вызывается вирусами, несмотря на неспособность обнаружить инфекционный вирус в центральной нервной системе пациентов с рассеянным склерозом. Данные других исследований показывают, что CD8 + T-клетки могут преодолевать гематоэнцефалический барьер, а также что у пациентов с рассеянным склерозом больше CD8 + T-клеток, специфичных для белков центральной нервной системы, по сравнению со здоровыми людьми.
В модели с двумя рецепторами аутоиммунная активность против нервного белка может продолжаться после уничтожения вируса. Пациенты с рассеянным склерозом обычно имеют высокие уровни антител, указывающие на то, что они заразились в прошлом несколькими распространенными вирусами, но живой вирус, связанный с рассеянным склерозом, постоянно не наблюдается. Таким образом, на сегодняшний день не подтверждено, что какой-либо конкретный вирус является возбудителем рассеянного склероза.
Авторы объяснили, что возможно, что несколько вирусов могут влиять на восприимчивость к рассеянному склерозу.Способность любого конкретного вируса вносить вклад в заболевание может зависеть от собственного репертуара индивидуума других предрасполагающих генов, воздействия других предрасполагающих факторов окружающей среды и случайной вероятности того, что были сгенерированы Т-клетки, которые распознают миелиновый белок и патоген.
рецепторов на Т-клетках генерируются случайным образом во время их развития. Это наблюдение помогает объяснить, почему рассеянный склероз отчасти является случайностью. У некоторых людей с генетической предрасположенностью и воздействием окружающей среды развивается болезнь, а у других с аналогичной генетической предрасположенностью и воздействием окружающей среды — нет.
По словам исследователей, неясно, насколько распространены эти Т-клетки с двойным рецептором, хотя есть сообщения, что до одной трети Т-клеток человека экспрессируют двойные рецепторы.