Внутриутробная гипоксия плода и асфиксия новорожденных — конспект — Медицина
по передней стенке. Трансвагинальный, надлобковый амниоцентез используется в основном
в ранних сроках.
Определение кислотно-щелочного равновесия. Можно сделать при исследовании
околоплодных вод, либо исследовать кровь из предлежащей части плода (поэтому делается
только в родах, когда нет пузыря).
Исследование маточно-плацентарного кровообращения.
Определение уровня плацентарных гормонов в моче: можно судить о состоянии
матчоно-плацентарного кровообращения и косвенно о состоянии плода. Определяют
эстриол, прегнандиол (метаболит прогестерона), термостабильную щелочную фосфатазу в
крови матери.
Изотопные методы ( более научный метод).
УЗИ: определяют размеры, структуру плаценты, гипотрофию при хронической
гипоксии.
Профилактика и лечение проводятся одними и теми же методами.
ЛЕЧЕНИЕ. Лечение должно состоять в ликвидации причины гипоксии, а также лечения
непосредственно гипоксии (медикаментозная патогенетическая терапия и скорейшее
родоразрешение).
Патогенетическая медикаментозная терапия:
1 гр.
Кислородотерапия проводится с помощью чистого кислорода, кислородно-воздушной
смеси (кислород составляет 60%), ингаляции в течение 10-15 минут.
Гипербарическая оксигенация. Можно даже вести роды в камере ГБО.
2 гр. Препараты направленные на улучшение плацентарного кровообращения.
Сосудорасширяющие средства: эуфиллин, трентал, курантил (последние 2 улучшают
реологические свойтсва крови являясь деагрегантами), также можно назначить
реополиглюкин.
Эстрогены — усиливают маточно-плацентарное кровообращение: естественные
эстрогены — фолликулин, искуственные — синестрол. Сигетин — препарат эстрогеноподобного
действия.
Токолитики — бета-адреномиметики: партусистен, бриканил, сальбутамол, ритодрин,
алупент.
3 гр. Средства, повышающие устойчивость плода к кислородной недостаточности. —
антигипоксанты — седуксен, этимизол, оксибутират натрия, буфенин, пирацетам, дроперидол.
4 гр. Препараты, направленные на усиление обменных процессов у плода: глюкоза,
Препараты, направленные на усиление обменных процессов у плода: глюкоза,
витамин С, группы В, глюконат кальция, кальция хлорид, унитиол, кокарбоксилаза, цитохром
С и т.п.
5 гр. Средства для борьбы с метабоилческим ацидозом. Гидрокарбонат натрия по
контролем кислотно-щелочного равновесия так как он может легко привести к дисбалансу.
Существуют женщины малой, средней, большой массы тела. В зависимости от этого вводят
различное количество соды: 100-150-200 мл внутривенно капельно и после этого
внутривенно 40 мл 40% глюкозы.
Скорейшее родоразрешение. Методы зависят от состояния организма матери.
Во время беременности и в пермо триместре родов используют кесарево сечение, во
втором периоде — акушерские щипцы при головном предлежании, при тазовом предлежании
— экстракция плода за тазовый конец.
Асфиксия при родах: Причины патологии,Симптомы асфиксии при родах,Лечение асфиксии
Причины патологии
Асфиксия при родах классифицируется на первичную и вторичную. Первичная асфиксия возникает в процессе родов и в большинстве случаев вызвана острой или хронической внутриутробной гипоксией. Другие причины асфиксии:
Первичная асфиксия возникает в процессе родов и в большинстве случаев вызвана острой или хронической внутриутробной гипоксией. Другие причины асфиксии:
- полученная в процессе родов внутричерепная травма;
- пороки развития плода, влияющие на нормальное дыхание;
- иммунологическая несовместимость матери и ребенка;
- пробка в дыхательных путях из-за слизи или околоплодных вод;
- болезни матери;
- патологии пуповины и т.д.
Вторичная асфиксия диагностируется спустя несколько часов или дней после родов. Основные причины: поражение центральной нервной системы, порок сердца, нарушение мозгового кровообращения, пневмопатия.
При асфиксии в организме новорожденного изменяются обменные процессы. Могут диагностироваться отеки и кровоизлияния в сердце, головном мозге, почках и других органах, возникающие из-за недостатка кислорода. Сокращается количество сердечных сокращений, нарушается функциональность почек.
Симптомы асфиксии при родах
В первые секунды после завершения родов врач может выявить данное патологическое состояние, оценивая адекватность и частоту дыхания, мышечный тонус, цвет кожи, сердцебиение, рефлексы. Главным симптомом является нарушение дыхательного процесса. В зависимости от степени патологии, отличают легкую, среднюю и тяжелую формы асфиксии, а также клиническую смерть.
Главным симптомом является нарушение дыхательного процесса. В зависимости от степени патологии, отличают легкую, среднюю и тяжелую формы асфиксии, а также клиническую смерть.
При легкой форме вдох ребенок делает в течение первой минуты жизни. Тем не менее, его дыхание ослаблено, а мышечный тонус низкий. При средней форме ребенок также делает вдох в течение первой минуты после появления на свет. Дыхание при этом ослабленное, может быть нерегулярным. Наблюдаются тахикардия, угасающие рефлексы, синюшный оттенок кожи.
При тяжелой форме дыхание нерегулярное либо отсутствующее. Крика нет, только редкое постанывание. Рефлексы отсутствуют, сердцебиение замедленное. Кожа бледная, пуповина не пульсирует. Очень часто следствием тяжелой асфиксии является развитие надпочечниковой недостаточности. При состоянии «клиническая смерть» необходимы срочные реанимационные мероприятия.
Лечение асфиксии
Эффективным способом борьбы с патологией является интенсивная терапия: введение специального зонда в полость рта и носа для очищения дыхательных путей. После извлечения малыша и перерезания пуповины проводится повторная аспирация желудка и носоглотки. После восстановления дыхательной активности действия врачей будут направлены на нормализацию процессов метаболизма, функционирования почек, на ликвидацию отеков и т.п.
После извлечения малыша и перерезания пуповины проводится повторная аспирация желудка и носоглотки. После восстановления дыхательной активности действия врачей будут направлены на нормализацию процессов метаболизма, функционирования почек, на ликвидацию отеков и т.п.
Для принятия комплекса правильных мер при асфиксии, важно, чтобы роды принимал опытный врач-акушер. Большое значение имеет качественная диагностика беременности, позволяющая вовремя обнаружить предрасположенность к асфиксии. Найти лучших медиков по данным направлениям и записаться к ним на прием и консультацию можно на сайте Doc.ua.
Влияние асфиксии на фибринолиз недоношенного новорожденного | #01/15
Асфиксия новорожденного (лат. asphyxia) — удушье, патологический процесс, возникающий в связи с нарушением газового обмена новорожденного, сопровождающийся недостатком кислорода в крови и тканях и накоплением углекислоты в организме.
Асфиксия является следствием многих видов акушерской патологии и различных заболеваний материнского организма и плода [1].
Асфиксии новорожденных делят по происхождению на первичные, или внутриутробные, и вторичные, или внеутробные (приобретенные), и по степени тяжести (легкая, среднетяжелая и тяжелая). После рождения оценивается состояние ребенка на 1-й и 5-й минуте по шкале Апгар (1–9 баллов). Асфиксией легкой степени считают 7–8-9 баллов, среднетяжелой — 4–6 балла и тяжелой — 1–3 балла.
Причинами первичной асфиксии являются острая и хроническая внутриутробная гипоксия плода, внутричерепная травма, иммунологическая несовместимость крови матери и плода, внутриутробная инфекция, полная или частичная закупорка дыхательных путей плода или новорожденного слизью, околоплодными водами (аспирационная асфиксия), пороки развития плода. Возникновению асфиксии способствуют экстрагенитальные заболевания беременной (сердечно-сосудистые, особенно в стадии декомпенсации, тяжелые заболевания легких, выраженная анемия, сахарный диабет, тиреотоксикоз, инфекционные болезни и др. ), поздние токсикозы беременных, преждевременная отслойка плаценты, патология пуповины, плодных оболочек и плаценты, осложнения в родах (несвоевременное излитие околоплодных вод, аномалии родовой деятельности, несоответствие размеров таза роженицы и головки плода, неправильные вставления головки плода и др.).
), поздние токсикозы беременных, преждевременная отслойка плаценты, патология пуповины, плодных оболочек и плаценты, осложнения в родах (несвоевременное излитие околоплодных вод, аномалии родовой деятельности, несоответствие размеров таза роженицы и головки плода, неправильные вставления головки плода и др.).
Наиболее частой причиной вторичных асфиксий у новорожденных первых дней жизни являются так называемые пневмопатии (полисегментарные и рассеянные ателектазы, гиалиновые мембраны, отечно-геморрагический синдром, массивные кровоизлияния в легкие и др.), которые формируются во внутриутробном периоде или во время родов и сопровождаются развитием синдрома дыхательных расстройств (СДР). Кроме пневмопатий, СДР может быть обусловлен внутричерепными кровоизлияниями, внутри—утробной инфекцией и др. [2].
Под асфиксией новорожденного понимают такое состояние, когда после его рождения дыхание не появляется или выражается в отдельных, нерегулярных, чаще всего судорожных или поверхностных дыхательных движениях при наличии сердечной деятельности. Асфиксия является одной из ведущих причин мертворождаемости.
Асфиксия является одной из ведущих причин мертворождаемости.
Кратковременная или умеренная гипоксия и гипоксемия вызывают включение компенсаторных адаптационных механизмов плода с активацией симпатико-адреналовой системы гормонами коры надпочечников и цитокинами. При этом увеличивается число циркулирующих эритроцитов, учащается сердечный ритм, возможно некоторое повышение систолического артериального давления без увеличения сердечного выброса.
Продолжающаяся гипоксия, гипоксемия, сопровождается снижением рО2 ниже 40 мм рт. ст. и способствует включению энергетически невыгодного пути обмена углеводов — анаэробного гликолиза. Накапливаются продукты нарушенного метаболизма, оказывая повреждающее действие на органы и ткани. Сердечно-сосудистая система отвечает на данное состояние перераспределением циркулирующей крови с преимущественным кровоснабжением жизненно важных органов (мозг, сердце, надпочечники, диафрагма), что приводит к кислородному голоданию кожи, легких, кишечника, мышечной ткани, почек и других органов. Сохранение фетального состояния легких является причиной шунтирования крови справа налево, которое приводит к перегрузке правых отделов сердца давлением, а левых — объемом, что способствует развитию сердечной недостаточности, усилению дыхательной и циркуляторной гипоксии. Централизация кровообращения, активация анаэробного гликолиза с накоплением лактата способствует развитию метаболического ацидоза.
Сохранение фетального состояния легких является причиной шунтирования крови справа налево, которое приводит к перегрузке правых отделов сердца давлением, а левых — объемом, что способствует развитию сердечной недостаточности, усилению дыхательной и циркуляторной гипоксии. Централизация кровообращения, активация анаэробного гликолиза с накоплением лактата способствует развитию метаболического ацидоза.
В случае тяжелой и (или) продолжающейся гипоксии возникает срыв механизмов компенсации: гемодинамики, функции коры надпочечников, что, наряду с брадикардией и снижением минутного кровообращения, приводит к артериальной гипотензии вплоть до шока. Нарастание метаболического ацидоза способствует активации плазменных протеаз, провоспалительных факторов, что ведет к повреждению клеточных мембран, развитию дисэлектролитемии.
Повышение проницаемости сосудистой стенки приводит к сладжированию (склеиванию) эритроцитов, образованию внутрисосудистых тромбов и кровоизлияниям. Выход жидкой части крови из сосудистого русла способствует развитию отека головного мозга и гиповолемии. Повреждение клеточных мембран усугубляет поражение центральной нервной системы (ЦНС), сердечно-сосудистой системы, почек, надпочечников с развитием полиорганной недостаточности. Указанные факторы приводят к изменению коагуляционного и тромбоцитарного звена гемостаза.
Повреждение клеточных мембран усугубляет поражение центральной нервной системы (ЦНС), сердечно-сосудистой системы, почек, надпочечников с развитием полиорганной недостаточности. Указанные факторы приводят к изменению коагуляционного и тромбоцитарного звена гемостаза.
В основе гипоксически-ишемического поражения головного мозга лежат цереброваскулярные расстройства и нарушения механизма ауторегуляции мозгового кровообращения, наступающие при дефиците кислорода.
Основные патогенетические механизмы формирования клинических проявлений гипоксии новорожденных, родившихся в асфиксии, со стороны системы гемостаза и эритропоэза — тромбоцитопения, витамин-К-дефицит, синдром диссеминированного внутрисосудистого свертывания.
Асфиксия на фоне хронической антенатальной гипоксии развивается на фоне антенатальной патологии: пневмопатии, энцефалопатии, незрелости ферментативных систем печени, низких резервов надпочечников и щитовидной железы, а также патологического ацидоза и вторичного иммунодефицитного состояния. Основным метаболическим компонентом такой гипоксии является сочетание гипоксемии, гиперкапнии и метаболического ацидоза с момента рождения. Ацидоз рано вызывает повреждение клеточных мембран с развитием гемодинамических, гемостатических нарушений и транскапиллярного обмена, что определяет механизмы развития дыхательной недостаточности (ДН), правожелудочковой сердечной недостаточности, коллапса с падением артериального давления (АД), гиповолемии на фоне недостаточности симпато-адреналовой системы, ишемии миокарда и фазовых расстройств гемостаза, что еще больше ухудшает микроциркуляцию. Важнейшая роль нарушений гемостаза в общей патологии человека определяется не только частотой, разнообразием геморрагических и тромбоэмболических заболеваний и синдромов, но и является существенным звеном патогенеза других заболеваний — инфекционно-септических, иммунных [3] и т. д. Целью данной работы было изучение показателей фибринолиза у недоношенных новорожденных детей с разной оценкой по шкале Апгар и разработать методы профилактики развития геморрагического синдрома.
Основным метаболическим компонентом такой гипоксии является сочетание гипоксемии, гиперкапнии и метаболического ацидоза с момента рождения. Ацидоз рано вызывает повреждение клеточных мембран с развитием гемодинамических, гемостатических нарушений и транскапиллярного обмена, что определяет механизмы развития дыхательной недостаточности (ДН), правожелудочковой сердечной недостаточности, коллапса с падением артериального давления (АД), гиповолемии на фоне недостаточности симпато-адреналовой системы, ишемии миокарда и фазовых расстройств гемостаза, что еще больше ухудшает микроциркуляцию. Важнейшая роль нарушений гемостаза в общей патологии человека определяется не только частотой, разнообразием геморрагических и тромбоэмболических заболеваний и синдромов, но и является существенным звеном патогенеза других заболеваний — инфекционно-септических, иммунных [3] и т. д. Целью данной работы было изучение показателей фибринолиза у недоношенных новорожденных детей с разной оценкой по шкале Апгар и разработать методы профилактики развития геморрагического синдрома.
Материалы и методы исследования
На базе педиатрического отделения для недоношенных детей ГБУЗ ГКБ № 24 ДЗМ (Москва) проводилось изучение показателей фибринолиза у новорожденных детей с различной оценкой по шкале Апгар. В исследовании приняли участие 60 новорожденных детей различного срока гестации, веса и половой принадлежности в возрасте до одного месяца жизни. Гестационный возраст детей был представлен 27–36 неделями. Вес обследуемых детей колебался в пределах 990–3000 г (табл. 1).
Все дети были разделены на три группы по интервалу оценки по шкале Апгар без учета веса и срока гестации (табл. 2).
При первичном осмотре изучался анамнез матерей, течения беременности и родов. Клинический осмотр новорожденных проводился на 1-й, 2-й, 3-й и 4-й неделе жизни. Оценивалось физическое развитие новорожденных по центильным таблицам. Особенное внимание уделялось выявлению признаков геморрагического синдрома и тромбоза. Основными диагнозами, с которыми наблюдались дети, были: внутриутробная пневмония, энтероколит, церебральная ишемия, внутрижелудочковое кровоизлияние.
Лабораторное изучение показателей фибринолиза проводилось без учета заболеваний и получаемого лечения. Взятие крови для исследования производился на 1-й, 2-й, 3-й и 4-й неделе жизни. Исследование препаратов крови проводилось в лаборатории ГБУЗ ГКБ № 24 ДЗМ и лаборатории Научного центра сердечно-сосудистой хирургии им. А. Н. Бакулева РАМН г. Москвы на аппарате АСL-9000 с использованием хромогенного субстрата стрептокиназы [4, 5].
Результаты и обсуждение
Изучив материнский анамнез, было выявлено, что 70% женщин имели отягощенный соматический и акушерско-гинекологический анамнез, часть из них имели обострения хронических болезней в период беременности. Большинство детей рождены от первой или второй беременности и первых родов. Оценивая физическое развитие детей при рождении, выявлено, что 12% новорожденных имеют задержку внутриутробного развития. В ходе клинического осмотра оценивалось состояние детей — наличие признаков геморрагического синдрома или тромбоза, выраженность ДН, уровень мышечного тонуса и рефлексов, менингеальные симптомы. В первой группе признаки геморрагического синдрома в виде желудочно-кишечного кровотечения отмечались у одного ребенка на 2-й неделе жизни, во второй группе у двух детей на 1-й неделе жизни и в третьей группе также у двух детей на 2-й неделе жизни. При рентгенографическом исследовании выявлены признаки энтероколита. Признаков тромбоза выявлено не было ни у одного ребенка. Проявления пневмонии отмечались у 8 детей первой группы в течение всего периода обследования, во второй группе у 6 детей до 3-й и 4-й недели жизни и в третьей группе у 5 новорожденных до 2-й и 3-й недели жизни в виде ДН различной степени выраженности и рентгенологической картины пневмонии. При нейросонографическом исследовании детей первой группы выявлены изменения ишемического характера у 8 детей и геморрагического (внутрижелудочковое кровоизлияние (ВЖК)) у 2 детей. Во второй группе ишемические изменения отмечены у 5 детей, ВЖК у 1 ребенка, а в третьей группе у 6 и 1 ребенка соответственно. Распределение заболеваний по группам приведено в табл.
В первой группе признаки геморрагического синдрома в виде желудочно-кишечного кровотечения отмечались у одного ребенка на 2-й неделе жизни, во второй группе у двух детей на 1-й неделе жизни и в третьей группе также у двух детей на 2-й неделе жизни. При рентгенографическом исследовании выявлены признаки энтероколита. Признаков тромбоза выявлено не было ни у одного ребенка. Проявления пневмонии отмечались у 8 детей первой группы в течение всего периода обследования, во второй группе у 6 детей до 3-й и 4-й недели жизни и в третьей группе у 5 новорожденных до 2-й и 3-й недели жизни в виде ДН различной степени выраженности и рентгенологической картины пневмонии. При нейросонографическом исследовании детей первой группы выявлены изменения ишемического характера у 8 детей и геморрагического (внутрижелудочковое кровоизлияние (ВЖК)) у 2 детей. Во второй группе ишемические изменения отмечены у 5 детей, ВЖК у 1 ребенка, а в третьей группе у 6 и 1 ребенка соответственно. Распределение заболеваний по группам приведено в табл. 3.
3.
Взятие крови для лабораторного анализа показателей фибринолиза проводился 4-кратно, на 1-й, 2-й, 3-й и 4-й неделе жизни.
Диапазон полученных данных с учетом оценки по шкале Апгар представлен в табл. 4.
В данной таблице приведены результаты показателей фибринолиза, от минимального до максимального, полученные в ходе исследования. Сравнив средние показатели АТ-111, видим, что практически одинаковые значения представлены во второй и третьей группе, низкие в первой группе. Что касается плазминогена, то наибольшие значения в третьей группе, минимальные во второй группе. Максимальный уровень РАИ-1 наблюдается в первой группе, а вторая и третья группы имеют почти одинаковые значения.
Чтобы оценить полученные данные относительно известных норм, обратимся к табл. 5.
При сравнении полученных данных с нормами для недоношенных детей видим, что уровень АТ-111 у обследуемых детей соответствует таковому во второй и третьей группе по данным Andrew. У недоношенных детей отмечается депрессия физиологических антикоагулянтов, особенно выраженная в первые сутки жизни [8]. Значения РАИ-1 имеют достаточно большой диапазон значений по сравнению с нормами у недоношенных. В каждой группе получены значения как меньше нормы, так и больше. Что касается плазминогена, то имеется тенденция к его снижению. Согласно данной таблице, приведены нормы для недоношенных детей 30–36 недели гестации, в то время как в исследовании участвовали дети с 27-й по 36,5-ю недели гестации. Из методов параметрической статистики применялся критерий t Стьюдента для оценки количественных непрерывных величин при нормальном распределении. Значение р считалось достоверным при α ≤ 0,05. Для оценки корреляционной взаимосвязи применяли метод Спирмена [9].
У недоношенных детей отмечается депрессия физиологических антикоагулянтов, особенно выраженная в первые сутки жизни [8]. Значения РАИ-1 имеют достаточно большой диапазон значений по сравнению с нормами у недоношенных. В каждой группе получены значения как меньше нормы, так и больше. Что касается плазминогена, то имеется тенденция к его снижению. Согласно данной таблице, приведены нормы для недоношенных детей 30–36 недели гестации, в то время как в исследовании участвовали дети с 27-й по 36,5-ю недели гестации. Из методов параметрической статистики применялся критерий t Стьюдента для оценки количественных непрерывных величин при нормальном распределении. Значение р считалось достоверным при α ≤ 0,05. Для оценки корреляционной взаимосвязи применяли метод Спирмена [9].
Выводы
Сравнивая результаты показателей фибринолиза у детей трех групп, можем выделить особенности данных показателей при асфиксии и оценить влияние асфиксии на фибринолитическую систему недоношенного новорожденного.
- Низкие значения РАИ-1 и АТ-111 наблюдаются у детей с геморрагическим синдромом (желудочно-кишечное кровотечение и ВЖК) как проявление гипокоагуляции. Данные изменения больше характерны для недоношенных из первой группы, то есть рожденных в асфиксии тяжелой степени.
- Имея данные о депрессии фибринолитической системы у недоношенных новорожденных относительно доношенных, следует ожидать более частого проявления геморрагического синдрома. Однако в ходе исследования данных, подтверждающих это высказывание, не получено. Из всех обследованных детей (30 человек) только у 16,7% (5 человек) были проявления гипокоагуляции.
- Относительно низкие значения плазминогена и встречающиеся в этот же возрастной период высокие цифры РАИ-1 во всех группах свидетельствует о периодах гиперкоагуляции, сменяющих гипокоагуляцию, но неподтвержденных клинически.
- У детей, родившихся в асфиксии тяжелой степени, получены более низкие значения плазминогена и АТ-111, чем при среднетяжелой и легкой степени.
 Фибринолиз идет быстрее, чем выше локальная концентрация плазминогена в сгустках [10].
Фибринолиз идет быстрее, чем выше локальная концентрация плазминогена в сгустках [10]. - Уровень РАИ-1 во всех группах имеет тенденцию к возрастанию от первой недели к месяцу жизни.
Учитывая вышеизложенное, можно сделать заключение о более выраженном ингибирующем влиянии асфиксии тяжелой степени, гипоксии на фибринолитическую систему недоношенных новорожденных в отличие от доношенных детей. Однако только имея данные особенности, касающиеся многих систем организма, недоношенный ребенок имеет больше возможности приспособиться к изменяющимся условиям среды и легче пережить период адаптации.
Литература
- Рогалёва Т. Е. Состояние иммунитета и гемостаза при перинатальных поражениях ЦНС у новорожденных детей от матерей с гестозами. Дис… к.м.н. Чита, 2009. С. 11–16.
- Любименко В. А., Пальчик А. Б., Шабалов Н. П., Ярославский В. К. Асфиксия новорожденных. 3-е изд-е. 2003. С. 9, 12, 15.
- Дементьева И.
 И., Чарная М. А., Морозов Ю. А. Патология системы гемостаза. М.: ГЕОТАР- Медиа, 2011. С. 25, 27.
И., Чарная М. А., Морозов Ю. А. Патология системы гемостаза. М.: ГЕОТАР- Медиа, 2011. С. 25, 27. - Баркаган З. С. Диагностики и контролируемая терапия нарушений гемостаза. М.: Ньюдиамед, 2008. С. 158–159, 277–278, 282.
- Баркаган З. С, Момот А. П. Диагностика и контролируемая терапия нарушений гемостаза. М.: Ньюдиамед, 2011. С. 13.
- Румянцев А. Г., Самочатова Е. В., Коколина В. Ф. Практическое руководство по детским болезням. Гематология/онкология детского возраста. М.: Медпрактика-М, 2004. С. 312, 318.
- Доскин В. А., Келлер Х., Мураенко Н. М., Тонкова-Ямпольская Р. В. Морфофункциональные константы детского организма. М.: Медицина, 1997. С 226.
- Володин Н. Н., Мухина Ю. Г., Чубарова А. И. Неонатология. Т. 1. М.: Династия, 2011. С. 159.
- Гореева Н. М., Демидова Л. Н., Орехов С. А. Статистика. М.: Эксмо, 2010.
- Булатов В. П.
 , Черезова И. П., Макарова Т. П., Шаммасов Р. З. Гематология детского возраста. Ростов-на-Дону: Феникс. Казань: Казанский государственный медицинский университет, 2006. С. 37–39.
, Черезова И. П., Макарова Т. П., Шаммасов Р. З. Гематология детского возраста. Ростов-на-Дону: Феникс. Казань: Казанский государственный медицинский университет, 2006. С. 37–39.
А. В. Катюхина
ГБУЗ ГКБ № 24 ДЗМ, Москва
Контактная информация: [email protected]
Перинатальная гипоксия как причина патоморфологических изменений надпочечников плодов и новорожденных при летальном сходе
DSpace preserves and enables easy and open access to all types of digital content including text, images, moving images, mpegs and data sets
Learn More
Please use this identifier to cite or link to this item:
http://repo.knmu.edu.ua/handle/123456789/5311
| Title: | Перинатальная гипоксия как причина патоморфологических изменений надпочечников плодов и новорожденных при летальном сходе |
| Authors: | Андреев, Андрей Валентинович Губина-Вакулик, Галина Ивановна |
| Keywords: | надпочечник внутриутробная гипоксия гистология новорожденный |
| Issue Date: | 2013 |
| Citation: | Андреев А. В. Перинатальная гипоксия как причина патоморфологических изменений надпочечников плодов и новорожденных при летальном сходе / А. В. Андреев, Г. И. Губина-Вакулик // Міжнародний медичний журнал. – 2013. – № 3. – С. 65–69. В. Перинатальная гипоксия как причина патоморфологических изменений надпочечников плодов и новорожденных при летальном сходе / А. В. Андреев, Г. И. Губина-Вакулик // Міжнародний медичний журнал. – 2013. – № 3. – С. 65–69. |
| Abstract: | Внутриутробная гипоксия плода и асфиксия новорожденного в родах в остром и хроническом варианте диагностируются приблизительно у каждого пятого новорожденного с массой тела 1000г и более: в частности, в Харьковской области в 2008-2012г.г. этот показатель варьировал в пределах 16,6-21,4%. Таким образом, у умерших плодов и новорожденных в связи с развитием острой гипоксии (асфиксии) на фоне внутриутробной хронической гипоксии или без нее надпочечники имеют патологические изменения структуры, отражающие развитие функциональной недостаточности. |
| URI: | http://repo.knmu.edu.ua/handle/123456789/5311 |
| Appears in Collections: | Наукові праці. Кафедра патологічної анатомії |
Items in DSpace are protected by copyright, with all rights reserved, unless otherwise indicated.
Внутриутробная гипоксия плода и асфиксия новорожденных (стр. 1 из 2)
Гипоксия внутриутробного плода — патологическое состояние, связанное с кислородной недостаточностью во время беременности и в родах. Эта патология относится к числу наиболее распространенных среди перинатальной патологии и является одной из самых частых причин перинатальной заболеваемости (21-45% в структуре всей перинатальной патологии).
Термин перинатальный обозначает период внутрутробного развития с 28 недель, период родов и 7 дней после рождения ребенка (период новорожденности).
Причины гипоксии плода и асфиксии новорожденного общие и разделены на 4 группы:
первые три являются общими для гипоксии внутриутробного плода и асфиксии новорожденных, 4 группы присуща только для асфиксии новорожденных.
Этапы на которых может страдать перенос кислорода.
Состояние матери.
Маточно-плацентарное кровообращение.
Состояние плода.
1. Группа — заболевания матери.
Группа — заболевания матери.
Кровопотеря — акушерские кровотечения — при отслойке плаценты, при предлежании плаценты, разрыве матки; заболевания крови (анемия, лейкоз и т.п.).
шоковые состояния любого происхождения.
Врожденые и приобретеные пороки сердца с нарушением гемодинамики.
Заболевания бронхо-легочной системы с нарушением газообмена.
Интоксикации любого вида — бытовые, промышленые, вредные привычки.
Вторая группа — патология маточно-плацентарного и пуповинного кровотока.
Патология пуповины (коллизии):
узлы пуповины
обвитие пуповины вокруг конечностей
выпадение пуповины
прижатие пуповины в процессе родов при тазовом предлежании (поэтому роды при тазовом предлежании являются пограничной патологией так как в одних случаях роды могут пройти без осложнений, а в других при небольшой задержке продвижения плода головка , выходя последней пережимает пуповину надолго.
Кровотечения:
при отслойке плаценты
при предлежании плаценты. При этом кровообращение замедляется или прекращается.
При этом кровообращение замедляется или прекращается.
Разрыв сосудов при оболочечном прикреплении пуповины ( см. Аномалии развития плодного яйца) — патология прикрепления пуповины ( к оболочкам , краю плаценты). Рост сосудов может привести к разрыву, вероятнее всего это происходит при амниотомии.
Нарушение плацентарного кровообращения в связи с дистрофическими изменения сосудов:
при гестозе
при переношенной беременности. Возникают процессы старения плаценты — трофические нарушения.
Аномалии родовой деятельности — очень затяжные или быстрые роды, дискоординация родовой деятельности.
3 группа — причины , связанные с плодом.
Генетические болезни новорожденных.
Гемолитическая болезнь новорожденного связана с иммуннологическим конфликтом между матерью и ребенком, начинается внутриутробно.
Пороки сердца.
Другие аномалии развития.
Внутриутробная инфекция.
Внутричерепная травма плода.
4 ГРУППА — единственная причина, характерна только для асфиксии новорожденных — частичная или поная закупорка дыхательных путей.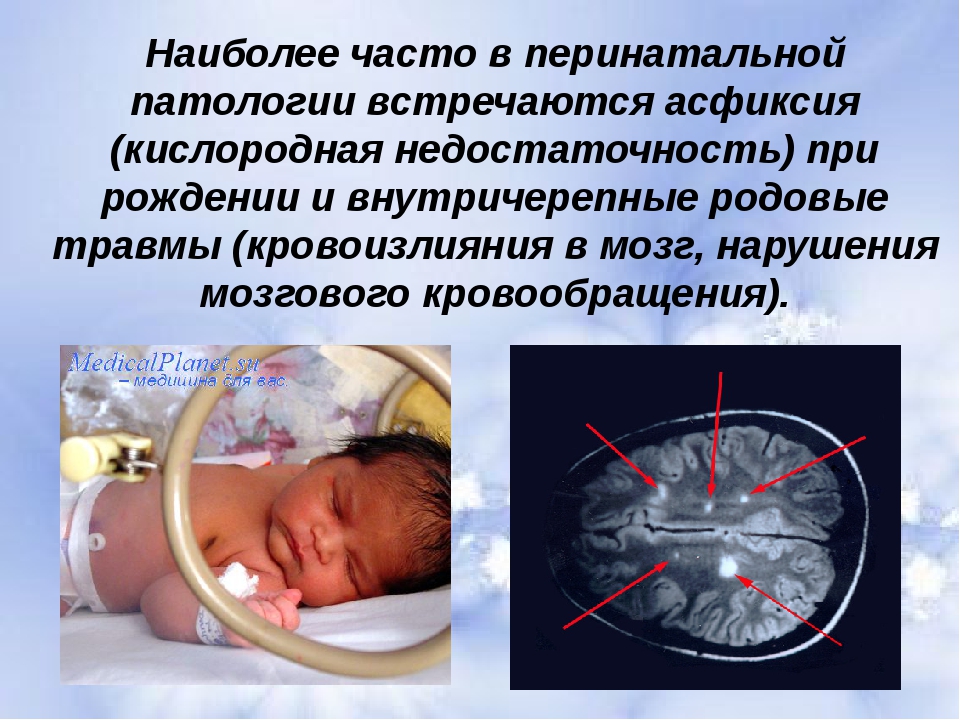
ПАТОГЕНЕЗ ГИПОКСИИ ВНУТРИУТРОБНОГО ПЛОДА. Состоит в многообразии патофизиологических и биохимических процессов.
В плоде в ответ на гипоксическое состояние , усиливается выброс кортикостероидов, увеличивается число циркулирующих эритроцитов, ОЦК. На этом этапе: тахикардия, усиление двигательной активности плода, увеличение дыхательных движений плода, закрытие голосовой щели. Дыхание внутриутробное — это просто экскурсии грудной клетки — как бы тренировочные дыхательныельные движения.
При нарастающей острой или продолжающейся хронической гипоксии мы видим процессы активации анаэробного гликолиза. Централизация кровообращения приводит к ухудшению периферического кровообращения. То есть плод стремится обеспечить кровью жизненноважные органы (сердце, головной мозг), при этом наступает гипоксия кишечника, почек, ног следовательно выделение мекония.
Затем происходит срыв адаптации — истощается кора надпочечников, клинически это выражается брадикардией, аритмией, приглушенностью сердечных тонов. Движения плода замедляются и в конечном итоге затихают.
Движения плода замедляются и в конечном итоге затихают.
Далее снижается МОК, возникает коллапс, гиповолемия с образованием тромбов, возникают многочисленные кровоизлияния, то есть ДВС синдром.
Поэтому причиной геморрагий всегда является гипоксический фон ( и при наложении щипцов, или длительном стоянии головки в одной плоскости).
Накопление углекислоты вызывает раздражение дыхательного центра. Плод начинает дышать через открытую голосовую щель, то есть аспирирует все что попадется на пути: околоплодные воды, слиз, кровь, и новорожденные рождается с готовыми ателектазами. Первый вдох такого ребенка может привести к спонтанному пневмотораксу даже без всяких внешних воздействий.
Классификация по клиническим проявлениям.
Гипоксия внутриутробного плода в зависимости от степени выраженности: острая и хроническая. В зависимости от того если ли клинические признаки ГВП, или нет ГВП классифицируют на:
угрожающая ГВП
начавшаяся ГВП
Угрожающая ГВП — это состояние когда нет еще клинических проявлений, но есть то состояние матери или плода которое может привести к ГВП (переношенная беременность, аномалии родовой деятельности и т. п.).
п.).
начавшаяся гипоксия — это состояние с клиническими проявлениями ГВП.
КЛИНИКА.
При гипоксии возникает тахикардия, брадикардия (при более глубокой ГВП), аритмия, приглушенность тонов. В норме сердцебиение 120-160 ударов в минуту.
Появление мекония в околоплодных водах.
В начале ГВП — учащение и усиление движений. При развитой ГВП — замедление и урежение движений.
Угрожающиая ГВП требует профилактики, начавшаяся — лечения.
Ранняя диагностика.
Различные пробы (биохимические, функциональные, аппаратные.
Клинические данные — особенно сердцебиение.
Функциональные пробы:
проба с физической нагрузкой заключается в изменении газового состава крови и воздухе.
Тепловые пробы: горячий компресс или холод к животу.
Введение атропина или окситоцина.
Эти пробы позволяют выявить компенсаторные возможности плода, пока не развилась гипоксия.
Бесстрессовый тест — реакция сердцебиения плода на собственные шевеления. В норме плод должен учащать сердцебиение на 10-12 ударов в минуту. Если плод реакции не дает следовательно это гипоксия. Сердцебиение также должно реагировать на схватку, что можно исследовнть с помощью кардиотокографа: используется ультразвуковой эффект (записывает сердцебиения, и схватки), суммирует сердцебиение и выдает ленту. Также записывается сократительная активность матки (токограмма). Децелерация — замедление сердцебиения во время схватки. Брадикардия раняя совпадает со временем схватки, как правило появляется во втором периоде родов , когда головка проходит узкую часть. Поздняя децелерация — брадикардция после схватки — признак поздней гипоксии.
В норме плод должен учащать сердцебиение на 10-12 ударов в минуту. Если плод реакции не дает следовательно это гипоксия. Сердцебиение также должно реагировать на схватку, что можно исследовнть с помощью кардиотокографа: используется ультразвуковой эффект (записывает сердцебиения, и схватки), суммирует сердцебиение и выдает ленту. Также записывается сократительная активность матки (токограмма). Децелерация — замедление сердцебиения во время схватки. Брадикардия раняя совпадает со временем схватки, как правило появляется во втором периоде родов , когда головка проходит узкую часть. Поздняя децелерация — брадикардция после схватки — признак поздней гипоксии.
Электрокардио и фонография сердцебиеия плода: очень сложная расшифровка, то есть нужен компьтер для обработки.
В первом периоде родов сердцебиение увеличивается в ответ на схватку, во втором периоде возможно кратковременное урежение сердцебиения, связанное с прижатием головки. При головном предлежании до 80 ударов в минут, при тазовом предлежании за норму можно считать даже тахикардию до 180 ударов в минут, что связано с особенностями расположения головки в области дна.
Двигательная активность. 5 движений за 30 минут — норма, во 1 периоде — 1-3 шевеления, во втором периоде плод в норме не шевелится.
Исследование околоплодных вод на предмет мекония — амниоскопия ( можно сказать есь или нет мекония) или оценить подтекающие воды (если нет плодного пузыря).
Амниоцентез как правило используется по показаниям со стороны матери или плода: генетическая патология, гемолитическая болезнь новорожденного. Делается прокол пузыря. Наиболее часто проводится трансабдоминальный амниоцентез с введением иглы в амниотическую полость. Для амниоцентеза должно быть исключено расположение плаценты по передней стенке. Трансвагинальный, надлобковый амниоцентез используется в основном в ранних сроках.
Определение кислотно-щелочного равновесия. Можно сделать при исследовании околоплодных вод, либо исследовать кровь из предлежащей части плода (поэтому делается только в родах, когда нет пузыря).
Исследование маточно-плацентарного кровообращения.
Определение уровня плацентарных гормонов в моче: можно судить о состоянии матчоно-плацентарного кровообращения и косвенно о состоянии плода. Определяют эстриол, прегнандиол (метаболит прогестерона), термостабильную щелочную фосфатазу в крови матери.
Изотопные методы ( более научный метод).
УЗИ: определяют размеры, структуру плаценты, гипотрофию при хронической гипоксии.
Профилактика и лечение проводятся одними и теми же методами.
ЛЕЧЕНИЕ. Лечение должно состоять в ликвидации причины гипоксии, а также лечения непосредственно гипоксии (медикаментозная патогенетическая терапия и скорейшее родоразрешение).
Патогенетическая медикаментозная терапия:
1 гр.
Кислородотерапия проводится с помощью чистого кислорода, кислородно-воздушной смеси (кислород составляет 60%), ингаляции в течение 10-15 минут.
Гипербарическая оксигенация. Можно даже вести роды в камере ГБО.
2 гр. Препараты направленные на улучшение плацентарного кровообращения.
Сосудорасширяющие средства: эуфиллин, трентал, курантил (последние 2 улучшают реологические свойтсва крови являясь деагрегантами), также можно назначить реополиглюкин.
Эстрогены — усиливают маточно-плацентарное кровообращение: естественные эстрогены — фолликулин, искуственные — синестрол. Сигетин — препарат эстрогеноподобного действия.
Токолитики — бета-адреномиметики: партусистен, бриканил, сальбутамол, ритодрин, алупент.
3 гр. Средства, повышающие устойчивость плода к кислородной недостаточности. — антигипоксанты — седуксен, этимизол, оксибутират натрия, буфенин, пирацетам, дроперидол.
Развитие детей, перенесших острую и хроническую гипоксию
На правах рукописи —
Пронина Ольга Александровна
РАЗВИТИЕ ДЕТЕЙ, ПЕРЕНЕСШИХ ОСТРУЮ И ХРОНИЧЕСКУЮ ГИПОКСИЮ
14,00.09 — педиатрия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата медицинских наук
Воронеж — 2009
003469525
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Воронежская государственная медицинская академия им. H.H. Бурденко Федерального агентства по здравоохранению и социальному развитию» (ГОУ ВПО ВГМА им. H.H. Бурденко Росздрава)
H.H. Бурденко Федерального агентства по здравоохранению и социальному развитию» (ГОУ ВПО ВГМА им. H.H. Бурденко Росздрава)
Научный руководитель: Официальные оппоненты:
Ведущая организация:
доктор медицинских наук, профессор Логвинова Ия Ивановна
доктор медицинских наук, профессор Ситникова Валентина Пантелеевна кандидат медицинских наук Савченко Андрей Пантелеевич
ГОУ ВПО «Волгоградский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Защита диссертации состоится «2» июня 2009 года в 10°° часов на заседании диссертационного совета Д.208.009.02 при ГОУ ВПО ВГМА им. H.H. Бурденко Росздрава по адресу: 394036, Россия, г. Воронеж, ул. Студенческая, д. 10.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО ВГМА им. H.H. Бурденко Росздрава
Автореферат разослан «30» апреля 2009 года.
Ученый секретарь диссертационного совета
A. B. Будневский
B. Будневский
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность
Перинатальная гипоксия занимает одно из ведущих мест среди перинатальных факторов, оказывающих влияние не только на состояние плода, но и на особенности течения периода новорожденное™, что, в конечном итоге, сказывается на здоровье и дальнейшем развитии ребенка (Баранов A.A., 2001, Балаболкин И.И., 2003). По данным Барашнева Ю.И. (2005) внутриутробная гипоксия и гипоксия в родах в 38,45% случаев является причиной перинатальной смертности, а в 59,04% — причиной мертворождений. Частота перинатальной гипоксии не имеет тенденции к уменьшению. 60-80% всех заболеваний ЦНС детского возраста связано с перинатальной гипоксией (Бадалян Л.О., 2001). Более половины всех случаев расстройств функций ЦНС у детей раннего возраста обусловлено не острой гипоксией в родах, а длительной, хронической гипоксией плода и новорожденного (Paneth N., 1983, Nelsons К.В., 1996, Volpe J.J., 2008). Значимость проблемы состоит в том, что поражения головного мозга гипоксического генеза определяют неврологическое здоровье и инвалидность с детства (Пальчик А. Б,, 2001; Барашнев Ю.И., 2005). Необходим поиск комплекса современных клинических и лабораторных критериев, позволяющих улучшить раннюю диагностику и прогноз повреждений нервной системы у детей. Своевременное выявление постгипоксических нарушений имеет огромное значение для построения адекватной терапии неврологических расстройств и их профилактики (Барашнев Ю.И., 1991, Баранов A.A., 2006).
Б,, 2001; Барашнев Ю.И., 2005). Необходим поиск комплекса современных клинических и лабораторных критериев, позволяющих улучшить раннюю диагностику и прогноз повреждений нервной системы у детей. Своевременное выявление постгипоксических нарушений имеет огромное значение для построения адекватной терапии неврологических расстройств и их профилактики (Барашнев Ю.И., 1991, Баранов A.A., 2006).
На современном этапе развития медицинской науки установлено, что гипоксия, ишемия, ацидоз индуцируют синтез эндотелина-1 (ЭТ-1) (Isozaki-Fukuda Y., 1991, Антонов А.Г., 2006). ЭТ-1 оказывается причастным к сердечно-сосудистой и почечной патологии, диабету (La М., 1995, Gray G., 1996, Pernow J., 1997, Rhoten R., 1997, Schiffrin E.L., 2001, D. Behrendt, 2002, Touyz RM, 2003,), а также участвует в патогенезе легочной гипертензии и постгипоксических нарушений сердечно-сосудистой системы у новорожденных (Kumar Р, 1996, Perreault Т, 2003, Зузенкова Л.В., 2008). Роль ЭТ-1 в развитии перинатальных гипоксических поражений ЦНС и их исходов у новорожденных изучена недостаточно.
В связи с изложенным выше, изучение дальнейшего физического, нервно-психического развития, соматической заболеваемости, оптимизация диагностики и прогнозирования неврологической патологии у детей, перенесших острую и хроническую перинатальную гипоксию, а также изучение роли ЭТ-1 в развитии неврологических расстройств у детей являются весьма актуальными.
Цель исследования
Провести мониторинг развития детей, перенесших острую и хроническую перинатальную гипоксию, а также определить роль ЭТ-1 в
развитии неврологических расстройств гипоксического генеза у детей и выявить наиболее значимые факторы, влияющие на их компенсацию.
Задачи исследования
1. Изучить течение раннего неонатального периода у детей, перенесших острую и хроническую гипоксию.
2. Оценить физическое развитие детей до 3-х лет, перенесших острую, хроническую и сочетанную перинатальную гипоксию.
3. Провести анализ соматической заболеваемости у детей до 3-х лет, перенесших внутриутробную и интранатальную гипоксию.
4. Сравнить неврологические нарушения и сроки их компенсации, в зависимости от вида перенесенной гипоксии.
5. Определить факторы, влияющие на наступление неврологической компенсации после 1,5 лет у детей, перенесших перинатальную гипоксию.
6. Изучить роль ЭТ-1 в развитии неврологических расстройств у новорожденных.
Новизна исследования
Установлены особенности течения раннего неонатального периода, физического развития, соматической заболеваемости у детей, перенесших острую, хроническую и сочетанную гипоксию.
Выявлены особенности неврологических нарушений и сроки их компенсации, в зависимости от вида перенесенной гипоксии.
Определен прогностический вклад факторов, влияющих на позднее наступление неврологической компенсации у детей, перенесших перинатальную гипоксию.
Выявлена диагностическая и прогностическая значимость ЭТ-1 в развитии ХВГП и неврологических нарушений у детей, перенесших внутриутробную гипоксию.
Практическая значимость
Определены особенности течения раннего неонатального периода, физического развития, соматической заболеваемости, неврологических нарушений и сроки их компенсации у детей, в зависимости от вида перенесенной гипоксии.
Установлено, что определение концентрации ЭТ-1 в плазме пуповинной крови и в период ранней неонатальной адаптации у детей с высоким риском хронической внутриутробной гипоксии позволяет судить о наличии постгипоксических нарушений. Показатели ЭТ-1 могут служить критерием раннего прогнозирования развития последствий перинатального поражения ЦНС у детей на первом году жизни.
Выявлено, что для прогнозирования сроков компенсации неврологических расстройств у детей с перинатальной гипоксией (при условии стандартных методов лечения) необходима комплексная оценка
группы факторов, включающих антенатальное развитие и интранатальный период, неонатальную заболеваемость и данные нейросонографии, заболеваемость на протяжении первых 3-х лет жизни.
Предложено комплексное обследование и наблюдение детей, перенесших перинатальную гипоксию, включающее в себя определение ЭТ-1 в пуповинной крови, оценку физического развития с обязательным ежемесячным определением окружностей головы и груди на протяжении 11,5 лет, оценку неврологического и соматического статуса, обязательное проведение нейросонографии не однократно, даже при отсутствии патологии при предыдущих исследованиях. Данный комплекс обследования позволяет выявить в более ранние сроки наличие соматических и неврологических расстройств, а также способствует определению «клинически немых» форм поражения головного мозга и своевременной коррекции выявленных нарушений.
Внедрение в практику
Рекомендации, разработанные на основании полученных в ходе диссертационного исследования данных, используются в учебном процессе на кафедре неонатологии ГОУ ВПО ВГМА им. H.H. Бурденко Росздрава.
Основные положения, выносимые иа защиту:
1. Особенности течения раннего неонатального периода, физического развития, соматической заболеваемости, неврологических нарушений и сроки их компенсации у детей, в зависимости от вида перенесенной гипоксии, необходимо учитывать для профилактики развития постгипоксических нарушений у детей сразу после рождения и в раннем возрасте.
2. Определение концентрации ЭТ-1 в плазме пуповинной крови и в период ранней неонатальной адаптации у детей с высоким риском хронической внутриутробной гипоксии позволяет судить о наличии постгипоксических нарушений. Показатели ЭТ-1 в пуповинной крови могут служить критерием раннего прогнозирования развития последствий перинатальных поражений ЦНС у детей на первом году жизни.
3. Для прогнозирования сроков компенсации неврологических расстройств у детей с перинатальной гипоксией (при условии стандартных методов лечения) необходима комплексная оценка группы материнских факторов и факторов, относящихся к состоянию ребенка.
4. Детям, перенесшим перинатальную гипоксию, необходимо комплексное обследование и наблюдение для выявления в более ранние сроки наличия соматических и неврологических расстройств и своевременной их коррекции.
Апробация работы
Основные результаты работы были представлены на III, V, VI Всероссийских университетских научно-практических конференциях молодых ученых и студентов по медицине (Тула, 2004, 2006, 2007), I Всероссийской Бурденковской студенческой научной конференции (Воронеж, 2005), X конгрессе педиатров России (Москва, 2006), Ежегодной междисциплинарной научно-практической конференции стран СНГ (Санкт-Петербург, 2006), ежегодном конгрессе специалистов перинатальной медицины (Москва, 2006), Первом Объединенном научно-практическом форуме детских врачей (Орел, 2008), И научно-практической конференции «Актуальные вопросы организации, оказания первичной, специализированной медицинской помощи в условиях многопрофильного стационара» (Воронеж, 2008).
Публикации
По материалам диссертации опубликовано 10 работ, две из которых в издании, рекомендованном ВАК РФ.
Объем и структура диссертации
Диссертация изложена на 144 страницах машинописного текста, состоит из введения, обзора литературы, главы, посвященной объекту и методам исследования, трех глав собственных исследований, заключения, выводов, практических рекомендаций, указателя литературы. Работа иллюстрирована 10 рисунками и 37 таблицами, содержащимися в тексте. Библиография содержит 286 источников, в том числе 179 отечественных и 107 иностранных авторов.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Объект и методы исследования
Проведено обследование 157 детей, В данное исследование были включены дети, перенесшие ХВГП и асфиксию новорожденного, со сроком гестации от 37 до 42 недель, рожденные в роддоме «Электроника» и областном родильном доме в 2002-2005 гг. Критериями исключения новорожденных из исследования стали срок гестации менее 37 недель, травматические повреждения и поражения ЦНС при инфекционных заболеваниях перинатального периода, а также врожденные пороки развития.
Перенесенная детьми гипоксия подтверждалась данными повторных (не менее двух) кардиотокографических и ультразвуковых исследований во 2-м и 3-м триместрах беременности, а также антенатальными и интранатальными факторами риска. Асфиксия новорожденного
устанавливалась согласно критериям диагностики — оценка по шкале Апгар и наличие клинических признаков полиорганных нарушений.
Дети были разделены на пять групп. Первая (контрольная) группа состояла из 30 здоровых доношенных новорожденных, матери которых не имели кардиотокографических признаков страдания плода и ультразвуковых признаков ФПН. Вторую группу составили 25 новорожденных с оценкой по шкале Апгар 4-6 баллов, матери которых также не имели кардиотокографических и ультразвуковых признаков хронической гипоксии плода, т.е. перенесших острую умеренную асфиксию в родах. В третью группу вошло 39 детей с признаками хронической внутриутробной гипоксии плода, не достигающими критических значений. В четвертой группе было 27 новорожденных, перенесших умеренную асфиксию в родах, развившуюся на фоне хронической антенатальной гипоксии. Пятую группу составили 36 детей, рожденных в тяжелой асфиксии на фоне хронической внутриутробной гипоксии плода. Основные характеристики детей представлены в таблице 1.
Пятую группу составили 36 детей, рожденных в тяжелой асфиксии на фоне хронической внутриутробной гипоксии плода. Основные характеристики детей представлены в таблице 1.
Таблица 1
1 группа (п=30) 2 группа (п=25) 3 группа (п=39) 4 группа (п=27) 5 группа (п=36)
Мальчики/ Девочки (абс(%) 15/15 (50/50) 17/8 (68/32) 14/25 (36/64) 12/15 (44/56) 21/15 (58/42)
Масса тела при рождении, г (М±а) 3509 ±345 3600 ±398 3247 ±339* 3200 ±289* 3394 ±332
Длина тела при рождении, см (М±сг) 53,1 ±1,7 53,8 ±1,9 51,7 ±2,0 52,3 ±2,5 53 ±2,7
Окружность головы, см (М±ст) 34,6 ±1,0 35,2 ±1,1 34,4 ±1,2 34,6 ±1,4 34,1 ±1,7
Окружность груди, см (М±о) 32,5 ±1,6 33,0 ±1,7 31,9 ±1,6 32,1 ±1,7 32,4 ±1,6
Гестационный возраст, нед (М±о) 39,1 ±0,7 39,5 ±1,0 39,1 ±0,9 38,9 ±0,8 39 ±0,9
Оценка по шкале Апгар 1 мин/5 мин (М±о) 7,0/8,0 5,8±0,5/ 7,0±0,5 7,0/ 7,9±0,2 5,9±0,3/ 7,15±0,4 2,0±0,8/ 4,8±1,3
Примечание: * р<0,01 между группами контроля, «с умеренной асфиксией» и группами «с ХВГП», «с ХВГП+ умеренная асфиксия»
Отмечалось отличие по массе тела в группах детей с перенесенной хронической и сочетанной гипоксией с умеренной асфиксией от контрольной группы и группы детей, перенесших острую умеренную асфиксию. Отличие между группами отмечалось также по тяжести состояния при рождении и оценивалось по шкале Апгар.
Отличие между группами отмечалось также по тяжести состояния при рождении и оценивалось по шкале Апгар.
Обследование новорожденных в родильном доме включало оценку состояния при рождении по шкапе Апгар, морфофункциональной зрелости
и физического развития, неврологического и соматического статуса, общеклиничекие лабораторные исследования.
Последующее наблюдение за детьми осуществлялось до достижения ими трёхлетнего возраста. Пациентам проводился комплекс клинических, лабораторных и инструментальных исследований в динамике. Все дети были консультированы неврологом, офтальмологом, хирургом.
Оценка физического развития детей в возрасте от 1 месяца до 3-х лет проводилась с использованием центильных таблиц И.М. Воронцова и А.Н. Мазурина соответственно возрасту и полу. Уровень психомоторного развития определялся по методике Л.Т. Журбы и Е.М. Мастюковой (1981), а также с использованием методики В.А. Доскина и соавторов (1997). Ультразвуковое исследование головного мозга проводилось аппаратом «Бшепз 80-450» (Германия), секторными датчиками 3,5 и 7,5 МГц.
С целью изучения состояния функций эндотелия у новорожденных, перенесших ХВГП, была определена концентрация ЭТ-1 в плазме крови у детей со сроком гестации 37-42 недели, рожденных в областном роддоме в 2007 году. Нами был обследован 41 ребенок, которые на основании анамнестических, клинических данных, кардиотокографии и допплерометрии перенесли хроническую внутриутробную гипоксию. Эти дети вошли в основную группу. Группу сравнения составили 12 новорожденных, родившихся у матерей с не осложненным течением беременности и родов. В ходе исследования дети основной группы, перенесшие ХВГП, были разделены на 2 подгруппы. В 1А подгруппу вошло 15 детей, которые в раннем неонатальном периоде не имели признаков гипоксически-ишемического поражения ЦНС. 1Б подгруппу составили 26 детей, имеющие в раннем неонатальном периоде признаки церебральной ишемии I и II степени. Общая характеристика обследуемых пациентов представлена в таблице 2.
Таблица 2
Общая характеристика групп детей, обследуемых на эндотелиальную
дисфункцию
Основная группа Группа сравнения (п=12)
1А подгруппа (п=15) 1Б подгруппа (п=26)
Мальчики/ Девочки (абс(%) 4/11 (27/73) 15/11. (58/42) 6/6 (50/50)
(58/42) 6/6 (50/50)
Масса тела при рождении, г (М±о) 3706±224 3246±504* 3615±486
Длина тела при рождении, см (М±сг) 54,2±1,5 52,8±2,1 54±2,8
Окружность головы, см (М±а) 35±1,2 33,9±1,3 35,1±1,4
Окружность груди, см (М±о) 33,6±1,4 32,5±1,5 33,6±1,0
Гестационный возраст, нед (М±о) 39,2±0,9 39,2±0,88 38,8±0,22
Примечание: * р<0,05 между 1А подгруппой, группой сравнения и 1Б подгруппой
Оценка по шкале Апгар у всех детей составила 7-8 баллов. Отмечалось отличие по массе тела в подгруппе детей с церебральной ишемией от контрольной группы и подгруппы без поражения ЦНС.
Количественное определение ЭТ-1 в ЭДТА-плазме производили с помощью иммуноферментного анализа (набор Biomedica).
Последующее наблюдение за детьми, у которых был определен ЭТ-1 в крови, осуществлялось на протяжении первого года жизни с оценкой физического и психомоторного развития, изучением соматической и неврологической патологии, проведением ультразвукового исследования головного мозга.
Статистическая обработка
Статистическая обработка полученных результатов проводилась на персональном компьютере с помощью пакета универсальных программ «Excel» и «Statistica v.6» с использованием общепринятых параметрических и непараметрических методов. Обработка вариационных рядов включала подсчет значений средних арифметических величин (М), стандартной ошибки (ш), стандартного отклонения (а). Частота признаков представлена с указанием стандартной ошибки для качественных признаков, стандартного отклонения для количественных признаков. Для сравнения средних величин количественных переменных использовали t-критерий Стьюдента. Качественные показатели сравнивали по критериям Хи-квадрат и Манна-Уитни. Достоверными считались различия между группами при вероятности ошибки менее 5% (р<0,05). Для выявления взаимосвязей между изучаемыми показателями применяли метод корреляционного анализа, включающий как оценку коэффициента корреляции Спирмена (г), так и уровень его значимости (р). Определение факторов риска поздней (после 1,5 лет) неврологической компенсации проводилось с помощью многомерного регрессионного анализа с 95% доверительным интервалом.
Определение факторов риска поздней (после 1,5 лет) неврологической компенсации проводилось с помощью многомерного регрессионного анализа с 95% доверительным интервалом.
Результаты исследований
Был проведен анализ антенатального, интранатального и раннего постнатального периодов каждого ребенка.
Средний возраст матерей в группах «с ХВГП» (3 группа — 26,33±5,90 лет), «с ХВГП + умеренная асфиксия» (4 группа — 28,48±4,95 лет), «с ХВГП + тяжелая асфиксия» (5 группа — 26,56±6,31 лет) достоверно не отличался между группами и от контроля (1 группа — 27,93±6,06 лет). Средний возраст матерей в группе «с умеренной асфиксией» (2 группа) составил 25,08±3,7б лет и достоверно отличался от контрольной группы и от группы «с ХВГП + умеренная асфиксия» (р<0,05). Следует отметить, что в группе «с ХВГП» и обеих группах с сочетанной гипоксией, а также в контрольной группе, женщины старше 35 лет встречались примерно с одинаковой частотой (в 1, 3, 4 группах — по 5 женщин (16,7%, 12,8%, 18,5% соответственно), в 5 группе — 6 (16,7%) женщин). В группе «с умеренной асфиксией» женщины старше 35 лет не встречались.
В группе «с умеренной асфиксией» женщины старше 35 лет не встречались.
Анализ соматической заболеваемости показал, что все женщины до наступления настоящей беременности имели ту или иную соматическую патологию. Во всех группах, включая контрольную, женщины имели высокий процент патологии (69,4% до 96,2%). Осложненный соматический анамнез встречался достоверно чаще только в группе «с ХВГП + умеренная асфиксия» (96,2%), чем во всех остальных (р<0,01). Более половины матерей в группах детей с перенесенной острой и/или хронической гипоксией имели осложненный гинекологический анамнез. В группе «с умеренной асфиксией» преобладали воспалительные (56%), а в группе «с ХВГП» невоспалительные (53,8%) болезни женских половых органов. У матерей в группах «с ХВГП + умеренная асфиксия» и «с ХВГП + тяжелая асфиксия» воспалительные и невоспалительные гинекологические заболевания встречались с одинаковой частотой (по 55,6% и 41,6% соответственно). В контрольной группе осложненный гинекологический анамнез имела четвертая часть женщин. Первая беременность регистрировалась почти у половины женщин в группах контроля, «с ХВГП» и «с ХВГП + тяжелая асфиксия». В группе «с ХВГП + умеренная асфиксия» одна треть детей была рождена от первой беременности. Течение беременности в группах детей с хронической и сочетанной гипоксией (3, 4, 5 группы) осложнилось гестозом второй половины у всех женщин. В 3-й, 4-й и 5-й группах у четверти, одной трети и почти у половины матерей, соответственно, гестоз был в виде нефропатии различной степени. Примерно у половины матерей в этих группах регистрировались анемия беременных, ранний токсикоз и угроза прерывания, каждая пятая женщина перенесла ОРВИ во время беременности. Течение беременности в группе «с умеренной асфиксией» осложнилось более чем у половины матерей анемией беременных, ранним токсикозом, водянкой беременных и угрозой прерывания, которая отмечалась однократно и без длительного лечения, каждая пятая перенесла ОРВИ во время беременности. В контрольной группе однократная угроза прерывания беременности регистрировалась в два раза, водянка беременных в пять раз, а токсикоз в семь раз реже, чем в группах с гипоксией (р<0,001).
Первая беременность регистрировалась почти у половины женщин в группах контроля, «с ХВГП» и «с ХВГП + тяжелая асфиксия». В группе «с ХВГП + умеренная асфиксия» одна треть детей была рождена от первой беременности. Течение беременности в группах детей с хронической и сочетанной гипоксией (3, 4, 5 группы) осложнилось гестозом второй половины у всех женщин. В 3-й, 4-й и 5-й группах у четверти, одной трети и почти у половины матерей, соответственно, гестоз был в виде нефропатии различной степени. Примерно у половины матерей в этих группах регистрировались анемия беременных, ранний токсикоз и угроза прерывания, каждая пятая женщина перенесла ОРВИ во время беременности. Течение беременности в группе «с умеренной асфиксией» осложнилось более чем у половины матерей анемией беременных, ранним токсикозом, водянкой беременных и угрозой прерывания, которая отмечалась однократно и без длительного лечения, каждая пятая перенесла ОРВИ во время беременности. В контрольной группе однократная угроза прерывания беременности регистрировалась в два раза, водянка беременных в пять раз, а токсикоз в семь раз реже, чем в группах с гипоксией (р<0,001).
Наличие внутриутробного страдания плода подтверждалось проведением КТГ и ультразвуковых допплерометрических исследований. Базальный ритм и ПСП в группах с хронической и сочетанной гипоксией был достоверно выше, чем в 1-й и 2-й группах (р<0,001). В группах с хронической гипоксией и сочетанной умеренной и тяжелой асфиксией выраженное страдание плода отмечалось более чем у половины женщин. В контрольной группе и в группе «с умеренной асфиксией» при кардиотокографическом исследовании патологии не выявлено. Допплерометрическое исследование показало наличие признаков ФПН в группах с хронической и сочетанной гипоксией у всех женщин, тогда как в группе «с умеренной асфиксией» только у 28% беременных (р<0,05). Необходимо отметить, что во 2-й группе встречалась только 1а степень ФПН. В контрольной группе плацентарный кровоток не нарушался.
Самостоятельные роды превалировали в контрольной группе у 66,7% и в группе «с ХВГП» у 53,8% женщин, из них физиологическими были 45% и 23,8% случаев соответственно. В группах «с умеренной асфиксией», «с ХВГП + умеренная асфиксия» и «с ХВГП + тяжелая асфиксия» ни у одной женщины роды не протекали физиологически. Аномалии родовой деятельности в группе «с ХВГП + тяжелая асфиксия» в два раза чаще осложняли течение родов, чем в контрольной группе (р<0,05). Во всех группах с перенесенной гипоксией практически половина родов осложнилась патологией пуповины, что достоверно чаще по сравнению с контролем (р<0,05). Дородовое излитие околоплодных вод в группах «с ХВГП + тяжелая асфиксия» и «с ХВГП» наблюдалось у каждой третьей женщины, что чаще, чем в группах «с умеренной асфиксией» и контроля. Меконий в околоплодных водах встречался примерно у каждой пятой женщины во всех группах с гипоксией.
В группах «с умеренной асфиксией», «с ХВГП + умеренная асфиксия» и «с ХВГП + тяжелая асфиксия» ни у одной женщины роды не протекали физиологически. Аномалии родовой деятельности в группе «с ХВГП + тяжелая асфиксия» в два раза чаще осложняли течение родов, чем в контрольной группе (р<0,05). Во всех группах с перенесенной гипоксией практически половина родов осложнилась патологией пуповины, что достоверно чаще по сравнению с контролем (р<0,05). Дородовое излитие околоплодных вод в группах «с ХВГП + тяжелая асфиксия» и «с ХВГП» наблюдалось у каждой третьей женщины, что чаще, чем в группах «с умеренной асфиксией» и контроля. Меконий в околоплодных водах встречался примерно у каждой пятой женщины во всех группах с гипоксией.
При анализе течения раннего неонатального периода выявлено, что в контрольной группе наблюдалась низкая заболеваемость. Только у 20% детей встречалась конъюгационная желтуха. В группах с перенесенной гипоксией (2, 3, 4, 5 группы) общая заболеваемость достоверно выше, чем в контрольной группе (р<0,001), и составила от 74,1 до 100%. В 5-й группе наблюдалась самая высокая заболеваемость по сравнению с другими группами (р<0,01). На первом месте во всех группах с перенесенной асфиксией стоят дыхательные и сердечно-сосудистые нарушения, ВЖК также превалировали в этих группах (14-16%). Транзиторное тахипноэ новорожденного достоверно чаще встречалось в 5-й группе, чем в остальных группах с гипоксией (р<0,01). ЗВУР регистрировалась только у детей с хронической гипоксией (3,4, 5 группа) от 14% до 33,3%.
В 5-й группе наблюдалась самая высокая заболеваемость по сравнению с другими группами (р<0,01). На первом месте во всех группах с перенесенной асфиксией стоят дыхательные и сердечно-сосудистые нарушения, ВЖК также превалировали в этих группах (14-16%). Транзиторное тахипноэ новорожденного достоверно чаще встречалось в 5-й группе, чем в остальных группах с гипоксией (р<0,01). ЗВУР регистрировалась только у детей с хронической гипоксией (3,4, 5 группа) от 14% до 33,3%.
Неврологическая патология в группе «с ХВГП + тяжелая асфиксия» так же, как и соматическая, наблюдалась чаще, чем в других группах. Гипоксическое поражение ЦНС имели все новорожденные этой группы, тогда как во 2-й, 3-й и 4-й группах церебральная ишемия была выявлена у 48%, 38,5%, 59,3% детей соответственно. Ведущим неврологическим синдромом в группах «с умеренной асфиксией», «с ХВГП» и «с ХВГП + умеренная асфиксия» явился гипертензионный синдром (28%, 20,5% и 22,2% соответственно), а в группе «с ХВГП + тяжелая асфиксия» — синдром гипервозбудимости и синдром угнетения (38,9% и 36,1% соответственно). В группе «с ХВГП + тяжелая асфиксия» судорожный синдром встречался у 13,9% детей, а в группе «с умеренной асфиксией» в 4% случаев.
В группе «с ХВГП + тяжелая асфиксия» судорожный синдром встречался у 13,9% детей, а в группе «с умеренной асфиксией» в 4% случаев.
Всем детям были исследованы в капиллярной крови на 1-е и на 5-е сутки концентрация гемоглобина и количество эритроцитов, повышение которых является адаптационным механизмом при кислородной недостаточности. Концентрация гемоглобина и количество эритроцитов на 1-е сутки и количество эритроцитов на 5-е сутки в группе «с ХВГП + тяжелая асфиксия», были достоверно выше, чем в остальных группах. Концентрация гемоглобина на 5-е сутки в группах достоверно не отличалась.
Катамнез детей исследуемых групп
На естественном вскармливании в контрольной группе находилось 76,5% детей, а в группе «с умеренной асфиксией» — 50% детей. Более половины детей в группах с хронической и сочетанной гипоксией вскармливались искусственно (3 группа — 52,3%, 4 группа — 57,1%, 5 группа — 77,8% детей).
При изучении физического развития к вариантам нормы были отнесены характеристики, свойственные 80% популяции и находящиеся в интервале от 10-го до 90-го центиля. К году в группах детей с перенесенной гипоксией от 15% до 50% детей имели дисгармоничное физическое развитие с избытком массы тела. В контрольной группе дисгармоничное физическое развитие с избытком массы тела наблюдалось только у 11,8%. Масса и длина тела ниже 10 центиля на первом году жизни встречалась лишь у детей 4-й (7,1%) и 5-й (5,6%) групп. К трем годам во всех группах отмечалась положительная динамика, кроме группы «с ХВГП», в которой количество детей с гармоничным физическим развитием снизилось до 71,4% (рис. 1).
К году в группах детей с перенесенной гипоксией от 15% до 50% детей имели дисгармоничное физическое развитие с избытком массы тела. В контрольной группе дисгармоничное физическое развитие с избытком массы тела наблюдалось только у 11,8%. Масса и длина тела ниже 10 центиля на первом году жизни встречалась лишь у детей 4-й (7,1%) и 5-й (5,6%) групп. К трем годам во всех группах отмечалась положительная динамика, кроме группы «с ХВГП», в которой количество детей с гармоничным физическим развитием снизилось до 71,4% (рис. 1).
Длина тела Масса тела
Рис. 1 Физическое развитие детей (длина тела, масса тела)
Окружность груди к году в контрольной группе у всех детей укладывалась в возрастные нормативы. В группе «с ХВГП + умеренная асфиксия» каждый пятый ребенок, а в группе «с ХВГП» более половины детей имели узкую грудную клетку. Показатели окружности головы в контрольной группе в изучаемые возрастные периоды (3 месяца, 1 год) у всех обследуемых укладывались в «коридор» от 10 до 90 центиля. В 4-й группе около половины имели показатели окружности головы ниже 10 центиля. У третьей части детей 5-й группы определялись увеличенные размеры окружности головы. К году в группах с хронической гипоксией и сочетанной умеренной и тяжелой асфиксией положительной динамики не
В 4-й группе около половины имели показатели окружности головы ниже 10 центиля. У третьей части детей 5-й группы определялись увеличенные размеры окружности головы. К году в группах с хронической гипоксией и сочетанной умеренной и тяжелой асфиксией положительной динамики не
наблюдалось, только у половины детей показатели окружности головы находились между 10 и 90 центилем (рис. 2).
Окружность головы Окружность груди
Рис. 2 Физическое развитие детей (окружность головы, окружность груди)
Анализируя соматическую патологию у детей, перенесших острую и хроническую гипоксию, в контрольной группе была выявлена более низкая заболеваемость, чем в группах сравнения (р<0,05). В раннем возрасте 70,5% пациентов перенесли ОРВИ, но только в одном случае вирусная инфекция сопровождалась бронхитом. В группах с перенесенной гипоксией все дети переносили ОРВИ в течение трех лет, из них 25% отнесены к группе часто болеющих. В группе «с ХВГП + тяжелая асфиксия» у половины детей, а в группе «с ХВГП + умеренная асфиксия» в 35,7% случаев ОРВИ осложнялась обструктивным бронхитом. Дисбиоз кишечника, атопический дерматит и анемия явились ведущими среди соматической патологии, наиболее часто выявляющиеся в группе с тяжелой асфиксией. Достаточно часто диагностировались астигматизм, конъюнктивиты и отиты в группах детей с гипоксией.
Дисбиоз кишечника, атопический дерматит и анемия явились ведущими среди соматической патологии, наиболее часто выявляющиеся в группе с тяжелой асфиксией. Достаточно часто диагностировались астигматизм, конъюнктивиты и отиты в группах детей с гипоксией.
Анализ неврологической заболеваемости в поздний неонатальный период показал, что процент диагностируемых гипоксических поражений ЦНС в группах с перенесенной гипоксией увеличился до 95,2% — 100%. Всем детям в возрасте 1 и 6 месяцев проводилась нейросонография. В контрольной группе на первом месяце жизни только у 17,6% детей наблюдались признаки перивентрикулярного отека. Ликвородинамические нарушения в группе «с умеренной асфиксией» определялись у 16,7% детей, что достоверно реже, чем в группе «с ХВГП + тяжелая асфиксия» (р<0,01). В группах с хронической гипоксией и сочетанной умеренной и тяжелой асфиксией нарушения ликвородинамики выявлено более чем у половины детей. При повторном нейросонографичсском обследовании в 6 месяцев в группе «с ХВГП» процент ликвородинамических нарушений снизился в 1,5
раза по сравнению с предыдущим исследованием и составил 33,3%, что достоверно ниже, чем в группе «с ХВГП + тяжелая асфиксия» (р<0,05). В группах с острой и сочетанной гипоксией (2, 4 и 5 группы) частота встречаемости признаков нарушения ликвородинамики увеличилась до 64,3%-72,2% (рис. 3).
В группах с острой и сочетанной гипоксией (2, 4 и 5 группы) частота встречаемости признаков нарушения ликвородинамики увеличилась до 64,3%-72,2% (рис. 3).
80 70 60 50 40 30 20 10 О
— 80 — 70 60 — 50 40 30 — 20 -■ 10 О
Признаки Признаки
ликвородинамических ликворалниймических нарушений (1 мес) нарушений (б мес)
-«с умеренной асфиксие й «
■ «ХВГП+умерення и асфиксия»
«ХВГП+тнжвлая асфиксия»
Рис. 3 Результаты нейросонографического обследования в 1 и 6 мес
На первом году жизни среди последствий гипоксических поражений ЦНС ведущее место принадлежит доброкачественной внутричерепной гипертензии, которая была диагностирована более чем у половины детей с перенесенной гипоксией. Сочетанные формы задержки развития, расстройства вегетативной нервной системы и церебрастенический синдром регистрировались только в группах с хронической и сочетанной гипоксией (3, 4, 5 группы). В группе «с умеренной асфиксией» нарушение моторного развития выявлялось достоверно реже, чем в группах «с ХВГП» и «с ХВГП + тяжелая асфиксия» у одной трети и в группе с «ХВГП + умеренная асфиксия» у половины детей (р<0,05). У 50% пациентов 5-й группы имелись клинические признаки гипервозбудимости. Одному ребенку в группе «с ХВГП + тяжелая асфиксия» был поставлен диагноз ДЦП. Следует отметить, что в контрольной группе неврологической патологии выявлено не было.
У 50% пациентов 5-й группы имелись клинические признаки гипервозбудимости. Одному ребенку в группе «с ХВГП + тяжелая асфиксия» был поставлен диагноз ДЦП. Следует отметить, что в контрольной группе неврологической патологии выявлено не было.
К 3-м годам нарушения моторного развития имел каждый пятый ребенок в группах с хронической и сочетанной гипоксией. Нарушения развития речи и гиперкинетические расстройства отмечались более чем у половины детей в группе «с ХВГП + тяжелая асфиксия», что достоверно чаще по сравнению с группами «с ХВГП» и с «ХВГП + умеренная асфиксия» (р<0,05). Дети 4-й и 5-й групп в 14,3 и 22,2% соответственно имели нарушения сна. У пятой части детей группы «с ХВГП + умеренная асфиксия» выявлена сообщающаяся гидроцефалия (рис. 4). В контрольной группе патология со стороны нервной системы к 3-м годам также не регистрировалась, а в группе «с умеренной асфиксией» наступила компенсация неврологических нарушений к году у всех обследуемых. Дети, перенесшие ХВГП, достигли компенсации неврологических нарушений к 3-м годам.
Расстройства сна (С 47)
■ Ко1гтрольняя группа О «с умеренной асфиксией» □ «с ХВГП» ЕЗ «с ХВГШ-умерениан асфиксия» И «с ХВГП+тижеляя асфиксия» _
Рис. 4 Структура неврологической заболеваемости к 3-м годам
Факторы, влияющие на компенсацию неврологических нарушений
На первом этапе исследования влияния некоторых факторов на сроки компенсации неврологических нарушений были построены корреляционные матрицы изучаемых факторов (61 фактор). В ходе исследования проведен корреляционный анализ для выявления факторов, имеющих высокую степень взаимосвязи. Статистически значимо с поздним (после 1,5 лет) наступлением компенсации неврологических нарушений связаны: кардиотокографические признаки страдания плода с коэффициентом корреляции г = 0,66 (р<0,0001), степень ФПН г = 0,69 (р<0,0001), степень тяжести гестоза г = 0,63 (р<0,0001), интубация трахеи г = 0,51 (р<0,0001), концентрация гемоглобина в первые сутки г = 0,45 (р<0,001), гипоксически-ишемическое поражение ЦНС в раннем г = 0,51 (р<0,0001) и позднем неонатальном периоде г = 0,65 (р<0,0001), диффузные изменения тканей мозга гипоксически-ишемического характера г = 0,49 (р<0,0001) и признаки ликвородинамических нарушений г = 0,51 (р<0,0001) при проведении нейросонографии. Слабая корреляционная связь обнаружена между поздней неврологической компенсацией и частыми ОРВИ г = 0,39 (р<0,001). Отмечена отрицательная взаимосвязь поздней неврологической компенсации с оценкой по шкале Апгар на первой г = -0,56 (р<0,0001) и пятой минуте г = -0,52 (р<0,0001), массой тела г = -0,33 (р<0,001) и окружностью головы при рождении г = -0,31 (р<0,001).
Слабая корреляционная связь обнаружена между поздней неврологической компенсацией и частыми ОРВИ г = 0,39 (р<0,001). Отмечена отрицательная взаимосвязь поздней неврологической компенсации с оценкой по шкале Апгар на первой г = -0,56 (р<0,0001) и пятой минуте г = -0,52 (р<0,0001), массой тела г = -0,33 (р<0,001) и окружностью головы при рождении г = -0,31 (р<0,001).
Мы поставили задачу провести сравнительный анализ зависимостей сочетанного воздействия изучаемых факторов с установлением приоритета каждого из них.
В качестве инструментального метода сравнения был использован многомерный регрессионный анализ. Тактика проведения анализа состояла в выявлении статистически значимых зависимостей каждого из изученных
показателей, установлении наиболее «отзывчивых» во влиянии изученных факторов и параметров.
Изучаемые факторы были разбиты на группы:
1. Группа антенатальных и интранатальных факторов:
а) факторы, отражающие соматическую патологию матери;
б) факторы, отражающие течение настоящей беременности;
в) факторы, отражающие период родов;
2. Группа факторов, относящихся к состоянию новорожденного:
Группа факторов, относящихся к состоянию новорожденного:
а) параметры, характеризующие состояние ребенка при рождении;
б) параметры, характеризующие течение периода новорожденности;
в) параметры, характеризирующие заболеваемость ребенка в раннем
возрасте.
В ходе исследования взаимосвязи соматической патологии матери и сроков компенсации неврологических нарушений, установлено, что ни одно из заболеваний не оказывало значимого влияния на позднюю (после 1,5 лет) неврологическую компенсацию. Суммарный вклад этой группы факторов составил только 4,46% и явился статистически не значимым (р = 0,9308).
Исследуя влияние течения беременности у матери на сроки неврологической компенсации у детей, установлено, что ни один из изучаемых параметров по отдельности не влиял на позднее наступление неврологической компенсации, но в совокупности факторы, отражающие течение настоящей беременности, дали около 53% вклада с вероятностью статистической значимости 99% (р = 0,0000).
При анализе взаимосвязи периода родов и сроков неврологической компенсации у детей, было выявлено, что из всех осложнений интранатального периода только экстренное кесарево сечение влияет на позднюю компенсацию с вероятностью статистической значимости более 95% (р = 0,0401). Суммарный вклад интранатальных факторов составил 14,72% с вероятностью статистической значимости всего 85%.
Общий вклад параметров, характеризующих состояние ребенка при рождении, в позднее наступление неврологической компенсации у детей составил 34% (р = 0,0006). По отдельности ни один из факторов не влиял на сроки неврологической компенсации.
Изучая влияние течения неонатального периода на позднее наступление компенсации неврологических нарушений, выявлена сильная зависимость между сроками компенсации и степенью тяжести церебральной ишемии (р = 0,0486) и синдромом гипервозбудимости (р = 0,0159). Совокупный вклад всех факторов неонатальной заболеваемости составил 50%.
Концентрация гемоглобина на первые (р = 0,0174) и пятые (р = 0,0078) сутки и количество эритроцитов на пятые сутки (р = 0,0315) влияют на сроки неврологической компенсации со статистической значимостью более 95%. Оценка суммарного воздействия этих параметров свидетельствует, что коэффициент детерминации равен 28% с вероятностью 99% (р = 0,0002).
Оценка суммарного воздействия этих параметров свидетельствует, что коэффициент детерминации равен 28% с вероятностью 99% (р = 0,0002).
Анализ влияния нейросонографических изменений головного мозга на сроки неврологической компенсации установил, что диффузные изменения тканей мозга гипоксически-ишемического характера (р = 0,0000), перивентрикулярный отек (р = 0,0202) и признаки ликвородинамических нарушений, сохраняющиеся после полугода жизни (р = 0,0001), влияют на позднее восстановление функций после неврологических нарушений у детей с вероятностью до 99%. В совокупности все нейросонографические изменения голоного мозга статистически значимо (р = 0,0000) влияют на время восстановления функций после неврологических нарушений с коэффициентом детерминации 53%.
Среди патологии детей в раннем возрасте значимо влияющим фактором на сроки неврологической компенсации явилась частота ОРВИ (р = 0,0115). Суммарный вклад заболеваемости детей в раннем возрасте в позднюю компенсацию составил 52%. Статистическая значимость сочетанного воздействия указанных факторов составляет 99% (р = 0,0000).
Статистическая значимость сочетанного воздействия указанных факторов составляет 99% (р = 0,0000).
Исследование показателей эндотелина-1 у новорожденных, перенесших хроническую внутриутробную гипоксию
Концентрация ЭТ-1 была определена в крови у 53 новорожденных (41 ребенок основной группы и ¡2 детей группы сравнения). В ходе исследования дети основной группы, перенесшие ХВГП, были разделены на 2 подгруппы. В 1А подгруппу вошло 15 детей, которые в раннем неонатальном периоде не имели признаков гипоксически-ишемического поражения ЦНС. 1Б подгруппу составили 26 детей с признаками церебральной ишемии I и II степени в раннем неонатальном периоде.
На первом этапе исследования маркера эндотелиальной дисфункции у новорожденных был проведен подробный анализ соматической и гинекологической патологии матери, течение настоящей беременности и родов.
Средний возраст матерей в группах достоверно не отличался и составил в контрольной группе 27,75±3,98 лет, в 1А подгруппе — 28,60±5,96 лет, 1Б подгруппе — 27,12±5,64 лет. Анализ экстрагенитальной патологии матерей показал, что различий в общей заболеваемости в группах не обнаружено. В контрольной группе среди экстрагенитальной патологии расстройства вегетативной нервной системы встречались чаще, чем в группе «с ХВГП с церебральной ишемией» (р<0,05). В подгруппах детей с ХВГП преобладали хронический пиелонефрит и расстройства вегетативной нервной системы.
Анализ экстрагенитальной патологии матерей показал, что различий в общей заболеваемости в группах не обнаружено. В контрольной группе среди экстрагенитальной патологии расстройства вегетативной нервной системы встречались чаще, чем в группе «с ХВГП с церебральной ишемией» (р<0,05). В подгруппах детей с ХВГП преобладали хронический пиелонефрит и расстройства вегетативной нервной системы.
В гинекологическом анамнезе достоверных различий между группами также не выявлено. Во всех группах преобладали воспалительные болезни женских половых органов.
Течение беременности у матерей в группах детей с хронической гипоксией (1А и 1Б подгруппы) осложнилось гестозом второй половины у всех женщин, угрозой прерывания в 1А подгруппе — у одной трети и в 1Б
подгруппе — у половины женщин. В контрольной группе гестоз и угроза прерывания не регистрировались.
Наличие внутриутробного страдания плода подтверждалось проведением КТГ и ультразвуковых допплерометрических исследований. ПСП, частота встречаемости ФПН и маловодие в группах с хронической гипоксией было достоверно выше, чем в контрольной (р<0,001). В 1Б подгруппе выраженное страдание плода отмечалось более чем у половины женщин, тогда как в 1А только у трети обследуемых. В контрольной группе при кардиотокографическом исследовании патологии не выявлено. Допплерометрическое исследование показало наличие признаков ФПН в грушах с хронической гипоксией у всех женщин. В контрольной группе у половины беременных встречалась только 1а степень ФПН.
ПСП, частота встречаемости ФПН и маловодие в группах с хронической гипоксией было достоверно выше, чем в контрольной (р<0,001). В 1Б подгруппе выраженное страдание плода отмечалось более чем у половины женщин, тогда как в 1А только у трети обследуемых. В контрольной группе при кардиотокографическом исследовании патологии не выявлено. Допплерометрическое исследование показало наличие признаков ФПН в грушах с хронической гипоксией у всех женщин. В контрольной группе у половины беременных встречалась только 1а степень ФПН.
Течение интранатального периода в группах не отличалось. Путем самостоятельных родов было рождено более половины детей во всех группах. Аномалии родовой деятельности и патология пуповины осложнили течение родов у одной трети женщин в группах с ХВГП. Дородовое излитие околоплодных вод в группе «с ХВГП с церебральной ишемией» наблюдалось у каждой пятой женщины. В контрольной группе более половины самостоятельных родов протекали физиологически.
Отсутствие достоверных различий в соматической и генитальной патологии у матерей, а также отличий по полу, сроку гестации, оценке по шкале Апгар у детей во всех исследуемых группах позволило нам провести сравнение показателей ЭТ-1 в подгруппах с ХВГП и оценить участие маркера эндотелиальной дисфункции в неонатальной заболеваемости. Для этого концентрация ЭТ-1 была определена у новорожденных в пуповинной крови и на 3-5 сутки (таблица 3).
Для этого концентрация ЭТ-1 была определена у новорожденных в пуповинной крови и на 3-5 сутки (таблица 3).
Таблица 3
Содержание ЭТ-1 в плазме крови новорожденных сразу после рождения
и на 3-5 день жизни
Контрольная группа (п= 12) Основная группа (п=41)
1А(п=15) 1Б (п=26)
ЭТ-1 в плазме пуповинной крови, фмоль/мл 0,81±0,21 2,21±0,66* 1,93±0,87*
ЭТ-1 в плазме на 3-5 сутки, фмоль/мл 1,14±0,42 1,62*0,49″» 1,51*0,49*’
Примечание: * р<0,001 между контрольной группой и группами с ХВГП
*1 р<0,05 между контрольной группой и группами с ХВГП
При анализе полученных данных было выявлено достоверное повышение ЭТ-1 в пуповинной крови как в 1А подгруппе — 2,21±0,17 фмоль/мл, так и в 1Б — 1,93±0,17 фмоль/мл, по сравнению с контрольной группой (р<0,001). Определение уровня ЭТ-1 в крови новорожденных детей в период ранней неонатальной адаптации на 31-5 сутки показало, что произошло его незначительное снижение, но все-таки он оставался
достоверно повышен 1,62±0,16 фмоль/мл в 1А подгруппе и 1,51 ±0,11 фмоль/мл в 1Б, по сравнению с контрольной группой (р<0,05). Вероятно, повышение маркера эндотелиальной дисфункции явилось следствием постгипоксических нарушений у детей в ранний неонатальный период.
Вероятно, повышение маркера эндотелиальной дисфункции явилось следствием постгипоксических нарушений у детей в ранний неонатальный период.
Соматическая патология в раннем неонатальном периоде в подгруппе 1Б встречалась чаще, чем в других группах. ЗВУР регистрировалась практически у половины новорожденных в подгруппе 1Б, каждый пятый перенес транзиторное тахипноэ, постгипоксическая кардиолатия и ВУИ были обнаружены по 15,4% случаев. В подгруппе без гипоксического поражения ЦНС были выявлены конъюгационная желтуха у пятой части детей и транзиторное тахипноэ в 13,3% случаев. В контрольной группе превалировали анемия, конъюгационная желтуха и транзиторное тахипноэ у детей рожденных путем кесарева сечения с одинаковой частотой (16,7%).
Критерием включения детей в 1Б подгруппу явилась церебральная ишемия. 1 и II степень тяжести этой патологии встречалась одинаково часто. Синдром гипервозбудимости был определен ведущим и составил 65,4% случаев среди всех неврологических синдромов. Гипертензионный синдром и синдром угнетения регистрировались у пятой части детей, в меньшем проценте (11,5%) встречался синдром вегето-висцеральных дисфункций (рис.5). ________
Гипертензионный синдром и синдром угнетения регистрировались у пятой части детей, в меньшем проценте (11,5%) встречался синдром вегето-висцеральных дисфункций (рис.5). ________
О Синдром
гипс рвозбуди мости
И Синдром
■ Синдром всгето-висцеральных дисфункций Ш Гипертеизион мый синдром
Рис. 5 Клинические синдромы церебральной ишемии в подгруппе «с ХВГП с церебральной ишемией»
Для выявления участия ЭТ-1 в формировании гипоксического поражения ЦНС было прослежено дальнейшее развитие на первом году жизни у 28 детей.
Показатели физического развития к году у детей в контрольной группе и 1А подгруппе находились между 10 и 90 центилем. В подгруппе «с ХВГП с церебральной ишемией» практически половина детей (41,7%) имели окружность груди ниже 10 центиля, и только у одного ребенка значения роста к году были ниже 10 центиля. Окружность головы на первом году жизни в контрольной группе соответствовала 10-90 центилю у всех обследуемых. Увеличение размеров окружности головы в первом полугодии произошло на 6,9±0,83 см, что соответствовало возрастной норме. Темпы роста окружности головы в первом полугодии у детей основной группы (8,4±1,3 см и 9,2±1,9 см в 1А и 1Б подгруппах соответственно) достоверно выше, чем в контрольной группе (р<0,01).
Увеличение размеров окружности головы в первом полугодии произошло на 6,9±0,83 см, что соответствовало возрастной норме. Темпы роста окружности головы в первом полугодии у детей основной группы (8,4±1,3 см и 9,2±1,9 см в 1А и 1Б подгруппах соответственно) достоверно выше, чем в контрольной группе (р<0,01).
Всем детям в возрасте 1 месяца проводилась нейросонография. В контрольной группе патологии не было выявлено. В подгруппе «с ХВГП без церебральной ишемии» на первое место выступали перивентрикулярный отек и диффузные изменения тканей мозга гипоксически-ишемического характера по 75% случаев. Эти же изменения в головном мозге у детей подгруппы «с ХВГП с церебральной ишемией» встречались также более чем у половины обследуемых. Более половины детей 1Б подгруппы имели признаки ликвородинамических нарушений, тогда как в 1А признаки нарушения ликвородинамики визуализированы в 37,5% случаев.
При неврологическом обследовании в 1А подгруппе клинические признаки последствий перинатального поражения ЦНС были обнаружены у всех детей, проявляющиеся у 75% нарушением моторного развития, у одной трети — сочетанными формами задержки развития. У половины обследуемых обнаружен гипертензионный синдром. В 1Б подгруппе последствия церебральной ишемии выявлены у 9 пациентов (75%). Среди неврологической патологии в этой подгруппе превалировали сочетанные формы задержки развития (66,7%). Нарушения моторного развития и гипертензионный синдром встречались с одинаковой частотой (по 58,3%)
У половины обследуемых обнаружен гипертензионный синдром. В 1Б подгруппе последствия церебральной ишемии выявлены у 9 пациентов (75%). Среди неврологической патологии в этой подгруппе превалировали сочетанные формы задержки развития (66,7%). Нарушения моторного развития и гипертензионный синдром встречались с одинаковой частотой (по 58,3%)
Рис. 6 Неврологическая патология у детей на первом году жизни
Нужно отметить, что неврологическая патология наблюдалась в группах с ХВГП у детей, Которые имели в раннем неонатальном периоде уровень ЭТ-1 выше, чем максимальное значение у детей в контрольной группе (1,1 фмоль/мл) (рис. 7).
I □ частоте
встречаемости последствий иереребральной ишемии
концентрация ЭТ-1 в пуповинной крови, фмоль/мл
Рис. 7 Частота встречаемости последствий
церебральной ишемии в зависимости от концентрации эндотелина-1
Учитывая, что симптомокомплекс при таких нозологических формах, как нарушение моторного развития и сочетанные формы задержки развития имеет диагностическое значение при исключении других причин, был проведен анализ соматической патологии. Во всех группах на первое место выступали ОРВИ от 62,5% до 83,3%, но в группу часто болеющих не был включен ни один ребенок. У одной трети детей основной группы встречалась анемия, у четверти пациентов — дисбиоз кишечника и атопический дерматит. В контрольной группе процент соматической патологии был ниже, однако, достоверных отличий в заболеваемости детей контрольной и основной групп выявлено не было.
Во всех группах на первое место выступали ОРВИ от 62,5% до 83,3%, но в группу часто болеющих не был включен ни один ребенок. У одной трети детей основной группы встречалась анемия, у четверти пациентов — дисбиоз кишечника и атопический дерматит. В контрольной группе процент соматической патологии был ниже, однако, достоверных отличий в заболеваемости детей контрольной и основной групп выявлено не было.
При проведении корреляционного анализа обнаружена прямая взаимосвязь концентрации эндотелина-1 в пуповинной крови с хроническим пиелонефритом у матери с коэффициентом корреляции г = 0,6 (р<0,001), гестозом г = 0,55 (р<0,001), инфекционными заболеваниями матери во время беременности г = 0,65 (р<0,001), концентрацией гемоглобина г = 0,67 (р<0,001) и количеством эритроцитов г = 0,59 (р<0,001) у новорожденных в крови на 1-е сутки. Статистически значимо с концентрацией ЭТ-1 в период ранней неонатальной адаптации связаны многоводие г = 0,58 (р<0,001), кардиотокографические признаками страдания плода г = 0,67 (р<0,001), ВУИ г = 0,58 (р<0,001). Проведенный корреляционный анализ выявил также прямую зависимость между концентрацией эндотелина-1 в пуповинной крови и на 3-5 сутки и диффузными изменениями тканей мозга гипоксически-ишемического характера с коэффициентом корреляции г =
Проведенный корреляционный анализ выявил также прямую зависимость между концентрацией эндотелина-1 в пуповинной крови и на 3-5 сутки и диффузными изменениями тканей мозга гипоксически-ишемического характера с коэффициентом корреляции г =
0.67 (р<0,001) и г = 0,56 (р<0,001), сочетанными формами задержки развития г = 0,53 (р<0,001) и г = 0,74 (р<0,0001), нарушением моторного развития г = 0,59 (р<0,001) и г = 0,58 (р<0,001) соответственно. Доброкачественная внутричерепная гипертензия коррелирует только с концентрацией ЭТ-1 на 3-5 сутки г = 0,67 (р<0,001).
На основании изложенного выше, можно сделать вывод, что дети, перенесшие хроническую внутриутробную гипоксию, имеют повышенные показатели ЭТ-1 как в плазме пуповинной крови, так и в плазме крови на 35 сутки. Увеличение уровня ЭТ-1 в крови сохраняется независимо от наличия клинических проявлений, что говорит о сохраняющихся в организме новорожденного постгипоксических нарушениях и о развитии эндотелиальной дисфункции, что впоследствии приводит к неврологическим нарушениям на первом году жизки.
ВЫВОДЫ
1. В раннем неонатальном периоде у трети детей с ХВГП в сочетании и без асфиксии встречалась ЗВУР. У новорожденных, перенесших асфиксию острую или на фоне ХВГП, преобладали дыхательные, сердечно-сосудистые нарушения и ВЖК гипоксического генеза. Наименьший процент
церебральной ишемии приходился на детей, перенесших только хроническую гипоксию.
2. Дисгармоничное физическое развитие с избытком массы тела у детей, перенесших острую и хроническую гипоксию, к году составило от 15% до 50%. Более половины детей с ХВГП в возрасте одного года имели узкую грудную клетку. Только у половины детей с ХВГП в сочетании и без асфиксии окружность головы соответствовала возрастным нормативам. Гармоничное физическое развитие к трем годам реже встречалось у детей, перенесших только ХВГП.
3. При анализе соматической заболеваемости установлено, что от 20% до 30% детей, перенесших острую, хроническую или сочетанную гипоксию, относятся к группе часто болеющих. Анемия, дисбиоз кишечника и атопический дерматит являются преобладающими в структуре заболеваемости.
Анемия, дисбиоз кишечника и атопический дерматит являются преобладающими в структуре заболеваемости.
4. В структуре неврологической заболеваемости на первом году жизни превалировали доброкачественная внутричерепная гипертензия, а к 3-м годам нарушения развития речи и гиперкинетические расстройства. Дети, перенесшие умеренную острую асфиксию, достигли компенсации неврологических нарушений к году, а дети с ХВГП, к 3-м годам. У пятой части детей с тяжелой асфиксией и у одной трети детей с умеренной асфиксией, развившихся на фоне ХВГП, компенсация неврологических нарушений к 3-м годам не наступила. Частота развития ДЦП составила 5,6%.
5. При изучении факторов риска поздней (после 1,5 лет) неврологической компенсации установлено, что наиболее высокая доля вклада принадлежит течению настоящей беременности, патологическим изменениям в головном мозге при нейросонографии и заболеваемости детей в течение 3-х лет (коэффициент детерминации = 53%). Суммарная доля неонатальной заболеваемости составила 50% вклада, а состояние ребенка при рождении -34% вклада.
6. Показатели ЭТ-1 у детей, перенесших хроническую внутриутробную гипоксию, являются повышенными как в пуповинной крови, так и на 3-5 сутки. У детей с ХВГП, имеющих уровень ЭТ-1 в пуповинной крови выше, чем максимальное значение у детей в контрольной группе развиваются неврологические нарушения на первом году жизни. Таким образом, ЭТ-1 можно считать маркером хронической внутриутробной гипоксии, имеющим прогностическое значение в развитии неврологических нарушений.
ПРАКТИЧЕСКИЕ РЕКОМЕНД АЦИИ
1. Для прогнозирования сроков компенсации неврологических расстройств у детей с перинатальной гипоксией (при условии стандартных методов лечения) необходима комплексная оценка группы факторов, включающих антенатальное развитие и интранатальный период, неонатальную заболеваемость и данные нейросонографии, заболеваемость на протяжении первых 3-х лет. Обследование и
наблюдение детей, перенесших перинатальную гипоксию, должно включать в себя оценку физического развития с обязательным ежемесячным определением окружностей головы и груди на протяжении 1-1,5 лет, оценку неврологического и соматического статуса, обязательное проведение нейросонографии всем детям в первом полугодии жизни не менее 2-х раз, даже при отсутствии патологии при предыдущем исследовании. Данный комплекс обследования позволяет выявить в более ранние сроки наличие соматических и неврологических расстройств, а также способствует определению «клинически немых» форм поражения головного мозга, что определяет своевременную коррекцию выявленных нарушений.
Данный комплекс обследования позволяет выявить в более ранние сроки наличие соматических и неврологических расстройств, а также способствует определению «клинически немых» форм поражения головного мозга, что определяет своевременную коррекцию выявленных нарушений.
2. Рекомендовано внедрить в практическую медицину определение концентрации ЭТ-1 в плазме пуповинной крови у детей с высоким риском хронической внутриутробной гипоксии для выявления наличия постгипоксических нарушений и раннего прогнозирования развития последствий перинатального поражения ЦНС у детей на первом году жизни.
Список работ опубликованных по теме диссертации:
1. Катамнез детей, перенесших тяжелую асфиксию в родах У O.A. Дрожжина, Л.И. Ипполитова, С.Л. Хачатурян, A.M. Якунинская, Е.В. Минакова // Пути повышения эффективности медицинской помощи детям: материалы X конгресса педиатров России. — М., 2006. — С. 186.
2. Физическое развитие и заболеваемость детей, перенесших тяжелую асфиксию в родах / O.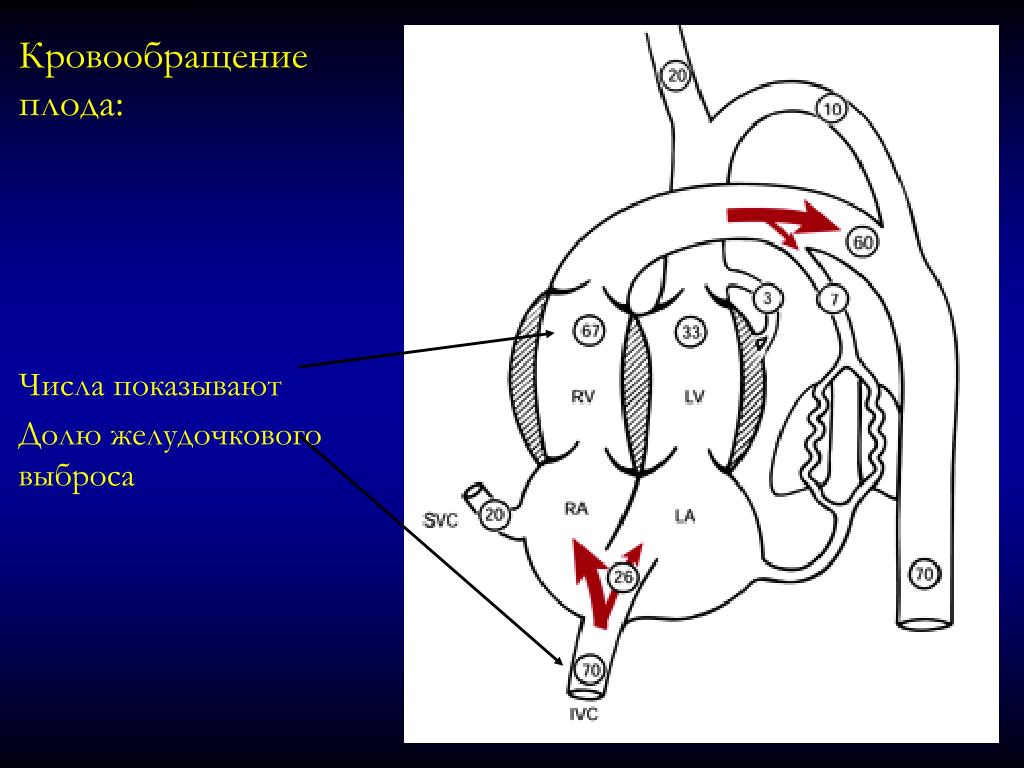 A. Дрожжина, Л.И. Ипполитова, С.Л. Хачатурян, А.М, Якунинская, Е.В. Минакова // Сборник материалов 5 Всероссийской университетской научно-практической конференции молодых ученых и студентов по медицине. — Тула, 2006. — С. 88 — 89.
A. Дрожжина, Л.И. Ипполитова, С.Л. Хачатурян, А.М, Якунинская, Е.В. Минакова // Сборник материалов 5 Всероссийской университетской научно-практической конференции молодых ученых и студентов по медицине. — Тула, 2006. — С. 88 — 89.
3. Оценка физического развития и структуры заболеваемости детей, перенесших тяжелую асфиксию в родах / O.A. Дрожжина, Л.И. Ипполитова, С.Л. Хачатурян, A.M. Якунинская, Е.В. Минакова // Перспективы и пути развития неотложной педиатрии: материалы ежегодной междисциплинарной научно-практической конференции стран СНГ. — Санкт-Петербург, 2006. — С. 69 — 70.
4. Дрожжина O.A. Развитие и структура заболеваемости детей, перенесших тяжелую асфиксию / O.A. Дрожжина // Новые технологии в перинатологии: материалы ежегодного конгресса специалистов перинатальной медицины. — М., 2006. — С. 22.
5. Пронина O.A. Катамнез развития детей, перенесших тяжелую асфиксию интранатально / O.A. Пронина, И.И. Логвинова // Сборник материалов VI Всероссийской университетской научно-практической конференции молодых ученых и студентов по медицине. — Тула, 2007. — С. 204 — 205.
— Тула, 2007. — С. 204 — 205.
6. Пронина O.A. Исследование показателей эндотелина-1 у новорожденных детей, перенесших хроническую внутриутробную гипоксию / O.A.
Пронина // Системный анализ и управление в биомедицинских системах. — 2008. — Т 7, № 3. — С. 691 — 693.
7. Эндотелии-1 — маркер внутриутробной гипоксии у новорожденных детей / O.A. Пронина, И.И. Логвинова, Л.И. Ипполитова, Л.П. Лободина, Н.П. Стасенкова // Вестник Российского государственного медицинского университета. — 2008. — № 4 (63). — С. 164.
8. Концентрация плазменного эндотелина у новорожденных с перинатальным гипоксическим поражением центральной нервной системы / O.A. Пронина, И.И. Логвинова, М.В. Сулина, Т.Г. Чистотинова, Е.В. Трухачева, Н.В. Заяц // Актуальные вопросы организации, оказания первичной, специализированной медицинской помощи в условиях многопрофильного стационара: материалы II научно-практической конференции, посвященной 130-летию родильного дома ГКБСМП № 10. — Воронеж, 2008. — С. 54 — 57.
— С. 54 — 57.
9. Пронина O.A. Эндотелиальная дисфункция у новорожденных детей, перенесших хроническую внутриутробную гипоксию / O.A. Пронина, И.И. Логвинова // Современная перинатология: организация, технологии и качество: материалы 3 ежегодного конгресса 6 съезда Российской ассоциации специалистов перинатальной медицины. — 2008. — С. 43.
10. Роль эндотелина-1 в развитии церебральной ишемии у новорожденных / О.А, Пронина, И.И. Логвинова, Л.П. Лободина, Н.П. Стасенкова, Т.Г. Чистотинова // Современные технологии в педиатрии и детской хирургии: материалы VII Российского конгресса. — 2008. — С. 198 — 199.
СПИСОК СОКРАЩЕНИЙ
ВЖК — внутрижелудочковое кровоизлияние ВУИ — внутриутробная инфекция ДЦП — детский церебральный паралич ЗВУР — задержка внутриутробного развития КТГ — кардиотокография
ОРВИ — острая респираторная вирусная инфекция
ПСП — показатель состояния плода
ФПН — фето-плацентарная недостаточность
ХВГП — хроническая внутриутробная гипоксия плода
ЦНС — центральная нервная система
ЭТ — эндотелии
Подписано в печать 15. 04.2009 г. Формат 60 х 84/16 . Бумага офсетная. Усл. печ. л. 1,4 Тираж 101 экз. Заказ № 1162
04.2009 г. Формат 60 х 84/16 . Бумага офсетная. Усл. печ. л. 1,4 Тираж 101 экз. Заказ № 1162
Отпечатано в типографии Воронежский ЦНТИ-филиал ФГУ «Объединение «Росинформресурс» Минпромэнерго России
394730, г. Воронеж, пр. Революции, 30
АСФИКСИЯ ПЛОДА И НОВОРОЖДЕННОГО симптомы, лечение, описание, и причины болезни
АСФИКСИЯ ПЛОДА И НОВОРОЖДЕННОГО обусловлена уменьшением или прекращением поступления в организм кислорода с накоплением в крови кедоокисленных продуктов обмена веществ. Причинами асфиксии являются многие виды акушерской патологии, различные экстрагенитальные заболевания, нарушения функции плаценты, патология пуповины и самого плода. Гипоксия независимо от ее генеза приводит к расстройствам окислительно-восстановительных реакций в организме плода, в результате чего развивается ацидоз, создающий условия, когда ткани перестают усваивать кислород. Накопление углекислоты в крови плода вызывает раздражение дыхательного центра, что приводит к внутриутробным дыхательным движениям плода и аспирации околоплодных вод.
Симптомы, течение. Различают угрожающую гипоксию плода, т. е. когда симптомов ее еще нет, но налицо неблагоприятная акушерская ситуация (переношенная беременность, затяжные роды и др.), при которой внутриутробная асфиксия возникает очень часто. Начавшаяся гипоксия характеризуется тахикардией плода (число сердцебиений 160 в 1 мин и более), затем сменяющейся брадикардией (число сердцебиений 100 в 1 мин и менее), появлением глухих сердечных тонов и аритмии. Этот признак асфиксии имеет значение только при головном предлежании плода. Из дополнительных методов исследования, позволяющих диагностировать начавшуюся внутриутробную гипоксию плода, применяют электро- и фонокардиографию, амниоскопию и исследование кислотно-щелочного состояния крови плода, полученной из предлежащей части. Оценку состояния новорожденного, в том числе и родившегося в состоянии асфиксии, производят по шкале Апгар в первую минуту после рождения ребенка. Она основана на учете состояния новорожденного по 5 важнейшим клиническим признакам: сердечному ритму, дыхательной активности, мышечному тонусу, рефлекторной возбудимости и цвету кожи. Каждый признак оценивается по трехбалльной системе (0; 1; 2). Определение состояния новорожденного с помощью метода Апгар является более точным, чем характеристика тяжести асфиксии по степеням.
Каждый признак оценивается по трехбалльной системе (0; 1; 2). Определение состояния новорожденного с помощью метода Апгар является более точным, чем характеристика тяжести асфиксии по степеням.
Лечение. При угрожающей и начавшейся асфиксии плода применяют так называемую триаду Николаева — вдыхание матерью кислорода, в/в введение ей до 50 мл 40% раствора глюкозы с добавлением 100 мг аскорбиновой кислоты и 1 мл 10% раствора кордиамина. Через 30—60 мин все это можно повторить. Эффективно назначение сигетина (1 % раствор по 2 мл в/м). Сигетин улучшает маточно-плацентарное кровообращение и оксигенацию крови плода. Для нормализации кислотно-щелочного состояния крови плода матери вводят в/в 150—250 мл 5% раствора гидрокарбоната натрия капельно со скоростью 50—60 капель в 1 мин. Сразу же после вливания щелочи вводят 100 мл 20% раствора глюкозы. Если родоразрешение через естественные родовые пути невозможно, особенно при сочетании внутриутробной гипоксии с другими осложнениями, то в интересах плода прибегают к операции кесарева сечения.
При оживлении новорожденного, родившегося в состоянии асфиксии (оценка по шкале Апгар до 5 баллов), дыхательные пути освобождают от слизи и околоплодных зсд, затем применяют теплую ванночку без отделения ребенка от матери. При отсутствии положительного эффекта переходят к аппаратной искусственной вентиляции легких. Для нормализации кислотно-щелочного состояния крови пледа в вену пуповины вводят 10—20 мл 5% раствора гидрокарбоната натрия, используют оксигенотерапию.
Новорожденным, перенесшим тяжелую асфиксию, показано проведение инфузионной терапии путем катетеризации яремной или подключичной вены. Вводят в/в растворы глюкозы, реополиглюкина, плазму, а также эуфиллин, кокарбоксилазу и кортикостероидные гормоны. Необходимо применять про-тивогеморрагическив препараты: 10% раствор хлорида кальция внутрь по 5 мл 4 раза в день, рутин и викасол по 0,002 г 2 раза в день.
Профилактика основана на своевременном и эффактивном лечении заболеваний и осложнений беременности, рациональном ведении родового акта с учетом интересов плода.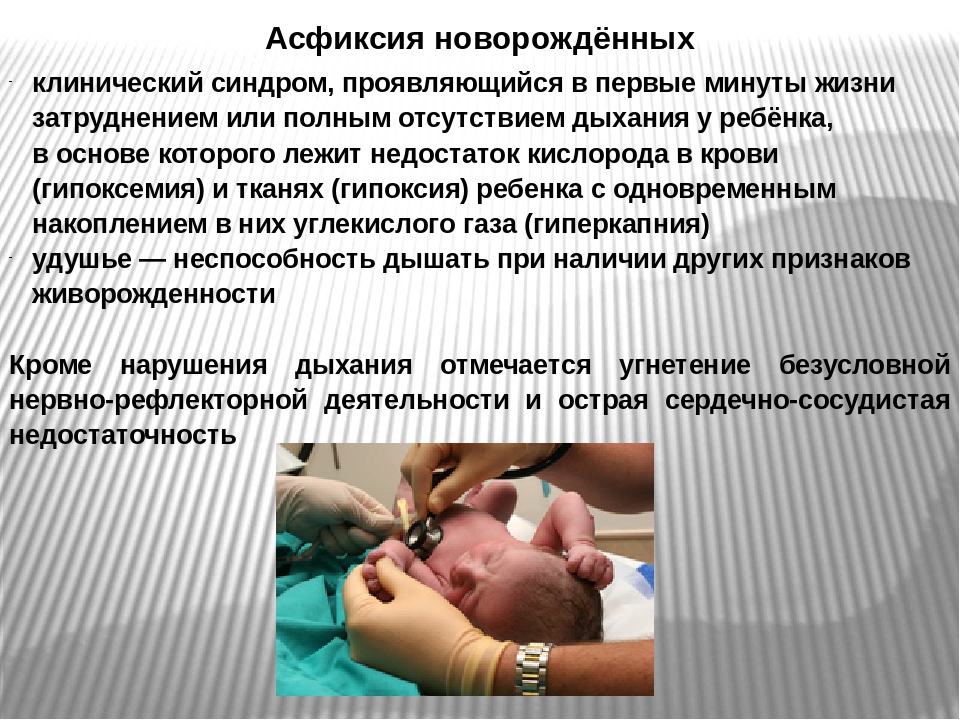
Влияние внутриутробной и внутриутробной асфиксии на переливание плаценты у недоношенных и доношенных детей
Биссоннетт, Дж. М .: Контроль объема сосудов в пуповине овец. J. Appl. Physiol. 38 , 1057–1061 (1975)
Google ученый
Браун, Э. Г., Кроскоп, Р. В., МакДоннелл, Ф. Э., Свит, А. Я .: Объем крови и артериальное давление у младенцев с респираторной недостаточностью.J. Pediatr. 87 , 1133–1138 (1975)
Google ученый
Кашор, В. Дж., Ашер, Р. Х .: Гиповолемия, возникающая из-за тугой затылочной пуповины при рождении. Педиатр. Res. 7 , 399 (1973)
Google ученый
Целандер, О .: Исследования периферического кровообращения. В: Сердце и кровообращение у новорожденных и младенцев (под ред. Д. Э. Касселса), стр.98–110. Нью-Йорк: Грюн и Страттон, 1966
Google ученый
Целандер, О., Морильд, К .: Реактивная гиперемия стопы и голени новорожденного. Acta Paediatr. Сканд. 51 , 544–552 (1962)
Google ученый
Чоу, П. Дж., Акерман, Б. Д .: Перматальный ацидоз и плацентарное переливание. Acta Paediatr. Сканд. 62 , 417–422 (1973)
Google ученый
Кон, Х. Э., Сакс, Э. Дж., Хейманн, М. А., Рудольф, А. М .: Сердечно-сосудистые реакции на гипоксемию и ацидемию у плодов ягнят. Am. J. Obstet. Гинеколь. 120 , 817–824 (1974)
А., Рудольф, А. М .: Сердечно-сосудистые реакции на гипоксемию и ацидемию у плодов ягнят. Am. J. Obstet. Гинеколь. 120 , 817–824 (1974)
Google ученый
Дауэс, Г. С .: Пуповинное кровообращение. Am. J. Obstet. Гинеколь. 84 , 1634–1648 (1962)
Google ученый
Дауэс, Г. С., Льюис, Б.В., Миллиган, Дж. Э., Роуч, М. Р., Талнер, Н. С .: Вазомоторные реакции в задних конечностях плодов и новорожденных ягнят на асфиксию и стимуляцию хеморецепторов аорты. J. Physiol. (Лондон) 195 , 55–81 (1968)
Google ученый
Факселиус, Г.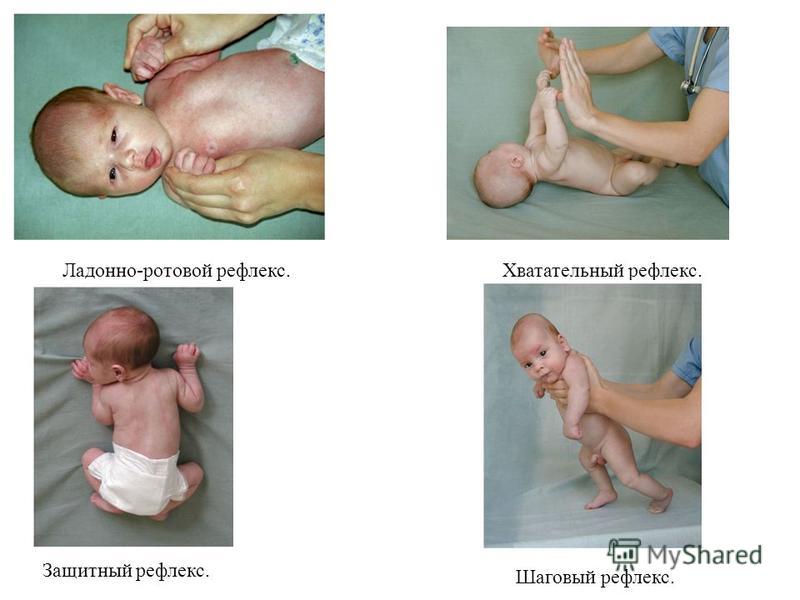 , Рэй, Дж., Гутберлет, Р., Суонстрем, С., Циантос, А., Долански, Э., Дехан, М., Дайер, Н., Линдстрем, Д. , Брилл, А.Б., Штальман, М .: Измерение объема эритроцитов и острая кровопотеря у новорожденных из группы высокого риска.J. Pediatr. 90 , 273–281 (1977)
, Рэй, Дж., Гутберлет, Р., Суонстрем, С., Циантос, А., Долански, Э., Дехан, М., Дайер, Н., Линдстрем, Д. , Брилл, А.Б., Штальман, М .: Измерение объема эритроцитов и острая кровопотеря у новорожденных из группы высокого риска.J. Pediatr. 90 , 273–281 (1977)
Google ученый
Флод, Н.Э., Акерман, Б.Д .: Перинатальная асфиксия и остаточный объем плацентарной крови. Acta Paediatr. Сканд. 60 , 433–436 (1971)
Google ученый
Хон, Э. Х., Куиллиган, Э. Дж .: Классификация частоты сердечных сокращений плода. II. Переработанная рабочая классификация. Conn. Med. 31 , 779–784 (1967)
Google ученый
Киттерман, Дж. А., Шлютер, М. А. Влияние внутриматочной асфиксии на объем крови новорожденных. Педиатр. Res. 8 , 173 (1974)
Google ученый
Клебе, Дж. Г., Ингомар, К. Дж., Норгаард-Педерсен, Б.: Объемы крови у недоношенных новорожденных от диабетических и недиабетических матерей, коррелированные со временем пережатия пуповины. Acta Paediatr. Сканд. 61 , 549–554 (1972)
Google ученый
Клейнберг, Ф., Фиббс, Р., Донг, Л .: Отсутствие плаценты при переливании крови младенцу с отсроченным пережатием пуповины после кесарева сечения. Педиатр. Res. 7 , 403 (1973)
Google ученый
Линдеркамп, О., Хольтхаузен, Х., Зайферт, Дж., Бутенандт, И., Ригель, К.П .: Точность оценки объема крови у тяжелобольных детей с использованием 125 I-меченного альбумина и 51 эритроцитов, меченных хромом.Europ. J. Pediatr. 125 , 143–151 (1977)
Google ученый
Линдеркамп О., Мадер Т., Бутенандт О., Ригель К.П .: Оценка объема плазмы у тяжелобольных младенцев и детей с использованием упрощенного метода голубого Эванса. Europ. J. Pediatr. 125 , 135–141 (1977)
Google ученый
Линдеркамп, О., Фендель, Х., Ферсмольд, Х. Т., Ригель, К. П., Бетке, К.: Ассоциация неонатального респираторного дистресса с асфиксией при рождении и дефицитом массы эритроцитов у недоношенных детей.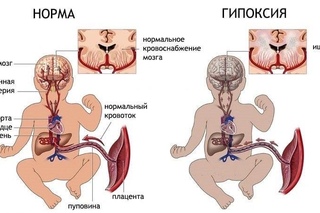 Europ. J. Pediatr. (представлен)
Europ. J. Pediatr. (представлен)
Манн, Л. И .: Влияние гипоксии на пупочное кровообращение и метаболизм плода. Am. J. Physiol. 218 , 1453–1458 (1970)
Google ученый
МакКью, К. М., Гарнер, Ф. Б., Хёрт, В. Г., Шелин, Э. К., Шарп, А.Р .: Переливание плаценты. J. Pediatr. 72 , 15–21 (1968)
Google ученый
Messow-Zahn, K., Sarafoff, M., Riegel, K.P .: Стресс при рождении: концентрация норадреналина в плазме у рожениц и в пуповинной крови. Клин. Wochenschr. (в печати)

Миллиган Дж. Э., Роуч М. Р., Талнер Н. С .: Вазомоторные реакции в задних конечностях новорожденных телят. Circ. Res. 21 , 237–244 (1967)
Google ученый
Мойан, М., Мейер, В. В., Линд, Дж.: Диаметры сосудов пуповины и вес пуповины в зависимости от времени пережатия. Am. J. Obstet. Гинеколь. 105 , 604–611 (1969)
Google ученый
Нелиган, Г. А., Оксон, Д. М., Смит, К. А .: Артериальное давление новорожденных в состоянии асфиксии и при болезни гиалиновой мембраны. Педиатрия 26 , 735–744 (1960)
Google ученый

О, В., Бланкеншип, В., Линд, Дж .: Дальнейшее изучение объема крови новорожденных в связи с переливанием плаценты. Анна. Педиатр. 207 , 147–159 (1966)
Google ученый
Омори, К., Фелпс, Д. Л., Эммануилидис, Г. К., О, У.: Переливание плаценты плоду внутриутробно во время острой гипоксемии у плода ягненка. Педиатр. Res. 7 , 168 (1973)
Google ученый
Филип А. Г. С., Йи, А. Б., Рози, М., Сурти, Н., Цамцурис, А., Ингалл, Д.: Переливание плаценты как внутриутробное явление при родах, осложненных дистрессом плода. Брит. Med. J. II , 11–13 (1969)
Google ученый
Сайгал, С., О’Нил, А., Сурайндер, Ю., Чуа, Л.-Б., Ашер, Р.: Переливание плаценты и гипербилирубинемия у недоношенных. Педиатрия 49 , 406–419 (1972)
Google ученый
Scheffé, H .: Метод оценки всех контрастов при дисперсионном анализе. Биометрика 40 , 87–104 (1953)
Google ученый
Сиссон, Т. Р., Кнутсон, С., Кендалл, Н .: Объем крови младенцев. IV. Младенцы, рожденные путем кесарева сечения. Am. J. Obstet. Гинеколь. 117 , 351–357 (1973)
Google ученый
Usher, R., Lind, J.: Объем крови новорожденного недоношенного ребенка. Acta Paediatr. Сканд. 54 , 419–431 (1965)
Acta Paediatr. Сканд. 54 , 419–431 (1965)
Google ученый
Usher, RH, Saigal, S., O’Neill, A., Surainder, Y., Chua, L.-B .: Оценка объема красных кровяных телец у недоношенных детей с респираторным дистресс-синдромом и без него. . Биол. Новорожденные 26 , 241–248 (1975)
Google ученый
Usher, R., Shephard, M., Lind, J .: Объем крови новорожденного и переливание плаценты. Acta Paediatr. Сканд. 52 , 497–512 (1963)
Google ученый
Яо, А. С., Хирвенсало, М., Линд, Дж .: Скорость переливания плаценты и сокращение матки. Ланцет 1 , 380–383 (1968)
Ланцет 1 , 380–383 (1968)
Google ученый
Яо, А. К., Линд, Дж.: Влияние силы тяжести на переливание плаценты. Ланцет 2 , 505–508 (1969)
Google ученый
Яо А. К., Линд Дж .: Объем крови у доношенного новорожденного, подвергшегося асфиксии. Биол. Новорожденные 21 , 199–209 (1972)
Google ученый
Yao, A.C., Lind, J., Tiisala, R., Michelsson, K .: Переливание плаценты недоношенным детям с наблюдением за клиническим течением и исходом.Acta Paediatr. Сканд. 58 , 561–566 (1969)
Google ученый
Яо А.С., Мойян М., Линд Дж .: Распределение крови между младенцем и плацентой после рождения. Ланцет 2 , 871–873 (1969)
Google ученый
Яо, А. К., Вист, А., Линд, Дж .: Объем крови новорожденного, родившегося с помощью кесарева сечения. Acta Paediatr.Сканд. 56 , 585–592 (1967)
Google ученый
Сложности родовой асфиксии, гипоксии и внутриутробной гипоксии
Стать родителем можно назвать одним из самых замечательных событий в жизни пары. Тем не менее, беременность иногда может быть сопряжена с осложнениями и не вызывать затруднений. Некоторые из наиболее серьезных проблем включают асфиксию при рождении, гипоксию при рождении и внутриутробную гипоксию, которые обсуждаются в этой статье.
Слово «асфиксия» означает недостаток кислорода. Во время беременности или сразу после рождения ребенок может в какой-то момент столкнуться с нехваткой кислорода, что может серьезно повлиять на правильный рост, развитие и функционирование новорожденного. Из-за этого недостатка кислорода функционирование клеток нарушается, а накопление шлаков может вызвать временное или постоянное повреждение ключевых органов ребенка. Асфиксия может быть вызвана множеством причин, некоторые из которых включают: раннее и резкое отделение плаценты от стенки матки, наличие анемических клеток у ребенка, инфекции любого рода, преобладающие у матери, осложнения, которые могут возникнуть во время родов, недостаток кислорода. в крови матери, неправильное или неполное развитие дыхательных путей ребенка и / или наличие препятствий в дыхательных путях.Асфиксия может нанести серьезный вред ребенку, но это зависит от тяжести состояния и того, как быстро будет проведено лечение. Младенцы с легкой формой асфиксии могут полностью выздороветь в течение определенного периода времени.
Во время беременности или сразу после рождения ребенок может в какой-то момент столкнуться с нехваткой кислорода, что может серьезно повлиять на правильный рост, развитие и функционирование новорожденного. Из-за этого недостатка кислорода функционирование клеток нарушается, а накопление шлаков может вызвать временное или постоянное повреждение ключевых органов ребенка. Асфиксия может быть вызвана множеством причин, некоторые из которых включают: раннее и резкое отделение плаценты от стенки матки, наличие анемических клеток у ребенка, инфекции любого рода, преобладающие у матери, осложнения, которые могут возникнуть во время родов, недостаток кислорода. в крови матери, неправильное или неполное развитие дыхательных путей ребенка и / или наличие препятствий в дыхательных путях.Асфиксия может нанести серьезный вред ребенку, но это зависит от тяжести состояния и того, как быстро будет проведено лечение. Младенцы с легкой формой асфиксии могут полностью выздороветь в течение определенного периода времени. Однако младенцы, клетки которых не могут получать достаточно кислорода в течение длительного времени, могут получить необратимые повреждения головного мозга, сердца, легких, почек, кишечника или других органов.
Однако младенцы, клетки которых не могут получать достаточно кислорода в течение длительного времени, могут получить необратимые повреждения головного мозга, сердца, легких, почек, кишечника или других органов.
Недостаточное снабжение мозга кислородом, когда это происходит, приводит к гипоксии и церебральному параличу, которые сначала поражают полушарие головного мозга, а затем и весь мозг.Кроме того, нарушения развития, синдром дефицита внимания и гиперактивности или нарушение зрения являются последующими рисками для здоровья, связанными с гипоксией. В некоторых тяжелых случаях, когда лечение откладывается, болезнь может вызвать органную недостаточность и привести к летальному исходу. В случае органной недостаточности в число вариантов лечения входят такие технологии, как непрерывный диализ при почечной недостаточности, ЭКМО при сердечной и / или легочной недостаточности и охлаждение всего тела с помощью прикроватного мониторинга мозга.
Похожее состояние, которое возникает во время осложнений, связанных с беременностью или родами, — это внутриутробная гипоксия, то есть лишение кислорода еще не родившемуся ребенку на стадии плода. Часто это вызвано опущением или окклюзией пуповины, инфарктом плаценты и курением матери. Он вызывает повреждение клеток нервной системы, повышая вероятность синдрома внезапной детской смерти (СВДС). Позднее это состояние может вызвать множество проблем, таких как эпилепсия, СДВГ и расстройства пищевого поведения, поскольку кислородное голодание является основным фактором этих неврологических расстройств. Курение сигарет будущими матерями имеет широкий спектр пагубных последствий для развивающегося плода.Среди отрицательных эффектов — гипоксия тканей, вызванная угарным газом, и плацентарная недостаточность, которая вызывает уменьшение кровотока от матки к плаценте, что снижает доступность насыщенной кислородом крови для плода. В настоящее время известно, что лечение младенцев, страдающих асфиксией при рождении, путем снижения внутренней температуры тела является эффективным методом снижения смертности и улучшения неврологического исхода у выживших. Внутриутробная гипоксия и асфиксия при рождении вместе были названы десятыми по значимости причинами неонатальной смертности.
Часто это вызвано опущением или окклюзией пуповины, инфарктом плаценты и курением матери. Он вызывает повреждение клеток нервной системы, повышая вероятность синдрома внезапной детской смерти (СВДС). Позднее это состояние может вызвать множество проблем, таких как эпилепсия, СДВГ и расстройства пищевого поведения, поскольку кислородное голодание является основным фактором этих неврологических расстройств. Курение сигарет будущими матерями имеет широкий спектр пагубных последствий для развивающегося плода.Среди отрицательных эффектов — гипоксия тканей, вызванная угарным газом, и плацентарная недостаточность, которая вызывает уменьшение кровотока от матки к плаценте, что снижает доступность насыщенной кислородом крови для плода. В настоящее время известно, что лечение младенцев, страдающих асфиксией при рождении, путем снижения внутренней температуры тела является эффективным методом снижения смертности и улучшения неврологического исхода у выживших. Внутриутробная гипоксия и асфиксия при рождении вместе были названы десятыми по значимости причинами неонатальной смертности.
Церебральных реакций при внутриутробной асфиксии у овец. I. Циркуляция и потребление кислорода в головном мозге плода
Экстракт
: Церебральный кровоток (CBF) с помощью метода клиренса 133 Xe и потребление кислорода в головном мозге были измерены у плодов ягненка с использованием анестезированных хиоралозой овец и экструдированных плодов с интактной пупочной тираж. Чтобы вызвать гипоксию плода при разных уровнях pH, использовали три различных процедуры: ( 1 ) овцу вентилировали смесью гипоксических газов, содержащей 8-15% O 2 в N 2 ; ( 2 ) 5–10% CO 2 добавляли в газовую смесь для гипоксии; ( 3 ) во время гипоксии плоду внутривенно вводили непрерывную быструю инфузию раствора NaHCO 3 .Напряжение газов крови, pH и насыщение кислородом измеряли повторно.
Множественный регрессионный анализ был проведен для данных с переменными Sa O2 , Pa O , Pa O2 , и pH рассматривались как независимые переменные, а поток — как зависимая переменная. Использованы полные наборы наблюдений, составившие 74 наблюдения на 11 животных. Не было обнаружено значимой корреляции между CBF и pH. Sa O2 показал самую высокую корреляцию с CBF.Никакого дальнейшего улучшения этой корреляции не было получено при добавлении Pa CO2 в качестве независимой переменной. Pa O2 и Pa CO2 совместно описали варианты CBF, а также только Sa O2 .
Использованы полные наборы наблюдений, составившие 74 наблюдения на 11 животных. Не было обнаружено значимой корреляции между CBF и pH. Sa O2 показал самую высокую корреляцию с CBF.Никакого дальнейшего улучшения этой корреляции не было получено при добавлении Pa CO2 в качестве независимой переменной. Pa O2 и Pa CO2 совместно описали варианты CBF, а также только Sa O2 .
Потребление кислорода головным мозгом снижалось во время гипоксии, когда Sa O2 снижалось ниже 40%. Снижение скорости метаболизма кислорода зависело как от степени гипоксии, так и от pH. Когда к гипоксии добавлялся ацидоз, в результате происходило значительное снижение потребления кислорода мозгом по сравнению с такой же степенью гипоксии при нормальных или только умеренно пониженных уровнях pH.
Предположение: Церебральный кровоток эмбриона ягненка регулируется в основном за счет количества кислорода, доступного для мозга, а изменения напряжения CO 2 влияют на CBF через смещение кривой диссоциации гемоглобина.
Потребление церебрального кислорода снижается до опасно низкого уровня, когда тяжелый ацидоз сочетается с гипоксией из-за неспособности извлечь кислород, доступный в артериальной крови.
Адвокаты по гипоксической ишемической энцефалопатии | Асфиксия рождения
Асфиксия при рождении, или кислородное голодание во время рождения, является частой причиной повреждения головного мозга младенцев.Повреждение головного мозга и другие осложнения, связанные с асфиксией при рождении, называются «родовыми травмами».
Если у ребенка недостаточно кислорода в крови или если кровоток к мозгу ограничен, он может родиться с серьезной родовой травмой, которая называется гипоксически-ишемической энцефалопатией (ГИЭ). ГИЭ можно лечить с помощью терапевтической гипотермии (охлаждения), но эту терапию необходимо начинать в течение шести часов после того, как возникла асфиксия при рождении (1). Лечебная гипотермия может уменьшить или предотвратить необратимое повреждение мозга у некоторых младенцев. Однако у многих младенцев ГИЭ вызывает долгосрочные проблемы, такие как следующие:
Однако у многих младенцев ГИЭ вызывает долгосрочные проблемы, такие как следующие:
Перейти к:
Причины асфиксии при рождении
Чтобы добраться до будущего ребенка, кислород должен пройти через легкие, сердце, сосудистую сеть, матку и плаценту матери, а затем пройти через пуповину. Проблема на любом этапе этого пути может привести к асфиксии при рождении, особенно если мать и ребенок не получают надлежащей медицинской помощи. Ниже приведены некоторые частые причины кислородной недостаточности плода / асфиксии при рождении:
- Отслойка плаценты : Это осложнение, при котором плацента отделяется от стенки матки еще до рождения ребенка.Отслойка может вызвать сильное материнское кровотечение и потерю кислорода у ребенка (3).
- Разрыв матки : Это происходит, когда есть разрыв матки / матки. Разрыв матки может вызвать сильное кровотечение у матери и потерю кислорода у плода (4).
- Проблемы с пуповиной : Осложнения с пуповиной включают выпадение пуповины, затылочную пуповину, короткий пуповину и настоящий узел.
 Все эти состояния могут вызвать серьезную кислородную недостаточность у ребенка (5).
Все эти состояния могут вызвать серьезную кислородную недостаточность у ребенка (5). - Плацентарная недостаточность : Когда сосуды в плаценте нарушены или нарушены, ребенок может испытывать длительную недостаточность кислорода и питания. Помимо асфиксии при рождении, у них может быть задержка внутриутробного развития (ЗВУР) / задержка роста плода (ЗРП) (6).
- Преэклампсия : Это происходит, когда у матери во время беременности диагностировано высокое кровяное давление, которое может вызвать снижение притока крови к ребенку и другие серьезные проблемы, включая эклампсию (7).
- Предлежание плаценты : Это происходит, когда плацента растет близко к отверстию матки, частично или полностью блокируя шейку матки, которая является отверстием в родовые пути (8).
- Инсульт : Инсульт плода возникает, когда кровеносные сосуды в головном мозге ребенка блокируются или сужаются. Это может быть вызвано асфиксией при рождении.
 Гипоксико-ишемическая энцефалопатия (ГИЭ) и инсульт часто возникают одновременно (9).
Гипоксико-ишемическая энцефалопатия (ГИЭ) и инсульт часто возникают одновременно (9). - Преждевременный разрыв плодных оболочек (PROM) : PROM происходит, когда у матери выделяется вода перед началом схваток.PROM может привести к выпадению и сжатию пуповины и, в конечном итоге, к нехватке кислорода в мозгу ребенка (10).
- Продолжительные и остановленные роды : схватки во время схваток доставляют ребенку большие затруднения, а при продолжительных родах может возникнуть опасная нехватка кислорода в мозгу плода (11).
- Олигогидрамнион : Это состояние, при котором у матери мало околоплодных вод. Олигогидрамнион подвергает ребенка значительному риску выпадения или сдавления пуповины, что может привести к асфиксии при рождении (12).
- Материнская гипотензия : Спинальная анестезия может вызвать снижение артериального давления (гипотонию) у матери и привести к гипотензивному кризу (13). Помимо угрозы жизни матери, это может вызвать асфиксию при рождении (14).
- Неспособность быстро родить ребенка, когда кислородная недостаточность (дистресс плода) очевидна на пульсометре (дополнительную информацию см. На нашей странице, посвященной отложенному экстренному кесареву сечению).
Нормальная функция плаценты и пуповины
Как асфиксия при рождении вызывает травмы головного мозга?
Степень травмы головного мозга ребенка при асфиксии при рождении зависит от:
- Тяжесть родовой асфиксии
- Сколько длится асфиксия
- Возраст ребенка и запасы кислорода
- Ведение ребенка во время и после родов.
Когда ребенок страдает асфиксией при рождении, датчик частоты сердечных сокращений плода покажет неутешительных сердечных сокращений . Когда эти записи происходят, медицинская бригада должна выполнить вмешательства, такие как введение матери внутривенно, изменение положения матери и введение кислорода, предназначенные для увеличения кровотока и оксигенации ребенка. Пока проводятся эти вмешательства, бригада также должна подготовиться к оперативному выполнению кесарева сечения. Кесарево сечение обычно является самым быстрым и безопасным способом родить ребенка в тяжелом состоянии.Чем раньше ребенок родится, тем скорее медицинская бригада сможет оказать ему непосредственную помощь.
Когда возникает асфиксия при рождении, ребенок становится гипоксическим, (не хватает кислорода) и обычно гиперкарбическим (имеет высокое содержание углекислого газа в крови). Гипоксия вызывает анаэробный метаболизм и выработку молочной кислоты. Когда в крови ребенка накапливается много кислоты, это называется ацидозом . Ацидоз и гипоксия могут снизить функцию сердца, что может привести к очень низкому кровяному давлению у ребенка ( гипотония ) и недостаточному кровотоку в головном мозге ( ишемия ).Затем ишемия еще больше ухудшает доставку кислорода ребенку. Гипоксия и ишемия также приводят к каскаду событий, нарушающих метаболические пути. Продолжительная асфиксия при рождении вызывает у ребенка гипоксически-ишемическое состояние , в результате чего мозг лишается глюкозы и всех других питательных веществ, а также кислорода. Кроме того, нарушается процесс вывоза мусора, что вызывает больше проблем с обменом веществ и других проблем со здоровьем.
Как правило, чем дольше продолжается гипоксически-ишемическое состояние, тем больше травм будет нанесен головной мозг (15).Гипоксически-ишемическое повреждение головного мозга может прогрессировать от нескольких минут до часов, поэтому для медицинской бригады важно провести исследования мозга ребенка с энцефалопатией и быстро вмешаться. Это часто связано с терапевтическим переохлаждением, о котором мы поговорим позже.
Признаки асфиксии при рождении
У ребенка с асфиксией при рождении могут быть следующие признаки:
- Отек мозга
- Судороги, особенно в первые 24-48 часов жизни
- Гипотония (ребенок вялый / вялый)
- Плохое питание
- Подавленный уровень сознания
- Проблемы с множественными органами
- Проблемы с дыханием
- Ненормальная реакция на свет (16)
- Низкий балл по шкале Апгар (17)
Типы асфиксии при рождении
Существует два основных типа травм, вызванных асфиксией при рождении:
- Острая почти полная асфиксия : Это также может называться паттерном повреждения базальных ганглиев и таламуса .Он в первую очередь затрагивает центральные серые ядра и окололандовую кору, а также может поражать гиппокамп и ствол мозга. Острая почти полная асфиксия чаще всего возникает после серьезного события, такого как разрыв матки, отслойка плаценты или выпадение пуповины. Этот тип черепно-мозговой травмы часто приводит к довольно тяжелым случаям церебрального паралича.
- Частичная продолжительная асфиксия: Это также можно назвать переломной формой травм. Поражает сосудистые водораздельные зоны.У младенцев с более тяжелым поражением может быть вовлечена вышележащая кора головного мозга. Частичная продолжительная асфиксия чаще всего вызывается проблемами с более медленным действием, такими как гипотензия, инфекция и гипогликемия. У младенцев с этим типом травм меньше вероятность развития серьезных двигательных нарушений, но они часто проявляются в других проблемах, таких как медленный рост головы, проблемы с поведением, когнитивные нарушения и задержка речевого развития.
Обратите внимание, что не все травмы пациента полностью соответствуют одной из этих категорий; есть также много других моделей, которые могут принимать асфиксия (18).
Лечебная гипотермия при гипоксически-ишемической энцефалопатии
Лечебная гипотермия (охлаждение мозга) — это лечение, которое может предотвратить или минимизировать необратимые травмы у детей с ГИЭ, при условии, что оно проводится в течение шести часов после рождения (хотя некоторые исследования показывают, что оно может иметь ценность, если его начать до 24 часов). после рождения [19]). Доказано, что терапевтическая гипотермия останавливает почти каждый повреждающий процесс, который начинается, когда мозг испытывает асфиксию.Это может предотвратить развитие церебрального паралича или привести к менее тяжелой форме церебрального паралича (20).
Другие методы лечения гипоксически-ишемической энцефалопатии
Помимо терапевтического переохлаждения, медицинская бригада также должна тщательно следить за здоровьем ребенка и предотвращать вред от осложнений, которые часто связаны с ГИЭ. К ним относятся судороги, плохая перфузия, дисбаланс электролитов и сахара в крови, мозговые кровотечения, респираторные проблемы и инфекции (21).
В долгосрочной перспективе младенцам с ГИЭ требуется частое наблюдение для выявления проблем с развитием / потенциальных нарушений и раннего вмешательства. Сюда могут входить физиотерапия, трудотерапия, логопедия, лекарства, операции и множество других вариантов.
Как произносится родовая асфиксия?
Удостоенные наград поверенные по асфиксии при рождении
Если вам нужна помощь юриста, очень важно выбрать юриста и фирму, занимающуюся исключительно случаями родовых травм.Юридические центры Reiter & Walsh ABC защищают детей с родовыми травмами, возникшими в результате асфиксии и врачебной халатности, более трех десятилетий.
Мы помогли детям по всей стране получить компенсацию за пожизненное лечение, терапию и безопасное будущее, и мы уделяем личное внимание каждому ребенку и семье, которых мы представляем. Наша фирма имеет множество многомиллионных приговоров и расчетов, подтверждающих наш успех, и вы ничего не платите нам, пока мы не выиграем ваше дело.Свяжитесь с нами сегодня для бесплатной юридической консультации:
Бесплатный обзор корпуса | Доступно 24/7 | Никаких комиссий, пока мы не выиграем
Позвоните на бесплатную телефонную линию 866-598-5405
Нажмите кнопку Live Chat в своем браузере
Заполните нашу онлайн-форму для связи
Информация, представленная выше, предназначена только для общего образовательного характера. Он не предназначен (и не должен интерпретироваться как) медицинский совет.
Источники
- Лечебная гипотермия новорожденных: рекомендации рабочей группы по неонатальной энцефалопатии .(2016). Получено 6 августа 2018 г. с https://www.rmf.harvard.edu/-/media/Files/-Global/KC/PDFs/Guidelines/crico-neonates.pdf?la=en
- Бано, С., Чаудхари, В., и Гарга, У. С. (2017). Неонатальная гипоксически-ишемическая энцефалопатия: радиологический обзор. Журнал детской неврологии , 12 (1), 1.
- (н.о.). Получено с https://www.uptodate.com/contents/placental-abruption-pathophysiology-clinical-features-diagnosis-and-consequences?search=placental abruption & source = search_result & selectedTitle = 1 ~ 150 & usage_type = default & display_rank = 1 # h28
- Топпенберг, К.С., и Блок, Дж. У. (2002). Разрыв матки: что нужно знать семейным врачам. Американский семейный врач , 66 (5), 823-828.
- Осложнения пуповины: обзор, длина пуповины, одиночная пупочная артерия. (2018, 01 июня). Получено с https://emedicine.medscape.com/article/262470-overview
- Плацентарная недостаточность: причины, симптомы и диагностика. (нет данных). Получено с https://www.healthline.com/health/placental-insufficiency
- Бэкес, К.Х., Маркхэм, К., Мурхед, П., Кордеро, Л., Нанкервис, К. А., и Джанноне, П. Дж. (2011). Преэклампсия у матери и исходы новорожденных. Журнал беременности , 2011 .
- Берхан, Ифру. «Предикторы перинатальной смертности, связанные с предлежанием и отслойкой плаценты: опыт страны с низким уровнем дохода». Журнал беременности 2014 (2014).
- Фишер, П. Г. (2016). Связаны ли неонатальный инсульт и гипоксически-ишемическая энцефалопатия? Журнал педиатрии , 173 , 1-3.
- Выпадение пуповины: причины, опасности и лечение. (2015, 30 ноября). Получено с http://americanpregnancy.org/pregnancy-complications/umbilical-cord-prolapse/
- Лафон, С. К., Бергелла, В., Редди, У. М., Сундарам, Р., Лу, З., и Хоффман, М. К. (2014). Неонатальные и материнские исходы при длительном втором периоде родов. Акушерство и гинекология , 124 (1), 57.
- Детская больница.(2014, 24 августа). Проблемы с околоплодными водами / Гидрамнион / Олигогидрамнион. Получено с https://www.chop.edu/conditions-diseases/amniotic-fluid-problemshydramniosoligohydramnios
- Факерпур, А., Гаем, Х., Фаттахи, З., и Зари, С. (2018). Материнские факторы риска и факторы риска, связанные с анестезией, и частота гипотонии, вызванной спинальной анестезией, при плановом кесаревом сечении: полиномиальная логистическая регрессия. Индийский журнал анестезии , 62 (1), 36.
- (п.г.). Получено с https://www.uptodate.com/contents/systemic-effects-of-perinatal-asphyxia
- (н.о.). Получено с https://www.uptodate.com/contents/systemic-effects-of-perinatal-asphyxia?search=birth asphyxia hypercarbia & source = search_result & selectedTitle = 1 ~ 150 & usage_type = default & display_rank = 1
- Клиническая картина гипоксически-ишемической энцефалопатии: история болезни, физикальное обследование. (2018, 26 июля). Получено с https://emedicine.medscape.com/article/973501-clinical#b2
- Алию, И., Лаваль, Т. О., и Онанкпа, Б. (2018). Гипоксически-ишемическая энцефалопатия и балльная система по шкале Апгар: опыт в условиях ограниченных ресурсов. Журнал клинических наук , 15 (1), 18.
- де Фрис, Л. С., и Грюнендал, Ф. (2010). Особенности неонатального гипоксически-ишемического повреждения головного мозга. Нейрорадиология , 52 (6), 555-566.
- Лэпток, А. Р., Шанкаран, С., Тайсон, Дж. Э., Муньос, Б., Белл, Э. Ф., Голдберг, Р. Н.,… и Дас, А.(2017). Влияние терапевтической гипотермии, инициированной после 6-часового возраста, на смерть или инвалидность среди новорожденных с гипоксически-ишемической энцефалопатией: рандомизированное клиническое исследование. Джама , 318 (16), 1550-1560.
- Дэвидсон, Дж. О., Вассинк, Г., ван ден Хейдж, Л. Г., Беннет, Л., и Ганн, А. Дж. (2015). Лечебная гипотермия при неонатальной гипоксии — ишемической энцефалопатии — куда дальше? Границы неврологии , 6 , 198.
- Гипоксически-ишемическая энцефалопатия: основы практики, предпосылки, патофизиология.(2018, 26 июля). Получено с https://emedicine.medscape.com/article/973501-overview
.
.
.
.
.
.
.
.
Атлас патологии новорожденных: асфиксия при рождении
Во время нормальных родов сокращение матки сдавливает маточную кровь
сосуды, что приводит к периодическому прерыванию кровотока
в плаценту. Доставка кислорода к плоду отсутствует
высота контрактов с последующим восстановлением кислорода
родоразрешение между схватками, когда матка расслаблена. Там
только небольшое снижение pH крови при нормальных родах с
здоровый плод и плацента.С другой стороны все отклонения
у матери, плаценты или плода, которые препятствуют такому успешному
адаптация к воздействию сокращений матки или факторов
что длительные роды приводят к гипоксемии плода во время родов.
Плод оснащен широким спектром адаптивных механизмов, поэтому
умеренная степень гипоксемии переносится некоторое время. Если
состояние сохраняется, переход на анаэробный метаболизм
приводит к увеличению выработки лактата, ацидозу и
асфиксия. Длительные периоды низкой концентрации кислорода
и ацидоз оказывают неблагоприятное воздействие на кровообращение плода,
внутриутробное дыхание плода, головного мозга, почек и др.
органы.Если не немедленная доставка, результат необратим.
повреждение чувствительных органов и, в конечном итоге, сердечной
арест и смерть в родах.
Причины асфиксии при рождении
Все состояния, предрасполагающие к внутриутробной гипоксии
(дистресс плода) до начала схваток может усилиться
удушающий стресс во время родов.
- Материнский — материнский шок, сердечный
арест или большие припадки, преэклампсия, беременность
холестаз, тяжелая анемия, курение, сдавление
аорта беременной маткой, хроническая почечная недостаточность и
болезни сердца, введение анестетиков, седативных и
гипотензивные препараты матери во время схваток, длительных
беременность, разрыв матки - Плацентарный — заболевания плаценты
часто являются продолжением материнского заболевания.Инфаркты,
аномальное созревание ворсинок, предлежание плаценты, плацентарный
отслойка, распространенный вилит, массивный перивиллярный фибрин
отложение, отек ворсинок, тромботическая окклюзия плода
сосуды хориона - Пуповина — аномальная длина пуповины,
защемления вокруг тела плода и затылочных связок (только веревка
плотно на шее более одного раза — фактор риска),
настоящие узлы, выпадение или компрессия пуповины, фунизит,
тромбоз пуповинных сосудов, введение велментозного канатика,
острая кровопотеря плода с разрывом предлежания сосудов - Заболевания плода — размер плода (большой
плод / маленький плод с задержкой роста), неправильное предлежание, плод
пороки развития, хроническая анемия плода и сердечная недостаточность
по любой причине - Механические факторы — чрезмерная матка
схватки, длительные роды, аномалии таза
Неврологические осложнения перинатальной асфиксии
Эта относительная устойчивость мозга к асфиксии, вероятно, является следствием различных механизмов плода, которые адаптируются к недостатку кислорода и снижению мозгового кровотока.Также обратите внимание, что ацидемия пупочной артерии при рождении не всегда присутствует у младенцев, рожденных с острой асфиксией при рождении. 2
Ряд других клинических и лабораторных признаков и симптомов указывают на наличие асфиксии. Изменения частоты сердечных сокращений плода были изучены как диагностический маркер. Валентин и его коллеги 3 продемонстрировали, что наиболее аномальные значения pH артерий пуповины связаны с паттерном пониженной вариабельности, пониженной вариабельностью с поздними замедлениями или брадикардией с поздними замедлениями.Прохождение мекония и присутствие околоплодных вод, окрашенных меконием, также указывает на дистресс плода и ассоциируется с гипоксией, ацидозом и асфиксией плода. 3 Раньше считалось, что низкая оценка по шкале Апгар предполагает асфиксию, но это было опровергнуто. Многочисленные исследования обнаружили низкие показатели по шкале Апгар у младенцев с нормальным уровнем pH пуповинной артерии и нормальные показатели по шкале Апгар у младенцев, страдающих асфиксией. 1,4,5
Лактат пуповины и сывороточные концентрации нейрон-специфической энолазы были предложены в качестве маркеров перинатальной асфиксии и в качестве показателя тяжести гипоксической ишемической энцефалопатии.Эти тесты еще не нашли широкого клинического применения. 6,7
Патологическое течение новорожденных, которое включает такие особенности, как задержка или нарушение дыхания, требующее реанимационных мероприятий, длительная депрессивная оценка по шкале Апгар, судороги, гипотония и выпуклый родничок, является наиболее важным признаком наличия перинатальной асфиксии. достаточной степени тяжести, чтобы вызвать неврологический дефицит. Менее очевидные аномалии — раздражительность, трудности с кормлением, чрезмерная дрожь или ненормальный крик.
Кроме того, могут присутствовать клинические или лабораторные доказательства асфиксического повреждения органов, отличных от головного мозга. Феномен полиорганной дисфункции связан с рефлексом ныряния. Этот рефлекс, активируемый асфиксией, заключается в оттоке крови от кожи и внутренних органов к сердцу, надпочечникам и мозгу, якобы для защиты этих жизненно важных органов от гипоксически-ишемического повреждения. В серии, проведенной Шахом и его коллегами, у 8 младенцев с асфиксией в головном мозге были обнаружены признаки дисфункции по крайней мере еще в 1 органе.
Младенец, роды которого были сложными, но неонатальный период протекал без осложнений, не подвержен повышенному риску неврологического повреждения. 9 Отсутствие отмеченных признаков и симптомов у подростка, который впоследствии поступает с церебральным параличом, указывает на причину, отличную от перинатальной асфиксии.
Повышенное количество ядросодержащих эритроцитов (яРБК) часто регистрируется у младенцев с острой, подострой или хронической асфиксией. Однако существует большое совпадение значений nRBC после острой и хронической асфиксии.Асфиксия любой продолжительности не всегда приводит к увеличению количества nRBC, и резкое увеличение может быть обнаружено при отсутствии асфиксии. 10
Поскольку белок спинномозговой жидкости (CSF) может быть повышен после перинатальной асфиксии, исследование CSF может предоставить некоторые диагностические доказательства. У новорожденного средняя концентрация белка в спинномозговой жидкости составляет 90 мг / дл; значения более 150 мг / дл считаются ненормальными. У недоношенных новорожденных средняя концентрация белка в спинномозговой жидкости составляет 115 мг / дл. 11 Присутствие крови из любого источника увеличивает общий белок на 1,5 мг / дл жидкости на каждые 1000 свежих эритроцитов / мкл. 12 Повышение отношения лактата в спинномозговой жидкости к пирувату, а также резкое повышение уровня изофермента креатинкиназы-BB в крови сохраняется у младенцев, страдающих асфиксией, в течение нескольких часов после восстановления нормальной оксигенации. Однако нормальный уровень спинномозговой жидкости не исключает возможности перинатальной асфиксии.
Исследования нейровизуализации — лучший способ определить степень асфиксии и дифференцировать асфиксию от пороков развития или других приобретенных аномалий.Ультрасонография, хотя ее легко выполнить, имеет несколько ограниченную ценность при оценке состояния ребенка, страдающего асфиксией. Хотя КТ полезна для обнаружения кровоизлияния, трудности возникают при КТ-анализе паренхиматозных изменений, и поэтому МРТ является предпочтительным инструментом визуализации для определения степени и природы асфиксического повреждения у клинически стабильного доношенного ребенка.
МРТ, проведенная младенцам с асфиксией в течение первых 10 дней жизни, демонстрирует 3 модели повреждений. 13,14 По одной схеме, наблюдаемой у доношенных детей, аномалии чаще всего ограничиваются таламусом и базальными ганглиями. В одном исследовании 14 почти все младенцы с этими поражениями перенесли острый глубокий асфиксический инсульт. Mercuri и соавторы 15 отметили более сильную связь между оценками по шкале Апгар и поражениями базальных ганглиев, чем с pH пуповины.
По другому типу аномалии преимущественно возникают в коре головного мозга и подкорковом белом веществе. Аномалии перивентрикулярного белого вещества обычно наблюдаются у недоношенных детей или у младенцев, которые, как считается, получили асфиксию в утробе матери до 34-35 недель беременности.Аномалии ствола мозга и мозжечка встречаются реже. В серии, проведенной Sie и соавторами, 14 26% младенцев, у которых была выявлена перивентрикулярная лейкомаляция (ПВЛ) на МРТ, родились доношенными.
У некоторых младенцев наблюдается смешанный паттерн отклонений, на который указывают визуальные исследования. 14 Повышение контрастности аномалий таламуса и базальных ганглиев, в частности, коррелирует с некрозом ткани и, таким образом, предсказывает плохой результат.
Очаговые паренхиматозные кровоизлияния, в основном в теменной или теменно-затылочной области, были обычным явлением в серии исследований Кини и его коллег. 16 Они были односторонними или двусторонними и, как правило, решались на замену атрофией, истончением миелина или отложением гемосидерина.
Кровоизлияние в базальные ганглии наблюдается у небольшой части детей, страдающих асфиксией. Кровоизлияние может рассосаться, стать кистозным или кальцифицированным. По неизвестным пока причинам кальциноз может появиться уже через 2 недели после удушья. После перинатальной асфиксии наблюдается задержка миелинизации. Лучше всего это определять в возрасте от 7 до 8 месяцев.
Нарушения, наблюдаемые при неонатальной визуализации головного мозга, еще лучше выявляются в невропатологических исследованиях. Эти исследования демонстрируют высокоселективную уязвимость определенных популяций нейронов к перинатальной асфиксии. Когда плод приматов подвергается острой полной асфиксии, возникает воспроизводимая картина нарушений мозга. Эта картина включает двусторонние симметричные поражения в таламусе и в ряде ядер ствола мозга, особенно в ядрах нижнего бугорка, верхней оливы и латерального лемниска.Нейроны коры головного мозга, в частности гиппокамп, особенно уязвимы, как и клетки Пуркинье мозжечка.
Факторы, определяющие это явление, изучены не полностью. Частично региональное распределение повреждения отражает сосудистое кровоснабжение головного мозга. Травма максимальна в пограничных зонах между магистральными артериями головного мозга. В полосатом теле топография гибели нейронов, вероятно, связана с плотностью возбуждающих рецепторов и экспрессией различных подтипов рецепторов. 17,18
Воспалительные реакции с участием различных цитокинов также могут способствовать гипоксически-ишемической гибели клеток. Повышение цитокинов может быть результатом инфекции, особенно ахориоамнионита, которая предшествует гипоксически-ишемическому инсульту, или может быть результатом активации микроглии при асфиксии.
Относительная частота пренатальных и перинатальных поражений, подтвержденная патологическими исследованиями, проиллюстрирована в таблице 1.
| Таблица 1. Типы и подтипы поражений головного мозга в исследуемой популяции из 297 младенцев | |||||||||
| Тип поражения | Число пострадавших пациентов (%) | ||||||||
| Пренатальный | 150 (50.5) | ||||||||
| Пороки развития | 93 (31,3) | ||||||||
| Синдромы Киари | 23 | 23 | |||||||
| Первичная микроцефалия | 9 | ||||||||
| Агенезия мозолистого тела | 8 | серое | 907 | Аномальный узор свертки | 6 | ||||
| Другие пороки развития | 23 | ||||||||
| Синдром Дауна | 31 (10.4) | ||||||||
| Гидроцефалия | 23 (7,7) | ||||||||
| Пренатальные инфекции | 2 (0,7) | ||||||||
| Перинатальный | 47 (15,8) | ||||||||
| Поражения кровообращения | 42 (14,1) | ||||||||
| Родовая механическая травма | 5 (1.7) | ||||||||
| Послеродовой (генетические нарушения, лейкодистрофии, липидозы и т. Д.) | 27 (9,1) | ||||||||
| Послеродовой (менингит, энцефалит и т. Д.) | 447 | 907 | 907 | ||||||
| Неизвестно (перинатальный или пренатальный) | 29 (9,8) | ||||||||
| * На 62 других вскрытиях не было обнаружено никаких морфологических повреждений |
Нейропатологические повреждения 6 Паразитарные поражения . Наиболее частым местом повреждения головного мозга у доношенных новорожденных является кора головного мозга. Экспериментальные исследования подтвердили, что парасагиттальная кора головного мозга является самой ранней и наиболее серьезно поврежденной при длительной асфиксии, причем размер повреждения геометрически увеличивается с увеличением продолжительности асфиксии.
Поражения обычно затрагивают территорию, снабжаемую наиболее периферическими ветвями 3 крупных мозговых артерий. 19 Инфаркты в этой области являются вторичными по отношению к артериальному или венозному застою и тромбозам.
Одна из распространенных закономерностей распределения поражений, называемая артериальной «пограничной зоной» или «водоразделом», обычно возникает в результате внезапного снижения систолического кровяного давления и церебральной перфузии. Наиболее известные водоразделные поражения в головном мозге находятся между кровообращением передней и средней церебральных артерий и между средним и задним церебральным кровообращением. Другая зона водораздела находится в тегментуме ствола мозга между территориями парамедиана, пронизывающими длинные окружные артерии. 20
Инфаркты в зоне водораздела головного мозга доношенных новорожденных обычно ишемические. Примерно в 30% случаев они геморрагические. У недоношенных детей геморрагические инфаркты водораздела встречаются чаще, чем ишемические инфаркты.
Поражения могут располагаться в коре или белом веществе. Когда поражено серое вещество, повреждение обычно затрагивает участки, расположенные по глубине бороздок. Частично это распределение может отражать влияние отека мозга на дренаж кортикальных вен, а частично оно может быть следствием недостаточного кровоснабжения этой области у здорового новорожденного.
Поражения, включающие повреждение более глубоких частей серого вещества, получили название «улегирия» (склероз мантии, долевой склероз и узловой склероз коркового вещества). 21 Улегирия составляет примерно треть клинических дефектов, вызванных нарушениями кровообращения в неонатальном периоде. 19 Характерной особенностью является локализованное разрушение нижних частей стенки извилины при относительной щаде коронки. Это дает «грибовидную» извилину.
Улегирия может быть обширной или настолько ограниченной, что общий вид мозга является нормальным. Когда улегирия широко распространена, часто возникает ассоциированный кистозный дефект подкоркового белого вещества (порэнцефальная киста) и дилатация боковых желудочков. Мозговые оболочки, покрывающие пораженный участок, утолщены, а на мелких артериях иногда обнаруживаются кальцификаты в эластиках. Реже улегирия поражает мозжечок.
Marin-Padilla 22 изучил изменения серого вещества после травмы при улегирии и обнаружил, что выжившая кора головного мозга приобретает корковую дисплазию, которая влияет на структурную и функциональную дифференциацию нейронов, глиальных элементов и синаптическую организацию.Марин-Падилья предположил, что последствия приобретенной корковой дисплазии представляют собой основной патогенетический механизм эпилепсии и других неврологических последствий перинатального повреждения головного мозга. 22
Селективный нейрональный некроз и ламинарный некроз коры. Распределение поражений головного мозга, вызванных острой тотальной асфиксией, редко воспроизводит распределение поражений, обнаруженных у младенцев, переживших частичную, но продолжительную асфиксию. Когда длительная частичная асфиксия вызывается экспериментально, у приматов развиваются высокие уровни парциального давления углекислого газа и смешанный метаболический и респираторный ацидоз.Эти изменения обычно сопровождаются выраженным отеком мозга, который сдавливает мелкие кровеносные сосуды паренхимы головного мозга.
Результирующее увеличение сосудистого сопротивления, наложенное на системные изменения, приводит к различным очаговым поражениям мозгового кровообращения, локализация которых частично определяется сосудистыми паттернами, а частично гестационным возрастом плода на момент асфиксии. 23 Селективный некроз нейронов может сопровождаться минерализацией этих клеток.
Кора головного мозга новорожденных уязвима для ламинарного некроза после тяжелого ишемического инсульта. Ламинарный некроз может быть идентифицирован на МРТ, особенно в последовательностях восстановления с инверсией, ослабленной жидкостью, как яркая линия повышенного сигнала внутри коры и параллельная поверхности мозга.
ПВЛ. PVL встречается с особой частотой у недоношенных детей. Это поражение представляет собой двусторонний довольно симметричный некроз с перивентрикулярным распределением.Два наиболее распространенных места возникновения — на уровне затылочного излучения и в белом веществе вокруг отверстия Монро. Кроме того, может развиться диффузный некроз белого вещества головного мозга, который обычно не затрагивает гиральные ядра.
Патогенез ПВЛ, скорее всего, многофакторный. 17 Основные факторы перечислены в таблице 2. 24
| Таблица 2 — Основные патогенные факторы в PVL2 | |
| Нарушение перфузии перивентрикулярной области, сопровождающееся нарушением регуляции сосудов головного мозга склонность к давлению и пассивному кровообращению. | |
| ПВЛ, перивентрикулярная лейкомаляция. |
Роль цитокинов в эволюции ПВЛ в последнее время привлекла большое внимание. Представляется вероятным, что цитокины, такие как интерферон-а, интерферон-g, фактор некроза опухоли а, интерлейкин (ИЛ) -6 и ИЛ-8, могут повреждать белое вещество, вызывая гипотензию или вызывая ишемию посредством внутрисосудистой коагуляции. Цитокины также могут оказывать прямое неблагоприятное воздействие на развитие олигодендроглии или индуцировать продукцию других цитокинов, таких как фактор активации тромбоцитов, который может еще больше повредить клетки. 25 Вклад перинатальной и пренатальной асфиксии в развитие ПВЛ был рассмотрен Folkerth. 25
С клинической точки зрения, спастическая диплегия является наиболее частым и наиболее стойким последствием ПВЛ. Он почти всегда двусторонний, хотя часто асимметричный по степени тяжести. Из-за предрасположенности перивентрикулярных некротических поражений к раннему и наиболее заметному появлению вокруг затылочных рогов боковых желудочков могут быть задействованы оптические лучевые волокна, что иногда также приводит к кортикальным нарушениям зрения.
Ряд неблагоприятных клинических перинатальных событий коррелируют с развитием ПВЛ. В одном исследовании 26 наибольшая частота встречаемости наблюдалась у младенцев в возрасте от 24 до 26 недель. Известные пренатальные факторы риска включают преждевременный, продолжительный или как преждевременный, так и продолжительный разрыв плодных оболочек; хориоамнионит; и внутриутробные инфекции. 27 Однако во многих случаях младенцы, пораженные ПВЛ, имеют относительно доброкачественное постнатальное течение. 27 Как правило, чем менее зрелая перивентрикулярная сосудистая сеть, тем менее значительны клинические осложнения, сопровождающие развитие ПВЛ.
Мультикистозная энцефаломаляция. Неонатальный мозг реагирует на инфаркт иначе, чем зрелый мозг. Вместо образования плотных глиотических рубцов обычные долговременные остаточные поражения представляют собой псевдокисты. Одна из причин образования кист заключается в том, что области инфаркта в мозге новорожденного имеют тенденцию быть больше, чем в мозге взрослого; коллатеральное кровообращение менее развито. Другая причина заключается в том, что способность неонатального мозга активировать реактивный глиоз ограничена.
Маленькие кисты трабекулируют и не сообщаются с желудочковой системой.В своей наиболее обширной форме они могут поражать оба полушария, оставляя лишь небольшие остатки корковой ткани. Эта патологическая картина наблюдается не только как следствие тяжелой перинатальной асфиксии, но и при беременности двойней после внутриутробной гибели плода и при вирусных энцефалитах плода, таких как инфекция простого герпеса. Тяжелая форма спастического квадрипареза обычно развивается у младенцев с данной патологической картиной.
Аномалии базальных ганглиев. Нарушения в базальных ганглиях развиваются у 84% пациентов, у которых возникает перинатальная асфиксия. 28 Одно распространенное поражение, наблюдаемое в этой области, было названо «status marmoratus». По сути, патологическая картина — это глиальное рубцевание, соответствующее участкам деструкции тканей. Он характеризуется сильным сокращением полосатого тела, особенно бледного шара, связанного с гипермиелинизацией и демиелинизацией, которые, вероятно, представляют собой разные реакции на одно и то же оскорбление. Хотя аномалии в базальных ганглиях часто наиболее заметны, в большинстве случаев можно обнаружить множество связанных кортикальных поражений.
По нашему опыту и опыту других 29 , это состояние является результатом острого тяжелого гипоксического инсульта. Как правило, асфиксия не столь продолжительна, как при мультикистозной энцефаломаляции, состоянии, при котором также наблюдается обширное повреждение коры головного мозга и белого вещества. Причины избирательной уязвимости базальных ганглиев к асфиксии до конца не выяснены.
Учитывая, что базальные ганглии имеют более высокое исходное потребление кислорода, чем другие области мозга, 30 должны действовать и другие факторы, чтобы учесть особую уязвимость скорлупы и переднего таламуса. 31 В настоящее время считается, что топография гибели нейронов указывает на первичную роль эксайтотоксичности глутамата в повреждении нейронов базальных ганглиев, при этом тип гибели клеток, вызванный асфиксией (некрозом или апоптозом), определяется зрелостью нейронов и тяжестью продолжительность асфиксии. 32
В регионах, содержащих большие количества ингибиторов апоптоза, преобладает некроз; наоборот, в отсутствие эндогенных ингибиторов апоптоза гипоксия-ишемия вызывает апоптоз. 33 Также играет роль плотность возбуждающих рецепторов, дифференциальная экспрессия ионотропных и метаботропных рецепторов глутамата, их дифференциальная чувствительность и экспрессия различных подтипов рецепторов. 34
Аномалии мозжечка, ствола мозга и моста. Иногда основные структурные изменения в результате перинатальной травмы локализуются в мозжечке. В большинстве случаев поражение носит диффузный характер, с повсеместным исчезновением клеточных элементов коры мозжечка, особенно клеток Пуркинье и зубчатого ядра. 23 Как и в случае перивентрикулярного зародышевого матрикса вокруг боковых желудочков, внешний зернистый слой мозжечка уязвим для спонтанного кровоизлияния, особенно у недоношенных детей раннего гестационного возраста. Однако у подавляющего большинства младенцев избирательное поражение мозжечка не является следствием асфиксии. 35
В целом ствол мозга новорожденного человека оказывается более устойчивым к ишемическим и гипоксическим воздействиям, чем кора головного мозга, но не неуязвим, и иногда поражения в стволе мозга более заметны, чем в супратенториальных структурах.Поражения обычно симметричны и затрагивают как ядра серого вещества, так и прилегающие участки белого вещества, но серое вещество вовлечено более локально, возможно, из-за его более высокой скорости метаболизма.
Поражения могут поражать нижний или верхний бугорок почти избирательно, 21 или инфаркт может возникать в центральном ядре ствола мозга или выборочно в периакведуктальном сером веществе ,21 Двусторонние тегментальные инфаркты моста и, в частности, продолговатого мозга частые последствия преходящей гипотонии плода, потому что, как уже упоминалось, покрышка является водоразделом. 20 Поскольку многие глубокие инфаркты являются микроскопическими, особенно инфаркты ствола мозга, их трудно идентифицировать при нейровизуализации.
Вовлечение неоднозначного ядра, которое вентролатерально по отношению к солитарному тракту, может привести к дисфагии, поскольку это ядро обеспечивает двигательные нейроны для мышц глотания. Вовлечение моторного ядра тройничного нерва в тегментарные инфаркты может привести к повреждению мотонейронов жевательных мышц, таких как жевательные мышцы и крыловидные кости.
Понто-субикулярная дегенерация. Понто-субикулярная дегенерация изолирована или сопровождается обширным церебральным поражением у недоношенных и доношенных детей. 21,36 Это не редкость; однако ее патогенез плохо изучен, а роль перинатальной асфиксии в ее возникновении изучена недостаточно.
Состояние представляет собой уникальную топологию патологического нейронального апоптоза в мозге плода и новорожденного после гипоксии или ишемии.Как следует из названия, он избирательно включает ретрансляционные ядра кортикопонтоцеребеллярного пути в основании моста и субикулума, переходной коры между 3-слойным гиппокампом и 6-слойной извилиной гиппокампа. Хотя он может сосуществовать с другими гипоксическими поражениями коры головного мозга, таламуса и мозжечка, эти другие области вовлечены непропорционально менее серьезно, чем ядра моста и субикулюм.
Такое распределение инфарктов обычно наблюдается у младенцев старше 29 недель беременности, чаще всего у младенцев на сроках от 32 до 36 недель.Понто-субикулярная дегенерация не лучше распознается клиницистами, потому что ее трудно продемонстрировать в течение жизни, и она остается по существу посмертным невропатологическим диагнозом.
Инфаркт мозга. Инфаркт, являющийся следствием очагового или генерализованного нарушения мозгового кровообращения, возникающего в антенатальном или раннем послеродовом периодах, является относительно редкой причиной поражения головного мозга. Предполагается, что это результат эмболизации, возникшей в результате инфаркта плаценты, или тромбоза, вызванного недоразвитием сосудов, сепсисом или асфиксией.
В серии исследований Фудзимото и его коллег 37 22% инфарктов головного мозга последовали за перинатальной асфиксией. Примерно у половины младенцев имеется предшествующая неонатальная энцефалопатия, а у примерно трети — тромбофильная патология, обычно гетерозиготность по фактору V Лейдена или высокая концентрация фактора VIII.
Анатомическим последствием инфаркта головного мозга обычно является порэнцефальная киста, представляющая собой интрапаренхиматозную кисту, которая сообщается с желудочковой системой и частично и обычно редко покрывается эпендимой.Клиническими коррелятами обычно являются спастический гемипарез, гемисенсорный дефицит и часто гемианопсия.
Эволюция двигательных паттернов у младенцев, страдающих асфиксией
Младенцы, у которых возникает перинатальная асфиксия, испытывают различные последовательные изменения мышечного тонуса и аномальную эволюцию постуральных рефлексов. Чаще всего наблюдается постепенный переход от генерализованной гипотонии в период новорожденности к спастичности в более позднем возрасте. Самым ранним признаком спастичности является наличие повышенного сопротивления при пассивной супинации предплечья или при сгибании и разгибании голеностопного сустава или колена.
При спастической диплегии этот ненормальный рефлекс растяжения сначала проявляется в нижних конечностях и часто сопровождается появлением разгибания и ножниц в вертикальном подвешивании, поздним появлением или асимметрией реакции размещения, рефлексом перекрещенных приводящих мышц, который сохраняется после 8 лет. месячного возраста, а также повышенная мобилизация разгибателей тонуса в опорной реакции. 38 При спастической гемиплегии аномалии сначала проявляются в верхней конечности.
Когда 5 младенцев с односторонними поражениями полушария, обнаруженными с помощью обычных визуализирующих исследований в течение первой недели жизни, подвергались регулярным неврологическим обследованиям, никаких отклонений не могло быть обнаружено до 3-месячного возраста, когда у 1 из младенцев обнаруживалось асимметричное пассивное расширение в подколенный угол. 39 В возрасте от 3 до 6 месяцев признаки были едва различимыми и обычно представляли собой асимметричные удары ногой в вертикальном подвешивании, которые наблюдались у 3 детей к 6 месяцам. Предпочтение рук стало очевидным в возрасте от 3 до 9 месяцев.
В некоторых случаях асимметрию общих движений и «суетливых» движений можно обнаружить уже в 3-недельном возрасте. 40 Отсутствие «суетливых» движений также является хорошим предиктором развития дискинетического и спастического квадрипаретического церебрального паралича.
Как правило, чем тяжелее гемиплегия, тем раньше появляются отклонения. Другие признаки гемипареза включают неравномерный мышечный тонус, асимметрию фистинга и неравномерную парашютную реакцию. Во многих случаях родители также отмечают плохое кормление и частые срыгивания.
Стадия перемежающейся дистонии часто проявляется, когда младенец впервые может поднять голову. В это время резкие изменения положения, особенно разгибание головы, вызывают реакцию, аналогичную жесткости разгибателя децеребратора.Вероятно, частота, с которой наблюдается эта промежуточная стадия дистонии, зависит от осторожности, с которой проводятся неврологические наблюдения. У большинства детей эпизоды дистонии наблюдаются в возрасте от 2 до 12 месяцев. В конечном счете, по мере появления ригидности эпизоды становятся менее частыми и их труднее выявить.
У небольшого числа детей с церебральным параличом происходит переход от диффузной гипотонии, наблюдаемой в неонатальном периоде, к экстрапирамидной форме церебрального паралича.Хотя характерной особенностью двигательной активности здоровых недоношенных и доношенных детей является наличие хорео-атетоидных движений кистей и стоп, полностью развернутая клиническая картина дискинезии обычно не проявляется до второго года жизни. До тех пор неврологическая картина характеризуется стойкой гипотонией, сопровождающейся сохранением незрелых постуральных рефлексов. В частности, у младенцев с экстрапирамидным церебральным параличом тонический шейный рефлекс, реакция выпрямления и рефлекс Моро сохраняются в течение более длительных периодов, чем у тех, у которых преобладает спастическая картина. 38
В общем, самое раннее конкретное свидетельство экстрапирамидной болезни наблюдается в позе пальцев, когда младенец тянется к объекту. Это можно заметить уже в 9-месячном возрасте, и, как правило, раннее появление экстрапирамидных движений указывает на то, что окончательная инвалидность будет легкой. У ребенка с дискинезией дистоническая поза может быть вызвана внезапными изменениями положения туловища или конечностей, в частности, вытягиванием головы.
Каждый врач, осматривавший младенцев с подозрением на родовую травму головного мозга, встречал пациента, у которого в раннем младенчестве наблюдались явные неврологические признаки, но двигательная дисфункция которого разрешилась при последующих обследованиях. Однако многие из этих младенцев не избежали повреждения мозга. Последующие исследования показывают, что у них отсрочены основные этапы работы и высока частота умственной отсталости. Тем не менее, примерно треть кажется нормальным или может демонстрировать только легкие нарушения восприятия или гиперкинетические модели поведения. 41
Ссылки:
ССЫЛКИ
1.
Perlman JM, Risser R. Тяжелая ацидемия плода: неврологические особенности новорожденных и краткосрочные исходы.
Pediatr Neurol.
1993; 9: 277-282.
2.
Hermansen MC. Парадокс ацидоза: асфиксическое повреждение головного мозга без сопутствующей ацидемии.
Dev Med Child Neurol.
2003; 45: 353-356.
3.
Валентин Л., Экман Г., Исберг П.Е. и др. Клиническая оценка плода и новорожденного: взаимосвязь между кардиотокографией во время родов, оценкой по шкале Апгар, кислотно-основным статусом пуповинной крови и заболеваемостью новорожденных.
Arch Gynecol Obstet.
1993; 253: 103-115.
4.
Goldenberg RL, Huddleston JF, Nelson KG. Оценка по шкале Апгар и pH пупочной артерии у недоношенных новорожденных.
Am J Obstet Gynecol.
1984; 149: 651-654.
5.
Socal ML, Garcia PM, Riter S. Депрессивные баллы по шкале Апгар, кислотно-щелочной статус и неврологический исход.
Am J Obstet Gynecol.
1994; 170: 991-998.
6.
Borruto F, Comparetto C, Wegher E, Treisser A. Скрининг дистресса плода путем оценки лактата пуповины.
Clin Exp Obstet Gynecol.
2006; 33: 219-222.
7.
Celtik C, Acunas B, Oner N, Pala O. Нейрон-специфическая энолаза как маркер тяжести и исхода гипоксической ишемической энцефалопатии.
Brain Dev.
2004; 26: 398-402.
8.
Шах П., Рифаген С., Бейен Дж., Перлман М. Мультиорганная дисфункция у младенцев с постасфиксиальной гипоксически-ишемической энцефалопатией.
Arch Dis Child Fetal Neonatal Ed.
2004; 89: F152-F155.
9.
Фриман Дж. М., Нельсон КБ. Асфиксия во время родов и детский церебральный паралич.
Педиатрия.
1988; 82: 240-249.
10.
Hermansen MC. Ядерные эритроциты у плода и новорожденного.
Arch Dis Child Fetal Neonatal Ed.
2001; 84: F211-F215.
11.
Volpe JJ. Неонатальное внутричерепное кровоизлияние.
Clin Perinatol.
1977; 4: 77-102.
12.
Tourtellotte WW, Somers JF, Parker JA и др. Исследование травматических люмбальных проколов.
Неврология.
1958; 8: 159-160.
13.
Баркович А.Ю. Перинатальная асфиксия: результаты МРТ в первые 10 дней.
AJNR.
1995; 16: 427-438.
14.
Sie LT, van der Knaap MS, Oosting J, et al.МРТ паттерны гипоксически-ишемического повреждения после пренатальной, перинатальной или послеродовой асфиксии.
Нейропедиатрия.
2000; 31: 128-136.
15.
Mercuri E, Rutherford M, Barnett A, et al. МРТ поражения у младенцев с неонатальной энцефалопатией. Является ли оценка по шкале Апгар прогнозирующей?
Нейропедиатрия.
2002; 35: 150-156.
16.
Keeney SE, Adcock EW, McArdle CB.Проспективные наблюдения за 100 новорожденными из группы высокого риска с помощью магнитно-резонансной томографии центральной нервной системы в сильном поле (1,5 Тесла). II. Поражения, связанные с гипоксически-ишемической энцефалопатией.
Педиатрия.
1991; 87: 431-438.
17.
Calabresi P, Centonze D, Bernardi G. Клеточные факторы, контролирующие уязвимость нейронов в головном мозге: урок полосатого тела.
Неврология.
2000; 55: 1249-1255.
18.
Джонстон М.В. Эксайтотоксичность при перинатальной травме головного мозга.
Brain Pathol.
2005; 15: 234-240.
19.
Freytag E, Lindenberg R. Невропатологические данные у пациентов больницы для умственно отсталых: исследование 359 случаев.
Johns Hopkins Med J.
1967; 121: 379-392.
20.
Sarnat HB.Раздражающие инфаркты ствола мозга плода и новорожденного. Этиология центральной гиповентиляции, дисфагии, синдрома Мебиуса и микрогнатии.
Eur J Paediatr Neurol.
2004; 8: 71-87.
21.
Friede RL.
Невропатология развития.
2-е изд. Берлин: Спрингер-Верлаг; 1989: 82-86.
22.
Марин-Падилла М. Нейропатология развития и влияние перинатального повреждения головного мозга, III: поражения серого вещества неокортекса.
J Neuropathol Exp Neurol.
1999; 58: 407-429.
23.
Towbin A. Гипоксическое поражение мозга у плода и новорожденного: основные закономерности и их клиническое значение.
Arch Neurol.
1969; 20: 35-43.
24.
Volpe JJ.
Неврология новорожденных.
4-е изд. Филадельфия: У. Б. Сондерс; 2001: 291-299.
25.
Folkerth RD. Перивентрикулярная лейкомаляция: обзор и недавние открытия.
Pediatr Dev Pathol.
2006; 9: 3-13.
26.
Baud O, Foix-L’Helias L, Kaminski M, et al. Антенатальное лечение глюкокортикоидами и кистозная перивентрикулярная лейкомаляция у очень недоношенных детей.
N Engl J Med.
1999; 341: 1190-1196.
27.
Perlman JM, Risser R, Broyles RS.Двусторонняя кистозная перивентрикулярная лейкомаляция у недоношенных детей: сопутствующие факторы риска.
Педиатрия.
1996; 97: 822-827.
28.
Кристенсен Э., Мельхиор Дж. Церебральный паралич: клиническое и невропатологическое исследование.
Clin Dev Med.
1967; 25.
29.
Пастернак Ю.Ф., Горей М.Т. Синдром острой почти тотальной внутриутробной асфиксии у доношенных детей.
Pediatr Neurol.
1998; 18: 391-398.
30.
Chugani HT, Phelps ME, Mazziotta JC. Позитронно-эмиссионная томография, исследование функционального развития мозга человека.
Энн Нейрол.
1987; 22: 487-497.
31.
Menkes JH, Curran J. Клиническая и магнитно-резонансная томография коррелируют у детей с экстрапирамидным церебральным параличом.
AJNR.
1994; 15: 451-457.
32.
Martin LJ, Brambrink AM, Lehmann C, et al. Гипоксия-ишемия вызывает аномалии переносчиков глутамата и гибель астроглии и нейронов в полосатом теле новорожденного.
Энн Нейрол.
1997; 42: 335-348.
33.
Джонстон М.В. Эксайтотоксичность при перинатальной травме головного мозга.
Brain Pathol.
2005; 15: 234-240.
34.
Calabresi P, Centonze D, Bernardi G. Клеточные факторы, контролирующие уязвимость нейронов в головном мозге: Урок из полосатого тела.
Неврология.
2000; 55: 1249-1255.
35.
Sarnat HB, Alcala H. Гипоплазия мозжечка человека: синдром различных причин.
Arch Neurol.
1980; 37: 300-305.
36.
Roland EH, Hill AG, Norman MG, et al.Избирательная травма ствола мозга у новорожденного, перенесшего асфиксию.
Энн Нейрол.
1988; 23: 89-92.
37.
Fujimoto S, Yokochi K, Togari H, et al. Инфаркт головного мозга новорожденных: симптомы, результаты КТ и прогноз.
Brain Dev.
1992; 14: 48-52.
38.
Пейн RS. Эволюция детских постуральных рефлексов при наличии хронических мозговых синдромов.
Dev Med Child Neurol.
1964; 6: 345-361.
39.
Bouza H, Rutherford M, Acolet D, et al. Эволюция ранних признаков гемиплегии у доношенных детей с односторонним поражением головного мозга в неонатальном периоде: проспективное исследование.
Нейропедиатрия.
1994; 25: 201-207.
40.
Guzzetta A, Mercuri E, Rapisardi G и др. Общие движения позволяют выявить ранние признаки гемиплегии у доношенных детей с инфарктом головного мозга новорожденных.
Нейропедиатрия.
2003; 34: 61-66.
41.
Taudorf K, Hansen EJ, Melchior JC, Pedersen H. Спонтанная ремиссия церебрального паралича.
Нейропедиатрия.
1986; 17: 19-22.
42.
Menkes JH, Sarnat HB. Перинатальная асфиксия и травмы. В: Menkes JH, Sarnat HB, Maria BL, ред.
Детская неврология.
7 изд.Балтимор: Липпинкотт, Уильямс и Уилкинс; 2006: 367-431.
Изменения бета (1) интегрина в эпителиальных клетках почечных канальцев после внутриутробной асфиксии детенышей кроликов
Дата публикации:
2009
Резюме:
ЦЕЛЬ: Мы исследовали роль бета (1) интегрина в остром повреждении почечных канальцев. путем внутриутробной асфиксии новорожденных кроликов путем изучения распределения и изменений экспрессии бета (1) интегрина и его мРНК в эпителиальных клетках почечных канальцев.Методы. Катетер использовался для временной блокады брюшной аорты беременных новозеландских кроликов с целью создания животной модели внутриутробной асфиксии. Детенышей кроликов случайным образом делили на контрольную группу, группу лечения асфиксии и группу вмешательства ингибитором кальпаина, и их ткани почечных канальцев исследовали через 2 часа после асфиксии. Иммунофлуоресценция и гибридизация in situ были использованы для изучения экспрессии бета (1) интегрина и его мРНК соответственно. Вестерн-блоттинг был использован для демонстрации протеолиза бета (1) интегрина.Ингибитор кальпаина I использовался для демонстрации защитного эффекта, заключающегося в предотвращении гидролиза бета (1) интегрина после асфиксии.
РЕЗУЛЬТАТЫ: (1) Обычно бета (1) интегрин локализовался исключительно на базальной поверхности эпителиальных клеток почечных канальцев. После асфиксии большое количество бета (1) интегрина переместилось с базальной поверхности в цитоплазму, а также на боковые и апикальные поверхности, и его экспрессия значительно снизилась с одновременным повреждением целостности и структуры почечных канальцев, многие отслоившиеся клетки и клеточные фрагменты заблокировали канальцы.

 Фибринолиз идет быстрее, чем выше локальная концентрация плазминогена в сгустках [10].
Фибринолиз идет быстрее, чем выше локальная концентрация плазминогена в сгустках [10]. И., Чарная М. А., Морозов Ю. А. Патология системы гемостаза. М.: ГЕОТАР- Медиа, 2011. С. 25, 27.
И., Чарная М. А., Морозов Ю. А. Патология системы гемостаза. М.: ГЕОТАР- Медиа, 2011. С. 25, 27. , Черезова И. П., Макарова Т. П., Шаммасов Р. З. Гематология детского возраста. Ростов-на-Дону: Феникс. Казань: Казанский государственный медицинский университет, 2006. С. 37–39.
, Черезова И. П., Макарова Т. П., Шаммасов Р. З. Гематология детского возраста. Ростов-на-Дону: Феникс. Казань: Казанский государственный медицинский университет, 2006. С. 37–39. Все эти состояния могут вызвать серьезную кислородную недостаточность у ребенка (5).
Все эти состояния могут вызвать серьезную кислородную недостаточность у ребенка (5). Гипоксико-ишемическая энцефалопатия (ГИЭ) и инсульт часто возникают одновременно (9).
Гипоксико-ишемическая энцефалопатия (ГИЭ) и инсульт часто возникают одновременно (9).