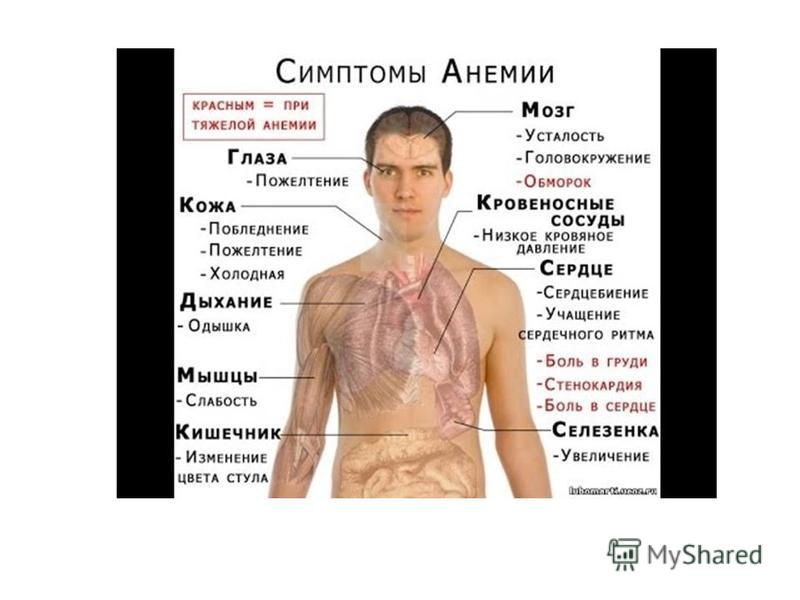
Злокачественное малокровие – признаки, симптомы, лечение
Справочная информация.
Злокачественное малокровие – это серьезное заболевание организма в целом, при котором поражается нервная и пищеварительная системы, кровеносная система из-за недостаточного количества витамина В12 – антианемический фактор.
Этиология.
К причинам образования малокровия относят: желудочную анемию, расстройство питания, кишечную аутоинтоксикацию, антианемический фактор (по составу похож на фолиевую кислоту).
Патогенез.
В норме у здорового человека слизистая желудка, для нормального кровоснабжения, вырабатывает внутренний фактор, вследствие взаимодействия с внешним фактором, который образует активные антианемические вещества при употреблении сырого мяса, отрубей, яиц. Противоанемические вещества появляются в желудочном пищеварении, всасываются в кишечнике и откладываются в печени, в виде гемолоэтиков, а, при необходимости, расходуются костным мозгом. У больных малокровием эти антианемические вещества отсутствуют в желудке и печени, что приводит к задержке созревания эритробласта в костном мозге, образуя мегабласт, мегалацит и эмбриональное кровотечение. Злокачественное малокровие относят к дефицитной В12 – фолиевой анемии из-за недостаточного извлечения из пищи гастромукопротеинов, разрушений в кишечнике лентеца и повышенного расходования в период беременности.
Клиника.
Заболевание начинается в одних случаях медленно, в других, наоборот, внезапно (в период инфекции, воспаления – грипп, ангина, малярия), из-за физических травм, нервно-психического расстройства.
У больного отмечается:
слабость
недомогание
быстрая утомляемость
разбитость
головная боль
головокружение
в ушах шумит
мелькают мушки перед глазами
учащенное сердцебиение
одышка
отрыжка горечью
тошнота
иногда рвота
снижается или отсутствует аппетит
жжение
боль в языке или во всей полости рта
парастезия
верхние и нижние конечности немеют, холодные на ощупь, возможна небольшая боль
шатающаяся походка
мышечная боль, судороги.

При визуальном осмотре:
кожные покровы сухие, бледные или цвета лимона
лицо одутловатое
склеры субиктеричные
голени и стопы пастозные, отечные
выпадают волосы
ногтевые пластинки ломкие, слоятся, утолщаются
язык и край языка бардового цвета
атрофируется слизистая языка и десен, а со временем атрофируется глотка, пищевод, слизистая оболочка желудка, боль во время глотания, развивается ахилия.
присоединяется тахикардия, гипотония, расширяются границы сердца, систолический шум связан с ускоренным током крови
увеличивается печень, селезенка, лимфатические узлы
фуникулярный миелоз
склероз заднего и бокового столба спинного мозга.
В период обострения:
поднимается температура тела до 39-40 градусов
понижаются рефлексы или полностью исчезают
нарушается чувствительность (больной не может ходить, двигаться)
в анализах крови присутствует гипохромная анемия, мегалациты, макроциты, лимфоцитоз, снижается количество кровяных пластинок.
Прогноз.
При своевременном и тщательном лечении течение злокачественного малокровия длительное, но благоприятное, снижается трудоспособность. При отсутствии лечения могут возникать коматозные состояния – больной теряет сознание, резко снижается артериальное давление и температура тела, возникает рвота, непроизвольное мочеиспускание, понижаются или отсутствуют рефлексы.
Лечение.
Назначают в первую очередь препараты В12, затем препараты печени (телячью, бычью слегка поджаренную или сырую печень), фолиевую кислоту, полноценную диету, богатую витаминами. При тяжелой форме переливают эритроцитарную массу.
Названы пять признаков злокачественной анемии, которые нельзя оставлять без внимания
Точная причина злокачественной анемии неясна, но медики из Британии назвали пять симптомов, которые могут привести к ее развитию, сообщают «Актуальные новости». Нехватка витамина В12 может привести к злокачественной анемии, и первый симптом, свидетельствующий о ее появлении, — непроходящее чувство усталости.
Нехватка витамина В12 может привести к злокачественной анемии, и первый симптом, свидетельствующий о ее появлении, — непроходящее чувство усталости.
Наличие в организме красных кровяных телец в недостаточном количестве приводит к тому, что кислород доставляется в части тела не в полном объеме. Появление одышки вместе с учащенным сердцебиением — тоже симптом развития злокачественной анемии.
В редких случаях у пациентов с таким заболеванием отмечались проблемы в области неврологии, появлялись головные боли. Также к симптомам относится отсутствие аппетита и потеря веса без каких-либо на то причин.
Злокачественная, или пернициозная анемия — это аутоиммунное заболевание, которое вызывают антитела собственной иммунной системы человека. Они атакуют ткани, которые не воспринимаются защитной системой организма, что вызывает воспаление слизистой оболочки желудка. Воспаление приводит к невозможности усваивать витамин В12, который обеспечивает нормальное кроветворение.
Злокачественная анемия чаще всего встречается у женщин старше 60 лет, у которых имеется предрасположенность к ней, а также к иным болезням иммунной системы. Медики рекомендуют при обнаружении вышеперечисленных симптомов обратиться к соответствующим специалистам, так как это заболевание может навредить не только физическому, но и психическому состоянию человека.
Интересно? Жми, чтобы подписаться на сайт в Яндексе
Автор: Сергей Зайцев
Злокачественная анемия — Справочник химика 21
Было бы лучше если бы мы знали, как предотвратить ревматоидный артрит, эпилепсию, злокачественную анемию, лечебные виды рака и диабета, но мы это не знаем и страдающие благодарны за лекарственное средство. [c.102]
[c.102]
Витамин Bi2 (цианкобаламин рис. 14.9) участвует в образовании эритроцитов. Его можно применять при лечении злокачественной анемии, и, по-видимому, из всех известных веществ он обладает наиболее высокой физиологической активностью прием 2 мкг (2-10 г) витамина Bi2 в сутки — достаточная доза при лечении этой болезни. Витамин Bi2 можно выделить из ткани печени его вырабатывают также плесени и другие микроорганизмы. Каждая молекула витамина В12 содержит один атом кобальта. Это единственное соединение кобальта, обнаруженное в тканях человеческого организма. [c.412]
Витамин Bi2 стал известен к концу 40-х годов нашего столетия. Его открытие относится к 1948 г., когда из экстракта печени было выделено кристаллическое вещество темно-красного цвета, обладающее высокой активностью против злокачественной анемии. Это вещество было названо витамином В12. Эмпирическая формула его показала содержание в нем кобальта, что определило его название — кобаламин. [c.407]
Витамин B , (кобаламин антианемический витамин) выделен из печени в кристаллическом виде в 1948 г. Задолго до этого было известно, что в печени животных содержится особое вещество, регулирующее процесс кроветворения и оказывающее лечебный эффект при пернициозной (злокачественной) анемии у людей. Однако только в 1955 г. Д. Ходжкин [c.232]
В медицине фолиевая кислота применяется для борьбы с болезнями кроветворной системы, особенно при злокачественных анемиях и лучевой болезни, так как участвует в процессах гемо- [c.678]
Применение. Витамин 8,2 применяют при лечении злокачественной анемии, цирроза печени, при нервных и психических расстройствах. Он широко используется в кормопроизводстве. В настоящее время большинство комбикормов для свиней и птиц обогащают витамином В а, особенно благоприятное действие на животных оказывает сочетание витамина с малыми дозами антибиотиков, в частности, биомицина. Витамин В]з воздействует на кроветворную функцию и на обмен белков, принимает участие в регуляции оптимального содержания в организме животного метионина, валина, треонина, лейцина, изолейцина. [c.46]
Витамин В]з воздействует на кроветворную функцию и на обмен белков, принимает участие в регуляции оптимального содержания в организме животного метионина, валина, треонина, лейцина, изолейцина. [c.46]
Физиологическое действие. Кобальт — жизненно важный микроэлемент для высших организмов. Витамин В12 (кобаламин) содержит кобальт. При недостатке кобальта в организме развивается злокачественная анемия (тяжелое, опасное для жизни заболевание). [c.435]
Недостаток витамина Ви ведет к злокачественной анемии сам витамин (или его фермент) участвует в многочисленных химических превращениях (см. разд. 24.3). [c.415]
Витамин В12 участвует в образовании красных кровяных клеток. Его можно применять при лечении злокачественной анемии, и, по-видимому, из всех известных веществ он обладает наиболее высокой физиологической активностью прием 1 1г витамина В г в сутки (1-10 г) — достаточная доза при лечении этой болезни. Данный витамин можно выделять из ткани печени, а также получать из культуральных жидкостей после выращивания некоторых плесеней или других микроорганизмов. Строение молекулы витамина В12 установлено совсем недавно. Молекулярный вес этого вещества примерно 1400, и каждая молекула содержит один атом кобальта. Это соединение является единственным известным соединением кобальта в человеческом организме. [c.494]
Отсутствие кобаламина у человека является причиной возникновения злокачественной анемии. [c.74]
Роль кобаламина в катаболизме аминокислот. Злокачественная анемия есть результат нарушения процесса усвоения кобаламина, что связано с отсутствием особого, вырабатываемого желудком гликопротеина (его называют внутренним фактором). Как влияет это нарушение на катаболизм аминокислот Касается ли это всех аминокислот в равной степени [c.598]
Витамин В12 (рис. 26-17) препятствует развитию злокачественной анемии (разд. [c.834]
[c.834]
Фолиевая кислота содержится в значительных количествах в печени, тем не менее она не идентична известному фактору против пернициозной (злокачественной) анемии, также находящемуся в печени. [c.174]
Таким образом, лечебное действие этих двух витаминов при пернициозной анемии связано с участием их в синтезе тимина и других пуриновых и пиримидиновых оснований, которые образуются в недостаточном количестве при данном заболевании. Это предположение подтверждается тем фактом, что большие количества тимина, введенные больному злокачественной анемией, иногда оказывают несомненное лечебное действие. [c.375]
Недостаточность фолиевой кислоты может также развиться при заболеваниях, связанных с нарушением процессов всасывания витаминов в кишечнике (спру и др.). Фолиевая кислота содержится в значительных количествах в печени. Однако она не идентична известному фактору против пернициозной (злокачественной) анемии, также находящемуся в печени. [c.181]
Считают, что у здоровых людей желудочный/сок содержит белок-мукопротеид — внутренний фактор Касл а, который соединяется с витамином В12 ( внешний фактор ), образуя новый, сложный белок. Витамин В а, связанный в таком белковом комплексе, может успешно всасываться из кишечника. При отсутствии внутреннего фактора всасывание витамина В12 резко нарушается. У больных злокачественной анемией в желудочном соке белок, необходимый для образования комплекса с витамином В 2> отсутствует. [c.184]
В этом случае всасывание витамина В а нарушается, уменьшается количество витамина, поступающего в ткани животного организма, и таким путем возникает состояние авитаминоза. Эти данные представили новое объяснение связи, которая существует между развитием злокачественной анемии и нарушением функции желудка. Пернициозная анемия хотя и является авитаминозом, но возникает на почве органического заболевания [c. 184]
184]
Серьезную опасность представляет цитотоксическое действие бензола или, по-видимому, продуктов его метаболизма. При этом снижается дыхание клеток костного мозга, наблюдается нарушение клеточных ростков в системе кровепворения, наблюдается лимфоцитотоксический эффект, увеличивается количество функционально измененных клеток [2, с. 94—108]. Бензол оказывает прямое повреждающее действие на окислительные процессы в кроветворной ткани. Учитывая склонность бензола депонироваться в костном мозгу, можно объяснить особое влияние его на кроветворение. Высказывается мнение [4], основывающееся на экспериментальных данных, что бензол может явиться причиной злокачественной анемии (лейкоза). На этом основании он внесен в США федеральной администрацией по охране труда (OSHA) в список наиболее опасных химических веществ. [c.320]
Недостаток витамина В12 в организме приводит к тяжелой болезни—злокачественной анемии, при которой уменьшается ко.1Ичество гемоглобина в крови, что вызывает тяжелое расстройство всех функций организма и смерть. Потребность организма человека в витамине В12 ничтожна — около 0,001 мг в сутки. Такое количество этого вит lмннa человек всегда получает с пищей при нормальном рационе. Однако анемия развивается вследствие того, что по каким-то неизвестным причинам в не- [c.460]
Витамин В12 не содержится в растительных кормах, поэтому его добавляют к ним. Витамин В12 является кроветворным, участвует в синтезе незаменимых для животного организма аминокнслот, в частности метионина, способствует вылечиванию злокачественной анемии, прибавлению привеса животных. Витамин синтезируется в рубце жвачных животных под действием микроорганизмов желудка, а также метанобразующими бактериями. [c.389]
Витамин В 2 регулирует углеводный и липидный обмен, участвует в метаболизме незаменимых аминокислот, пуриновых и пиримидиновых оснований, стимулирует образование предшественников гемоглобина в костном мозге применяется в медицине для лечения злокачественной анемии, лучевой болезни, заболеваний печени, полиневрита и т.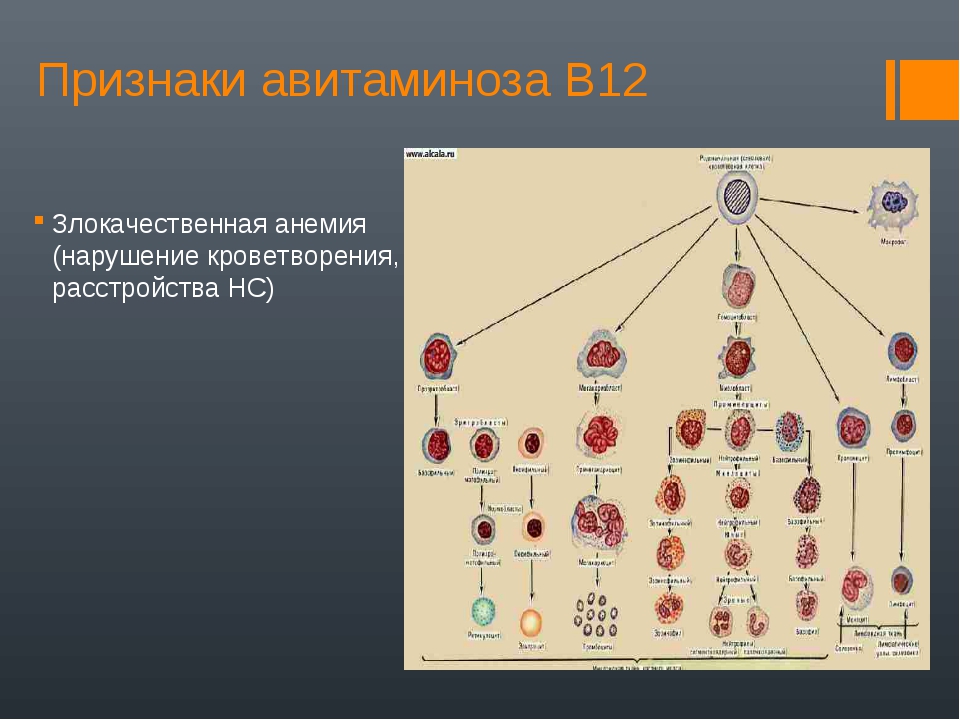 п. Добавление витамина к кормам способствует более полноцершому усвоению растительных белков и повышает продуктивность сельскохозяйственных животных на 10 —15 %. [c.54]
п. Добавление витамина к кормам способствует более полноцершому усвоению растительных белков и повышает продуктивность сельскохозяйственных животных на 10 —15 %. [c.54]
Производные бензоннран-4(4Я)-онов общей формулы (114, R = Н, Hal, NO2, N или другие группы R = Ai-, Het R» = незамещенный или галогензамещенный алкил, алкенил или арил R » = Н, алкил или ацил X = О, S или NH) или их соли могут быть использованы в качестве иммуномодуляторов и для профилактики и лечения разного рода болезней соединительных тканей, диабетов, псориаза, злокачественной анемии, язвенных колитов, хронических гепатитов [99]. Бепзони-раны 115 пригодны для синтеза полициклических гетероциклов [100]. [c.558]
Злокачественная анемия [2, 3], впервые ясно описанная в начале XIX столетия, характеризуется уменьшением эритроцитов, многие из которых при этом теряют обычную дисковидную форму. Некоторые из них имеют еще и гораздо большие размеры ( ме-галобласты ). К другим симптомам этого заболевания относятся лимонно-желтый цвет лица, краснота и повышенная чувствительность языка, отсутствие в желудке соляной кислоты и на более поздней стадии дегенерация нервной системы, связанная с постепенным параличем конечностей. Частота заболевания злокачественной анемией в Великобритании составляет примерно один случай на 1000 человек большая часть пациентов старше 40 лет. До 1922 г. заболевание приводило без исключения к смертельному исходу, наступавшему после постепенно ухудшавшегося состояния больного в течение примерно трех лет. Отталкиваясь от первых наблюдений Уиппла, врачи Майнот и Мэрфи в 1926 г. обнаружили, что прием больными злокачественной анемией диеты, содержавшей большие количества сырой печени, оказывал благоприятное действие. В этот момент химики столкнулись с исключительно сложной проблемой выделения активного начала этого явления, так называемого антианемийного фактора (АРА),, присутствующего в печени в концентрации всего лишь окола одной части на миллион (млн ). [c.650]
[c.650]
Между 1926 и 1939 гг. Коном и сотр. Генслленом, Дэкином, Уэстом, ЛаЛэндом и Клемом были разработаны принципиальные методы выделения фактора АРА. Благодаря их усилиям лечение злокачественной анемии стало более приятным занятием. Поедание печени было заменено периодическими инъекциями водного раствора частично очищенного активного начала. Парадоксально, но этот успех задержал дальнейшую очистку этого начала, поскольку число больных злокачественной анемией, на которых должны были испытываться высокоочищенные препараты, значительно уменьшилось. [c.651]
Вскоре после успешного применения печени в лечении злокачественной анемии (см. разд. 24.4.1.2) Кастлом было показано, что в желудочном соке лиц, страдающих этим заболеванием, отсутствует вещество ( внутренний фактор ), ответственное за связывание кобаламинов, поступающих с пищей, и их транспорт через стенку кишечника в кровоток [147]. В связи с этим для успешного лечения злокачественной анемии были признаны необходимыми внутримышечные инъекции (обычно 1 мг НО-СЫ, [c.689]
Витамин В12 (цианокобаламин) был выделен из экстракта печени (Мерк, 1948 г.), а также из гриба 81гер1отусе5 griseus. Он излечивает злокачественную анемию. Витамин В12 образует темно-красные кристаллы и содержит кобальт. Его весьма сложное строение было установлено методами рентгеноструктурного анализа (Кроуфут-Ходжкин, 1957 г.). Он представляет собой кобальтовый комплекс замещенного коррина [c.614]
Последнее явление изучалось, чтобы использовать его как тест при злокачественной анемии [1821. Соединение Ф-ХХУ вызывает умеренное подавление деятельности прокаинэстеразы в кровяной сыворотке человека [183] и задерживает рост дрожжевых клеток [184]. Он неэффективен в качестве противосу-дорожного средства, как об этом сообщалось ранее [185]. Соединение Ф-ХХУ может меркурироваться до 2,5-диацетоксимеркурпроизводного [186]. Оно ингибирует самоокисление льняного масла [187] и некоторых производных бутадиена [188]. [c.546]
[c.546]
Пигменты желчи образуются в результате окислительного разложения гема. Один из них — билирубин-1Ха (33), желтый пигмент, ответственный за характерное желтое окращивание кожи при желтухе. Циклическая система коррина схожа с порфиринами, но имеет в кольце на один атом углерода меньше. Наиболее важный коррин — витамин В12 (34), недостаток которого в организме человека приводит к злокачественной анемии. Уропорфириноген-111, будучи также предшественником витамина Ви, позволяет установить явную связь между биосинтезом основных порфиринов и корринов. [c.245]
Синтез кобаламинов осуществляется только микроорганизмами в промышленности также осуществляется бактериальный биосинтез. При недостатке витамина В,2 нарушается кроветворение и развивается злокачественная анемия. Ценный препарат при лечении малокровия. [c.556]
Витамин В12 не вырабатывается ни растениями, ни животными его синтезируют только некоторые виды микроорганизмов. Суточная потрфность здорового человека в этом витамине ничтожна—она составляет около 3 мкг. Роль витамина В12 в лечении злокачественной анемии будет рассмотрена в гл. 26. [c.287]
Является весьма эффективным лечебным средством при пернициозной (злокачественной) анемии. Будучи введен парэнтерально он устраняет успещно не только анемию, но и неврологические симптомы, характерные для этого заболевания (атаксию, обусловленную поражением спинного мозга). [c.302]
Основным признаком авитаминоза В12 следует считать злокачественную анемию с характерным для последней нарушением кровотворной функции и расстройством нервной системы. Витамин В12 выделен из печени в кристаллическом виде. Витамин В12 имеет минимальный молекулярный вес 1300 и содержит 4,5% кобальта. Это единственный витамии из всех известных в настоящее время, который содержит металл в своей молекуле и относится к группе координационных соединений с трехвалентным (возможно, двухвалентным) кобальтом.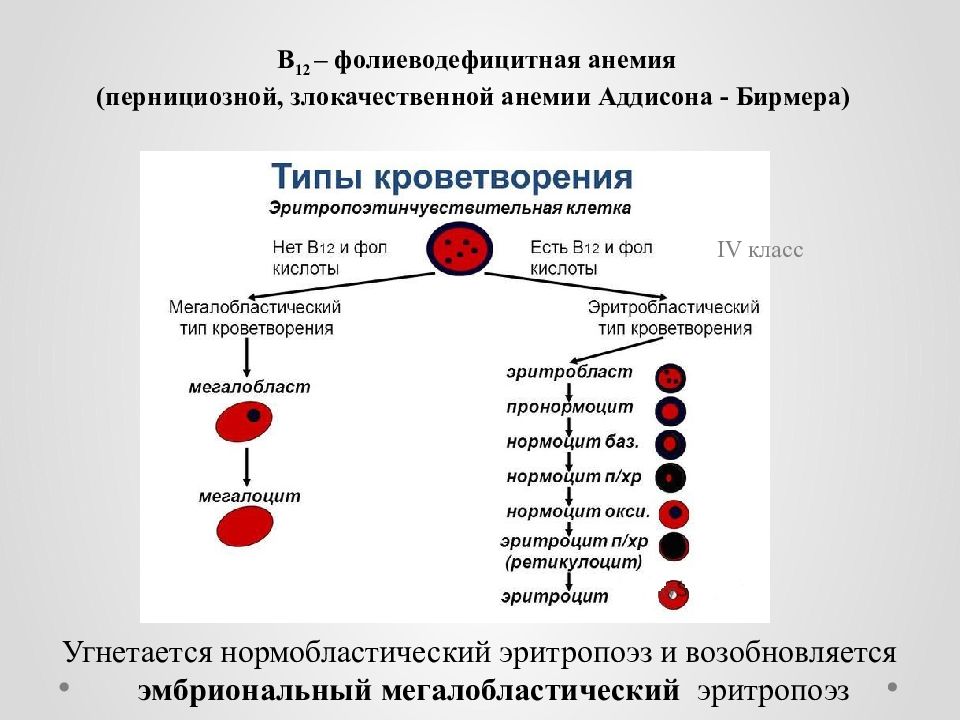 [c.175]
[c.175]
Основным признаком авитаминоза следует считать злокачественную анемию с характерным для последней нарушением кровотворной функции и расстройством нервной системы. [c.183]
ХГ циаиокобаламина достаточно, чтобы вызвать у больных злокачественной анемией сильную реакцию костного мозга. Лечебная эффективность кобаламина хорошо установлена не только при злокачественной анемии, но и при некоторых других формах анемии. Опыт показал, что около 45 хг кобаламина, вводимого внутримышечно через IV2 месяца, достаточно, чтобы предохранить от рецидивов заболевания. Применение витамина per os требует примерно в J00 раз большей дозы. Из исследованных кобалами-нов легче всего всасывается у человека цианокобаламин. [c.183]
Витамин Bi2 был выделен в чистом кристаллическом состоянии лить через двадцать лет после того, как Мёрфи в 1926 г. обнаружил, что печень содержит какой-то фактор, излечивающий злокачественную анемию. Между тем за истекшее время накапливались сведения о разнообразных проявлениях недостаточности витамина В12, который разные авторы именовали по-разному антианемический фактор, фактор X, фактор L.L.D и т. д. Первоначальные попытки очистить витамин Bj2 давали плохие результаты, во-первых, из-за низкого содержания этого витамина в печени и, во-вторых, из-за того, что для проведения тестов требовались больные злокачественной анемией. В 1948 г. группа Фолкерса в Соединенных Штатах и группа Смита в Англии почти одновременно опубликовали сообщения о выделении и кристаллизации чистого витамина Bj2 из печени. [c.236]
Лечим анемию. Чем опасен дефицит витамина В12 | Здоровая жизнь | Здоровье
Наш эксперт – врач-гематолог, кандидат медицинских наук Вероника Орешкина.
Пернициозная анемия (по-латыни «perniciosa» означает «гибельная, губительная») – это прогрессирующее заболевание крови, возникающее в связи с недостатком в организме витамина В12. Болезнь крайне редко развивается из-за отсутствия этого вещества в пище (что, например, может быть связано с голоданием и вегетарианством). Чаще злокачественная (она же пернициозная и мегалобластная) анемия возникает из-за нарушения усвоения витамина В12.
Болезнь крайне редко развивается из-за отсутствия этого вещества в пище (что, например, может быть связано с голоданием и вегетарианством). Чаще злокачественная (она же пернициозная и мегалобластная) анемия возникает из-за нарушения усвоения витамина В12.
Риск растёт с годами
Болеют обычно люди старше 40 лет (чаще женщины). Подавляющее большинство – пожилые (пернициозная анемия есть у 1 из 100 человек старше 60 лет).
Среди факторов риска выделяются тяжёлый атрофический гастрит (а также наличие в прошлом операции по частичному или полному удалению желудка). Важную роль играет и семейная предрасположенность (нередко болеют члены одной семьи – и в этом случае заболевание зачастую возникает в более молодом возрасте). Установлена и связь с аутоиммунными процессами в организме (у большинства больных в сыворотке крови обнаруживают два типа аутоантител – к особым клеткам желудка и к внутреннему желудочному фактору). Часто пернициозная анемия соседствует с заболеваниями щитовидной железы, паразитами в тонком кишечнике и раком желудка.
Впервые это заболевание под названием тяжёлое первичное малокровие было описано в 1855 году английским врачом Аддисоном (его имя эта болезнь сегодня носит официально). Долгое время гибельная анемия считалась неизлечимой, поскольку о причинах и возможностях её исцеления учёные поначалу не догадывались. Но в 1929 году учёный У. Кастл открыл внутренний желудочный фактор, из-за отсутствия которого у больных не может всасываться витамин В12 и соответственно не может происходить нормальное кроветворение. Сам витамин B12 (цианкобаламин) был открыт позднее, в 1948 г., учёными Риксом и Смитом.
Малиновый язык и шум в ушах
Поскольку запасы витамина В12 в организме велики, злокачественное малокровие развивается далеко не сразу, а только спустя 3–4 года после возникновения дефицита. Больше всего от нехватки В12 страдают костный мозг и нервная система. А среди симптомов, как правило, выделяются:
Внешние признаки. Кожа больных становится бледной, слегка желтоватой. Возникают стоматит (язвочки на слизистой рта) и глоссит, при котором язык приобретает малиновый или ярко-красный оттенок, сосочки сглаживаются и поверхность органа становится «лакированной». В самом языке возникает ощущение жжения.
Кожа больных становится бледной, слегка желтоватой. Возникают стоматит (язвочки на слизистой рта) и глоссит, при котором язык приобретает малиновый или ярко-красный оттенок, сосочки сглаживаются и поверхность органа становится «лакированной». В самом языке возникает ощущение жжения.
Анемический синдром. Характеризуется общей слабостью, вялостью, слегка повышенной температурой, головокружениями, обмороками, отёками. Пульс часто учащённый, а артериальное давление снижено. Возможны одышка даже при незначительных нагрузках, шум в ушах и мелькание мушек перед глазами. Впоследствии развивается сердечная недостаточность.
Неврологические нарушения. Возникают слабость мышц, онемение конечностей, головокружение, походка становится нетвёрдой, ухудшается равновесие. Из-за поражения спинного и головного мозга исчезает чувствительность рук и ног, возникают судороги. Могут развиваться импотенция у мужчин, нарушение мочеиспускания, расстройство зрения.
Изменения психики. Нервозность, повышенная раздражительность и другие изменения психики – всё, что многие из нас списывают на возрастное ухудшение характера, может быть тоже следствием нехватки витамина В12.
Пищеварительные проблемы. Характерны тошнота, рвота, снижение аппетита и веса, запоры. При гастроскопии выявляются атрофические изменения слизистой желудка.
Диагноз ставится как по результатам анализа жалоб пациента, сбора врачебного анамнеза и осмотра, так и на основании данных лабораторных анализов (крови и мочи). Для уточнения диагноза производится миелограмма (анализ костного мозга).
Укол вместо сырой печёнки
Специальная диета, заключающаяся в употреблении сырой печёнки, некогда стала первым лекарством от гибельной анемии. После употребления этого блюда все симптомы пропадали. Сегодня заболевание лечат уколами витамина В12. Первые 4–6 недель его вводят подкожно 1 раз в день по 200–500 мкг. Затем в течение трёх месяцев – раз в неделю, а потом переходят к инъекциям 2 раза в месяц (или приёму таблеток). Улучшение состояния, как правило, наступает после двух месяцев. Лечение должно сохраняться пожизненно.
Затем в течение трёх месяцев – раз в неделю, а потом переходят к инъекциям 2 раза в месяц (или приёму таблеток). Улучшение состояния, как правило, наступает после двух месяцев. Лечение должно сохраняться пожизненно.
Помимо введения витамина В12 комплексное лечение включает в себя устранение причины заболевания и нормализацию кроветворения. В частности, проводится лечение заболеваний пищеварительного тракта (при аутоиммунном поражении желудка назначаются глюкокортикостероиды). Обязательно назначается сбалансированный рацион питания, в котором должны присутствовать кисломолочные продукты, говядина, морепродукты, яйца.
Много витамина В12 содержат говяжья печень и щупальца осьминога. Меньше – свиная и куриная печёнка, скумбрия, сардины. Для усвоения нужна фолиевая кислота, ухудшают усвоение алкоголь, курение, приём некоторых антибиотиков и строгие диеты.
Смотрите также:
Hypervitaminosis B12 — a new marker and predictor of prognostically unfavorable diseases | Podzolkov
A high serum vitamin B12 level (hypercobalaminemia) is a underestimated anomaly. Clinically, it can be paradoxically accompanied by signs of deficiency, which are related to defects in tissue uptake of vitamin B12. The increase in the level of serum cobalamin occurs mainly in serious diseases that require early diagnosis: hemoblastosis, liver and kidney diseases, etc. This review presents data on the metabolism of vitamin B12 and the potential significance of increasing its level as a marker for the early diagnosis of these diseases.
ДИ — доверительный интервал МДС — миелодиспластический синдром ОШ — отношение шансов ТК — транскобаламины Введение Значимость высокого уровня кобаламина (витамина B12) в сыворотке крови длительное время недооценивалась, так как с момента его открытия большинство фундаментальных и клинических исследований посвящалось изучению витаминодефицита. Однако рост интереса практикующих врачей к роли витамина В12 в патогенезе различных заболеваний привел к формированию спроса на биологическое определение витамина, в ходе которого получены данные о достаточно высокой доле пациентов с высоким уровнем кобаламина в крови [1]. Также установлено, что этиология высокого уровня кобаламина в сыворотке крови обусловлена главным образом наличием потенциально жизнеугрожающих заболеваний, ранняя диагностика которых зачастую является определяющим прогностическим фактором [1-3]. Несмотря на получение этих данных, до настоящего времени не разработан алгоритм диагностики заболеваний, сопровождающихся высоким уровнем витамина В12. Эпидемиология нарушений обмена кобаламина Нормальные значения уровня витамина В12 соответствуют 190-950 пг/мл. Повышенным считается уровень витамина В12, превышающий верхнюю границу биологической нормы (>950 пг/мл, или 701 пмоль/л) [1]. Эпидемиологические данные о распространенности частоты гипо- и гипервитаминоза В12 в популяции весьма ограниченны, а исследования по изучению распространенности изменений уровня витамина В12 в российской популяции не проводились. Значимая популяционная частота высокого уровня кобаламина в сыворотке крови впервые представлена в опубликованном в 2009 г. ретроспективном исследовании T. Deneuville и соавт., включавшем 3702 госпитализированных больных, среди которых гипервитаминоз витамина B12 обнаружен в 12% случаев, тогда как дефицит наблюдался только в 10% случаев [3]. В рамках французского исследования, проведенного R. Carmel и соавт., распространенность гиперкобаламинемии >664 пмоль/л среди госпитализированных больных составила 14% [4]. В последнем эпидемиологическом исследовании J.F.B. Arendt и соавт. (2012) у 12 070 стационарных больных распространенность «высокого» (600-1000 пмоль) уровня кобаламина составила 13%, а «очень высокого» (>1000 пмоль/л) — 7% случаев [2]. В рамках многоцентрового европейского исследования BDOSE частота выявления повышения уровня витамина В12 в сыворотке крови в среднем составила 18% [5].
Однако рост интереса практикующих врачей к роли витамина В12 в патогенезе различных заболеваний привел к формированию спроса на биологическое определение витамина, в ходе которого получены данные о достаточно высокой доле пациентов с высоким уровнем кобаламина в крови [1]. Также установлено, что этиология высокого уровня кобаламина в сыворотке крови обусловлена главным образом наличием потенциально жизнеугрожающих заболеваний, ранняя диагностика которых зачастую является определяющим прогностическим фактором [1-3]. Несмотря на получение этих данных, до настоящего времени не разработан алгоритм диагностики заболеваний, сопровождающихся высоким уровнем витамина В12. Эпидемиология нарушений обмена кобаламина Нормальные значения уровня витамина В12 соответствуют 190-950 пг/мл. Повышенным считается уровень витамина В12, превышающий верхнюю границу биологической нормы (>950 пг/мл, или 701 пмоль/л) [1]. Эпидемиологические данные о распространенности частоты гипо- и гипервитаминоза В12 в популяции весьма ограниченны, а исследования по изучению распространенности изменений уровня витамина В12 в российской популяции не проводились. Значимая популяционная частота высокого уровня кобаламина в сыворотке крови впервые представлена в опубликованном в 2009 г. ретроспективном исследовании T. Deneuville и соавт., включавшем 3702 госпитализированных больных, среди которых гипервитаминоз витамина B12 обнаружен в 12% случаев, тогда как дефицит наблюдался только в 10% случаев [3]. В рамках французского исследования, проведенного R. Carmel и соавт., распространенность гиперкобаламинемии >664 пмоль/л среди госпитализированных больных составила 14% [4]. В последнем эпидемиологическом исследовании J.F.B. Arendt и соавт. (2012) у 12 070 стационарных больных распространенность «высокого» (600-1000 пмоль) уровня кобаламина составила 13%, а «очень высокого» (>1000 пмоль/л) — 7% случаев [2]. В рамках многоцентрового европейского исследования BDOSE частота выявления повышения уровня витамина В12 в сыворотке крови в среднем составила 18% [5]. В связи с отсутствием данных, касающихся отечественной популяции, в нашей стране требуется проведение масштабных исследований по оценке фактической частоты выявления и распространенности этой патологии в общей популяции, а также в группах высокого риска возникновения гиперкобаламинемии. Обмен витамина В12 В организм человека витамин B12 поступает из экзогенных источников преимущественно животного происхождения. Исследования второй половины ХХ в. показали, что синтезировать витамин B12 не способны ни грибы, ни растения, ни животные, а только пропионовокислые бактерии, археи и некоторые простейшие, которые имеют необходимые для такого синтеза ферменты [6]. Тем не менее многие пищевые продукты, получаемые благодаря симбиозу бактерий, служат природным источником витамина B12. Изначально суточная потребность в витамине, поступающем посредством сбалансированного питания, оценивалась на уровне 2-3 мкг, при этом концентрация витамина В12 достигает нижней границы принятой нормы в 190-200 пг/мл [7]. Однако согласно результатам более поздних исследований лишь уровень витамина B12 выше 400 пг/мл (т. е. вдвое выше принятой нижней границы нормы) способствует уменьшению образования микроядер в лимфоцитах периферической крови [7, 8], а также препятствует возникновению ошибки включения урацила в ДНК лейкоцитов [9], что требует пересмотра рекомендованной суточной дозы витамина B12. По мнению L.R. Solomon, лишь увеличение рекомендованной дозы витамина В12 до 7 мкг/сут приведет к достижению его уровня в плазме крови 400 пг/мл, что будет достаточным для поддержания геномной стабильности [10]. Витамин B12 открыт двумя независимыми группами ученых под руководством G.H. Whipple (1920) и G.R. Minot (1926) как антианемический фактор, содержащийся в печени и способный стимулировать гемопоэз у больных с пернициозной («злокачественной») анемией [11, 12]. Признанием важности данного открытия для медицинской науки стало присуждение этим научным группам Нобелевской премии в 1934 г. Начиная с 1930-х годов предпринимались попытки получения антианемического фактора в чистом виде, однако это удалось лишь в 1947 г.
В связи с отсутствием данных, касающихся отечественной популяции, в нашей стране требуется проведение масштабных исследований по оценке фактической частоты выявления и распространенности этой патологии в общей популяции, а также в группах высокого риска возникновения гиперкобаламинемии. Обмен витамина В12 В организм человека витамин B12 поступает из экзогенных источников преимущественно животного происхождения. Исследования второй половины ХХ в. показали, что синтезировать витамин B12 не способны ни грибы, ни растения, ни животные, а только пропионовокислые бактерии, археи и некоторые простейшие, которые имеют необходимые для такого синтеза ферменты [6]. Тем не менее многие пищевые продукты, получаемые благодаря симбиозу бактерий, служат природным источником витамина B12. Изначально суточная потребность в витамине, поступающем посредством сбалансированного питания, оценивалась на уровне 2-3 мкг, при этом концентрация витамина В12 достигает нижней границы принятой нормы в 190-200 пг/мл [7]. Однако согласно результатам более поздних исследований лишь уровень витамина B12 выше 400 пг/мл (т. е. вдвое выше принятой нижней границы нормы) способствует уменьшению образования микроядер в лимфоцитах периферической крови [7, 8], а также препятствует возникновению ошибки включения урацила в ДНК лейкоцитов [9], что требует пересмотра рекомендованной суточной дозы витамина B12. По мнению L.R. Solomon, лишь увеличение рекомендованной дозы витамина В12 до 7 мкг/сут приведет к достижению его уровня в плазме крови 400 пг/мл, что будет достаточным для поддержания геномной стабильности [10]. Витамин B12 открыт двумя независимыми группами ученых под руководством G.H. Whipple (1920) и G.R. Minot (1926) как антианемический фактор, содержащийся в печени и способный стимулировать гемопоэз у больных с пернициозной («злокачественной») анемией [11, 12]. Признанием важности данного открытия для медицинской науки стало присуждение этим научным группам Нобелевской премии в 1934 г. Начиная с 1930-х годов предпринимались попытки получения антианемического фактора в чистом виде, однако это удалось лишь в 1947 г. [13, 14]. Параллельно с этим W.B. Castle и соавт. открыта роль желудочного сока в запуске ретикулоцитоза у больных злокачественной анемией [15, 16], а затем выделен непосредственный субстрат, в отсутствие которого не происходит всасывания витамина В12, названный впоследствии внутренним фактором Кастла для разграничения с внешним фактором (собственно витамином B12) [17]. Характерно, что другие витамины, которым для обеспечения всасывания требуется специальный фактор, кроме витамина B12, не известны [15]. Всасывание комплекса «витамин B12 — внутренний фактор» происходит в терминальном отделе подвздошной кишки, посредством связи с рецептором, названным кубилином [18], обеспечивающим также эндоцитоз аполипопротеина A1 и липопротеинов высокой плотности [19]. Позднее установлено, что кубилин состоит из двух субъединиц, названных «кубам» (сubam) и «амнионлес» (amnionles), кодируемых разными генами, мутации в которых ведут к нарушению всасывания витамина B12 [20]. Это состояние часто сопровождается протеинурией, поскольку субъединица сubam также опосредует канальцевую реабсорбцию белка из первичной мочи [21]. Таким образом, ахлоргидрия, дефицит внутреннего фактора Кастла и нарушение функции рецептора кубилина — это факторы, предрасполагающие к развитию дефицита витамина B12 [22]. Для транспорта витамина в крови, а также его потребления тканями и печенью требуется присутствие транскобаламинов (ТК) [23, 24] — белков связывания, среди котроых выделяют три типа. ТК I типа (ТК I) и III типа (ТК III) обеспечивают связывание приблизительно 80% циркулирующего витамина B12; однако ТК II типа (ТК II) играет преобладающую роль в ключевых процессах потребления витамина B12 тканями и печенью. В большинстве случаев патологически высокий уровень кобаламина в сыворотке крови влечет за собой качественное и/или количественное нарушение ТК [25]. ТК I и III — сывороточные белки с молекулярной массой 60-70 кДа, которые называют также связующими R-белками или кобалофилинами, — обнаруживаются в различных тканях и биологических жидкостях [25-27], в том числе в составе вторичных нейтрофильных гранул гранулоцитов, обладающих, как предполагается, антибактериальной активностью, что объясняет повышение их уровня при миелопролиферативных нарушениях [1, 28].
[13, 14]. Параллельно с этим W.B. Castle и соавт. открыта роль желудочного сока в запуске ретикулоцитоза у больных злокачественной анемией [15, 16], а затем выделен непосредственный субстрат, в отсутствие которого не происходит всасывания витамина В12, названный впоследствии внутренним фактором Кастла для разграничения с внешним фактором (собственно витамином B12) [17]. Характерно, что другие витамины, которым для обеспечения всасывания требуется специальный фактор, кроме витамина B12, не известны [15]. Всасывание комплекса «витамин B12 — внутренний фактор» происходит в терминальном отделе подвздошной кишки, посредством связи с рецептором, названным кубилином [18], обеспечивающим также эндоцитоз аполипопротеина A1 и липопротеинов высокой плотности [19]. Позднее установлено, что кубилин состоит из двух субъединиц, названных «кубам» (сubam) и «амнионлес» (amnionles), кодируемых разными генами, мутации в которых ведут к нарушению всасывания витамина B12 [20]. Это состояние часто сопровождается протеинурией, поскольку субъединица сubam также опосредует канальцевую реабсорбцию белка из первичной мочи [21]. Таким образом, ахлоргидрия, дефицит внутреннего фактора Кастла и нарушение функции рецептора кубилина — это факторы, предрасполагающие к развитию дефицита витамина B12 [22]. Для транспорта витамина в крови, а также его потребления тканями и печенью требуется присутствие транскобаламинов (ТК) [23, 24] — белков связывания, среди котроых выделяют три типа. ТК I типа (ТК I) и III типа (ТК III) обеспечивают связывание приблизительно 80% циркулирующего витамина B12; однако ТК II типа (ТК II) играет преобладающую роль в ключевых процессах потребления витамина B12 тканями и печенью. В большинстве случаев патологически высокий уровень кобаламина в сыворотке крови влечет за собой качественное и/или количественное нарушение ТК [25]. ТК I и III — сывороточные белки с молекулярной массой 60-70 кДа, которые называют также связующими R-белками или кобалофилинами, — обнаруживаются в различных тканях и биологических жидкостях [25-27], в том числе в составе вторичных нейтрофильных гранул гранулоцитов, обладающих, как предполагается, антибактериальной активностью, что объясняет повышение их уровня при миелопролиферативных нарушениях [1, 28]. ТК II — белок с молекулярной массой 42-47 кДа, который обеспечивает доставку витамина B12 к клеткам и тканям. Несмотря на то что он переносит только 20% циркулирующих кобаламинов, именно его содержание определяется лабораторно как активная фракция сывороточного витамина B12 [28, 29]. Выработка ТК осуществляется главным образом гепатоцитами, а также вторичными эндотелиальными, моноцитарными клетками и клетками кишечника [1, 28, 29]. При врожденном дефиците ТК II наблюдаются тяжелые нарушения, в том числе пороки развития нервной системы, а также гематологические расстройства по типу панцитопении и агенеративной мегалобластной анемии [1, 23]. Определение уровня витамина B12 и диагностика его дефицита Как уже сказано, около четверти присутствующего в сыворотке крови витамина B12 связывается ТК, тогда как оставшаяся часть связывается другими белками [27, 28]. При этом определяемый автоматизированным оборудованием витамин В12 должен освободиться от белка и преобразоваться в кобаламин. Современные методики определения витамина В12 основаны, главным образом, на конкуренции за внутренний фактор Кастла между витамином B12 с радиоактивной меткой и кобаламином в образце сыворотки крови [22, 30]. К сожалению, ни специфические клинические симптомы, ни точные значения уровня витамина B12 в сыворотке крови не позволяют напрямую диагностировать причину дефицита. Изначально считалось, что специфическим симптомом дефицита витамина B12 является мегалобластная анемия, однако после восьми десятилетий колебаний во мнениях только в 1988 г. широкое признание получил тот факт, что единственным клиническим симптомом дефицита витамина B12 может быть неврологическая дисфункция. Несмотря на то что при дефиците кобаламина описано несколько типов неврологических нарушений в виде подострой комбинированной дегенерации задних и боковых канатиков спинного мозга (фуникулярный миелоз), сенсомоторной полиневропатии, невропатии зрительного нерва, а также различные психические и когнитивные расстройства, классическим неврологическим проявлением гиповитаминоза В12 считается фуникулярный миелоз, прогрессирующий от парестезий в ногах и снижения вибрационной чувствительности до спастического пара- или тетрапареза [30].
ТК II — белок с молекулярной массой 42-47 кДа, который обеспечивает доставку витамина B12 к клеткам и тканям. Несмотря на то что он переносит только 20% циркулирующих кобаламинов, именно его содержание определяется лабораторно как активная фракция сывороточного витамина B12 [28, 29]. Выработка ТК осуществляется главным образом гепатоцитами, а также вторичными эндотелиальными, моноцитарными клетками и клетками кишечника [1, 28, 29]. При врожденном дефиците ТК II наблюдаются тяжелые нарушения, в том числе пороки развития нервной системы, а также гематологические расстройства по типу панцитопении и агенеративной мегалобластной анемии [1, 23]. Определение уровня витамина B12 и диагностика его дефицита Как уже сказано, около четверти присутствующего в сыворотке крови витамина B12 связывается ТК, тогда как оставшаяся часть связывается другими белками [27, 28]. При этом определяемый автоматизированным оборудованием витамин В12 должен освободиться от белка и преобразоваться в кобаламин. Современные методики определения витамина В12 основаны, главным образом, на конкуренции за внутренний фактор Кастла между витамином B12 с радиоактивной меткой и кобаламином в образце сыворотки крови [22, 30]. К сожалению, ни специфические клинические симптомы, ни точные значения уровня витамина B12 в сыворотке крови не позволяют напрямую диагностировать причину дефицита. Изначально считалось, что специфическим симптомом дефицита витамина B12 является мегалобластная анемия, однако после восьми десятилетий колебаний во мнениях только в 1988 г. широкое признание получил тот факт, что единственным клиническим симптомом дефицита витамина B12 может быть неврологическая дисфункция. Несмотря на то что при дефиците кобаламина описано несколько типов неврологических нарушений в виде подострой комбинированной дегенерации задних и боковых канатиков спинного мозга (фуникулярный миелоз), сенсомоторной полиневропатии, невропатии зрительного нерва, а также различные психические и когнитивные расстройства, классическим неврологическим проявлением гиповитаминоза В12 считается фуникулярный миелоз, прогрессирующий от парестезий в ногах и снижения вибрационной чувствительности до спастического пара- или тетрапареза [30]. Отсутствие четкой связи между уровнем витамина B12 в сыворотке крови и его дефицитом привело к внедрению практики измерения уровня метаболитов как показателей функционального дефицита. Для этих целей используют метилмалоновую кислоту и гомоцистеин [31]. Функциональный дефицит витамина B12 ведет к повышению уровня метилмалоновой кислоты, поскольку этот витамин играет важную роль в преобразовании метилмалонил-кофермента А в сукцинил-кофермент А при участии фермента мутазы. Повышение уровня гомоцистеина обусловлено тем, что метионинсинтазе для преобразования гомоцистеина в метионин требуется метилкобаламин. Несмотря на развитие лабораторных методов диагностики, большинство специалистов сходятся во мнении, что «золотого стандарта» диагностики дефицита кобаламина по-прежнему не существует и оправданной является тактика пробного лечения при симптоматике, соответствующей клинической картине гиповитаминоза [32]. Следует учитывать и тот факт, что даже наличие высокого уровня кобаламина в сыворотке крови может сопровождаться его функциональным дефицитом [22, 32, 33]. Механизмы повышения уровня кобаламина в сыворотке крови Повышение уровня кобаламина в сыворотке крови обусловлено тремя основными патофизиологическими механизмами, которые возникают под воздействием любых этиологических факторов и включают в себя (рис. 1): • непосредственное повышение уровня витамина B12 в плазме крови в результате избыточного потребления или применения с медицинской целью; • непосредственное повышение уровня витамина B12 в плазме крови в результате высвобождения из внутреннего депо; • повышение уровня ТК в результате избыточной выработки или нарушения выведения, а также количественный дефицит или отсутствие у ТК аффинности к витамину B12 [1, 23]. Патологические последствия повышения уровня кобаламина в сыворотке крови Витамин B12 — кофермент, присутствующий во многих клетках организма и участвующий главным образом в реакциях синтеза ДНК и метионина из гомоцистеина. Этот факт объясняет, с одной стороны, разнообразие гематологических, неврологических и эпителиальных клинических проявлений при дефиците витамина B12, а с другой — накопление субстратов ферментативных реакций, а именно метилмалоновой кислоты и гомоцистеина [1, 33, 34].
Отсутствие четкой связи между уровнем витамина B12 в сыворотке крови и его дефицитом привело к внедрению практики измерения уровня метаболитов как показателей функционального дефицита. Для этих целей используют метилмалоновую кислоту и гомоцистеин [31]. Функциональный дефицит витамина B12 ведет к повышению уровня метилмалоновой кислоты, поскольку этот витамин играет важную роль в преобразовании метилмалонил-кофермента А в сукцинил-кофермент А при участии фермента мутазы. Повышение уровня гомоцистеина обусловлено тем, что метионинсинтазе для преобразования гомоцистеина в метионин требуется метилкобаламин. Несмотря на развитие лабораторных методов диагностики, большинство специалистов сходятся во мнении, что «золотого стандарта» диагностики дефицита кобаламина по-прежнему не существует и оправданной является тактика пробного лечения при симптоматике, соответствующей клинической картине гиповитаминоза [32]. Следует учитывать и тот факт, что даже наличие высокого уровня кобаламина в сыворотке крови может сопровождаться его функциональным дефицитом [22, 32, 33]. Механизмы повышения уровня кобаламина в сыворотке крови Повышение уровня кобаламина в сыворотке крови обусловлено тремя основными патофизиологическими механизмами, которые возникают под воздействием любых этиологических факторов и включают в себя (рис. 1): • непосредственное повышение уровня витамина B12 в плазме крови в результате избыточного потребления или применения с медицинской целью; • непосредственное повышение уровня витамина B12 в плазме крови в результате высвобождения из внутреннего депо; • повышение уровня ТК в результате избыточной выработки или нарушения выведения, а также количественный дефицит или отсутствие у ТК аффинности к витамину B12 [1, 23]. Патологические последствия повышения уровня кобаламина в сыворотке крови Витамин B12 — кофермент, присутствующий во многих клетках организма и участвующий главным образом в реакциях синтеза ДНК и метионина из гомоцистеина. Этот факт объясняет, с одной стороны, разнообразие гематологических, неврологических и эпителиальных клинических проявлений при дефиците витамина B12, а с другой — накопление субстратов ферментативных реакций, а именно метилмалоновой кислоты и гомоцистеина [1, 33, 34]. В отличие от дефицита витамина B12, патофизиология и клинические последствия повышения уровня кобаламина в сыворотке крови по-прежнему крайне мало изучены. Тем не менее в настоящее время принято считать, что повышение уровня витамина B12 в плазме крови может свидетельствовать о наличии функционального дефицита с клиническими последствиями, парадоксальным образом сходными с клиническими последствиями дефицита витамина B12 [22, 31, 33]. Действительно, повышение степени связывания витамина B12 транскобаламинами на фоне повышения их уровня в плазме крови (особенно ТК I и III, составляющими большую часть) ведет к потенциальному уменьшению степени связывания с ТК II и, как следствие, изменяет способ доставки витамина В12 к клеткам. Таким образом, даже при нормальном уровне витамина В12 может наблюдаться его функциональный дефицит с повышением уровня гомоцистеина и/или метилмалоновой кислоты [1, 31-34]. Кроме этих механизмов, функциональный дефицит может также развиться в результате неспособности поврежденной печени поглощать кобаламин из сыворотки крови, а также быть результатом «утечки» витамина B12 из поврежденной ткани печени в плазму крови [34-36]. Этиология повышения уровня кобаламина в сыворотке крови Простое повышение витамина B12 в плазме крови, не сопровождающееся клиническими симптомами (кроме потенциального функционального дефицита), следует более точно обозначать как гипервитаминемию B12, а не как гипервитаминоз B12 [22]. С практической точки зрения, при выявлении высокого уровня кобаламина в сыворотке крови в первую очередь следует искать причину этого состояния, так как этиотропное лечение часто приводит к нормализации его уровня [10, 22, 23]. Кроме того, отмечается значимая связь между повышением концентрации витамина В12 и развитием злокачественных гемопатий и солидных опухолей [1, 22, 37-41]. В исследованиях по изучению роли злокачественных новообразований в качестве причин гиперкобаламинемии подчеркивалось, что о наличии большинства диагностированных новообразований ранее не было известно и они находились на неметастатической стадии [1, 37]. В упомянутом выше исследовании J.F.B. Arendt и соавт. (2012) отмечалась статистически значимая связь между высоким уровнем кобаламина и наличием алкоголизма [отношение шансов (ОШ) 5,74; 95% доверительный интервал (ДИ) 2,76-11,96], заболеваниями печени (ОШ 8,53; 95% ДИ 3,59-20,23), а также злокачественными новообразованиями (ОШ 5,48; 95% ДИ 2,85-10,55) [2]. В рамках этого исследования повышенный уровень витамина B12 отмечался также у пациентов с заболеваниями почек, аутоиммунными и бронхолегочными заболеваниями [2]. В условиях клинической практики у пациента с предустановленным гипервитаминозом витамина В12 необходимо провести обследование, объем которого, с учетом описанных ранее патофизиологических механизмов, должен определяться онкологической настороженностью [22]. 1. Потребление избыточного количества витамина B12 Избыточное потребление витамина B12 при приеме внутрь обычно относительно несложно выявить по данным анамнеза [1]. Кроме того, длительное парентеральное применение витамина B12 может привести к образованию аутоантител к ТК II, что ведет к снижению его клиренса [1, 42, 43]. Такая спровоцированная аутоиммунизация наблюдалась у 30% пациентов, получавших лечение по поводу злокачественной анемии [44]. Однако в условиях клинической практики экзогенное повышение уровня кобаламина в сыворотке крови наблюдалось, главным образом, в двух основных ситуациях: самостоятельный (не рекомендованный врачом) прием мультивитаминных комплексов с витамином B12, о чем пациент забывает упомянуть, и парентеральное применение витамина B12. В настоящее время в Европе терапию витамином В12 чаще всего назначают для лечения подтвержденного витаминодефицита, в то же время в нашей стране назначение поли- и мультивитаминных препаратов, содержащих витамин В12, является рутинным в комплексной терапии нейропатий и радикулопатий различной этиологии (наряду с нестероидными противовоспалительными средствами и периферическими миорелаксантами). При этом часто назначаются парентеральные витаминные комплексы, как правило, без предшествующего определения уровня витамина В12 в сыворотке крови. Следует отметить, что клинических ситуаций, в которых парентеральный способ введения цианокобаламина оказался бы предпочтителен, становится все меньше, и прием витамина внутрь рассматривается в настоящее время как эффективная и достаточная мера, в том числе при «злокачественной» анемии [33, 45]. Также важно подчеркнуть, что при сохранении высокого уровня кобаламина в сыворотке крови после завершения лечения анемии, вызванной дефицитом внутреннего фактора Касла, следует исключить новообразование желудка, относительный риск которого у пациентов с атрофическим гастритом в три раза выше [33]. Во всех случаях избыточное потребление цианокобаламина как причина его гипервитаминемии должно рассматриваться в качестве диагноза исключения [1, 22]. 2. Высокий уровень кобаламина в сыворотке крови и солидные новообразования Связь между избыточным уровнем витамина В12 в сыворотке крови и развитием солидных новообразований впервые описана R. Carmel и соавт. в 1975 г. [32]. Результаты их наблюдений в последующем подтверждены несколькими исследованиями, в которых также предприняты попытки построения диагностических алгоритмов и определения прогнозов у больных с гипервитаминозом В12 [22, 37, 43, 44]. Так, установлено, что чаще всего значительное повышение уровня кобаламина отмечается при таких новообразованиях, как гепатоцеллюлярная карцинома и вторичные опухоли печени, рак молочной железы, рак толстой кишки, рак желудка и опухоли поджелудочной железы [37-41, 46, 47]. В исследовании S. Fremont и соавт. примерно у половины пациентов с гепатоцеллюлярной карциномой наблюдался высокий уровень кобаламина в сыворотке крови [40]. Среди пациентов с метастазами в печень высокий уровень витамина В12 диагностирован у 30-40%, при этом степень повышения уровня витамина B12 в сыворотке оказалась максимально высокой [2, 23, 41]. Корреляция гипервитаминоза В12 с неопластическими процессами также показана в исследовании BDOSE, в котором у 73% пациентов с высоким уровнем кобаламина в сыворотке крови в анамнезе имелось неизвестное солидное злокачественное новообразование, которое в 80% случаев было неметастатическим [1, 5]. Результаты анализа ретроспективного исследования T. Deneuville и соавт. позволили рассчитать риски развития злокачественных новообразований у больных с повышенным уровнем витамина В12 по сравнению с его нормальным уровнем. Так, ОШ составило 1,8 для всех злокачественных новообразований, 2,9 — для метастатических опухолей, 3,3 — для гепатоцеллюлярной карциномы, 4,7 — для других первичных опухолей печени и 6,2 — для новообразований с метастазами в печень [3]. Некоторыми авторами описаны корреляции между размерами опухоли (преимущественно локализованными в печени) и степенью повышения уровня витамина B12, на основании чего сделано предположение о возможности использования уровня кобаламина в сыворотке крови в качестве маркера неблагоприятного прогноза таких новообразований [46, 47]. В другом исследовании повышенный уровень витамина В12 коррелировал с повышенным риском смерти у больных со злокачественными новообразованиями на стадии паллиативного лечения и в группе пациентов старческого возраста [1, 48]. Первичным механизмом повышения уровня кобаламина в сыворотке крови при опухолях печени является снижение печеночного клиренса комплекса «ТК — кобаламин» и повышение уровня ТК в плазме крови вследствие цитолиза гепатоцитов [1]. Считается, что снижение печеночного клиренса обусловлено нарушением внутрипеченочной микроциркуляции и уменьшением количества рецепторов к ТК на поверхности опухолевых клеток. При других видах солидных опухолей высокий уровень кобаламина связывают, главным образом, с избыточным синтезом ТК опухолью или повышением их уровня вследствие гиперлейкоцитоза [1, 23]. В качестве примера приводим собственное наблюдение больной Г., 84 лет, у которой при плановом обследовании через 5 мес после оперативного лечения по поводу узловой меланомы надлопаточной области (рТ4NхМ0) уровень витамина В12 в сыворотке крови достигал 2642 пг/мл, троекратно превышая верхнюю границу нормы, а в последующем диагностировано метастатическое поражение печени, подтвержденное впоследствии результатами аутопсии. 3. Высокий уровень кобаламина и гемобластозы Высокий уровень кобаламина в сыворотке крови — нарушение, часто наблюдаемое при гемобластозах, в частности при хроническом миеломоноцитарном лейкозе, первичном гиперэозинофильном синдроме, МДС и остром лейкозе, особенно промиелоцитарном [1, 39, 48-50]. Высокий уровень витамина В12 в сыворотке крови включен в число биологических параметров, с высокой степенью достоверности указывающих на наличие миелопролиферативного синдрома, в том числе хронического миелоидного лейкоза, первичной полицитемии (болезни Вакеза), тромбоцитемии и других форм миелофиброза [47-50] (см. таблицу). Повышение уровня кобаламина в сыворотке крови при миелоидной пролиферации обусловлено, главным образом, высвобождением ТК опухолевыми гранулоцитами и их предшественниками и наблюдается как при миелопролиферативных заболеваниях, так и при вторичных формах нейтрофильного полинуклеоза [47-50]. В то же время случаи развития вторичной гиперэозинофилии с высоким уровнем кобаламина в сыворотке крови остаются изолированными и единичными, в связи с чем повышенную концентрацию витамина В12 потенциально можно использовать для разграничения первичного гиперэозинофильного синдрома миелопролиферативной этиологии и других причин эозинофилии [49]. Следует отметить, что лимфопролиферативные заболевания редко становятся причиной повышения уровня кобаламина в сыворотке крови, кроме случаев множественной миеломы, при которой может наблюдаться как гипер-, так и гиповитаминемия B12 [1]. Связь между уровнем витамина B12 выше 1275 пг/мл и наличием злокачественного гематологического заболевания, выявленная L. Chiche и соавт., оказалась настолько значимой, что авторами высказана рекомендация обследования пациентов с повышенным уровнем витамина В12, в первую очередь для исключения гемобластозов [1]. 4. Высокий уровень кобаламина и заболевания печени Важная роль печени в метаболизме кобаламина повышает вероятность того, что острые и хронические заболевания печени различной этиологии приведут к повышению уровня витамина В12 в сыворотке крови [36, 51]. Механизмы возникновения гипервитаминоза В12 различаются при острых заболеваниях печени, хронических заболеваниях печени и гепатоцеллюлярной карциноме, о которой шла речь выше. Так, в исследовании L. Chiche и соавт. из 65 пациентов с повышенным уровнем витамина В12 у 20 (31%) имелось заболевание печени неопухолевого генеза, при этом в 80% случаев оно имело хроническую форму и в 25% случаев находилось на стадии цирроза [1]. Аналогичные данные получены в работе T. Deneuville и соавт., доказавших наличие значимой связи между высоким уровнем кобаламина и наличием заболеваний печени (ОШ 4,3) [3]. Среди механизмов повышения уровня кобаламина в сыворотке крови, диагностируемого в 25-40% случаев острого гепатита, рассматривается как цитолитический синдром с избыточным высвобождением кобаламина из клеток, так и печеночно-клеточная недостаточность, сопровождающаяся снижением синтеза ТК II гепатоцитами [23, 36, 53]. При циррозе печени в качестве основных механизмов повышения уровня витамина В12 рассматриваются уменьшение потребления витамина B12 и комплекса «ТК-кобаламин» клетками печени и периферическими тканями [23, 52]. Считается, что степень повышения уровня кобаламина, иногда пятикратно превышающего верхнюю границу нормы, коррелирует со степенью тяжести цирроза [53]. Специфическим этиологическим фактором гипервитаминоза В12 при заболеваниях печени считаются алкогольные поражения печени, встречающиеся у 80% больных [1, 35, 52]. При алкогольных поражениях печени доказано повышение уровня ТК I и ТК III и снижение уровня ТК II, что приводит к нарушению поступления витамина B12 в ткани и сопровождается теми же клиническими проявлениями, что у истинного дефицита витамина [22, 53]. 5. Другие причины высокого уровня кобаламина в сыворотке крови Роль почек в метаболизме витамина B12 в настоящее время общепризнанна, но не до конца изучена. Зафиксированное при почечной недостаточности повышение уровня кобаламина обусловлено, как предполагается, нарушением клиренса ТК, а также увеличением количества рецепторов к ТК II на мембранах клеток — потребителей витамина В12 [3, 4, 23, 38, 54]. В литературе сообщается о единичных случаях выявления высокого уровня кобаламина в сыворотке крови различной этиологии. Эти случаи, в целом, связаны с образованием антител к ТК II, что ведет к снижению их клиренса вследствие образования иммунных комплексов [55] или к повышению уровня кобаламина в сыворотке крови вследствие синтеза аномальных белков, связывающих витамин B12 [56]. Сообщалось также о случаях выявления болезни Гоше, системной красной волчанки, ревматоидного артрита и болезни Стилла у больных с высоким уровнем кобаламина. Гипервитаминоз В12 при аутоиммунных и воспалительных заболеваниях может быть обусловлен повышением уровня ТК II в острой фазе воспаления [1, 55-58]. Этапы диагностического поиска при гипервитаминозе В12 В нашей стране отсутствуют исследования, посвященные изучению распространенности гипервитаминоза В12 как в популяции в целом, так и среди пациентов с различными нозологическими формами, а имеется лишь ограниченное количество работ, посвященных токсическим эффектам витамина В12 при его передозировке [59]. В связи с этим практические рекомендации для врачей, включающие различные инструментальные и детализированные лабораторные методы обследования на этапах диагностического поиска, до настоящего времени не разработаны. В иностранных источниках представлена тактика действий при выявлении высокого уровня кобаламина в сыворотке крови с учетом его потенциальных клинических последствий и наиболее распространенной этиологии [22, 60] (рис. 2). Лечебная тактика заключается в этиотропном лечении заболевания, приведшего к повышению уровня витамина В12, а при наличии его функционального дефицита — в витаминотерапии [22, 23]. Заключение Высокий уровень кобаламина — часто встречающееся нарушение, роль которого принято недооценивать. Это явление иногда может сопровождаться парадоксальными с клинической точки зрения признаками дефицита, отражающими наличие функционального дефицита, который обусловлен качественными нарушениями, связанными с дефектами в потреблении витамина B12 тканями и в его действии. Этиологическими факторами высокого уровня кобаламина чаще всего являются солидные новообразования, злокачественные гематологические новообразования и заболевания печени. Представляет научный и практический интерес разработка диагностических рекомендаций, а также изучение гипервитаминоза В12 у пациентов с вторичным поражением печени и почек, в том числе при полиорганной недостаточности. Авторы заявляют об отсутствии конфликта интересов.
В отличие от дефицита витамина B12, патофизиология и клинические последствия повышения уровня кобаламина в сыворотке крови по-прежнему крайне мало изучены. Тем не менее в настоящее время принято считать, что повышение уровня витамина B12 в плазме крови может свидетельствовать о наличии функционального дефицита с клиническими последствиями, парадоксальным образом сходными с клиническими последствиями дефицита витамина B12 [22, 31, 33]. Действительно, повышение степени связывания витамина B12 транскобаламинами на фоне повышения их уровня в плазме крови (особенно ТК I и III, составляющими большую часть) ведет к потенциальному уменьшению степени связывания с ТК II и, как следствие, изменяет способ доставки витамина В12 к клеткам. Таким образом, даже при нормальном уровне витамина В12 может наблюдаться его функциональный дефицит с повышением уровня гомоцистеина и/или метилмалоновой кислоты [1, 31-34]. Кроме этих механизмов, функциональный дефицит может также развиться в результате неспособности поврежденной печени поглощать кобаламин из сыворотки крови, а также быть результатом «утечки» витамина B12 из поврежденной ткани печени в плазму крови [34-36]. Этиология повышения уровня кобаламина в сыворотке крови Простое повышение витамина B12 в плазме крови, не сопровождающееся клиническими симптомами (кроме потенциального функционального дефицита), следует более точно обозначать как гипервитаминемию B12, а не как гипервитаминоз B12 [22]. С практической точки зрения, при выявлении высокого уровня кобаламина в сыворотке крови в первую очередь следует искать причину этого состояния, так как этиотропное лечение часто приводит к нормализации его уровня [10, 22, 23]. Кроме того, отмечается значимая связь между повышением концентрации витамина В12 и развитием злокачественных гемопатий и солидных опухолей [1, 22, 37-41]. В исследованиях по изучению роли злокачественных новообразований в качестве причин гиперкобаламинемии подчеркивалось, что о наличии большинства диагностированных новообразований ранее не было известно и они находились на неметастатической стадии [1, 37]. В упомянутом выше исследовании J.F.B. Arendt и соавт. (2012) отмечалась статистически значимая связь между высоким уровнем кобаламина и наличием алкоголизма [отношение шансов (ОШ) 5,74; 95% доверительный интервал (ДИ) 2,76-11,96], заболеваниями печени (ОШ 8,53; 95% ДИ 3,59-20,23), а также злокачественными новообразованиями (ОШ 5,48; 95% ДИ 2,85-10,55) [2]. В рамках этого исследования повышенный уровень витамина B12 отмечался также у пациентов с заболеваниями почек, аутоиммунными и бронхолегочными заболеваниями [2]. В условиях клинической практики у пациента с предустановленным гипервитаминозом витамина В12 необходимо провести обследование, объем которого, с учетом описанных ранее патофизиологических механизмов, должен определяться онкологической настороженностью [22]. 1. Потребление избыточного количества витамина B12 Избыточное потребление витамина B12 при приеме внутрь обычно относительно несложно выявить по данным анамнеза [1]. Кроме того, длительное парентеральное применение витамина B12 может привести к образованию аутоантител к ТК II, что ведет к снижению его клиренса [1, 42, 43]. Такая спровоцированная аутоиммунизация наблюдалась у 30% пациентов, получавших лечение по поводу злокачественной анемии [44]. Однако в условиях клинической практики экзогенное повышение уровня кобаламина в сыворотке крови наблюдалось, главным образом, в двух основных ситуациях: самостоятельный (не рекомендованный врачом) прием мультивитаминных комплексов с витамином B12, о чем пациент забывает упомянуть, и парентеральное применение витамина B12. В настоящее время в Европе терапию витамином В12 чаще всего назначают для лечения подтвержденного витаминодефицита, в то же время в нашей стране назначение поли- и мультивитаминных препаратов, содержащих витамин В12, является рутинным в комплексной терапии нейропатий и радикулопатий различной этиологии (наряду с нестероидными противовоспалительными средствами и периферическими миорелаксантами). При этом часто назначаются парентеральные витаминные комплексы, как правило, без предшествующего определения уровня витамина В12 в сыворотке крови. Следует отметить, что клинических ситуаций, в которых парентеральный способ введения цианокобаламина оказался бы предпочтителен, становится все меньше, и прием витамина внутрь рассматривается в настоящее время как эффективная и достаточная мера, в том числе при «злокачественной» анемии [33, 45]. Также важно подчеркнуть, что при сохранении высокого уровня кобаламина в сыворотке крови после завершения лечения анемии, вызванной дефицитом внутреннего фактора Касла, следует исключить новообразование желудка, относительный риск которого у пациентов с атрофическим гастритом в три раза выше [33]. Во всех случаях избыточное потребление цианокобаламина как причина его гипервитаминемии должно рассматриваться в качестве диагноза исключения [1, 22]. 2. Высокий уровень кобаламина в сыворотке крови и солидные новообразования Связь между избыточным уровнем витамина В12 в сыворотке крови и развитием солидных новообразований впервые описана R. Carmel и соавт. в 1975 г. [32]. Результаты их наблюдений в последующем подтверждены несколькими исследованиями, в которых также предприняты попытки построения диагностических алгоритмов и определения прогнозов у больных с гипервитаминозом В12 [22, 37, 43, 44]. Так, установлено, что чаще всего значительное повышение уровня кобаламина отмечается при таких новообразованиях, как гепатоцеллюлярная карцинома и вторичные опухоли печени, рак молочной железы, рак толстой кишки, рак желудка и опухоли поджелудочной железы [37-41, 46, 47]. В исследовании S. Fremont и соавт. примерно у половины пациентов с гепатоцеллюлярной карциномой наблюдался высокий уровень кобаламина в сыворотке крови [40]. Среди пациентов с метастазами в печень высокий уровень витамина В12 диагностирован у 30-40%, при этом степень повышения уровня витамина B12 в сыворотке оказалась максимально высокой [2, 23, 41]. Корреляция гипервитаминоза В12 с неопластическими процессами также показана в исследовании BDOSE, в котором у 73% пациентов с высоким уровнем кобаламина в сыворотке крови в анамнезе имелось неизвестное солидное злокачественное новообразование, которое в 80% случаев было неметастатическим [1, 5]. Результаты анализа ретроспективного исследования T. Deneuville и соавт. позволили рассчитать риски развития злокачественных новообразований у больных с повышенным уровнем витамина В12 по сравнению с его нормальным уровнем. Так, ОШ составило 1,8 для всех злокачественных новообразований, 2,9 — для метастатических опухолей, 3,3 — для гепатоцеллюлярной карциномы, 4,7 — для других первичных опухолей печени и 6,2 — для новообразований с метастазами в печень [3]. Некоторыми авторами описаны корреляции между размерами опухоли (преимущественно локализованными в печени) и степенью повышения уровня витамина B12, на основании чего сделано предположение о возможности использования уровня кобаламина в сыворотке крови в качестве маркера неблагоприятного прогноза таких новообразований [46, 47]. В другом исследовании повышенный уровень витамина В12 коррелировал с повышенным риском смерти у больных со злокачественными новообразованиями на стадии паллиативного лечения и в группе пациентов старческого возраста [1, 48]. Первичным механизмом повышения уровня кобаламина в сыворотке крови при опухолях печени является снижение печеночного клиренса комплекса «ТК — кобаламин» и повышение уровня ТК в плазме крови вследствие цитолиза гепатоцитов [1]. Считается, что снижение печеночного клиренса обусловлено нарушением внутрипеченочной микроциркуляции и уменьшением количества рецепторов к ТК на поверхности опухолевых клеток. При других видах солидных опухолей высокий уровень кобаламина связывают, главным образом, с избыточным синтезом ТК опухолью или повышением их уровня вследствие гиперлейкоцитоза [1, 23]. В качестве примера приводим собственное наблюдение больной Г., 84 лет, у которой при плановом обследовании через 5 мес после оперативного лечения по поводу узловой меланомы надлопаточной области (рТ4NхМ0) уровень витамина В12 в сыворотке крови достигал 2642 пг/мл, троекратно превышая верхнюю границу нормы, а в последующем диагностировано метастатическое поражение печени, подтвержденное впоследствии результатами аутопсии. 3. Высокий уровень кобаламина и гемобластозы Высокий уровень кобаламина в сыворотке крови — нарушение, часто наблюдаемое при гемобластозах, в частности при хроническом миеломоноцитарном лейкозе, первичном гиперэозинофильном синдроме, МДС и остром лейкозе, особенно промиелоцитарном [1, 39, 48-50]. Высокий уровень витамина В12 в сыворотке крови включен в число биологических параметров, с высокой степенью достоверности указывающих на наличие миелопролиферативного синдрома, в том числе хронического миелоидного лейкоза, первичной полицитемии (болезни Вакеза), тромбоцитемии и других форм миелофиброза [47-50] (см. таблицу). Повышение уровня кобаламина в сыворотке крови при миелоидной пролиферации обусловлено, главным образом, высвобождением ТК опухолевыми гранулоцитами и их предшественниками и наблюдается как при миелопролиферативных заболеваниях, так и при вторичных формах нейтрофильного полинуклеоза [47-50]. В то же время случаи развития вторичной гиперэозинофилии с высоким уровнем кобаламина в сыворотке крови остаются изолированными и единичными, в связи с чем повышенную концентрацию витамина В12 потенциально можно использовать для разграничения первичного гиперэозинофильного синдрома миелопролиферативной этиологии и других причин эозинофилии [49]. Следует отметить, что лимфопролиферативные заболевания редко становятся причиной повышения уровня кобаламина в сыворотке крови, кроме случаев множественной миеломы, при которой может наблюдаться как гипер-, так и гиповитаминемия B12 [1]. Связь между уровнем витамина B12 выше 1275 пг/мл и наличием злокачественного гематологического заболевания, выявленная L. Chiche и соавт., оказалась настолько значимой, что авторами высказана рекомендация обследования пациентов с повышенным уровнем витамина В12, в первую очередь для исключения гемобластозов [1]. 4. Высокий уровень кобаламина и заболевания печени Важная роль печени в метаболизме кобаламина повышает вероятность того, что острые и хронические заболевания печени различной этиологии приведут к повышению уровня витамина В12 в сыворотке крови [36, 51]. Механизмы возникновения гипервитаминоза В12 различаются при острых заболеваниях печени, хронических заболеваниях печени и гепатоцеллюлярной карциноме, о которой шла речь выше. Так, в исследовании L. Chiche и соавт. из 65 пациентов с повышенным уровнем витамина В12 у 20 (31%) имелось заболевание печени неопухолевого генеза, при этом в 80% случаев оно имело хроническую форму и в 25% случаев находилось на стадии цирроза [1]. Аналогичные данные получены в работе T. Deneuville и соавт., доказавших наличие значимой связи между высоким уровнем кобаламина и наличием заболеваний печени (ОШ 4,3) [3]. Среди механизмов повышения уровня кобаламина в сыворотке крови, диагностируемого в 25-40% случаев острого гепатита, рассматривается как цитолитический синдром с избыточным высвобождением кобаламина из клеток, так и печеночно-клеточная недостаточность, сопровождающаяся снижением синтеза ТК II гепатоцитами [23, 36, 53]. При циррозе печени в качестве основных механизмов повышения уровня витамина В12 рассматриваются уменьшение потребления витамина B12 и комплекса «ТК-кобаламин» клетками печени и периферическими тканями [23, 52]. Считается, что степень повышения уровня кобаламина, иногда пятикратно превышающего верхнюю границу нормы, коррелирует со степенью тяжести цирроза [53]. Специфическим этиологическим фактором гипервитаминоза В12 при заболеваниях печени считаются алкогольные поражения печени, встречающиеся у 80% больных [1, 35, 52]. При алкогольных поражениях печени доказано повышение уровня ТК I и ТК III и снижение уровня ТК II, что приводит к нарушению поступления витамина B12 в ткани и сопровождается теми же клиническими проявлениями, что у истинного дефицита витамина [22, 53]. 5. Другие причины высокого уровня кобаламина в сыворотке крови Роль почек в метаболизме витамина B12 в настоящее время общепризнанна, но не до конца изучена. Зафиксированное при почечной недостаточности повышение уровня кобаламина обусловлено, как предполагается, нарушением клиренса ТК, а также увеличением количества рецепторов к ТК II на мембранах клеток — потребителей витамина В12 [3, 4, 23, 38, 54]. В литературе сообщается о единичных случаях выявления высокого уровня кобаламина в сыворотке крови различной этиологии. Эти случаи, в целом, связаны с образованием антител к ТК II, что ведет к снижению их клиренса вследствие образования иммунных комплексов [55] или к повышению уровня кобаламина в сыворотке крови вследствие синтеза аномальных белков, связывающих витамин B12 [56]. Сообщалось также о случаях выявления болезни Гоше, системной красной волчанки, ревматоидного артрита и болезни Стилла у больных с высоким уровнем кобаламина. Гипервитаминоз В12 при аутоиммунных и воспалительных заболеваниях может быть обусловлен повышением уровня ТК II в острой фазе воспаления [1, 55-58]. Этапы диагностического поиска при гипервитаминозе В12 В нашей стране отсутствуют исследования, посвященные изучению распространенности гипервитаминоза В12 как в популяции в целом, так и среди пациентов с различными нозологическими формами, а имеется лишь ограниченное количество работ, посвященных токсическим эффектам витамина В12 при его передозировке [59]. В связи с этим практические рекомендации для врачей, включающие различные инструментальные и детализированные лабораторные методы обследования на этапах диагностического поиска, до настоящего времени не разработаны. В иностранных источниках представлена тактика действий при выявлении высокого уровня кобаламина в сыворотке крови с учетом его потенциальных клинических последствий и наиболее распространенной этиологии [22, 60] (рис. 2). Лечебная тактика заключается в этиотропном лечении заболевания, приведшего к повышению уровня витамина В12, а при наличии его функционального дефицита — в витаминотерапии [22, 23]. Заключение Высокий уровень кобаламина — часто встречающееся нарушение, роль которого принято недооценивать. Это явление иногда может сопровождаться парадоксальными с клинической точки зрения признаками дефицита, отражающими наличие функционального дефицита, который обусловлен качественными нарушениями, связанными с дефектами в потреблении витамина B12 тканями и в его действии. Этиологическими факторами высокого уровня кобаламина чаще всего являются солидные новообразования, злокачественные гематологические новообразования и заболевания печени. Представляет научный и практический интерес разработка диагностических рекомендаций, а также изучение гипервитаминоза В12 у пациентов с вторичным поражением печени и почек, в том числе при полиорганной недостаточности. Авторы заявляют об отсутствии конфликта интересов.
V I Podzolkov
Sechenov First Moscow State Medical University (Sechenov University)
Moscow, Russia
N A Dragomiretskaya
Sechenov First Moscow State Medical University (Sechenov University)
Email: [email protected]
Moscow, Russia
O Ts Dambaeva
Sechenov First Moscow State Medical University (Sechenov University)
Moscow, Russia
S T Auvinen
Sechenov First Moscow State Medical University (Sechenov University)
Moscow, Russia
I D Medvedev
Sechenov First Moscow State Medical University (Sechenov University)
Moscow, Russia
- Chiche L, Jean R, Romain F, Roux F, et al. Implications cliniques de la decouverte d’une hypervitaminemie B12 en medecine interne. Rev Med Interne. 2008;29:187-94. doi: 10.1016/j.revmed.2007.07.007
- Arendt J.F.B, Nexo E. Cobalamin related parameters and disease patterns in patients with increased serum cobalamin levels. PLoS ONE. 2012;9:e45979. doi: 10.1371/journal.pone.0045979
- Deneuville T, Mario N, Tiev K.P, Toledano C, Josselin-Mahr L, Gain M, et al. Concentration plasmatique elevee de la vitamin B12: un indicateur des maladies hepatiquesou tumorales? Rev Med Interne. 2009;30(Suppl. 2):S73. doi: 10.1016/j.revmed.2012.10.006
- Carmel R, Vasireddy H, Aurangzeb I, George K. High serum cobalamin levels in the clinical setting — clinical associations and holo — transcobalamin changes. Clin Lab Haematol. 2001;23:365-71. doi: 10.1046/j.1365-2257.2001.00134.x
- Chiche L, Mancini J, Arlet J.B, investigateurs. De l’etude BDOSE. Hypervitamineґmies B12 en medecine interne: resultats de l’etude BDOSE. Rev Med Interne. 2009;30(Suppl. 4):S377. doi: 10.1016/j.revmed.2009.10.142
- Воробьева Л.И. Пропионовокислые бактерии и образование витамина В12. М.: МГУ, 1986.
- Herbert V. Recommended dietary intakes (RDI) of vitamin B12 in humans. Am J Clin Nutr. 1987;45:671-8. doi: 10.1093/ajcn/45.4.671
- Fenech M.F, Dresoti I.E, Rinaldi J.R. Folate, vitamin B12, homocysteine status and chromosome damage rate in lymphocytes of older men. Carcinogenesis. 1997;18:1329-36. doi: 10.1093/carcin/18.7.1329
- Kapiszewska M, Kalemba M, Wojciech U, Milewicz T. Uracil misincorporation into DNA of leukocytes of young women with positive folate balance depends on plasma vitamin B12 concentrations and methylenetetrahydrofolate reductase polymorphisms. A pilot study. J Nutr Biochem. 2005;16:467-78. doi: 10.1016/j.jnutbio.2005.01.018
- Solomon L.R. Disorders of cobalamin (vitamin B12) metabolism: emerging concepts in pathophysiology, diagnosis and treatment. Blood Rev. 2007;21:113-30. doi: 10.1016/j.blre.2006.05.001
- Whipple G.H, Hooper C.W, Robscheit F.S. Blood regeneration following anemia. IV. Influence of meat, liver, and various extractives, alone or combined with standard diets. Am J Physiol. 1920;53:236-62. doi: 10.1152/ajplegacy.1920.53.2.236
- Minot G.R, Murphy W.P. Treatment of pernicious anemia by special diet. JAMA. 1926;87:470-6. doi: 10.1001/jama.1926.02680070016005
- Smith E.L. Purification of anti — pernicious anemia factors from liver. Nature. 1948;161:638-9. doi: 10.1038/161638a0
- Rickes E.L, Brink N.G, Koniuszy F.R, Wood T.R, Folkers K. Crystalline vitamin B12. Science. 1948;107:396-7. doi: 10.1126/science.107.2781.396
- Castle W.B. Observations on etiologic relationship of achylia gastrica to pernicious anemia. I. Effect of administration to patients with pernicious anemia of contents of normal human stomach recovered after ingestion of beef muscle. Am J Med Sci. 1929;178:748-64.
- Castle W.B, Heath C.W, Strauss M.B, Heinle R.W. Observations on etiologic relationship of achylia gastrica to pernicious anemia.VI. Site of interaction of food (extrinsic) and gastric (intrinsic) factors: failure of in vitro incubation to produce thermostable hematopoietic principle. Am J Med Sci. 1937;294:618-25.
- Gärsbeck R. Fractionation of human gastric juice and saliva employing starch electrophoresis. Gastroenterologia. 1955;84:99-102. doi: 10.1159/000200176
- Kozyraki R, Fyfe J, Kristiansen M, Gerdes C, et al. The intrinsic factor — vitamin B12 receptor, cubilin, is a high — affinity apolipoprotein A-I receptor facilitating endocytosis of high — density lipoprotein. Nat Med. 1999;5:656-61. doi: 10.1038/9504
- Tanner S.M, Aminoff M, Wright F.A, Liyanarachchi S, et al. Amnionless, essential for mouse gastrulation, is mutated in recessive hereditary megaloblastic anemia. Nat Genet. 2003;33:426-9. doi: 10.1038/ng1098
- Fyfe F.C, Madsen M, Hojrup P, Christensen E.I, et al. The functional cobalamin (vitamin B12)-intrinsic factor receptor is a novel complex of cubilin and amnionless. Blood. 2004;103:1573-9. doi: 10.1182/blood-2003-08-2852
- Gärsbeck R. Imerslund-Gärsbeck syndrome (selective vitamin B(12) malabsorption with proteinuria). Orphanet J Rare Dis. 2006;1:17. doi: 10.1186/1750-1172-1-17
- André S.E, Serraj K, Zhu J, Vermorken A.J.M. The pathophysiology of elevated vitamin B12 in clinical practice. Q J Med. 2013;106:505-15 doi: 10.1093/qjmed/hct051
- Ermens A.A, Vlasveld L.T, Lindemans J. Significance of elevated cobalamin (vitamin B12) levels in blood. Clin Biochem. 2003;36:585-90. doi: 10.1016/j.clinbiochem.2003.08.004
- Lindemans J, Kroes A.C.M, van Geel J, Van Kapel J, et al. Uptake of transcobalamin II — bound cobalamin by HL-60 cells: effects of differentiation induction. J Exp Cell Res. 1989;184:449-60. doi: 10.1016/0014-4827(89)90343-1
- Nicolas J.P, Gueant J.L, Fremont S. Cobalamin binding glycoproteins. In: Bhatt H.R, James V.H.T, Besser G.M, Bottazzo G.F, Keen H, eds. Advances in Thomas Addison’s Diseases. Bristol: Journal of Endocrinology Ltd., 1994. P. 253-67.
- Gärsbeck R. Intrinsic factor and the other vitamin B12 transport proteins. Prog Hematol. 1969;6:233-60.
- Burger R.L, Mehlman C.S, Allen R.H. Human plasma R-type vitamin B12-binding proteins. I. Isolation and characterization of transcobalamin I, transcobalamin III and the normal granulocyte vitamin B12-binding protein. J Biol Chem. 1975;250:7700-6.
- Zittoun J. Cobalamins: an update of fundamental and clinical data. Hematologie. 1996;2:119-29.
- Li N, Seetharam S, Lindemans J, Alpers D.H, Arwert F, Seetharam B. Isolation and sequence analysis of variant forms of human transcobalamin II. Biochim Biophys Acta. 1993;1172:21-30. doi: 10.1016/0167-4781(93)90264-E
- Павлов Ч.В., Дамулин И.В., Шульпекова О.Ю., Андреев Е.А. Неврологические расстройства при дефиците витамина В12. Терапевтический архив. 2019;91(4):122-9. doi: 10.26442/00403660.2019.04.000116
- Herrmann W, Schorr H, Obeid R, Geisel J. Vitamin B-12 status, particularly holotranscobalamin II and methylmalonic acid concentrations, and hyperhomocysteinemia in vegetarians. Am J Clin Nutr. 2003;78:131-6. doi: 10.1093/ajcn/78.1.131
- Carmel R. Current concepts in cobalamin deficiency. Annu Rev Med. 2000;51:357-75. doi: 10.1146/annurev.med.51.1.357
- Solomon L.R. More on failures of cobalamin assays in pernicious anemia. N Engl J Med. 2012;367:1570. doi: 10.1056/NEJMc1210169
- Baker H, Leevy C.B, De Angelis B, Frank O, Baker E.R. Cobalamin (vitamin B12) and holotranscobalamin changes in plasma and liver tissue in alcoholics with liver disease. J Am Coll Nutr. 1998; 17:235-8. doi: 10.1080/07315724.1998.10718752
- Kanazawa S, Herbert V. Total corrinoid, cobalamin and cobalamin analogue levels may be normal in serum despite cobalamin in liver depletion in patients with alcoholism. Lab Invest. 1985;53:108-10.
- Hagelskjaer L, Rasmussen K. Methylmalonic acid concentration in serum not affected in hepatic disease. Clin Chem. 1992;38:493-5
- Carmel R, Eisenberg L. Serum vitamin B12 and transcobalamin abnormalities in patients with cancer. Cancer. 1977;40:1348-53. doi: 10.1002/1097-0142(197709)40:3%3C1348::AID-CNCR2820400352% 3E3.0.CO;2-Q
- Carmel R. Extreme elevation of serum transcobalamin I in patients with metastatic cancer. N Engl J Med. 1975;292:282-4. doi: 10.1056/NEJM197502062920603
- Gimsing P. Cobalamin metabolism in chronic myelogenous leukemia. Dan Med Bull. 1998;45:459-79.
- Fremont S, Chamigneulle B, Gerard P, Felden P, et al. Blood transcobalamin levels in malignant hepatoma. Tumor Biol. 1991;12:353-9. doi: 10.1159/000217736
- Gimsing P, Hippe E. Increased concentration of transcobalamin I in a patient with metastatic carcinoma of the breast. Scand J Haematol. 1978;21:243-9. doi: 10.1111/j.1600-0609.1978.tb00359.x
- Carmel R, Tatsis B, Baril L. Circulating antibody to transcobalamin II causing retention of vitamin B12 in the blood. Blood. 1977;49:987-1000.
- Bowen R.A, Drake S.K, Vanjani R, Huey E.D, et al. Markedly increased vitamin B12 concentrations attributable to IgG-IgM-vitamin B12 immune complexes. Clin Chem. 2006;52:2107-14. doi: 10.1373/clinchem.2006.073882
- Schwartz M, Bastrup-Madsen P. A new vitamin B12 binding protein in serum causing excessively high serum vitamin B12 values. Scand J Haematol. 1968;5:35-40. doi: 10.1111/j.1600-0609.1968.tb01715.x
- André S.E, Henoun Loukili N, Noel E, Maloisel F, et al. Oral cobalamin (daily dose of 1000 mg) therapy for the treatment of patients with pernicious anemia. An open label study of 10 patients. Curr Ther Res. 2005;66:13-22. doi: 10.1016/j.curtheres.2005.02.001
- Kane S.P, Murray-Lyon I.M, Paradinas F.J, Johnson P.J, et al. Vitamin B12 binding protein as a tumour marker for hepatocellular carcinoma. Gut. 1978;19:1105-9. doi: 10.1136/gut.19.12.1105
- Wheeler K, Pritchard J, Luck W, Rossiter M. Transcobalamin I as a marker for fibrolamellar hepatoma. Med Ped Oncol. 1986;14:227-9. doi: 10.1002/mpo.2950140408
- Salles N, Herrmann F, Sakbani K, Rapin C.H, Sieber C. High vitamin B12 level: a strong predictor of mortality in elderly in patients. J Am Geriatr Soc. 2005;53:917-8. doi: 10.1111/j.1532-5415.2005.53278_7.x
- Gimsing P. The cobalamin forms and analogues in plasma and myeloid cells during the course of chronic myelogenous leukemia related to the clinical condition. Br J Haematol. 1995;89:812-9. doi: 10.1111/j.1365-2141.1995.tb08419.x
- Zittoun J, Farcet J.P, Marquet J, Sultan C, Zittoun R. Cobalamin vitamin B12 (vitamin B12) and B12 binding proteins in hypereosinophilic syndromes and secondary eosinophilia. Blood. 1984;63:779-83
- Rachmilewitz D, Rachmilewitz E.A, Polliack A, Herchko C.A. Acute promyelocytic leukemia. A report of five cases with a comment on the diagnostic significance of serum vitamin B12 determination. Br J Haematol. 1972;22:87-92. doi: 10.1111/j.1365-2141.1972.tb08789.x
- Lambert D, Benhayoun S, Adjalla C, Gelot M.M, et al. Alcoholic cirrhosis and cobalamin metabolism. Digestion. 1997;58:64-71. doi: 10.1159/000201425
- Fragasso A. Vitamin B12 Deficiency in Alcoholics. In: Watson R., Preedy V., Zibadi S. (eds). Alcohol, Nutrition, and Health Consequences. Nutrition and Health. Humana Press, Totowa, NJ, 2013. doi: 10.1007/978-1-62703-047-2_10
- Fragasso A, Mannarella C, Ciancio A, Sacco A. Functional vitamin B12 deficiency in alcoholics: an intriguing finding in a retrospective study of megaloblastic anemic patients. Eur J Intern Med. 2010;21:97-100. doi: 10.1016/j.ejim.2009.11.012
- Hofer L.J, Elian K.M. Parenteral vitamin B12 therapy of hyperhomocysteinemia in end — stage renal disease. Med Clin Exp. 2004;27:10-3.
- Reynolds E.H, Bottiglieri T, Laundry M, Stern J, et al. Subacute combined degeneration with high serum vitamin B12 level and abnormal vitamin B12 binding protein. Arch Neurol. 1993;50:739-42. doi: 10.1001/archneur.1993.00540070055015
- Molad Y, Rachmilewitz B, Sidi Y, Pinkhas J, Weinberger A. Serum transcobalamin and transcobalamin levels in systemic lupus erythematosus. Am J Med. 1989;88:141-4. doi: 10.1016/0002-9343(90)90463-N
- Grindulis K.A, Calverley M, Cox C. Rheumatoid arthritis: is serum vitamin B12 high in active disease? J Rheumatol. 1984;11:211-2.
- Kalyoncu U, Buyukasik Y, Akdogan A, Karadag O, et al. Increased serum vitamin B12 levels are associated with adult — onset Still’s disease with reactive macrophage activation syndrome. Joint Bone Spine. 2010;77:131-4. doi: 10.1016/j.jbspin.2009.09.010
- Belousov Y.B. Klinicheskaya farmakologiya i farmakoterapiya. M.: GEOTAR-Media, 2010.-S. 624-626, 855-857.
- Serraj K, Mecili M, Housni I, André S.E. L’hypervitaminemie B12: physiopathologie et interêt en pratique clinique. Press Med. 2011;40:1120-7. doi: 10.1016/j.lpm.2011.08.010
Views
Abstract — 823
PDF (Russian) — 67
Cited-By
Article Metrics
PlumX
Dimensions
Refbacks
- There are currently no refbacks.
Апластическая анемия | Фонд «Подари жизнь»
Суть болезни
Апластической анемией (АА) называют заболевание, при котором костный мозг больного перестает производить достаточные количества всех основных видов клеток крови – эритроцитов, лейкоцитов и тромбоцитов. Отсюда и название болезни: она сочетает в себе анемию (недостаточное число эритроцитов, низкий уровень гемоглобина) и аплазию кроветворения (угнетение выработки всех клеток крови).
Частота встречаемости, факторы риска
Апластическая анемия – редкая болезнь: ее частота составляет порядка 2-6 случаев на миллион жителей в год. АА может возникнуть как у детей, так и у взрослых; считается, что пики заболеваемости наблюдаются в молодом возрасте (15-30 лет) и затем в пожилом (свыше 60 лет). Мужчины и женщины заболевают одинаково часто.
В подавляющем большинстве случаев причина заболевания неизвестна – в этом случае говорят об идиопатической АА. Но иногда развитие болезни связано с некоторыми врожденными патологиями или с внешними факторами: использованием определенных лекарств (хинин, хлорамфеникол и др.), работой с токсичными веществами (гербициды, инсектициды, некоторые растворители, включая бензол), облучением или перенесенными инфекциями (инфицирование вирусами гепатитов, вирусом Эпштейна-Барр, ВИЧ; возможно, также цитомегаловирусом).
Считается, что идиопатическая АА обычно имеет аутоиммунную природу, то есть возникает тогда, когда иммунная система организма по какой-то причине начинает бороться против его собственных клеток костного мозга.
Признаки и симптомы
Проявления апластической анемии связаны с панцитопенией – дефицитом всех разновидностей клеток крови.
- Недостаток эритроцитов – бледность, слабость, одышка, учащенное сердцебиение, головокружения, головные боли.
- Недостаток тромбоцитов – кровотечения, в том числе из носа и десен; появление синяков и петехий (мелких подкожных кровоизлияний).
- Недостаток лейкоцитов – слабая сопротивляемость инфекциям. Могут возникнуть инфекционные заболевания, плохо поддающиеся терапии или часто повторяющиеся.
Апластическая анемия бывает разной степени тяжести: различают легкую, средней тяжести, тяжелую и сверхтяжелую формы АА.
Диагностика
Заподозрить АА можно при появлении у ребенка перечисленных жалоб и симптомов, а подтвердить – на основании результатов клинического анализа крови, где резко снижены количества эритроцитов, лейкоцитов и тромбоцитов. Производятся также другие клинические и лабораторные исследования, но окончательный диагноз ставится только по результатам анализа образца костного мозга, полученного с помощью пункции и трепанобиопсии. Исследование костного мозга необходимо для того, чтобы исключить другие возможные причины дефицита клеток крови, такие как лейкоз, миелодиспластические синдромы, миелофиброз и др.
При апластической анемии исследование костного мозга указывает на аплазию или гипоплазию кроветворения – то есть костный мозг практически не производит клетки крови или же производит их, но существенно меньше нужного.
В ходе диагностических исследований необходимо также надежно отличать АА от врожденной анемии Фанкони, так как лечение этих болезней (включая протоколы трансплантации костного мозга) заметно различается. Для подтверждения или исключения анемии Фанкони могут использоваться специальные исследования (такие как ДЭБ-тест).
Лечение
Лечение тяжелой и сверхтяжелой АА должно быть начато сразу после постановки диагноза, так как состояние серьезного дефицита всех клеток крови опасно для жизни.
Если развитие АА вызвано определенной внешней причиной (лекарства, радиация), то в первую очередь надо убрать эту причину. Однако, как уже говорилось, какой-то внешний фактор развития болезни удается установить лишь в очень небольшом числе случаев.
Так как АА предположительно имеет аутоиммунную природу, то для ее лечения широко применяется иммуносупрессивная терапия – то есть терапия, которая направлена на подавление иммунной системы, «атакующей» клетки костного мозга. Обычно такая терапия включает в себя антитимоцитарный глобулин (АТГ) или антилимфоцитарный глобулин (АЛГ) в сочетании с циклоспорином; для профилактики побочных действий АТГ могут использоваться стероидные гормоны, такие как метилпреднизолон. Ответ на эту терапию, как правило, возникает медленно: в случае успеха костный мозг постепенно восстанавливается через несколько недель или месяцев после введения лекарств и начинает производить здоровые клетки.
Для проведения курса иммуносупрессивной терапии с АТГ или АЛГ обычно необходима госпитализация. Основные осложнения в ходе лечения – это инфекции и кровотечения. Если нет ответа на первый курс терапии, может быть проведен повторный курс. Иммуносупрессивная терапия эффективна приблизительно в 70% случаев. К сожалению, у части больных после нее возникают рецидивы болезни.
Аллогенная трансплантация костного мозга в случае успеха приводит к полному излечению. Трансплантация особенно предпочтительна в случаях, когда больной молод и у него есть полностью совместимый родственный донор (брат или сестра). В отсутствие родственного донора допустимо использование совместимого неродственного донора или наполовину совместимого родственного дона (гаплотрансплантация). Ранее считалось, что трансплантации от неродственных или частично совместимых доноров при АА являются очень рискованными, но сейчас их результаты существенно улучшились.
В ходе лечения АА нередко нужна интенсивная заместительная терапия компонентами крови (переливания донорских тромбоцитов, эритроцитов, в случае тяжелых инфекций – иногда и гранулоцитов). Однако если планируется трансплантация костного мозга, то нужно помнить, что множественные переливания перед трансплантацией повышают вероятность отторжения трансплантата.
Очень важны профилактика и лечение бактериальных, вирусных и грибковых инфекций, которые представляют большую опасность для больных АА. Для лечения применяют сочетания эффективных антибиотиков и противогрибковых препаратов, иногда на протяжении долгого времени.
В качестве дополнительной терапии используются также факторы роста – препараты, помогающие костному мозгу производить нужные клетки. Среди них можно назвать гранулоцитарный колониестимулирующий фактор (нейпоген, лейкостим, граноцит), который стимулирует выработку лейкоцитов, и эритропоэтин, стимулирующий выработку эритроцитов.
Отличные результаты при АА показывает также элтромбопаг (револейд): этот препарат стимулирует выработку тромбоцитов и в целом улучшает ответ на терапию, поэтому, например, в НМИЦ ДГОИ имени Дмитрия Рогачева он уже включен в новые протоколы лечения.
Прогноз
Без лечения больные тяжелыми формами апластической анемии погибают в течение нескольких месяцев. Однако при современном адекватном лечении прогноз довольно хороший.
Как уже говорилось, во многих случаях эффективна иммуносупрессивная терапия. Больные после такой терапии могут продолжительное время чувствовать себя хорошо, однако у некоторых из них возникает рецидив (возвращение) болезни. Для своевременного обнаружения рецидива необходимы регулярные проверки, в первую очередь анализы крови.
Трансплантация костного мозга как от родственных, так и неродственных доноров связана с определенными рисками, в первую очередь иммунных и инфекционных осложнений. Но в случае успеха трансплантации наступает полное излечение.
Патогенетическая и заместительная коррекция анемии у пациентов со злокачественными новообразованиями | Романенко
1. Бессмельцев С.С., Романенко Н.А. Анемия при опухолевых заболеваниях системы крови: руководство для врачей. М.: СИМК, 2017. 228 с.
2. Bessmeltsev S.S., Romanenko N.A. Anemia in tumor diseases of the blood system. Moscow: SIMK, 2017. 228 p.
3. Baumeister P., Canis M., Reiter M. Preoperative anemia and perioperative blood transfusion in head and neck squamous cell carcinoma. PLoS One 2018;13(10):0205712. DOI: 10.1371/journal.pone.0205712.
4. Baumeister P., Rauch J., Jacobi C. et al. Impact of comorbidity and anemia in patients with oropharyngeal cancer primarily treated with surgery in the human papillomavirus era. Head Neck 2017;39(1):7–16. DOI: 10.1002/hed.24528.
5. Birgegard G., Samuelsson J., Ahlstrand E. et al. Inflammatory functional iron deficiency common in myelofibrosis, contributes to anaemia and impairs quality of life. From the Nordic MPN study group. Eur J Haematol 2019;102(3):235–40. DOI: 10.1111/ejh.13198.
6. Ceanga A.I., Ceanga M., Eveslage M. et al. Preoperative anemia and extensive transfusion during stay-in-hospital are critical for patient’s mortality: a retrospective multicenter cohort study of oncological patients undergoing radical cystectomy. Transfus Apher Sci 2018;57(6):739–45. DOI: 10.1016/j.transci.2018.08.003.
7. Liu X., Qiu H., Huang Y. et al. Impact of preoperative anemia on outcomes in patients undergoing curative resection for gastric cancer: a single-institution retrospective analysis of 2163 Chinese patients. Cancer Med 2018;7(2):360–9. DOI: 10.1002/cam4.1309.
8. Romanenko N., Potikhonova N., Chechetkin A. et al. Frequency of anemia in lymphoproliferative disorders patients during antitumor therapy. “Hemasphere”, The Abstract Book of the 23th Congress of the European Hematology Association (EHA-23). Stockholm, 2018;2(s1): 1109–1110.(PB2532).
9. Yasmeen T., Ali J., Khan K., Siddiqui N. Frequency and causes of anemia in Lymphoma patients. Pak J Med Sci 2019;35(1):61–5. DOI: 10.12669/pjms.35.1.91.
10. Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. Под рук. проф. И.В. Поддубной и проф. В.Г. Савченко. М.: Буки Веди, 2016. 324 с.
11. Danan D., Smolkin M.E., Varhegyi N.E. et al. Impact of blood transfusions on patients with head and neck cancer undergoing free tissue transfer. Laryngoscope 2015;125(1):86–91. DOI: 10.1002/lary.24847.
12. Romanenko N., Bessmeltsev S., Romanenko A. et al. Quality of life in anemic patients with hematological malignancies. Haematologica 2017;102(s1):843.
13. Левченкова О.С., Новиков В.Е. Индукторы регуляторного фактора адаптации к гипоксии. Российский медико-биологический вестник им. академика И.П. Павлова 2014;22(2):134–43.
14. Лямкина А.С., Поспелова Т.И., Обгольц Ю.Н. и др. Патогенез и современная терапия анемического синдрома у пожилых больных лимфопролиферативными заболеваниями. Сибирский научный медицинский журнал 2013;33(1):54–60.
15. Романенко Н.А., Бессмельцев С.С., Алборов А.Э. и др. Аспекты патогенеза анемии у пациентов онкологического профиля. Казанский медицинский журнал 2019;100(6):950–7. DOI: 10.17816/KMJ2019-950.
16. Buck I., Morceau F., Cristofanon S. et al. The inhibitory effect of the proinflammatory cytokine TNFalpha on erythroid differentiation involves erythroid transcription factor modulation. Int J Oncol 2009;34(3):853–60. DOI: 10.3892/ijo_00000212.
17. Buck I., Morceau F., Cristofanon S. et al. Tumor necrosis factor alpha inhibits erythroid differentiation in human erythropoietindependent cells involving p38 MAPK pathway, GATA-1 and FOG-1 downregulation and GATA-2 upregulation. Biochem Pharmacol 2008;76(10):1229–39. DOI: 10.1016/j.bcp.2008.08.025.
18. Chopra M., Langenhorst D., Beilhack A. et al. Interleukin-2 critically regulates bone marrow erythropoiesis and prevents anemia development. Eur J Immunol 2015;45(12): 3362–74. DOI: 10.1002/eji.201545596.
19. Romanenko N.A., Rozanova O.E., Glazanova T.V., Abdulkadyrov K.M. Role of cytokines in resistance to erythropoiesis stimulating agents treatment of anaemia in patients with lymphoproliferative disorders. Haematologica 2012;97(s1):550–1.
20. Tsopra O.A., Ziros P.G., Lagadinou E.D. et al. Disease-related anemia in chronic lymphocytic leukemia is not due to intrinsic defects of erythroid precursors: a possible pathogenetic role for tumor necrosis factoralpha. Acta Haematol 2009;121(4):187–95. DOI: 10.1159/000220331.
21. Wang T., Tu M.F., Zhu J. The role of cytokines in lymphoma with anemia. Zhongguo Shi Yan Xue Ye Xue Za Zhi 2013;21(2):392–5. DOI: 10.7534/j.issn.1009-2137.2013.02.027.
22. Романенко Н.А., Бессмельцев С.С., Чечеткин А.В. Коррекция иммунного статуса пациентов иммуноглобулином человека для внутривенного введения. Казанский медицинский журнал 2017;98(5):775–83. DOI: 10.17750/KMJ2017-775.
23. Романенко Н.А., Чечеткин А.В., Жигулева Л.Ю. и др. Коррекция анемии и оценка эффективности трансфузий эритроцитов у пациентов с онкогематологическими заболеваниями. Клиническая онкогематология 2018;11(3): 265–72. DOI: 10.21320/2500-2139-2018-11-3-265-272.
24. Kim A., Rivera S., Shprung D. et al. Mouse models of anemia of cancer. PloS One 2014;9(3):93283. DOI: 10.1371/journal.pone.0093283.
25. Nemeth E., Rivera S., Gabayan V. et al. IL-6 mediates hyppoferremia inducting the synthesis of the iron regulatory hormone hepcidin. J Clin Invest 2004;113(9):1271–6. DOI: 10.1172/JCI20945.
26. Song S.N., Tomosugi N., Kawabata H. et al. Down-regulation of hepcidin resulting from long-term treatment with an anti-IL-6 receptor antibody (tocilizumab) improves anemia of inflammation in multicentric Castleman disease. Blood 2010;116(18):3627–34. DOI: 10.1182/blood-2010-03-271791.
27. Ikuta K., Ito H., Takahashi K. et al. Safety and efficacy of intravenous ferric carboxymaltose in Japanese patients with iron-deficiency anemia caused by digestive diseases: an open-label, single-arm study. Int J Hematol 2019;109(1):50–8. DOI: 10.1007/s12185-018-2529-9.
28. Calleja J.L., Delgado S., del Val A. et al. Ferric carboxymaltose reduces transfusions and hospital stay in patients with colon cancer and anemia. Int J Colorectal Dis 2016;31(3):543–51. DOI: 10.1007/s00384-015-2461-x.
29. Cella D., Kallich J., McDermott A., Xu X. The longitudinal relationship of hemoglobin, fatigue and quality of life in anemic cancer patients: results from five randomized clinical trials. Ann Oncol 2004;15(6): 979–86. DOI: 10.1093/annonc/mdh335.
30. Keeler B.D., Simpson J.A., Ng S. et al. The feasibility and clinical efficacy of intravenous iron administration for preoperative anaemia in patients with colorectal cancer. Color Dis 2014;16(10):794–800. DOI: 10.1111/codi.12683.
31. Lebrun F., Klastersky J., Levacq D. et al. Intravenous iron therapy for anemic cancer patients: a review of recently published clinical studies. Support Care Cancer 2017;25(7):2313–9. DOI: 10.1007/s00520-017-3672-1.
32. Lima J., Gago P., Rocha M. et al. Role of intravenous iron in the treatment of anemia in patients with gastrointestinal tract tumors undergoing chemotherapy: a single-center, observational study. Int J Gen Med 2018;11:331–6. DOI: 10.2147/IJGM.S165947.
33. Verhaeghe L., Bruyneel L., Stragier E. et al. The effectiveness of intravenous iron for iron deficiency anemia in gastrointestinal cancer patients: a retrospective study. Ann Gastroenterol 2017;30(6):654–63. DOI: 10.20524/aog.2017.0189.
34. Мещерякова Л.М., Левина А.А., Цыбульская М.М., Соколова Т.В. Основные механизмы регуляции обмена железа и их клиническое значение. Онкогематология 2014;9(3):67–71. DOI: 10.17650/1818-8346-2014-9-3-67-71.
35. Протоколы клинических рекомендаций поддерживающей терапии в онкологии. Под ред. акад. РАН М.И. Давыдова, 2-е изд., перераб. и дополн. М., 2018. 228 с. Доступно по: www.rassc.org.
36. Снеговой А.В. Проблема железодефицитной анемии у пациентов с онкологическими заболеваниями: практика применения железосодержащих препаратов. Современная онкология 2013;15(2):65–72.
37. Elliot S., Sinclair A.M. The effect of erythropoietin on normal and neoplastic cellc. Biologics 2012;6:163–89. DOI: 10.2147/BTT.S32281.
38. Aapro M.S., Jelkmann W., Constantinescu S.N., Leyland-Jones B. Effects of erythropoietin receptors and erythropoiesisstimulating agents on disease progression in cancer. Br J Cancer 2012;106:1249–58. DOI: 10.1038/bjc.2012.42.
39. Oster H.S., Hoffman M., Prutchi-Sagiv S. et al. Erythropoietin in clinical practice: current use, effect on survival, and future directions. Isr Med Assoc J 2006;8(10):703–6.
40. Yang W.S., Chang J.W., Han N.J., Park S.K. Darbepoetin alfa suppresses tumor necrosis factor-α-induced endothelin-1 production through antioxidant action in human aortic endothelial cells: role of sialic acid residues. Free Radic Biol Med 2011;50(10):1242–51. DOI: 10.1016/j.freeradbiomed.2011.02.005.
41. Kaptanoglu E., Solaroglu I., Okutan O. et al. Erythropoietin exerts neuroprotection after acute spinal cord injury in rats: effect on lipid peroxidation and early ultrastructural findings. Neurosurg Rev 2004;27(2):113–20. DOI: 10.1007/s10143-003-0300-y.
42. Kumral A., Uysal N., Tugyan K. et al. Erythropoietin improves longterm spatial memory deficits and brain injury following neonatal hypoxia-ischemia in rats. Behav Brain Res 2004;153(1):77–86. DOI: 10.1016/j.bbr.2003.11.002.
43. Parsa C.J., Matsumoto A., Kim J. et al. A novel protective effect of erythropoietin in the infarcted heart. J Clin Invest 2003;112(7):999–1007. DOI: 10.1172/JCI18200.
44. Wright G.L., Hanlon P., Amin K. et al. Erythropoietin receptor expression in adult rat cardiomyocytes is associated with an acute cardioprotective effect for recombinant erythropoietin during ischemia-reperfusion injury. FASEB J 2004;18(9):1031–3. DOI: 10.1096/fj.03-1289fje.
45. Романенко Н.А., Бессмельцев С.С., Розанова О.Е. и др. Влияние уровня ФНО-альфа на эффективность коррекции анемии у больных лимфопролиферативными заболеваниями. Онкогематология 2010;3:22–8.
46. Bohlius J., Bohlke K., Castelli R. et al. Management of cancer-associated anemia with erythropoiesis-stimulating agents: ASCO/ASH clinical practice guideline update. Blood Adv 2019;3(8):1197–210. DOI: 10.1182/bloodadvances.2018030387.
47. Романенко Н.А., Беркос М.В., Бессмельцев С.С. и др. Прогностическое значение сывороточного эритропоэтина при коррекции анемии препаратами рекомбинантного эритропоэтина у пациентов с лимфопролиферативными заболеваниями. Казанский медицинский журнал 2012;93(4):584–90.
48. Романенко Н.А., Грицаев С.В., Бессмельцев С.С., Абдулкадыров К.М. Эффективность эритропоэзстимулирующих препаратов при анемии у больных миелодиспластическим синдромом. Гематология и трансфузиология 2013;58(4):18–21.
49. Gascón P., Krendyukov A., Mathieson N., Aapro M. Epoetin alfa for the treatment of myelodysplastic syndrome-related anemia: a review of clinical data, clinical guidelines, and treatment protocols. Leuk Res 2019;81:35–42. DOI: 10.1016/j.leukres.2019.03.006.
50. Романенко Н.А., Бессмельцев С.С., Беркос М.В. и др. Прогностическая значимость ряда лабораторных показателей крови при использовании препаратов, стимулирующих эритропоэз у больных лимфопролиферативными заболеваниями с анемией. Терапевтический архив 2013;85(8):81–6.
51. Bell D., Grimes D., Gurney H. et al. Outcomes and predicting response in anaemic chemotherapy patients treated with epoetin alfa. A multicentre, 4-month, open-label study in Australia and New Zealand. Intern Med J 2008;38(10):751–7. DOI: 10.1111/j.1445-5994.2008.01736.x.
52. Ukarma L., Johannes H., Beyer U. et al. Hepcidin as a predictor of response to epoetin therapy in anemic cancer patients. Clin Chem 2009;55(7):1354–60. DOI: 10.1373/clinchem.2008.121285.
53. Romanenko N.A., Rozanova O.E., Glazanova T.V., Abdulkadyrov K.M. A study of the influence of TNF-alpha on the efficacy of treatment with recombinant erythropoietin in patients with lymphoproliferative disorders. Haematologica 2010;95(s2):355–4.
54. Романенко Н.А. Патогенез и терапия анемии препаратами рекомбинантного эритропоэтина у онкогематологических больных (обзор литературы). Онкогематология 2012;(3):22–9.
55. Rizzo J.D., Brouwers M., Hurley P. et al. American Society of Hematology/ American Society of Clinical Oncology clinical practice guideline update on the use of epoetin and darbepoetin in adult patients with cancer. Blood 2010;116(20):4045–59. DOI: 10.1182/blood-2010-08-300541.
56. Douros A., Jobski K., Kollhorst B. et al. Risk of venous thromboembolism in cancer patients treated with epoetins or blood transfusions. J Clin Pharmacol 2016; 82(3):839–48. DOI: 10.1111/bcp.13019.
57. Henke M., Laszig R., Rube C. et al. Erythropoietin to treat head and neck cancer patients with anaemia undergoing radiotherapy: randomised, double-blind, placebo-controlled trial. Lancet 2003;362(9392):1255–60. DOI: 10.1016/S0140-6736(03)14567-9.
58. Wright J.R., Ung Y.C., Julian J.A. et al. Randomized, double-blind, placebocontrolled trial of erythropoietin in nonsmall- cell lung cancer with disease-related anemia. J Clin Oncol 2007;25(9):1027–32. DOI: 10.1200/JCO.2006.07.1514.
59. Hershman D.L., Buono D.L., Malin J. et al. Patterns of use and risks associated with erythropoiesis-stimulating agents among Medicare patients with cancer. J Natl Cancer Inst 2009;101(23):1633–41. DOI: 10.1093/jnci/djp387.
60. Bohlius J., Schmidlin K., Brillant C. et al. Recombinant human erythropoiesisstimulating agents and mortality in patients with cancer: a meta-analysis of randomised trials. Lancet 2009;373:1532–42. DOI: 10.1016/S0140-6736(09)60502-X.
61. Bohlius J., Wilson J., Seidenfeld J. et al. Recombinant human erythropoietins and cancer patients: updated meta-analysis of 57 studies including 9353 patients. J Natl Cancer Inst 2006:98(10):708–14. DOI: 10.1093/jnci/djj189.
62. Khorana A.A., Francis C.W., Blumberg N. et al. Blood transfusions, thrombosis, and mortality in hospitalized patients with cancer. Arch Intern Med 2008;168(21): 2377–81. DOI: 10.1001/archinte.168.21.2377.
63. Glaspy J. Current status of use of erythropoietic agents in cancer patients. Semin Thromb Hemost 2014;40(3): 306–12. DOI: 10.1055/s-0034-1370768.
64. Schrijvers D., de Samblanx H., Roila F. Erythropoiesis-stimulating agents in the treatment of anaemia in cancer patients: ESMO Clinical Practice Guidelines for use. Ann Oncol 2010;21(Suppl 5): 244–7. DOI: 10.1093/annonc/mdq202.
65. Сахин В.Т., Крюков Е.В., Рукавицын О.А. Значение интерлейкина 6 в патогенезе анемии у больных с солидными опухолями и возможности терапевтической коррекции. Вестник гематологии 2019;XV(1):22–8.
66. Об утверждении Правил заготовки, хранения, транспортировки и клинического использования донорской крови и ее компонентов и о признании утратившими силу некоторых актов Правительства Российской Федерации/Постановление Правительства Российской Федерации от 22 июня 2019 года № 797. Доступно по: http://publication.pravo.gov.ru/Document/View/0001201907020007.
67. Правила клинического использования донорской крови и(или) ее компонентов. Приказ Минздрава Российской Федерации от 2 апреля 2013 г. № 183н «Об утверждении правил клинического использования донорской крови и(или) ее компонентов» Доступно по: http://www.transfusion.ru/2013/08-29-1.pdf.
68. Заривчацкий М.Ф. Трансфузиология: Клиническое руководство. Пермь: ГБОУ ВПО ПГМА им. акад. Е.А. Вагнера Минздрава России, 2014. 900 с.
69. Романенко Н.А., Гришина Г.В., Бессмельцев С.С. и др. Оценка газотранспортной функции крови у пациентов с анемией на фоне трансфузий донорских эритроцитов. Трансфузиология 2017;18(4):30–41.
70. Hourfar M.K., Jork C., Schottstedt V. et al. Experience of German Red Cross blood donor services with nucleic acid testing: results of screening more than 30 million blood donations for human immunodeficiency virus-1, hepatitis C virus, and hepatitis B virus. Transfusion 2008;48(8):1558–66. DOI: 10.1111/j.1537-2995.2008.01718.x.
71. Roth W.K., Busch M.P., Schuller A. et al. International survey on NAT testing of blood donations: expanding implementation and yield from 1999 to 2009. Vox Sang 2012;102:82–90. DOI: 10.1111/j.1423-0410.2011.01506.x.
72. Грицаев С.В., Даваасамбуу Б., Романенко Н.А., Абдулкадыров К.М. Отбор больных для терапии хелаторами железа. Клиническая онкогематология 2013;6(2):204–9. [Gritsayev S.V.,
73. Романенко Н.А., Бессмельцев С.С., Абдулкадыров К.М. Патогенетическое лечение пациентки с неходжкинской лимфомой маргинальной зоны селезенки, осложненной синдромом Эванса. Казанский медицинский журнал 2012;93(5):843–6.
Витамин B12 или анемия, вызванная недостаточностью фолиевой кислоты — Причины
Витамин B12 или анемия, вызванная недостаточностью фолиевой кислоты, возникает, когда недостаток любого из этих витаминов влияет на способность организма вырабатывать полностью функционирующие эритроциты.
Красные кровяные тельца переносят кислород по телу. У большинства людей с анемией, вызванной недостаточностью витамина B12 или фолиевой кислоты, эритроциты недоразвиты, они больше, чем обычно. Медицинский термин для этого — мегалобластная анемия.
Дефицит витамина B12 или фолиевой кислоты может быть результатом множества проблем.
Причины дефицита витамина B12
Злокачественная анемия
Пагубная анемия — наиболее частая причина дефицита витамина B12 в Великобритании.
Пагубная анемия — это аутоиммунное заболевание, поражающее желудок.
Аутоиммунное заболевание означает, что ваша иммунная система, естественная защитная система организма, которая защищает от болезней и инфекций, атакует здоровые клетки вашего тела.
Витамин B12 сочетается с белком, который называется внутренним фактором вашего желудка. Эта смесь витамина B12 и внутреннего фактора затем всасывается в организм в части кишечника, называемой дистальным отделом подвздошной кишки.
Пагубная анемия заставляет вашу иммунную систему атаковать клетки вашего желудка, вырабатывающие внутренний фактор, что означает, что ваше тело не может усваивать витамин B12.
Точная причина злокачественной анемии неизвестна, но она чаще встречается у женщин в возрасте около 60 лет, людей с семейным анамнезом этого состояния и людей с другим аутоиммунным заболеванием, таким как болезнь Аддисона или витилиго.
Диета
У некоторых людей может развиться дефицит витамина B12 из-за того, что они не получают достаточного количества витамина B12 из своего рациона.
Диета, включающая мясо, рыбу и молочные продукты, обычно обеспечивает достаточно витамина B12, но люди, которые не едят эти продукты регулярно, например, те, кто придерживается веганской диеты или, как правило, очень плохо питаются, могут испытывать дефицит.
Запасы витамина B12 в организме могут длиться от 2 до 4 лет без восполнения, поэтому любые проблемы могут развиться после изменения диеты в течение длительного времени.
Заболевания, поражающие желудок
Некоторые желудочные заболевания или операции на желудке могут препятствовать всасыванию достаточного количества витамина B12.
Например, гастрэктомия, хирургическая процедура, при которой удаляется часть желудка, увеличивает риск развития дефицита витамина B12.
Заболевания кишечника
Некоторые состояния, влияющие на ваш кишечник, также могут препятствовать усвоению необходимого количества витамина B12.
Например, болезнь Крона, хроническое заболевание, вызывающее воспаление слизистой оболочки пищеварительной системы, иногда может означать, что ваше тело не получает достаточно витамина B12.
Лекарства
Некоторые лекарства могут привести к снижению количества витамина B12 в организме.
Например, ингибиторы протонной помпы (ИПП), лекарство, которое иногда используется для лечения расстройства желудка, могут усугубить дефицит витамина B12.
ИПП подавляют выработку желудочной кислоты, которая необходима для высвобождения витамина B12 из пищи, которую вы едите.
Ваш терапевт будет знать о лекарствах, которые могут повлиять на уровень витамина B12, и при необходимости будет следить за вами.
Функциональный дефицит витамина B12
Некоторые люди могут испытывать проблемы, связанные с дефицитом витамина B12, несмотря на то, что у них нормальный уровень витамина B12 в крови.
Это может произойти в результате проблемы, известной как функциональный дефицит витамина B12, когда существует проблема с белками, которые помогают транспортировать витамин B12 между клетками.
Это приводит к неврологическим осложнениям со стороны спинного мозга.
Причины недостаточности фолиевой кислоты
Фолат растворяется в воде, что означает, что ваше тело не может хранить его в течение длительного времени.
Запаса фолиевой кислоты в вашем организме обычно хватает на 4 месяца. Это означает, что вам нужен фолиевая кислота в ежедневном рационе, чтобы обеспечить достаточные запасы витамина в организме.
Подобно витаминно-B12-дефицитной анемии, фолат-дефицитная анемия может развиваться по ряду причин.
Диета
Хорошие источники фолиевой кислоты — брокколи, брюссельская капуста, спаржа, горох, нут и коричневый рис.
Если вы не едите эти продукты регулярно, у вас может развиться дефицит фолиевой кислоты.
Дефицит фолиевой кислоты, вызванный недостатком фолиевой кислоты в пище, чаще встречается у людей с несбалансированным и нездоровым питанием, у людей, регулярно злоупотребляющих алкоголем, и у людей, соблюдающих причудливую диету, которая не предполагает употребления хороших источников фолиевой кислоты.
Мальабсорбция
Иногда ваше тело может не усваивать фолиевую кислоту так эффективно, как должно. Обычно это вызвано основным заболеванием, влияющим на вашу пищеварительную систему, например глютеновой болезнью.
Чрезмерное писание
Вы можете потерять фолиевую кислоту из своего тела, если будете часто мочиться.
Это может быть вызвано основным заболеванием, которое влияет на один из ваших органов, например:
- застойная сердечная недостаточность — когда сердце не может перекачивать достаточно крови по телу
- острое поражение печени, часто вызываемое чрезмерным употреблением алкоголя
- долгосрочный диализ — аппарат, воспроизводящий функцию почек, используется для фильтрации отходов жизнедеятельности из крови
Медицина
Некоторые лекарства уменьшают количество фолиевой кислоты в организме или затрудняют его усвоение.
К ним относятся некоторые противосудорожные препараты (лекарства, применяемые для лечения эпилепсии), колестирамин, сульфасалазин и метотрексат.
Ваш терапевт будет знать о лекарствах, которые могут повлиять на уровень фолиевой кислоты, и при необходимости будет следить за вами.
Прочие причины
Вашему организму иногда требуется больше фолиевой кислоты, чем обычно. Это может вызвать дефицит фолиевой кислоты, если вы не можете удовлетворить потребности своего организма в этом витамине.
Вашему организму может потребоваться больше фолиевой кислоты, чем обычно, если вы:
- беременная
- больны раком
- имеют заболевание крови, такое как серповидно-клеточная анемия, наследственное заболевание крови, которое вызывает аномальное развитие красных кровяных телец
- борются с инфекцией или заболеванием, которое вызывает воспаление (покраснение и отек)
Недоношенные дети (рожденные до 37-й недели беременности) также более склонны к развитию дефицита фолиевой кислоты, потому что их развивающийся организм требует большего количества фолиевой кислоты, чем обычно.
Беременность
Если вы беременны или есть вероятность забеременеть, рекомендуется принимать 400 мкг фолиевой кислоты в таблетке каждый день до беременности и до 12 недель беременности.
Это гарантирует, что и у вас, и у вашего ребенка будет достаточно фолиевой кислоты, и поможет вашему ребенку расти и развиваться.
Таблетки
фолиевой кислоты можно приобрести по рецепту врача общей практики или купить в аптеках, крупных супермаркетах и магазинах здорового питания.
Если вы беременны и имеете другое заболевание, которое может увеличить потребность вашего организма в фолиевой кислоте, ваш терапевт будет внимательно следить за вами, чтобы не допустить развития анемии.
В некоторых случаях вам может потребоваться более высокая доза фолиевой кислоты. Например, если у вас диабет, вы должны принять 5 миллиграммов (5 мг) фолиевой кислоты вместо стандартных 400 микрограммов.
Ваш терапевт может назначить более высокую дозу фолиевой кислоты.
Подробнее о витаминах и питании при беременности
Последняя проверка страницы: 23 мая 2019 г.
Срок следующего рассмотрения: 23 мая 2022 г.
Что такое злокачественная анемия?
Автор
Srikanth Nagalla, MBBS, MS, FACP Заведующий отделением доброкачественной гематологии, Miami Cancer Institute
Srikanth Nagalla, MBBS, MS, FACP является членом следующих медицинских обществ: Американское общество гематологии, Ассоциация профессиональных профессоров
Раскрытие информации : Служить (d) в качестве директора, должностного лица, партнера, сотрудника, советника, консультанта или попечителя для: Alexion; Алнилам; Кедрион; Санофи.
Соавтор (ы)
Пол Шик, доктор медицины Заслуженный профессор кафедры внутренней медицины Медицинского колледжа Джефферсона Университета Томаса Джефферсона; Профессор-исследователь кафедры внутренней медицины Медицинского колледжа Дрексельского университета; Адъюнкт-профессор медицины, Госпиталь Ланкенау
Пол Шик, доктор медицинских наук, является членом следующих медицинских обществ: Американского колледжа врачей, Американского общества гематологии
Раскрытие информации: не подлежит разглашению.
Главный редактор
Эммануэль Беса, доктор медицины Почетный профессор кафедры медицины, отделение гематологических злокачественных новообразований и трансплантации гемопоэтических стволовых клеток, Онкологический центр Киммеля, Медицинский колледж Джефферсона Университета Томаса Джефферсона
Эммануэль Беса, доктор медицины, является членом следующих медицинских организаций. общества: Американская ассоциация по образованию в области рака, Американское общество клинической онкологии, Американский колледж клинической фармакологии, Американская федерация медицинских исследований, Американское общество гематологии, Нью-Йоркская академия наук
Раскрытие: нечего раскрывать.
Дополнительные участники
Марсель Конрад, доктор медицины Заслуженный профессор медицины (на пенсии), Медицинский колледж Университета Южной Алабамы
Марсель Конрад, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американская ассоциация содействия развитию науки , Американская ассоциация банков крови, Американское химическое общество, Американский колледж врачей, Американское физиологическое общество, Американское общество клинических исследований, Американское общество гематологии, Ассоциация американских врачей, Ассоциация военных хирургов США, Международное общество гематологов, Общество по экспериментальной биологии и медицине, SWOG
. Раскрытие информации: Партнер не получил никаких финансовых интересов ни для кого.
Благодарности
Дэвид Абулафия, доктор медицины Медицинский директор, Дом Бейли-Боушей, клинический профессор, кафедра медицины, отделение гематологии, лечащий врач, отделение гематологии / онкологии, клиника Вирджиния Мейсон; Исследователь, Программа онкологии общественной клиники Вирджинии Мейсон / SWOG
Дэвид Абулафия, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей, Американской медицинской ассоциации, Американской ассоциации медицинских директоров, Американского общества гематологии, Американского общества инфекционных болезней и Phi Beta Kappa
.
Раскрытие: Ничего не раскрывать.
Трой Х. Гатри, младший, доктор медицины Директор Института рака, Баптистский медицинский центр
Трой Х. Гатри, младший, доктор медицинских наук является членом следующих медицинских обществ: Американской федерации медицинских исследований, Американской медицинской ассоциации, Американского общества гематологии, Флоридской медицинской ассоциации, Медицинской ассоциации Джорджии и Южной медицинской ассоциации
.
Раскрытие: Ничего не раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
Анемия, вызванная дефицитом витамина B-12 | Сидарс-Синай
Не то, что вы ищете?
Что такое анемия, вызванная дефицитом витамина B-12?
Анемия с дефицитом витамина B-12
состояние, при котором в вашем теле не хватает здоровых эритроцитов из-за
недостаток витамина B-12.Этот витамин необходим для выработки красных кровяных телец. Эти клетки несут
кислород ко всем частям вашего тела. Без достаточного количества эритроцитов ваши ткани и
органы не получают достаточно кислорода. Без достаточного количества кислорода ваше тело не может работать.
Фолиевую кислоту также называют фолиевой кислотой.
Это еще один витамин B. Либо недостаток витамина B-12, либо недостаток фолиевой кислоты вызывает тип
анемии называют мегалобластной анемией (пернициозной анемией). При этих типах анемии
красные кровяные тельца не развиваются нормально.Они очень большие. И они имеют форму
как овал. Здоровые эритроциты имеют округлую форму. Это заставляет костный мозг производить
меньше красных кровяных телец. В некоторых случаях эритроциты умирают раньше, чем обычно.
Что вызывает анемию, вызванную дефицитом витамина B-12?
Анемия, вызванная недостаточностью витамина B-12
чаще встречается у людей, чьи семьи происходят из Северной Европы. Это вызвано:
- Отсутствие внутреннего фактора. Внутренний
Фактор — это белок, производимый в желудке. Он необходим для усвоения витамина B-12. Этот
тип B-12 дефицитной анемии называется
злокачественная анемия. Неспособность усваивать витамин B-12
. Операция по удалению или обходу конца тонкой кишки может быть одной из
причина того, что B-12 не может всасываться. Другие причины включают изменения в тонкой кишке.
это ограничивает количество витамина B-12, которое вы можете усвоить.
Невозможность сделать внутреннее
Фактор может быть вызван несколькими причинами, например:
- Хронический гастрит
- Операция по удалению всего или части
желудок (гастрэктомия) - Аутоиммунное заболевание, при котором
тело атакует собственные ткани
Другие виды мегалобластной анемии
может быть связано с диабетом 1 типа, заболеванием щитовидной железы и семейным анамнезом
болезнь.
Кто подвержен риску развития анемии, вызванной недостаточностью витамина B-12?
Факторы риска витамина B-12
дефицитная анемия включает:
- Семейная история болезни
- Наличие части или всего желудка или
кишка удалена - Аутоиммунные заболевания, в том числе 1 типа
диабет - Болезнь Крона
- ВИЧ
- Некоторые лекарства
- Строгие вегетарианские диеты
- Быть пожилым человеком
Каковы симптомы витаминно-дефицитной анемии?
Симптомы у каждого человека могут отличаться.Симптомы могут включать:
- Слабые мышцы
- Ощущение онемения или покалывания в руках и
ноги - Проблемы при ходьбе
- Тошнота
- Пониженный аппетит
- Похудание
- Раздражительность
- Недостаток энергии или легкая утомляемость
(усталость) - Диарея
- Гладкий и нежный язык
- Быстрый пульс
Симптомы анемии, вызванной витамином B-12, могут быть похожи на симптомы других заболеваний крови или
проблемы со здоровьем.Всегда обращайтесь к своему врачу за диагнозом.
Как диагностируется анемия, вызванная недостаточностью витамина B-12?
Этот тип анемии обычно
обнаружен во время медицинского осмотра с помощью обычного анализа крови. Ваш лечащий врач будет
Изучите историю своего здоровья и проведите медицинский осмотр.
Вам также может понадобиться другая кровь
тесты. Вам также могут быть назначены другие процедуры оценки, такие как биопсия костного мозга.
Как лечится анемия, вызванная дефицитом витамина B-12?
Анемия с недостаточностью витамина B-12 и анемия с недостаточностью фолиевой кислоты часто
происходят вместе, и их трудно отличить друг от друга. Лечение может включать инъекции витамина B-12 или таблетки фолиевой кислоты.
Продукты, богатые фолиевой кислотой
включают:
- Апельсиновый сок
- Апельсины
- Салат Ромэн
- Шпинат
- Печень
- Рис
- Ячмень
- Ростки
- Зародыши пшеницы
- Соевые бобы
- Листовые овощи гр
- Фасоль
- Арахис
- Брокколи
- Спаржа
- Горох
- Чечевица
- Нут (фасоль гарбанзо)
Продукты, богатые как фолиевой кислотой
кислоты и витамин B-12 включают:
- Яйца
- Мясо
- Птица
- Молоко
- Моллюски
- Крупы обогащенные
Прием фолиевой кислоты внутрь работает
лучше, чем есть продукты, богатые фолиевой кислотой.Витамин B-12 не так хорошо усваивается
рот как при инъекции.
Жизнь с витаминной B-12-дефицитной анемией
В зависимости от причины вашего
дефицит витамина B-12, возможно, потребуется принимать витамин
Добавки B-12 на всю оставшуюся жизнь. Эти
могут быть таблетки или уколы. Это может показаться трудным. Но это позволит вам жить нормальной жизнью
без симптомов.
Если ваш дефицит вызван
ограничительная диета, возможно, вы захотите поработать с диетологом.Он или она может помочь обеспечить
что вы получаете достаточно витамина B-12 и других витаминов. Расскажите своему врачу о
любые симптомы и следуйте своему плану лечения.
Основные сведения об анемии, вызванной недостаточностью витамина B-12
- В этом состоянии ваше тело
не хватает здоровых эритроцитов из-за недостатка (дефицита) витамина
B - Это один из нескольких типов
мегалобластная анемия. - Без достаточного количества эритроцитов ваш
ткани и органы не получают достаточно кислорода. Без достаточного количества кислорода ваше тело не сможет
тоже работать. - Симптомы включают слабость мышц,
онемение, проблемы с ходьбой, тошнота, потеря веса, раздражительность, утомляемость и повышенная
частота сердцебиения. - Лечение может включать добавки витамина B-12. Также важно съесть
хорошо сбалансированное питание.
Следующие шаги
Советы, которые помогут получить максимальную отдачу от
визит к вашему лечащему врачу:
- Знайте причину вашего визита и
что вы хотите. - Перед визитом запишите
вопросы, на которые вы хотите получить ответы. - Возьмите с собой кого-нибудь, чтобы помочь вам спросить
вопросы и запомните, что вам говорит ваш провайдер. - При посещении запишите имя
новый диагноз и любые новые лекарства, методы лечения или тесты. Также запишите любые новые
инструкции, которые дает вам ваш провайдер. - Узнайте, почему новое лекарство или лечение
прописан, и как он вам поможет. Также знайте, каковы побочные эффекты. - Спросите, можно ли вылечить ваше состояние
другими способами. - Знайте, почему тест или процедура
рекомендуются и что могут означать результаты. - Знайте, чего ожидать, если не примете
лекарство или пройти тест или процедуру. - Если вам назначен повторный прием,
запишите дату, время и цель визита. - Узнайте, как можно связаться со своим провайдером
Если у вас есть вопросы.
Не то, что вы ищете?
Как диагностируется злокачественная анемия? | HOA
Ваш врач диагностирует злокачественную анемию на основании вашего медицинского и семейного анамнеза, медицинского осмотра и результатов анализов.
Ваш врач захочет выяснить, вызвано ли заболевание отсутствием внутреннего фактора или другой причиной. Он или она также захотят узнать серьезность состояния, чтобы его можно было надлежащим образом вылечить.
Привлечено специалистов
Врачи первичного звена, такие как семейные врачи, терапевты и педиатры (врачи, лечащие детей), часто диагностируют и лечат злокачественную анемию. Также могут быть задействованы другие врачи, в том числе:
- Невролог (специалист по нервной системе)
- Кардиолог (кардиолог)
- Гематолог (специалист по болезням крови)
- Врач гастроэнтеролог (пищеварительный тракт)
Медицинские и семейные истории
Ваш врач может спросить о ваших признаках и симптомах.Он также может спросить:
- Были ли у вас операции на желудке или кишечнике
- Страдаете ли вы какими-либо расстройствами пищеварения, такими как целиакия или болезнь Крона.
- О вашем питании и лекарствах, которые вы принимаете
- Есть ли у вас в семейном анамнезе анемия или злокачественная анемия
- Есть ли у вас в семейном анамнезе аутоиммунные заболевания (например, болезнь Аддисона, диабет 1 типа, болезнь Грейвса или витилиго). Исследования показывают, что может существовать связь между этими аутоиммунными расстройствами и пагубной анемией, вызванной аутоиммунным ответом.
Физический осмотр
Во время медицинского осмотра ваш врач может проверить, нет ли бледной или желтоватой кожи и увеличенной печени. Он или она может прислушиваться к вашему сердцу на предмет учащенного или нерегулярного сердцебиения или шума в сердце.
Ваш врач также может проверить наличие признаков повреждения нервов. Он или она может захотеть посмотреть, насколько хорошо работают ваши мышцы, глаза, чувства и рефлексы. Ваш врач может задавать вопросы или проводить тесты, чтобы проверить ваше психическое состояние, координацию и способность ходить.
Диагностические тесты и процедуры
Анализы крови и процедуры могут помочь диагностировать злокачественную анемию и выяснить, что ее вызывает.
Общий анализ крови
Часто первым тестом, используемым для диагностики многих типов анемии, является общий анализ крови. Этот тест измеряет многие части вашей крови. Для этого теста небольшое количество крови берется из вены (обычно в вашей руке) с помощью иглы.
CBC проверяет уровень вашего гемоглобина (HEE-muh-glow-bin) и гематокрита (hee-MAT-oh-crit). Гемоглобин — это белок, богатый железом, который помогает эритроцитам переносить кислород из легких в остальные части тела.Гематокрит — это показатель того, сколько красных кровяных телец занимают в вашей крови. Низкий уровень гемоглобина или гематокрита — признак анемии.
Нормальный диапазон этих уровней может быть ниже у определенных расовых и этнических групп населения. Ваш врач может объяснить вам результаты ваших анализов.
Общий анализ крови также проверяет количество эритроцитов, лейкоцитов и тромбоцитов (PLATE-let) в вашей крови. Аномальные результаты могут быть признаком анемии, другого заболевания крови, инфекции или другого состояния.
Наконец, общий анализ крови смотрит на средний корпускулярный (кор-ПУС-кюляр) объем (MCV). MCV — это мера среднего размера ваших эритроцитов. MCV может указывать на причину анемии. При пернициозной анемии эритроциты, как правило, больше, чем обычно.
Другие анализы крови
Если результаты общего анализа крови подтверждают, что у вас анемия, вам могут потребоваться другие анализы крови, чтобы выяснить, какой у вас тип анемии.
Подсчет ретикулоцитов (re-TIK-u-lo-site) измеряет количество молодых эритроцитов в крови.Тест показывает, вырабатывает ли ваш костный мозг эритроциты с правильной скоростью. Люди с злокачественной анемией имеют низкое количество ретикулоцитов.
Тесты сыворотки на фолат, железо и железосвязывающую способность также могут помочь определить, есть ли у вас злокачественная анемия или другой тип анемии.
Другой распространенный тест, называемый Комбинированным тестом на люминесценцию связывания, иногда дает ложные результаты. Ученые работают над созданием более надежного теста.
Ваш врач может порекомендовать другие анализы крови для проверки:
- Ваш уровень витамина B12.Низкий уровень витамина B12 в крови указывает на злокачественную анемию. Однако может возникнуть ложно нормальное или высокое значение витамина B12 в крови, если антитела мешают проведению теста.
- Уровень гомоцистеина и метилмалоновой кислоты (ММА). Высокий уровень этих веществ в организме — признак пагубной анемии.
- Для антител к внутреннему фактору и антител к париетальным клеткам. Эти антитела также являются признаком злокачественной анемии.
Тесты костного мозга
Анализы костного мозга могут показать, здоров ли ваш костный мозг и вырабатывает ли он достаточное количество эритроцитов.Два теста костного мозга — это аспирация (as-pi-RA-shun) и биопсия.
Для аспирации ваш врач удаляет небольшое количество жидкости костного мозга через иглу. Для биопсии ваш врач удаляет небольшое количество ткани костного мозга через иглу большего размера. Затем образцы исследуют под микроскопом.
При злокачественной анемии клетки костного мозга, которые превращаются в клетки крови, крупнее нормальных.
Источник: Национальный институт сердца, легких и крови, Национальные институты здравоохранения.
Витаминодефицитная анемия — Симптомы и причины
Обзор
Витаминодефицитная анемия — это нехватка здоровых эритроцитов, вызванная низким уровнем определенных витаминов, чем обычно. Витамины, связанные с витаминной анемией, включают фолиевую кислоту, витамин B-12 и витамин C.
Анемия из-за дефицита витаминов может возникнуть, если вы не едите достаточно продуктов, содержащих фолиевую кислоту, витамин B-12 или витамин C, или она может возникнуть, если ваш организм имеет проблемы с усвоением или обработкой этих витаминов.
Очень важно, чтобы ваш врач диагностировал и лечил вашу анемию. Анемию, вызванную дефицитом витаминов, обычно можно исправить с помощью витаминных добавок и изменений в рационе питания.
Продукты и услуги
Показать больше продуктов от Mayo Clinic
Симптомы
Признаки и симптомы витаминной анемии включают:
- Усталость
- Одышка
- Головокружение
- Кожа бледная или желтоватая
- Нерегулярное сердцебиение
- Похудание
- Онемение или покалывание в руках и ногах
- Слабость мышц
- Изменения личности
- Неустойчивые движения
- Умственное замешательство или забывчивость
Дефицит витаминов обычно развивается медленно в течение нескольких месяцев или лет.Признаки и симптомы дефицита витамина сначала могут быть незаметными, но они усиливаются по мере усугубления дефицита.
Причины
Витаминодефицитная анемия развивается, когда вашему организму не хватает витаминов, необходимых для производства достаточного количества здоровых эритроцитов. Красные кровяные тельца переносят кислород из легких по всему телу.
Если в вашем рационе не хватает определенных витаминов, может развиться витаминная анемия.Или может развиться витаминная анемия из-за того, что ваш организм не может должным образом усваивать питательные вещества из продуктов, которые вы едите.
Причины авитаминоза:
Анемия, вызванная недостаточностью фолиевой кислоты.
Фолат, также известный как витамин B-9, является питательным веществом, содержащимся в основном во фруктах и листовых зеленых овощах. Диета, в которой постоянно не хватает этих продуктов, может привести к дефициту.
Дефицит
также может возникнуть, если ваше тело не может усваивать фолиевую кислоту из пищи.Большинство питательных веществ из пищи всасывается в тонком кишечнике. У вас могут возникнуть трудности с усвоением фолиевой кислоты или фолиевой кислоты, синтетической формы фолиевой кислоты, которая добавляется в пищевые продукты и добавки, если:
- У вас заболевание тонкой кишки, например целиакия
- Вам хирургическим путем удалили или обошли большую часть тонкой кишки
- Вы употребляете чрезмерное количество алкоголя
- Вы принимаете определенные лекарства, отпускаемые по рецепту, например, противосудорожные препараты
Беременные и кормящие женщины имеют повышенную потребность в фолиевой кислоте, как и люди, проходящие диализ по поводу болезни почек.Несоблюдение этого повышенного спроса может привести к дефициту.
Анемия из-за дефицита витамина B-12
Дефицит витамина B-12 может быть результатом диеты, в которой отсутствует витамин B-12, который содержится в основном в мясе, яйцах и молоке.
Однако наиболее частой причиной анемии, вызванной дефицитом витамина B-12, является недостаток вещества, называемого внутренним фактором, который может быть вызван тем, что ваша иммунная система по ошибке атакует клетки желудка, вырабатывающие это вещество.Этот тип анемии называется злокачественной анемией.
Внутренний фактор — это белок, выделяемый желудком, который присоединяется к витамину B-12 в желудке и перемещает его по тонкой кишке для всасывания в кровоток. Без внутреннего фактора витамин B-12 не может усваиваться и покидает ваше тело в виде отходов.
Люди с аутоиммунными нарушениями, связанными с эндокринной системой, такими как диабет или заболевание щитовидной железы, могут иметь повышенный риск развития злокачественной анемии.
Анемия, вызванная дефицитом витамина B-12, также может возникнуть, если ваш тонкий кишечник не может усваивать витамин B-12 по причинам, не связанным с отсутствием внутреннего фактора.Это может произойти, если:
- Вы перенесли операцию на желудке или тонком кишечнике, например, операцию обходного желудочного анастомоза
- У вас аномальный рост бактерий в тонком кишечнике
- У вас кишечное заболевание, такое как болезнь Крона или целиакия, которое препятствует всасыванию витамина
- Вы проглотили ленточного червя из-за поедания зараженной рыбы. Ленточный червь выводит из организма питательные вещества.
Анемия, вызванная недостаточностью витамина C
Дефицит витамина C может развиться, если вы не получаете достаточного количества витамина C из продуктов, которые вы едите.Дефицит витамина С также возможен, если что-то ухудшает вашу способность усваивать витамин С из пищи. Например, курение снижает способность вашего организма усваивать витамин С.
Некоторые хронические заболевания, такие как рак или хроническая болезнь почек, также повышают риск развития анемии, вызванной недостаточностью витамина С, поскольку влияют на всасывание витамина С.
Факторы риска
На запасы витаминов в вашем организме может влиять ряд факторов. В целом ваш риск авитаминоза увеличивается, если:
В вашем рационе мало или совсем нет натуральных источников витаминов, таких как мясо, молочные продукты, фрукты и овощи.В эту категорию могут попасть вегетарианцы, которые не едят молочные продукты, и веганы, которые не едят продукты животного происхождения.
Постоянное переваривание пищи также может вызвать дефицит витаминов.
- Вы беременны, и не принимаете поливитамины. Добавки фолиевой кислоты особенно важны во время беременности.
- У вас проблемы с кишечником или другие заболевания , мешающие усвоению витаминов.Аномальный рост бактерий в желудке или операция на кишечнике или желудке могут препятствовать всасыванию витамина B-12.
- Вы злоупотребляете алкоголем. Алкоголь препятствует усвоению фолиевой кислоты и витамина С, а также других витаминов.
- Вы принимаете определенные рецептурные лекарства , которые могут блокировать всасывание витаминов. Противосудорожные препараты могут блокировать всасывание фолиевой кислоты. Антациды и некоторые лекарства, используемые для лечения диабета 2 типа, могут мешать абсорбции B-12.
Осложнения
Дефицит витаминов увеличивает риск многих проблем со здоровьем, в том числе:
Осложнения беременности
Беременные женщины с дефицитом фолиевой кислоты могут с большей вероятностью столкнуться с такими осложнениями, как преждевременные роды. У развивающегося плода, который не получает достаточного количества фолиевой кислоты от матери, могут развиться врожденные дефекты головного и спинного мозга.
Если вы думаете о беременности, спросите своего врача, следует ли вам рассмотреть возможность приема добавок фолиевой кислоты, чтобы запасов фолиевой кислоты в вашем организме было достаточно для поддержки вашего ребенка.
Нарушения нервной системы
Хотя витамин B-12 важен для производства красных кровяных телец, он также важен для здоровья нервной системы.
Без лечения дефицит витамина B-12 может привести к неврологическим проблемам, таким как постоянное покалывание в руках и ногах или проблемы с равновесием. Это может привести к спутанности сознания и забывчивости, потому что витамин B-12 необходим для здорового функционирования мозга.
Без лечения дефицита витамина B-12 неврологические осложнения могут стать необратимыми.Дефицит витамина B-12 может вызвать эти и другие проблемы со здоровьем, прежде чем он приведет к анемии.
Цинга
Недостаток витамина С может привести к цинге. Признаки и симптомы этого редкого заболевания включают кровотечение под кожей и вокруг десен.
Профилактика
Выберите здоровую диету
Вы можете предотвратить некоторые формы авитаминоза, выбрав здоровую диету, включающую разнообразные продукты.
Продукты, богатые фолиевой кислотой, включают:
- Темно-зеленые листовые овощи
- Гайки
- Обогащенные зерновые продукты, такие как хлеб, крупы, макаронные изделия и рис
- Фрукты и фруктовые соки
Продукты, богатые витамином B-12, включают:
- Яйца
- Обогащенные продукты, такие как сухие завтраки
- Молоко, сыр и йогурт
- Мясо и моллюски
Продукты, богатые витамином С, включают:
- Брокколи
- Цитрусовые и соки
- Клубника
- Зеленый перец
- Помидоры
Большинство взрослых нуждаются в дневном рационе следующих витаминов:
- Витамин B-12 — 2.4 мкг (мкг)
- Фолат или фолиевая кислота — 400 мкг
- Витамин C — от 75 до 90 миллиграммов
Беременным и кормящим женщинам может потребоваться больше каждого витамина.
Подумайте о поливитаминах
Если вы беспокоитесь о том, чтобы получать достаточное количество витаминов из пищи, которую вы едите, спросите своего врача, подходят ли вам поливитамины. Большинство людей получают достаточное количество витаминов из продуктов, которые они едят.Но если ваша диета ограничена, вы можете принять поливитамины.
Не курите
Курение препятствует усвоению питательных веществ, таких как витамин С, поэтому может повысить риск дефицита витаминов.
Если вы курите, бросьте. Если вы не курите, не начинайте. Если вы пытались бросить курить самостоятельно и безуспешно, поговорите со своим врачом о стратегиях, которые помогут вам бросить курить.
Если употреблять алкоголь умеренно,
Алкоголь может способствовать развитию авитаминоза.Если вы решите употреблять алкоголь, делайте это умеренно. Для здоровых взрослых умеренное употребление алкоголя обычно считается равным:
.
- Два напитка в день для мужчин 65 лет и младше
- Один напиток в день для мужчин старше 65 лет
- Один напиток в день для женщин любого возраста
Напиток — это 12 унций (355 миллилитров) пива, 5 унций (148 миллилитров) вина или 1,5 унции (44 миллилитра) крепких спиртных напитков.
Декабрь10, 2019
Злокачественная анемия | BMJ
- Мухаджир Мохамед, гематолог-консультант и адъюнкт-профессор медицины1 2,
- Джоэл Тио, медицинский интерн3,
- Реми Сьюзан Томас, медицинский интерн4,
- Джехан Филлипс, терапевт5
- 1 1 of Medicine, Общая больница Лонсестона, Австралия
- 2 Университет Тасмании, Клиническая школа Лонсестона, Лонсестон, Австралия
- 3 Департамент медицины, Общая больница Лонсестона, Австралия.
- 4 Департамент медицины, Таунсвиллская больница, Таунсвилл, Австралия
- 5 First point Healthcare, Лонсестон, Австралия.
- Для корреспонденции: M Mohamed muhajirbm {at} yahoo.com
Что вам нужно знать
Рассмотрите возможность злокачественной анемии у пациентов с жалобами на необъяснимую усталость, потерю памяти, плохую концентрацию внимания или парестезию
Около трети пациентов могут иметь нормальный уровень B12 и нормоцитарную анемию, что приводит к пропущенному или отложенному диагнозу
Скрининговые тесты для пациентов с подозрением на злокачественную анемию должны включать полный анализ крови и анализ кобаламина в сыворотке
Быстрое лечение Добавка B12 обычно обращает вспять анемию и неврологические симптомы, и пациенты будут нуждаться в добавке B12 на протяжении всей жизни
Женщина 55 лет обращается к своему терапевту с утомляемостью, ощущением «иголок» в ногах и плохой концентрацией.Клиническое обследование и стандартные анализы крови без особенностей. Ее симптомы постепенно ухудшались в течение двух лет. У нее также появилась одышка при физической нагрузке и шаткость при ходьбе. При осмотре у нее была бледность, тахикардия в покое и сенсорная нейропатия обеих ног. Мазок периферической крови выявил макроцитарную анемию и гиперсегментированные нейтрофилы. Дальнейшие исследования подтвердили тяжелый дефицит B12, вызванный злокачественной анемией.
Что такое злокачественная анемия?
Пагубная анемия — это аутоиммунное заболевание, поражающее слизистую желудка с нарушением всасывания диетического кобаламина (витамина B12), что приводит к дефициту B12.На рисунке 1 изображена патофизиология злокачественной анемии. Витамин B12 необходим для образования клеток крови и миелинизации нервов. Его недостаток вызывает мегалобластную анемию. Демиелинизация нейронов и последующая дегенерация приводят к неврологическим и психоневрологическим проявлениям.1
Рис. 1
(a) Нормальный процесс всасывания кобаламина из пищи и (b) патофизиология злокачественной анемии
Насколько это распространено?
Пагубная анемия встречается относительно редко.От 50 до 200 на 100000 человек в Великобритании и 150 на 100000 человек в США страдают.2 Заболевание может поражать все возрастные группы, но чаще встречается у взрослых старше 70 лет.1 Из-за его связи с аутоиммунными заболеваниями. таких заболеваний, как аутоиммунный тиреоидит, болезнь Аддисона, витилиго и диабет 1 типа, личный или семейный анамнез этих состояний увеличивает вероятность злокачественной анемии.34…
Симптомы, причины, диагностика и лечение
Пагубная анемия — это аутоиммунное заболевание, при котором организм не может правильно усваивать витамин B12.Это приводит к появлению симптомов анемии (снижение количества функционирующих эритроцитов) и другим проблемам. Слово «пагубный» означает постепенно вредный и разрушительный. Исторически сложилось так, что до того, как мы поняли его роль и не стали доступны препараты витамина B12, он часто был фатальным.
Пагубную анемию также иногда называют «аутоиммунным гастритом» или «болезнью Бирмера». Это чаще встречается у пожилых людей и, по оценкам, поражает около 2% взрослых в возрасте старше 60 лет.
AlexRaths / iStock / Getty Images Plus / Getty Images
Симптомы пагубной анемии
Симптомы часто появляются постепенно и сначала незначительны, но могут усугубиться, если их не лечить.Например, первым признаком может быть легкая усталость. Другие симптомы злокачественной анемии могут включать следующее:
- Бледная кожа
- Слабость в руках и ногах
- Покалывание или покалывание в коже
- Одышка
- Головокружение
- учащенное сердцебиение
- Вздутие живота
- Диарея
- Потеря веса
- Отек конечностей
- Потемнение кожи
- Плохое равновесие
- Забывчивость и снижение общей когнитивной функции
Если не лечить злокачественную анемию в течение длительного периода времени, эти когнитивные проблемы могут усугубиться, что может вызвать психоз или слабоумие.В крайних случаях это может вызвать серьезные проблемы с нервной системой и даже смерть.
Люди с пагубной анемией также имеют гораздо более высокую, чем в среднем, вероятность наличия других аутоиммунных состояний, которые могут возникнуть до или после появления симптомов пагубной анемии. Например, у них повышен риск диабета 1 типа, аутоиммунного заболевания щитовидной железы и витилиго. Они могут вызывать дополнительные, отчетливые симптомы.
Люди с злокачественной анемией также имеют повышенный риск развития некоторых типов рака желудка, включая карциноидные опухоли желудка и аденокарциномы.Взаимодействие с другими людьми
Причины
Наиболее частой причиной злокачественной анемии является аутоиммунный гастрит, приводящий к дефициту витамина B12. Редко есть генетическая или врожденная причина. Существуют также другие состояния, приводящие к плохому усвоению или низкому содержанию витамина B12.
Дефицит витамина B12 вследствие аутоиммунного гастрита
Симптомы злокачественной анемии возникают из-за того, что она приводит к дефициту витамина B12 (также известного как «кобаламин»).
Витамин B12 важен для многих различных химических реакций в организме.Он выполняет несколько важных функций, включая помощь в синтезе ДНК. Он играет ключевую роль в мозге и нервной системе, а также необходим для выработки здоровых эритроцитов. Поэтому неудивительно, что симптомы возникают, когда в организме недостаточно витамина B12.
Витамин B12 должен поступать с пищей через продукты животного происхождения. Некоторые клетки, выстилающие внутреннюю часть желудка, вырабатывают особый белок, называемый внутренним фактором, который связывается с витамином B12.Он помогает транспортировать витамин в тонкий кишечник, где он может всасываться в кровь и в конечном итоге использоваться организмом.
При злокачественной анемии что-то влияет на способность организма эффективно вырабатывать внутренний фактор. Из-за аутоиммунного гастрита (основная причина злокачественной анемии) иммунная система организма активируется ненормально.
Антитела образуются против внутреннего фактора и клеток, которые его производят, вызывая воспаление в желудке. Из-за этого воспалительного процесса клетки желудка не вырабатывают столько внутреннего фактора, сколько следовало бы, и организм не усваивает достаточное количество витамина B12, что приводит к симптомам пагубной анемии.Взаимодействие с другими людьми
Исследователи все еще изучают, почему это происходит с некоторыми людьми. Наличие вариаций определенных генов, важных для иммунной системы, может увеличить вероятность этого, и у вас может быть больший риск, если это было у кого-то из членов вашей семьи. Риск также увеличивается с возрастом.
Другие причины дефицита витамина B12
Хотя симптомы злокачественной анемии вызваны дефицитом витамина B12, это не единственная возможная причина такого дефицита. Это может быть вызвано другими ситуациями, в том числе теми, которые снижают эффективное усвоение витамина B12.
Возможные причины включают болезнь Крона, паразитарную инфекцию, плохое питание (например, у лиц, придерживающихся веганской диеты), побочные эффекты лекарств (например, от метформина) или как побочный эффект некоторых операций на желудочно-кишечном тракте. Пагубная анемия считается основной причиной дефицита витамина B12 примерно в 20-50% случаев.
Технически говоря, злокачественная анемия относится к дефициту витамина B12 из-за отсутствия внутреннего фактора (из-за аутоиммунного гастрита).Однако иногда люди используют этот термин в более широком смысле для обозначения анемии и других проблем, возникающих из-за дефицита витамина B12 по любой причине.
Крайне редко злокачественная анемия может быть вызвана генетическим заболеванием, при котором организм не может нормально вырабатывать внутренний фактор. Этот тип называется «врожденная злокачественная анемия» или «недостаточность внутреннего фактора». В отличие от более распространенной формы симптомы обычно начинаются в детстве.
Диагностика
Для клиницистов важно исключить другие потенциальные причины ваших симптомов, включая различные проблемы, которые могут привести к дефициту витамина B12.
История болезни является отправной точкой для постановки диагноза. Врач спрашивает о недавних симптомах, долгосрочных медицинских проблемах и других важных темах.
Например, ваш врач может спросить вас, есть ли у вас другое аутоиммунное заболевание или перенесли ли вы операцию на желудочно-кишечном тракте (например, по поводу потери веса). Медицинский осмотр предоставляет дополнительную ключевую исходную информацию, например информацию о том, как работает нервная система.
Базовые лабораторные исследования могут помочь указать на возможный дефицит витамина B12.Анализ, называемый полным анализом крови (CBC), часто может дать некоторые ключевые подсказки.
У людей с злокачественной анемией эти тесты могут показать снижение количества функционирующих эритроцитов в организме. Например, низкий уровень гемоглобина — белка, переносящего кислород, — может быть признаком анемии. Низкий гематокрит, который показывает количество места, которое эритроциты занимают в крови, также может быть признаком.
У людей с пернициозной анемией красные кровяные тельца также больше, чем обычно, по результатам теста, называемого средним корпускулярным объемом (также выполняемого как часть общего анализа крови).Взаимодействие с другими людьми
В зависимости от ситуации вам могут потребоваться дополнительные тесты для определения причины анемии, хотя не всем эти тесты понадобятся. Возможные анализы крови могут включать:
- Витамин B12
- Число ретикулоцитов
- Тесты на железо
- Тесты на антитела к внутреннему фактору
- Метилмалоновая кислота и / или гомоцистеин (может быть повышен при пернициозной анемии)
- Гастрин (может быть повышен при злокачественной анемии)
Другой старый тест, тест Шиллинга, сейчас выполняется редко.
Пагубную анемию бывает труднее обнаружить у людей с дефицитом железа. Это потому, что дефицит железа может вызвать другой тип анемии, при которой красные кровяные тельца становятся меньше, а не больше.
У человека может быть дефицит как железа, так и B12, возможно, из-за очень плохого питания или проблем с абсорбцией из-за аутоиммунного гастрита. Это немного затрудняет интерпретацию.
К сожалению, диагностика иногда бывает сложной, потому что стандартные тесты не всегда можно использовать для прямой интерпретации.Иногда бывает полезно пройти еще один анализ — эндоскопическую биопсию желудка, если диагноз сомневается.
Крайне важно, чтобы врачи учитывали возможность злокачественной анемии, потому что лечение витамином B12 может значительно улучшить симптомы, которые могут стать опасными для жизни, если их не лечить.
Лечение
Лечение злокачественной анемии несложно. Пострадавшие люди должны принимать витамин B12, чтобы восполнить дефицит.Это часто делается в виде серии инъекций в мышцу с уменьшающейся частотой в течение нескольких месяцев. Большинство людей замечают радикальное улучшение своих симптомов в течение 24 часов, а сама анемия начинает улучшаться в течение недели.
Другой вариант — пероральный прием витамина B12, хотя он не рекомендуется людям с серьезными неврологическими симптомами. В любом случае вам нужно будет начать с более высокой и / или более частой дозы. Но вам, вероятно, придется принимать витамин B12 всю оставшуюся жизнь либо в виде ежемесячных инъекций, либо в виде ежедневного перорального приема.Взаимодействие с другими людьми
Если у вас пагубная анемия (и не только проблемы из-за недостаточного употребления продуктов с витамином B12), увеличения потребления B12 с помощью одной диеты обычно недостаточно для решения проблемы.
Профилактика и мониторинг
Ваш врач также может порекомендовать вам периодическую эндоскопию желудка, возможно, каждые три-пять лет.