Как победить состояние дисбактериоза у детей?
Дисбактериоз в последнее время — весьма распространённое состояние у детей, особенно у грудничков. Оно доставляет дискомфорт малышам, ухудшая их общее состояние, самочувствие, мешает нормальному набору веса ребенка и причиняет массу беспокойств их родителям. Кроме того, микрофлора играет немаловажную роль в жизнедеятельности человека. Она регулирует перистальтику кишечника, поддерживает и стимулирует иммунную систему, синтезирует многие витамины, обеспечивает противовирусную защиту хозяина, нормализует обменные процессы, помогает усваивать многие микроэлементы и аминокислоты, помогает очищать организм от токсинов и препятствует проникновению чужеродных микробов в кровь. Всего в организме человека в кишечнике в высушенном виде находится 1,5 килограмма полезных микробов – это целый «орган». Их деятельность, значимость, можно сравнить с функцией двух органов печени и почек вместе взятых! О причинах возникновения дисбактериоза и методах борьбы с ним рассказывает заведующий отделением детской гастроэнтерологии Челябинской областной детской клинической больницы, врач высшей категории Вадим Земляков.
— Вадим Леонидович, дисбактериоз некоторые врачи считают болезнью. Каково Ваше мнение по этому поводу?
— Дисбактериоз – это состояние, которое может развиваться при различных заболеваниях или неблагоприятных окружающих условиях человека. Приведу простой пример: вы сидите на лекции или в кино, в зале душно нарастает количество углекислого газа в воздухе. В этой ситуации постепенно начинает развиваться состояние дисбактериоза. На работе отругал начальник, человек получил новую порцию стресса, усилилась моторика кишечника, положено начало к развитию состояния дисбактериоза. На нормальную кишечную флору, и не только кишечную, но и на флору всех полостных органов влияет: неправильное питание, плохая экология, изменение климата, различные ионизирующие излучения, которые окружают человека в повседневной жизни, воспалительные заболевания, прием лекарственных средств. Но это не болезнь – это изменение флоры (состояние временное) в зависимости от внешних условий воздействия.
— Дисбактериоз может быть только в кишечнике или этому подвержены все слизистые оболочки организма?
— Нарушенная кишечная флора будет отрицательно действовать на слизистую всех полостных органов в которых она имеется (полость рта, пищевод, желудок, кишечник, влагалище и др.). Здесь появляется цепочка взаимосвязей: болезнь слизистой кишки влияет на состояние микрофлоры, нарушенная микрофлора – на слизистую.
— По каким признакам родители могут определить, что у ребенка имеется состояние дисбактериоза?
— Родителям стоит задуматься, если у ребенка снижается аппетит, ребенок бледный с синюшными кругами под глазами и под носом. Если у ребенка периодически отмечается подташнивание, бурчание и боли в животе, меняется стул, в кале присутствует зелень или кусочки непереваренной пищи. Ребенок плохо прибавляет в весе, срыгивает, начинает часто болеть простудными заболеваниями. Возможно, вечером, а именно в семь часов, отмечается субфебрильная температура — 37,1-37,2. При условии, что держат ртутный стеклянный (а не электронный) градусник именно 10 минут — это очень важно. Данные признаки могут говорить о болезнях органов пищеварения и в частности о состоянии дисбактериоз.
При условии, что держат ртутный стеклянный (а не электронный) градусник именно 10 минут — это очень важно. Данные признаки могут говорить о болезнях органов пищеварения и в частности о состоянии дисбактериоз.
— Насколько состояние кишечной флоры влияет на иммунитет ребенка?
— При изменении кишечной микрофлоры ребенка в худшую сторону происходит снижение иммунитета. Когда у ребенка появляются частые простудные заболевания, это тоже говорит о том, что органы пищеварения не позволяют иметь 100%-ный иммунитет. Ведь у человека иммунитет на 98% зависит от состояния микрофлоры толстой кишки. И когда она нарушается, иммунитет падает, а, значит, появляются частые простуды.
— То есть, если у родителей часто болеет ребенок, они должны задуматься о посещении гастроэнтеролога?
— Как один из моментов. Мы знаем, что многие болезни: кожи, зубов, слизистых, вплоть до бронхиальной астмы, – это порой осложнение болезней органов пищеварения. Когда мне задают подобные вопросы, я сразу вспоминаю один случай: выходит конферансье на сцену и говорит: «У меня сегодня что-то болит голова». Его напарник отвечает: «Наверное, ты что-то не то съел». Зрители в зале смеются, но ведь он сказал все правильно. Головная боль может быть прямым следствием проблем желудочно-кишечного тракта.
Его напарник отвечает: «Наверное, ты что-то не то съел». Зрители в зале смеются, но ведь он сказал все правильно. Головная боль может быть прямым следствием проблем желудочно-кишечного тракта.
— Как врач определяет наличие у ребенка состояния дисбактериоза?
— Существуют различные методы исследования микробной флоры у человека. Очень важно при оценке анализа кала на дисбактериоз учитывать возраст пациента, принципы его питания, период посева: как его собирали, и когда был сдан кал. И без учета данных факторов нельзя правильно оценить полученный результат. Потому что цифры в конечном итоге будут разные. Приведу простой пример: если пациент употребляет больше кисломолочных продуктов, то у него бактерий coli будет значительно меньше, но это не значит, что это болезнь. Если он ест больше мяса, у него бактерий coliбудет больше, а бифидум меньше и так далее. Поэтому сам анализ нужно интерпретировать с учетом этих всех моментов.
— Когда ребенок сдает анализ, все эти факторы обследуются досконально?
— Нет, конечно.
— Тогда получается нельзя с точностью определить у ребенка наличие дисбактериоза?
— Без учета данных факторов нельзя. Поэтому многие родители, когда обращаются к нам за помощью, часто удивляются, почему мы спрашиваем все тонкости и подробности питания, которые в принципе никто никогда не спрашивает. Поэтому мы положительно отличаемся и в плане лечения, и в плане диагностики, и в плане результата. И поэтому к нам всегда огромная очередь.
— Какие методы лечения состояния дисбактериоза существуют и надо ли его вообще лечить?
— Лечить обязательно надо! Начинать лечение необходимо с основного заболевания, приведшего к этому состоянию или с той причины, которая привела к нему. Естественно, первично назначаются лекарственные препараты, которые воздействуют непосредственно на устранение основной причины. Предположим, у ребенка имеется гастрит, проводится его лечение и плюс назначаются препараты улучшающие микрофлору кишечника ребенка. Если ребенок находится в помещениях, где имеются различные домашние «приборы-излучатели» (телевизор, компьютер, микроволновая печь, радиотелефон, и другие, то, соответственно, их необходимо использовать, как можно реже. Если фактором, приводящим к болезни, являются лекарственные препараты (антибиотики и др.), то их по возможности надо заменить или исключить совсем. То есть, сначала необходимо убрать факторы, отрицательно влияющие на нормальную кишечную флору ребенка. И только после этого, появляется возможность ее восстанавливать.
Если фактором, приводящим к болезни, являются лекарственные препараты (антибиотики и др.), то их по возможности надо заменить или исключить совсем. То есть, сначала необходимо убрать факторы, отрицательно влияющие на нормальную кишечную флору ребенка. И только после этого, появляется возможность ее восстанавливать.
— Врач сможет точно определить, отчего именно развился дисбактериоз?
— Чаще всего, мы видим причину.
— Существует ли профилактика дисбактериоза?
— В первую очередь необходимо следить за состоянием здоровья ребенка. Обязательно нужно придерживаться принципов здорового питания. В ежедневном рационе ребенка должна содержаться растительная клетчатка (овощи, фрукты, зерновые каши), которая способствует восстановлению кишечной микрофлоры. Естественно, набор должен быть полный: микроэлементы, витамины, ферменты. В рационе должна преобладать растительная пища, обязательно ребенку необходимо употреблять кисломолочные продукты и белки, в виде яиц, мяса, курицы, рыбы. Это будет способствовать восстановлению нормальной кишечной флоры.
Это будет способствовать восстановлению нормальной кишечной флоры.
— Можно вести здоровый образ жизни, но ведь от стрессов и излучений уберечься гораздо сложнее. Какой выход в этом случае?
— Единственный – избавиться от источника негатива. Если, допустим, у вас стресс на работе, то нужно заменить место работы. И это абсолютно серьезно, ведь мы живем один раз. Быть в постоянном стрессе и лечиться от болезней – это не лучшее решение проблемы. Это просто бессмысленно. Не зря считают японцы, что место работы надо менять один раз в пять лет. И на каждом предприятии у них имеется комната разгрузки, в которой стоят муляжи начальников. Если начальник тебя обидел, заходишь в эту комнату и имеющейся там палкой лупишь по данному муляжу. Начальника, чей муляж разрушается быстрее остальных, увольняют с предприятия. Это и есть профилактика болезней у сотрудников и борьба за более высокую производительность на предприятии.
— Получается, что также не рационально жить в Челябинской области, где экология не самая лучшая?
— Безусловно, проживать у Средиземного моря или в горах Грузии гораздо полезнее, чем в Челябинской области. Приведу простой пример: в 1991 году мы по линии «Зеленого креста» детей с гастроэнтерологической паталогией вывозили для оздоровления в Карловы Вары. Я взял с собой огромную коробку с лекарствами на случай обострения болезней, потому что каждый ребенок имел серьезное заболевание органов пищеварения. И прожив там 1,5 месяца, ни один из детей не пожаловался на плохое самочувствие. Но как только мы пересекли Брест и сходили в ресторан в поезде, ровно в течение двух суток, которые мы ехали, были использованы все припасенные лекарства. У детей начались проблемы со здоровьем в связи с ухудшением качества питания, воды и воздуха.
Приведу простой пример: в 1991 году мы по линии «Зеленого креста» детей с гастроэнтерологической паталогией вывозили для оздоровления в Карловы Вары. Я взял с собой огромную коробку с лекарствами на случай обострения болезней, потому что каждый ребенок имел серьезное заболевание органов пищеварения. И прожив там 1,5 месяца, ни один из детей не пожаловался на плохое самочувствие. Но как только мы пересекли Брест и сходили в ресторан в поезде, ровно в течение двух суток, которые мы ехали, были использованы все припасенные лекарства. У детей начались проблемы со здоровьем в связи с ухудшением качества питания, воды и воздуха.
— А какова роль наследственности в развитии болезней ЖКТ?
— Безусловно, большую роль в здоровье ребенка играет здоровье его родителей. Они передают ему предрасположенность к заболеваниям органов пищеварения. Если мама нездорова, то качество ее грудного молока будет низким, что является следующим фактором не в пользу ребенка.
— Во время грудного вскармливания мама должна соблюдать особый режим питания или диету?
— Питание должно быть полноценным и разнообразным. При наличии заболеваний ЖКТ у матери с профилактической целью могут быть назначены лекарства, улучшающие ее состояние. На это мама сама должна обратить внимание врача-гинеколога, потому что ее состояние здоровья на момент рождения ребенка играет большую роль в формировании здоровья малыша. В частности, насколько полноценным будет состав его микрофлоры кишечника. Ведь заселение нормальных микробов в кишечник ребенка происходит в утробе матери, начиная 26-28 недели.
При наличии заболеваний ЖКТ у матери с профилактической целью могут быть назначены лекарства, улучшающие ее состояние. На это мама сама должна обратить внимание врача-гинеколога, потому что ее состояние здоровья на момент рождения ребенка играет большую роль в формировании здоровья малыша. В частности, насколько полноценным будет состав его микрофлоры кишечника. Ведь заселение нормальных микробов в кишечник ребенка происходит в утробе матери, начиная 26-28 недели.
— Какие продукты детям не рекомендуется употреблять в пищу?
— Существует пять основных вредных продуктов – это газированные напитки, майонез, кетчуп, чипсы и жевательная резинка. Это все продукты генной инженерии. Например, длительное использование жевательной резинки приводит к слабоумию (наличие в ней фенолов). Более того, она покрыта вредным вкусообразующим веществом. А частое ее использование ведет к нарушению пищевого рефлекса. И в следующий раз при глотании пищи желудок не будет готов к ее перевариванию.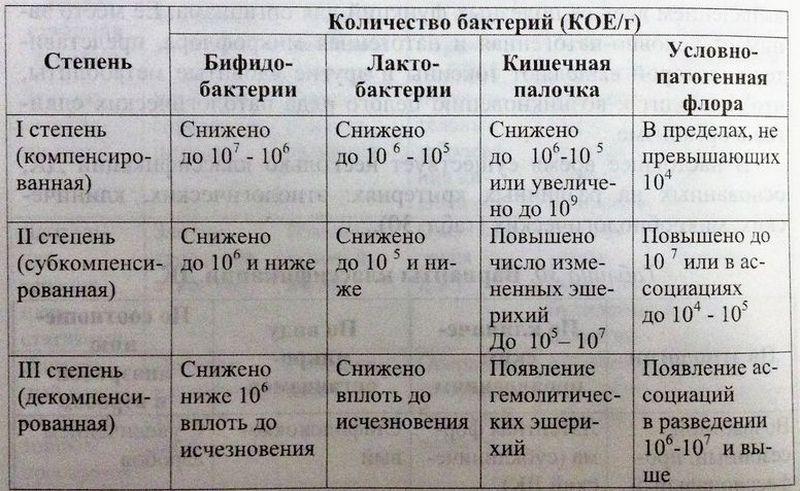
— А какие продукты лучше не давать до трех лет?
— Все продукты до трех лет должны быть натуральными, не консервированными! Использовать их можно в сыром или вареном виде. Жареное и копченое, маринованное, шоколадное, естественно, нельзя. Хотя в последнее время надо уже говорить и о вредных привычках у детей раннего возраста, когда малышам матери начинают давать по чайной ложке водки на ночь, чтобы они лучше спали. А для аппетита детям стали давать пиво. Это встречается достаточно часто в последнее время. К нам поступают дети раннего возраста с циррозом печени, потому что мама, вскармливая ребенка грудью, употребляла алкогольные напитки и курила.
— Как вы относитесь к употреблению молока в питании детей?
— Учитывая тот факт, что идеально здоровых детей нет, употребление молока многим из них может быть не на пользу. Молоко может способствовать излишнему росту микрофлоры, а порой, организм ребенка не способен его переварить (лактазная недостаточность). Поэтому мы, гастроэнтерологи, больше ратуем за употребление кисломолочных продуктов, сыров.
Поэтому мы, гастроэнтерологи, больше ратуем за употребление кисломолочных продуктов, сыров.
— Если ребенок вынужден принимать антибиотики, что нужно делать в профилактических целях, чтобы не развился дисбактериоз?
— Лучше всего прием антибиотиков сочетать с отваром трав, например, тысячелистника, подорожника, ромашки или душицы. Они на 80% снижают отрицательное воздействие антибиотиков на слизистую кишечника и его микрофлору.
— Как часто встречаются заболевания органов пищеварения?
— Заболевания желудочно-кишечного тракта у детей находятся на втором месте после респираторных инфекций. И это если учесть, что ребенок болеет ОРВИ 2-3 раза за год, а диагноз заболевания ЖКТ ставится однократно.
— Вы лечите детей только с области или из Челябинска тоже?
— ЧОДКБ обслуживает жителей Челябинской области вне зависимости от ее территорий, то есть сюда входит и Челябинск. Но учитывая тот факт, что в Челябинске имеются в достаточном количестве гастроэнтерологические койки и специалисты, диагностика тоже на высоком уровне, мы стараемся брать из Челябинска только самые тяжелые и сложные случаи. И последним этапом, если уже мы не можем оказать помощь, пациентами занимается институт педиатрии в Москве.
И последним этапом, если уже мы не можем оказать помощь, пациентами занимается институт педиатрии в Москве.
— Каким образом дети попадают к вам?
— Они приезжают по направлению врачей из территорий области на консультативный прием в детскую областную поликлинику к специалисту-гастроэнтерологу. Осмотрев ребенка, и проведя необходимые исследования, врач решает необходимость его госпитализации или лечения в амбулаторных условиях. Вторым вариантом прибытия пациента в областную детскую поликлинику или на госпитализацию в отделение является осмотр врача-гастроэнтеролога «выездной поликлиники». Это когда наши специалисты консультируют детей по месту их проживания.
Ольга Мельчакова, информационное агентство «Уралпресс»
Дисбактериоз у новорожденных и грудных детей | Bifiform ru
В норме микрофлора кишечника состоит в среднем из 1 млн микробов на 1 мл содержимого. Нормальную микрофлору составляют 15-20 представителей анаэробных (бактерии, которые не могут жить в присутствии кислорода) и аэробных (способных существовать в присутствии кислорода) бактерий основных родов: бактероиды, бифидобактерии, лактобактерии и другие. Бифидобактерии относятся к доминирующей микрофлоре (Ig10-11)1,2
Бифидобактерии относятся к доминирующей микрофлоре (Ig10-11)1,2
Здоровая микрофлора участвует в пищеварительных процессах организма, усиливает активность пищеварительных ферментов, действует на моторику желудочно-кишечного тракта, способствует выработке витаминов, гормонов, аминокислот и повышает иммунитет.
Также микрофлора выполняет детоксикационную и антиаллергенную функции. Защитные функции кишечника сводятся к созданию барьера для размножения болезнетворных бактерий и разрушения аллергенов. Нормальная микрофлора также обладает антиоксидантными, антимутагенными и противораковыми функциями1,2
Формирование микрофлоры
Формирование и функционирование иммунной системы происходит в 2 этапа. Первый заключается в формировании клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в период раннего эмбриогенеза (ранние этапы беременности).
Второй этап — начинается после рождения человека и заселения микробами слизистых оболочек, в том числе и ЖКТ. Кишечник – представляет собой не только часть пищеварительной системы, но и является иммунным органом, до 80% иммунных клеток располагаются именно в кишечнике. Таким образом, формирование собственного кишечного иммунитета у грудного ребенка происходит с период ранней микробной колонизации и начинается сразу после рождения ребенка. Поэтому момент появления на свет является одним из ключевых этапов в формировании здорового ЖКТ3.
Кишечник – представляет собой не только часть пищеварительной системы, но и является иммунным органом, до 80% иммунных клеток располагаются именно в кишечнике. Таким образом, формирование собственного кишечного иммунитета у грудного ребенка происходит с период ранней микробной колонизации и начинается сразу после рождения ребенка. Поэтому момент появления на свет является одним из ключевых этапов в формировании здорового ЖКТ3.
В становлении нормальной микрофлоры ребенка особенно важную роль играют бифидобактерии. Количество бифидобактерий в кишечнике ребенка, находящегося на грудном вскармливании, быстро нарастает в первые недели его жизни. В течение первого года жизни меняется видовой состав кишечной микрофлоры, что связано с различными периодами в жизни ребенка: периодом грудного вскармливания до введения прикорма, после введения прикорма, после появления в рационе твердой пищи, после прекращения грудного вскармливания. Беременность мамы, микрофлора родовых путей, течение родов, рождение раньше срока, наличие и продолжительность грудного вскармливания, раннее введение прикорма, частые простудные заболевания определяют становление этого процесса.
Нормальная микрофлора ребенка
Микрофлора обусловливает защиту слизистой кишечника от внедрения патогенных микроорганизмов, поддерживает и активирует иммунную систему, участвует в обмене белков, липидов, углеводов, выполняет антиаллергическую функцию, участвует в синтезе аминокислот, витаминов, гормонов, влияет на пищеварительные функции желудочно-кишечного тракта 1.
Пробиотический комплекс Бифиформ Бэби можно давать даже новорожденным с первых дней жизни. Его основное назначение – формирование сбалансированной микрофлоры кишечника, в том числе, при различных проблемах, связанных с кормлением. Особый комплекс бактерий может способствовать профилактикекишечных расстройств различного характера, включая колики 4.
Нормальную микрофлору кишечника составляют множество видов микроорганизмов. Одни из значимых и изученных на сегодняшний день:
Бифидобактерии
Представители рода Bifidobacterium являются наиболее важным компонентом нормальной микробиоты желудочно-кишечного тракта человека. Большая часть бифидобактерий находится в толстой кишке, составляя у детей более 90% всех микроорганизмов 5 Начинают доминировать в кишечной микрофлоре младенцев к концу первой недели жизни. Синтезируют аминокислоты и белки, витамин К, пантотеновую кислоту, витамины группы В: B1 — тиамин, B2 — рибофлавин, B3 — никотиновую кислоту, фолиевую кислоту, B6 — пиридоксин. Способствуют усилению процессов всасывания через стенки кишечника ионов кальция, железа, витамина D 6.
Большая часть бифидобактерий находится в толстой кишке, составляя у детей более 90% всех микроорганизмов 5 Начинают доминировать в кишечной микрофлоре младенцев к концу первой недели жизни. Синтезируют аминокислоты и белки, витамин К, пантотеновую кислоту, витамины группы В: B1 — тиамин, B2 — рибофлавин, B3 — никотиновую кислоту, фолиевую кислоту, B6 — пиридоксин. Способствуют усилению процессов всасывания через стенки кишечника ионов кальция, железа, витамина D 6.
Лактобактерии
Уменьшают активность пероксидазы, оказывая антиоксидантный эффект, обладают противоопухолевой активностью, стимулируют продукцию иммуноглобулина А (IgA), подавляют рост патогенной микрофлоры и стимулируют рост лакто- и бифидофлоры, оказывают противовирусное действие 6
Нарушения микрофлоры
Дисбактериоз является нарушением качественного и количественного состава микрофлоры кишечника. Это означает, что патогенных микроорганизмов может стать значительно больше, чем полезных. Иногда сам организм может справиться с временно возникшими изменениями в кишечной микрофлоре, но при определенных ситуациях для лечения дисбактериоза используются пробиотики, содержащие полезные микроорганизмы 2.
Иногда сам организм может справиться с временно возникшими изменениями в кишечной микрофлоре, но при определенных ситуациях для лечения дисбактериоза используются пробиотики, содержащие полезные микроорганизмы 2.
Дисбактериоз у грудных детей может проявляться в виде изменения частоты, состава и цвета стула, нарушения процессов переваривания пищи, повышенного газообразования, беспокойного поведения ребенка, плача, повышенной раздражительности, плохого аппетита и сна, ухудшение состояния кожного покрова и даже аллергических реакций 3.
Причины возникновения дисбактериоза у новорожденных и грудничков
В группе риска по нарушению баланса микрофлоры находятся дети, мамы которых имели различные осложнения в период беременности и родах, а также дети, находящиеся на искусственном вскармливании, недоношенные. Простудные заболевания, прием некоторых лекарственных препаратов (лечение антибиотиками) могут приводить к нарушениям баланса микрофлоры кишечника. Внешними проявлениями этого состояния могут быть нарушения сна, плаксивость, нарушение аппетита, аллергические высыпания, колики и постоянное бурчание в животе после кормления 1,3.
Внешними проявлениями этого состояния могут быть нарушения сна, плаксивость, нарушение аппетита, аллергические высыпания, колики и постоянное бурчание в животе после кормления 1,3.
Сдача анализов
При возникновении симптомов недомогания у Вашего ребенка, обязательно проконсультируйтесь с врачом. Для постановки диагноза дисбактериоза врач может порекомендовать сдать анализ кала на дисбактериоз.
Как правильно собрать кал для анализа на дисбактериоз:
Кал собирается в стерильную баночку, предварительно прокипяченную вместе с крышкой в течение 20 минут. Посуда для анализа, на основании результатов которого будет проводиться лечение дисбактериоза у грудных детей, должна храниться в холодильнике не более суток. Собранный в стерильную емкость анализ доставляется в лабораторию в течение 2 часов (не позднее). Результаты подготавливаются через 7-10 дней.
Для получения информации о том, где можно приобрести Бифиформ Бэби , посетите раздел «Где купить».
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
- Донских Е.Е. Микрофлора — Дисбактериоз у детей http://lekmed.ru/info/literatyra/disbakterioz-y-detei.html
- Корниенко Е.А., Мазанкова Л.Н., Горелов А.В. Применение пробиотиков в педиатрии: анализ лечебного и профилактического действия с позиций доказательной медицины. Лечащий врач 2015.
- И.А. Беляева. Пробиотические добавки для коррекции младенческих колик: перспективы использоавния.
- Беляева И.А., Митиш М.Д., Катосова Л.К. Эффективность использования пробиотиков у недоношенных детей. РМЖ 2009.
- Рыбальченко О.В., Бондаренко В.М. Оценка микробиоты и пробиотических штаммов с позиций новых научных технологий. Фарматека №11, 2016
- Бельмер С.В., Малкоч А.В. Кишечная микрофлора и значение пребиотиков для ее функционирования. Лечащий врач 2006, 4
PP-BIB-RUS-0082
Дисбактериоз у грудничка: симптомы и лечение
Как известно помимо стерильных областей нашего организма (такой как, например, кровь), у нас есть органы, в которых живут различные бактерии. Среди них различают «дружественные», «враждебные» и «нейтральные». Набор бактерий у каждого человека свой, именно его и называют микрофлорой. Как только состояние микрофлоры отклоняется от нормы (индивидуальной для каждого организма), диагностируется дисбактериоз. Причиной изменений во флоре ребенка всегда является стресс — смена климата, режима, нарушение биоритмов, болезнь, введение в рацион новых продуктов и пр. Самый верный сценарий поведения родителей в сложившейся ситуации — подождать.
Среди них различают «дружественные», «враждебные» и «нейтральные». Набор бактерий у каждого человека свой, именно его и называют микрофлорой. Как только состояние микрофлоры отклоняется от нормы (индивидуальной для каждого организма), диагностируется дисбактериоз. Причиной изменений во флоре ребенка всегда является стресс — смена климата, режима, нарушение биоритмов, болезнь, введение в рацион новых продуктов и пр. Самый верный сценарий поведения родителей в сложившейся ситуации — подождать.
Симптомы дисбактериоза у грудничка исчезнут при одном из условий:
1. Организм адаптируется к новым условиям
2. Причина, вызвавшая сбой (простуда или стресс), будет устранена.
Многие педиатры убеждены, что дисбактериоз нужно лечить и рекомендуют принимать препараты для восстановления микрофлоры. Зачастую они неэффективны, однако, мама принимает естественное возвращение здоровья малыша в норму за результат от лечения.
Какие симптомы указывают на дисбактериоз у грудничка:
-
Плохой аппетит -
Метеоризм, вздутие живота -
Боли в животе -
Молочница, стоматит -
Расстройство стула — запоры, понос -
Отрыжка, рвота -
Неприятный запах изо рта
Безусловно, эти симптомы могут сигнализировать о действительно серьезных заболеваниях ЖКТ. Поэтому для определения причин недомогания делают анализ кала. Дисбактериоз по нему определить невозможно, а вот выявить опасные кишечные инфекции (дизентерию, сальмонеллез и др.) — да.
Рекомендаций для лечения синдрома не существует, однако для профилактики дисбактериоза у младенцев стоит выполнять следующие советы педиатров:
-
Кормите ребенка грудью (как минимум полгода после рождения, в идеале —до 1–1,5 года). Мамино молоко — залог здоровья малыша. Грудничкам, страдающим от дисбактериоза, оно нужно особенно.
Грудничкам, страдающим от дисбактериоза, оно нужно особенно. -
Смесь для искусственников подбирайте вместе с наблюдающим ребенка педиатром. Хорошо, если в ней будет содержаться пребиотик ГОС (такой есть в каждой смеси Valio Baby®). Он похож на естественные пищевые волокна, которые содержатся в грудном молоке и способствуют формированию здоровой микрофлоры младенца.
#PROMO_BLOCK#
-
Не увлекайтесь стерильностью. Разумеется, это не значит, что ребенок должен жить в грязи, однако полностью ограждать детский организм от внешних бактерий не стоит. У малыша должен сформироваться иммунитет. -
Чаще и дольше гуляйте на свежем воздухе. -
Не кормите ребенка насильно, если у него нет аппетита или он перенес какой-либо стресс (смену режима, нововведения в меню, переезд). Доказано, что микрофлора быстрее приходит в норму, если кишечник не перегружен. Некоторые родители практикуют намеренное ограничение в питании малыша, чтобы он быстрее почувствовал себя лучше.
Сдать анализ на дисбактериоз у грудничка в СПб
Родители грудных детей часто встречаются с диагнозом «дисбактериоз кишечника». Что же означает диагноз «дисбактериоз», и какие анализы могут его выявить?
Дисбактериоз кишечника – это нарушение равновесного состояния кишечной микрофлоры. Считается, что при этом полезные бактерии, способствующие пищеварению, погибают, а патогенные (болезнетворные) размножаются. При этом дисбактериоз не является болезнью (этот диагноз отсутствует и в международных, и в отечественных классификациях болезней). Скорее, это состояние, которое может являться следствием некоторых заболеваний (энтериты, колиты), приема антибиотиков. У грудных детей с неустоявшейся кишечной микрофлорой симптомы дисбактериоза могут также возникать при смене питания, введения новых продуктов в рацион малыша или матери (при грудном вскармливании).
Как выявить дисбактериоз
Обычно для того, чтобы определить состояние кишечной микрофлоры, берут анализ на дисбактериоз у грудничка. Он делается не меньше недели и включает в себя копрограмму (анализ непереваренных остатков) и бактериальный посев, выявляющий патогенную и нормальную микрофлору. Также применяется ПЦР-диагностика, исследование продуктов обмена веществ бактерий и метод хромато-масс-спектрометрии. При этом все эти методы обладают погрешностью, ведь точно определить состав кишечной микрофлоры можно, только взяв пробу непосредственно из тонкого кишечника.
Он делается не меньше недели и включает в себя копрограмму (анализ непереваренных остатков) и бактериальный посев, выявляющий патогенную и нормальную микрофлору. Также применяется ПЦР-диагностика, исследование продуктов обмена веществ бактерий и метод хромато-масс-спектрометрии. При этом все эти методы обладают погрешностью, ведь точно определить состав кишечной микрофлоры можно, только взяв пробу непосредственно из тонкого кишечника.
Как правильно собрать биоматериал для анализа на дисбактериоз у детей
Для этого анализа необходимо собрать кал ребенка. Объем пробы не менее 10-15 мл, моча в кал попасть не должна. Кал должен быть свежим: его необходимо сдать в лабораторию в течение 2-3 часов после дефекации. При этом опорожнение кишечника должно быть естественным, его нельзя стимулировать специальными средствами.
Чтобы результаты анализа на дисбактериоз у грудничка не исказились, необходимо соблюдать следующие требования:
- сдавать анализ на дисбактериоз у детей через 2-3 недели после отмены антибиотиков, а также пробиотиков и пребиотиков;
- после отмены других лекарственных препаратов должна пройти 1 неделя;
- несколько дней перед сбором кала не вводить в рацион ребенка новых продуктов, если ребенок на искусственном вскармливании – не менять смесь.

- не применять ректальные препараты.
При соблюдении этих правил анализ на дисбактериоз у грудничка будет наиболее информативным.
Что покажет анализ на дисбактериоз у детей
Исследование кала покажет соотношение разных штаммов бактерий нормальной микрофлоры кишечника, а также наличие патогенных бактерий (сальмонеллы, грибы рода Кандида, клостридии и др.). При выявлении этих микроорганизмов нужно будет начать лечение.
Если в результате анализа кала на дисбактериоз у детей будет выявлено нарушение баланса кишечной микрофлоры, задача врача – избрать правильную тактику для устранения симптомов этого состояния. Обычно лечение начинается с устранения причины дисбактериоза, далее назначается симптоматическая терапия.
В сети клиник «Медицентр» Вы можете сдать анализ на дисбактериоз у своего ребенка, результат вы получите в течение нескольких дней.
Наши клиники в Санкт-Петербурге
Медицентр Юго-Запад
Пр. Маршала Жукова 28к2
Маршала Жукова 28к2
Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону
+7 (812) 640-55-25
🧬 Запор у детей до года
Обычно родителей младенцев беспокоит прямо противоположная проблема — слишком частый стул. Поэтому не все сразу понимают, что же делать, если у малыша до года случился запор.
Гастроэнтеролог, гепатолог GMS Clinic Сергей Вялов дал интервью интернет-порталу parents. ru и рассказал о запорах у детей до года.
ru и рассказал о запорах у детей до года.
Введение
Запор, он же адиарея, задержка стула, дисколия, капростаз, затрудненное опорожнение кишечника — это не универсальное состояние с однозначными характеристиками. У каждого человека, в том числе и ребенка, свои показатели нормы и отклонений от нее, связанные с возрастом, микрофлорой кишечника, рационом, состоянием психики и гормонального фона, сопутствующими болезнями. И все же есть несколько общих точек отсчета.
Что такое запор?
Специалисты диагностируют запор, если кроха делает «большие» дела:
- регулярно и без проблем, но при этом выделяется сухой и твердый кал;
- с трудом — ребенку приходится тужиться, кал выходит не с первой попытки;
- реже 5 раз за сутки.
В первые полгода жизни запор — довольно редкое явление, скорее, наоборот, — в период от 0 до 6 месяцев нормой считается от 6–10 испражнений в сутки. У детей на грудном вскармливании дефекация происходит чаще, у искусственников — реже.
У детей на грудном вскармливании дефекация происходит чаще, у искусственников — реже.
До 6 месяцев запор — редкость
Обычно родителей малышей первых месяцев жизни настораживает состояние противоположное запору, — слишком частое испражнение. Но у младенца, независимо от того, питается он грудным молоком или смесью, кишечник должен работать именно так — в режиме, который для детей постарше и взрослых считается поносом.
Другого варианта, по крайней мере, до введения прикорма в 4–6 месяцев, быть не должно. Ведь кроха получает в основном жидкую пищу, отходы которой имеют ту же консистенцию и покидают кишечник, не встречая на пути никаких препятствий, — малыш пока не научился управлять сфинктером, сдерживающим выделение кала.
Кишечник крохи еще только начал «знакомиться» с микроорганизмами, которые поступают из молока мамы, с ее кожи (малыш облизывает сосок), из окружающей среды. Принимаются далеко не все новые «партнеры»: есть отвергнутые, не прижившиеся и так далее. Проверка и отбраковка сопровождаются жидким нестабильным стулом.
Проверка и отбраковка сопровождаются жидким нестабильным стулом.
Слишком частое очищение кишечника не нуждается в коррекции и лечении, если ребенок прибавляет в весе и правильно развивается. Нормальные аппетит и сон, газы, отсутствие температуры и других признаков болезни указывают на то, что родителям не о чем беспокоиться. Если мама младенца, устав менять подгузники по 10 раз за одни сутки, захочет изменить ситуацию и попросит врача назначить крохе закрепляющие лекарства, то, сама того не желая, обречет своего малыша на хронический запор.
Не по правилам
И все-таки в первые 6 месяцев запор у младенцев не исключен. Вызвать его могут:
- микрофлора, передающаяся от мамы;
- недостаточный объем жидкости;
- стресс.
Допустим, у женщины в желудке и кишечнике слишком много бактерий, выделяющих метан, которые провоцируют запор. Они довольно медленно растут, перебраживают, выделяя углекислый газ, способствующий метеоризму и вздутию. С этим отклонением женщина и живет, приспособилась и научилась решать проблему с кишечником тем или иным способом. Заметив то же самое у ребенка, она решает, что малыш унаследовал ее особенности и «спасает» его теми же средствами, допуская ошибку. Малышам нельзя давать слабительные, особенно те, в которых содержится сенна. Организм крохи слишком быстро привыкает к таким препаратам и без них уже не может очистить кишечник.
С этим отклонением женщина и живет, приспособилась и научилась решать проблему с кишечником тем или иным способом. Заметив то же самое у ребенка, она решает, что малыш унаследовал ее особенности и «спасает» его теми же средствами, допуская ошибку. Малышам нельзя давать слабительные, особенно те, в которых содержится сенна. Организм крохи слишком быстро привыкает к таким препаратам и без них уже не может очистить кишечник.
Запор у малыша до 6 месяцев также провоцируют недостаток жидкости и гормональные перепады. В 6 месяцев кроха должен получать много влаги — в сутки примерно 140 мл на один килограмм веса. Ребенок, находящийся на грудном вскармливании, набирает эту норму за счет маминого молока и не нуждается в дополнительных источниках жидкости (но только при отсутствии предрасположенности к запору). Маленьких искусственников допаивают с момента перехода на смесь.
Если женщина напряжена или нервничает, то у нее повышается уровень гормона стресса — кортизола. Через грудное молоко, слюну или пот вещество попадает в организм малыша и тоже провоцирует запор.
Через грудное молоко, слюну или пот вещество попадает в организм малыша и тоже провоцирует запор.
Даже если мама не кормит ребенка грудью, микроорганизмы, вызывающие запор, рано или поздно добираются до желудочно-кишечной системы крохи и производят в ней негативные перемены.
Запор после введения прикорма
Малыш растет, совершенствует навыки, и наступает пора знакомить его с новыми продуктами питания. Эти обстоятельства, с одной стороны, помогают наладить перистальтику, а с другой — повышают риск запора.
К полугоду малыш уже пытается контролировать дефекацию, поскольку понял, что после нее появляются неприятные ощущения — зуд, жжение и прочий дискомфорт в зонах, куда попадают фекалии. Чтобы не испытать дискомфорта, ребенок старается сдерживать позывы. Сначала ему это не удается, поскольку прямая кишка уже научилась работать — рефлекторно сокращаться и выталкивать отходы. А спустя пару месяцев все получается, малыш побеждает и вступает на путь, ведущий к хроническому запору. Чтобы вывести ребенка за пределы этого замкнутого круга, мама должна свести к минимуму продолжительность контакта кожи младенца с фекалиями и расширить рацион его питания, осваивая прикорм.
Чтобы вывести ребенка за пределы этого замкнутого круга, мама должна свести к минимуму продолжительность контакта кожи младенца с фекалиями и расширить рацион его питания, осваивая прикорм.
Белки, жиры и углеводы, входящие в состав продуктов, всасываются в тонком кишечнике, а до толстого, где формируется кал, не доходят. Чего нельзя сказать о клетчатке. Пока кроха пьет грудное молоко или смесь, эта составляющая блюд ему не знакома. Даже если кормящая женщина сама употребляет много растительной пищи, малышу ничего не достается. Клетчатка, как уже было отмечено, не всасывается в кишечнике, не поступает в кровь, а значит, ее нет в грудном молоке. Впервые грудничок получает клетчатку с прикормом, пробуя свои первые 25 грамм пюре из кабачка, моркови и других овощей. Растительные волокна буквально притягивают к себе все отходы, в результате формируются каловые массы, которые помогают кишечнику освоить правильную перистальтику. В этом отделе ЖКТ, в кишечнике, много мышц, они должны научиться последовательно сокращаться — напрягаться и расслабляться, чтобы выдавливать отходы наружу.
Очередной новый продукт следует вводить через месяц после предыдущего. Новинка, скорее всего, сначала вызовет более частый и жидкий стул. Если он не имеет зеленый цвет и не пенится, не надо бежать к врачу и просить назначить закрепляющие средства. Наберитесь терпения, через некоторое время новшество будет освоено и даст плоды. Вместо жидких и бесформенных фекалий желто-белого цвета вы увидите сформировавшийся коричневый кал.
Особый запор
Есть и другие причины запора у младенцев. К сожалению, с ними гораздо сложнее разобраться, поскольку это патологии развития, болезни, травмы.
Острый запор. Развивается по анатомическим причинам, например, из-за непроходимости толстой кишки, или при инвагинации — внедрении одной части кишки в другую, что вызывает закупоривание просвета. На фоне полного благополучия малыш внезапно становится беспокойным, плачет, отказывается от еды. Приступ заканчивается так же неожиданно, как и начался, но через 3–5 минут повторяется и усиливается: появляется одно- или двукратная рвота с примесью желчи зеленого цвета. Если кал отходит, то в нем видны примеси крови. Спустя 5–6 часов стул прекращается, а из прямой кишки выделяются кровянистые выделения. При этом живот у малыша мягкий. Температура чаще всего нормальная. Ребенок даже может терять сознание. При подобных симптомах необходимо вызвать «скорую помощь».
Если кал отходит, то в нем видны примеси крови. Спустя 5–6 часов стул прекращается, а из прямой кишки выделяются кровянистые выделения. При этом живот у малыша мягкий. Температура чаще всего нормальная. Ребенок даже может терять сознание. При подобных симптомах необходимо вызвать «скорую помощь».
Болезнь Гиршпрунга. В ее основе лежит нарушение иннервации толстой кишки — центральная нервная система не может управлять этим отделом желудочно-кишечного тракта. В результате переработанная пища скапливается в кишечнике. Картина заболевания довольно разнообразна. Если поражена только короткая часть кишки, то запоры формируются постепенно, и без хирургического вмешательства удается обойтись довольно долго. Когда поражен более длинный отрезок, то отсутствие стула чревато тяжелым состоянием и требуется незамедлительное хирургическое вмешательство.
Инфекционная атака. Если в первые месяцы жизни кроха перенес кишечную инфекцию, нервные клетки в толстом кишечнике могут погибнуть, что приведет к задержке акта дефекации, скоплению каловых масс и развитию запора. При дизентерии возможен так называемый токсический мегаколон (резкое расширение толстой кишки). У ребенка развивается нарушение сознания и повторная рвота. Резко увеличивается живот из-за сильно расширенного кишечника. Осложнение требует экстренной хирургической помощи.
При дизентерии возможен так называемый токсический мегаколон (резкое расширение толстой кишки). У ребенка развивается нарушение сознания и повторная рвота. Резко увеличивается живот из-за сильно расширенного кишечника. Осложнение требует экстренной хирургической помощи.
Проблемы с ЦНС. Травмы при родах и синдром детского церебрального паралича также отражаются на работе желудочно-кишечного тракта, поскольку сопряжены с различными осложнениями, например, нарушением глотания, срыгивания, рвотой.
Васкулит. Воспаление сосудов распространяется и на нервные сплетения и чувствительные клетки, расположенные в кишечной стенке.
Нарушения в работе эндокринной системы. При гипотиреозе (недостатке функции щитовидной железы) замедляется продвижение содержимого по кишечнику. При дисфункции паращитовидных желез запор возникает из-за нарушения минерального обмена, при сахарном диабете становится следствием повреждения нервных сплетений кишечника или обезвоживания организма ребенка.
Медикаментозный запор. Перед тем, как давать ребенку любой препарат, назначенный врачом, внимательно ознакомьтесь с инструкцией. Так, средства от анемии, содержащие железо, могут вызывать запор. Избежать его поможет соблюдение правил приема — непосредственно во время еды, уменьшение доз железа при введении в рацион продуктов с высоким содержанием железа — гречка, яблоки, зелень. Особого внимания заслуживают запоры, ставшие следствием лечения нестероидными противовоспалительными, нейролептиками, сорбентами и антибиотиками, которые вызывают дисбактериоз кишечника.
Болезни и состояния, сопровождающиеся запором, у грудничков встречаются не так часто. Многие педиатры вспоминают о них не сразу. Перед тем, как добраться до истины, они назначают много ненужных лекарств, забывая про эффективные исследования кишечника, например, рентген.
Источник: parents.ru
Дисбактериоз симптомы, лечение в Новосибирске
Дисбактериоз: правда и миф. Симптомы и лечение в Новосибирске.
Симптомы и лечение в Новосибирске.
Дисбактериоз — одна из наиболее частых обсуждаемых проблем со здоровьем, в основном, среди детского населения. Давайте поговорим о том, что это такое в свете современных знаний.
Дисбактериоз – микро экологические нарушения в желудочно-кишечном тракте. Это клиническая совокупность нарушений в макроорганизме (человек), вызванных изменением количественных соотношений, состава и свойств микрофлоры. Дисбактериоз – по сути результат посева кала на известные и возможные для исследования микроорганизмы толстого кишечника. В последнее время чаще говорят о дисбиозе — это нарушение функционирования и механизмов взаимодействия организма человека, его микрофлоры и окружающей среды. Почему это важно ? В свете последних молекулярно — генетических исследований микрофлора заселяет практически все поверхности, все слизистые оболочки и полости тела, конечно, большая часть кишечник и толстый и тонкий, но при этом 80-90% не культивируются (т. е. не возможно вырастить и изучить ) вне тела человека, они являются только «человеческими» и о них мы практически ничего не знаем. На 1 клетку человека приходится примерно 10 микробных, при чем вся микрофлора несет в 150 раз больше генетической информации чем человек. Представьте: на 1 единицу «человек-информация» приходится 150 единиц «микробы-информация». Только в таком соотношении мы можем функционировать, жить полноценно. Как известно, у человека 4 основных группы крови, точно так выделены 3 энтеротипа микробиоценоза человека. Каждому человеку в рамках своего энтеротипа присуща своя микробная ассоциация. Энтеротип неизменен, но количество и качество поддерживающих бактерий очень зависит от питания, заболеваний, использования лекарств, окружающей среды.
е. не возможно вырастить и изучить ) вне тела человека, они являются только «человеческими» и о них мы практически ничего не знаем. На 1 клетку человека приходится примерно 10 микробных, при чем вся микрофлора несет в 150 раз больше генетической информации чем человек. Представьте: на 1 единицу «человек-информация» приходится 150 единиц «микробы-информация». Только в таком соотношении мы можем функционировать, жить полноценно. Как известно, у человека 4 основных группы крови, точно так выделены 3 энтеротипа микробиоценоза человека. Каждому человеку в рамках своего энтеротипа присуща своя микробная ассоциация. Энтеротип неизменен, но количество и качество поддерживающих бактерий очень зависит от питания, заболеваний, использования лекарств, окружающей среды.
Что же делает микрофлора в нашем теле?
-противостоит болезнетворным бактериям и сдерживает рост условно — патогенных бактерий
-участвует в синтезе и всасывании многих витаминов
-производит разрушение и выведение токсинов
-вырабатывает вещества, участвующие в обмене холестерина, жирных кислот, липопротеидов, оксалатов, стероидных гормонов
-участвует в формировании как местного, так и системного иммунитета. По сути , кишечник и находящиеся в нем бактерии являются самым «большим иммунным органом» человека
По сути , кишечник и находящиеся в нем бактерии являются самым «большим иммунным органом» человека
-участвует в переваривании многих пищевых ингредиентов
-питает, поддерживает работу клеток кишечной стенки
Это далеко не всё, только основные направления работы нашей микрофлоры. Не зря 20% поступающих пищевых ингредиентов и 10% вырабатываемой организмом энергии идёт на поддержание нашей микрофлоры.
Как проявляется дисбиоз хорошо известно всем: диспептический синдром (поносы, запоры , метеоризм, повышенное газообразование, отрыжка ), боли в животе, аллергия ( любая – кожные высыпания , бронхиальная астма , насморк , непереносимость некоторых пищевых продуктов ), частые простудные заболевания, как правило протекающие длительно и волнообразно, синдром мальабсорбции — нарушение всасывания (гиповитаминоз, анемия, неврологические расстройства, задержка роста и развития ), хроническая интоксикация (недомогание, плохой аппетит, головные боли, субфебрильная температура)
Как упоминалось выше, кишечная микробиота индивидуальна и в целом постоянна, она не существует как нечто неизменное, представляя собой динамически меняющуюся смесь микробов индивидуальных для каждого человека. К факторам, влияющим на становление кишечной микробиоты у младенцев, относят:
К факторам, влияющим на становление кишечной микробиоты у младенцев, относят:
-наличие у мамы любых инфекций: хронических урогенитальных и других, даже вне обострения, острых (ОРЗ и др.), прием лекарств, не рациональное питание
-роды путём кесарева сечения
-позднее (не в родовом зале) прикладывание к груди. Млечные ходы молочной железы заселены лакто — и бифидобактериями, даже если новорожденный высосет 3-5 мл молозива он получит первой «хорошую семейную» микрофлору, а не больничную, вероятнее всего вредную
-гипоксия нервной системы любой степени тяжести
-долгое нахождение в родильном доме
-раздельное нахождение мамы и младенца в роддоме
-искусственное вскармливание
-применение антибиотиков и многих других лекарств
-раннее введение прикормов и прекращение грудного вскармливания
-не рациональное питание
Какие анализы можно сдать для выявления дисбиоза:
-кал на дисбиоз
До 3 месяцев идет активное заселение кишечника, микрофлора меняется каждый день. В среднем, выдача результата анализа происходит через 7-10 дней, а значит говорит о прошлом состоянии, не о сегодняшнем. Можно ли по нему назначать какое-либо лечение? Нет. Поэтому до 3 месяцев не рекомендуют проводить этот анализ. Но после 3 месяцев микрофлора становится более устойчивой
В среднем, выдача результата анализа происходит через 7-10 дней, а значит говорит о прошлом состоянии, не о сегодняшнем. Можно ли по нему назначать какое-либо лечение? Нет. Поэтому до 3 месяцев не рекомендуют проводить этот анализ. Но после 3 месяцев микрофлора становится более устойчивой
-копрограмма
Показывает нарушения характера пищеварения: своевременно ли и в достаточном ли количестве выделяется желчь и секрет поджелудочной железы.
-газо — жидкостная хроматография и молекулярно — генетическое исследование фекалий
показывают истинное состояние микрофлоры, её полный количественный и качественный состав (в том числе тонкокишечный и то, который невозможно вырастить вне человека), энтеротип человека. Проводится в нескольких НИИ в мире, в широком применении будет только в ближайшие 5-10 лет.
У всех детей первого полугодия 99-98% микрофлоры — это бифидо и лактобактерии, значит надо обеспечить и их достаточное количество. Задача эта очень сложная. Почему? Эти бактерии очень нежные, могут жить и хорошо работать в определенных условиях. Например, при наличии лактозной недостаточности в кишечнике неблагоприятная среда, а бифидо и лактобактерии не могут ни жить, ни работать в такой среде. С введением прикормов, изменяется характер пищи, требуются другие бактерии, происходит заселение кишечника новыми видами. Когда вводить прикорм, какой? Есть определенные рекомендации, даже национальная программа вскармливания по рекомендациям ВОЗ (Всемирная Организация Здравоохранения), но решение принимается только индивидуально!
Задача эта очень сложная. Почему? Эти бактерии очень нежные, могут жить и хорошо работать в определенных условиях. Например, при наличии лактозной недостаточности в кишечнике неблагоприятная среда, а бифидо и лактобактерии не могут ни жить, ни работать в такой среде. С введением прикормов, изменяется характер пищи, требуются другие бактерии, происходит заселение кишечника новыми видами. Когда вводить прикорм, какой? Есть определенные рекомендации, даже национальная программа вскармливания по рекомендациям ВОЗ (Всемирная Организация Здравоохранения), но решение принимается только индивидуально!
Получается, мы живем в океане микробов, и только так мы можем жить. Если мы хотим жить долго и здорово — мы должны заботится о них. Лечение — это одно, а постоянное поддержание здоровья — это другое. Нет никакой волшебной таблетки, никаким однократным курсом лечения с дисбиозом не справится! Курсы биопрепаратов (разные, в разное время, разные детям и взрослым), рациональное питание, иногда в помощь – лекарственные препараты и всё по рекомендации врача!
Диагностика и коррекция дисбактериоза у детей | Мухина Ю.
 Г.
Г.
Значение микробиоценоза кишечника
Наиболее сложным биотопом микробиоценоза является кишечная кооперация, представленная различными популяциями микроорганизмов. Микробиоценоз кишечника — очень важная система организма, выполняющая или регулирующая многочисленные его функции по поддержанию гомеостаза.
| ФУНКЦИИ НОРМАЛЬНОЙ МИКРОФЛОРЫ КИШЕЧНИКА:
o обеспечение колонизационной резистентности
|
Одной из важнейших функций нормальной микрофлоры является обеспечение колонизационной резистентности, которая предотвращает заселение организма посторонними микробами. При снижении колонизационной резистентности происходит увеличение числа и спектра патогенных бактерий, возникает возможность развития инфекционного процесса. Интересно, что колонизационная способность микроорганизмов, (в частности, лактобактерий) строго специфична в отношении конкретного индивидуума. Исследования на добровольцах показывают, что аутомикроорганизмы обеспечивают очень быстрое восстановление нормального состояния микрофлоры кишечника.
Интересно, что колонизационная способность микроорганизмов, (в частности, лактобактерий) строго специфична в отношении конкретного индивидуума. Исследования на добровольцах показывают, что аутомикроорганизмы обеспечивают очень быстрое восстановление нормального состояния микрофлоры кишечника.
Слизистая кишечника покрыта биопленкой, внутри которой устойчивость бактерий к неблагоприятным воздействиям обеспечивают клеточный муцин и бактериальный полисахарид, заключающие матрикс микроколонии бактерий и простейших. Неиммобилизованные бактерии имеют устойчивость во много раз ниже, чем при колонизационной резистентности.
| У детей, находившихся на искусственном вскармливании, аутофлора кишечника чаще вызывает эндогенные инфекционные процессы |
Хорошо известна иммуномодулирующая функция микрофлоры кишечника. Становление иммунного ответа формируется в первые часы неонатального периода под влиянием микрофлоры. При отсутствии микроорганизмов происходит уменьшение глубины крипт слизистой кишки, снижение высоты ворсин, истончение собственной пластины, уменьшение пейеровых бляшек. При их участии выделяются лизоцим и другие адъювантно-активные соединения, которые стимулируют иммунную систему организма.
Становление иммунного ответа формируется в первые часы неонатального периода под влиянием микрофлоры. При отсутствии микроорганизмов происходит уменьшение глубины крипт слизистой кишки, снижение высоты ворсин, истончение собственной пластины, уменьшение пейеровых бляшек. При их участии выделяются лизоцим и другие адъювантно-активные соединения, которые стимулируют иммунную систему организма.
Микроорганизмами осуществляются физиологические, биохимические процессы в желудочно-кишечном тракте (ЖКТ) по перевариванию и всасыванию пищи. Метаболизм белков, углеводов, жиров, продукция витаминов, гормонов, ряда биологических аминов поддерживают функциональные возможности всего организма и, в частности, ЖКТ. Моторная функция кишечника регулируется также микробной флорой, которая осуществляется через ряд механизмов: образование и ингибирование субстанций типа брадикинина; продукция простагландинов бактериального происхождения; изменение метаболизма желчных кислот с образованием метаболитов, ускоряющих моторику. Образующиеся в процессе жизнедеятельности микроорганизмов амины — гистамин, брадикинин — регулируют сфинктерную деятельность ЖКТ.
Образующиеся в процессе жизнедеятельности микроорганизмов амины — гистамин, брадикинин — регулируют сфинктерную деятельность ЖКТ.
| Разнообразные неблагоприятные воздействия вызывают изменения иммунного ответа и поэтому могут влиять на качественные и количественные характеристики нормальной флоры кишечника |
Детоксикационная деятельность кишечной микробной флоры осуществляет защиту от ксенобиотиков: пестицидов, аминов, солей тяжелых металлов, многих лекарственных средств, нитратов и пр. Известен ряд бактерий, имеющих высокую активность нитратредуктазы (пропионибактерии, пептококки, вейлонеллы, грамотрицательные энтеробактерии и другие), которые предотвращают развитие метгемоглобинемии при высоком содержании нитратов. Особенно это важно у детей раннего детского возраста, имеющих высокую долю фетального гемоглобина.
Метаболические детоксикационные процессы протекают с участием преимущественно реакций гидролиза и восстановления, с биотрансформацией, приводящей к образованию нетоксических продуктов и ускорению элиминации.
Формирование микробиоценоза у детей
Становление микробного биоценоза ребенка начинается с первых этапов жизни. Во время родов при заглатывании происходит поступление микрофлоры родовых путей матери и колонизация вагинальной флоры в пищеварительной системе ребенка. В настоящее время отработаны рекомендации по коррекции вагинальной флоры беременной женщины в последнем триместре беременности с помощью бактерийного препарата желемик, представляющего собой лиофилизированные живые лактобактерии, выделенные из влагалища здоровых женщин. Колонизация кишечника ребенка микрофлорой матери обеспечивает предупреждение развития дисбактериозов у новорожденного.
| Приизмене ияхмикрофлор кишечни анеобхо им коррекцияпита иясучетоммотори и,секре орныхизме ений,фермент ойактивности пищева ительного трактаидоп л ительн мвведениемвитаминн -минераль ы комплексов |
После рождения происходит колонизация кишечника микробами матери, а также персонала и окружающей среды, которые в основном представлены аэробами и факультативно — анаэробами. Если ребенок прикладывается к груди в сроки от 12 до 24 ч после рождения, то бифидофлора выявляется лишь у половины детей, более позднее прикладывание детей дает заселение бифидобактериями только у каждого 3-4-го ребенка. Начиная с 4-го дня жизни, в толстой кишке новорожденного определяются лактобактерии, эшерихии, стрептококки, стафилококки. Отмечено, что кишечная палочка и стрептококки создают условия для появления и колонизации облигатных анаэробов. К концу первой недели жизни возрастает титр лактобактерий, эшерихий, бифидобактерий, появляются бактероиды, клостридии, анаэробные кокки.
Если ребенок прикладывается к груди в сроки от 12 до 24 ч после рождения, то бифидофлора выявляется лишь у половины детей, более позднее прикладывание детей дает заселение бифидобактериями только у каждого 3-4-го ребенка. Начиная с 4-го дня жизни, в толстой кишке новорожденного определяются лактобактерии, эшерихии, стрептококки, стафилококки. Отмечено, что кишечная палочка и стрептококки создают условия для появления и колонизации облигатных анаэробов. К концу первой недели жизни возрастает титр лактобактерий, эшерихий, бифидобактерий, появляются бактероиды, клостридии, анаэробные кокки.
Флора ребенка первого года жизни находится в прямой зависимости от характера вскармливания. Дети, получающие естественное вскармливание, имеют виды бифидумбактерий: B. bifidum и B. breve, а на искусственном — биовар в B. longum. После одного года жизни доминирующими становятся B. breve, B. adolscentis, B. longum, B. infantis. У взрослых чаще присутствует B.bifidum серовар а, B. adolscentis, B. longum. Лактобактерии определяют в более высоком титре при искусственном вскармливании. Клостридии превышают уровень 106 КОЕ/г исследуемого материала при использовании искусственных смесей. Нередко можно обнаружить у этих детей C. dificile и C. perfringens, способных вырабатывать энтеротоксины. Повышение уровня клостридий может происходить у более старших детей при использовании несбалансированной диеты со значительным увеличением содержания мясных продуктов.
У взрослых чаще присутствует B.bifidum серовар а, B. adolscentis, B. longum. Лактобактерии определяют в более высоком титре при искусственном вскармливании. Клостридии превышают уровень 106 КОЕ/г исследуемого материала при использовании искусственных смесей. Нередко можно обнаружить у этих детей C. dificile и C. perfringens, способных вырабатывать энтеротоксины. Повышение уровня клостридий может происходить у более старших детей при использовании несбалансированной диеты со значительным увеличением содержания мясных продуктов.
Просмотреть [ _Т а б л и ц у_ ]
У детей, получающих искусственное вскармливание, чаще и в более высоких титрах появляются бактероиды и вейлонеллы. При избыточном количестве последних может отмечаться повышенное газообразование, развитие диспепсических проявлений. В зависимости от характера питания находится и факультативно-анаэробная флора.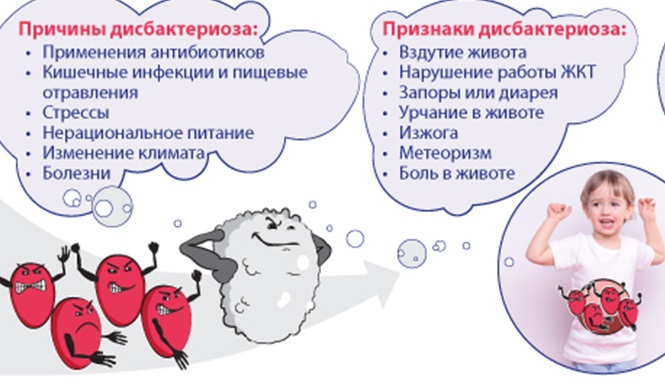 Пациенты, находящиеся на искусственном вскармливании чаще заболевают энтеритами, которые обусловлены эндогенными эшерихиями, или кишечными палочками с измененными свойствами (лактозонегативные и гемолизинпродуцирующие). Другие бактерии: клебсиеллы, протеи, морганеллы, энтеробактер, цитробактер, серрации являются условно-патогенными; при снижении резистентности организма они могут приобретать патогенные свойства, вызывать воспалительный процесс и диарею.
Пациенты, находящиеся на искусственном вскармливании чаще заболевают энтеритами, которые обусловлены эндогенными эшерихиями, или кишечными палочками с измененными свойствами (лактозонегативные и гемолизинпродуцирующие). Другие бактерии: клебсиеллы, протеи, морганеллы, энтеробактер, цитробактер, серрации являются условно-патогенными; при снижении резистентности организма они могут приобретать патогенные свойства, вызывать воспалительный процесс и диарею.
Непатогенные стафилококки (S. epidermidis) колонизируют кишечник детей с первых дней жизни. Иногда присутствуют в небольших концентрациях стафилококки с патогенными свойствами. Однако возможно развитие инфекционного процесса при передаче от носителей к ребенку нозокомиальных штаммов. Эти штаммы отличаются устойчивостью к антибактериальным препаратам и могут вызывать тяжелые воспалительные поражения кишечника и даже септический процесс.
| Результат комплексного лечения зависит от эффективности терапевтической тактики основного заболевания, адекватности выбора комплекса препаратов с учетом микробиологических изменений и особенностей организма ребенка |
Роль стрептококков в формировании оптимального уровня колонизационной резистентности достаточно велика. При естественном вскармливании уровень стрептококков сохраняется постоянным, а при искусственном вскармливании может значительно превышать норму. Однако при сниженном количестве облигатной микрофлоры у детей усиленный рост энтерококков способствует формированию эндогенного инфекционного процесса.
При естественном вскармливании уровень стрептококков сохраняется постоянным, а при искусственном вскармливании может значительно превышать норму. Однако при сниженном количестве облигатной микрофлоры у детей усиленный рост энтерококков способствует формированию эндогенного инфекционного процесса.
Таким образом, естественное вскармливание ребенка, начатое сразу после его рождения, формирует более благоприятную флору пищеварительного тракта, которая способна к колонизационной резистентности и обеспечивает адекватные процессы пищеварения. Искусственное вскармливание может являться одной из причин изменений микроэкологии ребенка с последующим участием эндогенной флоры в формировании инфекционных, аллергических, иммунопатологических процессов.
Микроорганизмы колонизируют просвет пищеварительного тракта, а также поверхность слизистых оболочек. В связи с этим разделяют мукозную микрофлору и полостную микрофлору. При ряде патологических состояний очень важно учитывать состав каждого пула. В настоящее время разрабатываются и внедряются методы раздельной оценки флоры пищеварительного тракта.
В настоящее время разрабатываются и внедряются методы раздельной оценки флоры пищеварительного тракта.
Клинические проявления дисбиоза появляются значительно позже, чем микробиологические изменения. Они очень неспецифичны, однако возможен ряд симптомов, которые формируются из-за нарушения процессов, происходящих при участии определенных бактерий.
Состав кишечной микрофлоры
Бифидобактерии — грамположительные палочки, строгие анаэробы — в толстой кишке детей составляют около 95% популяции бактерий. Являясь сахаролитическими микробами, выделяют большое количество кислых продуктов. Образующаяся молочная, уксусная кислоты способствуют усилению всасывания ионов кальция, железа, витамина D. Продукция ими лизоцима, бактериоцинов, спиртов и высокая антагонистическая активность по отношению к патогенным бактериям препятствуют проникновению микробов в верхние отделы ЖКТ и другие органы. Отмечена высокая способность у бифидобактерий к синтезу аминокислот, белков, многих витаминов группы В, которые затем всасываются в кишечнике. Поэтому при стойких, тяжелых нарушениях функций бифидобактерий может развиваться комплекс белково-витаминно-минеральной недостаточности. При снижении уровня бифидобактерий транслокация условно-патогенных микробов в верхние отделы кишечника может вызывать их избыточный рост с более тяжелыми проявлениями синдрома нарушенного всасывания.
Поэтому при стойких, тяжелых нарушениях функций бифидобактерий может развиваться комплекс белково-витаминно-минеральной недостаточности. При снижении уровня бифидобактерий транслокация условно-патогенных микробов в верхние отделы кишечника может вызывать их избыточный рост с более тяжелыми проявлениями синдрома нарушенного всасывания.
Лактобактерии включают 44 вида, но основными являются L. acidophilus, L. casei, L. plantarum, L. fermentum. Подавление гнилостных и гноеродных микробов и антибактериальная активность лактобактерий связаны с выработкой молочной кислоты, спирта и лизоцима, продуктов с высокой антибиотической активностью, интерферонов, интерлейкина 1, ряда других. Исчезновение лактобактерий приводит к сдвигу реакции среды в щелочную сторону, резко снижая утилизацию кишечником биологически активных соединений. Интересен факт, что люди, использующие строгую вегетарианскую диету, имеют очень высокое содержание лактобактерий.
Доказана важная роль эубактерий, которые представляют собой анаэробные грамположительные неспорообразующие палочки, в трансформации холестерола в копростанол. В связи с этим положением требует внимания педиатров ряд работ зарубежных исследователей по использованию функционального питания, обогащенного соответствующими микроорганизмами для снижения уровня холестерола у пациентов. Однако следует помнить, что эубактерии могут участвовать в развитии воспаления ротовой полости, формировании гнойных процессов в плевре и легких и инфекционного эндокардита.
В связи с этим положением требует внимания педиатров ряд работ зарубежных исследователей по использованию функционального питания, обогащенного соответствующими микроорганизмами для снижения уровня холестерола у пациентов. Однако следует помнить, что эубактерии могут участвовать в развитии воспаления ротовой полости, формировании гнойных процессов в плевре и легких и инфекционного эндокардита.
Клостридии также принимают участие в деконъюгации желчных кислот, многие поддерживают колонизационную резистентность, подавляют рост патогенных клостридий. Clostridium difficile и C. perfrigens способны вырабатывать энтеротоксины. Микробные пептидные токсины оказывают провоспалительный эффект, вызывают хемотаксис нейтрофилов, выделяют сериновые протеазы, окислители, формируют хроническое воспаление. При их участии происходит местная и системная сенсибилизация антигенами энтеральной системы, пищевая сенсибилизация. Так, развитие псевдомембранозного колита, обусловленного C. difficile (Рис. 1), связано с применением ряда антибиотиков, подавляющих нормальную микрофлору и резким снижением количества нетоксигенных клостридий.
difficile (Рис. 1), связано с применением ряда антибиотиков, подавляющих нормальную микрофлору и резким снижением количества нетоксигенных клостридий.
Бактероиды являются еще недостаточно изученными представителями микрофлоры, известна их определенная роль в расщеплении желчных кислот. Среди них B. fragilis обладает рядом факторов, обусловливающих патогенность: способность секретировать лактамазу, энтеротоксин, гиалуронидазу, гепариназу, фибролизин, нейраминидазу. Имеются указания, что 10% случаев диарей вызываются энтеротоксигенными штаммами B. fragilis, особенно часто диарея, обусловленная бактероидами, наблюдается у детей дошкольного возраста.
Целый ряд видов фузобактерий способны секретировать гемолизины, гемагглютинины и факторы агрегации тромбоцитов. Поэтому при тяжелых септицемиях, связанных с ростом фузобактерий, могут возникать тромбоэмболии, имеющие соответствующую клиническую характеристику.
Вейлонеллы способны к восстановлению нитратов. При избыточном размножении в кишечнике вейлонелл отмечается повышенное газообразование, могут возникать выраженные диспепсические расстройства.
При избыточном размножении в кишечнике вейлонелл отмечается повышенное газообразование, могут возникать выраженные диспепсические расстройства.
Некоторые штаммы эшерихий продуцируют колицины, которые тормозят рост энтеропатогенных штаммов кишечной палочки. Эти свойства обусловлены в первую очередь механизмом синтеза секреторных иммуноглобулинов в кишечнике. Эшерихии принимают участие в синтезе витамина К, обеспечивая гемостатические процессы. Однако следует указать на способность формирования госпитальных штаммов эшерихий с множественной резистентностью к антибактериальным средствам, что является причиной развития госпитальной инфекции.
Цитробактер, энтеробактер, протеи, клебсиеллы и другие при снижении иммунологической резистентности организма также могут приводить к изменению функции кишечника, формированию воспалительных процессов в различных органах в результате воздействия микробных пептидных токсинов.
Иммунная реактивность организма
Самые разнообразные неблагоприятные воздействия на ребенка: стрессы, физические и психоэмоциональные нагрузки, несбалансированное питание, экологическое неблагополучие и многие патологические состояния вызывают изменения иммунного ответа и поэтому могут влиять на качественные и количественные характеристики нормальной флоры кишечника. В случае развития дисбактериоза кишечника у больного ребенка могут выявляться клинические состояния, которые связаны со снижением колонизационной резистентности, расстройствами пищеварения и трофическими нарушениями, нарушением детоксицирующей функции кишечной микрофлоры и изменениями иммунного ответа.
В случае развития дисбактериоза кишечника у больного ребенка могут выявляться клинические состояния, которые связаны со снижением колонизационной резистентности, расстройствами пищеварения и трофическими нарушениями, нарушением детоксицирующей функции кишечной микрофлоры и изменениями иммунного ответа.
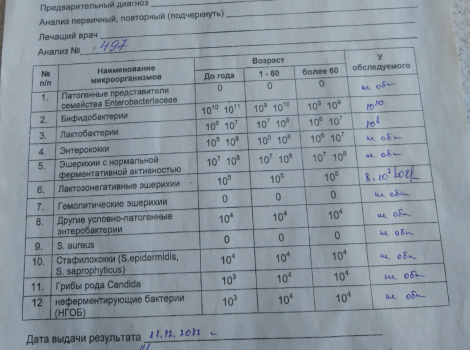
Диагностика и оценка тяжести кишечного дисбактериоза
В зависимости от степени выраженности клинических проявлений и особенностей микробиологических изменений выделяют 3 степени дисбактериоза: компенсированная, субкомпенсированная и декомпенсированная. Однако в оценке степеней дисбактериоза нет единой точки зрения, так как часто используются разные клинико-лабораторные критерии. Клинические проявления дисбактериоза кишечника в значительной степени определяются локализацией изменений. Дисбактериоз тонкой кишки — синдром избыточного бактериального роста (обсеменения), чаще характеризуется диареей и формированием синдрома нарушенного кишечного всасывания с самыми разнообразными отклонениями в гомеостазе. Дисбактериоз толстой кишки может не иметь клинических проявлений. В ряде случаев описывают связь запоров с нарушениями микрофлоры. Может формироваться тяжелое заболевание — псевдомембранозный колит.
Дисбактериоз толстой кишки может не иметь клинических проявлений. В ряде случаев описывают связь запоров с нарушениями микрофлоры. Может формироваться тяжелое заболевание — псевдомембранозный колит.
Лабораторная диагностика дисбактериоза чаще всего базируется на микробиологическом анализе фекалий. Микробиологическими критериями служат снижение бифидолактобактерий, снижение или увеличение эшерихий, появление штаммов с измененными свойствами, повышение количества кокков, обнаружение условно-патогенных грамотрицательных палочек, а также грибов и клостридий более 103 КОЕ/л. В анализах возможны различные сочетания указанных сдвигов.
В настоящее время применяется также газожидкостная хроматография. Хроматографический метод позволяет оценить химические соединения, связанные с жизнедеятельностью нормальной микрофлоры.
Оценка копрологии выявляет бродильную и гнилостную диспепсию, нарушения расщепления и всасывания пищевых ингредиентов.
В ряде случаев целесообразно определение ЛПС-О-антигена, уровня энтеротоксинов.
Коррекция микрофлоры
Лечебные программы по восстановлению нарушенной микрофлоры должны строиться с учетом возможных факторов, приводящих к ее изменению. Имея в своем арсенале широкий спектр различных препаратов, для выбора конкретных лекарств врач должен проанализировать индивидуальные изменения в организме ребенка с учетом преморбидного фона, возраста, характера вскармливания, аллергических реакций, перенесенных кишечных инфекций, а также препаратов, используемых для терапии основного заболевания.
Питание
Адекватное, соответствующее возрасту ребенка, сбалансированное питание при нормальном функционировании органов и систем предотвращает развитие дисбиозов. При изменениях микрофлоры необходима коррекция питания с учетом моторики, секреторных изменений ЖКТ, ферментативной активности пищеварительного тракта и дополнительным введением витаминно-минеральных комплексов. В настоящее время широкое распространение получает так называемое функциональное питание. При функциональном питании употребляются готовые пищевые продукты, в которые добавляют биопрепараты, антиоксиданты, каротиноиды, ферменты и другие субстраты. Для детей раннего возраста широко применяются адаптированные смеси, обогащенные представителями микрофлоры, — (Малютка), (Биолакт адаптированный), (Бифидок), (Бифилин), (Бифидолакт), (Бифилайф), (Виталакт) и ряд других. Во многих случаях оправдывает себя применение сухой смеси (Лактофидус), содержащий бифидобактерии и стрептококки, (НАН) с бифидобактериями. Для выхаживания детей в неонатальном периоде разработано функциональное питание в виде лиофилизированного грудного молока, обогащенного Bifidobacterium bifidum.
В настоящее время широкое распространение получает так называемое функциональное питание. При функциональном питании употребляются готовые пищевые продукты, в которые добавляют биопрепараты, антиоксиданты, каротиноиды, ферменты и другие субстраты. Для детей раннего возраста широко применяются адаптированные смеси, обогащенные представителями микрофлоры, — (Малютка), (Биолакт адаптированный), (Бифидок), (Бифилин), (Бифидолакт), (Бифилайф), (Виталакт) и ряд других. Во многих случаях оправдывает себя применение сухой смеси (Лактофидус), содержащий бифидобактерии и стрептококки, (НАН) с бифидобактериями. Для выхаживания детей в неонатальном периоде разработано функциональное питание в виде лиофилизированного грудного молока, обогащенного Bifidobacterium bifidum.
Большое значение для коррекции микрофлоры кишечника имеют пищевые волокна. Они являются естественными энтеросорбентами и влияют на состав микробоценоза. Микробная флора использует пищевые волокна в качестве субстрата для жизнедеятельности, однако следует помнить, что продукты их метаболизма могут оказывать как физиологическое, так и токсическое действие.
Пищевые волокна (пектины, лигнины, целлюлоза, гемицеллюлоза) содержатся в большом количестве в отрубях, морской капусте, яблоках, моркови, красной рябине и других овощах и фруктах; поступая в толстую кишку, они подвергаются воздействию глюкозидаз. Глюкоза является субстратом для многих анаэробных бактерий. Велика роль и других образующихся метаболитов, среди них молочная кислота, другие короткоцепочечные монокарбоновые кислоты, которые ингибируют патогенную флору и являются субстратом для восстановления кишечного эпителия. Пропионовая кислота регулирует микроциркуляцию толстой кишки через сосудистые сфинктеры, бутират участвует в пролиферации и дифференцировке эпителия кишечника. Пищевые волокна существенно снижают уровень эндогенного гистамина и других биологических аминов, которые реализуют аллергические проявления при болезнях пищеварительной системы. Хорошо зарекомендовали себя препараты лактулозы. Для лечения дисбиозов широко используется нормазе. Препарат высоко эффективен при наличии запоров и аллергического компонента.
Ферментные препараты
Для улучшения расщепления и всасывания пищевых ингредиентов могут использоваться ферментные препараты на основе панкреатина, а в сложных случаях — микротаблетированные ферменты, которые могут предотвращать гнилостные процессы. В последнее время с хорошим эффектом применяются комбинированные препараты вобензим, флагензим. Они особенно эффективны в комплексной терапии дисбиозов кишечника, сопровождающихся нарушениями кишечного всасывания и аллергическими проявлениями у детей.
Энтеросорбенты
Применение энтеросорбентов особенно важно в условиях возрастания полирезистентности микробов к антибактериальным средствам. Сорбенты обладают высокой сорбирующей активностью по отношению к экзо- и эндотоксинам, метаболитам бактерий, желчным кислотам, а также самим бактериям и вирусам. Применяются сорбенты на основе гранулированных активированных углей: карболен, микросорб П, активированный уголь СКН, энтеросорбент СКН, карболонг и ряд других. Энтеросорбент смекта, представляющий собой микропластины диоктаэдра кремния и алюминия также нашел свое применение в педиатрической практике. Этот препарат способствует улучшению свойств слизи ЖКТ, повышению резистентности слизистой оболочки , имеет цитопротективное действие. С хорошим терапевтическим эффектом применяются новые сорбенты — СУМС1 и альгисорб (альгинат кальция), они быстро выводят различные метаболиты, нормализуют показатели микрофлоры. СУМС1 представляет собой углеродоминеральный сорбент в виде гранул и порошка. Альгисорб изготавливается из морских водорослей — ламинарий, не влияет на обмен кальция, калия, железа, микроэлементов, поэтому может применяться в течении длительного времени. Он хорошо восстанавливает многие адаптационные механизмы.
Энтеросорбент смекта, представляющий собой микропластины диоктаэдра кремния и алюминия также нашел свое применение в педиатрической практике. Этот препарат способствует улучшению свойств слизи ЖКТ, повышению резистентности слизистой оболочки , имеет цитопротективное действие. С хорошим терапевтическим эффектом применяются новые сорбенты — СУМС1 и альгисорб (альгинат кальция), они быстро выводят различные метаболиты, нормализуют показатели микрофлоры. СУМС1 представляет собой углеродоминеральный сорбент в виде гранул и порошка. Альгисорб изготавливается из морских водорослей — ламинарий, не влияет на обмен кальция, калия, железа, микроэлементов, поэтому может применяться в течении длительного времени. Он хорошо восстанавливает многие адаптационные механизмы.
Бактерийные препараты
Широкое распространение получили бактерийные препараты на основе живых микроорганизмов, представителей нормальной микрофлоры — пробиотики (см. таблицу). В настоящее время появилось новое понятие — биотерапевтические агенты (БТА), представляющие собой препараты микроорганизмов, на основе штаммов лактобифидобактерий. Бифидумбактерин, лактобактерин, кисломолочный бифидумбактерин относятся к категории БТА. Для этих препаратов характерна способность выживать в кислой среде, эффективно прикрепляться к эпителиоцитам, осуществлять колонизацию слизистой, продуцировать антимикробные субстанции, стимулировать иммунную систему, предупреждать избыточный рост и размножение патогенных микроорганизмов, восстанавливать нормальную микрофлору.
таблицу). В настоящее время появилось новое понятие — биотерапевтические агенты (БТА), представляющие собой препараты микроорганизмов, на основе штаммов лактобифидобактерий. Бифидумбактерин, лактобактерин, кисломолочный бифидумбактерин относятся к категории БТА. Для этих препаратов характерна способность выживать в кислой среде, эффективно прикрепляться к эпителиоцитам, осуществлять колонизацию слизистой, продуцировать антимикробные субстанции, стимулировать иммунную систему, предупреждать избыточный рост и размножение патогенных микроорганизмов, восстанавливать нормальную микрофлору.
В ряде препаратов имеется сочетание микроорганизмов: бификол (бифидо-колибактерии), бифиформ (бифидум-энтерококк), бифоцит (бифидум-лактобактерии), линекс (три штамма лактобактерий), кисломолочный бифилакт. Имеются также комплексные препараты: бифидумбактерин-форте (с косточковым сорбентом), бифилиз (с лизоцимом), нутролин В (с витаминами группы В), кипацид (с иммуноглобулином). В настоящее время появляются рекомбинантные препараты (субалин).
В настоящее время появляются рекомбинантные препараты (субалин).
Имеются разные точки зрения на применение бактерийных препаратов, содержащих аэробные спорообразующие бактерии — бактисубтил, споробактерин и др. Существуют указания, что искусственное введение в кишечник этих бактерий в больших количествах и излишнее размножение бацилл в нехарактерной для них экологической нише, сопровождающееся распространением бацилл за пределы кишечника, на фоне снижения количества облигатной флоры может увеличивать степень дисбиотических нарушений, ухудшать состояние пациента. B. cereus синтезируют гемолизины, способные разрушать эритроциты. Препарат споробактерин содержит бациллы, продуцирующие протеолитические ферменты, фибринолизины. Штаммы, содержащиеся в споробактерине, из-за высокой протеолитической активности проникают через слизистую оболочку в кровь, лимфу, достигают лимфатических узлов, селезенки, печени. По сути эти штаммы обладают свойствами, характерными для патогенных микроорганизмов. Можно согласиться с мнением ряда авторов, что широкое применение указанных препаратов мало обосновано и должны быть строгие показания для их использования.
Можно согласиться с мнением ряда авторов, что широкое применение указанных препаратов мало обосновано и должны быть строгие показания для их использования.
В настоящее время при неэффективности коммерческих бактерийных препаратов в силу слабой их приживляемости в кишечнике больного могут использоваться аутоштаммы бифидо- и лактобактерий. Они могут длительно сохранять свою активность в лиофилизированном состоянии или в холодильнике при температуре -20оС. Особенно рекомендуется коррекция микрофлоры с помощью аутоштаммов у больных, требующих применения цитостатиков, глюкокортикоидов, антибиотиков, лучевой терапии.
Отработано применение донорских штаммов бифидо- и лактобактерий матери для ребенка через 2 ч после кесарева сечения с целью предотвращения патологической колонизации кишечника и формирования нормальной микрофлоры.
Также используются препараты пробиотики, состоящие из пищевых добавок, селективно стимулирующих рост нормальной флоры. Достаточно широко используются лизоцим, лактулоза, хилак-форте.
Достаточно широко используются лизоцим, лактулоза, хилак-форте.
В случаях дисбактериоза 2-3-й степени необходимо назначать средства, обладающие селективной антибактериальной активностью. Различные фаги часто бывают эффективны в лечении дисбактериозов. В настоящее время используют стафилококковый, клебсиеллезный, пиобактериофаг, интестибактериофаг, синегнойный и другие фаги.
В некоторых случаях, при низкой чувствительности к фагам могут использоваться антибактериальные препараты: фуразолидон, хлорофилипт, метронидазол, нифуроксазид, интетрикс, а также антибиотики и группа антигрибковые средства, среди последних следует указать кетоконазол, флюконазол, натамицин.
Комплексная терапия может включать иммуномодулирующие средства, в том числе витамины, стабилизаторы клеточных мембран, микроэлементы.
Результат лечения зависит от эффективности терапии основного заболевания, адекватности выбора комплекса препаратов с учетом не только микробиологических изменений, но и особенностей организма ребенка.
Литература
1. Бабушкин Н.В. Применение препарата (Хилак-форте) в комплексном лечении дисбактериоза кишечника. Рос. журн. гастроэнтерол., гепатол., колопроктол. 1997; 5: 96-7.
2. Запруднов А.М., Мазанкова Л.Н. Микробная флора кишечника и пробиотики. М. 1999.
3. Куваева И.Б., Ладодо К.С. Микроэкологические и иммунные нарушения у детей. М. 1991.
4. Коровина Н.А., Вихерева В.Н., Захарова И.Н. и др. Профилактика и коррекция нарушений микробиоциноза кишечника у детей раннего возраста. М. 1996.
5. Коршунов В.М., Смеянов В.В., Ефимов Б.А. Рациональные подходы к проблеме коррекции микрофлоры кишечника. Вестн. РАМН. 1996; 2: 60-5.
6. Коршунов В.М., Володин Н.Н., Ефимов Б.А. и др. Микроэкология желудочно-кишечного тракта. Коррекция микрофлоры при дисбактериозах кишечника. М. 1999.
8. Парфенов А.И. Микробная флора кишечника и дисбактериоз. Рус. мед. журн. 1998; 6 (18): 1170-3.
Рус. мед. журн. 1998; 6 (18): 1170-3.
9. Шендеров Б.А., Манвелова М.А. Функциональное питание и пробиотики: микроэкологические аспекты. М. 1997.
10. Щеплягина Л.А., Римарчук Г.В., Борисова О.И. и др. Организация медицинского наблюдения за детьми в районах экологического неблагополучия. (Лекция). М. 1998; 25-35.
.
архивов клинической микробиологии | Insight Medical Publishing
Импакт-фактор журнала: 0,72 *; 1,37 * (5-летний импакт-фактор)
Index Copernicus Value: 88.97
H Index: 3
Глобальный импакт-фактор: 0,564
Research Gate Journal Impact: 0,16
Архив клинической микробиологии (ISSN: 1989-8436) — это рецензируемый международный журнал, в состав редакционной коллегии которого входят всемирно признанные ученые.С быстрой публикацией статей во всех областях микробиологии и инфекционных болезней. Архив клинической микробиологии действует уже восьмой год, и он был включен в каталог Национальной медицинской библиотеки (NLM) (первый шаг для индексации в PubMed). Кроме того, он проиндексирован в Index Copernicus (ICV: 88.97), DeepDyve, Open J Gate, JournalSeek, EBSCO A-Z.
Архив клинической микробиологии действует уже восьмой год, и он был включен в каталог Национальной медицинской библиотеки (NLM) (первый шаг для индексации в PubMed). Кроме того, он проиндексирован в Index Copernicus (ICV: 88.97), DeepDyve, Open J Gate, JournalSeek, EBSCO A-Z.
https://www.imedpub.com/submissions/archives-clinical-microbiology.html или отправьте в виде вложения по электронной почте в редакцию по адресу [электронная почта защищена]
Патогенные бактерии
Патогенные бактерии — это бактерии, которые при попадании в организм способны вызывать заболевание и распространяться через воду, воздух, почву, а также при физическом контакте.В основном бактерии безвредны и полезны, но некоторые из них являются патогенными.
Связанные журналы патогенных бактерий
Журнал гепатита, Журнал иммунологических методов лечения инфекционных заболеваний, Журнал инфекционных заболеваний и терапии, Журнал инфекционных болезней и лечения, Журнал патологии и трансляционной медицины, Журнал патологии. Клинические исследования, Отчеты о клинических патологиях, Журнал микробиологии и патологии Джейкобса, Текущие отчеты по патобиологии, Международный журнал судебной медицины и патологии, Открытие патологии.
Клинические исследования, Отчеты о клинических патологиях, Журнал микробиологии и патологии Джейкобса, Текущие отчеты по патобиологии, Международный журнал судебной медицины и патологии, Открытие патологии.
Вирусная болезнь
Вирусные болезни — это инфекции, вызываемые вирусом или микроорганизмами. вирус, поражающий клетку, или формирование вирусной капсулы на поверхности клетки, которая может начать размножаться сама по себе и начинает распространяться, что приводит к вирусному заболеванию.
Журналы, относящиеся к вирусным заболеваниям
Журнал вирусологии и противовирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований,
Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Вирусная болезнь, Журнал болезней, передаваемых членистоногими, Всемирный вирусологический журнал, Текущее мнение в области вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Пищевая и экологическая вирусология, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Микобактериальные болезни
Микобактериальные заболевания — это инфекция одного типа, вызываемая скоплением микробов. Эти микобактериальные заболевания включают туберкулез, проказу, микобактерии язвы и Mycobacterium Para tuberculosis. Обычно они лечатся такими лекарствами, как рифампицин, этамбутол и изониазид. Mycobacterium leprae лечится дапсоном.
Журналы, относящиеся к микобактериальным болезням
Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Журнал патологии и эпидемиологии, Исследования первичного и приобретенного иммунодефицита, Журнал вирусологии и антивирусных исследований, Текущие отчеты о грибковых инфекциях, Журнал инвазивных грибковых инфекций, Отчеты о случаях медицинской микологии, Медицинские журнал микологии, Микология, Микозы, Микопатология, Микробиология будущего, Клеточный хозяин и микроб, Журнал Общества педиатрических инфекционных болезней.
Бактериальная инфекция
Бактериальные инфекции — это инфекции, вызываемые бактериями.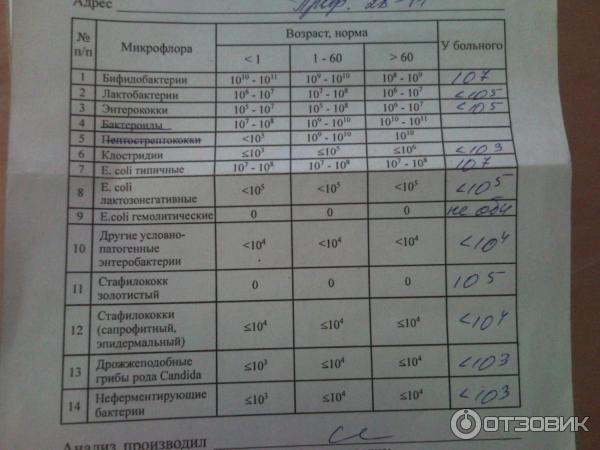 Инфекционная бактерия быстро размножается и выделяет токсичные химические вещества, которые повреждают ткани. Общие бактериальные инфекции включают пневмонию, ушные инфекции, диарею, инфекции мочевыводящих путей и кожные заболевания
Инфекционная бактерия быстро размножается и выделяет токсичные химические вещества, которые повреждают ткани. Общие бактериальные инфекции включают пневмонию, ушные инфекции, диарею, инфекции мочевыводящих путей и кожные заболевания
Журналы, связанные с бактериальной инфекцией
Журнал гепатита, Журнал иммунологических методов при инфекционных заболеваниях, Журнал инфекционных заболеваний и терапии, Журнал инфекционных заболеваний и лечения, Патогены и болезни, Текущие отчеты по клинической микробиологии, Международный журнал исследований микробиологии и иммунологии, Журнал прикладной микробиологии и окружающей среды , Журнал глобальной устойчивости к противомикробным препаратам, Спектр микробиологии, микробиология JSM, микробиология OA, микробиология и инфекционные заболевания SOJ, Универсальный журнал исследований микробиологии.
Вирусная инфекция
Вирусные инфекции — это небольшой инфекционный организм, который меньше грибка или бактерии. Вирус прикрепляется к поверхности клетки и высвобождает свою вирусную ДНК или РНК внутри клеток, которые затем реплицируются сами по себе внутри клетки, чтобы сделать клетку более заразной и распространяться от одной клетки к другой, что приводит к вирусной инфекции.
Вирус прикрепляется к поверхности клетки и высвобождает свою вирусную ДНК или РНК внутри клеток, которые затем реплицируются сами по себе внутри клетки, чтобы сделать клетку более заразной и распространяться от одной клетки к другой, что приводит к вирусной инфекции.
Журналы, связанные с вирусной инфекцией
Журнал ВИЧ и ретро-вирусов, Журнал инфекционных заболеваний и диагностики, Журнал медицинской микробиологии и диагностики, Микобактериальные заболевания, Детские инфекционные заболевания: открытый доступ, вирусология и микология, вирусные заболевания, Журнал болезней, передаваемых членистоногими, Всемирный вирусологический журнал, Текущее мнение в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Пищевая и экологическая вирусология, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Грибковая инфекция
Грибковые инфекции — это инфекция, которая обычно начинается в легких или на коже, прогрессирует медленно и редко бывает серьезной, если иммунная система не работает на выходных.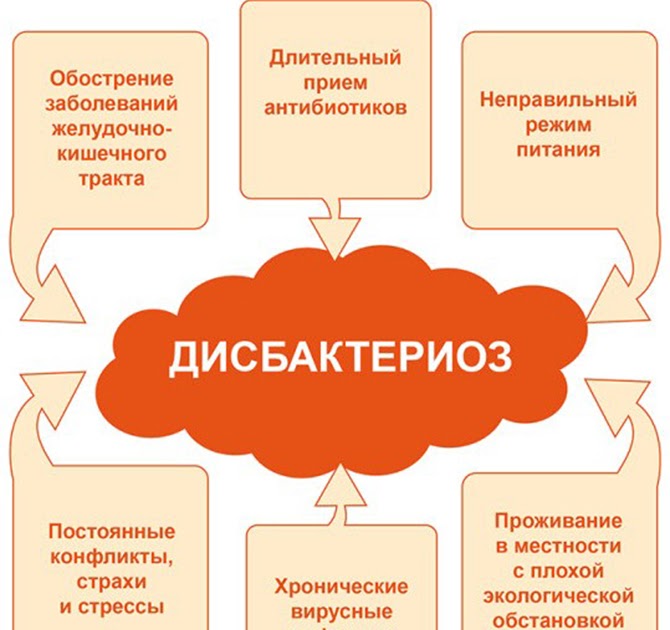 Когда иммунная система выходит на выходные, она может быть очень агрессивной и быстро распространяться, что приводит к смерти.
Когда иммунная система выходит на выходные, она может быть очень агрессивной и быстро распространяться, что приводит к смерти.
Журналы, относящиеся к грибковой инфекции
Медицинская микология: открытый доступ, Журнал патологии и эпидемиологии, Исследования первичного и приобретенного иммунодефицита, Журнал вирусологических и противовирусных исследований, Достижения в области антибиотиков и антител, Текущие отчеты о грибковых инфекциях, Журнал инвазивных грибковых инфекций, Отчеты о случаях медицинской микологии, Медицинская микология журнал, Микология, Микозы, Микопатология, Микробиология будущего, Клеточный хозяин и микроб, Журнал Общества педиатрических инфекционных болезней.
Медицинская микробиология
Медицинская микробиология начинается с обзора иммунной системы, с помощью которой микроорганизмы или токсины проникают силой, чтобы победить клетки и встретиться с ними. Это изучение микроорганизмов или микробов, которые влияют на все аспекты нашей жизни, а также включают реакцию хозяина на микроорганизмы.
Связанные журналы медицинской микробиологии
Клиническая микробиология: открытый доступ, журнал новых инфекционных заболеваний, журнал судебной патологии, журнал ВИЧ и ретро-вирусов, журнал инфекционных заболеваний и диагностики, открытый журнал медицинской микробиологии, журнал медицинской микробиологии, Международный журнал медицинской микробиологии, медицина Микробиология и иммунология, Индийский журнал медицинской микробиологии, Канадский журнал инфекционных заболеваний и медицинской микробиологии, Обзоры по медицинской микробиологии, Международный журнал медицинской микробиологии, Приложение, Письма по медицинской микробиологии.
Вирус гепатита
Гепатит — это заболевание печени, при котором печень набухает и воспаляется из-за вирусной инфекции, которая приводит к гепатиту. Состояние может быть самоограничивающимся или прогрессировать до фиброза, цирроза или рака печени. Вирусная инфекция гепатита бывает пяти типов: гепатит A, B, C, D и E, а также может возникать в результате употребления алкоголя.
Связанные журналы вируса гепатита
Журнал гепатита, Журнал иммунологических методов лечения инфекционных заболеваний, Журнал инфекционных заболеваний и терапии, Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Текущие отчеты гепатологии, Исследования и лечение гепатита, Вирусный гепатит на практике, Ежемесячный гепатит, Текущие отчеты о гепатите, Еженедельный гепатит, Журнал вирусных гепатитов, Обзоры вирусных гепатитов, Ежегодник по гепатиту B, Горячие темы по вирусным гепатитам
Microbial Genomics
Микробная геномика — это исследование микроорганизмов, генетический материал которых содержит микробы.Анализ всего микробного генома дает представление о микробной оценке и разнообразии микробов, помимо филогении одного белка или гена.
Связанные журналы микробной геномики
Микробная и сравнительная геномика, Наука и технологии генома, Новые микробы и инфекции, Микробная информатика и эксперименты, Микробная биотехнология, Фабрики микробных клеток, Микробные выбросы: вирусы, бактерии, грибы, Микробная экология в здоровье и болезнях.
Золотистый стафилококк
Staphylococcus aureus — это бактерии, вызывающие болезни человека. Чаще всего абсцессы или целлюлит — это инфекции, вызванные золотистым стафилококком. Это происходит, когда кожа порезается или царапается, что позволяет бактериям проникнуть внутрь, а затем инфицировать. В основном это происходит в ногах и руках.
Журналы, относящиеся к Staphylococcus aureus
Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Журнал патологии и эпидемиологии, Исследования первичного и приобретенного иммунодефицита, Журнал вирусологии и противовирусных исследований, Патогены и болезни, Текущие отчеты клинической микробиологии, Международный журнал исследований микробиологии и иммунологии, Журнал прикладной микробиологии и микробиологии окружающей среды, Журнал глобальной устойчивости к противомикробным препаратам, Спектр микробиологии, микробиология JSM, микробиология OA, микробиология и инфекционные заболевания SOJ, Универсальный журнал микробиологических исследований.
Вирус иммунодефицита человека
Вирус иммунодефицита человека — это вирус, который атакует иммунную систему, заражая лейкоциты. Лейкоциты являются важной частью иммунной системы, которая будет уничтожена определенным вирусом, называемым ВИЧ, что приводит к нехватке лейкоцитов, что снижает иммунную силу.
Связанные журналы вируса иммунодефицита человека
Журнал ВИЧ и ретро-вируса, Журнал инфекционных заболеваний и диагностики, Журнал медицинской микробиологии и диагностики, Микобактериальные заболевания, Детские инфекционные заболевания: открытый доступ, вирусология и микология, The lancet HIV, Журнал клинических исследований в области ВИЧ, СПИДа и профилактики, Исследования и лечение СПИДа, ВИЧ / СПИД (Окленд, Н.Z.), Журнал исследований СПИДа и ВИЧ (онлайн), Журнал эпиднадзора за ВИЧ и эпидемиологией СПИДа, Будущее лечение ВИЧ, Журнал профилактики ВИЧ / СПИДа у детей и молодежи, Исследования СПИДа и ретровирусы человека, Обзор ВИЧ и СПИДа.
Холера
Холера — это инфекционное заболевание, вызывающее диарею. Vibrio cholera — это бактерия, вызывающая холеру, которую можно найти в загрязненной воде или пище, и которая приводит к обезвоживанию организма из-за потери жидкости организма во время диареи.
Журналы по теме холеры
Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований, Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Архивы воспаления, Текущие отчеты об инфекционных заболеваниях, Медицина путешествий и инфекционные заболевания, Канадский журнал инфекционных заболеваний и медицинской микробиологии, Текущие клинические темы в инфекционных заболеваниях, Скандинавский журнал инфекционных заболеваний, Инфекционные добавки в клинической практике, Kansenshogaku zasshi.Журнал Японской ассоциации инфекционных заболеваний, Достижения в области детских инфекционных болезней, Междисциплинарные перспективы инфекционных заболеваний, Журнал глобальных инфекционных заболеваний, Американский журнал инфекционных заболеваний.
Болезнь, вызванная вирусом Эбола
Вирус Эбола — это вирус, вызывающий острое и серьезное заболевание, которое при отсутствии лечения часто заканчивается летальным исходом. Его иначе называют геморрагической лихорадкой Эбола, которая является смертельным вирусом, вызывающим внутреннее и внешнее кровотечение в организме.
Связанные журналы болезни, вызванной вирусом Эбола
Архив клинической микробиологии, Журнал вирусологии и противовирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований, Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Вирусные заболевания, Журнал болезней, передаваемых членистоногими, Всемирный журнал вирусология, Текущие мнения в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Пищевая и экологическая вирусология, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Ротавирусная инфекция
Инфекция, вызванная вирусом роты, является наиболее частой причиной тяжелой диареи, вызывающей обезвоживание. Она может распространяться через заражение рук, воды, пищи или любых предметов. Вирус попадает в организм через пищевые продукты и распространяется через слизистую оболочку, что в конечном итоге приводит к диарее из-за инфекции.
Журналы, относящиеся к ротавирусной инфекции
Журнал вирусологии и противовирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований,
Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Архив воспаления, вирусных заболеваний, Журнал болезней, передаваемых членистоногими, Всемирный журнал вирусология, Текущие мнения в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Пищевая и экологическая вирусология, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Связь между грибковым и бактериальным дисбиозом у младенцев и детским атопическим хрипом в непромышленных условиях
Общие сведения
Астма является наиболее распространенным хроническим заболеванием детского возраста. Недавно мы определили критическое окно в начале жизни мышей и младенцев в Канаде, в течение которого микробные изменения кишечника (дисбиоз) влияют на развитие астмы. Учитывая географические различия в микробиоте кишечника человека во всем мире, мы изучили влияние микробного дисбактериоза кишечника на атопическое дыхание у населения, живущего в разных условиях развивающегося мира.
Цель
Мы стремились определить, связаны ли микробные изменения в раннем младенчестве с развитием атопического хрипа в непромышленных условиях.
Методы
Мы провели исследование случай-контроль, вложенное в когорту новорожденных из сельских районов Эквадора, в котором мы идентифицировали 27 детей с атопическим хрипом и 70 здоровых контрольных субъектов в возрасте 5 лет. Мы проанализировали бактериальную и эукариотическую микробиоту кишечника в образцах стула, собранных в возрасте 3 месяцев, с использованием секвенирования 16S и 18S.Бактериальные метагеномы были предсказаны на основе данных 16S рРНК с использованием филогенетического исследования сообществ путем реконструкции ненаблюдаемых состояний и классифицированы по функциям с помощью Киотской энциклопедии генов и онтологии геномов. Концентрации фекальных короткоцепочечных жирных кислот определяли с помощью газовой хроматографии.
Мы проанализировали бактериальную и эукариотическую микробиоту кишечника в образцах стула, собранных в возрасте 3 месяцев, с использованием секвенирования 16S и 18S.Бактериальные метагеномы были предсказаны на основе данных 16S рРНК с использованием филогенетического исследования сообществ путем реконструкции ненаблюдаемых состояний и классифицированы по функциям с помощью Киотской энциклопедии генов и онтологии геномов. Концентрации фекальных короткоцепочечных жирных кислот определяли с помощью газовой хроматографии.
Результаты
Как ранее наблюдалось у канадских младенцев, микробный дисбиоз в возрасте 3 месяцев был связан с более поздним развитием атопического хрипа. Однако дисбактериоз у эквадорских младенцев затрагивал разные бактериальные таксоны, был более выраженным, а также затрагивал несколько грибковых таксонов.Прогнозируемый метагеномный анализ подчеркнул значительные связанные с дисбиозом различия в генах, участвующих в метаболизме углеводов и таурина. Уровни ацетата и капроата короткоцепочечных жирных кислот в кале были снижены и увеличены, соответственно, в 3-месячных образцах стула детей, у которых развился атопический хрип.
Выводы
Наши результаты подтверждают важность грибковой и бактериальной микробиоты в течение первых 100 дней жизни для развития атопического хрипа и обеспечивают дополнительную поддержку для рассмотрения модуляции микробиома кишечника в качестве основной стратегии профилактики астмы.
Ключевые слова
Астма
атопия
свистящее дыхание
микробиом кишечника
микобиом
короткоцепочечные жирные кислоты
непромышленные условия
используемые сокращения
AW
здоровый ребенок с атопической инфекцией
MaAsLin
Многомерная ассоциация с линейными моделями
MED
Минимальная энтропийная декомпозиция
OTU
Оперативная таксономическая единица
PICRUSt
Филогенетическое исследование сообществ путем реконструкции ненаблюдаемых состояний
SCFA
Короткоцепочечные жирные кислоты
Просмотр статей (Рекомендуемые статьи) Аннотация
© 2017 Авторы.Опубликовано Elsevier Inc. от имени Американской академии аллергии, астмы и иммунологии.
от имени Американской академии аллергии, астмы и иммунологии.
Рекомендуемые статьи
Ссылки на статьи
8 способов улучшить микробиом вашего ребенка
Вот что вы можете сделать, чтобы дать ей наилучший возможный старт.
Ах, микробиом кишечника, это изобилующее скопление грибов, вирусов и бактерий, живущее внутри нашего кишечника. Сегодня мы так много слышим об этом, что можно было почти поверить, что здоровый кишечник — панацея от всего, от ожирения до астмы.
К сожалению, вероятно, это не так. По крайней мере, не для тебя.
Но для вашего ребенка? Это уже другая история!
Исследования, проведенные за последнее десятилетие, показали, что микробиомы кишечника младенцев могут влиять на их метаболическое и иммунное здоровье, а также на их пожизненный риск ожирения, астмы, аллергии и аутоиммунных заболеваний.
Перевод? В преддверии родов не беспокойтесь о том, что он какает на стол во время родов (это, скорее всего, произойдет в любом случае), волнуйтесь о том, что ваш ребенок не принимает зараженную бактериями ванну по пути на улицу.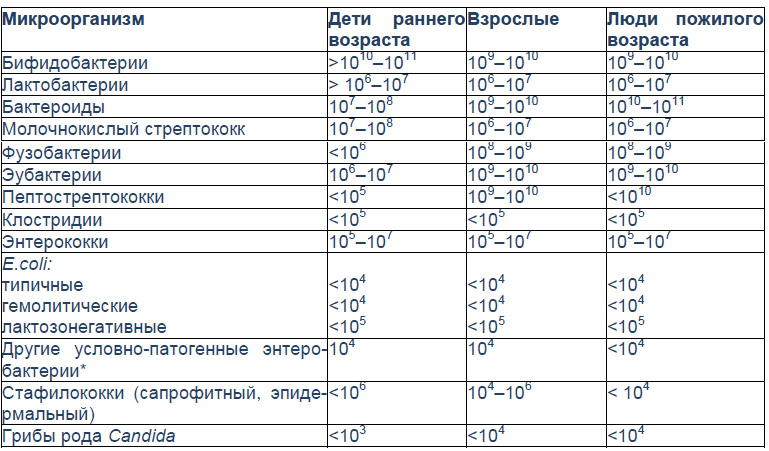
И в этом загвоздка. Теперь мы нарушаем нормальный забор кишечника ребенка мамиными бактериями более чем в половине всех родов в США. Кесарево сечение и антибиотики в раннем детстве прерывают передачу микробов от мамы к ребенку.
Микробиомы кишечника младенцев могут влиять на их метаболическое и иммунное здоровье, а также на их пожизненный риск ожирения, астмы, аллергии и аутоиммунных заболеваний.
Хотя то, что происходит во время родов, часто находится вне нашего контроля, есть простые шаги, которые вы можете предпринять сегодня, чтобы улучшить здоровье кишечника вашего ребенка, которые кажутся по крайней мере безопасными и, возможно, полезными.
Как улучшить микробиом ребенка?
1. Ешьте много продуктов, богатых клетчаткой, во время беременности и кормления грудью —
Рацион, богатый клетчаткой, увеличивает разнообразие наших кишечных клопов и приближает набор видов к тем, которые встречаются в традиционных сообществах охотников-собирателей.
В качестве побочного продукта метаболизма клопы, любящие клетчатку, вырабатывают ацетат и бутират — два соединения, которые помогают поддерживать барьер кишечника и, следовательно, могут снизить риск аутоиммунных заболеваний.
Речь идет не только о том, как кормить ребенка, когда он или она начинает есть твердую пищу в возрасте от четырех до шести месяцев. Увеличивая потребление клетчатки во время беременности и кормления грудью, вы можете передать эти здоровые, любящие клетчатку кишечные микробы вашему ребенку во время родов и через грудное молоко.
2. Перед родами примите меры, чтобы снизить риск кесарева сечения —
Давайте начнем с признания того, что кесарево сечение может спасти жизнь. Позвольте мне прояснить ситуацию: я невероятно благодарен за то, что кесарево сечение безопасно и широко доступно.Некоторые из моих самых близких друзей все еще с нами из-за кесарева сечения.
Но, как мы все знаем, не все выполняемые сегодня кесарево сечение необходимы. Частота кесарева сечения выросла с менее 20% в 1970-х годах до 32% сегодня. Хотя определить правильный коэффициент сложно, почти все согласны с тем, что 32% — это слишком много. Большинство экспертов считают, что процент родов, которым требуется кесарево сечение, составляет около 15-20%.
Частота кесарева сечения выросла с менее 20% в 1970-х годах до 32% сегодня. Хотя определить правильный коэффициент сложно, почти все согласны с тем, что 32% — это слишком много. Большинство экспертов считают, что процент родов, которым требуется кесарево сечение, составляет около 15-20%.
Кесарево сечение влечет за собой не только более длительное время восстановления и более высокую вероятность осложнений, особенно при повторном кесаревом сечении, но и может нарушить микробиом кишечника вашего ребенка на месяцы, если не годы.
Рожденные естественным путем младенцы рождаются с бактериальной массой, покрытой с головы до ног бактериями их матери, тогда как младенцы, рожденные через кесарево сечение, попадают в мир в стерильных хирургических условиях через нижнюю часть живота своей матери. Эта разница оказывает сильное влияние на колонизацию кишечника.
Кесарево сечение может нарушить микробиом кишечника вашего ребенка на месяцы, если не годы.
Исследователи теперь считают, что эти изменения в колонизации кишечника могут объяснить, почему дети, рожденные через кесарево сечение, имеют более высокий риск ожирения, аллергии и диабета 1 типа.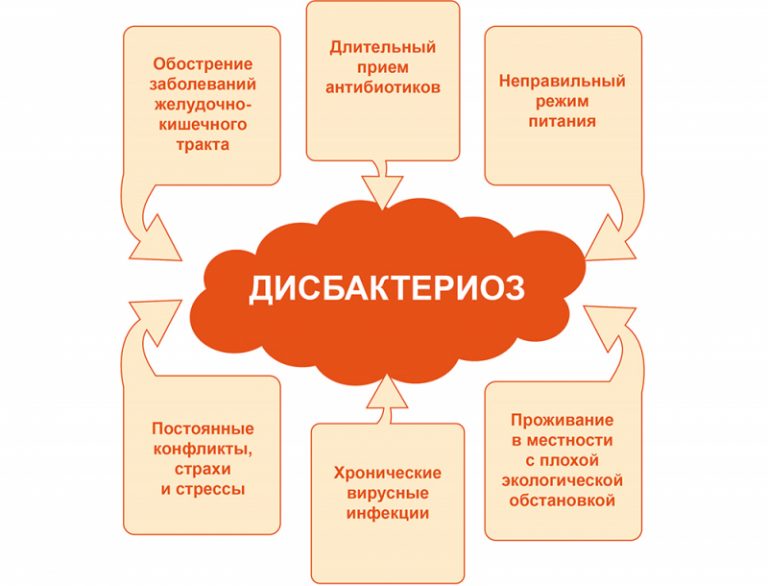
Очевидно, что роды непредсказуемы, и не всех кесарева сечения можно избежать. Лучшим способом снизить ваши шансы на ненужное кесарево сечение может быть тщательный выбор больницы. В США частота кесарева сечения в разных больницах различается в 10 раз: от 7% до 70%. Посетите этот веб-сайт, на котором перечислены тарифы больниц по штатам.
3. Тампоны —
Мазок — это обливание (или промокание) вашего ребенка кесаревым сечением всеми прекрасными жидкостями организма, которые он пропустил, минуя ваш родовой канал.
В то время как мазки тампонов становятся все более популярными среди некоторых родителей, в медицинской профессии это все еще вызывает споры.
Критики этой практики опасаются, что взятие мазка может подвергнуть вашего ребенка воздействию вредных бактерий и вирусов, таких как ВИЧ, герпес, хламидиоз и стрептококк группы B.
Другой серьезной критикой является то, что мы не знаем, действительно ли мазок приносит пользу здоровью в долгосрочной перспективе. Сторонники полагают, что мазок принесет пользу для здоровья. Но они делают логический скачок. Да, кесарево сечение связано с более высокими показателями ожирения, астмы, аллергии и аутоиммунных заболеваний.Однако мы не знаем наверняка, связано ли это с изменениями микробиома.
Сторонники полагают, что мазок принесет пользу для здоровья. Но они делают логический скачок. Да, кесарево сечение связано с более высокими показателями ожирения, астмы, аллергии и аутоиммунных заболеваний.Однако мы не знаем наверняка, связано ли это с изменениями микробиома.
Кесарево сечение также чаще встречается при беременностях с высоким риском, например при гестационном диабете, преэклампсии и дистрессе плода. Возможно, именно проблемы во время беременности и родов, а не недостаток микробов, повышают риск метаболических и иммунных нарушений.
Младенцы, рожденные с помощью кесарева сечения, также упускают не только микробы, они часто упускают из виду гормональные эффекты родов.
Потенциальные тампоны также сталкиваются с практической проблемой: никто не определил «правильный путь» для тампона. В исследовании, проведенном в 2016 году, исследователи пропитали марлю во влагалище роженицы. Вскоре после рождения они натирали марлей лицо, рот и попку новорожденного.
Новорожденные, рожденные с помощью кесарева сечения, но с мазком, имели микробные сообщества полости рта и кожи, которые более напоминали микробные сообщества новорожденных, рожденных естественным путем, но это было менее верно, когда дело касалось микробных сообществ кишечника.Возможно, потому, что, как мы все знаем, но не любим об этом говорить, новорожденные подвергаются — кхм — не только вагинальным выделениям во время родов.
В основе споров по поводу мазков лежит вопрос о статус-кво. Мазок имитирует естественные естественные роды. Тем не менее, как только вы что-то забираете, вы меняете систему координат и то, что воспринимается как статус-кво.
Для младенцев с кесаревым сечением это делает роды в стерильной хирургической среде новой нормой.
« В каком-то смысле наука еще не окончена. С другой стороны, по сравнению с другими вариантами, которые вы, возможно, делаете, это очень естественный выбор. Если бы вы не родили ребенка с помощью кесарева сечения, вы не смогли бы избежать покрытия вашего ребенка этими бактериями », — Роб Найт, микробиолог из Калифорнийского университета в Сан-Диего.

4. Дождитесь первой ванны —
нет необходимости окунать новорожденного в ванну, и многие больницы обновили свои процедуры так, что первая ванна откладывается как минимум на 24 часа, как рекомендует Всемирная организация здравоохранения.Раннее купание может не только повысить риск низкого уровня сахара в крови у новорожденных, но и помешать ранней бактериальной колонизации мамиными бактериями.
Не говоря уже о пользе для здоровья, кто хочет смыть этот восхитительный, слегка ванильный запах новорожденного. Наслаждайтесь!
5. Пробиотики —
А, дополнение du jour. «Живые культуры» рекламируются на вашей бутылке кефира. Слизистая мокрота на дне бутылки чайного гриба. По определению, любые микроорганизмы, которые могут пережить мучительный путь из вашего желудка с повышенной кислотностью в менее кислый кишечник.
Ммм… бактерии.
Итак, помимо маркетинга, приносит ли ребенку пользу употребление «здоровых кишечных микробов»?
Как ни странно, ответ кажется, по крайней мере, в некоторых случаях… ДА.
Для недоношенных детей пробиотики вдвое снижают риск некротического энтероколита — тяжелого и часто смертельного заболевания, распространенного у недоношенных детей. Они также снижают вероятность сепсиса, тяжелой и потенциально смертельной инфекции крови, на 12%. Для предотвращения этих серьезных осложнений недоношенности наиболее эффективны «коктейли» с пробиотиками, содержащие несколько штаммов бактерий, обычно смесь Lactobacillus и Bifidobacteria .
Для всех младенцев пробиотики также снижают риск детской экземы, но не риск детской аллергии или астмы. Опять же, коктейли с пробиотиками оказываются наиболее эффективными. Согласно метаанализу пяти рандомизированных исследований, пробиотики также могут уменьшить колики у новорожденных.
Для недоношенных детей пробиотики вдвое снижают риск некротического энтероколита.
Для детей старшего возраста, которые получают курс антибиотиков, пробиотики снижают риск развития диареи, связанной с антибиотиками, вдвое, при этом пробиотики в высоких дозах (> 5 миллиардов КОЕ / день) являются наиболее эффективными.
Никто не знает наверняка, но предварительный консенсус формируется вокруг того, что раньше было лучше. Пробиотики, вводимые в течение первого месяца жизни, снижают вероятность развития диабета 1 типа у детей из группы генетического риска, тогда как те, которые вводятся позже, не оказывают никакого эффекта. Исследователи аллергии начали называть первые «100 дней» критическим окном для раннего развития иммунной системы.
Короче говоря, исследования остаются неясными в отношении того, какие обычные пробиотики работают лучше всего, и в оптимальное время пробиотики кажутся безопасными даже для иммунологически уязвимых детей, таких как недоношенные (хотя сообщалось о редких побочных эффектах для очень недоношенных детей), а также в высоких дозах, многоразовых. Штаммовые коктейли имеют больше доказательств на своей стороне.
6. Заведите домашнюю собаку —
Завести новую собаку и завести ребенка в том же году? Приучить щенка к горшку, когда всю ночь кормит новорожденного?
Ага, это рецепт хаоса.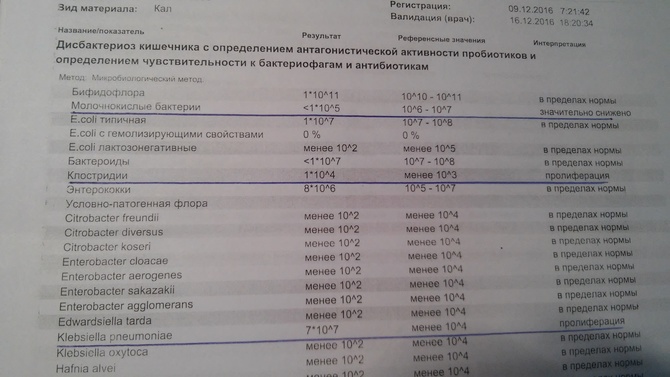
Тем не менее, когда дело доходит до профилактики аллергических заболеваний, собаки действительно могут быть лучшими друзьями вашего ребенка. Младенцы, воспитываемые в домашних условиях с собаками, реже страдают ушными инфекциями и простудными заболеваниями и нуждаются в меньшем количестве курсов антибиотиков в течение первого года жизни. Несколько исследований также показали, что домашняя собака в первый год жизни вашего ребенка снижает риск аллергической сенсибилизации, экземы, диабета 1 типа и астмы, возможно, потому, что собаки приносят пользу микробиому вашего ребенка.
Но, увы, недосыпающим молодым родителям, которые хотят отложить поиски своего нового лучшего друга, кажется, что контакт с собакой должен происходить вскоре после рождения, чтобы обеспечить защиту. Воздействие в детстве не приносит пользы.
«Абсолютно неправильно ставить собаку в дом детям, больным астмой. Да, раннее появление собаки в доме может защитить от хрипов и респираторных инфекций.
Но это разоблачение должно происходить в очень раннем возрасте ». — Карен ДеМут, доктор медицины, магистр здравоохранения, доцент педиатрии в Университете Эмори в Атланте
7.Не давайте своему малышу ненужные антибиотики —
Давайте проясним … антибиотики спасают жизнь. Когда они вам нужны, они вам действительно нужны.
Однако антибиотики назначают слишком часто. Их часто назначают при легких заболеваниях, которые проходят самостоятельно, и при вирусных заболеваниях, таких как простуда и большинство ушных инфекций, против которых они совершенно неэффективны.
Избыточное количество рецептов вызывает беспокойство не только из-за растущей волны штаммов бактерий с множественной лекарственной устойчивостью (а эти супербактерии очень страшны), но и потому, что у антибиотиков, как и у всех лекарств, есть обратная сторона: они могут сильно поразить наши кишечные бактерии.Они могут снизить общее видовое разнообразие, уничтожить комменсальные кишечные бактерии, которые приносят пользу нашему здоровью, и открыть дверь для инфекций, вызываемых такими бактериями, как C. difficile .
difficile .
Короче говоря, хотя полностью отказаться от антибиотиков невозможно, разумно попытаться уменьшить их воздействие. Прежде чем принимать антибиотики, дважды уточните у врача, действительно ли они необходимы. Спросите, можно ли подождать и посмотреть, исчезнет ли инфекция вашего ребенка сама по себе. Передайте дома антибактериальное мыло или чистящие средства — они не нужны и убивают хорошие бактерии с помощью плохих.Подойдет обычное старое мыло и вода.
Хотя полностью отказаться от приема антибиотиков невозможно, разумно попытаться уменьшить их воздействие.
8. Накормите ошибок —
Вот вам некоторая круговая логика: грудное вскармливание подпитывает кишечные бактерии, а преимущества грудного вскармливания могут зависеть от насекомых, потребляющих грудное молоко. Другими словами, нам нужно как кормить насекомых, так и следить за тем, чтобы насекомые были там, чтобы их можно было кормить для оптимального здоровья кишечника ребенка. Ясно, что эта тема заслуживает отдельного поста, и для любопытных, вам повезло!
Ясно, что эта тема заслуживает отдельного поста, и для любопытных, вам повезло!
ПОДРОБНЕЕ
В конце концов, помощь в улучшении микробиома вашего ребенка сводится к контролю над тем, что вы можете, и отказу от того, чего вы не можете. Прежде чем вы это узнаете, ваши малыши сами начнут глотать игрушки других детей, копаться в грязи и укреплять свой микробиом и иммунную систему
Роль микробиома в истоках развития здоровья и болезней
Abstract
Несмотря на то, что видная роль микробиома в здоровье человека была установлена, в настоящее время признается, что микробиом в раннем возрасте оказывает большое влияние на долгосрочное развитие. здоровье и развитие человека.Вариации в составе и функциональном потенциале микробиома в раннем возрасте являются результатом факторов образа жизни, таких как способ родов, грудное вскармливание, диета и использование антибиотиков. Кроме того, вариации в составе микробиома в раннем возрасте связаны с определенными исходами болезней, такими как астма, ожирение и нарушения развития нервной системы. Это указывает на этот бактериальный консорциум как на посредника между факторами раннего образа жизни и здоровьем и болезнями. Кроме того, изменения микробной внутриматочной среды могут предрасполагать новорожденных к определенным последствиям для здоровья в более позднем возрасте.В этом коллективном исследовании подтверждается роль микробиома в причинах развития здоровья и болезней. Подчеркивая критическое окно восприимчивости в раннем возрасте, связанное с развитием микробиома, мы обсуждаем микробную колонизацию младенцев, начиная с обмена микробами от матери к плоду внутриутробно и вплоть до влияния грудного вскармливания в первый год жизни. Кроме того, мы рассматриваем имеющиеся данные по конкретным заболеваниям, указывающие на то, что микробиом является механистическим посредником в развитии происхождения здоровья и болезни.
Это указывает на этот бактериальный консорциум как на посредника между факторами раннего образа жизни и здоровьем и болезнями. Кроме того, изменения микробной внутриматочной среды могут предрасполагать новорожденных к определенным последствиям для здоровья в более позднем возрасте.В этом коллективном исследовании подтверждается роль микробиома в причинах развития здоровья и болезней. Подчеркивая критическое окно восприимчивости в раннем возрасте, связанное с развитием микробиома, мы обсуждаем микробную колонизацию младенцев, начиная с обмена микробами от матери к плоду внутриутробно и вплоть до влияния грудного вскармливания в первый год жизни. Кроме того, мы рассматриваем имеющиеся данные по конкретным заболеваниям, указывающие на то, что микробиом является механистическим посредником в развитии происхождения здоровья и болезни.
За последнее десятилетие микробиом стал одним из основных факторов, влияющих на здоровье человека. 1 В текущих исследованиях было высказано предположение, что микробиом в молодом возрасте является решающим фактором для правильного иммунного развития и долгосрочного здоровья. 2 , 3 Преходящий микробный дисбиоз в течение этого периода времени был связан с развитием иммуноопосредованных, метаболических нарушений и нарушений нервного развития. 4 — 7 Кроме того, все больше данных используется для подтверждения жизненно важной роли материнского и внутриутробного микробиома в здоровье и развитии детей. 8 В совокупности эти результаты были использованы для поддержки микробиома как ключевого участника исследования «Истоки развития здоровья и болезней» (DOHaD). В этом обзоре мы обсудим текущие исследования, касающиеся созревания микробиома на ранних этапах жизни и того, как временные изменения в этом бактериальном консорциуме могут иметь долгосрочные последствия для здоровья человека.
2 , 3 Преходящий микробный дисбиоз в течение этого периода времени был связан с развитием иммуноопосредованных, метаболических нарушений и нарушений нервного развития. 4 — 7 Кроме того, все больше данных используется для подтверждения жизненно важной роли материнского и внутриутробного микробиома в здоровье и развитии детей. 8 В совокупности эти результаты были использованы для поддержки микробиома как ключевого участника исследования «Истоки развития здоровья и болезней» (DOHaD). В этом обзоре мы обсудим текущие исследования, касающиеся созревания микробиома на ранних этапах жизни и того, как временные изменения в этом бактериальном консорциуме могут иметь долгосрочные последствия для здоровья человека.
ДОХАД: где подходит микробиом?
Гипотеза о происхождении развития предполагает вариации в программировании плода и младенца из-за воздействия окружающей среды во время критического окна ранней жизни. 9 Первоначально названная гипотезой Баркера, 10 , 11 , в которой основное внимание уделялось связи между недостаточностью питания плода и гипертонией в более позднем возрасте, эта теория с тех пор расширилась, чтобы учесть многие типы воздействий в раннем возрасте. и исходы родов, связанные с долгосрочным здоровьем и развитием. Например, высокая масса тела при рождении связана с увеличением риска рака груди и толстой кишки, 12 , 13 , и основной механизм этой связи может быть связан с внутриутробным воздействием высоких уровней гормонов роста. 9
9 Первоначально названная гипотезой Баркера, 10 , 11 , в которой основное внимание уделялось связи между недостаточностью питания плода и гипертонией в более позднем возрасте, эта теория с тех пор расширилась, чтобы учесть многие типы воздействий в раннем возрасте. и исходы родов, связанные с долгосрочным здоровьем и развитием. Например, высокая масса тела при рождении связана с увеличением риска рака груди и толстой кишки, 12 , 13 , и основной механизм этой связи может быть связан с внутриутробным воздействием высоких уровней гормонов роста. 9
Инфекции раннего возраста и воздействие микробов изначально не были связаны с DOHaD, но были предложены в качестве значительного влияния окружающей среды на развитие иммунной системы младенцев в гигиенической гипотезе аллергических заболеваний. 14 С развитием исследований микробиома человека с тех пор было предложено современное расширение гигиенической гипотезы, известное как гипотеза микрофлоры. 15 В рамках гипотезы микрофлоры предполагается, что воздействие окружающей среды в раннем возрасте изменяет развитие микробиома человека. 15 Считается, что изменения в составе микробиома смещают созревание иммунной системы в сторону гиперчувствительного и / или гипервоспалительного состояния. 15 Например, врожденная и адаптивная ветви иммунной системы активно участвуют в стимулировании воспалительной реакции. Однако воздействие микробов обычно вызывает реакцию, опосредованную Т-хелпером 1, которая подавляет активность Т-хелпера 2, часто связанную с иммуноопосредованными реакциями и реакциями гиперчувствительности. 3 Обсуждение механизмов, регулирующих взаимодействие между иммунной системой и микробиотой, выходит за рамки этого обзора; пожалуйста, см. Тамбурини и др. 3 для недавнего углубленного обсуждения этой темы.
15 В рамках гипотезы микрофлоры предполагается, что воздействие окружающей среды в раннем возрасте изменяет развитие микробиома человека. 15 Считается, что изменения в составе микробиома смещают созревание иммунной системы в сторону гиперчувствительного и / или гипервоспалительного состояния. 15 Например, врожденная и адаптивная ветви иммунной системы активно участвуют в стимулировании воспалительной реакции. Однако воздействие микробов обычно вызывает реакцию, опосредованную Т-хелпером 1, которая подавляет активность Т-хелпера 2, часто связанную с иммуноопосредованными реакциями и реакциями гиперчувствительности. 3 Обсуждение механизмов, регулирующих взаимодействие между иммунной системой и микробиотой, выходит за рамки этого обзора; пожалуйста, см. Тамбурини и др. 3 для недавнего углубленного обсуждения этой темы.
Аналогично DOHaD, для микробиома также было предложено критическое окно развития на раннем этапе жизни. Преходящий микробный дисбиоз (нездоровое микробное состояние) в течение этого периода времени был связан с долгосрочными проблемами иммунного и метаболического здоровья, 2 заслуживает своего исследования в области происхождения развития (рис. 1).
Преходящий микробный дисбиоз (нездоровое микробное состояние) в течение этого периода времени был связан с долгосрочными проблемами иммунного и метаболического здоровья, 2 заслуживает своего исследования в области происхождения развития (рис. 1).
РИСУНОК 1
Микробиом младенца наиболее уязвим к воздействиям окружающей среды в раннем возрасте. Передача микробов от матери к плоду, способ рождения, антибиотики и диета могут изменить колонизацию и созревание микробиома в раннем возрасте. Эти вызванные образом жизни изменения в составе и функциях микробиома могут иметь продолжительное влияние на здоровье человека и могут привести к развитию заболеваний в более позднем возрасте.
Раннее развитие микробиома
Человеческая микробиота представляет собой сложный организм, состоящий из 10–100 триллионов микробных клеток (бактерий, архей и микробных эукариот) и вирусов. 16 , 17 Чтобы подчеркнуть впечатляющий функциональный потенциал микробиоты, геномный каталог этого суперорганизма, микробиома, состоит из примерно 3,3 миллиона неизбыточных генов. 16 Хотя термины «микробиота» и «микробиом» описывают микробный состав и геномный каталог, соответственно, в этой области исследований они используются взаимозаменяемо. Следующие разделы посвящены описанию начальной колонизации и становления бактериальной микробиоты человека в младенчестве, от зачатия до первого года жизни.
16 Хотя термины «микробиота» и «микробиом» описывают микробный состав и геномный каталог, соответственно, в этой области исследований они используются взаимозаменяемо. Следующие разделы посвящены описанию начальной колонизации и становления бактериальной микробиоты человека в младенчестве, от зачатия до первого года жизни.
Перенос микробов от матери к плоду
До недавнего времени внутриутробная среда считалась стерильной. 18 Однако с тех пор непатогенные бактерии были обнаружены молекулярными методами в околоплодных водах и плаценте здоровых младенцев, 19 , 20 , что предполагает обмен микробами от матери к плоду. Кроме того, путем сравнения микробиоты околоплодных вод, плаценты и мекония, Колладо и др. 21 сообщают, что микробиота мекония младенцев, рожденных посредством кесарева сечения, на ~ 55% разделяет бактериальные таксоны с микробиотой плаценты и околоплодных вод.Пренатальный материнский микробиом также может модулировать иммунную систему младенца. Например, сообщалось, что колонизация Escherichia coli HA107 только во время беременности изменяет врожденную иммунную систему слизистой оболочки кишечника и транскриптом у потомства. 22
Например, сообщалось, что колонизация Escherichia coli HA107 только во время беременности изменяет врожденную иммунную систему слизистой оболочки кишечника и транскриптом у потомства. 22
У людей вариации в составе микробиома плаценты были связаны с материнской беременностью (стресс и гестационный диабет) и исходами здоровья новорожденных (масса тела при рождении, преждевременные роды). 7 , 23 — 25 Также сообщалось, что микробиом плаценты недоношенных младенцев различается по составу в зависимости от гестационного набора веса, 26 предполагая, что этот бактериальный консорциум может опосредовать развитие плода в зависимости от состояние здоровья матери.
Выделение бактерий из плаценты часто связано с патофизиологическим состоянием, угрожающим здоровью матери и ребенка. Из-за отсутствия культурального анализа микробиома плаценты существуют некоторые разногласия по поводу его достоверности. 27 Кроме того, во многих молекулярных исследованиях, характеризующих внутриутробный микробиом, отсутствует включение соответствующих мер контроля для устранения фонового загрязнения. 28
27 Кроме того, во многих молекулярных исследованиях, характеризующих внутриутробный микробиом, отсутствует включение соответствующих мер контроля для устранения фонового загрязнения. 28
Также возможно, что плацента не содержит каких-либо жизнеспособных бактерий, а скорее состоит из фагоцитированных побочных продуктов микробов или компонентов клеточной стенки. 8 , 22 , 29 Отсутствие жизнеспособных бактерий не отменяет способность микробиома плаценты модулировать развитие плода, поскольку взаимодействие с молекулярными патогенами, связанными с патогенами, все еще может регулировать дифференцировку и пролиферацию клеток. 8 , 22 , 29 Кроме того, после реализации строгих стратегий валидации для метагеномных анализов плаценты микробиом плаценты может использоваться в качестве биомаркера здоровья и заболеваний матери и плода. Было проведено несколько исследований для изучения функции микробиома плаценты, 23 , 25 , подчеркивая возможность будущих исследований в этой области. Анализ микробных метаболитов и применение метатранскриптомических подходов для характеристики функциональной способности микробиома плаценты будут ключевыми в определении его роли в DOHaD.
Анализ микробных метаболитов и применение метатранскриптомических подходов для характеристики функциональной способности микробиома плаценты будут ключевыми в определении его роли в DOHaD.
Вагинальные роды: первый шаг в послеродовой микробной колонизации
Послеродовая бактериальная колонизация младенца начинается во время рождения, когда новорожденные подвергаются воздействию фекальных и вагинальных микробиот матери. 30 В течение 24 часов после родов микробиоты на различных участках тела (ротовая полость, кожа, меконий и т. Д.) Новорожденных после кесарева сечения изначально заселяются бактериями, обитающими на коже матери (например, Staphylococcus spp.), Тогда как вагинально рожденные младенцы населены типичными вагинальными бактериями (например, Prevotella , Atopobium spp.). 30 В недавнем исследовании Chu et al. 31 предполагают, что это открытие может быть специфическим для микробиома кишечника новорожденных. В их исследовании 81 диады матери и младенца микробиомы других участков тела (ноздри, кожа и т. Д.) Младенцев, рожденных естественным путем, выявили бимодальную структуру материнского происхождения, заселенную как влагалищными, так и кожными бактериями матери, а не одной или одной из них. другой. 31 Однако в обоих исследованиях предполагается, что микробиоты младенцев равномерно распределяются по участкам тела (например, меконию, коже, ноздрям и т. Д.) Сразу после рождения. 30
В их исследовании 81 диады матери и младенца микробиомы других участков тела (ноздри, кожа и т. Д.) Младенцев, рожденных естественным путем, выявили бимодальную структуру материнского происхождения, заселенную как влагалищными, так и кожными бактериями матери, а не одной или одной из них. другой. 31 Однако в обоих исследованиях предполагается, что микробиоты младенцев равномерно распределяются по участкам тела (например, меконию, коже, ноздрям и т. Д.) Сразу после рождения. 30
Профилирование микробиома кишечника новорожденных сразу после рождения и в возрасте до 2 лет позволяет предположить, что способ родов может привести к длительному микробному дисбиозу кишечника новорожденных. 32 В исследовании 43 диад матери и ребенка младенцы, родившиеся путем кесарева сечения, демонстрировали повышенное филогенетическое разнообразие сразу после рождения. 32 Однако после 1 месяца филогенетическое разнообразие младенцев, рожденных посредством кесарева сечения, снизилось по сравнению с младенцами, рожденными естественным путем. 32 Чу и др. 31 слегка оспаривают этот вывод. В их недавнем исследовании способ рождения был связан с вариациями микробиома ноздрей, кожи и ротовой полости сразу после рождения, но не с вариациями микробиома младенческого мекония. Исследователи обоих исследований подтверждают влияние способа рождения на колонизацию новорожденных в целом; однако необходимы дополнительные исследования, чтобы определить влияние этого фактора ранней жизни на микробиомы определенных участков тела.
32 Чу и др. 31 слегка оспаривают этот вывод. В их недавнем исследовании способ рождения был связан с вариациями микробиома ноздрей, кожи и ротовой полости сразу после рождения, но не с вариациями микробиома младенческого мекония. Исследователи обоих исследований подтверждают влияние способа рождения на колонизацию новорожденных в целом; однако необходимы дополнительные исследования, чтобы определить влияние этого фактора ранней жизни на микробиомы определенных участков тела.
Из-за преимуществ для здоровья, связанных с вагинальными родами, 33 Dominguez-bello et al. 34 провели первое исследование, направленное на повторное заселение младенцев, рожденных с помощью кесарева сечения, вагинальными бактериями. Авторы сообщают о частичном восстановлении микробиоты новорожденных, рожденных с помощью кесарева сечения, по сравнению с микробиотой новорожденных, рожденных естественным путем, в течение 2 минут после рождения. 34 Однако долгосрочные последствия для здоровья и состав микробиома младенца еще не известны..gif) 34 Будущий анализ новорожденных, родившихся после кесарева сечения, подвергшихся воздействию вагинального микробиома, будет чрезвычайно ценным для определения преимуществ бактерий, полученных из влагалища, для долгосрочного здоровья человека. Кроме того, проведение проспективных исследований на людях и животных моделей с попытками аналогичной колонизации вагинальными бактериями среди потомства, родившегося посредством кесарева сечения, будет иметь решающее значение для выяснения роли вагинальных микробов в развитии заболевания.
34 Будущий анализ новорожденных, родившихся после кесарева сечения, подвергшихся воздействию вагинального микробиома, будет чрезвычайно ценным для определения преимуществ бактерий, полученных из влагалища, для долгосрочного здоровья человека. Кроме того, проведение проспективных исследований на людях и животных моделей с попытками аналогичной колонизации вагинальными бактериями среди потомства, родившегося посредством кесарева сечения, будет иметь решающее значение для выяснения роли вагинальных микробов в развитии заболевания.
Грудное вскармливание способствует созреванию микробиоты в раннем возрасте
По мере роста новорожденного гомогенный микробиом, населяющий его или ее тело, расходится в специфические для микробов ниши. 18 , 31 Созревание всего микробиома младенца изучали в течение первого года жизни, но после этого времени большинство исследователей сосредотачиваются именно на микробиоме кишечника. Микробиом кишечника человека, в значительной степени обусловленный грудным вскармливанием и диетой младенцев, продолжает созревать до тех пор, пока ребенок не достигнет возраста 2–3 лет, после чего его состав стабилизируется. 35
35
Грудное вскармливание создает семена микробиома кишечника младенца через контакт с материнскими ареолярными микробами и микробами грудного молока и обеспечивает ключевые источники энергии для многих бактерий (олигосахариды грудного молока). 36 — 39 В исследовании 107 диад матери и младенца младенцы, находившиеся на грудном вскармливании в течение первых 30-40 дней жизни, получали в среднем около 28% бактерий из грудного молока и около 10% из них. материнская ареолярная кожа. 38 Авторы также сообщают о дозозависимой связи между составом микробиома кишечника младенца и долей ежедневного грудного вскармливания. 38
Существует четкое различие в составе между детьми, вскармливаемыми грудью и грудным вскармливанием, при этом в младенцах, вскармливаемых грудью, больше видов Bifidobacteria и Lactobacillus spp.а среди младенцев, вскармливаемых смесями, больше преобладают клостридиалы и протеобактерии. 32 , 40 Кроме того, у детей, вскармливаемых смесями, наблюдается снижение разнообразия и бактериального богатства даже после первого года жизни (в возрасте 12–24 месяцев). 32 В исследовании 30 недоношенных детей сообщалось также о том, что влияние грудного вскармливания (по сравнению с кормлением смесью) маскирует влияние веса при рождении на микробиом младенца, подчеркивая, что грудное вскармливание является потенциально защитным (по крайней мере, в отношении микробиома младенца). ) против традиционного фактора риска DOHaD. 41 Эпидемиологические данные подтверждают полезную роль грудного вскармливания в укреплении здоровья младенцев. Кормление смесью было связано с повышенным риском различных гипервоспалительных и иммуноопосредованных заболеваний. 42 , 43 Кроме того, исследователи недавнего эпидемиологического исследования сообщили, что грудное вскармливание защищает от хрипов в течение первого года жизни у младенцев, рожденных от матерей с астмой.
32 , 40 Кроме того, у детей, вскармливаемых смесями, наблюдается снижение разнообразия и бактериального богатства даже после первого года жизни (в возрасте 12–24 месяцев). 32 В исследовании 30 недоношенных детей сообщалось также о том, что влияние грудного вскармливания (по сравнению с кормлением смесью) маскирует влияние веса при рождении на микробиом младенца, подчеркивая, что грудное вскармливание является потенциально защитным (по крайней мере, в отношении микробиома младенца). ) против традиционного фактора риска DOHaD. 41 Эпидемиологические данные подтверждают полезную роль грудного вскармливания в укреплении здоровья младенцев. Кормление смесью было связано с повышенным риском различных гипервоспалительных и иммуноопосредованных заболеваний. 42 , 43 Кроме того, исследователи недавнего эпидемиологического исследования сообщили, что грудное вскармливание защищает от хрипов в течение первого года жизни у младенцев, рожденных от матерей с астмой. 43 В рамках работы, обсуждаемой в этом разделе, мы предполагаем, что микробиом может быть посредником между этими ассоциациями.
43 В рамках работы, обсуждаемой в этом разделе, мы предполагаем, что микробиом может быть посредником между этими ассоциациями.
Материнская диета, связанная с беременностью, формирует развивающийся микробиом младенца
Недавние данные были использованы для подтверждения значительной роли материнской диеты, связанной с беременностью, в формировании микробиома младенческого возраста. Сообщалось, что рацион матери с высоким содержанием жиров во время беременности и грудного вскармливания вызывает дисбактериоз в микробиоме потомства японских макак. 44 Эти вызванные материнской диетой микробные вариации сохранялись у молодых макак. 44 Кроме того, контрольная диета с низким содержанием жиров после отъема не смогла исправить дисбактериоз, вызванный материнской диетой с высоким содержанием жиров. 44 В проспективной когорте из 26 диад матери и ребенка гестационная диета матери с высоким содержанием жиров была связана с отчетливыми вариациями микробного состава кишечника новорожденных (меконий), которые сохранялись до 4–6-недельного возраста. 45 В модели на мышах рацион матери с высоким содержанием клетчатки был связан с увеличением производства короткоцепочечных жирных кислот (SCFA) у потомства. 46 Подчеркивая иммуномодулирующую способность микробиома материнской диеты во время беременности, у этих детенышей также были обнаружены более высокие частоты Т-регуляторных клеток тимуса. 46 Наконец, демонстрируя влияние материнского рациона на функциональную способность микробиома младенца, у поросят, рожденных от свиноматок, которых кормили западной диетой (высокоэнергетическая, высокожировая диета на основе фруктозы) во время беременности, отмечалось снижение продукции SCFA . 47 В этих исследованиях подтверждается важность микробиома как медиатора, связывающего рацион матери, связанный с беременностью, со здоровьем ребенка, что подтверждает роль микробиома в DOHaD. Будущие исследования могут пролить больше света на длительное воздействие на здоровье и развитие материнской диеты, связанной с беременностью.
45 В модели на мышах рацион матери с высоким содержанием клетчатки был связан с увеличением производства короткоцепочечных жирных кислот (SCFA) у потомства. 46 Подчеркивая иммуномодулирующую способность микробиома материнской диеты во время беременности, у этих детенышей также были обнаружены более высокие частоты Т-регуляторных клеток тимуса. 46 Наконец, демонстрируя влияние материнского рациона на функциональную способность микробиома младенца, у поросят, рожденных от свиноматок, которых кормили западной диетой (высокоэнергетическая, высокожировая диета на основе фруктозы) во время беременности, отмечалось снижение продукции SCFA . 47 В этих исследованиях подтверждается важность микробиома как медиатора, связывающего рацион матери, связанный с беременностью, со здоровьем ребенка, что подтверждает роль микробиома в DOHaD. Будущие исследования могут пролить больше света на длительное воздействие на здоровье и развитие материнской диеты, связанной с беременностью.
Антибиотики изменяют колонизацию младенца и уменьшают созревание микробиоты
Возможно, неудивительно, что пре- и послеродовое воздействие антибиотиков является основным фактором стресса окружающей среды в раннем возрасте для микробиома младенца. Сообщалось, что пренатальное воздействие антибиотиков на мать изменяет разнообразие как микробиоты новорожденных 48 — 50 , так и микробиоты матери 51 . Сообщалось также, что воздействие антибиотиков во время родов изменяет состав микробиома полости рта младенца. 52 В частности, бактериальные семейства streptococcaceae и gemellaceae и порядок лактобацилл были уменьшены, тогда как бактериальные семейства в типе протеобактерий были обогащены среди младенцев, матери которых получали антибиотики во время родов. 52 Кроме того, среди младенцев, матери которых получали антибиотики, состав микробиома полости рта младенца дополнительно дифференцировался в зависимости от того, получала ли мать коктейль из антибиотиков по сравнению с тем, если бы она получала только 1 антибиотик. 52
52
Постнатальные курсы антибиотиков, назначаемые младенцам в первые 3–9 месяцев жизни, приводили к изменению численности определенных кишечных бактериальных таксонов (а именно, Ruminococcus и клостридиалов). 32 Кроме того, использование антибиотиков в первые 6–12 месяцев жизни было связано со снижением созревания детской микробиоты. 32 Это говорит о том, что антибиотики могут задерживать развитие микробиоты, если их вводить в течение этого периода времени, что потенциально может предрасполагать младенцев к заболеваниям, связанным с микробиомом, в более позднем возрасте. 32
В эпидемиологических исследованиях было высказано предположение, что вызванный антибиотиками дисбактериоз в младенчестве способствует развитию многих неинфекционных заболеваний в более позднем детстве и в зрелом возрасте (например, ожирение, астма, воспалительное заболевание кишечника [ВЗК]). 53 — 56 Однако эти эпидемиологические анализы не выясняют, связаны ли эти заболевания причинно с использованием антибиотиков в раннем возрасте или они указывают на иммунную недостаточность в раннем возрасте или склонность к инфекции.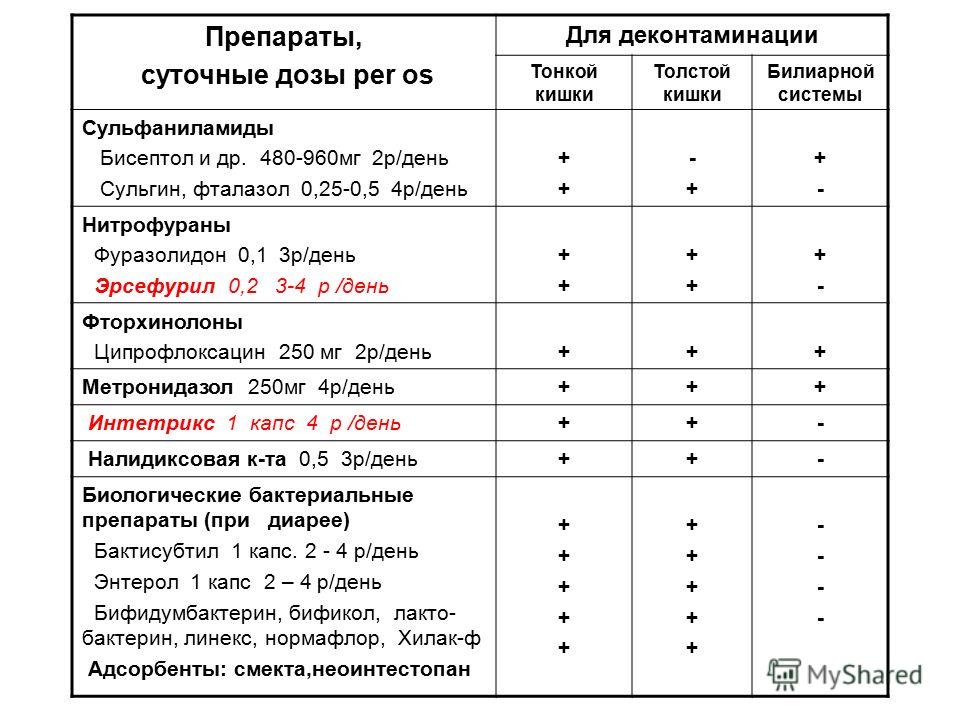 Тем не менее, есть несколько многообещающих моделей на животных и перспективных когортных исследований на людях, которые пытаются решить это затруднительное положение и обеспечить дополнительную поддержку микробиома как ключевого медиатора развития при DOHaD.
Тем не менее, есть несколько многообещающих моделей на животных и перспективных когортных исследований на людях, которые пытаются решить это затруднительное положение и обеспечить дополнительную поддержку микробиома как ключевого медиатора развития при DOHaD.
Неинфекционные заболевания, ассоциированные с дисбиозом, обеспечивают дополнительную поддержку микробиома в DOHaD
Критическое окно в раннем возрасте
Как упоминалось в начале этого обзора, DOHaD подчеркивает критическое окно восприимчивости от зачатия до раннего возраста, в котором факторы окружающей среды наиболее глубоко влияют на здоровье человека в долгосрочной перспективе.Аналогичное критическое окно появилось для развития микробиома. Ученые сузили критическое окно микробиома для ранней жизни до периода между зачатием и первым годом жизни (рис. 1). 1 Хотя для подтверждения этой теории необходимы дополнительные исследования, уязвимость микробиома к воздействиям окружающей среды, по-видимому, меняется во времени, становится более существенной на ранних этапах жизни и снижается по мере того, как он становится взрослым (рис. 1). В следующих разделах мы обсудим исследования конкретных заболеваний (в частности, некротический энтероколит [NEC], астму и атопические заболевания, ожирение и нарушения развития нервной системы), которые указывают на это критическое окно в раннем периоде жизни и дополнительно подтверждают роль микробиома в DOHaD (сведено в Таблицу 1).
1). В следующих разделах мы обсудим исследования конкретных заболеваний (в частности, некротический энтероколит [NEC], астму и атопические заболевания, ожирение и нарушения развития нервной системы), которые указывают на это критическое окно в раннем периоде жизни и дополнительно подтверждают роль микробиома в DOHaD (сведено в Таблицу 1).
ТАБЛИЦА 1
Исследования, в которых исследователи связывают микробиом в раннем возрасте с последствиями для здоровья в более позднем детстве и в зрелом возрасте
NEC
Помимо рисков для здоровья, связанных с преждевременными родами, у недоношенных детей наблюдается выраженный микробный дисбиоз новорожденных. Этот дисбактериоз увеличивает их восприимчивость к болезням, особенно к НЭК, которая может измениться под воздействием антибиотиков в этот критический период времени. 57 Путем анализа существующих данных о последовательности гена 16S рибосомной РНК, авт. Идентифицировали дифференциальную численность протеобактерий, фирмикутов и бактероидетов, которые предшествовали возникновению NEC.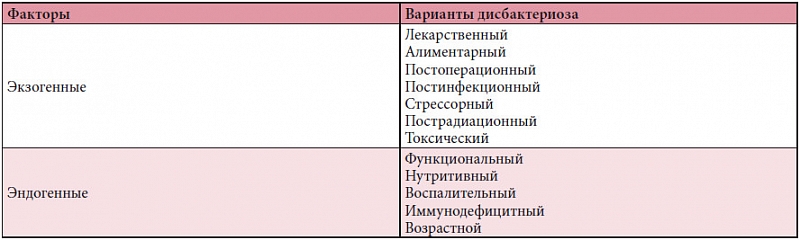 57 Дисбактериоз кишечника, характеризующийся аналогичными вариациями бактериальных таксонов, также предшествовал НЭК в исследовании 122 новорожденных с крайне низкой массой тела при рождении. 58 Увеличение протеобактерий наряду с повышенной активностью Toll-подобного рецептора 4 энтероцитов у этих новорожденных с NEC предполагает гипервоспалительный ответ на дисбиотический микробиом. 59 Однако недавнее исследование было проведено, в котором исследователи определили уропатогенную колонизацию E coli как значимый маркер риска для NEC. 59 Это предполагает, что инвазивные виды микробов могут иметь синергетический эффект в управлении этим расстройством, связанным с дисбиозом. Кроме того, младенцы, получавшие антибиотики в течение 7–14 дней (независимо от статуса NEC), были обогащены на E coli по сравнению с младенцами, получавшими антибиотики в течение 0–6 дней. 59 Это подтверждает роль неонатального антибиотик-индуцированного дисбиоза в НЭК, который может повысить уязвимость микробиома кишечника новорожденных к инвазии патогенов.
57 Дисбактериоз кишечника, характеризующийся аналогичными вариациями бактериальных таксонов, также предшествовал НЭК в исследовании 122 новорожденных с крайне низкой массой тела при рождении. 58 Увеличение протеобактерий наряду с повышенной активностью Toll-подобного рецептора 4 энтероцитов у этих новорожденных с NEC предполагает гипервоспалительный ответ на дисбиотический микробиом. 59 Однако недавнее исследование было проведено, в котором исследователи определили уропатогенную колонизацию E coli как значимый маркер риска для NEC. 59 Это предполагает, что инвазивные виды микробов могут иметь синергетический эффект в управлении этим расстройством, связанным с дисбиозом. Кроме того, младенцы, получавшие антибиотики в течение 7–14 дней (независимо от статуса NEC), были обогащены на E coli по сравнению с младенцами, получавшими антибиотики в течение 0–6 дней. 59 Это подтверждает роль неонатального антибиотик-индуцированного дисбиоза в НЭК, который может повысить уязвимость микробиома кишечника новорожденных к инвазии патогенов. Из-за очевидной связи между микробным дисбиозом и НЭК добавление пробиотиков к недоношенным новорожденным становится важной областью исследований для профилактики и лечения НЭК. 109 , 110 В систематическом обзоре и метаанализе 26 исследований пробиотического вмешательства для NEC предполагается, что пробиотическое вмешательство действительно предотвращает NEC. 60 Однако конкретные штаммы, которые будут использоваться, и их влияние на группы высокого риска (младенцы с крайне низкой массой тела при рождении) требуют дальнейшего изучения. 60 Тем не менее, в ближайшем будущем может появиться возможность оптимизировать микробиом новорожденных для борьбы с развитием этого заболевания и предотвращения связанной с этим детской смертности.
Из-за очевидной связи между микробным дисбиозом и НЭК добавление пробиотиков к недоношенным новорожденным становится важной областью исследований для профилактики и лечения НЭК. 109 , 110 В систематическом обзоре и метаанализе 26 исследований пробиотического вмешательства для NEC предполагается, что пробиотическое вмешательство действительно предотвращает NEC. 60 Однако конкретные штаммы, которые будут использоваться, и их влияние на группы высокого риска (младенцы с крайне низкой массой тела при рождении) требуют дальнейшего изучения. 60 Тем не менее, в ближайшем будущем может появиться возможность оптимизировать микробиом новорожденных для борьбы с развитием этого заболевания и предотвращения связанной с этим детской смертности.
Астма и атопическое заболевание
Исследования NEC подчеркивают динамическую связь между микробиомом кишечника и развивающейся иммунной системой. Однако, хотя иммунная система новорожденных находится в состоянии повышенной готовности к патогенным захватчикам, исследователи, проводившие исследования астмы и атопических заболеваний (пищевая аллергия, атопический дерматит и т. Д.), Предполагают, что на ее развитие сильно влияют комменсальные бактерии.
Д.), Предполагают, что на ее развитие сильно влияют комменсальные бактерии.
В недавней оценке микробиома в развитии астмы подтверждается более существенная роль материнской микробиоты в развитии плода, чем считалось ранее.В модели аллергического воспаления дыхательных путей на мышах кормление беременных мышей с высоким содержанием клетчатки (которое, как сообщается, стимулирует производство SCFAs микробиомом 111 ) или ацетатом (SCFA) модулировало материнскую микробиоту и защищало последующее потомство от развития. аллергическое заболевание дыхательных путей. 73 Авторы этого исследования также предоставили предварительные доказательства этой ассоциации у людей; высокие уровни ацетата в сыворотке беременных коррелировали с сокращением посещений терапевта по поводу кашля и хрипов у потомства в течение первых 12 месяцев жизни. 73
Постнатальный дисбактериоз в раннем возрасте кишечника человека 2 , 4 , 5 , 70 и микробиом дыхательных путей 78 , а также микробиомы, связанные с астмой развитие у детей. Этот дисбиоз характеризуется сдвигами в распространенности специфических бактерий 4 , 5 и таксонов грибов 70 , которые являются временными и наиболее заметными в период между рождением и 3 месяцами жизни.Большинство исследований на людях в этой области исследований выявляют только коррелятивные доказательства связи дисбактериоза в раннем возрасте с астмой. Тем не менее, Arrieta et al., , 4, предоставляют предварительные доказательства причинно-следственной связи, связанной с преходящим дисбиозом в раннем возрасте и развитием иммунной системы в контексте астмы. В этом исследовании инокуляция мышей, ранее свободных от микробов (GF), 4 видами бактерий, количество которых было снижено у младенцев с высоким риском астмы, уменьшила аллергическое воспаление дыхательных путей у этих мышей. 4
Этот дисбиоз характеризуется сдвигами в распространенности специфических бактерий 4 , 5 и таксонов грибов 70 , которые являются временными и наиболее заметными в период между рождением и 3 месяцами жизни.Большинство исследований на людях в этой области исследований выявляют только коррелятивные доказательства связи дисбактериоза в раннем возрасте с астмой. Тем не менее, Arrieta et al., , 4, предоставляют предварительные доказательства причинно-следственной связи, связанной с преходящим дисбиозом в раннем возрасте и развитием иммунной системы в контексте астмы. В этом исследовании инокуляция мышей, ранее свободных от микробов (GF), 4 видами бактерий, количество которых было снижено у младенцев с высоким риском астмы, уменьшила аллергическое воспаление дыхательных путей у этих мышей. 4
Есть также данные, подтверждающие роль микробиома раннего возраста в пищевой аллергии.Azad et al. 74 сообщают об уменьшении микробного разнообразия в возрасте 3 месяцев и увеличении соотношения энтеробактерий / бактериоидных в возрасте 3 месяцев и 1 года, что было связано с повышенной пищевой сенсибилизацией у детей в возрасте 1 года. Вариации микробиома кишечника в возрасте 3 и 6 месяцев также связаны с разрешением аллергии на молоко к 8 годам. 75 Таким образом, авторы текущего исследования микробиома астмы и аллергии предполагают период времени между рождением и возрастом в один год в качестве окна возникновения этого заболевания.Эта иммунная гиперчувствительность сохраняется в более позднем детстве и в зрелом возрасте, несмотря на преходящий характер микробного дисбиоза.
Вариации микробиома кишечника в возрасте 3 и 6 месяцев также связаны с разрешением аллергии на молоко к 8 годам. 75 Таким образом, авторы текущего исследования микробиома астмы и аллергии предполагают период времени между рождением и возрастом в один год в качестве окна возникновения этого заболевания.Эта иммунная гиперчувствительность сохраняется в более позднем детстве и в зрелом возрасте, несмотря на преходящий характер микробного дисбиоза.
Ожирение
Подобно астме и атопическому заболеванию, проспективные исследования выявили вариации в составе микробиома кишечника в раннем возрасте, которые предшествуют развитию ожирения. 88 , 91 Недавнее исследование выявило временные и композиционные ассоциации микробиома с ожирением в раннем детстве. 89 В частности, младенцы с высокой численностью Streptococcus в возрасте 6 месяцев демонстрировали повышенное ожирение в возрасте 18 месяцев. 89 Это подчеркивает важность как состава микробиома, так и времени созревания микробиома в развитии детского ожирения.
Исследования на мышиных моделях использовались для механистической поддержки потенциальных метаболических эффектов микробного дисбиоза в раннем возрасте и подчеркивали способность антибиотиков вызывать ожирение. В исследовании Cho et al., 90 антибиотиков, вводимых мышам в раннем возрасте, приводили к последующему увеличению ожирения и метаболических гормонов.Cox et al., , 6, , способствовали этому исследованию, воздействуя на микробиоту раннего возраста с помощью низких доз пенициллина (LDP). Здесь они сообщают, что воздействие LDP в молодом возрасте увеличивало влияние диеты с высоким содержанием жиров на микробиоту, которая могла быть передана мышам GF, чтобы вызвать ожирение. 6 Для будущих исследователей будет важно включить как проспективные исследования на людях, так и модели на животных, чтобы определить связанные с микробиомом эффекты воздействия антибиотиков в раннем возрасте на здоровье человека.
Расстройства нервного развития
Менее интуитивная роль микробиома кишечника в здоровье и развитии человека связана с влиянием микробного дисбиоза в раннем возрасте на развитие нервной системы (т. е. ось кишечник-мозг). Появляется все больше доказательств, подтверждающих вариации микробного состава в раннем возрасте при реакции на стресс и тревогу. В моделях на животных предполагается, что неонатальный стресс после разлучения с матерью приводит к долгосрочным изменениям состава кишечной микробиоты, 95 , 96 , а лечение крысят пробиотиками может противодействовать возникающему в результате повышенному уровню кортикостерона. 95 Пренатальное воздействие SCFA, пропионовой кислоты, также, как сообщается, усиливает тревожное поведение у мышей. 97 В недавнем исследовании Gur et al. 7 сообщают о влиянии пренатального материнского стресса на мышей и его способности изменять как материнский, так и неонатальный микробиомы кишечника. Взрослое потомство, подвергшееся пренатальному материнскому стрессу, также проявляло повышенное тревожное поведение. 7 Кроме того, пренатальный стресс также вызывал изменения в микробиоме плаценты.
е. ось кишечник-мозг). Появляется все больше доказательств, подтверждающих вариации микробного состава в раннем возрасте при реакции на стресс и тревогу. В моделях на животных предполагается, что неонатальный стресс после разлучения с матерью приводит к долгосрочным изменениям состава кишечной микробиоты, 95 , 96 , а лечение крысят пробиотиками может противодействовать возникающему в результате повышенному уровню кортикостерона. 95 Пренатальное воздействие SCFA, пропионовой кислоты, также, как сообщается, усиливает тревожное поведение у мышей. 97 В недавнем исследовании Gur et al. 7 сообщают о влиянии пренатального материнского стресса на мышей и его способности изменять как материнский, так и неонатальный микробиомы кишечника. Взрослое потомство, подвергшееся пренатальному материнскому стрессу, также проявляло повышенное тревожное поведение. 7 Кроме того, пренатальный стресс также вызывал изменения в микробиоме плаценты. 7 Это говорит о том, что внутриматочная микробная среда является потенциальным посредником материнского пренатального стресса и, как следствие, стресса у потомства.
7 Это говорит о том, что внутриматочная микробная среда является потенциальным посредником материнского пренатального стресса и, как следствие, стресса у потомства.
Вариации микробиома кишечника также связаны со многими аспектами социального поведения. Взрослые потомки традиционных самок (ранее GF, но колонизированные микробиомом мышей, свободных от конкретных патогенов [SPF]), как сообщалось, демонстрируют пониженную двигательную активность по сравнению с потомками от GF самок. 98 Buffington et al. 93 сообщают о нарушении социального поведения (аналогичном тому, которое наблюдается при расстройстве аутистического спектра) у потомков самок, получавших диету с высоким содержанием жиров, что опосредовано вариациями микробиома потомства.Кроме того, с помощью метагеномного секвенирования с использованием дробовика эта группа определила значительное снижение содержания Lactobacillus reuteri среди потомства, получавшего материнское питание с высоким содержанием жиров. 93 Пополнение питьевой воды л реутери привело к восстановлению социального дефицита потомства. 93 Примечательно, что большинство исследований с участием исследователей, сосредоточенных на критическом окне в раннем периоде жизни в отношении нервного развития, было проведено на животных моделях. Тем не менее, есть недавние данные, подтверждающие роль микробиома кишечника младенца в когнитивном развитии человека.Carlson et al., , 94, сообщили об изменениях в разнообразии α-разнообразия кишечного микробиома у годовалых детей, которые коррелировали с их когнитивными способностями, измеренными в возрасте 2 лет. Дополнительные исследования на людях подтвердят эти доказательства. Однако интересно отметить, что исследователи последовательно определяют период времени между беременностью и первым годом жизни как наиболее важный для развития человека.
93 Пополнение питьевой воды л реутери привело к восстановлению социального дефицита потомства. 93 Примечательно, что большинство исследований с участием исследователей, сосредоточенных на критическом окне в раннем периоде жизни в отношении нервного развития, было проведено на животных моделях. Тем не менее, есть недавние данные, подтверждающие роль микробиома кишечника младенца в когнитивном развитии человека.Carlson et al., , 94, сообщили об изменениях в разнообразии α-разнообразия кишечного микробиома у годовалых детей, которые коррелировали с их когнитивными способностями, измеренными в возрасте 2 лет. Дополнительные исследования на людях подтвердят эти доказательства. Однако интересно отметить, что исследователи последовательно определяют период времени между беременностью и первым годом жизни как наиболее важный для развития человека.
В совокупности это исследование, посвященное конкретному заболеванию, используется для подтверждения роли микробиома в раннем возрасте в развитии плода и ребенка в различных контекстах. Однако преддиагностические вариации в составе микробиома в раннем детстве были связаны с другими хроническими неинфекционными заболеваниями в более позднем детстве и в зрелом возрасте (например, ВЗК и диабет 1 типа, таблица 1). 1 Кроме того, Харрис и др. 112 определили связь между подростковой диетой и раком груди, диагностированным во взрослом возрасте, предположив, что время восприимчивости микробиома также может быть специфическим для заболевания. Таким образом, будущее исследований микробиома DOHaD открывает широкие возможности.
Однако преддиагностические вариации в составе микробиома в раннем детстве были связаны с другими хроническими неинфекционными заболеваниями в более позднем детстве и в зрелом возрасте (например, ВЗК и диабет 1 типа, таблица 1). 1 Кроме того, Харрис и др. 112 определили связь между подростковой диетой и раком груди, диагностированным во взрослом возрасте, предположив, что время восприимчивости микробиома также может быть специфическим для заболевания. Таким образом, будущее исследований микробиома DOHaD открывает широкие возможности.
Дисбактериоз микробиома кишечника и легких играет роль в развитии астмы
Бокулич Н.А., Чанг Дж., Батталья Т., Хендерсон Н., Джей М., Ли Х, Д. Либер А., Ву Ф., Перес-Перес Г. И., Чен Y, Schweizer W, Zheng X, Contreras M, Dominguez-Bello MG, Blaser MJ (2016) Антибиотики, способ рождения и диета формируют созревание микробиома в молодом возрасте. Sci Transl Med 8: 343ra82
Sci Transl Med 8: 343ra82
Статья
CAS
PubMed
PubMed Central
Google ученый
Эге MJ (2017) Гипотеза гигиены в эпоху микробиома. Ann Am Thorac Soc 14: S348 – SS53
Статья
PubMed
PubMed Central
Google ученый
Генсоллен Т., Айер С.С., Каспер Д.Л., Блумберг Р.С. (2016) Как колонизация микробиотой в раннем возрасте формирует иммунную систему. Science 352: 539–544
Статья
CAS
PubMed
PubMed Central
Google ученый
Morgan XC, Huttenhower C (2012) Глава 12: анализ микробиома человека. PLoS Comput Biol 8: e1002808
Статья
CAS
PubMed
PubMed Central
Google ученый
Sokolowska M, Frei R, Lunjani N, Akdis CA, O’Mahony L (2018) Микробиом и астма. Asthma Res Pract 4: 1
Статья
PubMed
PubMed Central
Google ученый
Хаффнагл, Б. Б., Диксон Р. П., Лукач Н. В. (2017) Микробиом дыхательных путей и воспаление легких: улица с двусторонним движением.Mucosal Immunol 10: 299–306
Статья
CAS
PubMed
PubMed Central
Google ученый
Диксон Р.П., Эрб-Даунворд Дж. Р., Мартинес Ф. Дж., Хаффнагл, Великобритания (2016) Микробиом и дыхательные пути. Annu Rev Physiol 78: 481–504
Статья
CAS
PubMed
PubMed Central
Google ученый
Legatzki A, Rosler B, von Mutius E (2014) Разнообразие микробиома и риск астмы и аллергии.Curr Allergy Asthma Rep 14: 466
Статья
CAS
PubMed
PubMed Central
Google ученый
Weiss ST, Litonjua AA (2015) Витамин D, микробиом кишечника и гигиеническая гипотеза. Как начинается астма? Am J Respir Crit Care Med 191: 492–493
Статья
PubMed
PubMed Central
Google ученый
Mathieu E, Escribano-Vazquez U, Descamps D, Cherbuy C, Langella P, Riffault S, Remot A, Thomas M (2018) Парадигмы функций микробиоты легких в отношении здоровья и болезней, в частности, при астме.Front Physiol 9: 1168
Артикул
PubMed
PubMed Central
Google ученый
Проект микробиома человека, C (2012) Структура, функции и разнообразие микробиома здорового человека. Nature 486: 207–214
Статья
CAS
Google ученый
Деуренберг Р.Х., Батхорн Э., Хлебович М.А., Коуто Н., Фердоус М., Гарсия-Кобос С., Коистра-Смид А.М., Раангс Е.С., Розема С., Велу А.С., Чжоу К., Фридрих А.В., Россен Дж. У. (2017 ) Применение секвенирования нового поколения в клинической микробиологии и профилактике инфекций.J Biotechnol 243: 16–24
Статья
CAS
PubMed
PubMed Central
Google ученый
Kozik AJ, Huang YJ (2019) Микробиом при астме: роль в патогенезе, фенотипе и ответе на лечение. Ann Allergy Asthma Immunol 122: 270–275
Статья
PubMed
PubMed Central
Google ученый
Hilty M, Burke C, Pedro H, Cardenas P, Bush A, Bossley C, Davies J, Ervine A, Poulter L, Pachter L, Moffatt MF, Cookson WO (2010) Нарушенные микробные сообщества в астматических дыхательных путях .PLoS One 5: e8578
Артикул
CAS
PubMed
PubMed Central
Google ученый
Bassis CM, Erb-Downward JR, Dickson RP, Freeman CM, Schmidt TM, Young VB, Beck JM, Curtis JL, Huffnagle GB (2015) Анализ микробиоты верхних дыхательных путей как источника легких и желудочные микробиоты у здоровых людей. MBio 6: e00037
Статья
CAS
PubMed
PubMed Central
Google ученый
Сегал Л.Н., Алексеенко А.В., Клементе Дж. К., Кулькарни Р., Ву Б., Гао З., Чен Х, Бергер К. И., Голдринг Р. М., Ром В. Н., Блазер М. Дж., Вайден М. Д. (2013) Обогащение микробиома легких надгортанными таксонами связано с увеличением легочное воспаление. Микробиом 1:19
И., Голдринг Р. М., Ром В. Н., Блазер М. Дж., Вайден М. Д. (2013) Обогащение микробиома легких надгортанными таксонами связано с увеличением легочное воспаление. Микробиом 1:19
Статья
PubMed
PubMed Central
Google ученый
Венкатараман А., Бассис С.М., Бек Дж. М., Янг В. Б., Кертис Дж. Л., Хаффнагл Г. Б., Шмидт Т. М. (2015) Применение модели нейтрального сообщества для оценки структурирования микробиома легких человека.MBio 6
Диксон Р.П., Мартинес Ф.Дж., Хаффнагл Г.Б. (2014) Роль микробиома в обострениях хронических заболеваний легких. Ланцет 384: 691–702
Артикул
CAS
PubMed
PubMed Central
Google ученый
Jensen-Jarolim E (2014) Сравнительная медицина — анатомия и физиология. Springer, Вена
Google ученый
Хан С., Маллампалли Р.К. (2015) Роль сурфактанта в заболевании легких и защите организма от легочных инфекций. Ann Am Thorac Soc 12: 765–774
Статья
PubMed
PubMed Central
Google ученый
Marsh RL, Kaestli M, Chang AB, Binks MJ, Pope CE, Hoffman LR, Smith-Vaughan HC (2016) Микробиота бронхоальвеолярного лаважа у маленьких детей с хроническим заболеванием легких включает таксоны, присутствующие в ротоглотке. и носоглотка.Микробиом 4:37
Статья
CAS
PubMed
PubMed Central
Google ученый
Lal CV, Travers C, Aghai ZH, Eipers P, Jilling T, Halloran B, Carlo WA, Keeley J, Rezonzew G, Kumar R, Morrow C, Bhandari V, Ambalavanan N (2016) Микробиом дыхательных путей при рождении. Sci Rep 6: 31023
Статья
CAS
PubMed
PubMed Central
Google ученый
Arrieta MC, Stiemsma LT, Dimitriu PA, Thorson L, Russell S, Yurist-Doutsch S, Kuzeljevic B, Gold MJ, Britton HM, Lefebvre DL, Subbarao P, Mandhane P, Becker A, McNagny KM, Sears MR, Kollmann T. , Investigators CS, Mohn WW, Turvey SE, Finlay BB (2015) Микробные и метаболические изменения в раннем младенчестве влияют на риск детской астмы. Sci Transl Med 7: 307ra152
Статья
CAS
PubMed
PubMed Central
Google ученый
Biesbroek G, Tsivtsivadze E, Sanders EA, Montijn R, Veenhoven RH, Keijser BJ, Bogaert D (2014) Ранний состав респираторной микробиоты определяет паттерны сукцессии бактерий и здоровье органов дыхания у детей. Am J Respir Crit Care Med 190: 1283–1292
Статья
PubMed
PubMed Central
Google ученый
Teo SM, Mok D, Pham K, Kusel M, Serralha M, Troy N, Holt BJ, Hales BJ, Walker ML, Hollams E, Bochkov YA, Grindle K, Johnston SL, Gern JE, Sly PD , Holt PG, Holt KE, Inouye M (2015) Микробиом носоглотки младенца влияет на тяжесть инфекции нижних дыхательных путей и риск развития астмы.Клеточный микроб-хозяин 17: 704–715
Статья
CAS
PubMed
PubMed Central
Google ученый
Korten I, Mika M, Klenja S, Kieninger E, Mack I, Barbani MT, Gorgievski M, Frey U, Hilty M, Latzin P (2016) Взаимодействие респираторных вирусов и микробиоты носа в течение первого года жизни здоровых младенцев. mSphere 1: e00312 – e00316
Статья
PubMed
PubMed Central
Google ученый
Рот-Вальтер Ф., Адкок И.М., Бенито-Виллалвилла С., Бьянкини Р., Бьермер Л., Карамори Дж., Кари Л., Чунг К.Ф., Диамант З., Эгуилуз-Грасиа I, Кнол Е.Ф., Колиос АГА, Леви-Шаффер Ф., Ночентини Г. , Palomares O, Puzzovio PG, Redegeld FA, van Esch B, Stellato C (2019) Сравнение биологических препаратов и низкомолекулярных препаратов для лечения хронических респираторных заболеваний: рабочая группа EAACI по позиционному документу по иммунофармакологии. Аллергия 74: 432–448
Статья.
PubMed
PubMed Central
Google ученый
Groves HT, Cuthbertson L, James P, Moffatt MF, Cox MJ, Tregoning JS (2018) Респираторное заболевание, вызванное вирусной инфекцией легких, изменяет микробиоту кишечника мышей. Фронт Иммунол 9: 182
Артикул
CAS
PubMed
PubMed Central
Google ученый
Pulvirenti G, Parisi GF, Giallongo A, Papale M, Manti S, Savasta S, Licari A, Marseglia GL, Leonardi S (2019) Микробиота нижних дыхательных путей. Front Pediatr 7: 393
Артикул
PubMed
PubMed Central
Google ученый
Макколи, К., Дурак, Дж., Валладарес, Р., Фадрош, Д.У., Лин, Д.Л., Калатрони, А, Лебо, П.К., Тран, HT, Фуджимура, К.Е., Ламере, Б., Мерана, Г., Линч, К., Коэн , RT, Pongracic, J, Khurana Hershey, GK, Kercsmar, CM, Gill, M, Liu, AH, Kim, H, Kattan, M, Teach, SJ, Togias, A, Boushey, HA, Gern, JE, Jackson, DJ, Lynch, SV, Национальный институт, A, Inner-City Asthma, спонсируемая инфекционными заболеваниями, C (2019) Определенные бактериальные микробиоты носовых дыхательных путей по-разному связаны с обострением у педиатрических пациентов с астмой. J Allergy Clin Immunol 144: 1187–1197
J Allergy Clin Immunol 144: 1187–1197
Teo SM, Tang HHF, Mok D, Judd LM, Watts SC, Pham K, Holt BJ, Kusel M, Serralha M, Troy N, Bochkov YA, Grindle K. , Lemanske RF Jr, Johnston SL, Gern JE, Sly PD, Holt PG, Holt KE, Inouye M (2018) Динамика микробиоты дыхательных путей открывает критическое окно для взаимодействия патогенных бактерий и аллергии при респираторных заболеваниях у детей. Клеточный микроб-хозяин 24 (341–52): e5
Google ученый
Robinson PFM, Pattaroni C, Cook J, Gregory L, Alonso AM, Fleming LJ, Lloyd CM, Bush A, Marsland BJ, Saglani S (2019) Микробиота нижних дыхательных путей связана с воспалительным фенотипом при тяжелом хрипе дошкольного возраста. J Allergy Clin Immunol 143 (1607–10): e3
Google ученый
Huang YJ, Boushey HA (2015) Микробиом при астме. J Allergy Clin Immunol 135: 25–30
Статья
PubMed
PubMed Central
Google ученый
Goleva E, Jackson LP, Harris JK, Robertson CE, Sutherland ER, Hall CF, Good JT Jr, Gelfand EW, Martin RJ, Leung DY (2013) Влияние микробиома дыхательных путей на реакцию кортикостероидов при астме. Am J Respir Crit Care Med 188: 1193–1201
Статья
CAS
PubMed
PubMed Central
Google ученый
Хуанг Й.Дж., Нельсон К.Э., Броди Э.Л., Десантис Т.З., Бэк М.С., Лю Дж., Войке Т., Аллгайер М., Бристоу Дж., Винер-Крониш Дж. П., Сазерленд Е.Р., Кинг Т.С., Ичитович Н., Мартин Р.Дж., Calhoun WJ, Castro M, Denlinger LC, Dimango E, Kraft M, Peters SP, Wasserman SI, Wechsler ME, Boushey HA, Lynch SV, National Heart L, Клинические исследования астмы Института крови, N (2011) Микробиота дыхательных путей и гиперчувствительность бронхов в пациенты с плохо контролируемой астмой. J Allergy Clin Immunol 127 (372–81): e1 – e3
J Allergy Clin Immunol 127 (372–81): e1 – e3
Google ученый
van Nimwegen FA, Penders J, Stobberingh EE, Postma DS, Koppelman GH, Kerkhof M, Reijmerink NE, Dompeling E, van den Brandt PA, Ferreira I, Mommers M, Thijs C (2011) Режим и место родовспоможения, микробиоты желудочно-кишечного тракта и их влияние на астму и атопию. J Allergy Clin Immunol 128 (948–55): e1 – e3
Google ученый
Stiemsma LT, Arrieta MC, Dimitriu PA, Cheng J, Thorson L, Lefebvre DL, Azad MB, Subbarao P, Mandhane P, Becker A, Sears MR, Kollmann TR, Canadian Healthy Infant Longitudinal Development Study, I, Mohn WW, Finlay BB, Turvey SE (2016) Сдвиги у Lachnospira и Clostridium sp. В 3-месячном стуле микробиом ассоциируется с астмой дошкольного возраста.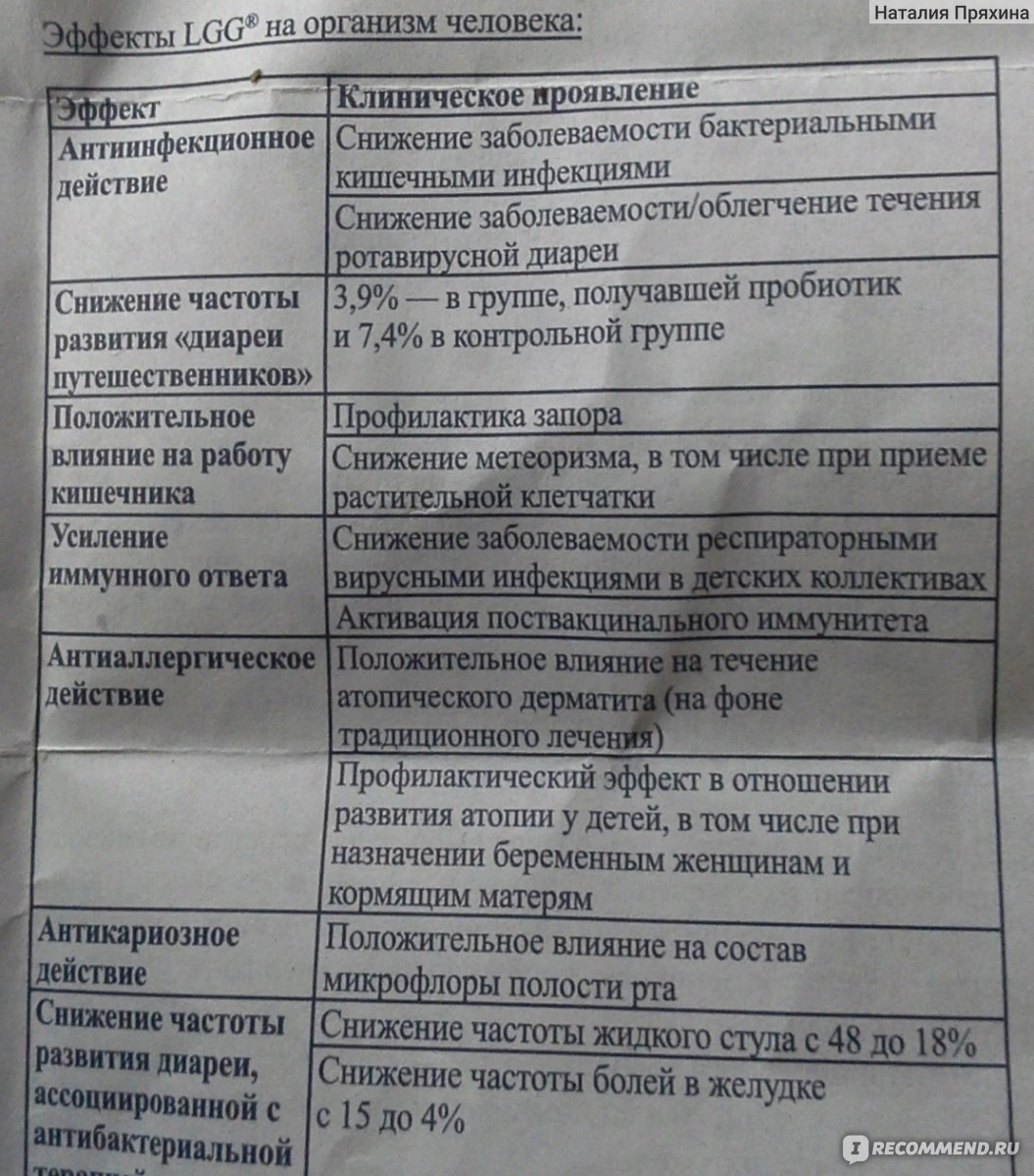 Clin Sci (Lond) 130: 2199–2207
Clin Sci (Lond) 130: 2199–2207
Статья
CAS
Google ученый
Chiu CY, Cheng ML, Chiang MH, Kuo YL, Tsai MH, Chiu CC, Lin G (2019) Бутират кишечного микробного происхождения обратно связан с реакциями IgE на аллергены при детской астме.Pediatr Allergy Immunol 30: 689–697
Статья
PubMed
PubMed Central
Google ученый
Durack J, Kimes NE, Lin DL, Rauch M, McKean M, McCauley K, Panzer AR, Mar JS, Cabana MD, Lynch SV (2018) Задержка развития микробиоты кишечника у младенцев с высоким риском астмы — это временно модифицируется добавлением Lactobacillus. Nat Commun 9: 707
Статья
CAS
PubMed
PubMed Central
Google ученый
Perez AC, Pang B, King LB, Tan L, Murrah KA, Reimche JL, Wren JT, Richardson SH, Ghandi U, Swords WE (2014) Размещение Streptococcus pneumoniae и Moraxella catarrhalis внутри полимикробной биопленки способствует устойчивости к антибиотикам и устойчивости бактерий в естественным образом. Pathog Dis 70: 280–288
Статья
CAS
PubMed
PubMed Central
Google ученый
Bisgaard H, Hermansen MN, Buchvald F, Loland L, Halkjaer LB, Bonnelykke K, Brasholt M, Heltberg A, Vissing NH, Thorsen SV, Stage M, Pipper CB (2007) Детская астма после бактериальной колонизации дыхательные пути у новорожденных.N Engl J Med 357: 1487–1495
Статья
CAS
PubMed
PubMed Central
Google ученый
Bosch A, de Steenhuijsen Piters WAA, van Houten MA, Chu M, Biesbroek G, Kool J, Pernet P, de Groot PCM, Eijkemans MJC, Keijser BJF, Sanders EAM, Bogaert D (2017) Созревание респираторная микробиота младенцев, факторы окружающей среды и последствия для здоровья. Проспективное когортное исследование. Am J Respir Crit Care Med 196: 1582–1590
Статья
PubMed
PubMed Central
Google ученый
Toivonen L, Hasegawa K, Waris M, Ajami NJ, Petrosino JF, Camargo CA Jr, Peltola V (2019) Ранняя назальная микробиота и острые респираторные инфекции в первые годы жизни. Thorax 74: 592–599
Статья
Google ученый
Depner M, Ege MJ, Cox MJ, Dwyer S, Walker AW, Birzele LT, Genuneit J, Horak E, Braun-Fahrlander C, Danielewicz H, Maier RM, Moffatt MF, Cookson WO, Heederik D, von Mutius E, Legatzki A (2017) Бактериальная микробиота верхних дыхательных путей и детская астма. J Allergy Clin Immunol 139 (826–34): e13
J Allergy Clin Immunol 139 (826–34): e13
Google ученый
von Mutius E (2018) Интимные перекрестные помехи в нижних дыхательных путях в начале жизни. Клеточный микроб-хозяин 24: 758–759
Статья
CAS
Google ученый
Карр Т.Ф., Алкатиб Р., Крафт М. (2019) Микробиом в механизмах астмы. Clin Chest Med 40: 87–96
Артикул
PubMed
PubMed Central
Google ученый
Marri PR, Stern DA, Wright AL, Billheimer D, Martinez FD (2013) Связанные с астмой различия в микробном составе индуцированной мокроты. J Allergy Clin Immunol 131 (346–52): e1 – e3
Google ученый
Taylor SL, Leong LEX, Choo JM, Wesselingh S, Yang IA, Upham JW, Reynolds PN, Hodge S, James AL, Jenkins C, Peters MJ, Baraket M, Marks GB, Gibson PG, Simpson JL , Rogers GB (2018) Воспалительные фенотипы у пациентов с тяжелой астмой связаны с особой микробиологией дыхательных путей.J Allergy Clin Immunol 141 (94–103): e15
Google ученый
Green B, Wiriyachaiporn S, Grainge C, Rogers GB, Kehagis V, Lau L, Carroll MP, Bruce KD, Howarth PH (2014) Потенциально патогенные бактерии дыхательных путей и нейтрофильное воспаление при устойчивой к лечению тяжелой астме. PLoS One 9: e100645
Артикул
CAS
PubMed
PubMed Central
Google ученый
Durack J, Lynch SV, Nariya S, Bhakta NR, Beigelman A, Castro M, Dyer AM, Israel E, Kraft M, Martin RJ, Mauger DT, Rosenberg SR, Sharp-King T, White SR, Woodruff PG, Avila PC , Denlinger LC, Holguin F, Lazarus SC, Lugogo N, Moore WC, Peters SP, Que L, Smith LJ, Sorkness CA, Wechsler ME, Wenzel SE, Boushey HA, Huang YJ, National Heart L, Институт крови, A (2017 ) Особенности бактериального микробиома бронхов, связанные с атопией, астмой и чувствительностью к лечению ингаляционными кортикостероидами. J Allergy Clin Immunol 140: 63–75
J Allergy Clin Immunol 140: 63–75
Статья
CAS
PubMed
PubMed Central
Google ученый
Abrahamsson TR, Jakobsson HE, Andersson AF, Bjorksten B, Engstrand L, Jenmalm MC (2014) Низкое разнообразие кишечной микробиоты в раннем младенчестве предшествует астме в школьном возрасте. Clin Exp Allergy 44: 842–850
Статья
CAS
PubMed
PubMed Central
Google ученый
Dang AT, Marsland BJ (2019) Микробы, метаболиты и ось кишечник-легкие. Mucosal Immunol 12: 843–850
Статья
CAS
PubMed
PubMed Central
Google ученый
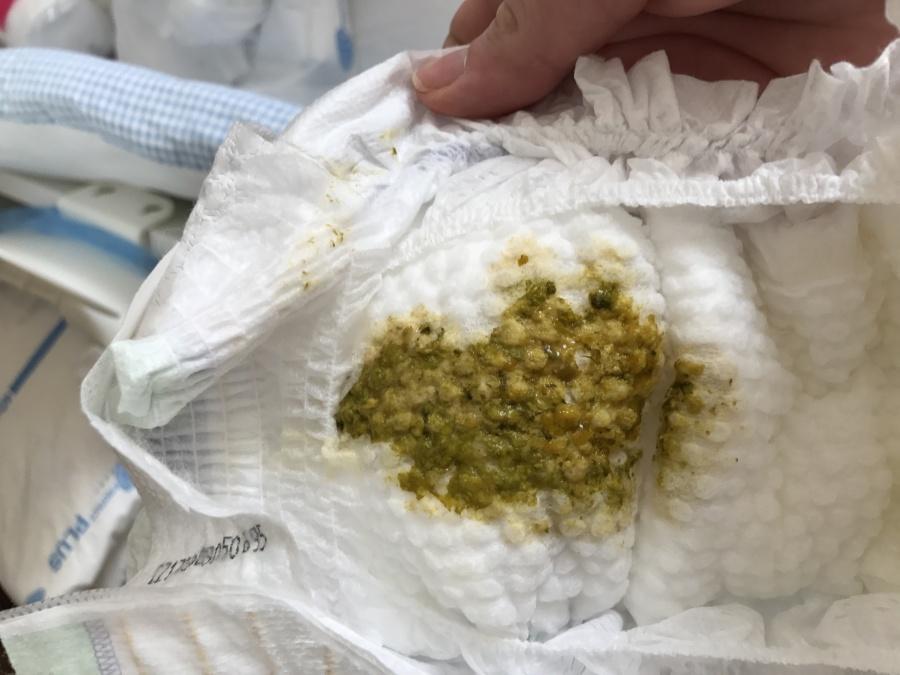
Tulic MK, Piche T, Verhasselt V (2016) Перекрестный разговор легких и кишечника: доказательства, механизмы и последствия для воспалительных заболеваний слизистой оболочки. Clin Exp Allergy 46: 519–528
Статья
CAS
PubMed
PubMed Central
Google ученый
Stokholm J, Blaser MJ, Thorsen J, Rasmussen MA, Waage J, Vinding RK, Schoos AM, Kunoe A, Fink NR, Chawes BL, Bonnelykke K, Brejnrod AD, Mortensen MS, Al-Soud WA, Sorensen SJ, Bisgaard H (2018) Созревание микробиома кишечника и риск астмы в детстве. Nat Commun 9: 141
Статья
CAS
PubMed
PubMed Central
Google ученый
Wang H, Liu JS, Peng SH, Deng XY, Zhu DM, Javidiparsijani S, Wang GR, Li DQ, Li LX, Wang YC, Luo JM (2013) Перекрестные помехи между кишечником и легкими при поражении легких с воспалительным процессом заболевания кишечника. World J Gastroenterol 19: 6794–6804
World J Gastroenterol 19: 6794–6804
Статья
PubMed
PubMed Central
Google ученый
Braun-Fahrlander C, Gassner M, Grize L, Neu U, Sennhauser FH, Varonier HS, Vuille JC, Wuthrich B (1999) Распространенность сенной лихорадки и аллергической сенсибилизации у детей фермеров и их сверстников, живущих в та же сельская община. Команда SCARPOL Швейцарское исследование детской аллергии и респираторных симптомов в отношении загрязнения воздуха Clin Exp Allergy 29: 28–34
CAS
Google ученый
Douwes J, Travier N, Huang K, Cheng S, McKenzie J, Le Gros G, von Mutius E, Pearce N (2007) Воздействие на ферму на протяжении всей жизни может значительно снизить риск астмы у взрослых. Аллергия 62: 1158–1165
Статья
CAS
PubMed
PubMed Central
Google ученый
Loss G, Apprich S, Waser M, Kneifel W, Genuneit J, Buchele G, Weber J, Sozanska B, Danielewicz H, Horak E, van Neerven RJ, Heederik D, Lorenzen PC, von Mutius E, Braun-Fahrlander C, group, GS (2011) Защитный эффект потребления молока на ферме на астму и атопию у детей: исследование GABRIELA.J Allergy Clin Immunol 128 (766–73): e4
Google ученый
Waser, M, Michels, KB, Bieli, C, Floistrup, H, Pershagen, G, von Mutius, E, Ege, M, Riedler, J, Schram-Bijkerk, D, Brunekreef, B, van Hage, M, Lauener, R, Braun-Fahrlander, C, team, PS (2007) Обратная связь потребления молока на ферме с астмой и аллергией у сельского и пригородного населения по всей Европе. Clin Exp Allergy 37: 661–670
Ege MJ, Frei R, Bieli C, Schram-Bijkerk D, Waser M, Benz MR, Weiss G, Nyberg F, van Hage M, Pershagen G, Brunekreef B, Riedler J, Lauener R, Braun-Fahrlander C, von Mutius E, team, PS (2007) Не все фермерские хозяйства защищают от развития астмы и хрипов у детей. J Allergy Clin Immunol 119: 1140–1147
J Allergy Clin Immunol 119: 1140–1147
Статья
PubMed
PubMed Central
Google ученый
Stein MM, Hrusch CL, Gozdz J, Igartua C, Pivniouk V, Murray SE, Ledford JG, Marques Dos Santos M, Anderson RL, Metwali N, Neilson JW, Maier RM, Gilbert JA, Holbreich M, Thorne PS, Martinez FD, von Mutius E, Vercelli D, Ober C, Sperling AI (2016) Врожденный иммунитет и риск астмы у фермерских детей амишей и гуттеритов. N Engl J Med 375: 411–421
Статья
CAS
PubMed
PubMed Central
Google ученый
Muller-Rompa, SEK, Markevych, I, Hose, AJ, Loss, G, Wouters, IM, Genuneit, J, Braun-Fahrlander, C, Horak, E, Boznanski, A, Heederik, D, von Mutius, E, Heinrich, J, Ege, MJ, Group, GS (2018) Подход к защитному эффекту фермы от астмы путем геокодирования: хорошие фермы и лучшие фермы. Pediatr Allergy Immunol 29: 275–282
Pediatr Allergy Immunol 29: 275–282
Статья
Google ученый
Обер С., Сперлинг А.И., фон Мутиус Э., Верчелли Д. (2017) Иммунное развитие и окружающая среда: уроки от детей амишей и гуттеритов.Curr Opin Immunol 48: 51–60
Статья
CAS
PubMed
PubMed Central
Google ученый
Tantoco JC, Elliott Bontrager J, Zhao Q, DeLine J, Seroogy CM (2018) У амишей снизилось количество астмы и аллергических заболеваний по сравнению с меннонитами старого порядка. Ann Allergy Asthma Immunol 121 (252–3): e1
Google ученый
Timm S, Frydenberg M, Abramson MJ, Bertelsen RJ, Braback L, Benediktsdottir B, Gislason T, Holm M, Janson C, Jogi R, Johannessen A, Kim JL, Malinovschi A. , Mishra J, Moratall , Sigsgaard T, Svanes C, Schlunssen V (2019) Астма и выборочная миграция из сельскохозяйственных угодий в когортном исследовании трех поколений.Eur J Epidemiol 34: 601–609
, Mishra J, Moratall , Sigsgaard T, Svanes C, Schlunssen V (2019) Астма и выборочная миграция из сельскохозяйственных угодий в когортном исследовании трех поколений.Eur J Epidemiol 34: 601–609
Статья
PubMed
PubMed Central
Google ученый
Кирьявайнен П.В., Карвонен А.М., Адамс Р.И., Таубель М., Ропонен М., Туоресмаки П., Потеря Г., Джаяпракаш Б., Депнер М., Эге М.Дж., Ренц Х., Пфефферле П.И., Шауб Б., Лауенер Р., Хиваринен А. , Knight R, Heederik DJJ, von Mutius E, Pekkanen J (2019) Домашняя микробиота, подобная ферме, в несельскохозяйственных домах защищает детей от развития астмы. Nat Med 25: 1089–1095
Статья
CAS
Google ученый
Hesselmar B, Hicke-Roberts A, Lundell AC, Adlerberth I, Rudin A, Saalman R, Wennergren G, Wold AE (2018) Содержание домашних животных в раннем возрасте снижает риск аллергии в зависимости от дозы. PLoS One 13: e0208472
PLoS One 13: e0208472
Статья
CAS
PubMed
PubMed Central
Google ученый
Барберан А., Данн Р.Р., Райх Б.Дж., Пасифици К., Лабер Э.Б., Меннингер Х.Л., Мортон Дж. М., Хенли Дж. Б., Лефф Дж. В., Миллер С. Л., Фирер Н. (2015) Экология микроскопической жизни в домашней пыли.Proc Biol Sci 282
Middelbos IS, Vester Boler BM, Qu A, White BA, Swanson KS, Fahey GC Jr (2010) Филогенетическая характеристика фекальных микробных сообществ собак, которых кормили диетами с добавлением пищевых волокон или без них, с использованием 454 пиросеквенирование. PLoS One 5: e9768
Артикул
CAS
PubMed
PubMed Central
Google ученый
Song SJ, Lauber C, Costello EK, Lozupone CA, Humphrey G, Berg-Lyons D, Caporaso JG, Knights D, Clemente JC, Nakielny S, Gordon JI, Fierer N, Knight R (2013) Cohabiting члены семьи делятся микробиотой друг с другом и со своими собаками.Elife 2: e00458
Артикул
PubMed
PubMed Central
Google ученый
Tun HM, Konya T, Takaro TK, Brook JR, Chari R, Field CJ, Guttman DS, Becker AB, Mandhane PJ, Turvey SE, Subbarao P, Sears MR, Scott JA, Kozyrskyj AL, Investigators CS (2017) Воздействие домашних пушистых домашних животных влияет на микробиоту кишечника младенца в возрасте 3-4 месяцев после различных сценариев рождения. Microbiome 5:40
Статья
PubMed
PubMed Central
Google ученый
фон Мутиус Э., Верчелли Д. (2010) Жизнь на ферме: влияние на детскую астму и аллергию. Nat Rev Immunol 10: 861–868
Статья
CAS
Google ученый
Debarry J, Hanuszkiewicz A, Stein K, Holst O, Heine H (2010) Аллергозащитные свойства Acinetobacter lwoffii F78 придает его липополисахарид. Allergy 65: 690–697
Статья.
CAS
PubMed
PubMed Central
Google ученый
Froidure A, Pilette C (2016) От гипотезы гигиены до A20: защитный эффект эндотоксинов против развития астмы. Clin Exp Allergy 46: 192–193
Статья
CAS
PubMed
PubMed Central
Google ученый
Schuijs MJ, Willart MA, Vergote K, Gras D, Deswarte K, Ege MJ, Madeira FB, Beyaert R, van Loo G, Bracher F, von Mutius E, Chanez P, Lambrecht B.N, Hammad H ( 2015) Фермерская пыль и эндотоксин защищают от аллергии за счет индукции A20 в эпителиальных клетках легких.Science 349: 1106–1110
Статья
CAS
PubMed
PubMed Central
Google ученый
Frei R, Ferstl R, Roduit C, Ziegler M, Schiavi E, Barcik W, Rodriguez-Perez N, Wirz, OF, Wawrzyniak M, Pugin B, Nehrbass D, Jutel M, Smolinska S, Konieczna P , Bieli C, Loeliger S, Waser M, Pershagen G, Riedler J, Depner M, Schaub B, Genuneit J, Renz H, Pekkanen J, Karvonen AM, Dalphin JC, van Hage M, Doekes G, Akdis M, Braun-Fahrlander C, Akdis CA, von Mutius E, O’Mahony L, Lauener RP, Предотвращение факторов риска аллергии для сенсибилизации у детей, связанных с, F, Исследование антропософского образа жизни, g, Исследование защиты от аллергии в сельской местности / Механизмы раннего защитного воздействия об исследовании развития аллергии, g (2018 г. ) Воздействие немикробной N-гликолилнейраминовой кислоты защищает детей фермеров от воспаления дыхательных путей и колита.J Allergy Clin Immunol 141 (382–90): e7
) Воздействие немикробной N-гликолилнейраминовой кислоты защищает детей фермеров от воспаления дыхательных путей и колита.J Allergy Clin Immunol 141 (382–90): e7
Google ученый
Roth-Walter F, Pacios LF, Bianchini R, Jensen-Jarolim E (2017) Связь дефицита железа с аллергией: роль молекулярных аллергенов и микробиома. Металломика 9: 1676–1692
Статья
CAS
PubMed
PubMed Central
Google ученый
Roth-Walter F, Pacios LF, Gomez-Casado C, Hofstetter G, Roth GA, Singer J, Diaz-Perales A, Jensen-Jarolim E (2014) Главный аллерген коровьего молока, Bos d 5, манипулирует T — клетки-помощники в зависимости от их нагрузки железом, связанным с сидерофором.PLoS One 9: e104803
Артикул
CAS
PubMed
PubMed Central
Google ученый
Hufnagl K, Ghosh D, Wagner S, Fiocchi A, Dahdah L, Bianchini R, Braun N, Steinborn R, Hofer M, Blaschitz M, Roth GA, Hofstetter G, Roth-Walter F, Pacios LF, Jensen-Jarolim E (2018) Ретиноевая кислота предотвращает иммуногенность липокалина Bos d 5 молока за счет связывания с его иммунодоминантным Т-клеточным эпитопом. Sci Rep 8: 1598
Статья
CAS
PubMed
PubMed Central
Google ученый
Singh V, Yeoh BS, Chassaing B, Zhang B, Saha P, Xiao X, Awasthi D, Shashidharamurthy R, Dikshit M, Gewirtz A, Vijay-Kumar M (2016) Индуцируемый микробиотой врожденный иммунный, связывающий сидерофор белок липокалин 2 — это критичен для гомеостаза кишечника. Cell Mol Gastroenterol Hepatol 2 (482–98): e6
Google ученый
Pawlowski M, Jerzynska J, Podlecka D, Stelmach W, Majak P, Stelmach I (2017) Эффективность иммунотерапии у детей зависит от места проживания — пилотное исследование.Allergol Immunopathol (Madr) 45: 272–275
Статья
CAS
Google ученый
Ege MJ, Bieli C, Frei R, van Strien RT, Riedler J, Ublagger E, Schram-Bijkerk D, Brunekreef B, van Hage M, Scheynius A, Pershagen G, Benz MR, Lauener R, von Mutius E, Braun-Fahrlander C, Parsifal Study, t (2006) Пренатальное воздействие на ферму связано с экспрессией рецепторов врожденного иммунитета и с атопической сенсибилизацией у детей школьного возраста.J Allergy Clin Immunol 117: 817–823
Статья
PubMed
PubMed Central
Google ученый
Финкина Е.И., Мельникова Д.Н., Богданов И.В., Овчинникова Т.В. (2017) Белки, связанные с патогенезом растений PR-10 и PR-14 как компоненты системы врожденного иммунитета и повсеместные аллергены. Curr Med Chem 24: 1772–1787
Статья
CAS
PubMed
PubMed Central
Google ученый
Roth-Walter F, Gomez-Casado C, Pacios LF, Mothes-Luksch N, Roth GA, Singer J, Diaz-Perales A, Jensen-Jarolim E (2014) Bet v 1 из пыльцы березы представляет собой липокалин-подобный белок, действующий как аллерген, только если он лишен железа, способствуя развитию лимфоцитов Th3. J Biol Chem 289: 17416–17421
Статья
CAS
PubMed
PubMed Central
Google ученый

Bulgarelli D, Schlaeppi K, Spaepen S, Ver Loren van Themaat E, Schulze-Lefert P (2013) Структура и функции бактериальной микробиоты растений.Анну Рев Завод Биол 64: 807–838
Артикул
CAS
PubMed
PubMed Central
Google ученый
Manirajan B, Ratering S, Rusch V, Schwiertz A, Geissler-Plaum R, Cardinale M, Schnell S (2016) Бактериальная микробиота, связанная с цветочной пыльцой, зависит от типа опыления и демонстрирует высокую степень разнообразия и видовая специфика. Environ Microbiol 18: 5161–5174
Статья
Google ученый
Obersteiner A, Gilles S, Frank U, Beck I, Haring F, Ernst D, Rothballer M, Hartmann A, Traidl-Hoffmann C, Schmid M (2016) Микробиом, связанный с пыльцой, коррелирует с параметрами загрязнения и аллергенностью пыльцы. PLoS One 11: e0149545
PLoS One 11: e0149545
Артикул
CAS
PubMed
PubMed Central
Google ученый
Oteros J, Bartusel E, Alessandrini F, Nunez A, Moreno DA, Behrendt H, Schmidt-Weber C, Traidl-Hoffmann C, Buters J (2019) Пыльца артемизии является основным переносчиком эндотоксина в воздухе.J Allergy Clin Immunol 143 (369–77): e5
Google ученый
Tripathy S, Tunno BJ, Michanowicz DR, Kinnee E, Shmool JLC, Gillooly S, Clougherty JE (2019) Гибридное регрессионное моделирование землепользования для оценки пространственно-временного воздействия PM2,5, BC и металлических компонентов через мегаполис со сложным рельефом и промышленными источниками. Sci Total Environ 673: 54–63
Статья
CAS
PubMed
PubMed Central
Google ученый
Li X, Sun Y, An Y, Wang R, Lin H, Liu M, Li S, Ma M, Xiao C (2019) Загрязнение воздуха в зимний период и микробный дисбаланс дыхательных путей у здорового молодого населения на северо-востоке Китая. Environ Pollut 246: 972–979
Статья
CAS
PubMed
PubMed Central
Google ученый
Chotirmall SH, Gellatly SL, Budden KF, Mac Aogain M, Shukla SD, Wood DL, Hugenholtz P, Pethe K, Hansbro PM (2017) Микробиомы в респираторном здоровье и болезнях: Азиатско-Тихоокеанский взгляд.Респирология 22: 240–250
Статья
PubMed
PubMed Central
Google ученый
Budden KF, Shukla SD, Rehman SF, Bowerman KL, Keely S, Hugenholtz P, Armstrong-James DPH, Adcock IM, Chotirmall SH, Chung KF, Hansbro PM (2019) Функциональные эффекты микробиоты в хроническом респираторная инфекция. Lancet Respir Med
Lancet Respir Med
Gao H, Shu Q, Chen J, Fan K, Xu P, Zhou Q, Li C, Zheng H (2019) Воздействие антибиотиков оказывает полозависимое воздействие на микробиоту кишечника и метаболизм коротких -цепочечные жирные кислоты и аминокислоты у мышей.mSystems 4: e00048 – e00019
Артикул
PubMed
PubMed Central
Google ученый
Werbner M, Barsheshet Y, Werbner N, Zigdon M, Averbuch I, Ziv O, Brant B, Elliott E, Gelberg S, Titelbaum M, Koren O, Avni O (2019) Микробиота, чувствительная к социальному стрессу индуцирует стимуляцию аутореактивных эффекторных Т-хелперов. mSystems: 4
Le Bastard Q, Al-Ghalith GA, Gregoire M, Chapelet G, Javaudin F, Dailly E, Batard E, Knights D, Montassier E (2018) Систематический обзор: дисбактериоз кишечника человека, вызванный -антибиотики по рецепту. Aliment Pharmacol Ther 47: 332–345
Aliment Pharmacol Ther 47: 332–345
Статья
PubMed
PubMed Central
Google ученый
Scholl I, Untersmayr E, Bakos N, Roth-Walter F, Gleiss A, Boltz-Nitulescu G, Scheiner O, Jensen-Jarolim E (2005) Противоязвенные препараты способствуют оральной сенсибилизации и гиперчувствительности к аллергенам лесного ореха при БАЛ / c мышей и человека. Am J Clin Nutr 81: 154–160
Артикул
PubMed
PubMed Central
Google ученый
Жернакова А., Курилщиков А., Бондер М.Дж., Тигчелаар Э.Ф., Ширмер М., Ватанен Т., Муджаджич З., Вила А.В., Фалони Г., Виейра-Силва С., Ван Дж., Имханн Ф., Брандсма Э, Янкиперсадсинг С.А., Джоосенс М., Сенит М.С. , Deelen P, Swertz MA, LifeLines cohort, s, Weersma RK, Feskens EJ, Netea MG, Gevers D, Jonkers D, Franke L, Aulchenko YS, Huttenhower C, Raes J, Hofker MH, Xavier RJ, Wijmenga C, Fu J (2016) Популяционный метагеномический анализ выявляет маркеры состава и разнообразия кишечного микробиома. Science 352: 565–569
Science 352: 565–569
Статья
CAS
PubMed
PubMed Central
Google ученый
Russell SL, Gold MJ, Reynolds LA, Willing BP, Dimitriu P, Thorson L, Redpath SA, Perona-Wright G, Blanchet MR, Mohn WW, Finlay BB, McNagny KM (2015) Перинатальные изменения микробиоты кишечника, вызванные антибиотиками, имеют дифференциальное воздействие на воспалительные заболевания легких. J Allergy Clin Immunol 135: 100–109
Статья
CAS
PubMed
PubMed Central
Google ученый
Oldenburg CE, Sie A, Coulibaly B, Ouermi L, Dah C, Tapsoba C, Barnighausen T, Ray KJ, Zhong L, Cummings S, Lebas E, Lietman TM, Keenan JD, Doan T (2018) Влияние обычно используемых детских антибиотиков на микробное разнообразие кишечника у детей дошкольного возраста в Буркина-фасо: рандомизированное клиническое исследование. Открытый форум Infect Dis 5: ofy289
Открытый форум Infect Dis 5: ofy289
Статья
CAS
PubMed
PubMed Central
Google ученый
Adami AJ, Bracken SJ, Guernsey LA, Rafti E, Maas KR, Graf J, Matson AP, Thrall RS, Schramm CM (2018) Антибиотики в раннем возрасте ослабляют генерацию регуляторных Т-клеток и увеличивают серьезность мышей астма, вызванная клещами домашней пыли. Pediatr Res 84: 426–434
Статья
CAS
PubMed
PubMed Central
Google ученый
Jackson MA, Goodrich JK, Maxan ME, Freedberg DE, Abrams JA, Poole AC, Sutter JL, Welter D, Ley RE, Bell JT, Spector TD, Steves CJ (2016) Ингибиторы протонной помпы изменяют состав микробиоты кишечника. Gut 65: 749–756
Статья
CAS
PubMed
PubMed Central
Google ученый
Mishiro T, Oka K, Kuroki Y, Takahashi M, Tatsumi K, Saitoh T, Tobita H, Ishimura N, Sato S, Ishihara S, Sekine J, Wada K, Kinoshita Y (2018) Изменения микробиома полости рта здоровых добровольцев с ингибитором протонной помпы.J Gastroenterol Hepatol 33: 1059–1066
Статья
CAS
PubMed
PubMed Central
Google ученый
Naito Y, Kashiwagi K, Takagi T, Andoh A, Inoue R (2018) Дисбиоз кишечника, вторичный по отношению к использованию ингибиторов протонной помпы. Пищеварение 97: 195–204
Статья
CAS
PubMed
PubMed Central
Google ученый
Takagi T, Naito Y, Inoue R, Kashiwagi S, Uchiyama K, Mizushima K, Tsuchiya S, Okayama T, Dohi O, Yoshida N, Kamada K, Ishikawa T. , Handa O, Konishi H, Okuda K , Tsujimoto Y, Ohnogi H, Itoh Y (2018) Влияние длительного использования ингибиторов протонной помпы на микробиоту кишечника: исследование случай-контроль с учетом возраста и пола.J Clin Biochem Nutr 62: 100–105
, Handa O, Konishi H, Okuda K , Tsujimoto Y, Ohnogi H, Itoh Y (2018) Влияние длительного использования ингибиторов протонной помпы на микробиоту кишечника: исследование случай-контроль с учетом возраста и пола.J Clin Biochem Nutr 62: 100–105
Артикул
CAS
PubMed
PubMed Central
Google ученый
Ходзё М., Асахара Т., Нагахара А., Такеда Т., Мацумото К., Уэяма Х, Мацумото К., Асаока Д., Такахаси Т., Номото К., Ямасиро Ю., Ватанабэ С. (2018) Состав микробиоты кишечника до и после использование ингибиторов протонной помпы. Dig Dis Sci 63: 2940–2949
Статья
CAS
PubMed
PubMed Central
Google ученый
Миналян А., Габриелян Л., Скотт Д., Джейкобс Дж., Писенья Дж. Р. (2017) Микробиом желудка и кишечника: роль ингибиторов протонной помпы. Curr Gastroenterol Rep 19:42
Р. (2017) Микробиом желудка и кишечника: роль ингибиторов протонной помпы. Curr Gastroenterol Rep 19:42
Артикул
PubMed
PubMed Central
Google ученый
Castellani C, Singer G, Kashofer K, Huber-Zeyringer A, Flucher C, Kaiser M, Till H (2017) Влияние ингибиторов протонной помпы на фекальный микробиом младенцев с гастроэзофагеальным рефлюксом — проспективный продольный интервенционное исследование.Front Cell Infect Microbiol 7: 444
Статья
CAS
PubMed
PubMed Central
Google ученый
Clooney AG, Bernstein CN, Leslie WD, Vagianos K, Sargent M, Laserna-Mendieta EJ, Claesson MJ, Targownik LE (2016) Сравнение микробиома кишечника между длительными пользователями и непользователями ингибиторы протонной помпы. Aliment Pharmacol Ther 43: 974–984
Aliment Pharmacol Ther 43: 974–984
Статья
CAS
PubMed
PubMed Central
Google ученый
Diesner SC, Bergmayr C, Pfitzner B, Assmann V, Krishnamurthy D, Starkl P, Endesfelder D, Rothballer M, Welzl G, Rattei T, Eiwegger T., Szepfalusi Z, Fehrenbach H, Jensen-Jarolim-E, Hartballer Scholl I, Untersmayr E (2016) Особый состав микробиоты связан с защитой от пищевой аллергии в модели оральной иммунизации мышей. Clin Immunol 173: 10–18
Статья
CAS
PubMed
PubMed Central
Google ученый
McAleer JP, Kolls JK (2018) Вклад кишечного микробиома в иммунитет легких. Eur J Immunol 48: 39–49
Статья
CAS
Google ученый
Черникова Д., Юань И., Шейкер М. (2019) Профилактика аллергии с разнообразной и здоровой микробиотой: обновление. Curr Opin Pediatr 31: 418–425
Статья
PubMed
PubMed Central
Google ученый
Obiakor CV, Tun HM, Bridgman SL, Arrieta MC, Kozyrskyj AL (2018) Связь между использованием антибиотиков в раннем возрасте и аллергическими заболеваниями у детей раннего возраста: последние выводы и их значение. Эксперт Рев Клин Иммунол 14: 841–855
Статья
CAS
PubMed
PubMed Central
Google ученый
Милликен С., Аллен Р.М., Ламонт РФ (2019) Роль антимикробного лечения во время беременности на микробиом кишечника новорожденных и развитие атопии, астмы, аллергии и ожирения в детстве. Мнение эксперта Drug Saf 18: 173–185
Мнение эксперта Drug Saf 18: 173–185
Статья
CAS
PubMed
PubMed Central
Google ученый
Loewen K, Monchka B, Mahmud SM, t Jong G, Azad MB (2018) Пренатальное воздействие антибиотиков и детская астма: популяционная. исследование Eur Respir J 52: 1702070
Статья
CAS
PubMed
PubMed Central
Google ученый
Mulder B, Pouwels KB, Schuiling-Veninga CC, Bos HJ, de Vries TW, Jick SS, Hak E (2016) Использование антибиотиков во время беременности и астмы у детей дошкольного возраста: влияние смешения.Clin Exp Allergy 46: 1214–1226
Статья
CAS
PubMed
PubMed Central
Google ученый
Домингес-Белло М.Г., Костелло Е.К., Контрерас М., Магрис М., Идальго Г., Фирер Н., Найт Р. (2010) Режим доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc Natl Acad Sci U S A 107: 11971–11975
Статья
PubMed
PubMed Central
Google ученый
Alm B, Goksor E, Pettersson R, Mollborg P, Erdes L, Loid P, Aberg N, Wennergren G (2014) Антибиотики в первую неделю жизни являются фактором риска аллергического ринита в школьном возрасте. Pediatr Allergy Immunol 25: 468–472
Статья
PubMed
PubMed Central
Google ученый
Taylor SL, Leong LEX, Mobegi FM, Choo JM, Wesselingh S, Yang IA, Upham JW, Reynolds PN, Hodge S, James AL, Jenkins C, Peters MJ, Baraket M, Marks GB, Gibson PG , Роджерс Г. Б., Симпсон Дж.Л. (2019) Азитромицин в течение длительного периода времени снижает уровень Haemophilus influenzae и повышает устойчивость к антибиотикам при тяжелой астме.Am J Respir Crit Care Med
Б., Симпсон Дж.Л. (2019) Азитромицин в течение длительного периода времени снижает уровень Haemophilus influenzae и повышает устойчивость к антибиотикам при тяжелой астме.Am J Respir Crit Care Med
Segal LN, Clemente JC, Wu BG, Wikoff WR, Gao Z, Li Y, Ko JP, Rom WN, Blaser MJ, Weiden MD (2017) Рандомизированный, двойной слепой, плацебо-контролируемое испытание азитромицина отбирает противовоспалительные микробные метаболиты в эмфизематозном легком. Thorax 72: 13–22
Статья
PubMed
PubMed Central
Google ученый
Donovan BM, Abreo A, Ding T, Gebretsadik T, Turi KN, Yu C, Ding J, Dupont WD, Stone CA, Hartert TV, Wu P (2019) Доза, время и тип детского антибиотика использование и риск детской астмы.Clin Infect Dis
Lu J, Xiong L, Zhang X, Liu Z, Wang S, Zhang C, Zheng J, Wang G, Zheng R, Simpson JL, Wang F (2017) Роль дисбактериоза нижних дыхательных путей при астме: дисбактериоз и астма. Mediat Inflamm 2017: 38
Google ученый
Mitre E, Susi A, Kropp LE, Schwartz DJ, Gorman GH, Nylund CM (2018) Связь между использованием кислотоподавляющих препаратов и антибиотиков в младенчестве и аллергическими заболеваниями в раннем детстве.JAMA Pediatr 172: e180315
Артикул
PubMed
PubMed Central
Google ученый
(2019) Глобальная инициатива по астме, отчет GINA: глобальная стратегия управления и профилактики астмы. https://ginasthma.org/wp-content/uploads/2019/06/GINA-2019-main-report-June-2019-wms. pdf По состоянию на 2 февраля 2020 г.
pdf По состоянию на 2 февраля 2020 г.
Ganti L, Rosario J (2019 ) Улучшают ли антибиотики исходы у пациентов с обострениями астмы? Энн Эмерг Мед
Denner DR, Sangwan N, Becker JB, Hogarth DK, Oldham J, Castillo J, Sperling AI, Solway J, Naureckas ET, Gilbert JA, White SR (2016) Кортикостероидная терапия и обструкция воздушного потока влияют на микробиом бронхов, который отличается от бронхоальвеолярный лаваж дыхательных путей при астме. J Allergy Clin Immunol 137 (1398–405): e3
Google ученый
Untersmayr E, Poulsen LK, Platzer MH, Pedersen MH, Boltz-Nitulescu G, Skov PS, Jensen-Jarolim E (2005) Влияние пищеварения в желудке на аллергенность трески. J Allergy Clin Immunol 115: 377–382
J Allergy Clin Immunol 115: 377–382
Статья
CAS
PubMed
PubMed Central
Google ученый
Zhang H, DiBaise JK, Zuccolo A, Kudrna D, Braidotti M, Yu Y, Parameswaran P, Crowell MD, Wing R, Rittmann BE, Krajmalnik-Brown R (2009) Микробиота кишечника человека при ожирении и после обходной желудочный анастомоз. Proc Natl Acad Sci U S A 106: 2365–2370
Статья
PubMed
PubMed Central
Google ученый
Shakeri-Leidenmuhler S, Lukschal A, Schultz C, Bohdjalian A, Langer F, Birsan T, Diesner SC, Greisenegger EK, Scheiner O, Kopp T, Jensen-Jarolim E, Prager G, Untersmayr E (2015) Хирургическое устранение Переваривание желудка с помощью обходного желудочного анастомоза по Ру влияет на пищевую сенсибилизацию — экспериментальное исследование. Obes Surg 25: 2268–2275
Obes Surg 25: 2268–2275
Артикул
PubMed
PubMed Central
Google ученый
Джордакиева Г., Кунди М., Унтерсмайр Э., Пали-Шолль I, Райхардт Б., Йенсен-Яролим Э. (2019) Медицинские записи по всей стране указывают на повышенный риск аллергии из-за ингибирования кислоты желудочного сока.Nat Commun 10: 3298
Статья
CAS
PubMed
PubMed Central
Google ученый
Hong SW, Eunju O, Lee JY, Lee M, Han D, Ko HJ, Sprent J, Surh CD, Kim KS (2019) Пищевые антигены вызывают спонтанное повышение уровня IgE в отсутствие комменсальной микробиоты. Sci Adv 5: eaaw1507
Статья
PubMed
PubMed Central
Google ученый
Feehley T., Plunkett CH, Bao R, Choi Hong SM, Culleen E, Belda-Ferre P, Campbell E, Aitoro R, Nocerino R, Paparo L, Andrade J, Antonopoulos DA, Berni Canani R, Nagler CR (2019) У здоровых младенцев есть кишечные бактерии, защищающие от пищевой аллергии.Nat Med 25: 448–453
Статья
CAS
PubMed
PubMed Central
Google ученый
Fiocchi A, Pawankar R, Cuello-Garcia C, Ahn K, Al-Hammadi S, Agarwal A, Beyer K, Burks W, Canonica GW, Ebisawa M, Gandhi S, Kamenwa R, Lee BW, Li H, Prescott S, Riva JJ, Rosenwasser L, Sampson H, Spigler M, Terracciano L, Vereda-Ortiz A, Waserman S, Yepes-Nunez JJ, Brozek JL, Schunemann HJ (2015) Рекомендации Всемирной аллергологической организации и Университета Макмастера для аллергиков профилактика заболеваний (ГЛАД-П): пробиотики.World Allergy Organ J 8: 4
Статья
PubMed
PubMed Central
Google ученый
Reddel S, Del Chierico F, Quagliariello A, Giancristoforo S, Vernocchi P, Russo A, Fiocchi A, Rossi P, Putignani L, El Hachem M (2019) Профиль микробиоты кишечника у детей, страдающих атопическим дерматитом и оценка устойчивости пробиотической смеси в кишечнике. Sci Rep 9: 4996
Статья
CAS
PubMed
PubMed Central
Google ученый
Данвуди Р., Стил А., Лэнди Дж., Симмондс Н. (2018) Clostridium difficile и муковисцидоз: стратегии управления и роль трансплантации фекалий. Педиатр Респир Ред. 26: 16–18
PubMed
PubMed Central
Google ученый
Herfarth H, Barnes EL, Long MD, Isaacs KL, Leith T, Silverstein M, Gerardin Y, Kassam Z (2019) Комбинированная эндоскопическая и оральная трансплантация фекальной микробиоты у пациентов с антибиотико-зависимым паучитом: низкая клиническая эффективность из-за низкого приживления донорских микробов. Воспаление кишечника Dis 4: 1–6
Воспаление кишечника Dis 4: 1–6
Статья
PubMed
PubMed Central
Google ученый
Korpela K, Salonen A, Vepsalainen O, Suomalainen M, Kolmeder C, Varjosalo M, Miettinen S, Kukkonen K, Savilahti E, Kuitunen M, de Vos WM (2018) Пробиотические добавки восстанавливают нормальный состав и функцию микробиоты у младенцев, получавших лечение антибиотиками, и у младенцев, рожденных после кесарева сечения Микробиом 6: 182
Статья
PubMed
PubMed Central
Google ученый
ВОЗ / ФАО (2006) Пробиотики в пищевых продуктах: полезные и питательные свойства и рекомендации по оценке. FAO Food Nutr Pap
Du X, Wang L, Wu S, Yuan L, Tang S, Xiang Y, Qu X, Liu H, Qin X, Liu C (2019) Эффективность пробиотической дополнительной терапии астмы, аллергический ринит и хрипы: метаанализ рандомизированных контролируемых исследований. Allergy Asthma Proc 40: 250–260
Статья
PubMed
PubMed Central
Google ученый
Dargahi N, Johnson J, Donkor O, Vasiljevic T, Apostolopoulos V (2019) Иммуномодулирующие эффекты пробиотиков: можно ли их использовать для лечения аллергии и аутоиммунных заболеваний? Maturitas 119: 25–38
Статья
CAS
PubMed
PubMed Central
Google ученый
Ozdemir O (2010) Различные эффекты различных штаммов пробиотиков при аллергических расстройствах: обновление лабораторных и клинических данных. Clin Exp Immunol 160: 295–304
Статья
CAS
PubMed
PubMed Central
Google ученый
Sharma G, Im SH (2018) Пробиотики как потенциальные иммуномодулирующие фармакабиотики при аллергических заболеваниях: текущее состояние и перспективы на будущее. Allergy Asthma Immunol Res 10: 575–590
Статья
CAS
PubMed
PubMed Central
Google ученый
Arpaia N, Campbell C, Fan X, Dikiy S, van der Veeken J, deRoos P, Liu H, Cross JR, Pfeffer K, Coffer PJ, Rudensky AY (2013) Метаболиты, продуцируемые комменсальными бактериями, способствуют развитию периферических регуляторных Т-клеток.Nature 504: 451–455
Статья
CAS
PubMed
PubMed Central
Google ученый
Wu CT, Chen PJ, Lee YT, Ko JL, Lue KH (2016) Влияние иммуномодулирующих добавок с Lactobacillus rhamnosus на воспаление дыхательных путей на модели астмы у мышей. J Microbiol Immunol Infect 49: 625–635
Статья
PubMed
PubMed Central
Google ученый
Russell SL, Gold MJ, Willing BP, Thorson L, McNagny KM, Finlay BB (2013) Перинатальное лечение антибиотиками влияет на микробиоту мышей, иммунные реакции и аллергическую астму. Кишечные микробы 4: 158–164
Статья
PubMed
PubMed Central
Google ученый
Forsythe P, Inman MD, Bienenstock J (2007) Пероральное лечение живыми Lactobacillus reuteri подавляет аллергическую реакцию дыхательных путей у мышей. Am J Respir Crit Care Med 175: 561–569
Статья
PubMed
PubMed Central
Google ученый
Blumer N, Sel S, Virna S, Patrascan CC, Zimmermann S, Herz U, Renz H, Garn H (2007) Применение Lactobacillus rhamnosus GG для беременных в перинатальном периоде подавляет аллергическое воспаление дыхательных путей у потомства мышей. Clin Exp Allergy 37: 348–357
Статья
CAS
PubMed
PubMed Central
Google ученый
Nunes CF, Nogueira JS, Vianna PHO, Ciambarella BT, Rodrigues PM, Miranda KR, Lobo LA, Domingues R, Busch M, Atella GC, Vale AM, Bellio M, Nobrega A, Canto FB, Fucs R (2018) Лечение пробиотиками в неонатальном возрасте обеспечивает оптимальную защиту от экспериментальной астмы за счет модуляции микробиоты и Т-клеток.Int Immunol 30: 155–169
Статья
CAS
PubMed
PubMed Central
Google ученый
Feleszko W, Jaworska J, Rha RD, Steinhausen S, Avagyan A, Jaudszus A, Ahrens B, Groneberg DA, Wahn U, Hamelmann E (2007) Подавление аллергической сенсибилизации и воспаления дыхательных путей, вызванное пробиотиками, связано с усилением Т-регуляторных механизмов на мышиной модели астмы. Clin Exp Allergy 37: 498–505
Статья
CAS
PubMed
PubMed Central
Google ученый
Cabana MD, McKean M, Caughey AB, Fong L, Lynch S, Wong A, Leong R, Boushey HA, Hilton JF (2017) Раннее добавление пробиотиков для профилактики экземы и астмы: рандомизированное контролируемое исследование. Педиатрия 140: e20163000
Статья
PubMed
PubMed Central
Google ученый
Gutkowski P, Madalinski K, Grek M, Dmenska H, Syczewska M, Michalkiewicz J (2010) Эффект перорально вводимых пробиотических штаммов «Lactobacillus» и «Bifidobacterium» у детей с атопической астмой.Central-Eur J Immunol: выходит раз в два месяца Польского общества иммунологии под совместным редактированием одиннадцати других центральных европейских иммунологических обществ 35: 233–238
CAS
Google ученый
Huang CF, Chie WC, Wang IJ (2018) Эффективность применения Lactobacillus у детей школьного возраста с астмой: рандомизированное плацебо-контролируемое исследование. Питательные вещества 10: E1678
Артикул
CAS
PubMed
PubMed Central
Google ученый
Chen Y, Jan RL, Lin YL, Chen HH, Wang JY (2010) Рандомизированное плацебо-контролируемое испытание лактобацилл у детей-астматиков с аллергическими ринитами. Педитр Пульмонол 45: 1111–1120
Артикул
Google ученый
Elazab N, Mendy A, Gasana J, Vieira ER, Quizon A, Forno E (2013) Введение пробиотиков в раннем возрасте, атопии и астме: метаанализ клинических испытаний. Педиатрия 132: e666 – e676
Статья
PubMed
PubMed Central
Google ученый
Azad MB, Coneys JG, Kozyrskyj AL, Field CJ, Ramsey CD, Becker AB, Friesen C, Abou-Setta AM, Zarychanski R (2013) Пробиотические добавки во время беременности или младенчества для профилактики астмы и хрипов: систематический обзор и мета -анализ. BMJ 347: f6471
Артикул
PubMed
PubMed Central
Google ученый
Mennini M, Dahdah L, Artesani MC, Fiocchi A, Martelli A (2017) Пробиотики в профилактике астмы и аллергии.Front Pediatr 5: 165
Артикул
PubMed
PubMed Central
Google ученый
Wang HT, Anvari S, Anagnostou K (2019) Роль пробиотиков в предотвращении аллергических заболеваний. Дети (Базель) 6: E24
Google ученый
Cuello-Garcia CA, Brozek JL, Fiocchi A, Pawankar R, Yepes-Nunez JJ, Terracciano L, Gandhi S, Agarwal A, Zhang Y, Schunemann HJ (2015) Пробиотики для профилактики аллергии: a систематический обзор и метаанализ рандомизированных контролируемых исследований.J Allergy Clin Immunol 136: 952–961
Статья
PubMed
PubMed Central
Google ученый
Эдвардс М.Р., Уолтон Р.П., Джексон Д.Д., Фелешко В., Скеваки С., Джартти Т., Макриноти Х., Никонова А., Шиловский И.П., Шварце Дж., Джонстон С.Л., Хаитов М.Р., Астма, EA-ii, Обострения астмы Task, F (2018) Потенциал противоинфекционных средств и иммуномодуляторов в качестве терапии астмы и обострений астмы. Аллергия 73: 50–63
Статья.
CAS
PubMed
PubMed Central
Google ученый
Esposito S, Soto-Martinez ME, Feleszko W, Jones MH, Shen KL, Schaad UB (2018) Неспецифические иммуномодуляторы для рецидивирующих инфекций дыхательных путей, хрипов и астмы у детей: систематический обзор механистических и клинических данных. Curr Opin Allergy Clin Immunol 18: 198–209
Статья
CAS
PubMed
PubMed Central
Google ученый
Esposito S, Bianchini S, Polinori I, Principi N (2019) Влияние OM-85 на детей с рецидивирующими инфекциями дыхательных путей в течение двух лет подряд: ретроспективное исследование.Int J Environ Res Public Health 16: E1065
Статья
CAS
Google ученый
Navarro S, Cossalter G, Chiavaroli C, Kanda A, Fleury S, Lazzari A, Cazareth J, Sparwasser T, Dombrowicz D, Glaichenhaus N, Julia V (2011) Пероральное введение бактериальных экстрактов предотвращает астму с помощью набор регуляторных Т-клеток в дыхательные пути. Mucosal Immunol 4: 53–65
Статья
CAS
Google ученый
Lu Y, Li Y, Xu L, Xia M, Cao L (2015) Бактериальный лизат увеличивает процент естественных Т-клеток-киллеров в периферической крови и облегчает астму у детей. Фармакология 95: 139–144
Статья
CAS
PubMed
PubMed Central
Google ученый
Razi CH, Harmanci K, Abaci A, Ozdemir O, Hizli S, Renda R, Keskin F (2010) Иммуностимулятор OM-85 BV предотвращает приступы хрипов у детей дошкольного возраста. J Allergy Clin Immunol 126: 763–769
Статья
CAS
PubMed
PubMed Central
Google ученый
Emeryk A, Bartkowiak-Emeryk M, Raus Z, Braido F, Ferlazzo G, Melioli G (2018) Механическое введение бактериального лизата предотвращает обострение у детей с аллергической астмой — исследование EOLIA. Pediatr Allergy Immunol 29: 394–401
Статья
PubMed
PubMed Central
Google ученый
Бейгельман А., Росас-Салазар С., Hartert TV (2018) Детская астма: все дело в бактериях, а не в вирусах? Споры за / против.J Allergy Clin Immunol Pract 6: 719–725
Статья
PubMed
PubMed Central
Google ученый
Что ДЕЙСТВИТЕЛЬНО лечит раздраженный кишечник у детей
Исцеление дырявого кишечника — одна из наиболее востребованных задач в моей педиатрической практике питания. Многие родители удивляются, когда я говорю, что — это , что можно исправить негерметичный кишечник у детей всех возрастов.
Но что действительно работает? О диетических подходах, пробиотиках и пищевых добавках много говорят, а исследования дырявого кишечника вызывают меньше, чем хотелось бы, особенно когда речь идет о младенцах, младенцах, детях или подростках.Однако после двадцати лет моей клинической педиатрической практики в области питания я могу сказать вам, какие пищевые добавки, которые я видел, постоянно работают, а какие стратегии часто терпят неудачу.
Во-первых, давайте поговорим о том, что такое дырявый кишечник, а что нет. Это не означает, что в кишечнике вашего ребенка есть настоящие язвы или дыры, которые «протекают». Но это может означать, что стенка кишечника потеряла некоторую целостность и стала слишком терпимой к размеру молекул, которые она позволяет проходить в ваш кровоток.
Другой способ, которым вы можете услышать описание дырявого кишечника, — это «кишечная проницаемость» или «гиперпроницаемость» — опять же, это состояние, при котором обычно очень избирательный, плотный процесс переваривания и всасывания пищи в кишечнике стал, ну, в общем, рыхлым и отрывочным!
Практикующие, включая меня, могут тщательно изучить зонулин, исследования микробов в кале (микробиологические культуры или методы ПЦР ДНК), воспалительные маркеры, такие как кальпротектин, или иммунные маркеры, такие как иммуноглобулин А, в образце стула, чтобы измерить кишечную среду.Некоторые врачи могут назначить тест на лактулозу и маннозу, во время которого пациенты пьют концентрированный раствор, сделанный из этих сахаров. То, как эти два сахара разного размера выводятся с мочой, может дать оценку проницаемости кишечника. Чтобы узнать больше о тестах на кишечную проницаемость, а также об их плюсах и минусах, нажмите здесь. Также можно измерить пищевую аллергию и пищевые реакции, не относящиеся к IgE, для чего требуется анализ крови.
Ключ к восстановлению дырявого кишечника….
Ключ к восстановлению здорового кишечника — это восстановление «плотных соединений» — это микроскопические структуры кишечника, нарушающие работу уличных полицейских.Они образуют плотное соединение между клетками в стенке кишечника. Когда эти соединения повреждаются, они разрушаются — и молекулы большего размера, чем идеальные, переходят из кишечника в кровоток, вызывая всевозможные реакции на наполнение, которое ваш кровоток и далекие ткани никогда не должны были видеть. Это может быть что угодно, от полипептидов (чрезмерно большие фрагменты молекул пищевого белка, которые могут маскироваться под ложные гормоны, ложные нейротрансмиттеры или вторгающиеся антигены) до токсинов, получающих доступ к вашему телу из кишечника, когда они не должны этого делать.Этот сценарий проницаемости является ловушкой-22, поскольку он может легко сохраниться, поскольку в кишечнике сохраняется все больше травм.
Кишечник — это самый крупный интерфейс нашей иммунной системы с внешним миром, поэтому дырявый кишечник также может нанести ущерб иммунной системе, от аутоиммунных проблем до частых инфекций и болезней.
Что повреждает кишечник? Многое из того, что усложняет задачу, симптомы дырявого кишечника часто бывают разрозненными и коварными. Они могут развиваться постепенно или с внезапным началом, которое так и не разрешится.Дырявый кишечник, конечно, может вызывать симптомы в желудочно-кишечном тракте, но также далеко от кишечника, такие как головные боли или боли в суставах, скованность, боль, усталость или частые простуды и инфекции.
, изображение предоставлено Джилл Карнахан, MD
Вот обычные подозрения на активацию дырявого кишечника
- использование антибиотиков
- Кишечные Candida или другие грибковые инфекции
- недиагностированная пищевая аллергия или пищевая чувствительность
- кишечный грипп или вирус
- пищевое отравление
- Чувствительность к глютену без целиакии
- Плохо переносимые плановые прививки
- хронический стресс
- черепно-мозговая травма или сотрясение мозга
- Рождение с кесаревым сечением (ребенок упускает возможность воздействия полезной микрофлоры влагалища)
- мама, принимающая антибиотики во время беременности или родов по любой причине
- Мастит (маме при грудном вскармливании нужны антибиотики)
- лучевая терапия
- недостаточный вес, особенно если вы младенец, ребенок или подросток
У большинства детей был хотя бы один из предметов из этого списка.Но последнее является ключевым. Сам по себе недостаточный вес может вызывать кишечную проницаемость, особенно у детей . Вы можете устранить все остальные триггеры, но если у вашего ребенка недостаточный вес, то есть более чем на пятнадцать процентильных пунктов от его или ее ожидаемой модели — кишечник вашего ребенка может оставаться «негерметичным». На борту просто не хватает сырья и энергии для того, чтобы ткань могла восстановить себя, а ваш ребенок тоже пытается расти.
Вот загвоздка: как правило, никто так внимательно не изучает характер роста вашего ребенка (я буду честен и скажу вам, что даже вижу, что гастроэнтерологические обследования упускают такой уровень деталей — и я регулярно читаю отчеты своих пациентов от их специалистов по желудочно-кишечным трактам по всей стране) .Без определения фактической ожидаемой модели роста вашего ребенка — то есть того, где ваш ребенок должен быть сегодня, учитывая родительский рост, историю беременности, историю рождений / родов и историю роста с момента рождения — тогда вы не узнаете, имеет ли ваш ребенок недостаточный вес или недоедание. Вы можете узнать больше об этом здесь.
Я встречаю много детей с недостаточным весом. Иногда это происходит из-за того, что семьи садят детей на слишком строгие диеты. Или некоторые семьи были настолько травмированы пугающей реакцией на еду, что просто не знали, как и чем кормить своих детей, поэтому они не знают.Иногда это вызвано добрыми намерениями практикующего, который не следил за ростом и потреблением пищи, потому что вместо этого они сосредоточились на лабораторных тестах и добавках, не давали никаких указаний о том, что на самом деле есть, и поощряли ограничительную диету без эффективных замен принимаемых продуктов из. Я также видел недостаточный вес, вызванный лекарствами от рефлюкса, которые могут снижать аппетит и пищеварение при использовании более нескольких недель или месяцев. Когда дело доходит до разборчивости в еде, это также снижает рост у детей, а также травмирует кишечник из-за недостаточного веса и неправильного питания.
Обратной стороной медали является оценка того, что ест ваш ребенок — сколько и что, и единственный способ определить, достаточно ли ваш ребенок ест, не вызывая реакции, питательной пищи — это составить дневник питания (часть каждого нового приема пациента I делать), а затем согласовать его с оценкой роста. Пища, которую ест ваш ребенок, — это древесина, которая будет использоваться для восстановления кишечника. — поэтому это должна быть правильная еда в нужном количестве. Добавки (включая глютамин, который является полезной аминокислотой, но не источником энергии), травы и пробиотики не обеспечивают этот строительный материал.Я встречаю много детей, которым дали много добавок, лабораторные анализы, противогрибковые препараты, специальные диеты и меры по устранению проницаемости кишечника. Но они все еще борются, потому что эта важная часть роста и питания теряется в беспорядке. Но составьте правильный план кормления с правильными дополнительными опорами и стрелой — теперь вы говорите!
Вот что работает для устранения дырявого кишечника у детей
- Сбалансируйте среду кишечных микробов с помощью трав или препаратов, отпускаемых по рецепту, чтобы напрямую решить проблему грибковой нагрузки, бремени клостридий (даже комменсальные штаммы могут быть проблематичными, если они намного превосходят другие полезные штаммы), стрептококковых или клебсиелл, паразитов, простейших и всего, что обнаруживается при тестировании.Совместите это с пробиотическими добавками, которые соответствуют исследованиям стула вашего ребенка. Мои предпочтительные инструменты для оценки — GI MAP и Doctors Data Stool Microbiology.
- Настройте специальную диету для вашего ребенка. Избегайте догматичных, универсальных подходов.
- Дайте достаточно белка! Детям может потребоваться от 1 до 2 граммов белка на килограмм веса тела в день в зависимости от степени нарушения роста.
- Дайте правильный белок; Сначала оцените, какие белки запускают с помощью лабораторных исследований.Замените триггерные белки равными или более ценными не триггерными источниками белка и поддерживайте их разнообразие.
- Используйте свободные аминокислоты. Добавление смесей аминокислот, которые содержат все 8 незаменимых аминокислот (а не только глютамин), было большим преимуществом в моей практике для детей, которым требуется глубокое восстановление кишечника. Доступны формулы и порошки. Это дает кишечнику прямой доступ к строительным блокам для роста и восстановления новых тканей. Я употребляю от 5 до 15 или даже 30 граммов этого источника белка в день, в зависимости от потребностей или статуса ребенка.Предостережение: Они не будут работать нормально без адекватной полноценной диеты, поддерживающей энергетические потребности.
- Давайте достаточно полноценной пищи, включая «чистые» (несладкие) углеводы, которые имеют решающее значение для роста детей (углеводы сохраняют структуру и функции белка и не позволяют ему сжигаться для получения энергии), а также большое количество полезных жиров и масел. Детям может потребоваться в 4-6 раз больше калорий на фунт, чем взрослым, в зависимости от возраста и статуса роста. Не кормите их, как маленьких взрослых, — давайте им высококалорийную и богатую питательными веществами пищу.
- Мастичная камедь, корень солодки, цинк-карнозин, глутатион, продукты, богатые минералами, или такие продукты, как Restore, — это лишь крошечная часть из тысяч продуктов, которые могут помочь в восстановлении тканей кишечника. Проконсультируйтесь с опытным врачом, который раньше использовал их у детей. Использование этих инструментов — обычная часть моей практики.
- Правильный режим сна, чтобы ребенок мог спать крепко и просыпаться отдохнувшим. Сон — это когда наши органы заняты восстановлением и очисткой. Подсказка: дети, которые недоедают, обычно плохо спят и чаще просыпаются.
- Сведите к минимуму стресс в мире вашего ребенка. Не обсуждайте «дырявый кишечник» с детьми младшего возраста и не считайте еду или их тело проблемой. Используйте позитивный язык и подчеркивайте силу исцеления, которая есть у всех нас.
- Дайте ему время (например, месяцы), расслабьтесь и помните, что тело вашего ребенка — это чудо со своим врожденным стремлением расти, восстанавливать и лечить.
А теперь отказ от дырявого кишечника…
- Использование жестких диетических стратегий для растущих детей может быть слишком ограничивающим, чтобы поддерживать рост, рост и восстановление кишечника.Бездрожжевая диета, GAPS, кетогенная диета, AIP, SCD, Paleo или Body Ecology — все они имеют свои достоинства (и преданные!), И я использую их компоненты в своей практике. Но сами по себе они не были созданы для использования у детей (кроме кетогенных диет для контроля припадков) и могут потерпеть неудачу, когда дети уже изо всех сил пытаются поправиться или вырасти. Если вы не видите хорошего роста, улучшения и прогресса в поведении или пищевых реакциях с помощью одной из этих стратегий в течение 2–4 недель или если первоначальные улучшения быстро исчезают, то, вероятно, это не подходит для вашего ребенка.Вместо этого настройте под своего ребенка!
- Необходимо, чтобы вашему ребенку понравилось что-либо из этого, включая прием пищевых добавок, анализ крови или прием другой пищи. Ты взрослый. Они не облегчат вам задачу — это само собой разумеющееся. Подсказка: разборчивый аппетит можно улучшить, выполнив эти три шага — не думайте, что ваш ребенок «не будет есть это».
- Пребывание на лекарствах от рефлюкса в течение нескольких месяцев. Они будут работать против ваших усилий по заживлению кишечника, поддерживая слишком низкий уровень pH в желудке, чтобы инициировать хорошее переваривание белка.Они также заставят вашего ребенка со временем чувствовать себя менее голодным, меньше есть и стать более разборчивым, в результате чего ваш ребенок останется недокормленным и недоеденным для выполнения задачи восстановления кишечника. Узнайте больше о недостатках лекарств от рефлюкса здесь.
- Используйте глутамин, витамины, минералы или большое количество добавок, прежде чем вы определите правильную стратегию кормления для вашего ребенка. Стратегия кормления означает знание того, какие продукты использовать, в каком количестве и какие источники белка, жиров и углеводов и как долго, чтобы поддерживать ожидаемый вес и рост вашего ребенка.
- Агрессивен в отношении ферментированных продуктов, пробиотиков или слишком большого количества Saccharomyces boulardii. Они могут иметь неприятные последствия, если их использовать слишком долго или в слишком высоких дозах, и могут даже начать создавать собственный дисбактериоз или дискомфорт.
- Оставление грибка, паразита, SIBO или SIFO или другого дисбактериоза без лечения или недостаточного лечения. Это может нарушить аппетит, пищеварение и дефекацию, а также предотвратить закупорку плотных контактов.
- Сдаю через 2-4 недели. Это восстановление и ремонт, которые могут занять месяцы, в зависимости от того, как долго кишечник вашего ребенка находился в сорняках.
Нужна помощь? Это очень много! Разрешите разобрать лучшие варианты для вашего ребенка . Свяжитесь со мной сегодня, чтобы назначить время для работы со мной удаленно или лично. Или ознакомьтесь с моими вариантами поддержки книг и онлайн-курсов.
Пробиотики значительно улучшают микробиом кишечника грудных детей
С Марком Андервудом, MD, и комментариями Кэролайн Аповиан, MD
Младенцы, находящиеся на грудном вскармливании, которые получали 3-недельный курс пробиотиков в течение первого месяца жизни, имели устойчивые улучшения в микробиоме кишечника, 1 согласно результатам, опубликованным в журнале, mSphere .
«Мы наблюдали за младенцами в северной Калифорнии на протяжении многих лет и сначала были очень удивлены, увидев большое количество ошибок, таких как E. coli , и небольшое количество ошибок, таких как бифидобактерии , в стуле младенцев, которые были родились вагинально, никогда не получали антибиотиков и находились на грудном вскармливании. Казалось бы, это идеальная популяция с низким уровнем риска, — сказал Марк Андервуд, доктор медицинских наук, заведующий отделением неонатологии и профессор педиатрии Калифорнийского университета в Дэвисе. — Вместо этого в кишечнике этих младенцев преобладали потенциальные патогены, и поэтому мы думаем , подвержены риску заболеваний, связанных с дисбактериозом, по мере взросления.” 2
Более пристальный взгляд на результаты исследования
Чтобы устранить этот долгосрочный риск повышенного риска хронических заболеваний, исследователи изучили, можно ли коренным образом изменить состав микробиоты у младенцев.
Младенцы в тестовой группе получили Bifidobacterium longum subsp. infantis ( B. infantis ) с 7 по 21 день. По сравнению с контрольной группой, у них было значительно больше популяции Bifidobacteriaceae и в четыре раза более низкие уровни фекального эндотоксина в стуле, при этом преимущества сохранялись через 30 дней после лечения. . 1
Грудное молоко собирали постнатально на 21 день, и образцы фекалий младенцев анализировали на исходном уровне (день 6) и снова после завершения приема добавок на 29 день. Оба образца были проанализированы на наличие основных питательных веществ, которые не усваиваются организмом. младенец. 1 Исследователи считают, что эти важные питательные вещества могут быть полезны в качестве биомаркеров в будущих исследованиях. 1
Опытная группа, получившая пробиотик B.Infantis в раннем возрасте, имел более низкий уровень pH в стуле, увеличение количества здоровых бактерий на 80% и уменьшение количества потенциальных патогенов на 80%. 1
«Мы выбрали этот организм не потому, что он хорошо растет, или потому, что его легко производить, или потому, что вы можете добавить его в пищевой продукт, но из-за его генетической способности расти и доминировать в кишечном тракте, а также из-за животных исследования, которые показывают, что это организм, который уменьшает воспаление кишечника и снижает проницаемость или неплотность кишечника.Поэтому для нас действительно интересно видеть эти убедительные результаты более чем десятилетнего исследования », — сказал д-р Андервуд.
«В предыдущих исследованиях они давали пробиотик, и они обнаружили небольшое количество этого пробиотика в кале», — сказал доктор Андервуд EndocrineWeb . «В этом случае мы стали свидетелями действительно глубокой реструктуризации этого сообщества, где в нем доминировал организм, который мы давали. И действительно поразительно то, что мы не видели в других исследованиях раньше, — это то, что это доминирование здорового или комменсального организма сохранялось в течение целого месяца после того, как мы прекратили давать пробиотический организм.”
Преимущества повышения микрофлоры у детей, находящихся на грудном вскармливании
«Антибиотики, кесарево сечение, кормление смесью, гигиена и другие вещи изменили микробиоту в нашем кишечнике, особенно у детей и младенцев, — сказал доктор Андервуд. — Я думаю, что доказательства того, что существует связь, стали довольно убедительными. между изменениями микробиоты кишечника в очень раннем возрасте и более поздним риском различных хронических заболеваний ».
Большая часть исследований на сегодняшний день подчеркивает важность микробиома кишечника и его здоровья.Но тучные и худощавые взрослые «похоже, имеют различия в микробиомах кишечника, которые коррелируют с болезнями и здоровьем», — сказала Кэролайн Аповиан, доктор медицины, FACP, FACN, профессор медицины и педиатрии Медицинской школы Бостонского университета и директор отдела питания и веса. Центр управления в Бостонском медицинском центре в Бостоне, штат Массачусетс.
«Это исследование показывает, что можно изменить микробиом младенца с помощью определенного пробиотика, связанного со здоровьем, и что это изменение сохраняется по крайней мере через месяц после периода кормления», -Аповиан сказал EndocrineWeb : «На данный момент актуальность для детей и взрослых является предварительной, и необходимо провести дополнительные исследования.

 Грудничкам, страдающим от дисбактериоза, оно нужно особенно.
Грудничкам, страдающим от дисбактериоза, оно нужно особенно.