Энтерит: почему возникает и чем грозит?
Статті
26/08/2015
Энтерит (от греч. enteron – кишка) – воспалительное или воспалительно-дистрофическое поражение слизистой оболочки тонкой кишки. В зависимости от преимущественной локализации воспалительного процесса различают еюнит – воспаление тощей кишки, а также илеит – воспаление подвздошной кишки. Воспалительный процесс часто охватывает слизистую оболочку не только тонкого кишечника, но и желудка (гастроэнтерит) и/или толстой кишки (гастроэнтероколит, энтероколит). Энтерит может протекать в острой форме и заканчиваться полным выздоровлением, а может приобретать хронический характер и приводить к тяжелым обменным нарушениям
Острый энтерит
Причины. Одной из наиболее распространенных причин развития острых энтеритов являются бактериальные инфекции. Острое воспаление кишечной слизистой развивается при таких тяжелых заболеваниях, как брюшной тиф, дизентерия, иерсиниоз, сальмонеллез, холера. Значительная доля острых энтеритов приходится на пищевые токсикоинфекции – острые инфекционные заболевания, вызываемые попаданием в желудочно-кишечный тракт пищи, содержащей определенные патогенные микроорганизмы (Staphylococcus aureus, Clostridium botulinum, Proteus vulgaris и др.). Клиническую картину пищевых токсикоинфекций в основном определяет действие микробных токсинов. В некоторых случаях возбудителями энтерита выступают вирусы или грибы.
Развитие острого энтерита могут спровоцировать алиментарные факторы: переедание с приемом большого количества острой, пряной, грубой пищи, а также употребление значительных доз алкоголя. Кроме того, воспаление слизистой кишечника может возникать в результате отравления токсинами грибов (бледной поганки, мухоморов, ложных опят и др.), растений (дурман, белена, красавка и др.), а также пестицидами и солями тяжелых металлов (свинца, мышьяка, меди, цинка, кадмия).
Читайте также: Лето. Жара. Холера!
Жара. Холера!
Среди причин возникновения симптомов острого энтерита также следует отметить аллергические реакции: индивидуальную непереносимость некоторых продуктов питания, а также аллергическую реакцию на медикаменты – препараты йода, брома, некоторые сульфаниламиды и др.
Классификация. Выделяют следующие формы острого энтерита:
– диффузный энтерит, при котором поражается вся тонкая кишка или процесс локализуется в определенном отделе;
– катаральный энтерит, характеризующийся гиперемией и отеком слизистой оболочки и подслизистой основы стенки тонкой кишки;
– фибринозный энтерит (чаще фибринозный энтероколит), при котором слизистая тонкой и толстой кишки пропитана фибринозным экссудатом, образующим серовато-желтую неотделяющуюся пленку;
– гнойный энтерит, сопровождающийся пропитыванием стенки тонкой кишки гноем (флегмона) или формирование мелких абсцессов;
– некротический энтерит, отличающийся некротическими изменениями слизистой оболочки кишечника, а также формированием эрозий и язв.
Патогенез. Повреждающее воздействие инфекционного агента и/или различных токсинов на слизистую оболочку тонкой кишки приводит к усилению интестинальной секреции и повышению проницаемости кишечной стенки.
Симптомы. Острый энтерит обычно начинается диареей, тошнотой, рвотой; пациента беспокоят выраженное урчание в животе, иногда – спастическая боль в верхней половине живота. Затем присоединяются симптомы общей интоксикации организма: головная боль, резкая слабость, лихорадка (температура может достигать 39°С), бледность, обложеность языка, вздутие живота. В других случаях общие симптомы появляются первыми, а признаки поражения кишечника присоединяются спустя 1-2 ч. В первые 2-3 суток – стул до 10-15 раз в сутки, кал обильный и водянистый, аппетит отсутствует. В кале определяются большое количество слизи, непереваренной клетчатки, мышечных волокон.
Читайте также: Что нужно знать о пищевых отравлениях?
В легких и среднетяжелых случаях острый энтерит заканчивается выздоровлением через несколько суток. В тяжелых случаях пациенту грозит обезвоживание организма и дефицит электролитов, что проявляется болью и судорогами в мышцах, понижением артериального давления, брадикардией, затем – кровоточивостью и тромбозами. Осложнением острого энтерита может стать острая сосудистая недостаточность. При токсических и аллергических энтеритах могут развиваться сопутствующие поражения сердца, печени, почек и других органов.
Диагностика и лечение. Диагноз «острый энтерит» устанавливают на основании клинической картины, оценки эпидемиологической ситуации, а также результатов лабораторных исследований. Детальный расспрос больного облегчает диагностику алиментарных, токсических, аллергических энтеритов. Для выявления инфекционного агента и определения его чувствительности к антибактериальным препаратам проводят бактериологическое исследование испражнений пациента.
Больных с тяжелым энтеритом обязательно госпитализируют. Следует отметить, что в связи с тем, что в первые часы заболевания трудно прогнозировать течение токсического энтерита, такие пациенты также направляются в стационар.
При легких формах острого энтерита в первые 12-24 ч от начала заболевания рекомендованы голод и обильное питье. При инфекционном энтерите могут быть назначены антидиарейные микробные препараты, содержащие бактерии с высокой антагонистической активностью по отношению к патогенным и условно-патогенным микроорганизмам.
Затем пациенту показана диета №4 (механически и химически щадящая пища; ограничение углеводов и жиров; исключение из рациона молока, клетчатки, пряностей, солений, копченостей) и рекомендован прием панкреатических ферментов. Через несколько суток диету расширяют и назначают пре- и пробиотические препараты для нормализации кишечной флоры. Для снятия болевого синдрома применяют спазмолитики (дротаверин, мебеверин).
Читайте также: Листерия: «микроб холодильника»
При тяжелых формах острого энтерита показан постельный режим. С целью удаления из желудочно-кишечного тракта токсинов требуется промывание желудка слабым раствором натрия гидрокарбоната, сифонная клизма, назначение энтеросорбентов. Если признаки обезвоживания выражены слабо, пациенту дают пить глюкозоэлектролитные растворы; при глубоком обезвоживании солевые растворы вводят внутривенно. При выраженной интоксикации парентерально вводят кортикостероиды, кровезамещающие жидкости, проводят переливание плазмы крови. При тромбогеморрагическом синдроме вводят антикоагулянты.
При остром инфекционном энтерите антибактериальную терапию, как правило, не проводят. Антибиотики или другие противомикробные средства (левомицетин, нифуроксазид, сульфаметоксазол/триметоприм и др.) могут быть назначены в случае вовлечения в патологический процесс слизистой толстого кишечника (энтероколит).
Профилактика острых энтеритов включает соблюдение правил личной гигиены, рациональное питание, исключение из пищи некачественных и несвежих продуктов, неизвестных грибов, рациональное использование лекарственных средств.
Хронический энтерит
Причины. Хронический энтерит может развиваться из острого, а может возникать самостоятельно. Среди причин возникновения хронических форм заболевания следует отметить систематические алиментарные нарушения: злоупотребление острой пищей, раздражающей стенки кишечника, несбалансированное питание, а также нарушение режима приема пищи. Воспаление слизистой кишечника обычно сопутствует алкоголизму, особенно при злоупотреблении крепкими алкогольными напитками. Причиной энтерита могут стать хронические отравления соединениями тяжелых металлов, радиационное поражение, пищевая аллергия, а также лекарственные интоксикации при злоупотреблении солевыми слабительными, НПВС, кортикостероидами, длительном бесконтрольном применении антибиотиков и др. Негативное влияние на слизистую оказывают протозойная и глистная инвазия (лямблиоз, аскаридоз, описторхоз и др. ). На фоне атеросклероза может развиваться ишемия стенки тонкой кишки, ведущая к нарушению регенеративных процессов в слизистой (ишемический энтерит). Хроническое воспаление тонкой кишки обычно сочетается с хроническим колитом.
Негативное влияние на слизистую оказывают протозойная и глистная инвазия (лямблиоз, аскаридоз, описторхоз и др. ). На фоне атеросклероза может развиваться ишемия стенки тонкой кишки, ведущая к нарушению регенеративных процессов в слизистой (ишемический энтерит). Хроническое воспаление тонкой кишки обычно сочетается с хроническим колитом.
Патогенез. Структурно-функциональным изменениям слизистой оболочки тонкой кишки при хроническом энтерите могут возникать в результате:
– непосредственного повреждающего (раздражающего, токсического) воздействия этиологического фактора на стенку тонкой кишки;
– под влиянием ферментов, токсинов и продуктов жизнедеятельности необычной кишечной флоры (органические кислоты, альдегиды, индол, скатол, метан, сероводород и др.), при длительно существующем дисбиозе кишечника;
– иммунологических реакций.
Развитию хронического воспаления в кишечнике способствуют нарушения всасывания в кишечной стенке, нарушение функции пищеварительных желез, двигательные расстройства кишечника, нарушение процесса регенерации в слизистой оболочке и др. При прогрессировании воспалительного процесса происходит атрофия слизистой, сглаживаются ворсинки эпителия, уменьшается продукция кишечных ферментов и нарушается всасывание питательных веществ.
Симптомы. Клиническая картина хронического энтерита складывается из двух симптомокомплексов: один из них обусловлен нарушением процесса пристеночного и полостного пищеварения (местный энтеральный синдром), другой – нарушением всасывания пищевых компонентов, ведущим к расстройству обмена веществ и изменению общего состояния организма (общий энтеральный синдром).
Местный энтеральный синдром характеризуется кишечными проявлениями: метеоризмом, громким урчанием в животе, диареей или запорами, иногда – их чередованием. Многие пациенты жалуются на тупую боль в околопупочной области. У пациента отмечается выделение значительно увеличенного количества кала; кал имеет глинистый вид.
Общий энтеральный синдром выражается в снижении массы тела, появлении отеков, развитии симптомов анемии, дефицита витаминов, нарушения электролитного обмена. Пациент страдает от расстройства желчевыделения, нарушения внешнесекреторной функций поджелудочной железы, а также от угнетения половой функции.
Классификация. При хроническом энтерите I степени тяжести у больного преобладают кишечные проявления. При хроническом энтерите II степени тяжести кишечные симптомы сочетаются с незначительными нарушениями обменных процессов. При энтерите III степени отмечают выраженные расстройства обмена веществ с развитием дистрофических (часто необратимых) изменений внутренних органов.
Диагностика и лечение. Диагноз «хронический энтерит» устанавливают с учетом клинической картины, данных осмотра, а также лабораторных и инструментальных исследований: биохимического анализа крови, определения всасывательной функции тонкой кишки (нагрузочные тесты), копрологического и бактериологического анализа, исследования желудочного сока, рентгенографии кишечника, гистологического исследования слизистой оболочки тонкой кишки и др.
При обострении хронического энтерита пациента следует госпитализировать. Ему назначают постельный режим и лечебное питание. В первые 2-3 суток пациенту показана химически и механически щадящая пища с низким содержанием жиров и углеводов, и противопоказаны растительная клетчатка и молоко (диета № 4а). Затем содержание жиров и углеводов в рационе может быть постепенно увеличено (диета № 4б, 4в).
Медикаментозная терапия обострения хронического энтерита включает:
– препараты панкреатических ферментов, не содержащие желчных кислот,
– антидиарейные препараты (лоперамид),
– обволакивающие и адсорбирующие средства (смектит, препараты висмута, отвары или настои лекарственных растений: цветов ромашки аптечной, листа подорожника, травы спорыша, плодов черники и др.),
– при болевом синдроме – спазмолитические средства (дротаверин, мебеверин),
– при кишечном дисбиозе – пре- и пробиотики, препараты, содержащие бактерии с высокой антагонистической активностью по отношению к патогенным и условно-патогенным микроорганизмам, в некоторых случаях – антибактериальные препараты (нифуроксазид, сульфаметоксазол/триметоприм и др. ),
),
– при явлениях авитаминоза – витамины, в первую очередь В1, В2, В6, В12, фолиевую кислоту, витамин А.
Для коррекции обменных нарушений при энтерите III степени назначают анаболические стероиды; для восстановления баланса электролитов вводят хлорид калия и натрия, глюконат кальция, сульфат магния; в тяжелых случаях показаны внутривенные вливания аминокислотных смесей и белковых препаратов.
В период ремиссии пациентам рекомендуют водолечение, физиотерапевтические процедуры и санаторное лечение. При адекватном лечении хронического энтерита прогноз благоприятный. При частых обострениях заболевания, приводящих к выраженным обменным нарушениям, возможна потеря трудоспособности.
Предотвратить развитие хронического энтерита помогут своевременное лечение острых кишечных заболеваний, рациональное питание и соблюдение режима приема пищи.
Читайте также: Сальмонеллез — актуальная проблема летней порой
“Фармацевт Практик”
Поділіться цим з друзями!
Вам також буде цікаво це:
симптомы, методы лечения, рекомендации. Консультация специалистов.
- Причины развития заболевания
- Лечение хронического энтерита
Энтерит — это острое или хроническое воспаление в области тонкого кишечника, при котором нарушаются основные функции кишки (расщепление и всасывание питательных веществ.
Острые энтериты протекают бурно, с выраженными симптомами, а хронические являются обычно исходом острого процесса, неправильно вылеченного или вообще оставленного без внимания. Энтериты возникают в любом возрасте:у детей встречается чаще острая форма, у взрослых — хроническая.
Хронические энтериты сопровождаются заболеваниями поджелудочной железы или желчевыделительной системы, аутоиммунными патологиями, наследственными заболеваниями.
Симптоматика патологии определяются:
- поносами после приема пищи,
- слабыми болями около пупка,
- чувством урчания и вздутия живота,
- дискомфортом при дефекации,
- постепенным развитием анемии, остеопороза из-за нарушения всасывания минералов,
- белым налетом на языке,
- снижением массы тела, дистрофией.

Причины развития заболевания
К основным причинам развития хронического энтерита можно отнести:
- поражение кишечника глистами,
- лямблиоз кишечника,
- переедание, прием острой, жирной, грубой пищи,
- вредные привычки (никотин, алкоголь),
- интоксикации на производстве (тяжелые металлы, химические соединения, лучевое воздействие),
- поражение кишечника вследствие приема некоторых медикаментов,
- аутоиммунные заболевания,
- наследственная предрасположенность,
- оперативные вмешательства на кишечнике.
Развитию хронического энтерита способствуют также курение и злоупотребление алкоголем, малоподвижный образ жизни, проблемы с почками и кровообращением, травмы живота и операции, спайки.
Лечение хронического энтерита
Для лечения хронических энтеритов существует определенная схема:
- соблюдение специфической диеты (исключение острого, жирного, раздражающего, мелкие порции, растительно-молочный стол с обогащением белком и минералами, исключение грубой клетчатки),
- назначение ферментных препаратов,
- назначение корректоров моторики при вздутии, тошноте, гипермоторике кишки,
- вяжущие растительные средства при упорных диареях,
- применение пробиотиков и биопрепаратов,
- поливитамины, дополнительное назначение минеральных добавок.
Коморбидность синдрома раздраженного кишечника и хронического энтерита. Клиническое наблюдение | Махов В.М., Соколова А.А.
Для цитирования: Махов В.М., Соколова А.А. Коморбидность синдрома раздраженного кишечника и хронического энтерита. Клиническое наблюдение. РМЖ. 2009;2:84.
В гастроэнтерологическое отделение факультетской терапевтической клиники (ФТК) Московской медицинской академии имени И. М Сеченова в сентябре 2009 г. поступил мужчина 46 лет.
М Сеченова в сентябре 2009 г. поступил мужчина 46 лет.
Пациент предъявлял жалобы на ноющие боли в околопупочной области, не зависящие от приема пищи и стихающие после стула и отхождения газов, на вздутие и урчание в животе, жидкий и кашицеобразный стул 3–4 раза, чаще в утренние часы. Эпизоды диареи длятся 3–4 дня и сменяются запорами (стул через 3 дня в виде твердых «лесных орехов»). В последние 10–15 лет отмечал появление диареи при негативных эмоциональных переживаниях, после употребления кофе и большого количества клетчатки. В январе 2009 г. после длительного психоэмоционального перенапряжения появились боли и вздутие в околопупочной области, стул участился до 3–4 раз в сутки. В поликлинике после проведения УЗИ органов брюшной полости, ЭГДС, были диагностированы хронический гастродуоденит, желчно–каменная болезнь. Лечение – рабепразол, мебеверин, креон, эубиотик. Боли и вздутие прекратились.
В мае после серии эмоциональных стрессов вновь появились боли, диарея и метеоризм. Консультирован и госпитализирован в ФТК. Проведены обследование, включавшее УЗИ органов брюшной полости, ЭГДС, колоноскопия, при информированном добровольном согласии – консультация психиатра. Состояние больного было расценено, как синдром раздраженного кишечника (СРК), вариант с болями, диареей, метеоризмом. Терапия включала папаверин 0,08, анестезин 0,1, висмута субнитрат 0,3 в сутки, панкреатин+диметикон по 1–2 таблетки во время еды, сульпирид по 100 мг утром и в 18 часов, клонозепам по 1 мг вечером. Боль в животе перестала беспокоить, нормализовался стул.
В августе на фоне самостоятельной отмены сульпирида, клонозепама вновь ухудшение – беспокоит метеоризм, боли в животе, неустойчивый стул.
Складывалось впечатление, что у пациента – СРК среднетяжелого течения с трансформацией одной клинической формы в другую.
Согласно Римским критериям III синдром раздраженного кишечника – совокупность функциональных кишечных нарушений с регулярностью симптомов <3 дней в месяц в течение 12 недель на протяжении последних 6 месяцев, проявляющихся болью и/или дискомфортом в животе, которые проходят после дефекации, сопровождаются изменениями частоты, консистенции стула и сочетаются не менее 25% времени заболевания не менее чем с двумя стойкими симптомами нарушения функции кишечника – метеоризмом, изменением частоты, консистенции стула, акта дефекации (императивные позывы, тенезмы, дополнительные усилия при дефекации, чувство неполного опорожнения кишечника), выделение слизи с калом.
В период предыдущей госпитализации было убедительно доказано отсутствие у пациента симптомов «тревоги», позволяющих заподозрить тяжелое органическое поражение, таких как:
• немотивированная потеря массы тела,
• ночная боль и диарея,
• нарастающие, не поддающиеся неанальгетической терапии, боли,
• начало в пожилом возрасте,
• лихорадка,
• гепатоспленомегалия,
• кровь в кале,
• лейкоцитоз,
• анемия,
• ускорение СОЭ,
• патологические изменения результатов биохимического исследования крови.
Важным моментом установления диагноза СРК является результат первого курса лечения. Рецидивирующее среднетяжелое течение заболевания требовало проведения углубленного диагностического поиска.
Были исключены при тщательном расспросе пищевые факторы, лекарственные препараты как причина клинических симптомов. Не влияло на течение болезни исключение жирной пищи, алкогольных и газообразующих продуктов (квас, пиво, шампанское), кофе, продукты, содержащие молочный сахар. Больной не принимал слабительные, антибиотики, желчегонные и другие препараты, воздействующие на моторику, флору и осмотический статус кишечника. «Диета исключения» позволила отвергнуть лактазную, дисахаридозную и аллергическую природу диареи. Последнее было подтверждено отрицательным результатом исследования кала с микроскопией для определения эозинофилов и кристаллов Шарко–Лейдена. Онкологические заболевания толстой кишки, неспецифический язвенный колит, болезнь Крона, полипоз, дивертикулит не были выявлены в мае при колоноскопии.
В процессе предстоящей госпитализации было необходимо расширить круг диагностического поиска и оптимизировать терапию.
При осмотре в отделении: состояние пациента удовлетворительное. Повышенного питания – индекс массы тела 43. Кожные покровы и видимые слизистые обычной окраски, повышенной влажности. Периферические лимфатические узлы не увеличены, пальпации не доступны. В легких дыхание везикулярное, проводится во все отделы, хрипов нет. ЧДД 16 в минуту. Тоны сердца ясные, ритмичные во всех точках аускультации, шумов нет. АД –125/80 мм рт.ст., ЧСС – 70 в минуту. Живот мягкий, симметричен, не вздут. Сигмовидная кишка чувствительна при пальпации, не урчит, спазмирована; околопупочная область при пальпации безболезненна. Перкуторно печень и селезенка не увеличены, не пальпируются.
В легких дыхание везикулярное, проводится во все отделы, хрипов нет. ЧДД 16 в минуту. Тоны сердца ясные, ритмичные во всех точках аускультации, шумов нет. АД –125/80 мм рт.ст., ЧСС – 70 в минуту. Живот мягкий, симметричен, не вздут. Сигмовидная кишка чувствительна при пальпации, не урчит, спазмирована; околопупочная область при пальпации безболезненна. Перкуторно печень и селезенка не увеличены, не пальпируются.
При проведении лабораторного обследования общий анализ крови: Нb 144,7 г/л, эритроциты 4,639х1012/л, ЦП 0,93, Hct 43,42%, лейкоциты 7,25х109/л, нейтрофилы 56,7%, лимфоциты 36,4%. Моноциты 5,8%, эозинофилы 0,8%, базофилы 0,3%, СОЭ 24 мм/ч, тромбоциты 240,6 тыс/мл. Уровень глюкозы, общий белок, альбумины в сыворотке в пределах нормы, что свидетельствует о нормальном всасывании нутриентов. Электролитный обмен не нарушен: Na – 145 мэкв/л; К – 4,8 мэкв/л ; Са – 2,09 ммоль/л. Липидный спектр: триглицериды – 1,9 ммоль/л, общий холестерин – 5,71 ммоль/л, ЛПОНП – 0,4 ммоль/л. Отмечено увеличение IgA 340 мг/дл (при норме 50–300), мочевой кислоты 482,0 мкмоль/л (норма 148,75–416,5) при нормальной концентрации креатинина 1,20 мг/дл (норма 0,5–1,2)
УЗИ брюшной полости: печень увеличена за счет обеих долей, контуры ровные (правая доля 178 мм, левая доля 87 мм). Паренхима однородной структуры, изменена по типу жировой дистрофии. В левой доле кистозное образование 17 мм. Желчный пузырь неправильной формы, перегиб в шейке, стенки не изменены, в просвете конкремент 10 мм. Поджелудочная железа гиперэхогенна, нормальных размеров и структуры. Селезенка не увеличена и не изменена. Почки не увеличены, контуры ровные. Паренхима 21 мм. Синусы не расширены. Конкрементов нет. Свободной жидкости в брюшной полости не отмечается.
При проведении анализа кала с микроскопией признаков стеатореи, креатореи, амилореи выявлено не было. Исследование кала на содержание эластазы–1 продемонстрировало ее нормальное содержание, что свидетельствовало о нормальной внешнесекреторной функции поджелудочной железы. Анализ кала на патогенную флору и дисбактериоз не выявил значительных изменений. Исследование кала на наличие паразитов было проведено в Институте паразитологии. Результат отрицательный. Определение антител к возбудителям показало незначительное повышение антител к сальмонеллам.
Анализ кала на патогенную флору и дисбактериоз не выявил значительных изменений. Исследование кала на наличие паразитов было проведено в Институте паразитологии. Результат отрицательный. Определение антител к возбудителям показало незначительное повышение антител к сальмонеллам.
Пациент был повторно проконсультирован психиатром. Повторная консультация потребовалась из–за несоответствия интенсивности жалоб, болезненных ощущений результатам проведенных на данный момент объективных лабораторно–инструментальных исследований и малой эффективностью терапии.
Психиатр выявил депрессивные расстройства, спровоцированные психогенными событиями.
Сочетание болей в околопупочной области, метеоризма, повышение антител к сальмонеллам требовало инструментального исследования тонкой кишки. Было принято решение провести видеокапсульную эндоскопию.
До настоящего времени тонкая кишка была малодоступным для визуализации органом, в особенности тощей и подвздошный ее отделы. В значительной степени это обусловлено большой протяженностью тонкой кишки, наличием ее многочисленных изгибов и отсутствием технологии эндоскопического исследования тощей и подвздошной кишки. С появлением видеокапсульной системы визуализация слизистой оболочки тонкой кишки стала возможной. Это принципиально новая система визуализации слизистой оболочки ЖКТ. Она состоит из капсулы с вмонтированной в нее миниатюрной видеокамерой и дистанционного передатчика. Капсула проглатывается после 12–часового ночного голодания с предварительным приемом 3 пакетов фортранса в 3 литрах воды. Процедура была проведена в межклиническом эндоскопическом отделении заведующим отделением к.м.н. В.Я. Заводновым, заведующим отделением гастроэнтерологии к.м.н Л.Н. Угрюмовой и врачом–эндоскопистом О.В. Тумановой.
Протокол видеозаписи: при осмотре видеозаписи желудка слизистая оболочка желудка обычной окраски, складчатый рельеф обычный, перистальтические волны четко прослеживаются.
Время прохождения видеокапсулы по тонкой кишке – 5 часов 28 мин.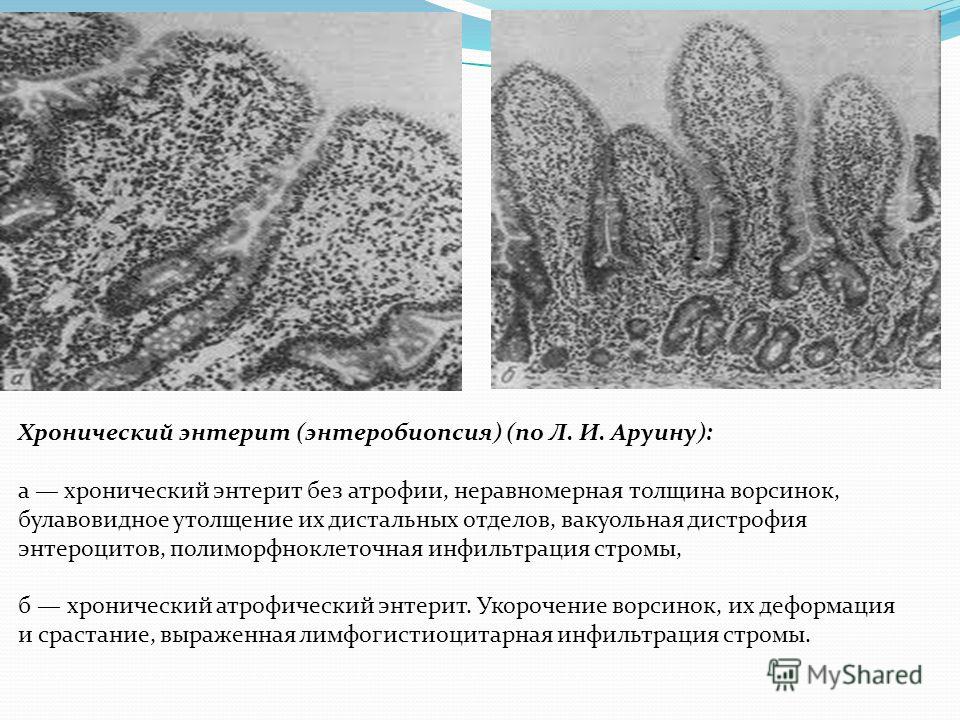 При осмотре видеозаписи – просвет тонкой кишки свободно проходим, перистальтические волны четко прослеживаются. Складчатый рельеф обычный. Ворсинки высокие, подвижные. В средних отделах тонкой кишки определяются очаги гиперемии с уплощением ворсинчатого рисунка. В дистальных отделах на слизистой определяются участки с утолщенными ворсинками белесоватого цвета (лимфэктазии).
При осмотре видеозаписи – просвет тонкой кишки свободно проходим, перистальтические волны четко прослеживаются. Складчатый рельеф обычный. Ворсинки высокие, подвижные. В средних отделах тонкой кишки определяются очаги гиперемии с уплощением ворсинчатого рисунка. В дистальных отделах на слизистой определяются участки с утолщенными ворсинками белесоватого цвета (лимфэктазии).
Таким образом, у пациента были отмечены локальные эндоскопические изменения слизистой стенки тонкой кишки, эти участки гиперемии, уплощения и утолщения ворсинок могут являть собой воспаление, т.е энтерит. Для уточнения морфологии изменения слизистой тонкой кишки было решено провести глубокую ЭГДС с биопсией слизистой тонкой кишки.
Результат ЭГДС: в пищеводе просвет проходим, слизистая белесоватая со следами от эрозий. Розетка кардии смыкается. В желудке жидкость и слизь. Слизистая желудка сочная, эластичная, неравномерно окрашена, перистальтика активная, складчатый рельеф обычный. Привратник и луковица свободно проходимы, слизистая луковицы с единичным полиповидным утолщением ворсинок белесоватого цветах. Дистальнее слизистая с обычным ворсинчатым рисунком. Биопсия.
Результат морфологического исследования: выраженный хронический дуоденит с признаками активности воспалительного процесса.
Выявленные при видеокапсульной эндоскопии изменения позволяют считать, что синдром раздраженного кишечника у данного пациента относится к постинфекционной форме СРК. Постинфекционный СРК встречается у 6–17% пациентов СРК.
В лечении данного пациента следует учесть наличие ЖКБ, видимо, высокую кислотопродукцию, тяжелые депрессивные расстройства и локальный катаральный энтерит.
Психосоматический компонент СРК, выразившийся в нарушении моторики и психической девиации – депрессии требовал усиления психотропной терапии. К получаемым сульпириду и клонозепаму был добавлен тианептин.
Выявление при УЗИ изменения желчного пузыря и поджелудочной железы позволяли предположить паренхиматозный панкреатит, результаты ЭГДС (полиповидные утолщения ворсинок – лимфэктазии) были косвенным тому подтверждением. Это потребовало увеличения заместительной терапии и усиления кислотоснижающей терапии. Был назначен панкреатин 25 тыс. ед во время еды.
Это потребовало увеличения заместительной терапии и усиления кислотоснижающей терапии. Был назначен панкреатин 25 тыс. ед во время еды.
Локальные катаральные изменения тонкой кишки не привели к нарушению всасывания, что подтверждалось стабильностью массы тела, нормальным метаболическим статусом и результатами микроскопии. Специальной терапии эти изменения не требовали.
Наблюдение за пациентом в течение 2 месяцев показало эффективность комплексной терапии.
В коморбидности СРК и локального катарального энтерита ведущим является СРК.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Лечение гастрита в Казани, энтерит и колит — «Золотое свечение»
Гастрит — острое или хроническое воспаление слизистой оболочки желудка, которое приводит к нарушению функций не только желудка, но и всего желудочно-кишечного тракта (ЖКТ).
Частая причина хронического гастрита – бактерия Helicobacter pylori, которая поражает слизистую желудка, вызывая гастрит или язвенную болезнь. Среди причин возникновения хронического гастрита также можно назвать: неправильное питание, курение и алкоголь, приём некоторых видов лекарственных препаратов.
Симптомы гастрита:
ноющая или острая жгучая боль в верхней части живота
тяжесть в верхней части живота после еды
тошнота, рвота, отрыжка
снижение аппетита и потеря веса
Энтерит и колит, энтероколит
Энтерит – воспаление тонкого кишечника, колит – воспаление толстой кишки. Энтерит и колит редко протекают отдельно. Одновременное воспаление тонкой и толстой кишки называют энтероколитом.
Симптомы заболеваний:
Боли, урчание в животе
Вздутие живота, метеоризм
Тошнота и рвота,
Диарея, чередование запоров и диареи
Похудение, слабость характерны для хронической формы заболеваний
Диагностика и лечение заболеваний
Диагностика проводится на основании анамнеза и результатах эндоскопического обследования. Лечение врач назначает комплексное.
Немаловажное значение имеет диета и нормализация режима питания. Если заболевание вызвано инфекцией, паразитами, в первую очередь устраняются эти причины.
Медицинский центр «Золотое свечение» специализируется на лечении заболеваний желудочно-кишечного тракта. Опытные врачи-гастроэнтерологи установят точный диагноз и проведут курс лечения для вашего скорого выздоровления!
Вернуться к перечню услуг
Для записи на прием к врачу позвоните по телефону +7 (843) 202-10-20 или оформите заявку онлайн через форму ниже. Администратор свяжется с вами с 8.00 до 20.00 и предложит удобное для Вас время.
ABC-медицина
Колит является воспалением слизистой оболочки толстой кишки. Хроническая разновидность колита представляет собой не только воспалительные, но также строфические и дистрофические изменения толстой кишки, сопровождающиеся секреторными и моторными нарушениями. Данное заболевание является одним из наиболее распространенных в мире. Оно часто сочетается с воспалительными поражениями желудка и тонкой кишки (энтероколит).
Причины
Инфекционные. Как правило, они вызываются возбудителями различных кишечных инфекций, чаще всего сальмонеллами и шигеллами. Также провоцируют развитие колита инфекционные заболевания (микобактерии туберкулеза и др.), условно-патогенная и сапрофитная флора кишечника человека, вызванная дисбактериозом.
Алиментарные. Они возникают из-за грубых и длительных нарушений режима питания и диеты. Нередко на фоне ахилических гастритов, панкреатитов и хронических энтеритов развиваются сопутствующие гастриты, их причиной является систематическое раздражение слизистой оболочки толстой кишки из-за неполного переваривания пищи.
Токсические. Они возникают по причине длительных интоксикаций соединениями свинца, ртути, мышьяка, фосфора и др. Токсические колиты эндогенного характера могут возникнуть из-за раздражения стенки кишки теми продуктами, которые она выводит, например при уремии, подагре.
Лекарственные. Их причиной, как правило, является длительный бесконтрольный прием слабительных средств, имеющих в своем составе антрогликоэиды (препараты крушины, корня ревеня, листа сенны, плода жостера и др.). Также негативно влияют антибиотики и некоторые другие лекарства.
Аллергические. Наблюдаются при пищевой аллергии, а также непереносимости ряда химических и лекарственных веществ, высокой индивидуальной чувствительности человека к некоторым разновидностям бактериальной флоры кишечника и продуктам распада микроорганизмов.
Симптомы
Существует ряд основных симптомов, сопровождающих хронический колит кишечника:
- урчание в животе;
- тенезмы – ложные позывы к дефекации, заканчивающиеся выделением лишь слизи;
- ноющая боль в животе, которая возникает после обильной еды;
- запоры, периодически сменяющиеся диареей;
- метеоризм при запорах, сопровождающийся ощущением тяжести, вздутием живота, психоэмоциональным и физическим дискомфортом у пациента;
- диспепсия (тошнота, отрыжка, горечь во рту).
Среди общих симптомов можно выделить нарушение сна, повышенную раздражительность, слабость и потерю веса.
Диагностика
Копрологическое исследование
В кале присутствует большое количество слизи, микроскопическое исследование позволяет выявить эритроциты и лейкоциты. Бактериологическое исследование кала дает возможность обнаружить нарушения в толстой кишке – условно-патогенную микрофлору, изменения нормальной микрофлоры (дисбактериоз).
Бактериологическое исследование кала дает возможность обнаружить нарушения в толстой кишке – условно-патогенную микрофлору, изменения нормальной микрофлоры (дисбактериоз).
Рентгенологическое исследование
Рентгенологическое исследование (ирригография) необходимо, чтобы локализовать процесс, зафиксировать изменения рельефа слизистой оболочки, дискинезию, отличить колит от других заболеваний.
Ректороманоскопия и колоноскопия
В ходе данных исследований выявляются катаральные (гиперемированная стенка кишки, отечность, слизистый налет) и атрофические (бледность, истонченность) изменения слизистой оболочки толстой кишки.
Лечение
Диета. Больным хроническим колитом строго показано соблюдение диеты. Во время обострения назначается № 4а, она включает в себя блюда из мяса и рыбы, приготовленные на пару, паровые омлеты, черствый белый хлеб, обезжиренные слабые рыбные и мясные бульоны, каши на воде, кисели, яйца всмятку, желе и отвары из черемухи, черники, айвы, груши, шиповника, чай.
Медикаментозное лечение. Если преобладает диарейный синдром, назначаются вяжущие, адсорбирующие препараты. В случаях, когда хроническому колиту сопутствует дисбактериоз, лечение проводится с помощью антибактериальных препаратов. Устранение усиленного газообразования осуществляется активированным углем.
Чтобы записаться в клинику «ABC-Медицина» для лечения хронического колита, позвоните по телефону +7 (495) 223-38-83.
Энтерит с синдромом мальабсорбиции — санатории где лечат, цены и отзывы
Энтерит – воспалительное проявление в тонком кишечнике, в результате чего происходит нарушение основных его функций и дистрофические отклонения в слизистой оболочке.
Причины возникновения заболевания
Причинами возникновения энтерита в острой фазе могут выступать:
- Острые инфекции кишечника (бактериальные или вирусные).

- Отравление веществами токсичного происхождения (к примеру, мышьяк).
- Отравление ядовитыми продуктами (грибами и несъедобными ягодами).
- Переедание пищи острой, жирной, очень пряной.
- Злоупотребление алкоголем.
- Аллергия на некоторые продукты питания и медикаменты.
Хронический энтерит может образоваться на фоне:
- Появления в кишечнике простейших паразитов, гельминтов и тому подобное.
- Вредные пищевые привычки.
- Систематическое отравление некоторыми тяжелыми металлами и едкими препаратами.
- Прием лекарств длительное время.
Возникновению энтерита способствует курение, почечная недостаточность, атеросклероз, расположенность к аллергиям, энзимопатия и тому подобное.
Симптомы заболевания
Энтерит острый протекает бурно, но при этом быстро заканчивается, для этого недуга характерны такие симптомы:
- Жидкий стул от 1 до 20 раз за сутки.
- Тошнота.
- Рвота.
- Боли в районе живота.
- Метеоризм и урчание.
- Повышение температуры тела 37-39 градусов и выше.
- Недомогание в целом наряду с головными болями.
- Обложенный язык.
- Обезвоживание.
- Нарушение свертывания, кома и шок (в тяжелых случаях).
Хронический энтерит не так остро протекает, но может продолжаться до нескольких месяцев:
- Поносы после еды.
- Незначительные боли в районе пупка.
- Метеоризм и урчание.
- Частый стул, желтого цвета, водянистый с частичками пищи.
- Дефекация дискомфортная, понижение давления.
- Нарушение всасывания минералов, как следствие анемия и остеопороз.
- Обложенный язык с отпечатками зубов.
- Признаки гиповитаминоза.
- Постепенное сокращение массы тела.
Виды/формы заболевания
Энтерит по причине возникновения бывает:
- Инфекционный.
- Токсический.
- Паразитарный.

- Медикаментозный.
- Алиментарный.
- Радиационный.
- Послеоперационный.
В общем, существует несколько разновидностей энтерита:
- Диффузный – поражена тонкая кишка.
- Катаральный – отек слизистой, гипертония.
- Гнойный – гной на стенках тонкой кишки.
- Некротический – красные участки некроза в тонкой кишке, отек, приводящий к сужению просвета.
По месту локализации энтерит бывает в тощей и подвздошной кишке, также разливают тотальный энтерит, когда воспаление затрагивает все отделы.
Стадии заболевания
Острый энтерит может характеризоваться более легкой, средней и тяжелой формами. Хронический энтерит различают в острой фазе или в стадии ремиссии.
Методы лечения заболевания
Острый энтерит лечится в стационаре, больным показан постельный режим, специальное питание, обильное питье и соответствующее лечение. Заболевание в острой фазе, как правило, излечивают за неделю. Хронический энтерит также лечат в стационаре с прописанным постельным режимом и специальным питанием.
Профилактика лечения в санаториях
Санитарно-курортное лечение оказывает благоприятное влияние на лечение больных с заболеванием энтерит. Профилактика энтерита в основном заключается в выполнении правил личной гигиены. А правильное питание – залог здоровья любого человека.
Коронавирусный энтерит собак
Коронавирусный энтерит (Coronavirus enteritis) – высокозаразное инфекционное заболевание собак, характеризующееся воспалением желудочно-кишечного тракта, обезвоживанием и общим истощением организма. Заболевание вызывается РНК-вирусом семейства Coronaviridae.
Как можно заразиться коронавирусом?
Заражение происходит, как и при парвовирусном энтерите, через инфицированные корма и воду, а также при обнюхивании и облизывании непосредственно больных животных или инфицированных ими объектов внешней среды. Период от заражения до проявления признаков заболевания составляет обычно 1-5 дней. Коронавирус, вызывающий энтерит, после внедрения в организм поражает в первую очередь эпителий слизистой оболочки тонкого кишечника и ободочной кишки (при фекально-оральном заражении) или слизистую носоглотки собак (при орально-назальном заражении). Вирус выделяется с калом больного животного в течение 3-16 недель после заражения, иногда дольше.
Коронавирус, вызывающий энтерит, после внедрения в организм поражает в первую очередь эпителий слизистой оболочки тонкого кишечника и ободочной кишки (при фекально-оральном заражении) или слизистую носоглотки собак (при орально-назальном заражении). Вирус выделяется с калом больного животного в течение 3-16 недель после заражения, иногда дольше.
Каковы симптомы заболевания?
Болезнь может проявляться в трех формах: сверхострой, острой и скрытой.
Сверхострую форму отмечают в основном при смешанных кишечных вирусных инфекциях (корона-, парво-, ротавирусных и др.) у щенков в возрасте 2-8 недель. Животные погибают в течение 24-48 часов.
Острую форму наблюдают также у щенков в раннем возрасте. Болезнь сопровождается рвотой, длительным поносом, анорексией, резким обезвоживанием организма и сердечно-сосудистой недостаточностью. Каловые массы сначала кашицеобразные слизистые, затем водянистые с примесью крови и резким зловонным запахом.
Скрытая (латентная) форма болезни характеризуется длительным бессимптомным течением, при этом могут наблюдаться отдельные маловыраженные клинические признаки вирусных кишечных инфекций: угнетенное состояние, потеря аппетита, хронический понос, снижение ритма сердечной деятельности, истощение. Скрытая форма может проявляться у собак-вирусоносителей, а также у животных с ослабленной иммунной системой.
Как диагностировать данное заболевание?
Предварительный диагноз ставят на основании клинического осмотра (внезапность появления болезни, наличие рвоты, геморрагичекий энтерит, обезвоживание организма), а окончательный – по результатам лабораторных тестов. У животного отбирают свежие каловые массы или берут мазок из прямой кишки для обнаружения возбудителя.
Как лечить коронавирусный энтерит?
Для лечения заболевания используют внутривенные вливания специальных растворов, применяют антибиотики, иммуностимуляторы и витаминные препараты. Внутрь назначают обволакивающие препараты. Иммунитет при коронавирусном энтерите собак непродолжительный, поэтому возможно повторное заражение. В связи с этим, даже после переболевания, необходима ежегодная вакцинация животных.
В связи с этим, даже после переболевания, необходима ежегодная вакцинация животных.
Как защитить животное от коронавирусного энтерита?
Для профилактики заболевания используют ассоциированные вакцины (Дюрамун, Мультикан), а также гипериммунные сыворотки и глобулины (Глобкан, Гискан). Первичную вакцинацию животных проводят в возрасте 8-9 недель с последующей ревакцинацией через 3-4 недели. Продолжительность иммунитета составляет 12 месяцев. После этого вакцинацию необходимо повторить.
последних разработок и клинических рекомендаций
Ther Adv Chronic Dis. 2014 Янв; 5 (1): 15–29.
и
Родри Стейси
Регистратор гастроэнтерологии, Университетская больница Лландо, Управление здравоохранения Университета Кардиффа и Вейла, Южный Уэльс, Великобритания
Джон Т. Грин
Консультант-гастроэнтеролог, отделение гастроэнтерологии, Университетская больница Лландо, Пенлан-роуд, Пенлан-роуд, CF64 2XX, UK
Rhodri Stacey, регистратор гастроэнтерологии, Университетская больница Лландо, Совет здоровья Университета Кардиффа и Вейла, Южный Уэльс, Великобритания;
Автор, ответственный за переписку.Эта статья цитировалась в других статьях в PMC.
Abstract
Ионизирующее излучение обычно используется для лечения ряда злокачественных новообразований. Несмотря на то, что он очень эффективен и теперь более адресный, многие пациенты страдают побочными эффектами. Число выживших после рака увеличилось, и поэтому больше пациентов обращаются с симптомами, возникшими в результате лучевой терапии. Радиационное повреждение ткани тонкой кишки может вызвать острый или хронический радиационный энтерит, вызывающий такие симптомы, как боль, вздутие живота, тошнота, позывы к фекалии, диарея и ректальное кровотечение, которые могут оказать значительное влияние на качество жизни пациента.В этом обзоре описывается патогенез лучевого поражения тонкой кишки, а также предотвращение радиационного поражения с помощью методов лучевой терапии и таких лекарств, как ингибиторы ангиотензинпревращающего фермента, статины и пробиотики. Он также охватывает лечение как острого, так и хронического лучевого энтерита с помощью различных медицинских (включая гипербарический кислород), диетических, эндоскопических и хирургических методов лечения.
Он также охватывает лечение как острого, так и хронического лучевого энтерита с помощью различных медицинских (включая гипербарический кислород), диетических, эндоскопических и хирургических методов лечения.
Ключевые слова: хронический лучевой энтерит, лучевая болезнь органов малого таза, лечение лучевого энтерита, лучевая энтеропатия
Введение
Лучевая терапия является основой онкологического лечения различных злокачественных заболеваний и обычно применяется в области живота и таза у пациентов с рак желудочно-кишечного тракта, урологический и гинекологический рак.Признано, что впоследствии у пациентов может развиться ряд побочных эффектов со стороны ЖКТ. Важно, чтобы эти симптомы были распознаны, а затем приняты меры различными медицинскими работниками, которые могут встречаться с этими пациентами в первичной медико-санитарной помощи и в больничной практике.
В этом обзоре излагается патофизиология лучевого энтерита, обсуждается, как можно снизить его частоту, и подробно описывается текущее лечение как острых, так и хронических проявлений.
Что такое лучевая болезнь тонкой кишки?
«Лучевой энтерит» — это термин, традиционно используемый для определения повреждения тонкой кишки в результате лучевой терапии.Это исключает повреждения толстой и прямой кишки, которые описываются как «лучевой колит», «лучевой проктит» или «лучевая проктопатия» соответственно. Эти презентации не рассматриваются в данном обзоре, но клиницисту важно помнить о пересечении различных радиационно-индуцированных повреждений ЖКТ, учитывая близость толстой и прямой кишки к тонкой кишке. Также важно понимать, что пациенты могут иметь сосуществующие урологические, сексуальные и психологические проблемы [Андреев, 2007а].Распространенный термин «радиационный энтерит» является неправильным, а термины «радиационная энтеропатия» или «радиационный мукозит» используются для более точного описания процесса заболевания. Недавно был достигнут консенсус в отношении того, что «лучевая болезнь таза» наиболее точно описывает феномен поражения желудочно-кишечного тракта, вторичный по отношению к лучевой терапии, однако «радиационно-индуцированное заболевание тонкой кишки», вероятно, является наиболее точным описанием процесса заболевания и будет использоваться в этой статье. . Лучевое поражение тонкой кишки можно разделить на острую и хроническую формы.Острое радиационно-индуцированное заболевание тонкой кишки обычно проявляется коликами в животе, вздутием живота, потерей аппетита, тошнотой, диареей и позывами на фекалии во время или вскоре после курса лучевой терапии. Почти все пациенты, получающие лучевую терапию органов малого таза или брюшной полости, испытывают те или иные симптомы со стороны желудочно-кишечного тракта [Андреев, 2007b]. Пациенты обычно замечают эти симптомы в течение второй недели лечения (когда повреждение тканей и воспаление, вероятно, максимальны), и они обычно достигают пика к четвертой-пятой неделе (когда гистологические изменения стабильны или улучшаются) [Khalid et al. 2006].
. Лучевое поражение тонкой кишки можно разделить на острую и хроническую формы.Острое радиационно-индуцированное заболевание тонкой кишки обычно проявляется коликами в животе, вздутием живота, потерей аппетита, тошнотой, диареей и позывами на фекалии во время или вскоре после курса лучевой терапии. Почти все пациенты, получающие лучевую терапию органов малого таза или брюшной полости, испытывают те или иные симптомы со стороны желудочно-кишечного тракта [Андреев, 2007b]. Пациенты обычно замечают эти симптомы в течение второй недели лечения (когда повреждение тканей и воспаление, вероятно, максимальны), и они обычно достигают пика к четвертой-пятой неделе (когда гистологические изменения стабильны или улучшаются) [Khalid et al. 2006].
Степень тяжести варьируется, примерно 15–20% пациентов нуждаются в изменении терапевтического курса. Обычно он проходит самостоятельно, часто проходит в течение 3 месяцев и часто требует только поддерживающих мер [Do et al. 2011].
Хроническая лучевая болезнь тонкого кишечника обычно развивается от 18 месяцев до 6 лет после завершения курса лучевой терапии, но, как сообщается, проявляется до 30 лет спустя [Kountouras and Zavos, 2008]. Это более распространенное явление, чем думают многие врачи: у 90% пациентов, получающих лучевую терапию органов малого таза, наблюдается необратимое изменение привычки кишечника [Olopade et al. 2005]. Это также проблематично, 50% пациентов с облучением таза описывают, что на их качество жизни отрицательно повлияли различные симптомы со стороны желудочно-кишечного тракта [Widmark et al. 1994; Crook et al. 1996; Gami et al. 2003], где 20–40% (в зависимости от типа опухоли) оценивают влияние на качество жизни как умеренное или тяжелое [Андреев, 2007b].
Хроническая энтеропатия проявляется многими различными способами, включая постпрандиальную боль, острую или периодическую непроходимость тонкой кишки, тошноту, анорексию, потерю веса, вздутие живота, диарею, стеаторею и мальабсорбцию выбранных или нескольких питательных веществ [Theis et al. 2010]. Они могут возникать в результате повреждения самого тонкого кишечника или связанных с ним явлений, таких как мальабсорбция желчных солей, избыточный бактериальный рост или непереносимость лактозы.
2010]. Они могут возникать в результате повреждения самого тонкого кишечника или связанных с ним явлений, таких как мальабсорбция желчных солей, избыточный бактериальный рост или непереносимость лактозы.
Патогенез
Радиотерапевтическое повреждение является сложным, и его заживление отличается от нормального заживления ран в результате повторяющихся повреждений [Denham and Hauer-Jensen, 2002]. Ионизирующее излучение вызывает несколько типичных изменений тканей кишечника. Они характеризуются воспалением или гибелью клеток, включая потерю клеток слизистой оболочки, острое воспаление собственной пластинки, образование абсцесса эозинофильных крипт и набухание эндотелиальной выстилки артериол [Theis et al. 2010]. Они могут разрешиться, но могут перерасти в более хронические изменения с постоянной активацией цитокинов в подслизистой основе и фиброзом соединительной ткани с артериолярным эндартериитом [Wong et al. 2010]. Эти изменения приводят к ишемии тканей, ведущей к рыхлости слизистой оболочки и неоваскуляризации, а также к прогрессирующему фиброзу [Theis et al. 2010]. Это может привести к дисфункции тонкого кишечника в нескольких областях и к заболеванию строгого режима. Клиническая картина будет зависеть от степени и степени повреждения ткани вместе с местом повреждения [Lange et al. 2009; Kennedy and Heise, 2005]. В этой статье основное внимание уделяется терапевтическим аспектам радиационно-индуцированного заболевания тонкой кишки, однако важно признать сложность основного патогенеза, выходящего за рамки описанного выше.
Серьезность симптома зависит от количества обнаруженного излучения. Симптомы могут появиться уже после 5–12 Гр фракционированным курсом, но обычно возникают при более высоких дозах [Theis et al. 2010]. В качестве иллюстрации Королевский колледж радиологов рекомендует, чтобы приемлемая схема лечения рака простаты составляла 74–78 Гр для простаты в 37–39 долях больше 7. 5–8 недель [Совет факультета клинической онкологии Королевского колледжа радиологов, 2006]. Поражение кишечника также связано с режимом облучения, размером и местоположением области лечения, областью нормального кишечника, которая подвергается воздействию, применением сопутствующей химиотерапии и наличием радиационных имплантатов [Kennedy and Heise, 2005]. К другим факторам пациента, влияющим на тяжесть симптомов, относятся перенесенные ранее операции на брюшной полости или тазу, дивертикулярные или воспалительные заболевания органов малого таза, гипертония, курение, диабет и плохое питание.Все они могут уменьшить приток крови к стенке кишечника, увеличивая риск лучевого поражения [Kennedy and Heise, 2005].
5–8 недель [Совет факультета клинической онкологии Королевского колледжа радиологов, 2006]. Поражение кишечника также связано с режимом облучения, размером и местоположением области лечения, областью нормального кишечника, которая подвергается воздействию, применением сопутствующей химиотерапии и наличием радиационных имплантатов [Kennedy and Heise, 2005]. К другим факторам пациента, влияющим на тяжесть симптомов, относятся перенесенные ранее операции на брюшной полости или тазу, дивертикулярные или воспалительные заболевания органов малого таза, гипертония, курение, диабет и плохое питание.Все они могут уменьшить приток крови к стенке кишечника, увеличивая риск лучевого поражения [Kennedy and Heise, 2005].
Клиническая оценка
Хотя симптомы со стороны желудочно-кишечного тракта, в том числе вызванные радиацией заболевания тонкой кишки, являются наиболее частыми из всех хронических физических побочных эффектов лечения рака и оказывают наибольшее влияние на качество жизни [Андреев, 2007b], меньше более 20% больных обращаются к гастроэнтерологу [Андреев и соавт. 2003].Пациенты занижают информацию о проблемах, которые могут смущаться, чувствовать, что они не связаны с предыдущим онкологическим лечением, или могут воспринимать их как неизбежные последствия успешной терапии рака. Пациенты, получающие лучевую терапию, должны быть тщательно обучены поиску потенциальных побочных эффектов со стороны желудочно-кишечного тракта, включая радиационно-индуцированное заболевание тонкой кишки, и следует поощрять самопознание. Симптомы со стороны желудочно-кишечного тракта также недооцениваются врачами, которые могут не спрашивать конкретно о «кишечнике» пациента [Андреев et al. 2012]. Такие группы, как Macmillan Cancer Support, были нацелены на повышение осведомленности как медицинских работников, так и широкой общественности о долгосрочной заболеваемости, которая может возникнуть после лечения, с помощью инициатив «Выживание при раке», и совместное руководство было опубликовано в 2012 году Британским обществом гастроэнтерологов. , Ассоциация колопроктологов Великобритании и Ирландии, Королевский колледж радиологов и Macmillan [Андреев et al. 2012].
, Ассоциация колопроктологов Великобритании и Ирландии, Королевский колледж радиологов и Macmillan [Андреев et al. 2012].
Острые проблемы могут распознать и лечить онкологи, которым необходимо исключить другие причины, например инфекцию.Если при систематическом обследовании выясняется, что у пациента есть хронические абдоминальные симптомы, которые отрицательно сказываются на качестве его жизни или есть «тревожные» признаки, такие как ректальное кровотечение или потеря веса, его следует направить к гастроэнтерологу для оперативной оценки. Практикующим следует рассмотреть возможность использования алгоритма Роял Марсден [Андреев, 2007b], который направляет исследования на основе симптомов. Очень важно понимать, что каждый симптом может иметь несколько основных причин, и у многих пациентов есть множество симптомов.Также важно учитывать возможность рецидива рака или злокачественного новообразования в другом месте. Хирурги также должны знать, что предшествующая лучевая терапия является фактором риска строгого купирования заболевания и спаек, которые могут проявляться как подострая или периодическая непроходимость тонкой кишки.
Помимо симптомов, вызванных повреждением желудочно-кишечного тракта, существуют вторичные явления, которые напрямую связаны с лучевой терапией. Например, диарея может возникать исключительно из-за дисфункции толстой и / или тонкой кишки с уменьшением времени прохождения через предшествующее облучение [Theis et al. 2010]. Кроме того, это может быть следствием любого из следующих факторов: избыточный бактериальный рост в тонкой кишке, мальабсорбция желчных солей из-за терминального повреждения подвздошной кишки, мальабсорбция лактозы или других ферментируемых сахаров, внешнесекреторная недостаточность поджелудочной железы или колит. Это также может быть связано с колоректальным раком и рядом других причин, напрямую не связанных с предшествующим онкологическим лечением, включая целиакию, воспалительное заболевание кишечника, тиреотоксикоз, психологические проблемы, побочные эффекты лекарств и избыток алкоголя [Андреев, 2007b; Theis et al. 2010].
2010].
Профилактика радиационно-индуцированных заболеваний тонкой кишки
Онкологи разработали методы уменьшения радиационно-индуцированных заболеваний тонкой кишки, включая модификации режимов лучевой терапии и лекарства, которые могут уменьшить повреждение тканей. Клинические рекомендации приведены во вставке 1.
Вставка 1.
Профилактика лучевой болезни тонкой кишки: клиническое руководство.
Использование современных методов визуализации и лучевой терапии для сведения к минимуму радиационного воздействия на нормальные ткани
Учет эффектов циркадного ритма и использование вечерних сеансов лучевой терапии
Продолжить применение ингибиторов ангиотензинпревращающего фермента и статинов и при необходимости рассмотреть возможность их введения
Рассмотреть возможность использования пробиотиков
Рассмотрение хирургических методов для минимизации радиационного воздействия на тонкую кишку, если это необходимо, и хирургическая бригада, имеющая опыт и компетентность в данной процедуре.
Методы лучевой терапии
Уменьшение размера поля, расположение нескольких полей, методы конформной лучевой терапии и лучевая терапия с модуляцией интенсивности (IMRT) могут снизить токсичность, связанную с лучевой терапией [Portelance et al. 2001; Рэндалл и Ибботт, 2006]. IMRT максимально щадит нормальные ткани, создавая различные формы лечения и крутые градиенты дозы [Mundt et al. 2002; Roeske et al. 2000]. В ней используется несколько лучей с сильно неоднородной дозой по полю, тогда как в традиционной лучевой терапии обычно используется небольшое количество лучей с равномерной интенсивностью.Исследования показали снижение дозы облучения кишечника до 40% за счет использования IMRT, а не трехмерной конформной или традиционной лучевой терапии всего таза [Portelance et al. 2001; Nutting et al. 2000].
Методы управления изображением могут также улучшить проведение лучевой терапии. Например, компьютерная томография с коническим лучом мегавольт и киловольт обеспечивает трехмерное изображение пациента непосредственно перед лучевой терапией, что улучшает нацеливание на рак и снижает дозу, получаемую нормальными тканями.Было показано, что более низкие дозы облучения кишечника при этих методах лечения также коррелируют с более низкими уровнями токсичности и симптомов [Guerrero Urbano et al. 2006].
Например, компьютерная томография с коническим лучом мегавольт и киловольт обеспечивает трехмерное изображение пациента непосредственно перед лучевой терапией, что улучшает нацеливание на рак и снижает дозу, получаемую нормальными тканями.Было показано, что более низкие дозы облучения кишечника при этих методах лечения также коррелируют с более низкими уровнями токсичности и симптомов [Guerrero Urbano et al. 2006].
Доступ к этим методам увеличивается (по оценкам, 81% британских центров теперь имеют доступ к IMRT) [Ahmad et al. 2012]. Хотя эти методы чрезвычайно многообещающие, хронические симптомы могут проявляться через три десятилетия после лучевой терапии, поэтому для получения долгосрочных данных потребуется много лет.
Устройства для позиционирования и позиционирования пациента
Различные положения пациента и устройства для позиционирования (например, доска для живота, устройство позиционирования, предназначенное для уменьшения объема облученной тонкой кишки пациентов, проходящих лечение в тазовой области, путем смещения тонкой кишки в положении лежа на животе ) были опробованы в попытке свести к минимуму непреднамеренное воздействие ионизирующего излучения на нормальный кишечник.
Обзор, анализирующий 46 статей, касающихся влияния положения пациента во время лечения злокачественных новообразований органов малого таза, показал, что положение на животе обычно приводит к меньшему облучаемому объему тонкой кишки, чем положение лежа на спине [Wiesendanger-Wittmer et al. 2012]. Однако более значительного уменьшения объема облученного тонкого кишечника можно достичь за счет дополнительного использования доски для живота в положении лежа как для планов лечения 3D-CRT (конформная лучевая терапия), так и для планов лечения IMRT. Также было отмечено, что полный мочевой пузырь может также уменьшить объем облучаемой тонкой кишки. Однако в настоящее время имеется мало данных о долгосрочном воздействии этих методов лечения на желудочно-кишечный тракт.
Циркадный ритм
Исследования на животных показали, что, когда мышей облучали в разное время дня, наблюдался четкий циркадный ритм в количестве апоптотических клеток в кишечном крипте [Ijiri and Potten, 1988].Считается, что это связано с влиянием циркадного ритма на циклы пролиферации клеток, и ткань оказывается более радиочувствительной, если ее клетки обладают большей пролиферативной способностью и быстрее делятся. Исследования клеточной пролиферации в слизистой оболочке прямой кишки человека показали, что наибольшая пролиферативная активность наблюдается утром между 03:00 и 11:30, а наименьшая — через 12 часов [Ijiri and Potten, 1990; Buchi et al. 1991].
В проспективном исследовании рандомизировано 229 пациентов, получавших лучевую терапию по поводу рака шейки матки, для лечения утром (08: 00–10: 00) или вечером (18: 00–20: 00) [Shukla et al. 2010]. Заболеваемость острым радиационно-индуцированным заболеванием тонкой кишки в двух группах оценивалась и сообщалась с точки зрения различных степеней диареи. Было обнаружено, что общее количество пациентов с диареей, а также пациентов с более тяжелой диареей было значительно больше у пациентов, получавших лечение утром, по сравнению с теми, кто получал идентичный режим облучения вечером. Онкологический терапевтический ответ в двух группах был одинаковым.
Хотя время начала лечения может снизить заболеваемость лучевой терапией, существуют логистические проблемы в центрах с ограниченными возможностями для вечернего лечения.
Лекарства
Статины и ингибиторы ангиотензинпревращающего фермента
Было отмечено, что желудочно-кишечная токсичность лучевой терапии ниже у пациентов, принимающих гипотензивные и понижающие холестерин агенты (в частности, ингибиторы ангиотензинпревращающего фермента [АПФ] и статины). Ингибиторы АПФ блокируют ферментативное превращение ангиотензина I в ангиотензин II, который играет важную роль в гомеостазе артериального давления. Исследования in vitro подтвердили противовоспалительный, антифибротический и антитромботический потенциал статинов в облученных клетках человека [Gaugler et al. 2005; Haydont et al. 2005, 2007] и было показано, что низкие дозы ловастатина обладают радиозащитным действием в эндотелиальных клетках человека [Ostrau et al. 2009].
Ретроспективное нерандомизированное когортное исследование 308 пациентов с лучевой терапией органов малого таза оценило влияние статинов и ингибиторов АПФ на развитие желудочно-кишечных симптомов [Wedlake et al. 2012]. Симптоматология желудочно-кишечного тракта регистрировалась проспективно до лучевой терапии, еженедельно во время лечения и через 1 год с использованием вопросника по воспалительным заболеваниям кишечника.Использование статинов или статинов + ингибитор АПФ во время радикальной лучевой терапии органов малого таза значительно уменьшало острые симптомы со стороны желудочно-кишечного тракта.
Пробиотики
Пробиотик — это препарат, содержащий жизнеспособные и определенные микроорганизмы в большом количестве, достаточном для изменения микрофлоры хозяина [Kligler and Cohrssen, 2008].
Лучевая терапия может нарушить естественную кишечную флору, которая играет важную роль в поддержании нормальной функции слизистой оболочки [Berthrong, 1986], и появляются новые доказательства того, что пробиотики могут иметь радиозащитный эффект.
Всего было проведено пять рандомизированных контролируемых испытаний различного качества и размера в отношении пробиотиков при лучевой болезни тонкой кишки [Salminen et al . 1988; Делия и др. . 2007; Урбанчек и др. . 2001; Giralt и др. . 2008; Chitapanarux и др. . 2010]. Исследованные агенты включают пробиотический препарат VSL # 3 (пробиотик, содержащий восемь штаммов живых молочнокислых бактерий и бифидобактерий) и живые Lactobacillus acidophilus плюс бифидобактерии bifidum.Хотя некоторые исследования показали значительное улучшение симптомов диареи и снижение использования противодиарейных препаратов, дизайн исследования и количество пациентов не позволяют нам в полной мере отстаивать пробиотики в настоящее время. Требуется полное тестирование безопасности отдельных соединений с последующими более крупными, хорошо спланированными двойными слепыми рандомизированными контролируемыми испытаниями.
Амифостин
Амифостин — это цитопротекторный адъювант, используемый в химиотерапии рака. Он снижает частоту возникновения ксеростомии при применении перед лучевой терапией рака головы и шеи [Jha et al. 2012]. Предварительные исследования показывают, что амифостин может также защищать кишечник от радиационно-индуцированной токсичности [Athanassiou et al. 2003; Бен-Йозеф и др. 2002; Леонард и др. . 2005], но необходимы дальнейшие исследования, чтобы определить его истинную ценность.
Антиоксиданты
Было высказано предположение, что цитотоксическое действие ионизирующего излучения на эпителий ЖКТ связано с окислительным стрессом. Исследования на животных показали, что обработка витамином Е и / или селеном перед лучевой терапией помогает минимизировать окислительный стресс [Felemovicius et al. 1995; Mutlu-Türkoğlu et al. 2000], указывая на то, что предварительная обработка антиоксидантами может иметь некоторые положительные эффекты против радиационно-индуцированного поражения кишечника [Empey et al. 1992]. Требуются дальнейшие исследования этих агентов.
Тедуглутид
Тедуглутид представляет собой аналог глюкагоноподобного пептида-2. Исследования на животных показали увеличение выживаемости стволовых клеток кишечных крипт при введении перед облучением всего тела у мышей [Booth et al. 2004].Теоретически это предполагает, что он может играть полезную защитную роль в предотвращении радиационно-индуцированного поражения кишечника, но на людях требуются дальнейшие исследования.
Пищевые добавки
Было показано, что глутамин и аргинин оказывают защитное действие на слизистую кишечника крыс, получавших лучевую терапию [Yavas et al. 2012]. Однако клинические исследования показали, что глутамин не защищает от острого радиационно-индуцированного заболевания тонкой кишки у людей [Kozelsky et al. 2003; Vidal-Casariego et al. 2013].
Нет никаких доказательств того, что диета с ограничением лактозы предотвратит вызванное радиацией заболевание тонкой кишки, несмотря на ее полезность при лечении диареи у некоторых пациентов, вызванной лучевой терапией [Stryker and Bartholomew, 1986]. Недавний обзор 22 исследований, посвященных эффективности диетических вмешательств для противодействия острой желудочно-кишечной токсичности во время терапевтической лучевой терапии органов малого таза [Wedlake et al. 2013] рассмотрели доказательства в пользу элементной формулы, диет с низким или модифицированным содержанием жиров, диет с низким или высоким содержанием клетчатки, диет с низким содержанием лактозы, пробиотиков и симбиотиков.Авторы обнаружили, что в настоящее время недостаточно убедительных доказательств, чтобы рекомендовать вмешательство в питание, и что необходимы дальнейшие исследования высокого качества.
Сукральфат
Сукральфат представляет собой высокосульфатированный полианионный дисахарид, используемый для лечения диспепсии. Считается, что он стимулирует заживление эпителия и формирует защитный барьер над поврежденными поверхностями слизистой оболочки [Denton et al. 2002]. Существуют рандомизированные контролируемые доказательства того, что сукральфат может помочь в лечении кровотечения при лучевом проктите, но нет доказательств того, что он полезен для профилактики радиационно-индуцированного заболевания тонкой кишки.Рандомизированное двойное слепое исследование не показало значительной разницы между сукралфатом и плацебо в этой ситуации [Martenson et al. 2000].
Хирургические методы
Описано хирургическое наложение рассасывающихся сетчатых перевязок и силиконовых протезов для предотвращения радиационно-индуцированного заболевания тонкой кишки [Devereux et al. 1984; Kavanah et al. 1985; Sener et al. 1989; Родье и др. 1991; Beitler et al. 1997; Шугарбейкер, 1983].Эти вмешательства направлены на снижение токсичности за счет исключения тонкой кишки из облученных областей. Однако результаты не всегда воспроизводятся в клинической практике и обычно не используются во многих центрах.
Полное исключение тонкой кишки с помощью сетчатой повязки в раннем послеоперационном периоде должно предотвратить прилипание тонкой кишки к тазу. Считается, что после абсорбции сеткой тонкий кишечник сохраняет достаточную подвижность, поэтому его можно временно исключить из таза с помощью простых методов позиционирования [Waddell et al. 1999]. В одной серии случаев из 60 пациентов после резекции ректальных или гинекологических злокачественных новообразований были вставлены сетчатые слинги из полигликолевой кислоты. Все пациенты получали послеоперационную лучевую терапию стандартными фракциями. При среднем сроке наблюдения 28 месяцев случаев радиационно-индуцированного заболевания тонкой кишки не наблюдалось [Devereux et al. 1988]. Исследование 45 пациентов с резектабельной карциномой прямой кишки показало аналогичные результаты [Dasmahapatra and Swaminathan, 1991].
Силиконовые протезы, занимающие много места, использовались для отделения тонкой кишки от таза [McGinley et al. 1980], однако они могут оказывать массовое воздействие на окружающие структуры, приводя к умеренному гидронефрозу [Nguyen and Hamper, 1997].
Для удаления протеза после завершения лучевой терапии может потребоваться повторная операция, хотя для решения этой проблемы были разработаны надувные солевые имплантаты [Sezeur et al. 1990].
Лечение острого радиационно-индуцированного заболевания тонкой кишки
Пациенты с острым энтеритом могут испытывать самые разные симптомы.
Лечение можно разделить на поддерживающие и диетические вмешательства, а также на специфические медикаментозные и хирургические методы лечения. В тяжелых случаях может потребоваться пересмотр последующего онкологического режима.
Поддерживающее лечение
Могут быть назначены многочисленные лекарства, которые не играют никакой роли в коррекции основной патофизиологии заболевания, но направлены на минимизацию симптомов.
Лечение первой линии острой лучевой диареи — это противодиарейные препараты, такие как лоперамид или кофенотроп [Wadler et al. 1998]. Субсалицилат висмута также рекомендован при диарее и тошноте [National Cancer Institute, 2012], но, как и в случае со многими из этих поддерживающих методов лечения, доказательная база основана только на клиническом опыте и единодушных мнениях. Пациентам также могут быть полезны антихолинергические спазмолитики для облегчения спазмов кишечника, анальгетики от боли или противорвотные средства от тошноты [National Cancer Institute, 2012]. Важно отметить, что симптомы часто исчезают после завершения режима лучевой терапии.Клиницисты должны обеспечить уверенность в себе наряду с обучением относительно потенциальных хронических проблем [Андреев et al. 2012]. Также появляются новые данные о том, что мальабсорбция желчных кислот может происходить в острой стадии, и это следует учитывать клиницистам [Harris et al . 2012].
Диетические процедуры
Ворсинки кишечника могут быть повреждены лучевой терапией, что приводит к снижению или потере пищеварительных ферментов, что приводит к нарушению всасывания питательных веществ [Czito and Willett, 2010].Важно обеспечить потребление достаточной калорийности и жидкости, что может быть затруднено в этих условиях; диетолог может дать целенаправленный совет. Был предложен ряд диетических модификаций для лечения симптомов радиационно-индуцированного заболевания тонкой кишки, но есть лишь ограниченные доказательства того, что они полезны.
Диета, не содержащая лактозы, с низким содержанием жиров и остатков, может улучшить симптомы у пациентов. Однако результаты других испытаний, оценивающих влияние диет с ограничением лактозы на радиационно-индуцированную диарею, дали противоречивые результаты [Stryker and Bartholomew, 1986; Пока, и др. 1992]. Важно учитывать, что при таком подходе следует использовать пищевые добавки, не содержащие лактозу.
В клинической практике предлагается прагматический подход, которому может помочь ведение дневника питания, соответствующего симптомам.
Октреотид
Аналог соматостатина октреотид используется для лечения диареи, вызванной химиотерапией, и радиационно-индуцированного заболевания тонкой кишки [Yavuz et al. 2002]. Это октапептид, имитирующий натуральный соматостатин и снижающий перистальтику кишечника.Рандомизированное контролируемое исследование, сравнивающее октреотида ацетат (100 мкг три раза в день) с гидрохлоридом дифеноксилата плюс сульфат атропина (2,5 мг четыре раза в день) при остром радиационно-индуцированном заболевании тонкой кишки, показало, что диарея проходит быстрее и уменьшается количество пациентов, нуждающихся в для прекращения лучевой терапии органов малого таза в группе октреотида [Yavuz et al. 2002].
5-аминосалициловые кислоты
Нет доказательств пользы 5-аминосалициловых кислот (5-ASA) при остром или хроническом радиационно-индуцированном заболевании тонкой кишки, и было показано, что они могут усиливать симптомы в острых условиях [ Гибсон и др. 2013].
Хирургия
Хирургия требуется при остром энтерите очень редко. По возможности этого следует избегать из-за плохого заживления ран и опасений по поводу утечки из хирургических анастомозов [Galland and Spencer, 1986]. Конечно, может потребоваться операция у некоторых пациентов, недавно перенесших лучевую терапию, но хирурги должны проявлять осторожность и осторожность при этом.
Лечение хронического радиационно-индуцированного заболевания тонкой кишки
Пациентам с абдоминальными симптомами, возникающими после предшествующей лучевой терапии, необходимо тщательное обследование и обследование гастроэнтерологом, а также план лечения, который может включать других специалистов в области здравоохранения.Лечение можно разделить на те, которые нацелены на конкретные вторичные образования, которые обычно возникают после лучевой терапии, и поддерживающие, пищевые, медиации и другие вмешательства, направленные на противодействие эффекту энтеропатии.
Поддерживающее лечение
В острых случаях пациенты могут нуждаться в симптоматических лекарствах периодически или на регулярной основе. Опять же, это включает средства против моторики, анальгетики и противорвотные средства. Одно небольшое исследование оценило эффективность лоперамида у пациентов с хроническим радиационно-индуцированным заболеванием тонкой кишки, показав улучшение времени прохождения через кишечник, абсорбции желчных солей и диареи [Yeoh et al. 1993].
Вторичные эффекты хронической радиационно-индуцированной болезни тонкой кишки
Антибиотики при избыточном бактериальном росте тонкой кишки
Повреждение тонкой кишки создает области нарушения моторики и застоя, ведущие к избыточному бактериальному росту [Husebye et al. 1995]. В отличие от толстой кишки, которая богата бактериями, в тонкой кишке обычно меньше 104 организмов на миллилитр [Quigley and Quera, 2006]. Когда происходит избыточный бактериальный рост, наиболее распространенными изолятами тощей кишки являются виды Escherichia coli, Streptococcus, Lactobacillus, Bacteroides и Enterococcus видов [Bouhnik et al. 1999].
Также используются антибиотики широкого спектра действия: к ним относятся тетрациклин, коамоксиклав, ципрофлоксацин и рифаксимин. Следует соблюдать рекомендации по применению местных антибиотиков. Пациентам часто требуется повторный курс лечения, а многим требуется длительная поддерживающая терапия в более низких дозах. Некоторые врачи рекомендуют чередовать разные антибиотики для снижения риска резистентности [Quigley and Abu-Shanab, 2010].
Хотя пробиотическая терапия использовалась для профилактики и лечения острого радиационно-индуцированного заболевания тонкой кишки, в настоящее время нет доказательств их эффективности в хронических условиях.
Холестирамин и колесевелам при мальабсорбции желчных солей
В общей сложности 95% желчных кислот абсорбируются в терминальном отделе подвздошной кишки, и радиационное поражение этой области может вызвать мальабсорбцию желчных кислот (BAM) [Andersson et al. 1978]. Это можно проверить с помощью исследования Se-HCAT, однако это исследование широко не используется, и многие клиницисты рекомендуют эмпирическое лечение. Считается, что БАМ отвечает за симптомы у 35–72% пациентов с хроническим радиационно-индуцированным заболеванием тонкой кишки, страдающих диареей [Theis et al. 2010; Андреев и др. 2005; Danielsson et al. 1991; Ладгейт и Меррик, 1985; Arlow et al. 1987]. Он хорошо реагирует на холестирамин, однако он не очень приятен на вкус, и 68% пациентов прекращают его прием через 1 год [Kamal-Bahl et al. 2007]. Альтернативами являются колестипол и колесевелам, которые также связывают соли желчных кислот. Колесевелам лучше переносится, и есть доказательства его пользы в этой ситуации; однако в настоящее время он не лицензирован для этого показания и относительно дорог по сравнению с другими препаратами [Puleston et al. 2005; Wedlake et al. 2009].
Питание и сопутствующие методы лечения
Было проведено исследование исключения определенных пищевых продуктов и использования пищевых добавок при хроническом радиационно-индуцированном заболевании тонкой кишки, но, опять же, данные об их пользе неодинаковы.
При рассмотрении исключающих диет важно учитывать диетические факторы. Пациентов можно обследовать на непереносимость лактозы и других углеводов с помощью таких методов, как дыхательный тест.Сниженная чувствительность этих неинвазивных тестов означает, что может потребоваться эмпирическое, но управляемое исследование исключения. Было доказано, что безлактозные диеты эффективны у пациентов с непереносимостью лактозы [Beer et al. 1985]. Мы также использовали диету исключения FODMAP (ферментируемые олигосахариды, дисахариды, моносахариды и пилолы) для некоторых из этих пациентов, которые впоследствии сообщили об улучшении их симптомов, однако в настоящее время нет опубликованных исследований, оценивающих этот подход.
Как ни странно, некоторые пациенты, кажется, связывают обострение своих симптомов с приемом определенных продуктов. Одно исследование 26 женщин с хроническим радиационно-индуцированным заболеванием тонкой кишки по сравнению с 21 нормальной контрольной группой показало, что 50% пациентов заметили усиление симптомов после употребления кексов с отрубями, ягод, капусты, брюссельской капусты, брокколи, салата, салата Цезарь. , печеная фасоль, чечевица и орехи по сравнению с 14% в контроле. В общей сложности 85% этих пациентов могли переносить только меньшие порции этих продуктов.Исследование предполагает, что меньшие, более частые порции могут улучшить переносимость определенных продуктов и подкрепляют тщательный сбор анамнеза и индивидуальный подход ко всем пациентам [Sekhon, 2000].
Важно, чтобы пациенты получали достаточное количество калорий и, по возможности, поддерживали энтерально. Некоторым пациентам потребуется длительный прием высококалорийных пищевых добавок: так называемого «глотка». Важны регулярные измерения и добавление витаминов и минералов, включая железо, фолиевую кислоту, витамин B12, витамин D, магний, кальций, микроэлементы и жирорастворимые витамины.
Некоторым пациентам необходима парентеральная поддержка жидкостью и электролитами. Кишечная недостаточность из-за обширной энтеропатии, вызванной предшествующей лучевой терапией, является признанным и относительно частым показанием для домашнего парентерального питания (ПП). Ведение таких пациентов должно координироваться в специализированных центрах. Последнее британское исследование по искусственному питанию показало, что 3,8% пациентов в Великобритании, получающих ПП на дому, страдали лучевой энтеропатией [Smith et al. 2011].
Было показано, что отдых кишечника с помощью PN может улучшить клинические и рентгенологические данные у пациентов с лучевым поражением тонкой кишки [Loiudice and Lang, 1983] и что пищевую автономию и выживаемость можно улучшить, если пациенты сначала будут лечить кишечным отдыхом и дома PN [Gavazzi et al. 2006]. Однако также сообщалось [Silvain, 1992], что пациенты с хроническим радиационно-индуцированным заболеванием тонкой кишки могут с большей вероятностью страдать от клинического рецидива при консервативном лечении с помощью PN по сравнению с пациентами, перенесшими хирургическое вмешательство [Scolapio et al. 1999, 2002].
Гипербарический кислород
Гипербарический кислород (ГБО) снижает гипоксию тканей кишечника, пораженного ишемическим повреждением от ионизирующего излучения, за счет стимулирования ангиогенеза.Также было высказано предположение об антибактериальном эффекте [Bennett et al. 2012]. ГБО является единственной терапией, увеличивающей количество кровеносных сосудов в облученной ткани [Bennett et al. 2012] и может позволить лечение нескольких участков тонкой кишки. Лечение проводится в барокамерах в течение нескольких недель.
Систематический обзор литературы показал, что в 67 из 74 публикаций сообщалось о положительных результатах, когда ГБО применялся в качестве лечения или профилактики отсроченного лучевого поражения [Feldmeier and Hampson, 2002].
Крупное многоцентровое исследование в Великобритании, исследование Hyperbaric Oxygen Therapy II (HOT-II), завершило набор, и его результаты с нетерпением ждут. Хотя ГБО терапия в значительной степени безопасна в использовании, она ограничена наличием камер.
Пентоксифиллин и токоферол
Пентоксифиллин является производным ксантина, а токоферолы представляют собой класс химических соединений с активностью витамина Е [Hamama et al. 2012]. Было высказано предположение, что комбинация этих препаратов может уменьшить радиационно-индуцированный фиброз за счет антиоксидантных эффектов [Gothard et al. 2005]. Исследование 30 пациентов с хроническим лучевым энтеритом или проктитом показало улучшение симптомов у 71% пациентов, получавших эту комбинированную терапию, по сравнению с 33% пациентов, получавших только поддерживающую терапию [Hille et al. 2005]. Для полной оценки этих методов лечения необходимы дальнейшие исследования.
Противовоспалительные средства
Исследования относительно использования аминосалицилатов при хроническом радиационно-индуцированном заболевании тонкой кишки ограничены. Сульфасалазин был исследован в серии случаев у четырех пациентов с хроническим радиационно-индуцированным заболеванием тонкой кишки, все пациенты показали клиническое и радиологическое улучшение в течение 1 года терапии [Goldstein et al. 1976]. Другое исследование показало, что метилпреднизолон может усиливать эффект «кишечного покоя», облегчаемого парентеральным питанием, но нет никаких существенных доказательств того, что кортикостероиды могут применяться у этих пациентов [Loiudice and Lang, 1983].
Эндоскопическая терапия
Иногда у пациентов может развиваться мелена или железодефицитная анемия. Телеангиэктазия может образовываться в любом облученном участке кишечника, и ее бывает трудно обнаружить. Капсульная эндоскопия может быть полезной, но ее следует избегать при стриктурах.Коагуляция аргоновой плазмы хорошо описана при лечении лучевой проктопатии [Leiper and Morris, 2007], но также успешно использовалась для радиационно-индуцированных поражений в дистальном отделе двенадцатиперстной кишки [Toyoda et al. 2004] и подвздошной кишки [Pasha et al. 2007] и может вводиться в тощую кишку, а также с помощью двойной баллонной энтероскопии. Его следует использовать разумно, учитывая риск перфорации, особенно в аномальных тканях. Энтероскопия также может оказаться альтернативой хирургическому лечению стриктур тонкой кишки [Haruta et al. 2005; Kita et al. 2007].
Хирургия
Хирургия является сложной задачей для пациентов, ранее перенесших абдоминальную лучевую терапию. Часто возникают спайки, кишечник может быть очень фиброзным, и с ним трудно справиться [Jao et al. 1986; Луна-Перес и др. 2001]. Заживление ран также может быть затруднено [Luna-Pérez et al. 2001]. Некоторые пациенты, особенно со стриктурами и обструктивными симптомами, нуждаются в хирургическом вмешательстве, поскольку они не могут контролировать симптомы или постоянно страдают от нарушения питания из-за заболевания тонкой кишки.Пациенты с обширным поражением тонкой кишки подвержены риску синдрома короткой кишки или проксимальной стомы с высоким выходом, что является серьезной проблемой для лечения. Важно отметить, что одна операция может привести к другой, еще больше увеличивая риск развития короткой кишки. Крайне важно, чтобы те, кому предстоит хирургическое вмешательство, прошли тщательную оценку с помощью радиологических и других методов и управлялись многопрофильной командой, которая включает в себя поддержку в области питания и хирурга, имеющего опыт ведения таких пациентов [Андреев et al. 2012].
В исследовании хирургического лечения радиационно-индуцированного заболевания тонкой кишки, в котором участвовали 48 пациентов, перенесших расширенную резекцию кишечника с анастомозом, была выявлена значительная послеоперационная заболеваемость — 21,7%. Общая выживаемость после радиационных осложнений у пациентов без рецидива неопластической болезни составила 89%, 79% и 69% через 1, 3 и 5 лет после операции соответственно [Onodera et al. 2005].
Заключение
Начинает вырисовываться более четкая картина ведения радиационно-индуцированного заболевания тонкой кишки.Однако оптимальные способы предотвращения радиационно-индуцированного повреждения тонкой кишки, а также эффективное лечение для всех пациентов до сих пор неясны. Новые методы лучевой терапии продолжают снижать непреднамеренное воздействие на соседние нормальные ткани, а профилактические средства, включая ингибиторы АПФ и статины, являются захватывающими областями будущих исследований. Лечение радиационно-индуцированного заболевания тонкой кишки в острой фазе в значительной степени является поддерживающим. Для тех, у кого проблемы с желудочно-кишечным трактом, возникшие в течение нескольких лет после лучевой терапии, ключевым моментом является признание и направление на консультацию специалиста от гастроэнтеролога, который интересуется этой областью.Предлагаемые клинические рекомендации приведены в. Пациентам необходимо целенаправленное обследование каждого из имеющихся у них симптомов, поскольку многие из них имеют несколько потенциальных причин. Могут быть предложены конкретные методы лечения, а также ценный вклад других специалистов в области здравоохранения, например диетологи. Новые методы лечения, такие как HBO, предлагают многообещающие перспективы. Небольшую группу пациентов, которым требуется операция для облегчения своих проблем, следует направлять к хирургам, имеющим опыт работы в этой сложной ситуации.
Таблица 1.
Клинические рекомендации по лечению лучевой болезни тонкой кишки.
| Все пациенты | Острое радиационно-индуцированное заболевание тонкой кишки | Хроническое радиационно-индуцированное заболевание тонкой кишки | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Тщательная клиническая оценка, включая направление к гастроэнтерологу | Связь с провайдером лучевой терапии в случае модификации лечения требуется режим | Направление к гастроэнтерологу | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рассмотрение дифференциальных диагнозов для каждого симптома и вторичных причин желудочно-кишечных симптомов, таких как SBO и BAM | Поддерживающее лечение и заверение пациента в том, что симптомы часто исчезают после завершения курса лучевой терапии ( консенсусное мнение из руководящих принципов Национального института рака) | Изучение и лечение вторичных эффектов радиационно-индуцированного заболевания тонкой кишки | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Поддерживающее лечение, такое как противодиарейные, противорвотные и т.д. ines) | Рассмотрите возможность применения октреотида для лечения стойких диарейных симптомов (данные РКИ) | Отслеживайте дефицит питательных веществ и вводите диетические данные.Рассмотрение ППП при наличии признаков кишечной недостаточности | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оценка питания и поддержка, если требуется (консенсусное мнение на основе рекомендаций Национального института рака) | Избегайте соединений 5-ASA (данные РКИ) | Гипербарический кислород при рефрактерных симптомах (данные РКИ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рассмотрите возможность применения пентоксифиллина и токоферола (данные не РКИ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рассмотрите возможность эндоскопического лечения, если оно доступно, и при наличии таких симптомов, как рецидивирующая анемия и / или кровотечение (данные РКИ) | Хирургия может рассматриваться в специализированных центрах для рефрактерных случаев, но рекомендуется соблюдать осторожность из-за высокой заболеваемости. -прибыльные секторы. Заявление о конфликте интересов: Авторы не заявляют о конфликте интересов. Информация для авторовРодри Стейси, регистратор гастроэнтерологии, Университетская больница Лландо, Совет здоровья Университета Кардиффа и Вейла, Южный Уэльс, Великобритания. Джон Т. Грин, консультант-гастроэнтеролог, отделение гастроэнтерологии, университетская больница Лландо, Пенлан-роуд, Пенарт CF64 2XX, Великобритания. Список литературы
последние разработки и клинические руководстваTher Adv Chronic Dis.2014 Янв; 5 (1): 15–29. и Родри СтейсиРегистратор гастроэнтерологии, Университетская больница Лландо, Управление здравоохранения Университета Кардиффа и Вейла, Южный Уэльс, Великобритания Джон Т. ГринКонсультант-гастроэнтеролог, отделение гастроэнтерологии, Университетская больница Лландо, Пенлан-роуд, Пенлан-роуд, CF64 2XX, UK Rhodri Stacey, регистратор гастроэнтерологии, Университетская больница Лландо, Совет здоровья Университета Кардиффа и Вейла, Южный Уэльс, Великобритания; Автор, ответственный за переписку.Эта статья цитировалась в других статьях в PMC. AbstractИонизирующее излучение обычно используется для лечения ряда злокачественных новообразований. Несмотря на то, что он очень эффективен и теперь более адресный, многие пациенты страдают побочными эффектами. Число выживших после рака увеличилось, и поэтому больше пациентов обращаются с симптомами, возникшими в результате лучевой терапии. Радиационное повреждение ткани тонкой кишки может вызвать острый или хронический радиационный энтерит, вызывающий такие симптомы, как боль, вздутие живота, тошнота, позывы к фекалии, диарея и ректальное кровотечение, которые могут оказать значительное влияние на качество жизни пациента.В этом обзоре описывается патогенез лучевого поражения тонкой кишки, а также предотвращение радиационного поражения с помощью методов лучевой терапии и таких лекарств, как ингибиторы ангиотензинпревращающего фермента, статины и пробиотики. Он также охватывает лечение как острого, так и хронического лучевого энтерита с помощью различных медицинских (включая гипербарический кислород), диетических, эндоскопических и хирургических методов лечения. Ключевые слова: хронический лучевой энтерит, лучевая болезнь органов малого таза, лечение лучевого энтерита, лучевая энтеропатия ВведениеЛучевая терапия является основой онкологического лечения различных злокачественных заболеваний и обычно применяется в области живота и таза у пациентов с рак желудочно-кишечного тракта, урологический и гинекологический рак.Признано, что впоследствии у пациентов может развиться ряд побочных эффектов со стороны ЖКТ. Важно, чтобы эти симптомы были распознаны, а затем приняты меры различными медицинскими работниками, которые могут встречаться с этими пациентами в первичной медико-санитарной помощи и в больничной практике. В этом обзоре излагается патофизиология лучевого энтерита, обсуждается, как можно снизить его частоту, и подробно описывается текущее лечение как острых, так и хронических проявлений. Что такое лучевая болезнь тонкой кишки?«Лучевой энтерит» — это термин, традиционно используемый для определения повреждения тонкой кишки в результате лучевой терапии.Это исключает повреждения толстой и прямой кишки, которые описываются как «лучевой колит», «лучевой проктит» или «лучевая проктопатия» соответственно. Эти презентации не рассматриваются в данном обзоре, но клиницисту важно помнить о пересечении различных радиационно-индуцированных повреждений ЖКТ, учитывая близость толстой и прямой кишки к тонкой кишке. Также важно понимать, что пациенты могут иметь сосуществующие урологические, сексуальные и психологические проблемы [Андреев, 2007а].Распространенный термин «радиационный энтерит» является неправильным, а термины «радиационная энтеропатия» или «радиационный мукозит» используются для более точного описания процесса заболевания. Недавно был достигнут консенсус в отношении того, что «лучевая болезнь таза» наиболее точно описывает феномен поражения желудочно-кишечного тракта, вторичный по отношению к лучевой терапии, однако «радиационно-индуцированное заболевание тонкой кишки», вероятно, является наиболее точным описанием процесса заболевания и будет использоваться в этой статье. . Лучевое поражение тонкой кишки можно разделить на острую и хроническую формы.Острое радиационно-индуцированное заболевание тонкой кишки обычно проявляется коликами в животе, вздутием живота, потерей аппетита, тошнотой, диареей и позывами на фекалии во время или вскоре после курса лучевой терапии. Почти все пациенты, получающие лучевую терапию органов малого таза или брюшной полости, испытывают те или иные симптомы со стороны желудочно-кишечного тракта [Андреев, 2007b]. Пациенты обычно замечают эти симптомы в течение второй недели лечения (когда повреждение тканей и воспаление, вероятно, максимальны), и они обычно достигают пика к четвертой-пятой неделе (когда гистологические изменения стабильны или улучшаются) [Khalid et al. 2006]. Степень тяжести варьируется, примерно 15–20% пациентов нуждаются в изменении терапевтического курса. Обычно он проходит самостоятельно, часто проходит в течение 3 месяцев и часто требует только поддерживающих мер [Do et al. 2011]. Хроническая лучевая болезнь тонкого кишечника обычно развивается от 18 месяцев до 6 лет после завершения курса лучевой терапии, но, как сообщается, проявляется до 30 лет спустя [Kountouras and Zavos, 2008]. Это более распространенное явление, чем думают многие врачи: у 90% пациентов, получающих лучевую терапию органов малого таза, наблюдается необратимое изменение привычки кишечника [Olopade et al. 2005]. Это также проблематично, 50% пациентов с облучением таза описывают, что на их качество жизни отрицательно повлияли различные симптомы со стороны желудочно-кишечного тракта [Widmark et al. 1994; Crook et al. 1996; Gami et al. 2003], где 20–40% (в зависимости от типа опухоли) оценивают влияние на качество жизни как умеренное или тяжелое [Андреев, 2007b]. Хроническая энтеропатия проявляется многими различными способами, включая постпрандиальную боль, острую или периодическую непроходимость тонкой кишки, тошноту, анорексию, потерю веса, вздутие живота, диарею, стеаторею и мальабсорбцию выбранных или нескольких питательных веществ [Theis et al. 2010]. Они могут возникать в результате повреждения самого тонкого кишечника или связанных с ним явлений, таких как мальабсорбция желчных солей, избыточный бактериальный рост или непереносимость лактозы. ПатогенезРадиотерапевтическое повреждение является сложным, и его заживление отличается от нормального заживления ран в результате повторяющихся повреждений [Denham and Hauer-Jensen, 2002]. Ионизирующее излучение вызывает несколько типичных изменений тканей кишечника. Они характеризуются воспалением или гибелью клеток, включая потерю клеток слизистой оболочки, острое воспаление собственной пластинки, образование абсцесса эозинофильных крипт и набухание эндотелиальной выстилки артериол [Theis et al. 2010]. Они могут разрешиться, но могут перерасти в более хронические изменения с постоянной активацией цитокинов в подслизистой основе и фиброзом соединительной ткани с артериолярным эндартериитом [Wong et al. 2010]. Эти изменения приводят к ишемии тканей, ведущей к рыхлости слизистой оболочки и неоваскуляризации, а также к прогрессирующему фиброзу [Theis et al. 2010]. Это может привести к дисфункции тонкого кишечника в нескольких областях и к заболеванию строгого режима. Клиническая картина будет зависеть от степени и степени повреждения ткани вместе с местом повреждения [Lange et al. 2009; Kennedy and Heise, 2005]. В этой статье основное внимание уделяется терапевтическим аспектам радиационно-индуцированного заболевания тонкой кишки, однако важно признать сложность основного патогенеза, выходящего за рамки описанного выше. Серьезность симптома зависит от количества обнаруженного излучения. Симптомы могут появиться уже после 5–12 Гр фракционированным курсом, но обычно возникают при более высоких дозах [Theis et al. 2010]. В качестве иллюстрации Королевский колледж радиологов рекомендует, чтобы приемлемая схема лечения рака простаты составляла 74–78 Гр для простаты в 37–39 долях больше 7.5–8 недель [Совет факультета клинической онкологии Королевского колледжа радиологов, 2006]. Поражение кишечника также связано с режимом облучения, размером и местоположением области лечения, областью нормального кишечника, которая подвергается воздействию, применением сопутствующей химиотерапии и наличием радиационных имплантатов [Kennedy and Heise, 2005]. К другим факторам пациента, влияющим на тяжесть симптомов, относятся перенесенные ранее операции на брюшной полости или тазу, дивертикулярные или воспалительные заболевания органов малого таза, гипертония, курение, диабет и плохое питание.Все они могут уменьшить приток крови к стенке кишечника, увеличивая риск лучевого поражения [Kennedy and Heise, 2005]. Клиническая оценкаХотя симптомы со стороны желудочно-кишечного тракта, в том числе вызванные радиацией заболевания тонкой кишки, являются наиболее частыми из всех хронических физических побочных эффектов лечения рака и оказывают наибольшее влияние на качество жизни [Андреев, 2007b], меньше более 20% больных обращаются к гастроэнтерологу [Андреев и соавт. 2003].Пациенты занижают информацию о проблемах, которые могут смущаться, чувствовать, что они не связаны с предыдущим онкологическим лечением, или могут воспринимать их как неизбежные последствия успешной терапии рака. Пациенты, получающие лучевую терапию, должны быть тщательно обучены поиску потенциальных побочных эффектов со стороны желудочно-кишечного тракта, включая радиационно-индуцированное заболевание тонкой кишки, и следует поощрять самопознание. Симптомы со стороны желудочно-кишечного тракта также недооцениваются врачами, которые могут не спрашивать конкретно о «кишечнике» пациента [Андреев et al. 2012]. Такие группы, как Macmillan Cancer Support, были нацелены на повышение осведомленности как медицинских работников, так и широкой общественности о долгосрочной заболеваемости, которая может возникнуть после лечения, с помощью инициатив «Выживание при раке», и совместное руководство было опубликовано в 2012 году Британским обществом гастроэнтерологов. , Ассоциация колопроктологов Великобритании и Ирландии, Королевский колледж радиологов и Macmillan [Андреев et al. 2012]. Острые проблемы могут распознать и лечить онкологи, которым необходимо исключить другие причины, например инфекцию.Если при систематическом обследовании выясняется, что у пациента есть хронические абдоминальные симптомы, которые отрицательно сказываются на качестве его жизни или есть «тревожные» признаки, такие как ректальное кровотечение или потеря веса, его следует направить к гастроэнтерологу для оперативной оценки. Практикующим следует рассмотреть возможность использования алгоритма Роял Марсден [Андреев, 2007b], который направляет исследования на основе симптомов. Очень важно понимать, что каждый симптом может иметь несколько основных причин, и у многих пациентов есть множество симптомов.Также важно учитывать возможность рецидива рака или злокачественного новообразования в другом месте. Хирурги также должны знать, что предшествующая лучевая терапия является фактором риска строгого купирования заболевания и спаек, которые могут проявляться как подострая или периодическая непроходимость тонкой кишки. Помимо симптомов, вызванных повреждением желудочно-кишечного тракта, существуют вторичные явления, которые напрямую связаны с лучевой терапией. Например, диарея может возникать исключительно из-за дисфункции толстой и / или тонкой кишки с уменьшением времени прохождения через предшествующее облучение [Theis et al. 2010]. Кроме того, это может быть следствием любого из следующих факторов: избыточный бактериальный рост в тонкой кишке, мальабсорбция желчных солей из-за терминального повреждения подвздошной кишки, мальабсорбция лактозы или других ферментируемых сахаров, внешнесекреторная недостаточность поджелудочной железы или колит. Это также может быть связано с колоректальным раком и рядом других причин, напрямую не связанных с предшествующим онкологическим лечением, включая целиакию, воспалительное заболевание кишечника, тиреотоксикоз, психологические проблемы, побочные эффекты лекарств и избыток алкоголя [Андреев, 2007b; Theis et al. 2010]. Профилактика радиационно-индуцированных заболеваний тонкой кишкиОнкологи разработали методы уменьшения радиационно-индуцированных заболеваний тонкой кишки, включая модификации режимов лучевой терапии и лекарства, которые могут уменьшить повреждение тканей. Клинические рекомендации приведены во вставке 1. Вставка 1.Профилактика лучевой болезни тонкой кишки: клиническое руководство.Использование современных методов визуализации и лучевой терапии для сведения к минимуму радиационного воздействия на нормальные ткани Учет эффектов циркадного ритма и использование вечерних сеансов лучевой терапии Продолжить применение ингибиторов ангиотензинпревращающего фермента и статинов и при необходимости рассмотреть возможность их введения Рассмотреть возможность использования пробиотиков Рассмотрение хирургических методов для минимизации радиационного воздействия на тонкую кишку, если это необходимо, и хирургическая бригада, имеющая опыт и компетентность в данной процедуре. Методы лучевой терапииУменьшение размера поля, расположение нескольких полей, методы конформной лучевой терапии и лучевая терапия с модуляцией интенсивности (IMRT) могут снизить токсичность, связанную с лучевой терапией [Portelance et al. 2001; Рэндалл и Ибботт, 2006]. IMRT максимально щадит нормальные ткани, создавая различные формы лечения и крутые градиенты дозы [Mundt et al. 2002; Roeske et al. 2000]. В ней используется несколько лучей с сильно неоднородной дозой по полю, тогда как в традиционной лучевой терапии обычно используется небольшое количество лучей с равномерной интенсивностью.Исследования показали снижение дозы облучения кишечника до 40% за счет использования IMRT, а не трехмерной конформной или традиционной лучевой терапии всего таза [Portelance et al. 2001; Nutting et al. 2000]. Методы управления изображением могут также улучшить проведение лучевой терапии. Например, компьютерная томография с коническим лучом мегавольт и киловольт обеспечивает трехмерное изображение пациента непосредственно перед лучевой терапией, что улучшает нацеливание на рак и снижает дозу, получаемую нормальными тканями.Было показано, что более низкие дозы облучения кишечника при этих методах лечения также коррелируют с более низкими уровнями токсичности и симптомов [Guerrero Urbano et al. 2006]. Доступ к этим методам увеличивается (по оценкам, 81% британских центров теперь имеют доступ к IMRT) [Ahmad et al. 2012]. Хотя эти методы чрезвычайно многообещающие, хронические симптомы могут проявляться через три десятилетия после лучевой терапии, поэтому для получения долгосрочных данных потребуется много лет. Устройства для позиционирования и позиционирования пациентаРазличные положения пациента и устройства для позиционирования (например, доска для живота, устройство позиционирования, предназначенное для уменьшения объема облученной тонкой кишки пациентов, проходящих лечение в тазовой области, путем смещения тонкой кишки в положении лежа на животе ) были опробованы в попытке свести к минимуму непреднамеренное воздействие ионизирующего излучения на нормальный кишечник. Обзор, анализирующий 46 статей, касающихся влияния положения пациента во время лечения злокачественных новообразований органов малого таза, показал, что положение на животе обычно приводит к меньшему облучаемому объему тонкой кишки, чем положение лежа на спине [Wiesendanger-Wittmer et al. 2012]. Однако более значительного уменьшения объема облученного тонкого кишечника можно достичь за счет дополнительного использования доски для живота в положении лежа как для планов лечения 3D-CRT (конформная лучевая терапия), так и для планов лечения IMRT. Также было отмечено, что полный мочевой пузырь может также уменьшить объем облучаемой тонкой кишки. Однако в настоящее время имеется мало данных о долгосрочном воздействии этих методов лечения на желудочно-кишечный тракт. Циркадный ритмИсследования на животных показали, что, когда мышей облучали в разное время дня, наблюдался четкий циркадный ритм в количестве апоптотических клеток в кишечном крипте [Ijiri and Potten, 1988].Считается, что это связано с влиянием циркадного ритма на циклы пролиферации клеток, и ткань оказывается более радиочувствительной, если ее клетки обладают большей пролиферативной способностью и быстрее делятся. Исследования клеточной пролиферации в слизистой оболочке прямой кишки человека показали, что наибольшая пролиферативная активность наблюдается утром между 03:00 и 11:30, а наименьшая — через 12 часов [Ijiri and Potten, 1990; Buchi et al. 1991]. В проспективном исследовании рандомизировано 229 пациентов, получавших лучевую терапию по поводу рака шейки матки, для лечения утром (08: 00–10: 00) или вечером (18: 00–20: 00) [Shukla et al. 2010]. Заболеваемость острым радиационно-индуцированным заболеванием тонкой кишки в двух группах оценивалась и сообщалась с точки зрения различных степеней диареи. Было обнаружено, что общее количество пациентов с диареей, а также пациентов с более тяжелой диареей было значительно больше у пациентов, получавших лечение утром, по сравнению с теми, кто получал идентичный режим облучения вечером. Онкологический терапевтический ответ в двух группах был одинаковым. Хотя время начала лечения может снизить заболеваемость лучевой терапией, существуют логистические проблемы в центрах с ограниченными возможностями для вечернего лечения. ЛекарстваСтатины и ингибиторы ангиотензинпревращающего ферментаБыло отмечено, что желудочно-кишечная токсичность лучевой терапии ниже у пациентов, принимающих гипотензивные и понижающие холестерин агенты (в частности, ингибиторы ангиотензинпревращающего фермента [АПФ] и статины). Ингибиторы АПФ блокируют ферментативное превращение ангиотензина I в ангиотензин II, который играет важную роль в гомеостазе артериального давления. Исследования in vitro подтвердили противовоспалительный, антифибротический и антитромботический потенциал статинов в облученных клетках человека [Gaugler et al. 2005; Haydont et al. 2005, 2007] и было показано, что низкие дозы ловастатина обладают радиозащитным действием в эндотелиальных клетках человека [Ostrau et al. 2009]. Ретроспективное нерандомизированное когортное исследование 308 пациентов с лучевой терапией органов малого таза оценило влияние статинов и ингибиторов АПФ на развитие желудочно-кишечных симптомов [Wedlake et al. 2012]. Симптоматология желудочно-кишечного тракта регистрировалась проспективно до лучевой терапии, еженедельно во время лечения и через 1 год с использованием вопросника по воспалительным заболеваниям кишечника.Использование статинов или статинов + ингибитор АПФ во время радикальной лучевой терапии органов малого таза значительно уменьшало острые симптомы со стороны желудочно-кишечного тракта. ПробиотикиПробиотик — это препарат, содержащий жизнеспособные и определенные микроорганизмы в большом количестве, достаточном для изменения микрофлоры хозяина [Kligler and Cohrssen, 2008]. Лучевая терапия может нарушить естественную кишечную флору, которая играет важную роль в поддержании нормальной функции слизистой оболочки [Berthrong, 1986], и появляются новые доказательства того, что пробиотики могут иметь радиозащитный эффект. Всего было проведено пять рандомизированных контролируемых испытаний различного качества и размера в отношении пробиотиков при лучевой болезни тонкой кишки [Salminen et al . 1988; Делия и др. . 2007; Урбанчек и др. . 2001; Giralt и др. . 2008; Chitapanarux и др. . 2010]. Исследованные агенты включают пробиотический препарат VSL # 3 (пробиотик, содержащий восемь штаммов живых молочнокислых бактерий и бифидобактерий) и живые Lactobacillus acidophilus плюс бифидобактерии bifidum.Хотя некоторые исследования показали значительное улучшение симптомов диареи и снижение использования противодиарейных препаратов, дизайн исследования и количество пациентов не позволяют нам в полной мере отстаивать пробиотики в настоящее время. Требуется полное тестирование безопасности отдельных соединений с последующими более крупными, хорошо спланированными двойными слепыми рандомизированными контролируемыми испытаниями. АмифостинАмифостин — это цитопротекторный адъювант, используемый в химиотерапии рака. Он снижает частоту возникновения ксеростомии при применении перед лучевой терапией рака головы и шеи [Jha et al. 2012]. Предварительные исследования показывают, что амифостин может также защищать кишечник от радиационно-индуцированной токсичности [Athanassiou et al. 2003; Бен-Йозеф и др. 2002; Леонард и др. . 2005], но необходимы дальнейшие исследования, чтобы определить его истинную ценность. АнтиоксидантыБыло высказано предположение, что цитотоксическое действие ионизирующего излучения на эпителий ЖКТ связано с окислительным стрессом. Исследования на животных показали, что обработка витамином Е и / или селеном перед лучевой терапией помогает минимизировать окислительный стресс [Felemovicius et al. 1995; Mutlu-Türkoğlu et al. 2000], указывая на то, что предварительная обработка антиоксидантами может иметь некоторые положительные эффекты против радиационно-индуцированного поражения кишечника [Empey et al. 1992]. Требуются дальнейшие исследования этих агентов. ТедуглутидТедуглутид представляет собой аналог глюкагоноподобного пептида-2. Исследования на животных показали увеличение выживаемости стволовых клеток кишечных крипт при введении перед облучением всего тела у мышей [Booth et al. 2004].Теоретически это предполагает, что он может играть полезную защитную роль в предотвращении радиационно-индуцированного поражения кишечника, но на людях требуются дальнейшие исследования. Пищевые добавкиБыло показано, что глутамин и аргинин оказывают защитное действие на слизистую кишечника крыс, получавших лучевую терапию [Yavas et al. 2012]. Однако клинические исследования показали, что глутамин не защищает от острого радиационно-индуцированного заболевания тонкой кишки у людей [Kozelsky et al. 2003; Vidal-Casariego et al. 2013]. Нет никаких доказательств того, что диета с ограничением лактозы предотвратит вызванное радиацией заболевание тонкой кишки, несмотря на ее полезность при лечении диареи у некоторых пациентов, вызванной лучевой терапией [Stryker and Bartholomew, 1986]. Недавний обзор 22 исследований, посвященных эффективности диетических вмешательств для противодействия острой желудочно-кишечной токсичности во время терапевтической лучевой терапии органов малого таза [Wedlake et al. 2013] рассмотрели доказательства в пользу элементной формулы, диет с низким или модифицированным содержанием жиров, диет с низким или высоким содержанием клетчатки, диет с низким содержанием лактозы, пробиотиков и симбиотиков.Авторы обнаружили, что в настоящее время недостаточно убедительных доказательств, чтобы рекомендовать вмешательство в питание, и что необходимы дальнейшие исследования высокого качества. СукральфатСукральфат представляет собой высокосульфатированный полианионный дисахарид, используемый для лечения диспепсии. Считается, что он стимулирует заживление эпителия и формирует защитный барьер над поврежденными поверхностями слизистой оболочки [Denton et al. 2002]. Существуют рандомизированные контролируемые доказательства того, что сукральфат может помочь в лечении кровотечения при лучевом проктите, но нет доказательств того, что он полезен для профилактики радиационно-индуцированного заболевания тонкой кишки.Рандомизированное двойное слепое исследование не показало значительной разницы между сукралфатом и плацебо в этой ситуации [Martenson et al. 2000]. Хирургические методыОписано хирургическое наложение рассасывающихся сетчатых перевязок и силиконовых протезов для предотвращения радиационно-индуцированного заболевания тонкой кишки [Devereux et al. 1984; Kavanah et al. 1985; Sener et al. 1989; Родье и др. 1991; Beitler et al. 1997; Шугарбейкер, 1983].Эти вмешательства направлены на снижение токсичности за счет исключения тонкой кишки из облученных областей. Однако результаты не всегда воспроизводятся в клинической практике и обычно не используются во многих центрах. Полное исключение тонкой кишки с помощью сетчатой повязки в раннем послеоперационном периоде должно предотвратить прилипание тонкой кишки к тазу. Считается, что после абсорбции сеткой тонкий кишечник сохраняет достаточную подвижность, поэтому его можно временно исключить из таза с помощью простых методов позиционирования [Waddell et al. 1999]. В одной серии случаев из 60 пациентов после резекции ректальных или гинекологических злокачественных новообразований были вставлены сетчатые слинги из полигликолевой кислоты. Все пациенты получали послеоперационную лучевую терапию стандартными фракциями. При среднем сроке наблюдения 28 месяцев случаев радиационно-индуцированного заболевания тонкой кишки не наблюдалось [Devereux et al. 1988]. Исследование 45 пациентов с резектабельной карциномой прямой кишки показало аналогичные результаты [Dasmahapatra and Swaminathan, 1991]. Силиконовые протезы, занимающие много места, использовались для отделения тонкой кишки от таза [McGinley et al. 1980], однако они могут оказывать массовое воздействие на окружающие структуры, приводя к умеренному гидронефрозу [Nguyen and Hamper, 1997]. Для удаления протеза после завершения лучевой терапии может потребоваться повторная операция, хотя для решения этой проблемы были разработаны надувные солевые имплантаты [Sezeur et al. 1990]. Лечение острого радиационно-индуцированного заболевания тонкой кишкиПациенты с острым энтеритом могут испытывать самые разные симптомы. Лечение можно разделить на поддерживающие и диетические вмешательства, а также на специфические медикаментозные и хирургические методы лечения. В тяжелых случаях может потребоваться пересмотр последующего онкологического режима. Поддерживающее лечениеМогут быть назначены многочисленные лекарства, которые не играют никакой роли в коррекции основной патофизиологии заболевания, но направлены на минимизацию симптомов. Лечение первой линии острой лучевой диареи — это противодиарейные препараты, такие как лоперамид или кофенотроп [Wadler et al. 1998]. Субсалицилат висмута также рекомендован при диарее и тошноте [National Cancer Institute, 2012], но, как и в случае со многими из этих поддерживающих методов лечения, доказательная база основана только на клиническом опыте и единодушных мнениях. Пациентам также могут быть полезны антихолинергические спазмолитики для облегчения спазмов кишечника, анальгетики от боли или противорвотные средства от тошноты [National Cancer Institute, 2012]. Важно отметить, что симптомы часто исчезают после завершения режима лучевой терапии.Клиницисты должны обеспечить уверенность в себе наряду с обучением относительно потенциальных хронических проблем [Андреев et al. 2012]. Также появляются новые данные о том, что мальабсорбция желчных кислот может происходить в острой стадии, и это следует учитывать клиницистам [Harris et al . 2012]. Диетические процедурыВорсинки кишечника могут быть повреждены лучевой терапией, что приводит к снижению или потере пищеварительных ферментов, что приводит к нарушению всасывания питательных веществ [Czito and Willett, 2010].Важно обеспечить потребление достаточной калорийности и жидкости, что может быть затруднено в этих условиях; диетолог может дать целенаправленный совет. Был предложен ряд диетических модификаций для лечения симптомов радиационно-индуцированного заболевания тонкой кишки, но есть лишь ограниченные доказательства того, что они полезны. Диета, не содержащая лактозы, с низким содержанием жиров и остатков, может улучшить симптомы у пациентов. Однако результаты других испытаний, оценивающих влияние диет с ограничением лактозы на радиационно-индуцированную диарею, дали противоречивые результаты [Stryker and Bartholomew, 1986; Пока, и др. 1992]. Важно учитывать, что при таком подходе следует использовать пищевые добавки, не содержащие лактозу. В клинической практике предлагается прагматический подход, которому может помочь ведение дневника питания, соответствующего симптомам. ОктреотидАналог соматостатина октреотид используется для лечения диареи, вызванной химиотерапией, и радиационно-индуцированного заболевания тонкой кишки [Yavuz et al. 2002]. Это октапептид, имитирующий натуральный соматостатин и снижающий перистальтику кишечника.Рандомизированное контролируемое исследование, сравнивающее октреотида ацетат (100 мкг три раза в день) с гидрохлоридом дифеноксилата плюс сульфат атропина (2,5 мг четыре раза в день) при остром радиационно-индуцированном заболевании тонкой кишки, показало, что диарея проходит быстрее и уменьшается количество пациентов, нуждающихся в для прекращения лучевой терапии органов малого таза в группе октреотида [Yavuz et al. 2002]. 5-аминосалициловые кислотыНет доказательств пользы 5-аминосалициловых кислот (5-ASA) при остром или хроническом радиационно-индуцированном заболевании тонкой кишки, и было показано, что они могут усиливать симптомы в острых условиях [ Гибсон и др. 2013]. ХирургияХирургия требуется при остром энтерите очень редко. По возможности этого следует избегать из-за плохого заживления ран и опасений по поводу утечки из хирургических анастомозов [Galland and Spencer, 1986]. Конечно, может потребоваться операция у некоторых пациентов, недавно перенесших лучевую терапию, но хирурги должны проявлять осторожность и осторожность при этом. Лечение хронического радиационно-индуцированного заболевания тонкой кишкиПациентам с абдоминальными симптомами, возникающими после предшествующей лучевой терапии, необходимо тщательное обследование и обследование гастроэнтерологом, а также план лечения, который может включать других специалистов в области здравоохранения.Лечение можно разделить на те, которые нацелены на конкретные вторичные образования, которые обычно возникают после лучевой терапии, и поддерживающие, пищевые, медиации и другие вмешательства, направленные на противодействие эффекту энтеропатии. Поддерживающее лечениеВ острых случаях пациенты могут нуждаться в симптоматических лекарствах периодически или на регулярной основе. Опять же, это включает средства против моторики, анальгетики и противорвотные средства. Одно небольшое исследование оценило эффективность лоперамида у пациентов с хроническим радиационно-индуцированным заболеванием тонкой кишки, показав улучшение времени прохождения через кишечник, абсорбции желчных солей и диареи [Yeoh et al. 1993]. Вторичные эффекты хронической радиационно-индуцированной болезни тонкой кишкиАнтибиотики при избыточном бактериальном росте тонкой кишкиПовреждение тонкой кишки создает области нарушения моторики и застоя, ведущие к избыточному бактериальному росту [Husebye et al. 1995]. В отличие от толстой кишки, которая богата бактериями, в тонкой кишке обычно меньше 104 организмов на миллилитр [Quigley and Quera, 2006]. Когда происходит избыточный бактериальный рост, наиболее распространенными изолятами тощей кишки являются виды Escherichia coli, Streptococcus, Lactobacillus, Bacteroides и Enterococcus видов [Bouhnik et al. 1999]. Также используются антибиотики широкого спектра действия: к ним относятся тетрациклин, коамоксиклав, ципрофлоксацин и рифаксимин. Следует соблюдать рекомендации по применению местных антибиотиков. Пациентам часто требуется повторный курс лечения, а многим требуется длительная поддерживающая терапия в более низких дозах. Некоторые врачи рекомендуют чередовать разные антибиотики для снижения риска резистентности [Quigley and Abu-Shanab, 2010]. Хотя пробиотическая терапия использовалась для профилактики и лечения острого радиационно-индуцированного заболевания тонкой кишки, в настоящее время нет доказательств их эффективности в хронических условиях. Холестирамин и колесевелам при мальабсорбции желчных солейВ общей сложности 95% желчных кислот абсорбируются в терминальном отделе подвздошной кишки, и радиационное поражение этой области может вызвать мальабсорбцию желчных кислот (BAM) [Andersson et al. 1978]. Это можно проверить с помощью исследования Se-HCAT, однако это исследование широко не используется, и многие клиницисты рекомендуют эмпирическое лечение. Считается, что БАМ отвечает за симптомы у 35–72% пациентов с хроническим радиационно-индуцированным заболеванием тонкой кишки, страдающих диареей [Theis et al. 2010; Андреев и др. 2005; Danielsson et al. 1991; Ладгейт и Меррик, 1985; Arlow et al. 1987]. Он хорошо реагирует на холестирамин, однако он не очень приятен на вкус, и 68% пациентов прекращают его прием через 1 год [Kamal-Bahl et al. 2007]. Альтернативами являются колестипол и колесевелам, которые также связывают соли желчных кислот. Колесевелам лучше переносится, и есть доказательства его пользы в этой ситуации; однако в настоящее время он не лицензирован для этого показания и относительно дорог по сравнению с другими препаратами [Puleston et al. 2005; Wedlake et al. 2009]. Питание и сопутствующие методы леченияБыло проведено исследование исключения определенных пищевых продуктов и использования пищевых добавок при хроническом радиационно-индуцированном заболевании тонкой кишки, но, опять же, данные об их пользе неодинаковы. При рассмотрении исключающих диет важно учитывать диетические факторы. Пациентов можно обследовать на непереносимость лактозы и других углеводов с помощью таких методов, как дыхательный тест.Сниженная чувствительность этих неинвазивных тестов означает, что может потребоваться эмпирическое, но управляемое исследование исключения. Было доказано, что безлактозные диеты эффективны у пациентов с непереносимостью лактозы [Beer et al. 1985]. Мы также использовали диету исключения FODMAP (ферментируемые олигосахариды, дисахариды, моносахариды и пилолы) для некоторых из этих пациентов, которые впоследствии сообщили об улучшении их симптомов, однако в настоящее время нет опубликованных исследований, оценивающих этот подход. Как ни странно, некоторые пациенты, кажется, связывают обострение своих симптомов с приемом определенных продуктов. Одно исследование 26 женщин с хроническим радиационно-индуцированным заболеванием тонкой кишки по сравнению с 21 нормальной контрольной группой показало, что 50% пациентов заметили усиление симптомов после употребления кексов с отрубями, ягод, капусты, брюссельской капусты, брокколи, салата, салата Цезарь. , печеная фасоль, чечевица и орехи по сравнению с 14% в контроле. В общей сложности 85% этих пациентов могли переносить только меньшие порции этих продуктов.Исследование предполагает, что меньшие, более частые порции могут улучшить переносимость определенных продуктов и подкрепляют тщательный сбор анамнеза и индивидуальный подход ко всем пациентам [Sekhon, 2000]. Важно, чтобы пациенты получали достаточное количество калорий и, по возможности, поддерживали энтерально. Некоторым пациентам потребуется длительный прием высококалорийных пищевых добавок: так называемого «глотка». Важны регулярные измерения и добавление витаминов и минералов, включая железо, фолиевую кислоту, витамин B12, витамин D, магний, кальций, микроэлементы и жирорастворимые витамины. Некоторым пациентам необходима парентеральная поддержка жидкостью и электролитами. Кишечная недостаточность из-за обширной энтеропатии, вызванной предшествующей лучевой терапией, является признанным и относительно частым показанием для домашнего парентерального питания (ПП). Ведение таких пациентов должно координироваться в специализированных центрах. Последнее британское исследование по искусственному питанию показало, что 3,8% пациентов в Великобритании, получающих ПП на дому, страдали лучевой энтеропатией [Smith et al. 2011]. Было показано, что отдых кишечника с помощью PN может улучшить клинические и рентгенологические данные у пациентов с лучевым поражением тонкой кишки [Loiudice and Lang, 1983] и что пищевую автономию и выживаемость можно улучшить, если пациенты сначала будут лечить кишечным отдыхом и дома PN [Gavazzi et al. 2006]. Однако также сообщалось [Silvain, 1992], что пациенты с хроническим радиационно-индуцированным заболеванием тонкой кишки могут с большей вероятностью страдать от клинического рецидива при консервативном лечении с помощью PN по сравнению с пациентами, перенесшими хирургическое вмешательство [Scolapio et al. 1999, 2002]. Гипербарический кислородГипербарический кислород (ГБО) снижает гипоксию тканей кишечника, пораженного ишемическим повреждением от ионизирующего излучения, за счет стимулирования ангиогенеза.Также было высказано предположение об антибактериальном эффекте [Bennett et al. 2012]. ГБО является единственной терапией, увеличивающей количество кровеносных сосудов в облученной ткани [Bennett et al. 2012] и может позволить лечение нескольких участков тонкой кишки. Лечение проводится в барокамерах в течение нескольких недель. Систематический обзор литературы показал, что в 67 из 74 публикаций сообщалось о положительных результатах, когда ГБО применялся в качестве лечения или профилактики отсроченного лучевого поражения [Feldmeier and Hampson, 2002]. Крупное многоцентровое исследование в Великобритании, исследование Hyperbaric Oxygen Therapy II (HOT-II), завершило набор, и его результаты с нетерпением ждут. Хотя ГБО терапия в значительной степени безопасна в использовании, она ограничена наличием камер. Пентоксифиллин и токоферолПентоксифиллин является производным ксантина, а токоферолы представляют собой класс химических соединений с активностью витамина Е [Hamama et al. 2012]. Было высказано предположение, что комбинация этих препаратов может уменьшить радиационно-индуцированный фиброз за счет антиоксидантных эффектов [Gothard et al. 2005]. Исследование 30 пациентов с хроническим лучевым энтеритом или проктитом показало улучшение симптомов у 71% пациентов, получавших эту комбинированную терапию, по сравнению с 33% пациентов, получавших только поддерживающую терапию [Hille et al. 2005]. Для полной оценки этих методов лечения необходимы дальнейшие исследования. Противовоспалительные средстваИсследования относительно использования аминосалицилатов при хроническом радиационно-индуцированном заболевании тонкой кишки ограничены. Сульфасалазин был исследован в серии случаев у четырех пациентов с хроническим радиационно-индуцированным заболеванием тонкой кишки, все пациенты показали клиническое и радиологическое улучшение в течение 1 года терапии [Goldstein et al. 1976]. Другое исследование показало, что метилпреднизолон может усиливать эффект «кишечного покоя», облегчаемого парентеральным питанием, но нет никаких существенных доказательств того, что кортикостероиды могут применяться у этих пациентов [Loiudice and Lang, 1983]. Эндоскопическая терапияИногда у пациентов может развиваться мелена или железодефицитная анемия. Телеангиэктазия может образовываться в любом облученном участке кишечника, и ее бывает трудно обнаружить. Капсульная эндоскопия может быть полезной, но ее следует избегать при стриктурах.Коагуляция аргоновой плазмы хорошо описана при лечении лучевой проктопатии [Leiper and Morris, 2007], но также успешно использовалась для радиационно-индуцированных поражений в дистальном отделе двенадцатиперстной кишки [Toyoda et al. 2004] и подвздошной кишки [Pasha et al. 2007] и может вводиться в тощую кишку, а также с помощью двойной баллонной энтероскопии. Его следует использовать разумно, учитывая риск перфорации, особенно в аномальных тканях. Энтероскопия также может оказаться альтернативой хирургическому лечению стриктур тонкой кишки [Haruta et al. 2005; Kita et al. 2007]. ХирургияХирургия является сложной задачей для пациентов, ранее перенесших абдоминальную лучевую терапию. Часто возникают спайки, кишечник может быть очень фиброзным, и с ним трудно справиться [Jao et al. 1986; Луна-Перес и др. 2001]. Заживление ран также может быть затруднено [Luna-Pérez et al. 2001]. Некоторые пациенты, особенно со стриктурами и обструктивными симптомами, нуждаются в хирургическом вмешательстве, поскольку они не могут контролировать симптомы или постоянно страдают от нарушения питания из-за заболевания тонкой кишки.Пациенты с обширным поражением тонкой кишки подвержены риску синдрома короткой кишки или проксимальной стомы с высоким выходом, что является серьезной проблемой для лечения. Важно отметить, что одна операция может привести к другой, еще больше увеличивая риск развития короткой кишки. Крайне важно, чтобы те, кому предстоит хирургическое вмешательство, прошли тщательную оценку с помощью радиологических и других методов и управлялись многопрофильной командой, которая включает в себя поддержку в области питания и хирурга, имеющего опыт ведения таких пациентов [Андреев et al. 2012]. В исследовании хирургического лечения радиационно-индуцированного заболевания тонкой кишки, в котором участвовали 48 пациентов, перенесших расширенную резекцию кишечника с анастомозом, была выявлена значительная послеоперационная заболеваемость — 21,7%. Общая выживаемость после радиационных осложнений у пациентов без рецидива неопластической болезни составила 89%, 79% и 69% через 1, 3 и 5 лет после операции соответственно [Onodera et al. 2005]. ЗаключениеНачинает вырисовываться более четкая картина ведения радиационно-индуцированного заболевания тонкой кишки.Однако оптимальные способы предотвращения радиационно-индуцированного повреждения тонкой кишки, а также эффективное лечение для всех пациентов до сих пор неясны. Новые методы лучевой терапии продолжают снижать непреднамеренное воздействие на соседние нормальные ткани, а профилактические средства, включая ингибиторы АПФ и статины, являются захватывающими областями будущих исследований. Лечение радиационно-индуцированного заболевания тонкой кишки в острой фазе в значительной степени является поддерживающим. Для тех, у кого проблемы с желудочно-кишечным трактом, возникшие в течение нескольких лет после лучевой терапии, ключевым моментом является признание и направление на консультацию специалиста от гастроэнтеролога, который интересуется этой областью.Предлагаемые клинические рекомендации приведены в. Пациентам необходимо целенаправленное обследование каждого из имеющихся у них симптомов, поскольку многие из них имеют несколько потенциальных причин. Могут быть предложены конкретные методы лечения, а также ценный вклад других специалистов в области здравоохранения, например диетологи. Новые методы лечения, такие как HBO, предлагают многообещающие перспективы. Небольшую группу пациентов, которым требуется операция для облегчения своих проблем, следует направлять к хирургам, имеющим опыт работы в этой сложной ситуации. Таблица 1.Клинические рекомендации по лечению лучевой болезни тонкой кишки.
|



