Гемолитическая болезнь новорожденного — Hemolytic disease of the newborn
Аллоиммунное состояние плода
Гемолитическая болезнь новорожденного , также известная как гемолитическая болезнь плода и новорожденного , HDN , HDFN или эритробластоз плода , представляет собой аллоиммунное заболевание, которое развивается у плода при рождении или в ближайшем будущем , когда молекулы IgG (один из пяти основных типов) из антител ) , полученных с помощью материнского прохода через плаценту . Среди этих антител некоторые , которые атакуют антигены о красных кровяных клетках в крови плода , разрушение и уничтожение клеток ( гемолиз ). У плода может развиться ретикулоцитоз и анемия . Это заболевание плода варьируется от легкой до очень тяжелой, и может произойти смерть плода от сердечной недостаточности ( водянка плода ). При средней или тяжелой форме заболевания в крови плода присутствует много эритробластов (незрелых красных кровяных телец), поэтому эти формы заболевания можно назвать эритробластозом плода (или эритробластозом плода ).
HDFN представляет собой нарушение иммунной привилегии плода или какую-либо другую форму нарушения иммунной толерантности во время беременности . Классифицируются различные типы HDFN, по которым аллоантиген вызывает ответ. В порядке заболеваемости типы включают ABO , анти-RhD , анти-RhE , анти-Rhc , анти-Rhe, анти-RhC, комбинации мультиантигенов и анти-Kell .
Признаки и симптомы
Признаки гемолитической болезни новорожденного включают положительный прямой тест Кумбса (также называемый тестом прямой агглютинации), повышенный уровень пуповинного билирубина и гемолитическую анемию . У новорожденного с этим заболеванием также возможны нейтропения и неонатальная аллоиммунная тромбоцитопения . Гемолиз приводит к повышению уровня билирубина . После родов не билирубин больше не очищается (через плаценту) из крови новорожденной и симптомов от желтухи (желтоватой кожи и пожелтения белков глаз, или желтухи ) увеличения в течение 24 часов после рождения. Как и при других формах тяжелой желтухи новорожденных , у новорожденных существует вероятность развития острой или хронической ядерной желтухи , однако риск ядерной желтухи при ГБН выше из-за быстрого и массивного разрушения клеток крови. Важно отметить, что изоиммунизация является фактором риска нейротоксичности и снижает уровень ядерной желтухи. Нелеченная глубокая анемия может вызвать сердечную недостаточность с высоким выбросом , бледность , увеличение печени и / или селезенки , генерализованный отек и респираторный дистресс .
Важно отметить, что изоиммунизация является фактором риска нейротоксичности и снижает уровень ядерной желтухи. Нелеченная глубокая анемия может вызвать сердечную недостаточность с высоким выбросом , бледность , увеличение печени и / или селезенки , генерализованный отек и респираторный дистресс .
ГБН может быть причиной водянки плода , часто тяжелой формы пренатальной сердечной недостаточности, которая вызывает отек плода .
Осложнения
Осложнения HDN могут включать ядерную желчь , гепатоспленомегалию , синдром уплотненной (утолщенной или высушенной) желчи и / или зеленоватое окрашивание зубов , гемолитическую анемию и повреждение печени из-за избытка билирубина. Состояния, которые могут вызывать подобные симптомы в период новорожденности, включают: приобретенную гемолитическую анемию , врожденную токсоплазму , врожденную инфекцию сифилиса , врожденную непроходимость желчных протоков и цитомегаловирусную (ЦМВ) инфекцию.
- Высокий при рождении или быстро повышающийся билирубин
- Длительная гипербилирубинемия
- Неврологическая дисфункция, вызванная билирубином
- Церебральный паралич
- Kernicterus
- Нейтропения
- Тромбоцитопения
- Гемолитическая анемия — НЕЛЬЗЯ лечить железом
- Поздняя анемия — НЕЛЬЗЯ лечить железом.
 Может сохраняться до 12 недель после рождения.
Может сохраняться до 12 недель после рождения.
Патофизиология
Антитела вырабатываются, когда организм подвергается воздействию антигена, чужеродного для организма. Если мать подвергается воздействию чужеродного антигена и продуцирует IgG (в отличие от IgM, который не проникает через плаценту), IgG будет нацеливаться на антиген, если он присутствует у плода, и может повлиять на него внутриутробно и сохраниться после родов. Три наиболее распространенных модели, в которых женщина становится сенсибилизированной к определенному антигену (т. Е. Вырабатывает антитела IgG против), — это кровотечение, переливание крови и несовместимость по системе АВО.
Кровоизлияние у плода и матери , которое представляет собой движение клеток крови плода через плаценту, может происходить во время аборта , внематочной беременности , родов , разрывов плаценты во время беременности (часто вызванных травмой) или медицинских процедур, проводимых во время беременности, которые нарушают стенка матки. При последующих беременностях, если у плода наблюдается аналогичная несовместимость, эти антитела могут проникать через плаценту в кровоток плода, прикрепляться к эритроцитам и вызывать их разрушение ( гемолиз ). Это основная причина ГБН, потому что 75% беременностей приводят к контакту между кровью плода и матери, а у 15–50% беременностей наблюдаются кровотечения с потенциалом иммунной сенсибилизации. Количество крови плода, необходимое для сенсибилизации матери, зависит от иммунной системы человека и колеблется от 0,1 мл до 30 мл.
При последующих беременностях, если у плода наблюдается аналогичная несовместимость, эти антитела могут проникать через плаценту в кровоток плода, прикрепляться к эритроцитам и вызывать их разрушение ( гемолиз ). Это основная причина ГБН, потому что 75% беременностей приводят к контакту между кровью плода и матери, а у 15–50% беременностей наблюдаются кровотечения с потенциалом иммунной сенсибилизации. Количество крови плода, необходимое для сенсибилизации матери, зависит от иммунной системы человека и колеблется от 0,1 мл до 30 мл.
Возможно, женщине сделали терапевтическое переливание крови . Типирование системы групп крови ABO и антигена D резус (Rh) системы групп крови является обычным делом перед переливанием. Были высказаны предложения, что женщинам детородного возраста или молодым девушкам не следует делать переливание Rhc-положительной крови или Kell 1 -положительной крови, чтобы избежать возможной сенсибилизации, но это приведет к перегрузке ресурсов служб переливания крови, и это в настоящее время считается неэкономичным проводить скрининг на эти группы крови. HDFN также может быть вызвана антителами к множеству других антигенов системы группы крови , но Kell и Rh встречаются наиболее часто.
HDFN также может быть вызвана антителами к множеству других антигенов системы группы крови , но Kell и Rh встречаются наиболее часто.
Третья модель сенсибилизации может возникать у женщин с группой крови O. Иммунный ответ на антигены A и B, широко распространенные в окружающей среде, обычно приводит к продукции IgM или IgG анти-A и анти-B антител в раннем возрасте. Женщины с группой крови O более склонны, чем женщины с типом A и B, к выработке IgG-антител к A и анти-B, и эти IgG-антитела способны проникать через плаценту. По неизвестным причинам частота материнских антител против антигенов типа A и B типа IgG, которые потенциально могут вызвать гемолитическую болезнь новорожденного, выше, чем наблюдаемая частота «болезни АВО». Около 15% беременностей происходит от матери типа O и ребенка типа A или типа B; только 3% этих беременностей заканчиваются гемолитической болезнью из-за несовместимости A / B / O. В отличие от антител к антигенам A и B, резус-антитела обычно не образуются при воздействии антигенов окружающей среды. В случаях несовместимости по системе ABO и несовместимости по резус-фактору риск аллоиммунизации снижается, поскольку эритроциты плода удаляются из материнского кровотока из-за антител против ABO до того, как они могут вызвать анти-резус-ответ.
В случаях несовместимости по системе ABO и несовместимости по резус-фактору риск аллоиммунизации снижается, поскольку эритроциты плода удаляются из материнского кровотока из-за антител против ABO до того, как они могут вызвать анти-резус-ответ.
Специфические антитела
- Anti-D — единственная предотвратимая форма ГБН. После введения в 1968 г. иммуноглобулина Rho-D ( Rhogam ), который предотвращает выработку материнских антител Rho-D, заболеваемость анти-D HDN резко снизилась.
- И анти-C, и анти-c могут показывать отрицательный DAT, но все же имеют тяжелое поражение младенца. Непрямой Кумбс также должен быть запущен.
- Anti-M также рекомендует тестирование на антигены, чтобы исключить наличие HDN, поскольку прямые половые клетки могут дать отрицательный результат у серьезно пораженного ребенка.
- Anti-Kell может вызвать тяжелую анемию независимо от титра. Anti-Kell подавляет костный мозг, подавляя клетки-предшественники эритроидных клеток.
- Антигены Kidd также присутствуют на эндотелиальных клетках почек.

- Одно исследование, проведенное Мораном и др., Показало, что титры анти-E ненадежны. Их наиболее тяжелый случай гемолитической болезни новорожденных произошел с титрами 1: 2. Моран заявляет, что было бы неразумно отвергать анти-Е как имеющий незначительные клинические последствия.
Диагностика
Диагноз из ГБН основывается на истории и лабораторных исследований:
Анализы крови новорожденного
- Биохимические тесты на желтуху, включая уровни общего и прямого билирубина .
- Полный анализ крови ( ОАК ), который может показать снижение гемоглобина и гематокрита из-за разрушения эритроцитов.
- Количество ретикулоцитов, которое обычно увеличивается по мере того, как костный мозг вырабатывает новые красные кровяные тельца, чтобы заменить те, которые разрушаются, и мазок периферической крови, чтобы посмотреть на морфологию клеток . При значительном гемолизе мазок покажет шистоциты (фрагментированные эритроциты), ретикулоцитоз и, в тяжелых случаях, эритробласты (также известные как ядросодержащие эритроциты).

- Положительный прямой тест Кумбса (может быть отрицательным после переливания межматочной крови плода)
Анализы крови матери
Анализы крови отца (необходимы редко)
- Статус антигена эритроцитов
Типы (классифицируются по серологии)
Типы ГБН классифицируются по типу задействованных антигенов. Основные типы — это ABO HDN, Rhesus HDN, Kell HDN и другие антитела. Гемолитическая болезнь АВО новорожденных может варьироваться от легкой до тяжелой, но, как правило, это легкое заболевание. Это может быть вызвано антителами к А и В. Резус-D гемолитическая болезнь новорожденных (часто называемая резус-болезнью) является наиболее распространенной формой тяжелой ГБН. Резус-гемолитическая болезнь новорожденных может варьироваться от легкой до тяжелой — это третья по частоте форма тяжелой ГБН. Резус Е и резус С гемолитической болезни новорожденных встречаются редко. Комбинации антител, например анти-Rhc и анти-RhE, встречающиеся вместе, могут быть особенно серьезными.
Анти-Келлская гемолитическая болезнь новорожденных чаще всего вызывается антителами против K 1 , второй по распространенности формой тяжелой ГБН. Более половины случаев ГБН, связанной с анти-K 1 , вызваны многократными переливаниями крови. Антитела к другим антигенам Kell встречаются редко.
Профилактика
В случае несовместимости Rho (D) для предотвращения сенсибилизации назначают иммуноглобулин Rho (D) . Однако не существует сопоставимой иммунотерапии при несовместимости других групп крови.
Ранняя беременность
- ВВИГ — ВВИГ означает внутривенный иммуноглобулин. Он используется в случаях предыдущей потери, высоких материнских титров, известных агрессивных антител и в случаях, когда религия препятствует переливанию крови. ВВИГ может быть более эффективным, чем только ВМИ. Смертность плода снизилась на 36% в группе ВВИГ и ВМИ, чем в группе только ВМО. Совместное использование ВВИГ и плазмафереза может снизить или исключить необходимость проведения ВМИ.

- Плазмаферез — плазмаферез направлен на снижение материнского титра путем прямого замещения плазмы и физического удаления антител. Плазмаферез и ВВИГ вместе можно использовать даже у женщин с ранее отечным плодом и потерей плода.
Средняя и поздняя беременность
- IUT — Внутриматочная трансфузия (IUT) выполняется либо внутрибрюшинным переливанием (IPT), либо внутривенным переливанием (IVT). IVT предпочтительнее IPT. ВМС проводятся только до 35 недель. После этого риск ВМС больше, чем риск послеродового переливания крови.
- Стероиды — стероиды иногда назначают матери перед ВМС и ранними родами для созревания легких плода.
- Фенобарбитал — иногда фенобарбитал назначают матери, чтобы помочь созреть печень плода и уменьшить гипербилирубинемию.
- Ранняя доставка — доставка может произойти в любое время после достижения возраста жизнеспособности. Возможны экстренные роды из-за неудавшейся ВМС вместе с индукцией родов на 35–38 неделе.
Резус-отрицательным матерям, беременным резус-положительным младенцем, предлагается иммуноглобулин Rho (D) (RhIG или RhoGam) на 28 неделе беременности, на 34 неделе и в течение 48 часов после родов, чтобы предотвратить сенсибилизацию к антигену D. . Он работает путем связывания любых эритроцитов плода с антигеном D до того, как мать сможет вызвать иммунный ответ и сформировать анти-D IgG. Недостатком дородового введения RhIG является то, что он вызывает положительный скрининг на антитела при тестировании матери, что может быть трудно отличить от естественных иммунологических ответов, которые приводят к продукции антител. Без иммуноглобулина Rho (D) риск изоиммунизации составляет примерно 17%; при правильном применении риск снижается до менее 0,1–0,2%.
. Он работает путем связывания любых эритроцитов плода с антигеном D до того, как мать сможет вызвать иммунный ответ и сформировать анти-D IgG. Недостатком дородового введения RhIG является то, что он вызывает положительный скрининг на антитела при тестировании матери, что может быть трудно отличить от естественных иммунологических ответов, которые приводят к продукции антител. Без иммуноглобулина Rho (D) риск изоиммунизации составляет примерно 17%; при правильном применении риск снижается до менее 0,1–0,2%.
Тестирование после рождения
- Кумбс — в определенных случаях (например, когда есть опасения по поводу несовместимости групп крови между мамой и ребенком) после рождения ребенку будет проведен прямой тест Кумбса, чтобы подтвердить наличие антител, прикрепленных к эритроцитам ребенка. Этот тест проводится на пуповинной крови младенца.
В некоторых случаях прямой результат Кумбса будет отрицательным, но может произойти тяжелая, даже фатальная ГБН. Непрямой Кумбс необходимо запускать в случаях анти-C, анти-c и анти-M. Младенцам с анти-М также рекомендуется пройти тестирование на антиген, чтобы исключить наличие ГБН. Приведенные ниже тесты часто полезны в случаях гемолитической болезни новорожденных, но не требуются для лечения всех новорожденных.
Младенцам с анти-М также рекомендуется пройти тестирование на антиген, чтобы исключить наличие ГБН. Приведенные ниже тесты часто полезны в случаях гемолитической болезни новорожденных, но не требуются для лечения всех новорожденных.
- Hgb — гемоглобин младенца следует исследовать из пуповинной крови.
- Количество ретикулоцитов — количество ретикулоцитов повышается, когда ребенок вырабатывает больше красных
Лекция 7. Детские болезни. Гемолитическая болезнь новорожденных. —
ГБН – это заболевание в основе которого лежит гемолиз эритроцитов плода и новорожденного, обусловленный несовместимостью крови матери и плода по различным эритроцитарным антигенам имеющимся в крови плода наследственно от отца и отсутствующих в крови матери.
Впервые заболевание было выявлено Буллом в 1875 году. В России Абрикосовым в 1915 году.
ГБН встречается у 0,5-0,7% новорожденных детей и занимает 4-5 место в структуре заболевания детей 1 недели жизни. В структуре перинатальной смертности составляет 3-7%. Тяжелые формы ведут к значительным социально экономическим потерям, так как дети рождаются инвалидами с тяжелыми церебральными нарушениями. Наиболее часто встречаются при несовместимости по Rh-фактору — 1 случай на 200-250 родов. …??? Основных эритроцитарных групповых систем объединяют более 100 антигенов, а также частные и общие с другими тканями эритроцитарные антигены. Следовательно, почти всегда эритроциты ребенка, имеют какие либо антигены отца, отсутствующие у матери. Вместе с тем ГБН вызывается несовместимостью по Rh-фактору (92%) или по АВО (7%) и редко по другим (1,5%) антигенным системам ввиду их меньшей иммуногенностью к эритроцитам (более 8000 Ag).
В структуре перинатальной смертности составляет 3-7%. Тяжелые формы ведут к значительным социально экономическим потерям, так как дети рождаются инвалидами с тяжелыми церебральными нарушениями. Наиболее часто встречаются при несовместимости по Rh-фактору — 1 случай на 200-250 родов. …??? Основных эритроцитарных групповых систем объединяют более 100 антигенов, а также частные и общие с другими тканями эритроцитарные антигены. Следовательно, почти всегда эритроциты ребенка, имеют какие либо антигены отца, отсутствующие у матери. Вместе с тем ГБН вызывается несовместимостью по Rh-фактору (92%) или по АВО (7%) и редко по другим (1,5%) антигенным системам ввиду их меньшей иммуногенностью к эритроцитам (более 8000 Ag).
Антигенная система Rh состоит из 6 основных антигенов, синтез которых определяет 3 пары генов. По Фишеру антигены обозначают Сс, Dd, Ee, Rh-положительные эритроциты содержат D-Ag, Rh-отрицательные его не имеют, хотя у них есть другие антигены системы Rh – d. Несовместимость по АВО-Ag приводит ГБН развивающейся при группе крови матери О(1), а у ребенка А(2) или В(3).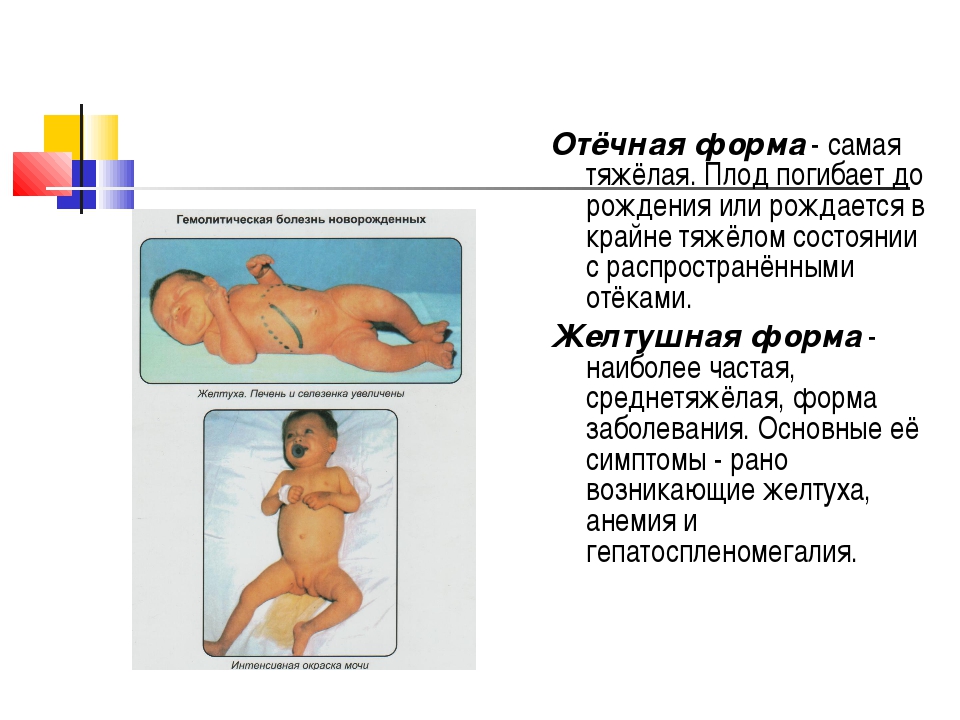 Встречается также часто, как и несовместимость по Rh?, в таком случае возникает чаще при первой беременности. Rh фактор, антигены А и В эритроцитов плода проникают через плаценту в кровь женщины вызывая появление анти-Rh, анти-А и анти-В антител, которые проникают через плаценту в кровоток плода, дополнительно через плаценту проникают иммунокомпетентные лейкоциты женского организма, которые синтезирют антитела, повреждая клетки плода. В норме плацента не проницаема для антител, она становится проницаемой при различных заболеваниях и патологических состояниях беременности и во время родов. Предшествующая сенсебилизация организма матери – непременное условие развития заболевания у ребенка. Rh-отрицательная женщина может сенсебилизироваться при переливании Rh-положительной крови, даже если оно было в раннем возрасте. Имеет значение иммунизация женщины предыдущим плодом в том числе и при первой беременности, однако не только первый но и последующий ребенок может быть здоровым возможно врожденная устойчивость беременных к Rh-фактору.
Встречается также часто, как и несовместимость по Rh?, в таком случае возникает чаще при первой беременности. Rh фактор, антигены А и В эритроцитов плода проникают через плаценту в кровь женщины вызывая появление анти-Rh, анти-А и анти-В антител, которые проникают через плаценту в кровоток плода, дополнительно через плаценту проникают иммунокомпетентные лейкоциты женского организма, которые синтезирют антитела, повреждая клетки плода. В норме плацента не проницаема для антител, она становится проницаемой при различных заболеваниях и патологических состояниях беременности и во время родов. Предшествующая сенсебилизация организма матери – непременное условие развития заболевания у ребенка. Rh-отрицательная женщина может сенсебилизироваться при переливании Rh-положительной крови, даже если оно было в раннем возрасте. Имеет значение иммунизация женщины предыдущим плодом в том числе и при первой беременности, однако не только первый но и последующий ребенок может быть здоровым возможно врожденная устойчивость беременных к Rh-фактору. Например, Rh-отрицательная женщина родилась от Rh-положительной матери и еще в эмбриональном периоде ее организм встречается с Rh-антигеном и вырабатывает иммунную толерантность к нему. После первой беременности Rh-положительным плодом сенсибилизируются только 10% Rh-отрицательных женщин. Если у Rh-отрицательных женщин не произошло иммунизации при 1 беременности Rh-положительным плодом, она может иммунизироваться при последующих беременностях, следовательно обычно дети при Rh-конфликте рождаются от 2, 3 беременности и реже от первой (только если предшествовало переливание Rh-положительной крови).
Например, Rh-отрицательная женщина родилась от Rh-положительной матери и еще в эмбриональном периоде ее организм встречается с Rh-антигеном и вырабатывает иммунную толерантность к нему. После первой беременности Rh-положительным плодом сенсибилизируются только 10% Rh-отрицательных женщин. Если у Rh-отрицательных женщин не произошло иммунизации при 1 беременности Rh-положительным плодом, она может иммунизироваться при последующих беременностях, следовательно обычно дети при Rh-конфликте рождаются от 2, 3 беременности и реже от первой (только если предшествовало переливание Rh-положительной крови).
Существует 3 вида Rh-антител, которые образуются в сенсебилизированном организме людей с Rh-отрицательной кровью:
- полные антитела – агглютинины
- неполные, блокирующие антитела
- скрытые антитела
Полные антитела — это анитела, …??? Путем обычного контакта, вызывают аглютинацию эритроцитов специфических для данной сыворотки. Эта реакция зависит от солевого или коллоидного состава среды.
Неполные антитела — это вызывают агглютинацию эритроцитов в среде содержащей альбумин, желатин
Скрытые антитела — находятся в сыворотке крови человека с Rh-отрицательной кровью в очень высоких концентрациях. В возникновении ГБН высока роль неполных Rh-антител, которые способны проникать через плаценту, так как имеют небольшой размер молекулы. Для развития заболевания имеет значение реактивность женского организма, состояние эндокринной системы, проницаемость сосудов плаценты. Гемолиз эритроцитов плода и новорожденного приводит к гипербиллирубинемии и анемии, образовавшийся непрямой биллирубин (в связи с распадом эритроцитов) в обычных условиях связывается в печеночных клетках м глюкуроновой кислотой при участии глюкоронилтрансферазы (непрямой-прямой), прямой выделяется в кишечнике. Если количество разрушаемых эритроцитов увеличивается коньгюгационная способность печени и накопление непрямого биллирубина в крови прекращается. При концентрации биллирубина 35 мкмоль/л он начинает выходить в ткани – развивается желтуха. Свободный биллирубин является нейротоксическим ядом, при определенных концентрациях (300 мкмоль/л у доношенных и 200мкмоль/л у недоношенных) может проникать через гематоэнцефалический размер приводя к повреждению подкорковых ядер и коры головного мозга, развивается так называемая биллирубиновая энцефалопатия (ядерная желтуха).
Свободный биллирубин является нейротоксическим ядом, при определенных концентрациях (300 мкмоль/л у доношенных и 200мкмоль/л у недоношенных) может проникать через гематоэнцефалический размер приводя к повреждению подкорковых ядер и коры головного мозга, развивается так называемая биллирубиновая энцефалопатия (ядерная желтуха).
Кроме концентрации на проницаемость гематоэнцефалического барьера влияют:
? Содержание альбуминов в сыворотке крови ( биллирубин находясь в крови вступает во временную связь с альбуминами теряя свои токсические свойства и возможность проникновения через ГЭБ).
? Концентрация неэтрифицированных жирных кислот (конкурируют с биллирубиом за связь с альбуминами).
? Концентрация глюкозы (служит исходным материалом для образования глюкуроновой кислоты, гипергликемия увеличивает уровень неэтрифицированных жирных кислот).
? Концентрация стероидных гормонов *
? Сульфаниламиды *
? Антибиотики * * — конкуренция за связь с альбуминами
? Саллицилаты *
? Транквилизаторы *
? Гипоксия подавляет реакцию превращения непрямой-прямой
? Ацидоз делает связь биллирубина с альбуминами непрочной
? Содержание непрямого биллирубина (тканевой яд, тормозит окислительные процессы и вызывает дегенеративные изменения клеток вплоть до некроза.
Токсическое повреждение печеночных клеток – в крови прямой биллирубин, способность выведения его снижена, так как незрелая экскреторная система и имеются анатомические особенности желчных каппиляров (их мало и они узкие), в желчных протоках развивается холестаз, нарушение выведения желчи в кишечник, возможно развитие реактивного гепатита.
При анемии из-за разрушения эритроцитов возникают очаги экстрамедуллярного кроветворения, стимулируется костномозговой гемопоэз, в результате чего в периферической крови наблюдаются молодые формы – эритробласты, определяется дефицит железа, меди, цинка, кобальта. В патологический процесс вовлекаются легкие, сердечно-сосудистая система, увеличивается печень и селезенка. При проникновении антител во время беременности ГБН развивается внутриутробно, тфжесть и форма (анемическая, желтушная, отечная) зависит от степени повреждения антителами, их титра, длительности повреждения, степени проницаемости плаценты, реактивностью плода и его компенсаторными возможностями.
При непродолжительном воздействии небольшой дозой антител в течении беременности или родов на зрелый плод и достаточной коньюгационной функции печени у ребенка в клинической картине будет доминировать анемияпри …??? желтухе, но есть развивается анемическая форма ГБН.
Желтушная форма ГБН : антитела действуют непродолжительно и не интенсивно во время беременности и родов на недостаточно зрелый плод не происходит …??? Механизмов, нет декомпенсации, плод живой. Осложнения желтушной формы: ядерная желтуха, обусловленная токсическим действием непрямого биллирубина на ядра головного мозга: субталамическое, ядра мозжечка, стриарное. Опастны поражнения ЦНС в том случае если уровень непрямого биллирубина превышает 300 мкмоль/л ( у недоношенных 170 мкмоль/л). В норме содержание непрямого биллирубина 3,4 – 13,7 мкмоль/л. Поражению ЦНС способствуют также факторы: недоношенность, анемия, асфиксия, гипогликемия, инфекции и др.
Отечная форма ГБН: при длительном и массивном действии антител во время беременности на незрелый плод. В патогенезе принимает участие сенсебилизация женщины …??? Отечная форма обусловлена материнскими Т-киллерами поникающими к плоду и вызывающие реакцию «трансплантат против хозяина» , материнских антител к тканям плода.
В патогенезе принимает участие сенсебилизация женщины …??? Отечная форма обусловлена материнскими Т-киллерами поникающими к плоду и вызывающие реакцию «трансплантат против хозяина» , материнских антител к тканям плода.
Классификация
? отечная
? желтушная
? анемическая
По степени тяжести (тяжесть определяется совокупностью степеней выраженности основных симптомов: отеков, желтухи, анемии; критерием степени тяжести, основные клинические признаки).
1 степень:
а) анемия Hb до 150 г/л
б) биллирубин до 85,5 мкмоль/л
в)отечность: пастозность подкожной клетчатки
2 степень:
а) анемия Hb 1500-100 г/л
б) биллирубин 85,6-136,8 мкмоль/л
в) отечность пастозность и асцит
3 степень:
а) анемия Hb 100 и ниже.
б) биллирубин 136,8 мкмоль/л и более
в) отечность универсальная
Если 1 степень то ГБН легкая, если имеется хотя бы один признак 2й то среднетяжелая ГБН, если хотя бы один из 3 то ГБН тяжелая.
Клиника.
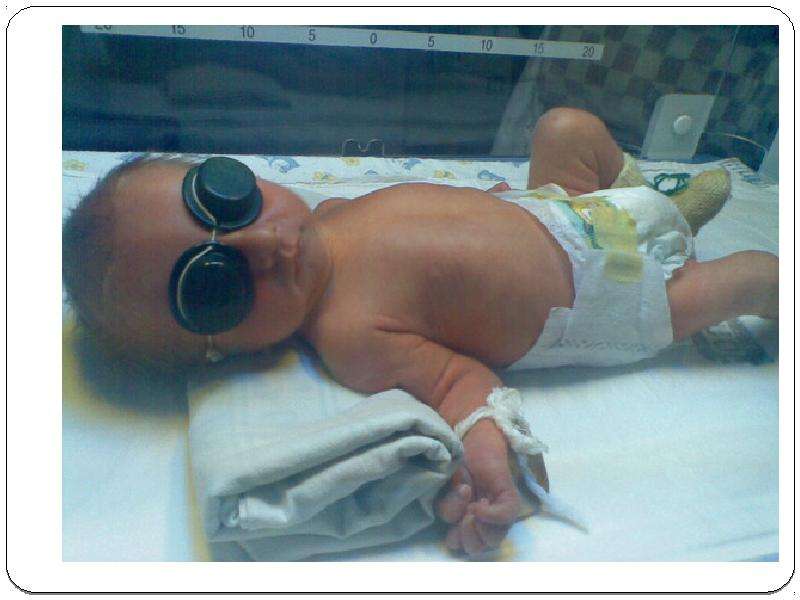
Отечная форма: наиболее тяжело протекающая форма ГБН. При рождении усиливается отек подкожно-жировой клетчатки с накоплением жидкости в полостях (плевральной, брюшной, сердечной), бледность кожи , небольшая желтушность, увеличена печень и селезенка, выраженная анемия (содержание гемоглобина 50-35 г/л, эритроцитов 1,5-1,0*10-12 /л), которая прогрессирует за счет гемолиза и угнетения кроветворения в костном мозге, за счет геморрагического симптома. Непрямой биллирубин при разрушении гемоглобина не подвергается конъюгации и выделяется плацентой в кровь матери, поэтому желтухи у плода практически не бывает, но ввиду увеличенной сосудистой проницаемости наряду с гипопротеинемией развиваются большие отеки и масса ребенка может быть больше в 2-3 раза. Выявляется анизоцитоз, пойкилоцитоз, эритробластоз, лейкоцититоз, нейтрофилез с резким сдвигом влево. Эти дети рождаются мертвыми или умирают в первые часы жизни, так как изменения внутренних органов необратимы. Имеют место случаи, когда дети выживали при раннем заменном переливании крови, однако развивались энцефалопатия, цирроз печени, тяжелая патология головного мозга.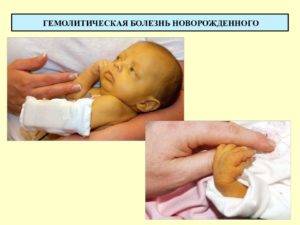
Желтушная форма: развивается чаще. Желтуха проявляется в первые часы жизни ребенка (на первые иногда 2 сутки), затем интенсивность ее увеличивается. Между степенью желтушности, анемии и гипербиллирубинемии связи нет. Желтушность кожи свидетельствует о уровне биллирубина выше 59 мкмоль/л, желтушность ладоней – выше 257 мкмоль/л. Ранее появление желтухи, оттенок постепенно меняется: апельсиновый, бронзовый, лимонный, незрелый лимон; увеличивается печень и селезенка ( с первых 2 суток, наибольшее увеличение наблюдается на 3-4 день), выявляется пастозность внизу живота, в тяжелых случаях ребенок рождается с желтушностью, такую же окраску имеют и органы ОПВ и первородная смазка, печень и селезенка увеличены, анемия с момента рождения. В анализах крови увеличение нормобластов и эритробластов в момент рождения, увеличение ретикулоцитов. Моча темная, кал в норме. Содержание биллирубина в норме (взятой из сосудов пуповины) 10-51 (28) мкмоль/л, почасовой прирост в норме 1,7-3,4 мкмоль/л/ч. При ГБН эти показатели выше, Тяжесть определяется темпом почасового прироста биллирубина.
При ГБН эти показатели выше, Тяжесть определяется темпом почасового прироста биллирубина.
Выделяют 3 степени тяжести в течение желтушной формы:
? легкая (почасовой прирост 3,43-4,27 мкмоль/л/ч в крови биллирубин – 51-85,5 мкмоль/л)
? среднетяжелая (почасовой прирост 4,28-5,8 мкмоль/л/ч, в крови биллирубин – 85,6-136,9 мкмоль/л)
? тяжелая (почасовой прирост 5,9 мкмоль/л/ч и выше, в крови биллирубин более 137 мкмоль/л).
Почасовой прирост рассчитывается по формуле:
Разность уровней биллирубина при 2 и 1 определении / разность времени жизни в часах при 2 и 1 определении.
Интенсивное нарастание биллирубина через 24-48 часов приводит к биллирубиновой интоксикации: вялость, утрата сознания, ослабление рефлексов новорожденного. Первые признаки: при уровне биллирубина 171 мкмоль/л и выше, вначале изменения обратимы, затем пропорциональны увеличению непрямого биллирубина в крови, дню желтушности, экспозиции, тяжесть и морфологические изменения усиливаются. Поражение нейронов – гибель и опустошение отделов мозга. Если в первые увеличение биллирубина пойдет за счет непрямого, то на 3-5 день жизни в крови появляется прямой биллирубин. Это связано со сгущением желчи и нарушением функции печени. Она увеличивается, кал становиться бесцветным, моча темная в ней определяются желчные пигменты, протромбин снижен, время кровотечения увеличено.
Поражение нейронов – гибель и опустошение отделов мозга. Если в первые увеличение биллирубина пойдет за счет непрямого, то на 3-5 день жизни в крови появляется прямой биллирубин. Это связано со сгущением желчи и нарушением функции печени. Она увеличивается, кал становиться бесцветным, моча темная в ней определяются желчные пигменты, протромбин снижен, время кровотечения увеличено.
Если биллирубин не снижается, то на 3-5 день развивается ядерная желтуха, ригидность затылочных мышц, глазодвигательные нарушения, выбухание родничков, исчезновение сосательного рефлекса, мозговой крик, приступы цианоза, судороги. Смерть наступает через 36 часов от развития энцефалитических нарушений, но чаще на 3-5 сутки.
Критически уровни биллирубина для доношенных:
? конец 1 суток 171 мкмоль/л
? конец 2 суток 256 мкмоль/л
? конец 3 суток 342 мкмоль/л
Для недоношенных энцефалопатия из-за морфологических и асфиксических изменений развивается при сниженных показателях:
? конец 1 суток 119 мкмоль/л
? конец 2 суток 205 мкмоль/л
? конец 3 суток 256 мкмоль/л
Требуется заменное переливание крови, редко проводят в 36 часов, чаще на 3-5 сутки.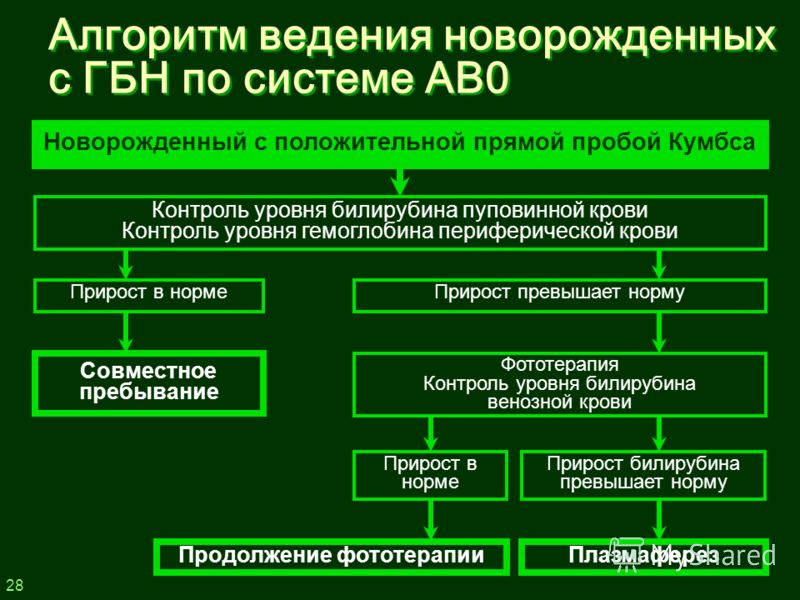 Выделяют 4 фазы биллирубиновой энцефалопатия:
Выделяют 4 фазы биллирубиновой энцефалопатия:
- Временное доминирование признаков биллирубиновой интоксикации: вялость, снижение мышечного тонуса,, снижение аппетита, срыгивание, рвота, отсутствие физиологических рефлексов, периодические приступы цианоза.
- Классические признак ядерной желтухи: ригидность затылочных мышц, периодическая возбудимость, мозговой крик, выбухание родничков, судороги, исчезновение сосательного рефлекса, брадикардия, увеличение температуры, остановка дыхания.
- Период мнимого благополучия. Исчезновение спастичности,со 2 недели жизни.
- Формирование клинической картины, неврологических осложнений. От конца периода новорожденности или с 3-5 дня жизни: парезы, параличи (ДЦП), задержка психомоторного развития.
Анемическая форма: 15% случаев протекают относительно …???, основной синдром – бледность кожных покровов, так как тяжелая анемия, бледность с 1 дней, в более легких маскируется эритемой, транзиторной желтухой, обычно проявляется к 7-10 дню. В тяжелых случаях бледность выражена, что прим «полотно», «лилия», «мраморная бледность», бледные слизистые, впоследствии может исчезать граница между кожей и слизистой губ, увеличение печени и селезенки, уровень белка умеренно повышен. В периферической крови: анемия, нормобластоз, ретикулоцитоз в зависимости от содержания гемоглобина, эритроцитов, подразделяется на степени тяжести:
- – гемоглобин 150 г/л.
- – гемоглобин 100-150 г/л. В норме содержание гемоглобина 200-300 г/л
- – гемоглобин менее 100 г/л.
ГБН связанная с несовместимостью по АВО-антигенам протекает легче, чаще проявляется анемической или легкой желтушной формой реже (1:2000 – 2200) тяжелая желтушная форма. Нарастание непрямого биллирубина замедленно, максимальная концентрация биллирубина наблюдается на 6-8 день жизни. На фоне этого внезапно возникает ядерная желтуха. Течение и прогноз зависит от формы, своевременности и правильности лечения, при отечной форме прогноз неблагоприятный, при выраженном увеличении биллирубина (даже после знаменного переливания крови и если не развивается ядерная желтуха) у 30% наблюдаются отклонения в нервно-психическом развитии. При анемической форме прогноз благоприятный. У детей которым было проведено заменное переливание крови может развиться переходящая гипо- или нормохромная анемия развивающаяся в результате временной недостаточности костного мозга. У некоторых к 1,5-2 месяцам развивается железодефицитная анемия. Летальность при ГБН 8-10%, занимает 3-7 место неонатальной смертности.
Диагностика.
Правильная оценка анамнеза, проведение инструментальных и дополнительных методов исследования. Предположительно, если у женщины имеется резус отрицательная кровь, а у мужчины резус положительной, при наличии указаний в анамнезе на переливание крови без учета резус-фактора, при отягощенном акушерском анамнезе ( выкидыши в поздние сроки, мертворождение с ГБН), в таких случаях исследуют кровь женщины на наличие Rh-антител и на титр их нарастания. Если антитела появляются в первые 3 месяца беременности, следовательно, имеется предшествующая сенсибилизация, если с 4 месяца иммунизация при настоящей беременности. Прогностически неблагоприятно «скачущий» титр Rh-антител у беременной.
При АВО несовместимости определяется титр L или B агглютининов. Внутриутробно у плода могут быть уст, биллирубин в ОПВ. Определение биллирубина в ОПВ проводят по оптической плотности (амниоцентез при 34-36 неделе), в норме оптическая плотность 0,1 относительных ЕД.
При ГБН:
? легкой степени – 0,1-0,2 ОЕД
? среднетяжелой – 0,21-0,34 ОЕД
? тяжелой – более 034 ОЕД
если выше 0,7 – гибель плода. Тяжелое течение — …???
УЗИ (с 20 недели): при ГБН увеличен тонус плаценты, увеличен живот плода. Ранняя желтуха (первые часы и дни), отеки, анемия, снижения уровня гемоглобина в пуповине ниже 166 г/л, наличие эритробластов и нормобластов, уровень непрямого биллирубина выше 51 мкмоль/л, почасовой прирост 5,1 и выше, снижение белка до 50-40 г/л указывают на ГБН.
Лечение.
Направлено на быстрое удаление антител, способствующих продолжению процесса гемолиза, на предотвращение роста уровня биллирубина до критического уровня, на ликвидацию анемии.
Всем детям назначают консервативное лечение, при анемической и легкой желтушной форме лечение только консервативное. При отечной форме ГБН и среднетяжелой и тяжелой желтушных формах необходимо заме
Гемолитическая болезнь новорожденных. Этиология, клиника, лечение, диагностика.
Этиология и патогенез. Возникает в результате изоиммунизации, развивающейся на почве несовместимости крови матери и плода по резус-фактору, его подтипам (резус -0, -1, -2), группам крови системы АВ0 и по более редким факторам крови. Чаще (80—85 % случаев) гемолитическая болезнь возникает в результате резус-конфликта. Болезнь развивается внутриутробно. Резус-фактор, содержащийся в эритроцитах плода и наследованный им от отца, попадает в кровь матери. На чуждый для него антиген организм матери реагирует образованием антирезус-антител. Часть этих антител снова переходит через плаценту в кровь плода и вызывает агглютинацию и гемолиз эритроцитов. Прямой зависимости между высоким титром антирезус-антител у матери и тяжестью гемолитиче-ской болезни у новорожденных нет. Гемолитическая болезнь у новорожденных при резус-несовместимости развивается обычно после второй беременности. У женщин, ранее сенсибилизированных в результате переливаний резус-положительной крови, уже при первой) беременности могут родиться дети с симптомами гемолитической болезни. Реже (15—20 % случаев) гемолитическая болезнь бывает обусловлена групповой несовместимостью крови матери и плода. При этом у ребенка группа крови А или В, а у матери — группа крови 0. Агглютиноген А или В содержится в эритроцитах ребенка и отсутствует у матери. В сыворотке крови матери содержатся изоагглютинины, агглютинирующие эритроциты ребенка и вызывающие гемолиз. Гемолитическая болезнь у детей с группой крови А встречается в 4 раза чаще, чем у детей с группой крови В. При несовместимости крови по системе АВ0 обычно страдают дети уже при первой беременности.
Клиническая картина. Гемолитическая болезнь новорожденных проявляется в трех формах: отечной, желтушной и анемической.
Отечная форманаиболее тяжелая. Дети часто рождаются недоношенными, мертвыми и мацерированными или умирают в первые минуты или часы после рождения. Характерен внешний вид новорожденного: восковидная бледность, иногда легкая желтушность или цианотичность кожных покровов, лунообразное лицо, общий отек подкожной клетчатки, свободная жидкость в полостях (плевральной, перикардиальной, брюшной), кровоподтеки, петехии. Селезенка и печень увеличены. В крови отмечаются резкое снижение содержания гемоглобина (менее 100 г/л) и эритроцитов (1,5— 1,7 • 1012/л и менее), эритробластоз, лейкоцитоз, высокий ретикулоцитоз, нормобласты, миелоциты.
Диагноз. Правильный диагноз может бытк поставлен еще внугриутробно с помощью рентгенологического исследования и амниоцентеза (изменение характера околоплодных вод).
Прогноз. Неблагоприятный.
Желтушная формаможет быть тяжелой, средней и легкой степени тяжести. Тяжелое течение желтушной формы гемолитической болезни может наблюдаться и при групповой несовместимости крови матери и плода.
Характерно появление желтухи сразу же после рождения или спустя несколько часов. При тяжелых формах ребенок рождается желтушным. При легких формах нередко выраженная желтуха появляется в первые двое суток. Околоплодные воды и первородная смазка могут быть окрашены в желтый цвет. Желтуха быстро нарастает, кожа принимает желто-зеленый, иногда желто-коричневый оттенок. Печень и селезенка увеличены. Наблюдается склонность к кровотечениям и кожным кровоизлияниям. Дети вялые, плохо сосут, физиологические рефлексы снижены. Тоны сердца приглушены. Желтуха продолжается до 3 нед и более. Моча темного цвета, проба Гмелина положительная. Окраска стула нормальная. В периферической крови анемия, цветовой показатель 1, макроцитоз, лейкоцитоз, ре-тикулоцитоз, эритробласты, миелобласты и миелоциты, умеренная СОЭ. Количество тромбоцитов, время кровотечения и свертываемости крови в пределах нормы. Осмотическая резистентность эритроцитов не изменена. Желтушная форма болезни в некоторых случаях протекает без выраженной анемизации. При рождении ребенка уровень прямого билирубина в пуповинной крови превышает 60—170 мкмоль/л (у здоровых новорожденных до 50 мкмоль/л). Почасовой прирост свыше 6 мкмоль/л. Как прямая, так и непрямая реакция ван дер Берга положительные. Уровень билирубина быстро нарастает. К 3—5-му дню после рождения содержание билирубина в крови достигает максимума. Уровень непрямого билирубина в крови свыше 342 мкмоль/л у доношенных и 250 мкмоль/л у недоношенных является токсичным для ЦНС. В этих случаях, если не будет предпринята активная терапия, развивается так называемая ядерная желтуха. На фоне нарастающей желтухи появляются вялость, гипотония, гиподинамия, исчезают физиологические рефлесы новорожденных. Вскоре развивается вторая фаза болезни, характеризующаяся явлениями внутричерепной гипертензии: запрокидыва-ние головки, ригидность затылочных мышц, тонические судороги, тремор конечностей. Характерным является преобладание тонуса разгибателей рук на фоне общей гипотонии. Ребенок лежит с открытым ртом, лицо маскообразное. Характерен монотонный сдавленный крик, вначале застывший фиксированный взгляд, затем симптом «заходящего солнца». Общий цианоз, глухие тоны сердца, тахикардия, нарушение дыхания, повышение температуры тела. При стволовых расстройствах развиваются брадикардия, брадипноэ.
Диагноз. Учитывают клинические симптомы и данные лабораторных исследований. Однако для диагноза большое значение имеют акушерский анамнез матери (указание на самопроизвольные аборты, мертво-рождения, смерть предшествующих детей от желтухи в первые дни после рождения), определение резус-фактора крови матери (проводится повторно). Сразу же после рождения у ребенка необходимо определить количество гемоглобина, уровень билирубина в крови, группу крови, резус-фактор и провести пробу Кумбса. Очень важно быстрое проведение этих исследований, так как снижение уровня гемоглобина, билирубинемия, положительная проба Кумбса предшествуют проявлению клинических признаков болезни. Показатели гемоглобина соответственно 150—156 г/л, билирубина — свыше 52 мкмоль/л. Отсутствие эритробластов в периферической крови не исключает болезни. Проба Кумбса не всегда бывает положительной.
Прогноз. При тяжелых формах болезни неблагоприятный. Смерть наступает на 3—4-й день после рождения. В некоторых случаях присоединение пневмонии ускоряет летальный исход. У выживших детей часто наблюдаются тяжелые поражения ЦНС: спастические парезы, параличи, атетоз, умственная отсталость. У некоторых детей развивается глухота. При раннем распознавании заболевания и своевременном лечении удается не только спасти жизнь ребенка, но и предотвратить у него тяжелое поражение мозга.
Анемическая форма — наиболее легкая форма гемолитической болезни. Бледность кожных покровов отчетливо выявляется к 7—10-му дню после рождения. В более тяжелых случаях бледность кожи выявляется уже в первые дни после рождения. Селезенка и печень увеличены. В крови снижено количество гемоглобина и эритроцитов, микроцитоз, анизоцитоз, ретикулоцигоз, эритробластоз (не всегда), полихромазия. Цветовой показатель 1. Небольшой сдвиг нейтрофилов влево.
Прогноз. Благоприятный.
Гемолитическая болезнь у недоношенных детей. Желтуха, увеличение печени и селезенки у детей с массой тела при рождении до 2000 г развиваются позднее, чем у доношенных (не ранее первых 24 ч жизни). Симптомы болезни более выражены на 2—3-й день жизни. Желтушное окрашивание кожи и слизистых оболочек появляется при уровне непрямого билирубина 100— 117 мкмоль/л. Поэтому тяжесть гемолитической болезни у недоношенных определяют по содержанию билирубина в крови и общему состоянию ребенка. Изменения в периферической крови не всегда соответствуют тяжести гемолитической болезни, эритробластоз может отсутствовать. Ретикулоцитоз и лейкоцитоз не характерны. Интоксикация ЦНС у глубоконедоношенных детей наступает при уровне билирубина в крови 150—210 мкмоль/л.
Прогноз. Чаще более неблагоприятный, чем у доношенных.
Гемолитическая болезнь у детей при перинатальных энцефалопатиях. Симптом билирубиновой интоксикации — ядерная желтуха возникает при более низком уровне непрямого билирубина в крови.
Лечение. В настоящее время основным методом лечения гемолитической болезни новорожденных является заменное переливание крови.
Наличие у ребенка резус-положительной крови, положительной пробы Кумбса, низкий уровень гемоглобина, высокий уровень билирубина пуповинной крови являются основными показаниями для заменного переливания крови.
Наиболее ранним и достоверным признаком гемолитической болезни и показанием к заменному переливанию крови является повышение уровня непрямого билирубина в крови пуповины свыше 60 мкмоль/л. В норме увеличение за час 0—15 мкмоль/л, у больных — 6 мкмоль/л и более.
Заменное переливание крови следует производить как можно скорее после рождения ребенка и в достаточном количестве, примерно 150—200 мл/кг донорской крови. При крайне тяжелом состоянии и наличии отечного синдрома переливание такого количества крови может ухудшить состояние новорожденного, поэтому в этих случаях следует переливать 70—80 мл/кг с тем, чтобы при улучшении состояния ребенка повторить заменное переливание уже в полном объеме.
Для заменного переливания лучше использовать резус-отрицательную кровь, одногруппную с кровью ребенка, либо О (I) группы с низким содержанием ан-ти-А- и анти-В-антител. При легкой форме гемолити-ческой болезни, удовлетворительном состоянии доношенного ребенка и низком титре антител у матери можно использовать резус-положительную одногруппную кровь, при этом нужно увеличить объем заменяемой крови до 200—250 мл/кг. Противопоказано переливание резус-положительной крови травмированным и недоношенным, а также детям с тяжелой формой гемолитической болезни, особенно при высоком титре антител у матери.
Непосредственно перед операцией переливания кровь необходимо подогреть на водяной бане до 37 «С. Для заменного переливания используют свежецитратную кровь не более чем 3-дневной давности.
Заменное переливание крови необходимо проводить медленно, со скоростью 100—150 мл/кг в час. При более быстром введении крови может наступить перегрузка правых отделов сердца и возникнет острая сердечная недостаточность, с которой трудно бывает справиться. Вследствие значительной гиперволемии у детей, особенно с отечным синдромом, для облегчения работы сердца выводят на 40—50 мл крови больше, чем вводят.
Для профилактики острой сердечной недостаточности целесообразно назначить 0,2 мл 0,06 % раствора корглюкона внутримышечно и постоянную ингаляцию кислорода во время заменного переливания крови.
Операцию производят в чистой операционной с соблюдением всех правил асептики и антисептики.
В вену пуповины вводят полиэтиленовый катетер (при его отсутствии — наконечник от шприца Брауна). При введении катетера на его пути встречаются два участка, через которые катетер проходит с некоторыми затруднениями. Первое препятствие встречается на расстоянии 2,5—4 см от пупочного кольца, где вена делает изгиб вверх и кзади, занимая интраперитонеальное положение. Второе препятствие обычно встречается на расстоянии около 8 см от пупочного кольца, на месте разделения пупочной вены на ветвь, идущую к печени, и венозный проток (аранциев проток). Во время преодоления второго препятствия при введении катетера на глубину 12—14 см от пупочного кольца конец катетера попадает в нижнюю полую вену и из наружного отверстия катетера появляется кровь. Введение и выведение крови необходимо производить медленно (по 20 мл). Начинать следует с выведения крови. После введения каждых 100 мл крови вводят по 2 мл 10 % раствора глюконата кальция и по 8 мл 20 % раствора глюкозы.
Во время операции следует проводить исследования кислотно-основного состояния крови ребенка, особенно когда используется цитратная кровь, чтобы при выявлении патологического ацидоза вовремя корригировать его введением 5 % раствора бикарбоната натрия по 3—5 мл/кг до и после операции.
В результате заменного переливания удается заменить 75—80 % крови. После операции необходим тщательный контроль за уровнем билирубина в крови.
Показаниями для повторных заменных переливаний крови являются нарастание уровня билирубина в крови свыше 6 мкмоль/л в час, клинические симптомы, указывающие на билирубиновую интоксикацию мозга, а также положительная проба Кумбса в течение 3 дней.
При тяжелой форме гемолитической болезни заменное переливание крови делают многократно (3— 5 раз), нередко в первые сутки жизни операцию заменного переливания проводят до 3 раз.
В течение 10 дней жизни ребенка необходимо производить исследование крови на содержание билирубина, эритроцитов, гемоглобина, эритробластов, чтобы следить за эффективностью лечения. Помимо гемотерапии, показана плазмотерапия не только во время, но и после заменного переливания для более быстрого выведения билирубина. Назначают внутривенные вливания плазмы по 10 мл/кг при нарастании содержания билирубина в крови выше критического уровня. При тяжелой форме заболевания целесообразно вводить гидрокортизон по 1 мг/кг внутримышечно в течение 5—6 дней либо преднизолон по 0,5—1,0 мг/кг внутримышечно в течение 5—6 дней, затем в течение 3 дней в половинной дозе.
При выраженной анемии и недостаточной функции печени у ребенка назначают метионин, витамины В1 и В2 по 10 мг в сутки внутримышечно; курс лечения 10 дней. Рекомендуются назначение метионина по 0,15 г 2 раза в день на протяжении 2—3 нед, внутримышечное введение антианемина по 0,5 г, всего до 10 раз. В качестве дезинтоксикационной терапии рекомендуется введение жидкости через зонд в желудок. Жидкость имеет следующий состав: плазмы 30 мл/кг, изотонического раствора хлорида натрия 50—100 мл, 20 % раствора глюкозы 100 мл, преднизолона 1 мг/кг, витаминов Bi и Ва по 5 мг, метионина 0,5 г. Жидкость вводят со скоростью 4—5 капель в минуту в течение 12 ч, что способствует выведению билирубина.
Для улучшения проходимости желчи по желчным путям назначают 25 % раствор сернокислой магнезии по 1 чайной ложке 2 раза в день в течение 4—6 дней и грелку на область печени.
При наличии у ребенка геморрагического синдрома вводят викасол внутримышечно по 5—6 мг в сутки в течение 3 дней подряд; при неврологической симптоматике требуются осмотр невропатолога и назначение индивидуального лечения.
В последние годы при гемолитической болезни новорожденных пытаются использовать вместо общего за-менного переливания крови гемосорбцию.
Фототерапию (светотерапия) применяют при легкой и средней тяжести гемолитической желтухе. Она способствует переходу билирубина в нетоксичный изомер. Используют излучение длиной волны 450 нм; сеансы продолжительностью 3 ч проводят с интервалами 2 ч (в сутки всего 12—16 ч). Возможными осложнениями фототерапии являются перегревание, дегидратация, жидкий стул, эритематозная сыпь, своеобразная пигментация (синдром «бронзового ребенка»). Глаза и половые органы ребенка необходимо закрывать соответственно специальными очками и марлевой повязкой.
Для ускорения метаболизма и экскреции билирубина назначают фенобарбитал в дозе 10 мг/кг в сутки (недоношенным в сочетании с кордиамином) или зик-сорин. Целесообразно применение фенобарбитала женщинами группы риска по развитию тяжелой гемолитической болезни новорожденных за 7—10 дней до родов по 0,1 г 3 раза в день.
В молоке матери находятся резус-антитела, поэтому чрезвычайно важно сразу после рождения кормить ребенка только сцеженным молоком от других матерей. Начинать грудное кормление можно только по исчезновении антител в молоке матери, но не ранее чем на 10—12-й день жизни ребенка. В начале кормления грудным молоком необходим контроль за содержанием гемоглобина в крови ребенка. Если количество его снижается, то кормление грудью временно прекращают. Обычно антитела в молоке матери исчезают спустя 2—3 нед после родов.
Профилактика. Определение резус-принадлежности у всех беременных при первой явке в женскую консультацию, взятие на учет всех женщин с резус-отрицательной кровью. Метод специфической профилактики резус-сенсибилизации женщин заключается в пассивном введении им противорезусных антител вскоре после рождения резус-положительного ребенка. Действие пассивно введенных антител заключается в отвлечении антигена. Антирезус-иммуногло-булин вводят внутримышечно не позднее 72 ч после родов. Эффективная доза иммуноглобулина — 200 мкг. Показанием для его введения является рождение у резус-отрицательной первородящей женщины резус-положительного ребенка, кровь которого совместима с кровью матери по системе АВО.
АВ0 — совместимые группы крови:
Целесообразно также введение препарата после вторых родов (в случае отсутствия сенсибилизации) и после абортов у женщин с резус-отрицательной кровью.
К неспецифическим
Это нормально и как лечить?
Выделения из глаз часто возникают у новорожденных и обычно возникают из-за закупорки слезного протока. Часто можно лечить младенца с закупоркой слезного протока в домашних условиях.
Однако выделения, которые возникают наряду с другими симптомами в области глаз, такими как покраснение, отек или болезненность, могут быть признаком инфекции или другой проблемы с глазами. Новорожденному с этими симптомами нужно будет обратиться к врачу.
В этой статье мы обсуждаем, нормальны ли выделения из глаз, и объясняем, как их лечить в домашних условиях.Мы также оплачиваем лечение, другие причины, осложнения и время обращения к врачу.
Выделения из глаз у новорожденных — обычное дело и редко вызывает беспокойство.
Частой причиной выделений из глаз является закупорка слезного протока. Врачи иногда называют это состояние дакриостенозом или обструкцией носослезного протока.
Слезы образуются в слезной железе, которая находится прямо над глазом. Слезная жидкость помогает очищать и смазывать поверхность глаза.
Слезный канал, или носослезный канал, представляет собой небольшой канал, расположенный в углу глаза возле носа.Когда человек моргает, веки сливают слезную жидкость в эти протоки, которые отводят ее в нос.
Если слезный канал закупоривается, слезная жидкость может перестать стекать с поверхности глаза. Закупорки могут вызвать очень слезящиеся глаза, а в углах могут образоваться липкие выделения.
По данным Американской академии офтальмологии, почти 20 процентов новорожденных имеют закупорку слезного протока. Это состояние может возникать из-за того, что конец слезного протока не открывается должным образом при рождении ребенка.Закупорка слезного протока может повлиять на один или оба глаза ребенка.
Если выделения из глаз вызваны закупоркой слезного протока, они обычно проходят без лечения в течение 4–6 месяцев.
Родители или опекуны часто могут лечить новорожденного с закупоркой слезного протока в домашних условиях. Прежде чем прикасаться к области, близкой к глазам ребенка, необходимо вымыть руки теплой водой с мылом, чтобы предотвратить инфекции. После мытья рук тщательно промойте руки, чтобы мыло не попало в глаза ребенку.
Чтобы удалить выделения, окуните чистый кусок марли или мягкой ткани в немного теплой воды, а затем осторожно протрите угол глаза. Если закупорка слезного протока поражает оба глаза, всегда используйте новую ткань или марлю для очистки другого глаза.
Ветер, холодная погода и сильный солнечный свет могут усугубить симптомы, поэтому они могут помочь защитить глаза новорожденного от этих факторов.
Врач может также порекомендовать осторожно массировать закупоренный слезный проток, чтобы помочь ему открыться, и он продемонстрирует, как это сделать безопасно.
Для массажа слезного протока:
- Слегка прижмите кончик указательного пальца к внутренней переносице новорожденного со стороны закупоренного слезного протока.
- Сделайте 2 или 3 коротких движения пальцем вниз вдоль носа. Они должны быть мягкими, но твердыми.
- Массаж выполняйте дважды в день, утром и вечером.
Если сторона носа новорожденного покраснела или опухла, немедленно прекратите массаж и обратитесь к врачу.
Поделиться на PinterestВрач может использовать обезболивающие глазные капли перед лечением хронически закупоренных слезных протоков.
У новорожденных закупорка слезных протоков имеет тенденцию открываться самостоятельно в течение нескольких месяцев после рождения. Однако, если закупорка не исчезла к 1 году жизни, врач может порекомендовать лечение, называемое зондированием носослезного протока.
Эта процедура включает введение небольшого зонда в слезный канал младенца. Используя зонды, размер которых постепенно увеличивается, врач сможет открыть слезный канал.Затем они будут использовать физиологический раствор, чтобы вымыть оставшийся мусор.
Иногда врач может также вставить небольшую трубку или стент в проток, чтобы он оставался открытым.
Перед проведением этой процедуры врач может дать ребенку глазные капли обезболивающего или поместить их под легкий общий наркоз. Это избавит малыша от боли или страданий.
Зондирование обычно помогает открыть слезный канал. Детям с серьезной закупоркой врач может порекомендовать более сложную хирургическую процедуру, называемую дакриоцисториностомией, чтобы очистить и открыть слезный канал.
Выделения из глаз у новорожденных также могут быть признаком конъюнктивита или конъюнктивита. Конъюнктивит — это воспаление конъюнктивы, которая представляет собой тонкую мембрану, защищающую переднюю часть глаза. В отличие от закупорки слезного протока, при конъюнктивите белая часть глаза часто становится красной.
Симптомы конъюнктивита у новорожденных могут включать:
- дренаж или выделения, которые появляются в период от 1 до 14 дней после рождения
- опухшие, красные или болезненные веки
- красные раздраженные глаза
Конъюнктивит у новорожденных иногда может возникать одновременно закупорка слезного протока.Однако беременная женщина также может передать ребенку бактериальную или вирусную инфекцию во время родов, что может привести к конъюнктивиту.
Если конъюнктивит вызван инфекцией, он может быть серьезным, и новорожденному необходимо немедленно обратиться к врачу.
Если выделения из глаз вызваны инфекцией, врач может назначить местные, пероральные или внутривенные антибиотики.
Прикладывание теплой ткани к инфицированному глазу может помочь снять раздражение и уменьшить отек.
Химическое раздражение также может вызывать конъюнктивит у новорожденных.Медицинские работники часто назначают новорожденным антибактериальные глазные капли для предотвращения инфекций. Эти глазные капли иногда могут вызывать раздражение, которое может вызвать симптомы конъюнктивита.
Закупорка слезных протоков иногда может привести к инфекции, называемой дакриоциститом. Симптомы дакриоцистита могут включать:
- чрезмерные густые выделения из глаза
- покраснение в уголке глаза
- болезненную шишку или припухлость сбоку от носа
- лихорадку
Если у новорожденного есть какая-либо из этих симптомы, родители или опекун должны показать их врачу.
Поделиться на Pinterest Человеку следует обратиться к педиатру, если слезные протоки ребенка не очищаются через несколько месяцев.
Новорожденным с выделениями из глаз или очень слезящимися глазами следует обратиться к педиатру или глазному врачу, специализирующемуся на детях, который называется детским офтальмологом. Эти специалисты могут диагностировать причину выделений и проверить наличие признаков инфекции.
Также важно обратиться за медицинской помощью к младенцу, если его слезный проток остается заблокированным после 6-8 месяцев.
Новорожденным с признаками глазной инфекции следует немедленно обратиться к врачу. Признаки глазной инфекции могут включать:
- красные, болезненные или опухшие глаза
- опухшие веки
- желтый или зеленый гной или выделения
- шишка или припухлость на внутреннем углу глаза
выделения из глаз у новорожденных является обычным явлением и часто является результатом закупорки слезного протока. Блокировка обычно проходит сама собой в течение 4-6 месяцев.
Однако новорожденным с покраснением глаз, выделениями из глаз или чрезмерным слезотечением из глаз следует обратиться к врачу, чтобы диагностировать причину и исключить инфекцию глаз.
Родители и опекуны могут лечить ребенка с закупоркой слезного протока в домашних условиях, вытирая выделения и осторожно массируя эту область два раза в день. Врач может продемонстрировать, как это сделать.
Покраснение, отек или болезненность в области глаз могут указывать на глазную инфекцию. Немедленно обратитесь к врачу, если у ребенка есть эти признаки.
Респираторный дистресс-синдром (РДС) у новорожденных: диагностика и лечение
RDS расшифровывается как «респираторный дистресс-синдром».»Это наиболее распространенное заболевание легких у недоношенных детей, и оно возникает из-за того, что легкие ребенка не полностью развиты. Чем более недоношенный ребенок, тем выше вероятность, что у него будет RDS.
RDS вызван недостатком сурфактанта в легких. Поверхностно-активное вещество обычно вырабатывается здоровыми легкими. Он покрывает крошечные воздушные мешочки в легких тонкой пленкой и помогает держать воздушные мешочки открытыми ( Рис. 1 ). Для правильного дыхания воздушные мешки должны быть открыты, чтобы кислород попадал в кровь из легких, а углекислый газ выходил из крови в легкие.
В то время как RDS чаще всего встречается у детей, родившихся рано, другие новорожденные могут получить RDS. Те, кто подвергается большему риску:
- Белые младенцы
- Младенцы мужского пола
- Брат или сестра с инфекцией RDS
- Рождение близнецов или близнецов
- Доставка кесарева сечения
- Мать больна диабетом
- Инфекция
Признаки и симптомы
Младенцы с RDS могут показывать следующие признаки:
- Быстрое дыхание
- Втягивание (кожа втягивается между ребрами или под грудной клеткой при быстром и тяжелом дыхании)
- Кряхтение (звук «тьфу» при каждом вдохе)
- Расширение (расширение) ноздрей при каждом вдохе
- Ребенку необходим дополнительный кислород, чтобы кожа оставалась розовой
Диагностика
Диагноз ставится после осмотра ребенка, результатов рентгена грудной клетки и анализа крови.Иногда эхокардиограмма с использованием звуковых волн проводится, чтобы узнать, есть ли пороки сердца. См. Helping Hand, HH-III-114, Эхокардиограмма для получения дополнительной информации.
Лечение
Кислород: Младенцам с RDS требуется дополнительный кислород, чтобы оставаться розовыми. Его можно передать несколькими способами:
- Назальная канюля. В ноздри вставляют небольшую трубку с зубцами.
- CPAP (Постоянное положительное давление в дыхательных путях). Это устройство, которое мягко нагнетает воздух или кислород в легкие, чтобы воздушные мешки оставались открытыми.
- Вентилятор для тяжелых РДС. Это устройство, которое помогает младенцу дышать, когда он или она не может дышать достаточно хорошо без посторонней помощи. Дыхательная трубка помещается в трахею младенца. Это называется интубацией (в тоже время избегайте). Затем младенца помещают на вентилятор, чтобы он мог дышать.
Поверхностно-активное вещество: Поверхностно-активное вещество можно вводить в легкие ребенка, чтобы заменить то, чего у него нет. Он подается прямо через дыхательную трубку, которая была вставлена в дыхательное горло.
Лечение с использованием внутривенного катетера: Очень маленькая трубка, называемая катетером , вводится в один или два кровеносных сосуда в пуповине. Таким образом младенец получает жидкости, питание и лекарства внутривенно. Он также используется для взятия образцов крови.
Лекарства: Иногда при подозрении на инфекцию назначают антибиотики. Для облегчения боли во время лечения могут быть назначены успокаивающие лекарства. Поверхностно-активное вещество — Поверхностно-активное вещество можно вводить в легкие ребенка, чтобы заменить то, чего у вашего ребенка нет.Он подается прямо через дыхательную трубку, которая была вставлена в дыхательное горло.
Чего ожидать
У каждого младенца разные пути к выздоровлению. Часто RDS ухудшается прежде, чем станет лучше. Некоторым детям нужно больше кислорода, чем другим. Некоторым может потребоваться обработка сурфактантом. Поскольку ребенок может лучше дышать, ему может потребоваться меньше кислорода и других вспомогательных средств для дыхания.
Как узнать, становится ли ваш младенец лучше
Вот некоторые признаки того, что вашему ребенку становится лучше:
- Ваш ребенок будет дышать легче и медленнее.Он или она будет выглядеть более комфортно для дыхания.
- Младенцу нужно меньше кислорода.
- Если ваш младенец находится на CPAP или аппарате ИВЛ, настройки аппарата уменьшаются. Через некоторое время помощь машин больше не понадобится.
Респираторный дистресс-синдром: новорожденный (PDF)
HH-I-267 5/11 Пересмотрено 17 марта Copyright 2011, Национальная детская больница
В мире только половина женщин получает лечение от предотвратимой убийцы новорожденных
Кредит: CC0 Public Domain
Только половина беременных женщин во всем мире, которые нуждаются в лечении, разработанном более 50 лет назад для предотвращения резус-инфекции — часто смертельного заболевания у плодов и новорожденных, которое сейчас чрезвычайно редко встречается в Соединенных Штатах и Западной Европе, — действительно получают его, говорится в исследовании. под руководством исследователей из Колледжа врачей и хирургов Вагелоса (VP&S) Медицинского центра Ирвинга Колумбийского университета.
Предыдущее исследование показало, что осложнения этого заболевания могут быть связаны со смертью не менее 50 000 плодов и 114 000 новорожденных во всем мире ежегодно.
Результаты исследования были опубликованы в Интернете в PLOS One .
«Эти результаты трагически удивительны и разочаровывают», — говорит Стивен Л. Спитальник, доктор медицины, профессор патологии и клеточной биологии в VP&S и старший автор исследования.«Это глобальный кризис, в котором сотни тысяч плодов и новорожденных подвергаются риску осложнений и смерти из-за резус-инфекции из-за недостаточной осведомленности, доступа и доступности эффективных мер по предотвращению этого заболевания».
Примерно половина плодов и новорожденных с резус-болезнью умирают
Примерно 15% женщин в США и 17% в Европе испытывают недостаток в белке красных кровяных телец, который называется резус-фактором. Однако предполагаемая распространенность женщин с так называемой резус-отрицательной группой крови широко варьируется среди различных этнических групп во всем мире.
Когда такие женщины беременеют, эритроциты резус-положительного плода могут попасть в кровоток матери во время беременности или родов. Эта несовместимость побуждает иммунную систему матери вырабатывать антитела и становиться «сенсибилизированными» к эритроцитам плода. Во время последующих беременностей сенсибилизированная иммунная система матери с большей вероятностью начнет атаку на ее плод, что приведет к резус-болезни.
Более половины плодов или новорожденных с резус-фактором умирают; выжившие с тяжелым заболеванием могут иметь значительные повреждения мозга.
В 1960-х годах врачи из VP&S разработали иммунопрофилактическую терапию — иммуноглобулин Rh (D), который предотвращает сенсибилизацию матери к клеткам крови ребенка. С тех пор резус-инфекция почти никогда не встречается в США и других странах с высоким уровнем доходов.
«Это лечение является стандартом профилактики резус-инфекции, но мы осознаем, что остаются серьезные препятствия для расширения доступа к этой спасающей жизни терапии по всему миру», — говорит Спитальник, который работал с международной командой врачей над расширением доступа. к терапии иммуноглобулином Rh (D) во всем мире.
Болезнь резус недостаточно распознана, недостаточно лечится в более бедных странах
Бремя резус-фактора в странах с низким уровнем дохода хорошо известно; самые последние оценки основаны на данных о частоте неонатальных осложнений, связанных с резус-несовместимостью.
Для текущего исследования исследователи измерили разрыв между женщинами, которые предположительно нуждаются в иммунопрофилактике резус-фактора, и теми, кто действительно ее получает.Во-первых, они оценили годовое количество беременностей во всем мире с резус-отрицательной матерью и резус-положительным плодом на основе зарегистрированных за год рождений и самых последних оценок распространенности резус-отрицательной группы крови в каждом регионе. Затем они вычислили количество доз иммуноглобулина Rh (D), необходимых для лечения этих женщин, и сравнили его с фактическим количеством доз, вводимых в мире.
Исследование показало, что годовой разрыв во всем мире составляет более 2,5 миллионов доз ниже минимального рекомендуемого порога для предотвращения резус-инфекции.
В частности, в 100 странах менее 80% беременных женщин, которым требовалась терапия, получали дозу после родов.
Наибольший дефицит наблюдается в Южной Азии и Африке к югу от Сахары: в обоих регионах высока частота неонатальных смертей из-за осложнений резус-болезни, но фактически не отпускался Rh (D) иммуноглобулин.
Исследователи обнаружили, что ни в одном из изученных регионов не было приемлемого уровня соблюдения рекомендованных руководств по профилактике резус-инфекции.
«Множество факторов, включая недостаточную осведомленность о несовместимости резус-фактора, ограниченную доступность терапии и другие приоритеты здравоохранения, играют роль в ограничении доступа к этой жизненно важной терапии во всем мире», — говорит Спитальник. «Теперь, когда мы лучше понимаем эти пробелы в лечении, мы можем приступить к их устранению на региональном уровне».
С этой целью Спитальник и Бри Стотлер, доктор медицинских наук, доцент кафедры патологии и клеточной биологии в VP&S и соавтор исследования, вместе с международной группой сотрудников в области акушерства и гинекологии, акушерства, педиатрии, неонатологии, эпидемиологии и трансфузионная медицина, созданная Всемирная инициатива по ликвидации резус-фактора, некоммерческая организация, деятельность которой направлена на улучшение просвещения по вопросам резус-фактора и расширение доступа к тестированию на группу крови и иммуноглобулину Rh (D).
Доказательств вертикальной передачи SARS-CoV-2 плоду не найдено
Дополнительная информация:
Валерия Пегораро и др., Гемолитическая болезнь плода и новорожденного из-за несовместимости резус (D): предотвратимое заболевание, которое по-прежнему вызывает значительную заболеваемость и смертность у детей, PLOS ONE (2020).DOI: 10.1371 / journal.pone.0235807
Предоставлено
Медицинский центр Ирвинга Колумбийского университета
Ссылка :
Во всем мире только половина женщин получает лечение от предотвратимого убийцы новорожденных (10 августа 2020 г.)
получено 24 ноября 2020
из https: // medicalxpress.ru / news / 2020-08-global-women-treatment-killer-newborns.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, нет
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Респираторный дистресс-синдром новорожденных | патология
Респираторный дистресс-синдром новорожденных , также называемый болезнью гиалиновой мембраны , частое осложнение у младенцев, особенно у недоношенных новорожденных, характеризующееся чрезвычайно затрудненным дыханием, цианозом (синюшным оттенком кожи или слизистых оболочек) и аномально низкий уровень кислорода в артериальной крови.До появления эффективных методов лечения респираторный дистресс-синдром часто приводил к летальному исходу. Вскрытие детей, умерших от этого заболевания, показало, что воздушные мешочки (альвеолы) в их легких разрушились, и в альвеолярных протоках образовалась «стекловидная» (гиалиновая) мембрана.
Британская викторина
Болезни, расстройства и многое другое: медицинская викторина
Какое состояние вызвано отложением солей мочевой кислоты? Как еще называют переломную лихорадку? Узнайте, что вы знаете о болезнях, расстройствах и многом другом.
Хотя респираторный дистресс-синдром возникает в основном у недоношенных детей с низкой массой тела при рождении (с массой тела менее 2,5 кг или около 5,5 фунтов), он также иногда развивается у доношенных детей, особенно у матерей с диабетом. Расстройство возникает из-за недостатка сурфактанта; это легочное вещество, которое предотвращает схлопывание альвеол после первого вдоха младенца. Ранее этот синдром был основной причиной смерти недоношенных детей, но значительный успех в спасении пораженных детей был достигнут за счет использования аппаратов искусственной вентиляции легких, которые доставляют воздух под давлением в альвеолы.Новорожденных с наиболее серьезными заболеваниями в течение нескольких дней лечат с помощью экстракорпорального мембранного оксигенатора, который выполняет работу легких, насыщая кровь кислородом и удаляя углекислый газ. Постоянное давление воздуха, создаваемое вентилятором, предотвращает сжатие воздушных мешков. Когда легкие младенца созревают и начинают вырабатывать сурфактант — обычно в течение трех-пяти дней после рождения — ребенка отлучают от аппарата ИВЛ. Большинство выживших детей не имеют последствий.
О лечении Covid-19 — Швейцарское исследование политики
Обновлено : 16 ноября 2020 г .; Опубликован : 2 июля 2020 г.
Языки : DE, EN; Поделиться на : Twitter / Facebook
Иммунологические и серологические исследования показывают, что у большинства людей при заражении новым коронавирусом развиваются только легкие или умеренные симптомы, в то время как у некоторых людей может наблюдаться более выраженное или критическое течение болезни (подробнее).
Основываясь на имеющихся научных данных и текущем клиническом опыте, SPR Collaboration рекомендует врачам и властям рассмотреть следующий протокол лечения covid-19 для профилактического и раннего лечения людей из группы высокого риска или высокого риска.
Согласно многочисленным международным исследованиям, риск тяжелого или смертельного заболевания можно значительно снизить с помощью профилактического или раннего лечения (см. Научные ссылки ниже).
Примечание. Пациентов просят проконсультироваться с врачом.
Протокол лечения
Профилактика
- Цинк (от 25 до 50 мг в день)
- Кверцетин (от 250 до 500 мг в день)
- Бромгексин (от 25 до 50 мг в день)
- Витамины D (2000 ед / день) и C (1000 мг)
- Аспирин (от 80 до 100 мг в день) *
Раннее лечение
- Цинк (от 75 до 150 мг в день)
- Кверцетин (от 500 мг до 1000 мг в день)
- Бромгексин (от 50 до 100 мг в день)
- Витамины D (5000 ед / день) и C (1000 мг)
- Аспирин (от 162 мг до 325 мг в день) *
Только по рецепту
- Ивермектин (0.2 мг / кг ежедневно в течение двух дней) *
- Витамин D в высоких дозах (до 100000 МЕ)
- Азитромицин (до 500 мг в сутки)
- Преднизон (от 60 до 80 мг в день) *
- Гепарин LMW (обычная дозировка)
*) Примечания : Противопоказания для аспирина должны соблюдаться, особенно при профилактическом применении. Ивермектин также можно использовать с профилактической целью на еженедельной основе (см. Ниже). Преднизон следует использовать при развитии легочных и респираторных симптомов.
Примечание о гидроксихлорохине (HCQ) : Правильно дозированный HCQ, препарат против малярии и аутоиммунных заболеваний, также был безопасен и эффективен для раннего лечения covid-19 в многочисленных исследованиях. HCQ обладает известными противовирусными, антитромботическими и противовоспалительными свойствами.
Успешное лечение
Для получения дополнительных результатов см. Полные научные ссылки внизу этой страницы.
цинк
- Американские врачи сообщили о снижении числа госпитализаций на 84%, снижении смертности среди уже госпитализированных пациентов на 45% и улучшении состояния пациентов в течение 8–12 часов на основе раннего лечения цинком в дополнение к HCQ.
- Испанское исследование показало, что низкие уровни цинка в плазме (ниже 50 мкг / дл) повышают риск госпитальной смерти пациентов с коронавирусом на 130%.
- Исследование, проведенное в США, сообщило о быстром разрешении (в течение нескольких часов) симптомов коронавируса, таких как одышка, на основе раннего амбулаторного лечения высокими дозами цинка.
Ивермектин
- Ивермектин продемонстрировал сильные противовирусные и противовоспалительные эффекты в многочисленных контролируемых и наблюдательных исследованиях, снижая смертность от вирусов даже в тяжелых случаях до 90%.
- На основании этих результатов Американский союз интенсивной терапии Covid-19 (FLCCC) рекомендует ивермектин для профилактики и раннего лечения COVID-19.
Бромгексин
- Иранские врачи сообщили в исследовании с 78 пациентами об уменьшении количества интенсивной терапии на 82%, уменьшении интубации на 89% и снижении смертности на 100%.
- китайских врачей сообщили о сокращении числа интубаций на 50% благодаря лечению бромгексином.
- В немецком исследовании обсуждается эффективность бромгексина на основе биохимических аспектов.
Витамин D
- В испанском рандомизированном контролируемом исследовании (РКИ) высокие дозы витамина D (100 000 МЕ) снижали риск потребности в интенсивной терапии на 96%.
- Исследование, проведенное во французском доме престарелых, показало снижение смертности на 89% среди жителей, которые получали высокие дозы витамина D незадолго до или во время заболевания COVID-19.
- Крупное израильское исследование показало тесную связь между дефицитом витамина D и тяжестью COVID-19.
- Мета-исследование 2017 года показало положительное влияние витамина D на инфекции дыхательных путей.
Аспирин
Режимы действия
- Цинк ингибирует активность РНК-полимеразы коронавирусов и, таким образом, блокирует репликацию вируса, как впервые обнаружил ведущий вирусолог SARS Ральф Барик в 2010 году.
- Q уерцетин поддерживает клеточную абсорбцию цинка и обладает дополнительными противовирусными свойствами, что было впервые обнаружено во время эпидемии SARS-1 в 2003 году.
- Ивермектин (противопаразитарный препарат) обладает широкими противовирусными и противовоспалительными свойствами.
- Бромгексин (муколитическое средство от кашля) подавляет экспрессию клеточной протеазы TMPRSS2 и, таким образом, проникновение вируса в клетку, как впервые было описано в 2017 году.
- Витамины C и D поддерживают и улучшают реакцию иммунной системы.
- Азитромицин (антибиотик) предотвращает бактериальные суперинфекции легких.
- Преднизон (кортикостероид) уменьшает системное воспаление, связанное с ковидом.
- Аспирин может помочь предотвратить инфекционные тромбозы и эмболии у пациентов из группы риска.
См. Также : Иллюстрация механизмов действия HCQ, кверцетина и бромгексина.
Дополнительные примечания
Раннее лечение пациентов при появлении первых типичных симптомов и даже без ПЦР-теста необходимо для предотвращения прогрессирования заболевания. Напротив, изоляция инфицированных пациентов из группы высокого риска дома и без раннего лечения до тех пор, пока у них не разовьются серьезные респираторные проблемы, как это часто случается во время карантина, может быть контрпродуктивным.
Людям из группы высокого риска, проживающим в эпидемически активной зоне, следует рассмотреть профилактическое лечение вместе со своим врачом. Причина этого — длительный инкубационный период covid-19 (до 14 дней): когда пациенты впервые замечают, что они заразились болезнью, вирусная нагрузка уже максимальна, и часто остается всего несколько дней, чтобы отреагировать. раннее лечебное вмешательство.
Раннее лечение, основанное на вышеупомянутом протоколе, направлено на избежание госпитализации .Если госпитализация все же становится необходимой, опытные врачи интенсивной терапии рекомендуют по возможности избегать инвазивной вентиляции (интубации) и вместо нее использовать кислородную терапию (HFNC).
Вполне возможно, что вышеупомянутый протокол лечения, который является простым, безопасным и недорогим, может сделать более сложные лекарства, вакцинацию и другие меры в значительной степени устаревшими.
Стадии заболевания ковидом (EVMS)
Список литературы
Общий
Ивермектин
- Обзор : Резюме международных исследований ивермектина covid (c19ivermectin.com)
- Обзор : Ивермектин — потенциальное глобальное решение пандемии Covid-19 (FLCCC)
- Обзор : Обзор новых данных в поддержку использования ивермектина для профилактики и лечения COVID-19 (FLCCC, ноябрь 2020 г.)
цинк
- Исследование : Низкий уровень цинка при госпитализации ассоциируется с плохими исходами COVID-19 (Vogel et al., MedRxiv, октябрь 2020 г.)
- Исследование : Гидроксихлорохин и азитромицин плюс цинк против гидроксихлорохина и только азитромицина: исходы у госпитализированных пациентов с COVID-19 (Carlucci et al., MedRxiv, май 2020 г.)
- Исследование : Лечение SARS-CoV-2 пероральными солями цинка в высоких дозах: отчет о четырех пациентах (Эрик Финци, Международный журнал инфекционных заболеваний, июнь 2020 г.)
- Исследование : Цинк ингибирует активность РНК-полимеразы коронавируса и артеривируса In vitro и ионофоры цинка блокируют репликацию этих вирусов в культуре клеток (Velthuis et al, PLOS Path, 2010)
- Исследование : Влияние солей цинка на репликацию респираторно-синцитиального вируса (Suara & Crowe, AAC, 2004)
- Исследование : Цинк от простуды (Cochrane Systematic Review, 2013)
- Обзор : Добавки цинка для улучшения результатов лечения детей с диагнозом респираторные инфекции (ВОЗ, Технический отчет, 2011 г.)
- Статья : Могут ли цинковые леденцы помочь при коронавирусной инфекции? (Университет Макгилла, март 2020 г.)
Кверцетин
- Исследование : Небольшие молекулы, блокирующие проникновение коронавируса тяжелого острого респираторного синдрома в клетки-хозяева (Ling Yi et al., Журнал вирусологии, 2004 г.)
- Исследование : Цинк-ионофорная активность кверцетина и эпигаллокатехин-галлата: от клеток Hepa 1-6 к модели липосом (Dabbagh et al., JAFC, 2014)
- Исследование : Кверцетин как противовирусный агент ингибирует проникновение вируса гриппа A (Wu et al, Viruses, 2016)
- Исследование : Кверцетин и витамин C: экспериментальная синергетическая терапия для профилактики и лечения заболевания, связанного с SARS-CoV-2 (Biancatelli et al, Front.in Immun., июнь 2020 г.)
- Отчет : Протокол управления Covid-19 EVMS Critical Care (Пол Марик, доктор медицины, июнь 2020 г.)
Бромгексин
- Исследование : TMPRSS2: потенциальная мишень для лечения вируса гриппа и коронавирусных инфекций (Wen Shen et al., Biochimie Journal, 2017)
- Письмо : Использование муколитического средства для подавления кашля и ингибитора протеазы TMPRSS2 бромгексина для профилактики и лечения инфекции SARS-CoV-2 (Maggio and Corsini, Pharmacological Research, April 2020)
- Исследование : Возможные новые стратегии лечения COVID-19: есть ли роль бромгексина в качестве дополнительной терапии? (Депфенхарт и др., Внутренняя и неотложная медицина, май 2020 г.)
- Исследование : Бромгексина гидрохлорид: потенциальный подход к профилактике или лечению ранней стадии COVID-19 (Степанов и Лирц, Журнал инфекционных заболеваний и эпидемиологии, июнь 2020 г.)
- Исследование : Ингибиторы TMPRSS2, бромгексин, апротинин, камостат и нафамостат в качестве потенциальных средств лечения COVID-19 (Арсалан Азими, Обзор лекарственных средств, июнь 2020 г.)
- Испытание : Влияние бромгексина на клинические исходы и смертность пациентов с COVID-19: рандомизированное клиническое испытание (Ansarin et al., BioImpacts, июль 2020 г.)
Аспирин и гепарин
- Исследование : Лечение антикоагулянтами связано со снижением смертности у пациентов с тяжелой коронавирусной инфекцией 2019 г. с коагулопатией (Tang et al, JTH, май 2020 г.)
- Исследование : Результаты аутопсии и венозная тромбоэмболия у пациентов с COVID-19 (Wichmann et al., Annals of Internal Medicine, май 2020 г.)
- Обзор : Руководство по антикоагуляции, появляющееся при тяжелой форме COVID-19 (Medpage Today)
- Исследование : Экспрессия и функция гена тромбоцитов у пациентов с COVID-19 (Manne et al., ASH Blood, сентябрь 2020 г.)
- Обзор : Следует ли использовать аспирин для профилактики коагулопатии, вызванной COVID-19? (Hussein et al., Medical Hypotheses, ноябрь 2020 г.)
См. Также
Поделиться в : Twitter / Facebook
Причины, симптомы и варианты лечения
Проверено с медицинской точки зрения Drugs.com. Последнее обновление: 22 января 2020 г.
Что такое дефицит витамина B12?
Витамин B12 необходим для производства достаточного количества здоровых эритроцитов в костном мозге.Витамин B12 содержится только в продуктах животного происхождения (мясных и молочных продуктах) или дрожжевых экстрактах (например, пивных дрожжах). Дефицит витамина B12 определяется низким уровнем запаса B12 в организме, что может привести к анемии — более низкому, чем обычно, количеству эритроцитов.
Дефицит витамина B12 может развиваться по следующим причинам:
- Отсутствие внутреннего фактора, также называемого злокачественной анемией — Внутренний фактор — это белок, секретируемый клетками слизистой оболочки желудка.Внутренний фактор присоединяется к витамину B12 и переносит его в кишечник для всасывания. Отсутствие внутреннего фактора — наиболее частая причина злокачественной анемии. Отсутствие внутреннего фактора часто связано с состоянием, называемым атрофическим гастритом, истончением слизистой оболочки желудка. Атрофический гастрит чаще встречается у пожилых людей афроамериканского или североевропейского происхождения. У этих людей злокачественная анемия развивается примерно в 60 лет.
У детей снижение уровня внутреннего фактора может быть наследственным (генетическим) заболеванием.Когда это происходит, низкие уровни внутреннего фактора вызывают симптомы юношеской пернициозной анемии у пациентов моложе 10 лет.
Пагубная анемия чаще возникает у людей, у которых уже есть заболевания, связанные с аномалиями иммунной системы, такие как болезнь Грейвса, гипотиреоз (недостаточная работа щитовидной железы), тиреоидит (воспаление щитовидной железы), витилиго и болезнь Аддисона (недостаточность коры надпочечников).
- Удаление или разрушение желудка — Дефицит витамина B12 может развиться у людей, перенесших операцию по удалению части или всего желудка.
- Чрезмерный рост бактерий — У некоторых людей дефицит витамина B12 развивается в результате состояний, замедляющих движение пищи по кишечнику (диабет, склеродермия, стриктуры, дивертикулы), что позволяет кишечным бактериям размножаться и разрастаться в верхней части кишечника. тонкий кишечник. Эти бактерии крадут B12 для собственных нужд, а не позволяют ему усваиваться организмом.
- Диетический дефицит — Веганы (строгие вегетарианцы, которые не едят мясо, рыбу, яйца или молочные продукты) могут развить дефицит витамина B12, потому что им не хватает витамина B12 в своем рационе.У пациентов с нервной булимией или нервной анорексией дефицит витамина B12 также может быть связан с диетой. Однако ваша печень может хранить витамин B12 до пяти лет, поэтому диета редко вызывает анемию.
Симптомы
Симптомы обычно развиваются медленно и не могут быть распознаны сразу. По мере ухудшения состояния общие симптомы включают:
- Слабость и утомляемость
- Бред и головокружение
- Сердцебиение и учащенное сердцебиение
- Одышка
- Болезненный язык, красный, мясистый вид
- Тошнота или плохой аппетит
- Похудание
- Диарея
- Желтоватый оттенок кожи и глаз
Если низкий уровень B12 сохраняется в течение длительного времени, состояние также может привести к необратимому повреждению нервных клеток, что может вызвать следующие симптомы:
- Онемение и покалывание в руках и ногах
- Затруднения при ходьбе
- Слабость мышц
- Раздражительность
- Потеря памяти
- Деменция
- Депрессия
- Психоз
Диагностика
Ваш врач спросит вас о вашей диете и о семейном анемии.Ваш врач также проверит вашу историю болезни на предмет заболеваний (диабет, иммунные нарушения) или операций, таких как удаление желудка, которые могут привести к дефициту B12.
Ваш врач может заподозрить, что у вас дефицит витамина B12, на основании вашей истории болезни и симптомов. Для подтверждения диагноза он осмотрит вас и назначит лабораторные анализы. Во время медицинского осмотра ваш врач будет искать красный мясистый язык, бледную или желтоватую кожу, учащенный пульс и шумы в сердце, вызванные увеличением потребности сердца в кровотоке из-за анемии.Лабораторные исследования будут включать:
- Стандартные анализы крови для измерения уровня красных кровяных телец и проверки их внешнего вида — При дефиците витамина B12 красные кровяные тельца имеют необычно большие размеры и выглядят ненормально.
- Анализы крови для измерения уровня B12 — Уровни железа и фолиевой кислоты также могут быть измерены для выявления дефицита этих питательных веществ.
- Анализ крови для измерения уровня метилмалоновой кислоты — Уровень метилмалоновой кислоты в крови повышается, когда у человека наблюдается дефицит B12.
- Анализы крови на антитела к внутреннему фактору — Ваш врач может назначить специальные тесты для определения уровня антител, чтобы определить, есть ли у вас злокачественная анемия. У большинства людей, у которых отсутствует внутренний фактор в желудке, есть эти антитела в крови.
- Биопсия костного мозга — Иногда для подтверждения диагноза проводится биопсия костного мозга. В этой процедуре берется небольшой образец костного мозга путем введения иглы в тазовую кость чуть ниже талии по обе стороны от позвоночника.Образец костного мозга исследуется в лаборатории для поиска других причин анемии и аномалий эритроцитов.
Ожидаемая продолжительность
При правильном лечении симптомы дефицита витамина B12 начинают улучшаться в течение нескольких дней. У веганов и других людей, у которых дефицит B12 связан с диетой, пероральные добавки B12 и диета, предназначенная для увеличения потребления витамина B12, должны вылечить это состояние. Людям с пагубной анемией или людям, которые не могут усвоить витамин B12 из своего кишечника, потребуются инъекции витамина B12 каждые один-три месяца на неопределенный срок.
Профилактика
Чтобы предотвратить дефицит витамина B12, веганы должны принимать достаточное количество добавок с витамином B12, чтобы восполнить его дефицит в своем рационе.
Для людей, которые не могут усваивать B12, это состояние невозможно предотвратить. Однако после постановки диагноза регулярные инъекции витамина B12 предотвратят возвращение симптомов.
Лечение
Лечение этого состояния включает восполнение недостающего витамина B12.Людям, которые не могут усваивать B12, нужны регулярные инъекции. При первом введении инъекций пациент с тяжелыми симптомами может получать от пяти до семи в течение первой недели для восстановления запасов этого питательного вещества в организме. Ответ обычно наблюдается в течение 48-72 часов с быстрой выработкой новых эритроцитов. Как только запасы B12 достигнут нормального уровня, каждые один-три месяца необходимо будет вводить витамин B12, чтобы симптомы не вернулись. Люди, которые не могут усваивать витамин B12, должны продолжать придерживаться хорошо сбалансированной диеты, которая обеспечивает другие питательные вещества (фолиевую кислоту, железо и витамин C), необходимые для производства здоровых клеток крови.Иногда люди могут принимать высокие дозы перорального B12 вместо инъекций, но врач должен внимательно следить за этим.
У людей, дефицит витамина B12 которых связан с чрезмерным ростом кишечных бактерий, лечение пероральными антибиотиками, такими как тетрациклин (продается под несколькими торговыми марками), может остановить чрезмерный рост бактерий и позволить абсорбции витамина B12 вернуться к норме.
Дефицит витамина B12, возникающий в результате неправильного питания, лечится легче всего.Состояние можно изменить, принимая пероральные добавки с витамином B12 и добавляя продукты, содержащие B12.
При тяжелой анемии и крайне низком уровне эритроцитов могут потребоваться переливания крови в течение первых двух дней, пока не начнут действовать инъекции витамина B12.
Когда обращаться к специалисту
Обратитесь к врачу для медицинского осмотра, если вы испытываете необъяснимую усталость, учащенное сердцебиение, одышку, болезненный язык или любые другие симптомы дефицита витамина B12.Это особенно верно, если вы веган, старше 50 лет и афроамериканского или североевропейского происхождения, страдаете диабетом, страдаете аутоиммунным заболеванием или вам удалили желудок.
Прогноз
Перспектива отличная, потому что эта форма анемии хорошо поддается лечению. Однако возможно, что повреждение нервных клеток будет необратимым. Некоторое остаточное повреждение нервной системы может остаться у людей, обратившихся за лечением на поздних стадиях болезни.
Подробнее о дефиците витамина B12
Сопутствующие препараты
IBM Watson Micromedex
Клинические коды МКБ-10 CM (внешние)
Внешние ресурсы
Национальный институт сердца, легких и крови (NHLBI)
http://www.nhlbi.nih.gov/
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности за медицинское обслуживание
.

 Может сохраняться до 12 недель после рождения.
Может сохраняться до 12 недель после рождения.