Обзор онкологических заболеваний крови
ЗЛОКАЧЕСТВЕННЫЕ ЗАБОЛЕАНИЯ КРОВИ
Опухоли кроветворной и лимфоидной тканей составляют приблизительно 8% от всех злокачественных новообразований, и все вместе входят в число 6 самых частых видов злокачественных заболеваний.
Предлагаем Вашему вниманию краткий, но очень подробный обзор онкологических заболеваний кроветворной системы.
Его подготовили высоко квалифицированные специалисты Отдела лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
Филиалы и отделения, где лечат злокачественные заболеания крови
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.

МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.

Злокачественные заболевания крови (современное обозначение: опухоли кроветворной и лимфоидной тканей ,онкогематологические заболевания , устаревшее название – гемобластозы , в бытовом понимании —рак крови ) – эти понятия объединяют различные по своим клиническим и биологическим свойствам, прогнозу и подходам к лечению заболевания, общим для которых является происхождение из той или иной клетки крови, находящейся на том или ином этапе развития. Иными словами, в организме здорового человека клетки-родоначальницы кроветворения непрерывно образуются новые клетки крови, такой процесс образования, развития и созревания клеток крови — лейкоцитов, эритроцитов, тромбоцитов носит название гемопоэз.
Каждая новая клетка проходит строго определенные этапы своего развития, результатом которых является изменение ее внешнего вида и свойств. Если на каком-либо этапе в силу разных повреждающих причин происходит «замирание» одной единственной клетки (=блок дифференцировки), а затем эта клетка начнет деление и новые клетки будут также лишены возможности дальнейшего развития, то исходом этого процесса будет накопление не завершивших все необходимые этапы дифференцировки клеток (=опухолевого клона), что собственно и будет обозначать начало гемобластоза. Интересно, что злокачественные клетки крови в той или иной мере сохраняют морфологические, иммунологические свойства и «биологическое поведение» своих нормальных аналогов.
Существующие классификационные системы опухолей лимфоидной и кроветворной тканей основываются на детальной иммуноморфологической характеристике опухоли, подкрепленной в ряде случаев дополнительной информацией о генетической и молекулярной ее структуре.
Иммунофенотипирование при лейкозе или лимфоме
– необходимый диагностический этап при остром лейкозе или лимфоме. Это комплексная характеристика типа клеток. С использованием иммунологических методов возможно выявление особых структур, антигенов, на поверхности клетки (как правило, белковых молекул, так называемых CD (claster differentiation), кластер дифференцировки). Комплекс данных антигенов составляет иммунологический фенотип (иммунофенотип) на основании которого каждая клетка может быть отнесена к определенному классу: негемопоэтическая, гемопоэтическая, миелоидная, лимфоидная, T-клетка, В-клетка, клетка-предшественник. В соответствии с иммунофенотипом определяется иммунологический вариант заболевания, что является принципиальным для выбора правильной терапии на этапе диагноза.
Цитогенетический метод исследования крови
в настоящее время входит в перечень необходимых диагностических мероприятий при большинстве онкогематологических заболеваний. Данный метод позволяет:
• Провести точную диагностику большинства опухолевых заболеваний системы крови.
• Определить прогноз заболевания.
• Использовать таргетную (точечную, прицельную терапию) при обнаружении определенных цитогенетических перестроек.
В основе развития онкогематологических заболеваний лежат перестройки (поломки) генетического материала в клетках кроветворной и лимфоидной тканей. Эти события приводят к трансформации нормальных кроветворных клеток в опухолевые. Они не затрагивают другие клетки организма (в т.ч. половые клетки). По этой причине онкогематологические заболевания, за редким исключением, не передаются по наследству. Хромосомные перестройки можно обнаружить при помощи стандартного цитогенетического исследования или более чувствительного метода – интерфазного анализа с использованием зондов (маркеров) к конкретным участкам хромосом (метод FISH). В ряде случаев цитогенетические изменения могут происходить на субмикроскопическом уровне (т.к называемые точечные мутации). Такие изменения возможно детектировать только с помощью ультратонких высокочувствительных методов молекулярного исследования (метод ПЦР- полимеразная цепная реакция).
Чем продиктована необходимость проведения молекулярно-цитогенетических исследований у онкогематологических больных? В настоящее время хорошо изучен ряд цитогенетических изменений, являющихся уникальными специфическими маркерами для различных вариантов опухолевых заболеваний системы крови. Их обнаружение является достоверным критерием диагноза. Яркими примерами могут служить транслокация t(9:22) или филадельфийская хромосома, присутствующая во всех случаях хронического миелолейкоза; транслокация t(15;17) — при остром промиелоцитарном лейкозе, транслокация t(8;14) – при лимфоме Беркитта. Кроме того, расшифровка цитогенетических событий привела к созданию таргетных препаратов, которые в отличие от химиопрепаратов обладают селективным действием на опухолевые клетки. Так, использование иматиниба при обнаружении филадельфийской хромосомы кардинально изменило прогноз хронического миелолейкоза.
В ходе больших международных исследований было обнаружено различное течение онкогематологических заболеваний в зависимости от обнаружения тех или иных хромосомных перестроек или мутаций генов. Известны изменения, ассоциированные с благоприятным, промежуточным или неблагоприятным агрессивным течением заболевания. Таким образом, молекулярно-цитогенетические характеристики являются предикторами прогноза. На этой основе при различных онкогематологических заболеваниях на ряду с другими признаками разрабатываются программы терапии разной интенсивности (риск-адаптированная терапия).
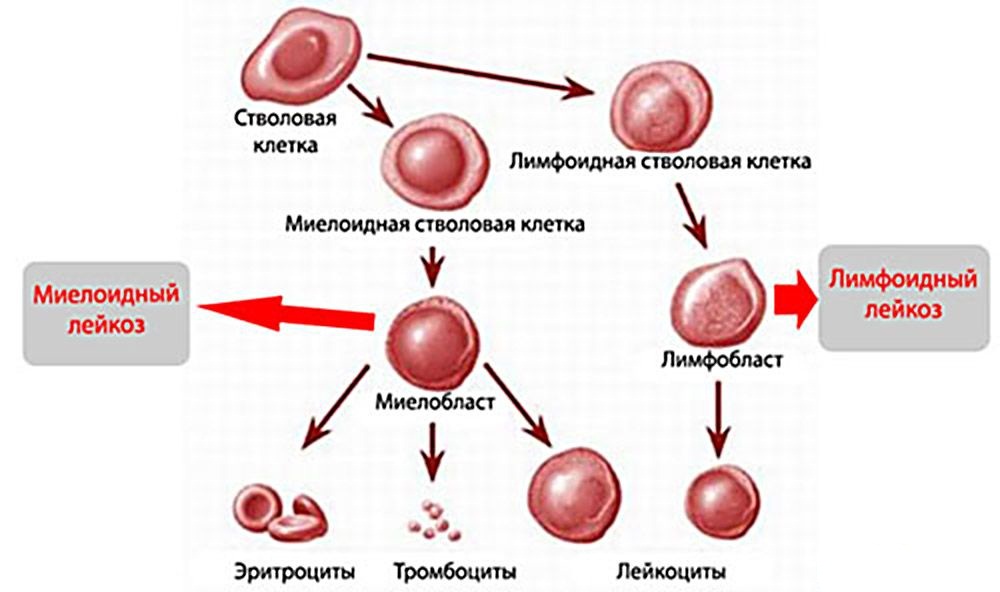
Среди опухолей кроветворной и лимфоидной тканей различают лимфомы и лейкозы. Исторически сложилось разделение лимфоидных опухолей (лимфом) на лимфому Ходжкина и неходжкинские лимфомы. Неходжкинские лимфомы в зависимости от клеточной линии подразделяются на В-клеточные, Т- и NK-клеточные опухоли. На сегодняшний день на основании морфоиммунологических и генетических характеристик выделяется несколько десятков видов неходжкинских лимфом, для многих из которых созданы обособленные терапевтические программы. Лейкозы представляют собой разнородную группу заболеваний, делятся на острые и хронические в зависимости от субстрата опухоли: при острых лейкозах основная масса клеточного субстрата представлена незрелыми клетками (бластами ), при этом блок дифференцировки происходит очень рано, на этапе клеток-родоначальниц кроветворения, в отличие от хронических лейкозов, где опухолевые клетки представлены зрелыми и созревающими элементами. Также принципиально важным является деление лейкозов на миелоидные и лимфоидные, что возможно только при проведении качественного морфо- цитохимического, иммунофенотипического и молекулярно-генетического исследований клеток крови еще до начала лечения.
Опухоли кроветворной и лимфоидной тканей составляют приблизительно 8% от всех злокачественных новообразований, и все вместе входят в число 6 самых частых видов злокачественных заболеваний. Уровень смертности при этом значительно снизился в последнее два десятилетии, что является следствием появления новых высоко эффективных программ лечения.
Филиалы и отделения Центра, в которых лечат злокачественные заболевания кроветворной системы
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
Отдел лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующая отделом, д.м.н. ФАЛАЛЕЕВА Наталья Александровна
8 (484) 399 – 31-30, г. Обнинск, Калужской области
Отдел лекарственного лечения опухолей МНИОИ имени П.А. Герцена –филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделом, д.м.н. ФЕДЕНКО Александр Александрович
8 (494) 150 11 22
Сами по себе онкологические заболевания крови проявляется по-разному и имеют довольно большое число симптомов, которые также могут указывать и на обычные болезни. Именно поэтому нужно в совокупности знать, как действует рак крови на организм человека, чтобы вовремя его диагностировать, а позже вылечить. Сегодня мы узнаем, как определить рак крови и многое-многое другое.
Что такое рак крови?
Обычно это совокупность различных патологий, из-за чего происходит полное угнетение системы кроветворения, и в результате здоровые клетки костного мозга заменяются на больные. При этом замена может быть практически всех клеток. Раковые образования в крови обычно быстро делятся и размножаются, тем самым заменяя здоровые клетки.
Есть как хронический рак крови, так и острый лейкоз, обычно злокачественное новообразование в крови имеет разные разновидности по типу поражения тех или иных групп клеток в крови. Также от этого зависит агрессивность самого рака и скорость его распространения.
Хронический лейкоз
Обычно болезнь подвергает видоизменению лейкоцитов, при мутации они становятся зернистыми. Само заболевание протекает довольно медленно. Позже в результате замены больных лейкоцитов на здоровые нарушается функция кроветворения.
Подвиды
- Мегакариоцитарный лейкоз. Стволовая клетка видоизменяется, появляются множественные патологии в костном мозге. В последствии появляются больные клетки, которые очень быстро делятся и заполняют кровь только ими. Увеличивается количество тромбоцитов.
- Хронический миелолейкоз. Самое интересное, что этим заболевание больше болеют именно мужчины. Процесс начинается после мутации клеток костного мозга.
- Хронический лимфолейкоз. Данное заболевание малосимптомное вначале. Лейкоциты скапливаются в тканях органов, и их становится очень много.
- Хронический моноцитарный лейкоз. Данная форма не увеличивает количество лейкоцитов, но при этом увеличивается количество моноцитов.
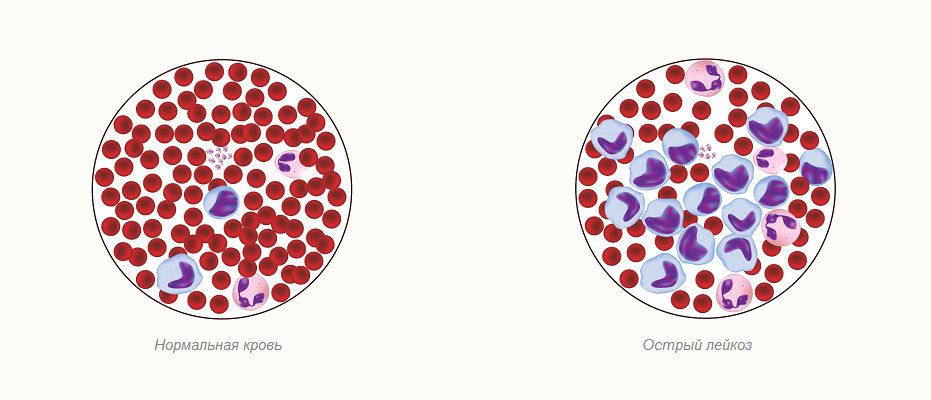
Острый лейкоз
В общем тут уже происходит увеличения количества кровяных клеток, при этом они очень быстро растут и быстро делятся. Этот вид рака развивается быстрее из-за чего острый лейкоз считается более тяжелой формой для больного.
Подвиды
- Лимфобластный лейкоз. Данное онкозаболевание чаще встречается у детей от 1 до 6 лет. При этом лимфоциты заменяются на больные. Сопровождается сильной интоксикацией и падением иммунитета.
- Эритромиелобластный лейкоз. В костном мозге начинается повышенная скорость роста эритробластов и нормобластов. Повышается количество красных клеток.
- Миелобластный лейкоз. Обычно идет поломка на уровне ДНК кровяных клеток. В итоге больные клетки полностью вытесняют здоровые. При этом начинается дефицит любого из основных: лейкоцитов, тромбоцитов, эритроцитов.
- Мегакариобластный лейкоз. Быстрое увеличение в костном мозге мегакариобластов и недифференцированных бластов. В частности, поражает детей с синдромом Дауна.
- Монобластный лейкоз. Во время этой болезни постоянно повышается температура и наступает общая интоксикация организма у пациента с раком крови.
Причины рака крови
Как вы наверно знаете, кровь состоит из нескольких основных клеток, которые выполняют свою функцию. Эритроциты доставляют кислород тканям всего организма, тромбоциты позволяют закупоривать раны и щели, а лейкоциты защищают наш организм от антител и чужеродных организмов.
Клетки рождаются в костном мозге, и на ранних этапах более подвержены внешним фактором. Любая клетка может превратиться в раковую, которая будет в последствии бесконечно делиться и размножаться. При этом эти клетки имеют другое строение и не выполняют свою функцию на 100 %.
Точные факторы, по которым может происходить мутация клеток, ученым пока не известны, но есть некоторые подозрения:
- Радиация и радиационный фон в городах.
- Экология
- Химические вещества.
- Неправильный курс лекарственных веществ и препаратов.
- Плохое питание.
- Тяжелые болезни, например, ВИЧ.
- Ожирение.
- Курение и алкоголь.
Почему опасен рак? Раковые клетки изначально начинают мутировать в костном мозге, они там бесконечно делятся и забирают питательные вещества у здоровых клеток, плюс выделяя большое количество продуктов жизнедеятельности.
Когда их становится слишком много, эти клетки уже начинают распространяться по крови во все ткани организма. Рак крови обычно идет от двух диагнозов: лейкоз и лимфосаркома. Но правильное научное название все-таки именно — «гемобластоз» то есть опухоль возникла в результате мутации кроветворных клеток.
Гемобластозы, которые появляются в костном мозге, называются лейкозом. Раньше его еще называли лейкемией или белокровьем — это когда в крови появляется большое количество незрелых лейкоцитов.
Если опухоль возникла вне костного мозга, то ее называют гематосаркома. Есть также более редкое заболевание лимфоцитома — это когда опухоль поражает зрелые лимфоциты. Рак крови или гемабластоз имеет плохое течение из-за того, что раковые клетки могут поражать любой орган, и при этом обязательно при любой форме поражение падет на костный мозг.
После того как начинаются метастазы, и злокачественные клетки распространяются на разные типы ткани, они в последствии ведут себя по-разному, и из-за этого ухудшается само лечение. Дело в том, что каждая такая клетка по-своему воспринимает лечение и может по-разному реагировать на химиотерапию.
Какое отличие злокачественного рака крови от доброкачественного? На самом деле доброкачественные опухоли не распространяются на другие органы и сама болезнь протекает без симптомов. Злокачественные же клетки растут очень быстро и еще быстрее метастазируют.
Симптомы рака крови
Рассмотрим самые первые признаки рака крови:
- Головные боли, головокружение
- Боли в костях и ломка в суставах
- Отвращение к еде и запахам
- Поднимается температура без определенных признаков и заболеваний.
- Общая слабость и быстрая утомляемость.
- Частые инфекционные заболевания.
Первые симптомы рака крови могут указывать и на другие болезни, из-за чего пациент редко обращается на этой стадии к врачу и теряет много времени. Позже могут появиться и другие симптомы, на которые обращают внимание родные и близкие:
- Бледность
- Желтизна кожи.
- Сонливость
- Раздражительность
- Кровотечения, которые долго не останавливаются.
В некоторых случаях может сильно увеличиваться лимфоузлы печени и селезенки, из-за чего живот раздувается в размере, появляется сильное ощущение вздутия живота. На более поздних этапах появляются высыпание на кожи, в слизистые во рту начинают кровоточить.
При поражении лимфатических узлов, вы увидите твердое их уплотнение, но без болезненных симптомов. При этом нужно сразу же обратиться к врачу и сделать УЗИ нужных зон.
ПРИМЕЧАНИЕ! Увеличение селезенки печени может быть и из-за других инфекционных болезней, так что нужно провести дополнительное обследование.
Диагностика рака крови
Как распознать рак крови на ранних стадиях? Обычно данное заболевание определяют уже на первом общем анализе крови. Позже делают пункцию мозга — довольно болезненная операция — с помощью толстой иглы протыкают тазовую кость и берут образец костного мозга.
Позже данные анализы отправляют в лабораторию, где смотрят на клетки под микроскопом и дальше говорят результат. Помимо всего можно сделать анализ на онкомаркеры. Вообще врачи проводят как можно больше обследований, даже после выявления самой опухоли.
Но почему? — дело в том, что лейкоз имеет очень много разновидностей и каждая болезнь имеет свой характер и более чувствительна к тем или иным типам лечения — именно поэтому нужно знать, чем именно болеет пациент, чтобы понять доктору, как правильно лечить рак крови.
Стадии рака крови
Обычно разделение на стадии позволяет врачу определить размер опухоли, степень ее поражения, а также наличие метастазирования и влияние на отдаленные ткани и органы.
1 стадия
Сначала в результате сбоя самой иммунной системы, в организме появляются клетки мутанты, которые имеют другой вид и структуру и постоянно делятся. На этой фазе рак довольно легко и быстро лечится.
2 стадия
Сами клетки начинаются сбиваться в стаи и образуют опухолевые сгустки. При этом лечение еще более эффективное. Метастазирование еще не началось.
3 стадия
Раковых клеток становится настолько много, что они сначала поражают лимфатические ткани, а потом распространяются по крови во все органы. Метастазы распространены по всему организму.
4 стадия
Метастазы начали глубоко поражать другие органы. Эффективность химиотерапии в разы снижается, из-за того, что остальные опухоли начинают по-разному реагировать на один и тот же химический реагент. Патология у женщин может распространяться на половые органы, матку и молочные железы.
Как рак крови лечится?
Для того, чтобы бороться с этим недугом обычно используют химиотерапию. С помощью иглы в кровь вводят химические реагенты, которые направлены непосредственно на раковые клетки. Понятно дело, что страдают и другие клетки, в результате чего появляется: выпадение волос, изжога, тошнота, рвота, жидкий стул, снижение иммунитета и анемия.
Проблема этой терапии в том, что конечно сами реагенты направлены на то, чтобы уничтожать только раковые клетки, но они очень похожи на наши родные. А позже они могут мутировать и менять свои свойства, из-за чего какой-либо реагент просто перестает действовать. В итоге применяют более токсичные вещества, которые уже пагубно влияют на сам организм.
Злокачественное заболевание крови — это очень противная болезнь, и по сравнению с другими опухолями она очень быстрая, поэтому, если вовремя ее не диагностировать и не лечить, то пациент умиряет в течение 5 месяцев.
Есть еще одна довольно опасный метод лечения, когда идет пересаживание костного мозга. При этом до этого с помощью химиотерапии уничтожают полностью костный мозг больного, чтобы полностью истребить раковые клетки.
ПРИМЕЧАНИЕ! Уважаемые читатели, помните, что никакие целители и знахари не смогут помочь вам вылечить этот недуг, а так как он развивается очень быстро, то вам обязательно нужно вовремя обратиться к врачу. При этом можно употреблять: витамины, отвары трав ромашки, тысячелистника, масло облепихи — они обладают свойствам противовоспалительного эффекта и помогут остановить кровь в случае чего. Не используйте народные средства типа: настойки мухомора, болиголова, чистотела и других средств с отправляющими веществами. Вы должны понимать, что в этом случае у организма больного очень ослабленный эффект, а это его может просто добить.
Излечим рак крови или нет?
Можно ли вылечить рак крови? Это все зависит от степени и стадии рака, а также от самого вида. При остром лейкозе обычно болезнь очень агрессивная и быстрая — врачам требуется больше курсов химиотерапия, поэтому в этом случае прогноз более печальный. Для Хронического лейкоза, все гораздо радужнее, так как болезнь распространяется и развивается не так быстро.
Рак крови у детей
На самом деле эта болезнь довольно часто встречается у маленьких пациентов с 1 до 5 лет. Связано это в основном с облучением, которое получают матери при беременности, а также при генетическом нарушении внутри ребенка.
При этом болезнь протекает так же как и у взрослых, со всеми сопутствующими симптомами. Отличием является то, что детки гораздо в большей степени подвержены выздоровлению — связано это с тем, что регенерация клеток и тканей у малышей на гораздо более высоком уровне чем у взрослых.
Прогноз при раке крови
- Заболевшие 4-10 человека на 100 000 человек.
- В полтора раза мужчины болеют чаще. У женщин недуг наблюдается реже.
- Хроническим лейкозом болеют больше люди от 40 до 50 лет.
- Острым лейкозом болеют чаще молодежь в возрасте от 10 до 18 лет.
- Детский лейкоз 3-4 заболевших на 100 000 человек.
- Острый лимфобластный лейкоз вылечивается на ранних стадиях — 85-95%. На более поздних стадиях 60-65 %.
- При правильной терапии даже на фоне острого лейкоза можно добиться результата до 6-7 лет жизни.
Сколько живут больные лейкозом? При правильной терапии и при раннем обнаружении болезни, можно прожить больше 5-7 лет. Вообще врачи дают неоднозначные прогнозы на острой и хронической форме рака крови.
 Загрузка…
Загрузка…
Рак крови | Рак — лечение и профилактика
Классификация опухолевых болезней кроветворной системы
 Рак крови
Рак крови
Рак крови – это обобщенное название опухолевых болезней кроветворной системы. В научной литературе их называют гемобластозами, которые подразделяются на:
— лимфомы – опухолевые клетки образуются вне костного мозга, поражается лимфатическая ткань, характерно раннее метастазирование, основным симптомом является увеличение лимфатических узлов;
— лейкозы – поражается непосредственно костный мозг.
В основе заболевания лежит процесс, при котором происходит перерождение отдельных кроветворных клеток в раковые. За счет их быстрого размножения, начинается замещение здоровых клеток крови и костного мозга на злокачественные.
Выделяют следующие виды лейкозов:
— острые – происходит бесконтрольный рост незрелых клеток, их течение значительно тяжелее, длятся не более года;
— хронические – характерно увеличение количества зрелых раковых клеток. Его течение более длительное, до 10 лет.
Следует заметить, что острые лейкозы не могут перейти в хроническую форму, а хронические в острую.
По статистике заболевание развивается преимущественно в детском и пожилом возрасте.
Причины заболевания
Возможные причины его развития следующие:
— действие радиационного излучения;
— наследственность;
— канцерогены;
— химические вещества;
— химиотерапия;
— заболевания органов кроветворения;
— ВИЧ;
— наличие врожденных патологий: синдром Дауна.
Симптомы
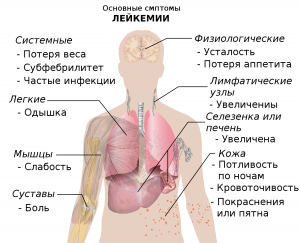 Симптомы рака крови
Симптомы рака крови
Клинические проявления рака зависят не только от вида, но и от стадии заболевания:
- Начальная – наблюдается полиморфоз симптомов. В анализе красной крови изменения практически не выявляются, только в редких случаях может быть анемия. При исследовании белой крови определяется лейкопения, низкий процент незрелых клеток в лейкограмме, снижение числа тромбоцитов.
- Острый – характеризуется нарушением процесса кроветворения, повышенным бластозом костного мозга, появлением незрелых патологических форм.
- Ремиссия – если этот период длится в течение 5 лет, это расценивают как выздоровление.
- Рецидив – каждый следующий рецидив болезни более тяжелый, чем предыдущий.
- Терминальный – происходит значительное нарушение функций кроветворения: развивается гранулоцитопения, анемия, тромбоцитопения. Появляются признаки необратимых изменений в органах и тканях, снижения иммунитета.
Существует множество разновидностей рака, для которых характерны свои специфические проявления, но их все объединяют 4-е основных синдрома заболевания:
- Анемический – происходит недостаточная выработка эритроцитов, поэтому могут появиться такие симптомы рака крови, как:
— усталость;
— головокружение;
— выпадение волос;
— бледность кожи;
— ломкость ногтей;
— сухость кожных покровов.
- Геморрагический – проявляется снижением количества тромбоцитов, что приводит к нарушению свертываемости крови. Для него характерны:
— кровоточивость десен;
— мелкие кровоизлияния в кожу или слизистые;
— образование синяков и обширных гематом;
— на поздних стадиях возникают обильные кровотечения.
- Синдром инфекционных осложнений – выявляется значительное снижение количества лейкоцитов, развивается следующая клиническая картина:
— общая слабость;
— быстрая потеря веса;
— снижение иммунитета;
— высокая температура тела;
— рвота;
— головная боль;
— тошнота;
— потеря аппетита;
— из-за снижения иммунитета начинают присоединяться вторичные инфекции.
- Метастазы – происходит проникновение раковых клеток в здоровые органы, это приводит к нарушению их функций, структуры, они начинают увеличиваться в размерах. Метастазы попадают сначала в лимфатические узлы, печень, селезенку, затем распространяются в другие органы.
Еще одним характерным симптомом для острых и хронических лейкозов является поражение кожных покровов. Выделяют 2-е группы:
- Без специфических особенностей – появляются симптомы различных кожных заболеваний, которые не являются явными признаками рака. К ним относятся:
— крапивница;
— герпес;
— эритэма;
— фурункулез;
— буллезные высыпания;
- Специфические — лейкемиды, это группа признаков поражения кожи, которые соответствуют типичным злокачественным изменениям, происходящим в органах кроветворения. Для них свойственно следующее:
— наличие новообразований в виде узелков;
— язвенно-некротические изменения;
— ограниченные инфильтраты в виде бляшек.
Кожные проявления заболевания необходимо отличать от тех изменений на коже, которые развиваются во время лечения больных цитостатиками и гормональными средствами, лучевой терапией, а также от геморрагического васкулита, импетиго, болезнью Дюринга и другими.
Особенность течения лейкозов у детей
В детском возрасте процент заболеваемости раком достаточно высок. Средний возраст больного ребенка равен 3–5 лет. Острые лейкозы встречаются намного чаще, чем хронические. Самая распространенная форма – лимфобластный лейкоз, до 85 %.
Основные симптомы:
— увеличение лимфатических узлов: шейных, подмышечных, паховых и других;
— поражение сердечной мышцы, кишечника и легких;
— появляется инфильтрация в тканях слезных и слюнных желез;
— боль в костях;
— происходит некротическое поражение слизистых оболочек и кожи, осложненное присоединившейся инфекцией;
— может развиться нейроликемия – состояние, при котором поражаются оболочки и вещества мозга, корешки периферических нервов, на ранних стадиях отмечается метастазирование в центральную нервную систему.
Диагностика
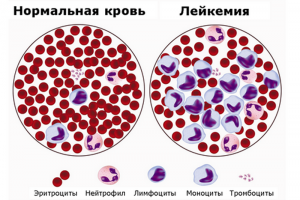 Диагностика рака крови
Диагностика рака крови
Выявить рак на ранних стадиях достаточно сложно, так как многие клинические проявления часто соответствуют другим заболеваниям, не представляющим большой опасности для здоровья. Поэтому процент больных, обратившихся к специалисту при появлении таких признаков очень низкий. Чаще болезнь удается обнаружить на более поздних стадиях.
Для постановки диагноза назначают комплекс обследований:
- Общий анализ крови – выявляется снижение уровня эритроцитов, гемоглобина, тромбоцитов, повышается СОЭ, количество лейкоцитов может значительно увеличиться, а в некоторых случаях наблюдается их снижение.
- Биохимический анализ – этот метод позволяет выявить характерные нарушения, появляющиеся при поражении почек и печени.
- Миелограмма – проводится исследование пунктата костного мозга, чтобы подтвердить диагноз лейкоза.
- Трепанобиопсия – позволяет определить разрастание опухолевых клеток, с вытеснением нормальных, материалом служит биоптат из подвздошной кости.
- Иммунологический метод – помогает выявить характерные поверхностные антигены, а также определить тип острого течения рака.
- Цитохимическое исследование – обнаруживает специфические ферменты бластов материала пункции костного мозга.
- Цитогенетика – это метод дает возможность исследовать хромосомы в раковых клетках крови. Его также применяют для определения типа рака.
- УЗИ органов брюшной полости – позволяет выявить увеличенные селезенку, печень и другие органы с метастазами.
- Рентгенологическое исследование – показывает наличие воспаления в лёгких и увеличенные лимфатические узлы.
Своевременная диагностика заболевания значительно повышает шансы на возможное выздоровление.
Опухоли других локализаций — Студопедия
Опухоли кроветворной системы
Цель:сформировать у студентов представления и знания о причинах, методах диагностики, лечения и профилактики гемобластозов, рака гортани, щитовидной железы, печени, поджелудочной железы, головного мозга
Уровни усвоения:
Представления:Этиология лейкозов .Лейкозы острые и хронгические. Принципы диагностики и лечения
Знания:. Факторы риска. Основные клинические проявления лейкозов. Способы диагностики. Стернальная пункция и трепанобиопсия. Способы лечения. Профилактика . Симптомы рака гортани, щитовидной железы, печени, поджелудочной железы. Диагностика, лечение и профилактика. Особенности симптоматики и диагностики опухолей мозга
План лекции.
1 Схема кроветворения. Понятие о гемобластозах
2.Распространенность, статистика заболеваний крови
3.Этиология, факторы риска
4. Классификация лейкозов
5. Острые лейкозы:
— распространенность,
— симптомы, стадии
-способы диагностики
-способы лечения, его результаты
-понятие о трансплантации костного мозга
6. Хронические лейкозы
-частота
-клинические проявления
-лечение и прогноз
-миеломная болезнь как форма парапротеинемическихъ гемобластозов
7. Лимфогранулематоз и неходжкинские лимфомы
8. Рак гортани
9. Рак щитовидной железы
10. рак печени
11. рак поджелужочной железы
12. Опухоли головного мозга
Опухоли системы крови – гемобластозы – имеют особенности в своем развитии, обусловленные тем, что очаги кроветворения распространены по всему телу, в основном локализованы в красном костном мозге, однако имеются и в печени, селезенке, лимфоузлах, вилочковой железе. Возникнув в одном месте, опухолевые клетки быстро распространяются по этим органам, в связи с чем основной метод лечения опухолей – хирургическое удаление – в данном случае неприменим. До недавнего времени, пока не были разработаны мощные схемы химеотерапии, диагноз лейкоза по сути означал приговор. Поэтому в народе еще силен страх перед этой группой заболеваний, и необходимым компонентом успешного лечения является психологическая подготовка пациента.
Структура заболеваемости опухолями различается у взрослых и детей. Если у взрослых преобладает рак, то в детском возрасте доминируют опухоли неэпителиального происхождения, и подавляющее большинство из них – заболевания крови.
В России острые лейкозы составляют 3,1—100 000, хронические 1,0—1,7:100 000.
Кроветворение
• Стволовая клетка (0,01%)
способность к пролиферации
способность к дифференцировке
• Полипотентные клетки-предшественники
Имеют рецепторы к колониестимулирующим факторам
• Унипотентные клетки-предшественники
Могут дифференцироваться в один росток
Эритропоэз Продолжительность эритропоэза около 12 суток, стимулирующий фактор – эритропоэтин, вырабатывается на 90% в почках
• Пронормоцит (из него обр. 16 эритроцитов)
• базофильные, полихроматофильные и оксифильные нормоциты.
• ретикулоцит (0,5-2% эритроцитов)
• Зрелый эритроцит (живет 120дней)
Нейтрофилопоэз :
• Миелолбласт
• Промиелоцит
• Миелоцит
• Метамиелоцит, палочкоядерный и сегментоядерный гранулоциты
Эозинофилопоэз происходит в костном мозге и во многом сходен с нейтрофилопоэзом. Основными функциями эозинофила являются участие в аллергических реакциях, противопаразитарная защита организма и удаление фибрина, возникшего в ходе воспалительных процессов.
Базофилы: основная функция базофилов и тучных клеток — участие в аллергических и воспалительных реакциях.
Моноцитопоэз происходит в костном мозге и во многом сходен с нейтрофилопоэзом. В моноцитопоэзе выделяют несколько морфологически различаемых стадий: монобласт, промоноцит и моноцит. Моноциты, попадая в ткани, дифференцируются в макрофаги
Лимфоцитопоэз
• Выделяют три основных вида лимфоцитов, Т-,В-лимфоциты и большие гранулярные лимфоциты.
• Все три вида лимфоцитов происходят из костномозговых клеток-предшественниц лимфоцитопоэза.
• Т-лимфоциты в норме составляют 70-80% лимфоцитов периферической крови. Т-лимфоциты — важная составная часть клеточного иммунитета.
• В-лимфоциты составляют 10-15% лимфоцитов периферической крови. Основной функцией В-лимфоцитов является продукция антител — иммуноглобулинов, участвующих в иммунных реакциях
• Большие гранулярные лимфоциты составляют 10-15% лимфоцитов периферической крови. Эти клетки участвуют участвуют в реакциях антителонезависимой клеточной цитотоксичности, а также обладают способностью к неиммунному неантителозависимому уничтожению клеток-мишеней, обычно злокачественных
• Тромбоцитопоэз. Тромбоциты, участвующие в гемостатических реакциях, представляют собой фрагменты цитоплазмы мегакариоцитов дискоидной формы, размером 1-2 мкм. Процесс дифференцировки мегакариоцитов и образования тромбоцитов регулируется с помощью недавно идентифицированного тромбопоэтина.
Опухоли системы крови+ гемобластозы
• Гемобластозы- опухоли, возникшие из кроветворных клеток
• Лейкозы- гемобластозы,при которых опухолевыми клетками заселен костный мозг
• Гематосаркомы – опухоли из кроветворных клеток, разрастающиеся вне костного мозга
Свойства гемобластозов
• Системность поражения(обусловлена ранним метастазированием в органы кроветворения)
• Угнетение нормального кроветворения
• Происходят из одной мутировавшей клетки (клон). Часто имеются хромосомные аберрации (филадельфийская хромосома)
• В процессе развития наблюдается опухолевая прогрессия (изменение свойств), связанная, по-видимому, с повторными мутациями в пределах клона
Этиология гемобластозов
• Ионизирующее излучение (ХМЛ,ОЛ)
• Химические мутагены (бензол, цитостатики -алкилирующие агенты (хлорамбуцил, мельфалан) /индукция вторичных лейкозов/).
• Вирусы (Эпштейна-Барра,Человеческий вирус Т-клеточного лейкоза)
• Наследственность (в т.ч.хромосомные болезни)
• Приобретенный иммунодефицит
– СПИД
– Иммуносупрессия при трансплантациях и при лечении аутоиммунных болезней
Классификация лейкозов
• Острые лейкозы – злокачественные новообразования, источником которых является патологический клон молодых (бластных) клеток
• Хронические –образуются из морфологически зрелых клеток
• Миелодиспластические синдромы — Гетерогенная группа нарушений у лиц старше 50 лет, характеризующихся периферическими цитопениями (одного или более ростков гемопоэза) при наличии нормо- или гиперцеллюлярного костного мозга и диспластического созревания клеток костного мозга, одного или более ростков; у 25-50 % больных заболевание прогрессирует в острый миелоидный лейкоз (ОМЛ) синдромы часто относят к предлейкозу.
Классификация острых лейкозов
• Лимфобластный
• Миелобластный
• Монобластный
• Миеломонобластный
• Промиелоцитарный
• Эритромиелоз
• Плазмобластный
• Мегакариобластный
• Малопроцентный
• Недифференцируемый
В настоящее время у гематологов принята FAB -классификация лейкозов
FAB- классификация (French-American-British).
• существуют три варианта ОЛЛ — L1, L2, L3 и семь вариантов ОМЛ:
• М0 — недифференцированный ОМЛ;
• М1 — миелобластный лейкоз без созревания клеток;
• М2 — миелобластный лейкоз с неполным созреванием клеток;
• М3 — промиелоцитарный лейкоз;
• М4 — миеломоноцитарный лейкоз;
• М5 — монобластный лейкоз;
• М6 — эритролейкоз;
• М7 — мегакариобластный лейкоз.
• В соответствии с экспрессируемыми антигенами ОЛЛ делится на Т-клеточный и В-клеточный типы
Костный мозг — это особый орган, главной функцией которого является кроветворение — создание новых клеток крови вместо погибающих. Он располагается внутри пластинчатых и губчатых костей. У взрослых людей в костном мозге содержится самое большое количество недифференцированных (незрелых) клеток (стволовых). Под влиянием факторов внутренней среды они могут развиваться в любой росток гемопоэза (кроветворения).
Такой термин, как рак костного мозга некорректен. Однако под ним пациенты, как правило, понимают злокачественную опухоль, которая произрастает из клеток костного мозга. Это могут быть следующие заболевания:
- Миелома — злокачественная опухоль, произрастающая из плазматических клеток (дифференцированных В-лимфоцитов).
- Лейкозы — злокачественные новообразования кроветворной системы. Это наиболее обширная и часто выявляемая группа заболеваний данной локализации.
- Лимфомы — злокачественные опухоли лимфатической ткани. Обычно лимфомы дебютируют с поражения лимфоузлов, но есть редкие случаи, когда первичные очаги обнаруживаются сразу в костном мозге. В основном же он поражается при 4 стадии лимфомы, когда опухоль покидает пределы лимфатической системы и начинает распространяться на внелимфатические органы и ткани.
Причины возникновения рака костного мозга
Чаще всего причинами развития так называемого рака костного мозга являются мутации в гемопоэтических стволовых клетках. Следует отметить, что мутации в человеческом организме возникают каждую секунду, но в норме есть много механизмов, которые исправляют ошибки, либо уничтожают поврежденные клетки. При раке эти механизмы нарушаются и злокачественно трансформированные клетки начинают активно делиться, колонизируя собою костный мозг и вытесняя здоровые клетки.
Чтобы развился рак, нужны особые обстоятельства, например, повторные мутации в уже мутировавших клетках, или нарушения иммунной защиты, которая вовремя не распознает патологию и пропускает ее.
Кто входит в группу риска
- Лица, ближайшие кровные родственники которых страдали миеломой, лейкозом или лимфомой.
- Больные первичными и вторичными иммунодефицитами.
- Лица, подвергавшиеся воздействию ионизирующего излучения (проходившие лучевую терапию, ликвидаторы последствий катастрофы на ЧАЭС) или химических канцерогенов.
- Лица, принимавшие или принимающие лекарственную противоопухолевую терапию.
- Наличие предрасполагающих заболеваний — мононуклеоз, моноклональная гаммапатия.
Симптомы рака костного мозга
Симптомы рака костного мозга определяются видом опухоли и ее патогенезом. Например, для миеломы характерны боли в костях. Сначала они носят мигрирующий характер и усиливаются при движении. Со временем симптоматика нарастает, боль становится нестерпимой и даже может полностью обездвижить больного.
Помимо этого, развиваются следующие проявления:
- Из-за расплавления костной ткани в крови повышается уровень кальция, что приводит к развитию симптомов интоксикации, тошноты и рвоты, нарушения сознания вплоть до комы.
- Поражение почек.
- Синдром гипервязкости крови: кровотечения, нарушение зрения и сознания.
- Неврологические проявления: парезы, параличи, онемение, боль. Развиваются при поражении позвонков и сдавлении корешков спинномозговых нервов.
Симптомы лейкозов в основном связаны с вытеснением опухолевыми клетками нормальных ростков кроветворения, что приводит к развитию анемии, глубоким иммунодефицитам и кровотечениям. При развитии нейролейкемии наблюдаются менингиальные симптомы: головная боль, тошнота и рвота, ригидность затылочных мышц. На поздних стадиях наблюдается увеличение лимфатических узлов, селезенки и печени.
Диагностика
Для диагностики рака костного мозга требуется комплексный подход. Первым моментом является сбор анамнеза с оценкой имеющихся жалоб и проведением физикального осмотра. Далее пациент направляется на обследование. Заподозрить миелому можно на основании рентгенограммы костей, лейкозов — по общему анализу крови.
Для подтверждения диагноза требуется морфологическое исследование опухолевого субстрата. С этой целью проводят биопсию или пункцию костного мозга. Помимо этого, проводят дополнительные тесты, направленные на уточнение молекулярно-генетического профиля рака. Это необходимо для определения тактики лечения и выбора оптимального метода химиотерапии.
Лечение
В подавляющем большинстве случаев так называемый рак костного мозга является системным заболеванием с большим объемом опухолевой массы, распространенной по всему организму. Поэтому для радикального лечения требуется системное воздействие на организм, что достигается с помощью химиотерапии, иммунотерапии и таргетной терапии.
Схема лечения будет определяться видом рака. Например, при лейкозах терапию проводят в несколько стадий:
- Индукция ремиссии. На этом этапе преследуется цель уничтожить как можно больше раковых клеток, поэтому используются мощные многокомпонентные схемы химиотерапии. При этом на организм оказывается токсическое действие с двух сторон — непосредственное воздействие химиотерапевтических препаратов плюс воздействие продуктов распада опухоли.
- Консолидация ремиссии. Индукционные препараты, какими мощными они бы не были, не могут за один курс уничтожить все раковые клетки, потому что часть из них находится в неактивном состоянии и «просыпается» по истечении какого-то времени, давая второе начало опухоли. Чтобы их уничтожить, проводится консолидационная терапия.
- Реиндукция ремиссии. Это повторение курса индукционной терапии с целью максимально полного уничтожения оставшихся раковых клеток.
- Поддерживающая терапия. Это последний этап. Его цель — уничтожение оставшихся злокачественных клеток. Для этого назначаются длительные курсы цитостатических препаратов в низких дозах.
При высокозлокачественных формах рака костного мозга (миеломы, агрессивные формы лейкозов, рецидивы заболевания) проводят мощную высокодозную химиотерапию, которая позволяет преодолеть резистентность опухоли. Однако она оказывает мощный уничтожительный эффект на костный мозг, оставляя больного фактически без кроветворения. Чтобы преодолеть это осложнение, проводят трансплантацию гемопоэтических стволовых клеток, которые в последующем послужат основой для восстановления кроветворения.
Стволовые клетки могут забираться у самого пациента на этапе консолидации ремиссии, или от донора. В последнем случае новый клон лейкоцитов будет оказывать противоопухолевое действие на возможные оставшиеся раковые клетки. Таким образом, лечебный эффект будет усиливаться. Однако аллогенные трансплантации могут приводить к развитию такого грозного осложнения, как реакция трансплантат против хозяина, которая в тяжелых случаях может привести к гибели реципиента.
Аллогенные трансплантации показаны далеко не всем пациентам. Их рекомендуют делать, например, при лечении миеломы. Некоторым таким пациентам показана двойная или тандемная трансплантация, при которой проводится две пересадки стволовых клеток.
Особенности болезни у беременных и пожилых
Рак костного мозга более неблагоприятно протекает у пожилых людей. Это связано с наличием сопутствующей патологии и наличием ограничений при применении высокодозной химиотерапии, которая потенциально могла бы привести к стойкой ремиссии. Например, при миеломе пациентам старше 65 лет двойная трансплантация стволовых клеток не проводится ввиду высоких рисков летальности.
Что касается беременности, то рекомендуется использовать надежную контрацепцию минимум в течение 2-х лет после достижения ремиссии. Если заболевание было впервые диагностировано на фоне беременности, то тактика выбирается индивидуально с учетом срока гестации и вида опухоли. Пациенткам в первом триместре беременности рекомендуется прерывание и незамедлительное начало химиотерапии. При вялотекущих формах лейкоза возможна выжидательная тактика. Начиная со второго триместра беременности, есть возможность проведения химиотерапевтического лечения препаратами, не оказывающими негативного влияния на плод. За несколько недель до родов терапию приостанавливают, чтобы костный мозг успел восстановиться. Метод родоразрешения избирается исходя из акушерской ситуации.
Если рак костного мозга диагностирован в конце третьего триместра, возможен вариант досрочного родоразрешения с последующим назначением полноценного курса химиотерапии.
Осложнения
При прогрессировании заболевания и неэффективности терапии происходит тотальное замещение костного мозга раковыми клетками. Это радикально угнетает кроветворение и приводит к тяжелым анемиям, иммунодефицитам, тромбоцитопениям с развитием кровотечений. Также для многих видов лейкозов и миеломы характерно нарастание болевого синдрома, который требует применения наркотических анальгетиков.
Рецидив
Вероятность развития рецидива зависит от вида рака. Например, большинство форм острого лейкоза хорошо поддаются терапии и дают высокую вероятность полного излечения. Хронические лейкозы склонны к медленному течению, но очень сложно поддаются излечению. Миелома также относится к неизлечимым формам рака костного мозга. Время до рецидива при применении стандартной терапии составляет около 29 месяцев, а при тандемной трансплантации — около 42 месяцев.
При развитии рецидива тактика лечения определяется в зависимости от периода безрецидивной выживаемости. Как правило, если прошло более 6-12 месяцев, можно использовать схемы химиотерапии первой линии. При меньших сроках тактику меняют и назначают препараты второй и последующих линий терапии, к которым рак еще не выработал устойчивость.
Прогноз и профилактика рака костного мозга
Прогноз при раке костного мозга определяется видом опухоли. Например, при острых лейкозах пятилетняя безрецидивная выживаемость колеблется в пределах 80%. При этом, чем больше времени прошло от начала ремиссии, тем вероятнее, что болезнь отступила полностью. Но в любой момент может развиться рецидив — возврат заболевания, который потребует повторного лечения. У некоторых больных таких рецидивов может быть несколько, при этом с каждым разом добиться ремиссии сложнее, но это не значит, что невозможно. У ряда пациентов даже после нескольких рецидивов можно добиться выздоровления.
Что касается хронических лейкозов, то они очень сложно поддаются излечению, но протекают длительное время с периодами обострения и затухания. Учитывая то, что в большинстве случаев они развиваются у людей старшего возраста, радикальное лечение может быть противопоказано ввиду наличия сопутствующей патологии. В этих случаях назначают поддерживающую терапию.
Миелома также относится к неизлечимым патологиям. Даже при успешном ответе на двойную пересадку стволовых клеток вероятность развития рецидива в ближайшие 3-4 года остается очень высокой.
Методов профилактики рака костного мозга на сегодняшний день нет. Единственное что можно рекомендовать, это защиту от воздействия канцерогенных факторов и по возможности предотвращение развития приобретенных иммунодефицитов. Пациентам, находящимся в группе риска, необходимо не пренебрегать ежегодной диспансеризацией.
Запись
на консультацию
круглосуточно
6. Опухоли кроветворной ткани
Среди опухолей кроветворной ткани различают:
1) лейкозы;
2) лимфомы (лимфосаркома, ретикулосаркома, плазмоцитома или миелома, лимфогрануломатоз).
В опухолевой ткани находятся 2 клеточных компонента: реактивный и опухолевый. Опухолевый компонент – гигантские одноядерные клетки (Ходжкина) и гигантские многоядерные клетки (2 ядра, в центре которых – клетки Березовского—Штернберга). Эти клетки являются диагностическими. Реактивный компонент: лимфоциты (Т и В), плазматические клетки, эозинофилы, лейкоциты, макрофаги, участки некроза, возникающие вследствие цитотоксического действия Т-лимфоцитов, участки реактивного склероза. Реактивный и опухолевый компоненты встречаются в различных соотношениях, тем самым обуславливая разнообразные варианты заболевания.
Лимфоцитарное преобладание
Наиболее благоприятный прогноз. Лимфоцитарное истощение (преобладание опухоли). Крайняя степень опухолевой прогрессии. Внутриорганные поражения. Селезенка макроскопически приобретает вид деревенской кровяной колбасы – темно-красного цвета, с узлами желтого цвета, по-другому – «порфирная селезенка» (порфир – вид отделочного камня). Смешанная клеточная форма (одинаковое соотношение опухолевого и реактивного компонентов).
Нодулярный (кольцевидный) склероз
Соотношение также равное, но особенность заключается в том, что соединительная ткань развивается в виде колечек. Чаще эта форма наблюдается у женщин, и в начальной стадии заболевания процесс локализуется в лимфатических узлах средостения.
Эпителиальные опухоли развиваются из плоского или железистого эпителия, не выполняющего какой-либо специфической функции. Это эпидермис, эпителий полости рта, пищевода, эндометрия, мочевыводящих путей и т. д. К доброкачественным опухолям относят папиллому и аденому. Папиллома – это опухоль из плоского или переходного эпителия. Она имеет шаровидную форму, плотная или мягкая, с поверхностью сосочкового вида, размером от просяного зерна до крупной горошины. Располагается над поверхностью кожи или слизистой оболочки на широком или узком основании. При травме папиллома легко разрушается и воспаляется, в мочевом пузыре может давать кровотечение. После удаления папилломы в редких случаях рецидивируют, иногда малигнизируют. Аденома – это опухоль железистых органов и слизистых оболочек, выстланных призматическим эпителием. Имеет вид хорошо отграниченного узла мягкой консистенции, на разрезе ткань бело-розовая, иногда в опухоли обнаруживаются кисты. Размеры различные – от нескольких миллиметров до десятков сантиметров. Аденомы слизистых оболочек выступают над их поверхностью в виде полипа. Их называют аденоматозными железистыми полипами. Аденома имеет органоидное строение и состоит из клеток призматического и кубического эпителия. К злокачественным относят:
1) рак на месте – это форма рака без инвазивного (инфильтрирующего) роста, но с выраженным атипизмом и пролиферацией эпителиальных клеток с атипичными митозами;
2) плоскоклеточный (эпидермальный) рак развивается в коже и в слизистых оболочках, покрытых плоским или переходным эпителием (полость рта, пищевод, шейка матки, влагалище). Опухоль состоит из тяжей атипичных клеток эпителия, врастающих в подлежащую ткань, разрушающих ее и образующих в ней гнездные скопления. Она может быть ороговевающей (образуются раковые жемчужины) и неороговевающей;
3) аденокарцинома (железистый рак) развивается из призматического эпителия слизистых оболочек и эпителия желез. Клетки атипичны, различной формы, ядра гиперхромны. Клетки опухоли образуют железистые образования различной формы и величины, которые врастают в окружающую ткань, разрушают ее, и при этом базальная мембрана их утрачивается;
4) слизистый (коллоидный) рак – аденогенная карцинома, клетки которой обладают признаками как морфологического, так и функционального атипизма. Раковые клетки продуцируют огромное количество слизи и в ней погибают;
5) солидный рак – это недифференцированный рак с выраженным атипизмом. Клетки рака располагаются в идее трабекул, разделенных прослойками соединительной ткани;
6) фиброзный рак или скирр – это форма недифференцированного рака, представленного крайне атипичными гиперхромными клетками, расположенными среди пластов и тяжей грубоволокнистой соединительной ткани;
7) мелкоклеточный рак – это недифференцированный рак, состоящий из мономорфных лимфоцитоподобных клеток, не образующих каких-либо структур, строма крайне скудная;
8) медуллярный (аденогенный) рак. Его основная черта – преобладание паренхимы над стромой, которой очень мало. Опухоль мягкая, бело-розового цвета. Представлена пластами атипичных клеток, содержит много митозов, быстро растет и рано подвергается некрозу;
9) смешанные формы рака (диморфные раки) состоят из зачатков двух видов эпителия (плоского и цилиндрического).
Данный текст является ознакомительным фрагментом.
Читать книгу целиком
Поделитесь на страничке
содержание ..
191
192
193
194 ..
Вопрос № 1
Выбор метода лечения лимфосаркомы основывается на данных, уточняющих
а)морфологический вариант опухоли
б)распространенность процесса
в)локализацию первичного очага
(+) г)все приведенные данные
Вопрос № 2
Миеломную болезнь отличает от хронических заболеваний почек
а)увеличение плазматических клеток в миелограмме
б)патологические очаги в скелете
в)протеинурия
г)лейкоцитурия
(+) д)только а) и б)
Вопрос № 3
Костный мозг при лимфогранулематозе вовлекается в процесс в виде
а)развития лейкемизации
(+) б)очагового поражения
в)и того, и другого
г)ни того, ни другого
Вопрос № 4
Поражение при лимфогранулематозе легочной ткани и медиастинальных лимфоузлов
означает наличие
а)I стадии
б)II стадии
в)III стадии
(+) г)I(+) стадии
Вопрос № 5
Наиболее часто начальными клиническими проявлениями лимфосаркомы являются
поражение
(+) а)лимфатических узлов
б)желудочно-кишечного тракта
в)лимфоидного аппарата кольца Пирогова — Вальдейера
г)всего перечисленного
Вопрос № 6
Поражение аксилярных лимфоузлов с двух сторон при лимфогранулематозе трактуется
а)как I стадия
(+) б)как II стадия
в)как III стадия
г)как I(+) стадия
Вопрос № 7
Наиболее прогностически благоприятными морфологическими вариантами
лимфогранулематоза являются
а)лимфоидное преобладание, лимфоидное истощение
(+) б)лимфоидное преобладание, нодулярный склероз
в)нодулярный склероз, смешанно-клеточный вариант
г)смешанно-клеточный вариант, лимфоидное истощение
Вопрос № 8
Основным методом лечения лимфосаркомы IIб, IIIа, IIIб стадии является
(+) а)химиотерапия
б)лучевая терапия
в)хирургический метод
г)комбинированный (химиолучевой) метод
Вопрос № 9
При поражении лимфоузлов выше диафрагмы и селезенки при лимфогранулематозе
должна быть поставлена
а)I стадия
б)II стадия
(+) в)III стадия
г)I(+) стадия
Вопрос № 10
Основными методами лечения нейролейкемии являются
а)системная химиотерапия
б)внутрилюмбальное введение химиопрепаратов
в)кранио-спинальное облучение
г)все приведенные методы лечения
(+) д)преимущественно б) и в)
Вопрос № 11
Суммарные дозы при лучевой терапии лимфогранулематоза на зоны поражения должны
составлять
а)20-25 Гр
(+) б)25-35 Гр
в)35-45 Гр
г)более 45 Гр
Вопрос № 12
Частота вовлечения лимфатического аппарата кольца Пирогова — Вальдейра при
лимфогранулематозе составляет
(+) а)ниже 10%
б)20-30%
в)30-50%
г)более 50%
Вопрос № 13
Поражение печени и селезенки при лимфогранулематозе означает
а)I стадию
б)II стадию
в)III стадию
(+) г)I(+) стадию
Вопрос № 14
Клиническая картина острого лимфобластного лейкоза у детей отличается от таковой
у взрослых
(+) а)более частым вовлечением в процесс лимфоидных органов (лимфатических
узлов, селезенки)
б)более выраженной гипертермией
в)более выраженным угнетением красного и тромбоцитарного ростка
г)всеми приведенными данными
д)только а) и б)
Вопрос № 15
Наиболее целесообразным является использование для лечения генерализованной
пролимфоцитарной лимфосаркомы следующих схем химиотерапии и противоопухолевых
препаратов
а)схема ХВПП
б)схема «3+7»
в)хлорбутин, циклофосфан, глюкокортикоиды
г)сарколизин
(+) д)сочетание а) и в)
Вопрос № 16
Основанием к использованию комбинированной (химиолучевой) терапии при
лимфогранулематозе IIа стадии является
а)СОЭ 50 мм/час
б)наличие смешанно-клеточного варианта и лимфоидного истощения
в)возраст старше 40 лет
(+) г)все вышеперечисленное
Вопрос № 17
При развитии острого лейкоза может нарушаться дифференцировка следующих ростков
нормального кроветворения
а)лимфоидного ростка
б)гранулоцитарного ростка
в)эритроцитарного ростка
(+) г)любого ростка кроветворения
Вопрос № 18
Частота лейкемизации при ретикулосаркоме составляет
(+) а)менее 5%
б)5-10%
в)15-20%
г)20-40%
д)более 40%
Вопрос № 19
Через 0.5 года после экстракции зуба у больной 45 лет выявлено опухолевидное
разрастание в области десны. Произведено радикальное удаление, гистологически —
плазмоцитома. Других проявлений болезни нет. Ей необходимы
а)наблюдение
б)химиотерапия
(+) в)локальная дистанционная g-терапия
г)близкофокусная рентгенотерапия
Вопрос № 20
Вакцинация противопоказана больным, страдающим
(+) а)хроническим лимфолейкозом
б)лимфогранулематозом
в)острым лейкозом
г)миеломной болезнью
Вопрос № 21
У больного 68 лет миеломная болезнь с множественным поражением костей и
частичной компрессией a-1, сопровождающейся болевым синдромом без
неврологических расстройств. На фоне химиотерапии ему целесообразно
а)введение радиоактивного фосфора
б)облучение поясничного отдела позвоночника электронами
(+) в)дистанционная g-терапия на поясничный отдел позвоночника
г)лучевая терапия нецелесообразна
Вопрос № 22
При ретикулосаркоме наиболее часто происходит лейкемизация по типу
(+) а)острого миелоидного лейкоза
б)острого лимфобластного лейкоза
в)хронического лимфолейкоза
г)хронического миелолейкоза
Вопрос № 23
У больного 38 лет диагностирована солитарная плазмоцитома левой подвздошной
кости. Наиболее целесообразна на первом этапе лечения
а)дистанционная g-терапия
б)лечение радиоактивным фосфором
в)лучевая терапия быстрыми электронами
г)химиотерапия алкилирующими препаратами
(+) д)правильные ответы а) и г)
Вопрос № 24
Поражение при лимфогранулематозе паховых лимфоузлов с одной стороны трактуется
(+) а)как I стадия
б)как II стадия
в)как III стадия
г)как I(+) стадия
Вопрос № 25
Острый лейкоз отличается от хронического лейкоза
(+) а)уровнем нарушения дифференцировки клеток костного мозга
б)количеством лейкоцитов в периферической крови
в)количеством тромбоцитов в периферической крови
г)всеми перечисленными параметрами
д)правильные ответы а) и б)
Вопрос № 26
Из перечисленных классификаций для определения клинической стадии
(распространенности) лимфосаркомы используется
а)международная классификация по системе TNM
б)отечественная классификация по стадиям
(+) в)классификация Ann-Arbor (1971 г.)
г)любая из перечисленных
Вопрос № 27
Для постановки диагноза миеломной болезни необходимо рентгенологическое
исследование
а)костей черепа
б)тазовых костей
в)позвоночника
г)трубчатых костей
(+) д)всех отделов скелета
Вопрос № 28
При лимфогранулематозе отмечается
а)лимфогенное метастазирование
б)гематогенное метастазирование
(+) в)оба вида метастазирования
Вопрос № 29
Гематосаркомы имеют склонность к метастазированию
а)лимфогенному
б)гематогенному
(+) в)смешанному
Вопрос № 30
Наименее благоприятными прогностическими вариантами лимфогранулематоза являются
а)лимфоидное преобладание, смешанно-клеточный вариант
б)нодулярный склероз, лимфоидное истощение
(+) в)смешанно-клеточный вариант, лимфоидное истощение
г)лимфоидное преобладание, нодулярный склероз
Вопрос № 31
Для подтверждения наличия миеломной болезни при проведении дифференциального
диагноза между миеломной болезнью и хроническим заболеванием мочек необходимо
а)исследование костного мозга
б)рентгенологическое исследование скелета
в)определение уровня сывороточного белка
г)обнаружение патологического иммуноглобулина в сыворотке и моче
(+) д)все перечисленное
Вопрос № 32
У больного 60 лет миеломная болезнь с преимущественным множественным поражением
плоских костей. К ранее эффективным химиопрепаратам развилась резистентность. С
обезболивающей целью из методов лучевой терапии применить наиболее целесообразно
а)введение радиоактивного фосфора
б)локальное облучение электронами отдельных зон поражения
(+) в)дистанционную g-терапию на отдельные зоны поражения
г)лучевая терапия нецелесообразна
Вопрос № 33
При лимфобластной лимфосаркоме наиболее часто происходит лейкемизация по типу
(+) а)острого лимфобластного лейкоза
б)острого миелобластного лейкоза
в)хронического лимфолейкоза
г)хронического миелолейкоза
Вопрос № 34
Лимфогранулематозом чаще болеют
а)женщины
(+) б)мужчины
в)заболеваемость не коррелирует с полом
Вопрос № 35
В полученной спинно-мозговой жидкости должно быть исследовано
а)уровень белка и клеточность
б)должны быть идентифицированы клеточные элементы
в)уровень сахара, мочевой кислоты
(+) г)все перечисленные показатели
д)правильные ответы только б) и в)
Вопрос № 36
Угнетение клеточного иммунитета при лимфогранулематозе подтверждается
а)увеличением количества вторых опухолей
б)увеличением частоты развития герпетических инфекционных заболеваний (herpes
zoster и др.)
в)увеличением частоты развития туберкулеза
(+) г)всем вышеперечисленным
Вопрос № 37
Течение хронического лимфолейкоза осложняется развитием
а)аутоиммунных процессов (гемолитическая анемия и т.д.)
б)инфекционных осложнений
в)опоясывающего лишая
(+) г)всех перечисленных осложнений
д)только а) и б)
Вопрос № 38
Частота развития острого лейкоза при лимфогранулематозе составляет
(+) а)менее 10%
б)10-20%
в)20-50%
г)более 50%
Вопрос № 39
В качестве первых проявлений лимфогранулематоза наиболее часто отмечается
увеличение
(+) а)шейно-надключичных лимфоузлов
б)медиастинальных лимфоузлов
в)забрюшинных лимфоузлов
г)паховых лимфоузлов
д)всех групп лимфоузлов с одинаковой частотой
Вопрос № 40
У больной 27 лет лимфогранулематоз (нодулярный склероз) pIа стадии с поражением
лимфоузлов левой надключичной области. Спленэктомия произведена. Наиболее
целесообразная лечебная тактика
(+) а)лучевая терапия по радикальной программе с объемом облучения всех зон
лимфатических узлов выше диафрагмы
б)лучевая терапия по радикальной программе с объемом облучения всех зон выше
диафрагмы + парааортальных лимфоузлов и ложа селезенки
в)2 курса полихимиотерапии ЦВПП, облучение левой шейно-надключичной зоны + 2
курса ЦВПП
г)6 курсов полихимиотерапии ЦВПП
Вопрос № 41
При лечении любого варианта лимфосаркомы I-IIа стадии лучевая терапия
целесообразна
а)как самостоятельный метод по радикальной программе
(+) б)как этап комбинированного лечения
в)нецелесообразна
г)верные ответы а) и б)
Вопрос № 42
На первом месте по частоте поражения среди наиболее частых проявлений
лимфосаркомы следует считать поражение
а)лимфоидного аппарата кольца Пирогова — Вальдейера
(+) б)лимфатических узлов
в)желудочно-кишечного тракта
Вопрос № 43
При дистанционной g-терапии на отдельные зоны костного поражения при миеломной
болезни наиболее целесообразны суммарные дозы
а)20-30 Гр
(+) б)35-45 Гр
в)50-60 Гр
г)больше 60 Гр
Вопрос № 44
Специфическое поражение оболочек мозга (нейролейкемия) наиболее часто
наблюдается
(+) а)при остром лимфобластном лейкозе
б)при остром миелобластном лейкозе
в)при хроническом миелолейкозе
г)при хроническом лимфолейкозе
Вопрос № 45
Под термином «гематосаркома» понимается наличие у больного
а)лимфогранулематоза
б)лимфосаркомы
в)ретикулосаркомы
г)любого из перечисленных заболеваний
(+) д)правильные ответы б) и в)
Вопрос № 46
Острый лейкоз диагностируется по данным миелограммы на основании
(+) а)увеличения количества бластных клеток
б)увеличения клеточности костного мозга
в)уменьшения эритроидного ростка
г)наличия всех параметров
д)только а) и в)
Вопрос № 47
Основным методом лечения миеломной болезни является
(+) а)лекарственный
б)лучевой
в)комбинированный (химиолучевой)
г)все ответы верные
д)верные ответы б) и в)
Вопрос № 48
Основным методом лечения лимфосаркомы Iа-IIа стадии является (кроме лимфосаркомы
пищеварительной трубки)
а)химиотерапия
б)лучевая терапия
в)хирургический метод
(+) г)комбинированный (химиолучевой) метод
Вопрос № 49
Наиболее частой причиной летального исхода при хроническом миелолейкозе являются
(+) а)прогрессирование лейкоза — развитие бластного криза
б)инфекционные осложнения
в)аутоиммунные нарушения
г)все приведенные причины
д)верно б) и в)
Вопрос № 50
Аутоиммунные осложнения встречаются наиболее часто
а)при хроническом миелолейкозе
(+) б)при хроническом лимфолейкозе
в)при лимфосаркоме
г)при миеломной болезни
Вопрос № 51
Поражение легочной ткани и забрюшинных лимфоузлов при лимфогранулематозе
трактуется
а)как I стадия
б)как II стадия
в)как III стадия
(+) г)как I(+) стадия
Вопрос № 52
При маргинальном рецидиве лимфогранулематоза после радикальной лучевой терапии
повторное облучение
а)невозможно
б)целесообразно в полной лечебной дозе как самостоятельный метод
в)целесообразно как самостоятельный метод, но при суммарной дозе не больше 30 Гр
(+) г)целесообразно как дополнительный метод после химиотерапии в СОД 30-35 Гр
Вопрос № 53
Основным методом лечения первичной лимфосаркомы пищеварительной трубки Iе-IIе
стадии является
а)химиотерапия
б)лучевая терапия
в)хирургический метод
(+) г)хирургическое лечение с последующей профилактической химиотерапией
д)правильные ответы в) и г)
Вопрос № 54
К симптомам интоксикации при лимфогранулематозе относятся
а)потеря веса, гипертермия (более 38-C)
б)потеря веса, профузная потливость
(+) в)потеря веса, гипертермия (более 38-C), профузная потливость
г)кожный зуд, потеря веса, профузная потливость, гипертермия (более 38-C)
Вопрос № 55
Наиболее часто у взрослых встречаются следующие варианты острого лейкоза
а)острый лимфобластный лейкоз
б)острый миелобластный лейкоз
в)острый эритроцитарный лейкоз
(+) г)правильные ответы а) и б)
д)правильные ответы б) и в)
Вопрос № 56
Лечебные суммарные очаговые дозы при лучевой терапии лимфосаркомы составляют
а)25-30 Гр
(+) б)30-35 Гр
в)35-45 Гр
г)более 50 Гр
Вопрос № 57
В лечении хронического лимфолейкоза лучевая терапия, как дополнительный метод,
может быть использована
а)для облучения селезенки
б)для массивных конгломератов лимфатических узлов
в)для головного мозга для профилактики нейролейкемии
г)лучевая терапия не применяется
(+) д)правильные ответы а) и б)
Вопрос № 58
Хронический лимфолейкоз чаще встречается в возрасте
а)до 15 лет
б)от 16 до 25 лет
в)от 26 до 40 лет
(+) г)старше 40 лет
д)в любом возрасте
Вопрос № 59
При нейролейкемии диагноз основывается на обнаружении следующих изменений в
ликворе, полученных при люмбальной пункции
а)увеличения цитоза ликвора
б)определения опухолевых клеток в ликворе в повышенном количестве
в)определения повышенного количества лимфоцитов
г)повышения уровня белка
(+) д)правильные ответы только а) и б)
Вопрос № 60
Миеломную болезнь следует дифференцировать
а)с метастазами неоплазий в кости
б)с первичным амилоидозом
в)с хроническими заболеваниями почек
(+) г)со всеми указанными процессами
д)только а) и в)
Вопрос № 61
При развитии лимфосаркомы опухолевый процесс включает следующие этапы
а)наличие солитарной опухоли
б)генерализованный процесс
в)поражение костного мозга — развитие лейкемизации
(+) г)все перечисленное
Вопрос № 62
Для определения распространенности при лимфогранулематозе обязательными
диагностическими исследованиями являются
а)трепанобиопсия костного мозга
б)эпифарингоскопия
в)рентгенологическое исследование органов грудной клетки
г)ультразвуковая томография органов брюшной полости и забрюшинного пространства
(+) д)все перечисленное
Вопрос № 63
Хронический лейкоз диагностируется при наличии следующих изменений гемограммы
а)наличия бластных клеток
б)увеличения промежуточных и зрелых клеток (в соответствии с вариантом лейкоза)
в)увеличения количества лейкоцитов
г)снижения уровня тромбоцитов
(+) д)правильные ответы б) и в)
Вопрос № 64
Развитие инфекционных осложнений наиболее характерно
(+) а)для хронического лимфолейкоза
б)для гематосаркомы
в)для лимфогранулематоза
г)для всех видов лейкоза
Вопрос № 65
Хронический лейкоз диагностируется при наличии следующих изменений миелограммы
а)увеличения бластных клеток
(+) б)увеличения промежуточных и зрелых клеток одного ряда костного мозга (в
соответствии с вариантом лейкоза)
в)уменьшения эритроцитарного ростка
г)наличия изменений, приведенных в а) и б)
д)наличия всех изменений
Вопрос № 66
Наиболее частой причиной летального исхода при остром лейкозе является
(+) а)прогрессирование лейкоза
б)инфекционные осложнения
в)гемолитические осложнения
г)все приведенные причины
д)только б) и в)
Вопрос № 67
У больной 65 лет выявлена миеломная болезнь с множественными поражениями
преимущественно плоских костей. Лечение целесообразно начать
а)с дистанционной g-терапии зон костного поражения
б)с облучения зон костного поражения быстрыми электронами
в)с введения радиоактивного фосфора
(+) г)с химиотерапии
Вопрос № 68
Поражение шейных лимфоузлов справа, медиастинальных лимфоузлов и аксилярных
лимфоузлов слева означает при лимфогранулематозе
а)I стадию
(+) б)II стадию
в)III стадию
г)I(+) стадию
Вопрос № 69
При пролимфоцитарной лимфосаркоме наиболее часто происходит лейкемизация по типу
а)острого лимфобластного лейкоза
б)острого миелобластного лейкоза
(+) в)хронического лимфолейкоза
г)хронического миелолейкоза
Вопрос № 70
Наиболее часто встречаются следующие варианты хронического лейкоза
а)хронический лимфолейкоз
б)хронический миелолейкоз
в)хронический моноцитарный лейкоз
г)все перечисленные варианты
(+) д)правильные ответы а) и б)
Вопрос № 71
Для постановки диагноза миеломной болезни необходимо
а)определение уровня СОЭ
б)определение уровня общего белка сыворотки
в)обнаружение патологического иммуноглобулина в сыворотке и/или моче
г)определение повышенного уровня плазматических клеток в миелограмме
(+) д)все исследования необходимы
Вопрос № 72
Лимфосаркомы диагностируются в начальных (I-II) стадиях с частотой
а)менее 20%
(+) б)20-30%
в)30-50%
г)50-70%
д)более 80%
Вопрос № 73
Прогностически благоприятными являются следующие морфологические варианты
лимфосаркомы
(+) а)лимфоплазмоцитарный и пролимфоцитарный
б)лимфобластный
в)иммунобластный
г)все перечисленные варианты
д)только б) и в)
Вопрос № 74
При хроническом миелолейкозе с выраженной спленомегалией облучение селезенки
(+) а)может быть проведено мелкими фракциями, РОД (разовая очаговая доза) 0.5-2
Гр
б)средними фракциями (РОД 3-4 Гр)
в)крупными фракциями (РОД 5-6 Гр)
г)облучение селезенки не применяют
Вопрос № 75
Для клинической картины хронической фазы хронического миелолейкоза наиболее
характерно
(+) а)увеличение размеров селезенки
б)увеличение периферических лимфатических узлов
в)повышение температуры тела
г)наличие всех проявлений
д)только а) и б)
Вопрос № 76
При проведении индукционной лекарственной терапии острого лейкоза основным
критерием оценки эффективности лечения являются
(+) а)данные миелограммы
б)данные гемограммы
в)динамика клинических проявлений
г)все приведенное
Вопрос № 77
При лимфогранулематозе поражение печени и медиастинальных лимфоузлов с
симптомами интоксикации означает наличие
а)IIб стадии
б)IIIа стадии
в)IIIб стадии
г)IVа стадии
(+) д)IVб стадии
Вопрос № 78
Для лечения генерализованных бластных лимфосарком целесообразно использовать
следующие схемы химиотерапии
а)ЦОП
б)АЦОП
в)АЦОП + вепезид
г)»3+7″
(+) д)все перечисленные
Вопрос № 79
Четкий цитогенетический маркер (филадельфийская хромосома) наблюдается
а)при остром лимфобластном лейкозе
б)при остром миелобластном лейкозе
в)при хроническом лимфолейкозе
(+) г)при хроническом миелолейкозе
д)при хроническом моноцитарном лейкозе
Вопрос № 80
Поражение шейных лимфоузлов слева, медиастинальных, паховых лимфоузлов и
селезенки при лимфогранулематозе трактуется
а)как I стадия
б)как II стадия
(+) в)как III стадия
г)как I(+) стадия
Вопрос № 81
Миеломную болезнь отличает от метастазов злокачественных опухолей в кости все
перечисленное, кроме
а)наличия патологического белка в сыворотке или моче
б)увеличения плазматических клеток в миелограмме
в)поражения преимущественно плоских костей
(+) г)всего перечисленного
Вопрос № 82
Клинически нейролейкемия проявляется
а)головной болью
б)неврологическими симптомами поражения оболочек мозга (симптом Кернига и т.д.)
в)гипертермией
г)всеми клиническими симптомами
(+) д)правильные ответы только а) и б)
Вопрос № 83
Основу опухолевой клеточной популяции при миеломной болезни составляют
а)лимфоциты
(+) б)плазматические клетки
в)моноциты
г)ретикулоциты
д)все перечисленные клетки
Вопрос № 84
Факторами риска для развития гипоплазии кроветворения являются
а)длительное воздействие фенола и его производных
б)воздействие ионизирующего излучения
в)инсоляция
(+) г)только а) и б)
Вопрос № 85
Для начальных проявлений лимфогранулематоза наиболее характерно поражение
(+) а)лимфоузлов выше диафрагмы
б)лимфоузлов ниже диафрагмы
в)частота поражения лимфоузлов выше и ниже диафрагмы одинакова
Вопрос № 86
Острый лейкоз встречается в возрасте
а)до 15 лет
б)от 16 до 25 лет
в)от 26 до 40 лет
г)старше 40 лет
(+) д)в любом возрасте
Вопрос № 87
Лимфогранулематоз диагностируется в начальных (I-II) стадиях с частотой
а)менее 20%
б)20-40%
(+) в)50-60%
г)более 80%
Вопрос № 88
Профилактическое облучение головного мозга при остром лимфобластном лейкозе
проводится в СОД
а)10-15 Гр
(+) б)22-26 Гр
в)30-40 Гр
г)более 40 Гр
Вопрос № 89
При решении вопроса о целесообразности использования лекарственной терапии
лимфосаркомы выбор комбинаций химиопрепаратов основывается на следующих данных
а)морфологическом варианте опухоли
б)распространенности процесса
в)локализации опухолевого поражения
(+) г)всем перечисленном
д)только а) и в)
Вопрос № 90
Поражение периферических лимфоузлов выше и ниже диафрагмы и селезенки при
лимфогранулематозе означает
а)I стадию
б)II стадию
(+) в)III стадию
г)I(+) стадию
Вопрос № 91
Поражение аксилярных лимфоузлов с одной стороны, медиастинальных, парааортальных
лимфоузлов, селезенки и наличие лихорадки (более 38-С) при лимфогранулематозе
расценивается
а)как IIа стадия
б)как IIб стадия
в)как IIIа стадия
(+) г)как IIIб стадия
д)как I(+) стадия
Вопрос № 92
Для постановки диагноза плазмоцитомы необходимо
(+) а)наличие опухолевого образования, состоящего из плазматических клеток
б)ускоренная СОЭ
в)увеличение числа плазматических клеток в миелограмме
г)обязательно наличие всех приведенных проявлений
д)обязательно наличие а) и б)
Вопрос № 93
Вовлечение при лимфогранулематозе селезенки и пахово-подвздошных лимфоузлов
трактуется
а)как I стадия
(+) б)как II стадия
в)как III стадия
г)как I(+) стадия
Вопрос № 94
При развитии хронического лейкоза может нарушаться дифференцировка следующих
ростков нормального кроветворения
а)лимфоидного ростка
б)гранулоцитарного ростка
в)эритроцитарного ростка
(+) г)любого ростка кроветворения
Вопрос № 95
Диагноз плазмоцитомы ставится на основании
(+) а)морфологического исследования опухолевого узла
б)биохимического исследования белков крови
в)исследования костного мозга
г)всех видов исследования
д)ни одного из перечисленного
Вопрос № 96
На характер и темпы метастазирования при лимфосаркоме оказывают наибольшее
влияние
а)морфологический вариант опухоли
б)локализация первичного опухолевого очага
в)возраст больного
г)все перечисленное
(+) д)правильные ответы только а) и б)
Вопрос № 97
Поражение паховых лимфоузлов как первое проявление лимфогранулематоза
встречается с частотой
(+) а)до 10%
б)от 20 до 50%
в)от 50 до 70%
г)более 70%
Вопрос № 98
У больного лимфогранулематозом выявлено поражение пахово-подвздошных лимфоузлов
с обеих сторон без симптомов интоксикации. Это соответствует
а)Iа стадии
(+) б)IIа стадии
в)IIIа стадии
г)IIIб стадии
д)I(+) стадии
Вопрос № 99
У больного лимфогранулематозом выявлено поражение всех групп лимфоузлов выше
диафрагмы, печени и лихорадка (более 38-С). Это соответствует
а)Iа стадии
б)IIа стадии
в)IIIа стадии
г)IIIб стадии
(+) д)IVб стадии
содержание ..
191
192
193
194 ..
Опухоли кроветворной и лимфоидной тканей
 Увеличенное изображение рака крови
Увеличенное изображение рака крови
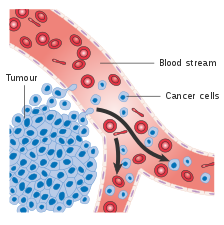
Рак крови — это тип рака или опухоли. Рак крови повреждает кровь, костный мозг, лимфу и лимфатическую систему. Иногда болят более одной части тела.
Причина обычно отличается от других видов рака. Способ узнать, есть ли у человека этот рак, также отличается.
Люди с раком крови обращаются к врачу-гематологу (врач по крови) или онкологу (онкологический врач).Есть и другие проблемы с кровью, которые не являются раком крови. Доктор крови также помогает людям с этими проблемами.
Опухоли кроветворной (образующей клетки крови) и лимфоидной ткани представляют собой локальные образования. Гематопоэтические и лимфоидные злокачественные опухоли — это раковые заболевания, которые поражают кровь, костный мозг, лимфу и лимфатическую систему. [1] [2] Поскольку кровь и лимфа соединяются как с кровеносной системой, так и с иммунной системой, заболевание, поражающее одного, часто поражает и других.
Типы [изменить | изменить источник]
Есть три типа:
Доктор проведет несколько тестов, чтобы выяснить, есть ли у человека рак крови. Один общий тест — это полный анализ крови. Клетки, которые циркулируют в кровотоке, обычно делятся на три типа: лейкоциты (лейкоциты), эритроциты (эритроциты) и тромбоциты (тромбоциты). Относительные пропорции — это то, что улавливает признаки проблемы.
Иногда доктор вынимает очень маленький кусочек тела, чтобы посмотреть на него.Это называется биопсией . Костный мозг — это место, где в организме образуется новая кровь. Биопсия костного мозга исследует кроветворные части, чтобы увидеть, есть ли у них рак.
Люди с раком крови часто принимают лекарства, называемые химиотерапией или иммунотерапией. Если рак крови находится в одном месте, они могут пройти лучевую терапию. Пересадка костного мозга — сложный способ убить рак крови.
Тысячи людей заболевают раком крови. Каждый год 30 000 человек в Великобритании узнают, что у них рак крови.
Лимфомы встречаются чаще, чем лейкемии.
- ↑ Vardiman J.W. и др. 2009 г. «Пересмотр классификации миелоидных новообразований и острых лейкозов Всемирной организации здравоохранения (ВОЗ) 2008 г.: обоснование и важные изменения». Кровь . 114 (5): 937–51. DOI: 10,1182 / кровь 2009-03-209262. PMID 19357394.
- ↑ Всемирный отчет по раку за 2014 год . Всемирная организация здравоохранения. 2014. С. Глава 5.13. ISBN 9283204298 .
,
1. Введение
Субстанцией трансплантации костного мозга является трансплантация органов. Точно, это пересадка кроветворной и иммунологической системы. По сравнению с трансплантацией твердого органа, при трансплантации гемопоэтических стволовых клеток (HSCT), больной орган, то есть гематопоэтическая и иммунологическая система, удаляется с помощью высокодозной химиотерапии и общего облучения тела (TBI) (режим кондиционирования).Таким образом, нормальные гемопоэтические стволовые клетки могут быть привиты, и нормальная функция кроветворной и иммунной системы может быть восстановлена. Стандартный миелоабляционный режим кондиционирования был бы разумным или достаточным для незлокачественных новообразований костного мозга, которые необходимы при замене терапии, такой как недостаточность костного мозга. Однако для лечения гематопоэтических злокачественных заболеваний, возможно, не излечиваются злокачественные заболевания, чтобы устранить нормальную гематопоэтическую, иммунную систему и восстановить нормальную функцию аллогенной гематопоэтической и иммунной системы пациентов.Поскольку лейкемические стволовые клетки (LSC) существуют не только в костном мозге, это может произойти в любом месте тела. Например, традиционный миелоабляционный режим кондиционирования для лечения лейкемии может иметь поразительный эффект уничтожения лейкозных клеток, а остаточные лейкозные клетки дополнительно уничтожаются под воздействием трансплантата против лейкоза (GVL), но злокачественные клетки не всегда удаляются вообще Таким образом, у некоторых пациентов может возникнуть рецидив после трансплантации.Фактически, традиционная аллогенная миелоабляционная HSCT может излечивать или улучшать исход пациентов с острым лейкозом со стандартным риском, однако рецидив заболевания после трансплантации для острого лейкоза с высоким риском и рефрактерностью составляет от 40% до 80% [1-4]. Более того, лейкозные клетки в большинстве случаев рецидивов происходят из лейкопемических клеток при первоначальном диагнозе [5-7], что четко указывает на то, что стандартная миелоабляционная схема кондиционирования может удалить нормальную лимфогематопоэтическую систему реципиентов и заставить трансплантаты успешно эксифицировать и пролиферировать , но не всегда мог убить остаточные лейкозные стволовые клетки in vivo, особенно те, которые находятся в экстрамедуллярных участках.Эти остаточные лейкозные стволовые клетки являются преступлением для рецидива заболевания. Мы впервые применили трансплантацию опухолевых аллогенных гемопоэтических стволовых клеток (TAHSCT) для лечения пациентов с высоким риском, резистентным и даже запущенным острым лейкозом. TAHSCT включает в себя все части процедуры трансплантации, основное содержание которой включает два элемента, которые используют индивидуальный режим лечения опухоли и улучшают иммунотерапию после трансплантации.
2.Показания к TAHSCT
Показанием к применению TAHSCT являются пациенты с высоким риском рецидивирующего, рефрактерного, даже прогрессирующего лейкоза. С одной стороны, рецидив заболевания после трансплантации у этих пациентов очень высок при стандартной миелоабляционной трансплантации. В последние годы, благодаря разработке иммунодепрессантов, антибиотиков и эффективной поддерживающей терапии, это значительно улучшило показатели заболеваемости и смертности от отсутствия рецидивов, таких как РТПХ, инфекции и полиорганная недостаточность, посталлогенная ТГСК, способы профилактики и лечение рецидива после аллогенной HSCT при этих острых лейкозах является ключевым моментом для увеличения долгосрочной выживаемости.В недавней ретроспективной когорте из Центра международных исследований по пересадке крови и костного мозга, общая трехлетняя выживаемость составила только 16% у пациентов, перенесших алло-HSCT при рецидиве или первичной недостаточности индукции острого лимфобластного лейкоза (ALL) [4]. для острого нелимфобластного лейкоза (ANLL) с высоким риском, резистентным и рецидивирующим, он может составлять до 20-40%. С другой стороны, мы сталкиваемся со все большим количеством таких пациентов в клинической трансплантации. Необходимо улучшить и оптимизировать традиционную процедуру HSCT.
3. Обоснование TAHSCT
Лейкемия — это злокачественная болезнь клонов, происходящая из кроветворных клеток. Лейкемическая стволовая клетка сильно отличается от нормальной гемопоэтической стволовой клетки по биохимическим характеристикам [8]. По сравнению с последним, первый имеет сильный рост и толерантность в некоторой степени к химиотерапии или лучевой терапии. Кроме того, лейкозная стволовая клетка находится не только в костном мозге, но также проникает в любые участки или органы, помимо кроветворной системы, включая некоторые участки, в которых лекарственные средства против лейкемии могут, но достигают концентрации лечения, такие как центральная нервная система, кожа и легкое и так далее.Из-за понимания биономики лейкозных стволовых клеток и результатов клинической трансплантации было продемонстрировано, что стандартного миелоабляционного HSCT недостаточно для того, чтобы укорениться в лейкозных или лейкозных стволовых клетках, особенно в экстрамедуллярных участках. Следовательно, миелоабляционный HSCT не равен TAHSCT, остаточная лейкозная или лейкозная стволовая клетка является осужденным за рецидив [9]. Хотя эффект GVL после трансплантации производит заметный эффект, он всегда позже после трансплантации.В конце концов, остаточные лейкозные стволовые клетки могут быть причиной пролиферации и рецидива заболевания [10].
Цель специализированного режима кондиционирования опухоли состоит не только в подавлении или разрушении иммунной и гематопоэтической системы, чтобы освободить место для приживления, но также в удалении лейкозных стволовых клеток, особенно лейкозных стволовых клеток в «убежище» экстрамедуллярных участков, и по возможности стимулировать или усиливать эффект GVL [11].
По сравнению с миелоабляционной трансплантацией, помимо удаления нормальной кроветворной ткани, TAHSCT больше внимания уделяет уничтожению остаточных опухолевых клеток, особенно удалению экстрамедуллярных остаточных опухолевых клеток.При выборе лекарств он делает больший упор на интенсивность уничтожения лекарств на лейкозных клетках, поддержание эффективной концентрации и достаточное время убивающего эффекта, а также снижение рецидива лейкемии после трансплантации до минимума [11]. По сравнению с немиелоабляционной трансплантацией или трансплантацией с пониженной токсичностью, последняя все еще сохраняет гематопоэтические стволовые клетки реципиента, в некоторой степени, для аутологичной гематопоэтической реконструкции, но также оставляет некоторое количество лейкозных стволовых клеток, которые могут вызвать рецидив, поэтому реконструированная смешанная гематопоэтическая химеризм часто требует донорской инфузии лимфоцитов (DLI), чтобы обеспечить возможность успешного приживления, а профилактика и лечение рецидива также зависят от DLI и последующей иммунотерапии или таргетной терапии [11].Их сравнение показано на рисунке 1.
Рисунок 1.
Сравнение опухолевой относительно миелоабляционной и немиелоабляционной трансплантации
4. Стратегия TAHSCT
Основываясь на регулярности и характеристиках рецидива заболевания после трансплантации, мы предложили профилактический путь рецидива лейкоза после трансплантации в начале 2007 года [12]. Это общая профилактика, раннее вмешательство и клиническая терапия. Общая профилактика означает избегание выбора высоких рисков (показано в таблице 1) во время процедуры трансплантации, ключевыми моментами в раннем вмешательстве являются установление разумного индивидуального режима лечения опухоли.Клиническая терапия заключается в лечении лейкемии при раннем или откровенном рецидиве, включая иммунотерапию после трансплантации. В клинической практике в течение 5 лет частота рецидивов в 85 и 83 случаях с высоким риском, рефрактерностью или рецидивом, полученным TAHSCT, в 2008 и 2009 годах составила 2,3% и 5% соответственно [11]. Это было поразительно заранее; однако, проблема все еще присутствует. Очевидно, что среди рисков, связанных с рецидивом, режим кондиционирования и иммунотерапия являются более важными.
| Элементы | Высокий риск рецидива | Низкий риск рецидива | |||
| Получатель | |||||
| Нагрузка на опухолевые клетки Внеклассная болезнь неблагоприятная хромосома неблагоприятная молекула чувствительная к химиотерапии статус производительности РТПХ после трансплантации | высокая да да да нечувствительная хуже нет | низкая нет нет нет чувствительная хорошая да | |||
| Трансплантаты | |||||
| периферическая стволовая клетка против костного мозга количество решеточных клеток Т-клеток истощено | низкая низкая да | высокая высокая нет нет | |||
| Техника прививки | |||||
| режим кондиционирования | немиелоабляционный | миелоабляционный | |||
| GVHD Профилактика | сильный | достаточно | |||
| иммунодепрессант вмешиваться в иммунотерапию | уменьшить или прекратить рано да | ||||
Таблица.
Риски, связанные с рецидивом при трансплантации
5. Подход к режиму лечения опухолей
Теоретически режим лечения опухолей должен содержать лекарства или ЧМТ для удаления нормальной гематопоэтической и иммунологической ткани, а также лекарства или средства для избавления от лейкемии или лейкозные стволовые клетки, особенно те, что находятся в экстрамедуллярных участках. Идеальные лекарства должны быть высокоэффективными и нацеленными на лейкозные или лейкозные стволовые клетки, однако эти специальные целевые агенты не были успешно использованы в клинической практике, и их следует использовать в будущем.В соответствии с клиническим опытом успешного лечения рефрактерной или рецидивирующей лейкемии, а также в сочетании со стандартной миелоабляционной схемой, мы выбрали несколько схем с высокой эффективностью и меньшей токсичностью и установили режимы противоопухолевой кондиционирования (показаны в таблице 2).
FLAG / уменьшенная интенсивная трансплантация (режим FLAG / RIT) Большое количество клинической практики подтвердило, что внутривенная инфузия высоких доз цитозина (Ara-C) была эффективной мерой спасения для лечения рефрактерной или рецидивирующей лейкемии, о 40% рефрактерной острой миелоидной лейкемии (ОМЛ) может достичь ремиссии.Фармакокинетическое исследование высоких доз Ara-C внутривенной инфузии показало, что при внутривенной инфузии Ara-C (1,8-32,0) г / м 2 в течение 2 часов каждые 12 часов концентрация в плазме может достигать (8-24) мкг / мл, концентрация спинномозговой жидкости составляла около (10-15)% от концентрации в плазме. Считалось, что такая высокая концентрация этого препарата в крови и спинномозговой жидкости является фармакологической основой значительно повышенной эффективности [13-15]. Ara-C в сочетании с антрациклиновыми (унихиноновыми) или акридиновыми препаратами может еще больше повысить частоту CR до 50% [16, 17].
Протокол FLAG
, состоящий из флударабина в сочетании с Ara-C плюс рекомбинантный человеческий гранулоцитостимулирующий фактор (G-CSF), в настоящее время является мощным и хорошо переносимым лечением рефрактерного и рецидивирующего ОМЛ. Флударабин является нуклеотидным аналогом, действует как ингибитор рибонуклеиновой кислоты путем фосфорилирования до активной трифосфатной формы F-ara-ATP. В качестве субстрата для синтеза ДНК в лейкозных клетках F-ara-ATP обладает антилейкозной активностью, ингибируя ДНК-полимеразу и рибозоредуктазу, особенно сильно воздействуя на покоящиеся клетки.Исследования in vitro и in vivo доказали, что добавление флударабина перед введением Ara-C может повысить внутриклеточную концентрацию Ara-CTP, повысить цитотоксичность и клиническую эффективность Ara-C, так что показатель CR рефрактерного и рецидивирующего AML достигает 50%. — 75%, период ЧР достигает 9 месяцев и выше [18]. Schmid и соавторы [19] использовали комбинированную химиотерапию с флударабином и Ara-C в течение 4 дней с последующей трансплантацией аллогенных гемопоэтических клеток со сниженной токсичностью и инфузией донорских лимфоцитов после трансплантации у 103 пациентов с рефрактерной острой миелоидной лейкемией, которые наблюдались в течение среднего периода 25 лет. месяцы.Было обнаружено, что 1, 2 и 4-летняя общая выживаемость составила 54%, 40% и 32% соответственно. Таким образом, режим FLAG / RIT в основном используется при лечении ANLL у прогрессирующих или продвинутых пациентов с ANLL.
TBI / FLAG / CY режим Он состоит из общего облучения организма, FLAG и восстановленного циклофосфамида и всегда используется для лечения ВСЕХ в прогрессирующей или продвинутой фазе. Потому что TBI был более эффективным при алло-HSCT для всех.
Режим праймирования G-CST Обычно он применяется для лечения ANLL при ремиссии или раннем рецидиве с высоким риском гипоплазии костного мозга или лейкопении.Гранулоцитостимулирующий фактор может индуцировать пролиферацию клеток AML и увеличивать долю клеток S-фазы in vitro или in vivo, тем самым повышая чувствительность клеток к химиотерапевтическим препаратам. Разумное и последовательное применение G-CSF и химиотерапевтических средств является еще одним эффективным вариантом лечения резистентного AML, такого как вышеупомянутый протокол FLAG и протокол CAG, состоящий из низких доз Ara-C (LD-Ara-C), аклациномицина и G-CSF. Фактически большое количество экспериментальных и клинических исследований подтвердило, что применение G-CSF перед трансплантацией не только способствовало дифференцировке Т-клеток в Th3 и улучшало функцию регуляторных Т-клеток, но также усиливало незрелые антиген-презентирующие клетки и плазмоцитоидный дендрит. клетки, что было полезно для поддержания функции Т-клеток после трансплантации и снижения частоты возникновения РТПХ.Моррис Е.С. и соавт. также подтвердили, что посредством модификации пегилирования и комбинации с Flt-3L G-CS может приводить к активации и амплификации донорно-инвариантных NKT-клеток (iNKT), значительному увеличению опосредованной посттрансплантационными клетками CD8 + T цитотоксичности и усилению эффекта ГВЛ [20]. Такахаши и соавт. Доказано, что применение G-CS вместе с режимом кондиционирования может уменьшить посттрансплантационный рецидив при рефрактерной миелоидной лейкемии [21]. Ooi et al. использовали G-CSF + Ara-C или + общее облучение организма и флударабин в качестве режима кондиционирования, а также выполняли несвязанную трансплантацию пуповинной крови у взрослых пациентов с ОМЛ, результаты показали, что 2-летняя безрецидивная выживаемость составила 76% [22].Рациональное применение G-CSF в режиме опухолевого кондиционирования не только усиливало эффект против лейкемии, но также в определенной степени разделяло GVHD и GVL, улучшало безопасность трансплантации и уменьшало рецидив [23].
| Схема | Содержание | Индикация |
| HDAra-C + Bu / Cy | Ara-C 2,5 г / м 2 IV, -11d- -9d Bu 1 мг / кг.6 часов, -8d- -6d MCCNU 250 мг / м 2 (ANLL) или Vm26 300 мг / м 2 (ALL), -5d CY 50 мг / кг.d IV, -3- -4d отдых, -2 — -1d, HSCT d 0 | Высокий риск в CR |
| G-CSF грунтованный HDAra-C + Bu / Cy | G-CSF 5 мкг / кг.d sc, -12- -9d Ara-C 3 г / м 2 IV, -11d- -9d Bu 1 мг / кг.6 часов, -8d- -6d MCCNU 250 мг / м 2 (ANLL) или Вм26 300 мг / м 2 (ALL), -5d CY 50 мг / кг.д. в / в, -3- -4d Отдых, -2-1 -1d, HSCT d 0 | Ремиссия или ранний рецидив у пациентов высокого риска с гипоплазией костного мозга или лейкопенией |
| FLAG / RIT | G-CSF 5 мкг / кг.d sc, -14- -9d Ara-C 2 г / м 2 .d CI, -13- -9d FDL 30 мг / м 2 .d IV, -13 — 9d BSF 0,8 мг / кг.6 час IV, -8 — -6d CY 50 мг / м 2 .d IV, -5 — -4d MCCNU 250 мг / м 2 .d, -3d Отдых, -2 — -1d, HSCT d 0 | Прогрессирующие или продвинутые пациенты с ANLL |
| TBI / FLAG / CY | TBI 1,5-2 Гр, ставка, -13- -11d Vm26 300 мг / м 2 . IV, -10d G-CSF 5 мкг / кг.d sc, -10- -5d Ara-C 2 г / м 2 .d CI, -9- -5d ФДЛ 30 мг / м 2 .d, IV, -9 — 5d CY 30 мг / кг.d IV, -4 — -3d Остальное, -2 — -1d, HSCT d 0 | У прогрессирующих или продвинутых пациентов с ALL |
Таблица 2.
Некоторые противоопухолевые схемы кондиционирования *
* Все схемы могут быть использованы при трансплантации HLA, сопоставимых неродственных и галоидентичных HSCT, но ATG должен быть добавленным ATG, антитимоцитарный глобулин; Ара-С, цитарабин; Бу, бусульфан; BSF, busulfex; Vm26, тенипозид; CY, циклофосфамид; FDL, флударабин; MCCNU, semustine; РИТ, уменьшенная интенсивная трансплантация; ЧМТ, общее облучение организма.
Схема с высоким содержанием Ara-C Для трансплантации ANLL с высоким риском полной ремиссии мы использовали схему с высоким содержанием Ara-C в качестве опухолевого кондиционера. Еще в 2004 году Lu DP et al. сообщили о применении протокола GIAC (Ara-C, бусульфан, циклофосфамид, MCCNU и G-CSF, активированный костный мозг и периферическая кровь), включая высокие дозы Ara-C, MCCNU и G-CSF, для мобильности стволовых клеток периферической крови у доноров реципиентам HLA-непревзойденная или гаплоидентичная трансплантация гемопоэтических стволовых клеток.Посттрансплантационное наблюдение подтвердило, что этот протокол привел к более высокой безрецидивной выживаемости (70%) и более низкой частоте рецидивов (13%), что также указывает на необходимость усиления мер с прямым действием против лейкемических клеток в режиме кондиционирования [24]. ,
Исходя из вышеизложенной теории и конкретной ситуации с отдельным пациентом, мы изменили протокол GIAC и разработали HDAra-C + Bu / Cy. Предварительные клинические попытки дали обнадеживающие результаты (Таблица 2).
В клинической практике около одной трети ОМЛ и более половины всех пациентов с ОЛЛ рецидивировали, впервые проявившись как экстрамедуллярный рецидив, такой как лейкозная саркома или инфильтрация в центральную нервную систему.Таким образом, препараты с хорошей липосорастворимостью и способностью проникать через гематоэнцефалический барьер, такие как кармустин (BCNU), метилциклогексилнитрозомочевина (MCCNU), тенипозид (VM26), а также высокие дозы Ara-C или MTX, следует выбирать в качестве часть опухолевого режима.
Наш режим лечения опухолей обладает следующими особенностями: во-первых, он может повысить интенсивность химиотерапии против лейкемии. Все схемы включали непрерывную инфузию средней дозы Ara-C в течение 72 часов, в то же время добавляли препараты с хорошей липосорастворимостью, такие как MCCNU (острый миелоидный лейкоз) и тенипозид (острый лимфоцитарный лейкоз).Продолжительность схемы лечения увеличилась до 11-14 дней, что не только усилило антилейкемическое действие на лейкозные (стволовые) клетки в кроветворной ткани, но также обеспечило более длительный период поддержания эффективной концентрации лекарственного средства в экстрамедуллярной ткани, включая центральную нервную систему, и дальнейшее истощение лейкозных (стволовых) клеток во всех тканях. Во-вторых, гранулоцитостимулирующий фактор был добавлен в некоторых режимах. Он не только привлекал покоящиеся лейкемические (стволовые) клетки в цикл пролиферации, увеличивал чувствительность к разрушающему действию лекарств, но также уменьшал или облегчал частоту посттрансплантационной РТПХ посредством регуляции иммунных клеток или мог вызывать эффекты GVL.В-третьих, уменьшение дозировки алкилирующего агента уменьшало или ослабляло токсические и побочные эффекты в условиях истощения нормальной кроветворной ткани и эффективного иммунодепрессанта. В-четвертых, была подчеркнута индивидуализация. В клинических условиях применение этих схем должно быть направлено на индивидуализацию с учетом различий цитогенетики и изменений генов в патогенезе лейкозных клеток, клинических проявлений и прогноза или предтрансплантационного заболевания, состояния работоспособности и лекарственной толерантности пациентов.Кроме того, схемы следует также корректировать в соответствии с донорским источником, например, трансплантация неродственного или гаплоидального донора, антилимфоцитарного глобулина (АТГ) должна быть включена в соответствующий режим кондиционирования [25]. Мы встречали случай AML-M5 с первичной устойчивостью к химиотерапии, бласты остаются более чем на 50% в костном мозге после индукции дауномицином плюс Ara-C (DA), идарубицином плюс Ara-C (IA), митоксантроном плюс Ara-C и Этопозид (MAE), режим CAG и FLAG, но после режима AE (амсакрин + Vm26) был достигнут почти CR.Затем он получил гаплоидентичную трансплантацию с использованием режима TBI / FLAG / CY в феврале 2012 года, в котором амсакрин + Vm26 вместо FLAG, потому что его лейкозная клетка чувствительна к амсакрину и Vm26. После успешного приживления он до сих пор живет в постоянном ЧР.
6. Обнаружение минимального остаточного заболевания и иммунотерапия после TAHSCT
Обнаружение минимального остаточного заболевания (MRD) и иммунотерапия после трансплантации являются очень бессильным принципом в TAHSCT [25].Хотя это почти специфический метод выявления морфологии костного мозга, культуры клонов, иммунофенотипа и аномального гена или белка лейкозной клетки, клинически проточная цитометрия (FCM) и полимеразная цепная реакция (ПЦР) являются более удобными, быстрыми и чувствительными. Это должно быть сделано обычно после трансплантации. У некоторых пациентов рецидив протекал в экстрамедуллярных местах, даже саркома, особенно ЦНС, подкожная клетчатка, кожа, серозная полость, легкие и кишечный тракт, поэтому необходим также анализ изображений, например, КТ, МИР, ПЭТ или ПЭТ-КТ.Мы использовали ПЭТ-КТ для выявления рецидива в экстрамедуллярных участках в запущенном случае с ANLL после перенесенного несвязанного HSCT и успешного точечного лечения с помощью киберножа.
Что касается иммунотерапии, во-первых, иммуносупрессивные препараты следует уменьшить или даже прекратить как можно быстрее, когда РТПХ строго контролируется. Затем, если необходимо, следует дать иммуномодуляторы, такие как интерферон, IL2 и тимопептиды. Для двух последних, которые не следует использовать при злокачественных новообразованиях Т-клеток.Наконец, это клеточная терапия [25, 26].
Донорский лимфоцит или G-CSF мобилизовал инфузию стволовых клеток периферической крови (DLI / DSI) для лечения рецидива лейкоза после введения алло-HSCT в начале 1990-х годов, будучи чрезвычайно эффективным при хроническом миелоидном лейкозе. DLI для рецидива ОМЛ после трансплантации был поставлен под сомнение в целом. Недавно Schmid C. и соавторы ретроспективно проанализировали данные 399 пациентов с ОМЛ при первом гематологическом рецидиве после ТГСК, лечение которых включало или не включало DLI.После коррекции дисбаланса и установленных факторов риска две группы сравнивались в отношении общей выживаемости. Кроме того, был проведен подробный анализ факторов риска для выживания среди реципиентов DLI. Результаты подтверждают роль аллогенного эффекта GVL при AML [27]. Различные модификации DLI были исследованы. Они включали в себя систематическое использование мобилизованных донорских концентратов PBSC вместо лимфоцитов или системное применение цитокин-индуцированных клеток-киллеров (CIK) для дополнительной иммуностимуляции для повышения эффективности GVL.Кроме того, инфузия аллогенных натуральных киллеров (NK) также является многообещающей инновационной иммунотерапией, так как сообщается, что аллореактивные NK-клетки вызывают сильный эффект GVL после гаплоидентичного HSCT у пациентов с распространенным ОМЛ, не вызывая GVHD [28]. Исследования in vitro предполагают возможность создания специфической противолейкозной цитотоксичности путем стимуляции донорских лимфоцитов с использованием дендритных клеток, полученных из AML. Портер и его коллеги сообщили об обнадеживающих результатах исследования I фазы с использованием обычного DLI с последующей дополнительной инфузией активированных ex vivo донорских Т-клеток.Поэтому мы использовали DLC, DSI или CIK в качестве поддерживающей терапии после HSCT для пациентов с ремиссией или в ситуации с минимальным остаточным заболеванием в нашей программе, чтобы использовать эффективность GVL, и получили даккий результат. Недавно мы лечили 18 случаев рецидивов после аллогенной HSCT, в том числе 11 из HLA-совместимого брата, 5 из гаплоидентичных и 2 из сопоставимых неродственных доноров с помощью CIK (DC-CIK), заполненных дендритными клетками. После введения среднего числа 3,6 × 10 9 DC-CIK полная ремиссия молекулы была получена в 12 случаях (68%), и 11 из 12 случаев были выживаемыми с медианой наблюдения 12 (диапазон 6-41) месяцев, кроме 1 умер от осложнений, связанных с лечением.Это подтверждает, что полученная от донора инфузия DC-CIK эффективна и безопасна в этих условиях [29]. Тем не менее, инфузия DLI или CIK часто ассоциировалась со значительным риском развития РТПХ, и клинически мы должны быть осторожны при анализе и профилактике РТПХ.
Наряду с скринингом и идентификацией нового иммуногенного опухолевого белка или пептидов, противоопухолевые специфические функциональные Т-клетки могут быть получены in vitro, специфическая иммунотерапия против лейкемии будет иметь более определенное положение в лечении рецидивов после трансплантации.Дальнейшие экспериментальные и клинические исследования необходимы для преодоления очевидно высокого бремени лейкозных бластов, чтобы избежать аллогенной иммунореакции у рецидивирующих пациентов после аллогенной HSCT по поводу рефрактерной острой лейкемии.
7. Клиническая практика TAHSCT
Фактически, первая TAHSCT с идентифицированным донором HLA, которую мы предварительно сформировали, была в 2007 году для 54-летней женщины с резистентным рецидивом. В июле 2004 года ей был поставлен диагноз ОМЛ, и она получила КР после 3 курсов химиотерапия дауномицином плюс Ara-C (DA), идарубицином плюс Ara-C (IA) и митоксантроном плюс Ara-C (MA), а затем получила 13 курсов интенсивной химиотерапии консолидации, включая высокие дозы Ara-C и аутологичной инфузии CIK в 3 раза.Ее лейкемия рецидивировала в конце декабря 2006 года, и не смогла ответить на несколько курсов химиотерапии повторной индукции. До того, как она получила опухолевый алло-HSCT, в костном мозге было 27% лейкозных бластов. Режим FLAG / RIT был подготовлен для HLA-идентичного HSCT сибсов 22 февраля 2007 года. Ее нейтрофил и тромбоциты были успешно приживлены на +18 день, анализ химеризма показал, что полный донорский химеризм достигнут на +30 дней. Периодически анализ MRD с помощью мониторинга FCM после TAHSCT был нулевым.I степень РТПХ кишечного тракта и печени произошла на +51 день, и после этого произошли инвазивные грибковые инфекции при синусите, легких, печени по поводу односторонности (слизистая инфекция, поддерживаемая патологической культурой). Аспергилл был обнаружен в культуре мокроты. Все вышеперечисленные осложнения контролировались и излечивались после симптоматического лечения. Она до сих пор жива и продолжает ремиссию до настоящего времени (более 78 месяцев).
Первый TAHSCT с гаплоидентичным донором мы сделали в 2008 году.Случай с 22-летним мужчиной был диагностирован как AML с t (8; 21), AML1 / ETO положительный в августе 2005 года. Он прошел несколько курсов интенсивной консолидации и поддерживающей химиотерапии, включая высокие дозы Ara-C. Три года спустя у него был рецидив лейкемии, и он не получил CR снова после химиотерапии повторной индукции. До трансплантации в костном мозге было 75% лейкозных бластов. Пациент получил от своего родного брата режим кондиционирования FLAG / RIC / ATG для гаплоидентичного TAHSCT HLA. 1 января 2008 года, после TAHSCT, приживление было длительным с полной донорской химеризацией и обнаружением не MDR с помощью FCM, хромосомы и ПЦР в реальном времени для мониторинга слитых генов AML1 / ETO.Ограниченный cGVHD контролировался CSA и преднизоном через меньшее количество месяцев. Пациент все еще жив в безрецидивной выживаемости (DFS) до сих пор.
В период с августа 2006 г. по март 2007 г. в общей сложности 57 пациентов с высоким риском / резистентным лейкозом получили опухолевые индивидуализированные кондиционирующие режимы, включая HDAra-C + Bu / Cy, G-CSF, праймированный HDAra-C + Bu / Cy, и FLAG / RIT. Из 57 пациентов 20 пациентов с острым лимфобластным лейкозом (ALL), 23 пациента с острым миелогенным лейкозом (AML) и 12 пациентов с хроническим миелоидным лейкозом (CML) в фазе ускоренного или бластного криза, а также 2 пациента с миелодиспластическим синдромом — рефрактерной анемией с избыток бластов (MDS-RAEB).28 пациентов получили гаплоидентичную трансплантацию, 17 пациентов HLA-идентичная неродственная трансплантация донора и 12 пациентов HLA-идентичная трансплантация родного брата. Результаты показали, что 56 пациентов, но один из которых выздоровел с аутологичным кроветворением, достигли длительного приживления. Среднее время до абсолютного количества нейтрофилов> 0,5×10 9 / л составляло 16 (диапазон: 12-21) дней. Среднее время до подсчета тромбоцитов> 20×10 9 / л было 18 (диапазон: 12–32) дней. Со средним периодом наблюдения 17.Через 5 (2-34) месяцев вероятности ОС и ДФС составили (74,7 ± 6,1)% и (62,4 ± 6,7)% соответственно. Частота возникновения aGVHD в классах II-IV и III-IV составила (19,3 ± 5,2)% и (12,3 ± 4,3)% соответственно. Обширная хроническая РТПХ наблюдалась у 36 (64,3%) пациентов. Цитомегаловиремия (ЦМВ) наблюдалась у 39 (68,42%) пациентов. Геморрагический цистит отмечен у 13 (22,8%) пациентов. Грибковая и бактериальная инфекция возникла у 16 (28,07%) и 38 (66,67%) пациентов соответственно. Рецидив у всех пациентов произошел у 14 (24.6%). Среди них частота рецидивов в группе высокого риска и в продвинутой группе (бластные клетки составляли более 20% в костном мозге) составила 28,1% и 15,6% соответственно. 11 из 14 пациентов с рецидивом в костном мозге, 3 из 14 с рецидивом в экстрамедуллярных участках, 15 пациентов умерли (6 от гематологического рецидива, 5 от бактериальной и грибковой инфекции, 4 от хронической РТПХ) через 100 дней. Токсичность в этом TAHSCT может быть переносимостью и преодолена [30,31].
Недавно мы сообщили о сорока девяти пациентах из первой родственной больницы, Китайской общей больницы PLA, гематологических злокачественных новообразований с высоким риском или резистентностью, включая 24 ОМЛ, 14 ОЛЛ, 9 неходжкинских лимфом (НХЛ) и 2 ХМЛ в взрывной кризис.Все пациенты получали гаплоидентичный TAHSCT, в который были добавлены мезенхимальные стволовые клетки пуповины. Все пациенты достигли приживления и полной ремиссии после TAHSCT. Связанные с режимом токсичности были терпимы. Только у пяти пациентов (10,2%) наблюдался рецидив в среднем через 192 дня после трансплантации. Вероятность двухлетней выживаемости без лейкемии (LFS) у пациентов с ОМЛ и ХМЛ составила 83,3%, что значительно выше, чем у пациентов с ОЛЛ и НХЛ (40,0%, P <0,05) [32]. Еще 45 наших пациентов из Пекинской больницы Даопея с рефрактерным рецидивирующим ОМЛ, получавшим лечение по TAHSCT [33].Медиана бластов в костном мозге до трансплантации составляла 36% (от 20% до 92%), в том числе 6 идентичных братьев и сестер HLA, 9 неродственных и 30 гаплоиндентичных трансплантаций. Все, кроме 2 пациентов, достигли длительного приживления. Частота встречаемости аритвии II-IV степени и цГВХД составила 34% и 59,1% соответственно. При медиане наблюдения 30 (от 0,5 до 57) месяцев частота рецидивов составила 29,2%. Двадцать девять (60,2%) пациентов остались с КР после трансплантации. Три года DFS и общая выживаемость (ОС) были 60,2% и 62,6%, соответственно.Эти данные подтвердили, что индивидуальная трансплантация опухолевой аллогенной гемопоэтической стволовой клетки является многообещающим и безопасным выбором для лечения лейкемии высокого риска, рефрактерной или рецидивирующей, даже с высоким бременем лейкемии.
В последнее время эти TAHSCT были проведены во многих больницах в Китае. В общей сложности было зарегистрировано 250 пациентов из 5 больниц, все пациенты с высоким риском, резистентностью или рецидивом, даже с запущенными гематологическими злокачественными новообразованиями, включая лейкоз и лимфому [32,33-34].Первичное клиническое наблюдение показало, что результаты аналогичны приведенным выше (данные не опубликованы). Очевидно, что его эффективность должна быть подтверждена рандомизированными проспективными клиническими испытаниями на большой популяции.
На самом деле, многие исследователи посвятили себя предотвращению и лечению рецидивов после трансплантации при рефрактерном лейкозе, включая Schmid C. и др., Которые использовали последовательное лечение с химиотерапией и кондиционированием пониженной интенсивности для трансплантации аллогенных стволовых клеток [19], и Такахаши С.и др., которые использовали комбинированную схему GCS-F для аллогенной трансплантации костного мозга, показанную выше [21]. Недавно Eom KS, et al. сообщили, что спасательная химиотерапия FLANG в качестве безопасного моста для трансплантации для пациентов с рецидивирующим или рефрактерным острым миелобластным лейкозом является эффективным режимом [35]. Арита К и соавт. описали, что последовательная химиотерапия и миелоаблативная аллогенная трансплантация гемопоэтических стволовых клеток при рефрактерной острой лимфобластной лейкемии [36] и так далее. Все они получили обнадеживающие результаты.По сравнению с ними наша стратегия TAHSCT подчеркивает большую целостность, индивидуальную и опухолевую эффективность в условиях переносимой токсичности.
8. Заключение
Таким образом, стратегия TAHSCT является основным комплексным подходом к лечению гематопоэтических злокачественных новообразований с высоким риском, рефрактерным или резистентным рецидивом, основанным на успешном опыте либо стандартной HSCT, либо химиотерапии для этих пациентов. Правда, после стратегии TAHSCT все еще имелись некоторые рецидивы, и она снизила частоту рецидивов у этих пациентов примерно до 20%, поэтому она также подчеркивает необходимость улучшения.Теоретически, остаточная лейкозная стволовая клетка является главным нарушителем в рецидиве после трансплантации. Мы можем использовать различия в биохарактеристиках между нормальными и лейкозными стволовыми клетками, которые являются результатом регуляции нарушения пролиферации, дифференцировки, апоптоза и экеза, сигнальных путей и т. Д. [8,37,38], чтобы использовать целевые препараты со специфическими убивающие эффекты на LSC и ниши для LSC, апоптоз-стимулирующие и дифференцирующие эффекты, такие как ингибитор тирозинкиназы, ингибитор FLT3 [39], гипометилирующий агент и так далее, вместе со специфической адоптивной иммунотерапией Т-клетками.Это должно обеспечить широкие перспективы для профилактики и радикального излечения рецидива после TAHSCT у пациентов с рефрактерной и рецидивирующей лейкемией.
Благодарности
Я благодарю всех сотрудников гематологического отделения, первой аффилированной больницы, Китайской больницы общего профиля PLA и Пекинской больницы Даопея за их самоотверженные работы в этих исследованиях. Спасибо доктору Хайянь Чжу за подготовку этой рукописи.
Гемопоэтические стволовые клетки (ГСК) играют ключевую роль в гематопоэтической системе, которая функционирует в основном в гомеостазе и иммунном ответе. Трансплантация ГСК была применена для лечения нескольких заболеваний. Тем не менее, ГСК сохраняются в небольшом количестве в организме, в основном в состоянии покоя. Понимание базовых знаний о ГСК полезно для исследований биологии стволовых клеток и развития терапевтической медицины.Таким образом, в данной статье делается акцент на происхождение, источник, развитие HSC, нишу и сигнальные пути, которые поддерживают поддержание HSC и баланс между самообновлением и пролиферацией, что будет полезно для продвижения расширения и трансплантации HSC в будущем.
1. Введение
Гематопоэтические стволовые клетки (ГСК) — это взрослые стволовые клетки, которые обладают способностью к самообновлению и дифференцировке в специализированные клетки крови, которые функционируют в некоторых биологических активностях: контролируют баланс гомеостаза, иммунную функцию и реакцию на микроорганизмы и воспаление.HSCs также могут дифференцироваться в другие специализированные клетки или так называемые пластические структуры, такие как адипоциты [1], кардиомиоциты [2], эндотелиальные клетки [3], фибробласты / миофибробласты [4], клетки печени [5, 6], остеохондроциты [7, 8 ] и клетки поджелудочной железы [9]. Большинство HSC находятся в состоянии покоя в нишах, которые поддерживают пул HSC, и будут реагировать на сигналы после того, как баланс клеток крови или пул HSC нарушается из-за внутренних или внешних стимулов.
Кроме того, HSC были тщательно изучены, особенно в терапевтических целях при лечении заболеваний крови, наследственных заболеваний крови и аутоиммунных заболеваний.Тем не менее, передовые разработки в этой области нуждаются в знаниях в области биологических исследований в качестве основы для реализации стратегии и поддержания ГСК. Таким образом, источник HSC, происхождение, ниши для пула HSC и сигнальные пути, необходимые для регуляции HSC, будут обсуждаться в этом обзоре.
2. Происхождение и развитие HSC
В гематопоэтической системе открытие HSC пролило свет на исследования биологии стволовых клеток, включая связь с другими взрослыми стволовыми клетками через основные концепции дифференциации, мультипотентности и самообновления.В ранний период этих открытий было обнаружено, что летально облученные животные были спасены клетками селезенки или костного мозга [17, 18]. После того, как клетки костного мозга мыши были трансплантированы облученным мышам, в селезенке образовалась клоногенная смешанная колония гемопоэтических клеток (часто состоящая из гранулоцитов / мегакариоцитов и эритроидных предшественников), которую эти колонии затем называли колониеобразующей единицей селезенки (CFU-S). ) [19]. Некоторые колонии первичного CFU-S могут восстанавливать кроветворную систему у вторично облученных мышей после трансплантации [20].Первоначально было предложено, что CFU-S можно дифференцировать от HSC, но впоследствии было показано, что CFU-S происходит из более преданных клеток-предшественников [21]. Открытие Тиллом и МакКаллохом открыло новый путь ко многим исследованиям для уточнения биологии ГСК, функциональной характеристики, очистки, культивирования и других исследований стволовых клеток.
Гематопоэз и развитие HSC являются ключевой ролью для улучшения эффективного расширения HSC для трансплантаций. Было проведено исследование эмбриогенеза для выявления происхождения и активности HSC из различных анатомических участков нескольких видов животных, таких как рыбки данио, курица и мышь, включая модель человеческих эмбрионов.Первоначально Мур и Меткалф показали, что гемопоэтические клетки в желточном мешке могут генерировать гематопоэтические предшественники, которые ограничены только эритроидными и миелоидными линиями [22]. Более того, Runx1 (транскрипционный фактор для начала дефинитивного кроветворения) был впервые идентифицирован для экспрессии в эмбриональный день 7,5 (E7,5) в желточном мешке, хорионической мезодерме и частях аллантоисной мезодермы [23]. Однако HSC, обнаруженные в желточном мешке, не имели определяющих гемопоэтических стволовых клеток, которые не проявляли длительной активности гематопоэтического восстановления у эмбрионов мыши до E11.5 [24]. С другой стороны, было показано, что длительно репопулирующие HSCs (LT-HSCs) в значительной степени увеличиваются в области аорта-гонадного мезонефроса (AGM) эмбриона мыши, включая серийно трансплантируемых облученных мышей, что указывает на то, что область AGM является первым сайтом для Обнаружение ГСК [24, 25]. Вителлиновые и пупочные артерии также были наделены гематопоэтическим потенциалом [26]. Наличие фенотипа HSC у эмбриона подтверждается данными о том, что было обнаружено большое количество неэритроидных предшественников с высоким пролиферативным потенциалом, из которых был удален зачаток печени [27].Было показано, что плотная популяция клеток CD34 + , прилипших к вентральной стороне эндотелия аорты в эмбриональном компартменте, демонстрирует клеточный поверхностный и молекулярный фенотип примитивных кроветворных предшественников (CD45 + , CD34 + , CD31 + , CD38 — , негатив для маркеров линии, GATA-2 + , GATA-3 + , c-myb + , SCL / TAL1 + , c-kit + , flk- 1 / КДР + ) [28, 29].Более того, автономное появление миелолимфоидной линии от предшественников было обнаружено в спланхноплевральной мезодерме и производной аорте внутри собственно эмбриона человека, тогда как в желточном мешке генерировались ограниченные предшественники [30]. В целом, область AGM зародыша предлагается в качестве источника дефинитивного кроветворения, поскольку генерация происходит между E10.5 и E12.0 с усилением активности HSC после 11-го дня беременности [10, 31–33]. Несмотря на то, что основным источником гематопоэза плода считалось AGM, включая вителлин и пупочные артерии, возникает вопрос, будет ли редкой популяции, произведенной в этих регионах, достаточно для распределения в печень плода для альтернативного развития огромных ГСК до перехода кроветворение продолжает происходить в тимусе плода и костном мозге в постнатальной жизни.Недавно плаценту, внезародышевый орган, рассматривали как другой кроветворный орган для кроветворения de novo [34, 35]. Это может быть связано с физиологией плаценты, содержащей сильно васкуляризованные кровеносные сосуды, а также цитокины и факторы роста, богатые средой для правильного микросреды кроветворения и развития [36]. Кроме того, сайт привилегий в плаценте может скрывать HSC от сигнала продвижения в стадию дифференцировки. Тем не менее, нет никаких экспериментальных данных, подтверждающих, что HSC генерируются de novo во внезародышевых тканях.Поэтому будущие работы будут необходимы для выяснения этой загадки. Обобщение источника клеток крови во время беременности во взрослой жизни было объяснено на рисунке 1.
Происхождение HSC в плаценте подвергается сомнению. Понимание того, как развивается плацента, может быть полезно для определения источника и ниш, поддерживающих развитие HSC. Плаценты мыши и человека анатомически сходны, и их гены имеют аналогичную идентичность [37, 38]. Плацента формируется из трофэктодермы, мезодермальных тканей, хорионической мезодермы и аллантоиса (рис. 2) [39].На E8.5 беременности мыши аллантоис развивается и сливается с хорионической мезодермой через ее дистальную часть, генерируя хориоаллантоисную мезенхиму в хорионической пластинке и продолжая формировать сосудистый отдел плода из плацентарного лабиринта, в то время как проксимальная часть становится пуповиной [ 11].
Первичные опухоли головного мозга, включая атипичные тератоидные / рабдоидные опухоли, представляют собой разнообразную группу заболеваний, которые вместе составляют наиболее распространенную солидную опухоль детского возраста. Сводные данные по лечению опухолей головного мозга у детей в основном организованы в соответствии с классификацией опухолей нервной системы, разработанной Всемирной организацией здравоохранения. [1,2] Опухоли головного мозга классифицируются в соответствии с гистологией, но с помощью иммуногистохимического анализа, цитогенетических и молекулярно-генетических данных и показателей митотической активности. все чаще используются в диагностике и классификации опухолей.Расположение опухоли и степень ее распространения являются важными факторами, влияющими на лечение и прогноз. Полное описание классификации опухолей нервной системы и ссылку на соответствующую сводку лечения для каждого типа опухоли головного мозга см. В сводке PDQ «Обзор лечения опухолей головного и спинного мозга у детей».
ЦНС атипичная тератоидная / рабдоидная опухоль (AT / RT) является редкой, клинически агрессивной опухолью, которая чаще всего поражает детей в возрасте от 3 лет и младше, но может встречаться у детей старшего возраста и взрослых.Приблизительно половина AT / RT возникает в задней ямке. [3] Диагностическая оценка включает магнитно-резонансную томографию (МРТ) при исследовании нейраксиса и спинномозговой жидкости. AT / RT был связан с соматическими и зародышевыми мутациями SMARCB1 и, реже, SMARCA4 , оба из которых являются генами-супрессорами опухоли. [4] В настоящее время нет стандартного лечения детей с AT / RT. Мультимодальное лечение, состоящее из хирургии, химиотерапии и лучевой терапии, находится на стадии оценки.
Основываясь на современном биологическом понимании, AT / RT является частью большого семейства рабдоидных опухолей. В данном описании термин AT / RT относится только к опухолям ЦНС, а термин рабдоидная опухоль отражает возможность опухолей как ЦНС, так и не ЦНС. Если специально не указано в тексте, это резюме относится к CNS AT / RT.
Детям, пережившим рак у подростков, требуется тщательный мониторинг, поскольку побочные эффекты терапии рака могут сохраняться или развиваться через месяцы или годы после лечения.(Обратитесь к сводке PDQ по поздним эффектам лечения рака у детей для получения конкретной информации о частоте, типе и мониторинге поздних эффектов у выживших детей и подростков.)
Заболеваемость
Точная частота заболеваемости ЦНС в детском возрасте AT / RT трудно определить, потому что опухоль распознается только с 1996 года. [5]
- В двух североамериканских проспективных исследованиях, проведенных Детской онкологической группой и Детской онкологической группой для детей в возрасте 3 лет и младше при постановке диагноза, ретроспективный обзор показал, что примерно 10% детей с опухолями головного мозга имели AT / RT.[6]
- Тайваньское исследование показало, что AT / RT составляют 26% примитивных или эмбриональных опухолей у детей младше 3 лет. [7]
- Австрийский реестр опухолей головного мозга (период пополнения, 1996-2006 гг.) Подтвердил, что AT / RT представляли шестую наиболее распространенную злокачественную опухоль головного мозга среди 311 вновь диагностированных детей (6,1%), с пиковой частотой в течение первых 2 лет жизни. [8]
Заболеваемость у пожилых пациентов неизвестна. Однако в Реестре атипичных тератоидных / рабдоидных опухолей центральной нервной системы (AT / RT Registry) 12 из 42 пациентов (29%) были старше 36 месяцев на момент постановки диагноза.[9]
Анатомия
УвеличитьАнатомия внутренней части головного мозга, показывающая шишковидную железу и гипофиз, зрительный нерв, желудочки (с спинномозговой жидкостью, выделенной синим цветом) и другие части мозга. Тенториум отделяет головной мозг от мозжечка. Инфратенториум (задняя ямка) — это область под тенториумом, которая содержит ствол мозга, мозжечок и четвертый желудочек. Супратенториум — это область над тенториумом, обозначающая область, в которой находится головной мозг.
Клиническая картина
Детство AT / RT — это клинически агрессивная опухоль, которая встречается в основном у детей младше 3 лет, но также может встречаться у детей старшего возраста и отмечалась у взрослых. [10,11]
Приблизительно одна половина всех AT / RT возникает в задней ямке, хотя это может произойти где-нибудь в ЦНС. [3,6] Опухоли задней ямки могут возникать в церебеллопонтиновом углу или более средней линии. Участие отдельных черепных нервов было отмечено.
Поскольку AT / RT быстро растет, пациенты, как правило, имеют довольно короткий анамнез прогрессирующих симптомов, измеряемый днями или неделями. Признаки и симптомы зависят от локализации опухоли. У молодых пациентов с опухолями задней ямки обычно присутствуют симптомы, связанные с гидроцефалией, в том числе следующие:
- Головные боли рано утром.
- Рвота.
- Летаргия.
- Увеличение окружности головы.
У них также может развиться атаксия или регресс двигательных навыков.
Данные реестра предполагают, что примерно 20% пациентов имеют диссеминированное заболевание. [9,12] Распространение обычно происходит через лептоменингеальные пути, проникающие через позвоночник и другие области головного мозга. До 35% пациентов могут иметь мутации зародышевой линии и быть склонными к синхронным, многоочаговым опухолям. Имеются также редкие сообщения о пациентах с синхронной рабдомидальной опухолью почек и АТ / РТ ЦНС. [13-15]
Диагностическая оценка
Все пациенты с подозрением на АТ / РТ в детском возрасте должны иметь МРТ головного мозга и позвоночника.Если с медицинской точки зрения противопоказано, пациенты должны также осматривать спинномозговой спинномозговой жидкости на наличие признаков опухоли. Пациенты также могут пройти УЗИ почек для выявления синхронных опухолей.
AT / RT нельзя надежно отличить от других злокачественных опухолей головного мозга на основании только истории болезни или рентгенологического исследования. Операция необходима для получения ткани и подтверждения диагноза. Иммуноокрашивание для потери экспрессии белка SMARCB1 используется для подтверждения диагноза.[16,17]
Прогноз
Прогностические факторы, которые влияют на выживаемость для AT / RTs, не определены в полной мере.
Известные факторы, связанные с плохим исходом, включают следующее:
- Мутация зародышевой линии. [18]
- Возраст моложе 2 лет. [19]
- Метастазы при диагностике. [19]
- Итоговая резекция. [20]
Большинство опубликованных данных об исходах пациентов с AT / RT получены из небольших серий и имеют ретроспективный характер. Первоначальные ретроспективные исследования показали, что средняя выживаемость от диагноза составляет всего около 12 месяцев[5,6,10,20,21] В ретроспективном отчете общая 2-летняя выживаемость была лучше для пациентов, перенесших резекцию общего объема, чем для тех, кто имел субтотальную резекцию. Однако в этом исследовании влияние лучевой терапии на выживаемость было менее очевидным. [20]
Есть сообщения о долгосрочных выживших. [22] Примечательно, что сообщалось об улучшении выживаемости для тех, кто получал интенсивную мультимодальную терапию. [12,15]
- У детей в возрасте 3 лет и старше с AT / RT, которые получили послеоперационное краниоспинальное облучение и высокие дозы химиотерапии на основе алкилатора, была улучшенная выживаемость по сравнению с с пациентами моложе 3 лет.В этом отчете частота метастазов лептоменинга также была выше в группе младенцев [23].
- В одном проспективном исследовании 25 детей с AT / RT, которые получали интенсивную мультимодальную терапию, включая лучевую и интратекальную химиотерапию, 2-летняя выживаемость без прогрессирования заболевания составила 53%, а общая выживаемость составила 70%. [24 ]
Список литературы
- Луи Д.Н., Охгаки Х., Уистлер О.Д. Классификация опухолей ВОЗ центральной нервной системы.4-е издание Лион, Франция: IARC Press, 2016.
- Луи Д.Н., Перри А., Рейфенбергер Дж. И др .: Всемирная организация здравоохранения, 2016 г. Классификация опухолей центральной нервной системы: резюме. Acta Neuropathol 131 (6): 803-20, 2016. [PUBMED Abstract]
- Dho YS, Kim SK, Cheon JE и др .: Исследование местоположения атипичной тератоидной / рабдоидной опухоли. Childs Nerv Syst 31 (8): 1305-11, 2015. [PUBMED Abstract]
- Hasselblatt M, Nagel I, Oyen F, и др .: SMARCA4-мутированные атипичные тератоидные / рабдоидные опухоли связаны с наследственными изменениями зародышевой линии и плохим прогнозом ,Acta Neuropathol 128 (3): 453-6, 2014. [PUBMED Abstract]
- Rorke LB, Packer RJ, Biegel JA: атипичные тератоидные / рабдоидные опухоли центральной нервной системы младенчества и детства: определение сущности. J Neurosurg 85 (1): 56-65, 1996. [PUBMED Abstract]
- Packer RJ, Biegel JA, Blaney S, и др .: Атипичная тератоидная / рабдоидная опухоль центральной нервной системы: отчет на семинаре. J Pediatr Hematol Oncol 24 (5): 337-42, 2002 июнь-июль. [ПОДТВЕРЖДЕНА] Аннотация:
- Ho DM, Hsu CY, Wong TT, et al.: Атипичная тератоидная / рабдоидная опухоль центральной нервной системы: сравнительное исследование с примитивной нейроэктодермальной опухолью / медуллобластомой. Acta Neuropathol 99 (5): 482-8, 2000. [PUBMED Abstract]
- Woehrer A, Slavc I, Waldhoer T и др.: Распространенность атипичных тератоидных / рабдоидных опухолей у детей: популяционное исследование, проведенное австрийцами Реестр опухолей головного мозга, 1996-2006. Cancer 116 (24): 5725-32, 2010. [PUBMED Abstract]
- Hilden JM, Meerbaum S, Burger P и др.: Атипичная тератоидная / рабдоидная опухоль центральной нервной системы: результаты терапии у детей, зарегистрированных в реестре.J Clin Oncol 22 (14): 2877-84, 2004. [PUBMED Abstract]
- Burger PC, Yu IT, Tihan T, и др .: Атипичная тератоидная / рабдоидная опухоль центральной нервной системы: очень злокачественная опухоль младенчества и детство часто принимают за медуллобластому: исследование группы детской онкологии. Am J Surg Pathol 22 (9): 1083-92, 1998. [PUBMED Abstract]
- Lutterbach J, Liegibel J, Koch D, и др .: Атипичные тератоидные / рабдоидные опухоли у взрослых пациентов: описание случая и обзор литературы , J Neurooncol 52 (1): 49-56, 2001.[ПРЕДСТАВЛЕНО Аннотация]
- Бартельхайм К., Немес К., Зерингер А. и др .: Улучшенная общая 6-летняя выживаемость при AT / RT — результаты исследования реестра Rhabdoid 2007. Cancer Med 5 (8): 1765-75, 2016 [PUBMED Abstract]
- Biegel JA, Fogelgren B, Wainwright LM и др.: Мутация зародышевой линии INI1 у пациента с атипичной тератоидной опухолью центральной нервной системы и рабдоидной опухолью почки. Гены Хромосомы Рак 28 (1): 31-7, 2000. [ПОДКЛЮЧЕНО Аннотация]
- Bourdeaut F, Lequin D, Brugières L, et al.: Частые мутации зародышевой линии hSNF5 / INI1 у пациентов с рабдоидной опухолью. Clin Cancer Res 17 (1): 31-8, 2011. [PUBMED Abstract]
- Зерингер А., Рейнхард Х, Хассельблатт М. и др .: Синхронная врожденная злокачественная рабдоидная опухоль орбиты и атипичная тератоидная / рабдоидная опухоль — осуществимость и эффективность мультимодальной терапии у выживших в долгосрочной перспективе. Cancer Genet 207 (9): 429-33, 2014. [PUBMED Abstract]
- Bruggers CS, Bleyl SB, Pysher T, и др .: Клинико-патологическое сравнение семейных и спорадических атипичных тератоидных / рабдоидных опухолей (AT / RT) Центральная нервная система.Pediatr Cancer Blood 56 (7): 1026-31, 2011. [PUBMED Abstract]
- Маргол А.С., Джудкинс А.Р .: Патология и диагностика SMARCB1-дефицитных опухолей. Cancer Genet 207 (9): 358-64, 2014. [PUBMED Abstract]
- Kordes U, Gesk S, Frühwald MC и др .: Клинические и молекулярные особенности у пациентов с атипичной тератоидной рабдоидной опухолью или злокачественной рабдоидной опухолью. Гены Хромосомы Рак 49 (2): 176-81, 2010. [PUBMED Abstract]
- Dufour C, Beaugrand A, Le Deley MC и др .: Клинико-патологические прогностические факторы при атипичных тератоидных и рабдоидных опухолях центральной нервной системы у детей: многоцентровое исследование.Cancer 118 (15): 3812-21, 2012. [PUBMED Abstract]
- Lafay-Cousin L, Hawkins C, Carret AS, и др .: Атипичные тератоидные рабдоидные опухоли центральной нервной системы: опыт Канадского педиатрического опухоли головного мозга. Eur J Cancer 48 (3): 353-9, 2012. [PUBMED Abstract]
- Athale UH, Duckworth J, Odame I и др .: Атипичная тератоидная рабдоидная опухоль центральной нервной системы в детстве: метаанализ наблюдательных наблюдений исследования. J Pediatr Hematol Oncol 31 (9): 651-63, 2009. [PUBMED Abstract]
- Олсон Т.А., Баяр Е., Косник Е. и др.: Успешное лечение диссеминированной злокачественной рабдоидной опухоли центральной нервной системы. J Pediatr Hematol Oncol 17 (1): 71-5, 1995. [PUBMED Abstract]
- Tekautz TM, Fuller CE, Blaney S, и др .: Атипичные тератоидные / рабдоидные опухоли (ATRT): повышение выживаемости у детей 3 лет возраст и старше с лучевой терапией и химиотерапией на основе высоких доз алкилатора. J Clin Oncol 23 (7): 1491-9, 2005. [PUBMED Abstract]
- Chi SN, Zimmerman MA, Yao X, и др .: Интенсивное комплексное лечение для детей с недавно диагностированной атипичной тератоидной опухолью опухоли ЦНС.J Clin Oncol 27 (3): 385-9, 2009. [PUBMED Abstract]
.
