! Тромбоз воротной вены — процесс образования тромба вплоть до полной окклюзии просвета сосуда, дренирующего русло органов ЖКТ. Возникновение заболевания, как и иных венозных тромбозов, может быть объяснено триадой Вирхова, включающей следующие элементы:  Реже пилефлебит возникает при гнойных холангите и лимфадените гепатодуоде-нальной связки либо язвенном колите Реже пилефлебит возникает при гнойных холангите и лимфадените гепатодуоде-нальной связки либо язвенном колитеЧастота послеоперационных тромбозов воротной вены у больных, страдающих раком печени или других органов, циррозом печени, составляет 17,7%. Клиническая картина зависит от локализации и протяжённости тромбоза воротной вены, быстроты его развития и природы предрасполагающего заболевания печени. Наиболее тяжёлое проявление заболевания — инфаркт печени либо атрофия её сегмента. Сочетание тромбоза воротной вены с тромбозом брыжеечных вен в большинстве случаев летально.  Специальные исследования ЛЕЧЕНИЕ Лекарственная терапия  Дозу препарата подбирают по времени свёртывания крови, толерантности плазмы к гепарину и результатам тромбоэластографии. Дозу препарата подбирают по времени свёртывания крови, толерантности плазмы к гепарину и результатам тромбоэластографии. Хирургическое лечение  Осложнения
|
Внепеченочная портальная гипертензия и тромбоз воротной вены (обзор литературы) | Фандеев
1. Khanna R., Sarin S.K. Non-cirrhotic portal hypertension – diagnosis and management. J. Hepatol. 2014; 60 (2): 421–441. doi: 10.1016/j.jhep.2013.08.013.
2. De Franchis R., Baveno V Faculty: Bosch J., Burroughs A.K., D’Amico G., de Franchis R., Garcia-Tsao G., Grace N.D., Groszmann R. J., Lebrec D., Merkel C., Primignani M., Salerno F., Sarin S.K., Sorensen T.I. Revising consensus in portal hypertension: Report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J. Hepatol. 2010; 53 (4): 762–768. doi: 10.1016/j.jhep.2010.06.004.
J., Lebrec D., Merkel C., Primignani M., Salerno F., Sarin S.K., Sorensen T.I. Revising consensus in portal hypertension: Report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J. Hepatol. 2010; 53 (4): 762–768. doi: 10.1016/j.jhep.2010.06.004.
3. Ерамишанцев А.К. Первичная внепеченочная портальная гипертензия и ее хирургическое лечение: дис. … докт. мед. наук. М., 1983. 325 с. Eramishantsev A.K. Pervichnaya vnepechenochnaya portal’naya gipertenziya i ieyo khirurgicheskoe lechenie [Primary extrahepatic portal hypertension and its surgical treatment: dis. … doct. of med. sci.]. Moscow, 1983. 325 p. (In Russian)
4. Chawla Y., Duseja A., Dhiman R.K. Review article: the modern management of portal vein thrombosis. Aliment. Pharmacol. Ther. 2009; 30 (9): 881–894. doi: 10.1111/j.1365-2036. 2009.04116.x.
2009.04116.x.
5. De Leve L.D., Valla D.C., Garcia-Tsao G. Vascular disorders of the liver. Hepatology. 2009; 49 (5): 1729–1764. doi: 10.1002/hep.22772.
6. De Stefano V., Za T., Ciminello A., Betii S., Rossi E. Causes of splanchnic vein thrombosis in the Mediterranean area. Mediterr. J. Hematol. Infect. Dis. 2011; 3 (1): e2011063. doi: 10.4084/MJHID.2011.063. Published online: http://europepmc.org/articles/PMCID 3248340.
7. Garbuzenko D.V. Portal hypertension – causes and complications. Rijeca. Croatia: InTech., 2012. 146 p.
8. Фандеев Е.Е. Лечебная тактика при внепеченочной портальной гипертензии, развившейся вследствие тромбоза воротной вены: дис. … канд. мед. наук. М., 2014. 177 с. Fandeyev E.E. Lechebnaya taktika pri vnepechenochnoy portal’noy gipertenzii, razvivsheysya vsledstvie tromboza vorotnoy veni [Management of extrahepatic portal hypertension caused by portal vein thrombosis: dis. … cand. med. sci.]. Moscow, 2014. 177 p. (In Russian)
177 с. Fandeyev E.E. Lechebnaya taktika pri vnepechenochnoy portal’noy gipertenzii, razvivsheysya vsledstvie tromboza vorotnoy veni [Management of extrahepatic portal hypertension caused by portal vein thrombosis: dis. … cand. med. sci.]. Moscow, 2014. 177 p. (In Russian)
9. Ogren M., Bergqvist D., Bjorck M., Acosta S., Eriksson H., Strenby N.H. Portal vein thrombosis: prevalence, patient characteristics and lifetime risk: a population study based on 23,796 consecutive autopsies. World J. Gastroenterol. 2006; 12 (13): 2115–2119. doi: 10.3748/wjg.v12.i13.2115.
10. Шерцингер А.Г., Киценко Е.А., Любивый Е.Д., Фандеев Е.Е., Сысоева Е.П. Тромбоз воротной вены: этиология, диагностика и особенности лечения. Вестник экспериментальной и клинической хирургии. 2012; 1 (5): 83–91. Shertsinger A.G., Kitsenko E.A., Lyubiviy E.D., Fandeyev E.E. , Sysoeva E.P. Portal vein thrombosis: etiology, diagnostics and treatment features. Vestnik eksperimental’noy i klinicheskoy khirurgii. 2012; 1 (5): 83–91. (In Russian)
, Sysoeva E.P. Portal vein thrombosis: etiology, diagnostics and treatment features. Vestnik eksperimental’noy i klinicheskoy khirurgii. 2012; 1 (5): 83–91. (In Russian)
11. Amitrano L., Guardascione M.A., Scaglione M., Pezzullo L., Sangiuliano N., Armellino M.F., Manguso F., Margaglione M., Ames P.R.J., Iannaccone L., Grandone E., Romano L., Balzano A. Prognostic factors in noncirrhotic patients with splanchnic vein thromboses. Am. J. Gastroenterol. 2007; 102 (11): 2464–2470. doi:10.1111/j.1572-0241.2007.01477.x.
12. Garcia-Pagan J.C., Hernandes-Guerra M., Bosch J. Extrahepatic portal vein thrombosis. Semin. Liver Dis. 2008; 28 (3): 282–292. doi: 10.1055/s-0028-1085096. Epub 2008 Sep 23.
13. Hoekstra J., Janssen H.L. Vascular liver disorders (II): portal vein thrombosis. Neth. J. Med. 2009; 67 (2): 46–53.
Neth. J. Med. 2009; 67 (2): 46–53.
14. Poddar U., Borkar V. Management of extra hepatic portal venous obstruction (EHPVO): current strategies. Trop. Gastroenterol. 2011; 32 (2): 94–102.
15. Sarin S.K., Kumar A., Angus P.W., Baijal S.S., Baik S.K., Bayraktar Y., Chawla Y.K., Choudhuri G., Chung J.W., de Franchis R., de Silva H.J., Garg H., Garg P.K., Helmy A., Hou M.C., Jafri W., Jia J.D., Lau G.K., Li C.Z., Lui H.F., Maruyama H., Pandey C.M., Puri A.S., Rerknimitr R., Sahni P., Saraya A., Sharma B.C., Sharma P., Shiha G., Sollano J.D., Wu J., Xu R.Y., Yachha S.K., Zhang C. Diagnosis and management of acute variceal bleeding: Asian Pacific association for study of the liver recommendations. Hepatol. Int. 2011; 5 (2): 607–624. doi: 10.1007/s12072-010-9236-9.
16. Spaander M.C. Portal vein thrombosis in non cirrhotic patients. Rotterdam. Netherlands.: Optima Grafische Comm., 2010. 108 p.
Spaander M.C. Portal vein thrombosis in non cirrhotic patients. Rotterdam. Netherlands.: Optima Grafische Comm., 2010. 108 p.
17. Spaander M.C., van Buuren H.R., Janssen H.L. Non-cirrhotic non-malignant portal vein thrombosis: a review on management of non-cirrhotic non-malignant portal vein thrombosis and the concurrent portal hypertension complications in adults. Aliment. Pharmacol. Ther. 2007; 26 (2): 203–209. doi: 10.1111/j.1365-2036.2007.03488.x.
18. Wani H., Ahmed B., Wani G., Masoodi I., Mustafa S. Extrahepatic portal vein obstruction (EHVPO). Internet J. Gastroenterol. 2010; 9 (1): 695. Published online: http://ispub.com/IJGE/9/1/11432.
19. Ponziani F.R., Zocco M.A., Campanale C., Rinninella E., Tortora A., Di Maurizio L., Bombardieri G., De Cristofaro R. , De Gaetano A.M., Landolfi R., Gasbarrini A. Portal vein thrombosis: insight into physiology, diagnosis, and treatment. World J. Gastroenterol. 2010; 16 (2): 143–155. doi: 10.3748/wjg.v16.i2.143.
, De Gaetano A.M., Landolfi R., Gasbarrini A. Portal vein thrombosis: insight into physiology, diagnosis, and treatment. World J. Gastroenterol. 2010; 16 (2): 143–155. doi: 10.3748/wjg.v16.i2.143.
20. Разумовский А.Ю., Рачков В.Е. Хирургическое лечение портальной гипертензии у детей. М.: Медицинское информационное агентство, 2012. 480 с. Razumovskiy A.Y., Rachkov V.E. Khirurgicheskoye lechenie portal’noy gipertenzii u detei [Surgical management of portal hypertension in children]. Moscow: Meditsinskoye informatsionnoye agentstvo, 2012. 480 p. (In Russian)
21. Morag I., Epelman M., Daneman A., Moineddin R., Parvez B., Shechter T., Hellmann J. Portal vein thrombosis in the neonate: risk factors, course, and outcome. J. Pediatr. 2006; 148 (6): 735–739. doi: 10.1016/j.jpeds.2006.01.051.
22. Weiss B., Shteyer E., Vivante A., Berkowitz D., Reif S., Weizman Z., Bujanover Y., Shapiro R. Etiology and long-term outcome of extrahepatic portal vein obstruction in children. World J. Gastroenterol. 2010; 16 (39): 4968–4972. doi: 10.3748/wjg.v16.i39.4968.
Weiss B., Shteyer E., Vivante A., Berkowitz D., Reif S., Weizman Z., Bujanover Y., Shapiro R. Etiology and long-term outcome of extrahepatic portal vein obstruction in children. World J. Gastroenterol. 2010; 16 (39): 4968–4972. doi: 10.3748/wjg.v16.i39.4968.
23. Janssen H.L., Wijnhoud A., Haagsma E.B., van Uum S.H., van Nieuwkerk C.M., Adang R.P., Chamuleau R.A., van Hattum J., Vlegaar F.P., Hansen B.E., Rosendaal F.R., van Hoek B. Extrahepatic portal vein thrombosis: aetiology and determinants of survival. Gut. 2001; 49 (5): 720–724. doi: 10.1136/gut.49.5.720.
24. Plessier A., Murad S.D., Hernandez-Guerra M., Consigny Y., Fabris F., Trebicka J., Heller J., Morard I., Lasser L., Langlet P., Denninger M.H., Vidaud D., Condat B., Hadengue A., Primignani M., Garcia-Pagan J.C., Janssen H.L., Valla D. Acute portal vein thrombosis unrelated to cirrhosis: a prospective multicenter follow-up study. Hepatology. 2010; 51 (1): 210–218. doi: 10.1002/hep.23259.
Hepatology. 2010; 51 (1): 210–218. doi: 10.1002/hep.23259.
25. Senzolo M., Riggio O., Primignani M., Italian Association for the Study of the Liver (AISF) ad hoc.: Marino L.B., Crema E.B., de Feo T., De Santis A., Fabris F.M., Guido M., Maggi U., Martinelli I., Merli M., Nicolini A., Rossi G., Sabba C., Sacerdoti D., Salerno F., Senzolo M., Vizzutti F. Vascular disorders of the liver: Recommendations from the Italian association for the study of the liver (AISF) ad hoc committee. Dig. Liver Dis. 2011; 43 (7): 503–514. doi: 10.1016/j.dld.2010.11.006.
26. Sogaard K.K., Astrup L.B., Vilstrup H., Gronbaek H. Portal vein thrombosis. Risk factors, clinical presentation and treatment. BMC Gastroenterol. 2007; 7: 34. doi: 10.1186/1471-230X-7-34.
27. Primignani M. , Mannucci M. The role of thrombophilia in splanchnic vein thrombosis. Semin. Liver Dis. 2008; 28 (3): 293–301. doi: 10.1055/s-0028-1085097.
, Mannucci M. The role of thrombophilia in splanchnic vein thrombosis. Semin. Liver Dis. 2008; 28 (3): 293–301. doi: 10.1055/s-0028-1085097.
28. Dentali F., Galli M., Gianni M., Ageno W. Inherited thrombophilic abnormalities and risk of portal vein thrombosis. A meta-analysis. Thromb. Haemost. 2008; 99 (4): 675–682. doi: 10.1160/TH07-08-0526.
29. Sakha S.H., Rafeey M., Tarzamani M.K. Portal venous thrombosis after umbilical vein catheterization. Indian J. Gastroenterol. 2007; 26 (6): 283–284.
30. Ferri P.M., Rodrigues Ferreira A., Fagundes E.D., Xavier S.G., Dias R.D. Evaluation of the presence of hereditary and acquired thrombophilias in brazilian children and adolescents with diagnoses of portal vein thrombosis. J. Pediatr. Gastroenterol. Nutr. 2012; 55 (5): 599–604. doi: 10.1097/MPG.0b013e318261814d.
doi: 10.1097/MPG.0b013e318261814d.
31. Qi X., De Stefano V., Wang J., Bai M., Yang Z., Han G., Fan D. Prevalence of inherited antithrombin, protein C, and protein S deficiencies in portal vein system thrombosis and Budd-Chiari syndrome: a systematic review and meta-analysis of observational studies. J. Gastroenterol. Hepatol. 2013; 28 (3): 432–442. doi: 10.1111/jgh.12085.
32. Sutkowska E., McBane R.D., Tafur A.J., Sutkowski K., Grill D.E., Slusser J.P., Wysokinski W.E. Thrombophilia differences in splanchnic vein thrombosis and lower extremity deep venous thrombosis in North America. J. Gastroenterol. 2013; 48 (10): 1111–1118. doi: 10.1007/s00535-012-0728-3.
33. Киценко Е.А., Любивый Е.Д., Лукина Е.А., Коршунов И.Б. Тромбофилия как причина внепеченочной портальной гипертензии. Анналы хирургической гепатологии. 2007; 12 (2): 26–30. Kitsenko E.A., Lyubiviy E.D., Lukina E.A., Korshunov I.B. Thrombophilia as a cause of extrahepatic portal hypertension. Annaly khirurgicheskoy gepatologii. 2007; 12 (2): 26–30. (In Russian)
Анналы хирургической гепатологии. 2007; 12 (2): 26–30. Kitsenko E.A., Lyubiviy E.D., Lukina E.A., Korshunov I.B. Thrombophilia as a cause of extrahepatic portal hypertension. Annaly khirurgicheskoy gepatologii. 2007; 12 (2): 26–30. (In Russian)
34. Kobayashi S., Ng C.S., Kazama T., Madoff D.C., Faria S.C., Vauthey J.N., Charnsangavej C. Hemodynamic and morphologic changes after portal vein embolization: differential effects in central and peripheral zones in the liver on multiphasic computed tomography. J. Comput. Assist. Tomogr. 2004; 28 (6): 804–810.
35. Tublin M.E., Towbin A.J., Federle M.P., Nalesnik M.A. Altered morphology after portal vein thrombosis: not always cirrhosis. Dig. Dis. Sci. 2008; 53 (10): 2784–2788. doi: 10.1007/s10620-008-0201-6.
36. Mesa R.A., Nagorney D.S., Schwager S., Allred J., Tefferi A. Palliative goals, patient selection, and preoperative platelet mana gement. Outcomes and lessons from 3 decades of splenectomy for myelofibrosis with myeloid metaplasia at the Mayo clinic. Cancer. 2006; 107 (2): 361–370. doi: 10.1002/cncr.22021.
Mesa R.A., Nagorney D.S., Schwager S., Allred J., Tefferi A. Palliative goals, patient selection, and preoperative platelet mana gement. Outcomes and lessons from 3 decades of splenectomy for myelofibrosis with myeloid metaplasia at the Mayo clinic. Cancer. 2006; 107 (2): 361–370. doi: 10.1002/cncr.22021.
37. Kraemer D., Rudiger T., Reimer P., Muller-Hermelink H.K., Wilhelm M. Splenectomy in patients with mixed myelodysplastic / myeloproliferative disease. Ann. Hematol. 2002; 81 (6): 308–311.
38. Дмитренко Е.В. Лечение и профилактика кровотечений из варикозно расширенных вен пищевода и желудка у больных с внепеченочной портальной гипертензией и заболеваниями системы крови: дис. … канд. мед. наук. М., 2009. 158 с. Dmitrenko E.V. Lechenie i profilaktika krovotecheniy iz varikozno rasshirennikh ven pischevoda i geludka u bol’nikh s vnepechenochnoy portal’noy gipertenziyey i zabolevaniyami sistemi krovi [Management and prevention of bleedings from esophageal and gastric varices in patients with extrahepatic portal hypertension and myeloproliferative diseases: dis. … cand. med. sci.] Moscow, 2009. 158 p. (In Russian)
… cand. med. sci.] Moscow, 2009. 158 p. (In Russian)
39. Ma J., Luo J., Liu Q., Wang J., Qui S. Rational classification of portal vein thrombosis and its clinical significance. PloS One. 2014; 9 (11): e112501. doi: 10.1371/journal.pone.0112501.
40. Bittencourt P.L., Farias A.Q., Strauss E., Mattos A.A., Pannel of the 1st Brazilian Concensus of Variceal Bleeding, Brazilian society of Hepatology: Ribeiro A.V., Brandao A.B., Lyra A., Cavalcanti A.R., Dominici A., Terra C., Marroni C.A., Tovo C.V., Crespo D., Parise E.R., Marinho F., Carrilho F.J., Souto F.J., Cotrim H., Coelho H.S., Paes I., Galizzi J., Soares J.S., Silva L., Lyra L.G., Costa M.A., Herman P., Mascarenhas R., Parana R. Variceal bleeding: Consensus meeting report from the Brazilian Society of Hepatology. Arq. Gastroenterol. 2010; 47 (2): 202–216. doi: 10.1590/S0004-28032010000200017.
41. Sheen C.L., Lamparelli H., Milne A., Green I., Ramage J.K. Clinical features, diagnosis and outcome of acute portal vein thrombosis. QJM. 2000; 93 (8): 531–534. doi: 10.1093/qjmed/93.8.531.
42. Harmanci O., Bayraktar Y. Portal hypertension due to portal venous thrombosis: etiology, clinical outcomes. World J. Gastroenterol. 2007; 13 (18): 2535–2540. doi: 10.3748/wjg.v13.i18.2535.
43. Khare R., Sikora S.S., Srikanth G., Choudhuri G., Saraswat V.A., Kumar A., Saxena R., Kapoor V.K. Extrahepatic portal venous obstruction and obstructive jaundice: approach to management. J. Gastroenterol. Hepatol. 2005; 20 (1): 56–61. doi: 10.1111/j.1440-1746.2004.03528.x.
44. Mutignani M. , Shah S.K., Bruni A., Perri V., Costamagna G. Endoscopic treatment of extrahepatic bile duct strictures in patients with portal biliopathy carries a high risk of haemobilia: report of 3 cases. Dig. Liver Dis. 2002; 34 (8): 587–591.
, Shah S.K., Bruni A., Perri V., Costamagna G. Endoscopic treatment of extrahepatic bile duct strictures in patients with portal biliopathy carries a high risk of haemobilia: report of 3 cases. Dig. Liver Dis. 2002; 34 (8): 587–591.
45. Nagi B., Kochhar R., Bhasin D., Singh K. Cholangiopathy in extrahepatic portal venous obstruction. Radiological appearances. Acta Radiol. 2000; 41 (6): 612–615. doi: 10.1080/028418500127345992.
46. Dumortier J., Vaillant E., Boillot O., Poncet G., Henry L., Scoazec J.Y., Partensky C., Valette P.J., Paliard P., Ponchon T. Diagnosis and treatment of biliary obstruction caused by portal cavernoma. Endoscopy. 2003; 35 (5): 446–450. doi: 10.1055/s-2003-38779.
47. Sharma M., Pathak A. Intracholedochal varices in portal hypertensive biliopathy. Eur. J. Radiol. 2009; Extra 72: e119–e123.
Eur. J. Radiol. 2009; Extra 72: e119–e123.
48. Vibert E., Azoulay D., Aloia T., Pascal G., Veilhan L.A., Adam R., Samuel D., Castaing D. Therapeutic strategies in symptomatic portal biliopathy. Ann. Surg. 2007; 246 (1): 97–104. doi: 10.1097/SLA.0b013e318070cada.
49. Colle I., van Vlierberghe H., Pattyn P., Troisi R., Vogelaers D., De Hemptinne B., De Vos M. Cholestasis as presenting symptom of portal cavernoma. Hepatol. Res. 2003; 25 (1): 32–37. doi: 10.1016/S1386-6346(02)00172-9.
50. Dhiman R.K., Behera A., Chawla Y.K., Dilawari J.B., Suri S. Portal hypertensive biliopathy. Gut. 2007; 56 (7): 1001–1008. doi: 10.1136/gut.2006.103606.
51. Sezgin O., Oguz D., Attritas E., Saritas U. , Sahin B. Endoscopic management of biliary obstruction carried by cavernous transformation of portal vein. Gastrointest. Endosc. 2003; 58 (4): 602–608. doi: 10.1067/S0016-5107(03)01975-8.
, Sahin B. Endoscopic management of biliary obstruction carried by cavernous transformation of portal vein. Gastrointest. Endosc. 2003; 58 (4): 602–608. doi: 10.1067/S0016-5107(03)01975-8.
52. Nihal N., Bapat M.R., Rathi P., Shah N.S., Karvat A., Abraham P., Bhatia S.J. Relation of insulin-like growth factor-1 and insulin-like growth factor binding protein-3 levels to growth retardation in extrahepatic portal vein obstruction. Hepatol. Int. 2009; 3 (1): 305–309. doi: 10.1007/s12072-008-9102-1.
53. Krebs-Schmitt D., Briem-Richter A., Grabhorn E., Burdelski M., Helmke K., Broering D.C., Ganschow R. Effectiveness of Rex shunt in children with portal hypertension following liver transplantation or with primary portal hypertension. Pediatr. Trans plant. 2009; 13 (5): 540–544. doi: 10.1111/j.1399-3046.2008.01109.x.
54. Камалов Ю.Р. Абдоминальное ультразвуковое исследование при синдроме портальной гипертензии. Методическое пособие. М., 2004. 48 с. Kamalov Y.R. Abdominal’noe ul’trazvukovoye issledovanie pri sindrome portal’noy gipertenzii. Metodicheskoye posobie [Abdominal ultrasonic in syndrome of portal hypertension. Methodical guideline]. Moscow, 2004. 48 p. (In Russian)
Камалов Ю.Р. Абдоминальное ультразвуковое исследование при синдроме портальной гипертензии. Методическое пособие. М., 2004. 48 с. Kamalov Y.R. Abdominal’noe ul’trazvukovoye issledovanie pri sindrome portal’noy gipertenzii. Metodicheskoye posobie [Abdominal ultrasonic in syndrome of portal hypertension. Methodical guideline]. Moscow, 2004. 48 p. (In Russian)
55. Камалов Ю.Р., Лебезев В.М., Ховрин В.В., Крюкова И.Е., Ким С.Ю., Гаврилов А.В., Архипов И.В. Возможности трехмерной реконструкции компьютерно-томографичеких изображений при дооперационной оценке состояния пациентов с синдромом портальной гипертензии. Медицинская визуализация. 2013; 3: 132–133. Kamalov Yu.R., Lebezev V.M., Khovrin V.V., Kryukova I.E., Kim S.Yu., Gavrilov A.V., Arkhipov I.V. The possibilities of 3D-reconstruction of computed-tomography images in preoperative evaluation of patients’ condition with portal hypertension syndrome. Meditsinskaya vizualizatsiya.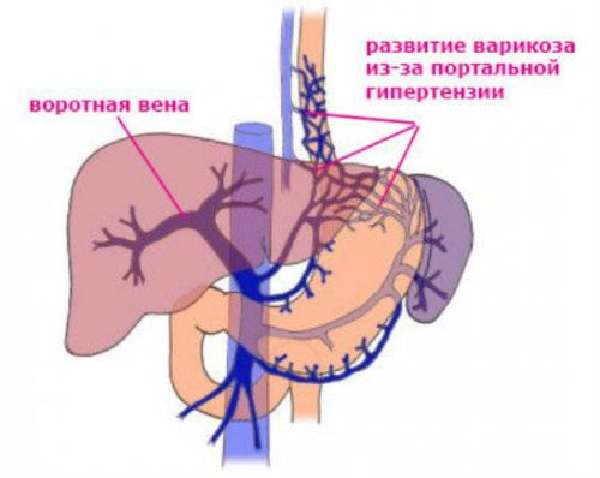 2013; 3: 132–133. (In Russian)
2013; 3: 132–133. (In Russian)
56. Basit S.A., Stone C.D., Gish R. Portal vein thrombosis. Clin. Liver Dis. 2015; 19 (1): 199–221. doi: 10.1016/j.cld.2014.09.012.
57. Lee H.K., Park S.J., Yi B.H., Yeon E.K., Kim J.H., Hong H.S. Portal vein thrombosis: CT features. Abdomin. Imaging. 2008; 33 (1): 72–79. doi: 10.1007/s00261-007-9200-x.
58. Spaander M.C., van Buuren H.R., Hansen B.E., Janssen H.L. Ascites in patients with non-cirrhotic non-malignant extrahepatic portal vein thrombosis. Aliment. Pharmacol. Ther. 2010; 32 (4): 529–534. doi: 10.1111/j.1365-2036.2007.03488.x.
59. Sharma P., Mishra S.R., Kumar M., Sharma B.C., Sarin S.K. Liver and spleen stiffness in patients with extrahepatic portal vein obstruction. Radiology. 2012; 263 (3): 893–899. doi: 10.1148/radiol.12111046.
Radiology. 2012; 263 (3): 893–899. doi: 10.1148/radiol.12111046.
60. Жигалова С.Б. Эндоскопические технологии в лечении и профилактике кровотечений из варикозно расширенных вен пищевода и желудка у больных портальной гипертензией: автореф. дис. … докт. мед. наук. М., 2011. 50 с. Zhigalova S.B. Endoskopicheskie tekhnologii v lechenii i profilaktike krovotecheniy iz varikozno rasshirennikh ven pischevoda i geludka u bol’nikh s portal’noy gipertenziyey [Endoscopic technologies for management and prevention of bleeding from esophageal and gastric varices in patients with portal hypertension: autoabstr. dis. … doc. med. sci.]. Moscow, 2011. 50 p. (In Russian)
61. Sato T., Akaike J., Toyota J., Karino Y., Ohmura T. Clinicopathological features and treatment of ectopic varices with portal hypertension. International J. Hepatol. 2011; 2011: 960720. doi: 10.4061/2011/960720.
doi: 10.4061/2011/960720.
62. Seeger M., Gunther R., Hinrichsen H., Both M., Helwig U., Arlt A., Stelck B., Brasen J.H., Sipos B., Schafmayer C., Braun F., Broring D.C., Schreiber S., Hampe J. Chronic portal vein thrombosis: transcapsular hepatic collateral vessels and communicating ectopic varices. Hampe Radiology. 2010; 257 (2): 568–578. doi: 10.1148/radiol.10100157.
63. De Franchis R., Dell’Era A., Primignani M. Diagnosis and monitoring of portal hypertension. Dig. Liver Dis. 2008; 40 (5): 312–317. doi: 10.1016/j.dld.2007.12.007.
64. Misra S.P., Dwivedi M., Misra V., Dharmani S., Kunwar B.K., Arora J.S. Colonic changes in patients with cirrhosis and in patients with extrahepatic portal vein obstruction. Endoscopy. 2005; 37 (5): 454–459. doi: 10.1055/s-2005-861252.
65. Ganguly S., Sarin S.K., Bhatia V., Lahoti D. The prevalence and spectrum of colonic lesions in patients with cirrhosis and noncirrhotic portal hypertension. Hepatology. 1995; 21 (5): 1226–1231.
66. Mustjoki S., Borze I., Lasho T.L., Alitalo R., Pardanani A., Knuutila S., Juvonen E. JAK2V617F mutation and spontaneous megakaryocytic or erythroid colony formation in patients with essential thrombocythaemia (ET) or polycythaemia vera (PV). Leuk. Res. 2009; 33 (1): 54–59. doi: 10.1016/j.leukres.2008.07.008.
67. Turnes J., Garcia-Pagan J.C., Gonzalez M., Aracil C., Calleja J.L., Ripoll C., Abraldes J.G., Banares R., Villanueva C., Albillos A., Ayuso J.R., Gilabert R., Bosch J. Portal hypertensive complications after acute portal vein thrombosis: impact of early anticoagulation. Clin. Gastroenterol. Hepatol. 2008; 6 (12): 1412–1417. doi: 10.1016/j.cgh.2008.07.031.
Clin. Gastroenterol. Hepatol. 2008; 6 (12): 1412–1417. doi: 10.1016/j.cgh.2008.07.031.
68. Tateishi A., Mitsui H., Oki T., Morishita J., Maekawa H., Yahagi N., Maruyama T., Ichinose M., Ohnishi S., Shiratori Y., Minami M., Koutetsu S., Hori N., Watanabe T., Nagawa H., Omata M. Extensive mesenteric vein and portal vein thrombosis successfully treated by thrombolysis and anticoagulation. J. Gastroenterol. Hepatol. 2001; 16 (12): 1429–1433. doi: 10.1046/j.1440-1746.2001.02557.x.
69. Condat B., Pessione F., Hillaire S., Denninger M.H., Guillin M.C., Poliquin M., Hadengue A., Erlinger S., Valla D. Current outcome of portal vein thrombosis in adults: risk and benefit of anticoagulant therapy. Gastroenterology. 2001; 120 (2): 490–497. doi: 10.1053/gast.2001.21209.
70. Congly S.E., Lee S.S. Portal vein thrombosis: should anticoagulation be used? Curr. Gastroenterol. Rep. 2013; 15 (2): 306. doi: 10.1007/s11894-012-0306-0.
Congly S.E., Lee S.S. Portal vein thrombosis: should anticoagulation be used? Curr. Gastroenterol. Rep. 2013; 15 (2): 306. doi: 10.1007/s11894-012-0306-0.
71. Franchini M., Mannicci P.M. A new era of anticoagulants. Eur. J. Intern. Med. 2009; 20 (6): 562–568. doi: 10.1016/j.ejim.2009.05.004.
72. Tripodi A., Mannucci P.M. The coagulopathy of chronic liver disease. N. Engl. J. Med. 2011; 365 (2): 147–156. doi: 10.1056/NEJMra1011170.
73. Adani G.L., Baccarani U., Risaliti A., Sponza M., Gasparini D., Bresadola F., de Anna D., Bresadola V. Percutaneous transhepatic portography for the treatment of early portal vein thrombosis after surgery. Cardiovasc. Intervent. Radiol. 2007; 30 (6): 1222–1226. doi: 10.1007/s00270-007-9056-z.
74. Aytekin C., Boyvat F., Kurt A., Yologlu Z., Coskun M. Catheter directed thrombolysis with transjugular access in portal vein thrombosis secondary to pancreatitis. Eur. J. Radiol. 2001; 39 (2): 80–82. doi: 10.1016/S0720-048X(01)00289-3.
Aytekin C., Boyvat F., Kurt A., Yologlu Z., Coskun M. Catheter directed thrombolysis with transjugular access in portal vein thrombosis secondary to pancreatitis. Eur. J. Radiol. 2001; 39 (2): 80–82. doi: 10.1016/S0720-048X(01)00289-3.
75. Bilbao J.I., Elorz M., Vivas I., Martinez-Cuesta A., Bastarrika G., Benito A. Transjugular intrahepatic portosystemic shunt (TIPS) in the treatment of venous symptomatic chronic portal thrombosis in non-cirrhotic patients. Cardiovasc. Intervent. Radiol. 2004; 27 (5): 474–480. doi: 10.1007/s00270-004-0241-z.
76. Ferro C., Rossi C.G., Bovio G., Dahamane M., Centenaro M. TIPS mechanical aspiration thrombectomy and direct thrombolysis in the treatment of acute portal and superior mesenteric vein thrombosis. Cardiovasc. Intervent. Radiol. 2007; 30 (5): 1070–1074. doi: 10.1007/s00270-007-9137-z.
77. Henao E.A., Bohannon W.T., Silva M.B. Jr. Treatment of portal venous thrombosis with selective superior mesenteric artery infusion of recombinant tissue plasminogen activator. J. Vasc. Surg. 2003; 38 (6): 1411–1415.
Henao E.A., Bohannon W.T., Silva M.B. Jr. Treatment of portal venous thrombosis with selective superior mesenteric artery infusion of recombinant tissue plasminogen activator. J. Vasc. Surg. 2003; 38 (6): 1411–1415.
78. Hollingshead M., Burke C.T., Mauro M.A., Weeks S.M., Dixon R.G., Jaques P.F. Transcatheter thrombolytic therapy for acute mesenteric and portal vein thrombosis. J. Vasc. Intervent. Radiol. 2005; 16 (5): 651–661.
79. Kercher K.W., Sing R.F., Watson K.W., Matthews B.D., LeQuire M.H., Heniford B.T. Transhepatic thrombolysis in acute portal vein thrombosis after laparoscopic splenectomy. Surg. Laparosc. Endosc. Percutan. Tech. 2002; 12 (2): 131–136.
80. Malkowski P., Pawlak J., Michalowicz B., Szczerban J., Wroblewski T., Leowska E., Krawczyk M. Thrombolytic treatment of portal thrombosis. Hepatogastroenterology. 2003; 50 (54): 2098–2100.
Thrombolytic treatment of portal thrombosis. Hepatogastroenterology. 2003; 50 (54): 2098–2100.
81. Oguzkurt P., Tercan F., Ince E., Ezer S.S., Hicsonmez A. Percutaneous treatment of portal vein thrombosis in a child who has undergone splenectomy. J. Pediatr. Surg. 2008; 43 (8): 29–32.
82. Pfammatter T., Binoit C., Cathomas G., Blum U. Budd–Chiari synd rome with spleno-mesenteric-portal thrombosis: treatment with extended TIPS. J. Vasc. Interv. Radiol. 2000; 11 (6): 781–784.
83. Senzolo M., Tibbals J., Cholongitas E., Triantos C.K., Burroughs A.K., Patch D. Transjugular intrahepatic portosystemic shunt for portal vein thrombosis with and without cavernous transformation. Aliment. Pharmacol. Ther. 2006; 23 (6): 767–775. doi: 10.1111/j.1365-2036.2006.02820. x.
x.
84. Smalberg J.H., Spaander M.C., Kon-Siong G.J., Pattynama P.M.T., van Buuren H.R., van den Berg B., Janssen H.L., Leebeek F.W.G. Risk and benefits of transcatheter thrombolytic therapy in patients with splanchnic venous thrombosis. Thromb. Haemost. 2008; 100 (6): 1084–1088. doi: 10.1160/TH08-01-0015.
85. Uflacker R. Applications of percutaneous mechanical thrombectomy in transjugular intrahepatic portosystemic shunt and portal vein thrombosis. Tech. Vasc. Interv. Radiol. 2003; 6 (1): 59–69. doi: 10.1053/tvir.2003.36433.
86. Boyer T.D., Henderson J.M., Heerey A.M., Arrigain S., Konig V., Connor J., Abu-Elmagd K., Galloway J., Rikkers L.F., Jeffers L. Cost of preventing variceal rebleeding with transjugular intrahepatic portal systemic shunt and distal splenorenal shunt. J. Hepatol. 2008; 48 (3): 407–414. doi: 10.1016/j.jhep.2007.08.014.
J. Hepatol. 2008; 48 (3): 407–414. doi: 10.1016/j.jhep.2007.08.014.
87. Лебезев В.М. Портокавальное шунтирование у больных с портальной гипертензией: дис. … докт. мед. наук. М., 1994. 213 с. Lebezev V.M. Portokaval’noe shuntirovanie u bol’nikh s portal’noy gipertenziyey [Portocaval shunting in patients with portal hypertension: dis. … doct. med. sci.]. Moscow, 1994. 213 p. (In Russian)
88. Pal S., Sahni P. Extrahepatic portal venous obstruction: Is the knife irrelevant? Indian J. Gastroenterol. 2009; 28 (6): 198–200. doi: 10.1007/s12664-009-0078-0.
89. Livingstone A.S., Koniaris L.G., Perez E.A., Alvarez N., Levi J.U., Hutson D.G. 507 Warren–Zeppa distal splenorenal shunts: a 34-year experience. Ann. Surg. 2006; 243 (6): 884–892. doi: 10.1097/01.sla. 0000219681.08312.87.
0000219681.08312.87.
90. Orloff M.J., Isenberg J.I., Wheeler H.O., Haynes K.S., Jinich-Brook H., Rapier R., Vaida F., Hye R.J. Direct costs of care in a randomized controlled trial of endoscopic sclerotherapy versus emergency portocaval shunt for bleeding esophageal varices in cirrhosis – Part 4. J. Gastrointest. Surg. 2010; 15 (1): 38–47. doi: 10.1007/s11605-010-1332-6.
91. Pedroso F.E., Koniaris L.G. Shunting: a better way to prevent variceal bleeding. J. Surg. Res. 2011; 167 (1): e1–e3. doi: 10.1016/j.jss.2010.12.037.
92. Wolff M., Hirner A. Current state of portosystemic shunt surgery. Langenbecks Arch. Surg. 2003; 388 (3): 141–149. doi: 10.1007/s00423-003-0367-5.
93. Wu J. , Li Z., Wang Z., Han X., Ji F., Zhang W.W. Surgical and endovascular treatment of severe complications secondary to noncirrhotic portal hypertension: experience of 56 cases. Ann. Vasc. Surg. 2013; 27 (4): 441–446. doi: 10.1016/j.avsg.2012.05.027.
, Li Z., Wang Z., Han X., Ji F., Zhang W.W. Surgical and endovascular treatment of severe complications secondary to noncirrhotic portal hypertension: experience of 56 cases. Ann. Vasc. Surg. 2013; 27 (4): 441–446. doi: 10.1016/j.avsg.2012.05.027.
94. Di Francesco F., Grimaldi C., de Ville de Goyet J. Meso-Rex bypass – a procedure to cure prehepatic portal hypertension: the insight and the inside. J. Am. Coll. Surg. 2014; 218 (2): e23–36. doi: 10.1016/j.jamcollsurg.2013.10.02.
95. Query J.A., Sandler A.D., Sharp W.J. Use of autogenous saphenous vein as a conduit for mesenterico-left portal vein bypass. J. Pediatr. Surg. 2007; 42 (6): 1137–1140. doi: 10.1016/j.jpedsurg.2007.01.066.
96. Superina R., Shneider B., Emre S., Sarin S.K., de Ville de Goyet J. Surgical guidelines for the management of extra-hepatic portal vein obstruction. Pediatr. Transplant. 2006; 10 (8): 908–913. doi: 10.1111/j.1399-3046.2006.00598.x.
Surgical guidelines for the management of extra-hepatic portal vein obstruction. Pediatr. Transplant. 2006; 10 (8): 908–913. doi: 10.1111/j.1399-3046.2006.00598.x.
97. Srivastava A., Yadav S.K., Lal R., Yachha S.K., Thomas M.A., Saraswat V.A., Gupta R.K. Effect of surgical portosystemic shunt on prevalence of minimal hepatic encephalopathy in children with extrahepatic portal venous obstruction: assessment by magnetic resonance imaging and psychometry. J. Pediatr Gastroenterol. Nutr. 2010; 51 (6): 766–772. doi: 10.1097/MPG.0b013e3181ecaf62.
98. Sharma P., Sharma B.C. Lactulose for minimal hepatic encephalopathy in patients with extrahepatic portal vein obstruction. Saudi J. Gastroenterol. 2012; 18 (3): 168–172. doi: 10.4103/1319-3767.96448.
99. Goyal N. , Singhal D., Gupta S., Soin A.S., Nundy S. Transabdo minal gastroesophageal devascularization without transection for bleeding varices: results and indicators of prognosis. J. Gastroenterol. Hepatol. 2007; 22 (1): 47–50. doi: 10.1111/j.1440-1746.2006.04330.x.
, Singhal D., Gupta S., Soin A.S., Nundy S. Transabdo minal gastroesophageal devascularization without transection for bleeding varices: results and indicators of prognosis. J. Gastroenterol. Hepatol. 2007; 22 (1): 47–50. doi: 10.1111/j.1440-1746.2006.04330.x.
100. Johnson M., Rajendran S., Balachandar T.G., Kannan D., Jeswanth S., Ravichadran P., Surendran R. Transabdominal modified devascularization procedure with or without esophageal stapler transection – an operation adequate for effective control of a variceal bleed. Is esophageal stapler transection necessary? World J. Surg. 2006; 30 (8): 1507–1519. doi: 10.1007/s00268-005-0754-x.
101. Singhal D., Goyal N., Soin A.S., Gupta S., Nundy S. What are the essential components of a transabdominal devascularization procedure for bleeding esophageal varices? World J. Surg. 2007; 31 (4): 861–864. doi: 10.1007/s00268-007-0630-y.
doi: 10.1007/s00268-007-0630-y.
102. Covarelli P., Badolato M., Boselli C., Noya G., Cristofani R., Mosca S., Tei F. Splenic vein thrombosis complicated by massive gastric bleeding: treatment with arterious embolization. Am. Surg. 2008; 74 (2): 184–186.
103. Saugel B., Gaa J., Phillip V., Schmid R.M., Huber W. Splenic artery embolization in a woman with bleeding gastric varices and splenic vein thrombosis: a case report. J. Med. Case Rep. 2010; 4: 247. doi: 10.1186/1752-1947-4-247.
104. Takahashi T., Yoshida H., Mamada Y., Taniani N., Tajiri T. Balloon-occluded retrograde transvenous obliteration for gastric varices in a child with extrahepatic portal vein obstruction. J. Nippon Med. Sch. 2009; 76 (3): 173–178. doi: 10.1272/jnms.76.173.
105. Spaander M.C., Murad S.D., van Buuren H.R., Hansen B.E., Kuipers E.J., Janssen H.L. Endoscopic treatment of esophagogastric variceal bleeding in patients with non-cirrhotic extrahepatic portal vein thrombosis: a long-term follow-up study. Gastrointest. Endosc. 2008; 67 (6): 821–827. doi: 10.1016/j.gie.2007.08.023.
Spaander M.C., Murad S.D., van Buuren H.R., Hansen B.E., Kuipers E.J., Janssen H.L. Endoscopic treatment of esophagogastric variceal bleeding in patients with non-cirrhotic extrahepatic portal vein thrombosis: a long-term follow-up study. Gastrointest. Endosc. 2008; 67 (6): 821–827. doi: 10.1016/j.gie.2007.08.023.
106. Thomas V., Jose T., Kumar S. Natural history of bleeding after esophageal variceal eradication in patients with extrahepatic portal venous obstruction. A 20-year follow-up. Indian J. Gastroenterol. 2009; 28 (6): 206–211. doi: 10.1007/s12664-009-0086-0.
107. Poddar U., Bhatnagar S., Yachha S.K. Endoscopic band ligation followed by sclerotherapy: is it superior to sclerotherapy in children with extrahepatic portal venous obstruction? J. Gastroenterol. Hepatol. 2011; 26 (2): 255–259. doi: 10.1111/j.1440-1746.2010.06397. x.
x.
108. Sarin S.K., Gupta N., Jha S.K., Agrawal A., Mishra S.R., Sharma B.C., Kumar A. Equal efficacy of endoscopic variceal ligation and propranolol in preventing variceal bleeding in patients with noncirrhotic portal hypertension. Gastroenterology. 2010; 139 (4): 1238–1245. doi: 10.1053/j.gastro.2010.06.017.
109. Zargar S.A., Javid G., Khan B.A., Shah O.J., Yattoo G.N., Shah A.H., Gulzar G.M., Singh J., Shah N.A., Shafi H.M. Endoscopic ligation vs. sclerotherapy in adults with extrahepatic portal venous obstruction: a prospective randomized study. Gastrointest. Endosc. 2005; 61 (1): 58–66. doi: 10.1016/S0016-5107(04)02455-1.
110. Pavini М.Т., Puyana J.C. Gastroesophageal balloon tamponade for acute variceal hemorrhage. Irwin and Rippe’s Intensive Care Medicine. 6-th edition. Edited by: Rippe J.M. Philadelphia. USA.: Lippincot Williams & Wilkins, 2008. P. 138–145.
6-th edition. Edited by: Rippe J.M. Philadelphia. USA.: Lippincot Williams & Wilkins, 2008. P. 138–145.
111. Bosch J., Garcia-Pagan J.C., Feu F., Luca A., Fernandez M., Pizcueta P., Rodes J. New approaches in the pharmacologic treatment of portal hypertension. J. Hepatol. 1993; 17 (2): 41–45.
112. Burroughs A.K., Panagou E. Pharmacological therapy for portal hypertension: rationale and results. Semin. Gastrointest. Dis. 1995; 6 (3): 23–27.
113. Burroughs A.K., McCormick P.A., Hughes M.D., Sprengers D., D’Heygere F., McIntyre N. Randomized double blind placebo controlled trial of somatostatin for variceal bleeding. Emergency control and prevention of early variceal bleeding. Gastroenterology. 1990; 99 (5): 1388–1395.
114. De La Pena J., Brullet E., Sanchez-Hernandez E., Rivero M., Vergara M., Martin-Lorente J.L., Garcia Suarez C. Variceal ligation plus nadolol compared with ligation for prophylaxis of variceal bleeding: a multicentre trial. Hepatology. 2005; 41 (3): 572–578. doi: 10.1002/hep.20584.
De La Pena J., Brullet E., Sanchez-Hernandez E., Rivero M., Vergara M., Martin-Lorente J.L., Garcia Suarez C. Variceal ligation plus nadolol compared with ligation for prophylaxis of variceal bleeding: a multicentre trial. Hepatology. 2005; 41 (3): 572–578. doi: 10.1002/hep.20584.
115. Schepke M., Kleber G., Nurnberg D., Willert J., Koch L., Veltzke-Schlieker W., Hellerbrand C., Kuth J., Schanz S., Kahl S., Fleig W.E., Sauerbruch T. Ligation versus propranolol for the primary prophylaxis of variceal bleeding in cirrhosis. Hepatology. 2004; 40 (1): 65–72. doi: 10.1002/hep.20284.
116. Banares R., Albillos A., Rincon D., Alonso S., Gonzalez M., Ruiz-del-Arbol L., Salcedo M., Molinero L.M. Endoscopic treatment versus endoscopic plus pharmacologic treatment for acute variceal bleeding: a meta-analysis. Hepatology. 2002; 35 (3): 609–615.
117. Kitchens C.S., Weidner M.H., Lottenberg R. Chronic oral anticoagulant therapy for extrahepatic visceral thrombosis is safe. J. Thromb. Thrombolysis. 2007; 23 (3): 223–228. doi: 10.1007/s11239-006-9017-4.
Чрескожная чреспеченочная реолитическая тромбэктомия в лечении пострезекционного тромбоза воротной вены
В последние годы в специализированных лечебных учреждениях резекция воротной и верхней брыжеечной вен при инвазии в них раковой опухоли головки и тела поджелудочной железы стали рутинной онкологической операцией [9]. Летальность и количество осложнений после подобных вмешательств не превышают аналогичные показатели после панкреатодуоденальных резекций без венозных реконструкций [13]. В то же время выполнение сосудистых резекций при раке головки поджелудочной железы, особенно на этапе накопления опыта, может сопровождаться таким грозным осложнением, как тромбоз воротной вены (ТВВ). Это довольно редкое осложнение, сопровождающееся высокой летальностью [5]. Традиционным методом лечения является назначение антикоагулянтной терапии. Хирургическое лечение (тромбэктомия) применяется при неэффективности медикаментозной терапии или наличии признаков ишемии кишечника. Эндоваскулярные вмешательства при ТВВ служат альтернативой хирургическому лечению благодаря малой травматичности и низкой частоте осложнений. Одним из эндоваскулярных устройств, применяемых для лечения венозных тромбозов, является система для реолитической тромбэктомии AngioJet 9000 (Possis Medical Inc., США). В ней используется струя физилогического раствора под высоким давлением, в результате чего создается так называемый эффект Вентури, позволяющий механически разрушить тромб и эвакуировать его через катетер.
Это довольно редкое осложнение, сопровождающееся высокой летальностью [5]. Традиционным методом лечения является назначение антикоагулянтной терапии. Хирургическое лечение (тромбэктомия) применяется при неэффективности медикаментозной терапии или наличии признаков ишемии кишечника. Эндоваскулярные вмешательства при ТВВ служат альтернативой хирургическому лечению благодаря малой травматичности и низкой частоте осложнений. Одним из эндоваскулярных устройств, применяемых для лечения венозных тромбозов, является система для реолитической тромбэктомии AngioJet 9000 (Possis Medical Inc., США). В ней используется струя физилогического раствора под высоким давлением, в результате чего создается так называемый эффект Вентури, позволяющий механически разрушить тромб и эвакуировать его через катетер.
Материал и методы
В клинике хирургии и онкологии Лечебно-реабилитационного центра Минздрава РФ с января 2010 г. пo май 2013 г. выполнены 61 панкреатодуоденальная резекция и 3 тотальные дуоденопанкреатэктомии по поводу злокачественных (59) и доброкачественных (5) заболеваний органов панкреатобилиарной зоны. В 20 наблюдениях произведена резекция воротной и/или верхней брыжеечной вены, в 2 из них мезентерико-портальный кровоток восстановлен с использованием синтетического графта, у остальных сформирован циркулярный венозный анастомоз конец в конец. После 3 операций развился тромбоз в зоне венозного анастомоза, что потребовало применения чрескожной чреспеченочной тромбэктомии с использованием устройства AngioJet 9000. В 2 из 3 наблюдений после тромбэктомии было выполнено стентирование участка воротной вены в зоне тромбоза. Приводим эти наблюдения.
выполнены 61 панкреатодуоденальная резекция и 3 тотальные дуоденопанкреатэктомии по поводу злокачественных (59) и доброкачественных (5) заболеваний органов панкреатобилиарной зоны. В 20 наблюдениях произведена резекция воротной и/или верхней брыжеечной вены, в 2 из них мезентерико-портальный кровоток восстановлен с использованием синтетического графта, у остальных сформирован циркулярный венозный анастомоз конец в конец. После 3 операций развился тромбоз в зоне венозного анастомоза, что потребовало применения чрескожной чреспеченочной тромбэктомии с использованием устройства AngioJet 9000. В 2 из 3 наблюдений после тромбэктомии было выполнено стентирование участка воротной вены в зоне тромбоза. Приводим эти наблюдения.
1. Больная 58 лет обратилась в наше учреждение в связи с болями в эпигастральной области. При обследовании (КТ, МРТ брюшной полости, эндосонография) в теле поджелудочной железы выявлено образование диаметром до 5 см, инвазирующее в зону конфлюенса селезеночной и верхней брыжеечной вен. Выполнена пункция образования. При морфологическом исследовании пунктата обнаружена картина аденокарциномы поджелудочной железы. 19.01.11 выполнена гастропанкреатодуоденальная резекция, расширенная за счет тела поджелудочной железы. Произведена резекция 3 см верхней брыжеечной вены с наложением циркулярного вено-венозного анастомоза. Объем кровопотери составил 1400 мл, продолжительность операции — 8 ч 10 мин. Реконструкция осуществлена на двух петлях тонкой кишки с гастроеюноанастомозом на сформированной по Ру петле. При гистологическом исследовании операционного препарата установлено наличие недифференцированного рака головки и тела поджелудочной железы с экстрапанкреатической периневральной инвазией, метастазами в 1 из 13 удаленных лимфатических узлов (pT3NlM0) и раковыми клетками в забрюшинном крае резекции поджелудочной железы (R1).
Выполнена пункция образования. При морфологическом исследовании пунктата обнаружена картина аденокарциномы поджелудочной железы. 19.01.11 выполнена гастропанкреатодуоденальная резекция, расширенная за счет тела поджелудочной железы. Произведена резекция 3 см верхней брыжеечной вены с наложением циркулярного вено-венозного анастомоза. Объем кровопотери составил 1400 мл, продолжительность операции — 8 ч 10 мин. Реконструкция осуществлена на двух петлях тонкой кишки с гастроеюноанастомозом на сформированной по Ру петле. При гистологическом исследовании операционного препарата установлено наличие недифференцированного рака головки и тела поджелудочной железы с экстрапанкреатической периневральной инвазией, метастазами в 1 из 13 удаленных лимфатических узлов (pT3NlM0) и раковыми клетками в забрюшинном крае резекции поджелудочной железы (R1).
В 1-е сутки после операции по данным КТ органов брюшной полости, выполненной в связи с большим количеством серозного отделяемого по дренажам, диагностирован ТВВ. Под контролем УЗИ осуществлен правосторонний чрескожный чреспеченочный доступ к ветвям воротной вены, установлен интродьюсер 7F длиной 11 см (Cordis, США). Чepeз диагностический катетер Pigtail 6F длиной 110 см (Cordis) выполнена портография проксимальнее места окклюзии (рис. 1, а).Рисунок 1. Чреспеченочные портограммы (клиническое наблюдение №1). а — окклюзирующий тромбоз воротной вены (верхушка тромба в виде дефекта контрастирования обведена). Далее за место окклюзии заведен периферический проводник Supra Core Peripheral диаметром 0,035 дюйма и длиной 300 см (Abbott Vascular), по нему проведен диагностический катетер MP 6F длиной 100 см (Cordis). Выполнена портография дистальнее зоны окклюзии (рис. 1, б), после чего проведена реолитическая тромбэктомия аппаратом AngioJet (общая продолжительность работы 143 с, аспирировано 150 мл крови).Рисунок 1. Чреспеченочные портограммы (клиническое наблюдение №1). б — дистальная граница тромба на уровне конфлюенса первой тощекишечной и подвздошно-ободочной вен.
Под контролем УЗИ осуществлен правосторонний чрескожный чреспеченочный доступ к ветвям воротной вены, установлен интродьюсер 7F длиной 11 см (Cordis, США). Чepeз диагностический катетер Pigtail 6F длиной 110 см (Cordis) выполнена портография проксимальнее места окклюзии (рис. 1, а).Рисунок 1. Чреспеченочные портограммы (клиническое наблюдение №1). а — окклюзирующий тромбоз воротной вены (верхушка тромба в виде дефекта контрастирования обведена). Далее за место окклюзии заведен периферический проводник Supra Core Peripheral диаметром 0,035 дюйма и длиной 300 см (Abbott Vascular), по нему проведен диагностический катетер MP 6F длиной 100 см (Cordis). Выполнена портография дистальнее зоны окклюзии (рис. 1, б), после чего проведена реолитическая тромбэктомия аппаратом AngioJet (общая продолжительность работы 143 с, аспирировано 150 мл крови).Рисунок 1. Чреспеченочные портограммы (клиническое наблюдение №1). б — дистальная граница тромба на уровне конфлюенса первой тощекишечной и подвздошно-ободочной вен. На контрольных портограммах визуализируется 80% стеноз верхней брыжеечной вены на уровне анастомоза (рис. 1, в).Рисунок 1. Чреспеченочные портограммы (клиническое наблюдение №1). в — после реолитической тромбэктомии тромбоз ликвидирован. Определяется гемодинамически значимый (80%) стеноз воротной вены на уровне анастомоза (обведен). В связи с гемодинамически значимым характером стеноза в зону сужения имплантирован саморасширяющийся стент Wallstent диаметром 9 мм и длиной 40 мм (Boston Scientific, США). Остаточный стеноз не более 20%, признаков повреждения вены не обнаружено (рис. 1, г).Рисунок 1. Чреспеченочные портограммы (клиническое наблюдение №1). г — стент в просвете воротной вены. В воротной вене оставлен чреспеченочный катетер для возможного регионарного тромболизиса.
На контрольных портограммах визуализируется 80% стеноз верхней брыжеечной вены на уровне анастомоза (рис. 1, в).Рисунок 1. Чреспеченочные портограммы (клиническое наблюдение №1). в — после реолитической тромбэктомии тромбоз ликвидирован. Определяется гемодинамически значимый (80%) стеноз воротной вены на уровне анастомоза (обведен). В связи с гемодинамически значимым характером стеноза в зону сужения имплантирован саморасширяющийся стент Wallstent диаметром 9 мм и длиной 40 мм (Boston Scientific, США). Остаточный стеноз не более 20%, признаков повреждения вены не обнаружено (рис. 1, г).Рисунок 1. Чреспеченочные портограммы (клиническое наблюдение №1). г — стент в просвете воротной вены. В воротной вене оставлен чреспеченочный катетер для возможного регионарного тромболизиса.
На следующие сутки после контрольной портографии был удален катетер из воротной вены, после чего у больной развилось внутрибрюшное кровотечение. Экстренно выполнена релапаротомия и место прокола венозной стенки (место стояния катетера) ушито. В дальнейшем выполнены еще две релапаротомии: в связи с некрозом сформированной по Ру петли и для ушивания микродефекта по линии панкреатоеюноанастомоза.
В дальнейшем выполнены еще две релапаротомии: в связи с некрозом сформированной по Ру петли и для ушивания микродефекта по линии панкреатоеюноанастомоза.
Больная была выписана в удовлетворительном состоянии через 29 дней после первой операции. Дальнейшее течение послеоперационного периода без осложнений. В настоящее время (31 мес после операции) признаков рецидива опухоли нет, наблюдается в Лечебно-реабилитационном центре.
2. Больной 64 лет без сопутствующих заболеваний, поступил для обследования и оперативного лечения по поводу механической желтухи на фоне опухолевой обструкции дистального отдела общего желчного протока. При KT органов брюшной полости было установлено наличие опухоли диаметром около 4 см в головке поджелудочной железы с вероятной инвазией воротной вены. После ретроградного стентирования общего желчного протока и разрешения желтухи больному выполнена гастропанкреатодуоденальная резекция с резекцией верхней брыжеечной вены и общей печеночной артерии. При гистологическом исследовании операционного препарата установлено наличие умеренно дифференцированной протоковой аденокарциномы головки поджелудочной железы с выраженной экстрапанкреатической периневральной инвазией, метастазами в 2 из 19 удаленных лимфатических узлов (рТ3N1M0).
При гистологическом исследовании операционного препарата установлено наличие умеренно дифференцированной протоковой аденокарциномы головки поджелудочной железы с выраженной экстрапанкреатической периневральной инвазией, метастазами в 2 из 19 удаленных лимфатических узлов (рТ3N1M0).
На 12-е сутки послеоперационного периода по данным КТ брюшной полости был выявлен окклюзирующий ТВВ (рис. 2, а).Рисунок 2. Чреспеченочные портограммы (клиническое наблюдение №2). а — окклюзирующий тромбоз воротной вены (верхушка тромба в виде дефекта контрастирования обведена). Как и в предыдущем наблюдении, больному выполнена реолитическая тромбэктомия с использованием аналогичной техники и инструментов. На контрольных портограммах получен оптимальный ангиографический результат (рис. 2, б), в связи с чем стентирование зоны тромбоза не выполнялось.Рисунок 2. Чреспеченочные портограммы (клиническое наблюдение №2). б — после реолитической тромбэктомии: тромба в просвете вены не определяется. Для ликвидации пункционного канала использован фибриновый клей Tissucol Kit (BaxterAG, Германия).
Для ликвидации пункционного канала использован фибриновый клей Tissucol Kit (BaxterAG, Германия).
В дальнейшем выполнены лапароскопическое дренирование подпеченочного абсцесса и лапароскопическая спленэктомия. Больной выписан на 41-е сутки послеоперационного периода в удовлетворительном состоянии с рекомендацией продолжать лечение фраксипарином. Умер через 19 мес после панкреатодуоденальной резекции от прогрессирования основного заболевания.
3. Больная 65 лет госпитализирована для оперативного лечения по поводу опухоли головки поджелудочной железы диаметром около 2 см. 07.02.13 выполнена гастропанкреатодуоденальная резекция. Во время операции отмечен тромбоз порто-портального анастомоза. После тромбэктомии сформирован мезентерико-портальный анастомоз. Реконструкция осуществлена на двух петлях тонкой кишки с гастроеюноанастомозом на сформированной по Ру петле. Кровопотеря составила 500 мл, продолжительность операции — 6 ч 5 мин. При гистологическом исследовании удаленного препарата установлено наличие умеренно дифференцированной аденокарциномы головки поджелудочной железы, экстрапанкреатической периневральной инвазии и метастазов в 16 удаленных лимфатических узлах нет (pT2N0M0).
Послеоперационный период в 1-е сутки осложнился ТВВ. Выявлен окклюзирующий тромб на уровне анастомоза и бифуркации воротной вены, распространяющийся в ее долевые ветви (рис. 3, а).Рисунок 3. Чреспеченочные портограммы (клиническое наблюдение №3). а — окклюзирующий тромбоз воротной вены. Выполнена чрескожная чреспеченочная реолитическая тромбэктомия с использованием аппарата AngioJet в зоне тромбоза. Полностью эвакуировать тромботические массы не удалось, в связи с чем в зону тромбоза имплантирован саморасширяющийся стент SMART диаметром 10 мм и длиной 40 мм (Cordis) после дилатации баллоном диаметром 9 мм и длиной 20 мм (рис. 3, б).Рисунок 3. Чреспеченочные портограммы (клиническое наблюдение №3). б — после реолитической тромбэктомии и стентирования: тромба в просвете вены не определяется.
В послеоперационном периоде у больной развилась острая почечная недостаточность в результате массивного гемолиза, проводилась заместительная терапия. После купирования проявлений синдрома полиорганной недостаточности возникла полинейропатия критических состояний.
На 37-е сутки после операции у больной развилось профузное желудочно-кишечное кровотечение. При экстренной ангиографии установлено, что его источником являлась ложная аневризма правой печеночной артерии. Кровотечение остановлено после установки графт-стента в просвет артерии, однако состояние больной после перенесенной массивной кровопотери ухудшилось, она умерла на 41-й день после операции от полиорганной недостаточности.
Одной из причин возникновения ТВВ являются хирургические вмешательства на печени [15]. С развитием интервенционных методов лечения в литературе чаще стали появляться сообщения об успешном их применении в лечении послеоперационного ТВВ [4]. Для проведения регионарного тромболизиса тромболитик вводят через катетер, установленный в верхней брыжеечной артерии или в воротной вене (чрескожно чреспеченочно или трансюгулярным доступом) [1, 7, 10, 14]. Описано выполнение регионарного тромболизиса при ТВВ в раннем (до 30 дней) послеоперационном периоде [12], однако введение тромболитического агента в столь ранний срок сопровождается высоким риском кровотечения.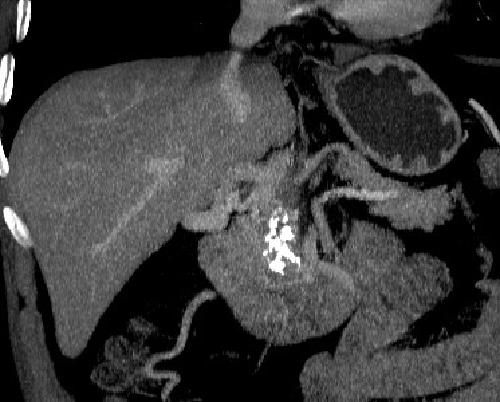 Регионарный тромболизис малоэффективен при возникновении острого тромбоза в зоне уже имеющегося хронического тромба [3, 7].
Регионарный тромболизис малоэффективен при возникновении острого тромбоза в зоне уже имеющегося хронического тромба [3, 7].
Применение комбинированной техники (механической тромбэктомии с регионарным тромболизисом) при ТВВ позволяет нивелировать эти недостатки [1, 12]. За счет механического уменьшения количества тромботических масс удается добиться сокращения продолжительности процедуры и уменьшить вводимую дозу тромболитика, что приводит к снижению риска кровотечения. Однако механическая тромбэктомия сама может привести к развитию тромбоэмболии, кровотечения или к травме стенки сосуда [2].
В недавно опубликованном исследовании [6] у 14 больных с послеоперационным ТВВ применяли иной подход к лечению этого осложнения — выполняли либо баллонную ангиопластику, либо прямое стентирование, либо комбинацию баллонной ангиопластики со стентированием в зоне ТВВ без предварительного тромболизиса или тромбэктомии. Анализ отдаленных результатов выявил недостатки такого подхода.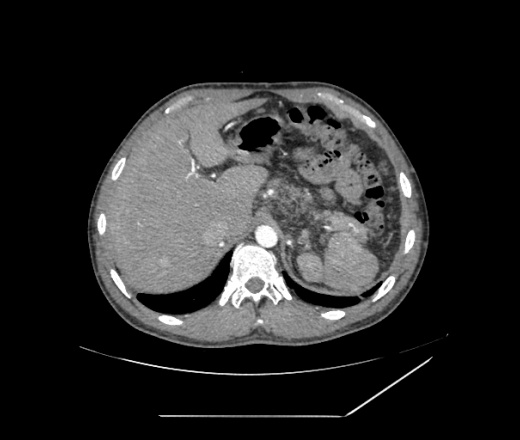 За период наблюдения (в среднем 16,3 мес) повторный ТВВ возник у 6 (43%) больных.
За период наблюдения (в среднем 16,3 мес) повторный ТВВ возник у 6 (43%) больных.
В 2000 г. M. Rosen и R. Sheiman описали удачный опыт применения нового устройства для реолитической тромбэктомии AngioJet в комбинации с регионарным тромболизисом при лечении тромбоза верхней брыжеечной вены [11]. В дальнейшем ряд авторов [8, 14] в единичных наблюдениях подтвердили безопасность и эффективность данной методики, однако во всех наблюдениях реолитическую тромбэктомию дополняли регионарным тромболизисом.
В нашем Центре была выполнена реолитическая тромбэктомия с использованием устройства AngioJet. Учитывая объем и ранние сроки после проведенного оперативного вмешательства (в 2 наблюдениях ТВВ развился в 1-е и в 1 — на 12-е сутки послеоперационного периода), риск кровотечения расценивали как крайне высокий, в связи с чем тромболитическую терапию не применяли.
Во всех 3 наших наблюдениях доступ к ветвям воротной вены осуществляли чрескожно чреспеченочно под контролем УЗИ. Кровотечение из места пункции печени, потребовавшее ушивания, отмечено в одном наблюдении (гемостаз осуществляли путем мануальной компрессии). В 2 других наблюдениях для закрытия пункционного канала использовали двухкомпонентный фибриновый клей Tissucol Kit (BaxterAG). Осложнений со стороны места пункции в этих наблюдениях отмечено не было.
Кровотечение из места пункции печени, потребовавшее ушивания, отмечено в одном наблюдении (гемостаз осуществляли путем мануальной компрессии). В 2 других наблюдениях для закрытия пункционного канала использовали двухкомпонентный фибриновый клей Tissucol Kit (BaxterAG). Осложнений со стороны места пункции в этих наблюдениях отмечено не было.
В клиническом наблюдении №2 после реолитической тромбэктомии ангиографический результат был расценен как удовлетворительный, поэтому от дальнейших вмешательств было решено отказаться. В наблюдениях №1 и 3 на контрольных портограммах был отмечен неудовлетворительный ангиографический результат (остаточный стеноз воротной вены более 70%). Выполнено стентирование участков воротной вены саморасширяющимися стентами. Баллонную ангиопластику в этих наблюдениях не производили из-за высокого риска разрыва воротной вены. Стентирование проходило без выраженных сложностей с применением стандартных техник и инструментария.
В отдаленном периоде наблюдения (максимальный срок 31 мес) рецидивов тромбоза не отмечено.
Таким образом, применение нескольких эндоваскулярных техник (реолитической тромбэктомии со стентированием и без него) при лечении больных с послеоперационным тромбозом воротной вены позволяет добиться удовлетворительного клинического результата.
Применение чрескожной чреспеченочной тромбэктомии является эффективным, малотравматичным и безопасным методом лечения при тромбозе воротной вены. Наш опыт применения эндоваскулярных техник у таких больных вносит вклад в небольшую коллекцию описанных наблюдений. Необходимо проводить дальнейшее исследование описанных методик для формирования значимой доказательной базы.
Публикации в СМИ
Тромбоз воротной вены — процесс образования тромба вплоть до полной окклюзии просвета сосуда, дренирующего русло органов ЖКТ. Частота. Точных статистических данных не существует. Известно, что тромбоз воротной вены поражает до 30% больных гепатоцеллюлярной карциномой и до 5% больных портальной гипертензией на фоне цирроза печени.
Патогенез. Возникновение заболевания, как и иных венозных тромбозов, может быть объяснено триадой Вирхова, включающей следующие элементы:
• Травма стенки вены во время хирургической операции.
• Снижение скорости потока крови воротной вены •• Сдавление сосуда извне опухолью, рубцами, эхинококковой кистой, альвеококком •• Хроническая сердечная недостаточность •• Констриктивный перикардит •• Синдроме Бадда–Киари (тромбоз печёночных вен).
• Повышение свёртываемости крови либо изменение соотношения её клеточных элементов •• В послеоперационном периоде, особенно у онкологических больных, а также после спленэктомии •• При воспалительных процессах ••• Гнойный пилефлебит (тромбофлебит воротной вены), наиболее часто возникающий как осложнение острого аппендицита. Реже пилефлебит возникает при гнойных холангите и лимфадените гепатодуоденальной связки либо язвенном колите ••• Панкреонекроз ••• Умбиликальная инфекция в неонатальном периоде (неонатальная септицемия, омфалит, инфицирование при катетеризации пупочной вены для обменного переливания крови) •• При осложнениях беременности (в частности, эклампсии) •• При некоторых гематологических заболеваниях, обусловливающих повышение свёртываемости крови (например, псевдосиндром Банти при висцеральном лейшманиозе).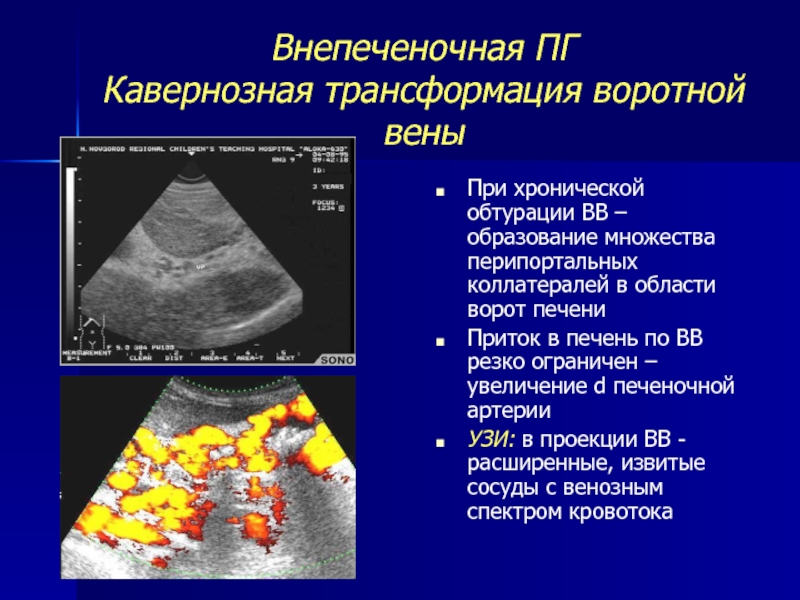
Клиническая картина зависит от локализации и протяжённости тромбоза воротной вены, быстроты его развития и природы предрасполагающего заболевания печени. Наиболее тяжёлое проявление заболевания — инфаркт печени либо атрофия её сегмента. Сочетание тромбоза воротной вены с тромбозом брыжеечных вен в большинстве случаев летально. Однако в одной трети случаев тромбоз формируется медленно, вследствие чего успевает развиться коллатеральный кровоток, а воротная вена со временем реканализируется (происходит кавернозная трансформация воротной вены). Тем не менее даже при относительно благоприятном течении развивается портальная гипертензия.
• Клинические проявления зависят от предрасполагающего заболевания.
• Тромбоз воротной вены проявляется кровотечением из варикозно расширенных вен пищевода. Кровотечение переносится относительно хорошо, т.к. у многих больных функции гепатоцитов сохранены.
• Характерно увеличение селезёнки, особенно у детей.
• Нарушения кровотока по брыжеечным венам обусловливают паралитическую непроходимость кишечника (боли в животе, вздутие его, отсутствие перистальтики). Итогом брыжеечного тромбоза могут стать инфаркт кишечника и последующий гнойный перитонит.
• При гнойном пилефлебите возникают признаки абсцессов печени (повторные потрясающие ознобы, болезненность при пальпации увеличенной печени, на поверхности которой прощупывают узлы — абсцессы).
• Асцит (для пилефлебита нехарактерен).
• Субиктеричность склер.
• Энцефалопатия и другие признаки печёночной недостаточности.
• Послеоперационный тромбоз воротной вены чаще всего возникает в период гиперкоагуляции (3–8 день).
Диагностика • Тромбоз воротной вены следует заподозрить в любом случае портальной гипертензии, сочетающейся с нормальными результатами биопсии печени • Коагулограмма: повышение содержания фибриногена, появление активированного фибриногена Б, увеличение ПТИ, уменьшение времени свёртывания крови • УЗИ: в просвете воротной вены можно выявить эхогенный тромб.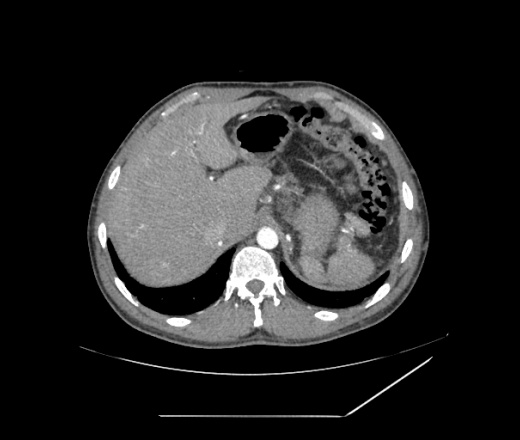 При цветном допплеровском картировании сигнал от кровотока либо отсутствует, либо он определяется пристеночно вокруг тромба, частично окклюзирующего вену, либо в сети узких коллатералей. Возможны кавернозные мальформации вены, спонтанные портокавальные и спленоренальные шунты. Могут быть найдены первопричины тромбоза вортной вены: гепатоцеллюлярная карцинома, метастазы, цирроз печени, новообразования пожделудочной железы и др. При пилефлебите обнаруживают абсцессы печени • КТ: обнаруживается тромб как дефект наполнения в просвете воротной вены, не усиливающий сигнала • При МРТ в просвете воротной вены выявляются участки патологического сигнала, не отличающегося по интенсивности от окружающих тканей на Т1-взвешенных изображениях и имеющие повышенную интенсивность на Т2-взвешенных изображениях • Ангиография (метод окончательного подтверждения диагноза). Из соображений безопасности чаще исследуется венозная фаза верхнебрыжеечной артериографии, реже выполняется спленопортография.
При цветном допплеровском картировании сигнал от кровотока либо отсутствует, либо он определяется пристеночно вокруг тромба, частично окклюзирующего вену, либо в сети узких коллатералей. Возможны кавернозные мальформации вены, спонтанные портокавальные и спленоренальные шунты. Могут быть найдены первопричины тромбоза вортной вены: гепатоцеллюлярная карцинома, метастазы, цирроз печени, новообразования пожделудочной железы и др. При пилефлебите обнаруживают абсцессы печени • КТ: обнаруживается тромб как дефект наполнения в просвете воротной вены, не усиливающий сигнала • При МРТ в просвете воротной вены выявляются участки патологического сигнала, не отличающегося по интенсивности от окружающих тканей на Т1-взвешенных изображениях и имеющие повышенную интенсивность на Т2-взвешенных изображениях • Ангиография (метод окончательного подтверждения диагноза). Из соображений безопасности чаще исследуется венозная фаза верхнебрыжеечной артериографии, реже выполняется спленопортография. В воротной вене выявляют дефект наполнения, либо она вообще не контрастируется.
В воротной вене выявляют дефект наполнения, либо она вообще не контрастируется.
ЛЕЧЕНИЕ
Лекарственная терапия
• Антикоагулянты •• Неотложная терапия: гепарин 40 000–60 000 ЕД в/в капельно в течение 4–6 ч, затем по 40 000 ЕД/сут (с 1-го по 8–10-й день) в/м. Дозу препарата подбирают по времени свёртывания крови, толерантности плазмы к гепарину и результатам тромбоэластографии •• Поддерживающая терапия: за 1–3 дня перед окончанием введения гепарина назначают антикоагулянты непрямого действия (фениндион, этил бискумацетат, аценокумарол), дозу подбирают индивидуально (снижение ПТИ до 40%). Например, дозы фениндиона: в 1-й день — 0,12–0,18 г/сут (в 3–4 приёма), во 2-й день — 0,09–0,06 г/сут, в последующие дни — 0,03–0,06 г/сут (в зависимости от ПТИ) •• Противопоказания к назначению антикоагулянтов ••• Абсолютные противопоказания: тяжёлое кровотечение, недавно (в течение 1 мес) перенесённые нейрохирургические операции, беременность, реакции непереносимости ••• Относительные противопоказания: недавно перенесённые тяжёлые кровотечения, хирургические операции (кроме нейрохирургических), язвенная болезнь в анамнезе или недавно перенесённый инсульт (не связанный с эмболией).
• Тромболитические препараты, например фибринолизин (20 000–40 000 ЕД с добавлением гепарина по 10 000 ЕД на каждые 20 тыс. ЕД фибринолизина) в/в в течение 3–4 ч, стрептокиназа, стрептодеказа.
• Реополиглюкин, реоглюман (в/в по 400–800 мл/сут в течение 3–5 дней).
• При пилефлебите — антибиотики широкого спектра, например имипенем+циластатин до 4 г/сут в/в в 3–4 приёма.
Хирургическое лечение
• Консервативные методы •• Применение зонда Сенгстакена–Блэйкмора. После введения зонда в желудок в манжеты нагнетают воздух, прижимая вены кардии и нижней трети пищевода. Во избежание пролежней баллоны каждые 5–6 ч освобождают от воздуха на 5–10 мин. Общая продолжительность применения зонда не должна превышать 48 ч •• Инъекционная склерозирующая терапия: во время эзофагоскопии в варикозно расширенные вены пищевода вводят склерозирующий препарат децилат (тромбовар), приводящий к их тромбозу.
• Оперативное лечение применяют при безуспешности консервативного •• При сохранении проходимости селезёночной вены операция выбора — наложение спленоренального анастомоза •• В противном случае создают мезентерико-кавальный анастомоз при помощи сосудистого протеза большого диаметра (16–18 мм) между верхней брыжеечной и нижней полой венами •• При продолжающемся пищеводном кровотечении может быть выполнено прошивание варикозных вен пищевода, например операция Таннера (поперечное пересечение желудка в кардиальном отделе с последующим сшиванием его стенок «конец в конец») •• При пилефлебите — вскрытие и дренирование абсцессов печени.
Осложнения • ОПН • Инфаркт кишечника • Подпечёночный или поддиафрагмальный абсцесс • Разлитой гнойный перитонит • Массивное кровотечение.
МКБ-10 • I81 Тромбоз портальной вены
Современное лечение тромбоза воротной вены — Современные методы диагностики и лечения заболеваний — Каталог статей
ТРОМБОЗ ВОРОТНОЙ ВЕНЫ
Тромбоз воротной вены (пилетромбоз) — редкое заболевание, идиопатический вариант встречается в 13—61% всех тромбозов воротной вены.
Этиология. Определенную роль могут играть прием контрацептивов, сдавление воротной вены извне опухолями, кистами; воспалительные изменения стенки воротной вены (при язвенной болезни, аппендиците, травмах брюшной стенки, живота).
Наблюдается при циррозе печени, интраабломинальном сепсисе, компрессии вены опухолью, при панкреатите и других воспалительных процессах в брюшной полости, как послеоперационное осложнение, при травмах, дегидратации, нарушении коагуляции.
Патогенез. Тромбоз воротной вены — это обычный тромбоз, который приводит к расширению вен на участках, расположенных перед местом образования тромба.
Возможно сращение тромба со стенкой, его организация и реканализация. При хроническом нарушении портального кровотока раскрываются шунты и формируются анастомозы между селезеночной и верхней брыжеечной венами, с одной стороны, и печенью — с другой.
Если тромбоз воротной вены формируется не на фоне цирроза, то изменений в печени может не быть.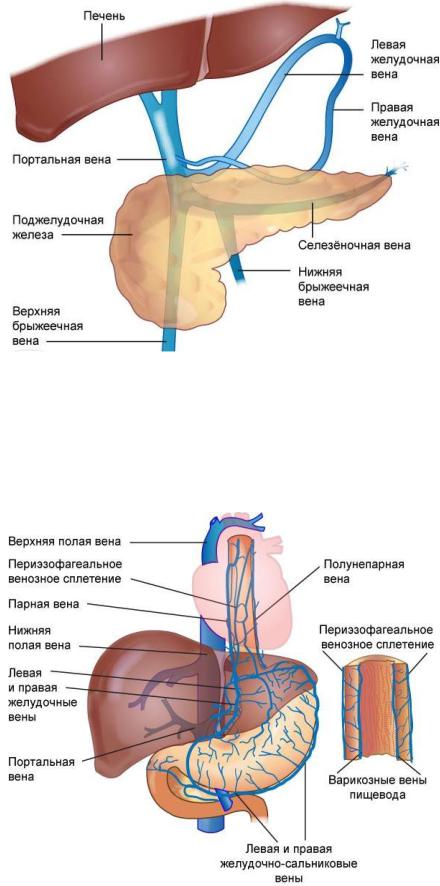
Возможны тромбоэмболии вен печени, а также распространение тромбоза на ветви воротной вены с развитием геморрагических инфарктов селезенки, кишечника. Клиническая картина.
Рассматривают варианты острого и хронического тромбоза воротной вены. Острый тромбоз характеризуется возникновением сильных болей в животе, поносом, кровавой рвотой и прогрессирующим падением АД, вплоть до коллапса.
Довольно быстро может сформироваться абсцесс печени, в асцитической жидкости могут быть эритроциты.
Если нет цирроза, то печень не изменена и, как правило, желтуха не развивается.
Довольно быстро присоединяются боли в левом подреберье, развивается инфаркт кишечника.
При хроническом тромбозе возможно возникновение портальной гипертензии, спленомегалии, варикоза вен пищевода, гиперспленизма, абсцесса печени, кровотечений.
Отличительной чертой портальной гипертензии в связи с тромбозом воротной вены является отсутствие изменений в самой печени, длительное сохранение нормальных показателей всех ее функциональных проб, т.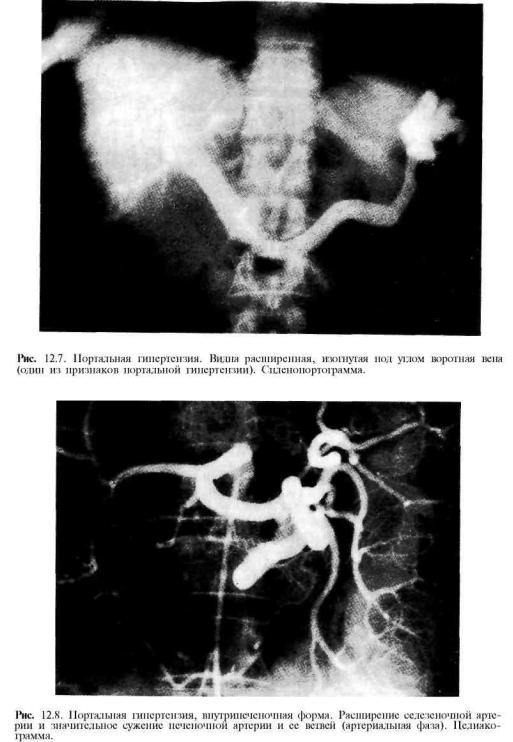 е. своеобразной интактной печени на фоне портальной гипертензии.
е. своеобразной интактной печени на фоне портальной гипертензии.
Такое сочетание говорит в пользу хронического тромбоза воротной вены.
Осложнения. На начальных этапах возможны желудочно-кишечные кровотечения.
Позже они становятся упорными, бывают случаи разрывов селезенки.
Далее нарастают инфаркты кишечника.
Может развиться печеночная кома.
Диагностика. Показательно неадекватно быстрое для имеющегося заболевания возникновение и развитие портальной гипертензии.
При остром и подостром тромбозе диаметр вены может быть увеличен более 13 мм.
При хроническом тромбозе он может быть нормальным, меньше и не определяться.
Характерно увеличение эхогенности просвета как результат фиброза, локация фрагментов кровотока при неокклюзирующем тромбозе, наличие перипортальных коллатералей при хроническом портальном тромбозе. Достоверным диагностическим методом является ангиография.
Используется также лапароскопия.
Лечение. Основной метод — назначение фибринолитиков и антикоагулянтов.
Например, сочетание 30 тыс. ЕД фибринолизина или 15 млн ЕД стрептокиназы с 15 тыс. ЕД гепарина ежедневно в течение 3 дней.
Широко применяется также хирургическое лечение: тромбэктомия и восстановление портального кровотока.
Лечение синдрома портальной гипертензии
- Главная
- Эндоваскулярная хирургия
- Эндоваскулярная хирургия в лечении синдрома портальной гипертензии
Что такое портальная гипертензия рассказывает врач-рентгеноваскулярный хирург, профессор, доктор медицинских наук, лауреат Премии Правительства Российской Федерации, Сергей Анатольевич Капранов.
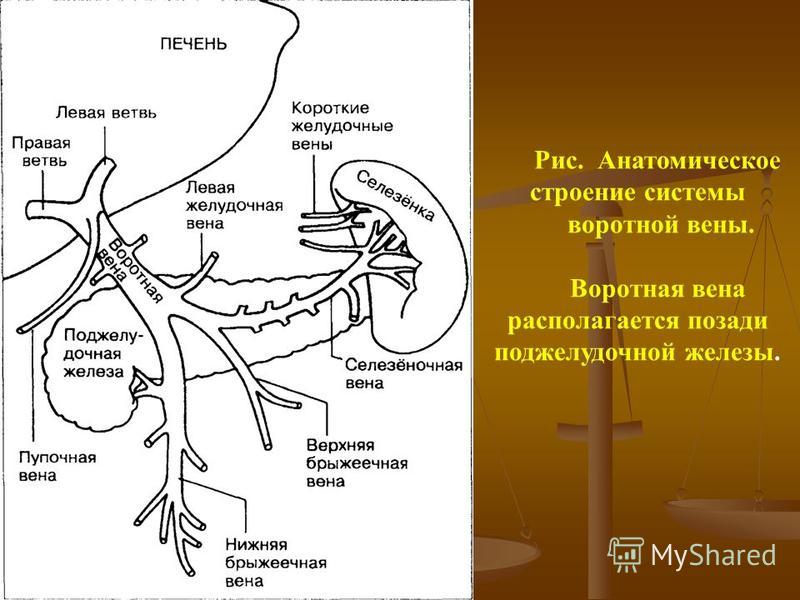
Синдром портальной гипертензии – это характерный симптомокомплекс, возникающий при повышении давления в системе воротной вены. Самым грозным проявлением портальной гипертензии является острое кровотечение из варикозно-расширенных вен пищевода и желудка. Кроме того, у таких больных нередко развивается асцит, возникает печеночная недостаточность.
Воротная вена и ее притоки обеспечивают отток крови от органов брюшной полости. В отличие от всех других вен, она не впадает напрямую в венозную систему большого круга кровообращения. Воротная вена впадает в печень, где разделяется на множество ветвей, которые заканчиваются синусоидными капиллярами печени. Оттуда уже по печеночным венам происходит отток в нижнюю полую вену. Любые препятствия на этом пути приводят к развитию синдрома портальной гипертензии. При этом кровь начинает оттекать по коллатеральным (обходным) путям. Существует множество путей коллатерального оттока (см. рисунок), но наибольшее клиническое значение имеет коллатеральный отток по венам пищевода и желудка. Этот компенсаторный механизм, к сожалению, может стать причиной грозных осложнений. Не приспособленные для больших объемов кровотока вены пищевода и желудка варикозно расширяются, их стенка истончается, и в конечном итоге они становятся источником тяжелых и опасных для жизни кровотечений.
В зависимости от уровня нарушения кровотока выделяют подпеченочный блок кровотока, внутрипеченочный и надпеченочный. Подпеченочным блоком называют нарушение кровотока в воротной вене до ее впадения в ворота печени. Причиной такого блока может являться тромбоз или стеноз воротной вены, ее сдавление опухолью, кавернозная трансформация воротной вены.
Подпеченочным блоком называют нарушение кровотока в воротной вене до ее впадения в ворота печени. Причиной такого блока может являться тромбоз или стеноз воротной вены, ее сдавление опухолью, кавернозная трансформация воротной вены.
Внутрипеченочный блок развивается как правило при циррозе печени. При этом происходит сдавление мелких синусоидных капилляров паренхимы печени,что значительно увеличивает периферическое сосудистое сопротивление. Надпеченочный блок возникает при нарушении венозного оттока из печени. Как правило, его причиной является болезнь Бадда-Киари – стенозы печеночных вен или синдром Бадда-Киари – сдавление нижней полой вены на уровне впадения печеночных вен.
Лечение синдрома портальной гипертензии направлено как на устранение самой причины заболевания, так и на уменьшение риска желудочно-кишечного кровотечения.
Необходимо подчеркнуть, что в комплексном лечении синдрома портальной гипертензии огромная роль принадлежит традиционной полостной хирургии и эндоскопическим методикам. Мы же остановимся только на эндоваскулярных методах лечения, которые в последние годы находят все более широкое применение в лечении больных с портальной гипертензией.
Мы же остановимся только на эндоваскулярных методах лечения, которые в последние годы находят все более широкое применение в лечении больных с портальной гипертензией.
К ним относятся:
Эндоваскулярная эмболизация варикозных вен пищевода и желудка
TIPS – эндоваскулярное наложение внутрипеченочного порто-кавального шунта
Эндоваскулярная редукция селезеночного/печеночного кровотока (парциальная эмболизация селезеночной/печеночной артерии)
Эндопротезирование печеночных и нижней полой вен
Эндоваскулярная эмболизация варикозных вен пищевода и желудка
Это вмешательство выполняют при кровотечении из варикозно-расширенных вен пищевода и желудка или при угрозе его возникновения. Через небольшой прокол на коже в воротную вену проводят тонкий катетер и устанавливают его в варикозно-расширенных венах. Через катетер вводят эмболизационные спирали, которые полностью закрывают варикозно-расширенные сосуды. Эффективность эмболизации достаточно высока. Практически у всех больных прекращается кровотечение и резко снижается риск его рецидива.
Практически у всех больных прекращается кровотечение и резко снижается риск его рецидива.
TIPS (transjugular intrahepatic portosystemic stent-shunting) – эндоваскулярное наложение внутрипеченочного порто-кавального шунта TIPS – это искусственное внутрипеченочное соустье между воротной и печеночной веной. ТИПС создает прямой сброс крови по относительно безопасному пути, обеспечивая декомпрессию системы воротной вены. Это довольно сложное в техническом отношении вмешательство, которое доступно только опытным эндоваскулярным хирургам. Для выполнения ТИПС производится прокол ткани печени из печеночной вены в воротную. В образовавшееся соустье устанавливают металлический каркас – стент, который не позволяет шунту закрыться.
Эндоваскулярная редукция селезеночного/печеночного кровотока (парциальная эмболизация селезеночной/печеночной артерии) Одним из способов уменьшения степени выраженности портальной гипертензии является снижение артериального притока путем редукции селезеночного кровотока.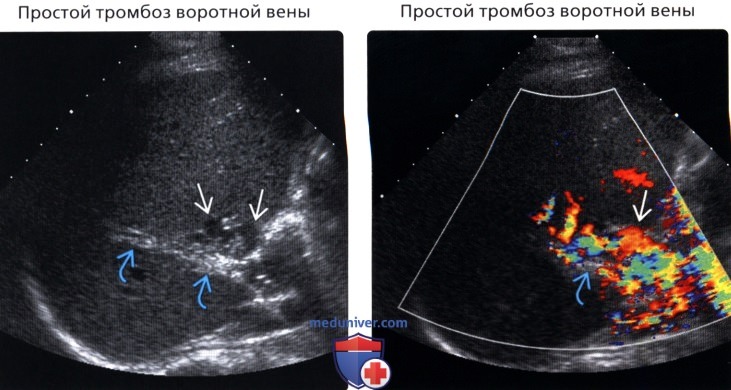 Для этого чрескожным доступом (пункция бедренной артерии) в селезеночную артерию вводят спирали, которые не перекрывают ее просвет полностью, а лишь уменьшают объем кровотока. Таким образом, уменьшается приток, а следовательно и отток крови от селезенки в воротную вену. Функция селезенки при этом не страдает.
Для этого чрескожным доступом (пункция бедренной артерии) в селезеночную артерию вводят спирали, которые не перекрывают ее просвет полностью, а лишь уменьшают объем кровотока. Таким образом, уменьшается приток, а следовательно и отток крови от селезенки в воротную вену. Функция селезенки при этом не страдает.
Эндопротезирование печеночных и нижней полой вен Если причиной портальной гипертензии является болезнь или синдром Бадда-Киари, возможно выполнение эндопротезирования воротной или нижней полой вен. Для этого в суженные или закупоренные вены устанавливаются стенты, восстанавливающие их просвет. Важно отметить, что при этом устраняется сама первопричина портальной гипертензии, а также ее вторичные симптомы.
В значительном количестве случаев возможно применение комбинаций различных эндоваскулярных методик. Кроме того, зачастую эндоваскулярные методы применяются в сочетании с методами традиционной полостной хирургии, эндоскопии.
Вы можете получить первую консультацию по телефону +7 (495) 021-82-99 или отправить нам сообщение с медицинской информацией, имеющей отношение к вашей проблеме.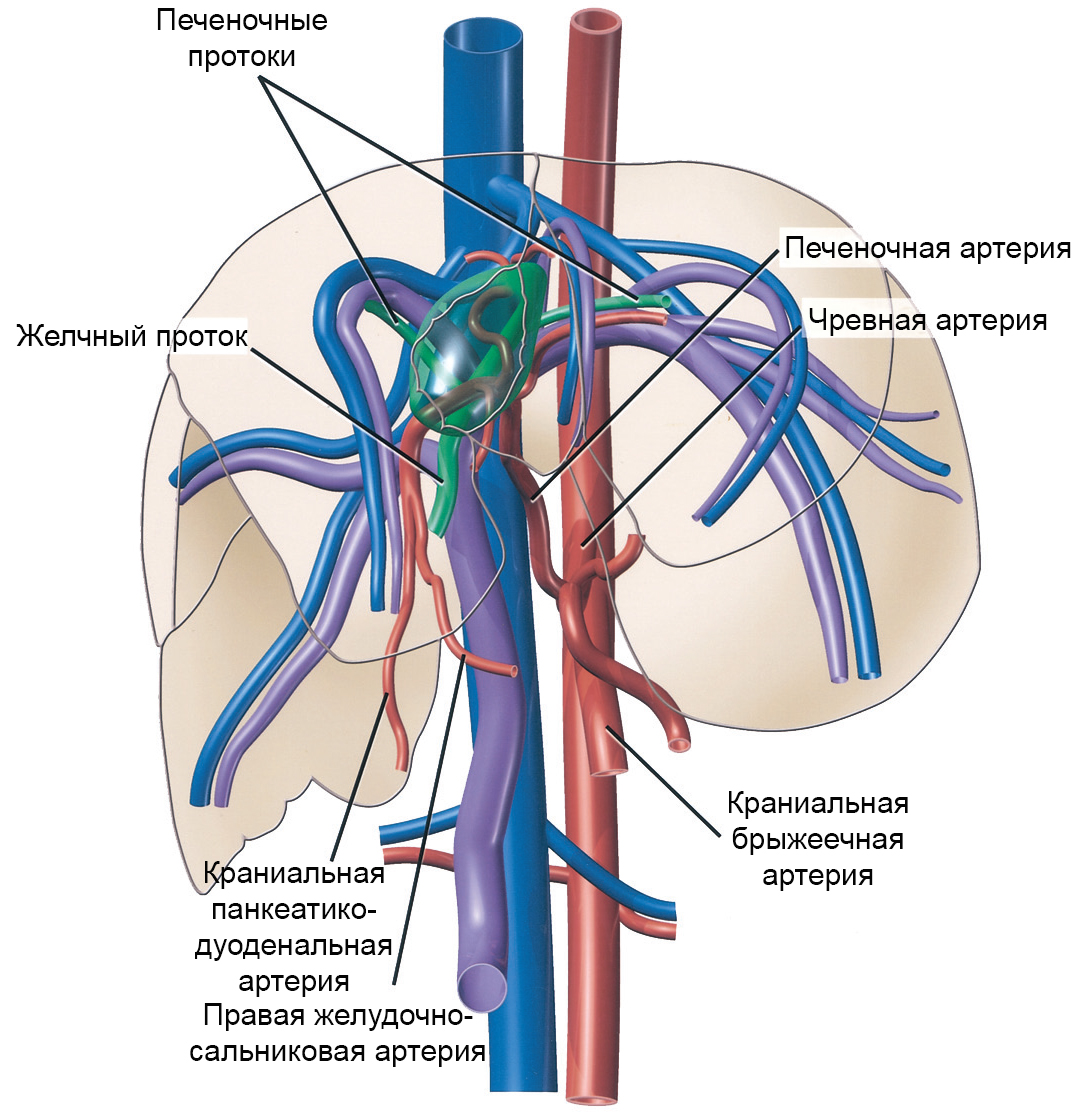
Что такое тромбоз воротной вены?
Тромбоз воротной вены является редким состоянием, при котором кровоток из органов брюшной полости в печень либо затрудняется, либо полностью блокируется сгустком крови. Это один из типов венозного тромбоза, который представляет собой наличие неподвижного сгустка крови в вене. Тромбоз воротной вены поражает печеночную воротную вену, которая технически является не веной, а сосудом, потому что она не несет кровь непосредственно к сердцу. Это может быть найдено в животе.
Некоторые из типичных причин тромбоза воротной вены включают цирроз, панкреатит и дивертикулит. Рак желчных протоков, или холангиокарцинома, также может привести к состоянию. Это также может быть осложнением процедуры, называемой спленэктомией, при которой удаляется часть или вся селезенка.
В некоторых случаях тромбоз воротной вены можно лечить с помощью лекарств. Разжижители крови иногда будет достаточно для лечения этого заболевания. Антикоагулянтные препараты также можно использовать для предотвращения образования будущих сгустков крови, хотя этот вид лечения обычно эффективен только для пациентов с острой формой заболевания.
Антикоагулянтные препараты также можно использовать для предотвращения образования будущих сгустков крови, хотя этот вид лечения обычно эффективен только для пациентов с острой формой заболевания.
Может быть необходимо лечить тромбоз воротной вены хирургическим путем. Шунтирование, процесс, при котором здоровые кровеносные сосуды из другой части тела пересаживаются на сосуд для перемещения крови вокруг сгустка, может использоваться для лечения этого заболевания. Если у пациента нет адекватных сосудов для шунтирования, может потребоваться пересадка. В других случаях введение небольшой трубки, известной как шунт, может помочь освободить кровоток.
Симптомы тромбоза воротной вены зависят от способа и скорости образования тромба в сосуде. Существует два основных типа тромбоза воротной вены: более распространенный хронический вариант и редкий и трудно диагностируемый острый тромбоз. У каждого типа есть свои симптомы.
Если состояние хроническое, симптомы обычно легко обнаружить. Они могут включать кровавую рвоту, потерю веса и тошноту. У некоторых пациентов также возникают боли в животе.
Они могут включать кровавую рвоту, потерю веса и тошноту. У некоторых пациентов также возникают боли в животе.
Острый тромбоз воротной вены обнаружить с помощью симптомов сложнее, поскольку они часто бывают легкими и не наносят чрезмерного вреда пациенту. Как с хроническим типом условия, у пациента может быть тошнота или кровавая рвота, хотя это не так вероятно. Там может быть скопление жидкости в области живота. У некоторых пациентов также повышается температура.
ДРУГИЕ ЯЗЫКИ
Тромбоз воротной вены (PVT): симптомы, причины и лечение
Что такое тромбоз воротной вены (PVT)?
Тромбоз воротной вены (ПВТ) — это тромб в воротной вене, также известный как воротная вена печени. Эта вена позволяет крови течь из кишечника в печень. PVT блокирует этот кровоток. Хотя PVT поддается лечению, это может быть опасно для жизни.
Сгустки крови чаще образуются, когда кровь течет в организме неравномерно. Хотя врачи обычно не знают, что вызывает тромбоз воротной вены, существует ряд факторов риска развития этого состояния.
Некоторые из наиболее распространенных включают:
К другим факторам риска, которые могут способствовать развитию PVT, относятся беременность и хирургическое вмешательство. В обоих случаях кровь более склонна к свертыванию, ограничивая приток крови к другим конечностям. В более тяжелых случаях эти факторы могут вызвать опасные для жизни осложнения.
Во многих случаях PVT вы можете проявлять незначительные симптомы или вообще не проявлять их. Некоторые из наиболее распространенных симптомов менее тяжелого сгустка:
Если у вас более тяжелый случай тромбоза воротной вены, у вас может развиться портальная гипертензия или высокое кровяное давление в воротной вене.Это состояние вызывает спленомегалию или увеличение селезенки из-за давления, мешающего нормальному кровотоку. По мере увеличения селезенки количество лейкоцитов резко снижается, что увеличивает риск заражения. Портальная гипертензия также может вызывать варикозное расширение вен (аномально увеличенные кровеносные сосуды) пищевода или желудка, которые могут стать склонными к кровотечению.
Другие серьезные симптомы тромбоза воротной вены включают:
Симптомы PVT уникальны, и врачи часто могут определить, что у вас тромб в воротной вене, если у вас есть комбинация следующих симптомов:
- увеличенная селезенка
- варикозное кровотечение
- рвота кровью
- инфекции печени
Существует также ряд тестов, которые помогут определить размер и опасность тромбоза воротной вены.
1. Допплерография
Это неинвазивный тест, отражающий звуковые волны от нормально функционирующих эритроцитов. В то время как обычный ультразвук использует звуковые волны для создания изображений, они не могут показать кровоток. С другой стороны, ультразвуковая допплерография может использовать визуализацию для отображения кровообращения в сосудах. Это можно использовать для диагностики тромбоза воротной вены и определения степени его тяжести.
2. КТ-сканирование
Компьютерная томография или компьютерная томография используют рентгеновское изображение и обработку для получения изображений костей и кровеносных сосудов. Чтобы идентифицировать тромбы, врачи вводят краситель в вены, которые будут отображаться на КТ.
Чтобы идентифицировать тромбы, врачи вводят краситель в вены, которые будут отображаться на КТ.
3. МРТ брюшной полости
Магнитно-резонансная томография (МРТ) использует радиоволны и магниты для идентификации:
Этот тест также может помочь идентифицировать опухоли, похожие на другие ткани тела. МРТ обычно используется для уточнения результатов других визуализационных тестов, таких как компьютерная томография.
4. Ангиография
Эта более инвазивная процедура представляет собой рентгеновский тест, используемый для получения изображений кровотока в артерии или вене.Ваш врач введет специальный краситель прямо в вену и проведет визуализационный тест, называемый рентгеноскопией, чтобы посмотреть на кровообращение в пораженном органе и определить тромбы.
Лечение во многом зависит от первоначальной причины образования тромба. Рекомендации по лечению тромбоза воротной вены будут сосредоточены на растворении сгустка крови или предотвращении роста в течение длительного периода времени.
Лекарства
При острой PVT врачи обычно рекомендуют лекарства в качестве тромболитического лечения.Эти отпускаемые по рецепту лекарства могут растворять тромбы. Для постепенного роста сгустка пациентам могут быть назначены антикоагулянты — разжижители крови, такие как гепарин, — чтобы предотвратить повторное образование сгустков и любой избыточный рост.
Если у вас более серьезный случай PVT, который вызывает кровотечение из пищевода, ваши врачи могут также порекомендовать прием бета-адреноблокаторов. Это помогает снизить давление в воротной вене и снизить риск чрезмерного кровотечения.
Еще одно лекарство, которое может порекомендовать врач, — это оцетротид.Этот препарат помогает уменьшить приток крови к печени и снижает давление в брюшной полости. Чтобы остановить кровотечение, это лекарство можно вводить непосредственно в вены.
Если у вас развился тромбоз воротной вены в результате инфекции, особенно у младенцев, врачи могут прописать антибиотики для лечения источника. В результате исчезнут и симптомы ПВТ.
В результате исчезнут и симптомы ПВТ.
Бандаж
В некоторых тяжелых случаях PVT может вызвать кровотечение из варикозно расширенных вен пищевода или желудка.Чтобы остановить кровотечение, через рот в пищевод вводят резинки, чтобы перевязать варикозное расширение вен.
Хирургия
Хирургические варианты могут быть рекомендованы в зависимости от серьезности повреждения PVT. В крайнем случае врач может порекомендовать шунтирующую операцию. Эта процедура включает установку трубки между воротной веной и печеночной веной в печени, чтобы предотвратить чрезмерное кровотечение и снизить давление в венах.
В некоторых случаях серьезного поражения печени вашему врачу может потребоваться трансплантация печени.
Тромбоз воротной вены — серьезное заболевание. При раннем выявлении PVT можно вылечить с помощью неинвазивных процедур и лечения. Если вы начали испытывать нерегулярные симптомы или дискомфорт, немедленно обратитесь к врачу.
Тромбоз воротной вены (PVT): симптомы, причины и лечение
Что такое тромбоз воротной вены (PVT)?
Тромбоз воротной вены (ПВТ) — это тромб в воротной вене, также известный как воротная вена печени. Эта вена позволяет крови течь из кишечника в печень.PVT блокирует этот кровоток. Хотя PVT поддается лечению, это может быть опасно для жизни.
Эта вена позволяет крови течь из кишечника в печень.PVT блокирует этот кровоток. Хотя PVT поддается лечению, это может быть опасно для жизни.
Сгустки крови чаще образуются, когда кровь течет в организме неравномерно. Хотя врачи обычно не знают, что вызывает тромбоз воротной вены, существует ряд факторов риска развития этого состояния.
Некоторые из наиболее распространенных включают:
К другим факторам риска, которые могут способствовать развитию PVT, относятся беременность и хирургическое вмешательство. В обоих случаях кровь более склонна к свертыванию, ограничивая приток крови к другим конечностям.В более тяжелых случаях эти факторы могут вызвать опасные для жизни осложнения.
Во многих случаях PVT вы можете проявлять незначительные симптомы или вообще не проявлять их. Некоторые из наиболее распространенных симптомов менее тяжелого сгустка:
Если у вас более тяжелый случай тромбоза воротной вены, у вас может развиться портальная гипертензия или высокое кровяное давление в воротной вене.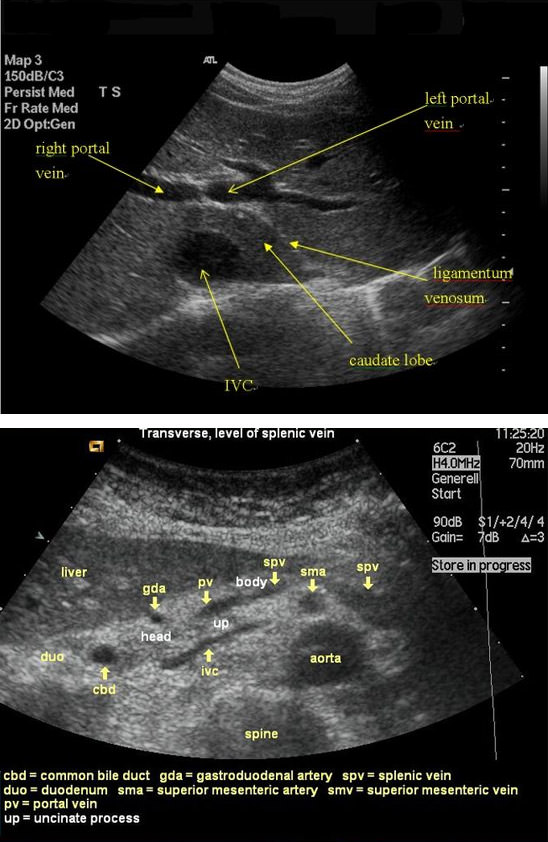 Это состояние вызывает спленомегалию или увеличение селезенки из-за давления, мешающего нормальному кровотоку. По мере увеличения селезенки количество лейкоцитов резко снижается, что увеличивает риск заражения.Портальная гипертензия также может вызывать варикозное расширение вен (аномально увеличенные кровеносные сосуды) пищевода или желудка, которые могут стать склонными к кровотечению.
Это состояние вызывает спленомегалию или увеличение селезенки из-за давления, мешающего нормальному кровотоку. По мере увеличения селезенки количество лейкоцитов резко снижается, что увеличивает риск заражения.Портальная гипертензия также может вызывать варикозное расширение вен (аномально увеличенные кровеносные сосуды) пищевода или желудка, которые могут стать склонными к кровотечению.
Другие серьезные симптомы тромбоза воротной вены включают:
Симптомы PVT уникальны, и врачи часто могут определить, что у вас тромб в воротной вене, если у вас есть комбинация следующих симптомов:
- увеличенная селезенка
- варикозное кровотечение
- рвота кровью
- инфекции печени
Существует также ряд тестов, которые помогут определить размер и опасность тромбоза воротной вены.
1. Допплерография
Это неинвазивный тест, отражающий звуковые волны от нормально функционирующих эритроцитов. В то время как обычный ультразвук использует звуковые волны для создания изображений, они не могут показать кровоток. С другой стороны, ультразвуковая допплерография может использовать визуализацию для отображения кровообращения в сосудах. Это можно использовать для диагностики тромбоза воротной вены и определения степени его тяжести.
С другой стороны, ультразвуковая допплерография может использовать визуализацию для отображения кровообращения в сосудах. Это можно использовать для диагностики тромбоза воротной вены и определения степени его тяжести.
2. КТ-сканирование
Компьютерная томография или компьютерная томография используют рентгеновское изображение и обработку для получения изображений костей и кровеносных сосудов.Чтобы идентифицировать тромбы, врачи вводят краситель в вены, которые будут отображаться на КТ.
3. МРТ брюшной полости
Магнитно-резонансная томография (МРТ) использует радиоволны и магниты для идентификации:
Этот тест также может помочь идентифицировать опухоли, похожие на другие ткани тела. МРТ обычно используется для уточнения результатов других визуализационных тестов, таких как компьютерная томография.
4. Ангиография
Эта более инвазивная процедура представляет собой рентгеновский тест, используемый для получения изображений кровотока в артерии или вене.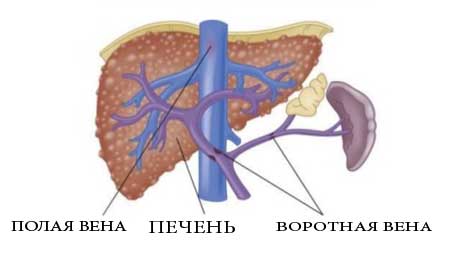 Ваш врач введет специальный краситель прямо в вену и проведет визуализационный тест, называемый рентгеноскопией, чтобы посмотреть на кровообращение в пораженном органе и определить тромбы.
Ваш врач введет специальный краситель прямо в вену и проведет визуализационный тест, называемый рентгеноскопией, чтобы посмотреть на кровообращение в пораженном органе и определить тромбы.
Лечение во многом зависит от первоначальной причины образования тромба. Рекомендации по лечению тромбоза воротной вены будут сосредоточены на растворении сгустка крови или предотвращении роста в течение длительного периода времени.
Лекарства
При острой PVT врачи обычно рекомендуют лекарства в качестве тромболитического лечения.Эти отпускаемые по рецепту лекарства могут растворять тромбы. Для постепенного роста сгустка пациентам могут быть назначены антикоагулянты — разжижители крови, такие как гепарин, — чтобы предотвратить повторное образование сгустков и любой избыточный рост.
Если у вас более серьезный случай PVT, который вызывает кровотечение из пищевода, ваши врачи могут также порекомендовать прием бета-адреноблокаторов. Это помогает снизить давление в воротной вене и снизить риск чрезмерного кровотечения.
Еще одно лекарство, которое может порекомендовать врач, — это оцетротид.Этот препарат помогает уменьшить приток крови к печени и снижает давление в брюшной полости. Чтобы остановить кровотечение, это лекарство можно вводить непосредственно в вены.
Если у вас развился тромбоз воротной вены в результате инфекции, особенно у младенцев, врачи могут прописать антибиотики для лечения источника. В результате исчезнут и симптомы ПВТ.
Бандаж
В некоторых тяжелых случаях PVT может вызвать кровотечение из варикозно расширенных вен пищевода или желудка.Чтобы остановить кровотечение, через рот в пищевод вводят резинки, чтобы перевязать варикозное расширение вен.
Хирургия
Хирургические варианты могут быть рекомендованы в зависимости от серьезности повреждения PVT. В крайнем случае врач может порекомендовать шунтирующую операцию. Эта процедура включает установку трубки между воротной веной и печеночной веной в печени, чтобы предотвратить чрезмерное кровотечение и снизить давление в венах.
В некоторых случаях серьезного поражения печени вашему врачу может потребоваться трансплантация печени.
Тромбоз воротной вены — серьезное заболевание. При раннем выявлении PVT можно вылечить с помощью неинвазивных процедур и лечения. Если вы начали испытывать нерегулярные симптомы или дискомфорт, немедленно обратитесь к врачу.
Тромбоз воротной вены (PVT): симптомы, причины и лечение
Что такое тромбоз воротной вены (PVT)?
Тромбоз воротной вены (ПВТ) — это тромб в воротной вене, также известный как воротная вена печени. Эта вена позволяет крови течь из кишечника в печень.PVT блокирует этот кровоток. Хотя PVT поддается лечению, это может быть опасно для жизни.
Сгустки крови чаще образуются, когда кровь течет в организме неравномерно. Хотя врачи обычно не знают, что вызывает тромбоз воротной вены, существует ряд факторов риска развития этого состояния.
Некоторые из наиболее распространенных включают:
К другим факторам риска, которые могут способствовать развитию PVT, относятся беременность и хирургическое вмешательство. В обоих случаях кровь более склонна к свертыванию, ограничивая приток крови к другим конечностям.В более тяжелых случаях эти факторы могут вызвать опасные для жизни осложнения.
В обоих случаях кровь более склонна к свертыванию, ограничивая приток крови к другим конечностям.В более тяжелых случаях эти факторы могут вызвать опасные для жизни осложнения.
Во многих случаях PVT вы можете проявлять незначительные симптомы или вообще не проявлять их. Некоторые из наиболее распространенных симптомов менее тяжелого сгустка:
Если у вас более тяжелый случай тромбоза воротной вены, у вас может развиться портальная гипертензия или высокое кровяное давление в воротной вене. Это состояние вызывает спленомегалию или увеличение селезенки из-за давления, мешающего нормальному кровотоку. По мере увеличения селезенки количество лейкоцитов резко снижается, что увеличивает риск заражения.Портальная гипертензия также может вызывать варикозное расширение вен (аномально увеличенные кровеносные сосуды) пищевода или желудка, которые могут стать склонными к кровотечению.
Другие серьезные симптомы тромбоза воротной вены включают:
Симптомы PVT уникальны, и врачи часто могут определить, что у вас тромб в воротной вене, если у вас есть комбинация следующих симптомов:
- увеличенная селезенка
- варикозное кровотечение
- рвота кровью
- инфекции печени
Существует также ряд тестов, которые помогут определить размер и опасность тромбоза воротной вены.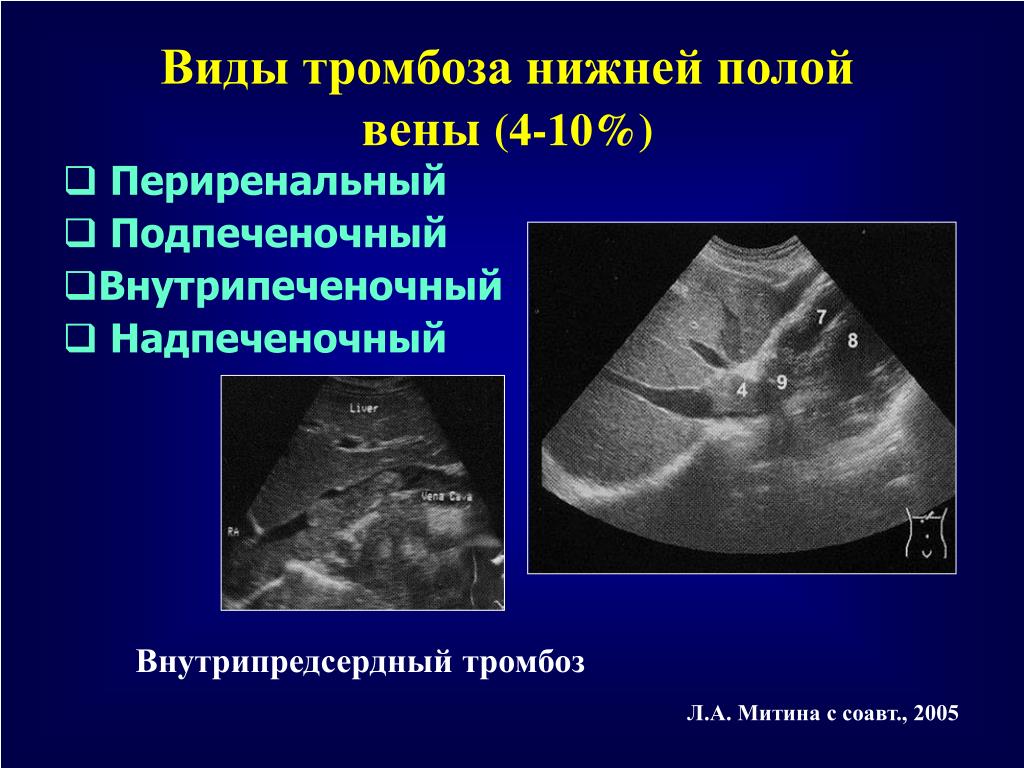
1. Допплерография
Это неинвазивный тест, отражающий звуковые волны от нормально функционирующих эритроцитов. В то время как обычный ультразвук использует звуковые волны для создания изображений, они не могут показать кровоток. С другой стороны, ультразвуковая допплерография может использовать визуализацию для отображения кровообращения в сосудах. Это можно использовать для диагностики тромбоза воротной вены и определения степени его тяжести.
2. КТ-сканирование
Компьютерная томография или компьютерная томография используют рентгеновское изображение и обработку для получения изображений костей и кровеносных сосудов.Чтобы идентифицировать тромбы, врачи вводят краситель в вены, которые будут отображаться на КТ.
3. МРТ брюшной полости
Магнитно-резонансная томография (МРТ) использует радиоволны и магниты для идентификации:
Этот тест также может помочь идентифицировать опухоли, похожие на другие ткани тела. МРТ обычно используется для уточнения результатов других визуализационных тестов, таких как компьютерная томография.
4. Ангиография
Эта более инвазивная процедура представляет собой рентгеновский тест, используемый для получения изображений кровотока в артерии или вене.Ваш врач введет специальный краситель прямо в вену и проведет визуализационный тест, называемый рентгеноскопией, чтобы посмотреть на кровообращение в пораженном органе и определить тромбы.
Лечение во многом зависит от первоначальной причины образования тромба. Рекомендации по лечению тромбоза воротной вены будут сосредоточены на растворении сгустка крови или предотвращении роста в течение длительного периода времени.
Лекарства
При острой PVT врачи обычно рекомендуют лекарства в качестве тромболитического лечения.Эти отпускаемые по рецепту лекарства могут растворять тромбы. Для постепенного роста сгустка пациентам могут быть назначены антикоагулянты — разжижители крови, такие как гепарин, — чтобы предотвратить повторное образование сгустков и любой избыточный рост.
Если у вас более серьезный случай PVT, который вызывает кровотечение из пищевода, ваши врачи могут также порекомендовать прием бета-адреноблокаторов. Это помогает снизить давление в воротной вене и снизить риск чрезмерного кровотечения.
Это помогает снизить давление в воротной вене и снизить риск чрезмерного кровотечения.
Еще одно лекарство, которое может порекомендовать врач, — это оцетротид.Этот препарат помогает уменьшить приток крови к печени и снижает давление в брюшной полости. Чтобы остановить кровотечение, это лекарство можно вводить непосредственно в вены.
Если у вас развился тромбоз воротной вены в результате инфекции, особенно у младенцев, врачи могут прописать антибиотики для лечения источника. В результате исчезнут и симптомы ПВТ.
Бандаж
В некоторых тяжелых случаях PVT может вызвать кровотечение из варикозно расширенных вен пищевода или желудка.Чтобы остановить кровотечение, через рот в пищевод вводят резинки, чтобы перевязать варикозное расширение вен.
Хирургия
Хирургические варианты могут быть рекомендованы в зависимости от серьезности повреждения PVT. В крайнем случае врач может порекомендовать шунтирующую операцию. Эта процедура включает установку трубки между воротной веной и печеночной веной в печени, чтобы предотвратить чрезмерное кровотечение и снизить давление в венах.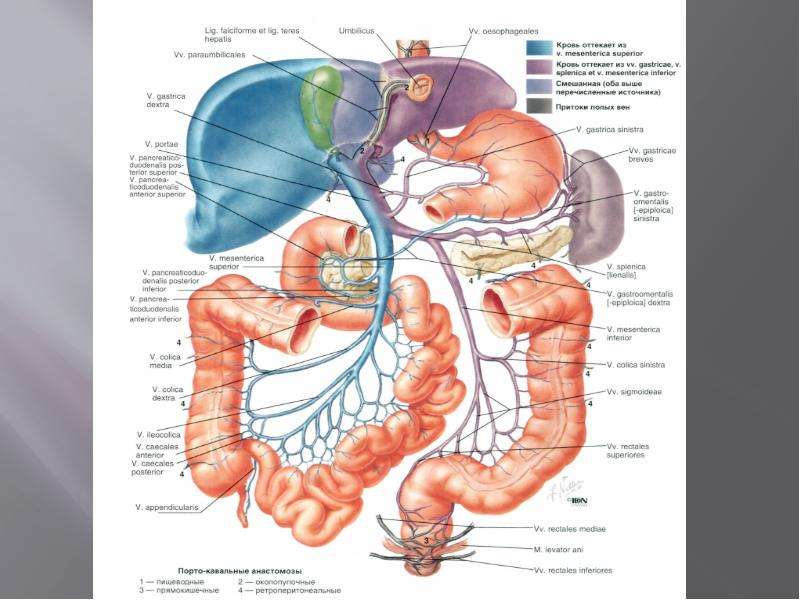
В некоторых случаях серьезного поражения печени вашему врачу может потребоваться трансплантация печени.
Тромбоз воротной вены — серьезное заболевание. При раннем выявлении PVT можно вылечить с помощью неинвазивных процедур и лечения. Если вы начали испытывать нерегулярные симптомы или дискомфорт, немедленно обратитесь к врачу.
Антикоагулянтная терапия при тромбозе воротной вены: быстрое исправление
Ключевые моменты обучения
- Тромбоз воротной вены может проявляться в острой или хронической форме у пациентов с циррозом или без него
- Краеугольным камнем терапии является антикоагулянтная терапия, которая является обязательной при наличии кишечной ишемии или основного прокоагулянтного состояния
- Рекомендуются антагонисты витамина К и гепарин, тогда как прямые пероральные антикоагулянты следует использовать только в контексте исследований
Введение
Клиническая картина и течение тромбоза воротной вены (ПВТ) отличаются значительной неоднородностью.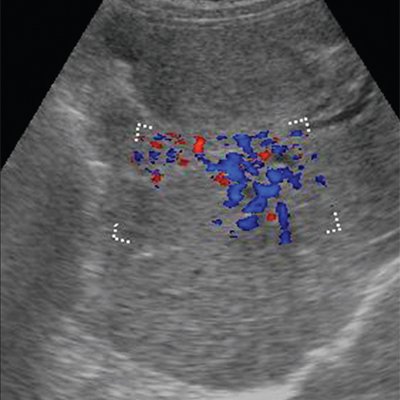 Полезно различать острый и хронический PVT (цирротический или нецирротический) на основе клинических проявлений (таблица 1). 1–3
Полезно различать острый и хронический PVT (цирротический или нецирротический) на основе клинических проявлений (таблица 1). 1–3
Острый PVT
Острый ПВТ связан с местными (например, панкреатит) и / или системными протромботическими состояниями (например, миелопролиферативным новообразованием, антифосфолипидным синдромом, пароксизмальной ночной гемоглобинурией и, иногда, наследственной тромбофилией). Пациенты могут иметь симптомы провоцирующего состояния (например,грамм. злокачественные новообразования, панкреатит) с PVT, обнаруживаемым случайно на ультразвуковом сканировании. Альтернативно, проявлением может быть рецидивирующая или сильная боль в животе, предполагающая венозную ишемию кишечника и распространение тромба на верхнюю брыжеечную вену (ВБВ). Из-за компенсаторного увеличения печеночного артериального кровотока функция печени обычно не изменяется даже при обширном остром PVT.
Хронический PVT
Хронический ПВТ обычно возникает при циррозе печени. Годовая заболеваемость оценивается в 10–15%.Он обычно проявляется бессимптомно при рутинном ультразвуковом обследовании или как вновь возникшая или усугубляющаяся декомпенсация. Патофизиологические характеристики включают снижение портального кровотока, гемостатический дисбаланс (повышение уровня фактора VIII и снижение естественных антикоагулянтов, таких как протеин C, протеин S или антитромбин III) и повреждение эндотелия (повышенный фактор фон Виллебранда и циркулирующие эндотелиальные микрочастицы). Все пациенты с хроническим PVT должны быть обследованы на предмет гепатоцеллюлярной карциномы. 1,2
Годовая заболеваемость оценивается в 10–15%.Он обычно проявляется бессимптомно при рутинном ультразвуковом обследовании или как вновь возникшая или усугубляющаяся декомпенсация. Патофизиологические характеристики включают снижение портального кровотока, гемостатический дисбаланс (повышение уровня фактора VIII и снижение естественных антикоагулянтов, таких как протеин C, протеин S или антитромбин III) и повреждение эндотелия (повышенный фактор фон Виллебранда и циркулирующие эндотелиальные микрочастицы). Все пациенты с хроническим PVT должны быть обследованы на предмет гепатоцеллюлярной карциномы. 1,2
Нераспознанный острый PVT может привести к хроническому PVT. В отсутствие цирроза хронический PVT является важной причиной портальной гипертензии у детей из развивающихся стран. У небольшого числа детей пупочный сепсис и внутрибрюшная инфекция являются преждевременными. У этих детей наблюдается хорошо переносимое кровотечение из варикозно расширенных вен и массивная спленомегалия с гиперспленизмом. Портальная кавернома и портальная билиопатия разной степени тяжести могут в конечном итоге развиться у детей с длительным PVT из-за обструкции желчных путей, вторичной по отношению к перихоледохальному варикозному расширению вен. 1
Портальная кавернома и портальная билиопатия разной степени тяжести могут в конечном итоге развиться у детей с длительным PVT из-за обструкции желчных путей, вторичной по отношению к перихоледохальному варикозному расширению вен. 1
Классификация PVT как анатомической (таблица 2) 4 или анатомически-функциональной (место PVT, степень окклюзии, продолжительность и проявление, степень вовлечения системы PV, тип и наличие основного заболевания печени) может помочь в установлении прогноза и в принятии общих управленческих решений. 5
Диагностика
Допплерография брюшной полости обычно является первоначальным тестом для диагностики PVT (Таблица 1). Визуализация поперечного сечения, такая как многофазная КТ с контрастным усилением (Таблица 1, Рисунок 1) и МР-холангиография, помогает определить степень, остроту и часто локальную причину PVT (гепатоцеллюлярная карцинома, панкреатит, источник внутрибрюшного сепсиса, инфаркт кишечника, портальная билиопатия)./21/4.jpg) Большинству пациентов будет полезна оценка системных протромботических состояний, причем степень ее следует определять индивидуально и руководствоваться клинической картиной. 1,2
Большинству пациентов будет полезна оценка системных протромботических состояний, причем степень ее следует определять индивидуально и руководствоваться клинической картиной. 1,2
Лечение
Антикоагуляция и лечение любого предрасполагающего фактора (факторов) остаются основой лечения PVT (рис. 2). Лечение осложнений ПВТ (например, кишечной ишемии и портальной билиопатии) и роль передовых методов лечения, таких как установка трансъюремного внутрипеченочного портосистемного шунта (TIPSS) и хирургическое вмешательство, выходят за рамки данной статьи.Антикоагулянтная терапия обязательна у пациентов с симптоматической ПВТ (кишечной ишемией) или прокоагулянтным состоянием.
Антикоагулянты
Самопроизвольное разрешение острого симптоматического нецирротического ПВТ крайне маловероятно, поэтому рекомендуется немедленное начало антикоагулянтной терапии. 1 Продолжительность лечения обычно составляет 6 месяцев, если выявлена исключительно преходящая местная причина, но может потребоваться продление при отсутствии идентифицируемой местной причины и / или идентификации постоянной системной причины.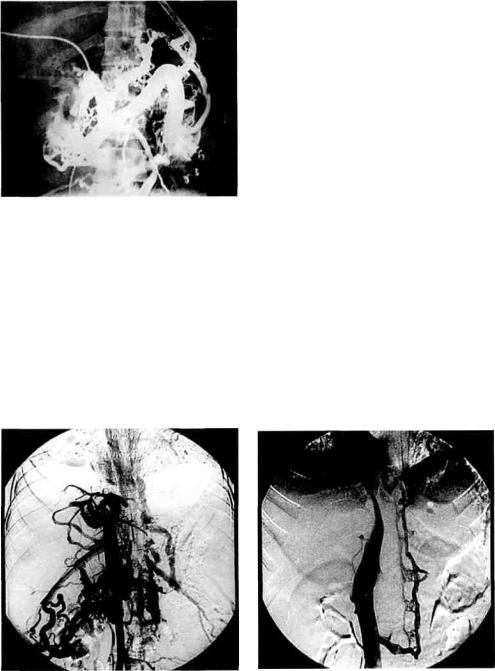 2
2
У пациентов с циррозом печени антикоагулянтная терапия может быть рассмотрена у пациентов с симптомами с расширением сгустка до SMV или определенного прокоагулянтного фактора риска. Несмотря на ограниченные данные, антикоагулянтная терапия в соответствии с рекомендациями 2 Европейской ассоциации по изучению печени (EASL) и консенсусом Baveno VI 3 может использоваться для поддержки пациентов с циррозом PVT, находящихся в списке ожидания трансплантации. Прогрессирование ПВТ может усложнить операцию и отрицательно повлиять на исходы после трансплантации.Риски и преимущества антикоагуляции в других условиях остаются неясными.
У пациентов с хроническим PVT без цирроза печени текущие рекомендации EASL и Baveno VI поддерживают неограниченную антикоагулянтную терапию. 2,3 Этот подход может быть неприменим для пациентов азиатского происхождения, поскольку сообщается об очень ограниченном преимуществе неселективной антикоагуляции для этих пациентов. 6
6
Всем пациентам с хроническим PVT перед антикоагулянтной терапией рекомендуется оценка и введение адекватной профилактики варикозного расширения вен пищевода. 7
Эффективны ли антикоагулянты?
В отношении острой PVT ограниченные данные позволяют предположить, что своевременная антикоагулянтная терапия эффективно предотвращает распространение тромба и может привести к реканализации у 38–45% пациентов. 8 Может быть полезен прямой тромболизис (через TIPSS). Некоторые данные свидетельствуют о высокой скорости немедленной реканализации и хорошей долгосрочной проходимости. 9 В недавнем британском исследовании пациентов с нецирротическим острым PVT с кишечной ишемией, реканализация была зарегистрирована у 86% из 22 пациентов с поэтапным подходом к системному тромболизису и терапии местного растворения сгустка с помощью TIPSS и тромболизиса. 10
Ретроспективные исследования показали, что антикоагулянты эффективны в достижении реканализации и профилактики тромботических событий de novo у пациентов с хроническим нецирротическим PVT без значительного увеличения кровотечений. 11
11
При хронической цирротической ТВВ у пациентов может наблюдаться спонтанная полная реканализация. Исследования показали, что антикоагуляция безопасна и эффективна для увеличения скорости реканализации (72% против 42% без антикоагуляции), но общая выживаемость не изменяется. 12
В тщательно отобранной группе пациентов использование антикоагулянтов не связано со значительным повышением риска кровотечений. Адекватное количество тромбоцитов (> 50 000 клеток / мм 3 или 50 × 10 9 / л) и профилактика варикозного расширения вен желудка и пищевода рекомендуется во время начала. 1–3,7
В одном рандомизированном исследовании антикоагулянтная терапия низкомолекулярным гепарином (НМГ) у пациентов с далеко зашедшим циррозом была эффективной в предотвращении PVT и снижении риска ухудшения декомпенсации. 13
Какие антикоагулянты безопасны и эффективны?
В литературе нет ясности относительно выбора антикоагулянтов. В клинической практике большинству пациентов, которым необходима антикоагулянтная терапия, назначают НМГ или нефракционированный гепарин и перекрывают их с антагонистами витамина К (VKA) для поддержания целевой международной скорости нормализации 2–3.
В клинической практике большинству пациентов, которым необходима антикоагулянтная терапия, назначают НМГ или нефракционированный гепарин и перекрывают их с антагонистами витамина К (VKA) для поддержания целевой международной скорости нормализации 2–3.
Прямые пероральные антикоагулянты (DOAC) являются пероральной альтернативой VKA. Эти препараты обладают более быстрым началом действия и меньшим риском кровотечения, что устраняет необходимость в мониторинге международной скорости нормализации (таблица 3).DOAC эквивалентны VKA по эффективности в лечении тромбоза глубоких вен и тромбоэмболии легочной артерии, а также в профилактике инсульта у пациентов с фибрилляцией предсердий. Однако пациенты с циррозом были исключены из большинства исследований из-за несбалансированного гемостаза. Хотя все DOAC в разной степени удаляются из печени, исследования показали, что они не связаны со значительным риском повреждения печени. 14 DOAC могут использоваться по лицензированным показаниям при заболевании ребенка A, но противопоказаны при циррозе печени ребенка B и C.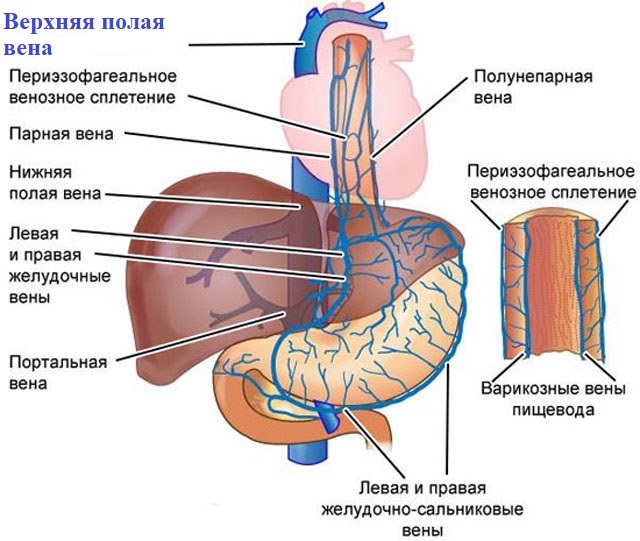
В небольших ретроспективных исследованиях было обнаружено, что использование DOAC безопасно и эффективно (эквивалентно VKA) при PVT, без увеличения общего числа кровотечений. 15,16 Рандомизированное исследование с участием 80 пациентов с компенсированным цирротическим ПВТ, связанным с вирусом гепатита С (вторичным по отношению к спленэктомии), показало, что ривароксабан был связан со значительно лучшими результатами при реканализации, чем варфарин (85% против 45%). 17 Выживаемость повысилась, а риск кровотечений значительно снизился.Исследование было ограничено небольшим размером выборки и включением только пациентов после спленэктомии. Необходимы более масштабные исследования, прежде чем можно будет дать четкие рекомендации относительно использования DOAC при циррозе печени.
Авторы считают, что использование DOAC в PVT должно быть ограничено исследованиями, поскольку текущие доказательства недостаточны по качеству и количеству.
Курс и прогноз
Самопроизвольное разрешение часто встречается у пациентов с недавно перенесенной PVT, особенно если она не окклюзионная. Эти пациенты обычно бессимптомны, и разрешение обычно демонстрируется при ультразвуковом наблюдении за циррозом. 1
Эти пациенты обычно бессимптомны, и разрешение обычно демонстрируется при ультразвуковом наблюдении за циррозом. 1
Потенциальное влияние PVT на ухудшение портальной гипертензии остается дискуссионным вопросом. Рандомизированное исследование показало, что реканализация ПВТ положительно влияет на декомпенсацию функции печени. 11 Напротив, крупное многоцентровое исследование не обнаружило связи между недавним PVT и печеночной декомпенсацией. 18
При циррозе PVT отражает тяжесть заболевания печени, и его влияние на общий исход трудно оценить.
Пациенты с хроническим PVT без цирроза печени обычно выживают в течение длительного времени с клиническим течением, характеризующимся кровотечением из варикозно расширенных вен, портосистемной энцефалопатией и портальной каверномой с билиопатией, которая может проявляться рецидивирующим холангитом и, в конечном итоге, билиарным циррозом.
Выводы
PVT может присутствовать в острой или хронической форме у пациентов с циррозом или без него. Краеугольным камнем терапии является антикоагулянтная терапия, которая является обязательной, если у пациента есть кишечная ишемия или лежащее в основе прокоагулянтное состояние.Роль антикоагулянтов в установлении цирроза спорна, но, как правило, рекомендуется для пациентов, которые находятся в списке ожидания пересадки и доказали PVT. Рекомендуются VKA и гепарин, тогда как DOAC следует использовать только в контексте исследования.
Краеугольным камнем терапии является антикоагулянтная терапия, которая является обязательной, если у пациента есть кишечная ишемия или лежащее в основе прокоагулянтное состояние.Роль антикоагулянтов в установлении цирроза спорна, но, как правило, рекомендуется для пациентов, которые находятся в списке ожидания пересадки и доказали PVT. Рекомендуются VKA и гепарин, тогда как DOAC следует использовать только в контексте исследования.
Список литературы
- Intagliata NM, Caldwell SH, Tripodi A. Диагностика, развитие и лечение тромбоза воротной вены у пациентов с циррозом и без него. Гастроэнтерология 2019; 156: 1582–99.
- Европейская ассоциация изучения печени. Руководство EASL по клинической практике: Сосудистые заболевания печени. J Hepatol 2016; 64: 179–202.
- de Franchis R, Baveno VIF. Расширение консенсуса в отношении портальной гипертензии: отчет семинара по консенсусу Baveno VI: стратификация риска и индивидуальный подход к лечению портальной гипертензии.
 J Hepatol 2015; 63: 743–52.
J Hepatol 2015; 63: 743–52. - Йердел М.А., Гансон Б., Мирза Д. и др. Тромбоз воротной вены у взрослых, перенесших трансплантацию печени: факторы риска, скрининг, лечение и исход. Трансплантация 2000; 69: 1873–81.
- Sarin SK, Philips CA, Kamath PS и др. К новой комплексной классификации тромбоза воротной вены у пациентов с циррозом печени. Гастроэнтерология 2016; 151: 574–77.e3.
- Sarin SK, Sollano JD, Chawla YK, et al. Консенсус по внепеченочной обструкции воротной вены. Liver Int 2006; 26: 512–19.
- Tripathi D, Stanley AJ, Hayes PC, et al. Руководство Великобритании по лечению кровотечения из варикозно расширенных вен у пациентов с циррозом печени. Кишечник 2015; 64: 1680–704.
- Plessier A, Darwish-Murad S, Hernandez-Guerra M, et al. Острый тромбоз воротной вены, не связанный с циррозом: проспективное многоцентровое катамнестическое исследование. Гепатология 2010; 51: 210–18.

- Klinger C, Riecken B, Schmidt A, et al. Трансъюгулярный местный тромболизис с / без TIPS у пациентов с острым нецирротическим доброкачественным тромбозом воротной вены. Dig Liver Dis 2017; 49: 1345–52.
- Benmassaoud A, AlRubaiy L, Yu D, et al.Поэтапный режим тромболизиса в лечении острого тромбоза воротной вены у пациентов с признаками кишечной ишемии. Aliment Pharmacol Ther 2019; 50: 1049–58.
- Condat B, Pessione F, Hillaire S и др. Текущие исходы тромбоза воротной вены у взрослых: риск и польза антикоагулянтной терапии. Гастроэнтерология 2001; 120: 490–97.
- Лоффредо Л., Пастори Д., Фаркомени А., Виоли Ф. Эффекты антикоагулянтов у пациентов с циррозом и тромбозом воротной вены: систематический обзор и метаанализ. Гастроэнтерология 2017; 153: 480–87.e1.
- Villa E, Cammà C, Marietta M и др. Эноксапарин предотвращает тромбоз воротной вены и декомпенсацию печени у пациентов с запущенным циррозом печени.
 Гастроэнтерология 2012; 143: 1253–60.
Гастроэнтерология 2012; 143: 1253–60. - Caldeira D, Barra M, Santos AT и др. Риск лекарственного поражения печени при применении новых пероральных антикоагулянтов: систематический обзор и метаанализ. Сердце 2014; 100: 550–56.
- Nagaoki Y, Aikata H, Daijyo K, et al.Эффективность и безопасность эдоксабана для лечения тромбоза воротной вены после данапароида натрия у пациентов с циррозом печени. Hepatol Res 2018; 48: 51–58.
- Intagliata NM, Henry ZH, Maitland H, et al. Прямые пероральные антикоагулянты у пациентов с циррозом представляют аналогичный риск кровотечения по сравнению с традиционными антикоагулянтами. Dig Dis Sci 2016; 61: 1721–27.
- Hanafy AS, Abd-Elsalam S, Dawoud MM. Рандомизированное контролируемое исследование ривароксабана по сравнению с варфарином в лечении острого неопухолевого тромбоза воротной вены. Vascul Pharmacol 2019; 113: 86–91.
- Nery F, Chevret S, Condat B и др.
 Причины и последствия тромбоза воротной вены у 1243 пациентов с циррозом печени: результаты лонгитюдного исследования. Гепатология 2015; 61: 660–67.
Причины и последствия тромбоза воротной вены у 1243 пациентов с циррозом печени: результаты лонгитюдного исследования. Гепатология 2015; 61: 660–67.
Таблица 1. Ключевые признаки, позволяющие дифференцировать острую PVT от хронической при представлении индекса
| Параметры | Острый PVT | Хроническая PVT | |
| Клинический | Презентация | 1.Случайное заболевание (например, острый панкреатит) 2. Ишемическая кишка (при поражении брыжеечных вен) | 1. Обычно бессимптомное течение 2. Ухудшение декомпенсации печени (асцит, варикозное кровотечение, печеночная энцефалопатия) 3. Холангит при билиопатии. |
| Осадки | 1. Обычно присутствуют местные и / или системные осадители | 1. Цирроз, будучи состоянием низкого кровотока, является фактором риска. 2.Необходимо исключить гепатоцеллюлярный рак | |
| Радиологический | Допплерография | Отсутствие потока | Множественный поводок коллатеральных сосудов (кавернома), замещающий воротную вену. |
| КТ брюшной полости | Может идентифицировать осадок и протяженность | · Обычно требуется для исключения гепатоцеллюлярной карциномы (при циррозе) · Портальная билиопатия |
Таблица 2.Анатомическая классификация PVT 4
| Класс PVT | Описание |
| Класс I | Частичный PVT (<50% просвета) |
| Класс II | > 50% PVT (включая полную окклюзию) |
| Класс III | Полный тромбоз PVT и проксимального SMV (дистальный SMV запатентован) |
| Класс IV | Полный тромбоз PVT и весь тромбоз SMV |
Таблица 3.Варианты антикоагулянтов в ПВТ
| Агенты | Механизм | Частота и способ применения | Мониторинг | Предостережения | Дисфункция печени | Обратный агент | Комментарии |
| Нефракционированный гепарин | Потенциал антитромбина | Непрерывная внутривенная инфузия / 3-4 раза в день внутривенно / подкожная инъекция | APTT | Почечная недостаточность, гепарин-индуцированная тромбоцитопения | Доза регулируется в соответствии с APTT | Сульфат протамина | Непригоден для обслуживания |
| Гепарин с низким молекулярным весом (например,г Эноксапарин) | Усиление антитромбина и инактивация фактора Ха | Один или два раза в день, подкожная инъекция | Фактор Xa (необязательно) | Почечная недостаточность | Без корректировки дозы | Сульфат протамина (может быть частично эффективным) | Использование, подтвержденное литературой, трудное в обслуживании |
| VKAs (например, Варфарин) | Подавить синтез факторов, зависимых от витамина К | Один раз в день, перорально | PT или INR (узкий терапевтический диапазон) | Непредсказуемо — требует пристального наблюдения, Трудно контролировать, продлено ли исходное МНО | Доза для поддержания целевого МНО | Витамин К, концентрат протромбинового комплекса | Использование подтверждено литературой |
| Прямой антитромбиновый агент (например,грамм. Дабигатран) | Фактор ингибирования IIa | пероральный | Не рекомендуется | Печеночная недостаточность (детский класс B и выше) Коррекция дозы для почечной функции | Без корректировки дозы (не рекомендуется в детском B / C) | Идаруцизумаб | Данные ограничены отчетами о случаях и сериями небольших случаев (не должны использоваться в APS) |
| Агенты прямого действия против Ха (например, ривароксабан, апиксабан, эдоксабан) | Фактор ингибирования Ха | пероральный | Не рекомендуется | Печеночная недостаточность (детский класс B и выше) Коррекция дозы для почечной функции | Без корректировки дозы (не рекомендуется в детском B / C) | Andexanet (одобрен EMA для ривароксабана и апиксабана) | Данные ограничены отчетами о случаях и сериями небольших случаев (не должны использоваться в APS) |
Внутривенное в / в; АЧТВ, активированный частичный тромбопластиновый стержень; PT — протромбиновое время; INR, международное нормализованное соотношение; EMA, Европейское агентство по лекарственным средствам; АФС, антифосфолипидный синдром.
Рис. 1. КТ-изображение, показывающее острую PVT с распространением на левую ветвь (желтая стрелка)
Рис. 2. Подход к антикоагулянтной терапии у пациентов с ПВТ.
Биографии авторов
Д-р Дхирадж Трипати
Д-р Ашиш Гоэль
Д-р Ашиш Гоэль — врач-специалист по печени в университетской больнице Бирмингема, Великобритания. В настоящее время он находится в отпуске с отделения гепатологии Христианского медицинского колледжа, Веллор, Индия.
Д-р Уильям Лестер
Д-р Уильям Лестер — гематолог-консультант в университетской больнице Бирмингема.Он является членом Королевского колледжа врачей и членом Королевского колледжа патологов. Его основные клинические интересы включают тромбоз и гемостаз, болезнь фон Виллебранда и акушерскую гематологию.
Войдите в свою учетную запись члена BSG, чтобы читать и оставлять комментарии на этой странице
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Антикоагулянты при тромбозе воротной вены при циррозе
Антикоагулянты при тромбозе воротной вены при циррозе печени | Практика
Мы обнаружили, что вы используете блокировщик рекламы.
PracticeUpdate бесплатен для конечных пользователей, но мы полагаемся на рекламу для финансирования нашего сайта. Пожалуйста, подумайте о поддержке PracticeUpdate, добавив нас в белый список в вашем блокировщике рекламы.
Мы отправили сообщение на указанный вами адрес электронной почты. Если это электронное письмо неверно, обновите настройки, указав правильный адрес.
Адрес электронной почты, который вы указали при регистрации, не является действительным. Пожалуйста, обновите свои настройки, указав действительный адрес, прежде чем продолжить использование PracticeUpdate.
Войти на практикуОбновить
Только зарегистрированные пользователи имеют полный доступ к контенту PracticeUpdate.
Дополнительная информация
Заявления о раскрытии информации доступны в профилях авторов:
Дополнительная литература
рекомендуемых
Риск рака при воспалительном заболевании кишечника
Воспаление.Кишечник.
·
03 марта 2021 г.рекомендуемых
Естественное течение острого заболевания почек у пациентов с циррозом печени
Дж.Гепатол.
·
2 марта 2021 г.рекомендуемых
Фиброз печени связан с множественными факторами риска кардиометаболических заболеваний
Гепатология
·
2 марта 2021 г.история недели
Функциональная диспепсия и гастропарез в третичной медицинской помощи — взаимозаменяемые синдромы
Гастроэнтерология
·
01 марта 2021 г.обновлено
рекомендуемых
Глубокая нейронная сеть точно предсказывает прогноз язвенного колита с помощью эндоскопических изображений
Гастроэнтерология
·
01 марта 2021 г.обновлено
рекомендуемых
Выявление аденомы с помощью эндокуфа по сравнению со стандартной колоноскопией
Эндоскопия
·
28 февраля 2021 г.история недели
Эндомикроскопия с привязанными капсулами у пациентов с пищеводом Барретта
Clin.Гастроэнтерол. Гепатол.
·
27 февраля 2021 г.рекомендуемых
Карведилол способствует увеличению выживаемости у пациентов с циррозом печени
Алимент.Pharmacol. Ther.
·
25 февраля 2021 г.обновлено
рекомендуемых
Влияние лечения ВГС на риск развития непеченочного рака у пациентов, инфицированных ВГС
Алимент.Pharmacol. Ther.
·
23 февраля 2021 г.обновлено
история недели
Вытяжение с двойным зажимом для эндоскопической диссекции подслизистой оболочки толстой кишки
Гастроинтест.Endosc.
·
23 февраля 2021 г.рекомендуемых
Цирроз ассоциируется с высокой смертностью и частотой повторной госпитализации независимо от COVID-19
Liver Transpl.·
23 февраля 2021 г.
Доброкачественная гематология Гастроэнтерология Доброкачественная гематология Гастроэнтерология
(PDF) Обновленная информация о лечении тромбоза воротной вены и роли новых антикоагулянтов
[2] Янг К., Вонг Р.Оценка и лечение острого и хронического тромбоза воротной вены
у пациентов с циррозом печени. Clin Liver Dis (Хобокен) 2018;
10: 152–156. DOI: 10.1002 / cld.679.
[3] Lang SA, Loss M, Wohlgemuth WA, Schlitt HJ. Тактика ведения острого
тромбоза воротной / брыжеечной вены. Висзералмедизин 2014; 30: 394–400. DOI:
10,1159 / 000369896.
[4] Ageno W, Dentali F, Squizzato A. Как я лечу тромбоз внутренних вен.
Кровь 2014; 124: 3685–3691.DOI: 10.1182 / кровь-2014-07-551515.
[5] Донадини М.П., Дентали Ф., Аджено В. Тромбоз внутренних вен: новый риск
факторов и лечение. Thromb Res 2012; 129: S93 – S96. DOI: 10.
1016 / S0049-3848 (12) 70025-7.
[6] Огрен М., Бергквист Д., Бьорк М., Акоста С., Эрикссон Х., Стернби Н.Х. Portal
тромбоз вен: распространенность, характеристики пациентов и пожизненный риск: популяционное исследование
, основанное на 23 796 последовательных вскрытиях. World J Gastro-
энтерол 2006; 12: 2115–2119.DOI: 10.3748 / wjg.v12.i13.2115.
[7] Amitrano L, Guardascione MA, Brancaccio V, Margaglione M, Manguso F,
Iannaccone L, et al. Факторы риска и клиническая картина тромбоза воротной вены
у пациентов с циррозом печени. J Hepatol 2004; 40: 736–741.
DOI: 10.1016 / j.jhep.2004.01.001.
[8] Окуда К., Охниши К., Кимура К., Мацутани С., Сумида М., Гото Н. и др. Частота
тромбоза воротной вены при циррозе печени. Ангиографическое исследование у 708 пациентов.
Гастроэнтерология 1985; 89: 279–286. DOI: 10.1016 / 0016-5085 (85)
-0.
[9] Белли Л., Романи Ф., Сансалоне С.В., Асени П., Рондинара Г. Портальный тромбоз у пациентов с циррозом печени
. Ретроспективный анализ. Энн Сург 1986; 203: 286–291. DOI: 10.
1097 / 00000658-198603000-00012.
[10] Франко С., Валла Д., Дюран Ф. Тромбоз воротной вены, цирроз и транс-
плантации печени. Журнал Hepatol 2012; 57: 203–212. DOI: 10.1016 / j.jhep.2011.12.034.
[11] Zocco MA, Di Stasio E, De Cristofaro R, Novi M, Ainora ME, Ponziani F, et al.
Факторы тромботического риска у пациентов с циррозом печени: корреляция с балльной системой
MELD и развитием тромбоза воротной вены. J Hepatol
2009; 51: 682–689. DOI: 10.1016 / j.jhep.2009.03.013.
[12] Trebicka J, Strassburg CP. Этиология и осложнения трома воротной вены —
боз. Висзералмедизин 2014; 30: 375–380. DOI: 10,1159 / 000369987.
[13] Куирк М., Ким Ю.Х., Сааб С., Ли Е.В. Лечение гепатоцеллюлярной карциномы
с тромбозом воротной вены.Всемирный журнал J Gastroenterol 2015; 21: 3462–3471.
DOI: 10.3748 / wjg.v21.i12.3462.
[14] Llovet JM, Bustamante J, Castells A, Vilana R, Ayuso Mdel C, Sala M, et al.
Естественная история нелеченой нехирургической гепатоцеллюлярной карциномы: рацион —
эль для планирования и оценки терапевтических испытаний. Гепатология 1999; 29:
62–67. DOI: 10.1002 / hep.5102
.
[15] Пириси М., Авеллини С., Фабрис С., Скотт С., Бардус П., Соардо Г. и др. Портальная вена
Тромбоз при гепатоцеллюлярной карциноме: возрастное и половое распределение в исследовании аутопсии
.J Cancer Res Clin Oncol 1998; 124: 397–400. DOI: 10.
1007 / s004320050189.
[16] Смалберг Дж. Х., Арендс Л. Р., Валла, округ Колумбия, Киладжян Дж. Дж., Янссен Х. Л., Либик Ф. В..
Миелопролиферативные новообразования при синдроме Бадда-Киари и воротной вене
Тромбоз: метаанализ. Кровь 2012; 120: 4921–4928. DOI: 10.
1182 / кровь-2011-09-376517.
[17] Андерсон Ф.А. младший, Спенсер Ф.А. Факторы риска венозной тромбоэмболии. Cir-
culation 2003; 107: I9 – I16.DOI: 10.1161 / 01.CIR.0000078469.07362.E6.
[18] Огрен М., Бергквист Д., Бьорк М., Акоста С., Стернби Н.Х. Высокая частота сочетанной венозной тромбоэмболии
у пациентов с тромом воротной вены —
боз: популяционное исследование, основанное на 23 796 последовательных аутопсиях. Дж. Тромб
Haemost 2007; 5: 198–200. DOI: 10.1111 / j.1538-7836.2006.02264.x.
[19] Согаард К.К., Фаркас Д.К., Педерсен Л., Соренсен ХТ. Спланхнический венозный тромбоз
является маркером рака и прогностическим фактором выживаемости при раке.
Кровь 2015; 126: 957–963. DOI: 10.1182 / кровь-2015-03-631119.
[20] Кройцигер Л.Б., Аджено В., Ли А. Лечение случайного тромбоза чревной вены
тромбоза у онкологических больных. Hematology Am Soc Hematol Educ Program
2014; 2014: 318–320. DOI: 10.1182 / asheducation-2014.1.318.
[21] Нери Ф, Шевре С., Кондат Б., де Раукур Э., Боудо Л., Рауту П.Е. и др.
Причины и последствия тромбоза воротной вены у 1243 пациентов с циррозом печени
: результаты длительного исследования.Гепатология 2015; 61: 660–667.
DOI: 10.1002 / hep.27546.
[22] Schöniger-Hekele M, Müller C, Kutilek M, Oesterreicher C, Ferenci P, Gangl A.
Гепатоцеллюлярная карцинома в Центральной Европе: особенности прогноза и перспективы
vival. Gut 2001; 48: 103–109. DOI: 10.1136 / gut.48.1.103.
[23] Ма Дж., Янь З., Ло Дж., Лю Кью, Ван Дж., Цю С. Рациональная классификация воротной вены
тромбоз и его клиническое значение. PLoS One 2014; 9: e112501. DOI: 10.
1371 / journal.pone.0112501.
[24] Зарин С.К., Филипс Калифорния, Камат П.С., Чоудхури А., Маруяма Х., Нери Ф.Г. и др.
К новой всеобъемлющей классификации тромбоза воротной вены у
пациентов с циррозом печени. Гастроэнтерология 2016; 151: 574–577.e3. DOI: 10.
1053 / j.gastro.2016.08.033.
[25] Плессье А., Рауту, ЧП, Валла, округ Колумбия. Лечение сосудистых заболеваний печени.
J Hepatol 2012; 56: S25 – S38. DOI: 10.1016 / S0168-8278 (12) 60004-X.
[26] Плессье А., Дарвиш-Мурад С., Эрнандес-Герра М., Консиньи Y, Фабрис Ф.,
Требика Дж. И др. Острый тромбоз воротной вены, не связанный с циррозом: проспективное многоцентровое катамнестическое исследование
. Гепатология 2010; 51: 210–218. DOI:
10.1002 / hep.23259.
[27] Amitrano L, Guardascione MA, Scaglione M, Pezzullo L, Sangiuliano N,
Armellino MF, et al. Факторы прогноза у пациентов без цирроза с тромбозами вены splanch-
nic.Am J Gastroenterol 2007; 102: 2464–2470. DOI: 10.
1111 / j.1572-0241.2007.01477.x.
[28] Кондат Б., Пессион Ф., Хелен Деннингер М., Хиллер С., Валла Д. Недавний портал
или тромбоз мезентериальных вен: повышенное распознавание и частая реканализация
на антикоагулянтной терапии. Гепатология 2000; 32: 466–470.
DOI: 10.1053 / jhep.2000.16597.
[29] Шин К.Л., Лампарелли Н, Милн А, Грин I, Рэймидж Дж.К. Клинические особенности,
Диагностика и исход острого тромбоза воротной вены.QJM 2000; 93:
531–534. DOI: 10.1093 / qjmed / 93.8.531.
[30] Акоста С., Альхадад А., Свенссон П., Экберг О. Эпидемиология, риск и прогноз
ностических факторов при тромбозе мезентериальных вен. Br J Surg 2008; 95: 1245–
1251. DOI: 10.1002 / bjs.6319.
[31] Согаард К.К., Аструп Л.Б., Вилструп Х., Гронбек Х. Тромбоз воротной вены; риск
факторов, клиническая картина и лечение. БМК Гастроэнтерол 2007; 7: 34.
DOI: 10.1186 / 1471-230X-7-34.
[32] Лука А., Карузо С., Милаццо М., Марроне Дж., Мамоне Дж., Крино Ф. и др. Natural
Курс внепеченочного незлокачественного частичного тромбоза воротной вены у пациентов
с циррозом печени. Радиология 2012; 265: 124–132. Doi: 10.1148 / radiol.12112236.
[33] Афифи А.Ф., Баша О.М., Вадеа FM, Самак А.Е., Хафез Р.А. Тромбоз воротной вены
у пациентов с циррозом печени: понимание факторов риска, клиническая картина
и исход. Int J of Adv Res 2015; 3: 1539–1548.
[34] Кагин Ю.Ф., Атаян Ю., Эрдоган М.А., Дагтекин Ф., Колак С. Заболеваемость и клинические проявления
Представление тромбоза воротной вены у пациентов с циррозом печени. Гепатобилиарный
Pancreat Dis Int 2016; 15: 499–503. DOI: 10.1016 / S1499-3872 (16) 60092-9.
[35] De Gaetano AM, Lafortune M, Patriquin H, De Franco A, Aubin B, Paradis K.
Кавернозная трансформация воротной вены: паттерны внутрипеченочного и
спланхнического коллатерального кровообращения, обнаруженные с помощью допплерографии.AJR Am
J Roentgenol 1995; 165: 1151–1155. DOI: 10.2214 / ajr.165.5.7572494.
[36] Кондат Б., Вилгрейн В., Ассела Т., О’Тул Д., Руфат П., Заппа М. и др. Portal
Холангиопатия, связанная с каверномой: клиническая и МР-холангиография
в сочетании с исследованием МР-портографии. Гепатология 2003; 37: 1302–
1308. DOI: 10.1053 / jhep.2003.50232.
[37] Intagliata NM, Argo CK, Stine JG, Lisman T., Caldwell SH, Violi F. Concepts
и разногласия по поводу гемостаза и тромбоза, связанных с печенью
Болезнь
: Труды 7-го Международного совещания по коагуляции при заболеваниях печени
Конференция.Тромб Хемост 2018; 118: 1491–1506. DOI: 10,1055 / с-
0038-1666861.
[38] Маргини С., Берциготти А. Тромбоз воротной вены: роль визуализации в клинических условиях
. Dig Liver Dis 2017; 49: 113–120. DOI: 10.1016 / j.dld.2016.
11.013.
[39] Росси С., Роза Л., Раветта В., Кашина А., Кваретти П., Аззаретти А. и др. Контрастность
улучшенная по сравнению с традиционной и цветной допплеровской сонографией для обнаружения тромбоза воротной и печеночной венозной систем.AJR Am
J Roentgenol 2006; 186: 763–773. DOI: 10.2214 / AJR.04.1218.
[40] Тарантино Л., Франсика Дж., Сорделли И., Эспозито Ф., Джорджио А., Соррентино П. и др.
Диагностика доброкачественного и злокачественного тромбоза воротной вены при циррозе печени
пациентов с гепатоцеллюлярной карциномой: цветной допплеровский УЗИ, контраст-
УЗИ и тонкоигольная биопсия. Визуализация брюшной полости 2006; 31: 537–544.
DOI: 10.1007 / s00261-005-0150-x.
[41] Тарантино Л., Амброзино П., Ди Минно Миннесота.Ультразвук с контрастным усилением в
, позволяющий дифференцировать злокачественный тромбоз воротной вены от доброкачественного тромбоза воротной вены гепатоцел-
люлярной карциномы. Всемирный журнал J Gastroenterol 2015; 21: 9457–9460. DOI: 10.
3748 / wjg.v21.i32.9457.
[42] Гросманн Р.Дж., Вонгчаратрави С. Градиент венозного давления в печени:
Все, что стоит делать, следует делать правильно. Гепатология 2004; 39: 280–282.
DOI: 10.1002 / hep.20062.
[43] Меркель С., Болоньези М., Сакердоти Д., Бомбонато Дж., Беллини Б., Бигин Р. и др.
Гемодинамический ответ на медикаментозное лечение портальной гипертензии как
предиктор клинической эффективности в первичной профилактике кровотечения из варикозно расширенных вен
при циррозе печени. Гепатология 2000; 32: 930–934. DOI: 10.1053 / jhep.
2000.19322.
[44] Киладжан Дж. Дж., Сервантес Ф., Либик Ф. У., Марзак С., Кассинат Б., Шевре С.,
и другие. Влияние мутаций JAK2 и MPL на диагностику и прогноз
тромбоза внутренних вен: отчет о 241 случае.Кровь 2008; 111:
4922–4929. DOI: 10.1182 / кровь-2007-11-125328.
[45] Шетти С., Кулкарни Б., Пай Н., Мукундан П., Касаткар П., Гош К. Мутация JAK2
по всему спектру случаев венозного тромбоза. Am J Clin Pathol 2010;
134: 82–85. DOI: 10.1309 / AJCP7VO4HAIZYATP.
[46] Как J, Zhou A, Oh ST. Тромбоз внутренних вен при миелопролиферативных новообразованиях
: патофизиология и молекулярные механизмы заболевания. Ther
Adv Hematol 2017; 8: 107–118.

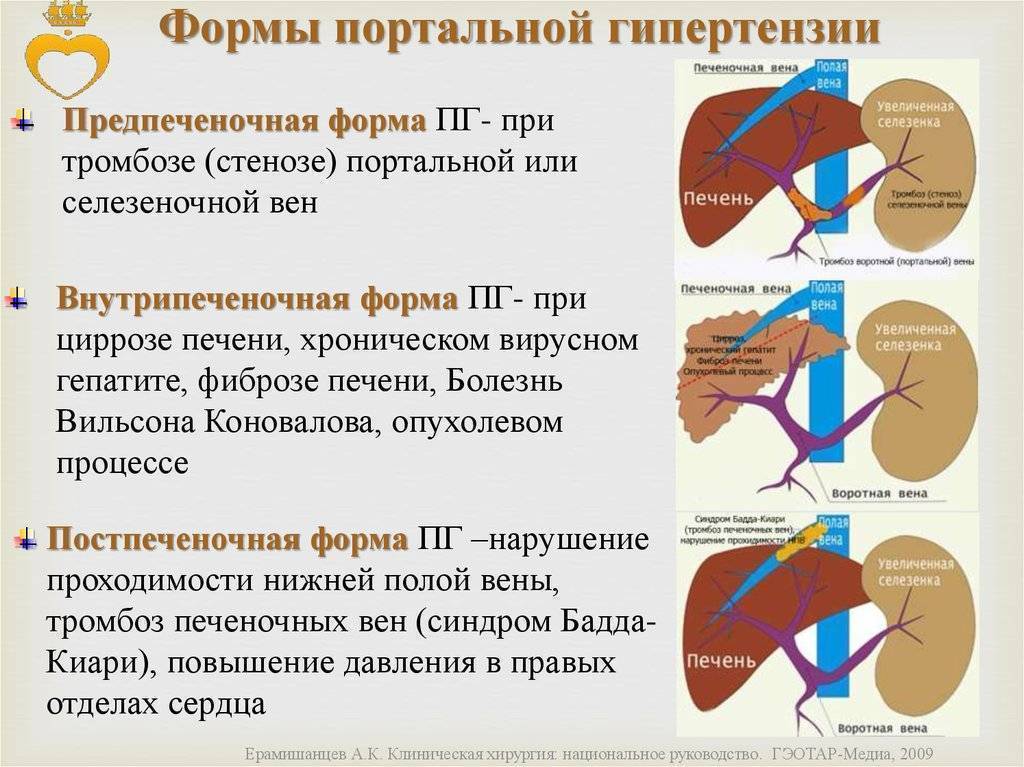 Однако в одной трети случаев тромбоз формируется медленно, вследствие чего успевает развиться коллатеральный кровоток, а воротная вена со временем реканализируется (происходит кавернозная трансформация воротной вены). Тем не менее даже при относительно благоприятном течении развивается портальная гипертёнзия.. Тем не менее даже при относительно благоприятном течении развивается портальная гипертёнзия.
Однако в одной трети случаев тромбоз формируется медленно, вследствие чего успевает развиться коллатеральный кровоток, а воротная вена со временем реканализируется (происходит кавернозная трансформация воротной вены). Тем не менее даже при относительно благоприятном течении развивается портальная гипертёнзия.. Тем не менее даже при относительно благоприятном течении развивается портальная гипертёнзия. J Hepatol 2015; 63: 743–52.
J Hepatol 2015; 63: 743–52.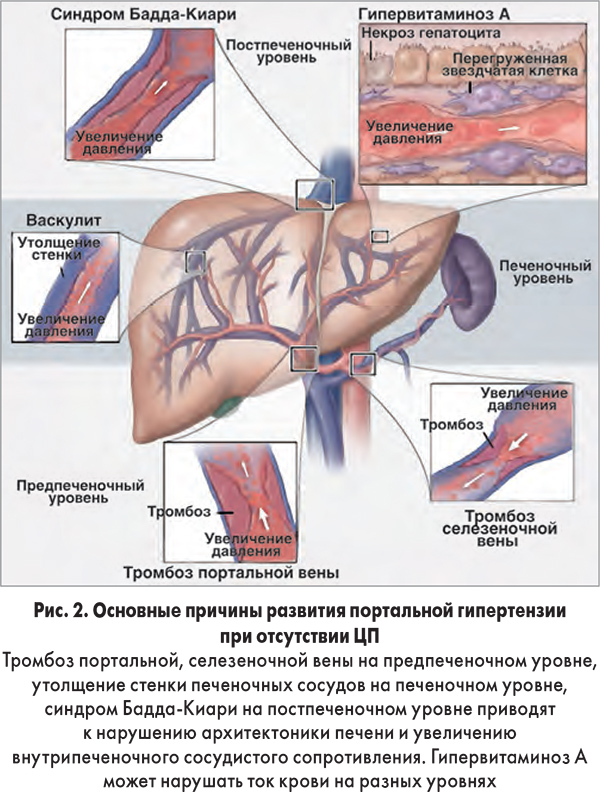
 Гастроэнтерология 2012; 143: 1253–60.
Гастроэнтерология 2012; 143: 1253–60. Причины и последствия тромбоза воротной вены у 1243 пациентов с циррозом печени: результаты лонгитюдного исследования. Гепатология 2015; 61: 660–67.
Причины и последствия тромбоза воротной вены у 1243 пациентов с циррозом печени: результаты лонгитюдного исследования. Гепатология 2015; 61: 660–67.