Лечение аллергического альвеолита легких в Самаре
Врач-пульмонолог высшей категории
врач-педиатр
АБАШИНА ИРИНА ПЕТРОВНА
Экзогенный аллергический альвеолит (ЭАА) или гиперчувствительный пневмонит, включает в себя группу близких интерстициальных заболеваний легких, характеризующихся преимущественно диффузными воспалительными изменениями легочной паренхимы и мелких дыхательных путей, развивающимися в ответ на повторную ингаляцию различных антигенов, являющихся продуктами бактерий, грибов, животных белков, некоторых низкомолекулярных химических соединений.
Заболевание было впервые описано в 1932 г. J. Campbell у пяти фермеров, у которых наблюдалось развитие острых респираторных симптомов после работы с влажным заплесневелым сеном. Эта форма заболевания получила название «легкое фермера». Затем были описаны варианты ЭАА, связанные с другими причинами. Так, вторая по значению форма ЭАА — «легкое любителей птиц» — была описана в 1965 г. С. Reed и соавт. у трех больных, занимавшихся разведением голубей.
Reed и соавт. у трех больных, занимавшихся разведением голубей.
Причиной развития болезни является регулярное вдыхание мелкодисперсной, сложной по составу пыли, компонентами которой могут быть частички различного происхождения: пылевого клеща и других насекомых, плесневых и дрожжеподобных грибов, споры актиномицетов, животные и растительные протеины, содержащиеся в продуктах жизнедеятельности, перьях, мехе домашних животных, стиральных порошков, компонентами которых являются ферменты, пищевых продуктов, пары металлов, красок и полиуретановых материалов.
врач-пульмонолог (1 категория)
врач-педиатр (высшая категория)
ЛИСЕЙЧЕВА ЕЛЕНА АЛЕКСАНДРОВНА
В сельскохозяйственных районах ведущими причинными агентами являются термофильные актиномицеты — бактерии размером менее 1 мкм, обладающие морфологическими свойствами грибов, они широко встречаются в почве, компосте, воде, в кондиционерах. Наиболее частыми видами термофильных актиномицет, ассоциированными с ЭАА, являются Мicropolyspora faeni, Thermoactinomyces vulgaris, Thermoactinomyces viridis, Thermoactinomyces saccharis, Thermoactinomyces candidum. Причины ЭАА значительно различаются в разных странах и регионах.
Причины ЭАА значительно различаются в разных странах и регионах.
Так, в Великобритании среди форм ЭАА преобладает «легкое любителей волнистых попугаев», в США — «легкое пользующихся кондиционерами и увлажнителями, в Японии — «летний тип» ЭЭА, этиологически связанный с сезонным ростом грибов вида Trichosporon cutaneum (75% всех вариантов). В крупных промышленных центрах (в Москве) в настоящее время ведущими причинами являются птичьи и грибковые (Аspergillus spp.) антигены. По данным статистики больные экзогенным аллергическим альвеолитом составляют около 3 % от общего числа больных, наблюдающихся у врачей пульмонологов. Также в группу риска входят: люди в возрасте старше 50-ти лет (в особенности мужчины), люди, проживающие в промышленных, районах и люди, у которых уже наблюдались аллергические реакции.
Симптомы альвеолита легких (гиперчувствительного пневмонита)
Патогенез ЭАА справедливо считается иммунопатологическим заболеванием, в развитии которого ведущая роль принадлежит аллергическим реакциям 3-го и 4-го типов (по классификации Gell, Coombs), имеет значение и неиммунное воспаление, при котором повторный контакт с антигеном у людей, имеющих наследственную предрасположенность, приводит к острому нейтрофильному и мононуклеарному альвеолиту, сопровождаемому интерстициальной инфильтрацией лимфоцитами и гранулематозной реакцией. При длительном контакте развивается фиброз с облитерацией бронхиол.
При длительном контакте развивается фиброз с облитерацией бронхиол.
Экзогенный альвеолит проявляется в острой и хронической формах, четкое разграничение которых часто не представляется возможным, нередко наблюдается смешанная картина болезни. Острый альвеолит не всегда перерастает в хроническое заболевание, даже при продолжающемся контакте с агентом. Хронический альвеолит может развиться без предшествующего острого и может прогрессировать даже после прекращения контакта с вызвавшим его агентом.
Острый альвеолит проявляется гриппоподобным состоянием с миалгиями, лихорадкой, головной болью и затруднением дыхания, развивающимися через несколько часов после повышения температуры. При обследовании выявляется тахикардия и хрипы в легких при аускультации. Исследование функции легких выявляет снижение жизненной емкости легких и нарушение газообмена; на рентгенограмме легких может обнаруживаться мелкоузловой или более диффузный инфильтрат. Поскольку развитие аллергического альвеолита сопровождается ухудшением очищения бронхиального дерева, спустя несколько дней после возникновения первых признаков заболевания к ним могут присоединяться симптомы инфекционно-воспалительных процессов в легких, например, острой пневмонии или бронхита. Симптомы обычно разрешаются через 48 часов, но изменения функций легких и рентгенологические аномалии могут сохраняться в течение месяцев.
Симптомы обычно разрешаются через 48 часов, но изменения функций легких и рентгенологические аномалии могут сохраняться в течение месяцев.
Хронический альвеолит может развиваться после повторных приступов острого альвеолита или начинается с прогрессирующей одышки от напряжения. Физикальные данные могут быть скудными или вообще отсутствовать. Пальцы в виде барабанных палочек развиваются редко и дыхательные шумы, как правило, в норме. Вентиляция легких нарушается по рестриктивному типу, изменяется газообмен и иногда возникает обструкция воздухоносных путей, что является следствием вовлечения в процесс бронхиол. Рентгенограмма грудной клетки показывает фиброзные тени в основном в верхних отделах.
Диагноз экзогенный аллергический альвеолит легких
Острый альвеолит часто неверно принимается за рецидивирующие респираторные инфекции, но тщательный сбор анамнеза выявляет связь с условиями окружающей среды. Диагноз в основном устанавливают на основании:
- клинической картины;
- гематологических нарушений, выражающихся в наличии лейкоцитоза, эозинофилии, повышении СОЭ;
- выявления антител в сыворотки к ожидаемым антигенам;
- функциональных легочных проб;
- данных о вредных производственных или бытовых факторах;
- наличия признаков фиброза на рентгенологических снимках;
- данных трахеобронхиальной биопсии, проводимой, если другие методы не дали достаточной информации для постановки диагноза.

Характерной особенностью гранулём при экзогенном аллергическом альвеолите, является наличие в них телец Шауманна (участки микрокальциноза).
В сомнительных случаях проводят дальнейшие исследования. Компьютерная томография (КТ) с высокой разрешающей способностью выявляет типичные признаки: центролобулярные узелки, окруженные имеющими неправильную форму участками легочной ткани повышенной прозрачности, отражающей обструкцию мелких дыхательных путей. Лучше всего они видны на снимках, сделанных в момент вдоха. Между острыми приступами КТ может не выявить изменений вовсе, или обнаружить малоспецифичные признаки фиброза легких.
Иногда затемнение по типу матового стекла является преобладающим или единственным изменением. Данные затемнения обычно диффузные, но иногда не затрагивают периферические отделы вторичных долек легкого. Локальные зоны повышенной интенсивности, подобные выявляемым при облитерирующем бронхиолите, могут быть основным проявлением у некоторых пациентов (например, мозаичное повышение плотности с задержкой воздуха при КТ на выдохе).
При хронической форме заболевания имеются симптомы фиброза легкого (например, уменьшение объема долей, затемнения линейной формы, усиление легочного рисунка или «сотовое легкое»). Некоторые некурящие пациенты имеют признаки эмфиземы верхних долей легких. Увеличение лимфатических узлов средостения встречается редко и помогает отличить аллергический альвеолит от саркоидоза. В бронхоальвеолярном смыве обнаруживаются повышенное содержание CD-8 лимфоцитов, что позволяет исключить инфекцию и саркоидоз, связанные с повышением CD-4 (Т-хелперов) лимфоцитов. К исследованиям, имеющим диагностическую ценность при выявлении других заболеваний, относятся серологические и микробиологические исследования (при орнитозе и других пневмониях) и исследования аутоантител (при системных заболеваниях и васкулитах). Повышенное количество эозинофилов может свидетельствовать о хронической эозинофильной пневмонии, а увеличение лимфоузлов в корнях легких и паратрахеальных лимфоузлов более характерно для саркоидоза.
Рекомендации и лечение аллергического фиброзного альвеолита легких в Самаре
Главный принцип в борьбе с аллергическим альвеолитом — как можно быстрее исключить взаимодействие, контакт с аллергеном. Часто случается, что исключения контакта бывает достаточно и болезнь отступает. А это значит, что нужно в самые короткие сроки выявить, на что именно возникает такая реакция. Затем врач-пульмонолог назначает лечение: цитостатики, глюкокортикостероиды (подавляют воспаление), бронхолитики (для подавления одышки). После терапии лекарственными средствами назначается кислородная терапия (кислородные ингаляции, озонотерапия), дыхательная гимнастика, массаж грудной клетки, физиотерапевтические мероприятия. Обычно лечение занимает от одного до четырех месяцев.
В тяжелых случаях, при отсутствии эффекта от лечения может потребоваться пересадка легкого. Следует помнить, что при лечении альвеолита легких противопоказаны антибиотики. После излечения заболевания требуется продолжить диспансерное наблюдение. Первый визит к пульмонологу советуют нанести через 1 месяц, следующий — через 3 месяца. Только при полной нормализации показателей больной может быть снят с учета. Взрослые, переболевшие альвеолитом, должны пересмотреть свою трудовую деятельность. Для профилактики экзогенного аллергического альвеолита рекомендуется своевременно лечить заболевания легких, ограничивать контакты с вышеназванными аллергенами, а также химическими и токсическими веществами и отказаться от такой вредной привычки как курение.
Первый визит к пульмонологу советуют нанести через 1 месяц, следующий — через 3 месяца. Только при полной нормализации показателей больной может быть снят с учета. Взрослые, переболевшие альвеолитом, должны пересмотреть свою трудовую деятельность. Для профилактики экзогенного аллергического альвеолита рекомендуется своевременно лечить заболевания легких, ограничивать контакты с вышеназванными аллергенами, а также химическими и токсическими веществами и отказаться от такой вредной привычки как курение.
Ранняя диагностика и своевременно начатое лечение позволяют избежать развитие необратимых изменений в лёгочной ткани. При запоздалом обнаружении патологический воспалительный процесс переходит в грубую микросотовую дегенерацию лёгких, ведущую к инвалидизации пациентов. Средняя продолжительность жизни пациентов с лёгочным фиброзом тяжёлой степени составляет от 3 до 5 лет.
Желаем Вам Здоровья и Долголетия!
терминология, классификация, течение, обострение, спорные вопросы
В последние годы наблюдается постоянный рост заболеваемости идиопатическими альвеолитами.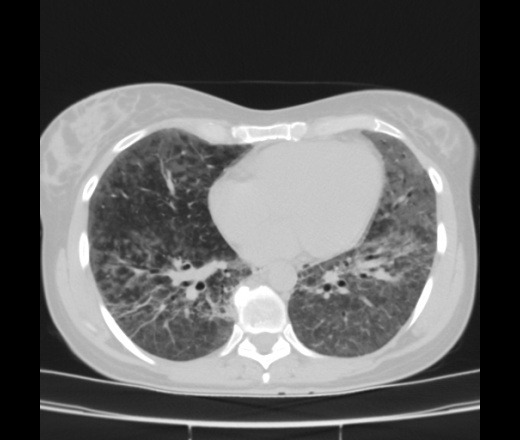 Длительные споры о существовании и обозначении этой распространенной патологии начинают стихать в связи с появлением четкого определения, патогенетических гипотез и схем ее лечения.
Длительные споры о существовании и обозначении этой распространенной патологии начинают стихать в связи с появлением четкого определения, патогенетических гипотез и схем ее лечения.
В 1933, 1935 и 1944 гг. L. Hamman и A. Rich первыми описали четырех молодых людей с симптомокомплексом быстропрогрессирующей одышки, мучительного непродуктивного кашля, периферическими отеками, гипоксией мозга с эпизодами бреда, синюшностью и лихорадкой. Эти случаи болезни привели к смерти больных в течение 2-6 месяцев. В дальнейшем подобную клиническую картину авторы наблюдали еще у пяти человек, погибших через 1-6 месяцев. При исследовании аутопсийного материала было установлено рассеянное паренхиматозно-фиброзное изменение в обоих легких (острый диффузный интерстициальный фиброз легких), заключающееся в разрушении стенок бронхов, бронхиол и легочных альвеол, в просвете которых находилось немного жидкости, а также эритроциты и «гиалиновые» клетки. Альвеолярный экссудат отсутствовал, плевральные полости были интактны.
Таким образом, при патогистологическом исследовании обнаруживался тяжелый пневмосклероз с нарушением структуры легких в виде чередования полей склероза и эмфиземы, что напоминало пчелиные соты (honeycomb lung – «сотовое» легкое). Вслед за описанными L. Hamman и A. Rich быстропрогрессирующими формами заболевания появились сообщения о хронических формах этого патологического процесса, длящегося в течение нескольких лет, в том числе с полисистемным поражением и сочетанием с другими заболеваниями. При описании новых случаев данной болезни L. Hamman и A. Rich сделали вывод, что болезнь может протекать хронически и часто у пожилых лиц. Другие авторы (G. Peabody, N. Rubin, J. Scadding и др.) отметили, что рассеянный паренхиматозный фиброз развивается медленно, а острые случаи, описанные Hamman и Rich, встречаются редко.
В 1990 г. аутопсийные препараты больных, описанные L. Hamman и A. Rich, были пересмотрены и оказалось, что морфологическая картина полностью соответствует критериям острой интерстициальной пневмонии (ОИП). В самостоятельную нозологическую единицу ОИП была выделена лишь в 1986 г. В современных руководствах ОИП рассматривается как заболевание, характеризующееся прогрессирующей дыхательной недостаточностью, в большинстве случаев приводящей к летальному исходу. Клиническая картина заболевания напоминает острый респираторный дистресс-синдром, однако при ОИП неизвестна причина заболевания и отсутствует вовлечение в процесс других систем организма (полиорганная недостаточность).
В самостоятельную нозологическую единицу ОИП была выделена лишь в 1986 г. В современных руководствах ОИП рассматривается как заболевание, характеризующееся прогрессирующей дыхательной недостаточностью, в большинстве случаев приводящей к летальному исходу. Клиническая картина заболевания напоминает острый респираторный дистресс-синдром, однако при ОИП неизвестна причина заболевания и отсутствует вовлечение в процесс других систем организма (полиорганная недостаточность).
То, что L. Hamman и A. Rich описали болезнь у лиц мужского пола, по-видимому, не было случайностью, так как впоследствии это заболевание у мужчин стали регистрировать чаще, чем у женщин. По данным эпидемиологических исследований последних лет, распространенность идиопатического фиброзирующего альвеолита (ИФА), а речь идет именно об этом заболевании, варьирует в широких пределах: от 3-6 случаев до 20,2 среди мужчин и 13,2 среди женщин на 100 тыс. населения. Смертность от ИФА составляет 3,3 у мужчин и 2,5 у женщин на 100 тыс. населения. Средняя продолжительность жизни с момента установления диагноза составляет 28 месяцев.
населения. Средняя продолжительность жизни с момента установления диагноза составляет 28 месяцев.
За период 1995-2003 гг. показатели заболеваемости ИФА в среднем увеличились в 4 раза: в разных странах от 7 до 30 на 100 тыс. населения. Согласно статистическим прогнозам к 2020 г. интерстициальные болезни легких по количеству «потерь лет жизни» будут сравнимы с раком легкого. В большинстве случаев ИФА приводит к снижению качества жизни и инвалидизации, а стационарно-диспансерное ведение больных предусматривает дорогостоящие лечебно-диагностические мероприятия. В связи с этим прямые и непрямые медицинские затраты, обусловленные преждевременной смертью от ИФА, приносят значительный экономический и социальный ущерб .
Этиология ИФА до сих пор не известна, что стало оправдывать его современное название – «идиопатический». В настоящее время эпонимический термин «синдром Хаммена-Рича» применяется лишь как синоним острого течения ИФА, то есть диссеминированного заболевания легких неизвестной этиологии, которое характеризуется воспалением и фиброзом интерстиция, дезорганизацией структурно-функциональных единиц паренхимы легких, ведущих к рестриктивным расстройствам, нарушению газообмена и прогрессированию дыхательной недостаточности (Turners-Warwick et al. , 1980).
, 1980).
Таким образом, ИФА – это патология преимущественно периферических отделов легких, характеризующаяся различной степенью интерстициального воспаления альвеолярного аппарата (лимфоциты, макрофаги, плазматические клетки), формированием фиброза вокруг альвеолярных ходов и «сотового» легкого. Со временем ИФА и многие другие заболевания, протекающие с поражением интерстиция, объединили под родовым названием «диссеминированные процессы в легких» (ДПЛ).
Однако за последнее десятилетие широкое распространение получило применяемое в англоязычной литературе понятие «интерстициальные заболевания легких» (ИЗЛ), использование которого представляется более корректным, нежели ДПЛ, так как клинико-рентгенологический синдром при ДПЛ преимущественно ориентирован на внешние проявления болезни (рентгенологически – легочная диссеминация, клинически – прогрессирующая одышка). В то же время ИЗЛ указывает не только на эти внешние признаки, но и на морфологические структуры, в которых развивается патологический процесс, то есть в межуточных пространствах или находящихся в них, принадлежащих к интерстициальной ткани, которая находится в паренхиме, образует строму, соединительнотканный и волокнистый скелет органа.
Однако термин «интерстициальные заболевания легких», претендуя на выражение сути проблемы, в некоторых случаях противоречит ей. Действительно, большинство заболеваний и синдромов, входящих в эту группу, характеризуется поражением интерстициальной ткани легких, однако это не означает, что другие структуры легочной паренхимы (альвеолярные клетки, выстилающие изнутри просвет альвеол, эндотелиальные клетки капилляров и др.) остаются интактными. Наконец, существует ряд заболеваний (альвеолярный протеиноз легких, микролитиаз легких и др.), при которых интерстициальная ткань практически не вовлекается в патологический процесс (особенно на ранних стадиях болезни).
Таким образом, определение «интерстициальный» в некоторых случаях не вполне корректно. В связи с этим ни одно из рассматриваемых понятий не является универсальным. Исходя из этого, представляется целесообразным использовать эти два понятия как синонимы, а предпочтение отдавать термину «интерстициальное заболевание легких», общепринятому в современной мировой литературе.
В свою очередь, понятие «фиброзирующий альвеолит», которое в 1964 г. предложил J. Scadding, адекватно отражает суть патологического процесса («фиброзирования»), наблюдающегося в паренхиме легких. Термин «альвеолит» характеризует место поражения (не только стенка альвеолы, но и сама альвеола) и воспаление (естественно, не бактериальное), в котором участвуют соответствующие клетки-эффекторы, приводящие к широкому спектру клеточной и тканевой дезорганизации. Определение «фиброзирующий» как нельзя лучше подчеркивает динамику этого заболевания и его исход. Понятие «идиопатический» вычленило этот патологический процесс из целой группы фиброзирующих альвеолитов известной природы и вызванных, как правило, экзогенными аллергическими, аллерготоксическими и токсическими агентами.
Как синоним ИФА в Великобритании используется понятие «криптогенный фиброзирующий альвеолит», а в американской литературе – «идиопатический легочный фиброз» (ИЛФ), который вряд ли можно считать удачным, так как этот термин указывает на то, что в легочной ткани имеется фиброз, развившийся по неизвестной причине. В то же время понятие «фиброз» – это не нозологическая форма, так же как и понятие «рубец» какой-либо природы. Следует напомнить, что патология человека вообще и легочных заболеваний в частности строится по нозологическому принципу. Это позволяет врачу индивидуализировать диагноз и более целесообразно ориентировать круг лечебных мероприятий. В то же время имеется ряд патологических процессов, которые, несмотря на нозологическую разнородность вследствие различной этиологии, а в ряде случаев при ее неизвестности (хроническое обструктивное заболевание легких – ХОЗЛ, бронхиальная астма – БА и др.) имеют общность во многих звеньях патогенеза, клинических проявлениях, исходах, а также в подходах к лечению (МКБ-10: J84.1 Другие интерстициальные легочные болезни с упоминанием о фиброзе; J84.9 Интерстициальная легочная болезнь неуточненная).
Итак, ИФА в процессе своего становления приобрел синонимы (ИЛФ, криптогенный фиброзирующий альвеолит, синдром Хаммена-Рича, болезнь Скедлинга и др.) и был сформулирован как хроническое, постоянно прогрессирующее заболевание неизвестной этиологии, морфологической основой которого является ОИП (кистозные изменения, фибропластические фокусы, вовлечение периферической части ацинуса, пятнистый тип распределения морфологических изменений).
Таким образом, морфологические изменения при ИФА, особенно в период обострения, включают сочетание картины ОИП и позднего (организующегося) диффузного альвеолярного повреждения (ДАП), то есть формирование гиалиновых мембран (гомогенные эозинофильные ленты, повторяющие контуры альвеол), реактивной гиперплазии альвеолоцитов II типа, замещение поврежденных эпителиальных клеток альвеол фибробластами и накопление коллагена (так называемая фибропролиферация). Полный набор указанных признаков наблюдается далеко не всегда, например в исследовании Enomoto T. et al. (2002) при наличии всех признаков ДАП ни в одном из описанных случаев не было выявлено гиалиновых мембран. В исследовании Hiwatari N. et al. (1994) при изучении биопсийного материала у больных с обострением ИФА были обнаружены гиалиновые мембраны (в 5 из 7 случаев), плоскоклеточная метаплазия бронхиолоальвеолярного эпителия (у 4 больных), фибриновые тромбы (у 1 больного).
Гены, кодирующие синтез цитокинов и их рецепторов, контролируются многочисленными транскрипционными факторами и регуляторными элементами, которые, как правило, не специфичны. Так, при ИФА на клетках эпителия бронхиол обнаруживается экспрессия Fas-лигандов, известных как маркеры апоптоза. Хотя апоптоз является необходимым компонентом клеточного цикла и рассматривается в основном как защитная реакция, при ИФА Fas-Fas-взаимодействия усиливают синтез медиаторов, стимулирующих фиброз: ИЛ-8, проколлагена и фибронектина.
Подобный генетический и морфологический «уклон» ИФА предопределил своеобразный патологический процесс в легких, развивающийся в ответ на неизвестный причинный агент, который вызывает стереотипную реакцию в легочной ткани: от интерстициального и альвеолярного отека через стадию альвеолита к интерстициальному фиброзу и формированию так называемого сотового легкого. В связи с этим ИФА следует рассматривать как единую нозологическую форму, клинические проявления и течение (острое, подострое или хроническое) которой зависят от выраженности экссудации и пролиферации легочной ткани. Выраженный отек легочной ткани – накопление в альвеолах серозной жидкости, альвеолярных макрофагов, десквамированных альвеолоцитов (десквамативная форма ИФА) – характеризуется острым течением (резкая одышка, лихорадка, двухсторонние крепитирующие хрипы, резко увеличенная скорость оседания эритроцитов (СОЭ). Своевременное назначение адекватной дозы кортикостероидных препаратов приводит не только к быстрому улучшению состояния больных, но и нередко к полному их выздоровлению.
В случаях, когда экссудация выражена незначительно, преобладает пролиферация фибробластов, гиперсинтез коллагена, и уже с самого начала закладываются основы будущего интерстициального фиброза, болезнь проявляется незаметно возникшей, постепенно прогрессирующей инспираторной одышкой при умеренной физической нагрузке. Эта форма болезни в литературе получила название «муральной». При использовании лучевых методов исследования (рентгенография, компьютерная томография (КТ), в том числе высокого разрешения – КТВР) выявляется усиление легочного рисунка за счет интерстициальной ткани, преимущественно видимое в нижних легочных полях. В последующем формируется тяжистый пневмофиброз, прогрессирует дыхательная недостаточность.
При исследовании функции внешнего дыхания определяется классический рестриктивный синдром. По мере прогрессирования болезни нарастает гипоксемия, повышается давление в легочной артерии. При муральной форме ИФА морфологические изменения более глубокие, чем при десквамативной, так как поражаются не только альвеолярные клетки, но и эндотелий капилляров, а также базальные мембраны. Слабо выраженная экссудация за счет преобладания пролиферативного компонента делает эту форму заболевания рефрактерной к проводимой терапии и прогностически неблагоприятной.
Существует широкий спектр разных вариантов поражения интерстиция легких, близких к ИФА по клиническим и морфологическим признакам, названных хроническими идиопатическими интерстициальными пневмониями (ИП). Большой вклад в исследование патоморфологических изменений легких при ИП внесли A.A. Liebow и его последователи, в первую очередь A. Katzenstein и J. Myers, обозначившие морфологические ориентиры для 6 гистологических форм идиопатических ИП: обычной, десквамативной, неспецифической, облитерирующего бронхиолита с организующейся пневмонией, лимфоцитарной, гигантоклеточной. Впоследствии в группу идиопатических ИП была включена криптогенная организующаяся пневмония, тогда как лимфоцитарную ИП стали относить к лимфоцитарным заболеваниям, а гигантоклеточную ИП – к поражениям легких, вызванных тяжелыми металлами (табл.).
Заметим, что понятие «интерстициальной пневмонии», взятое из классификаций A.A. Liebow и D.E. Smith (1968), а также A. Katzenstein et al. (1998), не вполне ясно для нас, так как термин «пневмония» используется нами для обозначения острого инфекционного заболевания, при котором обязательным компонентом патологического процесса является поражение респираторных структур легкого с экссудацией в просвет альвеол. При ИФА же в интерстициальной ткани развивается фиброзирующий воспалительный процесс, инфекционный генез которого весьма сомнителен. Кроме того, подразделение ИП согласно A. Katzenstein et al. на «обычную», «десквамативную», «острую» и «неспецифическую» не совсем понятно. Связано это с тем, что в ней, во-первых, нарушен классификационный принцип: ОИП – это клиническое понятие, характеризующее течение болезни, а остальные три формы отражают морфологические особенности. Во-вторых, использование данной морфологической классификации в широкой клинической практике сегодня практически невозможно, так как гистологическая верификация того или иного варианта течения ИФА пока остается малодоступной для подавляющего большинства лечебных учреждений и НИИ.
В то же время приведенная классификация привлекает своей простотой и акцентированием внимания на клиническом течении идиопатических ИП, зависящих от типа морфологических изменений в легких.
При отсутствии морфологической верификации диагноз ИФА высоко вероятен при наличии четырех больших диагностических критериев и как минимум трех малых.
Большие диагностические критерии:
· исключение других ИЗЛ, вызванных приемом лекарственных средств, экспозицией вредных факторов внешней среды, системными заболеваниями соединительной ткани;
· изменения функции внешнего дыхания, включающие рестриктивные изменения и нарушение газообмена;
· двухсторонние ретикулярные изменения в базальных отделах легких с минимальными изменениями по типу «матового стекла» по данным КТВР;
· по результатам трансбронхиальной биопсии или бронхоальвеолярного лаважа (БАЛ) нет признаков, свидетельствующих об альтернативном заболевании.
Малые диагностические критерии:
· возраст >50 лет;
· постепенное появление диспноэ при физической нагрузке;
· длительность заболевания >3 месяцев;
· инспираторная крепитация в базальных отделах легких.
Конечным итогом диагностического поиска при ИФА является установление первичного идиопатического характера легочных изменений с определением гистологического варианта болезни. Методы визуализации, особенно КТВР, оказывают огромную помощь в выявлении обострений ИФА. Характерными находками считаются «новые» паренхиматозные затемнения по типу «матового стекла», реже по типу консолидации, возникающие на фоне изменений, типичных для ИФА (нерегулярные линейные тени, кистозные просветления, дезорганизация легочной паренхимы, тракционные бронхоэктазы). Более того, КТВР может использоваться для оценки эффективности терапии. Показано, что снижение площади «матового стекла» на 30% от первоначального у большинства больных сопровождается приростом форсированной жизненной емкости легких (ФЖЕЛ) на 10%. Это служит косвенным подтверждением того, что симптом «матового стекла» отражает обратимый компонент легочного повреждения при ИФА – активность альвеолита. Была обнаружена прямая корреляция площади «матового стекла» с морфологической активностью воспалительной инфильтрации в интерстиции легких (r=0,66; р<0,01).
Таким образом, воспалительную реакцию (альвеолит) в интерстиции легких, КТВР-эквивалентом которой является «матовое стекло», следует считать точкой приложения кортикостероидов, особенно для больных с десквамативной формой ОИП. Другим диагностически важным признаком можно считать распространенный интерстициальный фиброз и как выражение конечной стадии его развития – кистозно-буллезную перестройку легочной ткани («сотовое» легкое). КТВР-признаки «сотового» легкого во многом сопоставимы с фибропластическими изменениями в паренхиме легких, представленными очагами грубого фиброза с образованием овальных и щелевидных структур. Кроме того, КТВР-мониторинг позволяет получить информацию о нарушениях легочной гемодинамики, включая легочную гипертензию. Таким образом, взаимосвязь признаков ИФА, обнаруживаемых на КТВР, с изменениями на территории интерстиция делает КТВР методом, сопоставимым по значимости с биопсией легких, считающейся золотым стандартом диагностики ИФА. Применение КТВР перспективно и для мониторинга ИФА с определением прогноза и эффективности лечения.
Чрезвычайно перспективным направлением диагностики в пульмонологии вообще и при ИФА в частности является исследование газового состава выдыхаемого воздуха и биохимического спектра его конденсата. Однако при этом золотым стандартом диагностики все же является гистологическая верификация легочных биоптатов. В то же время представляют интерес сообщения о наличии связи между проведением хирургической биопсии легких у больных с предполагаемым ИФА и обострением, а также снижением выживаемости. До сих пор не известно, ухудшает ли прогноз само оперативное вмешательство либо имеет место систематическая ошибка вследствие отбора больных для проведения манипуляции.
Собранные таким образом гистологические и КТ-данные, характеризующие распространенность «свежих» паренхиматозных затемнений, имеют чрезвычайную клиническую значимость. В исследовании Kuvano K. и соавт. (2002) летальность больных с диффузными паренхиматозными затемнениями составила 100%, мультифокальными – 50%, периферическими – 17%. Таким образом, прогноз больных с обострением ИФА очень неблагоприятен, а госпитальная летальность, по данным некоторых исследований, колеблется от 53 до 86% (в среднем 75%). Большинство больных в опубликованных работах находились на искусственной вентиляции легких. Основной причиной смерти больных с обострением ИФА была острая дыхательная недостаточность.
Принципиальным шагом вперед по унификации данной патологии стала разработка Международного соглашения по ИФА (Idiopathic pulmonary fibrosis: diagnosis and treatment. International consensus statement, 2000) ведущими экспертами Европейского респираторного общества и Американского торакального общества. Авторы этого соглашения пришли к заключению, что ОИП представляет собой гистопатологический паттерн, который следует отождествлять с «идиопатическим легочным фиброзом» (согласно принятой у нас терминологии – ИФА). Паттерны таких форм, как десквамативная интерстициальная пневмония, респираторная бронхиолитассоциированная интерстициальная болезнь легких, облитерирующий бронхиолит с организующей пневмонией, а также неспецифическая, лимфоцитарная и острая интерстициальная пневмонии должны рассматриваться в качестве отдельных нозологических форм и исключаться из группы пациентов с ИФА.
В любом случае прогноз таких больных очень неблагоприятен. По данным крупных эпидемиологических исследований, средняя выживаемость больных ИФА составляет около 3 лет, а выживаемость в течение 5 лет – около 30%. Наиболее частой причиной смерти является дыхательная недостаточность (40%), сердечная недостаточность (14%), бронхогенная карцинома (10%), ишемическая болезнь сердца (10%), легочные и внелегочные инфекции (7%), тромбоэмболия легочных артерий (3%) и др.
Положение больного оказывается очень сложным еще и потому, что для течения ИФА характерно неуклонное прогрессирование одышки и дыхательной недостаточности, похудание больных и развитие осложнений в виде легочной артериальной гипертензии, легочного сердца и гипоксемической комы. Пневмоторакс является редким осложнением (не более 1%) и наблюдается только на стадии «сотового» легкого (исход как мурального, так и десквамативного вариантов болезни). Еще реже (0,5%) у больных выявляются плевральные экссудаты. В финальных стадиях ИФА описаны эмболии легочной артерии, которые могут стать непосредственной причиной летального исхода.
Вполне закономерно, что в зависимости от особенностей течения заболевания стали выделять острые и хронические формы ИФА. Острый вариант ИФА, как уже было сказано выше, встречается довольно редко и характеризуется молниеносным развитием симптомов заболевания, быстро прогрессирующей дыхательной недостаточностью, выраженной гипоксемией и развитием легочной артериальной гипертензии. Летальный исход наступает в течение 2-3 месяцев от начала болезни. Хронический агрессивный вариант течения ИФА также отличается быстро прогрессирующей симптоматикой болезни, тяжелой дыхательной недостаточностью. Смерть наступает в течение года от начала заболевания. Хронический персистирующий вариант течения характеризуется не столь быстрым прогрессированием клинических симптомов. Продолжительность жизни в среднем составляет 4-5 лет. И, наконец, хронический медленно прогрессирующий вариант отличается медленным нарастанием симптомов болезни и продолжительностью жизни около 10 лет.
Несмотря на преобладающее хроническое и прогрессирующее течения, болезнь все равно может осложняться эпизодами усугубления симптоматики не связанных с инфекцией дыхательных путей, эмболией ветвей легочной артерии, декомпенсацией сердечной деятельности и другими известными осложнениями. Указанные эпизоды острого ухудшения течения ИФА было предложено обозначать как «обострение».
Для определения обострения ИФА предложены следующие критерии:
· нарастание одышки в течение 1-го месяца;
· появление новых диффузных изменений на рентгенограмме легких;
· снижение РаО2 на 10 мм рт. ст. и более;
· отсутствие связи обострения с инфекционными факторами и сердечной недостаточностью.
По данным исследования Katzenstein A., Myers J. (1998), вероятность развития обострения у больных с ИФА составляет около 9% в течение 1-го года.
Причины обострения ИФА, как правило, остаются неизвестными. Так, в большинстве исследований, посвященных данной проблеме, предпринимались все диагностические попытки для исключения респираторных инфекций, сердечной недостаточности, но причинный фактор обострения так и не был найден. Все же иногда можно проследить связь развития обострения ИФА с причинным фактором. В исследовании Kamp D.W. (2003) у 3 из 11 больных обострение ИФА развилось после выполнения инвазивных диагностических процедур (хирургической биопсии легких или проведения БАЛ). Ассоциацию инвазивных процедур с обострениями у больных ИФА подтверждают описания единичных клинических случаев, в которых отмечено развитие обострений ИФА после проведения хирургической биопсии и резекции легких, а также БАЛ.
В исследовании O. Nsshiyama и соавт. (2001), в котором были проанализированы исходы больных с ИЗЛ после хирургической биопсии легких за 10-летний период, выявлена довольно высокая ранняя летальность больных ИФА через 30 дней после биопсии – 16,7%. В то же время летальность больных с другими ИЗЛ после биопсии легких составляла 1,7%. В данном исследовании в 80% случаев причиной смерти больных ИФА после биопсии стало острое повреждение легких. С учетом таких причинно-следственных связей некоторые эксперты считают, что проведение инвазивных диагностических манипуляций – опасное мероприятие у больных с ИФА, за исключением некоторых случаев, когда высок риск инфекционных или онкологических осложнений. Среди возможных причин обострения ИФА некоторые исследователи отмечают использование противоопухолевых лекарственных средств, лучевую терапию, отмену или быстрое снижение доз противовоспалительных препаратов.
Список литературы находится в редакции.
СТАТТІ ЗА ТЕМОЮ
22.04.2021
Інфекційні захворювання
Урологія та андрологія
Лечение острого повреждения почек у пациентов с коронавирусной инфекцией COVID-19*
Вспышка коронавирусной инфекции 2019 (COVID-19) быстро распространилась по всему миру и стала пандемией. У большинства пациентов с COVID-19 наблюдаются легкие симптомы, но у примерно 5% пациентов развиваются тяжелые симптомы, включающие острый респираторный дистресс-синдром, септический шок и полиорганную недостаточность. Часто поражаются и почки, клинические проявления в этом случае варьируются от незначительной протеинурии до прогрессирующей острой почечной недостаточности (ОПН), требующей проведения заместительной почечной терапии (ЗПТ). …
22.04.2021
Нефрологія
Современные возможности лабораторной диагностики при остром повреждении почек
В марте этого года на базе международной медицинской образовательной платформы Medvoice состоялась очередная междисциплинарная конференция «Школа лабораторной диагностики критических состояний», собравшая множество врачей разных специальностей. Так, темой одного из докладов стало раннее определение острого повреждения почек, которую широко представил ассистент кафедры анестезиологии и реаниматологии научно-клинического центра анестезиологии и реаниматологии ПСПбГМУ им. акад. И.П. Павлова Дмитрий Васильевич Соколов….
Лечение альвеолита в Германии
Лечение альвеолита в Германии включает комплекс методов, с помощью которых немецким врачам удается переводить заболевание в длительную ремиссию и улучшать качество жизни пациента.
Альвеолит — воспалительное заболевание, которое поражает концевую часть легких – альвеолы, и приводит к замещению интерстициальной ткани соединительной тканью. Альвеолит может возникать самостоятельно или развиваться при аутоиммунных заболеваниях, инфекционных поражениях, болезнях соединительной ткани и других патологиях. Это заболевание достаточно опасно, так как сопровождается фиброзом легких, дыхательной недостаточностью и без лечения может привести к летальному исходу.
Альвеолит, который появляется самостоятельно, разделяют на несколько форм:
- идиопатический фиброзирующий альвеолит;
- токсический альвеолит;
- аллергический альвеолит.
Каждая из них имеет особенности терапии, поэтому лечить это заболевание нужно в специализированных клиниках. В Германии лечение альвеолита проводится в пульмонологических центрах, где знают, как лечить эту болезнь, чтобы добиться лучших результатов.
Методы лечения альвеолита в Германии
Прежде чем начинать лечение, проводится комплексная диагностика альвеолита, которая включает: лабораторные анализы, рентгенологические методы, бронхоскопию, МРТ, биопсию легкого.
После того, как заболевание точно определено и обозначена степень поражения тканей, врач подбирает нужное лечение.
Обычно для лечения альвеолита легких используют терапевтические методы. Это могут быть:
- Лекарственная терапия (цитостатики, глюкокортикоиды, антифиброзные препараты, иммунодепрессанты, антигистаминные препараты).
- Кислородная терапия (оксигенотерапия).
- Дыхательные упражнения.
Лекарственные препараты подбираются в зависимости от формы альвеолита и степени развития заболевания.
В некоторых случаях может быть рекомендована трансплантация легких.
У вас есть возможность попасть на лечение альвеолита в лучший пульмонологический центр Германии Клинику Асклепиос Гаутинг. Это очень авторитетное медицинское заведение, которое уже более 70 лет занимается лечением заболеваний легких. В этой клинике вас ждут лучшие пульмонологи, инновационные методы лечения и повышенный комфорт.
Клиника пульмонологии Асклепиос Гаутинг
Диагностика и лечение в Германии позволяет обнаруживать и эффективно лечить болезни любой сложности. Свяжитесь с нами, чтобы узнать, как поехать на лечение альвеолита и других болезней органов дыхания в Германию.
Срочная консультация по телефону
+49 8171 387 737
Динамика изменений кровообращения в легких при развитии хронической дыхательной недостаточности у пациентов с хронической обструктивной болезнью легких и идиопатическим фиброзирующим альвеолитом | Золотницкая
1. Авдеев С.Н. Современные подходы к диагностике и терапии легочной гипертензии у пациентов с хронической обструктивной болезнью легких. Пульмонология; 2009; 1: 90–101.
2. Чучалин А.Г., ред. Хроническая обструктивная болезнь легких. М.: Атмосфера; 2011.
3. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for diagnosis, management, and prevention of chronic obstructive pulmonary disease. NHLBI / WHO workshop report. Last updated 2011. www.goldcopd.org/
4. Kubo K., Ge R.L., Koizumi T. et al. Pulmonary artery remodeling modifies pulmonary hypertension during exercise in severe emphysema. Respir. Physiol. 2000; 120 (1): 71–79.
5. Rizkallah J., Man S.F., Sin D.D. Prevalence of pulmonary embolism in acute exacerbations of COPD: a systematic review and metaanalysis. Chest. 2009; 135 (3): 786–793.
6. Zakynthinos E., Daniil Z., Papanikolaou G., Makris D. Pulmonary hypertension in COPD: pathophysiology and therapeutic targets. Curr. Drug Targets. 2011; 12 (4): 501–513.
7. Лукина О.В., Амосов В.И., Золотницкая В.П. и др. Лучевая диагностика нарушений кровообращения у больных хронической обструктивной болезнью легких различных фенотипов. Лучевая диагностика и терапия. 2013; 4: 88–94.
8. Lee J.H., Lee Y.K., Kim E.K. et al. Responses to inhaled longacting betaagonist and corticosteroid according to COPD subtype. Respir. Med. 2010; 104: 542–549.
9. Амосов В.И. Лучевая диагностика интерстициальных заболеваний легких. Национальное руководство по лучевой диагностике и терапии. М.: ГЭОТАР’Медиа; 2014: 301–326.
10. Hasegava B. SPECT and SPECT – CT. 92nd Scientific Assembly and Annual Meeting Radiologic Society of North America. 2006: 171.
11. Савельев В.С., Яблоков Е.Г. Тромбоэмболия легочной артерии – актуальная проблема экстренной хирургии. Острые и хронические поражения холодом. В кн.: Савельев B.C., Яблоков Е.Г., Кириенко А.И. Тромбоэмболия легочной артерии. М.: Медицина; 1982: 68–70.
12. Савельев B.C., Яблоков Е.Г., Кириенко А.И. Массивная эмболия легочных артерий. М.: Медицина; 1990.
13. Амосов В.И., Золотницкая В.П. Способ функциональной перфузионной сцинтиграфии для диагностики заболеваний легких. Ученые записки СанктПетербургского государственного медицинского университета им. акад. И.П.Павлова. 2012; 19 (3): 55–58.
14. Илькович М.М., Новикова Л.Н. Идиопатический фиброзирующий альвеолит (ИФА). В кн.: Илькович М.М., Кокосов А.Н., ред. Интерстициальные заболевания легких. Руководство для врачей. СПб: Нормиздат; 2005: 127–183.
15. Weizenblum E., Demedts M. Treatment of pulmonary hypertension in chronic obstructive pulmonary disease. Eur. Respir. Mon. 1998; 7: 180–188.
Идиопатический легочный фиброз. Эффективный метод снижения одышки
Идиопатический легочный фиброз – заболевание легких, при котором происходит повреждение и утолщение стенок легочных альвеол. Альвеолы это такие маленькие «мешочки», через стенки которых происходит проникновение кислорода из воздуха в кровь. При поражении альвеол легочная ткань уплотняется (фиброзируется), что приводит к необратимому прогрессирующему снижению функции легких. Синонимами идиопатического легочного фиброза являются: идиопатический фиброзирующий альвеолит, фиброзирующий альвеолит. Как правило, заболевание возникает в возрасте старше 40 лет. К сожалению, до сих пор причина этой болезни не известна.
У кого может возникнуть идиопатический легочный фиброз (ИЛФ)?
В группе риска находятся:
- курильщики;
- люди, работающие во вредных производственных условиях;
- пациенты с отягощенной наследственностью (если ИЛФ есть у близких родственников).
Симптомы идиопатического легочного фиброза.
Как правило, заболевание начинается медленно и незаметно для больного.
Позднее появляются следующие симптомы:
- сухой кашель;
- одышка при физической нагрузке (сначала при выраженной нагрузке, затем и в покое).
Идиопатический легочный фиброз, диагностика.
Для подтверждения диагноза доктору обязательно нужно исключить заболевания легких известной природы, которые могут также проявляться кашлем и прогрессирующей одышкой. Если в результате тщательного обследования явной причины этих симптомов не найдено, то заболевание считают идиопатическим (неизвестной природы).
При подозрении на идиопатический легочный фиброз минимальный план обследования включает:
- анализ крови;
- исследование функции внешнего дыхания (спирография), которая помогает более точно определить причину одышки, т.к. она чаще всего встречается при ХОБЛ, эмфиземе легких , бронхиальной астме и других заболеваниях;
- компьютерную томографию легких.
В настоящее время компьютерная томография легких является одной из самых точных методик диагностики идиопатического легочного фиброза.
Если после тщательно проведенного расспроса, осмотра и проведенных исследований у доктора остаются сомнения в диагнозе, то проводится биопсия легких. Биопсия – процедура, при которой хирург оперативным путем получает маленький участок ткани пациента (в данном случае – легочной ткани). Затем полученный образец под микроскопом исследует врач-патоморфолог, для того чтобы найти признаки идиопатического легочного фиброза.
Лечение идиопатического легочного фиброза.
До сих пор, к сожалению, не разработано достаточно эффективного медикаментозного лечения ИЛФ. Заболевание медленно и неуклонно прогрессирует, одышка постепенно нарастает и беспокоит при малейших физических усилиях, даже при разговоре.
При ИЛФ условно выделяют стабильную стадию (ремиссия) и ухудшение (обострение).
При быстром ухудшении самочувствия, внезапном нарастании одышки необходимо срочно обратиться к Вашему доктору. Такая ситуация часто требует госпитализации в больницу. Так же при обострении ИЛФ доктор дополнительно назначит на короткое время гормональные препараты (глюкокортикоиды, например, преднизолон) и антибиотики (при присоединении воспаления легких). Для профилактики обострений Ваш лечащий доктор может рекомендовать противогриппозную вакцинацию 1 раз в год и однократную антипневмококковую вакцинацию (для профилактики развития воспаления легких).
При ИЛФ в стабильной стадии (ремиссия) больному необходимо:
- обязательно прекратить курение (в том числе пассивное), т.к. оно способствует прогрессированию болезни;
- участвовать в программах легочной реабилитации. Инструктор лечебной физкультуры расскажет Вам о различных дыхательных упражнениях, которые способствуют уменьшению одышки и общей слабости;
- лечить рефлюксную болезнь (при ее наличии). Гастроэзофагеальная (желудочно-пищеводная) рефлюксная болезнь – заболевание, при котором происходит заброс небольшого количества кислоты из желудка в пищевод и дыхательные пути. Доказано, что это заболевание способствует прогрессированию ИЛФ. Лечение рефлюксной болезни поможет уменьшить повреждение легких при ИЛФ;
- регулярно принимать лекарственные препараты, которые назначил Ваш лечащий доктор. В последние годы ведется активная разработка перспективных препаратов для лечения больных с ИЛФ. Уточните у своего лечащего врача о возможности наблюдения и лечения в крупном научно-исследовательском учреждении (например, НИИ пульмонологии), где могут быть доступны современные препараты;
- проводить длительную кислородотерапию. При ИЛФ, со временем, возникает гипоксемия (низкое содержание кислорода в крови).
Косвенно определить наличие гипоксемии может Ваш доктор. Для этого необходим пульсоксиметр. При гипоксемии только лечение кислородом может уменьшить одышку. В настоящее время самым удобным способом для длительной кислородотерапии является использование кислородных концентраторов. Это приборы, которые вырабатывают кислород из окружающего воздуха. Кроме устранения одышки, длительная кислородотерапия позволяет продлить жизнь пациентам с ИЛФ и дождаться радикального и самого эффективного способа лечения – трансплантации легких. Трансплантация легких – хирургическая операция по замене 1 или обоих поврежденных легких на легкие здорового донора.
Позвоните прямо сейчас по телефону и получите качественную консультацию касательно выбора оборудования!
Pulmonology — Идиопатический фиброзирующий альвеолит…
Идиопатический фиброзирующий альвеолит (синдром Хаммена-Рича) – диффузный прогрессирующий интерстициальный пневмофиброз, сопровождающийся нарастающей дыхательной недостаточностью.
Актуальность. Распространенность идиопатического фиброзирующего альвеолита (ИФА) варьирует в широких пределах: от 3-6 случаев до 20,2 среди мужчин и 13,2 среди женщин на 100 тыс. населения. Смертность от ИФА составляет 3,3 у мужчин и 2,5 у женщин на 100 тыс. населения. Средняя продолжительность жизни с момента установления диагноза составляет 28 месяцев. За период 1995-2003 гг. показатели заболеваемости ИФА в среднем увеличились в 4 раза: в разных странах от 7 до 30 на 100 тыс. населения. Согласно статистическим прогнозам к 2020 г. интерстициальные болезни легких по количеству «потерь лет жизни» будут сравнимы с раком легкого. В большинстве случаев ИФА приводит к снижению качества жизни и инвалидизации. Среди всех заболеваний пульмонологического профиля доля ИФА составляет около 3 %.
История. В 1933, 1935 и 1944 гг. L. Hamman и A. Rich первыми описали четырех молодых людей с симптомокомплексом быстропрогрессирующей одышки, мучительного непродуктивного кашля, периферическими отеками, гипоксией мозга с эпизодами бреда, синюшностью и лихорадкой. Эти случаи болезни привели к смерти больных в течение 2-6 месяцев. В дальнейшем подобную клиническую картину авторы наблюдали еще у пяти человек, погибших через 1-6 месяцев. При исследовании аутопсийного материала было установлено рассеянное паренхиматозно-фиброзное изменение в обоих легких, напоминающее пчелиные соты (honeycomb lung – «сотовое» легкое). Вслед за описанными L. Hamman и A. Rich быстропрогрессирующими формами заболевания появились сообщения о хронических формах этого патологического процесса, длящегося в течение нескольких лет, в том числе с полисистемным поражением и сочетанием с другими заболеваниями. При описании новых случаев данной болезни L. Hamman и A. Rich сделали вывод, что болезнь может протекать хронически и часто у пожилых лиц. Другие авторы (G. Peabody, N. Rubin, J. Scadding и др.) отметили, что рассеянный паренхиматозный фиброз развивается медленно, а острые случаи, описанные Hamman и Rich, встречаются редко.
Этиология ИФА не установлена. Наиболее признанной считается гипотеза о полиэтиологичности заболевания, согласно которой факторы бактериальной, вирусной, аллергической, аутоиммунной, токсической и др. природы играют роль пускового механизма. Высказывается предположение о генетической предрасположенности к ИФА.
Выделяют две клинико-морфологические формы ИФА:
1. муральную –с преимущественным поражением интерстициальной ткани легких и развитием диффузного фиброза,
2. десквамативную – поражение в основном альвеол с заполнением их слущенными альвеолоцитами и альвеолярными макрофагами и с последующим фиброзированием межальвеолярных перегородок.
Клиника ИФА
Начало заболевания может быть острым и постепенным.
Острое начало обычно наблюдается в молодом возрасте и характеризуется лихорадкой (до 38 – 40С), общей слабостью, нарастающей одышкой, кашлем, как правило, сухим.
Чаще встречается постепенное начало заболевания с неуклонно прогрессирующей одышкой, сухим кашлем, повышенной утомляемостью. Степень выраженности одышки отражает тяжесть заболевания. Характерной особенностью одышки считается невозможность сделать глубокий вдох. Из других признаков ИФА могут наблюдаться боли в грудной клетке, усиливающиеся при глубоком вдохе, повышение температуры тела, свидетельствующее об активности патологического процесса, общая слабость, похудение (отдельные больные теряют в весе 10-12 кг за 3-4 мес), артралгии, утренняя скованность, явления синдрома Рейно, миалгии.
При осмотре отмечается цианоз, выраженность которого зависит от тяжести заболевания. При длительном течении ИФА появляются характерные изменения ногтевых фаланг пальцев в виде «барабанных палочек» и «часовых стёкол». Перкуторно над лёгкими, чаще в нижних отделах, определяется укорочение перкуторного звука. При аускультации выявляются, обычно с обеих сторон, крепитация и влажные разнокалиберные хрипы, имеющие своеобразный тембр – «треск целлофана». У отдельных больных над верхними легочными полями (по передней поверхности) выслушивается на вдохе «попискивание», напоминающее звук трения пробки. Этот звуковой феномен считается признаком выраженных плевропневмосклеротических изменений.
Диагностика
Лабораторные тесты при ИФА обычно не несут ценной информации. До 70% больных имеют повышенное СОЭ, у большинства обнаруживают циркулирующие иммунные комплексы, повышение общего уровня иммуноглобулинов. Примерно 20-40% больных ИФА имеют повышенные титры ревматоидного и антинуклеарного факторов. У больных ИФА, как правило, повышен сывороточный уровень лактатдегидрогеназы (ЛДГ), возможным источником которой являются альвеолярные макрофаги и альвеолоциты 2-го типа. В одном из исследований сывороточный уровень ЛДГ был тесно связан с другими маркерами активности ИФА (числом нейтрофилов и эозинофилов бронхоальвеолярного лаважа) и снижение ЛДГ наблюдалось при успешной терапии заболевания. Перспективный маркер активности заболевания – сывороточный уровень протеинов А и D сурфактанта (surfactant proteins A and D – SP-A and SP-D) – основных гликопротеинов сурфактанта. Уровни протеинов сурфактанта достаточно хорошо отражают активность воспалительного процесса в легких при ИФА. Еще одно направление оценки активности альвеолита – определение в сыворотке муцин-антигенов, отражающих гиперплазию и гипертрофию альвеолоцитов 2-го типа и их повышенную секреторную функцию при интерстициальном воспалении.
Рентгенографические изменения в лёгких при ИФА, как правило, двусторонние и с наибольшей выраженностью в нижних долях лёгких, зависят от формы (муральная, десквамативная) и фазы заболевания. Характерны усиление и деформация легочного рисунка в нижних и средних отделах, перегородочные линии (линии Керли) и дисковидные ателектазы в латеральных отделах, расширение и нечёткость контуров сердечно-сосудистой тени за счёт фиброзно-индуративных изменений в корнях лёгких. По мере прогрессирования болезни в нижних отделах появляются нечётко очерченные очаги затемнения, часто сливающиеся, уменьшается объём нижних долей лёгких, что обусловливает подъём диафрагмы. Наряду с этим отмечаются муфтообразные утолщения стенок мелких бронхов и сосудов базальных сегментов. В поздней стадии регистрируется рентгенологическая картина «сотового лёгкого» — очаговые тени вперемежку с участками повышенной прозрачности.
Компьютерная томография — высокочувствительный метод выявления диссеминированных и диффузных интерстициальных поражений легких, нередко еще до появления выраженных клинических симптомов болезни. КТ-признаки ИФА: нерегулярные линейные тени, снижение прозрачности легочных полей по типу «матового стекла» и кистозные просветления от 2 до 20 мм в диаметре. Признаки «сотового легкого» выявляют в 70% случаев при КТ, при обзорной рентгенографии – в 15-30%.
При исследовании функции внешнего дыхания определяется рестриктивный тип нарушения вентиляции: увеличение частоты дыхания, уменьшение объема вдоха, снижение общей и жизненной ёмкости лёгких. Обструктивные нарушения на уровне периферических дыхательных путей наблюдаются при наличии выраженного пневмофиброза.
Частое поверхностное дыхание, характерное для ИФА, приводит к изменениям газового состава крови. По мере прогрессирования заболевания появляется гипоксемия , сопровождающаяся гипокапнией, гиперкапния появляется только на терминальных этапах ИФА.
Бронхоальвеолярный лаваж (БАЛ) имеет важное значение для определения активности воспалительного процесса в легких. При ИФА выявляется нейтрофильный тип лаважной жидкости, реже смешанный – нейтрофильно-лимфоцитарный. По характеру цитологического состава БАЛ можно судить о прогнозе заболевания, появление эозинофилов в бронхоальвеолярной жидкости служит неблагоприятным прогностическим признаком. Сочетание нейтрофилеза и эозинофилии в БАЛ характеризует выраженность альтерации и фибропластических процессов, является также неблагоприятным прогностическим признаком. Иногда у пациентов с ИФА наблюдается лимфоцитарный профиль БАЛ. Лимфоцитоз лаважа коррелирует с выраженностью альвеолярного и септального воспаления при относительном отсутствии признаков «сотового легкого», по данным открытой биопсии легких, и также связан с хорошим ответом на терапию стероидами. Лимфоцитарный характер БАЛ относится к положительным прогностическим факторам заболевания.
При отсутствии морфологической верификации диагноз ИФА высоко вероятен при наличии четырех больших диагностических критериев и как минимум трех малых.
Большие диагностические критерии:
• исключение других ИЗЛ, вызванных приемом лекарственных средств, экспозицией вредных факторов внешней среды, системными заболеваниями соединительной ткани;
• изменения функции внешнего дыхания, включающие рестриктивные изменения и нарушение газообмена;
• двухсторонние ретикулярные изменения в базальных отделах легких с минимальными изменениями по типу «матового стекла» по данным КТ;
• по результатам трансбронхиальной биопсии или бронхоальвеолярного лаважа (БАЛ) нет признаков, свидетельствующих об альтернативном заболевании.
Малые диагностические критерии:
• возраст >50 лет;
• постепенное появление диспноэ при физической нагрузке;
• длительность заболевания >3 месяцев;
• инспираторная крепитация в базальных отделах легких.
Конечным итогом диагностического поиска при ИФА является установление первичного идиопатического характера легочных изменений с определением гистологического варианта болезни.
Осложнения: легочная артериальная гипертензия, легочное сердце гипоксемическая кома, к редким осложнениям относится пневмоторакс (не более 1%) и наблюдается только на стадии «сотового» легкого (исход как мурального, так и десквамативного вариантов болезни), еще реже (0,5%) у больных выявляются плевральные экссудаты. В финальных стадиях ИФА описаны эмболии легочной артерии, которые могут стать непосредственной причиной летального исхода.
Лечение: препаратами выбора в лечении ИФА являются глюкокортикостероиды, иммунодепрессанты и Д-пенициламин. На ранних стадиях заболевания назначают преднизолон в дозе 1 мг/кг/сут. Эффективность терапии оценивают на 5-8 неделе лечения. В случае эффективности лечения, его продолжают в течении 3-6 мес. С последующей отменой препарата или уменьшением дозы до минимальной эффективной. В поздней стадии заболевания применение ГКС, особенно в больших дозаз, не показано, т.к. они, стимулируя ингибиторы протеиназ, способствуют усилению дозревания коллагена. Поэтому на поздних стадиях предпочтение отдают иммунодепрессантам (азатиоприн, циклофосфамид) и Д-пенициламину (купринилу). Азатиоприн назначают в по 2,5-3 мг/кг/сут на протяжении 1-2 мес, затем по 1,5-2 мг/кг/сут до 1-2 лет. Циклофосфамид применяют в качестве монотерапии или в сочетании с малыми дозами ГКС в дозе 100-200 мг 1 раз в сутки. Дозу подбирают в зависимости от количества лейкоцитов в гемограмме (не менее 3*109/л). Д-пенициламин подавляет избыточное коллагенообразование, назначается по схеме: 1 нед. – 300 мг/сут, 2 нед – 600 мг/сут, 3 нед. – 1200 мг/сут. Затем дозу снижают в аналогичном порядке до поддерживающей -150 мг/сут, которую пациент принимает в течении 1-2 лет. У больных молодого возраста в терминальной стадии заболевания препаратом выбора является трансплантация одного легкого.
Прогноз больных ИФА неблагоприятен. По данным крупных эпидемиологических исследований, средняя выживаемость больных ИФА составляет около 3 лет, а выживаемость в течение 5 лет – около 30%. Наиболее частой причиной смерти является дыхательная недостаточность (40%), сердечная недостаточность (14%), бронхогенная карцинома (10%), ишемическая болезнь сердца (10%), легочные и внелегочные инфекции (7%), тромбоэмболия легочных артерий (3%) и др.
Источники:
1. Середюк Н.М., Нейко Є.М. Госпітальна терапія. – Київ.: Здоров’я, 2003 – с. 638 – 644.
2. Гуйда П.П. Опыт лечения идиопатического фиброзирующего альвеолита. – Харьков.: Врачебная практика, №1, 2004 — с. 50 – 53.
3. Гаврисюк В.К. Интерстициальные заболевания легких: вопросы терминологии, классификации и эпидемиологии. – Київ.: Здоров’я України, тематичний номер (лютий), 2010 – с. 18 – 19.
4. Ходош Э.М., Крутько В.С. Идиопатический фиброзирующий альвеолит: терминология, классификация, течение, обострение, спорные вопросы. – Київ.: Здоров’я України, №18, 2007 – с. 40.
Системная склеродермия. Диагностика, лечение, прогноз
Системная склеродермия (ССД) — прогрессирующее полисиндромное заболевание с характерными изменениями кожи, опорно-двигательного аппарата, внутренних органов (легких, сердца, пищеварительного тракта, почек) и распространенными вазоспастическими нарушениями. В основе заболевания лежат нарушения микроциркуляции, воспаление и поражение соединительной ткани с преобладанием фиброза.
ССД относится к системным заболеваниям соединительной ткани и одновременно является характерным представителем склеродермической группы болезней, куда входят также ограниченная (очаговая, линейная) склеродермия, диффузный эозинофильный фасциит, склеродерма Бушке, мультифокальный фиброз, индуцированные формы склеродермии и псевдосклеродермические состояния.
Эпидемиология.
ССД является редким заболеванием, его распространенность в среднем составляет от 240 до 290 случаев на 1 миллион населения. Заболевают чаще женщины на пятом десятилетии жизни (соотношение женщин и мужчин — 7:1), но болезнь может начаться и в раннем детстве, и у людей пожилого возраста. Летальность составляет 1,4-5,3 на 1 млн населения. Поражения легких и сердца выходят на первый план среди причин летальных исходов при ССД.
Этиология и патогенез.
Этиология ССД сложна и недостаточно изучена. Предполагается мультифакторный генез ССД, обусловленный взаимодействием неблагоприятных экзо-и эндогенных факторов с генетической предрасположенностью к заболеванию. ССД является уникальной природной моделью генерализованного фиброза, изучение механизмов которого имеет общее клиническое значение.
Ведущим звеном патогенеза и морфогенеза ССД является нарушение микроциркуляции с пролиферацией и деструкцией эндотелия, утолщением стенки и сужением просвета микрососудов, вазоспазмом, агрегацией форменных элементов, стазом, деформацией и редукцией капиллярной сети (облитерирующая микроангиопатия).
Классификация.
В зависимости от распространенности кожных изменений и основного симптомокомплекса выделяют клинические формы ССД. Кроме того, в отечественную классификацию включены варианты течения и стадии развития ССД (Гусева Н.Г., 1975).
Склеродермия. Маскообразность лица, «кисет» вокруг рта, уменьшение ротового отвесттия, телеангиэктазии
Клинические формы.
1.Диффузная форма.
2.Лимитированная форма.
3.Перекрестная форма (overlap-syndrome) :сочетание клинических признаков ССД и еще одного или нескольких системных заболеваний соединительной ткани.
4.Висцеральная форма.
5.Ювенильная склеродермия.
6.Индуцированная склеродермия (в том числе — в рамках паранеопластического синдрома).
7.Пресклеродермия: клинически изолированный синдром Рейно (СР) в сочетании с капилляроскопическими и/или иммунологическими нарушениями, свойственными ССД.
Клинические проявления.
Синдром Рейно является одним из наиболее частых и первоначальных проявлений ССД, носит генерализованный характер, отражая системность процесса, может лежать в основе мигренеобразных болей в голове и иметь висцеральную локализацию (легкие, сердце, почки). При прогрессировании СР развиваются сосудисто-трофические нарушения, ишемические некрозы (дигитальные, висцеральные)
Поражение опорно-двигательного аппарата проявляется суставным и мышечным синдромами, остеолизом и кальцинозом, что наряду с поражением кожи и СР создает картину характерного для ССД периферического симптомокомплекса. Суставной синдром нередко является одним из начальных признаков заболевания, поэтому играет важную роль в ранней диагностике ССД. Может проявляться полиартралгией, склеродермическим полиартритом, в том числе- ревматоидоподобным с развитием контрактур. Возможно сочетание ССД с ревматоидным артритом в рамках overlap синдрома
Поражение органов дыхания отмечается примерно у 70% больных и в последние десятилетия выходит на первый план среди причин смерти. Для ССД характерны два типа поражения легких: 1) интерстициальное заболевание легких (фиброзирующий альвеолит и диффузный пневмофиброз с преимущественной локализацией в базальных отделах легких), 2) легочная гипертензия (изолированная или в сочетании с базальным пневмофиброзом). Интерстициальное поражение развивается преимущественно в первые годы болезни и более выражено при диффузной форме ССД, легочная гипертензия чаще выявляется при лимитированной форме с длительным хроническим течением и преобладанием сосудистой патологии. Клинические признаки интерстициального заболевания легких неспецифичны. Пациенты жалуются на одышку, сухой кашель, быструю утомляемость. При проведении функции внешнего дыхания отмечаются нарушения по рестриктивному типу.
Поражение сердца, особенно миокарда, занимает ведущее место среди висцеральных признаков склеродермии как по частоте, так и по значимости; является основной причиной внезапной смерти больных. В основе кардиальной патологии лежат свойственные заболеванию процессы фиброзирования, поражение мелких сосудов и нарушения микроцируляции (при интактности основных коронарных артерий), приводящие к развитию зон ишемии и некоронарогенного кардиосклероза. Нередко отмечаются увеличение сердца, нарушения ритма и проводимости, инфарктоподобные изменения на ЭКГ, снижение сократительной функции миокарда. Поражение клапанного эндокарда может вести к образованию склеродермического, чаще митрального, порока сердца, отдельных случаях выявляется картина серозно-фибринозного перикардита.
Поражение пищеварительного тракта, особенно пищевода и кишечника, имеет четко очерченную, своеобразную клинико-рентгенологическую картину и по своей диагностической ценности выходит на первый план среди других висцеральных проявлений ССД. Поражение пищевода характеризуется картиной склеродермического эзофагита: дисфагия, диффузное расширение пищевода при сужении в нижней трети его, ослабление перистальтики и ригидность стенок, явления рефлюкс-эзофагита; возможно развитие пептических язв, стриктур, грыжи пищеводного отверстия. Патология кишечника может проявляться склеродермическим дуоденитом, синдромом нарушения всасывания, упорными запорами, иногда с явлениями частичной, рецидивирующей непроходимости. Нередко сочетание лимитированной формы ССД с первичным билиарным циррозом печени.
Поражение почек выявляется реже (10-20%) и варьирует от острых фатальных до хронических, субклинических форм. Острая нефропатия (истинная склеродермическая почка, склеродермический почечный криз) характеризуется бурным развитием почечной недостаточности вследствие генерализованного поражения артериол и других сосудов почек, возникновением множественных кортикальных некрозов. Клинически внезапно выявляются нарастающая протеинурия, изменения в осадке мочи, олигоурия, нередко в сочетании со злокачественной (гиперрениновой) артериальной гипертензией, ретино- и энцефалопатией (у 10% больных АД остается нормальным, так называемый нормотензивный склеродер-мический почечный криз). Без лечения (обычно в течение 1-2 мес) развивается терминальная почечная недостаточность.
Неврологическая и эндокринная симптоматика также в значительной степени обусловлена сосудистыми и фиброзными изменениями соответствующих органов и тканей. Полиневритический синдром может быть связан с феноменом Рейно или первичным поражением периферических нервов. У 10% больных может возникнуть тригеминальная сенсорная невропатия, проявляющаяся одноили двусторонним онемением лица, иногда в сочетании с болью или парастезиями. У пациентов с диффузной формой ССД часто развивается синдром запястного канала.
Из общих проявлений заболевания наиболее характерна значительная потеря массы тела, наблюдающаяся в период генерализации или быстрого прогрессирования болезни. Лихорадочная реакция обычно мало выражена.
Диагностика системной склеродермии.
Диагноз ССД основывается на характерных клинических проявлениях болезни, варьирующих в зависимости от клинической формы, течения и преобладающей патологии. Для их выявления важную роль играют данные анамнеза, физикального обследования, лабораторных и инструментальных обследований.
Лабораторные показатели имеют относительную диагностическую ценность. Исключение составляют специфические для ССД антитопоизомеразные или ан-ти-Scl-70 и антицентромерные антитела (АЦА), причем первые характеризуют острое течение и диффузную склеродермию, а антитела к центромерам встречаются преимущественно при лимитированной форме ССД. Кроме того, АЦА выявляют у 12% больных первичным билиарным циррозом (половина из которых имеют признаки ССД),
Основные принципы лечения ССД.
Наиболее активная, иногда агрессивная терапия глюкоккортикостероидами и цитостатиками проводится в первые 3-5 лет заболевания, затем она в значительной степени носит поддерживающий, симптоматический и реабилитационный характер (в отношении доз и всего комплекса лечения), за исключением периодов возможной экзацербации процесса. Основные направления медикаментозного воздействия при ССД — сосудистая, противовоспалительная и антифиброзная терапия.
Прогноз.
Прогноз неблагоприятный при диффузной быстропрогрессирующей и относительно благоприятный при хронической лимитированной ССД. Предикторами неблагоприятного прогноза являются: диффузная форма ССД, возраст начала болезни старше 45 лет, мужской пол, фиброз легких, легочная гипертензия, аритмия, поражение почек в первые 3 года болезни, анемия, высокая СОЭ, протеинурия в начале заболевания.
На улучшение прогноза влияет ранняя диагностика и адекватная терапия этой тяжелой категории больных.
В ревматологическом отделении ГБУЗ ТОКБ им. В.Д.Бабенко, ежегодно проводится обследование 15-25 пациентов с склеродермоподобными синдромами с целью уточнения диагноза. В среднем у 35- 40 % обследованных больных выявляется неревматологическая причина ревматологического симптомокомплекса, наиболее часто- опухолевые поражения ЖКТ. У 20% данный симптомокомплекс сопровождает другую ведущую ревматическую патологию или служит её первыми проявлениями. У больных с верифицированным диагнозом «ССД» проводится комплексное лечение в соответствие с требованиями стандарта терапии этого заболевания. При динамическом наблюдении производится отбор пациентов на программную «пульс-терапию» цитостатиками, в некоторых случаях-в сочетании с глюкокортикостероидами, что позволяет контролировать активность течения воспалительного процесса, снизить частоту и объём поражения жизненно-важных органов. Ранняя диагностика и комплексный подход к лечению позволяют существенно улучшить качество и продолжительность жизни указанной категории пациентов.
12 фактов о прогнозе фиброза легких и ожидаемой продолжительности жизни
Фиброз легких — это хроническое и прогрессирующее заболевание легких, при котором воздушные мешочки в легких, называемые альвеолами, покрываются рубцами и становятся жесткими, что затрудняет дыхание и получение достаточного количества кислорода в кровоток . Чтобы устранить некоторые неправильные представления о прогнозе фиброза легких и ожидаемой продолжительности жизни пациентов, мы собрали несколько часто задаваемых вопросов (и ответов), которые помогут:
Что вызывает фиброз легких?
В некоторых случаях фиброз легких возникает без известной причины (это называется идиопатическим фиброзом легких).Другие случаи вызваны воздействием вредных факторов окружающей среды (например, асбеста) и аутоиммунных заболеваний (например, ревматоидного артрита). Легочный фиброз у некоторых пациентов может быть результатом повреждения легких, вызванного приемом лекарств (например, химиотерапией). В других редких случаях генетика может предрасполагать некоторых пациентов к развитию заболевания.
Может ли фиброз легких передаваться по наследству?
Многие врачи считают, что генетика может играть роль в развитии легочного фиброза. Наследственный тип фиброза легких называется семейным фиброзом легких.
Можно ли предотвратить фиброз легких?
Можно избежать факторов риска легочного фиброза, таких как курение, что может помочь снизить риск развития этого состояния.
Какие факторы влияют на прогноз фиброза легких?
Прогноз для пациентов с фиброзом легких будет отличаться в зависимости от их возраста, общего состояния здоровья, образа жизни и тяжести заболевания на момент постановки диагноза. Пожилой возраст обычно означает худший прогноз. Прогноз у женщин обычно лучше, чем у мужчин, но причины этой разницы неизвестны.
Какова продолжительность жизни человека с фиброзом легких?
Средняя продолжительность жизни пациентов с фиброзом легких составляет от трех до пяти лет после постановки диагноза. Однако раннее выявление заболевания является ключом к замедлению прогрессирования, а такие состояния, как хроническая обструктивная болезнь легких (ХОБЛ) или легочная артериальная гипертензия (ЛАГ), могут повлиять на прогноз заболевания.
ХОБЛ — это заболевание легких, при котором хроническое воспаление вызывает частый кашель, выделение слизи и повышенный риск инфицирования.Этот тип хронического воспаления может значительно усугубить рубцевание легких (вызванное легочным фиброзом).
ЛАГ, серьезное осложнение, которое может возникнуть в результате фиброза легких, представляет собой высокое кровяное давление в кровеносных сосудах, окружающих сердце и легкие, что может негативно повлиять на прогноз для пациентов с фиброзом легких.
Каковы стадии фиброза легких?
Четыре стадии легочного фиброза: легкая, умеренная, тяжелая и очень тяжелая.Стадия заболевания пациента определяется объемом легких и тяжестью симптомов. По мере прогрессирования заболевания пациенты теряют емкость легких до тех пор, пока на тяжелых стадиях они не смогут дышать без механической помощи.
Как быстро прогрессирует фиброз легких?
Каждый год по мере прогрессирования заболевания пациенты с фиброзом легких теряют в среднем от 150 до 200 мл емкости легких, что можно контролировать с помощью спирометрии (дыхательных тестов).
Как легочная реабилитация может замедлить прогрессирование заболевания?
Пациентам с легочным фиброзом рекомендуется пройти легочную реабилитацию, где они узнают о заболевании, доступных методах лечения и дыхательных техниках, а также будут включены в программу упражнений, которая поможет укрепить их легкие и замедлить прогрессирование заболевания.
Каковы осложнения фиброза легких?
По мере прогрессирования болезни пациенты с фиброзом легких подвергаются риску других осложнений, таких как сердечная недостаточность, инсульт, тромбоэмболия легочной артерии и легочные инфекции.Слабость в легких означает, что другие ткани не получают необходимый им кислород, а рубцовая ткань делает легкие более восприимчивыми к инфекции.
Есть ли лекарство от фиброза легких?
В настоящее время нет лекарств от фиброза легких, но методы лечения могут помочь уменьшить симптомы, так как новые методы лечения находятся в стадии разработки. Иммунодепрессанты также могут быть назначены для лечения фиброза легких. В тяжелых случаях может потребоваться пересадка легких.
Как лечится фиброз легких?
Для лечения легочного фиброза используются два препарата, которые, как было доказано, уменьшают обострения и замедляют прогрессирование заболевания.Офев и Эсбриет можно применять при легком и умеренном фиброзе легких.
Есть еще вопросы?
Узнайте больше о новостях и исследованиях в области легочного фиброза на нашем веб-сайте, который включает сообщения Шарлин Маршалл в ее колонке «Моложе 30 лет: жизнь с IPF». Кроме того, Марк Козиол, единственный реципиент трансплантата легкого, ведет колонку под названием «Собираюсь жить своей жизнью», а Кристи Пациент пишет о своем опыте ухода за своей матерью, страдающей идиопатическим фиброзом легких, в своей колонке «Смелость заботиться». .”
Мы также часто размещаем на нашем сайте подкасты и флеш-брифинги. Вы можете подписаться на наш канал Soundcloud, чтобы получать обновления при появлении новых сообщений.
Следующие организации также являются хорошими источниками информации и использовались в качестве источников в этой статье:
Последнее обновление: 13 августа 2019 г.
***
Новости о фиброзе легких — это исключительно новостной и информационный веб-сайт об этом заболевании.Он не предоставляет медицинских консультаций, диагностики или лечения. Этот контент не предназначен для замены профессиональных медицинских консультаций, диагностики или лечения. Всегда обращайтесь за советом к своему врачу или другому квалифицированному поставщику медицинских услуг по любым вопросам, которые могут у вас возникнуть относительно состояния здоровья. Никогда не пренебрегайте профессиональным медицинским советом и не откладывайте его обращение из-за того, что вы прочитали на этом веб-сайте.
Эмили имеет докторскую степень.Доктор биохимии из Университета Айовы и в настоящее время является докторантом в Университете Висконсин-Мэдисон. Она окончила Технологический институт Джорджии со степенью магистра химии и имеет степень бакалавра биологии и химии Университета Центрального Арканзаса.
Эмили увлечена научным общением и в свободное время пишет и иллюстрирует детские сказки.
Всего сообщений: 10
Озге имеет степень магистра.Доктор философии в области молекулярной генетики в Лестерском университете и докторская степень в области биологии развития в Лондонском университете королевы Марии. Она работала научным сотрудником постдокторантуры в Университете Лестера в течение шести лет в области поведенческой неврологии, прежде чем перешла в научную коммуникацию. Почти два года она работала научным сотрудником по связям с общественностью в благотворительной организации в Лондоне.
Стадии фиброза легких
Врачи определяют стадию прогрессирования легочного фиброза у пациента, чтобы лучше понимать, контролировать и сообщать о развитии болезни; принимать наилучшие возможные решения в отношении лечения; и предложить точный прогноз.
Традиционная стадия фиброза легких определяется оценкой пациента по результатам теста форсированной жизненной емкости легких (FVC). Тест прост, и его выполнение занимает всего около трех минут. Пациенты вдыхают, а затем выдыхают в течение длительного периода времени в спирометрическое устройство, которое измеряет максимальный выдох и максимальный вдох (продолжительный выдох с последующим вдохом).
Степень тяжести
IPF определяется на основании показателей спирометрии. Прогнозируемое значение ФЖЕЛ более 75% считается легким, от 50% до 75% — умеренным, от 25% до 49% — тяжелым и менее 25% — очень тяжелым.
Ограничения по шкале стадий фиброза легких
Хотя традиционная система определения стадии фиброза легких используется врачами в течение многих лет, некоторые исследователи полагают, что ее использование имеет диагностические ограничения. Несмотря на рейтинги FVC, традиционное определение стадии иногда может показаться произвольным и не основанным на эпидемиологических или биологических данных. И хотя использование этих стадий может помочь приблизиться к прогрессированию легочного фиброза, еще предстоит выяснить, действительно ли стадии актуальны для лечения заболевания, потому что прогрессирование легочного фиброза не является линейным, и каждый пациент имеет уникальный индивидуальный опыт.
Пытаясь улучшить стадирование фиброза легких, исследователи разрабатывают новые методы определения стадии, которые, вероятно, будут включать такие факторы, как возраст, недавняя респираторная госпитализация, исходный уровень FVC, 24-недельное изменение FVC и возможные биомаркеры. Другой метод стадирования, известный как модель GAP, учитывает пол (G), возраст (A) и две переменные физиологии легких (P) (форсированная жизненная емкость легких и диффузионная способность легких по монооксиду углерода).
Pulmonary Fibrosis News — это исключительно новостной и информационный веб-сайт об этом заболевании.Он не предоставляет медицинских консультаций, диагностики или лечения. Этот контент не предназначен для замены профессиональных медицинских консультаций, диагностики или лечения. Всегда обращайтесь за советом к своему врачу или другому квалифицированному поставщику медицинских услуг по любым вопросам, которые могут у вас возникнуть относительно состояния здоровья. Никогда не пренебрегайте профессиональным медицинским советом и не откладывайте его обращение из-за того, что вы прочитали на этом веб-сайте.
- http://pulmonaryfibrosismd.com/stages-of-idiopathic-pulmonary-fibrosis/
- http: // err.ersjournals.com/content/23/132/220
Озге имеет степень магистра. Доктор философии в области молекулярной генетики в Лестерском университете и докторская степень в области биологии развития в Лондонском университете королевы Марии. Она работала научным сотрудником постдокторантуры в Университете Лестера в течение шести лет в области поведенческой неврологии, прежде чем перешла в научную коммуникацию. Почти два года она работала научным сотрудником по связям с общественностью в благотворительной организации в Лондоне.
Всего сообщений: 110
Патриция имеет докторскую степень в области медицинской микробиологии и инфекционных заболеваний в Медицинском центре Лейденского университета в Лейдене, Нидерланды. Она изучала прикладную биологию в Universidade do Minho и была научным сотрудником в Институте молекулярной медицины в Лиссабоне, Португалия. Ее работа была сосредоточена на молекулярно-генетических особенностях инфекционных агентов, таких как вирусы и паразиты.
Тест на легочный фиброз, известный как спирометрия, измеряет функцию легких
Функциональный тест легких, известный как спирометрия, измеряет скорость потока воздуха в легкие и из них, а также предполагаемый размер легких человека.
Спирометрия — это лишь один из тестов, используемых для диагностики фиброза легких (ЛФ). Ни один тест не является окончательным, поэтому врачи часто назначают серию обследований, чтобы установить диагноз.
Спирометрические тесты могут использоваться для диагностики ряда заболеваний легких, включая астму, хроническую обструктивную болезнь легких (ХОБЛ) и другие состояния, влияющие на дыхание. Тест также можно использовать для проверки эффективности лечения.
Что такое скорость воздушного потока?
Скорость воздушного потока — это измерение количества воздуха, проходящего через легкие за определенный период.
Основные измерения расхода воздуха спирометрией включают:
- Принудительная жизненная емкость легких (FVC) — это измерение размера легких в литрах.Он представляет собой объем воздуха в легких, который можно выдохнуть после глубокого вдоха.
- Объем форсированного выдоха за одну секунду (FEV-1) — измеряет, сколько воздуха можно выдохнуть за одну секунду после глубокого вдоха.
Низкие значения ФЖЕЛ указывают на ограничение дыхания. Низкие значения ОФВ-1 указывают на значительную обструкцию.
Когда вы получите результаты спирометрии, вы, скорее всего, увидите соотношение ОФВ1 / ФЖЕЛ. Это число представляет собой процент размера легких (FVC), который можно выдохнуть за одну секунду.Если ОФВ1 равен 4, а ФЖЕЛ — 5, то соотношение ОФВ1 / ФЖЕЛ будет 4/5 или 80 процентов. Это означает, что пациент может выдохнуть 80 процентов вдыхаемого воздуха в легкие за одну секунду.
Как работает спирометрический тест?
Спирометрический тест требует, чтобы вы вдохнули через трубку, прикрепленную к устройству, называемому спирометром. Перед проведением теста врач или медсестра дадут вам инструкции. Воспользуйтесь моментом перед тестированием, чтобы прояснить вопросы, которые могут у вас возникнуть.
Во время теста вы, скорее всего, будете сидеть, и вам на нос наденут зажим, чтобы ноздри были закрыты.
Вам будет предложено сделать глубокий вдох и выдохнуть с максимальной силой в течение нескольких секунд. Убедитесь, что ваши губы закрывают трубку, в которую вы выдыхаете, чтобы воздух не выходил.
Вам нужно будет повторить тест не менее трех раз, чтобы результаты выровнялись. Если результаты сильно различаются, вас могут попросить повторить тест еще раз. Объединенные результаты — это окончательный результат. Обычно весь процесс тестирования и обратной связи занимает не более 15 минут.
Ваш врач может прописать вам бронходилататор, чтобы открыть ваши легкие после первого раунда спирометрии. Затем вам нужно подождать 15 минут и повторить тест. Ваш врач сравнит результаты с бронходилататорами и без них.
Как подготовиться к тесту
Спросите своего врача перед тестом, следует ли вам прекратить использовать ингаляционные дыхательные пути или другие лекарства, которые вы принимаете, и как долго вам следует прекратить это до теста.
Обязательно носите свободную одежду, которая не влияет на вашу способность делать глубокий вдох.И не ешьте много перед обследованием, чтобы было легче дышать.
Какие риски связаны с тестом?
Спирометрия безопасна. Сразу после обследования вы можете почувствовать головокружение или одышку, но это пройдет. Если у вас недавно был сердечный приступ или другой сердечный приступ, вам не следует проходить спирометрический тест. В редких случаях тест вызывал у пациента более серьезные проблемы с дыханием.
Примечание. «Новости о фиброзе легких» — это исключительно новостной и информационный веб-сайт об этом заболевании.Он не предоставляет медицинских консультаций, диагностики или лечения. Этот контент не предназначен для замены профессиональных медицинских консультаций, диагностики или лечения. Всегда обращайтесь за советом к своему врачу или другому квалифицированному поставщику медицинских услуг по любым вопросам, которые могут у вас возникнуть относительно состояния здоровья. Никогда не пренебрегайте профессиональным медицинским советом и не откладывайте его обращение из-за того, что вы прочитали на этом веб-сайте.
Озге имеет степень магистра.Доктор философии в области молекулярной генетики в Лестерском университете и докторская степень в области биологии развития в Лондонском университете королевы Марии. Она работала научным сотрудником постдокторантуры в Университете Лестера в течение шести лет в области поведенческой неврологии, прежде чем перешла в научную коммуникацию. Почти два года она работала научным сотрудником по связям с общественностью в благотворительной организации в Лондоне.
Всего сообщений: 110
Патриция имеет докторскую степень в области медицинской микробиологии и инфекционных заболеваний в Медицинском центре Лейденского университета в Лейдене, Нидерланды.Она изучала прикладную биологию в Universidade do Minho и была научным сотрудником в Институте молекулярной медицины в Лиссабоне, Португалия. Ее работа была сосредоточена на молекулярно-генетических особенностях инфекционных агентов, таких как вирусы и паразиты.
Физические признаки окончания срока службы
Как узнать, что человек с хроническим заболеванием легких вступает в последний этап жизни? На этой странице мы объясняем физические признаки заключительных стадий и способы борьбы с этими симптомами.Мы также объясняем, чего ожидать в последние дни.
На этой странице:
Каковы признаки того, что кто-то приближается к концу жизни?
По мере того, как люди достигают последней стадии хронического заболевания легких, часто происходят типичные физические изменения. Но не всегда легко предсказать, когда жизнь подойдет к концу.
Опыт каждого человека в конце жизни индивидуален. Наличие этих симптомов не обязательно означает, что кто-то близок к смерти.
Большинство хронических заболеваний легких постепенно ухудшаются в течение нескольких лет.Наиболее частым симптомом является учащение дыхания. У некоторых людей дыхание может ухудшиться намного быстрее, в течение недель или месяцев. Это особенно верно в отношении интерстициальных заболеваний легких, таких как IPF.
У тех, кто находится на последней стадии заболевания легких, дыхание заметно ухудшается. После каждого обострения или обострения их функция легких не возвращается на прежний уровень, и дыхание становится все труднее.
Ваши легкие становятся менее эффективными из-за долгосрочного заболевания легких.Любое усилие, даже простая смена позы, разговор или прием пищи, может вызвать у вас запыхание. Если вы лежите ровно, вам может стать неудобно дышать, поэтому вы можете попробовать спать в довольно вертикальном положении. Снижение функции легких может привести к снижению уровня кислорода в крови. Это может вызвать задержку жидкости в ногах и животе, что может вызывать дискомфорт. При обострениях обычно еще больше снижается содержание кислорода в крови, что может усугубить эти симптомы.
Другие симптомы могут включать неприятный кашель, плохой аппетит, боль в груди и нарушение режима сна.
Наиболее частые физические симптомы:
- сильная одышка
- снижение функции легких, затрудняющее дыхание
- с частыми обострениями
- , которым трудно поддерживать здоровую массу тела из-за потери аппетита
- чувствует себя более тревожно и подавленно.
Вы, ваша семья и лица, осуществляющие уход, можете попросить свою медицинскую бригаду дать дополнительные советы и информацию о том, чего ожидать в ваших конкретных обстоятельствах.
Борьба с симптомами в конце жизни
Боль — частый симптом любого запущенного физического заболевания и может быть частью нормального процесса умирания. Обычно это хорошо контролируется с помощью правильных лекарств. Эти лекарства могут включать опиоиды (морфиноподобные обезболивающие). Вы можете беспокоиться о приеме опиоидов, если у вас или у вашего близкого есть респираторное заболевание, но они безопасны для людей с заболеваниями легких.
Вам будут давать наркотики таким образом, чтобы вызвать наименьший дискомфорт, боль или стресс.Ваш врач может предложить попробовать низкую дозу жидкого морфина короткого действия. Это нужно для того, чтобы изначально увидеть, насколько вам нужна помощь с вашими симптомами. Если это поможет, ваш врач может посоветовать вам таблетки морфина длительного действия или морфиноподобный пластырь.
Одышка может быть уменьшена с помощью ингаляторов, таблеток и иногда небулайзеров. Если вы чувствуете одышку, может быть полезно использовать ручной вентилятор. Ощущение воздуха на лице может облегчить дыхание.Но если у вас более серьезная одышка и низкий уровень кислорода в крови, длительный прием кислорода может улучшить ваше дыхание и качество жизни.
Домашний кислород на длительный срок необходим, когда легкие больше не могут поддерживать достаточное количество кислорода в крови. Этот кислород обычно доставляется из машины, которая концентрирует кислород из воздуха, называемого концентратором кислорода. Вам необходимо использовать эту машину не менее 15 часов в день. Необходимое количество кислорода тщательно оценивается и контролируется, и со временем может потребоваться его увеличение.Узнать больше о кислородной терапии.
Кислород доступен только по рецепту и предоставляется местным поставщиком кислорода. Как правило, ваша местная команда респираторов оценит вашу потребность в кислороде. Переносной кислород, обычно из небольших баллонов, также доступен и позволяет путешествовать и выезжать на природу.
Ваш терапевт может назначить только паллиативный кислород. Это для людей, которые достигают конечной стадии жизни и имеют низкий уровень кислорода в крови.
Кислородная терапия, используемая для лечения низкого уровня кислорода в крови, не всегда может уменьшить одышку.Если ваша одышка становится очень неприятной, несмотря на использование кислорода, существует ряд лекарств, уменьшающих ощущение одышки. К ним относятся низкие дозы седативных средств, таких как диазепам или лоразепам, а также болеутоляющие средства, называемые опиоидами, такие как морфин.
Беспокойство и депрессия могут быть обычным явлением, если ваше дыхание затруднено и может ухудшить ваше самочувствие. Одиночество и изоляция также являются распространенными проблемами, если вы прикованы к дому с хроническим заболеванием легких.
Если вам трудно выйти из дома из-за затрудненного дыхания, обратитесь за помощью к специалисту в области здравоохранения. Беспокойство и депрессия могут стать настолько серьезными, что потребуют отдельного лечения.
Вы также можете найти методы расслабления или дыхания, которые помогают ослабить чувство напряжения и беспокойства. У нас есть больше информации о технике дыхания в Интернете.
Задержка жидкости можно лечить с помощью водных таблеток, называемых диуретиками.Частые походы в туалет могут стать проблемой, если вы чувствуете одышку и вам трудно двигаться. Спросите своего лечащего врача об использовании писсуара или комода. Катетеры — это трубки, по которым моча выходит из мочевого пузыря из организма. Они могут быть полезны в конце жизни, но есть риск осложнений, включая инфекцию и дискомфорт.
Потеря аппетита — обычная проблема и часто является естественной частью процесса болезни. Немного из того, что вам нравится, может помочь увеличить количество еды, доставить вам удовольствие и, в конечном итоге, повысить качество жизни.Если вам трудно глотать, выбирайте более мягкую и влажную пищу.
Иногда лучше подавать небольшие обеды и перекусывать в течение дня. Высококалорийные закуски могут включать пирожные и печенье, сыр и йогурты из цельных сливок. Выбирайте питательные напитки, такие как жирное молоко, горячий шоколад, солодовые напитки, смузи, фруктовые соки и обогащенные супы. Безрецептурные обогащенные супы и молочные коктейли можно купить в большинстве супермаркетов и аптек.
Если вы используете кислород, попробуйте использовать носовую канюлю во время еды.Если вы используете маску для лица, не забывайте заменять ее между глотками, чтобы уровень кислорода не падал во время еды.
Если есть действительно трудно, могут помочь пищевые добавки, которые могут назначить врач или медсестра. Также вас могут направить к диетологу. Вы можете купить некоторые пищевые добавки без рецепта, но всегда спрашивайте совета, чтобы подобрать для вас лучшую. Узнайте больше о правильном питании при заболевании легких.
Основные советы по уходу за тем, кому нужна помощь в приеме пищи:
- Посмотрите на человека, чтобы он мог видеть вас и свою еду.
- Если человек обычно носит очки или слуховой аппарат, помогите ему надеть их. Это поможет им увидеть, что вы делаете, и услышать, что вы говорите.
- Предлагайте небольшие обеды или порции, которые не подавляют человека.
- Дайте человеку есть медленно. Дайте им достаточно времени, чтобы пережевывать пищу и проглатывать ее. Возможно, им придется переводить дыхание перед каждым глотком.
- Следите за подсказками, которые помогут вам определить, когда они закончили глотать.Если сложно сказать, спросите человека, закончили ли он, или откройте рот, чтобы посмотреть, не осталась ли внутри еда.
- Для напитков используйте широкую чашку или стакан, чтобы пьющему не приходилось запрокидывать голову назад. Вы также можете использовать трубочку для холодных напитков.
- Не торопитесь с едой. Это может увеличить риск попадания пищи в дыхательные пути человека.
- Обратите внимание на признаки усталости. Если человек становится сонным, ему лучше прекратить есть, даже если он еще не закончил прием пищи.Это потому, что люди чаще кашляют или подавляются пищей.
- Если возможно, постарайтесь, чтобы человек выжидал не менее 15 минут, прежде чем снова лечь в постель или лечь. Это снижает вероятность того, что еда и питье снова попадут в горло и заставят их подавиться.
Кашель может быть проблемой. Сядьте максимально прямо, опираясь на подушки. Существуют лекарства, которые могут помочь остановить мучительный кашель. Их может прописать ваша медицинская бригада.Приступы кашля и сильная одышка также могут вызывать недержание мочи. С этим можно справиться, уменьшив количество напитков, содержащих кофеин, таких как чай и кофе, а также уменьшив потребление алкоголя. Есть также ряд средств для лечения недержания мочи, которые могут помочь, в том числе мочевой пузырь и мешок, называемый мочевым катетером. Поговорите со своей медицинской бригадой о том, может ли это помочь.
Икота, несварение желудка и рефлюкс могут быть трудными для лечения, если у вас неизлечимая болезнь. Доступно лечение, чтобы помочь справиться с этими симптомами, и есть вещи, которые вы или ваш опекун можете сделать, чтобы помочь вам чувствовать себя более комфортно.Более подробная информация об этом есть у Марии Кюри на своем веб-сайте.
Усталость (утомляемость) и нарушение сна являются обычным явлением по мере прогрессирования заболевания легких. Усталость может быть вызвана сочетанием беспокойства, депрессии, плохого сна и низкокалорийного потребления. Недостаток сна также может быть вызван такими симптомами, как одышка, боль и кашель, нарушающий сон. Дневной сон также может затруднить сон ночью. Усталость может никогда не исчезнуть полностью, но есть методы, которые помогут вам справиться с ней, а иногда и лекарства, которые могут помочь с некоторыми из причин.Поговорите со своим врачом о возможных причинах и о том, как с ними бороться.
Обострение болезни может произойти, если вы подхватите инфекцию грудной клетки. Инфекция грудной клетки означает, что у вас будет более сильный кашель с обесцвеченной, желтой или зеленой мокротой, и вы почувствуете одышку. Это следует лечить незамедлительно и обычно улучшается с помощью антибиотиков и короткого курса стероидов.
Если у вас серьезные обострения, вас могут госпитализировать, и вам может потребоваться неинвазивная вентиляция легких, чтобы повысить уровень кислорода, поступающего в легкие.Это осуществляется с помощью маски и портативного устройства, поддерживающего дыхание, путем подачи воздуха или кислорода под небольшим давлением.
Чего мне ожидать в последние несколько дней?
По мере приближения конца жизни вы можете испытать ряд физических и эмоциональных изменений. Они у всех разные. Вы можете заметить изменения в течение недель, дней или даже часов. Некоторые изменения могут быть похожи на признаки обострения, поэтому обсудите их со своим врачом или медсестрой.
Знаки, на которые следует обратить внимание, включают:
- Не хочет есть или пить очень много или совсем.Глотание может затрудниться
- Потеря физической энергии, способность или желание говорить и признаки ухода от семьи и друзей.
- Чувство сонливости или сонливости большую часть времени, очень малоподвижный образ жизни и в конечном итоге теряет сознание. Нет ничего необычного в том, чтобы оставаться в постели или в удобном кресле, а не вставать.
- Изменения частоты или характера дыхания. По мере того, как организм становится менее активным, потребность в кислороде снижается. Между вдохами могут быть длительные паузы, и животик может двигаться вверх и вниз больше, чем грудь.Вдыхание и выдох может вызвать бульканье или хрипы из-за скопления мокроты, которую невозможно откашлять. Помните, что это шумное влажное дыхание может причинить больше беспокойства окружающим, чем пострадавшему. Существуют лекарства, которые могут помочь высушить мокроту.
- Изменения цвета и температуры кожи. Непосредственно перед смертью кожа может стать бледной, влажной и немного прохладной.
- Непроизвольные подергивания. Это нормально и не означает, что кто-то расстроен или неудобен.Если вы заметили это, лучше всего рассказать о них любому специалисту в области здравоохранения, в котором они участвуют в данный момент.
- Требуется кислород, если он еще не используется, и поддержка другого медицинского оборудования. Это не должно мешать физическому контакту. Не бойтесь касаться друг друга и быть рядом.
Использование медицинского оборудования на заключительных этапах
Кислородная терапия может стать обременительной в последние дни и часы жизни. Это связано с тем, что вдувание в дыхательные пути может вызвать болезненность, а по мере того, как человек становится менее осведомленным о своем окружении, это может вызвать расстройство.В этом случае кислородную терапию можно прекратить, даже если уровень кислорода низкий. Это с осознанием того, что это поможет облегчить дискомфорт умирающего, а не способствовать смерти.
В целом, использование медицинского оборудования на заключительных этапах сосредоточено на утешении умирающего и сводится к минимуму, чтобы как можно меньше беспокоить его.
Ваш лечащий врач также может прописать «на всякий случай» лекарства, которые нужно держать дома.Обычно это инъекционные препараты, которые медсестра по месту жительства даст вам при таких симптомах, как боль или одышка, когда пероральные препараты — не лучший выбор. Иногда бывает трудно получить быстрый доступ к лекарствам ночью или в выходные дни. Наличие коробки с лекарствами «на всякий случай» означает, что ваш лечащий врач может быстро контролировать симптомы, если вы испытываете боль или начинаете чувствовать себя плохо.
Читать дальше: Забота о любимом на завершающем этапе
Загрузите нашу информацию об окончании срока службы (PDF, 490 КБ)
Каков уровень смертности от идиопатического фиброза легких (IPF)?
Рагху Дж., Коллард Х. Р., Иган Дж. Дж., Мартинес Ф. Дж., Бер Дж., Браун К. К..Официальное заявление ATS / ERS / JRS / ALAT: Идиопатический фиброз легких: научно обоснованные рекомендации по диагностике и лечению. Am J Respir Crit Care Med . 2011 15 марта. 183 (6): 788-824. [Медлайн].
Франкель СК, Шварц Мичиган. Обновленная информация по идиопатическому фиброзу легких. Curr Opin Pulm Med . 2009 Сентябрь 15 (5): 463-9. [Медлайн].
[Рекомендации] Рагху Г., Реми-Жардин М., Майерс Дж. Л. и др. Диагностика идиопатического фиброза легких.Официальное руководство по клинической практике ATS / ERS / JRS / ALAT. Am J Respir Crit Care Med . 2018 1 сентября 198 (5): e44-e68. [Медлайн].
Патель Н. М., Ледерер Д. Д., Борчук А. С., Кавут С. М.. Легочная гипертензия при идиопатическом фиброзе легких. Сундук . 2007 сентябрь 132 (3): 998-1006. [Медлайн].
Фишман А., Элиас Дж., Фишман Дж., Гриппи М., Старший Р., Пак А. Идиопатический фиброз легких. Фишман А.П. Легочные болезни и расстройства Фишмана .4-е изд. Компании Макгроу-Хилл, Инк .; 2008. Vol 1: 1143-60.
Мартинес Ф.Дж., Флаэрти К. Тестирование функции легких при идиопатических интерстициальных пневмониях. Proc Am Thorac Soc . 2006 июн. 3 (4): 315-21. [Медлайн]. [Полный текст].
Флаэрти К.Р., Андрей А.С., Мюррей С. и др. Идиопатический фиброз легких: прогностическая ценность изменений физиологии и тест шестиминутной ходьбы. Am J Respir Crit Care Med . 2006 г., 1. 174 (7): 803-9.[Медлайн]. [Полный текст].
Мисуми С., Линч Д.А. Идиопатический легочный фиброз / обычная интерстициальная пневмония: визуальный диагноз, спектр аномалий и временное прогрессирование. Proc Am Thorac Soc . 2006 июн. 3 (4): 307-14. [Медлайн].
Orens JB, Estenne M, Arcasoy S, et al. Международные рекомендации по отбору кандидатов на трансплантацию легких: обновление 2006 г. — консенсусный отчет Научного совета по легочным заболеваниям Международного общества трансплантации сердца и легких. J Пересадка легкого сердца . 2006 июл.25 (7): 745-55. [Медлайн].
Международная мультидисциплинарная консенсусная классификация идиопатических интерстициальных пневмоний Американского торакального общества / Европейского респираторного общества. Это совместное заявление Американского торакального общества (ATS) и Европейского респираторного общества (ERS) было принято советом директоров ATS в июне 2001 г. и Исполнительным комитетом ERS в июне 2001 г. Am J Respir Crit Care Med .2002 15 января. 165 (2): 277-304. [Медлайн].
Ley B, Collard HR, King TE Jr. Клинический курс и прогноз выживаемости при идиопатическом фиброзе легких. Am J Respir Crit Care Med . 2011 15 февраля. 183 (4): 431-40. [Медлайн].
Kim DS, Collard HR, King TE Jr. Классификация и естественное течение идиопатических интерстициальных пневмоний. Proc Am Thorac Soc . 2006 июн. 3 (4): 285-92. [Медлайн]. [Полный текст].
Visscher DW, Myers JL.Гистологический спектр идиопатических интерстициальных пневмоний. Proc Am Thorac Soc . 2006 июн. 3 (4): 322-9. [Медлайн].
Верма С, Слуцкий А.С. Идиопатический фиброз легких — новые открытия. N Engl J Med . 2007 29 марта. 356 (13): 1370-2. [Медлайн].
Harari S, Caminati A. IPF: новое понимание патогенеза и лечения. Аллергия . 2010 май. 65 (5): 537-53. [Медлайн].
Chen H, Chen Q, Jiang CM, Shi GY, Sui BW, Zhang W. и др.Триптолид подавляет паракват-индуцированный идиопатический фиброз легких, ингибируя TGFB1-зависимый эпителиальный мезенхимальный переход. Токсикол Летт . 2017 28 ноября. 284: 1-9. [Медлайн].
Giménez A, Duch P, Puig M, Gabasa M, Xaubet A, Alcaraz J. Нарушение регуляции гомеостаза коллагена за счет повышения жесткости матрицы и TGF-β1 в фибробластах у пациентов с идиопатическим фиброзом легких: роль FAK / Akt. Int J Mol Sci . 2017 16 ноября. 18 (11): [Medline].
Thannickal VJ, Horowitz JC.Развивающиеся концепции апоптоза при идиопатическом фиброзе легких. Proc Am Thorac Soc . 2006 июн. 3 (4): 350-6. [Медлайн]. [Полный текст].
Maher TM, Evans IC, Bottoms SE, Mercer PF, Thorley AJ, Nicholson AG. Снижение уровня простагландина E2 способствует парадоксу апоптоза при идиопатическом фиброзе легких. Am J Respir Crit Care Med . 2010 г. 1. 182 (1): 73-82. [Медлайн].
Armanios MY, Chen JJ, Cogan JD, et al.Мутации теломеразы в семьях с идиопатическим фиброзом легких. N Engl J Med . 2007 29 марта. 356 (13): 1317-26. [Медлайн].
Сейболд М.А., Мудрый А.Л., Шпир М.С., Стил М.П., Браун К.К., Лойд Дж. Э. Обычный полиморфизм промотора MUC5B и фиброз легких. N Engl J Med . 2011 г., 21 апреля. 364 (16): 1503-12. [Медлайн].
Wang XM, Zhang Y, Kim HP и др. Кавеолин-1: важный регулятор фиброза легких при идиопатическом фиброзе легких. J Exp Med . 2006 25 декабря. 203 (13): 2895-906. [Медлайн]. [Полный текст].
Lawson WE, Loyd JE. Генетический подход к лечению фиброза легких: может ли он дать ключ к разгадке этого сложного заболевания? Proc Am Thorac Soc . 2006 июн. 3 (4): 345-9. [Медлайн]. [Полный текст].
Таунсли Д.М., Думитриу Б., Лю Д., Бьянкотто А., Вайнштейн Б., Чен С. и др. Даназол Лечение заболеваний теломер. N Engl J Med . 2016 19 мая. 374 (20): 1922-31.[Медлайн].
Вуттон С.К., Ким Д.С., Кондо И. и др. Вирусная инфекция при обострении идиопатического фиброза легких. Am J Respir Crit Care Med . 2011, 15 июня. 183 (12): 1698-702. [Медлайн]. [Полный текст].
Fernandez Perez ER, Daniels CE, Schroeder DR, et al. Заболеваемость, распространенность и клиническое течение идиопатического фиброза легких: популяционное исследование. Сундук . 2010, январь, 137 (1): 129-37. [Медлайн]. [Полный текст].
Raghu G, Weycker D, Edelsberg J, Bradford WZ, Oster G. Заболеваемость и распространенность идиопатического легочного фиброза. Am J Respir Crit Care Med . 2006 г., 1. 174 (7): 810-6. [Медлайн].
Олсон А.Л., Свигрис Дж. Дж., Лезотт, округ Колумбия, Норрис Дж. М., Уилсон К. Г., Браун К. К.. Смертность от легочного фиброза увеличилась в Соединенных Штатах с 1992 по 2003 год. Am J Respir Crit Care Med . 2007 г., 1. 176 (3): 277-84. [Медлайн].
du Bois RM, Weycker D, Albera C, Bradford WZ, Costabel U, Kartashov A, et al.Установление индивидуального риска смерти пациентов с идиопатическим фиброзом легких. Am J Respir Crit Care Med . 2011 15 августа. 184 (4): 459-66. [Медлайн].
Лей Б., Райерсон С.Дж., Виттингхофф Э. и др. Многомерный индекс и система стадий идиопатического легочного фиброза. Анналы внутренней медицины . 2012/05. 156: 684-691.
Фанг А., Студер С., Кавут С.М., Ахья В.Н., Ли Дж., Вилле К. Повышенное давление в легочной артерии является фактором риска первичной дисфункции трансплантата после трансплантации легкого по поводу идиопатического легочного фиброза. Сундук . 2011 апр. 139 (4): 782-787. [Медлайн].
Flaherty KR, Thwaite EL, Kazerooni EA и др. Радиологический и гистологический диагноз при UIP и NSIP: последствия для выживания. Грудь . 2003 Февраль 58 (2): 143-8. [Медлайн]. [Полный текст].
Цилас В., Коти А., Папандринопулу Д., Цукалас Г. Факторы прогноза при идиопатическом фиброзе легких. Am J Med Sci . 2009 декабрь 338 (6): 481-5. [Медлайн].
Kinder BW, Brown KK, Schwarz MI, Ix JH, Kervitsky A, King TE Jr.Исходная нейтрофилия БАЛ прогнозирует раннюю смертность при идиопатическом фиброзе легких. Сундук . 2008, январь 133 (1): 226-32. [Медлайн].
Kinder BW, Brown KK, McCormack FX и др. Сывороточный сурфактантный протеин-А является надежным предиктором ранней смертности при идиопатическом фиброзе легких. Сундук . 2009 июнь 135 (6): 1557-63. [Медлайн]. [Полный текст].
Антониу К.М., Ханселл Д.М., Рубенс МБ и др. Идиопатический фиброз легких: исход в зависимости от статуса курения. Am J Respir Crit Care Med . 2008 15 января. 177 (2): 190-4. [Медлайн].
Ланкастер Л. Х., Мейсон В. Р., Парнелл Дж. А. и др. Обструктивное апноэ во сне часто встречается при идиопатическом фиброзе легких. Сундук . 2009 Сентябрь 136 (3): 772-8. [Медлайн]. [Полный текст].
Линч Д.А., Сверзеллати Н., Трэвис В.Д., Браун К.К., Колби ТВ, Галвин Дж. Р. и др. Диагностические критерии идиопатического фиброза легких: Белая книга Общества Флейшнера. Ланцет Респир Мед .2017 15 ноября. [Medline].
du Bois RM, Weycker D, Albera C, Bradford WZ, Costabel U, Kartashov A, et al. Форсированная жизненная емкость легких у пациентов с идиопатическим фиброзом легких: свойства теста и минимальная клинически значимая разница. Am J Respir Crit Care Med . 2011 15 декабря. 184 (12): 1382-9. [Медлайн].
Swigris JJ, Swick J, Wamboldt FS и др. Восстановление сердечного ритма после теста с 6-минутной ходьбой позволяет прогнозировать выживаемость пациентов с идиопатическим фиброзом легких. Сундук . 2009 Сентябрь 136 (3): 841-8. [Медлайн]. [Полный текст].
Bois RM, Weycker D, Albera C, et al. Тест с шестиминутной ходьбой при идиопатическом фиброзе легких: валидация теста и минимальная клинически значимая разница. Am J Respir Crit Care Med . 2011 г. 1. 183 (9): 1231-7. [Медлайн].
Ohshimo S, Bonella F, Cui A и др. Значение бронхоальвеолярного лаважа для диагностики идиопатического фиброза легких. Am J Respir Crit Care Med .2009 г., 1. 179 (11): 1043-7. [Медлайн].
Lee JS, Ryu JH, Elicker BM, Lydell CP, Jones KD, Wolters PJ, et al. Терапия гастроэзофагеального рефлюкса увеличивает выживаемость пациентов с идиопатическим фиброзом легких. Am J Respir Crit Care Med . 2011 15 декабря. 184 (12): 1390-4. [Медлайн].
Kozower BD, Meyers BF, Smith MA и др. Влияние оценки распределения легких на краткосрочные результаты трансплантации: многоцентровое исследование. J Торакальная кардиоваскулярная хирургия . 2008, январь, 135 (1): 166-71. [Медлайн].
Weiss ES, Allen JG, Merlo CA, Conte JV, Shah AS. Выживаемость после однократной трансплантации легких по сравнению с двусторонней трансплантацией легких для пациентов с высоким риском фиброза легких. Энн Торак Хирургия . 2009 ноябрь 88 (5): 1616-25; обсуждение 1625-6. [Медлайн].
Schaffer JM, Singh SK, Reitz BA, Zamanian RT, Mallidi HR. Трансплантация одного легкого или двойного легкого у пациентов с хронической обструктивной болезнью легких и идиопатическим фиброзом легких с момента осуществления распределения легких на основе медицинских потребностей. ЯМА . 2015 3 марта. 313 (9): 936-48. [Медлайн].
Ацуми К., Сайто Ю., Кусе Н., Кобаяши К., Танака Т., Кашивада Т. и др. Факторы прогноза в обострении идиопатического легочного фиброза: ретроспективное одноцентровое исследование. Медицинский работник . 2017 20 ноября. [Medline].
Hyzy R, Huang S, Myers J, Flaherty K, Martinez F. Острое обострение идиопатического легочного фиброза. Сундук . 2007 ноябрь132 (5): 1652-8. [Медлайн].
Song JW, Hong SB, Lim CM, Koh Y, Kim DS. Острое обострение идиопатического фиброза легких: частота, факторы риска и исход. Eur Respir J . 2011 Февраль 37 (2): 356-63. [Медлайн].
Magnani D, Lenoci G, Balduzzi S, Artioli G, Ferri P. Эффективность групп поддержки для улучшения качества жизни людей с идиопатическим фиброзом легких — предварительное пилотное испытание. Акта Биомед .2017 30 ноября. 88 (5-S): 5-12. [Медлайн].
Root ED, Graney B, Baird S, Churney T., Fier K, Korn M и др. Физическая активность и пространство активности у пациентов с фиброзом легких не назначают дополнительный кислород. ВМС Пульм Мед . 2017 23 ноября. 17 (1): 154. [Медлайн].
[Рекомендации] Pullen LC. Идиопатический фиброз легких: выпущены новые руководящие принципы. Медицинские новости Medscape. WebMD Inc. Доступно по адресу http://www.medscape.com/viewarticle/848220.17 июля 2015 г .;
Raghu G, Rochwerg B, Zhang Y, Garcia CA, Azuma A, et al. Официальное клиническое руководство ATS / ERS / JRS / ALAT: лечение идиопатического фиброза легких. Обновление Руководства по клинической практике 2011 г. Am J Respir Crit Care Med . 2015 15 июля. 192 (2): e3-e19. [Медлайн].
Филлипс Д. Новое руководство обновляет диагностические критерии для IPF. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/
0.12 сентября 2018 г .; Дата обращения: 26 сентября 2018 г.
Behr J, Kolb M, Cox G. Лечение IPF — все или ничего? Дискуссия PRO-CON. Респирология . 2009 14 ноября (8): 1072-81. [Медлайн].
Wiertz IA, Wuyts WA, van Moorsel CHM, Vorselaars ADM, van Es HW, van Oosterhout MFM и др. Неблагоприятный исход лечения глюкокортикоидами при подозрении на идиопатический фиброз легких. Респирология . 5 декабря 2017 г. [Medline].
Демедтс М., Бер Дж., Буль Р. и др.Высокие дозы ацетилцистеина при идиопатическом фиброзе легких. N Engl J Med . 2005 24 ноября. 353 (21): 2229-42. [Медлайн].
Преднизон, азатиоприн и N-ацетилцистеин для лечения легочного фиброза. N Engl J Med . 2012 г. 20 мая. [Medline].
Национальный институт сердца, легких и крови. Клиническое предупреждение: трехкомпонентная схема лечения легочного фиброза, которая обычно используется, является вредной. NIH останавливает одну экспериментальную группу лечения; Два других лечения, которые нужно продолжить. Национальные институты здравоохранения . 21 октября 2011 г. Доступно по адресу http://www.nlm.nih.gov/databases/alerts/2011_nhlbi_ifp.html.
Рагху Г., Браун К.К., Брэдфорд В.З. и др. Плацебо-контролируемое исследование интерферона гамма-1b у пациентов с идиопатическим фиброзом легких. N Engl J Med . 2004 8 января. 350 (2): 125-33. [Медлайн].
Raghu G, Brown KK, Costabel U, et al. Лечение идиопатического легочного фиброза этанерцептом: исследовательское плацебо-контролируемое исследование. Am J Respir Crit Care Med . 2008 г. 1. 178 (9): 948-55. [Медлайн].
King TE Jr, Albera C, Bradford WZ и др. Влияние интерферона гамма-1b на выживаемость пациентов с идиопатическим фиброзом легких (INSPIRE): многоцентровое рандомизированное плацебо-контролируемое исследование. Ланцет . 18 июля 2009 г. 374 (9685): 222-8. [Медлайн].
King TE Jr, Behr J, Brown KK и др. BUILD-1: рандомизированное плацебо-контролируемое исследование бозентана при идиопатическом фиброзе легких. Am J Respir Crit Care Med . 2008 г. 1. 177 (1): 75-81. [Медлайн].
Сеть клинических исследований идиопатического легочного фиброза, Zisman DA, Schwarz M, Anstrom KJ, Collard HR, Flaherty KR. Контролируемое испытание силденафила при запущенном идиопатическом фиброзе легких. N Engl J Med . 12 августа 2010 г. 363 (7): 620-8. [Медлайн].
Richeldi L, du Bois RM, Raghu G, Azuma A, Brown KK, Costabel U, et al. Эффективность и безопасность нинтеданиба при идиопатическом фиброзе легких. N Engl J Med . 2014 29 мая. 370 (22): 2071-82. [Медлайн].
Richeldi L, Costabel U, Selman M, et al. Эффективность ингибитора тирозинкиназы при идиопатическом фиброзе легких. N Engl J Med . 365: 1079-1087.
Благородный П.В., Альбера С., Брэдфорд В.З. и др. Пирфенидон у пациентов с идиопатическим фиброзом легких (ВОЗМОЖНОСТЬ): два рандомизированных исследования. Ланцет . 2011 21 мая. 377 (9779): 1760-9. [Медлайн].
King TE Jr, Брэдфорд WZ, Castro-Bernardini S, Fagan EA, Glaspole I, Glassberg MK и др.Фаза 3 исследования пирфенидона у пациентов с идиопатическим фиброзом легких. N Engl J Med . 2014 29 мая. 370 (22): 2083-92. [Медлайн].
Адзума А., Нукива Т., Цубои Э. и др. Двойное слепое плацебо-контролируемое исследование пирфенидона у пациентов с идиопатическим фиброзом легких. Am J Respir Crit Care Med . 2005 г. 1. 171 (9): 1040-7. [Медлайн].
Taniguchi H, Ebina M, Kondoh Y, et al. Пирфенидон при идиопатическом фиброзе легких. Eur Respir J . 2010 апр. 35 (4): 821-9. [Медлайн].
Esbriet® (пирфенидон). InterMune. Доступно на http://www.intermune.com/pirfenidone. Доступ: 3 мая 2014 г.
Альвеолит — обзор | ScienceDirect Topics
Идиопатический фиброз легких
IPF (иногда называемый в Европе «криптогенный фиброзирующий альвеолит») относится к особому типу хронического воспалительного / фиброзного интерстициального заболевания легких неизвестной причины, которое ограничивается легкими и связано с гистологическим исследованием. шаблон УИП (рис.67,2; Американское торакальное общество и Европейское респираторное общество, 2002 г.). Картина UIP при хирургической биопсии легкого также наблюдается у пациентов с мультисистемным аутоиммунным заболеванием, у которых клинические симптомы, связанные с легочными заболеваниями, аналогичны IPF (Harrison et al., 1991).
Рисунок 67.2. Связь идиопатического фиброза легких с другими идиопатическими интерстициальными расстройствами. Некоторые из редких заболеваний были исключены из списков [подробнее см. (Американское торакальное общество и Европейское респираторное общество, 2002; Кантин и Кристал, 1985; Шенбергер и Кристал, 1983)].
Лица с ИЛФ обычно проявляют постепенное начало симптомов, чаще всего одышку при физической нагрузке и непродуктивный кашель. У большинства из них до появления симптомов было не менее 6 месяцев, а средняя продолжительность — 24 месяца (Американское торакальное общество и Европейское респираторное общество, 2002). Клиническое течение обычно включает постепенное ухудшение, иногда перемежающееся периодами быстрого спада, хотя некоторые заболевания стабилизируются у некоторых людей. Наилучшие оценки ожидаемой продолжительности жизни с момента постановки диагноза до смерти получены на основе когортных исследований случай – контроль, которые не являются предвзятыми, как исследования распространенности, которые, как правило, чрезмерно представлены выжившими.Согласно двум таким исследованиям, средняя выживаемость с момента постановки диагноза до смерти составляет 3-4 года (Hubbard et al., 1998; Mapel et al., 1998). Этот средний показатель выживаемости, вероятно, отражает более агрессивные фазы болезни. С увеличением использования компьютерной томографии больше случаев ИЛФ было выявлено на более ранних стадиях заболевания и значительно медленнее прогрессировало.
При физикальном обследовании у пациентов с ИЛФ могут наблюдаться пальцевые булавы (25–50%) и мелкие инспираторные потрескивания, похожие на липучки, ограниченные основанием легких.Поскольку происходит прогрессирующая потеря альвеол и диффузионная способность падает ниже 50% от прогнозируемого, развивается легочная гипертензия, сначала при физической нагрузке, а затем в состоянии покоя (Crystal et al., 1976; McLees et al., 1979). После установления в состоянии покоя легочная гипертензия связана с увеличением легочного компонента S2 при кардиологическом обследовании и, в конечном итоге, фиксированным расщеплением второго звука. На поздних стадиях болезни могут появиться признаки правожелудочковой недостаточности, например, периферические отеки.
Исследование функции легких обычно показывает ограничительный паттерн вентиляционных дефектов и снижение диффузионной способности, хотя на ранних стадиях заболевания эти тесты могут быть нормальными (Cherniack et al., 1995; Фулмер и др., 1979; Кио и Кристал, 1980). Люди с IPF обычно имеют гипоксемию от легкой до умеренной степени с сопутствующим низким уровнем насыщения кислородом в состоянии покоя, который снижается при выполнении упражнений (Keogh and Crystal, 1980).
Рентгенограммы грудной клетки людей с IPF обычно ненормальны, с ретикулярным рисунком, видимым на периферии и в основании. Позже, при заболевании, в нижних долях появляются соты и потеря объема (Staples et al., 1987). На ранних стадиях заболевания рентгенограммы грудной клетки могут быть нормальными.КТВР более чувствительна и является предпочтительным методом визуализации. Типичные результаты КТВР — ретикулярно-узловые помутнения (рис. 67.3). Позднее при заболевании тракционные бронхоэктазы обычно наблюдаются в периферических и базальных сегментах нижних долей. Часто присутствует потеря объема и помутнение матового стекла. По мере прогрессирования заболевания сотовые кисты развиваются и увеличиваются со временем (Staples et al., 1987). Внешний вид IPF на рентгенограмме грудной клетки и КТВР почти идентичен таковому при легочном фиброзе, связанном с ревматическими расстройствами, за единственным исключением, возможно, более базального поражения, наблюдаемого на КТВР в IPF (Chan et al., 1997).
Рисунок 67.3. Диффузный ретикулярно-узловой узор на томографии грудной клетки высокого разрешения обычно наблюдается при идиопатическом фиброзе легких. Обратите внимание на участки с сотами.
Трансбронхиальной биопсии недостаточно для диагностики IPF, потому что образец биопсии слишком мал и не сохраняет архитектуру легкого. Однако трансбронхиальная биопсия может быть полезна для исключения других состояний, таких как саркоидоз, которые могут имитировать IPF. Бронхоскопическая криобиопсия легких — это новый метод, который позволяет получить больший образец легкого с помощью гибкого бронхоскопа, который предоставляет диагностическую информацию с меньшим риском (Lentz et al., 2017). В прошлом для точной постановки диагноза требовалась хирургическая биопсия легкого. Однако консенсусное заявление ATS и ERS позволяет диагностировать IPF при наличии типичных клинических и HRCT результатов IPF (Американское торакальное общество и Европейское респираторное общество, 2002; Hunninghake et al., 2001; Raghu et al., 2011). . Хирургическая биопсия легких по-прежнему рекомендуется при атипичных клинических проявлениях или при КТВР.
Гистологическая картина, характерная для IPF, обозначается как UIP (рис.67,4). Этот паттерн отличается от других форм идиопатических интерстициальных заболеваний легких, таких как DIP, лимфоцитарная интерстициальная пневмония, COP, неспецифическая интерстициальная пневмония и острая интерстициальная пневмония (American Thoracic Society and European Respiratory Society, 2002; Katzenstein and Fiorelli, 1994; Liebow and Кэррингтон, 1969). Обычно существует неоднородное распределение интерстициального фиброза, вкрапленного в области нормального легкого, что предполагает различные временные стадии поражения.Возникает очаговое воспаление, в котором преобладают альвеолярные макрофаги и, в меньшей степени, лимфоциты, нейтрофилы и иногда эозинофилы. Альвеолярный эпителий претерпевает заметные изменения, называемые «кубоидализацией», с потерей эпителиальных клеток типа I и их заменой кубовидными клетками, как альвеолярными эпителиальными клетками типа II, так и бронхиолярным эпителием. Одним из отличительных признаков IPF является субэпителиальный «фибробластический очаг», который представляет собой узелок мезенхимальных клеток в форме веретена, которые производят обильные отложения внеклеточного матрикса.Эти «очаги» считаются «передним краем» фиброзного процесса. Иногда интерстициальный фиброз распространяется через разрывы эпителия в альвеолярное пространство с образованием внутриальвеолярного фиброза (Basset et al., 1986). Позже при заболевании наблюдается разрушение архитектуры и фиброз с сотами. Часто субплевральная паренхима является наиболее пораженной областью. Когда биопсия показывает области как UIP, так и неспецифического интерстициального пневмонита, патологический диагноз по умолчанию становится клиническим диагнозом IPF, поскольку эти пациенты, как было показано, ведут себя аналогично IPF с паттерном только UIP (Raghu et al., 2011; Flaherty et al., 2001).
Рисунок 67.4. Гистологическая картина идиопатического фиброза легких. Эти закономерности часто называют «обычным интерстициальным пневмонитом». (A) Субплевральное, парасептальное и интерстициальное отложение коллагена вместе с участками слегка аномальной альвеолярной паренхимы (гематоксилин и эозин, полоса = 1 мм). (B) Утолщенный интерстиций с отложением коллагена, инфильтраты мононуклеарных клеток альвеолярной перегородки от легкой до умеренной, в основном лимфоцитов, кубоидизация эпителия и большие фибробластные очаги ( толстая стрелка ).Фибробластические очаги состоят из веретенообразных мезенхимальных клеток и, как полагают, представляют «передний край» прогрессирующего фибровоспалительного процесса (гематоксилин и эозин; полоса = 100 мкм).
Гистологические признаки легочного фиброза, связанного с мультисистемным аутоиммунным заболеванием, можно разделить на те же патологические описания идиопатических интерстициальных пневмоний, которые были предложены ATS и ERS, включая UIP, NSIP, DIP и COP (рис. 67.2). Паттерн UIP, наблюдаемый при мультисистемных аутоиммунных заболеваниях, по существу идентичен паттерну, наблюдаемому при IPF.При полимиозите, дерматомиозите и склеродермии NSIP является наиболее часто встречающимся гистологическим паттерном, за которым следует UIP (Bouros et al., 2002; Douglas et al., 2001). Распространенность различных гистологических подтипов идиопатических интерстициальных пневмоний не была хорошо охарактеризована при других мультисистемных аутоиммунных заболеваниях.
По оценкам, ежегодная заболеваемость ИЛФ составляет 7 случаев на 100 000 у женщин и 10 на 100 000 у мужчин. Большинство пациентов находятся в возрасте от 50 до 70 лет; однако заболеваемость, распространенность и смертность растут с возрастом (Coultas et al., 1994).
В нескольких исследованиях была предпринята попытка установить распространенность фиброза легких у пациентов с мультисистемными аутоиммунными заболеваниями, но результаты менялись в зависимости от метода скрининга пациентов на легочное поражение. Исследования, в которых используются данные аутопсии или биопсии легких, подвержены гипердиагностике, поскольку они показали, что они выявляют субклинические заболевания, которые не прогрессируют (Cervantes-Perez et al., 1980). Точно так же скрининговые исследования HRCT могут также переоценить распространенность заболевания, выявляя паренхиматозные изменения, которые могут не иметь клинического значения.При РА поперечные исследования с использованием рентгенограмм грудной клетки оценивают распространенность менее чем у 5% пациентов (Hyland et al., 1983). Когда HRCT используется для скрининга пациентов, распространенность составляет от 20% до 50%, хотя эти исследования ограничены систематической ошибкой отбора (Remy-Jardin et al., 1994; Gabbay et al., 1997). Легочный фиброз наиболее распространен при склеродермии, где серия аутопсий показала, что он присутствует в 70% случаев, а серия рентгенограмм грудной клетки оценивает распространенность от 25% до 65% (Wiedemann and Matthay, 1989; Minai et al., 1998). Распространенность клинически явного фиброза легких составляет 30% при полимиозите и дерматомиозите, 5% при системной красной волчанке и 10% при синдроме Шегрена (Schwarz, 1998; Gardiner, 1993; Eisenberg et al., 1973).
Идиопатический фиброз легких — NHS
Идиопатический фиброз легких (IPF) — это состояние, при котором легкие покрываются рубцами, и дыхание становится все более трудным.
Неясно, чем вызвано это заболевание, но обычно оно поражает людей в возрасте от 70 до 75 лет и редко встречается у людей моложе 50 лет.
Несколько процедур могут помочь снизить скорость ухудшения ИЛФ, но в настоящее время не существует лечения, которое могло бы остановить или обратить вспять рубцевание легких.
Информация:
Консультации по коронавирусу
Получите консультацию о коронавирусе и идиопатическом фиброзе легких:
Симптомы идиопатического фиброза легких
Симптомы ИЛФ имеют тенденцию к постепенному развитию и медленно ухудшаются с течением времени.
Симптомы могут включать:
Многие люди сначала игнорируют одышку и винят ее в том, что они стареют или теряют форму.
Но со временем даже легкая активность, например одевание, может вызвать одышку.
Когда обращаться за медицинской помощью
Обратитесь к терапевту, если вы какое-то время боролись с дыханием или кашляли более 3 недель.
Эти симптомы ненормальны, и их нельзя игнорировать.
Если терапевт считает, что у вас может быть такое заболевание легких, как IPF, он может направить вас к специалисту больницы для проведения таких анализов, как:
Узнайте больше о тестах на идиопатический фиброз легких
Причины идиопатического фиброза легких
У людей с ИЛФ крошечные воздушные мешочки в легких (альвеолах) повреждаются и все больше покрываются рубцами.
Из-за этого легкие становятся жесткими, что затрудняет попадание кислорода в кровь.
Причина этого не ясна. Идиопатический означает, что причина неизвестна.
IPF был связан с:
- воздействием определенных типов пыли, например металлической или деревянной пыли
- вирусных инфекций
- семейным анамнезом IPF — примерно у 1 из 20 человек с IPF есть другой член семьи с этим заболеванием
- гастроэзофагеальная рефлюксная болезнь (ГЭРБ)
- курение
Однако неизвестно, вызывают ли некоторые из этих факторов непосредственную причину ИЛФ.
Средства для лечения идиопатического фиброза легких
В настоящее время нет лекарства от ИЛФ, но есть несколько методов лечения, которые могут помочь облегчить симптомы и замедлить их прогрессирование.
Лечение включает:
- меры самопомощи, такие как отказ от курения, здоровое питание и регулярные упражнения
- лекарства для уменьшения скорости ухудшения рубцов, такие как пирфенидон и нинтеданиб
- дышать кислородом через маску — вы можете сделать это, пока вы дома или на улице, и около
- упражнений и советов, которые помогут вам легче дышать (легочная реабилитация)
- трансплантация легкого — это подходит в некоторых случаях, хотя донорские легкие встречаются редко
Узнайте больше о лечении идиопатического фиброза легких
Дополнительная информация
Благотворительные организации Великобритании по борьбе с фиброзом легких и Фонд легочного фиброза предоставляют информацию и поддержку людям, затронутым IPF, а также новости о текущих исследованиях этого заболевания.
Перспективы идиопатического фиброза легких
IPF со временем ухудшается, хотя скорость, с которой это происходит, сильно варьируется.
Некоторые люди хорошо поддаются лечению и остаются относительно свободными от симптомов в течение многих лет, в то время как у других может быстро ухудшиться состояние или одышка изнуряет.
Иногда могут развиваться и другие проблемы, включая инфекции грудной клетки, легочную гипертензию и сердечную недостаточность.
Очень сложно предсказать, как долго человек с ИЛФ проживет на момент постановки диагноза.
Регулярный мониторинг с течением времени может показать, быстро или медленно становится хуже.
До того, как стали доступны специфические методы лечения, такие как пирфенидон и нинтеданиб, около половины людей с ИЛФ жили как минимум 3 года с момента постановки диагноза. Примерно каждый пятый выжил более 5 лет.
Есть надежда, что эти цифры будут улучшены благодаря появлению новых методов лечения, замедляющих прогрессирование болезни.
Национальная служба регистрации врожденных аномалий и редких заболеваний
Если у вас есть IPF, ваша клиническая бригада передаст информацию о вас в Национальную службу регистрации врожденных аномалий и редких заболеваний (NCARDRS).
NCARDRS помогает ученым искать более эффективные способы профилактики и лечения ИЛФ. Вы можете отказаться от регистрации в любое время.
Последняя проверка страницы: 20 мая 2019 г.
Срок следующего рассмотрения: 20 мая 2022 г.
.

