Аппараты ЭКМО
Аппараты ЭКМО
Метод ЭКМО направлен на поддержание жизни тяжело больных пациентов с проблемами сердечной или/и легочной недостаточности, которые не способно устранить другое медицинское оборудование.
Лечение острой дыхательной недостаточности и недостаточной циркуляторной функции сердца остаются сложными и в наше время. Разработка аппаратов ЭКМО и другой медицинской техники поможет в решении главных задач, которые раньше казались непреодолимыми. Сейчас аппарат ЭКМО является единственным действующим методом для поддержания сердца и легких на долгий период времени, особенно при критических ситуациях, таких как остановка сердца, реанимация, и другие. Для многих ЭКМО – это единственный шанс.
Модели аппарата экстракорпоральной мембранной оксигенации. ЭКМО
Центрифужный насос Ротафлоу- это система, которая состоит из модуля, в котором находятся блоки блоки мониторинга, электромагнитного привода и экстренного (ручного) привода. Управление происходит с помощью специальной ручки. Режим работы, цифры потока и другие функции расположены на панели управления.
Технические характеристики ЭКМО:
1. Поток (литры в минуту, до 10/л)
2. Защиту от воздушной эмболии
3. Скорость (max 5000 об).
Контроль за давлением и температурой ведется с внешних приборов. ЭКМО имеет питание от сети, а также имеет встроенную батарею. Для удобства работы РотаФлоу насыщенны стойкой, удобный элемент для передвижения, и другими. На аппарате можно осуществлять поддержку легких (вено-венозная ЭКМО), поддержку сердца и легких (вено-артериальная ЭКМО), механический поддержку желудочков сердца (обход), операции по MECC-методике.
Центрифужный аппарат Cardiohelp-i последнего поколения, не имеющий аналогов – это корпус, в котором находятся электромагнитный центрифужный привод, блоки мониторинга температуры, давления, защиты от воздушной эмболии, параметров крови онлайн. Управление осуществляется и с экрана и с помощью кнопок.
Содержит 5 предустановленных режимов работы:
- Вено-артериальная ЭКМО
- Вено-венозная ЭКМО
- Низкопоточное удаление CO2
- Механическая поддержка желудочков сердца
- МЕСС-операции
Один режим-отдельное окно. Этот аппарат имеет весь ряд мониторинга. Он показывает все жизненные функции пациента и позволяет контролировать весь процесс. Все может осуществляться как с внешних датчиков, так и с интегрированных. Аппарат можно воссоединить со стойкой передвижения, смесителем и другими. В нем заложен специальный модуль, который необходим при транспортировке пациента. Вся система работает без замены 30 суток.
Аппарат ЭКМО LivaNova S5- это аппарат для искусственного обращения, который применяется больше в кардиохирургии. На жидкокристаллическом мониторе выводятся все данные по состоянию аппарата, к примеру, заряд аккумулятора. Сам корпус из нержавеющей стали. При создании данной одели были учтены все рекомендации специалистов, медиков, для создания сверхэффективной модели. Конструкция аппарата очень удобно для использования, так как подстраивается под каждого индивидуально. Имеется электрический зажим и система DNS.
ЭКМО в России
ГК «Вектор»- крупная компания, занимающаяся комплексным обеспечением медицинского и лабораторного оборудования, а также его обслуживанием. На рынке более 13 лет с представительствами во многих городах России. Гарантия на все оборудование. Всю подробную информацию Вы можете получить по телефонам: +7 (812) 385-51-80, +7 (812) 385-51-90. Оставьте заявку и наши менеджеры оперативно с Вами свяжутся.
Оставить запрос
МЧС передало во временное пользование Введенской больнице аппарат ЭКМО
МЧС передало во временное пользование Введенской больнице аппарат ЭКМО
Источник: © Доктор Питер http://doctorpiter.ru/articles/13483/
Академик Чучалин приехал с проверкой — в Петербурге от гриппа умерли уже семь человек
От гриппа и его осложнений в Петербурге умерли уже семь человек.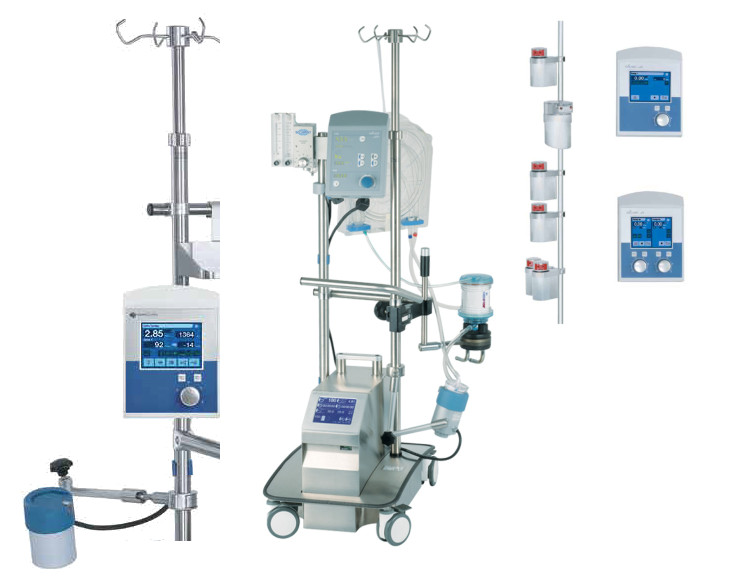 По результатам патологоанатомических заключений все смерти признаны непредотвратимыми. Чтобы убедиться в этом, в Петербург приехал главный терапевт России, директор Московского НИИ пульмонологии академик Александр Чучалин.
По результатам патологоанатомических заключений все смерти признаны непредотвратимыми. Чтобы убедиться в этом, в Петербург приехал главный терапевт России, директор Московского НИИ пульмонологии академик Александр Чучалин.
Сегодня в комитете по здравоохранению состоялась конференция для специалистов и руководителей медицинских учреждений по «клинико-патологоанатомическому разбору летальных случаев среди пациентов с гриппом и ОРВИ, которым оказывалась помощь в государственных учреждениях здравоохранения Петербурга», на нее специально прилетел академик Александр Чучалин. Вместе с ним петербургские врачи подробно рассматривали истории болезни пяти петербуржцев, умерших от гриппа. Все смерти были признаны непредотвратимыми — у пациентов были очень тяжелые патологии бронхо-легочной системы и полиорганные поражения.
Причем, как сообщили представители петербургского Роспотребнадзра, петербуржцы болеют особенно тяжело в сравнении с предыдущими сезонами гриппа при низком уровне заболеваемости — он даже не достиг эпидпорога. При этом самые сложные пациенты — с гриппом А h2N1 (пандемический 2009), который по привычке называют «свиным». Уже достоверно установлено, что из пяти погибших четверо были инфицированы именно этим вирусом грипп, один — гриппом А h4N2. Лабораторных данных о типе вируса, которым были инфицированы еще двое погибших, пока нет.
Академик Чучалин говорил о необходимости использования новых технологий при лечении пациентов с тяжелым поражением бронхолегочной системы с помощью аппарата ЭКМО (экстракорпоральной мембранной оксигинации), поскольку даже своевременное начало противовирусной терапии и подключение к аппаратам искусственной вентиляции легких при тяжелых случаях заболевания уже не могут спасти человека.
В Петербурге аппарат ЭКМО есть только в клинике МЧС. Она согласилась помочь городу и передала во временное пользование Введенской больнице. Сейчас там с помощью ЭКМО пытаются спасти женщину с тяжелейшим бронхо-легочным осложнением гриппа. В Москве тоже только в одной клинике аппарат ЭКМО применяется для лечения таких пациентов.
В Москве тоже только в одной клинике аппарат ЭКМО применяется для лечения таких пациентов.
По мнению председателя комитета по здравоохранению Валерия Колабутина, городу необходимо приобрести мобильный аппарат ЭКМО, чтобы иметь возможность использовать его в любой клинике, где в нем возникнет необходимость.
Справка:
ЭКМО назначается пациентам с тяжелой дыхательной недостаточностью, когда необратимых изменений в органах и тканях еще нет, но ИВЛ уже неэффективна. Мембранный оксигенатор подключается к кровеносному сосуду и забирает из него кровь. Она очищается, насыщается кислородом и возвращается обратно, попадает в общий кровоток, снижая уровень гипоксемии (насыщая кровь кислородом). В это время легкие не работают — «отдыхают», вместо них работает аппарат. Таким образом благодаря аппарату организм не испытывает недостатка в кислороде и «выигрывает время», в течение которого восстанавливаются функции легких.
В детской областной больнице появился аппарат ЭКМО | Новости здравоохранения
22 сентября 2020 г.
В детской областной больнице появился аппарат ЭКМО
В Кировскую областную детскую клиническую больницу поступил аппарат экстракорпоральной мембранной оксигенации (ЭКМО), который позволит спасать жизни маленьких пациентов в той ситуации, когда традиционное лечение малоэффективно. Это второй аппарат ЭКМО в Кировской области. Первый в сентябре 2018 года был установлен в Кировской областной клинической больнице. Теперь и детское население региона обеспечено новейшим, уникальным для регионов России оборудованием.
Как отметила главный врач детской областной больницы Наталья Муратова, сегодня у учреждения – исторический день, так как появление и установка ЭКМО дает новые большие возможности для работы в более совершенных условиях.
– Это уникальное оборудование, единственное для детей в Кировской области. Оно направлено не просто на то, чтобы помочь, а на то, чтобы спасти жизнь ребенка. При тяжелых заболеваниях сердечно-сосудистой системы этот аппарат просто незаменим. Мы долго ждали поставки этого оборудования, и этот момент настал, чему рад весь коллектив учреждения, – подчеркнула Наталья Муратова.
Мы долго ждали поставки этого оборудования, и этот момент настал, чему рад весь коллектив учреждения, – подчеркнула Наталья Муратова.
ЭКМО – это специальный метод лечения, при котором используется искусственное кровообращение для обеспечения временной поддержки жизни пациента и функционирования его организма. Аппарат экстракорпоральной мембранной оксигенации может поддерживать функцию сердца и легких в течение нескольких месяцев. Данная система позволяет насыщать кровь кислородом, когда организм не справляется с этой задачей.
– Аппарат ЭКМО, который появился в нашем учреждении, имеет уникальную комплектацию. Благодаря компактности и мобильности можно использовать его не только в стационарах, но и при транспортировке пациентов в тяжелом состоянии как наземным, так и авиатранспортом. Система ЭКМО даст возможность кировским медикам спасать жизни маленьких пациентов. Она может применяться для детей раннего возраста, – рассказала Наталья Муратова.
В прошлом году специалисты детской областной больницы уже имели опыт спасения мальчика с жизнеугрожающей сердечной патологией при помощи ЭКМО. Ребенок поступил в Кировскую областную детскую клиническую больницу из Тужинской ЦРБ осенью 2019 года. В ходе обследования врачи диагностировали у подростка критическое нарушение сердечного ритма.
– Учитывая, что центр аритмологии находится в Кировской областной клинической больнице, мы обратились за помощью к коллегам, и в течение часа был собран врачебный консилиум, – отметила Наталья Муратова. – В результате было определено, что у ребенка есть все показания для перевода его на ЭКМО. Такой аппарат тогда был только в областной больнице, поэтому мальчика транспортировали туда.
Этот случай стал первой процедурой ЭКМО ребенку в медицинской практике Кировской области, и к спасению жизни юного пациента подключилось врачебное российское сообщество. Были задействованы федеральные центры и специалисты, которые имеют опыт ведения детей на данном оборудовании. Совместными усилиями состояние мальчика было стабилизировано, после чего он был переведен в Национальный медицинский исследовательский центр им. В. А. Алмазова – один из ведущих российских центров по оказанию кардиологической и кардиохирургической помощи. Сейчас мальчик чувствует себя хорошо, учится в школе, посещает уроки физкультуры.
Совместными усилиями состояние мальчика было стабилизировано, после чего он был переведен в Национальный медицинский исследовательский центр им. В. А. Алмазова – один из ведущих российских центров по оказанию кардиологической и кардиохирургической помощи. Сейчас мальчик чувствует себя хорошо, учится в школе, посещает уроки физкультуры.
Отметим, в настоящее время на территории детской областной больницы продолжаются масштабные строительные работы. После завершения реконструкции в 2021 году она станет принципиально новым, современным, максимально комфортным медицинским учреждением. Сейчас здесь ведется строительство надземного перехода между двумя стационарными корпусами и надстройка трех этажей над 2-этажным пристроем корпуса № 1. Также в больнице идет реконструкция стационара. В новый операционный блок будет закуплено современное оборудование для оказания высокотехнологичной специализированной помощи.
– Все преобразования в детских учреждениях области направлены на то, чтобы сделать посещение их удобным для маленьких пациентов и их родителей, а также повысить доступность и качество медицинского обслуживания, – отметил первый зампред правительства региона Дмитрий Курдюмов. – Кроме того, важным направлением в регионе является реализация программ борьбы с сердечно-сосудистыми заболеваниями. Появление нового аппарата ЭКМО в детской областной больнице станет большим шагом в этом направлении. В наших учреждениях работают профессионалы и установлено современное оборудование – есть все условия для оказания медицинской помощи пациентам с сердечной патологией.
Новое на сайте
Вижу, что в сводке по коронавирусу появились пациенты на ЭКМО. Что это значит?
Минздрав Кубани 15 июня рассказал порталу Юга.ру о ситуации с аппаратами ЭКМО в регионе
Что такое ЭКМО? Экстракорпоральная мембранная оксигенация — специальный метод лечения, при котором используют искусственные сердце и легкие, чтобы у больных восстановились собственные органы. ЭКМО может поддерживать организм в течение длительного времени — от нескольких дней до нескольких месяцев.
ЭКМО может поддерживать организм в течение длительного времени — от нескольких дней до нескольких месяцев.
ЭКМО сама по себе не может вылечить пациентов, однако может дать необходимое время для восстановления. Чаще всего к такому методу прибегают после того, как все остальные методы уже испробовали (в том числе ИВЛ).
Почему все заговорили об ЭКМО? Оперштаб Кубани весь период пандемии публикует статистику заболеваемости коронавирусом в регионе. В ежедневной сводке по COVID-19 сообщают, сколько пациентов скончались, сколько находятся в тяжелом состоянии и сколько подключены к аппаратам ИВЛ. Однако 31 мая в отчете появилась информация, что в крае трое пациентов находятся на экстракорпоральной мембранной оксигенации.
Позже стало известно, что скончался первый пациент на ЭКМО — 1 июня в Армавире умер анестезиолог с коронавирусом, которого ранее перевели в краевую клиническую больницу и подключили к аппарату.
Последний раз оперштаб упоминал ЭКМО 6 июня: в отчете сообщалось, что в тяжелом состоянии на аппарате ИВЛ находятся 32 жителя края, а на экстракорпоральной мембранной оксигенации — двое.
Читайте также:
Какая ситуация с ЭКМО на Кубани? Портал Юга.ру 4 июня отправил запрос в краевой минздрав, в котором спросил, сколько в регионе ЭКМО, планируется ли их закупка и сколько пациентов к ним подключены. Также редакция поинтересовалась, в каких случаях больных подключают к аппаратам и какова статистика летальных исходов среди пациентов, находившихся на ЭКМО.
В пресс-службе министерства здравоохранения Краснодарского края 15 июня порталу Юга.ру ответили, что всего в регионе три аппарата экстракорпоральной мембранной оксигенации. Все они находятся в Краевой клинической больнице № 1. По данным министерства, сейчас пациентов на ЭКМО нет.
С начала пандемии COVID-19 на аппаратах находились трое пациентов: двое из них умерли. Отметим, что к моменту публикации новости оперштаб сообщал только об одной смерти больного на ЭКМО. Кем был второй пациент, не сообщается.
Кем был второй пациент, не сообщается.
Врачи в Тверской области спасли пациентку с полным поражением легких из-за коронавируса — Общество
ТАСС, 22 июля. Врачи Тверской областной больницы спасли пациентку с коронавирусной инфекцией со 100-процентным поражением легких с помощью методики экстракорпоральной мембранной оксигенации (ЭКМО). Об этом сообщает пресс-служба правительства региона.
«Благодаря врачам областной клинической больницы спасена пациентка с коронавирусной инфекцией. У женщины была выявлена тяжелая пневмония, полное поражение легких и тяжелая дыхательная недостаточность. Она 14 суток была подключена к системе жизнеобеспечения (к аппарату, который насыщает кровь кислородом, ЭКМО — экстракорпоральная мембранная оксигенация). Сейчас женщина идет на поправку и уже начала самостоятельно ходить», — говорится в сообщении.
Ранее пациентов, которым требовалось ЭКМО, переводили в федеральные медицинские учреждения Москвы или Санкт-Петербурга. Весной 2020 года аппарат был приобретен на средства, выделенные для борьбы с коронавирусной инфекцией. В региональном министерстве здравоохранения уточнили, что тверские медики прошли обучение работе на нем.
«Спасение этой пациентки — это огромная работа целой команды специалистов: реаниматологов, пульмонологов, эндоскопистов. Отдельное спасибо я хотел бы сказать среднему и младшему медицинскому персоналу, которые обеспечивали уход за тяжелой пациенткой на высочайшем уровне. Если бы не они, то говорить о благоприятном исходе в лечении не пришлось бы. Только за счет командной работы удается спасать подобных пациентов», — цитирует пресс-служба министерства здравоохранения Тверской области руководителя службы анестезиологии и реанимации областной клинической больницы Максима Петрушина.
Методику экстракорпоральной мембранной оксигенации применяют при вирусных пневмониях, отравлении продуктами горения, тяжелой сердечной недостаточности, при пересадке сердца и легких. Специальный насос прибора берет на себя работу сердца по перекачиванию крови, а мембранный оксигенатор выполняет газообмен легких. Аппарат ЭКМО позволяет поддерживать жизнедеятельность человека в течение нескольких недель.
Специальный насос прибора берет на себя работу сердца по перекачиванию крови, а мембранный оксигенатор выполняет газообмен легких. Аппарат ЭКМО позволяет поддерживать жизнедеятельность человека в течение нескольких недель.
К 22 июля в Тверской области выявлено 4 338 заразившихся коронавирусной инфекцией. Из них, по данным регионального оперативного штаба, выздоровели 3 749 человек, умерли 112.
Тамбовская областная детская больница получила аппарат для экстренного вспомогательного кровообращения
Тамбовская областная детская больница получила аппарат для экстренного вспомогательного кровообращения
Тамбовская областная детская клиническая больница получила от благотворительного фонда World Vita современное, высокотехнологичное оборудование — аппарат для экстренного вспомогательного кровообращения (ЭКМО).
Метод экстракорпоральной мембранной оксигенации (ЭКМО) – это современная инвазивная технология насыщения организма кислородом при тяжёлом поражении лёгких, когда проведение традиционной искусственной вентиляции лёгких неэффективно. Он является временным методом замещения функции лёгких. Кровь пациента по системе магистралей поступает в аппарат, где происходит её насыщение кислородом и освобождение от углекислого газа. После прохождения через аппарат кровь возвращается в кровеносное русло пациента, при этом обеспечивается дыхательная поддержка, то есть создаются «искусственные легкие».
Технология ЭКМО проводится в случае развития тяжёлой дыхательной недостаточности у больных с гриппом Н1N1, при тяжёлых врождённых пороках развития у новорождённых (диафрагмальная грыжа, гипоплазия лёгких), когда лёгкие не справляются со своей функцией. На сегодняшний день подобное оборудование в Тамбовской области отсутствует. Работа современного аппарата ЭКМО может обеспечивать функцию лёгких на протяжении нескольких недель, не вызывая тяжелых необратимых изменений во внутренних органах. Ежегодно, как минимум, двое детей нуждается в применении данного метода, что позволит повысить шансы на их выздоровление.
Выполнение ЭКМО требует от медицинского персонала высокой квалификации, специальной профессиональной теоретической и практической подготовки, навыков катетеризации магистральных сосудов.
Поставка аппаратуры для экстренного вспомогательного кровообращения включает обучение сотрудников, предоставление первых наборов для индивидуального применения.
Для спасения маленьких пациентов поставляются стационарная система вспомогательного кровообращения с возможностью оказания помощи в стационаре клиники и система вспомогательного кровообращения для оказания помощи при транспортировке пациентов в другие города и клиники.
Все права на материалы и новости, опубликованные на сайте Управления здравоохранения Тамбовской области, охраняются в соответствии с законодательством РФ. Допускается цитирование с обязательной прямой ссылкой на Управление здравоохранения Тамбовской области.
В Симферополе появился первый аппарат экстракорпоральной мембранной оксигенации
Пятница, 8 мая. «Крым 24».
Второе дыхание. В Симферополе появился первый в Республике аппарат экстракорпоральной мембранной оксигенации. Его установили в клинической больнице имени Семашко. О широких возможностях оборудования расскажет корреспондент телеканала «Крым 24» Алина Бакланова.
Новый аппарат экстракорпоральной мембранной оксигенации во многом отличается от традиционных ИВЛ. Главное преимущество – прибор полностью заменяет легочное дыхание и сам снабжает организм кислородом.
Аппарат приобрели для спасения тех, у кого коронавирус проходит с осложнениями. Установили его в кардиологическом отделении клинической больницы имени Семашко. Но прибор подойдёт и пациентам с другими диагнозами.
«Операции на открытом сердце делают с искусственным кровообращением, с остановкой сердца и лёгких. И после того, как запускают, часто бывают осложнения со стороны сердца. Можно больных поставить на этот аппарат и вспомогательно улучшить функции сердца и лёгких», – сказал Гаттас Ризк, главный внештатный кардиохирург министерства здравоохранения Республики Крым.
Это первый такой аппарат в Республике Крым. Его установили, проверили работоспособность. Приобрели за счёт спонсоров.
«Этот аппарат мы получили 7 мая, мы его протестировали. Этот аппарат готов к работе. Но всё-таки мы питаем глубокие надежды, что этот аппарат не будет использоваться для тяжёлых пациентов», – сказал Александр Остапенко, главный врач ГБУЗ РК «Республиканская клиническая больница им. Н.А. Семашко».
Прибор может работать и в механическом режиме, на случай отключения больницы от электроснабжения. Такой же есть и в Севастополе.
Алина Бакланова, Артём Баранов, «Новости 24».
Подписывайтесь на наш канал в Telegram и узнавайте самые важные новости раньше всех!
Теперь мы ещё и в TikTok, подписывайтесь @crimea24tv
И по-прежнему ждём вас: VK, OK, FB, Inst
___
Хотите рассказать о проблеме? Стали свидетелем происшествия? Пишите нам!
WhatsApp, Viber, Telegram +7 978 988 38 48
Как работает ЭКМО? | Dell Children’s
Специальные трубки, называемые канюлями, вводятся в кровеносные сосуды, которые входят непосредственно в сердце или кровоток вашего ребенка. Врач вашего ребенка выбирает размер трубок в зависимости от его или ее размера, возраста, веса и причины, по которой используется ЭКМО. Канюли переносят кровь из сердца ребенка с помощью насоса, проталкивая кровь по трубкам к аппарату, где кровь получает кислород и удаляет углекислый газ. Далее кровь подогревается до температуры тела.Наконец, теплая кровь проходит через другую канюлю обратно в тело вашего ребенка.
Посмотрите на следующие изображения цепи / механизма ECMO. Они помечены, чтобы помочь вам понять, как кровь течет от ребенка через канюли в машину и обратно к ребенку.
На этом изображении показаны различные части машины ЭКМО.
На этой диаграмме показано, как работает процесс оксигенации.
Какие режимы поддержки ECMO?
Вено-венозная (ВВ) : ЭКМО этого типа поддерживает только легкие.Одна или две канюли вводятся в большую вену (-а) сбоку шеи или в паховой области наверху ноги. Сердце вашего ребенка продолжит нормально работать. Аппарат ЭКМО будет откачивать кровь из вены через канюлю, в кровь добавляется кислород, удаляется углекислый газ, а затем кровь нагревается и возвращается обратно в правую часть сердца через канюлю. Сердце ребенка перекачивает насыщенную кислородом кровь к телу, так что легкие успевают отдохнуть и восстановиться.
Вено-артериальная (VA) : VA ECMO поддерживает как легкие, так и сердце. Две канюли вводятся в большие сосуды сбоку шеи, непосредственно в грудную клетку (при этом грудная клетка покрыта стерильным протектором) или в сосуды паха. Аппарат ЭКМО сливает кровь из вены, добавляет кислород и удаляет углекислый газ, нагревает кровь, а затем возвращает кровь в артерию и «прокачивает» кровь по телу. Этот метод позволяет крови «обойти» сердце и легкие, позволяя им отдохнуть и поправиться.
Эта диаграмма показывает упрощенную версию того, как кровь насыщается кислородом и возвращается в организм.
Чудо-машина
героически спасает и оставляет пациентов в подвешенном состоянии
[ОБНОВЛЕНО 19 июня]
Последняя чудо-машина в современной медицине, использование которой резко возросло в последние годы, спасает людей от смерти: взрослых, чьи легкие были разрушены гриппом; дальнобойщик, попавший в аварию под водой; человек, чье сердце перестало работать на удивительные семь часов.
Но за каждого взрослого, спасенного этим аппаратом, получившим название ЭКМО, для экстракорпоральной мембранной оксигенации, еще один взрослый, подключенный к аппарату, умирает в больнице. Для таких пациентов вмешательство — очень дорогая, трудоемкая и безуспешная попытка обмануть смерть.
ЭКМО, наиболее агрессивная форма жизнеобеспечения, выкачивает кровь из организма, насыщает ее кислородом и возвращает в организм, поддерживая жизнь человека в течение нескольких дней, недель или месяцев, даже когда его сердце или легкие не работают.
Изобретение создает «совершенно новую парадигму», — сказал доктор Кеннет Прагер, директор по клинической этике Медицинского центра Ирвинга Колумбийского университета. «У вас сердце не работает, но пациент жив».
Чаще всего используется для новорожденных, применение ЭКМО среди взрослых резко возросло. По данным Федерального агентства по исследованиям и качеству в области здравоохранения, в Соединенных Штатах с 2008 по 2014 год количество процедур увеличилось втрое, примерно до 6890.
Эксперты предупреждают, что по мере того, как ЭКМО становится все более доступной, ее также используют в качестве последней попытки выиграть больше времени для умирающих пациентов с низкими шансами на выживание.
ECMO — это не пункт назначения, а мост к чему-то — выздоровлению, трансплантации или имплантированному сердечному устройству. Но когда пациенты слишком больны, чтобы достичь этих целей, ЭКМО может стать «мостом в никуда», оставляя пациента в подвешенном состоянии, возможно, даже в бодрствующем состоянии, но без шансов на выживание за пределами отделения интенсивной терапии. Медицинские бригады и семьи могут быть жестко разделены по вопросу о том, когда отключать питание.
ЭКМО очень дорого, в основном из-за трудозатрат: человек, получающий ЭКМО, не может жить вне отделения интенсивной терапии и должен постоянно находиться под наблюдением на предмет таких осложнений, как образование тромбов, кровотечение, инфекция и потеря крови в конечностях. По данным AHRQ, медианная стоимость ЭКМО в 2014 году составила 550 000 долларов, что сделало ее 15-й по стоимости процедурой в том году.
По данным AHRQ, медианная стоимость ЭКМО в 2014 году составила 550 000 долларов, что сделало ее 15-й по стоимости процедурой в том году.
В одном недавнем случае учебная больница потребовала 4,2 миллиона долларов за 60-дневное пребывание в ЭКМО для 19-летнего мужчины с острым респираторным дистресс-синдромом, который все время находился в коме и не выжил, по словам доктора Меррита Куарума. Генеральный директор и основатель WellRithms, компании по ограничению затрат. Quarum сказал, что план медицинского страхования покрывает счет.
Номер U.Количество больниц, предлагающих ЭКМО, увеличилось более чем вдвое — со 108 в 2008 году до 264 на сегодняшний день, согласно реестру, который ведется Организацией экстракорпорального жизнеобеспечения (ELSO), которая отслеживает большинство, но не все программы.
«В Соединенных Штатах конкуренция между больницами настолько сильна, что каждая больница хочет иметь возможность предоставлять услуги такого уровня», — сказал Рэнди Бартилсон, президент консалтинговой фирмы ECMO Advantage.
Но «по мере того, как ECMO расширяется, есть еще много мест, которые до сих пор не до конца понимают, что он может делать и как его использовать», — сказал он.
Четыре истории пациентов подчеркивают перспективы и сложности этой революционной технологии.
Семичасовой код
Доктор Джессика Зиттер однажды работала в отделении интенсивной терапии в больнице Окленда, Калифорния, когда ее вызвали за синим кодом. Больной 60 лет поступил с сердечным приступом. Его сердце вошло в фибрилляцию желудочков, где оно просто шевелилось, как «мешок с червями», — сказала она.
Персонал больницы начал трогать мужчину ладонями по груди и вставил ему в горло трубку, чтобы помочь ему дышать.Время от времени они отступали и поражали его сердце электрическим током. Не сработало. Итак, они прикрепили к его груди тренажер LUCAS, который автоматически выполняет сжатие грудной клетки, как отбойный молоток.
Уровень кислорода у мужчины резко упал. В то же время, вспоминал Зиттер, он продолжал двигаться, давая ей ощущение, что есть жизнь, которую нужно спасти. Медицинская бригада решила перейти на следующий уровень: ЭКМО. Все ждали, все еще продолжая сжимать отбойные молотки, пока команда ЭКМО попыталась добраться туда из другой больницы в городе.
Зиттер с трепетом наблюдал, как команда ЭКМО из Калифорнийского университета в Сан-Франциско приступила к работе. Они воткнули одну огромную трубку в бедренную артерию, а другую — в бедренную вену. Когда они откачивали его кровь, она была черной от дезоксигенации. Но после того, как он прошел через аппарат ЭКМО, она вспоминала, что он стал ярко-красным.
(С разрешения больниц и клиник Университета Айовы)
На ЭКМО пациенту не нужно было сердце, поэтому оно могло сидеть без дела и восстанавливаться. Зиттер наблюдал, как кислород возвращается в его тело и мозг.Его увезли обратно в UCSF.
Зиттер, писавший о чрезмерном использовании современных технологий для продления смерти, не был оптимистичен. Пациент программировал с людьми и машинами, тараня его больное сердце, за удивительные семь часов до прибытия ЭКМО. Но, наблюдая за пациентом, она была поражена, узнав, что он смог выздороветь и вернуться домой.
Это дело было «большим шоком», — сказал Зиттер.
Но это был «сумасшедший, сумасшедший, сумасшедший случай с сумасшедшими, сумасшедшими, сумасшедшими отклонениями», — предупредила она.«Когда происходят такие вещи, люди склонны смотреть на них и предполагать, что у них будут те же шансы. На самом деле они этого не сделают ».
Согласно международной статистике ELSO, когда пациенты получают ECPR (ЭКМО для сердечно-легочной реанимации), только 29% покидают больницу живыми. По данным ELSO, выживаемость выше у людей, которые используют ЭКМО только для легких (59%) или только сердца (42%).
Спасение «Деда Мороза»
Более частый результат для ECPR выглядит примерно так, как Dr.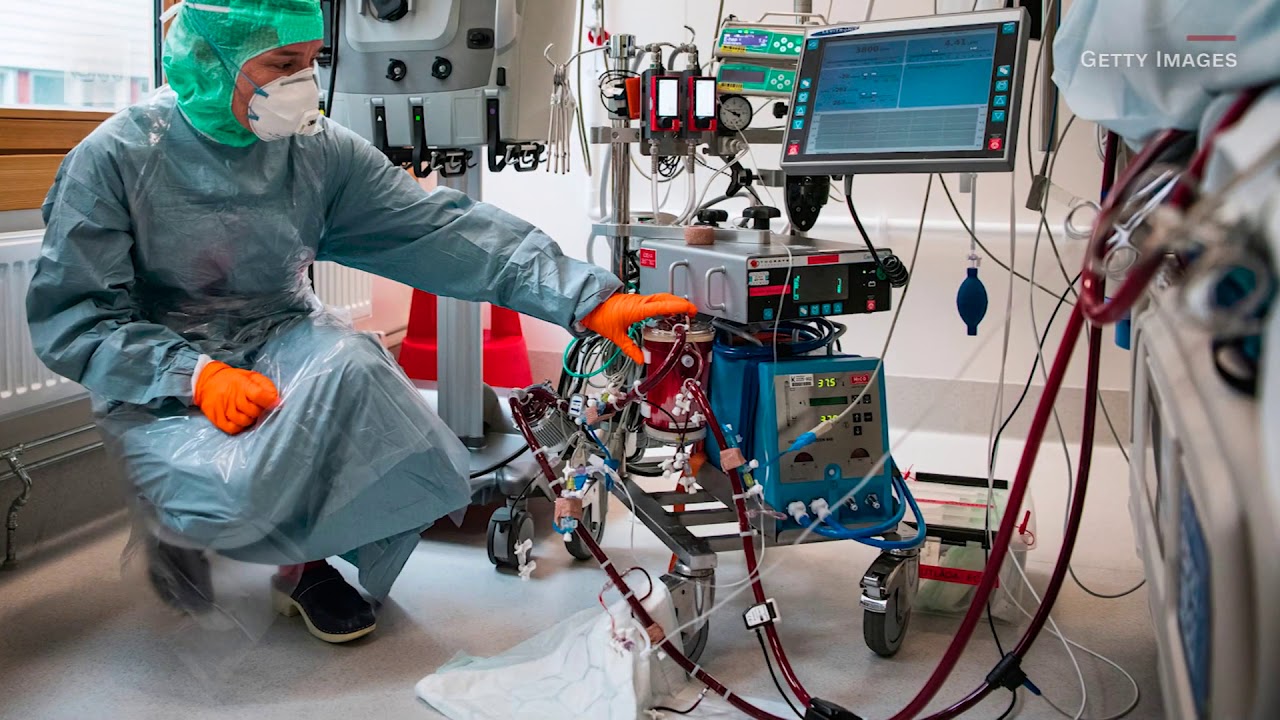 Хайдер Варрайх из Медицинского центра Университета Дьюка столкнулся с ним три или четыре года назад во время обучения кардиологу.
Хайдер Варрайх из Медицинского центра Университета Дьюка столкнулся с ним три или четыре года назад во время обучения кардиологу.
Warraich был вызван в зону ожидания клиники по пересадке легких, где мужчина в возрасте 60 лет упал на пол из-за сердечного приступа. Позже Уоррайч узнал, что этот человек с седыми волосами и взлохмаченной бородой играл Санту каждое Рождество. «Санта» — как Варрайч называет его в своей будущей книге «Состояние сердца» — получил новый набор легких после того, как он был разрушен курением и болезнью легких.
Сердце человека, лишенное кислорода, забилось в злобном ритме. СЛР и электрошок не вернули. Стремясь спасти не только пациента, но и полученный новый набор легких, команда вызвала ЭКМО.
Отряд ЭКМО прибыл с катетерами «размером с маленькое копье», — вспоминал Варрайч. Как только Санта подключился к ЭКМО, измученная команда СЛР могла остановиться. Кардиологи сделали операцию на закупоренной артерии, но так и не вернули его сердце в норму. Мужчина задержался в течение месяца, используя ЭКМО для сердца, вентилятор для легких и диализ для почек, прежде чем он умер.
В данном случае использование ЭКМО было уместным, сказал Уоррейч. Но он сказал, что врачам нужно больше рекомендаций, чтобы определить, какие пациенты принесут наибольшую пользу, и предотвратить чрезмерное употребление.
«Если перед тобой кто-то умирает, очень трудно сделать шаг назад и подумать об этом», — сказал он.
Технология, разработанная в 1970-х годах, первоначально использовалась в первую очередь для новорожденных. Ранние клинические испытания у взрослых обескураживали. Но в 2009 году исследование CESAR в Соединенном Королевстве показало положительные результаты ЭКМО у взрослых с тяжелой дыхательной недостаточностью.Эти результаты в сочетании с улучшенными технологиями и эпидемией свиного гриппа вызвали стремительный рост ЭКМО среди взрослых. Одно исследование показало, что средний возраст взрослого населения США, получающего ЭКМО, составляет 51 год. Примерно 1 из 10 случаев ЭКМО приходится на людей старше 65 лет.
Примерно 1 из 10 случаев ЭКМО приходится на людей старше 65 лет.
Варрайч и другие эксперты говорят, что теперь они обеспокоены тем, что новые правила донорства органов могут непреднамеренно побудить больницы переводить больше пациентов на ЭКМО: согласно руководящим принципам, утвержденным Сетью закупок и трансплантации органов в октябре прошлого года, пациенты, получающие ЭКМО, прыгают на передний край сердца. лист ожидания трансплантации.
«Невыносимый» выбор
Когда пациент находится на ЭКМО, решение о том, когда остановиться, может вызвать моральный стресс и разногласия среди медицинского персонала, сказал доктор Роберт Труог, директор Центра биоэтики Гарвардской медицинской школы.
В одном случае, описанном Труогом в The Lancet, 17-летний мальчик попал в отделение интенсивной терапии детской больницы Бостона, где Труог работает врачом. Мальчик, которому уже была сделана одна трансплантация легкого по поводу муковисцидоза, в настоящее время находится в терминальной стадии дыхательной недостаточности.Единственный способ спасти его жизнь — дать ему еще один набор легких. Он начал ЭКМО в качестве промежуточной терапии, пока ждал трансплантации.
Мальчик был полностью в сознании, делал уроки, писал друзьям и навещал семью. Но после двух месяцев пребывания в отделении интенсивной терапии у него обнаружили неизлечимый рак, что лишило его права на получение новых легких.
Клиницисты были глубоко разделены по поводу того, что делать дальше, сказал Труог. Некоторые хотели немедленно прекратить ЭКМО, потому что ее первоначальная цель — мост к трансплантации — больше не была возможна.
Другие утверждали, что, несмотря на то, что он не мог выжить вне отделения интенсивной терапии, у мальчика, казалось, было хорошее качество жизни на ЭКМО, и его семья и друзья «извлекли пользу из его продолжающегося выживания», — писал Труог. Они утверждали, что семья должна иметь право продолжать эту форму жизнеобеспечения, так же как диализ, вентиляцию или искусственное сердце.
Возник третий аргумент, сказал Труог: если оставить этого пациента на ЭКМО было уместно, то, справедливости ради, «почему бы нам не поместить всех с дыхательной недостаточностью на ЭКМО?»
Для родителей, сказал Труог, было «невыносимо» выбирать день или момент, чтобы выключить ЭКМО, потому что они знали, что их ребенок немедленно умрет.
Клиницисты придумали альтернативу, на которую согласилась бы семья: они решили не заменять оксигенатор ЭКМО, деталь, которую необходимо менять каждую неделю или две, когда в ней образуются тромбы. Примерно через неделю оксигенатор постепенно вышел из строя, пациент потерял сознание и умер, сказал Труог.
Решение «позволило ему умереть таким образом, чтобы мы не чувствовали, что выбираем момент его смерти», — сказал он.
Решение не было оптимальным, сказал Труог.Но «как бы вы это ни делали, это всех будет очень эмоционально расстроить. Это те случаи, когда некоторые люди бросают профессию, потому что они такие тяжелые ».
Долгое прощание
Карен Аюб никогда не слышала об ЭКМО, пока ее муж серьезно не заболел.
Филип Аюб, 58 лет, бухгалтер и бывший контролер Национальной футбольной лиги, был «большой личностью» и семейным человеком; пара вырастила мальчиков-близнецов в Гринвиче, штат Коннектикут.Болезнь сердца, которая была характерна для его семьи, поразила его рано: ему сделали первую операцию коронарного шунтирования в 30 лет, а вторую — в 43, сказала она.
«Он знал, что его жизнь может быть сокращена» и «старался вложить в нее как можно больше живого», — сказала 55-летняя Карен Аюб. Ее муж сказал ей, что не хочет никаких чрезвычайных мер по спасению жизни — он был доволен этим — сказала она.
В декабре 2017 года ему сделали третью операцию по шунтированию в больнице на Лонг-Айленде, и она не прошла.Его сердце было слабее, чем ожидалось. Он потерял сознание, и было неясно, проснется ли он когда-нибудь. Его перевели в Медицинский центр Ирвинга Колумбийского университета, где есть программа ЭКМО.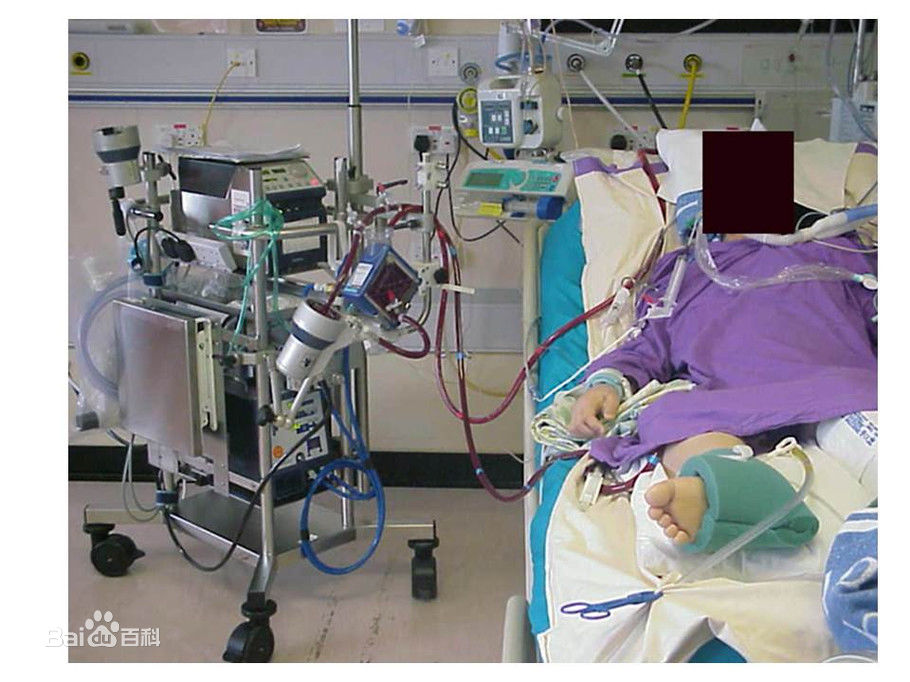
58-летний Филип Аюб, бухгалтер и бывший контролер Национальной футбольной лиги, со своими сыновьями-близнецами. Болезнь сердца, которая была характерна для его семьи, поразила его рано: ему сделали первую операцию коронарного шунтирования в 30 лет, а вторую — в 43.
Карен Аюб сказала, что перевести мужа на ЭКМО было довольно легко: «Я думала, что он заслуживает любого шанса на выздоровление», — сказала она.Но она не знала, как он отреагирует.
«Я не был уверен, собирается ли он проснуться и сказать:« Зачем ты это сделал? Я ничего этого не хотела! »- вспоминала она.
Когда ее муж пришел в сознание, он произнес слова: «Почему я здесь?»
Он оставался в отделении интенсивной терапии в течение двух месяцев, на трубке для кормления, дыхательной трубке, ЭКМО и диализе. По ее словам, его пребывание там было нелегким: ее муж, перенесший серию мини-инсультов во время операции по шунтированию, начал испытывать посттравматическое стрессовое расстройство, ночные кошмары и побочные эффекты от лекарств.
По ее словам, единственным вариантом дальнейшего лечения было имплантированное устройство, которое помогло бы его сердцу перекачивать кровь. Но по мере того, как он взвешивал это решение и качество своей жизни, окно времени закрылось, когда он получил право на устройство, сказала Карен Аюб.
Когда дальнейшее лечение стало недоступным, стало ясно, что ее муж умрет.
«Его тело подводило его», — сказала Карен Аюб. «Было время.»
Она сказала, что два месяца в отделении интенсивной терапии были для нее «подарком», потому что ей и ее детям пришлось проводить дополнительное время со своим мужем.
«Я всегда буду любить тебя, я всегда буду с тобой», — говорил он жене все это время снова и снова.
Она сказала, что сделает тот же выбор снова, чтобы начать ЭКМО, но «я не знаю о нем — он лежал в этой постели два месяца, пытаясь иглами и ночными видениями».
После того, как у них закончились варианты лечения, семья разрешила больнице прекратить жизнеобеспечение.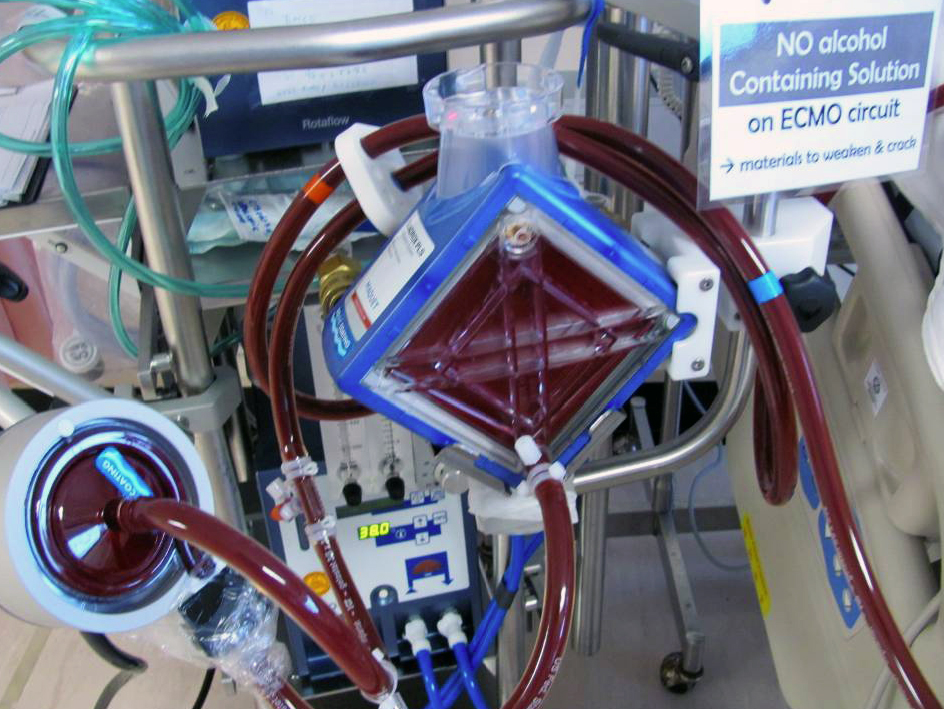 Она сказала, что Филип не испугался: приближаясь к его последнему дню, он сказал ей: «Не могу дождаться, чтобы увидеть, что будет дальше.”
Она сказала, что Филип не испугался: приближаясь к его последнему дню, он сказал ей: «Не могу дождаться, чтобы увидеть, что будет дальше.”
Филип получил успокоительное перед выключением ЭКМО. Карен Аюб положила голову своему мужу на грудь и держала его за руки, когда он умер.
«Это было мирно и уважительно, — сказала она, — именно то, чего он хотел».
«Бесполезный» уход
В то время как семья Аюб смело приняла свою судьбу, другие семьи не могут заставить себя отпустить, — сказал доктор Шуничи Накагава, врач паллиативной помощи из Колумбийского университета, который ухаживал за Филипом Аюбом.
Некоторые пациенты ЭКМО страдают серьезным необратимым повреждением головного мозга, не могут участвовать в принятии решений и не имеют шансов выйти из больницы живыми.Для них ЭКМО представляет собой «крайнюю форму медицинской бесполезности», — утверждал Накагава в статье, написанной им и Прагером в соавторстве с коллегой из журнала Circulation. Они утверждают, что, учитывая значительное количество пациентов на ЭКМО, которые не могут выжить, это «должно вызвать общественную дискуссию о текущих юридических ограничениях для врачей» в отношении отказа от «новых и мощных форм жизнеобеспечения».
Смогут ли они остановить ЭКМО, зависит от того, где они практикуют: законы в таких штатах, как Айдахо, Оклахома и Нью-Йорк затрудняют отмену поддерживающего жизнь лечения, такого как ЭКМО, без согласия пациентов или их семей, — сказал Таддеус Мейсон Поуп, директор клиники. Институт права здоровья в Юридической школе Митчелла Хэмлайна в Св.Пол, Миннесота. Но в таких штатах, как Калифорния, Техас и Вирджиния, врачи могут отменить ЭКМО без согласия, сказал он.
Доктор Роберт Бартлетт, пионер в области ЭКМО и почетный профессор Мичиганского университета, сказал, что он обучает врачей тому, что как только ЭКМО становится мостом в никуда, они должны сказать семье: «Мы говорили о бесполезности, а теперь мы» re там. Так что завтра мы отключим цепь.
«Для семьи крайне невежливо спрашивать, что ей делать, — сказал он.
В медицинском центре Cedars-Sinai в Лос-Анджелесе, где пациенты с низкими шансами на выживание были переведены на ЭКМО, а семьи получали противоречивые сообщения о потенциальной пользе, сотрудники предприняли меры по улучшению, которые привели к большему консенсусу и согласованности в отношении соответствующей ЭКМО. по словам доктора Майкла Нурока, медицинского директора кардиохирургического отделения интенсивной терапии.
В больнице Кек при Университете Южной Калифорнии каждая семья пациента с ЭКМО еженедельно встречается с представителями паллиативной помощи и другими клиницистами, чтобы обсудить цели лечения — беседы, которые «преобразуют» семьи, сказал доктор.Сунита Пури, медицинский директор по паллиативной медицине и поддерживающей терапии.
В Бостоне доктор Даниэла Ламас, врач интенсивной терапии в Бригаме и женской больнице, сказала, что она видела перспективы ЭКМО и ее ограничения.
«С каждой эскалацией и каждой модной машиной приходит много надежды», — сказал Ламас. «Очень трудно умерять эту надежду тем, что с каждой новой вещью возникает множество этических вопросов и дилемм».
По ее словам,
ECMO — это «фантастический пример того, что« только потому, что вы можете, это не значит, что вы должны ».’”
Какое оборудование необходимо для проведения педиатрической ЭКМО?
Автор
Эдвин Родригес-Крус, доктор медицины Директор отделения кардиологии педиатрического отделения детской больницы Сан-Хорхе, Пуэрто-Рико; Частная практика в области интервенционной детской кардиологии и внутренней медицины, Centro Pedíatrico y Cardiovascular
Эдвин Родригес-Крус, доктор медицины, является членом следующих медицинских обществ: Американского колледжа кардиологов, Американской кардиологической ассоциации, Американского общества эхокардиографии, Общества сердечно-сосудистой ангиографии и Вмешательства, Общество детской эхокардиографии, Американский колледж врачей — Американское общество внутренней медицины, Американская медицинская ассоциация, Медицинская ассоциация Пуэрто-Рико
Раскрытие информации: выступать (d) в качестве докладчика или члена бюро докладчиков для: St Jude’s Medical Co .
Получил грант / средства на исследования от NOVARTIS для исследователя; Получил гонорар от St. Jude Medical Corp. за выступление и преподавание.
Соавтор (ы)
Генри Уолтерс, III, доктор медицины Адъюнкт-профессор хирургии медицинского факультета Государственного университета Уэйна; Заведующий отделением хирургии отделения сердечно-сосудистой хирургии Детской больницы штата Мичиган
Генри Уолтерс, III, доктор медицинских наук является членом следующих медицинских обществ: Alpha Omega Alpha, Американская ассоциация торакальной хирургии, Американская медицинская ассоциация, Международное общество сердца. и трансплантация легких, Phi Beta Kappa, Общество торакальных хирургов
Раскрытие: Ничего не нужно раскрывать.
Санджив Аггарвал, MD, MBBS Штатный врач, Отделение педиатрии, Детская больница штата Мичиган
Санджив Аггарвал, MD, MBBS является членом следующих медицинских обществ: Американская академия педиатрии, Американская медицинская ассоциация
Раскрытие информации: ничего раскрывать.
Специальная редакционная коллегия
Мэри Л. Виндл, доцент PharmD , Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: нечего раскрывать.
Мэри К. Манчини, доктор медицинских наук, MMM Главный хирург и директор кардиоторакальной хирургии, Кристус Хайленд
Мэри К. Манчини, доктор медицины, доктор медицинских наук, MMM является членом следующих медицинских обществ: Американской ассоциации торакальной хирургии , Американский колледж хирургов, Американская хирургическая ассоциация, Фи Бета Каппа, Общество торакальных хирургов
Раскрытие информации: нечего раскрывать.
Главный редактор
Стюарт Бергер, MD Исполнительный директор Кардиологического центра, временный начальник отделения детской кардиологии детской больницы Лурье; Профессор кафедры педиатрии Северо-Западного университета, Медицинская школа им. Файнберга
Стюарт Бергер, доктор медицинских наук, является членом следующих медицинских обществ: Американская академия педиатрии, Американский колледж кардиологии, Американский колледж грудных врачей, Американская кардиологическая ассоциация, Общество. для сердечно-сосудистой ангиографии и вмешательств
Раскрытие: Ничего не раскрывать.
Дополнительные участники
Даниэль С. Шварц, доктор медицины, магистр делового администрирования, FACS Медицинский директор отделения торакальной онкологии, Медицинский центр Святой Екатерины Сиенской, Служба католического здравоохранения
Даниэль Шварц, доктор медицины, магистр делового администрирования, FACS является членом следующих медицинских обществ: Американский колледж врачей-терапевтов, Американский колледж хирургов, Общество торакальных хирургов, Западная торакальная хирургическая ассоциация
Раскрытие информации: нечего раскрывать.
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера на прием файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Исторические перспективы | Американская академия педиатрии
Введение
В 1984 и 1985 годах мы провели проспективное рандомизированное исследование экстракорпоральной жизнеобеспечения (ECLS) по сравнению с традиционным лечением при дыхательной недостаточности новорожденных, о котором сообщалось в Pediatrics в 1985 году.(1) Спустя два десятилетия ECLS является стандартным лечением респираторной недостаточности новорожденных, не поддающейся лечению другими методами. Редакторы NeoReviews предложили этот комментарий о разработке и клиническом внедрении ECLS при неонатальной дыхательной недостаточности.
Аппарат «сердце-легкие»
Аппарат «сердце-легкие» был изобретен Джоном Гиббоном и первоначально использовался в клинической практике в 1954 г. для восстановления функций сердца и легких на достаточно длительный период, позволяющий проводить операции на сердце.Благодаря этому изобретению возникла вся область кардиохирургии. Однако сам аппарат искусственного кровообращения вызвал повреждение крови и полиорганную недостаточность при использовании более 1 часа. Основной причиной повреждения крови было прямое воздействие на кровь газообразного кислорода. В 1960-х годах некоторые лаборатории и производители медицинского оборудования разработали газообменные устройства, в которых мембрана из силиконовой резины была вставлена между кровью и кислородом. Эта модификация (и другие) позволяла использовать аппарат искусственного кровообращения в течение нескольких дней или недель.
Эволюция в ECMO
В 1971 году длительное экстракорпоральное кровообращение было успешно использовано для лечения молодого человека, у которого после травмы был острый респираторный дистресс-синдром (ОРДС). (2) В следующие несколько лет сообщалось о нескольких других случаях использования длительной экстракорпоральной поддержки для лечения сердечной и дыхательной недостаточности по разным причинам. Поскольку мембранный тип искусственного легкого был уникальной частью устройства, вся технология пролонгированной ЭКМО стала известна как экстракорпоральная мембранная оксигенация (ЭКМО).Конечно, эта технология включает в себя гораздо больше, чем оксигенацию, но эта аббревиатура осталась.
В 1975 году Национальные институты здравоохранения (NIH) спонсировали проспективное рандомизированное многоцентровое исследование ЭКМО при ОРДС у взрослых пациентов. (3) Только 10%…
Экстракорпоральная мембранная оксигенация в отделении неотложной помощи | 2020-03-04 | Relias Media
Искусственное кровообращение в отделении неотложной помощи (ED)? Вы, должно быть, сумасшедший или ослепляюще высокомерный. Ну, возможно.Но чтобы обдумывать героические меры в ED требует немного высокомерия. Как описано в этом выпуске Emergency Medicine Reports , экстракорпоральная мембранная оксигенация (ЭКМО) может спасти жизнь у отдельных пациентов, хотя и с высокой частотой осложнений и некоторыми долгосрочными эффектами. Возможно, только несколько врачей скорой помощи в избранных городских больницах смогут внедрить ЭКМО в ED. Для остальных из нас, работающих в общественных больницах, целью этой статьи является понимание этой терапии и понимание потенциальных кандидатов.
— Джозеф Стефан Стапчински, доктор медицины, редактор
Введение
Экстракорпоральное жизнеобеспечение (ECLS) включает несколько методов временной механической сердечно-легочной поддержки, включая экстракорпоральное удаление углекислого газа (ECCO2R), искусственное кровообращение (CPB) и экстракорпоральную мембранную оксигенацию (ECMO). ЭКМО обеспечивает сердечную и респираторную поддержку пациентам, у которых есть потенциально обратимые причины сердечной или дыхательной недостаточности.В то время как CPB использует аппарат искусственного кровообращения для полного обхода сердечно-легочного кровообращения, ECMO функционирует за счет увеличения оксигенации, вентиляции и сердечного выброса. 1 Деоксигенированная кровь берется из венозного кровообращения; прокачивается через внешний мембранный оксигенатор, который удаляет диоксид углерода (CO 2 ) и восполняет кислород; и вернулся в венозное или артериальное кровообращение.
Из-за роста исследований ЭКМО и обучения специалистов по интенсивной терапии, использование ЭКМО в США увеличилось на 433% с 2006 по 2011 год. 2 Количество больниц в США, предлагающих ЭКМО, выросло со 108 в 2008 году до 264 сегодня. 3 Около 14 000 взрослых пациентов получили ЭКМО в период с 1990 по 2014 год, при этом коэффициент выживаемости до выписки составил 57% для пациентов с дыхательной недостаточностью и 41% для пациентов с сердечной недостаточностью. 4
Инициирование ЭКМО отделением неотложной помощи (ED) — относительно новая разработка, но со значительным потенциалом для роста. Это особенно заметно в центрах, уже выполняющих ЭКМО в отделениях интенсивной терапии (ОИТ). 5 Знакомство с показаниями и механизмами ЭКМО важно для поставщиков неотложной помощи на переднем крае ведения критически больных пациентов, которым требуется агрессивная реанимация.
История
Первое успешное использование экстракорпорального кровообращения у людей с аппаратом искусственного кровообращения было предпринято Гиббоном в 1953 году для восстановления дефекта межпредсердной перегородки. 6 В 1971 году ЭКМО успешно использовалась в течение 75 часов у 24-летнего пациента с дыхательной недостаточностью в условиях травматической перерезки грудной аорты, который в конечном итоге выздоровел. 7 Роберт Бартлетт стал известен как «отец ЭКМО» за его успешное использование ЭКМО у новорожденного пациента с аспирацией мекония в 1975 году. 8 Данные национального реестра, собранные между 1980 и 1987 годами, продемонстрировали выживаемость новорожденных 81%. пациенты с тяжелой дыхательной недостаточностью, поддерживаемые ЭКМО. 9 Это послужило поводом для серии рандомизированных контролируемых испытаний, которые показали обнадеживающие результаты применения ЭКМО у новорожденных. 10-12
Использование ЭКМО у взрослого населения дало неоднозначные результаты.Первоначальные отчеты были обескураживающими, так как рандомизированные контролируемые испытания не смогли показать какой-либо статистической разницы в выживаемости между группами традиционной интенсивной терапии и ЭКМО. 13,14 Испытание традиционной респираторной поддержки и экстракорпоральной мембранной оксигенации при тяжелой дыхательной недостаточности у взрослых (CESAR) было первым исследованием ЭКМО у взрослых пациентов, продемонстрировавшим увеличение выживаемости. Пациенты с острым респираторным дистресс-синдромом (ОРДС) чувствовали себя лучше при лечении в центре ЭКМО (но не обязательно в ЭКМО) по сравнению с традиционным лечением. 15 ЭКМО также широко использовалась для лечения взрослых пациентов во время пандемии гриппа h2N1 в 2009 году. 16
Исследование ЭКМО для лечения травм легких при тяжелом ОРДС (EOLIA) было большим многоцентровым рандомизированным контролируемым исследованием, которое продемонстрировало, что ЭКМО безопасна и подходит для использования без увеличения смертности по сравнению с традиционной терапией. Хотя EOLIA предназначалось для изучения эффектов раннего начала ЭКМО, оно было прекращено из-за высокой скорости кроссовера.Тем не менее, в нем подчеркивается роль ЭКМО как средства спасения, которое может снизить смертность у пациентов, у которых традиционные и другие методы лечения ОРДС оказались неэффективными. 17
Что такое ЭКМО?
При ЭКМО деоксигенированная кровь отводится из вены, прокачивается через мембранный оксигенатор, который удаляет CO 2 и восполняет кислород, а затем снова вводится в организм через артерию или вену.
Принципы ECMO
Основная цель ECMO — способствовать успешному газообмену как углекислого газа, так и кислорода.Мембранный оксигенатор во многом похож на естественное легкое — удаляет растворенный углекислый газ из крови и добавляет кислород к гемоглобину в красных клетках. Движение этих газов через мембрану зависит от разных факторов. В общем, удаление CO 2 более эффективно, чем добавление кислорода, что приводит к потенциальному дисбалансу газообмена. Кислородный обмен через мембранный оксигенатор зависит от толщины пленки крови, материала мембраны, доли вдыхаемого кислорода (FiO 2 ) и концентрации гемоглобина.Обмен углекислого газа определяется общей площадью поверхности, кровотоком и скоростью потока «продувочного газа». Иногда может потребоваться добавление CO 2 к продувочному газу для предотвращения респираторного алкалоза из-за чрезмерного удаления CO 2 . 18
В отличие от традиционной CPB, при которой сердце остановлено, ECMO не требует тотальной антикоагуляции с гепарином для предотвращения образования тромба из-за более высокой скорости кровотока (4 л / мин по сравнению с 2 л / мин при CPB).Контур ЭКМО также длится несколько недель по сравнению с часами с CPB. 19
Конфигурация в ECMO
Венозная ЭКМО применяется при изолированной дыхательной недостаточности с сохраненной сердечной функцией. Он забирает дезоксигенированную кровь из венозного кровообращения и возвращает насыщенную кислородом кровь в вены. Контур ЭКМО существует последовательно с легкими. 20
Напротив, веноартериальная (ВА) ЭКМО обеспечивает частичную или полную поддержку дыхания и кровообращения.Он забирает дезоксигенированную кровь из венозной системы и возвращает насыщенную кислородом кровь в артериальную систему. Схема работает параллельно с собственным сердцем и легкими. 20 Диализная мембрана может быть добавлена к любому контуру для обеспечения непрерывной заместительной почечной терапии. 21,22
ЭКМО в отделении неотложной помощи используется в основном либо в качестве временной меры при рефрактерном шоке (ЭКМО), либо при остановке сердца (экстракорпоральная сердечно-легочная реанимация или ECPR). 4,23
Цепь ECMO
Базовый контур ЭКМО представляет собой замкнутую систему, состоящую из канюли венозного дренажа, насоса, мембранного оксигенатора, теплообменника, блендера, центральной консоли, встроенных мониторов и возвратной канюли. 20,23 ( См. Рисунок 1. )
Насосы
Насос является важным компонентом машины ECMO. Он обеспечивает циркуляцию крови по контуру ЭКМО, а также обратно к пациенту, увеличивая венозный отток.Насос должен обеспечивать адекватный поток к пациенту в безопасном диапазоне давлений. Низкое выходное давление может привести к гемолизу, а высокое выходное давление может привести к разрыву контура. 24 В устройствах ECMO используются насосы двух типов: роликовый и центробежный.
Роликовые насосы работают за счет постепенного сжатия сегментов трубопроводов контура и проталкивания крови по изогнутой дорожке качения. Эта непрерывная перистальтика системы трубок создает отрицательное давление, которое отводит венозную кровь от пациента, а также положительное давление, которое толкает насыщенную кислородом кровь обратно в пациента.Преимущество роликовых насосов в том, что они обеспечивают непрерывный поток в контуре независимо от предварительной нагрузки. Их главный недостаток в том, что они вызывают гемолиз. 18,20,24
Центробежные насосы меньше по размеру и состоят из головки насоса, которая содержит крыльчатку с магнитным приводом, вращающуюся с высокой скоростью. Это создает перепад давления, который приводит к потоку крови через насос. Центробежные насосы связаны с меньшей степенью гемолиза. 25 Однако они также связаны с определенными недостатками, такими как застой и нагрев в головке насоса, образование тромбов в выпускной линии при низких расходах и неспособность поддерживать заданный расход.
Центробежные насосы нового поколения были разработаны с целью преодоления большинства этих недостатков и в значительной степени заменили роликовые насосы. Например, центробежные насосы с магнитной левитацией были связаны с улучшенными результатами. 26 Эти модификации центробежных насосов сыграли ключевую роль в обеспечении возможности расширенной поддержки через ECMO.
Газообменные мембраны
Газообменная мембрана в контуре ECMO выполняет функцию добавления кислорода и удаления CO 2 .Эффективность или номинальный поток оксигенатора измеряется как количество ненасыщенной крови, которая может быть почти полностью насыщена за минуту. Мембраны были разработаны с использованием различных материалов, включая силиконовый каучук, полипропилен, полиметилпентен (PMP), поливинилхлорид, полиуретан и нержавеющую сталь. 24
Двумя наиболее часто используемыми мембранами являются оксигенатор с силиконовой мембраной и оксигенатор из полых волокон (HFO). Легкие из силиконовой резины Kolobow использовались в машинах ЭКМО на протяжении десятилетий.Было обнаружено, что силиконовая мембрана очень эффективна при газообмене; однако у него было несколько недостатков. Размер мембраны требует корректировки в зависимости от роста пациента. Поэтому больницам необходимо было приобрести разные аппараты ЭКМО для педиатрического и взрослого населения. Было обнаружено, что сопротивление потоку было высоким, что сделало мембрану из силиконового каучука менее подходящей для использования с центробежными насосами. Транспортировка также была сложной из-за громоздкой конструкции и большей продолжительности грунтования. 27
В новом классе оксигенаторов из полых волокон PMP решено большинство этих проблем. Эти полые волокна представляют собой капиллярные трубки, содержащие газ внутри и кровь на поверхности. Это позволяет осуществлять газообмен через противоточный механизм. Мембраны HFO более прочные, чрезвычайно эффективны при газообмене, демонстрируют минимальную утечку плазмы и имеют относительно низкое сопротивление кровотоку. Кроме того, они реже образуют тромбы, их легче заправлять, они более компактны и хорошо подходят для использования с центробежными насосами для крови. 28
Теплообменник
Потеря тепла происходит во время ЭКМО из-за воздействия крови пациента на большую площадь экстракорпоральной поверхности, особенно у детей. По этой причине для всех контуров ECMO требуется теплообменник для поддержания температуры от 37 ° C до 40 ° C. Теплообменники обычно используют поток нагретой воды противотоком кровотоку. Следует избегать чрезмерного нагрева, поскольку это приведет к гемолизу и образованию пузырей. Мембранные оксигенаторы нового поколения содержат встроенное устройство теплообмена, которое сокращает количество компонентов и упрощает схему ECMO. 18
Встроенные мониторы
Контур ЭКМО
содержит встроенные мониторы, которые измеряют кровоток, химический состав, давление, pH, концентрацию оксигемоглобина и парциальное давление CO 2 (pCO 2 ). Эти мониторы размещаются как на венозном, так и на артериальном концах контура. Они помогают обнаруживать проблемы, такие как пузырьки в системе, отказ оксигенатора, повышенное давление и отключения. Насыщение оксигемоглобином конечности венозного доступа контура при ВА ЭКМО особенно полезно для оценки адекватности доставки кислорода. 24
Канюля
Венозная
Доступны три варианта размещения канюли VV ECMO ( см. Рисунок 2 ):
Перепечатано с разрешения: Kulkarni T, Sharma NS, Diaz-Guzman E. Экстракорпоральная мембранная оксигенация у взрослых: Практическое руководство для терапевтов. Cleve Clin J Med 2016; 83 (5): 373-384.DOI: 10.3949 / ccjm.83a.15021. Авторские права © 2016 Cleveland Clinic Foundation. Все права защищены. |
- Феморо-предсердный доступ обычно включает дренаж дезоксигенированной крови из бедренной вены и возврат насыщенной кислородом крови в правое предсердие через правую внутреннюю яремную вену. 23
- Bicaval Access использует одинарный двухпросветный катетер, который отводит венозную кровь через внутреннюю яремную вену и возвращает насыщенную кислородом кровь непосредственно в правое предсердие. 29 Одиночная канюля имеет преимущества уменьшения рециркуляции и инфицирования места канюли. Однако для обеспечения правильного размещения требуется чреспищеводная эхокардиография или рентгеноскопия.
- Бифеморальный доступ включает удаление дезоксигенированной крови из нижней полой вены (НПВ) через бедренную вену с одной стороны и возврат насыщенной кислородом крови в правое предсердие через контралатеральную бедренную вену. Бифеморальный доступ имеет несколько преимуществ. Обе бедренные вены большие и легко доступны, что позволяет быстро инициировать ВВ ЭКМО.Близость к бедренной артерии полезна в случае, если требуется поддержка VA. Бедренная канюляция также не требует чреспищеводной эхокардиографии или рентгенографии. 30
Веноартериальная
Для установки канюли VA ECMO доступны два основных варианта.
- Центральная канюляция выполняется через стернотомию в операционной, поскольку она включает прямой отток венозной крови из правого предсердия и возврат в проксимальный отдел восходящей аорты.Основное преимущество центральной канюляции — хороший венозный отток с надежным артериальным оттоком, что обеспечивает высокую скорость кровотока по всему телу. Он не лишен недостатков из-за его инвазивного характера и необходимости иммобилизации пациента. Возможные осложнения включают проблемы со стернотомией, расслоение аорты и тромбоэмболические осложнения. 31
- Установка периферической канюляции намного проще, потому что ее можно выполнить через чрескожный доступ у постели больного.Обычно для сосудистого доступа используются бедренная вена и ипсилатеральная бедренная артерия. Другие варианты включают внутреннюю яремную вену для венозного доступа и сонную или подключичную / подмышечную артерию для артериального доступа. Кончик канюли расположен в середине правого предсердия, а артериальная канюля — в общей подвздошной артерии.
Канюляция бедренной артерии связана со многими рисками, такими как ишемия нижних конечностей, отек легких и феномен водораздела (смешивание деоксигенированной крови из левого желудочка пациента с оксигенированной кровью из отделения ЭКМО), что приводит к коронарной и церебральной гипоксии .Эти риски лишь частично присутствуют при катетеризации подключичной артерии. 32 Выполнение катетеризации в условиях реанимации может быть сложной задачей, и в этих случаях может быть очень полезно использование чреспищеводной эхокардиографии (ЧЭ).
Антикоагулянт
Кровотечения и тромботические осложнения являются основными осложнениями, наблюдаемыми при ЭКМО. Согласно отчету реестра Организации экстракорпорального жизнеобеспечения (ELSO), частота замены контура из-за тромботических осложнений составляет около 20%. 33 Когда кровь подвергается воздействию больших неэндотелиальных поверхностей в цепи ЭКМО, стимулируются каскады воспалительного процесса и коагуляции. Основной болезненный процесс также может вызывать как тенденцию к кровотечению, так и состояние гиперкоагуляции, в зависимости от его воздействия на систему гемостаза.
Следовательно, пациенты, которым вводят ЭКМО, должны получать антикоагулянты. Наиболее распространенным антикоагулянтом является нефракционированный гепарин, который вводят в виде непрерывной инфузии. 34 При ECLS гепарин обычно вводят в виде болюса 100 МЕ / кг после открытия сосудистого доступа.Инфузия гепарина титруется для поддержания активированного времени свертывания 160-220 или активированного частичного тромбопластинового времени 45-55 секунд. 35 Низкомолекулярный гепарин также можно вводить подкожно взрослым пациентам во время ЭКМО, но он используется реже. Описаны прямые ингибиторы тромбина (например, бивалирудин) и ингибиторы фактора Ха (например, ривароксабан, аргатробан), но мало крупномасштабных исследований. 36 Антикоагулянтная терапия не назначается пациентам с риском кровотечения.
ECMO в ED
Появление нового оборудования для ЭКМО и подтверждающих данных из предыдущих исследований проложило путь для его использования в качестве терапии спасения в отделении неотложной помощи. Два термина, связанные с его использованием в ED, — это ECLS и экстракорпоральная сердечно-легочная реанимация (ECPR). ECLS описывается как ECMO, используемая для отлучения тяжелобольного пациента, в то время как ECPR относится к использованию VA ECMO при остановке сердца.
Было показано, что
ECPR играет роль в продолжающейся рефрактерной остановке сердца, 18 тяжелой случайной гипотермии, 37 при утоплении, 38 легочной эмболии, 39 септическом шоке, 40 и даже серьезных электролитных нарушениях. 41 ЭКМО в отделении неотложной помощи позволяет выиграть время для диагностического обследования или служить мостом для терапевтических вмешательств, таких как чрескожное коронарное вмешательство, согревание или хирургическое вмешательство при травмах. 41
Показания к ЭКМО в ED
Решение начать ЭКМО у пациента в отделении неотложной помощи является сложным и варьируется в зависимости от политики учреждения, факторов пациента и основного заболевания. Как правило, более молодые и здоровые пациенты с острым обратимым инсультом, приводящим к быстрому сердечно-легочному коллапсу, при наличии окончательного плана лечения, как правило, имеют лучшие результаты.Ниже приведены некоторые показания для ED ECMO:
.
ВА ЭКМО для остановки сердца (ECPR). Для службы экстренной помощи применение VA ECMO в ECPR было самым захватывающим событием. ECPR может быть полезен для сокращения времени от остановки до восстановления церебральной перфузии. 1 Бедренные артериальные и венозные катетеры под контролем ультразвука вводятся при продолжающейся сердечно-легочной реанимации (СЛР). После подключения к экстракорпоральному контуру подтверждается полное искусственное кровообращение и СЛР прекращается.
В настоящее время появляется все больше доказательств того, что пациенты с остановкой сердца вне больницы, начавшие с ECPR, имеют лучшие результаты по сравнению с традиционной CPR. Успешное начало ЭКМО врачами отделения неотложной помощи продемонстрировало улучшение неврологически неповрежденной выживаемости. 42,43 Наблюдаемая остановка или остановка ЭД, фибрилляция желудочков или желудочковая тахикардия в качестве исходного ритма, возрастной диапазон от 18 до 70 лет, предполагаемая сердечная причина и минимальное прерывание сжатия грудной клетки были связаны с положительными результатами и являются примерами, в которых ECPR следует считать.Результаты ECPR с остановкой сердца в больнице были относительно более обнадеживающими, вероятно, из-за более короткого времени до начала обходного анастомоза.
Основным ограничением исследований ECPR является то, что большинство данных являются ретроспективными и получены из отдельных центров; поэтому они склонны к предвзятости и ошибочности. Неврологические исходы после ECPR также могут быть лучше в группе ECMO, потому что эти пациенты также с большей вероятностью получили терапевтическую гипотермию и чрескожное коронарное вмешательство, оба из которых являются вмешательствами, которые, как известно, улучшают исходы после остановки сердца.
ВА ECMO для огнеупорных ударных нагрузок (ECLS). ECLS показал многообещающие результаты при использовании при септическом шоке или кардиогенном шоке, связанном с острым инфарктом миокарда, массивной тромбоэмболией легочной артерии или миокардитом. 1 Неспособность отлучить пациента от КПБ после кардиохирургической операции и первичная недостаточность трансплантата после трансплантации сердца являются другими распространенными показаниями для ЭКМО. 18 Это состояния с потенциалом выздоровления со временем или окончательным лечением (чрескожное коронарное вмешательство, имплантация устройства или трансплантация сердца).Однако ЭКМО увеличивает постнагрузку левого желудочка и потребность в кислороде из-за ретроградного аортального кровотока и потенциально может усугубить левую сердечную недостаточность. Чтобы бороться с этим, в контур часто добавляют дренаж левого желудочка.
ВВ ЭКМО при тяжелой острой дыхательной недостаточности. Стойкая гипоксемия, несмотря на максимальную искусственную вентиляцию легких при острой дыхательной недостаточности, является показанием для ВВ ЭКМО. Поскольку это позволяет легким отдыхать, VV ECMO предотвращает пагубные последствия травмы из-за избыточного давления, осложнений на ИВЛ и окислительного стресса. 44 Чаще всего он использовался у пациентов с ОРДС или как мостик у тех, кто ожидает трансплантации легких. Исследование EOLIA продемонстрировало, что экстренная ЭКМО улучшает результаты, «выигрывая время» у пациентов с крайне гипоксемией. 45 Исследование CESAR показало, что пациенты, получавшие ЭКМО при ОРДС, имели более высокую выживаемость без тяжелой инвалидности через шесть месяцев. 15 Несколько систем оценки, такие как оценка Мюррея, оценка индекса оксигенации с поправкой на возраст и оценка острой физиологии инсульта, использовались для определения подходящей кандидатуры.Согласно отчету реестра ELSO, ECLS следует рассматривать, когда риск смерти составляет 50% или больше, и указывается, когда риск смерти составляет 80% или больше. К сожалению, использование этих систем подсчета очков в экстренных ситуациях может оказаться сложной задачей.
Противопоказания к ЭД ЭКМО
Состояния, которые связаны с особенно плохим исходом, несмотря на терапию ЭКМО, обычно являются противопоказаниями к ее применению. К ним относятся пожилой возраст (> 65 лет), хронические состояния, такие как сердечная недостаточность в терминальной стадии или хроническая обструктивная болезнь легких, необратимая полиорганная недостаточность, неизлечимые злокачественные новообразования или состояния, исключающие использование антикоагулянтов, такие как внутричерепное кровоизлияние.
Пациенты с расслоением аорты или регургитацией аорты не являются кандидатами на ЭКМО, потому что существует риск распространения расслоения или чрезмерного растяжения левого желудочка, что приведет к ухудшению застойной сердечной недостаточности. Для пациентов с ОРДС длительная искусственная вентиляция легких с высоким давлением в дыхательных путях является относительным противопоказанием.
Противопоказания к ECPR включают длительную СЛР без адекватной тканевой перфузии, неизлечимое заболевание сердца и использование вспомогательных устройств для левого желудочка или нетрансплантацию.В этих случаях пациенты попадают в категорию «мост в никуда», поскольку они не могут выжить без ЭКМО и нет надежды на выздоровление.
Пересматриваются определенные ситуации, которые ранее были противопоказаниями к ЭКМО. Беременные и послеродовые пациентки считались пациентами с высоким риском кровотечения и, следовательно, не подходящими кандидатами. В последнее время это мнение изменилось, поскольку было продемонстрировано, что они не подвергаются повышенному риску катастрофического кровотечения по сравнению с беременными пациентами, не входящими в состав
человек. 46
Традиционно абсолютными противопоказаниями считались множественные травмы и тяжелые черепно-мозговые травмы. Появление цепей, связанных с гепарином, устранило необходимость в системной антикоагуляции, что позволило использовать ЭКМО у некоторых пациентов. 47 Морбидное ожирение также когда-то считалось противопоказанием из-за сложной канюляции, но было продемонстрировано отсутствие связи между массой тела и смертностью, вероятно, из-за разработки новых канюль. 48
Выбор кандидата
Ключом к успешным результатам при использовании ЭКМО в отделении неотложной помощи является отбор пациентов, которые являются подходящими кандидатами. Врач должен учитывать основной диагноз, факторы риска для конкретного пациента, ожидаемую продолжительность поддержки, жизнеспособную стратегию выхода, показания и противопоказания. Хотя баллы не могут заменить клинический гештальт, и кандидатура в конечном итоге определяется провайдером, было описано несколько баллов, чтобы обеспечить объективную помощь в этом процессе.Использование систем подсчета очков также полезно при разработке протокола на уровне отделения или больницы.
Оценки PRESERVE 49 и RESP 50 были исследованы для определения пациентов, подходящих для использования
VV ECMO при ОРДС в условиях отделения интенсивной терапии. Следовательно, они не могут быть распространены на популяции ED, которым преимущественно требуется VA ЭКМО для ECPR. Кроме того, внешняя проверка показателей PRESERVE и RESP показала плохую эффективность у пациентов с тяжелым ОРДС, получавших ECLS.
Оценка выживаемости после вено-артериальной ЭКМО (SAVE) предназначена для помощи в прогнозировании выживаемости взрослых пациентов, перенесших ЭКМО по поводу рефрактерного кардиогенного шока. Параметры оценки включают диагноз, возраст, вес, диастолическое артериальное давление и пульсовое давление до ЭКМО, продолжительность интубации до ЭКМО, пиковое давление на вдохе и наличие мультисистемной дисфункции. 51 Модифицированный балл SAVE, который эквивалентен комбинированному значению лактата и баллу SAVE, показал улучшенные прогнозы исходов для пациентов, перенесших экстренную VA ECLS в отделении неотложной помощи. 52 Оценка ENCOURAGE может быть полезна для прогнозирования смертности у пациентов с острым инфарктом миокарда при кардиогенном шоке на VA ECLS. 53
Еще одна система баллов, которая может быть особенно полезной при настройке ED, — это упрощенная оценка физиологии острой физиологии (SAPS) II до ЭКМО. SAPS II был изучен у пациентов, которым требуется начало ЭКМО в отделении неотложной помощи по поводу острой недостаточности кровообращения и / или дыхания. Показатели SAPS II до ЭКМО ≤ 80 были связаны с более высокой смертностью через 28 и 60 дней по сравнению с показателями> 80. 54
Провайдеры должны иметь в виду, что, хотя они интересны и потенциально полезны в будущем, многие из этих оценок не используются в повседневной практике. Проведенная внешняя проверка основана на исследованиях с небольшими числами.
Осложнения ЭКМО
ЭКМО ассоциируется с высоким уровнем осложнений как во время канюляции, так и во время постоянного лечения. 55 ( См. Таблицу 1. ) По крайней мере, одно значительное осложнение было отмечено более чем у половины пациентов, получающих ЭКМО. 56 Осложнения обычно связаны с канюляцией, кровотечением или инфекцией.
Осложнения механического происхождения |
|
Геморрагические осложнения |
|
Другие осложнения |
|
Поскольку пациенты ЭКМО нуждаются в агрессивной системной антикоагуляции из-за риска артериального тромбоза, они склонны к кровотечению в месте канюляции, а также в других местах.Внутримозговое кровоизлияние (ICH) является наиболее разрушительным геморрагическим осложнением, наблюдаемым у этих пациентов, и может привести к значительной инвалидности. Исследования с более высокой частотой компьютерной томографии (КТ) описали до 20% случаев ICH. Поскольку точный мониторинг неврологического статуса пациента, когда он находится под седативным действием на ЭКМО, является сложной задачей, ранняя КТ головы при поступлении была предложена в качестве стратегии для своевременного выявления ICH. 57 У пациентов с повышенным риском кровотечения или у которых кровотечение уже могло развиться, рекомендуется использовать гепарин-связанные схемы без системной антикоагуляции или нацеливать на более низкие уровни антикоагуляции. 35
Осложнения, связанные с канюляцией, включают образование тромба, ишемию конечности, расслоение или перфорацию сосуда, миграцию канюли, образование псевдоаневризмы и случайную деканюляцию, ведущую к кровотечению. Поскольку ЭКМО требует высокой скорости кровотока, используются канюли большого диаметра. Они могут механически перекрыть кровоток в дистальной артерии. В исследовании катетеризации бедренной артерии в ЭКМО
ВА, периферические сосудистые осложнения были зарегистрированы примерно у 20% пациентов, большинству (89%) из которых потребовалось хирургическое вмешательство в виде ангиопластики, шунтирования или ампутации. 58 Использование дистального перфузионного катетера может помочь избежать ишемии. Риск неправильного размещения канюли снижается за счет введения иглы и проводника под ультразвуковым контролем, а также проведения TEE или рентгеноскопии для подтверждения установки.
Инфекции часто встречаются у пациентов, получающих ЭКМО. Это могут быть инфекции кровотока, связанные с катетером, инфекции места канюляции или обострение сепсиса у пациентов с ОРДС. Острый канальцевый некроз, приводящий к почечной недостаточности и необходимости гемодиализа, также является обычным явлением, о чем сообщается примерно у 13% пациентов, получающих ЭКМО. 4
Логистика / Системы медицинского обслуживания
Для успешной реализации программы ED ECMO необходима мультидисциплинарная институциональная приверженность. Необходимо определить заранее определенные критерии включения и исключения, а также порог прекращения ЭКМО, когда состояние пациента не улучшается. Важное значение имеет координация между службами неотложной медицинской помощи (EMS), врачами скорой медицинской помощи, медперсоналом, банком крови, лабораторией катетеризации сердца, сосудистыми хирургами, нейрокритическими службами и отделением интенсивной терапии.Поставщики догоспитальной неотложной помощи должны иметь возможность быстро идентифицировать и транспортировать потенциальных кандидатов на ЭКМО. Врачи скорой помощи должны быть компетентными в проведении ЭКМО-катетеризации. Кардиологи должны иметь возможность и желание предоставить подходящим пациентам окончательную помощь в виде вспомогательного устройства левого желудочка или трансплантата. Возможности комбинированной терапии ЭКМО и трансплантации в течение нескольких дней должны быть доступны 24/7 как с точки зрения инфраструктуры, так и с точки зрения медсестер. Наконец, первостепенное значение имеет формальная схема нейропрогнозирования с постоянными целями обсуждения помощи паллиативной помощью, ведения пациентов и социальной работы.
В целом, более высокие ежегодные объемы госпитальной ЭКМО (> 30 в год) связаны с улучшением смертности. 59 Также необходимо учитывать возможности учреждения с точки зрения количества одновременных пациентов с ЭКМО. Во многих больницах с ограниченными ресурсами могут потребоваться региональные сети и связь с справочными центрами ЭКМО.
Практика и инструкции для конкретных организаций, вероятно, существуют, и их соблюдение имеет решающее значение. Немногие врачи неотложной медицины в настоящее время могут канюлировать ЭКМО и сотрудничать с коллегами-хирургами (сердечные, сосудистые, травматологические и т. Д.)) необходимо в большинстве учреждений для помещения пациента на ЭКМО.
Этика
Из-за все более широкого использования ЭКМО возникли новые этические дилеммы. Например, должны ли обсуждения с пациентами относительно их желания реанимировать в случае остановки сердца или дыхания, включать обсуждение ЭКМО? Кто решает, когда остановить схему и при каких обстоятельствах? 60 Другие сложности включают ранее существовавший статус кодекса, степень участия суррогатного лица, принимающего решения, этические обязательства врача, связанные с этим затраты и, наконец, долгосрочное качество жизни.Некоторые исследования сообщают о долгосрочных нейрокогнитивных нарушениях у более чем 50% выживших после ЭКМО. 1 Эти факторы необходимо тщательно взвесить при рассмотрении возможности использования экстракорпоральных средств у пациента.
ССЫЛКИ
- Mosier JM, Kelsey M, Raz Y, et al. Экстракорпоральная мембранная оксигенация (ЭКМО) для взрослых в критическом состоянии в отделении неотложной помощи: история, текущие применения и будущие направления. Crit Care 2015; 19: 431.
- Sauer CM, Yuh DD, Bonde P.Использование экстракорпоральной мембранной оксигенации у взрослых в Соединенных Штатах с 2006 по 2011 год увеличилось на 433%. ASAIO J 2015; 61: 31-36.
- Организация экстракорпорального жизнеобеспечения (ELSO). Реестр ЭКМО. Анн-Арбор, Мичиган. Январь 2020.
- Kulkarni T, Sharma NS, Diaz-Guzman E. Экстракорпоральная мембранная оксигенация у взрослых: практическое руководство для терапевтов. Cleve Clin J Med 2016; 83: 373-384.
- Тонна Дж. Э., Джонсон Н. Дж., Гринвуд Дж. И др .; Исследовательская группа Консорциума экстракорпоральной реанимации (ERECT).Практические характеристики программ экстракорпоральной сердечно-легочной реанимации (eCPR) в отделениях неотложной помощи в США: современное состояние экстракорпоральной мембранной оксигенации (ED ECMO) в отделениях неотложной помощи. Реанимация 2016 ; 107: 38-46.
- Gibbon JH Jr. Применение механического аппарата сердца и легких в кардиохирургии. Минн Мед 1954; 37: 171-185.
- Hill JD, O’Brien TG, Murray JJ и др. Длительная экстракорпоральная оксигенация при острой посттравматической дыхательной недостаточности (шоково-легочный синдром).Использование легкого с мембраной Брамсона. N Engl J Med 1972; 286: 629-634.
- Bartlett RH, Gazzaniga AB, Jefferies MR, et al. Экстракорпоральная мембранная оксигенация (ЭКМО) для сердечно-легочной поддержки в младенчестве. Trans Am Soc Artif Intern Organs 1976; 22: 80-93.
- Тоомасиан Дж. М., Снедекор С. М., Корнелл Р. Г. и др. Национальный опыт экстракорпоральной мембранной оксигенации при дыхательной недостаточности новорожденных. Данные по 715 случаям. ASAIO Trans 1988; 34: 140-147.
- Бартлетт Р.Х., Ролофф Д.В., Корнелл Р.Г. и др. Экстракорпоральное кровообращение при неонатальной дыхательной недостаточности: проспективное рандомизированное исследование. Педиатрия 1985; 76: 479-487.
- О’Рурк П.П., Крон Р.К., Vacanti JP и др. Экстракорпоральная мембранная оксигенация и традиционная медикаментозная терапия у новорожденных со стойкой легочной гипертензией новорожденных: проспективное рандомизированное исследование. Педиатрия 1989; 84: 957-963.
- [Авторы не указаны]. Совместное рандомизированное исследование неонатальной экстракорпоральной мембранной оксигенации в Великобритании. Совместная группа ECMO Trail в Великобритании. Ланцет 1996; 348: 75-82.
- Моррис А.Х., Уоллес С.Дж., Менлов Р.Л. и др. Рандомизированное клиническое испытание вентиляции с контролируемым давлением с обратной пропорцией и экстракорпорального удаления CO2 при респираторном дистресс-синдроме у взрослых. Am J Respir Crit Care Med 1994; 149: 295-305.
- Запол В.М., Снайдер М.Т., Хилл Дж. Д. и др. Экстракорпоральная мембранная оксигенация при тяжелой острой дыхательной недостаточности. Рандомизированное проспективное исследование. JAMA 1979; 242: 2193-2196.
- Peek GJ, Mugford M, Tiruvoipati R, et al.Эффективность и экономическая оценка традиционной искусственной вентиляции легких по сравнению с экстракорпоральной мембранной оксигенацией при тяжелой дыхательной недостаточности у взрослых (CESAR): многоцентровое рандомизированное контролируемое исследование. Ланцет 2009; 374: 1351-1363.
- Австралия и Новая Зеландия. Экстракорпоральная мембранная оксигенация (ANZ ECMO) Influenza Investigators, Davies A, Jones D, et al. Экстракорпоральная мембранная оксигенация при остром респираторном дистресс-синдроме гриппа A (h2N1) 2009 г. JAMA 2009; 302: 1888-1895.
- Комбинации A. Экстракорпоральная мембранная оксигенация (ЭКМО) при тяжелом остром респираторном дистресс-синдроме (ОРДС). Исследование EOLIA (ЭКМО для спасения травмы легких при тяжелом ОРДС): многоцентровое международное рандомизированное контролируемое открытое исследование [на французском языке]. Реанимация 2011; 20: 49-61.
- Аллен С., Холена Д., МакКанн М. и др. Обзор фундаментальных принципов и доказательной базы использования экстракорпоральной мембранной оксигенации (ЭКМО) у взрослых пациентов в критическом состоянии. J Intensive Care Med 2011; 26: 13-26.
- Kolla S, Awad SS, Rich PB, et al. Экстракорпоральное жизнеобеспечение 100 взрослых пациентов с тяжелой дыхательной недостаточностью. Ann Surg 1997; 226: 544-566.
- Джаяраман А.Л., Кормикан Д., Шах П., Рамакришна Х. Стратегии канюлирования при вено-артериальной и вено-венозной экстракорпоральной мембранной оксигенации у взрослых: методы, ограничения и особые соображения. Ann Card Anaesth 2017; 20 (Дополнение): S11 – S18.
- Мараско С.Ф., Лукас Г., Макдональд М. и др.Обзор поддержки ЭКМО (экстракорпоральной мембранной оксигенации) у взрослых пациентов в критическом состоянии. Heart Lung Circ 2008; 17 (Дополнение 4): S41-S47.
- Ван Дайк М. Использование CRRT у пациентов с ЭКМО. Египетский журнал реанимации 2018; 6: 95-100.
- Squiers JJ, Лима Б., ДиМайо Дж. М.. Современная экстракорпоральная мембранная оксигенационная терапия у взрослых: фундаментальные принципы и систематический обзор доказательств. J Thorac Cardiovasc Surg 2016; 152: 20-32.
- Lequier L, Horton SB, McMullan DM, Bartlett RH. Схема экстракорпоральной мембранной оксигенации. Pediatr Crit Care Med 2013; 14 (Приложение 1): S7-S12.
- Тоомасиан Дж. М., Бартлетт Р. Х. Насосы гемолиза и ЭКМО в 21 веке. Перфузия 2011; 26: 5-6.
- Лучани Г.Б., Ходжа С., Торре С. и др. Улучшение результатов оксигенации сердечной экстракорпоральной мембраны у младенцев и детей с использованием центробежных насосов с магнитной левитацией. Artif Organs 2016; 40: 27-33.
- Kolobow T, Bowman RL. Построение и оценка альвеолярной мембраны сердце-легкое. Trans Am Soc Artif Intern Organs 1963; 9: 238-243.
- Хошбин Э., Робертс Н., Харви С. и др. Оксигенаторы из полиметилпентена обладают улучшенной способностью к газообмену и снижают потребность в переливании крови при экстракорпоральной мембранной оксигенации взрослых. ASAIO J 2005; 51: 281-287.
- Bermudez CA, Rocha RV, Sappington PL, et al. Первоначальный опыт применения однократной канюляции для вено-венозной экстракорпоральной оксигенации у взрослых. Ann Thorac Surg 2010; 90: 991-995.
- Burrell AJC, Ihle JF, Pellegrino VA, et al. Техника катетеризации: бедренно-бедренная. J Thorac Dis 2018; 10 (Дополнение 5): S616-S623.
- Павлушков Э., Берман М., Волчанов К. Канюляционные методы экстракорпорального жизнеобеспечения. Энн Трансл Мед 2017; 5: 70.
- Napp LC, Kühn C, Hoeper MM и др. Стратегии канюлирования для чрескожной экстракорпоральной мембранной оксигенации у взрослых. Clin Res Cardiol 2016; 105: 283-296.
- Организация экстракорпорального жизнеобеспечения. Отчет реестра. Анн-Арбор: Мичиганский университет; 2013.
- Mulder MM, Fawzy I, Lancé MD. ЭКМО и антикоагулянт: всесторонний обзор. Neth J Crit Care 2018; 26: 6-13.
- Swol J, Belohlávek J, Brodie D, et al. Экстракорпоральное жизнеобеспечение в отделении неотложной помощи: повествовательный обзор для врача неотложной помощи. Реанимация 2018; 133: 108-117.
- Cho HJ, Kim DW, Kim GS, Jeong IS.Антикоагулянтная терапия при поддержке экстракорпорального мембранного оксигенатора у детей. Chonnam Med J 2017; 53: 110-117.
- Jarosz A, Darocha T, Kosiński S, et al. Экстракорпоральная мембранная оксигенация при тяжелом случайном переохлаждении. Intensive Care Med 2015; 41: 169-170.
- Ким К.И., Ли В.Й., Ким Х.С. и др. Экстракорпоральная мембранная оксигенация у почти утопающих пациентов с сердечной или легочной недостаточностью. Scand J Trauma Resusc Emerg Med 2014; 22: 77.
- Юсуфф Х.О., Зохиос В., Вуйлстеке А. Экстракорпоральная мембранная оксигенация при острой массивной тромбоэмболии легочной артерии: систематический обзор. Perfusion 2015; 30: 611-616.
- Takauji S, Hayakawa M, Ono K, Fujita S. Веноартериальная экстракорпоральная мембранная оксигенация при тяжелом сепсисе и септическом шоке у 3195 взрослых. Crit Care Med 2016; 44 (Приложение 1): 440-440.
- Palatinus JA, Lieber SB, Joyce KE, Richards JB. Поддержка экстракорпоральной мембранной оксигенации при остановке сердца, вызванной гипокалиемией: отчет о клиническом случае и обзор литературы. J Emerg Med 2015; 49: 159-164.
- Johnson NJ, Acker M, Hsu CH, et al. Экстракорпоральное жизнеобеспечение как стратегия спасения при остановке сердца вне больницы и отделения неотложной помощи. Реанимация 2014; 85: 1527-1532.
- Беллеццо-Дж. М., Шинар З., Дэвис Д. П. и др. Экстракорпоральная сердечно-легочная реанимация по инициативе врача скорой помощи. Реанимация 2012; 83: 966.
- Шмидт М., Стюарт С., Бейли М. и др. Управление искусственной вентиляцией легких во время экстракорпоральной мембранной оксигенации при остром респираторном дистресс-синдроме: ретроспективное международное многоцентровое исследование. Crit Care Med 2015; 43: 654-664.
- Gattinoni L, Vasques F, Quintel M. Использование ЭКМО при ОРДС: действительно ли помогает испытание EOLIA? Crit Care 2018; 22: 171.
- Sharma NS, Wille KM, Bellot SC, Diaz-Guzman E. Современное использование экстракорпоральной жизнеобеспечения во время беременности и в послеродовом периоде. ASAIO J 2015; 61: 110-114.
- Онтанеда А., Анних GM. Новые поверхности в контурах экстракорпоральной мембранной оксигенации. Front Med (Лозанна) 2018; 5: 321.
- Аль-Суфи С., Бушер Х., Нгуен Н.Д. и др. Отсутствие связи между массой тела и смертностью у пациентов с вено-венозной экстракорпоральной мембранной оксигенацией. Intensive Care Med 2013; 39: 1995-2002.
- Schmidt M, Zogheib E, Rozé H и др. Оценка риска смертности PRESERVE и анализ отдаленных результатов после экстракорпоральной мембранной оксигенации при тяжелом остром респираторном дистресс-синдроме. Intensive Care Med 2013; 39: 1704-1713.
- Шмидт М., Бейли М., Шелдрейк Дж. И др.Прогнозирование выживаемости после экстракорпоральной мембранной оксигенации при тяжелой острой дыхательной недостаточности. Оценка выживаемости при респираторной экстракорпоральной мембранной оксигенации (RESP). Am J Respir Crit Care Med 2014; 189: 1374-1382.
- Шмидт М., Баррелл А., Робертс Л. и др. Прогнозирование выживаемости после ЭКМО при рефрактерном кардиогенном шоке: выживаемость после оценки вено-артериальной ЭКМО (SAVE). Eur Heart J 2015; 36: 2246-2256.
- Chen WC, Huang KY, Yao CW, et al.Модифицированная оценка SAVE: прогнозирование выживаемости с использованием срочной вено-артериальной экстракорпоральной мембранной оксигенации в течение 24 часов после прибытия в отделение неотложной помощи. Crit Care 2016; 20: 336.
- Muller G, Flecher E, Lebreton G, et al. Оценка риска смертности ENCOURAGE и анализ отдаленных результатов после VA-ECMO по поводу острого инфаркта миокарда с кардиогенным шоком. Intensive Care Med 2016; 42: 370-378.
- Ким К.И., Ли Х.С., Ким Х.С. и др. Предварительная ЭКМО упростила показатель острой физиологии II в качестве предиктора смертности у пациентов с начальной ЭКМО-поддержкой в отделении неотложной помощи по поводу острой недостаточности кровообращения и / или дыхания: ретроспективное исследование. Scand J Trauma Resusc Emerg Med 2015; 23:59.
- Zangrillo A, Landoni G, Biondi-Zoccai G, et al. Метаанализ осложнений и смертности от экстракорпоральной мембранной оксигенации. Crit Care Resusc 2013; 15: 172-178.
- Combes A, Leprince P, Luyt CE, et al. Исходы и долгосрочное качество жизни пациентов, поддерживаемых экстракорпоральной мембранной оксигенацией при рефрактерном кардиогенном шоке. Crit Care Med 2008; 36: 1404-1411.
- Кавайяс Ю.А., Дель Сорбо Л., Фан Э.Внутричерепное кровоизлияние у взрослых на ЭКМО. Perfusion 2018; 33 (1_suppl): 42-50.
- Aziz F, Brehm CE, El-Banyosy A, et al. Артериальные осложнения у пациентов, перенесших экстракорпоральную мембранную оксигенацию через бедренную канюляцию. Ann Vasc Surg 2014; 28: 178-183.
- Барбаро Р.П., Одетола Ф.О., Кидвелл К.М. и др. Связь больничного объема случаев экстракорпоральной мембранной оксигенации и смертности. Анализ реестра организации экстракорпорального жизнеобеспечения. Am J Respir Crit Care Med 2015; 191: 894-901.
- Кортрайт А.М., Робинсон Е.М., Фейнс К. и др. Консультации этического комитета и экстракорпоральная мембранная оксигенация. Ann Am Thorac Soc 2016; 13: 1553-1558.
Экстракорпоральная мембранная оксигенация | Медицинский журнал Австралии
После первого успешного использования ЭКМО в 1971 году, клинические исследования, оправдывающие использование этой инвазивной техники, периодически продвигались вперед и включали уникальные дизайны испытаний и этические соображения, связанные с клиническим равновесием.6,7
Дыхательная недостаточность
Данные четырех рандомизированных контролируемых испытаний подтверждают использование ЭКМО при дыхательной недостаточности новорожденных. 8-12 В первом была принята неортодоксальная схема «игры в победителя»: новорожденные с тяжелой дыхательной недостаточностью имели вероятность случайным образом назначается в группу вмешательства или в контрольную группу, на которую повлиял исход предыдущих пациентов в каждой группе. После выживания первого пациента, который был отнесен к группе ЭКМО, и смерти второго пациента, который был отнесен к контрольной группе, 10 последующих пациентов были случайным образом распределены для лечения ЭКМО и выжили, что привело к выводу, что ЭКМО обеспечила выживаемость (P = 10-8).7,8
Несмотря на теоретическую валидность этого дизайна исследования, неравномерное распределение пациентов вызывало значительный скептицизм, и последовали более рандомизированные контролируемые испытания. 9-12 Крупнейшие из них продемонстрировали, что у 185 новорожденных с тяжелой дыхательной недостаточностью направление на ЭКМО (VA) или VV) дает относительный риск смерти в возрасте до 1 года 0,55 (95% ДИ, 0,39–0,77) 12, а данные последующих исследований свидетельствуют о том, что преимущество с точки зрения смерти или инвалидности сохраняется в течение 7 лет.13
Последующий метаанализ сообщил о повышенной выживаемости новорожденных с тяжелой дыхательной недостаточностью, получающих ЭКМО. Относительный риск смерти перед выпиской составил 0,44 (95% ДИ, 0,31–0,61) для новорожденных, получавших ЭКМО, по сравнению с теми, кто получал традиционную ИВЛ, или 0,33 (95% ДИ, 0,21–0,53), когда были исключены новорожденные с врожденной диафрагмальной грыжей.
Не было опубликовано рандомизированных исследований ЭКМО для респираторной поддержки у детей, хотя ретроспективный многоцентровый анализ 29 пациентов с ЭКМО с одним или двумя подобранными контрольными группами выявил значительное снижение смертности среди детей, которым проводилась ЭКМО, по сравнению с детьми, получавшими традиционную поддержку (26 % v 47%, P <0.01) .15
История исследований использования ЭКМО при дыхательной недостаточности у взрослых отражает проблемы изучения новых инвазивных технологий. Проспективное многоцентровое рандомизированное контролируемое исследование, проведенное между 1974 и 1977 годами, не показало увеличения выживаемости по сравнению с традиционным лечением16, «фактически остановившее исследования ЭКМО при дыхательной недостаточности у взрослых на следующие 15 лет» 7. Благодаря использованию ВА ЭКМО, чрезмерно всеобъемлющий отбор критериев и неопытности исследователей с этой технологией, в настоящее время широко признано, что это исследование больше не имеет клинического применения.17 Широко распространенный интерес к ЭКМО при дыхательной недостаточности у взрослых возродился в конце 1980-х годов, когда была определена значимость повреждения легких, вызванного вентилятором.
Исследование низкопоточной формы ВВ ЭКМО для экстракорпорального удаления углекислого газа (ECCO2R) в сочетании с защитной вентиляцией легких показало многообещающие, но неконтролируемые результаты у пациентов с дыхательной недостаточностью. У пациентов с 90% риском смертности до начала экстракорпоральной жизнеобеспечения лечение ECCO2R и «вентиляция покоя» было связано с 48.8% выживаемость.19 Однако последующее рандомизированное контролируемое исследование, оценивающее этот метод у 40 пациентов с острым респираторным дистресс-синдромом, не выявило улучшения 30-дневной выживаемости для пациентов, получавших ECCO2R, по сравнению с пациентами, получавшими традиционную искусственную вентиляцию легких. и неопытность исследователей с экстракорпоральной поддержкой были обвинены в отрицательных результатах испытания, от ECCO2R в значительной степени отказались.21
Центры
с персоналом, имеющим опыт работы с ЭКМО, продолжали предлагать ЭКМО с высоким потоком (обеспечивающую полную оксигенацию) в качестве респираторной поддержки для взрослых и вскоре начали демонстрировать показатели выживаемости, превышающие 50% для пациентов, которые могут умереть при традиционном лечении.22-24 Эти результаты были приписаны строгим критериям отбора (включая ограничения в отношении предшествующей механической вентиляции), использованию ВВ ЭКМО и минимальной одновременной вентиляции.
Успех использования ЭКМО в различных учреждениях привел к недавнему заключению рандомизированного контролируемого исследования ЭКМО при дыхательной недостаточности у взрослых. В исследование традиционной вентиляции легких или ЭКМО при тяжелой дыхательной недостаточности у взрослых (CESAR) было включено 180 пациентов в возрасте 18–65 лет с 2001 по 2006 годы.21,25 Пациенты были случайным образом распределены для направления на ЭКМО в больницу Гленфилд (Лестер, Соединенное Королевство) или для получения обычного лечения (как правило, в больнице, куда они направлялись). Были представлены многообещающие результаты этого исследования, которые ожидают публикации (Peek GJ, презентация на симпозиуме экстракорпорального жизнеобеспечения, Мельбурн, 29 мая 2008 г.).
Сердечная недостаточность
Поскольку контролируемых исследований использования ЭКМО при сердечной недостаточности не проводилось, анализ данных реестра является лучшим показателем эффективности ЭКМО для поддержки сердца.Совокупные данные из реестра ELSO на июль 2009 г. показывают, что для неонатальных (возраст от 0 до 30 дней), педиатрических (возраст от 31 дня до <16 лет) и взрослых (возраст 16 лет и старше) пациентов, получавших ЭКМО, выживаемость до выписки или перевода составляла 38%, 46% и 35% соответственно за период поддержки2. В 2008 году выживаемость в этих группах составила 43%, 54% и 35% соответственно, несмотря на предполагаемое увеличение тяжести заболевания у поддерживаемых пациентов с течением времени. .2 Однако эти данные трудно интерпретировать изолированно, набор данных для взрослых ограничен, а текущая эволюция показаний для ЭКМО ограничивает использование исторических средств контроля.Кроме того, по разным причинам агрегированные данные ELSO искажены, чтобы отразить поддержку пациентов с врожденными дефектами, которые демонстрируют более высокие показатели смертности, чем большинство других пациентов, которым показана ЭКМО.
