Правила сбора мокроты на исследования — Студопедия
Сбор мокроты на общий анализ:
Цель:
— диагностическая.
Показания:
— заболевания органов дыхания и ССС.
Оснащение:
— чистая стеклянная широкогорлая банка из прозрачного стекла, направление.
Последовательность действий:
1. Объяснить правила сбора, получить согласие.
2. Утром почистить зубы и прополоскать рот кипяченой водой.
3. Откашлять и собрать в банку 3-5 мл мокроты, закрыть крышкой.
4. Оформить направление.
5. Доставить в клиническую лабораторию в течение 2 часов.
Примечание:
— Для определения суточного количества мокроту собирают в течение суток в одну большую посуду и хранят в прохладном месте.
— Мокроту рекомендуется собирать в специально оборудованном помещении у открытого окна или форточки.
— Не допускается загрязнение банки с наружной стороны.
Оценивается: консистенция (вязкая, студенистая, стекловидная), цвет (прозрачная, гнойная, серая, кровянистая), клеточный состав (наличие лейкоцитов, эритроцитов, эпителия, дополнительных включений.
Сбор мокроты на бактериологическое исследование:
Цель:
— выявления возбудителя заболевания и определение чувствительности его к антибиотикам.
Оснащение:
— стерильная пробирка или банка с крышкой (заказывается в бак. лаборатории), направление.
Последовательность действий:
1. Объяснить цель и суть сбора мокроты, получить согласие.
2. Утром натощак после туалета полости рта и до назначения а/б.
3. Пробирку или банку поднести ко рту, открыть ее, не касаясь краев посуды руками и ртом откашлять мокроту и сразу закрыть крышкой, соблюдая стерильность.
4. Отправить анализ в баклабораторию в течение 2 часов в контейнере спецтранспортом. Примечание: стерильность посуды сохраняется в течение 3 суток.
Сбор мокроты на МБТ (микобактерии туберкулеза):
Цель:
— диагностическая.
Порядок сбора мокроты:
1. Объяснить суть и цель назначения, получить согласие.
2. Оформить направление.
3. Утром натощак после туалета полости рта после нескольких глубоких вдохов откашлять мокроту в чистую сухую банку (15-20 мл), закрыть крышкой. Если мокроты мало, то ее можно собирать в течение 1-3 суток, сохраняя в прохладном месте.
4. Доставить анализ в клиническую лабораторию.
Примечание: Если назначается посев мокроты на ВК, то мокрота собирается в стерильную посуду в течение 1 суток, храня в прохладном месте, и доставляется в баклабораторию.
Сбор мокроты на атипичные клетки:
Цель:
— диагностическая (диагностика, исключение онкопатологии).
Последовательность сбора:
1. Объяснить пациенту правила сбора мокроты.
2. Утром после туалета полости рта собрать мокроту в чистую сухую банку.
3. Оформить направление.
4. Доставить в цитологическую лабораторию сразу, т.к. атипичные клетки быстро разрушаются.
Правила пользования карманной плевательницей:
Плевательницей пользуются пациенты, выделяющие мокроту.
Запрещается:
— сплевывать мокроту на улице, в помещении, в платок, полотенце;
— проглатывать мокроту.
Плевательница дезинфицируются по мере заполнения, но не реже 1 раза в сутки. При большом количестве мокроты – после каждого использования.
Для обеззараживания мокроты: залить 10% хлорной известью в соотношении 1:1 на 60 мин или засыпать сухой хлорной известью из расчета 200 г/л мокроты на 60 мин.
При выделении или подозрении на ВК — 10% хлорная известь на 240 мин или сухая хлорная известь на 240 мин в тех же соотношениях; 5% хлорамином на 240 мин.
После обеззараживания мокроту сливают в канализацию, а посуду, в которой обеззараживалась мокрота, моют обычным способом с последующей дезинфекцией.
Обеззараживание карманных плевательниц: кипячение в 2% растворе соды 15 мин или в 3% хлорамин на 60 мин.
Анализ мокроты: правила сбора, показания, расшифровка

Анализ мокроты — исследование патологического секрета, образующегося при воспалении трахеи, бронхов, легких и выделяющегося наружу во время кашля. Трахеобронхиальная слизь обладает бактерицидным действием, увлажняет слизистую оболочку респираторного тракта, способствует выведению чужеродных веществ и очищению бронхов. Специалисты изучают качество и количество мокроты, ее физико-химические признаки, цитологические и бактериологические свойства. Чтобы собрать материал для анализа, больному предлагают самостоятельно откашляться или проводят бронхоскопию — инвазивную медицинскую манипуляцию.
У здоровых людей мокрота не образуется. Железистые структуры респираторного тракта продуцируют менее 100 мл жидкости ежедневно. Вся она незаметно проглатывается человеком. В норме секрет состоит из слущенного эпителия, антител, белков и лимфоцитов. Под воздействием негативных факторов в органах дыхания развивается патологический процесс, который сопровождается повышением активности бокаловидных клеток, образованием избыточного количества бронхиального секрета, раздражением кашлевых рецепторов. По мере прогрессирования воспаления снижается местный иммунитет, присоединяется бактериальная инфекция. В результате подобных явлений выделяется слизисто-гнойная мокрота.
Общий анализ мокроты проводят для диагностики бронхолегочных заболеваний и дифференциации патологий, сопровождающихся продуктивным кашлем. Он включает несколько лабораторных исследований: макроскопическое, цитологическое, химическое, микробиологическое. Характеристика мокроты очень важна при выявлении деструктивных и воспалительных процессов в нижних отделах респираторного тракта. Ее состав неоднородный. Отделяемое бронхов может включать нити фибрина, комочки слизи, кровавые прожилки, гнойные элементы, бактериальные клетки. Во время общего анализа оценивают органолептические свойства образца, обнаруживают клеточные и иные включения. В ходе исследования бронхиальной слизи выделяют возбудителя болезни, а затем определяют его восприимчивость к антибактериальным средствам. Данная методика позволяет определить вероятность развития онкологии и отсеять аллергию, которая тоже проявляется мучительным кашлем.
 Анализ мокроты проводится для:
Анализ мокроты проводится для:
- Постановки диагноза,
- Оценки качества терапевтических мероприятий,
- Контроля над общим состоянием лиц с хроническими болезнями легких и бронхов,
- Определения характера имеющегося заболевания.
Правильно расшифровать анализ мокроты может только квалифицированный специалист. Сделать это совсем непросто – один и тот же показатель часто служит признаком разных респираторных заболеваний. Чтобы правильно определить причину патологии и назначить эффективное лечение, необходимо также учитывать данные осмотра, клинической картины, результаты аппаратных испытаний и лабораторных исследований. Доктор должен исключить такие опасные болезни, как туберкулез, пневмония, абсцесс легкого, обструктивный бронхит, бронхиальная астма, коклюш, опухоли, ХОБЛ. Все они имеют схожую симптоматику и сопровождаются продуктивным кашлем. Чтобы решить проблему, следует выполнить анализ мокроты, а также провести рентгенографическое или томографическое исследование органов грудной полости.
Сбор материала
Лабораторное исследование мокроты проводится при наличии у больного продуктивного кашля и прочих признаков, позволяющих врачу заподозрить бронхолегочную патологию.

Анализ мокроты показан пациентам с симптомами:
- Пневмонии,
- Бронхита,
- ХОБЛ,
- Бронхоэктатической болезни,
- Грибкового поражения легких,
- Легочного гельминтоза,
- Новообразований в органах дыхания,
- Интерстициальных болезней легких,
- Туберкулеза,
- Силикоза,
- Коклюша.
Опасные заболевания респираторного тракта — основное показание к назначению анализа мокроты. Специалисты-пульмонологи осматривают горло больного, прослушивают грудную клетку и ставят предварительный диагноз. Исследование отхаркиваемой флегмы необходимо, если:
- Кашель не проходит более двух недель,
- Прописанное лечение не приносит облегчения,
- У больного неблагополучный аллергический анамнез,
- Имеется наследственная предрасположенность к онкологическим процессам,
- Пациент лежачий.
Как сдать мокроту на анализ? Ее собирают рано утром натощак. Достоверность результатов исследования во многом зависит от правильности сбора биоматериала. Подготовка пациента – ответственный процесс. При игнорировании простых правил в слизи появляются дополнительные примеси, снижающие качество диагностики, мешающие специалисту установить причину кашля и респираторной патологии в целом.
Существует специальный алгоритм действий, который необходимо строго выполнять:
- Накануне вечером употреблять много жидкости,
- Не чистить зубы за час до исследования,
- Прополоскать рот непосредственно перед сбором,
- Сделать три глубоких медленных вдоха и резко откашляться,
- Поднести контейнер к нижней губе и сплюнуть слизь,
- Не прикасаться губами к краям емкости,
- Плотно закрыть стерильный контейнер с образцом мокроты,
- В течение двух часов доставить материал в лабораторию,
- Сказать врачу название и дозу всех принимаемых медикаментов.
Если у пациента кашель с трудноотделяемой мокротой, ее необходимо разжижать. Для этого рекомендуют вечером накануне исследования пить много щелочной минеральной воды, теплого чая с молоком. По согласованию с врачом можно использовать отхаркивающие средства. Спровоцировать кашель непосредственно перед сбором поможет десятиминутная содо-солевая ингаляция. Пары раствора способствуют усиленному образованию секрета, раздражению кашлевых рецепторов и беспрепятственному выходу мокроты наружу. При наличии сухого кашля больному рекомендуют лечь на живот, голову свесить ниже туловища и глубоко откашляться. Подобное положение облегчает процесс выведения слизи из легких.
Взрослый человек без труда справиться с процессом сбора флегмы. Гораздо сложнее получить материал от маленьких детей. Им раздражают нервные окончания, расположенные у корня языка, а когда начинаются кашлевые толчки, подносят ко рту открытую чашку Петри, в которую попадает мокрота. Подобную процедуру выполняют в лечебном учреждении. Аналогичным эффектом обладает дренажный массаж. Он помогает собрать мокроту у детей.
Когда сбор материала осуществляется описанным способом, слюна попадает в исследуемый образец во время кашля. Альтернативным методом является забор мокроты с помощью бронхоскопа. Эндоскопия — инвазивная манипуляция, во время которой врач осматривает слизистую оболочку респираторного тракта и при необходимости отбирает секрет для лабораторных испытаний.
Виды анализов мокроты
Общий анализ мокроты – диагностический метод, позволяющий определить, какое именно заболевание органов дыхания имеется у больного. Результаты проведенных испытаний оценивает лечащий врач, учитывая особенности состояния пациента. Он сначала осматривает мокроту невооруженным глазом, а затем переходит к проведению специализированного исследования — химического, бактериологического, цитологического. Специалист изучает характер мокроты, ее консистенцию, количество, цвет, прозрачность, запах, слоистость, посторонние примеси. Важное значение имеют клеточные элементы, эластичные волокна, кристаллы и прочие структуры. В диагностически сложных случаях используют дополнительное окрашивание мокроты, например, для обнаружения эозинофилов.
Макроскопическое исследование
Макроскопический анализ – изучение мокроты сразу после ее получения. Эта диагностическая процедура используется врачами с давних времен, когда не было микроскопов и современных анализаторов. Раньше медики ставили диагнозы по внешнему виду отхаркиваемой жидкости. Макроскопическое исследование оценивает качественные и количественные характеристики мокроты: объем, густоту, плотность, прозрачность, окраску, запах, патологические включения.

- Количество бронхолегочной слизи может быть различным. Оно варьируется от единичных плевков до целого литра в сутки. При остром воспалении органов дыхания образуется небольшой объем мокроты. При бронхите и пневмонии ее количество считается незначительным. Интенсивная продукция и выделение флегмы — признак прогрессирования патологии и ухудшения общего состояния больного. Обильное образование мокроты наблюдается при гнойно-деструктивных процессах в легочной ткани: абсцессе, гангрене, бронхоэктазии, туберкулезной каверне. При стихании воспаления количество бронхиального секрета постепенно уменьшается.
- По характеру мокрота бывает слизистой, гнойной, геморрагической, серозной. Слизь образуется при бронхиальной астме и вирусном поражении органов дыхания. Она является густой и полупрозрачной. При хронической пневмонии, бронхите, бронхоэктазии, эхинококкозе и актиномикозе легких выделяется слизисто-гнойная мокрота. В большинстве случаев она обусловлена вторичным бактериальным инфицированием. По характеру секрет представляет собой вязкую и мутную массу. Гнойные выделения появляются при абсцедировании легочной ткани или наличии гнойного плеврита. Они имеют желтовато-зеленую окраску, густую и непрозрачную структуру, неприятный запах. Мокрота с кровяными прожилками и сгустками — признак онкопатологии, туберкулезной инфекции, инфаркта легкого, травмы. Алая кровь выделяется при легочном кровотечении. Розовая прозрачная жидкость попадает в легкие непосредственно из кровеносных сосудов. Причиной образования серозного секрета – нарушение гемодинамики и застойные явления в системе легочной артерии.
- Цвет мокроты зависит от характера патологии и ее состава. Слизистый и серозный секрет бесцветный или белый, гнойное отделяемое имеет зеленовато-желтый оттенок. Мокрота с кровяными включениями обычно ржавая или коричневая. Это наиболее часто встречающиеся варианты патологических изменений. При эозинофильной пневмонии мокрота приобретает канареечный цвет, при сидерозе — цвет охры, при отеке легкого она бледно-розовая, а при антракозе — черная.
- Запах мокроты – важный диагностический критерий при деструктивно-некротических процессах в легких. При гангрене и абсцессе, бронхоэктазах, раке легкого бронхолегочный секрет имеет гнилостный, трупный “аромат».
- Мокрота гнилостного характера имеет слоистую структуру. При длительном стоянии она делится на два или три слоя: пенистый, серозный и гнойный.
- В бронхиальном секрете могут содержаться различные примеси. Пищевые частицы появляются при раке пищевода, кусочки некротизированной ткани — при гангрене или абсцессе легкого, частицы опухолей — при онкопатологии, фибринозные нити — при пневмонии или туберкулезе, гельминты и паразиты — у ослабленных больных.
Микроскопическое исследование
Изучение мокроты под микроскопом позволяет узнать ее точный состав и определить присутствие в ней клеточных элементов: эпителиоцитов, лейкоцитов, эозинофилов, эритроцитов. Цитология бронхолегочного секрета имеет важное диагностическое значение. С помощью данного анализа можно установить характер патологического процесса — инфекционный или аллергический, а также провести мониторинг активности заболеваний органов дыхания. Цитологический метод используют для выявления рака легкого и определения его гистологического типа. Это исследование отличается доступностью, высокой информативностью и частым практическим применением.
 Цилиндрические эпителиоциты появляются в секрете при астме, обструктивном бронхите, бронхогенном раке.
Цилиндрические эпителиоциты появляются в секрете при астме, обструктивном бронхите, бронхогенном раке.- Лейкоцитарные клетки заполняют все поле зрения при микроскопии гнойной жидкости.
- Эозинофильные лейкоциты обнаруживаются в мокроте у лиц, страдающих аллергическими процессами и гельминтозом.
- Лимфоциты являются показателем коклюшной и туберкулезной инфекции.
- Неизмененные красные кровяные тельца появляются при кровотечении из пораженных легочных сосудов, а выщелоченные — при застое крови в малом круге кровообращения.
- Атипичные клетки — признак злокачественных опухолей.
- Спирали и кристаллы — особые трубчатые тела, обнаруживаемые у лиц с бронхиальной астмой.
Химическое исследование
Химический анализ мокроты менее информативен, но очень важен. С помощью него оценивают изменения, происходящие в альвеолоцитах и реснитчатом эпителии бронхов.
- Кислотность биоматериала и реакция на гемосидерин.
- Присутствие большого количества белка в мокроте указывает на туберкулезный процесс, его следы — признак хронического воспаления бронхов.
- Желчные пигменты обнаруживают при пневмонии, когда происходит внутрилегочный распад эритроцитов и последующие превращения гемоглобина.
Бактериоскопическое исследование
Бактериологический анализ мокроты заключается в выделении возбудителя инфекции, его полной идентификации до вида и определении чувствительности к антибиотикам. Результаты антибиотикограммы крайне необходимы врачам-клиницистам для назначения мощной и эффективной антибиотикотерапии.

Мокроту в микробиологической лаборатории стерильным ватно-марлевым тампоном засевают на дифференциально-диагностические питательные среды: Эндо, желточно-солевой агар, кровяной агар, Сабуро, а также в среды накопления — сахарный и солевой бульоны. Посевы инкубируют в термостате в течение 3-5 суток. Их проверяют ежедневно на наличие выросших колоний. На Эндо вырастают энтеробактерии, на ЖСА — стафилококки, на КА — стрептококки, на Сабуро — патогенный грибы. Колонии каждого вида отбирают, готовят из них мазок для микроскопии, изучают морфологические и тинкториальные свойства бактерий. Выделенную чистую культуру накапливают, а затем ставят различные тесты для определения биохимических и антигенных свойств. После полной идентификации возбудителя определяют его восприимчивости к противомикробным средствам. На специальную среду засевают культуру бактерий и сверху помещают бумажные диски, пропитанные антибиотиками. Чем больше зона просветления вокруг диска, тем более чувствителен микроорганизм к данному препарату.
С помощью микробиологического исследования мокроты диагностируют как неспецифическую, так и туберкулезную инфекцию. Это один из важных методов обнаружения палочки Коха и верификации туберкулеза легких. Анализ мокроты на БК — выявление в слизи микобактерий, являющихся возбудителем туберкулезной инфекции. Мокроту окрашивают специальными маркерами. Чем больше микобактерий в мазке, тем тяжелее патологический процесс. Этот дополнительный микробиологический анализ проводят при наличии у больного признаков туберкулеза: стойкого субфебрилитета, немотивированной слабости, гипергидроза по ночам, приступообразного продуктивного кашля.
Исследование мокроты на КУМ – бактериоскопический анализ секрета на наличие кислотоустойчивых микобактерий. Материал окрашивают по Цилю-Нильсену: его обрабатывают карболовым фуксином, обесцвечивают спиртом, докрашивают метиленовой синькой. КУМ приобретают красный цвет, а окружающий фон становится синим. Анализ мокроты на КУМ и БК – важное диагностическое мероприятие при подозрении на туберкулезную инфекцию.
При тяжелых заболеваниях органов дыхания больным назначают все виды исследований мокроты. На основании полученных результатов врачи подбирают соответствующее лечение.
Расшифровка
Перечень определяемых параметров зависит от состояния пациента. Врач указывает в направлении, какие именно показатели его интересуют. Не всегда проводится бактериологический посев и подробное цитологическое исследование мокроты. Каждый параметр по-разному изменяется при той или иной патологии. Расшифровкой анализа мокроты занимаются специалисты в области пульмонологии, терапии, фтизиатрии. Результаты исследования позволяют поставить окончательный диагноз и назначить адекватное лечение.
- Мокрота розового цвета слизистой консистенции в сочетании с БК+ указывает на наличие у больного туберкулеза.
- Слизисто-гнойное отделяемое с большим количеством лейкоцитарных клеток и кокков — признак бактериального бронхита.
- Обильная гнойная мокрота с неприятным запахом, множеством лейкоцитов и эластичных волокон свидетельствует о наличии абсцесса.
Кашель с мокротой – клинический признак большинства респираторных заболеваний, диагностика которых включает лабораторные и инструментальные методы исследования. Одним из них является анализ мокроты на бактериологические, цитологические и химические показатели. По результатам проведенных испытаний врачи назначают больным эффективную терапию.
Видео: исследование мокроты
Мнения, советы и обсуждение:
ВЗЯТИЕ МОКРОТЫ ДЛЯ БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
Цель: диагностическая.
Показания: определяет врач.
Противопоказания: определяет врач.
ПРИМЕЧАНИЕ: Мокроту для бактериологического исследования собирают во время кашлевого толчка или при бронхоскопии. Медицинская сестра должна обучить пациента правилам сбора мокроты во время кашлевого толчка Обычно собирают утреннюю порцию мокроты. Пациенту следует внушать необходимость соблюдения всех правил сбора мокроты.
I. Подготовка к процедуре:
1. Приготовить:
· стерильные чашки Петри или плевательница;
· набор для чистки зубок,
· бланки направлений в лабораторию;
· авторучку;
· перчатки,
· стакан с водой или слабым антисептическим раствором.
2. Информируйте пациента о ходе предстоящей процедуры, получите его согласие на проведение процедуры.
3. Наденьте перчатки.
II. Выполнение процедуры:
1. Дайте пациенту стерильную емкость (чашку Петри или плевательницу), предупредив о соблюдении стерильности
2. Проследите, чтобы пациент:
· тщательно почистил зубы, затем прополоскал рот кипяченой водой или слабым антисептическим раствором;
· аккуратно снял крышку стерильной емкости (плевательницы или чашки Петри) и не прикасался пальцами к внутренней поверхности крышки;
· поднес ко рту открытую емкость (не прикасаясь к ней губами) и откашлял в нее небольшое количество мокроты;
· закрыл крышкой емкость с мокротой и передал ее Вам (медицинской сестре).
ЗАПОМНИТЕ! Пациент не должен прилагать усилия для отхаркивания, если в данный момент он не может выделить мокроту.
3. Заполните направление в бактериологическую лабораторию, прикрепите его к емкости с мокротой.
Следует помнить, что мокроту до исследования в лаборатории можно хранить не более 1-2 час в холодильнике при температуре +4°С. Поэтому нужно доставить материал в лабораторию как можно быстрее, снабдив его сопроводительным документом.
III. Окончание процедуры:
1. Спросите больного о самочувствии.
2. Отправьте емкость с мокротой в лабораторию.
3. Уберите все лишнее.
4. Снимите перчатки, поместите их в емкость для дезинфекции.
5. Вымойте и осушите руки (с использованием мыла или антисептика).
6. Сделайте отметку о выполнении манипуляции в листе динамического наблюдения за пациентом.
Для общего анализа мокроту собирают в чистую широкогорлую банку. Лучше собирать мокроту утром до еды, предварительно больной должен почистить зубы и прополоскать рот водой. К банке с мокротой прикрепляют направление с указанием фамилии больного, отделения и палаты, даты и цели исследования.
ПАМЯТКА ПАЦИЕНТУ
ДЛЯ СБОРА МОКРОТЫ НА ИССЛЕДОВАНИЕ
Мокрота на общий анализ
Утром, натощак почистить зубы и прополоскать рот водой, после этого сделайте несколько глубоких вздохов и откашливайте мокроту в чистую сухую банку, всего 3-5 мл. Банку с мокротой закройте и оставьте в специальном месте для сбора мокроты.
Анализ мокроты на бактериологическое исследование
Почистите зубы и тщательно прополощите рот кипяченой водой перед откашливанием, затем сделайте 2-3 плевка мокроты в банку, стараясь не допускать попадания слюны. Посуда стерильная, поэтому не касайтесь ее краев руками или ртом, а после откашливания мокроты сразу же закройте крышкой и отдайте медсестре.
Анализ мокроты на атипичные клетки
Утром, натощак, перед откашливанием, почистите зубы и тщательно прополощите рот водой. Затем сделайте несколько плевков мокроты в банку и сразу же отдайте медсестре.
ИССЛЕДОВАНИЕ МОЧИ
· Для общего анализа обычно собирают утреннюю порцию мочи.
· Перед сбором мочи проводят тщательный туалет наружных половых органов. Лежачих больных предварительно подмывают слабым раствором марганцовокислого калия, затем промежность вытирают сухим стерильным ватным тампоном в направлении от половых органов к заднему проходу. Собирая мочу у лежачих больных, необходимо следить, чтобы сосуд был расположен выше промежности во избежание загрязнения из области анального отверстия.
· По возможности надо собирать мочу сразу в посуду, в которой она будет доставлена в лабораторию. Желательно использовать широкогорлый сосуд (размер диаметра горла сосуда — не менее 4 см) вместимостью 50 – 100 мл с крышкой. Сосуд должен иметь широкое основание, чтобы избежать случайного разбрызгивания. Мочу из судна, утки, горшка брать нельзя, так как даже после ополаскивания этих сосудов на стенках может сохраняться осадок фосфатов, способствующих разложению свежей мочи.
· В настоящее время выпускаются специальные разовые контейнеры для сбора мочи объемом 100 мл из небьющегося материала (пластика), инертного по отношению к составным частям мочи, градуированные, с плотно закрывающейся крышкой. Такие контейнеры могут быть частью вакуумной системы для сбора мочи (при необходимости соблюдения стерильности при сборе мочи). Контейнер должен иметь соответствующую маркировку, после сбора на сосуд приклеивается этикетка, которая должна вмещать все необходимые данные о пациенте (полное имя, идентификационный номер, дату и время сбора образца, применение охлаждения или консерванта). Этикетку располагают на контейнере, а не на крышке, чтобы избежать ошибок в идентификации.
СБОР МОЧИ ДЛЯ ОБЩЕГО КЛИНИЧЕСКОГО АНАЛИЗА.
Цель: диагностическая.
Показания: определяет врач.
Противопоказания: определяет врач
I. Подготовка к процедуре
1. Приготовить:
· чистую сухую емкость объемом 200-250 мл,
· бланк направления в лабораторию,
· авторучку,
· перчатки.
2. Объясните пациенту ход процедуры (перед сбором мочи нужно провести туалет наружных половых органов).
3. Дайте пациенту чистую сухую емкость.
II. Выполнение процедуры
1. Пациент утром должен собрать всю утреннюю свежевыпущенную мочу, не менее 100 мл.
III. Окончание процедуры
1. Заполните направление в лабораторию.
2. Наденьте перчатки.
3. На посуду с мочой наклейте направление:
4. Отправьте посуду с мочой в лабораторию
5. Снимите перчатки, поместите их в емкость для дезинфекции.
6. Вымойте и осушите руки (с использованием мыла или антисептика).
7. Сделайте отметку о выполнении манипуляции в листе динамического наблюдения за пациентом.
| НАПРАВЛЕНИЕ
В клиническую лабораторию |
| Моча на общий анализ. |
| Ф., И., О. больного. |
| Возраст больного |
| Отделение_____________________________________ |
| Номер медицинской карты стационарного больного |
| Предполагаемый диагноз |
| Дата и время взятия материала. |
| Дата и время доставки в лабораторию. |
| Подпись медсестры. |
ПАМЯТКА ПАЦИЕНТУ
ДЛЯ СБОРА МОЧИ НА ИССЛЕДОВАНИЕ
Общий анализ мочи
Утром, после пробуждения, тщательно провести гигиену наружных половых органов и выделить первую струю мочи в унитаз на счет: 1, 2, а затем собрать 100-150 мл мочи в посуду. Желательно, чтобы предыдущее мочеиспускание было не позже, чем в 2 часа ночи.
Закрыть емкость крышкой и оставить в месте приема анализов вместе с направлением.
АЛГОРИТМ ДЕЙСТВИЙ ПРИ СБОРЕ МОЧИ НА ГЛЮКОЗУ
Цель: диагностическая.
Показания: определяет врач.
Противопоказания: определяет врач.
I. Подготовка к процедуре
1. Приготовить:
· чистую сухую емкость (3 л),
· флакон емкостью 100-200 мл,
· бланк направления в лабораторию,
· авторучку,
· перчатки.
2. Объясните больному ход сбора мочи.
3. Дайте пациент емкость для сбора мочи (3 л).
4. В 6 часов утра больной опорожняет мочевой пузырь в унитаз.
II. Выполнение процедуры.
1. В течение суток всю выделенную мочу (до 6 часов следующего дня) больной собирает только в емкость для сбора мочи (3 л).
2. Утром следующего дня:
· наденьте перчатки,
· измерьте общее количество мочи,
· тщательно размешайте всю мочу и отлейте в отдельную емкость 100-150 мл мочи.
III. Окончание процедуры
1. Вылейте оставшуюся мочу в унитаз.
2. Проведите дезинфекцию 3-литровой банки.
3. Заполните направление в клиническую лабораторию и прикрепите к емкости с отлитой мочой. В направлении помимо обычных данных укажите суточное количество мочи.
4. Отправьте емкость с отлитой мочой в лабораторию.
5. Снимите перчатки, поместите их в емкость для дезинфекции.
6. Вымойте и осушите руки (с использованием мыла или антисептика).
7. Сделайте отметку о выполнении манипуляции в листе динамического наблюдения за пациентом.
ПАМЯТКА ПАЦИЕНТУ
Анализ суточной мочи на сахар
В 8 часов утра опорожните мочевой пузырь в унитаз и далее, до 8 часов утра следующего дня, всю мочу собирайте в одну емкость (трехлитровую банку). Последний раз помочитесь в банку в 8 часов утра следующего дня. Измерив и записав объем выделенной за сутки мочи, ее следует перемешать, затем отлить 100 мл в небольшой сосуд, закрыть крышкой и передать в место приема анализа вместе с направлением, указав на нем объем выделенной за сутки мочи.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Сбор мокроты, мочи, кала для лабораторного исследования.
⇐ ПредыдущаяСтр 5 из 6Следующая ⇒
Сбор мокроты
Для общего анализа мокроту собирают в чистую широкогорлую банку. Лучше собирать мокроту утром до еды, предварительно больной должен почистить зубы и прополоскать рот водой. К банке с мокротой прикрепляют направление с указанием фамилии больного, отделения и палаты, даты и цели исследования.
Для бактериологического анализа мокрота собирается в стерильную посуду (банка или чашка Петри). Больному необходимо объяснить, что во время сбора мокроты он не должен касаться краев стерильной посуды руками, ртом, а после откашливания мокроты должен сразу же закрыть ее крышкой.
Взятие кала для бактериологического исследования
Кал берут из прямой кишки стерильной проволочной петлей или ватным тампоном в стерильную пробирку с консервантом.
1. Уложить больного на бок с полусогнутыми ногами, под таз подложить клеенку
2. Достать из пробирки проволочную петлю и вращательными движениями ввести ее в прямую кишку на 9-10 см, стараясь снять со стенки кишки кусочек ее содержимого
3. Опустить петлю в пробирку с консервантом
4. Написать направление и доставить пробирку в лабораторию
Сбор мочи для лабораторного исследования.
Чаще всего мочу берут утром сразу после сна. Предварительно больной должен обработать теплой водой наружное отверстие мочеиспускательного канала. Посуда для мочи должна быть тщательно вымыта и не содержать следов мыла.
Для общего клинического анализа мочи больной должен собрать в чистую сухую стеклянную посуду 100-200 мл утренней свежевыпущенной мочи из «средней порции». На посуду с мочой наклеивают этикетку с указанием фамилии больного, номера палаты и отделения, а также характера исследования. У женщин в период менструации мочу берут катетером.
Для подсчета количество форменных элементов и цилиндром в 1 мл мочи используют метод Нечипоренко, для чего берут утро «среднюю порцию» струи мочи.
Для бактериологического исследования мочу собирают в стерильную пробирку. Необходимо проинструктировать больного, чтобы пробирка оставалось открытой как можно меньше времени и не соприкасалась с нестерильными поверхностями. Наполнять пробирку нужно не полностью, так как через намокшую ватную пробку в нее могут проникать бактерии из окружающей среды.
Для исследования на глюкозу мочу собирают в течение суток:
1. В 6 утра больной опорожняет мочевой пузырь (эту мочу не собирают)
2. Всю выделенную в течение суток (до 6 часов следующего утра) мочу больной собирает в один сосуд
3. Медсестра измеряет общее количество мочи, затем тщательно размешивает и наливает в отдельный сосуд 100-150 мл для доставки в лабораторию
4. На этикетке, помимо обычных данных, указывается количество мочи
Проба по Зимницкому позволяет оценить дневной, ночной, суточный диурез, количество, относительную плотность мочи в каждой из порций. Мочу собирают на протяжении суток каждые 3 часа (8 порций). Больничный и питьевой режим, питание больного не изменяются.
1. Подготовить 8 банок с этикетками. На каждой из них указать порядковый номер (от 1 до 8), фамилию, инициалы больного, номер палаты и промежуток времени, за который мочу необходимо собрать в каждый из сосудов
2. В 6 ч утра больной опорожняет мочевой пузырь (эту мочу не собирают)
3. Больной последовательно собирает мочу в 8 банок (мочиться в каждый сосуд один или несколько раз, но только в течении 3 часов; если в этот интервал времени позывов к мочеиспусканию не возникает, сестра напоминает больному о необходимости опорожнить мочевой пузырь, при этом если мочи не окажется, банка останется пустой)
4. Утром следующего дня медицинская сестра или лаборант измеряет объем и относительную плотность каждой трехчасовой порции мочи.
Подготовка больного к ирригоскопии и колоноскопии, УЗИ органов брюшной полости.
Ирригоскопия — рентгенологическое исследование толстой кишки с помощью контрастной клизмы, колоноскопия — эндоскопическое исследование толстой кишки.
Методика подготовки больного к ирригоскопии и колоноскопии:
1. В течение 3 дней до исследования исключают пищу, способствующую метеоризму; назначают каши, кисели, омлеты, отварныемясные и рыбные продукты; трижды в день дают внутрь настой ромашки
2. Накануне исследования больному дают перед обедом 30 г касторового масла
3. Вечером ставят две очистительные клизмы (вопрос 7) с интервалом в один час, больной не ужинает; утром дают легкий завтрак и (за 2 часа до исследования) повторно ставят 1-2 очистительных клизмы.
При необходимости проведения экстренной колоноскопии (например при подозрении на непроходимость толстой кишки) подготовку ограничивают сифонной клизмой, через 30—60 минут после нее проводят колоноскопию.
При наличии сильного метеоризма в толстую кишку вводят газоотводную трубку:
1. Уложить больного на спину, подложить под него клеенку
2. Между ногами больного поставить судно с небольшим количеством воды
3. Смазать закругленный конец трубки вазелином
4. Ввести трубку на 20-30 см в прямую кишку (наружный конец трубки опустить в судно, т.к. вместе с газами через него могут выделяются и жидкие каловые массы)
5. Через 1 час осторожно извлечь трубку и обтереть заднепроходное отверстие салфеткой. Дольше держать трубку не стоит, т.к. могут образоваться пролежни на слизистой прямой кишки.
6. Погрузить трубку на 30 мин в антисептик.
Методика подготовки больных к УЗИ органов брюшной полости.
1. УЗИ органов брюшной полости проводится натощак.
2. Необходимо устранить газы в кишечнике, затрудняющие ультразвуковую визуализацию органов:
а) избегать продукты, вызывающие усиленное газообразование
б) прием активированного угля или карболена (по 0,5—1,0 г 3—4 раза в день) за 1-2 дня перед исследованием. Возможен прием ферментных препаратов (фестала).
в) введение газоотводной трубки непосредственно за несколько часов до исследования
Оказание первой помощи при кровохаркании и желудочно-кишечных кровотечениях.
Кровохарканье — выделение (откашливание) мокроты с кровью в виде прожилок и точечных вкраплений вследствие выхождения элементов крови через неповрежденные стенки мелких сосудов при повышенной их проницаемости и разрыве капилляров.
Легочное кровотечение — выделение (откашливание) чистой алой пенистой крови в количестве 5-50 мл и больше (малые кровотечения — до 100 мл, средние — до 500 мл, большие профузные — более 500 мл).
Последовательность действий:
1. Полусидячее положение, строгий постельный режим.
2. Создать больному спокойную обстановку, запретить громко разговаривать, натуживаться, принимать горячую пищу.
3. Дать больному лоток для откашливания мокроты
4. Больной должен пить мелкими глотками холодную воду или воду со льдом.
5. Наложить на руки и ноги жгуты, чтобы пережать только вены, а не артерии (с целью уменьшения притока крови в малый круг кровообращения)
6. Немедленно известить врача
7. Ввести следующие ЛС:
а) раствор кальция хлорида / кальция глюконата 10% — 10 мл в/в
б) раствор дицинона (этамзилата) 2,5% — 2 мл в/в или в/м
в) раствор викасола 1% — 2-5 мл в/м
г) раствор кислоты аминокапроновой 5% — 100 мл в/в капельно
д) при массивном кровотечении: фибриноген 3-4 г в/в, тромбоцитарная масса в/в капельно, эритроцитарная масса в/в капельно, плазмозаменители (реополиглюкин, полиглюкин)
8. Даже после прекращения кровотечения больной должен соблюдать строгий постельный режим и находится в положении полусидя. Кормить больного следует небольшими порциями легкоусвояемой полужидкой холодной пищи, богатой витаминами. Рекомендуется холодное питье. Острая пища и приправы запрещаются. Категорически нельзя ставить банки и горчичники.
При кровотечениях из ЖКТ:
1. Горизонтальное положение, строгий постельный режим
2. Полный покой, запретить принимать пищу и воду
3. Холод на переднюю брюшную стенку
4. Немедленно известить врача
5. Наблюдать за стулом
6. Ввести необходимые ЛС (такие же, как при легочном кровотечении)
7. При кровотечениях из прямой кишки ввести в нее тампон с 10% хлористым кальцием, сделать Т-образную повязку на промежность
Какой метод применяют для исследования мокроты на туберкулёз
Палочки размножаются в лёгких, образуют там колонии, выделяются при кашле, именно поэтому исследование мокроты – важный диагностический этап. Лабораторная диагностика делается в основном микроскопическим, микробиологическим методом, бактерии культивируют на плотных средах Левенштейна-Йенсена или Финна-II, окрашивание выполняют по Цилю-Нильсену. Есть и другие технологии, но все они не идеальны, имеют свои преимущества и недостатки.
Общие сведенья о туберкулёзе
Туберкулёз легких называют ещё чахоткой, что является устаревшим названием. Возбудитель – различные представители вида Mycobacterium tuberculosis complex, которых ещё называют палочками Коха (в честь первооткрывателя). Бактерии туберкулёза поражают в основном лёгкие, где образуют многочисленные колонии. Именно поэтому можно исследовать мокроту на наличие возбудителя. Также они формируют туберкулы – полые узелки из соединительной ткани, внутри которых находится гной и масса бактерий.

Ценность лабораторной диагностики мокроты
Лабораторное исследование мокроты довольно редко проводится для обнаружения людей, заражённых туберкулёзом. Чаще применяется для подтверждения диагноза, анализа состояния пациента, подстройки лечения, дозировки при химиотерапии, контроля результатов терапии. То есть оценка мокроты является постоянным необходимым способом исследования.
К лабораторной диагностике относится множество методов:
- макроскопия;
- микроскопия;
- иммуноферментный анализ;
- флуоресцентная микроскопия;
- полимеразная цепная реакция;
- культивирование.
Показанием к исследованию мокроты лабораторными методами являются признаки туберкулёза:
- гипертермия;
- длительный продуктивный кашель;
- затемнения на флюорографии.
К достоинствам технологии относят следующие факты:
- результат можно получить достаточно быстро при ПЦР и микроскопии;
- установить точный штамм бактерии;
- проконтролировать влияние химиотерапии или антибиотиков.
Минусы анализа мокроты следующие:
- при скрытой форме туберкулёза бактерии не выделяются при кашле, из-за чего результат лабораторной диагностики будет отрицательным;
- мокроту довольно трудно собрать, для этого нужна специальная герметичная ёмкость;
- некоторые методы (культивирование) довольно длительные – более месяца.
Сбор мокроты
Можно брать экссудат следующего рода:
- материал после ингаляции небулайзером;
- промыванием бронхов специальными растворами;
- мокрота из альвеол;
- получение слизи при бронхоскопии;
- взятие биоптата их трахеи, бронхов или плевры;
- мокрота из бронхов;
- мазки с гортани.
Мокроту собирают в плотно закрывающиеся стерильные и герметичные ёмкости. Это нужно для снижения вероятности занесения микробов в окружающий мир.
Ёмкости должны соответствовать следующим требованиям:
- делаться из ударопрочного материала;
- иметь хорошую прозрачность для возможности визуальной оценки качества и количества мокроты;
- расплавляться при температуре 40-45 градусов;
- иметь объём не меньше 40-50 мл;
- отверстие должно быть шире 3 см.

Результативность и достоверность исследования мокроты зависит от правильности её сбора, соблюдения рекомендаций, которые должны минимизировать вероятность загрязнения материала. Кроме того, откашливание производится в герметичной комнате, так как данная процедура опасна для всех окружающих.
Что нужно знать при сборе мокроты?
При сборе материала нужно соблюдать ряд правил:
- откашливание мокроты во флакон делается до начала химиотерапии;
- также его проводят обязательно с утра, до завтрака и приёма препаратов;
- при исследовании берут 3 пробы (каждый раз откашливая в новую ёмкость) в течение 3 суток подряд;
- материал сразу же отвозят в лабораторию (в течение часа). В идеале она должна находиться в одном здании с туберкулёзным стационаром;
- при невозможности это сделать пробу ставят в холодильник при +4оС, но держать там можно не более 2 суток;
- крайне важно следить за целостностью ёмкостей. Нарушение герметичности приводит не только к порче пробы, но и к опасному заражению окружающей среды;
- объём одной пробы должен составлять 3-5 мл;
- медицинский работник обязательно одевает халат, шапку, медицинскую маску, резиновые перчатки и специальный фартук;
- больному нужно откашливать не слюну или слизь из носа и глотки, а именно мокроту из нижних отделов бронхов. Для создания продуктивного кашля можно сделать 2-3 глубоких вдоха;
- перед откашливанием рот тщательно промывают водой, чтобы удалить естественную микрофлору и кусочки пищи;
- ёмкость держат у самых губ, после откашливания мокроту сразу сплёвывают;
- медицинский работник стоит сзади больного, чтобы мокрота не попала на него. Его задача – контролировать правильность сбора материала;
- после сбора слизи флаконы сразу герметично запечатывают;
- если больному трудно откашливать мокроту, то накануне вечером, а также рано утром перед сбором слизи пациенту даёт отхаркивающие препараты.
Режим сбора материала для лабораторного анализа на туберкулёз легких зависит от стадии развития и лечения заболевания:
- При первом поступлении в течение 3 суток делают по 3 пробы ежедневно.
- Во время лечения ежемесячно собирают 3 пробы за раз.
- На долечивании каждые 2-3 месяца берут 2 пробы мокроты.
Методы диагностики
Исследование мокроты делается множеством способов. У каждого метода есть свои преимущества и недостатки, выбор технологии диагностики зависит от решения врача и оснащения больницы.
Макроскопический анализ
Характер мокроты зависит от стадии туберкулёза лёгких:
- При инфицировании на латентной стадии мокроты может не быть, или она имеется, но в минимальном количестве и обладает белым цветом или прозрачностью.
- При развитии клинической стадии мокрота приобретает выраженный гнойный характер, оттенок меняется на серый, жёлтый или зелёный, появляется неприятный запах.
- На более поздних стадиях, при появлении рецидивов в мокроте обнаруживаются прожилки крови.

Микроскопический анализ
Наиболее быстрый, простой и дешёвый способ оценки материала на туберкулёз легких. За счёт этого может применяться для постановки диагноза, однако он не имеет достаточно высокой надёжности, поэтому его сочетают с флюорографией. Используется для оценки состояния больного в процессе лечения.
Применяется 2 метода:
- Прямая микроскопия. Материал готовится непосредственно из мокроты.
- Микроскопия осадка. Материал концентрируется с помощью центрифугирования.
Для 50% достоверности метода нужно минимум 5000 бактерий на мл мокроты.
Для увеличения надёжности способа исследуют минимум 3 пробы материала. Получение отрицательного результата не означает отсутствие туберкулёза, так как мокрота может содержать очень малое количество возбудителей из-за закрытой формы.
Окраска делается по Цилю-Нельсену:
- В материал вносится карболовый фуксин при повышенной температуре и протравливании фенолом, который проникает во все бактерии препарата.
- Препарат обесцвечивается 25% серной кислотой и 3% солянокислым спиртом. Из-за восково-липидной мембраны палочки Коха не подвергаются воздействию кислот, поэтому они сохраняют окраску.
- Остальные микробы подкрашиваются 0,3% метиленовой синью. Бактерии туберкулёза не восприимчивы к анилиновым краскам, из-за этого цвет у них не меняется.
В итоге палочки Коха приобретают красный цвет, а все остальные клетки – синий. Препарат надо рассматривать через световой бинокулярный иммерсионный микроскоп с тысячекратным увеличением. Для постановки диагноза обычно хватает 100 полей зрения. При отсутствии бактерий рекомендуется просмотреть ещё 200 полей.

Иммуноферментный анализ
Метод основан на реакции антигена и антитела. Антитела – специфические иммуноглобулины, которые образуются в ответ на проникновение бактерий и вирусов. Антиген – протеины, вызывающие выработку иммуноглобулинов.
Проводится в 2 этапа:
- Берётся антитело, меченное каким-либо веществом. Оно добавляется в материал, где присутствует антитело. В ходе реакции образуется единый комплекс.
- Добавляется фермент, который меняет цвет меченных комплексов антиген-антитело. Интенсивность окраски материала указывает на количество иммуноглобулинов.
Автоматизированная система ВАСТЕС MGIT 960
ВАСТЕС MGIT960 – автоматизированный прибор на 960 проб, который самостоятельно проводит исследование материала. Суть метода состоит в следующем:
- В ёмкость вносится флюоресцирующий материал, флуоресцентные свойства которого блокируются с помощью кислорода.
- Бактерии при своей жизнедеятельности поглощают кислород, уменьшают его количество.
- Из-за снижения концентрации усиливаются флуоресцентные свойства материала. Оно регистрируется в автоматическом режиме.
Первые результата регистрируются на 4-5 день, а для достижения максимума нужно 11 суток.
Флуоресцентная микроскопия
Люминесценция позволяет поднять результативность исследования на 10-15%, а требуемое время на это снизить в 2-3 раза. Применяют флуоресцентные краски: аурамин и родамин. Их действие связано со способностью вступать в реакцию с воскоподобными веществами бактериальной мембраны возбудителя. При облучении ультрафиолетом окрашенные таким способом палочки Коха начинают светиться оранжевым или красным цветом, при том, что остальной материал имеет чёрный или тёмно-зелёный оттенок.
Важно! Недостатком является сравнительно высокая стоимость метода.
Из-за того, что бактерии в препарате становятся очень яркими и контрастными, то можно уменьшить расширение микроскопа в 4-10 раз, сократив тем самым необходимое время на исследование материала. К тому же флуоресцентная окраска при соотнесении с окрашиванием по Цилю-Нельсену может дать информацию, сколько бактерий потеряло кислотоустойчивые свойства вследствие химиотерапии.
Полимеразная цепная реакция
Метод основан на увеличении количества ДНК возбудителя в материале в 100-110 раз за счёт специальных ферментов. Данный способ применим лишь для тех микробов, у которых точно установлен состав нуклеотидной последовательности. В отличие от копирования ДНК в результате деления клеток при ПЦР создаются лишь обрывчатые короткие участки ДНК.
Метод имеет множество преимуществ:
- для положительного результата достаточно 10-100 бактерий в пробе;
- абсолютная специфичность, так как метод применяется для конкретной ДНК;
- результат становится известным через 4-5 часов.
Тем не менее, из-за высокой чувствительности метода возможны ложноположительные результаты, что является существенным минусом. Диагностика проводится с помощью амплификатора – специального прибора, в котором проходит реакция. Он создаёт условия для ПЦР и может использоваться для хранения препарата.
Культивирование на средах
Для культивирования рекомендуется плотная среда. На западе используется состав Левенштейна-Йенсена, который даёт колонии через 15-25 суток. В России применяют среду Финна-II, которая уменьшает срок получения результата на 2-3 дня и увеличивает вероятность появления колонии на 6-8%. Однако при любой среде рекомендуется посев минимум 2-3 материалов. Связано это с тем, что даже при нескольких пробах нет точной гарантии достоверности результата. Установлено, что при 6 посевах вероятность обнаружения туберкулёза увеличивается на 7-8%.

Заключение
Исследование мокроты при лечении туберкулёза – обязательное условие для контроля состояния пациента. Сбор слизи должен соответствовать всем требованиям, иначе будет портиться материал, появиться опасность заражения. Анализ можно проводить разными методами, каждый из которых имеет свои плюсы и минусы. При исследовании желательно сочетать сразу несколько технологий, чтобы повысить достоверность.
Сбор мокроты для общего клинического анализа
⇐ ПредыдущаяСтр 10 из 38Следующая ⇒
Цель: обеспечение качественной подготовки пациента к сбору мокроты на исследование, информирование и обучение; обеспечение хранения и доставки материала на исследование.Показания:назначение врача
Оснащение: чистая сухая стеклянная широкогорлая банка из прозрачного стекла, направление.
Обязательное условие! Мокрота собирается утром натощак.
Внимание! Обязательное условие – пациентам надо указать на то, что исследованию подлежит только мокрота, отделяющаяся при кашле, а не при отхаркивании!
| № Отделения № Палаты
Направление В клиническую лабораторию Мокрота на общий анализ Иванов С.П. Дата Подпись м/с |
ПОДГОТОВКА К ПРОЦЕДУРЕ
1.Установить доверительные отношения с пациентом.
2.Предупредить и объяснить пациенту смысл и необходимость предстоящего исследования и получить согласие на исследование.
3.Обеспечить лабораторной посудой, направлением накануне вечером. Провести инструктаж. Указать, к каким последствиям приведёт нарушение рекомендаций медсестры.
4.Почистить зубы утром за 2 часа до сбора мокроты, прополоскать рот и глотку кипячёной водой непосредственно перед сбором мокроты.
Запомните! Гигиена ротовой полости предохраняет от попадания микроорганизмов ротовой полости в мокроту.
ВЫПОЛНЕНИЕ ПРОЦЕДУРЫ
1.Откашлять и собрать мокроту в чистую банку в количестве не менее 3-5мл.
ОКОНЧАНИЕ ПРОЦЕДУРЫ
1.Прикрепить направление и доставить в клиническую лабораторию в течение 1-2 часов
2.Полученные на следующий день результаты подклеить в историю болезни.
Инструктаж пациента:
» Вам необходимо собрать для исследования утреннюю мокроту. За 2 часа до сбора мокроты, натощак, почистите зубы. Тщательно прополощите рот и глотку кипячёной водой непосредственно перед сбором мокроты. После этого сделайте несколько глубоких вдохов, на выдохе делайте кашлевые движения. На выдохе – должна откашливаться мокрота. Соберите мокроту в банку, всего 3-5 мл (чайную ложку). Банку с мокротой закройте и оставьте в специальном ящике в санитарной комнате».
Примечание: Если у пациента имеется кровоточивость десен, зубы чистить не следует. Тщательно прополоскать рот раствором фурацилина, содой, чистой водой.
Сбор мокроты на суточное количество
Цель: собрать мокроту за сутки
Показания: необходимость узнать , сколько мокроты выделяется за сутки.
Оснащение: сухая чистая градуированная карманная плевательница.
Внимание! Обязательное условие – пациентам надо указать на то, что исследованию подлежит только мокрота, отделяющаяся при кашле, а не при отхаркивании!
ПОДГОТОВКА К ПРОЦЕДУРЕ
1.Установить доверительные отношения с пациентом.
2.Предупредить и объяснить пациенту смысл и необходимость предстоящего исследования и получить согласие на исследование.
3.Обеспечить посудой, накануне вечером. Провести инструктаж.
ВЫПОЛНЕНИЕ ПРОЦЕДУРЫ:
1.Открыть крышку плевательницы и сплюнуть в неё мокроту; каждый раз при её выделении.
Обратите внимание! При необходимости (по назначению врача) в течение дня записывать выделившееся количество мокроты пор часам.
ОКОНЧАНИЕ ПРОЦЕДУРЫ
1.Данные о суточном количестве мокроты занести в температурный лист.
Ф.И.О.- Иванов И.И.
Суточное количество мокроты:
Дата: Кол-во (мл)
17.03.09. 100.0
18.03.09. 25.0
19.03.09. 25.0
Примечание:Если в температурном листе отсутствует соответствующая графа, подклеить в историю болезни:
2.Надеть перчатки и продезинфицировать мокроту и плевательницу.
3.Снять перчатки, положить их в КСБУ.
4.Вымыть и осушить руки.
Инструктаж пациента:
«Вашему лечащему врачу необходимо иметь сведения о количестве мокроты, выделяемой Вами за сутки. Собирайте в эту плевательницу мокроту с 8 часов утра этого дня до 8.00 утра следующего дня».
Читать книгу Полный медицинский справочник фельдшера П. Вяткина : онлайн чтение
Микроскопическое исследование
Микроскопическое исследование необходимо проводить сразу же после получения дуоденального содержимого. Желчь из пробирки выливают в чашку Петри и рассматривают на белом и черном фоне. Пастеровской пипеткой вылавливают хлопья слизи, переносят их на предметное стекло, накрывают покровным и изучают под микроскопом (окуляр 10х, объектив 40х).
В разных порциях желчи возможно выявление слизи, лейкоцитов, кристаллов холестерина, билирубина, билирубината кальция, эпителиальных клеток. В норме клеточные элементы либо отсутствуют, либо встречаются единичные лейкоциты, эритроциты.
Лейкоциты
Большое количество лейкоцитов в порциях В и С может указывать на наличие воспалительного процесса в желчевыводящих путях (холецистит, холецистохолангит). Также возможно их внежелчное происхождение (примесь желудочного и панкреатического соков, миграция из слизистой оболочки двенадцатиперстной кишки – пищевой лейкопедез).
Эпителиальные клетки
Наличие большого количества круглых эпителиальных клеток в порциях В и С (лейкоцитоидов) может быть обусловлено патологическими изменениями в двенадцатиперстной кишке, влиянием вводимых желчегонных средств (сернокислой магнезии). Обнаружение цилиндрических эпителиальных клеток является более диагностически значимым для верификации воспаления желчных путей.
Обнаружение в дуоденальном содержимом кристаллических и аморфных осадочных образований желчи указывает на то, что она потеряла свою коллоидную стабильность. Причиной появления их может быть воспалительный процесс в желчных путях, нарушение коллоидной стабильности в результате длительного стояния или попадания в желчь желудочного содержимого. Диагностическое значение имеют следующие кристаллические образования: микролиты, кристаллы холестерина, желчные и жирные кислоты, билирубинат кальция.
Микролиты – темноватые, округлые или многогранные компактные образования, иногда имеющие концентрическую исчерченность; состоят из извести, слизи и небольшого количества холестерина.
Кристаллы холестерина – тонкие, бесцветные четырехугольные пластинки, иногда с «обломанным» углом. Билирубинат кальция представляет собой аморфные крупинки бурого, черного, коричневого или золотисто-желтого пигмента. Часто встречается в сочетании с кристаллами холестерина.
Кристаллы жирных кислот
Нежные, тонкие, бесцветные иглы, превращающиеся при подогревании нативного препарата на пламени спиртовки в капли, имеют диагностическое значение только при исключении попадания в желчь желудочного содержимого.
Простейшие и гельминты
Исследование дуоденального содержимого рекомендуется проводить при подозрении на гельминтозы печени и желчного пузыря (описторхоз, фасциолез, клонорхоз, дикроцелиоз) и двенадцатиперстной кишки (стронгилоидоз, трихостронгилоидоз). Из простейших в дуоденальном содержимом чаще всего определяются лямблии.
Бактериологическое исследование желчи проводится для определения состава микрофлоры и чувствительности ее к антибиотикам.
Биохимическое исследование желчи дает представление о концентрационной функции желчного пузыря и коллоидальной устойчивости желчи, а также о наличии воспалительного процесса. В связи с этим производят определение билирубина, холестерина, желчных кислот, липидных комплексов, белка, СРБ. Чаще всего эти исследования проводятся в научных целях. Однако высокая распространенность желчнокаменной болезни в мире требует решения проблемы диагностики этого заболевания на ранней физико-химической стадии его развития.
Исследование мокроты
Характеристика трахеобронхиального секрета
Одним из основных защитных барьеров бронхов является слизь – трахеобронхиальный секрет, покрывающий эпителий дыхательной трубки. Она рассматривается как постоянно восстанавливающийся фильтр, способствующий удалению ингалированных частиц, в том числе и микроорганизмов.
Одновременно слизь представляет собой среду, в которой действуют системы специфической и неспецифической иммунологической защиты и находятся клетки «быстрого реагирования». Под влиянием различных механизмов, и прежде всего в результате деятельности реснитчатого эпителия, трахеобронхиальный секрет перемещается от мельчайших бронхов до трахеи и глотки, чем обеспечивает мукоцитарный клиренс – выведение из респираторного тракта ингалированных частиц, бактерий и продуктов метаболизма. Основной источник бронхиального секрета – секреторный эпителий серозных и слизистых желез трахеи, крупных бронхов и бокаловидные клетки, а также клетки Клара. Кроме того, в состав бронхиального секрета входят сурфактант альвеол, составные части плазмы крови, попадающие туда в процессе экссудации или транссудации, и секретируемые местно белки, а также продукты дегенерации и распада микроорганизмов и собственных тканей. Особое значение имеют протеолитические системы, входящие в состав трахеобронхиального секрета. Изменения в трахеобронхиальном секрете при наличии различных видов воспаления носят защитно-приспособительный характер, направлены прежде всего на уменьшение интенсивности повреждающего воздействия. Патологический характер процесс приобретает тогда, когда мера защиты превышена и извращена. При воспалительном процессе в составе трахеобронхиального секрета происходят изменения, приводящие к изменению их реологических свойств, отмечается увеличение вязкости пропорционально тяжести течения заболевания. Таким образом, мокрота – патологический продукт, выделяемый больными при различных заболеваниях дыхательной системы. Состав мокроты определяется патофизиологическими механизмами, характерными для того или иного заболевания, видом воспаления, соотношением дистрофических и репаративных процессов.
Сбор мокроты
Для большинства исследований мокрота собирается утром натощак (до завтрака). Чтобы предотвратить примешивание к мокроте содержимого полости рта, перед выделением мокроты больной должен тщательно прополоскать рот кипяченой водой. При наличии зубных протезов рекомендуется полоскание 1 %-ным раствором алюмокалиевых квасцов, вяжущее действие которых предупреждает попадание в мокроту ороговевшего плоского эпителия. Затем следует глубокое откашливание. Для усиления выработки трахеобронхиального секрета перед сбором мокроты рекомендуется проведение ингаляций 10 %-ного раствора хлорида натрия, 1–3 %-ного раствора йодида калия. Пробы нужно собирать в пригодный для стерилизации герметичный контейнер с завинчивающейся крышкой. Исследуется мокрота в первые 2–3 ч после выделения. Взятие мокроты у детей можно производить следующим образом: рот ребенка удерживается открытым при помощи шпателя. Чтобы вызвать кашель, находят надгортанник (за корнем языка) и прикасаются к нему тампоном на стержне. Материал из трахеи откашливается на тампон, и его можно использовать для исследования. При исследовании мокроты на микобактерии туберкулеза используется биоматериал, собранный в течение суток, или утренняя мокрота. Если мокроту невозможно исследовать сразу, то хранить ее следует в холодильнике или прохладном месте. В качестве консерванта может быть использован 3 %-ный раствор борной кислоты, который добавляется к мокроте в равном объеме и перемешивается. Для обеззараживания мокроты и посуды, в которой она находилась, используют 5 %-ный раствор хлорамина.
Макроскопическое исследование
Проба мокроты переносится в стерильную чашку Петри, распределяется тонким слоем, рассматривается невооруженным глазом или с помощью лупы на темном фоне (рис. 28).
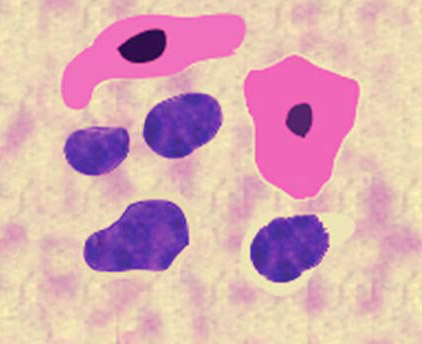
Рис. 28. Исследование мокроты а – в поле зрения: клетки плоского и цилиндрического эпителия, эритроциты, лейкоциты; б – эластические волокна в мокроте; в – макрофаги альвеолярные, содержащие гемосидерин (окраска на берлинскую лазурь; г – микобактерии туберкулеза в мокроте (окраска по Цилю – Нильсену)
Количество
Объем отделяющейся за сутки мокроты колеблется в широких пределах: от 10 до 100 мл. Для определения количества выделенной за сутки мокроты ее собирают, а затем выливают в градуированную стеклянную посуду. У пациентов с хроническим бронхитом, абсцессами легкого или бронхиальной астмой изменение суточного объема мокроты часто указывает на ухудшение или улучшение состояния.
Консистенция и внешний вид
Консистенция зависит от состава мокроты. Различают жидкую, густую и вязкую мокроту. Деление на 3 слоя наблюдается при гнилостном бронхите, гангрене легких, бронхоэктазах. Нижний слой представляет собой непрозрачную массу, содержащую клеточные элементы, средний – мутноватую желтовато-зеленую жидкость. Верхний – пенистый слой. При абсцессе легкого чаще имеется разделение мокроты только на два слоя. Нижний слой состоит из непрозрачной зеленовато-желтой гнойной массы, верхний – из серозной жидкости.
Цвет
Нормальная мокрота светлая и прозрачная. Желтоватый оттенок может указывать на наличие гноя и эпителия. Зеленоватый цвет свидетельствует о застое гнойной мокроты и объясняется присутствием фермента вердопероксидазы, содержащейся в нейтрофильных лейкоцитах и освобождающейся при их распаде. Мокрота может быть ярко-желтого или канареечного цвета, что связано с наличием в ней большого количества эозинофильных лейкоцитов, что наблюдается при эозинофильном инфильтрате в легком (синдром Леффлера) или при атопическом варианте бронхиальной астмы. Появление мокроты ржавого цвета обусловлено наличием гематина, который образуется в результате распада гемоглобина эритроцитов, проникших в просвет альвеол в процессе диапедеза на стадии «красного опеченения» при крупозной пневмонии.
«Шоколадная» мокрота наблюдается при гематоме и гангрене легкого в связи с появлением кристаллов гематоидина. Черный цвет мокроты определяется примесью в ней частиц угля, что бывает при пневмокониозе. Необходимо помнить, что такие препараты, как рифампицин, окрашивают биологические жидкости (мочу, пот, слезы, мокроту) в красный цвет.
Характер
По характеру различают следующие виды мокроты.
Слизистая – бесцветная, тягучая, вязкая. Встречается при остром и хроническом бронхите, бронхиальной астме, трахеите.
Гнойная без примесей слизи – наблюдается очень редко, так как при прохождении через дыхательные пути к ней примешивается слизь. Наблюдается при бронхоэктазах, стафилококковых пневмониях, абсцессах, гангрене.
Слизисто-гнойная и гнойно-слизистая мокрота встречаются наиболее часто, представляют слизистую вязкую массу, в которой тесно смешаны слизь и гной. Слизисто-гнойная мокрота отмечается при абсцессах и гангрене легких, гнойном бронхите, обострении хронического бронхита.
Гнойно-слизистая – преимущественно при бронхопневмонии.
Кровянистая мокрота содержит прожилки крови или сгустки крови. Встречается при инфаркте легких, тромбоэмболии легочной артерии, новообразованиях, туберкулезе, иногда при пневмонии.
Серозная мокрота – прозрачная, пенистая, жидкая, иногда слегка розоватого цвета, может наблюдаться при отеке легкого.
Серозно-гнойная мокрота встречается при абсцессе легкого или при гипостатической пневмонии. При описании смешанного характера мокроты преобладающий компонент (слизистый, гнойный и т. д.) ставится на второе место.
Запах
Свежевыделенная мокрота обычно запаха не имеет. Не прият ный запах появляется при бронхоэктазах, абсцессе легкого, кавернозном туберкулезе, гнойном бронхите. При присоединении гнилостной инфекции (гангрена легкого, гнилостный бронхит, распад злокачественной опухоли) имеет место гнилостный запах.
Определение реакции
Исследование рН мокроты производится с помощью рН-метра или индикаторной бумаги. В норме реакция слабощелочная, она становится кислой при примешивании к ней желудочного содержимого и при воспалении бронхолегочного аппарата. Величина рН колеблется от 5,0 до 9,0 в зависимости от характера и активности патологического процесса.
Макроскопическая оценка патологических примесей (оценивается в чашке Петри визуально)
1. Прожилки крови.
2. Спирали Куршмана – спазмированная слизь из мелких бронхов. Встречаются в основном при бронхиальной астме.
3. Линзы Коха (или рисовые тельца, чечевицы) – плотные, с булавочную головку, творожистые по консистенции образования. Характерны для туберкулеза, содержат эластические волокна, холестерин, микобактерии туберкулеза.
4. Пробки Дитериха – беловатые или желтоватые комочки, напоминающие гнойные пробки из миндалин, величиной от булавочной головки до просяного зерна. Состоят из бактерий, продуктов клеточного распада, кристаллов жирных кислот, жировых включений. Эти пробки чаще встречаются при бронхоэктазах, абсцессе, гангрене легкого, бронхитах.
5. Фибриновые сгустки – беловатые пленки, иногда с древовидным разветвлением. Бывают при бронхите, туберкулезе, пневмонии.
6. Кусочки легочной ткани – темные, эластичные. Наблюдаются только при распаде легочной ткани.
7. Крупинки, напоминающие пшено или манную крупу. Состоят из друз актиномицетов, обнаруживаемых при актиномикозе легких.
8. Слепки бронхов. Их размеры зависят от диаметра бронхов, из которых они были выделены. Наблюдаются при бронхиальной астме, бронхите, иногда при пневмонии.
9. Бронхолиты (легочные камни) – формируются из-за обызвествления некротической инфицированной ткани в крупном бронхе или полости. При обнаружении бронхолитов в первую очередь необходимо исключить наличие туберкулеза органов дыхания.
10. Элементы эхинококка – обрывки хитиновой оболочки пузыря, мелкие пузыри, головка обнаруживается при вскрывшемся эхинококке легких.
11. Легочная двуустка (Paragonimus Westermani) – паразит размером 7-13 мм, имеется несколько вдвинутая внутрь яйца крышечка.
12. Личинка аскариды (Ascaris Lumbricoides) – длиной 1,5–2 мм. Появляется в мокроте в период миграции.
13. Чужеродные тела – обычно предметы, которые вдохнул ребенок. Чаще всего горошина или пуговица.
Химическое исследование
Химическое исследование мокроты включает определение белка, билирубина. Концентрация белка в мокроте значительно увеличивается при отеке легких, крупозной пневмонии, туберкулезе. Билирубин в мокроте может появиться при прорыве в легкое абсцесса печени, но в незначительных количествах билирубин находят и при пневмонии.
Микроскопическое исследование
Выявленные при осмотре мокроты слизистые, гнойные, кровянистые участки или чем-либо отличающиеся по плотности, цвету кусочки выделяются препаровальной иглой или металлическим шпателем, переносятся на предметное стекло. Из них приготавливают нативный препарат, обязательно с покровным стеклом. Правильно приготовленный препарат не содержит пузырьков воздуха, материал не выходит за пределы покровного стекла. В нативном препарате при микроскопии можно обнаружить спирали Куршмана, эластические волокна, частички гриба или мицелия.
Дополнительную информацию получают при цитологическом исследовании фиксированных окрашенных препаратов мокроты. Для этого выбранные частицы биоматериала переносят на предметные стекла и размазывают круговыми движениями. Из каждой порции мокроты готовят 5-10 препаратов. После высыхания на воздухе мазки фиксируют метиловым спиртом в течение 10 мин. Полученный мазок окрашивают по Граму.
При микроскопии нативного препарата можно выделить три группы элементов:
1) клеточные;
2) волокнистые;
3) кристаллические образования.
Клеточные элементы мокроты
При количественном анализе учитываются следующие типы клеток: эпителиальные (реснитчатые, бокаловидные, промежуточные, базальные, дистрофически измененные клетки мерцательного эпителия), альвеолярные макрофаги, нейтрофильные, базофильные и эозинофильные лейкоциты, моноциты, тучные клетки.
Клетки цилиндрического мерцательного эпителия имеют правильную призматическую форму и овальное ядро, расположенное в средней части клетки. Каждая клетка несет на свободной поверхности короткие микроворсинки и около 200 мерцательных ресничек. Большое количество клеток цилиндрического мерцательного эпителия обнаруживается при бронхитах, трахеитах, бронхиальной астме, злокачественных новообразованиях легких.
Бокаловидные клетки выделяют слизистый секрет. Вместе с клетками цилиндрического мерцательного эпителия осуществляют мукоцилиарный клиренс. Базальные и промежуточные клетки расположены в глубине эпителиального пласта и не достигают свободной поверхности бронхов. За счет них осуществляется регенерация. Альвеолярные макрофаги круглой и овальной формы, диаметром 10–30 мкм. Ядро имеет бобовидную, округлую или дискообразную форму и небольшие размеры относительно цитоплазмы. В одной клетке может содержаться два и более ядер. Цитоплазма пенистая, бледноголубого или розового цвета. Эти клетки при обильных включениях могут превращаться в коричневые или черные шары без видимых ядер. Их можно обнаружить при воспалительных процессах. Альвеолярные макрофаги, содержащие включения гемосидерина, называются сидерофагами или «клетками сердечных пороков»: выявляются при инфаркте легкого, кровоизлиянии, застое в малом круге кровообращения с помощью реакции на берлинскую лазурь на предметном стекле.
Гемосидерин
Гемосидерин, лежащий внутриклеточно, окрашивается в голубой или сине-зеленый цвет. Преобладание нейтрофильных лейкоцитов указывает на острую гнойную инфекцию. Лимфоциты чаще встречаются при туберкулезе. Высокое содержание эозинофильных лейкоцитов в бронхиальном секрете нередко наблюдается при синдроме Леффлера, эозинофильном инфильтрате, микозе легких, астме. Моноциты чаще обнаруживаются при вирусных инфекциях. Иногда при продуктивном воспалении, наиболее характерном для туберкулеза легких, в мокроте могут быть обнаружены гигантские клетки Пирогова – Ланганса диаметром до 60 мкм с 5-15 ядрами, расположенными по периферии.
Эпителий бронхов под влиянием различных патологических процессов может подвергаться гиперплазии, дисплазии, метаплазии. Гиперплазия характеризуется увеличением числа и объема клеток, укрупнением их ядра. Ядерно-цитоплазматическое соотношение при этом не нарушено. Появление признаков атипии в гиперплазированных клетках эпителия бронхов расценивается как дисплазия. Различают три степени дисплазии (слабую, умеренную, выраженную). Слабая дисплазия характеризуется дегенеративными изменениями цитоплазмы клеток (вакуолизация, жировая дистрофия). Умеренная дисплазия эпителия характеризуется появлением в мокроте отдельных крупных клеток с крупными ядрами и ядрышками. Выраженная дисплазия эпителия характеризуется вариабельностью числа клеток, ядер и ядерно-цитоплазматического соотношения.
Плоскоклеточная метаплазия эпителия бронхов
Различают большие метаплазированные клетки и малые (Рар-клетки). При полной плоскоклеточной метаплазии цитоплазма эпителиальных клеток подвергается ороговению. Малые метаплазированные клетки по размеру несколько больше лейкоцитов. Различают три степени (слабую, умеренную и выраженную) плоскоклеточной метаплазии. При слабой и умеренной метаплазии реснитчатые клетки теряют свою обычную цилиндрическую форму, увеличиваются ядра, появляется вариабельность их размеров и гиперхромия. При выраженной степени плоскоклеточной метаплазии эпителия бронхов в метаплазированных клетках обнаруживаются признаки атипии ядер.
Обнаружение в мокроте клеток злокачественных опухолей при микроскопическом исследовании
Признаки злокачественности клеток – полиморфизм их размеров, нарушение ядерно-цитоплазматического соотношения в сторону увеличения ядра, изменение формы ядра, наличие в нем ядрышек неправильной формы, митоз клеток. Проводить цитологическое исследование при подозрении на опухоль и давать заключение должен специалист-цитолог.
Волокнистые образования
Эластические волокна – соединительнотканные элементы, появляющиеся при деструкции легочной ткани (туберкулез, абсцесс, новообразования), представляют собой длинные, блестящие, часто извитые тонкие нити, собирающиеся в пучки и преломляющие свет.
В старых туберкулезных кавернах эластические волокна покрываются мылами, и из них образуются так называемые коралловидные волокна (волокна Коппена – Джонса). Они неблестящие, толще обычных эластических волокон, грубые, ветвящиеся, бугристые. При действии на них 10 %-ного раствора NaOH мыла удаляются и обнажаются обычные эластические волокна. Для выявления эластических волокон используется специфическая окраска резорцин-фуксином Вейгерта.
Обызвествленные эластические волокна можно обнаружить при распаде туберкулезного петрификата. Выглядят они как грубые, пропитанные солями извести палочковидные образования. Их фрагменты имеют вид пунктирной линии, состоящей из сероватых, преломляющих свет палочек. Фибриновые волокна похожи на сетевидно расположенные плоские волоконца, лежащие параллельно. Они растворяются при добавлении хлороформа и становятся тоньше и светлее при добавлении к препарату 30 %-ного раствора уксусной кислоты. Спирали Куршмана состоят из слизи и имеют более плотную осевую нить (центральная плотно закрученная часть) и рыхлую наружную мантию.
Кристаллические образования
Кристаллы Шарко – Лейдена встречаются вместе с эозинофилами и имеют вид вытянутых, блестящих, гладких, бесцветных различной величины ромбов, иногда с тупо обрезанными концами. Кристаллы Шарко – Лейдена образуются из белковых продуктов деградирующих эозинофильных лейкоцитов. Свежевыделенная мокрота их не содержит. Они образуются после нахождения в замкнутой посуде в течение 24–48 ч и встречаются при бронхиальной астме, эозинофильном инфильтрате, глистных инвазиях.
Кристаллы гематоидина имеют форму ромбов, иголок, пучков, звезд от золотисто-желтого до коричнево-оранжевого цвета, что придает мокроте шоколадный цвет. Они образуются в глубине гематом, а также при некрозе тканей. Кристаллы холестерина имеют вид бесцветных, прямоугольной или ромбической формы фигур со ступенчатым углом, нередко накладывающихся друг на друга. Они образуются при распаде жира и жироперерожденных клеток при застое мокроты в полостях (туберкулез, абсцесс легкого, бронхоэктатическая болезнь, эхинококкоз, новообразования).
В гнойной мокроте часто можно выявить кристаллы жирных кислот в виде тонких игл и капель жира.
Метод обнаружения микобактерий
Характер мокроты во многом зависит от формы туберкулеза, фазы воспаления. Наиболее типичным для фазы распада является симптомокомплекс под названием «тетрада Эрлиха». Он включает в себя наличие микобактерий туберкулеза, эластических волокон, солей кальция и кристаллов холестерина. Прямая бактериоскопия мазка после флотации с окраской по Цилю – Нильсену остается одним из основных методов. Способы обогащения значительно повышают эффективность диагностики туберкулеза.
Туберкулезные микобактерии имеют вид тонких, слегка изогнутых палочек различной длины с утолщениями на концах или посередине, располагаются группами или поодиночке. Наиболее достоверные результаты в обнаружении микобактерий туберкулеза дают бактериологические методы исследования.
Образцы мокроты и крови и лабораторные тесты на культуру
Что такое микробная культура?
Микробная культура является одним из диагностических методов микробиологии и используется для определения причины инфекционного заболевания, позволяя микроорганизмам размножаться в определенных конкретных средах в контролируемых лабораторных условиях. Это помогает определить тип и серьезность инфекции путем подсчета колоний микроорганизмов в образце.
Типы образцов для микробной культуры
Микробные инфекции могут быть вызваны бактериями, вирусами, грибами и паразитами, и образец, который нужно собрать для посева, зависит от признаков и симптомов заболевания.В идеале правильное количество образца должно быть собрано до начала лечения противомикробным агентом, например антибиотиком, и после извлечения его следует немедленно отправить в лабораторию для культивирования. Следует соблюдать особые меры предосторожности, чтобы избежать заражения образца организмами окружающей кожи, слизистой оболочки и воздуха во время сбора. Также могут проводиться тесты на чувствительность для определения относительной чувствительности отдельных микроорганизмов к определенным лекарствам.
Типы образцов, которые могут быть использованы для посева:
- Кровь (см. Посев крови)
- Мокрота (см. Посев мокроты)
- Моча
- Стул
- Цереброспинальная жидкость (CSF)
- Раневые экссудаты
- Гной
- Выделения из дыхательных путей
- Мазок из горла
- Выделения из уретры
- Выделения из влагалища или шейки матки
- Соскоб кожи
- Экссудаты или гной из ушей и глаз
- Бронхоскопический посев
Что такое посев мокроты?
Материал, который откашливается из легких, а затем выплевывается или отхаркивается, называется мокротой или иногда ее называют мокротой.Посев мокроты проводится для выявления микроорганизмов, вызывающих инфекции нижних дыхательных путей, такие как пневмония и туберкулез. Лихорадка с хроническим кашлем вместе с кровью или гноем в мокроте обычно является показанием для проведения посева мокроты.
Сбор образцов мокроты
Мокроту следует собирать в стерильный контейнер, желательно рано утром, перед едой или питьем. Рот следует прополоскать водой, чтобы вымыть изо рта бактерии и разбавить слюну, которая может загрязнить образец.При сильном кашле следует немедленно выплюнуть мокроту в стерильную емкость, избегая длительного скопления в ротовой полости. При тестировании на туберкулез может потребоваться отобрать три последовательных пробы.
Специальное окрашивание, называемое кислотостойким красителем , может быть выполнено в лаборатории для выявления туберкулезных бацилл. Различные типы микроорганизмов можно идентифицировать с помощью окраски по Граму. Посев на грибок может быть сделан при подозрении на грибковую инфекцию, а посев на вирус сделан для выявления вирусной инфекции, такой как пневмония.Из-за распространенности бактериальных инфекций дыхательных путей большинство образцов мокроты сначала проверяется на наличие бактерий.
Отчет о культуре мокроты
Бактериальная культура
Первоначальный отчет, указывающий на присутствие каких-либо бактерий, может быть доступен в тот же день. Окончательный отчет займет от одного до трех дней, и он будет включать определение конкретного типа и количества бактерий, а также наиболее эффективных против них антибиотиков. Посев на туберкулез может занять от двух до четырех недель.
Культура грибов
Отчет может занять несколько недель.
Вирусная культура
Получение отчета может занять от нескольких дней до нескольких недель в зависимости от типа присутствующего вируса.
Что такое посев крови?
Этот тест рекомендуется при наличии симптомов инфекции крови, таких как септицемия или бактериемия, и при посеве крови для выявления бактерий или других микроорганизмов. Ваш врач запросит микробный посев крови в зависимости от вашей истории болезни и клинических данных после физического осмотра.
Забор крови
Около 10 мл (0,3 жидких унций) крови отбирают с помощью иглы и шприца из вены на внутренней стороне локтя или тыльной стороны руки и собирают в два флакона. Его отправляют в лабораторию, где помещают в чашку Петри с агаром. Это идеальная среда для роста бактерий, и после инкубации она покажет чистые зоны роста бактерий, если в образце крови присутствовали бактерии.
Посев крови делается в основном на бактерии, и если замечен какой-либо рост, проводятся дальнейшие тесты для определения типа бактерий.Окрашивание по Граму может быть выполнено с использованием специальных типов красителей для идентификации различных организмов. Некоторые микроорганизмы улавливают и сохраняют пурпурный цвет и называются грамположительными организмами , в то время как другие организмы теряют пурпурное пятно и сохраняют красное пятно и называются грамотрицательными . Перед посевом крови не требуется специальной подготовки, кроме укола иглой особого дискомфорта нет.
Нормальное значение означает, что ни один организм не может быть выращен в лаборатории и, следовательно, в крови нет инфекции, тогда как положительный результат покажет рост и размножение организмов в образце.Затем можно начинать лечение в зависимости от идентифицированного микроорганизма и чувствительности или действия на него различных лекарств. Для подтверждения результатов может потребоваться три посева крови из-за различных бактериальных инфекций в крови.
Отчет о культуре крови
В первоначальном или предварительном отчете будет указано, были ли обнаружены какие-либо бактерии, а результаты должны быть доступны в течение дня, в зависимости от страны или лаборатории. В окончательном отчете будет указан тип бактерий и их чувствительность к антибиотикам, и он будет доступен через пять-семь дней.
.
Многочисленные применения и методы использования чашки Петри
Чашка Петри — это неглубокая круглая чашка, которая используется для выращивания культур различных организмов. Это имеет особое значение в области биологии. Давайте узнаем больше об этом полезном блюде в этой статье ScienceStruck.
Для детального изучения таких микроорганизмов, как бактерии и вирусы, очень важно изолировать их от других видов. Это можно сделать с помощью питательной среды в подходящей емкости. Лучшим примером этой чашки питательной среды является чашка Петри.Чашка Петри представляет собой мелкую цилиндрическую круглую стеклянную чашку, которая используется для культивирования различных микроорганизмов и клеток. Ее изобрел немецкий бактериолог Юлиус Рихард Петри, отсюда и название «чашка Петри». С тех пор он стал одним из самых важных элементов лабораторного оборудования из-за его разнообразного использования. В этой статье ScienceStruck мы обсудим различные применения и правильный способ использования этого блюда, чтобы избежать заражения.
Хотите написать для нас? Что ж, мы ищем хороших писателей, которые хотят распространять информацию.Свяжитесь с нами, и мы поговорим …
Давайте работать вместе!
До изобретения чашки Петри было много других контейнеров, которые использовались для выращивания культур, но они обычно были загрязнены или имели площадь их поверхности, которая использовалась для культивирования очень маленькой клетки. Например, если говорить о пробирках, то они длинные и цилиндрические. Хотя материал, используемый в нем, сделан так, чтобы он стоял под наклоном, клетки не получают столько места, сколько они получают в чашке Петри.Кроме того, даже если пробирки закрываются с помощью ватных пробок, через некоторое время они становятся загрязненными, а чашки Петри снабжены крышками. Эти крышки легко закрываются и защищают культуру клеток от загрязнения. Ниже приводится правильный метод использования чашки Петри.
Использование чашки Петри
Чашка Петри в основном используется в качестве лабораторного оборудования в области биологии. Ниже приведены некоторые из наиболее распространенных его применений.
- Чашки Петри наиболее часто используются для культивирования клеток.Клеткам предоставляются соответствующие условия окружающей среды и пища, которая помогает им расти в данной среде. Чашка Петри обеспечивает пространство и защищает их от загрязнения.
- Поскольку эта посуда сделана из стекла, вы можете очень четко наблюдать через нее рост микроорганизмов.
- Размер чашки Петри позволяет держать ее прямо под микроскопом, а также наблюдать и даже препарировать образец для дальнейших исследований.
- Его также можно использовать для наблюдения за прорастанием семян в школах и колледжах.
- Использованные чашки Петри можно обрабатывать отбеливателем, мыть и стерилизовать для дальнейшего использования.
Способ использования
Стеклянные чашки Петри можно использовать повторно. Их можно стерилизовать, поместив чашку Петри в автоклав. Ниже приведены шаги по его использованию.
- Первое, что нужно сделать при использовании чашки Петри, — это ее стерилизовать. Это убьет другие микроорганизмы, которые могут присутствовать в чашке Петри.
- После этого его можно заполнить агаровой средой, приготовленной с помощью красных водорослей.Агаровая среда также содержит питательные вещества, соль, кровь, индикаторы, антибиотики и т. Д., Которые помогают в правильном росте бактерий или любых других микроорганизмов.
- Затем эти содержащие агар чашки хранятся в холодильнике в перевернутом положении и вынимаются, когда они необходимы.
- Если вам понадобятся чашки с культурой, просто достаньте их из холодильника и дайте им нагреться до комнатной температуры.
- Теперь возьмите образец бактерий или любого другого микроорганизма и вылейте его на культуру.Или возьмите ватный тампон и медленно зигзагообразно проведите им по культуре. Старайтесь не оказывать слишком сильного давления, так как это может нарушить культуру.
- Закройте крышку чашки Петри и плотно накройте ее. Держите его в месте с температурой около 37 ° C и дайте ему подрасти в течение нескольких дней. Как только культура клеток вырастет, возьмите образцы и используйте их для дальнейших исследований.
Помните о методах использования чашки Петри и проведите эксперимент. Соблюдайте необходимые правила безопасности в лаборатории и избегайте контакта с образцом, поскольку он может содержать некоторые вредные организмы.
.
Что такое чашка Петри? (с иллюстрациями)
Чашка Петри — это неглубокая круглая чашка из стекла или пластика с плотно прилегающей крышкой, которая является важным инструментом в научных лабораториях. Использование этого оборудования разнообразно, но наиболее известно, что оно содержит культуральную среду, на которой можно выращивать и изучать клетки, бактерии и вирусы. Большинству крупных научных достижений в значительной степени способствовало использование чашек Петри, независимо от того, связаны ли они со структурой вируса или способностью клонировать мясо.
Ученые используют чашки Петри для хранения образцов для изучения.
Изобретение названо в честь Юлиуса Ричарда Петри, который задумал эту идею в 1877 году, разочаровавшись в существующих инструментах для культур. Большинство ученых использовали неглубокие миски или бутылки, с которыми было неудобно работать и которые были подвержены загрязнению.Петри подумал, что с неглубокой круглой посудой будет легче работать, и с ней легко сделать крышку. Крышка предохраняет чашки Петри от загрязнения, а основная форма позволяет легко складывать их друг на друга и размещать в различных конфигурациях.
Агар, гель, изготовленный из экстрактов красных водорослей, обычно используется в чашках Петри.
Когда чашка Петри используется для культивирования клеток, она обычно заполняется средой для выращивания из агара, гелем, приготовленным из экстрактов красных водорослей, и различными питательными веществами. Среда для выращивания имеет студенистую консистенцию, на которой процветает большинство культур, хотя иногда необходимо варьировать питательные вещества, чтобы удовлетворить потребности культивируемого организма.Чтобы удовлетворить потребности привередливых организмов, ученому может потребоваться несколько недель, чтобы настроить среду для серии блюд. Как только культура начнет развиваться, организм можно будет исследовать.
Хотя чашки Петри можно запечатать, исследователи все равно должны носить перчатки при работе с ними.
Есть и другие способы использования чашки Петри: например, во многих школах они используются для обучения студентов прорастанию семян, поскольку прозрачная чашка позволяет наблюдателю видеть каждый шаг роста. Кроме того, эта тарелка обычно используется для препарирования, поскольку ее размер идеально подходит для размещения под микроскопом. Его также можно использовать для основных экспериментальных целей, таких как транспортировка жидкостей в стерильных контейнерах или сушка жидкостей для исследования.
Поскольку наборы чашек Петри продаются одинакового размера, они исключают любые пространственные переменные, которые могут повлиять на рост бактерий.
Другие варианты использования чашки Петри постоянно исследуются научным сообществом, и это лабораторный инструмент, от которого вряд ли откажутся в ближайшем будущем.Основные достижения в науке, такие как выращивание клеток, интегрированных в электронные схемы, клонирование органов и понимание вирусов, были достигнуты с помощью скромной чашки Петри. Хотя разрабатываются и другие методы изучения организмов в лаборатории, потребность в базовой способности быстро культивировать организмы в стерильной среде никогда не исчезнет.
Чашка Петри идеально подходит для размещения под микроскопом..

 Цилиндрические эпителиоциты появляются в секрете при астме, обструктивном бронхите, бронхогенном раке.
Цилиндрические эпителиоциты появляются в секрете при астме, обструктивном бронхите, бронхогенном раке.