|
Лекарственные препараты, используемые для лекарственного электрофореза
| ||
|
Применяемое лекарственное вещество
|
Концентрация раствора (%) или количество (г, ЕД)
|
Полярность
|
|
Адебит
|
2-5% в 25% ДМСО
|
+ —
|
|
Адреналина гидрохлорид*
|
0,1%0,5-1 мл
|
+
|
|
Актовегин
|
рН – 5,2 подкисл
|
+
|
|
Аминазин
|
1%
|
+
|
|
Аминалон (гамма –аминомасляная к-та)
|
2%
|
—
|
|
Ампициллин*
|
0,25-0,5г
|
—
|
|
Анальгин* (метамизол)
|
2-5%
5-10% в 25% ДМСО
|
—
+-
|
|
Анаприлин* (обзидан, индерал)
|
0,1% — 5 мл
|
+-
|
|
Андекалин, очищенный экстракт поджелудочной железы свиньи
|
5мл-40 ЕД на прокл
|
—
|
|
Апизатрон (компонент пчелиного яда)
|
0,01-0,1%
|
+ —
|
|
Апитоксин (пчелиный яд)1 мл
|
|
+ —
|
|
Апифор
|
От1 до 10 таблеток растворить в 20 мл.
|
+
|
|
Апрофен (на 100 мл-1мл 1% мезатр)
|
0,5-1%
|
+
|
|
Аскорбиновая кислота*
|
2-5%
|
—
|
|
Аспергин (на 70% спирте)
|
0,2%
|
+
|
|
Атропина сульфат*
|
0,1 -1 мл
|
+
|
|
АТФ
|
1%
|
+ —
|
|
Ацетилсалициловая кислота, радикал* (аспирин)
|
5-10% в 50% ДМСО
|
—
|
|
Ацетилхолина хлорид
|
0,1-0,5%
|
+
|
|
Баралгин
|
2%
|
—
|
|
Бензогексоний*
|
1-2%
|
+
|
|
Беротек* (фенотероламид –бромид, фенотерол)
|
0,1%
|
+
|
|
Берлитион (этилендиаминовая соль альфалипоевой к-ты)
|
|
—
|
|
Биомицин (хлортетрациклина гидрохлорид)
|
10000едв 1 мл дист.
1%
|
—
+
|
|
Випраксин (змеиный яд)
|
1 мл
|
+
|
|
Витамины:
|
2%
|
+
|
|
0,1%
|
—
|
|
1-5%
|
+
|
|
100-200мкг на проц.
|
+
|
|
0,5-1%
|
—
|
|
2-5%
|
—
|
|
1%
|
+
|
|
2% на 25%ДМСО 0,5 мл на процедуру
|
+
|
|
1%
|
—
| |
|
Вицеин (глазные капли)
|
1 мл на прокладку
|
+
|
|
Галантамина гидрохлорид (галантамин, нивалин)
|
0,5%
|
+
|
|
Галоперидол*
|
0,5%
|
+
|
|
Гамма-глобулин*
|
В физ.
|
—
|
|
Ганглерон
|
0,25-0,5% 2 мл на прокладку
|
+
|
|
Гексаметилентетрамин
|
5%
|
+
|
|
Гексаметоний
|
2%
|
+
|
|
Гексоний
|
2,5%
|
+
|
|
Гепарин* (гепарина натриевая соль)
|
5000-10000ЕД в 30 мл дистиллированной воды
|
—
|
|
Гиалуронидаза
|
0,1-0,2г на 30 мл дистил воды с добавл 5-8 кап 0,1н р-ра соляной кислоты
|
+
|
|
Гистамин дегидрохлорид
|
0,01% 1 мл
|
+
|
|
Гидрокарбонат натрия
|
2%
|
—
|
|
Гидрокортизона сукцинат водорастворимый*
|
1 амп.
|
—
|
|
Гиперсол
|
2%
|
+ —
|
|
Гистамина гидрохлорид
|
0,1% 1 мл на прокладку
|
+
|
|
Гистидина гидрохлорид
|
1-4%
|
+
|
|
Гликозим
|
|
+
|
|
Глицерризиновая кислота
|
25-30% р-р
|
—
|
|
Глутаминовая кислота *
|
0,5-2г готов. На 1-2% р-ре гидрокарбоната натрия
|
—
|
|
Гордокс*
|
½ или 1 ампула (50-100000 ЕД на прокладку)
|
—
|
|
Гризеофульвин*
|
1% на физ.
|
—
|
|
Грязь (компоненты) лечебная (нативная грязь, грязевой раствор)
|
|
+ —
|
|
Гумат – натрия
|
|
—
|
|
Гумизоль (грязевой р-р)
|
2-4 мл
|
+ —
|
|
Даларгин
|
1 мг ампульного порошка в 3 мл дист. воды (рН=5,5)
|
+
|
|
Дезоксипеганин гидрохлорид
|
1%
|
+
|
|
Дексаметазон* (дексазон)
|
0,1% на 25% растворе ДМСО
|
+
|
|
Делагил (хингамин)
|
2-5%
|
+
|
|
Диазепам*(седуксен, реланиум)
|
0,5%
|
+
|
|
Дибазол*
|
0,5-2%
|
+
|
|
Дикаин
|
0,5-1%
|
+
|
|
Дильминал
|
|
|
|
Димедрол/*
|
0,25-1%
|
+
|
|
Димекумарин*
|
1-2%
|
+
|
|
Димексид, диметилсульфоксид, ДМСО
|
10-50% р-р
|
+-
|
|
Димефосфон (комплексон)
|
1,5%
|
+-
|
|
Диоксидин
|
2%
|
+ —
|
|
Дионин (этилморфина гидрохлорид)
|
0,1-1%
|
+
|
|
Дипразин* (пипольфен)
|
1%
|
+
|
|
Дифазин
|
0,5%
на 100 мл 1 мл 0,1% адреналина
|
+
|
|
Дифацил
|
0,5%
|
+
|
|
Дихлорамин
|
5%
|
—
|
|
Допан
|
0,06% в 50% ДМСО (разовая доза 2 мл)
|
+
|
|
Железа лактат*
|
3%
|
+
|
|
Изониазид*(тубазид)
|
1-3%
|
+
|
|
Интал*
|
1%, 1 капсулу растворить в 3 мл дист.
|
—
|
|
Интерферон*
|
1 амп на прокладку
|
+ —
|
|
Ихтиол
|
2-5-10%
|
—
|
|
Йод* (калия (натрия) йодид)
|
2-5%
|
—
|
|
Иманин
|
1%
|
—
|
|
Йодбромная вода (минеральная)
|
|
—
|
|
Кавинтон*
|
1 мл (5мг) 0,5% р-ра добавляют в 1 мл ДМСО
|
+
|
|
Калия хлорид* ( йодид)
|
1-5%
|
+
|
|
Кальция хлорид*
|
2%
|
+
|
|
Кальций пантотенат*
|
2%
|
—
|
|
Канамицина сульфат*
|
2 мл на прокладку 0,5 г на процедуру
|
—
|
|
Карбаин
|
5%
|
+
|
|
Карбахолин
|
0,1%
|
+
|
|
Карипазим
|
10мг разводят в 5-10 мл физ.
|
+
|
|
Карипаин
|
10мг разводят в 5-10 мл физ.р-ра + 2-3 капли ДМСО
|
+
|
|
Кватерон
|
0,5%
|
+
|
|
Кислота глютаминовая*
Кислота никотиновая* (РР)
Кислота парааминосалициловая *(ПАСК)
Кислота салициловая *(Na)
Кислота фосфорная (Na)
|
1%
1%
3%
2,5%
3-5%
|
—
—
—
—
—
|
|
Кобальт (хлорид, нитрат)
|
0,5 -1%
|
+
|
|
Кодеина фосфат
|
1%
|
+
|
|
Кокарбоксилаза*
|
1 амп 0,025-0,05г на прокладку смоченную физ.
|
+
|
|
Коллагеназа
|
подкисл
|
+
|
|
Коллализин
|
50 КЕ в 10 мл дистил воды
|
+
|
|
Контрикал* (трасилол)
|
5000-20000ЕД растворить в 10-20 мл дист.воды, подкисленной до рН=6,0-6,2
|
+
|
|
Кортексин*
|
|
+
|
|
Кофеин* (кофеин бензоат натрия )
|
А)1%
Б) 1% в 5% р-ре натрия гидрокарбоната
|
+
—
|
|
Ксантинола никотинат (компламин, теоникол)
|
5% 5 мл
|
+
|
|
Ксидифон
|
2%
|
+
|
|
Курантил * (дипиридамол)
|
0,5%2мл
|
+
|
|
Леводопа* (L-ДОПА)
|
0,5г в 5 мл физ р-ра
|
—
|
|
Левомицетин * (сукцинат)
|
0,5-1г готовят
20% р-р на проц.
|
+
|
|
Лейкеран
|
5 мг
|
—
|
|
Лекопаин
|
14 МЕ в 50 мл,
рН-5,0 – 7,0
|
+
|
|
Лидаза
|
(0,1г (64 АЕ)растворяют в 30мл дистил воды с добавлением 5-8 кап 0,1н р-ра хлористоводородной кислоты
|
+
|
|
Лидокаин *(ксикаин)
|
2-5%
(на 100 мл 1 мл 1% мезатона или 0,1% адреналина
|
+
|
|
Лизоцим
|
20 мг в 15-20 мл дист воды,рН-7,6
|
+
|
|
Ликозим (папален)
|
35-70ЕД на прокл 0,5%
|
+
|
|
Линкомицин*
|
0,5г 500тыс ЕД
|
+
|
|
Литическая смесь (натрий, калий, магний, новокаин)
(эуфиллин, фосфор двузамещенный, бром)
|
|
+
—
|
|
Магния сульфат
|
2-5%
|
+
|
|
Марганца сульфат
|
2-5%
|
+
|
|
Меди сульфат
|
2-5%
|
+
|
|
Мезатон*
|
1-2%
|
+
|
|
Мексидол (мексидант, мексиприм, мексифин)*
|
2,5%
|
+
|
|
Мелиссин «Апитосин»
|
|
+
|
|
Мелливенон
|
1 амп на 10 мл буферного р-ра
|
+ —
|
|
Меркамин гидрохлорид(профилактическое действие при радиации)
|
10%, 2 мл
|
+
|
|
Метацин
|
0,1%
|
+
|
|
Метиленовый синий
|
2%
|
+
|
|
Метиллметионин-сульфония хлорид ( витамин U)
|
1%
|
+
|
|
Метилурацил
|
0,01%
|
+
|
|
Метионин
|
0,5-2г, готовят на дистил.
|
+
|
|
Мехолил
|
0,5%
|
+
|
|
Мидокалм*
|
1-2 мл 1%
|
+
|
|
Мицин
|
10000ЕД в 1 мл дист.воды
|
+
|
|
Мономицин
|
0,5г или 5тыс ЕД в 1мл изотонич.р-ра NaCl
|
+
|
|
Морфина гидрохлорид*
|
0,2%
|
+
|
|
Мочевина (карбамид)
|
3%
|
+
|
|
Натрия бромид
|
205%
|
—
|
|
Натрия парааминосалицилат(парааминосалициловой кислоты радикал)
|
1-2%
|
—
|
|
Натрия фторид
|
1-2%
|
—
|
|
Натрия салицилат, хлорид
|
2-5%
|
—
|
|
Натрия (магния) тиосульфат (теосерной кислоты радикал)
|
1-3%
|
—
|
|
Нафталан (озвученная эмульсия)
|
10%
|
+ —
|
|
Нейромидин
|
0,5%
|
+
|
|
Неомицина сульфат*
|
5000-10000ЕД/мл
|
+
|
|
Нивалин (галантанин)
|
0,25%
|
+
|
|
Никотиновая кислота*
|
0,5 — 1%
|
—
|
|
Нистатин*
|
(30 тыс ЕД в мл дистил воды)
|
—
|
|
Нитразепам *(эуноктин)
|
0,2%, 2 таб.
|
—
|
|
Нитроглицерин*
|
0,05% р-ор, 0,5 мл 1%спирт.р-ора в 99,5мл дист.воды
|
+
|
|
Новокаина гидрохлорид*
|
0,25-5%
|
+
|
|
Новокаинамид*
|
2-5%
|
+
|
|
Норсульфазол-натрия
|
1-2%
|
—
|
|
Но-шпа*
|
1-2%
|
+
|
|
Обзидан *
|
0,1%
|
+
|
|
Оксибутират натрия*(гамма-аминомасляной кислоты радикал)
|
2,5-5%
|
—
|
|
Оксилидин (бензоилоксихинуклидин)
|
2%
|
+
|
|
Окситетрациклин гидрохлорид
Окситетрациклина дигидрат (террамицин)
|
50000ЕД в 1мл физ.
0,25-0,5г на проц.
|
—
+
|
|
Оптохин
|
0,1%
|
+
|
|
Осархил
|
0,5 растворить в 50мл 0,5%р-ра Na гидрохлорида или (в 0,5% р-ре 1% соды)
|
+
|
|
Осарсол
|
0,5г в 50мл 0,5% р-ра натрия гидрокарбоната
|
+
|
|
Панангин *(аспарагиновой кислоты радикал)
|
1-2%(готовится на 1-2%
р-ре гидрокарбоната Na)
|
—
|
|
Панкреатин
|
в 5% соды 2-5% р-р
|
+
|
|
Пантоник
|
|
+-
|
|
Пантрипин
|
в ДМСО
|
+
|
|
Папаверин гидрохлорид
|
0,1-0,5%
|
+
|
|
Папаин (лекозим)
|
0,01 г в 20 мг изиотонич.
|
+
|
|
Пармидин
|
2,5% в 50% ДМСО
|
|
|
ПАСК(парааминосалицилат натрия)
|
3%
|
—
|
|
Пахикарпин гидрохлорид
|
1%
|
+
|
|
Педутин-депо
|
|
+
|
|
Пелоидин
|
|
+ —
|
|
Пенициллин
|
5-10тыс ЕД в 1 мл изотонич.р-ра
|
—
|
|
Пентамин
|
5%
|
+
|
|
Пентоксифиллин (трентал)
|
2%
|
+
|
|
Пилокарпина гидрохлорид
|
0,1-0,5%
|
+
|
|
Пипольфен
|
1%
|
+
|
|
Пирацетам (ноотропил)
|
5%
|
+
|
|
Пирикаин
|
5%
|
+
|
|
Пирилен
|
0,1-0,5%
|
+
|
|
Платифиллина гидротартрат
|
0,05-0,1%
|
+
|
|
Плазма крови
|
10%
|
+ —
|
|
Плазмол
|
|
—
|
|
Преднизолона гидрохлорид*
|
0,1% 0,5%
|
+
|
|
Продигиозан
|
50мкг
|
—
|
|
Прозерин *
|
0,1%
|
+
|
|
Ронидаза
|
0,5г в 30мл дистил воды +5-8 кап 0,1н р-ра хлористоводородной кислоты
|
+
|
|
Резорцин
|
0,5%
|
—
|
|
Роданистый аммоний
|
2-5%
|
—
|
|
Салафур (фурагин)
|
0,1%
|
—
|
|
Салицилат натрия (салициловая кислота)
|
2,5%
|
—
|
|
Салюзид
|
3%
|
—
|
|
Сальсолина гидрохлорида
|
0,1%
|
+
|
|
Семакс
|
0,1%
|
+
|
|
Сера органическая
|
ихтиол 10-30%, унитиол 2-5%
|
—
|
|
Серебра нитрат
|
1-2%
|
+
|
|
Сероводородная вода
|
концентрация до 400 мг
|
—
|
|
Серотонин
|
1%
|
+
|
|
Синтомицин
|
0,3-0,5%; 1%
|
+
|
|
Сорбит
|
20%
|
+ —
|
|
Спазмолитин
|
0,5% 1%
|
+
|
|
Совкаин
|
0,25-1%
|
+
|
|
Стрептомицина сульфат
|
5000-10000 ЕД/мл
|
+
|
|
Строфантин К*
|
|
+
|
|
Сульфадимезин
|
1-2%подкисл
|
+
|
|
Сульфапиридазин натрия
|
1-2%
|
—
|
|
Супрастин *
|
2%
|
+
|
|
Танин
|
2%
|
—
|
|
Темисал
|
2%
|
—
|
|
Теофиллин*
|
на дистиллирован воде подщелач.
|
—
|
|
Террамицин (окситетрациклина дигидрат)
|
5000 ЕД/мл
|
+
|
|
Террилитин
|
1%
|
+
|
|
Тетаман
|
5-10%
|
+
|
|
Тетрациклина гидрохлорид *
|
5000-10000ЕД /мл
|
+
|
|
Тизерцин *
|
2-3 мл 0,25%, разбавить в 30 мл дистил воды
|
+
|
|
Тиокаин
|
2%
|
+
|
|
Тиосульфат натрия
|
5%
|
—
|
|
Тиофосфамид
|
10 мг в 10 мл воды для инъекц.
|
+
|
|
Трилон Б
|
3%
|
+
|
|
Тримекаин
|
0,5-2%
|
+
|
|
Трипседил
|
0,25%
|
+
|
|
Трипсин
|
5-10мг на 10мл натрия гидрокарбоната ,
5-10 мг на подкисленной дистил воде
ТРИПСИН (Spofa) 0.5-1% на дистил воде с «+»
|
—
+
|
|
Триседил
|
0,25%
|
+
|
|
Тропацин
|
1%
|
+
|
|
Туберкулин
|
5-25%
|
+
|
|
Туберкулин хлорид (миорелаксант)
|
1-2%
|
+
|
|
Унитиол (органическая сера)
|
2-5%
|
—
|
|
Уродан
|
20%
|
+
|
|
Уросульфан
|
в 50% ДМСО
|
+
|
|
Уротропин
|
2-5%
|
+
|
|
Фенибут*
|
5%
|
+
|
|
Фенкарол*
|
0,5% в 25% в ДМСО
|
+
|
|
Фенобарбитал *
|
1-2%
|
+
|
|
Фибринолизин*
|
Флакон (20000ЕД разводят в 200 мл одного из растворителей :
1 Дистил вода, подкислен до рН 5-5,2 или ацетатный буфер
2 Дистил вода, подщел до рН=8,6-8,8 (на процедуру – 30мл приготовленного р-ра)
3.
|
+
—
+
|
|
ФиБС
|
|
+ —
|
|
Физостигмин салицилат (эзерин)
|
0,1%
|
+
|
|
Фосфорной кислоты радикал (фосфат натрия)
|
3-5%
|
—
|
|
Френолон
|
0,5%
|
+
|
|
Фторафур
|
1-2%
|
—
|
|
Фторид натрия
|
ex tempore
|
—
|
|
Фторурацил
|
1-2%
|
—
|
|
фубромеган
|
2%
|
+
|
|
Фуразолин
|
0,03-0,1%
|
—
|
|
Фурагин (солафур)
|
0,1%
|
—
|
|
Фурадонин
|
на дистил воде подщелач до рН=8,4-8,8 1-2%
|
—
|
|
Хинин дигидрохлорид
|
1%
|
+
|
|
Химотрипсин
|
в глазной практике, 10мг 0,2% р-ра разводят в 5мл дистил.
|
+
|
|
Хонсурид
|
0,05 г в 5 мл 30% ДМСО
|
—
|
|
Цинка сульфат
|
1-2%
|
+
|
|
Цистамин
|
0,1%
|
+
|
|
Цистеин
|
2-5%
|
—
|
|
Церебролизин *
|
подкисл.
|
+
|
|
Цистамин дигидрохлорид
|
1%
|
+
|
|
Эзерина салицилат(физостигмин)
|
0,1%
|
+
|
|
Экмолин
|
0,5%
|
—
|
|
Эластолитин
|
20-30 мг в дист.
|
+
|
|
Элениум
|
0,1%
|
+
|
|
Элкорапан
|
|
+-
|
|
Эпсилон-аминокапроновая кислота (аминокапроновой кислоты радикал)*
|
1-5%
|
+
|
|
Эритромицина фосфат*
|
0,1-0,25 г на проц(готовится на 70% спирте)
|
+
|
|
Этазол натрия
|
5-10%
|
—
|
|
Этилморфин гидрохлорид (дионин)
|
0,1-1%
|
+
|
|
Эуфиллин *
|
2-5%
|
+-
|
|
Эфедрина гидрохлорид*
|
0,1-1%
|
+
|
|
Яд змеиный (компоненты), випраксин
|
1мл
|
+ —
|
|
Яд пчелиный, компоненты:
|
апизатрон 0,01-0,1%, апитоксин 1мл, апифор 1таб в 10мл буферного р-ра (рН=4,6)
|
+ —
|
|
Янтарная кислота
|
2-3%
|
—
|
Электрофорез в лечении заболеваний позвоночника и суставов.

Аппарат для электрофореза
МИТ-ЭФ2
Электрофорез (ионофорез) –это метод физиотерапии который заключается во введении в ткани тела лекарственного вещества через неповреждённую кожу с помощью постоянного электрического тока (гальванического тока). Применяется электрофорез как лечебный метод с 1802 года. Таким образом, ему уже около 210 лет, однако он до сих пор не утратил своей актуальности.
Как действует электрофорез.
С помощью электрического тока ионы лекарственного вещества движутся от одного электрода к другому (от «+» к «–» или наоборот, в зависимости от заряда ионов лекарства), проходя через ткани тела, и задерживаясь там, создавая высокие концентрации лекарства в зоне воздействия. Высокая концентрация лекарственного вещества может сохраняться в тканях организма до 15 и более часов, оказывая необходимый терапевтический эффект.
Крайне важно то, что методом электрофореза можно лечить органы с нарушенной микроциркуляцией, куда невозможна доставка лекарства с кровотоком. Такая ситуация может сложиться при диабетической ангиопатии сосудов нижних конечностей, тромбозах крупных кровеносных сосудов, некрозах тканей.
Такая ситуация может сложиться при диабетической ангиопатии сосудов нижних конечностей, тромбозах крупных кровеносных сосудов, некрозах тканей.
Также большое значение имеет тот факт, что при электрофорезе лекарство доставляется напрямую к больному органу, не проходя через печень и другие фильтры организма. Таким образом, лекарственное вещество оказывает меньшее токсическое действие на печень и системы выделения. При таком способе лечения требуется меньшая доза лекарства, хотя его концентрация в тканях, требующих лечения, гораздо выше.
Интересно, что во время электрофореза (ионофореза) лекарственные вещества приобретают заряд, и поступают к больным тканям в виде ионов, которые обладают гораздо большей терапевтической активностью.
Выгодные отличия электрофореза от инъекционного введения лекарств.
1. При электрофорезе лекарство более концентрированное, а суммарная доза гораздо меньше.
2. Лекарство напрямую доставляется в ткани организма, не проходя обработку в печени, и оказывая на неё меньшее токсическое действие.
3. В тканях более длительное время задерживается необходимая концентрация лекарства.
4. Действие лекарства эффективнее за счет ионизирования его при электрофорезе.
5. Слабый гальванический ток также оказывает лечебное действие. Он улучшает кровообращение, уменьшает отёк и воспаление.
6. Лечение комфортное, безболезненное и неинвазивное (не повреждаются кожные покровы), в отличие от инъекционного введения.
7. Меньше аллергических реакций, поскольку лекарственное вещество вводится в чистом виде без примесей и растворителей.
Воздействие гальванического тока при электрофорезе.
Гальванический ток сам по себе обладает противовоспалительным, обезболивающим, иммуностимулирующим действием. Это способствует усилению действия процедуры на организм. Наряду с этим, постоянный ток низкого напряжения ионизирует лекарственное вещество, делая его более активным. В результате достигается тот же лечебный эффект меньшей дозой лекарства.
Как выполняется процедура электрофореза.
На практике процедура электрофореза проводится очень просто. Используются две тканевые прокладки по размеру электродов. Они должны быть сшиты таким образом, чтобы электрод свободно входил внутрь прокладки и полностью был покрыт ею с двух сторон. Прокладки кипятятся, отжимаются и остывают.
Перемещение ионов лекарства
при электрофорезе.
На теплую влажную прокладку наносится раствор лекарственного вещества, причём лекарство наносится строго на положительный или отрицательный электрод, соответсвенно таблице. Далее электроды в тканевых прокладках прикладываются к коже пациента и сверху фиксируются целлофановой плёнкой или целлофановыми мешочками с песком.
Пациента укрывают и включают аппарат. Силу тока нужно добавлять плавно, и выставить такой уровень, чтобы пациент ощутил лёгкое покалывание в месте наложения электродов. Ни в коем случае больной не должен ощущать жжение или боль вовремя процедуры, есть опасность ожога.
Длительность сеанса электрофореза от 10 до 15 минут. Курс обычно включает 10 – 20 сеансов электрофореза, которые могут отпускаться каждый день или через день.
Показания для применения электрофореза.
Электрофорез (ионофорез) – это универсальный метод лечения. С помощью него можно вводить очень многие лекарственные вещества. Он используется при заболеваниях органов дыхания, в гинекологии, офтальмологии, косметологии, заболеваниях позвоночника и суставов, внутренних болезнях.
Назначается электрофорез для чрескожного или полостного введения антибиотиков, витаминов, противовоспалительных и обезболивающих средств, отхаркивающих, хондропротекторов и других препаратов. В центре вертебрологии доктора Ковриженко электрофорез используется очень широко.
Он назначается при болях в спине, при остеохондрозе и его осложнениях — протрузиях и грыжах межпозвонковых дисков, при заболеваниях суставов – деформирующем артрозе и плече-лопаточном периартрозе, эпикондилите, бурсите, тендините и тендовагините, невритах и невралгиях, полиневропатиях. В нашем центре процедура электрофореза назначается как в комплексном лечении, так и как самостоятельный метод терапии.
Грамотное применение электрофореза в комплексе лечения заболеваний опорно-двигательного аппарата позволяет нашим специалистам быстро снять болевой синдром, уменьшить продолжительность лечения и ускорить выздоровление.
Противопоказания для назначения электрофореза.
Противопоказания такие же, как и для всех остальных электропроцедур. А именно: различные онкозаболевания, болезни и повреждения кожи, острые инфекционные заболевания, высокая температура тела, психические заболевания, наличие кардиостимулятора, при тяжёлом общем состоянии пациента, кахексии, при нарушениях ритма сердца, высоком артериальном давлении.
Таким образом, электрофорез (ионофорез) является эффективной современной физиотерапевтической процедурой и с успехом применяется во многих областях медицины.
Также Вы можете ознакомиться с другими методами физиотерапии, которые применяются в нашем центре:
Магнитолазерная терапия,
Электромиостимуляция.
Если у Вас есть вопросы по поводу электрофореза или других методов лечения, можете задать их на странице ВОПРОС ВРАЧУ, или приходите на бесплатную консультацию к специалистам в наш центр.
Записаться на приём.
Способ лечения дисфункции слуховой трубы
Изобретение относится к медицине, а именно к оториноларингологии, физиотерапии, и может быть использовано при лечении пациентов с дисфункцией слуховой трубы. Выполняют катетеризацию слуховой трубы, во время которой кончик катетера вводят в устье Евстахиевой трубы. В барабанную полость нагнетают воздух, а затем 1 мл дексаметазона и 1 мл 25% раствора диметилсульфоксида. Выполняют транстубарный электрофорез, для чего в слуховой проход помещают часть ватного тампона, смоченного в смеси растворов дексаметазона и 25% диметилсульфоксида — 1:1. Другую часть тампона располагают в ушной раковине и накладывают на нее анод. Катод накладывают на затылочную область. Плотность тока выбирают в зависимости от процедуры, а именно: 1 процедура — 0,15 мА/см2, 2 процедура — 0,13 мА/см2, 3 процедура — 0,11 мА/см2, 4 процедура — 0,9 мА/см2, 5 процедура — 0,7 мА/см2. Продолжительность воздействия 10 минут. После электрофореза выполняют пневмомассаж барабанных перепонок в течение 10 минут. Курс лечения составляет 5 ежедневных процедур. Способ позволяет повысить эффективность лечения, уменьшить количество рецидивов заболевания за счет суммирования лечебного действия лекарственного препарата и физических факторов, пролонгировать лечебный эффект препарата за счет создания его депо в тканях. 2 з.п. ф-лы, 2 пр.
Изобретение относится к области медицины, в частности к оториноларингологии, физиотерапии, и может быть использовано при лечении пациентов с дисфункцией слуховой трубы.
Дисфункция слуховой трубы часто приводит к различным патологическим изменениям в полости среднего уха — от латентного тубоотита до экссудативного, а в последующем адгезивного среднего отита, являющихся важными звеньями развития многих форм тугоухости (Бобошко М.Ю. Вопросы патогенеза, диагностики и лечения дисфункций слуховой трубы: Автореф. дис. … д-ра мед. наук. СПб 2006, Петухова Н.А. Дисфункция слуховой трубы и эндотелиальная дисфункция: современный взгляд на проблему. Вестн. оториноларингологии. №4. 2012. 88-92). Длительное нарушение вентиляционной функции слуховой трубы с выраженным снижением интратимпанального давления способствует формированию ретракционных карманов, развитию острого гнойного среднего отита и его переходу в хронический, а также формированию эпитимпанита с холестеатомой (McNamee L.A., Harmsen A.G. Both Infl uenza-Induced Neutrophil Dysfunction and Neutrophil-Independent Mechanisms Contribute to Increased Susceptibility to a Secondary Streptococcus pneumoniae Infection. Infect Immun 2006; 74: 12: 6707-6721. 7. Nell M.J., Grote J.J. Endotoxin and TNF-alpha in middle ear eff usions: in relation with upper airway infection. Laryngoscope 1999; 109: 1815-1819; Nell M.J., Grote J.J. Endotoxin and TNF-alpha in middle ear eff usions: in relation with upper airway infection. Laryngoscope 1999; 109: 1815-1819).
Известен целый ряд методик лечения дисфункции слуховой трубы. Среди них можно выделить инвазивные методики — с применением функционального шунта (Крюков А.И., Гаров Е.В., Сидорина Н.Г., Царапкин Г.Ю., Загорская Е.Е., Акмулдиева Н.Р. Способ лечения дисфункции слуховой трубы с использованием функционального шунта // Медицинский совет, 2013, №3, с. 37-39). Для его установки проводят тимпанотомию. Наиболее часто данную процедуру выполняют после ринологических операций, что позволяет устранить длительную дисфункцию слуховой трубы и предотвращает развитие экссудативного среднего отита в отдаленном послеоперационном периоде. У данного метода имеются недостатки: необходимость проведения хирургического вмешательства с последующим уходом за шунтом и проведения процедуры удаления шунта в конце лечения.
Среди неинвазивных методов лечения дисфункции слуховой трубы наиболее распространенными являются следующие методы лечения:
1) Способ Полицера (Т.П. Мчелидзе. Оториноларингологический словарь. 2007, СПБ, с. 270) — метод лечения дисфункции слуховой трубы путем резкого повышения воздушного давления в носовой полости. Недостатками данной методики являются: воздействие повышенного воздушного давления действует на оба уха, в том числе и на здоровое ухо при одностороннем процессе; существует риск попадания патологического отделяемого из полости носа в барабанную полость при проведении процедуры с развитием еще большего воспаления, в том числе и в здоровом ухе.
2) Метод катеризации слуховой трубы с введением противоотечных препаратов, гормонов, муколитиков или ферментов (Е.С.Янюшкина Консервативное лечение секреторной стадии экссудативного среднего отита // Автореферат кандидатской диссертации, 2010 г.) Катетеризацию проводят с применением ушного катетера для Евстахиевой трубы по Hartmann, представляющего собой цилиндрическую трубочку длиной 15-18 см, один конец которой расширен в виде раструба, а другой загнут под углом 140-150° и имеет форму закругленного клюва. Имеются катетеры разной ширины просвета от 1 до 3 мм и толщиной стенки от 0,5 до 1 мм. Для нагнетания воздуха служит ушной баллон Полицера, вмещающий 200-250 мл воздуха.
Известна методика катетеризации слуховой трубы с помощью катетера для Евстахиевой трубы по Hartmann (Т.П. Мчелидзе. Оториноларингологический словарь. 2007, СПБ, с. 123). Катетеризацию производят в сидячем положении больного. Голова его должна быть прислонена к твердой подставке в вертикальном положении. Перед катетеризацией больной должен высморкаться. Проводят предварительную анестезию слизистой оболочки полости носа раствором лидокаина 10% — 2 мл.
Техника катетеризации
Под контролем передней риноскопии катетер вводят клювом вниз в нижний носовой ход. Скользя по дну носовой полости, катетер должен попасть в носоглотку. Затем его продвигают до соприкосновения с задней стенкой, поворачивают на 90° так, чтобы его клюв был направлен к уху противоположной стороны, и тянут к себе до тех пор, пока клюв его не наткнется на задний край перегородки, и поворачивают катетер на 180° в сторону исследуемого уха так, чтобы его кольцо было обращено к наружно-верхнему углу глазницы катетеризируемой стороны. Тогда клюв катетера входит в устье Евстахиевой трубы. Можно, не поворачивая клюв катетера, извлекать его до соприкосновения с мягким небом и совершить затем поворот клюва в сторону устья Евстахиевой трубы. После этого в раструб катетера вставляют наконечник баллона и вдувают несколько раз воздух, извлекая баллон после каждого вдувания. Вхождение воздуха в барабанную полость контролируют через резиновую слуховую трубку, один конец которой вставлен в ухо больного, а другой — в ухо врача. Для лечения дисфункции слуховой трубы обычно проводят 10 процедур в зависимости от улучшения степени проходимости слуховой трубы.
Одним из методов лечения дисфункции слуховой трубы является транстубарный электрофорез (В.Н. Ткаченко. К вопросу лечения больных секреторным средним отитом. Журнал ушных, носовых и горловых болезней, Киев, №4, 2007 с. 33-38). Вышеуказанная методика является наиболее близкой к предлагаемому нами изобретению.
Электрофорез — это электрокинетическое явление перемещения частиц дисперсной фазы (коллоидных или белковых растворов) в жидкой или газообразной среде под действием внешнего электрического поля (Парфенов А.П. Электрофорез лекарственных веществ. Л., 1973). Но как метод физиотерапевтического лечения дисфункции слуховой трубы в последнее время его применение практически прекращено ввиду травматичности методики выполнения из-за того, что для его проведения применятся металлический катетер.
Нами была поставлена задача разработки способа лечения пациентов с патологией слуховой трубы, лишенного указанных недостатков.
Разработанный нами способ позволяет добиться следующих технических результатов: повышается качество лечения, сокращается время лечения и количество проводимых процедур, уменьшается количество рецидивов заболевания.
Указанные результаты обусловлены следующим. Диметилсульфоксиду присуща способность усиливать действие вводимых при помощи электрофореза препаратов, так как он обладает выраженным транспортирующим свойством. ДМСО нами был использован, во-первых, в связи с тем, что дексаметазон обладает низкой электрофоретичностью и потому для обеспечения необходимой глубины проникновения электрофрез с ним проводится на растворе диметилсульфоксида (ДМСО). Во-вторых, так как применяемые электроды обладают малой площадью (интратубарный 2 мм2, наружный 25 см2).
Максимальная плотность тока при проведении электрофореза на слизистых оболочках не должна превышать 0,2 мА/см2. Для расчета силы тока применяется формула J=σ⋅S, где J — сила тока, σ — плотность тока, S — площадь прокладки или электрода. При использовании только интратубарного электрода площадью 2 мм2 максимально возможная мощность равняется I=0,2-0,02-0,004 мА, что недостаточно для проведения процедуры электрофореза. Соответственно, нами была выбрана методика биполярного электрофореза с применением наружного электрода 5×5 см=25 см2. Так как при биполярном электрофорезе площади активных электродов при расчете мощности складываются, получаем 0,02+16=16,02 см2, что дает максимально возможную мощность 0,2-25,02=5,004 мА, что обеспечивает хорошее проникновение препарата в ткани. Так как у некоторых пациентов субъективные ощущения достижения максимальной мощности (чувство вибрации, покалывания в области электродов) возникали на мощности 2-3 мА, применение ДМСО давало гарантию того, что даже на такой мощности препарат поступит в ткани в достаточном количестве.
Положительным аспектом применения электрофореза является то, что при этом происходят суммирование лечебного действия препарата и физического фактора, пролонгирование лечебного эффекта препарата за счет создания депо в подлежащих тканях с последующим длительным высвобождением.
Нами было выявлено, что комплексное применение указанных выше лечебных методов дает наилучший эффект, чем их изолированное применение. Катетеризация слуховой трубы с введением лекарственных препаратов является общепринятой методикой лечения тубарной дисфункции, так как вводимые препараты обладают противовоспалительным действием, улучшая проходимость слуховой трубы и, как следствие, аэрацию среднего уха. Электрофорез, проводимый после катетеризации, позволяет создать депо препарата в тканях по ходу слуховой трубы, пролонгируя его действие до 48 часов.
Способ осуществляется следующим образом.
Производится курс катетеризаций слуховой трубы с помощью катетера в количестве 5 процедур 1 раз в день.
Для этого после проведенной местной анестезии раствором лидокаина 10% 2 мл и обработки слизистой оболочки полости носа адреналином в полость носа под контролем эндоскопа 0° вводится катетер для катетеризации слуховой трубы.
Катеризацию целесообразно использовать с помощью катетера, выполненного из эластичного материала — из силиконовой резины, что позволяет снизить риск травмирования тканей.
Катетер продвигают до соприкосновения с задней стенкой носоглотки и поворачивают на 90° в сторону исследуемого уха. Потянув катетер на себя, кончик катетера входит в устье Евстахиевой трубы. После этого на катетер надевают наконечник баллона и нагнетают несколько раз воздух. Вхождение воздуха в барабанную полость контролируют через резиновую слуховую трубку, один конец которой вставлен в ухо больного, а другой — в ухо врача. Убедившись в прохождении воздуха в катетер, нагнетается 1 мл дексаметазона и 1 мл 25% раствора диметилсульфоксида. В качестве активного электрода (анод) используется металлический проводник диаметром 1 мм с закругленным концом с целью препятствия травмирования тканей слуховой трубы. После катетеризации и нагнетания раствора проводник проводится через катетер на заранее известную длину так, чтобы его конец выступал на 2 мм из торцевого края катетера, после чего осуществляется электрофорез.
С целью обеспечения более эффективного воздействия препарата применялся биполярный электрофорез (транстубарный электрофорез) раздвоенным электродом, для чего в слуховой проход помещают часть ватного тампона, смоченного в смеси растворов дексаметазона и 25% диметилсульфоксида -1:1, при этом другую часть тампона располагают в ушной раковине и накладывают на нее электрод (анод).
Катод накладывается на затылочную область (расположение электродов стандартное — по средней линии от С3 до С7). Плотность тока варьируют в ходе лечения. Начинают с 0,15 мА/см2, как максимальной для достижения наилучшего начального эффекта, так как в начале лечения наблюдается наиболее выраженный отек слизистой слуховой трубы, уменьшающийся по мере проведения лечения за счет проводимой противовоспалительной терапии и депонирования препарата в тканях за счет электрофореза, и постепенно снижают по разработанной нами оригинальной схеме:
1 процедура — 0,15 мА/см2,
2 процедура — 0,13 мА/см2,
3 процедура — 0,11 мА/см2,
4 процедура — 0,9 мА/см2,
5 процедура — 0,7 мА/см2.
Так как в процессе лечения происходит депонирование препарата в слизистой слуховой трубы, последующие процедуры можно проводить с меньшей мощностью, что позволяет уменьшить риск повреждения слизистой оболочки электротоком, а применение ДМСО обеспечивает достаточное проникновение препарата в ткани при меньшей силе и плотности тока.
Продолжительность каждой процедуры составляла 10 минут. После проведенного электрофореза проводят пневмомассаж барабанных перепонок в течение 10 минут. Пневмомассаж предпочтительно проводить после электрофореза потому, что в результате проведенной процедуры восстанавливается проходимость слуховой трубы и подвижность барабанной перепонки становится лучше.
Курс лечения состоит из 5 ежедневных процедур катетеризации слуховой трубы с введением 1 мл дексометазона и 1 мл 25% раствора диметилсульфоксида, проведением электрофореза и пневмомассажа барабанных перепонок.
Метод лечения дисфункции слуховой трубы апробирован на 20 больных с острым средним отитом в возрасте от 18 до 57 лет.
Иллюстрацией эффективности метода лечения дисфункции слуховой трубы могут служить 2 истории болезни.
Клинический пример N1
Больная О.Н., 29 лет. Обратилась в КДО НИКИО им. Л.И. Свержевского с диагнозом дисфункция слуховой трубы слева.
При поступлении предъявляла жалобы на заложенность левого уха, ощущение собственного голоса внутри головы.
Со слов пациентки, больна в течение 5 дней после перенесенного ОРВИ. Лечилась самостоятельно применением противовирусных препаратов, на фоне приема препаратов симптомы ОРВИ купировались, однако появилась заложенность левого уха. Жалобы возникли впервые. Ранее заложенности ушей не отмечала.
При отоскопии левого уха наружный слуховой проход широкий, свободный. Барабанная перепонка серого цвета, втянута. Опознавательные знаки укорочены. Шепотная речь 5,5 м, разговорная речь — более 6 м. При отоскопии правого уха наружный слуховой проход широкий, свободный. Барабанная перепонка серого цвета. Опознавательные знаки контурируются. Шепотная речь 6 м, разговорная речь — более 6 м. При проведении опыта Вебера имеется латерализация в левое ухо.
Пациентке проведен курс катетеризации слуховой трубы слева в количестве 5 процедур. После проведенной местной анестезии раствором лидокаина 10% 2 мл и обработки слизистой оболочки полости носа адреналином в полость носа под контролем эндоскопа 0° вводился катетер для катеризации слуховой трубы. Катетер продвигали до соприкосновения с задней стенкой носоглотки и поворачивали на 90° в сторону исследуемого уха. Потянув катетер на себя, кончик катетера входил в устье Евстахиевой трубы. После этого к катетеру вставляли наконечник баллона и нагнетали несколько раз воздух. Вхождение воздуха в барабанную полость контролировали через резиновую слуховую трубку, один конец которой вставлен в ухо больного, а другой — в ухо врача. Убедившись в прохождении воздуха, в катетер нагнетается 1 мл дексометазона и 1 мл 25% раствора диметилсульфоксида. В качестве активного электрода (анод) использовался металлический проводник диаметром 1 мм с закругленным концом. Проводник проводится через катетер так, чтобы его конец выступал на 2 мм из торцевого края катетера, после чего осуществляли биполярный электрофорез раздвоенным электродом, для чего дексаметазон вводился дополнительно через наружный слуховой проход — в слуховой проход помещался ватный тампон, смоченный раствором лекарственного вещества, другим концом заполнялась ушная раковина и накладывался на нее электрод. Катод накладывался на затылочную область. Первую процедуру начинали с 0,15 мА/см2, вторую процедуру — 0,13 мА/см2. Продолжительность каждой процедуры составляла 10 минут. После проведенного электрофореза проводился пневмомассаж барабанных перепонок в течение 10 минут.
После проведения второй процедуры катетеризации слуховой трубы слева пациентка отметила уменьшение заложенности левого уха. Жалобы на аутофонию регрессировали.
Третью процедуру проводили с установкой плотности тока — 0,11 мА/см3, четвертую процедуру — 0,9 мА/см2, пятую процедуру — 0,7 мА/см2.
После проведенной пятой процедуры пациентка жалоб не предъявляет. При объективном осмотре: наружный слуховой проход широкий, свободный. Барабанная перепонка серого цвета. Опознавательные знаки контурируются. Шепотная речь 6 м, разговорная речь — более 6 м. При проведении опыта Вебера латерализации нет.
Клинический пример N2
Больная Г.О., 32 лет. Обратилась в КДО НИКИО им. Л.И. Свержевского с диагнозом правосторонний экссудативный средний отит, дисфункция слуховой трубы справа.
При поступлении предъявляла жалобы на заложенность правого уха, снижение слуха справа, боль в правом ухе.
Со слов пациентки, больна в течение 7 дней после переохлаждения (купалась в проруби). Обращалась в поликлинику по месту жительства, где ЛОР-врачом было назначено консервативное лечение: капли Отипакс в правое ухо, сосудосуживающие капли в нос, продувание по Политцеру справа, пневмомассаж. Однако выраженного клинического эффекта пациентка не отметила. Жалобы возникли впервые. Ранее отитов не было.
При отоскопии левого уха: наружный слуховой проход широкий, свободный. Барабанная перепонка серого цвета. Опознавательные знаки контурируются. Шепотная речь 6 м, разговорная речь — более 6 м. При отоскопии правого уха: наружный слуховой проход широкий, свободный. Барабанная перепонка гиперемирована, выбухает. Опознавательные знаки стерты. Шепотная речь 4 м, разговорная речь — 5 м. При проведении опыта Вебера имеется латерализация в правое ухо. При тимпанометрии: тип «В» справа, тип «А» слева.
Пациентке проведен курс катетеризации слуховой трубы справа в количестве 5 процедур. После проведенной местной анестезии раствором лидокаина 10% 2 мл и обработки слизистой оболочки полости носа адреналином. В правую половину полости носа под контролем эндоскопа 0° вводили катетер для катетеризации слуховой трубы. Катетер продвигали до соприкосновения с задней стенкой носоглотки и поворачивали на 90° в сторону правого уха. Потянув катетер на себя кончик катетера, вводят в устье Евстахиевой трубы справа. После этого к катетеру присоединяли наконечник баллона и нагнетали несколько раз воздух. Вхождение воздуха в барабанную полость контролировали через резиновую слуховую трубку, один конец которой вставлен в правое ухо больного, а другой — в ухо врача. Убедившись в прохождении воздуха, в катетер нагнетался 1 мл дексометазона и 1 мл 25% раствора диметилсульфоксида. В качестве активного электрода (анод) использовался металлический проводник диаметром 1 мм с закругленным концом. Проводник проводится через катетер так, чтобы его конец выступал на 2 мм из торцевого края катетера, после чего осуществляли биполярный электрофорез раздвоенным электродом, для чего дексаметазон вводился дополнительно через наружный слуховой проход — в слуховой проход помещался ватный тампон, смоченный раствором лекарственного вещества, другим концом заполнялась ушная раковина и накладывался на нее электрод.
Катод накладывался на затылочную область. Первую процедуру начинали с 0,15 мА/см2, вторую процедуру — 0,13 мА/см2, третью процедуру — 0,11 мА/см2. Продолжительность каждой процедуры составляла 10 минут. После проведенного электрофореза проводился пневмомассаж барабанных перепонок в течение 10 минут.
После проведения третьей процедуры катетеризации слуховой трубы справа пациентка отметила уменьшение болей в правом ухе. Жалобы на заложенность, снижение слуха справа регрессировали.
Четвертую процедуру проводили с установкой плотности тока — 0,9 мА/см2, пятую процедуру — 0,7 мА/см2. После проведенной пятой процедуры пациентка жалоб не предъявляет. При объективном осмотре: наружный слуховой проход широкий, свободный. Барабанная перепонка серого цвета. Опознавательные знаки контурируются. Шепотная речь 6 м, разговорная речь — более 6 м. При проведении опыта Вебера латерализации нет. Пациентке проведена контрольная тимпанометрия: тип «А» с 2-х сторон.
1. Способ лечения дисфункции слуховой трубы, включающий катетеризацию слуховой трубы, во время которой кончик катетера вводят в устье Евстахиевой трубы, в барабанную полость нагнетают воздух, а затем 1 мл дексаметазона и 1 мл 25% раствора диметилсульфоксида, после чего выполняют транстубарный электрофорез, для чего в слуховой проход помещают часть ватного тампона, смоченного в смеси растворов дексаметазона и 25% диметилсульфоксида — 1:1, при этом другую часть тампона располагают в ушной раковине и накладывают на нее анод, катод накладывают на затылочную область, при этом плотность тока выбирают в зависимости от процедуры, а именно:
1 процедура — 0,15 мА/см2,
2 процедура — 0,13 мА/см2,
3 процедура — 0,11 мА/см2,
4 процедура — 0,9 мА/см2,
5 процедура — 0,7 мА/см2;
продолжительность воздействия 10 минут, после электрофореза выполняют пневмомассаж барабанных перепонок в течение 10 минут; курс лечения составляет 5 ежедневных процедур.
2. Способ по п. 1, в котором предварительно проводят местную анестезию раствором лидокаина 10% 2 мл и обработку слизистой оболочки полости носа раствором адреналина.
3. Способ по п. 1, в котором катетеризацию выполняют с помощью катетера, изготовленного из эластичного материала.
Электрофорез — цена на услугу в Таганроге
Электрофорез – один из самых распространённых, проверенных временем классических методов физиотерапии. Во время процедуры лекарственный препарат под действием слабого электрического тока глубоко проникает в кожу, не повреждая ее.
Суть процедуры заключается в том, что на кожу человека с двух сторон кладутся тканевые прокладки, пропитанные лекарственным раствором, и прижимаются к коже электродами. Под действие тока медикамент распадается на ионы, что способствует быстрому проникновению действующего вещества через кожу и слизистые и равномерному распределению в клетках и межклеточной жидкости. Из эпидермиса и дермы лекарство хорошо всасывается в кровь и лимфу и доставляется ко всем органам и тканям, хотя и достигает максимальной концентрации в области введения.
Ожидаемый положительный эффект электрофореза:
- улучшение обмена веществ не только в местных тканях, но и во всём организме
- снижение выраженности воспалительного процесса
- устранение отеков
- болеутоляющее действие
- стимуляция выработки веществ с биологической активностью
- повышение иммунитета
- успокаивающий эффект, благотворное влияние на ЦНС
- улучшение микроциркуляции крови
- ускорение регенерации тканей
Показания:
- травмы и заболевания опорно-двигательного аппарата
- болезни центральной и периферической нервной системы
- болезни дыхательной системы
- патологии сердечно-сосудистой и пищеварительной систем
- болезни органов слуха и зрения
- стоматологические и кожные болезни
- болезни мочеполовой и эндокринной системы
- послеоперационная реабилитация (послеоперационные раны и рубцы)
Противопоказания
Метод электрофореза достаточно безопасен, но его нельзя применять при некоторых патологиях:
- лихорадка
- нарушение кожных покровов в области наложения электродов
- гнойные воспалительные заболевания
- злокачественные новообразования
- бронхиальная астма в тяжелой форме
- индивидуальная непереносимость медикаментов
- наличие кардиостимулятора
Физиотерапия — «Стоматологическая поликлиника №19»
В кабинете физиотерапии
Рациональное сочетание медикаментозной терапии и физических факторов в значительной мере увеличивает эффективность лечения и медицинской реабилитации больных.
Лечебные физические факторы имеют ряд преимуществ перед традиционными методами лечения. Они крайне редко вызывают осложнения, то есть чрезвычайно физиологичны. На практике методы физиотерапии чаще применяют в комплексном лечении, но они зачастую эффективны и в случае монотерапии.
В связи с особенностями иннервации и микроциркуляции челюстно-лицевой области все физиотерапевтические воздействия на неё, помимо местных реакций, вызывают мощный регуляторный ответ целостного организма. Для уменьшения рефлекторных реакций и повышения качества лечения широко используется внутриполостные методики (в полости рта, зуба), что позволяет локализовать воздействие и уменьшить энергетическую нагрузку на организм.
При множественном кариесе, гипоплазии и флюорозе используется 10% раствор глюконата кальция для электрофореза внутриротового (используется поперечная и продольная методики .
— Для снятия болевых ощушений синдромов различной этиологии применяем флюктооризацию и диадинамотерапию.
— Мягкое воздействие токов дАрсонваля применяем на кожу и слизистую оболочку полости рта для улучшения питания тканей и их кровоснабжения при заболеваниях пародонта, повреждениях целостности кожи и слизистой оболочки воспалительного и травматического характера.
— Противоотёчное действие электромагнитных полей и магнитотерапии используется при острых воспалительных заболеваниях челюстно – лицевой области.
— При заболеваниях височно – нижнечелюстного сустава (артритах и артрозах) применяем магнитотерапию, ультразвукотерапию и фонофорез 5 % мази хондроитина или 5 % хондроксида.
— Фонофорез и электрофорез лидазы применяем при рубцовых изменениях кожи и слизистой.
— Ультрафиолетовое облучение слизистой оболочки полости рта применяем при воспалительных заболеваниях -стоматитах.
— Инфракрасное и красное лазерное излучение применяется при невралгиях ветвей тройничного нерва, парестезии слизистой, воспалительных заболеваниях слизистой и пародонта.
Используемые методы ФТЛ:
Как лечить артроз плечевого сустава?
« Назад
18.03.2020 00:00
Артрозы – это такие поражения суставов, которые возникают по причине нарушения обмена веществ в околосуставных тканях и из-за изнашивания ткани сустава. Чаще всего артроз проявляет себя у людей старше 40 лет.
Артроз не надо путать с артритом, под которым подразумеваются воспалительные процессы, проходящие в суставе, причиной которых являются изменения в суставной жидкости. А при артрозе изменяется сама структура хряща, и появляются признаки его преждевременной изнашиваемости – в основном это микротрещинки.
Что касается артроза плечевого сустава, то для него характерно отложение солей в местах повреждения хряща. Поэтому, если не начать своевременное лечение, то заболевание может привести к появлению контрактуры, дефекту, который будет блокировать некоторые движения.
Симптомы артроза плечевого сустава:
— появление болевых ощущений при физических нагрузках;
— ограниченная подвижность сустава;
— хруст в суставе;
— периодическое появление отёчности сустава;
— напряженность мышц при выполнении обычных действий;
— невозможность сделать некоторые движения.
Для того чтобы заподозрить артроз, достаточно отметить хотя бы пару из этих симптомов. В таком случае Здоровая жизнь рекомендует поскорее обратиться к специалисту для уточнения диагноза и назначения необходимого лечения.
Причины появления артроза плечевого сустава могут быть разными:
— травма или неожиданная чрезмерная физическая нагрузка;
— образ жизни, который ограничивает подвижность плечевого сустава;
— наследственность.
Как лечить артроз плечевого сустава?
Выбор препаратов для лечения и необходимых процедур делается с учетом ряда обстоятельств. Сначала проводят рентген сустава, чтобы точно выявить, какие изменения в суставе имеются, и какое лечение потребуется.
Если выявлен первичный артроз, то для восстановления кровообращение в суставе назначают медикаменты, процедуры, советуют внести коррективы в образ жизни. Лучше всего, чтобы лечение носило комплексный характер: медикаменты сочетались с физиопроцедурами, а потом проводилось санаторно-курортное лечение.
Чтобы снять воспаление плечевого сустава, назначают такие нестероидные препараты, как ортофен, индометацин, диклофенак. А чтобы восстановить микроциркуляцию крови в плечевом суставе, обычно приписывают применять гепарин, АТФ, никошпан, троксевазин, трентал, продектин и т.д.
Для улучшения усвоения тканями кислорода необходимо принимать витамины группы В. Кроме названных препаратов хорошо себя зарекомендовал в лечении артроза и аспирин для получения обезболивающего и противовоспалительного эффекта.
Если у больного артрозом имеются болезни желудочно-кишечного тракта или язва желудка, то назначают препарат с щадящим действием на желудок – это Фепразон.
Чтобы снизить проявления дистрофических изменений на суставах назначают такие препараты, как артепарон, хлорохин, румалон.
Иногда врач может приписать внутрисуставное введение дексаметазона, гидрокортизона и иных подобных препаратов.
Чтобы лечение было комплексным, при артрозе плечевого сустава применяют физиотеревтические процедуры: ультразвуковое воздействие, электрофорез, скипидарные или хлоридно-натриевые ванны. Если клиника обладает современным оборудованием, то больному могут прописать посещение сеансов лазерного лечения, криотерапии, вакуумного массажа и т.д.
При артрозе с отёками следует соблюдать низкосолевую диету с достаточным количеством жидкости. То есть следует снизить потребление соленых блюд, острых приправ, помидоров и шпината. Такая диета помогает избавляться от лишней жидкости, что способствует снятию отеков.
Источник
Клинические исследование Множественная миелома: Помалидомид, Карфилзомиб, дексаметазон, Даратумумаб — Реестр клинических исследований
Критерии включения:
— Рецидивирующая и рецидивирующая / рефрактерная множественная миелома, требующая системной терапии
— Не удалось хотя бы одно предыдущее лечение множественной миеломы (должно быть леналидомид)
— Для включения в программу терапии второй линии: должен быть невосприимчив к леналидомиду. (прогрессирование при терапии или в течение 60 дней после приема леналидомида)
— Измеримое заболевание, на что указывает одно или несколько из следующего:
— Сывороточный М-белок> = 0,5 г / дл
— М-белок в моче> = 200 мг / 24 часа
— Если электрофорез сывороточного протеина ненадежен для стандартного М-протеина измерение, тогда допустимы количественные уровни иммуноглобулинов
— Вовлеченные свободные легкие цепи сыворотки ≥ 10 мг / дл (коэффициент изменения свободного света должен быть аномальный)
— Возраст 18 лет и старше
— Продолжительность жизни более 3 месяцев
— Статус работы Восточной совместной онкологической группы (ECOG) 0-2
— Адекватная функция печени
— Билирубин <1,5-кратного верхнего предела нормы (ВГН)
— Аспартатаминотрансфераза (АСТ) <2,5 раза ВГН
— Аланинаминотрансфераза (АЛТ) <2,5 раза ВГН
— Абсолютное количество нейтрофилов (ANC)> = 1,0 x 10 ^ 9 / л
— Гемоглобин> = 8 г / дл
— Количество тромбоцитов> = 75 x 10 ^ 9 / л (не зависит от переливаний тромбоцитов в течение минимум 2 недели)
— Расчетный или измеренный клиренс креатинина> = 30 мл / мин.
— Письменное информированное согласие
— Отрицательный тест на беременность (для женщин детородного возраста) в течение 10-14 дней после начало исследуемого лечения и повторное введение в течение 24 часов после первой дозы помалидомида
— Должен согласиться практиковать воздержание или использовать два приемлемых метода контроля рождаемости.
— Мужчины должны дать согласие на использование латексных презервативов во время половых контактов с женщинами детородного возраста. потенциал (даже после вазэктомии)
— Должен согласиться соблюдать все требования исследования, график посещений, амбулаторное лечение, Необходимые сопутствующие препараты и лабораторный мониторинг
— Должен зарегистрироваться в обязательной программе POMALYST REMS ™ и иметь желание и возможность соблюдать с требованиями программы POMALYST REMS ™
Критерий исключения:
— Пациенты, которым в ближайшие 6 лет существует перспектива трансплантации стволовых клеток. месяцы из плана лечения исключены
— синдром ПОЭМС (полинейропатия, органегалия, эндокринопатия, моноклональный белок и изменения кожи)
— Плазматический лейкоз
— макроглобулинемия Вальденстрема или миелома иммуноглобулина M (IgM)
— Лучевая терапия в несколько участков или иммунотерапия в течение 4 недель до начала протокол лечения (локализованная лучевая терапия в одном месте не менее чем за 1 неделю до старт допустим)
— Участие в исследовательском терапевтическом исследовании в течение 3 недель или в течение 5 препаратов период полураспада (t1 / 2) до первой дозы, в зависимости от того, какое время больше
— Пациенты, резистентные к любому ингибитору протеасом, кроме бортезомиба или карфилзомиб
— Беременные или кормящие
— Наличие в анамнезе аллергии на маннит или предшествующей гиперчувствительности к талидомиду, леналидомиду или помалидомид
— серьезная операция в течение 3 недель до первой дозы,
— Предварительная трансплантация периферических стволовых клеток в течение 12 недель после включения в исследование
— Получал любую противораковую терапию, включая химиотерапию, иммунотерапию, лучевая терапия, гормональная (за исключением гормонов при заболеваниях щитовидной железы или заместительная терапия эстрогенами [ЗЭТ]) или любую экспериментальную терапию в течение 21 дня после зачисление
— Инфаркт миокарда в течение 6 месяцев до зачисления, New York Heart Associate (NYHA) сердечная недостаточность III или IV класса, неконтролируемая стенокардия, тяжелая неконтролируемая форма желудочковые аритмии или электрокардиографические свидетельства острой ишемии или активной аномалии проводящей системы
— Неконтролируемая гипертензия или диабет
— Острая активная инфекция, требующая системных антибиотиков, противовирусных или противогрибковых препаратов в течение двух недель до первой дозы
— Известная или предполагаемая инфекция иммунодефицита человека (ВИЧ), известная серопозитивность к ВИЧ
— Активная инфекция гепатита A, B или C
— Негематологические злокачественные новообразования в течение последних 3 лет, за исключением адекватно леченного базального клеточный, плоскоклеточный рак кожи, рак щитовидной железы, карцинома in situ шейки матки или рак груди, простаты <6 степени по Глисону со стабильным уровнем специфического антигена простаты или рак считается излеченным только с помощью хирургической резекции
— Любое клинически значимое заболевание или состояние, которое, по мнению исследователя, мнение, может помешать соблюдению протокола или способности субъекта давать информированные согласие
— Значительная невропатия (3-4 степени или 2 степени с болью) во время первого дозу и / или в течение 14 дней до зачисления
— Противопоказания к любому из необходимых сопутствующих препаратов, в том числе к протонной помпе. ингибитор (например, лансопразол), аспирин с энтеросолюбильным покрытием, аллопуринол или если в анамнезе предшествующее тромботическое заболевание, варфарин или низкомолекулярный гепарин
— Субъекты, которым противопоказана необходимая программа перорального и внутривенного гидратации жидкости, например, из-за уже существующей легочной, сердечной или почечной недостаточности
— Субъекты с известным или подозреваемым амилоидозом любого органа
— Субъекты с плевральным выпотом, требующим плевроцентеза или асцитом, требующим парацентез
— Предыдущее воздействие даратумумаба .
Электрофоретическое осаждение нагруженных дексаметазоном желатиновых наносфер / хитозанового покрытия и его двойная функция в противовоспалительном и остеогенезе
Коллоиды Surf B Биоинтерфейсы
. 2018 1 сентября; 169: 249-256.
DOI: 10.1016 / j.colsurfb.2018.05.029.
Epub 2018 18 мая.
Принадлежности
Расширять
Принадлежности
- 1 Ключевая лаборатория космической биологии и биотехнологии, Школа наук о жизни, Северо-Западный политехнический университет, Сиань, Шэньси 710072, Китай.
- 2 Национальный инженерно-исследовательский центр передовых технологий обработки полимеров, Университет Чжэнчжоу, Чжэнчжоу, Хэнань 450002, Китай.
- 3 Ключевая лаборатория космической биологии и биотехнологии, Школа наук о жизни, Северо-Западный политехнический университет, Сиань, Шэньси 710072, Китай. Электронный адрес: [email protected].
Элемент в буфере обмена
Hongfei Qi et al.Коллоиды Surf B Биоинтерфейсы.
.
Показать детали
Показать варианты
Показать варианты
Формат
АннотацияPubMedPMID
Коллоиды Surf B Биоинтерфейсы
.2018 1 сентября; 169: 249-256.
DOI: 10.1016 / j.colsurfb.2018.05.029.
Epub 2018 18 мая.
Принадлежности
- 1 Ключевая лаборатория космической биологии и биотехнологии, Школа наук о жизни, Северо-Западный политехнический университет, Сиань, Шэньси 710072, Китай.
- 2 Национальный инженерно-исследовательский центр передовых технологий обработки полимеров, Университет Чжэнчжоу, Чжэнчжоу, Хэнань 450002, Китай.
- 3 Ключевая лаборатория космической биологии и биотехнологии, Школа наук о жизни, Северо-Западный политехнический университет, Сиань, Шэньси 710072, Китай. Электронный адрес: [email protected].
Элемент в буфере обмена
Полнотекстовые ссылки
Опции CiteDisplay
Показать варианты
Формат
АннотацияPubMedPMID
Абстрактный
Модификация поверхности металлических имплантатов с помощью биоактивных и биоразлагаемых покрытий может быть многообещающим подходом к регенерации кости.Целью данного исследования было приготовить композитное покрытие хитозан / желатиновые наносферы (GN) для доставки дексаметазона (DEX). ГН с узким распределением по размерам и отрицательным поверхностным зарядом были впервые получены методом двухэтапной десольватации. Гомогенные и стабильные композитные покрытия желатиновые наносферы / хитозан (GNs / CTS) были сформированы методом электрофоретического осаждения (EPD). Нагрузка лекарством, эффективность инкапсуляции и высвобождение DEX in vitro оценивали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ).Противовоспалительный эффект покрытий, нагруженных DEX, на клетки макрофага RAW 264.7 оценивали по секреции фактора некроза опухоли (TNF) и индуцибельной синтазы оксида азота (iNOS). Остеогенная дифференцировка остеобластов MC3T3-E1 на покрытии, нагруженном DEX, была исследована по экспрессии и минерализации остеогенных генов. DEX в композитном покрытии GNs / CTS показало, что двухэтапный паттерн высвобождения может не только подавлять воспаление во время периода всплеска высвобождения, но также способствовать остеогенной дифференцировке в период длительного высвобождения.Это исследование может предложить реальный метод модификации поверхности металлических имплантатов при регенерации кости.
Ключевые слова:
Противовоспалительный; Дексаметазон; Электрофоретическое напыление покрытия; Желатиновые наносферы; Остеогенез.
Copyright © 2018 Elsevier B.V.Все права защищены.
Похожие статьи
Электрофоретическое нанесение биоадаптивных покрытий для доставки лекарств на магниевый сплав для восстановления костей.
Qi H, Heise S, Zhou J, Schuhladen K, Yang Y, Cui N, Dong R, Virtanen S, Chen Q, Boccaccini AR, Lu T.
Ци Х и др.
Интерфейсы ACS Appl Mater. 2019 27 февраля; 11 (8): 8625-8634. DOI: 10.1021 / acsami.9b01227. Epub 2019 18 февраля.Интерфейсы ACS Appl Mater. 2019.PMID: 30715842
Электрофоретическое осаждение хитозановых покрытий, модифицированных желатиновыми наносферами, для регулировки высвобождения антибиотиков.
Сонг Дж., Чен К., Чжан И, Диба М., Колвейк Э, Шао Дж., Янсен Дж. А., Ян Ф., Боккаччини А. Р., Левенбург, Южная Каролина.
Song J и др.
Интерфейсы ACS Appl Mater. 2016 8 июня; 8 (22): 13785-92. DOI: 10.1021 / acsami.6b03454. Epub 2016 23 мая.
Интерфейсы ACS Appl Mater. 2016 г.PMID: 27167424
Оценка in vitro и in vivo хитозан-желатиновых наносферных покрытий, нагруженных тетрациклином, для функционализации поверхности титана.
Ма К., Цай Икс, Чжоу И, Ван И, Цзян Т.
Ма К. и др.
Macromol Biosci. 2017 Февраль; 17 (2). DOI: 10.1002 / mabi.201600130. Epub 2016 30 августа.Macromol Biosci. 2017 г.PMID: 27572918
Наногибридные электропокрытия для терапевтических имплантатов с контролируемым потенциалом доставки лекарств для регенерации костей.
Патель К.Д., Сингх Р.К., Махапатра С., Ли Э.Дж., Ким Х.В.
Патель К.Д. и др.
J Biomed Nanotechnol. 2016 Октябрь; 12 (10): 1876-89. DOI: 10.1166 / jbn.2016.2301.
J Biomed Nanotechnol. 2016 г.PMID: 29359903
Биочувствительные и антибактериальные покрытия на металлических материалах для медицинского применения.
Goldmann WH.
Goldmann WH.
Cell Biol Int. 2021 5 апреля. Doi: 10.1002 / cbin.11604. Онлайн до печати.
Cell Biol Int. 2021 г.PMID: 33818836
Рассмотрение.
Процитировано
4
статей
Покрытие из фосфата кальция, стронция, цинка и интерлейкина-4 вызывает контролируемую поляризацию макрофагов и способствует остеоинтеграции на титановом имплантате.
Zhao DW, Zuo KQ, Wang K, Sun ZY, Lu YP, Cheng L, Xiao GY, Liu C.
Чжао DW и др.
Mater Sci Eng C Mater Biol Appl. 2021 Янв; 118: 111512. DOI: 10.1016 / j.msec.2020.111512. Epub 2020 16 сен.
Mater Sci Eng C Mater Biol Appl. 2021 г.PMID: 33255069
Бесплатная статья PMC.Подавление жизнеспособности и подвижности клеток путем послойной сборки и биоминерализации.
Вэй И, Сюй Х, Сюй С, Су Х, Чжан Л., Сунь Р., Хуан Д., Чжао Л., Ван К., Ху И, Лянь X.
Wei Y, et al.
САУ Омега. 2020 10 июля; 5 (28): 17118-17128. DOI: 10.1021 / acsomega.0c00846. eCollection 2020 21 июля.
САУ Омега. 2020.PMID: 32715197
Бесплатная статья PMC.Направленный противоопухолевый механизм наносфер C-PC / CMC-CD55sp в раковых клетках шейки матки HeLa.
Лю Г, Сюй Х, Цзян Л., Цзи Х, Чжу Ф, Цзинь Б., Хань Дж, Дун Х, Ян Ф, Ли Б.Лю Джи и др.
Front Pharmacol. 2020 18 июня; 11: 906. DOI: 10.3389 / fphar.2020.00906. Электронная коллекция 2020.
Front Pharmacol. 2020.PMID: 32636744
Бесплатная статья PMC.Характеристика поверхности титановых имплантатов с электроусилением: мультитехнологический подход.
Комета С., Бонифачо М.А., Феррейра А.М., Джентиле П., Де Джильо Э.
Cometa S и др.
Материалы (Базель).2020 5 февраля; 13 (3): 705. DOI: 10.3390 / ma13030705.
Материалы (Базель). 2020.PMID: 32033256
Бесплатная статья PMC.Рассмотрение.
Условия MeSH
- Противовоспалительные агенты, нестероидные / химические
- Противовоспалительные средства, нестероидные / фармакологические *
- Дифференциация клеток / эффекты лекарств
- Дексаметазон / химия
- Дексаметазон / фармакология *
- Остеогенез / эффекты лекарств *
Вещества
- Противовоспалительные средства, нестероидные
LinkOut — дополнительные ресурсы
Источники полных текстов
Источники другой литературы
Материалы исследований
[Икс]
цитировать
Копировать
Формат:
AMA
APA
ГНД
NLM
Моделирование искусственной нейронной сетью электрофоретической подвижности дексаметазона и двух добавок в мицеллярной электрокинетической капиллярной хроматографии
Моделирование искусственной нейронной сетью электрофоретической подвижности дексаметазона и двух добавок в мицеллярной электрокинетической капиллярной хроматографии
Одновременная оптимизация множественного отклика была использована для разработки метода мицеллярной электрокинетической капиллярной хроматографии (MEKC) для определения дексаметазона натрия фосфата (DEX) и двух добавок, креатинина (CRE) и пропилпарабена (PRO) в ампулах DEX.Цель состоит в том, чтобы оптимизировать параметры разделения для достижения максимального разрешения между тремя компонентами за разумное время работы. Состав и напряжение буфера были оптимизированы с помощью искусственной нейронной сети (ИНС). Использовалась лучшая нейронная сеть со структурой «2-10-4» и 150 эпохами. Для построения ИНС использовался алгоритм обратного распространения с функцией сигмоидального преобразования в узлах. Способность к обобщению была изучена путем обращения к сети с тестовыми данными и расчета параметров производительности, e.грамм. Корреляция ( R ), среднеквадратичная ошибка (MSE), среднеквадратичная ошибка (RMSE) и относительная ошибка в процентах ( E r %). Прогнозируемые результаты хорошо согласуются с экспериментальными значениями, что указывает на то, что нейронная сеть является потенциальным методом выбора условий разделения в MEKC. Оптимальное разделение было достигнуто при использовании фонового электролита 20 мМ боратного буфера, содержащего 30 мМ додецилсульфата натрия (SDS), при pH 9.5 вместе с подачей высокого напряжения (30 кВ) на капилляр. Полное разделение было достигнуто за 4,39 мин. Этот оптимизированный метод был применен для анализа коммерческих ампул DEX. Метод был полностью проверен в соответствии с рекомендациями ICH.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент…
Что-то пошло не так. Попробуй еще раз?
Исследование множественных констант связывания дексаметазона с сывороточным альбумином человека с помощью капиллярного электрофореза — фронтального анализа и многомерной регрессии
Holford NHG, Benet LZ, Katzung BG (1998) Основы и клиническая фармакология, 7-е изд. Эпплтон и Ланге, Стэмфорд
Google Scholar
Su TJ, Lu JR, Cui ZF, Thomas RK (2000) J Membrane Sci 173: 167–178
Google Scholar
Gonzalez-Alonso I, Sanchez-Navarro A (1998) Biofarmacia y farmacocinética II. Síntesis, Мадрид, стр. 467
Evans WE, Schentag JJ, Jusko WJ, Relling MV (1992) Прикладная фармакокинетика — принципы терапевтического мониторинга лекарственных средств. Братья Эдвардс, Ванкувер
Google Scholar
Kwong TC (1985) Clin Chim Acta 151: 193
Артикул
CAS
Google Scholar
Курц Х. (1986) Связывание с лекарственным белком. Praeger, New York
Ascoli G, Bertucci C, Salvadori P (1995) J Pharm Sci 84: 737
Article
CAS
Google Scholar
He X, Munson SH, Twigg PD, Gernert KM, Broom MB, Miller TY, Carter DC (1989) Science 244: 1195
Статья
Google Scholar
Birkett DJ, Wade DN, Sudlow G (1976) Mol Pharmacol 12: 1052
Google Scholar
Heegaard NHH, Kennedy RT (1999) Electrophoresis 20: 3122–3133
Article
CAS
Google Scholar
Kraak JC, Busch S, Poppe H (1992) J Chromatogr 608: 257–264
Статья
CAS
Google Scholar
Busch MHA, Carels LB, Boelens HFM, Kraak JC, Poppe H (1997) J Chromatogr A 777: 311–328
Артикул
CAS
Google Scholar
Tanaka Y, Terabe S (2002) J Chromatogr B 768: 81–92
Артикул
CAS
Google Scholar
Saux TL, Varenne A, Perreau F, Siret L, Duteil S, Duhau L, Gareil P (2006) J Chromatogr A 1132: 289
Артикул
Google Scholar
Yan W, Colyer CL (2006) J Chromatogr A 1135: 115–121
Артикул
CAS
Google Scholar
Мартинес-Гомес М.А., Саградо С., Вильянуэва-Каманас Р.М., Медина-Эрнандес М.Дж. (2006) Электрофорез 27: 3410–3419
Статья
Google Scholar
Martínez-Gómez MA, Carril-Aviles MM, Sagrado S, Villanueva-Camanas RM, Medina-Hernández MJ (2007) J Chromatogr A 1147: 261–269
Статья
Google Scholar
Yu XM, Zhao P, Zhang WB, Zhang LH, Zhang YK (2007) J Pharm Biomed Anal 45: 701–705
Статья
CAS
Google Scholar
Jensen H, Ostergaard J, Thomsen AE, Hansen SH (2007) Electrophoresis 28: 322–327
Article
CAS
Google Scholar
Jensen H, Ostergaard J, Hansen SH (2007) Электрофорез 28: 2975–2980
Статья
CAS
Google Scholar
Zhou N, Liang YZ, Wang B, Wang P, Chen X, Zeng MM (2008) Biomed Chromatogr 22: 223–231
Статья
CAS
Google Scholar
Лу QH, Ba CD, Chen DY (2008) J Pharm Biomed Anal 47: 888–891
Статья
CAS
Google Scholar
Лю X, Чен X, Юэ Y, Zhang J, Song Y (2008) Электрофорез 29: 2876–2883
Google Scholar
Клотц И.М., Ханстон Д.Л. (1971) Биохимия 10: 3065
Статья
CAS
Google Scholar
Klotz IM, Hunston DL (1975) J Biol Chem 250: 3001–3009
CAS
Google Scholar
Klotz IM, Hunston DL (1984) J Biol Chem 259: 10060–10062
CAS
Google Scholar
Klotz IM (1993) Proc Natl Acad Sci USA 90: 7191–7194
Статья
CAS
Google Scholar
Klotz IM (1996) Proc Natl Acad Sci USA 93: 14411–14415
Статья
CAS
Google Scholar
Huang Y, Zhang Z (2004) J Pharm Biomed Anal 35: 1293–1299
Статья
CAS
Google Scholar
Gao ZB, Ding PT, Xu H, Zhang L, Wei J, Chen DW (2007) Pharmazie 62: 115–116
CAS
Google Scholar
Scatchard G (1949) Ann NY Acad Sci 51: 660
Google Scholar
Чжоу Д., Ли Ф. (2004) J Pharm Biomed Anal 35: 879–885
Статья
CAS
Google Scholar
Идентификация Yb-глутатион-S-трансферазы как основного белка печени крысы, меченного 21-метансульфонатом дексаметазона на JSTOR
Abstract
Дексаметазон 21-метансульфонат, аффинная метка к глюкокортикоидсвязывающим белкам, инкубировали с препаратами цитозоля печени крысы.Преобладающий ковалентно меченый компонент был идентифицирован как Yb-глутатион-S-трансфераза на основании хроматографических свойств, электрофоретической подвижности и специфического удерживания анти-Yb-иммуноадсорбентом. Мечение аффинности этого белка блокировалось избытком дексаметазона. Предпочтительная реакционная способность 21-метансульфоната дексаметазона с подклассом Yb глутатион-S-трансферазы (глутатионтрансфераза, EC 2.5.1.18) также была очевидна для смесей, содержащих множественные формы фермента.Yb-глутатион-S-трансфераза, ненасыщаемый глюкокортикоидсвязывающий компонент цитозоля печени крысы, поэтому должна быть переклассифицирована; из-за своей высокой концентрации и избирательного взаимодействия со стероидами этот фермент может быть внутриклеточным глюкокортикоид-связывающим белком и, таким образом, влиять на транспорт, метаболизм и действие стероидов.
Информация о журнале
PNAS — это самый цитируемый в мире междисциплинарный научный сериал.
Он публикует высокоэффективные исследовательские отчеты, комментарии, мнения, обзоры и т. Д.
доклады коллоквиума и акции Академии.В соответствии с руководящими
принципы, установленные Джорджем Эллери Хейлом в 1914 году, PNAS издает
краткие первые объявления членов Академии и иностранных партнеров подробнее
важный вклад в исследования и работу, которая, по мнению Участника,
иметь особое значение.
Информация об издателе
Национальная академия наук (НАН) — это частная некоммерческая организация ведущих исследователей страны. НАН признает и продвигает выдающуюся науку путем избрания в члены; публикация в своем журнале PNAS; и его награды, программы и специальные мероприятия.Через Национальные академии наук, инженерии и медицины NAS предоставляет объективные, научно обоснованные советы по важнейшим вопросам, затрагивающим нацию.
Дексаметазон подавляет апоптоз, индуцированный фактором некроза опухоли, в остеобластах: возможная роль церамида * | Эндокринология
Церамид был предложен в качестве второй молекулы-посредника, участвующей в различных биологических процессах, включая апоптоз. Недавно сообщалось, что фактор некроза опухоли-α (TNF-α) активирует высвобождение церамида и что церамид действует как медиатор для индуцированной TNF-α стимуляции аффинности связывания ядерного фактора-κB (NF-κB ), широко распространенный фактор транскрипции, имеющий особое значение для иммунных и воспалительных реакций.В этом исследовании мы демонстрируем, что дексаметазон, который снижает выработку церамида, значительно ингибирует TNF-α-индуцированную активацию NF-κB, N-концевую киназу c-Jun, также известную как активирующая стресс протеинкиназа, подобная каспазе-3. цистеиновая протеаза, перераспределение цитохрома c и апоптоз в остеобластах MC3T3E1. По сравнению с активацией JNK, индуцированной TNF-α, церамид вызывает более быструю активацию JNK в течение 30 мин. C 2 -керамид активирует NF-κB и каспазу-3-подобную протеазу в одинаковой степени и с кинетикой, аналогичной таковой у TNF-α.Это исследование предоставляет доказательства того, что высвобождение церамида может потребоваться в качестве второго посредника при апоптозе, индуцированном TNF-α. Эти результаты также предполагают регуляторную роль дексаметазона в апоптозе, индуцированном TNF-α, посредством ингибирования высвобождения церамида. Таким образом, наши результаты in vitro и предполагают, что терапия, направленная на ингибирование высвобождения церамидов, может устранить воспалительные процессы при заболеваниях, связанных с TNF-α, включая ревматоидный артрит и пародонтит.
ЗАПРОГРАММИРОВАННАЯ СМЕРТЬ КЛЕТОК, или апоптоз, — это процесс, с помощью которого клетки вызывают активацию собственной смерти или клеточного самоубийства.Апоптоз встречается в самых разных типах клеток и, как известно, оказывает большое влияние на развитие множества систем. Гистологически термин апоптоз относится к характерной морфологии клеток, претерпевающих запрограммированную гибель клеток. Апоптозные клетки кажутся сморщенными, с обширными мембранными пузырями и фрагментацией ядер. Конечная точка апоптоза включает фрагментацию клеток на связанные с мембраной везикулы, содержащие клеточные остатки белка и фрагментированный хроматин, называемые апоптотическими тельцами.Эти мембраносвязанные везикулы в конечном итоге фагоцитируются макрофагами без участия воспалительной реакции (1–3).
В костном микроокружении существует динамический баланс резорбции и образования, который поддерживает гомеостаз скелета. Клеткам, отвечающим за эти функции, остеокластам и остеобластам, требуется множество различных медиаторов, включая остеотропные гормоны и провоспалительные цитокины (4). Из последних факторов фактор некроза опухоли-α (TNF-α) и интерлейкин-1β являются медиаторами воспалительной потери костной массы, тогда как сообщалось, что интерферон-γ селективно ингибирует резорбцию кости.Было показано, что TNF-α играет важную роль в местном контроле ремоделирования кости (5).
Новый путь передачи сигнала, который участвует в опосредовании апоптотических эффектов TNF-α, был идентифицирован в нескольких типах клеток (6, 7). Этот путь апоптоза, называемый путем сфингомиелина, инициируется активацией нейтральной сфингомиелиназы, которая гидролизует сфингомиелин мембраны до церамида. Керамид функционирует как вторичная молекула-мессенджер и может стимулировать мембраносвязанную серин / треонинкиназу, называемую церамид-активируемой протеинкиназой (8).Активация этого пути, по-видимому, происходит на ранней стадии действия TNF-α, в течение секунд или минут, и тесно связана с рецепторным комплексом, поскольку это событие может быть восстановлено в бесклеточной системе.
Глюкокортикоиды хорошо известны как противовоспалительные и иммунодепрессивные препараты, которые успешно используются в качестве репрессоров иммунного ответа и воспалительных процессов (9, 10). Некоторые свойства глюкокортикоидов объясняются его воздействием на факторы транскрипции. Одним из важных механизмов является ингибирование активации ядерного фактора-κB (NF-κB).Поскольку NF-κB активирует многие иммунорегуляторные гены в ответ на провоспалительные стимулы, ингибирование его активности может быть одним из основных компонентов противовоспалительной активности глюкокортикоидов (11, 12). Другой возможный механизм — ингибирование c-Jun-N-концевой киназы, известной как стресс-активирующая протеинкиназа (JNK / SAPK), члена семейства митоген-активируемых протеинкиназ, которые, как было определено, участвуют в сигнальных путях, которые приводят к апоптозу (13, 14).
Механически дексаметазон блокировал пути передачи апоптотического сигнала, включая NF-κB, JNK / SAPK, активацию каспаза-3-цистеиновой протеазы и перераспределение цитохрома c в обработанных TNF-α остеобластах MC3T3E1.
В этом исследовании мы наблюдали, что дексаметазон, мощный противовоспалительный агент, предотвращает апоптоз, индуцированный TNF-α, путем ингибирования продукции церамидов в остеобластах MC3T3E1. Наши результаты показали, что NF-κB, JNK / SAPK, активация каспаза-3-цистеиновой протеазы и перераспределение цитохрома c связаны с защитными эффектами дексаметазона. Кроме того, это исследование убедительно показало, что ингибирование церамида отвечает за антиапоптотическую активность дексаметазона против TNF-α в остеобластах MC3T3E1.
10″ data-legacy-id=»s02″> Реагенты
Рекомбинантный мышиный TNF-α был получен от Genzyme Corp. (Кембридж, Массачусетс). Дексаметазон, C 2 -церамид, дигидро-C 2 — керамид, Hoechst 33258 и 3- [4,5-диметилтиазол-2-ил] -2,5-дифенилтетразолийбромид (МТТ) были приобретены у Sigma ( Сент-Луис, Миссури). N -Ацетил-Asp-Glu-Val-Asp-7-амино-4-метилкумарин (AC-DEVD-AMC) и N -ацетил-Тир-Вал-Ala-Asp-7-амино-4-метилкумарин (AC-YVAD-AMC) были получены от Calbiochem-Behring Corp.(Ла-Хойя, Калифорния). Z-Val-Ala-Asp-фторметилкетон (Z-VAD-FMK) был приобретен у Kamiya Bio Co. (Сиэтл, Вашингтон). Набор для очистки геномной ДНК был получен от Promega Corp. (Мэдисон, Висконсин). Антитело JNK1 было получено от Santa Cruz Biotechnology, Inc. (Санта-Крус, Калифорния). Глутатион- S -трансфераза (GST) -c-Jun N-концевой белок был приобретен у Stratagene (La Jolla, CA). Антитело к цитохрому c было приобретено в PharMingen (Сан-Диего, Калифорния). [γ- 32 P] ATP и [α — 32 P] CTP были приобретены у NEN Life Science Products (Бостон, Массачусетс).Все изделия для культивирования были приобретены у Nunc, Inc. (Напервилль, Иллинойс). Другие реактивы для культивирования, включая α MEM, HBSS и FBS, были приобретены у Life Technologies, Inc. (Gaithersburg, MD).
14″ data-legacy-id=»s04″> Анализ жизнеспособности клеток МТТ
Жизнеспособность клеток
TNF-α определяли для каждой тестируемой концентрации дексаметазона или для каждых часов предварительной обработки дексаметазоном.Жизнеспособность клеток определяли с помощью микроанализа восстановления МТТ-красителя по методу Green et al. (15). Вкратце, после 48-часовой инкубации 10 мкл МТТ добавляли на 3 часа в 96-луночные микропланшеты, и оптическую плотность считывали при 540 нм на ридере Titer-Tek multiscan MicroElisa. Жизнеспособность клеток рассчитывали как отношение оптических плотностей в лунках с TNF-α и без него в присутствии или в отсутствие дексаметазона.
18″ data-legacy-id=»s06″> Количественное определение фрагментации ДНК
Фрагментация ДНК
была по существу проанализирована, как сообщалось ранее (17). Вкратце, после инкубации клетки соскребали с планшетов для культивирования, ресуспендировали в 250 мкл ТЕ-буфера (10 мМ Трис и 1 мМ EDTA, pH 8.0) и инкубировали с дополнительным объемом буфера для лизиса [5 мМ Трис, 20 мМ ЭДТА (pH 8,0) и 0,5% Тритон Х-100] в течение 30 мин при 4 ° С. После лизиса неповрежденный хроматин (осадок) отделяли из фрагментов ДНК (супернатант) центрифугированием в течение 15 мин при 13000 × g . После добавления 5% трихлоруксусной кислоты (300 мкл) образцы кипятили 15 мин. Содержание фрагментированной ДНК определяли количественно с использованием реагентов дифениламина. Процент фрагментированной ДНК рассчитывали как отношение содержания ДНК в супернатанте к количеству в осадке.
Кроме того, была проведена морфологическая оценка апоптотической гибели клеток, как описано ранее, с некоторыми модификациями (18). Покровные стекла фиксировали в течение 5 мин в 3,7% параформальдегиде в PBS. После сушки на воздухе покровные стекла окрашивали в течение 10 минут в Hoechst 33258 (10 мкг / мл), помещали в 50% глицерин, содержащий 20 ммоль / литр лимонной кислоты и 50 ммоль / литр ортофосфата, и хранили при -20 ° C перед анализом. Морфологию ядра оценивали с использованием флуоресцентного микроскопа Carl Zeiss IM 35 (Нью-Йорк, Нью-Йорк) при длинах волн возбуждения и испускания 440 и 460 нм соответственно.Апоптозные клетки были идентифицированы как клетки, ядро которых обнаруживало ярко окрашивающийся конденсированный хроматин или ядерную фрагментацию.
23″ data-legacy-id=»s08″> Измерения цитохрома с
Митохондриальные фракции получали из 1 × 10 7 остеобластов MC3T3E1 путем дифференциального центрифугирования в буфере, содержащем 250 мМ сахарозы, как описано ранее (19).Образцы белка в количестве 25 мкг загружали в SDS-15% полиакриламидные гели, подвергали электрофорезу, а затем электрофоретически переносили на нитроцеллюлозные мембраны. Вестерн-блоттинг анализировали первичным моноклональным антицитохромом c антителом (PharMingen, Сан-Диего, Калифорния) и вторичным антителом, конъюгированным с пероксидазой хрена мыши (Santa Cruz Biotechnology, Inc., Санта-Крус, Калифорния), а затем проявляли с усиленной хемилюминесценцией (Amersham Pharmacia Biotech, Эйлсбери, Великобритания).
27″ data-legacy-id=»s10″> Анализ иммунопреципитации и киназ
Клетки лизировали в модифицированном буфере для радиоиммунного преципитации [25 мМ Трис-HCl, pH 8,0, содержащем 137 мМ NaCl, 10% (об. / Об.) Глицерин, 0.1% SDS, 0,5% (об. / Об.) Дезоксихолата, 1% (об. / Об.) Nonidet P-40, 2 мм EDTA, 1 мм Pefabloc, 1 мм ванадат натрия, 5 мм бензамидин, 5 мкг / мл апротинина и 5 мкг / мл лейпептина] на льду в течение 30 мин. Клеточный дебрис удаляли центрифугированием при 15000 об / мин в течение 10 мин. Затем супернатанты инкубировали с анти-JNK1 в течение 2 часов при 4 ° C. Иммунокомплексы осаждали пансорбином (Calbiochem, La Jolla, CA) и тщательно промывали буфером для лизиса [50 мМ LiCl / 100 мМ Трис-HCl (pH 7,6). / 0,1% (об. / Об.) Тритон Х-100/1 мм дитиотрейтол].Осадки оставляли в виде суспензии 1: 1 в буфере для анализа и добавляли 20 мкл (0,3 мг / мл) GST-c-Jun. Киназные реакции инициировали добавлением 15 мкл раствора γ — 32 P-меченного Mg / АТФ (50 мМ MgCl / 500 мкМ АТФ / 10 мкКи [γ — 32 P] АТФ) и проводили при 30 ° C в течение 30 минут. мин. Реакции останавливали добавлением буфера для образцов Лэммли и кипячением в течение 5 мин. Образцы разделяли с помощью SDS-PAGE [12% (вес / объем) гель] и после сушки подвергали авторадиографии. Количественную оценку выполняли с помощью анализатора PhosphorImager (BSA, Fuji Photo Film Co., Ltd., Токио, Япония).
31″ data-legacy-id=»s12″> Статистический анализ
Различия между группами проверяли на статистическую значимость с помощью ANOVA. P <0,05 был выбран в качестве уровня значимости.
34″ data-legacy-id=»s14″> Дексаметазон индуцирует устойчивость клеток к цитотоксичности, индуцированной TNF-α
Чтобы выяснить, модифицирует ли дексаметазон индуцированные TNF-α ответы в остеобластах MC3T3E1, клетки предварительно обрабатывали различными концентрациями дексаметазона, глюкокортикоидного гормона, а затем тестировали с 20 нг / мл TNF-α.На рисунке 1А показано влияние дексаметазона (от 1 нм до 10 мкм) на цитотоксичность, оказываемую 20 нг / мл TNF-α на остеобласты MC3T3E1 через 48 часов. Синтетический глюкокортикоид вызывал явное увеличение жизнеспособности клеток после 48 ч инкубации с TNF-α. Этот эффект становился значительным при концентрациях дексаметазона более 100 нМ и достигал максимума при 1 мкМ. Рисунок 1B также показал, что предварительная обработка дексаметазоном в течение более 16 часов была необходима для максимального ингибирования цитотоксичности, индуцированной TNF-α.Это подтверждает, что предварительная обработка глюкокортикоидом защищает от цитотоксичности, вызванной TNF-α в остеобластах MC3T3E1.
Рисунок 1.
Дексаметазон снижает цитотоксичность, вызванную TNF-α, в остеобластах MC3T3E1. Остеобласты A, MC3T3E1 предварительно обрабатывали различными дозами дексаметазона (0,001, 0,01, 0,1, 1 или 10 мкм) в течение 16 часов, а затем дополнительно подвергали TNF-α (20 нг / мл) в течение 48 часов. Жизнеспособность клеток измеряли с помощью анализа МТТ. B. Предварительная обработка дексаметазоном в течение более 16 часов требовалась для достижения максимального ингибирования цитотоксичности, индуцированной TNF-α.После предварительной обработки дексаметазоном (1 мкм) в течение различных периодов (0, 2, 4, 8, 16 или 32 ч) TNF-α (20 нг / мл) обрабатывали остеобластами MC3T3E1 в течение 48 часов. Затем жизнеспособность клеток измеряли с помощью анализа МТТ. Результаты четырех экспериментов выражены как среднее ± средн. *, P <0,05 по сравнению с без дексаметазона.
Рисунок 1.
Дексаметазон снижает индуцированную TNF-α цитотоксичность в остеобластах MC3T3E1. Остеобласты A, MC3T3E1 предварительно обрабатывали различными дозами дексаметазона (0.001, 0,01, 0,1, 1 или 10 мкм) в течение 16 часов, а затем подвергали воздействию TNF-α (20 нг / мл) в течение 48 часов. Жизнеспособность клеток измеряли с помощью анализа МТТ. B. Предварительная обработка дексаметазоном в течение более 16 часов требовалась для достижения максимального ингибирования цитотоксичности, индуцированной TNF-α. После предварительной обработки дексаметазоном (1 мкм) в течение различных периодов (0, 2, 4, 8, 16 или 32 ч) TNF-α (20 нг / мл) обрабатывали остеобластами MC3T3E1 в течение 48 часов. Затем жизнеспособность клеток измеряли с помощью анализа МТТ. Результаты четырех экспериментов выражены как среднее ± средн.*, P <0,05 по сравнению с без дексаметазона.
40″ data-legacy-id=»s16″> Дексаметазон ингибирует TNF-α-индуцированную активацию каспазы-3
В первой серии экспериментов, направленных на определение активности каспазы-1 или -3 в TNF-α-индуцированной гибели клеток в остеобластах MC3T3E1, интенсивность флуоресценции продукта расщепления каспазной протеазой AMC отслеживали в различные периоды инкубации TNF-α. Активность каспазо-3-подобной протеазы увеличивалась в зависимости от времени и достигала максимального уровня через 48 ч после обработки TNF-α, тогда как на активность, подобную каспазе-1, не влияла обработка TNF-α (рис.3А). Для дальнейшей оценки влияния дексаметазона на TNF-α-индуцированную активацию каспазы, каспазо-3-подобную протеазу измеряли в гомогенатах MC3T3E1 в присутствии либо 20 нг / мл TNF-α, либо TNF-α в присутствии 16- ч. предварительно обработанным дексаметазоном (1 мкМ). Как показано на фиг. 3B, TNF-α-индуцированная активация активности, подобной каспазе-3, была значительно снижена при предварительной обработке дексаметазоном (1 мкм). Кроме того, для изучения роли активации каспазы в апоптозе остеобластов, индуцированном TNF-α, остеобласты MC3T3E1 предварительно обрабатывали ингибитором панкаспазы Z-VAD-FMK, специфическим ингибитором каспазы-1 (Ac-YVAD-CHO), или специфический ингибитор каспазы-3 DEVD-CHO.Как показано на фиг. 3C, предварительная обработка остеобластов MC3T3E1 100 мкм Z-VAD-FMK и 100 мкм DEVD-CHO в значительной степени предотвращала фрагментацию ДНК, которая наблюдалась после обработки 20 нг / мл TNF-α. Однако ингибитор протеазы, подобной каспазе-1 (Ac-YVAD-CHO), не оказывал ингибирующего действия на TNF-α-индуцированную фрагментацию ДНК. Наши данные предполагают, что активность цистеинпротеазы, подобная каспазе-3, необходима для индукции апоптоза в остеобластах MC3T3EI и что дексаметазон, глюкокортикоидный гормон, выполняет регуляторную функцию TNF-α-индуцированного апоптоза посредством ингибирования цистеиновой протеазы, подобной каспазе-3. активность в остеобластах MC3T3E1.
Рисунок 3.
Дексаметазон ингибирует TNF-α-индуцированную активацию каспаза-3-цистеиновой протеазы в остеобластах MC3T3E1. Остеобласты A, MC3T3E1 обрабатывали TNF-α (20 нг / мл) в течение различных периодов времени, как указано. *, P <0,05 по сравнению с контролем . Остеобласты B, MC3T3E1 обрабатывали TNF-α (20 нг / мл) в присутствии или в отсутствие дексаметазона (1 мкм; предварительная обработка 16 часов) в течение 48 часов. Затем измеряли активность каспазы, как описано в Materials and Methods .Результаты четырех экспериментов выражены как среднее ± средн. *, P <0,05 по сравнению с контролем ; # , P <0,05 по сравнению с обработанными TNF-α. Остеобласты C, MC3T3E1 обрабатывали TNF-α (20 нг / мл) в присутствии или в отсутствие Z-VAD-CHO, Ac-DEVD-CHO или Ac-YVAD-CHO (100 мкм) в течение 48 часов. Затем была приготовлена геномная ДНК и проанализирована с использованием электрофореза в агарозном геле, как описано в «Материалы и методы» . M, маркер; 1, контроль; 2, TNF-α; 3, TNF-α плюс Z-VAD-CHO; 4, TNF-α плюс Ac-DEVD-CHO; 5, TNF-α плюс Ac-YVAD-CHO.
Рисунок 3.
Дексаметазон ингибирует TNF-α-индуцированную активацию каспаза-3-цистеиновой протеазы в остеобластах MC3T3E1. Остеобласты A, MC3T3E1 обрабатывали TNF-α (20 нг / мл) в течение различных периодов времени, как указано. *, P <0,05 по сравнению с контролем . Остеобласты B, MC3T3E1 обрабатывали TNF-α (20 нг / мл) в присутствии или в отсутствие дексаметазона (1 мкм; предварительная обработка 16 часов) в течение 48 часов. Затем измеряли активность каспазы, как описано в Materials and Methods .Результаты четырех экспериментов выражены как среднее ± средн. *, P <0,05 по сравнению с контролем ; # , P <0,05 по сравнению с обработанными TNF-α. Остеобласты C, MC3T3E1 обрабатывали TNF-α (20 нг / мл) в присутствии или в отсутствие Z-VAD-CHO, Ac-DEVD-CHO или Ac-YVAD-CHO (100 мкм) в течение 48 часов. Затем была приготовлена геномная ДНК и проанализирована с использованием электрофореза в агарозном геле, как описано в «Материалы и методы» . M, маркер; 1, контроль; 2, TNF-α; 3, TNF-α плюс Z-VAD-CHO; 4, TNF-α плюс Ac-DEVD-CHO; 5, TNF-α плюс Ac-YVAD-CHO.
46″ data-legacy-id=»s18″> Дексаметазон блокирует TNF-α-индуцированную активацию NF-κB
Сообщалось, что
NF-κB, фактор транскрипции, является важным компонентом пути передачи сигнала TNF-α-индуцированного апоптоза (26). Поэтому мы исследовали, может ли NF-κB активироваться в клетках, обработанных TNF-α, и может ли дексаметазон влиять на активацию факторов транскрипции NF-κB. Связывание ядерных экстрактов из TNF-α-обработанных клеток с олигонуклеотидом консенсусных связывающих последовательностей NF-κB наблюдали с помощью анализа сдвига электрофоретической подвижности геля (рис.5A), но активация NF-κB явно устранялась предварительной обработкой 1 мкМ дексаметазона (фиг. 5B). Эти результаты предполагают, что ингибирование TNF-α-индуцированного апоптоза дексаметазоном может происходить посредством предотвращения активации NF-κB в остеобластах MC3T3E1.
Рисунок 5.
Дексаметазон блокирует TNF-α-индуцированную активацию NF-κB в остеобластах MC3T3E1. Остеобласты A, MC3T3E1 обрабатывали TNF-α (20 нг / мл) в течение различных периодов времени, как указано. Остеобласты B, MC3T3E1 обрабатывали TNF-α (20 нг / мл) в течение 1 часа в присутствии или в отсутствие дексаметазона (1 мкм; предварительная обработка 16 часов).Затем были приготовлены ядерные экстракты. Анализ сдвига электрофоретической подвижности геля проводили с α — 32 P-меченным олигонуклеотидом, содержащим консенсусную последовательность NF-κB, в присутствии ядерных белков.
Рисунок 5.
Дексаметазон блокирует TNF-α-индуцированную активацию NF-κB в остеобластах MC3T3E1. Остеобласты A, MC3T3E1 обрабатывали TNF-α (20 нг / мл) в течение различных периодов времени, как указано. Остеобласты B, MC3T3E1 обрабатывали TNF-α (20 нг / мл) в течение 1 часа в присутствии или в отсутствие дексаметазона (1 мкм; предварительная обработка 16 часов).Затем были приготовлены ядерные экстракты. Анализ сдвига электрофоретической подвижности геля проводили с α — 32 P-меченным олигонуклеотидом, содержащим консенсусную последовательность NF-κB, в присутствии ядерных белков.
52″ data-legacy-id=»s20″> Дексаметазон блокирует TNF-α-индуцированное высвобождение церамида
TNF-α индуцировал быстрое повышение уровней эндогенных церамидов примерно до 200% от контрольных уровней в течение 45 минут после стимуляции. Сопоставимые пиковые уровни (204% от контроля) наблюдались через 45 минут после обработки TNF-α, а затем концентрация церамида постепенно снижалась до базального уровня через 90 минут (фиг. 7A). Кроме того, показано, что предварительная обработка дексаметазоном (1 мкМ) значительно снижает стимулированное TNF-α высвобождение церамида (рис.7Б). Эти результаты предполагают, что снижение содержания церамида может быть необходимо для ингибирования гибели клеток после предварительной обработки дексаметазоном в клетках, стимулированных TNF-α.
Рисунок 7.
Дексаметазон ингибирует TNF-α-индуцированное высвобождение церамида в остеобластах MC3T3E1. Остеобласты A, MC3T3E1 обрабатывали 20 нг / мл TNF-α в течение указанных периодов. Затем измеряли концентрацию церамида. Остеобласты B, MC3T3E1 обрабатывали в течение 30 минут 20 нг / мл TNF-α или без него в присутствии или в отсутствие дексаметазона (1 мкм; предварительная обработка 16 ч).Затем измеряли концентрацию церамида, как описано в Материалы и методы . Данные выражены в процентах от уровня церамидов. Результаты четырех экспериментов выражены как среднее ± средн. *, P <0,05 по сравнению с контролем ; # , P <0,05 по сравнению с обработанными TNF-α.
Рисунок 7.
Дексаметазон ингибирует TNF-α-индуцированное высвобождение церамида в остеобластах MC3T3E1. Остеобласты A, MC3T3E1 обрабатывали 20 нг / мл TNF-α в течение указанных периодов.Затем измеряли концентрацию церамида. Остеобласты B, MC3T3E1 обрабатывали в течение 30 минут 20 нг / мл TNF-α или без него в присутствии или в отсутствие дексаметазона (1 мкм; предварительная обработка 16 ч). Затем измеряли концентрацию церамида, как описано в Материалы и методы . Данные выражены в процентах от уровня церамидов. Результаты четырех экспериментов выражены как среднее ± средн. *, P <0,05 по сравнению с контролем ; # , P <0.05 против , обработанных TNF-α.
58″ data-legacy-id=»s22″> Церамид индуцирует активацию цистеиновой протеазы, подобной каспазе-3, NF-κB и JNK / SAPK
В этом исследовании мы документально подтвердили, что активность цистеин-протеазы, подобная каспазе-3, необходима для TNF-α-индуцированного апоптоза, и предположили, что высвобождение церамида играет важную роль в апоптозе. Активацию каспазы-1 или каспазы-3 в клетках, обработанных церамидом C 2 , измеряли с помощью флуорометрического анализа с субстратами Ac-YVAD-AMC и Ac-DEVD-AMC, соответственно.В остеобластах MC3T3E1 максимальная активность каспазы-3 наблюдалась после обработки 100 мкМ C 2 -церамида в течение 48 часов (фиг. 9A). Хотя каспаза-1 не активировалась обработкой C 2 -церамидом, C 2 -церамид индуцировал заметное повышение активности протеазы каспазы-3, достигающее пика через 48 часов (в 3,5 раза выше базальных уровней).
Рисунок 9.
Церамид индуцирует активацию каспазо-3-подобной цистеиновой протеазы, NF-κB и JNK / SAPK в остеобластах MC3T3E1.Клетки обрабатывали 100 мкМ C 2 -церамида в течение указанных периодов и собирали. Активность каспазы-1 или -3-подобная (A), анализ сдвига электрофоретической подвижности геля для NF-κB (B) и активность JNK (C) измеряли, как описано в Materials and Methods . *, P <0,05 по сравнению с контролем .
Рисунок 9.
Церамид индуцирует активацию каспазо-3-подобной цистеиновой протеазы, NF-κB и JNK / SAPK в остеобластах MC3T3E1. Клетки обрабатывали 100 мкМ C 2 -церамида в течение указанных периодов и собирали.Активность каспазы-1 или -3-подобная (A), анализ сдвига электрофоретической подвижности геля для NF-κB (B) и активность JNK (C) измеряли, как описано в Materials and Methods . *, P <0,05 по сравнению с контролем .
Недавние исследования показали, что TNF-α является мощным активатором фактора транскрипции NF-κB в различных клеточных линиях (9, 11). В этой системе ранняя фаза активации NF-κB, которая произошла после стимуляции церамидами, была проанализирована с помощью анализа сдвига электрофоретической подвижности геля (рис.9Б). Сигналы были обнаружены после 15 мин стимуляции 100 мкМ церамида C 2 . Паттерны полос NF-κB также были довольно похожи при стимуляции TNF-α и C 2 -церамида. Ядерный белок из клеток, обработанных 100 мкМ C 2 -дигидроцерамида (обычно используемый в качестве отрицательного контроля в исследованиях церамида C 2 ) не реагировал с зондом NF-κB (данные не показаны). Кроме того, анализ периода времени C 2 -церамида на остеобластах MC3T3E1 позволяет предположить, что TNF-α стимулирует активацию JNK / SAPK посредством высвобождения церамида.C 2 -керамид вызывал временное повышение активности JNK, которое достигало максимума через 10–30 мин и снижалось через 1 час после стимуляции (фиг. 9C). Активация JNK, индуцированная C 2 -церамидом, была более быстрой, чем активация JNK, индуцированная TNF-α, которая достигла пика между 30 мин и 1 часом и возвращалась к базовой активности через 12 часов после стимуляции (фиг. 6A).
65″ data-legacy-id=»s24″> Обсуждение
Глюкокортикоиды — одни из самых сильнодействующих и клинически важных противовоспалительных препаратов.При некоторых условиях, таких как острые инфекции, повышение уровня надпочечников, по-видимому, является важным механизмом защиты от вредного действия воспалительных цитокинов. В нашей модели лечение дексаметазоном увеличивало устойчивость остеобластов MC3T3E1 к цитотоксической активности TNF-α, многофункционального цитокина, играющего важную роль в иммунном ответе и воспалении, таких как ревматоидный артрит и заболевания пародонта. Помимо вызываемого глюкокортикоидами противовоспалительного действия, глюкокортикоиды, такие как кортикостерон, используются в качестве иммунодепрессантов и в этом контексте известны как классические индукторы апоптотической гибели клеток в первичных остеобластах (29).Однако остеобласты MC3T3E1 устойчивы к апоптозу, индуцированному дексаметазоном, а дексаметазон предотвращает индуцированный TNF-α апоптоз в остеобластах MC3T3E1. Защитный эффект дексаметазона зависел от дозы и достигал максимума при микромолярных концентрациях. Это согласуется с несколькими другими сообщениями, в которых документально подтверждается, что глюкокортикоиды подавляют апоптоз в различных типах клеток, включая остеобласты (24, 25, 30–32). Точные механизмы, с помощью которых глюкокортикоиды влияют на ремоделирование костей, особенно на апоптоз, не очень хорошо известны, а изменения, которые они вызывают в костных клетках и тканях, в некоторой степени противоречивы, вероятно, из-за различий в типе вводимого стероида и типе используемых клеток. (30, 33–35).
Таким образом, мы решили дополнительно охарактеризовать биохимические пути, ведущие к сигнальным молекулам, непосредственно участвующим в индуцированных дексаметазоном защитных эффектах при апоптозе, индуцированном TNF-α. Как известно, путь, ведущий к цитотоксичности / апоптозу, включает высвобождение цитохрома c митохондриями и последующую активацию каспаза-3-цистеиновой протеазы (36, 37). Наши эксперименты показывают, что процессинг каспазой-3 и высвобождение цитохрома c предшествуют апоптозу с помощью TNF-α, что указывает на временную и, возможно, случайную связь.Более того, высвобождение цитохрома c в цитоплазму блокируется дексаметазоном, что позволяет предположить, что синтетический глюкокортикоидный агент распространяет ингибирующий сигнал, который определяет высвобождение митохондриального цитохрома c .
Глюкокортикоиды снижают транскрипцию генов, участвующих в воспалении, и эти гены не имеют идентифицируемого элемента ответа глюкокортикоидов в их промоторной области (38). Эти данные предполагают, что какой-то другой механизм должен опосредовать ингибирующий эффект гормонов.Хотя молекулярный механизм действия глюкокортикоида на хроническое воспаление не совсем понятен, появляется все больше свидетельств того, что глюкокортикоид подавляет действие факторов транскрипции, таких как NF-κB (11, 12). NF-κB был впервые идентифицирован как регулятор экспрессии гена легкой цепи κ в B-лимфоцитах мыши (39), но впоследствии был обнаружен во многих различных клетках. Хотя нет прямых доказательств того, что активация NF-κB, стимулированная TNF-α, вызывает апоптоз остеобластов MC3T3E1, многие исследования показывают, что регуляция NF-κB является одним из наиболее апоптотических сигнальных путей (26, 40, 41). .
Дексаметазон значительно снижает активность JNK в остеобластах MC3T3E1. JNK является членом семейства митоген-активируемых протеинкиназ и фосфорилирует серин по аминоконцевому домену активации trans c- jun . Подобно другим митоген-активируемым протеинкиназам, JNK активируется посредством двойного фосфорилирования по мотиву Thr-Pro-Tyr. Многие исследования показали, что JNK необходим для индукции апоптоза в различных клетках (42–44). Поскольку дексаметазон снижает уровень активности JNK / SAPK и ослабляет апоптоз, индуцированный TNF-α, возможно, что неспособность поддерживать активность JNK после клеточного стресса снижает восприимчивость к апоптозу.Исследование, безусловно, не исключает возможности участия других факторов, на которые влияет дексаметазон, в ингибировании апоптоза, и в настоящее время ведутся дальнейшие исследования для определения участия JNK / SAPK или NF-κB в этом механизме.
Путь передачи сигнала, используемый TNF-α для индукции биосинтеза церамидов, имеет большое значение. Керамид считается важным аспектом апоптотического пути и играет роль в таких фундаментальных биологических процессах, как дифференцировка и гибель клеток (45, 46).Wolff et al. (47) недавно сообщил о результатах с использованием клеток HL-60, в которых TNF-α вызывал ранний и обратимый гидролиз сфингомиелиназы через 30–60 минут. Кроме того, синтетические аналоги церамидов и сфингомиелиназа имитировали действие TNF-α в инициации апоптоза в этих клетках.
Церамид образуется во время гибели клеток, запускаемой TNF-α, и может служить медиатором апоптоза в остеобластах MC3T3E1. Наши исследования показывают, что гибель клеток, вызванная TNF-α, значительно снижается за счет синтетического глюкокортикоида, который ингибирует выработку церамида из остеобластов MC3T3E1.Однако на индуцированный церамидами апоптоз остеобластов мышей не влияет дексаметазон в остеобластах. Эти явления предполагают, что продукция церамида может быть важным триггером апоптоза в клетках, подвергнутых воздействию TNF-α. Параллельно с этим церамид-индуцированная активация JNK / SAPK, фактора транскрипции NF-κB и цистеиновой протеазы каспазы-3 не ингибировалась предварительно обработанным дексаметазоном, хотя глюкокортикоид отменял активацию путей передачи сигнала в TNF-α- обнаженные остеобласты.Кроме того, экзогенный церамид индуцировал активацию NF-κB с той же скоростью, что и TNF-α. Добавление церамида стимулировало активацию JNK / SAPK до того, как TNF-α сделал это в остеобластах MC3T3E1. Активация NF-κB и JNK / SAPK обычно считается важным этапом в активации апоптоза в различных модельных системах, прерывание апоптотического сигнального пути предварительно обработанным дексаметазоном, по-видимому, происходит через ингибирование высвобождения церамида в остеобластах MC3T3E1.
Что касается открытия, что дексаметазон либо блокирует активность факторов транскрипции NF-κB, либо ингибирует активность JNK / SAPK, можно предположить, что глюкокортикоид может ингибировать апоптоз в остеобластах, блокируя активности NF-κB и JNK / SAPK, которые являются необходим для апоптотического пути.С другой стороны, глюкокортикоиды также способствуют апоптозу в других системах, который может быть опосредован, по крайней мере частично, аналогичными механизмами (30, 48). Например, TNF-α способен одновременно вызывать про- и антиапоптотические сигналы (49), и каждый сигнал зависит от активации NF-κB, а также JNK / SAPK (50, 51). Будет интересно исследовать, будет ли и если да, то какой набор специфических факторов клеточной транскрипции и связанных со стрессом киназ определяет, проявляют ли глюкокортикоиды про- или антиапоптотическую активность.В этом контексте мы показали для остеобластов MC3T3E1, что дексаметазон подавлял активацию факторов транскрипции NF-κB и JNK / SAPK, высвобождение цитохрома c в цитоплазму и последующую активацию каспазо-3-подобных цистеиновых протеаз. Это предполагает, что эти механизмы передачи сигнала могут быть вовлечены в ингибирование высвобождения церамидов и возникающие в результате защитные эффекты, проявляемые синтетическим глюкокортикоидом, дексаметазоном, в остеобластах.
75″> Список литературы
1
Webster
KA
,
Discher
DJ
,
Kaiser
S
,
Hernandez
O
,
Sato
B
,
активированный апоптоз сердечных миоцитов требует реоксигенации или сдвига pH и не зависит от p53.
J Clin Invest
104
:
239
—
252
2
Wyllie
AH
1987
Апоптоз: гибель клеток в регуляции тканей.
J Pathol
153
:
313
—
316
3
Xu
Y
,
Bialik
S
,
Jones
BE
,
000
Iimuro RN
,
Srinivasan
A
,
Brenner
DA
,
Czaja
MJ
1998
Инактивация NF-κB превращает пролиферацию клеточной линии гепатоцитов TNF-α в ответ апоптоза 9000.
Am J Physiol
275
:
C1058
—
C1066
4
Jilka
RL
,
Weinstein
RS
,
Bellido
000 AM
000
000
000
000
000
000
000
000 SC
1998
Остеобластная запрограммированная гибель клеток (апоптоз): модуляция факторами роста и цитокинами.
J Bone Miner Res
13
:
793
–
802
5
Scharla
SH
,
Strong
DD
,
Mohan
S
,
000 Chevalley
TA
1994
Влияние фактора некроза опухоли альфа на экспрессию инсулиноподобного фактора роста I и белка 4, связывающего инсулиноподобный фактор роста, в остеобластах мыши.
Eur J Эндокринол
131
:
293
—
301
6
Cai
Z
,
Korner
M
,
Tarantino
000
N
a,
Tarantino
N
a,
a
Сверхэкспрессия IκBα в клетках MCF7 карциномы молочной железы человека подавляет активацию ядерного фактора-κB, но не апоптоз, индуцированный фактором некроза опухоли-α.
J Biol Chem
272
:
96
—
101
7
Джарвис
WD
,
Kolesnick
RN
,
Fornari
FA
or, RS
DA
,
Grant
S
1994
Индукция апоптического повреждения ДНК и гибели клеток путем активации пути сфингомиелина.
Proc Natl Acad Sci USA
91
:
73
—
77
8
Kim
MY
,
Linardic
C
,
Obeid
Han
,
L
,
1991
Идентификация оборота сфингомиелина как эффекторного механизма действия фактора некроза опухоли α и γ-интерферона. Специфическая роль в дифференцировке клеток.
J Biol Chem
266
:
484
—
489
9
Удо
KM
,
Gundula
W
,
Verena
AB
Глюкокортикоиды эффективно блокируют апоптотическую гибель клеток, вызванную фактором некроза опухолей-α и липополисахаридами, в эндотелиальных клетках клубочков крупного рогатого скота до активации каспазы-3.
Br J Pharmacol
127
:
1633
—
1640
10
Роберт
IS
,
Патрисия
CC
,
Алан
KL
d
Alan Jr
1995
Роль транскрипционной активации IκBα в опосредовании иммуносупрессии глюкокортикоидами.
Science
270
:
283
—
286
11
Wissink
S
,
van Heerde
EC
,
van der Burg
B
r
van der
,
1998
Двойной механизм опосредует подавление активности NF-κB глюкокортикоидами.
Mol Endocrinol
12
:
355
—
363
12
Dumont
A
,
Hehner
SP
,
Schmitz
000 L
000 J
000 ML
,
000 J
,
Окрет
S
,
van der Saag
PT
,
Wissink
S
,
van der Burg
B
,
Herrlich
P
,
De Bosscher
K
,
Fiers
W
1998
Перекрестный разговор между стероидами и NF-κB: на каком языке?
Trends Biochem Sci
23
:
233
—
235
13
Zou
H
,
Li
Y
,
Liu
X
W
Мультимерный комплекс APRF-1, цитохром c представляет собой функциональную апоптосому, которая активирует прокаспазу-9.
J Biol Chem
274
:
11549
—
11556
14
Li
P
,
Nijhawan
D
,
Budihardjo
0002
Ahmivula
,
, Budihardjo
I
,
M
,
Alnemri
ES
,
Wang
X
1997
Cytochrome c и dATP-зависимое образование комплекса Apaf-1 / caspase-9 инициирует каскад апоптотической протеазы.
Ячейка
91
:
479
—
489
15
Зеленый
LM
,
Reade
JL
,
Wave
CF
1984
Цвет для быстрой проверки цветов приложение для количественного определения цитотоксических и ингибирующих рост лимфокинов.
J Immunol Methods
20
:
257
16
Альбина
JE
,
Cui
S
,
Mateo
RB
,
Reichner
000
000
000 Reichner
000
000
000 опосредованный апоптоз перитонеальных макрофагов мышей.
J Immunol
150
:
5080
—
5085
17
Palayoor
ST
,
Macklis
RM
,
Bump
EA
000 CN
000
000 CN
000
000 CN
000
000 CN
000 Модуляция радиационно-индуцированного апоптоза и G2 / M-блокада в клетках Т-лимфомы мышей.
Radiat Res
141
:
235
—
243
18
Nakazawa
M
,
Uehara
T
,
Nomura
кислота
Ингибитор 3-фосфатдегидрогеназы) -индуцированная фрагментация и конденсация ДНК в клетках NG108-15.
J Neurochem
68
:
2493
—
2499
19
Ян
J
,
Liu
X
,
Bhalla
K
000 CN
,
Ким Ibra
AM
,
Cai
J
,
Peng
TI
,
Jones
DP
,
Wang
X
1997
Предотвращение апоптоза с помощью выпуска ccltoch с Bcl-2: митохондрии заблокированы.
Science
275
:
1129
—
1132
20
Bligh
E
,
Dyer
WA
1959
Быстрый метод общей экстракции липидов и очистки.
Can J Biochem Physiol
37
:
911
—
917
21
Fredman
P
,
Nilsson
O
,
Tayot
000 Svenner
JL
Разделение ганглиозидов на анионообменной смоле нового типа.
Biochim Biophys Acta
618
:
42
—
52
22
Dignam
JD
,
Lebovitz
RM
,
Roeder
RG
Инициация Roeder
RG
RG II в растворимом экстракте из изолированных ядер млекопитающих.
Res
11
:
1475
—
1489
23
Im
SY
,
Han
SJ
,
Ko
HM
,
Chi
SB
,
Lee
DG
,
Ha
TY
,
Lee
HK
1997
Участие ядерного фактора-κB в экспрессии фактора некроза опухоли, опосредованного тромбоцитами.
Eur J Immunol
27
:
2800
–
2804
24
Iida
N
,
Sugiyama
A
,
Myoubudani
0003
H
H
M
,
Ihara
T
,
Ueno
Y
,
Tashiro
F
1998
Подавление каскадно-опосредованного арахидоновой кислотой апоптозного гепатокатоза в клетках афлатокса, индуцированного глюкокортикостероидом.
Канцерогенез
19
:
1191
—
1202
25
Naumann
U
,
Durka
S
,
Wellerf
M
Обладает медикаментозной защитой. ассоциация с накоплением белка p21 WAFI / CIPI .
Онкоген
17
:
1567
—
1575
26
Китадзима
I
,
Soejima
Y
,
Hakasaki
000 Beka
000
000
000
000
000
000
000
000
000
000
000
,
Маруяма
I
1996
Индуцированная церамидом ядерная транслокация NF-κB является потенциальным медиатором апоптотического ответа на TNF-α в клональных остеобластах мыши.
Кость
19
:
263
—
270
27
Ким
JH
,
Oh
SO
,
июн
SS
,
Jung
SS
,
Jung
,
Kim
YK
,
Lee
SH
1999
Активация SAPK и увеличение уровней Bak во время индуцированного церамидом и индометацином апоптоза в клетках HT29.
Korean J Physiol Pharmacol
3
:
75
—
82
28
Chae
HJ
,
Chae
SW
,
Weon
KH
KH
,
HR
1999
Сигнальная трансдукция апоптоза, индуцированного тапсигаргином, в остеобластах.
Bone
25
:
453
—
458
29
Gohel
A
,
McCarthy
MB
,
Gronowicz
G
, индуцированный глюкозоидом, вызываемым эстрогенами. in vivo и in vitro .
Эндокринология
140
:
5339
—
5347
30
Накашима
T
,
Sasaki
H
,
Tsuboi
M
M
ak2
M
ak2
,
Kiriyama
T
,
Eguchi
K
,
Ichikawa
M
,
Nagataki
S
1998
Ингибирующий эффект глюкокортикоидов в крови, индуцированный околопукторными клетками, индуцированный глюкокортикоидными клетками.
Эндокринология
139
:
2032
—
2040
31
Чанг
TC
,
Хунг
МВт
,
Цзян
SY
000
000 Jiang
SY
000
000
Чу
,
Tsai
LL
1997
Дексаметазон подавляет апоптоз в клеточной линии рака желудка человека посредством модуляции экспрессии гена bcl-x .
FEBS Lett
415
:
11
—
15
32
Cox
G
,
Austin
RC
1997
, вызванное дексаметазоном, требует подавления нейттоза, вызванного дексаметазоном, у человека синтез белка.
J Leukocyte Biol
61
:
224
—
230
33
О’Коннелл
SL
,
Tresham
J
,
Fortune
CL
,
McDougall
JG
,
Scoggins
BA
,
Wark
JD
1993
Влияние преднизолона и дефлазакорта на метаболизм остеокальцина у овец.
Calcif Tissue Int
53
:
117
—
121
34
Сайто
JK
,
Davis
JW
,
Wasnich
RD
У пользователей низких доз глюкокортикоидов увеличилась скорость потери костной массы: продольное исследование.
Calcif Tissue Int
57
:
115
—
119
35
Weinstein
RS
,
Jilka
RL
,
Parfitt
000
000
000
000
Ингибирование остеобластогенеза и стимулирование апоптоза остеобластами и остеоцитами глюкокортикоидами.
J Clin Invest
102
:
274
—
282
36
Shigeomi
S
,
Yoshihide
T
2000
Члены семьи Proapoptotic только cytocl высвобождает, но не снижает потенциал митохондриальной мембраны, и не модулирует напрямую потенциал-зависимую активность анионных каналов.
Proc Natl Acad Sci USA
97
:
577
—
582
37
Susin
SA
,
Lorenzo
HK
,
Zamzami
000
NN Сноу
BE
,
Brothers
GM
,
Mangion
J
,
Jacotot
E
,
Costantini
P
,
Loeffler
M
DR
,
Aebersold
R
,
Siderovski
DP
,
Penninger
JM
,
Kroemer
G
1999
Фактор молекулярной индукции
Nature
397
:
441
—
446
38
Wiegers
GJ
,
Reul
JM
1998
Индукция цитокиновых рецепторов функциональное и патологическое значение.
Trends Pharmacol Sci
19
:
317
—
321
39
Liu
JL
,
Chiles
TC
,
Sen
RJ
s
s
Индуцируемая ядерная экспрессия NF-κB в первичных В-клетках, стимулированная через поверхностный рецептор Ig.
J Immunol
146
:
1685
—
1691
40
Li
N
,
Karin
M
1998
Ионизирующее излучение NF и коротковолновое УФ-излучение .
Proc Natl Acad Sci USA
95
:
13012
—
13017
41
Ahn
YS
,
Kim
CH
,
Kim
JH
на активацию NF-κB и гибель клеток в церебральных эндотелиальных клетках крупного рогатого скота.
Korean J Physiol Pharmacol
3
:
11
—
18
42
Baffy
G
,
Miyashita
T
,
Williamson
R
1993
Апоптоз, индуцированный изъятием интерлейкина-3 (IL-3) из IL-3-зависимой линии гемопоэтических клеток, связан с перераспределением внутриклеточного кальция и блокируется усиленной продукцией онкобелка Bcl-2.
J Biol Chem
268
:
6511
–
6519
43
Jiang
S
,
Chow
SC
,
Nicotera
P
000
P
P
P
Внутриклеточные сигналы Ca 2+ активируют апоптоз в тимоцитах: исследования с использованием ингибитора Ca 2+ -АТФазы тапсигаргина.
Exp Cell Res
212
:
84
—
92
44
Лам
M
,
Дубяк
G
,
Chen
L
,
Nunez
Nunez2000
RL
,
Distelhorst
CW
1994
Доказательства того, что BCL-2 подавляет апоптоз, регулируя потоки Ca 2+ , связанные с эндоплазматическим ретикулумом.
Proc Natl Acad Sci США
91
:
6569
—
6573
45
Wantanabe
R
,
Asakura
K
,
Rodriguez
000
M 1999
Интернализация и сортировка аналогов сфинголипидов плазматической мембраны в дифференцирующихся олигодендроцитах.
J Neurochem
73
:
1375
—
1383
46
Bieberich
E
,
Kawaguchi
T
,
Yu
RK
900
900
RK
9000 новый имитатор церамидов, вызывающий апоптоз в клетках нейробластомы.
J Biol Chem
275
:
177
—
181
47
Wolff
RA
,
Dobrowsky
RT
,
Bielawska
A
YA
1994
Роль церамид-активированной протеинфосфатазы в церамид-опосредованной передаче сигнала.
J Biol Chem
269
:
19605
—
19609
48
Miyashita
T
,
Nagao
K
,
Krajewski
0003
S
JC
,
Иноуэ
T
,
Ямада
M
1998
Исследование пути апоптоза, индуцированного глюкокортикоидами; процессинг каспазы-6, но не каспазы-3.
Дифференциал смерти клеток
5
:
1034
—
1041
49
Ван Антверпен
DJ
,
Мартин
SJ
,
Verma
IM
DR
Зеленый
Ингибирование TNF-индуцированного апоптоза с помощью NF-κB.
Trends Cell Biol
8
:
107
—
111
50
Stehlik
C
,
de Martin
R
,
Kumabashiri
I
J
BR
,
Lipp
J
1998
Ядерный фактор (NF) -κB-регулируемый X-хромосомно-связанный iap экспрессия гена защищает эндотелиальные клетки от апоптоза, индуцированного фактором некроза опухоли α.
J Exp Med
188
:
211
—
216
51
Eskew
JD
,
Vanacore
RM
,
Sung
L
,
000
L
,
000
A
1999
Механизмы защиты клеток от внеклеточного гема. Гем-гемопексин, но не свободный гем, активирует N-концевую киназу c-jun.
J Biol Chem
274
:
638
—
648
Заметки автора
Авторские права © 2000, Общество эндокринологов
Протеомная оценка путей, связанных с индуцированным дексаметазоном апоптозом и резистентностью при множественной миеломе.| Кровь
Глюкокортикоиды являются основой лечения пациентов с миеломой (ММ). К сожалению, многие пациенты становятся невосприимчивыми к терапии, и средняя выживаемость составляет примерно 4,5 года. В этом исследовании использовался подход глобальной экспрессии белка для дальнейшей характеристики путей индуцированного дексаметазоном (dex) апоптоза и резистентности в чувствительной и устойчивой подлинии MM.1 (MM.1S и MM.1R соответственно). После обработки dex белок из MM.1S отделяли с помощью 2-мерного электрофореза в полиакриламидном геле (2D-PAGE) с использованием диапазона pH 4-7 в первом измерении.Изменения в паттерне экспрессии были идентифицированы между dex-обработанными и необработанными клетками с пониженной регуляцией 24 пятен и повышенной регуляцией 3 пятен. Идентификация с помощью масс-спектрометрии (анализатор 4700 Proteomics: MALDI TOF-TOF, Applied Biosystems) продемонстрировала, что 10/24 белков с пониженной регуляцией участвовали в выживании и пролиферации клеток, тогда как три протеина с повышенной регуляцией участвовали в посттрансляционной модификации, сворачивании и транспортировке белков. Сравнение с исследованиями экспрессии генов выявило ряд соответствующих генов, а также ряд белков / генов, выделенных в одном исследовании, но не в другом.Интересно, что повышающая регуляция FKBP51, ключевого регуляторного компонента комплекса стероидных рецепторов Hsp90, наблюдалась как при анализе генов, так и при анализе белков. Важно отметить, что 2D-PAGE dex-резистентной линии MM.1R не продемонстрировал увеличения FKBP51, подтверждая его роль в опосредовании dex-индуцированного апоптоза. Рецепторный комплекс Hsp90 важен для поддержания рецептора глюкокортикоидов (GR) в состоянии, восприимчивом к dex, и состоит из ряда молекул, включая GR, Hsp90 и FKBP51 и FKBP52 иммунофилина.Вестерн-анализ и иммуноблоттинг комплекса в клеточной линии MM.1S выявили, что экспрессия FKBP51 / 52 и GR увеличивается во времени, в то время как экспрессия Hsp90 остается постоянной. Никаких изменений в устойчивой линии после воздействия препарата не наблюдалось. Сверхэкспрессия FKBP51 в состоянии покоя или неспособность индуцировать экспрессию после лечения dex были связаны с устойчивостью к глюкокортикоидам при других заболеваниях. Анализ генного массива 29 случаев миеломы не показал статистической разницы в экспрессии FKBP51 между представленными случаями миеломы, чувствительными к dex, и рецидивирующими рефрактерными случаями, устойчивыми к dex, что позволяет предположить, что устойчивость к миеломе не опосредуется положительной регуляцией FKBP51 в состоянии покоя.RQ-PCR MM.1S и ряда других клеточных линий, чувствительных к dex, показала от 5 до 24-кратного изменения экспрессии FKBP51 после воздействия лекарственного средства, тогда как клеточные линии, устойчивые к dex, показали <2-кратное изменение. Аналогичные результаты наблюдались в первичных патологических клетках, предполагая, что увеличение FKBP51 после воздействия dex может быть суррогатным маркером чувствительности dex. В заключение, эти исследования профилей белков выявили ряд новых белков, участвующих в dex-индуцированном апоптозе и резистентности, многие из которых требуют дальнейшего изучения.
Какова роль электрофореза и иммунофиксации в диагностике множественной миеломы (ММ)?
Димопулос М., Кайл Р., Ферманд Дж. П., Раджкумар С.В., Сан-Мигель Дж. И др. Консенсусные рекомендации для стандартных следственных действий: отчет консенсусной группы Международного семинара по миеломе 3. Кровь . 2011 5 мая. 117 (18): 4701-5. [Медлайн].
[Рекомендации] Национальная комплексная онкологическая сеть. Руководство NCCN по клинической практике в онкологии, множественной миеломе.Доступно на http://www.nccn.org/professionals/physician_gls/pdf/myeloma.pdf. Версия 4.2021 — 10 декабря 2020 г .; Дата обращения: 3 февраля 2021 г.
Rajkumar SV. Миелома сегодня: определения заболеваний и достижения в лечении. Ам Дж. Гематол . 2016, январь 91 (1): 90-100. [Медлайн].
Palumbo A, Rajkumar SV. Лечение впервые выявленной миеломы. Лейкемия . 2009 23 марта (3): 449-56. [Медлайн].
Бенсингер Висконсин.Роль трансплантации аутологичных и аллогенных стволовых клеток при миеломе. Лейкемия . 2009 23 марта (3): 442-8. [Медлайн]. [Полный текст].
Лониал С., Ли Х.С., Бадрос А., Трудель С. и др. Белантамаб мафодотин при рецидивирующей или рефрактерной множественной миеломе (DREAMM-2): рандомизированное открытое исследование фазы 2 с двумя группами. Ланцет Онкол . 2020 21 февраля (2): 207-221. [Медлайн].
Аттал М., Ричардсон П.Г., Раджкумар С.В., Сан-Мигель Дж., Бексак М., Спика И. и др.Изатуксимаб плюс помалидомид и низкие дозы дексаметазона по сравнению с помалидомидом и низкими дозами дексаметазона у пациентов с рецидивирующей и рефрактерной множественной миеломой (ICARIA-MM): рандомизированное многоцентровое открытое исследование фазы 3. Ланцет . 7 декабря 2019 г. 394 (10214): 2096-2107. [Медлайн].
Добавление изатуксимаба к помалидомиду и дексаметазону в низких дозах улучшает ВБП при рецидивирующей и рефрактерной множественной миеломе. ESMO. Доступно по адресу https://www.esmo.org/oncology-news/adding-isatuximab-to-pomalidomide-and-low-dose-dexamethasone-improves-pfs-in-relapsed-and-refractory-multiple-myeloma.20 ноября 2019 г .; Дата обращения: 3 февраля 2021 г.
FDA одобрило первую генную терапию на основе клеток для взрослых пациентов с множественной миеломой. Управление по контролю за продуктами и лекарствами. Доступно по адресу https://www.fda.gov/news-events/press-announcements/fda-approves-first-cell-based-gene-therapy-adult-patients-multiple-myeloma. 21 марта 2021 г .; Дата обращения: 5 апреля 2021 г.
van Nieuwenhuijzen N, Spaan I, Raymakers R, Peperzak V. От MGUS до множественной миеломы, парадигма клональной эволюции предраковых клеток. Cancer Res . 2018 15 мая. 78 (10): 2449-2456. [Медлайн]. [Полный текст].
Kuehl WM, Bergsagel PL. Молекулярный патогенез множественной миеломы и ее предраковых предшественников. Дж Клин Инвест . 2012 Октябрь 122 (10): 3456-63. [Медлайн]. [Полный текст].
Raab MS, Podar K, Breitkreutz I, Richardson PG, Anderson KC. Множественная миелома. Ланцет . 2009 г. 25 июля. 374 (9686): 324-39. [Медлайн].
Ludwig H, Drach J, Graf H, Lang A, Meran JG.Лечение острой почечной недостаточности с помощью химиотерапии на основе бортезомиба у пациентов с множественной миеломой. Гематология . 2007 Октябрь 92 (10): 1411-4. [Медлайн].
Zucchelli P, Pasquali S, Cagnoli L, Ferrari G. Испытание контролируемого плазмообмена при острой почечной недостаточности из-за множественной миеломы. Почечный Инт . 1988 июн. 33 (6): 1175-80. [Медлайн].
Основные статистические данные о множественной миеломе. Американское онкологическое общество. Доступно по адресу http: // www.race.org/cancer/multiplemyeloma/detailedguide/multiple-myeloma-key-statistics. 12 января 2021 г .; Дата обращения: 3 февраля 2021 г.
Koutros S, Baris D, Bell E, Zheng T, Zhang Y, Holford TR и др. Использование средств для окрашивания волос и риск множественной миеломы среди женщин в США. Оккуп Энвирон Мед . 2009 Январь 66 (1): 68-70. [Медлайн]. [Полный текст].
Wadhera RK, Kyle RA, Larson DR, et al. Заболеваемость, клиническое течение и прогноз вторичной моноклональной гаммопатии неустановленного значения у пациентов с множественной миеломой. Кровь . 2011 15 сентября. 118 (11): 2985-7. [Медлайн].
Yiin JH, Anderson JL, Daniels RD, Seel EA, Fleming DA, Waters KM и др. Вложенное исследование случай-контроль риска множественной миеломы и воздействия урана среди рабочих на газодиффузионном заводе Ок-Ридж. Радиат Рес . 2009 июнь 171 (6): 637-45. [Медлайн].
Caers J, Vande broek I, De Raeve H, Michaux L, Trullemans F, Schots R, et al. Множественная миелома — обновленная информация о диагностике и лечении. Eur J Haematol . 2008 ноябрь 81 (5): 329-43. [Медлайн].
Кайл Р.А., Раджкумар С.В. Критерии диагностики, стадии, стратификации риска и оценки ответа множественной миеломы. Лейкемия . 2009 23 января (1): 3-9. [Медлайн]. [Полный текст].
Программа эпиднадзора, эпидемиологии и конечных результатов. Информационные бюллетени SEER Stat: Миелома. Национальный институт рака. Доступно по адресу http://seer.cancer.gov/statfacts/html/mulmy.html. Дата обращения: 3 февраля 2021 г.
Ailawadhi S, Aldoss IT, Yang D, Razavi P, Cozen W., Sher T. и др. Различия в исходах при множественной миеломе: сравнительный анализ этнических подгрупп на основе SEER. Br J Haematol . 2012 26 апреля. [Medline].
Ludwig H, Durie BG, Bolejack V, Turesson I, Kyle RA, Blade J, et al. Миелома у пациентов моложе 50 лет имеет более благоприятные черты и лучшую выживаемость: анализ 10 549 пациентов из Международной рабочей группы по миеломе. Кровь . 2008 г. 15 апреля. 111 (8): 4039-47. [Медлайн].
Bataille R, Boccadoro M, Klein B, Durie B, Pileri A. С-реактивный белок и бета-2 микроглобулин создают простую и мощную систему определения стадии миеломы. Кровь . 1 августа 1992 г. 80 (3): 733-7. [Медлайн].
Огюстсон Б.М., Бегум Дж., Данн Дж. А., Барт Нью-Джерси, Дэвис Ф., Морган Дж. И др. Ранняя смертность после диагностики множественной миеломы: анализ пациентов, включенных в исследования Совета медицинских исследований Соединенного Королевства в период с 1980 по 2002 год — Рабочая группа Совета по медицинским исследованиям по лейкемии взрослых. Дж. Клин Онкол . 2005 20 декабря. 23 (36): 9219-26. [Медлайн].
Blimark C, Holmberg E, Mellqvist UH, Landgren O, Björkholm M, Hultcrantz M, et al. Множественная миелома и инфекции: популяционное исследование с участием 9253 пациентов с множественной миеломой. Гематология . 2015 Январь 100 (1): 107-13. [Медлайн]. [Полный текст].
Bladé J, Fernández-Llama P, Bosch F, Montolíu J, Lens XM, Montoto S и др. Почечная недостаточность при множественной миеломе: особенности и предикторы исхода у 94 пациентов из одного учреждения. Арк Интерн Мед. . 1998, 28 сентября, 158 (17): 1889-93. [Медлайн].
Dimopoulos M, Terpos E, Comenzo RL, Tosi P, Beksac M, Sezer O, et al. Согласованное заявление и руководящие принципы международной рабочей группы по миеломе в отношении текущей роли методов визуализации в диагностике и мониторинге множественной миеломы. Лейкемия . 2009 Сентябрь 23 (9): 1545-56. [Медлайн].
Hung GU, Tsai CC, Tsai SC, Lin WY. Сравнение Tc-99m сестамиби и F-18 FDG-PET при оценке множественной миеломы. Противоопухолевое лечение . 2005 ноябрь-декабрь. 25 (6C): 4737-41. [Медлайн].
Shortt CP, Gleeson TG, Breen KA, McHugh J, O’Connell MJ, O’Gorman PJ, et al. МРТ всего тела в сравнении с ПЭТ в оценке активности множественной миеломы. AJR Ам Дж. Рентгенол . 2009 Апрель 192 (4): 980-6. [Медлайн].
Zamagni E, Patriarca F, Nanni C и др. Прогностическая значимость ПЭТ / КТ с 18-F ФДГ у пациентов с впервые диагностированной множественной миеломой, которым была проведена аутотрансплантация. Кровь . 2011 декабрь 1. 118 (23): 5989-95. [Медлайн].
Durie BG, Salmon SE. Система клинической стадии множественной миеломы. Корреляция измеренной клеточной массы миеломы с клиническими признаками, ответом на лечение и выживаемостью. Рак . 1975, сентябрь, 36 (3): 842-54. [Медлайн].
Greipp PR, San Miguel J, Durie BG, Crowley JJ, Barlogie B, Bladé J и др. Международная система стадирования множественной миеломы. Дж. Клин Онкол .2005 20 мая. 23 (15): 3412-20. [Медлайн].
Palumbo A, Avet-Loiseau H, Oliva S и др. Пересмотренная международная система стадирования множественной миеломы: отчет Международной рабочей группы по миеломе. Дж. Клин Онкол . 2015 10 сентября. 33 (26): 2863-9. [Медлайн]. [Полный текст].
Dimopoulos MA, Moulopoulos A, Smith T., Delasalle KB, Alexanian R. Риск прогрессирования заболевания при бессимптомной множественной миеломе. Ам Дж. Мед. . 1993 Янв.94 (1): 57-61. [Медлайн].
He Y, Wheatley K, Clark O, Glasmacher A, Ross H, Djulbegovic B. Раннее и отсроченное лечение множественной миеломы на ранней стадии. Кокрановская база данных Syst Rev . 2003. CD004023. [Медлайн].
Munshi NC, Anderson KC, Bergsagel PL, et al. Консенсусные рекомендации по стратификации риска множественной миеломы: отчет консенсусной группы Международного семинара по миеломе 2. Кровь . 2011 5 мая.117 (18): 4696-700. [Медлайн].
Klein U, Jauch A, Hielscher T, et al. Хромосомные аберрации + 1q21 и del (17p13) позволяют прогнозировать выживаемость пациентов с рецидивирующей множественной миеломой, получавших леналидомид и дексаметазон. Рак . 2011 15 мая. 117 (10): 2136-44. [Медлайн].
Небен К., Локхорст Х.М., Яух А. и др. Введение бортезомиба до и после трансплантации аутологичных стволовых клеток улучшает исход у пациентов с множественной миеломой с делецией 17p. Кровь . 2012 26 января, 119 (4): 940-8. [Медлайн].
Матеос М.В., Эрнандес М.Т., Хиральдо П. и др. Леналидомид плюс дексаметазон для лечения тлеющей множественной миеломы с высоким риском. N Engl J Med . 2013 авг., 1. 369 (5): 438-47. [Медлайн].
Препарат обещает замедлить прогрессирование тлеющей миеломы до рака. Национальный институт рака. Доступно по адресу https://www.cancer.gov/news-events/cancer-currents-blog/2019/lenalidomide-slows-progression-smoldering-myeloma.7 июня 2019 г .; Дата обращения: 5 марта 2020 г.
Zonder JA, Crowley J, Hussein MA, Bolejack V, Moore DF Sr, Whittenberger BF и др. Леналидомид и высокие дозы дексаметазона в сравнении с дексаметазоном в качестве начальной терапии множественной миеломы: рандомизированное исследование Юго-Западной онкологической группы (S0232). Кровь . 2010, 23 декабря. 116 (26): 5838-41. [Медлайн]. [Полный текст].
Нельсон Р. Тлеющая миелома с высоким риском дает преимущества при раннем лечении. Медицинские новости Medscape . 1 августа 2013 г. [Полный текст].
Матеос М.В., Эрнандес М.Т., Хиральдо П. и др. Леналидомид плюс дексаметазон для лечения тлеющей множественной миеломы с высоким риском. N Engl J Med . 2013 авг., 1. 369 (5): 438-47. [Медлайн].
Morgan GJ, Child JA, Gregory WM, et al. Эффекты золедроновой кислоты по сравнению с клодроновой кислотой на заболеваемость скелетом у пациентов с впервые диагностированной множественной миеломой (MRC Myeloma IX): вторичные результаты рандомизированного контролируемого исследования. Ланцет Онкол . 2011 12 августа (8): 743-52. [Медлайн].
Беренсон Дж. Р., Лихтенштейн А., Портер Л., Димопулос М. А., Бордони Р., Джордж С. и др. Эффективность памидроната в уменьшении скелетных явлений у пациентов с запущенной множественной миеломой. Группа изучения миеломы аредии. N Engl J Med . 1996 22 февраля. 334 (8): 488-93. [Медлайн].
[Рекомендации] Андерсон К., Исмаила Н., Кайл Р.А. Роль костно-модифицирующих агентов при множественной миеломе: Резюме обновления клинических рекомендаций Американского общества клинической онкологии. Дж. Онкол Практик . 2018 14 апреля (4): 266-269. [Медлайн]. [Полный текст].
Mikkilineni L, Kochenderfer JN. CAR Т-клеточная терапия для пациентов с множественной миеломой. Нат Рев Клин Онкол . 2021 18 февраля (2): 71-84. [Медлайн].
Дхакал Б., Хари П.Н., Усмани С.З., Хамадани М. Т-клеточная терапия химерного антигенного рецептора при множественной миеломе: перспективы и проблемы. Пересадка костного мозга . 2021 Январь 56 (1): 9-19. [Медлайн].
[Рекомендации] Terpos E, et al; Костная рабочая группа Международной рабочей группы по миеломе. Лечение заболеваний костей, связанных с множественной миеломой: рекомендации Рабочей группы по костям Международной рабочей группы по миеломе. Ланцет Онкол . 2021 2 февраля. [Medline]. [Полный текст].
Zonder JA, Crowley J, Hussein MA, et al. Превосходство леналидомида (Len) в сочетании с высокими дозами дексаметазона (HD) по сравнению с одним HD в лечении впервые выявленной множественной миеломы (NDMM): результаты рандомизированного двойного слепого плацебо-контролируемого исследования SWOG S0232 [аннотация 77]. Кровь . 2007. 110: 32a. [Полный текст].
Lokhorst HM, Sonneveld P, Cornelissen JJ, Joosten P, van Marwijk Kooy M, Meinema J, et al. Индукционная терапия винкристином, адриамицином, дексаметазоном (VAD) и мелфаланом в промежуточных дозах (IDM) с последующей трансплантацией аутологичных или аллогенных стволовых клеток при впервые выявленной множественной миеломе. Пересадка костного мозга . 1999, 23 февраля (4): 317-22. [Медлайн].
Zervas K, Mihou D, Katodritou E, Pouli A, Mitsouli CH, Anagnostopoulos A, et al.VAD-доксил в сравнении с VAD-доксилом плюс талидомид в качестве начального лечения множественной миеломы: результаты многоцентрового рандомизированного исследования греческой группы по изучению миеломы. Энн Онкол . 2007 18 августа (8): 1369-75. [Медлайн].
Леналидомид улучшает выживаемость при впервые выявленной множественной миеломе. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/807706. Доступ: 23 июля 2013 г.
Rajkumar SV, Jacobus S, Callander NS, Fonseca R, Vesole DH, Williams ME, et al.Леналидомид плюс дексаметазон в высоких дозах по сравнению с леналидомидом плюс дексаметазон в низких дозах в качестве начальной терапии впервые диагностированной множественной миеломы: открытое рандомизированное контролируемое исследование. Ланцет Онкол . 2010 января, 11 (1): 29-37. [Медлайн].
Niesvizky R, Jayabalan DS, Christos PJ, Furst JR, Naib T, Ely S, et al. Комбинированная терапия BiRD (биаксин [кларитромицин] / ревлимид [леналидомид] / дексаметазон) приводит к высоким показателям полного и общего ответа при не получавшей лечения симптоматической множественной миеломе. Кровь . 2008 г. 1. 111 (3): 1101-9. [Медлайн].
Ричардсон П.Г., Барлоги Б., Беренсон Дж., Сингхал С., Джаганнат С., Ирвин Д. и др. Фаза 2 исследования бортезомиба при рецидивирующей рефрактерной миеломе. N Engl J Med . 26 июня 2003 г. 348 (26): 2609-17. [Медлайн].
Harousseau JL, Mathiot C, Attal M и др. VELCADE / дексаметазон (Vel / D) в сравнении с VAD в качестве индукционной терапии перед трансплантацией аутологичных стволовых клеток (ASCT) при впервые выявленной множественной миеломе (MM): обновленные результаты исследования IFM 2005/01 [аннотация 450]. Кровь . 2007. 110: 139a. [Полный текст].
Cavo M, Patriarca F, Tacchetti P, et al. . Бортезомиб (Велкейд [R]) — талидомид-дексаметазон (VTD) по сравнению с талидомид-дексаметазоном (TD) при подготовке к трансплантации аутологичных стволовых клеток (SC) при впервые выявленной множественной миеломе (MM) [аннотация 73]. Кровь . 2007. 110: 30а. [Полный текст].
Шер Т., Айлавадхи С., Миллер К.С. и др. Стероид-независимый режим бортезомиба, липосомального доксорубицина и талидомида демонстрирует высокие показатели ответа у пациентов с впервые диагностированной множественной миеломой. Br J Haematol . 2011 Июль 154 (1): 104-10. [Медлайн].
Harousseau JL, Palumbo A, Richardson PG, Schlag R, Dimopoulos MA, Shpilberg O, et al. Превосходные результаты, связанные с полным ответом у пациентов с впервые диагностированной множественной миеломой, получавших неинтенсивную терапию: анализ исследования фазы 3 VISTA бортезомиба плюс мелфалан-преднизон по сравнению с мелфалан-преднизоном. Кровь . 11 ноября 2010 г. 116 (19): 3743-50. [Медлайн].
Моро П., Пилипенко Н., Гросицкий С. и др.Сравнение подкожного и внутривенного введения бортезомиба пациентам с рецидивирующей множественной миеломой: рандомизированное исследование не меньшей эффективности, фаза 3. Ланцет Онкол . 2011 Май. 12 (5): 431-40. [Медлайн].
Mateos MV, Gutierrez NC, Martin-Ramos ML, et al. Результат в соответствии с цитогенетическими аномалиями и плоидностью ДНК у пациентов с миеломой, получавших короткую индукцию бортезомибом еженедельно с последующей поддерживающей терапией. Кровь . 2011 27 октября. 118 (17): 4547-53.[Медлайн].
Moreau, Philippe, et al. Бортезомиб, талидомид и дексаметазон с даратумумабом или без него до и после трансплантации аутологичных стволовых клеток при впервые выявленной множественной миеломе (КАССИОПЕЯ): рандомизированное открытое исследование фазы 3. Ланцет . 6 июля 2019 г. 394 (10192): 29-38. [Медлайн].
Джаганнатх С., Ричардсон П.Г., Зонневельд П., Шустер М.В., Ирвин Д., Штадтмауэр Е.А. и др. Бортезомиб, по-видимому, преодолевает плохой прогноз, связанный с делецией хромосомы 13 в исследованиях фазы 2 и 3. Лейкемия . 2007 21 января (1): 151-7. [Медлайн].
Sagaster V, Ludwig H, Kaufmann H, Odelga V, Zojer N, Ackermann J, et al. Бортезомиб при рецидиве множественной миеломы: частота ответа и продолжительность ответа не зависят от делеции 13q хромосомы. Лейкемия . 2007 21 января (1): 164-8. [Медлайн].
Совместная группа исследователей миеломы. Комбинированная химиотерапия в сравнении с мелфаланом и преднизоном в качестве лечения множественной миеломы: обзор 6633 пациентов из 27 рандомизированных исследований. Дж. Клин Онкол . 1998 16 декабря (12): 3832-42. [Медлайн].
Facon T, Мэри JY, Hulin C, Benboubker L, Attal M, Pegourie B и др. Мелфалан и преднизон плюс талидомид по сравнению с мелфаланом и преднизоном в отдельности или трансплантация аутологичных стволовых клеток пониженной интенсивности у пожилых пациентов с множественной миеломой (IFM 99-06): рандомизированное исследование. Ланцет . 6 октября 2007 г. 370 (9594): 1209-18. [Медлайн].
Хулин С., Факон Т., Родон П., Пегури Б., Бенбубкер Л., Дойен С. и др.Эффективность мелфалана и преднизона плюс талидомид у пациентов старше 75 лет с впервые диагностированной множественной миеломой: испытание IFM 01/01. Дж. Клин Онкол . 2009, 1 августа. 27 (22): 3664-70. [Медлайн].
Waage A, Gimsing P, Fayers P, Abildgaard N, Ahlberg L, Björkstrand B и др. Мелфалан и преднизон плюс талидомид или плацебо у пожилых пациентов с множественной миеломой. Кровь . 2 сентября 2010 г. 116 (9): 1405-12. [Медлайн].
Файерс П.М., Палумбо А., Хулин С. и др.Талидомид для ранее нелеченных пожилых пациентов с множественной миеломой: метаанализ данных 1685 отдельных пациентов из 6 рандомизированных клинических испытаний. Кровь . 2011, 4 августа, 118 (5): 1239-47. [Медлайн].
Zweegman S, van der Holt B, Mellqvist UH, et al. Мелфалан, преднизон и леналидомид в сравнении с мелфаланом, преднизоном и талидомидом при нелеченой множественной миеломе. Кровь . 2016 3 марта. 127 (9): 1109-16. [Медлайн]. [Полный текст].
Гей Ф, Ларокка А., Виджерманс П. и др.Полный ответ коррелирует с длительной выживаемостью без прогрессирования и общей выживаемостью при миеломе пожилого возраста, получавшей новые препараты: анализ 1175 пациентов. Кровь . 2011 17 марта. 117 (11): 3025-31. [Медлайн].
Матеос М.В. и др. Для исследователей испытаний ALCYONE. Даратумумаб плюс бортезомиб, мелфалан и преднизон при нелеченной миеломе. N Engl J Med . 2017 12 декабря [Medline]. [Полный текст].
Facon T, et al.Даратумумаб плюс леналидомид и дексаметазон при невылеченной миеломе. N Engl J Med . 30 мая 2019. 380 (22): 2104-2115. [Медлайн]. [Полный текст].
Спенсер А., Принц Х.М., Робертс А.В. и др. Консолидационная терапия низкими дозами талидомида и преднизолона продлевает выживаемость пациентов с множественной миеломой, перенесших одну процедуру трансплантации аутологичных стволовых клеток. Дж. Клин Онкол . 2009 10 апреля. 27 (11): 1788-93. [Медлайн].
Lokhorst HM, van der Holt B, Zweegman S, et al.Рандомизированное исследование фазы 3 по влиянию талидомида в сочетании с адриамицином, дексаметазоном и высокими дозами мелфалана с последующим поддерживающим лечением талидомидом у пациентов с множественной миеломой. Кровь . 2010 11 февраля. 115 (6): 1113-20. [Медлайн].
Морган Дж. Дж., Грегори В. М., Дэвис Ф. Е. и др. Роль поддерживающей терапии талидомидом при множественной миеломе: результаты MRC Myeloma IX и метаанализ. Кровь . 2012 5 января. 119 (1): 7-15. [Медлайн].
McCarthy PL, Owzar K, Hofmeister CC, et al.Леналидомид после трансплантации стволовых клеток по поводу множественной миеломы. N Engl J Med . 2012 10 мая. 366 (19): 1770-81. [Медлайн]. [Полный текст].
Attal M, Lauwers-Cances V, Marit G и др. Поддерживающая терапия леналидомидом после трансплантации стволовых клеток при множественной миеломе. N Engl J Med . 2012 10 мая. 366 (19): 1782-91. [Медлайн].
Ян Б., Ю Р.Л., Чи XH, Лу XC. Лечение множественной миеломы леналидомидом: систематический обзор и метаанализ рандомизированных контролируемых исследований. PLoS Один . 2013. 8 (5): e64354. [Медлайн]. [Полный текст].
Sonneveld P, Schmidt-Wolf IG, van der Holt B, et al. Индукция и поддерживающая терапия бортезомибом у пациентов с впервые диагностированной множественной миеломой: результаты рандомизированного исследования III фазы HOVON-65 / GMMG-HD4. Дж. Клин Онкол . 2012 20 августа. 30 (24): 2946-55. [Медлайн].
Palumbo A, Hajek R, Delforge M, et al. Непрерывное лечение впервые выявленной множественной миеломы леналидомидом. N Engl J Med . 2012 10 мая. 366 (19): 1759-69. [Медлайн].
Palumbo A, Mina R. Часть II: роль поддерживающей терапии у пациентов, не подходящих для трансплантации. J Natl Compr Canc Netw . 2013 г. 1. 11 (1): 43-9. [Медлайн].
FDA одобрило применение карфилзомиба и даратумумаба с дексаметазоном для лечения множественной миеломы. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступно по адресу https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-carfilzomib-and-daratumumab-dexamethasone-multiple-myeloma.21 августа 2020 г .; Дата обращения: 2 сентября 2020 г.
San-Miguel JF, Hungria VT, Yoon SS, Beksac M, Dimopoulos MA, Elghandour A, et al. Панобиностат плюс бортезомиб и дексаметазон в сравнении с плацебо плюс бортезомиб и дексаметазон у пациентов с рецидивирующей или рефрактерной множественной миеломой: многоцентровое рандомизированное двойное слепое исследование фазы 3. Ланцет Онкол . 2014 15 октября (11): 1195-206. [Медлайн].
Кипролис (карфилзомиб) [лист-вкладыш].Южный Сан-Франциско, Калифорния: Onyx Pharmaceuticals. Июль 2012 г. Доступно в [Полный текст].
Стюарт А.К., Райкумар С.В., Димопулос М.А., Массзи Т., Шпичка И., Ориол А. и др. Карфилзомиб, леналидомид и дексаметазон при рецидиве множественной миеломы. N Engl J Med . 2015 8 января. 372 (2): 142-52. [Медлайн]. [Полный текст].
Димопулос М.А., Моро П., Палумбо А., Джошуа Д., Пур Л., Хайек Р. и др. Карфилзомиб и дексаметазон в сравнении с бортезомибом и дексаметазоном у пациентов с рецидивирующей или рефрактерной множественной миеломой (ENDEAVOR): рандомизированное открытое многоцентровое исследование фазы 3. Ланцет Онкол . 2016 17 января (1): 27-38. [Медлайн].
Dimopoulos MA, Goldschmidt H, Niesvizky R, Joshua D, Chng WJ, Oriol A, et al. Карфилзомиб или бортезомиб при рецидивирующей или рефрактерной множественной миеломе (ENDEAVOR): промежуточный анализ общей выживаемости открытого рандомизированного исследования фазы 3. Ланцет Онкол . 2017 18 октября (10): 1327-1337. [Медлайн].
Lonial S, Weiss BM, Usmani SZ, Singhal S, Chari A, et al.Монотерапия даратумумабом у пациентов с резистентной к лечению множественной миеломой (SIRIUS): открытое рандомизированное исследование фазы 2. Ланцет . 2016 г. 9 апреля. 387 (10027): 1551-60. [Медлайн]. [Полный текст].
Lokhorst HM, Plesner T, Laubach JP, Nahi H, Gimsing P, Hansson M и др. Нацеливание на CD38 с помощью монотерапии даратумумабом при множественной миеломе. N Engl J Med . 2015 24 сентября. 373 (13): 1207-19. [Медлайн].
Моро П. и др. Для исследовательской группы TOURMALINE-MM1.Иксазомиб, леналидомид и дексаметазон для приема внутрь при множественной миеломе. N Engl J Med . 2016 28 апреля. 374 (17): 1621-34. [Медлайн]. [Полный текст].
Lonial S, Dimopoulos M, Palumbo A, White D, Grosicki S, Spicka I, et al. Терапия элотузумабом при рецидивирующей или рефрактерной множественной миеломе. N Engl J Med . 2015 13 августа. 373 (7): 621-31. [Медлайн].
Димопулос М.А., Дитфельд Д., Гросицки С., Моро П., Такезако Н., Хори М. и др.Элотузумаб плюс помалидомид и дексаметазон при множественной миеломе. N Engl J Med . 2018 8 ноября. 379 (19): 1811-1822. [Медлайн].
FDA одобрило использование изатуксимаба-irfc для лечения множественной миеломы. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступно по адресу https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-isatuximab-irfc-multiple-myeloma. 31 марта 2021 г .; Дата обращения: 15 апреля 2021 г.
Kumar S, Witzig TE, Rajkumar SV. Талидомид: современная роль в лечении злокачественных новообразований, не связанных с плазматическими клетками. Дж. Клин Онкол . 2004 15 июня. 22 (12): 2477-88. [Медлайн].
Weber DM, Chen C, Niesvizky R, Wang M, Belch A, Stadtmauer EA, et al. Леналидомид плюс дексаметазон при рецидиве множественной миеломы в Северной Америке. N Engl J Med . 2007 22 ноября. 357 (21): 2133-42. [Медлайн].
Lacy MQ, Allred JB, Gertz MA, et al. Помалидомид плюс дексаметазон в низких дозах при миеломе, резистентной как к бортезомибу, так и к леналидомиду: сравнение двух стратегий дозирования при болезни с двойной рефрактерностью. Кровь . 2011 15 сентября. 118 (11): 2970-5. [Медлайн].
Leleu X, Attal M, Arnulf B, Moreau P, Traulle C, Marit G и др. Помалидомид в сочетании с дексаметазоном в низких дозах активен и хорошо переносится при резистентной к бортезомибу и леналидомиду множественной миеломе: IFM 2009-02. Кровь . 2013 14 января [Medline].
Chustecka Z, Mulcahy N. FDA одобрило применение помалидомида для лечения множественной миеломы. Медицинские новости Medscape. Доступно по адресу http: // www.medscape.com/viewarticle/779048. 8 февраля 2013 г .; Доступ: 11 января 2018 г.
Miguel JS, Weisel K, Moreau P, Lacy M, Song K, Delforge M и др. Помалидомид плюс дексаметазон в низких дозах по сравнению с одним дексаметазоном в высоких дозах у пациентов с рецидивирующей и рефрактерной множественной миеломой (MM-003): рандомизированное открытое исследование фазы 3. Ланцет Онкол . 2013 2 сентября [Medline].
Ajai C, Vogl DT, et al. Результаты исследования Pivotal STORM (часть 2) у пациентов с пентарефрактерной множественной миеломой (ММ): глубокие и стойкие реакции на пероральный селинексор плюс низкие дозы дексаметазона у пациентов с пентарефрактерной ММ.Кровь 2018 132: 598. [Полный текст].
Xpovio (selinexor) [вкладыш в упаковке]. Ньютон, Массачусетс: Karyopharm Therapeutics, Inc., июль 2019 г. Доступно на [Полный текст].
FDA предоставило ускоренное разрешение на применение белантамаба мафодотин-blmf для лечения множественной миеломы. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступно по адресу https://www.fda.gov/drugs/drug-approvals-and-databases/fda-granted-accelerated-approval-belantamab-mafodotin-blmf-multiple-myeloma. 5 августа 2020 г .; Доступ: 6 августа 2020 г.
Моро П., Хуллин С., Гарбан Ф., Якоуб-Ага И., Бенбубкер Л., Аттал М. и др. Тандемная трансплантация аутологичных стволовых клеток при высоком риске множественной миеломы de novo: окончательные результаты проспективного и рандомизированного протокола IFM 99-04. Кровь . 2006 г. 1 января. 107 (1): 397-403. [Медлайн].
Cavo M, Tosi P, Zamagni E, Cellini C, Tacchetti P, Patriarca F и др. Проспективное рандомизированное исследование одиночной и двойной трансплантации аутологичных стволовых клеток при множественной миеломе: клиническое исследование Болоньи 96. Дж. Клин Онкол . 2007, 10 июня. 25 (17): 2434-41. [Медлайн].
Барлоги Б., Аттал М., Кроули Дж., Ван Ри Ф., Шимонифка Дж., Моро П. и др. Долгосрочное наблюдение за испытаниями аутотрансплантации множественной миеломы: обновление протоколов, проведенное франкоязычной межгруппой миеломов, юго-западной онкологической группой и университетом медицинских наук Арканзаса. Дж. Клин Онкол . 2010 г. 1. 28 (7): 1209-14. [Медлайн]. [Полный текст].
Attal M, Harousseau JL, Stoppa AM, Sotto JJ, Fuzibet JG, Rossi JF и др.Проспективное рандомизированное исследование аутотрансплантации костного мозга и химиотерапии множественной миеломы. Intergroupe Français du Myélome. N Engl J Med . 1996 г. 11 июля. 335 (2): 91-7. [Медлайн].
Gerull S, Goerner M, Benner A, Hegenbart U, Klein U, Schaefer H и др. Отдаленные результаты немиелоаблативной аллогенной трансплантации у пациентов с множественной миеломой высокого риска. Пересадка костного мозга . 2005 декабрь 36 (11): 963-9. [Медлайн].
Vesole DH, Zhang L, Flomenberg N, Greipp PR, Lazarus HM, Huff CA. Испытание фазы II трансплантации аутологичных стволовых клеток с последующей трансплантацией миниаллогенных стволовых клеток для лечения множественной миеломы: анализ Восточной кооперативной онкологической группы ECOG E4A98 и E1A97. Пересадка костного мозга Biol . 2009 15 января (1): 83-91. [Медлайн].
Бруно Б., Ротта М., Патриарка Ф., Маттей Д., Аллионе Б., Карневале-Скианка Ф. и др.Немиелоаблативная аллотрансплантация недавно диагностированной множественной миеломы: опыт итальянской группы Trapianti di Midollo. Кровь . 2009, 2 апреля. 113 (14): 3375-82. [Медлайн]. [Полный текст].
Ротта М., Сторер Б.Э., Сахеби Ф., Шизуру Дж. А., Бруно Б., Ланге Т. и др. Отдаленные результаты пациентов с множественной миеломой после трансплантации аутологичных гемопоэтических клеток и немиелоаблативной аллотрансплантации. Кровь . 2009, 2 апреля. 113 (14): 3383-91. [Медлайн].[Полный текст].
Моро П., Атталь М., Пегури Б. и др. Достижение VGPR для индукционной терапии является важным прогностическим фактором для более длительной ВБП в исследовании IFM 2005-01. Кровь . 17 марта 2011 г. 117 (11): 3041-3044. [Медлайн].
Harousseau JL, Attal M, Avet-Loiseau H, et al. Бортезомиб плюс дексаметазон превосходит винкристин плюс доксорубицин плюс дексаметазон в качестве индукционного лечения перед трансплантацией аутологичных стволовых клеток при впервые диагностированной множественной миеломе: результаты исследования III фазы IFM 2005-01. Дж. Клин Онкол . 20 октября 2010 г. 28 (30): 4621-9. [Медлайн].
Cavo M, Tacchetti P, Patriarca F, Petrucci MT, Pantani L, Galli M и др. Сравнение бортезомиба с талидомидом и дексаметазоном с талидомидом и дексаметазоном в качестве индукционной терапии до и консолидационной терапии после двойной трансплантации аутологичных стволовых клеток при впервые выявленной множественной миеломе: рандомизированное исследование фазы 3. Ланцет . 18 декабря 2010 г. 376 (9758): 2075-85. [Медлайн].
Garderet L, Iacobelli S, Moreau P, Dib M, Lafon I, Niederwieser D, et al. Превосходство тройной комбинации бортезомиб-талидомид-дексаметазон над двойной комбинацией талидомид-дексаметазон у пациентов с множественной миеломой, прогрессирующей или рецидивирующей после аутологичной трансплантации: MMVAR / IFM 2005-04 рандомизированное исследование III фазы от Рабочей группы по хроническому лейкозу Европейская группа по трансплантации крови и костного мозга. Дж. Клин Онкол .2012 г. 14 мая. [Medline].
Munshi NC, Anderson LD Jr, Shah N, et al. Idecabtagene Vicleucel при рецидивирующей и рефрактерной множественной миеломе. N Engl J Med . 2021 25 февраля. 384 (8): 705-716. [Медлайн].
Купер М.Р., Уважаемый К., Макинтайр, Орегон, Озер Х, Эллертон Дж., Канеллос Дж. И др. Рандомизированное клиническое испытание, сравнивающее мелфалан / преднизон с интерфероном альфа-2b или без него у недавно диагностированных пациентов с множественной миеломой: исследование рака и лейкемии группы B. Дж. Клин Онкол . 1993, 11 января (1): 155-60. [Медлайн].
Морган Г.Дж., Дэвис Ф.И., Грегори В.М., Кокс К., Белл С.Е., Шуберт А.Дж. и др. Лечение первой линии золедроновой кислотой по сравнению с клодроновой кислотой при множественной миеломе (MRC Myeloma IX): рандомизированное контролируемое исследование. Ланцет . 2010 декабрь 11, 376 (9757): 1989-99. [Медлайн].
Terpos E, Roodman GD, Willenbacher W., Shimizu K, Garcia-Sanz R, Durie B., et al. Сравнение деносумаба (DMB) с золедроновой кислотой (ZA) для лечения заболеваний костей у пациентов с впервые диагностированной множественной миеломой; международное рандомизированное двойное слепое исследование (устная презентация S782).Представлен на 22-м ежегодном конгрессе Европейской гематологической ассоциации, Мадрид, Испания. 2017 г. 25 июня. [Полный текст].
[Рекомендации] Ruggiero SL, Dodson TB, Fantasia J, Goodday R, Aghaloo T, Mehrotra B, et al. Позиционный документ Американской ассоциации челюстно-лицевых хирургов по поводу лекарственного остеонекроза челюсти — обновление 2014 г. Дж. Орал Максиллофак Хирургия . 2014 Октябрь 72 (10): 1938-56. [Медлайн]. [Полный текст].
Джулбегович Б., Уитли К., Росс Дж., Кларк О, Бос Дж., Гольдшмидт Х. и др.Бисфосфонаты при миеломной болезни. Кокрановская база данных Syst Rev . 2001. CD003188. [Медлайн].
Блумфилд DJ. Должны ли бисфосфонаты быть частью стандартной терапии пациентов с множественной миеломой или метастазами в кости от других видов рака? Обзор, основанный на фактах. Дж. Клин Онкол . 1998 16 марта (3): 1218-25. [Медлайн].
Людвиг Х., Фриц Э., Коцманн Х., Хёкер П., Гисслингер Х., Барнас У. Лечение эритропоэтином анемии, связанной с множественной миеломой. N Engl J Med . 14 июня 1990 г. 322 (24): 1693-9. [Медлайн].
Уилсон Дж., Яо Г.Л., Рафтери Дж., Бохлиус Дж., Бранскилл С., Сандеркок Дж. И др. Систематический обзор и экономическая оценка эпоэтина альфа, эпоэтина бета и дарбэпоэтина альфа при анемии, связанной с раком, особенно при лечении рака. Оценка медицинских технологий . 2007 апр.11 (13): 1-202, iii-iv. [Медлайн].
Парих Г.К., Амджад А.И., Салиба Р.М., Казми С.М., Хан З.У., Лахоти А. и др.Трансплантация аутологичных гемопоэтических стволовых клеток может обратить вспять почечную недостаточность у пациентов с множественной миеломой. Пересадка костного мозга Biol . 2009 июл.15 (7): 812-6. [Медлайн].
[Рекомендации] Terpos E, Kleber M, Engelhardt M, et al; Европейская сеть миеломы. Руководство Европейской сети миеломы по лечению осложнений, связанных с множественной миеломой. Гематология . 2015 Октябрь 100 (10): 1254-66. [Медлайн]. [Полный текст].
Golombick T, Diamond TH, Manoharan A, Ramakrishna R.Моноклональная гаммопатия неопределенного значения, тлеющая множественная миелома и куркумин: рандомизированное двойное слепое плацебо-контролируемое перекрестное исследование 4g и открытое расширенное исследование 8g. Ам Дж. Гематол . 2012 май. 87 (5): 455-60. [Медлайн].
Chang ET, Canchola AJ, Cockburn M, et al. Ультрафиолетовое излучение взрослого населения, чувствительность к солнцу, диетический витамин D и риск лимфоидных злокачественных новообразований в Калифорнийском исследовании учителей. Кровь .2011 г. 11 августа. 118 (6): 1591-9. [Медлайн]. [Полный текст].
[Рекомендации] Rajkumar SV, Dimopoulos MA, Palumbo A, et al. Международная рабочая группа по миеломе обновила критерии диагностики множественной миеломы. Ланцет Онкол . 2014 15 ноября (12): e538-48. [Медлайн].
[Рекомендации] Димопулос М.А., Моро П., Терпос Э., Матеос М.В., Цвигман С., Кук Г. и др. Множественная миелома: клинические рекомендации EHA-ESMO по диагностике, лечению и последующему наблюдению. Полусфера . 2021 5 (2) февраля: e528. [Медлайн]. [Полный текст].
[Рекомендации] Палумбо А., Авет-Луазо Н., Олива С. и др. Пересмотренная международная система стадирования множественной миеломы: отчет Международной рабочей группы по миеломе. Дж. Клин Онкол . 2015 10 сентября. 33 (26): 2863-9. [Медлайн]. [Полный текст].
[Рекомендации] Bohlius J, Bohlke K, Castelli R, Djulbegovic B., Lustberg MB, Martino M, et al. Управление анемией, связанной с раком, с помощью агентов, стимулирующих эритропоэз: Обновление клинических рекомендаций ASCO / ASH. Дж. Клин Онкол . 2019 20 мая. 37 (15): 1336-1351. [Медлайн]. [Полный текст].
[Рекомендации] Национальная комплексная онкологическая сеть. Венозная тромбоэмболическая болезнь, связанная с раком. NCCN. Доступно на https://www.nccn.org/professionals/physician_gls/pdf/vte.pdf. Версия 1.2020 — 16 апреля 2020 г .; Дата обращения: 3 февраля 2021 г.
Палумбо А., Раджкумар С.В., Димопулос М.А. и др. Профилактика тромбоза, связанного с талидомидом и леналидомидом, при миеломе. Лейкемия . 2008 22 февраля (2): 414-23. [Медлайн]. [Полный текст].
Людвиг Х., Боккадоро М., Моро П. и др. Рекомендации по вакцинации при множественной миеломе: консенсус Европейской сети миеломы. Лейкемия . 2021 января, 35 (1): 31-44. [Медлайн]. [Полный текст].
van de Donk NWCJ, Pawlyn C, Yong KL. Множественная миелома. Ланцет . 2021 30 января. 397 (10272): 410-427. [Медлайн].
Матеос М.В., Ричардсон П.Г., Шлаг Р., Хуагева Н.К., Димопулос М.А., Шпильберг О. и др.Сравнение бортезомиба в сочетании с мелфаланом и преднизоном с мелфаланом и преднизоном при ранее нелеченой множественной миеломе: обновленное наблюдение и влияние последующей терапии в исследовании III фазы VISTA. Дж. Клин Онкол . 2010 г. 1. 28 (13): 2259-66. [Медлайн].
Palumbo A, Falco P, Falcone A, Benevolo G, Canepa L, Gay F и др. Мелфалан, преднизон и леналидомид при впервые выявленной миеломе: кинетика нейтропении и тромбоцитопении и время до наступления события. Клин Лимфома Миелома . 2009 Апрель 9 (2): 145-50. [Медлайн].
Attal M, Harousseau JL, Leyvraz S и др. Поддерживающая терапия талидомидом улучшает выживаемость пациентов с множественной миеломой. Кровь . 2006 15 ноября. 108 (10): 3289-94. [Медлайн].
Barlogie B, Pineda-Roman M, van Rhee F, et al. Подразделение талидомида Total Therapy 2 улучшает продолжительность полной ремиссии и выживаемость у пациентов с миеломой с метафазными цитогенетическими аномалиями. Кровь . 2008, 15 октября. 112 (8): 3115-21. [Медлайн]. [Полный текст].
Ludwig H, Hajek R, Tóthová E, Drach J, Adam Z, Labar B и др. Талидомид-дексаметазон по сравнению с мелфаланом-преднизолоном у пожилых пациентов с множественной миеломой. Кровь . 2009, 9 апреля. 113 (15): 3435-42. [Медлайн].
van Rhee F, Dhodapkar M, Shaughnessy JD Jr, Anaissie E, Siegel D, Hoering A, et al. Первое клиническое испытание талидомида при множественной миеломе: десятилетие. Кровь . 2008 15 августа. 112 (4): 1035-8. [Медлайн]. [Полный текст].
[Рекомендации] Моро П., Сан-Мигель Дж., Сонневельд П., Матеос М.В., Заманьи Е., Авет-Луазо Х. и др. Множественная миелома: клинические рекомендации ESMO по диагностике, лечению и последующему наблюдению †. Энн Онкол . 2017 г. 27 апреля. [Medline]. [Полный текст].
Morgan GJ, Davies FE, Gregory WM, et al. Циклофосфамид, талидомид и дексаметазон (CTD) в качестве начальной терапии для пациентов с множественной миеломой, не подходящих для аутотрансплантации. Кровь . 2011, 4 августа. 118 (5): 1231-8. [Медлайн]. [Полный текст].
Vickrey E, Allen S, Mehta J, Singhal S. Ацикловир для предотвращения реактивации вируса ветряной оспы (опоясывающий герпес) у пациентов с множественной миеломой, получающих терапию бортезомибом. Рак . 2009 г., 1. 115 (1): 229-32. [Медлайн].
Петруччи М.Т., Хиральдо П., Коррадини П. и др. Проспективное международное исследование фазы 2 повторного лечения бортезомибом у пациентов с рецидивом множественной миеломы. Br J Haematol . 2013 7 января [Medline].
Родон П. Ведение и лечение множественной миеломы у пожилых пациентов. Энн Долгосрочная помощь . 2002. 10: 20-7.
Palumbo A, Cavo M, Bringhen S и др. Тромбопрофилактика аспирином, варфарином или эноксапарином у пациентов с множественной миеломой, получавших талидомид: открытое рандомизированное исследование фазы III. Дж. Клин Онкол . 2011 10 марта. 29 (8): 986-93. [Медлайн].
Джексон Г. Х., Морган Г. Дж., Дэвис Ф. Е., Ву П., Грегори В. М., Белл С. Е.

 изотонич.р-ра NaCl (перед процедурой)
изотонич.р-ра NaCl (перед процедурой) воды
воды р-ре или дист.воде при рН 8,6-9,0
р-ре или дист.воде при рН 8,6-9,0 растворяют в 0,2% р-ре натрия гидрокарбоната или подщелоченной (до рН=9.0)воде
растворяют в 0,2% р-ре натрия гидрокарбоната или подщелоченной (до рН=9.0)воде р-ре
р-ре воды
воды р-ра + 2-3 капли ДМСО
р-ра + 2-3 капли ДМСО р-ром
р-ром 2-5 мл 20%
2-5 мл 20%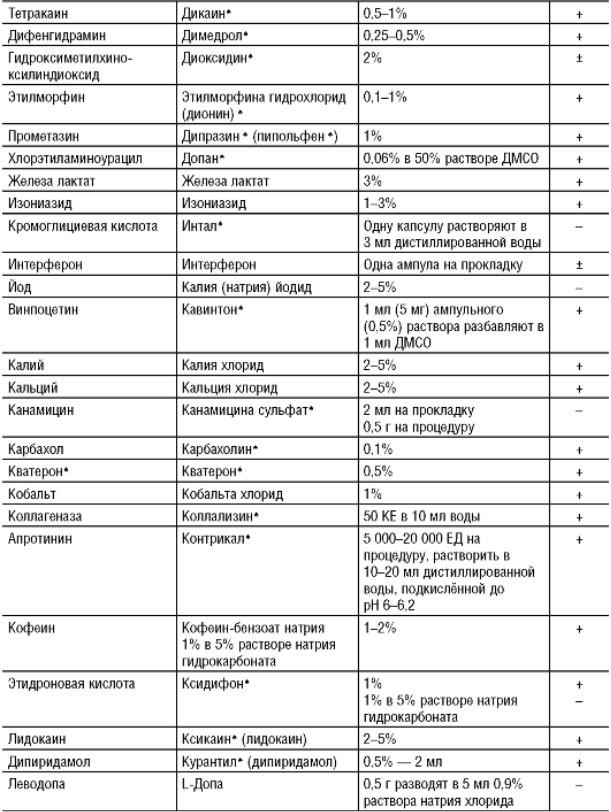 воде + 5-8 кап 0,1н р-ра хлористоводородной кислоты на 30 мл воды или 1-2% р-ре гидрокарбоната натрия
воде + 5-8 кап 0,1н р-ра хлористоводородной кислоты на 30 мл воды или 1-2% р-ре гидрокарбоната натрия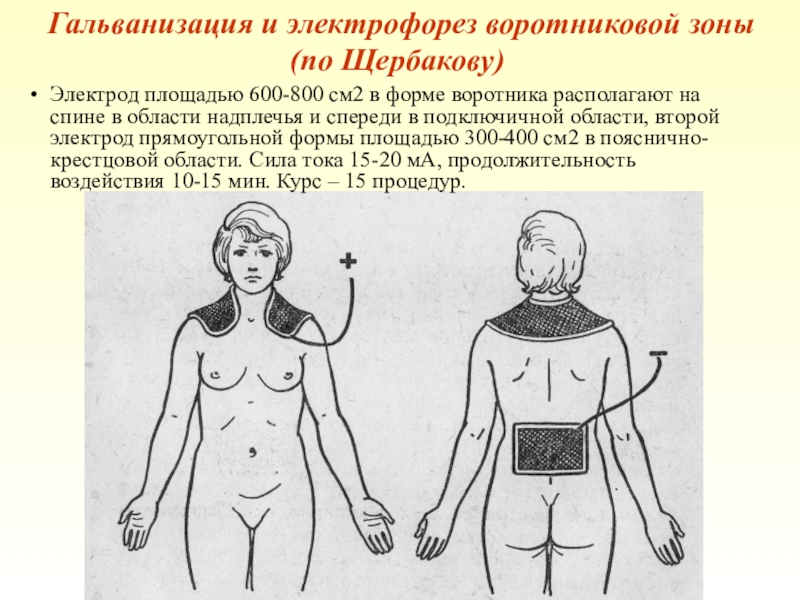 на 5 мл 70% спирта
на 5 мл 70% спирта р-ра, 0,1г
р-ра, 0,1г р-ра
р-ра до рН=8,5-8,7
до рН=8,5-8,7 непосред перед процед.
непосред перед процед. в глазной практике 300-400 ЕД в 3-5-10 мл дистил воды (хранить не более 3 суток)
в глазной практике 300-400 ЕД в 3-5-10 мл дистил воды (хранить не более 3 суток) воды, хранится в течение в течение суток при Т +2-50С
воды, хранится в течение в течение суток при Т +2-50С Воде
Воде