Препараты допамина для лечения печеночной энцефалопатии
Печеночная энцефалопатия — это серьезное осложнение тяжелой болезни печени. Это заболевание часто проявляется широким спектром симптомов, от незначительных едва различимых признаков до глубокой комы. Симптомы часто развиваются в связи со стрессом, связанным с инфекцией, обезвоживанием, запорами или желудочно-кишечным кровотечением. Точные механизмы, лежащие в основе развития болезни, неизвестны. Экспериментальные исследования позволяют предположить, что изменения в психике, наблюдаемые при печеночной энцефалопатии, отражают изменения в равновесии нейромедиаторов головного мозга.
Допамин играет важнейшую роль в передаче нервного импульса. Причиной нескольких заболеваний нервной системы, в том числе и болезни Паркинсона, является дисфункция в допаминовой системе. Симптомы некоторых пациентов с печеночной энцефалопатией схожи с симптомами пациентов с болезнью Паркинсона (замедленная мозговая деятельность, скованность движений, тремор). Лекарства, известные как препараты допамина (лекарства, имитирующие эффект нейромедиатора допамина), смягчают симптомы у пациентов с болезнью Паркинсона. Применение этих лекарств также было изучено у пациентов с печеночной энцефалопатией.
Лекарства, известные как препараты допамина (лекарства, имитирующие эффект нейромедиатора допамина), смягчают симптомы у пациентов с болезнью Паркинсона. Применение этих лекарств также было изучено у пациентов с печеночной энцефалопатией.
Мы провели настоящий систематический обзор, чтобы определить полезные и вредные эффекты препаратов допамина у пациентов с печеночной энцефалопатией. Наш анализ включил в себя пять небольших испытаний, опубликованных в 1982 году или ранее. Во всех испытаниях, кроме одного, наблюдался высокий риск смещения (т.е. риск систематических ошибок или риск переоценки полезных эффектов или риск недооценки вредных эффектов). Только 144 пациента были включены в пять испытаний, следовательно, присутствует риск случайных ошибок (т.е. игры случая). Наш анализ показал отсутствие значимых различий в симптомах печеночной энцефалопатии или смертности у пациентов, которых лечили препаратами допамина, в сравнении с пациентами, получавшими неактивное плацебо или не получавшими никакого лечения. Число пациентов с неблагоприятными событиями в двух группах вмешательства было сопоставимым. Основываясь на имеющихся доказательствах, мы пришли к выводу, что нет доказательств, чтобы рекомендовать или ограничить использование препаратов допамина при печеночной энцефалопатии. Необходимо больше рандомизированных плацебо-контролируемых клинических испытаний без риска систематических и случайных ошибок, чтобы получить убедительные доказательства по применению препаратов допамина у пациентов с печеночной энцефалопатией.
Число пациентов с неблагоприятными событиями в двух группах вмешательства было сопоставимым. Основываясь на имеющихся доказательствах, мы пришли к выводу, что нет доказательств, чтобы рекомендовать или ограничить использование препаратов допамина при печеночной энцефалопатии. Необходимо больше рандомизированных плацебо-контролируемых клинических испытаний без риска систематических и случайных ошибок, чтобы получить убедительные доказательства по применению препаратов допамина у пациентов с печеночной энцефалопатией.
особенности ведения пациентов на амбулаторном и стационарном этапах
00:00
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
— Сейчас профессор Марина Викторовна Маевская сделает сообщение «Печеночная энцефалопатия».
Марина Викторовна Маевская, профессор:
— Спасибо, Владимир Трофимович. Добрый день, дорогие коллеги.
Печеночная энцефалопатия – это, к сожалению, обычное явление в гастроэнтерологической (более точно, в гипотологической практике). Это одно из основных осложнений цирроза печени, которое встречает каждый врач, сталкивающийся в своей профессиональной жизни с пациентами, страдающими циррозом печени.
Это одно из основных осложнений цирроза печени, которое встречает каждый врач, сталкивающийся в своей профессиональной жизни с пациентами, страдающими циррозом печени.
Печеночная энцефалопатия – это комплекс потенциально обратимых нервно-психических нарушений, которые возникают либо в результате печеночной недостаточности, либо в результате портосистемного шунтирования крови. Как правило, у пациента присутствует тот и другой фактор.
В 1998-м году была принята классификация печеночной энцефалопатии, которую мы не очень используем в своей клинической практике. Во всяком случае, мы никогда не выносим как категорию печеночную энцефалопатию класса А, В, С.
Если пояснить, что это означает, то печеночная энцефалопатия класса А – это энцефалопатия, которая развивается у пациентов с острой печеночной недостаточностью без цирроза печени. Например, острый вирусный гепатит, протекающий с угнетением функций печени, острый алкогольный гепатит без цирроза печени. Аббревиатура А появилась от слова «acute».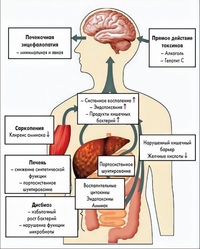
Портосистемное шунтирование в отсутствие заболевания печени приводит к развитию печеночной энцефалопатии класса В. То, с чем мы работаем в своей повседневной практике, наиболее частая форма печеночной энцефалопатии – та, которая наблюдается у пациентов с циррозом печени.
Гораздо более актуально знать особенности течения печеночной энцефалопатии и соответственно строить свою лечебную практику. Термин «минимальная энцефалопатия» заменил такое понятие как «латентная энцефалопатия.
Формы клинически манифестной печеночной энцефалопатии, в основном служат основанием для госпитализации пациентов. Острая, рецидивирующая или хроническая (или персистирующая) энцефалопатия. Она требует непрерывного наблюдения за пациентом и искусства относительно его лечебной тактики.
02:37
Если говорить о том, с какой частотой встречаются различные формы энцефалопатии, то следует сказать, что минимальная энцефалопатия наблюдается по данным разных авторов от 32% до 85% случаев.
Чуть позже я более подробно остановлюсь на этой форме энцефалопатии. Это пациент, который, как правило, находится в амбулаторных условиях. У него клинических проявлений энцефалопатии нет. Но есть определенные аспекты жизни, которые представляют и весьма достойны пристального врачебного внимания. Клинически выраженная энцефалопатия у пациентов с циррозом печени встречается почти у половины и очень часто служит поводом для госпитализации.
Печеночная энцефалопатия – это клинический эквивалент печеночной недостаточности. Она определяет жизненный прогноз пациента. Около 42% пациентов живут в течение первого года появления этого осложнения. Трехлетняя выживаемость этих пациентов составляет всего 23%.
Мы больше привыкли в своей клинической работе к разделению печеночной энцефалопатии на следующие стадии: 1, 2, 3 и 4. Это фигурирует в нашем клиническом диагнозе. Стадии 1, 2, 3 и 4 отражают степень нарушения сознания и других (в том числе интеллектуальных и ментальных) функций у пациентов с циррозом печени с клинически выраженной энцефалопатией.
Стадия 1 – нарушение ритма сна, сонливость, снижение концентрации внимания. Пациент нуждается в дополнительном времени для того, чтобы отвечать на вопросы. Стадия 2 – летаргия или апатия. Стадия 3 – это уже сомноленция и дезориентация. Очень редко пациенты с циррозом и энцефалопатией бывают агрессивными. Но это тоже встречается в нашей практике. Стадия 4 – это печеночная кома. Минимальная энцефалопатия (раньше ее называли латентной энцефалопатией) требует применения психометрических тестов для того, чтобы этот диагноз можно было поставить.
Если пытаться количественно выразить степень глубины энцефалопатии, то при стадии 3 и 4 можно использовать шкалу для оценки глубины комы Глазго. Она включает в себя такие критерии как открывание глаз от спонтанного до отсутствия вообще какого-то ответа и измерения в баллах этого признака, речь и движение. Сумма колеблется от 3-х до 15-ти баллов. Чем меньше сумма по шкале Глазго, тем хуже прогноз пациента, тем глубже нарушение его сознания.
05:47
(Демонстрация слайда).
Тест связи чисел хорошо знаком тем, кто работает с пациентами, страдающими циррозом печени. Он стандартизован. Его количественное выражение представлено на слайде справа. Делается поправка на возраст пациента.
Прежде чем оценивать тест связи чисел, пациенту обязательно нужно дать возможность потренироваться, потому что это тоже влияет на скорость его выполнения. Первый раз он соединяет цифры в том порядке, в котором это положено – это тренировочный тест. Когда он это делает повторно, то уже оценивается время. Но расположение цифр должно быть другим.
Клинически выраженная энцефалопатия – это, как правило, пациент стационарный. Минимальная энцефалопатия (или латентная, как ее называли раньше) – пациент амбулаторный. Соответственно, принципы лечения и наблюдения за этими пациентами немного отличаются.
Но, когда речь идет об энцефалопатии, самое важное – устранение разрешающего фактора. Разрешающие факторы могут быть разными.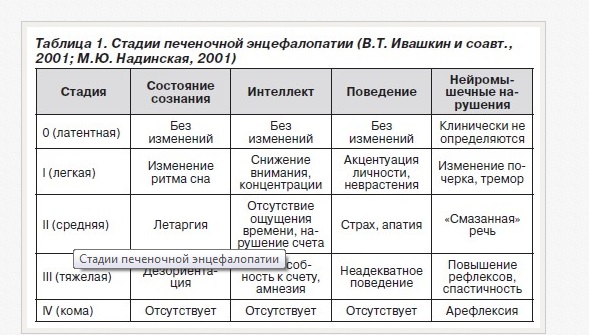 Это может быть какая-то инфекция (вплоть до острой вирусной инфекции). Это может быть кровотечение. Может быть любая стрессовая ситуация для организма.
Это может быть какая-то инфекция (вплоть до острой вирусной инфекции). Это может быть кровотечение. Может быть любая стрессовая ситуация для организма.
Очень важно контролировать какие-то сопутствующие патологические состояния, которые часто встречаются при циррозе печени. Это электролитные нарушения.
Я помню, что когда у нас была монотематическая конференция по циррозу печени в 2009-м году в Суздале, Владимир Трофимович Ивашкин читал лекцию по гипонатриемии при циррозе печени. У пациентов с циррозом гипонатриемия разведения может иметь разную природу и сама по себе вызывать нарушение сознания, весьма серьезные и глубокие.
В тот период времени Владимир Трофимович уделял в своей лекции время дифференциальному диагнозу энцефалопатии при циррозе. Это результат электролитных нарушений или проявления печеночной недостаточности (гипогликемия, уремия). Все это может вносить свой вклад в развитие энцефалопатии.
08:09
Если мы фиксируем печеночную энцефалопатию, мы должны очень быстро начинать эмпирическую терапию. На сегодняшний день для эмпирической терапии печеночной энцефалопатии существует три препарата, которые мы используем либо последовательно, либо одновременно. Это «Лактулоза» («Lactulose»), «Рифаксимин» («Rifaximin») и «L-орнитин-L-аспартат». Каждый из этих препаратов имеет собственную точку приложения.
На сегодняшний день для эмпирической терапии печеночной энцефалопатии существует три препарата, которые мы используем либо последовательно, либо одновременно. Это «Лактулоза» («Lactulose»), «Рифаксимин» («Rifaximin») и «L-орнитин-L-аспартат». Каждый из этих препаратов имеет собственную точку приложения.
Подавление продукции аммония. Аммоний продуцируется протеолитической кишечной флорой. Для того чтобы подавить разложение этой флоры и уменьшить продукцию аммония, используются антибиотики и дисахариды. Дисахариды – это «Лактулоза», «Лактитол» («Lactitol»). На рынке в России присутствует только «Лактулоза».
Воздействие на метаболизм аммония. Для этого используется препарат «L-орнитин-L-аспартат». Это препарат «Гепа-Мерц» («Gepa-Merc»). Все другие препараты в клинической практике не используются. Но о них нужно знать.
«Лактулоза» на протяжении десятилетий входит в стандарт лечения печеночной энцефалопатии. При циррозе печени она используется перорально, в клизмах, вводится через назогастральный зонд. Ее эффективность исследовалась в мета-анализах, в Кохрейновских обзорах. На сегодняшний день постулировано, что это препарат, который относится к препаратам первой линии в лечении печеночной энцефалопатии.
Ее эффективность исследовалась в мета-анализах, в Кохрейновских обзорах. На сегодняшний день постулировано, что это препарат, который относится к препаратам первой линии в лечении печеночной энцефалопатии.
Антибиотики в лечении энцефалопатии при циррозе печени тоже используются очень давно. Многие годы назад в клинической практике применялся «Неомицин» («Neomycin»), «Канамицин» («Kanamycin»), которые обладают ототоксичностью, нефротоксичностью.
Сейчас их вытеснили совсем другие препараты, более эффективные, невсасывающиеся и имеющие очень широкий спектр действия. К таким препаратам относится «Рифаксимин», который в 2009- м году был одобрен FDA как препарат (в том числе первой линии) выбора для лечения печеночной энцефалопатии.
Это очень разумно, потому что в патогенезе практически всех осложнений цирроза печени (в том числе печеночной энцефалопатии) играет роль бактериальная транслокация. Это происходит на фоне застойных явлений в тонкой и в толстой кишке. В условиях портальной гипертензии бактериальная транслокация выступает как пусковой фактор порочного круга. Играет роль в развитии гепаторенального синдрома, варикозных кровотечений (которые, казалось бы, далеки от этого феномена) и, естественно, печеночной энцефалопатии. Изучение эффективности антибиотиков представляется весьма рациональным в этих условиях.
Играет роль в развитии гепаторенального синдрома, варикозных кровотечений (которые, казалось бы, далеки от этого феномена) и, естественно, печеночной энцефалопатии. Изучение эффективности антибиотиков представляется весьма рациональным в этих условиях.
11:26
На сегодняшний день среди них лидирует «Рифаксимин». Этот антибиотик является производным «Рифампицина» («Rifampicin»). Он подавляет ДНК-зависимую РНК-полимеразу и угнетает синтез РНК и различных белков бактерий. У него широкий спектр действия. Он влияет как на анаэробную, так и аэробную флору, как грамположительную, так и грамотрицательную.
Рациональность для использования какого-либо препарата и результаты клинических исследований – это два процесса, которые идут параллельно, но не всегда взаимно дополняют друг друга. В данной ситуации можно сделать ссылки на весьма убедительные клинические исследования.
Одно было опубликовано в 2007-м году. Это исследование было посвящено ретроспективному анализу истории болезни пациентов с циррозом и энцефалопатией в одном лечебном центре. Части пациентов назначалась «Лактулоза». Части пациентов – «Рифаксимин» на протяжении 6-ти месяцев. Было показано, что за период приема этих препаратов на фоне лечения «Рифаксимином» количество госпитализаций пациентов из-за рецидива печеночной энцефалопатии и сам по себе период госпитализации (когда речь шла о стационарных пациентах) были достоверно меньше.
Части пациентов назначалась «Лактулоза». Части пациентов – «Рифаксимин» на протяжении 6-ти месяцев. Было показано, что за период приема этих препаратов на фоне лечения «Рифаксимином» количество госпитализаций пациентов из-за рецидива печеночной энцефалопатии и сам по себе период госпитализации (когда речь шла о стационарных пациентах) были достоверно меньше.
Минимальная печеночная энцефалопатия. Последний результат говорит о том, что пациенты с минимальной печеночной энцефалопатией – это объект для исследования. Минимальная энцефалопатия клинически, как правило, не проявляется. Но она может переходить в клинически манифестную энцефалопатию и служить поводом для госпитализации пациента и экономических затрат.
13:23
Тем не менее, пациенты с минимальной энцефалопатией, когда она выявляется только с использованием специальных тестов, в обычных условиях с точки зрения врача имеют определенные особенности. У них снижены внимание и память. Снижена концентрация внимания.
Они послужили объектом исследования в очень интересном аспекте. Исследование, результаты которого были опубликованы в 2004-м году, было призвано оценить их способность к вождению автомобиля. Этих пациентов разделили на 2 группы. Часть пациентов была с минимальной энцефалопатией. Часть без печеночной энцефалопатии вообще, но с циррозом печени.
В результате было показано, что пациенты с минимальной энцефалопатией и группой контроля вели себя за рулем совершенно по-другому. Правильно оценивать ситуацию, адаптироваться в сложной дорожной ситуации, хорошо концентрировать свое внимание на дороге пациенты с минимальной энцефалопатией не могли.
Их было 14 человек. В пяти случаях потребовалось вмешательство инструктора, чтобы предотвратить дорожно-транспортное происшествие. Пациенты с циррозом, у которых признаков минимальной энцефалопатии не было, никоим образом по своему водительскому мастерству не отличались от группы контроля (группы здоровых).
Не буду здесь приводить, чтобы не терять время, ужасные клинические наблюдения, которые связаны с этим аспектом. Но это исследование лишний раз иллюстрирует то, что пациент с циррозом печени должен очень тщательно мониторироваться на амбулаторном этапе. Минимальную энцефалопатию тоже нужно лечить.
Но это исследование лишний раз иллюстрирует то, что пациент с циррозом печени должен очень тщательно мониторироваться на амбулаторном этапе. Минимальную энцефалопатию тоже нужно лечить.
Это иллюстрируют результаты исследования, которое было опубликовано в любимом журнале нашего руководителя Владимира Трофимовича Ивашкина «The New England Journal of Medecine». Оценивалась эффективность «Рифаксимина» для лечения минимальной энцефалопатии у пациентов на амбулаторном этапе. Курс лечения тоже составил 6 месяцев.
Для того чтобы предотвратить вопрос, хочу сказать, что пациенты непрерывно получали «Рифаксимин» в течение 6-ти месяцев в дозе 1100 мг в сутки. Было показано, что у пациентов на фоне приема «Рифаксимина» по сравнению с группой, которая принимала плацебо, количество рецидивов и госпитализаций из-за обострения энцефалопатии было достоверно меньше.
В заключение мне бы хотелось сказать, что «Рифаксимин» достоверно эффективнее поддерживает ремиссию печеночной энцефалопатии в сравнении с плацебо. Достоверно уменьшает риск госпитализации пациентов из-за рецидивов энцефалопатии.
Достоверно уменьшает риск госпитализации пациентов из-за рецидивов энцефалопатии.
Суммируя все, о чем я говорила, нужно акцентировать внимание на том, что энцефалопатия – это неблагоприятный фактор прогноза для больных циррозом печени. Ранняя диагностика, правильное и своевременное лечение энцефалопатии могут предупредить прогрессирование этого осложнения вплоть до комы.
Диагностика и лечение минимальной энцефалопатии, лечение, в частности с использованием «Рифаксимина», позволяет снизить риск рецидива клинически манифестной энцефалопатии, риск повторных госпитализаций. Это очень важно в экономическом аспекте.
Спасибо за внимание.
Печёночная энцефалопатия: лечение, прогноз.
ЛЕЧЕНИЕ ПЕЧЁНОЧНОЙ ЭНЦЕФАЛОПАТИИ
Лечебная тактика больных ПЭ в первую очередь направлена на устранение факторов, способствующих поддержанию или прогрессированию ПЭ: остановку желудочно-кишечного кровотечения, ликвидацию анемии, инфекции, отказ от алкоголя, отмену больших доз диуретиков и седативных препаратов.
Лечение больных с ОПечН или декомпенсацией ХПечН должно проводиться в условиях отделений интенсивной терапии. Ведение больных в этих состояниях предусматривает поддержание основных жизненно важных функций организма.
Интенсивная терапия проводится в условиях постоянного мониторинга сознания и степени энцефалопатии, показателей гемодинамики (ЧСС, АД, ЦВД), дыхания (ЧДД, SaO2), Нв и Нt, электролитных показателей (К+, Na+), уровня гликемии, биохимических анализов, коагулограммы и др. При развитии дыхательной недостаточности необходимо обеспечить адекватную искусственную вентиляцию лёгких.
В задачи инфузионной терапии входят: восполнение объёма циркулирующей крови, нормализация микроциркуляции, коррекция водно-электролитных и кислотно-основных нарушений, уменьшение уровня интоксикации за счёт дилюции токсинов и стимуляции диуреза. Инфузионная терапия проводится растворами кристаллоидов, глюкозы, крахмалов и декстранов. Для устранения нарушений в системе гемостаза может потребоваться переливание свежезамороженной плазмы, при выраженной анемии – эритроцитной массы. При угнетении сократительной способности миокарда назначают препараты с инотропным действием – норадреналин, добутамин. Развитие полиорганной недостаточности требует соблюдения всех принципов ведения больных в критических состояниях.
При угнетении сократительной способности миокарда назначают препараты с инотропным действием – норадреналин, добутамин. Развитие полиорганной недостаточности требует соблюдения всех принципов ведения больных в критических состояниях.
1. Диета.
Особое внимание у больных ПечН следует уделять коррекции белковой недостаточности, поскольку при возрастании белковой нагрузки на печень могут усугубляться признаки ПЭ. Соблюдение диеты больными приводит к уменьшению образования аммиака и других токсинов в толстой кишке и соответствующему снижению гипераммониемии.
В случаях хронической ПЭ рекомендуется ограничить потребление белка до 1 г на 1 кг массы тела, а при прогрессировании печёночной энцефалопатии до III-IV стадии – до 20-30 г/сут. Во время выздоровления содержание белка увеличивают на 10 г/сут через день. После ликвидации признаков ПЭ количество вводимого в организм белка может быть увеличено до 80-100 г/сут. Предпочтение следует отдавать растительным белкам, поскольку они имеют меньший аммониегенный эффект и содержат небольшое количество ароматических аминокислот.
В качестве источников энергии у больных ХПечН используют глюкозу и жиры. Считается, что за счет глюкозы потребности в небелковых калориях должны удовлетворяться на 50-60%. За счёт жиров у больных ХПечН удовлетворяется 40-50% потребностей в небелковой энергии. Установлено, что при ЦП окисление введённых липидов и их клиренс не нарушены.
Имеются специальные смеси для проведения энтерального питания, например Нутриэн Гепа (Нутритек, Россия). Это специализированная смесь с повышенным содержанием разветвлённых аминокислот и пониженным – ароматических аминокислот, предназначенная для использования у больных с заболеваниями печени и печёночной энцефалопатией. По количеству и качеству питательных веществ смесь соответствует современным подходам к предупреждению и лечению белково-энергетических нарушений у больных печёночной недостаточностью (ПечН) с целью нормализации азотистого баланса, питательного статуса, разрешения ПЭ. В одном литре продукта содержится 26 г белка, 24 г жиров, 170 г углеводов. Белок представлен на 50% легко усвояемым нативным белком молока с соотношением казеин/сывороточный белок равным 1: 1 и на 50% смесью кристаллических аминокислот L-лейцина, L-изолейцина, L-валина в соотношении 9: 5: 4. Жиры включают смесь среднецепочечных триглицеридов (50%) с натуральными растительными маслами. Отношение среднецепочечных к длинноцепочечным триглицеридам составляет 1: 1. Углеводы включают смесь мальтодекстрина и сахарозы. С целью обеспечения потребности в белках используются специальные растворы аминокислот для парентерального введения с приставкой Гепа. В соответствии с рекомендациями ESPEN (2009) растворы аминокислот назначяются при ПЭ III-IV стадии.
Белок представлен на 50% легко усвояемым нативным белком молока с соотношением казеин/сывороточный белок равным 1: 1 и на 50% смесью кристаллических аминокислот L-лейцина, L-изолейцина, L-валина в соотношении 9: 5: 4. Жиры включают смесь среднецепочечных триглицеридов (50%) с натуральными растительными маслами. Отношение среднецепочечных к длинноцепочечным триглицеридам составляет 1: 1. Углеводы включают смесь мальтодекстрина и сахарозы. С целью обеспечения потребности в белках используются специальные растворы аминокислот для парентерального введения с приставкой Гепа. В соответствии с рекомендациями ESPEN (2009) растворы аминокислот назначяются при ПЭ III-IV стадии.
2. Медикаментозная терапия.
Лекарственные препараты, применяемые в терапии ПЭ, различаются по механизму действия и точки приложения. Одно из основных мест занимают лекарственные средства, снижающие гипераммониемию. Этот эффект достигается за счёт уменьшения образования аммиака в кишечнике, усиления обезвреживания аммиака в печени и связывания аммиака в крови.
Лактулоза (β-галактозидофруктоза) представляет собой синтетический дисахарид, который расщепляется в толстой кишке под действием микрофлоры на молочную и уксусную кислоты. В свою очередь снижение рН кишечника, припятствует размножению бактерий-амминопродуцентов и всасыванию аммиака. Лактулоза считается «золотым стандартом» лечения больных ПЭ. Доза препарата составляет 15-45 мл каждые 8-12 часов до получения стула 2-3 раза в сутки. В случае невозможности использования лактулозы per os назначяются клизмы в объёме 300 мл лактулозы на 700 мл воды. Положительный эффект применения лактулозы отмечается у 60-70% больных с ПЭ.
Неомицин считается альтернативой невсасывающимся дисахаридам. Неомицин назначается в случае непереносимости невсасывающихся дисахаридов или при невозможности наблюдения за их воздействием, например у больных с диареей. Неомицин оказывает воздействие на микрофлору кишечника, вырабатывающую аммиак. Неомицин плохо всасывается в кишечнике, поэтому его токсичность (нефро- и ототоксичность) может возникать в результате длительного приёма. Доза препарата составляет от 3 до 6 г/сут в течение первых 2-3 дней, затем следует снизить дозу до 1-2 г/сут.
Доза препарата составляет от 3 до 6 г/сут в течение первых 2-3 дней, затем следует снизить дозу до 1-2 г/сут.
L-орнитин-L-аспартат (Гепа-Мерц) , представляет собой стабильную соль двух аминокислот L-орнитина и L-аспартата. L-орнитин активирует в перипортальных гепатоцитах карбомаилфосфатсинтетазу I – ведущий фермент синтеза мочевины. Кроме того, L-орнитин и L-аспартат относятся к субстратам цикла синтеза мочевины и глутамина, причем образование глутамина активируется не только в печени, но и в мышцах. Это наиболее важно для больных ПечН, когда активность ферментов орнитинового цикла снижена, а синтез глутамина в мышцах является основной реакцией обезвреживания аммиака.
При проведении лечения Гепа-Мерцем используют следующие схемы: на 1-м этапе препарат вводят внутривенно по 20-40 г в сутки в течение 7 дней, на 2-м этапе препарат назначают per os по 18 г/сут в течение 14 дней.
a-Кетоглюконат орнитина усиливает обезвреживание аммиака в крови. Препарат вводят внутривенно в дозе 15-25 г/сут или внутримышечно – 2-6 г/сут в зависимости от тяжести ПЭ. Механизм гипоаммониемического действия схож с Гепа-Мерцем.
Препарат вводят внутривенно в дозе 15-25 г/сут или внутримышечно – 2-6 г/сут в зависимости от тяжести ПЭ. Механизм гипоаммониемического действия схож с Гепа-Мерцем.
Для лечения ПЭ применяют лекарственные средства, механизм действия которых направлен на уменьшение тормозных процессов в ЦНС. Наиболее известным из них является антагонист бензодиазепиновых рецепторов – флумазенил. Флумазенил назначают внутривенно струйно в дозе 0, 8-1 мг, после улучшения состояния больного переходят на пероральный приём препарата в дозе 50 мг/сут. В клинических исследованиях у 560 больных ХПечН было установлено, что в группе, где назначали флумазенил, уменьшение степени ПЭ наблюдали у 15% больных, в контрольной группе улучшение наступило лишь у 3% больных.
Дополнительно для подавления флоры кишечника, которая продуцирует аммиак и другие токсины, назначают приём антибиотиков (рифаксимин, метронидазол, ципрофлоксацин, ванкомицин, неомицин). Наиболее часто в практике используются метронидазол-800 мг/сут, ванкомицин-0, 6-2, 0 г/сут и ципрофлоксацин-500 мг/сут. Длительность терапии антибактериальными препаратами обычно составляет 5 дней. Назначение антибиотиков сочетают с применением высоких клизм, позволяющих очистить толстую кишку на максимальном протяжении. Санация кишечника с целью удаления азотсодержащих субстанций особенно актуальна при желудочно-кишечных кровотечениях.
Длительность терапии антибактериальными препаратами обычно составляет 5 дней. Назначение антибиотиков сочетают с применением высоких клизм, позволяющих очистить толстую кишку на максимальном протяжении. Санация кишечника с целью удаления азотсодержащих субстанций особенно актуальна при желудочно-кишечных кровотечениях.
Гепасол А представлен фирмой производителем как специальное средство для парентерального питания. В состав препарата входят L-аргинин, аспарагиновая кислота, сорбит, L-яблочная кислота, витамины и электролиты. Энергетическая ценность 1000 мл составляет 200 ккал. Однако основным лечебным действием Гепасола А служит его способность снижать выраженность гипераммониемии. L-аргинин и аспарагиновая кислота относятся к числу важных субстратов орнитинового цикла синтеза мочевины, который происходит в печени. Яблочная кислота служит основой для пополнения запасов аспарагина в организме. Показаниями к назначению являются ПЭ на фоне острых и хронических заболеваний печени, ПЭ после наложения портосистемных анастамозов. Отмечен положительный эффект от применения Гепасола А у больных с ПЭ I-II степени. Гепасол А вводят внутривенно в дозе 500 мл, возможно повторное введение каждые 12 ч. Однако при углублении тяжести ПЭ больных переводили на терапию L-орнитином-L-аспартатом.
Отмечен положительный эффект от применения Гепасола А у больных с ПЭ I-II степени. Гепасол А вводят внутривенно в дозе 500 мл, возможно повторное введение каждые 12 ч. Однако при углублении тяжести ПЭ больных переводили на терапию L-орнитином-L-аспартатом.
3. Окклюзия шунтов.
Одной из причин развития ПЭ является формирование портокавальных шунтов. Крупные спонтанные портокавальные шунты обычно сочетаются со стойкой ПЭ и могут привести к госпитализации больного в состоянии комы. У больных ХПечН ПЭ может также возникать после ТВПШ. Лечебная тактика подразумевает окклюзию шунтов в случае постоянной и рефрактерной энцефалопатии. Большая часть эпизодов ПЭ развивается через 2 месяца после ТВПШ и хорошо отвечает на лечение лактулозой. С течение времени происходит уменьшение просвета шунтов, что тоже может привести к регрессу энцефалопатии. При тяжёлой ПЭ производят окклюзию портосистемных шунтов рентгенэндоваскулярными методами. Считается, что рентгенэндоваскулярные методы более безопасна по сравнению с хирургическими методами.
4. Применение экстракорпоральных методов детоксикации.
Потенциально эффективными методами терапии критических состояний, к которым относится ПечН, являются экстракорпоральные методы лечения (ЭМЛ). В настоящий момент ЭМЛ стали неотъемлемым компонентом терапии больных в критических состояниях: 67-84% больным, находящихся в отделениях интенсивной терапии, проводится эктракорпоральная детоксикация. В основе действие ЭМЛ на организм больного лежит снижение уровня интоксикации, коррекция уремических нарушений, контроль водно-электролитного и кислотно-основного обменов.
У больных с ПечН экстракорпоральная поддержка направлена на создание условий для восстановления функции печени. На данный момент ЭМЛ используются как «мост» для трансплантации, т. е. жизнь больного, поддерживается максимально долго с целью подбора донорского органа и выполнения успешной операции. В других случаях ЭМЛ создает условия для регенерации гепатоцитов и восстановления функции печени.
На протяжении нескольких десятилетий для поддержания функции печени и борьбы с осложнениями ПечН использовались следующие виды ЭМЛ (табл. ).
Таблица
Виды экстракорпоральных методов лечения
печёночной недостаточности
|
Год
|
Метод
|
|
1956
|
Гемодиализ
|
|
1958
|
Обменное переливание крови
|
|
1965
|
Перфузия через свиную печень
|
|
1968
|
Гемосорбция через сорбенты без покрытия
|
|
1972
|
Гемосорбция через сорбенты с покрытием
|
В настоящее время в клинической практике для купирования клинических проявлений ПЭ в настоящее время применяются следующие виды экстракорпоральной поддержки:
1. Плазмаферез.
Плазмаферез.
2. Сепарация и адсорбция фракционированной плазмы.
3. Молекулярная Адсорбирующая Рециркулирующая Система (МАРС).
Плазмаферез (ПА) – это метод, в основе которого лежит возможность удаления большого объёма плазмы с последующим её замещением растворами кристаллоидов, коллоидов, свежезамороженной донорской плазмой и альбумином. ПА является эффективным методом, так как в состоянии удалять широкий спектр токсических веществ, включая альбуминсвязанные токсины (АСТ) (билирубин, ароматические аминокислоты и др. ). Исследования показали, что ПА уменьшает проявления интоксикации, снижает степень ПЭ.
Для проведения ПА используются сепараторы клеток с непрерывно-поточным разделением крови на клеточные элементы и плазму и плазмофильтры где происходит разделение цельной крови на плазму и форменные элементы.
При ПЭ осуществляют эксфузию 0, 5-2 объёмов циркулирующей плазмы за один сеанс в зависимости от степени проявления клинических симптомов энцефалопатии. Для поддержания гемодинамической стабильности при проведении ПА, а также для компенсации удалённых факторов свертывания, замещение удаляемого объёма плазмы осуществляют свежеразмороженной донорской плазмой, раствором альбумина, коллоидов и кристаллоидов.
Для поддержания гемодинамической стабильности при проведении ПА, а также для компенсации удалённых факторов свертывания, замещение удаляемого объёма плазмы осуществляют свежеразмороженной донорской плазмой, раствором альбумина, коллоидов и кристаллоидов.
Сепарация и адсорбция фракционированной плазмы Prometheus (Фрезениус, Германия). Система Prometheus состоит из двух экстракорпоральных контуров: контур циркуляции крови и контур циркуляции плазмы. Сепарация плазмы происходит с помощью высокопроницаемого фильтра. Мембрана проницаема для молекул с весом 250 кДа, т. е. для альбумина (коэффициент просеивания 0, 6). Молекула альбумина больного вместе с АСТ циркулирует по контуру через колонку с нейтральной смолой (prometh 01) и колонку с анионообменной смолой (prometh 02). Затем кровь проходит через высокопоточный диализатор из полисульфонового волокна. В результате альбумин освобождается от токсинов и возвращается в контур с кровью. Затем кровь проходит через высокопроницаемый диализатор, где удаляются водорастворимые токсины. Клиническое использование системы Prometheus показало, что во время процедуры удаляются билирубин, желчные кислоты, креатинин, мочевина и аммиак.
Клиническое использование системы Prometheus показало, что во время процедуры удаляются билирубин, желчные кислоты, креатинин, мочевина и аммиак.
Молекулярная Адсорбирующая Рециркулирующая Система (МАРС) комбинирует два метода – диализа и адсорбции, позволяющей удалять водорастворимые и АСТ. МАРС был разработан в начале 90-х годов XX века (г. Росток, Германия). Кровь больного с помощью перистальтического насоса аппарата искусственной почки поступает через катетер в экстракорпоральный контур, где проходит капиллярный гемодиализатор. Гемодиализатор имеет специальную мембрану, в процессе работы наружная сторона этой мембраны омывается диализирующим раствором, содержащим 20% альбумин, а внутренняя – кровью. Раствор альбумина, насыщенный гидрофобными и водорастворимыми токсинами, направляется к низкопроницаемому фильтру, где за счёт применения бикарбонатного диализирующего раствора происходит удаление водорастворимых веществ: мочевины, креатинина, аммиака. Через этот элемент возможно проведение ультрафильтрации и коррекции водно-электролитных нарушений. Далее происходит регенерация альбумина, а точнее делигандилизация молекул альбумина во время его перфузии через активированный уголь и анионобменную смолу, после чего регенерированный альбумин вновь поступает в капиллярный гемодиализатор. На уровне МАРС-фильтра АСТ по градиенту концентрации переходят из крови больного в концентрированный альбуминсодержащий диализирующий раствор. Снижение уровня АСТ в крови больного приводит к уменьшению уровня интоксикации, тем самым, способствуя регенерации печеночных клеток.
Далее происходит регенерация альбумина, а точнее делигандилизация молекул альбумина во время его перфузии через активированный уголь и анионобменную смолу, после чего регенерированный альбумин вновь поступает в капиллярный гемодиализатор. На уровне МАРС-фильтра АСТ по градиенту концентрации переходят из крови больного в концентрированный альбуминсодержащий диализирующий раствор. Снижение уровня АСТ в крови больного приводит к уменьшению уровня интоксикации, тем самым, способствуя регенерации печеночных клеток.
5. Трансплпнтация печени.
Трансплантация печени является окончательным решением проблемы ПЭ, в частности у больных с ХПечН.
Различают ортотопическую трансплантацию печени (ОТП) и гетеротопическую трансплантацию печени (ГТП).
При выполнении ОТП, печень реципиента полностью удаляют и заменяют донорским органом с последующей анатомической реконструкцией. В связи с высоким риском смерти среди реципиентов, были предложены альтернативные варианты трансплантации целого трупного органа, к которым можно отнести трансплантацию печени уменьшенного объёма, split трансплантацию, auxillary трансплантацию печени.
При ГТП печень реципиента сохраняется на своем месте, а печень донора трансплантируют на эктопической территории. Первая ГТП от донора-родственника ребёнку была выполнена в 1989 году Strong R. W. (Австралия) и Nagasue N. (Япония). Наиболее часто методика ГТП используется у детей. Широкому внедрению ГТП у взрослых препятствовало два обстоятельства: безопасность обширных резекций печени для донора и необходимость в обеспечении рецепиента достаточной массой печёночной ткани. ГТП у взрослых стала выполняться, начиная с 1998 года. В соответствии с литературными данными наиболее часто ГТП выполняется у больных с хроническими ВГВ и ВГС, алкогольной болезнью печени, холестатическими заболеваниями печени, гепатоцеллюлярной карциномой.
По данным UNOS общая выживаемость после ТП в течение 1-го, 3-х и 5-ти лет составляет 82, 5, 73, 5 и 67, 5% соответственно. Статистический анализ результатов ТП показывает, что выживаемость при нехолестатических ЦП в течение 1-го года составлет 86, 6%, в течение 5-ти лет – 71, 4%. При холестатических ЦП в течение 1-го года и 5-ти лет – 90, 8% и 81, 2% соответственно.
При холестатических ЦП в течение 1-го года и 5-ти лет – 90, 8% и 81, 2% соответственно.
Основными причинами смерти является дисфункция трансплантата, злокачественные новообразования, рецедивирующие заболевания (ВГС), сердечно-сосудистые заболевания.
ПРОГНОЗ ПЕЧЁНОЧНОЙ ЭНЦЕФАЛОПАТИИ
Следует отметить, что ПЭ является одним из прогностических факторов течения ПечН. Прогноз исхода ПЭ зависит от течения ПечН. На фоне ОПечН приблизительно в 85% случаев кома заканчивается смертью больного. При ХПечН на течение и исход ПЭ влияют такие осложнения как асцит, желтуха, низкий уровень альбумина, присоединение вторичной инфекции, кровотечение из варикозно расширенных вен пищевода и желудка.
Выживаемость больных в стационаре при ПЭ II стадии составляет 60-75%, при III-IV стадиях – около 30%. Интересные данные представлены по изучению годичной выживаемости у больных с дебютом ПЭ. При анализе 111 случаев было установлено, что в течение первого года выживаемость составила 42%, а в течение 3 лет – 23%.
Статья добавлена 4 мая 2016 г.
Острая печеночная недостаточность
Острая печеночная недостаточность
Острая печеночная недостаточность – это тяжелое, быстро развивающееся нарушение работы печени. Ее причиной является быстрая массивная гибель клеток печени. В результате она не справляется со своими функциями, что приводит к нарушению работы всех органов, в частности головного мозга, то есть к энцефалопатии.
Печеночная недостаточность считается острой, если энцефалопатия развивается в течение 8 недель после первых симптомов болезни у людей без предшествовавших заболеваний печени или в течение 3 недель после появления желтухи у людей с предшествовавшими заболеваниями печени.
Это достаточно редкое, но очень опасное для жизни состояние, требующее незамедлительной медицинской помощи. Оно развивается быстро – от 48 часов до нескольких дней или недель. Зачастую ранняя диагностика острой печеночной недостаточности вызывает трудности, так как в начале заболевания отсутствуют ее специфические симптомы.
Зачастую ранняя диагностика острой печеночной недостаточности вызывает трудности, так как в начале заболевания отсутствуют ее специфические симптомы.
Прогноз заболевания напрямую зависит от того, насколько быстро начато лечение. К сожалению, смертность при острой печеночной недостаточности достигает 60-70 %.
Синонимы русские
Молниеносная печеночная недостаточность, фульминантная печеночная недостаточность.
Синонимы английские
Acute liver failure, acute hepatic failure, fulminant hepatic failure, fulminant hepatitis.
Симптомы
Острая печеночная недостаточность может развиваться очень быстро даже у людей, ранее не страдавших заболеваниями печени. При первых признаках болезни необходимо срочно обратиться к врачу для определения точной причины их возникновения. Основные симптомы включают в себя:
- желтушность кожи и склер;
- боль и тяжесть в правом подреберье;
- тошноту, рвоту;
- повышенную кровоточивость;
- слабость;
- отеки;
- чрезмерную сонливость, дезориентацию.

Общая информация о заболевании
Печень – это жизненно важный орган в правой верхней части брюшной полости, под диафрагмой, который граничит с желудком, петлями кишечника и правой почкой. Она состоит из двух основных долей – правой и левой.
Основные функции печени
- Обезвреживание токсинов, аллергенов, ядов. Кровь от органов желудочно-кишечного тракта поступает по воротной вене в печень, где очищается от всех чужеродных вредных веществ, а также токсичных продуктов обмена.
- Синтез белков крови (компонентов свертывающей и противосвертывающей систем крови), гормонов, ферментов, холестерина, жиров и их производных.
- Регуляция уровня гормонов и витаминов посредством хранения запасов жирорастворимых витаминов, микроэлементов, разрушения избытка гормонов.
- Участие в обмене углеводов за счет хранения запасов гликогена – полисахарида, образованного молекулами глюкозы.
- Участие в пищеварении – синтез желчи, которая необходима для переваривания жиров.
 Желчь вырабатывается клетками печени, накапливается в желчном пузыре и по желчным протокам попадает в кишечник.
Желчь вырабатывается клетками печени, накапливается в желчном пузыре и по желчным протокам попадает в кишечник.
В основе печеночной недостаточности лежит гибель большого количества клеток печени. В результате ткань печени не успевает восстанавливаться (регенерироваться), что приводит к нарушению всех ее основных функций.
Причины повреждения клеток печени бывают следующими.
- Прием лекарственных препаратов – противоэпилептических, противотуберкулезных, некоторых антибиотиков, нестероидных противовоспалительных средств (аспирина, ибупрофена), обезболивающих (парацетамола).
- Вирусные гепатиты – чаще гепатит В и А, реже С, D, Е, а также вирус Эпштейна – Барр, цитомегаловирус.
- Отравление ядовитыми грибами.
- Заболевания других органов и систем: инсульт, инфаркт миокарда, массивное кровотечение, тяжелая инфекция, обезвоживание.
- Рак печени.
- Сосудистые заболевания: тромбоз воротной вены и синдром Бадда – Киари (нарушение оттока крови от печени по печеночной вене).

- Болезни обмена веществ: болезнь Вильсона – Коновалова (врождённое нарушение обмена меди, которая накапливается в печени и других органах, нарушая их работу), синдром Рейе (тяжелое поражение печени и головного мозга у детей после перенесенных вирусных инфекций, в основе которого лежит нарушение работы ферментов клеток печени).
Все эти факторы могут вызывать разрушение клеток печени, что приводит к симптомам острой печеночной недостаточности. Печень увеличивается в размерах, воспаляется. Это сопровождается тяжестью, болью в правом подреберье. Нарушается ток крови по печеночным сосудам, и возникает портальная гипертензия – затруднение тока крови и повышение давления в воротной вене, по которой кровь от органов пищеварения попадает в печень. В результате кровь направляется в сосуды пищевода, геморроидальные и околопупочные вены. Эти сосуды из-за увеличенного тока крови могут расширяться, что в сочетании с нарушением синтеза в печени факторов свертывания и повышенной кровоточивостью грозит серьезным кровотечением.
Следствием нарушения оттока крови от органов пищеварения может быть асцит – скопление большого количества жидкости в брюшной полости. При асците живот увеличивается, растягивается, расширяются вены на животе, растет масса тела.
Повреждение клеток печени и то, что кровь от органов желудочно-кишечного тракта течет в обход печени и не очищается, приводит к попаданию токсических веществ в другие органы, в частности в головной мозг. Интоксикация и отек головного мозга вызывают печеночную энцефалопатию – она проявляется дезориентацией, сонливостью, нарушениями речи, двигательными нарушениями, затруднением мышления и восприятия и даже комой.
Отеки возникают из-за нарушения синтетической функции печени, то есть из-за уменьшения синтеза белка. Из-за пониженного количества белка в плазме крови (гипопротеинемии) жидкость выходит из сосудов в ткани, и образуются отеки.
Желтушность кожи, слизистых оболочек, склер при острой печеночной недостаточности является следствием повышения уровня билирубина в крови. Билирубин – это вещество желто-коричневого цвета, которое образуется преимущественно при разрушении эритроцитов. В норме он, попадая в печень, связывается с глюкуроновой кислотой и выводится из организма с желчью. При нарушении работы печени увеличивается количество связанного с глюкуроновой кислотой (прямого) билирубина, который попадает в кровь при разрушении клеток печени. Он и определяет характерную желтоватую окраску кожи.
Билирубин – это вещество желто-коричневого цвета, которое образуется преимущественно при разрушении эритроцитов. В норме он, попадая в печень, связывается с глюкуроновой кислотой и выводится из организма с желчью. При нарушении работы печени увеличивается количество связанного с глюкуроновой кислотой (прямого) билирубина, который попадает в кровь при разрушении клеток печени. Он и определяет характерную желтоватую окраску кожи.
Кто в группе риска?
- Люди, использующие лекарственные препараты в дозах, не предусмотренных инструкцией.
- Употребляющие наркотики.
- Злоупотребляющие алкоголем.
- Не привитые против гепатита А и В.
- Часто контактирующие с высокими дозами токсичных химических веществ – пестицидами, инсектицидами, бытовой химией – без соответствующих средств защиты (маски, перчаток).
- Беременные.
Диагностика
Диагностика острой печеночной недостаточности осложняется тем, что это состояние встречается достаточно редко, развивается стремительно и его симптомы на начальных стадиях носят неспецифический характер, то есть могут быть вызваны другими заболеваниями. При подозрении на печеночную недостаточность большое значение имеют лабораторные исследования.
При подозрении на печеночную недостаточность большое значение имеют лабораторные исследования.
- АСТ (аспартатаминотрансфераза), АЛТ (аланинаминотрансфераза) – печеночные ферменты, которые попадают в кровь при повреждении ткани печени. При острой печеночной недостаточности могут быть повышены.
- Лактатдегидрогеназа (ЛДГ) – фермент, присутствующий во всех тканях организма и участвующий в энергетическом обмене. При повреждении печени его активность увеличивается.
- Билирубин общий – при острой печеночной недостаточности может быть повышен преимущественно за счет прямой (связанной) фракции.
- Протромбиновый индекс. Протромбин – предшественник тромбина, который участвует в образовании сгустков крови. Анализ применяют, чтобы определить скорость свертываемости крови. При острой печеночной недостаточности протромбиновый индекс может быть повышен, что указывает на увеличение времени свертывания крови.
- Фибриноген – фактор свертываемости крови, который синтезируется клетками печени.
 При повреждении печеночной ткани его уровень может быть снижен.
При повреждении печеночной ткани его уровень может быть снижен. - Общий белок сыворотки. При острой печеночной недостаточности уровень общего белка бывает снижен за счет уменьшения количества альбуминов – основных белков плазмы крови, которые синтезируются в печени. Снижение их количества говорит о повреждении клеток печени и нарушении ее синтетической функции.
- Холестерол общий – вещество, которое синтезируется в печени и является элементом клеточных мембран, предшественником желчных кислот и некоторых гормонов. При печеночной недостаточности уровень холестерола может быть понижен, что указывает на нарушение синтетической функции печени.
- Гепатиты А, В, С. Гепатит рассматривается как возможная причина острой печеночной недостаточности.
- Скрининговое исследование на предмет наличия наркотических, психотропных и сильнодействующих веществ. Определение соединений, которые могли стать причиной разрушения клеток печени.

Дополнительные методы исследования
- УЗИ органов брюшной полости. Его используют для того, чтобы выявить увеличение печени, наличие жидкости в брюшной полости (асцит), внутренние кровотечения.
- Биопсия печени. Взятие образца ткани печени с помощью тонкой полой иглы, которая вводится через кожу брюшной стенки после анестезии. При микроскопии взятого образца определяется нарушение структуры печени, повреждение клеток.
Лечение
Пациенты с подозрением на острую печеночную недостаточность должны быть госпитализированы как можно скорее. Лечение направлено на поддержание основных функций организма до восстановления печеночной ткани. При особенно тяжелом течении проводится трансплантация печени. Если известна причина острой печеночной недостаточности, лечение заключается в устранении этого первичного фактора. Часто главной задачей бывает борьба с такими осложнениями заболевания, как отек головного мозга, кровотечения.
Профилактика
- Своевременная вакцинация против гепатита А, В.
- Отказ от алкоголя и наркотиков.
- Использование средств защиты при контакте с токсичными веществами.
- Использование индивидуальных средств гигиены (зубные щетки, бритвы).
- Использование презервативов.
- При пирсинге, татуировках необходимо удостовериться в стерильности используемых инструментов.
- Следование предписаниям врача при приеме любых лекарств.
Рекомендуемые анализы
патогенез, клиника, лечение – тема научной статьи по клинической медицине читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
Печеночная энцефалопатия: патогенез, клиника, лечение
И.В. Дамулин
Одним из осложнений, которое возникает у больных с поражениями печени, является печеночная энцефалопатия (ПЭ). Энцефалопатия развивается у подавляющей части больных с хронической печеночной недостаточностью. Однако в большинстве случаев она протекает субклинически и выявляется лишь при использовании специальных нейропсихологических тестов или по данным параклинических методов исследования, а при своевременной адекватной и успешной терапии печеночной недостаточности эти изменения регрессируют. Однако даже при минимально выраженной ПЭ у больных может нарушаться качество жизни.
Энцефалопатия развивается у подавляющей части больных с хронической печеночной недостаточностью. Однако в большинстве случаев она протекает субклинически и выявляется лишь при использовании специальных нейропсихологических тестов или по данным параклинических методов исследования, а при своевременной адекватной и успешной терапии печеночной недостаточности эти изменения регрессируют. Однако даже при минимально выраженной ПЭ у больных может нарушаться качество жизни.
Развитие печеночной недостаточности может быть острым или подост-рым, либо она может протекать хронически. В основе острого развития, как правило, лежит некий провоцирующий фактор [4, 24]. ПЭ отмечается у 50-80% больных циррозом печени, при этом чаще всего она носит латентный характер [5]. Термин “хроническая ПЭ” (или “портосистемная энцефалопатия”) используется для обозначения состояний у больных с циррозом и портосистемным шунтированием, у которых энцефалопатия носит постоянный или эпизодический характер, причем неврологическая симптоматика может сохраняться или полностью регрессировать в зависимости от течения основного заболевания [24]. ПЭ также может быть связана с синдромом Рейе, врожденными нарушениями метаболизма, болезнью Вильсона-Коновалова, порфирией.
ПЭ также может быть связана с синдромом Рейе, врожденными нарушениями метаболизма, болезнью Вильсона-Коновалова, порфирией.
Причины печеночной энцефалопатии
Наиболее частыми причинами ПЭ являются алкогольный цирроз печени и вирусный гепатит (В и С) [11]. У больных циррозом печени летальность в течение 1 года после возникновения ПЭ достигает 50%, а в течение 5 лет умирает почти 80% больных [24]. Причиной летального исхода в подавляющем большинстве случаев является нарастающая гепатоцеллюлярная недостаточность. Хронические заболевания печени часто сопровождаются портальной гипертензией, а у больных с портальной гипертензией нередко развивается спонтанное портосистемное шунтирование. По данным МР-венографии практически у всех больных циррозом печени, который осложнился развитием ПЭ, выявляются функционирующие портосистемные анастомозы [5]. При портосистемном шунтировании кровь из портальной системы, минуя печень, поступает в системный кровоток. При этом потенциально токсичные агенты, включая аммиак и меркаптаны, которые в норме метаболизируются печеночной тканью, оказывают повреждающее воздействие на головной мозг [15, 16]. И спонтанное, и ятрогенное портосистемное шунтирование (последнее проводится с целью снижения портального венозного давления и уменьшения риска развития кровотечений) являются факторами риска развития энцефалопатии [11]. В частности, при ятрогенном портосистемном шунтировании в 20-25% случаев отмечается развитие клинической картины энцефалопатии, сопровождающейся повышением уровня аммиака в сыворотке крови.
При этом потенциально токсичные агенты, включая аммиак и меркаптаны, которые в норме метаболизируются печеночной тканью, оказывают повреждающее воздействие на головной мозг [15, 16]. И спонтанное, и ятрогенное портосистемное шунтирование (последнее проводится с целью снижения портального венозного давления и уменьшения риска развития кровотечений) являются факторами риска развития энцефалопатии [11]. В частности, при ятрогенном портосистемном шунтировании в 20-25% случаев отмечается развитие клинической картины энцефалопатии, сопровождающейся повышением уровня аммиака в сыворотке крови.
Помимо портосистемного шунтирования факторами риска развития
ПЭ являются возраст и более тяжелое течение заболеваний печени, низкий уровень альбумина в сыворотке крови, гипербилирубинемия, асцит и использование диуретиков. Наличие у пациентов с печеночной недостаточностью сопутствующего гастрита, ассоциированного с H.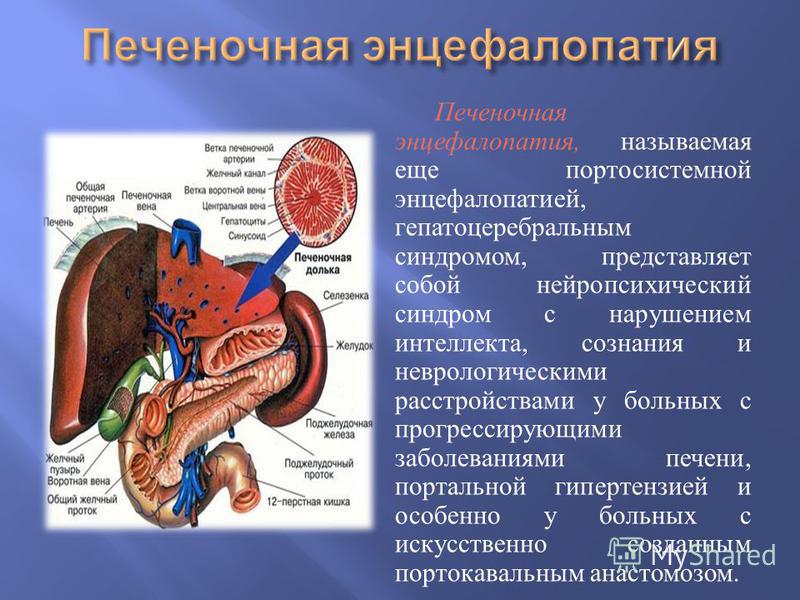 pylori, сопровождается увеличением частоты встречаемости и более тяжелым течением ПЭ, что может быть обусловлено дополнительной продукцией аммиака Helicobacter pylori [5, 40]. Также неблагоприятны снижение моторики тонкой кишки и избыточная бактериальная пролиферация в кишечнике [5].
pylori, сопровождается увеличением частоты встречаемости и более тяжелым течением ПЭ, что может быть обусловлено дополнительной продукцией аммиака Helicobacter pylori [5, 40]. Также неблагоприятны снижение моторики тонкой кишки и избыточная бактериальная пролиферация в кишечнике [5].
Патогенез
Предполагается несколько механизмов, объясняющих повреждение головного мозга при печеночной недостаточности: недостаток выработки поврежденной тканью печени веществ, необходимых для нормального функционирования головного мозга; синтез веществ, обладающих нейро-токсическим действием; снижение способности печени метаболизиро-вать нейротоксические вещества или их предшественники [11, 24]. В практике именно последний механизм имеет наибольшее значение в патогенезе ПЭ. Традиционно в этой ситуации определенное значение придается и патологии, связанной с кишечником. Подтверждением этому является то, что развитие ПЭ может быть спровоцировано употреблением богатой белками пищи, желудочно-кишечным кровотечением или запорами, а ее проявления уменьшены при очистке кишечника и употреблении пищи, бедной белками [11, 24].
Поражение печени приводит к повышению содержания в крови около 20 различных веществ, потенциально
Игорь Владимирович Дамулин —
докт. мед. наук, профессор кафедры нервных болезней Московской медицинской академии им. И.М. Сеченова.
способных приводить к церебральной дисфункции. Среди них наиболее важным считается аммиак [7]. Значимость гипераммониемии как ведущего патогенетического фактора возникновения ПЭ подтверждается целым рядом клинических и экспериментальных данных [7, 11, 12, 15, 24, 30, 33, 43].
Аммиак образуется в кишечнике под действием бактерий, а также при расщеплении белков пищи и глутамина [4]. При ПЭ уровень аммиака в артериальной крови повышен у 90% больных [5], что имеет важное дифференциал ьно-диагностическое значение [15]. Кроме того, при ПЭ определенное значение придается также повышению уровня магния [11].
Кроме того, при ПЭ определенное значение придается также повышению уровня магния [11].
В норме уровень и аммиака, и магния регулируется печенью [11]. Концентрация аммиака в системе портальной вены в 5-10 раз выше, чем в периферической крови [34]. Клиренс аммиака при печеночной недостаточности снижен, и он с артериальной кровью проникает в головной мозг. Выраженность клинических проявлений ПЭ в большинстве случаев коррелирует с уровнем аммиака в сыворотке крови и ткани головного мозга [15, 43]. При этом проницаемость гематоэнцефалического барьера для аммиака при ПЭ существенно нарастает [12].
С повышением уровня аммиака связывают снижение уровня регионарного метаболизма глюкозы [11, 31]. Кроме того, у больных ПЭ в цереброспинальной жидкости отмечается увеличение концентрации продуктов обмена аммиака — глутамина и а-кетоглу-тарата, уровень которых коррелирует с выраженностью неврологических расстройств [5]. В условиях избытка аммиака происходит накопление глутамина, что имеет определенное патогенетическое значение при ПЭ [5, 6, 11, 12]. Наиболее подвержены поражению под действием токсинов глиальные элементы [5]. В эксперименте введение аммиака может вызвать возникновение ПЭ с развитием характерных для этого состояния изменений астроцитов. У экспериментальных животных в условиях гипераммо-
В условиях избытка аммиака происходит накопление глутамина, что имеет определенное патогенетическое значение при ПЭ [5, 6, 11, 12]. Наиболее подвержены поражению под действием токсинов глиальные элементы [5]. В эксперименте введение аммиака может вызвать возникновение ПЭ с развитием характерных для этого состояния изменений астроцитов. У экспериментальных животных в условиях гипераммо-
ниемии возникает астроцитоз, эти животные становятся весьма чувствительными даже к незначительному увеличению концентрации аммиака. Помимо деполяризации мембран корковых астроцитов происходит активация нейрональных ЫМЮА-рецеп-торов и нарушение межклеточной передачи возбуждения. Высказывается предположение, что возникновение поведенческих расстройств у больных ПЭ обусловлено преимущественной локализацией астроцитарных изменений в лобных и височных отделах головного мозга [37]. Повышение концентрации аммиака приводит к повышению активности Ш-синтетазы и связанному с этим процессом окси-дантному стрессу [11]. При этом отмечается повышение потребления _-ар-гинина, предшественника Ш-синте-тазы [11]. Возможно, что повышение концентрации аммиака приводит к нарушениям метаболизма меркаптанов и короткоцепочечных жирных кислот (последние являются недоокисленны-ми продуктами окисления длинноцепочечных жирных кислот) [15]. Таким образом, возможно сочетанное токсическое действие на головной мозг целого ряда веществ, включая аммиак, меркаптаны и короткоцепочечные жирные кислоты, а также фенолов, метаболизм которых при печеночной недостаточности тоже нарушается [5].
При этом отмечается повышение потребления _-ар-гинина, предшественника Ш-синте-тазы [11]. Возможно, что повышение концентрации аммиака приводит к нарушениям метаболизма меркаптанов и короткоцепочечных жирных кислот (последние являются недоокисленны-ми продуктами окисления длинноцепочечных жирных кислот) [15]. Таким образом, возможно сочетанное токсическое действие на головной мозг целого ряда веществ, включая аммиак, меркаптаны и короткоцепочечные жирные кислоты, а также фенолов, метаболизм которых при печеночной недостаточности тоже нарушается [5].
Рассматривая значение аммиака в патогенезе ПЭ, следует учитывать и то, что при очень высоком его уровне в сыворотке крови, превышающем обычно выявляемые при ПЭ величины, может возникать клиническая картина, отличная от классических проявлений ПЭ [23, 24, 43]. Для начальных проявлений этих состояний, весьма гетерогенных по происхождению (наследственные нарушения метаболизма, длительно существующее кровотечение в желудочно-кишечный тракт и др. ) и по клиническим проявлениям, характерно наличие возбуждения, спутанности, атаксии и зрительных нарушений [23]. Также могут возникать тошнота, сонливость и гипервентиляция. При этом часто развиваются эпилептические припадки, обуслов-
) и по клиническим проявлениям, характерно наличие возбуждения, спутанности, атаксии и зрительных нарушений [23]. Также могут возникать тошнота, сонливость и гипервентиляция. При этом часто развиваются эпилептические припадки, обуслов-
ленные повышенной возбудимостью нейронов (в противовес этому для поражений, обусловленных повышением уровня аммиака, характерно усиление процессов торможения в структурах центральной нервной системы) [43].
Кроме того, назначение аммиака в виде солей больным ПЭ обычно не приводит к появлению характерных для этого состояния изменений на ЭЭГ [24], а кратковременные эпизоды повышения уровня аммиака в крови у больных циррозом не сопровождаются психомоторными нарушениями [35]. У 10% больных ПЭ уровень аммиака в крови не повышен [5]. Всё это свидетельствует о том, что гиперам-мониемия является важным, но не единственным патогенетическим фактором развития ПЭ [8]. При печеночной недостаточности происходит повышение проницаемости гематоэнце-фалического барьера не только для аммиака [12], но и для веществ, обладающих нейроингибиторными свойствами, в частности для ГАМК [24]. Некоторые авторы именно с повышением уровня ГАМК связывают возникновение двух основных проявлений ПЭ -двигательных расстройств и снижения уровня сознания [24]. Помимо повышения проницаемости гематоэнцефа-лического барьера, в основе усиления ГАМК-ергических влияний может лежать нарушение пресинаптического ингибирования высвобождения этого нейромедиатора, связанное с уменьшением рецепторов ГАМК-В, а также усиление синтеза и высвобождения астроцитами нейростероидов [24]. Определенное значение в возникновении и прогрессировании когнитивных расстройств при ПЭ также придается изменениям бензодиазепиновых рецепторов [25].
При печеночной недостаточности происходит повышение проницаемости гематоэнце-фалического барьера не только для аммиака [12], но и для веществ, обладающих нейроингибиторными свойствами, в частности для ГАМК [24]. Некоторые авторы именно с повышением уровня ГАМК связывают возникновение двух основных проявлений ПЭ -двигательных расстройств и снижения уровня сознания [24]. Помимо повышения проницаемости гематоэнцефа-лического барьера, в основе усиления ГАМК-ергических влияний может лежать нарушение пресинаптического ингибирования высвобождения этого нейромедиатора, связанное с уменьшением рецепторов ГАМК-В, а также усиление синтеза и высвобождения астроцитами нейростероидов [24]. Определенное значение в возникновении и прогрессировании когнитивных расстройств при ПЭ также придается изменениям бензодиазепиновых рецепторов [25].
Патогенетическое значение выявляемых при ПЭ изменений ГАМК-ре-цепторов и бензодиазепиновых рецепторов (так же как и значение короткоцепочечных жирных кислот и меркаптанов) является предметом дискуссий [43]. В частности, об этом свидетельствует неоднозначный клинический эффект (несмотря на улучшение ЭЭГ-параметров) антагониста
В частности, об этом свидетельствует неоднозначный клинический эффект (несмотря на улучшение ЭЭГ-параметров) антагониста
бензодиазепиновых рецепторов флу-мазенила, действующего также на ГАМК-рецепторы [30].
Помимо ГАМК-ергической системы изменения при ПЭ могут затрагивать и другие нейротрансмиттерные системы, включая глутаматергическую, се-ротонинергическую и дофаминергиче-скую [3, 4, 11, 13, 24]. Высказывается мнение, что ряд клинических проявлений ПЭ может быть обусловлен дисбалансом между глутаматергической и ГАМК-ергической системами на уровне базальных ганглиев [24]. Кроме того, в условиях печеночной недостаточности в головном мозге происходит накопление фенилаланина, тирозина и триптофана, что приводит к образованию так называемых “ложных нейромедиаторов” (фенилэтаноламина, октопамина, тирамина) [5]. Эти вещества могут синтезироваться не в головном мозге -они могут образовываться в кишечнике под действием бактерий и в условиях печеночно-клеточной недостаточности или при формировании портосистемных анастомозов проникать через гематоэнцефалический барьер [5]. При этом “ложные” нейротрансмиттеры замещают “истинные” нейротрансмиттеры и таким образом препятствуют распространению процессов возбуждения и торможения в структурах центральной нервной системы.
При этом “ложные” нейротрансмиттеры замещают “истинные” нейротрансмиттеры и таким образом препятствуют распространению процессов возбуждения и торможения в структурах центральной нервной системы.
Макроскопически головной мозг больных ПЭ часто выглядит неизмененным. Патоморфологические изменения выявляются микроскопически и заключаются в развитии ламинарного или псевдоламинарного некроза коры, образовании множественных микрополостей на границе серого и белого веществ коры головного мозга, а также в базальных ганглиях и мозжечке [18]. Возможно наличие церебральной атрофии (включая атрофию мозжечка), однако это более характерно для ПЭ, обусловленной алкоголизмом, и связано с уменьшением числа клеток Пуркинье и реактивным глио-зом [2, 11].
Характерным для ПЭ микроскопическим феноменом является наличие измененных астроцитов (печеночная глия, альцгеймеровская глия II типа,
астроцитоз альцгеймеровского типа II) с образованием гликогенсодержащих гранул в цитоплазме клеток (в норме гликоген в клетках головного мозга отсутствует) [7, 10, 14, 38]. Астроциты альцгеймеровского типа II характеризуются крупным бледным ядром с краевым отложением хроматина [11, 12]. Выраженность подобных микроскопических изменений нарастает при увеличении уровня аммиака в сыворотке крови, однако они могут отсутствовать при фульминантной печеночной недостаточности [7, 24]. Возникновение астроцитарных нарушений при ПЭ связывают с процессами эк-сайтотоксичности [38]. При этом меняются иммунологические свойства аст-роцитов и активность в них ряда ферментов [11, 12, 38]. Высказывается мнение, что в основе астроцитарной дисфункции лежит внутриклеточный отек без признаков внутричерепной гипертензии [22], что подтверждается результатами МР-спектроскопии [21]. При этом столь характерный для цирроза печени и тяжелой ПЭ респираторный алкалоз рассматривается как адаптивный механизм, поскольку ги-покапния приводит к уменьшению гидратации астроцитов [22]. Впрочем, для остро развившейся печеночной недостаточности и энцефалопатии довольно характерно наличие выраженного отека головного мозга [12, 40].
Астроциты альцгеймеровского типа II характеризуются крупным бледным ядром с краевым отложением хроматина [11, 12]. Выраженность подобных микроскопических изменений нарастает при увеличении уровня аммиака в сыворотке крови, однако они могут отсутствовать при фульминантной печеночной недостаточности [7, 24]. Возникновение астроцитарных нарушений при ПЭ связывают с процессами эк-сайтотоксичности [38]. При этом меняются иммунологические свойства аст-роцитов и активность в них ряда ферментов [11, 12, 38]. Высказывается мнение, что в основе астроцитарной дисфункции лежит внутриклеточный отек без признаков внутричерепной гипертензии [22], что подтверждается результатами МР-спектроскопии [21]. При этом столь характерный для цирроза печени и тяжелой ПЭ респираторный алкалоз рассматривается как адаптивный механизм, поскольку ги-покапния приводит к уменьшению гидратации астроцитов [22]. Впрочем, для остро развившейся печеночной недостаточности и энцефалопатии довольно характерно наличие выраженного отека головного мозга [12, 40].
Клинические особенности и диагностика
Диагностика ПЭ основывается на характерных анамнестических, клинических и параклинических данных и требует исключения иных причин энцефалопатии. При этом не существует какого-либо теста, являющегося чувствительным или специфичным для этого состояния, так же как не существует и патогномоничных для ПЭ клинических проявлений [11, 40].
Когда врач имеет дело с пациентом, у которого обнаруживаются ней-ропсихиатрические или неврологические расстройства, то вне зависимости от наличия заболевания печени в анамнезе необходимо получить ответ
на два вопроса — имеется ли у данного пациента ПЭ и может ли ПЭ лежать в основе имеющихся нарушений [24]. Ответы на эти два вопроса лежат в основе диагностики ПЭ: первый из них определяет наличие клинически явной или субклинически протекающей ПЭ, а второй направлен на выявление признаков гепатоцеллюлярной недостаточности и портосистемного шунтирования.
При оценке анамнеза особое внимание уделяется перенесенным в прошлом или имеющимся в настоящем заболеваниям печени, а также указаниям в семейном анамнезе на эту патологию. Кроме того, важно уточнить, не принимал ли пациент потенциально гепатотоксичные лекарственные препараты, не было ли у него отравлений гепатотоксинами и не переносил ли он в прошлом вирусный гепатит. Следует заметить, что лекарственные поражения печени составляют около 10% всех побочных реакций, связанных с применением фармакологических препаратов [3]. При этом особенно подвержены подобным осложнениям пациенты онкологического профиля [3].
Таким образом, для диагностики ПЭ необходимо наличие соответствующих клинических или параклинических признаков, свидетельствующих о наличии поражения головного мозга, подтверждения гепатоцеллюлярной недостаточности и исключения всех иных возможных причин энцефалопатии [24]. Основные клинические соматические нарушения, которые могут выявляться у больных ПЭ, — это жел-тушность кожных покровов, задержка жидкости в организме, проявляющаяся асцитом или отеком суставов, склонность к кровотечениям, что внешне может проявляться подкожными кровоподтеками. Клинические признаки портосистемного шунтирования включают асцит, расширение вен брюшной стенки и венозные шумы в пупочной области и в области мечевидного отростка. Кроме того, у больных могут выявляться такие “классические”, но неспецифичные признаки поражения печени, как характерные
Клинические признаки портосистемного шунтирования включают асцит, расширение вен брюшной стенки и венозные шумы в пупочной области и в области мечевидного отростка. Кроме того, у больных могут выявляться такие “классические”, но неспецифичные признаки поражения печени, как характерные
кожные ангиомы и эритема ладоней. Также может отмечаться характерный печеночный запах (“fetor hepaticus”), обусловленный образованием диме-тилсульфида и триметиламина, и гипервентиляция [4, 11].
Клиническая симптоматика при ПЭ по своей феноменологии и выраженности нарушений весьма многообразна — от минимальных изменений поведения или нарушений сна до коматозного состояния. Следует подчеркнуть, что выраженность симптомов при ПЭ может меняться в зависимости от течения основного заболевания, особенностей диеты и употребления больным алкоголя.
На ранних стадиях у пациентов могут отмечаться лишь негрубые нарушения поведения и когнитивные расстройства, заметные скорее родственникам и близким больного, чем осматривающим больного врачам [7, 24, 43]. Нередко эти нарушения принимаются за проявления психических заболеваний или действие алкоголя. У больных с циррозом печени вне зависимости от того, проявляется он клинически или нет, выявляются нарушения внимания, расстройства исполнительных функций и замедление скорости психомоторных процессов. Нарушения выражены в большей степени при алкогольном генезе цирроза печени, чем при иных его причинах (при сопоставимой тяжести собственно печеночной недостаточности) [45]. Нередко у пациентов отмечается раздражительность, эмоциональная лабильность и депрессия, а их поведение становится агрессивным [44]. Всё это может приводить к нарушениям активности в повседневной жизни [47] и работоспособности [44]. В основе расстройств на начальных стадиях ПЭ лежит легкая дисфункция лобных, теменных и височных отделов полушарий головного мозга [7, 24], что сопровождается изменениями параметров когнитивного вызванного потенциала Р300 [29, 42, 50]. Эти изменения выявляются у 30-70% больных с субклинической ПЭ.
Нередко эти нарушения принимаются за проявления психических заболеваний или действие алкоголя. У больных с циррозом печени вне зависимости от того, проявляется он клинически или нет, выявляются нарушения внимания, расстройства исполнительных функций и замедление скорости психомоторных процессов. Нарушения выражены в большей степени при алкогольном генезе цирроза печени, чем при иных его причинах (при сопоставимой тяжести собственно печеночной недостаточности) [45]. Нередко у пациентов отмечается раздражительность, эмоциональная лабильность и депрессия, а их поведение становится агрессивным [44]. Всё это может приводить к нарушениям активности в повседневной жизни [47] и работоспособности [44]. В основе расстройств на начальных стадиях ПЭ лежит легкая дисфункция лобных, теменных и височных отделов полушарий головного мозга [7, 24], что сопровождается изменениями параметров когнитивного вызванного потенциала Р300 [29, 42, 50]. Эти изменения выявляются у 30-70% больных с субклинической ПЭ. Иногда наличие когнитивного дефекта маскируется за счет сохранных речевых функций больного [24]. Довольно характер-
Иногда наличие когнитивного дефекта маскируется за счет сохранных речевых функций больного [24]. Довольно характер-
ны для этой стадии нарушения зрительно-пространственных функций. Однако еще до появления зрительнопространственных расстройств, а также мнестических или речевых нарушений у больных могут выявляться нарушения внимания и затруднения при выполнении тонких движений руками. Возникновение этой симптоматики обусловлено субкортикальными расстройствами, связанными с дисфункцией базальных ганглиев и их связей с корой. Перечисленные расстройства чреваты производственным и бытовым травматизмом. Кроме того, у больных с патологией печени нередко выявляется синдром хронической усталости, генез которого связывают с серото-нинергическими нарушениями [24].
Уже на ранних стадиях ПЭ может отмечаться “порхающий” тремор -астериксис, являющийся вариантом негативного миоклонуса, а не собственно тремором [7, 9, 51]. Негативный миоклонус проявляется характерными внезапными нерегулярными непроизвольными короткими и быстрыми движениями, обусловленными ингибированием мышечной активности. Астериксис при ПЭ обычно носит билатеральный характер, однако насильственные движения в руках асимметричны и, как правило, с одной стороны выражены больше, чем с другой. Частота осцилляций этого гиперкинеза при ПЭ — 1-2 в секунду [7]. Для ас-териксиса характерно усиление, когда пациент вытягивает руки, а пальцы находятся в положении гиперэкстензии и не соприкасаются друг с другом [7, 9, 24]. Предложен еще один прием для выявления этого феномена: пациент сжимает своей ладонью два пальца исследователя, при этом если у больного имеется астериксис, то исследователь чувствует, как периодически меняется сила сжатия [16]. Для оценки выраженности астериксиса предложена шкала, рубрификация которой основана на частоте возникновения этого феномена [16]. Астериксис характерен, но не патогномоничен для ПЭ, поскольку он также может отмечаться при церебральной гипоксии, гиперкапнии, уремии, сердечной не-
Негативный миоклонус проявляется характерными внезапными нерегулярными непроизвольными короткими и быстрыми движениями, обусловленными ингибированием мышечной активности. Астериксис при ПЭ обычно носит билатеральный характер, однако насильственные движения в руках асимметричны и, как правило, с одной стороны выражены больше, чем с другой. Частота осцилляций этого гиперкинеза при ПЭ — 1-2 в секунду [7]. Для ас-териксиса характерно усиление, когда пациент вытягивает руки, а пальцы находятся в положении гиперэкстензии и не соприкасаются друг с другом [7, 9, 24]. Предложен еще один прием для выявления этого феномена: пациент сжимает своей ладонью два пальца исследователя, при этом если у больного имеется астериксис, то исследователь чувствует, как периодически меняется сила сжатия [16]. Для оценки выраженности астериксиса предложена шкала, рубрификация которой основана на частоте возникновения этого феномена [16]. Астериксис характерен, но не патогномоничен для ПЭ, поскольку он также может отмечаться при церебральной гипоксии, гиперкапнии, уремии, сердечной не-
достаточности и передозировке седативных препаратов [7, 15, 16, 24, 51].
Для развернутых стадий ПЭ характерно возникновение выраженных нарушений внимания и памяти, изменений письма, конструктивной апрак-сии, акалькулии, психомоторных расстройств, дизартрии и дисфазии, дезориентировки, спутанности, нарушений поведения, апатии, в неблагоприятных случаях возможно развитие коматозного состояния. У больных также может выявляться рефлекторная пирамидная симптоматика в виде оживления глубоких рефлексов, появления патологических пирамидных рефлексов и клонусов в стопах. Кроме того, возможно возникновение гемипареза. По мере прогрессирования патологического процесса (включая развитие коматозного состояния) глубокие рефлексы становятся торпид-ными, а мышечный тонус снижается.
Помимо пирамидной симптоматики у больных могут отмечаться экстра-пирамидные расстройства — гипоми-мия, олигобрадикинезия, повышение мышечного тонуса по пластическому типу, диспросодия, тремор, хореоате-тоз, а также мозжечковая атаксия [32]. В генезе гиперкинетических расстройств при ПЭ имеет значение корковая дисфункция [48]. Возможность возникновения экстрапирамидных нарушений отличает ПЭ от большинства других вариантов дисметаболических энцефалопатий [24]. Важно заметить, что характерные для ПЭ двигательные феномены (в частности, астериксис) на момент осмотра могут у пациента отсутствовать [14].
В генезе гиперкинетических расстройств при ПЭ имеет значение корковая дисфункция [48]. Возможность возникновения экстрапирамидных нарушений отличает ПЭ от большинства других вариантов дисметаболических энцефалопатий [24]. Важно заметить, что характерные для ПЭ двигательные феномены (в частности, астериксис) на момент осмотра могут у пациента отсутствовать [14].
Лечение
Лечение ПЭ основывается на следующих принципах: удаление или ограничение любых факторов, которые могут спровоцировать ее проявления; снижение абсорбции азотсодержащих веществ из желудочно-кишечного тракта; снижение выраженности портосистемного шунтирования; уменьшение патологических изменений головного мозга, обусловленных печеночной недостаточностью [1, 4, 5, 10-12, 24, 26, 40]. Пациентам реко-
мендуют ограничить потребление белков. Желательно употребление белков растительного происхождения (содержащих в меньшем количестве метионин и ароматические аминокислоты и в большем — орнитин и аргинин) и лактальбумина [1].
Поскольку около 50% аммиака в кишечнике продуцируется кишечной флорой, то очищение кишечника является быстрым и эффективным способом удаления аммиакогенных веществ [19]. Для очищения кишечника применяются слабительные средства и очистительные клизмы [1, 4]. С учетом особенностей патогенеза ПЭ основные усилия должны быть направлены на снижение уровня аммиака [11, 14, 24]. Назначение перорального приема лак-тулозы и антибиотиков широкого спектра действия (например, неомицина), а также очищение кишечника направлены на уменьшение всасывания аммиака в кишечнике [1, 3, 4, 10-12, 14, 24, 32, 40]. Лактулоза, расщепляясь бактериями в кишечнике, приводит к снижению pH каловых масс и уменьшению абсорбции аммиака [4, 19]. При этом также нормализуется моторика тонкой кишки [5]. Примерно до 20% больных отмечают появление на первых этапах терапии тошноты, метеоризма, крампи, которые в подавляющем большинстве случаев в течение нескольких дней самостоятельно регрессируют и не требуют отмены препарата. Однако передозировка лакту-лозы может приводить к диарее и дегидратации [19]. На фоне терапии лактулозой крайне редко возможно возникновение летального исхода, обусловленного гипернатриемией [9]. Иногда больные жалуются на чрезмерно сладкий вкус лактулозы, поэтому используются другие формы этого препарата (кристаллическая лактуло-за в виде гранул, добавление специальных ароматизаторов).
Однако передозировка лакту-лозы может приводить к диарее и дегидратации [19]. На фоне терапии лактулозой крайне редко возможно возникновение летального исхода, обусловленного гипернатриемией [9]. Иногда больные жалуются на чрезмерно сладкий вкус лактулозы, поэтому используются другие формы этого препарата (кристаллическая лактуло-за в виде гранул, добавление специальных ароматизаторов).
Эффективность лечения с использованием неомицина примерно аналогична эффективности терапии с применением лактулозы [19, 40]. При лечении неомицином следует учитывать присущие этому антибиотику ото-токсический и нефротоксический эф-
фекты [4, 12, 40], которые обусловлены тем, что небольшое количество этого считающегося неадсорбирующимся антибиотика всё же попадает в кровь [19]. Эффективность метронидазола аналогична эффективности неомици-на, а применение этого препарата ограничивается побочными эффектами, в основном со стороны желудочнокишечного тракта [40]. В последнее время предпочтение отдается ципро-флоксацину, рифаксимину [1, 5]. Недостатком всех этих мер является то, что они приводят к нарушению метаболизма других веществ и не действуют избирательно на обмен аммиака. Поэтому более предпочтительно использование препаратов, селективно снижающих концентрацию аммиака в сыворотке крови, — орнитина, аспарта-та, аргинина и бензоата натрия [11, 12, 24]. Бензоат (и фенилацетат) натрия используются с целью связывания аммиака крови, однако их применение ограничено вследствие непродолжительности эффекта [1].
В последнее время предпочтение отдается ципро-флоксацину, рифаксимину [1, 5]. Недостатком всех этих мер является то, что они приводят к нарушению метаболизма других веществ и не действуют избирательно на обмен аммиака. Поэтому более предпочтительно использование препаратов, селективно снижающих концентрацию аммиака в сыворотке крови, — орнитина, аспарта-та, аргинина и бензоата натрия [11, 12, 24]. Бензоат (и фенилацетат) натрия используются с целью связывания аммиака крови, однако их применение ограничено вследствие непродолжительности эффекта [1].
В последнее время в практической деятельности широко используется _-орнитин-_-аспартат (Гепа-Мерц), активизирующий орнитиновый цикл детоксикации аммиака [1, 5, 11, 12, 17, 19, 26-28, 40, 46]. Этот препарат считается одним из наиболее удачных лекарственных средств, применяемых в настоящее время с целью обезвреживания аммиака [12]. Препарат Гепа-Мерц (Мегг) может использоваться как перорально, так и парентерально и способствует обезвреживанию аммиака в печени, стимулируя синтез мочевины и глутамина [1, 3-5, 19, 28]. Орнитин активирует карба-милфосфатсинтетазу и орнитинкар-бамилтрансферазу и таким образом стимулирует образование глутамина и мочевины [3, 4]. Аспартат активирует синтез глутамина [3, 4].
Орнитин активирует карба-милфосфатсинтетазу и орнитинкар-бамилтрансферазу и таким образом стимулирует образование глутамина и мочевины [3, 4]. Аспартат активирует синтез глутамина [3, 4].
Экспериментальные данные свидетельствуют о способности _-орни-тин-_-аспартата предотвращать развитие печеночной комы [41]. Механизм протективного эффекта препарата связан со снижением уровня аммиака крови, происходящим параллельно увеличению образования мо-
чевины, глутамата и глутамина [41]. Кроме того, имеет значение увеличение в структурах центральной нервной системы концентрации лейцина и аланина [41]. Эффективность _-орнитин-_-аспартата была убедительно продемонстрирована при помощи МР-спек-троскопии [17]. Следует заметить, что параллельно улучшению со стороны центральной нервной системы происходит нормализация белкового обмена и стимулирование синтеза белка в мышечной ткани [28].
В серии двойных слепых плацебо-контролируемых исследований было показано, что на фоне терапии происходит снижение уровня аммиака крови параллельно улучшению в когнитивной сфере [26-28, 46]. При этом препарат характеризуется хорошей переносимостью как при парентеральном, так и при пероральном назначении. Побочные эффекты при назначении _-орнитин-_-аспартата встречаются существенно реже, чем при назначении лактулозы [26, 46]. В основном они связаны с дисфункцией желудочно-кишечного тракта (чаще — тошнота, в ряде случаев сопровождающаяся рвотой) и отмечаются примерно в 5% случаев [27].
При этом препарат характеризуется хорошей переносимостью как при парентеральном, так и при пероральном назначении. Побочные эффекты при назначении _-орнитин-_-аспартата встречаются существенно реже, чем при назначении лактулозы [26, 46]. В основном они связаны с дисфункцией желудочно-кишечного тракта (чаще — тошнота, в ряде случаев сопровождающаяся рвотой) и отмечаются примерно в 5% случаев [27].
Считается, что _-орнитин-_-аспар-тат особенно показан для профилактики развития ПЭ у больных циррозом печени с указанием в анамнезе на повторные желудочно-кишечные кровотечения [41]. Эффективность препарата выше у тех больных, которые полностью отказались от приема алкоголя.
Использование антагониста бензо-диазепиновых рецепторов флумазени-ла, действующего также на ГАМК-ре-цепторы, основывается на ГАМК-ерги-ческой гипотезе патогенеза ПЭ и на предположении о роли увеличенного содержания в головном мозге бензо-диазепиновых агонистов [9, 14, 19, 24, 40]. Эффективность препарата выше, если причиной клинической манифестации ПЭ явился прием бензодиазе-пиновых производных или барбитуратов [1]. Однако возможно, что действие агонистов бензодиазепиновых рецепторов является не единственной причиной усиления ГАМК-ергических
Эффективность препарата выше, если причиной клинической манифестации ПЭ явился прием бензодиазе-пиновых производных или барбитуратов [1]. Однако возможно, что действие агонистов бензодиазепиновых рецепторов является не единственной причиной усиления ГАМК-ергических
влияний при ПЭ. Подобное предположение объясняет факт лишь частичной эффективности флумазенила [5, 24]. В этой связи следует заметить, что существуют экспериментальные данные, свидетельствующие об эффективности антагониста NMDA-рецепторов ме-мантина при печеночной энцефалопатии, что связывают со способностью этого препарата уменьшать выраженность процессов эксайтотоксичности [13, 49].
В тяжелых, трудно поддающихся лечению случаях печеночной недостаточности решается вопрос о пересадке печени [40]. При проведении адекватной терапии и после пересадки печени изменения на МРТ и ЭЭГ могут регрессировать [93]. Однако довольно сложно предсказать, уменьшится или нет после операции неврологическая симптоматика [32]. Кроме того, после операции нередко развиваются осложнения со стороны центральной нервной системы: по клиническим данным это имеет место в 13-47% случаев, а по данным патоморфологического исследования — в 80% случаев [20].
Кроме того, после операции нередко развиваются осложнения со стороны центральной нервной системы: по клиническим данным это имеет место в 13-47% случаев, а по данным патоморфологического исследования — в 80% случаев [20].
Прогноз при субклинической ПЭ и ее легких формах в целом благоприятный — при адекватной и своевременной терапии можно добиться полного регресса клинических и параклинических признаков поражения головного мозга. Однако наличие выраженной ПЭ существенно нарушает качество жизни больных с заболеваниями печени и является прогностически неблагоприятным в плане выживания признаком [36]. Если у больных циррозом без клинических проявлений ПЭ 5-летняя выживаемость составляет 55-70%, то у больных циррозом и ПЭ она снижается до 16-22%.
Список литературы
1. Буеверов А.О. // Рус. мед. журн. 2003.
Т. 5. № 1. С. 32.
5. № 1. С. 32.
2. Дамулин И.В. // Рос. мед. журн. 2005.
№ 2. С. 44.
3. Ларионова В.Б. и др. // Вестник интенсивной терапии. 2004. № 3. С. 1.
4. Наместников Е.В., Лопаткина Т.Н. Печеночная энцефалопатия при хронических заболеваниях печени: лечение и профилактика. М., 2004.
5. Цодиков Г.В., Богомолов П.О. // Рус. мед. журн. 2003. Т. 5. № 2. С. 76.
6. Albrecht J., Dolinska M. // J. Neurosci. Res. 2001. V. 65. P 1.
7. Albrecht J., Jones E.A. // J. Neurol. Sci. 1999. V. 170. P 138.
8. Basile A.S., Jones E.A. // Hepatology. 1997. V. 25. P 103.
9. Basile A.S. et al. // Pharmacol. Rev. 1991.
Basile A.S. et al. // Pharmacol. Rev. 1991.
V 43. P 27.
10. Butterworth R.F. // J. Hepatol. 2000. V 32. P. 171.
11. Butterworth R.F. Cerebral consequences of alcoholic liver disease // Ethanol and the Liver / Ed. by Sherman D.I.N. et al. L. etc., 2002. P 512.
12. Butterworth R.F. // Metabol. Brain Dis.
2002. V. 17. P 221.
13. Chamuleau R.A., Vogels B.A. // Adv. Exp. Med. Biol. 1997. V. 420. P 173.
14. Clark C.M. Metabolic and nutritional disorders associated with dementia // Handbook of Dementing Illnesses / Ed. by Morris J.C. N.Y etc., 1994. P 413-439.
15. Conn H. O. The hepatic encephalopathies // Hepatic Encephalopathy: Syndromes and Therapies / Ed. by Conn H.O., Bircher J. Bloomington, 1994. P 1-12.
O. The hepatic encephalopathies // Hepatic Encephalopathy: Syndromes and Therapies / Ed. by Conn H.O., Bircher J. Bloomington, 1994. P 1-12.
16. Conn H.O. Quantifying the severity of hepatic encephalopathy // Hepatic Encephalopathy: Syndromes and Therapies / Ed. by Conn H.O., Bircher J. Bloomington, 1994. P. 13-26.
17. Delcker A. et al. // Metabol. Brain Dis.
2002. V. 17. P 103.
18. Esiri M.M. Dementia due to other metabolic diseases and toxins // The Neuropathology of Dementia / Ed. by Esiri M.M., Morris J.H. Cambridge, 1997. P 307-331.
19. Ferenci P et al. // Semin. Liver Dis. 1996.
V 16. P 329.
20. Guarino M. et al. // J. Neurol. 1996. V. 243. P. 137.
// J. Neurol. 1996. V. 243. P. 137.
21. Haussinger D. et al. // Gastroenterol. 1994. V. 107. P. 1475.
22. Haussinger D. et al. // J. Hepatol. 2000.
V 32. P 1035.
23. Hawkes N.D. et al. // Postgrad. Med. J.
2001. V. 77. P 717.
24. Jones E.A., Weissenborn K. // J. Neurol. Neurosurg. Psychiatry. 1997. V. 63. P 279.
25. Kapczinski F. et al. // J. Neurol. Neurosurg. Psychiatry. 1996. V. 60. P 1676.
26. Kircheis G. et al. L-ornithine-L-aspartate in the treatment of hepatic encephalopathy // Hepatic Encephalopathy: Syndromes and Therapies / Ed. by Conn H.O., Bircher J. Bloomington, 1994. P 373-383.
Bloomington, 1994. P 373-383.
27. Kircheis G. et al. // Hepatology. 1997. V. 25. P 1351.
28. Kircheis G. et al. // Metabol. Brain Dis. 2002. V. 17. P 453.
29. Kramer L. et al. // Amer. J. Gastroenterol.
2002. V. 97. P 162.
30. Kunze K. // J. Neurol. 2002. V 249. P 1150.
31. Larsen F.S. // Metabol. Brain Dis. 2002. V. 17. P 229.
32. Layrargues G.P // Metabol. Brain Dis. 2001. V. 16. P 27.
33. Lockwood A.H. // Metabol. Brain Dis. 2004. V. 19. P 345.
34. Marchesini G. et al. Endocrine aspects of ammonia and amino acid metabolism // Hepatic Encephalopathy: Syndromes and Therapies / Ed. by Conn H.O., Bircher J. Bloomington, 1994. P. 63-74.
by Conn H.O., Bircher J. Bloomington, 1994. P. 63-74.
35. Masini A. et al. // Metabol. Brain Dis.
2003. V. 18. P 27.
36. Montagnese S. et al. // Metabol. Brain Dis. 2004. V. 19. P 281.
37. Neary D., Snowden J.S. // Pract. Neurol.
2003. V. 3. P. 268.
38. Norenberg M.D. // Semin. Liver Dis.
1996. V. 16. P 245.
39. Pujol A. et al. // Neurology. 1993. V. 43. P. 65.
40. Riordan S.M., Williams R. // N. Engl. J. Med. 1997. V. 337. P 473.
41. Rose C. et al. // Metabol. Brain Dis. 1998. V. 13. P. 147.
Rose C. et al. // Metabol. Brain Dis. 1998. V. 13. P. 147.
42. Saxena N. et al. // Neurol. India. 2001. V. 49. P 350.
43. Schenker S., Brady C.E. Pathogenesis of hepatic encephalopathy // Hepatic Encephalopathy: Syndromes and Therapies / Ed. by Conn H.O., Bircher J. Bloomington, 1994. P 43-61.
44. Schomerus H., Hamster W. // Metabol. Brain Dis. 2001. V. 16. P 37.
45. Schomerus H. et al. // Dig. Dis. Sci. 1981. V. 26. P. 622.
46. Stauch S. et al. // J. Hepatol. 1998. V. 28. P. 856.
47. Tarter R.E. et al. // Gastroenterol. 1984. V. 86. P 1421.
48. Timmermann L. et al. // Neurology. 2002. V. 58. P. 295.
49. Vogels B.A.PM. et al. // Hepatology.
Vogels B.A.PM. et al. // Hepatology.
1997. V. 25. P 820.
50. Weissenborn K. et al. // Electroencepha-logr. Clin. Neurophysiol. 1990. V. 75. P. 289.
51. Young R.R., Shahani B.T. // Adv. Neurol. 1986. V. 43. P 137. J
диагностика и принципы лечения – тема научной статьи по клинической медицине читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
I медицинами совет »1 I 20«
Т.Н. ЛОПАТКИНА, к.м.н., доцент, ЕЛ. ТАНАЩУК, Клиника нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева УКБ №3 Первого МГМУ им. И.М. Сеченова
ПЕЧЕНОЧНАЯ ЭНЦЕФАЛОПАТИЯ
В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ:
ДИАГНОСТИКА И ПРИНЦИПЫ ЛЕЧЕНИЯ
Печеночная энцефалопатия (ПЭ) требует знания всех аспектов ее клинического проявления и специальных психометрических методов для ее выявления. Наличие ПЭ существенно снижает качество жизни больных хроническими диффузными заболеваниями печени. Обсуждается раннее назначение патогенетической терапии для коррекции наиболее распространенной среди больных циррозом печени минимальной ПЭ с целью профилактики очевидной ПЭ, повышения качества жизни больных и их выживаемости.
Наличие ПЭ существенно снижает качество жизни больных хроническими диффузными заболеваниями печени. Обсуждается раннее назначение патогенетической терапии для коррекции наиболее распространенной среди больных циррозом печени минимальной ПЭ с целью профилактики очевидной ПЭ, повышения качества жизни больных и их выживаемости.
Ключевые слова: печеночная энцефалопатия, диагностика, лечение, лактулоза, рифаксимин
ВВЕДЕНИЕ
ПЭ является клиническим проявлением отека мозга, который развивается у больных острыми и хроническими заболеваниями печени (в первую очередь циррозом печени) в ответ на действие различных нейротоксинов (преимущественно аммиака), и свидетельствует о серьезном осложнении заболеваний печени. ПЭ относится к нейропсихиа-трическим синдромам и представляет, как правило, потенциально обратимое нарушение функций головного мозга: психомоторной, интеллектуальной, эмоциональной и поведенческой, обусловленных метаболическими нарушениями вследствие острой или хронической печеночной недостаточности и/или портосистемного шунтирования крови [1, 2, 3]. Непосредственной причиной ПЭ может быть собственно поражение печеночных клеток или нарушение кровотока в воротной вене с формированием коллатерального кровообращения. Чаще всего у больных с синдромом печеночной энцефалопатии присутствуют оба фактора: нарушение дезинтоксикационной функции гепатоци-
Непосредственной причиной ПЭ может быть собственно поражение печеночных клеток или нарушение кровотока в воротной вене с формированием коллатерального кровообращения. Чаще всего у больных с синдромом печеночной энцефалопатии присутствуют оба фактора: нарушение дезинтоксикационной функции гепатоци-
тов (синдром печеночно-клеточной недостаточности) и изменение венозного кровотока в системе воротной вены (синдром портальной гипертен-зии). Острая ПЭ связана с острым поражением печени или хирургическими вмешательствами на печени. Отличается быстроразвивающимися симптомами, прогрессирует в течение нескольких дней, иногда нескольких часов и проявляется яркими неврологическими нарушениями. Хроническую ПЭ часто называют портосистемной энцефалопатией, т. к. у большинства больных присутствует синдром портальной гипертензии.
ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ПЭ
В патогенезе ПЭ доказанной считается гипотеза «глии»: индуцированная токсинами дисфункция астроцитов вызывает изменение процессов нейро-трансмиссии, повышение проницаемости гемато-энцефалического барьера, снижение энергетического обеспечения нейронов и изменение пост-синаптических рецепторов (рис. -АТФазы нейронов. Жирные кислоты тормозят синтез мочевины в печени, чем также способствуют гипераммониемии.
-АТФазы нейронов. Жирные кислоты тормозят синтез мочевины в печени, чем также способствуют гипераммониемии.
Анализ литературных данных показывает, что в настоящее время отсутствует единственный и однозначный фактор патогенеза ПЭ. Существует множество доказательств многофакторного генеза развития ПЭ.
Рисунок 1. Патогенез развития ПЭ
Аммиак
Аминокислотный дисбаланс
Меркаптаны
Жирные кислоты с короткой цепью
ОТЕК И ДИСФУНКЦИЯ АСТРОГЛИИ
Изменение процесса нейротрансмиссии
Изменение постсина-птических рецепторов
Повышение Снижение
проницаемости ГЭБ энергетического обеспечения нейронов
1 1
ЭНЦЕФАЛОПАТИЯ
КЛИНИЧЕСКИЕ СТАДИИ ПЭ
Выделяют несколько, как правило, последовательно развивающих стадий ПЭ (табл. 1). Клинические проявления ПЭ включают расстройства психики и нервно-мышечную симптоматику и варьируют от субклинических, выявляемых лишь специальными психометрическими тестами, до глубокой печеночной комы, являющейся наиболее частой причиной смерти при циррозе печени. Изменения психики развиваются внезапно, особенно после приема большого количества белка, применения седативных препаратов или
1). Клинические проявления ПЭ включают расстройства психики и нервно-мышечную симптоматику и варьируют от субклинических, выявляемых лишь специальными психометрическими тестами, до глубокой печеночной комы, являющейся наиболее частой причиной смерти при циррозе печени. Изменения психики развиваются внезапно, особенно после приема большого количества белка, применения седативных препаратов или
Таблица 1. Стадии ПЭ в соответствии с критериями Международной ассоциации по изучению болезней печени (West-Haven в модификации Conn)
Стадия Психический статус Двигательные нарушения
1 Нарушение ритма сна и бодрствования, легкая несобранность, апатия, возбуждение, беспокойство, эйфория, утомляемость Легкий тремор, нарушение координации, астериксис
2 Сонливость, летаргия, дезориентация, неадекватное поведение Астериксис, дизартрия, примитивные рефлексы (сосательный, хоботковый), атаксия
3 Сопор, выраженная дезориентация, нечеткая речь Гиперрефлексия, патологические рефлексы (Гордона, Бабин-ского, Жуковского), миоклонии, гипервентиляция
4 Кома (нет ответа на вербальные и/или раздражающие стимулы) Децеребрационная ригидность (разгибание в руках и ногах), окулоцефалический феномен. На ранней стадии сохранен ответ на болевые раздражители, на поздней стадии — отсутствие ответа на все раздражители
На ранней стадии сохранен ответ на болевые раздражители, на поздней стадии — отсутствие ответа на все раздражители
I медицинами совет »1 I 20«
действия других провоцирующих факторов. Больные перестают ориентироваться в окружающей обстановке, совершают немотивированные поступки. Постепенно снижается память, развиваются изменения в эмоциональной сфере. Двигательные расстройства представлены экстрапирамидными симптомами, наиболее часто — тремором, который распространяется на мышцы рук (астериксис). Большинство проявлений ПЭ обратимы при лечении, однако у некоторых больных она прогрессирует с развитием деменции, спастического парапареза, церебральной дегенерации и экстрапирамидных двигательных нарушений, обусловленных органическими нарушениями центральной нервной системы. Рецидивируют психические расстройства с нарушениями сознания, увеличивается деградация личности. Наблюдается снижение интеллекта, тремор с атаксией, нистагмом, ригидностью, усиление при эмоциональном возбуждении аномальных движений хореоатетоидного типа.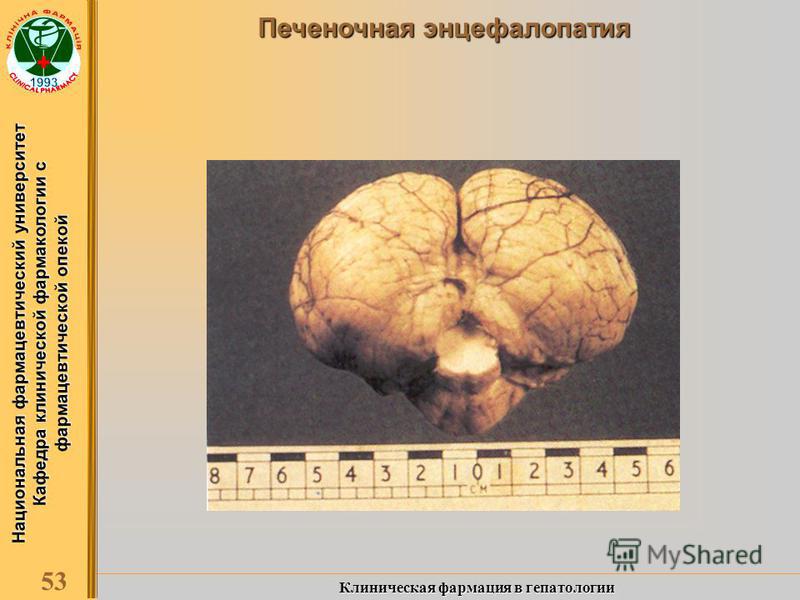 Могут возникать нарушения равновесия, появляться эпилептические припадки, спастическая параплегия [2, 3, 7]. В таком случае следует говорить о необратимой энцефалопатии, которая может частично регрессировать после удачной трансплантации печени.
Могут возникать нарушения равновесия, появляться эпилептические припадки, спастическая параплегия [2, 3, 7]. В таком случае следует говорить о необратимой энцефалопатии, которая может частично регрессировать после удачной трансплантации печени.
В последние годы выяснилось, что кроме явно выраженной ПЭ существует еще субклиническая или латентная форма ПЭ, получившая название минимальной печеночной энцефалопатии (МПЭ). Больные с МПЭ не имеют субъективных симптомов заболевания, однако при специальных психометрических тестах (например, тест связи чисел на скорость реакции) демонстрируют явные нарушения функции головного мозга: снижение быстроты познавательной деятельности и точности тонкой моторики. Чаще всего выявляется дефицит внимания и моторные нарушения, что может реализоваться в невозможность обеспечения должного контроля, например, при управлении сложными механизмами (автотранспортом), а также нарушениями сна. Распространенность минимальной ПЭ среди больных циррозом печени варьирует от 30 до 84% [3]. Клиническая значимость МПЭ определяется двумя факторами. Во-первых, МПЭ может быть стадией,
Клиническая значимость МПЭ определяется двумя факторами. Во-первых, МПЭ может быть стадией,
которая является предвестником последующего развития клинически выраженной печеночной энцефалопатии. Во-вторых, психомоторные нарушения, обнаруживаемые при МПЭ, оказывают негативное влияние на повседневную активность пациентов. В частности, больным сложнее управлять автомобилем и выполнять работу, требующую точных и скоординированных движений. ЗЛошегш Н. и соавт. (1981) оценивали способность к вождению автомобиля у 110 больных циррозом печени. 60% больных циррозом печени были признаны неспособными к вождению, а 25% — способными частично [4]. Большая часть этих пациентов может причинить вред, работая по специальности, требующей концентрации внимания (диспетчерская служба, работа с движущимися механизмами, интеллектуальный труд и т. п.). Исследования свидетельствуют о широкой распространенности субклинической портосистемной энцефалопатии среди больных циррозом печени [3, 4, 5, 6, 7].
ДИАГНОСТИКА ПЭ
Ведущую роль в диагностике ПЭ играет оценка клинических данных, в первую очередь оценка психического состояния больного. Хотя диагностика выраженной ПЭ не представляет особых трудностей, на более ранних стадиях верифицировать этот синдром непросто, т. к. ни один симптом не является абсолютно чувствительным и специфичным. Однако именно ранние стадии ПЭ, особенно МПЭ, имеют особое клиническое значение, т. к., с одной стороны, влияют на качество жизни больных циррозом печени, а с другой — поддаются медикаментозной коррекции. Инструментальные методы обследования играют второстепенную роль и позволяют только заподозрить ПЭ. Среди всех методов выделяется метод вызванных потенциалов как наиболее специфичный для данной патологии, однако его применение ограничено из-за технической сложности. Вызванные потенциалы представляют собой электрические потенциалы, полученные при стимуляции корковых и подкорковых нейронов зрительными или слуховыми стимулами или при раздра-
жении соматосенсорных нервов. Метод позволяет оценить проводимость и функциональное состояние афферентных путей между стимулированными периферическими нервными окончаниями в тканях и коре головного мозга. У больных с клинически выраженной и субклинической энцефалопатией выявляют изменение слуховых и зрительных вызванных потенциалов мозгового ствола, соматосенсорных вызванных потенциалов, однако чувствительность этих методов изменяется от исследования к исследованию и уступает психометрическим тестам.
Метод позволяет оценить проводимость и функциональное состояние афферентных путей между стимулированными периферическими нервными окончаниями в тканях и коре головного мозга. У больных с клинически выраженной и субклинической энцефалопатией выявляют изменение слуховых и зрительных вызванных потенциалов мозгового ствола, соматосенсорных вызванных потенциалов, однако чувствительность этих методов изменяется от исследования к исследованию и уступает психометрическим тестам.
Для выявления МПЭ используют психометрическое тестирование. Психометрические тесты позволяют также объективизировать нарушения функции центральной нервной системы и оценивать их в динамике при лечении МПЭ. Выделяют тесты, направленные на определение быстроты познавательной деятельности (тест связи чисел и тест «число — символ»), и тесты для определения быстроты и точности тонкой моторики (тест линий и тест
обведения пунктирных фигур). У больных с МПЭ страдает также оптико-пространственная деятельность, одним из вариантов нарушения которой является конструктивная апраксия — неспособность скопировать простой узор из спичек или специальных палочек. Конструктивная апраксия выявляется также в нарушении почерка [2, 3, 7]. В диагностике МПЭ имеет значение выявление всего комплекса признаков печеночно-клеточной недостаточности, одним из проявлений которой является ПЭ. Поэтому наряду с оценкой портальной гипертензии (сплено-мегалия, асцит, ВРВП, расширение портальной и селезеночной, а также верхних прямокишечных вен) необходимо исследовать состояние синтетической функции печени (уровень альбумина, протромбина, холестерина и холинэстеразы сыворотки, а также учитывать гипогликемию как маркер более тяжелого поражения печени). Клиническим проявлением печеночно-клеточной недостаточности являются асцит и отечно-асцитический, геморрагический синдромы, прогрессирующая желтуха.
У больных с МПЭ страдает также оптико-пространственная деятельность, одним из вариантов нарушения которой является конструктивная апраксия — неспособность скопировать простой узор из спичек или специальных палочек. Конструктивная апраксия выявляется также в нарушении почерка [2, 3, 7]. В диагностике МПЭ имеет значение выявление всего комплекса признаков печеночно-клеточной недостаточности, одним из проявлений которой является ПЭ. Поэтому наряду с оценкой портальной гипертензии (сплено-мегалия, асцит, ВРВП, расширение портальной и селезеночной, а также верхних прямокишечных вен) необходимо исследовать состояние синтетической функции печени (уровень альбумина, протромбина, холестерина и холинэстеразы сыворотки, а также учитывать гипогликемию как маркер более тяжелого поражения печени). Клиническим проявлением печеночно-клеточной недостаточности являются асцит и отечно-асцитический, геморрагический синдромы, прогрессирующая желтуха.
ООО «Эбботт Лэбораториз»
125171, Москва, Ленинградское шоссе, 16а, стр. 1,6 этаж Тал. +7 (495) 258 42 80; факс: +7 (495) 258 42 81
1,6 этаж Тал. +7 (495) 258 42 80; факс: +7 (495) 258 42 81
ИЕНИШИШМ
I медицинами совет »1 I 20«
Клиническое подозрение на наличие ПЭ может быть объективизировано определением концентрации аммиака в сыворотке крови, однако следует помнить об отсутствии четкой зависимости между концентрацией аммиака в крови и степенью ПЭ. Для подтверждения ПЭ используется электроэнцефалография, при которой изменения выявляются еще до появления биохимических и психических проявлений. Вызванные потенциалы головного мозга на слуховые или зрительные раздражители относятся к более чувствительным методам диагностики ПЭ, однако требуют специальной аппаратуры. Компьютерная и магнитно-резонансная томография позволяют оценить атрофические изменения в коре головного мозга и наличие отека головного мозга. Магнитно-резонансная спектроскопия также относится к высокочувствительным методам диагностики ПЭ, в т.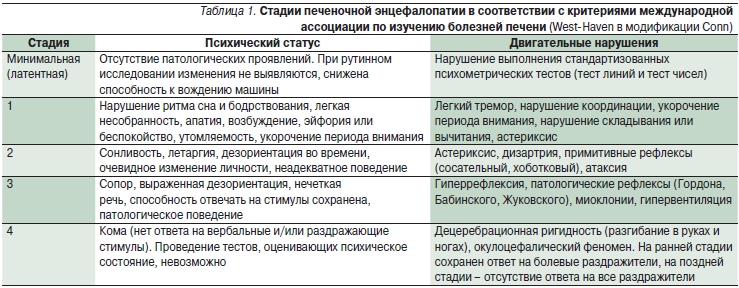 ч. МПЭ [3, 6, 7].
ч. МПЭ [3, 6, 7].
ЛЕЧЕНИЕ ПЭ
ПЭ является серьезным и частым осложнением цирроза печени, которое может приводить к печеночной коме и смерти, поэтому ранняя диагностика и своевременное лечение позволяют существенно улучшить прогноз и выживаемость больных. С учетом патогенетических механизмов развития
Таблица 2. Факторы, способствующие развитию ПЭ
Нарушения электролитного баланса
■ Диуретики
■ Рвота
■ Диарея Кровотечение
■ Варикозно-расширенные вены пищевода и желудка
■ Гастродуоденальные язвы
■ Разрывы при синдроме Меллори — Вейса
Препараты
■ Психотропные средства
■ Алкоголь
Инфекции
■ Спонтанный бактериальный перитонит»
■ Инфекции мочевыводящих путей
■ Бронхолегочная инфекция
Запоры
Богатая белками пища
энцефалопатии принципы терапии включают ряд мероприятий. Лечение прежде всего начинается с выявления и устранения факторов, способствующих развитию ПЭ (табл. 2).
Лечение прежде всего начинается с выявления и устранения факторов, способствующих развитию ПЭ (табл. 2).
Факторы риска развития ПЭ («преципитирую-щие факторы») выявляются у 97% больных с эпизодом энцефалопатии и у более чем 70% больных с персистирующей энцефалопатией. Могут выявляться сразу несколько факторов развития энцефалопатии. Коррекция факторов риска является терапией первой линии. Необходимо исключить другие причины нарушения сознания у больных циррозом печени (гипоксия, гиперкапния, гипо- и гипергликемия, сепсис, алкогольный психоз, ацидоз, уремия, гиповолемия). Учитывая, что наиболее признанной, хотя и не способной объяснить все аспекты развития ПЭ, является гипотеза ведущего значения аммиака, показано, что лечебные мероприятия, способствующие уменьшению образования аммиака (и других нейротоксинов) в кишечнике и препятствующие попаданию их в кровь, а также направленные на связывание аммиака в плазме крови, являются наиболее эффективными [1, 8]. Уменьшение выработки и поступления эндонейротоксинов из кишечника является главным принципом лечения ПЭ. При обострении ПЭ используются высокие очистительные клизмы, в т. ч. сифонные клизмы. Проводится коррекция питания с обеспечением адекватного калора-жа 35-40 ккал/кг/сут и белка 1,2 -1,5 г/кг/сут, который должен быть преимущественно растительным. Для уменьшения образования аммиака в кишечнике наиболее широко используются лактулоза и рифак-симин. Роль лактулозы в уменьшении уровня аммиака довольно понятна: после приема внутрь лактулоза полностью достигает ободочной кишки, расщепляется лактобактериями и бифидобактериями, способствует их размножению и подавляет рост бактерий, разлагающих белок, разлагает молочную кислоту, способствует поддержанию кислотно-щелочного баланса кишечника, снижая рН до 4 ~ 4,5. Кроме того, ее осмотическое давление и стимулирующее действие могут привести к слабительным эффектам, и в конце концов будет достигнуто уменьшение образования и поглощения аммиака. Результаты исследований показывают, что лечение лактулозой
снижает аммиак крови, улучшает психометрические тесты, повышает качество жизни больных в области физической активности, психологии и общественных отношений. Лактулоза может назначаться в клизме у больных, не способных принимать медикаменты через рот. С терапевтической точки зрения доказывается рациональность гипотезы токсического воздействия аммиака на развитие ПЭ.
Показано, что длительное лечение лактулозой способствует снижению уровня аммиака в крови, улучшению психометрических тестов и качества жизни больных ПЭ [9, 10]. Положительный эффект лактулозы достигается у 70-85% больных ПЭ в зависимости от тяжести цирроза печени, степени портальной гипертензии и стадии энцефалопатии [11]. Раннее назначение лактулозы обеспечивает профилактику клинически очевидной энцефалопатии. Препарат принимают в дозах 15-60 мл в день, подбирая оптимальное количество лактулозы для достижения 2-3-кратной дефекации полуоформленным стулом. Основным нежелательным эффектом, наблюдающимся у небольшого числа больных, является вздутие живота в начале лечения. Оно обычно исчезает при длительном приеме препарата параллельно росту сахаролитической флоры кишечника.
Рифаксимин относится к полусинтетическим антибиотикам, селективным для кишечника. Антимикробное действие реализуется через инги-бирование синтеза РНК бактерий кишечника. Препарат относится к невсасываемым антибиотикам и обеспечивает действие в просвете кишки. У здоровых людей при приеме внутрь сохраняется 97% радиомеченного рифаксимина: 96% в кале
и только 0,32% в моче [12]. Препарат можно использовать в курсовом режиме и постоянном приеме, особенно у больных циррозом печени класса В и С по Child. Курсовой прием 2 недели каждого месяца наиболее принят в Европе, в то время как в США рекомендуется ежедневный прием рифакси-мина. Ежедневная доза препарата составляет 1 200 мг. Рифаксимин относится ко второй линии терапии ПЭ, частично в связи с высокой стоимостью препарата, а также в связи с тем, что в ряде случаев лактулоза одна решает поставленные задачи в лечении ПЭ. По частоте нежелательных явлений применение рифаксимина сравнимо с плацебо.
К препаратам, стимулирующим обезвреживание аммиака в печени и мышцах и снижающим уровень аммиака в крови, относится Ь-орнитин-Ь-аспартат, который увеличивает синтез мочевины в печени и глутамина в скелетной мускулатуре, что способствует утилизации аммиака. Препарат также используется в длительной терапии ПЭ. Суточные дозы препарата составляют от 12 до 27 г внутрь в зависимости от тяжести энцефалопатии. При ПЭ 2-3-й стадии препарат можно вводить внутривенно.
Возможно использование комбинированной терапии небольшими дозами лактулозы (15-30 мл) и L-орнитина-Ь-аспартата (6-9 г), что позволяет уменьшить проявления астенического синдрома, улучшить когнитивные функции, а также снизить количество эпизодов клинически выраженной энцефалопатии. Больным циррозом печени, получающим такое лечение, нет необходимости строго контролировать поступление белка с пищей, что также улучшает качество жизни.
ЛИТЕРАТУРА
1. Абдуллаев С. М. Печеночная энцефалопатия: диагностика, профилактика и лечение. — Клиническая гепатология, 2007. №3. — С. 41-45.
2. Ардатская М. Д., Баркалова Л. В., Минушкин О. Н. Печеночная энцефалопатия: определение, вопросы патогенеза, клиника, методы диагностики и принципы лечебной коррекции. — Фарматека, 2011. — №11. — С. 23-28.
3. Бурневич Э. З., Лопаткина Т. Н., Краснова М. С. Печеночная энцефалопатия при циррозе печени. — Гепатологический форум, 2008. — №2. — С. 19-24.
4. Schomerus H., Hamster W., Blunck H. et al. Latent portasystemic encephalopathy. 1. Nature of cerebralfunctionaldefects and their effect on fitness to drive. Dig Dis Sci, 1981; 26: 622-630.
Полный список литературы вы можете запросить в редакции.
Гепатоэнцефалия или печёночная энцефалопатия у собак
Печёночная энцефалопатия у собак — это токсическая патология центральной нервной системы. Она связана с метаболическими нарушениями, причиной которых является недостаточность печени.
Причины заболевания
Гепатоэнцефалия или печёночная энцефалопатия у собак может развиваться вследствие следующих факторов:
- Наличие патологических соединений между воротной веной и системным кровотоком
- Фиброзные изменения в печени
- Гепатит, связанный с нарушением работы иммунитета или инфекциями
- Опухолевый процесс
- Врожденный дефект некоторых печеночных ферментов
- Некоторые особенности кормления животного
Возникновению симптомов этого заболевания способствует диета, насыщенная белками, стрессовые ситуации и сопутствующие патологии.
Патогенез
В основе патогенеза такого состояния лежит повышение содержания в крови веществ, образование которых связано с нарушением деятельности печени. Замедление обмена веществ способствует к длительному нахождению этих веществ в кровеносном русле. В результате, поражаются мембраны нейронов, глиальные клетки и прочие элементы нервной системы.
Выделяют следующие теории поражения ЦНС при патологии печени:
- Повышение концентрации аммиака, для которого характерна нейротоксичность
- Комбинированное воздействие на нервную систему таких токсинов, как индолы, меркаптан и пр.
- Образование веществ, схожих по структуре с бензодиазепинами, которые воздействуют с нервными рецепторами. Вследствие этого, нарушается работа ЦНС.
- Снижение всасывания аминокислот
Поражение нервной системы считается причиной цитотоксического отека. Также снижается активность возбуждаемых рецепторов. Возникают расстройства гематоэнцефалического барьера. Как правило, после этого возникают постепенные дегенеративные изменения.
Печёночная энцефалопатия — симптомы и клиническая картина
В первых стадиях печёночная энцефалопатия у собак проявляется изменением поведения. Это может быть кружение на месте, беспокойство, наклоны головы. Позже наблюдается угнетение сознания вплоть до комы и судороги. Для молодых собак с патологическими соединениями между сосудами характерно замедление роста. Отмечается снижение рефлексов и расстройство зрения.
Диагностика заболевания
Как правило, в крови больных животных повышен билирубин и печеночные ферменты. Стоит отметить, что цирроз проявляется уменьшением содержания ферментов печени. Типичным признаком заболевания считается увеличение содержания аммиака в крови.
Чтобы определить размеры печени, показано проведение рентгенографии собаки. Для обнаружения патологических сосудистых соединений, пользуются контрастной портографией. Для обнаружения структурных изменений печени проводится ультразвуковое исследование. Для исключения других причин поражения мозга осуществляется компьютерная томография и пр. Для подтверждения диагноза показана печёночная биопсия. Чтобы оценить степень угнетения нервной системы, назначается электроэнцефалография.
Гепатоэнцефалию у собак необходимо отличать от травматического повреждения ЦНС и гидроцефалии. Также не стоит путать её с гипоксией мозга, отравлением препаратами, опухолями мозга, бешенством, чумой собак и пр.
Печёночная энцефалопатия у собак — лечение
В первую очередь, назначается диета с ограниченным количеством белка. Для снижения выработки аммиака показано использование лактулозы. Также назначается инфузионная терапия. При этом применяется физиологический раствор, глюкоза и калий хлорид. При отёке мозга используется мочегонный препарат (маннитол). Кома является показанием к внутривенному введению лекарственных средств.
Патологические соединения между сосудами подлежат хирургическому лечению.
Печеночная энцефалопатия: симптомы, стадии и перспективы
Что такое печеночная энцефалопатия?
Печеночная энцефалопатия — это снижение функции мозга, которое возникает в результате тяжелого заболевания печени. В этом состоянии ваша печень не может должным образом удалять токсины из крови. Это вызывает накопление токсинов в кровотоке, что может привести к повреждению мозга.
Печеночная энцефалопатия может быть острой (краткосрочной) или хронической (длительной). В некоторых случаях человек с печеночной энцефалопатией может перестать отвечать и впасть в кому.
Острая печеночная энцефалопатия развивается из-за тяжелого заболевания печени. В основном это происходит у людей с такими состояниями:
- Острый фульминантный вирусный гепатит. Это тяжелый тип вирусного гепатита, который возникает внезапно.
- Токсический гепатит. Токсический гепатит может быть вызван воздействием алкоголя, химических веществ, лекарств или пищевых добавок.
- Синдром Рея. Это редкое и серьезное заболевание чаще встречается у детей.Это вызывает внезапный отек и воспаление печени и мозга.
Острая печеночная энцефалопатия также может быть признаком терминальной печеночной недостаточности.
Хроническая печеночная энцефалопатия может быть постоянной или рецидивирующей.
Те, у кого рецидивирующая версия, будут иметь несколько эпизодов печеночной энцефалопатии на протяжении всей жизни. Им также потребуется постоянное лечение, чтобы предотвратить развитие симптомов. Рецидивирующие случаи обычно наблюдаются у людей с тяжелым циррозом или рубцеванием печени.
Постоянные случаи заболевания редки и наблюдаются у людей, которые не реагируют на лечение и имеют постоянные неврологические заболевания, такие как:
Симптомы печеночной энцефалопатии различаются в зависимости от основной причины повреждения печени.
Симптомы и признаки умеренной печеночной энцефалопатии могут включать:
Симптомы тяжелой печеночной энцефалопатии:
Немедленно обратитесь за неотложной медицинской помощью, если у вас появятся симптомы тяжелой печеночной энцефалопатии.Эти симптомы могут привести к коме, если их не лечить быстро.
Точная причина печеночной энцефалопатии неизвестна. Однако обычно это происходит из-за накопления токсинов в кровотоке. Это происходит, когда ваша печень не может правильно расщеплять токсины.
Печень выводит из организма токсичные химические вещества, такие как аммиак. Эти токсины остаются, когда белки метаболизируются или расщепляются для использования различными органами вашего тела. Ваши почки превращают эти токсины в более безопасные вещества, которые затем удаляются с мочеиспусканием.
Когда ваша печень повреждена, она не может отфильтровать все токсины. Токсины могут накапливаться в кровотоке и потенциально попасть в мозг. Накопление токсинов может также повредить другие органы и нервы.
Печеночная энцефалопатия может быть вызвана:
Несколько тестов используются для диагностики печеночной энцефалопатии.
Анализы крови
Общий анализ крови проверяет ваши эритроциты, лейкоциты и тромбоциты. Низкое количество эритроцитов указывает на потерю крови и недостаток кислорода.
Анализы крови также можно использовать для проверки уровня натрия, калия и аммиака в крови. Слишком большое количество этих веществ является признаком нарушения функции печени.
Визуализирующие тесты
Визуализационные тесты, такие как компьютерная томография или МРТ, могут проверить наличие кровотечения в голове или отклонений в мозге.
Функциональные пробы печени
Функциональные пробы печени проверяют повышенный уровень ферментов. Повышение уровня ферментов указывает на нагрузку на печень или повреждение печени.
Сообщите своему врачу, если у вас заболевание почек или печени.Симптомов, которые вы испытываете вместе с историей болезни, иногда может быть достаточно для диагностики печеночной энцефалопатии.
Печеночная энцефалопатия подразделяется на стадии в зависимости от тяжести симптомов. Общие системы классификации включают критерии Вест-Хейвена и шкалу комы Глазго.
Пять стадий печеночной энцефалопатии, согласно критериям Вест-Хейвена, следующие:
- Стадия 0. На этой стадии симптомы минимальны.
- 1 этап. Симптомы легкие. Они могут включать сокращение концентрации внимания и изменения в ваших привычках сна, такие как гиперсомния или бессонница.
- 2 этап. Симптомы умеренные. На этом этапе вы можете чувствовать себя дезориентированным или вялым.
- Этап 3. Симптомы серьезные. Вы не сможете выполнять основные задачи. Вы также почувствуете смущение и испытаете изменения личности.
- Этап 4. Эта стадия характеризуется комой.
Варианты лечения печеночной энцефалопатии зависят от тяжести и основной причины заболевания.
Скорее всего, вам нужно будет есть меньше белка, если причиной этого состояния стало употребление слишком большого количества белка. Поскольку белок необходим вашему организму для правильного функционирования, диетолог или врач могут составить диету, которая позволит вам получать достаточно белка, не ухудшая ваши симптомы. Продукты с высоким содержанием белка, которых следует избегать, включают:
Лекарства также могут помочь снизить скорость поглощения токсинов в крови. Ваш врач может назначить антибиотики и лактулозу (энулозу), синтетический сахар. Эти лекарства могут притягивать аммиак, созданный кишечными бактериями из крови, в толстую кишку.Затем ваше тело удалит кровь из толстой кишки.
В тяжелых случаях, вызывающих затрудненное дыхание, может потребоваться вентилятор или кислородная маска.
Некоторые люди с этим заболеванием могут иметь право на пересадку печени.
Люди с хронической печеночной энцефалопатией быстрее выздоравливают, чем люди с острой формой этого состояния. Скорость выздоровления увеличивается, если вы получаете лечение до того, как состояние ухудшится.
Печеночная энцефалопатия и ее симптомы могут быть обратимы при правильном лечении.
Осложнения, которые могут быть необратимыми, включают:
Лучший способ предотвратить печеночную энцефалопатию — это предотвратить или лечить заболевание печени. Чтобы снизить вероятность заболевания печени, выполните следующие действия:
Чтобы избежать вирусного гепатита:
- Хорошо мойте руки после посещения туалета или смены подгузника.
- Не передавайте зараженные иглы.
- Избегайте тесного контакта с людьми, у которых диагностирован вирусный гепатит.
- Сделайте прививку от гепатита А и гепатита В.
Печеночная энцефалопатия: симптомы, стадии и перспективы
Что такое печеночная энцефалопатия?
Печеночная энцефалопатия — это снижение функции мозга, которое возникает в результате тяжелого заболевания печени. В этом состоянии ваша печень не может должным образом удалять токсины из крови. Это вызывает накопление токсинов в кровотоке, что может привести к повреждению мозга.
Печеночная энцефалопатия может быть острой (краткосрочной) или хронической (длительной). В некоторых случаях человек с печеночной энцефалопатией может перестать отвечать и впасть в кому.
Острая печеночная энцефалопатия развивается из-за тяжелого заболевания печени. В основном это происходит у людей с такими состояниями:
- Острый фульминантный вирусный гепатит. Это тяжелый тип вирусного гепатита, который возникает внезапно.
- Токсический гепатит. Токсический гепатит может быть вызван воздействием алкоголя, химических веществ, лекарств или пищевых добавок.
- Синдром Рея. Это редкое и серьезное заболевание чаще встречается у детей.Это вызывает внезапный отек и воспаление печени и мозга.
Острая печеночная энцефалопатия также может быть признаком терминальной печеночной недостаточности.
Хроническая печеночная энцефалопатия может быть постоянной или рецидивирующей.
Те, у кого рецидивирующая версия, будут иметь несколько эпизодов печеночной энцефалопатии на протяжении всей жизни. Им также потребуется постоянное лечение, чтобы предотвратить развитие симптомов. Рецидивирующие случаи обычно наблюдаются у людей с тяжелым циррозом или рубцеванием печени.
Постоянные случаи заболевания редки и наблюдаются у людей, которые не реагируют на лечение и имеют постоянные неврологические заболевания, такие как:
Симптомы печеночной энцефалопатии различаются в зависимости от основной причины повреждения печени.
Симптомы и признаки умеренной печеночной энцефалопатии могут включать:
Симптомы тяжелой печеночной энцефалопатии:
Немедленно обратитесь за неотложной медицинской помощью, если у вас появятся симптомы тяжелой печеночной энцефалопатии.Эти симптомы могут привести к коме, если их не лечить быстро.
Точная причина печеночной энцефалопатии неизвестна. Однако обычно это происходит из-за накопления токсинов в кровотоке. Это происходит, когда ваша печень не может правильно расщеплять токсины.
Печень выводит из организма токсичные химические вещества, такие как аммиак. Эти токсины остаются, когда белки метаболизируются или расщепляются для использования различными органами вашего тела. Ваши почки превращают эти токсины в более безопасные вещества, которые затем удаляются с мочеиспусканием.
Когда ваша печень повреждена, она не может отфильтровать все токсины. Токсины могут накапливаться в кровотоке и потенциально попасть в мозг. Накопление токсинов может также повредить другие органы и нервы.
Печеночная энцефалопатия может быть вызвана:
Несколько тестов используются для диагностики печеночной энцефалопатии.
Анализы крови
Общий анализ крови проверяет ваши эритроциты, лейкоциты и тромбоциты. Низкое количество эритроцитов указывает на потерю крови и недостаток кислорода.
Анализы крови также можно использовать для проверки уровня натрия, калия и аммиака в крови. Слишком большое количество этих веществ является признаком нарушения функции печени.
Визуализирующие тесты
Визуализационные тесты, такие как компьютерная томография или МРТ, могут проверить наличие кровотечения в голове или отклонений в мозге.
Функциональные пробы печени
Функциональные пробы печени проверяют повышенный уровень ферментов. Повышение уровня ферментов указывает на нагрузку на печень или повреждение печени.
Сообщите своему врачу, если у вас заболевание почек или печени.Симптомов, которые вы испытываете вместе с историей болезни, иногда может быть достаточно для диагностики печеночной энцефалопатии.
Печеночная энцефалопатия подразделяется на стадии в зависимости от тяжести симптомов. Общие системы классификации включают критерии Вест-Хейвена и шкалу комы Глазго.
Пять стадий печеночной энцефалопатии, согласно критериям Вест-Хейвена, следующие:
- Стадия 0. На этой стадии симптомы минимальны.
- 1 этап. Симптомы легкие. Они могут включать сокращение концентрации внимания и изменения в ваших привычках сна, такие как гиперсомния или бессонница.
- 2 этап. Симптомы умеренные. На этом этапе вы можете чувствовать себя дезориентированным или вялым.
- Этап 3. Симптомы серьезные. Вы не сможете выполнять основные задачи. Вы также почувствуете смущение и испытаете изменения личности.
- Этап 4. Эта стадия характеризуется комой.
Варианты лечения печеночной энцефалопатии зависят от тяжести и основной причины заболевания.
Скорее всего, вам нужно будет есть меньше белка, если причиной этого состояния стало употребление слишком большого количества белка. Поскольку белок необходим вашему организму для правильного функционирования, диетолог или врач могут составить диету, которая позволит вам получать достаточно белка, не ухудшая ваши симптомы. Продукты с высоким содержанием белка, которых следует избегать, включают:
Лекарства также могут помочь снизить скорость поглощения токсинов в крови. Ваш врач может назначить антибиотики и лактулозу (энулозу), синтетический сахар. Эти лекарства могут притягивать аммиак, созданный кишечными бактериями из крови, в толстую кишку.Затем ваше тело удалит кровь из толстой кишки.
В тяжелых случаях, вызывающих затрудненное дыхание, может потребоваться вентилятор или кислородная маска.
Некоторые люди с этим заболеванием могут иметь право на пересадку печени.
Люди с хронической печеночной энцефалопатией быстрее выздоравливают, чем люди с острой формой этого состояния. Скорость выздоровления увеличивается, если вы получаете лечение до того, как состояние ухудшится.
Печеночная энцефалопатия и ее симптомы могут быть обратимы при правильном лечении.
Осложнения, которые могут быть необратимыми, включают:
Лучший способ предотвратить печеночную энцефалопатию — это предотвратить или лечить заболевание печени. Чтобы снизить вероятность заболевания печени, выполните следующие действия:
Чтобы избежать вирусного гепатита:
- Хорошо мойте руки после посещения туалета или смены подгузника.
- Не передавайте зараженные иглы.
- Избегайте тесного контакта с людьми, у которых диагностирован вирусный гепатит.
- Сделайте прививку от гепатита А и гепатита В.
Печеночная энцефалопатия: симптомы, стадии и перспективы
Что такое печеночная энцефалопатия?
Печеночная энцефалопатия — это снижение функции мозга, которое возникает в результате тяжелого заболевания печени. В этом состоянии ваша печень не может должным образом удалять токсины из крови. Это вызывает накопление токсинов в кровотоке, что может привести к повреждению мозга.
Печеночная энцефалопатия может быть острой (краткосрочной) или хронической (длительной). В некоторых случаях человек с печеночной энцефалопатией может перестать отвечать и впасть в кому.
Острая печеночная энцефалопатия развивается из-за тяжелого заболевания печени. В основном это происходит у людей с такими состояниями:
- Острый фульминантный вирусный гепатит. Это тяжелый тип вирусного гепатита, который возникает внезапно.
- Токсический гепатит. Токсический гепатит может быть вызван воздействием алкоголя, химических веществ, лекарств или пищевых добавок.
- Синдром Рея. Это редкое и серьезное заболевание чаще встречается у детей.Это вызывает внезапный отек и воспаление печени и мозга.
Острая печеночная энцефалопатия также может быть признаком терминальной печеночной недостаточности.
Хроническая печеночная энцефалопатия может быть постоянной или рецидивирующей.
Те, у кого рецидивирующая версия, будут иметь несколько эпизодов печеночной энцефалопатии на протяжении всей жизни. Им также потребуется постоянное лечение, чтобы предотвратить развитие симптомов. Рецидивирующие случаи обычно наблюдаются у людей с тяжелым циррозом или рубцеванием печени.
Постоянные случаи заболевания редки и наблюдаются у людей, которые не реагируют на лечение и имеют постоянные неврологические заболевания, такие как:
Симптомы печеночной энцефалопатии различаются в зависимости от основной причины поражения печени.
Симптомы и признаки умеренной печеночной энцефалопатии могут включать:
Симптомы тяжелой печеночной энцефалопатии:
Немедленно обратитесь за неотложной медицинской помощью, если у вас появятся симптомы тяжелой печеночной энцефалопатии.Эти симптомы могут привести к коме, если их не лечить быстро.
Точная причина печеночной энцефалопатии неизвестна. Однако обычно это происходит из-за накопления токсинов в кровотоке. Это происходит, когда ваша печень не может правильно расщеплять токсины.
Печень выводит из организма токсичные химические вещества, такие как аммиак. Эти токсины остаются, когда белки метаболизируются или расщепляются для использования различными органами вашего тела. Ваши почки превращают эти токсины в более безопасные вещества, которые затем удаляются с мочеиспусканием.
Когда ваша печень повреждена, она не может отфильтровать все токсины. Токсины могут накапливаться в кровотоке и потенциально попасть в мозг. Накопление токсинов может также повредить другие органы и нервы.
Печеночная энцефалопатия может быть вызвана:
Несколько тестов используются для диагностики печеночной энцефалопатии.
Анализы крови
Общий анализ крови проверяет ваши эритроциты, лейкоциты и тромбоциты. Низкое количество эритроцитов указывает на потерю крови и недостаток кислорода.
Анализы крови также можно использовать для проверки уровня натрия, калия и аммиака в крови. Слишком большое количество этих веществ является признаком нарушения функции печени.
Визуализирующие тесты
Визуализационные тесты, такие как компьютерная томография или МРТ, могут проверить наличие кровотечения в голове или отклонений в мозге.
Функциональные пробы печени
Функциональные пробы печени проверяют повышенный уровень ферментов. Повышение уровня ферментов указывает на нагрузку на печень или повреждение печени.
Сообщите своему врачу, если у вас заболевание почек или печени.Симптомов, которые вы испытываете вместе с историей болезни, иногда может быть достаточно для диагностики печеночной энцефалопатии.
Печеночная энцефалопатия подразделяется на стадии в зависимости от тяжести симптомов. Общие системы классификации включают критерии Вест-Хейвена и шкалу комы Глазго.
Пять стадий печеночной энцефалопатии, согласно критериям Вест-Хейвена, следующие:
- Стадия 0. На этой стадии симптомы минимальны.
- 1 этап. Симптомы легкие. Они могут включать сокращение концентрации внимания и изменения в ваших привычках сна, такие как гиперсомния или бессонница.
- 2 этап. Симптомы умеренные. На этом этапе вы можете чувствовать себя дезориентированным или вялым.
- Этап 3. Симптомы серьезные. Вы не сможете выполнять основные задачи. Вы также почувствуете смущение и испытаете изменения личности.
- Этап 4. Эта стадия характеризуется комой.
Варианты лечения печеночной энцефалопатии зависят от тяжести и основной причины заболевания.
Скорее всего, вам нужно будет есть меньше белка, если причиной этого состояния стало употребление слишком большого количества белка. Поскольку белок необходим вашему организму для правильного функционирования, диетолог или врач могут составить диету, которая позволит вам получать достаточно белка, не ухудшая ваши симптомы. Продукты с высоким содержанием белка, которых следует избегать, включают:
Лекарства также могут помочь снизить скорость поглощения токсинов в крови. Ваш врач может назначить антибиотики и лактулозу (энулозу), синтетический сахар. Эти лекарства могут притягивать аммиак, созданный кишечными бактериями из крови, в толстую кишку.Затем ваше тело удалит кровь из толстой кишки.
В тяжелых случаях, вызывающих затрудненное дыхание, может потребоваться вентилятор или кислородная маска.
Некоторые люди с этим заболеванием могут иметь право на пересадку печени.
Люди с хронической печеночной энцефалопатией быстрее выздоравливают, чем люди с острой формой этого состояния. Скорость выздоровления увеличивается, если вы получаете лечение до того, как состояние ухудшится.
Печеночная энцефалопатия и ее симптомы могут быть обратимы при правильном лечении.
Осложнения, которые могут быть необратимыми, включают:
Лучший способ предотвратить печеночную энцефалопатию — это предотвратить или лечить заболевание печени. Чтобы снизить вероятность заболевания печени, выполните следующие действия:
Чтобы избежать вирусного гепатита:
- Хорошо мойте руки после посещения туалета или смены подгузника.
- Не передавайте зараженные иглы.
- Избегайте тесного контакта с людьми, у которых диагностирован вирусный гепатит.
- Сделайте прививку от гепатита А и гепатита В.
Печеночная энцефалопатия: симптомы, стадии и перспективы
Что такое печеночная энцефалопатия?
Печеночная энцефалопатия — это снижение функции мозга, которое возникает в результате тяжелого заболевания печени. В этом состоянии ваша печень не может должным образом удалять токсины из крови. Это вызывает накопление токсинов в кровотоке, что может привести к повреждению мозга.
Печеночная энцефалопатия может быть острой (краткосрочной) или хронической (длительной). В некоторых случаях человек с печеночной энцефалопатией может перестать отвечать и впасть в кому.
Острая печеночная энцефалопатия развивается из-за тяжелого заболевания печени. В основном это происходит у людей с такими состояниями:
- Острый фульминантный вирусный гепатит. Это тяжелый тип вирусного гепатита, который возникает внезапно.
- Токсический гепатит. Токсический гепатит может быть вызван воздействием алкоголя, химических веществ, лекарств или пищевых добавок.
- Синдром Рея. Это редкое и серьезное заболевание чаще встречается у детей.Это вызывает внезапный отек и воспаление печени и мозга.
Острая печеночная энцефалопатия также может быть признаком терминальной печеночной недостаточности.
Хроническая печеночная энцефалопатия может быть постоянной или рецидивирующей.
Те, у кого рецидивирующая версия, будут иметь несколько эпизодов печеночной энцефалопатии на протяжении всей жизни. Им также потребуется постоянное лечение, чтобы предотвратить развитие симптомов. Рецидивирующие случаи обычно наблюдаются у людей с тяжелым циррозом или рубцеванием печени.
Постоянные случаи заболевания редки и наблюдаются у людей, которые не реагируют на лечение и имеют постоянные неврологические заболевания, такие как:
Симптомы печеночной энцефалопатии различаются в зависимости от основной причины повреждения печени.
Симптомы и признаки умеренной печеночной энцефалопатии могут включать:
Симптомы тяжелой печеночной энцефалопатии:
Немедленно обратитесь за неотложной медицинской помощью, если у вас появятся симптомы тяжелой печеночной энцефалопатии.Эти симптомы могут привести к коме, если их не лечить быстро.
Точная причина печеночной энцефалопатии неизвестна. Однако обычно это происходит из-за накопления токсинов в кровотоке. Это происходит, когда ваша печень не может правильно расщеплять токсины.
Печень выводит из организма токсичные химические вещества, такие как аммиак. Эти токсины остаются, когда белки метаболизируются или расщепляются для использования различными органами вашего тела. Ваши почки превращают эти токсины в более безопасные вещества, которые затем удаляются с мочеиспусканием.
Когда ваша печень повреждена, она не может отфильтровать все токсины. Токсины могут накапливаться в кровотоке и потенциально попасть в мозг. Накопление токсинов может также повредить другие органы и нервы.
Печеночная энцефалопатия может быть вызвана:
Несколько тестов используются для диагностики печеночной энцефалопатии.
Анализы крови
Общий анализ крови проверяет ваши эритроциты, лейкоциты и тромбоциты. Низкое количество эритроцитов указывает на потерю крови и недостаток кислорода.
Анализы крови также можно использовать для проверки уровня натрия, калия и аммиака в крови. Слишком большое количество этих веществ является признаком нарушения функции печени.
Визуализирующие тесты
Визуализационные тесты, такие как компьютерная томография или МРТ, могут проверить наличие кровотечения в голове или отклонений в мозге.
Функциональные пробы печени
Функциональные пробы печени проверяют повышенный уровень ферментов. Повышение уровня ферментов указывает на нагрузку на печень или повреждение печени.
Сообщите своему врачу, если у вас заболевание почек или печени.Симптомов, которые вы испытываете вместе с историей болезни, иногда может быть достаточно для диагностики печеночной энцефалопатии.
Печеночная энцефалопатия подразделяется на стадии в зависимости от тяжести симптомов. Общие системы классификации включают критерии Вест-Хейвена и шкалу комы Глазго.
Пять стадий печеночной энцефалопатии, согласно критериям Вест-Хейвена, следующие:
- Стадия 0. На этой стадии симптомы минимальны.
- 1 этап. Симптомы легкие. Они могут включать сокращение концентрации внимания и изменения в ваших привычках сна, такие как гиперсомния или бессонница.
- 2 этап. Симптомы умеренные. На этом этапе вы можете чувствовать себя дезориентированным или вялым.
- Этап 3. Симптомы серьезные. Вы не сможете выполнять основные задачи. Вы также почувствуете смущение и испытаете изменения личности.
- Этап 4. Эта стадия характеризуется комой.
Варианты лечения печеночной энцефалопатии зависят от тяжести и основной причины заболевания.
Скорее всего, вам нужно будет есть меньше белка, если причиной этого состояния стало употребление слишком большого количества белка. Поскольку белок необходим вашему организму для правильного функционирования, диетолог или врач могут составить диету, которая позволит вам получать достаточно белка, не ухудшая ваши симптомы. Продукты с высоким содержанием белка, которых следует избегать, включают:
Лекарства также могут помочь снизить скорость поглощения токсинов в крови. Ваш врач может назначить антибиотики и лактулозу (энулозу), синтетический сахар. Эти лекарства могут притягивать аммиак, созданный кишечными бактериями из крови, в толстую кишку.Затем ваше тело удалит кровь из толстой кишки.
В тяжелых случаях, вызывающих затрудненное дыхание, может потребоваться вентилятор или кислородная маска.
Некоторые люди с этим заболеванием могут иметь право на пересадку печени.
Люди с хронической печеночной энцефалопатией быстрее выздоравливают, чем люди с острой формой этого состояния. Скорость выздоровления увеличивается, если вы получаете лечение до того, как состояние ухудшится.
Печеночная энцефалопатия и ее симптомы могут быть обратимы при правильном лечении.
Осложнения, которые могут быть необратимыми, включают:
Лучший способ предотвратить печеночную энцефалопатию — это предотвратить или лечить заболевание печени. Чтобы снизить вероятность заболевания печени, выполните следующие действия:
Чтобы избежать вирусного гепатита:
- Хорошо мойте руки после посещения туалета или смены подгузника.
- Не передавайте зараженные иглы.
- Избегайте тесного контакта с людьми, у которых диагностирован вирусный гепатит.
- Сделайте прививку от гепатита А и гепатита В.
Печеночная энцефалопатия: симптомы, стадии и перспективы
Что такое печеночная энцефалопатия?
Печеночная энцефалопатия — это снижение функции мозга, которое возникает в результате тяжелого заболевания печени. В этом состоянии ваша печень не может должным образом удалять токсины из крови. Это вызывает накопление токсинов в кровотоке, что может привести к повреждению мозга.
Печеночная энцефалопатия может быть острой (краткосрочной) или хронической (длительной). В некоторых случаях человек с печеночной энцефалопатией может перестать отвечать и впасть в кому.
Острая печеночная энцефалопатия развивается из-за тяжелого заболевания печени. В основном это происходит у людей с такими состояниями:
- Острый фульминантный вирусный гепатит. Это тяжелый тип вирусного гепатита, который возникает внезапно.
- Токсический гепатит. Токсический гепатит может быть вызван воздействием алкоголя, химических веществ, лекарств или пищевых добавок.
- Синдром Рея. Это редкое и серьезное заболевание чаще встречается у детей.Это вызывает внезапный отек и воспаление печени и мозга.
Острая печеночная энцефалопатия также может быть признаком терминальной печеночной недостаточности.
Хроническая печеночная энцефалопатия может быть постоянной или рецидивирующей.
Те, у кого рецидивирующая версия, будут иметь несколько эпизодов печеночной энцефалопатии на протяжении всей жизни. Им также потребуется постоянное лечение, чтобы предотвратить развитие симптомов. Рецидивирующие случаи обычно наблюдаются у людей с тяжелым циррозом или рубцеванием печени.
Постоянные случаи заболевания редки и наблюдаются у людей, которые не реагируют на лечение и имеют постоянные неврологические заболевания, такие как:
Симптомы печеночной энцефалопатии различаются в зависимости от основной причины повреждения печени.
Симптомы и признаки умеренной печеночной энцефалопатии могут включать:
Симптомы тяжелой печеночной энцефалопатии:
Немедленно обратитесь за неотложной медицинской помощью, если у вас появятся симптомы тяжелой печеночной энцефалопатии.Эти симптомы могут привести к коме, если их не лечить быстро.
Точная причина печеночной энцефалопатии неизвестна. Однако обычно это происходит из-за накопления токсинов в кровотоке. Это происходит, когда ваша печень не может правильно расщеплять токсины.
Печень выводит из организма токсичные химические вещества, такие как аммиак. Эти токсины остаются, когда белки метаболизируются или расщепляются для использования различными органами вашего тела. Ваши почки превращают эти токсины в более безопасные вещества, которые затем удаляются с мочеиспусканием.
Когда ваша печень повреждена, она не может отфильтровать все токсины. Токсины могут накапливаться в кровотоке и потенциально попасть в мозг. Накопление токсинов может также повредить другие органы и нервы.
Печеночная энцефалопатия может быть вызвана:
Несколько тестов используются для диагностики печеночной энцефалопатии.
Анализы крови
Общий анализ крови проверяет ваши эритроциты, лейкоциты и тромбоциты. Низкое количество эритроцитов указывает на потерю крови и недостаток кислорода.
Анализы крови также можно использовать для проверки уровня натрия, калия и аммиака в крови. Слишком большое количество этих веществ является признаком нарушения функции печени.
Визуализирующие тесты
Визуализационные тесты, такие как компьютерная томография или МРТ, могут проверить наличие кровотечения в голове или отклонений в мозге.
Функциональные пробы печени
Функциональные пробы печени проверяют повышенный уровень ферментов. Повышение уровня ферментов указывает на нагрузку на печень или повреждение печени.
Сообщите своему врачу, если у вас заболевание почек или печени.Симптомов, которые вы испытываете вместе с историей болезни, иногда может быть достаточно для диагностики печеночной энцефалопатии.
Печеночная энцефалопатия подразделяется на стадии в зависимости от тяжести симптомов. Общие системы классификации включают критерии Вест-Хейвена и шкалу комы Глазго.
Пять стадий печеночной энцефалопатии, согласно критериям Вест-Хейвена, следующие:
- Стадия 0. На этой стадии симптомы минимальны.
- 1 этап. Симптомы легкие. Они могут включать сокращение концентрации внимания и изменения в ваших привычках сна, такие как гиперсомния или бессонница.
- 2 этап. Симптомы умеренные. На этом этапе вы можете чувствовать себя дезориентированным или вялым.
- Этап 3. Симптомы серьезные. Вы не сможете выполнять основные задачи. Вы также почувствуете смущение и испытаете изменения личности.
- Этап 4. Эта стадия характеризуется комой.
Варианты лечения печеночной энцефалопатии зависят от тяжести и основной причины заболевания.
Скорее всего, вам нужно будет есть меньше белка, если причиной этого состояния стало употребление слишком большого количества белка. Поскольку белок необходим вашему организму для правильного функционирования, диетолог или врач могут составить диету, которая позволит вам получать достаточно белка, не ухудшая ваши симптомы. Продукты с высоким содержанием белка, которых следует избегать, включают:
Лекарства также могут помочь снизить скорость поглощения токсинов в крови. Ваш врач может назначить антибиотики и лактулозу (энулозу), синтетический сахар. Эти лекарства могут притягивать аммиак, созданный кишечными бактериями из крови, в толстую кишку.Затем ваше тело удалит кровь из толстой кишки.
В тяжелых случаях, вызывающих затрудненное дыхание, может потребоваться вентилятор или кислородная маска.
Некоторые люди с этим заболеванием могут иметь право на пересадку печени.
Люди с хронической печеночной энцефалопатией быстрее выздоравливают, чем люди с острой формой этого состояния. Скорость выздоровления увеличивается, если вы получаете лечение до того, как состояние ухудшится.
Печеночная энцефалопатия и ее симптомы могут быть обратимы при правильном лечении.
Осложнения, которые могут быть необратимыми, включают:
Лучший способ предотвратить печеночную энцефалопатию — это предотвратить или лечить заболевание печени. Чтобы снизить вероятность заболевания печени, выполните следующие действия:
Чтобы избежать вирусного гепатита:
- Хорошо мойте руки после посещения туалета или смены подгузника.
- Не передавайте зараженные иглы.
- Избегайте тесного контакта с людьми, у которых диагностирован вирусный гепатит.
- Сделайте прививку от гепатита А и гепатита В.
Печеночная энцефалопатия: типы, причины, симптомы, лечение
Обзор
Что такое печеночная энцефалопатия?
Печеночная энцефалопатия — это часто временное неврологическое расстройство (нервная система), вызванное хроническим тяжелым заболеванием печени. Больная печень изо всех сил пытается отфильтровать токсины (вещества, образующиеся при расщеплении пищи, алкоголя, лекарств и даже мышц) из кровотока.Эти токсины накапливаются в организме и попадают в мозг. Токсичность влияет на функцию мозга и вызывает когнитивные нарушения.
Люди с печеночной энцефалопатией могут казаться сбитыми с толку или иметь трудности с обработкой своих мыслей. Лечение может удалить токсины и обратить проблему вспять. По мере прогрессирования заболевания печени состояние может ухудшиться и стать менее поддающимся лечению. Печеночная энцефалопатия также известна как портосистемная энцефалопатия (PSE).
Кто может заболеть печеночной энцефалопатией?
До 50% людей с циррозом печени в конечном итоге развивают симптомы печеночной энцефалопатии.
Цирроз — это образование рубцовой ткани в печени. Эта рубцовая ткань блокирует кровоток и влияет на способность печени фильтровать токсины, гормоны и питательные вещества.
Какие виды печеночной энцефалопатии?
Существует три типа печеночной энцефалопатии:
- Тип А возникает в результате острой печеночной недостаточности (без хронического заболевания печени).
- Тип B встречается у некоторых людей, у которых есть шунт, соединяющий две вены внутри печени без основного заболевания печени.
- Тип C возникает в результате хронического заболевания печени и рубцевания (цирроза).
Симптомы и причины
Что вызывает печеночную энцефалопатию?
Когда у вас заболевание печени, печень изо всех сил пытается отфильтровать естественные токсины из организма. В крови накапливаются токсины, например, аммиак.Токсины из кровотока могут попадать в мозг и временно (а иногда и навсегда) влиять на работу мозга.
Люди с хроническим заболеванием печени подвержены риску печеночной энцефалопатии. Что-то обычно вызывает условие, например:
Каковы симптомы печеночной энцефалопатии?
У людей с печеночной энцефалопатией нарушена функция мозга. Симптомы включают:
- Беспокойство или раздражительность.
- Когнитивные нарушения (спутанное мышление или суждение).
- Проблемы с координацией или балансом.
- Проблемы с концентрацией внимания или непродолжительное внимание.
- Движение рук (звездочка).
- Изменения настроения или личности.
- Подергивание мышц (миоклонус).
- Пониженная настороженность.
- Проблемы со сном.
- Невнятная речь,
Диагностика и тесты
Как диагностируется печеночная энцефалопатия?
Не существует стандартного теста для выявления печеночной энцефалопатии.Однако анализы крови могут выявить такие проблемы, как инфекции и кровотечения, связанные с заболеванием печени. Ваш врач может назначить другие тесты, чтобы исключить состояния, вызывающие похожие симптомы, такие как инсульты и опухоли головного мозга. Эти тесты включают магнитно-резонансную томографию (МРТ), компьютерную томографию (КТ) и электроэнцефалограмму (ЭЭГ).
Как правило, ваш врач ставит диагноз на основании вашего:
- История болезни.
- Симптомы.
- Офисный экзамен.
Ведение и лечение
Как лечится или лечится печеночная энцефалопатия?
Лечение зависит от ваших симптомов и общего состояния здоровья, а также от степени тяжести состояния. Важно принимать лекарства от печеночной энцефалопатии точно по назначению.С помощью лечения можно замедлить, а иногда и остановить прогрессирование болезни. Ваш врач может порекомендовать одно или оба из этих лечения:
- Антибиотики: Бактерии в вашем организме вырабатывают естественные токсины из переваренной пищи. Антибиотики, такие как рифаксимин (Ксифаксан®), останавливают рост бактерий. В результате организм вырабатывает меньше токсинов.
- Слабительные: Раствор лактулозы для перорального применения, слабительное, изготовленное из лактозного сахара, выводит токсины в толстую кишку.Слабительное стимулирует частые испражнения, которые помогают выводить токсины из организма.
Каковы осложнения печеночной энцефалопатии?
Заболевание печени требует лечения, например, приема лекарств и изменения образа жизни, в том числе отказа от алкоголя. Если не лечить основную причину заболевания печени, функция печени ухудшается, и токсины продолжают накапливаться. Некоторые люди с запущенной печеночной энцефалопатией теряют сознание и впадают в печеночную кому.
Профилактика
Как предотвратить печеночную энцефалопатию?
Правильное ведение и лечение заболеваний печени являются ключом к снижению шансов развития печеночной энцефалопатии.Эти шаги могут снизить ваш риск:
- Избегайте употребления алкоголя, который повреждает клетки печени.
- Избегайте лекарств, влияющих на нервную систему, таких как снотворные и антидепрессанты.
- Придерживайтесь полноценной диеты, занимайтесь спортом и поддерживайте здоровый вес (особенно важно, если у вас жировая болезнь печени).
- Принимайте назначенные лекарства для лечения заболеваний печени.
- Сдавайте регулярные функциональные пробы печени.
Перспективы / Прогноз
Каков прогноз (перспективы) для людей с печеночной энцефалопатией?
Люди с печеночной энцефалопатией могут замедлить, остановить или обратить вспять болезнь, придерживаясь предписанного плана лечения.Людям с хроническим заболеванием печени может потребоваться продолжить лечение печеночной энцефалопатии, чтобы симптомы не ухудшились или не вернулись.
При первых признаках печеночной энцефалопатии важно сразу же обратиться к врачу. При отсутствии лечения печеночная энцефалопатия может ухудшиться и увеличить риск серьезных осложнений, таких как кома.
Людям, у которых развивается терминальная стадия заболевания печени (также называемое печеночной недостаточностью), может потребоваться пересадка печени. Вам предстоит пройти тестирование, чтобы узнать, выдержите ли вы такую сложную процедуру.Новая печень часто избавляет от печеночной энцефалопатии.
Жить с
Когда мне следует вызвать врача?
Вам следует позвонить своему врачу, если у вас заболевание печени и вы заметили признаки печеночной энцефалопатии. Симптомы включают нарушение мышления, изменения настроения, проблемы со сном и хлопанье руками.
Вы также должны сообщить своему врачу, если у вас есть заболевание печени и запор. Опорожнение кишечника помогает избавить организм от токсинов. Меньшее количество испражнений может вызвать накопление токсинов в организме.
Какие вопросы я должен задать своему врачу?
Если у вас или вашего близкого есть печеночная энцефалопатия, вы можете спросить своего врача:
- Как болезнь печени влияет на мой организм?
- Что я могу сделать, чтобы улучшить функцию печени или замедлить ее развитие?
- Какое лечение заболевания печени лучше всего подойдет мне сейчас?
- Как лучше всего лечить печеночную энцефалопатию?
- Как долго мне нужно принимать лекарства от печеночной энцефалопатии?
- Есть ли лекарства, которых мне следует избегать?
- Следует ли мне вносить какие-либо изменения в рацион для поддержки функции печени?
- Могу ли я получить пользу от пересадки печени?
- Стоит ли обращать внимание на признаки осложнений?
Помните, печеночная энцефалопатия — серьезное, но излечимое заболевание.Симптомы часто проходят при раннем выявлении и надлежащем лечении. Если у вас заболевание печени, спросите своего врача о тревожных признаках печеночной энцефалопатии, чтобы вы могли быстро начать лечение. Вам также следует обсудить, как лучше всего управлять заболеванием печени, чтобы не допустить возникновения или ухудшения печеночной энцефалопатии.
Печеночная энцефалопатия: типы, причины, симптомы, лечение
Обзор
Что такое печеночная энцефалопатия?
Печеночная энцефалопатия — это часто временное неврологическое расстройство (нервная система), вызванное хроническим тяжелым заболеванием печени.Больная печень изо всех сил пытается отфильтровать токсины (вещества, образующиеся при расщеплении пищи, алкоголя, лекарств и даже мышц) из кровотока. Эти токсины накапливаются в организме и попадают в мозг. Токсичность влияет на функцию мозга и вызывает когнитивные нарушения.
Люди с печеночной энцефалопатией могут казаться сбитыми с толку или иметь трудности с обработкой своих мыслей. Лечение может удалить токсины и обратить проблему вспять. По мере прогрессирования заболевания печени состояние может ухудшиться и стать менее поддающимся лечению.Печеночная энцефалопатия также известна как портосистемная энцефалопатия (PSE).
Кто может заболеть печеночной энцефалопатией?
До 50% людей с циррозом печени в конечном итоге развивают симптомы печеночной энцефалопатии.
Цирроз — это образование рубцовой ткани в печени. Эта рубцовая ткань блокирует кровоток и влияет на способность печени фильтровать токсины, гормоны и питательные вещества.
Какие виды печеночной энцефалопатии?
Существует три типа печеночной энцефалопатии:
- Тип А возникает в результате острой печеночной недостаточности (без хронического заболевания печени).
- Тип B встречается у некоторых людей, у которых есть шунт, соединяющий две вены внутри печени без основного заболевания печени.
- Тип C возникает в результате хронического заболевания печени и рубцевания (цирроза).
Симптомы и причины
Что вызывает печеночную энцефалопатию?
Когда у вас заболевание печени, печень изо всех сил пытается отфильтровать естественные токсины из организма.В крови накапливаются токсины, например, аммиак. Токсины из кровотока могут попадать в мозг и временно (а иногда и навсегда) влиять на работу мозга.
Люди с хроническим заболеванием печени подвержены риску печеночной энцефалопатии. Что-то обычно вызывает условие, например:
Каковы симптомы печеночной энцефалопатии?
У людей с печеночной энцефалопатией нарушена функция мозга. Симптомы включают:
- Беспокойство или раздражительность.
- Когнитивные нарушения (спутанное мышление или суждение).
- Проблемы с координацией или балансом.
- Проблемы с концентрацией внимания или непродолжительное внимание.
- Движение рук (звездочка).
- Изменения настроения или личности.
- Подергивание мышц (миоклонус).
- Пониженная настороженность.
- Проблемы со сном.
- Невнятная речь,
Диагностика и тесты
Как диагностируется печеночная энцефалопатия?
Не существует стандартного теста для выявления печеночной энцефалопатии.Однако анализы крови могут выявить такие проблемы, как инфекции и кровотечения, связанные с заболеванием печени. Ваш врач может назначить другие тесты, чтобы исключить состояния, вызывающие похожие симптомы, такие как инсульты и опухоли головного мозга. Эти тесты включают магнитно-резонансную томографию (МРТ), компьютерную томографию (КТ) и электроэнцефалограмму (ЭЭГ).
Как правило, ваш врач ставит диагноз на основании вашего:
- История болезни.
- Симптомы.
- Офисный экзамен.
Ведение и лечение
Как лечится или лечится печеночная энцефалопатия?
Лечение зависит от ваших симптомов и общего состояния здоровья, а также от степени тяжести состояния. Важно принимать лекарства от печеночной энцефалопатии точно по назначению.С помощью лечения можно замедлить, а иногда и остановить прогрессирование болезни. Ваш врач может порекомендовать одно или оба из этих лечения:
- Антибиотики: Бактерии в вашем организме вырабатывают естественные токсины из переваренной пищи. Антибиотики, такие как рифаксимин (Ксифаксан®), останавливают рост бактерий. В результате организм вырабатывает меньше токсинов.
- Слабительные: Раствор лактулозы для перорального применения, слабительное, изготовленное из лактозного сахара, выводит токсины в толстую кишку.Слабительное стимулирует частые испражнения, которые помогают выводить токсины из организма.
Каковы осложнения печеночной энцефалопатии?
Заболевание печени требует лечения, например, приема лекарств и изменения образа жизни, в том числе отказа от алкоголя. Если не лечить основную причину заболевания печени, функция печени ухудшается, и токсины продолжают накапливаться. Некоторые люди с запущенной печеночной энцефалопатией теряют сознание и впадают в печеночную кому.
Профилактика
Как предотвратить печеночную энцефалопатию?
Правильное ведение и лечение заболеваний печени являются ключом к снижению шансов развития печеночной энцефалопатии.Эти шаги могут снизить ваш риск:
- Избегайте употребления алкоголя, который повреждает клетки печени.
- Избегайте лекарств, влияющих на нервную систему, таких как снотворные и антидепрессанты.
- Придерживайтесь полноценной диеты, занимайтесь спортом и поддерживайте здоровый вес (особенно важно, если у вас жировая болезнь печени).
- Принимайте назначенные лекарства для лечения заболеваний печени.
- Сдавайте регулярные функциональные пробы печени.
Перспективы / Прогноз
Каков прогноз (перспективы) для людей с печеночной энцефалопатией?
Люди с печеночной энцефалопатией могут замедлить, остановить или обратить вспять болезнь, придерживаясь предписанного плана лечения.Людям с хроническим заболеванием печени может потребоваться продолжить лечение печеночной энцефалопатии, чтобы симптомы не ухудшились или не вернулись.
При первых признаках печеночной энцефалопатии важно сразу же обратиться к врачу. При отсутствии лечения печеночная энцефалопатия может ухудшиться и увеличить риск серьезных осложнений, таких как кома.
Людям, у которых развивается терминальная стадия заболевания печени (также называемое печеночной недостаточностью), может потребоваться пересадка печени. Вам предстоит пройти тестирование, чтобы узнать, выдержите ли вы такую сложную процедуру.Новая печень часто избавляет от печеночной энцефалопатии.
Жить с
Когда мне следует вызвать врача?
Вам следует позвонить своему врачу, если у вас заболевание печени и вы заметили признаки печеночной энцефалопатии. Симптомы включают нарушение мышления, изменения настроения, проблемы со сном и хлопанье руками.
Вы также должны сообщить своему врачу, если у вас есть заболевание печени и запор. Опорожнение кишечника помогает избавить организм от токсинов. Меньшее количество испражнений может вызвать накопление токсинов в организме.
Какие вопросы я должен задать своему врачу?
Если у вас или вашего близкого есть печеночная энцефалопатия, вы можете спросить своего врача:
- Как болезнь печени влияет на мой организм?
- Что я могу сделать, чтобы улучшить функцию печени или замедлить ее развитие?
- Какое лечение заболевания печени лучше всего подойдет мне сейчас?
- Как лучше всего лечить печеночную энцефалопатию?
- Как долго мне нужно принимать лекарства от печеночной энцефалопатии?
- Есть ли лекарства, которых мне следует избегать?
- Следует ли мне вносить какие-либо изменения в рацион для поддержки функции печени?
- Могу ли я получить пользу от пересадки печени?
- Стоит ли обращать внимание на признаки осложнений?
Помните, печеночная энцефалопатия — серьезное, но излечимое заболевание.


 Желчь вырабатывается клетками печени, накапливается в желчном пузыре и по желчным протокам попадает в кишечник.
Желчь вырабатывается клетками печени, накапливается в желчном пузыре и по желчным протокам попадает в кишечник.
 При повреждении печеночной ткани его уровень может быть снижен.
При повреждении печеночной ткани его уровень может быть снижен.