Метаболизм костной ткани и остеопороз | #10/15
Остеопороз (ОП) — прогрессирующее системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники (качества) костной ткани, что приводит к хрупкости костей и повышению риска переломов. ОП — самое распространенное заболевание костной ткани: остеопоротические переломы отмечается у половины всех женщин, находящихся в периоде постменопаузы, а также у мужчин старших возрастных групп [1]. Очевидно, что рано начатые активные профилактические мероприятия у значительной части населения могут существенно повлиять на распространенность, прогрессирование и исходы заболевания, а также снизить риск переломов. В связи с этим изучение различных лекарственных препаратов и методов, применяемых для профилактики ОП, приобретает особый смысл.
Кость — специализированная разновидность соединительной ткани, состоящая из клеток и межклеточного вещества.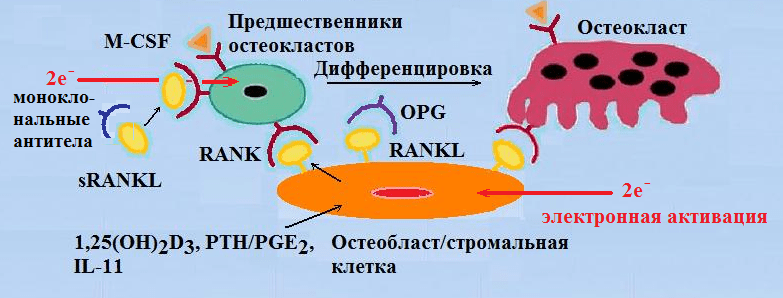 В течение всей жизни основные функции костной ткани, такие как жесткость и гибкость, снижаются, поскольку с возрастом наблюдаются повреждение матрикса и потеря минералов. В противовес указанным проявлениям, в кости осуществляется ремоделирование — процесс, направленный на самостоятельное обновление и сохранение скелета как структурного и функционального органа.
В течение всей жизни основные функции костной ткани, такие как жесткость и гибкость, снижаются, поскольку с возрастом наблюдаются повреждение матрикса и потеря минералов. В противовес указанным проявлениям, в кости осуществляется ремоделирование — процесс, направленный на самостоятельное обновление и сохранение скелета как структурного и функционального органа.
Основными клетками костной ткани, функциями которой регулируется гомеостаз кости, являются остеобласты, остеокласты и остеоциты. Основной функцией остеобластов является создание органического межклеточного матрикса кости, остеоида. Остеобласты синтезируют и выделяют в окружающую среду фибриллы коллагена, протеогликаны и гликозаминогликаны. Наряду с этим остеобласты активно синтезируют и выделяют во внеклеточное пространство значительное количество глицерофосфолипидов, способствующих связыванию Ca2+ и участвующих в процессах минерализации. Клетки сообщаются между собой через десмосомы, которые позволяют проходить Ca2+ и цАМФ. Они также обеспечивают непрерывный рост кристаллов гидроксиапатитов и выступают в качестве посредников при связывании минеральных кристаллов с белковой матрицей.
В ходе формирования кости некоторые остеобласты оказываются замурованными в толщу матрикса и становятся остеоцитами. Остеоциты контактируют друг с другом через отростки, являются основными компонентами в сформировавшейся костной ткани. Основная функция остеоцитов — поддержание нормального состояния костного матрикса и баланса кальция и фосфора в организме.
Остеокласты — клетки, выполняющие функцию разрушения кости; развиваются из стволовой кроветворной клетки и являются специализированными макрофагами. В процессе ремоделирования кости резорбтивный стимул запускает процесс привлечения остеокластов к участку кости. Прикрепившись к кости, остеокласты продуцируют множество протеолитических ферментов и формируют полость в кальцинированном матриксе. Таким образом, они осуществляют непрерывный процесс резорбции и обновления костной ткани, обеспечивая необходимый рост и развитие скелета, структуру, прочность и упругость.
Важнейшим компонентом костной ткани является межклеточное вещество — уникальный комплекс органических и неорганических компонентов, заполняющих пространство между клетками. Минерализованный матрикс костной ткани поддерживает структуру скелета и под координирующим влиянием остеобластов и остеокластов обеспечивает резервуар как ионов, так и факторов роста, которые высвобождаются в процессе метаболизма.
Органический межклеточный матрикс костной ткани представлен семейством коллагеновых белков. Состав кости необычен тем, что фактически в ней представлен только коллаген I типа (90%), хотя наряду с коллагеном I типа в кости все же присутствуют следы других типов коллагена, таких как V, XI, XII. Скорее всего, что эти типы коллагена принадлежат другим тканям, которые и находятся в костной ткани, но не входят в состав костного матрикса. Например, коллаген V типа обычно обнаруживается в сосудах, которые пронизывают кость. Коллаген XI типа находится в хрящевой ткани и может соответствовать остаткам кальцифицированного хряща. Коллагеновые фибриллы в кости строго ориентированы в соответствии с распределенной функциональной нагрузкой на кость, что обеспечивает упругость и эластичность кости. Веретенообразные и пластинчатые кристаллы гидроксиапатита находятся на коллагеновых волокнах, в их пределах и в окружающем пространстве. Как правило, они ориентированы в том же направлении, что и коллагеновые волокна.
Неколлагеновая часть матрикса (10%) представлена основным веществом (витамин К-зависимыми глютамилпротеинами (остеокальцином), матричными протеинами, остеопонтином, остеонектином, фибронектином, фосфопротеидами, сиалопротеидами, а также протеогликанами).
Минеральные вещества, которыми пропитан органический матрикс, представлены главным образом кристаллами гидроксиапатита Ca10(PO4)6(OH)2. Кроме того, в кости обнаружены ионы Mg2+, Na+, K+, SO42-, HCO3-, гидроксильные и другие ионы, которые могут принимать участие в образовании кристаллов.
Важно подчеркнуть, что ОП является результатом уменьшения органического матрикса кости, а вовсе не плохой кальцификацией костной ткани. При ОП существенно снижается скорость образования остеоида, необходимого для формирования кости. Поэтому при планировании профилактических мероприятий чрезвычайно важно учитывать потенциальную возможность препаратов, наряду с адекватной минерализацией, оказывать влияние на синтез органического матрикса.
Разумеется, качественная структура и прочность кости, ее эффективное функционирование и своевременное самообновление возможны лишь при адекватной обеспеченности макро- и микроэлементами, которые, подобно кальцию и витамину D, принимают непосредственное участие в биохимических процессах костной ткани [2–5]. Магний, медь, цинк, марганец, бор, являясь кофакторами ферментов, регулируют синтез костного матрикса, его минерализацию, а также равномерный рост, гибкость и прочность костной ткани. Известно, что дефицит этих веществ замедляет формирование костной массы в детстве и подростковом возрасте, способствует ее ускоренной потере в пожилом возрасте. Соответственно, дефицит любого из известных минеральных веществ в организме препятствует успешной терапии и профилактике нарушений структуры кости [6, 7].
Одним из основных минералов, играющих важную роль в формировании и поддержании структуры костной ткани, является кальций. Поскольку кальций не производится в организме, то для поддержания оптимальной концентрации он должен регулярно поступать извне. Причем желательно, чтобы его поступление в организм обеспечивалось за счет натуральных молочных продуктов, молока и его производных (кефира, простокваши, ряженки, йогурта, творога, сыра). Вместе с тем биодоступность кальция из пищи составляет порядка 30%, причем с высокой индивидуальной вариабельностью. Более того, у лиц пожилого возраста нередко имеет место непереносимость молочных продуктов, связанная со снижением концентрации лактазы в желудочном соке, что приводит к низкому потреблению кальция.
Согласно эпидемиологическим исследованиям, среди женщин в возрасте старше 45 лет, проживающих в мегаполисах, непереносимость молока встречается с частотой 25,0–34,0%. При этом достаточное потребление кальция с продуктами питания имеет место менее чем у 5% женщин [8]. Фактически содержание кальция в пищевом рационе постменопаузальных женщин не соответствует рекомендованным нормам. Очевидно, что обеспечение должного уровня потребления кальция возможно лишь при условии дополнительного регулярного назначения медикаментозных препаратов.
Витамин D — основной регулятор активной абсорбции кальция в организме. Витамин D относят к группе жирорастворимых витаминов. Хотя в отличие от всех других витаминов он биологически не активен. В активную, гормональную, форму он превращается за счет двухступенчатой метаболизации в организме и оказывает многообразные биологические эффекты за счет взаимодействия со специфическими рецепторами, локализованными в ядрах клеток тканей и органов. Другое дело — активный метаболит витамина D. Он действует как истинный гормон, хотя в научной литературе его традиционно называют витамином D [9, 10].
Природная форма витамина D — витамин D2 (эргокальциферол) поступает в организм человека в относительно небольших количествах — не более 20–30% от потребности. В основном из злаковых растений, рыбьего жира, сливочного масла, маргарина, молока, яичного желтка и др. В организме витамин D2 метаболизируется с образованием производных, обладающих сходным с метаболитами витамина D3 действием.
Еще одна природная форма витамина D — витамин D3, или холекальциферол, является ближайшим аналогом витамина D2, но его синтез мало зависит от поступления извне. Холекальциферол образуется в организме позвоночных животных, в том числе амфибий, рептилий, птиц и млекопитающих, в связи с чем играет значительно бóльшую роль в процессах жизнедеятельности человека, чем поступающий в небольших количествах с пищей витамин D2. В организме витамин D3 образуется из находящегося в дермальном слое кожи предшественника (7-дегидрохолестерина) под влиянием коротковолнового ультрафиолетового облучения спектра В (УФ–В/солнечного света, длина волны 290–315 нм) при температуре тела в результате фотохимической реакции раскрытия В-кольца стероидного ядра и термоизомеризации, характерной для секостероидов [9, 10].
В последующем поступивший с пищей и/или образовавшийся в организме в процессе эндогенного синтеза витамин D подвергается реакции 25-гидроксилирования в печени. Важно, что гидроксилирование витамина D3 в печени представляет собой полностью субстратзависимый процесс, который протекает весьма быстро и ведет к повышению уровня 25(ОН)D в сыворотке крови. Уровень этого вещества отражает как образование витамина D в коже, так и его поступление с пищей, в связи с чем может использоваться как маркер статуса витамина D [9, 10].
Вторая реакция гидроксилирования 25(ОН)D, с образованием наиболее важной, качественно и количественно значимой активной гормональной формы — 1a,25-дигидроксивитамина D3 (1α,25(ОН)2D3), называемой также D-гормоном, кальцитриолом, протекает уже в основном в почках, в клетках проксимальных отделов канальцев коры почек при участии фермента 1α-гидроксилазы (CYP27В1). Этот процесс строго регулируется рядом эндогенных и экзогенных факторов. Во-первых, регуляция синтеза 1a,25(ОН)2D3 в почках является непосредственной функцией паратиреоидного гормона (ПТГ), на концентрацию которого в крови, в свою очередь, по механизму обратной связи оказывают влияние как уровень самого активного метаболита витамина D3, так и концентрация кальция и фосфора в плазме крови. Во-вторых, активация синтеза 1a-гидроксилазы и реакции 1a-гидроксилирования зависит от половых гормонов (эстрогенов и андрогенов), кальцитонина, пролактина, гормона роста (через ИПФР-1) и др. В-третьих, ингибирующее влияние на активность 1a-гидроксилазы оказывают глюкокортикостероидные гормоны, 1α,25(ОН)2D3 и ряд его синтетических аналогов. Фактор роста из фибробластов (FGF23), секретируемый в клетках кости, вызывает образование натрий-фосфат-котранспортера, который действует в клетках почек и тонкого кишечника, оказывает тормозящее влияние на синтез 1,25-дигидроксивитамина D3. На метаболизм витамина D оказывают влияние и некоторые лекарственные средства, например, противоэпилептические препараты.
Основными реакциями, в которых участвует D-гормон, являются абсорбция кальция в желудочно-кишечном тракте и его реабсорбция в почках. D-гормон усиливает кишечную абсорбцию кальция в тонком кишечнике за счет взаимодействия со специфическими РВD. Об эффективности данного механизма свидетельствует тот факт, что без участия витамина D лишь 10–15% пищевого кальция и 60% фосфора абсорбируются в кишечнике. Взаимодействие между 1a,25-дигидроксивитамином D3 и РВD повышает эффективность кишечной абсорбции Са2+ до 30–40%, т. е. в 2–4 раза, а фосфора — до 80%. Сходные механизмы действия D-гормона лежат в основе осуществляемой под его влиянием реабсорбции Са2+ в почках.
В костях 1α,25(ОН)2D3 связывается с рецепторами на кость-формирующих клетках — остеобластах, вызывая повышение экспрессии ими лиганда рецептора активатора ядерного фактора кВ (RANKL). Рецептор-активатор ядерного фактора кВ (RANK), являющийся рецептором для RANKL, локализованным на преостеокластах, связывает RANKL, что вызывает быстрое созревание преостеокластов и их превращение в зрелые остеокласты. В процессах костного ремоделирования зрелые остеокласты резорбируют кость, что сопровождается выделением кальция и фосфора из минерального компонента (гидроксиапатита) и обеспечивает поддержание уровня кальция и фосфора в крови. В свою очередь, адекватный уровень кальция (Са2+) и фосфора необходим для нормальной минерализации скелета [11–13].
Многочисленные исследования показали, что назначение препаратов кальция и/или витамина D способствует уменьшению потери костной ткани [14–19]. У женщин в поздней постменопаузе с низким употреблением пищевого кальция прием кальция предотвращает потерю костной ткани в позвоночнике [20, 21]. В свою очередь, назначение добавок кальция лицам старше 60 лет приводит к снижению потери костной массы в области бедра среди белых мужчин и женщин в возрасте моложе 72 лет [22]. Эффект назначения цитрата кальция на минеральную плотность кости (МПК) у женщин в раннем (до 5 лет) и среднем (от 5 до 10 лет) постменопаузальном периоде в течение двух лет проявлялся в виде прироста МПК в поясничном отделе на 1%, наряду со значимым снижением МПК на 2,4% в группе, получавшей плацебо [23]. Метаанализ 9 рандомизированных клинических исследований с общей выборкой более 50 тыс. человек, в 6 из которых сравнивалось комбинированное лечение витамином D (400 или 700–800 МЕ/сут) и кальцием с группами плацебо или без лечения, продемонстрировал достоверное снижение риска перелома бедра на 18% (RR 0,82 [95% ДИ 0,71–0,94], р = 0,0005) и риска внепозвоночных переломов на 12% (RR 0,88 [95% ДИ 0,78–0,99], р = 0,036) в группах, получавших комбинированную терапию, по сравнению с группами без добавок [24]. В исследованиях, где применялся витамин D в дозе 700–800 МЕ/сут, эффект на риск перелома бедра был выше, чем при приеме 400 МЕ (21% и 18% соответственно). Соответственно, в исследованиях, в которых пациенты получали только витамин D или плацебо (4 РКИ с общей численностью 9083 пациента), не было получено снижения риска внепозвоночных переломов как при применении дозы 400 МЕ (RR 1,14 [95% ДИ 0,87–1,49]), так при использовании 700–800 МЕ (RR 1,04 [95% ДИ 0,75–1,46]), что подтверждает ранее представленные данные о том, что витамин D без добавления кальция не снижает риск переломов [24].
Магний
Известно, что 60–65% магния находится именно в скелете и от обеспеченности костей магнием зависит обмен кальция и витамина D. Являясь структурным компонентом значительного числа ферментов, магний образует кристаллы с фосфатами, принимает участие в росте и стабилизации кристалла гидроксиапатита — структурной единицы минерального компонента костной ткани [25, 26]. Магний регулирует секрецию паратгормона (ПГ), повышает чувствительность клеток-мишеней к ПГ и витамину D, стимулирует действие кальцитонина. Длительное во времени нарушение соотношения Mg/Ca в сторону дефицита магния сопровождается замедлением обменных процессов в кости. Специальные магний-дефицитные диеты, сопровождающиеся уменьшением сывороточной концентрации магния, способствуют системной потере костной массы, снижению толщины надкостницы, характерным изменениям провоспалительных маркеров и маркеров резорбции кости. Уже по истечении достаточно короткого срока (4 недели), магний-дефицитная диета приводит к значимому снижению содержания минеральных веществ кости (р < 0,001). Даже слабо выраженный диетарный дефицит магния (например, 50% от рекомендованного суточного потребления магния) в течение нескольких месяцев приводит к формированию начальных стадий ОП. Более высокое значение отношения Mg/Ca в питании, соответственно, сопровождается замедлением возрастных потерь костной массы у пожилых женщин [27], меньшей частотой ОП [28]. У женщин в постменопаузе дополнительный прием магния в течение 12 месяцев способствует как минимум стабилизации или даже некоторому увеличению МПК, чего не наблюдается у лиц, не компенсирующих диетарный дефицит магния [29]. Обогащение пищевого рациона магнием сопряжено с повышенной МПК не только у женщин, но и у мужчин. Так, при исследовании когорты из 2038 человек после поправок на возраст, калорийность диеты, потребление кальция и витамина D, индекс массы тела, курение, алкоголь, физическую активность, использование тиазидных диуретиков и эстроген-содержащих препаратов, потребление магния с пищей положительно ассоциировалась с более высокой МПК [30]. Несомненным достоинством магния является профилактика депонирования металлов, оказывающих токсическое воздействие на кость (кадмия, свинца).
Медь
Являясь кофактором лизилоксидазы — ключевого фермента, ответственного за образование внутри- и межмолекулярных поперечных связей (сшивок) в волокнах костного коллагена, медь обеспечивает механическую прочность кости. Соответственно, именно дефицит меди и связанное с этим нарушение формирования сшивок коллагена способствует нарушению роста, остеогистогенеза и хрупкости костей [31], а также тяжелой патологии легких и сердечно-сосудистой системы [32]. Дефицит меди способствует нарушению такого механического свойства кости, как устойчивость к скручиванию и угловой деформации [31–33]. Сниженная концентрация меди в сыворотке крови у пожилых женщин коррелирует с низкой МПК [33].
Марганец
К эффектам долгосрочного дефицита марганца в рационе питания относят увеличение резорбции, снижение плотности и массы костей. Марганец активирует многие ферменты, в том числе марганец-зависимые гликозилтрансферазы и костную щелочную фосфатазу, что служит указанием на его участие в оссификации. Восстановление марганца в диете способствует восстановлению нормальной структуры кости и увеличению МПК [34].
Бор
Основными эффектами бора являются экскреция кальция с мочой, повышение уровня витамина D в крови, улучшение ассимиляции кальция костной тканью посредством нормализации гормонального фона [35, 36]. Известно, что бор дозозависимо влияет на процессы дифференцировки стромальных клеток костного мозга, способствует синтезу коллагена и костного матрикса, белков остеогенеза — остеокальцина (р < 0,05) [37–39], остеопонтина, сиалопротеина кости (ген BSP), белка Runx2 и других [40].
Цинк
Цинк — непосредственный участник синтеза органического матрикса. Являясь структурным компонентом значительного числа ферментов (более 400), участвует в дифференцировке остеобластов, контролирует синтез инсулиноподобного фактора роста (ИФР-1), коллагена [41–44]. Соответственно, длительный дефицит Zn приводит к нарушению синтеза ДНК и метаболизма белка, что ведет к нарушению синтеза органического матрикса.
Связь между обеспеченностью остеотропными микроэлементами, характеристикой костной ткани и возможностью коррекции дефицита потребления с помощью лекарственных средств, в состав которых входят соли кальция и микроэлементы, продемонстрирована в многочисленных исследованиях последних лет, выполненных в разных возрастных группах. Одним из наиболее изученных препаратов, рекомендованных для профилактики метаболических нарушений костной ткани, связанных с дефицитом микроэлементов, является Кальцемин Адванс [45–49].
Так, при обследовании подростков недостаточное содержание бора, меди, марганца и цинка в волосах положительно ассоциировалось со снижением МПК. При этом назначение подросткам препарата Кальцемин Адванс по 1 таблетке 2 раза в сут (соответственно 1000 мг кальция, 400 МЕ холекальциферола, 80 мг магния, 15 мг цинка, 2 мг меди, 3,6 мг марганца и 500 мкг бората натрия в сутки) на протяжении 8–12 мес привело к существенной динамике не только концентрации микроэлементов, но и МПК [45].
В исследовании продолжительностью 24 месяца показано повышение МПК в постменопаузе у женщин, принимавших Са в сочетании с цинком, медью и марганцем, в то время как у женщин, принимавших только Са, или только микроэлементы, или только плацебо, показано уменьшение МПК, при этом уменьшения риска переломов выявлено не было [46].
Применение Кальцемина Адванс у постменопаузальных женщин с остеопенией (Т-критерий в Л1–Л4 и/или шейке бедра от –1,5 до –2,5 SD) в дозировке по 1 таблетке 2 раза в сут (соответственно 1000 мг кальция, 400 МЕ холекальциферола, 80 мг магния, 15 мг цинка, 2 мг меди, 3,6 мг марганца и 500 мкг бората натрия в сутки) по сравнению с группой, получившей только рекомендации по питанию, обнаружило отсутствие снижения МПК в течение года, тогда как в контрольной группе она уменьшилась во всех исследуемых зонах [47].
Применение Кальцемина Адванс постменопаузальными женщинами, имеющими два и более факторов риска развития ОП на протяжении 52 недель, сопровождалось сохранением исходной МПК или ее повышением (прирост костной массы составил в среднем 3,55%) [48].
Эффективность препарата Кальцемин Адванс сравнивалась с различными видами лечебно-профилактических вмешательств у женщин с остеопенией в проспективном 3-летнем многоцентровом клиническом исследовании, выполненном в трех российских центрах профилактики ОП из Москвы, Ярославля, Иркутска. В группе пациенток, получавших Кальцемин Адванс (по 1 таблетке 2 раза в сут), по сравнению с группой, получившей только рекомендации по коррекции питания, уже через 12 мес наблюдалось уменьшение болевых ощущений и улучшение ежедневной активности. Наряду с этим МПК в основной группе оставалась стабильной [49].
Таким образом, при выборе средств для профилактики и лечения потерь костной ткани, восстановления ее структуры и качества необходимо использовать препараты, которые наряду с восполнением дефицита потребления остеотропных микроэлементов, участвующих в жизненно важных метаболических процессах организма, способствуют синтезу коллагена, формированию костного матрикса, его минерализации и, соответственно, увеличению плотности и прочности кости.
Литература
- Institute for Clinical Systems Improvement (ICSI) Health Care Guideline: Diagnosis and Treatment of Osteoporosis. 3 rd edition, July 2004. www.icsi.org.
- De Francisco A. L., Rodriguez M. Magnesium — its role in CKD // Nefrologia. 2013; 33 (3): 389–399 doi.
- Swaminathan R. Nutritional factors in osteoporosis // Int J Clin Pract. 1999; 53 (7): 540.
- Parlier R., Hioco D., Leblanc R. Metabolism of magnesium and its relation to that of calcium. I. Apropos of a study of magnesium balance in the normal man, in osteopathies and nephropathies // Rev Fr Endocrinol Clin. 1963; 4: 93–135.
- Ryder K. M., Shorr R. I., Bush A. J., Kritchevsky S. B., Harris T., Stone K., Cauley J., Tylavsky F. A. Magnesium intake from food and supplements is associated with bone mineral density in healthy older white subjects // J Am Geriatr Soc. 2005, 53: 1875–1880.
- Schaafsma A., de Vries P. J, Saris W. H. Delay of natural bone loss by higher intakes of specific minerals and vitamins // Crit Rev Food Sci Nutr. 2001. Vol. 41 (4). Р. 225–249.
- Lakhkar N. J., Lee I. H., Kim H. W., Salih V., Wall I. B., Knowles J. C. Bone formation controlled by biologically relevant inorganic ions: role and controlled delivery from phosphate-based glasses // Adv Drug Deliv Rev. 2013. Vol. 65 (4). Р. 405–420.
- Торопцова Н. В., Никитинская О. А., Беневоленская Л. И. Профилактика первичного остеопороза с помощью различных препаратов кальция // Научно-практическая ревматология. 2005; 1: 36–39.
- Дамбахер М. А., Шахт Е. Остеопороз и активные метаболиты витамина D: мысли, которые приходят в голову. Basel: Eular Publishers, 1996. 139 p.
- Шварц Г. Я. Витамин D, D-гормон и альфакальцидол: молекулярно-биологические и фармакологические аспекты // Остеопороз и остеопатии. 1998. № 3. С. 2–7.
- Holik M. F. Vitamin D deficiency // New. Engl. J. Med. 2007. Vol. 357. P. 266–281.
- Forman J. P., Giovannucci E., Holmes M. D. et al. Plasma 25-hydroxyvitamin D level and risk of incidents hypertension // Hypertension. 2007. Vol. 49. P. 1063–1069.
- Vervloet M. G., Twisk J. W. Mortality reduction by vitamin D receptor activation in end–stage renal disease: a commentary on the robustness of current data // Nephrol. Dial. Transplant. 2009. Vol. 24. № 3. P. 703–706.
- Shea B., Wells G. et al. Calcium supplementation on bone loss in postmenopausal women (Cochrane review) // Cochrane Library, 2004.
- Cumming R. G., Nevitt M. C. Calcium for prevention of osteoporotic fractures in postmenopausal women // J. Bone Mineral. Res. 1997, V. 12: 1321–1329.
- Nordin B. E. C. Calcium and Osteoporosis // Nutrition. 1997, V. 13: 664–686.
- Baksgaard L., Andersen K. P., Hyldstrup L. Calcium and vitamin D supplementation increases spinal BMD in healthy, postmenopausal women // Osteoporosis Int. 1998, 8, 225–260.
- Devine A., Prince R. L., Dhalival S. S. et al. Results of a 5 Yaer Doudle Blinde, Placebo Controlled Trial of Calcium Supplementation (CAIFOS): Bone Density Outcomes // J. Bone Miner. Res. 2004, SA 416.
- Gillespie W. J., Avenell A., Henry D. A. et al. Vitamin D and vitamin D analogues for preventing fractures associated with involutional and postmenopausal osteoporosis (Cochrane Review). The Cochrane Library, Issue I, 2004.
- Dauson-Hughes B., Dallal G. E., Krall E. A. et al. A controlled trial of the effect of calcium supplementation on bone density in postmenopausal women // N. Engl. J. Med. 1990; 323 (13): 878–883.
- Dauson-Hughes B., Harris S. S., Krall E. A. et al. Effect of calcium and vitamin D supplementation on bone density in men and women 65 years of age or older // N. Engl. J. Med. 1997; 337 (10): 670–676.
- McCabe L. D., Martin B. R., McCabe G. P. et al. Dairy intakes affect bone density in the elderly // Am. J. Clin. Nutr. 2004; 80 (4): 1066–1074.
- Ruml L. A., Sakhaee K., Peterson R. et al. The effect of calcium citrate on bone density in the early and mid–postmenopausal period: a randomized placebo-controlled study // Am J Ther. 1999. V. 6. P. 303–311.
- Boonen S., Lips P., Bouillon R. et al. Need for additional calcium to reduce the risk of hip fracture with Vitamin D supplementation: evidence from a comparative meta–analysis of randomized controlled trials // J Clin Endocrinol Metab. 2007; 92: 1415–1423.
- Lakhkar N. J., Lee I. H., Kim H. W., Salih V., Wall I. B., Knowles J. C. Bone formation controlled by biologically relevant inorganic ions: role and controlled delivery from phosphate-based glasses // Adv Drug Deliv Rev. 2013; 65 (4): 405–420 doi.
- Baksgaard L., Andersen K. P., Hyldstrup L. Calcium and vitamin D supplementation increases spinal BMD in healthy, postmenopausal women // Osteoporosis Int. 1998, 8, 225–260.
- Rude R. R. Magnesium deficiency; a possible risk factors for osteoporosis. In: Burckhard P., Dowson-Hughes B., Heaney R. P., eds. Nutritional aspects of osteoporosis. San Diego: Academic Press, 2001. 263–271.
- Swaminathan R. Nutritional factors in osteoporosis // Int J Clin Pract. 1999; 53 (7): 540.
- Sojka J. E., Weaver C. M. Magnesium supplementation and osteoporosis // Nutr. Rev. 1995; 53: 71–74.
- Ryder K. M., Shorr R. I., Bush A. J., Kritchevsky S. B., Harris T., Stone K., Cauley J., Tylavsky F. A. Magnesium intake from food and supplements is associated with bone mineral density in healthy older white subjects // J Am Geriatr Soc. 2005, 53: 1875–1880.
- Jorgensen L., Skjelbakken T., Lochen M. L., Ahmed L., Bjornerem A., Joakimsen R., Jacobsen B. K. Anemia and the risk of non-vertebral fractures: the Tromso Study // Osteoporos Int. 2010; 21 (10): 1761–1768.
- Smoliar V. I., Biniashevskii E. V. Effect of copper deficiency on growth and bone tissue formation // Vopr Pitan. 1988; (6): 28–32.
- Opsahl W., Zeronian H., Ellison M., Lewis D., Rucker R. B., Riggins R. S. Role of copper in collagen cross-linking and its influence on selected mechanical properties of chick bone and tendon // J Nutr. 1982; 112 (4): 708–771.
- Lowe N. M., Fraser W. D., Jackson M. J. Is there a potential therapeutic value of cooper and zinc for osteoporosis? // Proceedings of the Nutrition Siciety. 2002; 61: 181–185.
- Strause L. G., Hegenauer J., Saltman P., Cone R., Resnick D. Effects of long-term dietary manganese and copper deficiency on rat skeleton // J Nutr. 1986; 116 (1): 135–141.
- Sheng M. H., Taper L. J., Veit H., Qian H., Ritchey S. J., Lau K. H. Dietary boron supplementation enhanced the action of estrogen, but not that of parathyroid hormone, to improve trabecular bone quality in ovariectomized rats // Biol Trace Elem Res. 2001; 82 (1–3): 109–123.
- Liao S. F., Monegue J. S., Lindemann M. D., Cromwell G. L., Matthews J. C. Dietary supplementation of boron differentially alters expression of borate transporter (NaBCl) mRNA by jejunum and kidney of growing pigs // Biol Trace Elem Res. 2011; 143 (2): 901–912.
- Tasli P. N., Dogan A., Demirci S., Sahin F. Boron enhances odontogenic and osteogenic differentiation of human tooth germ stem cells (hTGSCs) in vitro // Biol Trace Elem Res. 2013; 153 (1–3): 419–427 doi.
- Ying X., Cheng S., Wang W., Lin Z., Chen Q., Zhang W., Kou D., Shen Y., Cheng X., Rompis F. A., Peng L., Zhu Lu C. Effect of boron on osteogenic differentiation of human bone marrow stromal cells // Biol Trace Elem Res. 2011; 144 (1–3): 306–315.
- Hakki S. S., Bozkurt B. S., Hakki E. E. Boron regulates mineralized tissue-associated proteins in osteoblasts (MC3 T3-E1) // J Trace Elem Med Biol. 2010; 24 (4): 243–250 doi.
- Yamaguchi M., Fukagawa M. Role of zinc in regulation of protein tyrosine phosphatase activity in osteoblastic MC3 T3-E1. 2005.
- Lai Y. L., Yamaguchi M. Effects of copper on bone component in the femoral tissues of rats: anabolic effect of zinc is weakened by copper // Biol Pharm Bull. 2005; 28: 2296–2301.
- Yamaguchi M., Osishi H., Suketa Y. Stimulatory effect of zinc on bone formation in tissue culture // Biochem Pharmacol. 1987; 36: 4007–4012.
- Yamaguchi M., Oishi H., Suketa Y. Zinc stimulation of bone protein synthesis in tissue culture. Activation of aminoacyl-tRNA synthetase // Biochem Pharmacol. 1988; 37: 4075–4080.
- Захарова И. Н., Творогова Т. М., Воробьева А. С., Кузнецова О. А. Микроэлементоз как фактор формирования остеопении у подростков // Педиатрия. 2012. Т. 91. № 1. С. 68–75.
- Saltman P. D., Strause L. G. The role of trace minerals in osteoporosis // J. Am. Coll. Nutr. 1993. Vol. 12. № 4. P. 384–389.
- Никитинская О. А., Торопцова Н. В., Беневоленская О. А. Фармакологическая профилактика первичного остеопороза // РМЖ. 2008. Т. 16. № 6. С. 3–8.
- Лила А. М., Мазуров В. И. Роль Кальцемина адванс в профилактике постменопаузального остеопороза (результаты 12-месячного клинического исследования) // РМЖ. 2007. Т. 15. № 26. С. 1991–1996.
М. И. Шупина, кандидат медицинских наук
Г. И. Нечаева1, доктор медицинских наук, профессор
Д. В. Шупин
Е. В. Надей
А. А. Семенкин, доктор медицинских наук, профессор
ГБОУ ВПО ОмГМУ МЗ РФ, Омск
1 Контактная информация: [email protected]
Молекулярное управление разрушением костей
Давно известно, что костное вещество постоянно претерпевает разнообразные изменения. Это и понятно, поскольку костям приходится перестраивать свою структуру, чтобы приспосабливаться к меняющимся нагрузкам. Существуют специализированные клетки, остеобласты, которые работают в качестве ремонтников, устраняющих костные дефекты. Однако есть у них и клетки-антагонисты, которые называются остеокластами.
Эти клетки выполняют одну единственную функцию – разрушают костную и хрящевую ткань. Незрелые остеокласты циркулируют по кровяному руслу и в этом состоянии не представляют опасности для целостности костей. Однако они могут получать определенные химические сигналы, которые вынуждают их мигрировать к поверхности кости, доходить до состояния полной зрелости и приступать к выполнению своего черного дела. Именно это и происходит при остеопорозе и других заболеваниях, приводящих к деградации костной ткани.
Ученые уже давно ведут поиск сигнальных молекул, влияющих на поведение незрелых остеокластов. Один из таких проектов был выполнен в лаборатории Рональда Джермейна [Ronald Germain] из американского Национального института аллергии и инфекционных болезней. Джермейн и его сотрудники вместе с гостем из университета Осаки Масару Ишии [Masaru Ishii] пришли к выводу, что миграцией незрелых остеокластов управляют молекулы сфингозин-1-фосфата, которые всегда присутствуют в плазме крови.
В последние годы было доказано, что это жироподобное вещество выполняет целый ряд важнейших сигнальных функций, связанных с иммунитетом, обновлением кожных покровов и работой сосудистой системы. Теперь появились основания считать, что оно также играет ключевую роль в мобилизации предшественников остеокластов на разрушение костного вещества.
Если этот результат подтвердится, можно будет думать о возможности лечении остеопороза и ревматоидного артрита с помощью препаратов, воздействующих на молекулы сфингозин-1-фосфата. Это сообщение 8 февраля появилось на интернет-сайте журнала Nature.
Osteoclast Derivation from Mouse Bone Marrow
Возможность легко изолировать и вырастить большое количество остеокластов в пробирке был ответственен за помощь для углубления понимания биологии кости и остеокластов-опосредованных заболеваний. Это было определение RANKL, что приведет к этому, когда он был недавно идентифицирован в качестве основного регулятора образование остеокластов, дифференцировки и выживания 16-18.
Это был наш опыт, что выращивание в пробирке остеокластов из костного мозга в значительной степени зависит от плотности посева. Мы заметили, что неудача этого протокола, получая остеокластов, как правило, из-за неоптимального плотности посева, когда покрытие мозга, полученных клеток костного. Таким образом, в данном протоколе, рекомендуется, чтобы отобрать 200000 клеток на 24-луночный планшет хорошо. Кроме того, для достижения максимального успеха с этой техникой, рекомендуется, чтобы подготовить индукции остеокластов носитель точно, как описано выше, и, чтобы изменить носитель в секАм время каждый день, после первых 3-х дней, когда не нужно тревожить культуры пластины. Это может позволить постоянной концентрации факторов индукции остеокластов медиа. Кроме того, мы обнаружили, что использование конкретных реагентов также позволяет больший потенциал для культивирования большого числа многоядерных остеокластов.
Эта методика ограничивается наличием центрифуги РТ, в котором можно изменить параметры ускорения и торможения и закупки специфических реагентов. Это иначе очень простой протокол, с помощью которого мы имели особого успеха, в диапазоне мышей различного возраста и генетические предпосылки (например, C57BL / 6, CD1, NOD SCID, Лепа дБ — / -).
Эта методика предлагает надежный способ генерировать остеокластов в пробирке и определять их способность поглощать минерализованной матрицы. Используя этот протокол, можно выделить большое количество многоядерных остеокластов в ВИТРо, как правило, в течение одной недели. Наш опыт показывает, что изоляция остеокластов и в пробирке культуру, используя ранее опубликованные методы результаты в сильно изменяющихся результатов с точки зрения производства остеокластов, что часто приводит к неспособности вырастить остеокластов 9,12,14.
Функция остеокластов является сложным и резорбции кости представляет собой высоко организованы процесс, который опосредован на местном уровне перекрестных помех между остеобластов и остеокластов 19. В дополнение к местным управлением баланса костной ткани, возникающие данные свидетельствуют о том, что активность остеокластов регулируется системно факторами, связанными с иммунной, нейронов и других систематических факторов 20-24.
Как понимание остеокластов биологии продолжает быстро продвигаться, в том числе их разнообразную роль в процессах, начиная от костной ткани, чтобы их роль в регулировании метастазы рака в кости 25-27, этот протокол позволит исследователям состоятвидимому изолировать большое количество остеокластов в пробирке.
Subscription Required. Please recommend JoVE to your librarian.
чем можно ей помочь – Наука – Коммерсантъ
Кости составляют основу опорно-двигательного аппарата. Под прочной защитой костей находятся ценные структуры организма — костный мозг, в котором в течение всей жизни идет образование всех клеток крови и иммунитета, а также головной и спинной мозг, осуществляющие регуляцию всех функций организма.
Долгая эволюция создала совершенный механизм образования костной ткани в нашем организме — механизм остеогенеза. Он обеспечивает как ее постоянное обновление (физиологическую регенерацию или так называемое ремоделирование), так и восстановление после травм (репаративную регенерацию).
Кость формально можно назвать композиционным материалом, в состав которого входят органические вещества (основной белок-коллаген) и неорганические вещества (основные соли — кальция и фосфора). Два главных вида клеток — разрушающие кость (остеокласты) и формирующие кость (остеобласты) — трудятся в течение всей нашей жизни, обеспечивая обновление костной ткани и ее восстановление после травм.
Биоминерализацию белков могли осуществлять организмы уже более 600 млн лет назад. Раковины моллюсков, иглы морского ежа, наружный скелет членистоногих — результат этого процесса. Процесс биоминерализации коллагена при образовании костной ткани (то есть инкрустация его солями кальция, фосфора и некоторыми микроэлементами) эволюционно древний, с одной стороны, а с другой — находящийся под контролем нервной и гуморальной (через кровь с помощью биологически активных веществ и гормонов) систем. Кроме того, в костной ткани и костном мозге находится глубокий резерв организма — центральное депо стволовых клеток, замещающих в течение жизни состарившиеся или погибшие клетки во многих органах и тканях.
Изучение механизмов и процессов остеогенеза постепенно привело к пониманию того, какие материалы и конструкты на их основе нужно разрабатывать, чтобы осуществлять органотипическое (то есть с формированием типичного для этого органа структур) замещение костных дефектов. Этот подход называется биомиметическим.
Когда же может понадобиться помощь регенерационным процессам в костной ткани, если они такие совершенные, эволюционно древние? Есть такие ситуации. Во-первых, это так называемые костные дефекты, превосходящие по размерам критические, костные дефекты у пожилых людей с нарушениями кальциевого обмена и, наконец, костные дефекты у онкологических больных после химио- или лучевой терапии, когда регенерация затруднена.
То есть такие материалы востребованы при реконструктивно-пластических операциях в травматологии, челюстно-лицевой хирургии, стоматологии и, конечно, в онкологии.
Сегодня опухоли костей и метастазы в костную ткань не приговор. Их удаляют, замещая дефекты остеопластическими материалами. Полнота реабилитации у этой категории больных напрямую зависит от успехов в медицинском материаловедении.
История создания остеопластических биоматериалов насчитывает более 60 лет. Первое поколение таких материалов составляли биоинертные материалы, второе — биоактивные, биодеградируемые, третье — материалы для стимулирования специфических клеточных ответов на молекулярном уровне.
Золотым стандартом, тем не менее, остается использование аутологичной (собственной) костной ткани. Однако необходимость дополнительного оперативного вмешательства и недостаточное количество материала для закрытия крупных дефектов привели к идее использовать аллогенную (другого организма) костную ткань. Но при этом появилась опасность переноса от донора неидентифицированных инфекционных, а также аллергизирующих агентов. Материаловеды предложили использовать для этих целей синтетические кальций-фосфатные материалы, близкие по составу к неорганической составляющей костной ткани. Они широко применяются и сегодня, так как биосовместимы, обладают остеоиндуктивными (стимулирующими остеогенез) свойствами и используются клетками для построения новой кости. Однако оказалось, что они растворяются медленнее, чем образуется кость.
Неожиданный толчок в развитии биоматериалов дало изучение скелета кораллов. Он состоит из карбоната кальция, имеет особо прочную кристаллическую решетку-арагонит, сквозную пористость (что обеспечивает поток питательных веществ, газов, прорастание сосудов) и скорость биорезорбции сходную со скоростью остеогенеза. Он оказался блестящим материалом природного происхождения для замещения костных дефектов. Однако добыча кораллов ограниченна, и трудно стандартизировать их микроэлементный состав. Это привело к идее трехмерной печати для создания конструктов с целью замещения костных дефектов заданной формы, пористости и архитектоники поверхности, используя в качестве «чернил» кальций-фосфатные материалы.
Следующим этапом развития этого направления стала 3D-печать композиционных конструктов, содержащих как натуральную кость, так и органическую составляющую. В качестве таковой используют полимеры как природного (коллаген, альгинат, хитозан), так и синтетического происхождения. Еще более стимулировать остеогенез удалось при насыщении таких конструктов собственными стволовыми клетками из костного мозга, что открыло возможности изготовления персонализированных имплантатов заданной геометрии, пористости и архитектоники.
И, наконец, современные исследования в этой области посвящены разработке технологий функционализации таких 3D-конструктов биологически активными веществами (например, для пожилых людей или при крупных дефектах), антибиотиками (при открытых костных травмах, опасности инфицирования и развития воспалительных процессов) или противоопухолевыми препаратами. В последнем случае предполагается с помощью конструктов осуществлять адресную доставку химиопрепаратов с пролонгированным действием, что позволит снизить нагрузку системной (внутривенной) химиотерапии у онкологических больных.
Наталья Сергеева, доктор биологических наук, профессор, завлабораторией МНИОИ им. П. А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России
ЭНДОКРИННАЯ ФУНКЦИЯ КОСТНОЙ ТКАНИ | Гребенникова
1. Дедов И.И., Мельниченко Г.А., Белая Ж.Е., Рожинская Л.Я.: «Остеопороз — от редкого симптома эндокринных болезней до безмолвной эпидемии 20-21 века» // Ж. Проблемы Эндокринологии, 2011, том 57, стр. 35-45,
2. Белая Ж.Е., Рожинская Л.Я., Мельниченко Г.А. «Современные представления о действии тиреоидных гормонов и тиреотропного гормона на костную ткань» Ж. Проблемы эндокринологии, 2006 том 52 № 1, стр. 48-54
3. Schwetz V., Pieber V., Obermayer-Pietsch. The endocrine role of the skeleton: background and clinical evidence. Eur J Endocrinol. 2012 Jun; 166(6): 959-67. doi: 10.1530/EJE-12-0030.
4. Fukumoto S., Martin T.J. Bone as an endocrine organ. Trends Endocrinol Metab. 2009 Jul; 20(5): 230-6. doi: 10.1016/j. tem.2009.02.001.
5. Shalhoub V., Shatzen E.M., Ward S.C. FGF23 neutralization improves chronic kidney disease-associated hyperparathyroidism yet increases mortality. J Clin Invest. 2012 Jul 2; 122(7): 25432553. doi: 10.1172/JCI61405,
6. Carpenter T.O., Imel E.A., Ruppe M.D. et al. Randomized trial of the anti-FGF23 antibody KRN23 in X-linked hypophosphatemia. J Clin Invest. 2014 Apr; 124(4): 1587-97. doi: 10.1172/JCI72829
7. Vervloet M.G., Massy Z.A., Brandenburg V.M. Bone: a new endocrine organ at the heart of chronic kidney disease and mineral and bone disorders. Lancet Diabetes Endocrinol. 2014 May; 2(5): 427-36. doi: 10.1016/S2213-8587(14)70059-2.
8. Yamashita T., Yoshioka M., Itoh N. Identification of a novel fibroblast growth factor, FGF-23, preferentially expressed in the ventrolateral thalamic nucleus of the brain. Biochem Biophys Res Commun. 2000 Oct 22; 277(2): 494-8.
9. Goetz R., Beenken A., Ibrahimi O.A. Molecular insights into the klotho-dependent, endocrine mode of action of fibroblast growth factor 19 subfamily members. Mol Cell Biol. 2007 May; 27(9): 3417-28.
10. Martin A., Quarles L.D. Evidence for FGF23 involvement in a bone-kidney axis regulating bone mineralization and systemic phosphate and vitamin D homeostasis. Adv Exp Med Biol. 2012; 728: 65-83. doi: 10.1007/978-1-4614-0887-1_4.
11. Hu M.C., Kuro-o M., Moe O.W. Secreted klotho and chronic kidney disease. Adv Exp Med Biol. 2012; 728: 126-57. doi: 10.1007/978-1-4614-0887-1_9.
12. Urakawa I., Yamazaki Y., Shimada T. et al. Klotho converts canonical FGF receptor into a specific receptor for FGF23. Nature. 2006 Dec 7; 444(7120): 770-4. Epub 2006 Oct 29.
13. Yu X., Ibrahimi O.A., Goetz R. Analysis of the biochemical mechanisms for the endocrine actions of fibroblast growth factor-23. Endocrinology. 2005 Nov; 146(11): 4647-56.
14. Li S.A., Watanabe M., Yamada H. et al. Immunohistochemical localization of Klotho protein in brain, kidney and reproductive organs of mice. Cell Struct Funct. 2004 Dec; 29(4): 91-9.
15. Yamazaki Y., Tamada T., Kasai N. Anti-FGF23 neutralizing antibodies show the physiological role and structural features of FGF23. J Bone Miner Res 2008; 23(9): 1509-18.
16. John G.B., Cheng C.Y, Kuro-o M. Role of Klotho in aging, phosphate metabolism, and CKD. Am J Kidney Dis. 2011 Jul; 58(1): 127-34. doi: 10.1053/j.ajkd.2010.12.027.
17. Martin A., David V., Darryl Quarles L. Regulation and function of the FGF23/Klotho endocrine pathways. Physiol Rev. 2012 Jan; 92(1): 131-55. doi: 10.1152/physrev.00002.2011.
18. Oliveira R.B., Cancela A.L.E., Gracioli F.G. Early control of PTH and FGF23 in normophosphatemic CKD patients: a new target in CKD-MBD therapy? Clin J Am Soc Nephrol. 2010 Feb; 5(2): 286-91. doi: 10.2215/CJN.05420709.
19. Kuro-o M., Matsumura Y., Aizawa H. Mutation of the mouse klotho gene leads to a syndrome resembling ageing. Nature. 1997 Nov 6; 390(6655): 45-51.
20. Мелентьева А.А., Барышева О.Ю., Везикова Н.Н. и др. Роль фактора роста фибробластов 23 и фактора Klotho в развитии минерально-костных нарушений при хронической болезни почек. Курский научно-практический вестник “Человек и его здоровье”. 2014. № 3. С. 102-109.
21. Ben-Dov I.Z., Galitzer H., Lavi-Moshayoff V. The parathyroid is a target organ for FGF23 in rats. J Clin Invest. 2007 Dec; 117(12): 4003-8.
22. Wang H., Yoshiko Y., Yamamoto R. Overexpression of fibroblast growth factor 23 suppresses osteoblast differentiation and matrix mineralization in vitro. J Bone Miner Res 2008; 23(6): 939-48.
23. Liu S., Zhou J., Tang W. Pathogenic role of Fgf23 in Hyp mice. Am J Physiol Endocrinol Metab 2006; 291(1): E38-49.
24. Shimada T., Kakitani M., Yamazaki Y. Targeted ablation of Fgf23 demonstrates an essential physiological role of FGF23 in phosphate and vitamin D metabolism. J Clin Invest 2004; 113(4): 561-8.
25. Sitara D., Razzaque M.S., Hesse M. Homozygous ablation of fibroblast growth factor-23 results in hyperphosphatemia and impaired skeletogenesis and reverses hypophosphatemia in Phex-deficient mice. Matrix Biol 2004; 23(7): 421-32.
26. Hesse M., Fröhlich L.F., Zeitz U. Ablation of vitamin D signaling rescues bone, mineral and glucose homeostasis in Fgf-23 deficient mice. Matrix Biol 2007; 26(2): 75-84.
27. Sitara D., Razzaque M.S., St-Arnaud R. Genetic ablation of vitamin d activation pathway reverses biochemical and skeletal anomalies in fgf-23-null animals. Am J Pathol 2006; 169(6): 2161-70.
28. Stubbs J., Liu S., Tang W. et al. Role of Hyperphosphatemia and 1,25(OH)2D3 in Vascular Calcifications and Mortality in FGF23 Null Mice. J Am Soc Nephrol 2007; 17: 689A.
29. Yilmaz M.I., Sonmez A., Saglam M. Comparison of calcium acetate and sevelamer on vascular function and fi broblast growth factor 23 in CKD patients: a randomized clinical trial. Am J Kidney Dis 2012; 59: 177-85.
30. Jovanovich A., Ix J.H., Gottdiener J., et al. Fibroblast growth factor 23, left ventricular mass, and left ventricular hypertrophy in community-dwelling older adults. Atherosclerosis 2013; 231: 114-19.
31. The HYP Consortium. A gene (PEX) with homologies to endopeptidases is mutated in patients with X-linked hypophosphatemic rickets. Nat Genet. 1995 Oct; 11(2): 130-6.
32. Feng J.Q., Ward L.M., Liu S. et al. Loss of DMP1 causes rickets and osteomalacia and identifies a role for osteocytes in mineral metabolism. Nat Genet. 2006 Nov; 38(11): 1310-5.
33. Lorenz-Depiereux B., Bastepe M., Benet-Pagès A. DMP1 mutations in autosomal recessive hypophosphatemia implicate a bone matrix protein in the regulation of phosphate homeostasis. Nat Genet. 2006 Nov; 38(11): 1248-50.
34. Riminucci M., Collins M.T., Fedarko N.S. FGF-23 in fibrous dysplasia of bone and its relationship to renal phosphate wasting. J Clin Invest. 2003 Sep; 112(5): 683-92.
35. Bai X.Y., Miao D., Goltzman D. The autosomal dominant hypophosphatemic rickets R176Q mutation in fibroblast growth factor 23 resists proteolytic cleavage and enhances in vivo biological potency. J Biol Chem 2003; 278(11): 9843-9.
36. Benet-Pagès A., Lorenz-Depiereux B, Zischka H. FGF23 is processed by proprotein convertases but not by PHEX. Bone 2004; 35(2): 455-62.
37. Lyles K.W., Burkes E.J., Ellis G.J. Genetic transmission of tumoral calcinosis: autosomal dominant with variable clinical expressivity. J Clin Endocrinol Metab 1985; 60(6): 1093-6.
38. Benet-Pagès A., Orlik P., Strom T.M. An FGF23 missense mutation causes familial tumoral calcinosis with hyperphosphatemia. Hum Mol Genet. 2005 Feb 1; 14(3): 385-90
39. Ichikawa S., Imel E.A., Kreiter M.L. et al. A homozygous missense mutation in human KLOTHO causes severe tumoral calcinosis. J Clin Invest. 2007 Sep; 117(9): 2684-91.
40. Topaz O., Shurman D.L., Bergman R. Mutations in GALNT3, encoding a protein involved in O-linked glycosylation, cause familial tumoral calcinosis. Nat Genet. 2004 Jun; 36(6): 579-
41. Epub 2004 May 9.
42. Razzaque M.S., Sitara D., Taguchi T. Premature aging-like phenotype in fibroblast growth factor 23 null mice is a vitamin D-mediated process. FASEB J 2006; 20(6): 720-2.
43. Liu S., Tang W., Zhou J. Fibroblast growth factor 23 is a counter-regulatory phosphaturic hormone for vitamin D. J Am Soc Nephrol 2006; 17(5): 1305-15.
44. Zhang F., Zhai G., Kato B.S. Association between KLOTHO gene and hand osteoarthritis in a female Caucasian population. Osteoarthritis Cartilage. 2007 Jun; 15(6): 624-9.
45. Шутов Е.В. Значение фактора роста фибробластов-23 у больных хронической болезнью почек — обзор современных исследований. Лечащий врач. — 2012. — № 8. — C. 12-16.
46. Добронравов В.А. Современный взгляд на патофизиологию вторичного гиперпаратиреоза: роль фактора роста фибробластов 23 и Klotho. Нефрология. — 2011. — Т. 15, № 4. — С. 11-20.
47. Милованова Л.Ю., Милованов Ю.С., Козловская Л.В. Нарушения фосфорно-кальциевого обмена при хронической болезни почек III-V стадий. Клиническая нефрология. — 2011. — № 1. — С. 58-68.
48. Koizumi M., Komaba H., Nakanishi S. Cinacalcet treatment and serum FGF23 levels in haemodialysis patients with secondary hyperparathyroidism. Nephrol Dial Transplant. 2012 Feb; 27(2): 784-90. doi: 10.1093/ndt/gfr384.
49. Tebben PJ, Singh RJ, Clarke BL. Fibroblast growth factor 23, parathyroid hormone and 1alpha,25-dihydroxyvitamin D in surgically treated primary hyperparathyroidism. Mayo Clin Proc 2004; 79(12): 1508-13.
50. Kawata T., Imanishi Y., Kobayashi K. Parathyroid hormone regulates fibroblast growth factor-23 in a mouse model of primary hyperparathyroidism. J Am Soc Nephrol 2007; 18(10): 2683-8.
51. Saji F., Shiizaki K., Shimada S. Regulation of fibroblast growth factor 23 production in bone in uremic rats. Nephron Physiol 2009; 111(4): p59-66.
52. Xiao Z.S., Crenshaw M., Guo R. et al. Intrinsic mineralization defect in Hyp mouse osteoblasts. Am J Physiol 1998; 275(4 Pt 1): E700-8.
53. Liu S., Zhou J., Tang W. Pathogenic role of Fgf23 in Dmp1-null mice. Am J Physiol Endocrinol Metab 2008; 295(2): E254-61.
54. Liu S., Vierthaler L., Tang W. FGFR3 and FGFR4 do not mediate renal effectso of FGF23 in vivo. J Am Soc Nephrol. 2008 Dec; 19(12): 2342-50. doi: 10.1681/ASN.2007121301
55. Ogbureke K.U., Fisher L.W. Expression of SIBLINGs and their partner MMPs in salivary glands. J Dent Res 2004; 83(9): 664-70.
56. Goebel S., Lienau J., Rammoser U. et al. FGF23 is a putative marker for bone healing and regeneration. J Orthop Res. 2009 Sep; 27(9): 1141-6. doi: 10.1002/jor.20857.
57. Matsumura Y., Aizawa H., Shiraki-Iida T. Identification of the human klotho gene and its two transcripts encoding membrane and secreted klotho protein. Biochem Biophys Res Commun. 1998; 242(3): 626-630.
58. Shiraki-Iida T., Aizawa H., Matsumura Y. Structure of the mouse klotho gene and its two transcripts encoding membrane and secreted protein. FEBS Lett. 1998 Mar 6; 424(1-2): 6-10.
59. Tohyama O., Imuxa A., Iwano A. Klotho is a novel beta-glucuronidase capable of hydrolyzing steroid beta-glucuxonides. J Biol Chem. 2004 Mar 12; 279(11): 9777-84
60. Chen C.D., Podvin S., Gillespie E. Insulin stimulates the cleavage and release of the extracellular domain of Klotho by ADAM10 and ADAM17. Proc Natl Acad Sci USA. 2007; 104(50): 19796-19801.
61. Bloch L., Sineshchekova O., Reichenbach D. Klotho is a substrate for alpha-, beta- and gamma-secretase. FEBS Lett. 2009; 583(19): 3221-3224.
62. Cha S.K., Hu M.C., Kurosu H. Regulation of renal outer medullary potassium channel and renal K(+) excretion by Klotho. Mol Pharmacol. 2009; 76(1): 38-46.
63. Cha S.K., Ortega B., Kurosu H. Removal of sialic acid involving Klotho causes cell-surface retention of TRPV5 channel via binding to galectin-1. Proc Natl Acad Sci USA. 2008; 105(28): 9805-9810.
64. Hu M.C., Shi M., Zhang J. Klotho: a novel phosphaturic substance acting as an autocrine enzyme in the renal proximal tubule. FASEB J. 2010; 24(9): 3438-3450.
65. Fukagawa M., Kazama J.J. With or without the kidney: the role of FGF23 in CKD. Nephrol Dial Transplant. 2005; 20(7): 1295-1298.
66. Weber T.J., Liu S., Indridason O.S. Serum FGF23 levels in normal and disordered phosphorus homeostasis. J Bone Miner Res. 2003; 18(7): 1227-1234.
67. Nakatani T., Sarraj B., Ohnishi M. In vivo genetic evidence for klotho-dependent, fibroblast growth factor 23 (Fgf23)-mediated regulation of systemic phosphate homeostasis. FASEB J. 2009; 23(2): 433-441.
68. Hu M.C., Shi M., Zhang J. Klotho deficiency causes vascular calcification in chronic kidney disease. J Am Soc Nephrol. 2011; 22(1): 124-136.
69. Jono S., Shioi A., Ikari Y. Vascular calcification in chronic kidney disease. J Bone Miner Metab. 2006; 24(2): 176-181.
70. London G.M. Cardiovascular calcifications in uremic patients: clinical impact on cardiovascular function. J Am Soc Nephrol. 2003; 14 Suppl 4(9): S305-S309.
71. Liu H., Fergusson M.M., Castilho R.M. Augmented Wnt signaling in a mammalian model of accelerated aging. Science. 2007; 317(5839): 803-806.
72. De Oliveira R.M. Klotho RNAi induces premature senescence of human cells via a p53/p21 dependent pathway. FEBS Lett. 2006; 580(24): 5753-5758.
73. Ming Chang Hu, Makoto Kuro-o, Orson W. Moe. Secreted Klotho and chronic disease. Adv Exp Med Biol. 2012; 728: 126-157. doi: 10.1007/978-1-4614-0887-1_9.
74. Nakamura T., Saito Y., Ohyama Y., et al. Production of nitric oxide, but not prostacyclin, is reduced in klotho mice. Jpn J Pharmacol. 2002; 89(2): 149-156.
75. Shimada T., Takeshita Y., Murohara T., et al. Angiogenesis and vasculogenesis are impaired in the precocious-aging klotho mouse. Circulation. 2004; 110(9): 1148-1155.
76. Taniyama Y., Morishita R. Does therapeutic angiogenesis overcome CKD? Hypertens Res. 2010; 33(2): 114-115.
77. Mu W., Long D.A., Ouyang X. Angiostatin over expression is associated with an improvement in chronic kidney injury by an anti-inflammatory mechanism. Am J Physiol Renal Physiol. 2009; 296(1): F145-F152.
78. Westerweel P.E., Hoefer I.E., Blankestijn P.J. End-stage renal disease causes an imbalance between endothelial and smooth muscle progenitor cells. Am J Physiol Renal Physiol. 2007; 292(4): F1132-F1140.
79. Sugiura H., Yoshida T., Kohei J., et al. TGF-ß Was Upregulated in Renal Fibrosis Model of Klotho Defect Mouse and Affected Renal Klotho Expression Level (Abstract). J Am Soc Nephrol. 2010; 21: 376A.
80. Zeisberg M., Hanai J., Sugimoto H., et al. BMP-7 counteracts TGF-beta1-induced epithelial-to-mesenchymal transition and reverses chronic renal injury. Nat Med. 2003; 9(7): 964-968.
81. Iwano M. EMT and TGF-beta in renal fibrosis. Front Biosci (Schol Ed). 2010; 2: 229-238.
82. Sato M., Muragaki Y., Saika S. Targeted disruption of TGF-betal/Smad3 signaling protects against renal tubulointerstitial fibrosis induced by unilateral ureteral obstruction. J Clin Invest.2003; 112(10): 1486-1494.
83. Takeshita K., Yamamoto K., Ito M. Increased expression of plasminogen activator inhibitor-1 with fibrin deposition in a murine model of aging, «Klotho» mouse. Semin Thromb Hemost.2002; 28(6): 545-554.
84. Krajisnik T., Olauson H., Mirza M.A. Parathyroid Klotho and FGF-receptor 1 expression decline with renal function in hyperparathyroid patients with chronic kidney disease and kidney transplant recipients. Kidney Int. 2010; 78(10): 1024-1032.
85. Canalejo R., Canalejo A., Martinez-Moreno J.M. FGF23 fails to inhibit uremic parathyroid glands. J Am Soc Nephrol. 2010; 21(7): 1125-1135.
86. Tomida K., Hamano T., Mikami S., et al. Serum 25-hydroxy vitamin D as an independent determinant of 1-84 PTH and bone mineral density in nondiabetic predialysis CKD patients. Bone. 2009; 44(4): 678-683.
87. Jassal S.K., von Muhlen D., Barrett-Connor E. Measures of renal function, BMD, bone loss, and osteoporotic fracture in older adults: the Rancho Bernardo study. J Bone Miner Res. 2007; 22(2): 203-210.
88. Yamazaki Y., Imura A., Urakawa I. et al. Establishment of sandwich ELISA for soluble alpha-Klotho measurement: Age-dependent change of soluble alpha-Klotho levels in healthy subjects.Biochem Biophys Res Commun. 2010; 398(3): 513-518.
89. Appledorn D.M., Seregin S., Amalfitano A. Adenovirus vectors for renal-targeted gene delivery. Contrib Nephrol. 2008; 159: 47-62.
90. Imai E. Gene therapy approach in renal disease in the 21st century. Nephrol Dial Transplant. 2001; 16(Suppl 5): 26-34.
91. Huang C.L. Regulation of ion channels by secreted Klotho: mechanisms and implications. Kidney Int. 2010; 77(10): 855-860.
92. Kurosu H., Ogawa Y., Miyoshi M. Regulation of fibroblast growth factor-23 signaling by klotho. J Biol Chem. 2006; 281(10): 6120-6123.
93. Hu M.C., Shi M., Zhang J. Klotho deficiency is an early biomarker of renal ischemia-reperfusion injury and its replacement is protective. Kidney Int. 2010; 78(12): 1240-1251.
94. Mitani H., Ishizaka N., Aizawa T. In vivo klotho gene transfer ameliorates angiotensin II-induced renal damage. Hypertension. 2002; 39(4): 838-843.
95. London G.M., Guerin A.P., Marchais S.J., Metivier F., Pannier B., Adda H. Arterial media calcification in end-stage renal disease: impact on all-cause and cardiovascular mortality. Nephrol Dial Transplant. 2003; 18(9): 1731-1740. doi: 10.1093/ndt/gfg414.
96. Nitta K., et al. Left ventricular hypertrophy is associated with arterial stiffness and vascular calcification in hemodialysis patients. Hypertens Res. 2004; 27(1): 47-52. doi: 10.1291/hypres.27.47.
97. Chertow G.M., Raggi P., Chasan-Taber S., Bommer J., Holzer H., Burke S.K. Determinants of progressive vascular calcification in haemodialysis patients. Nephrol Dial Transplant. 2004; 19(6): 1489-1496. doi: 10.1093/ndt/gfh225.
98. Block G.A., Hulbert-Shearon T.E., Levin N.W. Association of serum phosphorus and calcium x phosphate product with mortality risk in chronic hemodialysis patients: a national study. Am J Kidney Dis. 1998; 31(4): 607-617. doi: 10.1053/ajkd.1998.v31.pm9531176.
99. Sambrook P.N., Chen J.S., March L.M. Serum parathyroid hormone is associated with increased mortality independent of 25-hydroxy vitamin d status, bone mass, and renal function in the frail and very old: a cohort study. J Clin Endocrinol Metab. 2004; 89(11): 5477-5481. doi: 10.1210/jc.2004-0307.
100. Fliser D., Kollerits B., Neyer U. Fibroblast growth factor 23 (FGF23) predicts progression of chronic kidney disease: the Mild to Moderate Kidney Disease (MMKD) Study. J Am Soc Nephrol. 2007; 18(9): 2600-2608. doi: 10.1681/ASN.2006080936.
101. Gutiérrez O.M., Januzzi J.L., Isakova T. Fibroblast growth factor 23 and left ventricular hypertrophy in chronic kidney disease. Circulation. 2009; 119(19): 2545-2552. doi: 10.1161/ CIRCULATIONAHA. 108.844506
102. Seiler S., Reichart B., Roth D. FGF-23 and future cardiovascular events in patients with chronic kidney disease before initiation of dialysis treatment. Nephrol Dial Transplant. 2010; 25(12): 3983-3989. doi: 10.1093/ndt/gfq309.
103. Jean G., Terrat J.C., Vanel T. High levels of serum fibroblast growth factor (FGF)-23 are associated with increased mortality in long haemodialysis patients. Nephrol Dial Transplant. 2009; 24(9): 2792-2796. doi: 10.1093/ndt/gfp191.
104. Sun N., Guo Y., Liu W. FGF23 neutralization improves bone quality and osseointegration of titanium implants in chronic kidney disease mice. Sci Rep. 2015 Feb 10; 5: 8304. doi: 10.1038/srep08304.
105. Lee A.J., Hodges S., Eastell R. Measuremant of osteocalcin. Ann Clin Biochem. 2000 Jul; 37 ( Pt 4): 432-46.
106. Белая Ж.Е., Рожинская Л.Я., Мельниченко Г.А., Ильин А.В., Драгунова Н.В., Колесникова Г.С., Бутрова С.А., Трошина Е.А.: Возможности маркёра костного обмена — остеокальцина — для диагностики эндогенного гиперкортицизма и вторичного остеопороза. // Ж. Остеопороз и Остеопатии, 2011, № 2, стр. 7-10
107. Delmas P.D., Malaval L., Arlot M.E. Serum bone Glaprotein compared to bone histomorphometry in endocrine diseases. Bone. 1985; 6(5): 339-41.
108. Charles P., Poser J.W., Mosekilde L. Estimation of bone turnover evaluated by 47Ca-kinetics. Efficiency of serum bone gammacarboxyglutamic acid-containing protein, serum alkaline phosphatase, and urinary hydroxyproline excretion. J Clin Invest. 1985 Dec; 76(6): 2254-8.
109. Ducy P., Desbois C., Boyce B. et al. Increased bone formation in osteocalcin-deficient mice. Nature. 1996 Aug 1; 382(6590): 448-52
110. Lee, N.K. и Karsenty, G. Reciprocal regulation of bone and energy metabolism. Trends Endocrinol Metab. 2008 Jul; 19(5): 161-6. doi: 10.1016/j.tem.2008.02.006
111. Wellendorph P., Bräuner-Osborne H. Molecular cloning, expression, and sequence analysis of GPRC6A, a novel family C G-protein-coupled receptor. Gene 2004; 335: 37-46
112. Lee N.K., Sowa H., Hinoi E. Endocrine regulation of energy metabolism by the skeleton. Cell 2007; 130: 456-69.
113. Ferron M., Hinoi E., Karsenty G. et al. (2008) Osteocalcin differentially regulates beta cell and adipocyte gene expression and affects the development of metabolic diseases in wild-type mice. Proc Natl Acad Sci U S A. 2008 Apr 1; 105(13): 5266-70. doi: 10.1073/pnas.0711119105
114. Shi Y., Yadav V.K., Suda N. Dissociation of the neuronal regulation of bone mass and energy metabolism by leptin in vivo. Proc Natl Acad Sci U S A. 2008 Dec 23; 105(51): 20529-33. doi: 10.1073/pnas.0808701106
115. Hinoi E., Gao N., Jung D.Y. The sympathetic tone mediates leptin’s inhibition of insulin secretion by modulating osteocalcin bioactivity. J Cell Biol. 2008 Dec 29; 183(7): 1235-42. doi: 10.1083/jcb.200809113
116. Booth S.L., Centi A., Smith S.R. The role of osteocalcin in human glucose metabolism: marker or mediator? Nat Rev Endocrinol 2013; 9: 43-55.
117. Sokoll L.J., Booth S.L., O’Brien M.E. et al. Changes in serum osteocalcin, plasma phylloquinone, and urinary y-carboxyglutamic acid in response to altered intakes of dietary phylloquinone in human subjects. Am J Clin Nutr 1997; 65: 779-84.
118. Kindblom J.M., Ohlsson C., Ljunggren O. Plasma osteocalcin is inversely related to fat mass and plasma glucose in elderly Swedish men. J Bone Miner Res. 2009 May; 24(5): 785-91. doi: 10.1359/jbmr.081234.
119. Pittas A.G., Harris S.S., Eliades M. Association between serum osteocalcin and markers of metabolic phenotype. J Clin Endocrinol Metab. 2009 Mar; 94(3): 827-32. doi: 10.1210/ jc.2008-1422.
120. Im J.A., Yu B.P., Jeon J.Y. et al. Relationship between osteocalcin and glucose metabolism in postmenopausal women. Clin Chim Acta. 2008 Oct; 396(1-2): 66-9. doi: 10.1016/j.cca.2008.07.001
121. Fernândez-Real J.M., Izquierdo M., Ortega F. et al. The relationship of serum osteocalcin concentration to insulin secretion, sensitivity, and disposal with hypocaloric diet and resistance training. J Clin Endocrinol Metab. 2009 Jan; 94(1): 237-45. doi: 10.1210/jc.2008-0270.
122. Patti A., Gennari L., Merlotti D. et al. Endocrine Actions of Osteocalcin. Int J Endocrinol. 2013; 2013: 846480. doi: 10.1155/2013/846480.
123. Oury F., Sumara G., Sumara O. Endocrine regulation of male fertility by the skeleton. Cell. 2011 Mar 4; 144(5): 796-809. doi: 10.1016/j.cell.2011.02.004.
124. Kirmani S., Atkinson E.J., Melton L.J. 3rd et al. Relationship of testosterone and osteocalcin levels during growth. J Bone Miner Res. 2011 Sep; 26(9): 2212-6. doi: 10.1002/jbmr.421.
125. Kanazawa I., Tanaka K., Ogawa N. et al. Undercarboxylated osteocalcin is positively associated with free testosterone in male patients with type I diabetes mellitus. Osteoporos Int. 2013 Mar; 24(3): 1115-9. doi: 10.1007/s00198-012-2017-7.
126. Hannemann A., Breer S., Wallaschofski H. Osteocalcin is associated with testosterone in the general population and selected patients with bone disorders. Andrology. 2013 May; 1(3): 469-74. doi: 10.1111/j.2047-2927.2012.00044.x.
127. Seeman E. Pathogenesis of bone fragility in women and men. Lancet. 2002 May 25; 359(9320): 1841-50.
Из чего состоят кости
автор: Dr. med. Gesche Tallen, erstellt am 2013/04/12, редактор: Dr. Natalie Kharina-Welke, Последнее изменение: 2017/08/30
В первую очередь наши кости состоят из костного вещества, которое содержит соли кальция. В целом кость как орган состоит ещё из таких мягких тканей как суставные хрящи и надкостница (на языке специалистов периост), костного мозга внутри костей, а также кровеносных сосудов и нервов, которые проходят через надкостницу и костный мозг.
Костное вещество
Костное вещество составляет основную массу наших костей. Оно очень прочное, так как содержит кальций (специалисты говорят о солях кальция), его вес может доходить до 70% веса костей. Костное вещество бывает в костях в основном в двух формах: компактное костное вещество и губчатое костное вещество.
Компактное костное вещество – это твёрдая, плотная беловатая масса. В первую очередь она как бы окутывает (покрывает) толстым слоем костномозговые полости внутри длинных трубчатых костей (например, бедренных костей или плечевых костей). Зато губчатое костное вещество состоит из достаточно тонких пластинок/перекладинок. Его можно найти в наших коротких, плоских костях, например, в позвонках.
Костное вещество состоит из зрелых костных клеток, они называются остеоциты. У остеоцитов есть отростки и с помошью этих отростков они соединяются между собой. Работая вместе с молодыми клетками остеобластами, которые отвечают за формирование костей, начинает расти новая кость. А разрушается костная ткань с помощью клеток, которые называются остеокласты.
Суставные хрящи
Суставные хрящи есть практически во всех костях, за исключением костей черепа. Они покрывают суставные поверхности и являются последней оставшейся частью скелета из эмбрионального (зародышевого, эмбриональный) развития.
Надкостница
Надкостница (которую специалисты называют периостом) покрывает снаружи все наши кости. Поэтому нигде не видно самого костного вещества. Его покрывает либо надкостница, либо суставной хрящ.
Костный мозг
Костный мозг – это мягкая масса, которая находится в полостях внутри костей. Костный мозг бывает красным и жёлтым. Красный костный мозг отвечает в организме за кроветворение. А жёлтый костный мозг – это в основном жировая ткань.
Жёлтый костный мозг появляется у человека не сразу, а постепенно в ходе развития человека красный костный мозг заменяется на жёлтый. Поэтому чем старше становится человек, тем больше у него становится жёлтого костного мозга. У взрослых жёлтый костный мозг заполняет центральную часть длинных трубчатых костей (это могуть быть, например, плечевые кости), которую специалисты называют диафизом. Красный костный мозг находится в основном внутри коротких и плоских костей (например, внутри позвонков).
Кровеносные сосуды и нервы
Кровеносные сосуды и нервы находятся и в костном веществе, и в надкостнице, и в костном мозге. Они передают костным клеткам информацию, питательные вещества и кислород. Через мельчайшие отверстия на поверхности костей они попадают внутрь кости, а из кости выходят в систему кровообращения или соответственно в нервы, которые их соединяют с нервной системой.
404 Not Found
Дата вступления в силу: «12» ноября 2015 г.
Настоящие Условия онлайн-использования регламентируют Ваш доступ к веб-сайтам, контролируемым компанией «Верофарм», включая ее подразделения и филиалы (совместно именуемые «Верофарм»), которые ссылаются на настоящие Условия онлайн- использования (совместно именуемые «веб-сайтами компании «Верофарм»). Настоящие Условия онлайн-использования не применимы к веб-сайтам компании «Верофарм», которые не ссылаются на настоящие Условия онлайн-использования и к веб-сайтам третьих лиц, с которыми могут быть связаны веб-сайты компании «Верофарм». Использование Вами веб-сайтов компании «Верофарм» подпадает под действие настоящих Условий онлайн-использования и Политики в отношении обработки персональных данных на веб-сайтах компании «Верофарм».
В пределах, допустимых применимым законодательством, компания «Верофарм» сохраняет за собой право вносить поправки в данные Условия онлайн-использования с учетом технологического прогресса, юридических и правовых изменений, надлежащей бизнес-практики. Если компания «Верофарм» внесет изменения в настоящие Условия онлайн-использования, обновленная версия Условий онлайн-использования будет отражать соответствующие изменения, и мы уведомим Вас об их наличии, обновив дату вступления в силу Условий онлайн-использования, указанную выше.
Осуществляя доступ и используя веб-сайты компании «Верофарм», Вы соглашаетесь с тем, что прочитали, поняли и согласились соблюдать настоящие Условия онлайн-использования в их текущей версии, с которыми Вы имели возможность ознакомиться при доступе к веб-сайтам компании «Верофарм». Если Вы не согласны с данными Условиями онлайн-использования или не удовлетворены деятельностью веб-сайтов компании «Верофарм», Вашим единственным и исключительным способом правовой защиты, в пределах допустимых применимым законодательством, является прекращение использования данного веб-сайта компании «Верофарм».
Отказ от ответственности
Вы признаете и соглашаетесь с тем, что:
а. Несмотря на то что на веб-сайтах компании «Верофарм» мы всегда стремимся представить новейшие разработки, связанные с нашими продуктами и услугами, а также иную информацию о компании «Верофарм», информация представлена в формате «КАК ЕСТЬ» и может содержать технические неточности, типографские ошибки или являться неактуальной. Компания «Верофарм» сохраняет за собой право добавлять, удалять или изменять информацию, содержащуюся на веб-сайтах компании «Верофарм» в любое время без предварительного уведомления.
б. Компания «Верофарм» не предоставляет никаких заверений или гарантий какого-либо рода или характера относительно информации или данных, размещенных на веб-сайтах компании «Верофарм».
В пределах, допустимых действующим законодательством, настоящим компания «Верофарм» снимает с себя ответственность за любые утверждения или гарантии, высказанные или подразумеваемые, предписанные законом, контрактом или иным образом, ни в коем случае компания «Верофарм» не несет ответственности за любой ущерб любого рода или характера, в том числе, без ограничений, прямой, косвенный, особый (включая упущенную выгоду), явившийся следствием или случайным, ущерб, возникший в связи или на основе существования или использования веб-сайтов компании «Верофарм», и/или информации или сведений, размещенных на веб-сайтах компании «Верофарм» независимо от того, предполагала ли компания «Верофарм» возможность такого ущерба.
в. Компания «Верофарм» не несет ответственности и не предоставляет никаких гарантий относительно точности, эффективности, своевременности и приемлемости любой информации или сведений, полученных от третьих лиц, включая гиперссылки на или с сайтов третьих лиц. За исключением случаев, оговоренных на веб-сайтах компании «Верофарм», компания «Верофарм» не проводит редактирование, рецензирование или иной контроль информационного наполнения, представляемого третьими лицами на досках объявлений, в чатах и на других аналогичных форумах, размещаемых на веб-сайтах компании «Верофарм». В этой связи, такая информация должна рассматриваться как подозрительная и не является подтвержденной компанией «Верофарм».
г. Веб-сайты компании «Верофарм» могут содержать прогностические утверждения, которые отражают ожидания компании «Верофарм» в отношении предстоящих событий и развития бизнеса. Прогностические утверждения предполагают риски и неопределенность. Реальное развитие событий или результаты могут значительно отличаться от предполагаемых и зависят от множества факторов, включая (но не ограничиваясь этим) успешным завершением продолжающихся программ разработки, результатами текущих или будущих клинических исследований, продолжающимся коммерческим внедрением продукции, регуляторным одобрением фармацевтических препаратов, достоверностью и приведением в действие патентов, стабильностью коммерческих взаимоотношений и общими экономическими условия. Компания «Верофарм» намерена регулярно обновлять свои веб-сайты, однако не принимает на себя никаких обязательств по обновлению любого информационного наполнения веб-сайтов.
Ваше использование
Вы понимаете, принимаете к сведению и соглашаетесь, что:
а. Используя веб-сайты компании «Верофарм», Вы согласны не изменять и не разрушать нашу электронную информацию, размещенную на веб-сайтах компании «Верофарм» или на любых наших серверах. Кроме того, Вы также соглашаетесь не пытаться обойти меры безопасности веб-сайтов компании «Верофарм» и соблюдать требования всех действующих местных, государственных, федеральных и международных законов, правил и постановлений.
б. Вы предоставляете компании «Верофарм» право использовать любые материалы, которые Вы загружаете или иным образом передаете на веб-сайты компании «Верофарм», в соответствии с настоящими Условиями онлайн-использования и Политикой в отношении обработки персональных данных на веб-сайтах компании «Верофарм», любым способом, который компания «Верофарм» сочтет предпочтительным, включая, но не ограничиваясь копированием, показом, воспроизводством или публикацией в каком бы то ни было формате, с изменением материалов, включением в иные материалы или проведением основанных на этих материалах работ.
в. За исключением случаев, специально оговоренных и заранее согласованных компанией «Верофарм», отношения по конфиденциальности между компанией «Верофарм» и пользователем веб-сайтов компании «Верофарм» не будут возникать в том случае, если пользователь веб-сайтов компании «Верофарм» направит какое-либо устное, письменное или электронное сообщение компании «Верофарм» (обратная связь, вопросы, комментарии, предложения, идеи и т.д.).
Если какой-либо веб-сайт компании «Верофарм» требует или просит предоставить такую информацию, и эта информация содержит сведения, позволяющие идентифицировать личность (например, фамилию, адрес, номер телефона, электронный адрес), компания «Верофарм» намерена получить, использовать и сохранить эту информацию с согласия соответствующего пользователя в соответствии с положениями, указанными в Политике в отношении обработки персональных данных на веб-сайтах компании «Верофарм».
В ином случае такие сообщения и любая информация, предоставленная в их контексте, будет рассматриваться как не конфиденциальная, и компания «Верофарм» будет располагать правом воспроизводить, публиковать или иным образом использовать эту информацию для каких бы то ни было целей, включая, без ограничений, исследование, разработку, производство, использование или продажу продукции, предполагающие внедрение данной информации. Лицо, направившее какую-либо информацию в компанию «Верофарм», несет полную ответственность за ее содержание, включая ее достоверность, точность и тот факт, что она не несет в себе нарушения чьих-либо прав, в том числе, права собственности.
Маркировка продукции
Локальные веб-сайты компании «Верофарм» содержат общую информацию о компании «Верофарм» и ее продуктах, которые официально зарегистрированы на соответствующей территории и находятся в свободном обращении, рекламные материалы, строго соответствующие локальному законодательству, а также иную научную информацию, которую мы посчитали полезной для размещения на соответствующем веб-сайте для Вашего ознакомления с такой информации в личных некоммерческих целях или для повышения Вашего профессионального уровня, если Вы являетесь медицинским, фармацевтическим работником или иным работником системы здравоохранения.
Тем не менее, обращаем Ваше внимание на то, что на локальных веб-сайтах соответствующей страны могут иметься ссылки на зарубежные веб-сайты компании «Верофарм». В таком случае названия, описания и маркировки продуктов могут иметь более тесную связь или быть созданы в соответствии с законодательством иной страны, которая не является страной вашего постоянного места жительства. Некоторые продукты могут быть доступны не во всех странах или быть доступны под другими торговыми наименованиями, в другой дозировке или с иными показаниями к применению. Многие из перечисленных продуктов могут отпускаться только по назначению местного специалиста в области здравоохранения.
За исключением случаев, заранее согласованных компанией «Верофарм», директор, сотрудники, агенты или представители компании «Верофарм», ее дочерних компаний и филиалов, не принимают участия в проведении медицинских консультаций, диагностике, лечении или осуществлении иных медицинских услуг, которые могли бы создать какую бы то ни было взаимосвязь, как, например, «врач-пациент», посредством веб-сайтов компании «Верофарм». В любом случае никакая информация о наших продуктах, размещенная на наших веб-сайтах, не должна рассматриваться и пониматься как непосредственная консультация специалиста или замена такой консультации у соответствующего специалиста (врача).
Обращаем Ваше внимание на то, что у продуктов «Верофарм» имеются противопоказания к применению, поэтому перед их употреблением необходимо внимательно ознакомится с инструкцией по их применению и обратиться за консультацией врача.
Ни в коем случае информация, размещенная на веб-сайтах компании «Верофарм», не должна использоваться для самостоятельной диагностики Вашего здоровья и возможных заболеваний.
В соответствии с требованиями законодательства РФ, информация, расположенная в некоторых разделах веб-сайтов компании «Верофарм», может предназначаться исключительно для медицинских и фармацевтических работников, а также иных работников системы здравоохранения. В этом случае доступ к таким разделам может быть ограничен в соответствии с правилами, указанными в Правилах пользования разделом по рецептурным лекарственным средствам и медицинским изделиям, для использования которых требуется специальная подготовка.
Для входа в такие разделы компания «Верофарм» оставляет за собой право попросить Вас ответить на некоторые вопросы, связанные с медициной или фармацевтикой, и/или предоставить информацию путем осуществления дополнительной регистрации на веб-сайтах для целей подтверждения действительного статуса медицинского, фармацевтического работника или иного работника системы здравоохранения на момент посещения соответствующего веб-сайта.
Интеллектуальная собственность
Информация, документы и соответствующая графика, опубликованные на веб-сайтах компании «Верофарм» (далее — «Информация») являются исключительной собственностью компании «Верофарм», за исключением информации, предоставленной третьим лицом, связанным с компанией «Верофарм» контрактными взаимоотношениями. Разрешение на использование Информации предоставляется при условии, что (1) на всех копиях будет приведено ссылка на оригинальный источник и вышеупомянутое заявление об авторском праве; (2) Информация будет использоваться для информационных некоммерческих целей и только в рамках личного использования; (3) Информация не будет никаким образом изменяться; (4) графические изображения, представленные на данном веб-сайте компании «Верофарм», не будут использоваться отдельно от сопровождающего их текста.
Компания «Верофарм» не несет ответственности за информационное наполнение, предоставленное третьим лицом, и Вы не вправе использовать и распространять такие материалы без разрешения их правообладателей. За исключением описанных выше разрешенных случаев, никому не предоставляются никакие лицензии или права, явные и подразумеваемые, ни по каким патентам, торговым маркам или иным правам собственности компании «Верофарм».
Использование товарных знаков, торговых названий, фирменного стиля или продуктов компании «Верофарм» на веб-сайтах компании «ВЕРОФАРМ» не допускается без предварительного письменного разрешения компании «ВЕРОФАРМ».
КОНФИДЕНЦИАЛЬНОСТЬ И БЕЗОПАСНОСТЬ
Компания «Верофарм» обязуется сохранять конфиденциальность Вашей информации, переданной через настоящий веб-сайт. Мы осознаем важность конфиденциальности для наших потребителей и посетителей веб-сайтов компании «Верофарм». Использование нами персональных данных определяется нашей Политикой в отношении обработки персональных данных на веб-сайтах компании «Верофарм», свое согласие с которой Вы подтвердили, начав использовать веб-сайты компании «Верофарм».
Настоящим Вы признаете и согласны с тем, что при отправке Ваших персональных данных на веб-сайты компании «Верофарм», несмотря на то, что компания «Верофарм» располагает действенными мерами защиты для предотвращения неавторизованного доступа или вмешательства, абсолютная конфиденциальность Ваших персональных данных, предоставленных на веб-сайты компании «Верофарм», не может полностью зависеть от принятых компанией «Верофарм» мер.
В том маловероятном случае, если, несмотря на наши усилия, произойдет вмешательство или неавторизованный доступ, компания «Верофарм» не будет нести ответственности за подобное вмешательство или неавторизованный доступ в пределах, допустимых применимиым законодательством, а также за любой прямой, косвенный, особый, случайный или явившийся следствием ущерб (также упущенную выгоду), от которого пострадает потребитель или пользователь, даже в том случае, если ранее компания «Верофарм» была предупреждена о возможности такого ущерба, компания «Верофарм» не гарантирует прямо или косвенно, что информация, предоставленная пользователем, не подвергнется вмешательству или неавторизованному доступу, и не предоставляет никаких потенциальных гарантий относительно коммерческого качества и пригодности при применении для определенных целей.
Каждый пользователь несет самостоятельную ответственность за сохранение конфиденциальности своего пароля.
Ограничения ответственности
Компания «Верофарм» не принимает на себя никаких обязательств в отношении материалов, информации или мнений, представленных, направленных или иным путем попавших на веб-сайты компании «Верофарм». Вы можете полагаться на достоверность этих материалов, информации и мнений исключительно на свой риск. Компания «Верофарм» не несет ответственности за вред и/или ущерб, причиненный в результате использования веб-сайтов компании «Верофарм» или представленных на них материалов.
Веб-сайты компании «Верофарм», содержимое сайта, продукты и услуги, предоставляемые на сайтах или через веб-сайты компании «Верофарм» представлены в форме «как есть» и «по мере поступления», со всеми вытекающими последствиями. Ни в каком случае компания «Верофарм» или ее поставщики, или, соответственно, их руководители, сотрудники или агенты (именуемые ниже «лица, связанные с «Верофарм», не будут нести ответственность за какой-либо ущерб любого рода, возникший на основе или в связи с вашим использованием или неспособностью использовать веб-сайты компании «Верофарм».
А также материалов сайтов, услуги, предоставляемые на сайтах или через них, или на каких-либо связанных с ними сайтах, включая любой особый, косвенный, штрафной, случайный, присужденный в порядке наказания или явившийся следствием ущерб, в том числе (но не ограничиваясь этим) вред, потерю выгоды или ущерб, связанный с задержкой, временным прекращением услуг, вирусами, удалением файлов или электронных сообщений, ошибками, пропусками или другими неточностями на веб-сайтах компании «Верофарм» или в материалах сайтов, независимо от того, связано ли это с какими-либо упущениями со стороны компании «Верофарм» и была ли предупреждена компания «Верофарм» о возможности такого ущерба.
Помните, что к веб-сайтам компании «Верофарм» могут быть применены дополнительные официальные уведомления, заявления об отказе от ответственности и прочие правила и условия.
Общие положения
Настоящим Вы соглашаетесь, что настоящие Условия онлайн-использования и Политика в отношении обработки персональных данных на веб-сайтах компании «Верофарм» являются единым неделимым соглашением. Настоящим Вы соглашаетесь с тем, что, ознакомившись с настоящими Условиями онлайн-использования и Политикой в отношении обработки персональных данных на веб-сайтах компании «Верофарм». Вы подтверждаете свое согласие с ними, и уведомлены, что указанные Условия онлайн-использования, а также иные условия функционирования Веб-сайтов компании «Верофарм» регулируются в том числе законами штата Иллинойс и иными федеральными законами США.
Законы штата Иллинойс будут контролировать выполнение настоящих Условий онлайн-использования в той степени, в какой законы штата Иллинойс не противоречат императивным нормам законодательства Российской Федерации, в частности, законодательства о защите прав потребителя. В том случае, если компетентные судебные органы решат, что какое-либо положение настоящих Условий онлайн-использования недействительно или не имеет юридической силы, Вы соглашаетесь с тем, что остальные положения настоящих Условий онлайн-использования сохранят свою полную силу и действие.
В связи с вышеизложенным любыми Вашим действиями, направленными на использование Вами веб-сайтов компании «Верофарм» посредством Вашего доступа или иного использования веб-сайтов и содержащейся на них информации, Вы подтверждаете, что ознакомлены с настоящими Условиями онлайн-использования и полностью согласны с такими Условиями онлайн-использования. Таким образом, Вы автоматически принимаете на себя обязательства по их безусловному соблюдению и обеспечению их выполнения с Вашей стороны без каких-либо ограничений или оговорок в процессе Вашего посещения и использования веб-сайтов компании «Верофарм», а также любой информации, содержащейся на них.
Остеокласты играют в костях несколько ролей помимо костной резорбции
Crit Rev Eukaryot Gene Expr. Авторская рукопись; доступно в PMC 19 апреля 2010 г.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC2856465
NIHMSID: NIHMS180726
Брендан Ф. Бойс
1 Кафедра патологии и лабораторной медицины, Университет Рочестера Center, 601 Elmwood Ave, Box 626, Rochester, NY 14642, USA
2 Центр исследований опорно-двигательного аппарата, Медицинский центр Университета Рочестера, 601 Elmwood Ave, Box 626, Rochester, NY 14642, США
Zhenqiang Yao
1 Отделение патологии и лабораторной медицины, Медицинский центр Университета Рочестера, 601 Elmwood Ave, Box 626, Rochester, NY 14642, USA
Lianping Xing
1 Отделение патологии и лабораторной медицины, Медицинский центр Университета Рочестера , 601 Elmwood Ave, Box 626, Rochester, NY 14642, USA
2 Центр исследований опорно-двигательного аппарата, Университет Рочестера Медик al Center, 601 Elmwood Ave, Box 626, Rochester, NY 14642, USA
1 Департамент патологии и лабораторной медицины, Медицинский центр Университета Рочестера, 601 Elmwood Ave, Box 626, Rochester, NY 14642, USA
2 Центр исследований опорно-двигательного аппарата, Медицинский центр Университета Рочестера, 601 Elmwood Ave, Box 626, Rochester, NY 14642, USA
См. Другие статьи в PMC, в которых цитируется опубликованная статья.
Abstract
Остеокласты — это клетки, которые разрушают кость, чтобы инициировать нормальное ремоделирование кости и опосредовать потерю костной массы при патологических состояниях, увеличивая их резорбтивную активность. Они происходят из предшественников миелоидного / моноцитарного происхождения, которые циркулируют в крови после их образования в костном мозге. Эти предшественники остеокластов (OCP) притягиваются к участкам на поверхности кости, предназначенным для резорбции, и сливаются друг с другом с образованием многоядерных клеток, которые резорбируют кальцифицированные матрицы под влиянием остеобластических клеток в костном мозге.Недавние исследования определили функции ХОП и остеокластов в кости и вокруг нее, помимо резорбции кости. Например, они регулируют дифференцировку предшественников остеобластов и перемещение гемопоэтических стволовых клеток из костного мозга в кровоток; они участвуют в иммунных ответах и секретируют цитокины, которые могут влиять на их собственные функции и функции других клеток при воспалительных и неопластических процессах, влияющих на кости. Здесь мы рассматриваем эти результаты, которые определяют новые роли остеокластов и ХОП в развивающейся области остеоиммунологии и в распространенных патологических состояниях, при которых резорбция кости увеличивается.
Ключевые слова: Остеокласт, цитокин, остеобласт, резорбция кости, воспалительный артрит
ВВЕДЕНИЕ
Остеокласты — это клетки, которые разрушают (резорбируют) кость во время нормального ремоделирования кости и при патологических состояниях, при которых резорбция кости увеличивается. Ремоделирование кости — это процесс, при котором на поверхности костных трабекул губчатой кости образуются микроскопические канавки, видимые на концах длинных костей и внутри позвонков. Остеокласты образуют эти траншеи, секретируя соляную кислоту и протеазы, такие как катепсин К, во внеклеточный лизосомный компартмент под взъерошенной частью их базальной клеточной мембраны для одновременного растворения минеральных и матричных компонентов кости (1).Предшественники остеобластов, клетки, которые образуют кость, рекрутируются в эти траншеи из соседней популяции стромальных клеток костного мозга и дифференцируются в остеобласты, которые закладывают новый матрикс и минерализуют его. Ремоделирование костей может усиливаться в ответ на многие воздействия, включая механическое напряжение, цитокины, гормоны и факторы роста. При многих патологических состояниях, таких как постменопаузальный остеопороз, ревматоидный артрит и пародонтит, количество кости, удаленной остеокластами, превышает количество кости, отложенной остеобластами, и кость становится ослабленной.
Формирование остеокластов из предшественников остеокластов (OCP) регулируется преимущественно остеобластическими клетками во время нормального ремоделирования кости (). Остеобластные клетки костного мозга экспрессируют два цитокина, которые необходимы для дифференцировки ОСР в остеокласты: фактор, стимулирующий колонии макрофагов (M-CSF) и активатор рецептора лиганда NF-κB (RANKL). M-CSF связывается со своим рецептором c-fms на OCP и активирует передачу сигналов через MAP-киназы и ERK во время ранней фазы дифференцировки OCP (2).RANKL связывается со своим рецептором RANK на поверхности ОСР, активируя передачу сигналов через NF-κB, c-Fos, фосфолипазу Cγ (PLCγ) и ядерный фактор активированных Т-клеток c1 (NFATc1), чтобы вызвать дифференцировку ОСР в остеокласты (3) . Т- и В-лимфоциты также экспрессируют RANKL (4,5) и регулируют образование остеокластов при патологических состояниях, при которых их количество увеличивается, например, после дефицита половых стероидов после менопаузы и в воспаленных суставах пациентов с ревматоидным артритом.
Остеокласты взаимодействуют с другими клетками в кости и в полости костного мозга, чтобы регулировать несколько механизмов
1) Как и остеоциты в кости, преостеобласты (преОБ) также имеют обширные дендритные отростки, отходящие от тел их клеток для взаимодействия с различными типами клеток в полости костного мозга, включая гемопоэтические и иммунные клетки, гемопоэтические стволовые клетки (HSC), предшественники остеокластов (OCP) и другие preOB, помимо остеоцитов в кости.
2) Остеобласты влияют на дифференцировку ОСР через пути передачи сигналов RANKL / RANK и ephrinB2 / EphB4; последний также влияет на дифференцировку остеобластов.
3) Остеокласты регулируют мобилизацию HSC с помощью c-kit и модулируют функции иммунных клеток, продуцируя цитокины и другие факторы.
Формирование остеокластов также регулируется так называемой костимулирующей иммуноопосредованной передачей сигналов через рецепторы, включая рецептор, связанный с остеокластами (OSCAR) и запускающий рецептор, экспрессируемый в миелоидных клетках-2 (TREM2) (6).Эти рецепторы активируют иммунорецепторные мотивы активации на основе тирозина (ITAM) в адапторных молекулах, таких как общая субъединица γ рецептора Fc (FcRγ) и ДНКX-активирующий белок 12 (DAP12) в OCP. Эта активация, как и передача сигналов RANKL / RANK, приводит к фосфорилированию PLCγ и кальций-зависимой активации NFATc1 (3). Недавно было показано, что эти два пути напрямую связаны друг с другом в OCP белками каркаса (7). Лиганд OSCAR экспрессируется остеобластическими клетками, но он и лиганд для этих других рецепторов в OCPs не идентифицированы.Костимуляторная передача сигналов необходима для образования остеокластов во время эмбрионального развития и, вероятно, активируется при воспалительных заболеваниях костей.
Образование и активность остеокластов ограничиваются множеством цитокинов, в частности остеопротегерином (OPG), родственным ингибитором RANKL, который связывается с RANKL и предотвращает его взаимодействие с RANK (обзор см. В (8)). Остеобластические клетки и В-клетки индуцируются для экспрессии OPG в ответ на многие воздействия, которые индуцируют экспрессию RANKL, чтобы ограничить деградацию кости, а соотношение RANKL / OPG является основным детерминантом резорбции кости и костной массы.Однако остеокласты и OCP также могут негативно регулировать свое образование непосредственно в ответ на RANKL. Например, хотя активация c-Fos RANKL индуцирует активацию NFATc1 в ОСР, она также индуцирует секрецию интерферона β посредством ОСР. Связывание интерферона β с его рецептором на ОСР (9) приводит к деградации белка 6, ассоциированного с рецептором фактора некроза опухоли (TRAF6). RANK не обладает внутренней киназной активностью. TRAF6 представляет собой адапторную молекулу, которая опосредует RANKL / RANK-индуцированную активацию различных сигнальных путей в OCP (обзор см. В (8)), а также действует как лигаза E3 (10), которая способствует собственной деградации, отрицательно ограничивая образование остеокластов ( 9).
Идентификация этих цитокинов и сигнальных путей, которые они активируют, значительно расширила наше понимание того, как образование остеокластов и резорбция кости регулируются остеобластическими клетками. Однако недавно отношения между остеокластами и другими клетками костного мозга были добавлены к одному или двум неожиданным поворотам. В результате теперь признано, что остеокластические клетки не только резорбируют кость; они также регулируют функцию других типов клеток, таких как клетки остеобластов, они секретируют цитокины, регулируют выход кроветворных стволовых клеток из костного мозга и действуют как иммунные клетки при воспалительных заболеваниях костей.Многие препараты, используемые для лечения распространенных заболеваний костей, подавляют образование или активность остеокластов. Эти новые результаты предполагают, что ингибирование некоторых функций остеокластов может иметь неожиданные пагубные или положительные эффекты на клетки в кости и вокруг кости.
ОСТЕОКЛАСТИЧЕСКИЕ ВЗАИМОДЕЙСТВИЯ С ОСТЕОБЛАСТИЧЕСКИМИ КЛЕТКАМИ
Остеобластическая регуляция образования остеокластов до недавнего времени считалась односторонней регуляторной зависимостью между этими двумя типами клеток, при этом остеобластные клетки играли доминирующую роль.Подобно остеоцитам в кости, остеобластические клетки также имеют обширные дендритные отростки, простирающиеся от их клеточных тел в костный мозг (). Таким образом, они могут взаимодействовать со многими гемопоэтическими клетками в полости костного мозга, включая ОКР, а также с клетками выстилки костей и остеоцитами внутри кости (11). Таким образом, существует обширная коммуникационная сеть между различными типами остеобластических клеток, которая простирается от костного мозга до глубины кости ().
Остеобластические клетки в костном мозге выполняют свою регуляторную роль в отношении остеокластов за счет усиления экспрессии RANKL на поверхности этих цитоплазматических отростков, которые взаимодействуют с подобными типами выступов с поверхностей OCP и остеокластов.Недавние исследования показывают, что остеокластические клетки не являются пассивными рабами в этом взаимодействии и что они могут напрямую регулировать остеобластические клетки (12). Существует также прямой контакт между этими типами клеток не только через взаимодействие RANKL / RANK, но также через ephrinB2, лиганд, экспрессируемый OCP, и его рецептор EphB4 на остеобластических клетках. Передача сигналов Ephrin / Eph способствует нахождению пути нейронных аксонов и артериально-венозному соединению во время эмбрионального развития, процессов, в которых клеточные процессы распространяются на относительно большие расстояния (обзор в (13)).Zhao et al. (14) неожиданно обнаружили, что во время взаимодействий между остеокластическими и остеобластическими клетками так называемая обратная передача сигналов через лиганд ephrinB2 обратно в ОСР ингибирует дифференцировку ОСР. Это ингибирование происходит посредством механизма, который подавляет активацию c-Fos NFATc1. Более неожиданным открытием в исследованиях Zhao et al. Было то, что передача сигналов через рецептор EphB4 в остеобластных клетках способствует дифференцировке остеобластов от предшественников. Стимулирующий путь в остеобластических клетках еще не идентифицирован, и точно не известно, где в единицах ремоделирования кости происходят эти взаимодействия.Неизвестно, возникают ли они рядом с режущими кромками единиц ремоделирования, где остеокласты активно резорбируются и где OCPs активно рекрутируются для пополнения пула остеокластов, или в центрах этих единиц, где предшественники остеобластов дифференцируются в остеобласты, формирующие матрикс. Какими бы ни были задействованные механизмы, эти результаты повышают вероятность того, что стимуляция передачи сигналов Ephrin / Eph может привести к увеличению костной массы у людей с такими заболеваниями, как остеопороз и ревматоидный артрит, при которых наблюдается общее увеличение резорбции костной ткани и уменьшение костной ткани. формирование.
Передача сигналов Ephrin / Eph, как было показано недавно, участвует в др. Аспектах функций костных клеток. Анализ микроматрицы показал, что экспрессия мРНК ephrinB2 была повышена в линии стромальных клеток костного мозга мыши, Kusa 4b10, после обработки PTH (1-34) или PTHrP (1-141). Это было подтверждено количественной ПЦР в реальном времени in vitro и в образцах РНК, взятых из метафизарных костей мышей после лечения ПТГ (15). Экспрессия белка EphrinB2 увеличивалась как в остеокластах, так и в остеобластах, как показали вестерн-блоттинг и иммуноокрашивание срезов бедренной кости от мышей, получавших ПТГ.Блокада взаимодействия ephrinB2 / EphB4 ингибировала минерализацию клеток Kusa 4b10. Эти данные предполагают, что PTH или PTHrP могут системно повышать экспрессию ephrinB2 в остеобластах, способствуя их дифференцировке и образованию костей посредством EphB4 и, таким образом, способствуют анаболическому действию PTH или PTHrP (15). Таким образом, PTHrP может регулировать функции остеобластов через ephrinB2 паракринным или аутокринным образом, учитывая известную роль PTHrP в том, чтобы действовать таким образом в остеобластах (16).
Ephrin-b1 является лигандом для рецепторов тирозинкиназы eph, и передача сигналов через них имеет решающее значение для эпителиальных мезенхимальных взаимодействий, регулирующих морфогенез черепа и полости рта.Было описано более 20 мутаций в гене EFNB1 , кодирующем эфрин-b1, у пациентов с краниофронтоназальным синдромом, Х-сцепленным заболеванием, основные клинические проявления которого включают коронарный краниосиностоз, лобно-носовую дисплазию и дефекты пальцев (17). Дисфункция передачи сигналов Ephrin-b1 / eph может быть ответственной за преждевременное сращение костей свода черепа и деформацию конечностей, относительно частый врожденный дефект, наблюдаемый у пациентов с краниофронтоназальным синдромом (18).
Еще один неожиданный поворот к растущим комплексным функциям ХОП был предложен Lee et al.(19). Они использовали сравнительное профилирование экспрессии мРНК для изучения различий между остеокластами и макрофагами и идентифицировали фрагмент кДНК в мРНК ОСР, который кодирует белок (Atp6v0d2), который почти идентичен субъединице v-АТФазы. Atp6v0d2 является компонентом комплекса протонной помпы V-типа H + ATP6i в остеокластах, который секретирует H + (20). H + образуют HCl в местах ремоделирования вместе с Cl — , пассивно протекающим через канал хлорида остеокластов, ClC-7, и таким образом растворяется минерал в костном матриксе.Atp6v0d2 высоко экспрессируется в цитоплазматической мембране остеокластов вокруг так называемой зоны уплотнения, которая образует плотное соединение между клеткой и костью и окружает часть клетки взъерошенными границами, под которой происходит резорбция. Не выражается остеобластами. Ли и др. сгенерировал Atp6v0d2-дефицитных мышей для изучения его функции в остеокластах. Они обнаружили, что у мышей были маленькие остеокласты из-за неправильного слияния предшественников остеокластов и снижения резорбции кости.Это привело к остеопетрозу, врожденному нарушению моделирования кости, при котором полости костного мозга заполнены или частично заполнены нерезорбированным костным и хрящевым матриксом из-за дефектного образования или активности остеокластов. Неожиданно у этих мышей также было увеличенное количество остеобластов, связанное с усиленным формированием кости. Дефект слияния OCP не был обусловлен сниженной экспрессией DC-STAMP, который необходим в OCP для слияния предшественников (21). Atp6v0d2 не экспрессируется остеобластами, и механизм, посредством которого он ингибирует образование кости, неизвестен.Интуитивно, для остеокластов было бы разумно иметь механизм, ингибирующий образование остеобластической кости в тех местах, где они резорбируют кость. Секреция ими ингибирующего белка через функцию Atp6v0d2 — возможный механизм. Как или если функция этой субъединицы протеинового насоса связана с ее положительной ролью в слиянии ОСР, еще предстоит определить. Эти данные и результаты Zhao et al. повышают вероятность того, что один терапевтический агент может ингибировать активность остеокластов и увеличивать образование костной ткани, предположительно за счет различных механизмов.
ОСТЕОЦИТЫ РЕГУЛИРУЮТ ОСТЕОКЛАСТЫ
Остеоциты происходят из остеобластов, образующих кость, которые встраиваются в неминерализованный костный матрикс (остеоид), откладывая его на поверхности кости во время моделирования и ремоделирования кости. Это самые многочисленные остеобластические клетки, составляющие> 90% костных клеток. Остеоциты имеют обширные дендритные отростки, которые широко распространяются в кальцинированном матриксе внутри микроскопических канальцев, заполненных интерстициальной жидкостью. Считается, что они играют важную роль в минеральном гомеостазе, регулируя движение ионов и катионов в матрицу вокруг них и из нее в интерстициальную жидкость.Дендритные отростки остеоцитов взаимодействуют с процессами других остеоцитов и со стромальными клетками в прилегающем костном мозге (рассмотрено в (22)), и, таким образом, остеоциты могут управлять функциями клеток в этой сети и отвечать на сигналы от них. Эти процессы могут обнаруживать изменения давления внутри каналов в ответ на механическое напряжение и другие воздействия. Они повреждаются при переломах костей или при микротрещинах трабекулярных или кортикальных компонентов кости.Предыдущие исследования показали, что по мере того, как остеоциты подвергаются апоптозу, они могут посылать сигналы остеобластическим клеткам в костном мозге, чтобы вызвать образование остеокластов (23), и что жизнеспособные остеоциты могут посылать сигналы для ингибирования активации остеокластов (24).
Более убедительные доказательства того, что остеоциты регулируют образование и активацию остеокластов, были предоставлены Tatsumi et al. (11). Они разработали стратегию уничтожения остеоцитов в кости путем создания трансгенных мышей, экспрессирующих рецептор дифтерийного токсина (DT) в остеоцитах, а затем путем инъекции DT мышам.Через два дня после инъекций они наблюдали, что уровни мРНК RANKL увеличиваются в клетках костного мозга мышей. Шесть дней спустя они обнаружили, что 70–80% лакун остеоцитов в костях мышей были пустыми в результате DT-индуцированного апоптоза остеоцитов. Авторы пришли к выводу, что поскольку эти остеоциты претерпевают апоптоз, они посылают сигналы через свои дендритные процессы к остеобластическим клеткам в костном мозге, чтобы индуцировать повышенную экспрессию ими RANKL и способствовать дифференцировке остеокластов.Через 40 дней после инъекции DT мыши имели значительную потерю костной массы из-за повышенной активности остеокластов. Остеобласты впоследствии заменили потерянную кость, что указывает на то, что DT не оказывает отрицательного воздействия на предшественников остеобластов в костном мозге.
Для дальнейшего исследования функции остеоцитов Tatsumi et al. использовали модель подвешивания хвоста для потери костной массы, вызванной неиспользованием. Контрольные мыши потеряли кость в задних конечностях после подвешивания хвоста из-за повышенной резорбции остеокластической кости. Напротив, трансгенные мыши, экспрессирующие рецептор DT и которым вводили DT за 1 день до подвешивания за хвост, не теряли кость.Предположительно, эти мыши не потеряли кость, потому что DT индуцировал апоптоз остеоцитов или, по крайней мере, предотвращал передачу индуцированных разгрузкой сигналов от остеоцитов к остеобластам для стимуляции образования остеокластов. Как именно происходит эта индуцированная разгрузкой передача сигналов, еще предстоит определить, но эти находки подтверждают предполагаемую регуляторную роль остеоцитов в регуляции резорбции кости и объема кости (22).
ОСТЕОКЛАСТЫ КАК ИММУННЫЕ КЛЕТКИ
Множество типов клеток, включая Т- и В-лимфоциты, макрофаги и дендритные клетки, участвуют в иммунных ответах и на протяжении многих лет были признаны иммунными клетками.ХПК образуются в костном мозге из миелоидных предшественников, которые также могут давать начало макрофагам и дендритным клеткам, когда ХОП культивируются с M-CSF или GM-CSF плюс IL-4 (25). До сих пор неясно, на какой именно стадии OCPs теряют свой потенциал к дифференцировке по множественным путям или когда «транс-дифференцировка» происходит in vivo. Подобно макрофагам, ОКР экспрессируют рецепторы Fcγ (6,26). Их участие в иммунных ответах и их происхождение от циркулирующих моноцитов было признано в течение многих лет (27), хотя их связь с макрофагами была спорной (28).Однако в последнее время их роль как иммунных клеток или модуляторов иммунного ответа стала более ясной (3,29). ХПК попадают в кровоток и циркулируют подобно другим кроветворным клеткам. Их можно обнаружить в крови и селезенке мышей, а также в кровотоке человека с помощью антител к CD11b, c-kit, Gr-1, c-fms (рецептор для c-Fos) и RANK (30) (31) ( 32). Их количество увеличивается в крови людей (30) и мышей (30) (33) с различными формами воспалительного артрита, при которых увеличивается продукция TNF.Трансгенные мыши со сверхэкспрессией TNF (TNF-Tg) имеют высокие уровни TNF в сыворотке и у них развивается форма воспалительного эрозивного артрита, аналогичная ревматоидному артриту. Лечение этих мышей анти-TNF терапией обращало вспять увеличение количества OCP в их крови, предполагая, что TNF индуцирует выход OCP из крови.
ОСР экспрессируют CXCR4, рецептор фактора роста стромальных клеток (SDF-1). SDF-1 регулирует движение гемопоэтических клеток из костного мозга в кровоток и из него дозозависимым образом (см. Обзор (34)).Уровни экспрессии SDF-1 стромальными клетками костного мозга снижены у мышей TNF-Tg (35), и мы полагаем, что это один из механизмов, посредством которого TNF способствует выходу OCP из костного мозга в кровоток. Другой механизм может быть связан с TNF, увеличивающим экспрессию c-Fms с помощью OCP, тем самым увеличивая пул OCP костного мозга (36). Уровни SDF-1 и TNF повышены в суставах мышей TNF-Tg и пациентов с воспалительным артритом. Таким образом, ХОП могут быть привлечены к участкам воспаления в пораженных костях и вокруг них, где концентрация SDF-1 повышена (34).Почему уровни SDF-1 снижены в костном мозге этих мышей и увеличиваются в их суставах в ответ на повышенную продукцию TNF, остается невыясненным, но может зависеть от концентрации TNF.
ОКР не только реагируют на TNF, они и остеокласты также секретируют TNF и другие цитокины, такие как IL-6 и IL-1 (37,38). Секреция этих цитокинов увеличивается в ответ на TNF (39). Таким образом, TNF может индуцировать цикл аутоамплификации в местах воспаления в костях и вокруг них, чтобы усилить образование остеокластов (34) непосредственно через аутокринные и косвенно через паракринные механизмы.Эти механизмы могут усиливать установленное действие TNF по увеличению образования остеокластов опосредованно, способствуя экспрессии RANKL дополнительными клетками, такими как Т-клетки и синовиоциты (8).
TNF, экспрессируемый OCP, может также увеличивать активность остеокластов за счет механизма, включающего активацию c-Fos в OCP (34). c-Fos активируется ниже NF-κB в OCP в ответ на RANKL и TNF, регулируя дифференцировку остеокластов (34). Мы обнаружили, что когда мы сверхэкспрессировали c-Fos в OCP и обрабатывали клетки TNF, остеокласты, полученные из этих клеток, обладали повышенной резорбтивной активностью (34).Таким образом, в тех участках в кости, где уровни TNF повышены, TNF может увеличивать резорбцию кости с помощью ряда механизмов: косвенно путем увеличения экспрессии RANKL дополнительными клетками и непосредственно путем увеличения не только образования остеокластов, но также активности резорбции остеокластов.
Хотя TNF опосредует потерю костной массы при различных патологических состояниях, подобно RANKL, он также может напрямую ограничивать образование остеокластов. Однако задействованные механизмы ингибирования отличаются от описанных ранее и активируются RANKL.И RANKL, и TNF активируют канонический путь NF-κB в OCP, чтобы непосредственно индуцировать образование остеокластов, индуцируя фосфорилирование и последующую деградацию ингибирующей каппа-киназы β (IKKβ) (обзор в (40)). Следовательно, димеры NF-κB p65 / p50 высвобождаются из IKKβ и перемещаются в ядро, где они вызывают экспрессию остеокластогенных генов. RANKL, но не TNF, также активирует неканонический или альтернативный путь NF-κB в OCP. Этот путь активируется фосфорилированием и деградацией другого ингибирующего белка NF-κB, p100, который связывается с белком NF-κB, RelB, и предотвращает его перемещение в ядра.После активации альтернативного пути p100 процессируется в протеасоме, и его фрагмент p52 высвобождается. P52 связывается с RelB, и димеры p52 / RelB могут затем перемещаться в ядро, чтобы вызвать экспрессию гена. RANKL индуцирует больше остеокластов, чем TNF in vitro (34), но причина этого не выяснена. Мы обнаружили, что TNF, но не RANKL, регулирует экспрессию p100 NF-κB в ОСР (41) и предположили, что p100 может ограничивать образование остеокластов с помощью TNF. Мы обработали ОСР от NF-κB p100-дефицитных мышей TNF и обнаружили, что он индуцировал такое же количество остеокластов из них, как RANKL, предполагая, что индукция экспрессии p100 ограничивает TNF-опосредованное образование остеокластов.Повышающая регуляция экспрессии NF-κB p100 или предотвращение его деградации может быть механизмом ограничения чрезмерной резорбции кости при различных заболеваниях костей. Недавно мы обнаружили, что остеокласты могут увеличивать свою активность посредством другого аутокринного механизма в ответ на RANKL. Например, они увеличивают секрецию VEGF-C, члена семейства ангиогенных белков VEGF, в ответ на RANKL и TNF. VEGF-C, в свою очередь, увеличивает резорбтивную активность остеокластов непосредственно in vitro, хотя не увеличивает образование остеокластов из ОКР (35).Остеокласты в воспаленных суставах TNF-трансгенных мышей имеют повышенную экспрессию VEGF-C (42), что подтверждает наши данные in vitro. Основная функция VEGF-C — способствовать образованию лимфатических каналов. Мы обнаружили, что количество и размер лимфатических сосудов вокруг пораженных суставов у этих мышей TNF-Tg увеличены (42,43). Это увеличение может усилить иммунные реакции вокруг этих суставов, позволяя увеличить скорость оттока лимфы и других медиаторов воспаления из пораженных суставов.Будет важно определить, оказывает ли ингибирование остеокластов положительное или отрицательное влияние на эту и другие недавно открытые функции ОКР и остеокластов при воспалительном артрите и других состояниях, связанных с повышенным образованием и активностью индуцированных цитокинами остеокластов, и полностью исследовать функцию VEFG. -C продуцируется остеокластами.
ЭФФЕКТЫ ВЗАИМОДЕЙСТВИЯ ОСТЕОКЛАСТА С КОСТНЫМ МАТРИЦОМ
В исследованиях, посвященных изучению влияния цитокинов на OCP, сверхэкспрессирующие c-Fos, мы сделали неожиданное наблюдение, что взаимодействие OCP с костным матриксом увеличивает образование остеокластов.Мы культивировали c-Fos, экспрессирующие ОСР, на костных срезах в присутствии M-CSF и обнаружили, что они спонтанно дифференцировались в остеокласты в отсутствие каких-либо других цитокинов, но не при культивировании этих клеток на пластике (38). Чтобы определить, произошло ли это образование остеокластов в ответ на фактор, секретируемый c-Fos-экспрессирующими OCP, мы культивировали OCP на костных срезах в верхней камере культуральной системы Transwell. Неожиданно мы обнаружили, что GFP-экспрессирующие OCP в контрольных культурах на костных срезах в верхних камерах индуцируют образование остеокластов из c-Fos-экспрессирующих OCP, культивируемых на пластике в нижней камере.Мы использовали рецептор IL-1 и антагонисты TNF, чтобы определить, является ли IL-1 или TNF ответственным за образование остеокластов, и обнаружили, что первый, но не последний, был ингибирующим, что указывает на то, что IL-1 высвобождается OCP в ответ на их образование. взаимодействие с костным матриксом.
Подобно TNF, IL-1 индуцирует экспрессию RANKL дополнительными клетками, но, в отличие от TNF, сам по себе не индуцирует образование остеокластов. Предыдущие исследования показали, что ИЛ-1 является мощным стимулятором резорбции костной ткани in vivo (44).Он активирует остеокласты (45), продлевает их выживание (45) in vitro и может индуцировать образование остеокластов из OCP, экспрессирующих c-Fos, в отсутствие RANKL (38). Взаимодействие остеокластов с костным матриксом увеличивает выживаемость остеокластов в результате индуцированной интегрином передачи сигналов, и это увеличивает резорбцию кости (46). IL-1, продуцируемый ОСР, связанными с костным матриксом, может усиливать этот эффект на резорбцию, особенно если экспрессия c-Fos остеокластами также увеличивается, например, в ответ на TNF и RANKL в участках воспаления в кости.
Производство ИЛ-1 ОКР может иметь дальнейшее клиническое значение. Например, остеокласты, культивируемые на костных срезах, более устойчивы к индуцирующим апоптоз эффектам бисфосфонатов, наиболее часто назначаемых препаратов для предотвращения потери костной массы. Для индукции апоптоза остеокластов, культивируемых на кости, требуются более высокие концентрации бисфосфонатов по сравнению с клетками, культивируемыми на пластике (47). Эта повышенная выживаемость может быть частично связана с опосредованной интегрином передачей сигналов от костного матрикса (46), но также может быть результатом эффектов IL-1, высвобождаемого OCP и остеокластами.Бисфосфонаты являются менее эффективными ингибиторами резорбции костной ткани вокруг суставов пациентов с воспалительным артритом, чем в позвоночнике и бедрах пациентов с остеопорозом (48,49). Частично это может быть связано с эффектами усиления выживания и активации IL-1, высвобождаемого в пораженных суставах остеокластами и другими клетками, а также с TNF-опосредованной активацией антиапоптотического белка Bcl-xL в остеокластах (50). ).
ОСТЕОКЛАСТЫ КАК РЕГУЛЯТОРЫ ГЕМАТОПОЭТИЧЕСКОЙ ФУНКЦИИ КЛЕТОК
Гематопоэтические клетки костного мозга происходят из гемопоэтических стволовых клеток (ГСК), некоторые из которых покидают костный мозг и циркулируют в крови.Остеобластические клетки в костном мозге и на эндостальных поверхностях костей у мышей поддерживают HSC посредством сигналов, которые поддерживают потенциал самообновления в недифференцированных стволовых клетках (обзор в (51)). ГСК, по-видимому, располагаются на эндостальных поверхностях в нишах, откуда они покидают костный мозг и попадают в кровь. Остеобластическая регуляция выхода гемопоэтических стволовых клеток и клеток-предшественников из костного мозга в кровоток частично опосредуется ПТГ (52) посредством циклического AMP-Jagged-1-зависимого механизма (53).
Недавние исследования выявили неожиданную роль остеокластов в этом процессе. Изучая мобилизацию HSC, Kollet et al (54) отметили, что это было связано с увеличением количества остеокластов на поверхностях костей. Они знали, что условия, вызывающие стресс, такие как химиотерапия и воспаление, или лечение пациентов факторами, стимулирующими колонии гранулоцитов (G-CSF), вызывают массивную мобилизацию стволовых клеток из костного мозга. Это было связано с активацией протеолитических ферментов, которые высвобождают адгезию между стволовыми клетками и их микроокружением костного мозга (см. Обзор (55)).Они обработали мышей RANKL и обнаружили, что он индуцировал повышенное образование остеокластов in vivo. Это сопровождалось мобилизацией стволовых клеток и клеток-предшественников, связанной с повышенной экспрессией в остеокластах ММР-9 и катепсина К. Эти ферменты разрушают белки в кости, но они также расщепляют мембраносвязанный лиганд набора, фактор роста и адгезии для HSC. RANKL также снижает экспрессию лиганда набора остеобластов и остеопонтина, которые также влияют на количество стволовых клеток. Коллет и др. Исследовали мышей с дефицитом протеинтирозинфосфатазы-эпсилон (PTP ε), у которых есть остеокласты с дефектной резорбирующей активностью и умеренным остеопетрозом.Они обнаружили, что RANKL не мобилизует HSC и клетки-предшественники из костного мозга у этих мышей, дополнительно связывая эту мобилизацию с остеокластами. Эти данные связывают остеобласты и HSC с остеокластами при нормальном и патологическом ремоделировании кости.
РЕЗЮМЕ
Остеокласты на протяжении многих лет были признаны клетками, резорбирующими кость в ответ на большое количество воздействий, большинство из которых косвенно воздействуют на остеокласты и их предшественники через клетки линии остеобластов.Недавние сообщения показывают, что остеокласты и OCP выполняют множество дополнительных функций, которые влияют на активность клеток в кости и вокруг нее. К ним относятся положительные и отрицательные эффекты на функции остеобластических клеток, такие как формирование и минерализация костного матрикса, а также проникновение гемопоэтических стволовых клеток из костного мозга в кровь. Во время нормального и патологического ремоделирования кости остеокласты и OCP также секретируют цитокины и другие факторы, которые могут играть важную регулирующую роль в этих процессах.Фармацевтические компании отреагировали на растущую потребность в разработке новых лекарств, которые могут ингибировать образование и / или активность остеокластов, чтобы предотвратить потерю костной массы, которая происходит после менопаузы, при старении и при других патологических воспалительных процессах. Эти новые результаты предполагают, что препараты, которые глубоко влияют на образование или активность остеокластов, могут иметь неожиданные отрицательные или положительные эффекты на гомеостаз костей.
Предшественники остеокластов взаимодействуют с костным матриксом для усиления образования и функционирования остеокластов посредством аутокринных и паракринных механизмов.
1) Предшественники остеокластов (OCP) продуцируют и высвобождают TNF и IL-1, взаимодействуя с костным матриксом.
2) TNF стимулирует экспрессию c-Fos предшественниками остеокластов.
3) IL-1 индуцирует дифференцировку предшественников, экспрессирующих c-Fos, в зрелые остеокласты для резорбции кости, что усиливается экспрессией c-Fos.
Благодарности
Некоторые работы, представленные в этом обзоре, поддерживаются грантами NIH: AR43510 для BFB и AR48697 для LX.
Справочные документы
2. Фукути М., Фукаи Ю., Масуда Н., Миядзаки Т., Накадзима М., Сохда М., Манда Р., Цукада К., Като Х., Кувано Х.Cancer Res. 2002. 62 (24): 7162–7165. [PubMed] [Google Scholar] 4. Kanamaru F, Iwai H, Ikeda T, Nakajima A, Ishikawa I, Azuma M. Immunol Lett. 2004. 94 (3): 239–246. [PubMed] [Google Scholar] 5. Каваи Т., Мацуяма Т., Хосокава Ю., Макихира С., Секи М., Каримбукс, штат Нью-Йорк, Гонсалвес, Р. Б., Вальверде П., Дибарт С., Ли Ю. П., Миранда Л. А., Эрнст С.ВО., Изуми Ю., Таубман М.А. Am J Pathol. 2006. 169 (3): 987–998. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Шинохара М., Кога Т., Окамото К., Сакагути С., Араи К., Ясуда Х, Такай Т., Кодама Т., Морио Т., Геха Р.С., Китамура Д., Куросаки Т., Эллмайер В., Такаянаги Х.Клетка. 2008 г. В печати. [PubMed] [Google Scholar] 8. Такаянаги Х. Журнал молекулярной медицины (Берлин, Германия) 2005; 83 (3): 170–179. [PubMed] [Google Scholar] 9. Такаянаги Х., Ким С., Мацуо К., Сузуки Х., Сузуки Т, Сато К., Йокочи Т, Ода Х, Накамура К., Ида Н., Вагнер Э. Ф., Танигучи Т. Природа. 2002. 416 (6882): 744–749. [PubMed] [Google Scholar] 10. Wooff J, Pastushok L, Hanna M, Fu Y, Xiao W. FEBS Lett. 2004. 566 (1–3): 229–233. [PubMed] [Google Scholar] 11. Тацуми С., Исии К., Амизука Н., Ли М., Кобаяши Т., Коно К., Ито М., Такешита С., Икеда К.Клеточный метаболизм. 2007. 5 (6): 464–475. [PubMed] [Google Scholar] 14. Чжао К., Ирие Н., Такада Ю., Симода К., Миямото Т., Нишиваки Т., Суда Т., Мацуо К. Клеточный метаболизм. 2006. 4 (2): 111–121. [PubMed] [Google Scholar] 15. Аллан Э. Х., Хауслер К. Д., Вей Т., Гуи Дж. Х., Куинн Дж. М., Крымген-Ирвин Б., Помполо С., Симс Н. А., Гиллеспи М. Т., Ония Д. Э., Мартин Т. Дж.. J Bone Miner Res 2008 [PubMed] [Google Scholar] 16. Мяо Д., Хэ Би, Цзян И, Кобаяши Т., Сорочану М.А., Чжао Дж., Су Х, Тонг Х, Амизука Н., Гупта А., Генант Х. К., Кроненберг Х. М., Гольцман Д., Караплис А.С.J Clin Invest. 2005. 115 (9): 2402–2411. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Шотелерсук В., Сириван П., Аусаварат С. Расщелина неба. Краниофак Дж. 2006; 43 (2): 152–154. [PubMed] [Google Scholar] 18. Де Костер П.Дж., Мортье Дж., Маркс Л.А., Мартенс Л.К. J Oral Pathol Med. 2007. 36 (8): 447–455. [PubMed] [Google Scholar] 19. Lee SH, Rho J, Jeong D, Sul JY, Kim T, Kim N, Kang JS, Miyamoto T., Suda T, Lee SK, Pignolo RJ, Koczon-Jaremko B, Lorenzo J, Choi Y. Nat Med. 2006. 12 (12): 1403–1409. [PubMed] [Google Scholar] 20.Sun-Wada GH, Yoshimizu T, Imai-Senga Y, Wada Y, Futai M. Gene. 2003. 302 (1–2): 147–153. [PubMed] [Google Scholar] 21. Яги М., Миямото Т., Саватани Ю., Ивамото К., Хосогане Н., Фудзита Н., Морита К., Ниномия К., Сузуки Т., Миямото К., Оике Ю., Такея М., Тояма Ю., Суда Т. Дж. Эксп. Мед. 2005. 202 (3): 345–351. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Верборгт О., Гибсон Г.Дж., Шаффлер МБ. J Bone Miner Res. 2000. 15 (1): 60–67. [PubMed] [Google Scholar] 24. Томкинсон А., Геверс Э. Ф., Вит Дж. М., Рив Дж., Благородный Б.С. J Bone Miner Res.1998. 13 (8): 1243–1250. [PubMed] [Google Scholar] 25. Миямото Т., Онеда О, Араи Ф, Ивамото К., Окада С., Такаги К., Андерсон Д.М., Суда Т. Блад. 2001. 98 (8): 2544–2554. [PubMed] [Google Scholar] 27. Gowen M, MacDonald BR, Hughes DE, Skjodt H, Russell RG. Adv Exp Med Biol. 1986; 208: 261–273. [PubMed] [Google Scholar] 28. Хортон М.А., Риммер Э.Ф., Льюис Д., Прингл Дж. А., Фуллер К., Чемберс Т.Дж. J Pathol. 1984. 144 (4): 281–294. [PubMed] [Google Scholar] 30. Ли П., Шварц Е.М., О’Киф Р.Дж., Ма Л., Луни Р.Дж., Ритчлин К.Т., Бойс Б.Ф., Син Л.Ревматоидный артрит. 2004. 50 (1): 265–276. [PubMed] [Google Scholar] 31. Jacquin C, Gran DE, Lee SK, Lorenzo JA, Aguila HL. J Bone Miner Res. 2006. 21 (1): 67–77. [PubMed] [Google Scholar] 33. Yao Z, Li P, Zhang Q, Schwarz EM, Keng P, Arbini A, Boyce BF, Xing L.J Biol Chem. 2006. 281 (17): 11846–11855. [PubMed] [Google Scholar] 34. Boyce BF, Schwarz EM, Xing L. Curr Opin Rheumatol. 2006. 18 (4): 427–432. [PubMed] [Google Scholar] 36. Yao Z, Li P, Zhang Q, Schwarz EM, Keng P, Arbini A, Boyce BF, Xing L.J Biol Chem.2006. 281 (17): 11846–11855. [PubMed] [Google Scholar] 37. Блейн Т.А., Розье Р.Н., Пузас Дж. Э., Луни Р. Дж., Рейнольдс ПР, Рейнольдс С.Д., О’Киф Р.Дж. J Bone Joint Surg Am. 1996. 78 (8): 1181–1192. [PubMed] [Google Scholar] 39. О’Киф Р.Дж., Теот Л.А., Сингх Д., Пузас Дж. Э., Розье Р.Н., Хикс Д.Г. Lab Invest. 1997. 76 (4): 457–465. [PubMed] [Google Scholar] 41. Яо З, Син Л., Бойс Б.Ф. J Bone Miner Res. 2007; 22 (Дополнение): S42. [Google Scholar] 43. Proulx ST, Kwok E, You Z, Beck CA, Shealy DJ, Ritchlin CT, Boyce BF, Xing L, Schwarz EM.Летопись Нью-Йоркской академии наук. 2007. [PubMed] [Google Scholar] 44. Бойс Б.Ф., Ауфдеморте ТБ, Гарретт И.Р., Йейтс А.Дж., Манди Г.Р. Эндокринология. 1989. 125 (3): 1142–1150. [PubMed] [Google Scholar] 45. Ван Х.Р., Чжан Й., Оздамар Б., Огунджими А.А., Александрова Э., Томсен Г.Х., Врана Дж.Л. Наука. 2003. 302 (5651): 1775–1779. [PubMed] [Google Scholar] 47. Хьюз Д.Е., Райт К.Р., Уй Х.Л., Сасаки А., Йонеда Т., Рудман Г.Д., Манди Г.Р., Бойс Б.Ф. J Bone Miner Res. 1995. 10 (10): 1478–1487. [PubMed] [Google Scholar] 48. Лоддер М.С., Ван Пелт П.А., Лемс В.Ф., Костенсе П.Дж., Кокс С.Х., Дийкманс Б.А.J Rheumatol. 2003. 30 (9): 2080–2081. [PubMed] [Google Scholar] 49. Валлеала Х, Лаасонен Л., Койвула М.К., Манделин Дж., Фриман С., Ристели Дж., Континен Ю.Т. J Rheumatol. 2003. 30 (3): 468–473. [PubMed] [Google Scholar] 50. Zhang Q, Badell IR, Schwarz EM, Boulukos KE, Yao Z, Boyce BF, Xing L. Arthritis Rheum. 2005. 52 (9): 2708–2718. [PubMed] [Google Scholar] 51. Далгарно Д., Стеле Т., Нарула С., Шеллинг П., ван Шравендейк М. Р., Адамс С., Андраде Л., Китс Дж., Рам М., Джин Л., Гроссман Т., Макнейл И., Меткалф К., 3-й, Шекспир В., Ван Й, Кинан Т. , Сундарамурти Р., Бохачек Р., Вейгеле М., Сойер Т.Chem Biol Drug Des. 2006. 67 (1): 46–57. [PubMed] [Google Scholar] 52. Кальви Л.М., Адамс Г.Б., Вайбрехт К.В., Вебер Дж. М., Олсон Д.П., Найт М.С., Мартин Р.П., Шипани Э., Дивиети П., Брингхерст Ф.Р., Милнер Л.А., Кроненберг Х.М., Скадден Д.Т. Природа. 2003. 425 (6960): 841–846. [PubMed] [Google Scholar] 53. Вебер Дж. М., Форсайт С. Р., Кристиансон, Калифорния, Фриш Б. Дж., Джильотти Б. Дж., Джордан К. Т., Милнер Л. А., Гусман М. Л., Кальви Л. М.. Кость. 2006. 39 (3): 485–493. [PubMed] [Google Scholar] 54. Kollet O, Dar A, Shivtiel S, Kalinkovich A, Lapid K, Sztainberg Y, Tesio M, Samstein RM, Goichberg P, Spiegel A, Elson A, Lapidot T.Nat Med. 2006. 12 (6): 657–664. [PubMed] [Google Scholar] 55. Cottler-Fox MH, Lapidot T, Petit I, Kollet O, DiPersio JF, Link D, Devine S. Hematology / Образовательная программа Американского общества гематологов. Американское общество гематологии; 2003. С. 419–437. [PubMed] [Google Scholar]
Регулирование функции остеокластов и резорбции кости малыми GTPases
Small GTPases. 2011 май-июнь; 2 (3): 117–130.
Программа исследований опорно-двигательного аппарата; Институт медицинских наук; Университет Абердина; Абердин, Шотландия, Великобритания
Автор, ответственный за переписку.
Поступило 25 февраля 2011 г .; Пересмотрено 22 апреля 2011 г .; Принято 10 мая 2011 г.
Эта статья цитировалась в других статьях в PMC.
Abstract
Остеокласты — это многоядерные клетки, которые отвечают за резорбцию кости, и повышенная активность этих клеток связана с несколькими распространенными заболеваниями костей, включая постменопаузальный остеопороз. После адгезии к кости остеокласты становятся поляризованными и реорганизуют свой цитоскелет и мембрану, чтобы сформировать уникальные домены, включая зону уплотнения (SZ), которая представляет собой плотное кольцо из подосом, богатых F-актином, ограничивающих взъерошенную границу (RB), где протоны и протеазы секретируются для деминерализации и разрушения костного матрикса, соответственно.Эти процессы зависят от активности малых GTPases. Хорошо известно, что Rho GTPases контролируют организацию F-актина и адгезионных структур различных типов клеток, влияя впоследствии на их миграцию. В остеокластах RhoA, Rac, Cdc42, RhoU, а также Arf6 регулируют сборку подосом и их организацию в SZ. Напротив, образование RB вовлекает везикулярные пути трафика, которые регулируются семейством Rab GTPases, в частности лизосомным Rab7. Наконец, выживаемость остеокластов зависит от активности Ras GTPases.Правильная функция почти всех этих GTPases полностью зависит от посттрансляционного пренилирования, которое позволяет им локализоваться на конкретных мембранах-мишенях. Бисфосфонатные препараты, которые широко используются при лечении заболеваний костей, таких как остеопороз, действуют, предотвращая пренилирование малых GTPases, что приводит к потере SZ и RB и, следовательно, к ингибированию активности остеокластов, а также вызывает апоптоз остеокластов. В этом обзоре мы суммируем текущее понимание роли специфических пренилированных малых GTPases в поляризации, функции и выживании остеокластов.
Ключевые слова: остеокласт, кость, Rab, Rho, Rac, Ras, Arf, бисфосфонат, пренилирование
Введение
Остеокласты представляют собой большие многоядерные подвижные клетки, которые образуются путем слияния гематопоэтических клеток моноцита / происхождение макрофагов. 1 , 2 Это единственные клетки в организме, которые способны разрушать (резорбировать) внеклеточный костный матрикс, процесс, который необходим для морфогенеза кости во время развития, для постоянного восстановления микроповреждений в скелете и для адаптации кости к механической нагрузке. 3 , 4
Эти клетки представляют собой увлекательную модель поляризации клеток, потому что при активации для резорбции остеокласты реорганизуют свою мембрану в четыре отдельных и уникальных домена, а именно зону уплотнения (SZ), взъерошенную границу ( RB), базолатеральный домен (BD) и функциональный секреторный домен (FSD) (). SZ, где остеокласт плотно прикрепляется к костному матриксу, образован плотно упакованными специфическими, богатыми актином адгезионными структурами, называемыми подосомами.Они состоят из ядра плотно упакованных актиновых филаментов и белков, связанных с F-актином, таких как кортактин, WASp и Arp2 / 3, окруженных интегринами и белками, связанными с прикреплением, такими как винкулин и талин. 5 , 6 По сравнению с фокальными спайками эти структуры очень динамичны и имеют срок службы всего 2–12 мин. 7 , 8 Это плотное соединение остеокласта с внеклеточным матриксом эффективно изолирует компартмент под клеткой, где происходит деградация кости (лакуна резорбции). 9 Впоследствии поляризованные везикулярные пути трафика приводят к развитию мембраны, заключенной SZ, в сильно извилистую взъерошенную границу, где протоны и протеазы секретируются для деминерализации и деградации костного матрикса, соответственно. 10 — 12 Полученные продукты деградации затем подвергаются эндоцитозу в RB, транспортируются через остеокласт посредством трансцитоза и, наконец, высвобождаются на противоположной стороне клетки в FSD.
Изменения мембранных доменов во время активации остеокластов. Неполяризованные, неактивные остеокласты представляют собой диспергированные подосомы. Во время активации остеокластов эти подосомы сливаются в периферический пояс, а затем в отчетливое «актиновое кольцо», которое формирует зону уплотнения, в которой остеокласт плотно прилегает к поверхности кости. Вслед за этим перемещение поздних эндосом / лизосом к поверхности кости приводит к образованию взъерошенной границы, резорбтивной органеллы остеокласта.Наконец, мембранный домен, известный как функциональный секреторный домен, формируется в верхней части клетки, к которому нацелены трансцитотические пузырьки, сформированные на взъерошенной границе.
Малые GTPases суперсемейства Ras, включая подсемейства Ras, Rho, Arf, Ran и Rab, являются ключевыми регуляторами различных клеточных событий, включая деление клеток, транспорт пузырьков, сборку ядер и контроль цитоскелета. В этом обзоре будет освещена их роль в функции остеокластов, в частности, в регуляции подосом, везикулярном переносе и выживании клеток.
Фармакологические доказательства важности малых ГТФаз в функции остеокластов
В целом малые ГТФазы локализуются в определенных мембранных компартментах. Это свойство зависит от посттрансляционного пренилирования, которое включает присоединение гидрофобной изопреноидной липидной группы (либо 15-углеродный фарнезильный, либо 20-углеродный геранилгеранильный фрагмент) к консервативному остатку цистеина, содержащемуся в характерных мотивах пренилирования на С-конце самые маленькие GTPases.Эта модификация выполняется одним из трех ферментов протеин-пренилтрансферазы (фарнезилтрансфераза, геранилгеранилтрансфераза (GGTase) I или Rab GGTase), специфичность определяется мотивом пренилирования в белковом субстрате. 13 Большинство малых GTPases, включая подсемейство Rab и большую часть подсемейства Rho, модифицированы геранилгеранильными группами; ГТФазы, модифицированные фарнезилированием, включают большинство белков Ras и некоторые белки семейства Rho.
Фундаментальная важность малых GTPases в биологии остеокластов стала очевидной десять лет назад после нашего открытия, что азотсодержащие препараты бисфосфонатов (N-BP) ингибируют резорбцию костей, блокируя пренилирование белков. 14 , 15 Эти «блокбастеры» представляют собой негидролизуемые аналоги пирофосфата, которые быстро воздействуют на скелет и используются во всем мире в качестве передового средства лечения распространенных заболеваний, связанных с повышенной резорбцией кости, таких как постменопаузальный остеопороз. , связанное с раком заболевание костей и болезнь Педжета. 16 Препараты N-BP, такие как ризедронат, алендронат и золедронат, являются очень эффективными ингибиторами резорбции кости, поскольку они селективно интернализуются в остеокласты во время резорбции покрытой лекарством кости. 17 , 18 После интернализации N-BP нарушают поляризацию остеокластов (предотвращая образование актинового кольца, нарушая нормальный везикулярный транспорт и образование RB), а также вызывают апоптоз остеокластов. 18 В настоящее время известно, что эти эффекты N-BP являются результатом нарушения пренилирования белков, поскольку эти препараты имитируют структуру изопреноидных липидов, таких как геранилдифосфат (GPP), и тем самым сильно ингибируют синтазу фарнезилдифосфата (FPP), a ключевой фермент мевалонатного пути биосинтеза изопреноидов и холестерина. 19 — 21 Точный механизм ингибирования FPP-синтазы был недавно выяснен из рентгеновской кристаллической структуры фермента и включает «медленно-плотное» связывание лекарства с одним из двух изопреноидных липидов. субстратные карманы, приводящие к конформационным изменениям фермента. 22 — 24 Некоторые N-BP также являются слабыми ингибиторами других ферментов мевалонатного пути, таких как геранилгеранилдифосфат (GGPP) синтаза, скваленсинтаза и изомераза IPP. 18
Ингибирование активности FPP-синтазы в остеокластах приводит к истощению FPP и GGPP, которые необходимы для пренилирования малых GTPases. В результате малые ГТФазы накапливаются в непренилированной форме и не могут локализоваться в компартментах мембраны (). 25 Этот эффект можно легко измерить в культивируемых клетках, отслеживая метаболическое включение [ 14 C] мевалоната в пренилированные белки (), 14 , 18 , 26 с помощью белкового гелевого блоттинга. анализ клеточных лизатов с использованием антитела, которое специфически гибридизуется с непренилированной формой малой ГТФазы Rap1A (), 27 или путем визуализации субклеточной локализации малых ГТФаз, таких как Rab6 (). 25
Бисфосфонатные препараты ингибируют пренилирование малых GTPases. (A) Ингибирование пренилирования белков азотсодержащими бисфосфонатами может быть продемонстрировано in vitro путем культивирования клеток с [ 14 C] мевалонатом, который включается в пренилированные белки, меченные 14 C. Пренилированные белки с радиоактивной меткой (21–26 кДа, область в рамке) могут быть затем обнаружены авторадиографией после электрофоретического разделения. Лечение бисфосфонатными препаратами алендронатом (ALN), ибандронатом (IBA), инкадронатом (INC) и ризедронатом (RIS) явно ингибирует пренилирование по сравнению с контрольными (Ctrl) клетками.Воспроизведено из Luckman et al. 14 с разрешения Американского общества исследований костей и минералов. (B) Ингибирование пренилирования белков бисфосфонатными препаратами приводит к накоплению непренилированной формы малых GTPases в остеокластах. Накопление непренилированного Rap1A (красный) может быть определено с помощью белкового гелевого блоттинга, например, после обработки культивированных клеток золедронатом ≥10 мкМ (изображение любезно предоставлено Gemma Shay). Непренилированная форма (красный цвет) имеет более высокую молекулярную массу, чем пренилированная форма (зеленый цвет) из-за отсутствия расщепления концевого трипептида.(C) Ингибирование пренилирования белков бисфосфонатными препаратами изменяет субклеточное распределение малых GTPases, таких как Rab6. Многоядерные остеокласты иммуноокрашивали на Rab6, который локализуется в перинуклеарных гольджи в необработанном остеокласте (слева), но имеет цитозольное распределение в остеокласте, обработанном в течение 48 часов бисфосфонат ризедронатом (справа).
Поскольку пренилированные малые GTPases действуют как молекулярные переключатели, их активность необходимо строго контролировать. Недавние исследования показывают, что некоторые непренилированные малые ГТФазы, такие как Rac, которые накапливаются в цитозоле после воздействия на клетки N-BP, в основном являются их активным GTP-связанным состоянием (предположительно из-за отсутствия взаимодействия с регуляторными белками GAP), вызывая несоответствующую активацию нижестоящие сигнальные киназы, такие как p38. 28 Ингибирование мевалонатного пути N-BP, следовательно, по-видимому, нарушает функцию остеокластов, вызывая потерю пренилированных белков (и потерю нисходящей передачи сигналов) и / или накопление непренилированных белков (и, следовательно, несоответствующую активацию нижестоящих сигнальных путей или секвестрацию). эффекторов). 18 Эти эффекты на передачу сигналов малой GTPase приводят к нарушению организации цитоскелета и везикулярному переносу в остеокластах, вызывая потерю SZ и RB и апоптозу остеокластов.В частности, геранилгеранилированные, а не фарнезилированные, малые ГТФазы необходимы для функции и выживания остеокластов, поскольку геранилгераниол (клеточно-проницаемая форма GGPP) преодолевает ингибирование образования остеокластов и резорбции кости с помощью N-BP. 15 , 29 Кроме того, небольшие GTPases, геранилгеранилированные GGTase I (такие как Rho, Rac и Cdc42), имеют решающее значение для функции остеокластов (см. Ниже), поскольку ингибитор GGTase I (GGTI-298) близко имитирует влияние N-BP на поляризацию и выживаемость остеокластов. 30 Мы также идентифицировали первые известные специфические ингибиторы Rab GGTase (RGGT), которые очень напоминают структуру N-BP, но содержат карбоксилатный фрагмент вместо одной из фосфонатных групп. 25 , 31 Эти фосфонокарбоксилатные (PC) соединения, по-видимому, ингибируют RGGT, предотвращая вторую стадию геранилгеранилирования Rab-белков, которые обычно дигеранилгеранилированы, возможно, путем связывания с сайтом узнавания GG-цистеина на RGGT, который может быть требуется для выравнивания негеранилгеранилированных Rab для второй стадии модификации липидов. 32 Эти агенты специфически нарушают пренилирование и локализацию Rab GTPases в остеокластах, а также ингибируют резорбцию кости, нарушая везикулярный транспорт. 25 , 31
Встречающаяся в природе линия мышей, известная как gunmetal , представляет собой интересную модель дефектного пренилирования Rab in vivo. Этот дефект характеризуется снижением активности RGGT на 75% из-за аутосомно-рецессивной мутации в гене, кодирующем α-цепь этого фермента. 33 Мы показали, что макрофаги и остеокласты этих мышей более чувствительны к действию ПК, тем самым подтверждая, что эти препараты действуют через ингибирование RGGT. 34 Более того, хотя мыши gunmetal не проявляют явного костного фенотипа, остеокласты, полученные in vitro от этих мышей, демонстрируют пониженную способность к резорбции, несмотря на способность реорганизовывать свой цитоскелет в кольца F-актина. 35 Этот фенотип близко имитирует эффекты фармакологического ингибирования RGGT на остеокласты 31 и подтверждает, что пренилирование Rab необходимо для активности остеокластов; однако идентичность недопренилированных GTPases Rab, которые вносят вклад в дефект резорбции, остается неясной.
Регуляция расположения цитоскелета и полярности остеокластов с помощью малых GTPases
Остеокласты обладают уникальной подосомной организацией, которая зависит от субстрата, к которому они прикрепляются. Адгезия к покровным стеклам вызывает образование кластеров подосом, которые впоследствии собираются в небольшие кольца подосом и, в конечном итоге, в пояс подосом по периферии клетки, в котором можно четко различить отдельные подосомы. 7 Напротив, в остеокластах, засеянных на костные или костеподобные минерализованные субстраты, подосомы становятся плотно упакованными в плотное кольцо F-актина, также называемое зоной уплотнения (SZ).Хотя отдельные подосомы не могут быть различимы в SZ с помощью классической флуоресцентной микроскопии, сканирующая электронная микроскопия с высоким разрешением в сочетании с флуоресцентной микроскопией продемонстрировала, что эта структура состоит из плотной сети ядер подосом, соединенных между собой радиальными актиновыми волокнами, которые называются облаком F-актина. . 6 , 9 Различие в организации подосом на этих субстратах предполагает, что, хотя адгезия способствует образованию подосом, другие внеклеточные сигналы регулируют организацию подосом.Прикрепление остеокластов к поверхности кости в основном зависит от интегринов, в частности, рецептора витронектина (α v β 3 ), одного из основных интегринов в остеокластах, 36 , 37 , который в большей степени присутствует на них. ячеек, чем любой другой тип ячеек. 38 , 39 Делеция субъединицы β3 у мышей оказывает драматическое влияние на распространение остеокластов и организацию цитоскелета, приводя к прогрессирующему остеопетрозу, что указывает на снижение активности остеокластов. 37 При связывании лиганда α v β 3 интегрины привлекают многочисленные белки, включая нерецепторные тирозинкиназы Pyk2, Src и Syk, а также содержащую палец RING убиквитинлигазу c-Cbl, 40 — 42 , которые передают сигналы для регулирования как сборки / разборки подосом, так и организации подосом. Остеокласты мышей с нокаутом src, pyk2 или syk неспособны формировать надлежащую зону уплотнения, демонстрируя, что все эти три тирозинкиназы играют важную роль в организации подосом в остеокластах. 42 — 44 Напротив, дефицит убиквитинлигазы c-Cbl не влияет на формирование зоны уплотнения, но миграция остеокластов нарушается как in vitro, так и in vivo, что позволяет предположить, что Cbl может участвовать в оборот подосомы. 41 , 45 Число подосом и их продолжительность жизни снижены в src — / — остеокластах, подтверждая, что Src также играет критическую роль в формировании и стабильности подосом. 46 Более того, скорость потока мономеров актина в подосомы мышей с дефицитом Src или Pyk2 снижается, указывая тем самым, что киназы Src и Pyk2 регулируют полимеризацию актина. 44 , 46
Учитывая их роль в регуляции цитоскелета, неудивительно, что GTPases семейства Rho оказываются необходимыми для образования и организации подосом в остеокластах и для поляризации этих клеток (). Семейство Rho GTPases состоит из 20 членов, и анализ профилей транскриптов выявил присутствие 18 Rho GTPases в остеокластах. 47 Однако до сих пор идентифицировано только четыре члена этого семейства, которые играют роль в регуляции организации цитоскелета и поляризации остеокластов: RhoA, Rac1, Cdc42 и RhoU. 48 Недавно другое семейство, ARF GTPases, которые, как известно, регулируют мембранный перенос и динамику актина, 49 было вовлечено в регуляцию цитоскелета остеокластов и формирование герметичной зоны. 50
Роль малых GTPases в сигнальных путях, регулирующих поляризацию остеокластов.При адгезии остеокластов к костному матриксу взаимодействие рецептора витронектина (α v β 3 ) и CD44 активирует несколько нижестоящих сигнальных путей, способствующих образованию зоны уплотнения и поляризации остеокластов. Эти пути включают множество малых GTPаз (синий), GAP (красный), GEF (розовый) и эффекторов GTPase (зеленый), а также могут быть активированы через другие рецепторы, такие как рецептор M-CSF и рецептор, связанный с G-белком GPR55. .
Rho
Rho была первой GTPase, изученной в остеокластах.Ингибирование RhoA, RhoB и RhoC с помощью экзофермента Clostridium botulinum C3 нарушило образование SZ, что привело к инактивации остеокластов. 51 Действительно, когда остеокласты культивируются на кости, экзофермент C3 вызывает распространение остеокластов и реорганизацию подосом из SZ в пояс на периферии клетки, предполагая, что активность RhoA необходима для образования SZ, но не для пояса актина. формирование. 52 В соответствии с этим мы недавно показали, что каннабиноидные агонисты рецептора GPR55, сопряженного с G-белком, стимулируют поляризацию остеокластов и резорбцию кости, которая связана с активацией RhoA, вероятно, через Gα13. 53 Более того, микроинъекция конститутивно активируемого RhoA в остеокласты, культивируемые на покровных стеклах, не вызывала образования зоны уплотнения, но вызывала нарушение пояса подосом и создание кластеров подосом, что позволяет предположить, что одной активации RhoA недостаточно для индукции SZ. Это требует дополнительных сигналов от костного матрикса или более сложной регуляции активности RhoA. 54 — 56 Действительно, несколько наблюдений подтверждают важность регуляции активности RhoA для индукции образования подосом и герметичной зоны.С одной стороны, активный RhoA индуцирует синтез фосфатидилинозитол-4-фосфат-5-киназой (PI4P-5-киназой) фосфатидилинозитол-4,5-бисфосфата (PI (4,5) P2), который впоследствии взаимодействует с WASp для способствовать формированию зоны уплотнения. 57 С другой стороны, в клетках, трансформированных Src, ERK5 ограничивает активацию Rho за счет усиления экспрессии RhoGAP7 и тем самым индуцирует образование подосом. 58 Более того, в остеокластах активированный Rho индуцирует HDAC6-опосредованное деацетилирование микротрубочек через его эффектор mDia2, что приводит к нарушению SZ. 56 Pyk2-дефицитные остеокласты, которые обладают снижением ацетилирования микротрубочек и образования SZ, обладают повышенной активностью Rho, что указывает на то, что Pyk2 подавляет активность Rho, что делает возможным стабилизацию микротрубочек и SZ. 44 Это демонстрирует, что жесткая регуляция активности RhoA важна для поляризации остеокластов.
Rac
Как и другие типы клеток, Rac1 опосредует образование ламеллиподий и распространение клеток в остеокластах, например, в ответ на M-CSF, который способствует распространению и подвижности остеокластов. 59 , 60 Его роль в организации подосом менее изучена. Ори и др. сообщили, что Rac имеет эффекты, противоположные Rho в многоядерных гигантских клетках, поскольку экспрессия конститутивно активного Rac способствует образованию ламеллиподий и распространению клеток, тогда как экспрессия доминантно-негативного Rac вызывает ретракцию клеток и дезорганизацию подосом. 54 , 60 Razzouk et al. предприняли альтернативный подход, включающий использование нейтрализующих антител к Rac1 и Rac2, чтобы продемонстрировать, что ингибирование активности Rac нарушает кольца актина, снижает резорбтивную активность и вызывает ретракцию остеокластов крыс. 61 Совсем недавно было показано, что остеокласты мышей rac2 — / — имеют дефекты в образовании SZ и M-CSF-индуцированной миграции in vitro, что приводит к снижению активности остеокластов как in vitro, так и in vivo, 62 , таким образом, подтверждая важную роль белков Rac в формировании подосом и зон уплотнения.
Относительно мало известно о регуляции Rac и Rho факторами обмена гуаниновых нуклеотидов (GEF) и белками, активирующими GTPase (GAP) в остеокластах.У млекопитающих существует более 70 RhoGEF, принадлежащих к двум разным группам: домен, содержащий Dbl-гомологичный домен, и белки CZH. 63 , 64 Анализ профилей транскриптов выявил экспрессию 42 RhoGEF в остеокластах, включая Vav3, FARP2, Dock5 и αPIX. 47 В настоящее время есть доказательства того, что некоторые из них, которые специфически регулируют активность Rac, играют роль в остеокластах.
Все три белка Vav экспрессируются остеокластами, но до сих пор было показано, что только Vav3 играет решающую роль в остеокластах, 65 опосредуя M-CSF-индуцированную перестройку цитоскелета и распространение остеокластов посредством ассоциации с Rac1. 60 Дефицит Vav3 у мышей приводит к остеопетрозу из-за дефекта резорбирующих костную ткань остеокластов, которые демонстрируют дефектные кольца актина и потерю поляризации. 65 FARP2 — это GEF семейства Dbl, специфичный для Rac1, который важен для организации цитоскелета. 66 Его экспрессия повышается во время остеокластогенеза и локализуется в актиновом ядре подосом. 67 Избыточная экспрессия доминантно-отрицательной формы FARP2, лишенной домена RacGEF, приводит к дезорганизации актинового пояса и отсутствию резорбции кости.
Dock5, Rac1 GEF семейства CZH, также недавно был вовлечен в образование SZ. 68 Экспрессия Dock5 повышается во время индуцированного RANKL остеокластогенеза. 47 Остеокласты мышей с нокаутом Dock5 обладают пониженной активностью Rac1 и нарушенным актиновым цитоскелетом, 68 дополнительно указывает на то, что регулируемые Rac1 пути играют важную роль в формировании SZ.
ARF6
Недавно было определено, что ARF6, который, как известно, регулирует локализацию Rac1 в плазматической мембране, 69 , 70 , необходим для образования зоны уплотнения. 50 , 69 Белки GIT (GIT1 и GIT2), которые представляют собой ARF-GAP, являются мишенями для киназы Src и локализуются в зоне уплотнения в поляризованных остеокластах. 50 , 71 GIT2, как было показано, подавляет активность ARF и, возможно, рекрутирование Rac1 в SZ, тем самым поддерживая полярность остеокластов. 50 Более того, остеокласты мышей с нокаутом GIT1 имеют нарушенный актиновый цитоскелет, подтверждая важность белков GIT в формировании SZ. 50 Белки GIT могут взаимодействовать с α и βPIX, факторами обмена для Rac1 и Cdc42, которые окружают актиновое ядро подосом в макрофагах, где они контролируют образование подосом 72 и координируют Rho и ARF-индуцированные перестройки цитоскелета и оборот фокальной адгезии. 73 , 74 PIX-белки также участвуют в образовании подосомоподобных столбцов F-актина в обработанных форболовым эфиром гладкомышечных клетках сосудов. 75 Однако было обнаружено, что αPIX не нужен для ARF6 / GIT2-опосредованной регуляции образования SZ, предполагая, что другой GEF участвует в координации сигнальных путей ARF6 и Rac1 / Cdc42 в остеокластах. 50 Путь ARF6 / Rac1 также может играть роль в лизосомном трафике (см. Раздел об эффекторах Rab7).
Cdc42
Cdc42 является важным регулятором полимеризации актина за счет его прямого связывания с белками синдрома Вискотта-Олдрича (WASp и N-WASP), что вызывает конформационные изменения, позволяющие связывать WASp с комплексом Arp2 / 3, тем самым способствует зарождению актина. 76 , 77 Микроинъекция активированного Cdc42 в остеокласты приводит к нарушению организации подосом, но после последующего лечения остеопонтином наблюдается усиление взаимодействия между WASp и Arp2 / 3, способствующего полимеризации актина, что позволяет предположить, что только Cdc42 не может активировать WASp в остеокластах. 57 Cdc42 может также регулировать полярность эпителиальных клеток, взаимодействуя с комплексом полярности Par, содержащим Par-3, Par-6 и атипичный PKC. 78 Экспрессия этих белков в остеокластах предполагает, что ассоциация Cdc42 и Par-6 может контролировать поляризацию остеокластов. 79 Хотя истощение Cdc42 в остеокластах не влияло на образование актиновых колец, когда поляризация клеток была нарушена сывороточным голоданием, восстановление актиновых колец задерживалось, что указывает на то, что Cdc42 играет важную, но несущественную роль в установлении поляризации остеокластов. .
Остеокласты мышей с нокаутом WASp обнаруживают снижение образования подосом и, следовательно, неспособны поляризоваться. 80 Более того, фосфорилирование WASp по Tyr-291 регулируется несколькими киназами, включая Src, который увеличивает Arp2 / 3-опосредованную полимеризацию актина и образование SZ. 81 , 82 WASp также взаимодействует с WIP (WASp-взаимодействующий белок), который индуцирует его локализацию в подосомах и защищает от кальпаин-зависимой деградации. 83 Дефицит WIP в остеокластах вызывает снижение уровня белка WASp и количества подосом; оба эти изменения могут быть восстановлены путем активации рецепторов CD44, подтверждая критическую роль WASp в поляризации остеокластов. 84
Другой группой эффекторных молекул семейства Rho, участвующих в образовании подосом, является семейство p21-активируемых киназ (PAK), которое содержит шесть членов, которые могут взаимодействовать как с Cdc42, так и с Rac, опосредуя перестройку цитоскелета. 85 Экспрессия доминантно-отрицательных мутантов PAK4 приводила к уменьшению размера и количества подосом в макрофагах. 72 Более того, экспрессия киназно-активного мутанта PAK1 индуцировала образование подосомоподобных столбцов F-актина в гладкомышечных клетках сосудов. 75 Кортактин, белок, связывающий F-актин, который взаимодействует с комплексом Arp2 / 3, чтобы стимулировать нуклеацию актина и регулировать образование подосом, 86 , 87 может фосфорилироваться PAK, тем самым влияя на его связывание с актином в клетки гладких мышц сосудов. 88 В остеокластах нейтрализующие антитела к PAK1 разрушают кольца актина, аналогично эффектам нейтрализующих антител против Rac, предполагая, что белки PAK способствуют не только образованию подосом, но также опосредуют образование Rac-индуцированной зоны уплотнения. 61
RhoU
Самым последним членом семейства Rho GTPase, участвующим в регуляции цитоскелета остеокластов, является RhoU, также известный как Wrch2 (Wnt1-Responsive Cdc42 Homolog 1). RhoU обладает значительной последовательностью и функциональным сходством с Cdc42, но в отличие от Cdc42, RhoU обладает чрезвычайно быстрой собственной активностью обмена гуаниновых нуклеотидов. 89 Более того, RhoU имеет предполагаемые мотивы, взаимодействующие с доменом Src гомологии 3 (Sh4) в его N-концевой области. В отличие от RhoA, Rac1 и Cdc42, экспрессия RhoU активируется во время дифференцировки остеокластов. 47 RhoU колокализуется с винкулином вокруг ядер актина в клетках, которые образуют подосомы, то есть в остеокластах и в клетках Hela, трансфицированных конститутивно активной формой Src. 90 Исследования на других типах клеток показали, что RhoU участвует в реорганизации цитоскелета и полярности клеток.В клетках MDCK взаимодействие RhoU и Par-6 регулирует сборку плотных контактов, необходимую для поляризации эпителиальных клеток и для цистогенеза. 91 Более того, фосфорилирование Src RhoU по Tyr-254 необходимо для цистогенеза в 3D-культуре клеток MDCK. 92 В клетках h2299 Src-опосредованное фосфорилирование RhoU вызывает его субклеточную релокализацию и подавляет его связывание с GTP, что приводит к снижению индуцированного RhoU аутофосфорилирования PAK и Pyk2. 92 Однако в остеокластах сверхэкспрессия дикого типа и конститутивно активного RhoU дестабилизирует подосомный пояс и увеличивает образование кластеров актина, но не влияет на формирование зоны запечатывания или резорбцию кости in vitro, 93 предполагая, что RhoU не является необходим для поляризации остеокластов, и его роль в остеокластах еще предстоит определить.
Регуляция везикулярного обмена в остеокластах с помощью малых GTPases
Процессы везикулярного транспорта необходимы в остеокластах для установления и поддержания поляризации клеток, высвобождения медиаторов костной резорбции в лакуну резорбции и для рециркуляции рецепторов, таких как интегрины, которые способствуют подвижности остеокластов и функция. Решающим мембранным доменом для резорбции кости, который формируется в результате везикулярного переноса и слияния, является RB, сильно извитая мембрана, которая формируется только после того, как остеокласты претерпели перестройку цитоскелета с образованием SZ. 10 — 12 В отличие от обычных плазматических мембран, RB экспрессирует ряд белков, связанных с эндосомным / лизосомным путем, таких как LAMP1, LAMP2, lgp110 и Rab7, определяя RB как лизосомальную мембрану; 12 , 94 маркеры ранних эндосом, таких как EEA1, не обнаруживаются в RB, но ограничены пузырьками в цитоплазме остеокластов. 95 Лизосомная природа RB не удивительна, поскольку деградация костного матрикса требует подкисления лакуны резорбции и высвобождения протеаз, которые разрушают органический матрикс.Это опосредуется как слиянием лизосом в RB, которое непосредственно высвобождает кислоту в лакуну резорбции, так и продолжающимся действием V-АТФазы, которая вставляется в RB в результате этого пути транспортировки. 96 V-АТФаза подкисляет поздние эндосомы и лизосомы, перекачивая протоны, генерируемые карбоангидразой II, в просвет везикулы. 97 Для поддержания электронейтральности везикул хлорид-ионы транспортируются в просвет с помощью H + / Cl — антипортера ClC-7, который высоко экспрессируется в остеокластах и также доставляется в RB посредством лизосомального транспорта. 98 Секреция протеаз, в частности катепсина K, посредством этого пути опосредует деградацию органического матрикса, который преимущественно представляет собой коллаген I типа. 99 — 101 Этот эндоцитарный путь, который отвечает за образование и поддержание RB, берет свое начало от базолатеральной мембраны, поскольку эндосомные маркеры, такие как HRP и нагруженный железом трансферрин, интернализуются в эндосомы из этого мембранного домена перед доставкой к периферийной области РБ, близкой к зоне уплотнения, но отличной от нее. 102 Хотя известно, что подосомы и инвадоподии опосредуют деградацию матрикса посредством высвобождения металлопротеаз, таких как MMP9, которые могут разрушать коллаген, именно катепсин K, доставляемый по эндоцитарному пути, имеет решающее значение для деградации кости, 102 и сама зона уплотнения не является основным местом резорбции кости.
Rab-белки, самое большое семейство малых GTPases, включающее более 70 членов у людей, 103 являются главными регуляторами везикулярного транспорта, играя роль в почковании пузырьков, транспорте и слиянии с мембранами назначения.Хотя многие Rab-белки, вероятно, играют сходные фундаментальные роли во всех типах клеток, экспрессия некоторых Rab ограничена специализированными типами клеток, где у них есть отличная функция; например, Rab17 специфически экспрессируется поляризованными эпителиальными клетками, где он обеспечивает апикальный поляризованный транспорт рециркулирующих эндосом. 104 Поскольку остеокласты обнаруживают уникальные пути доставки пузырьков для поддержания их поляризации, вполне вероятно, что некоторые Rab белки играют уникальные роли в функции остеокластов ().Одним сильным кандидатом, который, как известно, имеет ограниченное тканевое распределение, является Rab27a, поскольку он участвует в перемещении «секреторных лизосом» в другие типы клеток, такие как меланоциты и цитотоксические Т-клетки. Однако Rab27a не экспрессируется в остеокластах, несмотря на то, что он присутствует в клетках-предшественниках, тогда как пепельные мыши, дефицитные по Rab27a, не имеют явного костного фенотипа (Coxon FP и Seabra MC, неопубликованные данные). Интересно, однако, что изоформы Rab27a и b экспрессируются в костеобразующих остеобластах, где они играют роль в транспортировке везикул, экспрессирующих лиганд RANK, к плазматической мембране. 105 Следовательно, это, вероятно, влияет на активность остеокластов in vivo, поскольку лиганд RANK важен для дифференцировки и функции остеокластов.
Гипотетическая модель транспорта поздних эндосом / лизосом к взъерошенной границе в остеокластах. Rab7 локализован в поздних эндосомах / лизосомах и в периферической области взъерошенной границы (рядом с зоной уплотнения) в остеокластах и регулирует перемещение этих пузырьков к положительному концу микротрубочек.Другие медиаторы этого процесса остаются неизвестными, хотя Rab7-связывающий белок Plekhm1, который рекрутируется в поздние эндосомы / лизосомы с помощью Rab7, вероятно, участвует, поскольку остеокласты пациентов с остеопетрозом с мутациями в этом белке имеют дефектные взъерошенные границы. Одна возможность состоит в том, что Plekhm1 может соединять Rab7 и мотор кинезина, чтобы сделать возможным перемещение транспорта по микротрубочкам. Было показано, что Rab7 взаимодействует непосредственно с Rac1 вблизи зоны уплотнения, и было высказано предположение, что это взаимодействие может опосредовать перенос поздних эндосом / лизосом из сети микротрубочек в сеть кортикального актина до слияния с акцептором взъерошенной границы. мембрана и высвобождение катепсина К и кислоты на периферии RB в лакуну резорбции.Этот процесс также служит для вставки V-АТФазы, ClC-7 и Rab7 в взъерошенную пограничную мембрану. Сама V-АТФаза также может играть роль в этом процессе, поскольку было показано, что субъединицы помпы связываются с актиновыми микрофиламентами. Трансцитотические везикулы, которые участвуют в дальнейшей деградации и удалении фрагментов коллагена и перемещаются по микротрубочкам к функциональному секреторному домену (FSD), происходят из центральной области взъерошенной границы; пока что Rab GTPases, управляющие этим путем, остаются неизвестными.
Хотя исследования выявили экспрессию Rab1B, Rab3A / B / C / D, Rab4B, Rab5C, Rab7, Rab9, Rab10, Rab11B и Rab35 в остеокластах, 95 , 106 , 107 Мало что известно о функции большинства этих Rab в остеокластах. Rab9 колокализуется с Rab7 в поздних эндосомах, но не в RB при резорбции остеокластов. 95 , 106 Rab6 также высоко экспрессируется на уровне белка и обнаруживает перинуклеарную локализацию Гольджи, но его точная роль остается неопределенной. 32 , 108 Rab11 локализован в компартментах перинуклеарного рециклинга в остеокластах, где он может участвовать в обороте рыхлой пограничной мембраны, способствуя миграции и резорбции остеокластов. 95 Однако определяющая роль в везикулярном переносе в RB остеокластов до сих пор приписывалась только Rab7 и Rab3D.
Rab7
Rab7 обеспечивает гетеротипическое слияние между ранними эндосомами и поздними эндосомами, а также между поздними эндосомами и лизосомами. 109 , 110 Он также регулирует ретроградный транспорт поздних эндосом по микротрубочкам к центру организации микротрубочек посредством взаимодействий с эффекторным белком RILP и моторным белком динеином. 111 Учитывая важность этого пути переноса в формировании RB, Rab7 может, следовательно, участвовать в формировании RB, контролируя как слияние поздних / зрелых эндосом друг с другом, так и с RB, 12 и / или перемещение этих эндосом. везикулы на микротрубочках.В подтверждение этого Rab7 локализуется совместно с маркерами взъерошенной границы и поздних эндосом, но не с маркерами ранних эндосом или аппарата Гольджи в остеокластах. 12 , 112 Кроме того, исследования антисмыслового нокдауна подтвердили, что Rab7 необходим для образования и резорбции RB остеокластами, а также для доставки V-АТФазы в RB. 112 В то время как захват трансферрина ранними эндосомами является нормальным в Rab7-истощенных клетках, транспорт в RB нарушается, обеспечивая дополнительные доказательства того, что Rab7 регулирует последние стадии эндосомного пути от базолатеральной мембраны к RB. 112
Эффекторы Rab7
В настоящее время нет доказательств роли установленных эффекторов Rab7, таких как RILP, ORP1L, Rabring7, hVPS34 или FYCO-1, в функции остеокластов. Однако было показано, что Rab7 взаимодействует с небольшой GTPase Rac1 в остеокластах GTP-зависимым образом. 113 Как указано выше, Rac1 играет важную роль в формировании зоны уплотнения, и оба Rac1 и Rab7 совместно локализуются в зоне слияния RB, как раз внутри зоны уплотнения.Была выдвинута гипотеза, что эта ассоциация может быть необходима для слияния поздних эндосом в RB, контролируя переключение поздних эндосом с транспорта на основе микротрубочек на кортикальную актиновую сеть (). В этом отношении можно провести аналогию с транспортом меланосом в меланоцитах, который требует взаимодействия Rab27a с меланофилином для переключения с микротрубочек на транспорт на основе актина в периферических дендритах. 114 Однако недавно было показано, что Arf6-активированный Rac1 рекрутирует эффекторный Armus, член семейства TBC / RabGAP, что приводит к инактивации Rab7 и способствует деградации лизосом E-кадгерина, что предполагает еще одну возможную функцию для Rac1 / Rab7. сложный. 115 Более того, есть доказательства того, что V-АТФаза на поздних эндосомах / лизосомах может быть медиатором их связывания в кортикальной актиновой сети путем прямого связывания с F-актином. 116 , 117
Интересно, что белок Plekhm1 был идентифицирован как еще один предполагаемый эффектор Rab7 в остеокластах. 118 Мутации в Plekhm1 являются причиной остеопетроза при заболевании костей, при котором остеокласты дисфункциональны из-за дефектного образования RB, указывая тем самым, что Plekhm1 участвует в Rab7-зависимом эндосомном / лизосомном транспорте в RB. 118 Plekhm1 представляет собой большой цитозольный белок, который также обнаруживает некоторую локализацию на эндосомных / лизосомных пузырьках, куда он рекрутируется с помощью GTP-связанного Rab7. 118 Мутация, вызывающая остеопетроз, приводит к введению преждевременного стоп-кодона и, следовательно, укороченной формы Plekhm1, которая не может локализоваться в эндосомах / лизосомах, предполагая, что транспорт лизосом к RB в остеокластах зависит от ассоциации Plekhm1 с Rab7. Физическое взаимодействие между Plekhm1 и Rab7 недавно было подтверждено, хотя любопытно, что в этом исследовании авт. Предполагают, что Plekhm1 негативно регулирует эндоцитотический путь в клетках Hela. 119 Интересно, что в другом исследовании сообщалось о точечной мутации (R714C) в мутации Plekhm1, которая не влияет на локализацию Plekhm1, но вызывает генерализованную остеопению (низкую костную массу), что позволяет предположить, что это может быть мутация увеличения функции. 120 Взятые вместе, мы предлагаем модель (), в которой Plekhm1 может связывать Rab7 с основанным на микротрубочках транспортом поздних эндосом / лизосом к RB (например, посредством взаимодействия с кинезиновым двигателем), где взаимодействие между Rab7 и Rac1 может обеспечить переход от микротрубочек к кортикальной актиновой сети.
Rab7 также необходим для слияния лизосом с аутофагосомами с образованием аутолизосом и обеспечения деградации материала внутри аутофагосомы. 121 Кроме того, транспорт автолизосом по микротрубочкам стимулируется взаимодействием Rab7 с его эффектором FYCO1. 122 Интересно, что недавно было высказано предположение, что RB также проявляет характеристики мембран аутофагосом, такие как экспрессия белка Atg8 / LC3, который участвует в рекрутировании материала, который разрушается в результате аутофагии, а также в слиянии аутофагосом с лизосомами. . 123 , 124 Это поднимает интригующую возможность того, что слияние лизосом с RB может быть опосредовано через LC3 и / или что аутофагосомы транспортируются в RB в остеокластах. Недавняя статья указывает, что LC3 также играет роль в фагосомах в макрофагах, подтверждая идею о том, что локализация и функция LC3 не могут быть ограничены аутофагосомами. 125
Rab3D
Белки Rab3 участвуют в регулируемом экзоцитозе и поэтому в основном экспрессируются в клетках с высокими секреторными потребностями, особенно в нейронах и нейроэндокринных клетках.126,127 Изоформ Rab3 Rab3D высоко экспрессируется в остеокластах как на уровне мРНК, так и на уровне белка, тогда как экспрессия Rab3A, Rab3B и Rab3C намного ниже. 95 , 107 Кроме того, Rab3D важен для функции остеокластов, поскольку Rab3D-дефицитные мыши проявляют остеосклеротический фенотип (высокая костная масса) из-за дефектной резорбции остеокластами, которая может воспроизводиться сверхэкспрессией доминантно-отрицательных форма Rab3D в остеокластах in vitro. 107 Более того, остеокласты Rab3D-дефицитных мышей обнаруживают аномальный RB, что указывает на дефект везикулярного транспорта в этот домен.Однако Rab3D, по-видимому, не участвует в пути передачи лизосом, поскольку он локализуется в субпопуляции пост-TGN везикул в остеокластах. Rab3D может, следовательно, регулировать биогенез секреторного компартмента от TGN, хотя неясно, представляет ли этот компартмент полностью отличную везикулярную популяцию от Rab7-регулируемого эндоцитарного пути или эти везикулы сливаются с эндоцитарным путем, чтобы достичь RB. Rab3D может регулировать движение этих предполагаемых секреторных везикул путем рекрутирования моторного компонента динеина Tctex-1, с которым он связывается GTP-зависимым образом. 128
Трансцитоз
Высокая концентрация деградированных фрагментов коллагена, кальция и фосфата создается в результате разрушения костного матрикса, который необходимо удалить из лакуны резорбции, чтобы в конечном итоге они могли быть выведены с мочой. Однако SZ непроницаема для молекул размером более 10 кДа, что свидетельствует о существовании клеточного пути для очистки лакун этих продуктов. 128 Действительно, продукты деградации костей могут быть обнаружены внутри внутриклеточных везикул, в определенном домене базальной мембраны и во внеклеточном пространстве рядом с этой мембраной, 130 , 131 , что позволяет предположить, что эти продукты деградации передаются, хотя остеокласт путем трансцитоза.
Этот процесс может играть роль в уравновешивании мембранных доменов в остеокластах, а также в обеспечении дальнейшей деградации матричных фрагментов за счет действия устойчивой к тартрату кислой фосфатазы (TRAcP). 132 Центральная область домена базолатеральной мембраны, по которой транспортируются трансцитотические пузырьки, поэтому стала известна как функциональный секреторный домен (FSD) и имеет характеристики апикальной мембраны в эпителиальных клетках. 10 , 94 В соответствии с моделью трансцитоза центральная область RB проявляет обширную эндоцитарную активность, а белки оболочки везикул, такие как клатрин и AP-2, ограничены этим доменом вместе с динамином GTPase, 102 , 133 , что имеет решающее значение для отделения почкующихся пузырьков от мембраны.Точно так же, чтобы компенсировать потерю мембраны во время процесса поглощения матрикса, недавние данные свидетельствуют о том, что существует дополнительный «обратный» трансцитотический путь, который доставляет мембрану от FSD к RB. 134
Несмотря на выяснение этих уникальных путей переноса в остеокластах, Rab GTPases, которые их регулируют, остаются полностью неизвестными. В эпителиальных клетках Rab17 участвует в трансцитозе полимерного рецептора иммуноглобулина от базолатерального к апикальному домену, 135 , тогда как более недавнее сообщение указывает, что эффектор Rab11 Rab11-FIP5 также играет роль в этом процессе. 136 Однако эти данные трудно экстраполировать на остеокласты, учитывая уникальную природу мембран, между которыми происходит трансцитоз.
Малые ГТФазы и выживание остеокластов
Малые ГТФазы играют важную роль в выживании остеокластов, примером чего может служить способность бисфосфонатных препаратов вызывать апоптоз остеокластов в результате ингибирования пренилирования этих белков. 137 Ras GTPases являются ключевыми регуляторами выживаемости клеток и активируются многочисленными рецепторами клеточной поверхности для индукции ключевых путей передачи сигналов, включая ERK, MAP-киназу и PI3-киназу. 138 При активации Ras рекрутирует Raf-1, серин / треониновую киназу, которая впоследствии фосфорилирует и активирует MEK (MAPK / Erk киназа), которая, в свою очередь, фосфорилирует и активирует Erk1 и Erk2, которые необходимы для выживания клеток. 36 , 138 Другим эффектором Ras является фосфатидилинозитол-3-киназа (PI3K), которая активирует серин / треонинкиназу Akt / PKB, способствующую выживанию. 139 Сверхэкспрессия конститутивно активного Ras в остеокластах мышей способствует выживанию клеток, которое блокируется ингибированием PI3K или Raf-1, демонстрируя участие обоих Ras-индуцированных путей в выживании остеокластов. 140 Подтверждая участие Raf-1-зависимого пути, конститутивно активная форма MEK значительно увеличивает выживаемость остеокластов, не влияя на активность резорбции костей. 141
Недавно было описано, что PAK1 активирует экспрессию сурвивина ниже Raf-1 MEK-независимым образом, способствуя выживанию остеокластов. 142 Мутации в гене nf1, кодирующем нейрофибромин Ras GAP, приводят к нейрофиброматозу 1 типа, заболеванию, характеризующемуся опухолями нейрофибромы, дефектами пигментации кожи, костными пороками, дефектами обучения и предрасположенностью к избранным злокачественным новообразованиям. 143 У пациентов с Nf1 наблюдается потеря костной массы из-за дефектов как остеобластов, так и остеокластов. 143 Остеокласты этих пациентов выживают дольше в отсутствие сыворотки, чем контрольные остеокласты, подтверждая, что Ras является важным регулятором выживания остеокластов. 144
Хотя Ras играет роль в выживании остеокластов, его влияние на активность остеокластов остается неясным. Непрямое вмешательство в функцию большинства форм Ras путем ингибирования его пренилирования (с использованием специфического ингибитора фарнезилтрансферазы, FTI-277) не оказывало влияния на цитоскелет или активность остеокластов кролика. 30 Напротив, доминантная отрицательная экспрессия Ras в остеокластах птиц увеличивает секрецию лизосомальных ферментов, предполагая, что Ras может отрицательно регулировать активность остеокластов. 145 Более того, мышиные остеокласты от мышей Nf1 / — обладают повышенной активностью Ras, образованием и резорбцией актинового кольца. 146 , 147 Этот эффект опосредуется Rac, поскольку отсутствие Rac отменяет поляризацию и активность остеокластов, индуцированную Nf1. 147 Таким образом, точная роль Ras GTPases в остеокластах еще предстоит полностью выяснить.
Мало что известно о роли других малых GTPases в выживании остеокластов. Однако способность специфического ингибитора GGTase I, GGTI-298, сильно индуцировать апоптоз в остеокластах предполагает, что белки семейства Rho могут участвовать в этом процессе. 30 Действительно, сверхэкспрессия доминантно-отрицательной формы Rac1 в остеокластах мыши вызывает апоптоз и снижает резорбцию кости, в то время как конститутивно активный Rac1 увеличивает выживаемость клеток PI3K-зависимым образом, предполагая, что Rac действует не только на цитоскелет остеокластов, но также способствует выживанию остеокластов. 59
Заключение
В заключение, очевидно, что функция остеокластов и, следовательно, резорбция кости в значительной степени зависят от малых GTPases семейств Ras, Rho и Rab, которые все требуют посттрансляционного пренилирования для их правильной локализации и функция. Ингибирование пренилирования малых GTPases является основным механизмом действия препаратов, которые наиболее широко используются для ингибирования резорбции костей при обычных метаболических заболеваниях костей. Исследования роли специфических малых GTPases открыли дальнейшее понимание уникального расположения цитоскелета и путей переноса везикул в резорбирующихся остеокластах.Однако необходимы дальнейшие такие исследования, чтобы полностью понять, как эти пути регулируются в этом интересном типе клеток.
Благодарности
Текущее исследование авторов малых GTPases в остеокластах финансируется программным грантом 17285 и грантом проекта 19379 от Arthritis Research UK.
Аббревиатуры
| ARF | Фактор ADP-рибозилирования | ||||||||||
| BD | базолатеральный домен | ||||||||||
| CZH | CDM-зизимин 908 с гомологией | ||||||||||
| фарнезилдифосфат | |||||||||||
| FSD | Функциональный секреторный домен | ||||||||||
| GAP | GTPase Активирующий белок | ||||||||||
| GEF | GEF | Фактор обмена гуаниновых нуклеотидов Gran835 | геранилгеранилтрансфераза | ||||||||
| GPP | геранилдифосфат | ||||||||||
| HDAC | гистондеацетилаза | ||||||||||
| HRP | хрена | дипоксидаза | |||||||||
| MMP | матриксная металлопротеиназа | ||||||||||
| M-CSF | Фактор, стимулирующий колонии макрофагов | ||||||||||
| MEK | MAPK / Erk киназа | -бисфосфат-киназа | Nf1 | нейрофибромин | |||||||
| PAK | p21-активированная киназа | ||||||||||
| PI3K | фосфатидилинозитол-3-киназа | ||||||||||
| 3-киназа PI3- | |||||||||||
| -киназа PI3-фосфат-90-8-s-90-8-k-8 | PI (4,5) P2 | фосфатидилинозитол-4,5-бисфосфат | |||||||||
| PKC | протеинкиназа C | ||||||||||
| RANK | активатор рецептора NFkappaB | ruff | RGGT | Rab геранилгеранилтрансфераза | |||||||
| SZ | зона уплотнения | ||||||||||
| TGN | сеть транс-Гольджи | ||||||||||
| TRAcP | тартрат-устойчивая кислая фосфатаза | ||||||||||
| V-ATPase | вакуолярный тип H + 6-ATPase Белки синдрома Альдриха | ||||||||||
| WIP | WASp-взаимодействующий белок |
Ссылки
1.Бойл В.Дж., Саймонет В.С., Лейси Д.Л. Дифференциация и активация остеокластов. Природа. 2003. 423: 337–342. DOI: 10,1038 / природа01658. [PubMed] [CrossRef] [Google Scholar] 2. Negishi-Koga T, Takayanagi H. Передача сигналов Ca 2+ -NFATc1 является важной осью дифференцировки остеокластов. Immunol Rev.2009; 231: 241–256. DOI: 10.1111 / j.1600-065X.2009.00821.x. [PubMed] [CrossRef] [Google Scholar] 3. Teitelbaum SL. Резорбция кости остеокластами. Наука. 2000. 289: 1504–1508. [PubMed] [Google Scholar] 4. Vaananen HK, Zhao H, Mulari M, Halleen JM.Клеточная биология функции остеокластов. J Cell Sci. 2000. 113: 377–381. [PubMed] [Google Scholar] 5. Spinardi L, Marchisio PC. Подосомы как умные регуляторы клеточной адгезии. Eur J Cell Biol. 2006; 85: 191–194. DOI: 10.1016 / j.ejcb.2005.08.005. [PubMed] [CrossRef] [Google Scholar] 6. Jurdic P, Saltel F, Chabadel A, Destaing O. Подосома и зона уплотнения: Специфика модели остеокластов. Eur J Cell Biol. 2006. 85: 195–202. DOI: 10.1016 / j.ejcb.2005.09.008. [PubMed] [CrossRef] [Google Scholar] 7. Дестаинг О, Сальтел Ф, Джеминард Дж. К., Юрдич П., Бард Ф.Подосомы демонстрируют оборот актина и динамическую самоорганизацию в остеокластах, экспрессирующих актин-зеленый флуоресцентный белок. Mol Biol Cell. 2003. 14: 407–416. DOI: 10.1091 / mbc.E02-07-0389. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Block MR, Badowski C, Millon-Fremillon A, Bouvard D, Bouin AP, Faurobert E, et al. Спайки подосомного типа и фокальные спайки, такие похожие, но такие разные. Eur J Cell Biol. 2008. 87: 491–506. DOI: 10.1016 / j.ejcb.2008.02.012. [PubMed] [CrossRef] [Google Scholar] 9.Luxenburg C, Geblinger D, Klein E, Anderson K, Hanein D, Geiger B и др. Архитектура адгезивного аппарата культивируемых остеокластов: от образования подосом до сборки зоны уплотнения. PLoS One. 2007; 2: 179. DOI: 10.1371 / journal.pone.0000179. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 10. Mulari M, Vaaraniemi J, Vaananen HK. Внутриклеточный мембранный перенос остеокластов, резорбирующих костную ткань. Microsc Res Tech. 2003. 61: 496–503. DOI: 10.1002 / jemt.10371. [PubMed] [CrossRef] [Google Scholar] 11.Lakkakorpi PT, Vaananen HK. Цитоскелетные изменения остеокластов во время цикла резорбции. Microsc Res Tech. 1996; 33: 171–181. DOI: 2-W. [PubMed] [Google Scholar] 12. Палокангас Х, Мулари М, Ваананен Х. Эндоцитарный путь от базальной плазматической мембраны к взъерошенной пограничной мембране в остеокластах, резорбирующих кость. J Cell Sci. 1997; 110: 1767–1780. [PubMed] [Google Scholar] 13. Чжан Флорида, Кейси П.Дж. Пренилирование белков: молекулярные механизмы и функциональные последствия. Анну Рев Биохим. 1996. 65: 241–269.DOI: 10.1146 / annurev.bi.65.070196.001325. [PubMed] [CrossRef] [Google Scholar] 14. Luckman SP, Hughes DE, Coxon FP, Graham R, Russell G, Rogers MJ. Азотсодержащие бисфосфонаты ингибируют мевалонатный путь и предотвращают посттрансляционное пренилирование GTP-связывающих белков, включая ras. J Bone Miner Res. 1998. 13: 581–589. DOI: 10.1359 / jbmr.1998.13.4.581. [PubMed] [CrossRef] [Google Scholar] 15. Фишер Дж. Э., Роджерс М. Дж., Халаси Дж. М., Лакман С. П., Хьюз Д. Е., Масарачиа П. Дж. И др. Механизм действия алендроната: геранилгераниол, промежуточное звено мевалонатного пути, предотвращает ингибирование образования остеокластов, резорбции костей и активации киназ in vitro.Proc Natl Acad Sci USA. 1999. 96: 133–138. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Рассел Р.Г., Уоттс Н.Б., Эбетино Ф.Х., Роджерс М.Дж. Механизмы действия бисфосфонатов: сходства и различия и их потенциальное влияние на клиническую эффективность. Osteoporos Int. 2008; 19: 733–759. DOI: 10.1007 / s00198-007-0540-8. [PubMed] [CrossRef] [Google Scholar] 17. Coxon FP, Thompson K, Roelofs AJ, Ebetino FH, Rogers MJ. Визуализация связывания минералов и поглощения бисфосфоната остеокластами и нерезорбирующимися клетками.Кость. 2008; 42: 848–860. DOI: 10.1016 / j.bone.2007.12.225. [PubMed] [CrossRef] [Google Scholar] 18. Роджерс MJ, Crockett JC, Coxon FP, Monkkonen J. Биохимические и молекулярные механизмы действия бисфосфонатов. Кость. 2010 г. doi: 10.1016 / j.bone.2010.11.008. [PubMed] [CrossRef] [Google Scholar] 19. van Beek E, Pieterman E, Cohen L, Lowik C, Papapoulos S. Фарнезилпирофосфатсинтаза является молекулярной мишенью азотсодержащих бисфосфонатов. Biochem Biophys Res Commun. 1999; 264: 108–111. DOI: 10.1006 / bbrc.1999.1499. [PubMed] [CrossRef] [Google Scholar] 20. Данфорд Дж. Э., Томпсон К., Коксон Ф. П., Лакман С. П., Хан Ф. М., Поултер С. Д. и др. Отношения структура-активность для ингибирования фарнезилдифосфатсинтазы in vitro и ингибирования резорбции костей in vivo азотсодержащими бисфосфонатами. J Pharmacol Exp Ther. 2001; 296: 235–242. [PubMed] [Google Scholar] 21. Роджерс MJ. Новое понимание молекулярных механизмов действия бисфосфонатов. Curr Pharm Des. 2003; 9: 2643–2658. [PubMed] [Google Scholar] 22.Кавана К.Л., Гуо К., Данфорд Дж. Э., Ву Х, Кнапп С., Эбетино Ф. Х. и др. Молекулярный механизм действия азотсодержащих бисфосфонатов как противостеопорозных препаратов. Proc Natl Acad Sci USA. 2006; 103: 7829–7834. DOI: 10.1073 / pnas.0601643103. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Rondeau JM, Bitsch F, Bourgier E, Geiser M, Hemmig R, Kroemer M, et al. Структурная основа исключительной эффективности бисфосфонатных препаратов in vivo. ChemMedChem. 2006; 1: 267–273. DOI: 10.1002 / cmdc.200500059. [PubMed] [CrossRef] [Google Scholar] 24.Данфорд Дж. Э., Квази А. А., Роджерс М. Дж., Барнетт Б. Л., Эбетино Ф. Х., Рассел Р. Г. и др. Взаимосвязь между структурой и активностью азотсодержащих бисфосфонатов при клиническом использовании и других аналогов: Зависящее от времени ингибирование фарнезилпирофосфатсинтазы человека. J Med Chem. 2008. 51: 2187–2195. DOI: 10,1021 / jm7015733. [PubMed] [CrossRef] [Google Scholar] 25. Coxon FP, Ebetino FH, Mules EH, Seabra MC, McKenna CE, Rogers MJ. Фосфонокарбоксилатные ингибиторы геранилгеранилтрансферазы кролика нарушают пренилирование и мембранную локализацию кроличьих белков в остеокластах in vitro и in vivo.Кость. 2005. 37: 349–358. DOI: 10.1016 / j.bone.2005.04.021. [PubMed] [CrossRef] [Google Scholar] 26. Luckman SP, Coxon FP, Ebetino FH, Russell RG, Rogers MJ. Гетероциклсодержащие бисфосфонаты вызывают апоптоз и ингибируют резорбцию костей, предотвращая пренилирование белков: данные о взаимосвязи структура-активность в макрофагах J774. J Bone Miner Res. 1998. 13: 1668–1678. DOI: 10.1359 / jbmr.1998.13.11.1668. [PubMed] [CrossRef] [Google Scholar] 27. Рулофс А.Дж., Томпсон К., Гордон С., Роджерс М.Дж. Молекулярные механизмы действия бисфосфонатов: современное состояние.Clin Cancer Res. 2006; 12: 6222–6230. DOI: 10.1158 / 1078-0432.CCR-06-0843. [PubMed] [CrossRef] [Google Scholar] 28. Данфорд Дж. Э., Роджерс М. Дж., Эбетино Ф. Х., Фиппс Р. Дж., Коксон Ф. П.. Ингибирование пренилирования белков бисфосфонатами вызывает длительную активацию rac, Cdc42 и rho GTPases. J Bone Miner Res. 2006. 21: 684–694. DOI: 10.1359 / jbmr.060118. [PubMed] [CrossRef] [Google Scholar] 29. van beek E, Lowik C, van der Pluijm G, Papapoulos S. Роль геранилгеранилирования в резорбции кости и его подавление бисфосфонатами в костных эксплантатах плода in vitro: ключ к механизму действия азотсодержащих бисфосфонатов.J Bone Miner Res. 1999; 14: 722–729. DOI: 10.1359 / jbmr.1999.14.5.722. [PubMed] [CrossRef] [Google Scholar] 30. Coxon FP, Helfrich MH, Van’t Hof R, Sebti S, Ralston SH, Hamilton A и др. Геранилгеранилирование белков необходимо для образования, функционирования и выживания остеокластов: ингибирование бисфосфонатами и GGTI-298. J Bone Miner Res. 2000; 15: 1467–1476. DOI: 10.1359 / jbmr.2000.15.8.1467. [PubMed] [CrossRef] [Google Scholar] 31. Coxon FP, Helfrich MH, Larijani B., Muzylak M, Dunford JE, Marshall D, et al.Идентификация нового фосфонокарбоксилатного ингибитора геранилгеранилтрансферазы кролика, который специфически предотвращает пренилирование кролика в остеокластах и макрофагах. J Biol Chem. 2001; 276: 48213–48222. DOI: 10.1074 / jbc.M106473200. [PubMed] [CrossRef] [Google Scholar] 32. Барон Р.А., Таваре Р., Фигейредо А.С., Блажевска К.М., Кашемиров Б.А., МакКенна С.Е. и др. Фосфонокарбоксилаты ингибируют второе присоединение геранил-геранила рабгеранилгеранилтрансферазой. J Biol Chem. 2009. 284: 6861–6868. DOI: 10.1074 / JBC.M806952200. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 33. Деттер Дж. К., Чжан К., Мулс Е. Х., Новак Е. К., Мишра В. С., Ли В. и др. Альфа-мутация рабгеранилгеранилтрансферазы у мышей бронзового цвета снижает пренилирование кролика и синтез тромбоцитов. Proc Natl Acad Sci USA. 2000. 97: 4144–4149. DOI: 10.1073 / pnas.080517697. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 34. Coxon FP, Taylor A, Stewart CA, Baron R, Seabra MC, Ebetino FH и др. Мышь с бронзовым покрытием обнаружила, что геранилгеранилтрансфераза раба является основной молекулярной мишенью для фосфонокарбоксилатных аналогов бисфосфонатов.Кость. 2011 г. DOI: 10.1016 / j.bone.2011.03.686. [PubMed] [CrossRef] [Google Scholar] 35. Тейлор А., Мулз Э. Х., Сибра М. Х., Хелфрих М. Х., Роджерс М. Дж., Коксон Ф. П.. Нарушение пренилирования Rab GTPases у мышей Gunmetal вызывает дефекты функции костных клеток. Малые GTPases. 2011; 2: 131–142. DOI: 10.4161 / sgtp.2.3.16488. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 36. Накамура И., Пилкингтон М.Ф., Лаккакорпи П.Т., Липферт Л., Симс С.М., Диксон С.Дж. и др. Роль интегрина альфа (v) бета (3) в миграции остеокластов и формировании зоны уплотнения.J Cell Sci. 1999; 112: 3985–3993. [PubMed] [Google Scholar] 37. МакХью К.П., Ходивала-Дилке К., Чжэн М.Х., Намба Н., Лам Дж., Новак Д. и др. Мыши, лишенные интегринов бета3, остеосклеротичны из-за дисфункциональных остеокластов. J Clin Invest. 2000; 105: 433–440. DOI: 10.1172 / JCI8905. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 38. Клевер Дж., Доддс Р.А., Гоуэн М. Экспрессия субъединицы интегрина человеческими остеобластами и остеокластами in situ и в культуре. J Cell Sci. 1992. 103: 267–271. [PubMed] [Google Scholar] 39.Шинар Д.М., Шмидт А., Гальперин Д., Родан Г.А., Вайнреб М. Экспрессия субъединиц интегрина alphav и beta3 в остеокластах крысы in situ. J Bone Miner Res. 1993. 8: 403–414. DOI: 10.1002 / jbmr.5650080404. [PubMed] [CrossRef] [Google Scholar] 40. Duong LT, Lakkakorpi PT, Nakamura I, Machwate M, Nagy RM, Rodan GA. PYK2 в остеокластах представляет собой киназу адгезии, локализованную в зоне уплотнения, активируемую лигированием интегрина альфа (v) бета3 и фосфорилируемую киназой src. J Clin Invest. 1998. 102: 881–892. DOI: 10.1172 / JCI3212. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 41. Sanjay A, Houghton A, Neff L, DiDomenico E, Bardelay C, Antoine E, et al. Cbl связывается с Pyk2 и src для регулирования активности киназы src, передачи сигналов, опосредованной интегрином альфа (v) бета (3), клеточной адгезии и подвижности остеокластов. J Cell Biol. 2001; 152: 181–195. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Цзоу В., Китаура Х., Рив Дж., Лонг Ф., Тибулевич В.Л., Шаттил С.Дж. и др. Syk, c-src, интегрин alphavbeta3 и иммунорецепторы ITAM совместно регулируют резорбцию костной ткани остеокластами.J Cell Biol. 2007; 176: 877–888. DOI: 10.1083 / jcb.200611083. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 43. Миядзаки Т., Санджай А., Нефф Л., Танака С., Хорн В. К., Барон Р. Активность киназы Src необходима для функции остеокластов. J Biol Chem. 2004. 279: 17660–17666. DOI: 10.1074 / jbc.M311032200. [PubMed] [CrossRef] [Google Scholar] 44. Гил-Хенн Х., Дестейн О, Симс Н.А., Аоки К., Аллес Н., Нефф Л. и др. Дефектная микротрубочка-зависимая организация подосом в остеокластах приводит к увеличению плотности костной ткани у мышей Pyk2 (- / -).J Cell Biol. 2007; 178: 1053–1064. DOI: 10.1083 / jcb.200701148. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Чиусароли Р., Санджай А., Хенриксен К., Энгсиг М. Т., Хорн В. К., Гу Х и др. Делеция гена, кодирующего c-cbl, изменяет способность остеокластов к миграции, задерживая резорбцию и оссификацию хряща во время развития длинных костей. Dev Biol. 2003. 261: 537–547. [PubMed] [Google Scholar] 46. Дестаинг О, Санджай А., Итцштейн С., Хорн В. К., Тоомре Д., Де Камилли П. и др. Активность тирозинкиназы c-src регулирует динамику актина и организацию подосом в остеокластах.Mol Biol Cell. 2008; 19: 394–404. DOI: 10.1091 / mbc.E07-03-0227. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 47. Brazier H, Stephens S, Ory S., Fort P, Morrison N, Blangy A. Профиль экспрессии RhoGTPases и RhoGEFs во время остеокластогенеза, стимулированного RANKL: Идентификация основных генов в остеокластах. J Bone Miner Res. 2006; 21: 1387–1398. DOI: 10.1359 / jbmr.060613. [PubMed] [CrossRef] [Google Scholar] 48. Ory S, Brazier H, Pawlak G, Blangy A. Rho GTPases в остеокластах: оркестраторы расположения подосом.Eur J Cell Biol. 2008; 87: 469–477. DOI: 10.1016 / j.ejcb.2008.03.002. [PubMed] [CrossRef] [Google Scholar] 50. Heckel T, Czupalla C, Expirto Santo AI, Anitei M, Arantzazu Sanchez-Fernandez M, Mosch K и др. Src-зависимая репрессия ARF6 необходима для поддержания богатых подосомами герметизирующих зон в переваривающих кость остеокластах. Proc Natl Acad Sci USA. 2009; 106: 1451–1456. DOI: 10.1073 / pnas.0804464106. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Чжан Д., Удагава Н., Накамура И., Мураками Х., Сайто С., Ямасаки К. и др.Небольшой GTP-связывающий белок, rho p21, участвует в резорбции кости, регулируя организацию цитоскелета в остеокластах. J Cell Sci. 1995; 108: 2285–2292. [PubMed] [Google Scholar] 52. Saltel F, Destaing O, Bard F, Eichert D, Jurdic P. Апатит-опосредованная динамика актина в резорбирующихся остеокластах. Mol Biol Cell. 2004; 15: 5231–5241. DOI: 10.1091 / mbc.E04-06-0522. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 53. Уайт Л.С., Райберг Э., Симс Н.А., Ридж С.А., Маки К., Гресли П.Дж. и др. Предполагаемый каннабиноидный рецептор GPR55 влияет на функцию остеокластов in vitro и костную массу in vivo.Proc Natl Acad Sci USA. 2009. 106: 16511–16516. DOI: 10.1073 / pnas.03106. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 54. Ory S, Munari-Silem Y, Fort P, Jurdic P. Rho и rac обладают антагонистическими функциями в отношении распространения многоядерных клеток, полученных из макрофагов, и не требуются для образования актиновых волокон. J Cell Sci. 2000; 113: 1177–1188. [PubMed] [Google Scholar] 55. Chellaiah MA, Soga N, Swanson S, McAllister S, Alvarez U, Wang D, et al. Rho-A имеет решающее значение для организации подосомы остеокластов, подвижности и резорбции кости.J Biol Chem. 2000; 275: 11993–12002. [PubMed] [Google Scholar] 56. Дестаинг О, Салтел Ф, Гилкин Б., Хабадель А., Хочбин С., Ори С. и др. Новый путь rho-mDia2-HDAC6 контролирует формирование паттерна подосом посредством ацетилирования микротрубочек в остеокластах. J Cell Sci. 2005. 118: 2901–2911. DOI: 10.1242 / jcs.02425. [PubMed] [CrossRef] [Google Scholar] 57. Chellaiah MA. Регуляция образования актинового кольца rho-GTPases в остеокластах. J Biol Chem. 2005; 280: 32930–32943. DOI: 10.1074 / jbc.M500154200. [PubMed] [CrossRef] [Google Scholar] 58.Шрамп М., Инь О, Ким Т.Ю., Мартин Г.С. ERK5 способствует src-индуцированному образованию подосом, ограничивая активацию rho. J Cell Biol. 2008. 181: 1195–1210. DOI: 10.1083 / jcb.200801078. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Фукуда А., Хикита А., Вакеяма Х, Акияма Т., Ода Х, Накамура К. и др. Регулирование апоптоза и подвижности остеокластов с помощью малого GTPase-связывающего белка Rac1. J Bone Miner Res. 2005; 20: 2245–2253. DOI: 10.1359 / JBMR.050816. [PubMed] [CrossRef] [Google Scholar] 60. Сакаи Х, Чен Й, Итокава Т, Ю КП, Чжу М.Л., Инсогна К.Активированный c-fms рекрутирует vav и rac во время индуцированного CSF-1 ремоделирования цитоскелета и распространения в остеокластах. Кость. 2006; 39: 1290–1301. DOI: 10.1016 / j.bone.2006.06.012. [PubMed] [CrossRef] [Google Scholar] 61. Razzouk S, Lieberherr M, Cournot G. Rac-GTPase, цитоскелет остеокластов и резорбция кости. Eur J Cell Biol. 1999; 78: 249–255. [PubMed] [Google Scholar] 62. Итокова Т., Чжу М.Л., Троиано Н., Биан Дж., Кавано Т., Инсогна К. Остеокласты, лишенные Rac2, обладают дефектным хемотаксисом и резорбтивной активностью.Calcif Tissue Int. 2010 г. DOI: 10.1007 / s00223-010-9435-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 63. Россман К.Л., Дер С.Дж., Сондек Дж. ГЭФ означает: «Включение RHO GTPases с факторами обмена гуаниновых нуклеотидов». Nat Rev Mol Cell Biol. 2005; 6: 167–180. DOI: 10,1038 / nrm1587. [PubMed] [CrossRef] [Google Scholar] 64. Меллер Н., Мерло С., Гуда С. Белки CZH: новое семейство rho-GEF. J Cell Sci. 2005. 118: 4937–4946. DOI: 10.1242 / jcs.02671. [PubMed] [CrossRef] [Google Scholar] 65. Фаччио Р., Тейтельбаум С.Л., Фуджикава К., Чаппел Дж., Заллоне А., Тибулевич В.Л. и др.Vav3 регулирует функцию остеокластов и костную массу. Nat Med. 2005; 11: 284–290. DOI: 10,1038 / нм1194. [PubMed] [CrossRef] [Google Scholar] 66. Кубо Т., Ямашита Т., Ямагути А., Сумимото Н., Хосокава К., Тохьяма М. Новый домен FERM, включающий фактор обмена гуаниновых нуклеотидов, участвует в передаче сигналов rac и регулирует ремоделирование нейритов. J Neurosci. 2002; 22: 8504–8513. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Такегахара Н., Кан С., Нодзима С., Такамацу Х., Окуно Т., Кикутани Х. и др. Интегральная роль фактора обмена гуаниновых нуклеотидов, FARP2, в перестройках подосом остеокластов.FASEB J. 2010; 24: 4782–4792. DOI: 10.1096 / fj.10-158212. [PubMed] [CrossRef] [Google Scholar] 68. Вивес В., Лаурин М., Црес Дж., Ларрус П., Моришо З., Ноэль Д. и др. Фактор обмена Rac1 Dock5 необходим для резорбции костной ткани остеокластами. J Bone Miner Res. DOI 2010: 10.1002 / jbmr.282. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 69. Радхакришна Х., Аль-Авар О, Хачикян З., Дональдсон Дж. Г.. Необходимость ARF6 для взъерошивания раковых клеток предполагает роль мембранного транспорта в кортикальных перестройках актина.J Cell Sci. 1999; 112: 855–866. [PubMed] [Google Scholar] 70. Tushir JS, D’Souza-Schorey C. ARF6-зависимая активация ERK и Rac1 модулирует развитие эпителиальных канальцев. EMBO J. 2007; 26: 1806–1819. DOI: 10.1038 / sj.emboj.7601644. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 71. Menon P, Yin G, Smolock EM, Zuscik MJ, Yan C, Berk BC. Белок 1, взаимодействующий с киназой 2 GPCR (GIT1), регулирует функцию остеокластов и костную массу. J. Cell Physiol. 2010; 225: 777–785. DOI: 10.1002 / jcp.22282. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 72.Грингель А., Вальц Д., Розенбергер Г., Минден А., Кутше К., Копп П. и др. PAK4 и alphaPIX определяют размер и количество подосом в макрофагах посредством локальной регуляции актина. J. Cell Physiol. 2006. 209: 568–579. DOI: 10.1002 / jcp.20777. [PubMed] [CrossRef] [Google Scholar] 73. Франк С.Р., Хансен Ш. Комплекс PIX-GIT: сигнальная кассета G-белка, контролирующая форму клеток. Semin Cell Dev Biol. 2008. 19: 234–244. DOI: 10.1016 / j.semcdb.2008.01.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 74.Розенбергер Г., Кутше К. AlphaPIX и betaPIX и их роль в формировании фокальной адгезии. Eur J Cell Biol. 2006. 85: 265–274. DOI: 10.1016 / j.ejcb.2005.10.007. [PubMed] [CrossRef] [Google Scholar] 75. Уэбб Б.А., Ив Р., Кроули С.В., Чжоу С., Кот Г.П., Мак А.С. PAK1 индуцирует образование подосом в клетках гладких мышц сосудов A7r5 зависимым от PAK-взаимодействующего фактора обмена образом. Am J Physiol Cell Physiol. 2005; 289: 898–907. DOI: 10.1152 / ajpcell.00095.2005. [PubMed] [CrossRef] [Google Scholar] 76. Рохатги Р., Ма Л., Мики Х., Лопес М., Кирххаузен Т., Такенава Т. и др.Взаимодействие между N-WASP и комплексом Arp2 / 3 связывает Cdc42-зависимые сигналы со сборкой актина. Клетка. 1999; 97: 221–231. [PubMed] [Google Scholar] 77. Монипенни Дж., Чоу Х.С., Банон-Родригес И., Трэшер А.Дж., Антон И.М., Джонс Г.Е. и др. Роль WASP в клеточной полярности и подосомной динамике миелоидных клеток. Eur J Cell Biol. 2010 г. doi: 10.1016 / j.ejcb.2010.05.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 78. Джоберти Г., Петерсен С., Гао Л., Макара И.Г. Белок клеточной полярности Par6 связывает Par3 и атипичную протеинкиназу C с Cdc42.Nat Cell Biol. 2000; 2: 531–539. DOI: 10,1038 / 35019573. [PubMed] [CrossRef] [Google Scholar] 79. Ито Ю., Тейтельбаум С.Л., Цзоу В., Чжэн Ю., Джонсон Дж. Ф., Чаппел Дж. И др. Cdc42 регулирует моделирование и ремоделирование костей у мышей путем модуляции передачи сигналов RANKL / M-CSF и поляризации остеокластов. J Clin Invest. 2010; 120: 1981–1993. DOI: 10,1172 / JCI39650; 10.1172 / JCI39650. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 80. Calle Y, Jones GE, Jagger C, Fuller K, Blundell MP, Chow J, et al. Дефицит WASp у мышей приводит к неспособности формировать зоны уплотнения остеокластов и дефектам резорбции кости.Кровь. 2004. 103: 3552–3561. DOI: 10.1182 / кровь-2003-04-1259. [PubMed] [CrossRef] [Google Scholar] 81. Chellaiah MA, Kuppuswamy D, Lasky L, Linder S. Фосфорилирование сигнального комплекса, связанного с белком синдрома Вискотта-Олдрича, имеет решающее значение для резорбции костной ткани остеокластами. J Biol Chem. 2007. 282: 10104–10116. DOI: 10.1074 / jbc.M608957200. [PubMed] [CrossRef] [Google Scholar] 82. Ма Т, Саманна V, Челлайя М.А. Резкое ингибирование образования герметизирующего кольца остеокластов и резорбции кости in vitro с помощью WASP-пептида, содержащего аминокислоту pTyr 294 .Сигнал J Mol. 2008; 3: 4. DOI: 10.1186 / 1750-2187-3-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 83. Чоу ХК, Антон И.М., Холт М.Р., Курсио С., Ланзардо С., Уорт А. и др. WIP регулирует стабильность и локализацию WASP в подосомах в мигрирующих дендритных клетках. Curr Biol. 2006; 16: 2337–2344. DOI: 10.1016 / j.cub.2006.10.037. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 84. Chabadel A, Banon-Rodriguez I, Cluet D, Rudkin BB, Wehrle-Haller B, Genot E, et al. Интегрин CD44 и бета3 организуют два функционально различных домена на основе актина в остеокластах.Mol Biol Cell. 2007. 18: 4899–4910. DOI: 10.1091 / mbc.E07-04-0378. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 85. Szczepanowska J. Участие пути Rac / Cdc42 / PAK в перестройках цитоскелета. Acta Biochim Pol. 2009. 56: 225–234. [PubMed] [Google Scholar] 86. Уэбб Б.А., Евс Р., Мак А.С. Кортактин регулирует образование подосом: роли доменов взаимодействия с белками. Exp Cell Res. 2006; 312: 760–769. DOI: 10.1016 / j.yexcr.2005.11.032. [PubMed] [CrossRef] [Google Scholar] 87. Люксенбург К., Парсонс Дж. Т., Аддади Л., Гейгер Б.Участие пути src-cortactin в формировании и обороте подосом во время поляризации культивируемых остеокластов. J Cell Sci. 2006; 119: 4878–4888. DOI: 10.1242 / jcs.03271. [PubMed] [CrossRef] [Google Scholar] 88. Уэбб Б.А., Чжоу С., Ив Р., Шен Л., Цзя Л., Мак А.С. Фосфорилирование кортактина р21-активированной киназой. Arch Biochem Biophys. 2006; 456: 183–193. DOI: 10.1016 / j.abb.2006.06.011. [PubMed] [CrossRef] [Google Scholar] 89. Сарас Дж., Воллберг П., Аспенстром П. Wrch2 представляет собой GTPase-дефицитный Cdc42-подобный белок с необычными характеристиками связывания и клеточными эффектами.Exp Cell Res. 2004. 299: 356–369. DOI: 10.1016 / j.yexcr.2004.05.029. [PubMed] [CrossRef] [Google Scholar] 90. Ory S, Brazier H, Blangy A. Идентификация сигнала локализации двусторонней фокальной адгезии в RhoU / Wrch-1, GTPase семейства rho, которая регулирует клеточную адгезию и миграцию. Biol Cell. 2007; 99: 701–716. DOI: 10.1042 / BC20070058. [PubMed] [CrossRef] [Google Scholar] 91. Брэди, округ Колумбия, Алан Дж. К., Мэдиган Дж. П., Фаннинг А.С., Кокс А.Д. Трансформирующая GTPase wrch-1 семейства rho разрушает плотные соединения эпителиальных клеток и эпителиальный морфогенез.Mol Cell Biol. 2009; 29: 1035–1049. DOI: 10.1128 / MCB.00336-08. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 92. Алан Дж. К., Берзат А. С., Дьюар Б. Дж., Грейвс Л. М., Кокс А. Д.. Регулирование малой GTPase wrch-1 / RhoU семейства rho с помощью C-концевого фосфорилирования тирозина требует src. Mol Cell Biol. 2010. 30: 4324–4338. DOI: 10.1128 / MCB.01646-09. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 93. Brazier H, Pawlak G, Vives V, Blangy A. rho GTPase Wrch2 регулирует адгезию и миграцию предшественников остеокластов.Int J Biochem Cell Biol. 2009; 41: 1391–1401. DOI: 10.1016 / j.biocel.2008.12.007. [PubMed] [CrossRef] [Google Scholar] 94. Сало Дж., Метсикко К., Палокангас Х., Лехенкари П., Ваананен Х. К.. Остеокласты, резорбирующие кости, обнаруживают динамическое разделение базальной плазматической мембраны на два разных домена. J Cell Sci. 1996; 109: 301–307. [PubMed] [Google Scholar] 95. Чжао Х., Эттала О, Ваананен Х. Пути внутриклеточного транспорта через мембрану в резорбирующих костную ткань остеокластах выявлены с помощью клонирования и исследований субклеточной локализации малых GTP-связывающих белков кролика.Biochem Biophys Res Commun. 2002; 293: 1060–1065. DOI: 10.1016 / S0006-291X (02) 00326-1. [PubMed] [CrossRef] [Google Scholar] 96. Блэр Х.С., Тейтельбаум С.Л., Гизелли Р., Глюк С. Остеокластическая резорбция кости с помощью поляризованного вакуолярного протонного насоса. Наука. 1989; 245: 855–857. [PubMed] [Google Scholar] 97. Тоемура Т., Мурата Ю., Ямамото А., Ока Т., Сан-Вада Г.Х., Вада Ю. и др. От лизосом к плазматической мембране: локализация вакуолярной H + -АТФазы с изоформой a3 во время дифференцировки остеокластов.J Biol Chem. 2003; 278: 22023–22030. DOI: 10.1074 / jbc.M302436200. [PubMed] [CrossRef] [Google Scholar] 98. Корнак У., Каспер Д., Босл М.Р., Кайзер Э., Швайцер М., Шульц А. и др. Потеря хлоридного канала ClC-7 приводит к остеопетрозу у мышей и человека. Клетка. 2001; 104: 205–215. [PubMed] [Google Scholar] 99. Чжао Х., Ваананен Х. Фармакологическая секвестрация внутриклеточного холестерина в поздних эндосомах нарушает образование неровных границ в остеокластах. J Bone Miner Res. 2006; 21: 456–465. DOI: 10.1359 / JBMR.051204. [PubMed] [CrossRef] [Google Scholar] 100. Zaidi M, Troen B, Moonga BS, Abe E. Катепсин K, остеокластическая резорбция и терапия остеопороза. J Bone Miner Res. 2001; 16: 1747–1749. DOI: 10.1359 / jbmr.2001.16.10.1747. [PubMed] [CrossRef] [Google Scholar] 101. Everts V, Delaisse JM, Korper W., Niehof A, Vaes G, Beertsen W. Распад коллагена в резорбирующем кость компартменте под остеокластом включает как цистеин-протеиназы, так и матриксные металлопротеиназы. J. Cell Physiol. 1992; 150: 221–231.DOI: 10.1002 / jcp.1041500202. [PubMed] [CrossRef] [Google Scholar] 102. Mulari MT, Zhao H, Lakkakorpi PT, Vaananen HK. Рифленая граница остеокластов имеет отдельные субдомены для секреции и захвата деградированного матрикса. Движение. 2003. 4: 113–125. [PubMed] [Google Scholar] 103. Schwartz SL, Cao C, Пилипенко O, Rak A, Wandinger-Ness A. Rab GTPases с первого взгляда. J Cell Sci. 2007; 120: 3905–3910. DOI: 10.1242 / jcs.015909. [PubMed] [CrossRef] [Google Scholar] 104. Закки П., Стенмарк Х., Партон Р.Г., Ориоли Д., Лим Ф., Гинер А. и др.Rab17 регулирует перенос через мембрану посредством апикальных рециклирующих эндосом в поляризованных эпителиальных клетках. J Cell Biol. 1998; 140: 1039–1053. [Бесплатная статья PMC] [PubMed] [Google Scholar] 105. Кария Й., Хонма М., Ханамура А., Аоки С., Ниномия Т., Накамичи Ю. и др. Rab27a и Rab27b участвуют в зависимом от стимуляции высвобождении RANKL из секреторных лизосом в остеобластных клетках. J Bone Miner Res. DOI 2010: 10.1002 / jbmr.268. [PubMed] [CrossRef] [Google Scholar] 106. Ha BG, Hong JM, Park JY, Ha MH, Kim TH, Cho JY и др.Протеомный профиль белков мембраны остеокластов: идентификация домена обменника Na + / H + , содержащего 2, и его роль в слиянии остеокластов. Протеомика. 2008; 8: 2625–2639. DOI: 10.1002 / pmic.200701192. [PubMed] [CrossRef] [Google Scholar] 107. Павлос Нью-Джерси, Сюй Дж., Ридель Д., Йео Дж. С., Тейтельбаум С. Л., Пападимитриу Дж. М. и др. Rab3D регулирует новый путь везикулярного транспорта, который необходим для резорбции остеокластической кости. Mol Cell Biol. 2005; 25: 5253–5269. DOI: 10.1128 / MCB.25.12.5253-69.2005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 108. Тейлор А., Роджерс М.Дж., Тош Д., Коксон Ф.П. Новый метод эффективного получения трансфицированных остеокластов человека. Calcif Tissue Int. 2007. 80: 132–136. DOI: 10.1007 / s00223-006-0245-6. [PubMed] [CrossRef] [Google Scholar] 109. Feng Y, Press B, Wandinger-Ness A. Rab 7: важный регулятор позднего мембранного движения эндоцитов. J Cell Biol. 1995; 131: 1435–1452. [Бесплатная статья PMC] [PubMed] [Google Scholar] 111. Jordens I, Fernandez-Borja M, Marsman M, Dusseljee S, Janssen L, Calafat J, et al.Эффекторный белок RILP Rab7 контролирует лизосомный транспорт, индуцируя рекрутирование динеин-динактиновых моторов. Curr Biol. 2001; 11: 1680–1685. [PubMed] [Google Scholar] 112. Чжао Х., Лайтала-Лейнонен Т., Парикка В., Ваананен Х. К.. Подавление малой GTPase Rab7 нарушает поляризацию остеокластов и резорбцию кости. J Biol Chem. 2001; 276: 39295–39302. DOI: 10.1074 / jbc.M010999200. [PubMed] [CrossRef] [Google Scholar] 113. Sun Y, Buki KG, Ettala O, Vaaraniemi JP, Vaananen HK. Возможная роль прямого взаимодействия Rac1-Rab7 в формировании взъерошенных границ остеокластов.J Biol Chem. 2005; 280: 32356–32361. DOI: 10.1074 / jbc.M414213200. [PubMed] [CrossRef] [Google Scholar] 114. Юм А.Н., Ушаков Д.С., Тарафдер А.К., Ференци М.А., Seabra MC. Rab27a и MyoVa являются первичными интеракторами mlph, регулирующими транспорт меланосом в меланоцитах. J Cell Sci. 2007; 120: 3111–3122. DOI: 10.1242 / jcs.010207. [PubMed] [CrossRef] [Google Scholar] 115. Frasa MA, Maximiano FC, Smolarczyk K, Francis RE, Betson ME, Lozano E, et al. Armus — это эффектор Rac1, который инактивирует Rab7 и регулирует деградацию E-кадгерина.Curr Biol. 2010. 20: 198–208. DOI: 10.1016 / j.cub.2009.12.053. [PubMed] [CrossRef] [Google Scholar] 116. Накамура И., Такахаши Н., Удагава Н., Морияма Ю., Курокава Т., Джими Е. и др. Отсутствие ассоциации вакуолярной протонной АТФазы с цитоскелетом в остеокластах остеосклеротических (oc / oc) мышей. FEBS Lett. 1997; 401: 207–212. [PubMed] [Google Scholar] 117. Zuo J, Jiang J, Chen SH, Vergara S, Gong Y, Xue J и др. Актин-связывающая активность субъединицы B вакуолярной H + -АТФазы участвует в ее нацеливании на взъерошенные мембраны остеокластов.J Bone Miner Res. 2006; 21: 714–721. DOI: 10.1359 / jbmr.060201. [PubMed] [CrossRef] [Google Scholar] 118. Ван Везенбек Л., Одгрен П.Р., Коксон Ф.П., Фраттини А., Моэнс П., Перду Б. и др. Участие PLEKHM1 в остеокластическом везикулярном транспорте и остеопетрозе резцов у крыс и людей. J Clin Invest. 2007; 117: 919–930. DOI: 10,1172 / JCI30328. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 119. Табата К., Мацунага К., Сакане А., Сасаки Т., Нода Т., Йошимори Т. Рубикон и PLEKHM1 негативно регулируют эндоцитозный / аутофагический путь через новый Rab7-связывающий домен.Mol Biol Cell. 2010. 21: 4162–4172. DOI: 10.1091 / mbc.E10-06-0495. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 120. Дель Фатторе А., Форнари Р., Ван Везенбек Л., де Фрейтас Ф., Тиммерманс Дж. П., Перуцци Б. и др. Новая гетерозиготная мутация (R714C) гена остеопетроза, домен гомолога плекстрина, содержащий член 1 семейства M (с доменом run) (PLEKHM1), нарушает везикулярное закисление и увеличивает секрецию TRACP в остеокластах. J Bone Miner Res. 2008. 23: 380–391. DOI: 10.1359 / jbmr.071107.[PubMed] [CrossRef] [Google Scholar] 121. Ягер С., Буччи С., Танида И., Уэно Т., Коминами Е., Сафтиг П. и др. Роль Rab7 в созревании поздних аутофагических вакуолей. J Cell Sci. 2004. 117: 4837–4848. DOI: 10.1242 / jcs.01370. [PubMed] [CrossRef] [Google Scholar] 122. Панкив С., Алему Е.А., Бреч А., Бруун Дж. А., Ламарк Т., Оверватн А. и др. FYCO1 является эффектором Rab7, который связывается с LC3 и PI3P, опосредуя микротрубочки и направленный на конец транспорт везикул. J Cell Biol. 2010. 188: 253–269. DOI: 10.1083 / jcb.2005.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 123. Bjorkoy G, Lamark T, Brech A, Outzen H, Perander M, Overvatn A и др. p62 / SQSTM1 образует белковые агрегаты, разлагаемые аутофагией, и оказывает защитное действие на индуцированную хантингтином гибель клеток. J Cell Biol. 2005; 171: 603–614. DOI: 10.1083 / jcb.200507002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 124. Нода Т., Фудзита Н., Йошимори Т. Поздние стадии аутофагии: как начинается конец? Смерть клетки отличается. 2009; 16: 984–990. DOI: 10.1038 / cdd.2009.54. [PubMed] [CrossRef] [Google Scholar] 125. Санджуан М.А., Диллон С.П., Тейт С.В., Мошиах С., Дорси Ф., Коннелл С. и др. Передача сигналов Toll-подобного рецептора в макрофагах связывает путь аутофагии с фагоцитозом. Природа. 2007; 450: 1253–1257. DOI: 10,1038 / природа06421. [PubMed] [CrossRef] [Google Scholar] 126. Лледо П.М., Йоханнес Л., Вернье П., Зорек Р., Дарчен Ф., Винсент Дж. Д. и др. Белки Rab3: ключевые игроки в контроле экзоцитоза. Trends Neurosci. 1994; 17: 426–432. [PubMed] [Google Scholar] 127.Миллар А.Л., Павиос, штат Нью-Джерси, Сюй Дж., Чжэн М.Х. Rab3D: регулятор экзоцитоза в ненейрональных клетках. Histol Histopathol. 2002; 17: 929–936. [PubMed] [Google Scholar] 128. Павлос Нью-Джерси, Сюй Дж., Фенг Х., Нг П, Ченг Т., Энг Э и др. Rab3D направляет транспорт органелл путем привлечения цитоплазматического моторного белка динеина tctex-1 к секреторным мембранам остеокластов. Кость. 2009; 44: 160. DOI: 10.1016 / j.bone.2009.01.354. [CrossRef] [Google Scholar] 129. Стенбек Г., Хортон М.А. Новое специализированное взаимодействие между клетками и матрицей при активном резорбировании остеокластов.J Cell Sci. 2000; 113: 1577–1587. [PubMed] [Google Scholar] 130. Сало Дж., Лехенкари П., Мулари М., Метсикко К., Ваананен Х. К.. Удаление продуктов резорбции костной ткани остеокластов путем трансцитоза. Наука. 1997. 276: 270–273. [PubMed] [Google Scholar] 131. Несбитт С.А., Хортон М.А. Транспортировка матричных коллагенов через резорбирующие костную ткань остеокласты. Наука. 1997. 276: 266–269. [PubMed] [Google Scholar] 132. Vaaraniemi J, Halleen JM, Kaarlonen K, Ylipahkala H, Alatalo SL, Andersson G и др. Внутриклеточный механизм деградации матрикса в остеокластах, резорбирующих кость.J Bone Miner Res. 2004; 19: 1432–1440. DOI: 10.1359 / JBMR.040603. [PubMed] [CrossRef] [Google Scholar] 133. Стенбек Г., Хортон М.А. Эндоцитарный перенос активно резорбирующихся остеокластов. J Cell Sci. 2004. 117: 827–836. DOI: 10.1242 / jcs.00935. [PubMed] [CrossRef] [Google Scholar] 134. Мулари М.Т., Нарс М., Лайтала-Лейнонен Т., Кайсто Т., Метсикко К., Сан Й. и др. Рекомбинантные белки VSV G обнаруживают новый рафт-зависимый эндоцитарный путь резорбции остеокластов. Exp Cell Res. 2008; 314: 1641–1651. DOI: 10.1016 / j.yexcr.2008.02.011. [PubMed] [CrossRef] [Google Scholar] 135. Hunziker W, Peters PJ. Rab17 локализуется в рециркулирующих эндосомах и регулирует опосредованный рецепторами трансцитоз в эпителиальных клетках. J Biol Chem. 1998; 273: 15734–15741. [PubMed] [Google Scholar] 136. Су Т, Брайант Д.М., Лутон Ф., Вержес М., Ульрих С.М., Хансен К.С. и др. Каскад киназ, ведущий к Rab11-FIP5, контролирует трансцитоз полимерного рецептора иммуноглобулина. Nat Cell Biol. 2010; 12: 1143–1153. DOI: 10,1038 / NCB2118. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 137.Бенфорд Х.Л., Макгоуэн Н.В., Хелфрих М.Х., Наттолл М.Э., Роджерс М.Дж. Визуализация бисфосфонат-индуцированной активности каспазы-3 в апоптотических остеокластах in vitro. Кость. 2001. 28: 465–473. [PubMed] [Google Scholar] 140. Брэдли Е.В., Руан М.М., Врабл А, Оурслер М.Дж. Перекрестное взаимодействие между Ras / Raf и PI3K в стимулировании M-CSF-индуцированной MEK / ERK-опосредованной выживаемости остеокластов. J Cell Biochem. 2008; 104: 1439–1451. DOI: 10.1002 / jcb.21719. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 141. Миядзаки Т., Катагири Х., Канеги Й., Такаянаги Х., Савада Й., Ямамото А. и др.Взаимная роль путей ERK и NFkappaB в выживании и активации остеокластов. J Cell Biol. 2000. 148: 333–342. [Бесплатная статья PMC] [PubMed] [Google Scholar] 142. Брэдли Е.В., Руан М.М., Оурслер М.Дж. PAK1 представляет собой новую MEK-независимую мишень raf, контролирующую экспрессию сурвивина IAP в M-CSF-опосредованном выживании остеокластов. J. Cell Physiol. 2008. 217: 752–758. DOI: 10.1002 / jcp.21550. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 143. Schindeler A, Little DG. Недавние исследования развития, гомеостаза и восстановления костей при нейрофиброматозе 1 типа (NF1) Кость.2008. 42: 616–622. DOI: 10.1016 / j.bone.2007.11.006. [PubMed] [CrossRef] [Google Scholar] 144. Хеерва Э., Аланн М.Х., Пелтонен С., Куорилехто Т., Хентунен Т., Ваананен К. и др. Остеокласты при нейрофиброматозе 1 типа демонстрируют повышенную способность к резорбции, аберрантную морфологию и устойчивость к сывороточной депривации. Кость. 2010; 47: 583–590. DOI: 10.1016 / j.bone.2010.06.001. [PubMed] [CrossRef] [Google Scholar] 145. Паско Д., Оурслер М.Дж. Сигнальный путь src регулирует секрецию лизосомальных ферментов остеокластов и быстро модулируется эстрогеном.J Bone Miner Res. 2001; 16: 1028–1036. DOI: 10.1359 / jbmr.2001.16.6.1028. [PubMed] [CrossRef] [Google Scholar] 146. Ян Ф.К., Чен С., Роблинг А.Г., Ю Х, Небесио Т.Д., Ян Дж. И др. Гиперактивация p21ras и PI3K взаимодействует с изменением функций остеокластов, связанных с нейрофиброматозом мыши и человека 1-го типа. J Clin Invest. 2006; 116: 2880–2891. DOI: 10.1172 / JCI29092. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 147. Ян Дж, Чен С., Чжан И, Ли Х, Ли И, Ву Х и др. Rac1 опосредует усиление функции остеокластов, вызванное гаплонедостаточностью Nf1.Hum Mol Genet. 2008; 17: 936–948. DOI: 10,1093 / hmg / ddm366. [PubMed] [CrossRef] [Google Scholar]
Регулирование функции остеокластов и резорбции кости малыми GTPases
Small GTPases. 2011 май-июнь; 2 (3): 117–130.
Программа исследований опорно-двигательного аппарата; Институт медицинских наук; Университет Абердина; Абердин, Шотландия, Великобритания
Автор, ответственный за переписку.
Поступило 25 февраля 2011 г .; Пересмотрено 22 апреля 2011 г .; Принято 10 мая 2011 г.
Эта статья цитировалась в других статьях в PMC.
Abstract
Остеокласты — это многоядерные клетки, которые отвечают за резорбцию кости, и повышенная активность этих клеток связана с несколькими распространенными заболеваниями костей, включая постменопаузальный остеопороз. После адгезии к кости остеокласты становятся поляризованными и реорганизуют свой цитоскелет и мембрану, чтобы сформировать уникальные домены, включая зону уплотнения (SZ), которая представляет собой плотное кольцо из подосом, богатых F-актином, ограничивающих взъерошенную границу (RB), где протоны и протеазы секретируются для деминерализации и разрушения костного матрикса, соответственно.Эти процессы зависят от активности малых GTPases. Хорошо известно, что Rho GTPases контролируют организацию F-актина и адгезионных структур различных типов клеток, влияя впоследствии на их миграцию. В остеокластах RhoA, Rac, Cdc42, RhoU, а также Arf6 регулируют сборку подосом и их организацию в SZ. Напротив, образование RB вовлекает везикулярные пути трафика, которые регулируются семейством Rab GTPases, в частности лизосомным Rab7. Наконец, выживаемость остеокластов зависит от активности Ras GTPases.Правильная функция почти всех этих GTPases полностью зависит от посттрансляционного пренилирования, которое позволяет им локализоваться на конкретных мембранах-мишенях. Бисфосфонатные препараты, которые широко используются при лечении заболеваний костей, таких как остеопороз, действуют, предотвращая пренилирование малых GTPases, что приводит к потере SZ и RB и, следовательно, к ингибированию активности остеокластов, а также вызывает апоптоз остеокластов. В этом обзоре мы суммируем текущее понимание роли специфических пренилированных малых GTPases в поляризации, функции и выживании остеокластов.
Ключевые слова: остеокласт, кость, Rab, Rho, Rac, Ras, Arf, бисфосфонат, пренилирование
Введение
Остеокласты представляют собой большие многоядерные подвижные клетки, которые образуются путем слияния гематопоэтических клеток моноцита / происхождение макрофагов. 1 , 2 Это единственные клетки в организме, которые способны разрушать (резорбировать) внеклеточный костный матрикс, процесс, который необходим для морфогенеза кости во время развития, для постоянного восстановления микроповреждений в скелете и для адаптации кости к механической нагрузке. 3 , 4
Эти клетки представляют собой увлекательную модель поляризации клеток, потому что при активации для резорбции остеокласты реорганизуют свою мембрану в четыре отдельных и уникальных домена, а именно зону уплотнения (SZ), взъерошенную границу ( RB), базолатеральный домен (BD) и функциональный секреторный домен (FSD) (). SZ, где остеокласт плотно прикрепляется к костному матриксу, образован плотно упакованными специфическими, богатыми актином адгезионными структурами, называемыми подосомами.Они состоят из ядра плотно упакованных актиновых филаментов и белков, связанных с F-актином, таких как кортактин, WASp и Arp2 / 3, окруженных интегринами и белками, связанными с прикреплением, такими как винкулин и талин. 5 , 6 По сравнению с фокальными спайками эти структуры очень динамичны и имеют срок службы всего 2–12 мин. 7 , 8 Это плотное соединение остеокласта с внеклеточным матриксом эффективно изолирует компартмент под клеткой, где происходит деградация кости (лакуна резорбции). 9 Впоследствии поляризованные везикулярные пути трафика приводят к развитию мембраны, заключенной SZ, в сильно извилистую взъерошенную границу, где протоны и протеазы секретируются для деминерализации и деградации костного матрикса, соответственно. 10 — 12 Полученные продукты деградации затем подвергаются эндоцитозу в RB, транспортируются через остеокласт посредством трансцитоза и, наконец, высвобождаются на противоположной стороне клетки в FSD.
Изменения мембранных доменов во время активации остеокластов. Неполяризованные, неактивные остеокласты представляют собой диспергированные подосомы. Во время активации остеокластов эти подосомы сливаются в периферический пояс, а затем в отчетливое «актиновое кольцо», которое формирует зону уплотнения, в которой остеокласт плотно прилегает к поверхности кости. Вслед за этим перемещение поздних эндосом / лизосом к поверхности кости приводит к образованию взъерошенной границы, резорбтивной органеллы остеокласта.Наконец, мембранный домен, известный как функциональный секреторный домен, формируется в верхней части клетки, к которому нацелены трансцитотические пузырьки, сформированные на взъерошенной границе.
Малые GTPases суперсемейства Ras, включая подсемейства Ras, Rho, Arf, Ran и Rab, являются ключевыми регуляторами различных клеточных событий, включая деление клеток, транспорт пузырьков, сборку ядер и контроль цитоскелета. В этом обзоре будет освещена их роль в функции остеокластов, в частности, в регуляции подосом, везикулярном переносе и выживании клеток.
Фармакологические доказательства важности малых ГТФаз в функции остеокластов
В целом малые ГТФазы локализуются в определенных мембранных компартментах. Это свойство зависит от посттрансляционного пренилирования, которое включает присоединение гидрофобной изопреноидной липидной группы (либо 15-углеродный фарнезильный, либо 20-углеродный геранилгеранильный фрагмент) к консервативному остатку цистеина, содержащемуся в характерных мотивах пренилирования на С-конце самые маленькие GTPases.Эта модификация выполняется одним из трех ферментов протеин-пренилтрансферазы (фарнезилтрансфераза, геранилгеранилтрансфераза (GGTase) I или Rab GGTase), специфичность определяется мотивом пренилирования в белковом субстрате. 13 Большинство малых GTPases, включая подсемейство Rab и большую часть подсемейства Rho, модифицированы геранилгеранильными группами; ГТФазы, модифицированные фарнезилированием, включают большинство белков Ras и некоторые белки семейства Rho.
Фундаментальная важность малых GTPases в биологии остеокластов стала очевидной десять лет назад после нашего открытия, что азотсодержащие препараты бисфосфонатов (N-BP) ингибируют резорбцию костей, блокируя пренилирование белков. 14 , 15 Эти «блокбастеры» представляют собой негидролизуемые аналоги пирофосфата, которые быстро воздействуют на скелет и используются во всем мире в качестве передового средства лечения распространенных заболеваний, связанных с повышенной резорбцией кости, таких как постменопаузальный остеопороз. , связанное с раком заболевание костей и болезнь Педжета. 16 Препараты N-BP, такие как ризедронат, алендронат и золедронат, являются очень эффективными ингибиторами резорбции кости, поскольку они селективно интернализуются в остеокласты во время резорбции покрытой лекарством кости. 17 , 18 После интернализации N-BP нарушают поляризацию остеокластов (предотвращая образование актинового кольца, нарушая нормальный везикулярный транспорт и образование RB), а также вызывают апоптоз остеокластов. 18 В настоящее время известно, что эти эффекты N-BP являются результатом нарушения пренилирования белков, поскольку эти препараты имитируют структуру изопреноидных липидов, таких как геранилдифосфат (GPP), и тем самым сильно ингибируют синтазу фарнезилдифосфата (FPP), a ключевой фермент мевалонатного пути биосинтеза изопреноидов и холестерина. 19 — 21 Точный механизм ингибирования FPP-синтазы был недавно выяснен из рентгеновской кристаллической структуры фермента и включает «медленно-плотное» связывание лекарства с одним из двух изопреноидных липидов. субстратные карманы, приводящие к конформационным изменениям фермента. 22 — 24 Некоторые N-BP также являются слабыми ингибиторами других ферментов мевалонатного пути, таких как геранилгеранилдифосфат (GGPP) синтаза, скваленсинтаза и изомераза IPP. 18
Ингибирование активности FPP-синтазы в остеокластах приводит к истощению FPP и GGPP, которые необходимы для пренилирования малых GTPases. В результате малые ГТФазы накапливаются в непренилированной форме и не могут локализоваться в компартментах мембраны (). 25 Этот эффект можно легко измерить в культивируемых клетках, отслеживая метаболическое включение [ 14 C] мевалоната в пренилированные белки (), 14 , 18 , 26 с помощью белкового гелевого блоттинга. анализ клеточных лизатов с использованием антитела, которое специфически гибридизуется с непренилированной формой малой ГТФазы Rap1A (), 27 или путем визуализации субклеточной локализации малых ГТФаз, таких как Rab6 (). 25
Бисфосфонатные препараты ингибируют пренилирование малых GTPases. (A) Ингибирование пренилирования белков азотсодержащими бисфосфонатами может быть продемонстрировано in vitro путем культивирования клеток с [ 14 C] мевалонатом, который включается в пренилированные белки, меченные 14 C. Пренилированные белки с радиоактивной меткой (21–26 кДа, область в рамке) могут быть затем обнаружены авторадиографией после электрофоретического разделения. Лечение бисфосфонатными препаратами алендронатом (ALN), ибандронатом (IBA), инкадронатом (INC) и ризедронатом (RIS) явно ингибирует пренилирование по сравнению с контрольными (Ctrl) клетками.Воспроизведено из Luckman et al. 14 с разрешения Американского общества исследований костей и минералов. (B) Ингибирование пренилирования белков бисфосфонатными препаратами приводит к накоплению непренилированной формы малых GTPases в остеокластах. Накопление непренилированного Rap1A (красный) может быть определено с помощью белкового гелевого блоттинга, например, после обработки культивированных клеток золедронатом ≥10 мкМ (изображение любезно предоставлено Gemma Shay). Непренилированная форма (красный цвет) имеет более высокую молекулярную массу, чем пренилированная форма (зеленый цвет) из-за отсутствия расщепления концевого трипептида.(C) Ингибирование пренилирования белков бисфосфонатными препаратами изменяет субклеточное распределение малых GTPases, таких как Rab6. Многоядерные остеокласты иммуноокрашивали на Rab6, который локализуется в перинуклеарных гольджи в необработанном остеокласте (слева), но имеет цитозольное распределение в остеокласте, обработанном в течение 48 часов бисфосфонат ризедронатом (справа).
Поскольку пренилированные малые GTPases действуют как молекулярные переключатели, их активность необходимо строго контролировать. Недавние исследования показывают, что некоторые непренилированные малые ГТФазы, такие как Rac, которые накапливаются в цитозоле после воздействия на клетки N-BP, в основном являются их активным GTP-связанным состоянием (предположительно из-за отсутствия взаимодействия с регуляторными белками GAP), вызывая несоответствующую активацию нижестоящие сигнальные киназы, такие как p38. 28 Ингибирование мевалонатного пути N-BP, следовательно, по-видимому, нарушает функцию остеокластов, вызывая потерю пренилированных белков (и потерю нисходящей передачи сигналов) и / или накопление непренилированных белков (и, следовательно, несоответствующую активацию нижестоящих сигнальных путей или секвестрацию). эффекторов). 18 Эти эффекты на передачу сигналов малой GTPase приводят к нарушению организации цитоскелета и везикулярному переносу в остеокластах, вызывая потерю SZ и RB и апоптозу остеокластов.В частности, геранилгеранилированные, а не фарнезилированные, малые ГТФазы необходимы для функции и выживания остеокластов, поскольку геранилгераниол (клеточно-проницаемая форма GGPP) преодолевает ингибирование образования остеокластов и резорбции кости с помощью N-BP. 15 , 29 Кроме того, небольшие GTPases, геранилгеранилированные GGTase I (такие как Rho, Rac и Cdc42), имеют решающее значение для функции остеокластов (см. Ниже), поскольку ингибитор GGTase I (GGTI-298) близко имитирует влияние N-BP на поляризацию и выживаемость остеокластов. 30 Мы также идентифицировали первые известные специфические ингибиторы Rab GGTase (RGGT), которые очень напоминают структуру N-BP, но содержат карбоксилатный фрагмент вместо одной из фосфонатных групп. 25 , 31 Эти фосфонокарбоксилатные (PC) соединения, по-видимому, ингибируют RGGT, предотвращая вторую стадию геранилгеранилирования Rab-белков, которые обычно дигеранилгеранилированы, возможно, путем связывания с сайтом узнавания GG-цистеина на RGGT, который может быть требуется для выравнивания негеранилгеранилированных Rab для второй стадии модификации липидов. 32 Эти агенты специфически нарушают пренилирование и локализацию Rab GTPases в остеокластах, а также ингибируют резорбцию кости, нарушая везикулярный транспорт. 25 , 31
Встречающаяся в природе линия мышей, известная как gunmetal , представляет собой интересную модель дефектного пренилирования Rab in vivo. Этот дефект характеризуется снижением активности RGGT на 75% из-за аутосомно-рецессивной мутации в гене, кодирующем α-цепь этого фермента. 33 Мы показали, что макрофаги и остеокласты этих мышей более чувствительны к действию ПК, тем самым подтверждая, что эти препараты действуют через ингибирование RGGT. 34 Более того, хотя мыши gunmetal не проявляют явного костного фенотипа, остеокласты, полученные in vitro от этих мышей, демонстрируют пониженную способность к резорбции, несмотря на способность реорганизовывать свой цитоскелет в кольца F-актина. 35 Этот фенотип близко имитирует эффекты фармакологического ингибирования RGGT на остеокласты 31 и подтверждает, что пренилирование Rab необходимо для активности остеокластов; однако идентичность недопренилированных GTPases Rab, которые вносят вклад в дефект резорбции, остается неясной.
Регуляция расположения цитоскелета и полярности остеокластов с помощью малых GTPases
Остеокласты обладают уникальной подосомной организацией, которая зависит от субстрата, к которому они прикрепляются. Адгезия к покровным стеклам вызывает образование кластеров подосом, которые впоследствии собираются в небольшие кольца подосом и, в конечном итоге, в пояс подосом по периферии клетки, в котором можно четко различить отдельные подосомы. 7 Напротив, в остеокластах, засеянных на костные или костеподобные минерализованные субстраты, подосомы становятся плотно упакованными в плотное кольцо F-актина, также называемое зоной уплотнения (SZ).Хотя отдельные подосомы не могут быть различимы в SZ с помощью классической флуоресцентной микроскопии, сканирующая электронная микроскопия с высоким разрешением в сочетании с флуоресцентной микроскопией продемонстрировала, что эта структура состоит из плотной сети ядер подосом, соединенных между собой радиальными актиновыми волокнами, которые называются облаком F-актина. . 6 , 9 Различие в организации подосом на этих субстратах предполагает, что, хотя адгезия способствует образованию подосом, другие внеклеточные сигналы регулируют организацию подосом.Прикрепление остеокластов к поверхности кости в основном зависит от интегринов, в частности, рецептора витронектина (α v β 3 ), одного из основных интегринов в остеокластах, 36 , 37 , который в большей степени присутствует на них. ячеек, чем любой другой тип ячеек. 38 , 39 Делеция субъединицы β3 у мышей оказывает драматическое влияние на распространение остеокластов и организацию цитоскелета, приводя к прогрессирующему остеопетрозу, что указывает на снижение активности остеокластов. 37 При связывании лиганда α v β 3 интегрины привлекают многочисленные белки, включая нерецепторные тирозинкиназы Pyk2, Src и Syk, а также содержащую палец RING убиквитинлигазу c-Cbl, 40 — 42 , которые передают сигналы для регулирования как сборки / разборки подосом, так и организации подосом. Остеокласты мышей с нокаутом src, pyk2 или syk неспособны формировать надлежащую зону уплотнения, демонстрируя, что все эти три тирозинкиназы играют важную роль в организации подосом в остеокластах. 42 — 44 Напротив, дефицит убиквитинлигазы c-Cbl не влияет на формирование зоны уплотнения, но миграция остеокластов нарушается как in vitro, так и in vivo, что позволяет предположить, что Cbl может участвовать в оборот подосомы. 41 , 45 Число подосом и их продолжительность жизни снижены в src — / — остеокластах, подтверждая, что Src также играет критическую роль в формировании и стабильности подосом. 46 Более того, скорость потока мономеров актина в подосомы мышей с дефицитом Src или Pyk2 снижается, указывая тем самым, что киназы Src и Pyk2 регулируют полимеризацию актина. 44 , 46
Учитывая их роль в регуляции цитоскелета, неудивительно, что GTPases семейства Rho оказываются необходимыми для образования и организации подосом в остеокластах и для поляризации этих клеток (). Семейство Rho GTPases состоит из 20 членов, и анализ профилей транскриптов выявил присутствие 18 Rho GTPases в остеокластах. 47 Однако до сих пор идентифицировано только четыре члена этого семейства, которые играют роль в регуляции организации цитоскелета и поляризации остеокластов: RhoA, Rac1, Cdc42 и RhoU. 48 Недавно другое семейство, ARF GTPases, которые, как известно, регулируют мембранный перенос и динамику актина, 49 было вовлечено в регуляцию цитоскелета остеокластов и формирование герметичной зоны. 50
Роль малых GTPases в сигнальных путях, регулирующих поляризацию остеокластов.При адгезии остеокластов к костному матриксу взаимодействие рецептора витронектина (α v β 3 ) и CD44 активирует несколько нижестоящих сигнальных путей, способствующих образованию зоны уплотнения и поляризации остеокластов. Эти пути включают множество малых GTPаз (синий), GAP (красный), GEF (розовый) и эффекторов GTPase (зеленый), а также могут быть активированы через другие рецепторы, такие как рецептор M-CSF и рецептор, связанный с G-белком GPR55. .
Rho
Rho была первой GTPase, изученной в остеокластах.Ингибирование RhoA, RhoB и RhoC с помощью экзофермента Clostridium botulinum C3 нарушило образование SZ, что привело к инактивации остеокластов. 51 Действительно, когда остеокласты культивируются на кости, экзофермент C3 вызывает распространение остеокластов и реорганизацию подосом из SZ в пояс на периферии клетки, предполагая, что активность RhoA необходима для образования SZ, но не для пояса актина. формирование. 52 В соответствии с этим мы недавно показали, что каннабиноидные агонисты рецептора GPR55, сопряженного с G-белком, стимулируют поляризацию остеокластов и резорбцию кости, которая связана с активацией RhoA, вероятно, через Gα13. 53 Более того, микроинъекция конститутивно активируемого RhoA в остеокласты, культивируемые на покровных стеклах, не вызывала образования зоны уплотнения, но вызывала нарушение пояса подосом и создание кластеров подосом, что позволяет предположить, что одной активации RhoA недостаточно для индукции SZ. Это требует дополнительных сигналов от костного матрикса или более сложной регуляции активности RhoA. 54 — 56 Действительно, несколько наблюдений подтверждают важность регуляции активности RhoA для индукции образования подосом и герметичной зоны.С одной стороны, активный RhoA индуцирует синтез фосфатидилинозитол-4-фосфат-5-киназой (PI4P-5-киназой) фосфатидилинозитол-4,5-бисфосфата (PI (4,5) P2), который впоследствии взаимодействует с WASp для способствовать формированию зоны уплотнения. 57 С другой стороны, в клетках, трансформированных Src, ERK5 ограничивает активацию Rho за счет усиления экспрессии RhoGAP7 и тем самым индуцирует образование подосом. 58 Более того, в остеокластах активированный Rho индуцирует HDAC6-опосредованное деацетилирование микротрубочек через его эффектор mDia2, что приводит к нарушению SZ. 56 Pyk2-дефицитные остеокласты, которые обладают снижением ацетилирования микротрубочек и образования SZ, обладают повышенной активностью Rho, что указывает на то, что Pyk2 подавляет активность Rho, что делает возможным стабилизацию микротрубочек и SZ. 44 Это демонстрирует, что жесткая регуляция активности RhoA важна для поляризации остеокластов.
Rac
Как и другие типы клеток, Rac1 опосредует образование ламеллиподий и распространение клеток в остеокластах, например, в ответ на M-CSF, который способствует распространению и подвижности остеокластов. 59 , 60 Его роль в организации подосом менее изучена. Ори и др. сообщили, что Rac имеет эффекты, противоположные Rho в многоядерных гигантских клетках, поскольку экспрессия конститутивно активного Rac способствует образованию ламеллиподий и распространению клеток, тогда как экспрессия доминантно-негативного Rac вызывает ретракцию клеток и дезорганизацию подосом. 54 , 60 Razzouk et al. предприняли альтернативный подход, включающий использование нейтрализующих антител к Rac1 и Rac2, чтобы продемонстрировать, что ингибирование активности Rac нарушает кольца актина, снижает резорбтивную активность и вызывает ретракцию остеокластов крыс. 61 Совсем недавно было показано, что остеокласты мышей rac2 — / — имеют дефекты в образовании SZ и M-CSF-индуцированной миграции in vitro, что приводит к снижению активности остеокластов как in vitro, так и in vivo, 62 , таким образом, подтверждая важную роль белков Rac в формировании подосом и зон уплотнения.
Относительно мало известно о регуляции Rac и Rho факторами обмена гуаниновых нуклеотидов (GEF) и белками, активирующими GTPase (GAP) в остеокластах.У млекопитающих существует более 70 RhoGEF, принадлежащих к двум разным группам: домен, содержащий Dbl-гомологичный домен, и белки CZH. 63 , 64 Анализ профилей транскриптов выявил экспрессию 42 RhoGEF в остеокластах, включая Vav3, FARP2, Dock5 и αPIX. 47 В настоящее время есть доказательства того, что некоторые из них, которые специфически регулируют активность Rac, играют роль в остеокластах.
Все три белка Vav экспрессируются остеокластами, но до сих пор было показано, что только Vav3 играет решающую роль в остеокластах, 65 опосредуя M-CSF-индуцированную перестройку цитоскелета и распространение остеокластов посредством ассоциации с Rac1. 60 Дефицит Vav3 у мышей приводит к остеопетрозу из-за дефекта резорбирующих костную ткань остеокластов, которые демонстрируют дефектные кольца актина и потерю поляризации. 65 FARP2 — это GEF семейства Dbl, специфичный для Rac1, который важен для организации цитоскелета. 66 Его экспрессия повышается во время остеокластогенеза и локализуется в актиновом ядре подосом. 67 Избыточная экспрессия доминантно-отрицательной формы FARP2, лишенной домена RacGEF, приводит к дезорганизации актинового пояса и отсутствию резорбции кости.
Dock5, Rac1 GEF семейства CZH, также недавно был вовлечен в образование SZ. 68 Экспрессия Dock5 повышается во время индуцированного RANKL остеокластогенеза. 47 Остеокласты мышей с нокаутом Dock5 обладают пониженной активностью Rac1 и нарушенным актиновым цитоскелетом, 68 дополнительно указывает на то, что регулируемые Rac1 пути играют важную роль в формировании SZ.
ARF6
Недавно было определено, что ARF6, который, как известно, регулирует локализацию Rac1 в плазматической мембране, 69 , 70 , необходим для образования зоны уплотнения. 50 , 69 Белки GIT (GIT1 и GIT2), которые представляют собой ARF-GAP, являются мишенями для киназы Src и локализуются в зоне уплотнения в поляризованных остеокластах. 50 , 71 GIT2, как было показано, подавляет активность ARF и, возможно, рекрутирование Rac1 в SZ, тем самым поддерживая полярность остеокластов. 50 Более того, остеокласты мышей с нокаутом GIT1 имеют нарушенный актиновый цитоскелет, подтверждая важность белков GIT в формировании SZ. 50 Белки GIT могут взаимодействовать с α и βPIX, факторами обмена для Rac1 и Cdc42, которые окружают актиновое ядро подосом в макрофагах, где они контролируют образование подосом 72 и координируют Rho и ARF-индуцированные перестройки цитоскелета и оборот фокальной адгезии. 73 , 74 PIX-белки также участвуют в образовании подосомоподобных столбцов F-актина в обработанных форболовым эфиром гладкомышечных клетках сосудов. 75 Однако было обнаружено, что αPIX не нужен для ARF6 / GIT2-опосредованной регуляции образования SZ, предполагая, что другой GEF участвует в координации сигнальных путей ARF6 и Rac1 / Cdc42 в остеокластах. 50 Путь ARF6 / Rac1 также может играть роль в лизосомном трафике (см. Раздел об эффекторах Rab7).
Cdc42
Cdc42 является важным регулятором полимеризации актина за счет его прямого связывания с белками синдрома Вискотта-Олдрича (WASp и N-WASP), что вызывает конформационные изменения, позволяющие связывать WASp с комплексом Arp2 / 3, тем самым способствует зарождению актина. 76 , 77 Микроинъекция активированного Cdc42 в остеокласты приводит к нарушению организации подосом, но после последующего лечения остеопонтином наблюдается усиление взаимодействия между WASp и Arp2 / 3, способствующего полимеризации актина, что позволяет предположить, что только Cdc42 не может активировать WASp в остеокластах. 57 Cdc42 может также регулировать полярность эпителиальных клеток, взаимодействуя с комплексом полярности Par, содержащим Par-3, Par-6 и атипичный PKC. 78 Экспрессия этих белков в остеокластах предполагает, что ассоциация Cdc42 и Par-6 может контролировать поляризацию остеокластов. 79 Хотя истощение Cdc42 в остеокластах не влияло на образование актиновых колец, когда поляризация клеток была нарушена сывороточным голоданием, восстановление актиновых колец задерживалось, что указывает на то, что Cdc42 играет важную, но несущественную роль в установлении поляризации остеокластов. .
Остеокласты мышей с нокаутом WASp обнаруживают снижение образования подосом и, следовательно, неспособны поляризоваться. 80 Более того, фосфорилирование WASp по Tyr-291 регулируется несколькими киназами, включая Src, который увеличивает Arp2 / 3-опосредованную полимеризацию актина и образование SZ. 81 , 82 WASp также взаимодействует с WIP (WASp-взаимодействующий белок), который индуцирует его локализацию в подосомах и защищает от кальпаин-зависимой деградации. 83 Дефицит WIP в остеокластах вызывает снижение уровня белка WASp и количества подосом; оба эти изменения могут быть восстановлены путем активации рецепторов CD44, подтверждая критическую роль WASp в поляризации остеокластов. 84
Другой группой эффекторных молекул семейства Rho, участвующих в образовании подосом, является семейство p21-активируемых киназ (PAK), которое содержит шесть членов, которые могут взаимодействовать как с Cdc42, так и с Rac, опосредуя перестройку цитоскелета. 85 Экспрессия доминантно-отрицательных мутантов PAK4 приводила к уменьшению размера и количества подосом в макрофагах. 72 Более того, экспрессия киназно-активного мутанта PAK1 индуцировала образование подосомоподобных столбцов F-актина в гладкомышечных клетках сосудов. 75 Кортактин, белок, связывающий F-актин, который взаимодействует с комплексом Arp2 / 3, чтобы стимулировать нуклеацию актина и регулировать образование подосом, 86 , 87 может фосфорилироваться PAK, тем самым влияя на его связывание с актином в клетки гладких мышц сосудов. 88 В остеокластах нейтрализующие антитела к PAK1 разрушают кольца актина, аналогично эффектам нейтрализующих антител против Rac, предполагая, что белки PAK способствуют не только образованию подосом, но также опосредуют образование Rac-индуцированной зоны уплотнения. 61
RhoU
Самым последним членом семейства Rho GTPase, участвующим в регуляции цитоскелета остеокластов, является RhoU, также известный как Wrch2 (Wnt1-Responsive Cdc42 Homolog 1). RhoU обладает значительной последовательностью и функциональным сходством с Cdc42, но в отличие от Cdc42, RhoU обладает чрезвычайно быстрой собственной активностью обмена гуаниновых нуклеотидов. 89 Более того, RhoU имеет предполагаемые мотивы, взаимодействующие с доменом Src гомологии 3 (Sh4) в его N-концевой области. В отличие от RhoA, Rac1 и Cdc42, экспрессия RhoU активируется во время дифференцировки остеокластов. 47 RhoU колокализуется с винкулином вокруг ядер актина в клетках, которые образуют подосомы, то есть в остеокластах и в клетках Hela, трансфицированных конститутивно активной формой Src. 90 Исследования на других типах клеток показали, что RhoU участвует в реорганизации цитоскелета и полярности клеток.В клетках MDCK взаимодействие RhoU и Par-6 регулирует сборку плотных контактов, необходимую для поляризации эпителиальных клеток и для цистогенеза. 91 Более того, фосфорилирование Src RhoU по Tyr-254 необходимо для цистогенеза в 3D-культуре клеток MDCK. 92 В клетках h2299 Src-опосредованное фосфорилирование RhoU вызывает его субклеточную релокализацию и подавляет его связывание с GTP, что приводит к снижению индуцированного RhoU аутофосфорилирования PAK и Pyk2. 92 Однако в остеокластах сверхэкспрессия дикого типа и конститутивно активного RhoU дестабилизирует подосомный пояс и увеличивает образование кластеров актина, но не влияет на формирование зоны запечатывания или резорбцию кости in vitro, 93 предполагая, что RhoU не является необходим для поляризации остеокластов, и его роль в остеокластах еще предстоит определить.
Регуляция везикулярного обмена в остеокластах с помощью малых GTPases
Процессы везикулярного транспорта необходимы в остеокластах для установления и поддержания поляризации клеток, высвобождения медиаторов костной резорбции в лакуну резорбции и для рециркуляции рецепторов, таких как интегрины, которые способствуют подвижности остеокластов и функция. Решающим мембранным доменом для резорбции кости, который формируется в результате везикулярного переноса и слияния, является RB, сильно извитая мембрана, которая формируется только после того, как остеокласты претерпели перестройку цитоскелета с образованием SZ. 10 — 12 В отличие от обычных плазматических мембран, RB экспрессирует ряд белков, связанных с эндосомным / лизосомным путем, таких как LAMP1, LAMP2, lgp110 и Rab7, определяя RB как лизосомальную мембрану; 12 , 94 маркеры ранних эндосом, таких как EEA1, не обнаруживаются в RB, но ограничены пузырьками в цитоплазме остеокластов. 95 Лизосомная природа RB не удивительна, поскольку деградация костного матрикса требует подкисления лакуны резорбции и высвобождения протеаз, которые разрушают органический матрикс.Это опосредуется как слиянием лизосом в RB, которое непосредственно высвобождает кислоту в лакуну резорбции, так и продолжающимся действием V-АТФазы, которая вставляется в RB в результате этого пути транспортировки. 96 V-АТФаза подкисляет поздние эндосомы и лизосомы, перекачивая протоны, генерируемые карбоангидразой II, в просвет везикулы. 97 Для поддержания электронейтральности везикул хлорид-ионы транспортируются в просвет с помощью H + / Cl — антипортера ClC-7, который высоко экспрессируется в остеокластах и также доставляется в RB посредством лизосомального транспорта. 98 Секреция протеаз, в частности катепсина K, посредством этого пути опосредует деградацию органического матрикса, который преимущественно представляет собой коллаген I типа. 99 — 101 Этот эндоцитарный путь, который отвечает за образование и поддержание RB, берет свое начало от базолатеральной мембраны, поскольку эндосомные маркеры, такие как HRP и нагруженный железом трансферрин, интернализуются в эндосомы из этого мембранного домена перед доставкой к периферийной области РБ, близкой к зоне уплотнения, но отличной от нее. 102 Хотя известно, что подосомы и инвадоподии опосредуют деградацию матрикса посредством высвобождения металлопротеаз, таких как MMP9, которые могут разрушать коллаген, именно катепсин K, доставляемый по эндоцитарному пути, имеет решающее значение для деградации кости, 102 и сама зона уплотнения не является основным местом резорбции кости.
Rab-белки, самое большое семейство малых GTPases, включающее более 70 членов у людей, 103 являются главными регуляторами везикулярного транспорта, играя роль в почковании пузырьков, транспорте и слиянии с мембранами назначения.Хотя многие Rab-белки, вероятно, играют сходные фундаментальные роли во всех типах клеток, экспрессия некоторых Rab ограничена специализированными типами клеток, где у них есть отличная функция; например, Rab17 специфически экспрессируется поляризованными эпителиальными клетками, где он обеспечивает апикальный поляризованный транспорт рециркулирующих эндосом. 104 Поскольку остеокласты обнаруживают уникальные пути доставки пузырьков для поддержания их поляризации, вполне вероятно, что некоторые Rab белки играют уникальные роли в функции остеокластов ().Одним сильным кандидатом, который, как известно, имеет ограниченное тканевое распределение, является Rab27a, поскольку он участвует в перемещении «секреторных лизосом» в другие типы клеток, такие как меланоциты и цитотоксические Т-клетки. Однако Rab27a не экспрессируется в остеокластах, несмотря на то, что он присутствует в клетках-предшественниках, тогда как пепельные мыши, дефицитные по Rab27a, не имеют явного костного фенотипа (Coxon FP и Seabra MC, неопубликованные данные). Интересно, однако, что изоформы Rab27a и b экспрессируются в костеобразующих остеобластах, где они играют роль в транспортировке везикул, экспрессирующих лиганд RANK, к плазматической мембране. 105 Следовательно, это, вероятно, влияет на активность остеокластов in vivo, поскольку лиганд RANK важен для дифференцировки и функции остеокластов.
Гипотетическая модель транспорта поздних эндосом / лизосом к взъерошенной границе в остеокластах. Rab7 локализован в поздних эндосомах / лизосомах и в периферической области взъерошенной границы (рядом с зоной уплотнения) в остеокластах и регулирует перемещение этих пузырьков к положительному концу микротрубочек.Другие медиаторы этого процесса остаются неизвестными, хотя Rab7-связывающий белок Plekhm1, который рекрутируется в поздние эндосомы / лизосомы с помощью Rab7, вероятно, участвует, поскольку остеокласты пациентов с остеопетрозом с мутациями в этом белке имеют дефектные взъерошенные границы. Одна возможность состоит в том, что Plekhm1 может соединять Rab7 и мотор кинезина, чтобы сделать возможным перемещение транспорта по микротрубочкам. Было показано, что Rab7 взаимодействует непосредственно с Rac1 вблизи зоны уплотнения, и было высказано предположение, что это взаимодействие может опосредовать перенос поздних эндосом / лизосом из сети микротрубочек в сеть кортикального актина до слияния с акцептором взъерошенной границы. мембрана и высвобождение катепсина К и кислоты на периферии RB в лакуну резорбции.Этот процесс также служит для вставки V-АТФазы, ClC-7 и Rab7 в взъерошенную пограничную мембрану. Сама V-АТФаза также может играть роль в этом процессе, поскольку было показано, что субъединицы помпы связываются с актиновыми микрофиламентами. Трансцитотические везикулы, которые участвуют в дальнейшей деградации и удалении фрагментов коллагена и перемещаются по микротрубочкам к функциональному секреторному домену (FSD), происходят из центральной области взъерошенной границы; пока что Rab GTPases, управляющие этим путем, остаются неизвестными.
Хотя исследования выявили экспрессию Rab1B, Rab3A / B / C / D, Rab4B, Rab5C, Rab7, Rab9, Rab10, Rab11B и Rab35 в остеокластах, 95 , 106 , 107 Мало что известно о функции большинства этих Rab в остеокластах. Rab9 колокализуется с Rab7 в поздних эндосомах, но не в RB при резорбции остеокластов. 95 , 106 Rab6 также высоко экспрессируется на уровне белка и обнаруживает перинуклеарную локализацию Гольджи, но его точная роль остается неопределенной. 32 , 108 Rab11 локализован в компартментах перинуклеарного рециклинга в остеокластах, где он может участвовать в обороте рыхлой пограничной мембраны, способствуя миграции и резорбции остеокластов. 95 Однако определяющая роль в везикулярном переносе в RB остеокластов до сих пор приписывалась только Rab7 и Rab3D.
Rab7
Rab7 обеспечивает гетеротипическое слияние между ранними эндосомами и поздними эндосомами, а также между поздними эндосомами и лизосомами. 109 , 110 Он также регулирует ретроградный транспорт поздних эндосом по микротрубочкам к центру организации микротрубочек посредством взаимодействий с эффекторным белком RILP и моторным белком динеином. 111 Учитывая важность этого пути переноса в формировании RB, Rab7 может, следовательно, участвовать в формировании RB, контролируя как слияние поздних / зрелых эндосом друг с другом, так и с RB, 12 и / или перемещение этих эндосом. везикулы на микротрубочках.В подтверждение этого Rab7 локализуется совместно с маркерами взъерошенной границы и поздних эндосом, но не с маркерами ранних эндосом или аппарата Гольджи в остеокластах. 12 , 112 Кроме того, исследования антисмыслового нокдауна подтвердили, что Rab7 необходим для образования и резорбции RB остеокластами, а также для доставки V-АТФазы в RB. 112 В то время как захват трансферрина ранними эндосомами является нормальным в Rab7-истощенных клетках, транспорт в RB нарушается, обеспечивая дополнительные доказательства того, что Rab7 регулирует последние стадии эндосомного пути от базолатеральной мембраны к RB. 112
Эффекторы Rab7
В настоящее время нет доказательств роли установленных эффекторов Rab7, таких как RILP, ORP1L, Rabring7, hVPS34 или FYCO-1, в функции остеокластов. Однако было показано, что Rab7 взаимодействует с небольшой GTPase Rac1 в остеокластах GTP-зависимым образом. 113 Как указано выше, Rac1 играет важную роль в формировании зоны уплотнения, и оба Rac1 и Rab7 совместно локализуются в зоне слияния RB, как раз внутри зоны уплотнения.Была выдвинута гипотеза, что эта ассоциация может быть необходима для слияния поздних эндосом в RB, контролируя переключение поздних эндосом с транспорта на основе микротрубочек на кортикальную актиновую сеть (). В этом отношении можно провести аналогию с транспортом меланосом в меланоцитах, который требует взаимодействия Rab27a с меланофилином для переключения с микротрубочек на транспорт на основе актина в периферических дендритах. 114 Однако недавно было показано, что Arf6-активированный Rac1 рекрутирует эффекторный Armus, член семейства TBC / RabGAP, что приводит к инактивации Rab7 и способствует деградации лизосом E-кадгерина, что предполагает еще одну возможную функцию для Rac1 / Rab7. сложный. 115 Более того, есть доказательства того, что V-АТФаза на поздних эндосомах / лизосомах может быть медиатором их связывания в кортикальной актиновой сети путем прямого связывания с F-актином. 116 , 117
Интересно, что белок Plekhm1 был идентифицирован как еще один предполагаемый эффектор Rab7 в остеокластах. 118 Мутации в Plekhm1 являются причиной остеопетроза при заболевании костей, при котором остеокласты дисфункциональны из-за дефектного образования RB, указывая тем самым, что Plekhm1 участвует в Rab7-зависимом эндосомном / лизосомном транспорте в RB. 118 Plekhm1 представляет собой большой цитозольный белок, который также обнаруживает некоторую локализацию на эндосомных / лизосомных пузырьках, куда он рекрутируется с помощью GTP-связанного Rab7. 118 Мутация, вызывающая остеопетроз, приводит к введению преждевременного стоп-кодона и, следовательно, укороченной формы Plekhm1, которая не может локализоваться в эндосомах / лизосомах, предполагая, что транспорт лизосом к RB в остеокластах зависит от ассоциации Plekhm1 с Rab7. Физическое взаимодействие между Plekhm1 и Rab7 недавно было подтверждено, хотя любопытно, что в этом исследовании авт. Предполагают, что Plekhm1 негативно регулирует эндоцитотический путь в клетках Hela. 119 Интересно, что в другом исследовании сообщалось о точечной мутации (R714C) в мутации Plekhm1, которая не влияет на локализацию Plekhm1, но вызывает генерализованную остеопению (низкую костную массу), что позволяет предположить, что это может быть мутация увеличения функции. 120 Взятые вместе, мы предлагаем модель (), в которой Plekhm1 может связывать Rab7 с основанным на микротрубочках транспортом поздних эндосом / лизосом к RB (например, посредством взаимодействия с кинезиновым двигателем), где взаимодействие между Rab7 и Rac1 может обеспечить переход от микротрубочек к кортикальной актиновой сети.
Rab7 также необходим для слияния лизосом с аутофагосомами с образованием аутолизосом и обеспечения деградации материала внутри аутофагосомы. 121 Кроме того, транспорт автолизосом по микротрубочкам стимулируется взаимодействием Rab7 с его эффектором FYCO1. 122 Интересно, что недавно было высказано предположение, что RB также проявляет характеристики мембран аутофагосом, такие как экспрессия белка Atg8 / LC3, который участвует в рекрутировании материала, который разрушается в результате аутофагии, а также в слиянии аутофагосом с лизосомами. . 123 , 124 Это поднимает интригующую возможность того, что слияние лизосом с RB может быть опосредовано через LC3 и / или что аутофагосомы транспортируются в RB в остеокластах. Недавняя статья указывает, что LC3 также играет роль в фагосомах в макрофагах, подтверждая идею о том, что локализация и функция LC3 не могут быть ограничены аутофагосомами. 125
Rab3D
Белки Rab3 участвуют в регулируемом экзоцитозе и поэтому в основном экспрессируются в клетках с высокими секреторными потребностями, особенно в нейронах и нейроэндокринных клетках.126,127 Изоформ Rab3 Rab3D высоко экспрессируется в остеокластах как на уровне мРНК, так и на уровне белка, тогда как экспрессия Rab3A, Rab3B и Rab3C намного ниже. 95 , 107 Кроме того, Rab3D важен для функции остеокластов, поскольку Rab3D-дефицитные мыши проявляют остеосклеротический фенотип (высокая костная масса) из-за дефектной резорбции остеокластами, которая может воспроизводиться сверхэкспрессией доминантно-отрицательных форма Rab3D в остеокластах in vitro. 107 Более того, остеокласты Rab3D-дефицитных мышей обнаруживают аномальный RB, что указывает на дефект везикулярного транспорта в этот домен.Однако Rab3D, по-видимому, не участвует в пути передачи лизосом, поскольку он локализуется в субпопуляции пост-TGN везикул в остеокластах. Rab3D может, следовательно, регулировать биогенез секреторного компартмента от TGN, хотя неясно, представляет ли этот компартмент полностью отличную везикулярную популяцию от Rab7-регулируемого эндоцитарного пути или эти везикулы сливаются с эндоцитарным путем, чтобы достичь RB. Rab3D может регулировать движение этих предполагаемых секреторных везикул путем рекрутирования моторного компонента динеина Tctex-1, с которым он связывается GTP-зависимым образом. 128
Трансцитоз
Высокая концентрация деградированных фрагментов коллагена, кальция и фосфата создается в результате разрушения костного матрикса, который необходимо удалить из лакуны резорбции, чтобы в конечном итоге они могли быть выведены с мочой. Однако SZ непроницаема для молекул размером более 10 кДа, что свидетельствует о существовании клеточного пути для очистки лакун этих продуктов. 128 Действительно, продукты деградации костей могут быть обнаружены внутри внутриклеточных везикул, в определенном домене базальной мембраны и во внеклеточном пространстве рядом с этой мембраной, 130 , 131 , что позволяет предположить, что эти продукты деградации передаются, хотя остеокласт путем трансцитоза.
Этот процесс может играть роль в уравновешивании мембранных доменов в остеокластах, а также в обеспечении дальнейшей деградации матричных фрагментов за счет действия устойчивой к тартрату кислой фосфатазы (TRAcP). 132 Центральная область домена базолатеральной мембраны, по которой транспортируются трансцитотические пузырьки, поэтому стала известна как функциональный секреторный домен (FSD) и имеет характеристики апикальной мембраны в эпителиальных клетках. 10 , 94 В соответствии с моделью трансцитоза центральная область RB проявляет обширную эндоцитарную активность, а белки оболочки везикул, такие как клатрин и AP-2, ограничены этим доменом вместе с динамином GTPase, 102 , 133 , что имеет решающее значение для отделения почкующихся пузырьков от мембраны.Точно так же, чтобы компенсировать потерю мембраны во время процесса поглощения матрикса, недавние данные свидетельствуют о том, что существует дополнительный «обратный» трансцитотический путь, который доставляет мембрану от FSD к RB. 134
Несмотря на выяснение этих уникальных путей переноса в остеокластах, Rab GTPases, которые их регулируют, остаются полностью неизвестными. В эпителиальных клетках Rab17 участвует в трансцитозе полимерного рецептора иммуноглобулина от базолатерального к апикальному домену, 135 , тогда как более недавнее сообщение указывает, что эффектор Rab11 Rab11-FIP5 также играет роль в этом процессе. 136 Однако эти данные трудно экстраполировать на остеокласты, учитывая уникальную природу мембран, между которыми происходит трансцитоз.
Малые ГТФазы и выживание остеокластов
Малые ГТФазы играют важную роль в выживании остеокластов, примером чего может служить способность бисфосфонатных препаратов вызывать апоптоз остеокластов в результате ингибирования пренилирования этих белков. 137 Ras GTPases являются ключевыми регуляторами выживаемости клеток и активируются многочисленными рецепторами клеточной поверхности для индукции ключевых путей передачи сигналов, включая ERK, MAP-киназу и PI3-киназу. 138 При активации Ras рекрутирует Raf-1, серин / треониновую киназу, которая впоследствии фосфорилирует и активирует MEK (MAPK / Erk киназа), которая, в свою очередь, фосфорилирует и активирует Erk1 и Erk2, которые необходимы для выживания клеток. 36 , 138 Другим эффектором Ras является фосфатидилинозитол-3-киназа (PI3K), которая активирует серин / треонинкиназу Akt / PKB, способствующую выживанию. 139 Сверхэкспрессия конститутивно активного Ras в остеокластах мышей способствует выживанию клеток, которое блокируется ингибированием PI3K или Raf-1, демонстрируя участие обоих Ras-индуцированных путей в выживании остеокластов. 140 Подтверждая участие Raf-1-зависимого пути, конститутивно активная форма MEK значительно увеличивает выживаемость остеокластов, не влияя на активность резорбции костей. 141
Недавно было описано, что PAK1 активирует экспрессию сурвивина ниже Raf-1 MEK-независимым образом, способствуя выживанию остеокластов. 142 Мутации в гене nf1, кодирующем нейрофибромин Ras GAP, приводят к нейрофиброматозу 1 типа, заболеванию, характеризующемуся опухолями нейрофибромы, дефектами пигментации кожи, костными пороками, дефектами обучения и предрасположенностью к избранным злокачественным новообразованиям. 143 У пациентов с Nf1 наблюдается потеря костной массы из-за дефектов как остеобластов, так и остеокластов. 143 Остеокласты этих пациентов выживают дольше в отсутствие сыворотки, чем контрольные остеокласты, подтверждая, что Ras является важным регулятором выживания остеокластов. 144
Хотя Ras играет роль в выживании остеокластов, его влияние на активность остеокластов остается неясным. Непрямое вмешательство в функцию большинства форм Ras путем ингибирования его пренилирования (с использованием специфического ингибитора фарнезилтрансферазы, FTI-277) не оказывало влияния на цитоскелет или активность остеокластов кролика. 30 Напротив, доминантная отрицательная экспрессия Ras в остеокластах птиц увеличивает секрецию лизосомальных ферментов, предполагая, что Ras может отрицательно регулировать активность остеокластов. 145 Более того, мышиные остеокласты от мышей Nf1 / — обладают повышенной активностью Ras, образованием и резорбцией актинового кольца. 146 , 147 Этот эффект опосредуется Rac, поскольку отсутствие Rac отменяет поляризацию и активность остеокластов, индуцированную Nf1. 147 Таким образом, точная роль Ras GTPases в остеокластах еще предстоит полностью выяснить.
Мало что известно о роли других малых GTPases в выживании остеокластов. Однако способность специфического ингибитора GGTase I, GGTI-298, сильно индуцировать апоптоз в остеокластах предполагает, что белки семейства Rho могут участвовать в этом процессе. 30 Действительно, сверхэкспрессия доминантно-отрицательной формы Rac1 в остеокластах мыши вызывает апоптоз и снижает резорбцию кости, в то время как конститутивно активный Rac1 увеличивает выживаемость клеток PI3K-зависимым образом, предполагая, что Rac действует не только на цитоскелет остеокластов, но также способствует выживанию остеокластов. 59
Заключение
В заключение, очевидно, что функция остеокластов и, следовательно, резорбция кости в значительной степени зависят от малых GTPases семейств Ras, Rho и Rab, которые все требуют посттрансляционного пренилирования для их правильной локализации и функция. Ингибирование пренилирования малых GTPases является основным механизмом действия препаратов, которые наиболее широко используются для ингибирования резорбции костей при обычных метаболических заболеваниях костей. Исследования роли специфических малых GTPases открыли дальнейшее понимание уникального расположения цитоскелета и путей переноса везикул в резорбирующихся остеокластах.Однако необходимы дальнейшие такие исследования, чтобы полностью понять, как эти пути регулируются в этом интересном типе клеток.
Благодарности
Текущее исследование авторов малых GTPases в остеокластах финансируется программным грантом 17285 и грантом проекта 19379 от Arthritis Research UK.
Аббревиатуры
| ARF | Фактор ADP-рибозилирования | ||||||||||
| BD | базолатеральный домен | ||||||||||
| CZH | CDM-зизимин 908 с гомологией | ||||||||||
| фарнезилдифосфат | |||||||||||
| FSD | Функциональный секреторный домен | ||||||||||
| GAP | GTPase Активирующий белок | ||||||||||
| GEF | GEF | Фактор обмена гуаниновых нуклеотидов Gran835 | геранилгеранилтрансфераза | ||||||||
| GPP | геранилдифосфат | ||||||||||
| HDAC | гистондеацетилаза | ||||||||||
| HRP | хрена | дипоксидаза | |||||||||
| MMP | матриксная металлопротеиназа | ||||||||||
| M-CSF | Фактор, стимулирующий колонии макрофагов | ||||||||||
| MEK | MAPK / Erk киназа | -бисфосфат-киназа | Nf1 | нейрофибромин | |||||||
| PAK | p21-активированная киназа | ||||||||||
| PI3K | фосфатидилинозитол-3-киназа | ||||||||||
| 3-киназа PI3- | |||||||||||
| -киназа PI3-фосфат-90-8-s-90-8-k-8 | PI (4,5) P2 | фосфатидилинозитол-4,5-бисфосфат | |||||||||
| PKC | протеинкиназа C | ||||||||||
| RANK | активатор рецептора NFkappaB | ruff | RGGT | Rab геранилгеранилтрансфераза | |||||||
| SZ | зона уплотнения | ||||||||||
| TGN | сеть транс-Гольджи | ||||||||||
| TRAcP | тартрат-устойчивая кислая фосфатаза | ||||||||||
| V-ATPase | вакуолярный тип H + 6-ATPase Белки синдрома Альдриха | ||||||||||
| WIP | WASp-взаимодействующий белок |
Ссылки
1.Бойл В.Дж., Саймонет В.С., Лейси Д.Л. Дифференциация и активация остеокластов. Природа. 2003. 423: 337–342. DOI: 10,1038 / природа01658. [PubMed] [CrossRef] [Google Scholar] 2. Negishi-Koga T, Takayanagi H. Передача сигналов Ca 2+ -NFATc1 является важной осью дифференцировки остеокластов. Immunol Rev.2009; 231: 241–256. DOI: 10.1111 / j.1600-065X.2009.00821.x. [PubMed] [CrossRef] [Google Scholar] 3. Teitelbaum SL. Резорбция кости остеокластами. Наука. 2000. 289: 1504–1508. [PubMed] [Google Scholar] 4. Vaananen HK, Zhao H, Mulari M, Halleen JM.Клеточная биология функции остеокластов. J Cell Sci. 2000. 113: 377–381. [PubMed] [Google Scholar] 5. Spinardi L, Marchisio PC. Подосомы как умные регуляторы клеточной адгезии. Eur J Cell Biol. 2006; 85: 191–194. DOI: 10.1016 / j.ejcb.2005.08.005. [PubMed] [CrossRef] [Google Scholar] 6. Jurdic P, Saltel F, Chabadel A, Destaing O. Подосома и зона уплотнения: Специфика модели остеокластов. Eur J Cell Biol. 2006. 85: 195–202. DOI: 10.1016 / j.ejcb.2005.09.008. [PubMed] [CrossRef] [Google Scholar] 7. Дестаинг О, Сальтел Ф, Джеминард Дж. К., Юрдич П., Бард Ф.Подосомы демонстрируют оборот актина и динамическую самоорганизацию в остеокластах, экспрессирующих актин-зеленый флуоресцентный белок. Mol Biol Cell. 2003. 14: 407–416. DOI: 10.1091 / mbc.E02-07-0389. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Block MR, Badowski C, Millon-Fremillon A, Bouvard D, Bouin AP, Faurobert E, et al. Спайки подосомного типа и фокальные спайки, такие похожие, но такие разные. Eur J Cell Biol. 2008. 87: 491–506. DOI: 10.1016 / j.ejcb.2008.02.012. [PubMed] [CrossRef] [Google Scholar] 9.Luxenburg C, Geblinger D, Klein E, Anderson K, Hanein D, Geiger B и др. Архитектура адгезивного аппарата культивируемых остеокластов: от образования подосом до сборки зоны уплотнения. PLoS One. 2007; 2: 179. DOI: 10.1371 / journal.pone.0000179. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 10. Mulari M, Vaaraniemi J, Vaananen HK. Внутриклеточный мембранный перенос остеокластов, резорбирующих костную ткань. Microsc Res Tech. 2003. 61: 496–503. DOI: 10.1002 / jemt.10371. [PubMed] [CrossRef] [Google Scholar] 11.Lakkakorpi PT, Vaananen HK. Цитоскелетные изменения остеокластов во время цикла резорбции. Microsc Res Tech. 1996; 33: 171–181. DOI: 2-W. [PubMed] [Google Scholar] 12. Палокангас Х, Мулари М, Ваананен Х. Эндоцитарный путь от базальной плазматической мембраны к взъерошенной пограничной мембране в остеокластах, резорбирующих кость. J Cell Sci. 1997; 110: 1767–1780. [PubMed] [Google Scholar] 13. Чжан Флорида, Кейси П.Дж. Пренилирование белков: молекулярные механизмы и функциональные последствия. Анну Рев Биохим. 1996. 65: 241–269.DOI: 10.1146 / annurev.bi.65.070196.001325. [PubMed] [CrossRef] [Google Scholar] 14. Luckman SP, Hughes DE, Coxon FP, Graham R, Russell G, Rogers MJ. Азотсодержащие бисфосфонаты ингибируют мевалонатный путь и предотвращают посттрансляционное пренилирование GTP-связывающих белков, включая ras. J Bone Miner Res. 1998. 13: 581–589. DOI: 10.1359 / jbmr.1998.13.4.581. [PubMed] [CrossRef] [Google Scholar] 15. Фишер Дж. Э., Роджерс М. Дж., Халаси Дж. М., Лакман С. П., Хьюз Д. Е., Масарачиа П. Дж. И др. Механизм действия алендроната: геранилгераниол, промежуточное звено мевалонатного пути, предотвращает ингибирование образования остеокластов, резорбции костей и активации киназ in vitro.Proc Natl Acad Sci USA. 1999. 96: 133–138. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Рассел Р.Г., Уоттс Н.Б., Эбетино Ф.Х., Роджерс М.Дж. Механизмы действия бисфосфонатов: сходства и различия и их потенциальное влияние на клиническую эффективность. Osteoporos Int. 2008; 19: 733–759. DOI: 10.1007 / s00198-007-0540-8. [PubMed] [CrossRef] [Google Scholar] 17. Coxon FP, Thompson K, Roelofs AJ, Ebetino FH, Rogers MJ. Визуализация связывания минералов и поглощения бисфосфоната остеокластами и нерезорбирующимися клетками.Кость. 2008; 42: 848–860. DOI: 10.1016 / j.bone.2007.12.225. [PubMed] [CrossRef] [Google Scholar] 18. Роджерс MJ, Crockett JC, Coxon FP, Monkkonen J. Биохимические и молекулярные механизмы действия бисфосфонатов. Кость. 2010 г. doi: 10.1016 / j.bone.2010.11.008. [PubMed] [CrossRef] [Google Scholar] 19. van Beek E, Pieterman E, Cohen L, Lowik C, Papapoulos S. Фарнезилпирофосфатсинтаза является молекулярной мишенью азотсодержащих бисфосфонатов. Biochem Biophys Res Commun. 1999; 264: 108–111. DOI: 10.1006 / bbrc.1999.1499. [PubMed] [CrossRef] [Google Scholar] 20. Данфорд Дж. Э., Томпсон К., Коксон Ф. П., Лакман С. П., Хан Ф. М., Поултер С. Д. и др. Отношения структура-активность для ингибирования фарнезилдифосфатсинтазы in vitro и ингибирования резорбции костей in vivo азотсодержащими бисфосфонатами. J Pharmacol Exp Ther. 2001; 296: 235–242. [PubMed] [Google Scholar] 21. Роджерс MJ. Новое понимание молекулярных механизмов действия бисфосфонатов. Curr Pharm Des. 2003; 9: 2643–2658. [PubMed] [Google Scholar] 22.Кавана К.Л., Гуо К., Данфорд Дж. Э., Ву Х, Кнапп С., Эбетино Ф. Х. и др. Молекулярный механизм действия азотсодержащих бисфосфонатов как противостеопорозных препаратов. Proc Natl Acad Sci USA. 2006; 103: 7829–7834. DOI: 10.1073 / pnas.0601643103. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Rondeau JM, Bitsch F, Bourgier E, Geiser M, Hemmig R, Kroemer M, et al. Структурная основа исключительной эффективности бисфосфонатных препаратов in vivo. ChemMedChem. 2006; 1: 267–273. DOI: 10.1002 / cmdc.200500059. [PubMed] [CrossRef] [Google Scholar] 24.Данфорд Дж. Э., Квази А. А., Роджерс М. Дж., Барнетт Б. Л., Эбетино Ф. Х., Рассел Р. Г. и др. Взаимосвязь между структурой и активностью азотсодержащих бисфосфонатов при клиническом использовании и других аналогов: Зависящее от времени ингибирование фарнезилпирофосфатсинтазы человека. J Med Chem. 2008. 51: 2187–2195. DOI: 10,1021 / jm7015733. [PubMed] [CrossRef] [Google Scholar] 25. Coxon FP, Ebetino FH, Mules EH, Seabra MC, McKenna CE, Rogers MJ. Фосфонокарбоксилатные ингибиторы геранилгеранилтрансферазы кролика нарушают пренилирование и мембранную локализацию кроличьих белков в остеокластах in vitro и in vivo.Кость. 2005. 37: 349–358. DOI: 10.1016 / j.bone.2005.04.021. [PubMed] [CrossRef] [Google Scholar] 26. Luckman SP, Coxon FP, Ebetino FH, Russell RG, Rogers MJ. Гетероциклсодержащие бисфосфонаты вызывают апоптоз и ингибируют резорбцию костей, предотвращая пренилирование белков: данные о взаимосвязи структура-активность в макрофагах J774. J Bone Miner Res. 1998. 13: 1668–1678. DOI: 10.1359 / jbmr.1998.13.11.1668. [PubMed] [CrossRef] [Google Scholar] 27. Рулофс А.Дж., Томпсон К., Гордон С., Роджерс М.Дж. Молекулярные механизмы действия бисфосфонатов: современное состояние.Clin Cancer Res. 2006; 12: 6222–6230. DOI: 10.1158 / 1078-0432.CCR-06-0843. [PubMed] [CrossRef] [Google Scholar] 28. Данфорд Дж. Э., Роджерс М. Дж., Эбетино Ф. Х., Фиппс Р. Дж., Коксон Ф. П.. Ингибирование пренилирования белков бисфосфонатами вызывает длительную активацию rac, Cdc42 и rho GTPases. J Bone Miner Res. 2006. 21: 684–694. DOI: 10.1359 / jbmr.060118. [PubMed] [CrossRef] [Google Scholar] 29. van beek E, Lowik C, van der Pluijm G, Papapoulos S. Роль геранилгеранилирования в резорбции кости и его подавление бисфосфонатами в костных эксплантатах плода in vitro: ключ к механизму действия азотсодержащих бисфосфонатов.J Bone Miner Res. 1999; 14: 722–729. DOI: 10.1359 / jbmr.1999.14.5.722. [PubMed] [CrossRef] [Google Scholar] 30. Coxon FP, Helfrich MH, Van’t Hof R, Sebti S, Ralston SH, Hamilton A и др. Геранилгеранилирование белков необходимо для образования, функционирования и выживания остеокластов: ингибирование бисфосфонатами и GGTI-298. J Bone Miner Res. 2000; 15: 1467–1476. DOI: 10.1359 / jbmr.2000.15.8.1467. [PubMed] [CrossRef] [Google Scholar] 31. Coxon FP, Helfrich MH, Larijani B., Muzylak M, Dunford JE, Marshall D, et al.Идентификация нового фосфонокарбоксилатного ингибитора геранилгеранилтрансферазы кролика, который специфически предотвращает пренилирование кролика в остеокластах и макрофагах. J Biol Chem. 2001; 276: 48213–48222. DOI: 10.1074 / jbc.M106473200. [PubMed] [CrossRef] [Google Scholar] 32. Барон Р.А., Таваре Р., Фигейредо А.С., Блажевска К.М., Кашемиров Б.А., МакКенна С.Е. и др. Фосфонокарбоксилаты ингибируют второе присоединение геранил-геранила рабгеранилгеранилтрансферазой. J Biol Chem. 2009. 284: 6861–6868. DOI: 10.1074 / JBC.M806952200. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 33. Деттер Дж. К., Чжан К., Мулс Е. Х., Новак Е. К., Мишра В. С., Ли В. и др. Альфа-мутация рабгеранилгеранилтрансферазы у мышей бронзового цвета снижает пренилирование кролика и синтез тромбоцитов. Proc Natl Acad Sci USA. 2000. 97: 4144–4149. DOI: 10.1073 / pnas.080517697. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 34. Coxon FP, Taylor A, Stewart CA, Baron R, Seabra MC, Ebetino FH и др. Мышь с бронзовым покрытием обнаружила, что геранилгеранилтрансфераза раба является основной молекулярной мишенью для фосфонокарбоксилатных аналогов бисфосфонатов.Кость. 2011 г. DOI: 10.1016 / j.bone.2011.03.686. [PubMed] [CrossRef] [Google Scholar] 35. Тейлор А., Мулз Э. Х., Сибра М. Х., Хелфрих М. Х., Роджерс М. Дж., Коксон Ф. П.. Нарушение пренилирования Rab GTPases у мышей Gunmetal вызывает дефекты функции костных клеток. Малые GTPases. 2011; 2: 131–142. DOI: 10.4161 / sgtp.2.3.16488. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 36. Накамура И., Пилкингтон М.Ф., Лаккакорпи П.Т., Липферт Л., Симс С.М., Диксон С.Дж. и др. Роль интегрина альфа (v) бета (3) в миграции остеокластов и формировании зоны уплотнения.J Cell Sci. 1999; 112: 3985–3993. [PubMed] [Google Scholar] 37. МакХью К.П., Ходивала-Дилке К., Чжэн М.Х., Намба Н., Лам Дж., Новак Д. и др. Мыши, лишенные интегринов бета3, остеосклеротичны из-за дисфункциональных остеокластов. J Clin Invest. 2000; 105: 433–440. DOI: 10.1172 / JCI8905. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 38. Клевер Дж., Доддс Р.А., Гоуэн М. Экспрессия субъединицы интегрина человеческими остеобластами и остеокластами in situ и в культуре. J Cell Sci. 1992. 103: 267–271. [PubMed] [Google Scholar] 39.Шинар Д.М., Шмидт А., Гальперин Д., Родан Г.А., Вайнреб М. Экспрессия субъединиц интегрина alphav и beta3 в остеокластах крысы in situ. J Bone Miner Res. 1993. 8: 403–414. DOI: 10.1002 / jbmr.5650080404. [PubMed] [CrossRef] [Google Scholar] 40. Duong LT, Lakkakorpi PT, Nakamura I, Machwate M, Nagy RM, Rodan GA. PYK2 в остеокластах представляет собой киназу адгезии, локализованную в зоне уплотнения, активируемую лигированием интегрина альфа (v) бета3 и фосфорилируемую киназой src. J Clin Invest. 1998. 102: 881–892. DOI: 10.1172 / JCI3212. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 41. Sanjay A, Houghton A, Neff L, DiDomenico E, Bardelay C, Antoine E, et al. Cbl связывается с Pyk2 и src для регулирования активности киназы src, передачи сигналов, опосредованной интегрином альфа (v) бета (3), клеточной адгезии и подвижности остеокластов. J Cell Biol. 2001; 152: 181–195. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Цзоу В., Китаура Х., Рив Дж., Лонг Ф., Тибулевич В.Л., Шаттил С.Дж. и др. Syk, c-src, интегрин alphavbeta3 и иммунорецепторы ITAM совместно регулируют резорбцию костной ткани остеокластами.J Cell Biol. 2007; 176: 877–888. DOI: 10.1083 / jcb.200611083. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 43. Миядзаки Т., Санджай А., Нефф Л., Танака С., Хорн В. К., Барон Р. Активность киназы Src необходима для функции остеокластов. J Biol Chem. 2004. 279: 17660–17666. DOI: 10.1074 / jbc.M311032200. [PubMed] [CrossRef] [Google Scholar] 44. Гил-Хенн Х., Дестейн О, Симс Н.А., Аоки К., Аллес Н., Нефф Л. и др. Дефектная микротрубочка-зависимая организация подосом в остеокластах приводит к увеличению плотности костной ткани у мышей Pyk2 (- / -).J Cell Biol. 2007; 178: 1053–1064. DOI: 10.1083 / jcb.200701148. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Чиусароли Р., Санджай А., Хенриксен К., Энгсиг М. Т., Хорн В. К., Гу Х и др. Делеция гена, кодирующего c-cbl, изменяет способность остеокластов к миграции, задерживая резорбцию и оссификацию хряща во время развития длинных костей. Dev Biol. 2003. 261: 537–547. [PubMed] [Google Scholar] 46. Дестаинг О, Санджай А., Итцштейн С., Хорн В. К., Тоомре Д., Де Камилли П. и др. Активность тирозинкиназы c-src регулирует динамику актина и организацию подосом в остеокластах.Mol Biol Cell. 2008; 19: 394–404. DOI: 10.1091 / mbc.E07-03-0227. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 47. Brazier H, Stephens S, Ory S., Fort P, Morrison N, Blangy A. Профиль экспрессии RhoGTPases и RhoGEFs во время остеокластогенеза, стимулированного RANKL: Идентификация основных генов в остеокластах. J Bone Miner Res. 2006; 21: 1387–1398. DOI: 10.1359 / jbmr.060613. [PubMed] [CrossRef] [Google Scholar] 48. Ory S, Brazier H, Pawlak G, Blangy A. Rho GTPases в остеокластах: оркестраторы расположения подосом.Eur J Cell Biol. 2008; 87: 469–477. DOI: 10.1016 / j.ejcb.2008.03.002. [PubMed] [CrossRef] [Google Scholar] 50. Heckel T, Czupalla C, Expirto Santo AI, Anitei M, Arantzazu Sanchez-Fernandez M, Mosch K и др. Src-зависимая репрессия ARF6 необходима для поддержания богатых подосомами герметизирующих зон в переваривающих кость остеокластах. Proc Natl Acad Sci USA. 2009; 106: 1451–1456. DOI: 10.1073 / pnas.0804464106. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Чжан Д., Удагава Н., Накамура И., Мураками Х., Сайто С., Ямасаки К. и др.Небольшой GTP-связывающий белок, rho p21, участвует в резорбции кости, регулируя организацию цитоскелета в остеокластах. J Cell Sci. 1995; 108: 2285–2292. [PubMed] [Google Scholar] 52. Saltel F, Destaing O, Bard F, Eichert D, Jurdic P. Апатит-опосредованная динамика актина в резорбирующихся остеокластах. Mol Biol Cell. 2004; 15: 5231–5241. DOI: 10.1091 / mbc.E04-06-0522. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 53. Уайт Л.С., Райберг Э., Симс Н.А., Ридж С.А., Маки К., Гресли П.Дж. и др. Предполагаемый каннабиноидный рецептор GPR55 влияет на функцию остеокластов in vitro и костную массу in vivo.Proc Natl Acad Sci USA. 2009. 106: 16511–16516. DOI: 10.1073 / pnas.03106. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 54. Ory S, Munari-Silem Y, Fort P, Jurdic P. Rho и rac обладают антагонистическими функциями в отношении распространения многоядерных клеток, полученных из макрофагов, и не требуются для образования актиновых волокон. J Cell Sci. 2000; 113: 1177–1188. [PubMed] [Google Scholar] 55. Chellaiah MA, Soga N, Swanson S, McAllister S, Alvarez U, Wang D, et al. Rho-A имеет решающее значение для организации подосомы остеокластов, подвижности и резорбции кости.J Biol Chem. 2000; 275: 11993–12002. [PubMed] [Google Scholar] 56. Дестаинг О, Салтел Ф, Гилкин Б., Хабадель А., Хочбин С., Ори С. и др. Новый путь rho-mDia2-HDAC6 контролирует формирование паттерна подосом посредством ацетилирования микротрубочек в остеокластах. J Cell Sci. 2005. 118: 2901–2911. DOI: 10.1242 / jcs.02425. [PubMed] [CrossRef] [Google Scholar] 57. Chellaiah MA. Регуляция образования актинового кольца rho-GTPases в остеокластах. J Biol Chem. 2005; 280: 32930–32943. DOI: 10.1074 / jbc.M500154200. [PubMed] [CrossRef] [Google Scholar] 58.Шрамп М., Инь О, Ким Т.Ю., Мартин Г.С. ERK5 способствует src-индуцированному образованию подосом, ограничивая активацию rho. J Cell Biol. 2008. 181: 1195–1210. DOI: 10.1083 / jcb.200801078. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Фукуда А., Хикита А., Вакеяма Х, Акияма Т., Ода Х, Накамура К. и др. Регулирование апоптоза и подвижности остеокластов с помощью малого GTPase-связывающего белка Rac1. J Bone Miner Res. 2005; 20: 2245–2253. DOI: 10.1359 / JBMR.050816. [PubMed] [CrossRef] [Google Scholar] 60. Сакаи Х, Чен Й, Итокава Т, Ю КП, Чжу М.Л., Инсогна К.Активированный c-fms рекрутирует vav и rac во время индуцированного CSF-1 ремоделирования цитоскелета и распространения в остеокластах. Кость. 2006; 39: 1290–1301. DOI: 10.1016 / j.bone.2006.06.012. [PubMed] [CrossRef] [Google Scholar] 61. Razzouk S, Lieberherr M, Cournot G. Rac-GTPase, цитоскелет остеокластов и резорбция кости. Eur J Cell Biol. 1999; 78: 249–255. [PubMed] [Google Scholar] 62. Итокова Т., Чжу М.Л., Троиано Н., Биан Дж., Кавано Т., Инсогна К. Остеокласты, лишенные Rac2, обладают дефектным хемотаксисом и резорбтивной активностью.Calcif Tissue Int. 2010 г. DOI: 10.1007 / s00223-010-9435-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 63. Россман К.Л., Дер С.Дж., Сондек Дж. ГЭФ означает: «Включение RHO GTPases с факторами обмена гуаниновых нуклеотидов». Nat Rev Mol Cell Biol. 2005; 6: 167–180. DOI: 10,1038 / nrm1587. [PubMed] [CrossRef] [Google Scholar] 64. Меллер Н., Мерло С., Гуда С. Белки CZH: новое семейство rho-GEF. J Cell Sci. 2005. 118: 4937–4946. DOI: 10.1242 / jcs.02671. [PubMed] [CrossRef] [Google Scholar] 65. Фаччио Р., Тейтельбаум С.Л., Фуджикава К., Чаппел Дж., Заллоне А., Тибулевич В.Л. и др.Vav3 регулирует функцию остеокластов и костную массу. Nat Med. 2005; 11: 284–290. DOI: 10,1038 / нм1194. [PubMed] [CrossRef] [Google Scholar] 66. Кубо Т., Ямашита Т., Ямагути А., Сумимото Н., Хосокава К., Тохьяма М. Новый домен FERM, включающий фактор обмена гуаниновых нуклеотидов, участвует в передаче сигналов rac и регулирует ремоделирование нейритов. J Neurosci. 2002; 22: 8504–8513. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Такегахара Н., Кан С., Нодзима С., Такамацу Х., Окуно Т., Кикутани Х. и др. Интегральная роль фактора обмена гуаниновых нуклеотидов, FARP2, в перестройках подосом остеокластов.FASEB J. 2010; 24: 4782–4792. DOI: 10.1096 / fj.10-158212. [PubMed] [CrossRef] [Google Scholar] 68. Вивес В., Лаурин М., Црес Дж., Ларрус П., Моришо З., Ноэль Д. и др. Фактор обмена Rac1 Dock5 необходим для резорбции костной ткани остеокластами. J Bone Miner Res. DOI 2010: 10.1002 / jbmr.282. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 69. Радхакришна Х., Аль-Авар О, Хачикян З., Дональдсон Дж. Г.. Необходимость ARF6 для взъерошивания раковых клеток предполагает роль мембранного транспорта в кортикальных перестройках актина.J Cell Sci. 1999; 112: 855–866. [PubMed] [Google Scholar] 70. Tushir JS, D’Souza-Schorey C. ARF6-зависимая активация ERK и Rac1 модулирует развитие эпителиальных канальцев. EMBO J. 2007; 26: 1806–1819. DOI: 10.1038 / sj.emboj.7601644. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 71. Menon P, Yin G, Smolock EM, Zuscik MJ, Yan C, Berk BC. Белок 1, взаимодействующий с киназой 2 GPCR (GIT1), регулирует функцию остеокластов и костную массу. J. Cell Physiol. 2010; 225: 777–785. DOI: 10.1002 / jcp.22282. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 72.Грингель А., Вальц Д., Розенбергер Г., Минден А., Кутше К., Копп П. и др. PAK4 и alphaPIX определяют размер и количество подосом в макрофагах посредством локальной регуляции актина. J. Cell Physiol. 2006. 209: 568–579. DOI: 10.1002 / jcp.20777. [PubMed] [CrossRef] [Google Scholar] 73. Франк С.Р., Хансен Ш. Комплекс PIX-GIT: сигнальная кассета G-белка, контролирующая форму клеток. Semin Cell Dev Biol. 2008. 19: 234–244. DOI: 10.1016 / j.semcdb.2008.01.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 74.Розенбергер Г., Кутше К. AlphaPIX и betaPIX и их роль в формировании фокальной адгезии. Eur J Cell Biol. 2006. 85: 265–274. DOI: 10.1016 / j.ejcb.2005.10.007. [PubMed] [CrossRef] [Google Scholar] 75. Уэбб Б.А., Ив Р., Кроули С.В., Чжоу С., Кот Г.П., Мак А.С. PAK1 индуцирует образование подосом в клетках гладких мышц сосудов A7r5 зависимым от PAK-взаимодействующего фактора обмена образом. Am J Physiol Cell Physiol. 2005; 289: 898–907. DOI: 10.1152 / ajpcell.00095.2005. [PubMed] [CrossRef] [Google Scholar] 76. Рохатги Р., Ма Л., Мики Х., Лопес М., Кирххаузен Т., Такенава Т. и др.Взаимодействие между N-WASP и комплексом Arp2 / 3 связывает Cdc42-зависимые сигналы со сборкой актина. Клетка. 1999; 97: 221–231. [PubMed] [Google Scholar] 77. Монипенни Дж., Чоу Х.С., Банон-Родригес И., Трэшер А.Дж., Антон И.М., Джонс Г.Е. и др. Роль WASP в клеточной полярности и подосомной динамике миелоидных клеток. Eur J Cell Biol. 2010 г. doi: 10.1016 / j.ejcb.2010.05.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 78. Джоберти Г., Петерсен С., Гао Л., Макара И.Г. Белок клеточной полярности Par6 связывает Par3 и атипичную протеинкиназу C с Cdc42.Nat Cell Biol. 2000; 2: 531–539. DOI: 10,1038 / 35019573. [PubMed] [CrossRef] [Google Scholar] 79. Ито Ю., Тейтельбаум С.Л., Цзоу В., Чжэн Ю., Джонсон Дж. Ф., Чаппел Дж. И др. Cdc42 регулирует моделирование и ремоделирование костей у мышей путем модуляции передачи сигналов RANKL / M-CSF и поляризации остеокластов. J Clin Invest. 2010; 120: 1981–1993. DOI: 10,1172 / JCI39650; 10.1172 / JCI39650. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 80. Calle Y, Jones GE, Jagger C, Fuller K, Blundell MP, Chow J, et al. Дефицит WASp у мышей приводит к неспособности формировать зоны уплотнения остеокластов и дефектам резорбции кости.Кровь. 2004. 103: 3552–3561. DOI: 10.1182 / кровь-2003-04-1259. [PubMed] [CrossRef] [Google Scholar] 81. Chellaiah MA, Kuppuswamy D, Lasky L, Linder S. Фосфорилирование сигнального комплекса, связанного с белком синдрома Вискотта-Олдрича, имеет решающее значение для резорбции костной ткани остеокластами. J Biol Chem. 2007. 282: 10104–10116. DOI: 10.1074 / jbc.M608957200. [PubMed] [CrossRef] [Google Scholar] 82. Ма Т, Саманна V, Челлайя М.А. Резкое ингибирование образования герметизирующего кольца остеокластов и резорбции кости in vitro с помощью WASP-пептида, содержащего аминокислоту pTyr 294 .Сигнал J Mol. 2008; 3: 4. DOI: 10.1186 / 1750-2187-3-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 83. Чоу ХК, Антон И.М., Холт М.Р., Курсио С., Ланзардо С., Уорт А. и др. WIP регулирует стабильность и локализацию WASP в подосомах в мигрирующих дендритных клетках. Curr Biol. 2006; 16: 2337–2344. DOI: 10.1016 / j.cub.2006.10.037. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 84. Chabadel A, Banon-Rodriguez I, Cluet D, Rudkin BB, Wehrle-Haller B, Genot E, et al. Интегрин CD44 и бета3 организуют два функционально различных домена на основе актина в остеокластах.Mol Biol Cell. 2007. 18: 4899–4910. DOI: 10.1091 / mbc.E07-04-0378. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 85. Szczepanowska J. Участие пути Rac / Cdc42 / PAK в перестройках цитоскелета. Acta Biochim Pol. 2009. 56: 225–234. [PubMed] [Google Scholar] 86. Уэбб Б.А., Евс Р., Мак А.С. Кортактин регулирует образование подосом: роли доменов взаимодействия с белками. Exp Cell Res. 2006; 312: 760–769. DOI: 10.1016 / j.yexcr.2005.11.032. [PubMed] [CrossRef] [Google Scholar] 87. Люксенбург К., Парсонс Дж. Т., Аддади Л., Гейгер Б.Участие пути src-cortactin в формировании и обороте подосом во время поляризации культивируемых остеокластов. J Cell Sci. 2006; 119: 4878–4888. DOI: 10.1242 / jcs.03271. [PubMed] [CrossRef] [Google Scholar] 88. Уэбб Б.А., Чжоу С., Ив Р., Шен Л., Цзя Л., Мак А.С. Фосфорилирование кортактина р21-активированной киназой. Arch Biochem Biophys. 2006; 456: 183–193. DOI: 10.1016 / j.abb.2006.06.011. [PubMed] [CrossRef] [Google Scholar] 89. Сарас Дж., Воллберг П., Аспенстром П. Wrch2 представляет собой GTPase-дефицитный Cdc42-подобный белок с необычными характеристиками связывания и клеточными эффектами.Exp Cell Res. 2004. 299: 356–369. DOI: 10.1016 / j.yexcr.2004.05.029. [PubMed] [CrossRef] [Google Scholar] 90. Ory S, Brazier H, Blangy A. Идентификация сигнала локализации двусторонней фокальной адгезии в RhoU / Wrch-1, GTPase семейства rho, которая регулирует клеточную адгезию и миграцию. Biol Cell. 2007; 99: 701–716. DOI: 10.1042 / BC20070058. [PubMed] [CrossRef] [Google Scholar] 91. Брэди, округ Колумбия, Алан Дж. К., Мэдиган Дж. П., Фаннинг А.С., Кокс А.Д. Трансформирующая GTPase wrch-1 семейства rho разрушает плотные соединения эпителиальных клеток и эпителиальный морфогенез.Mol Cell Biol. 2009; 29: 1035–1049. DOI: 10.1128 / MCB.00336-08. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 92. Алан Дж. К., Берзат А. С., Дьюар Б. Дж., Грейвс Л. М., Кокс А. Д.. Регулирование малой GTPase wrch-1 / RhoU семейства rho с помощью C-концевого фосфорилирования тирозина требует src. Mol Cell Biol. 2010. 30: 4324–4338. DOI: 10.1128 / MCB.01646-09. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 93. Brazier H, Pawlak G, Vives V, Blangy A. rho GTPase Wrch2 регулирует адгезию и миграцию предшественников остеокластов.Int J Biochem Cell Biol. 2009; 41: 1391–1401. DOI: 10.1016 / j.biocel.2008.12.007. [PubMed] [CrossRef] [Google Scholar] 94. Сало Дж., Метсикко К., Палокангас Х., Лехенкари П., Ваананен Х. К.. Остеокласты, резорбирующие кости, обнаруживают динамическое разделение базальной плазматической мембраны на два разных домена. J Cell Sci. 1996; 109: 301–307. [PubMed] [Google Scholar] 95. Чжао Х., Эттала О, Ваананен Х. Пути внутриклеточного транспорта через мембрану в резорбирующих костную ткань остеокластах выявлены с помощью клонирования и исследований субклеточной локализации малых GTP-связывающих белков кролика.Biochem Biophys Res Commun. 2002; 293: 1060–1065. DOI: 10.1016 / S0006-291X (02) 00326-1. [PubMed] [CrossRef] [Google Scholar] 96. Блэр Х.С., Тейтельбаум С.Л., Гизелли Р., Глюк С. Остеокластическая резорбция кости с помощью поляризованного вакуолярного протонного насоса. Наука. 1989; 245: 855–857. [PubMed] [Google Scholar] 97. Тоемура Т., Мурата Ю., Ямамото А., Ока Т., Сан-Вада Г.Х., Вада Ю. и др. От лизосом к плазматической мембране: локализация вакуолярной H + -АТФазы с изоформой a3 во время дифференцировки остеокластов.J Biol Chem. 2003; 278: 22023–22030. DOI: 10.1074 / jbc.M302436200. [PubMed] [CrossRef] [Google Scholar] 98. Корнак У., Каспер Д., Босл М.Р., Кайзер Э., Швайцер М., Шульц А. и др. Потеря хлоридного канала ClC-7 приводит к остеопетрозу у мышей и человека. Клетка. 2001; 104: 205–215. [PubMed] [Google Scholar] 99. Чжао Х., Ваананен Х. Фармакологическая секвестрация внутриклеточного холестерина в поздних эндосомах нарушает образование неровных границ в остеокластах. J Bone Miner Res. 2006; 21: 456–465. DOI: 10.1359 / JBMR.051204. [PubMed] [CrossRef] [Google Scholar] 100. Zaidi M, Troen B, Moonga BS, Abe E. Катепсин K, остеокластическая резорбция и терапия остеопороза. J Bone Miner Res. 2001; 16: 1747–1749. DOI: 10.1359 / jbmr.2001.16.10.1747. [PubMed] [CrossRef] [Google Scholar] 101. Everts V, Delaisse JM, Korper W., Niehof A, Vaes G, Beertsen W. Распад коллагена в резорбирующем кость компартменте под остеокластом включает как цистеин-протеиназы, так и матриксные металлопротеиназы. J. Cell Physiol. 1992; 150: 221–231.DOI: 10.1002 / jcp.1041500202. [PubMed] [CrossRef] [Google Scholar] 102. Mulari MT, Zhao H, Lakkakorpi PT, Vaananen HK. Рифленая граница остеокластов имеет отдельные субдомены для секреции и захвата деградированного матрикса. Движение. 2003. 4: 113–125. [PubMed] [Google Scholar] 103. Schwartz SL, Cao C, Пилипенко O, Rak A, Wandinger-Ness A. Rab GTPases с первого взгляда. J Cell Sci. 2007; 120: 3905–3910. DOI: 10.1242 / jcs.015909. [PubMed] [CrossRef] [Google Scholar] 104. Закки П., Стенмарк Х., Партон Р.Г., Ориоли Д., Лим Ф., Гинер А. и др.Rab17 регулирует перенос через мембрану посредством апикальных рециклирующих эндосом в поляризованных эпителиальных клетках. J Cell Biol. 1998; 140: 1039–1053. [Бесплатная статья PMC] [PubMed] [Google Scholar] 105. Кария Й., Хонма М., Ханамура А., Аоки С., Ниномия Т., Накамичи Ю. и др. Rab27a и Rab27b участвуют в зависимом от стимуляции высвобождении RANKL из секреторных лизосом в остеобластных клетках. J Bone Miner Res. DOI 2010: 10.1002 / jbmr.268. [PubMed] [CrossRef] [Google Scholar] 106. Ha BG, Hong JM, Park JY, Ha MH, Kim TH, Cho JY и др.Протеомный профиль белков мембраны остеокластов: идентификация домена обменника Na + / H + , содержащего 2, и его роль в слиянии остеокластов. Протеомика. 2008; 8: 2625–2639. DOI: 10.1002 / pmic.200701192. [PubMed] [CrossRef] [Google Scholar] 107. Павлос Нью-Джерси, Сюй Дж., Ридель Д., Йео Дж. С., Тейтельбаум С. Л., Пападимитриу Дж. М. и др. Rab3D регулирует новый путь везикулярного транспорта, который необходим для резорбции остеокластической кости. Mol Cell Biol. 2005; 25: 5253–5269. DOI: 10.1128 / MCB.25.12.5253-69.2005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 108. Тейлор А., Роджерс М.Дж., Тош Д., Коксон Ф.П. Новый метод эффективного получения трансфицированных остеокластов человека. Calcif Tissue Int. 2007. 80: 132–136. DOI: 10.1007 / s00223-006-0245-6. [PubMed] [CrossRef] [Google Scholar] 109. Feng Y, Press B, Wandinger-Ness A. Rab 7: важный регулятор позднего мембранного движения эндоцитов. J Cell Biol. 1995; 131: 1435–1452. [Бесплатная статья PMC] [PubMed] [Google Scholar] 111. Jordens I, Fernandez-Borja M, Marsman M, Dusseljee S, Janssen L, Calafat J, et al.Эффекторный белок RILP Rab7 контролирует лизосомный транспорт, индуцируя рекрутирование динеин-динактиновых моторов. Curr Biol. 2001; 11: 1680–1685. [PubMed] [Google Scholar] 112. Чжао Х., Лайтала-Лейнонен Т., Парикка В., Ваананен Х. К.. Подавление малой GTPase Rab7 нарушает поляризацию остеокластов и резорбцию кости. J Biol Chem. 2001; 276: 39295–39302. DOI: 10.1074 / jbc.M010999200. [PubMed] [CrossRef] [Google Scholar] 113. Sun Y, Buki KG, Ettala O, Vaaraniemi JP, Vaananen HK. Возможная роль прямого взаимодействия Rac1-Rab7 в формировании взъерошенных границ остеокластов.J Biol Chem. 2005; 280: 32356–32361. DOI: 10.1074 / jbc.M414213200. [PubMed] [CrossRef] [Google Scholar] 114. Юм А.Н., Ушаков Д.С., Тарафдер А.К., Ференци М.А., Seabra MC. Rab27a и MyoVa являются первичными интеракторами mlph, регулирующими транспорт меланосом в меланоцитах. J Cell Sci. 2007; 120: 3111–3122. DOI: 10.1242 / jcs.010207. [PubMed] [CrossRef] [Google Scholar] 115. Frasa MA, Maximiano FC, Smolarczyk K, Francis RE, Betson ME, Lozano E, et al. Armus — это эффектор Rac1, который инактивирует Rab7 и регулирует деградацию E-кадгерина.Curr Biol. 2010. 20: 198–208. DOI: 10.1016 / j.cub.2009.12.053. [PubMed] [CrossRef] [Google Scholar] 116. Накамура И., Такахаши Н., Удагава Н., Морияма Ю., Курокава Т., Джими Е. и др. Отсутствие ассоциации вакуолярной протонной АТФазы с цитоскелетом в остеокластах остеосклеротических (oc / oc) мышей. FEBS Lett. 1997; 401: 207–212. [PubMed] [Google Scholar] 117. Zuo J, Jiang J, Chen SH, Vergara S, Gong Y, Xue J и др. Актин-связывающая активность субъединицы B вакуолярной H + -АТФазы участвует в ее нацеливании на взъерошенные мембраны остеокластов.J Bone Miner Res. 2006; 21: 714–721. DOI: 10.1359 / jbmr.060201. [PubMed] [CrossRef] [Google Scholar] 118. Ван Везенбек Л., Одгрен П.Р., Коксон Ф.П., Фраттини А., Моэнс П., Перду Б. и др. Участие PLEKHM1 в остеокластическом везикулярном транспорте и остеопетрозе резцов у крыс и людей. J Clin Invest. 2007; 117: 919–930. DOI: 10,1172 / JCI30328. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 119. Табата К., Мацунага К., Сакане А., Сасаки Т., Нода Т., Йошимори Т. Рубикон и PLEKHM1 негативно регулируют эндоцитозный / аутофагический путь через новый Rab7-связывающий домен.Mol Biol Cell. 2010. 21: 4162–4172. DOI: 10.1091 / mbc.E10-06-0495. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 120. Дель Фатторе А., Форнари Р., Ван Везенбек Л., де Фрейтас Ф., Тиммерманс Дж. П., Перуцци Б. и др. Новая гетерозиготная мутация (R714C) гена остеопетроза, домен гомолога плекстрина, содержащий член 1 семейства M (с доменом run) (PLEKHM1), нарушает везикулярное закисление и увеличивает секрецию TRACP в остеокластах. J Bone Miner Res. 2008. 23: 380–391. DOI: 10.1359 / jbmr.071107.[PubMed] [CrossRef] [Google Scholar] 121. Ягер С., Буччи С., Танида И., Уэно Т., Коминами Е., Сафтиг П. и др. Роль Rab7 в созревании поздних аутофагических вакуолей. J Cell Sci. 2004. 117: 4837–4848. DOI: 10.1242 / jcs.01370. [PubMed] [CrossRef] [Google Scholar] 122. Панкив С., Алему Е.А., Бреч А., Бруун Дж. А., Ламарк Т., Оверватн А. и др. FYCO1 является эффектором Rab7, который связывается с LC3 и PI3P, опосредуя микротрубочки и направленный на конец транспорт везикул. J Cell Biol. 2010. 188: 253–269. DOI: 10.1083 / jcb.2005.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 123. Bjorkoy G, Lamark T, Brech A, Outzen H, Perander M, Overvatn A и др. p62 / SQSTM1 образует белковые агрегаты, разлагаемые аутофагией, и оказывает защитное действие на индуцированную хантингтином гибель клеток. J Cell Biol. 2005; 171: 603–614. DOI: 10.1083 / jcb.200507002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 124. Нода Т., Фудзита Н., Йошимори Т. Поздние стадии аутофагии: как начинается конец? Смерть клетки отличается. 2009; 16: 984–990. DOI: 10.1038 / cdd.2009.54. [PubMed] [CrossRef] [Google Scholar] 125. Санджуан М.А., Диллон С.П., Тейт С.В., Мошиах С., Дорси Ф., Коннелл С. и др. Передача сигналов Toll-подобного рецептора в макрофагах связывает путь аутофагии с фагоцитозом. Природа. 2007; 450: 1253–1257. DOI: 10,1038 / природа06421. [PubMed] [CrossRef] [Google Scholar] 126. Лледо П.М., Йоханнес Л., Вернье П., Зорек Р., Дарчен Ф., Винсент Дж. Д. и др. Белки Rab3: ключевые игроки в контроле экзоцитоза. Trends Neurosci. 1994; 17: 426–432. [PubMed] [Google Scholar] 127.Миллар А.Л., Павиос, штат Нью-Джерси, Сюй Дж., Чжэн М.Х. Rab3D: регулятор экзоцитоза в ненейрональных клетках. Histol Histopathol. 2002; 17: 929–936. [PubMed] [Google Scholar] 128. Павлос Нью-Джерси, Сюй Дж., Фенг Х., Нг П, Ченг Т., Энг Э и др. Rab3D направляет транспорт органелл путем привлечения цитоплазматического моторного белка динеина tctex-1 к секреторным мембранам остеокластов. Кость. 2009; 44: 160. DOI: 10.1016 / j.bone.2009.01.354. [CrossRef] [Google Scholar] 129. Стенбек Г., Хортон М.А. Новое специализированное взаимодействие между клетками и матрицей при активном резорбировании остеокластов.J Cell Sci. 2000; 113: 1577–1587. [PubMed] [Google Scholar] 130. Сало Дж., Лехенкари П., Мулари М., Метсикко К., Ваананен Х. К.. Удаление продуктов резорбции костной ткани остеокластов путем трансцитоза. Наука. 1997. 276: 270–273. [PubMed] [Google Scholar] 131. Несбитт С.А., Хортон М.А. Транспортировка матричных коллагенов через резорбирующие костную ткань остеокласты. Наука. 1997. 276: 266–269. [PubMed] [Google Scholar] 132. Vaaraniemi J, Halleen JM, Kaarlonen K, Ylipahkala H, Alatalo SL, Andersson G и др. Внутриклеточный механизм деградации матрикса в остеокластах, резорбирующих кость.J Bone Miner Res. 2004; 19: 1432–1440. DOI: 10.1359 / JBMR.040603. [PubMed] [CrossRef] [Google Scholar] 133. Стенбек Г., Хортон М.А. Эндоцитарный перенос активно резорбирующихся остеокластов. J Cell Sci. 2004. 117: 827–836. DOI: 10.1242 / jcs.00935. [PubMed] [CrossRef] [Google Scholar] 134. Мулари М.Т., Нарс М., Лайтала-Лейнонен Т., Кайсто Т., Метсикко К., Сан Й. и др. Рекомбинантные белки VSV G обнаруживают новый рафт-зависимый эндоцитарный путь резорбции остеокластов. Exp Cell Res. 2008; 314: 1641–1651. DOI: 10.1016 / j.yexcr.2008.02.011. [PubMed] [CrossRef] [Google Scholar] 135. Hunziker W, Peters PJ. Rab17 локализуется в рециркулирующих эндосомах и регулирует опосредованный рецепторами трансцитоз в эпителиальных клетках. J Biol Chem. 1998; 273: 15734–15741. [PubMed] [Google Scholar] 136. Су Т, Брайант Д.М., Лутон Ф., Вержес М., Ульрих С.М., Хансен К.С. и др. Каскад киназ, ведущий к Rab11-FIP5, контролирует трансцитоз полимерного рецептора иммуноглобулина. Nat Cell Biol. 2010; 12: 1143–1153. DOI: 10,1038 / NCB2118. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 137.Бенфорд Х.Л., Макгоуэн Н.В., Хелфрих М.Х., Наттолл М.Э., Роджерс М.Дж. Визуализация бисфосфонат-индуцированной активности каспазы-3 в апоптотических остеокластах in vitro. Кость. 2001. 28: 465–473. [PubMed] [Google Scholar] 140. Брэдли Е.В., Руан М.М., Врабл А, Оурслер М.Дж. Перекрестное взаимодействие между Ras / Raf и PI3K в стимулировании M-CSF-индуцированной MEK / ERK-опосредованной выживаемости остеокластов. J Cell Biochem. 2008; 104: 1439–1451. DOI: 10.1002 / jcb.21719. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 141. Миядзаки Т., Катагири Х., Канеги Й., Такаянаги Х., Савада Й., Ямамото А. и др.Взаимная роль путей ERK и NFkappaB в выживании и активации остеокластов. J Cell Biol. 2000. 148: 333–342. [Бесплатная статья PMC] [PubMed] [Google Scholar] 142. Брэдли Е.В., Руан М.М., Оурслер М.Дж. PAK1 представляет собой новую MEK-независимую мишень raf, контролирующую экспрессию сурвивина IAP в M-CSF-опосредованном выживании остеокластов. J. Cell Physiol. 2008. 217: 752–758. DOI: 10.1002 / jcp.21550. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 143. Schindeler A, Little DG. Недавние исследования развития, гомеостаза и восстановления костей при нейрофиброматозе 1 типа (NF1) Кость.2008. 42: 616–622. DOI: 10.1016 / j.bone.2007.11.006. [PubMed] [CrossRef] [Google Scholar] 144. Хеерва Э., Аланн М.Х., Пелтонен С., Куорилехто Т., Хентунен Т., Ваананен К. и др. Остеокласты при нейрофиброматозе 1 типа демонстрируют повышенную способность к резорбции, аберрантную морфологию и устойчивость к сывороточной депривации. Кость. 2010; 47: 583–590. DOI: 10.1016 / j.bone.2010.06.001. [PubMed] [CrossRef] [Google Scholar] 145. Паско Д., Оурслер М.Дж. Сигнальный путь src регулирует секрецию лизосомальных ферментов остеокластов и быстро модулируется эстрогеном.J Bone Miner Res. 2001; 16: 1028–1036. DOI: 10.1359 / jbmr.2001.16.6.1028. [PubMed] [CrossRef] [Google Scholar] 146. Ян Ф.К., Чен С., Роблинг А.Г., Ю Х, Небесио Т.Д., Ян Дж. И др. Гиперактивация p21ras и PI3K взаимодействует с изменением функций остеокластов, связанных с нейрофиброматозом мыши и человека 1-го типа. J Clin Invest. 2006; 116: 2880–2891. DOI: 10.1172 / JCI29092. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 147. Ян Дж, Чен С., Чжан И, Ли Х, Ли И, Ву Х и др. Rac1 опосредует усиление функции остеокластов, вызванное гаплонедостаточностью Nf1.Hum Mol Genet. 2008; 17: 936–948. DOI: 10,1093 / hmg / ddm366. [PubMed] [CrossRef] [Google Scholar]
Регулирование функции остеокластов и резорбции кости малыми GTPases
Small GTPases. 2011 май-июнь; 2 (3): 117–130.
Программа исследований опорно-двигательного аппарата; Институт медицинских наук; Университет Абердина; Абердин, Шотландия, Великобритания
Автор, ответственный за переписку.
Поступило 25 февраля 2011 г .; Пересмотрено 22 апреля 2011 г .; Принято 10 мая 2011 г.
Эта статья цитировалась в других статьях в PMC.
Abstract
Остеокласты — это многоядерные клетки, которые отвечают за резорбцию кости, и повышенная активность этих клеток связана с несколькими распространенными заболеваниями костей, включая постменопаузальный остеопороз. После адгезии к кости остеокласты становятся поляризованными и реорганизуют свой цитоскелет и мембрану, чтобы сформировать уникальные домены, включая зону уплотнения (SZ), которая представляет собой плотное кольцо из подосом, богатых F-актином, ограничивающих взъерошенную границу (RB), где протоны и протеазы секретируются для деминерализации и разрушения костного матрикса, соответственно.Эти процессы зависят от активности малых GTPases. Хорошо известно, что Rho GTPases контролируют организацию F-актина и адгезионных структур различных типов клеток, влияя впоследствии на их миграцию. В остеокластах RhoA, Rac, Cdc42, RhoU, а также Arf6 регулируют сборку подосом и их организацию в SZ. Напротив, образование RB вовлекает везикулярные пути трафика, которые регулируются семейством Rab GTPases, в частности лизосомным Rab7. Наконец, выживаемость остеокластов зависит от активности Ras GTPases.Правильная функция почти всех этих GTPases полностью зависит от посттрансляционного пренилирования, которое позволяет им локализоваться на конкретных мембранах-мишенях. Бисфосфонатные препараты, которые широко используются при лечении заболеваний костей, таких как остеопороз, действуют, предотвращая пренилирование малых GTPases, что приводит к потере SZ и RB и, следовательно, к ингибированию активности остеокластов, а также вызывает апоптоз остеокластов. В этом обзоре мы суммируем текущее понимание роли специфических пренилированных малых GTPases в поляризации, функции и выживании остеокластов.
Ключевые слова: остеокласт, кость, Rab, Rho, Rac, Ras, Arf, бисфосфонат, пренилирование
Введение
Остеокласты представляют собой большие многоядерные подвижные клетки, которые образуются путем слияния гематопоэтических клеток моноцита / происхождение макрофагов. 1 , 2 Это единственные клетки в организме, которые способны разрушать (резорбировать) внеклеточный костный матрикс, процесс, который необходим для морфогенеза кости во время развития, для постоянного восстановления микроповреждений в скелете и для адаптации кости к механической нагрузке. 3 , 4
Эти клетки представляют собой увлекательную модель поляризации клеток, потому что при активации для резорбции остеокласты реорганизуют свою мембрану в четыре отдельных и уникальных домена, а именно зону уплотнения (SZ), взъерошенную границу ( RB), базолатеральный домен (BD) и функциональный секреторный домен (FSD) (). SZ, где остеокласт плотно прикрепляется к костному матриксу, образован плотно упакованными специфическими, богатыми актином адгезионными структурами, называемыми подосомами.Они состоят из ядра плотно упакованных актиновых филаментов и белков, связанных с F-актином, таких как кортактин, WASp и Arp2 / 3, окруженных интегринами и белками, связанными с прикреплением, такими как винкулин и талин. 5 , 6 По сравнению с фокальными спайками эти структуры очень динамичны и имеют срок службы всего 2–12 мин. 7 , 8 Это плотное соединение остеокласта с внеклеточным матриксом эффективно изолирует компартмент под клеткой, где происходит деградация кости (лакуна резорбции). 9 Впоследствии поляризованные везикулярные пути трафика приводят к развитию мембраны, заключенной SZ, в сильно извилистую взъерошенную границу, где протоны и протеазы секретируются для деминерализации и деградации костного матрикса, соответственно. 10 — 12 Полученные продукты деградации затем подвергаются эндоцитозу в RB, транспортируются через остеокласт посредством трансцитоза и, наконец, высвобождаются на противоположной стороне клетки в FSD.
Изменения мембранных доменов во время активации остеокластов. Неполяризованные, неактивные остеокласты представляют собой диспергированные подосомы. Во время активации остеокластов эти подосомы сливаются в периферический пояс, а затем в отчетливое «актиновое кольцо», которое формирует зону уплотнения, в которой остеокласт плотно прилегает к поверхности кости. Вслед за этим перемещение поздних эндосом / лизосом к поверхности кости приводит к образованию взъерошенной границы, резорбтивной органеллы остеокласта.Наконец, мембранный домен, известный как функциональный секреторный домен, формируется в верхней части клетки, к которому нацелены трансцитотические пузырьки, сформированные на взъерошенной границе.
Малые GTPases суперсемейства Ras, включая подсемейства Ras, Rho, Arf, Ran и Rab, являются ключевыми регуляторами различных клеточных событий, включая деление клеток, транспорт пузырьков, сборку ядер и контроль цитоскелета. В этом обзоре будет освещена их роль в функции остеокластов, в частности, в регуляции подосом, везикулярном переносе и выживании клеток.
Фармакологические доказательства важности малых ГТФаз в функции остеокластов
В целом малые ГТФазы локализуются в определенных мембранных компартментах. Это свойство зависит от посттрансляционного пренилирования, которое включает присоединение гидрофобной изопреноидной липидной группы (либо 15-углеродный фарнезильный, либо 20-углеродный геранилгеранильный фрагмент) к консервативному остатку цистеина, содержащемуся в характерных мотивах пренилирования на С-конце самые маленькие GTPases.Эта модификация выполняется одним из трех ферментов протеин-пренилтрансферазы (фарнезилтрансфераза, геранилгеранилтрансфераза (GGTase) I или Rab GGTase), специфичность определяется мотивом пренилирования в белковом субстрате. 13 Большинство малых GTPases, включая подсемейство Rab и большую часть подсемейства Rho, модифицированы геранилгеранильными группами; ГТФазы, модифицированные фарнезилированием, включают большинство белков Ras и некоторые белки семейства Rho.
Фундаментальная важность малых GTPases в биологии остеокластов стала очевидной десять лет назад после нашего открытия, что азотсодержащие препараты бисфосфонатов (N-BP) ингибируют резорбцию костей, блокируя пренилирование белков. 14 , 15 Эти «блокбастеры» представляют собой негидролизуемые аналоги пирофосфата, которые быстро воздействуют на скелет и используются во всем мире в качестве передового средства лечения распространенных заболеваний, связанных с повышенной резорбцией кости, таких как постменопаузальный остеопороз. , связанное с раком заболевание костей и болезнь Педжета. 16 Препараты N-BP, такие как ризедронат, алендронат и золедронат, являются очень эффективными ингибиторами резорбции кости, поскольку они селективно интернализуются в остеокласты во время резорбции покрытой лекарством кости. 17 , 18 После интернализации N-BP нарушают поляризацию остеокластов (предотвращая образование актинового кольца, нарушая нормальный везикулярный транспорт и образование RB), а также вызывают апоптоз остеокластов. 18 В настоящее время известно, что эти эффекты N-BP являются результатом нарушения пренилирования белков, поскольку эти препараты имитируют структуру изопреноидных липидов, таких как геранилдифосфат (GPP), и тем самым сильно ингибируют синтазу фарнезилдифосфата (FPP), a ключевой фермент мевалонатного пути биосинтеза изопреноидов и холестерина. 19 — 21 Точный механизм ингибирования FPP-синтазы был недавно выяснен из рентгеновской кристаллической структуры фермента и включает «медленно-плотное» связывание лекарства с одним из двух изопреноидных липидов. субстратные карманы, приводящие к конформационным изменениям фермента. 22 — 24 Некоторые N-BP также являются слабыми ингибиторами других ферментов мевалонатного пути, таких как геранилгеранилдифосфат (GGPP) синтаза, скваленсинтаза и изомераза IPP. 18
Ингибирование активности FPP-синтазы в остеокластах приводит к истощению FPP и GGPP, которые необходимы для пренилирования малых GTPases. В результате малые ГТФазы накапливаются в непренилированной форме и не могут локализоваться в компартментах мембраны (). 25 Этот эффект можно легко измерить в культивируемых клетках, отслеживая метаболическое включение [ 14 C] мевалоната в пренилированные белки (), 14 , 18 , 26 с помощью белкового гелевого блоттинга. анализ клеточных лизатов с использованием антитела, которое специфически гибридизуется с непренилированной формой малой ГТФазы Rap1A (), 27 или путем визуализации субклеточной локализации малых ГТФаз, таких как Rab6 (). 25
Бисфосфонатные препараты ингибируют пренилирование малых GTPases. (A) Ингибирование пренилирования белков азотсодержащими бисфосфонатами может быть продемонстрировано in vitro путем культивирования клеток с [ 14 C] мевалонатом, который включается в пренилированные белки, меченные 14 C. Пренилированные белки с радиоактивной меткой (21–26 кДа, область в рамке) могут быть затем обнаружены авторадиографией после электрофоретического разделения. Лечение бисфосфонатными препаратами алендронатом (ALN), ибандронатом (IBA), инкадронатом (INC) и ризедронатом (RIS) явно ингибирует пренилирование по сравнению с контрольными (Ctrl) клетками.Воспроизведено из Luckman et al. 14 с разрешения Американского общества исследований костей и минералов. (B) Ингибирование пренилирования белков бисфосфонатными препаратами приводит к накоплению непренилированной формы малых GTPases в остеокластах. Накопление непренилированного Rap1A (красный) может быть определено с помощью белкового гелевого блоттинга, например, после обработки культивированных клеток золедронатом ≥10 мкМ (изображение любезно предоставлено Gemma Shay). Непренилированная форма (красный цвет) имеет более высокую молекулярную массу, чем пренилированная форма (зеленый цвет) из-за отсутствия расщепления концевого трипептида.(C) Ингибирование пренилирования белков бисфосфонатными препаратами изменяет субклеточное распределение малых GTPases, таких как Rab6. Многоядерные остеокласты иммуноокрашивали на Rab6, который локализуется в перинуклеарных гольджи в необработанном остеокласте (слева), но имеет цитозольное распределение в остеокласте, обработанном в течение 48 часов бисфосфонат ризедронатом (справа).
Поскольку пренилированные малые GTPases действуют как молекулярные переключатели, их активность необходимо строго контролировать. Недавние исследования показывают, что некоторые непренилированные малые ГТФазы, такие как Rac, которые накапливаются в цитозоле после воздействия на клетки N-BP, в основном являются их активным GTP-связанным состоянием (предположительно из-за отсутствия взаимодействия с регуляторными белками GAP), вызывая несоответствующую активацию нижестоящие сигнальные киназы, такие как p38. 28 Ингибирование мевалонатного пути N-BP, следовательно, по-видимому, нарушает функцию остеокластов, вызывая потерю пренилированных белков (и потерю нисходящей передачи сигналов) и / или накопление непренилированных белков (и, следовательно, несоответствующую активацию нижестоящих сигнальных путей или секвестрацию). эффекторов). 18 Эти эффекты на передачу сигналов малой GTPase приводят к нарушению организации цитоскелета и везикулярному переносу в остеокластах, вызывая потерю SZ и RB и апоптозу остеокластов.В частности, геранилгеранилированные, а не фарнезилированные, малые ГТФазы необходимы для функции и выживания остеокластов, поскольку геранилгераниол (клеточно-проницаемая форма GGPP) преодолевает ингибирование образования остеокластов и резорбции кости с помощью N-BP. 15 , 29 Кроме того, небольшие GTPases, геранилгеранилированные GGTase I (такие как Rho, Rac и Cdc42), имеют решающее значение для функции остеокластов (см. Ниже), поскольку ингибитор GGTase I (GGTI-298) близко имитирует влияние N-BP на поляризацию и выживаемость остеокластов. 30 Мы также идентифицировали первые известные специфические ингибиторы Rab GGTase (RGGT), которые очень напоминают структуру N-BP, но содержат карбоксилатный фрагмент вместо одной из фосфонатных групп. 25 , 31 Эти фосфонокарбоксилатные (PC) соединения, по-видимому, ингибируют RGGT, предотвращая вторую стадию геранилгеранилирования Rab-белков, которые обычно дигеранилгеранилированы, возможно, путем связывания с сайтом узнавания GG-цистеина на RGGT, который может быть требуется для выравнивания негеранилгеранилированных Rab для второй стадии модификации липидов. 32 Эти агенты специфически нарушают пренилирование и локализацию Rab GTPases в остеокластах, а также ингибируют резорбцию кости, нарушая везикулярный транспорт. 25 , 31
Встречающаяся в природе линия мышей, известная как gunmetal , представляет собой интересную модель дефектного пренилирования Rab in vivo. Этот дефект характеризуется снижением активности RGGT на 75% из-за аутосомно-рецессивной мутации в гене, кодирующем α-цепь этого фермента. 33 Мы показали, что макрофаги и остеокласты этих мышей более чувствительны к действию ПК, тем самым подтверждая, что эти препараты действуют через ингибирование RGGT. 34 Более того, хотя мыши gunmetal не проявляют явного костного фенотипа, остеокласты, полученные in vitro от этих мышей, демонстрируют пониженную способность к резорбции, несмотря на способность реорганизовывать свой цитоскелет в кольца F-актина. 35 Этот фенотип близко имитирует эффекты фармакологического ингибирования RGGT на остеокласты 31 и подтверждает, что пренилирование Rab необходимо для активности остеокластов; однако идентичность недопренилированных GTPases Rab, которые вносят вклад в дефект резорбции, остается неясной.
Регуляция расположения цитоскелета и полярности остеокластов с помощью малых GTPases
Остеокласты обладают уникальной подосомной организацией, которая зависит от субстрата, к которому они прикрепляются. Адгезия к покровным стеклам вызывает образование кластеров подосом, которые впоследствии собираются в небольшие кольца подосом и, в конечном итоге, в пояс подосом по периферии клетки, в котором можно четко различить отдельные подосомы. 7 Напротив, в остеокластах, засеянных на костные или костеподобные минерализованные субстраты, подосомы становятся плотно упакованными в плотное кольцо F-актина, также называемое зоной уплотнения (SZ).Хотя отдельные подосомы не могут быть различимы в SZ с помощью классической флуоресцентной микроскопии, сканирующая электронная микроскопия с высоким разрешением в сочетании с флуоресцентной микроскопией продемонстрировала, что эта структура состоит из плотной сети ядер подосом, соединенных между собой радиальными актиновыми волокнами, которые называются облаком F-актина. . 6 , 9 Различие в организации подосом на этих субстратах предполагает, что, хотя адгезия способствует образованию подосом, другие внеклеточные сигналы регулируют организацию подосом.Прикрепление остеокластов к поверхности кости в основном зависит от интегринов, в частности, рецептора витронектина (α v β 3 ), одного из основных интегринов в остеокластах, 36 , 37 , который в большей степени присутствует на них. ячеек, чем любой другой тип ячеек. 38 , 39 Делеция субъединицы β3 у мышей оказывает драматическое влияние на распространение остеокластов и организацию цитоскелета, приводя к прогрессирующему остеопетрозу, что указывает на снижение активности остеокластов. 37 При связывании лиганда α v β 3 интегрины привлекают многочисленные белки, включая нерецепторные тирозинкиназы Pyk2, Src и Syk, а также содержащую палец RING убиквитинлигазу c-Cbl, 40 — 42 , которые передают сигналы для регулирования как сборки / разборки подосом, так и организации подосом. Остеокласты мышей с нокаутом src, pyk2 или syk неспособны формировать надлежащую зону уплотнения, демонстрируя, что все эти три тирозинкиназы играют важную роль в организации подосом в остеокластах. 42 — 44 Напротив, дефицит убиквитинлигазы c-Cbl не влияет на формирование зоны уплотнения, но миграция остеокластов нарушается как in vitro, так и in vivo, что позволяет предположить, что Cbl может участвовать в оборот подосомы. 41 , 45 Число подосом и их продолжительность жизни снижены в src — / — остеокластах, подтверждая, что Src также играет критическую роль в формировании и стабильности подосом. 46 Более того, скорость потока мономеров актина в подосомы мышей с дефицитом Src или Pyk2 снижается, указывая тем самым, что киназы Src и Pyk2 регулируют полимеризацию актина. 44 , 46
Учитывая их роль в регуляции цитоскелета, неудивительно, что GTPases семейства Rho оказываются необходимыми для образования и организации подосом в остеокластах и для поляризации этих клеток (). Семейство Rho GTPases состоит из 20 членов, и анализ профилей транскриптов выявил присутствие 18 Rho GTPases в остеокластах. 47 Однако до сих пор идентифицировано только четыре члена этого семейства, которые играют роль в регуляции организации цитоскелета и поляризации остеокластов: RhoA, Rac1, Cdc42 и RhoU. 48 Недавно другое семейство, ARF GTPases, которые, как известно, регулируют мембранный перенос и динамику актина, 49 было вовлечено в регуляцию цитоскелета остеокластов и формирование герметичной зоны. 50
Роль малых GTPases в сигнальных путях, регулирующих поляризацию остеокластов.При адгезии остеокластов к костному матриксу взаимодействие рецептора витронектина (α v β 3 ) и CD44 активирует несколько нижестоящих сигнальных путей, способствующих образованию зоны уплотнения и поляризации остеокластов. Эти пути включают множество малых GTPаз (синий), GAP (красный), GEF (розовый) и эффекторов GTPase (зеленый), а также могут быть активированы через другие рецепторы, такие как рецептор M-CSF и рецептор, связанный с G-белком GPR55. .
Rho
Rho была первой GTPase, изученной в остеокластах.Ингибирование RhoA, RhoB и RhoC с помощью экзофермента Clostridium botulinum C3 нарушило образование SZ, что привело к инактивации остеокластов. 51 Действительно, когда остеокласты культивируются на кости, экзофермент C3 вызывает распространение остеокластов и реорганизацию подосом из SZ в пояс на периферии клетки, предполагая, что активность RhoA необходима для образования SZ, но не для пояса актина. формирование. 52 В соответствии с этим мы недавно показали, что каннабиноидные агонисты рецептора GPR55, сопряженного с G-белком, стимулируют поляризацию остеокластов и резорбцию кости, которая связана с активацией RhoA, вероятно, через Gα13. 53 Более того, микроинъекция конститутивно активируемого RhoA в остеокласты, культивируемые на покровных стеклах, не вызывала образования зоны уплотнения, но вызывала нарушение пояса подосом и создание кластеров подосом, что позволяет предположить, что одной активации RhoA недостаточно для индукции SZ. Это требует дополнительных сигналов от костного матрикса или более сложной регуляции активности RhoA. 54 — 56 Действительно, несколько наблюдений подтверждают важность регуляции активности RhoA для индукции образования подосом и герметичной зоны.С одной стороны, активный RhoA индуцирует синтез фосфатидилинозитол-4-фосфат-5-киназой (PI4P-5-киназой) фосфатидилинозитол-4,5-бисфосфата (PI (4,5) P2), который впоследствии взаимодействует с WASp для способствовать формированию зоны уплотнения. 57 С другой стороны, в клетках, трансформированных Src, ERK5 ограничивает активацию Rho за счет усиления экспрессии RhoGAP7 и тем самым индуцирует образование подосом. 58 Более того, в остеокластах активированный Rho индуцирует HDAC6-опосредованное деацетилирование микротрубочек через его эффектор mDia2, что приводит к нарушению SZ. 56 Pyk2-дефицитные остеокласты, которые обладают снижением ацетилирования микротрубочек и образования SZ, обладают повышенной активностью Rho, что указывает на то, что Pyk2 подавляет активность Rho, что делает возможным стабилизацию микротрубочек и SZ. 44 Это демонстрирует, что жесткая регуляция активности RhoA важна для поляризации остеокластов.
Rac
Как и другие типы клеток, Rac1 опосредует образование ламеллиподий и распространение клеток в остеокластах, например, в ответ на M-CSF, который способствует распространению и подвижности остеокластов. 59 , 60 Его роль в организации подосом менее изучена. Ори и др. сообщили, что Rac имеет эффекты, противоположные Rho в многоядерных гигантских клетках, поскольку экспрессия конститутивно активного Rac способствует образованию ламеллиподий и распространению клеток, тогда как экспрессия доминантно-негативного Rac вызывает ретракцию клеток и дезорганизацию подосом. 54 , 60 Razzouk et al. предприняли альтернативный подход, включающий использование нейтрализующих антител к Rac1 и Rac2, чтобы продемонстрировать, что ингибирование активности Rac нарушает кольца актина, снижает резорбтивную активность и вызывает ретракцию остеокластов крыс. 61 Совсем недавно было показано, что остеокласты мышей rac2 — / — имеют дефекты в образовании SZ и M-CSF-индуцированной миграции in vitro, что приводит к снижению активности остеокластов как in vitro, так и in vivo, 62 , таким образом, подтверждая важную роль белков Rac в формировании подосом и зон уплотнения.
Относительно мало известно о регуляции Rac и Rho факторами обмена гуаниновых нуклеотидов (GEF) и белками, активирующими GTPase (GAP) в остеокластах.У млекопитающих существует более 70 RhoGEF, принадлежащих к двум разным группам: домен, содержащий Dbl-гомологичный домен, и белки CZH. 63 , 64 Анализ профилей транскриптов выявил экспрессию 42 RhoGEF в остеокластах, включая Vav3, FARP2, Dock5 и αPIX. 47 В настоящее время есть доказательства того, что некоторые из них, которые специфически регулируют активность Rac, играют роль в остеокластах.
Все три белка Vav экспрессируются остеокластами, но до сих пор было показано, что только Vav3 играет решающую роль в остеокластах, 65 опосредуя M-CSF-индуцированную перестройку цитоскелета и распространение остеокластов посредством ассоциации с Rac1. 60 Дефицит Vav3 у мышей приводит к остеопетрозу из-за дефекта резорбирующих костную ткань остеокластов, которые демонстрируют дефектные кольца актина и потерю поляризации. 65 FARP2 — это GEF семейства Dbl, специфичный для Rac1, который важен для организации цитоскелета. 66 Его экспрессия повышается во время остеокластогенеза и локализуется в актиновом ядре подосом. 67 Избыточная экспрессия доминантно-отрицательной формы FARP2, лишенной домена RacGEF, приводит к дезорганизации актинового пояса и отсутствию резорбции кости.
Dock5, Rac1 GEF семейства CZH, также недавно был вовлечен в образование SZ. 68 Экспрессия Dock5 повышается во время индуцированного RANKL остеокластогенеза. 47 Остеокласты мышей с нокаутом Dock5 обладают пониженной активностью Rac1 и нарушенным актиновым цитоскелетом, 68 дополнительно указывает на то, что регулируемые Rac1 пути играют важную роль в формировании SZ.
ARF6
Недавно было определено, что ARF6, который, как известно, регулирует локализацию Rac1 в плазматической мембране, 69 , 70 , необходим для образования зоны уплотнения. 50 , 69 Белки GIT (GIT1 и GIT2), которые представляют собой ARF-GAP, являются мишенями для киназы Src и локализуются в зоне уплотнения в поляризованных остеокластах. 50 , 71 GIT2, как было показано, подавляет активность ARF и, возможно, рекрутирование Rac1 в SZ, тем самым поддерживая полярность остеокластов. 50 Более того, остеокласты мышей с нокаутом GIT1 имеют нарушенный актиновый цитоскелет, подтверждая важность белков GIT в формировании SZ. 50 Белки GIT могут взаимодействовать с α и βPIX, факторами обмена для Rac1 и Cdc42, которые окружают актиновое ядро подосом в макрофагах, где они контролируют образование подосом 72 и координируют Rho и ARF-индуцированные перестройки цитоскелета и оборот фокальной адгезии. 73 , 74 PIX-белки также участвуют в образовании подосомоподобных столбцов F-актина в обработанных форболовым эфиром гладкомышечных клетках сосудов. 75 Однако было обнаружено, что αPIX не нужен для ARF6 / GIT2-опосредованной регуляции образования SZ, предполагая, что другой GEF участвует в координации сигнальных путей ARF6 и Rac1 / Cdc42 в остеокластах. 50 Путь ARF6 / Rac1 также может играть роль в лизосомном трафике (см. Раздел об эффекторах Rab7).
Cdc42
Cdc42 является важным регулятором полимеризации актина за счет его прямого связывания с белками синдрома Вискотта-Олдрича (WASp и N-WASP), что вызывает конформационные изменения, позволяющие связывать WASp с комплексом Arp2 / 3, тем самым способствует зарождению актина. 76 , 77 Микроинъекция активированного Cdc42 в остеокласты приводит к нарушению организации подосом, но после последующего лечения остеопонтином наблюдается усиление взаимодействия между WASp и Arp2 / 3, способствующего полимеризации актина, что позволяет предположить, что только Cdc42 не может активировать WASp в остеокластах. 57 Cdc42 может также регулировать полярность эпителиальных клеток, взаимодействуя с комплексом полярности Par, содержащим Par-3, Par-6 и атипичный PKC. 78 Экспрессия этих белков в остеокластах предполагает, что ассоциация Cdc42 и Par-6 может контролировать поляризацию остеокластов. 79 Хотя истощение Cdc42 в остеокластах не влияло на образование актиновых колец, когда поляризация клеток была нарушена сывороточным голоданием, восстановление актиновых колец задерживалось, что указывает на то, что Cdc42 играет важную, но несущественную роль в установлении поляризации остеокластов. .
Остеокласты мышей с нокаутом WASp обнаруживают снижение образования подосом и, следовательно, неспособны поляризоваться. 80 Более того, фосфорилирование WASp по Tyr-291 регулируется несколькими киназами, включая Src, который увеличивает Arp2 / 3-опосредованную полимеризацию актина и образование SZ. 81 , 82 WASp также взаимодействует с WIP (WASp-взаимодействующий белок), который индуцирует его локализацию в подосомах и защищает от кальпаин-зависимой деградации. 83 Дефицит WIP в остеокластах вызывает снижение уровня белка WASp и количества подосом; оба эти изменения могут быть восстановлены путем активации рецепторов CD44, подтверждая критическую роль WASp в поляризации остеокластов. 84
Другой группой эффекторных молекул семейства Rho, участвующих в образовании подосом, является семейство p21-активируемых киназ (PAK), которое содержит шесть членов, которые могут взаимодействовать как с Cdc42, так и с Rac, опосредуя перестройку цитоскелета. 85 Экспрессия доминантно-отрицательных мутантов PAK4 приводила к уменьшению размера и количества подосом в макрофагах. 72 Более того, экспрессия киназно-активного мутанта PAK1 индуцировала образование подосомоподобных столбцов F-актина в гладкомышечных клетках сосудов. 75 Кортактин, белок, связывающий F-актин, который взаимодействует с комплексом Arp2 / 3, чтобы стимулировать нуклеацию актина и регулировать образование подосом, 86 , 87 может фосфорилироваться PAK, тем самым влияя на его связывание с актином в клетки гладких мышц сосудов. 88 В остеокластах нейтрализующие антитела к PAK1 разрушают кольца актина, аналогично эффектам нейтрализующих антител против Rac, предполагая, что белки PAK способствуют не только образованию подосом, но также опосредуют образование Rac-индуцированной зоны уплотнения. 61
RhoU
Самым последним членом семейства Rho GTPase, участвующим в регуляции цитоскелета остеокластов, является RhoU, также известный как Wrch2 (Wnt1-Responsive Cdc42 Homolog 1). RhoU обладает значительной последовательностью и функциональным сходством с Cdc42, но в отличие от Cdc42, RhoU обладает чрезвычайно быстрой собственной активностью обмена гуаниновых нуклеотидов. 89 Более того, RhoU имеет предполагаемые мотивы, взаимодействующие с доменом Src гомологии 3 (Sh4) в его N-концевой области. В отличие от RhoA, Rac1 и Cdc42, экспрессия RhoU активируется во время дифференцировки остеокластов. 47 RhoU колокализуется с винкулином вокруг ядер актина в клетках, которые образуют подосомы, то есть в остеокластах и в клетках Hela, трансфицированных конститутивно активной формой Src. 90 Исследования на других типах клеток показали, что RhoU участвует в реорганизации цитоскелета и полярности клеток.В клетках MDCK взаимодействие RhoU и Par-6 регулирует сборку плотных контактов, необходимую для поляризации эпителиальных клеток и для цистогенеза. 91 Более того, фосфорилирование Src RhoU по Tyr-254 необходимо для цистогенеза в 3D-культуре клеток MDCK. 92 В клетках h2299 Src-опосредованное фосфорилирование RhoU вызывает его субклеточную релокализацию и подавляет его связывание с GTP, что приводит к снижению индуцированного RhoU аутофосфорилирования PAK и Pyk2. 92 Однако в остеокластах сверхэкспрессия дикого типа и конститутивно активного RhoU дестабилизирует подосомный пояс и увеличивает образование кластеров актина, но не влияет на формирование зоны запечатывания или резорбцию кости in vitro, 93 предполагая, что RhoU не является необходим для поляризации остеокластов, и его роль в остеокластах еще предстоит определить.
Регуляция везикулярного обмена в остеокластах с помощью малых GTPases
Процессы везикулярного транспорта необходимы в остеокластах для установления и поддержания поляризации клеток, высвобождения медиаторов костной резорбции в лакуну резорбции и для рециркуляции рецепторов, таких как интегрины, которые способствуют подвижности остеокластов и функция. Решающим мембранным доменом для резорбции кости, который формируется в результате везикулярного переноса и слияния, является RB, сильно извитая мембрана, которая формируется только после того, как остеокласты претерпели перестройку цитоскелета с образованием SZ. 10 — 12 В отличие от обычных плазматических мембран, RB экспрессирует ряд белков, связанных с эндосомным / лизосомным путем, таких как LAMP1, LAMP2, lgp110 и Rab7, определяя RB как лизосомальную мембрану; 12 , 94 маркеры ранних эндосом, таких как EEA1, не обнаруживаются в RB, но ограничены пузырьками в цитоплазме остеокластов. 95 Лизосомная природа RB не удивительна, поскольку деградация костного матрикса требует подкисления лакуны резорбции и высвобождения протеаз, которые разрушают органический матрикс.Это опосредуется как слиянием лизосом в RB, которое непосредственно высвобождает кислоту в лакуну резорбции, так и продолжающимся действием V-АТФазы, которая вставляется в RB в результате этого пути транспортировки. 96 V-АТФаза подкисляет поздние эндосомы и лизосомы, перекачивая протоны, генерируемые карбоангидразой II, в просвет везикулы. 97 Для поддержания электронейтральности везикул хлорид-ионы транспортируются в просвет с помощью H + / Cl — антипортера ClC-7, который высоко экспрессируется в остеокластах и также доставляется в RB посредством лизосомального транспорта. 98 Секреция протеаз, в частности катепсина K, посредством этого пути опосредует деградацию органического матрикса, который преимущественно представляет собой коллаген I типа. 99 — 101 Этот эндоцитарный путь, который отвечает за образование и поддержание RB, берет свое начало от базолатеральной мембраны, поскольку эндосомные маркеры, такие как HRP и нагруженный железом трансферрин, интернализуются в эндосомы из этого мембранного домена перед доставкой к периферийной области РБ, близкой к зоне уплотнения, но отличной от нее. 102 Хотя известно, что подосомы и инвадоподии опосредуют деградацию матрикса посредством высвобождения металлопротеаз, таких как MMP9, которые могут разрушать коллаген, именно катепсин K, доставляемый по эндоцитарному пути, имеет решающее значение для деградации кости, 102 и сама зона уплотнения не является основным местом резорбции кости.
Rab-белки, самое большое семейство малых GTPases, включающее более 70 членов у людей, 103 являются главными регуляторами везикулярного транспорта, играя роль в почковании пузырьков, транспорте и слиянии с мембранами назначения.Хотя многие Rab-белки, вероятно, играют сходные фундаментальные роли во всех типах клеток, экспрессия некоторых Rab ограничена специализированными типами клеток, где у них есть отличная функция; например, Rab17 специфически экспрессируется поляризованными эпителиальными клетками, где он обеспечивает апикальный поляризованный транспорт рециркулирующих эндосом. 104 Поскольку остеокласты обнаруживают уникальные пути доставки пузырьков для поддержания их поляризации, вполне вероятно, что некоторые Rab белки играют уникальные роли в функции остеокластов ().Одним сильным кандидатом, который, как известно, имеет ограниченное тканевое распределение, является Rab27a, поскольку он участвует в перемещении «секреторных лизосом» в другие типы клеток, такие как меланоциты и цитотоксические Т-клетки. Однако Rab27a не экспрессируется в остеокластах, несмотря на то, что он присутствует в клетках-предшественниках, тогда как пепельные мыши, дефицитные по Rab27a, не имеют явного костного фенотипа (Coxon FP и Seabra MC, неопубликованные данные). Интересно, однако, что изоформы Rab27a и b экспрессируются в костеобразующих остеобластах, где они играют роль в транспортировке везикул, экспрессирующих лиганд RANK, к плазматической мембране. 105 Следовательно, это, вероятно, влияет на активность остеокластов in vivo, поскольку лиганд RANK важен для дифференцировки и функции остеокластов.
Гипотетическая модель транспорта поздних эндосом / лизосом к взъерошенной границе в остеокластах. Rab7 локализован в поздних эндосомах / лизосомах и в периферической области взъерошенной границы (рядом с зоной уплотнения) в остеокластах и регулирует перемещение этих пузырьков к положительному концу микротрубочек.Другие медиаторы этого процесса остаются неизвестными, хотя Rab7-связывающий белок Plekhm1, который рекрутируется в поздние эндосомы / лизосомы с помощью Rab7, вероятно, участвует, поскольку остеокласты пациентов с остеопетрозом с мутациями в этом белке имеют дефектные взъерошенные границы. Одна возможность состоит в том, что Plekhm1 может соединять Rab7 и мотор кинезина, чтобы сделать возможным перемещение транспорта по микротрубочкам. Было показано, что Rab7 взаимодействует непосредственно с Rac1 вблизи зоны уплотнения, и было высказано предположение, что это взаимодействие может опосредовать перенос поздних эндосом / лизосом из сети микротрубочек в сеть кортикального актина до слияния с акцептором взъерошенной границы. мембрана и высвобождение катепсина К и кислоты на периферии RB в лакуну резорбции.Этот процесс также служит для вставки V-АТФазы, ClC-7 и Rab7 в взъерошенную пограничную мембрану. Сама V-АТФаза также может играть роль в этом процессе, поскольку было показано, что субъединицы помпы связываются с актиновыми микрофиламентами. Трансцитотические везикулы, которые участвуют в дальнейшей деградации и удалении фрагментов коллагена и перемещаются по микротрубочкам к функциональному секреторному домену (FSD), происходят из центральной области взъерошенной границы; пока что Rab GTPases, управляющие этим путем, остаются неизвестными.
Хотя исследования выявили экспрессию Rab1B, Rab3A / B / C / D, Rab4B, Rab5C, Rab7, Rab9, Rab10, Rab11B и Rab35 в остеокластах, 95 , 106 , 107 Мало что известно о функции большинства этих Rab в остеокластах. Rab9 колокализуется с Rab7 в поздних эндосомах, но не в RB при резорбции остеокластов. 95 , 106 Rab6 также высоко экспрессируется на уровне белка и обнаруживает перинуклеарную локализацию Гольджи, но его точная роль остается неопределенной. 32 , 108 Rab11 локализован в компартментах перинуклеарного рециклинга в остеокластах, где он может участвовать в обороте рыхлой пограничной мембраны, способствуя миграции и резорбции остеокластов. 95 Однако определяющая роль в везикулярном переносе в RB остеокластов до сих пор приписывалась только Rab7 и Rab3D.
Rab7
Rab7 обеспечивает гетеротипическое слияние между ранними эндосомами и поздними эндосомами, а также между поздними эндосомами и лизосомами. 109 , 110 Он также регулирует ретроградный транспорт поздних эндосом по микротрубочкам к центру организации микротрубочек посредством взаимодействий с эффекторным белком RILP и моторным белком динеином. 111 Учитывая важность этого пути переноса в формировании RB, Rab7 может, следовательно, участвовать в формировании RB, контролируя как слияние поздних / зрелых эндосом друг с другом, так и с RB, 12 и / или перемещение этих эндосом. везикулы на микротрубочках.В подтверждение этого Rab7 локализуется совместно с маркерами взъерошенной границы и поздних эндосом, но не с маркерами ранних эндосом или аппарата Гольджи в остеокластах. 12 , 112 Кроме того, исследования антисмыслового нокдауна подтвердили, что Rab7 необходим для образования и резорбции RB остеокластами, а также для доставки V-АТФазы в RB. 112 В то время как захват трансферрина ранними эндосомами является нормальным в Rab7-истощенных клетках, транспорт в RB нарушается, обеспечивая дополнительные доказательства того, что Rab7 регулирует последние стадии эндосомного пути от базолатеральной мембраны к RB. 112
Эффекторы Rab7
В настоящее время нет доказательств роли установленных эффекторов Rab7, таких как RILP, ORP1L, Rabring7, hVPS34 или FYCO-1, в функции остеокластов. Однако было показано, что Rab7 взаимодействует с небольшой GTPase Rac1 в остеокластах GTP-зависимым образом. 113 Как указано выше, Rac1 играет важную роль в формировании зоны уплотнения, и оба Rac1 и Rab7 совместно локализуются в зоне слияния RB, как раз внутри зоны уплотнения.Была выдвинута гипотеза, что эта ассоциация может быть необходима для слияния поздних эндосом в RB, контролируя переключение поздних эндосом с транспорта на основе микротрубочек на кортикальную актиновую сеть (). В этом отношении можно провести аналогию с транспортом меланосом в меланоцитах, который требует взаимодействия Rab27a с меланофилином для переключения с микротрубочек на транспорт на основе актина в периферических дендритах. 114 Однако недавно было показано, что Arf6-активированный Rac1 рекрутирует эффекторный Armus, член семейства TBC / RabGAP, что приводит к инактивации Rab7 и способствует деградации лизосом E-кадгерина, что предполагает еще одну возможную функцию для Rac1 / Rab7. сложный. 115 Более того, есть доказательства того, что V-АТФаза на поздних эндосомах / лизосомах может быть медиатором их связывания в кортикальной актиновой сети путем прямого связывания с F-актином. 116 , 117
Интересно, что белок Plekhm1 был идентифицирован как еще один предполагаемый эффектор Rab7 в остеокластах. 118 Мутации в Plekhm1 являются причиной остеопетроза при заболевании костей, при котором остеокласты дисфункциональны из-за дефектного образования RB, указывая тем самым, что Plekhm1 участвует в Rab7-зависимом эндосомном / лизосомном транспорте в RB. 118 Plekhm1 представляет собой большой цитозольный белок, который также обнаруживает некоторую локализацию на эндосомных / лизосомных пузырьках, куда он рекрутируется с помощью GTP-связанного Rab7. 118 Мутация, вызывающая остеопетроз, приводит к введению преждевременного стоп-кодона и, следовательно, укороченной формы Plekhm1, которая не может локализоваться в эндосомах / лизосомах, предполагая, что транспорт лизосом к RB в остеокластах зависит от ассоциации Plekhm1 с Rab7. Физическое взаимодействие между Plekhm1 и Rab7 недавно было подтверждено, хотя любопытно, что в этом исследовании авт. Предполагают, что Plekhm1 негативно регулирует эндоцитотический путь в клетках Hela. 119 Интересно, что в другом исследовании сообщалось о точечной мутации (R714C) в мутации Plekhm1, которая не влияет на локализацию Plekhm1, но вызывает генерализованную остеопению (низкую костную массу), что позволяет предположить, что это может быть мутация увеличения функции. 120 Взятые вместе, мы предлагаем модель (), в которой Plekhm1 может связывать Rab7 с основанным на микротрубочках транспортом поздних эндосом / лизосом к RB (например, посредством взаимодействия с кинезиновым двигателем), где взаимодействие между Rab7 и Rac1 может обеспечить переход от микротрубочек к кортикальной актиновой сети.
Rab7 также необходим для слияния лизосом с аутофагосомами с образованием аутолизосом и обеспечения деградации материала внутри аутофагосомы. 121 Кроме того, транспорт автолизосом по микротрубочкам стимулируется взаимодействием Rab7 с его эффектором FYCO1. 122 Интересно, что недавно было высказано предположение, что RB также проявляет характеристики мембран аутофагосом, такие как экспрессия белка Atg8 / LC3, который участвует в рекрутировании материала, который разрушается в результате аутофагии, а также в слиянии аутофагосом с лизосомами. . 123 , 124 Это поднимает интригующую возможность того, что слияние лизосом с RB может быть опосредовано через LC3 и / или что аутофагосомы транспортируются в RB в остеокластах. Недавняя статья указывает, что LC3 также играет роль в фагосомах в макрофагах, подтверждая идею о том, что локализация и функция LC3 не могут быть ограничены аутофагосомами. 125
Rab3D
Белки Rab3 участвуют в регулируемом экзоцитозе и поэтому в основном экспрессируются в клетках с высокими секреторными потребностями, особенно в нейронах и нейроэндокринных клетках.126,127 Изоформ Rab3 Rab3D высоко экспрессируется в остеокластах как на уровне мРНК, так и на уровне белка, тогда как экспрессия Rab3A, Rab3B и Rab3C намного ниже. 95 , 107 Кроме того, Rab3D важен для функции остеокластов, поскольку Rab3D-дефицитные мыши проявляют остеосклеротический фенотип (высокая костная масса) из-за дефектной резорбции остеокластами, которая может воспроизводиться сверхэкспрессией доминантно-отрицательных форма Rab3D в остеокластах in vitro. 107 Более того, остеокласты Rab3D-дефицитных мышей обнаруживают аномальный RB, что указывает на дефект везикулярного транспорта в этот домен.Однако Rab3D, по-видимому, не участвует в пути передачи лизосом, поскольку он локализуется в субпопуляции пост-TGN везикул в остеокластах. Rab3D может, следовательно, регулировать биогенез секреторного компартмента от TGN, хотя неясно, представляет ли этот компартмент полностью отличную везикулярную популяцию от Rab7-регулируемого эндоцитарного пути или эти везикулы сливаются с эндоцитарным путем, чтобы достичь RB. Rab3D может регулировать движение этих предполагаемых секреторных везикул путем рекрутирования моторного компонента динеина Tctex-1, с которым он связывается GTP-зависимым образом. 128
Трансцитоз
Высокая концентрация деградированных фрагментов коллагена, кальция и фосфата создается в результате разрушения костного матрикса, который необходимо удалить из лакуны резорбции, чтобы в конечном итоге они могли быть выведены с мочой. Однако SZ непроницаема для молекул размером более 10 кДа, что свидетельствует о существовании клеточного пути для очистки лакун этих продуктов. 128 Действительно, продукты деградации костей могут быть обнаружены внутри внутриклеточных везикул, в определенном домене базальной мембраны и во внеклеточном пространстве рядом с этой мембраной, 130 , 131 , что позволяет предположить, что эти продукты деградации передаются, хотя остеокласт путем трансцитоза.
Этот процесс может играть роль в уравновешивании мембранных доменов в остеокластах, а также в обеспечении дальнейшей деградации матричных фрагментов за счет действия устойчивой к тартрату кислой фосфатазы (TRAcP). 132 Центральная область домена базолатеральной мембраны, по которой транспортируются трансцитотические пузырьки, поэтому стала известна как функциональный секреторный домен (FSD) и имеет характеристики апикальной мембраны в эпителиальных клетках. 10 , 94 В соответствии с моделью трансцитоза центральная область RB проявляет обширную эндоцитарную активность, а белки оболочки везикул, такие как клатрин и AP-2, ограничены этим доменом вместе с динамином GTPase, 102 , 133 , что имеет решающее значение для отделения почкующихся пузырьков от мембраны.Точно так же, чтобы компенсировать потерю мембраны во время процесса поглощения матрикса, недавние данные свидетельствуют о том, что существует дополнительный «обратный» трансцитотический путь, который доставляет мембрану от FSD к RB. 134
Несмотря на выяснение этих уникальных путей переноса в остеокластах, Rab GTPases, которые их регулируют, остаются полностью неизвестными. В эпителиальных клетках Rab17 участвует в трансцитозе полимерного рецептора иммуноглобулина от базолатерального к апикальному домену, 135 , тогда как более недавнее сообщение указывает, что эффектор Rab11 Rab11-FIP5 также играет роль в этом процессе. 136 Однако эти данные трудно экстраполировать на остеокласты, учитывая уникальную природу мембран, между которыми происходит трансцитоз.
Малые ГТФазы и выживание остеокластов
Малые ГТФазы играют важную роль в выживании остеокластов, примером чего может служить способность бисфосфонатных препаратов вызывать апоптоз остеокластов в результате ингибирования пренилирования этих белков. 137 Ras GTPases являются ключевыми регуляторами выживаемости клеток и активируются многочисленными рецепторами клеточной поверхности для индукции ключевых путей передачи сигналов, включая ERK, MAP-киназу и PI3-киназу. 138 При активации Ras рекрутирует Raf-1, серин / треониновую киназу, которая впоследствии фосфорилирует и активирует MEK (MAPK / Erk киназа), которая, в свою очередь, фосфорилирует и активирует Erk1 и Erk2, которые необходимы для выживания клеток. 36 , 138 Другим эффектором Ras является фосфатидилинозитол-3-киназа (PI3K), которая активирует серин / треонинкиназу Akt / PKB, способствующую выживанию. 139 Сверхэкспрессия конститутивно активного Ras в остеокластах мышей способствует выживанию клеток, которое блокируется ингибированием PI3K или Raf-1, демонстрируя участие обоих Ras-индуцированных путей в выживании остеокластов. 140 Подтверждая участие Raf-1-зависимого пути, конститутивно активная форма MEK значительно увеличивает выживаемость остеокластов, не влияя на активность резорбции костей. 141
Недавно было описано, что PAK1 активирует экспрессию сурвивина ниже Raf-1 MEK-независимым образом, способствуя выживанию остеокластов. 142 Мутации в гене nf1, кодирующем нейрофибромин Ras GAP, приводят к нейрофиброматозу 1 типа, заболеванию, характеризующемуся опухолями нейрофибромы, дефектами пигментации кожи, костными пороками, дефектами обучения и предрасположенностью к избранным злокачественным новообразованиям. 143 У пациентов с Nf1 наблюдается потеря костной массы из-за дефектов как остеобластов, так и остеокластов. 143 Остеокласты этих пациентов выживают дольше в отсутствие сыворотки, чем контрольные остеокласты, подтверждая, что Ras является важным регулятором выживания остеокластов. 144
Хотя Ras играет роль в выживании остеокластов, его влияние на активность остеокластов остается неясным. Непрямое вмешательство в функцию большинства форм Ras путем ингибирования его пренилирования (с использованием специфического ингибитора фарнезилтрансферазы, FTI-277) не оказывало влияния на цитоскелет или активность остеокластов кролика. 30 Напротив, доминантная отрицательная экспрессия Ras в остеокластах птиц увеличивает секрецию лизосомальных ферментов, предполагая, что Ras может отрицательно регулировать активность остеокластов. 145 Более того, мышиные остеокласты от мышей Nf1 / — обладают повышенной активностью Ras, образованием и резорбцией актинового кольца. 146 , 147 Этот эффект опосредуется Rac, поскольку отсутствие Rac отменяет поляризацию и активность остеокластов, индуцированную Nf1. 147 Таким образом, точная роль Ras GTPases в остеокластах еще предстоит полностью выяснить.
Мало что известно о роли других малых GTPases в выживании остеокластов. Однако способность специфического ингибитора GGTase I, GGTI-298, сильно индуцировать апоптоз в остеокластах предполагает, что белки семейства Rho могут участвовать в этом процессе. 30 Действительно, сверхэкспрессия доминантно-отрицательной формы Rac1 в остеокластах мыши вызывает апоптоз и снижает резорбцию кости, в то время как конститутивно активный Rac1 увеличивает выживаемость клеток PI3K-зависимым образом, предполагая, что Rac действует не только на цитоскелет остеокластов, но также способствует выживанию остеокластов. 59
Заключение
В заключение, очевидно, что функция остеокластов и, следовательно, резорбция кости в значительной степени зависят от малых GTPases семейств Ras, Rho и Rab, которые все требуют посттрансляционного пренилирования для их правильной локализации и функция. Ингибирование пренилирования малых GTPases является основным механизмом действия препаратов, которые наиболее широко используются для ингибирования резорбции костей при обычных метаболических заболеваниях костей. Исследования роли специфических малых GTPases открыли дальнейшее понимание уникального расположения цитоскелета и путей переноса везикул в резорбирующихся остеокластах.Однако необходимы дальнейшие такие исследования, чтобы полностью понять, как эти пути регулируются в этом интересном типе клеток.
Благодарности
Текущее исследование авторов малых GTPases в остеокластах финансируется программным грантом 17285 и грантом проекта 19379 от Arthritis Research UK.
Аббревиатуры
| ARF | Фактор ADP-рибозилирования | ||||||||||
| BD | базолатеральный домен | ||||||||||
| CZH | CDM-зизимин 908 с гомологией | ||||||||||
| фарнезилдифосфат | |||||||||||
| FSD | Функциональный секреторный домен | ||||||||||
| GAP | GTPase Активирующий белок | ||||||||||
| GEF | GEF | Фактор обмена гуаниновых нуклеотидов Gran835 | геранилгеранилтрансфераза | ||||||||
| GPP | геранилдифосфат | ||||||||||
| HDAC | гистондеацетилаза | ||||||||||
| HRP | хрена | дипоксидаза | |||||||||
| MMP | матриксная металлопротеиназа | ||||||||||
| M-CSF | Фактор, стимулирующий колонии макрофагов | ||||||||||
| MEK | MAPK / Erk киназа | -бисфосфат-киназа | Nf1 | нейрофибромин | |||||||
| PAK | p21-активированная киназа | ||||||||||
| PI3K | фосфатидилинозитол-3-киназа | ||||||||||
| 3-киназа PI3- | |||||||||||
| -киназа PI3-фосфат-90-8-s-90-8-k-8 | PI (4,5) P2 | фосфатидилинозитол-4,5-бисфосфат | |||||||||
| PKC | протеинкиназа C | ||||||||||
| RANK | активатор рецептора NFkappaB | ruff | RGGT | Rab геранилгеранилтрансфераза | |||||||
| SZ | зона уплотнения | ||||||||||
| TGN | сеть транс-Гольджи | ||||||||||
| TRAcP | тартрат-устойчивая кислая фосфатаза | ||||||||||
| V-ATPase | вакуолярный тип H + 6-ATPase Белки синдрома Альдриха | ||||||||||
| WIP | WASp-взаимодействующий белок |
Ссылки
1.Бойл В.Дж., Саймонет В.С., Лейси Д.Л. Дифференциация и активация остеокластов. Природа. 2003. 423: 337–342. DOI: 10,1038 / природа01658. [PubMed] [CrossRef] [Google Scholar] 2. Negishi-Koga T, Takayanagi H. Передача сигналов Ca 2+ -NFATc1 является важной осью дифференцировки остеокластов. Immunol Rev.2009; 231: 241–256. DOI: 10.1111 / j.1600-065X.2009.00821.x. [PubMed] [CrossRef] [Google Scholar] 3. Teitelbaum SL. Резорбция кости остеокластами. Наука. 2000. 289: 1504–1508. [PubMed] [Google Scholar] 4. Vaananen HK, Zhao H, Mulari M, Halleen JM.Клеточная биология функции остеокластов. J Cell Sci. 2000. 113: 377–381. [PubMed] [Google Scholar] 5. Spinardi L, Marchisio PC. Подосомы как умные регуляторы клеточной адгезии. Eur J Cell Biol. 2006; 85: 191–194. DOI: 10.1016 / j.ejcb.2005.08.005. [PubMed] [CrossRef] [Google Scholar] 6. Jurdic P, Saltel F, Chabadel A, Destaing O. Подосома и зона уплотнения: Специфика модели остеокластов. Eur J Cell Biol. 2006. 85: 195–202. DOI: 10.1016 / j.ejcb.2005.09.008. [PubMed] [CrossRef] [Google Scholar] 7. Дестаинг О, Сальтел Ф, Джеминард Дж. К., Юрдич П., Бард Ф.Подосомы демонстрируют оборот актина и динамическую самоорганизацию в остеокластах, экспрессирующих актин-зеленый флуоресцентный белок. Mol Biol Cell. 2003. 14: 407–416. DOI: 10.1091 / mbc.E02-07-0389. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Block MR, Badowski C, Millon-Fremillon A, Bouvard D, Bouin AP, Faurobert E, et al. Спайки подосомного типа и фокальные спайки, такие похожие, но такие разные. Eur J Cell Biol. 2008. 87: 491–506. DOI: 10.1016 / j.ejcb.2008.02.012. [PubMed] [CrossRef] [Google Scholar] 9.Luxenburg C, Geblinger D, Klein E, Anderson K, Hanein D, Geiger B и др. Архитектура адгезивного аппарата культивируемых остеокластов: от образования подосом до сборки зоны уплотнения. PLoS One. 2007; 2: 179. DOI: 10.1371 / journal.pone.0000179. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 10. Mulari M, Vaaraniemi J, Vaananen HK. Внутриклеточный мембранный перенос остеокластов, резорбирующих костную ткань. Microsc Res Tech. 2003. 61: 496–503. DOI: 10.1002 / jemt.10371. [PubMed] [CrossRef] [Google Scholar] 11.Lakkakorpi PT, Vaananen HK. Цитоскелетные изменения остеокластов во время цикла резорбции. Microsc Res Tech. 1996; 33: 171–181. DOI: 2-W. [PubMed] [Google Scholar] 12. Палокангас Х, Мулари М, Ваананен Х. Эндоцитарный путь от базальной плазматической мембраны к взъерошенной пограничной мембране в остеокластах, резорбирующих кость. J Cell Sci. 1997; 110: 1767–1780. [PubMed] [Google Scholar] 13. Чжан Флорида, Кейси П.Дж. Пренилирование белков: молекулярные механизмы и функциональные последствия. Анну Рев Биохим. 1996. 65: 241–269.DOI: 10.1146 / annurev.bi.65.070196.001325. [PubMed] [CrossRef] [Google Scholar] 14. Luckman SP, Hughes DE, Coxon FP, Graham R, Russell G, Rogers MJ. Азотсодержащие бисфосфонаты ингибируют мевалонатный путь и предотвращают посттрансляционное пренилирование GTP-связывающих белков, включая ras. J Bone Miner Res. 1998. 13: 581–589. DOI: 10.1359 / jbmr.1998.13.4.581. [PubMed] [CrossRef] [Google Scholar] 15. Фишер Дж. Э., Роджерс М. Дж., Халаси Дж. М., Лакман С. П., Хьюз Д. Е., Масарачиа П. Дж. И др. Механизм действия алендроната: геранилгераниол, промежуточное звено мевалонатного пути, предотвращает ингибирование образования остеокластов, резорбции костей и активации киназ in vitro.Proc Natl Acad Sci USA. 1999. 96: 133–138. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Рассел Р.Г., Уоттс Н.Б., Эбетино Ф.Х., Роджерс М.Дж. Механизмы действия бисфосфонатов: сходства и различия и их потенциальное влияние на клиническую эффективность. Osteoporos Int. 2008; 19: 733–759. DOI: 10.1007 / s00198-007-0540-8. [PubMed] [CrossRef] [Google Scholar] 17. Coxon FP, Thompson K, Roelofs AJ, Ebetino FH, Rogers MJ. Визуализация связывания минералов и поглощения бисфосфоната остеокластами и нерезорбирующимися клетками.Кость. 2008; 42: 848–860. DOI: 10.1016 / j.bone.2007.12.225. [PubMed] [CrossRef] [Google Scholar] 18. Роджерс MJ, Crockett JC, Coxon FP, Monkkonen J. Биохимические и молекулярные механизмы действия бисфосфонатов. Кость. 2010 г. doi: 10.1016 / j.bone.2010.11.008. [PubMed] [CrossRef] [Google Scholar] 19. van Beek E, Pieterman E, Cohen L, Lowik C, Papapoulos S. Фарнезилпирофосфатсинтаза является молекулярной мишенью азотсодержащих бисфосфонатов. Biochem Biophys Res Commun. 1999; 264: 108–111. DOI: 10.1006 / bbrc.1999.1499. [PubMed] [CrossRef] [Google Scholar] 20. Данфорд Дж. Э., Томпсон К., Коксон Ф. П., Лакман С. П., Хан Ф. М., Поултер С. Д. и др. Отношения структура-активность для ингибирования фарнезилдифосфатсинтазы in vitro и ингибирования резорбции костей in vivo азотсодержащими бисфосфонатами. J Pharmacol Exp Ther. 2001; 296: 235–242. [PubMed] [Google Scholar] 21. Роджерс MJ. Новое понимание молекулярных механизмов действия бисфосфонатов. Curr Pharm Des. 2003; 9: 2643–2658. [PubMed] [Google Scholar] 22.Кавана К.Л., Гуо К., Данфорд Дж. Э., Ву Х, Кнапп С., Эбетино Ф. Х. и др. Молекулярный механизм действия азотсодержащих бисфосфонатов как противостеопорозных препаратов. Proc Natl Acad Sci USA. 2006; 103: 7829–7834. DOI: 10.1073 / pnas.0601643103. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Rondeau JM, Bitsch F, Bourgier E, Geiser M, Hemmig R, Kroemer M, et al. Структурная основа исключительной эффективности бисфосфонатных препаратов in vivo. ChemMedChem. 2006; 1: 267–273. DOI: 10.1002 / cmdc.200500059. [PubMed] [CrossRef] [Google Scholar] 24.Данфорд Дж. Э., Квази А. А., Роджерс М. Дж., Барнетт Б. Л., Эбетино Ф. Х., Рассел Р. Г. и др. Взаимосвязь между структурой и активностью азотсодержащих бисфосфонатов при клиническом использовании и других аналогов: Зависящее от времени ингибирование фарнезилпирофосфатсинтазы человека. J Med Chem. 2008. 51: 2187–2195. DOI: 10,1021 / jm7015733. [PubMed] [CrossRef] [Google Scholar] 25. Coxon FP, Ebetino FH, Mules EH, Seabra MC, McKenna CE, Rogers MJ. Фосфонокарбоксилатные ингибиторы геранилгеранилтрансферазы кролика нарушают пренилирование и мембранную локализацию кроличьих белков в остеокластах in vitro и in vivo.Кость. 2005. 37: 349–358. DOI: 10.1016 / j.bone.2005.04.021. [PubMed] [CrossRef] [Google Scholar] 26. Luckman SP, Coxon FP, Ebetino FH, Russell RG, Rogers MJ. Гетероциклсодержащие бисфосфонаты вызывают апоптоз и ингибируют резорбцию костей, предотвращая пренилирование белков: данные о взаимосвязи структура-активность в макрофагах J774. J Bone Miner Res. 1998. 13: 1668–1678. DOI: 10.1359 / jbmr.1998.13.11.1668. [PubMed] [CrossRef] [Google Scholar] 27. Рулофс А.Дж., Томпсон К., Гордон С., Роджерс М.Дж. Молекулярные механизмы действия бисфосфонатов: современное состояние.Clin Cancer Res. 2006; 12: 6222–6230. DOI: 10.1158 / 1078-0432.CCR-06-0843. [PubMed] [CrossRef] [Google Scholar] 28. Данфорд Дж. Э., Роджерс М. Дж., Эбетино Ф. Х., Фиппс Р. Дж., Коксон Ф. П.. Ингибирование пренилирования белков бисфосфонатами вызывает длительную активацию rac, Cdc42 и rho GTPases. J Bone Miner Res. 2006. 21: 684–694. DOI: 10.1359 / jbmr.060118. [PubMed] [CrossRef] [Google Scholar] 29. van beek E, Lowik C, van der Pluijm G, Papapoulos S. Роль геранилгеранилирования в резорбции кости и его подавление бисфосфонатами в костных эксплантатах плода in vitro: ключ к механизму действия азотсодержащих бисфосфонатов.J Bone Miner Res. 1999; 14: 722–729. DOI: 10.1359 / jbmr.1999.14.5.722. [PubMed] [CrossRef] [Google Scholar] 30. Coxon FP, Helfrich MH, Van’t Hof R, Sebti S, Ralston SH, Hamilton A и др. Геранилгеранилирование белков необходимо для образования, функционирования и выживания остеокластов: ингибирование бисфосфонатами и GGTI-298. J Bone Miner Res. 2000; 15: 1467–1476. DOI: 10.1359 / jbmr.2000.15.8.1467. [PubMed] [CrossRef] [Google Scholar] 31. Coxon FP, Helfrich MH, Larijani B., Muzylak M, Dunford JE, Marshall D, et al.Идентификация нового фосфонокарбоксилатного ингибитора геранилгеранилтрансферазы кролика, который специфически предотвращает пренилирование кролика в остеокластах и макрофагах. J Biol Chem. 2001; 276: 48213–48222. DOI: 10.1074 / jbc.M106473200. [PubMed] [CrossRef] [Google Scholar] 32. Барон Р.А., Таваре Р., Фигейредо А.С., Блажевска К.М., Кашемиров Б.А., МакКенна С.Е. и др. Фосфонокарбоксилаты ингибируют второе присоединение геранил-геранила рабгеранилгеранилтрансферазой. J Biol Chem. 2009. 284: 6861–6868. DOI: 10.1074 / JBC.M806952200. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 33. Деттер Дж. К., Чжан К., Мулс Е. Х., Новак Е. К., Мишра В. С., Ли В. и др. Альфа-мутация рабгеранилгеранилтрансферазы у мышей бронзового цвета снижает пренилирование кролика и синтез тромбоцитов. Proc Natl Acad Sci USA. 2000. 97: 4144–4149. DOI: 10.1073 / pnas.080517697. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 34. Coxon FP, Taylor A, Stewart CA, Baron R, Seabra MC, Ebetino FH и др. Мышь с бронзовым покрытием обнаружила, что геранилгеранилтрансфераза раба является основной молекулярной мишенью для фосфонокарбоксилатных аналогов бисфосфонатов.Кость. 2011 г. DOI: 10.1016 / j.bone.2011.03.686. [PubMed] [CrossRef] [Google Scholar] 35. Тейлор А., Мулз Э. Х., Сибра М. Х., Хелфрих М. Х., Роджерс М. Дж., Коксон Ф. П.. Нарушение пренилирования Rab GTPases у мышей Gunmetal вызывает дефекты функции костных клеток. Малые GTPases. 2011; 2: 131–142. DOI: 10.4161 / sgtp.2.3.16488. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 36. Накамура И., Пилкингтон М.Ф., Лаккакорпи П.Т., Липферт Л., Симс С.М., Диксон С.Дж. и др. Роль интегрина альфа (v) бета (3) в миграции остеокластов и формировании зоны уплотнения.J Cell Sci. 1999; 112: 3985–3993. [PubMed] [Google Scholar] 37. МакХью К.П., Ходивала-Дилке К., Чжэн М.Х., Намба Н., Лам Дж., Новак Д. и др. Мыши, лишенные интегринов бета3, остеосклеротичны из-за дисфункциональных остеокластов. J Clin Invest. 2000; 105: 433–440. DOI: 10.1172 / JCI8905. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 38. Клевер Дж., Доддс Р.А., Гоуэн М. Экспрессия субъединицы интегрина человеческими остеобластами и остеокластами in situ и в культуре. J Cell Sci. 1992. 103: 267–271. [PubMed] [Google Scholar] 39.Шинар Д.М., Шмидт А., Гальперин Д., Родан Г.А., Вайнреб М. Экспрессия субъединиц интегрина alphav и beta3 в остеокластах крысы in situ. J Bone Miner Res. 1993. 8: 403–414. DOI: 10.1002 / jbmr.5650080404. [PubMed] [CrossRef] [Google Scholar] 40. Duong LT, Lakkakorpi PT, Nakamura I, Machwate M, Nagy RM, Rodan GA. PYK2 в остеокластах представляет собой киназу адгезии, локализованную в зоне уплотнения, активируемую лигированием интегрина альфа (v) бета3 и фосфорилируемую киназой src. J Clin Invest. 1998. 102: 881–892. DOI: 10.1172 / JCI3212. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 41. Sanjay A, Houghton A, Neff L, DiDomenico E, Bardelay C, Antoine E, et al. Cbl связывается с Pyk2 и src для регулирования активности киназы src, передачи сигналов, опосредованной интегрином альфа (v) бета (3), клеточной адгезии и подвижности остеокластов. J Cell Biol. 2001; 152: 181–195. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Цзоу В., Китаура Х., Рив Дж., Лонг Ф., Тибулевич В.Л., Шаттил С.Дж. и др. Syk, c-src, интегрин alphavbeta3 и иммунорецепторы ITAM совместно регулируют резорбцию костной ткани остеокластами.J Cell Biol. 2007; 176: 877–888. DOI: 10.1083 / jcb.200611083. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 43. Миядзаки Т., Санджай А., Нефф Л., Танака С., Хорн В. К., Барон Р. Активность киназы Src необходима для функции остеокластов. J Biol Chem. 2004. 279: 17660–17666. DOI: 10.1074 / jbc.M311032200. [PubMed] [CrossRef] [Google Scholar] 44. Гил-Хенн Х., Дестейн О, Симс Н.А., Аоки К., Аллес Н., Нефф Л. и др. Дефектная микротрубочка-зависимая организация подосом в остеокластах приводит к увеличению плотности костной ткани у мышей Pyk2 (- / -).J Cell Biol. 2007; 178: 1053–1064. DOI: 10.1083 / jcb.200701148. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Чиусароли Р., Санджай А., Хенриксен К., Энгсиг М. Т., Хорн В. К., Гу Х и др. Делеция гена, кодирующего c-cbl, изменяет способность остеокластов к миграции, задерживая резорбцию и оссификацию хряща во время развития длинных костей. Dev Biol. 2003. 261: 537–547. [PubMed] [Google Scholar] 46. Дестаинг О, Санджай А., Итцштейн С., Хорн В. К., Тоомре Д., Де Камилли П. и др. Активность тирозинкиназы c-src регулирует динамику актина и организацию подосом в остеокластах.Mol Biol Cell. 2008; 19: 394–404. DOI: 10.1091 / mbc.E07-03-0227. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 47. Brazier H, Stephens S, Ory S., Fort P, Morrison N, Blangy A. Профиль экспрессии RhoGTPases и RhoGEFs во время остеокластогенеза, стимулированного RANKL: Идентификация основных генов в остеокластах. J Bone Miner Res. 2006; 21: 1387–1398. DOI: 10.1359 / jbmr.060613. [PubMed] [CrossRef] [Google Scholar] 48. Ory S, Brazier H, Pawlak G, Blangy A. Rho GTPases в остеокластах: оркестраторы расположения подосом.Eur J Cell Biol. 2008; 87: 469–477. DOI: 10.1016 / j.ejcb.2008.03.002. [PubMed] [CrossRef] [Google Scholar] 50. Heckel T, Czupalla C, Expirto Santo AI, Anitei M, Arantzazu Sanchez-Fernandez M, Mosch K и др. Src-зависимая репрессия ARF6 необходима для поддержания богатых подосомами герметизирующих зон в переваривающих кость остеокластах. Proc Natl Acad Sci USA. 2009; 106: 1451–1456. DOI: 10.1073 / pnas.0804464106. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Чжан Д., Удагава Н., Накамура И., Мураками Х., Сайто С., Ямасаки К. и др.Небольшой GTP-связывающий белок, rho p21, участвует в резорбции кости, регулируя организацию цитоскелета в остеокластах. J Cell Sci. 1995; 108: 2285–2292. [PubMed] [Google Scholar] 52. Saltel F, Destaing O, Bard F, Eichert D, Jurdic P. Апатит-опосредованная динамика актина в резорбирующихся остеокластах. Mol Biol Cell. 2004; 15: 5231–5241. DOI: 10.1091 / mbc.E04-06-0522. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 53. Уайт Л.С., Райберг Э., Симс Н.А., Ридж С.А., Маки К., Гресли П.Дж. и др. Предполагаемый каннабиноидный рецептор GPR55 влияет на функцию остеокластов in vitro и костную массу in vivo.Proc Natl Acad Sci USA. 2009. 106: 16511–16516. DOI: 10.1073 / pnas.03106. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 54. Ory S, Munari-Silem Y, Fort P, Jurdic P. Rho и rac обладают антагонистическими функциями в отношении распространения многоядерных клеток, полученных из макрофагов, и не требуются для образования актиновых волокон. J Cell Sci. 2000; 113: 1177–1188. [PubMed] [Google Scholar] 55. Chellaiah MA, Soga N, Swanson S, McAllister S, Alvarez U, Wang D, et al. Rho-A имеет решающее значение для организации подосомы остеокластов, подвижности и резорбции кости.J Biol Chem. 2000; 275: 11993–12002. [PubMed] [Google Scholar] 56. Дестаинг О, Салтел Ф, Гилкин Б., Хабадель А., Хочбин С., Ори С. и др. Новый путь rho-mDia2-HDAC6 контролирует формирование паттерна подосом посредством ацетилирования микротрубочек в остеокластах. J Cell Sci. 2005. 118: 2901–2911. DOI: 10.1242 / jcs.02425. [PubMed] [CrossRef] [Google Scholar] 57. Chellaiah MA. Регуляция образования актинового кольца rho-GTPases в остеокластах. J Biol Chem. 2005; 280: 32930–32943. DOI: 10.1074 / jbc.M500154200. [PubMed] [CrossRef] [Google Scholar] 58.Шрамп М., Инь О, Ким Т.Ю., Мартин Г.С. ERK5 способствует src-индуцированному образованию подосом, ограничивая активацию rho. J Cell Biol. 2008. 181: 1195–1210. DOI: 10.1083 / jcb.200801078. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Фукуда А., Хикита А., Вакеяма Х, Акияма Т., Ода Х, Накамура К. и др. Регулирование апоптоза и подвижности остеокластов с помощью малого GTPase-связывающего белка Rac1. J Bone Miner Res. 2005; 20: 2245–2253. DOI: 10.1359 / JBMR.050816. [PubMed] [CrossRef] [Google Scholar] 60. Сакаи Х, Чен Й, Итокава Т, Ю КП, Чжу М.Л., Инсогна К.Активированный c-fms рекрутирует vav и rac во время индуцированного CSF-1 ремоделирования цитоскелета и распространения в остеокластах. Кость. 2006; 39: 1290–1301. DOI: 10.1016 / j.bone.2006.06.012. [PubMed] [CrossRef] [Google Scholar] 61. Razzouk S, Lieberherr M, Cournot G. Rac-GTPase, цитоскелет остеокластов и резорбция кости. Eur J Cell Biol. 1999; 78: 249–255. [PubMed] [Google Scholar] 62. Итокова Т., Чжу М.Л., Троиано Н., Биан Дж., Кавано Т., Инсогна К. Остеокласты, лишенные Rac2, обладают дефектным хемотаксисом и резорбтивной активностью.Calcif Tissue Int. 2010 г. DOI: 10.1007 / s00223-010-9435-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 63. Россман К.Л., Дер С.Дж., Сондек Дж. ГЭФ означает: «Включение RHO GTPases с факторами обмена гуаниновых нуклеотидов». Nat Rev Mol Cell Biol. 2005; 6: 167–180. DOI: 10,1038 / nrm1587. [PubMed] [CrossRef] [Google Scholar] 64. Меллер Н., Мерло С., Гуда С. Белки CZH: новое семейство rho-GEF. J Cell Sci. 2005. 118: 4937–4946. DOI: 10.1242 / jcs.02671. [PubMed] [CrossRef] [Google Scholar] 65. Фаччио Р., Тейтельбаум С.Л., Фуджикава К., Чаппел Дж., Заллоне А., Тибулевич В.Л. и др.Vav3 регулирует функцию остеокластов и костную массу. Nat Med. 2005; 11: 284–290. DOI: 10,1038 / нм1194. [PubMed] [CrossRef] [Google Scholar] 66. Кубо Т., Ямашита Т., Ямагути А., Сумимото Н., Хосокава К., Тохьяма М. Новый домен FERM, включающий фактор обмена гуаниновых нуклеотидов, участвует в передаче сигналов rac и регулирует ремоделирование нейритов. J Neurosci. 2002; 22: 8504–8513. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Такегахара Н., Кан С., Нодзима С., Такамацу Х., Окуно Т., Кикутани Х. и др. Интегральная роль фактора обмена гуаниновых нуклеотидов, FARP2, в перестройках подосом остеокластов.FASEB J. 2010; 24: 4782–4792. DOI: 10.1096 / fj.10-158212. [PubMed] [CrossRef] [Google Scholar] 68. Вивес В., Лаурин М., Црес Дж., Ларрус П., Моришо З., Ноэль Д. и др. Фактор обмена Rac1 Dock5 необходим для резорбции костной ткани остеокластами. J Bone Miner Res. DOI 2010: 10.1002 / jbmr.282. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 69. Радхакришна Х., Аль-Авар О, Хачикян З., Дональдсон Дж. Г.. Необходимость ARF6 для взъерошивания раковых клеток предполагает роль мембранного транспорта в кортикальных перестройках актина.J Cell Sci. 1999; 112: 855–866. [PubMed] [Google Scholar] 70. Tushir JS, D’Souza-Schorey C. ARF6-зависимая активация ERK и Rac1 модулирует развитие эпителиальных канальцев. EMBO J. 2007; 26: 1806–1819. DOI: 10.1038 / sj.emboj.7601644. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 71. Menon P, Yin G, Smolock EM, Zuscik MJ, Yan C, Berk BC. Белок 1, взаимодействующий с киназой 2 GPCR (GIT1), регулирует функцию остеокластов и костную массу. J. Cell Physiol. 2010; 225: 777–785. DOI: 10.1002 / jcp.22282. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 72.Грингель А., Вальц Д., Розенбергер Г., Минден А., Кутше К., Копп П. и др. PAK4 и alphaPIX определяют размер и количество подосом в макрофагах посредством локальной регуляции актина. J. Cell Physiol. 2006. 209: 568–579. DOI: 10.1002 / jcp.20777. [PubMed] [CrossRef] [Google Scholar] 73. Франк С.Р., Хансен Ш. Комплекс PIX-GIT: сигнальная кассета G-белка, контролирующая форму клеток. Semin Cell Dev Biol. 2008. 19: 234–244. DOI: 10.1016 / j.semcdb.2008.01.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 74.Розенбергер Г., Кутше К. AlphaPIX и betaPIX и их роль в формировании фокальной адгезии. Eur J Cell Biol. 2006. 85: 265–274. DOI: 10.1016 / j.ejcb.2005.10.007. [PubMed] [CrossRef] [Google Scholar] 75. Уэбб Б.А., Ив Р., Кроули С.В., Чжоу С., Кот Г.П., Мак А.С. PAK1 индуцирует образование подосом в клетках гладких мышц сосудов A7r5 зависимым от PAK-взаимодействующего фактора обмена образом. Am J Physiol Cell Physiol. 2005; 289: 898–907. DOI: 10.1152 / ajpcell.00095.2005. [PubMed] [CrossRef] [Google Scholar] 76. Рохатги Р., Ма Л., Мики Х., Лопес М., Кирххаузен Т., Такенава Т. и др.Взаимодействие между N-WASP и комплексом Arp2 / 3 связывает Cdc42-зависимые сигналы со сборкой актина. Клетка. 1999; 97: 221–231. [PubMed] [Google Scholar] 77. Монипенни Дж., Чоу Х.С., Банон-Родригес И., Трэшер А.Дж., Антон И.М., Джонс Г.Е. и др. Роль WASP в клеточной полярности и подосомной динамике миелоидных клеток. Eur J Cell Biol. 2010 г. doi: 10.1016 / j.ejcb.2010.05.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 78. Джоберти Г., Петерсен С., Гао Л., Макара И.Г. Белок клеточной полярности Par6 связывает Par3 и атипичную протеинкиназу C с Cdc42.Nat Cell Biol. 2000; 2: 531–539. DOI: 10,1038 / 35019573. [PubMed] [CrossRef] [Google Scholar] 79. Ито Ю., Тейтельбаум С.Л., Цзоу В., Чжэн Ю., Джонсон Дж. Ф., Чаппел Дж. И др. Cdc42 регулирует моделирование и ремоделирование костей у мышей путем модуляции передачи сигналов RANKL / M-CSF и поляризации остеокластов. J Clin Invest. 2010; 120: 1981–1993. DOI: 10,1172 / JCI39650; 10.1172 / JCI39650. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 80. Calle Y, Jones GE, Jagger C, Fuller K, Blundell MP, Chow J, et al. Дефицит WASp у мышей приводит к неспособности формировать зоны уплотнения остеокластов и дефектам резорбции кости.Кровь. 2004. 103: 3552–3561. DOI: 10.1182 / кровь-2003-04-1259. [PubMed] [CrossRef] [Google Scholar] 81. Chellaiah MA, Kuppuswamy D, Lasky L, Linder S. Фосфорилирование сигнального комплекса, связанного с белком синдрома Вискотта-Олдрича, имеет решающее значение для резорбции костной ткани остеокластами. J Biol Chem. 2007. 282: 10104–10116. DOI: 10.1074 / jbc.M608957200. [PubMed] [CrossRef] [Google Scholar] 82. Ма Т, Саманна V, Челлайя М.А. Резкое ингибирование образования герметизирующего кольца остеокластов и резорбции кости in vitro с помощью WASP-пептида, содержащего аминокислоту pTyr 294 .Сигнал J Mol. 2008; 3: 4. DOI: 10.1186 / 1750-2187-3-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 83. Чоу ХК, Антон И.М., Холт М.Р., Курсио С., Ланзардо С., Уорт А. и др. WIP регулирует стабильность и локализацию WASP в подосомах в мигрирующих дендритных клетках. Curr Biol. 2006; 16: 2337–2344. DOI: 10.1016 / j.cub.2006.10.037. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 84. Chabadel A, Banon-Rodriguez I, Cluet D, Rudkin BB, Wehrle-Haller B, Genot E, et al. Интегрин CD44 и бета3 организуют два функционально различных домена на основе актина в остеокластах.Mol Biol Cell. 2007. 18: 4899–4910. DOI: 10.1091 / mbc.E07-04-0378. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 85. Szczepanowska J. Участие пути Rac / Cdc42 / PAK в перестройках цитоскелета. Acta Biochim Pol. 2009. 56: 225–234. [PubMed] [Google Scholar] 86. Уэбб Б.А., Евс Р., Мак А.С. Кортактин регулирует образование подосом: роли доменов взаимодействия с белками. Exp Cell Res. 2006; 312: 760–769. DOI: 10.1016 / j.yexcr.2005.11.032. [PubMed] [CrossRef] [Google Scholar] 87. Люксенбург К., Парсонс Дж. Т., Аддади Л., Гейгер Б.Участие пути src-cortactin в формировании и обороте подосом во время поляризации культивируемых остеокластов. J Cell Sci. 2006; 119: 4878–4888. DOI: 10.1242 / jcs.03271. [PubMed] [CrossRef] [Google Scholar] 88. Уэбб Б.А., Чжоу С., Ив Р., Шен Л., Цзя Л., Мак А.С. Фосфорилирование кортактина р21-активированной киназой. Arch Biochem Biophys. 2006; 456: 183–193. DOI: 10.1016 / j.abb.2006.06.011. [PubMed] [CrossRef] [Google Scholar] 89. Сарас Дж., Воллберг П., Аспенстром П. Wrch2 представляет собой GTPase-дефицитный Cdc42-подобный белок с необычными характеристиками связывания и клеточными эффектами.Exp Cell Res. 2004. 299: 356–369. DOI: 10.1016 / j.yexcr.2004.05.029. [PubMed] [CrossRef] [Google Scholar] 90. Ory S, Brazier H, Blangy A. Идентификация сигнала локализации двусторонней фокальной адгезии в RhoU / Wrch-1, GTPase семейства rho, которая регулирует клеточную адгезию и миграцию. Biol Cell. 2007; 99: 701–716. DOI: 10.1042 / BC20070058. [PubMed] [CrossRef] [Google Scholar] 91. Брэди, округ Колумбия, Алан Дж. К., Мэдиган Дж. П., Фаннинг А.С., Кокс А.Д. Трансформирующая GTPase wrch-1 семейства rho разрушает плотные соединения эпителиальных клеток и эпителиальный морфогенез.Mol Cell Biol. 2009; 29: 1035–1049. DOI: 10.1128 / MCB.00336-08. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 92. Алан Дж. К., Берзат А. С., Дьюар Б. Дж., Грейвс Л. М., Кокс А. Д.. Регулирование малой GTPase wrch-1 / RhoU семейства rho с помощью C-концевого фосфорилирования тирозина требует src. Mol Cell Biol. 2010. 30: 4324–4338. DOI: 10.1128 / MCB.01646-09. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 93. Brazier H, Pawlak G, Vives V, Blangy A. rho GTPase Wrch2 регулирует адгезию и миграцию предшественников остеокластов.Int J Biochem Cell Biol. 2009; 41: 1391–1401. DOI: 10.1016 / j.biocel.2008.12.007. [PubMed] [CrossRef] [Google Scholar] 94. Сало Дж., Метсикко К., Палокангас Х., Лехенкари П., Ваананен Х. К.. Остеокласты, резорбирующие кости, обнаруживают динамическое разделение базальной плазматической мембраны на два разных домена. J Cell Sci. 1996; 109: 301–307. [PubMed] [Google Scholar] 95. Чжао Х., Эттала О, Ваананен Х. Пути внутриклеточного транспорта через мембрану в резорбирующих костную ткань остеокластах выявлены с помощью клонирования и исследований субклеточной локализации малых GTP-связывающих белков кролика.Biochem Biophys Res Commun. 2002; 293: 1060–1065. DOI: 10.1016 / S0006-291X (02) 00326-1. [PubMed] [CrossRef] [Google Scholar] 96. Блэр Х.С., Тейтельбаум С.Л., Гизелли Р., Глюк С. Остеокластическая резорбция кости с помощью поляризованного вакуолярного протонного насоса. Наука. 1989; 245: 855–857. [PubMed] [Google Scholar] 97. Тоемура Т., Мурата Ю., Ямамото А., Ока Т., Сан-Вада Г.Х., Вада Ю. и др. От лизосом к плазматической мембране: локализация вакуолярной H + -АТФазы с изоформой a3 во время дифференцировки остеокластов.J Biol Chem. 2003; 278: 22023–22030. DOI: 10.1074 / jbc.M302436200. [PubMed] [CrossRef] [Google Scholar] 98. Корнак У., Каспер Д., Босл М.Р., Кайзер Э., Швайцер М., Шульц А. и др. Потеря хлоридного канала ClC-7 приводит к остеопетрозу у мышей и человека. Клетка. 2001; 104: 205–215. [PubMed] [Google Scholar] 99. Чжао Х., Ваананен Х. Фармакологическая секвестрация внутриклеточного холестерина в поздних эндосомах нарушает образование неровных границ в остеокластах. J Bone Miner Res. 2006; 21: 456–465. DOI: 10.1359 / JBMR.051204. [PubMed] [CrossRef] [Google Scholar] 100. Zaidi M, Troen B, Moonga BS, Abe E. Катепсин K, остеокластическая резорбция и терапия остеопороза. J Bone Miner Res. 2001; 16: 1747–1749. DOI: 10.1359 / jbmr.2001.16.10.1747. [PubMed] [CrossRef] [Google Scholar] 101. Everts V, Delaisse JM, Korper W., Niehof A, Vaes G, Beertsen W. Распад коллагена в резорбирующем кость компартменте под остеокластом включает как цистеин-протеиназы, так и матриксные металлопротеиназы. J. Cell Physiol. 1992; 150: 221–231.DOI: 10.1002 / jcp.1041500202. [PubMed] [CrossRef] [Google Scholar] 102. Mulari MT, Zhao H, Lakkakorpi PT, Vaananen HK. Рифленая граница остеокластов имеет отдельные субдомены для секреции и захвата деградированного матрикса. Движение. 2003. 4: 113–125. [PubMed] [Google Scholar] 103. Schwartz SL, Cao C, Пилипенко O, Rak A, Wandinger-Ness A. Rab GTPases с первого взгляда. J Cell Sci. 2007; 120: 3905–3910. DOI: 10.1242 / jcs.015909. [PubMed] [CrossRef] [Google Scholar] 104. Закки П., Стенмарк Х., Партон Р.Г., Ориоли Д., Лим Ф., Гинер А. и др.Rab17 регулирует перенос через мембрану посредством апикальных рециклирующих эндосом в поляризованных эпителиальных клетках. J Cell Biol. 1998; 140: 1039–1053. [Бесплатная статья PMC] [PubMed] [Google Scholar] 105. Кария Й., Хонма М., Ханамура А., Аоки С., Ниномия Т., Накамичи Ю. и др. Rab27a и Rab27b участвуют в зависимом от стимуляции высвобождении RANKL из секреторных лизосом в остеобластных клетках. J Bone Miner Res. DOI 2010: 10.1002 / jbmr.268. [PubMed] [CrossRef] [Google Scholar] 106. Ha BG, Hong JM, Park JY, Ha MH, Kim TH, Cho JY и др.Протеомный профиль белков мембраны остеокластов: идентификация домена обменника Na + / H + , содержащего 2, и его роль в слиянии остеокластов. Протеомика. 2008; 8: 2625–2639. DOI: 10.1002 / pmic.200701192. [PubMed] [CrossRef] [Google Scholar] 107. Павлос Нью-Джерси, Сюй Дж., Ридель Д., Йео Дж. С., Тейтельбаум С. Л., Пападимитриу Дж. М. и др. Rab3D регулирует новый путь везикулярного транспорта, который необходим для резорбции остеокластической кости. Mol Cell Biol. 2005; 25: 5253–5269. DOI: 10.1128 / MCB.25.12.5253-69.2005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 108. Тейлор А., Роджерс М.Дж., Тош Д., Коксон Ф.П. Новый метод эффективного получения трансфицированных остеокластов человека. Calcif Tissue Int. 2007. 80: 132–136. DOI: 10.1007 / s00223-006-0245-6. [PubMed] [CrossRef] [Google Scholar] 109. Feng Y, Press B, Wandinger-Ness A. Rab 7: важный регулятор позднего мембранного движения эндоцитов. J Cell Biol. 1995; 131: 1435–1452. [Бесплатная статья PMC] [PubMed] [Google Scholar] 111. Jordens I, Fernandez-Borja M, Marsman M, Dusseljee S, Janssen L, Calafat J, et al.Эффекторный белок RILP Rab7 контролирует лизосомный транспорт, индуцируя рекрутирование динеин-динактиновых моторов. Curr Biol. 2001; 11: 1680–1685. [PubMed] [Google Scholar] 112. Чжао Х., Лайтала-Лейнонен Т., Парикка В., Ваананен Х. К.. Подавление малой GTPase Rab7 нарушает поляризацию остеокластов и резорбцию кости. J Biol Chem. 2001; 276: 39295–39302. DOI: 10.1074 / jbc.M010999200. [PubMed] [CrossRef] [Google Scholar] 113. Sun Y, Buki KG, Ettala O, Vaaraniemi JP, Vaananen HK. Возможная роль прямого взаимодействия Rac1-Rab7 в формировании взъерошенных границ остеокластов.J Biol Chem. 2005; 280: 32356–32361. DOI: 10.1074 / jbc.M414213200. [PubMed] [CrossRef] [Google Scholar] 114. Юм А.Н., Ушаков Д.С., Тарафдер А.К., Ференци М.А., Seabra MC. Rab27a и MyoVa являются первичными интеракторами mlph, регулирующими транспорт меланосом в меланоцитах. J Cell Sci. 2007; 120: 3111–3122. DOI: 10.1242 / jcs.010207. [PubMed] [CrossRef] [Google Scholar] 115. Frasa MA, Maximiano FC, Smolarczyk K, Francis RE, Betson ME, Lozano E, et al. Armus — это эффектор Rac1, который инактивирует Rab7 и регулирует деградацию E-кадгерина.Curr Biol. 2010. 20: 198–208. DOI: 10.1016 / j.cub.2009.12.053. [PubMed] [CrossRef] [Google Scholar] 116. Накамура И., Такахаши Н., Удагава Н., Морияма Ю., Курокава Т., Джими Е. и др. Отсутствие ассоциации вакуолярной протонной АТФазы с цитоскелетом в остеокластах остеосклеротических (oc / oc) мышей. FEBS Lett. 1997; 401: 207–212. [PubMed] [Google Scholar] 117. Zuo J, Jiang J, Chen SH, Vergara S, Gong Y, Xue J и др. Актин-связывающая активность субъединицы B вакуолярной H + -АТФазы участвует в ее нацеливании на взъерошенные мембраны остеокластов.J Bone Miner Res. 2006; 21: 714–721. DOI: 10.1359 / jbmr.060201. [PubMed] [CrossRef] [Google Scholar] 118. Ван Везенбек Л., Одгрен П.Р., Коксон Ф.П., Фраттини А., Моэнс П., Перду Б. и др. Участие PLEKHM1 в остеокластическом везикулярном транспорте и остеопетрозе резцов у крыс и людей. J Clin Invest. 2007; 117: 919–930. DOI: 10,1172 / JCI30328. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 119. Табата К., Мацунага К., Сакане А., Сасаки Т., Нода Т., Йошимори Т. Рубикон и PLEKHM1 негативно регулируют эндоцитозный / аутофагический путь через новый Rab7-связывающий домен.Mol Biol Cell. 2010. 21: 4162–4172. DOI: 10.1091 / mbc.E10-06-0495. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 120. Дель Фатторе А., Форнари Р., Ван Везенбек Л., де Фрейтас Ф., Тиммерманс Дж. П., Перуцци Б. и др. Новая гетерозиготная мутация (R714C) гена остеопетроза, домен гомолога плекстрина, содержащий член 1 семейства M (с доменом run) (PLEKHM1), нарушает везикулярное закисление и увеличивает секрецию TRACP в остеокластах. J Bone Miner Res. 2008. 23: 380–391. DOI: 10.1359 / jbmr.071107.[PubMed] [CrossRef] [Google Scholar] 121. Ягер С., Буччи С., Танида И., Уэно Т., Коминами Е., Сафтиг П. и др. Роль Rab7 в созревании поздних аутофагических вакуолей. J Cell Sci. 2004. 117: 4837–4848. DOI: 10.1242 / jcs.01370. [PubMed] [CrossRef] [Google Scholar] 122. Панкив С., Алему Е.А., Бреч А., Бруун Дж. А., Ламарк Т., Оверватн А. и др. FYCO1 является эффектором Rab7, который связывается с LC3 и PI3P, опосредуя микротрубочки и направленный на конец транспорт везикул. J Cell Biol. 2010. 188: 253–269. DOI: 10.1083 / jcb.2005.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 123. Bjorkoy G, Lamark T, Brech A, Outzen H, Perander M, Overvatn A и др. p62 / SQSTM1 образует белковые агрегаты, разлагаемые аутофагией, и оказывает защитное действие на индуцированную хантингтином гибель клеток. J Cell Biol. 2005; 171: 603–614. DOI: 10.1083 / jcb.200507002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 124. Нода Т., Фудзита Н., Йошимори Т. Поздние стадии аутофагии: как начинается конец? Смерть клетки отличается. 2009; 16: 984–990. DOI: 10.1038 / cdd.2009.54. [PubMed] [CrossRef] [Google Scholar] 125. Санджуан М.А., Диллон С.П., Тейт С.В., Мошиах С., Дорси Ф., Коннелл С. и др. Передача сигналов Toll-подобного рецептора в макрофагах связывает путь аутофагии с фагоцитозом. Природа. 2007; 450: 1253–1257. DOI: 10,1038 / природа06421. [PubMed] [CrossRef] [Google Scholar] 126. Лледо П.М., Йоханнес Л., Вернье П., Зорек Р., Дарчен Ф., Винсент Дж. Д. и др. Белки Rab3: ключевые игроки в контроле экзоцитоза. Trends Neurosci. 1994; 17: 426–432. [PubMed] [Google Scholar] 127.Миллар А.Л., Павиос, штат Нью-Джерси, Сюй Дж., Чжэн М.Х. Rab3D: регулятор экзоцитоза в ненейрональных клетках. Histol Histopathol. 2002; 17: 929–936. [PubMed] [Google Scholar] 128. Павлос Нью-Джерси, Сюй Дж., Фенг Х., Нг П, Ченг Т., Энг Э и др. Rab3D направляет транспорт органелл путем привлечения цитоплазматического моторного белка динеина tctex-1 к секреторным мембранам остеокластов. Кость. 2009; 44: 160. DOI: 10.1016 / j.bone.2009.01.354. [CrossRef] [Google Scholar] 129. Стенбек Г., Хортон М.А. Новое специализированное взаимодействие между клетками и матрицей при активном резорбировании остеокластов.J Cell Sci. 2000; 113: 1577–1587. [PubMed] [Google Scholar] 130. Сало Дж., Лехенкари П., Мулари М., Метсикко К., Ваананен Х. К.. Удаление продуктов резорбции костной ткани остеокластов путем трансцитоза. Наука. 1997. 276: 270–273. [PubMed] [Google Scholar] 131. Несбитт С.А., Хортон М.А. Транспортировка матричных коллагенов через резорбирующие костную ткань остеокласты. Наука. 1997. 276: 266–269. [PubMed] [Google Scholar] 132. Vaaraniemi J, Halleen JM, Kaarlonen K, Ylipahkala H, Alatalo SL, Andersson G и др. Внутриклеточный механизм деградации матрикса в остеокластах, резорбирующих кость.J Bone Miner Res. 2004; 19: 1432–1440. DOI: 10.1359 / JBMR.040603. [PubMed] [CrossRef] [Google Scholar] 133. Стенбек Г., Хортон М.А. Эндоцитарный перенос активно резорбирующихся остеокластов. J Cell Sci. 2004. 117: 827–836. DOI: 10.1242 / jcs.00935. [PubMed] [CrossRef] [Google Scholar] 134. Мулари М.Т., Нарс М., Лайтала-Лейнонен Т., Кайсто Т., Метсикко К., Сан Й. и др. Рекомбинантные белки VSV G обнаруживают новый рафт-зависимый эндоцитарный путь резорбции остеокластов. Exp Cell Res. 2008; 314: 1641–1651. DOI: 10.1016 / j.yexcr.2008.02.011. [PubMed] [CrossRef] [Google Scholar] 135. Hunziker W, Peters PJ. Rab17 локализуется в рециркулирующих эндосомах и регулирует опосредованный рецепторами трансцитоз в эпителиальных клетках. J Biol Chem. 1998; 273: 15734–15741. [PubMed] [Google Scholar] 136. Су Т, Брайант Д.М., Лутон Ф., Вержес М., Ульрих С.М., Хансен К.С. и др. Каскад киназ, ведущий к Rab11-FIP5, контролирует трансцитоз полимерного рецептора иммуноглобулина. Nat Cell Biol. 2010; 12: 1143–1153. DOI: 10,1038 / NCB2118. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 137.Бенфорд Х.Л., Макгоуэн Н.В., Хелфрих М.Х., Наттолл М.Э., Роджерс М.Дж. Визуализация бисфосфонат-индуцированной активности каспазы-3 в апоптотических остеокластах in vitro. Кость. 2001. 28: 465–473. [PubMed] [Google Scholar] 140. Брэдли Е.В., Руан М.М., Врабл А, Оурслер М.Дж. Перекрестное взаимодействие между Ras / Raf и PI3K в стимулировании M-CSF-индуцированной MEK / ERK-опосредованной выживаемости остеокластов. J Cell Biochem. 2008; 104: 1439–1451. DOI: 10.1002 / jcb.21719. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 141. Миядзаки Т., Катагири Х., Канеги Й., Такаянаги Х., Савада Й., Ямамото А. и др.Взаимная роль путей ERK и NFkappaB в выживании и активации остеокластов. J Cell Biol. 2000. 148: 333–342. [Бесплатная статья PMC] [PubMed] [Google Scholar] 142. Брэдли Е.В., Руан М.М., Оурслер М.Дж. PAK1 представляет собой новую MEK-независимую мишень raf, контролирующую экспрессию сурвивина IAP в M-CSF-опосредованном выживании остеокластов. J. Cell Physiol. 2008. 217: 752–758. DOI: 10.1002 / jcp.21550. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 143. Schindeler A, Little DG. Недавние исследования развития, гомеостаза и восстановления костей при нейрофиброматозе 1 типа (NF1) Кость.2008. 42: 616–622. DOI: 10.1016 / j.bone.2007.11.006. [PubMed] [CrossRef] [Google Scholar] 144. Хеерва Э., Аланн М.Х., Пелтонен С., Куорилехто Т., Хентунен Т., Ваананен К. и др. Остеокласты при нейрофиброматозе 1 типа демонстрируют повышенную способность к резорбции, аберрантную морфологию и устойчивость к сывороточной депривации. Кость. 2010; 47: 583–590. DOI: 10.1016 / j.bone.2010.06.001. [PubMed] [CrossRef] [Google Scholar] 145. Паско Д., Оурслер М.Дж. Сигнальный путь src регулирует секрецию лизосомальных ферментов остеокластов и быстро модулируется эстрогеном.J Bone Miner Res. 2001; 16: 1028–1036. DOI: 10.1359 / jbmr.2001.16.6.1028. [PubMed] [CrossRef] [Google Scholar] 146. Ян Ф.К., Чен С., Роблинг А.Г., Ю Х, Небесио Т.Д., Ян Дж. И др. Гиперактивация p21ras и PI3K взаимодействует с изменением функций остеокластов, связанных с нейрофиброматозом мыши и человека 1-го типа. J Clin Invest. 2006; 116: 2880–2891. DOI: 10.1172 / JCI29092. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 147. Ян Дж, Чен С., Чжан И, Ли Х, Ли И, Ву Х и др. Rac1 опосредует усиление функции остеокластов, вызванное гаплонедостаточностью Nf1.Hum Mol Genet. 2008; 17: 936–948. DOI: 10,1093 / hmg / ddm366. [PubMed] [CrossRef] [Google Scholar]
Что такое остеокласты?
Остеокласты — это специализированные многоядерные клетки, которые играют жизненно важную роль в развитии и регенерации костей.
Источник: vetpathologist / Shutterstock.com
Скелет — важная часть тела позвоночного. Он обеспечивает поддержку органов и общую целостность всей органической системы, обеспечивая движение и другие функции здорового организма.
Кости постоянно реконструируются в течение жизни организма из-за таких факторов, как реакция на стресс, повреждения и необходимость постоянного регулирования содержания кальция. Существуют специальные механизмы для выполнения этой функции. За синхронизированный процесс ремоделирования кости отвечают два специализированных типа клеток: остеобласты (костеобразующие клетки) и остеокласты.
Что такое остеокласты?
Остеокласты — это большие многоядерные клетки миелоидного происхождения, которые имеют функцию удаления минерализованных и кальцинированных компонентов костного матрикса, которые стареют или повреждены.Они имеют 2-12 ядер (обычно 5) и имеют диаметр 150-200 мкм. Они сильно положительны по кислой фосфатазе.
Остеокласт отличается двумя отличительными чертами: волнистая кайма и зона уплотнения. Рифленая граница состоит из извитой мембраны, которая образуется в результате слияния секреторных лизосом с плазматической мембраной. Зона запечатывания содержит кольцо актиновых нитей, которое окружает взъерошенную границу, изолируя подкисленную микросреду внутри клетки от общего внеклеточного пространства.
Остеокласты выполняют несколько функций. Они косвенно реагируют на кальций-регулирующие гормоны, такие как гормон паращитовидной железы, и включают факторы роста, такие как IGF-1 (инсулиноподобный фактор роста-1), в костный матрикс, что влияет на связь резорбции кости с образованием кости (это также потенциально нацелено на другие клетки, такие как метастатические опухоли.) Наконец, остеокласты сохраняют свойства других миелоидных клеток, включая продукцию цитокинов и регуляцию антигена. Эта способность дает остеокластам возможность влиять на иммунный ответ на несколько состояний.
Образование и дифференциация остеокластов
Остеокласты происходят из гемопоэтических стволовых клеток (HSC), которые содержатся в костном мозге. Это те же стволовые клетки, которые продуцируют все другие типы клеток крови, включая эритроциты и систему мононуклеарных фагоцитов, из которых возникают остеокласты. Они образуются в присутствии макрофагального колониестимулирующего фактора и активатора рецептора лиганда NF-KB.
Обычная миелоидная клетка-предшественник продуцируется из HSC, которая дифференцируется в предшественника гранулоцитов / макрофагов под влиянием фактора, стимулирующего колонию гранулоцитов / макрофагов.
Хотя исследования показали, что HSCs являются предшественниками остеокластов, начальные шаги в развитии клонов до конца не изучены. Самый ранний предшественник , который может быть выделен и обработан in vitro , — это макрофаг костного мозга или его селезеночный аналог. Неполностью изученные сигнальные пути участвуют в образовании остеокластов и дифференцировке от других типов макрофагов.
Функция резорбции кости
Есть несколько факторов, запускающих процесс резорбции кости.Основным определяющим фактором является уровень кальция в организме. Когда уровень кальция в крови снижается, паращитовидная железа (расположенная в области шеи) инициирует секрецию паратиреоидного гормона (ПТГ). ПТГ ускоряет процесс резорбции, чтобы восполнить уровень кальция в крови. Другие инициирующие факторы включают такие состояния, как псориатический артрит, неиспользование, отсутствие раздражителей и пожилой возраст.
Процесс резорбции кости начинается с поляризации остеокластов, что приводит к образованию рыхлой мембраны, прилегающей к кости.Затем остеокласт прикрепляется к поверхности кости, при этом зона уплотнения образует изолированную микросреду.
Взъерошенная мембрана затем выделяет соляную кислоту для растворения костного материала, а деминерализованный костный матрикс разрушается ферментами катепсином К и матриксной металлопротеазой. В этом процессе вырабатываются кальций и фосфат, и они попадают в кровь.
Чтобы регулировать этот процесс, паращитовидная железа снижает количество паратироидного гормона, когда обнаруживает, что уровень кальция в крови слишком высок, что приводит к инактивации остеокластов.
Патологические состояния
Ремоделирование здоровой кости предполагает прочное связывание резорбции с образованием для обеспечения правильного сохранения костной массы и качества. Когда этот процесс сцепления нарушен или функция остеокластов нарушена, может возникнуть несколько дегенеративных состояний костей.
Сюда входят:
- Остеопороз — это наиболее распространенное патологическое состояние, которое влияет на регуляцию здорового костного материала. Он характеризуется аномальным увеличением активности остеокластов.Это приводит к снижению целостности костного материала, что приводит к более частым переломам. Чаще всего это вызвано старением, но такие факторы, как гормональный дисбаланс и снижение уровня эстрогена у женщин в постменопаузе, также могут повышать активность остеокластов.
- Болезнь Педжета — это деформирующее заболевание костей, характеризующееся увеличением количества и размера остеокластов. Это приводит к локальному разрушению кости и компенсаторной активности остеобластов. Мутации в генах, ответственных за регулирование продукции остеокластов, являются причиной этого состояния.
- Ревматоидный артрит — Активация патологических остеокластов на поздних стадиях заболевания приводит к болезненным и эрозивным поражениям.
Сводка
В здоровом организме активность остеокластов регулируется эффективно после того, как они продуцируются гемопоэтическими стволовыми клетками, что происходит посредством процессов, которые до сих пор полностью не изучены. Нарушение регуляции, вызванное такими состояниями, как болезнь, старение и гормональный дисбаланс, может привести к различным дегенеративным состояниям.Понимание процесса образования и регуляции остеокластов имеет решающее значение для эффективного лечения этих состояний.
Остеобласты и остеокласты Играть
Источники:
Фенг, X и Тейтельбаум, S.L (2013) Остеокласты: новое исследование костей 1 стр. 11-26. https://www.nature.com/articles/boneres20133.pdf?origin=ppub
Новак Д.В. и Мбалавиеле Г. (2015) Остеокласты, ключевые факторы здоровья скелета и болезней Microbiol Spectr.Vol. 4 Выпуск 3 https://www.ncbi.nlm.nih.gov/pubmed/27337470
Henricksen, K et al. (2011) Активность и подтипы остеокластов в зависимости от физиологии и патологии — значение для будущего лечения остеопороза Endocr Rev. Vol. 32 Выпуск 1 стр. 31–63 https://www.ncbi.nlm.nih.gov/pubmed/20851921
Рубин Дж., Гринфилд Э.М. (2005) Остеокласты: происхождение и дифференциация. В: Броннер Ф., Фарач-Карсон М.К., Рубин Дж. (Ред.) Костная резорбция. Темы биологии костей, том 2. Springer, London https://doi.org/10.1007/1-84628-016-8_1
Дополнительная литература
Osteoclast — обзор | ScienceDirect Topics
Базовая биология остеокластов
Остеокласт, единственная клетка, способная к деградации кости, имеет гематопоэтическое происхождение. Этот факт был подтвержден на человеке в элегантном эксперименте, в котором трансплантация мужского костного мозга женщине-реципиенту, страдающей злокачественным остеопетрозом, привела к разрешению болезни, сопровождавшейся появлением остеокластов, несущих только Y-хромосому [10].Многие эксперименты подтвердили первоначальное открытие, включая множество примеров репликативного восстановления костного мозга из ранних работ, а также исследования, в которых у мышей, лишенных раннего миелоид-специфического гена PU.1, не развиваются остеокласты [11].
Хотя ясно, что гемопоэтические стволовые клетки (HSCs) являются предшественниками остеокластов, начальные шаги в развитии клонов полностью не определены [12]. Таким образом, самым ранним предшественником, который может быть выделен и легко обработан in vitro, является макрофаг костного мозга (BMM) или его селезеночный аналог, клетки, которые возникают из HSC по не совсем понятным сигнальным путям.Теперь возможно генерировать достаточно зрелых мышиных остеокластоподобных клеток для выполнения широкого спектра исследований клеточной биологии, подвергая BMM воздействию всего двух цитокинов, M-CSF и RANKL, рецепторами которых являются c-Fms и RANK, соответственно [13]. Генетическая делеция и / или инактивация цитокина или его соответствующего рецептора в результате естественных мутаций или манипуляций с геномом приводит к глубокому остеопетрозу, сопровождающемуся полным отсутствием остеокластов [13,14]. Интерлейкин (IL) 34, трехмерная структура которого имитирует структуру M-CSF без двух молекул, проявляющих детектируемую аминокислотную гомологию, был недавно клонирован и, как было показано, функционально заменяет цитокин как in vitro, так и in vivo [15].Это наблюдение объясняет давнюю загадку, заключающуюся в том, что делеция c-Fms приводит к более глубокому остеопетрозу, чем тот, который наблюдается у мышей, лишенных M-CSF [16]. Тем не менее, тот факт, что введение M-CSF мышам и крысам, которые не могут продуцировать M-CSF, восстанавливает костный фенотип [17,18], говорит о важной роли, которую эта молекула играет в биологии остеокластов. Интересно, что IL-34 секретируется на высоких уровнях стромальным, предположительно онкогенным, компонентом гигантоклеточной опухоли кости [19], что помогает объяснить, почему пациенты, демонстрирующие это состояние, обладают заметной литической способностью.Наконец, хотя M-CSF и RANKL являются базальными белками, необходимыми для генерации и активации остеокластов, ряд вторичных стимуляторов также играет важную роль в том же процессе. Основные факторы, у человека и / или мыши, включают фактор некроза опухоли (TNF) и интерлейкины (IL) -1 [20–23], -6 [24,25] — 11 [26] и -17 [27] –29], тогда как данные о трансформирующем факторе бета (TGF-β) [30,31] и костных морфогенетических белках (BMP) [32] требуют дальнейшей проверки. Многие другие цитокины влияют на образование остеокластов, индуцируя RANKL и M-CSF, уменьшая при этом OPG в стромальном и лимфоидном компартментах кости [5].
Передача сигналов ELMO1 является промотором функции остеокластов и потери костной массы
Мыши
C57BL / 6 J, DBA / 1 J, NOD, Cx3cr1 -Cre, Opg — / — и Rosa мыши были получены от Jackson Laboratories. Elmo1 fl / fl и Elmo1 — / — мышей были описаны ранее 22 . Для получения мышей с делецией Elmo1 в линии макрофагов мышей Elmo1 fl / fl скрещивали с мышами Cx3cr1 -Cre.Для создания Elmo1 — / — на фоне DBA для экспериментов с коллаген-индуцированным артритом мышей Elmo1 — / — скрещивали на фоне DBA / 1 J в течение по меньшей мере пяти поколений. Трансгенные мыши KRN TCR 40 были подарком доктора Дайан Матис из Гарвардской медицинской школы и были скрещены с мышами NOD для получения мышей K / BxN 41 , у которых развивается прогрессирующий спонтанный артрит. Сыворотку K / BxN собирали у мышей K / BxN в возрасте 9 недель путем пункции сердца.Сыворотку для измерения TRAcP 5b и CTX-I собирали с помощью сердечной пункции и выполняли ELISA в соответствии с инструкциями производителя (Immunodiagnostic Systems, Великобритания). Во всех экспериментах использовались контрольные животные того же возраста и пола, и оценивались как самцы, так и самки. Животных содержат в вентилируемых стойках Аллентауна с водой обратного осмоса через автоматическую систему полива. Они получают неограниченную диету и содержатся в режиме 14.10 свет: темнота при температуре 72 градуса по Фаренгейту и влажности 40%.Все процедуры с животными были одобрены и выполнены в соответствии с руководящими принципами Институционального комитета по уходу и использованию животных (IACUC) Университета Вирджинии в соответствии с протоколом № 2992.
Остеопороз, вызванный овариэктомией
Самок в возрасте восьми недель анестезировали ингаляцией изофлуорана, выстригали шерсть на спине и дезинфицировали кожу хирургическим йодом и 70% этанолом с использованием стерильных тампонов. После 4–7 мм разрезов кожи / брюшной полости, параллельных и вентрально по отношению к позвоночнику, использовались щипцы для удаления яичника, предотвращая кровотечение.Рог матки и жировая подушечка были возвращены в брюшную полость. Разрез брюшной стенки ушили швами. Всем мышам подкожно вводили анальгетик (кетопрофен 2–5 мг / кг каждые 24 часа в течение 72 часов после операции) и антибиотик (байтрил 5 мг / кг каждые 24 часа в течение 7 дней после операции). Через шесть месяцев после операции мышей умерщвляли, извлекали позвоночные столбы и фиксировали в 10% формалине (Fisher) для анализа микроКТ.
Артрит и коллаген-индуцированный артрит, индуцированный переносом сыворотки K / BxN (CIA)
Для индукции артрита с использованием сыворотки K / BxN мышам вводили 150 мкл сыворотки от мышей K / BxN в дни 0 и 2.При коллаген-индуцированном артрите мышей Elmo1 — / — на фоне DBA иммунизировали в основание хвоста путем внутрикожной инъекции раствора 10 мМ уксусной кислоты в соотношении 1: 1, содержащего 100 мкг бычьего коллагена. II и полный адъювант Фрейнда (Sigma), содержащий 100 мкг убитой нагреванием Mycobacterium tuberculosis h47Ra (BD) и усиленный иммунизацией на 21 день. Набухание лапы и клинические показатели измеряли, как ранее сообщалось 8 . Все оценки производились исследователем, не знающим генотипов мышей.
Гистология
Для экспериментов с артритом, вызванным переносом сыворотки K / BxN, и экспериментами CIA мышей умерщвляли в указанные моменты времени и фиксировали лапы в 10% формалине (Fisher). Декальцификация, срезы, заливка парафином и окрашивание гематоксилином и эозином (H&E) были выполнены HistoTox Labs (Боулдер, Колорадо). Оценку гистологии выполнял исследователь, не знающий генотипов мышей. Для оценки воспаления использовались следующие критерии — 0, нет; 1, легкая; 2 — умеренный; 3, тяжелая.Для оценки эрозии костей использовали следующие критерии: 0 — эрозий костей не наблюдалось; 1, умеренная эрозия кортикальной кости; 2, тяжелая эрозия кортикальной кости без потери целостности кости; 3, тяжелая эрозия кортикальной кости с потерей целостности кортикальной кости и эрозия губчатой кости. Для окрашивания TRAP лапы фиксировали в фосфатно-солевом буфере (PBS), содержащем 4% параформальдегида, в течение 72 часов при 4 ° C с последующей декальцинацией 10% EDTA, pH 7,0 в течение 3 недель с двумя еженедельными сменами буфера.Разделение и заливка парафином были выполнены, как указано выше. Депарафинизированные срезы инкубировали в 0,2 М Трис, pH 9,0 в течение 1 ч при 37 ° C с последующим окрашиванием с использованием набора для окрашивания кислотной фосфатазой, лейкоцитов (TRAP) (Sigma), следуя инструкциям производителя. Для выделения РНК и белка лапы быстро замораживали в жидком азоте в указанные моменты времени и подвергали механическому разрушению с использованием измельчителя тканей (Spectrum Laboratories, Inc.).
Анализ двухэнергетической рентгеновской абсорбциометрии (DEXA).
Мышей анестезировали стерильным физиологическим раствором, содержащим 20 мг / мл кетамина и 2 мг / мл ксилазина, и все тело сканировали на Piximus 2 (GE Medical Systems Lunar Corp.) DEXA-сканер и анализировали с помощью программного обеспечения Lunar Piximus 2.10.
Анализ с помощью микрокомпьютерной томографии (MicroCT)
Анализ MicroCT проводился на изолированных тканях с использованием сканера SCANCO VivaCT 40 (Scanco). Ноги или позвоночные столбы мышей сканировали в пробирках объемом 10-15 мл, заполненных PBS, содержащим 4% параформальдегид, при 55 кВ и 145 мкА с размером вокселя 12,5 мкм. Проекционные изображения были реконструированы, а трехмерная визуализация выполнена с помощью Scanco IPL V5.15. Для анализа губчатой кости интересующие области были определены непосредственно под пластинами роста кости.Все лодыжки задних лап сканировали и анализировали. Для количественной оценки эрозии костей образцы сканировали на HECTOR (разработанный в сотрудничестве с XRE, www.xre.be) 42 , используя направленный источник рентгеновского излучения, установленный на 130 кВ и мощность луча 10 Вт с алюминиевой фильтрацией 1 мм. Детектор представлял собой плоскую панель Perkin – Elmer размером 40 × 40 см с шагом пикселя 200 мкм. Всего было записано 2000 прогнозов времени экспозиции 1 с каждый. Результирующие отсканированные изображения имеют размер вокселя 4.5 мкм. Полученные проекционные изображения всех сканированных изображений были реконструированы с помощью Octopus Reconstruction 43 , программного обеспечения, первоначально разработанного UGCT на основе стандартного алгоритма FDK для восстановления данных КТ. 3D-визуализации были выполнены с использованием коммерческого программного обеспечения для рендеринга VGStudioMAX (Volume Graphics). Анализ эрозии поверхности пяточной кости был выполнен с использованием специального скрипта в ImageJ. В пределах внешнего слоя пяточной кости толщиной 50 мкм поверхностные эрозии заполняли цифровым способом для получения гладкой поверхности.Затем измеряли объем этой пломбы, представляющий объем поверхностной эрозии, и выражали его как отношение к общему объему кости. Наш скрипт использовал плагин «Оптимизировать порог» от BoneJ для преобразования изображений в градациях серого в двоичный формат. Позвоночные столбы от овариэктомированных мышей сканировали в Scanco Medical, используя Scanco Medical mCT 40. Все сканирования проводили с использованием уровня энергии рентгеновского излучения 55 квп и разрешения вокселей 8 мкм. 3d-морфометрический анализ был проведен с использованием встроенного программного обеспечения Scanco на интересующем объеме, выбранном для включения области трабекулярной кости тела позвонка с порогом 290.
Культуры макрофагов и остеокластов
Для культур макрофагов и остеокластов, полученных из костного мозга, бедренные кости удаляли у мышей в возрасте 6-8 недель, промывали стерильной бессывороточной α-MEM (Corning) и получали суспензии одноклеточных клеток, используя сетчатый фильтр для клеток 70 мкм (Fisher). Клетки центрифугировали и культивировали на чашках Петри в α-MEM, содержащем 10% FBS и 1% пенициллин / стрептомицин / глутамин, при 37 ° C и 5% двуокиси углерода в течение 16 часов. Остеокласты дифференцировали, как описано ранее 44 .Вкратце, суспензионные клетки собирали и культивировали на чашках Петри, как указано выше, с добавлением 10% кондиционированной среды для клеток L929 (ATCC, # CCL-1) в качестве источника фактора, стимулирующего колонии макрофагов. Через 3 дня клетки, прикрепленные к чашкам, собирали и 50000 клеток помещали на 24-луночные планшеты, покрытые культурой ткани (Corning), планшеты OsteoAssay (Corning), срезы бычьей кости (Immunodiagnostic Systems) или стеклянные покровные стекла (Fisher) и культивировали в течение дополнительных 7–14 дней с 50 нг / мл GST-RANKL (подарок от Dr.Стивен Тейтельбаум, Университет Вашингтона в Сент-Луисе, Миссури) для получения остеокластов или контроля носителя. Ингибирующий пептид ELMO1 (EIP), состоящий из пептида TAT (GRKKRRQRRRPQ), слитого с N-концом ELMO1-связывающей аминокислоты DOCK2 86-108 38 , скремблированный пептид (пептид TAT, слитый со скремблированной пептидной последовательностью DOCK2 ), а ТАТ-Cre (пептид ТАТ, слитый с ферментом рекомбиназы Cre 39 ) были синтезированы в Genscript. Все пептиды добавляли на 3-й день дифференцировки остеокластов в концентрации 10 мкМ и пополняли ежедневно до 7-го дня.Окрашивание TRAP проводили с использованием набора для окрашивания кислотной фосфатазой, лейкоцитов (TRAP) (Sigma), следуя инструкциям производителя. Для выявления ямок резорбции остеокластов клетки, помещенные на планшеты OsteoAssay, отбеливали, а планшеты сушили в соответствии с инструкциями производителя. Ямки резорбции были количественно определены с использованием Image J. Cell Profiler v3.1.9, который использовался для создания конвейера для автоматического анализа эродированных областей. Цветные изображения были преобразованы в оттенки серого и установлены пороговые значения с использованием глобального трехклассового алгоритма Оцу до того, как ямки были идентифицированы как первичные объекты.Были измерены основные объекты, и сумма площадей была разделена на общее количество пикселей, чтобы определить процент разрушенной площади.
Культура остеобластов
Бедренные кости удаляли у мышей в возрасте 6-8 недель, промывали стерильной бессывороточной α-MEM (Corning) и получали суспензии одноклеточных клеток с использованием фильтра для клеток 70 мкм (Fisher). Клетки центрифугировали, и 1-2 миллиона клеток культивировали на лунку в 6-луночных чашках, покрытых культурой ткани, в α-MEM, содержащем 10% FBS и 1% пенициллин / стрептомицин / глутамин, при 37 ° C и 5% углекислого газа.Суспензионные клетки удаляли через 16 часов, и прилипшие клетки выращивали до слияния. Дифференцировку остеобластов индуцировали культивированием в α-MEM, содержащем 10% FBS, 1% пенициллин / стрептомицин / глутамин, 50 мкМ аскорбиновой кислоты (Sigma), 10 мМ β-глицерофосфата (Sigma) и 10 нМ дексаметазон (Calbiotech) 45 . Через 14–21 день дифференцировки клетки фиксировали 10% нейтральным забуференным формалином (Fisher), окрашивали 40 мМ ализариновым красным (Sigma), pH 5,6, отображали на EVOS FL Auto (Thermo Fisher) и анализировали с помощью прилагаемого программного обеспечения. .
Перитонеальный макрофагальный эффероцитоз апоптотических тимоцитов
Восьминедельный возраст Elmo1 + / + ( n = 3) и Elmo1 — / — 49 ( 49) были подвергнуты эвтаназии и клетки перитонеального лаважа были собраны с использованием 10 мл PBS с 10% FBS. Клетки брюшины центрифугировали, ресуспендировали в X-VIVO-10 (Lonza), содержащем 1% пенициллин / стрептомицин / глутамин, и 500000 клеток на лунку высевали в 24-луночный планшет, не обработанный культурой ткани, и инкубировали при 37 ° C и 5% углекислый газ в течение 16 ч.Затем неприлипающие клетки удаляли путем обширной промывки, а прикрепленные клетки окрашивали антителами против CD11b (1: 100, eBioscience # 11-0112-82) и анти-F4 / 80 (1: 100, BioLegend # 123114) и анализировали в проточном режиме. цитометрия для проверки чистоты перитонеальных макрофагов (> 95%). Тимус собирали у трехнедельной мыши, фильтровали через фильтр 70 мкм (Fisher), и апоптоз тимоцитов индуцировали путем инкубации в 10 мкм дексаметазоне (Calbiotech) в среде RPMI 1640, содержащей 10% FBS и 1% пенициллин / стрептомицин / глутамин 37 ° C и 5% углекислого газа в течение 4 часов.Апоптоз подтверждали окрашиванием аннексином V (BD Bioscience # 550474) и 7AAD (Thermo Fisher) в соответствии с инструкциями производителя и получением проточной цитометрии с использованием FACS Diva и анализа с использованием FlowJo (BD Bioscience). Апоптотические тимоциты окрашивали 1 мкМ CypHer-5E (GE Healthcare) и добавляли к перитонеальным макрофагам в соотношении 10: 1 (мишень: фагоцит) в течение 30 минут при 37 ° C и 5% углекислого газа. В качестве контроля некоторые макрофаги обрабатывали цитохалазином D (Sigma, 1 мкМ) в течение 30 минут перед добавлением апоптотических тимоцитов и на протяжении всего анализа эффероцитоза для ингибирования поглощения апоптоза трупом.Затем перитонеальные макрофаги тщательно промывали для удаления несвязанных мишеней, окрашивали анти-CD11b (1: 100, eBioscience # 11-0112-82) и анализировали эффероцитоз с помощью проточной цитометрии.
CRISPR / Cas9-опосредованная делеция гена в клетках Hoxb8
Иммортализованные первичные предшественники макрофагов ER-Hoxb8 (клетки Hoxb8) были получены, как сообщалось ранее 46 от мышей с конститутивной экспрессией Cas9 и GFP (Jackson Laboratories, номер запаса 026179) . Клетки-предшественники макрофагов поддерживали в α-MEM, содержащем 100 нг / мл гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) и 0.5 мкМ β-эстрадиола (Sigma) и дифференцировали в макрофаги и остеокласты, как описано выше. LentiCas9-EGFP был подарком от P. Sharp и F. Zhang (плазмида Addgene 63592). Делецию гена в клетках Hoxb8 проводили с использованием плазмиды sgRNA lentiGuide-Puro (подарок от F. Zhang, плазмида Addgene 52963) и выделения пуромицина (5 мкг / мл). Делеция была подтверждена иммуноблот-анализом с использованием анти-ELMO1 (1: 1000, кроличьи поликлональные антитела собственного производства) 5 , анти-катепсина G (1: 1000, LS-C373215, LSBio) или анти-миелопероксидазы (1). : 1000, AF3667, R&D Systems) антител.
Использовали следующие направляющие РНК:
Elmo1 guide, 5′-CACCGGATAGGCGGAGGTGCATCC-3 ‘и 3′-CCTATCCGCCTCCACGTAGGCAAA-5’.
Ctsg руководство 5′- CACCGCTGGGTCCTTTCTCGCATT-3 ‘и 3′-CGACCCAGGAAAGAGCGTAACAAA-5’.
Mpo руководство 5′-CACCGTCGTTGTAAGATCGGTACT-3 ‘
3′-CAGCAACATTCTAGCCATGACAAA-5′.
Руководство Aoah , 5′-CACCGGCGTACATTTGTTCAGGAG-3 ′ и
3′-CCGCATGTAAACAAGTCCTCCAAA-5 ′.
Rasgef1a , 5′-CACCGCGGTCACCCGTTGTGGACAA-3 ‘и
3′-CGCCAGTGGGCAACACCTGTTCAAA-5′.
Ero1lb guide, 5′-CACCGGGTTCCGCCGGGCCGTTAC-3 ‘и
3′-CCCAAGGCGGCCCGGCAATGCAAA-5′
Microscopy
Зрелые фиксированные остеокласты, окрашенные в метаноле, и окрашенные ледяной PBS субъединица e1 (1: 1000, PA5-29899, Thermo Fisher), анти-катепсин K (1: 100, ab37259, Abcam), анти-винкулин (1: 100, V9264, Sigma) или контрольное антитело (1: 100, 5415 S, Cell Signaling), а затем флуоресцентно меченые вторичные антитела, следуя инструкциям производителя (Fisher).Некоторые клетки также окрашивали фаллоидином, меченным Alexa Fluor 647 (Thermo Fisher), в соответствии с инструкциями производителя. Ядра окрашивали 1 мкг / мл Hoechst 33342 (Fisher) в PBS. Изображения были получены на EVOS FL Auto (Thermo Fisher) и проанализированы с помощью прилагаемого программного обеспечения. Из-за интенсивного окрашивания TRAP в культурах остеокластов Elmo1 — / — мы подсчитали количество остеокластов после окрашивания катепсином К методом иммунофлуоресценции. Катепсин К-положительные клетки с тремя или более ядрами подсчитывали с использованием Image J. RosaYFP и культуры остеокластов, окрашенные фаллоидином, были визуализированы на Zeiss Imager Z2 с апотомом и проанализированы с использованием программного обеспечения AxioVision 4.8 (Zeiss).
Количественная RT-PCR
Суммарную РНК выделяли из культивированных клеток или измельченных лап с использованием набора RNA Easy (Qiagen) и кДНК, полученной с использованием набора QuantiTect (Qiagen) в соответствии с инструкциями производителя. Количественную экспрессию генов-мишеней и генов домашнего хозяйства проводили с использованием зондов Taqman (Thermo Fisher Scientific, перечисленных в дополнительной таблице 4), запускаемых в системе ПЦР в реальном времени StepOnePlus (Applied Biosystems).
Иммуноблоттинг
Белковые экстракты получали из культивированных клеток или измельченных лапок с использованием буфера для лизиса RIPA с добавленным коктейлем ингибиторов протеаз (Calbiochem), 1 мМ фенилметилсульфонилфторида (PMSF, Sigma) и 1 мМ ортованадата натрия (Sigma). Равные количества белкового экстракта загружали в гели TGX Precast (Bio-Rad), подвергали SDS-PAGE и переносили на мембраны из PVDF с использованием системы переноса Trans-Blot Turbo (Bio-Rad). В некоторых экспериментах активный Rac1 был извлечен из равных количеств белкового экстракта с использованием GST-меченного субстрата Rac1 CRIB 5 .Иммуноблоттинг проводили с использованием кроличьих поликлональных антител против ELMO1 собственного производства (1: 1000, кроличьи поликлональные антитела собственного производства) 5 , анти-Rac1 (1: 500, Cytoskeleton # ARC03), анти-ERK2 (1 : 3000, Santa Cruz # 154-G), анти-GAPDH-HRP (1: 10 000, Sigma # G9295) или анти-бета-Actin-HRP (1: 100 000, Sigma # A3854). Блоты экспонировали с использованием набора Western Lightning Plus ECL (Perkin – Elmer) на системе визуализации ChemiDoc Touch и анализировали с помощью ImageLab (Bio-Rad).
Протеомика и масс-спектрометрия
Elmo1 + / + и Elmo1 — / — остеокласты были помечены EZ-Link TM NHS-Biotin (инструкции производителя Fisher) в соответствии с инструкциями производителя Fisher.Экстракты клеток готовили в буфере для лизиса Triton X-100 (20 мМ Трис, pH 8,0, 137 мМ NaCl, 10% глицерин, 0,2% Triton X-100, коктейль ингибиторов протеаз (Calbiochem), 1 мМ PMSF и 5 мМ ортованадат натрия. ) в течение 1 ч на льду. Лизаты очищали центрифугированием в течение 10 мин при 16 800x g . ELMO1 иммунопреципитировали с использованием мышиных антител против ELMO1, изготовленных в компании (клон № 7G9-A10-A3-D7) 5 и агарозных гранул с белком A (Amersham), а иммунные комплексы промывали и разделяли на две части.Одна часть была подвергнута SDS-PAGE. Вторую часть нагревали в течение 5 минут при 95 ° C, и шарики агарозы удаляли центрифугированием. Биотинилированные белки в оставшемся иммунопреципитате обогащали агарозой NeutrAvidin TM (Pierce, следуя инструкциям производителя) и подвергали SDS-PAGE. Гели окрашивали красителем SimplyBlue Safe (Invitrogen) и обесцвечивали водой. Полосы геля вырезали и замораживали при -80 ° C. После обесцвечивания в 25 мМ NH 4 HCO 3 (pH 8.3) с 50% ацетонитрилом и сушкой в вакуумной центрифуге, полосы геля расщепляли 100 мкл трипсина (Promega) (20 мкг / мл) при 37 ° C в течение 16 часов. Расщепленные пептиды трижды экстрагировали 100 мкл 70% ацетонитрила, 5% муравьиной кислоты в ванне для обработки ультразвуком. Каждый образец пептида сушили в вакуумной центрифуге и ресуспендировали в 16 мкл 0,1% TFA. Переваривание каждой полосы геля анализировали с помощью нанопоточной жидкостной хроматографии (ЖХ) (Easy-nLC1200, Thermo Fisher Scientific Inc.) в сочетании с Orbitrap Fusion Lumos Tribrid MS (Thermo Fisher Scientific), образцы загружали на колонку с наноловушкой C18. (Acclaim PepMap100 C18, 2 см, nanoViper, Thermo Scientific) и разделен на колонке C18 Easy-Spray (Acclaim PepMap RSLC C18, 2 мкм, 100 Å, 75 мкм x 500 мм, nanoViper, Thermo Scientific) с линейным градиентом 2% подвижная фаза B (95% ацетонитрил с 0.1% муравьиной кислоты) до 32% подвижной фазы B в течение 60 мин при постоянной скорости потока 250 нл / мин. Колонку C18 Easy-Spray во время анализа нагревали до 50 ° C. 12 наиболее интенсивных молекулярных ионов в каждом сканировании MS были последовательно выбраны для высокоэнергетической столкновительной диссоциации (HCD) с использованием нормированной энергии столкновения 35%. Масс-спектры получены в диапазоне масс m / z 400–1600. Капиллярное напряжение и температура источника ионов Easy-Spray (Thermo Scientific) были установлены на 2.0 кВ и 275 ° C соответственно. Динамическое исключение (15 с) было включено во время сбора данных МС / МС, чтобы минимизировать повторяющиеся события фрагментации пептидов. Линза RF была установлена на 30% во время анализа MS, и спектры MS1 и MS2 были собраны в режиме профиля. Поиск данных проводился в базе данных белков мыши Swiss-Prot (http://www.uniprot.org/uniprot/) с использованием Proteome Discoverer (v.2.2.0.388, Thermo Fisher Scientific) через Mascot (v. 2.6.0, Matrix Science). Inc.) с установленной опцией автоматического поиска ложных целей с последующей обработкой Percolator частоты ложных обнаружений (FDR).Данные были проанализированы с допуском по массе предшественника 10 ppm и толерантностью к ионам фрагментов 0,05 Да, максимум двумя ошибками расщепления трипсином и динамическими модификациями окисления (15,9949 Да) остатка метионина и биотинилирования (226,0776 Да) остатков лизина. Полученные в результате спектральные совпадения пептидов (PSM) фильтровали с использованием FDR ≤1% (значение Percolator q ≤0,01). Белковые сети анализировали через STRING (www.string-db.org). Цветные узлы обозначают белки запроса (цвета были присвоены программой произвольно).Закрашенные узлы представляют собой белки с известной или предсказанной трехмерной структурой. Известные белковые взаимодействия обозначены пурпурным (экспериментально определенным) и голубым (указана тщательно подобранная база данных) цветными линиями. Прогнозируемые белковые взаимодействия обозначены линиями зеленого (соседство гена), оливкового (анализ текста), черного (совместная экспрессия) и фиолетового (гомология белков) линий.
RNA-seq анализ
Остеокласты были дифференцированы из костного мозга мышей Elmo1 +/– или Elmo1 — / — мышей с 50 нг / мл GST-RANKL в течение 7 дней , как описано выше.Полная РНК была извлечена, и библиотека мРНК была подготовлена с использованием платформы Illumina TruSeq с последующим секвенированием транскриптома с использованием NextSeq System Suite для картриджа Illumina NextSeq 500. Были секвенированы культуры от четырех мышей на группу, по две мыши на условие на эксперимент. Пакет статистических программ R (версия 3.3.2) использовался для всех анализов. Пакет Bioconductor DESeq2 использовался для нормализации данных RNA-seq. Из-за присущей вариабельности культур остеокластов мы проанализировали две группы мышей (две мыши в каждом состоянии) относительно друг друга, чтобы идентифицировать гены для дальнейшего исследования, а также тепловые карты.Мы использовали статистический метод, ранее установленный для сильно изменчивых данных секвенирования TCR 47 , который анализирует среднее значение экспериментальных условий, деленное на сумму контрольных и экспериментальных условий. Результирующее значение представляет собой соотношение между 0 и 1, которое обеспечивает стандартизованный показатель для генов, которые значительно увеличиваются или уменьшаются по сравнению с нулевым значением 0,5. Тепловые карты были созданы с использованием gplots пакета R через пакет heatmap.2. Код R, используемый для биоинформатического анализа и создания тепловой карты, предоставляется по запросу.
GWAS и экспериментальный анализ сцепления
SNP по заболеванию и SNP по фенотипу взаимодействий определяли с использованием баз данных ассоциации SNP-заболевание и SNP-фенотип GWASdb. Данные нанесены на график с использованием стандартизованного значения p , как указано 48 . Для определения экспериментальной связи был проведен поиск в тщательно подобранных базах данных, таких как экспериментальная база данных ассоциации ген-заболевание DISEASES (базы данных перечислены в дополнительной таблице 1). Значимость экспериментальной ассоциации сцепления была определена с помощью ранее установленной совокупной оценки 49,50,51,52,53 .
