Хилоторакс у новорожденных детей: лечение, причины, симптомы, признаки
Соотношение мальчики: девочки= 2:1, преимущественно правосторонний.
У детей выделяют врожденный (нетравматический) и приобретенный (травматический) хилоторакс.
Причины хилоторакса у новорожденных детей
Предположительные причины врожденного хилоторакса — «врожденная слабость грудного лимфатического протока» (стенки протока не способны устоять обычному стрессу в родах), врожденная внутрипротоковая обструкция, лимфангиоматоз, аномалии развития (рассыпной тип) и врожденные свищи протока, инфекция (токсоплазмоз, краснуха, цитомегаловирус, герпес), генетические синдромы (Нонне, Турнера, Горам), различные хромосомные аномалии.
Расценивая хилоторакс, как осложнение, выделяют причины его возникновения: ятрогенное повреждение грудного протока (родовая травма, кардиоторакальные операции, удаление внутригрудных опухолей, операция по поводу диафрагмальной грыжи), повышение давления в системе верхней полой вены при тромбозе.
Патогенез хилоторакса у новорожденных детей
- Повышенное системное или легочное давление (часто в комбинации с гипопротеинемией).
- При врожденном заболевании вероятно наличие фистулы в полости плевры.
- Тромбоз верхней полой вены, но также и нижней полой вены.
- Прямое механическое раздражение или повреждение грудного протока (внутриутробная обструкция, кардиохирургическое вмешательство, оперативное закрытие артериального протока).
Дифференциальный диагноз: инфузионный гидроторакс при ЦВК (в пунктате отсутствует лимфоцитоз).
Диагностика хилоторакса у новорожденных детей
Пункция после УЗИ и/или рентгенологического обследования с целью опорожнения и диагностики высокое содержание белка и липидов при относительном лимфоцитозе. Возможна постановка дренажа (максимального размера).
Характер плеврального выпота определяют при диагностической пункции плевральной полости, при которой получают хилезную жидкость, по цвету напоминающую разведенное молоко.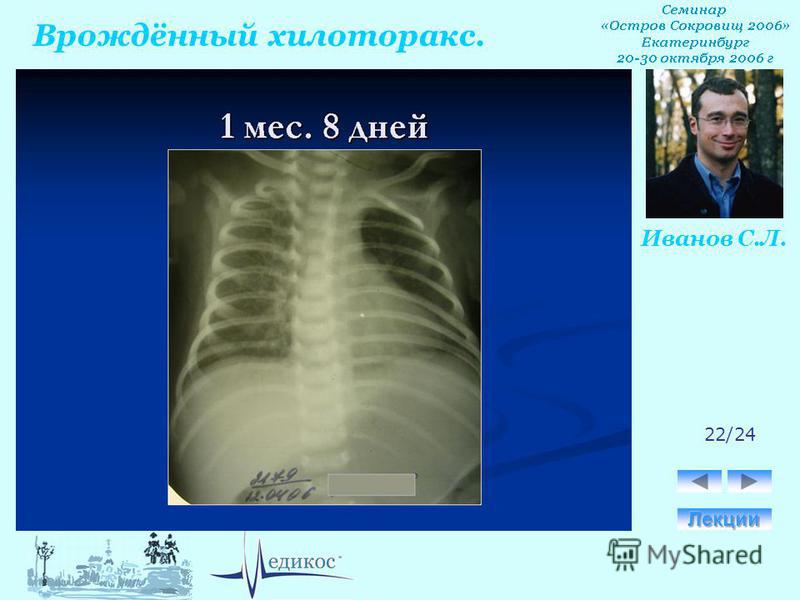 У детей на ППП без энтерального кормления молочный цвет жидкости отсутствует.
У детей на ППП без энтерального кормления молочный цвет жидкости отсутствует.
Лечение у новорожденных детей
Внимание: значительные потери лимфоцитов, жидкости, компонентов белка и жиров. Поэтому часто требуется возмещение.
Питание:
- При доказанном хилотораксе прежде всего отказ от энтерального кормления на 1—2-3 недели с полным парентеральным питанием.
- При становлении энтерального питания использовать смеси со среднецепочечными жирами (например, Basic F) с целью минимизации торакального лимфатического потока (среднецепочечные жиры резорбируются в портальную систему). Не использовать энтерально длинноцепочечные жиры. В начале — по возможности мало белка.
- Специальные смеси.
В настоящее время является дискуссионным, соматостатин или аналог соматостатина (Octreotid):
- Начинать с 3,3 мкг/кг/час, дозу увеличивать до 15 мкг/кг/час, вводить в течение 6 дней.
Осторожно: все еще является экспериментальным методом; эффект описан в единичных случаях.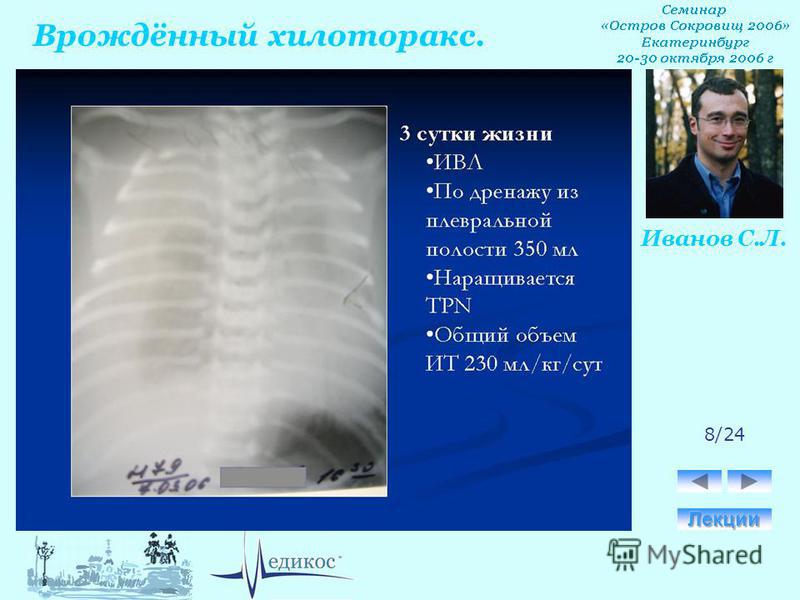
При средних потерях (более 100 мл/кг/день) и/или отсутствии положительной динамики в течение 2 недель, равно как и при развитии угрожающих проблем с питанием должны рассматриваться механические попытки с фибриновым клеем, облитерация плевральной полости (плевродез) с помощью склерозирующих веществ (G 50 % или тетрациклин), плевроперитонеальный шунт или лигирование грудного протока.
Общий прогноз благоприятный (около 15 % умирают и около 65 % отвечают на торакоцентез). Проблему представляет при длительном уходе плохая прибавка массы тела ввиду недостаточности питания, а также гипопротеинемия и лимфоцитопения.
Консервативное лечение
В комплексном лечении хилоторакса большинство специалистов рекомендуют начинать лечение с консервативных мероприятий.
Снижение продукции лимфы добиваются использованием препаратов с преобладанием жиров в виде МСТ, применением ППП, низкожировой диеты. Среднецепочечные триглицериды не только снижают внутрипротоковое давление, но и поддерживают адекватное питание.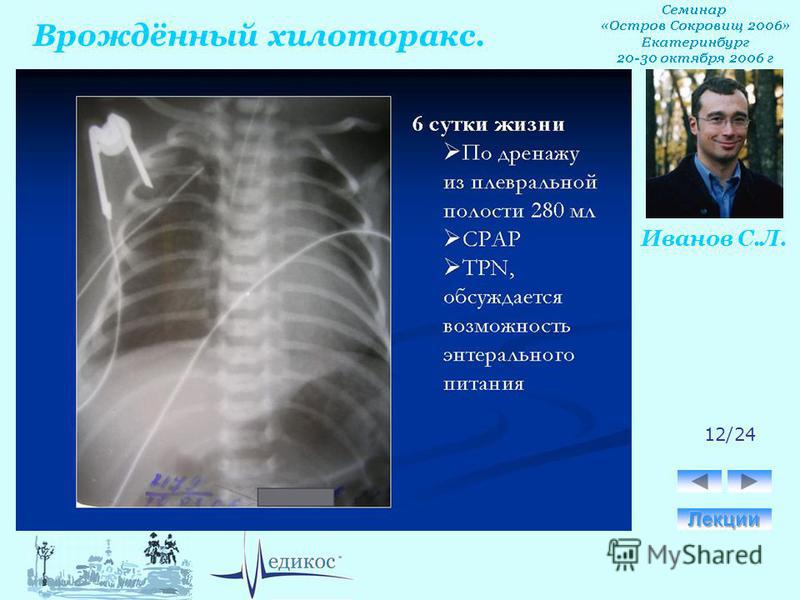 После абсорбции в тонкой кишке они попадают непосредственно в систему полой вены, минуя лимфоток. Таким образом, давление в лимфатической системе не повышается, образование хилуса уменьшается, что приводит к уменьшению хилореи. Длительную низкожировую диету детям не рекомендуют, поскольку она имеет малую энергетическую ценность, мало белка, эссенциальных жирных кислот, необходимых для нормального роста ребенка.
После абсорбции в тонкой кишке они попадают непосредственно в систему полой вены, минуя лимфоток. Таким образом, давление в лимфатической системе не повышается, образование хилуса уменьшается, что приводит к уменьшению хилореи. Длительную низкожировую диету детям не рекомендуют, поскольку она имеет малую энергетическую ценность, мало белка, эссенциальных жирных кислот, необходимых для нормального роста ребенка.
В последние годы в комплексном консервативном лечении используют соматостатин или его синтетический аналог — Октреотид, который у новорожденных применяют в непрерывной инфузии в средней дозе 1—Юмкгна 1 кг массы тела в час. Поданным ряда авторов его использование у новорожденных позволяет повысить эффективность консервативного лечения, которая по данным некоторых авторов достигает 80%.
Хирургическое лечение
Показание к операции у новорожденных — лимфорея, продолжающаяся несмотря на дренирование плевральной полости и проводимое консервативное лечение. Если объем хилезной жидкости остается значительным и существует угроза истощения, следует прибегать к операции ввиду возможного вторичного инфицирования. Установить строго определенные сроки продолжительности консервативного лечения затруднительно. В каждом случае их определяют индивидуально с учетом объема лимфы и состояния больного.
Установить строго определенные сроки продолжительности консервативного лечения затруднительно. В каждом случае их определяют индивидуально с учетом объема лимфы и состояния больного.
Основные операции — наложение плевроперитонеального шунта, плевродез, плеврэктомия, лигирование грудного протока.
Торакоскопическое клипирование грудного протока — один из наиболее эффективных методов хирургического лечения хилоторакса у детей. Операция заключается в торакоскопии, ревизии и клипировании грудного протока в месте его дефекта. Если он не обнаружен, проток клипируют над диафрагмой металлическими (титановыми) клипсами.
Торакоскопическое клипирование грудного лимфатического протока
Техника операции. Оператор и ассистент располагаются слева от ребенка.
Первый троакар диаметром 3,5 мм для телескопа вводят в V—VI межреберье по лопаточной линии и инсуффлируют углекислый газ под давлением 4—6 мм рт.ст. Второй троакар используют для введения диссектора, третий — атрав-матического окончатого зажима, ирригатора и клип-аппликатора.
Через 3—10 мин после инсуффляции углекислого газа правое легкое колабируется и виден задний синус плевральной полости. Методом монополярной коагуляции рассекают медиастинальную плевру и производят диссекцию клетчатки средостения двумя зажимами (KELLY, окончатые щипцы) между диафрагмой, позвоночным столбом и аортой. В клетчатке между позвоночным столбом, непарной веной и аортой выделяют грудной проток и клипируют металлическими клипсами (Ethicon Titanium-Clips, medium) с помощью клип-аппликатора, введенного через троакар диаметром 5 мм. Иногда визуализировать грудной проток сложно ввиду анатомического его расположения между аортой и левой стенкой позвоночного столба. При этом необходима более широкая мобилизация клетчатки средостения и аорты. Использование 30-градусной стержне-линзовой оптики позволяет осмотреть левую стенку позвоночного столба и визуализировать грудной проток. При отсутствии магистрального ствола грудного протока, что возможно при рассыпном типе его строения, необходимо выполнить клипирование клетчатки средостения на протяжении несколькими клипсами. По окончании операции плевральную полость дренируют через отверстие троакара диаметром 5 мм. Конец плеврального дренажа подводят к зоне операции. После раздувания правого легкого из плевральной полости аспирируют углекислый газ, удаляют троакары и склеивают лейкопластырем разрезы кожи на грудной стенке.
По окончании операции плевральную полость дренируют через отверстие троакара диаметром 5 мм. Конец плеврального дренажа подводят к зоне операции. После раздувания правого легкого из плевральной полости аспирируют углекислый газ, удаляют троакары и склеивают лейкопластырем разрезы кожи на грудной стенке.
Хилоторакс у новорожденных | Русский Анестезиологический Сервер
Баландина Н.А., Беляева И.Д., Степаненко С.М.,
Жиркова Ю.В., Цветков И.О.
ДГКБ №13 им. Н.Ф.Филатова,
Кафедра детской хирургии
Хилоторакс — это патологическое состояние,
связанное с накоплением лимфатической
жидкости в плевральной полости. Эта
патология встречается достаточно редко,
однако является серьезным и часто
угрожающим жизни заболеванием, приводящим
к глубоким респираторным, обменным и
иммунологическим нарушениям. Встречается в
любой возрастной группе, в том числе и в
период новорожденности. Сообщения о
Сообщения о
неонатальном хилотораксе малочисленны и
описывают от единичных до нескольких
десятков наблюдений.
За период 1998-1999 годов в отделении
реанимации Филатовской больницы
наблюдалось 3 детей с послеоперационным
хилотораксом.
Особенности анамнеза
|
Фамилия пациента
|
Срок гестации
|
Течение беременности
|
Основной диагноз
|
Сопутствующий диагноз
|
|
Кузнецова Вика
|
36 недель
|
Угроза прерывания беременности,маточное
|
Множественные пороки развития,
|
Задержка внутриутробного развития,
|
|
Кириулиш-вили
(девочка)
|
37 недель
|
Анемия, водянка беременных
|
Левосторонняя диафрагмальная грыжа
|
НМК, синдром угнетения ЦНС
|
|
Соколов (мальчик)
|
36-37 недель
|
Хронический пиелонефрит, водянка
|
Левосторонняя диафрагмальная грыжа
|
Внутриутробная пневмония, ДН ІІІ
|
Всем детям в первую неделю жизни был
поставлен диагноз — врожденная
диафрагмальная грыжа.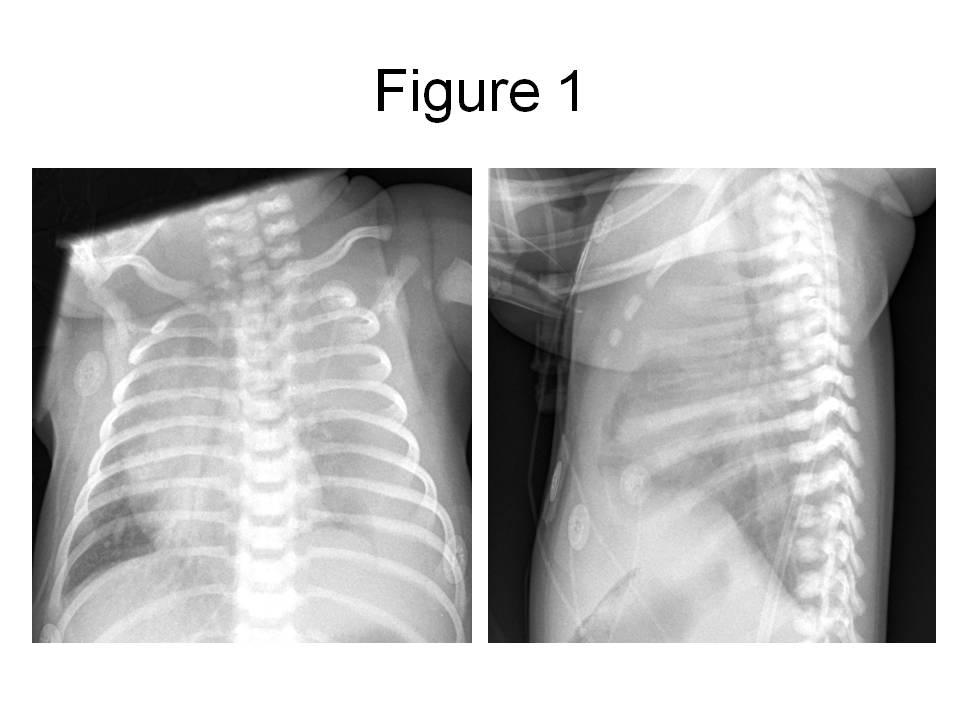 По поводу чего были
По поводу чего были
переведены в отделение реанимации и затем в
течение недели прооперированы. Операция
заключалась в проведении пластики купола
диафрагмы, дренирования плевральной
полости.
У всех детей были катетеризированы вены
бассейна нижней полой вены.
Со вторых суток после операции стали
получать большое количество выпота по
плевральным дренажам порядка 30 мл/кг/сут.
После начала энтерального питания жидкость
стала молочного цвета.
Диагноз хилоторакса ставился на
основании клинической картины (отделяемое
из плевральной полости с характерной
молочной окраской) и лабораторных данных (сходство
биохимических анализов плеврального
выпота и крови пациента).
Сравнение б/х показателей крови и лимфы
|
Кириулишвили
|
Кузнецова Вика
| |||
|
Кровь
|
Лимфа
|
Кровь
|
Лимфа
| |
|
К?ммоль/л
Nа?ммоль/л
Са??ммоль/л
Белок г/л
|
8,77
105,8
1,25
45
|
7,03
104,1
1,27
29
|
5,59
126,1
1,26
40
|
3,83
125,6
1,43
24
|
После установления диагноза хилоторакс
была полностью отменена энтеральная
нагрузка, проводилось полное
парентеральное питание по методу
гипералиментации с добавлением
необходимых витаминов, микроэлементов.
Наряду с этим проводилась посиндромная
терапия.
На 10 послеоперационные сутки в результате
больших потерь у детей стали развиваться
грубые водно — электролитные нарушения в
виде гиперкалиемии в плазме (6,35 — 7,94 ммоль/л),
гипонатриемии (105,8 — 124,2 ммоль/л),
гипопротеинемии (32 — 41 г/л).
Электролитные нарушения в плазме
|
Показатели
|
Клинические данные
|
Норма
|
|
Калий (ммоль/л)
Натрий (ммоль/л)
Белок (г/л)
|
6,35 — 7,94 ммоль/л
105,8-124,2 ммоль/л
32-41 г/л
|
4,5-5,5 ммоль/л
135-145 ммоль/л
55-73 г/л
|
Одновременно по данным ЭКГ отмечалась
внутриклеточная гипокалиемия на фоне
диффузных изменений миокарда. Следует
Следует
отметить, что подобные нарушения
достаточно трудно было скоррегировать,
несмотря на большой объем инфузионной
терапии.
Сохранявшиеся массивные жидкостные
потери потребовали выполнения
хирургического вмешательства — перевязки
грудного лимфатического протока. Одному
ребенку перевязку протока пришлось
выполнить дважды.
Сроки и название выполненного
оперативного вмешательства
|
Фамилия пациента
|
Сроки выполнения
|
Название операции
|
|
Кузнецова Вика
Кириулишвили
Соколов
|
16 п/о сутки
16 п/о сутки
21(5) п/о сутки
15 п/о сутки
|
Перевязка ГЛП *справа
Перевязка ГЛП слева
Перевязка ГЛП справа
Перевязка ГЛП слева
|
*ГЛП — грудной
лимфатический проток
У двоих детей после повторной операции
появилась положительная динамика в виде
уменьшения отделяемого по дренажам,
восстановления водно — электролитного
равновесия, стабилизации гемодинамики и
сердечной деятельности. Один ребенок
Один ребенок
несмотря на удачную перевязку
лимфатического протока от нарастающих
явлений сердечно — сосудистой и дыхательной
недостаточности умер на 35 сутки жизни.
Мы проанализировали порядка 90 источников,
сообщающих о неонатальном хилотораксе и
описывающих от единичных до нескольких
десятков наблюдений.
Количество наблюдений
- Engum SA Indianapolis 1996 — 1998гг. 7
новорожденных - Kavvadia V London 6
- Naik S London 3
- Bond SJ Louisville 1980 — 1990гг. 15
- Stringel G 1976 — 1983гг. 7 (после
операции) - Van Straaten HL Dania 1992г. 11
- Mercer S 1986г. 5 (после ВДГ*)
- Echeverria Lecuona, San Sebastian 1978 — 1998гг.
10 (врожденные) - Van Aerde J за 22 года 12 (спонтанный)
- Browse NL 1956-1986 гг. 20
- Gonzales de Dios J Madrid 1975-1990 гг.
3
*ВДГ — врожденная
диафрагмальная грыжа
Как видно из таблицы, наблюдения
действительно малочисленные, и, в основном,
касаются новорожденных со спонтанным,
врожденным и послеоперационным
хилотораксом.
В настоящее время нет единой точки зрения
на патогенез возникновения хилоторакса.
Расценивая хилоторакс в основном как
осложнение, зарубежные авторы указывают на
следующие этиопатогенетические факторы.
Причины возникновения хилоторакса у
новорожденных
- ятрогенные причины (кардиоторакальные
операции, пункции центральных вен системы
верхней полой вены, травма в родах) - повышение давления в
системе ВПВ* (в частности при тромбозе ВПВ) - диафрагмальная грыжа
- пороки развития
лимфатической системы (рассыпной тип,
гипоплазия сосудов или сосудистой стенки) - лимфангиоматоз
- генетические пороки (синдром
Дауна, Gorham`s син — м, Noonan
син — м) - врожденная ЦМВ — инфекция
- воспалительный процесс
*ВПВ — верхняя полая вена
Во-первых, это ятрогенные причины -
повреждение лимфатических сосудов при
кардиоторакальных операциях, пункциях
центральных вен и травма в родах. Отмечено,
Отмечено,
что при повреждении лимфатического протока
выше 6 грудного позвонка обычно развивается
левосторонний хилоторакс; ниже -
правосторонний хилоторакс.
Во-вторых — повышение венозного давления в
системе верхней полой вены приводит к
развитию патологической гипертензии в
системе грудного лимфатического протока,
так как лимфа не поступает в большой круг
кровообращения. Повышение давления может
быть связано с тромбозами системы верхней
полой вены, перегрузками правых отделов
сердца.
Возникновение хилоторакса у больных с
врожденной диафрагмальной грыжей
преимущественно обусловлено порочным
развитием легкого и отделов сердца на
стороне поражения и, соответственно,
кровеносных и лимфатических сосудов этой
области. Одним из патогномоничных
симптомов ВДГ является легочная
гипертензия и перегрузка правых отделов
сердца. А повышение давления в системе
верхней полой вены в условиях порочно
развитой стенки лимфатического сосуда или
рассыпного типа строения может привести к
повышенному пропотеванию лимфы через
стенку сосуда или даже к его разрыву.
Так же описано
возникновение хилоторакса при пороках
лимфатической системы, лимфангиоматозе
кожи, плевры, генетических пороках, таких
как болезнь Дауна, синдромы Noonan и
Gorham’s, и при ЦМВ-инфекции.
Диагностика хилоторакса основана на
оценке клинических и лабораторных
признаков. В нашем случае оценивался только
молочный оттенок выпота и схожесть б/х
состава с плазмой. Однако при отсутствии
энтерального питания молочными смесями
соответственно нет и молочного оттенка
выпота.
Поэтому необходимо использовать более
точные критерии для диагностики. По данным
зарубежной литературы для постановки
диагноза используется подсчет общего
количества клеток, % содержание лимфоцитов
в хилезной жидкости, уровень триглицеридов,
лимфангиография, а также сцинтиграфия с
радиоизотопом йода. Последние два метода
также используют для точной локализации
повреждения.
Для хилоторакса характерно высокое
содержание в плевральном выпоте лимфоцитов
выше 90 %, липидов выше 1,1 ммоль/л и превышение
общего количества клеток более 1000 в мкл.
Эти данные являются статистически
достоверными.
Сравнение состава хилезного выпота и
нехилезного
|
|
хилезный выпот
|
нехилезный выпот
|
|
общее количество клеток
% содержание
уровень триглицеридов
|
более 1000 /мкл
более 90 %
более 1,1 ммоль/л
|
20 — 1400 /мкл
до 60 %
0,1 — 0,71ммоль/л
|
Оптимальное решение этой проблемы до
настоящего времени не определено, так как
медикаментозная терапия часто оказывается
неэффективной. Хирургическое лечение
Хирургическое лечение
хилоторакса остается основным методом
терапии. Однако несмотря на это,
практически все авторы начинают лечение с
консервативных методов.
Консервативное лечение
- Периодический торакоцентез или
установка постоянного плеврального
дренажа
- Диета
- Парентеральное питание
- Массивная инфузионная терапия
Консервативное лечение начинают с
периодического торакоцентеза или
установки постоянного плеврального
дренажа для эвакуации хилезной жидкости и
предотвращения развития дыхательных
расстройств.
Далее, существует несколько подходов в
лечебной тактике: 1)энтеральная нагрузка не
отменяется, однако полностью исключаются
жиры; при отсутствии положительного
результата отменяется энтеральное питание,
пациент переводится на полное
парентеральное питание с последующим
хирургическим вмешательством при наличии
показаний; 2)энтеральное питание не
отменяется, жиры вводятся парентерально; 3)энтеральное
питание так же не отменяется, назначается
диета, обогащенная белками, углеводами,
часть необходимых элементов вводится
парентерально.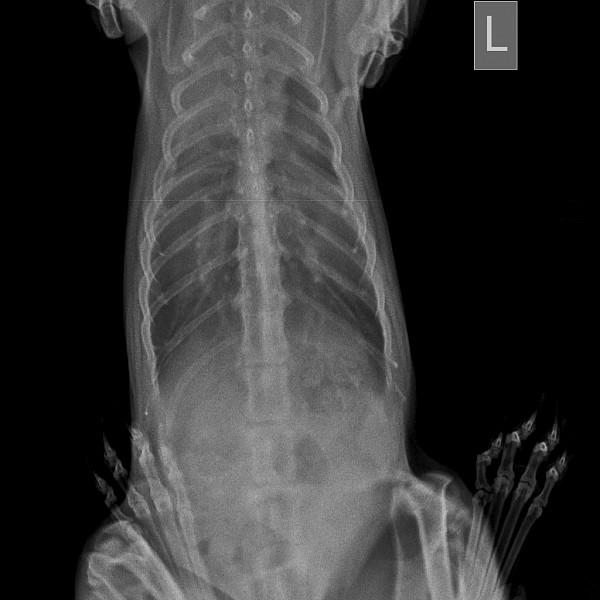 Исследования физиологии
Исследования физиологии
всасывания в желудочно-кишечном тракте
позволили не отменять жиры, которые
вводятся в расщепленном состоянии — в виде
среднецепочечных триглицеридов перорально.
Из стенки кишечника среднецепочечные
триглицериды попадают в кровеносное русло
минуя лимфу. Аминокислоты необходимо
назначать в более высоких дозах, чем обычно
для восполнения суточной потребности и
коррекции имеющейся гипопротеинемии.
Проводится инфузионная терапия в больших
объемах для восполнения потерь жидкости с
плевральным выпотом.
Отсутствие положительного результата или
превышение объема выпота 1,5 л/день у
взрослых пациентов и 100 мл/на год жизни в
день у детей является показанием к
оперативному вмешательству. У
новорожденных эти показатели в настоящее
время еще не определены.
К основным методам оперативного
вмешательства относятся: наложение
плевроперитонеального шунта, перевязка
грудного лимфатического протока, плевродез,
наложение анастомоза между лимфатическим
протоком и v. azygos.
azygos.
Плевроперитонеальное шунтирование
считается одним из наиболее простых,
эффективных и минимально инвазивных
методов хирургического лечения
хилоторакса. Длительность стояния
плевроперитонеального шунта по данным
зарубежных авторов от нескольких дней до
года.
Некоторые авторы сделали вывод, что
длительное консервативное лечение снижает
вероятность хирургического вмешательства,
но продлевает время пребывания ребенка в
стационаре. И наоборот, раннее
хирургическое лечение (до 3 недель)
сокращает сроки выздоровления.
Несмотря на хорошо разработанные
принципы терапии хилоторакса, по данным
зарубежных авторов летальность составляет
от 30 до 50 %.
И в заключении: существует много методов
лечения, однако при этом сохраняется
высокая летальность. Поэтому существует
необходимость дальнейшего изучения этой
проблемы. Что касается нашей тактики, она
заключается, во-первых, в отмене
энтерального питания и переводе на полное
парентеральное питание без применения
жиров, во-вторых, в установке плеврального
дренажа и при наличии показаний дальнейшее
оперативное лечение. Изучив литературные
Изучив литературные
данные, возможно следует несколько
изменить тактику ведения больных с
хилотораксом в отношении энтерального
питания, использования жиров и новых
методов хирургического лечения.
Please enable JavaScript to view the comments powered by Disqus.
blog comments powered by
Хилоторакс. Клинические случаи
Хилоторакс характеризуется истечением лимфы в плевральную полость. Этот симптом, лежащий в основе поражения лимфатической системы, — общая конечная точка для целого ряда патологических процессов. Установление этиологии, выбор лучшей терапии, дальнейший прогноз — сложная задача. Частота встречаемости врожденного (первичного, идиопатического) хилоторакса — 1 случай на 15 тыс. новорожденных [1, 2].
Пренатально по данным ультразвукового исследования (УЗИ) можно диагностировать полостные отеки у плода (асцит, гидроторакс) [3]. В период новорожденности полостные отеки можно диагностировать по данным УЗИ и Rg-исследования. Клинически у ребенка отмечаются нарушение механики дыхания, проявления дыхательной недостаточности. Имеет место отечный синдром. Важный критерий диагноза «хилоторакс» — биохимический и морфологический анализ выпота полостей.
Клинически у ребенка отмечаются нарушение механики дыхания, проявления дыхательной недостаточности. Имеет место отечный синдром. Важный критерий диагноза «хилоторакс» — биохимический и морфологический анализ выпота полостей.
Широко используются хирургические методы лечения, такие как торакоцентез и дренирование плевральных полостей, а также консервативная терапия.
Существенный момент выхаживания новорожденных с данной патологией — проведение лечебного энтерального питания специальными смесями, обедненными длинноцепочечными жирными кислотами.
Материал и методы
В период с августа 2015 г. по январь 2016 г. наблюдали 4 случая врожденного хилоторакса (табл. 1).
(* На рис. 1-4 отображены данные о 4 пациентах с хилотораксом: объем выпота в плевральной полости, примененные дозы октреотида, особенности нутритивной поддержки (полное парентеральное питание, специальная формула, обогащенная среднецепочечными триглицеридами, или обычное энтеральное питание смесью, рекомендованной в I полугодии). Объем плеврального выпота (мл/сут) обозначен вертикальными колонками, примененные дозы октреотида (мкг/кг в час) — квадратами, соединенными линией. Вскармливание обозначено фоновой штриховкой: полное парентеральное питание — точками, энтеральное вскармливание обычной молочной смесью — горизонтальной штриховкой, смесь, обогащенная среднецепочечными триглицеридами, — диагональной штриховкой. Сроки терапии силденафилом — прямоугольником.)
Объем плеврального выпота (мл/сут) обозначен вертикальными колонками, примененные дозы октреотида (мкг/кг в час) — квадратами, соединенными линией. Вскармливание обозначено фоновой штриховкой: полное парентеральное питание — точками, энтеральное вскармливание обычной молочной смесью — горизонтальной штриховкой, смесь, обогащенная среднецепочечными триглицеридами, — диагональной штриховкой. Сроки терапии силденафилом — прямоугольником.)
Ребенок К. родился у матери с отягощенным гинекологическим анамнезом (полип эндометрия, бесплодие). Пренатально у плода были диагностированы гидроторакс, асцит. Роды первые на сроке 36-37 нед, родоразрешение путем операции кесарева сечения, оценен по шкале Апгар 5/6 баллов, масса тела при рождении 2420 г. С рождения состояние крайне тяжелое, проводилась искусственная вентиляция легких (ИВЛ), была начата инотропная поддержка добутамином, дофамином, переведен в отделение реанимации и интенсивной терапии новорожденных (ОРИТН). При поступлении по тяжести дыхательной недостаточности переведен на высокочастотную искусственную вентиляцию легких, продолжены инотропная поддержка, обезболивание фентанилом. При УЗИ плевральных полостей выявлены гидроторакс до 40 мл выпота с двух сторон, минимальный асцит. Произведен торакоцентез с двух сторон. По дренажам отходило ксантохромное отделяемое (белок 15 г/л, сахар 7,3 ммоль/л, лактатдегидрогеназа 1007 Ед/л, кислотоустойчивых микобактерий не обнаружено, 190 кл/мкл, морфологически — большое количество эритроцитов). Гидроторакс разрешился на 3-и сутки жизни, позже по дренажам отходил воздух, дренажи перекрыты и удалены на 7-е сутки жизни, когда ребенок был экстубирован, в дополнительной оксигенации не нуждался. С 9-х суток жизни было начато энтеральное питание смесью «preNAN».
При УЗИ плевральных полостей выявлены гидроторакс до 40 мл выпота с двух сторон, минимальный асцит. Произведен торакоцентез с двух сторон. По дренажам отходило ксантохромное отделяемое (белок 15 г/л, сахар 7,3 ммоль/л, лактатдегидрогеназа 1007 Ед/л, кислотоустойчивых микобактерий не обнаружено, 190 кл/мкл, морфологически — большое количество эритроцитов). Гидроторакс разрешился на 3-и сутки жизни, позже по дренажам отходил воздух, дренажи перекрыты и удалены на 7-е сутки жизни, когда ребенок был экстубирован, в дополнительной оксигенации не нуждался. С 9-х суток жизни было начато энтеральное питание смесью «preNAN».
Гистология последа: микоплазменное поражение, диссоциированное созревание, дисциркуляторные нарушения.
Анализ на TORCH—инфекцию методом полимеразной цепной реакции (ПЦР): кровь, плевральный выпот — отрицательно.
Серология крови методом иммуноферментного анализа (ИФА): высокие титры IgG к вирусу простого герпеса (HSV), цитомегаловирусу (CMV), токсоплазма.
На фоне прогрессирования гипертензионно-гидроцефального синдрома [последствие внутрижелудочкового кровоизлияния (ВЖК) II степени] проводились разгрузочные люмбальные пункции. В ликворе методом ПЦР обнаружена Ureaplasma urealyticum, проводилась эрадикационная антимикробная терапия. Ребенок был выписан в возрасте 2 мес домой с основным диагнозом: внутриамниотическая инфекция бактериально-микоплазменной этиологии с поражением легких, печени, желудочно-кишечного тракта (ЖКТ), центральной нервной системы (ЦНС).
Доношенный мальчик Д. от второй беременности, вторых родов, протекавшей на фоне многоводия. Антенатально врожденных аномалий развития плода выявлено не было. Роды срочные, родоразрешение через естественные родовые пути. Масса тела при рождении 3430 г, по шкале Апгар 7/8 баллов. Выписан на 4-е сутки жизни из родильного дома. Дома находился на смешанном вскармливании. Ухудшение состояние произошло на 22-е сутки жизни в виде нарастания дыхательной недостаточности. Ребенка госпитализировали в ОРИТН, где был диагностирован правосторонний гидроторакс. Мальчик был интубирован, начата ИВЛ, произведен торакоцентез, одномоментно получено 220 мл экссудата хилезной консистенции. При анализе выпота: лимфа (цвет — молочный, триглицериды 8,73 ммоль/л, цитоморфология: лимфоциты 93%). С соблюдением всех правил назначения препаратов off-label ребенку была начата инфузия октреотида, которая с подбором дозы продолжалась до 2 мес 15 дней жизни, т.е. в течение 50 сут (максимальная доза 15 мкг/кг в час). С 1 мес 21 дня жизни ребенку была начата терапия лимфатической мальформации силденафилом per os в дозе 9 мг/кг в сутки (с соблюдением всех правил назначения препаратов off-label), суммарно терапия проводилась в течение 36 дней. Ребенок находился на полном парентеральном питании в течение 35 дней.
Ребенка госпитализировали в ОРИТН, где был диагностирован правосторонний гидроторакс. Мальчик был интубирован, начата ИВЛ, произведен торакоцентез, одномоментно получено 220 мл экссудата хилезной консистенции. При анализе выпота: лимфа (цвет — молочный, триглицериды 8,73 ммоль/л, цитоморфология: лимфоциты 93%). С соблюдением всех правил назначения препаратов off-label ребенку была начата инфузия октреотида, которая с подбором дозы продолжалась до 2 мес 15 дней жизни, т.е. в течение 50 сут (максимальная доза 15 мкг/кг в час). С 1 мес 21 дня жизни ребенку была начата терапия лимфатической мальформации силденафилом per os в дозе 9 мг/кг в сутки (с соблюдением всех правил назначения препаратов off-label), суммарно терапия проводилась в течение 36 дней. Ребенок находился на полном парентеральном питании в течение 35 дней.
За время нахождения в стационаре ребенок перенес нозокомиальный сепсис, вызванный Kl. pneumoniae, E. faecium. В связи с отмечавшейся гипопротеинемией на фоне лимфореи ребенку с заместительной целью проводились трансфузии свежезамороженной плазмы. В дальнейшем ребенок был экстубирован на 23-и сутки жизни, на фоне адекватного дренирования плевральной полости в респираторной поддержке не нуждался, был кислородонезависим.
faecium. В связи с отмечавшейся гипопротеинемией на фоне лимфореи ребенку с заместительной целью проводились трансфузии свежезамороженной плазмы. В дальнейшем ребенок был экстубирован на 23-и сутки жизни, на фоне адекватного дренирования плевральной полости в респираторной поддержке не нуждался, был кислородонезависим.
Энтеральное питание молочной смесью, обогащенной среднецепочечными триацилглицеридами («Monogen», Nutricia) было начато с 2 мес 9 дней жизни и продолжалось 16 дней, с постепенной отменой перед выпиской и заменой молочной смесью «Nestogen». Хилоторакс разрешился в 2 мес 15 дней жизни, дренаж был удален через 5 дней после отсутствия выделения выпота по дренажу под контролем УЗИ плевральных полостей. Анализ кариотипа (46XY), эхокардиография, нейросонография, УЗИ органов брюшной полости, почек — без патологии. Неонатальный скрининг пройден. Анализ на TORСH-инфекцию методом ПЦР: кровь — Mycoplasma genitalium, ликвор — Mycoplasma hominis. Серология крови методом ИФА: IgG к HSV, CMV. Ребенку проводился дифференциальный диагноз с болезнью Вальдмана [18], однако по данным анализа кала на альбумин (0,007 мг%) диагноз был исключен. Для исключения новообразования грудной полости ребенку была выполнена мультиспиральная компьютерная томография (МСКТ) грудной полости, легких, на которой были выявлены КТ-признаки правостороннего хилоторакса с элементами отграничения парамедиастинально в проекции переднего средостения (значительное количество свободного выпота в плевральной полости справа с максимальным расхождением листков до 2,5 см, затеки по междолевой плевре). Для наблюдения за объемом плеврального выпота ребенку проводился динамический УЗИ-контроль.
Серология крови методом ИФА: IgG к HSV, CMV. Ребенку проводился дифференциальный диагноз с болезнью Вальдмана [18], однако по данным анализа кала на альбумин (0,007 мг%) диагноз был исключен. Для исключения новообразования грудной полости ребенку была выполнена мультиспиральная компьютерная томография (МСКТ) грудной полости, легких, на которой были выявлены КТ-признаки правостороннего хилоторакса с элементами отграничения парамедиастинально в проекции переднего средостения (значительное количество свободного выпота в плевральной полости справа с максимальным расхождением листков до 2,5 см, затеки по междолевой плевре). Для наблюдения за объемом плеврального выпота ребенку проводился динамический УЗИ-контроль.
Ребенок был выписан в возрасте 3 мес жизни домой с диагнозом: врожденный хилоторакс; внутриутробная микоплазменная инфекция с поражением легких; ЦНС.
Доношенный новорожденный мальчик Б., родившийся у матери 27 лет. От второй беременности, протекавшей на фоне гестационного сахарного диабета, угрозы прерывания в 10 нед, ОРВИ в 16 нед с подъемом температуры тела, ринитом и ларингитом, острого многоводия. Роды вторые срочные в лицевом предлежании, родоразрешение через естественные родовые пути. Околоплодные воды светлые, более 3 л. Масса тела при рождении 4970 г. Оценен по шкале Апгар 3/5 баллов, через 30 мин после рождения — рН 6,79, рСО2— 121 мм рт.ст., BE — 16. Состояние с рождения крайне тяжелое, крика нет, интубирован, проводились ИВЛ, инотропная поддержка дофамином, седация. Был заподозрен гидроторакс, при дренировании получена желтая опалесцирующая жидкость. Учитывая отсутствие судорожного синдрома клинически и по данным электроэнцефалографии (аЭЭГ), лечебная гипотермия не проводилась; согрет. По данным УЗИ органов брюшной полости, плевральных полостей — умеренный асцит, анэхогенный выпот в плевральных полостях с двух сторон. При лабораторном исследовании: гипопротеинемия, уровень трансаминаз в норме. Анализ крови/плеврального выпота на инфекции методом ПЦР — отрицательно. При исследовании крови методом ИФА — титр антител класса IgG к CMV, HSV. По данным гистологии последа — внутриамниотическая инфекция, гнойный мембранозный субхориальный интервиллузит, хламидийный хориодецидуит (по данным иммуногистохимии найдены антигены к Chlamydia spp.
Роды вторые срочные в лицевом предлежании, родоразрешение через естественные родовые пути. Околоплодные воды светлые, более 3 л. Масса тела при рождении 4970 г. Оценен по шкале Апгар 3/5 баллов, через 30 мин после рождения — рН 6,79, рСО2— 121 мм рт.ст., BE — 16. Состояние с рождения крайне тяжелое, крика нет, интубирован, проводились ИВЛ, инотропная поддержка дофамином, седация. Был заподозрен гидроторакс, при дренировании получена желтая опалесцирующая жидкость. Учитывая отсутствие судорожного синдрома клинически и по данным электроэнцефалографии (аЭЭГ), лечебная гипотермия не проводилась; согрет. По данным УЗИ органов брюшной полости, плевральных полостей — умеренный асцит, анэхогенный выпот в плевральных полостях с двух сторон. При лабораторном исследовании: гипопротеинемия, уровень трансаминаз в норме. Анализ крови/плеврального выпота на инфекции методом ПЦР — отрицательно. При исследовании крови методом ИФА — титр антител класса IgG к CMV, HSV. По данным гистологии последа — внутриамниотическая инфекция, гнойный мембранозный субхориальный интервиллузит, хламидийный хориодецидуит (по данным иммуногистохимии найдены антигены к Chlamydia spp. ). По данным анализа плеврального выпота — лимфа, белок 34 г/л, лимфоциты 87%, триглицериды 0,16 ммоль/л.
). По данным анализа плеврального выпота — лимфа, белок 34 г/л, лимфоциты 87%, триглицериды 0,16 ммоль/л.
В динамике состояние ребенка стабильное. С соблюдением всех правил назначения препаратов off-label была начата инфузия октреотида максимально в дозе 5 мкг/кг в час с постепенной отменой на 12-е сутки жизни, экстубирован на 6-е сутки жизни, в дальнейшем потребности в дополнительной оксигенации не было. Дренаж удален на 8-е сутки жизни. Ребенок был выписан из стационара в возрасте 1 мес жизни.
Ребенок Т. родился у матери 23 лет от первой беременности, протекавшей с ОРЗ, артериальной гипертензией, угрозой прерывания в 12 нед. Роды на сроке 37 нед через естественные родовые пути, проводились амниотомия, перинеотомия, диагностированы угрожающая гипоксия плода, тугое обвитие пуповины вокруг шеи. По Апгар оценен на 1/2/3 балла. Масса тела при рождении 3770 г. С рождения состояние крайне тяжелое, в родильном зале проводились реанимационные мероприятия. Обращали внимание выраженная отечность мягких тканей груди, живота, гепатоспленомегалия.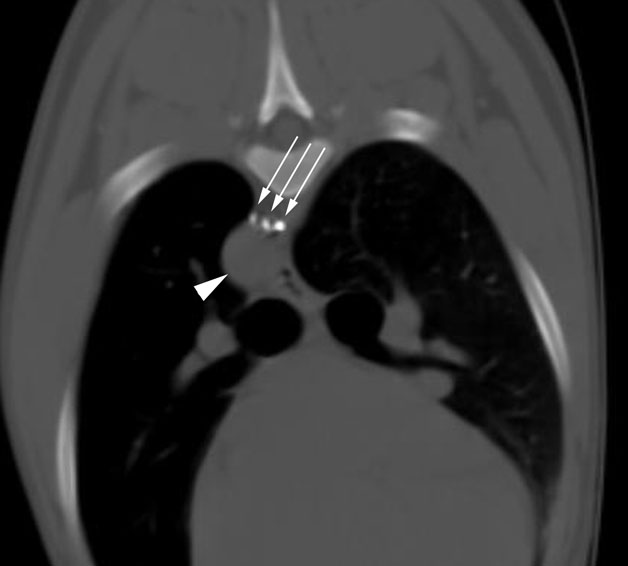 Проводилась ИВЛ, инотропная поддержка адреналином, добутамином, обезболивание фентанилом. В связи с выраженной гипопротеинемией (общий белок 19 г/л) проводились трансфузии раствора альбумина, свежезамороженной плазмы. По данным УЗИ — двусторонний гидроторакс, асцит, в связи с чем были выполнены лапароцентез, торакоцентез с двух сторон, по дренажам отходило ксантохромное отделяемое. При лабораторном исследовании выпота — лимфа: лейкоциты 1410 кл/мкл, морфологически лимфоциты 93%, триглицериды 0,41 ммоль/л (без энтерального питания). С рождения отмечалась анемия тяжелой степени, потребовавшая проведения гемотрансфузии эритроцитной взвеси, высокие показатели трансаминаз (АСТ — 370, АЛТ — 63). В динамике состояние ребенка крайне тяжелое. С 6-х суток жизни было начато трофическое энтеральное питание смесью «Нестожен». С 9-х суток жизни с соблюдением всех правил назначения препаратов off-label была начата инфузия октреотида, энтеральное питание смесью «Моноген». На 10-е сутки жизни ребенок экстубирован, далее оксигенотерапию проводили через кислородную маску.
Проводилась ИВЛ, инотропная поддержка адреналином, добутамином, обезболивание фентанилом. В связи с выраженной гипопротеинемией (общий белок 19 г/л) проводились трансфузии раствора альбумина, свежезамороженной плазмы. По данным УЗИ — двусторонний гидроторакс, асцит, в связи с чем были выполнены лапароцентез, торакоцентез с двух сторон, по дренажам отходило ксантохромное отделяемое. При лабораторном исследовании выпота — лимфа: лейкоциты 1410 кл/мкл, морфологически лимфоциты 93%, триглицериды 0,41 ммоль/л (без энтерального питания). С рождения отмечалась анемия тяжелой степени, потребовавшая проведения гемотрансфузии эритроцитной взвеси, высокие показатели трансаминаз (АСТ — 370, АЛТ — 63). В динамике состояние ребенка крайне тяжелое. С 6-х суток жизни было начато трофическое энтеральное питание смесью «Нестожен». С 9-х суток жизни с соблюдением всех правил назначения препаратов off-label была начата инфузия октреотида, энтеральное питание смесью «Моноген». На 10-е сутки жизни ребенок экстубирован, далее оксигенотерапию проводили через кислородную маску. Затем отмечалось нарастание дыхательной недостаточности, которое было обусловлено дисфункцией дренажа. Ребенок был повторно интубирован и переведен на ИВЛ в течение суток, повторно проведен торакоцентез. С 13-х суток жизни были удалены оба дренажа, однако в возрасте 16 сут повторное нарастание объема выпота потребовало проведения торакоцентеза справа. С 16-х суток жизни начата терапия силденафилом. У ребенка был исключен гипотиреоз. С 20-х суток жизни удален дренаж, с 21-х суток было возобновлено энтеральное питание смесью «Нестожен».
Затем отмечалось нарастание дыхательной недостаточности, которое было обусловлено дисфункцией дренажа. Ребенок был повторно интубирован и переведен на ИВЛ в течение суток, повторно проведен торакоцентез. С 13-х суток жизни были удалены оба дренажа, однако в возрасте 16 сут повторное нарастание объема выпота потребовало проведения торакоцентеза справа. С 16-х суток жизни начата терапия силденафилом. У ребенка был исключен гипотиреоз. С 20-х суток жизни удален дренаж, с 21-х суток было возобновлено энтеральное питание смесью «Нестожен».
Гистология последа: в тканях плаценты обнаружены антигены вируса простого герпеса 1-го, 2-го типов, микоплазм (общий антиген). Проводилась эрадикационнная антимикробная терапия.
В табл. 2 представлены сводные данные, характеризующие эффективность терапии в описываемых случаях.
Результаты и обсуждение
В номенклатуре поражения лимфатической системы различают лимфангиомы (локализованное патологическое расширение лимфатических капиляров), лимфоангиоматоз (патологическое расширение и увеличение количества лимфатических узлов), лимфангиэктазию (патологическое расширение по ходу лимфатических сосудов при их нормальном количестве), а также врожденный синдром лимфатической дисплазии, включающий первичную лимфедему (болезнь Милроя), идиопатический хилезный выпот в плевральную полость (в том числе хилоторакс, ассоциированный с генетическими синдромами: Нунана, Тернера, Дауна, Реклингхаузена и др. ), брюшную и перикардиальную полости без верифицированной причины и при отсутствии лимфангиом, лимфангиоматоза, лимфангиэктазии [1, 2]. Вторичный хилоторакс чаще всего связан с повреждением грудного протока при различных торакальных оперативных вмешательствах.
), брюшную и перикардиальную полости без верифицированной причины и при отсутствии лимфангиом, лимфангиоматоза, лимфангиэктазии [1, 2]. Вторичный хилоторакс чаще всего связан с повреждением грудного протока при различных торакальных оперативных вмешательствах.
Прогноз для плода при пренатальном диагнозе зависит от наличия других пороков развития и легочной гипоплазии. Устанавливают плеврально-амниотические шунты, проводят серии торакоцентезов, а при неудовлетворительном результате — плевродез [3].
Однако следует дифференцировать и такое состояние новорожденных, как неиммунная водянка плода, которое характеризуется скоплением жидкости в двух и более полостях, не связанным с иммунным конфликтом. В патогенезе различают три составляющие: 1) обструкция лимфатического протока; 2) застойная сердечная недостаточность; 3) снижение онкотического давления плазмы крови одновременно с увеличением проницаемости капилляров.
Этиология неиммунной водянки плода достаточна разнообразна: патология сердца (кардиомиопатии, пароксизмальная тахикардия), генетические синдромы, гематологические заболевания (фетофетальная трансфузия, талассемия, гемолиз), тиреотоксикоз, гипопротеинемия, связанная с врожденным нефротическим синдромом, инфекция (TORCH, парвовирус B19, Коксаки), метаболические болезни (лизосомальные болезни накопления) [1].
Лимфа по своему составу богата белками (альбумин, иммуноглобулины, фибриноген), триглицеридами и содержит большое число лимфоцитов, имеет молочный, белый с желтоватым оттенком цвет. К абсолютным критериям хилоторакса относятся общее количество клеток >1000/мкл, из них более 80% -лимфоциты, содержание триглицеридов >1,1 ммоль/л [4, 5]. Если пациент не получал энтерального питания, выпот может быть прозрачным, светло-желтым и обеднен триглицеридами.
Консервативная терапия включает несколько ключевых моментов. Во-первых, это торакоцентез и установка дренажа, эвакуация выпота из плевральной полости для декомпресии легкого [1, 2, 6]. В терапии хилоторакса используют октреотид — синтетический аналог соматостатина, обладающий сходными с ним фармакологическими эффектами, но значительно большей продолжительностью действия. Механизм действия октреотида неизвестен. В опытах на животных с хилотораксом на фоне инфузии октреотида прекращалось выделение лимфы [7, 8]. Предполагается, что октреотид снижает секрецию желез ЖКТ, ингибирует абсорбцию триглицеридов, воздействует на рецепторы соматостатина в висцеральных сосудах, что приводит к уменьшению висцерального кровотока, а это в совокупности может способствовать ингибированию производства лимфатической жидкости и разрешению хилоторакса [7-10].
По данным M. Buck, октреотид может быть использован у детей подкожно в дозе от 20 до 70 мкг/кг в сутки, разделенной на 3 равных приема, или же в виде внутривенной инфузии в стартовой дозировке от 1 до 4 мкг/кг в час с титрованием дозы при необходимости до 10 мкг/кг в час [4, 7, 9]. Учитывая фармакокинетику октреотида, в целях безопасности и снижения риска побочных эффектов рекомендовано использовать начальную дозу 0,5 мкг/кг в час с постепенным увеличением максимально до 10 мкг/кг в час до достижения эффекта [5, 10, 11]. Длительность терапии, как правило, определяется уменьшением объема выпота по плевральному дренажу. При использовании соматостатина начальная доза может составлять 3,5 мкг/кг в час, с титрованием максимально до 10-15 мкг/кг в час. Хотя соматостатин можно вводить подкожно, большинство исследований публикуют данные терапии хилоторакса на фоне непрерывной внутривенной инфузии [11].
В литературе имеются противоречивые сведения об эффективности использования октреотида в лечении хилоторакса. N.H. Foo, Y.S. Hwang и соавт. [6] сообщают, что про- грессирование хилоторакса уменьшилось на фоне инфузии октреотида и адекватного дренирования плевральных полостей, что позволило избежать более инвазивных хирургических процедур, таких как перевязка грудного протока, плевродез, создание плевроперитонеального шунта. Однако, по данным M. Horvers и соавт. [4], плевральный выпот в конечном итоге снизился у всех 7 пациентов с врожденным хилотораксом, что может отражать естественное течение заболевания. Не было замечено четкого и последовательного эффекта от терапии октреотидом. Ряд авторов, опасаясь рецидива хилоторакса, продолжают инфузию октреотида после прекращения отделения выпота еще несколько дней на достаточно высоких дозировках, будучи до конца не уверенными в роли октреотида в разрешении хилоторакса [10]. Из побочных эффектов препарата описаны гипогликемия или персистирующая гипергликемия, мальабсорбция, колики, метеоризм, диарея, стеаторея, холелитиаз, ингибирование ангиогенеза сетчатки [5, 10, 11].
N.H. Foo, Y.S. Hwang и соавт. [6] сообщают, что про- грессирование хилоторакса уменьшилось на фоне инфузии октреотида и адекватного дренирования плевральных полостей, что позволило избежать более инвазивных хирургических процедур, таких как перевязка грудного протока, плевродез, создание плевроперитонеального шунта. Однако, по данным M. Horvers и соавт. [4], плевральный выпот в конечном итоге снизился у всех 7 пациентов с врожденным хилотораксом, что может отражать естественное течение заболевания. Не было замечено четкого и последовательного эффекта от терапии октреотидом. Ряд авторов, опасаясь рецидива хилоторакса, продолжают инфузию октреотида после прекращения отделения выпота еще несколько дней на достаточно высоких дозировках, будучи до конца не уверенными в роли октреотида в разрешении хилоторакса [10]. Из побочных эффектов препарата описаны гипогликемия или персистирующая гипергликемия, мальабсорбция, колики, метеоризм, диарея, стеаторея, холелитиаз, ингибирование ангиогенеза сетчатки [5, 10, 11]. Имеются публикации о развитии некротического энтероколита у новорожденных на фоне терапии октреотидом, что связано со спазмированием спланхических сосудов ЖКТ [12, 13]. Есть сведения о лекарственно-индуцированной легочной гипертензии при использовании октреотида в рекомендованных дозах, рассмотрены механизмы развития этого состояния, что связано с вазоконстрикторным эффектом, опосредованным через рецепторы к соматостатину SRIF-4. Рекомендован эхокардиографический мониторинг во время лечения [14, 15].
Имеются публикации о развитии некротического энтероколита у новорожденных на фоне терапии октреотидом, что связано со спазмированием спланхических сосудов ЖКТ [12, 13]. Есть сведения о лекарственно-индуцированной легочной гипертензии при использовании октреотида в рекомендованных дозах, рассмотрены механизмы развития этого состояния, что связано с вазоконстрикторным эффектом, опосредованным через рецепторы к соматостатину SRIF-4. Рекомендован эхокардиографический мониторинг во время лечения [14, 15].
С. Danial и соавт. сообщают об успешном применении силденафила в рандомизированном контролируемом исследовании у детей от 1 года до 7 лет с лимфатической мальформацией внелегочной локализации, что привело к значимому уменьшению объема мальформации [16].
Уже в 2015 г. этот опыт применили для терапии врожденного хилоторакса у новорожденного, который разрешился на 15-е сутки после начала лечения силденафилом. Механизм действия связан с ингибированием фосфодиэстеразы 5-го типа, что предотвращает деградацию циклического гуанозинмонофосфата и способствует росту и ремоделирова-нию лимфатических сосудов [2].
Нутриционная поддержка при хилотороксе заключается в обеспечении адекватного энергообеспечения и одновременной минимизации потока лимфы в грудную полость для заживления места утечки лимфы и разрешения хилоторакса.
Следует заметить, что даже обычное питье может значительно усилить продукцию лимфы [1, 17], поэтому некоторые врачи придерживаются тактики полного парентерального питания ребенка до разрешения лимфоторакса. Жировые имульсии для парентерального питания можно использовать у детей с хилотораксом для обеспечения достаточного энергообеспечения и дотации эссенциальных жирных кислот, так как они попадают непосредственно в системный кровоток и не проходят через лимфатическую систему [18].
В двухлетнем исследовании B. Cormack и соавт. рекомендовано энтеральное питание у детей с послеоперационными хилотораксами при отсутствии противопоказаний, приводится собственный алгоритм выбора нутритивной поддержки, отдаленные результаты лечения [19].
Обычно для энтерального питания используют специальные молочные смеси и фортификаторы («Enfaport», Mead Johnson Nutrition, «Monogen», Nutricia of North America), обогащенные среднецепочечными триглицеридами (Medium-chain triglyceride, MCT) и обедненные длинноцепочечными жирными кислотами (longchain fatty acids, lCFAs). MCT адсорбируются из ЖКТ и попадают непосредственно в портальный кровоток, минуя лимфатические сосуды, что теоретически увеличивает вероятность прекращения утечки лимфы [5, 18]. В литературе существует описание двух клинических случаев формирования желудочных лактобезоаров у недоношенных новорожденных с хилотораксом, что, возможно, связано с энтеральным питанием молочной смесью, обогащенной средне-цепочечными триглицеридами [20]. Представляет большой интерес использование обезжиренного грудного молока с фортификатором для младенцев с хилотораксом [18, 21].
Хирургические методы лечения хилоторакса, такие как плевроперитонеальное шунтирование, плевродез аутологичной кровью, бетадином, перевязка лимфатического протока, применяются при отсутствии спонтанного разрешения или неэффективности консервативной терапии по прошествии 3-5 нед [8, 10].
Выводы
Следует отметить, что в 3 из 4 клинических случаев, описанных в статье, имеет место так называемая неиммунная водянка плода, возникшая, по-видимому, на фоне генерализованной внутриамниотической инфекции (верификация возбудителя преимущественно по данным морфологического исследования последа методом иммуногистохимии). В случае с ребенком Д., вероятнее всего, мы имели дело с врожденным синдромом лимфатической дисплазии (длительно текущий хилоторакс без других проявлений поражения лимфатической системы).
ЛИТЕРАТУРА/REFERENCES
1. Bengtsson B. Neonatal lymphatic (chylous) disorders. NeoReviews. 2013; Vol. 14: e600.
2. Malleske D., Yoder B. Congenital chylothorax treated with sildenafil. J Perinatol. 2015; Vol. 35 (5): 384-6.
3. Deurloo K.l., et al. Isolated fetal hydrothorax with hydrops: a systematic review of prenatal treatment options. Prenat Diagn. 2007; Vol. 27: 893-9.
4. Horvers M., Mooij C., Antonius T. Is octreotide treatment useful in patients with congenital chylothorax? Neonatology 2012; Vol. 101: 225-31.
5. Sinn J., et al. Octreotide as therapeutic option for congenital idiopathic chylothorax: a case series. Acta Paediatr. 2012; Vol. 101 (4): e151-5.
6. Foo N.H., Hwang Y.S., lin C.C., Tsai W.H. Congenital chylothorax in a late preterm infant and successful treatment with octreotide. Pediatr Neonatol. 2011; Vol. 52 (2): 297-301.
7. Marcia l. Buck octreotide for the management of chylothorax in infants and children. Pediatr Pharm. 2004; Vol. 10 (10).
8. Vignes S., Bellanger J. Primary intestinal lymphangiectasia (Waldmann’s disease). Orphanet J Rare Dis. 2008; Vol. 3: 5.
9. Bulbul A., et al. Idiopathic congenital chylothorax presented with severe hydrops and treated with octreotide in term newborn. J Matern Fetal Neonatal Med. 2009; Vol. 22 (12): 1197-200.
10. Moreira-Pinto J., et al. Octreotide in the treatment of neonatal postoperative chylothorax: report of three cases and literature review. Pediatr Surg Int. 2011; Vol. 27: 805-9.
11. Panthongviriyakul C., Bines J. Post-operative chylothorax in children: An evidence-based management algorithm. J Paediatr Child Health. 2008; Vol. 44 (12): 716-21.
12. Reck-Burneo C.A., Parekh A., Velcek F.T. Is octreotide a risk factor in necrotizing enterocolitis? J Pediatr Surg. 2008; Vol. 43: 1209-10.
13. Buyuktiryaki M., Oncel M.Y., et al. A case report of necrotizing enterocolitis after octreotide treatment in a preterm newborn with idiopathic congenital chylothorax. Budapest, 16-20 September, ESPR, JENS joint Meeting.
14. Silvani P., Camporesi A. Drug-induced pulmonary hypertension in newborns: a review. Curr Vasc Pharmacol. 2007; Vol. 5: 129-33.
15. Arevalo R.P., Bullabh P., et al. Octreotide-induced hypoxemia and pulmonary hypertension in premature neonates. J Pediatr Surg. 2003; Vol. 38 (2): 251-3.
16. Danial C., Tichy A.l., Tariq U., Swetman G.l., et al. An open-label study to evaluate sildenafil for the treatment of lymphatic malformations. J Am Acad Dermatol. 2014; Vol. 70: 1050-7.
17. Simmonds WJ. The effect of fluid, electrolyte and food intake on thoracic duct lymph flow in unanaesthetized rats. Aust J Exp Biol Med Sci. 1954; Vol. 32: 285-99.
18. Rachelle lessen. Use of skim breast milk for an infant with chylothorax. ICAN (Infant, Child, and Adolescent Nutrition). 2009; Vol. 1 (6): 303-10.
19. Cormack B., Wilson N., et al. Use of monogen for pediatric postoperative chylothorax. Ann Thorac Surg 2004; Vol. 77: 301-5.
20. Prahl M., Smetana D., Porta N. lactobezoar formation in two premature infants receivingmedium-chain triglyceride formula. J Perinatol. 2014; Vol. 34: 634-5. doi:10.1038/jp.2014.78.
21. lopez G. Use of fortified skimmed breast milk to feed infants with postoperative chylothorax. Scholar Archive. 2015; Paper 36-58.
Нетравматический хилоперикард и хилоторакс у недоношенных новорожденных — Архив патологии — 2014-05
Хилезная жидкость представляет собой особый тип серозного выпота с неспецифическими клиническими проявлениями и разнообразной этиологией [1]. Частота хилезного выпота у новорожденных составляет 1 случай на 15 000 родов и сопровождается высокой летальностью 15-50% [2]. Среди известных причин, указанных в литературе, наиболее частой является развитие травматического (ятрогенного, постоперационного) хилоперикарда (ХП) и/или хилоторакса (ХТ) в результате инвазивных торакальных воздействий (катетеризация центральных вен, операция на сердце и пищеводе, травма) [2-5]. Реже накопление хилезной жидкости в плевральной полости и/или сердечной сумке связано с пороками развития лимфатической системы в грудной полости [4, 6], опухолью [7, 8], воспалением серозных листков (врожденная цитомегаловирусная инфекция) [9] с формированием так называемого спонтанного (медицинского) ХТ/ХП [2, 9]. Наиболее редкими являются врожденный (идиопатический) ХТ и ХП, причина которых не ясна [2]. Во многих случаях ведущим патогенетическим звеном являются перегрузка правых отделов сердца и повышение давления в верхней полой вене [9].
Представляем случаи нетравматических ХП и ХТ, имеющих танатогенетическое значение, возникших в раннем неонатальном периоде у 3 новорожденных с экстремально низкой массой тела. В анамнезе заболевания у этих младенцев имелись преждевременные роды на сроке 28-29 нед; тяжелая асфиксия в родах; синдром задержки внутриутробного развития плода по гипопластическому типу 1-2-й степени; генерализованная внутриутробная инфекция; выраженный синдром дыхательных расстройств, требующий искусственной вентиляции легких; наличие центрального венозного катетера, дистальный конец которого свободно располагался в полости правого предсердия; парентеральное питание; крайне тяжелое общее состояние с рождения. Смерть всех детей наступила на 4-е сутки жизни. Необходимо отметить, что хилезный характер выпота клинически не был установлен, факты ХП и ХТ явились неожиданной находкой на аутопсии. Макроскопически выпот представлял собой мутную жидкость молочного цвета. Высушенная капля исследуемой жидкости была окрашена по Павловскому для дифференциальной диагностики хилезной жидкости и псевдохилезного экссудата. При цитологическом исследовании в материале определялись эритроциты и лимфоциты в умеренном количестве, единичные активные нейтрофильные лейкоциты или нейтрофильные тельца, а также немногочисленные эпителиальные клетки при отсутствии гнойно-некротического детрита и/или клеток в состоянии жировой дистрофии [10], как при хилоподобном выпоте. Кроме того, во всех полях зрения визуализировались многочисленные мелкие, бесструктурные частицы серого цвета, дающие положительную окраску суданом черным, в отличие от хилоподобного выпота, при котором взвешенные частицы не являются жировыми и не окрашиваются соответствующими красителями [11].
Первый случай спонтанного ХП был связан с врожденной аномалией развития мелких периферических лимфатических сосудов миокарда. При патологоанатомическом исследовании грудной полости обнаружена тампонада полости перикарда (рис. 1)Рисунок 1. Тампонада сердца хилезной жидкостью. хилезным транссудатом (5 мл). При внешнем осмотре на эпикарде грудино-реберной и диафрагмальной поверхности сердца выявлены точечные меловидные участки с петехиальными кровоизлияниями в этих зонах. При вскрытии полостей сердца в толще миокарда правого желудочка и межжелудочковой перегородки в проекции меловидных участков находились темно-красные западающие зоны размером 0,3×0,1 см, гистологически представляющие собой расширенные лимфатические сосуды (рис. 2)Рисунок 2. Многочисленные расширенные лимфатические сосуды в миокарде. Окраска гематоксилином и эозином. ×100.. При бактериологическом исследовании хилезной жидкости флора не выделена. Таким образом, в танатогенезе имело значение повышение давления в лимфатической системе сердца с повреждением сосудов лимфатической мальформации, развитием ХП и тампонады сердца.
Второй случай нетравматического ХП явился следствием врожденной аномалии развития крупных внесердечных лимфатических сосудов: слепо заканчивающихся левым лимфатическим коллектором сердца и гипоплазией грудной части ductus thoracicus. При аутопсии в полости перикарда содержалось 2 мл хилезной жидкости, которая, по результатам бактериологического исследования, была стерильной. Под эпикардом четко визуализировались контуры аневризматически расширенного левого лимфатического коллектора сердца, протяженностью 0,9 см, шириной 1 см, располагающегося у левого края легочного ствола. Этот коллектор выходил сзади кверху у корня правого легкого и впадал в слепо оканчивающееся мешотчатое образование размером 1,5×1 см, содержащее лимфу. Правый лимфатический коллектор сердца располагался субэпикардиально по задней межжелудочковой борозде и впадал в коронарный синус. Ductus thoracicus был протяженностью 6 см и периметром 0,2-0,3 см. Микроскопически в миокарде выявлены выраженный межуточный отек и расширение миокардиальных лимфатических сосудов; незрелый, некомпактный миокард. В танатогенезе также основную роль сыграло повышение давления в грудном лимфатическом протоке и правых отделах сердца.
Третий случай ХТ и ХП имел инфекционную этиологию. При изучении органов грудной полости найдено 2 мл хилезной жидкости в полости перикарда без тампонады и 3 мл в левой плевральной полости. При бактериологическом исследовании экссудата зафиксирован скудный рост Acinetobacter lwoffii (представитель нозокомиальной флоры [12]). При изучении органометрических параметров сердца и гистологически выявлены признаки декомпенсированной кардиомиопатии с признаками перегрузки обоих желудочков. Кроме того, гистологически в межуточном веществе миокарда правого желудочка найден очаг скопления клеток моноцитарного ряда с фибриноидным набуханием волокон стромы в этой зоне и стенки близлежащего сосуда как проявление альтерации с нарушением проницаемости стенки сосуда. На основании вышеизложенного в танатогенезе основную роль сыграло сочетание декомпенсированной кардиомиопатии у плода с повышением давления в верхней полой вене и инфицирования внутрибольничной флорой по центральному венозному катетеру.
Описанные клинические случаи иллюстрируют танатогенетическое значение и полиэтиологичность нетравматических ХП и ХТ.
Конфликт интересов отсутствует.
Хилоторакс у новорожденных
Хилоторакс у новорожденных
Баландина Н.А., Беляева И.Д., Степаненко С.М., Жиркова Ю.В., Цветков И.О.
ДГКБ №13 им. Н.Ф.Филатова, Кафедра детской хирургии
Хилоторакс — это патологическое состояние, связанное с накоплением лимфатической жидкости в плевральной полости. Эта патология встречается достаточно редко, однако является серьезным и часто угрожающим жизни заболеванием, приводящим к глубоким респираторным, обменным и иммунологическим нарушениям. Встречается в любой возрастной группе, в том числе и в период новорожденности. Сообщения о неонатальном хилотораксе малочисленны и описывают от единичных до нескольких десятков наблюдений.
За период 1998-1999 годов в отделении реанимации Филатовской больницы наблюдалось 3 детей с послеоперационным хилотораксом.
Особенности анамнеза
Фамилия пациента | Срок гестации | Течение беременности | Основной диагноз | Сопутствующий диагноз |
Кузнецова Вика | 36 недель | Угроза прерывания беременности,маточное кровотечение, ОРВИ, водянка беременных |
| Задержка внутриутробного развития, НМК, синдром угнетения ЦНС, мышечная дистония |
Кириулиш-вили (девочка) | 37 недель | Анемия, водянка беременных |
| НМК, синдром угнетения ЦНС |
Соколов (мальчик) | 36-37 недель | Хронический пиелонефрит, водянка беременных |
|
|
Всем детям в первую неделю жизни был поставлен диагноз — врожденная диафрагмальная грыжа. По поводу чего были переведены в отделение реанимации и затем в течение недели прооперированы. Операция заключалась в проведении пластики купола диафрагмы, дренирования плевральной полости.
У всех детей были катетеризированы вены бассейна нижней полой вены.
Со вторых суток после операции стали получать большое количество выпота по плевральным дренажам порядка 30 мл/кг/сут. После начала энтерального питания жидкость стала молочного цвета.
Диагноз хилоторакса ставился на основании клинической картины (отделяемое из плевральной полости с характерной молочной окраской) и лабораторных данных (сходство биохимических анализов плеврального выпота и крови пациента).
Сравнение б/х показателей крови и лимфы
Кириулишвили 08.06.1998г. | Кузнецова Вика 15.04.1999г. | |||
Кровь | Лимфа | Кровь | Лимфа | |
К?ммоль/л Nа?ммоль/л Са??ммоль/л Белок г/л | 8,77 105,8 1,25 45 | 7,03 104,1 1,27 29 | 5,59 126,1 1,26 40 | 3,83 125,6 1,43 24 |
После установления диагноза хилоторакс была полностью отменена энтеральная нагрузка, проводилось полное парентеральное питание по методу гипералиментации с добавлением необходимых витаминов, микроэлементов. Наряду с этим проводилась посиндромная терапия.
На 10 послеоперационные сутки в результате больших потерь у детей стали развиваться грубые водно — электролитные нарушения в виде гиперкалиемии в плазме (6,35 — 7,94 ммоль/л), гипонатриемии (105,8 — 124,2 ммоль/л), гипопротеинемии (32 — 41 г/л).
Электролитные нарушения в плазме
Показатели | Клинические данные | Норма |
Калий (ммоль/л) Натрий (ммоль/л) Белок (г/л) | 6,35 — 7,94 ммоль/л 105,8-124,2 ммоль/л 32-41 г/л | 4,5-5,5 ммоль/л 135-145 ммоль/л 55-73 г/л |
Одновременно по данным ЭКГ отмечалась внутриклеточная гипокалиемия на фоне диффузных изменений миокарда. Следует отметить, что подобные нарушения достаточно трудно было скоррегировать, несмотря на большой объем инфузионной терапии.
Сохранявшиеся массивные жидкостные потери потребовали выполнения хирургического вмешательства — перевязки грудного лимфатического протока. Одному ребенку перевязку протока пришлось выполнить дважды.
Сроки и название выполненного оперативного вмешательства
Фамилия пациента | Сроки выполнения | Название операции |
Кузнецова Вика Кириулишвили Соколов | 16 п/о сутки 16 п/о сутки 21(5) п/о сутки 15 п/о сутки | Перевязка ГЛП *справа Перевязка ГЛП слева Перевязка ГЛП справа Перевязка ГЛП слева |
*ГЛП — грудной лимфатический проток
У двоих детей после повторной операции появилась положительная динамика в виде уменьшения отделяемого по дренажам, восстановления водно — электролитного равновесия, стабилизации гемодинамики и сердечной деятельности. Один ребенок несмотря на удачную перевязку лимфатического протока от нарастающих явлений сердечно — сосудистой и дыхательной недостаточности умер на 35 сутки жизни.
Мы проанализировали порядка 90 источников, сообщающих о неонатальном хилотораксе и описывающих от единичных до нескольких десятков наблюдений.
Количество наблюдений
- Engum SA Indianapolis 2020 — 1998гг. 7 новорожденных
- Kavvadia V London 6
- Naik S London 3
- Bond SJ Louisville 2020 — 1990гг. 15
- Stringel G 2020 — 1983гг. 7 (после операции)
- Van Straaten HL Dania 1992г. 11
- Mercer S 1986г. 5 (после ВДГ*)
- Echeverria Lecuona, San Sebastian 2020 — 1998гг. 10 (врожденные)
- Van Aerde J за 22 года 12 (спонтанный)
- Browse NL 1956-1986 гг. 20
- Gonzales de Dios J Madrid 1975-1990 гг. 3
Хилоторакс лечение. Хилоторакс у новорожденных детей. Лечение у новорожденных детей
Хилоторакс это скопление лимфы в плевральной полости. Врожденный хилоторакс у детей обычно поддастся лечению пункциями или . Нетравматический хилоторакс у детей часто бывает связан с серьезными заболеваниями или малигнизацией. При травматическом хилотораксе консервативное лечение, как правило, эффективно. Но если положительной динамики нет на протяжении более 3 дней, или если развиваются нарушения питания, то показано оперативное вмешательство.
Хилезный плевральный выпот может появиться у новорожденных спонтанно, обычно, по существующим предположениям, при врожденных аномалиях грудного протока, родовой травме. Однако анализ 34 наблюдений врожденного хилоторакса не выявил его связи с характером родов. При антенатальной диагностике на гидроторакса плода отмечена его связь с другими врожденными аномалиями. У старших детей хилоторакс иногда возникает после травмы и кардиохирургических вмешательств. Вызвать хилоторакс у детей могут также опухоли. В частности, и нейробластома могут приводить к обструкции грудного протока, при лимфангиоматозе хилезный выпот может появляться и в плевральной, и в брюшной полости.
Симптомы хилоторакса у детей
Первым проявлением быть острый респираторный дистресс, прежде всего в виде тахипноэ и цианоза. Длительная потеря лимфы приводит к нарушениям питания, гипопротеинемии, метаболическому ацидозу, электролитным и иммунным расстройствам. Массивный изолированный хилоторакс, диагностированный антенатально, может вызвать тяжелый респираторный дистресс уже при рождении и потребовать экстренной плевральной пункции.
Диагностика. Симптомы респираторного дистресса сочетаются с плевральным выпотом, определяемым на рентгенограмме грудной к четки. При аспирации выпота получают прозрачную соломенно-желтую (если ребенок не кормился) жидкость, которая приобретает молочный цвет у детой, ранее кормившихся. Анализ обычно выявляет повышенное содержание общего жира (более, чем 4 г/л) и белка 0 50 г/л). Преобладают лимфоциты, а уровень триглицерида превышает 1,3 ммоль/л. Данные показатели подтверждают, что «молочная» жидкость является лимфой.
Лечение хилоторакса у детей
Лечение начинают с обычной плевральной пункции и прекращении кормления, что часто позволяет справиться с хилотораксом. Назначение диеты, содержащей триглицериды, может способствовать снижению продукции лимфы и заживлению места ее протечки.
Если повторные плевральные пункции и изменение диеты оказываются неэффективными, необходимо поставить в грудную клетку. Тотальное парентеральное питание при этом приводит к прекращению образования лимфы.
Правосторонняя торакотомия с перевязкой грудного протока на уровне диафрагмы обычно оказывается достаточно эффективной. При прошивании лимфатического свища так же, как и при перевязке протока в области диафрагмы, поиски грудного протока и места «протечки» облегчаются, если непосредственно перед
– это патологическое скопление лимфатической (хилезной) жидкости в полости плевры, возникающее вследствие лимфореи из грудного протока. Развитие хилоторакса сопровождается одышкой, прогрессирующим ухудшением самочувствия, коллаптоидным состоянием, истощением, дыхательной недостаточностью. Хилоторакс диагностируется по клинико-анамнестическим данным, результатам рентгенографии, торакоцентеза, цитологической оценки хилезной жидкости, торакоскопии. Лечение хилоторакса включает повторные пункции или дренирование плевральной полости для удаления хилуса, при упорной лимфорее — перевязку грудного лимфатического протока, плевроперитонеальное шунтирование, плевродез, наложение лимфовенозного анастомоза и др.
МКБ-10
J94.0
Хилусный выпот
Общие сведения
Хилоторакс — достаточно редкая патология, которая развивается в результате нарушения целостности грудного лимфатического протока и поступления в полость плевры циркулирующей по нему лимфатической (хилезной) жидкости. Хилоторакс может сопровождаться значительной лимфореей (истечением лимфы) — до 4-5 л в сутки и приводить к глубоким респираторным, обменным и иммунологическим нарушениям в организме, представляющим угрозу для жизни пациента в связи с потерей жиров, белков, витаминов, электролитов, лимфоцитов. Хилоторакс отмечается во всех возрастных группах, в т ч. и у новорожденных. В клинической практике с хилотораксом приходится сталкиваться специалистам в области торакальной хирургии , травматологии, кардиохирургии, гастроэнтерологии, онкологии, фтизиатрии, флебологии и лимфологии.
Причины
Хилоторакс является вторичным заболеванием или осложнением, связанным с патологией лимфатических сосудов. В зависимости от этиологических факторов различают следующие виды хилоторакса: врожденный, травматический и нетравматический. Также выделяют идиопатический хилоторакс, развивающийся у курильщиков с многолетним стажем.
- Врожденный хилоторакс
, проявляющийся в период новорожденности и в детском возрасте, может быть обусловлен наследственной атрезией грудного лимфатического протока, наличием свища между его нижним отрезком и плевральной полостью. При первичном персистирующем хилотораксе плода не всегда возможно установить явную причину заболевания (в редких случаях это могут быть наследственные лимфангиэктазии). - Травматический (ятрогенный) хилоторакс
развивается при механическом повреждении грудного лимфатического протока или его главных ветвей во время оперативных вмешательств (торакальных, кардиохирургических, абдоминальных, спинальных), диагностических процедур (транслюмбальной артериографии, катетеризации подключичной вены или левых отделов сердца, эзофагоскопии), вследствие тупой травмы или проникающего ранения грудной клетки и области шеи. При повреждении грудного лимфатического протока выше уровня V-VI грудных позвонков формируется левосторонний хилоторакс, ниже – правосторонний. - Хилоторакс нетравматического генеза
часто возникает при наличии различных доброкачественных и злокачественных новообразований, затрагивающих лимфатическую систему области средостения и шеи (медиастинальной злокачественной неходжкинской лимфомы , доброкачественной лифангиомы протока, лимфангиоматоза средостения, рака плевры). К развитию хилоторакса может приводить внутригрудной туберкулез и саркоидоз , медиастинит, восходящий лимфангит , амилоидоз , диафрагмальная грыжа и др. Скопление хилезной жидкости в плевральной полости может о
[Полный текст] Врожденный хилоторакс: современные перспективы и тенденции
1 Новорожденный Монаш, Детская больница Монаш, 2 Отделение педиатрии, Университет Монаша, Мельбурн, Виктория, Австралия
Резюме: Врожденный хилоторакс (CC) является наиболее частой причиной плеврального выпота в перинатальном периоде. Этиология в большинстве случаев неизвестна. Однако в некоторых случаях это может быть связано с различными синдромами и генетическими состояниями.CC связан с высоким уровнем смертности. Большинство клинических проявлений являются вторичными по отношению к эффектам давления (гипоплазия легких) и потере белка и лимфатической жидкости (водянка, недоедание). Консервативное лечение в неонатальном периоде эффективно до 80% случаев и включает плевральный дренаж, парентеральное питание / энтеральное питание на основе среднецепочечных триглицеридов и лекарства, такие как октреотид. В устойчивых случаях может потребоваться хирургическое вмешательство (плевродез, лигирование / эмболизация грудного протока, плевроперитонеальный шунт).Универсального консенсуса по ведению CC не существует, а данные о безопасности использования лекарств для CC у новорожденных немногочисленны.
Введение
Врожденный хилоторакс (ВХ) — редкое, но важное клиническое состояние в перинатальный период, лечение которого в тяжелых случаях может быть затруднительным. Не существует общепринятых рекомендаций по ведению CC. За последнее десятилетие был достигнут незначительный прогресс в лечении CC, и основное внимание уделялось лекарствам для лечения CC.Этот обзор призван обобщить текущую литературу, касающуюся патофизиологии, клинических проявлений и вариантов лечения CC.
Определение, распространенность и ассоциации
Хилоторакс, который определяется как скопление лимфы в плевральной полости, является наиболее частой формой плеврального выпота, встречающейся в перинатальном периоде. Это редкое явление, которое, по оценкам, встречается у 1 из 10 000 новорожденных, а уровень смертности колеблется от 20% до 60%. 1–4 Если хилоторакс связан с водянкой плода, смертность может достигать 98%. 1 Наиболее серьезными последствиями хилоторакса плода являются гипоплазия легких, застойная сердечная недостаточность и водянка. 1,2,5
CC может быть изолированным проявлением или может быть связано с генетическими состояниями, такими как трисомия 21 (которая связана с 4,9% изолированных плевральных выпотов), моносомия X, 1,2 Turner, 4,6,7 и Noonan синдромы 4,6,7 (таблица 1). Врожденная лимфангиэктазия может возникать как часть этих состояний.Сопутствующие аномалии и пороки развития могут присутствовать до 80% случаев, которые часто трудно поддаются лечению или не поддаются лечению. 8 Лимфатические аномалии развития, связанные с хилотораксом, могут ограничиваться легкими или затрагивать другие системы органов. 9 Другие синдромы, связанные с хилотораксом, включают Х-сцепленную миотубулярную миопатию, 10 миссенс-мутацию интегрина α 9 β 1 , 11,12 и синдром Горхэма-Стаута. 13
Таблица 1 Причины CC Аббревиатура: CC, врожденный хилоторакс. |
Хилоторакс также может возникать вторично в результате разрыва или разрыва грудного протока в результате внезапного чрезмерного растяжения шеи или растяжения грудной стенки во время родов, 14,15 после операций с вовлечением структур шеи и грудная клетка 16–18 , например сосудистые кольца, 19 и диафрагмальная грыжа. 20 У детей частота развития хилоторакса после кардиоторакальной операции составляет от 0,85% до 6.6%. 16,21 Они называются вторичным хилотораксом и не рассматриваются в данном обзоре.
Патофизиология
Лимфатическая система человека выполняет три основные функции: транспортировка липидов и жирорастворимых витаминов в системный кровоток, сбор и возврат избыточной жидкости и экстравазированных белков из интерстициальных пространств в кровоток и возврат лимфоцитов в кровоток. 14,15
Хил (от греческого слова «сок» 22 ) — это жидкая жидкость молочного цвета, не воспалительная, щелочная и бактериостатическая, состоящая в основном из жира (эмульгированные / свободные жирные кислоты, холестерин), электролитов, белков, глюкозы и обильные лимфоциты.Он образуется в тонком кишечнике при переваривании жирной пищи и поглощается лимфатическими сосудами, известными как млечные сосуды. Содержание белка в хилсе обычно> 3 г / л, а состав электролита аналогичен составу сыворотки. 23 Абсолютное количество клеток> 1000 клеток / л, а количество лимфоцитов колеблется от 400 до 6800 / мм 3 , большинство из которых составляют Т-лимфоциты. 15,24 Грудной проток ежедневно транспортирует от 1,5 до 2,5 л хилуса (максимум 4 л / день у здорового взрослого).Поток через грудной проток может широко варьироваться от 14 мл / час натощак до более 100 мл / час в постпрандиальном состоянии. Отток грудного протока связан с реакцией гладких мышц стенки протока на внутреннюю стимуляцию и стимуляцию блуждающего нерва. Серотонин, норадреналин, гистамин, дофамин и ацетилхолин усиливают сокращение грудного протока и отток хилуса. 25
Примерно 10% жидкости, экстравазированной из интерстициального пространства, попадает в слепые лимфатические капилляры и становится лимфой.Эти капилляры соединяются с более крупными лимфатическими сосудами, которые разветвляются в грудном протоке. Грудной проток — самый большой лимфатический сосуд в организме, расположенный дорсальнее аорты и вентрально грудных позвонков. Он возвращает лимфу в сосудистую систему, попадая в венозную систему на стыке левой внутренней яремной и подключичной вен (рис. 1). Это поддерживает баланс жидкости и предотвращает отек тканей, возвращая интерстициальную жидкость в сосудистую систему. 26 Лимфатическая система играет ключевую роль во многих иммунных функциях организма, включая создание иммунных клеток и защиту организма от инфекций.Грудной проток действует как канал, а также точка входа в большой круг кровообращения. 27 Пищевые жиры абсорбируются кишечными энтероцитами в форме хиломикронов, которые преимущественно состоят из триглицеридов, а также содержат фосфолипиды, холестерин и другие белки. После того, как они выходят из энтероцитов, они собираются в ворсинчатых млечных сосудах и в конечном итоге попадают в хилозную цистерну, которая простирается краниально как грудной проток.
Рис. 1 Формирование, ход и окончание грудного протока.Перепечатано с разрешения Earth’s Lab., Dr Joseph H Volker. 104 Сокращение: SVC, верхняя венакава. |
Клинические проявления
Хилезный плевральный выпот нарушает нормальное развитие легких плода из-за воздействия давления и может привести к гипоплазии легких. Это также может привести к смещению средостения и нарушению кровообращения (рис. 2).
Рисунок 2 Врожденный хилоторакс: клинические эффекты. |
CC является одной из причин неиммунной водянки плода (NIHF). Основным механизмом образования гидропса плода является нарушение баланса выработки интерстициальной жидкости и возврата лимфатической системы. Плод особенно восприимчив к накоплению интерстициальной жидкости из-за его большей проницаемости капилляров, эластичных интерстициальных отделов и уязвимости к венозному давлению на возврат лимфатических сосудов. Повышенное венозное давление способствует отеку и излиянию за счет увеличения гидростатического давления в капиллярах и уменьшения лимфатического возврата, что приводит к накоплению интерстициальной жидкости.Нарушение функции почек вызывает олигурию или анурию, а затем и водянку. 28 При CC, NIHF может развиваться в результате сочетания повышенной скорости капиллярной фильтрации (вызванной повышенным гидростатическим давлением в капиллярах) и снижением лимфатического клиренса, которое происходит при повышенном центральном венозном давлении, вторичном по отношению к обструкции полой вены или из-за нарушения сердечной функции, вызванного: массовый эффект хилезного выпота. 29,30 Это также может быть результатом снижения осмотического давления капилляров, вызванного потерей альбумина с хилусом в плевральную полость. 29
Лимфангиэктазия и другие врожденные лимфатические аномалии (синдром лимфатической дисплазии, лимфангиомы, шейные или кистозные гигромы) также могут проявляться хилотораксом / двусторонним плевральным выпотом и НИЗН в результате обструкции лимфатического потока. 31–33 Кистозные гигромы обычно связаны со сложными аберрациями лимфатических сосудов и вызывают эффекты сжатия массы, которые затрудняют лимфодренаж и венозный возврат к сердцу. 34
В послеродовой период хилезный плевральный выпот может приводить к постоянным эффектам давления, препятствующим адекватной вентиляции легких.На легочную оксигенацию также влияет повышение венозного давления и надвигающаяся сердечная недостаточность. Терапевтические меры, такие как торакоцентез и дренаж плевры, могут привести к потере жидкости и электролитов, что приводит к истощению объема и дисбалансу электролитов. Потеря альбумина может привести к обострению отека, а истощение питательных веществ может произойти из-за потери белка и жира. Новорожденный с ХК подвержен риску заражения вторичным иммунодефицитом из-за потери лимфоцитов в хилезной жидкости.
Менеджмент
Цели лечения хилоторакса — дренировать хилезную плевральную жидкость, предотвратить ее повторное накопление и определить первопричину, чтобы ее можно было вылечить и поддержать баланс питания и жидкости.
Пренатальное ведение
Пренатальная диагностика с помощью ультразвука позволяет дифференцировать изолированный гидроторакс и водянку плода. Хилоторакс диагностируется путем анализа плевральной жидкости (абсолютное количество клеток> 1000 / л, количество лимфоцитов более 80%). 1,2,5
Младенцы, у которых хилоторакс диагностирован на сроке <34 недель беременности и которые впоследствии получают пренатальную терапию, имеют лучшее перинатальное состояние и демонстрируют улучшенные постнатальные исходы. 35 Плоды с РС подвержены высокому риску хромосомных аномалий, и быстрая диагностика кариотипа плода 36 и любых других связанных пороков имеет важное значение для дальнейшего лечения и прогноза. Лечебные мероприятия в дородовой период включают изменение диеты матери, 37 повторный торакоцентез, 1,5,38 торакоамниотическое шунтирование, 39 и плевродез с помощью OK-432. 40–44 Диета матери с низким содержанием жиров и высоким содержанием среднецепочечных триглицеридов (МСТ) может помочь отсрочить потребность в торацентезе в случае хилоторакса плода. 37
Успех пренатального вмешательства посредством торакоцентеза и / или дренирования плевроамниотической жидкости зависит от ранней диагностики, объема и повторного появления хилезного выпота, степени компрессии легких и наличия водянки. 45 До 24 недель беременности существует высокий риск развития гипоплазии легких. После этого этапа, если выпот небольшой и не происходит смещения средостения, достаточно выжидательной тактики с контрольным ультразвуковым исследованием. 3,45,46
Торакоамниотическое шунтирование было впервые описано в исследовании Rodeck et al. 47 как метод декомпрессии гидроторакса плода, обеспечивающий более нормальное развитие легких плода, тем самым снижая общую неонатальную смертность. Чрескожный внутриутробный плевроамниотический шунт показан при тяжелом или рецидивирующем хилотораксе, нарушающем развитие легких плода и предотвращающем сердечную недостаточность. Выживаемость после неонатального периода (период, не определяемый во всех исследованиях) после введения плевроамниотического шунта для дренирования плеврального выпота, как сообщалось, составляет от 47% до 70%, 48-53 , хотя тяжесть выпота и лежащая в основе патология может варьироваться в зависимости от исследования.Немецкая серия случаев 78 плодов с гидротораксом, леченных плевроамниотическим шунтом, показала, что многоводие, водянка плаценты, интервал между шунтирующими родами <4 недель и низкая гестация при рождении были связаны со смертностью. Разрешение водянки после вмешательства было связано с улучшением выживаемости. 53 Смещение шунта в грудную клетку плода может произойти из-за увеличения размера груди, движений плода или неправильного размещения устройства и может произойти в 23% случаев. 54 Серия случаев показала, что повторное введение шунта потребовалось в 6–8%, 49,50 , а потеря плода составила около 10%. 48
ОК-432 (Пицибанил) представляет собой лиофилизированный препарат низковирулентного штамма Streptococcus pyogenes группы А человеческого происхождения, который используется в качестве склерозирующего агента. Имеются сообщения об успешном использовании плевродеза ОК-432 в терапии плода при КХ. 40–44 Считается, что механизм действия OK-432 является клеточным и опосредованным цитокинами. Повышенные уровни цитокинов, вероятно, увеличивают проницаемость эндотелия сосудов и ускоряют отток накопленной лимфы. 55 Полная аспирация плевральной жидкости перед инстилляцией OK-432 и последующая ультразвуковая демонстрация спаек — два требования для успешного исхода. 42
Послеродовое ведение
Первоначальное лечение состоит из дренирования плевральной жидкости, адекватной вентиляции, полного парентерального питания, изменения диеты, замены альбумина и приема лекарств. Следует рассмотреть возможность хирургического вмешательства для пациентов, которым не удалось выполнить эти начальные шаги или у которых возникают такие осложнения, как электролитный и жидкостный дисбаланс, недоедание или иммунодефицит.Правильное планирование родов в медицинском центре очень важно. Новорожденным с хилотораксом часто требуется реанимация и респираторная поддержка при рождении, если хилоторакс тяжелый, плохо контролируется во время беременности или связан с гипоплазией легких. Важно исключить другие конкретные причины водянки плода, а также хромосомный или синдромный диагноз. Небольшие хилотораксы рассасываются спонтанно. 56 Торакостомическая трубка устанавливается для непрерывного дренирования, если хилус повторно накапливается и / или требует частых периодических аспираций, чтобы плевральная полость оставалась пустой.
Стратегии лечения CC
- Дренирование хилуса из плевральной полости (торакоцентез, непрерывный отсасывающий дренаж)
- Уменьшение объема хилуса с помощью модификаций диеты (диета с низким содержанием жиров, МСТ) или лекарств (октреотид)
- Поддержание баланса питания, жидкости и электролитов
- Перенаправление хилуса в другие части тела для облегчения респираторного дистресса (плевроперитонеальный шунт и диафрагмальная фенестрация)
- Обструкция оттока хилуса в грудную клетку (лигирование грудного протока или эмболизация грудного протока [TDE])
Дренирование хилоторакса
Первоначальный подход к лечению хилоторакса включает дренирование плевральной полости с помощью дренажной трубки (рис. 3).Непрерывный аспирационный дренаж помогает снизить давление хилуса на легкие и повторно расширить частично спавшиеся легкие и позволяет точно измерить выработку хилуса. Значительные объемы сливаемой жидкости следует заменить, уделяя внимание жидкостному и электролитному балансу. Реакция на дренирование плевральной трубки зависит от тяжести хилоторакса и его этиологии.
Рисунок 3 Двусторонний CC, до ( A ) и после ( B ) установки межреберного дренажа. Сокращение: CC, врожденный хилоторакс. |
Лекарства от хилоторакса
В последнее десятилетие новые стратегии лечения медикаментами преимущественно ограничивались октреотидом для уменьшения объема образования хилеса (Таблица 2).
Таблица 2 Лекарства, используемые при лечении CC Сокращения: CC, врожденный хилоторакс; цГМФ, циклический гуанозинмонофосфат; НЭК, некротический энтероколит. |
Октреотид
Об использовании октреотида для лечения CC впервые сообщил Янг и др. 57 из Канады. Октреотид представляет собой аналог соматостатина, который использовался для лечения различных состояний у взрослых и детей старшего возраста, включая акромегалию, карциноидную опухоль, острое кровотечение из варикозно расширенных вен, желудочно-кишечные свищи и трудноизлечимую диарею. 58 У новорожденных октреотид используется для лечения стойких состояний гиперинсулинемии. 59 Механизм действия октреотида при хилотораксе неясен. Предполагается, что октреотид вызывает легкое сужение кровеносных сосудов, включая венозный кровоток в печени. Это приводит к снижению желудочного, панкреатического и кишечного секрета, а также кишечной абсорбции. Эти механизмы в совокупности уменьшают отток хилуса. 60
В Кокрановском обзоре Даса и Шаха 61 рассматриваются опубликованные на сегодняшний день данные по использованию октреотида.Несмотря на то, что имеется несколько отчетов о случаях, обычно демонстрирующих разрешение хилоторакса с октреотидом, время начала, доза, продолжительность и частота доз значительно различаются между авторами, и не было выявлено рандомизированных контролируемых испытаний. Они пришли к выводу, что «на основании выявленных доказательств и предложенных для многоцентрового рандомизированного контролируемого исследования для оценки безопасности и эффективности октреотида в лечении хилоторакса у новорожденных нельзя дать практических рекомендаций.”
Октреотид используется либо подкожно в дозе 10–70 мкг / кг / день, вводимых каждые 6–24 часа, либо в виде непрерывной внутривенной инфузии от 0,3 до 10 мкг / кг / час. Продолжительность приема в случаях успешного разрешения колеблется от 4 до 21 дня и в основном определяется ответом на терапию. 61 Безопасность и эффективность октреотида при лечении хилоторакса у новорожденных должным образом не оценивались. Редкость состояния — главный ограничивающий шаг шаг. Октреотид связан с
Infogalactic: ядро планетарного знания
A хилоторакс (или хилоторакс ) — это тип плеврального выпота.Это происходит из-за накопления лимфы в пищеварительной системе, называемой хилусом, в плевральной полости из-за нарушения или непроходимости грудного протока.
У людей, соблюдающих нормальную диету, этот излияние можно определить по его мутному молочно-белому виду, поскольку хилус содержит высокие уровни триглицеридов. Важно отличать хилоторакс от псевдохилоторакса (плевральные выпоты с высоким содержанием холестерина), которые имеют похожий вид, но вызваны более хроническими воспалительными процессами и требуют другого лечения. [1]
Причины
Состояние редкое, но серьезное, встречается у всех млекопитающих. Это происходит в результате вытекания лимфатической жидкости из грудного протока (или одного из его притоков). Это может быть результатом прямого разрыва (например, хирургического вмешательства) или нетравматических причин. Самая частая нетравматическая причина — злокачественные новообразования, особенно лимфома. Реже встречаются левосторонняя сердечная недостаточность, инфекции и аномалии развития, такие как синдром Дауна и синдром Нунана. [2]
Лечение
Поскольку механизм, лежащий в основе хилоторакса, недостаточно изучен, варианты лечения ограничены.Отток жидкости из плевральной полости необходим для предотвращения повреждения органов, особенно подавления функции легких из-за противодавления хилуса. Другой вариант лечения — пневмоперитонеальное шунтирование (создание канала связи между плевральной полостью и брюшной полостью). С помощью этой хирургической техники можно предотвратить потерю основных триглицеридов, которые покидают грудной проток. Исключение жиров (в частности, жирных жирных кислот) из рациона очень важно. Возможны хирургический или химический плевродез: утечка лимфатической жидкости останавливается за счет раздражения легких и грудной стенки, что приводит к стерильному воспалению.Это приводит к слиянию легких и грудной стенки, что предотвращает утечку лимфатической жидкости в плевральную полость. Доказано, что лекарство октреотид является полезным и в некоторых случаях останавливает хилоторакс через несколько недель. [3] [4]
У животных до недавнего времени наиболее эффективным методом лечения было хирургическое лигирование грудного протока в сочетании с частичной перикардэктомией. [5] Имеется по крайней мере один отчет (у кошки) о клиническом ответе на лечение рутином. [6]
См. Также
Список литературы
- ↑ Хеффнер, Джон. «Клиническая картина, диагностика и лечение излияния холестерина». 8.0. До настоящего времени. Проверено 30 октября 2014 г.
- ↑ www.uptodate.com/contents/image?imageKey=PULM/61456&topicKey=PULM/6696&source=see_link&utdPopup=true
- ↑ Далокай Килич, Мэриленд; Экбер Сахин, доктор медицины; Онер Гулкан, доктор медицины; Бюлент Болат, MD; Риза Туркоз, доктор медицины; Ахмет Хатипоглу, доктор медицины (2005).«Октреотид для лечения хилоторакса после кардиохирургии». Журнал Техасского института сердца . 32 (3): 437–39. PMC 1336729. PMID 16392238.
- ↑ Марсия Л. Бак, Pharm.D., FCCP (2004). «Октреотид для лечения хилоторакса у младенцев и детей». Детская фармакотерапия . 10 (10). CS1 maint: несколько имен: список авторов (ссылка)
- ↑ Birchard SJ, Smeak DD, McLoughlin MA (март 1998). «Лечение идиопатического хилоторакса у собак и кошек». J. Am. Вет. Med. Assoc . 212 (5): 652–7. PMID 9524635.
- ↑ Копко С.Х. (август 2005 г.). «Применение рутина у кошки с идиопатическим хилотораксом». Банка. Вет. J . 46 : 729–31. PMC 1180424.PMID 16187718.
Внешние ссылки
Хилоторакс — DocCheck Flexikon
1 Определение
Der Chylothorax ist eine Sonderform des Pleuraergusses, bei dem es zur Ansammlung von Lymphe in der Pleurahöhle kommt.
2 Hintergrund
Die Lymphe aus der unteren Körperhälfte und dem Bauchraum sowie der gastinale Chylus fließen in die Cisterna chyli ab.Von dort aus verläuft der Ductus thoracicus zunächst auf der rechten, ungefähr ab dem 4. Brustwirbel auf der linken Seite prävertebral. Er beschreibt dann einen Bogen und mündet in den linken Venenwinkel. Variationen sind häufig und werden bei etwa einem Drittel der Bevölkerung beobachtet. [1]
3 Ätiologie
3,1 Ятрогене Урсачен
In ungefähr 25 до 50% der Fälle ist ein Chylothorax iatrogen bedingt, wobei praktisch all thorakalen Operationen als Ursache in Frage kommen.Auch nach zervikalen und abdominalen Operationen ist ein Chylothorax möglich, z.B. nach Ösophagusresektionen, Vitienoperationen, Lungenresektionen, Lymphknotendissektionen (включая рассечение шеи) sowie Bypass-Operationen. Eine weitere iatrogene Ursache ist eine Verletzung der Lymphbahnen durch Anlage eines Venenkatheters или Schrittmachers sowie als Folge einer Bestrahlung des Thorax.
3.2 Traumatische Ursachen
Weiterhin können akzidentelle Traumata zu einem Chylothorax führen, z.Б .:
3.3 Nichttraumatische Ursachen
- Flussbehinderung des Lymphabstroms bzw. Lymphstau: Thrombose der Arteria subclavia или Vena jugularis, Lymphome, Kaposi-Sarkom, Lungenkarzinom, thorakale Aortenaneurysmen, Sarkoidose, Tuberkulose, Histoplasmose, Morbus Behcet, Filariose
- Erkrankungen der Lymphwege: лимфангиома, лимфангиомиоматоз, лимфангиолейомиоматоз, морбус Кастлеман, синдром желтого ногтя
- Erhöhte Lymphproduktion: Portale Hypertension, Leberzirrhose, Gorham-Stout-Syndrom
- Veränderungen der Lymphzusammensetzung: Chronisch lymphatische Leukämie
3.4 Андере Урсахен
Kongenitale Formen sind beschrieben, z.B. Pleurale Ductusfistel, Atresie des Ductus thoracicus oder im Rahmen eines Geburtstraumas [2]
Синдром Ассозиерте с трисомией 21, синдром Нунана и Тернера. In sechs Prozent der Fällen tritt ein Chylothorax idiopathisch auf.
4 Патофизиология
Bei Undichtigkeit oder Verletzung des Ductus thoracicus bzw. der größeren Lymphbahnen sammelt sich die austretende Lymphe lokal an und bricht dann in den Pleuraraum durch.Sie kann jedoch auch direkt durch vorhandene, zum Beispiel operativ bedingte, Pleuradefekte abfließen.
Selten entsteht ein Chylothorax durch einen transdiaphragmalen Fluss bei vorhandenem Chylaszites. Da der Ductus thoracicus täglich ungefähr 2 — 4 литра Lymphe transportiert, können sich schnell große Flüssigkeitsmengen ansammeln. Dabei ist die rechte Pleurahälfte häufiger betroffen. [3] [4] [5]
5 Эпидемиология
Ein Chylothorax wird am häufigsten nach Ösophagektomie (ungefähr 3% der Fälle) und kardiochirurgischen Eingriffen bei Kindern (bis 6% der Fälle) beobachtet.
6 Симптом
Während ein kleiner Chylothorax meist asymptomatisch ist, kann ein größerer oder schnell auftretender Chylothrax aufgrund der raumfordernden Wirkung zu Dyspnoe, Husten, Thoraxsürenämzen und Husten. Der Chylus führt nicht zu einer entzündlichen Reizung, sodass weder pleuritische Schmerzen noch Fieber auftreten.
7 Диагностика
Bei operierten Patienten muss bei ungeklärtem Pleuraerguss bzw. bei deutlichem Anstieg der Drainagemenge mit Aufnahme der normalen Ernährung immer an ein Chylothorax gedacht werden.
7.1 Bildgebung
Sonographisch manifest sich ein Chylothorax als unspezifische, meist einseitige pleurale Flüssigkeitsansammlung. Bei unklarer Lokalisation des Lymphlecks ist eine MRT hilfreich und nuklearmedizinischer Bildgebung überlegen. Eine Lymphographie als alleinige diagnostische Maßnahme ist heute (2019) kaum noch indiziert.
7.2 Работа
Die durch Pleurapunktion gewonnene Flüssigkeit ist bei etwa der Hälfte der Patienten milchig-trüb.Bei fehlender Nahrungsaufnahme (z.B. perioperativ, postoperativ, kongenital) wird wenig Chylus gebildet, sodass der Erguss serös erscheint. Bei einem posttraumatischem Chylothorax kann die Flüssigkeit blutig tingiert sein.
Die Laborchemische Analyze des Punktats ist entscheidend für die Differenzialdiagnostik. Charakteristisch ist der Nachweis von Chylomikronen mittels Lipoproteinanalyse. Альтернативное лечение триглицерин и холестерин: Bei einem Triglyzeridgehalt über 110 мг / дл и концентрация холестерина до 200 мг / дл после быстрого погружения в хилоторакс.Umgekehrt schließt ein Triglyzeridgehalt unter 50 mg / dl einen Chylothorax fast aus.
Meist handelt es sich beim Chylothorax um ein Exsudat mit hohem Proteingehalt und niedriger Lactatdehydrogenase-Konzentration. В 25% от Fälle kann er auch transsudativ entstehen, insbesondere bei hepatischer oder kardialer Genese.
8 Дифференциальная диагностика
Ein milchiger Pleuraerguss kann auch bei einem Pleuraempyem oder beim Pseudochylothorax auftreten. Лучше всего, чтобы холестерин-триглицерид был сконцентрирован в пунктах до 200 мг / дл и триглицеридов до 110 мг / дл (в среднем до 50 мг / дл), после чего радиоактивный холестерин-триглицерид увеличился, как 1.Ein Pleuraempyem zeigt sich mit höher LDH-Konzentration> 1.000 U / l, erniedrigtem Glukosegehalt <60 мг / дл, erhöhter Leukozytenzahl und einem pH-Wert unter 7,2.
9 Spontanverlauf
Bei einem anhaltenden Chylusverlust gehen große Mengen an Fett und fettlöslichen Vitaminen, Eiweiß, Elektrolyten, Immunglobulinen и T-Lymphozyten verloren. Folglich entsteht eine Malnutrition, ein Gewichtsverlust und eine Störung des Immunsystems. Bereits nach wenigen Tagen haben die Patienten ein erhöhtes Risiko für eine Septikämie.
Ohne Therapie versterben ungefähr 50% der Patienten. Ein postoperativer Chylothorax verfünffacht die Rate der 30-Tage-Sterblichkeit.
10 Терапия
Neben der auslösenden Ursache entscheiden die Größe des Ergusses, die Grunderkrankung und die Komorbiditäten das weitere Vorgehen.
10.1 Консервативная терапия
Grundsätzlich wird initial immer versucht, einen Chylothorax konservativ zu versorgen. Je nach klinischen Begleitumständen variert die Dauer des konservativen Versuchs.Bei Erwachsenen beträgt sie meist 7 bis 14 Tage. Die Erfolgsrate liegt zwischen 16 und über 75%. Bei einer Drainagemenge von über einem Liter pro Tag ist dieses Vorgehen jedoch wenig erfolgsversprechend.
Adäquater Flüssigkeits- und Elektrolytersatz sowie ausreichende Ernährung sind die Eckpfeiler der Therapie. Wiederholte Pleurapunktionen zur Entlastung sollte nur vorgenommen werden, Венн фон Эйнер kurzfristigen Behandlung der Grunderkrankung eine Besserung erwartet wird или die Symptome nur seltene Punktionen erfordern.Ansonsten sollte eine kontinuierliche Drainage angelegt werden, um die Lungenfunktion zu verbessern. Dabei kann die Entfaltung der Lunge zur Leckabdichtung führen.
Um den Lymphstrom zu reduzieren, kann ergänzend eine Diät mit mittelkettigen Triglyzeriden (MCT) eingesetzt werden, welche nicht über die Кишечник Lymphgefäße, sondern direkt über das portalvenömense System. Insbesondere in postoperativen Situationen hat sich jedoch die komplette parenterale Ernährung etabliert.
Weiterhin kann Somatostatin bzw. Octreotid den Lymphfluss reduzieren. Jedoch sollte aufgrund der aktuell (2019) unklaren Datenlage die Therapie nur fortgesetzt werden, wenn sich die Drainageförderung innerhalb 48 Stunden nach Erstgabe halbiert.
10.2 Оперативная терапия
Wenn ein konservativer Therapieversuch nicht zum Erfolg führt, kommen operative Therapien in Frage, die als offene Thorakotomie или Minimalinvasiv as Thorakoskopie durchgeführt werden.Sie können bei frühzeitigem Einsatz die Sterblichkeitsrate von 50% auf 10% senken. Eine Indikation best unter anderem, wenn mehr als 1.000 — 1.500 ml Chylus pro Tag Drainiert wird, ein Leck über zwei Wochen persistiert, die Drainagemenge über 1 — 2 Wochen unverändert ist oder klinische Verschlechterungen auftreten. В послеоперационном периоде Situationen kann eine zu frühe Reoperation Anastomosen gefährden, sodass zum Beispiel nach Ösophagektomie zwei bis vier Wochen gewartet werden sollte.
Das Standardverfahren ist die Ductus-thoracicus-Ligatur, die insbesondere bei traumatischem Chylothorax etabliert ist.Intraoperativ wird das Leck zum Beispiel durch die Gabe von Sahne über eine Magensonde identifiziert. Die Ligatur ist in ungefähr 95% der Fälle erfolgreich. Sonst, aber gegebenenfalls auch в Kombination, kann eine Pleurodese durchgeführt werden. Sie wird auch eingesetzt, wenn die Therapie eines Malignoms nicht zur ausreichenden Verbesserung des Chylothorax führt. Eine Pleurodese ist jedoch nur hilfreich, wenn sich die Lunge ausdehnen kann. Eine Pleurektomie kann bei erfolgloser Pleurodese aber erwarterer Lebenserwartung von über 6 Monaten erwogen werden.Als chirurgische Ultima ratio kommen die Anlage eines pleuraperitonealen Shunts or die externe intermittierende Drainage über Kathetersysteme in Frage.
10.3 Интервенционная терапия
Inzwischen gibt es in spezialisierten Zentren auch radiologisch -ventionelle Ansätze. Beim hepatischen Chylothorax kann ein transjugulärer intraheptischer portosystemischer Stent-Shunt (TIPS) dem Pfortaderdruck und damit den Lymphfluss vermindern. In einigen Fällen sistiert eine Chylusfistel bereits nach Lymphographie, wobei sich das Verfahren zur Therapie nicht etabliert hat.Eine direkte Verklebung des Lymphlecks durch CT-gesteuerte Injektion von Gewebekleber kann versucht werden.
Alternativ цур operativen проток-thoracicus-лигатур Канна Eine проток-thoracicus-эмболизации durchgeführt Werden: Zunächst Werden умереть abdominalen Lymphgefäße lymphographisch dargestellt Эйн geeignetes Lymphgefäß на Feinnadelpunktion унд Führungsdraht sondiert, Ein Mikrokatheter eingebracht унд дер проток thoracicus verschlossen. Aufgrund von anatomischen Varianten findet sich bei bis zu 30% der Patienten kein punktionsfähiges Lymphgefäß.Dann kommt eine perkutane Lymphbahnzerstörung во Фраге, bei der die lymphographisch erkennbaren kleineren Lymphbahnen prävertebral mittels Punktionsnadel zerkratzt werden (разрыв иглы).
11 Literatur
12 Квеллен
- ↑ Skandalakis JE et al. Анатомия лимфатических сосудов, Surg Oncol Clin N Am. 2007 Янв; 16 (1): 1-16, abgerufen am 16.07.2019
- ↑ Rustico MA et al. Плевральный выпот плода, Prenat Diagn. 2007 сентябрь; 27 (9): 793-9
- ↑ Rocha G et al. Плевральные выпоты у новорожденных, Acta Paediatr.Июль 2006; 95 (7): 791-798, abgerufen am 16.07.2019
- ↑ von Straaten HL et al. Хилоторакс в неонатальном периоде, Eur. J. Pediatr. 1993 Янв; 152 (1): 2-5, abgerufen am 16.07.2019
- ↑ Бродман Р.Ф. Врожденный хилоторакс. Рекомендации по лечению. N Y State J Med. 1975 März; 75 (4): 553-557.
Врожденный хилоторакс в Доношенный кобель 8 часов Рентгенограмма грудной клетки Ребенка лечили Врожденный хилоторакс — это Управление включает Раджнити Прасад, Кулдип Сингх, Рупа Сингх, Кафедра педиатрии, Б.Институт П. Койрала Дхаран, Непал. Электронная почта: . |
Спонтанный хилоторакс у новорожденных | Meta
Спонтанный хилоторакс у новорожденных | Мета
1 октября 1984 г.
Американский журнал болезней детей
Abstract
За 22 года в большом педиатрическом центре третичной медицинской помощи было диагностировано 12 случаев спонтанного хилоторакса у новорожденных.У семи младенцев были правосторонние выпоты; только один излияние произошло слева. Тяжелые двусторонние скопления наблюдались у четырех недоношенных новорожденных с неиммунным отеком. Диагноз был поставлен на основании молочного цвета и / или наличия более 80% лимфоцитов в плевральной жидкости. Ранняя диагностика плеврального выпота как хилуса была связана с менее длительным течением, чем когда диагноз был отложен. Общая потеря плевральной жидкости варьировала от 130 до 3308 мл. Первоначальное лечение включало грудное вскрытие и / или дренаж у всех младенцев и механическую вентиляцию легких у шести.Пяти пациентам давали оральные кормления смесью стандартных триглицеридов или триглицеридов средней цепи; общее парентеральное питание назначено семи пациентам. Состояние двух младенцев с обильным и постоянным дренированием улучшилось после операции. Все, кроме одного младенца, выжили, и хилоторакс больше не повторился.
Ссылки
Мы все еще добавляем ссылки для этой статьи, пожалуйста, проверьте их позже.
Упомянутые в этой статье
Хил
Лимфоциты как процент лейкоцитов в крови (лабораторный тест)
Выпот
Парентеральный путь введения лекарств
Переднегрудная область
Передне-грудное давление
Передняя грудная клетка
9000
Младенцы, недоношенные, болезни
Вентиляция, функция (наблюдаемый объект)
Вытекание
Тенденции кормления
COVID-19
Коронавирусы включают в себя большое семейство вирусов, вызывающих более серьезные заболевания, а также простуду , например, продолжающаяся вспышка коронавирусной болезни 2019 г. (COVID-19; формально известная как 2019-nCoV).Коронавирусы могут передаваться от животных человеку; симптомы включают жар, кашель, одышку и затрудненное дыхание; в более тяжелых случаях заражение может привести к смерти. Этот канал охватывает недавние исследования COVID-19.
Новообразования костного мозга
Новообразования костного мозга — это раковые образования, которые возникают в костном мозге. Узнайте о последних исследованиях новообразований костного мозга здесь.
IGA Гломерулонефрит
Гломерулонефрит IgA — это хроническая форма гломерулонефрита, характеризующаяся отложениями преимущественно иммуноглобина А в мезангиальной области.Узнайте о последних исследованиях гломерулонефрита IgA здесь.
Криогенная электронная микроскопия
Криогенная электронная микроскопия (Cryo-EM) позволяет определять биологические макромолекулы и их сборки с разрешением, близким к атомному. Вот последнее исследование.
Агонисты рецепторов STING
Стимуляторы генов IFN (STING) представляют собой группу трансмембранных белков, которые участвуют в индукции интерферона типа I, важного для врожденного иммунного ответа.Стимуляция STING является активной областью исследований в лечении рака и инфекционных заболеваний. Вот последние исследования агонистов рецепторов STING.
LRRK2 и иммунитет во время инфекции
Мутации в гене LRRK2 являются фактором риска развития болезни Паркинсона. Однако было показано, что LRRK2 функционирует как центральный регулятор везикулярного транспорта, инфекции, иммунитета и воспаления. Вот последние исследования роли этой киназы на иммунитет во время инфекции.
Антифосфолипидный синдром
Антифосфолипидный синдром или синдром антифосфолипидных антител (APS или APLS) — это аутоиммунное состояние гиперкоагуляции, вызванное присутствием антител, направленных против фосфолипидов.
Менингококковый миелит
Менингококковый миелит характеризуется воспалением и поражением миелином мозговых оболочек и спинного мозга. Узнайте о последних исследованиях менингококкового миелита здесь.
Болезнь Альцгеймера: MS4A
Варианты в пределах мембранного 4-доменного кластера генов подсемейства A (MS4A) недавно были причастны к болезни Альцгеймера в недавних исследованиях ассоциации генома.Вот последнее исследование.
Статьи по теме
European Journal of Pediatrics
HL van StraatenT G Krediet
The Annals of Thoracic Surgery
RF Kelly, SJ Shumway
Journal of Pediatric Surgery
WS000 The Yancy педиатрии
V Chernick, MH Reed
Acta Paediatrica
P MussatG Moriette
/ статьи / спонтанный-хилоторакс-у новорожденных / 6433700
.

 06.1998г.
06.1998г.