Кризы при миастении — причины, симптомы, диагностика и лечение
Кризы при миастении – это состояния острой декомпенсации патологии в виде пароксизмального нарушения витальных функций. Резкое усиление мышечной слабости сопровождается угнетением дыхания, бульбарными, сердечно-сосудистыми расстройствами. Чаще всего кризы сочетают в себе признаки миастенического и холинергического вариантов, что придает им более тяжелое течение. В диагностике используют клинические, лабораторные методы, электронейромиографию, КТ и МРТ органов грудной клетки. Неотложные состояния требуют ИВЛ, медикаментозной терапии, экстракорпоральной детоксикации, решения вопроса о хирургической коррекции.
Общие сведения
Кризы при миастении достаточно редки – в общей популяции регистрируется 50–400 случаев на 1 млн. населения. На протяжении жизни их испытывают 10–45% пациентов с мышечной слабостью, особенно в первые два года болезни. Ежегодный риск возникновения кризов находится в пределах 2–3%. Декомпенсация миастении может наступить в любом возрасте, но значительно чаще встречается среди людей 18–40 лет. В гендерной структуре пароксизмальных состояний практически пятикратное преимущество принадлежит женщинам репродуктивного периода. В пожилом возрасте существенно возрастает показатель распространенности среди мужчин, выравнивая соотношение с женщинами.
Ежегодный риск возникновения кризов находится в пределах 2–3%. Декомпенсация миастении может наступить в любом возрасте, но значительно чаще встречается среди людей 18–40 лет. В гендерной структуре пароксизмальных состояний практически пятикратное преимущество принадлежит женщинам репродуктивного периода. В пожилом возрасте существенно возрастает показатель распространенности среди мужчин, выравнивая соотношение с женщинами.
Кризы при миастении
Причины кризов
Осложненное течение характерно для приобретенной генерализованной миастении или локальных форм, за исключением глазной. Хотя некоторые авторы указывают на роль наследственной предрасположенности, но врожденные варианты болезни крайне редко сопровождаются кризами. Возникновение тяжелой декомпенсации связано с рядом внешних и внутренних факторов. Значимыми триггерами выступают следующие состояния:
- Респираторные инфекции. Вирусные и бактериальные инфекции дыхательных путей являются наиболее распространенной причиной клинического ухудшения при миастении – на их долю приходится 30–70% случаев.
 Значение имеют как бронхолегочные заболевания, так и ОРВИ с поражением верхних отделов респираторного тракта. Отдельное место занимают аспирационная пневмония, сепсис.
Значение имеют как бронхолегочные заболевания, так и ОРВИ с поражением верхних отделов респираторного тракта. Отдельное место занимают аспирационная пневмония, сепсис. - Операции. Частой причиной становятся оперативные вмешательства, выполняемые под общей анестезией, особенно тимэктомия. Декомпенсацию наблюдают при миастенических кризах в анамнезе, длительности заболевания свыше 3 месяцев, наличии бульбарных симптомов перед операцией. В зоне повышенного риска находятся пациенты, у которых экстубация была отложена более чем на 24 часа.
- Прием лекарств. Прямым или опосредованным влиянием на нервно-мышечную передачу обладают многие лекарства. Дебют миастении либо развитие криза могут провоцировать бензодиазепины, миорелаксанты, антидепрессанты. Так действуют антибиотики (аминогликозиды, макролиды, тетрациклины), йодсодержащие вещества, препараты магния. Важное значение имеет нарушение схемы приема кортикостероидов и антихолинэстеразных средств.

- Эндокринно-обменные нарушения. Миастения подвержена декомпенсации на фоне дисфункции щитовидной железы, сахарного диабета, ожирения. Риск кризов увеличивается вдвое при патологии тимуса (тимомах). Имеют значение гормональные сдвиги у женщин – при менструациях, климаксе, в период беременности, после родов. Усугубить мышечную слабость могут электролитные расстройства (гипокалиемия, гипофосфатемия).
Вероятность тяжелого пароксизмального течения увеличивается у пожилых людей с сопутствующей соматической патологией (гипертонической, ишемической болезнью), при травмах. Провоцирующим фактором могут стать тяжелые стрессовые ситуации, интенсивные физические нагрузки, перегревание. В группу риска попадают лица в возрасте до 18 и старше 60 лет, с ранней генерализацией миастении, длительно принимавшие антихолинэстеразные препараты. Более половины кризов ассоциируют с неправильным ведением пациентов, но в трети случаев явную причину определить не удается.
Патогенез
Основой патогенеза кризов при миастении является массивная аутоиммунная агрессия против структур мионеврального синапса. Патологический процесс сопровождается образованием антител к ацетилхолиновым рецепторам, белкам постсинаптической мембраны (MuSK, LRP4), что приводит к комплемент-связанной деструкции и резкому уменьшению их количества. В результате не происходит генерации потенциала действия на постсинаптической мембране, что проявляется курареподобным блоком нервно-мышечной проводимости.
Особый механизм развития присущ холинергическому кризу. Генез моторных и вегетативных расстройств связан с гиперполяризацией постсинаптических мембран, вызванной чрезмерным количеством ацетилхолина. Как результат, снижается чувствительность незатронутых аутоиммунным процессом никотиновых и мускариновых рецепторов. Во всех случаях появление криза обусловлено передозировкой антихолинэстеразных препаратов. Кроме мышечной слабости, он характеризуется комплексом холинергических эффектов.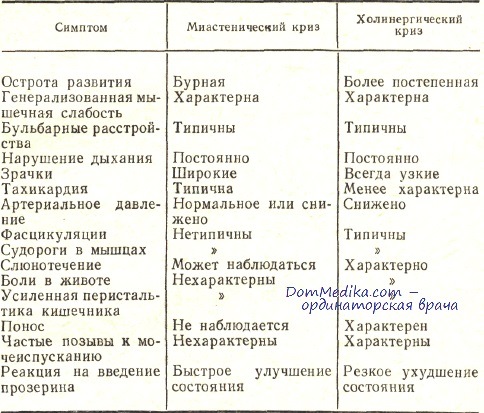
Дыхательные расстройства во время кризов обусловлены феноменом генерализации мышечного утомления, распространяющегося на области, испытывающие функциональную нагрузку. Респираторные расстройства при осложненном течении патологии связаны со слабостью скелетной мускулатуры: диафрагмы, межреберий, брюшного пресса. Не последнюю роль в этом процессе играют нарушение функции надгортанника, накопление слизи в дыхательных путях при недостаточности кашлевого толчка.
Классификация
Согласно классификации миастении по степени тяжести, кризы относят к V классу, когда дыхательные и бульбарные нарушения достигают такого уровня, что без искусственной вентиляции легких и зондового питания не обойтись. Разделение же самих пароксизмов достаточно условно, поскольку один быстро переходит в другой. В практической неврологии выделяют следующие кризы:
- Миастенический. Возникает при неэффективности ингибиторов холинэстеразы. Встречаются парциальные (дыхательный, кардиальный) или генерализованные варианты.

- Холинергический. Обусловлен нерациональным использованием антихолинэстеразных средств. По клиническим формам схож с миастеническим, но протекает с мускариновыми и никотиновыми эффектами.
- Смешанный. Встречается чаще других. Представляет собой наиболее тяжелый вариант криза, который имеет две фазы – миастеническую и холинергическую.
Существует три типа дыхательных расстройств при декомпенсированной миастении – скелетно-мышечный, бульбарный, смешанный. Первый характеризуется поражением мышц грудной клетки и диафрагмы. Бульбарный вариант предполагает парез надгортанника и западение языка с развитием асфиксии. У большинства пациентов оба типа развиваются одновременно.
Симптомы кризов при миастении
Декомпенсация болезни возникает внезапно (за 12–48 часов), сопровождается резким ухудшением жизненно важных функций из-за прогрессирующей мышечной слабости. Иногда наблюдается подострое развитие, когда симптомы нарастают в течение 3–14 дней. У пятой части пациентов кризы являются первым проявлением миастении, что обычно наблюдается при ее поздней манифестации. Склонность к повторному развитию пароксизмов свидетельствует о крайне тяжелом течении основного заболевания.
У пятой части пациентов кризы являются первым проявлением миастении, что обычно наблюдается при ее поздней манифестации. Склонность к повторному развитию пароксизмов свидетельствует о крайне тяжелом течении основного заболевания.
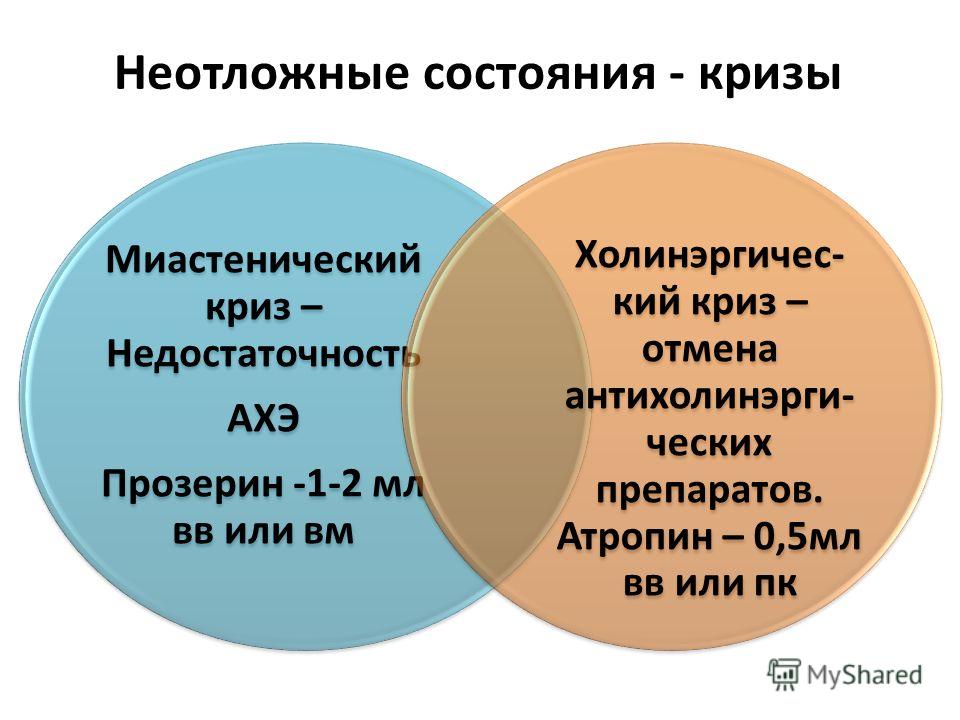
Миастенический и холинергический кризы имеют ряд общих признаков, к которым относят нарастающую слабость скелетной и бульбарной мускулатуры, глазодвигательные нарушения, гипомимию. Наиболее грозный симптом – дыхательные нарушения, представляющие прямую угрозу жизни пациента. Оба варианта характеризуются психомоторным возбуждением с беспокойством, страхом, спутанностью сознания, обусловленными нарастающей гипоксией головного мозга.
Миастенический криз
Помимо описанных симптомов, миастенический криз сопровождается вегетативной дисфункцией – гипергидрозом, гиперсаливацией, бледностью и цианозом кожных покровов. Он развивается постепенно, так как необходимо время на вовлечение вспомогательной мускулатуры. Пациент принимает вынужденную позу – полусидя, держась за спинку кровати для фиксации плечевого пояса. При генерализованном приступе усиливаются общая слабость, птоз, ограничивается подвижность глазных яблок. Бульбарные нарушения сочетаются с расстройствами дыхания и деятельности сердца.
При генерализованном приступе усиливаются общая слабость, птоз, ограничивается подвижность глазных яблок. Бульбарные нарушения сочетаются с расстройствами дыхания и деятельности сердца.
Одним из вариантов проявления парциального кардиального миастенического криза становятся приступы, схожие со стенокардическими: пациент ощущает дискомфорт в области сердца, перебои в его работе. Объективно выявляют гипотонию, тахикардию. Пароксизм обычно возникает в ночное время, проходит после приема антихолинэстеразных препаратов. Парциальные дыхательные кризы развиваются по бульбарному или спинальному типу с нарастанием слабости в соответствующих группах мышц.
Холинергический криз
Характеризуется парадоксальным снижением мышечной силы в ответ на введение антихолинэстеразных средств. В клинической картине присутствуют отчетливо выраженные мускариновый и никотиновый эффекты. Первый проявляется усилением секреции слюны и бронхиальной слизи, повышенной потливостью, сужением зрачков. Возникают абдоминальные боли, диспепсические явления (тошнота, рвота, понос), брадикардия. Активация никотиновых рецепторов сопровождается мышечными фасцикуляциями, судорогами.
Возникают абдоминальные боли, диспепсические явления (тошнота, рвота, понос), брадикардия. Активация никотиновых рецепторов сопровождается мышечными фасцикуляциями, судорогами.
Смешанный криз
Учитывая быструю трансформацию кризов при миастении, их разграничение затруднено, поэтому чаще констатируют смешанный вариант. Он сопровождается несостоятельностью бульбарных и дыхательных мышц при незначительном снижении силы в конечностях. Сопутствующие нарушения туловищной локализации остаются чувствительны к анитихолинэстеразным препаратам. Но в сочетании с холинергическими симптомами такой криз представляет существенную опасность для пациента.
Осложнения
Кризы угрожают остановкой дыхания и сердечно-сосудистой недостаточностью, повышающими летальность при миастении вдвое. У трети пациентов пароксизмы имеют тенденцию к рецидивированию. При миастеническом кризе возрастает риск экстубационной дыхательной недостаточности, частота которой составляет 27%. Поражение бульбарных мышц ведет к развитию аспирационных состояний (пневмонии, синдрома Мендельсона).
Поражение бульбарных мышц ведет к развитию аспирационных состояний (пневмонии, синдрома Мендельсона).
Распространенными осложнениями кризов являются различные инфекции – бронхолегочные, мочевыводящих путей, колит, сепсис. В состоянии декомпенсации пациенты подвергаются повышенному риску сосудистых осложнений, включая тромбоз глубоких вен, острый инфаркт миокарда, аритмии. Существует несколько сообщений о возникновении у пациентов стресс-индуцированной кардиомиопатии (синдрома такоцубо).
Диагностика
Важной задачей для врача-невролога является ранняя диагностика дыхательных нарушений с выявлением риска кризового течения миастении. Тяжесть процесса устанавливается по международной классификации, шкале мышечной силы. Клиническими критериями являются прогрессирующая мышечная слабость, дисфагия, респираторный дистресс (одышка, тахипноэ, вовлечение вспомогательных мышц). Для выявления факторов декомпенсации применяются методы лабораторного и инструментального контроля:
- Биохимический анализ крови.
 Определение концентрации антител, направленных против ацетилхолиновых рецепторов и мышечно-специфической тирозинкиназы (MuSK), проводится иммуноферментным анализом, радиоиммунологическим методом. Исследование газов артериальной крови при дыхательных расстройствах показывает гиперкапнию, гипоксию, снижение сатурации.
Определение концентрации антител, направленных против ацетилхолиновых рецепторов и мышечно-специфической тирозинкиназы (MuSK), проводится иммуноферментным анализом, радиоиммунологическим методом. Исследование газов артериальной крови при дыхательных расстройствах показывает гиперкапнию, гипоксию, снижение сатурации. - Фармакологические пробы. При введении антихолинэстеразных ЛС наблюдается регресс симптоматики миастенического криза. Холинергическая форма сопровождается отрицательной прозериновой пробой, при которой симптомы не исчезают, а нарастают. Если же пациент нуждается в ИВЛ, то проводить ее для разграничения двух вариантов нет необходимости.
- Электрофизиологическое исследование. Ритмическая стимуляционная электронейромиография является наиболее чувствительным тестом для обнаружения нарушений в мионевральном синапсе. Электрофизиологическим предиктором развития криза признается генерализованное снижение М-ответа на первый вызванный электрический стимул в пораженной мышце.

- Томография. КТ-сканирование грудной клетки выполняется для исключения патологии вилочковой железы — тимомы. Исследование имеет гораздо более высокую информативность по сравнению с традиционной рентгенографией. Высокой точностью при выявлении мягкотканных образований обладает МРТ, ее выполнение увеличивает диагностическую ценность рентгенологического метода.
Дифференцировать кризы при миастении необходимо с другими тяжелыми состояниями, сопровождающимися респираторными расстройствами. В списке вероятных заболеваний могут присутствовать синдром Ламберта-Итона, ботулизм, полиомиелит. Необходимо учитывать врожденные миастенические состояния, острые нарушения мозгового кровообращения, синдром Гийена-Барре и прочие нарушения со схожей симптоматикой.
Лечение кризов при миастении
Консервативное лечение
Резкая декомпенсация мышечной слабости – это жизнеугрожающее состояние, требующее оказания ургентной помощи. Все пациенты поступают в отделение реанимации и интенсивной терапии, где проводится восстановление дыхания и сердечной деятельности. В терапии кризов практикуется последовательный междисциплинарный подход, включающий общие и патогенетические (специфические) мероприятия консервативной коррекции.
Все пациенты поступают в отделение реанимации и интенсивной терапии, где проводится восстановление дыхания и сердечной деятельности. В терапии кризов практикуется последовательный междисциплинарный подход, включающий общие и патогенетические (специфические) мероприятия консервативной коррекции.
Купирование дыхательной недостаточности проводится путем санации ротоглотки и трахеобронхиального дерева, интубации трахеи, перевода пациента на ИВЛ. Объем респираторной поддержки определяется тяжестью нарушений. Одновременно отменяют препараты антихолинэстеразного ряда и другие, усугубляющие проведение нервных импульсов. К мероприятиям общего характера относят выявление и устранение инфекционных осложнений, профилактику тромбозов. Специфическое лечение при кризах включает:
- Введение иммуноглобулинов. Может рекомендоваться как метод первой линии при лечении тяжелой генерализованной миастении и кризов. Внутривенные иммуноглобулины G способны угнетать аутоиммунную агрессию, оказывая быстрый кратковременный эффект.
 Метод дает сопоставимые с плазмаферезом результаты, но более доступен и прост в применении, лучше переносится пациентами.
Метод дает сопоставимые с плазмаферезом результаты, но более доступен и прост в применении, лучше переносится пациентами. - Плазмаферез. Экстракорпоральная детоксикация считается эффективным методом лечения кризовых состояний при миастении, назначается перед и после тимэктомии. Обменный плазмаферез позволяет вывести из плазмы крови антитела, обеспечивая большинству пациентов позитивный эффект, сохраняющийся 1–2 месяца. Альтернативой является селективная иммуносорбция.
- Кортикостероидную терапию. Патогенетически обосновано применение пульс-терапии кортикостероидами (метилпреднизолоном), которая способна купировать проявления криза. У некоторых пациентов сопровождается кратковременным ухудшением состояния или резистентностью. Риск негативных явлений уменьшается при одновременном применении плазмафереза, иммуноглобулинов.
В комплексной терапии используются различные средства симптоматической и вспомогательной коррекции, действие которых направлено на усиление выработки ацетилхолина, улучшение мышечной функции, подавление побочных эффектов патогенетического лечения. Используются метаболические средства (метионин, глутаминовая кислота, витамины), препараты кальция, адаптогены. Профилактику кортикостероид-ассоциированного остеопороза осуществляют ретаболилом, фторидом натрия.
Используются метаболические средства (метионин, глутаминовая кислота, витамины), препараты кальция, адаптогены. Профилактику кортикостероид-ассоциированного остеопороза осуществляют ретаболилом, фторидом натрия.
Хирургическое лечение
Своевременное удаление тимуса (тимэктомия) оказывает превентивный эффект – уменьшает частоту и тяжесть кризов при миастении, особенно при ранней декомпенсации. В послеоперационном периоде у 6–22% пациентов отмечаются рецидивы тяжелых пароксизмов, но риск отрицательных последствий снижается при использовании малоинвазивных техник: цервикотомии, частичной стернотомии, торакоскопии под видеоконтролем. Пациенты с тяжелыми бульбарными расстройствами нуждаются в трахеостомии.
Экспериментальное лечение
Для лечения кризов при миастении предлагают использовать другие иммуносупрессивные препараты – азатиоприн, мофетила микофенолат, циклоспорин. Их рассматривают в качестве альтернативы кортикостероидам при наличии противопоказаний или неадекватного терапевтического ответа. Но в силу отсроченного действия эти препараты обладают ограниченным применением. При злокачественном течении болезни отмечена эффективность моноклональных антител (ритуксимаба).
Но в силу отсроченного действия эти препараты обладают ограниченным применением. При злокачественном течении болезни отмечена эффективность моноклональных антител (ритуксимаба).
Прогноз и профилактика
Своевременно оказанная медицинская помощь делает прогноз благоприятным, исход кризов может ухудшиться из-за сопутствующей патологии. Смертность от декомпенсации миастении составляет около 4%, но за счет активной респираторной поддержки и ранней интенсивной терапии ее удается избежать. Прогрессирование моторных нарушений оказывает инвалидизирующий эффект, снижая качество жизни. Для профилактики кризов проводят динамическое наблюдение за пациентами, рассматривают целесообразность тимэктомии, устраняют факторы риска, в том числе разъясняют важность правильного приема лекарств .
Холинергическая крапивница — причины, симптомы, диагностика и лечение
Холинергическая крапивница – это редкая аутоиммунная разновидность аллергической крапивницы. Клинически характеризуется острым (в течение часа) высыпанием мелких зудящих пузырьков с серозным содержимым на открытых участках кожного покрова. Сыпь имеет тенденцию к распространению, сопровождается продромой. Диагностируется на основании анамнеза, клинических проявлений, провокационных проб на ацетилхолин, искусственной стимуляции аллергической реакции, анализа крови на аллергены, консультаций узкопрофильных специалистов. Лечение холинергической крапивницы заключается в нейтрализации провоцирующего фактора и коррекции сопутствующей патологии.
Клинически характеризуется острым (в течение часа) высыпанием мелких зудящих пузырьков с серозным содержимым на открытых участках кожного покрова. Сыпь имеет тенденцию к распространению, сопровождается продромой. Диагностируется на основании анамнеза, клинических проявлений, провокационных проб на ацетилхолин, искусственной стимуляции аллергической реакции, анализа крови на аллергены, консультаций узкопрофильных специалистов. Лечение холинергической крапивницы заключается в нейтрализации провоцирующего фактора и коррекции сопутствующей патологии.
Общие сведения
Холинергическая крапивница – острый зудящий аллергодерматоз, возникающий в качестве иммунного ответа на раздражающее действие ацетилхолина, продуцируемого собственным организмом пациента. В структуре дерматологической заболеваемости на долю холинергической крапивницы приходится около 7% от всех разновидностей «крапивных дерматозов». Внутри группы только 50% случаев патологии достоверно имеют аутоиммунный генез, что подтверждается тестом с аутосывороткой (ASST), механизмы развития остальных 50% пока окончательно не выяснены.
Патологический процесс не имеет возрастных, гендерных, сезонных рамок, не обладает эндемичностью. Особенностью холинергической крапивницы является возможность контроля рецидивов с учетом провоцирующего фактора. Актуальность проблемы для клинической дерматологии на современном этапе связана с постоянным ростом количества аллергических дерматозов, являющихся основой развития холинергической крапивницы, которая существенно нарушает качество жизни пациентов.
Холинергическая крапивница
Причины
Триггером заболевания является ацетилхолин, который выделяется клетками организма в ответ на физическую нагрузку, стресс, прием горячей ванны и т. д. Половина случаев холинергической крапивницы имеет аутоиммунный генез. Для её возникновения характерно постоянное присутствие в крови антител, родственных иммуноглобулину Е (IgE), который отвечает за развитие аллергических реакций немедленного типа. Эти антитела располагаются на рецепторах тучных клеток и постоянно стимулируют их, что обуславливает IgE- аллергическую настроенность организма пациентов и сенсибилизацию кожных покровов.
Действие провоцирующих факторов на уже аллергизированную кожу вызывает дегрануляцию тучных клеток, которые высвобождают сосудистые медиаторы, в том числе и ацетилхолин. Повышенное количество ацетилхолина обуславливает гиперчувствительность иммунной системы, провоцирует развитие острой холинэргической аутоиммунной реакции.
Вторая половина случаев холинергической крапивницы развивается по идиопатическому сценарию, который возникает на фоне хронических заболеваний (патологии пищеварительного тракта, эндокринных нарушений, вегето-сосудистой дистонии), стресса и усиленного потоотделения. В этом варианте холинергической крапивницы достаточным оказывается разрушение тучных клеток (основных эффекторных клеток любой крапивницы) неясного генеза. Клетки начинают вырабатывать гистамин и простагландины, стимулирующие воспаление и активирующие ацетилхолин – медиатор нервного возбуждения, в ответ на действие которого возникает иммунный ответ, что клинически проявляется появлением сыпи.
Симптомы холинергической крапивницы
Первым клиническим проявлением заболевания становятся острые высыпания на почти неизменённой, слегка отёчной коже, возникающие в течение нескольких минут, максимум – часа с момента контакта пациента с провоцирующими факторами. Первичные элементы холинергической крапивницы представляют собой мелкие пузырьки до 3мм в диаметре, бледно-розовые в центре и алые по периметру. Локализуется сыпь на шее, туловище и конечностях, сопровождается сильным зудом.
Поскольку пусковым раздражителем является «проводник» нервных импульсов ацетилхолин, вместе с кожными проявлениями возникают симптомы патологии нервной системы: тошнота, рвота, диспепсия, повышенное слюнотечение. Спонтанно повышается температура, появляется недомогание, обостряется сопутствующая патология.
Степень тяжести клинических проявлений зависит от уровня повышения ацетилхолина в организме. Отличительной особенностью клиники холинергической крапивницы является спонтанное достаточно быстрое разрешение кожных проявлений и других симптомов, связанных с прямым раздражением нервной системы высоким содержанием ацетилхолина, в сочетании с прогрессированием сопутствующей патологии (заболеваний желудочно-кишечного тракта, эндокринных нарушений).
Диагностика
Клинические проявления крапивницы типичны. Детального анамнеза пациента в сочетании с симптомами достаточно для диагностики патологии врачом-дерматологом. Оценивают дермографизм кожи и её реакцию на УФО, выполняют давление на кожу с целью исключения физической крапивницы. Подтверждение именно холинэргического характера заболевания требует использования специальных методик.
- Аллергопробы. Наиболее проста диагностика холинергической крапивницы с помощью провоцирующих факторов, когда руки пациента опускают на 2-3 минуты в горячую воду (> 50 градусов), что немедленно вызывает холинэргический ответ. Провокационный тест заключается в подкожном введении ацетилхолина, что в течение 20 минут даёт симптомы холинергической крапивницы. Кожное тестирование внутрикожным введением аутологичной сыворотки (ASST) относится к скрининговым методам.
- Лабораторные тесты. Выполняется ОАК, ОАМ, биохимическое тестирование на С-реактивный белок, паразитологическое обследование, анализ кала на яйца глист, мазок из носоглотки на инфекционное начало.
 Анализ крови на антинуклеарные антитела проводится для исключения других разновидностей аутоиммунной крапивницы. На основании данных об общем количестве IgE и белков, участвующих в развитии аллергии, исключают хроническую крапивницу.
Анализ крови на антинуклеарные антитела проводится для исключения других разновидностей аутоиммунной крапивницы. На основании данных об общем количестве IgE и белков, участвующих в развитии аллергии, исключают хроническую крапивницу. - Инструментальные методики. В сложных случаях, в связи с тем, что холинергическая крапивница часто протекает на фоте системных заболеваний, осуществляют биопсию кожи, УЗИ щитовидной железы и сердца, ЭФГДС и анализ на бактерию H. Pylori с оценкой результатов узкими специалистами.
Все анализы никогда не назначают одновременно, решение о целесообразности применения тех или иных методик принимает врач. Холинергическую крапивницу дифференцируют от других видов крапивницы на основании результатов диагностических проб.
Лечение холинергической крапивницы
Терапия заболевания имеет каскадный характер и состоит из нескольких линий, призванных устранить триггеры патологии и применить фармакотерапию, необходимую с учетом тяжести клинических проявлений. Первая линия лечения предполагает исключение провоцирующих факторов (стрессов, алкоголя, перегрева) и обучение пациентов правильному поведению в быту. На этом этапе задействуют антигистаминные препараты первого поколения, в том числе и для уменьшения зуда. Назначают гипоаллергенную диету, проводят коррекцию сопутствующих заболеваний.
Первая линия лечения предполагает исключение провоцирующих факторов (стрессов, алкоголя, перегрева) и обучение пациентов правильному поведению в быту. На этом этапе задействуют антигистаминные препараты первого поколения, в том числе и для уменьшения зуда. Назначают гипоаллергенную диету, проводят коррекцию сопутствующих заболеваний.
Вторая линия терапии холинергической крапивницы включает применение кортикостероидов, антидепрессантов, седативных препаратов, блокаторов кальциевых каналов, рецепторов к лейкотриенам (АЛР), биологически активных добавок и витаминов. Третья линия подключается при резистентности патологического процесса к первым двум, предполагает использование иммуномодуляторов и плазмафереза, иногда в сочетании с иммунодепрессантами. Наружно назначают препараты, содержащие красавку.
Прогноз и профилактика
Прогноз относительно благоприятный с учётом тяжести аллергии и её осложнений. Если не устранить первопричину крапивницы, то неизбежны рецидивы заболевания. Профилактика холинергической крапивницы заключается в исключении провоцирующих факторов.
Профилактика холинергической крапивницы заключается в исключении провоцирующих факторов.
Гиперкальциемический криз — причины, симптомы, диагностика и лечение
Гиперкальциемический криз – это тяжелое неотложное состояние, характеризующееся резким повышением уровня кальция в крови. Проявляется симптомами интоксикации: нарастающей слабостью, сильной жаждой, сниженным аппетитом, тошнотой, неукротимой рвотой, спастическими абдоминальными болями, апатией, рассеянностью, забывчивостью, артралгиями и миалгиями. В результате кальциноза нарушается работа внутренних органов. Ключевые диагностические методы – лабораторное определение гиперкальциемии, рентгенография костей и почек, ЭКГ. Лечение включает процедуры, нормализующие концентрацию кальция – диурез, гемодиализ, хирургическое удаление источника гиперсекреции ПТГ.
Общие сведения
Синонимы гиперкальциемического криза, вызванного гиперпаратиреозом – гиперпаратиреоидный криз, острая гиперпаратиреоидная интоксикация. Состояние развивается в случаях, когда количество поступающего в кровоток кальция превышает функциональные возможности почек по его выведению. Значение критической концентрации кальция индивидуально, но у большинства людей его токсическое действие проявляется при показателях 3,49-4,19 ммоль/л и выше. Достоверные эпидемиологические данные о распространенности гиперкальциемического криза отсутствуют. Среди женщин заболеваемость в 4 раза выше, чем среди мужчин. Около 80% пациентов относятся к возрастной группе от 40 до 70 лет. Более всего подвержены кризу люди старше 60 лет.
Состояние развивается в случаях, когда количество поступающего в кровоток кальция превышает функциональные возможности почек по его выведению. Значение критической концентрации кальция индивидуально, но у большинства людей его токсическое действие проявляется при показателях 3,49-4,19 ммоль/л и выше. Достоверные эпидемиологические данные о распространенности гиперкальциемического криза отсутствуют. Среди женщин заболеваемость в 4 раза выше, чем среди мужчин. Около 80% пациентов относятся к возрастной группе от 40 до 70 лет. Более всего подвержены кризу люди старше 60 лет.
Гиперкальциемический криз
Причины
К группе риска по развитию кризового состояния относятся пациенты с гиперкальциемией. В основе патологии лежит нарушение кальциевого обмена: усиленное всасывание микроэлемента из кишечника, интенсивное вымывание из костей, недостаточная экскреция почками, пониженное поглощение костной тканью. К распространенным причинам криза относят:
- Гиперпаратиреоз.
 Острая гиперкальциемия характерна для тяжелого течения первичного, вторичного или третичного гиперпаратиреоза. Спровоцировать криз может обострение болезни, грубая пальпация околощитовидных желез, стремительная дегидратация, беременность, инфекция, перелом, обездвиженность, лечение всасывающимися антацидами.
Острая гиперкальциемия характерна для тяжелого течения первичного, вторичного или третичного гиперпаратиреоза. Спровоцировать криз может обострение болезни, грубая пальпация околощитовидных желез, стремительная дегидратация, беременность, инфекция, перелом, обездвиженность, лечение всасывающимися антацидами. - Онкологические заболевания. Часто гиперкальциемическое состояние становится результатом формирования опухоли кости или распространения метастазов в костную ткань. Кроме этого, повышение количества кальция наблюдается при миеломной болезни вследствие остеолиза и при гормонсекретирующих новообразованиях, проявляющих активность схожую с паратгормоном.
- Прием препаратов. Наиболее вероятная причина – гипервитаминоз D, при котором повышается всасываемость кальция через кишечник и его повторная абсорбция в почках. Реже криз возникает при применении тиазидных диуретиков, гормональных средств, препаратов с литием, магнием.
- Острая почечная недостаточность.
 При ОПН нарушаются все почечные функции, включая выделительную и фильтрационную. Кальций не выводится из организма, его плазменный уровень непрерывно повышается.
При ОПН нарушаются все почечные функции, включая выделительную и фильтрационную. Кальций не выводится из организма, его плазменный уровень непрерывно повышается.
Существуют и менее вероятные факторы развития гиперкальциемического криза. Ими являются синдром Бернетта, тиреотоксикоз, гипотиреоз, надпочечниковая недостаточность, акромегалия, семейная доброкачественная гиперкальциемия, болезнь Педжета, гранулематозные заболевания (саркоидоз, туберкулез, гистоплазмоз), иммобилизация.
Патогенез
Гиперкальциемический криз – результат быстрого и внезапного повышения концентрации в плазме кальция, провоцирующего состояние острой интоксикации. Мнения о критическом уровне микроэлемента расходятся, приблизительный диапазон – 3,5-4,2 ммоль/л. В норме показатели составляют от 2,4 до 2,9 ммоль/л. Избыток кальция обусловлен его чрезмерным поступлением извне и/или активным выведением из кости, интенсивной почечной реабсорбцией. Наиболее частой причиной гиперкальциемического криза является первичный гиперпаратиреоз. При этом заболевании возникает избыточная секреция паратгормона аденомой либо гиперплазированными тканями паращитовидных желез. Под влиянием ПТГ увеличивается содержание сывороточного кальция.
При этом заболевании возникает избыточная секреция паратгормона аденомой либо гиперплазированными тканями паращитовидных желез. Под влиянием ПТГ увеличивается содержание сывороточного кальция.
Паратиреоидный гормон, воздействуя непосредственно на кости, повышает активность остеокластов, вследствие чего усиленно выделяется лимонная кислота. Развивается ацидоз, который мобилизует транспорт кальция, фосфора из костных тканей в плазму. Действие ПТГ на почки заключается в стимуляции реабсорбции кальция и угнетении повторного всасывания фосфора, хлоридов, натрия, калия. Развивающаяся гиперкальциемия подавляет активность вазопрессина, что ведет к полиурии и полидипсии, а также снижает нервно-мышечную возбудимость с формированием мышечной гипотонии. Кроме избытка паратиреоидного гормона острую гиперкальциемию может спровоцировать дисбаланс АКТГ, глюкокортикоидов, соматотропина, тироксина, андрогенов, эстрогенов.
Симптомы гиперкальциемического криза
Характерно быстрое и внезапное нарастание признаков острой гиперкальциемии. Вначале пациенты отмечают беспричинную слабость, снижение тонуса мышц, тошноту, суставные и мышечные боли, повышение артериального давления. По мере нарастания интоксикации появляется неукротимая рвота, запор, боли в области эпигастрия, которые могут носить опоясывающий характер. Мочеиспускания становятся частыми и обильными, усиливается чувство жажды, исчезает аппетит. Из-за обезвоживания больные ощущают сухость во рту, кожный зуд, головные боли и головокружения. Через некоторое время полиурия сменяется олигурией, а затем анурией.
Вначале пациенты отмечают беспричинную слабость, снижение тонуса мышц, тошноту, суставные и мышечные боли, повышение артериального давления. По мере нарастания интоксикации появляется неукротимая рвота, запор, боли в области эпигастрия, которые могут носить опоясывающий характер. Мочеиспускания становятся частыми и обильными, усиливается чувство жажды, исчезает аппетит. Из-за обезвоживания больные ощущают сухость во рту, кожный зуд, головные боли и головокружения. Через некоторое время полиурия сменяется олигурией, а затем анурией.
Рвота провоцирует дегидратацию, водно-электролитный дисбаланс. Абдоминальные боли носят спастический характер, иногда схожи с таковыми при остром аппендиците, что значительно затрудняет диагностику. При наличии заболеваний желудочно-кишечного-тракта или осложнений такого типа на фоне гиперпаратиреоза возможна перфорация пептической язвы, желудочное или кишечное кровотечение, острый панкреатит. Соли кальция откладываются в паренхиме различных органов. В зависимости от локализации кальцификатов симптоматика криза может напоминать пневмонию, острую легочную, сердечную или почечную недостаточность. Иногда развиваются внутрисосудистые тромбозы, ДВС-синдром.
В зависимости от локализации кальцификатов симптоматика криза может напоминать пневмонию, острую легочную, сердечную или почечную недостаточность. Иногда развиваются внутрисосудистые тромбозы, ДВС-синдром.
Нервно-психические расстройства при кризе представлены сонливостью, частичной утратой памяти, психастенией, депрессией. При усилении гиперкальциемии больные становятся заторможенными или, наоборот, чрезмерно возбудимыми. В критических случаях формируется бред со зрительными галлюцинациями, эпилептические приступы, психотические состояния, комы.
Осложнения
Тяжелое течение криза наблюдается при повышении содержания кальция до 5 ммоль/л. Угнетается деятельность центральной нервной системы, тормозятся функции дыхательного и сосудодвигательного центров в головном мозге, развивается необратимый шок. Формируется сердечно-сосудистая недостаточность с коллапсом, тяжелые дыхательные расстройства (отек легких). Прогрессирует заторможенность, замедленность движений, нарастает риск ступора и комы с летальным исходом. Общий показатель смертности составляет 60%, среди пациентов от 60-65 лет он достигает 80-90%. Непосредственной причиной летальности часто становится тромбоз крупных сосудов, инфаркты жизненно важных органов (почек, легких, сердца).
Общий показатель смертности составляет 60%, среди пациентов от 60-65 лет он достигает 80-90%. Непосредственной причиной летальности часто становится тромбоз крупных сосудов, инфаркты жизненно важных органов (почек, легких, сердца).
Диагностика
Диагноз гиперкальциемического криза устанавливается врачом-эндокринологом на основании данных анамнеза, оценки клинических проявлений, результатов инструментальных исследований состояния костной ткани и лабораторных тестов, выявляющих гиперкальциемию. В анамнезе пациентов часто определяется гиперпаратиреоз, опухоли костей или метастазирование в кости, лечение легко абсорбирующимися антацидами, нарушение почечных функций. К объективным методам диагностики относятся:
- Общий, биохимический анализ крови. На начальных стадиях криза отмечается умеренный лейкоцитоз, увеличение СОЭ и умеренная нормохромная анемия. При дисфункции почек – повышение белка, креатинина, мочевины.
- Исследование кальция.
 При первичной экстренной диагностике гиперкальциемии проводится проба Сулковича (образец мутный, результат положительный). Показатели анализа крови на кальций – более 2,39 ммоль/л. По данным дополнительных тестов определяется гипокалиемия, гипомагниемия и гипофосфатемия.
При первичной экстренной диагностике гиперкальциемии проводится проба Сулковича (образец мутный, результат положительный). Показатели анализа крови на кальций – более 2,39 ммоль/л. По данным дополнительных тестов определяется гипокалиемия, гипомагниемия и гипофосфатемия. - Рентгенография. При денситометрии обнаруживается уменьшение плотности костной ткани, субпериостальная резорбция на концевых, средних и основных фалангах кистей. Концевые фаланги часто фестончатые, кружевные. Рентгенография почек выявляет признаки нефрокальциноза (кальцификаты).
- Электрокардиография. ЭКГ позволяет оценить влияние гиперкальциемии на работу сердца. Характерна тахикардия, интервал QТ укорочен, интервал РR удлинен.
Дифференциальная диагностика проводится с целью определения причины криза – первичный, вторичный или третичный гиперпаратиреоз, онкологическое заболевание, патология почек. Установление основного заболевания необходимо для подбора адекватной терапии. При тяжелом состоянии с поражением органов криз дифференцируют с острым приступом почечнокаменной болезни, обострением панкреатита или язвы желудка, острым психозом, пневмонией, отеком легких, гипертоническим кризом.
При тяжелом состоянии с поражением органов криз дифференцируют с острым приступом почечнокаменной болезни, обострением панкреатита или язвы желудка, острым психозом, пневмонией, отеком легких, гипертоническим кризом.
Лечение гиперкальциемического криза
Пациентов госпитализируют в отделение интенсивной терапии и реанимации. В экстренном порядке проводят мероприятия, восстанавливающие объем циркулирующей крови. Следующий этап лечения – нормализация уровня кальция. Для устранения гиперкальциемии используются следующие методы:
- Форсированный диурез. Процедуры позволяют увеличить почечную экскрецию кальция. Внутривенно капельно вводится раствор хлорида натрия изотонический, затем – раствор фуросемида. На протяжении курса лечения мониторируется уровень калия.
- Связывание кальция плазмы. При сохранности работы почек применяется метод внутривенного введения раствора цитрата натрия или натрий-калий-фосфатного буфера. Фосфаты связывают ионы кальция, снижая их концентрацию.

- Костная фиксация кальция. Осуществляется терапия кальцитонином – гормоном щитовидной железы, который стимулирует переход кальция из крови в костные ткани. Данный способ лечения безопасен для больных с почечной недостаточностью.
- Уменьшение кишечной абсорбции кальция. Для снижения экзогенной абсорбции кальция и усиления его экскреции через почки назначаются глюкокортикоиды. Они особенно эффективны при передозировке витамином D, множественной миеломе, саркоидозе.
- Терапия антагонистами ПТГ. Примером антагониста паратгормона является антибиотик митрамицин. Препарат токсичен, поэтому его применение в эндокринологии ограничено.
- Диализ. Распространены процедуры гемодиализа с бескальциевым диализатом. Особое показание для данного метода – гиперкальциемический криз, осложненный олиго- или анурией.
- Терапия НПВС. В случае, когда гиперкальциемия обусловлена резорбцией костей, вымыванием из них кальция, рекомендована терапия нестероидными противовоспалительными средствами.
 Они блокируют производство простагландинов – медиаторов деструкции кости.
Они блокируют производство простагландинов – медиаторов деструкции кости. - Хирургическая операция. При аденоме, карциноме или гиперплазии паратиреоидных желез эффективным вариантом терапии является операция. Выполняется удаление опухоли либо резекция гиперплазированной железистой ткани.
Прогноз и профилактика
Гиперкальциемический криз прогностически благоприятен при отсутствии прогрессирующей почечной дисфункции, азотемии и фосфатемии. Основные профилактические меры – своевременная диагностика и адекватное лечение гиперпаратиреоза, онкологических заболеваний, почечной недостаточности. Лицам из групп риска необходимо контролировать поступление кальция – не использовать всасывающиеся антацидные средства, только по назначению врача принимать витамин D, тиазидные диуретики, препараты магния и лития.
Миастения. Клинические рекомендации.
Оглавление
Ключевые слова
-
Антихолинэстеразные препараты
-
Глюкокортикостероидные препараты
-
Миастения
-
Миастенический криз
-
Холинергический криз
-
Смешанный криз
-
Тимэктомия
-
Человеческий иммуноглобулин для внутривенного введения
-
Патологическая мышечная утомляемость
-
Нарушение нервно-мышечной передачи
-
Прозериновая проба
-
Декремент-тест
-
Программа терапии
-
Оценка эффекта проводимой терапии
-
Критерии оценки качества медицинской помощи
Список сокращений
АХР – ацетилхолиновые рецепторы
КТ – компьютерная томография
МРТ – магнитно-резонансная томография
QMGS — количественная шкала оценки тяжести миастении
MGFA – американская ассоциация по изучению миастении
РИА – радиоиммунный анализ
ИФА – иммуноферментный анализ
АД – артериальное давление
ЧД – частота дыхания
КОС – кислотно-основное состояние
ГОМК – гамма-окси-масляная кислота
ЖЕЛ – жизненная емкость легких
МОВ – минимальный объем вдоха
ДО – дыхательный объем
БАС – боковой амиотрофический склероз
ИВЛ – искусственная вентиляция легких
М – миастения
ЭМГ – электромиография
Ig – иммуноглобулин
MuSK – мышечная специфическая киназа
RyR – рианодиновые рецепторы
Термины и определения
-
Состояние — изменения организма, возникающие в связи
с воздействием патогенных и (или) физиологических факторов и требующие
оказания медицинской помощи; -
Инструментальная диагностика – диагностика с использованием для обследования больного различных приборов, аппаратов и инструментов.

-
Лабораторная диагностика — совокупность методов, направленных на анализ исследуемого материала с помощью различного специализированного оборудования.
-
Миастенический криз — это внезапно развившееся
критическое состояние у больных М, которое свидетельствует не только о
количественном, но и о качественном изменении характера процесса.
Патогенез криза связан не только с уменьшением плотности
холинорецепторов постсинаптической мембраны вследствие
комплемент-опосредованного их разрушения, но и с изменением
функционального состояния оставшихся рецепторов и ионных каналов. -
Холинергический криз — это состояние, имеющее особый
механизм развития, обусловленный избыточной активацией никотиновых и
мускариновых холинорецепторов вследствие передозировки
антихолинестеразными препаратами.
-
Смешанный криз — это самый тяжелый вариант витальных
нарушений у больных М., при котором больной нуждается в немедленном
приеме антихолинэстеразных препаратов, а с другой – он не переносит эти
препараты, и состояние его ухудшается на фоне их приема. -
Уровень достоверности доказательств – отражает степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным.
-
Уровень убедительности рекомендаций
– отражает не только степень уверенности в достоверности эффекта
вмешательства, но и степень уверенности в том, что следование
рекомендациям принесет больше пользы, чем вреда в конкретной ситуации.
1. Краткая информация
1.1 Определение
Миастения (М), myasthenia gravis, болезнь Эрба-Гольдфлама —
классическое, аутоиммунное заболевание, клинические проявления которого в
виде слабости и патологической мышечной утомляемости обусловлены
явлениями аутоагрессии с образованием антител, направленных к различным
антигенным мишеням периферического нейромоторного аппарата [8,10].
1.2 Этиология и патогенез
При миастении антитела и аутореактивные Т-клетки поражают антигенные
мишени полипептидной природы, расположенные на постсинаптической
мембране и в мышечной клетке. К ним относятся мышечный ацетилхолиновый
рецептор (АХР), мышечно-специфическая тирозинкиназа (MuSK), рианодиновый
рецептор (RyR), титин-протеин и др. В последние годы также обнаружены
антитела к некоторым цитокинам, ганглиозидам миелина нервной ткани и
другим белковым структурам [2,6,8,10,25].
1.3 Эпидемиология
В настоящее время распространённость заболевания составляет 10
человек на 100 000 населения. Миастения может дебютировать в любом
возрасте, начиная с раннего детства и заканчивая глубокой старостью.
Средний возраст начала болезни у женщин — 26 лет, у мужчин — 31 год.
Соотношение мужчин и женщин среди заболевших составляет 1:3 [8,20,25].
1.4 Кодирование по МКБ-10
G70.0 – Myasthenia gravis.
G70.2 – Врожденная или приобретенная миастения.
1.5 Классификация
-
Генерализованная миастения.
-
Миастения новорождённых.
-
Врождённая миастения.
-
Доброкачественная миастения с офтальмопарезом или офтальмоплегией.
-
Семейная детская миастения.
-
Юношеская миастения.
-
Генерализованная миастения взрослых:
-
лёгкая;
-
тяжёлая;
-
острая молниеносная;
-
поздняя тяжёлая;
-
с развитием мышечных атрофий.
-
-
Глазная миастения:
-
юношеская;
-
взрослая.
-
Комментарии: при дифференциации различных форм
миастении также используют широкий спектр клинических,
электрофизиологических и иммунологических критериев, позволяющих выявить
подгруппы (подклассы) заболевания, например, такие, как миастения,
сочетающаяся с тимомой, миастения с ранним и поздним началом без тимомы,
серонегативная миастения.
2. Диагностика
2.1 Жалобы и анамнез
-
Рекомендовано получить данные о наличии или отсутствии в ближайшем
прошлом кратковременных эпизодов слабости и утомляемости полностью или
частично регрессировавших самопроизвольно или на фоне неспецифического
лечения. В 90% случаев эти эпизоды связаны с вовлечением экстраокулярной
мускулатуры и проявлялись диплопией и птозом век. Значительно реже это
эпизоды бульбарных расстройств или слабости туловищной мускулатуры
[8,20].
Уровень убедительности – С (уровень достоверности – 3)
-
Рекомендовано получить данные о наличие или отсутствие у
родственников нервно-мышечных, аутоиммунных и онкологических заболеваний
[22,40].
Уровень убедительности – С (уровень достоверности – 3)
-
Рекомендовано получить данные о наличие или отсутствие признаков
опухоли переднего средостения, выявленных при рентгенографии, КТ или МРТ
[8,40,44].
Уровень убедительности – С (уровень достоверности – 3)
Комментарии: однако, сам факт наличия
образования в средостении никоим образом не свидетельствует о наличии М и
не может являться критерием диагностики
2.2 Физикальное обследование
-
Рекомендовано использование для оценки степени выраженности
двигательных расстройств шкалу, предложенную Szobor A. (1976) [8, 16,
18].
Уровень убедительности – A (уровень достоверности – 2а)
Комментарии: удобство настоящей шкалы состоит в
том, что, несмотря на значительную субъективность оценки степени
снижения мышечной силы она не требует значительных временных затрат и
легко воспроизводима одним и тем же исследователем при проведении
функциональных (физическая нагрузка) и фармакологических (введение
неостигмина метилсульфата) проб. Использование этой шкалы позволяет
выявить преимущественность поражения отдельных мышечных групп у больных с
различными клиническими формами миастении. К существенным недостаткам
шкалы относится невозможность объективной оценки степени выраженности
глазодвигательных, бульбарных и дыхательных нарушений.
-
Рекомендовано для объективной оценки тяжести клинических проявлений миастении использование количественной шкалы (QMGS), предложенной Barohn R.J. et al., (1998) [8,17].
Уровень убедительности – A (уровень достоверности – 2а)
Комментарии: существенным преимуществом QMGS
является большая объективность оценки выраженности двигательных
расстройств, которая не зависит от силы исследователя. Применение этой
шкалы позволяет оценить важный клинический симптом – мышечную
утомляемость. Безусловно, оценка слабости мимической мускулатуры и
нарушений речи не лишена элементов субъективизма, тем не менее,
совокупность получаемой клинической информации достаточно высока.
Недостатком данной шкалы является невозможность оценки
преимущественности поражения отдельных мышечных групп и значительно
большее время необходимое для проведения рекомендуемых тестов.
-
Рекомендовано применение оценочной шкалы MGFA, предложенной Barohn R.J., (1996) [8,18].
Уровень убедительности – B (уровень достоверности – 3)
Комментарии: Существенным достоинством MGFA
является возможность анализа выраженности двигательных расстройств с
оценкой преимущественности и степени вовлечения в патологический процесс
экстраокулярной, бульбарной и туловищной мускулатуры. К числу
недостатков наиболее целесообразно отнести отсутствие информации о
степени возможной компенсации на фоне введения антихолинэстеразных
препаратов. Вместе с тем следует подчеркнуть, что использование шкалы
существенно облегчает формулировку диагноза. Например, Миастения (1) –
Миастения, глазная форма, или Миастения (3А) – Миастения,
генерализованная форма средней степени тяжести с преимущественным
поражением мышц туловища и конечностей.
2.3 Лабораторная диагностика
-
Рекомендовано исследования сыворотки крови для определения уровня аутоантител к АХР (РИА) [6,26,29,35].
Уровень убедительности – A (уровень достоверности – 1b)
-
Рекомендовано изучение уровня аутоантител к титин-белку (ИФА) [8,16,22],.
Уровень убедительности – A (уровень достоверности – 2b)
Комментарии: наиболее показательно у больных М
сочетающейся с тимомой, у которых повышение этого показателя отмечено в
78% случаев, также как у больных с поздним началом М без тимомы (84%). У
больных с ранним началом М без тимомы при длительном и тяжелом течении
заболевания увеличение уровня антител к титин-белку отмечено в 41%
случаев.
-
Рекомендовано для больных миастенией, сочетающейся с тимомой,
исследование уровня антител к рианодиновым рецепторам (RyR)
саркоплазматического ретикулума [16,25].
Уровень убедительности – A (уровень достоверности – 2b)
Комментарии: увеличение титра антител к рианодиновым рецепторам выявляется у 35% больных и свидетельствует о тяжести течения миастении.
-
Рекомендовано исследование аутоантител к мышечной специфической тирозинкиназе – MusK (РИА) [6,8,15,25,35].
Уровень убедительности – A (уровень достоверности – 2a)
Комментарии: исследование показательно у 40-50% больных с серонегативной миастенией
2.4 Инструментальная диагностика
-
Рекомендовано исследование нервно-мышечной передачи, определяемое
посредством электрофизиологического исследования изменений вызванных
электрических ответов мышцы (М-ответов) при ее непрямой
супрамаксимальной стимуляции различными частотами – повторная стимуляция
или так называемый декремент-тест [8,28,30,31].
Уровень убедительности – A (уровень достоверности – 1a)
Комментарии: многообразие клинических форм М и
других заболеваний нервно-мышечного синапса, избирательность и
неравномерность вовлечения в патологический процесс различных мышечных
групп не предполагает понятия «стандартная для исследования мышца».
Нельзя при «кранио-бульбарной» форме М исследовать клинически не
пораженную дельтовидную мышцу, а по отсутствию нарушений нервно-мышечной
передачи в круговой мышце глаза, которая относится к мимическим, а не к
экстраокулярным мышцам – исключить глазную форму болезни – это приведет
к диагностическим ошибкам. Между тем, точное выявление клинически
пораженной мышцы и ее исследование, позволяет поставить правильный
диагноз. В то же время, для объективизации нарушений нервно-мышечной
передачи важно не только уметь правильно выбрать мышцу и владеть
методикой ее тестирования, необходимо знать и основные
электрофизиологические параметры нервно-мышечной передачи в норме и при
различных формах патологии синапса.
-
Рекомендовано проведение КТ переднего средостения [8,9,50].
Уровень убедительности – A (уровень достоверности – 2a)
2.5 Иная диагностика
-
Рекомендовано проведение пробы с введением антихолинэстеразных препаратов [1,2,8,12,15,22,24,30,39].
Уровень убедительности – A (уровень достоверности – 1a)
Комментарии: неостигмина метилсульфата 1,5 мл
0,05% раствора или галантамина в дозе 10 мг вводят подкожно или при весе
больного 50-60 кг, в дозе 2,0 мл или 20 мг при весе 60-80 кг
соответственно и 2,5 мл или 30 мг при весе от 80 до 100 кг. У детей доза
препаратов составляет 1,0 мл или 5 мг соответственно. При возникновении
мускариновых эффектов антихолинэстеразных препаратов после оценки
эффективности теста вводят с атропин в дозе 0,2–0,5 мл 0,1% раствора.
Оценка теста проводится в интервале от 40 минут до 1,5 часов после
введения препарата.
Изучение эффективности пробы с введением антихолинэстеразных
препаратов показало, что полная компенсация двигательных нарушений
выявляется только у 15% больных М. Необходимо обратить внимание, что
полная компенсация предполагает восстановление силы мышцы до нормальных
значений (5 баллов), независимо от степени ее исходного снижения. У
большинства больных М (75%), реакция на введение неостигмина
метилсульфата была неполной, т.е. сопровождалась увеличением силы мышцы
на 2-3 балла, но не достигала 5 баллов. Частичная компенсация
характеризовалась увеличением силы на 1 балл в отдельных мышцах, тогда
как в других тестируемых мышцах не изменялась.
При проведении и оценке фармакологического теста решающее
значение имеет доза вводимого препарата, поскольку только при введении
адекватных доз правомочна та или иная оценка эффективности пробы.
В основе оценки лежит изменение выраженности клинических
симптомов. При полной и неполной компенсации двигательных нарушений
проба оценивается как позитивная. При частичной компенсации –
сомнительная, при отсутствии – негативная.
Важно подчеркнуть то обстоятельство, что фармакологический тест с
введением антихолинэстеразных препаратов является одним из наиболее
значимых критериев диагностики М.
2.6 Диагностика острых состояний (кризов) при миастении
-
отдельные периоды течения М могут возникать внезапные нарушения
витальных функций, называемые «кризами». Эти состояния наблюдаются у
10-15% больных миастенией. Различают миастенический и холинергический
кризы. Имеющиеся диагностические трудности их дифференциации обусловлены
тем обстоятельством, что чаще всего они развиваются параллельно в виде
смешанного криза. Несмотря на сходство клинической картины
миастенического и холинергического кризов, патогенетические механизмы их
развития отличаются и соответственно, лечение этих состояний требует
разных подходов.
Дифференциация кризов при М базируется на оценке эффективности пробы с введением адекватной дозы неостигмина метилсульфата:
-
При миастеническом кризе проба позитивная, причем полная компенсация
двигательного дефекта по нашим данным отмечается у 12%, а неполная — у
88% больных. -
При холинергическом кризе проба негативная, однако, у 13% больных может наблюдаться частичная компенсация.
-
Наиболее часто (в 80% случаев) частичная компенсация наблюдается при
смешанном характере криза, а в 20% случаев отмечается неполная
компенсация.2.7 Дифференциальная диагностика
Теоретически дифференциальный диагноз М очень сложен, поскольку
существует много заболеваний, при которых может иметь место поражение
мышц иннервируемых черепными нервами, а также слабость мышц туловища и
конечностей. С другой стороны клиническая дифференциация М не вызывает
трудностей, поскольку для подтверждения диагноза существуют
фармакологический, электрофизиологический и иммунологический критерии.
Наиболее часто ошибочная постановка диагноза М связана с наличием
птоза и различной степенью выраженности глазодвигательных расстройств.
Следует отметить, что постановка диагноза глазной формы М вызывает
наибольшие трудности. Это связано с тем, что клинические проявления
нарушения функции экстраокулярной мускулатуры могут быть выражены
минимально, реакция на введение неостигмина метилсульфата недостаточной,
патологии нервно-мышечной передачи при исследовании не экстраокулярных,
а анатомически наиболее близких мимических мышц не выявляется, а
антитела альфа субъединице АХР могут выявляться только в 30- 50%
случаев. В ряду дифференциальной диагностики могут быть следующие
болезни, проявляющиеся поражением экстраокулярной мускулатуры:
эндокринная офтальмопатия, совокупность синдромов определяемых как
«офтальмоплегия плюс», окулофарингеальная мышечная дистрофия, рассеянный
склероз, синдром Фишера и др.
Бульбарные проявления М следует дифференцировать с сосудистыми и
опухолевыми поражениями мозга, где главным отличием является
выраженность общемозговых симптомов, а также отсутствие динамичности
симптомов и реакции на введение антихолинэстеразных препаратов.
Иногда значительные трудности дифференциации может представлять
боковой амиотрофический склероз (БАС) в некоторых случаях которого могут
отмечаться не только большинство клинических симптомов М, но и наличие
нарушений нервно-мышечной передачи и реакции на введение
антихолинэстеразных препаратов. В таких случаях только ЭМГ исследование
позволяет выявить признаки денервации и реиннервации, а также наличие
большого числа потенциалов фасцикуляций, характерных для БАС.
Дыхательные расстройства и кризы при М следует дифференцировать с
острыми демиелинизирующими невропатиями типа Гийена-Барре, при которых
имеет место арефлексия, нарушение состава спинномозговой жидкости,
отсутствие нарушений нервно-мышечной передачи и реакции на введение
антихолинэстеразных препаратов.
Слабость мышц туловища и конечностей у больных М дифференцируют с
различными формами врожденных и приобретенных миопатий. Миопатический
процесс, как правило, характеризуется иным, отличным от миастении,
характером распределения двигательных расстройств: отсутствием (за
редким исключением) признаков поражения экстраокулярной и бульбарной
мускулатуры, дыхательных нарушений; чаще сопровождается снижением или
отсутствием сухожильных рефлексов, наличием различной степени
выраженности мышечных атрофий.
Клинические симптомы, напоминающие М, могут встречаться и при других
формах нарушения нервно-мышечной передачи, таких как синдром
Ламберта-Итона и ботулизм. Причем если для синдрома Ламберта-Итона не
типичны эктраокулярные, бульбарные и дыхательные нарушения, то именно
они составляют основное клиническое ядро ботулизма. Характерные для
синдрома Ламберта-Итона слабость и утомляемость мышц туловища и
конечностей при ботулизме выявляются относительно редко. Для обеих форм
характерна гипо- или арефлексия. Эффект от введения антихолинэстеразных
препаратов при синдроме Ламберта-Итона – минимальный, при ботулизме –
отсутствует. Нарушения нервно-мышечной передачи характеризуются
снижением исходной амплитуды М-ответа и ее существенным увеличением в
процессе высокочастотной стимуляции (инкремент) или после максимального
произвольного усилия.
Таким образом, главным и основным отличием, при дифференциации всех
клинических проявлений М от других форм патологии, является отсутствие
динамичности симптомов и реакции на введение антихолинэстеразных
препаратов.
3. Лечение
Сохраняют
свою актуальность различные методы лечения М, медикаментозные и
хирургические. Каждый из методов преследует определенные цели и является
наиболее целесообразным на том или ином этапах развития болезни. Важно
подчеркнуть, что многообразие клинических форм заболевания: особенности
возраста, характер течения, степень компенсации антихолинэстеразными
препаратами, наличие или отсутствие патологии тимуса, особенности
иммунного ответа (серопозитивная и серонегативная) М определяют
стратегию и тактику лечения.
В основу стратегии лечения миастении положены следующие принципы:
1) Этапность лечебных мероприятий;
2) Сочетания компенсирующей, патогенетической и неспецифической терапии;
3) Лечение хронической и острой (кризы) фаз течения заболевания.
3.1 Консервативное лечение
Уровень убедительности – A (уровень достоверности – 1a)
-
Рекомендованы препараты калия: калия хлорид обычно
назначается в порошках по 1,0 г 3 раза в сутки. Порошок растворяют в
стакане воды или сока и принимают во время еды. Калия хлорид в таблетках
принимают перорально в суммарной дозе 3 г в сутки [1,8,22].
Уровень убедительности – B (уровень достоверности –3)
-
Рекомендованы спиронолактоны. Препараты принимают внутрь в дозе 0,025 – 0,05 г 3-4 раза в день [8,20].
Уровень убедительности – B (уровень достоверности –3)
Комментарии: способность препаратов задерживать
калий в клетках служит основанием для широкого их применения при лечении
миастении. Относительно противопоказаны в первые 3 месяца беременности.
-
Рекомендованы 4-аминопиридины (ипидакрин) обладает
небольшим антихолинэстеразным эффектом и активируют процессы
освобождения ацетилхолина из нервной терминали. Принимают в дозе 20 мг
2-4 раза в день иногда в сочетании с антихолинэстеразными препаратами
{8,30,48].
Уровень убедительности – B (уровень достоверности –3)
-
3.1.2 Рекомендовано лечение глюкокортикоидными препаратами [1,4,8,15,22,40,48].
Уровень убедительности – A (уровень достоверности –1a)
Комментарии: эффективность глюкокортикоидных
препаратов при лечении М достигает по отдельным данным 80% случаев.
Из-за относительно быстрого наступающего терапевтического действия они
используются как первоочередное лечение у больных с витальными
нарушениями, являются препаратами выбора при начале заболевания с
бульбарных нарушений, а также при глазной форме миастении.
В настоящее время наиболее оптимальной терапией является прием
глюкокортикоидных препаратов по схеме через день, одномоментно всю дозу,
утром. Доза преднизолона** (метилпреднизолона**) у пациентов с
миастенией основывается на индивидуальной оценке тяжести состояния
больного. В среднем дозировка определяется из расчета 1 мг на 1 кг массы
тела преднизолона, или 0.8 мг на 1 кг массы тела метилпреднизолона,
однако не должна быть менее 50 мг. Учитывая действие глюкокортикоидных
препаратов на вегетативную нервную систему (сердцебиение, тахикардия,
потливость), первый прием препарата составляет половинную дозу. Затем, в
случае хорошей переносимости, переходят на терапевтическую дозу. Эффект
лечения оценивают через 10-15 приемов. Однако первые несколько приемов
некоторые пациенты могут отмечать эпизоды ухудшения состояния в виде
нарастания мышечной слабости и утомляемости. Возможно, что эти эпизоды
не случайны, а связаны с прямым действием глюкокортикоидных препаратов
на процессы освобождения синаптического передатчика и способствуют
десенситизации рецепторов. Это обстоятельство диктует необходимость
возможного уменьшения на некоторое время дозы антихолинэстеразных
препаратов, а также осторожности при назначении глюкокортикоидных
препаратов больным с миастенией (желательное начало терапии в условиях
стационара). По мере достижения эффекта и улучшения состояния больных,
доза препарата постепенно снижается по 1/2 таб. на каждый прием, и
пациент постепенно переходит на поддерживающие дозы. На фоне приема
поддерживающих доз глюкокортикоидных препаратов, больные могут
находиться в состоянии медикаментозной ремиссии в течение многих лет.
В случаях недостаточной эффективности, выявления побочных эффектов
глюкокортикоидной терапии или необходимости уменьшить дозу
глюкокортикоидных препаратов целесообразно назначение цитостатических
препаратов.
-
Рекомендован прием азатиоприн** [8,30,31,44].
Уровень убедительности – A (уровень достоверности –2a)
Комментарии: Азатиоприн обычно хорошо
переносится и эффективен у 70-90% больных М. По сравнению с
преднизолоном. Азатиоприн действует более медленно, клинический эффект
его появляется только через 2-3 месяца, однако у препарата отмечено
меньше побочных эффектов. Азатиоприн может использоваться в качестве
монотерапии, а также в сочетании с глюкокортикоидными препаратами, когда
действие последних является неэффективным или, когда из-за развития
побочных эффектов необходимо снижение дозы глюкокортикоидных препаратов.
Азатиоприн назначается перорально ежедневно с дозы 50 мг в день с
последующим увеличением ее до 150-200 мг в сутки.
Уровень убедительности – B (уровень достоверности –2b)
Комментарии: препарат
хорошо переносится больными и эффективен у 60-70% больных М. По
сравнению с азатиоприном действует более быстро, клинический эффект его
появляется через 3-4 недели, у препарата отмечено значительно меньше
побочных эффектов. Однако в качестве монотерапии эффективен недостаточно
и используется для снижения дозы глюкокортикоидных препаратов при
развития побочных эффектов стероидной терапии. Микофеналата мофетил
назначается перорально ежедневно в дозе 2 г в день с последующей
коррекцией дозы в зависимости от эффективности лечения.
-
Рекомендован прием циклоспорина** [8,16,19,5,30].
Уровень убедительности – A (уровень достоверности –2a)
Комментарии: циклоспорин успешно применяется при
лечении тяжелых форм М, в случаях резистентности к другим видам
иммунокоррекции. Эффект циклоспорина практически не зависит от
предшествующей терапии, он с успехом используется в лечении
стероидозависимых пациентов, а также у больных миастенией с инвазивными
тимомами. Преимущества циклоспорина заключаются в его более
избирательном (по сравнению с другими иммуносупрессантами) воздействии
на отдельные механизмы иммунного ответа, отсутствии подавления всей
иммунной системы больного. Циклоспорин назначается перорально, с
начальной дозы 3 мг на 1 кг массы тела. Затем, при отсутствии
токсических реакций, доза препарата может быть увеличена до 5 мг на 1 кг
веса 2 раза в день. Улучшение отмечается у большинства больных через
1-2 месяца от начала терапии и достигает максимума к 3-4 месяцам. После
достижения стойкого терапевтического эффекта доза циклоспорина может
быть снижена до минимума, а контроль эффективности лечения
осуществляется на основе оценки клинического статуса и концентрации
препарата в плазме.
-
3.1.4 Рекомендовано внутривенное ведение иммуноглобулинов G 5% и 10% [8,22,29,40,49].
Уровень убедительности – A (уровень достоверности –2a)
Комментарий: внутривенное ведение
иммуноглобулинов G 5% и 10% может вызывать быстрое временное улучшение
течения М. Человеческий иммуноглобулин представляет собой иммуноактивный
белок. Применение высоких доз иммуноглобулинов обладает способностью
подавлять иммунные процессы.
Общепринятым режимом терапии считаются короткие (пятидневные
курсы) внутривенного введения препарата в дозе 400 мг на 1 кг массы тела
ежедневно. В среднем клинический эффект наступал на 4-й день от начала
лечения и продолжался в течение 50-100 дней после окончания курса. Через
3-4 мес. возможен повторный курс терапии иммуноглобулинами. Побочные
эффекты проявляются в виде повышения температуры тела (4%), тошноты
(1.5%), головной боли (1.5%). Большинство из этих явлений проходило
после уменьшения скорости введения препарата, или после временного
прекращения инфузии. По имеющимся данным, эффективность лечения
иммуноглобулинами составляет 70-80% случаев.
Уровень убедительности – C (уровень достоверности –3)
Комментарий: антиоксидантные свойства препаратов
тиоктовой кислоты дают основание для применения их у больных
миастенией. Препараты тиоктовой кислоты способствуют активации
митохондриального синтеза. Кроме того, они уменьшают выраженность
окислительного стресса у больных, находящихся в состоянии
миастенического и холинергического кризов, путем снижения содержания в
крови свободных радикалов, способствующих повреждению клеточных и
митохондриальных мембран во время ишемии. Лечение следует начинать с
внутривенного капельного введения в количестве 600 – 900 мг/сутки с
дальнейшим переходом на пероральный прием в той же дозировке.
3.2 Хирургическое лечение
-
Рекомендовано проведение тимэктомии [6,8,15,19].
Уровень убедительности – A (уровень достоверности –2b)
При хорошей эффективности препаратов используемых на первом этапе, но
сохраняющихся легких бульбарных нарушениях на фоне суточной отмены
пиридостигмина бромид показано проведение тимэктомии.
Возможные механизмы благоприятного влияния тимэктомии на течение
миастении связаны с 1) удалением источника антигенов по отношению к
ацетилхолиновым рецепторам, обнаруженных в миоидных клетках тимуса,
которые способны провоцировать выработку иммунных тел; 2) удалением
источника антител к ацетилхолиновым рецепторам; 3) удалением источника
ненормальных лимфоцитов. Эффективность тимэктомии в настоящее время
составляет 50-60%. Результатом операции может являться клинически полное
выздоровление (эффект А), стойкая ремиссия при значительном уменьшении
дозы антихолинэстеразных препаратов (эффект В), Незначительное улучшение
состояния на фоне прежнего количества антихолинэстеразных препаратов
(эффект С), отсутствие улучшения состояния (эффект D).
Комментарии: показаниями к тимэктомии являются
наличие опухоли вилочковой железы (тимома), вовлечение в процесс
краниобульбарной мускулатуры, а также прогрессирующее течение миастении.
У детей тимэктомия показана при генерализованной форме болезни, плохой
компенсации нарушенных функций в результате медикаментозного лечения и
при прогрессировании болезни.
Тимэктомия должна проводиться в отделениях грудной хирургии, наиболее часто применяется видеоторокоскопический доступ.
Противопоказаниями к тимэктомии являются тяжелые соматические
заболевания пациентов, а также острая фаза миастении (выраженные, не
компенсированные бульбарные нарушения, а также нахождение больного в
кризе). Тимэктомия нецелесообразна у больных, длительно страдающих
миастенией при стабильном ее течении, а также у больных с отсутствием
антител к АХР (серонегативной) и при локальной глазной формах М.
Как правило, в 80% случаев подготовка к хирургическому лечению
осуществляется назначением глюкокортикоидных препаратов, и только по
достижении клинического эффекта лечения проводится операция. При тяжелых
формах М в качестве подготовки к операции наряду с глюкокортикоидными
препаратами, может быть проведено несколько сеансов плазмафереза или
внутривенных капельных введений больших доз человеческого
иммуноглобулина. Проведение хирургического лечения без предшествующей
подготовки возможно только у больных с легкой формой генерализованной М,
во всех остальных случаях, т.е. без предшествующей подготовки
тимэктомия может приводить к ухудшению состояния с развитием
криза.
3.3 Иное лечение
-
Рекомендовано проведение плазмафереза [8,33,39,45].
Уровень убедительности – A (уровень достоверности –2a)
Комментарии: плазмаферез считается наиболее
эффективным лечебным мероприятием при развитии миастенических и
холинергических кризов. Метод плазмафереза основан на заборе крови из
локтевой или одной из центральных вен с последующим центрифугированием
ее, отделением форменных элементов и заменой плазмы либо на донорскую,
либо на искусственную плазму. Эта процедура приводит к быстрому — иногда
в течение нескольких часов — улучшению состояния больных. Возможно
повторное извлечение плазмы в течение нескольких дней или через день.
Уровень убедительности – B (уровень достоверности –3)
Комментарий: гамма терапия области тимуса
применяется у тех пациентов, которым в силу определенных обстоятельств
невозможно провести тимэктомию, а также как метод комплексной терапии
после удалении тимомы (особенно в случаях инфильтративного роста опухоли
в расположенные рядом органы). Суммарная доза курса гамма-облучения
выбирается индивидуально в каждом конкретном случае, составляя, в
среднем, 40-60 Грей. Лучевая терапия у ряда больных может осложняться
развитием лучевого дерматита, пневмонита, развитием фиброзных изменений
клетчатки переднего средостения, что требует прекращения процедур.
3.4 Лечение кризов
По современным представлениям, патофизиологические механизмы развития
кризов при миастении связаны с различными вариантами изменения
плотности и функционального состояния холинорецепторов вследствие их
аутоиммунного поражения. В соответствии с этим, лечение кризов должно
быть направлено на компенсацию нарушений нервно-мышечной передачи и
коррекцию иммунных расстройств.
-
Рекомендовано проведение ИВЛ [8,20,31,43].
Уровень убедительности – A (уровень достоверности –2b)
Комментарии: в каждом конкретном случае вопрос о
переводе пациента на ИВЛ решается на основании данных клинической
картины (нарушение ритма и глубины дыхания, цианоз, возбуждение, потеря
сознания, участие в дыхании вспомогательной мускулатуры, изменение
величины зрачков, отсутствие реакции на введение антихолинэстеразных
препаратов и др.), а также объективных показателей, отражающих газовый
состав крови, насыщение гемоглобина кислородом, кислотно-основное
состояние (КОС) и др. (ЧД — свыше 40 в 1 мин., ЖЕЛ менее 15 мл/кг, РаО2
ниже 60 мм. рт. ст., РаСО2 выше 60 мм. рт. ст., рН около 7,2, НbО2 ниже
70-80%).
Собственный опыт и данные, имеющиеся в литературе, показывают,
что иногда бывает достаточным проведение ИВЛ и лишение больного
антихолинэстеразных препаратов на 16 – 24 часа для прекращения
холинергического и смешанного кризов. В этой связи, ИВЛ вначале может
проводиться через интубационную трубку, и только при затянувшихся
нарушениях дыхания в течение 3 – 4 дней и более показано наложение
трахеостомы в связи с опасностью развития пролежня трахеи. В период проведения искусственной вентиляции полностью исключается введение антихолинэстеразных препаратов, проводится интенсивное лечение интеркуррентных заболеваний и патогенетическое
лечение миастении. Через 16 – 24 часа после начала ИВЛ, при условии
ликвидации клинических черт холинергического или смешанного кризов,
следует провести пробу с введением неостигмина метилсульфата. При
положительной реакции на введение пиридостигмина бромид или неостигмина
метилсульфата можно прервать ИВЛ и, убедившись в возможности адекватного
дыхания, перевести больного на прием пероральных антихолинэстеразных
препаратов. При отсутствии положительной реакции на введение
антихолинэстеразных препаратов необходимо продолжить ИВЛ, повторяя пробу
с введением пиридостигмина бромид или неостигмина метилсульфата через
каждые 24-36 часов.
Проведение ИВЛ требует тщательного контроля работы респираторов,
особого ухода за больными, своевременного применения мер по профилактике
возможных осложнений.
-
Рекомендовано проведение плазмафереза [8,33,39,45].
Уровень убедительности – A (уровень достоверности –2a)
-
Рекомендовано внутривенное ведение иммуноглобулинов G 5% и 10% [8,22,29,40,49].
Уровень убедительности – A (уровень достоверности –2a)
Уровень убедительности – C (уровень достоверности –3)
-
Рекомендованы антихолинэстеразные препараты [1,8,20,23,25,27].
Уровень убедительности – A (уровень достоверности – 1a)
4. Реабилитация
Противопоказания при миастении
Чрезмерные физические нагрузки, препараты магния, курареподобные
миорелаксанты, нейролептики и транквилизаторы (кроме грандаксина), ГОМК,
мочегонные (кроме спиронолактонов), антибиотики фторхинолонового ряда,
аминогликозиды, стрептомицины, а тетрациклин — под наблюдением врача,
фторсодержащие кортикостероиды, производные хинина, D-пеницилламин.
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1 Беременность и роды при миастении
М не является заболеванием, передающимся по наследству, и потому
семья может иметь полноценных здоровых детей. Единственным ограничением
может служить тяжесть самой М, но в условиях компенсации заболевания и
это ограничение снимается. Более того, у многих женщин, больных
миастенией, во время беременности развивается ремиссия, и они либо
совсем не нуждаются в приеме антихолинэстеразных препаратов, либо
принимают минимальные дозы. Возможны некоторые ухудшения состояния на
поздних сроках беременности — 37–38 нед. Крайне редко могут возникать
ухудшения состояния, требующие прерывания беременности. Значительно
более сложным является ранний послеродовой период, в котором около 30%
женщин отмечает ухудшение течения миастении. Однако усиление
патогенетической терапии позволяет справиться и с этой проблемой.
Методы лечения миастении при беременности
-
Воздействия, направленные на компенсацию нарушений нервно-мышечной передачи.
-
Воздействия, направленные на коррекцию иммунных расстройств.
-
Глюкокортикоидные препараты (преднизолон, метилпреднизон).
-
Плазмаферез приводит к быстрому снижению концентрации антител к
холинорецепторам (проводят замещение 2–3 л плазмы 3 раза в неделю до
стойкого уменьшения слабости при отсутствии эффекта от других методов
лечения, обострении миастении, миастеническом и холинергическом кризах и
настойчивом желании женщины пролонгировать беременность). При
применении плазмафереза необходимо помнить о возможности нарушения
электролитного баланса, расстройств гемостаза, гипоальбуминемиии и т.д. -
Иммуноглобулин человеческий нормальный (Ig G) для внутривенного
введения содержит полный спектр антител. Внутривенное введение 10–30 г
иммуноглобулина с интервалом 7–10 недель проводится трижды в течение
беременности.
-
Комментарии: имеющийся в настоящее время опыт не
выявил побочных эффектов применения антихолинэстеразных препаратов в
период беременности. Доза пиридостигмина бромида определялась
клиническим состоянием пациенток и могла уменьшаться или несколько
увеличиваться в различные триместры беременности. Поскольку период
вскармливания наиболее часто сопровождается относительным ухудшением
течения миастении, а препарат попадает в материнское молоко, кормление
грудью у женщин, больных миастенией, нежелательно.
Прием глюкокортикоидных препаратов также не сказывается негативно на состоянии беременной женщины и ребенка.
Иммуносупрессанты противопоказано принимать в период
беременности. Более того, прием этих препаратов целесообразно прекратить
за несколько месяцев до планируемой беременности, поскольку они могут
обладать тератогенным эффектом.
При благоприятном течении заболевания и стойкой ремиссии
беременная женщина с миастенией приходит в женскую консультацию с
подробными рекомендациями. В случае выявления заболевания во время
беременности врачом женской консультации беременная срочно направляется
на консультацию невролога для подтверждения диагноза и коррекции
лечения.
Планируя беременность, необходимо помнить, что искусственное
прерывание беременности не рекомендуется, т.к. велика опасность
ухудшения клинических симптомов, и миастения после прерывания
беременности протекает неблагоприятно. Показанием к прерыванию
беременности считают только прогрессирующее нарастание миастенических
симптомов, не компенсируемое проводимым лечением. При вовлечении в
процесс жизненно важных функций (нарушение дыхания) – прерывание
беременности показано на любом сроке беременности по жизненным
показаниям.
6.2 Ведение родов
Роды необходимо вести через естественные родовые пути под
кардиомониторным контролем за состоянием плода, регулярной профилактикой
внутриутробной гипоксии плода, с максимальным обезболиванием
ненаркотическими анальгетиками. Введение с целью обезболивания таких
препаратов, как тримеперидин, диазепам, противопоказано.
Первый период родов у женщин с миастенией часто осложняется вторичной
слабостью родовой деятельности. Поэтому необходима готовность для
родостимуляции (внутривенное введение 5 МЕ окситоцина в разведении 400
мл физиологического раствора).
Во втором периоде родов, как правило, развивается слабость родовых
сил в связи с утомлением мышц брюшного пресса. Поэтому в конце первого
периода родов с целью профилактики слабости целесообразно начать
внутривенное капельное введение окситоцина (10–12 капель в мин.) и
дополнительно внутримышечно ввести 1,0 мл 0,05% раствора неостигмина
метилсульфата или 30 мг преднизолона. Введение окситоцина можно
продолжить и в третьем периоде родов, как профилактику кровотечения.
Родоразрешение путем операции кесарева сечения беременным с
миастенией нежелательно и может производиться только в случае
невозможности родов через естественные родовые пути по акушерским
показаниям или при резком нарастании мышечной слабости с нарушением
витальных функций. При обезболивании во время операции нельзя применять
курареподобные миорелаксанты. Предпочтительна перидуральная анестезия.
6.3 Ведение послеродового периода
Вопрос о возможности кормления грудью женщинам с легким течением
миастении рекомендуется решать индивидуально в каждом конкретном случае,
рассматривая лактацию как физическую нагрузку. Лактацию можно разрешить
родильницам в случае хорошего самочувствия, небольшого размера молочных
желез, отсутствия риска развития инфекционных заболеваний.
Родильницам с более тяжелым течением миастении показано обязательное
подавление лактации независимо от состояния и характера течения родов.
В случае оперативного родоразрешения (кесарево сечение, наложение
акушерских щипцов), осложненного течения родов (слабость родовой
деятельности и длительная родостимуляция, ручное вхождение в полость
послеродовой матки по тем или иным акушерским показаниям), наличия,
сопутствующих хронических воспалительных заболеваний и высокого риска их
обострения показано подавление лактации всем родильницам с миастенией.
У 10% детей, рожденных от матерей, больных миастенией, особенно при
тяжелом течении заболевания, возможно развитие преходящей миастении
новорожденных. При наличии неонатальной миастении у детей отмечается:
общая вялость, слабый крик, нарушение глотания и дыхания. Эти симптомы
значительно уменьшаются после введения антихолинэстеразных препаратов.
Причина миастении новорожденных связана с наличием антител к
ацетилхолиновым рецепторам, которые попали в кровь детей от больной
матери. Однако срок действия этих антител ограничен, а поскольку
собственные антитела нормальные – миастенические симптомы исчезают в
период от одной недели до одного месяца.
Лечение неонатальной миастении состоит в инъекциях 0,1–0,2 мл 0,05%
раствора неостигмина метилсульфата (в зависимости от веса ребенка) перед
каждым кормлением, а также и 30 мг преднизолона утром в инъекциях – до
полной компенсации симптомов миастении.
6.4 Прогноз
Резюмируя изложенное, следует подчеркнуть, что правильная диагностика
и своевременное назначение адекватных методов лечения приводит к
компенсации двигательных расстройств более чем у 80% больных миастенией.
Критерии оценки качества медицинской помощи
|
№
|
Критерии качества
|
Уровень достоверности доказательств
|
Уровень убедительности рекомендаций
|
|
1.
|
Выполнен тест с введением антихолинэстеразных препаратов (при постановки диагноза и/или при кризе)
|
1a
|
A
|
|
2.
|
Выполнена электронейромиография с декремент-тестом
|
1a
|
A
|
|
3.
|
Выполнена оценка тяжести клинических проявлений миастении по количественной шкале QMGS
|
2a
|
A
|
|
4.
|
|
1a
|
A
|
|
5.
|
|
2a
|
A
|
Список литературы
-
Ветшев П.С., Ипполитов Л.И., Меркулова Д.М., Животов В.А.
Хирургическое лечение тимом у больных генерализованной миастенией //
Хирургия. – 2003. – №10. – С.15-20. -
Ветшев П.С., Санадзе А.Г., Сиднев Д.В. Животов В.А. Антитела к титину
у больных с миастенической и не миастенической тимомой // Хирургия. –
2007. – №6. – С.42-48. -
Гехт Б.М. Синдромы патологической мышечной утомляемости. М. Мед. 1974. – 164 с.
-
Ланцова В.Б., Сепп Е.К. Иммунобиохимические особенности IgG антител
при миастении // Бюл. Эксперим. биол. и мед. – 2002. – Т. 133. – №6. –
С.678-680. -
Кузин М.И., Гехт Б.М. Миастения. — М.; Медицина, 1996. – 224 с.
-
Санадзе А.Г., Сиднев Д.В., Гехт Б.М., Хлебникова Н.Н., Чугунова Н.А.,
Щербакова Н.И. Антитела к ацетилхолиновому рецептору в диагностике
миастении и других форм, связанных с патологией нервно-мышечной
передачи. Неврологический журнал. – М.: Медицина. – 2003. – Т.8. –
Приложение.1. – С.19-20. -
Санадзе А.Г., Сиднев Д.В., Давыдова Т.В., Щербакова Н.И., Капитонова
Ю.А., Касаткина Л.Ф., Семятицкая Р.Н., Гильванова О.В., Мененкова Е.Ю.
Антитела к мышцам (антититиновые антитела) у больных с поздним началом
миастении: клинические и электрофизиологические корреляции //
Неврологический журнал. – Т.8. – Приложение 1. – 2003. – С. 23-26. -
Санадзе А.Г. Миастения и миастенические синдромы. М. Литера, 2012. –250 с.
-
Санадзе А.Г., Сиднев Д.В., Ветшев П.С., Ипполитов Л.И. Титин, тимома и
миастения // Журнал Нейроиммунология. – 2006. – Т.5. – №3-4. – С.23-26 -
Сиднев Д.В., Санадзе А.Г., Щербакова Н.И., Давыдова Т.В., Гильванова
О.В., Галкина О.И., Кононенко Ю.В. Антитела к мышцам (антититиновые
антитела) в диагностике миастении, сочетающейся с тимомой //
Неврологический журнал. – Т.8. – Приложение 1. – 2003. – С.21-23. -
Сиднев Д.В., Карганов М.Ю., Щербакова Н.И., Алчинова И.Б., Санадзе
А.Г. Антитела к ацетилхолиновому рецептору у больных с различными
клиническими формами миастении и миастеническим синдромом Ламберта-Итона
// Журнал неврологии и психиатрии имени С.С. Корсакова. – 2006. –
Т.106. – №1. – С.55-58. -
Харченко В.П., Саркисов Д.С., Ветшев П.С., Галил-Оглы Г.А.,
Зайратьянц О.В. Болезни вилочковой железы. – М.: Триада-Х. – 1998. – 232
с.
-
Aarli J.A., Stefansson K., Marton L., Wollmann R.L. Patient with
myasthenia gravis and thymoma have in their sera IgG autoantibodies
against titin // Clin. Exp. Immunol. – 1990. – V.82. – №.2. – P.284-288. -
Aarli J., Skeie G., Mygland A., Gilhus N. Muscle striation antibodies
in myasthenia gravis. Diagnostic and functional significance // Ann.
N.Y. Acad. Sci. – 1998. – V. 841. – P.505-515.
- Aarli J.A. Titin, thymoma, and myasthenia gravis. // Arch. Neurol. – 2001. – Jun. – V.8. – №.6. – P.869-870.
-
- Aarli J.A., Romi F., Skeie N.G. Myasthenia Gravis in Individuals over 40 //– 2003. – V.998. – P.424-431.
-
Barohn RJ. How to administer the quantitative Myasthenia Gravis Foundation of America, Inc. – 1996.
-
Barohn RJ, McIntire D, Herbelin L, Wolfe GI, Nations S, Bryan WW.
Reliability testing of the quantitative myasthenia gravis score // Ann.
N.Y. Acad. Sci. – 1998. – V.841. – P.769-772. -
Beekman R., Kuks J.B., Oosterhuis H.J. MG: diagnosis and follow-up of
100 consecutive patients // Neurol. – 1983. – V.244. – №.2. –
P.112-118. -
Buckley C., Newsom – Davis J., Willcox N., Vincent A. Do titin and
cytokine antibodies in MG patients predict thymoma or thymoma recurrence
? // J. Neurology. – 2001. – V.57. – №9. – P.1579-1582.
-
Carlson B., Wallin J., Pirskanen R. et al. Different HLA DR-DQ
assosiations in subgroups of idiopathic Myasthenia Gravis//
Immunogenetics. – 1990. – V.31. – P.285-290. -
Chen X.J., Qiao J., Xiao B.G., Lu C.Z. The significance of titin
antibodies in myasthenia gravis-correlation with thymoma and severity of
myasthenia gravis. // Neurol. – 2004. – Aug. – V. 251. – №.8. –
P.1006-1011.
-
Dhall G., Ginsburg H.B., Bodenstein L., Fefferman N.R., Greco M.A.,
Chang M.W., Gardner S. Thymoma in children: report of two cases and
review of literature // J Pediatr Hematol Oncol. – 2004. – V.26. – №10. –
P.681-685. -
Drachman D.B. Myasthenia gravis. Biology and Treatment // New-York. – 1987. – 912 p.
-
Evoli A., Batocchi A.P., Tonali P. A. Practical guide to the
recognition and management of Myasthenia gravis // J. Drugs. — 1996. –
V.52. – №.5. – P.662-670. -
Janossy G., Bofill M., Tredosiewicz L. Cellular differentiation of
lymphoid subpopulations and their microinviron // In: The Human Thymus /
Ed. H.K. M?uller-Hermelink. – 1986. – Berlin. — Springer Verlag. –
1986. – P.89-127. -
Iwasa K., Komai K., Takamori M. Spontaneous thymoma rat as model for
myasthenic weakness caused by anti-ryanodine receptor antibodies //
Muscle & Nerve. – 1998. – V.21. – P.1655-1660. -
Kondo K, Monden Y. Myasthenia gravis appearing after thymectomy for
thymoma // Eur. Cardiothorac. Surg. – 2005. –V. 28. – P. 22-25. -
Kuks J.B., Limburg P.C., Horst G., Oosterhuis H.J. Antibodies to
skeletal muscle in myastrenia gravis. Prevalence in non-thymoma patiens
// J. Neurol. Sci. – 1993. – V.120. – P.78-81. -
Kusner L.L., Mygland A., Kaminski H.J. Ryanodine receptor gene
expression thymomas // Muscle & Nerve. – 1998. – V.21. – №10. –
P.1299-1303. -
Labiet S., Kolmerer B. Titin: giant proteins in charge of muscle
ultrastructure and elasticity // J. Sci.1995. – V.270. – P.293-296. -
Lennon V.A., Ermilov L.G., Szurszewski J.H., Vernino S. Immunization
with neuronal nicotinic acetylcholine receptor induces neurological
autoimmune disease // J. Clin. Invest. — 2003. – V.111. – P.907-913. -
Lindstrom J., Lambert E.H. Content of acetylcholine receptor and
antibodies bound to receptor to myasthenia gravis, experimental
autoimmune myasthenia gravis and Eaton-Lambert syndrome // Neurol.
(Minneap.). – 1978. – V.28. – P.130-138. -
Lindstrom J. Nicotinic Acetylcholine receptors in Health and Disease
// Molecular Neurobiology. – 1997. – V.15. – №2. – Р.193-222. -
Lindstrom J. Acetylcholine receptor and myasthenia // Muscle & Nerve. – 2000. – №23. – P.453-477.
-
Luebke E., Freiburg A., Skeie G.O., Kolmerer B., Labeit S., Aarli
J.A., Gilhus N.E. Striational autoantibodies in miasthenia gravis
patients recognize I-band titin epitopes // J. Neuroimmunol. – 1988. –
V.81. – №1-2. – P.98-108. -
Marx A., Osborne M., Tzartos S., Geuder K., Shalke B., Nix W.,
Kirchner T., Muller-Hermelink H. // A striational muscle antigen and
myasthenia gravis- associated thymomas share an acetylcholine receptor
epitope // Dev. Immunol. – 1992. – V.2. – P.77-83. -
Meager A., Wadhwa M., Dilger P., Bird C., Thorpe R., Newsom-Davis J.,
Willcox N. Anti-cytokine autoantibodies in autoimmunity: preponderance
of neutralizing autoantibodies against interferon-alpha,
interferon-omega and interleukin-12 in patients with thymoma and/or
myasthenia gravis // Clin. Exp. Immunol. — 2003. – V.132. – №1. –
P.128-136. -
Mygland A., Aarli J.A., Matre R., Gilhus N.T. Ryanodine receptor
antibodies related to severity of thymomas associated myasthenia gravis
// J. Neurol. Neurosurg. Psychiatry. – 1994. – V.57. – №7. – P.843-846.
-
- Mygland A., Vincent A., Newsom-Davis J., Kaminski H., Zorzato F.,
Agius M., Gilhus N.E., Aarli J. A. Autoantibodies in Thymoma-Associated
Myasthenia Gravis With Myositis or Neuromyotonia // Arch. Neurol. –– V.57. – P.527-531.
- Mygland A., Vincent A., Newsom-Davis J., Kaminski H., Zorzato F.,
-
Muller-Hermelink H., Marx A., Geuder K., Kirchner T. The pathological
basis of thymoma-associated myasthenia gravis // Ann. N.Y. Acad. Sci. –
1994. – V.681. – P.56-65. -
Newsom-Davis J., Willcex N.,Schluep M. Et al. // In: Myasthenia
Gravis: biology and treatmen / Ed. D. Drachman. – 1987. – P.12-27. -
Ooserhuis H.J. Myasthenia gravis. – New York, 1984.
-
Poea S., Guyon T., Levasseur P., Birrin-Aknin S. Expression of
ciliary neurotrophic factor receptor in myasthenia gravis // J.
Neuroimmunol. – 2001. – V.120. – №1-2. – P.180-189. -
Rena O., Papalia E., Maggi G., Oliaro A., Ruffini E., Filosso P.,
Mancuso M., Novero D., Casadio C. World Health Organization histologic
classification: an independent prognostic factor in resected thymomas //
Lung Cancer. – 2005. – V.50. – P.59-66. -
Romi F, Gilhus NE, Varhaug JE, Myking A, Aarli JA. Disease severity
and outcome in thymoma myasthenia gravis: a long-term observation study
// Eur. J. Neurol. – 2003. – V.10. – №.6. – P. 701-706.
-
Romi F, Skeie G.O., Gilhus N.E.,Aarli J.A. Striational antibodies in
myasthenia gravis: reactivity and possible clinical significance.//
Arch. Neurol. – 2005. – V.62. – №.3. – P. 442-446. -
Romi F., Skeie G.O., Aarli J.A., Gilhus N.E. The severity myasthenia
gravis correlates with the serum concentration of titin and ryanodine
receptor antibodies // Arch. Neurol. – 2000. – V.57. – P.1596-1600. -
Roses A.D., Olanov C.W., McAdams M.W., Lane R.J.M. No direct
correlation between serum antyacetylcholine receptor antibody levels and
clinical state of individual patient with myasthenia gravis //
Neurology. – 1981. – V.31. – P.220-224. -
Sela B.A. Titin: some aspects of the largest protein in the body // Harefuah. – 2002. – V.131. – P.631-635.
-
Skeie G.O., Mygland A., Aarli J.A., Gilhus N.E. Titin antibodies in
patients with late onset myasthenia gravis: clinical correlations// J.
Autoimmun. – 1995. – V.20. – №.2. – P.99-104. -
Skeie G.O., Freiburg A., Kolmerer B., Labeit S., Aarli J.A.,
Appiah-Boadu S., Gilhus N.E. Titin transcripts in thymomas // J.
Autoimmun. – 1997. – V.10. – №6. – P.551-557. -
Skeie G.O., Lunde P.K., Sejersted O.M., Mygland A., Aarli J.A.,
Gilhus N.E. Myasthenia gravis sera containing antiryanodine receptor
antibodies inhibit binding of 3H ryanodine to sarcoplasmic reticulum. //
Muscle & Nerve. – 1998. – V.21. – №3. – P.329-335. -
Skeie G. O. Skeletal muscle titin: physiology and pathophysiology //Cell Mol. Life Sci. 2000. – V.57. – №.11. – P.1570-1576.
-
Skeie G.O., Mygland A., Treves S., Aarli J.A., Gilhus N.E., Zorzato
F.// Ryanodine receptor antibodies in myasthenia gravis: epitope mapping
and effect on calcium release in vitro// Muscle & Nerve. – 2003. —
№27 (1). – P.81-89. -
Smith C., Carlsson B., Hammarstrom L. Et al // In: Myasthenia Gravis:
biology and treatment / Ed. D. Drachman. – N.Y., – 1987. – P.816-820. -
Sund K.K., Skeie G.O., Gilhus N.E., Aarli J., Varhaug J.E. Diagnosis
of thymoma and thymic atrophy in patients with myasthenia gravis //
Tidsskr. Nor. Laegeforen. – 1997. – V. 117. – P.4212-4214. -
Tseng Y.L.,Chang J.M., Shu I.L., Wu M.H. Myasthenia gravis developed
30 months after resection of recurrent thymoma. // Eur. J. Cardiothorac.
Surg. – 2006. –V.29. – №2. – P. 268-269. -
Vernino S., Lennon V.A. Autoantibody profiles and neurological
correlations of thymoma // Clin. Cancer Res. – 2004. – V.10. – №21. –
P.7270-7275. -
Vincent A., Beeson D., Lang B. Molecular targets for autoimmune and
genetic disorders of neuromuscular transmission // Eur. J. Biochem. –
2000. – V.267. – P.6717-6728. -
Voltz R., Albrich W., Hohlfeld R., Nagel D., Wick M. et al.
Anti-titin antibodies are not associated with a specific thymoma
histology // J. Neurol. Neurosurg. Psychiatry. – 2003. – V.4. – P.282. -
Willcox N. Myasthenia gravis // Curr. Opin. Immunol. – 1993. – V.5. – P.910-917.
-
Willcox N., Schluep M., Ritter M. A., Schuurman H. J., Newsom-Davis
J., Christenson B. Myasthenic and nonmyasthenic thymoma: an expansion of
a minor cortical epithelial cell subser? // Am. J. Pathol. – 1987. –
V.127. – P. 447-460. -
Zhang W., Lie J.L., Meager A., Newsom-Davis J., Willcox N.
Autoantibodies to IL-12 in myasthenia gravis patients with thymoma;
effects on the IFN-gamma responses of healthy CD4+ T cells // J.
Neuroimmunol. – 2003. – V.139. – №1-2. – P.102-108.
Приложение А1. Состав рабочей группы
- Санадзе Александр Георгиевич, заведующий амбулаторным кабинетом для
больных миастенией ГБУЗ «ГКБ №51 ДЗМ», д.м.н., профессор. Член
Всероссийского общества неврологов. - Сиднев Дмитрий Владимирович, врач-невролог амбулаторного кабинета
для больных миастенией ГБУЗ «ГКБ №51 ДЗМ», д.м.н. Член Всероссийского
общества неврологов.
Конфликт интересов отсутствует
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- Врачи неврологи, терапевты, врачи общей практики;
- Студенты медицинских ВУЗов, ординаторы, аспиранты;
- Преподаватели, научные сотрудники.
Таблица П1 – Уровни достоверности доказательств
|
Уровень достоверности
|
Источник доказательств
|
|
I (1)
|
Проспективные рандомизированные контролируемые исследования
Достаточное количество исследований с достаточной мощностью, с
Крупные мета-анализы
Как минимум одно хорошо организованное рандомизированное контролируемое исследование
Репрезентативная выборка пациентов
|
|
II (2)
|
Проспективные с рандомизацией или без исследования с ограниченным количеством данных
Несколько исследований с небольшим количеством пациентов
Хорошо организованное проспективное исследование когорты
Мета-анализы ограничены, но проведены на хорошем уровне
Результаты не презентативны в отношении целевой популяции
Хорошо организованные исследования «случай-контроль»
|
|
III (3)
|
Нерандомизированные контролируемые исследования
Исследования с недостаточным контролем
Рандомизированные клинические исследования с как минимум 1
Ретроспективные или наблюдательные исследования
Серия клинических наблюдений
Противоречивые данные, не позволяющие сформировать окончательную рекомендацию
|
|
IV (4)
|
Мнение эксперта/данные из отчета экспертной комиссии, экспериментально подтвержденные и теоретически обоснованные
|
Таблица П2 – Уровни убедительности рекомендаций
|
Уровень убедительности
|
Описание
|
Расшифровка
|
|
A
|
Рекомендация основана на высоком уровне доказательности (как минимум 1
|
Метод/терапия первой линии; либо в сочетании со стандартной методикой/терапией
|
|
B
|
Рекомендация основана на среднем уровне доказательности (как минимум 1
|
Метод/терапия второй линии; либо при отказе, противопоказании, или
|
|
C
|
Рекомендация основана на слабом уровне доказательности (но как
нет убедительных данных ни о пользе, ни о риске)
|
Нет возражений против данного метода/терапии или нет возражений против продолжения данного метода/терапии
Рекомендовано при отказе, противопоказании, или неэффективности
|
|
D
|
Отсутствие убедительных публикаций I, II или III уровня
|
Не рекомендовано
|
Порядок обновления клинических рекомендаций – пересмотр 1 раз в 3 года
Приложение А3. Связанные документы
Данные клинические рекомендации разработаны с учётом следующих нормативно-правовых документов:
-
Приказ Минздрава России от 7 июля 2015 г. N 422ан «Об утверждении критериев
оценки качества медицинской помощи».
.
Приложение Б. Алгоритмы ведения пациента
Приложение В. Информация для пациентов
Можно ли жить нормально, болея миастенией?
Ответ на этот вопрос – безусловно, ДА! Поскольку миастения
относится к болезням, которые можно лечить, а не просто сочувствовать
больному человеку. Используемый в настоящее время комплекс лечебных
препаратов и мероприятий позволяет добиться стойкой ремиссии заболевания
и вернуть более 70% пациентов к нормальной полноценной жизни. Для
миастении характерны ремиссии, возникающие на фоне базовой терапии,
после тимэктомии или спонтанные – вообще без всякого лечения. Возможна
хорошая компенсация болезни на фоне малых или умеренных доз
антихолинэстеразных препаратов, которая не препятствует трудовой
деятельности и активному отдыху пациентов. Даже в тех случаях, когда
больные вынуждены проводить лечение поддерживающими дозами
глюкокортикоидных и иммуносупрессорных препаратов, жизнь для них не
останавливается. Семьи больных миастенией имеют здоровых детей. Женщина
сама может выносить ребенка и быть уверенной, что он будет здоров. Да,
существуют определенные ограничения, но они не столь значимы и не влияют
на качество жизни больных при условии адекватной компенсации миастении.
Приложение Г.
Шкала для оценки степени выраженности двигательных расстройств, предложенная Szobor A. (1976).
Сила мышц конечностей определяется в баллах на основании противодействия пациента усилиям исследователя где:
0 баллов — движения в мышце отсутствуют.
1 балл — есть минимальные движения в мышце, но вес конечности больной не удерживает.
2 балла — удерживает вес конечности, но сопротивление, оказываемое исследователю минимальное.
3 балла — оказывает сопротивление усилиям изменить положение конечности, но сопротивление незначительно.
4 балла — хорошо сопротивляется усилиям изменить положение конечности, но имеется некоторое снижение силы.
5 баллов — сила мышцы соответствует возрастной и конституциональной норме обследуемого.
Количественная шкала (QMGS), предложенная Barohn R.J. et al., (1998).
В данной шкале оценивают выраженность (0; 1; 2; 3) вовлечения в
патологический процесс различных мышц (глазодвигательных, бульбарных,
мимических, дыхательных, проксимальных и дистальных мышц конечностей, а
также мышц шеи).
Для выполнения исследования необходимо: наличие секундомера, динамометра, спирометра, а также ? стакана воды.
Исследование проводится на фоне предварительной отмены антихолинэстеразных препаратов.
Определяют:
-
Наличие или отсутствие, а также степень выраженности (по времени появления) диплопии при взгляде в сторону.
-
Птоза при взгляде вверх
-
Дизартрии при счете до 50
-
Слабости дельтовидной мышцы при отведении вытянутой руки в сторону в положении сидя
-
Слабости мышц шеи при подъеме головы под углом в 45 градусов в положении лежа на спине
-
Слабости проксимальных мышц ног при вытягивании прямой ноги под углом в 45 градусов в положении лежа на спине.
-
При помощи динамометра определяют слабость мышц кисти в положении сидя. Имеются нормы отдельно для мужчин и отдельно для женщин.
-
При помощи спирометра определяют жизненную емкость легких (ЖЕЛ) в процентах от нормы.
-
Определяют слабость круговой мышцы глаза
-
Нарушение глотания с использованием ? стакана воды.
Ниже приводится таблица, в которую в зависимости от времени появления
клинического симптома, силы сжатия динамометра и характеристик ЖЕЛ в
числитель вносятся показатели в секундах, килограммах или процентах, а в
знаменатель соответствующая степень тяжести от 0 до 3.
|
Предмет исследования
|
Отсутствует
|
Умеренный
|
Средний
|
Тяжелый
|
Показатель
|
|
Тяжесть (выраженность симптома)
|
0
|
1
|
2
|
3
|
|
|
Диплопия при боковом взгляде влево или вправо), секунды
|
61
|
11-60
|
1-10
|
Спонтанно
|
15/1
|
|
Птоз (взгляд верх), секунды
|
61
|
11-60
|
1-10
|
Спонтанно
|
61/0
|
|
Мышцы лица
|
Нормальное закрытие века
|
Полное, слабое, некоторое сопротивление
|
Полное, без сопротивления
|
Неполное
|
2
|
|
Глотание 1/2 чашки воды
|
нормальное
|
Минимальное покашливание или прочистка горла
|
Тяжелое кашлянье, удушье или носовая регургитация
|
Не может глотать (тест не проводится)
|
1
|
|
Разговор после счета вслух от 1 до 50 (начало дизартрии)
|
Отсутствует на 50
|
Дизартрия на 30-49
|
Дизартрия на 10-29
|
Дизартрия на 9
|
35/1
|
|
Вытягивание правой руки (90 градусов сидячее положение), секунды
|
240
|
90-239
|
10-89
|
0-9
|
50/2
|
|
Вытягивание левой руки (90 градусов сидячее положение), секунды
|
240
|
90-239
|
10-89
|
0-9
|
41/2
|
|
Жизненная емкость легких, % от должного
|
?80
|
65-79
|
50-64
|
<50
|
83/0
|
|
Динамометрия
Пр.рука, кгВ
Мужчины
Женщины
|
?45
?30
|
15-44
10-29
|
5-14
5-9
|
0-4
0-4
|
12/2
|
|
Динамометрия
Лев.рука, кгВ
Мужчины
Женщины
|
?35
?25
|
15-34
10-24
|
5-14
5-9
|
0-4
0-4
|
11/2
|
|
Подъем головы (в положении лежа на спине 45 градусов), секунды
|
120
|
30-119
|
1-29
|
0
|
60/1
|
|
Вытягивание правой ноги (в положении лежа на спине 45 градусов), секунды
|
100
|
31-99
|
1-30
|
0
|
30/2
|
|
Вытягивание левой ноги (в положении лежа на спине 45 градусов), секунды
|
100
|
31-99
|
1-30
|
0
|
35/1
|
|
Общий количественный показатель МГ (диапазон, 0-39)
|
17
|
Количественный диапазон составляет от 0 баллов (отсутствие каких-либо
глазодвигательных и бульбарных нарушений, а также мышечной слабости —
полная ремиссия), до максимально возможных 39 баллов (наибольшая
выраженность глазодвигательных и бульбарных нарушений, а также мышечной
слабости).
После обследования в крайнюю по горизонтали ячейку вносится
количественный показатель и выраженность симптома, например диплопия
-9/3 или вытягивание руки в сторону -115/1. Затем суммируется каждый
показатель выраженности симптома и подводится окончательный итог в
баллах (таблица заполнена).
Шкале тяжести клинических проявлений миастении – MGFA, предложенная Barohn R.J., (1996):
1 – изолированная слабость только окулярных мышц, во всех других мышцах сила нормальная.
2А – преобладание умеренной слабости мышц туловища, либо
проксимальных отделов конечностей, либо и того и другого. Также может
быть умеренное вовлечение в процесс бульбарной мускулатуры и слабость
окулярных мышц любой степени выраженности.
2В – преобладание умеренной слабости бульбарной и дыхательной
мускулатуры, либо и того и другого. Также может быть умеренное
вовлечение мышц туловища, либо проксимальных отделов конечностей и
слабость окулярных мышц любой степени выраженности.
3А – преобладание средней степени слабости мышц туловища, либо
проксимальных отделов конечностей, либо и того и другого. Также может
быть умеренное вовлечение в процесс бульбарной и дыхательной мускулатуры
и слабость окулярных мышц любой степени выраженности.
3В – преобладание средней степени слабости бульбарной и дыхательной
мускулатуры, либо и того и другого. Также может быть умеренное или
средней степени тяжести вовлечение мышц туловища, либо проксимальных
отделов конечностей и слабость окулярных мышц любой степени
выраженности.
4А – преобладание тяжелой степени слабости мышц туловища, либо
проксимальных отделов конечностей, либо и того и другого. Также может
быть умеренное вовлечение в процесс бульбарной и дыхательной мускулатуры
и слабость окулярных мышц любой степени выраженности.
4В – преобладание тяжелой степени слабости бульбарной и дыхательной
мускулатуры, либо и того и другого. Также может быть умеренное, среднее
или тяжелое вовлечение мышц туловища, либо проксимальных отделов
конечностей и слабость окулярных мышц любой степени выраженности.
5 – интубация с или без механической вентиляции, кроме случаев обычных послеоперационных вмешательств.
Миастенический криз: симптомы, неотложная помощь, лечение
Некоторые нервные болезни при первичном обращении пациентов врачами диагностируются достаточно сложно. К таким заболеваниям относится миастения. Первоначальные жалобы, озвучиваемые больным, на быструю усталость. Но после отдыха мышечная усталость на краткое время отступает, и больной снова чувствует себя вполне нормально.
Между тем миастения и заключается в нарушении нервно-мышечной передачи сигналов от центральной нервной системы в поперечнополосатые мышцы, из-за чего появляется ненормальная циклическая усталость после незначительной нагрузки.
Различают иммуннозависимую миастению и миастенические синдромы.
Причиной первой являются аутоиммунные заболевания, развитие синдромов обусловлено совокупностью дефектов развития: постсинаптических и пресинаптических.
Эти дефекты не что иное, как нарушения синтеза необходимых для нормальной жизнедеятельности организма веществ и дефекта органов восприятия. Вследствие патологий органических процессов нарушается функция вилочковой железы.
Толчком к запуску аутоиммунных заболеваний или нарушений биохимических процессов в организме могут быть все факторы, ослабляющие иммунный статус, а именно инфекционные болезни, стрессы или травмы.
Можно выделить следующие формы миастении:
- глазную;
- бульбарную;
- генерализованную.
Некоторые медики считают, что бульбарная миастения объединяется с глазной, и как отдельное состояние ее не классифицируют.
- Первые симптомы миастении глазной формы – поражение мышц век. Пациенты жалуются на опущение век, быструю усталость глаз, удвоение изображения.
- Затем присоединяются признаки бульбарной миастении – атрофируются глоточные мышцы, также иннервируемые черепно-мозговыми нервами.
- Нарушаются жевательные и глотательные функции, в дальнейшем будет меняться тембр голоса, пропадает способность к членораздельной речи.
- При генерализованной миастении блокируются постепенно все мышцы – сверху вниз – от шейных и лопаточных к спинным, потом поражаются мышцы конечностей. Появляется слюнотечение, больному становится трудно обслуживать себя, выполнять простейшие действия, возникает чувство слабости в конечностях.
Нарастание симптоматики может остановиться на любом этапе.
У детей заболевание не проявляется раньше полугодовалого возраста, в большинстве случаев ее диагностируют у мальчиков старше 10 лет. У них от первых симптомов – слабости мышц век – до последующих проходит до 2 лет
Во взрослом возрасте в период от 20 до 40 лет чаще заболевают женщины, а в возрасте старше 65 проявление болезни от половой принадлежности уже не зависит.
Выделяют несколько миастенических синдромов, вызванных генетическими дефектами.
Все они наследуются аутосомно-рецессивно, кроме аутосомно-доминантного синдрома, который вызывается медленным закрытием иммунных каналов:
- Синдром Ламберта-Итона чаще диагностируется у мужчин старше 40 лет. Его основные признаки – слабость проксимальных мышц конечностей при сохранении бульбарных и экстраокулярных мышц. Симптомы могут опережать клинические проявления, при физических нагрузках – занятиях спортом, слабость мышц удается купировать;
- Врожденный миастенический синдром. Признаки – нарушение симметричного движения глазных яблок и птоз век;
- Симптомы – слабость лицевых и скелетных мышц, функция сосания нарушена;
- Гипотония мышц и недоразвитие синаптического аппарата вызывает редкий миастенический синдром, при котором снижаются сухожильные рефлексы. Типичные признаки состояния – асимметрия лица, молочных желез и туловища;
- Миастенические синдромы могут вызваться приемами некоторых препаратов: D-пеницилламина и антибиотиков: аминогликозидов и полипептидов. Улучшение состояния наступает через 6-8 месяцев после отмены препарата.
Синдром, обусловленный медленным закрытием ионных канальцев, имеет следующие симптомы:
- слабость глазодвигательных мышц;
- мышечные атрофии;
- слабость в конечностях.
Лечение каждого случая миастении осуществляется по определенному алгоритму.
Могут применяться:
- кортикостероиды;
- антибиотики;
- антихолинэстазорные препараты;
- плазмаферез и другие виды специфической терапии.
Препараты, применяемые при одной форме заболевания, неэффективны для других форм.
Основные симптомы миастенического криза – обширные нарушения функций бульбарной мускулатуры, к которой относится и дыхательная, вплоть до наступления апноэ.
Интенсивность симптомов нарастает с критической скоростью – гипоксия мозга может возникнуть в течение получаса.
Если не будет оказана неотложная помощь при внезапном миастеническом кризе, пациент задохнется.
Причинами развития криза могут быть следующие факторы:
- стрессовые состояния;
- усиленные физические нагрузки;
- грипп;
- острые респираторные заболевания;
- нарушения метаболических процессов;
- гормональный сбой;
- интоксикации различной этиологии.
Эти факторы провоцируют блокировку нервно-мышечной проводимости, вызывают потерю возбудимости в мышцах и сухожилиях.
Больные миастенией всегда имеют с собой записку, на которой написано, что они страдают такой-то формой заболевания и какие препараты необходимы для оказания первой помощи. В большинстве случаев препараты больные носят с собой – это прозерин и каневин.
Если среди окружающих, на чьих глазах развивался миастенический криз, есть хоть 1 человек, который умеет делать инъекции, жизнь человека будет спасена. Но вызвать «скорую» все равно необходимо.
Метод лечения миастенического криза полностью определяется состоянием пациента и тем, как быстро была оказана неотложная помощь прибывшей на место вызова спец. бригадой.
Как можно быстрее пострадавшего требуется поместить в реанимацию и подключить к аппарату ИВЛ – искусственного дыхания. Искусственная вентиляция легких должна производиться в течение 24 часов, не меньше.
Эффективно восстанавливает состояние плазмаферез, но может потребоваться внутривенное введение иммуноглобулина. Вместе с иммуноглобулином применяются: метилпреднизолон и хлористый калий.
Совместное лечение иммуноглобулином, хлористым калием и метилпреднизолоном применяется при наличии в анамнезе воспалительных процессов.
Используются антиоксиданты – липоевая кислота в частности. Они снижают количество свободных радикалов, накопившихся в крови, уменьшают выраженность окислительного стресса в организме пациентов.
Переход с аппарата ИВЛ на самостоятельное дыхание производится на основании клинической картины, оцениваются следующие факторы:
- стабилизация сердечного ритма и глубины и частоты дыхания;
- отсутствие цианоза и возбуждения;
- отсутствие расстройства сознания;
- дыхательная мускулатура начинает участвовать в процессе дыхания;
- реакции зрачков на световые раздражители.
Кроме того, обязательно принимаются во внимание показатели анализов крови, полученные лабораторным путем.
На аппарате ИВЛ больной может находиться до 4 суток. Если за это время самостоятельное дыхание не восстанавливается, проводится хирургическое вмешательство по наложению трахеостомы – это помогает купировать пролежни трахеи.
Благодаря уровню развития современной медицины в общем и оснащению реанимационных отделений в частности, подготовки специальных медицинских бригад, уровень смертности от миастенического криза уменьшился по сравнению с ситуациями в 1990 годах в 12 раз.
Если на улице видишь человека, который начинает на глазах задыхаться, кожа его начинает бледнеть или синеть, обязательно требуется вызвать «скорую помощь». Жизнь таких людей во многом зависит от отсутствия равнодушия окружающих.
Материалы, размещённые на данной странице, носят информационный характер и предназначены для образовательных целей. Посетители сайта не должны использовать их в качестве медицинских рекомендаций. Определение диагноза и выбор методики лечения остаётся исключительной прерогативой вашего лечащего врача.
МИАСТЕНИЯ — Большая Медицинская Энциклопедия
Миастения (myasthenia; греч. my[s] мышца + astheneia бессилие, слабость; син.: астенический бульбарный паралич, myasthenia gravis pseudoparalytica) — нервно-мышечное заболевание, характеризующееся мышечной слабостью и патологической утомляемостью. Первое описание Миастении сделано в 1879 г. В. Эрбом. В 1894 г. Жолли (F. Jolly) установил типичное для данного заболевания изменение электровозбудимости мышц: быстрое истощение их сокращения при повторных раздражениях фарадическим током с восстановлением возбудимости после отдыха, получившее название миастенической реакции.
Этиология и патогенез
Этиология Миастении полностью не выяснена. Описаны семейные случаи, но наследственный характер не доказан. Часто выявляется сочетание Миастении с гиперплазией или опухолью вилочковой железы.
Патогенетические механизмы связывают с блоком нервно-мышечной передачи. Имеются указания на дефект активности ферментов синтеза ацетилхолина. Более вероятной причиной является конкурентный (курареподобный) блок синаптической проводимости в результате связывания холинорецептора полипептидом, секретируемым вилочковой железой (см.). Миастению относят к аутоиммунным заболеваниям. С помощью различных иммунологических методов показано, что в сыворотке крови больных М. имеются антитела к белку скелетных мышц и эпителиальных клеток вилочковой железы. Наряду с миастенией — нозологической формой, наблюдаются миастенические синдромы при органических заболеваниях нервной системы различной этиологии.
Патологическая анатомия
Патоморфологическое исследование выявляет гиперплазию или опухоль тимуса более чем в 70% . Гиперплазия представляет собой увеличение лимфоидных элементов с наличием телец вилочковой железы (телец Гассаля) и может быть различной выраженности. Опухоли вилочковой железы при М. чаще доброкачественные (лимфоэпителиомы), иногда злокачественные. В поперечнополосатых мышцах находят атрофические и дистрофические изменения отдельных волокон и инфильтрацию лимфогистиоцитарными элементами межуточной ткани. Очаговые лимфоидные инфильтраты обнаруживают также в миокарде, легких, печени, почках, надпочечниках. Электронно-микроскопическое исследование позволило установить изменение синаптической щели и постсинаптических структур, в тяжелых случаях —-полное разрушение синаптических контактов.
Клиническая картина
Клиническая картина полиморфна. Начало заболевания в большинстве случаев относится к 20—30 годам, однако в 10% случаев первые симптомы развиваются в детском возрасте; заболевание может проявиться и после 50 лет. Женщины болеют значительно чаще мужчин. Развитие М. преимущественно подострое или хроническое. Для начала заболевания типично появление глазодвигательных расстройств в виде птоза, диплопии, часто отмечается слабость лицевой и жевательной мускулатуры. В ряде случаев первые симптомы проявляются со стороны мышц глотки, гортани (затруднение глотания, изменение голоса, речи). Реже М. начинается со слабости поперечнополосатых мышц конечностей и шеи. Характерна лабильность, динамичность симптомов с их резким ухудшением при чтении, фиксации взгляда, иногда при общей физической нагрузке (феномен генерализации мышечного утомления) и с уменьшением и даже исчезновением их во время отдыха. М. может быть генерализованной и локальной (поражение мышц глаз, глотки, гортани, мимической мускулатуры или мускулатуры туловища). Генерализованная форма может быть с дыхательными расстройствами и без них.
По течению различают прогрессирующую форму Миастении, миастенические эпизоды (короткие по времени миастенические расстройства и длительные спонтанные ремиссии) и миастенические состояния (стабильные дефекты миастенического типа на протяжении значительного срока). В детском возрасте М. протекает в виде следующих клин, форм: врожденной, ранней детской и ювенильной. Врожденная М. может проявиться слабым шевелением плода, в постнатальном периоде — слабым криком, затруднением сосания, глотания. М. может также отмечаться у детей, родившихся от матерей с М.; через 4—6 нед. симптомы ее постепенно исчезают. Ранняя детская форма характеризуется сравнительно мягким течением, преимущественно локальными симптомами. Наиболее часто у детей встречается ювенильная М., к-рая начинается в 11 — 16 лет и проявляется генерализованными расстройствами. В пожилом возрасте болеют преимущественно лица мужского пола; М., как правило, генерализованная, отличается быстрым течением, часто сопровождается тимомой.
Помимо симптомов, связанных с нарушением нервно-мышечной передачи, особенно при тяжелых генерализованных формах М., отмечается нарушение деятельности эндокринных желез. Нередко выявляется гиперфункция щитовидной железы, как правило, имеется недостаточность надпочечников. Изменения электролитного обмена, в частности гипокалиемия, обусловлены патологией надпочечников. Отмечаются нарушения со стороны сердечно-сосудистой системы, связанные частично со снижением содержания калия (миастеническое сердце), изменение деятельности жел.-киш. тракта, печени. У всех больных с тяжелой формой М. нарушается функция внешнего дыхания.
Под влиянием экзогенных причин (чаще грипп, острые респираторные заболевания, реже интоксикации, физическое или психическое перенапряжение) или эндогенных (эндокринные сдвиги, метаболические нарушения), а иногда и без них у больных М. может наступить резкое ухудшение состояния, называемое миастеническим кризом. В основе кризовых состояний лежит грубый блок нервно-мышечной проводимости по типу конкурентного (курареподобного) блока, или блока нечувствительности, вследствие привыкания к антихолинэстеразным препаратам при их длительном приеме.
Клинически миастенический криз проявляется быстрой генерализацией миастенических расстройств с выраженными глазодвигательными и бульбарными нарушениями. Последние могут достигать степени бульбарного паралича (миастенический бульбарный паралич Эрба — Гольдфлама) с афонией, дизартрией, дисфагией. Больные не могут проглатывать не только пищу, но и слюну. Появляется затруднение дыхания — оно становится частым, поверхностным. Развивается парез диафрагмы, межреберных мышц, а также паралич конечностей. Характерно состояние тревоги, психомоторное возбуждение, сменяющееся вялостью, апатией, типичные вегетативные расстройства— мидриаз, тахикардия, слабый пульс, сухость кожи или гипергидроз, парез кишечника и сфинктеров. Интенсивность всех симптомов быстро нарастает, иногда в течение 10—20 мин. может развиться острая гипоксия мозга, потеря сознания и наступить летальный исход.
Миастенический криз следует отличать от холинергической), развивающегося при передозировке антихолинэстеразных препаратов и представляющего собой неконкурентный деполяризационный блок. Внешне холинергический криз напоминает миастенический и характеризуется ухудшением состояния, генерализацией мышечной слабости, появлением или усугублением бульбарных расстройств, развитием дыхательных нарушений. После одного из очередных приемов антихолинэстеразных препаратов может наступить внезапная остановка дыхания, цианоз. В отличие от миастенического криза, вегетативные расстройства выражаются мускариновыми и никотиновыми эффектами: наблюдаются усиленная саливация и бронхорея, потливость, рвота, бурная перистальтика кишечника, иногда с профузным жидким стулом, боли в животе, частое мочеиспускание. Отмечаются также сужение зрачков, брадикардия, гипотония, распространенные фасцикуляции в мышцах всего тела, иногда судороги. Следует иметь в виду, что в отдельных случаях криз может носить смешанный характер, когда сочетаются миастенические и холинергические симптомы.
Диагноз
Диагноз ставится на основании характерных жалоб на утомляемость, усиление имеющихся расстройств к вечеру и при физической нагрузке. Важное значение имеет наличие миастенической реакции. Подтверждением диагноза служит положительная прозериновая проба (резкое уменьшение симптомов через 30—60 мин. после введения 2,0—3,0 мл 0,05% р-ра прозерина внутримышечно). Дифференциальный диагноз проводится со стволовым энцефалитом (см.) и опухолью ствола мозга, базальным менингитом (см.), глазной формой миопатии (см.), болезнью Мак-Ардла (см. Гликогенозы).
Миастению следует отличать от миастенических синдромов, к к-рым относится синдром Ламберта — Итона. Симптомы его напоминают миастеническую утомляемость, проявляются, как правило, в мышцах конечностей, иногда туловища. В основе процесса лежит дефект синаптической проводимости в связи с нарушением освобождения ацетилхолина, поэтому антихолинэстеразные средства оказывают слабый эффект. Чаще синдром Ламберта — Итона развивается при карциноме легкого, иногда при раке молочной железы, предстательной железы, яичника; диагноз ставится на основании характерной ЭМГ с феноменом «врабатывания» при проведении ритмической стимуляции. Миастенический синдром может развиться при врожденной аномалии синапса. Иногда он наблюдается при поли- и дерматомиозите, боковом амиотрофическом склерозе и других органических поражениях нервной системы.
Лечение
Лечение сводится к коррекции относительного дефицита ацетилхолина и подавлению аутоиммунного процесса. При прогрессирующей форме заболевания в любом возрасте проводится оперативное лечение — тимэктомия (см.). В пожилом возрасте может быть рекомендовано рентгенооблучение области тимуса. Показано длительное (1 —1,5 года) лечение стероидными гормонами, иногда в сочетании с анаболическими гормонами и цитостатиками. Всем больным назначают антихолинэстеразные препараты — прозерин, оксазил, местинон (калимин) и другие в дозах, которые подбираются сугубо индивидуально. Степень компенсации под влиянием лечения этими препаратами различна — может быть полная компенсация или лишь незначительное улучшение после приема препарата. Хороший эффект оказывает дополнительное назначение верошпирона (200—400 мг в сутки). При миастеническом кризе срочно вводят 0,5—1,0 мл 0,05% р-ра прозерина внутривенно и затем 2—3 мл внутримышечно. При отсутствии эффекта и нарастающих явлениях дыхательных расстройств необходима срочная интубация (см.) или наложение трахеостомы (см. Трахеостомия), проведение искусственной вентиляции легких (см. Искусственное дыхание) и другие реанимационные мероприятия. При холинергической кризе необходима отмена антихолинэстеразных средств, введение 0,5—1 мл 0,1% р-ра атропина внутривенно (повторно) и подкожно — реактиватора холинэстеразы — дипироксима по 1 мл 15% р-ра; в тяжелых случаях показано наложение трахеостомы, аппаратное дыхание.
Оперативное лечение и особенности обезболивания
Тесная связь М. с патологией вилочковой железы, благоприятный эффект удаления этой железы на течение заболевания дают основание рассматривать тимэктомию как один из наиболее патогенетически обоснованных методов лечения М.
Впервые тимэктомию для ликвидации миастенических расстройств с успехом выполнил Ф. Зауэрбрух (1912) у больного с базедовой болезнью. Однако только в 1939 г. Блелок (A. Blalock) целенаправленно произвел это вмешательство у больного с тяжелой формой М. Начиная с 50-х гг. тимэктомия становится признанным методом оперативного лечения М.
Наиболее благоприятные результаты дает оперативное вмешательство в первые три года от начала заболевания; при тяжелой, бурно прогрессирующей форме, сопровождающейся бульбарными расстройствами, оно проводится и в более ранние сроки.
Операция выполняется в условиях общей анестезии. Особенности общей анестезии в значительной степени зависят от тяжести и характера течения болезни, степени генерализации процесса, наличия дыхательных расстройств, степени компенсации при приеме антихолинэстеразных препаратов. Наиболее сложно проведение общей анестезии у больных с генерализованной формой М. Это связано гл. обр. с тем, что у них при явлениях бульбарного симптомокомплекса наблюдаются недостаточность функции внешнего дыхания, различные нарушения сердечной деятельности (миастеническое сердце), нарушены взаимоотношения гипоталамо-гипофизарно-надпочечниковой системы, снижены Дезинтоксикационная и белковообразующая функции печени, развивается гипокалиемия.
Предоперационная подготовка заключается в коррекции гипокалиемии путем внутривенного введения р-ра хлористого калия. Проводят также оксигенотерапию (см. Кислородная терапия) и специальные комплексы дыхательных упражнений. Премедикация накануне операции включает назначение снотворных и антигистаминных препаратов в меньших по сравнению с общепринятыми дозах. Применение седуксена противопоказано из-за выраженного эффекта центральной релаксации. Для уменьшения холинергической эффекта антихолинэстеразных препаратов обязательно введение за 30 мин. до операции 0,5—0,7 мл 0,1% р-ра атропина подкожно.
Все больные М. как накануне, так и в день операции должны получать обычные для них дозы антихолинэстеразных препаратов. Для индукции в наркоз применяют производные барбитуровой к-ты, хотя предпочтительнее анестетики, близкие к метаболитам организма (виадрил), но в меньших по сравнению с общепринятыми дозировках. Препараты, используемые для обеспечения основного наркоза, не должны усугублять нарушений нейромышечной проводимости, поэтому уровень общей анестезии не должен превышать стадии I3—III1 по классификации Гведела (см. Наркоз). Противопоказан эфир, к-рый усугубляет нарушение нейромышечной проводимости. Применение газонаркотической смеси закиси азота и кислорода в соотношении не более чем 2:1 с добавлением препаратов для нейролептаналгезии в сниженных дозировках возможно лишь у больных со средней степенью выраженности заболевания. При выраженных признаках заболевания, при наличии бульбарных нарушений, а также тимомы показано применение комбинированной электроанестезии (см. Электронаркоз). При этом используют импульсный ток с длительностью импульса 0,5 мсек, частотой 130 гц, силой тока в амплитудном значении 30—50 ма и с дополнительной постоянной составляющей 0,5 ма. Анодные электроды располагают на сосцевидных отростках, раздвоенный катод — в лобной области. Электроанестезию начинают сразу же после интубации трахеи на фоне инсуффляции закисно-кислородной смеси в соотношении 2:1 или 1,5:1. Такая методика общей анестезии обеспечивает на только достаточную вегетативную защиту, но и лучшее соотношение медиаторных гормонов, что способствует быстрому выходу из наркоза с восстановлением на операционном столе адекватного самостоятельного дыхания.
Для миорелаксации используют препараты деполяризующего типа действия, к-рые вызывают кратковременный неглубокий антидеполяризующий блок, полностью устранимый прозерином. Применение у таких больных истинных кураре противопоказано, т. к. они вызывают стойкий антидеполяризующий блок, к-рый плохо поддается декураризации. Искусственную вентиляцию легких (ИВЛ) во время операции целесообразно осуществлять в режиме нормо- или умеренной гипервентиляции.
Для обнажения вилочковой железы предпочтительна полная срединная сагиттальная стернотомия, к-рая дает возможность выполнить операцию радикально, вне зависимости от анатомической конфигурации вилочковой железы. Фасцию, покрывающую железу, целесообразно рассечь на границе с плевральными мешками, к-рые тупо сдвигают в стороны, что позволяет избежать их ранения. Одним из трудных моментов операции является выделение верхних и нижних отростков железы, уходящих высоко на шею или спускающихся до корней легких. После удаления железы края грудины сводят 3—4 отдельными капроновыми швами, в переднем средостении оставляют дренаж для аспирации раневого отделяемого. Всем больным за 10—20 мин. до окончания операции в одном шприце вводят 0,5 мг атропина и 0,75 мг прозерина подкожно. Внутривенное введение прозерина противопоказано из-за возможности развития холинергического криза.
Больным с выраженными до операции нарушениями внешнего дыхания и бульбарными нарушениями операцию заканчивают наложением трахеостомы для проведения ИВЛ в ближайшем послеоперационном периоде (см.). В случае необходимости проведения ИВЛ в послеоперационном периоде применение антихолинэстеразных препаратов снижают до минимальных доз, что позволяет восстановить чувствительность нейромышечного синапса к ним и сократить период ИВЛ.
Непосредственная послеоперационная летальность при Миастении составляет 1-3%.
Прогноз
Полная ремиссия или значительное улучшение состояния после тимэктомии наблюдается у 60—80% больных, однако улучшение не всегда наступает сразу после операции, а нередко через 5—7 лет.
Библиография: Аносов H. Н. и др. Патоморфологические изменения в мышцах при локальных формах миастении, Журн, невропат, и психиат., т. 74, № 12, с. 1784, 1974; Гаджиев С. А., Догель Л. В. и Ваневский В. Л. Диагностика и хирургическое лечение миастении, Л., 1971, библиогр.; Гехт Б. М. Синдромы патологической мышечной утомляемости, М., 1974; Горнак К. А. и Копьева Т. Н. К патологической анатомии миастении, Арх. патол., т. 27, № 10, с. 12, 1965; Коломенская Е. А., Сигаев В. В. и Перельман Л. Б. Электромиографическая характеристика действия листенона на нервно-мышечную передачу больных миастенией, Эксперим, хир., № 4, с. 71, 1972, библиогр.; Кузин М. И. Тимэктомия и ее место в оперативном лечении миастении, Хирургия, № 4, с. 78, 1964; он же, Хирургические аспекты лечения больных миастенией, там же, № 5, с. 114, 1968; Миастенические расстройства, под ред. Н. И. Гращенкова, М., 1965; Скрипниченко Д. Ф. Опыт хирургического лечения больных миастенией, Грудн. хир., № 3, с. 115, 1977; Чернега М. Я. Клиника врожденной (неонатальной) миастении новорожденных, Вопр. охр. мат. и дет., т. 24, № 8, с. 40, 1979; Disorders of voluntary muscle, ed. by J. N. Walton, Edinburgh, 1974; Goldstein G. a. Manganoro A. Thymin, a thymic polypeptide causing the neuromuscular block of myasthenia gravis, Ann., N. Y. Acad. Sci., v. 183, p. 230, 1971; Jenkins R. B. Treatment of myasthenia gravis with prednisone, Lancet, v. 1, p. 765, 1972; Keynes G. Surgery of thymus gland, ibid., v. 1, p. 1197, 1954; Menkes J. H. Textbook of child neurology, Philadelphia, 1974; Myasthenia gravis und andere Storungen der neuromusku-laren Synapse, hrsg. v. G. Hertel u. a., Stuttgart, 1977; Osserman K. E. Myasthenia gravis, N. Y.— L., 1958; Vlets H. R. a. Sсhwab R. S. Thymectomy for myasthenia gravis, Springfield, 1960.
H. А. Ильина; М. И. Кузин (хир.), В. И. Сачков, В. В. Сигаев (анест.).
Холинергический кризис — StatPearls — Книжная полка NCBI
Введение
Холинергический кризис — это клиническое состояние, которое развивается в результате чрезмерной стимуляции никотиновых и мускариновых рецепторов в нервно-мышечных соединениях и синапсах. Обычно это вторично по отношению к инактивации или ингибированию ацетилхолинэстеразы (AChE), фермента, ответственного за разложение ацетилхолина (ACh). Чрезмерное накопление ацетилхолина (ACh) в нервно-мышечных соединениях и синапсах вызывает симптомы как мускариновой, так и никотиновой токсичности.К ним относятся судороги, повышенное слюноотделение, слезотечение, мышечная слабость, паралич, мышечная фасцикуляция, диарея и нечеткое зрение [1] [2] [3].
В клинической практике это состояние наиболее часто встречается у:
Пациенты с миастенией, получающие лечение ингибиторами ацетилхолинэстеразы в высоких дозах.
Пациенты после общей анестезии, получавшие высокие дозы ингибиторов ацетилхолинэстеразы для отмены эффектов нервно-мышечных блокаторов, например неостигмина.
Воздействие химического вещества, которое вызывает инактивацию ацетилхолинэстеразы. Примерами таких веществ являются нервно-паралитический газ, такой как зарин, табун, зоман, и другие органофосфаты, такие как пестициды и инсектициды.
Этиология
Несколько клинических состояний могут вызвать холинергический криз. Ниже описаны наиболее часто встречающиеся расстройства:
Избыточная терапия ингибиторами ацетилхолинэстеразы AChEI при лечении миастении Gravis
Myasthenia gravis (MG) — это аутоиммунное заболевание, которое влияет на нервно-мышечный переход путем выработки аутоантител против рецепторов ACh в постсинаптическая мембрана [4].Это клиническое заболевание характеризуется общей слабостью или легкой утомляемостью, которые могут быстро прогрессировать до дыхательной недостаточности [5]. Другая форма MG, обычно наблюдаемая у женщин, связана с выработкой антител против мышечно-специфической тирозинкиназы (MuSK) [6] [7].
Одним из методов лечения миастении гравис является использование ингибиторов ацетилхолинэстеразы (AChEI), таких как пиридостигмин. AChEI предотвращает пробой ACh, инактивируя AChE. Это останавливает распад ACh и увеличивает его уровень и продолжительность действия на постсинаптической мембране.Чрезмерное использование АХЭИ при лечении пациента с MG может спровоцировать холинергический криз, который характеризуется как мускариновой, так и никотиновой токсичностью [2].
Миастенический криз — осложнение МГ. Причины миастенического криза включают инфекцию, хирургическое вмешательство, менструацию и некоторые лекарства, такие как хинидин, блокаторы кальциевых каналов (верапамил, нифедипин, фелодипин) и антибиотики (гентамицин, ампициллин, стрептомицин, эритромицин, ципрофлоксацин) [8] [9]. Клиническая симптоматика миастенического криза и холинергического криза очень похожа.Холинергический криз всегда следует рассматривать при миастеническом кризе, хотя холинергический криз не так часто встречается при миастеническом кризисе [10] [11] [12].
Важно определить, какое из двух состояний вызывает мышечную слабость. Простой тест, который можно сделать, включает введение дозы 2 мг эдрофония внутривенно. Лекарство вызывает клиническое улучшение при миастеническом кризе, но ухудшение симптомов при холинергическом кризе
Воздействие органофосфатов
Холинергический кризис может быть спровоцирован воздействием препаратов, ингибирующих АХЭ, например, нервно-паралитического газа и фосфорорганических соединений, используемых в пестицидах, инсектицидах , и гербициды.Воздействие может происходить через вдыхание паров, проглатывание или прямой контакт химического вещества с кожей или слизистой оболочкой [13] [14].
Органофосфаты — это химические соединения, широко используемые в качестве боевых отравляющих веществ. Нервно-паралитические газы — один из самых смертоносных агентов химического оружия. Примерами таких химических веществ являются зарин, табун, зоман, GF и VX. Органофосфаты действуют, подавляя действие AChE. Это вызывает чрезмерную стимуляцию мускариновых и никотиновых рецепторов на постсинаптической мембране.ACh связывается с замыкательными пластинами гладких мышц и секреторных желез, вызывая тошноту, рвоту, бронхоспазм, миоз, нечеткое зрение, бронхорею и сиалохоррею. Никотиновый эффект на скелетные мышцы может вызвать фасцикуляцию и вялый паралич. Отравление нервным газом может варьироваться от легкой до средней или тяжелой степени.
Острое или хроническое воздействие пестицидов и инсектицидов, содержащих органофосфаты, также может вызвать холинергический кризис. Обычно используемые инсектициды — это малатион, паратион, диазинон, фентион и трихлорфон.Обычно пациенты встречаются в сельской местности, где широко используются пестициды и гербициды. Примерами пестицидов, помимо органофосфатов, являются инсектициды карбамата, хлорорганических соединений и пиретроиды. Помимо мускариновых и никотиновых эффектов, наблюдаемых при холинергическом кризе, пациенты, подвергшиеся воздействию органофосфатов, могут также проявлять неврологические симптомы, такие как головная боль, головокружение, тремор и парестезия [15].
Преодоление нервно-мышечной блокады
Наконец, использование реверсивного агента, такого как неостигмин или пиридостигмин, для нервно-мышечной блокады также может вызвать холинергический кризис [16] [17].Неостигмин — это соединение, которое ингибирует AChE и обычно используется для отмены эффектов недеполяризующих паралитических агентов, таких как векуроний, рокуроний, мивакуриум и панкуроний. Ингибирование AChE позволяет аккумулировать ACh в нервно-мышечном соединении, преодолевая, таким образом, конкурентное ингибирование недеполяризующих блокирующих агентов. Неостигмин, как и другие ингибиторы AChE, может стимулировать мускариновые рецепторы и вызывать холинергический криз. Бронхоспазм, миоз, усиление перистальтики и секреции обычно наблюдаются после введения неостигмина.Чтобы минимизировать эти эффекты на мускариновые рецепторы, одновременно вводят антихолинергический агент, такой как гликопирролат, во время отмены нервно-мышечных блокаторов.
Эпидемиология
Данных по эпидемиологии холинергического криза очень мало. Тем не менее, это известный факт, что холинергический криз часто наблюдается в педиатрической популяции и у пациентов с миастенией. В детской возрастной группе этот криз обычно возникает в результате случайного контакта или проглатывания органофосфатов.Дети, живущие в сельской местности, подвергаются очень высокому риску. С 2013 года в США действуют более строгие федеральные правила продажи органофосфатов.
Во всем мире около трех миллионов человек ежегодно подвергались отравлению фосфорорганическими соединениями и примерно 300 000 смертей. Отравление происходит в результате случайного или преднамеренного проглатывания сельскохозяйственных инсектицидов или пестицидов. При холинергическом кризисе, связанном с органофосфатами, отравление может быть вызвано пищевыми продуктами, такими как пшеница, мука, растительное масло, фрукты и овощи.
После Второй мировой войны производство нервно-паралитических газов, таких как зарин и табун, было ограничено. Производство нервно-паралитического газа считалось военным преступлением со времен Женевской конвенции 1925 года [2]. Снижение производства в наше время значительно снизило количество случаев отравления нервно-паралитическими газами. Последнее крупномасштабное использование нервно-паралитического газа произошло в Сирии в 2013 году [15].
Холинергический кризис против миастенического кризиса Обзор NCLEX
В этом обзоре NCLEX будет обсуждаться миастенический кризис ихолинергический криз.
Как студент медсестры, вы должны быть знакомы с этими осложнениями нервных заболеваний, а также с тем, как оказывать помощь пациенту, страдающему одним из этих состояний.
Не забудьте пройти тест на сравнение миастенического кризиса и холинергического кризиса.
Из этого обзора NCLEX вы узнаете следующее:
- Определение каждого кризиса
- Патофизиология
- Признаки и симптомы
- Медсестринское вмешательство
- Тестирование
- Процедуры
Миастенический vs.Лекция по сестринскому делу при холинергическом кризисе
Холинергический кризис
Как это происходит? Это происходит из-за чрезмерной стимуляции нервно-мышечного соединения ацетилхолином (слишком много ACh), что приводит к перегрузке холинергической реакции .
Причины: передозировка антихолинэстеразными препаратами, применяемыми при миастении
Почему? эти препараты останавливают распад ацетилхолина, поэтому в нервно-мышечном соединении доступно БОЛЬШЕ.Это отлично подходит для лечения миастении, но слишком большое количество лекарства может вызвать холинергический кризис и чрезмерно стимулировать мышечные волокна, которые в конечном итоге перестанут сокращаться.
Признаки и симптомы:
Мышечным волокнам хватило стимуляции, поэтому они перестают реагировать на импульс, который приведет к:
Дыхательная недостаточность
Мышечная слабость
Однако другие признаки и симптомы, которые будут присутствовать, похожи на парасимпатическую стимуляцию (система «отдых и переваривание пищи»), но в режиме OVERDRIVE !!
- Проблемы с желудочно-кишечным трактом: рвота, диарея, спазмы
- Сужение зрачка
- Увеличение слюноотделения и слезоотделения….Помутнение зрения и увеличение респираторной секреции
- Мышечная фасцикуляция / подергивание… от чрезмерной стимуляции со временем до паралича
- Низкое артериальное давление и частота пульса
Итак, кроме симптомов, как диагностируются эти состояния?
Тенсилон-тест: Дан Edrophonium, который является ингибитором холинэстеразы, и это вызовет у пациента еще большую слабость (добавление большего количества ACh в этом месте … это не требуется, потому что в нервно-мышечном соединении уже достаточно ACh место соединения, вызывающее чрезмерную стимуляцию).Признаки и симптомы пациента не реагируют, но ухудшаются… .. поиск: ОТРИЦАТЕЛЬНЫЙ результат
Лечение: УДЕРЖИВАЙТЕ прием антихолинэстеразного препарата и вводите атропин (антидот) в соответствии с приказом врача
Миастенический кризис
Как это происходит? Это происходит из-за слабой стимуляции или ее отсутствия в нервно-мышечном соединении ацетилхолином (рецепторы не могут выполнять свою работу из-за антител, атакующих рецепторы), что приводит к серьезной мышечной слабости .
Причины : недостаточное количество антихолинэстеразного препарата или заболевание (респираторная инфекция), стресс и т. Д., Вызвавшие обострение заболевания миастенией гравис.
Признаки и симптомы:
Помните, что рецепторы для приема ACh отсутствуют, поэтому НЕТ стимуляции мышечных волокон, что приводит к НЕ сокращению, а вялости.
(примечание: будут оба условия):
Дыхательная недостаточность
Мышечная слабость
Однако признаки и симптомы влияют на все произвольные мышцы, вызывая их вялость (от глаз до кишечника):
- зрачки расширены
- тахикардия / HTN
- без кашля и рвоты
- аспирация (не может глотать и кашлять)
- недержание (отсутствие мышечной силы) кишечника и мочевого пузыря
Как отличить, кроме симптомов:
Tensilon Test: Дан Edrophonium, который является ингибитором холинэстеразы, и это вызовет у пациента УЛУЧШЕНИЕ мышечной силы (добавление большего количества ACh в нервно-мышечном соединении, потому что это ингибирует распад ACh)…признаки и симптомы временно уменьшаются … .. находки: ПОЛОЖИТЕЛЬНЫЙ результат
Лечение: дайте больше антихолинэстеразных препаратов в соответствии с приказом врача
Артикул:
- Информационный бюллетень по миастении | Национальный институт неврологических расстройств и инсульта . Ninds.nih.gov . Получено 27 ноября 2017 г. с сайта https: //www.ninds.nih.gov / Disorders / Patient-Caregiver-Education / Fact-Sheets / Myasthenia-Gravis-Fact-Sheet
- Распознавание болезней, связанных с воздействием химических агентов — США, 2003 . (2003) (стр.939). Получено с https://www.cdc.gov/nceh/hsb/chemicals/pdfs/mmwr5239p938.pdf
.
Холинергический кризис: обзор
Что такое холинергический кризис?
Холинергический криз — это заболевание, характеризующееся чрезмерной стимуляцией нервно-мышечного соединения.4].
Что вызывает холинергический кризис?
Две основные причины холинергического криза:
- Передозировка ингибитором холинэстеразы
- Воздействие нервно-паралитических агентов, известных как органофосфаты
Ингибиторы холинэстеразы — это класс препаратов, используемых при различных состояниях. Ингибиторы холинэстеразы лечат миастению-гравис, аутоиммунное заболевание, приводящее к слабости скелетных мышц. 6]
Каковы осложнения холинергического кризиса?
Если не лечить холинергический криз, он может быть опасным для жизни, потому что мышцы перестают реагировать на Ach.6]:
- Отказ дыхательной системы в результате недостаточного газообмена
- Снижение мышечного тонуса, вызванное параличом или ослаблением, также известное как вялый паралич
Холинергический кризис против миастении Гравис
Холинергический криз часто можно спутать с другим заболеванием, известным как миастенический криз.
Различие между этими состояниями нечеткое, потому что они имеют схожее представление.
Но различение холинергического и миастенического кризов имеет решающее значение, поскольку основная патология различается в том смысле, что они прямо противоположны, и прием неправильного лекарства может быть фатальным [7].7]. Таким образом, ключевой элемент холинергического кризиса, мышечный паралич, который связан с опасной для жизни остановкой дыхания, не улучшается с помощью атропина.
Пациентам с респираторной токсичностью требуется искусственная вентиляция легких, то есть интубация для поддержки дыхания до разрешения криза.
Пралидоксим
Пралидоксим — это оксим, связывающий ферменты ацетилхолинэстеразы, инактивированные органофосфатами. Следовательно, неудивительно, что пралидоксим клинически используется для борьбы с отравлением фосфорорганическими соединениями в сочетании с атропином
и диазепамом.7]: Hetherington KA, Losek JD. (2005) Myasthenia gravis: миастения против холинергического кризиса. Педиатр неотложной помощи 21 (8): 546-8
Что такое холинергический кризис? (с изображением)
Биохимическое явление, известное как холинергический криз, представляет собой эпизод чрезмерной стимуляции одной из точек нервно-мышечного соединения тела. Такое событие возникает в результате накопления ацетилхолина (ACh) в результате неактивности или недостаточности ацетилхолинэстеразы. Частой причиной эпизодов холинергических кризов является непреднамеренная передозировка лечебных препаратов у пациентов с миастенией.Дополнительные причины включают воздействие нервно-паралитических агентов и послеоперационную передозировку ингибиторов холинэстеразы, предназначенных для устранения остаточного паралича мышц. Когда возникает холинергический криз, мышцы больше не могут реагировать на приток ACh, что может привести к дыхательной недостаточности, вялому параличу, чрезмерному слюноотделению и потоотделению.
Холинергический кризис может сопровождаться крайней мышечной слабостью.
Пациенты с диагнозом миастения, у которых наблюдаются приступы вялого паралича, могут создавать диагностические трудности, поскольку невозможно сразу определить, вызвана ли проблема обострением основного заболевания или холинергическим кризом, возникшим в результате передозировки лекарством. Чтобы установить истинную причину паралича, врач, скорее всего, проведет тест с использованием препарата эдрофониум. Люди с миастенией, которым вводят это лекарство, увидят усиление паралича после введения лекарственного средства, если они испытывают настоящий холинергический кризис.И наоборот, если пациент видит увеличение мышечной силы после приема препарата, он, вероятно, испытывает ухудшение своего основного состояния. Важно, чтобы этот тип диагностической процедуры выполнял только опытный практикующий врач, готовый при необходимости использовать методы интубации, вентиляции и реанимации.
После того, как диагностическое обследование подтвердит, что пациент действительно страдает холинергическим кризом, а не миастеническим кризом, последует стандартный курс лечения.Атропин — общепринятый антидот, когда у пациента была передозировка антихолинэстеразы. Очень важно, чтобы больные миастенией, которые сталкиваются с этой конкретной диагностической загадкой и регулярно проходят антихолинэстеразную терапию, имели немедленный доступ к лечению атропином. Если атропин не вводить вскоре после начала холинергического криза, могут возникнуть серьезные побочные эффекты, включая сильную мышечную слабость и, возможно, дыхательную недостаточность, ведущую к смерти.
Холинергический криз, вызванный отравлением фосфорорганическими соединениями после воздействия нервно-паралитических агентов, приводит к тем же типам симптомов, что и у больных миастенией после передозировки лечения.Вредные эффекты нервно-паралитических агентов развиваются, когда их сложные химические вещества связываются с ацетилхолинэстеразой в организме и делают ее неэффективной. Результатом является агрегация избыточного ACh в нервно-мышечных соединениях, что соответствует холинергическому событию. Вероятно, за этим последуют мышечная слабость, дыхательная недостаточность и избыточное слюноотделение. Протоколы лечения криза, вызванного возбудителями нервно-паралитического действия, включают обеззараживание тела, одежды и связанных с ними поверхностей, а также введение атропина и оксимов, способных разрушить связь между нервно-паралитическим агентом и ферментом ACh.
Холинергический кризис — Инфогалактика: ядро планетарного знания
Холинергический кризис — это чрезмерная стимуляция нервно-мышечного соединения из-за избытка ацетилхолина (ACh) в результате бездействия (возможно, даже ингибирования) Фермент AChE, который обычно расщепляет ацетилхолин.Это следствие действия некоторых типов нервно-паралитического газа (например, зарина). В медицине это наблюдается у пациентов с миастенией, которые принимают слишком высокую дозу своих препаратов ингибитора холинэстеразы, или наблюдается после общей анестезии, когда слишком высокая доза препарата ингибитора холинэстеразы назначается для обращения хирургического паралича мышц.
Симптомы и диагностика
В результате холинергического кризиса мышцы перестают реагировать на бомбардировку АХ, что приводит к вялому параличу, дыхательной недостаточности и другим признакам и симптомам, напоминающим отравление фосфорорганическими соединениями.Другие симптомы включают повышенное потоотделение, слюноотделение, бронхиальный секрет вместе с миозом.
Этот кризис может быть замаскирован одновременным применением атропина вместе с ингибитором холинэстеразы для предотвращения побочных эффектов. Вялый паралич, возникающий в результате холинергического криза, можно отличить от миастении гравис при помощи препарата эдрофониум (Тенсилон), который ухудшает паралич, вызванный холинергическим кризом, но укрепляет мышцы в случае миастении гравис.(Эдрофоний является ингибитором холинэстеразы, следовательно, увеличивает концентрацию присутствующего ацетилхолина).
Лечение
Некоторые элементы холинергического криза можно лечить антимускариновыми препаратами, такими как атропин, но самый важный элемент — остановка дыхания — нельзя. Нервно-мышечный узел, где мозг взаимодействует со скелетными мышцами (такими как диафрагма, основная дыхательная мышца), работает за счет ацетилхолина, активируя никотиновые рецепторы ацетилхолина и приводя к сокращению мышц.Атропин блокирует мускариновые рецепторы ацетилхолина (другой подтип, чем никотиновые рецепторы нервно-мышечного соединения), поэтому атропин не улучшит мышечную силу и способность дышать у человека с холинергическим кризом. Такому пациенту потребуется искусственная вентиляция легких через интубацию трахеи до тех пор, пока кризис не разрешится сам по себе. Респираторный компромисс в результате холинергического криза, к сожалению, не имеет фармакологического решения или терапии.
См. Также
Разница между холинергическим и миастеническим кризисами
Myastenia gravis — это заболевание, передающееся через нервно-мышечные соединения.При этом заболевании сигналы к мышцам не передаются из-за уменьшения количества рецепторов на постсинаптических мембранах, то есть на мембранах мышц. Это снижение рецепторов связано с аутоиммунным заболеванием. Против этих рецепторов ацетилхолина образуются антитела, которые их разрушают. А это приводит к снижению силы мышц. Потому что, когда потенциал действия достигает пресинаптического нейрона, он вызывает высвобождение ацетилхолина. Этот ацетилхолин присоединяется к некоторым рецепторам, но, поскольку большинство рецепторов разрушено, эффекта недостаточно, или мы можем сказать, что потенциал концевой пластинки не генерируется, и большая часть ацетилхолина разлагается ферментом ацетилхолинэстеразой.
Пациентов с миастенией лечат холинергическими агонистами, то есть теми, которые действуют косвенно. Это означает, что эти холинергические агонисты назначаются тем пациентам, которые ингибируют ферменты ацетилхолиновых эфиров. Это лечение может облегчить симптомы миастении. Но это также может привести к двум различным худшим ситуациям, которые называются холинергическим кризисом и миастеническим кризисом. Разница между ними обсуждается ниже.

 Значение имеют как бронхолегочные заболевания, так и ОРВИ с поражением верхних отделов респираторного тракта. Отдельное место занимают аспирационная пневмония, сепсис.
Значение имеют как бронхолегочные заболевания, так и ОРВИ с поражением верхних отделов респираторного тракта. Отдельное место занимают аспирационная пневмония, сепсис.

 Определение концентрации антител, направленных против ацетилхолиновых рецепторов и мышечно-специфической тирозинкиназы (MuSK), проводится иммуноферментным анализом, радиоиммунологическим методом. Исследование газов артериальной крови при дыхательных расстройствах показывает гиперкапнию, гипоксию, снижение сатурации.
Определение концентрации антител, направленных против ацетилхолиновых рецепторов и мышечно-специфической тирозинкиназы (MuSK), проводится иммуноферментным анализом, радиоиммунологическим методом. Исследование газов артериальной крови при дыхательных расстройствах показывает гиперкапнию, гипоксию, снижение сатурации.
 Метод дает сопоставимые с плазмаферезом результаты, но более доступен и прост в применении, лучше переносится пациентами.
Метод дает сопоставимые с плазмаферезом результаты, но более доступен и прост в применении, лучше переносится пациентами. Анализ крови на антинуклеарные антитела проводится для исключения других разновидностей аутоиммунной крапивницы. На основании данных об общем количестве IgE и белков, участвующих в развитии аллергии, исключают хроническую крапивницу.
Анализ крови на антинуклеарные антитела проводится для исключения других разновидностей аутоиммунной крапивницы. На основании данных об общем количестве IgE и белков, участвующих в развитии аллергии, исключают хроническую крапивницу.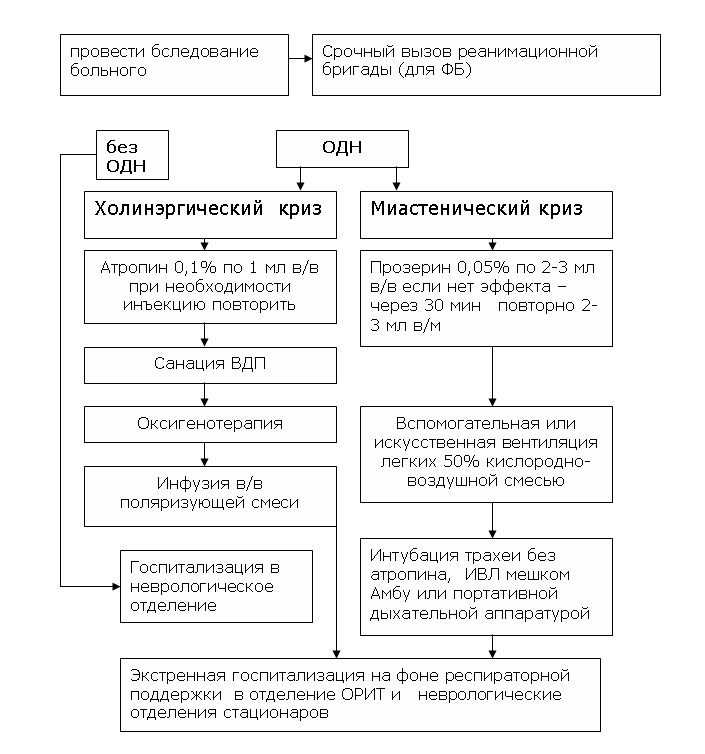 Острая гиперкальциемия характерна для тяжелого течения первичного, вторичного или третичного гиперпаратиреоза. Спровоцировать криз может обострение болезни, грубая пальпация околощитовидных желез, стремительная дегидратация, беременность, инфекция, перелом, обездвиженность, лечение всасывающимися антацидами.
Острая гиперкальциемия характерна для тяжелого течения первичного, вторичного или третичного гиперпаратиреоза. Спровоцировать криз может обострение болезни, грубая пальпация околощитовидных желез, стремительная дегидратация, беременность, инфекция, перелом, обездвиженность, лечение всасывающимися антацидами. При ОПН нарушаются все почечные функции, включая выделительную и фильтрационную. Кальций не выводится из организма, его плазменный уровень непрерывно повышается.
При ОПН нарушаются все почечные функции, включая выделительную и фильтрационную. Кальций не выводится из организма, его плазменный уровень непрерывно повышается. При первичной экстренной диагностике гиперкальциемии проводится проба Сулковича (образец мутный, результат положительный). Показатели анализа крови на кальций – более 2,39 ммоль/л. По данным дополнительных тестов определяется гипокалиемия, гипомагниемия и гипофосфатемия.
При первичной экстренной диагностике гиперкальциемии проводится проба Сулковича (образец мутный, результат положительный). Показатели анализа крови на кальций – более 2,39 ммоль/л. По данным дополнительных тестов определяется гипокалиемия, гипомагниемия и гипофосфатемия.
 Они блокируют производство простагландинов – медиаторов деструкции кости.
Они блокируют производство простагландинов – медиаторов деструкции кости.