Полисерозит плода — Униклиника — экспертное УЗИ, бережное ведение беременности, щадящая гинекология | UNIKLINIKA
Полисерозит плода
ВОДЯНКА ПЛОДА
РЕЗЮМЕ И РЕКОМЕНДАЦИИ
Up-to-date, 2013
Hydrops fetalis — наличие свободной жидкости в двух или более полостях плода. Типичные проявления: отек подкожной клетчатки, плевральный выпот, перикардиальный выпот, асцит, полигидрамнион.
Может быть вызван иммунными или неиммунными процессами.
Женщины, вынашивающие плод с водянкой, могут иметь,
— увеличенные для срока, размеры матки,
— отмечать снижение движений плода,
— у них самих может развиваться генерализованный отек с преэклампсией или без нее ( т.н. «Зеркальный синдром»).
Пренатальный диагноз устанавливается при ультразвуковым исследовании. Попытка определить этиологию должна быть предпринята уже во время диагностики, так как некоторые причины выявляются именно эхоскопически.
Причины неиммунных водянок являются гетерогенными и включают анеуплоидии (кариотипирование), структурные аномалии (экспертное УЗИ), нарушения обмена веществ плода (исследование АЖ), анемию (оценка пиковой систолической скорости кровотока в средней мозговой артерии), аритмии плода (М-режим) и инфекцию (исследование АЖ и крови матери).
Важно определить, существует ли потенциально подлежащая лечению причина и выявлять патологию с риском рецидива при будущих беременностях.
***
Базовое обследование таких пациентов включает:
— подробный анамнез для поиска наследуемых расстройств или воздействия инфекции.
— Подробная сонография, в частности эхокардиография, допплерография для поиска анатомических, сердечно-сосудистых и анемических причин
— компьютеризированная КТГ
— Лабораторная оценка, такая как выявление АТ к эритроцитам (Кумбс), тест Kleihauer-Betke, оценка иммунологического статуса матери или ПЦР амниотической жидкости (парвовирусная инфекция, сифилис, токсоплазмоз, ЦМВ)
— Кариотип плода + в идеале геномная гибридизация (microarray)
***
Наличие водянки является плохим прогностическим фактором для перинатальной выживаемости.
— Потенциально коррегируема водянка плода. связанная с аритмией (лечение – «Роттердамский протокол»).
— Внутриутробное переливание отмытых эритроцитов следует рассматривать в сроке до 32 недель в случаях парвовирусной инфекции B19 или анемии плода на фоне резус-конфликта.![]()
— Торакоамниотическое шунтирование грудной клетки может улучшить показатели выживаемости анатомически гармоничных новорожденных с нормальным кариотипом без метаболических нарушений (хилоторакс).
****
Госпитализация должна проводиться в центре третичной помощи с отделением интенсивной терапии новорожденных.
Специалисты по материнско-плодовой медицине и неонатологи должны участвовать в ведении этих беременностей. Тщательное наблюдение за материнским статусом важно из-за повышенного риска преэклампсии, зеркального синдрома, дистоции плечиков во время родов и послеродового кровотечения.
Водянка плода у стабильных плодов не является показанием для рутинного кесарева сечения (не улучшает исходов, повышая материнские риски). принятие решения о способе родоразрешения – с учетом сопутствующих факторов. Показание к перманентному фетальному мониторингу.
Водянка плода — Hydrops fetalis
Болезнь человека. Аномальное накопление жидкости в двух или более отделах плода, включая асцит, плевральный выпот, перикардиальный выпот и отек кожи.
Водянка плода является состоянием в плоде характеризуется накоплением жидкости или отека , по меньшей мере , два отсеков плода. Для сравнения, водянка аллантоиса или водянка амниона представляет собой скопление чрезмерного количества жидкости в аллантоисном или амниотическом пространстве соответственно.
Признаки и симптомы
Локализация может включать подкожную клетчатку на коже черепа , плевру ( плевральный выпот ), перикард ( перикардиальный выпот ) и брюшную полость ( асцит ). Обычно наблюдается отек подкожной клетчатки плода, иногда приводящий к самопроизвольному аборту . Это пренатальная форма сердечной недостаточности , при которой сердце не может удовлетворить потребность (в большинстве случаев аномально высокую) в кровотоке.
Причины
Водянка плода обычно возникает в результате анемии плода , когда сердцу необходимо перекачивать гораздо больший объем крови, чтобы доставить такое же количество кислорода. Эта анемия может иметь как иммунную, так и неиммунную причину. Неиммунная водянка также может быть не связана с анемией, например, если опухоль плода или врожденная кистозно-аденоматоидная мальформация увеличивает потребность в кровотоке. Повышенная потребность в сердечном выбросе приводит к сердечной недостаточности и соответствующему отеку.
Эта анемия может иметь как иммунную, так и неиммунную причину. Неиммунная водянка также может быть не связана с анемией, например, если опухоль плода или врожденная кистозно-аденоматоидная мальформация увеличивает потребность в кровотоке. Повышенная потребность в сердечном выбросе приводит к сердечной недостаточности и соответствующему отеку.
Иммунная патофизиология
Резус-инфекция — единственная иммунная причина водянки плода. Эритробластоз плода, также известный как резус-болезнь, представляет собой гемолитическое заболевание новорожденных. Беременные матери не всегда имеют ту же группу крови, что и их ребенок. Во время родов или во время беременности мать может контактировать с кровью младенца. В случае беременности, когда у плода есть антиген крови Rh-D, а у матери нет, иммунная система матери будет реагировать на красные кровяные тельца как на чужеродные и вырабатывать антитела против антигена Rh-D в клетках крови плода. Резус-болезнь развивается в случае второй беременности, когда иммунная система матери начинает атаку через IgG против Rh-D-положительных клеток крови ребенка. Иммунный ответ приводит к гемолизу эритроцитов плода, вызывая тяжелую анемию.
Иммунный ответ приводит к гемолизу эритроцитов плода, вызывая тяжелую анемию.
Гемолиз, вызванный несовместимостью резус-фактора, вызывает экстрамедуллярный гемопоэз в печени и костном мозге плода. Стремление производить больше эритробластов для компенсации гемолиза перерабатывает печень, вызывая гепатомегалию. В результате дисфункция печени снижает выход альбумина, что, в свою очередь, снижает онкотическое давление . Как следствие, снижение давления приводит к общим периферическим отекам и асциту.
В настоящее время резус-инфекция является редкой причиной иммуноопосредованной водянки плода. Благодаря профилактическим методам, разработанным в 1970-х годах, заболеваемость резус-фактором заметно снизилась. Резус-болезнь можно предотвратить путем введения инъекций анти-D IgG ( иммунный глобулин Rho (D) ) RhD-отрицательным матерям во время беременности и / или в течение 72 часов после родов. Однако небольшой процент беременных по-прежнему подвержен резус-инфекции даже после приема анти-D IgG (иммунный глобулин Rho (D)).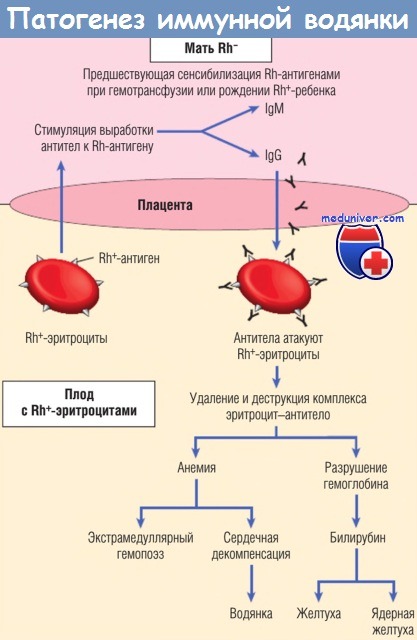
Неиммунная патофизиология
Тяжелая анемия приводит к гипердинамическому кровообращению, что означает, что сердечная недостаточность с высоким выбросом приводит к быстрой циркуляции крови. Чрезмерное перекачивание крови приводит к отказу левой половины сердца, что приводит к отеку легких. Накопление жидкости в легких увеличивает давление в легких, что приводит к сужению сосудов. Сочетание вазоконстрикции и легочной гипертензии вызывает отказ правой стороны сердца, что, в свою очередь, увеличивает венозное гидростатическое давление в организме. Суммирование этих эффектов в конечном итоге приводит к периферическим отекам и асциту. В целом, левосторонняя сердечная недостаточность приведет к отеку легких, тогда как правосторонняя недостаточность приведет к периферическому отеку и асциту. Неиммунная форма водянки плода имеет множество причин, в том числе:
Диагностика
Водянку плода можно диагностировать и контролировать с помощью ультразвукового исследования . Официальный диагноз ставится путем выявления избытка серозной жидкости как минимум в одном пространстве (асцит, плевральный выпот, выпот в перикард), сопровождающийся отеком кожи (толщиной более 5 мм). Диагноз также можно поставить, определив избыток серозной жидкости в двух потенциальных областях без отека. Пренатальное ультразвуковое сканирование позволяет на раннем этапе распознавать водянку плода и было улучшено с введением допплерографии MCA .
Официальный диагноз ставится путем выявления избытка серозной жидкости как минимум в одном пространстве (асцит, плевральный выпот, выпот в перикард), сопровождающийся отеком кожи (толщиной более 5 мм). Диагноз также можно поставить, определив избыток серозной жидкости в двух потенциальных областях без отека. Пренатальное ультразвуковое сканирование позволяет на раннем этапе распознавать водянку плода и было улучшено с введением допплерографии MCA .
лечение
Лечение зависит от причины и стадии беременности.
- Плоды с тяжелой анемией , в том числе с резус-фактором и большой альфа-талассемией, можно лечить с помощью переливания крови, пока они еще находятся в утробе матери. Это лечение увеличивает вероятность того, что плод доживет до рождения.
- Терапия сердечной тахиаритмии, наджелудочковой тахикардии, трепетания предсердий или фибрилляции предсердий — это трансплацентарное введение матери антиаритмических препаратов. Этот вид лечения рекомендуется, если плод не приближается к сроку.

- Терапия анемии плода, вызванной парвовирусной инфекцией или кровоизлиянием у плода, заключается в заборе крови плода с последующим внутриматочным переливанием. Это лечение на более позднем сроке беременности сопряжено с риском, и его не следует проводить, если риски, связанные с родами, считаются меньшими, чем риски, связанные с процедурой.
- Гидроторакс, хилоторакс плода или большой плевральный выпот, связанный с бронхолегочной секвестрацией, следует лечить с помощью дренирования плода с помощью иглы или установки торакоамниотического шунта. Эта процедура может быть выполнена до родов, если срок беременности уже превысил.
- Водянка плода, возникшая в результате CPAM плода, можно лечить либо с помощью дренирования излияния плода с помощью иглы, либо установки торакоамниотического шунта, либо путем введения матери кортикостероидов, бетаметазона 12,5 мг внутримышечно каждые 24 часа × 2 дозы или дексаметазона 6,25 мг внутримышечно каждые 12 часов × 4 дозы.
- Терапия водянки плода, вызванной TTTS или TAPS, требует лазерной абляции плацентарных анастомозов или селективного прерывания.

- Терапия водянки плода на основе TRAPS требует чрескожной радиочастотной абляции.
Смотрите также
Рекомендации
внешние ссылки
<img src=»https://en.wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
неонатологи МГКБ спасли тяжелого малыша,
Водянка одно из редких состояний плода, которое может привести к гибели новорожденного. Неиммунная, значит чаще не связанная ни с чем, трудно уточнить причину заболевания, при котором плод стремительно набирает огромное количество лишней жидкости, отекает. Как результат — поражение внутренних органов, невозможность самостоятельно дышать. По словам заведующей отделения новорождённых, главного окружного внештатного неонатолога Веры Крикуновой, чаще всего поражение плода могут вызывать обычные вирусные инфекции, парво вирус, как это случилось сейчас.
«Роды проходили сложно. Ребенок родился в крайне тяжелом состоянии. Правила золотого часа в реанимации никто не отменял. Уже при первом осмотре стало понятно, что у малыша неиммунная водянка. Он не дышал, и сразу в родильном зале потребовались реанимационные мероприятия. Трое суток неонатологи-реаниматологи не отходили от малыша, проводилась интенсивная терапия. За новорожденного, с рождения дышал аппарат искусственной вентиляции легких, артериальное давление, питание поддерживали внутривенной инфузией дорогостоящих препаратов. Для коррекции иммунного статуса использовали современные иммуноглобулины. Хирургическим методом, детские хирурги МГКБ помогли убрать более 500 мл жидкости из брюшной полости. Постоянно проводились консультации с лучшими детскими специалистами Московской области и Москвы. Кардиологами, врачами отделения гемодиализа Русаковской больницы, неонатологами и реаниматологами РКЦН (реанимационно-консультативного центра неонатологии) и МОНИКИ. К 3-4 суткам состояние ребенка улучшилось, общими усилиями удалось убрать более 1000мл «лишней» жидкости. Какова же была общая радость, когда потеряв более 1 кг, ребенок начал дышать самостоятельно, стал активнее», — рассказала врач анестезиолог-реаниматолог ОРИТНН, Оксана Шкаева.
Уже при первом осмотре стало понятно, что у малыша неиммунная водянка. Он не дышал, и сразу в родильном зале потребовались реанимационные мероприятия. Трое суток неонатологи-реаниматологи не отходили от малыша, проводилась интенсивная терапия. За новорожденного, с рождения дышал аппарат искусственной вентиляции легких, артериальное давление, питание поддерживали внутривенной инфузией дорогостоящих препаратов. Для коррекции иммунного статуса использовали современные иммуноглобулины. Хирургическим методом, детские хирурги МГКБ помогли убрать более 500 мл жидкости из брюшной полости. Постоянно проводились консультации с лучшими детскими специалистами Московской области и Москвы. Кардиологами, врачами отделения гемодиализа Русаковской больницы, неонатологами и реаниматологами РКЦН (реанимационно-консультативного центра неонатологии) и МОНИКИ. К 3-4 суткам состояние ребенка улучшилось, общими усилиями удалось убрать более 1000мл «лишней» жидкости. Какова же была общая радость, когда потеряв более 1 кг, ребенок начал дышать самостоятельно, стал активнее», — рассказала врач анестезиолог-реаниматолог ОРИТНН, Оксана Шкаева.
Малыша начали кормить молоком мамы, которая проявила настоящей героиней. И своим вниманием и верой поддерживала малыша. Врачебным консилиумом, согласованным с МЗМО, было решено, что ребёночка для продолжения обследования и лечения нужно перевести в одну из Федеральных клиник. Учитывая возможность отсроченных осложнений, может потребоваться использование высоких медицинских технологий и расширенное обследование. Пожелаем скорейшего выздоровления малышу. Специалисты МГКБ будут рады встречи с семьей после выписки. А также ждут всех желающих, семейные пары и близких им людей на роды. Рождение здоровых малышей огромное счастье, радость первого крика, незабываемые минуты общения семьи в момент рождения, незабываемые минуты. Спасение тяжелого ребенка – подвиг!
Клинический случай неиммунной водянки плода при врожденном сифилисе у недоношенного новорожденного Текст научной статьи по специальности «Клиническая медицина»
КЛИНИЧЕСКИЕ СЛУЧАИ
Клинический случай неиммунной водянки плода при врожденном сифилисе у недоношенного новорожденного
Харламова Н. В., Межинский С.С., Ананьева М.А., Чаша Т. В., Андреев А.В., Шилова Н.А.
В., Межинский С.С., Ананьева М.А., Чаша Т. В., Андреев А.В., Шилова Н.А.
ФГБУ «Ивановский научно-исследовательский институт материнства и детства им. В.Н. Городкова» Минздрава России
Описан случай неиммунной водянки у недоношенного ребенка, вызванной Treponema pallidum, с клиническими проявлениями в виде врожденной пневмонии, плеврита, менингита, гепатоспленомегалии, тромбоцитопении.
Ключевые слова:
недоношенный новорожденный, врожденный сифилис, неиммунная водянка плода, гепато-спленомегалия, тромбоцитопения
Неонатология: новости, мнения, обучение. 2018. Т. 7. № 1. С. 77-82.
Статья поступила в редакцию: 24.01.2018. Принята в печать: 20.02.2018.
Clinical case of non-immune hydrops fetalis congenital syphilis atpreterminfant
Kharlamova N. V., Mezhinsky S.S., Ananieva M.A., Chasha T.V., AndreevA.V., Shilova N.A.
V., Mezhinsky S.S., Ananieva M.A., Chasha T.V., AndreevA.V., Shilova N.A.
Ivanovo Research Institute of Motherhood and Childhood named after V.N. Gorodkov
A case of non-immune hydropsy in a premature child caused by Treponema pallidum, with clinical manifestations of congenital pneumonia, pleurisy, meningitis, hepatosplenomegaly, thrombocytopenia.
Keywords:
preterm newborn, congenital syphilis, non-immune hydrops, hepatosplenomegaly, thrombocytopenia
Neonatology: News, Opinions, Training. 2018; 7 (1): 77-82.
Received: 24.01.2018. Accepted: 20.02.2018.
Неиммунная водянка плода (НВП) — это гетерогенная патология, являющаяся, как правило, заключительным этапом развития некоторых внутриутробных заболеваний плода и клинически характеризующаяся признаками выраженной общей гидратации, обусловленной внеклеточным скоплением жидкости в тканях и серозных полостях при отсутствии признаков иммунной сенсибилизации [1, 2].
НВП в настоящее время остается патологией, характеризующейся достаточно высокой смертностью, достигающей, по некоторым данным, 80-90% [1-3]. Распространенность НВП варьирует от 1:1500 до 1:4000 [4].
НВП может возникнуть на разных этапах развития плода [1]. На ранних сроках беременности чаще всего причиной НВП становятся хромосомные аберрации и генные
болезни (дефицит глюкозо-6-фосфатдегидрогеназы, гомозиготная а-талассемия, синдромы Пена-Шокея, Нунан, синдром множественных птеригиумов, ахондрогенез, ахон-дроплазия, танатофорная карликовость и др.) [5, 6], врожденные пороки развития (пороки сердца, диафрагамальные грыжи, кистозно-аденоматозный порок легких, пороки развития лимфатической системы) [1, 2]. На более поздних сроках беременности этиологическим фактором НВП в большинстве случаев являются инфекции [1, 2, 7-11]. До 20% случаев НВП связано с развитием парвовирусной инфекции В19 [12]. Кроме того, причинно-значимыми микроорганизмами в отношении НВП являются также вирус простого герпеса [13], цитомегаловирус [14], а также возбудитель сифилиса — бледная трепонема [10, 15-17]. Клиническая картина врожденного сифилиса может варьировать от бессимптомного течения до ярких клинических проявлений заболевания, включая НВП, тяжелую анемию, гепатоспленомегалию, тромбоцитопению, сифилитический ринит, воспаление внутренних органов, скелетные повреждения и нейросифилис [10, 15-18].
Кроме того, причинно-значимыми микроорганизмами в отношении НВП являются также вирус простого герпеса [13], цитомегаловирус [14], а также возбудитель сифилиса — бледная трепонема [10, 15-17]. Клиническая картина врожденного сифилиса может варьировать от бессимптомного течения до ярких клинических проявлений заболевания, включая НВП, тяжелую анемию, гепатоспленомегалию, тромбоцитопению, сифилитический ринит, воспаление внутренних органов, скелетные повреждения и нейросифилис [10, 15-18].
Приводим клинический случай НВП при раннем врожденном сифилисе у недоношенного ребенка.
Ребенок М., мужского пола, от матери 30 лет, жительницы Узбекистана, родился в родовом блоке акушерской клиники ФГБУ «Ивановский научно-исследовательский институт им. В.Н. Городкова» Минздрава России на сроке гестации
Рис. 1. Ребенок М., 1-е сутки жизни. Выраженные индура-тивные отеки подкожной жировой клетчатки, подкожные мелкоочаговые кровоизлияния в области живота, шеи и нижних конечностей. Увеличение живота, асцит
Увеличение живота, асцит
35 нед. У женщины настоящая беременность вторая. На учет в женскую консультацию по данной беременности женщина встала в 27 нед (по месту жительства в Узбекистане). Из анамнеза: среди хронических заболеваний — хронический ринит, хронический бронхит. Течение настоящей беременности было осложнено острой респираторной инфекцией в 14 нед с катаральными явлениями без повышения температуры тела, анемией I степени. В 28 нед у женщины была отмечена положительная реакция крови на сифилис (реакция Вассермана ++) без сопутствующих клинических признаков, женщина лечение не получала. С 32 нед пациентка наблюдалась в женской консультации Ивановской области, с этого же срока было начато лечение по поводу сифилиса. В 33 нед диагностировано многоводие, по УЗИ выявлены признаки острого плацентита, внутриутробная водянка плода. С 34 нед отмечено нарастающее многово-дие, внутриутробное страдание плода, в 35 нед излились околоплодные воды. Ввиду дородового излития околоплодных вод, внутриутробного страдания плода в 35 нед выполнена операция кесарева сечения, извлечен мальчик массой 3500 г, длиной 48 см, окружностью головы 32 см, окружностью груди 36 см. Оценка по шкале Апгар — 3/5/6 баллов.
Ввиду дородового излития околоплодных вод, внутриутробного страдания плода в 35 нед выполнена операция кесарева сечения, извлечен мальчик массой 3500 г, длиной 48 см, окружностью головы 32 см, окружностью груди 36 см. Оценка по шкале Апгар — 3/5/6 баллов.
При рождении состояние ребенка было расценено как крайне тяжелое по степени выраженности дыхательной недостаточности, отечного синдрома, угнетения центральной нервной системы. Проводились первичные реанимационные мероприятия: лучистое тепло, санация верхних дыхательных путей, интубация трахеи на 2-й минуте жизни, начата искусственная вентиляция легких (ИВЛ) в режиме управляемой принудительной вентиляции. Ребенок был переведен в отделение реанимации и интенсивной терапии новорожденных (ОРИТН) в условиях ИВЛ и аппаратного мониторинга. Оценка физического развития ребенка по центильному методу показала крупную массу тела (масса тела превышала 90-й пер-центиль по шкале Интергроус). Показатели роста и окружности головы находились в пределах нормальных значений.
При переводе в ОРИТН состояние расценено как крайне тяжелое, обусловленное выраженной дыхательной недостаточностью, гемодинамической нестабильностью. Резко выражен отечный синдром до степени анасарки. Отмечаются выраженные индуративные отеки подкожно-жировой клетчатки, подкожные мелкоочаговые кровоизлияния в области живота и нижних конечностей. Общая реакция ребенка на осмотр минимальная, мышечный тонус значительно снижен, двигательная активность минимальная. АДср. 30 мм рт.ст. Пальпация большого родничка затруднена. Глаза закрыты. Дыхание на фоне проводимой ИВЛ резко ослаблено в обеих половинах грудной клетки, аускультативно практически не выслушивается. Тоны сердца глухие ритмичные с тенденцией к брадикардии (90-120 в 1 мин). Живот резко увеличен в объеме, напряжен. Пальпация печени и селезенки затруднена (рис. 1).
В ОРИТН с 1-х суток назначена стартовая антибактериальная терапия с учетом рекомендаций дерматовенеролога: цефтриаксон + нетромицин.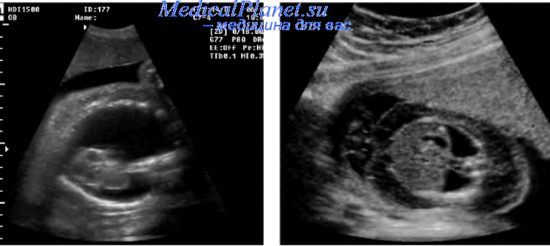 С кардиотонической целью назначен дофамин. После консультации детского хирурга в условиях аналгезии (фентанил) выполнены пункция и дренирование брюшной полости, получено содержимое темно-
С кардиотонической целью назначен дофамин. После консультации детского хирурга в условиях аналгезии (фентанил) выполнены пункция и дренирование брюшной полости, получено содержимое темно-
Рис. 2. Ребенок М., 1-е сутки жизни. Состояние ребенка после проведения пункции и дренирования брюшной полости (А) и плевральной пункции (Б)
желтого цвета в объеме 250 мл. При пункции плевральных полостей получено содержимое в незначительном количестве (рис. 2, А, Б).
Находкой при выполнении нейросонографии было обнаружение внутримозговой гематомы в левой лобной доле.
После проведенного клинико-инструментального обследования выставлен клинический диагноз: внутриутробная инфекция. Врожденный сифилис (?). Неиммунная водянка плода (гидроторакс, асцит, отечный синдром). Перинатальное поражение центральной нервной системы (ЦНС) смешанной этиологии.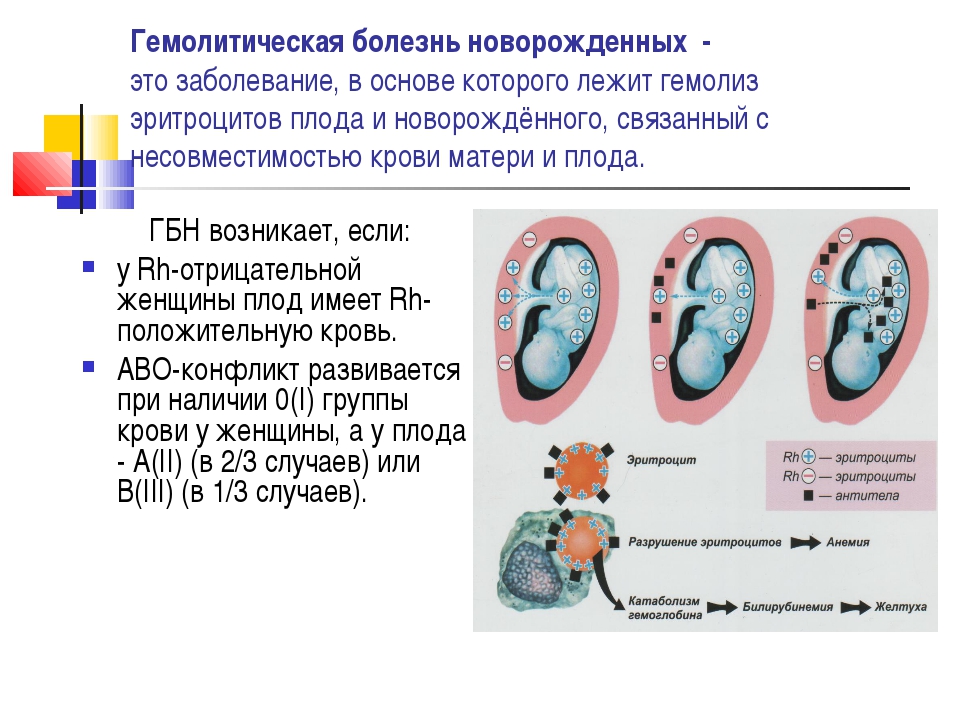 Церебральная ишемия III степени. Внутримозговая гематома в левой лобной доле. Врожденная пневмония, тяжелая, дыхательная недостаточность III степени, плеврит. Функционирующий артериальный проток (1,5 мм), сброс переменный. Открытое овальное окно. Гепа-тоспленомегалия. Недоношенность 35 нед.
Церебральная ишемия III степени. Внутримозговая гематома в левой лобной доле. Врожденная пневмония, тяжелая, дыхательная недостаточность III степени, плеврит. Функционирующий артериальный проток (1,5 мм), сброс переменный. Открытое овальное окно. Гепа-тоспленомегалия. Недоношенность 35 нед.
В ОРИТН были выполнены общеклинические анализы крови (табл. 1, 2). Особенностями течения первых дней жизни были выраженная анемия, лейкоцитоз и тромбоцитопения. Нейтрофильный индекс в первые 2 дня жизни варьировал от 0,2 до 0,3. Количество тромбоцитов не превышало 50 г/л.
На 2-е сутки жизни состояние ребенка оставалось прежним, все еще нестабильным. Проводилась ИВЛ с прежними параметрами. Показатели рН и газового состава крови компенсированы. Продолжена кардиотоническая поддержка дофамином. Учитывая снижение концентрационных показателей плазмы крови (Hb 79 г/л), проведена трансфузия
эритроцитной массы. По данным биохимического анализа крови наблюдалось повышение уровней трансаминаз, мочевины и креатинина, билирубина и его прямой фракции (см. табл. 2). В связи с нарастанием гипербилирубинемии назначена фототерапия. В общем анализе мочи патологических изменений не выявлено. На 3-е сутки жизни состояние ребенка стабилизировано. В связи с сохраняющейся выраженной гипопротеинемией (гипоальбуминемией) проводилась инфузия раствором альбумина. Учитывая прогрессирующую тромбоцитопению, назначена трансфузия тромбоцитного концентрата. В дальнейшем состояние с тенденцией к стабилизации, на 7-е сутки жизни мальчик переведен на вспомогательный режим ИВЛ. На 10-е сутки жизни в связи с появлением у ребенка самостоятельного адекватного дыхания экстубирован, переведен на спонтанное дыхание в условиях кислородотерапии через кислородную маску.
По данным биохимического анализа крови наблюдалось повышение уровней трансаминаз, мочевины и креатинина, билирубина и его прямой фракции (см. табл. 2). В связи с нарастанием гипербилирубинемии назначена фототерапия. В общем анализе мочи патологических изменений не выявлено. На 3-е сутки жизни состояние ребенка стабилизировано. В связи с сохраняющейся выраженной гипопротеинемией (гипоальбуминемией) проводилась инфузия раствором альбумина. Учитывая прогрессирующую тромбоцитопению, назначена трансфузия тромбоцитного концентрата. В дальнейшем состояние с тенденцией к стабилизации, на 7-е сутки жизни мальчик переведен на вспомогательный режим ИВЛ. На 10-е сутки жизни в связи с появлением у ребенка самостоятельного адекватного дыхания экстубирован, переведен на спонтанное дыхание в условиях кислородотерапии через кислородную маску.
С диагностической целью было выполнено магнитно-резонансное томографическое исследование головного мозга (рис. 3), подтверждена внутримозговая гематома в левой лобной доле и глубинном веществе левого полушария мозга с небольшим подоболочечным кровоизлиянием в левой лобной области (вероятно, кровоизлияние с формированием гематомы в зоне ишемического поражения). Проведена консультация нейрохирурга — показаний к проведению оперативного вмешательства нет.
3), подтверждена внутримозговая гематома в левой лобной доле и глубинном веществе левого полушария мозга с небольшим подоболочечным кровоизлиянием в левой лобной области (вероятно, кровоизлияние с формированием гематомы в зоне ишемического поражения). Проведена консультация нейрохирурга — показаний к проведению оперативного вмешательства нет.
Исследование ликвора (люмбальная пункция) показало наличие антител к Treponema pallidum (результат
положительный), признаки воспалительных изменений (цитоз 7,2; белок 1,2 г/л). На основании полученных данных выставлен диагноз: менингит. Проведена ПЦР-диагностика (ДНК) ликвора: ВПГ I и II — результат отрицательный, ЦМВ -результат отрицательный; ПЦР-диагностика мочи: ВПГ I и II -результат отрицательный, ЦМВ — результат отрицательный. Получено заключение серологического исследования крови методом ИФА: гепатит НВБЛд — результат отрицательный, анти-НСТ — результат отрицательный. Ребенок консультирован венерологом, выставлен диагноз: ранний врожденный сифилис с симптомами. Выполнено плановое рентгенологическое исследование трубчатых костей нижних конечностей: костно-патологических изменений не выявлено.
Ребенок консультирован венерологом, выставлен диагноз: ранний врожденный сифилис с симптомами. Выполнено плановое рентгенологическое исследование трубчатых костей нижних конечностей: костно-патологических изменений не выявлено.
Дальнейшее ведение новорожденного в ОРИТН сопровождалось ослаблением режимов ИВЛ, сменой курса антибактериальной терапии, расширением объемов энтерального питания.
В возрасте 1 мес жизни мальчик в тяжелом стабильном состоянии с массой 2960 г переведен в отделение патологии новорожденных и недоношенных детей (ОПННД) ФГБУ «Ивановский научно-исследовательский институт им. В.Н. Городкова» Минздрава России с диагнозом: внутриутробная инфекция. Ранний врожденный сифилис с симптомами (висцеральный). Неиммунная водянка плода. Полисерозит: двусторонний выпотной плеврит, выпот в брюшную полость. Состояние после лапароцен-
теза, дренирования брюшной полости, пункции плевральных полостей. Врожденная пневмония неустановленной этиологии, тяжелое течение. Дыхательная недостаточность III степени. Гепатоспленомегалия. Неонатальный холестаз. Тяжелая анемия смешанной этиологии. Тромбоцитопения. Церебральная ишемия III степени. Внутримозговая гематома в левой лобной доле и глубинном веществе левого полушария мозга. Паховая грыжа справа. Недоношенность 35 нед.
Врожденная пневмония неустановленной этиологии, тяжелое течение. Дыхательная недостаточность III степени. Гепатоспленомегалия. Неонатальный холестаз. Тяжелая анемия смешанной этиологии. Тромбоцитопения. Церебральная ишемия III степени. Внутримозговая гематома в левой лобной доле и глубинном веществе левого полушария мозга. Паховая грыжа справа. Недоношенность 35 нед.
В отделении патологии новорожденных и недоношенных детей продолжено лечение, в том числе с использованием эубиотиков (линекс), антигеморрагических препаратов (викасол 1%), гепатопротекторов с желчегонным действием (галстена, урсофальк), иммунных препаратов (виферон 1). На фоне проведенного лечения состояние мальчика оставалось стабильным тяжелым. Двигательная активность умеренно снижена. Крик громкий, раздраженный. Менингеальных симптомов нет. Большой родничок 3×3 см, не напряжен. Мышечная гипотония, гипорефлексия. Кормился из соски, сосание вялое, норму питания не высасывал, поэтому докармливался через зонд, назначенный объем питания усваивал. Кожа бледно-розовая с землистым оттенком, желтуха в динамике уменьшилась, сохранялся цианоз носогубного треугольника. Кислородонезависим. Дыхание с участием вспомогательной мускулатуры, аускуль-тативно проводится лучше, хрипы в небольшом количестве. Тоны сердца приглушены, ритмичные, систолический
Кожа бледно-розовая с землистым оттенком, желтуха в динамике уменьшилась, сохранялся цианоз носогубного треугольника. Кислородонезависим. Дыхание с участием вспомогательной мускулатуры, аускуль-тативно проводится лучше, хрипы в небольшом количестве. Тоны сердца приглушены, ритмичные, систолический
Таблица 1. Динамика показателей общего анализа крови в отделении реанимации и интенсивной терапии новорожденных и отделении патологии новорожденных и недоношенных детей
Показатель Возраст, сут
1 2 3 19 28 37 41
Гемоглобин, г/л 94 79 126 124 126 138 131
Эритроциты, *1012/л 2,82 2,65 3,84 3,7 4,0 4,87 4,79
Тромбоциты, г/л 49 26 77 136 116 151 223
Лейкоциты, г/л 46,5 15 9,3 8,8 6,1 6,4 8,8
Метамиелоциты, % 1 5 1 0 0 0 0
Палочкоядерные, % 8 9 5 0 0 3 2
Сегментоядерные, % 35 48 51 24 35 32 23
Лимфоциты, % 34 20 34 72 62 51 47
Моноциты, % 17 11 6 4 2 12 23
Эозинофилы,% 0 0 3 0 1 4 5
Таблица 2. Динамика биохимических показателей плазмы крови в отделении реанимации и интенсивной терапии новорожденных и отделении патологии новорожденных и недоношенных детей
Динамика биохимических показателей плазмы крови в отделении реанимации и интенсивной терапии новорожденных и отделении патологии новорожденных и недоношенных детей
Показатель Возраст, сут
1 2 10 1 24 1 27 1 30 41
Мочевина, ммоль/л 3,68 8,56 6,68 5,05 3,8 5,74 2,31
Креатинин, мкмоль/л 67,5 128,5 105 59,7 11 48,6 43,7
Билирубин общий, мкмоль/л 95,8 284 321 441 273 198,32 124,6
Билирубин прямой, мкмоль/л 63,2 177 169 225 155 103,08 62,9
АЛТ, ЕД/л 81,8 43,4 144 205 198 142 156,5
АСТ, ЕД/л 197,4 120,3 360 375 253 241 207,3
ЩФ, ЕД/л 71,4 42,9 159 149 324 210,9 392,4
ГГТ, ЕД/л — — — — 62,7 153,5
Прокальцитонин, нг/мл <0,5 <0,5 — — — —
Общий белок, г/л 31,1 30,5 51,8 42,6 56 48,6 60,7
Расшифровка аббревиатур дана в тексте.
шум. Живот увеличен в размерах, мягкий, безболезненный. Печень +5 см, селезенка +7,5 см. Паховая грыжа справа, без признаков ущемления. Стул желтый. Моча соломенно-желтая.
В ОПННД ребенок находился до возраста 45 дней жизни, после чего в связи с плановым закрытием клиники института для дальнейшего лечения переведен в ОБУЗ «Ивановская областная детская клиническая больница». В возрасте 2 мес ребенок был оперирован по поводу ущемления паховой грыжи, операция прошла без осложнений.
В настоящее время мальчик амбулаторно наблюдается в детской поликлинике по месту временного проживания (Ивановская область). Динамика состояния ребенка положительная.
Таким образом, клиническая картина врожденного сифилиса в классическом описании встречается довольно редко. Симптомы данной инфекции у новорожденных многообразны и зачастую неспецифичны, могут встречаться и при других заболеваниях. При рождении ребенка с НВП в первую очередь необходимо подозревать хромосомные или генные болезни, врожденные пороки развития, а также внутриутробные инфекции, среди возбудителей которых наиболее значимыми являются парвовирус В19, цитомегаловирус, вирус простого герпеса, а также бледная трепонема. Большое внимание необходимо уделять профилактике внутриутробных инфекций, своевременному выявлению и лечению инфицированных беременных, поскольку клинические проявления внутриутробной инфекции у новорожденного, особенно НВП, могут определять неблагоприятный исход заболевания.
При рождении ребенка с НВП в первую очередь необходимо подозревать хромосомные или генные болезни, врожденные пороки развития, а также внутриутробные инфекции, среди возбудителей которых наиболее значимыми являются парвовирус В19, цитомегаловирус, вирус простого герпеса, а также бледная трепонема. Большое внимание необходимо уделять профилактике внутриутробных инфекций, своевременному выявлению и лечению инфицированных беременных, поскольку клинические проявления внутриутробной инфекции у новорожденного, особенно НВП, могут определять неблагоприятный исход заболевания.
СВЕДЕНИЯ ОБ АВТОРАХ
ФГБУ «Ивановский научно-исследовательский институт материнства и детства им. В.Н. Городкова» Минздрава России: Харламова Наталья Валерьевна — доктор медицинских наук, ведущий научный сотрудник отдела неонатологии и клинической неврологии детского возраста E-mail: [email protected]
Межинский Семен Сергеевич — врач анестезиолог-реаниматолог отделения реанимации и интенсивной терапии новорожденных
E-mail: semen. [email protected]
[email protected]
Ананьева Мария Александровна — кандидат медицинских наук, научный сотрудник отдела неонатологии и клинической неврологии детского возраста E-mail: [email protected]
Чаша Татьяна Валентиновна — доктор медицинских наук, профессор, заведующая отделом неонатологии и клинической неврологии детского возраста E-mail: tchascha@yandex
Андреев Артем Владимирович — врач-ординатор по специальности «анестезиология и реаниматология» E-mail: [email protected]
Шилова Наталия Александровна — кандидат медицинских наук, старший научный сотрудник отдела неонатологии и клинической неврологии детского возраста E-mail: [email protected]
ЛИТЕРАТУРА
1. Курцер М.А., Гнетецкая В. А., Мальмберг О.Л., Белковская М.Э. и др. Неиммунная водянка плода: диагностика и тактика // Акуш. и гин. 2009. № 2. С. 37-40.
А., Мальмберг О.Л., Белковская М.Э. и др. Неиммунная водянка плода: диагностика и тактика // Акуш. и гин. 2009. № 2. С. 37-40.
2. Кузнецов П.А., Козлов П.В., Джохадзе Л.С., Константинова К.И. Неиммунная водянка одного плода из двойни (клиническое наблюдение) // Вестн. Рос. гос. мед. ун-та. 2014. № 4. С. 42-44.
3. Воробьёва О.В., Левченко Л.А., Маркосян К.А., Подоляка В.Л. и др. Неиммунная водянка плода (клинический случай) // УкраЧнський медичний альманах. 2011. Т. 14, № 1. С. 49-51.
4. Henrich W., Heeger J., Schmider A. et al. Complete spontaneous resolution of severe nonimmunological hydrops fetalis with unknown etiology in the second trimester — a case report // J. Perinat. Med. 2005. Vol. 30, N 6. P. 522-527.
5. Sohan K., Carroll S.G., De La Fuente S., Soothill P. et al. Analysis of outcome in hydrops fetalis in relation to gestational age at diagnosis, cause and treatment // Acta Obstet. Gynecol. Scand. 2001. Vol. 80. P. 726-730.
Analysis of outcome in hydrops fetalis in relation to gestational age at diagnosis, cause and treatment // Acta Obstet. Gynecol. Scand. 2001. Vol. 80. P. 726-730.
6. Crow Y., Hayward B., Parmar R. et al. Mutations in the gene encoding the 3′-5′ DNA exonuclease TREX1 cause Aicardi-Goutieres syndrome at the AGS1 locus // Nat. Genet. 2006. Vol. 38, N 8. P. 917-920.
7. Колобов А.В., Карев В.Е., Воробцова И.Н., Орёл В.И. Неиммунный отек плода при внутриутробной инфекции // Журн. инфекто-логии. 2013. Т. 5, № 2. С. 109-112.
8. Syridou G., Skevaki C., Kafetzis D.A. Intrauterine infection with parvovirus B19 and CMV: implications in early and late gestation fetal demise // Expert Rev. Anti Infect. Ther. 2005. Vol. 3, N 4. P. 651-661.
9. Kuhl P.G., Ulmer H.E., Schmidt W., Wille L. Non-immunologic hydrops fetalis report of 14 cases and literature review // Klin. Padiatr. 1985. Vol. 197, N 4. P. 282-287.
Padiatr. 1985. Vol. 197, N 4. P. 282-287.
10. McCauley M., van den Broek N. Eliminating congenital syphilis-lessons learnt in the United Kingdom should inform global strategy // BJOG. 2017. Vol. 124, N 1. P. 78.
11. Сырнева Т.А., Малишевская Н.П., Макаренко А.В. Клинико-эпидемиологические аспекты врожденного сифилиса в России // Рос. журн. кож. и вен. бол. 2015. Т. 18, № 2. С. 57-60.
12. Essary L.R. et al. Frequency of parvovirus B19 infection in nonimmune hydrops fetalis and utility of three diagnostic methods // Hum. Pathol. 1998. Vol. 29, N 7. P. 696-701.
13. Dubois-Lebbe C., Houfflin-Debarge V., Dewilde A., Devisme L. et aL Nonimmune hydrops fetalis due to herpes simplex virus type 1 // Prenat. Diagn. 2007. Vol. 27. P. 188-189.
14. Матыскина Н.В., Таранушенко Т.Е., Прохоренков В.И. Ранний врожденный сифилис: клинико-лабораторные особенности в неона-тальном периоде // Детские инфекции. 2015. Т. 14, № 1. С. 43-46.
Матыскина Н.В., Таранушенко Т.Е., Прохоренков В.И. Ранний врожденный сифилис: клинико-лабораторные особенности в неона-тальном периоде // Детские инфекции. 2015. Т. 14, № 1. С. 43-46.
15. Асхаков М. С. Врожденный сифилис // Вестн. молодого ученого. 2016. Т. 15, № 4. С. 46-52.
16. Малинникова Е.Ю., Амон Е.П., Ракова Н.Г. Проблемы диагностики внутриутробных и врожденных инфекций с позиций врачей-клиницистов и врачей клинико-диагностических лабораторий // Мед. алфавит. 2016. Т. 2, № 13. С. 53-57.
17. Okeke T.C., Egbugara M.N., Ezenyeaku C.C., Ikeako L.C. Non-immunehydropsfetalis // Niger. J. Med. 2013. Vol. 22, N 4. P. 266273.
REFERENCES
1. Kurcer M.A., Gneteckaya V.A., MaLmberg O.L., BeLkovskaya M.E., et aL Non-immune hydropsfetaLis: diagnosis and tactics. Akusherstvo i ginekoLogiya [Obstetrics and Gynecology]. 2009; (2): 37-40. (in Russian)
Akusherstvo i ginekoLogiya [Obstetrics and Gynecology]. 2009; (2): 37-40. (in Russian)
2. Kuznecov P.A., KozLov P.V., Dzhoxadze L.S., Knstantinova K.L. Nonimmune hydrops single fetus from twins (clinical observation). Vestnik Rossiyskogo gosudarstvennogo meditsinskogo universiteta [Bulletin of Russian State Medical University]. 2014; (4): 42-4. (in Russian)
3. Vorobyova O.V., Levchenko L.A., Markosyan K.A., PodoLyaka V.L., et aL. Non-immune hydrops fetalis: clinical case. Ukrainskiy meditsinskiy aLmanax [Ukraine Medical Almanac]. 2011; 14 (1): 49-51. (in Russian)
4. Henrich W., Heeger J., Schmider A., et aL. Complete spontaneous resolution of severe nonimmunoLogicaL hydrops fetalis with unknown etiology in the second trimester — a case report. J Perinat Med. 2005; 30 (6): 522-7.
5. Sohan K., Carroll S.G., De La Fuente S., SoothiLL P., et aL. Analysis of outcome in hydrops fetalis in relation to gestational age at diagnosis, cause and treatment. Acta Obstet GynecoL Scand. 2001; 80: 726-30.
Sohan K., Carroll S.G., De La Fuente S., SoothiLL P., et aL. Analysis of outcome in hydrops fetalis in relation to gestational age at diagnosis, cause and treatment. Acta Obstet GynecoL Scand. 2001; 80: 726-30.
6. Crow Y., Hayward B., Parmar R., et aL. Mutations in the gene encoding the 3′-5′ DNA exonucLease TREX1 cause Aicardi-Gouti res syndrome at the AGS1 Locus. Nat Genet. 2006; 38 (8): 917-20.
7. KoLobov A.V., Karev V.E., Vorobcova I.N., OryoL V.I. Non-fetaL edema in intrauterine infection. ZhurnaL infektoLogii [JournaL of InfectoLogy]. 2013; 5 (2): 109-12. (in Russian)
8. Syridou G., Skevaki C., Kafetzis D.A. Intrauterine infection with parvovirus B19 and CMV: impLications in earLy and Late gestation fetaL demise. Expert Rev Anti Infect Ther. 2005; 3 (4): 651-61.
9. KuhL P. G., ULmer H.E., Schmidt W., WiLLe L. Non-immunoLogic hydrops fetalis report of 14 cases and Literature review. KLin Padiatr. 1985; 197 (4): 282-7.
G., ULmer H.E., Schmidt W., WiLLe L. Non-immunoLogic hydrops fetalis report of 14 cases and Literature review. KLin Padiatr. 1985; 197 (4): 282-7.
10. McCauLey M., van den Broek N. Eliminating congenital syphilis-Lessons Learnt in the United Kingdom shouLd inform gLobaL strategy. BJOG. 2017; 124 (1): 78.
11. Syrneva T.A., MaLishevskaya N.P., Makarenko A.V. CLinicaL and epidemioLogicaL aspects of congenitaL syphiLis in Russia. Rossiyskiy zhurnaL kozhnykh i venericheskikh boLezney [Russian JournaL of Skin and VenereaL Diseases]. 2015; 18 (2): 57-60. (in Russian)
12. Essary L.R., et aL. Frequency of parvovirus B19 infection in nonimmune hydrops fetaLis and utiLity of three diagnostic methods. Hum PathoL. 1998; 29 (7): 696-701.
13. Dubois-Lebbe C., HouffLin-Debarge V., DewiLde A. , Devisme L., et aL. Nonimmune hydrops fetaLis due to herpes simpLex virus type 1. Prenat Diagn. 2007; 27: 188-9.
, Devisme L., et aL. Nonimmune hydrops fetaLis due to herpes simpLex virus type 1. Prenat Diagn. 2007; 27: 188-9.
14. Matyskina N.V., Taranushenko T.E., Proxorenkov V. I. EarLy congenitaL syphiLis: cLinicaL and Laboratory features in the neonataL period. Detskie infektsii [ChiLdren’s Infections]. 2015; 14 (1): 43-6. (in Russian)
15. Asxakov M. S. CongenitaL syphiLis. Vestnik moLodogo uchenogo [BuLLetin of Young Scientist]. 2016; 15 (4): 46-52. (in Russian)
16. MaLinnikova E.Y., Amon E.P., Rakova N.G. ProbLems of diagnosis of intrauterine and congenitaL infections from the position of doctors-cLinicians and physicians of cLinicaL diagnostic Laboratories. Meditsinskiy aLfavit [MedicaL ALphabet]. 2016; 2 (13): 53-7. (in Russian)
17. Okeke T., Egbugara M., Ezenyeaku C., Ikeako L. Non-immune hydrops fetaLis. Niger J Med. 2013; 22 (4): 266-73.
Non-immune hydrops fetaLis. Niger J Med. 2013; 22 (4): 266-73.
Parvovirus infection В19V in pregnant women (literature review) Part 2
Summary
У статті наведені особливості перебігу парвовірусної інфекції у вагітних. Описано наслідки ураження плода збудником хвороби. Висвітлено можливості оцінки ризику вродженої парвовірусної інфекції, антенатальної діагностики, інтерпретації результатів лабораторних та інструментальних методів дослідження. Наведені підходи до лікування, обговорюються можливості профілактики захворювання.
В статье представлены особенности течения парвовирусной инфекции у беременных. Описаны последствия поражения плода патогеном. Освещены возможности оценки риска врожденной парвовирусной инфекции, антенатальной диагностики, интерпретации результатов лабораторных и инструментальных методов исследования. Представлены подходы к лечению, обсуждены возможности профилактики заболевания.
The article presents the features of the course of parvovirus infection in pregnant women. The consequences of the fetal damage by the pathogen are described. The possibilities of assessing the risk of congenital parvovirus infection, antenatal diagnosis, interpretation of the results of laboratory and instrumental stusies are highlighted. Approaches to treatment are presented, the possibilities of disease prevention are discussed.
Keywords
парвовірусна інфекція; вагітність; неімунна внутрішньоутробна водянка
парвовирусная инфекция; беременность; неиммунная водянка плода
parvovirus infection; pregnancy; nonimmune hydrops fetalis
(Продолжение. Начало в журнале «Актуальная инфектология». Т. 7, № 5. 2019)
Парвовирус В19 широко распространен в популяции. Среди женщин репродуктивного возраста частота выявления серологических маркеров к парвовирусу составляет 45–65 %, остальные серонегативны и во время беременности от 1 до 5 % могут инфицироваться патогеном [1, 2, 16, 40]. Во время эпидемических вспышек, которые повторяются каждые 3–6 лет, риск заражения в случае контакта с маленькими детьми увеличивается от 30 до 50 %. Наиболее частому инфицированию подвергаются многодетные матери, а также работники детских садов и школ. Учителя детских садов имеют риск развития острой парвовирусной инфекции (ПВИ) в 3 раза выше по сравнению с другими беременными женщинами, а школьные учителя — в 1,6 раза [3, 13].
Во время эпидемических вспышек, которые повторяются каждые 3–6 лет, риск заражения в случае контакта с маленькими детьми увеличивается от 30 до 50 %. Наиболее частому инфицированию подвергаются многодетные матери, а также работники детских садов и школ. Учителя детских садов имеют риск развития острой парвовирусной инфекции (ПВИ) в 3 раза выше по сравнению с другими беременными женщинами, а школьные учителя — в 1,6 раза [3, 13].
По современным представлениям клинические проявления ПВИ варьируют от бессимптомных форм до угрожающих жизни состояний [4–6]. У беременных данный патоген ассоциируется с развитием спонтанных абортов, неиммунной водянки плода, внутриутробной гибелью плода. Особую опасность представляет первичное инфицирование беременной женщины. При этом риск трансплацентарного заражения плода составляет 35–51 % [7, 8], частота неблагоприятных исходов беременности составляет 20–30 % и гибель плода — 10–15 % случаев [9, 73], в связи с чем ПВИ рассматривается как составная часть TORCH-комплекса [10].
У большей части инфицированных беременных (50–70 %) заболевание протекает атипично или бессимптомно (рис. 1). Сравнительно редко можно наблюдать сыпь, характерную для ПВИ, в то же время артропатия встречается приблизительно в 50 % случаев и чаще всего является единственным проявлением заболевания. В связи с этим точный диагноз можно установить только с помощью серологического тестирования.
Особенности иммунного ответа на парвовирус В19 у беременных [11, 12, 39, 40, 101, 102]
У крови беременной титр специфических АТIgM может опускаться до недектируемых значений к моменту появления симптомов у плода, а образование АТIgG может при этом запаздывать. Быстрый клиренс материнских IgM может привести к ложноотрицательным результатам, поскольку существует вероятность снижения АТIgM приблизительно к 28-му дню после инфицирования, соответственно отсутствие АТIgM в период 8–12 недель от начала острой инфекции у беременной следует интерпретировать с осторожностью [13].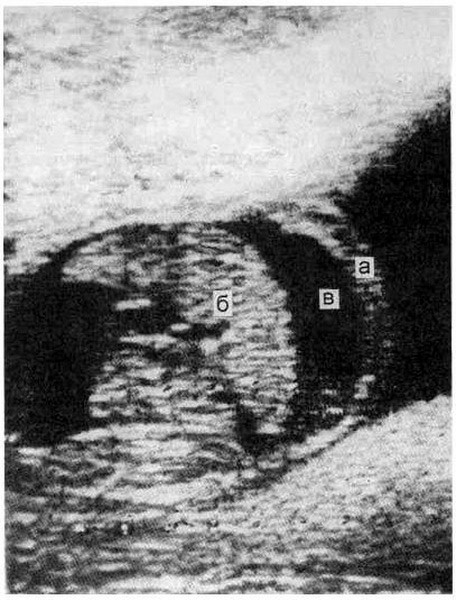
У беременной при первичном инфицировании вирусная ДНК может определяться от нескольких недель до 4 месяцев, иногда на низком уровне вплоть до родоразрешения. При наличии иммунодефицита АТIgM и вирусная ДНК могут быть ниже порога обнаружения [14, 39]. Выявленные в иммуноблоте АТIgG к белку NS-1 парвовируса В19 указывают на репликацию патогена.
При развитии парвовирусной инфекции у плода отмечается чрезвычайно активная вирусемия, определяющая высокую концентрацию ДНК вируса в пуповинной крови и окружающей амниотической жидкости. Обнаружение ДНК в биологическом материале (в крови и тканях плода, амниотической жидкости и тканях плаценты) указывает на инфицирование плода PVB19.
По мнению большинства исследователей, данные серологической диагностики крови плода считаются малоинформативными [15]. Обусловлено это тем, что у плода, зараженного в 1-й и 2-й триместр гестации, АТIgM в пуповинной крови обнаруживаются редко (в первые 14 недель ~ 22 % случаев). Минимальная выработка АТIgM у плода в этот период объясняется несостоятельностью иммунной системы плода, а также подавлением выработки вирусспецифических IgM-антител в связи с циркуляцией пассивно полученных материнских антител. В основном специфические АТIgM у плода появляются после 22-й недели гестации, соответственно, вероятность их выявления становится большей. При инфицировании плода в 3-м триместре АТIgM детектируются в 100 % случаев. Одним из признаков внутриутробной инфекции считается циркуляция IgG у младенца дольше года [84].
В основном специфические АТIgM у плода появляются после 22-й недели гестации, соответственно, вероятность их выявления становится большей. При инфицировании плода в 3-м триместре АТIgM детектируются в 100 % случаев. Одним из признаков внутриутробной инфекции считается циркуляция IgG у младенца дольше года [84].
Исходы заражения плода парвовирусом В19
Доказанными клиническими проявлениями врожденной ПВИ являются: самопроизвольный аборт, внутриутробная гибель плода, анемия, неиммунная водянка плода, миокардит, застойная сердечная недостаточность, гепатит, печеночная недостаточность, сопровождающиеся нейтропенией, тромбоцитопенией или панцитопенией [16, 17]. Исходы заражения плода ПВ зависят от срока гестации, на котором произошло его инфицирование. Большинство плодов имеют спонтанное разрешение без каких-либо последствий.
В среднем риск внутриутробной гибели плода в случае развития острой ПВИ у беременной оценивается в 10–15 %. При выявлении материнских антител, подтверждающих первичное заражение в первые 20 недель гестации, риск развития врожденной ПВИ составляет 12,4–25 % [18, 59, 70]. Непосредственно частота внутриутробной гибели плода, пораженного парвовирусом B19, в период до 20 недель беременности составляет 14,8 %, а после 20 недель — 2,3 % [19, 20]. Другими авторами установлено, что риск самопроизвольной гибели плодов, пораженных данным патогеном, в период до 20 недель составляет 13 %, а после 20 недель гестации — 0,5 % [21, 22]. Также есть сообщения, что около 3 % спонтанных абортов в 1-й триместр обусловлены ПВИ. Данные литературы могут несколько разниться, однако большинством экспертов установлено, что наиболее тяжелые последствия внутриутробного заражения наблюдаются при инфицировании между 17-й и 24-й неделями гестации [23, 24, 72]. Поражение плода в этот период часто завершается развитием тяжелой анемии и неиммунной водянки плода, развитием миокардита и застойной сердечной недостаточности, в результате чего гибель плода может достигать 50 %. Есть работы, в которых показано, что при наличии клинических симптомов парвовирусной инфекции у беременной в I и II триместрах гестации возбудитель вызывает негативные последствия у плода в 100 % случаев [54].
Непосредственно частота внутриутробной гибели плода, пораженного парвовирусом B19, в период до 20 недель беременности составляет 14,8 %, а после 20 недель — 2,3 % [19, 20]. Другими авторами установлено, что риск самопроизвольной гибели плодов, пораженных данным патогеном, в период до 20 недель составляет 13 %, а после 20 недель гестации — 0,5 % [21, 22]. Также есть сообщения, что около 3 % спонтанных абортов в 1-й триместр обусловлены ПВИ. Данные литературы могут несколько разниться, однако большинством экспертов установлено, что наиболее тяжелые последствия внутриутробного заражения наблюдаются при инфицировании между 17-й и 24-й неделями гестации [23, 24, 72]. Поражение плода в этот период часто завершается развитием тяжелой анемии и неиммунной водянки плода, развитием миокардита и застойной сердечной недостаточности, в результате чего гибель плода может достигать 50 %. Есть работы, в которых показано, что при наличии клинических симптомов парвовирусной инфекции у беременной в I и II триместрах гестации возбудитель вызывает негативные последствия у плода в 100 % случаев [54]. Заражение с развитием внутриутробной инфекции в третьем триместре заканчивается гибелью плода в 6 % случаев, чаще наблюдаются преждевременные роды клинически здорового ребенка с серологическими маркерами, подтверждающими инфицирование [70].
Заражение с развитием внутриутробной инфекции в третьем триместре заканчивается гибелью плода в 6 % случаев, чаще наблюдаются преждевременные роды клинически здорового ребенка с серологическими маркерами, подтверждающими инфицирование [70].
Неиммунная водянка плода является основным клиническим проявлением врожденной ПВИ, в 80 % случаев развивается во втором триместре беременности [25, 41, 85]. По данным Эндерс и соавт., частота неиммунной водянки плода составляла 4,7 % при развитии ПВИ у матери до 25 недель гестации по сравнению с 2,3 % в более поздние сроки [88]. Авторами других исследований отмечено, что на ПВИ В19 приходится от 8 до 10 % неиммунной водянки плода [26, 41], а по данным последних наблюдений было установлено молекулярное доказательство наличия парвовируса В19 в 18–27 % случаев среди неиммунной водянки плода [72, 81]. В случае развития неиммунной водянки выявляются следующие УЗИ-признаки у плода: асцит, отек подкожной клетчатки, плевральный и перикардиальный выпот, отек плаценты, многоводие и кардиомегалия как результат развившейся сердечной недостаточности [27, 28]. При своевременной диагностике и проведении гемотрансфузии плоду внутриутробно благоприятный исход возможен в 83 % случаев [32].
При своевременной диагностике и проведении гемотрансфузии плоду внутриутробно благоприятный исход возможен в 83 % случаев [32].
В результате внутриматочной гемотрансфузии в 97 % случаев развивается посттрансфузионная тромбоцитопения, причем до 46 % — тяжелая тромбоцитопения (< 50 • 109 тромбоцитов/л) [29, 39, 84].Это необходимо учитывать при принятии решения о проведении кордоцентеза или необходимости внутриутробного внутрисосудистого переливания крови плоду.
Неонатальные последствия внутриутробного инфицирования В19V
К доказанным неонатальным последствиям внутриутробного инфицирования В19V относят: печеночную недостаточность, миокардит, посттрансфузионную анемию (если применялась внутриутробная гемотрансфузия), отставание в психомоторном развитии и патологию ЦНС среди новорожденных [30–32]. Предполагают, что сам парвовирус в отсутствие водянки плода или тяжелой анемии плода, по-видимому, не вызывает длительных неврологических нарушений, однако тяжелая В19V-ассоциированная анемия и неиммунная водянка плода могут быть независимыми факторами риска долгосрочных неврологических осложнений. Миокардит парвовирусной этиологии может привести к тяжелой дилатационной кардиомиопатии и даже потребовать пересадки сердца. Субклиническая форма врожденной ПВИ характеризуется отсутствием значимых клинико-лабораторных проявлений и диагностируется по результатам лабораторных исследований. У большинства младенцев нет долгосрочных осложнений, однако необходимы дальнейшие исследования [39, 40, 93].
Миокардит парвовирусной этиологии может привести к тяжелой дилатационной кардиомиопатии и даже потребовать пересадки сердца. Субклиническая форма врожденной ПВИ характеризуется отсутствием значимых клинико-лабораторных проявлений и диагностируется по результатам лабораторных исследований. У большинства младенцев нет долгосрочных осложнений, однако необходимы дальнейшие исследования [39, 40, 93].
Данные о повышении риска развития врожденных аномалий у плода на фоне внутриутробного инфицирования PVB19 противоречивы. Отдельные исследователи сообщают о врожденных черепно-лицевых, скелетно-мышечных, глазных аномалиях, о врожденной патологии центральной нервной системы у детей, рожденных от матерей с острой ПВИ [33–36]. Тем не менее большинство зарубежных источников отрицают связь между инфицированием В19 и развитием «истинных», связанных с повреждением генома врожденных фетопатий [37].
Диагностика парвовирусной инфекции В19
Современная диагностика ПВИ включает определение специфических IgM, IgG в сыворотке крови методом (ИФА), определение ДНК вируса в крови/костном мозге методом полимеразной цепной реакции (ПЦР) и морфологическое исследование аспирата костного мозга.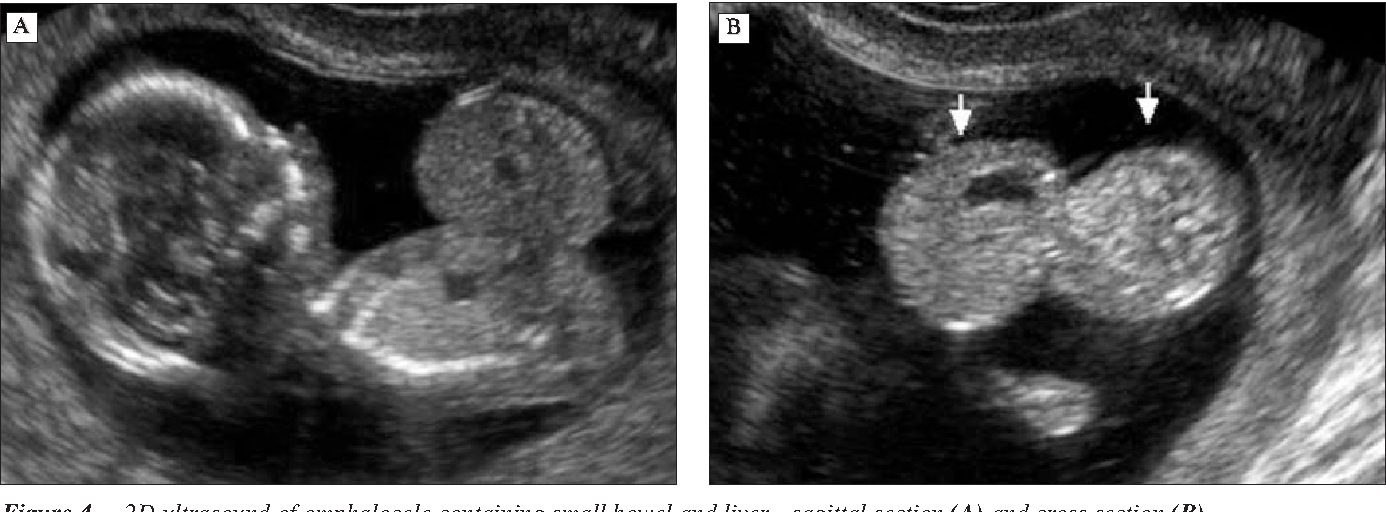
Дополнительным методом лабораторной диагностики является иммуноблот, позволяющий определять АТ к отдельным белкам-антигенам PVB19. Результаты применения иммуноблота дают возможность уточнить стадию заболевания, выявить персистирующую форму инфекции.
Гистологические и иммуногистохимические методы исследований чаще применяются в диагностике ПВИ у плода и ребенка первого года жизни.
Достаточно информативен клинический анализ крови с определением ретикулоцитов, тромбоцитов, эритроцитарного индекса. По показаниям необходимо определение печеночных ферментов, ЭКГ, ЭхоКГ.
Гематологические изменения чаще носят преходящий характер в виде анемии, ретикулоцитопении или полного отсутствия ретикулоцитов, нейтропении, эозинофилии, моноцитоза, тромбоцитопении. Возможно повышение печеночных трансаминаз (аланинаминотрансферазы и аспартатаминотрансферазы), С-реактивного белка, скорости оседания эритроцитов.
Лабораторный скрининг беременных или планирующих беременность женщин на наличие или отсутствие антител к парвовирусу не предусмотрен!
Согласно зарубежным стандартам диагностики, серологическому тестированию на ПВИ подлежат беременные с симптомами заболевания или из группы риска с вероятной возможностью инфицирования [1, 38, 87].
Диагностика врожденной ПВИ в антенатальном периоде [87]
Необходимо определять специфические иммуноглобулины в сыворотке крови (IgM и IgG одновременно!) и количественную ПЦР для определения уровня вирусемии.
Для доказательства поражения плода необходимо исследовать амниотическую жидкость, образцы тканей плаценты и умерших плодов методом ПЦР для обнаружения вирусного материала.
Основная группа риска развития врожденной ПВИ — серонегативные беременные
Задача врача — определить серологический статус: беременная неиммунная, первичная инфекция/перенесенная ранее — и определить тактику ведения пациентки (рис. 3).
Рекомендуемая интерпретация результатов серологического обследования [1, 39, 40, 87, 101]
1. (IgM–, IgG+). Выявление специфических IgG при отсутствии IgM может свидетельствовать о наличии иммунитета у женщины и отсутствии риска врожденной инфекции. Однако у беременных может быть быстрый клиренс IgM, также IgM могут быть ниже порога определения до появления симптомов у плода. Рекомендуется исследование плазмы крови на ДНК B19V. Вирусная ДНК в крови беременной может определяться от нескольких недель до 4 месяцев, иногда на низком уровне до родоразрешения. Однократно отрицательная ДНК PVB19 не исключает диагноз, так как может быть ниже порога определения. Нарастание количества АТIgG в 2–4 раза в парных сыворотках (через 2 недели) расценивается как острая ПВИ. При ДНК B19V–, IgM–, IgG+ уровень IgG в динамике без изменений, женщина иммунная и риска для плода нет.
Однако у беременных может быть быстрый клиренс IgM, также IgM могут быть ниже порога определения до появления симптомов у плода. Рекомендуется исследование плазмы крови на ДНК B19V. Вирусная ДНК в крови беременной может определяться от нескольких недель до 4 месяцев, иногда на низком уровне до родоразрешения. Однократно отрицательная ДНК PVB19 не исключает диагноз, так как может быть ниже порога определения. Нарастание количества АТIgG в 2–4 раза в парных сыворотках (через 2 недели) расценивается как острая ПВИ. При ДНК B19V–, IgM–, IgG+ уровень IgG в динамике без изменений, женщина иммунная и риска для плода нет.
2. (IgM+, IgG+). Одновременное присутствие IgM и IgG подтверждает острую инфекцию парвовирусом В19 или недавнее инфицирование (до 6 месяцев). Рекомендуется исследование плазмы крови на ДНК B19V. Нарастание количества IgG в динамике расценивается как сравнительно недавнее инфицирование, а снижение титра считается признаком заражения до 6 месяцев тому назад.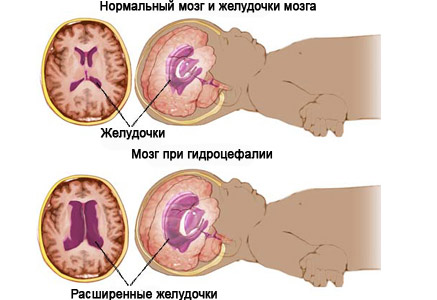
3. (IgM+, IgG–). В случае обнаружения IgM, при отсутствии IgG речь идет о совсем недавнем инфицировании или возможен ложноположительный результат. Рекомендуется исследование плазмы крови на ДНК B19V, через 2 недели повторить серологическое исследование на IgM и IgG. При острой ПВИ должна произойти сероконверсия IgG. При отсутствии IgG и повторном выявлении IgM — ложноположительный результат. Необходимо рекомендовать иммуноблот на IgM.
4. (IgM–, IgG–). При отсутствии иммуноглобулинов IgM и IgG беременная считается неиммунной и относится к группе риска возможного заражения парвовирусом. Может быть в инкубационном периоде, не исключается наличие серологического окна или у беременной IgM могут быть ниже порога обнаружения. Рекомендуется исследование плазмы крови на ДНК B19V, повторить исследование на IgM и IgG через 2–4 недели, при необходимости иммуноблот IgM и IgG. Если повторные серологические тесты отрицательные, ПЦР–, то беременную следует проинформировать о профилактических мерах, чтобы избежать инфекции.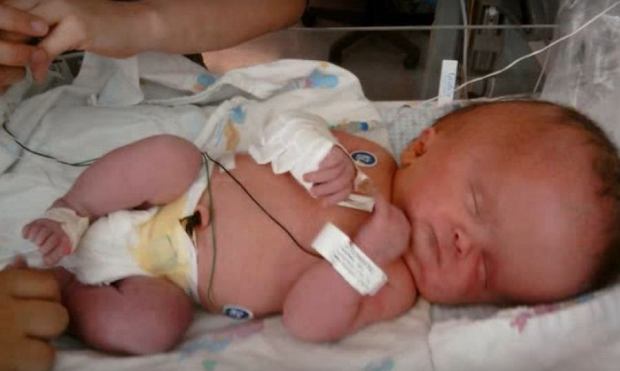
5. Иммунодефицит (IgM–, IgG–/+, ДНК PVB19–/+). При отсутствии иммуноглобулинов IgM, IgG и ДНК PVB19 беременная считается неиммунной и относится к группе риска возможного заражения парвовирусом. При отсутствии иммуноглобулинов IgM, IgG и наличии ДНК PVB19 — у беременной острая ПВИ. Рекомендуется повторить исследование на IgM и IgG через 2–4 недели, при необходимости иммуноблот IgM и IgG. При острой ПВИ должна произойти сероконверсия IgM и IgG, через 2 недели титр АТIgG нарастет в 2–4 раза. Если ДНК PVB19+, IgM–, IgG +, при этом титр АТIgG в динамике не нарастает или незначительно повышается, необходимо рассмотреть хроническое течение ПВИ у лиц с иммунодефицитом.
Инструментальная диагностика врожденной ПВИ в антенатальный период
Согласно зарубежным стандартам, после подтверждения острой ПВИ у беременной рекомендуется УЗИ-мониторинг состояния плода с целью своевременной диагностики развития неиммунной водянки плода. Рандомизированных исследований для определения необходимой частоты УЗИ плода не проводилось, большинство экспертов рекомендуют выполнять УЗИ плода каждые 1–2 недели, при необходимости каждую неделю в течение 12 недель после диагностирования острой ПВИ у матери, поскольку развитие неиммунной водянки плода может быть отсроченным [101, 102]. Некоторые авторы рекомендуют продолжить серийные УЗИ плода каждые 1–2 недели, при необходимости каждую неделю до 32 недель гестации [40]. Развитие неиммунной водянки плода является подтверждением диагноза врожденной ПВИ. Среди других УЗИ-признаков, указывающих на ПВИ у плода, можно выявить: увеличенную толщину плаценты, ультразвуковые признаки мекониевого перитонита, нарушения объема околоплодных вод [39, 41]. Последующие УЗИ ограничиваются оценкой объема околоплодных вод и выявлением неиммунной водянки плода. Плоды с водянкой, как правило, двигаются меньше, поэтому беременной следует предложить ежедневно фиксировать частоту движений плода [42]. Если нет информации об иммунном статусе беременной к PVB19 и нет возможности ее обследовать с помощью серологических методов, при этом нельзя исключить ПВИ, рекомендовано выполнять серийные УЗИ для выявления неиммунной водянки плода [43].
Некоторые авторы рекомендуют продолжить серийные УЗИ плода каждые 1–2 недели, при необходимости каждую неделю до 32 недель гестации [40]. Развитие неиммунной водянки плода является подтверждением диагноза врожденной ПВИ. Среди других УЗИ-признаков, указывающих на ПВИ у плода, можно выявить: увеличенную толщину плаценты, ультразвуковые признаки мекониевого перитонита, нарушения объема околоплодных вод [39, 41]. Последующие УЗИ ограничиваются оценкой объема околоплодных вод и выявлением неиммунной водянки плода. Плоды с водянкой, как правило, двигаются меньше, поэтому беременной следует предложить ежедневно фиксировать частоту движений плода [42]. Если нет информации об иммунном статусе беременной к PVB19 и нет возможности ее обследовать с помощью серологических методов, при этом нельзя исключить ПВИ, рекомендовано выполнять серийные УЗИ для выявления неиммунной водянки плода [43].
Для оценки анемии у плода необходимо проводить допплерометрию с измерением пиковой систолической скорости кровотока в СМА [39, 40, 44].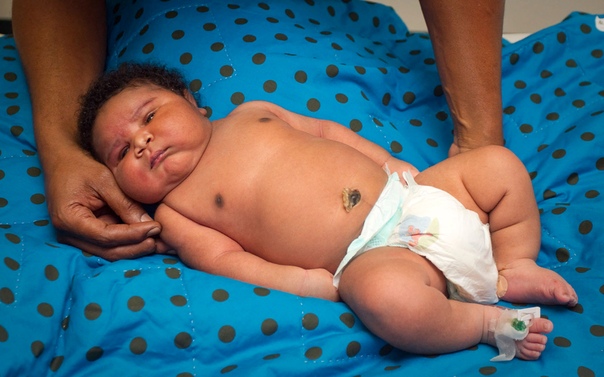 Чувствительность указаного метода — 83–100 %, а специфичность — 93–100 % [45, 46]. Уровень гемоглобина плода определяют при проведении кордоцентеза [47]. Следует учитывать, что амниоцентез/кордоцентез выполняют только при наличии показаний, а подозрение на врожденную ПВИ не является основанием для их проведения.
Чувствительность указаного метода — 83–100 %, а специфичность — 93–100 % [45, 46]. Уровень гемоглобина плода определяют при проведении кордоцентеза [47]. Следует учитывать, что амниоцентез/кордоцентез выполняют только при наличии показаний, а подозрение на врожденную ПВИ не является основанием для их проведения.
Для доказательства внутриутробного инфицирования В19V наиболее информативным считается обнаружение вирусного материала методами ПЦР и лигазной цепной реакции (ЛЦР) в амниотической жидкости, крови плода (при кордоцентезе), крови, моче и слюне новорожденного, в образцах тканей плаценты и умерших плодов. Гистологическое выявление специфических ядерных включений в клетках эритроидного ростка на фиксированных препаратах плаценты или тканей плода также подтверждает инфицирование [48].
Терапевтические подходы к лечению парвовирусной инфекции В19
Этиотропная терапия не разработана.
Не рекомендуется введение высокотитражных IgG (иммуноглобулины показали ограниченную эффективность).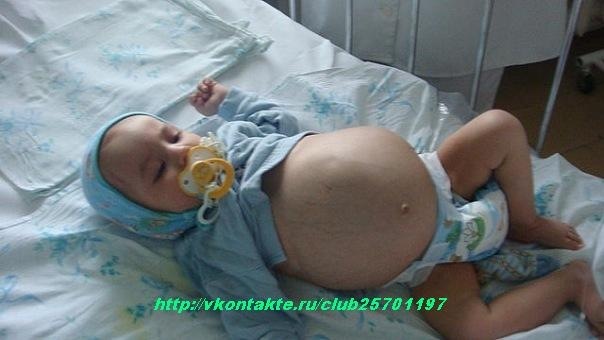
Патогенетическая терапия. При апластических кризах необходимо переливать эритроцитную массу. Введение эритроцитной массы в начале криза обычно позволяет добиться полного купирования анемии у большинства больных. При тяжелом и затяжном артрите используют нестероидные противовоспалительные препараты.
Лечение врожденной ПВИ. Антенатальная терапия
Основой терапии врожденной ПВИ является заместительная патогенетическая терапия путем внутривенных трансфузий компонентов крови. Состав вводимых компонентов крови, объем, кратность введения определяются динамикой клинико-лабораторных показателей.
Рекомендуется внутриутробная гемотрансфузия (эритромасса) при тяжелой анемии плода — гемоглобин ниже 80 г/л. При необходимости — трансфузии тромбоцитарной массы, лейкоконцентрата.
Неиммунная водянка плода может разрешиться самопроизвольно после внутриутробного переливания компонентов крови, до 80 % плодов с водянкой выживают после внутриутробного переливания [84].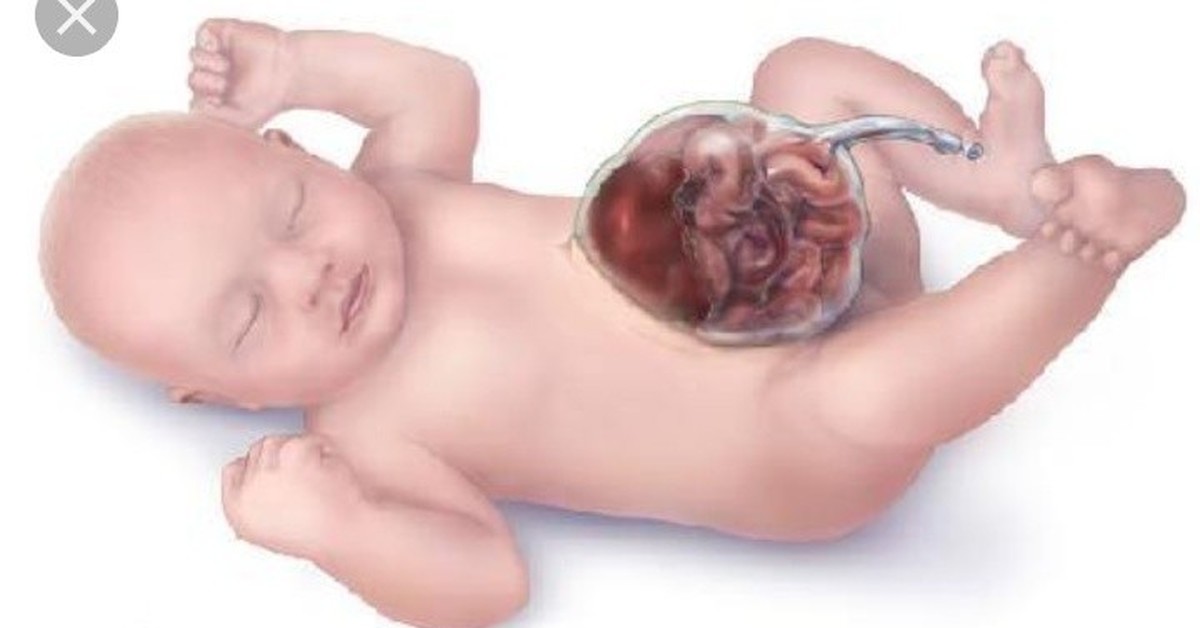
При подтверждении врожденной ПВИ после 32-й недели гестации рекомендуются досрочные роды (цель — ускорить созревание легочной ткани и увеличить насыщаемость гемоглобина кислородом).
Профилактика парвовирусной инфекции В19 [49, 50]
Эффективной профилактики парвовирусной инфекции в настоящее время не существует. Ведется разработка безопасной и иммуногенной вакцины против ПВИ.
Согласно зарубежным рекомендациям, обследованию на ПВИ подлежат беременные с клиническими симптомами заболевания, из групп риска с вероятностью инфицирования.
Каждую женщину из группы риска следует проконсультировать о ее индивидуальном риске, исходя из ее риска инфицирования, гестационного возраста и других акушерских соображений.
Серонегативным беременным, которые имеют профессиональный контакт с детьми, можно рекомендовать повторять серологические тесты на специфические АТ каждые 4 недели.
Частое мытье рук может быть рекомендовано в качестве меры профилактики для уменьшения риска заражения парвовирусом.
Количественное тестирование на PV В19 донорской крови, переливаемой больным, находящимся в состоянии иммуносупрессии.
Заключение
Парвовирус представляет потенциальную опасность для беременных. Риск инфицирования данным патогеном во время гестации составляет от 1 до 5 %, а в период эпидемических вспышек беременные из группы риска могут заразиться в 30–50 % случаев, при этом риск трансплацентарной передачи составляет 33–51 % случаев, с возможностью развития тяжелого врожденного заболевания. В Украине нет точных данных о частоте ПВИ среди женщин детородного возраста, частоте врожденной инфекции. Крайне редкое обследование беременных на ПВИ позволяет предполагать, что часть случаев врожденных инфекций неустановленной этиологии связана именно с трансплацентарной передачей парвовируса. Иммунологическое обследование беременных из группы риска позволит не только своевременно выявить парвовирусную инфекцию, но и будет способствовать снижению развития патологии беременности и гибели плода.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Bibliography
1. Neu N. et al. TORCH Infections. Clin. Perinatol. 2015. 42. 77. Available from: [http://pngpaediatricsociety.org/wp-content/uploads/2016/03/Neu-N-TORCHinfections-Clinics-in-Perinatology-2015.pdf], last accessed Sept 13, 2018.
2. Cossart Y.E., Field A.M., Cаnt B., Widdows D. Parvovius-like particles in human sera. Lancet. 1975. 1 (7898). 72-73.
3. Zadori Z., Szelei J., Lacoste M.C. et al. A viral phospholipase A2 is required for parvovirus infectivity. Dev. Cell. 2001. 1. 291-302.
4. Kaufmann B., Chipman P.R., Kostyuchenko V.A. et al. Visualization of the externalized VP2 N termini of infectious human parvovirus B19. J. Virol. 2008. 82. 7306-7312.
5. Wan Z., Zhi N., Wong S. et al. Human parvovirus B19 causes cell cycle arrest of human erythroid progenitors via deregulation of the E2 F family of transcription factors. J. Clin. Invest. 2010. 120. 3530-3544.
J. Clin. Invest. 2010. 120. 3530-3544.
6. Servant-Delmas A., Lefrère J.J., Morinet F., Pillet S. Advances in human B19 erythrovirus biology. J. Virol. 2010. 84 (19). 9658-65.
7. Chen A.Y. et al. The small 11 kDa non-structural protein of human parvovirus B19 plays a key role in inducing apoptosis during B19 virus infection of primary erythroid progenitor cells. Blood. 2010. 115. 1070-1080.
8. Brown K.E., Hibbs J.R., Gallinella G. et al. Resistance to parvovirus B19 infection due to lack of virus receptor (erythrocyte P antigen). NEJM. 1994. 330. 1192-1196.
9. Kaufmann B. et al. The structure of human parvovirus B19. Proc. Natl. Acad. Sci. USA. 2004. 101. 11628-11633.
10. Schneider B., Höne A., Tolba R.H., Fischer Y.-P., Blümel J., Eis-Hübinger A.M. Simultaneous persistence of multiple genome variants of human parvovirus B19. J. Gen. Virol. 2008. 89. 164-176.
Gen. Virol. 2008. 89. 164-176.
11. Servant A., Laperche S., Lallemand F. et al. Genetic diversity within human erythroviruses: identification of three genotypes. J. Virol. 2002. 76. 9124.
12. Parsyan A., Szmaragd C., Allain J.P., Candotti D. Identification and genetic diversity of two human parvovirus B19 genotype 3 subtypes. J. Gen. Virol. 2007. 88. 428.
13. Stelma F.F. et al. Occupational risk of human cytomegalovirus and parvovirus B19 infection in female day care personnel in the Netherlands; a study based on seroprevalence. Eur. J. Clin. Microbiol. Infect. Dis. 2009. 28. 393-397.
14. Anderson L.J. et al. Risk of infection following exposures to human parvovirus B19. Behring Inst. Mitt. 1990. 85. 60-63.
15. Jordan J., Tiangco B., Kiss J., Koch W. Human parvovirus B19: prevalence of viral DNA in volunteer blood donors and clinical outcomes of transfusion recipients. Vox Sang. 1998. 75. 97-102.
16. Lamont R.F., Sobel J., Vaisbuch E. et al. Parvovirus B19 infection in human pregnancy. BJOG. 2011. 118 (2). 175-186.
Lamont R.F., Sobel J., Vaisbuch E. et al. Parvovirus B19 infection in human pregnancy. BJOG. 2011. 118 (2). 175-186.
17. Климович Н.В., Матвеев В.Л., Романов О.М., Черновецкий М.А. Эпидемиологическая характеристика парвовирусной инфекции у детей с гематологическими заболеваниями. Охрана материнства и детства. 2011. 1. 42-46.
18. Kleinman S.H., Glynn S.A., Lee T.H., Tobler L., Montalvo L., Todd D., Kiss J.E., Shyamala V., Busch M.P. Prevalence and quantitation of parvovirus B19 DNA levels in blood donors with a sensitive polymerase chain reaction screening assay. Transfusion. 2007. 47 (10). 1756.
19. Kleinman S.H., Glynn S.A., Lee T.H., Tobler L.H., Schlumpf K.S., Todd D.S., Qiao H., Yu M.Y., Busch M.P. A linked donor-recipient study to evaluate parvovirus B19 transmission by blood component transfusion. Blood. 2009. 114 (17). 3677.
20. FDA Biologics Guidances. www. fda. Gov/Biologics Blood Vaccines/Guidance Compliance Regulatory information/Guidances/default. htm (Accessed on March 20, 2017).
htm (Accessed on March 20, 2017).
21. Mossong J. et al. Parvovirus B19 infection in five European countries: seroepidemiology, force of infection and maternal risk of infection. Epidemiol. Infect. 2008. 136. 1059-1068.
22. Mortimer P.P., Humphries R.K., Moore J.G., Purcell R.H., Young N.S. A human parvovirus-like virus inhibits haematopoietic colony formation in vitro. Nature. 1983. 302. 426.
23. Brown K.E., Anderson S.M., Young N.S. Erythrocyte P antigen: cellular receptor for B19 parvovirus. Science. 1993. 262. 114.
24. Lunardi C., Tinazzi E., Bason C., Dolcino M., Corrocher R., Puccetti A. Human parvovirus B19 infection and autoimmunity. Autoimmun. Rev. 2008. 8 (2). 116-20.
25. Weigel-Kelley K.A., Yoder M.C., Srivastava A. Alpha5beta1 integrin as a cellular coreceptor for human parvovirus B19: requirementof functional activation of beta1 integrin for viral entry. Blood. 2003. 102. 3927.
26. Munakata Y., Saito-Ito T., Kumura-Ishii K., Huang J., Kodera T., Ishii T., Hirabayashi Y., Koyanagi Y., Sasaki T. Ku80 autoantigen as a cellular coreceptor for human parvovirus B19 infection. Blood. 2005. 106. 3449.
Munakata Y., Saito-Ito T., Kumura-Ishii K., Huang J., Kodera T., Ishii T., Hirabayashi Y., Koyanagi Y., Sasaki T. Ku80 autoantigen as a cellular coreceptor for human parvovirus B19 infection. Blood. 2005. 106. 3449.
27. Weigel-Van Aken K.A. Pharmacological activation of guanine nucleotide exchange factors for the small GTPase Rap1 recruits high-affinity beta1 integrins as coreceptors for parvovirus B19: improved ex vivo gene transfer to human erythroid progenitor cells. Hum. Gene Ther. 2009. 20 (12). 1665-78.
28. Seve P. et al. Systemic manifestations of Parvovirus B19 infections. Rev. Med. Interne. 2004 Oct. 25 (10). 740-51.
29. Heegaard E.D., Brown K.E. Human parvovirus B19. Clin. Microbiol. Rev. 2002. 15 (3). 485-505.
30. Abe K., Kiuchi T., Tanaca K., Edamoto Y., Ajba N., Sala T. Characterization of erythrovirus B19 genomes isolated in Iiver tissues from patients with fulminant hepatitis and biliary atresia who underwent liver transpanlatation. Int. J. Med. Sei. 2007. 4 (2). 105-109.
Int. J. Med. Sei. 2007. 4 (2). 105-109.
31. Левада А.И. Парвовирусная инфекция В19. Педиатр онлайн. 2012.
32. Ergaz Z., Ornoy A. Parvovirus B19 in pregnancy. Reproductive Toxicology. 2006. 21. 421-435.
33. Chiasaka H. et al. Parvovirus B19 and the pathogenesis of anaemia. Rev. Med. Virol. 2003 Nov-Dec. 13 (6). 347-59.
34. Harger J.H., Adler S.P., Koch W.C., Harger G.F. Prospective evaluation of 618 pregnant women exposed to parvovirus B19: risks and symptoms. Obstet. Gynecol. 1998. 91. 413-420.
35. Caforio A.L.P., Bottaro S., Iliceto S. Dilated cardiomyopathy (DCM) and myocarditis: classification, clinical and autoimmune features. Applied Cardiopulmonary Pathophysiology. 2012. 16. 82-95.
36. Norja P. et al. Bioportfolio lifelong persistence of variant and prototypic erythrovirus DNA genomes in human tissue. Proc. Natl. Acad. Sci. USA. 2006. 103. 7450-7453.
37. Parvovirus B19 Infection in Pregnancy (2014). Available from: [https://sogc.org/wp-content/uploads/2014/12/gui 3161012E.pdf], last accessed Sept 13, 2018.
Available from: [https://sogc.org/wp-content/uploads/2014/12/gui 3161012E.pdf], last accessed Sept 13, 2018.
38. Neal S. Young, Kevin E. Brown. Parvovirus B19. The New England Journal of Medicine. 2004. 350. 586-97.
39. de Jong E.P., Walther F.J., Kroes A.C., Oepkes D. Parvovirus B19 infection in pregnancy: new insights and management. Prenat. Diagn. 2011. 31. 419-425.
40. Dijkmans A.C., de Jong E.P., Dijkmans B.A., Lopriore E., Vossen A., Walther F.J. et al. Parvovirus B19 in pregnancy: prenatal diagnosis and management of fetal complications. Curr. Opin Obstet. Gynecol. 2012. 24. 95-101.
41. O’Malley A. et al. Parvovirus infects cardiac myocytes in hydrops fetalis. Pediatr. Dev. Pathol. 2003. 6 (5). 414-420.
42. Lefrère J.J., Servant-Delmas A., Candotti D. et al. Persistent B19 infection in immunocompetent individuals: implications for transfusion safety. Blood. 2005. 106. 2890-2895.
43. Broliden K., Tolfvenstam T., Norbeck O. Clinical aspects of parvovirus B19 infection. J. Intern. Med. 2006. 260. 285-304.
44. Heegaard E.D., Petersen B.L., Heilmann C.J., Hornsleth A. Prevalence of parvovirus B19 and parvovirus V9 DNA and antibodies in paired bone marrow and serum samples from healthy individuals. J. Clin. Microbiol. 2002. 40 (3). 933-6.
45. Kurtzman G.J., Cohen B.J., Field A.M., Oseas R., Blaese R.M., Young N.S. Immune response to B19 parvovirus infection and an antibody defect in persistent viral infection. J. Clin. Invest. 1989. 84 (4). 1114-23.
46. Chisaka H., Ito K., Niikura H., Sugawara J., Takano T., Murakami T., Terada Y., Okamura K., Shiroishi H., Sugamura K., Yaegashi N. Clinical manifestations and outcomes of parvovirus B19 infection duting pregnancy in Tohoku. J. Exp. Med. 2006. 209. 277-283.
47. Corcioli F., Zakrzewska K., Fanci R., De Giorgi V., Innocenti M., Rotellini M. , Di Lollo S., Azzi A. Human parvovirus PARV4 DNA in tissues from adult individuals: a comparison with human parvovirus B19 (B19V). Virol. J. 2010. 7. 272. Mode of access. http://www.virologyj.com/content/7/1/272 568-1.
, Di Lollo S., Azzi A. Human parvovirus PARV4 DNA in tissues from adult individuals: a comparison with human parvovirus B19 (B19V). Virol. J. 2010. 7. 272. Mode of access. http://www.virologyj.com/content/7/1/272 568-1.
48. Young N.S., Brown K.E. Mechanisms of disease: Parvovirus. N. Engl. J. Med. 2004. 350 (6). 586-597.
49. Noyola D.E., Lourdes Padilla-Ruiz M., Guadalupe Obregón-Ramos M. et al. Parvovirus B19 infection in medical students during a hospital outbreak. J. Med. Microbiol. 2004. 53. 141-146.
50. Tolfvenstam T., Broliden K. Parvovirus B19 infection. Semin. Fetal. Neonatal. Med. 2009. 14 (4). 218-221.
51. Anderson L.J. Role of parvovirus B19 in human disease. Pediatr. Infect. Dis. 1987. 6. 711-718.
52. Koch W.C. Fifth (human parvovirus) and sixth (herpesvirus 6) diseases. Curr. Opin. Infect. Dis. 2001. 14. 343-356.
53. Nicolay N. et al. Clinical and epidemiological aspects of parvovirus B19 infections in Ireland, January 1996 — June 2008. Euro Surveill. 2009. 14. 1-5.
Euro Surveill. 2009. 14. 1-5.
54. Valentin M.N., Cohen P.J. Pediatric Parvovirus B19: spectrum of clinical manifestations. Cutis. 2013. 92. 179-184.
55. Pavlovic M.D. Papular-purpuric «gloves and socks» syndrome caused by parvovirus B19. Vojnosanit Pregl. 2003. 60 (2). 223-225.
56. Heckler G.T., Dal Ri N.M.K., Almeida H.L. Jr. Case for diagnosis. An. Bras. Dermatol. 2012. 87 (5). 793-794.
57. Kumano K. Various clinical symptoms in human parvovirus B19 infection. Japanese Journal of Clinical Immunology. 2008. 31 (6). 448-453.
58. Muir K., Todd W.T., Watson W.H., Fitzsimons E. Viral-associated haemophagocytosis with parvovirus-B19-related pancytopenia. Lancet. 1992. 339. 1139-1140.
59. Poole B.D., Karetnyi Y.V., Naides S.J. Parvovirus B19-induced apoptosis of hepatocytes. Journal of virology. 2004. 78 (14). 7775-7783.
60. Bihari Ch., Rastogi A., Saxena P. et al. Parvovirus B19 associated hepatitis.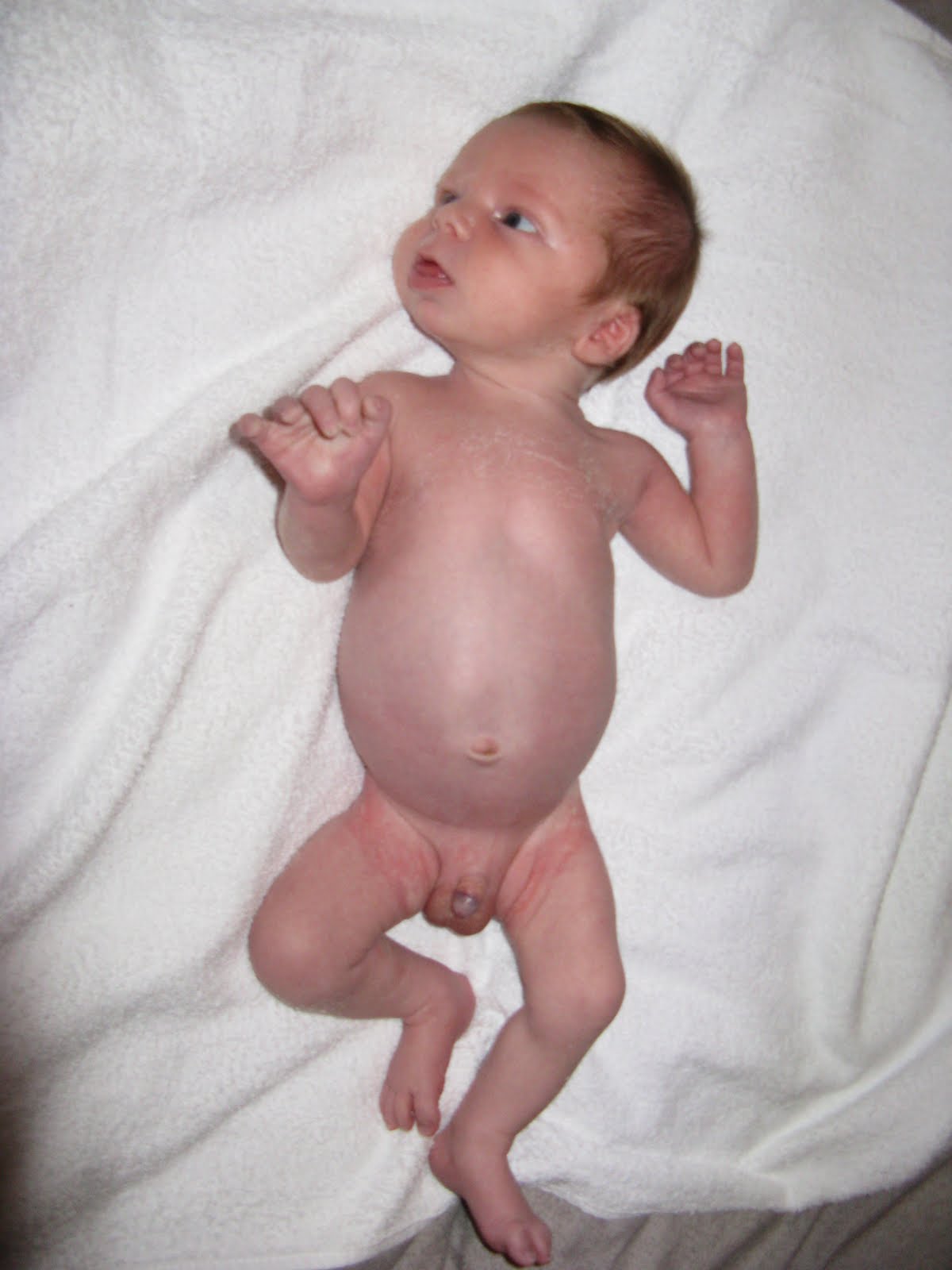 Hindawi Publishing Corporation. Hepatitis Research and Treatment. 2013. Article ID 472027. 1-9.
Hindawi Publishing Corporation. Hepatitis Research and Treatment. 2013. Article ID 472027. 1-9.
61. Mihály I., Trethon A., Arányi Z. et al. Observations on human parvovirus B19 infection diagnosed in 2011. Orvosi Hetilap. 2012. 153 (49). 1948-1957. View at Google Scholar.
62. Sun L., Zhang J.-C. Acute fulminant hepatitis with bone marrow failure in an adult due to parvovirus B19 infection. Hepatology. 2012. 55 (1). 329-330.
63. Yang S.-H., Lin L.-W., Fang Y.-J., Cheng A.-L., Kuo S.-H. Parvovirus B19 infection-related acute hepatitis after rituximab-containing regimen for treatment of diffuse large B-cell lymphoma. Annals of Hematology. 2012. 91 (2). 291-294.
64. Hatakka A., Klein J., He R. et al. Acute hepatitis as a manifestation of parvovirus B19 infection. Journal of Clinical Microbiology. 2011. 49 (9). 3422-3424.
65. Kindermann I., Barth C., Mahfoud F. et al. Update on Myocarditis. Journal of the American College of Cardiology. 2012. 59 (9). 779-792.
Update on Myocarditis. Journal of the American College of Cardiology. 2012. 59 (9). 779-792.
66. Schultheiss H.-P., Kuhl U., Cooper L.T. The management of myocarditis. European Heart Journal. 2011; doi: 10.1093. 1-13.
67. Lotze U., Egerer R., Gluck B., Zell R., Sigusch H., Erhardt C., Heim A., Kandolf R., Bock T., Wutzler P., Figulla H.R. Low level myocardial parvovirus B19 persistence is a frequent finding in patients with heart disease but unrelated to ongoing myocardial injury. J. Med. Virol. 2010. 82. 1449-1457.
68. Schenk T., Enders M., Pollak S., Hahn R., Huzly D. High prevalence of human parvovirus B19 DNA in myocardial autopsy samples from subjects without myocarditis or dilative cardiomyopathy. J. Clin. Microbiol. 2009. 47. 106-110.
69. Barah F., Whiteside S. et al. Neurological aspects of human parvovirus B19 infection: a systematic review. J. Rev. Med. Virol. 2014 May. 24 (3). 154-68.
70. Douvoyiannis M., Litman N., Goldman D.L. Neurologic manifestations associated with Parvovirus B19 Infection. CID. 2009. 48 (15). 1713-1723.
Douvoyiannis M., Litman N., Goldman D.L. Neurologic manifestations associated with Parvovirus B19 Infection. CID. 2009. 48 (15). 1713-1723.
71. Alger L.S. Toxoplasmosis and parvovirus B19. Infect. Dis. Clin. North Am. 1997. 11. 55-75.
72. Waring G.J. Parvovirus B19 infection. Timely diagnosis in pregnancy essential. Case Rep. Womens Health. 2018. 18. e00057. DOI: 10.1016/j.crwh.2018. e00057
73. Ornoy A., Ergaz Z. Parvovirus. B 19 infection during pregnancy and risks to the fetus. Birth. Defects Res. 2017. Mar 15. 109 (5). 311-323.
74. Courtier J., Schauer G.M., Parer J.T., Regenstein A.C., Callen P.W., Glenn O.A. Parvovirus. B19 infection during pregnancy and risks to the fetus. Ultrasound Obstet Gynecol. 2012. 40 (5). 604-6.
75. Röhrer C.I., Gärtner B., Sauerbrei A., Böhm, S., Hottenträger B., Raab U. et al. Seroprevalence of parvovirus B19 in the German population. Epidemiol. Infect. 2008. 136. 1564-1575.
Epidemiol. Infect. 2008. 136. 1564-1575.
76. Valeur-Jensen A.K., Pedersen C.B., Westergaard T., Jensen I.P., Lebech M., Andersen P.K. et al. Risk factors for parvovirus B19 infection in pregnancy. JAMA. 1999. 281. 1099-1105.
77. Centers for Disease Control (CDC). Risks associated with human parvovirus B19 infection. Morb. Mortal. Wkly. Rep. 1989. 38. 81-88 (93-7).
78. Gilbert N.L. et al. Seroprevalence of parvovirus B19 infection in daycare educators. Epidemiol. Infect. 2005. 133. 299-304.
79. Giorgio E., Antonietta De Oronzo M., Iozza I. Parvovirus B19 during pregnancy: a review. Journal of Prenatal Medicine. 2010. 4 (4). 63-66.
80. Schulert G.S., Walsh W.F., Weitkamp J.H. Polymicrogyria and congenital Parvovirus B19 infection. Am. J. Perinatol. Rep. 2011. 1. 105-110.
81. Crane J., Mundle W., Boucoiran I. Parvovirus B19 infection in pregnancy. 2014 Dec. 36 (12). 1107-1116.
82. Leduc L. SOGC Maternal-Fetal Medicine Committee. Stillbirth and bereavement: guidelines for stillbirth investigation. SOGC Clinical Practice Guidelines. J. Obstet. Gynaecol. Can. 2006. 28. 540-552.
Leduc L. SOGC Maternal-Fetal Medicine Committee. Stillbirth and bereavement: guidelines for stillbirth investigation. SOGC Clinical Practice Guidelines. J. Obstet. Gynaecol. Can. 2006. 28. 540-552.
83. Watt A.P., Brown M., Pathiraja M., Anbazhagan A., Coyle P.V. The lack of routine surveillance of parvovirus B19 infection in pregnancy prevents an accurate understanding of this regular cause of fetal loss and the risks posed by occupational exposure. J. Med. Microbiol. 2013. 62. 86-92.
84. Simms R.A., Liebling R.E., Patel R.R., Denbow M.L., Abdel-Fattah S.A., Soothill P.W. et al. Management and outcome of pregnancies with parvovirus B19 infection over seven years in a tertiary fetal medicine unit. Fetal. Diagn. Ther. 2009. 25. 373-378.
85. Enders M., Schalasta G., Baisch C., Weidner A., Pukkila L., Kaikkonen L. et al. Human parvovirus B19 infection during pregnancy-value of modern molecular and serological diagnostics. J. Clin. Virol. 2006. 35. 400-406.
2006. 35. 400-406.
86. Australasian Society for Infectious Diseases. Management of Perinatal Infection (2014). Available from: [https://www.asid.net.au/documents/item/368], last accessed Sept 13, 2018.
87. SOGC Clinical Practice guideline. Parvovirus B19 Infection in Pregnancy (2014). Available from: [https://sogc.org/wp-content/uploads/2014/12/gui3161012E.pdf], last accessed Sept 13, 2018.
88. Enders M., Weidner A., Zoellner I., Searle K., Enders G. Fetal morbidity and mortality after acute human parvovirus B19 infection in pregnancy: prospective evaluation of 1018 cases. Prenat. Diagn. 2004. 24. 513-518.
89. Matsuda H., Sakaguchi K., Shibasaki T., Takahashi H. et al. Intrauterine therapy for parvovirus B19 infected symptomatic fetus using B19 IgG-rich high titer gammaglobulin. J. Perinat. Med. 2005. 33 (6). 561-563.
90. Sarfraz A.A., Samuelsen S.O., Bruu A.L., Jenum P.A., Eskild A. Maternal human parvovirus B19 infection and the risk of fetal death and low birthweight: a case-control study within 35 940 pregnant women. BJOG. 2009. 116. 1492-8.
BJOG. 2009. 116. 1492-8.
91. Smith J. Human parvovirus B19: a literature review and case study. Infant. 2008. 4 (5). 101-104.
92. de Haan T.R., van den Akker E.S., Porcelijn L., Oepkes D., Kroes A.C., Walther F.J. Thrombocytopenia in hydropic fetuses with parvovirus B19 infection: incidence, treatment and correlation with fetal B19 viral load: BJOG. 2008. 115. 76-81.
93. Adler S., Koch W.C. Human parvovirus B19. In: J.S. Remington, J.O. Klein (Eds). Infectious diseases of the fetus and newborn infant. 7th ed. Saunders, Philadelphia. 2010. 845 (5).
94. Cohen B. Parvovirus B19: an expanding spectrum of disease. BMJ. 1995. 311. 1549-1552.
95. Levy R., Weissman A., Blomberg G., Hagay Z.J. Infection by parvovirus B19 during pregnancy: a review. Obstet. Gynecol. Surv. 1997. 52. 254-259.
96. Segata M., Chaoui R., Khalek N., Bahado-Singh R., Paidas M.J., Mari G. Fetal thrombocytopenia secondary to parvovirus infection. Am. J. Obstet. Gynecol. 2007. Jan. 196 (1). 61. e1-4.
Am. J. Obstet. Gynecol. 2007. Jan. 196 (1). 61. e1-4.
97. Enders M., Weidner A., Zoellner I., Searle K., Enders G. Fetal morbidity and mortality after acute human parvovirus B19 infection in pregnancy: prospective evaluation of 1018 cases. Prenat. Diagn. 2004 Jul. 24 (7). 513-8.
98. Markenson G.R., Yancey M.K. Parvovirus B19 infections in pregnancy. Semin. Perinatol. 1998. 22. 309-317.
99. Barton L.L., Lax D., Shehab Z.M., Keith J.C. Congenital cardiomyopathy associated with human parvovirus B19 infection. Am. Heart J. 1997. 133. 131-133.
100. Enders M., Weidner A., Rosenthal T., Baisch C., Hedman L., Söderlund-Venermo M., Hedman K. Improved diagnosis of gestational parvovirus B19 infection at the time of nonimmune fetal hydrops. J. Infect. Dis. 2008. 197. 58-62.
101. Health Protection Agency Rash Guidance Working Group. Guidance on viral rash in pregnancy: investigation, diagnosis and management of viral rash illness, or exposure to viral rash illness, in pregnancy. Health Protection Agency, London. 2011.
Health Protection Agency, London. 2011.
102. Miller E., Fairley C.K., Cohen B.J., Seng C. Immediate and long term outcome of human parvovirus B19 infection in pregnancy. Br. J. Obstet. Gynaecol. 1998. 105. 174-178.
103. Nyman M., Tolfvenstam T., Petersson K., Krassny C., Skjöldebrand-Sparre L., Broliden K. Detection of Human Parvovirus B19 Infection in First-Trimester Fetal Loss. Obstetrics & Gynecology. 2002. 99 (5). Part 1. 795-798.
104. von Kaisenberg C.S., Jonat W. Fetal parvovirus B19 infection. Ultrasound. Obstet. Gynecol. 2001. 18. 280-288.
105. Rodis J.F. Parvovirus infection. Clin. Obstet. Gynecol. 1999. 42. 107-120 (quiz 174-5).
106. Barrett J., Ryan G., Morrow R., Farine D., Kelly E., Mahony J. Human parvovirus B19 during pregnancy. J. Soc. Obstet. Gynaecol. Can. 1994. 16. 1253-1258.
107. Borna S., Mirzaie F., Hanthoush-Zadeh S., Khazardoost S., Rahimi-Sharbaf F. Middle cerebral artery peak systolic velocity and ductus venosus velocity in the investigation of nonimmune hydrops. J. Clin. Ultrasound. 2009. 37. 385-388.
Middle cerebral artery peak systolic velocity and ductus venosus velocity in the investigation of nonimmune hydrops. J. Clin. Ultrasound. 2009. 37. 385-388.
108. Chauvet A., Dewilde A., Thomas D., Joriot S., Vaast P., Houfflin-Debarge V. et al. Ultrasound diagnosis, management and prognosis in a consecutive series of 27 cases of fetal hydrops following maternal parvovirus B19 infection. Fetal. Diagn. Ther. 2011. 30. 41-47.
109. Delle Chiaie L., Buck G., Grab D., Terinde R. Prediction of fetal anemia with Doppler measurement of the middle cerebral artery peak systolic velocity in pregnancies complicated by maternal blood group alloimmunization or parvovirus B19 infection. Ultrasound Obstet Gynecol. 2001. 18. 232-236.
110. Morgan-Capner P. Guidelines on the management of, and exposure to, rash illness in pregnancy (including consideration of relevant antibody screening programmes in pregnancy). Commun. Dis. Public Health. 2002. 5. 59-71.
111. Koppelman M.H.G.M. et al. Quantitative real-time detection of parvovirus B19 DNA in plasma. Transfusion. 2004. 44. 97-103.
112. Rodis J.F., Hovick T.J. Jr., Quinn D.L., Rosengren S.S., Tattersall P. Human parvovirus infection in pregnancy. Obstet. Gynecol. 1988. 72. 733-738.
113. Bernstein D.I., Sahly H., Keitel W.A. et al. Safety and immunogenicity of a candidate Parvovirus B19 vaccine. Vaccine. 2011. 29 (43). 7357-7363.
114. Pickering L.K., Baker C.J., Kimberlin D.W. et al. Parvovirus B19. Report of the Committee on Infectious Diseases. American Academy of Pediatrics. 2009. 491-494.
Клиническое руководство №7 медицинского общества матери и плода: неиммунная водянка плода
Цель
Неиммунная водянка — это наличие 2 патологических скоплений жидкости плода при отсутствии аллоиммунизации красных кровяных клеток. Наиболее частая этиология включает кардиоваскулярные, хромосомные и гематологические нарушения, следующие после структурных аномалий плода, осложнений монохориальной двойни, инфекций и патологий плаценты. Мы хотели предоставить доказательное руководство для оценки и ведения неиммунной водянки плода.
Мы хотели предоставить доказательное руководство для оценки и ведения неиммунной водянки плода.
Методы
Был выполнен систематический обзор литературы, используя MEDLINE, PubMed, EMBASE, и Кокрановскую библиотеку (Cochrane Library). Наш поиск был ограничен англоязычными статьями, опубликованными с 1966 по июнь 2014. Преимущество было отдано статьям, сообщающим об оригинальном исследовании, хотя и обзорные статьи и статьи с комментариями также были приняты во внимание. Абстракты исследований, представленных на симпозиумах и научных конференциях, не рассматривались как адекватные для включения в этот документ. Доказательные сообщения и рекомендации, опубликованные организациями или учреждениями, такими как национальный институт здоровья (National Institutes of Health), агентство исследования здоровья и качества (Agency for Health Research and Quality), американский конгресс акушерства и гинекологии (American Congress of Obstetricians and Gynecologists,), и общество медицины плода и матери (Society for Maternal-Fetal), были также пересмотрены и дополнительные исследования были обнаружены по обзорному списку использованных источников выбранных статей. Методология градации анализа, разработки и оценки рекомендаций (Grading of Recommendations Assessment, Development, and Evaluation) была использована для определения силы рекомендаций и качества классификации доказательства. Совместно с рекомендациями превентивной службы США (US Preventive Task Force), ссылки были оценены по качеству, основанному на высочайшем уровне доказательства.
Методология градации анализа, разработки и оценки рекомендаций (Grading of Recommendations Assessment, Development, and Evaluation) была использована для определения силы рекомендаций и качества классификации доказательства. Совместно с рекомендациями превентивной службы США (US Preventive Task Force), ссылки были оценены по качеству, основанному на высочайшем уровне доказательства.
Результаты и рекомендации
Оценка водянки начинается со скрининга на антитела (непрямой тест Кумбса (антиглобулиновый)), чтобы определить не иммунная ли это водянка, подробной сонографии плода и плаценты, включая эхокардиографию и оценку сердечного ритма плода, оценки допплеровских показаний средней мозговой артерии при анемии, так же как и фетального кариотипа и/или хромосомного микроматричного анализа, невзирая на то, идентифицирована ли какая-либо структурная аномалия плода или нет. Рекомендованное лечение зависит от основной этиологии и гестационного срока; преждевременные роды рекомендованы только по акушерским показаниям, включая развитие зеркального синдрома у матери. Кандидаты на применение кортикостероидов и дородовое наблюдение включают пациенток с идиопатической этиологией, этиологией приведшей к пренатальному или постнатальному лечению и тех, у кого планировалось вмешательство в случае ухудшения состояния плода. Такие беременности должны родоразрешаться в учреждениях с возможностью стабилизировать и лечить новорожденных в критическом состоянии. Прогноз зависит от этиологии, ответа на терапию, если поддается лечению, и гестационного срока на момент диагностики и родов. Анеуплоидия дает неблагоприятный исход и , даже при отсутствии анеуплоидии, неонатальная выживаемость составляет менее 50 %. Зеркальный синдром — это форма тяжелой преэклампсии, которая может развиться в ассоциации с водянкой плода и где в большинстве случаев необходимо родоразрешение.
Кандидаты на применение кортикостероидов и дородовое наблюдение включают пациенток с идиопатической этиологией, этиологией приведшей к пренатальному или постнатальному лечению и тех, у кого планировалось вмешательство в случае ухудшения состояния плода. Такие беременности должны родоразрешаться в учреждениях с возможностью стабилизировать и лечить новорожденных в критическом состоянии. Прогноз зависит от этиологии, ответа на терапию, если поддается лечению, и гестационного срока на момент диагностики и родов. Анеуплоидия дает неблагоприятный исход и , даже при отсутствии анеуплоидии, неонатальная выживаемость составляет менее 50 %. Зеркальный синдром — это форма тяжелой преэклампсии, которая может развиться в ассоциации с водянкой плода и где в большинстве случаев необходимо родоразрешение.
Ключевые слова
фетальные осложнения, водянка, неиммунная водянка плода
Society for Maternal-Fetal Medicine (SMFM) Clinical Guideline #7: nonimmune hydrops fetalis
Society for Maternal-Fetal Medicine (SMFM), Mary E. Norton, MD, Suneet P. Chauhan, MD, Jodi S. Dashe, MD
Norton, MD, Suneet P. Chauhan, MD, Jodi S. Dashe, MD
American Journal of Obstetrics & Gynecology
February 2015Volume 212, Issue 2, Pages 127–139
Key words: fetal complications, hydrops, nonimmune hydrops fetalis
Колмакова Мария Сергеевна
ВОДЯНКА ПЛОДА: ПРИЧИНЫ, ПЕРСПЕКТИВЫ, ЛЕЧЕНИЕ, СИМПТОМЫ И МНОГОЕ ДРУГОЕ — ЗДОРОВЬЕ
Водянка плода — это серьезное, опасное для жизни состояние, при котором у плода или новорожденного наблюдается аномальное скопление жидкости в тканях вокруг легких, сердца, брюшной полости или под кож
Содержание:
Что такое водянка плода?
Водянка плода — это серьезное, опасное для жизни состояние, при котором у плода или новорожденного наблюдается аномальное скопление жидкости в тканях вокруг легких, сердца, брюшной полости или под кожей. Обычно это осложнение другого заболевания, которое влияет на то, как организм выводит жидкость.
Обычно это осложнение другого заболевания, которое влияет на то, как организм выводит жидкость.
Водянка плода встречается только у 1 из 1000 родов. Если вы беременны и у вашего ребенка водянка плода, ваш врач может назначить ранние роды и роды. Ребенку, рожденному с водянкой плода, может потребоваться переливание крови и другие процедуры для удаления лишней жидкости.
Даже после лечения более половины детей с водянкой плода умрут незадолго до или после родов.
Виды водянки плода
Существует два вида водянки плода: иммунная и неиммунная. Тип зависит от причины состояния.
Неиммунный водянка плода
Неиммунная водянка плода в настоящее время является наиболее распространенным типом водянки плода. Это происходит, когда другое состояние или заболевание мешает ребенку регулировать жидкость. Примеры состояний, которые могут помешать оттоку ребенка, включают:
- тяжелые анемии, включая талассемию
- кровотечение плода (кровоизлияние)
- пороки сердца или легких у ребенка
- генетические и метаболические нарушения, включая синдром Тернера и болезнь Гоше
- вирусные и бактериальные инфекции, такие как болезнь Шагаса, парвовирус B19, цитомегаловирус (CMV), токсоплазмоз, сифилис и герпес
- сосудистые мальформации
- опухоли
В некоторых случаях причина водянки плода неизвестна.
Иммунная водянка плода
Иммунная водянка плода обычно возникает, когда группы крови матери и плода несовместимы друг с другом. Это известно как резус-несовместимость. Тогда иммунная система матери может атаковать и разрушить красные кровяные тельца ребенка. В тяжелых случаях резус-несовместимости может развиться водянка плода.
Иммунная водянка плода сегодня встречается гораздо реже после изобретения лекарства, известного как резус-иммуноглобулин (RhoGAM). Это лекарство назначают беременным женщинам с риском несовместимости резус-фактора для предотвращения осложнений.
Каковы симптомы водянки плода?
Беременные женщины могут испытывать следующие симптомы, если у плода водянка плода:
- избыток околоплодных вод (многоводие)
- толстая или аномально большая плацента
У плода также может быть увеличенная селезенка, сердце или печень, а также жидкость, окружающая сердце или легкие, что можно наблюдать во время ультразвукового исследования.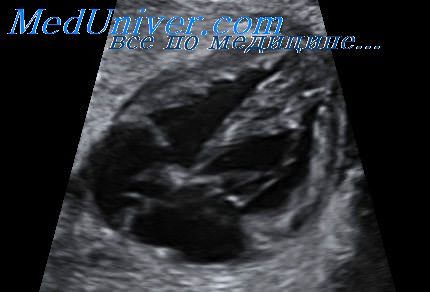
У ребенка, рожденного с водянкой плода, могут быть следующие симптомы:
- бледная кожа
- кровоподтеки
- сильный отек (отек), особенно в области живота
- увеличенная печень и селезенка
- затрудненное дыхание
- сильная желтуха
Диагностика водянки плода
Диагноз водянки плода обычно ставится во время ультразвукового исследования. Врач может заметить водянку плода на УЗИ во время планового осмотра на беременность. Ультразвук использует высокочастотные звуковые волны, чтобы помочь захватить живые изображения внутренней части тела. Вам также могут сделать УЗИ во время беременности, если вы заметите, что ребенок шевелится реже или у вас возникли другие осложнения беременности, например высокое кровяное давление.
Другие диагностические тесты могут быть выполнены, чтобы помочь определить серьезность или причину состояния. Это включает:
- забор крови плода
- амниоцентез, то есть забор околоплодных вод для дальнейшего исследования
- эхокардиография плода, которая ищет структурные дефекты сердца
Как лечится водянка плода?
Водянку плода обычно нельзя лечить во время беременности. Иногда врач может назначить ребенку переливание крови (внутриутробное переливание крови плода), чтобы повысить шансы на то, что ребенок доживет до рождения.
Иногда врач может назначить ребенку переливание крови (внутриутробное переливание крови плода), чтобы повысить шансы на то, что ребенок доживет до рождения.
В большинстве случаев врачу необходимо будет стимулировать ранние роды, чтобы дать ребенку наилучшие шансы на выживание. Это можно сделать с помощью лекарств, вызывающих ранние роды, или с помощью экстренного кесарева сечения (кесарево сечение). Ваш врач обсудит с вами эти варианты.
После рождения ребенка лечение может включать:
- использование иглы для удаления лишней жидкости из пространства вокруг легких, сердца или брюшной полости (плевроцентез)
- поддержка дыхания, такая как дыхательный аппарат (вентилятор)
- лекарства для контроля сердечной недостаточности
- лекарства, которые помогают почкам выводить лишнюю жидкость
При иммунной водянке ребенку может быть назначено прямое переливание эритроцитов, соответствующих его группе крови. Если водянка плода была вызвана другим основным заболеванием, ребенок также получит лечение от этого состояния.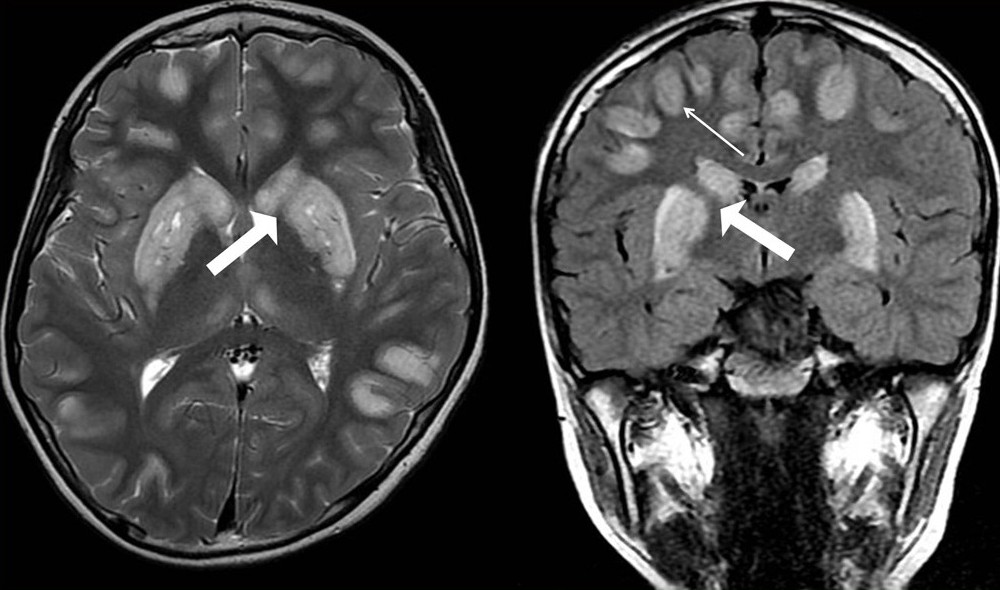 Например, антибиотики используются для лечения инфекции сифилиса.
Например, антибиотики используются для лечения инфекции сифилиса.
Женщины, чьи дети страдают отечностью плода, подвержены риску другого состояния, известного как синдром зеркала. Синдром зеркала может привести к опасной для жизни гипертонии (высокое кровяное давление) или судорогам. Если у вас разовьется синдром зеркала, вам придется немедленно родить ребенка.
Каковы перспективы водянки плода?
Перспективы водянки плода зависят от основного состояния, но даже при лечении выживаемость ребенка невысока. Лишь около 20 процентов детей, у которых до рождения была диагностирована водянка плода, доживают до родов, и только половина из них выживет после родов. Риск смерти наиболее высок для младенцев, которым поставлен диагноз на очень ранней стадии (менее 24 недель беременности) или у которых есть структурные аномалии, такие как структурный порок сердца.
Дети, рожденные с водянкой плода, также могут иметь недоразвитые легкие и подвергаться более высокому риску:
- сердечная недостаточность
- повреждение мозга
- гипогликемия
- припадки
Новости животноводства, Информация о животноводстве, Животноводство
Реферат
Крупный рогатый скот подвержен высокому риску отечности плодных оболочек в основном в последнем триместре беременности.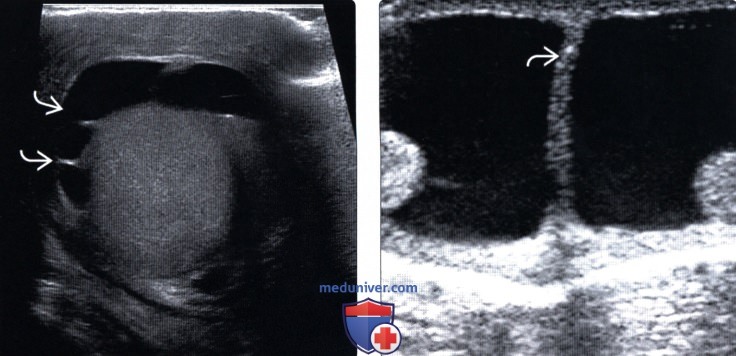 В настоящем обзоре рассматривается водянка плодных оболочек, которая включает водянку амниона, водянку аллантоиса и отек хорио-аллантоиса. Точные причины отечного состояния были неопределенными и требуют дальнейших исследований, как отечное состояние развилось in utero в период беременности.Различные существующие факторы, влияющие на матку, плацентарные оболочки и плод, ответственные за формирование отечности плодных оболочек, однако некоторые из них были обоснованы логическими интерпретациями. Существует значительная корреляция между аномалиями плода и степенью образования водянки. Это состояние причиняет фермерам потери в виде гибели плода, аномального развития плода и, кроме того, дает плохой прогноз для жизни матери, а также для фертильности. Ранняя диагностика и назначение лечения могут дать хороший прогноз без каких-либо осложнений.
В настоящем обзоре рассматривается водянка плодных оболочек, которая включает водянку амниона, водянку аллантоиса и отек хорио-аллантоиса. Точные причины отечного состояния были неопределенными и требуют дальнейших исследований, как отечное состояние развилось in utero в период беременности.Различные существующие факторы, влияющие на матку, плацентарные оболочки и плод, ответственные за формирование отечности плодных оболочек, однако некоторые из них были обоснованы логическими интерпретациями. Существует значительная корреляция между аномалиями плода и степенью образования водянки. Это состояние причиняет фермерам потери в виде гибели плода, аномального развития плода и, кроме того, дает плохой прогноз для жизни матери, а также для фертильности. Ранняя диагностика и назначение лечения могут дать хороший прогноз без каких-либо осложнений.
Введение
Несчастные случаи беременности регистрируются у всех видов животных и людей. Водянка плодных оболочек — случайное явление, сопровождающееся поражением плода, плаценты и, в конечном итоге, опасностью для матери. Патологическими состояниями, поражающими плодные оболочки, были гидрамнион, гидраллантоис и отек хориоаллантоиса. Что касается видов крупного рогатого скота, гидраллантоис плодных оболочек имеет большое значение из-за его распространенности на полевом уровне, но у человека наиболее часто встречаются гидрамнионы.Водянка плодной оболочки — это чрезмерный уровень накопления жидкости в роге беременной матки, это патологическое состояние, обнаруживаемое по отдельности, но редко связанное друг с другом у одного и того же животного. У одноплодных животных состояние, обычно характеризующееся увеличением живота, может быть принято за гидроперитонеум (асцит) и гидрометру у крупных и мелких жвачных соответственно. Если заболевание не лечить на ранней стадии и на поздней стадии беременности, это может привести к тому, что животное не сможет подняться, и ухудшит прогноз для жизни матери.
Патологическими состояниями, поражающими плодные оболочки, были гидрамнион, гидраллантоис и отек хориоаллантоиса. Что касается видов крупного рогатого скота, гидраллантоис плодных оболочек имеет большое значение из-за его распространенности на полевом уровне, но у человека наиболее часто встречаются гидрамнионы.Водянка плодной оболочки — это чрезмерный уровень накопления жидкости в роге беременной матки, это патологическое состояние, обнаруживаемое по отдельности, но редко связанное друг с другом у одного и того же животного. У одноплодных животных состояние, обычно характеризующееся увеличением живота, может быть принято за гидроперитонеум (асцит) и гидрометру у крупных и мелких жвачных соответственно. Если заболевание не лечить на ранней стадии и на поздней стадии беременности, это может привести к тому, что животное не сможет подняться, и ухудшит прогноз для жизни матери.
Hydrallantois
У крупного рогатого скота аллантоис формируется на второй и третьей неделе беременности, однако у крупных домашних животных аллантоис полностью формируется через 24–28 дней после зачатия. Жидкости, которые заполняют аллантоисную полость, называемую аллантоисной жидкостью, в этой полости хранятся продукты жизнедеятельности плода, которые проходят из мочевого пузыря плода через урахус. Количество аллантоидной жидкости варьировалось от вида к виду, которое было занесено в таблицу.
Жидкости, которые заполняют аллантоисную полость, называемую аллантоисной жидкостью, в этой полости хранятся продукты жизнедеятельности плода, которые проходят из мочевого пузыря плода через урахус. Количество аллантоидной жидкости варьировалось от вида к виду, которое было занесено в таблицу.
Виды | Объем аллантоисной жидкости в конце беременности |
| Корова | 9.5лит |
| Овцы и козы | 0,5-1,5 лит |
| Собака | 10-50 мл |
| Свинья | 100-200 мл |
| Кот | 3-15 мл |
Hydrallantois — это гестационное патологическое состояние плодной оболочки, характеризующееся быстрым чрезмерным накоплением водянистой жидкости янтарного цвета, заполняющей аллантоисную полость в течение 5-20 дней на поздних сроках беременности. Hydrallantois встречается примерно в 85-90% отечных состояний, поражающих плод и плодные оболочки
Hydrallantois встречается примерно в 85-90% отечных состояний, поражающих плод и плодные оболочки
Заболеваемость
Эти записи объясняют, что гидраллантоис поражает как телок, так и полных животных всех видов, независимо от пород. Но сообщений о гидраллантоисе у видов свиней было немного.
Этиология: Этиология состояния была разделена на 3 группы.
| Основные причины |
|
| Вторичные причины |
|
| Разные причины |
|
Hydramnios
Амнион образуется примерно через 13–16 дней после зачатия у жвачных и лошадей, несколько раньше у домашних животных (собак, кошек) и свиней.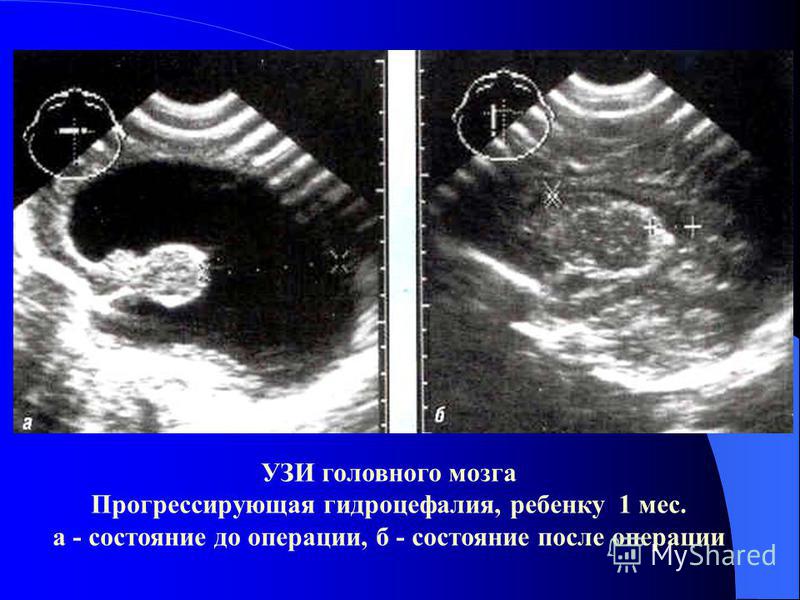 Это мешок с двойными стенками, окружающий плод, за исключением пупочного кольца. Объем амниотической жидкости варьируется от вида к виду. Слизистые околоплодные воды по своей природе получают из слюны и носоглоточного секрета плода. Объем можно регулировать с помощью мочеиспускания плода, глотания плода и секреции легочной жидкости плода, внутримембранного потока через сосуды плода на поверхности плаценты и через амниотическую мембрану.
Это мешок с двойными стенками, окружающий плод, за исключением пупочного кольца. Объем амниотической жидкости варьируется от вида к виду. Слизистые околоплодные воды по своей природе получают из слюны и носоглоточного секрета плода. Объем можно регулировать с помощью мочеиспускания плода, глотания плода и секреции легочной жидкости плода, внутримембранного потока через сосуды плода на поверхности плаценты и через амниотическую мембрану.
| Виды | Объем околоплодных вод в конце беременности. |
| Корова | 5-6 литров |
| Маре | 3-7 литров |
| Коза | 0,4-1,2 литр |
| Ewe | 0,35-0,70 лит |
| Свинья | 0,04-0,20 л |
| Собака, кошка | 8-30 мл |
Заболеваемость:
Состояние гидрамниона развивается медленно от нескольких дней до более чем месяца, особенно в последние 6 недель беременности у крупного рогатого скота, иногда у овец и коз, редко регистрируется у свиней, собак и кошек. Очень редко встречается у лошадей. Степень состояния зависит от аномалий плода.
Очень редко встречается у лошадей. Степень состояния зависит от аномалий плода.
Этиология
Наиболее распространенными для этого состояния были аномалии плода, дефект центральной нервной системы, сахарный диабет, тяжелая анемия плода с высоким сердечным выбросом, идиопатическое многоводие, беременность двойней также поддерживает многоводие.
Клинические признаки, Диагностика, Дифференциальный диагноз, прогноз как Hydroamnion, так и Hydroallantois.
| Компоненты | Hydroallantois | Гидроамнион |
| 1.Заболеваемость | Около 85-90% случаев | Около 5-10% случаев |
| 2. Увеличение живота | Развивается 5-20 дней | Медленно развивается в течение месяцев |
| 3. Брюшная стенка | Круглый с сильным растяжением и напряжением | Форма груши и менее напряженная |
4. Перректальное обследование Перректальное обследование | Растянутый рог матки пальпируется.Но не может пальпировать плод и плацентомы. | Рог матки трудно пальпируется. Но способна пальпировать плод и плацентомы . |
| 5. Характеристики плода | Плод в норме Иногда при вскрытии возникают дефекты почек и печени плода. | В основном обнаружен дефект и аномальный плод . |
| 6.Характеристики плаценты и карункулов | Расширенные, кожистые, студенистые и гипертрофированные плацентомы. Цветная капуста похожа на карункулы. | Нормальные характеристики плаценты, плаценты, хориоаллантоиса. |
| 7. Заправочная емкость | Быстрое наполнение емкости после аллантоцентеза. | Медленное пополнение или отсутствие повторного наполнения |
8. Дифференциальная диагностика Дифференциальная диагностика | Кишечная непроходимость, асцит, разрыв мочевого пузыря, опухоль. | Рубцовая барабанная перепонка, несварение блуждающего нерва, смещение сычуга вправо. |
| 9. Осложнения | Грыжа живота, вывих бедра ( Внешний вид раздутой бычьей лягушки ), Задержка плодной оболочки, Метрит | Редко наблюдаются осложнения. Фетальный аномальный монстр вызывает дистоцию. |
| 10. Прогноз | Плотина будущего плодородия и жизни бедняков. | Плотина будущего плодородия и жизни от хорошей до хорошей. |
III. Отек аллантоис-хориона
Он характеризуется сильным отеком аллантоисхориона толщиной 4-6 дюймов, в основном связанным с бруцеллезом у крупного рогатого скота (Roberts, 2004), однако он редко связан с состоянием гидроаллантоза.
Гематобиохимические и электролитные изменения при отеке:
- Компоненты клеток крови: Животные, пораженные гидраллантоисом, страдают нормоцитарной нормохромной анемией, т.
 е.е. снижение уровней Hb, PCV, TLC и RBC из-за накопления продуктов метаболизма, присутствующих в аллантоисной жидкости, и послеоперационных спаек на матке с последующим внутренним кровотечением.
е.е. снижение уровней Hb, PCV, TLC и RBC из-за накопления продуктов метаболизма, присутствующих в аллантоисной жидкости, и послеоперационных спаек на матке с последующим внутренним кровотечением. - Профиль печени: Нормальные роды без осложнений у крупного рогатого скота оказывают незначительное влияние на ферменты плазмы сыворотки, однако после гидроллантоза и его коррекции путем медицинского прерывания беременности или хирургической коррекции активность сывороточной глутамат-оксалоуксусной трансаминазы (SGOT) и уровень глутаматпируваттрансаминазы в сыворотке крови (SGPT) был повышен, что могло быть связано с спаечным процессом на матке
- Почечный профиль: Увеличенный живот вызывает стресс у животного, приводит к вызванному стрессом уменьшению кровотока в почечной системе, может осложняться обезвоживанием, шоком и почечными изменениями, или токсическое вещество, выделяемое мертвым плодом, приводит к почечной недостаточности.
 Кроме того, повышен уровень специфического для почек креатинина.
Кроме того, повышен уровень специфического для почек креатинина. - Уровень кортизола: Уровень кортизола повышается в отсроченных случаях с серьезными респираторными осложнениями в сильно вздутом животе.
- Уровень глюкозы в крови: Высокий уровень глюкозы в крови матери при отечном состоянии, связанном с диабетической беременностью у женщин.
- Концентрация электролитов: Гипонатриемия матери при отечном состоянии, связанном с диабетической беременностью, однако Ducommun (1967) не зафиксировал никаких изменений уровня кальция и натрия при одновременном повышении уровня фосфора и снижении уровня магния.
- Концентрация электролитов в жидкости плода: Нет недавних сообщений о концентрации электролитов в жидкости плода при отечном состоянии, только в 1967 г. Докуммун зафиксировал, что уровни кальция были нормальными, тогда как уровни фосфора были высокими.
 Уровни натрия не статичны в случаях гидраллантоиса из-за изменений проницаемости плацентарных мембран.
Уровни натрия не статичны в случаях гидраллантоиса из-за изменений проницаемости плацентарных мембран.
Лечение:
Метод амниоредукции
Человеку на поздних сроках беременности с большим объемом околоплодных вод, связанным с респираторным осложнением, может потребоваться метод амниоредукции с использованием стерильной внутривенной трубки, соединенной с эвакуированным контейнером.Эта процедура необходима еженедельно (или) раз в две недели на поздних сроках беременности. Однако возможность риска разрыва мембраны, повреждения плаценты, преждевременных родов. Для выполнения этой процедуры необходимы передовые технические знания. Таким образом, эта процедура не применяется в ветеринарной практике, особенно для крупных животных в полевых условиях.
Трансцервикальная катетеризация Фолея
Трансцервикальная катетеризация Фолея аналогична технике аллантоцентеза. В этом методе 18-дюймовый катетер Руша фиксируется во внутреннем зеве шейки матки с помощью прикрепленного к нему надувного баллона с последующим введением аналога простагландинов и дексаметазона, что приводит к медленному оттоку аллантоисной жидкости через 48 часов лечения. Если неправильная фиксация (или) полное повреждение аллантоисной полости приводит к внезапному выбросу аллантоисной жидкости, может закончиться гиповолемическим шоком. Гиповолемический шок можно купировать с помощью внутривенного введения гипертонического солевого раствора.
Если неправильная фиксация (или) полное повреждение аллантоисной полости приводит к внезапному выбросу аллантоисной жидкости, может закончиться гиповолемическим шоком. Гиповолемический шок можно купировать с помощью внутривенного введения гипертонического солевого раствора.
Пересечение шейки матки и введение окситоцина
Сама по себе трансцервикальная катетеризация Фолея не дает полного ответа на гидраллантоис, связанный с атонией матки, для борьбы с атонией матки ненасильственное сокращение матки было достигнуто четырехкратным введением 20 МЕ окситоцина с интервалом 20 минут приводит к медленному оттоку аллантоисной жидкости.
Абдоминоцентез
Этот метод не является полным выбором для прекращения гидраллантоиса у крупных животных, но в некоторых случаях он возможен у овец и коз для облегчения респираторного дистресса, игла калибра 16, троакар и канюля используются для удаления аллантоисной жидкости, с последующей индукцией лютеолитическим препаратом.
Медикаментозное прерывание беременности
Прерывание беременности было лучшим вариантом лечения по сравнению с другими методами, более того, в первую очередь МТП использовался во всех методах лечения.В другом месте ученые в основном пытались использовать комбинацию простагландинов и дексаметазона во время беременности, а не только одно лекарство. Группы простагландинов, такие как динопрост (общая доза 25 мг в / м), клопростенол (общая доза 500 мкг в / м). Либо один из простагландинов в сочетании с дексаметазоном (50-60 мг). Прерывание беременности, связанное с введением дексаметазона, стимулирует кортикостероиды плода и стимулирует фермент 17-альфа-гидроксилазу в плаценте, а простагландины вызывают лютеолиз функционального желтого тела.
Кесарево сечение
Медикаментозное прерывание беременности не всегда дает полные результаты из-за недозревания шейки матки и неполного раскрытия шейки матки, поэтому для решения этого состояния необходимо кесарево сечение. Мера предосторожности при кесаревом сечении — медленный отток аллантоисной жидкости с помощью стерильного рубцового троакара и одновременного внутривенного введения гипертонического раствора для борьбы с гиповолемическим шоком.
Мера предосторожности при кесаревом сечении — медленный отток аллантоисной жидкости с помощью стерильного рубцового троакара и одновременного внутривенного введения гипертонического раствора для борьбы с гиповолемическим шоком.
Заключение
Отёчное состояние является одним из основных препятствий, препятствующих будущему плодородию и сроку службы плотины.Это хорошо известная проблема на полевом уровне, когда ветеринары могут управлять этим состоянием из-за опасного для жизни гиповолемического шока при внезапном оттоке фетальной жидкости. Различные неизвестные причины влияют на формирование этого состояния на поздних сроках беременности. Ранняя диагностика этого состояния на полевом уровне с помощью перректального и перивагинального обследования в соответствии с положительными результатами в анамнезе в первом или втором триместре беременности может помочь в дифференциации других гестационных происшествий.В соответствии с клиническим статусом животного протоколы лечения варьировались от одного медикаментозного прерывания беременности или комбинации с техникой катетеризации для решения данного состояния. В безнадежных отсроченных случаях с респираторным осложнением и боковым лежачим положением прогноз животного был осторожным. Постакушерское лечение этого состояния может заключаться в приеме антибиотиков для борьбы с инфекциями. Экболический препарат, бороглюконат кальция для восстановления моторики матки для изгнания плодных оболочек и их содержимого.Спасите животное, если предполагается, что состояние является наследственным, и воспрепятствуйте повторному выведению этого животного.
В безнадежных отсроченных случаях с респираторным осложнением и боковым лежачим положением прогноз животного был осторожным. Постакушерское лечение этого состояния может заключаться в приеме антибиотиков для борьбы с инфекциями. Экболический препарат, бороглюконат кальция для восстановления моторики матки для изгнания плодных оболочек и их содержимого.Спасите животное, если предполагается, что состояние является наследственным, и воспрепятствуйте повторному выведению этого животного.
Содержание статей точное и правдивое, насколько известно автору. Он не предназначен для замены диагноза, прогноза, лечения, рецепта или официального и индивидуального совета ветеринарного врача. Животные, проявляющие признаки и симптомы дистресса, должны быть немедленно осмотрены ветеринаром. |
Доктор Тангамани. А
Аспирант ветеринарной гинекологии и акушерства, Колледж ветеринарных наук NTR, Gannavaram-AP
Наследственные пороки: врожденная водянка крупного рогатого скота и анрезия свиней
НАСЛЕДСТВЕННЫЕ ДЕФЕКТЫ ВРОЖДЕННАЯ ПАМЯТКА КРС И АТРЕЗИЯ МИ СВИНЕЙ РОБЕРТА ЭДВАРДА ТОМАСА ИРВИНА ЭТО ПРЕДСТАВЛЕНО ПРИ ЧАСТИЧНОМ ВЫПОЛНЕНИИ ТРЕБОВАНИЙ К СТЕПЕНИ МАСТЕРА НАУКИ В ОТНОШЕНИИ СЕЛЬСКОГО ХОЗЯЙСТВА в соответствии со стандартом Министерства сельского хозяйства требуется от кандидатов на степень магистра сельскохозяйственных наук БРИТАНСКИЙ КОЛУМБИЙСКИЙ УНИВЕРСИТЕТ Октябрь 1951 г.РЕФЕРАТ Два наследственных дефекта.Исследованы врожденная водянка крупного рогатого скота и атрезия свиней. Во введении делается ссылка на эволюционное значение смертоносных и сублетальных охотников и сравнивается их важность для практического разведения скота. Перечислены некоторые опубликованные отзывы о наследственных пороках сельскохозяйственных животных. Первая часть связана с врожденным дефектом водянки, который наблюдался и изучался в убиссейском стаде зарегистрированного эйрширского молочного скота, принадлежащего и разводимого Университетом Британской Колумбии.Изложена история стада и методы разведения, использованные на его основе. Формулируется и проверяется однофакторная рецессивная генетическая гипотеза, объясняющая возникновение десяти дефектных яйцеклеток. Генетический анализ родословных 153 из 501 детеныша, родившихся в стаде до 30 сентября 1951 г., показал, что средняя теоретическая вероятность излечения дефекта составляет 0,0853. Был применен тест на «степень соответствия», который показал, что выборка изучила гипотезу.
Этиология и патогенез дефекта исследуются в рамках действующей гипотезы иммуногенеза, основанной на двух предположениях: 1) что дефект, врожденная водянка, является аналогом наследственного заболевания новорожденных, эритробластоза плода; 2) что теория изоиммунизации резуса, служащая для объяснения семейной; Заболеваемость людей может быть адаптирована к генетике популяций крупного рогатого скота. Описываются иммуногенетические исследования, предпринятые для проверки этой гипотезы, и предлагается объяснение результатов, отклоняющихся от гипотезы.Вторая часть посвящена более сложному наследственному дефекту. Atresia ani свиней. Обзор литературы. Представлены истории и родословные трех аномальных пометов, рожденных в местном стаде зарегистрированных йоркширских свиней. Предлагаются два объяснения возможного способа наследования дефекта, которые проверяются на доступной для изучения выборке. Приведены рекомендации, данные заводчику, которые позволят ему избавить его конкретное стадо племенного поголовья от дефекта.
Заключение представляет собой краткое обсуждение проблем, с которыми сталкивается заводчик зарегистрированного поголовья, в стадах или отарах которого имеет место наследственный дефект.я обрисовал в общих чертах. Также представлены процедуры серологических реакций, используемых при исследовании иммуногенности крупного рогатого скота. БЛАГОДАРНОСТЬ За предложения и рекомендации по проведению генетических исследований, включенных в эту диссертацию, автор глубоко признателен доктору Дж. К. Берри, профессору кафедры животноводства Университета Британской Колумбии. Особая благодарность д-ру С. Н. Вуду, профессору кафедры животноводства Университета Британской Колумбии, за его неоценимую помощь на этапе иммуногенетической работы.СОДЕРЖАНИЕ СТРАНИЦА ПРИЗНАНИЕ ВВЕДЕНИЕ ЧАСТЬ I I Отечные телята в стаде Убисси Эйршир A Стадо Убисси Эйршир 1 B Врожденная отечность молочного скота 2 C Эритробластоз плода у людей 3 D Иммуногенетическое исследование клеточных антигенов у крупного рогатого скота 5 1); Агглютинация и гемолиз 2) Число и взаимодействия клеточных антигенов у крупного рогатого скота.
Гипотезы E для объяснения возникновения врожденного отека 7 1) Генетическая гипотеза 2) Иммуногенетическая гипотеза II Формулировка генетической гипотезы A Родословные и учетные записи 9 B Формулировка гипотезы 10 1) Основные предположения 2) Гетерозиготы в родословных C Проверка гипотезы 13 l) Вероятности гомозиготных рецессивов D Обсуждение результатов 16 III Формулировка и проверка иммуногенетической гипотезы Формулировка гипотезы 19 B Проверка гипотезы 20 C Обсуждение результатов 21 ЧАСТЬ II Atresia rvni в йоркширском стаде свиней Обзор литературы 23 B История возникновения Atresia ani в местном стаде 24 C Анализ родословных D Генетические гипотезы 25 1) Однофакторный рецессивный 2) Двухфакторный доминантный E Рекомендации для селекционер 27 ЗАКЛЮЧЕНИЕ ПРИЛОЖЕНИЯ СПИСОК ЛИТЕРАТУРЫ i IHTRODTJC'i'ION Вариации формы и функции организмов позволяют популяциям соответствует принципу отбора, будь то естественный отбор или селекция, практикуемая селекционерами * Если популяции не обладают достаточным разнообразием, чтобы соответствовать изменениям в окружающей среде, они вымирают * Никакая среда не является статичной Управляющий эволюционным процессом, селекция, постоянная- Лай использует вариации в развитии форм, наиболее приспособленных к окружающей среде.
Если индивидуальная форма выходит за пределы вариаций, допускаемых окружающей средой, в которой она должна жить, она не может воспроизводиться, и зародышевая плазма, которую она несет, уничтожается * Это отбор * Пассивный отбор природы для многих видов был вытеснен - ред активным отбором человека. Хотя живое существо не является неизменным, а склонно к изменению, выбор человека основан на статической концепции гена. Для практического селекционера достаточно концепции statio. Для биолога динамическая концепция необходима, чтобы учитывать вариации наследственности. * В практике селекции заводчики предполагают, что потомки отобранных родителей получат выборочную половину наследственности родителя.Если потомство отличается от ожидаемого за пределами, допускаемыми стандартами заводчиков, то обычно правильно предполагать, что один или оба родителя несли нежелательную зародышевую плазму. Если несколько потомков сильно отличаются по форме, то генетический контроль был изменен мутацией. Хотя естественный отбор пассивен, формы, которым он позволил развиваться, хорошо адаптированы к существующей среде.
Отклонения от нормального i i по большей части менее приспособлены к выживанию и поэтому вредны. * Аномалии называются наследственными дефектами и, как говорят, находятся под контролем летальных или сублетальных генов.Естественный отбор в значительной степени устранил однофакторные доминантные летальные и сублетальные. В каждой популяции имеется очень большое количество однофакторных рецессивных летальных клеток *. Гены, контролирующие последнюю, способны к фенотипической экспрессии только тогда, когда они находятся в гомозиготном состоянии. Сьюолл Райт (1931) показал, что случайное спаривание большой популяции может поддерживать большое количество реципиентных генов. Но с одомашниванием видов, созданием рас, известных как породы, и разделением популяции на изоляты, истинное случайное спаривание невозможно.Количество рецессивных генов, которые могут быть носителями в популяции, значительно сокращается. Инбридинг, который по необходимости должен происходить с изолятами, увеличивает вероятность отсутствия гомозиготного рецессивного генотипа и летального или сублетального фонотипа.
По мере того как практика разведения в закрытых популяциях продолжается, все больше и больше гомозиготных реоессивов будет сегрегироваться. готовы рискнуть произвести большее количество гомозиготных рецессивов * Не все, но большинство гомозиготных рецессивов вредны.Легкость, с которой популяция может быть избавлена от генов, вызывающих вредоносный фенотип, зависит не только от основного способа наследования, но также от плодовитости и плодовитости животных. Давление выбора, которое может быть применено, регулируется скоростью воспроизводства, а также эоономической ценностью каждого человека. Наследственные дефекты домашнего скота были рассмотрены Hadley и Warwick (1927). Более поздние обзоры включают обзоры Императорского бюро животноводства (1931 г.), Батта (1934 г.) и Eatfcn (1937 г.).Лернер (1944), Рио и Эндрюс (1951) составили списки всех зарегистрированных случаев смерти и частичной гибели скота и человека. Известен способ наследования большинства дефектов. Из тридцати четырех признаков, по которым был определен наследственный контроль, только два являются доминирующими.
Более реальный список включает только девять признаков неизвестной наследственности. Наследственные дефекты у животных - это либо анатомические, либо физиологические изменения, проявляющиеся в виде изменений внешнего вида или функций задействованных частей тела по сравнению с исходными.Аберрантное эмбриологическое развитие может вызывать аналогичные дефекты, но они не могут быть наследственными. Необходимо провести племенные испытания или изучить семейный анамнез, чтобы определить, является ли данный дефект наследственным. 1 ЧАСТЬ II Отечные телята в стаде в Убисси Эйршир A Стадо в Эйршире в Убисси Стадо молочного овса Университета Британской Колумбии в Эйршире основано на 24 головах, импортированных из Шотландии в 1929 году. Нынешнее стадо в семьдесят пять голов является линейным трем фундаментным импортным коровам.Этими стадами были Rainton Rosalind V -130259-, Ardgowan Gladness II -130282-, Lochinch Lassie-130269- • Все животные в стаде отслеживают от двух до шести раз к одной или более из этих коров.
Сыновьями этих коров являются трое недавних производителей стада. Эти производители: Адмирал Убисси Розалинды -226521- *, Спитфайр губернатора Убисси -246791-, Белая кокарда Убисси -269047-. Адмирал - сын Розалинды и внук Глэднесс, в то время как Спитфайр - сын Глэднесс и внук Розалинды, Белая кокарда - сын Лесси от Спитфайра.Нынешний отец - Коммодор Адмирала Убиссей -307558-, сын Адмирала от дочери Спитфайра. Младший родитель стада, сенатор Ubyssey Cockade's -339650- является двойным внуком Лесси от Белой кокарды и дочери адмирала. Коммодор произвел на свет восемьдесят телят. Восемь его телят были аномальными при рождении. Восемь, четыре мужчины и четыре женщины страдали от скопления биологических жидкостей в подкожной фасое, что проявлялось в виде острого отека. Только у двух телят, рожденных ранее в стаде, наблюдались похожие отклонения.Их отец Адмирал. Высокая частота аномальных телят среди телят, рожденных Коммодором, привела к необходимости проведения генетического анализа проблемы.
Казалось более чем случайным, что Коммодор, сводный брат двух ненормальных олав, произвел на свет восемь аналогичных аномальных телят * B Врожденная отечность молочного скота Аномалия, наблюдаемая в клетках Убисси, сопоставима с условиями, которые, как сообщается, наблюдались в некоторых случаях. Скандинавские стада молочного скота. В свой список смертельных генов крупного рогатого скота Лернер (1944) включил «Врожденную отечность».Состояние шведского фризского скота было изучено Ларссоном (1935) и было сообщено Йоханссоном (1939) на Международном конгрессе генетиков. Коркман (1940) описал аналогичные случаи, встречавшиеся среди эрширского скота Финляндии. Наблюдаемые им оазисы произошли от потомства быка Данлоп Талисман, привезенного из Шотландии. Йоханссон сообщил, что врожденная водянка имеет широкий спектр проявлений: некоторые плоды значительно увеличиваются в размерах из-за накопления жидкости в подкожной фасции и в полостях тела, тогда как другие имеют лишь незначительные отклонения от нормы.
Он утверждает, что период беременности при водянке плода в среднем составляет 226 дней, с диапазоном от менее 150 дней до 277 дней8. Ранняя отечная дегенерация сопровождается ранним абортом, когда
Йоханссон отмечает, что случаи, которые он наблюдал, произошли только от потомков некоторых несанкционированных спариваний, и предполагает, что контроль осуществляется одним рецессивным геном. Анализ Коркмана количества аномалий показал, что наследование контролируется одним рецессивным геном. О расследовании этиологии или патогенеза заболевания не сообщалось. C. Эритробластоз плода у людей. Эритробластоз плода у людей имеет выраженную семейную распространенность, но способ наследования, определяющий его проявление, неизвестен.Изучение болезни дополнительно осложняется многочисленными обычно наблюдаемыми клиническими проявлениями. В большинстве случаев заболевание проявляется в виде отеков у новорожденных. Согласно Weiner (1946) существует два клинических синдрома: врожденное гемолитическое заболевание с анемией и / или водянкой; второй - ioterus gravis (острая желтая атрофия печени). Дэвидсон (1945) утверждает, что все клинические проявления болезни связаны генетически и этиологически, но ни один из синдромов не является патогномоничным (свойственным болезни). Он изложил принцип патогенеза эритробластоза плода, который основан на изоиммунологических реакциях группы антигенов резуса (Rh), которые присутствуют примерно у 85% американцев. Резус-положительный муж резус-отрицательной женщины передает, как менделевский доминант, резус-фактор (ы) плоду. Резус-антигенные вещества проходят от резус-положительного плода через плаценту и вызывают выработку резус-антител у матери. Последние переходят от матери через плаоэнту к плоду, где действуют как гемолитические агенты и инициируют последовательность взаимосвязанных патологических изменений.Аналогичные объяснения были предложены Weiner (1946), Levine и др. (1939, 1941), Поттер и Уилсон (1945) и Ирвин (1947). Теория Rh-изоиммунизации эритробластоза плода может объяснить семейную заболеваемость. В то время как вышеупомянутые авторы утверждают, что человеческая плацента проницаема для агглютининов и антител, по крайней мере, на поздних стадиях беременности, Ранстрем (1947) рассматривает поражение плаценты как необходимое условие для изоиммунизации.
Он выдвигает теорию о том, что первичным элементом болезни является эндокринная дисфункция у матери, которая вызывает пагубные изменения.Любое возникшее в результате плаоентальное поражение открывает путь для изоиммунизации Rh при наличии соответствующих серологических условий. Поттер и Уилсон (1945) предполагают, что аномалия плаоенты позволяет эритроцитам плода проникать в кровообращение матери. Теория Ранстрома позволяет объяснить низкую заболеваемость этой болезнью. Заболеваемость эритробластозом плода составляет от одной из 300 до 400 рождений, в то время как каждая одиннадцатая беременная женщина является резус-отрицательной и вынашивает резус-положительный плод (Potter and Wilson, 1945).Ирвин (1947) утверждает, что примерно одна из 50 резус-отрицательных женщин, вовлеченных в критическое спаривание, становится сенсибилизированной. Ничто не объясняет, почему в первую очередь должны участвовать антитела к группе антигенов Rh. С другой стороны, Левин (1947, 1948) предполагает, что между матерью и плодом также может быть взаимодействие антигенов A и B.
Крю и др. (1947) утверждают, что в оазисах имели место акушерские катастрофы, когда отец был P-положительным, а мать P-отрицательным.«Теория Rh-изоиммунизации поднимает ряд вопросов, на которые нет удовлетворительного ответа. Ранстром поставил под сомнение отсутствие изоиммунизации Rh во многих случаях заболевания; и присутствующее Rh изоиммунизация без проявления болезни. Levine и др. 5 (1941) утверждают, что у младенцев есть оазисы гемолитической болезни, когда мать резус-положительна. Дэвидсон (1945) перечислил состояния, которые влияют на тяжесть эритробластоза плода. i) Возраст плода, когда антитела Eh становятся активными в его кровотоке.i i) Продолжительность времени, в течение которого плод подвергается этому воздействию. iii) Сила Eh-антител, титр анти-Eh-агглютининов в материнской крови не может быть измерен (нет связи между титром этих антител у матери и тяжестью заболевания у младенца. ). iv) Проницаемость глаоэнты: количественные различия у разных женщин или у одной и той же женщины в разное время.
Он приходит к выводу, что гемолитическая анемия, вызванная действием антител к Eh, является не только основной причиной эритробластоза плода, но и объясняет генез комплексных проявлений заболевания.D Иммуногенетическое исследование клеточных антигенов у крупного рогатого скота. Термин «иммуногенез» был предложен иммунологами Wisoonsin для обозначения исследований, в которых методы генетики и иммунологии использовались совместно (Irwin, 1947). Этот термин указывает на изучение генетических признаков, которые еще можно обнаружить только с помощью иммунологических реакций. 1 Теория антигенов, агглютинация и гемолитические тесты Основой изучения иммунологии является теория антигенов. Эта теория предполагает, что выработка антител нарушается, когда чужеродные антигены вводятся в организм.Открытия в области иммунохимии доказали, что антигены, распознаваемые иммунологическими методами, являются определенными химическими соединениями. Различия между антигенами заключаются в их гемиологических структурах, а не только в их физическом состоянии.
Ланд-Штайнер (1951) обнаружил, что вещества более простой формы, чем белки, могут быть антигенными, если присоединены к белкам. Эти вещества получили 6 названий гаптенов. Применение серологических реагентов привело к открытию того, что белки у животных и растений различны и специфичны для каждого вида.Антитело специфично к антигену, который вызывал его образование. Присутствие этих антител в сыворотке крови может быть замечено. Если красные кровяные тельца коровы, обладающие тремя антигенами, A, B и G, вводятся второй корове, эритроциты которой не содержат ни одного из этих антигенов, производство изоиммунной сыворотки, содержащей три высокоспецифичных антитела к антигенам A, B , и C следовало ожидать. Антитела столь же качественно различны, как и определяемые ими антигены.При тестировании этой изоиммунной сыворотки в свежем виде с отмытыми тельцами индивидуумов, имеющими антигены A, B и C, или любую их комбинацию, эорпусолы агглютинируются в скопления, видимые глазу. Если свежую иммунную сыворотку нагревают в течение одного часа при температуре 56 ° С или выдерживают в течение нескольких дней, она теряет способность агглютифицировать клетки, содержащие антигены.
Это происходит из-за потери третьего компонента, называемого комплементом, термолабильного, неспецифического вещества в нормальной сыворотке.Добавление свежей нормальной говяжьей сыворотки, содержащей комплемент, восстановит способность изоиммунной сыворотки * агглютинировать клетки. Более чувствительный тест возможен, если в качестве источника комплемента используется свежая нормальная кроличья сыворотка. Когда иммунная сыворотка смешивается с клетками, несущими любой из соответствующих антигенов, в присутствии сыворотки комплемента, клетки гемолизируются. Гемолиз красных кровяных телец легко наблюдается in vitro из-за того, что из клеток высвобождается свободный пигмент гемоглобина.Комплемент соединяется с антителами только тогда, когда последние абсорбируются на угрях в силу их союза со своими специфическими антигенами. Таким образом, три основных компонента положительного гемолитического теста: антиген, его специфическое антитело и комплемент. 7 2 Число и взаимодействие клеточных антигенов у крупного рогатого скота В клетках крупного рогатого скота обнаруживается более сорока антигенов.
Большинство из них может быть обнаружено по отдельности, поэтому количество различных вариантов оомбин-40, возможных у крупного рогатого скота, составляет не менее 2.Если каждый антиген представляет собой химическую единицу, биохимическая индивидуальность возможна у вида крупного рогатого скота. Хотя антигены могут быть обнаружены независимо, многие из них связаны унаследованием. Например, из антигенов, называемых B, 6 и K, B и G могут встречаться по отдельности или вместе, тогда как K не встречается, кроме как в комбинации с B и G. Генетически существует два вида животных, обладающих B и G вместе. , а именно те, у которых потомство B и G разделяются, как если бы родитель был гетерозиготным, и $ h # s «, чье потомство не несло оба антигена или ни один из них.Следовательно, должно быть сцепление генов, вызывающих эти три вещества, или они контролируются генами в аллельной серии. Анализ, проведенный рабочими из Висконсина (Ferguson, 1941; Ferguson, et al, 1942; Stormont and Cumley, 1943), показывает, что причинные гены расположены на десяти из тридцати пар хромосом крупного рогатого скота.
По-видимому, существует по крайней мере два набора множественных аллелей, каждый из которых включает несколько фаутов. Это уменьшает количество вовлеченных в процесс, и не исключено, что большинство антигенов, каждый из которых определяется доминантным геном, передаются по наследству независимо.Различия между породами в частотах генов, ответственных за контроль клеточных антигенов, предлагают наиболее подробную информацию, пока еще доступную для генотипов популяций крупного рогатого скота. Оуэнс и др. (1944) обнаружили, что породы Голштин и Гернси различаются только частотами действия тридцати изученных антигенов. B Гипотезы, объясняющие возникновение врожденного отека 1 A Генетическая гипотеза Точные родословные всех членов исследуемой популяции позволяют надежно проанализировать генетическую проблему.Родословные 8 зарегистрированных голов крупного рогатого скота очень надежны и в большинстве случаев являются полными для нескольких поколений. Полные записи о предках доступны для каждого человека в стаде Убисси Эйршир.
Эти записи позволили провести генетический анализ проблемы отеков и лоханок. Была сформулирована рабочая гипотеза, основанная на предположении, что наследственность дефекта контролируется однофакторными рецессивными генами. Родословная каждого животного в стаде была исследована и проанализирована. Коэффициенты вероятности были рассчитаны, чтобы установить вероятность наступления определенных событий, если гипотеза верна.Сравнение теоретически ожидаемых с наблюдаемыми результатами с помощью теста на добротность дало довольно надежную проверку работающей генетической гипотезы. 2 Иммуногенетическая гипотеза Была проверена вторая гипотеза, объясняющая этиологию и патогенез заболевания. Эта гипотеза была основана на сходстве проявлений врожденной водянки у крупного рогатого скота и эритробластоза плода у человека. Если теория изоиммунизации Rh, принятая в евгенике как объяснение семейной заболеваемости эритробластозом плода, имеет аналог в генетике крупного рогатого скота, гипотеза, основанная на знании клеточных антигенов крупного рогатого скота, могла бы служить для объяснения возникновения врожденной водянки.
в овсянке.Одновременно с анализом родословной, предпринятым для проверки гипотезы genetio, были проведены исследования иммуногенеза с использованием методов Фергюсона (1941) для проверки гипотезы изоиммунизации. Селекционные тесты, которые могли бы окончательно установить способ наследования болезни, не были сочтены ни возможными, ни практичными. Статистически значимые результаты, которые позволили бы установить менделевскую регенерацию сегмента 9, могли быть получены только после большого количества тестовых спариваний. Селекционные испытания с овсяным скотом являются необходимостью длительных экспериментов.Получение достаточных данных не только будет дорогостоящим, но и снизит среднюю племенную ценность стада. Вредоносный ген будет заражен по всему стаду в гетерозиготном состоянии. Последующее скрещивание гетерозигот могло вызвать усиление иноидного дефекта. Потребуется несколько поколений селекции, чтобы снизить частоту гена до его нынешнего значения. Низкая жизнеспособность дефектных яйцеклеток усложняет не только собственное проведение экспериментов по разведению, но и интерпретацию результатов.
II. Формулировка генетической гипотезы. Как уже говорилось ранее, отечные овцы, рожденные в стаде Uby-ssey, были близкими родственниками по боковой линии. Это семейное происшествие вместе с сообщениями Ларссона (1935), Йоханссона (1939) и Коркмана (1940) привело к предположению, что это состояние было наследственным. Патологические исследования при вскрытии не дали убедительных доказательств того, что заболевание могло быть вызвано конкретной инфекцией. Также не было изменений в способах кормления. Практика кормления во время беременности, которая привела к образованию отечных плодных яиц, была по существу такой же, как и в течение нескольких лет.Поэтому кажется маловероятным, что недостаток питания был предрасполагающим фактором * A P & digrees и отчеты об отелах Родословные отечных овец, рожденных в стаде Ubyssey, представлены на рисунках с 1 по 9 включительно. Овцам присвоены римские числа, и они перечислены в порядке их рождения. Телята I и II были от отца-адмирала, а телята с III по X включительно - от его сына Коммодора.
Теленок X был полным братом Теленку VI. Из расширенных родословных каждого из этих телят, диаграммы типа стрелок, чтобы показать линии происхождения от 10 Рисунок 1.Стрелочная диаграмма из родословной отечного теленка I »Адмирал-, Галахад - Веселость. «Капеллан Джесси» 11 Рис. 3 * Стрелочная диаграмма, взятая из родословной отечного олфа III, командор-адмирал Натали III Джоанн Капеллан, человек войны Рисунок 4. Стрелочная диаграмма, взятая из родословной эматозного олфа IV, коммодора _ адмирала - Галахад - Веселого человека of War Eunice Mainspring • 12 Рисунок 5. Стрелочная диаграмма, взятая из родословной отечной овцы Ve Рисунок 6. Стрелочная диаграмма, сделанная из родословной отечной овцы VI * 13 Рисунок 7.Morven • Свидание с теленком Хизер 15 *. Gam I.C. Описание IM 21/9/41 Адмирал Джесси 12 * 5 Бомб мертвый, усиленный жидкостью II M 27.10.43 Адмирал Эйли 20.3 Родился мертвым, наполненный жидкостью III P 16/6/49 Коммодор Люси 19.5 Голова и ноги отечные IV M 3/7/49 Коммодор Офелия 18.
2 Отечные VF 22/11/49 Коммодор Квакер 7.1 Отечные VI F 8/1/50 Коммодор Регина 9 * 8 Отечные, умерли при рождении от удушья VII F 7/4/50 Коммодор Первоцвет 16.4 Мертворожденный отечный VIII M 4/9/60 Коммодор Рамона 17.3 Отечный, живой, активный IX F 31/12/50 Commodore Rennle X M 15/1/51 Commodore Regina 7.8 Прервано через шесть месяцев. Узкий отек, гипокапли 9,8 Прозрачная отечная жидкость в подкожно-аневидной фасции - газообразный отек. IC. - Коэффициент инбридинга (per oent) Ботэ: Галахад, а не Морвен, считается отцом Джесси. Оба производителя обслуживали корову во время одной и той же течки. Таблица Ix. Данные и записи. Выявление отечных тельцов, рожденных в стаде Убиссей *, общих предков. Эти диаграммы представлены на рисунках с 10 по 18 включительно.Коэффициенты инбридинга рассчитывались с помощью стрелочных диаграмм; и они вместе с другими данными и записями, касающимися каждого отечного теленка, представлены в таблице I. Записи об отелах, относящиеся к моменту основания стада, были изучены и выявили следующую информацию. От 146 самок родилось 539 телят. Было восемь пар близнецов. Имена 12 быков и количество рожденных от каждого телят представлены в басне II. КОЛИЧЕСТВО СИРОВЫХ ТЕЛЕБ Королевский капеллан Auohenbrain -130252- 64 Grandview Man 0 * War -159659- i «Gr and view Mainspring -165506- 39 Ubyssey Royal Gaiety -165532- 18 Fintry Morven -178672- 37 Dbyssey Gaiety Sir Galahad -202516- 53 Губернатор Убисси Розалинды -202521- 14 Убисси Морвен Гладгоуэн - 218123- 7 Адмирал Убисси Розалинда - 226521- 93 Спитфайр губернатора Убисси -246791- 38 Белая кокарда Убисси -269047- 66 Используется в коммодоре адмирала Убисси -307558- 79 501 Стол литературный Стадо и количество телят, отпущенных Eaoh.B Формулировка гипотезы 1. Основные предположения. Для целей анализа было предположено, что экспрессия pheno-17 typio, наблюдаемая как отек у новорожденных яйцеклеток, возможна только в генотипах, несущих оба рецессивных гена. То есть в популяции возможны три генотипа: гомозиготный доминантный (AA), гетерозиготный (Aa) и гомозиготный рецессивный (aa). Поскольку наблюдались только два фенотипа, а именно нормальный и отечный, мы должны предполагать полное доминирование.Генотипы AA и Aa, имеющие одинаковую экспрессию фенотипа, нормальные; и генотип аа - фенотипическая экспрессия, отечный. Изучение стрелочных диаграмм, составленных на основе родословных отечных телят, а также с учетом практики разведения и результирующих линий происхождения, наиболее часто встречающихся в стаде, показывает, что некоторые предки этих телят подозреваются в гетерозиготности по признаку. тер. В популяции нормальных животных возможны только три типа вязок, а именно.i) гомозиготный доминант Z гомозиготный доминант i i) гомозиготный доминант Z гетерозиготный i i i) гетерозиготный Z гетерозиготный Частота каждого типа спаривания в случайно спаривающейся популяции будет функцией частоты гена. Менделирующая сегрегация от спариваний этих двух генотипов будет следующей: i) Родители AA X AA Гаметы все AF x все AA ii) Родители AA Z Aa Гаметы все A £ A, £ a Fx '£ AA, £ Aa iii) Родители Aa Z Aa Gametes g A, £ a £ A, £ a Fx i AA, £ Aa, £ aa Iff Только в экспериментальных условиях спаривания с участием гомозиготной рецессивной особи будут вероятными.2 Гетерозигота8 в родословных Таким образом, получить гомозиготного рецессивного индивида можно только при скрещивании двух гетерозигот. При скрещивании двух известных гетерозигот только одно из каждых четырех потомков оказывается гомозиготным реоессивным. Вероятность получения гомозиготного рецессивного потомства от скрещивания двух животных неизвестного генотипа, случайно выбранных из популяции, крайне мала. Для увеличения вероятности возникновения какого-либо события до уровней, подходящих для практических экспериментов по разведению, необходимо вязать животных известной родословной и генотипа.Спаривания Sinoe al в стаде Ubyssey были нормального фенотипа, те спаривания, которые дали отечных телят, были вязками двух гетерозиготных животных. Самцы и самки любых отечных овец были гетерозиготами. Имена этих одиннадцати известных гетерозигот включены в Таблицу I. Кроме того, изучая родословные этих животных, можно предположить, что некоторые другие предки отечных овец, в достаточных пределах вероятности, также были гетерозиготами. Линия происхождения от капеллана к Гейети, Галахаду и Адмиралу является общей для всех отечных овалов.из родословных (VIII и IX) один или несколько из этих производителей являются общим предком. Поэтому / возможно, что пять производителей этой линии происхождения были гетерозиготными. Поскольку в одной родословной, кроме VIII и IX, есть по крайней мере две линии происхождения от по крайней мере одного из этих производителей, единственная рецессивная гипотеза приемлема. Чтобы учесть отечные овцы VIII родословной или IS i t, необходимо признать гетерозиготными животных, не являющихся потомками любого из этих пяти производителей.Хотя Адмирал И.С. гетерозиготен и, предположив, что его отец также был гетерозиготным, генотип его матери, Розалинды, можно предположить гетерозиготным с вероятностью половинной. Предполагая, что Розалинда была гетерозиготной, можно объяснить появление отечных овалов у породистой VIII или IX. Розалинда является общим предком во всех, кроме родословной I. Расчет вероятности передачи рецессивных генов по обеим линиям потомков в каждой родословной от одного или нескольких гетерозиготных (предполагаемых) предков служит для проверки гипотезы и позволяет тест на соответствие.Гипотеза, сформулированная на основе изучения родословных отечных яйцеклеток, может быть изложена следующим образом: 1) предполагается, что персонаж находится под контролем одной пары джиннов. i i) предполагалось полное доминирование. i i i) взял на себя линию desoent от капеллана до Гейети, до адмирала и отечного оленя; или от адмирала до коммодора, до отеков. Предполагается, что все эти производители были гетерозиготными. iv) предположил, что Розалинда была гетерозиготной. C Проверка гипотезы Родословные всех животных, рожденных в стаде, были объединены, чтобы определить, у каких телят был капеллан, веселость, галахад или адмирал в качестве общего предка.Существует 153 родословных, в которых один из этих производителей фигурирует как общий предок. Капеллан - общий предок в 123 родословных; Веселость в 13 родословных; Галахад в 26 родословных; и Адмирал появляется в 27 родословных. Существует 37 родословных, в которых двое или более этих быков имеют общих предков. Стрелочные диаграммы были построены на основе родословных каждого потомства и рассчитана вероятность того, что каждое потомство будет гомозиготным реоэссивным. 20, 1 Вероятности гомозиготных рецессивов. Средние вероятности получения отечных яйцеклеток вместе с предположениями, на основании которых они были рассчитаны, представлены в виде схемы.i) Предполагая, что капелланом был Аа, игнорируя, что у овалов есть другие общие предки, игнорируя то, что Гейети, Галахад и адмирал были Аа; средняя вероятность - 0,0132. - предполагая, что Гейети, Галахад и Адмирал были Аа; средняя вероятность - 0,0526. (на основе 123 родословных) i i) Предполагая, что Веселость была Аа, игнорируя других общих предков овец: - игнорируя Адмирала, Галахада и Коммодора были Аа; средняя вероятность - 0,0189. - предполагая, что Галахад, адмирал и коммодор были Аа; средняя вероятность - 0.0697. (на основе 13 родословных) i i i) Предполагая, что Галахад - Аа, игнорируя, что у овец есть другие предки oommon: - игнорируя, что Адмирал и Коммодор были Aa; средняя вероятность - 0,0396. - предполагая, что адмирал и коммодор были Аа; средняя вероятность - 0,0865. (на основе 26 родословных) iv) Предполагая, что Адмирал - это Аа, игнорируя, что у овец есть другой предок oommon - игнорируя, что Коммодор - это Аа; средняя вероятность - 0,0549. - предполагая, что Коммодор - Аа; средняя вероятность - 0,0914.(на основе 27 родословных) 7) Предположим, что все производители, капеллан, веселость, галахад, адмирал и коммодор были Аа. (Это естественно следует из основного предположения о том, что линия происхождения от капеллана была общей для всех телят Коммодором.) Средняя вероятность - 0,0772. (на основе 146 родословных) vi) Предполагается, что все производители. Капеллан, Гейети, Галахад, Адмирал и Коммодор были Аа; предполагая также, что Розалинда была Аа; средняя вероятность - 0,0853. (на основе 91 родословной) 2. Степень соответствия. К данным, полученным в результате анализа родословных, применялся критерий «ohi-квадрат (% **)» на «степень соответствия».Из формулы: где f 0 - наблюдаемая частота, а f - теоретическая частота, можно получить значение хи-квадрат. С помощью таблицы ohi-squar-ed (Snedeoor pi90, 1949) можно оценить добротность f i t. В таблицах ohi-squared значения указывают на вероятность получения f i t исключительно по случайности, равную или более низкую, чем полученная расчетным путем. Если эта вероятность мала, вероятность того, что расхождения между наблюдаемыми и рассчитанными данными являются случайными, также мала.Если это так, то проверка гипотезы, вероятно, с честью применима к решению исследуемой проблемы. Средняя вероятность получения отечного оленя в любой из 146 проанализированных родословных составляет 0,0853. На основе этой гипотезы можно было бы исключить, что из 153 родившихся телят 13 телят будут отечными, фактическая частота отечных телят в анализируемых родословных составляет десять из 153 или выражается как вероятность 0,0653. По этим двум частотам можно рассчитать значение квадрата охи.Вводя таблицы 22 хи-квадрат при одной степени свободы (на одну меньше, чем количество классов), можно получить значение P путем интерполяции. Когда ohi-квадрат равно 0,00469, P составляет 0,9325 при одной степени свободы. Другими словами, примерно в 93,25% подобных оазисов будут обнаружены большие или большие отклонения от теоретической вероятности, и нынешняя популяция не соответствует гипотезе. D Несоответствие результатов Хотя наблюдения и данные, полученные из этой довольно большой выборки, подтверждают, что рабочая гипотеза была изначально сформулирована, гипотеза не подтверждается.Больше доказательств, подтверждающих гипотезу, могло быть получено путем тестовых спариваний и обратных оросий, если было возможно поднять гомозиготных рецессивных животных до репродуктивной зрелости. Однако ведение полных учетных записей об отелах и точных родословных, как это требуется для зарегистрированного овсянки, позволит провести дальнейший анализ для проверки гипотезы. Типы спариваний, возможных в популяции нормальных особей, уже были обозначены. Если в популяции есть отечные особи, возможны три схожих типа вязок.Если бы скрещивание двух гомозиготных рецессивов было возможно, гипотеза подверглась бы абсолютному тесту, и можно было бы получить только отечное потомство синоэ. если только потомки двух гомозигот сами не являются гомозиготами, персонаж не находится под контролем одной пары джиннов. В настоящее время в стаде Ubyssey всего шесть животных с доказанным генотипом. Это отец Коммодор и пять маток отечных овец, оставшихся в стаде. Коровы, с которыми вязался Commodore aan, являются либо гомозиготными доминантными, либо гетерозиготными.Потомки Розалинды и особенно потомки Адмирала с большей вероятностью будут гетерозиготными, чем гомозиготными доминантами. Спаривание Commodore с боковыми родственниками увеличивает вероятность получения отечных яйцеклеток. Вероятность появления гомозиготного рецессива в каждом случае должна быть не менее 0,25. Если самка отечного теленка от Commodore родится живой и в зрелом возрасте будет фертильной 23, она может быть повязана со своим отцом, и в этом случае вероятность получения отечного теленка будет равна 0.50. Такое спаривание представляет только генетический интерес. Обычно такую самку не вырастили бы. Однако ее можно использовать для тестирования других быков неизвестного генотипа. Такие тестовые скрещивания вряд ли будут оправданы. Из-за долгого периода вынашивания и небольшого количества потомства для подтверждения генотипа одного быка потребуется несколько лет. Число производителей, которых можно было бы испытать на скрещивание с одной самкой, очень ограничено. быть 0.50. Еще один метод проверки гипотезы, который вряд ли станет доступным, - это скрещивание двух отечных особей. Вероятность получения двух телят противоположного пола, у которых совпадают периоды зексуальной зрелости и f e r t i l i t y, очень мала. Было высказано предположение, что состояние, наблюдаемое у новорожденных телят и названное врожденной водянкой, связано с наличием одной пары рецессивных аллелей. Также предполагалось, что существует полное доминаное, что один рецессивный аллель полностью затмевается фенотипическим выражением доминанты all e l.Затем предполагается, что состояние жидкостного баланса неполовозрелого крупного рогатого скота находится под контролем одной пары джиннов. Если присутствуют один или оба доминантных аллеля, индивидуум является нормальным фенотипом. Если присутствуют оба рецессивных аллеля, человек отечен. Баланс жидкости в организме должен, по ряду факторов, влияющих на баланс, находиться под комплексным контролем; но из-за хрупкого характера этого баланса он может быть нарушен одним простым изменением физиологических процессов, которые контролируют накопление и распределение жидкостей организма.Если хотя бы один шаг в одном из этих процессов зависит от присутствия 8fc и фенотипической экспрессии по крайней мере одного доминантного гена в аллельной паре, отсутствие обоих доминантных генов предотвратит инициирование серии событий, необходимых для производства система контроля водного баланса организма. Хотя анализ родословных показал, что наследственность врожденной водянки с большой вероятностью находится под контролем одного рецессивного гена, может показаться, что широкие вариации в проявлении противоречат этому предположению и скорее указывают на сложный способ наследования.Поскольку у каждого индивида гены оказывают свое раздельное влияние на эквивалентных стадиях развития, можно ожидать, что одна пара джиннов вызовет такой же синдром у всех индивидов, обладающих им. Однако внутриматочная среда может быть достаточно разнообразной, чтобы вызвать различную степень тяжести дефекта, наблюдаемого при рождении. Если бы группа сцепления или несколько генов частично или полностью отвечали за контроль жидкостного баланса, возможно, слабым местом в этой группе было то, что было бы унаследовано, и эта слабость могла бы влиять на разные гены в пределах группа в каждом отдельном человеке.Снова предполагая, что каждый этап физиологических процессов находится под контролем отдельного гена, этот этап процесса, который будет удален, будет зависеть от того, на какой ген повлияла наследственная слабость. Формулировка и проверка иммуногенетической гипотезы Обзор литературы по врожденным заболеваниям младенцев делает очевидным сходство между проявлениями эритробластоза плода у людей и врожденной водянкой крупного рогатого скота. Теория изоиммунизации R h e 8 U 8, принятая многими как объяснение болезни плода эритробластоз, уже была изложена.Дан обзор иммуногенетических исследований клеточных антигенов крупного рогатого скота. Принимая во внимание теорию резус-изоиммунизации и имеющуюся информацию о клеточных антигенах крупного рогатого скота, существует вероятность того, что: 2S-объяснение заболевания человека может служить объяснением заболевания у овса. Один. или группа антигенов крупного рогатого скота может действовать, как считается, что резус-антигены действуют у людей, вызывая отек новорожденного. Анализ для определения антигенного набора у особей в семьях, производящих дефектных телят, покажет, может ли теория изоиммунизации объяснить частоту возникновения отечных ягодиц.Была сформулирована рабочая гипотеза, основанная на следующих предположениях. i) Предполагается, что эритробластоз плода является аналогом врожденной водянки у крупного рогатого скота. i i) Предполагается, что теория резус-изоиммунизации объясняет частоту возникновения эритробластоза плода. i i i) Предполагается, что аналогичная теория изоиммунизации применима к наследованию и взаимодействию клеточных антигенов крупного рогатого скота. А. Формулировка гипотезы. Гипотеза применительно к оазисам в стаде Убисси может быть сформулирована следующим образом.Т # е отец. Коммодор, обладает *? определенный клеточный антиген или группа антигенов, которой не обладают самки отечных телят. Если плод от Commodore является положительным по антигенам, для которых мать отрицательна, а антигены проходят через плаценту и попадают в кровоток матери, стимулируется выработка антител, специфичных для каждого антигена. Эти антитела, содержащиеся в сыворотке матери, могут проходить через плаценту и попадать в сыворотку плода. Антитела плотины вызывают гемолиз эритроцитов или эритробластов плода и инициируют цепь развития, ведущую к проявлению врожденной водянки.Коммодор передаст своему потомству половину наследственного образца, определяющего фенотипическую экспрессию антигенов, для которых он 26 является положительным. Необязательно, чтобы все матки отечных яиц были отрицательными по одним и тем же антигенам. Если кровь Коммодора несовместима с кровью каждой из маток отечных телят, теория, принятая в генетике человека, может быть применима к генетике крупного рогатого скота. B Проверка гипотезы. Гипотеза была проверена путем проведения тестов на гемолиз крови с использованием промытых клеток и сывороток семи имеющихся животных и четырех нормальных кроликов.Была исследована кровь Коммодора, Люси, Офелии, Примулы, Квакера, Регины и отечного овца Примулы. Свежую нормальную кроличью сыворотку использовали в качестве источника комплемента в 1 1 гемолитических тестах. Подробные процедуры проведения гемолитических тестов представлены в приложениях. Коммодор-иммунные сыворотки получали путем многократного внутривенного введения нормальным кроликам суспензий промытых клеток от Commodore. Также были приготовлены суспензии промытых клеток крови каждой коровы. Гемолитические тесты проводили с использованием иммунной сыворотки кроликов отдельно и суспензий промытых клеток каждого человека.Подобные тесты были проведены с использованием так называемой изоиммунной сыворотки каждой коровы и суспензий промытых клеток Commodore. Эти последние тесты служили для проверки веры в то, что плод может унаследовать определенные антигены от своего отца, которые будут стимулировать выработку антител в матери. Изоиммунные и иммунные сыворотки использовали в трех разведениях, и во всех тестах готовили адекватные контроли. Испытания проводились в трех экземплярах и повторялись дважды. Ни одна из так называемых изоиммунных сывороток не вызвала гемолиза клеток Коммодора.Иммунная к Commodore кроличья сыворотка eaoh вызвала гемолиз в l оазах при тестировании с суспензиями промытых клеток коров *. Эти результаты показывают, что клетки Commodore обладают антигенами, которые вызывают выработку антител в сыворотке кроликов. Эти антитела были специфичны по крайней мере к одному антигену в каждой из клеток коровы, показывая, что Commodore имеет по крайней мере один клеточный антиген, общий с каждой коровой. Тесты с использованием сыворотки (антител) каждого из семи животных и клеток (антигенов) шести других животных показали, что сыворотка Луой содержала антитела, которые лизировали клетки Офелии, Квакера и Регины.Ни одна из других сывороток не содержала антител к антигенам клеток других животных. C Обсуждение результатов Хотя использованные тесты не были достаточно обширными, чтобы доказать ошибочность этой гипотезы, может показаться вероятным, что изоиммунная теория неприменима к случаям врожденной водянки. Можно было бы ожидать, что выработка антител, вызванных у матери отцовскими антигенами плода, приведет к накоплению достаточных количеств антител, чтобы вызвать гемолиз клеток коммодора.Это можно было бы ожидать, особенно в оазисе Примулы, поскольку ее сыворотка использовалась в тестах вскоре после рождения ее отечной овцы, когда титр антител, вероятно, был максимальным. Ни одна из сывороток коров не вызвала гемолиза клеток Commodore, следовательно, ни одна сыворотка не содержала антитела к антигенам Commodore. Сыворотка Primrose не вызвала гемолиза клеток ее теленка, показывая, что она не вырабатывала никаких антител, специфичных к антигенам, которые плод унаследовал от Commodore.Возможно, но крайне маловероятно, что Примроуз будет нести в своих клетках те же антигены, которые плод унаследовал от Коммодора. Если гипотеза верна, сыворотка Примулы должна была вызвать лизис как клеток Коммодора, так и клеток ее теленка *. Результаты тестов с использованием сыворотки кроликов, иммунных к Коммодору, последовательно противоречат гипотезе. Однако, учитывая большое количество антигенов крупного рогатого скота и признавая, что все животные имеют сходное наследование, маловероятно, что какие-либо из них будут иметь комплемент антигена, полностью отличный от антигена Commodore.Тесты с использованием клеток и сывороток каждого животного показали, что Люси несет антитела к антигенам трех других коров. Луй, должно быть, был сенсибилизирован антигенами, обычными для каждой из этих коров, но не обнаруженными у других животных. Поскольку ее сыворотка не будет лизировать клетки Коммодора, она не могла быть сенсибилизирована плодом Коммодора. Тщательная проверка гипотезы потребует полного антигенического анализа многих отдельных животных. Такой анализ потребует производства изоиммунных, а также иммунных сывороток.Рабочие из Висконсина ссылаются на оазисы анафилактического шока при производстве изоиммунных сывороток. При работе с ценным племенным поголовьем риск слишком велик. Любое решение было бы очень сложным из-за большого количества клеточных антигенов, обнаруживаемых у крупного рогатого скота. 29 PARI II II Atresia ani в йоркширском стаде свиней Второй наследственный дефект был обнаружен в зарегистрированном стаде свиней * Несмотря на то, что родословные всех животных доступны, сложный способ наследования дефекта не делает возможным генетический анализ без обширного разведения Тесты * Из-за высокой плодовитости и меньшей ценности каждой особи, племенные тесты намного легче проводить со свиньями, чем с другими классами домашнего скота.Однако никаких племенных тестов суо не проводилось. Изучение родословных позволило дать селекционеру определенные рекомендации, которые позволили бы ему избавить стадо свиней от дефотта * Обзор литературы Дефект, наблюдаемый у этих зарегистрированных йоркширских свиней, аналогичен состоянию описанный Берге (1941) как разведение той же породы в Норвегии *. Берге также цитирует работы Кинзельбао (1931) и Картенса и др. (1937), которые описывают возникновение у йоркширских свиней в Германии.Аномалия называется Atresia ani и включена в список летальных и сублетальных признаков, наблюдаемых у свиней Лернером (1944). Райс и Эндрюс (1951) также рассматривают это состояние как смертельное, но не определяют способ наследования дефота. Берге заявляет, что пороки развития у свиноматок и хряков различаются. Типичным для кабанов является закрытый задний проход. Свиньи обычно недолговечны из-за непроходимости прямой кишки. У свиноматок, по-прежнему, анус отсутствует, но обычно в брюшной стенке прямой кишки находится отверстие, сообщающееся с влагалищем, что приводит к типу олоэ.Некоторые из этих свиноматок доживают до зрелости и плодовиты. 39i. Б. История появления Atresia ani в местном стаде. Условия, наблюдаемые в местном стаде свиней, кажутся очень похожими на те, которые описаны Берге. Есть несколько случаев Atresia ani до 1951 г., но они не были подробно зарегистрированы и изучены селекционером. На днях родились три помета, некоторые поросята были аномальными. В одном помете из одиннадцати самцов и пяти самок 1111 были ненормальными. Мать помета была ненормальной, но была повязана с нормальным кабаном, который произвел несколько нормальных пометов.Ранее она уронила несколько ненормальных свиней. Второй помет аномальных свиней (восемь самцов и шесть самок) был получен от импортного хряка и произошел от свиноматки, которая ранее дала двух нормальных пометов. Однако самка этой свиноматки показала ненормальное образование ануса и вульвы. Третья партия аномальных свиней также была от импортного хряка. Из восемнадцати свиней десять были самцами и восемь - самками, четыре из самок были мертворожденными. Свиноматка ранее родила пять пометов нормальных свиней.Импортированный хряк ранее не вязался ни с одной из этих свиноматок. Все три матки ненормальных свиней проходят мимо. тот же кабан. У них тоже нет сводных сестер. Двое бабушек сами были из сводных сестер. Ни в одной из родословных нет инбридинга, по крайней мере, в пяти поколениях. C Анализ родословной В своей работе на племенной станции Aas в Норвегии Берге провел испытание хряков, известных как носители aaslng atresia ani. Оба хряка были явно нормальными, но передавали atresia ani по-разному.У одного из пометов с аномальными поросятами было 21,2% атрезии заднего прохода, а у другого - 14,3%. Процентное соотношение для обоих полов 315 было одинаковым. Две полные сестры, дочери кабана A, с клоакой достигли зрелости и были повязаны с кабаном A, кабаном B и не родственным ему кабаном C «Результаты представлены в таблице III. SIRE SOW I SOW II Процент Нормальные Патологические Нормальные Патологические Атрезия ani A 6 i 15 3 16.0 B 2 3 9 1 26.7 0 4 0 12 0 0,0 Таблица III * Частота встречаемости Atresia ani в двух инбредных пометах и одном помете с внекостными пометами (Berge, 1941 .) Число потомков было недостаточно велико, чтобы оправдать расчет коэффициента сегрегации, хотя было ясно, что моногенный способ наследования не контролировался. Бердж предложил двухфакторную гипотезу, но он заявляет, что невозможно сказать, что если оба фактора доминируют, то один или ни один из факторов в основном доминирует. В заключение он заявляет, что при таком обычном способе наследования покупка племенного стебля была бы невозможна, если бы покупатель требовал, чтобы животные не имели генов, вызывающих пагубный характер.Родословные свиней с Atresia ani в местном стаде представлены на рисунках 10, 11 и 12. D Гипотезы Genetio 1 Простой менделевский рецессивный Поскольку в приведенных случаях все свиньи в каждом помете были аномальными, очень маловероятно, что этот дефект не соответствует норме. контроль простого рецессивного фактора Менделя. Так много сублетальных и летальных признаков, изученных на сельскохозяйственных животных, относятся к этому типу, это может показаться наиболее вероятной гипотезой для проверки. Родословные, исследованные в рамках этой гипотезы, показывают, что два животных, C и Q 32 Рисунок 10.Родословная I X (zox 29e) при вязке с A 8 кобелей / 6 сук \ 2 папоротника. sb \ B (qual 15a) A tresia ani \ / "" A (arr 264e) два нормальных> помета ранее C (qual 19b) A tresia ani 3 3 Рисунок 11, Родословная II N 34 Рисунок 12, Родословная III 10 кобелей 4 суки 4 папоротник, sb Y (hnf 107c) 'ранее имел si red без аномальных свиней B (qual 15a) A tresia ani £ (arr 9b) A tresia ani, аномальное потомство P (HHP) 35 в дополнение к свиньям из трех пометов , являются гомозиготными рецессивными.Следовательно, животные X, I, A, M, B, F, G и R также должны быть гетерозиготными. У родословных I и II, оба родителя синоэ гетерозиготны, можно ожидать, что только одно из четырех потомков будет гомозиготным рецессивным. Если предполагается доминантное, фенотипы должны проявляться в соотношении три нормальных к одному ненормальному. В родословной III, поскольку один родитель является гомозиготным рецессивным, а другой - гетерозиготным, можно ожидать, что будет получено равное количество нормальных и ненормальных потомков. Синоэ ни один нормальный потомок не рождался во всех сорока девяти рождениях, и разумно предположить, что все контролируется более сложным типом интерилантации.2 Доминант с двумя факторами. Если состояние Atresia ani находится под контролем доминантного характера с двумя факторами, что, по мнению Берджа, вероятно, можно объяснить результаты в вышеуказанных родословных. Фенотипическая экспрессия возможна, если генотип - AABB, AABb, AaBB или AaBb. Это ненормальные фенотипы. Экспрессия Phenotypio невозможна, если генотип aabb, aaBb, Aabb, AAbb или aaBB. Это нормальные животные. Типы спариваний, возможные в соответствии с двухфакторной гипотезой, можно обозначить следующим образом.i) Нормальных животных. Существует десять возможных сочетаний нормальных фенотипов. Только в четырех из них можно получить каких-либо аномальных животных. В двух случаях вероятность равна 0,50; в одном оазе вероятность - 0,25; и в одном случае l l потомство будет ненормальным. i i) аномальных животных. Существует шесть возможных вязок аномальных животных. В четырех оазисах один ребенок будет ненормальным. В двух оазисах вероятность ненормального потомства составляет 0,75. Маловероятно, что такой вид спаривания будет осуществлен без экспериментальных исследований.36 i i i) Нормальных и ненормальных животных. Существует двадцать возможных вязок этого типа. В семи оазисах все потомство будет ненормальным. В восьми оазисах вероятность равна 0,50. В двух оазисах вероятность 0,75 и еще в двух оазисах 0,375. В финальных оазисах вероятность получения ненормального потомства составляет 0,25. В родословной I есть вязка нормальная или нормальная. Ни A, ни X генотипически не являются aabb. Если животное A или животное X является Aabb или aaBb, тогда другое не является ни AAbbn, ни aaBB.Если любое из животных имеет Aabb и любое из них - aaBb, то вероятность получения ненормального потомства составляет 0,25. Если либо A, либо X являются Aabb или aaBB, а другой является гомозиготным доминантным по другому локусу, вероятность получения аномальных свиней составляет 1,00. Средневзвешенная вероятность получения аномального потомства - 0,233. В той же родословной вязка B и C является аномальной для нормального спаривания. Независимо от генотипа этих животных всегда есть шанс на рождение ненормального потомства.Синоэ А было нормальным, семь из двадцати возможных вязок могут быть опущены. У остальных видов вероятность получения аномальных животных колеблется от 0,75 до 0,25. Средневзвешенная вероятность - 0,50. В родословной III вязка I с Q также является отклонением от нормального спаривания, но в отличие от вязки B с C, нормального потомства не было. Следовательно, совокупление могло быть любым из двадцати типов в этой группе. Средневзвешенная вероятность получения аномального потомства при таком типе спаривания равна 0.75. B Рекомендации заводчику Следующие рекомендации, сделанные после изучения родословных и литературы по дефотту, были предложены заводчику, чтобы он мог предпринять необходимые шаги для избавления своего стада от дефекта. n i) Немедленно прекратить обслуживание кабана X. Разделите его сейчас или отложите окончательный приговор до тех пор, пока уже выведенные свиноматки не опоросятся. i i) Butoher a l свиноматки, у которых родилось дефектное потомство, и потомство от этих свиноматок. i i i) По возможности воздерживаться от использования самок, близких к вышеуказанным свиноматкам.Например, потомки или любые близкие родственники кабана B. iv) Любые кабаны в servioe сейчас или в будущем должны сами быть свободными от дефекта и выбираться из семей, которые заведомо свободны от этого дефекта. Весьма вероятно, что хряк X является переносчиком возбудителей Atresia ani, поскольку у свиноматок A и M ранее не было аномальных свиней от других хряков. Если хряк Y используется на нормальных свиноматках из семьи &?> 3, не имеющих дефекта, вероятность получения ненормального потомства очень низка.Однако ни одно из его потомков не должно считаться племенным поголовьем. В программе отбора должна быть значительная дискриминация потомков и родственников хряков B и F, потому что они тесно связаны с самками аномальных пометов. Это строгие рекомендации, но для борьбы с этим типом дефектов в племенном поголовье необходимо предпринять довольно решительные шаги. Необходимо будет постоянно наблюдать, и практика выбраковки должна быть очень серьезной в течение нескольких поколений, прежде чем стадо избавится от этого дефекта.ЗАКЛЮЧЕНИЕ Бридинг, который часто называют прикладным инбридингом, позволяет заводчику поддерживать высокую степень родства с предками, высоко ценящими наследственные черты, на которых он основывает свою селекционную практику. Его отбор будет проще и точнее, если он сможет оценить свое поголовье по достоинству анестезии, а также по достоинству каждого человека в стаде. * Продолжение скрещивания увеличит инбридинг у его животных до значительного уровня * Делая больше генных локусов, которые раньше были гетерозиготными гомозиготными, он увеличивает преобладание каждого индивидуума *. В качестве оплаты за повышение репотентности он должен рисковать большей вероятностью возникновения гомозиготных рецессивов.Не один, но большинство гомозиготных красных эссив менее желательны, чем гетерозиготные гомозиготные доминанты. Заводчик, который следует программе линейного разведения, должен ожидать, что рано или поздно он столкнется с наследственным дефектом. Defeots suoh, поскольку отсутствие одного или нескольких клешней росы у крупного рогатого скота, не имеют практического значения, так как это не влияет на продуктивность животного. Но заводчика должны серьезно беспокоить серьезные дефекты, классифицируемые как летальные или сублетальные, которые влияют на репродуктивную эффективность и индивидуальную производительность.Прогрессивный заводчик может получить значительный доход от продажи племенного поголовья. Если его размножающийся корм из-за его гомозиготности доминирует, он будет очень востребован. Если селекция для продуцирования преобладания также допускает экспрессию генов (ранее несущихся в гетерозиготном состоянии), которые контролируют вредные признаки, то сразу же страдает продажная стоимость и спрос на его поголовье. Чтобы избавить свое стадо от дефекта, ему, возможно, придется принести в жертву животных, имеющих высокую племенную ценность за характеристики, имеющие экономическое значение.Для развития особей суох, вероятно, потребуется несколько поколений тщательного отбора и выращивания. Если факты, касающиеся возникновения дефекта, не предаются огласке, а более широкий круг осмотрительных при выборе животных для продажи в качестве племенного поголовья, репутация его стада может поддерживаться, пока дефект будет устранен. Если он продолжит продавать животных, которые могут быть носителями дефекта, рано или поздно гены расщепятся как гомозиготные рецессивы, и дефект будет обнаружен.Между тем, вредные гены могли быть распространены на несколько стад. Неиденое даже летального характера может быть настолько низким, что не имеет практического значения ни для одного селекционера. Максимальная вероятность возникновения дефекта, рассчитанная на основе генетической теории режима наследования, редко достигается в небольших семьях. Установление истинного способа наследования и сегрегации, которая может быть исключена, должно быть доступно заводчику, чтобы позволить ему справиться с проблемой наименее вредным для породы методом и в то же время экономически возможным для него.Дефекты, находящиеся под контролем одиночных генио-пар, могут быть устранены легче, чем дефекты, имеющие более полный генетический контроль. При малоплодородных и менее плодовитых классах домашнего скота устранение даже однофакторного реагента затруднено. Большая часть животных в племенном стаде находится под подозрением при возникновении дефекта. Селекционные тесты для подтверждения генотипов подозреваемых гетерозигот не являются практическими. Заводчик может применять лишь несколько пассивное давление отбора против подозреваемых особей, поскольку экономические характеристики должны получить приоритет отбора, если его предприятие должно оставаться прибыльным.Затраты на замену подозреваемых другими животными равной ценности могут быть непомерно высокими для менее плодовитых классов животноводства. Утилизационная стоимость животных, взятых из стад или стад этих животных, слишком мала, чтобы покрывать расходы на их воспроизводство. 40 Однако в отношении свиней можно предпринять довольно решительные меры, чтобы избавить стадо от наследственного дефекта. Утилизационная стоимость зрелого стебля соответствует закупочной цене незрелых заменителей равной стоимости. Быстрое созревание, высокая плодовитость и большая плодовитость позволяют племенному производителю быстро заменить свое стадо.Чтобы он заменил свое стадо животными, лишенными того же самого или другого дефекта, он должен иметь доступный способ наследования и коэффициенты сегрегации, относящиеся к наследственным порокам свиней. Селекционные тесты и бэкероссы возможны со свиньями, и их должны проводить квалифицированные генетики, которые, таким образом, расширят знания о наследственности свиней, а также помогут практическому селекционеру в его работе. ССЫЛКИ 7f Berge, S., (1941), Journal of Heredity, vol 32, pp 271-374.Cartens, Wenzer and Durr (1937), Zuohtungsk, vol 12, p 205. Crew, Oliver and Boyd, (1947), Генетика в отношении клинической медицины, Эдинбург. Дэвидсон, I. (1945), Журнал Американской медицинской ассоциации, том 127, номер 11, стр. 633-638. Eaton, 0. N., (1937), Journal of Heredity, vol 228, pp 320-326. Фергюсон, Л.К. (1941), Журнал иммунологии, том 40, стр. 213-242. Фергюсон, Стормонт и Ирвин, (1942), Журнал иммунологии, том 44, стр. 147-164. Hadley, F. B. и B. L. Warwick, (1927), журнал Американской ветеринарной медицинской ассоциации, том 70, стр. 492-504.Hutt, F. B., (1934), Cornell Veterinarian, vol? 24, pp 1-25, Imperial Bureau of Animal Genetics, (1931), Quarterly Bulletin. том 2, номер 3, стр 49-50. Ирвин М. Р. (1947), «Иммуногенетика», «Достижения в генетике», том 1, стр. 133–153. Международный конгресс генетиосов, (1939), Труды Седьмого Конгресса, Эдинбург, статья 144, стр. 169. Kinzelbaeh, (1931), Верерб, т. 60, стр. 84. Коркман, (1944), Биологические абстракции, т. 22 , abstract 10625. Land8teiner, K ,, (193l), Science, vol 73, p 403. Largson, E.Л., (1935), Lantbr. Век Хэндл, стр 310-331. Лернер, И. М. (1944). Журнал наследственности, том 35, 219-224. Levine, P., (1947), опубликовано в Advanoes in Genetics, том 1, pI133. Левин П. (1948), цитируется в Advanoes in Genetios vol 1, p 133. Levine, Burnham, Katzin, and Vogel, (1941), American Journal of Obstetrios and Gynecology, vol 42, pp 925-937. Левин, Кацин и Бернхэм (1941), Журнал Американской ассоциации медицинских работников, том 116, стр. 825. Оуэн, Стормонт и Ирвин, (1944), Журнал животных Soienoe, том 3, стр. 315-321.Поттер, £ • Л. и Вилсерви, Дж. К., (1945), журнал Американской медицинской ассоциации, том 127, номер 8, стр 458-459. Ранстром, С. (1947), Журнал Американской ассоциации медицинских работников, том 134, номер 13, стр. 1136. Био, В. А. и Эндрюс, Ф. Нот, (1951), Разведение и улучшение сельскохозяйственных животных, Макгроу-Хилл. Книжная компания Incorporated, Нью-Йорк, стр. 342-343. Стормонт и Камли, (1943), Журнал наследственности, том 34, $ | W35-41. Вайнер, А.С. (1946), Журнал Американской медиальной ассоциации, том 133, номер 13, стр. 1097.Райт, Сьюолл, (1931), Genetios, том 16, стр. 97–159. ПРИЛОЖЕНИЯ i Расчет коэффициента инбридинга Коэффициент инбридинга - это мера степени уменьшения гетерозиготности, которую следует ожидать от определенного количества унсанкин-ous спариваний. Это указывает на степень гетерозиготности всей группы генов у отдельного животного. Коэффициент составляет ровно половину отношения между двумя родителями особи, если сами родители не являются инбредными. Формула имеет следующий вид: F x _ i S [(i) n (1 + F a)], где Fx - коэффициент инбридинга животного X; n - количество поколений в линии, по которой отец и мать связаны между собой; Fa - коэффициент инбридинга общего предка A, от которого отделяется эта линия происхождения; и S - сумма отдельно оцененных результатов.Фаотор 1 плюс Fa исправляет большее сходство, которое можно ожидать между гаметами инбредной особи. B Вычисление коэффициентов вероятности При расчете вероятности получения гомозиготного рецессива от скрещивания двух неизвестных генотипов предполагается, что вероятность того, что генотип родителя будет гетерозиготным, повышается до степени, равной количеству поколений родителя. удаляется из общего предка обоих родителей, который предположительно или известен как гетерозиготный.Если оба родителя известны как гетерозиготы, вероятность гомозиготности потомства составляет 50 фунтов стерлингов; гомозиготности реоэссивности составляет 0,25. Если известно, что общий дедушка или бабушка гетерозиготны, вероятность того, что генотип потомков, удаленных на одно поколение, будет гомозиготным и реаэссивным, увеличивается вдвое до четвертой степени; или одна шестнадцатая. i i C Тест на пригодность Биометристы измеряют качество f i t путем сложения пропорциональных отклонений класса eaoh, получая константу, известную как ohi-squared, и это определяет вероятность того, что такое большое или большее отклонение произойдет случайно.Хи-квадрат получается возведением в квадрат отклонения каждого оласса от теоретического ожидания этого класса, делением его на теоретическое ожидание для этого класса и сложением результатов одного класса. Из подготовленных таблиц можно получить для данного значения ohi-square и данного числа классов значение F, которое измеряет вероятность того, что отклонение, большое или большее, произойдет случайно, другими словами, процент случаи, в которых можно ожидать отклонения случайно.D Процедуры для серологических исследований Подготовка иммунной сыворотки Источник сбора антигена 6 т Материалы для образцов крови * вата, спирт, подкожная игла, прикрепленная к резиновой пробирке, 200 мл стерильная колба с пробкой, 76 мл раствора изотонио цитрата (2 доллара цитрата натрия - 0,5 $ хлорид натрия), пробирка на 50 мл с пробкой, содержащая стеклянные шарики. Метод: капля крови из яремной вены с помощью иглы для подкожных инъекций и резиновой трубки. Приблизительно 75 мл крови помещается в колбу на 200 мл, содержащую 75 мл изотонического раствора цитрата.Колбу закрывают пробкой и охлаждают. В колбу на 50 мл набирается примерно 25 мл крови. Колбу быстро закрывают и встряхивают в течение пяти минут для дефибринирования образца крови. Дефибринированная кровь используется для приготовления клеточных суспензий. Его необходимо нагреть до 56 ° C в течение получаса, чтобы разрушить комплемент. iii Приготовление суспензионных материалов эритроцитов * Один раствор желатинового лука, 50 мл физиологического раствора (0,85%), стерильный 15 мл пипет, 4 • 20 мл стерильные градуированные центрифужные пробирки, стерильная градуировка, 50 мл стерильные колба с пробкой, 60 мл цитратной крови.Метод: поместите 5 мл отобранной пробы крови в каждую из четырех центрифужных пробирок. Центрифуга до десяти минут. Слейте или удалите пипеткой цитратно-сывороточную смесь. Добавьте 5 мл раствора желатина Lookes в каждую пробирку, тщательно встряхните и повторно центрифугируйте в течение десяти минут. Повторите стирку четыре раза! раз. Перенести 1 мкл клеток в одну пробирку, упаковать клетки путем отжимания, записать объем упакованных клеток. Перенесите клетки в стерильную колбу на 50 мл, используя равный объем стерильного физиологического раствора. Место 3.5 мл суспензии 50 $ в каждой из девяти флаконов с резиновыми пробками. Инокуляция RabVf ts Инокуляции Материалы: три зрелых нормальных здоровых кролика, бритва, ватная полоска, спирт, стерильный шприц для подкожных инъекций 5 мл, суспензия эритроцитов, 3 стерильные иглы для подкожных инъекций (Ho. 22) • Методы: шерсть над краевой веной выбрит сухим способом. Область стерилизована спиртом. Шприц наполняется воздухом и один мл вводится в вену. Каждому кролику вводят внутривенные инъекции три раза в неделю в течение трех недель по одному (1) мл 50% суспензии.Взятие иммунизированной крови Кролика держат в кровоточащей ложе на спине, голова его находится в хорошо закругленной выемке, а четыре лапы, удерживаемые ремнями, затянуты, чтобы вытянуть конечности до полного разгибания. Кровь забирается методом пункции оардиао. Кровь сливают в стерильные пробирки с ватными пробками и дают ей свернуться. Иммунная сыворотка забирается стерильной пипеткой. iv Сыворотка комплемента может быть получена с использованием того же метода, что и у нормальных здоровых кроликов. Кровь следует охладить, как только она засеяна, а сыворотку следует использовать вскоре после взятия крови.Тестовые суспензии промытых клеток Образцы крови отбирают в дефибринирующие колбы, как описано выше, 25 мл крови является достаточно большим образцом для снабжения клеток 2,5% -ными суспензиями, используемыми в тестах. В то же время 40 мл крови набирается в стерильные пробирки, снабженные ватными пробками, в которых ей дают свернуться перед охлаждением. Примечание: для обеспечения строгой стерильности каждая трубка снабжена иглой для подкожных инъекций, прикрепленной пластиковой трубкой. Собранное оборудование подвергается автолаживанию при 15 фунтах в течение тридцати минут и не разбирается до тех пор, пока сыворотка не будет извлечена стерильной пипеткой.Приготовление 2,5-кратных суспензий промытых клеток происходит параллельно с приготовлением 50-кратных суспензий. Гемолитические тесты Разведения иммунных сывороток Материалы: неразбавленные кроличьи сыворотки во флаконах на 25 мл, пробирки на 9–20 мл, физиологический раствор, пипетки на 5–10 мл. • Метод: поместите пять мл сыворотки A в пробирку I и в пробирку II. Добавьте 10 мл физиологического раствора в пробирку II. Удалите 5 мл раствора из пробирки II и поместите в пробирку III. Добавьте 10 мл физиологического раствора в пробирку III. Пробирки Пробирка Eaoh должна содержать: - 1 каплю 2 шт.5% суспензии промытых клеток - 2 капли неразбавленной или разбавленной сыворотки от одного иммунизированного кролика - 1 капля сыворотки комплемента. Контрольные пробирки и повторные тесты следует готовить в тех же условиях.
2021 Код МКБ-10-CM O36.23 — Уход за матерью при водянке плода, третий триместр
Отек
Также называется: Водянка
Отек — это отек, вызванный жидкостью в тканях вашего тела.Обычно это происходит в ступнях, лодыжках и ногах, но может затрагивать все ваше тело.
Причины отека включают
- Слишком много соли
- Солнечный ожог
- Сердечная недостаточность
- Заболевание почек
- Проблемы с печенью от цирроза
- Беременность
- Проблемы с лимфатическими узлами, особенно после мастэктомии
- Некоторые лекарства
- Стоять или много гуляйте в теплую погоду
Чтобы уменьшить отек, ваш врач может порекомендовать держать ноги приподнятыми, когда сидите, носить поддерживающие чулки, ограничивать количество потребляемой соли или принимать лекарство, называемое мочегонным средством — также называется водная таблетка.
- Абдоминальная пункция (Медицинская энциклопедия)
- Ангионевротический отек (Медицинская энциклопедия)
- Отек стопы, голени и лодыжки (Медицинская энциклопедия)
- Отек легких (Медицинская энциклопедия)
- Отек (Медицинская энциклопедия)
9
[Узнать больше]
Здоровье и развитие плода
Нормальная беременность длится девять месяцев. Каждый трехмесячный период беременности называется триместром. В течение каждого триместра плод растет и развивается.Регулярные медицинские осмотры и пренатальные анализы очень важны. Они могут
- Помочь сохранить здоровье вам и вашему ребенку
- Выявить проблемы с ребенком (если они есть). В некоторых случаях специалисты здравоохранения могут вылечить проблему до рождения ребенка. Но даже если они не могут этого сделать, все равно может быть полезно узнать о проблеме на раннем этапе. Это дает вам время узнать о состоянии вашего ребенка и подготовиться к любым трудностям, с которыми вы можете столкнуться после рождения ребенка.
- Предотвращение проблем во время доставки.Например, если у вашего ребенка тазовое предлежание (сначала нижняя часть или ноги вперед, а не голова вперед), вам может потребоваться кесарево сечение, чтобы избежать осложнений.
Помимо медицинской помощи, вы можете делать и другие вещи, чтобы сохранить здоровье своего ребенка. Важно не пить и не курить. Постарайтесь придерживаться здоровой диеты и позаботьтесь о любых проблемах со здоровьем, которые возникают у вас во время беременности.
- Развитие плода (Медицинская энциклопедия)
- Ограничение внутриутробного развития (Медицинская энциклопедия)
[Узнать больше]
Rh несовместимость
Существует четыре основных группы крови: A, B, O и AB.Типы основаны на веществах на поверхности клеток крови. Другая группа крови называется Rh. Резус-фактор — это белок красных кровяных телец. Большинство людей резус-положительные; у них есть резус-фактор. У резус-отрицательных людей этого нет. Резус-фактор наследуется через гены.
Когда вы беременны, кровь вашего ребенка может попасть в ваш кровоток, особенно во время родов. Если вы резус-отрицательный, а ваш ребенок резус-положительный, ваше тело будет реагировать на кровь ребенка как на инородное вещество.Он создаст антитела (белки) против крови ребенка. Эти антитела обычно не вызывают проблем во время первой беременности.
Но резус-несовместимость может вызвать проблемы при более поздних беременностях, если у ребенка резус-положительный результат. Это потому, что антитела остаются в вашем теле после того, как они сформировались. Антитела могут проникать через плаценту и атаковать красные кровяные тельца ребенка. Ребенок может заболеть резус-фактором — серьезным заболеванием, которое может вызвать серьезный тип анемии.
Анализы крови могут определить, есть ли у вас резус-фактор и вырабатываются ли в вашем организме антитела.Инъекции препарата, называемого резус-иммуноглобулином, могут препятствовать выработке организмом резус-антител. Это помогает предотвратить проблемы несовместимости резус-фактора. Если ребенку требуется лечение, оно может включать добавки, помогающие организму вырабатывать красные кровяные тельца, и переливание крови.
NIH: Национальный институт сердца, легких и крови
- Распределение эритроцитов плода и матери (Медицинская энциклопедия)
- Гемолитическая болезнь новорожденного (Медицинская энциклопедия)
- Rh несовместимость (Медицинская энциклопедия)
[Узнать больше]
Икке-иммунная водянка av fosteret: årsaker og konsekvenser
Graviditet er en fantastisk tid i live til en kvinne.I løpet av denne perioden må du nøye overvåke din helsemessige og prenatale utvikling av babyen, fordi selv små forstyrrelser eller tilsetning av enfeksjon kan føre til uopprettelige konsekvenser, hvorav den en unterety ikos-anti-drops. Hva det er og hva konsekvensene av denne sykdommen kan forårsake, vurderer vi i artikkelen.
определение
Dropsy er en patologisk tilstand som oppstår under fosterutvikling, or er preget av opphopning av væske i kroppens hulrom.Det er to typer av denne sykdommen:
- Иммун. Hovedårsaken til utviklingen av denne typen er Rh-konflikten til moren og fosteret. Foreløpigbeendles patologien, noe som medfører lav dødelighet.
- Неиммунная водянка av fosteret (ICD-10 er tildelt koden R83.2). En mer farlig type sykdom som kan utløse en rekke faktorer. Til tross for at medisinen ikke står stille, har denne patologien en stor andel dødsfall. Dette gjelder spesielt для недоношенных детей. Медико-иммунная водянка с прогнозом от патологической диагностики на стадионе.Dette vil идентифицируйте og ekskludere en provokerende faktor, samt bestemme den mest Effektivebeendlingsplanen. Et bilde av den ikke-иммунная водянка fostale (ultralyd) er presentert nedenfor.
årsaker
Årsakene til fosterets ikke-imnedfall er fortsatt ikke fullt ut forstått og karakteriseres bare ved gjentakelsen av visse manifestasjoner. Til tross for dette er de vanligste faktorene som utfordrer utviklingen av patologi preget:
- Kromosomal patologi.Рассматривайте инклюдерер триплоидии, синдром Шерешевского — Тернера.
- Улике инфекционер. Экземпель токсоплазмоз, меслингер, краснуха и андре.
- Patologier i det kardiovaskulære systemet — medfødte hjertefeil, cava trombose og andre.
- Gen sykdommer. Для эксемпеля, ахондрогенного синдрома Пена — Шоки.
- Аномалия грудного отдела позвоночника. Рассмотрите инклюдерер диафрагматиск брокк и кристаллы дисплазии.
- Medfødte svulster.
- Også årsaken til fosterets ikke-иммунный недостаток kan være utviklingsdefekter av nyrene og andre indre organer.
- Хлев Metabolske sykdommer hos.
- Graviditetens patologi. Распространение инклюдерера, трансфузии плаценты, синдрома цитомегали, вируса язвы, хориоангиомы плаценты, анемии и диабета.
Диагностический тилтак
Эт комплекс по диагностике тильтак брюк, чтобы определить, что патологические тильстенден и артен ав форкомстен. Vurder dem mer детали:
- Det viktigste Diagnostiske Tiltaket er en ultralyd, der det er mulig å идентифицирует внутриматочные теги på patologi og graden av utvikling.
- Angi blodtype и Rh-фактор. Denne studien er svært viktig for å utelukke sykdomens Immun natur.
- Legen intervjuer en gravid kvinne, som klargjør tilstedeværelsen av kroniske sykdommer, Infoksjoner og kirurgiske inngrep. Komplikasjoner som oppstår i løpet av babyens svangerskap og det generelle løpet av svangerskapet er også viktige.
- Generell анализирует мочу и кровь.
- Biokjemisk analysis av blod.
- ЭКГ.
- Forskning kvinner for tilstedevrelse av infexjoner.
Intrauterin undersøkelser av fosteret er tildelt for å bekrefte ikke-immun fosterfall i løpet av svangerskapet:
- Undersøkelse av fostervann.
- Кордоцинтез.
- ПЦР на мистенкте инфекционер.
- Доплеровская сонография.
Клиниск bilde
De første symptomene på ikke-иммунная водянка av fosteret kan ses på ultralyd. Инклюдерер Disse:
- redusert føtale aktivitet;
- субкутант ødem;
- асцитов;
- такыкарди;
- Tilstedeværelsen av væske i kroppens hulrom;
- høy vannstrømning;
- forstørret hjerte;
- magen er forstørret på grunn av ascites.
En kvinne kan utvikle symptomer som hypertensjon og massiv hevelse.
Men de mest åpenbare tegnene Obserres umiddelbart etter fødselen. Det kliniske bildet lar deg nesten nøyaktig bestemme sykdommen:
- Den første er en alvorlig tilstand av babyen.
- Suturene av skallen er åpne, våren er utbulende.
- Det er hevelse.
- Subkutant vev er dårlig uttrykt, så kroppstemperaturen er avhengig av miljøet.
- Det er også diagnostisert depresjon av отражатель и lavt blodtrykk.
- Ascites er ofte notert.
- Рычаг Forstørret и milt.
Graviditet og fødsel
Etter å ha bekreftet diagnosen, blir kvinnen henvist til FIRL. Неиммунная водянка av fosteret er en patologi med økt fare, noe som krever høy klasse utstyr og kvalifiserte spesialister.
Først og fremst viser det seg and de Diagnostiserte avvikene er kompatible med live. En kvinne skal bli fortalt hvilke mulige konsekvenser for barnet i fremtiden.Неиммунная водянка может вызвать любое отклонение от нормы и утвердить ее в организме, но не в том случае, если она будет сокращена и восстановлена. Hvis du ikke kan finne ut årsaken til sykdommen, er det umulig å foreskrive enffektiv behavior, det anbefales abort. Dersom beslutningen fattes for å bevare barnet, utføres ytterligere undersøkelser, hvor resultatene avgjør at i dette tilfellet vil det bli mer korrekt — для улучшения качества жизни и роста на гравидите. Valget er komplisert av det faktum at ikke-иммунная водянка er utsatt for spontan remisjon.
Доступен для подъема на нижнем уровне, когда он будет стоять на ногах и перейти на новый уровень. Før fødselen utføres en ultralydundersøkelse для å vurdere tilstedeværelsen av ascites og effusjon. Dette vil forberede seg på mulig væskeutsuging. I de fleste tilfeller anbefales en keisersnitt, da det er тариф для asfyksi под вагинальным tilførsel.
Mulig Beendling
Подержанный
Når мужского опознавателя årsakene til og konsekvensene av ikke-иммунная водянка av fosteret, tas det tiling til mulig behavior.Dette tar hensyn til alvorlighetsgraden og omfanget av sykdommen. Kord blodtransfusjon kan angis. Denne prosedyren anbefales ved senking av гематокрит менее 30 г / л. Etter 2-3 uker gjentas prosedyren om nødvendig. Også er transfusjon angitt for alvorlig anemi.
Før fødselen av babyen, er forsyningsrommet forsiktig forberedt, utstyrt med alt nødvendig utstyr for nødopplæring. Et team av flere neonatologer og gjenoppliving spesialister blir dannet.
Umiddelbart etter fødselen utføres følgende prosedyrer:
- perikardiocentese, hvor det akkumulerte fluidet fjernes ved punktering av perikardiet;
- плевральная пункция — væskeinnholdet fjernes fra pleurhulen
- лапароцентез — это флайтенде иннхольд из бухуленов.
Disse terapeutiske tiltakene utføres под ultralydskontroll.
Følgende beans er foreskrevet etter behov:
- антибактериэль;
- krampestillende;
- Anti;
- metabolske og andre.
Деталь скальпитала и годт органисерт и годт координирует арбейд на дет медисинске персональе, давая фёрстехелп тил эн нюфёдт, кан крон мед стор суксесс. Под graviditeten må kvinnen og barnet være под nøye tilsyn.
Реанимация в послеродовом периоде
Интенсивное лечение неонатологов и реаниматологов:
- Det er nødvendig å forberede på forhånd fersk frosne Plasma- og erytrocyttmasse;
- På grunn av mulig ødem i luftveiene er det nødvendig å ha ETT av all størrelser i lengingsrommet, siden pustemetoden ved hjelp av en maske or enpose er i dette tilfellet noteffektiv;
- det er nødvendig å forberede avløp som kan være nødvendig for å utføre forskjellige prosedyrer og fjerne overflødig væske;
- må være forberedt på akutt blodtransfusjon;
- korreksjon av kalsium og glukose er nødvendig;
- et kateter settes inn i navlestrengen
- antibiotikabehandling utføres, og om nødvendig behavior av samtidig smittsomme sykdommer.
Undersøkelser av nyfødte
Med неиммунной водянки, начинающейся с недержанием мочи и с помощью рычага. Инклюдерер Disse:
- tar blod fra navlestrengen, org avslører dermed bilirubin, blodgruppe, Rh, гематокрит и гемоглобин;
- en biokjemisk blodprøve utføres для очищенной мочевины, креатинина, общего белка, АЛТ и АСТ;
- тест blodsukker;
- инфексйонсфорскнинг;
- generell radiografi;
- анализатор ascitiske og pleurale væsker, для eksempel bacposa;
- ultralyd undersøkelse av bukhulen og hjernen;
- ytterligere тестер для выявления ошибок в системе.
эффектор
Med fosterets ikke-immmunforsvar kan konsekvensene for barnet i fremtiden være ganske alvorlig. Selv når man Diagnostiserer en patologi på et tidlig stadium av utviklingen, er det risiko for komplikasjoner, blant hvilke de vanligste er:
- patologi av luftveiene;
- alvorlige patologier i hjernen og kardiovaskulær system;
- patologi av huden;
- kardiovaskulær svikt;
- kryptorchidisme hos gutter;
- dødelig utfall.
переделка
Неиммунная водянка er farlig fordi det sjelden er mulig å fastslå den eksakte årsaken til forekomsten. Forebyggende tiltak i dette tilfellet er de generelt aksepterte anbefalinger for graviditet. Инклюдерер Disse:
- graviditetsplanlegging, hvor paret gjennomgår en omfattende undersøkelse для идентификации и kurere kroniske, gynekologiske og arvelige sykdommer;
- rettidig registrering i kvinnelig konsultasjon;
- systematiske besøk til obstetrikeren-gynekologen og gjennomføringen av all hans anbefalinger;
- идентификация и полный функционал на smittsomme, virale и somatiske sykdommer hos kvinner под graviditet;
- полная и стильная одежда для одежды.
Det anbefales ikke å forsømme rutineundersøkelser og ultralyd fordi det er i analysis undersøkelsene and utviklingspatologi kan identifiseres.
внешний вид
Медико-иммунная фетальная водянка, er prognosen i de fleste tilfeller dessverre ugunstig. Antall overlevende barn er ca. 30%. Чрезмерно высокий уровень патологической диагностики, такой как патологический ассистент мед денне тильстанден. For eksempel, i hjerteavvik, vil prognosen være mer skuffende.Graden avinflytelse av smittsomme sykdommer ved forekomst av водянка avhenger av graviditetens varighet. Jo senere denne tilstanden har utviklet seg, desto gunstigere er prognosen til babyen.
Med utviklingen av ikke-иммунная водянка i første halvdel av svangerskapet, er risikoen for spontan abort høy. I senere perioder kan fosterdød forekomme.
Prognosen vil være gunstig dersom sykdommen diagnostiseres tidlig i utviklingen, og det er ikke identifisert noen medfødte abnormiteter i hjertet og andre vitale organer.Огромное количество раз, когда вы хотите узнать много нового, чтобы идентифицировать или провоцировать факты.
крышка
Неиммунная водянка av fosteret er en svært farlig sykdom, med en høy andel dødelighet. Gjennomføringen av forebyggende tiltak i perioden med planlegging og bære en baby vil redusere risikoen for patologi. For tiden står ikke medisinen stille. Nye måter å диагностировать sykdommen på et tidlig stadium blir opprettet. Betingelser er også opprettet for Effektiv gjenopplivning av nyfødte med denne diagnosen, etterfølgende behavior og реабилитации.
случаев гибели плода, связанной с преждевременным развитием молочной железы и лактацией у кобылы, получавшей еженедельные инъекции прогестерона длительного действия Мета
Journal of Equine Veterinary Science
Jessie L McAfoosIgor F Canisso
Abstract
14-летняя повторнородящая кобыла весом 530 кг была направлена для оценки преждевременного развития молочной железы и лактации.Кобыла была на седьмом месяце беременности. У кобылы в анамнезе была недостаточная фертильность, и она получала еженедельные инъекции прогестерона длительного действия, назначенные ветеринаром. Последняя доза была введена за четыре дня до обращения. При осмотре кобыла имела жизненно важные показатели в пределах нормы, умеренно развитое, безболезненное вымя с галактореей и отсутствие выделений из вульвы. Трансректальная пальпация выявила матку и шейку матки в хорошем тонусе, а также незаметно пальпируемые части плода, однако баллотирование плода не привело к заметным движениям плода.Трансректальное УЗИ не показало никаких особенностей, но трансабдоминальное УЗИ выявило один недоразвитый, неподвижный плод в левом роге матки без сердцебиения. Аборт был вызван повторными дозами клопростенола. Спустя пятьдесят четыре часа после первой инъекции клопростенола у кобылы появились признаки родов, шейка матки была расширена вручную, а плод и плодные оболочки были извлечены с помощью осторожных ручных манипуляций. Стандартный послеабортный уход включал промывание матки и введение окситоцина за 48 часов до беременности…Продолжить чтение
Цитаты
7 декабря 2020 г. · Журнал биологии и неоплазии молочной железы · Кэтрин Хьюз
Связанные концепции
Metazoa
Fetal Mummification
000
000 Прогестерон, (17 альфа) -изомер
Преждевременные роды
Разведение
Клопростенол
Фетальные мембраны
Движение плода
Трендовые корма
COVID-19
большое семейство распространенных вирусов, вызывающих вирус COVID-19
простуда, а также более серьезные заболевания, такие как продолжающаяся вспышка коронавирусной болезни 2019 г. (COVID-19; формально известная как 2019-nCoV).Коронавирусы могут передаваться от животных человеку; симптомы включают жар, кашель, одышку и затрудненное дыхание; в более тяжелых случаях заражение может привести к смерти. Этот канал охватывает недавние исследования COVID-19.
Нервная активность: визуализация
Визуализация нервной активности in vivo в последнее время быстро развивалась с развитием флуоресцентной микроскопии, включая новые применения с использованием миниатюрных микроскопов (минископов). Этот корм следует за прогрессом в этой развивающейся области.
Инкретины
Инкретины — это метаболические гормоны, которые стимулируют снижение уровня глюкозы в крови, и они участвуют в регуляции гликемии в фазе ремиссии диабета 1 типа. Вот последнее исследование.
Сеть семян сухожилий
Сухожилия богаты внеклеточным матриксом и распространены по всему телу, обеспечивая важные функции, включая структуру и подвижность. Транскриптом сухожилий составляется, чтобы понять микроанатомическое функционирование сухожилий.Ознакомьтесь с последними исследованиями сети Tendon Seed Network здесь.
Синдром хронической усталости
Синдром хронической усталости — заболевание, характеризующееся необъяснимой инвалидизирующей усталостью; патология которого до конца не изучена. Ознакомьтесь с последними исследованиями синдрома хронической усталости здесь.
Вычислительные методы для структур белка
Вычислительные методы, использующие алгоритмы машинного обучения, являются мощными инструментами, которые можно использовать для прогнозирования влияния мутаций на структуру белка.Это важно при нейродегенеративных заболеваниях, когда некоторые мутации могут вызывать образование скоплений токсичных белков. Этот корм основан на последних сведениях о взаимосвязи между мутациями и структурой белка, что позволяет лучше понять болезнь.
Компьютерная аксиальная томография: мозг
Компьютерная аксиальная томография (КТ или CAT) — это неинвазивный метод визуализации, который использует рентгеновские лучи для получения срезов конкретной интересующей области. Эти данные отправляются на компьютер, где создается 2D-изображение.КТ головного мозга может помочь в понимании патологических процессов некоторых заболеваний. Узнайте о последних исследованиях компьютерной томографии головного мозга здесь.
Пространственно-временная регуляция репарации ДНК
Реставрация ДНК — это сложный процесс, регулируемый несколькими различными классами ферментов, включая лигазы, эндонуклеазы и полимеразы. Этот корм фокусируется на пространственной и временной регуляции, которая сопровождает передачу сигналов о повреждении ДНК и восстановление ферментов и процессов.
Врожденный гиперинсулинизм
Врожденный гиперинсулинизм вызывается генетическими мутациями, приводящими к избыточной секреции инсулина бета-клетками поджелудочной железы.Вот последнее исследование.
Статьи по теме
Журнал Американской ветеринарной медицинской ассоциации
П.Дж. Мейерс, Д.Д. Варнер
Вопросы охраны материнства и детства
А.В. : Официальное издание Американской ассоциации ветеринарных лабораторных диагностов, Inc
Aime K JohnsonJ Michael Donahue
Irish Veterinary Journal
C CumminsV Duggan
/ статьи / смерть плода, связанная с-преждевременной-молочной / 31668309
неиммунных водян | Павильон для женщин
Что такое водянка?
Водянка плода или водянка плода — это серьезное заболевание, при котором жидкость накапливается в двух или более частях тела ребенка, вызывая сильный отек.Состояние может быть фатальным.
В жидкости может скапливаться:
- в брюшной полости (асцит)
- вокруг легких (плевральный выпот)
- вокруг сердца (перикардиальный выпот)
- в коже или волосистой части головы (отек)
Виды водянки (плевральный выпот)
,00
Существует два типа отека плода:
- Неиммунная водянка , наиболее распространенный тип, вызывается заболеванием плода или врожденным дефектом, который влияет на способность организма управлять жидкостью.Сегодня до 90% всех случаев водянки являются неиммунными.
- Иммунная водянка возникает, когда иммунная система матери атакует и разрушает эритроциты ребенка из-за несовместимости групп крови матери и плода. Эта форма водянки сегодня редко встречается из-за доступных лекарств для предотвращения этого состояния.
Как водянка (плевральный выпот) влияет на моего ребенка?
Водянка представляет серьезную опасность для плода и беременности, в том числе:
- Сильный отек
- Увеличенная селезенка, сердце или печень
- Утолщенная плацента
- Многоводие (избыток околоплодных вод)
- Преждевременные роды
- Сердечная недостаточность
- Мертворождение
- Для выживших детей с проблемами дыхания при рождении из-за недоразвитых легких
,00
,00
В некоторых случаях может возникать синдром материнского зеркала, когда состояние матери отражает состояние плода, вызывая преэклампсию и отек, которые угрожают ее здоровью и требуют немедленных родов.
Прогноз
Прогноз для каждого ребенка зависит от первопричины водянки, гестационного возраста и возможности лечения.
По оценкам, 50% детей с водянкой не доживают до рождения.
Как правило, чем раньше возникает заболевание, тем выше риск для плода.
Причины и распространенность
Сообщаемый уровень заболеваемости неиммунной водянкой широко варьируется: от 1 на 1000 до 4000 рождений.
Причины неиммунного отека включают:
Во многих случаях точная причина не установлена.
Диагноз
Водянка обычно диагностируется во время обычного ультразвукового исследования, которое обнаруживает аномальное скопление жидкости по крайней мере в двух областях тела ребенка.
Если диагностирована водянка, вас могут направить в центр для плода для всестороннего обследования и специализированной помощи.
В Детском фетальном центре Техаса мы организуем для вас как можно более быстрое посещение для детальной оценки командой специалистов, имеющих опыт диагностики и лечения этого опасного для жизни состояния, включая врачей по материнско-фетальной медицине специалисты по визуализации, гематологи, генетические консультанты и неонатологи.
Дополнительное тестирование для определения серьезности состояния и основной причины может включать:
- УЗИ анатомии высокого разрешения
- Сверхбыстрая МРТ для более детального изучения анатомии и функций плода для выявления врожденных дефектов
- Эхокардиограмма плода для оценки сердца плода
- Амниоцентез и хромосомный анализ для выявления генетических аномалий
- Забор крови плода — процедура, аналогичная амниоцентезу для получения пробы крови плода из пуповины (также известна как чрескожный забор крови из пуповины или PUBS)
- Группа крови матери и скрининг, чтобы определить, является ли причиной аллоиммунизация резус-фактора, для тестирования антител и для определения титров TORCH для проверки различных инфекций, которые могут вызвать водянку
После этой тщательной оценки наши специалисты встретятся с вами для обсуждения ваших результатов, ответят на любые ваши вопросы и обсудят прогноз вашего ребенка и возможные варианты лечения.
В некоторых случаях водянка диагностируется только после рождения. Симптомы у новорожденного могут включать затрудненное дыхание, анемию, бледность кожи, сильный отек по всему телу, а также увеличение печени и селезенки.
Лечение во время беременности
Вы и ваш ребенок будете находиться под пристальным наблюдением с помощью регулярного ультразвукового исследования, чтобы выявить признаки осложнений и определить, нужны ли ранние роды. Нестрессовое тестирование также можно использовать для наблюдения за самочувствием ребенка.
Лечение во время беременности будет зависеть от основной причины водянки и гестационного возраста.
Стратегии лечения плода включают:
Доставка
Для достижения наилучшего результата роды должны проходить в больнице со специализированной помощью и ресурсами, необходимыми для младенцев с водянкой, включая отделение интенсивной терапии новорожденных (NICU) высшего уровня для недоношенных или тяжелобольных новорожденных.
Роды следует тщательно планировать и координировать с командой специалистов, имеющих опыт ведения беременностей и родов с высоким риском.Команда нашего Фетального центра тесно сотрудничает с педиатрами из Детской больницы Техаса, включая неонатологов, имеющих опыт лечения новорожденных с водянкой, обеспечивая наилучший уход за вашим ребенком на каждом этапе его пути.
Texas Children’s неизменно входит в число лучших детских больниц в стране по версии U.S. News & World Report.
Лечение после родов
Потребности в лечении после родов зависят от первопричины водянки и состояния здоровья новорожденного.
Стратегии лечения включают:
- Опора дыхательная
- Удаление лишней жидкости из пространств вокруг легких, сердца или брюшной полости
- Переливание крови
- Операция по устранению дефекта, например порока сердца или легкого
- Лекарства для лечения основной причины
Бригада послеродового ухода
Уникальным и явным преимуществом для матерей, рожающих в Детском павильоне для женщин Техаса, является то, что мы находимся внутри одной из крупнейших и самых известных детских больниц в мире, что дает беспрепятственный доступ к услугам интенсивной терапии и специалистам, которые могут понадобиться вашему ребенку после рождения.
Для новорожденных с водянкой плода это означает отсутствие переноса в критический постнатальный период. Это также означает, что педиатры-специалисты, отвечающие за лечение вашего ребенка, были неотъемлемой частью их команды ухода с момента рождения.
В зависимости от потребностей вашего ребенка в его или ее послеродовую бригаду могут входить:
Служба поддержки пациентов
Образование, пропаганда и эмоциональная поддержка жизненно важны, чтобы помочь семьям справиться с проблемами диагностики водянки.
Пациенты нашего Фетального центра получают:
Истории пациентов
водянок плода у младенцев | Детская Миннесота
Hydrops fetalis (HIGH-drops fee-TAH-lis) — это опасное для жизни состояние, при котором ненормальное количество жидкости накапливается в двух или более частях тела еще не родившегося ребенка. Хотя скопление жидкости может появиться в любом месте тела ребенка, чаще всего это происходит в брюшной полости, вокруг сердца или легких или под кожей. Другие симптомы состояния включают повышенное, чем обычно, количество амниотической жидкости (многоводие) и утолщение плаценты.
Водянка плода — это не болезнь, а симптом основной проблемы со здоровьем ребенка. При отсутствии лечения избыток жидкости может вызвать нагрузку на сердце и другие жизненно важные органы ребенка, подвергая риску жизнь ребенка.
Существует два типа водянки плода:
- Неиммунный отек. На этот тип водянки плода приходится примерно от 80 до 90 процентов всех случаев заболевания. Это происходит, когда основное заболевание, генетическое заболевание или врожденный дефект препятствуют способности организма ребенка управлять жидкостью.
- Иммунная водянка. Этот тип водянки плода возникает, когда эритроциты матери и ребенка несовместимы. Самый распространенный пример — это когда у беременной женщины резус-отрицательная кровь, а у ее будущего ребенка резус-положительная кровь (известная как Rh несовместимость ). Иммунная система матери рассматривает резус-положительные эритроциты ребенка как «чужеродных захватчиков» и посылает антитела для борьбы с ними. Это приводит к разрушению многих красных кровяных телец ребенка, что приводит к анемии.Тяжелая анемия у ребенка может привести к сердечной недостаточности и аномальному скоплению жидкости. В большинстве случаев несовместимость эритроцитов создает для ребенка проблемы со здоровьем от легких до умеренных. Однако примерно в одном из четырех случаев ситуация становится более серьезной и приводит к развитию водянки плода.
С 1960-х годов заболеваемость иммунной водянкой значительно снизилась из-за появления лекарства под названием RhoGAM. Лекарство, которое назначают женщинам, беременность которых подвержена риску резус-несовместимости, препятствует выработке организмом матери антител против красных кровяных телец ее ребенка.
Кто будет в моей бригаде по уходу?
В Центре ухода за плодами Midwest, созданном в сотрудничестве между Children’s Minnesota и Allina Health, мы специализируемся на индивидуальном подходе, который начинается с того, что у вас есть собственный координатор по уходу за ребенком, который поможет вам ориентироваться в процессе лечения вашего ребенка. Мы используем комплексный командный подход к водянке плода и любым связанным с ней аномалиям. Таким образом, вы можете быть уверены, что получите самую точную информацию от некоторых из самых опытных врачей страны.В случае водянки плода в вашу команду будут входить специалист по материнству и плоду, детский кардиолог, неонатолог, генетик, координатор медицинской помощи медсестры, перинатальный социальный работник и несколько других технических специалистов. В вашу медицинскую бригаду также может входить детский хирург или другие педиатрические специалисты, в зависимости от причины водянки. Вся эта команда будет внимательно следить за вами и вашим ребенком на протяжении всего процесса оценки и будет нести ответственность за разработку и выполнение вашего полного плана ухода.
Познакомьтесь с командой
Что вызывает водянку плода?
Неиммунная водянка имеет множество возможных причин, включая следующие:
- Врожденные дефекты, влияющие на работу сердца, например порок сердца или аритмия (ненормальное сердцебиение или ритм биения), или опухоль, сдавливающая сердце или приток крови к сердцу
- Аномалия гемоглобина или другое генетическое заболевание, которое вызывает разрушение клеток крови ребенка
- Хромосомные нарушения, такие как синдром Дауна (трисомия 21) или синдром Тернера
- Врожденные инфекции (переданные от матери ребенку до рождения), включая парвовирус B19 (пятое заболевание) и цитомегаловирус (CMV)
- Болезнь печени
- Опухоли с большим кровотоком
- Монохориальная беременность (при которой два или более генетически идентичных ребенка имеют одну и ту же плаценту)
- Анемия плода, вызванная неиммунными причинами, включая некоторые из перечисленных выше состояний, а также кровотечение в брюшной полости матери, иногда вызванное травмой
В некоторых случаях, однако, нет явной причины появления неиммунной водянки.
Иммунная водянка вызвана несовместимостью красных кровяных телец между матерью и ее еще не родившимся ребенком. Эта несовместимость приводит к разрушению большого количества красных кровяных телец ребенка (также известное как гемолитическая болезнь). По мере того как организм ребенка пытается вырабатывать новые эритроциты, а сердце работает интенсивнее, излишки жидкости могут образовываться и заполнять пространства вокруг сердца, легких и других органов ребенка.
Как диагностируется водянка плода?
Водянка плода часто диагностируется во время обычного пренатального ультразвукового исследования.Однако в некоторых случаях ваш врач может назначить УЗИ, чтобы конкретно проверить это состояние. Это может произойти, если шевеления вашего будущего ребенка значительно уменьшаются, если размер матки соответствует гестационному возрасту ребенка (количество недель, в течение которых ребенок находился в матке) или если у матери развивается преэклампсия с ранним началом (высокое кровяное давление во время беременности). Если существует известный риск, связанный с материнскими антителами к эритроцитам (несовместимость эритроцитов), будет рекомендовано обычное ультразвуковое исследование для выявления анемии и водянки плода.
Диагноз водянки плода ставится, если ультразвуковое исследование обнаруживает ненормальное количество жидкости в двух или более областях тела ребенка. Ультразвук также может выявить другие признаки, связанные с водянкой плода, включая большое количество околоплодных вод, утолщение плаценты и увеличенное сердце, печень или селезенку.
Чтобы отличить неиммунный гидропс от иммунного, кровь матери будет проверена на наличие антител, связанных с несовместимостью эритроцитов.
Как лечить водянку плода до рождения?
Пренатальное ведение новорожденных с водянкой плода начинается с получения как можно большего количества информации о тяжести состояния и основной причине. Будет получен подробный анамнез здоровья матери для выявления инфекций или других возможных факторов, связанных со здоровьем матери, которые могут привести к анемии плода и водянке плода. Мы также будем собирать информацию с помощью нескольких различных технологий, включая ультразвуковое исследование плода с высоким разрешением, эхокардиографию плода и амниоцентез.
Что такое УЗИ плода с высоким разрешением?
Ультразвуковое исследование плода с высоким разрешением — это неинвазивный тест, выполняемый одним из наших ультразвуковых специалистов. В тесте используются отраженные звуковые волны для создания изображений вашего ребенка в утробе матери. Мы будем использовать ультразвуковое исследование для выявления возможных врожденных дефектов, связанных с водянкой плода, а также для наблюдения за развитием внутренних органов вашего ребенка и общим ростом на протяжении всей беременности. Тест также позволит нам отслеживать количество околоплодных вод, окружающих вашего ребенка, а также то, насколько хорошо кровь течет через пуповину и другие кровеносные сосуды вашего ребенка.Кровоток в средней мозговой артерии (СМА) в головном мозге поможет нам определить, есть ли признаки анемии плода.
Что такое эхокардиография плода?
Эхокардиография плода (сокращенно «эхо») проводится в нашем центре детским кардиологом (врачом, специализирующимся на пороках сердца плода). Эта неинвазивная ультразвуковая процедура с высоким разрешением конкретно исследует, как устроено сердце вашего ребенка и насколько хорошо оно функционирует в утробе матери.
Что такое амниоцентез?
Амниоцентез проводится для анализа околоплодных вод вокруг вашего ребенка. Эта жидкость будет содержать некоторые из клеток вашего ребенка, которые предоставят нам полный набор хромосом вашего ребенка для анализа. Затем мы можем оценить, связана ли причина водянки плода с генетической или хромосомной аномалией. В околоплодных водах также можно проверить наличие инфекции или заболевания печени / обмена веществ — если есть подозрение, что это возможные причины. Процедура амниоцентеза проста и может быть проведена в нашей клинике.Для взятия пробы жидкости требуется ввести небольшую иглу в брюшную полость матери и в амниотический мешок. Получение окончательных результатов теста в нашей лаборатории обычно занимает несколько дней. Эта информация будет очень важна для создания вашего плана ухода и помощи неонатологу в уходе за вашим младенцем после рождения.
Что произойдет после завершения моей оценки?
После того, как мы соберем всю анатомическую и диагностическую информацию из тестов, вся наша команда встретится с вами, чтобы обсудить результаты и любые возможности лечения.Лечение будет зависеть от нескольких факторов, в том числе от причины водянки плода вашего ребенка, степени заболевания и гестационного возраста вашего ребенка.
Если предполагаемой причиной состояния является потеря эритроцитов (анемия плода), ваш врач может порекомендовать чрескожный забор образцов пуповинной крови (PUBS), также называемый кордоцентезом. Будет использоваться очень тонкая игла, чтобы взять образец красных кровяных телец вашего ребенка из пуповины. Если количество эритроцитов низкое, может быть рекомендовано внутриутробное переливание крови плода.Эта процедура, которая похожа на амниоцентез, вводит эритроциты совместимого донора в пуповину ребенка.
В редких случаях водянки плода, вызванной опухолью, может обсуждаться возможность пренатальной хирургии по удалению опухоли.
Пренатальная хирургия также может обсуждаться в случаях осложненной монохориальной беременности двойней.
Если у вашего ребенка сердечная аритмия, врач может порекомендовать лекарство, которое поможет регулировать сердцебиение ребенка.Лекарство будет дано матери, а затем передано ребенку через плаценту.
Избыточная жидкость внутри ребенка иногда может быть удалена внутриутробно во время одной процедуры с помощью иглы или может быть установлен шунт для непрерывного слива жидкости. Например, если вокруг легких ребенка собирается жидкость, в грудную клетку можно вставить небольшую изогнутую трубку, чтобы слить жидкость в амниотическую полость. Это лечение снимает давление на сердце и легкие ребенка.
Однако часто водянка плода не поддается лечению во время беременности. В таких случаях мы будем внимательно следить за матерью и ребенком на протяжении всей беременности, ища любые изменения, которые могут потребовать досрочных родов. В зависимости от гестационного возраста мы можем порекомендовать исследования биофизического профиля (BPP) для оценки благополучия ребенка. Во время этого теста на живот матери помещают датчик сердечного ритма, чтобы наблюдать за частотой сердечных сокращений ребенка в дополнение к ультразвуковому исследованию, оценивающему движения ребенка.Ваш врач будет использовать тест, который может длиться до 30 минут, чтобы определить, получает ли ваш ребенок достаточно кислорода из плаценты. Тест также помогает оценить количество околоплодных вод, окружающих ребенка.
Наша цель — доставить вашего ребенка как можно ближе к сроку, поскольку ранние роды могут быть опасными для жизни ребенка. Пожелания родителей будут учтены при обсуждении сроков родов и вмешательства. Независимо от любого потенциального лечения водянка плода является серьезным заболеванием, и есть вероятность, что ребенок не переживет беременность или роды.
Немедленные роды с водянкой плода иногда необходимы для защиты здоровья матери. Женщины, чьи дети страдают водянкой плода, подвергаются повышенному риску развития потенциально опасной для жизни формы высокого кровяного давления, связанной с беременностью, известной как «зеркальный синдром». (Это называется так, потому что симптомы матери отражают накопление жидкости у ребенка.) Единственное лечение зеркального синдрома — это роды.
Как лечится водянка плода после рождения?
Наша цель будет состоять в том, чтобы рождение вашего ребенка произошло как можно ближе к дате родов, но младенцы с водянкой плода часто должны родиться раньше срока.Роды часто осуществляются путем кесарева сечения, поскольку существует повышенный риск того, что ребенок не перенесет роды. Ваш ребенок родится в Центре матери и ребенка в Эбботт Северо-Западный и Детский Миннесота в Миннеаполисе или в Центре матери и ребенка в Юнайтед и Детском Миннесоте в Сент-Поле. Детский Миннесота — один из немногих центров по всей стране, где родильный дом расположен на территории больничного комплекса. Это означает, что ваш ребенок родится всего в нескольких футах от нашего отделения интенсивной терапии новорожденных (NICU).Кроме того, многие врачи, с которыми вы уже встречались, будут присутствовать во время или сразу после рождения вашего ребенка, чтобы помочь сразу же позаботиться о нем.
Вашему ребенку потребуется специализированная медицинская помощь после рождения, поэтому его доставят в наше отделение интенсивной терапии. Чтобы помочь ребенку дышать, можно использовать механический дыхательный аппарат (вентилятор), а для удаления жидкости из пространств вокруг сердца, легких и брюшной полости можно использовать иглу. Вашему ребенку также будут помещены специальные внутривенные (IV) линии для доставки необходимых питательных веществ и лекарств.Скорее всего, в состав этих лекарств войдут те, которые поддерживают работу сердца и помогают почкам выводить лишнюю жидкость из организма ребенка. Если у вашего ребенка иммунная водянка, ему могут сделать обменное переливание эритроцитов.
Наша цель — как можно быстрее поставить окончательный диагноз основной причины водянки плода. Для постановки этого диагноза вскоре после рождения будут проведены дополнительные анализы.
Потребуется ли моему ребенку операция?
Вашему ребенку может потребоваться операция для лечения основной причины водянки плода.Ваша бригада комплексного ухода в Центре ухода за плодами Среднего Запада объяснит вам все варианты лечения, включая операцию, для вашего ребенка.
Как долго мой ребенок будет в больнице?
Ваш ребенок будет выписан из больницы после того, как основное заболевание, вызвавшее водянку плода, стабилизировалось, ребенок выздоровел после всех хирургических вмешательств, и он или она без проблем принимает пищу через рот.
Каков прогноз моего ребенка?
Прогноз для детей с водянкой плода зависит от основной причины заболевания.Однако в целом выживаемость низкая. Более половины всех детей с этим заболеванием умирают до рождения или вскоре после родов.

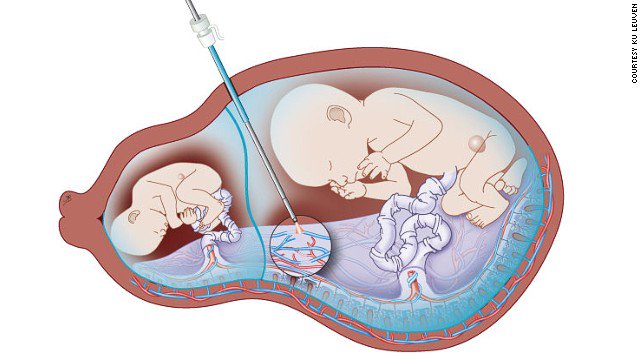 е.е. снижение уровней Hb, PCV, TLC и RBC из-за накопления продуктов метаболизма, присутствующих в аллантоисной жидкости, и послеоперационных спаек на матке с последующим внутренним кровотечением.
е.е. снижение уровней Hb, PCV, TLC и RBC из-за накопления продуктов метаболизма, присутствующих в аллантоисной жидкости, и послеоперационных спаек на матке с последующим внутренним кровотечением.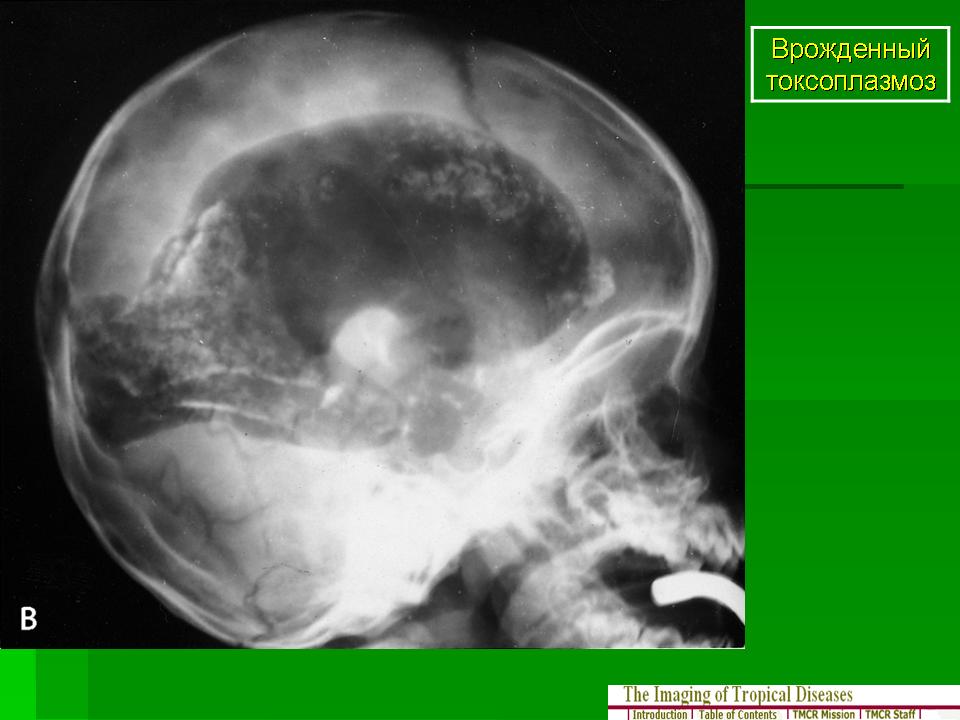 Кроме того, повышен уровень специфического для почек креатинина.
Кроме того, повышен уровень специфического для почек креатинина. Уровни натрия не статичны в случаях гидраллантоиса из-за изменений проницаемости плацентарных мембран.
Уровни натрия не статичны в случаях гидраллантоиса из-за изменений проницаемости плацентарных мембран. РЕФЕРАТ Два наследственных дефекта.Исследованы врожденная водянка крупного рогатого скота и атрезия свиней. Во введении делается ссылка на эволюционное значение смертоносных и сублетальных охотников и сравнивается их важность для практического разведения скота. Перечислены некоторые опубликованные отзывы о наследственных пороках сельскохозяйственных животных. Первая часть связана с врожденным дефектом водянки, который наблюдался и изучался в убиссейском стаде зарегистрированного эйрширского молочного скота, принадлежащего и разводимого Университетом Британской Колумбии.Изложена история стада и методы разведения, использованные на его основе. Формулируется и проверяется однофакторная рецессивная генетическая гипотеза, объясняющая возникновение десяти дефектных яйцеклеток. Генетический анализ родословных 153 из 501 детеныша, родившихся в стаде до 30 сентября 1951 г., показал, что средняя теоретическая вероятность излечения дефекта составляет 0,0853. Был применен тест на «степень соответствия», который показал, что выборка изучила гипотезу.
РЕФЕРАТ Два наследственных дефекта.Исследованы врожденная водянка крупного рогатого скота и атрезия свиней. Во введении делается ссылка на эволюционное значение смертоносных и сублетальных охотников и сравнивается их важность для практического разведения скота. Перечислены некоторые опубликованные отзывы о наследственных пороках сельскохозяйственных животных. Первая часть связана с врожденным дефектом водянки, который наблюдался и изучался в убиссейском стаде зарегистрированного эйрширского молочного скота, принадлежащего и разводимого Университетом Британской Колумбии.Изложена история стада и методы разведения, использованные на его основе. Формулируется и проверяется однофакторная рецессивная генетическая гипотеза, объясняющая возникновение десяти дефектных яйцеклеток. Генетический анализ родословных 153 из 501 детеныша, родившихся в стаде до 30 сентября 1951 г., показал, что средняя теоретическая вероятность излечения дефекта составляет 0,0853. Был применен тест на «степень соответствия», который показал, что выборка изучила гипотезу. Этиология и патогенез дефекта исследуются в рамках действующей гипотезы иммуногенеза, основанной на двух предположениях: 1) что дефект, врожденная водянка, является аналогом наследственного заболевания новорожденных, эритробластоза плода; 2) что теория изоиммунизации резуса, служащая для объяснения семейной; Заболеваемость людей может быть адаптирована к генетике популяций крупного рогатого скота. Описываются иммуногенетические исследования, предпринятые для проверки этой гипотезы, и предлагается объяснение результатов, отклоняющихся от гипотезы.Вторая часть посвящена более сложному наследственному дефекту. Atresia ani свиней. Обзор литературы. Представлены истории и родословные трех аномальных пометов, рожденных в местном стаде зарегистрированных йоркширских свиней. Предлагаются два объяснения возможного способа наследования дефекта, которые проверяются на доступной для изучения выборке. Приведены рекомендации, данные заводчику, которые позволят ему избавить его конкретное стадо племенного поголовья от дефекта.
Этиология и патогенез дефекта исследуются в рамках действующей гипотезы иммуногенеза, основанной на двух предположениях: 1) что дефект, врожденная водянка, является аналогом наследственного заболевания новорожденных, эритробластоза плода; 2) что теория изоиммунизации резуса, служащая для объяснения семейной; Заболеваемость людей может быть адаптирована к генетике популяций крупного рогатого скота. Описываются иммуногенетические исследования, предпринятые для проверки этой гипотезы, и предлагается объяснение результатов, отклоняющихся от гипотезы.Вторая часть посвящена более сложному наследственному дефекту. Atresia ani свиней. Обзор литературы. Представлены истории и родословные трех аномальных пометов, рожденных в местном стаде зарегистрированных йоркширских свиней. Предлагаются два объяснения возможного способа наследования дефекта, которые проверяются на доступной для изучения выборке. Приведены рекомендации, данные заводчику, которые позволят ему избавить его конкретное стадо племенного поголовья от дефекта.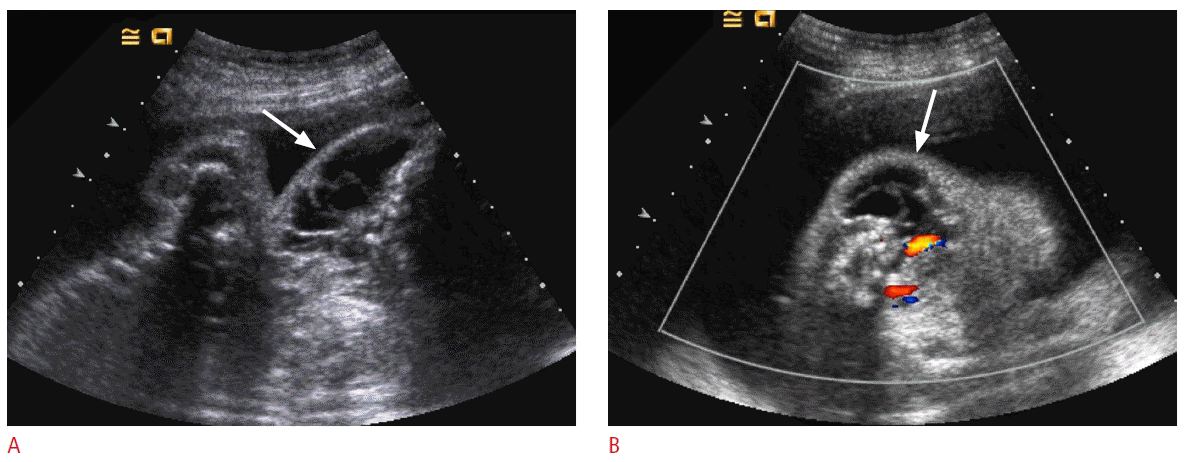 Заключение представляет собой краткое обсуждение проблем, с которыми сталкивается заводчик зарегистрированного поголовья, в стадах или отарах которого имеет место наследственный дефект.я обрисовал в общих чертах. Также представлены процедуры серологических реакций, используемых при исследовании иммуногенности крупного рогатого скота. БЛАГОДАРНОСТЬ За предложения и рекомендации по проведению генетических исследований, включенных в эту диссертацию, автор глубоко признателен доктору Дж. К. Берри, профессору кафедры животноводства Университета Британской Колумбии. Особая благодарность д-ру С. Н. Вуду, профессору кафедры животноводства Университета Британской Колумбии, за его неоценимую помощь на этапе иммуногенетической работы.СОДЕРЖАНИЕ СТРАНИЦА ПРИЗНАНИЕ ВВЕДЕНИЕ ЧАСТЬ I I Отечные телята в стаде Убисси Эйршир A Стадо Убисси Эйршир 1 B Врожденная отечность молочного скота 2 C Эритробластоз плода у людей 3 D Иммуногенетическое исследование клеточных антигенов у крупного рогатого скота 5 1); Агглютинация и гемолиз 2) Число и взаимодействия клеточных антигенов у крупного рогатого скота.
Заключение представляет собой краткое обсуждение проблем, с которыми сталкивается заводчик зарегистрированного поголовья, в стадах или отарах которого имеет место наследственный дефект.я обрисовал в общих чертах. Также представлены процедуры серологических реакций, используемых при исследовании иммуногенности крупного рогатого скота. БЛАГОДАРНОСТЬ За предложения и рекомендации по проведению генетических исследований, включенных в эту диссертацию, автор глубоко признателен доктору Дж. К. Берри, профессору кафедры животноводства Университета Британской Колумбии. Особая благодарность д-ру С. Н. Вуду, профессору кафедры животноводства Университета Британской Колумбии, за его неоценимую помощь на этапе иммуногенетической работы.СОДЕРЖАНИЕ СТРАНИЦА ПРИЗНАНИЕ ВВЕДЕНИЕ ЧАСТЬ I I Отечные телята в стаде Убисси Эйршир A Стадо Убисси Эйршир 1 B Врожденная отечность молочного скота 2 C Эритробластоз плода у людей 3 D Иммуногенетическое исследование клеточных антигенов у крупного рогатого скота 5 1); Агглютинация и гемолиз 2) Число и взаимодействия клеточных антигенов у крупного рогатого скота. Гипотезы E для объяснения возникновения врожденного отека 7 1) Генетическая гипотеза 2) Иммуногенетическая гипотеза II Формулировка генетической гипотезы A Родословные и учетные записи 9 B Формулировка гипотезы 10 1) Основные предположения 2) Гетерозиготы в родословных C Проверка гипотезы 13 l) Вероятности гомозиготных рецессивов D Обсуждение результатов 16 III Формулировка и проверка иммуногенетической гипотезы Формулировка гипотезы 19 B Проверка гипотезы 20 C Обсуждение результатов 21 ЧАСТЬ II Atresia rvni в йоркширском стаде свиней Обзор литературы 23 B История возникновения Atresia ani в местном стаде 24 C Анализ родословных D Генетические гипотезы 25 1) Однофакторный рецессивный 2) Двухфакторный доминантный E Рекомендации для селекционер 27 ЗАКЛЮЧЕНИЕ ПРИЛОЖЕНИЯ СПИСОК ЛИТЕРАТУРЫ i IHTRODTJC'i'ION Вариации формы и функции организмов позволяют популяциям соответствует принципу отбора, будь то естественный отбор или селекция, практикуемая селекционерами * Если популяции не обладают достаточным разнообразием, чтобы соответствовать изменениям в окружающей среде, они вымирают * Никакая среда не является статичной Управляющий эволюционным процессом, селекция, постоянная- Лай использует вариации в развитии форм, наиболее приспособленных к окружающей среде.
Гипотезы E для объяснения возникновения врожденного отека 7 1) Генетическая гипотеза 2) Иммуногенетическая гипотеза II Формулировка генетической гипотезы A Родословные и учетные записи 9 B Формулировка гипотезы 10 1) Основные предположения 2) Гетерозиготы в родословных C Проверка гипотезы 13 l) Вероятности гомозиготных рецессивов D Обсуждение результатов 16 III Формулировка и проверка иммуногенетической гипотезы Формулировка гипотезы 19 B Проверка гипотезы 20 C Обсуждение результатов 21 ЧАСТЬ II Atresia rvni в йоркширском стаде свиней Обзор литературы 23 B История возникновения Atresia ani в местном стаде 24 C Анализ родословных D Генетические гипотезы 25 1) Однофакторный рецессивный 2) Двухфакторный доминантный E Рекомендации для селекционер 27 ЗАКЛЮЧЕНИЕ ПРИЛОЖЕНИЯ СПИСОК ЛИТЕРАТУРЫ i IHTRODTJC'i'ION Вариации формы и функции организмов позволяют популяциям соответствует принципу отбора, будь то естественный отбор или селекция, практикуемая селекционерами * Если популяции не обладают достаточным разнообразием, чтобы соответствовать изменениям в окружающей среде, они вымирают * Никакая среда не является статичной Управляющий эволюционным процессом, селекция, постоянная- Лай использует вариации в развитии форм, наиболее приспособленных к окружающей среде. Если индивидуальная форма выходит за пределы вариаций, допускаемых окружающей средой, в которой она должна жить, она не может воспроизводиться, и зародышевая плазма, которую она несет, уничтожается * Это отбор * Пассивный отбор природы для многих видов был вытеснен - ред активным отбором человека. Хотя живое существо не является неизменным, а склонно к изменению, выбор человека основан на статической концепции гена. Для практического селекционера достаточно концепции statio. Для биолога динамическая концепция необходима, чтобы учитывать вариации наследственности. * В практике селекции заводчики предполагают, что потомки отобранных родителей получат выборочную половину наследственности родителя.Если потомство отличается от ожидаемого за пределами, допускаемыми стандартами заводчиков, то обычно правильно предполагать, что один или оба родителя несли нежелательную зародышевую плазму. Если несколько потомков сильно отличаются по форме, то генетический контроль был изменен мутацией. Хотя естественный отбор пассивен, формы, которым он позволил развиваться, хорошо адаптированы к существующей среде.
Если индивидуальная форма выходит за пределы вариаций, допускаемых окружающей средой, в которой она должна жить, она не может воспроизводиться, и зародышевая плазма, которую она несет, уничтожается * Это отбор * Пассивный отбор природы для многих видов был вытеснен - ред активным отбором человека. Хотя живое существо не является неизменным, а склонно к изменению, выбор человека основан на статической концепции гена. Для практического селекционера достаточно концепции statio. Для биолога динамическая концепция необходима, чтобы учитывать вариации наследственности. * В практике селекции заводчики предполагают, что потомки отобранных родителей получат выборочную половину наследственности родителя.Если потомство отличается от ожидаемого за пределами, допускаемыми стандартами заводчиков, то обычно правильно предполагать, что один или оба родителя несли нежелательную зародышевую плазму. Если несколько потомков сильно отличаются по форме, то генетический контроль был изменен мутацией. Хотя естественный отбор пассивен, формы, которым он позволил развиваться, хорошо адаптированы к существующей среде. Отклонения от нормального i i по большей части менее приспособлены к выживанию и поэтому вредны. * Аномалии называются наследственными дефектами и, как говорят, находятся под контролем летальных или сублетальных генов.Естественный отбор в значительной степени устранил однофакторные доминантные летальные и сублетальные. В каждой популяции имеется очень большое количество однофакторных рецессивных летальных клеток *. Гены, контролирующие последнюю, способны к фенотипической экспрессии только тогда, когда они находятся в гомозиготном состоянии. Сьюолл Райт (1931) показал, что случайное спаривание большой популяции может поддерживать большое количество реципиентных генов. Но с одомашниванием видов, созданием рас, известных как породы, и разделением популяции на изоляты, истинное случайное спаривание невозможно.Количество рецессивных генов, которые могут быть носителями в популяции, значительно сокращается. Инбридинг, который по необходимости должен происходить с изолятами, увеличивает вероятность отсутствия гомозиготного рецессивного генотипа и летального или сублетального фонотипа.
Отклонения от нормального i i по большей части менее приспособлены к выживанию и поэтому вредны. * Аномалии называются наследственными дефектами и, как говорят, находятся под контролем летальных или сублетальных генов.Естественный отбор в значительной степени устранил однофакторные доминантные летальные и сублетальные. В каждой популяции имеется очень большое количество однофакторных рецессивных летальных клеток *. Гены, контролирующие последнюю, способны к фенотипической экспрессии только тогда, когда они находятся в гомозиготном состоянии. Сьюолл Райт (1931) показал, что случайное спаривание большой популяции может поддерживать большое количество реципиентных генов. Но с одомашниванием видов, созданием рас, известных как породы, и разделением популяции на изоляты, истинное случайное спаривание невозможно.Количество рецессивных генов, которые могут быть носителями в популяции, значительно сокращается. Инбридинг, который по необходимости должен происходить с изолятами, увеличивает вероятность отсутствия гомозиготного рецессивного генотипа и летального или сублетального фонотипа. По мере того как практика разведения в закрытых популяциях продолжается, все больше и больше гомозиготных реоессивов будет сегрегироваться. готовы рискнуть произвести большее количество гомозиготных рецессивов * Не все, но большинство гомозиготных рецессивов вредны.Легкость, с которой популяция может быть избавлена от генов, вызывающих вредоносный фенотип, зависит не только от основного способа наследования, но также от плодовитости и плодовитости животных. Давление выбора, которое может быть применено, регулируется скоростью воспроизводства, а также эоономической ценностью каждого человека. Наследственные дефекты домашнего скота были рассмотрены Hadley и Warwick (1927). Более поздние обзоры включают обзоры Императорского бюро животноводства (1931 г.), Батта (1934 г.) и Eatfcn (1937 г.).Лернер (1944), Рио и Эндрюс (1951) составили списки всех зарегистрированных случаев смерти и частичной гибели скота и человека. Известен способ наследования большинства дефектов. Из тридцати четырех признаков, по которым был определен наследственный контроль, только два являются доминирующими.
По мере того как практика разведения в закрытых популяциях продолжается, все больше и больше гомозиготных реоессивов будет сегрегироваться. готовы рискнуть произвести большее количество гомозиготных рецессивов * Не все, но большинство гомозиготных рецессивов вредны.Легкость, с которой популяция может быть избавлена от генов, вызывающих вредоносный фенотип, зависит не только от основного способа наследования, но также от плодовитости и плодовитости животных. Давление выбора, которое может быть применено, регулируется скоростью воспроизводства, а также эоономической ценностью каждого человека. Наследственные дефекты домашнего скота были рассмотрены Hadley и Warwick (1927). Более поздние обзоры включают обзоры Императорского бюро животноводства (1931 г.), Батта (1934 г.) и Eatfcn (1937 г.).Лернер (1944), Рио и Эндрюс (1951) составили списки всех зарегистрированных случаев смерти и частичной гибели скота и человека. Известен способ наследования большинства дефектов. Из тридцати четырех признаков, по которым был определен наследственный контроль, только два являются доминирующими. Более реальный список включает только девять признаков неизвестной наследственности. Наследственные дефекты у животных - это либо анатомические, либо физиологические изменения, проявляющиеся в виде изменений внешнего вида или функций задействованных частей тела по сравнению с исходными.Аберрантное эмбриологическое развитие может вызывать аналогичные дефекты, но они не могут быть наследственными. Необходимо провести племенные испытания или изучить семейный анамнез, чтобы определить, является ли данный дефект наследственным. 1 ЧАСТЬ II Отечные телята в стаде в Убисси Эйршир A Стадо в Эйршире в Убисси Стадо молочного овса Университета Британской Колумбии в Эйршире основано на 24 головах, импортированных из Шотландии в 1929 году. Нынешнее стадо в семьдесят пять голов является линейным трем фундаментным импортным коровам.Этими стадами были Rainton Rosalind V -130259-, Ardgowan Gladness II -130282-, Lochinch Lassie-130269- • Все животные в стаде отслеживают от двух до шести раз к одной или более из этих коров.
Более реальный список включает только девять признаков неизвестной наследственности. Наследственные дефекты у животных - это либо анатомические, либо физиологические изменения, проявляющиеся в виде изменений внешнего вида или функций задействованных частей тела по сравнению с исходными.Аберрантное эмбриологическое развитие может вызывать аналогичные дефекты, но они не могут быть наследственными. Необходимо провести племенные испытания или изучить семейный анамнез, чтобы определить, является ли данный дефект наследственным. 1 ЧАСТЬ II Отечные телята в стаде в Убисси Эйршир A Стадо в Эйршире в Убисси Стадо молочного овса Университета Британской Колумбии в Эйршире основано на 24 головах, импортированных из Шотландии в 1929 году. Нынешнее стадо в семьдесят пять голов является линейным трем фундаментным импортным коровам.Этими стадами были Rainton Rosalind V -130259-, Ardgowan Gladness II -130282-, Lochinch Lassie-130269- • Все животные в стаде отслеживают от двух до шести раз к одной или более из этих коров. Сыновьями этих коров являются трое недавних производителей стада. Эти производители: Адмирал Убисси Розалинды -226521- *, Спитфайр губернатора Убисси -246791-, Белая кокарда Убисси -269047-. Адмирал - сын Розалинды и внук Глэднесс, в то время как Спитфайр - сын Глэднесс и внук Розалинды, Белая кокарда - сын Лесси от Спитфайра.Нынешний отец - Коммодор Адмирала Убиссей -307558-, сын Адмирала от дочери Спитфайра. Младший родитель стада, сенатор Ubyssey Cockade's -339650- является двойным внуком Лесси от Белой кокарды и дочери адмирала. Коммодор произвел на свет восемьдесят телят. Восемь его телят были аномальными при рождении. Восемь, четыре мужчины и четыре женщины страдали от скопления биологических жидкостей в подкожной фасое, что проявлялось в виде острого отека. Только у двух телят, рожденных ранее в стаде, наблюдались похожие отклонения.Их отец Адмирал. Высокая частота аномальных телят среди телят, рожденных Коммодором, привела к необходимости проведения генетического анализа проблемы.
Сыновьями этих коров являются трое недавних производителей стада. Эти производители: Адмирал Убисси Розалинды -226521- *, Спитфайр губернатора Убисси -246791-, Белая кокарда Убисси -269047-. Адмирал - сын Розалинды и внук Глэднесс, в то время как Спитфайр - сын Глэднесс и внук Розалинды, Белая кокарда - сын Лесси от Спитфайра.Нынешний отец - Коммодор Адмирала Убиссей -307558-, сын Адмирала от дочери Спитфайра. Младший родитель стада, сенатор Ubyssey Cockade's -339650- является двойным внуком Лесси от Белой кокарды и дочери адмирала. Коммодор произвел на свет восемьдесят телят. Восемь его телят были аномальными при рождении. Восемь, четыре мужчины и четыре женщины страдали от скопления биологических жидкостей в подкожной фасое, что проявлялось в виде острого отека. Только у двух телят, рожденных ранее в стаде, наблюдались похожие отклонения.Их отец Адмирал. Высокая частота аномальных телят среди телят, рожденных Коммодором, привела к необходимости проведения генетического анализа проблемы.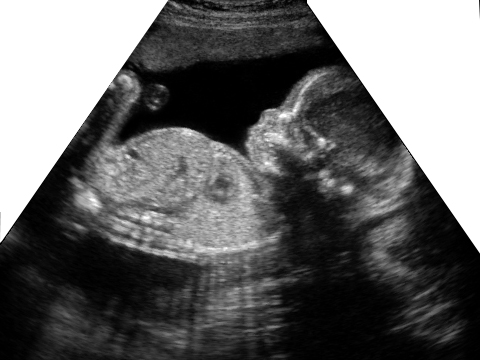 Казалось более чем случайным, что Коммодор, сводный брат двух ненормальных олав, произвел на свет восемь аналогичных аномальных телят * B Врожденная отечность молочного скота Аномалия, наблюдаемая в клетках Убисси, сопоставима с условиями, которые, как сообщается, наблюдались в некоторых случаях. Скандинавские стада молочного скота. В свой список смертельных генов крупного рогатого скота Лернер (1944) включил «Врожденную отечность».Состояние шведского фризского скота было изучено Ларссоном (1935) и было сообщено Йоханссоном (1939) на Международном конгрессе генетиков. Коркман (1940) описал аналогичные случаи, встречавшиеся среди эрширского скота Финляндии. Наблюдаемые им оазисы произошли от потомства быка Данлоп Талисман, привезенного из Шотландии. Йоханссон сообщил, что врожденная водянка имеет широкий спектр проявлений: некоторые плоды значительно увеличиваются в размерах из-за накопления жидкости в подкожной фасции и в полостях тела, тогда как другие имеют лишь незначительные отклонения от нормы.
Казалось более чем случайным, что Коммодор, сводный брат двух ненормальных олав, произвел на свет восемь аналогичных аномальных телят * B Врожденная отечность молочного скота Аномалия, наблюдаемая в клетках Убисси, сопоставима с условиями, которые, как сообщается, наблюдались в некоторых случаях. Скандинавские стада молочного скота. В свой список смертельных генов крупного рогатого скота Лернер (1944) включил «Врожденную отечность».Состояние шведского фризского скота было изучено Ларссоном (1935) и было сообщено Йоханссоном (1939) на Международном конгрессе генетиков. Коркман (1940) описал аналогичные случаи, встречавшиеся среди эрширского скота Финляндии. Наблюдаемые им оазисы произошли от потомства быка Данлоп Талисман, привезенного из Шотландии. Йоханссон сообщил, что врожденная водянка имеет широкий спектр проявлений: некоторые плоды значительно увеличиваются в размерах из-за накопления жидкости в подкожной фасции и в полостях тела, тогда как другие имеют лишь незначительные отклонения от нормы..jpg) Он утверждает, что период беременности при водянке плода в среднем составляет 226 дней, с диапазоном от менее 150 дней до 277 дней8. Ранняя отечная дегенерация сопровождается ранним абортом, когда
Он утверждает, что период беременности при водянке плода в среднем составляет 226 дней, с диапазоном от менее 150 дней до 277 дней8. Ранняя отечная дегенерация сопровождается ранним абортом, когда  Он изложил принцип патогенеза эритробластоза плода, который основан на изоиммунологических реакциях группы антигенов резуса (Rh), которые присутствуют примерно у 85% американцев. Резус-положительный муж резус-отрицательной женщины передает, как менделевский доминант, резус-фактор (ы) плоду. Резус-антигенные вещества проходят от резус-положительного плода через плаценту и вызывают выработку резус-антител у матери. Последние переходят от матери через плаоэнту к плоду, где действуют как гемолитические агенты и инициируют последовательность взаимосвязанных патологических изменений.Аналогичные объяснения были предложены Weiner (1946), Levine и др. (1939, 1941), Поттер и Уилсон (1945) и Ирвин (1947). Теория Rh-изоиммунизации эритробластоза плода может объяснить семейную заболеваемость. В то время как вышеупомянутые авторы утверждают, что человеческая плацента проницаема для агглютининов и антител, по крайней мере, на поздних стадиях беременности, Ранстрем (1947) рассматривает поражение плаценты как необходимое условие для изоиммунизации.
Он изложил принцип патогенеза эритробластоза плода, который основан на изоиммунологических реакциях группы антигенов резуса (Rh), которые присутствуют примерно у 85% американцев. Резус-положительный муж резус-отрицательной женщины передает, как менделевский доминант, резус-фактор (ы) плоду. Резус-антигенные вещества проходят от резус-положительного плода через плаценту и вызывают выработку резус-антител у матери. Последние переходят от матери через плаоэнту к плоду, где действуют как гемолитические агенты и инициируют последовательность взаимосвязанных патологических изменений.Аналогичные объяснения были предложены Weiner (1946), Levine и др. (1939, 1941), Поттер и Уилсон (1945) и Ирвин (1947). Теория Rh-изоиммунизации эритробластоза плода может объяснить семейную заболеваемость. В то время как вышеупомянутые авторы утверждают, что человеческая плацента проницаема для агглютининов и антител, по крайней мере, на поздних стадиях беременности, Ранстрем (1947) рассматривает поражение плаценты как необходимое условие для изоиммунизации. Он выдвигает теорию о том, что первичным элементом болезни является эндокринная дисфункция у матери, которая вызывает пагубные изменения.Любое возникшее в результате плаоентальное поражение открывает путь для изоиммунизации Rh при наличии соответствующих серологических условий. Поттер и Уилсон (1945) предполагают, что аномалия плаоенты позволяет эритроцитам плода проникать в кровообращение матери. Теория Ранстрома позволяет объяснить низкую заболеваемость этой болезнью. Заболеваемость эритробластозом плода составляет от одной из 300 до 400 рождений, в то время как каждая одиннадцатая беременная женщина является резус-отрицательной и вынашивает резус-положительный плод (Potter and Wilson, 1945).Ирвин (1947) утверждает, что примерно одна из 50 резус-отрицательных женщин, вовлеченных в критическое спаривание, становится сенсибилизированной. Ничто не объясняет, почему в первую очередь должны участвовать антитела к группе антигенов Rh. С другой стороны, Левин (1947, 1948) предполагает, что между матерью и плодом также может быть взаимодействие антигенов A и B.
Он выдвигает теорию о том, что первичным элементом болезни является эндокринная дисфункция у матери, которая вызывает пагубные изменения.Любое возникшее в результате плаоентальное поражение открывает путь для изоиммунизации Rh при наличии соответствующих серологических условий. Поттер и Уилсон (1945) предполагают, что аномалия плаоенты позволяет эритроцитам плода проникать в кровообращение матери. Теория Ранстрома позволяет объяснить низкую заболеваемость этой болезнью. Заболеваемость эритробластозом плода составляет от одной из 300 до 400 рождений, в то время как каждая одиннадцатая беременная женщина является резус-отрицательной и вынашивает резус-положительный плод (Potter and Wilson, 1945).Ирвин (1947) утверждает, что примерно одна из 50 резус-отрицательных женщин, вовлеченных в критическое спаривание, становится сенсибилизированной. Ничто не объясняет, почему в первую очередь должны участвовать антитела к группе антигенов Rh. С другой стороны, Левин (1947, 1948) предполагает, что между матерью и плодом также может быть взаимодействие антигенов A и B. Крю и др. (1947) утверждают, что в оазисах имели место акушерские катастрофы, когда отец был P-положительным, а мать P-отрицательным.«Теория Rh-изоиммунизации поднимает ряд вопросов, на которые нет удовлетворительного ответа. Ранстром поставил под сомнение отсутствие изоиммунизации Rh во многих случаях заболевания; и присутствующее Rh изоиммунизация без проявления болезни. Levine и др. 5 (1941) утверждают, что у младенцев есть оазисы гемолитической болезни, когда мать резус-положительна. Дэвидсон (1945) перечислил состояния, которые влияют на тяжесть эритробластоза плода. i) Возраст плода, когда антитела Eh становятся активными в его кровотоке.i i) Продолжительность времени, в течение которого плод подвергается этому воздействию. iii) Сила Eh-антител, титр анти-Eh-агглютининов в материнской крови не может быть измерен (нет связи между титром этих антител у матери и тяжестью заболевания у младенца. ). iv) Проницаемость глаоэнты: количественные различия у разных женщин или у одной и той же женщины в разное время.
Крю и др. (1947) утверждают, что в оазисах имели место акушерские катастрофы, когда отец был P-положительным, а мать P-отрицательным.«Теория Rh-изоиммунизации поднимает ряд вопросов, на которые нет удовлетворительного ответа. Ранстром поставил под сомнение отсутствие изоиммунизации Rh во многих случаях заболевания; и присутствующее Rh изоиммунизация без проявления болезни. Levine и др. 5 (1941) утверждают, что у младенцев есть оазисы гемолитической болезни, когда мать резус-положительна. Дэвидсон (1945) перечислил состояния, которые влияют на тяжесть эритробластоза плода. i) Возраст плода, когда антитела Eh становятся активными в его кровотоке.i i) Продолжительность времени, в течение которого плод подвергается этому воздействию. iii) Сила Eh-антител, титр анти-Eh-агглютининов в материнской крови не может быть измерен (нет связи между титром этих антител у матери и тяжестью заболевания у младенца. ). iv) Проницаемость глаоэнты: количественные различия у разных женщин или у одной и той же женщины в разное время. Он приходит к выводу, что гемолитическая анемия, вызванная действием антител к Eh, является не только основной причиной эритробластоза плода, но и объясняет генез комплексных проявлений заболевания.D Иммуногенетическое исследование клеточных антигенов у крупного рогатого скота. Термин «иммуногенез» был предложен иммунологами Wisoonsin для обозначения исследований, в которых методы генетики и иммунологии использовались совместно (Irwin, 1947). Этот термин указывает на изучение генетических признаков, которые еще можно обнаружить только с помощью иммунологических реакций. 1 Теория антигенов, агглютинация и гемолитические тесты Основой изучения иммунологии является теория антигенов. Эта теория предполагает, что выработка антител нарушается, когда чужеродные антигены вводятся в организм.Открытия в области иммунохимии доказали, что антигены, распознаваемые иммунологическими методами, являются определенными химическими соединениями. Различия между антигенами заключаются в их гемиологических структурах, а не только в их физическом состоянии.
Он приходит к выводу, что гемолитическая анемия, вызванная действием антител к Eh, является не только основной причиной эритробластоза плода, но и объясняет генез комплексных проявлений заболевания.D Иммуногенетическое исследование клеточных антигенов у крупного рогатого скота. Термин «иммуногенез» был предложен иммунологами Wisoonsin для обозначения исследований, в которых методы генетики и иммунологии использовались совместно (Irwin, 1947). Этот термин указывает на изучение генетических признаков, которые еще можно обнаружить только с помощью иммунологических реакций. 1 Теория антигенов, агглютинация и гемолитические тесты Основой изучения иммунологии является теория антигенов. Эта теория предполагает, что выработка антител нарушается, когда чужеродные антигены вводятся в организм.Открытия в области иммунохимии доказали, что антигены, распознаваемые иммунологическими методами, являются определенными химическими соединениями. Различия между антигенами заключаются в их гемиологических структурах, а не только в их физическом состоянии. Ланд-Штайнер (1951) обнаружил, что вещества более простой формы, чем белки, могут быть антигенными, если присоединены к белкам. Эти вещества получили 6 названий гаптенов. Применение серологических реагентов привело к открытию того, что белки у животных и растений различны и специфичны для каждого вида.Антитело специфично к антигену, который вызывал его образование. Присутствие этих антител в сыворотке крови может быть замечено. Если красные кровяные тельца коровы, обладающие тремя антигенами, A, B и G, вводятся второй корове, эритроциты которой не содержат ни одного из этих антигенов, производство изоиммунной сыворотки, содержащей три высокоспецифичных антитела к антигенам A, B , и C следовало ожидать. Антитела столь же качественно различны, как и определяемые ими антигены.При тестировании этой изоиммунной сыворотки в свежем виде с отмытыми тельцами индивидуумов, имеющими антигены A, B и C, или любую их комбинацию, эорпусолы агглютинируются в скопления, видимые глазу. Если свежую иммунную сыворотку нагревают в течение одного часа при температуре 56 ° С или выдерживают в течение нескольких дней, она теряет способность агглютифицировать клетки, содержащие антигены.
Ланд-Штайнер (1951) обнаружил, что вещества более простой формы, чем белки, могут быть антигенными, если присоединены к белкам. Эти вещества получили 6 названий гаптенов. Применение серологических реагентов привело к открытию того, что белки у животных и растений различны и специфичны для каждого вида.Антитело специфично к антигену, который вызывал его образование. Присутствие этих антител в сыворотке крови может быть замечено. Если красные кровяные тельца коровы, обладающие тремя антигенами, A, B и G, вводятся второй корове, эритроциты которой не содержат ни одного из этих антигенов, производство изоиммунной сыворотки, содержащей три высокоспецифичных антитела к антигенам A, B , и C следовало ожидать. Антитела столь же качественно различны, как и определяемые ими антигены.При тестировании этой изоиммунной сыворотки в свежем виде с отмытыми тельцами индивидуумов, имеющими антигены A, B и C, или любую их комбинацию, эорпусолы агглютинируются в скопления, видимые глазу. Если свежую иммунную сыворотку нагревают в течение одного часа при температуре 56 ° С или выдерживают в течение нескольких дней, она теряет способность агглютифицировать клетки, содержащие антигены. Это происходит из-за потери третьего компонента, называемого комплементом, термолабильного, неспецифического вещества в нормальной сыворотке.Добавление свежей нормальной говяжьей сыворотки, содержащей комплемент, восстановит способность изоиммунной сыворотки * агглютинировать клетки. Более чувствительный тест возможен, если в качестве источника комплемента используется свежая нормальная кроличья сыворотка. Когда иммунная сыворотка смешивается с клетками, несущими любой из соответствующих антигенов, в присутствии сыворотки комплемента, клетки гемолизируются. Гемолиз красных кровяных телец легко наблюдается in vitro из-за того, что из клеток высвобождается свободный пигмент гемоглобина.Комплемент соединяется с антителами только тогда, когда последние абсорбируются на угрях в силу их союза со своими специфическими антигенами. Таким образом, три основных компонента положительного гемолитического теста: антиген, его специфическое антитело и комплемент. 7 2 Число и взаимодействие клеточных антигенов у крупного рогатого скота В клетках крупного рогатого скота обнаруживается более сорока антигенов.
Это происходит из-за потери третьего компонента, называемого комплементом, термолабильного, неспецифического вещества в нормальной сыворотке.Добавление свежей нормальной говяжьей сыворотки, содержащей комплемент, восстановит способность изоиммунной сыворотки * агглютинировать клетки. Более чувствительный тест возможен, если в качестве источника комплемента используется свежая нормальная кроличья сыворотка. Когда иммунная сыворотка смешивается с клетками, несущими любой из соответствующих антигенов, в присутствии сыворотки комплемента, клетки гемолизируются. Гемолиз красных кровяных телец легко наблюдается in vitro из-за того, что из клеток высвобождается свободный пигмент гемоглобина.Комплемент соединяется с антителами только тогда, когда последние абсорбируются на угрях в силу их союза со своими специфическими антигенами. Таким образом, три основных компонента положительного гемолитического теста: антиген, его специфическое антитело и комплемент. 7 2 Число и взаимодействие клеточных антигенов у крупного рогатого скота В клетках крупного рогатого скота обнаруживается более сорока антигенов.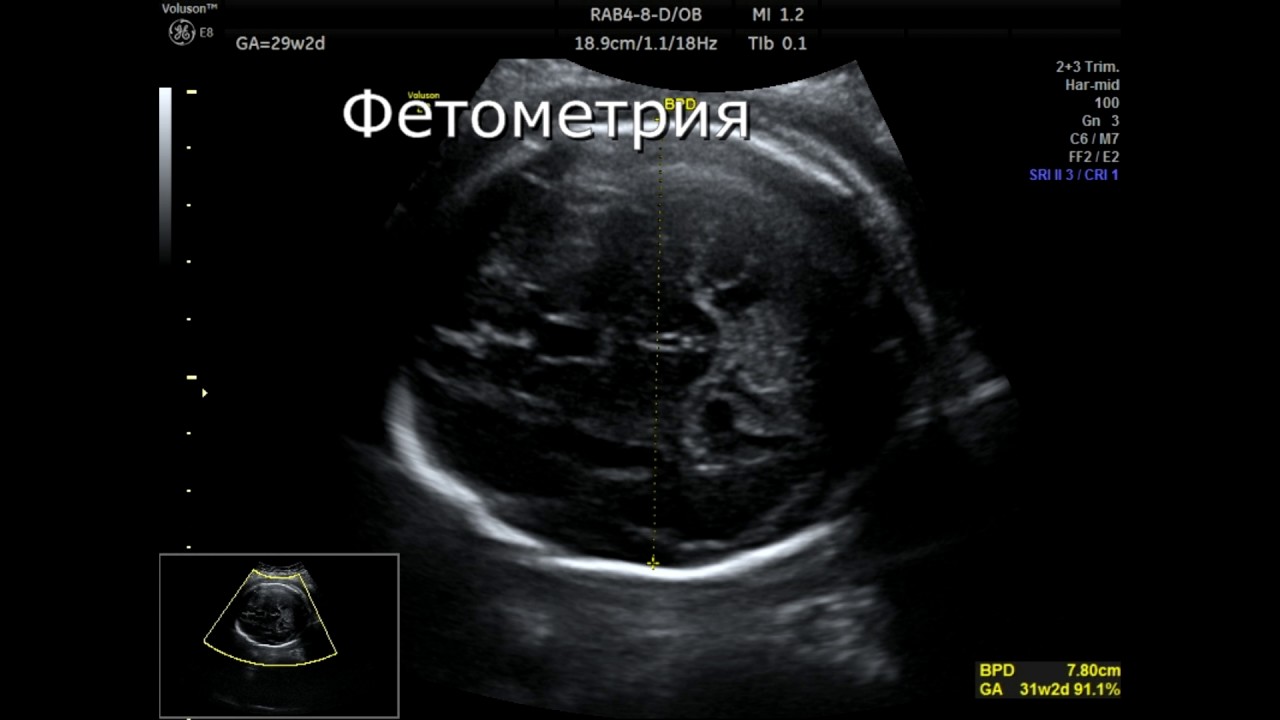 Большинство из них может быть обнаружено по отдельности, поэтому количество различных вариантов оомбин-40, возможных у крупного рогатого скота, составляет не менее 2.Если каждый антиген представляет собой химическую единицу, биохимическая индивидуальность возможна у вида крупного рогатого скота. Хотя антигены могут быть обнаружены независимо, многие из них связаны унаследованием. Например, из антигенов, называемых B, 6 и K, B и G могут встречаться по отдельности или вместе, тогда как K не встречается, кроме как в комбинации с B и G. Генетически существует два вида животных, обладающих B и G вместе. , а именно те, у которых потомство B и G разделяются, как если бы родитель был гетерозиготным, и $ h # s «, чье потомство не несло оба антигена или ни один из них.Следовательно, должно быть сцепление генов, вызывающих эти три вещества, или они контролируются генами в аллельной серии. Анализ, проведенный рабочими из Висконсина (Ferguson, 1941; Ferguson, et al, 1942; Stormont and Cumley, 1943), показывает, что причинные гены расположены на десяти из тридцати пар хромосом крупного рогатого скота.
Большинство из них может быть обнаружено по отдельности, поэтому количество различных вариантов оомбин-40, возможных у крупного рогатого скота, составляет не менее 2.Если каждый антиген представляет собой химическую единицу, биохимическая индивидуальность возможна у вида крупного рогатого скота. Хотя антигены могут быть обнаружены независимо, многие из них связаны унаследованием. Например, из антигенов, называемых B, 6 и K, B и G могут встречаться по отдельности или вместе, тогда как K не встречается, кроме как в комбинации с B и G. Генетически существует два вида животных, обладающих B и G вместе. , а именно те, у которых потомство B и G разделяются, как если бы родитель был гетерозиготным, и $ h # s «, чье потомство не несло оба антигена или ни один из них.Следовательно, должно быть сцепление генов, вызывающих эти три вещества, или они контролируются генами в аллельной серии. Анализ, проведенный рабочими из Висконсина (Ferguson, 1941; Ferguson, et al, 1942; Stormont and Cumley, 1943), показывает, что причинные гены расположены на десяти из тридцати пар хромосом крупного рогатого скота. По-видимому, существует по крайней мере два набора множественных аллелей, каждый из которых включает несколько фаутов. Это уменьшает количество вовлеченных в процесс, и не исключено, что большинство антигенов, каждый из которых определяется доминантным геном, передаются по наследству независимо.Различия между породами в частотах генов, ответственных за контроль клеточных антигенов, предлагают наиболее подробную информацию, пока еще доступную для генотипов популяций крупного рогатого скота. Оуэнс и др. (1944) обнаружили, что породы Голштин и Гернси различаются только частотами действия тридцати изученных антигенов. B Гипотезы, объясняющие возникновение врожденного отека 1 A Генетическая гипотеза Точные родословные всех членов исследуемой популяции позволяют надежно проанализировать генетическую проблему.Родословные 8 зарегистрированных голов крупного рогатого скота очень надежны и в большинстве случаев являются полными для нескольких поколений. Полные записи о предках доступны для каждого человека в стаде Убисси Эйршир.
По-видимому, существует по крайней мере два набора множественных аллелей, каждый из которых включает несколько фаутов. Это уменьшает количество вовлеченных в процесс, и не исключено, что большинство антигенов, каждый из которых определяется доминантным геном, передаются по наследству независимо.Различия между породами в частотах генов, ответственных за контроль клеточных антигенов, предлагают наиболее подробную информацию, пока еще доступную для генотипов популяций крупного рогатого скота. Оуэнс и др. (1944) обнаружили, что породы Голштин и Гернси различаются только частотами действия тридцати изученных антигенов. B Гипотезы, объясняющие возникновение врожденного отека 1 A Генетическая гипотеза Точные родословные всех членов исследуемой популяции позволяют надежно проанализировать генетическую проблему.Родословные 8 зарегистрированных голов крупного рогатого скота очень надежны и в большинстве случаев являются полными для нескольких поколений. Полные записи о предках доступны для каждого человека в стаде Убисси Эйршир. Эти записи позволили провести генетический анализ проблемы отеков и лоханок. Была сформулирована рабочая гипотеза, основанная на предположении, что наследственность дефекта контролируется однофакторными рецессивными генами. Родословная каждого животного в стаде была исследована и проанализирована. Коэффициенты вероятности были рассчитаны, чтобы установить вероятность наступления определенных событий, если гипотеза верна.Сравнение теоретически ожидаемых с наблюдаемыми результатами с помощью теста на добротность дало довольно надежную проверку работающей генетической гипотезы. 2 Иммуногенетическая гипотеза Была проверена вторая гипотеза, объясняющая этиологию и патогенез заболевания. Эта гипотеза была основана на сходстве проявлений врожденной водянки у крупного рогатого скота и эритробластоза плода у человека. Если теория изоиммунизации Rh, принятая в евгенике как объяснение семейной заболеваемости эритробластозом плода, имеет аналог в генетике крупного рогатого скота, гипотеза, основанная на знании клеточных антигенов крупного рогатого скота, могла бы служить для объяснения возникновения врожденной водянки.
Эти записи позволили провести генетический анализ проблемы отеков и лоханок. Была сформулирована рабочая гипотеза, основанная на предположении, что наследственность дефекта контролируется однофакторными рецессивными генами. Родословная каждого животного в стаде была исследована и проанализирована. Коэффициенты вероятности были рассчитаны, чтобы установить вероятность наступления определенных событий, если гипотеза верна.Сравнение теоретически ожидаемых с наблюдаемыми результатами с помощью теста на добротность дало довольно надежную проверку работающей генетической гипотезы. 2 Иммуногенетическая гипотеза Была проверена вторая гипотеза, объясняющая этиологию и патогенез заболевания. Эта гипотеза была основана на сходстве проявлений врожденной водянки у крупного рогатого скота и эритробластоза плода у человека. Если теория изоиммунизации Rh, принятая в евгенике как объяснение семейной заболеваемости эритробластозом плода, имеет аналог в генетике крупного рогатого скота, гипотеза, основанная на знании клеточных антигенов крупного рогатого скота, могла бы служить для объяснения возникновения врожденной водянки. в овсянке.Одновременно с анализом родословной, предпринятым для проверки гипотезы genetio, были проведены исследования иммуногенеза с использованием методов Фергюсона (1941) для проверки гипотезы изоиммунизации. Селекционные тесты, которые могли бы окончательно установить способ наследования болезни, не были сочтены ни возможными, ни практичными. Статистически значимые результаты, которые позволили бы установить менделевскую регенерацию сегмента 9, могли быть получены только после большого количества тестовых спариваний. Селекционные испытания с овсяным скотом являются необходимостью длительных экспериментов.Получение достаточных данных не только будет дорогостоящим, но и снизит среднюю племенную ценность стада. Вредоносный ген будет заражен по всему стаду в гетерозиготном состоянии. Последующее скрещивание гетерозигот могло вызвать усиление иноидного дефекта. Потребуется несколько поколений селекции, чтобы снизить частоту гена до его нынешнего значения. Низкая жизнеспособность дефектных яйцеклеток усложняет не только собственное проведение экспериментов по разведению, но и интерпретацию результатов.
в овсянке.Одновременно с анализом родословной, предпринятым для проверки гипотезы genetio, были проведены исследования иммуногенеза с использованием методов Фергюсона (1941) для проверки гипотезы изоиммунизации. Селекционные тесты, которые могли бы окончательно установить способ наследования болезни, не были сочтены ни возможными, ни практичными. Статистически значимые результаты, которые позволили бы установить менделевскую регенерацию сегмента 9, могли быть получены только после большого количества тестовых спариваний. Селекционные испытания с овсяным скотом являются необходимостью длительных экспериментов.Получение достаточных данных не только будет дорогостоящим, но и снизит среднюю племенную ценность стада. Вредоносный ген будет заражен по всему стаду в гетерозиготном состоянии. Последующее скрещивание гетерозигот могло вызвать усиление иноидного дефекта. Потребуется несколько поколений селекции, чтобы снизить частоту гена до его нынешнего значения. Низкая жизнеспособность дефектных яйцеклеток усложняет не только собственное проведение экспериментов по разведению, но и интерпретацию результатов. II. Формулировка генетической гипотезы. Как уже говорилось ранее, отечные овцы, рожденные в стаде Uby-ssey, были близкими родственниками по боковой линии. Это семейное происшествие вместе с сообщениями Ларссона (1935), Йоханссона (1939) и Коркмана (1940) привело к предположению, что это состояние было наследственным. Патологические исследования при вскрытии не дали убедительных доказательств того, что заболевание могло быть вызвано конкретной инфекцией. Также не было изменений в способах кормления. Практика кормления во время беременности, которая привела к образованию отечных плодных яиц, была по существу такой же, как и в течение нескольких лет.Поэтому кажется маловероятным, что недостаток питания был предрасполагающим фактором * A P & digrees и отчеты об отелах Родословные отечных овец, рожденных в стаде Ubyssey, представлены на рисунках с 1 по 9 включительно. Овцам присвоены римские числа, и они перечислены в порядке их рождения. Телята I и II были от отца-адмирала, а телята с III по X включительно - от его сына Коммодора.
II. Формулировка генетической гипотезы. Как уже говорилось ранее, отечные овцы, рожденные в стаде Uby-ssey, были близкими родственниками по боковой линии. Это семейное происшествие вместе с сообщениями Ларссона (1935), Йоханссона (1939) и Коркмана (1940) привело к предположению, что это состояние было наследственным. Патологические исследования при вскрытии не дали убедительных доказательств того, что заболевание могло быть вызвано конкретной инфекцией. Также не было изменений в способах кормления. Практика кормления во время беременности, которая привела к образованию отечных плодных яиц, была по существу такой же, как и в течение нескольких лет.Поэтому кажется маловероятным, что недостаток питания был предрасполагающим фактором * A P & digrees и отчеты об отелах Родословные отечных овец, рожденных в стаде Ubyssey, представлены на рисунках с 1 по 9 включительно. Овцам присвоены римские числа, и они перечислены в порядке их рождения. Телята I и II были от отца-адмирала, а телята с III по X включительно - от его сына Коммодора. Теленок X был полным братом Теленку VI. Из расширенных родословных каждого из этих телят, диаграммы типа стрелок, чтобы показать линии происхождения от 10 Рисунок 1.Стрелочная диаграмма из родословной отечного теленка I »Адмирал-, Галахад - Веселость. «Капеллан Джесси» 11 Рис. 3 * Стрелочная диаграмма, взятая из родословной отечного олфа III, командор-адмирал Натали III Джоанн Капеллан, человек войны Рисунок 4. Стрелочная диаграмма, взятая из родословной эматозного олфа IV, коммодора _ адмирала - Галахад - Веселого человека of War Eunice Mainspring • 12 Рисунок 5. Стрелочная диаграмма, взятая из родословной отечной овцы Ve Рисунок 6. Стрелочная диаграмма, сделанная из родословной отечной овцы VI * 13 Рисунок 7.Morven • Свидание с теленком Хизер 15 *. Gam I.C. Описание IM 21/9/41 Адмирал Джесси 12 * 5 Бомб мертвый, усиленный жидкостью II M 27.10.43 Адмирал Эйли 20.3 Родился мертвым, наполненный жидкостью III P 16/6/49 Коммодор Люси 19.5 Голова и ноги отечные IV M 3/7/49 Коммодор Офелия 18.
Теленок X был полным братом Теленку VI. Из расширенных родословных каждого из этих телят, диаграммы типа стрелок, чтобы показать линии происхождения от 10 Рисунок 1.Стрелочная диаграмма из родословной отечного теленка I »Адмирал-, Галахад - Веселость. «Капеллан Джесси» 11 Рис. 3 * Стрелочная диаграмма, взятая из родословной отечного олфа III, командор-адмирал Натали III Джоанн Капеллан, человек войны Рисунок 4. Стрелочная диаграмма, взятая из родословной эматозного олфа IV, коммодора _ адмирала - Галахад - Веселого человека of War Eunice Mainspring • 12 Рисунок 5. Стрелочная диаграмма, взятая из родословной отечной овцы Ve Рисунок 6. Стрелочная диаграмма, сделанная из родословной отечной овцы VI * 13 Рисунок 7.Morven • Свидание с теленком Хизер 15 *. Gam I.C. Описание IM 21/9/41 Адмирал Джесси 12 * 5 Бомб мертвый, усиленный жидкостью II M 27.10.43 Адмирал Эйли 20.3 Родился мертвым, наполненный жидкостью III P 16/6/49 Коммодор Люси 19.5 Голова и ноги отечные IV M 3/7/49 Коммодор Офелия 18. 2 Отечные VF 22/11/49 Коммодор Квакер 7.1 Отечные VI F 8/1/50 Коммодор Регина 9 * 8 Отечные, умерли при рождении от удушья VII F 7/4/50 Коммодор Первоцвет 16.4 Мертворожденный отечный VIII M 4/9/60 Коммодор Рамона 17.3 Отечный, живой, активный IX F 31/12/50 Commodore Rennle X M 15/1/51 Commodore Regina 7.8 Прервано через шесть месяцев. Узкий отек, гипокапли 9,8 Прозрачная отечная жидкость в подкожно-аневидной фасции - газообразный отек. IC. - Коэффициент инбридинга (per oent) Ботэ: Галахад, а не Морвен, считается отцом Джесси. Оба производителя обслуживали корову во время одной и той же течки. Таблица Ix. Данные и записи. Выявление отечных тельцов, рожденных в стаде Убиссей *, общих предков. Эти диаграммы представлены на рисунках с 10 по 18 включительно.Коэффициенты инбридинга рассчитывались с помощью стрелочных диаграмм; и они вместе с другими данными и записями, касающимися каждого отечного теленка, представлены в таблице I. Записи об отелах, относящиеся к моменту основания стада, были изучены и выявили следующую информацию. От 146 самок родилось 539 телят. Было восемь пар близнецов. Имена 12 быков и количество рожденных от каждого телят представлены в басне II. КОЛИЧЕСТВО СИРОВЫХ ТЕЛЕБ Королевский капеллан Auohenbrain -130252- 64 Grandview Man 0 * War -159659- i «Gr and view Mainspring -165506- 39 Ubyssey Royal Gaiety -165532- 18 Fintry Morven -178672- 37 Dbyssey Gaiety Sir Galahad -202516- 53 Губернатор Убисси Розалинды -202521- 14 Убисси Морвен Гладгоуэн - 218123- 7 Адмирал Убисси Розалинда - 226521- 93 Спитфайр губернатора Убисси -246791- 38 Белая кокарда Убисси -269047- 66 Используется в коммодоре адмирала Убисси -307558- 79 501 Стол литературный Стадо и количество телят, отпущенных Eaoh.B Формулировка гипотезы 1. Основные предположения. Для целей анализа было предположено, что экспрессия pheno-17 typio, наблюдаемая как отек у новорожденных яйцеклеток, возможна только в генотипах, несущих оба рецессивных гена. То есть в популяции возможны три генотипа: гомозиготный доминантный (AA), гетерозиготный (Aa) и гомозиготный рецессивный (aa). Поскольку наблюдались только два фенотипа, а именно нормальный и отечный, мы должны предполагать полное доминирование.Генотипы AA и Aa, имеющие одинаковую экспрессию фенотипа, нормальные; и генотип аа - фенотипическая экспрессия, отечный. Изучение стрелочных диаграмм, составленных на основе родословных отечных телят, а также с учетом практики разведения и результирующих линий происхождения, наиболее часто встречающихся в стаде, показывает, что некоторые предки этих телят подозреваются в гетерозиготности по признаку. тер. В популяции нормальных животных возможны только три типа вязок, а именно.i) гомозиготный доминант Z гомозиготный доминант i i) гомозиготный доминант Z гетерозиготный i i i) гетерозиготный Z гетерозиготный Частота каждого типа спаривания в случайно спаривающейся популяции будет функцией частоты гена. Менделирующая сегрегация от спариваний этих двух генотипов будет следующей: i) Родители AA X AA Гаметы все AF x все AA ii) Родители AA Z Aa Гаметы все A £ A, £ a Fx '£ AA, £ Aa iii) Родители Aa Z Aa Gametes g A, £ a £ A, £ a Fx i AA, £ Aa, £ aa Iff Только в экспериментальных условиях спаривания с участием гомозиготной рецессивной особи будут вероятными.2 Гетерозигота8 в родословных Таким образом, получить гомозиготного рецессивного индивида можно только при скрещивании двух гетерозигот. При скрещивании двух известных гетерозигот только одно из каждых четырех потомков оказывается гомозиготным реоессивным. Вероятность получения гомозиготного рецессивного потомства от скрещивания двух животных неизвестного генотипа, случайно выбранных из популяции, крайне мала. Для увеличения вероятности возникновения какого-либо события до уровней, подходящих для практических экспериментов по разведению, необходимо вязать животных известной родословной и генотипа.Спаривания Sinoe al в стаде Ubyssey были нормального фенотипа, те спаривания, которые дали отечных телят, были вязками двух гетерозиготных животных. Самцы и самки любых отечных овец были гетерозиготами. Имена этих одиннадцати известных гетерозигот включены в Таблицу I. Кроме того, изучая родословные этих животных, можно предположить, что некоторые другие предки отечных овец, в достаточных пределах вероятности, также были гетерозиготами. Линия происхождения от капеллана к Гейети, Галахаду и Адмиралу является общей для всех отечных овалов.из родословных (VIII и IX) один или несколько из этих производителей являются общим предком. Поэтому / возможно, что пять производителей этой линии происхождения были гетерозиготными. Поскольку в одной родословной, кроме VIII и IX, есть по крайней мере две линии происхождения от по крайней мере одного из этих производителей, единственная рецессивная гипотеза приемлема. Чтобы учесть отечные овцы VIII родословной или IS i t, необходимо признать гетерозиготными животных, не являющихся потомками любого из этих пяти производителей.Хотя Адмирал И.С. гетерозиготен и, предположив, что его отец также был гетерозиготным, генотип его матери, Розалинды, можно предположить гетерозиготным с вероятностью половинной. Предполагая, что Розалинда была гетерозиготной, можно объяснить появление отечных овалов у породистой VIII или IX. Розалинда является общим предком во всех, кроме родословной I. Расчет вероятности передачи рецессивных генов по обеим линиям потомков в каждой родословной от одного или нескольких гетерозиготных (предполагаемых) предков служит для проверки гипотезы и позволяет тест на соответствие.Гипотеза, сформулированная на основе изучения родословных отечных яйцеклеток, может быть изложена следующим образом: 1) предполагается, что персонаж находится под контролем одной пары джиннов. i i) предполагалось полное доминирование. i i i) взял на себя линию desoent от капеллана до Гейети, до адмирала и отечного оленя; или от адмирала до коммодора, до отеков. Предполагается, что все эти производители были гетерозиготными. iv) предположил, что Розалинда была гетерозиготной. C Проверка гипотезы Родословные всех животных, рожденных в стаде, были объединены, чтобы определить, у каких телят был капеллан, веселость, галахад или адмирал в качестве общего предка.Существует 153 родословных, в которых один из этих производителей фигурирует как общий предок. Капеллан - общий предок в 123 родословных; Веселость в 13 родословных; Галахад в 26 родословных; и Адмирал появляется в 27 родословных. Существует 37 родословных, в которых двое или более этих быков имеют общих предков. Стрелочные диаграммы были построены на основе родословных каждого потомства и рассчитана вероятность того, что каждое потомство будет гомозиготным реоэссивным. 20, 1 Вероятности гомозиготных рецессивов. Средние вероятности получения отечных яйцеклеток вместе с предположениями, на основании которых они были рассчитаны, представлены в виде схемы.i) Предполагая, что капелланом был Аа, игнорируя, что у овалов есть другие общие предки, игнорируя то, что Гейети, Галахад и адмирал были Аа; средняя вероятность - 0,0132. - предполагая, что Гейети, Галахад и Адмирал были Аа; средняя вероятность - 0,0526. (на основе 123 родословных) i i) Предполагая, что Веселость была Аа, игнорируя других общих предков овец: - игнорируя Адмирала, Галахада и Коммодора были Аа; средняя вероятность - 0,0189. - предполагая, что Галахад, адмирал и коммодор были Аа; средняя вероятность - 0.0697. (на основе 13 родословных) i i i) Предполагая, что Галахад - Аа, игнорируя, что у овец есть другие предки oommon: - игнорируя, что Адмирал и Коммодор были Aa; средняя вероятность - 0,0396. - предполагая, что адмирал и коммодор были Аа; средняя вероятность - 0,0865. (на основе 26 родословных) iv) Предполагая, что Адмирал - это Аа, игнорируя, что у овец есть другой предок oommon - игнорируя, что Коммодор - это Аа; средняя вероятность - 0,0549. - предполагая, что Коммодор - Аа; средняя вероятность - 0,0914.(на основе 27 родословных) 7) Предположим, что все производители, капеллан, веселость, галахад, адмирал и коммодор были Аа. (Это естественно следует из основного предположения о том, что линия происхождения от капеллана была общей для всех телят Коммодором.) Средняя вероятность - 0,0772. (на основе 146 родословных) vi) Предполагается, что все производители. Капеллан, Гейети, Галахад, Адмирал и Коммодор были Аа; предполагая также, что Розалинда была Аа; средняя вероятность - 0,0853. (на основе 91 родословной) 2. Степень соответствия. К данным, полученным в результате анализа родословных, применялся критерий «ohi-квадрат (% **)» на «степень соответствия».Из формулы: где f 0 - наблюдаемая частота, а f - теоретическая частота, можно получить значение хи-квадрат. С помощью таблицы ohi-squar-ed (Snedeoor pi90, 1949) можно оценить добротность f i t. В таблицах ohi-squared значения указывают на вероятность получения f i t исключительно по случайности, равную или более низкую, чем полученная расчетным путем. Если эта вероятность мала, вероятность того, что расхождения между наблюдаемыми и рассчитанными данными являются случайными, также мала.Если это так, то проверка гипотезы, вероятно, с честью применима к решению исследуемой проблемы. Средняя вероятность получения отечного оленя в любой из 146 проанализированных родословных составляет 0,0853. На основе этой гипотезы можно было бы исключить, что из 153 родившихся телят 13 телят будут отечными, фактическая частота отечных телят в анализируемых родословных составляет десять из 153 или выражается как вероятность 0,0653. По этим двум частотам можно рассчитать значение квадрата охи.Вводя таблицы 22 хи-квадрат при одной степени свободы (на одну меньше, чем количество классов), можно получить значение P путем интерполяции. Когда ohi-квадрат равно 0,00469, P составляет 0,9325 при одной степени свободы. Другими словами, примерно в 93,25% подобных оазисов будут обнаружены большие или большие отклонения от теоретической вероятности, и нынешняя популяция не соответствует гипотезе. D Несоответствие результатов Хотя наблюдения и данные, полученные из этой довольно большой выборки, подтверждают, что рабочая гипотеза была изначально сформулирована, гипотеза не подтверждается.Больше доказательств, подтверждающих гипотезу, могло быть получено путем тестовых спариваний и обратных оросий, если было возможно поднять гомозиготных рецессивных животных до репродуктивной зрелости. Однако ведение полных учетных записей об отелах и точных родословных, как это требуется для зарегистрированного овсянки, позволит провести дальнейший анализ для проверки гипотезы. Типы спариваний, возможных в популяции нормальных особей, уже были обозначены. Если в популяции есть отечные особи, возможны три схожих типа вязок.Если бы скрещивание двух гомозиготных рецессивов было возможно, гипотеза подверглась бы абсолютному тесту, и можно было бы получить только отечное потомство синоэ. если только потомки двух гомозигот сами не являются гомозиготами, персонаж не находится под контролем одной пары джиннов. В настоящее время в стаде Ubyssey всего шесть животных с доказанным генотипом. Это отец Коммодор и пять маток отечных овец, оставшихся в стаде. Коровы, с которыми вязался Commodore aan, являются либо гомозиготными доминантными, либо гетерозиготными.Потомки Розалинды и особенно потомки Адмирала с большей вероятностью будут гетерозиготными, чем гомозиготными доминантами. Спаривание Commodore с боковыми родственниками увеличивает вероятность получения отечных яйцеклеток. Вероятность появления гомозиготного рецессива в каждом случае должна быть не менее 0,25. Если самка отечного теленка от Commodore родится живой и в зрелом возрасте будет фертильной 23, она может быть повязана со своим отцом, и в этом случае вероятность получения отечного теленка будет равна 0.50. Такое спаривание представляет только генетический интерес. Обычно такую самку не вырастили бы. Однако ее можно использовать для тестирования других быков неизвестного генотипа. Такие тестовые скрещивания вряд ли будут оправданы. Из-за долгого периода вынашивания и небольшого количества потомства для подтверждения генотипа одного быка потребуется несколько лет. Число производителей, которых можно было бы испытать на скрещивание с одной самкой, очень ограничено. быть 0.50. Еще один метод проверки гипотезы, который вряд ли станет доступным, - это скрещивание двух отечных особей. Вероятность получения двух телят противоположного пола, у которых совпадают периоды зексуальной зрелости и f e r t i l i t y, очень мала. Было высказано предположение, что состояние, наблюдаемое у новорожденных телят и названное врожденной водянкой, связано с наличием одной пары рецессивных аллелей. Также предполагалось, что существует полное доминаное, что один рецессивный аллель полностью затмевается фенотипическим выражением доминанты all e l.Затем предполагается, что состояние жидкостного баланса неполовозрелого крупного рогатого скота находится под контролем одной пары джиннов. Если присутствуют один или оба доминантных аллеля, индивидуум является нормальным фенотипом. Если присутствуют оба рецессивных аллеля, человек отечен. Баланс жидкости в организме должен, по ряду факторов, влияющих на баланс, находиться под комплексным контролем; но из-за хрупкого характера этого баланса он может быть нарушен одним простым изменением физиологических процессов, которые контролируют накопление и распределение жидкостей организма.Если хотя бы один шаг в одном из этих процессов зависит от присутствия 8fc и фенотипической экспрессии по крайней мере одного доминантного гена в аллельной паре, отсутствие обоих доминантных генов предотвратит инициирование серии событий, необходимых для производства система контроля водного баланса организма. Хотя анализ родословных показал, что наследственность врожденной водянки с большой вероятностью находится под контролем одного рецессивного гена, может показаться, что широкие вариации в проявлении противоречат этому предположению и скорее указывают на сложный способ наследования.Поскольку у каждого индивида гены оказывают свое раздельное влияние на эквивалентных стадиях развития, можно ожидать, что одна пара джиннов вызовет такой же синдром у всех индивидов, обладающих им. Однако внутриматочная среда может быть достаточно разнообразной, чтобы вызвать различную степень тяжести дефекта, наблюдаемого при рождении. Если бы группа сцепления или несколько генов частично или полностью отвечали за контроль жидкостного баланса, возможно, слабым местом в этой группе было то, что было бы унаследовано, и эта слабость могла бы влиять на разные гены в пределах группа в каждом отдельном человеке.Снова предполагая, что каждый этап физиологических процессов находится под контролем отдельного гена, этот этап процесса, который будет удален, будет зависеть от того, на какой ген повлияла наследственная слабость. Формулировка и проверка иммуногенетической гипотезы Обзор литературы по врожденным заболеваниям младенцев делает очевидным сходство между проявлениями эритробластоза плода у людей и врожденной водянкой крупного рогатого скота. Теория изоиммунизации R h e 8 U 8, принятая многими как объяснение болезни плода эритробластоз, уже была изложена.Дан обзор иммуногенетических исследований клеточных антигенов крупного рогатого скота. Принимая во внимание теорию резус-изоиммунизации и имеющуюся информацию о клеточных антигенах крупного рогатого скота, существует вероятность того, что: 2S-объяснение заболевания человека может служить объяснением заболевания у овса. Один. или группа антигенов крупного рогатого скота может действовать, как считается, что резус-антигены действуют у людей, вызывая отек новорожденного. Анализ для определения антигенного набора у особей в семьях, производящих дефектных телят, покажет, может ли теория изоиммунизации объяснить частоту возникновения отечных ягодиц.Была сформулирована рабочая гипотеза, основанная на следующих предположениях. i) Предполагается, что эритробластоз плода является аналогом врожденной водянки у крупного рогатого скота. i i) Предполагается, что теория резус-изоиммунизации объясняет частоту возникновения эритробластоза плода. i i i) Предполагается, что аналогичная теория изоиммунизации применима к наследованию и взаимодействию клеточных антигенов крупного рогатого скота. А. Формулировка гипотезы. Гипотеза применительно к оазисам в стаде Убисси может быть сформулирована следующим образом.Т # е отец. Коммодор, обладает *? определенный клеточный антиген или группа антигенов, которой не обладают самки отечных телят. Если плод от Commodore является положительным по антигенам, для которых мать отрицательна, а антигены проходят через плаценту и попадают в кровоток матери, стимулируется выработка антител, специфичных для каждого антигена. Эти антитела, содержащиеся в сыворотке матери, могут проходить через плаценту и попадать в сыворотку плода. Антитела плотины вызывают гемолиз эритроцитов или эритробластов плода и инициируют цепь развития, ведущую к проявлению врожденной водянки.Коммодор передаст своему потомству половину наследственного образца, определяющего фенотипическую экспрессию антигенов, для которых он 26 является положительным. Необязательно, чтобы все матки отечных яиц были отрицательными по одним и тем же антигенам. Если кровь Коммодора несовместима с кровью каждой из маток отечных телят, теория, принятая в генетике человека, может быть применима к генетике крупного рогатого скота. B Проверка гипотезы. Гипотеза была проверена путем проведения тестов на гемолиз крови с использованием промытых клеток и сывороток семи имеющихся животных и четырех нормальных кроликов.Была исследована кровь Коммодора, Люси, Офелии, Примулы, Квакера, Регины и отечного овца Примулы. Свежую нормальную кроличью сыворотку использовали в качестве источника комплемента в 1 1 гемолитических тестах. Подробные процедуры проведения гемолитических тестов представлены в приложениях. Коммодор-иммунные сыворотки получали путем многократного внутривенного введения нормальным кроликам суспензий промытых клеток от Commodore. Также были приготовлены суспензии промытых клеток крови каждой коровы. Гемолитические тесты проводили с использованием иммунной сыворотки кроликов отдельно и суспензий промытых клеток каждого человека.Подобные тесты были проведены с использованием так называемой изоиммунной сыворотки каждой коровы и суспензий промытых клеток Commodore. Эти последние тесты служили для проверки веры в то, что плод может унаследовать определенные антигены от своего отца, которые будут стимулировать выработку антител в матери. Изоиммунные и иммунные сыворотки использовали в трех разведениях, и во всех тестах готовили адекватные контроли. Испытания проводились в трех экземплярах и повторялись дважды. Ни одна из так называемых изоиммунных сывороток не вызвала гемолиза клеток Коммодора.Иммунная к Commodore кроличья сыворотка eaoh вызвала гемолиз в l оазах при тестировании с суспензиями промытых клеток коров *. Эти результаты показывают, что клетки Commodore обладают антигенами, которые вызывают выработку антител в сыворотке кроликов. Эти антитела были специфичны по крайней мере к одному антигену в каждой из клеток коровы, показывая, что Commodore имеет по крайней мере один клеточный антиген, общий с каждой коровой. Тесты с использованием сыворотки (антител) каждого из семи животных и клеток (антигенов) шести других животных показали, что сыворотка Луой содержала антитела, которые лизировали клетки Офелии, Квакера и Регины.Ни одна из других сывороток не содержала антител к антигенам клеток других животных. C Обсуждение результатов Хотя использованные тесты не были достаточно обширными, чтобы доказать ошибочность этой гипотезы, может показаться вероятным, что изоиммунная теория неприменима к случаям врожденной водянки. Можно было бы ожидать, что выработка антител, вызванных у матери отцовскими антигенами плода, приведет к накоплению достаточных количеств антител, чтобы вызвать гемолиз клеток коммодора.Это можно было бы ожидать, особенно в оазисе Примулы, поскольку ее сыворотка использовалась в тестах вскоре после рождения ее отечной овцы, когда титр антител, вероятно, был максимальным. Ни одна из сывороток коров не вызвала гемолиза клеток Commodore, следовательно, ни одна сыворотка не содержала антитела к антигенам Commodore. Сыворотка Primrose не вызвала гемолиза клеток ее теленка, показывая, что она не вырабатывала никаких антител, специфичных к антигенам, которые плод унаследовал от Commodore.Возможно, но крайне маловероятно, что Примроуз будет нести в своих клетках те же антигены, которые плод унаследовал от Коммодора. Если гипотеза верна, сыворотка Примулы должна была вызвать лизис как клеток Коммодора, так и клеток ее теленка *. Результаты тестов с использованием сыворотки кроликов, иммунных к Коммодору, последовательно противоречат гипотезе. Однако, учитывая большое количество антигенов крупного рогатого скота и признавая, что все животные имеют сходное наследование, маловероятно, что какие-либо из них будут иметь комплемент антигена, полностью отличный от антигена Commodore.Тесты с использованием клеток и сывороток каждого животного показали, что Люси несет антитела к антигенам трех других коров. Луй, должно быть, был сенсибилизирован антигенами, обычными для каждой из этих коров, но не обнаруженными у других животных. Поскольку ее сыворотка не будет лизировать клетки Коммодора, она не могла быть сенсибилизирована плодом Коммодора. Тщательная проверка гипотезы потребует полного антигенического анализа многих отдельных животных. Такой анализ потребует производства изоиммунных, а также иммунных сывороток.Рабочие из Висконсина ссылаются на оазисы анафилактического шока при производстве изоиммунных сывороток. При работе с ценным племенным поголовьем риск слишком велик. Любое решение было бы очень сложным из-за большого количества клеточных антигенов, обнаруживаемых у крупного рогатого скота. 29 PARI II II Atresia ani в йоркширском стаде свиней Второй наследственный дефект был обнаружен в зарегистрированном стаде свиней * Несмотря на то, что родословные всех животных доступны, сложный способ наследования дефекта не делает возможным генетический анализ без обширного разведения Тесты * Из-за высокой плодовитости и меньшей ценности каждой особи, племенные тесты намного легче проводить со свиньями, чем с другими классами домашнего скота.Однако никаких племенных тестов суо не проводилось. Изучение родословных позволило дать селекционеру определенные рекомендации, которые позволили бы ему избавить стадо свиней от дефотта * Обзор литературы Дефект, наблюдаемый у этих зарегистрированных йоркширских свиней, аналогичен состоянию описанный Берге (1941) как разведение той же породы в Норвегии *. Берге также цитирует работы Кинзельбао (1931) и Картенса и др. (1937), которые описывают возникновение у йоркширских свиней в Германии.Аномалия называется Atresia ani и включена в список летальных и сублетальных признаков, наблюдаемых у свиней Лернером (1944). Райс и Эндрюс (1951) также рассматривают это состояние как смертельное, но не определяют способ наследования дефота. Берге заявляет, что пороки развития у свиноматок и хряков различаются. Типичным для кабанов является закрытый задний проход. Свиньи обычно недолговечны из-за непроходимости прямой кишки. У свиноматок, по-прежнему, анус отсутствует, но обычно в брюшной стенке прямой кишки находится отверстие, сообщающееся с влагалищем, что приводит к типу олоэ.Некоторые из этих свиноматок доживают до зрелости и плодовиты. 39i. Б. История появления Atresia ani в местном стаде. Условия, наблюдаемые в местном стаде свиней, кажутся очень похожими на те, которые описаны Берге. Есть несколько случаев Atresia ani до 1951 г., но они не были подробно зарегистрированы и изучены селекционером. На днях родились три помета, некоторые поросята были аномальными. В одном помете из одиннадцати самцов и пяти самок 1111 были ненормальными. Мать помета была ненормальной, но была повязана с нормальным кабаном, который произвел несколько нормальных пометов.Ранее она уронила несколько ненормальных свиней. Второй помет аномальных свиней (восемь самцов и шесть самок) был получен от импортного хряка и произошел от свиноматки, которая ранее дала двух нормальных пометов. Однако самка этой свиноматки показала ненормальное образование ануса и вульвы. Третья партия аномальных свиней также была от импортного хряка. Из восемнадцати свиней десять были самцами и восемь - самками, четыре из самок были мертворожденными. Свиноматка ранее родила пять пометов нормальных свиней.Импортированный хряк ранее не вязался ни с одной из этих свиноматок. Все три матки ненормальных свиней проходят мимо. тот же кабан. У них тоже нет сводных сестер. Двое бабушек сами были из сводных сестер. Ни в одной из родословных нет инбридинга, по крайней мере, в пяти поколениях. C Анализ родословной В своей работе на племенной станции Aas в Норвегии Берге провел испытание хряков, известных как носители aaslng atresia ani. Оба хряка были явно нормальными, но передавали atresia ani по-разному.У одного из пометов с аномальными поросятами было 21,2% атрезии заднего прохода, а у другого - 14,3%. Процентное соотношение для обоих полов 315 было одинаковым. Две полные сестры, дочери кабана A, с клоакой достигли зрелости и были повязаны с кабаном A, кабаном B и не родственным ему кабаном C «Результаты представлены в таблице III. SIRE SOW I SOW II Процент Нормальные Патологические Нормальные Патологические Атрезия ani A 6 i 15 3 16.0 B 2 3 9 1 26.7 0 4 0 12 0 0,0 Таблица III * Частота встречаемости Atresia ani в двух инбредных пометах и одном помете с внекостными пометами (Berge, 1941 .) Число потомков было недостаточно велико, чтобы оправдать расчет коэффициента сегрегации, хотя было ясно, что моногенный способ наследования не контролировался. Бердж предложил двухфакторную гипотезу, но он заявляет, что невозможно сказать, что если оба фактора доминируют, то один или ни один из факторов в основном доминирует. В заключение он заявляет, что при таком обычном способе наследования покупка племенного стебля была бы невозможна, если бы покупатель требовал, чтобы животные не имели генов, вызывающих пагубный характер.Родословные свиней с Atresia ani в местном стаде представлены на рисунках 10, 11 и 12. D Гипотезы Genetio 1 Простой менделевский рецессивный Поскольку в приведенных случаях все свиньи в каждом помете были аномальными, очень маловероятно, что этот дефект не соответствует норме. контроль простого рецессивного фактора Менделя. Так много сублетальных и летальных признаков, изученных на сельскохозяйственных животных, относятся к этому типу, это может показаться наиболее вероятной гипотезой для проверки. Родословные, исследованные в рамках этой гипотезы, показывают, что два животных, C и Q 32 Рисунок 10.Родословная I X (zox 29e) при вязке с A 8 кобелей / 6 сук \ 2 папоротника. sb \ B (qual 15a) A tresia ani \ / "" A (arr 264e) два нормальных> помета ранее C (qual 19b) A tresia ani 3 3 Рисунок 11, Родословная II N 34 Рисунок 12, Родословная III 10 кобелей 4 суки 4 папоротник, sb Y (hnf 107c) 'ранее имел si red без аномальных свиней B (qual 15a) A tresia ani £ (arr 9b) A tresia ani, аномальное потомство P (HHP) 35 в дополнение к свиньям из трех пометов , являются гомозиготными рецессивными.Следовательно, животные X, I, A, M, B, F, G и R также должны быть гетерозиготными. У родословных I и II, оба родителя синоэ гетерозиготны, можно ожидать, что только одно из четырех потомков будет гомозиготным рецессивным. Если предполагается доминантное, фенотипы должны проявляться в соотношении три нормальных к одному ненормальному. В родословной III, поскольку один родитель является гомозиготным рецессивным, а другой - гетерозиготным, можно ожидать, что будет получено равное количество нормальных и ненормальных потомков. Синоэ ни один нормальный потомок не рождался во всех сорока девяти рождениях, и разумно предположить, что все контролируется более сложным типом интерилантации.2 Доминант с двумя факторами. Если состояние Atresia ani находится под контролем доминантного характера с двумя факторами, что, по мнению Берджа, вероятно, можно объяснить результаты в вышеуказанных родословных. Фенотипическая экспрессия возможна, если генотип - AABB, AABb, AaBB или AaBb. Это ненормальные фенотипы. Экспрессия Phenotypio невозможна, если генотип aabb, aaBb, Aabb, AAbb или aaBB. Это нормальные животные. Типы спариваний, возможные в соответствии с двухфакторной гипотезой, можно обозначить следующим образом.i) Нормальных животных. Существует десять возможных сочетаний нормальных фенотипов. Только в четырех из них можно получить каких-либо аномальных животных. В двух случаях вероятность равна 0,50; в одном оазе вероятность - 0,25; и в одном случае l l потомство будет ненормальным. i i) аномальных животных. Существует шесть возможных вязок аномальных животных. В четырех оазисах один ребенок будет ненормальным. В двух оазисах вероятность ненормального потомства составляет 0,75. Маловероятно, что такой вид спаривания будет осуществлен без экспериментальных исследований.36 i i i) Нормальных и ненормальных животных. Существует двадцать возможных вязок этого типа. В семи оазисах все потомство будет ненормальным. В восьми оазисах вероятность равна 0,50. В двух оазисах вероятность 0,75 и еще в двух оазисах 0,375. В финальных оазисах вероятность получения ненормального потомства составляет 0,25. В родословной I есть вязка нормальная или нормальная. Ни A, ни X генотипически не являются aabb. Если животное A или животное X является Aabb или aaBb, тогда другое не является ни AAbbn, ни aaBB.Если любое из животных имеет Aabb и любое из них - aaBb, то вероятность получения ненормального потомства составляет 0,25. Если либо A, либо X являются Aabb или aaBB, а другой является гомозиготным доминантным по другому локусу, вероятность получения аномальных свиней составляет 1,00. Средневзвешенная вероятность получения аномального потомства - 0,233. В той же родословной вязка B и C является аномальной для нормального спаривания. Независимо от генотипа этих животных всегда есть шанс на рождение ненормального потомства.Синоэ А было нормальным, семь из двадцати возможных вязок могут быть опущены. У остальных видов вероятность получения аномальных животных колеблется от 0,75 до 0,25. Средневзвешенная вероятность - 0,50. В родословной III вязка I с Q также является отклонением от нормального спаривания, но в отличие от вязки B с C, нормального потомства не было. Следовательно, совокупление могло быть любым из двадцати типов в этой группе. Средневзвешенная вероятность получения аномального потомства при таком типе спаривания равна 0.75. B Рекомендации заводчику Следующие рекомендации, сделанные после изучения родословных и литературы по дефотту, были предложены заводчику, чтобы он мог предпринять необходимые шаги для избавления своего стада от дефекта. n i) Немедленно прекратить обслуживание кабана X. Разделите его сейчас или отложите окончательный приговор до тех пор, пока уже выведенные свиноматки не опоросятся. i i) Butoher a l свиноматки, у которых родилось дефектное потомство, и потомство от этих свиноматок. i i i) По возможности воздерживаться от использования самок, близких к вышеуказанным свиноматкам.Например, потомки или любые близкие родственники кабана B. iv) Любые кабаны в servioe сейчас или в будущем должны сами быть свободными от дефекта и выбираться из семей, которые заведомо свободны от этого дефекта. Весьма вероятно, что хряк X является переносчиком возбудителей Atresia ani, поскольку у свиноматок A и M ранее не было аномальных свиней от других хряков. Если хряк Y используется на нормальных свиноматках из семьи &?> 3, не имеющих дефекта, вероятность получения ненормального потомства очень низка.Однако ни одно из его потомков не должно считаться племенным поголовьем. В программе отбора должна быть значительная дискриминация потомков и родственников хряков B и F, потому что они тесно связаны с самками аномальных пометов. Это строгие рекомендации, но для борьбы с этим типом дефектов в племенном поголовье необходимо предпринять довольно решительные шаги. Необходимо будет постоянно наблюдать, и практика выбраковки должна быть очень серьезной в течение нескольких поколений, прежде чем стадо избавится от этого дефекта.ЗАКЛЮЧЕНИЕ Бридинг, который часто называют прикладным инбридингом, позволяет заводчику поддерживать высокую степень родства с предками, высоко ценящими наследственные черты, на которых он основывает свою селекционную практику. Его отбор будет проще и точнее, если он сможет оценить свое поголовье по достоинству анестезии, а также по достоинству каждого человека в стаде. * Продолжение скрещивания увеличит инбридинг у его животных до значительного уровня * Делая больше генных локусов, которые раньше были гетерозиготными гомозиготными, он увеличивает преобладание каждого индивидуума *. В качестве оплаты за повышение репотентности он должен рисковать большей вероятностью возникновения гомозиготных рецессивов.Не один, но большинство гомозиготных красных эссив менее желательны, чем гетерозиготные гомозиготные доминанты. Заводчик, который следует программе линейного разведения, должен ожидать, что рано или поздно он столкнется с наследственным дефектом. Defeots suoh, поскольку отсутствие одного или нескольких клешней росы у крупного рогатого скота, не имеют практического значения, так как это не влияет на продуктивность животного. Но заводчика должны серьезно беспокоить серьезные дефекты, классифицируемые как летальные или сублетальные, которые влияют на репродуктивную эффективность и индивидуальную производительность.Прогрессивный заводчик может получить значительный доход от продажи племенного поголовья. Если его размножающийся корм из-за его гомозиготности доминирует, он будет очень востребован. Если селекция для продуцирования преобладания также допускает экспрессию генов (ранее несущихся в гетерозиготном состоянии), которые контролируют вредные признаки, то сразу же страдает продажная стоимость и спрос на его поголовье. Чтобы избавить свое стадо от дефекта, ему, возможно, придется принести в жертву животных, имеющих высокую племенную ценность за характеристики, имеющие экономическое значение.Для развития особей суох, вероятно, потребуется несколько поколений тщательного отбора и выращивания. Если факты, касающиеся возникновения дефекта, не предаются огласке, а более широкий круг осмотрительных при выборе животных для продажи в качестве племенного поголовья, репутация его стада может поддерживаться, пока дефект будет устранен. Если он продолжит продавать животных, которые могут быть носителями дефекта, рано или поздно гены расщепятся как гомозиготные рецессивы, и дефект будет обнаружен.Между тем, вредные гены могли быть распространены на несколько стад. Неиденое даже летального характера может быть настолько низким, что не имеет практического значения ни для одного селекционера. Максимальная вероятность возникновения дефекта, рассчитанная на основе генетической теории режима наследования, редко достигается в небольших семьях. Установление истинного способа наследования и сегрегации, которая может быть исключена, должно быть доступно заводчику, чтобы позволить ему справиться с проблемой наименее вредным для породы методом и в то же время экономически возможным для него.Дефекты, находящиеся под контролем одиночных генио-пар, могут быть устранены легче, чем дефекты, имеющие более полный генетический контроль. При малоплодородных и менее плодовитых классах домашнего скота устранение даже однофакторного реагента затруднено. Большая часть животных в племенном стаде находится под подозрением при возникновении дефекта. Селекционные тесты для подтверждения генотипов подозреваемых гетерозигот не являются практическими. Заводчик может применять лишь несколько пассивное давление отбора против подозреваемых особей, поскольку экономические характеристики должны получить приоритет отбора, если его предприятие должно оставаться прибыльным.Затраты на замену подозреваемых другими животными равной ценности могут быть непомерно высокими для менее плодовитых классов животноводства. Утилизационная стоимость животных, взятых из стад или стад этих животных, слишком мала, чтобы покрывать расходы на их воспроизводство. 40 Однако в отношении свиней можно предпринять довольно решительные меры, чтобы избавить стадо от наследственного дефекта. Утилизационная стоимость зрелого стебля соответствует закупочной цене незрелых заменителей равной стоимости. Быстрое созревание, высокая плодовитость и большая плодовитость позволяют племенному производителю быстро заменить свое стадо.Чтобы он заменил свое стадо животными, лишенными того же самого или другого дефекта, он должен иметь доступный способ наследования и коэффициенты сегрегации, относящиеся к наследственным порокам свиней. Селекционные тесты и бэкероссы возможны со свиньями, и их должны проводить квалифицированные генетики, которые, таким образом, расширят знания о наследственности свиней, а также помогут практическому селекционеру в его работе. ССЫЛКИ 7f Berge, S., (1941), Journal of Heredity, vol 32, pp 271-374.Cartens, Wenzer and Durr (1937), Zuohtungsk, vol 12, p 205. Crew, Oliver and Boyd, (1947), Генетика в отношении клинической медицины, Эдинбург. Дэвидсон, I. (1945), Журнал Американской медицинской ассоциации, том 127, номер 11, стр. 633-638. Eaton, 0. N., (1937), Journal of Heredity, vol 228, pp 320-326. Фергюсон, Л.К. (1941), Журнал иммунологии, том 40, стр. 213-242. Фергюсон, Стормонт и Ирвин, (1942), Журнал иммунологии, том 44, стр. 147-164. Hadley, F. B. и B. L. Warwick, (1927), журнал Американской ветеринарной медицинской ассоциации, том 70, стр. 492-504.Hutt, F. B., (1934), Cornell Veterinarian, vol? 24, pp 1-25, Imperial Bureau of Animal Genetics, (1931), Quarterly Bulletin. том 2, номер 3, стр 49-50. Ирвин М. Р. (1947), «Иммуногенетика», «Достижения в генетике», том 1, стр. 133–153. Международный конгресс генетиосов, (1939), Труды Седьмого Конгресса, Эдинбург, статья 144, стр. 169. Kinzelbaeh, (1931), Верерб, т. 60, стр. 84. Коркман, (1944), Биологические абстракции, т. 22 , abstract 10625. Land8teiner, K ,, (193l), Science, vol 73, p 403. Largson, E.Л., (1935), Lantbr. Век Хэндл, стр 310-331. Лернер, И. М. (1944). Журнал наследственности, том 35, 219-224. Levine, P., (1947), опубликовано в Advanoes in Genetics, том 1, pI133. Левин П. (1948), цитируется в Advanoes in Genetios vol 1, p 133. Levine, Burnham, Katzin, and Vogel, (1941), American Journal of Obstetrios and Gynecology, vol 42, pp 925-937. Левин, Кацин и Бернхэм (1941), Журнал Американской ассоциации медицинских работников, том 116, стр. 825. Оуэн, Стормонт и Ирвин, (1944), Журнал животных Soienoe, том 3, стр. 315-321.Поттер, £ • Л. и Вилсерви, Дж. К., (1945), журнал Американской медицинской ассоциации, том 127, номер 8, стр 458-459. Ранстром, С. (1947), Журнал Американской ассоциации медицинских работников, том 134, номер 13, стр. 1136. Био, В. А. и Эндрюс, Ф. Нот, (1951), Разведение и улучшение сельскохозяйственных животных, Макгроу-Хилл. Книжная компания Incorporated, Нью-Йорк, стр. 342-343. Стормонт и Камли, (1943), Журнал наследственности, том 34, $ | W35-41. Вайнер, А.С. (1946), Журнал Американской медиальной ассоциации, том 133, номер 13, стр. 1097.Райт, Сьюолл, (1931), Genetios, том 16, стр. 97–159. ПРИЛОЖЕНИЯ i Расчет коэффициента инбридинга Коэффициент инбридинга - это мера степени уменьшения гетерозиготности, которую следует ожидать от определенного количества унсанкин-ous спариваний. Это указывает на степень гетерозиготности всей группы генов у отдельного животного. Коэффициент составляет ровно половину отношения между двумя родителями особи, если сами родители не являются инбредными. Формула имеет следующий вид: F x _ i S [(i) n (1 + F a)], где Fx - коэффициент инбридинга животного X; n - количество поколений в линии, по которой отец и мать связаны между собой; Fa - коэффициент инбридинга общего предка A, от которого отделяется эта линия происхождения; и S - сумма отдельно оцененных результатов.Фаотор 1 плюс Fa исправляет большее сходство, которое можно ожидать между гаметами инбредной особи. B Вычисление коэффициентов вероятности При расчете вероятности получения гомозиготного рецессива от скрещивания двух неизвестных генотипов предполагается, что вероятность того, что генотип родителя будет гетерозиготным, повышается до степени, равной количеству поколений родителя. удаляется из общего предка обоих родителей, который предположительно или известен как гетерозиготный.Если оба родителя известны как гетерозиготы, вероятность гомозиготности потомства составляет 50 фунтов стерлингов; гомозиготности реоэссивности составляет 0,25. Если известно, что общий дедушка или бабушка гетерозиготны, вероятность того, что генотип потомков, удаленных на одно поколение, будет гомозиготным и реаэссивным, увеличивается вдвое до четвертой степени; или одна шестнадцатая. i i C Тест на пригодность Биометристы измеряют качество f i t путем сложения пропорциональных отклонений класса eaoh, получая константу, известную как ohi-squared, и это определяет вероятность того, что такое большое или большее отклонение произойдет случайно.Хи-квадрат получается возведением в квадрат отклонения каждого оласса от теоретического ожидания этого класса, делением его на теоретическое ожидание для этого класса и сложением результатов одного класса. Из подготовленных таблиц можно получить для данного значения ohi-square и данного числа классов значение F, которое измеряет вероятность того, что отклонение, большое или большее, произойдет случайно, другими словами, процент случаи, в которых можно ожидать отклонения случайно.D Процедуры для серологических исследований Подготовка иммунной сыворотки Источник сбора антигена 6 т Материалы для образцов крови * вата, спирт, подкожная игла, прикрепленная к резиновой пробирке, 200 мл стерильная колба с пробкой, 76 мл раствора изотонио цитрата (2 доллара цитрата натрия - 0,5 $ хлорид натрия), пробирка на 50 мл с пробкой, содержащая стеклянные шарики. Метод: капля крови из яремной вены с помощью иглы для подкожных инъекций и резиновой трубки. Приблизительно 75 мл крови помещается в колбу на 200 мл, содержащую 75 мл изотонического раствора цитрата.Колбу закрывают пробкой и охлаждают. В колбу на 50 мл набирается примерно 25 мл крови. Колбу быстро закрывают и встряхивают в течение пяти минут для дефибринирования образца крови. Дефибринированная кровь используется для приготовления клеточных суспензий. Его необходимо нагреть до 56 ° C в течение получаса, чтобы разрушить комплемент. iii Приготовление суспензионных материалов эритроцитов * Один раствор желатинового лука, 50 мл физиологического раствора (0,85%), стерильный 15 мл пипет, 4 • 20 мл стерильные градуированные центрифужные пробирки, стерильная градуировка, 50 мл стерильные колба с пробкой, 60 мл цитратной крови.Метод: поместите 5 мл отобранной пробы крови в каждую из четырех центрифужных пробирок. Центрифуга до десяти минут. Слейте или удалите пипеткой цитратно-сывороточную смесь. Добавьте 5 мл раствора желатина Lookes в каждую пробирку, тщательно встряхните и повторно центрифугируйте в течение десяти минут. Повторите стирку четыре раза! раз. Перенести 1 мкл клеток в одну пробирку, упаковать клетки путем отжимания, записать объем упакованных клеток. Перенесите клетки в стерильную колбу на 50 мл, используя равный объем стерильного физиологического раствора. Место 3.5 мл суспензии 50 $ в каждой из девяти флаконов с резиновыми пробками. Инокуляция RabVf ts Инокуляции Материалы: три зрелых нормальных здоровых кролика, бритва, ватная полоска, спирт, стерильный шприц для подкожных инъекций 5 мл, суспензия эритроцитов, 3 стерильные иглы для подкожных инъекций (Ho. 22) • Методы: шерсть над краевой веной выбрит сухим способом. Область стерилизована спиртом. Шприц наполняется воздухом и один мл вводится в вену. Каждому кролику вводят внутривенные инъекции три раза в неделю в течение трех недель по одному (1) мл 50% суспензии.Взятие иммунизированной крови Кролика держат в кровоточащей ложе на спине, голова его находится в хорошо закругленной выемке, а четыре лапы, удерживаемые ремнями, затянуты, чтобы вытянуть конечности до полного разгибания. Кровь забирается методом пункции оардиао. Кровь сливают в стерильные пробирки с ватными пробками и дают ей свернуться. Иммунная сыворотка забирается стерильной пипеткой. iv Сыворотка комплемента может быть получена с использованием того же метода, что и у нормальных здоровых кроликов. Кровь следует охладить, как только она засеяна, а сыворотку следует использовать вскоре после взятия крови.Тестовые суспензии промытых клеток Образцы крови отбирают в дефибринирующие колбы, как описано выше, 25 мл крови является достаточно большим образцом для снабжения клеток 2,5% -ными суспензиями, используемыми в тестах. В то же время 40 мл крови набирается в стерильные пробирки, снабженные ватными пробками, в которых ей дают свернуться перед охлаждением. Примечание: для обеспечения строгой стерильности каждая трубка снабжена иглой для подкожных инъекций, прикрепленной пластиковой трубкой. Собранное оборудование подвергается автолаживанию при 15 фунтах в течение тридцати минут и не разбирается до тех пор, пока сыворотка не будет извлечена стерильной пипеткой.Приготовление 2,5-кратных суспензий промытых клеток происходит параллельно с приготовлением 50-кратных суспензий. Гемолитические тесты Разведения иммунных сывороток Материалы: неразбавленные кроличьи сыворотки во флаконах на 25 мл, пробирки на 9–20 мл, физиологический раствор, пипетки на 5–10 мл. • Метод: поместите пять мл сыворотки A в пробирку I и в пробирку II. Добавьте 10 мл физиологического раствора в пробирку II. Удалите 5 мл раствора из пробирки II и поместите в пробирку III. Добавьте 10 мл физиологического раствора в пробирку III. Пробирки Пробирка Eaoh должна содержать: - 1 каплю 2 шт.5% суспензии промытых клеток - 2 капли неразбавленной или разбавленной сыворотки от одного иммунизированного кролика - 1 капля сыворотки комплемента. Контрольные пробирки и повторные тесты следует готовить в тех же условиях.
2 Отечные VF 22/11/49 Коммодор Квакер 7.1 Отечные VI F 8/1/50 Коммодор Регина 9 * 8 Отечные, умерли при рождении от удушья VII F 7/4/50 Коммодор Первоцвет 16.4 Мертворожденный отечный VIII M 4/9/60 Коммодор Рамона 17.3 Отечный, живой, активный IX F 31/12/50 Commodore Rennle X M 15/1/51 Commodore Regina 7.8 Прервано через шесть месяцев. Узкий отек, гипокапли 9,8 Прозрачная отечная жидкость в подкожно-аневидной фасции - газообразный отек. IC. - Коэффициент инбридинга (per oent) Ботэ: Галахад, а не Морвен, считается отцом Джесси. Оба производителя обслуживали корову во время одной и той же течки. Таблица Ix. Данные и записи. Выявление отечных тельцов, рожденных в стаде Убиссей *, общих предков. Эти диаграммы представлены на рисунках с 10 по 18 включительно.Коэффициенты инбридинга рассчитывались с помощью стрелочных диаграмм; и они вместе с другими данными и записями, касающимися каждого отечного теленка, представлены в таблице I. Записи об отелах, относящиеся к моменту основания стада, были изучены и выявили следующую информацию. От 146 самок родилось 539 телят. Было восемь пар близнецов. Имена 12 быков и количество рожденных от каждого телят представлены в басне II. КОЛИЧЕСТВО СИРОВЫХ ТЕЛЕБ Королевский капеллан Auohenbrain -130252- 64 Grandview Man 0 * War -159659- i «Gr and view Mainspring -165506- 39 Ubyssey Royal Gaiety -165532- 18 Fintry Morven -178672- 37 Dbyssey Gaiety Sir Galahad -202516- 53 Губернатор Убисси Розалинды -202521- 14 Убисси Морвен Гладгоуэн - 218123- 7 Адмирал Убисси Розалинда - 226521- 93 Спитфайр губернатора Убисси -246791- 38 Белая кокарда Убисси -269047- 66 Используется в коммодоре адмирала Убисси -307558- 79 501 Стол литературный Стадо и количество телят, отпущенных Eaoh.B Формулировка гипотезы 1. Основные предположения. Для целей анализа было предположено, что экспрессия pheno-17 typio, наблюдаемая как отек у новорожденных яйцеклеток, возможна только в генотипах, несущих оба рецессивных гена. То есть в популяции возможны три генотипа: гомозиготный доминантный (AA), гетерозиготный (Aa) и гомозиготный рецессивный (aa). Поскольку наблюдались только два фенотипа, а именно нормальный и отечный, мы должны предполагать полное доминирование.Генотипы AA и Aa, имеющие одинаковую экспрессию фенотипа, нормальные; и генотип аа - фенотипическая экспрессия, отечный. Изучение стрелочных диаграмм, составленных на основе родословных отечных телят, а также с учетом практики разведения и результирующих линий происхождения, наиболее часто встречающихся в стаде, показывает, что некоторые предки этих телят подозреваются в гетерозиготности по признаку. тер. В популяции нормальных животных возможны только три типа вязок, а именно.i) гомозиготный доминант Z гомозиготный доминант i i) гомозиготный доминант Z гетерозиготный i i i) гетерозиготный Z гетерозиготный Частота каждого типа спаривания в случайно спаривающейся популяции будет функцией частоты гена. Менделирующая сегрегация от спариваний этих двух генотипов будет следующей: i) Родители AA X AA Гаметы все AF x все AA ii) Родители AA Z Aa Гаметы все A £ A, £ a Fx '£ AA, £ Aa iii) Родители Aa Z Aa Gametes g A, £ a £ A, £ a Fx i AA, £ Aa, £ aa Iff Только в экспериментальных условиях спаривания с участием гомозиготной рецессивной особи будут вероятными.2 Гетерозигота8 в родословных Таким образом, получить гомозиготного рецессивного индивида можно только при скрещивании двух гетерозигот. При скрещивании двух известных гетерозигот только одно из каждых четырех потомков оказывается гомозиготным реоессивным. Вероятность получения гомозиготного рецессивного потомства от скрещивания двух животных неизвестного генотипа, случайно выбранных из популяции, крайне мала. Для увеличения вероятности возникновения какого-либо события до уровней, подходящих для практических экспериментов по разведению, необходимо вязать животных известной родословной и генотипа.Спаривания Sinoe al в стаде Ubyssey были нормального фенотипа, те спаривания, которые дали отечных телят, были вязками двух гетерозиготных животных. Самцы и самки любых отечных овец были гетерозиготами. Имена этих одиннадцати известных гетерозигот включены в Таблицу I. Кроме того, изучая родословные этих животных, можно предположить, что некоторые другие предки отечных овец, в достаточных пределах вероятности, также были гетерозиготами. Линия происхождения от капеллана к Гейети, Галахаду и Адмиралу является общей для всех отечных овалов.из родословных (VIII и IX) один или несколько из этих производителей являются общим предком. Поэтому / возможно, что пять производителей этой линии происхождения были гетерозиготными. Поскольку в одной родословной, кроме VIII и IX, есть по крайней мере две линии происхождения от по крайней мере одного из этих производителей, единственная рецессивная гипотеза приемлема. Чтобы учесть отечные овцы VIII родословной или IS i t, необходимо признать гетерозиготными животных, не являющихся потомками любого из этих пяти производителей.Хотя Адмирал И.С. гетерозиготен и, предположив, что его отец также был гетерозиготным, генотип его матери, Розалинды, можно предположить гетерозиготным с вероятностью половинной. Предполагая, что Розалинда была гетерозиготной, можно объяснить появление отечных овалов у породистой VIII или IX. Розалинда является общим предком во всех, кроме родословной I. Расчет вероятности передачи рецессивных генов по обеим линиям потомков в каждой родословной от одного или нескольких гетерозиготных (предполагаемых) предков служит для проверки гипотезы и позволяет тест на соответствие.Гипотеза, сформулированная на основе изучения родословных отечных яйцеклеток, может быть изложена следующим образом: 1) предполагается, что персонаж находится под контролем одной пары джиннов. i i) предполагалось полное доминирование. i i i) взял на себя линию desoent от капеллана до Гейети, до адмирала и отечного оленя; или от адмирала до коммодора, до отеков. Предполагается, что все эти производители были гетерозиготными. iv) предположил, что Розалинда была гетерозиготной. C Проверка гипотезы Родословные всех животных, рожденных в стаде, были объединены, чтобы определить, у каких телят был капеллан, веселость, галахад или адмирал в качестве общего предка.Существует 153 родословных, в которых один из этих производителей фигурирует как общий предок. Капеллан - общий предок в 123 родословных; Веселость в 13 родословных; Галахад в 26 родословных; и Адмирал появляется в 27 родословных. Существует 37 родословных, в которых двое или более этих быков имеют общих предков. Стрелочные диаграммы были построены на основе родословных каждого потомства и рассчитана вероятность того, что каждое потомство будет гомозиготным реоэссивным. 20, 1 Вероятности гомозиготных рецессивов. Средние вероятности получения отечных яйцеклеток вместе с предположениями, на основании которых они были рассчитаны, представлены в виде схемы.i) Предполагая, что капелланом был Аа, игнорируя, что у овалов есть другие общие предки, игнорируя то, что Гейети, Галахад и адмирал были Аа; средняя вероятность - 0,0132. - предполагая, что Гейети, Галахад и Адмирал были Аа; средняя вероятность - 0,0526. (на основе 123 родословных) i i) Предполагая, что Веселость была Аа, игнорируя других общих предков овец: - игнорируя Адмирала, Галахада и Коммодора были Аа; средняя вероятность - 0,0189. - предполагая, что Галахад, адмирал и коммодор были Аа; средняя вероятность - 0.0697. (на основе 13 родословных) i i i) Предполагая, что Галахад - Аа, игнорируя, что у овец есть другие предки oommon: - игнорируя, что Адмирал и Коммодор были Aa; средняя вероятность - 0,0396. - предполагая, что адмирал и коммодор были Аа; средняя вероятность - 0,0865. (на основе 26 родословных) iv) Предполагая, что Адмирал - это Аа, игнорируя, что у овец есть другой предок oommon - игнорируя, что Коммодор - это Аа; средняя вероятность - 0,0549. - предполагая, что Коммодор - Аа; средняя вероятность - 0,0914.(на основе 27 родословных) 7) Предположим, что все производители, капеллан, веселость, галахад, адмирал и коммодор были Аа. (Это естественно следует из основного предположения о том, что линия происхождения от капеллана была общей для всех телят Коммодором.) Средняя вероятность - 0,0772. (на основе 146 родословных) vi) Предполагается, что все производители. Капеллан, Гейети, Галахад, Адмирал и Коммодор были Аа; предполагая также, что Розалинда была Аа; средняя вероятность - 0,0853. (на основе 91 родословной) 2. Степень соответствия. К данным, полученным в результате анализа родословных, применялся критерий «ohi-квадрат (% **)» на «степень соответствия».Из формулы: где f 0 - наблюдаемая частота, а f - теоретическая частота, можно получить значение хи-квадрат. С помощью таблицы ohi-squar-ed (Snedeoor pi90, 1949) можно оценить добротность f i t. В таблицах ohi-squared значения указывают на вероятность получения f i t исключительно по случайности, равную или более низкую, чем полученная расчетным путем. Если эта вероятность мала, вероятность того, что расхождения между наблюдаемыми и рассчитанными данными являются случайными, также мала.Если это так, то проверка гипотезы, вероятно, с честью применима к решению исследуемой проблемы. Средняя вероятность получения отечного оленя в любой из 146 проанализированных родословных составляет 0,0853. На основе этой гипотезы можно было бы исключить, что из 153 родившихся телят 13 телят будут отечными, фактическая частота отечных телят в анализируемых родословных составляет десять из 153 или выражается как вероятность 0,0653. По этим двум частотам можно рассчитать значение квадрата охи.Вводя таблицы 22 хи-квадрат при одной степени свободы (на одну меньше, чем количество классов), можно получить значение P путем интерполяции. Когда ohi-квадрат равно 0,00469, P составляет 0,9325 при одной степени свободы. Другими словами, примерно в 93,25% подобных оазисов будут обнаружены большие или большие отклонения от теоретической вероятности, и нынешняя популяция не соответствует гипотезе. D Несоответствие результатов Хотя наблюдения и данные, полученные из этой довольно большой выборки, подтверждают, что рабочая гипотеза была изначально сформулирована, гипотеза не подтверждается.Больше доказательств, подтверждающих гипотезу, могло быть получено путем тестовых спариваний и обратных оросий, если было возможно поднять гомозиготных рецессивных животных до репродуктивной зрелости. Однако ведение полных учетных записей об отелах и точных родословных, как это требуется для зарегистрированного овсянки, позволит провести дальнейший анализ для проверки гипотезы. Типы спариваний, возможных в популяции нормальных особей, уже были обозначены. Если в популяции есть отечные особи, возможны три схожих типа вязок.Если бы скрещивание двух гомозиготных рецессивов было возможно, гипотеза подверглась бы абсолютному тесту, и можно было бы получить только отечное потомство синоэ. если только потомки двух гомозигот сами не являются гомозиготами, персонаж не находится под контролем одной пары джиннов. В настоящее время в стаде Ubyssey всего шесть животных с доказанным генотипом. Это отец Коммодор и пять маток отечных овец, оставшихся в стаде. Коровы, с которыми вязался Commodore aan, являются либо гомозиготными доминантными, либо гетерозиготными.Потомки Розалинды и особенно потомки Адмирала с большей вероятностью будут гетерозиготными, чем гомозиготными доминантами. Спаривание Commodore с боковыми родственниками увеличивает вероятность получения отечных яйцеклеток. Вероятность появления гомозиготного рецессива в каждом случае должна быть не менее 0,25. Если самка отечного теленка от Commodore родится живой и в зрелом возрасте будет фертильной 23, она может быть повязана со своим отцом, и в этом случае вероятность получения отечного теленка будет равна 0.50. Такое спаривание представляет только генетический интерес. Обычно такую самку не вырастили бы. Однако ее можно использовать для тестирования других быков неизвестного генотипа. Такие тестовые скрещивания вряд ли будут оправданы. Из-за долгого периода вынашивания и небольшого количества потомства для подтверждения генотипа одного быка потребуется несколько лет. Число производителей, которых можно было бы испытать на скрещивание с одной самкой, очень ограничено. быть 0.50. Еще один метод проверки гипотезы, который вряд ли станет доступным, - это скрещивание двух отечных особей. Вероятность получения двух телят противоположного пола, у которых совпадают периоды зексуальной зрелости и f e r t i l i t y, очень мала. Было высказано предположение, что состояние, наблюдаемое у новорожденных телят и названное врожденной водянкой, связано с наличием одной пары рецессивных аллелей. Также предполагалось, что существует полное доминаное, что один рецессивный аллель полностью затмевается фенотипическим выражением доминанты all e l.Затем предполагается, что состояние жидкостного баланса неполовозрелого крупного рогатого скота находится под контролем одной пары джиннов. Если присутствуют один или оба доминантных аллеля, индивидуум является нормальным фенотипом. Если присутствуют оба рецессивных аллеля, человек отечен. Баланс жидкости в организме должен, по ряду факторов, влияющих на баланс, находиться под комплексным контролем; но из-за хрупкого характера этого баланса он может быть нарушен одним простым изменением физиологических процессов, которые контролируют накопление и распределение жидкостей организма.Если хотя бы один шаг в одном из этих процессов зависит от присутствия 8fc и фенотипической экспрессии по крайней мере одного доминантного гена в аллельной паре, отсутствие обоих доминантных генов предотвратит инициирование серии событий, необходимых для производства система контроля водного баланса организма. Хотя анализ родословных показал, что наследственность врожденной водянки с большой вероятностью находится под контролем одного рецессивного гена, может показаться, что широкие вариации в проявлении противоречат этому предположению и скорее указывают на сложный способ наследования.Поскольку у каждого индивида гены оказывают свое раздельное влияние на эквивалентных стадиях развития, можно ожидать, что одна пара джиннов вызовет такой же синдром у всех индивидов, обладающих им. Однако внутриматочная среда может быть достаточно разнообразной, чтобы вызвать различную степень тяжести дефекта, наблюдаемого при рождении. Если бы группа сцепления или несколько генов частично или полностью отвечали за контроль жидкостного баланса, возможно, слабым местом в этой группе было то, что было бы унаследовано, и эта слабость могла бы влиять на разные гены в пределах группа в каждом отдельном человеке.Снова предполагая, что каждый этап физиологических процессов находится под контролем отдельного гена, этот этап процесса, который будет удален, будет зависеть от того, на какой ген повлияла наследственная слабость. Формулировка и проверка иммуногенетической гипотезы Обзор литературы по врожденным заболеваниям младенцев делает очевидным сходство между проявлениями эритробластоза плода у людей и врожденной водянкой крупного рогатого скота. Теория изоиммунизации R h e 8 U 8, принятая многими как объяснение болезни плода эритробластоз, уже была изложена.Дан обзор иммуногенетических исследований клеточных антигенов крупного рогатого скота. Принимая во внимание теорию резус-изоиммунизации и имеющуюся информацию о клеточных антигенах крупного рогатого скота, существует вероятность того, что: 2S-объяснение заболевания человека может служить объяснением заболевания у овса. Один. или группа антигенов крупного рогатого скота может действовать, как считается, что резус-антигены действуют у людей, вызывая отек новорожденного. Анализ для определения антигенного набора у особей в семьях, производящих дефектных телят, покажет, может ли теория изоиммунизации объяснить частоту возникновения отечных ягодиц.Была сформулирована рабочая гипотеза, основанная на следующих предположениях. i) Предполагается, что эритробластоз плода является аналогом врожденной водянки у крупного рогатого скота. i i) Предполагается, что теория резус-изоиммунизации объясняет частоту возникновения эритробластоза плода. i i i) Предполагается, что аналогичная теория изоиммунизации применима к наследованию и взаимодействию клеточных антигенов крупного рогатого скота. А. Формулировка гипотезы. Гипотеза применительно к оазисам в стаде Убисси может быть сформулирована следующим образом.Т # е отец. Коммодор, обладает *? определенный клеточный антиген или группа антигенов, которой не обладают самки отечных телят. Если плод от Commodore является положительным по антигенам, для которых мать отрицательна, а антигены проходят через плаценту и попадают в кровоток матери, стимулируется выработка антител, специфичных для каждого антигена. Эти антитела, содержащиеся в сыворотке матери, могут проходить через плаценту и попадать в сыворотку плода. Антитела плотины вызывают гемолиз эритроцитов или эритробластов плода и инициируют цепь развития, ведущую к проявлению врожденной водянки.Коммодор передаст своему потомству половину наследственного образца, определяющего фенотипическую экспрессию антигенов, для которых он 26 является положительным. Необязательно, чтобы все матки отечных яиц были отрицательными по одним и тем же антигенам. Если кровь Коммодора несовместима с кровью каждой из маток отечных телят, теория, принятая в генетике человека, может быть применима к генетике крупного рогатого скота. B Проверка гипотезы. Гипотеза была проверена путем проведения тестов на гемолиз крови с использованием промытых клеток и сывороток семи имеющихся животных и четырех нормальных кроликов.Была исследована кровь Коммодора, Люси, Офелии, Примулы, Квакера, Регины и отечного овца Примулы. Свежую нормальную кроличью сыворотку использовали в качестве источника комплемента в 1 1 гемолитических тестах. Подробные процедуры проведения гемолитических тестов представлены в приложениях. Коммодор-иммунные сыворотки получали путем многократного внутривенного введения нормальным кроликам суспензий промытых клеток от Commodore. Также были приготовлены суспензии промытых клеток крови каждой коровы. Гемолитические тесты проводили с использованием иммунной сыворотки кроликов отдельно и суспензий промытых клеток каждого человека.Подобные тесты были проведены с использованием так называемой изоиммунной сыворотки каждой коровы и суспензий промытых клеток Commodore. Эти последние тесты служили для проверки веры в то, что плод может унаследовать определенные антигены от своего отца, которые будут стимулировать выработку антител в матери. Изоиммунные и иммунные сыворотки использовали в трех разведениях, и во всех тестах готовили адекватные контроли. Испытания проводились в трех экземплярах и повторялись дважды. Ни одна из так называемых изоиммунных сывороток не вызвала гемолиза клеток Коммодора.Иммунная к Commodore кроличья сыворотка eaoh вызвала гемолиз в l оазах при тестировании с суспензиями промытых клеток коров *. Эти результаты показывают, что клетки Commodore обладают антигенами, которые вызывают выработку антител в сыворотке кроликов. Эти антитела были специфичны по крайней мере к одному антигену в каждой из клеток коровы, показывая, что Commodore имеет по крайней мере один клеточный антиген, общий с каждой коровой. Тесты с использованием сыворотки (антител) каждого из семи животных и клеток (антигенов) шести других животных показали, что сыворотка Луой содержала антитела, которые лизировали клетки Офелии, Квакера и Регины.Ни одна из других сывороток не содержала антител к антигенам клеток других животных. C Обсуждение результатов Хотя использованные тесты не были достаточно обширными, чтобы доказать ошибочность этой гипотезы, может показаться вероятным, что изоиммунная теория неприменима к случаям врожденной водянки. Можно было бы ожидать, что выработка антител, вызванных у матери отцовскими антигенами плода, приведет к накоплению достаточных количеств антител, чтобы вызвать гемолиз клеток коммодора.Это можно было бы ожидать, особенно в оазисе Примулы, поскольку ее сыворотка использовалась в тестах вскоре после рождения ее отечной овцы, когда титр антител, вероятно, был максимальным. Ни одна из сывороток коров не вызвала гемолиза клеток Commodore, следовательно, ни одна сыворотка не содержала антитела к антигенам Commodore. Сыворотка Primrose не вызвала гемолиза клеток ее теленка, показывая, что она не вырабатывала никаких антител, специфичных к антигенам, которые плод унаследовал от Commodore.Возможно, но крайне маловероятно, что Примроуз будет нести в своих клетках те же антигены, которые плод унаследовал от Коммодора. Если гипотеза верна, сыворотка Примулы должна была вызвать лизис как клеток Коммодора, так и клеток ее теленка *. Результаты тестов с использованием сыворотки кроликов, иммунных к Коммодору, последовательно противоречат гипотезе. Однако, учитывая большое количество антигенов крупного рогатого скота и признавая, что все животные имеют сходное наследование, маловероятно, что какие-либо из них будут иметь комплемент антигена, полностью отличный от антигена Commodore.Тесты с использованием клеток и сывороток каждого животного показали, что Люси несет антитела к антигенам трех других коров. Луй, должно быть, был сенсибилизирован антигенами, обычными для каждой из этих коров, но не обнаруженными у других животных. Поскольку ее сыворотка не будет лизировать клетки Коммодора, она не могла быть сенсибилизирована плодом Коммодора. Тщательная проверка гипотезы потребует полного антигенического анализа многих отдельных животных. Такой анализ потребует производства изоиммунных, а также иммунных сывороток.Рабочие из Висконсина ссылаются на оазисы анафилактического шока при производстве изоиммунных сывороток. При работе с ценным племенным поголовьем риск слишком велик. Любое решение было бы очень сложным из-за большого количества клеточных антигенов, обнаруживаемых у крупного рогатого скота. 29 PARI II II Atresia ani в йоркширском стаде свиней Второй наследственный дефект был обнаружен в зарегистрированном стаде свиней * Несмотря на то, что родословные всех животных доступны, сложный способ наследования дефекта не делает возможным генетический анализ без обширного разведения Тесты * Из-за высокой плодовитости и меньшей ценности каждой особи, племенные тесты намного легче проводить со свиньями, чем с другими классами домашнего скота.Однако никаких племенных тестов суо не проводилось. Изучение родословных позволило дать селекционеру определенные рекомендации, которые позволили бы ему избавить стадо свиней от дефотта * Обзор литературы Дефект, наблюдаемый у этих зарегистрированных йоркширских свиней, аналогичен состоянию описанный Берге (1941) как разведение той же породы в Норвегии *. Берге также цитирует работы Кинзельбао (1931) и Картенса и др. (1937), которые описывают возникновение у йоркширских свиней в Германии.Аномалия называется Atresia ani и включена в список летальных и сублетальных признаков, наблюдаемых у свиней Лернером (1944). Райс и Эндрюс (1951) также рассматривают это состояние как смертельное, но не определяют способ наследования дефота. Берге заявляет, что пороки развития у свиноматок и хряков различаются. Типичным для кабанов является закрытый задний проход. Свиньи обычно недолговечны из-за непроходимости прямой кишки. У свиноматок, по-прежнему, анус отсутствует, но обычно в брюшной стенке прямой кишки находится отверстие, сообщающееся с влагалищем, что приводит к типу олоэ.Некоторые из этих свиноматок доживают до зрелости и плодовиты. 39i. Б. История появления Atresia ani в местном стаде. Условия, наблюдаемые в местном стаде свиней, кажутся очень похожими на те, которые описаны Берге. Есть несколько случаев Atresia ani до 1951 г., но они не были подробно зарегистрированы и изучены селекционером. На днях родились три помета, некоторые поросята были аномальными. В одном помете из одиннадцати самцов и пяти самок 1111 были ненормальными. Мать помета была ненормальной, но была повязана с нормальным кабаном, который произвел несколько нормальных пометов.Ранее она уронила несколько ненормальных свиней. Второй помет аномальных свиней (восемь самцов и шесть самок) был получен от импортного хряка и произошел от свиноматки, которая ранее дала двух нормальных пометов. Однако самка этой свиноматки показала ненормальное образование ануса и вульвы. Третья партия аномальных свиней также была от импортного хряка. Из восемнадцати свиней десять были самцами и восемь - самками, четыре из самок были мертворожденными. Свиноматка ранее родила пять пометов нормальных свиней.Импортированный хряк ранее не вязался ни с одной из этих свиноматок. Все три матки ненормальных свиней проходят мимо. тот же кабан. У них тоже нет сводных сестер. Двое бабушек сами были из сводных сестер. Ни в одной из родословных нет инбридинга, по крайней мере, в пяти поколениях. C Анализ родословной В своей работе на племенной станции Aas в Норвегии Берге провел испытание хряков, известных как носители aaslng atresia ani. Оба хряка были явно нормальными, но передавали atresia ani по-разному.У одного из пометов с аномальными поросятами было 21,2% атрезии заднего прохода, а у другого - 14,3%. Процентное соотношение для обоих полов 315 было одинаковым. Две полные сестры, дочери кабана A, с клоакой достигли зрелости и были повязаны с кабаном A, кабаном B и не родственным ему кабаном C «Результаты представлены в таблице III. SIRE SOW I SOW II Процент Нормальные Патологические Нормальные Патологические Атрезия ani A 6 i 15 3 16.0 B 2 3 9 1 26.7 0 4 0 12 0 0,0 Таблица III * Частота встречаемости Atresia ani в двух инбредных пометах и одном помете с внекостными пометами (Berge, 1941 .) Число потомков было недостаточно велико, чтобы оправдать расчет коэффициента сегрегации, хотя было ясно, что моногенный способ наследования не контролировался. Бердж предложил двухфакторную гипотезу, но он заявляет, что невозможно сказать, что если оба фактора доминируют, то один или ни один из факторов в основном доминирует. В заключение он заявляет, что при таком обычном способе наследования покупка племенного стебля была бы невозможна, если бы покупатель требовал, чтобы животные не имели генов, вызывающих пагубный характер.Родословные свиней с Atresia ani в местном стаде представлены на рисунках 10, 11 и 12. D Гипотезы Genetio 1 Простой менделевский рецессивный Поскольку в приведенных случаях все свиньи в каждом помете были аномальными, очень маловероятно, что этот дефект не соответствует норме. контроль простого рецессивного фактора Менделя. Так много сублетальных и летальных признаков, изученных на сельскохозяйственных животных, относятся к этому типу, это может показаться наиболее вероятной гипотезой для проверки. Родословные, исследованные в рамках этой гипотезы, показывают, что два животных, C и Q 32 Рисунок 10.Родословная I X (zox 29e) при вязке с A 8 кобелей / 6 сук \ 2 папоротника. sb \ B (qual 15a) A tresia ani \ / "" A (arr 264e) два нормальных> помета ранее C (qual 19b) A tresia ani 3 3 Рисунок 11, Родословная II N 34 Рисунок 12, Родословная III 10 кобелей 4 суки 4 папоротник, sb Y (hnf 107c) 'ранее имел si red без аномальных свиней B (qual 15a) A tresia ani £ (arr 9b) A tresia ani, аномальное потомство P (HHP) 35 в дополнение к свиньям из трех пометов , являются гомозиготными рецессивными.Следовательно, животные X, I, A, M, B, F, G и R также должны быть гетерозиготными. У родословных I и II, оба родителя синоэ гетерозиготны, можно ожидать, что только одно из четырех потомков будет гомозиготным рецессивным. Если предполагается доминантное, фенотипы должны проявляться в соотношении три нормальных к одному ненормальному. В родословной III, поскольку один родитель является гомозиготным рецессивным, а другой - гетерозиготным, можно ожидать, что будет получено равное количество нормальных и ненормальных потомков. Синоэ ни один нормальный потомок не рождался во всех сорока девяти рождениях, и разумно предположить, что все контролируется более сложным типом интерилантации.2 Доминант с двумя факторами. Если состояние Atresia ani находится под контролем доминантного характера с двумя факторами, что, по мнению Берджа, вероятно, можно объяснить результаты в вышеуказанных родословных. Фенотипическая экспрессия возможна, если генотип - AABB, AABb, AaBB или AaBb. Это ненормальные фенотипы. Экспрессия Phenotypio невозможна, если генотип aabb, aaBb, Aabb, AAbb или aaBB. Это нормальные животные. Типы спариваний, возможные в соответствии с двухфакторной гипотезой, можно обозначить следующим образом.i) Нормальных животных. Существует десять возможных сочетаний нормальных фенотипов. Только в четырех из них можно получить каких-либо аномальных животных. В двух случаях вероятность равна 0,50; в одном оазе вероятность - 0,25; и в одном случае l l потомство будет ненормальным. i i) аномальных животных. Существует шесть возможных вязок аномальных животных. В четырех оазисах один ребенок будет ненормальным. В двух оазисах вероятность ненормального потомства составляет 0,75. Маловероятно, что такой вид спаривания будет осуществлен без экспериментальных исследований.36 i i i) Нормальных и ненормальных животных. Существует двадцать возможных вязок этого типа. В семи оазисах все потомство будет ненормальным. В восьми оазисах вероятность равна 0,50. В двух оазисах вероятность 0,75 и еще в двух оазисах 0,375. В финальных оазисах вероятность получения ненормального потомства составляет 0,25. В родословной I есть вязка нормальная или нормальная. Ни A, ни X генотипически не являются aabb. Если животное A или животное X является Aabb или aaBb, тогда другое не является ни AAbbn, ни aaBB.Если любое из животных имеет Aabb и любое из них - aaBb, то вероятность получения ненормального потомства составляет 0,25. Если либо A, либо X являются Aabb или aaBB, а другой является гомозиготным доминантным по другому локусу, вероятность получения аномальных свиней составляет 1,00. Средневзвешенная вероятность получения аномального потомства - 0,233. В той же родословной вязка B и C является аномальной для нормального спаривания. Независимо от генотипа этих животных всегда есть шанс на рождение ненормального потомства.Синоэ А было нормальным, семь из двадцати возможных вязок могут быть опущены. У остальных видов вероятность получения аномальных животных колеблется от 0,75 до 0,25. Средневзвешенная вероятность - 0,50. В родословной III вязка I с Q также является отклонением от нормального спаривания, но в отличие от вязки B с C, нормального потомства не было. Следовательно, совокупление могло быть любым из двадцати типов в этой группе. Средневзвешенная вероятность получения аномального потомства при таком типе спаривания равна 0.75. B Рекомендации заводчику Следующие рекомендации, сделанные после изучения родословных и литературы по дефотту, были предложены заводчику, чтобы он мог предпринять необходимые шаги для избавления своего стада от дефекта. n i) Немедленно прекратить обслуживание кабана X. Разделите его сейчас или отложите окончательный приговор до тех пор, пока уже выведенные свиноматки не опоросятся. i i) Butoher a l свиноматки, у которых родилось дефектное потомство, и потомство от этих свиноматок. i i i) По возможности воздерживаться от использования самок, близких к вышеуказанным свиноматкам.Например, потомки или любые близкие родственники кабана B. iv) Любые кабаны в servioe сейчас или в будущем должны сами быть свободными от дефекта и выбираться из семей, которые заведомо свободны от этого дефекта. Весьма вероятно, что хряк X является переносчиком возбудителей Atresia ani, поскольку у свиноматок A и M ранее не было аномальных свиней от других хряков. Если хряк Y используется на нормальных свиноматках из семьи &?> 3, не имеющих дефекта, вероятность получения ненормального потомства очень низка.Однако ни одно из его потомков не должно считаться племенным поголовьем. В программе отбора должна быть значительная дискриминация потомков и родственников хряков B и F, потому что они тесно связаны с самками аномальных пометов. Это строгие рекомендации, но для борьбы с этим типом дефектов в племенном поголовье необходимо предпринять довольно решительные шаги. Необходимо будет постоянно наблюдать, и практика выбраковки должна быть очень серьезной в течение нескольких поколений, прежде чем стадо избавится от этого дефекта.ЗАКЛЮЧЕНИЕ Бридинг, который часто называют прикладным инбридингом, позволяет заводчику поддерживать высокую степень родства с предками, высоко ценящими наследственные черты, на которых он основывает свою селекционную практику. Его отбор будет проще и точнее, если он сможет оценить свое поголовье по достоинству анестезии, а также по достоинству каждого человека в стаде. * Продолжение скрещивания увеличит инбридинг у его животных до значительного уровня * Делая больше генных локусов, которые раньше были гетерозиготными гомозиготными, он увеличивает преобладание каждого индивидуума *. В качестве оплаты за повышение репотентности он должен рисковать большей вероятностью возникновения гомозиготных рецессивов.Не один, но большинство гомозиготных красных эссив менее желательны, чем гетерозиготные гомозиготные доминанты. Заводчик, который следует программе линейного разведения, должен ожидать, что рано или поздно он столкнется с наследственным дефектом. Defeots suoh, поскольку отсутствие одного или нескольких клешней росы у крупного рогатого скота, не имеют практического значения, так как это не влияет на продуктивность животного. Но заводчика должны серьезно беспокоить серьезные дефекты, классифицируемые как летальные или сублетальные, которые влияют на репродуктивную эффективность и индивидуальную производительность.Прогрессивный заводчик может получить значительный доход от продажи племенного поголовья. Если его размножающийся корм из-за его гомозиготности доминирует, он будет очень востребован. Если селекция для продуцирования преобладания также допускает экспрессию генов (ранее несущихся в гетерозиготном состоянии), которые контролируют вредные признаки, то сразу же страдает продажная стоимость и спрос на его поголовье. Чтобы избавить свое стадо от дефекта, ему, возможно, придется принести в жертву животных, имеющих высокую племенную ценность за характеристики, имеющие экономическое значение.Для развития особей суох, вероятно, потребуется несколько поколений тщательного отбора и выращивания. Если факты, касающиеся возникновения дефекта, не предаются огласке, а более широкий круг осмотрительных при выборе животных для продажи в качестве племенного поголовья, репутация его стада может поддерживаться, пока дефект будет устранен. Если он продолжит продавать животных, которые могут быть носителями дефекта, рано или поздно гены расщепятся как гомозиготные рецессивы, и дефект будет обнаружен.Между тем, вредные гены могли быть распространены на несколько стад. Неиденое даже летального характера может быть настолько низким, что не имеет практического значения ни для одного селекционера. Максимальная вероятность возникновения дефекта, рассчитанная на основе генетической теории режима наследования, редко достигается в небольших семьях. Установление истинного способа наследования и сегрегации, которая может быть исключена, должно быть доступно заводчику, чтобы позволить ему справиться с проблемой наименее вредным для породы методом и в то же время экономически возможным для него.Дефекты, находящиеся под контролем одиночных генио-пар, могут быть устранены легче, чем дефекты, имеющие более полный генетический контроль. При малоплодородных и менее плодовитых классах домашнего скота устранение даже однофакторного реагента затруднено. Большая часть животных в племенном стаде находится под подозрением при возникновении дефекта. Селекционные тесты для подтверждения генотипов подозреваемых гетерозигот не являются практическими. Заводчик может применять лишь несколько пассивное давление отбора против подозреваемых особей, поскольку экономические характеристики должны получить приоритет отбора, если его предприятие должно оставаться прибыльным.Затраты на замену подозреваемых другими животными равной ценности могут быть непомерно высокими для менее плодовитых классов животноводства. Утилизационная стоимость животных, взятых из стад или стад этих животных, слишком мала, чтобы покрывать расходы на их воспроизводство. 40 Однако в отношении свиней можно предпринять довольно решительные меры, чтобы избавить стадо от наследственного дефекта. Утилизационная стоимость зрелого стебля соответствует закупочной цене незрелых заменителей равной стоимости. Быстрое созревание, высокая плодовитость и большая плодовитость позволяют племенному производителю быстро заменить свое стадо.Чтобы он заменил свое стадо животными, лишенными того же самого или другого дефекта, он должен иметь доступный способ наследования и коэффициенты сегрегации, относящиеся к наследственным порокам свиней. Селекционные тесты и бэкероссы возможны со свиньями, и их должны проводить квалифицированные генетики, которые, таким образом, расширят знания о наследственности свиней, а также помогут практическому селекционеру в его работе. ССЫЛКИ 7f Berge, S., (1941), Journal of Heredity, vol 32, pp 271-374.Cartens, Wenzer and Durr (1937), Zuohtungsk, vol 12, p 205. Crew, Oliver and Boyd, (1947), Генетика в отношении клинической медицины, Эдинбург. Дэвидсон, I. (1945), Журнал Американской медицинской ассоциации, том 127, номер 11, стр. 633-638. Eaton, 0. N., (1937), Journal of Heredity, vol 228, pp 320-326. Фергюсон, Л.К. (1941), Журнал иммунологии, том 40, стр. 213-242. Фергюсон, Стормонт и Ирвин, (1942), Журнал иммунологии, том 44, стр. 147-164. Hadley, F. B. и B. L. Warwick, (1927), журнал Американской ветеринарной медицинской ассоциации, том 70, стр. 492-504.Hutt, F. B., (1934), Cornell Veterinarian, vol? 24, pp 1-25, Imperial Bureau of Animal Genetics, (1931), Quarterly Bulletin. том 2, номер 3, стр 49-50. Ирвин М. Р. (1947), «Иммуногенетика», «Достижения в генетике», том 1, стр. 133–153. Международный конгресс генетиосов, (1939), Труды Седьмого Конгресса, Эдинбург, статья 144, стр. 169. Kinzelbaeh, (1931), Верерб, т. 60, стр. 84. Коркман, (1944), Биологические абстракции, т. 22 , abstract 10625. Land8teiner, K ,, (193l), Science, vol 73, p 403. Largson, E.Л., (1935), Lantbr. Век Хэндл, стр 310-331. Лернер, И. М. (1944). Журнал наследственности, том 35, 219-224. Levine, P., (1947), опубликовано в Advanoes in Genetics, том 1, pI133. Левин П. (1948), цитируется в Advanoes in Genetios vol 1, p 133. Levine, Burnham, Katzin, and Vogel, (1941), American Journal of Obstetrios and Gynecology, vol 42, pp 925-937. Левин, Кацин и Бернхэм (1941), Журнал Американской ассоциации медицинских работников, том 116, стр. 825. Оуэн, Стормонт и Ирвин, (1944), Журнал животных Soienoe, том 3, стр. 315-321.Поттер, £ • Л. и Вилсерви, Дж. К., (1945), журнал Американской медицинской ассоциации, том 127, номер 8, стр 458-459. Ранстром, С. (1947), Журнал Американской ассоциации медицинских работников, том 134, номер 13, стр. 1136. Био, В. А. и Эндрюс, Ф. Нот, (1951), Разведение и улучшение сельскохозяйственных животных, Макгроу-Хилл. Книжная компания Incorporated, Нью-Йорк, стр. 342-343. Стормонт и Камли, (1943), Журнал наследственности, том 34, $ | W35-41. Вайнер, А.С. (1946), Журнал Американской медиальной ассоциации, том 133, номер 13, стр. 1097.Райт, Сьюолл, (1931), Genetios, том 16, стр. 97–159. ПРИЛОЖЕНИЯ i Расчет коэффициента инбридинга Коэффициент инбридинга - это мера степени уменьшения гетерозиготности, которую следует ожидать от определенного количества унсанкин-ous спариваний. Это указывает на степень гетерозиготности всей группы генов у отдельного животного. Коэффициент составляет ровно половину отношения между двумя родителями особи, если сами родители не являются инбредными. Формула имеет следующий вид: F x _ i S [(i) n (1 + F a)], где Fx - коэффициент инбридинга животного X; n - количество поколений в линии, по которой отец и мать связаны между собой; Fa - коэффициент инбридинга общего предка A, от которого отделяется эта линия происхождения; и S - сумма отдельно оцененных результатов.Фаотор 1 плюс Fa исправляет большее сходство, которое можно ожидать между гаметами инбредной особи. B Вычисление коэффициентов вероятности При расчете вероятности получения гомозиготного рецессива от скрещивания двух неизвестных генотипов предполагается, что вероятность того, что генотип родителя будет гетерозиготным, повышается до степени, равной количеству поколений родителя. удаляется из общего предка обоих родителей, который предположительно или известен как гетерозиготный.Если оба родителя известны как гетерозиготы, вероятность гомозиготности потомства составляет 50 фунтов стерлингов; гомозиготности реоэссивности составляет 0,25. Если известно, что общий дедушка или бабушка гетерозиготны, вероятность того, что генотип потомков, удаленных на одно поколение, будет гомозиготным и реаэссивным, увеличивается вдвое до четвертой степени; или одна шестнадцатая. i i C Тест на пригодность Биометристы измеряют качество f i t путем сложения пропорциональных отклонений класса eaoh, получая константу, известную как ohi-squared, и это определяет вероятность того, что такое большое или большее отклонение произойдет случайно.Хи-квадрат получается возведением в квадрат отклонения каждого оласса от теоретического ожидания этого класса, делением его на теоретическое ожидание для этого класса и сложением результатов одного класса. Из подготовленных таблиц можно получить для данного значения ohi-square и данного числа классов значение F, которое измеряет вероятность того, что отклонение, большое или большее, произойдет случайно, другими словами, процент случаи, в которых можно ожидать отклонения случайно.D Процедуры для серологических исследований Подготовка иммунной сыворотки Источник сбора антигена 6 т Материалы для образцов крови * вата, спирт, подкожная игла, прикрепленная к резиновой пробирке, 200 мл стерильная колба с пробкой, 76 мл раствора изотонио цитрата (2 доллара цитрата натрия - 0,5 $ хлорид натрия), пробирка на 50 мл с пробкой, содержащая стеклянные шарики. Метод: капля крови из яремной вены с помощью иглы для подкожных инъекций и резиновой трубки. Приблизительно 75 мл крови помещается в колбу на 200 мл, содержащую 75 мл изотонического раствора цитрата.Колбу закрывают пробкой и охлаждают. В колбу на 50 мл набирается примерно 25 мл крови. Колбу быстро закрывают и встряхивают в течение пяти минут для дефибринирования образца крови. Дефибринированная кровь используется для приготовления клеточных суспензий. Его необходимо нагреть до 56 ° C в течение получаса, чтобы разрушить комплемент. iii Приготовление суспензионных материалов эритроцитов * Один раствор желатинового лука, 50 мл физиологического раствора (0,85%), стерильный 15 мл пипет, 4 • 20 мл стерильные градуированные центрифужные пробирки, стерильная градуировка, 50 мл стерильные колба с пробкой, 60 мл цитратной крови.Метод: поместите 5 мл отобранной пробы крови в каждую из четырех центрифужных пробирок. Центрифуга до десяти минут. Слейте или удалите пипеткой цитратно-сывороточную смесь. Добавьте 5 мл раствора желатина Lookes в каждую пробирку, тщательно встряхните и повторно центрифугируйте в течение десяти минут. Повторите стирку четыре раза! раз. Перенести 1 мкл клеток в одну пробирку, упаковать клетки путем отжимания, записать объем упакованных клеток. Перенесите клетки в стерильную колбу на 50 мл, используя равный объем стерильного физиологического раствора. Место 3.5 мл суспензии 50 $ в каждой из девяти флаконов с резиновыми пробками. Инокуляция RabVf ts Инокуляции Материалы: три зрелых нормальных здоровых кролика, бритва, ватная полоска, спирт, стерильный шприц для подкожных инъекций 5 мл, суспензия эритроцитов, 3 стерильные иглы для подкожных инъекций (Ho. 22) • Методы: шерсть над краевой веной выбрит сухим способом. Область стерилизована спиртом. Шприц наполняется воздухом и один мл вводится в вену. Каждому кролику вводят внутривенные инъекции три раза в неделю в течение трех недель по одному (1) мл 50% суспензии.Взятие иммунизированной крови Кролика держат в кровоточащей ложе на спине, голова его находится в хорошо закругленной выемке, а четыре лапы, удерживаемые ремнями, затянуты, чтобы вытянуть конечности до полного разгибания. Кровь забирается методом пункции оардиао. Кровь сливают в стерильные пробирки с ватными пробками и дают ей свернуться. Иммунная сыворотка забирается стерильной пипеткой. iv Сыворотка комплемента может быть получена с использованием того же метода, что и у нормальных здоровых кроликов. Кровь следует охладить, как только она засеяна, а сыворотку следует использовать вскоре после взятия крови.Тестовые суспензии промытых клеток Образцы крови отбирают в дефибринирующие колбы, как описано выше, 25 мл крови является достаточно большим образцом для снабжения клеток 2,5% -ными суспензиями, используемыми в тестах. В то же время 40 мл крови набирается в стерильные пробирки, снабженные ватными пробками, в которых ей дают свернуться перед охлаждением. Примечание: для обеспечения строгой стерильности каждая трубка снабжена иглой для подкожных инъекций, прикрепленной пластиковой трубкой. Собранное оборудование подвергается автолаживанию при 15 фунтах в течение тридцати минут и не разбирается до тех пор, пока сыворотка не будет извлечена стерильной пипеткой.Приготовление 2,5-кратных суспензий промытых клеток происходит параллельно с приготовлением 50-кратных суспензий. Гемолитические тесты Разведения иммунных сывороток Материалы: неразбавленные кроличьи сыворотки во флаконах на 25 мл, пробирки на 9–20 мл, физиологический раствор, пипетки на 5–10 мл. • Метод: поместите пять мл сыворотки A в пробирку I и в пробирку II. Добавьте 10 мл физиологического раствора в пробирку II. Удалите 5 мл раствора из пробирки II и поместите в пробирку III. Добавьте 10 мл физиологического раствора в пробирку III. Пробирки Пробирка Eaoh должна содержать: - 1 каплю 2 шт.5% суспензии промытых клеток - 2 капли неразбавленной или разбавленной сыворотки от одного иммунизированного кролика - 1 капля сыворотки комплемента. Контрольные пробирки и повторные тесты следует готовить в тех же условиях.