исследование и время проведения, подготовка и сдача, подведение итогов
Мазок из зева и носа на стафилококк особенно необходим тем людям, которые часто наблюдают у себя очаги воспаления на кожном покрове или, при наличии нередких простуд. Этот факт требует вмешательства по подтверждению либо опровержению наличия колоний пагубных стафилококковых микроорганизмов и в условиях присутствия назначения адекватного лечения.
Исследования для определения стафилококков
Стафилококки обладают сферообразной типичной формой, относятся к категории грамположительных бактерий, насчитывают их в районе 30 видов. Следует обратить внимание на то, что определённые виды всегда находятся внутри человеческого организма, не нанося ущерба здоровью – кожному и слизистому покрову.
Вместе с этим необходимо отметить, что именно золотистый, эпидермальный и сапрофитный стафилококки особо опасны для человеческого здоровья. Из-за наличия подобных бактерий могут быть спровоцированы воспалительные процессы. Потому как стафилококки выделяют специфические токсины от собственной жизнедеятельности, подавляя иммунитет человека.
Потому как стафилококки выделяют специфические токсины от собственной жизнедеятельности, подавляя иммунитет человека.
Сапрофитный стафилококк типично располагается в мочеполовой системе, преимущественно у представительниц слабого пола, образуя цистит. Стафилококк эпидермального значения, как правило, локализуется на коже людей. Опасность его состоит в том, что из-за травмы кожи он может переместиться в кровь, что при иммунной дисфункции грозит заражением.
В свою очередь, золотистый стафилококк может причинить тяжёлый вред всем органам, вне зависимости от пола и возраста пациента. Типично проявляется гнойными очагами кожных покровов или органов.
Известны случаи, когда из-за этой бактерии развилось пищевое отравление, менингит и воспаление лёгких. Золотистый стафилококк страшен тем, что обладает значительной устойчивостью к температурным воздействиям, спирту, антисептическим и антибактериологическим препаратам.
Заражение золотистым стафилококком происходит следующими способами:
- Воздушно-капельным.

- Контактным.
- От проникновения в кровь.
- Через медицинские заражённые приспособления.
- Просроченными пищевыми продуктами.
Кроме того, активное действие стафилококков становится возможным из-за переохлаждения, применения внутрь алкоголя и табакокурения, нецелесообразного режима дня и стрессов.
По причине того, что данная бактерия может осесть в любой точке организма, только врачу следует назначать сдачу требуемого анализа. Это может быть исследование мазка из зева, носа либо прочих слизистых поверхностей. Не исключена сдача, таких биоматериалов, как: кровь, кал, моча и грудное молоко.
Время проведения анализа
В случае когда человек обнаруживает на кожном покрове высыпания, и безосновательно воспалённые потовые и сальные железы, а также волосяные фолликулы, требуется принять решение об обращении к врачу.
Кроме того, может проявляться продолжительная заложенность носа с насморком, болевой синдром горла с кашлем, повышение температуры также могут свидетельствовать о возможном наличии стафилококка, что требует провести мазок на стафилококк.
Существует группа риска – люди с онкологическими заболеваниями, ВИЧ-инфицированные, диабетики и больные, регулярно проходящие процедуру гемодиализа. Вместе с этим к данной группе относятся медицинские работники, люди с повышенным риском травмирования кожи (ожоги или порезы), работники сельского хозяйства, новорождённые дети, женщины, кормящие грудью, пожилые люди и представители с иммунной дисфункцией, которые с лёгкостью могут подвергнуться атаке стафилококка.
Анализ на выявление стафилококка обычно назначают беременным женщинам для исключения передачи бактерии плоду, с целью предупреждения госпитализированным больным, а также медицинским сотрудникам и работникам, касающихся продуктов питания (повара, продавцы).
Направить на выполнение подобного анализа, может: детский специалист-педиатр, лечащий терапевт, отоларинголог, уролог, дерматолог, инфекционист, маммолог и не исключён гастроэнтеролог.
Когда ожидаемое назначение на прохождение анализа получено, важно прислушаться к рекомендациям по подготовке к прохождению процедуры.
Подготовка и сдача биоматериала
Мазок из зева на стафилококк или из носа требует определённых подготовительных мер. Например, исключить употребление препаратов-антибиотиков желательно сроком на 8 недель, а в ситуации, когда пациент принимал их в недавнее время, существует необходимость известить об этом лечащего доктора.
Если в качестве биоматериала для анализа используется кровь, то в условиях недавнего принятия противовирусных лекарственных средств создаётся необходимость в сообщении этой информации специалисту. Забор пробы типично производится с утра натощак, поэтому следует воздержаться от табакокурения за несколько часов до осуществления забора.
В условиях, когда человеку предписано сдать мазок из зева или полости носа, то необходимо за ½ суток до исследования употребить значительный объём жидкости. Так, выделения будут легче отделяться. Важно примерно за 8 часов до изъятия мазка из носа или зева не употреблять пищу и жидкость, не чистить зубы. По этой причине забор мазка, как правило, осуществляется в утренние часы.
По этой причине забор мазка, как правило, осуществляется в утренние часы.
Когда врач назначает анализ мочи пациента, то за пару дней до процедуры требуется отказаться от мочегонных препаратов, а в условиях сдачи анализа кала необходимо исключить приём слабительных медикаментов.
Если ситуация требует брать анализ из половых органов, то мужчинам необходимо не пользоваться туалетом 3 часа до сдачи, а женскому полу следует сдать мазок до менструации или через несколько дней по её окончанию.
В условиях самостоятельного сбора пробы анализа на стафилококк (моча или кал), то только пациент несёт ответственность за исход исследования. Именно поэтому лучше приобрести специальную стерильную ёмкость, продающуюся в ближайшей городской аптеке по копеечной цене.
Анализ на стафилококк, как берут исследуемый мазок из носа, а также зева знают не многие люди. Так, для выполнения анализа потребуется:
- Забор пробы ватным тампоном.
- Помещение мазка в питательные условия.

- Выжидание времени для выявления колоний стафилококка.
Брать порцию крови для анализа принято из вены, из-за чего возможен некоторый дискомфорт.
Мазок выделений на стафилококк из ран осуществляется посредством ватного тампона. Болезненность проведения процедуры зависит от тяжести травмы. В типичной ситуации мазок требуется в малом количестве, что достаточно терпимо для больного.
Подведение итогов обработки
Результаты проведённого анализа мазка из носа или зева специалисты-микробиологи заполняют на специально предназначенном бланке, где указано наименование микроорганизма, и число патогенных клеток.
У каждого человека на слизистой поверхности носа или глотки обитают защитные бактерии, которые не причиняют вреда. Но из-за патогенных факторов их численность качественно растёт, что и объясняет вредоносное действие стафилококка.
youtube.com/embed/0sYetTqSWoI»/>
В нормальном состоянии у людей условные бактерии должны находиться на уровне 103 – 10 4 КОЕ /мл, а наличие патогенных частиц не должно определяться.
После анализа на стафилококк мазка, например, из носа, определяется единственно верный метод лечения, требуемый для устранения болезнетворного микроорганизма. Назначаются только те лекарственные средства, к влиянию которых бактерии наиболее чувствительны.
как берут, подготовка к анализу, норма
Чтобы определить патогенные микроорганизмы и узнать уровень их чувствительности к антибактериальным препаратам, доктор назначит мазок на стафилококк из зева и носа.
Результат обследования даст возможность прописать средства для лечения недуга. Ведь вредоносные бактерии выделяют токсины, отравляющие организм, блокируют работу иммунной системы.
Симптомы наличия в организме стафилококка
Если у пациента в носу завелся стафилококк, то появится насморк, повысится температура тела, нос будет заложен, на стенках носа постоянно будут образовываться корочки.
При появлении бактерии в ротовой полости симптомы будут отличаться:
- пациент чувствует сильную слабость;
- поднимается высокая температура;
- лимфоузлы увеличиваются;
- больной ощущает першение, возможен налет гноя на слизистой.
Пациент должен принимать лекарственные препараты, чтобы избавиться от бактерий. Микроорганизмы могут вызвать у больного ряд недугов, среди которых менингит, остеомиелит, холецистит и другие.
Некоторые болезни несут угрозу жизни – в медицине есть случаи смерти пациента от стафилококковой пневмонии.
Заразиться стафилококком можно в местах, в которых не соблюдаются правила гигиены или нарушается техника санитарной обработки инструментов. К таким местам можно отнести салоны пирсинга и тату, медицинские учреждения и другие.
Если медицинский работник относится халатно к гигиене и не меняет стерильные перчатки, то риск у больного заразиться стафилококком возрастает.
Бактерия выдерживает перепады температур и некоторые виды антисептика, поэтому справиться с ним непросто.
Человек может заразиться стафилококком, но на его здоровье это не отразится. В этом случае индивид будет считаться носителем бактерии.
Есть несколько способов заражения;
- контактный — в ранку попали патогенные бактерии вместе с пылью или грязью;
- артифициальный — заражение происходит через медицинские инструменты в результате их некачественной обработки;
- аэрогенный — воздушно-капельным путем;
- алиментарный — при употреблении зараженных продуктов питания.
Как правильно подготовиться к процедуре?
Перед тем как сдать мазок из зева на стафилококк, необходимо правильно подготовиться к процедуре. Пациент должен отказаться от приема антисептических, антибактериальных средств.
Надо прекратить обработку слизистой носоглотки лекарствами за 2 недели до проведения обследования. Если больной будет продолжать обработку, то результаты мазка будут искажены.
Диагностика на стафилококк имеет отрицательную сторону. Перед взятием мазка около двух недель нельзя проводить лечебные мероприятия – за это время бактерия может заразить близлежащие органы.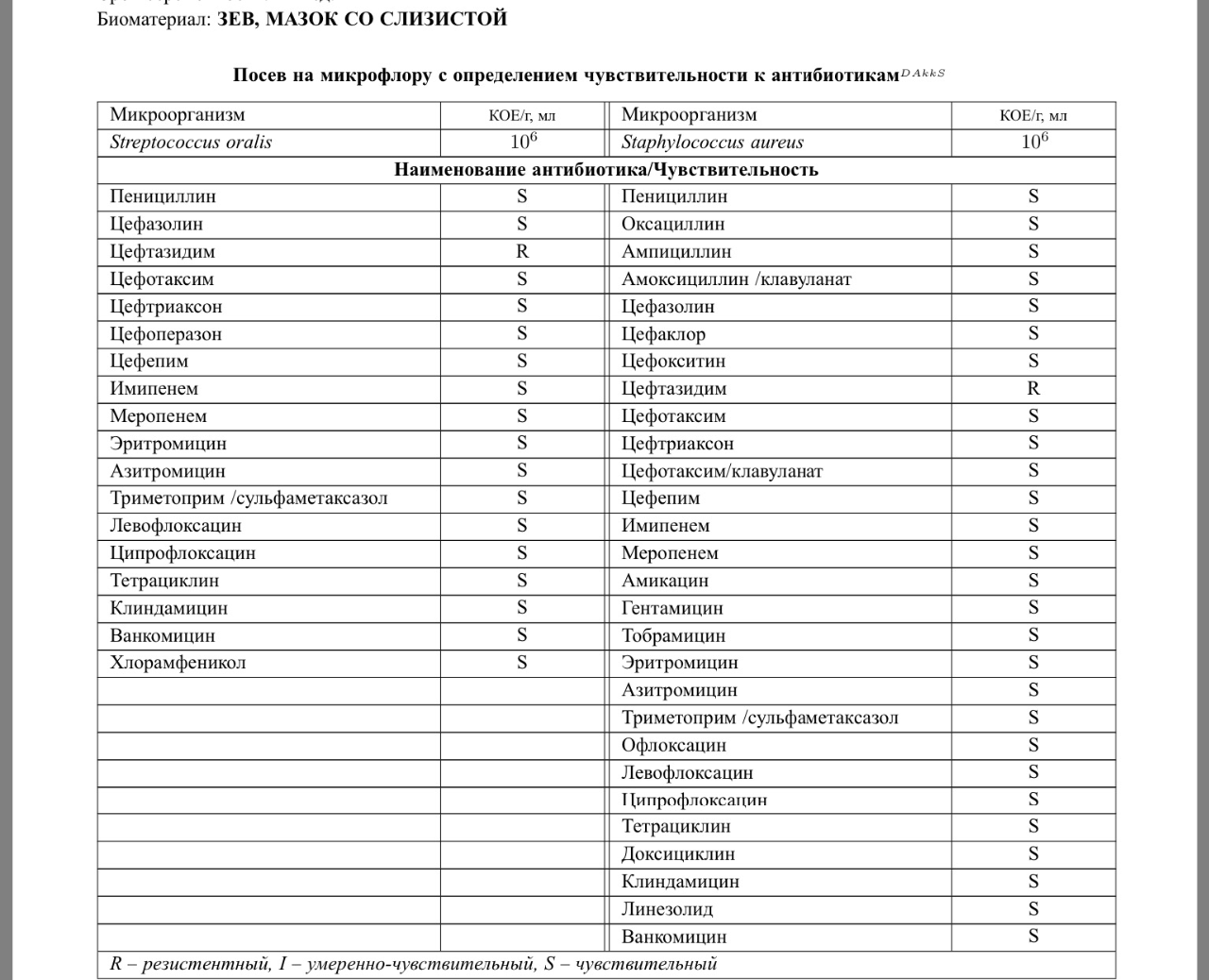
За 10 – 12 часов до проведения обследования пациент должен пить много жидкости. Таким образом, секрет, который выделяется на слизистой, становится реже, что облегчит обследование.
Когда до момента взятия мазка на стафилококк из зева и носа остается 8 часов, больной не должен кушать, пить любую жидкость, жевать жвачку или чистить зубы.
Процедура чаще всего проводится рано утром – в это время подготовка к мазку не доставит неудобств больному.
Чтобы результаты обследования были достоверными, надо правильно провести анализ. Если необходимо определить наличие стафилококка в носу, то следует усадить больного на стул.
Пациент должен запрокинуть голову. Если носовой проход содержит слизь, то ее аккуратно удаляют, слизистую обрабатывают спиртовым раствором.
После этого в каждую ноздрю надо ввести стерильный валик и хорошо прижать его к стенкам слизистой. В этом случае можно собрать достаточное количество биоматериала.
При заборе материала из зева больной тоже запрокидывает голову.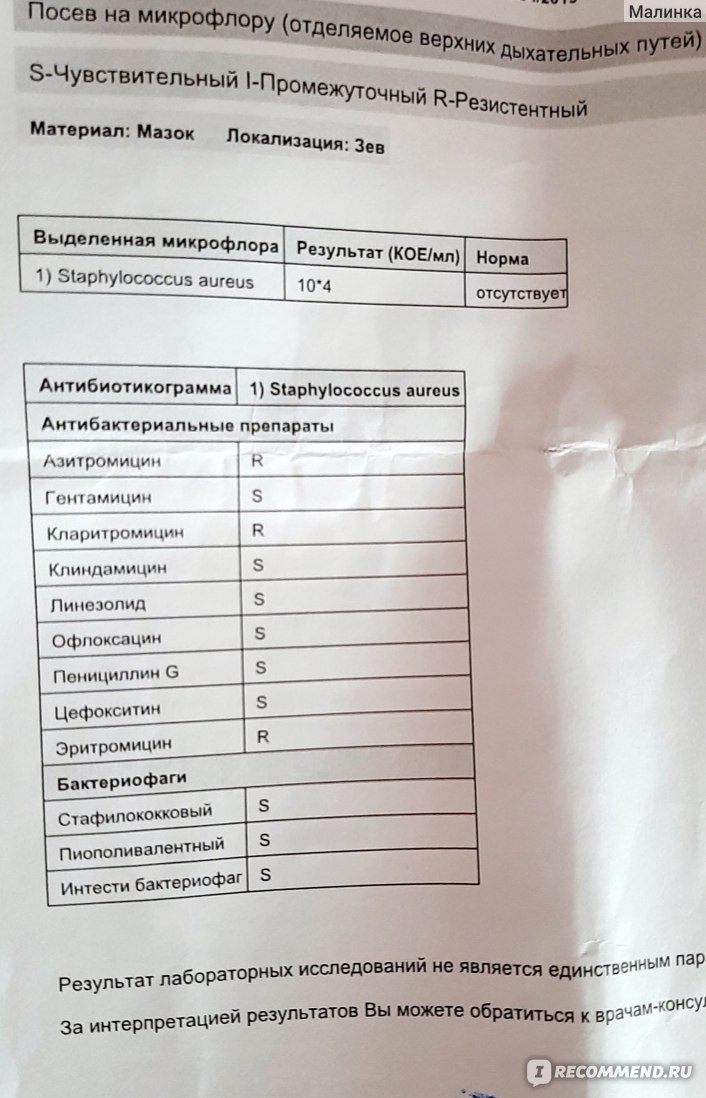 Доктор фиксирует язык специальным инструментом, чтобы появилась возможность добраться до слизистой и взять мазок. Отобранная слизь из носа и глотки перемещается в стерильную емкость.
Доктор фиксирует язык специальным инструментом, чтобы появилась возможность добраться до слизистой и взять мазок. Отобранная слизь из носа и глотки перемещается в стерильную емкость.
В пробирке должна находиться жидкость, благодаря которой бактерии не погибнут. 2 часа жизни стафилококков достаточно, чтобы провести необходимые исследования. Все данные заносятся на специальный бланк и передаются лечащему врачу.
Норма бактерий
Изучая внешний вид бактерий, можно определить их количество и морфологические свойства. Биоматериал наносят на стекло и окрашивают по Граму.
Так можно определить, какие агенты содержит слизь больного:
- скопления бактерий выглядят как виноградная гроздь — наличие стафилококка;
- положительное окрашивание — есть стафилококк;
- кокки располагаются парами или образовывают цепочку — присутствуют стафилококки;
- если обнаружены грамотрицательные кокки, то присутствуют нейссерии;
- грамотрицательные бактерии имеют закругленные кончики, цвет капсул светлый — наличие клебсиелл;
- грамотрицательные палочки небольшого размера свидетельствуют о наличии синегнойной палочки.

При исследовании мазка из носа на стафилококк оценивается не только наличие бактерий, но и выявляется концентрация организмов в материале. Микроорганизмы помещаются в питательную среду, где размножаются и образовывают колонии.
Видео:
Специалисты различают 4 степени роста микроорганизмов:
- I – в жидкости бактерии растут крайне медленно и скудно;
- II – в плотной среде бактерии одного вида растут до 10 колоний;
- III – образовывается от 10 до 100 колоний;
- IV – в жидкой среде более 100 колоний.
Если специалист определил в мазке пациента одну из двух последних степеней роста, то в организме пациента протекает воспалительный процесс.
В этом случае больной должен начать лечение лекарственными препаратами. Первые две степени указывают на то, что в биоматериале есть небольшое количество микроорганизмов.
Если количество золотистого стафилококка не превышает 106, то такое значение считается нормой.
Как проходит исследование?
Чтобы определить стафилококковый агент в бакпосеве, надо культивировать бактерии на определенном участке.
Большинство бактерий предпочитают находиться в среде, где для них созданы комфортные условия. Материал помещают в термостат, в котором сохраняется комфортная для микроорганизмов среда.
Процедура перемещения производится исключительно в стерильном боксе. Специалист должен быть в специальной одежде, которая должна защитить работника лаборатории от опасных бактерий.
Для исследования используется определенная среда:
- кровяной агар — в нем живут патогенные организмы и сапрофиты;
- среда Сабуро — ее предпочитают практически все микроорганизмы;
- желто-солевой агар — культивируют стафилококки;
- шоколадный агар — живут гонококки, возбудители гнойного менингита, гемофильные палочки;
- среда Эндо — культивируют энтеробактерии.

Чтобы исследовать биоматериал, используется чашка Петри. Изделие представляет собой цилиндрический сосуд с крышкой.
На дно чашки втирается слизь из носоглотки и аккуратно рассеивается. Посев должен находиться в термостате 24 часа. После этого лаборант сможет узнать, какие микроорганизмы находятся в мазке и в каком количестве.
Видео:
После того как мазок из носа или из ротовой полости будет исследован, лаборант составляет расшифровку. В ней указываются род, вид микроорганизмов — название пишется на латыни. Обязательно указывается уровень патогенности флоры и количество клеток.
Если в мазке обнаружили стафилококк, то больного направят на дополнительные обследования. После того как бактерии проверят на устойчивость к лекарственным препаратам, доктор сможет назначить лечение.
Вы здесь:
Посев на стафилококк из носоглотки
Мазок из зева берут для проведения стандартного бактериологического исследования с целью изучения микробного состава и количественного соотношения микрофлоры носоглотки. Это метод лабораторной диагностики, позволяющий выявить возбудителей инфекционно-воспалительных заболеваний верхних отделов респираторного тракта. Для определения этиологии инфекции необходимо провести бактериологическое исследование отделяемого носа и зева на микрофлору.
Это метод лабораторной диагностики, позволяющий выявить возбудителей инфекционно-воспалительных заболеваний верхних отделов респираторного тракта. Для определения этиологии инфекции необходимо провести бактериологическое исследование отделяемого носа и зева на микрофлору.
Специалисты направляют больных с хроническим ринитом, тонзиллитом и фарингитом в микробиологическую лабораторию, где стерильным ватным тампоном отбирают биоматериал из носа и зева и проводят его исследование. По результатам анализа специалист определяет возбудителя патологии и его чувствительность к антибиотикам.
Причины и цели взятия мазка на микрофлору из зева и носа:
Диагностика ангины, вызванной бета-гемолитическим стрептококком и приводящей к развитию тяжелых осложнений — гломерулонефрита, ревматизма, миокардита. Наличие в носоглотке золотистого стафилококка, провоцирующего образование фурункулов на коже. Бактериологический посев клинического материала при воспалении носоглотки проводится с целью исключения дифтерийной инфекции. Подозрение на менингококковую или коклюшную инфекцию, а также респираторные недуги. Диагностика стенозирующего ларингита, мононуклеоза, абсцессов, расположенных рядом с миндалинами, включает однократное проведение анализа. Лица, контактные с инфекционным больным, а также дети, поступающие в детский сад или школу, проходят профилактическое обследование с целью выявления бактерионосительства. Полное обследование беременных женщин включает взятие мазка из зева на микрофлору. Мазок из зева и носа на стафилококк с профилактической целью сдают все медицинские работники, воспитатели детских садов, повара и продавцы продуктовых магазинов. Мазок из зева для определения клеточного состава отделяемого. Исследуемый материал наносят на специальное предметное стекло. Под микроскопом врач-лаборант подсчитывает количество эозинофилов и прочих клеток в поле зрения. Проводится исследование для определения аллергической природы заболевания.
Подозрение на менингококковую или коклюшную инфекцию, а также респираторные недуги. Диагностика стенозирующего ларингита, мононуклеоза, абсцессов, расположенных рядом с миндалинами, включает однократное проведение анализа. Лица, контактные с инфекционным больным, а также дети, поступающие в детский сад или школу, проходят профилактическое обследование с целью выявления бактерионосительства. Полное обследование беременных женщин включает взятие мазка из зева на микрофлору. Мазок из зева и носа на стафилококк с профилактической целью сдают все медицинские работники, воспитатели детских садов, повара и продавцы продуктовых магазинов. Мазок из зева для определения клеточного состава отделяемого. Исследуемый материал наносят на специальное предметное стекло. Под микроскопом врач-лаборант подсчитывает количество эозинофилов и прочих клеток в поле зрения. Проводится исследование для определения аллергической природы заболевания.
В баклабораторию направляют больных для исследования материала из носоглотки с целью исключения или подтверждения конкретной инфекции. В направлении указывают микроорганизм, наличие которого необходимо подтвердить или опровергнуть.
В направлении указывают микроорганизм, наличие которого необходимо подтвердить или опровергнуть.
Микрофлора носоглотки
На слизистой оболочке зева и носа обитает множество микроорганизмов, составляющих нормальную микрофлору носоглотки. Исследование отделяемого горла и носа показывает качественное и количественное соотношение микробов, обитающих в данном локусе.
Типы микроорганизмов, обитающих на слизистой носоглотки у здоровых людей:
Бактероиды, Veillonella, Escherichia coli, Branhamella, Pseudomonas, Streptococcus matans, Neisseria meningitides, Klebsiella pneumonia, Эпидермальный стафилококк, Зеленящий стрептококк, Неболезнетворные нейссерии, Дифтероиды, Коринебактерии, Candida spp., Haemophilis spp., Actinomyces spp.
При патологии в мазке из зева и носа можно обнаружить такие микроорганизмы:
Бета-гемолитический стрептококк группы А, Пневмококк, S. aureus, Коринобактерии дифтерии, Haemophilis influenzae, Neisseria meningitidis, Candida albicans, Бордетелла, Листерия, Branhamella catarrhalis, Acinetobacter baumannii, Энтеробактерии.
Подробнее о встречающемся в мазке стафилококке, его патогенности и стафилококковой инфекции рекомендуем почитать по ссылке.
Подготовка к анализу
Чтобы результаты анализа были максимально достоверными, необходимо правильно отобрать клинический материал. Для этого следует подготовиться.
За две недели до забора материала прекращают прием системных антибиотиков, а за 5-7 суток рекомендуют перестать использовать антибактериальные растворы, ополаскиватели, спреи и мази для местного применения. Сдавать анализ следует натощак. Перед этим запрещено чистить зубы, пить воду и жевать жвачку. В противном случае результат анализа может оказаться ложным.
Мазок из носа на эозинофилы сдают также натощак. Если человек поел, необходимо подождать как минимум два часа.
Взятие материала
Чтобы правильно взять материал из зева, пациенты откидывают голову назад и широко раскрывают рот. Специально обученный персонал лаборатории шпателем прижимает язык и собирает отделяемое глотки специальным инструментом — стерильным ватным тампоном. Затем извлекает его из полости рта и опускает в пробирку. Пробирка содержит специальный раствор, которой предотвращает гибель микробов во время транспортировки материала. Пробирку необходимо доставить в лабораторию в течение двух часов с момента забора материала. Взятие мазка из горла — процедура безболезненная, но неприятная. Прикосновение ватного тампона к слизистой глотки может спровоцировать рвотные позывы.
Затем извлекает его из полости рта и опускает в пробирку. Пробирка содержит специальный раствор, которой предотвращает гибель микробов во время транспортировки материала. Пробирку необходимо доставить в лабораторию в течение двух часов с момента забора материала. Взятие мазка из горла — процедура безболезненная, но неприятная. Прикосновение ватного тампона к слизистой глотки может спровоцировать рвотные позывы.
Чтобы взять мазок из носа, необходимо усадить пациента напротив и слегка запрокинуть ему голову. Перед анализом необходимо очистить нос от имеющейся слизи. Кожу ноздрей обрабатывают 70% спиртом. Стерильный тампон вводят поочередно сначала в один, а затем в другой носовой ход, проворачивая инструмент и плотно прикасаясь к его стенкам. Тампон быстро опускают в пробирку и направляют материал на микроскопическое и микробиологическое исследование.
Микроскопическое исследование
Исследуемый материал наносят на предметное стекло, фиксируют в пламени горелки, окрашивают по Граму и изучают под микроскопом с иммерсионным маслом. В мазке обнаруживают грамотрицательные или грамположительные палочки, кокки или коккобациллы, изучают их морфологические и тинкториальные свойства.
В мазке обнаруживают грамотрицательные или грамположительные палочки, кокки или коккобациллы, изучают их морфологические и тинкториальные свойства.
Микроскопические признаки бактерий — важный диагностический ориентир. Если в мазке находятся грамположительные кокки, расположенные скоплениями, напоминающими гроздья винограда, предполагают, что возбудителем патологии является стафилококк. Если кокки окрашены по Граму положительно и располагаются в мазке цепочками или парами, возможно это стрептококки; грамотрицательные кокки — нейсерии; грамотрицательные палочки с закругленными концами и светлой капсулой — клебсиеллы, мелкие грамотрицательные палочки — эшерихии, синегнойные палочки. Дальнейшее микробиологическое исследование продолжают с учетом микроскопических признаков.
Посев исследуемого материала
Каждый микроорганизм растет на своей «родной» среде с учетом рН и влажности. Среды бывают дифференциально-диагностическими, селективными, универсальными. Их основное предназначение — обеспечение питания, дыхания, роста и размножения бактериальных клеток.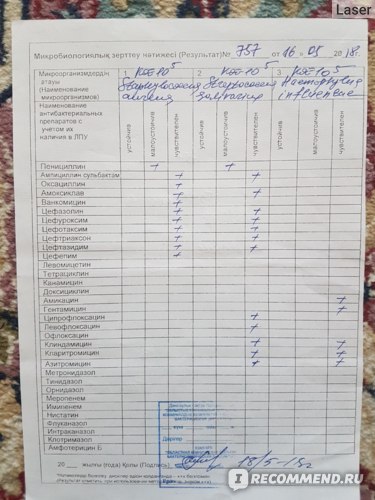
Посев исследуемого материала необходимо проводить в стерильном боксе или ламинарном шкафу. Медработник должен быть одет в стерильную одежду, перчатки, маску и бахилы. Это необходимо для соблюдения стерильности в рабочей зоне. В боксе следует работать молча, аккуратно, обеспечивая личную безопасность, поскольку любой биологический материал считается подозрительным и заведомо заразным.
Мазок из носоглотки засевают на питательные среды и инкубируют в термостате. Спустя несколько суток на средах вырастают колонии, имеющие различную форму, размер и цвет.
Существуют специальные питательные среды, которые являются селективными для конкретного микроорганизма.
Основной средой для микробов зева и носа является кровяной агар. Это высокочувствительная среда, содержащая питательные вещества для сапрофитных и патогенных бактерий. Пневмококки и золотистый стафилококк продуцируют гемолизины и вызывают гемолиз эритроцитов. Гемолитическая активность микробов — основной фактор патогенности, которым обладает большинство болезнетворных бактерий. Характер роста, цвет и зона гемолиза отличаются у микробов разных родов и видов. Среда Сабуро или тиогликолевая среда являются универсальными и подходят для широкого круга микробов. Желточно-солевой агар — элективная среда для выращивания стафилококков. Агар с гретой кровью — шоколадный агар. Это неселективная, обогащенная питательная среда, применяемая для выращивания патогенных бактерий. На этой среде растут гонококки, гемофильная палочка и возбудители гнойных бактериальных менингитов. Среда Эндо — дифференциально-диагностическая среда для культивирования энтеробактерий. Энтерококкагар — питательная среда для выделения энтерококков.
Характер роста, цвет и зона гемолиза отличаются у микробов разных родов и видов. Среда Сабуро или тиогликолевая среда являются универсальными и подходят для широкого круга микробов. Желточно-солевой агар — элективная среда для выращивания стафилококков. Агар с гретой кровью — шоколадный агар. Это неселективная, обогащенная питательная среда, применяемая для выращивания патогенных бактерий. На этой среде растут гонококки, гемофильная палочка и возбудители гнойных бактериальных менингитов. Среда Эндо — дифференциально-диагностическая среда для культивирования энтеробактерий. Энтерококкагар — питательная среда для выделения энтерококков.
Материал втирают тампоном в среду на небольшой площадке размером 2 кв. см., а затем с помощью бактериологической петли штрихами рассевают по всей поверхности чашки Петри. Посевы инкубируют в термостате при определенной температуре. На следующий день посевы просматривают, учитывают количество выросших колоний и описывают их характер. Пересевают отдельные колонии на селективные питательные среды для выделения и накопления чистой культуры. Микроскопическое изучение чистой культуры позволяет оп
Микроскопическое изучение чистой культуры позволяет оп
Мазок из носа и из зева на стафилококк
Идентификация стафилококковой инфекции осуществляется посредством мазка с дальнейшим посевом полученного материала на питательные среды.
Показания к выполнению анализа на стафилококк.
По внешнему виду стафилококк представляет собой неподвижные шаровидные скопления, по внешнему виду напоминающие виноградную гроздь (см. фото справа). В медицинских источниках можно встретить информацию, что стафилококк принадлежит к грамположительным микробам. Это значит, что он при окраске по Граму (фамилия ученого) он приобретает характерный синий цвет.
В организме человека может находиться несколько видов стафилококка, среди которых – золотистый, эпидермальный, сапрофитный. Все они являются патогенными или условно патогенными. Это значит, что, попадая в организм, они вызывают тяжелые заболевания – гнойный раневой сепсис, дифтерию, менингит, коклюш, пневмонию, воспалительные заболевания слизистых оболочек носа, горла, глаз.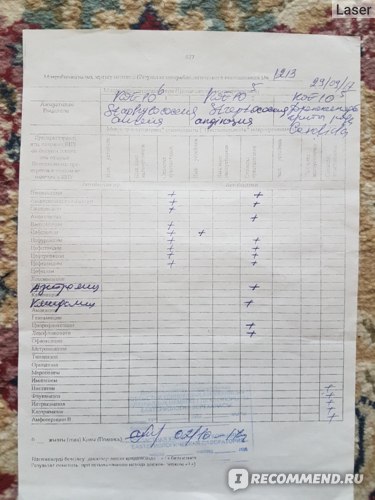
Но у некоторых лиц носительство может быть бессимптомным, и проявляться лишь в результате провоцирующих факторов – переохлаждений, стрессов, сопутствующих заболеваний.
Мазок используют для выявления стафилококка при различных заболеваниях, а также у бессимптомных носителей.
Данный метод диагностики осуществляют при плановом профилактическом медицинском обследовании некоторых категорий лиц, потенциально опасных в эпидемиологическом плане – работников торговли и пищевой промышленности, дошкольных учреждений, школ, больниц, родильных домов.
Методика взятия анализа на стафилококк
Мазок с носа и зева берется с помощью стерильной ваты, намотанной на такую же стерильную петлю. Причем для носа и зева необходимы разные петли. Перед взятием мазка из носа необходимо высморкаться. Далее петля с ватой вводится поочередно в носовые ходы на глубину 1-2 см. с последующими мягкими круговыми касаниями их стенок.
За 2-4 ч. до взятия мазка из зева нельзя принимать пищу, питье, полоскать рот и чистить зубы.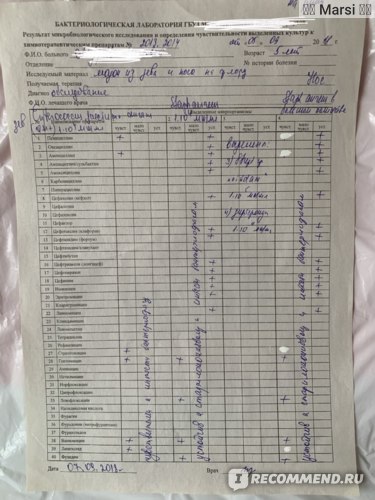 Язык прижимают стерильным шпателем, затем проволочной петлей с ватой проводя по небным миндалинам, небным дужкам и задней стенке глотки. При этом следует избегать касаний языка и слизистой ротовой полости.
Язык прижимают стерильным шпателем, затем проволочной петлей с ватой проводя по небным миндалинам, небным дужкам и задней стенке глотки. При этом следует избегать касаний языка и слизистой ротовой полости.
Проволочные петли с ватой и полученным материалом помещаются в стерильные пробирки, и в течение 3 часов должны быть направлены в лабораторию, где их сеют на питательные среды.
Ответ, как правило, готов в течение 4 дней после взятия мазка и посева.
Мазок из зева на микрофлору: как сдавать, норма, отклонения, расшифровка результата
Мазки в гинекологии
15.06.2017
11.5 тыс.
7.7 тыс.
5 мин.
2
Мазок из зева на микрофлору и чувствительность к антибиотикам является стандартным бактериологическим обследованием.
Он проводится с целью исследования состава микрофлоры носоглотки и позволяет получить достоверную информацию о наличии какой-либо патологии, выявить ее причину и возбудителя, а также определить реакцию организма на определенные медикаменты. Обладая этой информацией, врач может назначить необходимое лечение и подходящие лекарственные препараты.
Обладая этой информацией, врач может назначить необходимое лечение и подходящие лекарственные препараты.
Анализ на мазок из зева и носа требует некоторой подготовки и выполнения определенных правил, нарушение которых может привести к получению недостоверного результата. Чтобы избежать этого, необходимо следовать следующим правилам:
- Прекратить прием антибактериальных препаратов за пять дней до анализа.
- За несколько дней до исследования исключить использование препаратов для ополаскивания полости рта, содержащих антисептики, а также мазей и спреев, в составе которых имеются противомикробные вещества или антибиотики. Это может привести к уничтожению большей части микробов, и анализ не выявит в мазке бактерии, которые стали причиной заболевания.
- Сдавать анализ рекомендуется утром и натощак. Нельзя принимать пищу, напитки и использовать зубную пасту за несколько часов до процедуры.
- Непосредственно перед взятием мазка категорически запрещается жевательная резинка.

- Взятие образца из носа также выполняется натощак. Если же пациент успел принять пищу, требуется подождать несколько часов, после чего можно выполнять процедуру.
Исходя из вышеперечисленного болезнетворным бактериям необходимо дать свободно размножаться в слизистой на протяжении 3-5 дней. Это позволит получить реальную картину и максимально достоверный результат.
Процедура забора материала для исследования назначается в следующих случаях:
- Для профилактического обследования при приеме на работу в пищевую отрасль, а также в детские и лечебные учреждения.
- В качестве полного обследования беременных женщин, для предупреждения развития инфекций, угрожающих пациенту или ребенку.
- При поступлениях детей в детский сад или школу, чтобы исключить возможность инфекционных вспышек в группах.
- В предоперационный и послеоперационный периоды, а также перед госпитализацией пациента.
- При бактериальной ангине. Анализ позволяет выявить возбудителя и определить тяжесть патогенности для предотвращения таких осложнений, как ревматизм, гломерулонефрит и миокардит.

- В случае воспаления носоглотки для исключения подозрений на дифтерийную инфекцию.
- При подозрении на менингококковую инфекцию или коклюш (данное заболевание достаточно тяжело распознать по клинической картине, поскольку симптомы очень смазаны).
- Для поиска в носоглотке золотистого стафилококка, являющегося причиной образования фурункулов и пиодермии.
- В качестве посева на чувствительность к антибиотикам. Поскольку в результате длительного самостоятельного применения лекарственных препаратов бактерии способны вырабатывать к ним устойчивость.
- Для диагностирования мононуклеза, стенозирующего ларингита и абсцессов, которые находятся вблизи миндалин.
Следовательно, мазок на флору сдают для подтверждения или исключения определенной патологии.
Взятие мазка микрофлоры – это простая и безболезненная процедура, при которой пациенту требуется расслабиться и потерпеть буквально несколько секунд. Некоторый дискомфорт ощущают только люди с хорошо развитым рвотным рефлексом.
Алгоритм получения материала из зева пациента следующий:
- 1. Пациенту необходимо запрокинуть голову назад и широко раскрыть рот, чтобы врачу была видна задняя глоточная стенка (при взятии мазка у детей, специалисту может понадобиться помощь).
- 2. Далее шпателем фиксируется кончик языка, и при помощи удлиненной петли со стерильным ватно-марлевым наконечником выполняется забор материала с глоточной стенки, дужек и миндалин.
- 3. После этого петля быстро помещается в специальную пробирку, которая содержит раствор, предотвращающий гибель бактерий во время транспортировки материала в лабораторию. Если пробирка с таким раствором отсутствует, взятый анализ требуется доставить на исследование в течение двух часов.
- 4. Брать мазок необходимо предельно осторожно, чтобы избежать задевания других поверхностей полости рта (языка, зубов, щек).
как берут и где сдать
Приходилось ли вам когда-нибудь сдавать анализ на стафилококк? Как берут такую проб, какой биоматериал для этого используют, мы расскажем в данной статье. Из нее вы узнаете и о том, как следует подготавливаться к этому исследованию, в каких случаях назначают данный анализ, где его можно сдать и прочее.
Из нее вы узнаете и о том, как следует подготавливаться к этому исследованию, в каких случаях назначают данный анализ, где его можно сдать и прочее.
Общая информация о бактерии
Прежде чем рассказать вам о том, как берут анализ на стафилококк для медкнижки, следует поведать, что представляет собой эта бактерия.
Стафилококком называют грамположительную бактерию, которая имеет сферическую или овальную форму.
В настоящее время известно около 30 видов упомянутого микроорганизма. При этом 10 из них являются постоянными жителями человеческой кожи и не представляют собой никакой опасности.
Какая бактерия может нанести вред
Почему некоторым пациентам назначают анализ на стафилококк (как берут биоматериал, мы расскажем далее)? Дело в том, что наряду с безвредными, существуют и опасные виды этой бактерии. К ним относят эпидермальный, сапрофитный и золотистый стафилококки.
Согласно мнению специалистов, такие микроорганизмы способы не только блокировать защитные функции организма, но и выделять сильнейшие токсины.
Чтобы выявить опасные виды этой бактерии, сдают анализ на стафилококк. Как берут его, известно немногим. Поэтому мы и решили осветить эту тему в представленной статье.
Такой анализ материала является микробиологическим. В ходе лабораторных исследований выявляется тип опасной бактерии, а также определяется ее чувствительность к различным антибиотикам.
Какой биоматериал используется
Теперь вы знаете, для чего назначают анализ на стафилококк. Как сдавать биоматериал для его дальнейшего исследования? Прежде чем ответить на этот вопрос, следует выяснить, откуда его берут.
Чаще всего для лабораторного исследования используют мазок из зева или носа. Однако бывают случаи, когда для анализа необходимо сдать мокроту, кровь, грудное молоко, мазок с конъюнктивы, разовую порцию мочи, кал, вещество, которое выделяется из уха или раны, ректальный и урогенитальный мазки (вместе с секретом предстательной железы).
Какой из вышеперечисленных материалов использовать, должен определять только лечащий врач.
Где сдать анализ на стафилококк
Большинство пациентов не имеют ни малейшего понятия о том, где сдать такой анализ. В этом случае рекомендуем проконсультироваться с тем врачом, который его назначил.
Чаще всего забор, а также исследование биоматериала осуществляют в больницах или поликлиниках. Кроме того, анализ могут провести в узко направленных лабораторных центрах и частных клиниках.
Подготовка к забору материала
Как подготовиться к такому исследованию, как анализ на стафилококк? Как сдавать его правильно, чтобы результаты не оказались ложными? Это зависит от того, какой биоматериал для этого используется. Однако в любом случае перед его сдачей категорически запрещается принимать антибактериальные препараты, так как это может непосредственным образом сказаться на результатах исследования.
Анализ крови на стафилококк следует проводить только натощак, утром. При этом за несколько дней до забора материала ни в коем случае нельзя пить противовирусные средства и использовать антибиотики (даже местного воздействия).
Перед тем как сдать мокроту, пациенту следует выпить большой объем жидкости (за 8-12 часов до посещения клиники).
За 2 дня до сдачи мочи требуется исключить прием мочегонных средств. А за 3 суток до сбора кала следует отказаться от слабительных лекарств и трав, а также таблеток, которые непосредственным образом влияют на его окрас и перистальтику кишечника. Помимо этого, категорически запрещается вводить любые ректальные свечи и мази.
Перед тем как сдать урогенитальный мазок, представителям сильного пола нельзя мочиться на протяжении трех часов. Что касается женщин, то забор этого же биоматериала должен осуществляться за несколько дней перед менструацией или через 2 суток после ее окончания.
Забор материала из зева и носа
Теперь вы знаете, что необходимо сделать, прежде чем сдать свой биоматериал на анализ на стафилококк. Как берут пробу (кровь, мазок), не должно вас волновать. Ведь эта ответственность полностью ложится на плечи специалистов. Следует только отметить, что такой забор осуществляется очень быстро и безболезненно.
Чаще всего для выявления опасных видов стафилококка используют мазок из зева и носа. Это связано с тем, что если в таких биоматериалах находят бактерию, то она непременно обнаруживается и в других.
Прежде чем сдать этот анализ, пациенту рекомендуют подготовиться. Для этого ему требуется прекратить прием пищи и воды за 8 часов до исследования.
Забор биоматериала осуществляют только ранним утром. Перед посещением поликлиники пациенту запрещается чистить зубы, споласкивать рот, горло и сморкаться. Если не соблюсти эти требования, то результаты исследования могут оказаться неточными.
Кто выписывает направление на анализ
Теперь вы знаете, для чего делают анализ на патогенный стафилококк. Как берут биоматериал для исследования, мы также рассказали. Сейчас же хочется поведать вам о том, кто может назначить такой анализ.
Золотистым стафилококком называют условно-патогенную бактерию, которая проявляется при ослабленном иммунитете или нарушенном составе микрофлоры. При отсутствии должного лечения она довольно быстро приводит к инфекционным и воспалительным поражениям местного и системного характера.
При отсутствии должного лечения она довольно быстро приводит к инфекционным и воспалительным поражениям местного и системного характера.
То, как берут анализы на стафилококк (энтерококк, стрептококк), мы выяснили. Но кто же отправляет пациентов на такое исследование? Это зависит от того, какие поражения у них имеются.
Наиболее часто встречающими являются следующие повреждения:
- Кожные покровы (импетиго, карбункулы, фолликулит). В этом случае на анализ отправляет дерматолог.
- Молочные железы (мастит) – маммолог.
- ЛОР-органы (тонзиллит, отит, гайморит, ларинготрахеит, фарингит, пневмонии) – отоларинголог.
- Мочевыводящие пути (уретрит, пиелонефрит, цистит) – уролог.
- Пищеварительная система (энтероколит, перитонит, аппендицит, холецистит, парапроктит) – гастроэнтеролог.
- Костно-суставная система (артрит, остеомиелит) – хирург, ортопед.
Как проводят анализ на золотистый стафилококк
Как берут биоматериал для определения стафилококка? В случае зева и носа используют инструмент, напоминающий длинную ватную палочку. Ею аккуратно проводят по слизистым, а затем помещают в стерильную и плотно закрывающуюся баночку.
Ею аккуратно проводят по слизистым, а затем помещают в стерильную и плотно закрывающуюся баночку.
Для определения вредной бактерии в лабораторных условиях проводится посев биоматериала. Делают это на питательных средах. Примерно через 20-24 часа специалистами наблюдается заметный рост колоний. Именно это является подтверждающим фактом того, что бактерия присутствует в полученном материале.
Помимо того, что анализ на стафилококк помогает определить его наличие в организме человека, такое исследование позволяет выявить его чувствительность к тем или иным антибиотикам.
Когда назначают
Сдать биоматериал на анализ на стафилококк рекомендуют при подозрении на инфекцию, которая может быть вызвана данным микроорганизмом. Кроме того, такое исследование используют при диагностике внутрибольничных заболеваний.
Если же человек не болеет и не имеет никаких жалоб, то такой анализ может быть назначен во время регулярного и планового профессионального осмотра медицинского персонала и работников общепита, а также при наличии беременности.
Нередко такое исследование проводят для лечения заболеваний, которые вызваны стафилококком. Этот метод позволяет диагностировать имеющееся отклонение и оценить эффективность антибактериального лечения. Также его используют для выявления бактерионосительства и правильного подбора лекарственных средств.
Результаты анализа
Сегодня не возникает никаких проблем с тем, где и как сдать анализ на стафилококк. Осуществить забор материала и провести лабораторное исследование могут и сотрудники обычной больницы, и специалисты частных клиник.
Как правило, результат такого анализа никогда не вызывает сомнений. Здесь может быть всего 2 варианта: рост бактерий и его отсутствие.
Положительный результат анализа говорит о наличии острой инфекции, которая вызвана стафилококком, а также о его бессимптомном носительстве. Что касается отрицательного, то он указывает на отсутствие бактерии в организме.
Носительство стафилококка, которое не причиняет никакого дискомфорта пациенту, терапии не подлежит.
Кто находится в зоне риска
В настоящее время выделяют особую группу людей, которая больше всех подвержена развитию инфекционных и воспалительных заболеваний, вызванных стафилококком. К ней относят медработников, больных с ослабленным иммунитетом, серьезными травмами, хирургическими ранами, ожогами, а также фермеров, пожилых людей, детей, наркоманов, солдат, кормящих матерей, заключенных, онкобольных, зараженных СПИДом, пациентов с диабетом и тех, кто находится на гемодиализе.
Стафилококк в мазке: причины появления, норма
Симптомы напрямую зависят от локализации очага инфекции. Таким образом, при развитии инфекции дыхательных путей происходит первая колонизация слизистой оболочки ротовой полости и носоглотки. Это проявляется в виде воспаления, отека и гиперемии. Возникает боль при глотании, потливость, жжение в горле, заложенность носа, присоединяется ринит с выделением желто-зеленой слизи в зависимости от степени тяжести патологии.
По мере прогрессирования инфекционного процесса появляются признаки интоксикации, повышается температура, появляется слабость, снижается общая сопротивляемость организма, снижается иммунитет, в результате чего патологический процесс только обостряется.
Могут быть признаки системного поражения органов. По нисходящим дыхательным путям инфекция спускается вниз, вызывая бронхит, пневмонию, плеврит с сильным кашлем, обильное отделение мокроты.
При развитии инфекции мочеполовых путей и репродуктивных органов в первую очередь возникает раздражение слизистых оболочек, возникают зуд, жжение, гиперемия.Постепенно патологический процесс прогрессирует, воспаление, боль, белые выделения со специфическим запахом. Боль при мочеиспускании, жжение. Прогрессирование болезни приводит к развитию интенсивного инфекционного процесса, который распространяется на область прямой кишки, промежности, внутренних органов.
При локализации воспалительного процесса на коже и поверхности раны рана раненая, появляется специфический запах, местный и затем может повыситься температура тела. Очаги инфекции все время распространяются, рана «мокнет», не заживает, все время разрастается.
При развитии стафилококковой инфекции в пищеварительном тракте появляются признаки пищевого отравления: тошнота, рвота, диарея, расстройство желудка, стул, снижение аппетита. В желудочно-кишечном тракте возникают боли и воспаления: гастрит, энтерит, энтероколит, проктит. При генерализации воспалительного процесса и нарастании признаков интоксикации повышается температура тела, появляется озноб, лихорадка.
В желудочно-кишечном тракте возникают боли и воспаления: гастрит, энтерит, энтероколит, проктит. При генерализации воспалительного процесса и нарастании признаков интоксикации повышается температура тела, появляется озноб, лихорадка.
Первые признаки
Известны ранние симптомы, которые являются предвестниками болезни.Они развиваются по мере увеличения концентрации стафилококка в крови и появляются задолго до появления реальных симптомов.
Итак, развитие стафилококковой инфекции сопровождается учащением пульса и дыхания, появляется дрожь в теле, озноб, повышение температуры тела. При ходьбе повышенная нагрузка, возможно напряжение сердца, легких, появляется небольшая одышка. Возможны головная боль, мигрень, заложенность носа, ушей, реже — слезотечение, потливость и сухость в горле, сухость кожи и слизистых оболочек.
Часто возникает ощущение повышенной температуры, но при измерении остается нормальной. Человек быстро утомляется, резко снижается работоспособность, появляется раздражение, плаксивость, сонливость.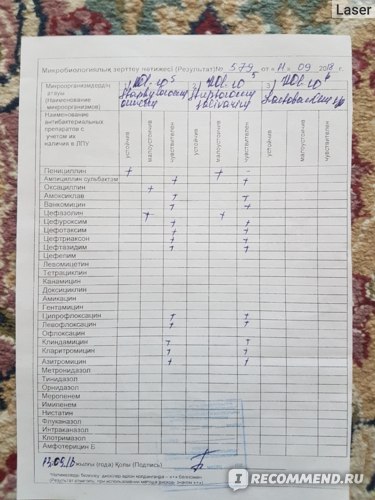 Может уменьшаться концентрация концентрации, способность к концентрации.
Может уменьшаться концентрация концентрации, способность к концентрации.
[19], [20], [21], [22], [23], [24], [25], [26], [27], [28], [29]
Золотистый стафилококк в мазке
Золотистый стафилококк, S. Aureus, является частым возбудителем воспалительных и инфекционных заболеваний внутренних органов человека и животных.Известно более 100 нозологических форм заболеваний, вызываемых этим возбудителем. В основе патогенеза золотистого стафилококка лежит целый комплекс токсических веществ и факторов агрессии, ферментов, вырабатываемых микроорганизмами. Кроме того, было установлено, что патогенность микроорганизма обусловлена генетическими факторами и влиянием окружающей среды.
Стоит подчеркнуть, что золотистый стафилококк имеет полиорганный тропизм, то есть может стать возбудителем патологического процесса в любом органе.Это сам по себе проявляется в способности вызывать гнойно-воспалительные процессы в коже, подкожная клетчатка, лимфатические узлы, дыхательные пути, мочевая система и даже опорно-двигательный аппарат. Это частый возбудитель пищевых отравлений. Особое значение этого микроорганизма определяется его ролью в этиологии внутрибольничных инфекций. Среди золотистого стафилококка часто встречаются метициллинрезистентные штаммы, обладающие высокой устойчивостью к действию любых антибиотиков и антисептиков.
Это частый возбудитель пищевых отравлений. Особое значение этого микроорганизма определяется его ролью в этиологии внутрибольничных инфекций. Среди золотистого стафилококка часто встречаются метициллинрезистентные штаммы, обладающие высокой устойчивостью к действию любых антибиотиков и антисептиков.
В мазке его достаточно легко распознать, так как он имеет форму грамположительных кокков, диаметр которых колеблется от 0,5 до 1,5 мкм, расположенных парами, короткими цепочками или гроздьями в виде грозди винограда. Исправлено, спор не формируется. Выращивайте в присутствии 10% хлорида натрия. Поверхностные структуры способны синтезировать ряд токсинов и ферментов, которые играют важную роль в метаболизме микроорганизмов и определяют их роль в этиологии стафилококковых инфекций.
Также в мазке легко распознать по таким морфологическим признакам, как наличие клеточной стенки, мембранных структур, капсулы и фактора флокуляции. Важную роль в патогенезе играет белок аглютиноген А, который равномерно распределен по толщине клеточной стенки и ковалентно связан с пептидогликаном. Биологическая активность этого белка разнообразна и является неблагоприятным фактором для макроорганизма. Он способен реагировать с иммуноглобулином слизистой оболочки, образовывать комплексы, которые сопровождаются повреждением тромбоцитов и развитием тромбоэмболических реакций.Также является препятствием для активного фагоцитоза, способствует развитию аллергической реакции.
Биологическая активность этого белка разнообразна и является неблагоприятным фактором для макроорганизма. Он способен реагировать с иммуноглобулином слизистой оболочки, образовывать комплексы, которые сопровождаются повреждением тромбоцитов и развитием тромбоэмболических реакций.Также является препятствием для активного фагоцитоза, способствует развитию аллергической реакции.
Эпидермальный стафилококк в мазке
Долгое время считалось, что эпидермальный стафилококк не имеет патогенности. Но недавние исследования подтвердили, что это не так. Является представителем нормальной микрофлоры кожи и может вызывать заболевания у некоторых людей. Особенно это касается людей со сниженным иммунитетом, после ожогов, нарушения целостности кожных покровов, с различными травмами.В результате развития стафилококковой инфекции довольно быстро развивается гнойно-септический воспалительный процесс, появляются зоны некроза, эрозий, язв, нагноений.
В мазке достаточно легко распознать образование пигментированных колоний, диаметром до 5 мм.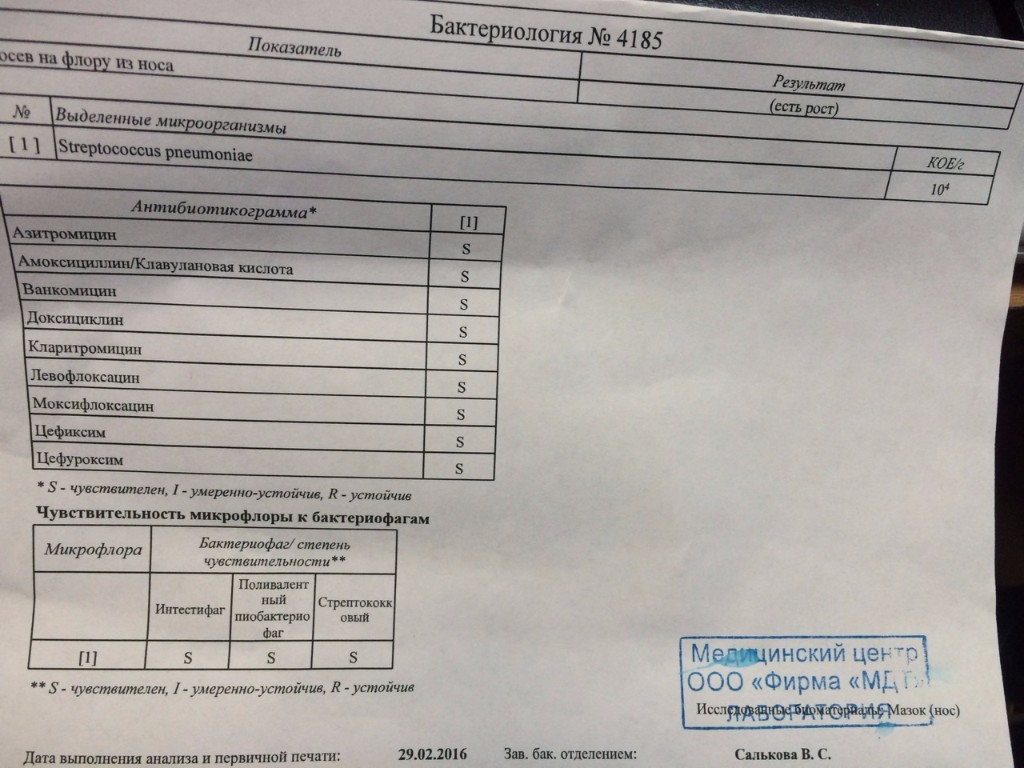 Образуют форму кокков, могут быть одиночными или объединяться в полисоединения, напоминающие виноград. Они могут расти как в аэробных, так и в анаэробных условиях.
Образуют форму кокков, могут быть одиночными или объединяться в полисоединения, напоминающие виноград. Они могут расти как в аэробных, так и в анаэробных условиях.
[30], [31], [32], [33], [34], [35], [36]
Гемолитический стафилококк в мазке
Гемолитические свойства стафилококка заключаются в его способности лизировать кровь.Это свойство обеспечивается синтезом плазмакоагулазы и лейкоцидина, бактериальных токсинов, расщепляющих кровь. Это способность расщеплять и коагулировать плазму, является ведущим и постоянным критерием, по которому легко идентифицируются патогенные стафилококки.
Принцип реакции заключается в том, что плазмакоагулаза вступает в реакцию с кофактором плазмы, образует с ним коагулазотромбин, который превращает тромбиноген в тромбин с образованием тромба.
Плазмакоагулаза — фермент, довольно легко разрушающийся под действием протеолитических ферментов, например трипсина, хемотрипсина, а также при нагревании до температуры 100 градусов и выше в течение 60 минут.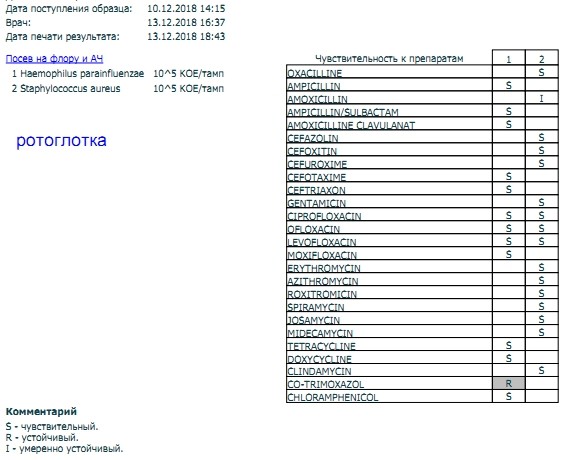 Большие концентрации коагулазы приводят к снижению способности крови к свертыванию, нарушается гемодинамика, происходит оксигенация тканей. Кроме того, фермент способствует образованию фибриновых барьеров вокруг микробной клетки, тем самым снижая эффективность фагоцитоза.
Большие концентрации коагулазы приводят к снижению способности крови к свертыванию, нарушается гемодинамика, происходит оксигенация тканей. Кроме того, фермент способствует образованию фибриновых барьеров вокруг микробной клетки, тем самым снижая эффективность фагоцитоза.
В настоящее время известно 5 типов гемолизинов, каждый из которых имеет свой механизм действия. Альфа-токсин не активен в отношении эритроцитов человека, но лизирует эритроциты овец, кроликов, свиней, агрегирует тромбоциты, оказывает смертельное и дермонекротическое действие.
Бета-токсин вызывает лизис эритроцитов человека, оказывает цитотоксическое действие на фибробласты человека.
Гамма-токсин лизирует эритроциты человека. Также известно его литическое действие на лейкоциты. Не оказывает токсического действия при внутрикожном введении. При внутривенном введении приводит к смерти.
Дельта-токсин отличается от всех остальных токсинов термолабильностью, широким спектром цитотоксической активности, повреждает эритроциты, лейкоциты, лизосомы и митохондрии.
Эпсилон-токсин обеспечивает максимально широкую зону действия, лизируя все типы клеток крови.
Коагулазонегативный стафилококк в мазке
Значение коагулазонегативных стафилококков в развитии патологии внутренних органов не вызывает сомнений. По мнению исследователей, именно эта группа ответственна за развитие патологии урогенитального тракта примерно в 13-14% случаев. Они являются возбудителями кожных и раневых инфекций, конъюнктивита, воспалительных процессов и сепсиса у новорожденных. Самая тяжелая форма инфекции — эндокардит.Особенно увеличилось количество таких осложнений в связи с высокой распространенностью операций на сердце при установке искусственных клапанов и шунтировании сосудов.
Рассматривая биологические свойства, стоит отметить, что микроорганизмы представляют собой кокки диаметром не более 5 мкм, пигменты не образуются, могут расти как в аэробных, так и в анаэробных условиях. Выращивайте в присутствии 10% хлорида натрия. Способен к гемолизу, восстановлению нитратов, уреазе, не продуцирует ДНК. В аэробных условиях они способны производить лактозу, сахарозу, маннозу.Не способен сбраживать маннит и трегалозу.
В аэробных условиях они способны производить лактозу, сахарозу, маннозу.Не способен сбраживать маннит и трегалозу.
Наиболее важным из них является эпидермальный стафилококк, который является одним из ведущих клинически значимых патогенов. Вызывает сепсис, конъюнктивит, пиодермию, инфекции мочевыводящих путей. Также среди коагулазонегативных штаммов много представителей внутрибольничных инфекций.
[37], [38], [39], [40], [41], [42], [43]
Staphylococcus saprophyticus, сапрофитный в мазке
Относится к коагулазонегативным штаммам, которые способны существовать как в аэробных, так и в анаэробных условиях.Активно размножаются на раневой поверхности, на поврежденных участках кожи, при сильных ожогах, при инородном теле в мягких тканях, при трансплантатах, протезах, при инвазивных процедурах.
Часто приводят к развитию токсического шока. Этот эффект обусловлен действием эндотоксинов. Часто развивается при использовании сорбирующих тампонов у женщин во время менструации, в послеродовом периоде, после абортов, выкидышей, гинекологических операций, после длительного использования барьерных контрацептивов.
Клиническая картина представлена резким повышением температуры, тошнотой, резкими болями в мышцах и суставах.Позже появляются типичные пятнистые высыпания, чаще всего генерализованные. Развивается артериальная гипотензия, сопровождающаяся потерей сознания. Летальность достигает 25%.
Золотистый стафилококк в мазке
Это основной возбудитель пищевых токсических инфекций. Хорошо сохранился в окружающей среде. Основной путь передачи — фекально-оральный. Выбрасывается в окружающую среду с фекалиями. Попадает в организм с плохо перевариваемой пищей, грязными руками, немытыми продуктами.
Механизм действия обусловлен стафилококковыми энтеротоксинами, которые представляют собой термостабильные полипептиды, образующиеся при размножении энтеротоксигенных штаммов стафилококков в пище, кишечнике и искусственных питательных средах.Они проявляют высокую устойчивость к действию пищевых ферментов.
Энтеропатогенность токсинов определяется их ассоциацией с эпителиальными клетками желудка и кишечника, воздействуя на ферментативные системы эпителиальных клеток. Это, в свою очередь, приводит к увеличению скорости образования простагландинов, гистамина, усилению секреции жидкости в просвете желудка и кишечника. Кроме того, токсины повреждают мембраны эпителиальных клеток, увеличивая проницаемость кишечной стенки для других токсичных продуктов бактериального происхождения.
Это, в свою очередь, приводит к увеличению скорости образования простагландинов, гистамина, усилению секреции жидкости в просвете желудка и кишечника. Кроме того, токсины повреждают мембраны эпителиальных клеток, увеличивая проницаемость кишечной стенки для других токсичных продуктов бактериального происхождения.
Вирулентность фекальных энтеропатогенных стафилококков регулируется генетическим аппаратом бактериальной клетки в ответ на действие факторов окружающей среды, что позволяет микроорганизму быстро адаптироваться к условиям окружающей среды, что позволяет микроорганизму быстро адаптироваться к изменяющимся условиям в переходный период. от одного микробиоценоза к другому.
Лечение инфекций, вызванных Staphylococcus aureus
ДЭВИД М. БАМБЕРГЕР, доктор медицины, и САРА Э. БОЙД, М.D.
Университет Миссури — Канзас-Сити, Канзас-Сити, Миссури
Am Fam Physician. , 15 декабря 2005 г .; 72 (12): 2474-2481.
Из-за высокой заболеваемости, заболеваемости и устойчивости к противомикробным препаратам инфекции, вызываемые Staphylococcus aureus, вызывают все большую озабоченность у семейных врачей. В настоящее время известны штаммы S. aureus, устойчивые к ванкомицину. Увеличение числа случаев нераспознанных внебольничных инфекций, устойчивых к метициллину, S. aureus, представляет высокий риск заболеваемости и смертности.Хотя заболеваемость комплексными инфекциями, вызванными S. aureus, растет, для лечения доступны новые противомикробные препараты, включая даптомицин и линезолид. S. aureus является распространенным патогеном при инфекциях кожи, мягких тканей, катетера, костей, суставов, легких и центральной нервной системы. Бактеремии, вызванные S. aureus, представляют особую проблему из-за высокой частоты сопутствующих осложненных инфекций, включая инфекционный эндокардит. Соблюдение мер предосторожности, рекомендованных Центрами по контролю и профилактике заболеваний, особенно мытье рук, является неоптимальным.
Примерно 20 процентов здоровых людей являются стойкими носителями Staphylococcus aureus, а 60 процентов являются носителями с перерывами. Уровень колонизации увеличивается у пациентов, находящихся на гемодиализе, потребителей запрещенных инъекционных наркотиков, хирургических пациентов и пациентов с инсулинозависимым или плохо контролируемым диабетом.1 Национальная система надзора за внутрибольничными инфекциями2 обнаружила, что 60 процентов изолятов S. aureus, приобретенных в больницах в 2003 году, были метициллином -резистентный S. aureus (MRSA). Госпитализированные пациенты с S.aureus в пять раз выше риска внутрибольничной смертности по сравнению с пациентами без этой инфекции.3
Просмотреть / распечатать таблицу
СОРТИРОВКА: ОСНОВНЫЕ РЕКОМЕНДАЦИИ ДЛЯ ПРАКТИКИ
| Клиническая рекомендация | Рейтинг доказательности | Ссылки |
|---|---|---|
Ванкомицин (ванкоцин) не следует использовать для лечения известных метициллин-чувствительных инфекций Staphylococcus aureus, если нет аллергии на беталактам. | C | 10, 11 |
Врачи должны знать о региональной распространенности внебольничного MRSA и соответственно планировать эмпирическую терапию для инфекций S. aureus. | C | 8 |
У пациентов с бактериемией следует удалить нетуннелированные центральные венозные катетеры и туннельные катетеры с туннельной, карманной или внешней инфекцией. | C | 20 |
Все центральные венозные катетеры следует удалить, если у пациента бактериемия сохраняется более 72 часов. | C | 16, 20 |
Большинству взрослых пациентов с остеомиелитом требуется парентеральная терапия от четырех до шести недель или длительные курсы (от трех до шести месяцев) пероральных антибиотиков с высокой биодоступностью. Некоторые дети с острым гематогенным остеомиелитом восприимчивых организмов реагируют на более короткий курс парентеральной терапии с последующим курсом пероральной терапии. | C | 22, 23 |
Большинство инфицированных аппаратных устройств, таких как шунты центральной нервной системы, устройства ортопедической фиксации и протезы суставов, необходимо удалить, но имеются ограниченные доказательства того, что ранняя стабилизация Инфекции протезных суставов могут реагировать на длительные курсы комбинированной терапии хинолон-рифампицином (рифадин) для восприимчивых организмов. | B | 22, 25 |
Большинство абсцессов и эмпием требует дренирования, но из отчетов о случаях доступны ограниченные доказательства того, что некоторые небольшие абсцессы восприимчивых организмов у клинически стабильных пациентов поддаются медикаментозной терапии без дренажа . | C | 28 |
Госпитализированным пациентам, инфицированным или колонизированным MRSA, следует соблюдать меры предосторожности при контакте.Использование активных культур для наблюдения может предотвратить распространение MRSA среди госпитализированных пациентов. | C | 29–31 |
СОРТИРОВКА: КЛЮЧЕВЫЕ РЕКОМЕНДАЦИИ ДЛЯ ПРАКТИКИ
| Клиническая рекомендация | Оценка доказательности | c |
|---|---|---|
C | 10, 11 | |
Врачи должны знать о региональной распространенности внебольничного MRSA и соответственно планировать эмпирическую терапию для инфекций S. aureus. | C | 8 |
У пациентов с бактериемией следует удалить нетуннелированные центральные венозные катетеры и туннельные катетеры с туннельной, карманной или внешней инфекцией. | C | 20 |
Все центральные венозные катетеры следует удалить, если у пациента бактериемия сохраняется более 72 часов. | C | 16, 20 |
Большинству взрослых пациентов с остеомиелитом требуется парентеральная терапия от четырех до шести недель или длительные курсы (от трех до шести месяцев) пероральных антибиотиков с высокой биодоступностью. Некоторые дети с острым гематогенным остеомиелитом восприимчивых организмов реагируют на более короткий курс парентеральной терапии с последующим курсом пероральной терапии. | C | 22, 23 |
Большинство инфицированных аппаратных устройств, таких как шунты центральной нервной системы, устройства ортопедической фиксации и протезы суставов, необходимо удалить, но имеются ограниченные доказательства того, что ранняя стабилизация Инфекции протезных суставов могут реагировать на длительные курсы комбинированной терапии хинолон-рифампицином (рифадин) для восприимчивых организмов. | B | 22, 25 |
Большинство абсцессов и эмпием требует дренирования, но из отчетов о случаях доступны ограниченные доказательства того, что некоторые небольшие абсцессы восприимчивых организмов у клинически стабильных пациентов поддаются медикаментозной терапии без дренажа . | C | 28 |
Госпитализированным пациентам, инфицированным или колонизированным MRSA, следует соблюдать меры предосторожности при контакте.Использование активных культур для наблюдения может предотвратить распространение MRSA среди госпитализированных пациентов. | C | 29–31 |
Внебольничные инфекции MRSA, которые обычно вызывают инфекции кожи и мягких тканей, стали более распространенными.4,5 Возникновение этих инфекций увеличилось у спортсменов, новобранцы, дети, жители тихоокеанских островов, коренные жители Аляски, коренные американцы, мужчины, практикующие секс с мужчинами, и заключенные6
Эти изоляты часто связаны с лейкоцидином Пантона-Валентайна и стафилококковой кассетной хромосомой IV типа, что не является типичным госпитализированных MRSA.Также наблюдались постгриппозные пневмонии 7, некротический фасциит, пиомиозит 8 и синдром Уотерхауса-Фридериксена9, вызванные внебольничным MRSA.
Антимикробная терапия
В таблице 1 перечислены затраты на антибактериальную терапию при инфекциях, вызванных S. aureus. При антимикробной терапии следует руководствоваться профилем чувствительности организма.6 Штаммы метициллин-чувствительного S. aureus (MSSA), продуцирующие бета-лактамазу, предпочтительно лечить полусинтетическим пенициллином (например,например, внутривенный нафциллин, оксациллин [бактоцил], пероральный диклоксациллин [динапен]) пациентам, не страдающим аллергией на пенициллин. Альтернативой являются цефалоспорины первого поколения (например, цефалексин для перорального приема [Keflex], цефазолин для внутривенного введения [Ancef]). Ванкомицин (ванкоцин) следует использовать только для лечения MSSA у пациентов с аллергией на пенициллины из-за чрезмерного использования и развития резистентных организмов, а также из-за того, что выведение бактериемии может быть медленным.10
Просмотр / печать таблицы
ТАБЛИЦА 1
Стоимость антибиотикотерапии при инфекциях, вызванных Staphylococcus aureus
| Антибиотик | Репрезентативная доза | Стоимость в день (дженерик) * | |
|---|---|---|---|
Цефалексин (Keflex) | |||
Диклоксациллин (Динапен) | 500 мг перорально каждые шесть часов | 8 (от 5 до 7) | |
Триметраптрим | 160 мг / 800 мг каждые 12 часов | 2 (от 1 до 2) | |
C линдамицин (Клеоцин) | 300 мг перорально каждые шесть часов | 24 (14-15) | |
600 мг внутривенно каждые восемь часов | 25 (13) | 600 мг перорально каждые 12 часов | 130 |
600 мг внутривенно каждые 12 часов | 164 | ||
124 | |||
Цефазолин (Анцеф) | 2 г внутривенно каждые восемь часов | 33 (от 7 до 16) | |
| com | 1 г внутривенно каждые 12 часов | 69 (от 18 до 40) | |
D аптомицин (кубицин) | 300 мг внутривенно один раз в сутки | 171 |
ТАБЛИЦА 1
Стоимость антибактериальной терапии при инфекциях, вызванных Staphylococcus aureus,
| Типичная доза антибиотика | Типичная доза антибиотика | ) * | ||||
|---|---|---|---|---|---|---|
Цефалексин (Кефлекс) | 500 мг перорально каждые шесть часов | $ 14 (от 2 до 5) | ||||
Диклоксациллин 9203 каждые 500 мг шесть часов | 8 (от 5 до 7) | |||||
Триметоприм / сульфаметоксазол (Bactrim, Septra) | 160 мг / 800 мг каждые 12 часов | 2 (от 1 до 2) | ||||
Клиндамицин (Клеоцин) | 300 мг перорально каждые шесть часов | 24 (14-15) 9 0123 | ||||
600 мг внутривенно каждые восемь часов | 25 (13) | |||||
Линезолид (Зивокс) | 600 мг внутрь каждые 12 часов | 02 | 02 600 мг внутривенно каждые 12 часов | 164 | ||
Нафциллин | 2 г внутривенно каждые четыре часа | 124 | внутривенно | |||
каждые восемь часов | 33 (от 7 до 16) | |||||
Ванкомицин (Ванкоцин) | 1 г внутривенно каждые 12 часов | 69 (от 18 до 40) | 300 мг внутривенно один раз в сутки | 171 |
Ванкомицин предпочтителен для лечения тяжелых инфекций MRSA и используется только внутривенно, поскольку пероральный препарат плохо всасывается из желудочно-кишечного тракта.Сообщалось о штаммах S. aureus с промежуточной чувствительностью к ванкомицину и устойчивостью к ванкомицину. Даже у пациентов с чувствительным к ванкомицину MRSA были сообщения о неэффективности лечения ванкомицином, что, как полагают, связано с гетерогенными субпопуляциями с различной чувствительностью к ванкомицину 11 или связано с присутствием регуляторного гена agr-группы II полиморфизма.
Линезолид (Зивокс) обладает бактериостатической активностью в отношении S. aureus и одобрен для лечения сложных инфекций кожи и мягких тканей, а также пневмонии у взрослых и детей.Он включен в класс оксазолидиноновых препаратов и имеет парентеральные и пероральные препараты с хорошей биодоступностью при пероральном введении. Один ретроспективный анализ13 базы данных проспективного рандомизированного исследования показал повышенную эффективность линезолида по сравнению с ванкомицином при нозокомиальной пневмонии MRSA. Обоснование может быть связано с повышенными концентрациями линезолида в жидкости эпителиальной выстилки легких. Основным нежелательным явлением, связанным с приемом линезолида, является угнетение функции костного мозга, особенно тромбоцитопения, которая увеличивается с увеличением дозировки и продолжительности терапии.Следует избегать одновременного приема селективных ингибиторов обратного захвата серотонина и адренергических препаратов из-за токсичности для центральной нервной системы.
Даптомицин (кубицин) из нового класса циклических липопептидов представляет собой антибиотик с активностью против MSSA и MRSA. Быстро бактерицидно против S. aureus in vitro; одобрен для взрослых с осложненными инфекциями кожи и мягких тканей14; сильно связывается с белками сыворотки крови, но плохо проникает в ткань легких; и инактивирован сурфактантом, поэтому его нельзя использовать при легочных инфекциях.Во время терапии следует контролировать уровни креатининкиназы, поскольку были сообщения о токсичности для мышц. Даптомицин доступен только для внутривенного введения, а рекомендуемая доза составляет 4 мг на кг в течение 30 минут путем внутривенной инфузии 0,9% хлорида натрия один раз в день в течение одной-двух недель.
Внебольничные изоляты MRSA часто чувствительны к фторхинолонам, триметоприму / сульфаметоксазолу (Бактрим, Септра), тетрациклинам и клиндамицину (Клеоцин). Если очаг инфекции поверхностный, возможно, имеет смысл обработать его одним из этих агентов.На основании результатов тестирования минимальной ингибирующей концентрации в лаборатории могут быть указаны внебольничные MRSA как чувствительные к клиндамицину и устойчивые к эритромицину. В этих случаях клиндамицин может иметь индуцибельную резистентность, которая может возникнуть при терапии, поэтому лаборатория может провести тест диффузии с двумя дисками, чтобы проверить индуцибельную резистентность и определить истинную чувствительность15
Инфекции кожи и мягких тканей
S. aureus ассоциируется с различными инфекциями кожи и мягких тканей, включая фолликулит, импетиго, фурункулы, карбункулы, гнойный гидраденит и целлюлит.Управление зависит от степени вовлеченности. Уход за раной и дренирование могут быть всем, что необходимо при небольших локализованных поражениях. Локализованное импетиго можно лечить местно с помощью мупироцина (бактробана). Системные антибиотики используются при целлюлите или при наличии системных симптомов. Рекомендуются короткие курсы (то есть от пяти до 14 дней) (таблица 2). Более крупные карбункулы или локализованные абсцессы требуют разреза и дренирования. Из-за растущей озабоченности по поводу внебольничного MRSA, гнойные поражения, требующие системной терапии, следует культивировать, чтобы можно было провести тестирование на чувствительность к противомикробным препаратам, а при первоначальном эмпирическом лечении следует учитывать местную распространенность внебольничных MRSA.8
Просмотр / печать таблицы
ТАБЛИЦА 2
Антимикробная терапия инфекций, вызванных Staphylococcus aureus
| Тип инфекции | Выбор антибиотика | Альтернативный выбор антибиотиков | Продолжительность лечения кожные инфекции | От пяти до семи дней | |||||
|---|---|---|---|---|---|---|---|---|---|
MSSA | Цефалексин (Кефлекс), диклоксациллин (Динапен) | Клиндамицин 1230003 | |||||||
–– | |||||||||
Комплексные инфекции кожи и мягких тканей | От двух до четырех недель (в зависимости от) 03 | Нафциллин | Цефазолин (Анцеф), клиндамицин | ||||||
MRSA | Ванкомицин (Ванкомицин) | Линезолид, даптомицин (Кубицин) от | MSSA | Нафциллин | Цефазолин, ванкомицин | ||||
MRSA | Ванкомицин 2 MRSA | Ванкомицин 2 | 3 | ||||||
MSSA | Nafcillin | Цефазолин, ванкомицин | |||||||
MRSA | Ванкомицин | линезолид, даптомицин | |||||||
Osteomyeli tis | От четырех до шести недель | ||||||||
MSSA | Нафциллин, цефазолин | Клиндамицин, хинолон плюс рифампицин (Рифадин 13 | |||||||
Пневмония | от 10 до 14 дней | ||||||||
MSSA | Нафциллин 0003 9123 , линезолид | — | |||||||
ТАБЛИЦА 2
Антимикробная терапия при инфекциях, вызванных Staphylococcus aureus
| Тип инфекции | Выбор антибиотика | Ple, неосложненные кожные инфекции | От пяти до семи дней | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
MSSA | Цефалексин (Кефлекс), диклоксациллин (Динапен) | Клиндамицин, триметоприм / сульфаметоксазол (Бактрим, Септра), линезолид (Зивокс) | –– | |||||||||||||||
Сложные инфекции кожи и мягких тканей | ||||||||||||||||||
MSSA | Нафциллин | Цефазолин (Анцеф), клиндамицин | ||||||||||||||||
MRSA | 3 | 2 | ||||||||||||||||
Две-четыре недели | ||||||||||||||||||
M SSA | Нафциллин | Цефазолин, ванкомицин | ||||||||||||||||
MRSA | Ванкомицин | 03 | ||||||||||||||||
MSSA | Nafcillin | цефазолин, ванкомицин | ||||||||||||||||
MRSA | ванкомицин | линезолида, даптомицин | ||||||||||||||||
остеомиелит | От четырех до шести недель | |||||||||||||||||
MSSA | Нафциллин, цефазолин | Клиндамицин, хинолон плюс рифампин (рифампин) 0003 | ||||||||||||||||
Пневмония | от 10 до 14 дней | |||||||||||||||||
MSSA | Нафциллин | Нафциллин | cls , линезолид | — | ||||||||||||||
S.aureus, опосредованный выработкой токсина, также может вызывать синдром токсического шока и синдром ошпаренной стафилококковой инфекции. Синдром токсического шока проявляется в виде лихорадки, гипотонии, макулярной сыпи, которая позже шелушится, и полиорганной недостаточности. Лечение включает удаление очага S. aureus (например, дренирование абсцесса или удаление тампона) и использование резистентного к беталактамазе антистафилококкового антибиотика в сочетании с клиндамицином, который может снизить выработку токсинов. Лечение синдрома обожженной кожи стафилококком часто требует внутривенного введения антибиотиков и, возможно, дренирования очагов поражения, которые являются основой инфекции штаммами, продуцирующими токсины.
Бактериемия
Бактериемия S. aureus может привести к нескольким осложнениям, включая инфекционный эндокардит, сепсис или метастатические очаги инфекции. Около 12 процентов пациентов с бактериемией, вызванной S. aureus, имеют инфекционный эндокардит. 16 Чреспищеводная эхокардиография превосходит трансторакальную эхокардиографию в диагностике перивальвулярного абсцесса, поражения протезного клапана и распознавания более мелких вегетаций. Трансторакальная эхокардиография помогает диагностировать инфекционный эндокардит и прогнозировать серьезные внутрисердечные осложнения.17 Исследование экономической эффективности18 показало, что при клинически неосложненной катетер-ассоциированной бактериемии S. aureus использование чреспищеводной эхокардиографии было рентабельным по сравнению с двух-четырехнедельной эмпирической антимикробной терапией, хотя этот вопрос остается спорным. Консультации со специалистом по инфекционным заболеваниям могут быть полезными.19 Алгоритм лечения бактериемии S. aureus представлен на рисунке 1.
Просмотр / печать Рисунок
Лечение бактериемии Staphylococcus aureus
Рисунок 1.
Алгоритм лечения бактериемии Staphylococcus aureus. (ЧВЭ = чреспищеводная эхокардиография.)
Лечение бактериемии Staphylococcus aureus
Рис. 1.
Алгоритм лечения бактериемии Staphylococcus aureus. (ЧВЭ = чреспищеводная эхокардиография.)
Инфекции, связанные с катетером
Руководства Американского общества инфекционных болезней20 рекомендуют удаление центральных венозных катетеров без туннелирования, связанных с S.бактериемия aureus. Туннелируемый (например, катетер Хикмана) или имплантируемое устройство следует удалить, если есть гной или эритема в месте выхода или вдоль туннеля, свидетельства инфекции кармана или если это связано с сложной глубокой инфекцией. При оценке катетерных инфекций кровотока рекомендуется чреспищеводная эхокардиография. При отсутствии эндокардита, септического флебита или глубокой инфекции рекомендуется 14 дней системной антимикробной терапии.20 Попытка спасти катетер у пациентов с неосложненными инфекциями должна включать терапию антибиотикотерапией (то есть заполнение просвета катетера антибиотиками высокой концентрацией и оставление их там на несколько часов или дней) с двухнедельной парентеральной антимикробной терапией.20 Катетер должен быть удаляется при наличии стойкой бактериемии в течение 72 или более часов терапии, клинического ухудшения или рецидива бактериемии. Бета-лактам (т.е. нафциллин) — препарат выбора для пациентов с MSSA, не имеющих аллергии на пенициллин; ванкомицин предпочтителен при инфекциях, ассоциированных с катетером MRSA.20
Остеомиелит
S. aureus является наиболее часто изолированным микроорганизмом при остеомиелите, и более одной трети этих изолятов могут быть MRSA.21 Гематогенное распространение S. aureus может привести к позвоночному остеомиелиту и потенциально эпидуральному образованию абсцесса. Лечение остеомиелита, вызванного S. aureus, должно включать в себя по крайней мере четыре-шесть недель антимикробной терапии.22 Пациенты с остеомиелитом позвоночника, особенно при наличии неврологических симптомов, должны быть обследованы с помощью магнитно-резонансной томографии на предмет образования эпидурального абсцесса.У детей гематогенное распространение часто вызывает остеомиелит длинных костей. Короткие курсы (т.е. две недели) внутривенного введения антибиотиков с последующими двумя-четырьмя неделями перорального приема антибиотиков могут использоваться у детей, которые быстро реагируют на первоначальные антибиотики и не имеют осложнений.23 В дополнение к длительной антимикробной терапии обычно требуется хирургическое лечение. при остеомиелите, вторичном по отношению к прилегающему очагу инфекции, обычно наблюдается после ортопедической операции или травмы. Зараженные аппаратные средства обычно требуют удаления, что может быть отложено с использованием пероральных противомикробных препаратов до тех пор, пока не будет обеспечена стабильность при несращении костей.24
Совместные инфекции
S. aureus является основным возбудителем инфекций суставов. Хотя есть ограниченные данные о лечении, обычно оно проводится с использованием дренажа в сочетании с четырехнедельным курсом противомикробных препаратов. В течение последних двух недель пациентам без бактериемии иногда назначают внутрь противомикробные препараты. Инфекции протезных суставов трудно искоренить с помощью инородного материала, и обычно требуется удаление протеза с последующим введением антибиотиков в течение четырех-шести недель для лечения инфекции.Ограниченные данные показывают, что инфицированные суставные протезы с ранним началом можно лечить ранней обработкой раны и продолжительными курсами хинолона плюс рифампицин (рифадин) без удаления протеза.25
Легочные инфекции
Пневмония S. aureus может быть вызвана гематогенным распространением или аспирацией. и является частым возбудителем внутрибольничных пневмоний. Внебольничная пневмония, вызванная S. aureus, чаще возникает после инфицирования гриппом, и описан внебольничный MRSA, связанный с лейкоцидином Пантона-Валентайна.7 Результаты рентгенограммы грудной клетки могут различаться по представлению от локализованного уплотнения до абсцесса и многодолевых диффузных инфильтратов. Эмпиема вызвана распространением местной пневмонии. Терапия включает дренаж через трубку грудной клетки, а иногда требуется тораскопический или открытый дренаж. 26
Инфекции центральной нервной системы
S. aureus, по оценкам, вызывает примерно 2% всех случаев бактериального менингита из гематогенного или послеоперационного происхождения. Восемьдесят четыре процента пациентов с послеоперационным С.При менингите aureus был установлен катетер, обычно шунт или эпидуральный катетер27. Такие устройства необходимо удалить и заменить после того, как инфекция исчезнет.
S. aureus вызывает от 10 до 15 процентов абсцессов головного мозга и от 60 до 90 процентов эпидуральных абсцессов и септических венозных тромбозов. Обычно требуется хирургический или рентгенологический дренаж, но некоторые небольшие абсцессы у пациентов без неврологических нарушений поддаются медикаментозному лечению.28
Профилактика
Контактные меры предосторожности, рекомендованные Центрами по контролю и профилактике заболеваний для госпитализированных пациентов с MRSA, включают использование частного при входе в палату в перчатках, в халате, если ожидается контакт с пациентом или предметами в комнате, и мытье рук при снятии перчаток.29 Несмотря на эти рекомендации, частота нозокомиального MRSA увеличивается.2 Неясно, насколько эти рекомендации эффективны в борьбе с MRSA, 30,31 и хорошо спланированные рандомизированные контролируемые исследования не проводились. Соблюдение рекомендаций было неоптимальным, и мытье рук, в частности, было недостаточным. Около 5 процентов госпитализированных пациентов инфицированы MRSA. Защитники предположили, что более активное наблюдение с использованием превентивной изоляции и скрининга пациентов с более строгим соблюдением контактных мер предосторожности и мытья рук может быть более успешным.29
Местный мупироцин эффективен в снижении носовой колонизации S. aureus, 32 но использование местного мупироцина для снижения риска хирургических или нехирургических инфекций, вызванных S. aureus, не было надежно успешным.33,34 Это также неэффективно. ясно, что местный мупироцин снижает колонизацию MRSA35. Попытки сочетать местный мупироцин с антибактериальными ваннами (например, с хлоргексидином или системными средствами) заслуживают дальнейшего изучения.
Морфология колонии Staphylococcus aureus и микроскопический вид, основные характеристики и тесты для идентификации S.aureus бактерии. Изображения золотистого стафилококка. Лечение антибиотиками стафилококковых инфекций.
Золотистый стафилококк
Staphylococcus aureus на колумбийском агаре с 5% дефибринированной овечьей кровью (Bio-Rad ™).
Отдельные колонии на агаре круглые, выпуклые, диаметром 1-4 мм с резкой границей. На чашках с кровяным агаром колонии Staphylococcus aureus
часто окружены зонами чистого бета-гемолиза .Золотистый вид колоний некоторых штаммов является этимологическим корнем названия бактерии; aureus означает « золотой » на латыни.
Метициллин-устойчивые штаммы из Staphylococcus aureus (то есть MRSA) часто имеют только слабый бета-гемолиз или его отсутствие, поэтому для их выделения используются специальные среды для культивирования с оксациллином, маннитом и NaCl. MRSA может расти на этой среде и производить колонии.
определенного цвета, в зависимости от используемого индикатора pH (на этом рисунке розового).
Staphylococcus aureus может встречаться как комменсал на коже человека ; также встречается в носу часто
( примерно у трети населения ) и горло реже. Появление S. aureus при этих обстоятельствах
не всегда указывает на инфекцию и поэтому не всегда требует лечения (действительно, лечение может быть неэффективным и может произойти повторная колонизация). Он может выжить на домашних животных, таких как собаки, кошки и лошади. S. aureus может инфицировать другие ткани при нарушении барьеров (например, кожи или слизистой оболочки). Это приводит к фурункулам (фурункулам) и карбункулам (скоплению фурункулов). У младенцев S. aureus инфекция может
вызывают тяжелое заболевание Синдром ошпаренной кожи стафилококка (SSSS) .
Глубоко проникающая инфекция S. aureus может быть тяжелой. Протезирование суставов подвергает человека особому риску септического артрита и стафилококкового эндокардита
(инфекция сердечных клапанов) и пневмония , которые могут быстро распространяться.
Сокращенно из Википедии.
Staphylococcus aureus Основные характеристики
- ГРАМПОЛОЖИТЕЛЬНЫЙ КОЧИ В КЛАСТЕРАХ
- НЕМОТИЛЬНОЕ
- НЕФОРМИРУЮЩИЕ
- КАТАЛАЗ: ПОЛОЖИТЕЛЬНЫЙ
- ОКСИДАЗА: ОТРИЦАТЕЛЬНАЯ
- ФАКУЛЬТАТИВНО АНАЭРОБНЫЙ
Идентификация Staphylococcus aureus
- производство коагулазы (свободной коагулазы)
- наличие фактора слипания (клеточно-связанная коагулаза)
- толерантность к хлориду натрия (7.5%)
- ферментация маннита
- производство гиалуронидазы (положительный тест декапсуляции с S.equi )
Лечение антибиотиками Staphylococcus aureus инфекций
Всегда руководствоваться тестами на чувствительность in vitro !!
Выбор подходящих антибиотиков зависит от диагноза !!
ЕСЛИ ДОПУСТИМО:
Staphylococcus aureus Колонии на агаровой среде для культивирования
Staphylococcus aureus на кровяном агаре
Золотистый стафилококк Бета-гемолиз
Staphylococcus aureus желтый пигмент
Staphylococcus aureus без желтого пигмента (стафилоксантина)
Фактор слипания (коагулаза, связанная с клетками) и свободная коагулаза
Толерантность к хлориду натрия (7.5-10%) и ферментация маннита
Продукция лецитиназы и активность липазы на агаре Baird Parker
Производство гиалуронидазы (тест декапсуляции с использованием S.equi ssp. zooepidemicus )
Золотистый стафилококк MRSA
Золотистый стафилококк Образование биопленки
Staphylococcus aureus Окраска по Граму
Staphylococcus aureus прочие
Золотистый стафилококк 3D
Полезные ссылки
ВИКИПЕДИЯ
ЦЕНТРЫ КОНТРОЛЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ (CDC)
Интернет-учебник бактериологии Тодара
ЭЛЕКТРОННАЯ МЕДИЦИНА
www.antimicrobe.org
Microbe Wiki (ресурс по микробиологии, редактируемый студентами)
www.vetbact.org
Руководство Merck
Блог Юрия
Границы | Носовая колонизация Staphylococcus aureus: обновленная информация о механизмах, эпидемиологии, факторах риска и последующих инфекциях
Введение
Staphylococcus aureus является комменсалом как кожи, так и слизистых оболочек человека, но также является частой причиной серьезных инфекций с высокой заболеваемостью, смертностью и расходами, связанными со здравоохранением (Schmidt et al., 2015). Наиболее частым местом носительства является vestibulum nasi (или передние ноздри), который служит резервуаром для распространения патогена (Williams, 1963; Sivaraman et al., 2009). Эти бактерии могут устанавливать прочное взаимодействие с эпителиальными клетками носа через различные белки и многие компоненты клеточной поверхности (Wertheim et al., 2005a; Mulcahy and McLoughlin, 2016), тем самым трансформируясь в постоянное носительство. S. aureus колонизирует передние ноздри от 20% до 80% человеческой популяции (Brown et al., 2014). Было показано, что носительство играет ключевую роль в патогенезе инфекций S. aureus (Kluytmans et al., 1997) у пациентов, перенесших операцию (Perl et al., 2002; Bode et al., 2010), диализ ( Kluytmans et al., 1996; Nouwen et al., 2006), а также у пациентов в отделениях интенсивной терапии (ICU) (Garrouste-Orgeas et al., 2001) с более высокими рисками инфицирования у постоянных носителей (Nouwen et al., 2006) .
Ранее опубликованные обзоры носительства S. aureus обычно независимо фокусировались на колонизации или инфекциях или выявляли конкретное основное заболевание или операцию.Здесь мы полностью рассмотрим последние достижения в составе носовой микробиоты и межвидовых взаимодействиях, эпидемиологии и факторах риска колонизации S. aureus , а также связь между носительством через нос и инфекциями как в сообществе, так и в нозокомиальном контексте.
Микробиота носа и взаимодействия между бактериями
Микробиота носа у взрослых особей различается, но виды, принадлежащие к родам Corynebacterium, Propionibacterium и Staphylococcus , являются наиболее распространенными бактериями (Frank et al., 2010; Консорциум проекта по микробиому человека, 2012 г .; Ян и др., 2013; Каспар и др., 2016). В исследовании, проведенном на носовой микробиоте 178 взрослых, 88,2% были носителями Corynebacterium , 83,7% носителями Propionibacterium acnes и 90,4% носителями Staphylococcus epidermidis . Пропорциональная численность значительно различалась между особями (Liu C.M. et al., 2015).
Состояние здоровья может влиять на микробиоту носа и наоборот. В исследовании, в котором участвовали здоровые и госпитализированные люди, здоровые взрослые имели микробиоту ноздрей, в которой преобладали актинобактерий (в основном Propionibacterium и Corynebacterium spp.), тогда как в микробиоте пациентов преобладали S. aureus и S. epidermidis . Колонизация S. aureus была отрицательно связана с присутствием других бактерий, включая S. epidermidis (Frank et al., 2010). Такой противовес между бактериями может быть результатом взаимозависимых механизмов ингибирования активации, как описано Krismer et al. (2017). Фактически, некоторые виды бактерий способны секретировать антистафилококковые молекулы, модулирующие S.aureus (рисунок 1). Например, продукция in vitro, H 2 O 2 с помощью Streptococcus pneumoniae , может оказывать бактерицидное действие на S. aureus (Regev-Yochay et al., 2006; Selva et al., 2009). Недавно исследование in vitro и исследование на людях продемонстрировало, что лугдунин, биоактивное соединение, синтезируемое не рибосомами, продуцируемое стафилококком Staphylococcus lugdunensis , может предотвращать носовую колонизацию S. aureus за счет бактерицидного эффекта (Zipperer et al., 2016).
РИСУНОК 1. Основные бактериальные взаимодействия с носовыми S. aureus .
В некоторых случаях секретируемые бактериями молекулы могут изменять адгезионные свойства S. aureus . Некоторые типы S. epidermidis , по-видимому, способны синтезировать сериновую протеазу Esp, которая устраняет назальный S. aureus у здоровых людей (Iwase et al., 2010), вероятно, за счет разрушения поверхностных белков стафилококков и человеческих рецепторов, критических для хозяина. –Патогенное взаимодействие (Sugimoto et al., 2013). Кроме того, виды Propionibacterium продуцируют копропорфирин III, метаболит порфирина, который вызывает агрегацию S. aureus , влияющую на носовую колонизацию (Wollenberg et al., 2014).
Corynebacterium видов, как предполагается, противодействуют S. aureus с помощью механизмов конкуренции связывания человеческих клеток (Uehara et al., 2000; Lina et al., 2003). У 156 здоровых добровольцев Uehara et al. (2000) наблюдали общий уровень эрадикации назальных S.aureus после выполнения до 15 инокуляций Corynebacterium sp. штамм в ноздри носителей S. aureus .
Описана также внутривидовая конкуренция. В перекрестном клиническом исследовании было высказано предположение, что метициллин-чувствительный S. aureus (MSSA) и метициллин-устойчивый S. aureus (MRSA) конкурируют за колонизацию, причем MSSA защищает от носительства MRSA (Dall ‘ Антония и др., 2005). С другой стороны, ранее существовавшая носовая каретка с S.aureus может предрасполагать взрослых пациентов к дальнейшей колонизации стафилококками (Ghasemzadeh-Moghaddam et al., 2015).
Распространение и передача S. aureus
Staphylococcus aureus может быть обнаружен в различных участках тела, таких как кожа, прямая кишка, влагалище, желудочно-кишечный тракт и подмышечная впадина, причем передние ноздри выступают в качестве основного резервуара. Из кожного комменсального участка S. aureus может входить в контакт со слизистой носа, а затем взаимодействовать с лигандами эпителиальных клеток, такими как лорикрин и цитокератин 10 (K10) (Таблица 1).Как только защитные силы хозяина преодолены, S. aureus может распространяться в передние ноздри, так что хозяин становится носителем S. aureus (Wertheim et al., 2005a). У человека колонизация носа может начаться в первые дни жизни (Maayan-Metzger et al., 2017). Это было продемонстрировано в когортном исследовании по оценке носового носительства S. aureus в 100 парах ребенок – мать в течение 6 месяцев после родов (Peacock et al., 2003). Частота носительства в первые 8 недель жизни составляла около 40–50%, а затем снизилась до 21% через 6 месяцев.Кроме того, это исследование обнаружило конкордантность носительства у 68% пар младенец – мать, подтверждая роль факторов окружающей среды в носительстве S. aureus (Peacock et al., 2003). Другое исследование обнаружило идентичные штаммы у 80% пар младенец – мать. У 90% этих новорожденных источником S. aureus был материнский носовой штамм (Leshem et al., 2012; Рисунок 2).
ТАБЛИЦА 1. Основные лиганды-хозяева S. aureus .
РИСУНОК 2. Основные механизмы распространения и передачи S. aureus и влияние носительства через нос на последующие инфекции.
После рождения руки являются основным вектором передачи S. aureus с поверхностей на нос (Wertheim et al., 2005a). Гипотеза о связи между рукой и носом S. aureus подтверждается двойным слепым рандомизированным плацебо-контролируемым исследованием, проведенным Reagan et al. (1991), которые продемонстрировали, что деколонизация носа с помощью мупироцина, применяемого к медицинским работникам, приводит к уменьшению носа и ношения рук.В когортном исследовании с участием амбулаторных пациентов и здоровых сотрудников больниц носительство оценивалось с помощью одного или нескольких мазков. Участники заполнили анкету об их поведении ковыряния в носу, и была обнаружена положительная корреляция между этой привычкой и носительством S. aureus . Однако неизвестно, чаще ли у ковыряющих в носу пациентов колонизировались дополнительные носовые участки (Wertheim et al., 2006).
Исследования, проведенные с участием людей, живущих в одних и тех же домохозяйствах, показали, что эти люди имеют тенденцию нести генетически похожие штаммы в ноздрях (Nouwen and Optima Grafische Communicatie, 2004; Muthukrishnan et al., 2013), предполагая горизонтальную передачу. Носительство MRSA в нескольких местах увеличивает риск колонизации носа MRSA (Harbarth et al., 2000).
Несмотря на нечастость, воздушно-капельная передача является еще одним возможным путем распространения S. aureus (Wertheim et al., 2005a) и может играть роль в возникновении больничных вспышек (Sherertz et al., 1996).
Во время вирусных инфекций верхних дыхательных путей повышается риск распространения эндогенного S. aureus в воздухе и могут возникать вспышки инфекции.В 1996 году вспышка MRSA, охватившая 8 из 43 пациентов, произошла в хирургическом отделении интенсивной терапии университетской больницы в США. Расследование причины показало, что причиной этой вспышки был один врач; он носил MRSA через нос и страдал от инфекции верхних дыхательных путей. Чтобы оценить распространение по воздуху S. aureus , авторы завершили свои выводы экспериментальным клиническим испытанием этого врача и показали, что передача бактерии увеличилась в 40 раз, когда он был инфицирован риновирусной инфекцией, чем когда он не был.Использование маски значительно снизило рассеяние ( P = 0,015) (Sherertz et al., 1996).
Медицинские работники, которые являются бессимптомными носителями через нос, иногда могут быть источником вспышек MRSA (Wang et al., 2001; Vonberg et al., 2006; Haill et al., 2013; Lamanna et al., 2017). С другой стороны, в ситуациях, не связанных со вспышками, и при наличии мер контроля медицинские работники нечасто являются источниками передачи S. aureus (Price et al., 2017).
Мобильные телефоны медицинских работников могут быть резервуаром S.aureus (Chang et al., 2017). В недавнем исследовании оценивалась частота бактериального заражения мобильных телефонов медицинского персонала, работающего в операционной. Семьдесят два медицинских специалиста взяли бактериальные культуры со своих телефонов, передних носовых ходов и рук. Результаты показали, что у 31 сотрудника было S. aureus , выделенных из их ноздрей, у 8 — из мобильных телефонов и у 4 — из рук. Генотипирование подтвердило, что 7/8 штаммов мобильных телефонов идентичны штаммам, выделенным из ноздрей (Chang et al., 2017).
Механизмы колонизации
vestibulum nasi или передняя часть ноздрей выстлана многослойным ороговевшим плоским плоским эпителием, в то время как остальная часть носовой полости, то есть ее внутренняя часть, выстлана мерцательным столбчатым эпителием (Peacock et al., 2001; Weidenmaier et al., 2012).
Оба эпителия были описаны как места обитания для S. aureus (Mulcahy et al., 2012; Baur et al., 2014), поскольку они будут рассмотрены в этом разделе.Также была описана внутриклеточная локализация в ткани носа у здоровых добровольцев (Hanssen et al., 2017). Для успешной колонизации S. aureus экспрессирует адгезивные молекулы (Burian et al., 2010), которые необходимы для установления взаимодействий с компонентами поверхности клеток человека, как было продемонстрировано in vitro и in vivo (Mulcahy et al. al., 2012; Baur et al., 2014; рисунок 3). Основные взаимодействия лигандов перечислены в таблице 1.
РИСУНОК 3. Механизмы S. aureus носовой колонизации.
Взаимодействие между S. aureus и плоским эпителием передних ноздрей
vestibulum nasi выстланы кожей (Cunningham, 1905; Vuyk, Watts, 2006). Самый верхний слой эпидермиса — это stratum corneum или ороговевший слой (Candi et al., 2005; Eckhart et al., 2013). Этот слой содержит кератиноциты, которые экспрессируют белки, такие как лорикрин, цитокератин 10 (K10), инволюкрин, филаггрин и другие белки (Eckhart et al., 2013).
Фактор слипания B (ClfB) и регулируемая железом поверхностная детерминанта A (IsdA) представляют собой стафилококковые поверхностные белки, которые могут прикрепляться к белкам ороговевшей оболочки (Clarke et al., 2004, 2006; Schaffer et al., 2006; Wertheim et al., 2008; Mulcahy et al., 2012) и поддерживают назальную колонизацию, поскольку она будет развита в этом разделе.
Недавно Mulcahy et al. (2012) продемонстрировали, что лорикрин, самый распространенный белок в ороговевшей оболочке (Steinert, Marekov, 1995), был основным лигандом-мишенью для ClfB в течение S.aureus колонизация носа. Колонизация носа штаммом ClfB + S. aureus была снижена на 80% у мышей с дефицитом лорикрина по сравнению с мышами дикого типа. Также было показано, что ClfB взаимодействует с цитокератином 10 (O’Brien et al., 2002; Schaffer et al., 2006; Wertheim et al., 2008), цитокератином 8 (Haim et al., 2010) и фибриногеном (Perkins et al., 2001; таблица 1). Роль ClfB в прикреплении S. aureus к назальному эпителию была изучена in vitro (O’Brien et al., 2002; Mulcahy et al., 2012), на моделях животных (Schaffer et al., 2006; Mulcahy et al., 2012) и в исследованиях на людях (Wertheim et al., 2008).
Schaffer et al. (2006) продемонстрировали, что мутантные штаммы S. aureus , дефицитные по ClfB, приводили к снижению носовой колонизации как у мышей, так и у крыс по сравнению со штаммом дикого типа (ClfB + ). Сообщалось, что у человека мутантный штамм ClfB — из S. aureus выводится быстрее, чем штамм дикого типа (медиана 3 ± 1 vs.7 ± 4 дня, p = 0,006), тогда как штамм дикого типа сохранялся в течение 28 дней после инокуляции (Wertheim et al., 2008).
IsdA также играет роль в прикреплении S. aureus к носовым клеткам, как показано in vitro и in vivo (Clarke et al., 2004). Мутация в гене IsdA снижает способность бактерий связывать человеческие носовые клетки in vitro и колонизировать передние носовые ходы хлопковых крыс (Clarke et al., 2006). Было также показано, что этот поверхностный белок связывается с фибриногеном и фибронектином (Clarke et al., 2004). Роль IsdA в носовой колонизации еще не была четко продемонстрирована в исследованиях на людях.
Другие поверхностные белки S. aureus , такие как поверхностный белок G (SasG), SasX и белки с серин-аспартатными повторами SdrC и SdrD, также могут служить лигандами для эпителиальных клеток (Corrigan et al., 2009; Liu Q . et al., 2015). Десмоглеин 1 был идентифицирован как лиганд-хозяин для SdrD (Askarian et al., 2016). Их роль у людей еще не исследована (Mulcahy et al., 2012).
Взаимодействие во внутренней носовой полости
Помимо vestibulum nasi , внутренняя часть носовой полости составляет еще одну экологическую нишу для S. aureus. Стафилококковый небелковый адгезин, названный клеточной стенкой тейхоевой кислотой (WTA), рассматривается как важный фактор в процессе колонизации (Weidenmaier et al., 2004). В исследовании in vivo , WTA-дефицитные мутанты S. aureus не могли прикрепиться к носовым клеткам и не могли колонизировать ноздри хлопковых крыс по сравнению с контрольными штаммами дикого типа (Weidenmaier et al., 2004).
В исследовании, объединяющем оценки in vitro, и in vivo, , Baur et al. (2014) изучали молекулярные детали адгезии WTA к носовым клеткам. Они впервые обнаружили, что SREC-1 (член акцепторного рецептора F-типа) экспрессируется на эпителиальных клетках внутренней носовой полости человека и хлопковых крыс. Авторы также сообщили, что SREC-1 взаимодействует с WTA, и подтвердили эти данные на инфицированных хлопковых крысах, предварительно обработанных антителом против SREC-1.Значительное уменьшение колонизации наблюдалось через 8 часов и 6 дней после инокуляции в группе, получавшей анти-SREC-1 антитело, по сравнению с контролем (Baur et al., 2014). В согласии с этим Weidenmaier et al. (2008) ранее продемонстрировали роль WTA на начальных стадиях колонизации S. aureus .
Внутриклеточная локализация S. aureus
Внутриклеточная локализация S. aureus в ткани носа была описана с использованием методов, включая иммуногистохимический анализ, окраску гематоксилином и эозином (Hayes et al., 2015; Ou et al., 2016, 2017). Эпителиальные клетки, эндотелиальные клетки и воспалительные клетки, особенно тучные клетки (Plouin-Gaudon et al., 2006; Tan et al., 2014; Hayes et al., 2015; Ou et al., 2016) были описаны как места обитания для внутриклеточный S. aureus (ICSA). Используя биопсию кожи из вестибулума носа случайно выбранных здоровых участников, Hanssen et al. (2017) обнаружили внутриклеточный S. aureus в stratum spinosum , одном из слоев, образующих эпидермис.Сообщалось о внутриклеточной локализации S. aureus как у пациентов с риносинуситом (Clement et al., 2005; Plouin-Gaudon et al., 2006; Ou et al., 2016, 2017), так и у здоровых добровольцев (Hanssen et al. , 2017). В контрольной популяции из исследования Ou et al. (2016), 38% имели ICSA. Однако из-за отсутствия крупномасштабных популяционных исследований истинную распространенность ICSA у здоровых людей еще предстоит определить.
Внутриклеточная локализация S. aureus , по-видимому, защищает бактерии от защитных механизмов хозяина (Clement et al., 2005) и благоприятствуют неэффективности противомикробных препаратов, как это было продемонстрировано в недавнем исследовании по оценке системных и местных антибиотиков. Используя модель клеток S. aureus уклонения носового эпителия, Rigaill et al. (2018) обнаружили, что большинство деколонизирующих агентов, включая мупироцин, проявляют слабую активность против ICSA. Выведение ICSA также изучали на модели мышей с использованием ванкомицина. В этом исследовании внутриклеточные бактерии смогли установить инфекцию даже в присутствии этого антибиотика (Lehar et al., 2015), тогда как планктонные бактерии уничтожались ванкомицином и не вызывали инфекции. Внутриклеточная резидентность S. aureus может объяснить повторную колонизацию и неудачи в деколонизации, наблюдаемые у некоторых здоровых носителей, а также рецидив инфекций, наблюдаемый у пациентов с хроническим риносинуситом (Clement et al., 2005; Ou et al., 2017; Rigaill et al., 2018).
Иммунная система и S. aureus Колонизация
Наши знания относительно реакции хоста во время S.aureus носовая колонизация все еще ограничена по сравнению с иммунным ответом при инвазивной инфекции S. aureus (Brown et al., 2014). Связь между иммунной системой хозяина и носительством S. aureus была недавно рассмотрена Mulcahy и McLoughlin (2016). Присутствие S. aureus в ноздрях, по-видимому, вызывает как врожденную, так и адаптивную иммунную систему. S. aureus может иначе преодолеть защитные механизмы хозяина. Стафилококковый протеин A (SpA) и экзопротеин стафилокиназа могут играть ключевую роль в адаптации бактерий к иммунной системе и процессу колонизации (Peschel and Sahl, 2006; Cole et al., 2016).
Врожденный иммунный ответ
Человеческие выделения из носа обладают эффективным естественным антимикробным действием (Cole et al., 1999). В самом деле, они содержат секретируемые эпителиальными клетками антимикробные пептиды (АМП), способствующие защите носа первой линии. Первичные эпителиальные клетки носа продуцируют АМП, такие как hBD3 и РНКаза-7, после стимуляции цитокинами (IFN-g, IL-1b и TNF-a) (Burgey et al., 2016). Среда, содержащая S. aureus , индуцирует экспрессию этих AMP менее эффективно, чем воспалительные цитокины (Burgey et al., 2016). Профили дифференциальной экспрессии AMPs могут быть первичными детерминантами для различных состояний носительства S. aureus (Burgey et al., 2016).
Антистафилококковые ответы могут быть вызваны участием Toll-подобных рецепторов (TLR). Следовательно, роль TLR2 была документально подтверждена в носовой колонизации S. aureus (González-Zorn et al., 2005). Было показано, что штаммы-носители S. aureus задерживают иммунный ответ хозяина по сравнению со штаммами, не являющимися носителями, из-за замедленной экспрессии TLR2, которую они стимулируют в эпителиальных клетках носа (Quinn and Cole, 2007).Различные полиморфизмы были обнаружены у носителей и не носителей S. aureus ; они нацелены на растворимые или связывающиеся с мембраной молекулы, такие как гены, кодирующие маннозу-связывающий лектин, глюкокортикоидный рецептор, C-реактивный белок, бета-дефенсин 1, TLR-9 и интерлейкин-4 (van den Akker et al., 2006; Emonts et al. al., 2008; Ruimy et al., 2010; Mulcahy, McLoughlin, 2016; Nurjadi et al., 2018).
Исследование по оценке истощения нейтрофилов было проведено на мышах для определения важности притока нейтрофилов во время носительства.У мышей, которые получали антитела против истощения нейтрофилов, наблюдалось значительное увеличение скорости колонизации S. aureus по сравнению с контролем. Это исследование in vivo подчеркивает, что приток нейтрофилов играет роль в клиренсе S. aureus (Archer et al., 2013).
Адаптивный иммунный ответ
Как было документально подтверждено анализом сыворотки, носительство S. aureus вызывает адаптивный гуморальный иммунный ответ. Сообщалось, что сывороточные уровни иммуноглобулинов IgG и IgA, специфичных к нескольким стафилококковым белкам, выше у постоянных носителей, чем у людей, не являющихся носителями (van Belkum et al., 2009; Colque-Navarro et al., 2010). Но доказательства того, что эти антитела защищают от колонизации, отсутствуют.
В модели носовой колонизации на мышах клиренс S. aureus оказался независимым от В-клеток, но опосредован Т-клетками. Клетки Th27, функциональная линия Т-клеток, отличная от Th2 и Th3, как известно, вовлечены в барьеры слизистой оболочки и поверхностный клиренс патогенов. Они обычно продуцируют семейство цитокинов IL-17. Арчер и др. (2013, 2016) показали, что мыши с дефицитом IL-17A и IL-17F не могут очистить S.aureus , экспериментально инокулированный через нос; IL-17A требовался для экспрессии AMP, вызванной носовой колонизацией. В мышиной модели цитокин семейства IL-10 IL-22 секретируется клетками Th27 и способствует локальной экспрессии AMP. IL-22 также снижает экспрессию стафилококковых лигандов лорикрина и цитокератина 10 и, таким образом, контролирует носовую колонизацию (Mulcahy et al., 2016).
Напротив, в исследовании на людях, оценивающем воспалительные факторы носовой жидкости и носительство с S.aureus , ИЛ-17 не обнаружен (Cole et al., 2016). Это было неожиданно, и авторы предположили, что IL-17 может быть нерастворим в носовых секретах (Cole et al., 2016). Было обнаружено, что низкое соотношение цитокинов Th2 к Th27 является предиктором носительства S. aureus у добровольцев после стимуляции цельной кровью S. aureus (Nurjadi et al., 2016). Будущие исследования на людях должны быть проведены, чтобы лучше понять роль цитокинов Th27 в носительстве через нос.
Классификация носовых носителей на основе микробиологии
Для подтверждения носового носительства S.aureus , образцы обычно собирают с помощью коммерческих сухих или увлажненных стерильных тампонов, при этом значительных различий между ними не обнаружено (Warnke et al., 2016). Протокол отбора образцов на самом деле не стандартизован, но обычно состоит из протирания тампоном передних носовых ходов каждой ноздри примерно за четыре вращательных движения (Wertheim et al., 2006; Bode et al., 2010). Затем мазки анализируются для проверки наличия S. aureus . Два обычно используемых лабораторных теста для идентификации S.aureus — это культивирование на хромогенной твердой среде, что является менее дорогим тестом, и полимеразная цепная реакция, которая является золотым стандартом и наиболее быстрым методом обнаружения MRSA (Pournajaf et al., 2014). Важно отметить, что хроническое носительство S. aureus может быть результатом не только носовой колонизации. Отбор проб вне носовых участков, таких как ротоглотка, прямая кишка, раны, подмышечная впадина, увеличивает частоту выявления MRSA у пациентов с риском нозокомиальной инфекции S. aureus (Miller et al., 2012; McKinnell et al., 2013).
Эпидемиологические исследования, проводившиеся в течение периодов от 12 недель до 3 лет, описали три модели носительства в носу для S. aureus среди здоровых добровольцев, взятых несколько раз. Постоянные носители, частота которых варьировалась от 10% до 30% (Williams, 1963; Eriksen et al., 1995; VandenBergh et al., 1999; Nouwen et al., 2004; Muthukrishnan et al., 2013), не носители, которые оценивают колеблется от 10% до 47%, а остальные считались прерывистыми носителями (Williams, 1963; Eriksen et al., 1995; VandenBergh et al., 1999; Nouwen et al., 2004). Определения, используемые для этой классификации, варьировались от одного исследования к другому. В некоторых исследованиях постоянными носителями были те, у кого результаты всех мазков были положительными на S. aureus (Muthukrishnan et al., 2013). В других исследованиях были определены пороговые значения для индекса носительства (количество положительных мазков / общее количество мазков для каждого человека) (Eriksen et al., 1995; VandenBergh et al., 1999). Однако нет четкого определения количества мазков, которые следует взять, и какой доли должен быть положительным перед определением состояния носительства.
Nouwen et al. (2004) предложили правило посева, основанное на сочетании качественных и количественных результатов двух последовательных мазков из носа, взятых с интервалом примерно в неделю, для прогнозирования состояния носового носительства S. aureus среди здоровых добровольцев. Когда обе культуры дают положительный результат более 10 3 колониеобразующих единиц (КОЕ), человек классифицируется как стойкий носитель. Когда только одна из культур является положительной или когда обе культуры положительны с низким КОЕ, человек рассматривается как прерывистый носитель.ван Белкум и др. (2009) провели исследование с участием 51 добровольца с известным состоянием носительства, которые были искусственно колонизированы смесью штаммов S. aureus после лечения деколонизацией и наблюдались в течение 22 недель. Средняя выживаемость носовых бактерий составляла 4 дня у не носителей, 14 дней у прерывистых носителей и более 154 дней у постоянных носителей ( P = 0,017). Мазки с посевами стойких носителей содержали больше бактериальных нагрузок по сравнению с другими группами.Как указывалось ранее, сывороточные уровни антистафилококковых антител у постоянных и непостоянных носителей различались. Авторы пришли к выводу, что прерывистые и не носители имеют сходные характеристики, и, таким образом, предложили реклассификацию носителей S. aureus в постоянных носителей и «других» носителей (van Belkum et al., 2009). Было показано, что стойкие носители имеют более высокое количество S. aureus (Nouwen et al., 2004; van Belkum et al., 2009) и более высокий риск инфекции по сравнению с другими носителями (Wertheim et al., 2004; Nouwen et al., 2005). Однако бактериальная нагрузка у постоянных носителей всегда различна, и трудно определить фиксированный порог для диагностики (Burian et al., 2010; Verhoeven et al., 2012; Nilsson et al., 2015). Устойчивое носительство чаще встречается у детей, чем у взрослых, но многие люди меняют свое носительство в возрасте от 10 до 20 лет (Armstrong-Esther, 1976). Выводы о том, что у постоянных носителей один и тот же штамм в течение многих лет, а у прерывистых носителей, по-видимому, есть изменяющиеся штаммы (Eriksen et al., 1995; VandenBergh et al., 1999) недавно стали предметом споров (Muthukrishnan et al., 2013).
Поперечные исследования показывают распространенность примерно 20-30% носителей в общей популяции, которая представляет собой смесь постоянных и периодических носителей (Gorwitz et al., 2008; den Heijer et al., 2013; Saadatian-Elahi et al. ., 2013; Chen et al., 2017).
Индивидуальные факторы риска для S. aureus Колонизация носа
Колонизация носа зависит от факторов хозяина, таких как основное состояние или заболевания (Таблица 2).Некоторые исследования показали, что носительство через нос чаще встречается у пациентов, инфицированных вирусом иммунодефицита человека (ВИЧ) (Raviglione et al., 1990; Weinke et al., 1992; Kotpal et al., 2016) или у пациентов с ожирением (Olsen et al., 2013) по сравнению со здоровыми людьми. Эта более высокая распространенность была также обнаружена среди пациентов с диабетом, проходящих диализ, по сравнению с пациентами, не страдающими диабетом, в той же популяции (Luzar et al., 1990). Другие заболевания, такие как гранулематоз с полиангиитом (ранее известный как гранулематоз Вегенера), ревматоидный артрит (Laudien et al., 2010), инфекции кожи и мягких тканей (Immergluck et al., 2017), атопический дерматит (Breuer et al., 2002) и рецидивирующий фурункулез (Demos et al., 2012) связаны с повышенным уровнем носительства.
ТАБЛИЦА 2. Предрасполагающие факторы для носового носительства.
У здоровых людей Liu C.M. и другие. (2015) обнаружили схожие показатели носительства у мужчин и женщин, в то время как у мужчин плотность бактерий была выше. Сообщения о более высоком риске носительства S. aureus через нос среди больничных работников, чем остальная часть населения, не подтверждаются (Elie-Turenne et al., 2010; Saadatian-Elahi et al., 2013; Чен и др., 2015; Price et al., 2017). Связь между курением и носовым носом также противоречива. В исследовании Olsen et al. (2012), было обнаружено, что активное курение у здоровых взрослых является защитным фактором для носительства S. aureus с предполагаемой бактерицидной активностью сигаретного дыма. Напротив, недавнее исследование показало, что курильщики чаще подвергались колонизации, чем некурящие, и отказ от курения улучшил клиренс назального S.aureus в ходе экспериментального исследования инокуляции (Cole et al., 2018). Многие другие состояния хозяина были тщательно изучены и описаны как дополнительные предрасполагающие факторы, такие как гормональная контрацепция (Zanger et al., 2012) и присутствие гемоглобина в выделениях из носа (Pynnonen et al., 2011).
На генетическом уровне не было обнаружено корреляции между генетическими факторами и носительством S. aureus . В исследованиях близнецов и семей не было обнаружено значимой наследственности для S. aureus носовой колонизации (Roghmann et al., 2011; Андерсен и др., 2012). Интересно, что некоторые полиморфизмы генов воспалительной реакции хозяина были связаны с носительством S. aureus через нос. Наличие фенотипа антигена гистосовместимости HLA-DR3 может быть предрасположенностью (Kinsman et al., 1983).
Как было сказано ранее, на уровне иммунной системы полиморфизмы генов, кодирующих некоторые белки, и профили дифференциальной экспрессии AMP могут быть детерминантами различных состояний носительства.
В исследовании с участием 93 пациентов с диабетом 1 типа был определен полиморфизм рецепторов витамина D в дезоксирибонуклеиновой кислоте (ДНК), выделенной из лейкоцитов периферической крови.Анализ показал, что наличие специфических аллелей, кодирующих рецепторы витамина D, было связано с повышенной скоростью колонизации S. aureus (Panierakis et al., 2009).
Носительство S. aureus как фактор риска инфекций
Staphylococcus aureus назальная колонизация была определена как основной фактор риска развития явных стафилококковых инфекций, приобретенных погодных условий или нозокомиальных (Von Eiff et al., 2001; Wertheim et al., 2004, 2005b), что увеличивает риск от 2 до 10 раз (Perl, Golub, 1998). Риск инфицирования носителей носа изучается в основном у хирургических пациентов (общих, ортопедических, кардиохирургических и нейрохирургических) (Perl et al., 2002; Bode et al., 2010; Walsh et al., 2017), пациентов, находящихся на гемодиализе. (Kluytmans et al., 1996; Katneni and Hedayati, 2007), пациенты на хроническом амбулаторном перитонеальном диализе (CAPD) (Luzar et al., 1990), ВИЧ-инфицированные пациенты (Nguyen et al., 1999; Sissolak et al., 2002) и пациентов отделения интенсивной терапии (Nardi et al., 2001). Также было показано, что это основной фактор риска рецидива фурункулеза, носовая колонизация присутствует почти у 60% людей с фурункулами и импетиго (Durupt et al., 2007) (Рисунок 2 и Таблица 3).
ТАБЛИЦА 3. S. aureus носовая колонизация, фактор риска инфекций.
Инфекции хирургического участка
Развитие послеоперационной инфекции — это многофакторный процесс, обычно сочетающий предоперационные, интраоперационные и послеоперационные факторы (Savage and Anderson, 2013).Колонизацию носа можно рассматривать как предоперационный фактор риска инфекций MRSA и MSSA. S. aureus может распространяться от передних носовых ходов к другим участкам поверхности кожи и, таким образом, заражать хирургическую рану во время операции (NICE Clinical Guidelines, 2008; Savage and Anderson, 2013). Было показано, что около 80% штаммов, вызывающих стафилококковую инфекцию в месте операции, имеют молекулярную идентичность с изолятами S. aureus в ноздрях затронутых пациентов (Perl et al., 2002).
Инфекции области хирургического вмешательства (ИОХВ) являются одним из наиболее распространенных послеоперационных осложнений и составляют от 20 до 30% инфекций, связанных с оказанием медицинской помощи (ИСМП) (Klevens et al., 2007; Magill et al., 2012; Savage and Anderson, 2013 ). В то время как энтеробактерии и другие уро-пищеварительные бактерии преобладают при инфекциях после желудочно-кишечных, урологических и гинекологических операций (Trautman et al., 2007), S. aureus преобладает в ортопедических и кардиохирургических условиях (Lepelletier et al., 2005; Траутман и др., 2007; Muñoz et al., 2008). У ортопедических пациентов на имплантатах могут образовываться биопленки, что затрудняет лечение (Chen et al., 2013). По данным Французского института надзора за общественным здоровьем в 2014 году, S. aureus составляли 19,4% изолированных микробов в ИОХВ после коронарных операций, 51,9% организмов, вызывающих ИОХВ при ортопедических операциях, и 29,3% организмов, вызывающих инфекции в гинекологической акушерской хирургии. в 2014 г. (Le Réseau d’alerte, d’investigation et de Survival des Infosocomiales (Raisin), 2015).Аналогичные последствия были обнаружены и в других странах (Saadatian-Elahi et al., 2008; Negi et al., 2015).
Несколько исследований, включающих случай-контроль и многофакторный анализ, идентифицировали носительство S. aureus через нос как независимый фактор риска ИОХВ (Kluytmans et al., 1995; Kalmeijer et al., 2000; Muñoz et al., 2008). В исследовании случай – контроль, проведенном Kluytmans et al. (1995) за день до операции кардиохирургические пациенты обследовались на предмет их носового носительства и наблюдались на предмет развития ИОХВ. S. aureus раневых инфекций имели место у 40 пациентов по сравнению с 120 контрольной группой, у которых инфекция не развивалась. Носительство через нос, выявленное в 52% случаев по сравнению с 12% в контрольной группе, оказалось значительным фактором риска развития этих послеоперационных инфекций с OR = 9,6, 95% доверительный интервал (3,9–23,7). В исследовании с участием 357 пациентов, перенесших обширную операцию на сердце, носители носа имели более высокую частоту ИОХВ, чем не носители (12,5% против 5%, P = 0,01) (Muñoz et al., 2008). Аналогичные выводы были получены для ортопедических пациентов с увеличением заболеваемости от 3 до 11 раз (Kalmeijer et al., 2000; Yano et al., 2000; Weiser and Moucha, 2015).
Инфекции в области хирургического вмешательства оказывают большое влияние на пациента и систему здравоохранения. Эти инфекции увеличивают продолжительность госпитализации (Leaper et al., 2004), смертность и расходы на здравоохранение и снижают качество жизни, связанное со здоровьем (Anderson et al., 2009; Lamarsalle et al., 2013; Savage and Anderson, 2013).Ретроспективный анализ базы данных во Франции пришел к выводу, что стафилококковые инфекции привели к примерно 1,0 и 1,4 дополнительных госпитализаций на пациента, 22,1 и 22,4 дополнительных дня в стационаре и дополнительным расходам в размере 15 475 евро и 13 389 евро после кардиоторакальных и ортопедических операций соответственно (Schmidt et al. 2015). Уровень внутрибольничной смертности был в 2,6 раза и в шесть раз выше среди инфицированных пациентов, чем у неинфицированных пациентов при кардиоторакальных и ортопедических процедурах (Schmidt et al., 2015).
Метициллин-устойчивый Носительство S. aureus может увеличить риск развития ИОХВ. В систематическом обзоре у пациентов, колонизированных MRSA, вероятность развития инвазивной инфекции в четыре раза выше, чем у пациентов, колонизированных MSSA (Safdar and Bradley, 2008). Сообщается, что инфекции MRSA являются причиной до 40% HCAI во всем мире, причем особенно высока заболеваемость в США и многих европейских странах (McKinnell et al., 2013), и было показано, что они вызывают повышенную смертность по сравнению с MSSA (Anderson et al. al., 2009). В исследовании, проведенном Anderson et al. (2009), пациенты с ИОХВ из-за MRSA имели в 2,6 раза более высокий риск смерти в течение 3 месяцев, продолжительность пребывания в больнице была на 6 дней больше, а связанные с этим расходы были увеличены на 23000 долларов по сравнению с пациентами с SSI из-за MSSA. С другой стороны, метаанализ 31 когортного исследования бактериемии S. aureus показал значительно более высокую смертность при MRSA, чем при MSSA (Cosgrove et al., 2003). Однако причины повышенной смертности от инфекций MRSA неясны.Некоторые авторы предполагают, что бактерии MRSA и MSSA одинаково вирулентны, но инфекции MRSA обычно развиваются у пациентов, ранее леченных антибиотиками. Таким образом, как предполагалось ранее, различия в уровне смертности пациентов могут скорее отражать тяжесть основных состояний, чем повышенную вирулентность, связанную с бактериями (Humphreys, 2012; Hraiech et al., 2013).
Инфекции у нехирургических пациентов
Носительство S. aureus в носу также является фактором риска последующих инфекций у нехирургических пациентов.Wertheim et al. (2004) обследовали 14 008 взрослых, у которых мазок из носа брали при поступлении в нехирургическое отделение, 3420 (24%) были положительными на S. aureus . Последующее наблюдение выявило 81 пациента, у которых в период от 2 до 120 дней после взятия мазка развилось бактерий S. aureus , что в три раза чаще у носителей, чем у лиц, не являющихся носителями. Интересно, что уровень смертности от бактериемии S. aureus был выше у не-носителей, чем у носителей. Это могло быть связано с защитным иммунитетом антистафилококковых антител (Wertheim et al., 2004; Holtfreter et al., 2006). Примерно 80% из изолятов S. aureus , вызывающих бактериемию, имели эндогенное происхождение и были идентичны изолятам, выделенным из передних носовых ходов соответствующих пациентов, что подтверждает предыдущее сообщение (Von Eiff et al., 2001).
Проспективное когортное исследование оценило возникновение инфекций S. aureus у 5161 пациента, у которых был проведен скрининг носительства при поступлении в отделение интенсивной терапии. S. aureus -ассоциированных инфекций, связанных с ОИТ, определяли по развитию инфекции> 48 ч после их поступления в отделение.Эти инфекции произошли у 113 пациентов, и носовая колонизация была связана с повышением риска в 2,5–4,7 раза (Honda et al., 2010).
У ВИЧ-инфицированных пациентов проспективное когортное исследование, оценивающее 231 субъекта каждые 3 месяца в течение как минимум двух лет, сообщило о 6% -ной заболеваемости инфекциями S. aureus , носители через нос более подвержены риску [ p = 0,04 , OR = 3,6 (0,9–15,4)] (Nguyen et al., 1999).
У пациентов, находящихся на гемодиализе и хроническом перитонеальном диализе, большинство инфекционных осложнений возникает эндогенного происхождения (Luzar et al., 1990; Ena et al., 1994). S. aureus — наиболее распространенный изолированный агент бактериемии, связанной с центральным венозным катетером (Katneni and Hedayati, 2007), или инфекций места выхода перитонеальных диализных катетеров (Luzar et al., 1990). Носители через нос имеют повышенный риск заражения этими инфекциями (Nouwen et al., 2005; Ong et al., 2017).
Staphylococcus aureus — наиболее часто выделяемый возбудитель инфекций диабетической стопы. В исследовании сравнивали генотипические профили S.aureus , выделенных из инфекций ноздрей и язв диабетической стопы 276 пациентов. Бактерия была выделена из обоих участков у 36% населения, а идентичные штаммы были обнаружены в 65% случаев. Необходимо провести дополнительные исследования, чтобы подтвердить пользу скрининга и лечения носителей через нос в этой популяции (Dunyach-Remy et al., 2017).
Носительство S. aureus через нос представляет собой фактор риска развития инфекций кожи и мягких тканей, вызываемых этим микробом, у пациентов, не госпитализированных и не заболевших (Chou et al., 2015). Было показано, что он является основным фактором риска рецидива фурункулеза (Demos et al., 2012). Носительство через нос также является фактором риска вторичной бактериальной пневмонии у пациентов, инфицированных вирусом гриппа А. Вирусная инфекция вызывает физиологические изменения хозяина, которые вызывают распространение S. aureus из носовой ткани в легкие, как показано на модели мыши (Reddinger et al., 2016).
Перспективы
Носительство S. aureus через нос носительство многофакторно и может предрасполагать носителей к последующим инфекциям.Таким образом, назальная деколонизация носителей рекомендуется пациентам, перенесшим кардиоторакальные и ортопедические операции (De Jonge et al., 2016).
Полное понимание взаимодействий «хозяин-патоген» может помочь найти новые стратегии деколонизации. Необходимо исследовать новые области механизмов колонизации. Например, роль микобиоты начинает описываться в патофизиологии хронических респираторных заболеваний (Brégeon and Rolain, 2015). Взаимодействие назального S. aureus с назальными грибковыми сообществами было бы интересной перспективой для развития.С другой стороны, некоторые сообщения предполагают, что S. aureus может регулировать экспрессию воспалительного гена хозяина (Modak et al., 2014). Было бы интересно изучить механизмы эпигенетики, чтобы лучше понять механизмы толерантности в процессах колонизации S. aureus .
Авторские взносы
AS написал обзорную статью. FB, J-LM, OB и J-MR исправили рукопись. Все авторы одобрили и отредактировали окончательную версию рукописи.
Финансирование
Это исследование было поддержано IHU Méditerranée Infection, Марсель, Франция, и правительством Франции в рамках программы «Investissements d’Avenir» («Инвестиции во имя будущего») под управлением «Agence Nationale de la Recherche» (ANR, fr: National Agency для исследований) (ссылка: Méditerranée Infection 10-IAHU-03).Работа выполнена при поддержке региона Прованс-Альпы-Лазурный берег и европейского финансирования FEDER PRIMI. AS был поддержан грантом CIFRE PhD от «Национальной ассоциации исследований и технологий».
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
Андерсен, П.С., Педерсен, Дж.K., Fode, P., Skov, R.L., Fowler, V.G., Stegger, M., et al. (2012). Влияние генетики хозяина и окружающей среды на носительство Staphylococcus aureus у датских близнецов среднего и пожилого возраста. J. Infect. Дис. 206, 1178–1184. DOI: 10.1093 / infdis / jis491
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Андерсон, Д. Дж., Кей, К. С., Чен, Л. Ф., Шмадер, К. Э., Чой, Ю., Слоан, Р., и др. (2009). Клинические и финансовые результаты в связи с инфекцией области хирургического вмешательства Staphylococcus aureus , резистентной к метициллину: многоцентровое исследование сопоставленных результатов. PLoS One 4: e8305. DOI: 10.1371 / journal.pone.0008305
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арчер, Н. К., Адаппа, Н. Д., Палмер, Дж. Н., Коэн, Н. А., Харро, Дж. М., Ли, С. К. и др. (2016). Интерлейкин-17A (IL-17A) и IL-17F имеют решающее значение для продукции антимикробных пептидов и клиренса Staphylococcus aureus , колонизации носа. Заражение. Иммун. 84, 3575–3583. DOI: 10.1128 / IAI.00596-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арчер, Н.К., Харро, Дж. М., и Шертлифф, М. Э. (2013). Клиренс золотистого стафилококка носительства через нос Т-лимфоцитов зависит от экспрессии интерлейкина-17А и притока нейтрофилов. Заражение. Иммун. 81, 2070–2075. DOI: 10.1128 / IAI.00084-13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Армстронг-Эстер, К. А. (1976). Модели носительства золотистого стафилококка в здоровом небольничном населении взрослых и детей. Ann. Гм. Биол. 3, 221–227. DOI: 10.1080 / 03014467600001381
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аскарян, Ф., Аджайи, К., Ханссен, А.-М., ван Зорге, Н. М., Петтерсен, И., Дип, Д. Б. и др. (2016). Взаимодействие между Staphylococcus aureus SdrD и десмоглеином 1 важно для адгезии к клеткам-хозяевам. Sci. Отчет 6: 22134. DOI: 10.1038 / srep22134
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баур, С., Rautenberg, M., Faulstich, M., Faulstich, M., Grau, T., Severin, Y., et al. (2014). Назальный эпителиальный рецептор для Staphylococcus aureus WTA регулирует адгезию к эпителиальным клеткам и модулирует колонизацию носа. PLoS Pathog. 10: e1004089. DOI: 10.1371 / journal.ppat.1004089
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bode, L.G.M., Kluytmans, J.A.J. W., Wertheim, H. F. L., Bogaers, D., Vandenbroucke-Grauls, C.M.J.E., Roosendaal, R., и другие. (2010). Профилактика инфекций в области хирургического вмешательства у носителей инфекции Staphylococcus aureus . N. Engl. J. Med. 362, 9–17. DOI: 10.1056 / NEJMoa0808939
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брейер К., Хаусслер С., Капп А. и Верфель Т. (2002). Staphylococcus aureus : особенности колонизации и влияние антибактериального лечения у взрослых с атопическим дерматитом. руб. J. Dermatol. 147, 55–61.DOI: 10.1046 / j.1365-2133.2002.04872.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Браун А.Ф., Пиявка Дж. М., Роджерс Т. Р. и Маклафлин Р. М. (2014). Staphylococcus aureus Колонизация: модуляция иммунного ответа хозяина и влияние на дизайн вакцины для человека. Фронт. Иммунол. 4: 507. DOI: 10.3389 / fimmu.2013.00507
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Burgey, C., Kern, W. V., Römer, W., и Риг, С. (2016). Дифференциальная индукция антимикробных пептидов врожденной защиты в первичных эпителиальных клетках носа при стимуляции воспалительными цитокинами, цитокинами Th27 или бактериальной кондиционированной средой из изолятов Staphylococcus aureus . Microb. Патог. 90, 69–77. DOI: 10.1016 / j.micpath.2015.11.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Burian, M., Wolz, C., and Goerke, C. (2010). Регулирующая адаптация Staphylococcus aureus во время носовой колонизации человека. PLoS One 5: e10040. DOI: 10.1371 / journal.pone.0010040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chang, C.-H., Chen, S.-Y., Lu, J.-J., Chang, C.-J., Chang, Y., and Hsieh, P.-H. (2017). Колонизация носа и бактериальное заражение мобильных телефонов, которые несет медицинский персонал в операционной. PLoS One 12: e0175811. DOI: 10.1371 / journal.pone.0175811
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, А.Ф., Хейл, А. Э., Сюй, П. З., Рао, Н., Клатт, Б. А. (2013). Предоперационная деколонизация эффективна для уменьшения колонизации стафилококками у пациентов с тотальной артропластикой. J. Артропластика 28, 18–20. DOI: 10.1016 / j.arth.2013.03.036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chen, B., Dai, X., He, B., Pan, K., Li, H., Liu, X., et al. (2015). Различия в носительстве и молекулярных характеристиках золотистого стафилококка среди местных жителей и медицинских работников в Университете Сунь Ятсена, Гуанчжоу, Южный Китай. BMC Infect. Дис. 15: 303. DOI: 10.1186 / s12879-015-1032-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chen, B.J., Xie, X.Y., Ni, L.J., Dai, X.L., Lu, Y., Wu, X.Q., et al. (2017). Факторы, связанные с носительством в носу и молекулярными характеристиками золотистого стафилококка среди населения в целом в кампусе медицинского колледжа в Гуанчжоу, Южный Китай. Ann. Clin. Microbiol. Антимикробный. 16:28. DOI: 10.1186 / s12941-017-0206-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чоу, Ю.-H., Lee, M.-S., Lin, R.-Y., and Wu, C.-Y. (2015). Факторы риска метициллин-резистентных инфекций кожи и мягких тканей Staphylococcus aureus у амбулаторных больных в Тайване. Epidemiol. Заразить. 143, 749–753. DOI: 10.1017 / S0950268814001642
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кларк С. Р., Браммелл К. Дж., Хорсбург М. Дж., МакДауэлл П. В., Мохамад С. А. С., Стэплтон М. Р. и др. (2006). Идентификация in vivo -экспрессированных антигенов Staphylococcus aureus и их использование в вакцинации для защиты от носительства через нос. J. Infect. Дис. 193, 1098–1108. DOI: 10.1086 / 501471
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кларк, С. Р., Уилтшир, М. Д., и Фостер, С. Дж. (2004). IsdA Staphylococcus aureus представляет собой регулируемый железом адгезин широкого спектра действия. Мол. Microbiol. 51, 1509–1519. DOI: 10.1111 / j.1365-2958.2003.03938.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Clement, S., Vaudaux, P., Francois, P., Schrenzel, J., Huggler, E., Kampf, S., et al. (2005). Свидетельства наличия внутриклеточного резервуара в слизистой оболочке носа у пациентов с рецидивирующим риносинуситом Staphylococcus aureus . J. Infect. Дис. 192, 1023–1028. DOI: 10.1086 / 432735
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коул, А. Л., Мутукришнан, Г., Чонг, К., Бивис, А., Ид, К. Р., Вуд, М. П., и др. (2016). Врожденные воспалительные факторы хозяина и стафилококковый белок А влияют на продолжительность носительства человека Staphylococcus aureus . Mucosal Immunol. 9, 1537–1548. DOI: 10,1038 / mi.2016.2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коул, А. Л., Шмидт-Оуэнс, М., Бивис, А. К., Чонг, К. Ф., Таруотер, П. М., Шаус, Дж. И др. (2018). Отказ от курения улучшает врожденную защиту хозяина и выведение экспериментально инокулированных назальных S. aureus. Заразить. Иммунная . 86, e912 – e917. DOI: 10.1128 / IAI.00912-17
PubMed Аннотация | CrossRef Полный текст
Коул, А.М., Деван П. и Ганц Т. (1999). Врожденная антимикробная активность выделений из носа. Заражение. Иммун. 67, 3267–3275.
Google Scholar
Colque-Navarro, P., Jacobsson, G., Andersson, R., Flock, J.-I., and Möllby, R. (2010). Уровни антител против 11 Staphylococcus aureus антигенов в организме
Staphylococcus aureus: не ковыряйте в носу!
Да, это LOLStaphylococcus. Они не называют меня Безумным Биологом для нутин
Один из коллег прислал эту статью: «Выбор в носу и носовое носительство Staphylococcus aureus »:
ЦЕЛЬ.Носительство Staphylococcus aureus через нос является важным фактором риска заражения S. aureus и резервуаром для метициллин-резистентных S. aureus [MRSA]. Мы исследовали, было ли ковыряние в носу одним из факторов, определяющих носительство S. aureus.
УСТАНОВКА И УЧАСТНИКИ. В когорту исследования вошли 238 пациентов, которые посетили амбулаторную клинику по лечению заболеваний уха, носа и горла (ЛОР) больницы третичного уровня и не имели жалоб, связанных с носом (определяемые как пациенты ЛОР), и 86 здоровых сотрудников больницы (включая студентов-медиков). и лабораторный персонал).
ИЗМЕРЕНИЯ. Все участники заполнили анкету по поведению в отношении носа и прошли скрининг на носительства S. aureus ; только ЛОР-пациенты прошли осмотр носа специалистом по лечению ушей, носа и горла на предмет выявления клинических признаков ковыряния в носу.
РЕЗУЛЬТАТОВ. Среди ЛОР-пациентов «ковыряющие в носу» значительно чаще, чем «не ковыряющие в носу» носили S. aureus (37 [53,6%] из 69 против 60 [35,5%] из 169 пациентов; относительный риск 1.51 [95% доверительный интервал, 1.03–2.19]). Среди здоровых добровольцев наблюдалась статистически значимая положительная корреляция между самооценкой частоты ковыряния в носу и частотой положительных результатов посева (R = 0,31; P = 0,004) и количеством S. aureus , присутствующих в нос (R = 0,32; P = 0,003).
ЗАКЛЮЧЕНИЕ. Выщипывание носа связано с носовым носом S. aureus . В определенных случаях роль ковыряния в носу при носительстве может быть причинной.Преодоление привычки ковыряться в носу может помочь стратегиям деколонизации S. aureus .
Это не так абсурдно, как кажется. Большинство людей являются временными носителями S. aureus, но у нас нет четкого представления о том, какие факторы влияют на носовую колонизацию (большинство стафилококков живут в вашем носу и не вызывают заболеваний). Конечно, мы также не знаем, почему исчезает стафилококк из носа. На бумагу. Во-первых, они задали участникам исследования ряд вопросов об их привычках ковыряния в носу:
Затем они вставили носовые мазки в нос испытуемым и попытались культивировать S.aureus :
Они также сообщили о приблизительной оценке количества «колониеобразующих единиц» на шноза (в основном, количество колоний, выросших на один мазок):
Итак, ковыряние в носу действительно увеличивает вероятность носительства S. aureus . Но такого вывода мне в голову не пришло (курсив мой):
Мы пришли к выводу, что ковыряние в носу связано с носительством в носу S. aureus и вполне может быть причиной. Будущие исследования должны выявить, является ли ковыряние в носу причиной или следствием S.aureus носительство и предотвращает ли прекращение привычки ковыряться в носу носовую колонизацию S. aureus .
Было бы действительно интересно, если бы S. aureus каким-то образом изменили поведение человека, увеличив его собственную передачу. Тем не менее, авторы правы в этом:
Понимание патогенеза носительства S. aureus поможет оптимизировать профилактические стратегии для предотвращения болезни S. aureus и распространения MRSA.
Теперь, если бы они только провели эксперимент, в котором они уничтожили S. aureus с помощью мупироцина, а затем посмотрим, является ли ковыряние в носу причиной ….
STAPHYLOCOCCUS AUREUS — Скачать PDF бесплатно
Общие правила пищевой гигиены
Общие правила пищевой гигиены Почему важна пищевая гигиена? Хорошая пищевая гигиена важна для того, чтобы пища, которую вы едите и ваша семья, была безопасной.Плохие гигиенические процедуры в вашем доме могут подвергнуть вас риску.
Подробнее
СИСТЕМА УПРАВЛЕНИЯ БЕЗОПАСНОСТЬЮ ПИЩЕВЫХ ПРОДУКТОВ
СИСТЕМА УПРАВЛЕНИЯ БЕЗОПАСНОСТЬЮ ПИЩЕВЫХ ПРОДУКТОВ Последняя редакция, май 2014 г. Рецензент: H&S Mgr. Следующая редакция Январь 2016 г. Соответствие нормам гигиены пищевых продуктов (Англия и Уэльс) 2006 г. Сопутствующие политики Содержание Все политики ОТ и ТБ
Подробнее
ПИЩЕВАЯ ГИГИЕНА И БЕЗОПАСНОСТЬ НА КУХНЕ
ГИГИЕНА ПИЩИ И БЕЗОПАСНОСТЬ КУХНИ [Они собраны для использования в Union Baptist Church.Мы признательны пресвитерию Галашиилов за отличную работу по подготовке оригинального документа, из которого
Подробнее
ПЯТЬ КЛЮЧЕЙ К РУКОВОДСТВУ БЕЗОПАСНОГО ПИЩА
ПЯТЬ КЛЮЧЕЙ К БЕЗОПАСНОСТИ ПИЩЕВЫХ ПРОДУКТОВ РУКОВОДСТВО ПО БЕЗОПАСНОСТИ ПИЩЕВЫХ ПРОДУКТОВ, ЗОНОЗОВ И ПИЩЕВЫХ ЗАБОЛЕВАНИЙ ПЯТЬ КЛЮЧЕВ К БЕЗОПАСНОСТИ ПИЩЕВЫХ ПРОДУКТОВ РУКОВОДСТВО ПО БЕЗОПАСНОСТИ ПИЩЕВЫХ ПРОДУКТОВ, ЗООНОЗАМ И ПИЩЕВЫМ ЗАБОЛЕВАНИЯМ ВВЕДЕНИЕ Безопасность пищевых продуктов
Подробнее
РЕКОМЕНДАЦИИ ПО ФЕРМЕРСКОМУ РЫНКУ
ПРАВИЛА ФЕРМЕРСКОГО РЫНКА Фермерский рынок — это краткосрочная операция по продаже продуктов и готовых пищевых продуктов под руководством назначенного оператора.Это правило также относится к блохам
.
Подробнее
Доставка и хранение еды
экран 1 Доставка и хранение продуктов питания 7. Мешки для мусора на пути доставки На этом экране показана сцена доставки с рядом потенциальных опасностей для безопасности пищевых продуктов. В качестве отправной точки рекомендуется учащимся
Подробнее
ДИПЛОМ ПО УХОДУ ЗА ДЕТЯМИ. Образец курса
ДИПЛОМ ПО УХОДУ ЗА ДЕТЯМИ Образец курса CHP2 Обеспечение физических потребностей детей, включая здоровье и безопасность. Законодательная база EYFS является требованием для всех зарегистрированных поставщиков услуг раннего детства.
Подробнее
3.0 Лечение инфекции
3.0 Лечение инфекции Антибиотики и медицина Ссылка на национальную учебную программу SCN 3-13b SCN 3-20b HWB 3-15a HWB 3-16a HWB 3-17a Результаты обучения Все учащиеся будут знать: наиболее распространенные инфекции получают
Подробнее
Безопасное хранение сырых продуктов животного происхождения
Обзор модуля 13: Безопасное хранение сырых кормов для животных ТРЕНЕР: Прочтите эту страницу заранее, чтобы подготовиться к преподаванию модуля.УЧАСТНИКИ: 1. Определят ПЕРЕКРЕСТНОЕ ЗАГРЯЗНЕНИЕ. 2. Найдите СЫРОЙ ЖИВОТНЫЙ КОРМ.
Подробнее
ПРАВИЛА ОБРАБОТКИ ПИЩЕВЫХ ПРОДУКТОВ
РУКОВОДСТВО ДЛЯ ОБРАБОТЧИКОВ ПИЩЕВЫХ ПРОДУКТОВ МЕДИЦИНСКОЕ НАБЛЮДЕНИЕ ЗА ОБРАБОТЧИКАМИ ПРОДУКТОВ AMPATH 2007 Мы — то, что мы едим Одно, что объединяет всех нас — мы едим! И едим каждый день. Служба экономических исследований предполагает, что
Подробнее
БАКТЕРИИ В СЫРОМ МОЛОКЕ
БАКТЕРИИ В СЫРОМ МОЛОКЕ Ричард Л.Уоллес ПОЛУЧИТЕ ДОМАШНЕЕ СООБЩЕНИЕ Бактериальное заражение сырого молока обычно может происходить из трех основных источников; внутри вымени, вне вымени и с поверхности
Подробнее
ТРЕБОВАНИЯ К ВЫСТАВКАМ
ТРЕБОВАНИЯ К ВЫСТАВКАМ Все операторы выставочных стендов, раздающие образцы продуктов питания, должны быть одобрены до мероприятия и иметь лицензию от Regina Qu Appelle Health Region до открытия.Продовольствие продается сразу за
Подробнее
Советы Bosch по гигиене кухни.
Советы Bosch по гигиене кухни. www.bosch-home.com/ae Знаете ли вы? Ванная может иметь репутацию самой грязной комнаты в доме, но кухня на самом деле представляет собой опасную зону, наполненную микробами
Подробнее
Введение в пищевую гигиену
экран 1 Введение в пищевую гигиену На этом экране показана сцена на кухне с рядом опасностей для безопасности пищевых продуктов.В качестве отправной точки учащимся рекомендуется смотреть на экран и предлагать то, что
Подробнее
ПОЛИТИКА КОНТРОЛЯ ИНФЕКЦИЙ
ПОЛИТИКА КОНТРОЛЯ ИНФЕКЦИИ Инфекционный контроль — это название, данное широкому спектру политик, процедур и методов, предназначенных для предотвращения распространения инфекционных заболеваний среди персонала и пользователей услуг.
Подробнее
Руководитель по безопасности пищевых продуктов
Руководство FSS для супервайзера по безопасности пищевых продуктов Руководство для студентов SITXOHS002A Соблюдайте правила гигиены на рабочем месте и SITXFSA001A Выполняйте процедуры безопасности пищевых продуктов из пакета учебных материалов по туризму и гостеприимству SIT07
Подробнее
С.difficile Инфекции
Инфекции, вызванные C. difficile. Введение. C. difficile — это тип бактерий, которые могут вызывать диарею и инфекцию толстой кишки. Эта бактерия с большей вероятностью заразит пациентов в больницах и других медицинских учреждениях
Подробнее
.







