Эволюция рака
Рак — причина 12 процентов всех смертей в мире. Ежегодно врачи выявляют более 12 миллионов новых онкологических пациентов, а 7 миллионов людей погибает. Долгое время рак был неизлечимым проклятием человечества — прогресс в его лечении наметился только в XIX веке. При этом рак еще не побежден — борьба с болезнью ведется до сих пор. Вместе с компанией BIOCAD разобрались, как люди болели (и лечились) от рака в прошлые эпохи, и какого прогресса человечество достигло в этом вопросе в наши дни.
Правда ли, что древние люди реже болели раком?
Это утверждение звучит резонно. Особенно если учесть, что среди причин онкологических заболеваний есть употребление табака, воздействие радиации и контакт с промышленными веществами-канцерогенами.
Однако утверждать, что онкологических заболеваний в древности было намного меньше, со всей уверенностью нельзя. Хотя бы потому, что 5-10 процентов всех видов рака связаны с генами, унаследованными от родителей — то есть получить онкологическую болезнь «по наследству» в древности можно было точно так же, как и в наши дни.
Узнать правду о том, насколько были распространены онкологические заболевания в прошедшие эпохи, должны помочь древние захоронения. Однако изучать заболеваемость раком по костям очень сложно.
Во-первых, если речь идет о по-настоящему давних временах, до нас доходит не так уж много костных остатков. Во-вторых — и это самое главное — не все онкологические заболевания оставляют следы на костях.
Исследуя скелеты людей, живших в прошлые эпохи, проще всего найти первичные опухоли костей — а это менее 0,2 процента всех онкозаболеваний
Library of Congress
Еще в костях порой можно обнаружить метастазы некоторых других видов онкологических болезней: рака молочной железы, предстательной железы и легкого. Однако это не так просто, как кажется. В 1996 году английский палеонтолог Тони Вальдрон изучил регистр смертей за 1901–1905 годы и выяснил, что вероятность обнаружения признаков рака в костных останках мужчин составляет 0–2 процента, а у женщин — 4–7 процентов.
Поэтому с уверенностью мы можем утверждать только одно — раком люди болели всегда: и в каменном веке, и в более поздние эпохи. Например, в 2007 году ученые из Мюнхена обнаружили пять случаев рака среди 905 скелетов в египетских некрополях, и тринадцать случаев — среди 2547 захоронений на средневековом кладбище в Германии.
Другое дело, что характер заболеваемости и частота встречаемости различных онкологических заболеваний в стародавние времена, скорее всего, был совсем иным, чем сейчас. Хотя бы потому, что продолжительность жизни людей все время увеличивается.
По прогнозам, к 2030 году 70 процентов всех случаев рака будет выявляться у людей в возрасте 65 лет и старше. Но всего 200 лет назад (то есть в середине XIX века) средняя ожидаемая продолжительность жизни мужчин составляла 40 лет, а женщин — 42 года. Получается, что до многих видов рака, распространенных в наши дни, предки попросту не доживали.
Как лечили рак до XX века
Самый древний метод лечения рака был описан в медицинском папирусе Эберса — то есть в 1500 году до нашей эры. Египетский фараон Имхотеп рекомендовал «прото-иммунотерапию»: нужно было сделать припарку возле опухоли, а потом надрезать ее. Фараон рассчитывал, что в месте надреза начнется воспаление, которое уничтожит опухоль.
Фараон рассчитывал, что в месте надреза начнется воспаление, которое уничтожит опухоль.
Самое интересное, что «фараонский» метод вполне мог сработать. Например, редкая раковая опухоль святого Перегрина способна к спонтанной регрессии — но только в том случае, если в рану попадет инфекция. Однако куда чаще целители из Египта, Греции, Рима и Индии ограничивались тем, что прикладывали к опухоли тепло — в надежде, что нагревание поможет справиться с болезнью.
Рак святого Перегрина: болезнь с чудесным исцелением
Отец Перегрин жил на рубеже XIII-XIV веков, происходил из хорошей семьи и вел праведную жизнь — а прославился благодаря необычной истории своей болезни. В молодости священник заболел раком голени, которая потребовала ампутации ноги. Однако, когда подошел срок операции, врач увидел, что опухоль исчезла — так что удачливый священник ушел из его «кабинета» на обеих ногах.
Сегодня мы знаем, что «самопроизвольное» излечение от рака — вполне возможное, хотя и достаточно редкое явление. Иногда попавшие в рану микробы действительно «модифицируют» иммунный ответ, и организм оказывается в состоянии победить рак. На этом принципе основана современная иммунотерапия. Однако в средние века о работе иммунитета ничего не знали, так что чудесное исцеление приписали не микробам, а божественному вмешательству.
Долгие годы «иммунотерапия» путем загрязнения хирургической раны шла «в комплекте» с хирургическим лечением рака. Поскольку о стерильности хирургических кабинетов и инструментов речь не шла, вырезавшие раковые опухоли хирурги неизбежно заносили в них болезнетворных бактерий (например, Streptococcus pyogenes и Serratia marcescens).
Для многих прооперированных людей это заканчивалось плачевно, поскольку приводило к сепсису (смертельному заражению крови — прим.ред). Однако некоторые пациенты, страдавшие способным к регрессии раком, вытягивали «счастливый билетик» и исцелялись. Подобные случаи описывали и в XVIII, и в XIX, и даже в начале XX века.
Авторство термина «рак» приписывают греческому врачу Гиппократу (460-370 годы до нашей эры). Считается, что он первым использовал слово «carcinos» для описания не образующих язвы опухолей, а слово «carcinoma» — для описания «язвенных» опухолей.
Оба термина — «carcinos» и «carcinoma» — восходят к греческому слову «краб». Возможно, ученый решил, что силуэт опухоли под кожей напоминает это животное
За второй термин, «онкология», мы должны быть признательны второму греческому врачу, Галену (130-200 годы нашей эры). Для описания опухолей он использовал греческое слово «отек», или «oncos». Оба знаменитых грека придерживались гуморальной теории, в соответствии с которой за здоровье человека отвечают четыре жидкости организма: кровь, мокрота, желтая и черная желчь. Если баланс этих жидкостей нарушается, человек заболевает. В соответствии с этой теорией к раку приводил избыток черной желчи, которая скапливается в некоторых органах и тканях. Их идеи продержались до конца Средних веков.
Чтобы вылечить рак «по Галену», нужно было либо нормализовать образ жизни при помощи правильного питания и переезда в «здоровое место» подальше от болот с их тлетворными испарениями — либо попытаться выпустить избыток черной желчи из опухоли хирургическим путем. Однако в отсутствие антибиотиков хирургическое лечение онкологических болезней было крайне болезненным и рискованным делом.
Вплоть до середины XIX века большинство пациентов предпочитало хирургии самое фантастическое якобы «медикаментозное» лечение. Аптекари запаслись зубом кабана, легкими лис, настойкой свинца, молотым белым кораллом и другими сомнительными средствами. Хирургические операции применялись нечасто — лишь изредка хирурги-парикмахеры проводили мастэктомию (удаление опухоли груди). Разумеется, без анестезии и в антисанитарных условиях.
Разумеется, без анестезии и в антисанитарных условиях.
В XVIII веке на смену гуморальной теории пришла теория лимфы. Но это было немногим лучше гуморальной теории. В то время считалось, что рак возникает, если в органах и тканях понемногу накапливается разрушающая и отравляющая организм лимфатическая жидкость.
Истинный прорыв в лечении рака произошел только в XX веке. В это время на помощь хирургам пришли методы, которые до сих пор широко используются в онкологии: лучевая терапия, гормональная терапия, иммунотерапия и химиотерапия
Library of Congress
Прорыв в понимании причин рака случился только в середине XIX века, с появлением микроскопа современного типа. «Отцом онкологии» стал немецкий ученый Рудольф Вирхов — он не только впервые описал раковые клетки, но и установил, что между воспалением и онкологическими заболеваниями есть прямая связь. Теперь удаленные хирургом опухолевые ткани можно было исследовать и уверенно отличать от здоровых.
А поскольку к тому времени уже была изобретена асептическая хирургия (спасибо за нее мы должны сказать английскому доктору Джозефу Листеру) и анестезия (которую изобрел бостонский стоматолог Уильям Мортон), оперативное лечение онкологических заболеваний впервые перестало напоминать гусарскую рулетку.
Лечение рака в XX веке: краткая история
Лучевая терапия. В 1898 году Мари и Пьер Кюри открыли, что радий и полоний могут испускать радиоактивное излучение. Через четыре года после этого немецкий биолог Теодор Бовери пришел к выводу, что раковые опухоли возникают из обычных клеток с поврежденными хромосомами.
Примерно в то же время удалось выяснить, что излучение радия тоже способно повреждать хромосомы в клетках. Еще через год радий впервые использовали, чтобы повредить раковые клетки еще сильнее — и уничтожить их. В эксперименте приняли участие два пациента с базально-клеточным раком — и оба выздоровели.
Еще через год радий впервые использовали, чтобы повредить раковые клетки еще сильнее — и уничтожить их. В эксперименте приняли участие два пациента с базально-клеточным раком — и оба выздоровели.
Долгое время главной проблемой лучевой терапии была ее неуправляемость. Возникали сложности как с расчетами нужной дозы облучения, так и с четким нацеливанием его на раковые клетки. Это очень важно: если перестараться с облучением и промахнуться мимо опухоли, облучение неизбежно повреждало в том числе и здоровые клетки. К счастью, в последней четверти XX века была изобретена конформная лучевая терапия. При этом подходе луч направляют при помощи компьютерной томографии, которая позволяет получить точные трехмерные модели облучаемой ткани.
Затем появилась лучевая терапия с модуляцией интенсивности (IMRT), которая позволяет регулировать интенсивность воздействия, и радиосенсибилизаторы — вещества, которые делают раковые клетки более чувствительными к воздействию радиации. Все это позволило заметно уменьшить побочные эффекты от лечения.
Химиотерапия. В 1909 году немецкий химик Пауль Эрлих предположил, что иммунная система организма способна выслеживать и уничтожать раковые клетки. Впоследствии эта идея превратилась в «гипотезу иммунного надзора», а Эрлих стал «отцом» сразу двух методов лечения онкологических заболеваний — иммунотерапии и химиотерапии.
Однако прорыв в химиотерапии случился только после Второй мировой войны, в 1949 году. В то время ученые активно изучали ядовитый иприт, больше известный как горчичный газ, который применялся в качестве химического оружия. Неожиданно исследователи выяснили, что азотистые соединения иприта помогают бороться с раком лимфатических узлов (лимфомой). «Доработанные» соединения иприта стали первыми в истории химиотерапевтическими лекарствами от рака.
В дальнейшем было открыто множество химиотерапевтических лекарств: от аминоптерина (соединение фолиевой кислоты, или витамина В9), способного обращать вспять острый лейкоз у детей, до адъювантной терапии, которая помогала в борьбе с неуловимыми метастазами. В 1958 году появилась комбинированная химиотерапия, при которой применяется сразу несколько препаратов, и которая действует более эффективно.
В 1958 году появилась комбинированная химиотерапия, при которой применяется сразу несколько препаратов, и которая действует более эффективно.
Гормонотерапия. В 1941 году американский физиолог Чарльз Хаггинс обнаружил, что снижение уровня тестостерона одновременно с повышением уровня эстрогенов в организме обращает вспять опухоль простаты. Чтобы добиться этой цели, Хиггинс удалял яички и вводил пациентам женские половые гормоны — так появилась гормональная терапия, которая до сих пор лежит в основе лечения рака предстательной и молочных желез.
В наши дни с той же целью применяют более щадящее лечение — используют препараты, блокирующие мужские и женские половые гормоны. Например, ингибиторы ароматазы и лютеинизирующего гормона.
Иммунотерапия. Этот метод лечения рака одновременно и самый передовой, и самый древний — если, конечно, считать первооткрывателем иммунотерапии фараона Имхотепа. На самом деле, осознанное применение этой методики стало возможно только с 1970-х годов, когда ученые наконец научились массово производить моноклональные антитела.
Антитело — особый белок, который белые клетки используют для «маркировки» всего опасного и нежелательного, от микробов до раковых клеток. Ориентируюсь на антитела, как на дорожные знаки, другие белые клетки быстро находят и уничтожают патоген.
Когда исследователи поняли, что можно создать антитела, которые будут распознавать раковые клетки, это был настоящий прорыв. Дело в том, что наиболее универсальные и эффективные методы лечения онкологических заболеваний — химиотерапия и лучевая терапия — токсичны для организма и дают тяжелые побочные эффекты. Одно из таких осложнений — нейтропения, то есть резкое снижение количества белых клеток в крови.
Химиотерапия, как воздушная гимнастика, требует страховки: чем опасна нейтропения и как ее победить
Химиотерапия (ХТ) – один из базовых методов лечения онкологических пациентов. Лекарства, которые применяют при химиотерапии (цитостатики), нарушают процессы роста, развития, механизмы деления всех клеток организма и обладают высокой пролиферативной активностью. Этим качеством, как правило, характеризуются клетки злокачественных новообразований. Клинические исследования подтверждают, что противоопухолевый эффект зависит от дозы цитостатиков и режима химиотерапии.
Этим качеством, как правило, характеризуются клетки злокачественных новообразований. Клинические исследования подтверждают, что противоопухолевый эффект зависит от дозы цитостатиков и режима химиотерапии.
Одно из самых частых осложнений цитотоксической терапии — нейтропения, или аномально низкий уровень белых клеток крови (нейтрофилов), которые играют важную роль в формировании иммунного ответа организма. Под воздействием химиотерапии уничтожаются не только нейтрофилы, но и место их продукции – костный мозг. Организм со сниженным числом нейтрофилов практически беззащитен перед инфекцией любой природы и силы. Кроме того, нейтропения сильно снижает эффективность проводимого лечения, так как из-за этого осложнения врачу приходится изменять оптимальный режим терапии и редуцировать дозы цитостатиков.
Однако нейтропения нейтропении рознь. На фоне одних схем химиотерапии количество нейтрофилов снижается не очень сильно, а при применении других у пациентов развивается «нейтропеническая лихорадка», или фебрильная нейтропения (ФН). Это жизнеугрожающее состояние, требующее неотложной медицинской помощи. Высокий риск развития ФН наблюдается при лечении многих онкологических болезней и сопровождает практически все схемы терапии онкогематологических заболеваний. Среди онкологических нозологий можно выделить рак молочной железы, рак легкого, рак шейки матки и яичников, рак яичка, колоректальный рак, саркомы и рак желудка. В группе высокого риска развития ФН находятся пациенты с такими лимфопролиферативными заболеваниями как лимфома Ходжкина и неходжкинские лимфомы, острый лимфобластный лейкоз, множественная миелома, диффузная B-крупноклеточная лимфома, первичная медиастинальная лимфома, лимфома ЦНС и другие.
При ФН число циркулирующих в крови нейтрофилов падает ниже 500/мм³. Это предельно малый уровень, абсолютно недостаточный для защиты организма от инфекций. По этой причине у страдающих ФН людей риск развития тяжелых инфекционных осложнений увеличивается на 30 процентов, а риск гибели — на 15 процентов.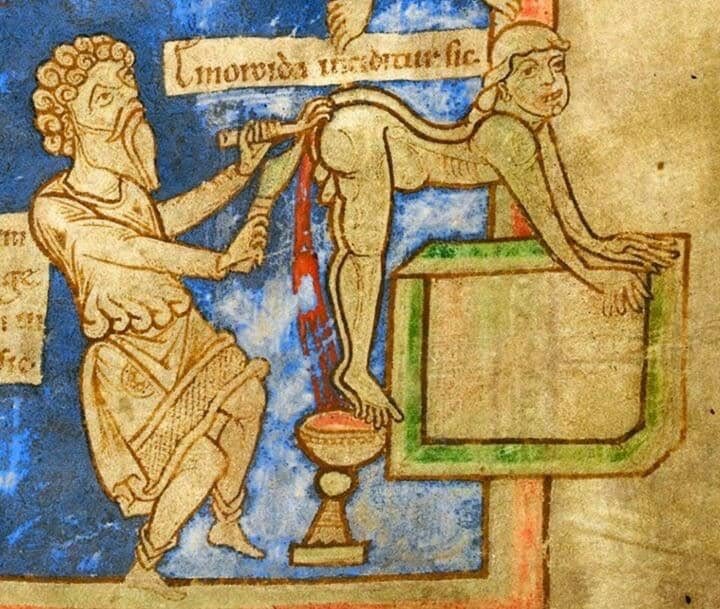
К счастью, своевременная профилактика заметно уменьшает риски, связанные с воздействием химиотерапии, и достоверно снижает вероятность развития нейтропении. Для этого на фоне лечения химиотерапией применяют специальные препараты — гранулоцитарные колониестимулирующие факторы (Г-КСФ). Эти вещества относятся к цитокинам — небольшим сигнальным молекулам, которые синтезируются в организме человека. Цитокины «побуждают» костный мозг создавать больше клеток крови и активно выпускать их в кровь.
На сегодняшний день считается, что применение Г-КСФ сокращает сроки восстановления кроветворения (гемопоэза) в костном мозге, снижает частоту развития инфекционных осложнений и позволяет сохранить дозоинтенсивность терапии (объем дозы и интервал между курсами), необходимую для эффективного лечения онкологических заболеваний. Снижение дозоинтенсивности ХТ приводит к сокращению общей выживаемости больных раком молочной железы и раком яичников на 37 процентов.
Согласно российским и международным исследованиям, первичная профилактика Г-КСФ достоверно уменьшает риски снижения дозоинтенсивности.
Препараты класса Г-КСФ существуют в двух формах: короткого и пролонгированого действия. Г-КСФ пролонгированного действия – это пегилированные (модифицированные в лабораторных условиях) молекулы, которые, по сути, являются усовершенствованной версией коротких Г-КСФ. Пегилированные Г-КСФ работают дольше, и их необходимо вводить всего один раз на курс химиотерапии. Это позволяет минимизировать посещения клиник, поддерживать оптимальные дозы химиотерапевтических лекарств и повышает эффективность лечения в целом.
В России применяются препараты Г-КСФ пролонгированного действия для снижения продолжительности нейтропении и уменьшения риска возникновения фебрильной нейтропении, такие как, например, эмпэгфилграстим.
Сегодня такие препараты входят в перечень жизненно необходимых и важнейших лекарственных препаратов. Это означает, что пациенты вправе получать их бесплатно, за счет бюджетных средств.
Cписок литературы.
Препараты на основе моноклональных антител помогают при лимфоме и раке молочной железы
National Cancer Institute / unsplash
В конце 1990-х годов исследователи создали первые в мире иммунотерапевтические препараты — моноклональные антитела к компонентам раковых клеток на основе химерных (частично мышиных, частично человеческих) антител, которые «не реагируют» на здоровые клетки организма: ритуксимаб и трастузумаб. Эти препараты применяют для лечения лимфомы и рака молочной железы.
Однако мышиные антитела живут в организме людей недолго, а еще они недостаточно эффективно проникают в опухоль и в целом работают хуже человеческих. Поэтому, чтобы эффективно бороться с человеческим раком, антитела тоже должны быть человеческими.
Проблема в том, что разработка лекарств на основе человеческих моноклональных антител — очень непростая работа. Чтобы получить антитела у мышей, нужно сначала создать «бессмертные» клетки, которые и будут «печатать» лечебный белок. Их делают путем слияния белых В-клеток с опухолевыми клетками (используют клетки миеломы, которые, как известно, не умирают). Однако клетки человеческой миеломы оказалось очень трудно культивировать в лаборатории.
Так что ученым пришлось действовать иначе — брать за основу мышиные антитела, и при помощи методов генной инженерии переделывать их, чтобы они работали в человеческом организме. Именно так создали препарат ритуксимаб. Процесс это дорогой, сложный, долгий и затратный — так что неудивительно, что готовое лекарство стоит порядка 100 долларов за десятимиллилитровую инъекцию.
Ритуксимаб в России: как в нашей стране научились создавать лекарства на основе моноклональных антител
Современные биотехнологии позволили разработать новые виды лечения. Это открыло путь к таргетной терапии многих заболеваний и способствовало улучшению качества жизни пациентов. Один из ярких примеров биологического препарата направленного действия — ритуксимаб. Это лекарство изменило взгляд мировой общественности на подходы к лечению пациентов с лимфопролиферативными заболеваниями.
Это открыло путь к таргетной терапии многих заболеваний и способствовало улучшению качества жизни пациентов. Один из ярких примеров биологического препарата направленного действия — ритуксимаб. Это лекарство изменило взгляд мировой общественности на подходы к лечению пациентов с лимфопролиферативными заболеваниями.
Наряду с оригинальными биологическими препаратами существуют биоаналоги. Биоаналогом называют биологический препарат, по параметрам безопасности, качества и эффективности схожий с оригинальным препаратом в такой же лекарственной форме и имеющий идентичный способ введения. Разработка биоаналогов — важная задача современной медицины и фармацевтики, так как позволяет обеспечить более широкое внедрение современных лекарственных препаратов в клиническую практику. И, соответственно, увеличить число успешно пролеченных пациентов.
В 2009–2010 годах компания ЗАО «БИОКАД» приступила к разработке и полному циклу исследований отечественного препарата ритуксимаба. Разработку проводили в рамках проекта государственного значения «Организация опытно-промышленного производства субстанций и лекарственных средств на основе моноклональных антител, необходимых для выпуска дорогостоящих импортозамещающих препаратов». Проект был утвержден Комиссией при Президенте Российской Федерации по модернизации и технологическому развитию экономики России.
Полный цикл сравнительных доклинических испытаний in vitro и in vivo завершился к середине 2011 года. В проведенных исследованиях биоаналог ритуксимаба по структуре и специфическому действию оказался идентичен оригинальному препарату «Мабтера» Ф. Хоффманн-Ля Рош, Лтд., Швейцария. Аналогичные данные получены в результате сравнительных физико-химических испытаний, а также доклинического исследования in vivo.
На следующем этапе проводились клинические испытания препарата на пациентах с лимфопролиферативными заболеваниями в сравнении с оригинальным препаратом «Мабтера». Результаты исследования свидетельствуют о том, что оба препарата одинаково воздействовали на В-лимфоциты, и не отличались по профилю безопасности и по эффективности.
На основании полученных данных биоаналог ритуксимаба производства ЗАО «БИОКАД» был зарегистрирован для медицинского применения у больных злокачественными В-клеточными лимфопролиферативными заболеваниями (рег. No ЛП-002420 от 04.04.14, код ATX: L01XC02). Новый отечественный препарат был назван «Ацеллбия». Такое название (A — Сell — B — ia) происходит от нескольких слов: A (от lat. attero) — уничтожать, ослаблять, уменьшать; Cell — клетка; B — вид клетки.
Список онкологических заболеваний, при которых применяют «Ацеллбию», велик: чаще всего препараты применяют при В-клеточных неходжкинских лимфомах, хроническом лимфолейкозе, ревматоидном артрите и гранулёматозе Вегенера.
Как мы лечим рак сегодня: открытия и достижения
За последние десятилетия XXI века ученые и врачи узнали об онкологических заболеваниях едва ли не больше, чем за все предшествующие эпохи. Лечение рака продвинулось очень далеко даже по сравнению с XX веком. Однако онкологические заболевания пока не торопятся сдавать позиции — чтобы их победить или хотя бы уверенно держать под контролем, человечеству предстоит узнать еще очень и очень много.
Все направления исследований в современной онкологии можно условно разделить на два больших направления: совершенствование старых методов и разработка новых. Одно из самых многообещающих «старых» направлений исследовательской онкологии — иммунотерапия. В XXI веке исследователи активно ищут для нее новые цели и мишени.
Современная иммунотерапия: как российские антитела помогают лечить меланому
16 апреля 2020 года Министерство здравоохранения РФ одобрило применение первого российского оригинального PD-1 ингибитора — пролголимаба. Препарат предназначен для лечения метастатической меланомы — одного из наиболее агрессивных видов рака.
По данным ВОЗ, на меланому кожи приходится около 3-4 процентов всех онкологических заболеваний взрослых. Согласно прогнозам, к 2025 году число заболевших меланомой кожи в мире увеличится на 25 процентов. В нашей стране проблема стоит не менее остро, чем во всем мире. По данным справочника «Состояние онкологической помощи населению России в 2018 г.», в 19 процентах случаев у наших соотечественников меланома кожи выявлялась уже на запущенных стадиях, когда лечить ее уже очень сложно. Так что средство для лечения этого опасного заболевания более чем актуально.
В нашей стране проблема стоит не менее остро, чем во всем мире. По данным справочника «Состояние онкологической помощи населению России в 2018 г.», в 19 процентах случаев у наших соотечественников меланома кожи выявлялась уже на запущенных стадиях, когда лечить ее уже очень сложно. Так что средство для лечения этого опасного заболевания более чем актуально.
У российского препарата есть аналоги за рубежом: пембролизумаб и ниволумаб. До появления отечественного ингибитора на российском рынке терапии меланомы кожи были только эти два лекарства. Пролголимаб — первый PD-1 ингибитор на основе моноклональных антител IgG1 c дополнительными модификациями его эффекторных свойств. Механизм действия ингибиторов PD-1 направлен на восстановление способности Т-лимфоцитов (иммунные клетки) распознавать и уничтожать злокачественные клетки, в результате чего иммунная система человека снова начинает бороться с опухолью.
Вакцины от рака — перспективное направление в иммунотерапии
National Cancer Institute / unsplash
Помимо моноклональных антител, в иммунотерапии есть еще одно перспективное направление — вакцины от рака. Первую вакцину от рака простаты, который не отвечает на гормональное лечение, FDA — американский аналог Минздрава и Роспотребнадзора — одобрил уже в XXI веке, в 2010 году. Это был препарат «Provenge». В отличие от привычных вакцин, лекарство не предотвращает болезнь, а помогает белым клеткам уже болеющего человека бороться с раком. К сожалению, вакцинация не излечивает рак простаты — зато помогает жить лучше и дольше.
Генная терапия. Новое направление, которое стало активно развиваться уже в XXI веке. Исследователи активно разрабатывают новые классы молекул, способных сражаться с раковыми клетками — например, антисмысловые олигонуклеотиды. Эти молекулы проникают в клетки и связываются с мишенью — матричной РНК (мРНК). В результате клетка прекращает создавать белки, за синтез которых отвечает ген, носители которого имеют предрасположенность к наследственным онкологическим заболеваниям. Если все получится, антисмысловые олигонуклеотиды будут просто «отключать гены рака»! Правда, к сожалению, пока не удалось зарегистрировать ни один такой препарат.
Эти молекулы проникают в клетки и связываются с мишенью — матричной РНК (мРНК). В результате клетка прекращает создавать белки, за синтез которых отвечает ген, носители которого имеют предрасположенность к наследственным онкологическим заболеваниям. Если все получится, антисмысловые олигонуклеотиды будут просто «отключать гены рака»! Правда, к сожалению, пока не удалось зарегистрировать ни один такой препарат.
Но кое-что у нас есть и сегодня. Например, мы уже научились лечить онкогематологические заболевания при помощи T-клеток с химерными рецепторами антигена (CAR-T). Если немного упростить, то в ходе этой процедуры у пациента берут его собственные лейкоциты (конкретно — Т-клетки), и модифицируют их, вставляя в клетки ген CAR. В результате Т-клетки выращивают на поверхности специальные рецепторы CD-19, которые помогают им узнавать и уничтожать раковые клетки.
В 2017-2018 годах в клиники поступило два CAR-T препарата: Kymriah от Novartis и Yescarta от Gilead. В нашей стране CAR-T-препараты разрабатывает группа под руководством Михаила Масчана. Из 46 пациентов с В-клеточным острым лимфобластным лейкозом, получивших российские CAR-T-препараты, выздоровело 40 человек. Это очень много: обычно выживаемость таких пациентов не превышает 10 процентов.
Второе направление генной терапии связано с подбором идеального лекарства. Исследователи активно ищут генные мутации, носители которых будут лучше реагировать на конкретный противораковый препарат. Это поможет сделать терапию по-настоящему индивидуальной — то есть максимально эффективной для конкретного человека, и при этом лишенной большей части побочных эффектов.
Роботизированная хирургия. Предполагается, что точный металлический робот-помощник поможет хирургам-онкологам делать идеально точные операции, которые будут одновременно малоинвазивными (по минимуму повреждающими здоровые ткани — прим.ред.) и высокоэффективными — то есть помогут убрать все до одной раковые клетки.
Другие направления онкологии касаются скорее диагностики, чем лечения рака. Например, нанотехнологии позволяют создать мельчайшие частицы — метки, которые будут точно показывать местонахождение опухоли.
Например, нанотехнологии позволяют создать мельчайшие частицы — метки, которые будут точно показывать местонахождение опухоли.
А протеомика (наука о всех белках, которые есть в организме) поможет больше узнать о том, как ведут себя в организме разные раковые клетки. Протеомика поможет отличать агрессивные опухоли от менее агрессивных — в будущем это может помочь избавить пациента от опасного и ненужного лечения.
А еще протеомические исследования нужны, чтобы разработать новые диагностические тесты. Возможно, когда-нибудь благодаря таким тестам мы сможем «ловить» онкологические заболевания на стадии всего одной клетки. То есть тогда, когда справиться с ними совсем просто.
Даниил Давыдов
Методы лечения рака от средневековья до наших дней
Автор фото, Science Photo Library
Подпись к фото,
На протяжении столетий с раком пытались бороться лишь путем хирургического вмешательства. На фото: клетка рака молочной железы
Новый метод лечения, настраивающий иммунную систему человека на борьбу с раковыми клетками, помог более чем 90% смертельно больных людей, участвовавших в клинических испытаниях, перейти в стадию ремиссии. Это известие вселило надежду в огромное число онкобольных по всему миру. Однако эксперты, хотя и признают результаты испытаний впечатляющими, говорят, что пока это лишь детский шажок в сторону победы над болезнью.
На фоне новых открытий в поисках средства борьбы с этим страшным заболеванием Би-би-си решила напомнить, как лечили рак на более ранних этапах истории.
До XVI века: В те времена рак считался неизлечимым заболеванием. Единственным методом борьбы с ним являлось хирургическое вмешательство, однако было установлено, что после операции опухоль возвращается снова.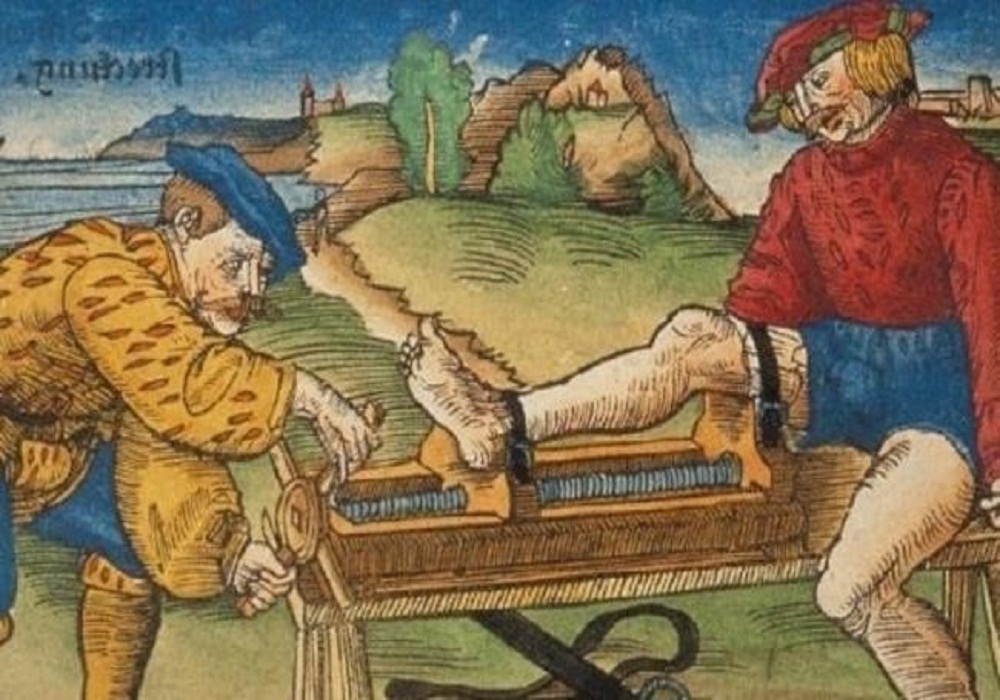 В методах лечения рака не наблюдалось никакого прогресса, что укрепило медиков того времени во мнении, что заболевание вообще невозможно лечить.
В методах лечения рака не наблюдалось никакого прогресса, что укрепило медиков того времени во мнении, что заболевание вообще невозможно лечить.
XVI-XVIII века: Ученые получили больше представления о человеческом теле, анатомии и развитии болезней. Эти знания помогли продвинуться в вопросе изучения онкологии.
XIX-XX века: Большой шаг был сделан в области общей хирургии, включая методы проведения операций и анестезию. Операции по удалению раковых опухолей стали более сложными и предполагали также удаление тканей вокруг поврежденного участка, куда могли проникнуть раковые клетки.
Раздел науки, изучающий онкологию, появился благодаря современному микроскопу, с помощью которого стало возможно изучать зараженные ткани. Как следствие, стало понятнее, какой именно эффект оказывает заболевание на организм человека, и значительно продвинулась хирургия в этой области.
Такие разработки в области борьбы с раком сохранялись почти 100 лет – до середины 70-х годов XX века.
Новый век в лечении рака
Автор фото, Science Photo Library
Подпись к фото,
Так выглядит рак крови. Прогресс в области изучения раковых заболеваний начался в XIX веке
Параллельно развивались теоретические знания в области метастаз, которые позволили медикам понять, какие существуют ограничения на хирургическое вмешательство, и помогли в разработке иных способов предотвращения распространения опухолей в организме.
После открытия рентгеновского излучения в конце XIX века, радиотерапия стала применяться для лечения онкологических заболеваний.
В XX веке был разработан метод химиотерапии, этому во многом способствовали химические вещества, созданные в период между Первой и Второй мировыми войнами, которые, как оказалось, способны уничтожать быстро размножающиеся раковые клетки.
В 1970-е годы выяснилось, что для борьбы с раком груди точечная хирургия подходит для большинства женщин не хуже, чем радикальная мастэктомия. При лампэктомии у пациентки удаляется только первичная опухоль, а не вся грудь, а затем применяется радиотерапия.
При лампэктомии у пациентки удаляется только первичная опухоль, а не вся грудь, а затем применяется радиотерапия.
В последние десятилетия XX века хирурги технически усовершенствовали операции с тем, чтобы свести к минимуму удаление здоровой ткани.
Сегодня хирургические операции стали еще менее инвазивными благодаря оптоволоконным технологиям и миниатюрным видеокамерам, которые вводятся внутрь и помогают при операциях.
Ведутся также работы по развитию криохирургии, когда для уничтожения злокачественных клеток используется жидкий азот. Все большее распространение получает также лазерная хирургия, как для надрезов, так и для уничтожения раковых клеток.
В новом методе лечения используются генетически модифицированные клетки, которые остаются в крови пациента и создают пожизненный иммунитет от возобновления ракового заболевания. Однако нам пока ничего не известно о долгосрочном эффекте такой терапии.
рак. История лечения / Блог компании «Атлас» / Хабр
Злокачественная опухоль отличается от других видов опухолей и заболеваний тем, что её клетки схожи со здоровыми клетками организма. Поэтому перед учеными стоит непростая задача: различить клетки и уничтожить только зараженные. На протяжении истории у врачей были разные идеи о том, как это сделать. Сегодня Атлас расскажет о том, как развивалась онкология и чем лечат рак в наши дни.
Иллюстрации: Майкл Ковальски
Гуморальная теория Гиппократа
До 18 века онкологические заболевания было трудно изучать: подходящее оборудование еще не изобрели, церковь запрещала вскрытия, а чума и оспа уносили больше жизней и притягивали к себе внимание. Поэтому с древних времен до нас дошло мало записей о злокачественных опухолях, но все же они есть.
Первые упоминания рака встречаются в папирусе Эдвина Смита — медицинском тексте Древнего Египта, который датируется 16 веком до нашей эры. Этот папирус можно полистать и почитать. Случай № 45 как раз описывает злокачественные опухоли. Там же отмечается, что метода лечения нет.
Случай № 45 как раз описывает злокачественные опухоли. Там же отмечается, что метода лечения нет.
Гиппократ (400 лет до нашей эры) первым начал различать доброкачественные и злокачественные опухоли. Он считал, что тело человека содержит четыре гумора, или жидкости — кровь, слизь, желтую и черную желчь, — а любой дисбаланс приводит к заболеваниям. Считалось, что причина злокачественных опухолей — скопление черной желчи в определенном месте. Гиппократ отмечал, что без лечения больные могут прожить дольше: черная желчь уже распространилась по организму и удалить ее нельзя.
Конечно, никакой черной желчи в организме человека нет, но идея о распространении опухоли по организму оказалась верной. Злокачественные клетки со временем отделяются от опухоли и дают метастазы.
Врачи и знахари пользовались гуморальной теорией более 1300 лет. В течение этого периода вскрытия были запрещены по религиозным соображениям, что ограничивало изучение опухолей. Доступными методами лечения в древние времена и Средневековье были хирургия, прижигание, кровопускание и обряды.
Первые хирургические вмешательства
Хирургия — одна из самых древних отраслей медицины. Однако в средневековые времена вмешательства не всегда приводили к нужным результатам из-за большой потери крови, высокого риска заражения после операции, отсутствия антисептиков.
Гален
Римский врач Гален (130-200 годы нашей эры) писал о хирургическом лечении рака молочной железы на ранней стадии, но не считал этот метод эффективным для лечения крупных и «скрытых» опухолей. Он придерживался гуморальной теории и предполагал, что черную желчь удалить из организма полностью нельзя. Такой подход спас жизнь многим людям: в Средневековье пациенты часто умирали во время операции или из-за осложнений после нее.
Отмена гуморальной теории
После отмены запрета на вскрытия в 16 веке Андреас Везалий составил первый анатомический справочник тела человека, а веком позже Метью Бейли описал строение различных патологий. Гуморальную теорию пришлось пересмотреть, так как никакой черной желчи ученые не нашли.
Гуморальную теорию пришлось пересмотреть, так как никакой черной желчи ученые не нашли.
В 17 веке начали развиваться хирургические методы удаления опухолей. Немецкий хирург Вильгельм Фабри во время операции по удалению рака молочной железы вырезал опухоль вместе с увеличенными лимфоузлами, а голландский хирург Адриан Гельвеций проводил мастэктомию, полное удаление молочной железы. Несколько лет спустя, он писал про один из случаев: «С тех пор пациентка полностью выздоровела. Боли совершенно прекратились, рубцы зажили, и она наслаждается тем же состоянием здоровья, которое у нее было до рака».
В 1850–х немецкий ученый Рудольф Вирхов обнаружил в опухолях бесконтрольное деление клеток. Он назвал это явление неоплазией, а его главный труд «Клеточная патология» стал основой для понимания причин развития онкологических заболеваний.
Обезболивание и антисептик
В 1846 году был изобретен наркоз. Это решило проблему с болью, так как до этого людям приходилось переживать операцию в сознании. А в 1867 году французский врач Джозеф Листер открыл, что мазь на основе карболовой кислоты действует как антисептик и способствует заживлению раны после операции.
Анестезия и первый антисептик расширили возможности хирургии, и операции стали проводиться повсеместно. Однако в некоторых случаях опухоли появлялись вновь. Тогда хирурги начали расширять объемы вмешательств, что в итоге привело к возникновению метода радикальной хирургии.
Радикальная хирургия
Хирург Уильям Холстед думал, что чем больше тканей удалить во время операции, тем меньше будет вероятность рецидивов. Вывод не совсем верный, так как злокачественные клетки еще до операции могли распространиться по организму и метастазировать в другие ткани.
Только в 1970–х годах в ходе клинических испытаний было доказано, что менее обширные операции эффективны так же, как и радикальные. К сожалению, к этому времени радикальная мастэктомия набрала большую популярность и считалась практически единственным верным методом лечения рака молочной железы.
Современность
В 1990-е годы хирурги минимизировали вмешательства в здоровые ткани человека. Сегодня операции делятся на два вида: открытые и малоинвазивные. Для открытой операции врач делает большой разрез, чтобы удалить опухоль, нездоровые ткани и, возможно, лимфоузлы.
Для проведения малоинвазивной операции врач делает несколько небольших разрезов, находит опухоль с помощью тонкой трубки с камерой (лапароскопа) и через другой разрез удаляет опухоль инструментами. После этой операции пациент восстанавливается быстрее.
Лучевая терапия
В конце 19 века ученых обратили внимание на способность рентгеновских лучей убивать злокачественные клетки. Тогда никто еще не догадывался, насколько губительно излучение действует и на здоровые ткани.
Рентгеновские трубки
Рентгеновские лучи были открыты в 1895 году, одновременно с развитием радикальной хирургии. Через год после этого молодой врач Эмиль Груббе заметил, как разрушаются кожа и ногти у людей, которые работали с источниками излучения. Он предположил, что лучи убивают и клетки опухоли, и был первым, кто использовал лучевую терапию для лечения онкологии.
Метод быстро набрал популярность: в Европе и США открывались новые клиники, предлагающие лучевую терапию. Она была эффективной в тех случаях, когда опухоль не успела распространиться на другие органы.
Идея использовать излучение была отличной, но она не учитывала два существенных минуса рентгеновской трубки: неоднородный поток излучения и недостаточную проникающую способность. Большая часть дозы поглощается другими тканями или рассеивается. Таким образом рентгеновские лучи увеличивают количество мутаций в здоровых клетках, что приводит к формированию новых опухолей. Такой вариант нельзя считать подходящим лечением.
Радий
В 1902 году ученые Пьер и Мария Кюри открыли радиоактивные свойства радия. На первый взгляд, это вещество проникало глубже рентгеновских лучей и давало больше возможностей для лечения. На протяжении 10 лет после открытия радия у многих врачей и ученых, не знающих об опасности облучения, развивались различные злокачественные заболевания. Так продолжалось до тех пор, пока не появились первые дозиметры и стандарты измерений радиоактивного излучения.
На протяжении 10 лет после открытия радия у многих врачей и ученых, не знающих об опасности облучения, развивались различные злокачественные заболевания. Так продолжалось до тех пор, пока не появились первые дозиметры и стандарты измерений радиоактивного излучения.
Ускоритель электронов и радиоактивный кобальт
В 1940 Дональд Керст собрал бетатрон — циклический ускоритель электронов. Устройство испускает частицы, обладающие высокой энергией и проникающей способностью, поэтому при его использовании возникает мало рассеянных лучей. В 1951 шведский нейрохирург Ларс Лекселл разработал аппарат «Гамма-нож». Он имеет несколько источников излучения радиоактивного кобальта и дает однородный пучок большой энергии. Бетатрон и гамма-нож успешно применяются для лечения опухолей и сегодня.
Излучение разрушает ДНК клеток прямо или косвенно. Во втором случае вода, которая содержится в клетках, превращается в свободные радикалы — заряженные частицы, повреждающие ДНК. Излучение не разбирает, какие клетки разрушать, здоровые или злокачественные, поэтому аппараты требуют внимательной настройки, чтобы пик дозы приходился на нужную глубину.
Современность
Сегодня в онкологии используют рентгеновское излучение, гамма-лучи и заряженные частицы. Они могут поступать в тело и воздействовать на злокачественные клетки через специальное устройство либо исходить от радиоактивного материала, помещенного в тело пациента рядом с опухолью (брахитерапия).
Существует также третий вид лучевой терапии — системный. Пациенту вводят радиоактивную жидкость, например йод, который находит и убивает клетки опухоли. Но в этом случае трудно учесть точное количество изотопа, которое поглощает организм, и доза может нанести вред.
Химиотерапия
Хирургия и лучевая терапия применялись для лечения солидных опухолей, которые развиваются не из клеток кроветворной системы. Как лечить лимфомы и лейкемию никто не знал.
Горчичный газ
Идея использовать токсичные вещества для лечения этих заболеваний возникла после Первой мировой войны. В это время в качестве химического оружия применялся иприт — горчичный газ. Он обжигал кожу и слизистые оболочки, а также убивал лейкоциты: у раненых они практически отсутствовали.
В это время в качестве химического оружия применялся иприт — горчичный газ. Он обжигал кожу и слизистые оболочки, а также убивал лейкоциты: у раненых они практически отсутствовали.
Ученые задались вопросом, может ли иприт вылечить лимфому — опухоль лимфатической ткани. При этом заболевании лимфоциты бесконтрольно делятся и нарушают работу лимфатических узлов и других органов, поэтому сокращение лимфоцитов казалось верным решением. В 1942 году после исследований на животных больному лимфомой ввели внутривенно 10 доз иприта. Количество лимфоцитов быстро упало, а опухоль уменьшилась, но позже начала расти вновь. Это означало, что терапия подействовала, но дозы было недостаточно для полного выздоровления.
Ремиссия наступала потому, что горчичный газ входит в группу алкилирующих агентов, которые разрушают ДНК клеток и не дают им делиться. Но тогда об этом еще ничего не знали.
Предшественник метотрексата
В 1947 году врач Сидни Фарбер показал, что производное фолиевой кислоты, аметоптерин, подавляет у детей развитие острого лейкоза, который характеризуется бесконтрольным делением белых клеток крови. Этот препарат был предшественником метотрексата, который применяют и сейчас.
Результаты биопсии костного мозга пациентов после курса лечения аметоптерина были в норме. Химиотерапия продлевала жизнь детей до 6 месяцев, но затем болезнь возвращалась. Фарбер бросил все силы на то, чтобы найти лекарство, которое смогло бы вылечить лейкемию полностью. Тогда трудно было предположить, что нужно использовать сразу несколько токсичных веществ, а не одно.
В 1950 году Гертруда Элион разработала препарат 6-меркаптопурин (6-МП), который быстро получил разрешение к применению у детей с лейкозом. После него врачи снова наблюдали недолгую ремиссию.
Комбинированная химиотерапия
Позже были проведены рандомизированные клинические испытания, в ходе которых стало ясно, что использование двух препаратов вместо одного продлевает ремиссию и улучшает прогноз.
В 1956 году доктор Мин Чиу Ли клинически подтвердил, что комбинация из четырех препаратов вылечила метастатическую хориокарциному у беременных. Национальный институт онкологии сначала расценил эти действия как агрессивное и лишнее лечение пациентов, и ученого отстранили от работы. Только потом стало понятно, что выжили только те женщины, которые прошли полный курс лечения Ли. Это был первый случай полного излечения методом химиотерапии.
Адъювантная химиотерапия
В 60 и 70–е годы ученые пробовали использовать химиотерапию как дополнительный метод лечения рака молочной железы после операции. Хирурги неохотно шли на клинические исследования: никто не хотел иметь дело с дополнительными побочными эффектами у пациентов. Но они были неправы.
На деле, любая опухоль — системное заболевание. Злокачественные клетки распространяются по организму даже на ранних стадиях в виде микрометастазов. Они остаются в организме даже после удаления опухоли, поэтому локальных методов лечения недостаточно. Нужно системно воздействовать на заболевание с помощью лекарственного лечения. Например, адъювантная терапия (курс химиотерапии после операции) позволяет снизить риск рецидива и смерти.
Несколько исследований доказали положительный результат адъювантной химиотерапии для лечения рака молочной железы и колоректального рака. Также в 1974 году был доказан положительный эффект в случае метастатического рака яичек, и химиотерапию стали применять для лечения солидных опухолей.
Препараты для химиотерапии останавливают и замедляет деление клеток. Во время курса лечения гибнут те клетки, которые быстро делятся. Это не только злокачественные клетки, но и здоровые, что приводит к побочным эффектам: выпадению волос, тошноте, подверженности инфекциям.
Иммунотерапия
Иммунотерапия — относительно новый вид лечения рака. В его основе лежит использование препаратов, тренирующих клетки иммунитета пациента. Это стало возможным благодаря открытию структуры ДНК, изучению особенностей злокачественных клеток и клеток иммунной системы.
Вакцина Коли
В 1891 году Вильям Коли заметил, что у онкобольных, перенесших скарлатину или рожистую болезнь, наступала ремиссия. После этого он начал вводить пациентам с последней стадией рака бактерии стрептококков. Опухоль уменьшалась, но больные умирали от инфекции. Тогда Коли нагревал вакцину и вводил пациентам мертвые стрептококки.
Результат для того времени был впечатляющим: больные выздоравливали и жили несколько лет. Однако вакцина Коли не получила широкого распространения. Ученые не могли объяснить механизм, как бактерии действуют на опухоль, а риск инфицирования был высоким. Всех гораздо больше интересовала химио- и лучевая терапия.
В 1976 году для лечения рака мочевого пузыря успешно применили вакцину BCG, которая использовалась для предупреждения туберкулеза. Она активизирует иммунную систему и помогает организму бороться с этим видом рака.
Моноклональные антитела
В 1975 году Жорж Кёллер и Сезар Мильштейн опубликовали статью о методе получения клеточного гибрида опухолевой клетки и лимфоцита. Гибридомная технология позволяет обнаружить антигены, характерные для опухолей определенных тканей, получить к ним антитела и использовать их для диагностики и типирования опухолей. Такие антитела называются моноклональными: они вырабатываются иммунными клетками-клонами, которые происходят из одной родительской клетки.
Другие типы антител маркируют раковые клетки, чтобы иммунной системе было легче найти и уничтожить их.
В конце 1990 годов FDA одобрила первые терапевтические моноклональные антитела, ритуксимаб и трастузумаб. Первый для лечения лимфомы, а второй — рака молочной железы.
В 2010 году Стивен Розенберг объявил об успехе терапии химерными антигенными рецепторами. В основе нее лежит генетическая модификация Т-клеток пациента для лечения злокачественной опухоли.
Цитокины
Другой метод иммунотерапии — введение в мышцу или вену цитокинов, биологически активных белков, которые регулируют иммунную реакцию. Интерлейкин-2 помогает клеткам иммунной системы быстрее делиться, а интерферон — бороться с вирусными инфекциями и злокачественными опухолями.
Интерлейкин-2 помогает клеткам иммунной системы быстрее делиться, а интерферон — бороться с вирусными инфекциями и злокачественными опухолями.
Контрольные точки
Еще одно перспективное направление — воздействие на иммунные контрольные точки, которые подавляют ответ иммунной системы. Ученые научились блокировать контрольные точки на Т-клетках, что помогает иммунной системе распознавать и атаковать злокачественные клетки. Этот метод уже одобрен FDA для лечения онкологических заболеваний.
Подобрать оптимальное лечение можно с помощью молекулярной диагностики. Ученые исследуют операционный материал или биопсию пациента, чтобы выявить мутации в протоонкогенах и генах супрессорах. Набор мутаций индивидуален для каждой опухоли, поэтому лечение должно быть персонализированным. В следующий раз Атлас подробно расскажет о молекулярной диагностике.
Как лечили рак древние люди | N+1
Многие люди думают, что рак появился относительно недавно, а древние люди от него не страдали. Но это не так: ученые нашли множество доказательств, что люди болели раком и в каменном веке, и в Древнем Египте, и в средневековой Германии. И, конечно, врачи пытались его лечить. Рассказываем о способах лечения рака в прошлом и о том, как мы боремся с этой болезнью сейчас.
Правда ли, что древние люди реже болели раком?
Это утверждение звучит резонно. Особенно если учесть, что среди причин онкологических заболеваний есть употребление табака, воздействие радиации и контакт с промышленными веществами-канцерогенами.
Однако утверждать, что онкологических заболеваний в древности было намного меньше, со всей уверенностью нельзя. Хотя бы потому, что 5-10 процентов всех видов рака связаны с генами, унаследованными от родителей — то есть получить онкологическую болезнь «по наследству» в древности можно было точно так же, как и в наши дни.
Узнать правду о том, насколько были распространены онкологические заболевания в прошедшие эпохи, должны помочь древние захоронения. Однако изучать заболеваемость раком по костям очень сложно.
Во-первых, если речь идет о по-настоящему давних временах, до нас доходит не так уж много костных остатков. Во-вторых — и это самое главное — не все онкологические заболевания оставляют следы на костях.
Исследуя скелеты людей, живших в прошлые эпохи, проще всего найти первичные опухоли костей — а это менее 0,2 процента всех онкозаболеваний
Library of Congress
Еще в костях порой можно обнаружить метастазы некоторых других видов онкологических болезней: рака молочной железы, предстательной железы и легкого. Однако это не так просто, как кажется. В 1996 году английский палеонтолог Тони Вальдрон изучил регистр смертей за 1901–1905 годы и выяснил, что вероятность обнаружения признаков рака в костных останках мужчин составляет 0–2 процента, а у женщин — 4–7 процентов.
Поэтому с уверенностью мы можем утверждать только одно — раком люди болели всегда: и в каменном веке, и в более поздние эпохи. Например, в 2007 году ученые из Мюнхена обнаружили пять случаев рака среди 905 скелетов в египетских некрополях, и тринадцать случаев — среди 2547 захоронений на средневековом кладбище в Германии.
Другое дело, что характер заболеваемости и частота встречаемости различных онкологических заболеваний в стародавние времена, скорее всего, был совсем иным, чем сейчас. Хотя бы потому, что продолжительность жизни людей все время увеличивается.
По прогнозам, к 2030 году 70 процентов всех случаев рака будет выявляться у людей в возрасте 65 лет и старше. Но всего 200 лет назад (то есть в середине XIX века) средняя ожидаемая продолжительность жизни мужчин составляла 40 лет, а женщин — 42 года. Получается, что до многих видов рака, распространенных в наши дни, предки попросту не доживали.
Как лечили рак до XX века
Самый древний метод лечения рака был описан в медицинском папирусе Эберса — то есть в 1500 году до нашей эры. Египетский фараон Имхотеп рекомендовал «прото-иммунотерапию»: нужно было сделать припарку возле опухоли, а потом надрезать ее. Фараон рассчитывал, что в месте надреза начнется воспаление, которое уничтожит опухоль.
Самое интересное, что «фараонский» метод вполне мог сработать. Например, редкая раковая опухоль святого Перегрина способна к спонтанной регрессии — но только в том случае, если в рану попадет инфекция. Однако куда чаще целители из Египта, Греции, Рима и Индии ограничивались тем, что прикладывали к опухоли тепло — в надежде, что нагревание поможет справиться с болезнью.
Рак святого Перегрина: болезнь с чудесным исцелением
Отец Перегрин жил на рубеже XIII-XIV веков, происходил из хорошей семьи и вел праведную жизнь — а прославился благодаря необычной истории своей болезни. В молодости священник заболел раком голени, которая потребовала ампутации ноги. Однако, когда подошел срок операции, врач увидел, что опухоль исчезла — так что удачливый священник ушел из его «кабинета» на обеих ногах.
Сегодня мы знаем, что «самопроизвольное» излечение от рака — вполне возможное, хотя и достаточно редкое явление. Иногда попавшие в рану микробы действительно «модифицируют» иммунный ответ, и организм оказывается в состоянии победить рак. На этом принципе основана современная иммунотерапия. Однако в средние века о работе иммунитета ничего не знали, так что чудесное исцеление приписали не микробам, а божественному вмешательству.
Долгие годы «иммунотерапия» путем загрязнения хирургической раны шла «в комплекте» с хирургическим лечением рака. Поскольку о стерильности хирургических кабинетов и инструментов речь не шла, вырезавшие раковые опухоли хирурги неизбежно заносили в них болезнетворных бактерий (например, Streptococcus pyogenes и Serratia marcescens).
Для многих прооперированных людей это заканчивалось плачевно, поскольку приводило к сепсису (смертельному заражению крови — прим.ред). Однако некоторые пациенты, страдавшие способным к регрессии раком, вытягивали «счастливый билетик» и исцелялись. Подобные случаи описывали и в XVIII, и в XIX, и даже в начале XX века.
Авторство термина «рак» приписывают греческому врачу Гиппократу (460-370 годы до нашей эры). Считается, что он первым использовал слово «carcinos» для описания не образующих язвы опухолей, а слово «carcinoma» — для описания «язвенных» опухолей.
Оба термина — «carcinos» и «carcinoma» — восходят к греческому слову «краб». Возможно, ученый решил, что силуэт опухоли под кожей напоминает это животное
За второй термин, «онкология», мы должны быть признательны второму греческому врачу, Галену (130-200 годы нашей эры). Для описания опухолей он использовал греческое слово «отек», или «oncos». Оба знаменитых грека придерживались гуморальной теории, в соответствии с которой за здоровье человека отвечают четыре жидкости организма: кровь, мокрота, желтая и черная желчь. Если баланс этих жидкостей нарушается, человек заболевает. В соответствии с этой теорией к раку приводил избыток черной желчи, которая скапливается в некоторых органах и тканях. Их идеи продержались до конца Средних веков.
Чтобы вылечить рак «по Галену», нужно было либо нормализовать образ жизни при помощи правильного питания и переезда в «здоровое место» подальше от болот с их тлетворными испарениями — либо попытаться выпустить избыток черной желчи из опухоли хирургическим путем. Однако в отсутствие антибиотиков хирургическое лечение онкологических болезней было крайне болезненным и рискованным делом.
Вплоть до середины XIX века большинство пациентов предпочитало хирургии самое фантастическое якобы «медикаментозное» лечение. Аптекари запаслись зубом кабана, легкими лис, настойкой свинца, молотым белым кораллом и другими сомнительными средствами. Хирургические операции применялись нечасто — лишь изредка хирурги-парикмахеры проводили мастэктомию (удаление опухоли груди). Разумеется, без анестезии и в антисанитарных условиях.
В XVIII веке на смену гуморальной теории пришла теория лимфы. Но это было немногим лучше гуморальной теории. В то время считалось, что рак возникает, если в органах и тканях понемногу накапливается разрушающая и отравляющая организм лимфатическая жидкость.
Истинный прорыв в лечении рака произошел только в XX веке. В это время на помощь хирургам пришли методы, которые до сих пор широко используются в онкологии: лучевая терапия, гормональная терапия, иммунотерапия и химиотерапия
Library of Congress
Прорыв в понимании причин рака случился только в середине XIX века, с появлением микроскопа современного типа. «Отцом онкологии» стал немецкий ученый Рудольф Вирхов — он не только впервые описал раковые клетки, но и установил, что между воспалением и онкологическими заболеваниями есть прямая связь. Теперь удаленные хирургом опухолевые ткани можно было исследовать и уверенно отличать от здоровых.
А поскольку к тому времени уже была изобретена асептическая хирургия (спасибо за нее мы должны сказать английскому доктору Джозефу Листеру) и анестезия (которую изобрел бостонский стоматолог Уильям Мортон), оперативное лечение онкологических заболеваний впервые перестало напоминать гусарскую рулетку.
Лечение рака в XX веке: краткая история
Лучевая терапия. В 1898 году Мари и Пьер Кюри открыли, что радий и полоний могут испускать радиоактивное излучение. Через четыре года после этого немецкий биолог Теодор Бовери пришел к выводу, что раковые опухоли возникают из обычных клеток с поврежденными хромосомами.
Примерно в то же время удалось выяснить, что излучение радия тоже способно повреждать хромосомы в клетках. Еще через год радий впервые использовали, чтобы повредить раковые клетки еще сильнее — и уничтожить их. В эксперименте приняли участие два пациента с базально-клеточным раком — и оба выздоровели.
Долгое время главной проблемой лучевой терапии была ее неуправляемость. Возникали сложности как с расчетами нужной дозы облучения, так и с четким нацеливанием его на раковые клетки. Это очень важно: если перестараться с облучением и промахнуться мимо опухоли, облучение неизбежно повреждало в том числе и здоровые клетки. К счастью, в последней четверти XX века была изобретена конформная лучевая терапия. При этом подходе луч направляют при помощи компьютерной томографии, которая позволяет получить точные трехмерные модели облучаемой ткани.
Затем появилась лучевая терапия с модуляцией интенсивности (IMRT), которая позволяет регулировать интенсивность воздействия, и радиосенсибилизаторы — вещества, которые делают раковые клетки более чувствительными к воздействию радиации. Все это позволило заметно уменьшить побочные эффекты от лечения.
Химиотерапия. В 1909 году немецкий химик Пауль Эрлих предположил, что иммунная система организма способна выслеживать и уничтожать раковые клетки. Впоследствии эта идея превратилась в «гипотезу иммунного надзора», а Эрлих стал «отцом» сразу двух методов лечения онкологических заболеваний — иммунотерапии и химиотерапии.
Однако прорыв в химиотерапии случился только после Второй мировой войны, в 1949 году. В то время ученые активно изучали ядовитый иприт, больше известный как горчичный газ, который применялся в качестве химического оружия. Неожиданно исследователи выяснили, что азотистые соединения иприта помогают бороться с раком лимфатических узлов (лимфомой). «Доработанные» соединения иприта стали первыми в истории химиотерапевтическими лекарствами от рака.
В дальнейшем было открыто множество химиотерапевтических лекарств: от аминоптерина (соединение фолиевой кислоты, или витамина В9), способного обращать вспять острый лейкоз у детей, до адъювантной терапии, которая помогала в борьбе с неуловимыми метастазами. В 1958 году появилась комбинированная химиотерапия, при которой применяется сразу несколько препаратов, и которая действует более эффективно.
Гормонотерапия. В 1941 году американский физиолог Чарльз Хаггинс обнаружил, что снижение уровня тестостерона одновременно с повышением уровня эстрогенов в организме обращает вспять опухоль простаты. Чтобы добиться этой цели, Хиггинс удалял яички и вводил пациентам женские половые гормоны — так появилась гормональная терапия, которая до сих пор лежит в основе лечения рака предстательной и молочных желез.
В наши дни с той же целью применяют более щадящее лечение — используют препараты, блокирующие мужские и женские половые гормоны. Например, ингибиторы ароматазы и лютеинизирующего гормона.
Иммунотерапия. Этот метод лечения рака одновременно и самый передовой, и самый древний — если, конечно, считать первооткрывателем иммунотерапии фараона Имхотепа. На самом деле, осознанное применение этой методики стало возможно только с 1970-х годов, когда ученые наконец научились массово производить моноклональные антитела.
Антитело — особый белок, который белые клетки используют для «маркировки» всего опасного и нежелательного, от микробов до раковых клеток. Ориентируюсь на антитела, как на дорожные знаки, другие белые клетки быстро находят и уничтожают патоген.
Когда исследователи поняли, что можно создать антитела, которые будут распознавать раковые клетки, это был настоящий прорыв. Дело в том, что наиболее универсальные и эффективные методы лечения онкологических заболеваний — химиотерапия и лучевая терапия — токсичны для организма и дают тяжелые побочные эффекты. Одно из таких осложнений — нейтропения, то есть резкое снижение количества белых клеток в крови.
Химиотерапия, как воздушная гимнастика, требует страховки: чем опасна нейтропения и как ее победить
Химиотерапия (ХТ) – один из базовых методов лечения онкологических пациентов. Лекарства, которые применяют при химиотерапии (цитостатики), нарушают процессы роста, развития, механизмы деления всех клеток организма и обладают высокой пролиферативной активностью. Этим качеством, как правило, характеризуются клетки злокачественных новообразований. Клинические исследования подтверждают, что противоопухолевый эффект зависит от дозы цитостатиков и режима химиотерапии.
Одно из самых частых осложнений цитотоксической терапии — нейтропения, или аномально низкий уровень белых клеток крови (нейтрофилов), которые играют важную роль в формировании иммунного ответа организма. Под воздействием химиотерапии уничтожаются не только нейтрофилы, но и место их продукции – костный мозг. Организм со сниженным числом нейтрофилов практически беззащитен перед инфекцией любой природы и силы. Кроме того, нейтропения сильно снижает эффективность проводимого лечения, так как из-за этого осложнения врачу приходится изменять оптимальный режим терапии и редуцировать дозы цитостатиков.
Однако нейтропения нейтропении рознь. На фоне одних схем химиотерапии количество нейтрофилов снижается не очень сильно, а при применении других у пациентов развивается «нейтропеническая лихорадка», или фебрильная нейтропения (ФН). Это жизнеугрожающее состояние, требующее неотложной медицинской помощи. Высокий риск развития ФН наблюдается при лечении многих онкологических болезней и сопровождает практически все схемы терапии онкогематологических заболеваний. Среди онкологических нозологий можно выделить рак молочной железы, рак легкого, рак шейки матки и яичников, рак яичка, колоректальный рак, саркомы и рак желудка. В группе высокого риска развития ФН находятся пациенты с такими лимфопролиферативными заболеваниями как лимфома Ходжкина и неходжкинские лимфомы, острый лимфобластный лейкоз, множественная миелома, диффузная B-крупноклеточная лимфома, первичная медиастинальная лимфома, лимфома ЦНС и другие.
При ФН число циркулирующих в крови нейтрофилов падает ниже 500/мм³. Это предельно малый уровень, абсолютно недостаточный для защиты организма от инфекций. По этой причине у страдающих ФН людей риск развития тяжелых инфекционных осложнений увеличивается на 30 процентов, а риск гибели — на 15 процентов.
К счастью, своевременная профилактика заметно уменьшает риски, связанные с воздействием химиотерапии, и достоверно снижает вероятность развития нейтропении. Для этого на фоне лечения химиотерапией применяют специальные препараты — гранулоцитарные колониестимулирующие факторы (Г-КСФ). Эти вещества относятся к цитокинам — небольшим сигнальным молекулам, которые синтезируются в организме человека. Цитокины «побуждают» костный мозг создавать больше клеток крови и активно выпускать их в кровь.
На сегодняшний день считается, что применение Г-КСФ сокращает сроки восстановления кроветворения (гемопоэза) в костном мозге, снижает частоту развития инфекционных осложнений и позволяет сохранить дозоинтенсивность терапии (объем дозы и интервал между курсами), необходимую для эффективного лечения онкологических заболеваний. Снижение дозоинтенсивности ХТ приводит к сокращению общей выживаемости больных раком молочной железы и раком яичников на 37 процентов.
Согласно российским и международным исследованиям, первичная профилактика Г-КСФ достоверно уменьшает риски снижения дозоинтенсивности.
Препараты класса Г-КСФ существуют в двух формах: короткого и пролонгированого действия. Г-КСФ пролонгированного действия – это пегилированные (модифицированные в лабораторных условиях) молекулы, которые, по сути, являются усовершенствованной версией коротких Г-КСФ. Пегилированные Г-КСФ работают дольше, и их необходимо вводить всего один раз на курс химиотерапии. Это позволяет минимизировать посещения клиник, поддерживать оптимальные дозы химиотерапевтических лекарств и повышает эффективность лечения в целом.
В России применяются препараты Г-КСФ пролонгированного действия для снижения продолжительности нейтропении и уменьшения риска возникновения фебрильной нейтропении, такие как, например, эмпэгфилграстим.
Сегодня такие препараты входят в перечень жизненно необходимых и важнейших лекарственных препаратов. Это означает, что пациенты вправе получать их бесплатно, за счет бюджетных средств.
Cписок литературы.
Препараты на основе моноклональных антител помогают при лимфоме и раке молочной железы
National Cancer Institute / unsplash
В конце 1990-х годов исследователи создали первые в мире иммунотерапевтические препараты — моноклональные антитела к компонентам раковых клеток на основе химерных (частично мышиных, частично человеческих) антител, которые «не реагируют» на здоровые клетки организма: ритуксимаб и трастузумаб. Эти препараты применяют для лечения лимфомы и рака молочной железы.
Однако мышиные антитела живут в организме людей недолго, а еще они недостаточно эффективно проникают в опухоль и в целом работают хуже человеческих. Поэтому, чтобы эффективно бороться с человеческим раком, антитела тоже должны быть человеческими.
Проблема в том, что разработка лекарств на основе человеческих моноклональных антител — очень непростая работа. Чтобы получить антитела у мышей, нужно сначала создать «бессмертные» клетки, которые и будут «печатать» лечебный белок. Их делают путем слияния белых В-клеток с опухолевыми клетками (используют клетки миеломы, которые, как известно, не умирают). Однако клетки человеческой миеломы оказалось очень трудно культивировать в лаборатории.
Так что ученым пришлось действовать иначе — брать за основу мышиные антитела, и при помощи методов генной инженерии переделывать их, чтобы они работали в человеческом организме. Именно так создали препарат ритуксимаб. Процесс это дорогой, сложный, долгий и затратный — так что неудивительно, что готовое лекарство стоит порядка 100 долларов за десятимиллилитровую инъекцию.
Ритуксимаб в России: как в нашей стране научились создавать лекарства на основе моноклональных антител
Современные биотехнологии позволили разработать новые виды лечения. Это открыло путь к таргетной терапии многих заболеваний и способствовало улучшению качества жизни пациентов. Один из ярких примеров биологического препарата направленного действия — ритуксимаб. Это лекарство изменило взгляд мировой общественности на подходы к лечению пациентов с лимфопролиферативными заболеваниями.
Наряду с оригинальными биологическими препаратами существуют биоаналоги. Биоаналогом называют биологический препарат, по параметрам безопасности, качества и эффективности схожий с оригинальным препаратом в такой же лекарственной форме и имеющий идентичный способ введения. Разработка биоаналогов — важная задача современной медицины и фармацевтики, так как позволяет обеспечить более широкое внедрение современных лекарственных препаратов в клиническую практику. И, соответственно, увеличить число успешно пролеченных пациентов.
В 2009–2010 годах компания ЗАО «БИОКАД» приступила к разработке и полному циклу исследований отечественного препарата ритуксимаба. Разработку проводили в рамках проекта государственного значения «Организация опытно-промышленного производства субстанций и лекарственных средств на основе моноклональных антител, необходимых для выпуска дорогостоящих импортозамещающих препаратов». Проект был утвержден Комиссией при Президенте Российской Федерации по модернизации и технологическому развитию экономики России.
Полный цикл сравнительных доклинических испытаний in vitro и in vivo завершился к середине 2011 года. В проведенных исследованиях биоаналог ритуксимаба по структуре и специфическому действию оказался идентичен оригинальному препарату «Мабтера» Ф. Хоффманн-Ля Рош, Лтд., Швейцария. Аналогичные данные получены в результате сравнительных физико-химических испытаний, а также доклинического исследования in vivo.
На следующем этапе проводились клинические испытания препарата на пациентах с лимфопролиферативными заболеваниями в сравнении с оригинальным препаратом «Мабтера». Результаты исследования свидетельствуют о том, что оба препарата одинаково воздействовали на В-лимфоциты, и не отличались по профилю безопасности и по эффективности.
На основании полученных данных биоаналог ритуксимаба производства ЗАО «БИОКАД» был зарегистрирован для медицинского применения у больных злокачественными В-клеточными лимфопролиферативными заболеваниями (рег. No ЛП-002420 от 04.04.14, код ATX: L01XC02). Новый отечественный препарат был назван «Ацеллбия». Такое название (A — Сell — B — ia) происходит от нескольких слов: A (от lat. attero) — уничтожать, ослаблять, уменьшать; Cell — клетка; B — вид клетки.
Список онкологических заболеваний, при которых применяют «Ацеллбию», велик: чаще всего препараты применяют при В-клеточных неходжкинских лимфомах, хроническом лимфолейкозе, ревматоидном артрите и гранулёматозе Вегенера.
Как мы лечим рак сегодня: открытия и достижения
За последние десятилетия XXI века ученые и врачи узнали об онкологических заболеваниях едва ли не больше, чем за все предшествующие эпохи. Лечение рака продвинулось очень далеко даже по сравнению с XX веком. Однако онкологические заболевания пока не торопятся сдавать позиции — чтобы их победить или хотя бы уверенно держать под контролем, человечеству предстоит узнать еще очень и очень много.
Все направления исследований в современной онкологии можно условно разделить на два больших направления: совершенствование старых методов и разработка новых. Одно из самых многообещающих «старых» направлений исследовательской онкологии — иммунотерапия. В XXI веке исследователи активно ищут для нее новые цели и мишени.
Современная иммунотерапия: как российские антитела помогают лечить меланому
16 апреля 2020 года Министерство здравоохранения РФ одобрило применение первого российского оригинального PD-1 ингибитора — пролголимаба. Препарат предназначен для лечения метастатической меланомы — одного из наиболее агрессивных видов рака.
По данным ВОЗ, на меланому кожи приходится около 3-4 процентов всех онкологических заболеваний взрослых. Согласно прогнозам, к 2025 году число заболевших меланомой кожи в мире увеличится на 25 процентов. В нашей стране проблема стоит не менее остро, чем во всем мире. По данным справочника «Состояние онкологической помощи населению России в 2018 г.», в 19 процентах случаев у наших соотечественников меланома кожи выявлялась уже на запущенных стадиях, когда лечить ее уже очень сложно. Так что средство для лечения этого опасного заболевания более чем актуально.
У российского препарата есть аналоги за рубежом: пембролизумаб и ниволумаб. До появления отечественного ингибитора на российском рынке терапии меланомы кожи были только эти два лекарства. Пролголимаб — первый PD-1 ингибитор на основе моноклональных антител IgG1 c дополнительными модификациями его эффекторных свойств. Механизм действия ингибиторов PD-1 направлен на восстановление способности Т-лимфоцитов (иммунные клетки) распознавать и уничтожать злокачественные клетки, в результате чего иммунная система человека снова начинает бороться с опухолью.
Вакцины от рака — перспективное направление в иммунотерапии
National Cancer Institute / unsplash
Помимо моноклональных антител, в иммунотерапии есть еще одно перспективное направление — вакцины от рака. Первую вакцину от рака простаты, который не отвечает на гормональное лечение, FDA — американский аналог Минздрава и Роспотребнадзора — одобрил уже в XXI веке, в 2010 году. Это был препарат «Provenge». В отличие от привычных вакцин, лекарство не предотвращает болезнь, а помогает белым клеткам уже болеющего человека бороться с раком. К сожалению, вакцинация не излечивает рак простаты — зато помогает жить лучше и дольше.
Генная терапия. Новое направление, которое стало активно развиваться уже в XXI веке. Исследователи активно разрабатывают новые классы молекул, способных сражаться с раковыми клетками — например, антисмысловые олигонуклеотиды. Эти молекулы проникают в клетки и связываются с мишенью — матричной РНК (мРНК). В результате клетка прекращает создавать белки, за синтез которых отвечает ген, носители которого имеют предрасположенность к наследственным онкологическим заболеваниям. Если все получится, антисмысловые олигонуклеотиды будут просто «отключать гены рака»! Правда, к сожалению, пока не удалось зарегистрировать ни один такой препарат.
Но кое-что у нас есть и сегодня. Например, мы уже научились лечить онкогематологические заболевания при помощи T-клеток с химерными рецепторами антигена (CAR-T). Если немного упростить, то в ходе этой процедуры у пациента берут его собственные лейкоциты (конкретно — Т-клетки), и модифицируют их, вставляя в клетки ген CAR. В результате Т-клетки выращивают на поверхности специальные рецепторы CD-19, которые помогают им узнавать и уничтожать раковые клетки.
В 2017-2018 годах в клиники поступило два CAR-T препарата: Kymriah от Novartis и Yescarta от Gilead. В нашей стране CAR-T-препараты разрабатывает группа под руководством Михаила Масчана. Из 46 пациентов с В-клеточным острым лимфобластным лейкозом, получивших российские CAR-T-препараты, выздоровело 40 человек. Это очень много: обычно выживаемость таких пациентов не превышает 10 процентов.
Второе направление генной терапии связано с подбором идеального лекарства. Исследователи активно ищут генные мутации, носители которых будут лучше реагировать на конкретный противораковый препарат. Это поможет сделать терапию по-настоящему индивидуальной — то есть максимально эффективной для конкретного человека, и при этом лишенной большей части побочных эффектов.
Роботизированная хирургия. Предполагается, что точный металлический робот-помощник поможет хирургам-онкологам делать идеально точные операции, которые будут одновременно малоинвазивными (по минимуму повреждающими здоровые ткани — прим.ред.) и высокоэффективными — то есть помогут убрать все до одной раковые клетки.
Другие направления онкологии касаются скорее диагностики, чем лечения рака. Например, нанотехнологии позволяют создать мельчайшие частицы — метки, которые будут точно показывать местонахождение опухоли.
А протеомика (наука о всех белках, которые есть в организме) поможет больше узнать о том, как ведут себя в организме разные раковые клетки. Протеомика поможет отличать агрессивные опухоли от менее агрессивных — в будущем это может помочь избавить пациента от опасного и ненужного лечения.
А еще протеомические исследования нужны, чтобы разработать новые диагностические тесты. Возможно, когда-нибудь благодаря таким тестам мы сможем «ловить» онкологические заболевания на стадии всего одной клетки. То есть тогда, когда справиться с ними совсем просто.
Даниил Давыдов
Камень, побеждающий онкологию
Пять веков назад запрос алхимиков спровоцировал открытие уникальных свойств этого минерала, известного к тому времени уже на протяжении тысячелетий. Будучи по своей природе недрагоценным металлом он способен превращаться в золото.
Сегодня этот камень панацея для медиков и настоящая находка в борьбе с онкологическими заболеваниями. Металл радужного цвета, который поначалу шахтеры принимали за серебро, называется висмут. Использовать его в медицине и индустрии красоты не мешает даже тот факт, что он радиоактивен.
Древние индейцы делали из висмута оружие, которое переливалось на солнце всеми цветами радуги. На Руси висмут применяли в мирных целях. Представительницы слабого пола пользовались висмутовыми белилами. Такая пудра давала эффект плотной краски и даже на дальнем расстоянии была заметна. Англичане в те времена сравнивали русских женщин с женами мельников, у которых лица постоянно испачканы мукой. Такой макияж в конце дня даже приходилось соскребать с лица ножом.
Висмут можно смело назвать подобием философского камня. Так, в конце двадцатого века при помощи ускорителя частиц американским ученым удалось получить из этого минерала золото и воплотить в жизнь многовековую мечту алхимиков. Правда овчинка, как говорится, выделки не стоила. Сам процесс получения золота оказался весьма дорогостоящим удовольствием. Чтобы выделить 30 грамм золота таким способом, необходимо было потратить более одного квадриллиона долларов.
© Форпост Северо-Запад / Горный музей
Самой древней профессией висмута остается медицина. Начиная с семнадцатого века, им лечили диарею и холеру. Современная фармацевтика – главный потребитель этого минерала. Из металла делают антисептики, препараты против язв, ожогов и сифилиса. Применение висмута при лучевой терапии злокачественных опухолей считается одним из самых перспективных методов борьбы с подобными заболеваниями.
Висмут способен улучшить состояние человека не только изнутри, но и снаружи. Этот минерал входит в состав большинства косметических средств. Именно висмуту мы должны быть благодарны за блеск губной помады, пудры и лака для ногтей. Удивительно, но будучи таким полезным минералом, висмут относится к радиоактивным металлам с очень маленькой дозой излучения. В СССР когда еще не знали об этой интересной особенности, решили его именем засекретить предприятия по добычи урана на территории Германии. Тогда американцы иронично подшучивали над русскими, наивно полагая, что «Висмут» добывает одноименный металл, а не главное сырье для атомной бомбы. Сегодня висмут оберегает человека от пожаров. Металл входит в состав специального сплава, который плавиться при очень низких температурах. Датчики из такого материала способны реагировать даже на малейшие изменения температуры в помещениях.
© https://pixabay.com
В идеальных условиях внешний вид висмута очень необычный. Формы его кристаллов напоминают фигуру, стремящуюся к пирамиде. Именно поэтому в древности люди были уверенны, что висмут способен сконцентрировать всю негативную энергетику своего владельца на себе. Висмут спасает от депрессии, нервных и физических расстройств. Неудивительно, почему он был так популярен среди алхимиков и магов, минерал способен в буквальном смысле парить в воздухе. Если кусочек камня положить между двумя магнитами, он начнет левитировать.
Приобретая изделия из висмута можно быть уверенным в его уникальности. Ведь каждый кристалл по-своему преломляет свет, благодаря чему радужная картина на минерале никогда не повторяется.
Висмут редкий металл, его содержание в рудах едва доходит до тысячных процента. Больший интерес у покупателей вызывает висмут не самородный, а искусственный. Ведь минерал, выращенный в лаборатории, отличается особенно интересными формами и радужными переливами.
Еще одна тайна древнего Египта: здесь не болели раком
Авторы сенсационных выводов — Майкл Циммерман (Michael Zimmerman), профессор Университета Манчестера (Manchester University) и его коллега Розалия Дэвид (Rosalie David). Им предшествовали многолетние исследования — ученые изучили сотни мумий древнего Египта и Южной Америки возрастом около 3 тысяч лет. И не нашли у них явных признаков опухолей. Лишь у одной египетской мумии вроде бы обнаружился рак толстой кишки.
Если верить ученым, то и в литературных источниках, включая древнейшие письменные свидетельства, нет намеков на заболевание, которое спустя тысячелетия стало чуть ли не самым массовым на Земле. А уж второе место — после смертей от сердечно-сосудистых недугов — оно держит прочно.
— В мумифицированном виде ткани злокачественных опухолей сохраняются лучше здоровых, — говорит Циммерман. — Мумию с раком мы бы не пропустили. Тем более, что в Египте хирургия была слабо развита. Никто бы не рискнул вырезать опухоль.
Не найдя древних следов злокачественных новообразований, британские ученые сделали вывод: рака в древности не было. Значит, это современный недуг. Словом, плата за прогресс.
— В древние времена раком, если все-таки и болели, то крайне редко, — говорит Розалия. — Потому что в природе практически нет факторов, способствующих развитию онкологических заболеваний. Ныне же рак вызывают загрязнение окружающей среды, изменения в нашем питании и в образе жизни.
Журнал New Scientist привлек экспертов — других британских ученых, которые возразили своим коллегам из Университета Манчестера.
Например, онколог Кэт Арни (Kat Arney) из британского Центра исследования рака (Cancer Research UK) полагает, что в природе все-таки есть факторы, провоцирующие рак. Хотя бы ультрафиолет. А помимо него — естественная радиация. И некоторые вирусы, которые сопутствуют развитию рака матки и печени.
Кэт полагает, что ее коллеги не нашли опухолей у мумий по одной простой причине: в те далекие времена люди редко жили дольше 50 лет. И рак у них не успевал развиться. А протяни большинство еще лет 10 или 20 — обязательно бы нажили себе какую-нибудь опухоль.
— Возраст — одна из главных причин рака, — соглашается французский онколог Йохим Шуз (Joachim Schüz). — Почти 90 процентов заболеваний приходятся на тех, кому за 50. И если сейчас вдруг бы нашлась тысяча современных мумий, которым при жизни не исполнилось 50 лет, то вряд ли удалось бы обнаружить у них много опухолей.
А как обойти мумию с раком прямой кишки? Значит, заболевание в том или ином виде все же существовало? И никакой новой тайны древнего Египта нет.
Есть тайна всех времен и народов. Ведь в природе онкологических заболеваний не удалось разобраться и по сей день. Гипотез, конечно, полно. Равно как и подозреваемых. Но точного понимания нет. Хотя пошло уже более 200 лет с тех пор, как появились первые научные работы, выделяющие опухоли в отдельное заболевание. Еще в 1761 году был опознан и описан рак носоглотки у любителей нюхать табак, а чуть позднее — в 1775 году — рак мошонки у трубочистов.
Ведущие онкологи поговорили в «РГ» о том, как победить рак — Российская газета
Будет ли когда-нибудь создана вакцина от рака? Какие раки лечатся труднее всего? Где и как готовят онкологов? Надо ли следовать примеру Анджелины Джоли, которая предлагает для профилактики онкологии женщинам удалять не только грудь, но и все, что есть женского?… Эти и другие вопросы обсуждали за «круглым столом» в редакции «Российской газеты» ведущие онкологи России.
Разговор был непростым. Несмотря на то, что онкологические заболевания известны с глубокой древности — тысячелетия назад люди болели и в муках умирали от рака, этот недуг не уходит от нас. До сих пор нет полной разгадки почему, откуда он возникает, как от него избавляться. Время от времени появляются сенсационные сообщения о том, что создана вакцина от рака, или о том, что кофе уменьшает риск попасть в раковые щупальца. Или совсем наоборот: кофеманы более рискуют подхватить недуг. Каждая «онконовость» с ходу становится горячей — так велико наше желание избавиться от рака.
На встрече в редакции о чудесах и предсказаниях не говорили. Говорили о другом: все зависит от того, когда человек обратился за помощью. Выявленная на ранних стадиях опухоль излечивается или полностью, или протекает более спокойно. Например, рак молочной железы в первой стадии излечивается в 90 процентах случаев. Тяжелее всего выявляются и лечатся рак поджелудочной железы, рак пищевода.
Чаще всего люди спрашивают, где лечить рак?
Михаил Давыдов: Только в онкологических учреждениях.
Но согласно приказу Минздрава России, можно онкологические заболевания лечить в любой многопрофильной больнице, была бы там хирургия.
Михаил Давыдов: Это неправильно. Но приказ есть приказ, он все равно выполняется. Почему? Потому что есть определенная заинтересованность некоторых структур, в том числе и коммерческих, заниматься отдельными видами лечения онкологических больных. Чаще всего это хирургические методы. Хотя, как правило, требуется комбинированное комплексное лечение. Оно включает операцию, лучевую терапию, химиотерапию. И в каждом отдельном случае решается вопрос последовательности применения этих методик.
Что же делать с этим приказом?
Михаил Давыдов: Его нужно пересматривать, с моей точки зрения. Но это моя точка зрения, с ней могут не согласиться.
Анатолий Махсон: С Михаилом Ивановичем невозможно не согласиться. Сравнительные данные по выживаемости больных, лечившихся в специализированном учреждении и в неспециализированном, различаются в 10-15 и даже в 20 процентов. Предположим, результаты лечения рака желудка в общей сети на 15 процентов хуже, чем у тех, кто лечился в специализированном онкологическом учреждении.
Есть сомнительный тезис: деньги идут за больными. Сам больной уже не интересен. Начинается борьба за деньги, а не за здоровье пациента
И все-таки пациента с тем же раком желудка нередко направляют в обычную больницу?
Анатолий Махсон: Пациент может сам выбрать место лечения. Но раньше был приказ Минздрава РФ, согласно которому онкологическая патология должна лечиться только в специализированных учреждениях. К этому идет сейчас весь мир. Но потом тот приказ поменяли на другой, по которому онкологический пациент может лечиться везде.
Михаил Давыдов: Определенный интерес к этой проблеме возник в коммерческих структурах, которые хотят получить деньги, и они лоббировали этот приказ. Есть такой сомнительный тезис: деньги идут за больными. А когда деньги идут за больными, сам больной уже не интересен. Интересны деньги, которые за ним идут. И начинается борьба за деньги, а не за здоровье пациента. Поэтому те учреждения, которые раньше не брались за онкологические патологии, сейчас активно берутся за них, пытаются лечить. А онкологические учреждения завалены рецидивами, возвратом болезни. И лечить эти рецидивы куда сложнее.
Анатолий Махсон: Практически это выглядит так. Больного прооперировали. Дальнейшего лечения грамотно не назначили. Да и условий комбинированного лечения там нет. А когда начинаются осложнения, направляют пациента к онкологу. Но время упущено. Да и операцию должен делать не просто хирург, а хирург-онколог.
Владимир Поляков: Особый контингент онкобольных — дети.
Кстати, с какого года строится детский онкоцентр при Центре имени Блохина? Более 20 лет? …
Владимир Поляков: Долгое время строительство было заморожено. Теперь мы реанимировали эту стройку. По плану в 2017 году детский центр на 250 коек должен начать работать.
Считается, что рак — заболевание приобретенное, что это поломка гена. Тогда как объяснить, что рак появляется у малышей, даже у новорожденных?
Владимир Поляков: Есть генетически обусловленный рак в детской онкологии, в частности рак мозга. В России заболевает до 5 тысяч детей в возрасте до 15 лет. Под наблюдением примерно 15-19 тысяч.
Когда речь об онкологическом заболевании, все чувствуют тревогу. Но когда речь о ребенке… Создается фонд, поднимаются близкие, дальние родственники, знакомые знакомых. И очень часто говорят: вам поможет Израиль, Германия, Китай… Это медицинский туристический бизнес? Или есть некоторые виды заболеваний, которые не лечат у нас, а за рубежом лечат?
Владимир Поляков: Это мне напоминает стародавние времена, когда говорили: заграница вам поможет. Наши формы лечения, наши возможности практически не отличаются от тех, которые существуют в развитых странах, в тех же Соединенных Штатах. Мы страдаем в части лекарственного обеспечения. У нас проблемы с новыми препаратами, таргетной терапией и так далее. Тут мы чуть-чуть отстаем. Особенно это касается детей.
Я побывал во многих странах, видел, как лечат. По части хирургии, российским хирургам нет равных. Что касается сопроводительной, поддерживающей терапии, других условий… Нередко едут именно за условиями. Там на одного больного 5 сестер, 4 врача. Такого мы не можем себе позволить в силу финансовых обстоятельств. Результаты лечения у нас практически близки к тем, которые дают нам западные коллеги. Детская онкология более успешна в лечении. И результаты значительно лучше, чем у взрослых. Большинство детишек выздоравливает. Еще совсем недавно выздоравливало 20-25 процентов. Сейчас — 80.
А статистика взрослых у нас есть? Например, каковы результаты лечения самых распространенных раков: рака молочной железы у женщин, рака легкого у мужчин? Мы здесь на какой ступеньке?
Анатолий Махсон: Кого-то мы опережаем, а от кого-то отстаем. Например, по раку молочной железы американцы дают статистику 95 процентов выздоровлений. Мы — 75. Все зависит от стадии заболевания. Нужно своевременно выявить недуг, правильно лечить современными препаратами.
Появился новый препарат для лечения рака молочной железы…
Даниил Строяковский: Сейчас много препаратов. Если мы говорим о her-2 позитивном раке молочной железы (это 20 процентов от всех раков молочной железы), то вышло целых три новых препарата, которые очень эффективны. И ситуация в этой группе больных могла бы поменяться. Препараты только проходят регистрацию. Один из них скоро появится. Но будет труднодоступна помощь этими препаратами в виду их стоимости.
Многие читательницы наслушались, начитались, насмотрелись историй об Анджелине Джоли, которая предлагает для профилактики удалять все, что есть женского… Следовать ее примеру? Есть массовый психоз, есть ракобоязнь. Есть люди, которые несколько раз в сутки находят у себя рак и пишут в редакцию письма, просят направить их на лечение. Как быть? С одной стороны, человек должен внимательно относиться к своему здоровью. А с другой?… Все-таки ни одна машина не может сама пройти ТО. Это должен делать только механик и специалист.
Михаил Давыдов: Существует научно-обоснованная практика, так называемые скрининговые программы, которые во всем мире внедрены. В России пока государственной программы скрининга нет. Это очень дорогостоящее удовольствие. Есть региональные программы, которые проходили с нашим участием, например в Татарстане, по поводу рака молочной железы. Они дали неплохие результаты. Суть программ: обследование в определенных возрастных группах наиболее подверженных к частоте заболевания той или иной патологии для рака молочной железы. Если у женщины выявляется такой рак в одной груди, то ей может быть показано удаление второй. Потому что обязательно возникнет рак во второй молочной железе. Это сегодня мировая практика.
Практика или все-таки исключение?
Даниил Строяковский: У Анджелины Джоли наследственная мутация, которая встречается редко. Где-то у 3-5 процентов женщин в зависимости от национальности. Чаще у евреек-ашкенази, реже в других национальных группах. Поставить генетический скрининг всех женщин на поток? Весьма проблематично. Нужно ли это делать? В каком возрасте это делать? Сложный этический вопрос.
У женщин, имеющих эту наследственную мутацию, если уже она выявилась и выявлен рак молочной железы, вопрос о профилактическом удалении обеих желез оправдан. Но тоже не всегда. Там с высокой долей вероятности может быть еще и рак яичников. Все очень индивидуально. Решать должны опытные специалисты, которые этим занимаются. И не нужно всех подряд, особенно молодых девушек, скринировать на наличие этой мутации. Это может испортить им всю жизнь. Но если есть раковый анамнез по маме, по бабушке, по материнской линии, то об этом стоит задуматься. После 30 лет риск намного возрастает по сравнению с женщинами моложе. Однако всем подряд это делать не нужно.
Михаил Давыдов: Эпидемиологические исследования выявляли популяцию, у которой рак шейки матки чаще всего возникает. Как правило, это женщины много рожавшие — по 7-8 родов. Объясняют это постоянными разрывами, воспалениями в зоне шейки матки. А когда посмотрели популяцию монашек-девственниц, то оказалось, что у них, нерожавших, на первом месте рак тела матки. Самая высокая частота развития рака шейки матки в Индии: не очень обследованное население, частые роды, необрезанное мужское население вкупе с частой сменой половых партнеров.
Обрезанное мужское население снижает риск развития рака шейки матки?
Даниил Строяковский: Да.
А для самих мужчин это имеет значение в предохранении от рака?
Даниил Строяковский: Нет.
Существуют ли возрастные ограничения для операции, например, рака молочной железы?
Михаил Давыдов: Не существуют. Существуют функциональные ограничения. Когда к человеку нельзя притронуться из-за сопутствующих заболеваний.
А вот одну нашу 76-летнюю читательницу не стали оперировать…
Михаил Давыдов: Это не возраст. Я оперировал больных раком пищевода, которым 89-90 лет.
Михаил Личиницер: Каждый год бывает День борьбы против рака. Но бороться с недугом надо постоянно. Вот мы говорим о новых препаратах, есть они или их нет. Главное, чтобы они были доступны всем, кому требуется, независимо от места жительства, толщины кошелька. И были грамотно назначены.
Есть у нас успехи в лечении рака? Безусловно. Если раньше многие состоятельные люди уезжали в другие страны, чтобы получить лечение, то сегодня они лечатся у нас. Сейчас очень важно создание национального противоракового центра на основе Онкологического центра имени Блохина. Это поможет сделать доступным эффективное лечение не только в Москве, Санкт-Петербурге — повсюду в России.
Что значит «национального»?
Михаил Личиницер: Это значит, отвечать на все вопросы и решать задачи в течение года, а не только в Международный день борьбы против рака. Недавно Давыдов и ведущие коллеги нашего центра посетили онкологический диспансер в Тамбове. Проводили мастер-классы. За полтора дня сделали 14 показательных операций. Центр имени Блохина способен улучшить положение дел с онкологией во всей стране.
Почему же не улучшает?
Михаил Личиницер: Не все зависит от центра. Мы делаем все, что необходимо для того, чтобы это лечение было доступным, чтобы оно было бесплатным. Люди получают невысокую заработную плату. Они не способны платить за дорогостоящее лечение. Во всем мире существует настоящая страховая медицина. И лучшие образцы страховой медицины должны быть воспроизведены в России.
Мы говорим об этом давно и постоянно. Но это же не делается! Не оплачивает страховая медицина эффективное лечения. Не могут люди лечиться бесплатно.
Михаил Личиницер: Могут. Возьмите Барнаул, наши филиалы. Регионы сегодня много делают. Но они нуждаются в методическом руководстве.
Раковые заболевания — это поломка генома Но почему у одного она происходит, у другого нет?
Михаил Давыдов: Она происходит фактически у всех. Только в разные сроки. Чем больше мы накапливаем долгожителей, тем больше у нас будет случаев злокачественных опухолей. Каждый доживает до своего рака, есть такая теория. Только некоторые умирают раньше от других причин — инфаркта, инсульта. В Японии онкологическая смертность на первом месте, потому что японцы долго живут.
27 стран мира сегодня подтвердили: у них рак вышел на первое место, опередил сердечно-сосудистые болезни. Наш сотрудник Давид Георгиевич Заридзе участвовал в исследовании комитета Всемирной организации здравоохранения. Исследовали 40 тысяч больных, умерших в Барнауле, в Алтайском крае с диагнозом «острая сердечная сосудистая смерть». Только у 3 процентов этих пациентов причина смерти инфаркт. В Швейцарии, Франции — 70 процентов. А у наших граждан — это избыточная доза алкоголя в крови, как у мужчин, так и у женщин. То есть провокация сердечной смертности. Гипертоник выпил некачественный алкоголь в большом количестве и… провокация: коронарный синдром, смерть.
Когда-нибудь будет вакцина против рака?
Михаил Давыдов: Не будет. Это приобретенное генетически обусловленное заболевание.
Кто прежде всего в зоне риска?
Михаил Давыдов: Все люди старше 50 лет .
Михаил Личиницер: Плюс те, кто имеет вредные привычки. 70 процентов рака легкого возникает у курильщиков. Каждый год в мире 14 миллионов новых случаев рака, а 8 миллионов умирает от недугов, связанных со злокачественными опухолями. Правительство России обратило внимание на сверхсмертность в стране от онкологии. Проводятся мероприятия, направленные на то, чтоб снизить смертность до 60 тысяч в год. Пока у нас ежегодно 500 тысяч новых случаев рака. Примерно 300 тысяч человек умирает в год от рака. Примерно 27 процентов среди них те, кто заболел в этом году. Есть только один способ изменить ситуацию: раннее выявление, первичная и вторичная профилактика.
На ваш взгляд, самый злой рак?
Михаил Давыдов: Они все недобрые. Есть злейшая опухоль меланома. Или, например, мелкоклеточный рак легкого. Сантиметровая опухоль, а больной весь обсыпан метастазами.
В нашем разговоре не обойти проблему обезболивания онкобольных.
Михаил Давыдов: Когда я был ординатором, дежурил, то перед дежурством перед операцией выписывали промедол в любом количестве. И после операции обезболивали промедолом. Никаких проблем не было — моя запись, и все. Сегодня иной порядок: создаются специальные комиссии, специальные группы, которые ездят к пациентам и обезболивают больных. Диктует комитет по обороту наркотиков.
В регионах нередко онкологами работают люди, не имеющие специализации в этой сложнейшей области. Много совместителей
Это же нелепость?
Михаил Давыдов: Не мы ее придумали.
Анатолий Махсон: Если взять, собрать все медицинские наркотики, это будет меньше одного процента незаконного оборота наркотиков. Официальные данные — до ста тонн героина в год. А на морфий, промедол — меньше тонны. А мы с этим боремся. И страдают больные.
Владимир Поляков: Самое главное, что никто из нас, сколько лет мы работаем в онкологии, в детской в том числе, никто не стал наркоманом из этих больных. Никто! Дети, которым применялись наркотики на протяжении какого-то определенного времени, не стали наркоманами. Во Франции через рот принимаемый морфин — это норма. Не нужно делать уколы. Это обычная практика.
В стране не хватает около 3-3,5 тысячи онкологов.
Михаил Давыдов: В регионах нередко онкологами работают люди, не имеющие специализации в этой области, много совместителей. В вузах онкологов не готовят. Готовят на кафедрах постдипломного образования. Во всем мире онкологи готовятся не на кафедрах, а на базе крупных специализированных центров. Там более жесткий порядок. Наша система устарела. Врачей нельзя готовить формально, дав ему прослушать цикл лекций и показав ему издалека операции.
Онкология — самая сложная из медицинских специальностей. Почему? Да потому что все наши вздохи по поводу сверхсмертности от сердечно-сосудистых заболеваний устарели. Последние 30 лет борьба с ними — это шаблон. Давно проводится стентирование, аорто-коронарное шунтирование, есть те или иные пособия, которые помогают предотвратить инфаркт или инсульт.
В онкологии ситуация другая. Это многопрофильная гигантская задача. Не случайно в передовых странах мира курируют онкологию либо президент, либо кто-то из первых лиц государства. В США директор Национального института рака назначается лично президентом. И уходит в отставку вместе с президентом, когда оканчивается срок полномочий президента. Вот такое внимание к онкологии.
Ключевой вопрос
Немосквич может бесплатно лечиться в московской онкологической больнице N 62? Об этом нас часто просят иногородние пациенты.
Анатолий Махсон: Есть программа ОМС и каждый больной может пойти в онкологическое учреждение и лечиться за счет средств ОМС. Другой вопрос, какой уровень помощи он получит на эти средства. Есть виды помощи, которые в рамках ОМС оплатить нельзя. Тогда мы используем средства, выделенные на высокотехнологичную помощь. Но и их может не хватить. Поэтому, повторюсь, получить бесплатную помощь может каждый. Но в каком объеме?
А пациент из другого региона — это вообще целая проблема. Есть закон, по которому каждый может выбрать себе учреждение и врача. Однако забыли сказать, а что нужно, чтобы у этого учреждения была возможность принять данного больного. Возьмем Онкологический центр: 1200 коек, всероссийский, лечит 15 тысяч больных в год. И он не может лечить 40 тысяч больных, даже если захочет.
Вторая сторона вопроса. Если человек пришел в 62-ю больницу, у нас должна быть возможность принять этого больного. Но к нашей 62-й приписано 3 с половиной миллиона жителей четырех округов Москвы. И понятно, что мы своим жителям, москвичам, не можем отказать. И если приехал пациент из Тамбова, мы не можем москвичу сказать: мы возьмем жителя Тамбова, а вы езжайте в Тамбов. Мы обязаны выполнить задание, которое нам дали.
Если же возникает возможность принять иногороднего пациента, мы его принимаем, и московский фонд ОМС оплачивает его лечение. За исключением химиотерапии, которая стоит огромных денег. В тарифы ОМС она не входит. Московское правительство выделило отдельные деньги и централизованно закупило химиопрепараты для москвичей. Из другого региона нам возместить химиотерапию не могут. Тут все не так просто. Может, что-то изменится.
Михаил Личиницер: Наша задача — сделать уровень медицины одинаковым: что в Москве, что в Якутске, что в Волгограде, в других регионах. Для этого надо иметь не только техническую оснащенность, но и профессиональную базу. Кадры надо готовить.
Пациенту должно быть без разницы, где он лечится?
Михаил Давыдов: Это научно-обоснованная классика. Помните в советское время, когда вы поступали в больницу, у вас спрашивали о наличии страхового полиса? Нет. Был паспорт гражданина Советского Союза. А теперь попробуйте без страхового полиса куда-то поступить. Кто оплачивает? Частные страховые компании за вас платят. Таков закон.
Какова онкологическая ситуация в новых субъектах Федерации — в Крыму, Севастополе? Там такой же уровень заболеваний?
Михаил Давыдов: Там ситуация значительно хуже. Потребуются большие финансовые вливания, потому что материально-технической базы там нет. Все устарело безнадежно. И кадры нужно готовить тоже.
Как лечили рак в Древней Греции?
Несмотря на то, что первый случай рака был зарегистрирован в Египте в 1600 году до нашей эры, именно Гиппократ (410–360 до нашей эры), отец медицины, определил и дал название «раку» болезни, которая поражает человечество по сей день.
Гиппократ описал несколько видов рака, назвав их «каркинос», что по-гречески означает краб, или каркинома (карцинома). Слово произошло от вида среза твердой злокачественной опухоли, с венами, растянутыми со всех сторон, как лапки краба.
Концепция рака Гиппократом была гуморальной, поскольку он считал, что тело содержит четыре жидкости (биологические жидкости), а именно кровь, мокроту, желтую желчь и черную желчь. Любой дисбаланс этих жидкостей приводил к заболеванию, а избыток черной желчи в определенном участке органа считался причиной рака.
Во 2 веке нашей эры Гален называл доброкачественные опухоли «oncos», от греческого слова «опухоль», опухоль или уплотнение, оставляя каркино Гиппократа для злокачественных опухолей.
Гуморальная теория рака была стандартной в Средние века более 1300 лет.В тот период вскрытие было запрещено по религиозным причинам, что ограничивало знания о раке. Лечение на основе гуморальной теории оставалось популярным до 19 века, когда были открыты клетки.
Поскольку древнегреческая традиция запрещала открывать тело, Гиппократ описывал и рисовал только видимые опухоли на коже, носу и груди. Лечение основывалось на гуморальной теории. В зависимости от настроения пациента, лечение включало диету, кровопускание и / или слабительные.
Гиппократ считал, что рак является результатом избытка черной желчи в любой возможной части тела. Если селезенка не сможет очистить эту желчь, у пациента разовьется какой-то рак. Он также описал как ранние симптомы рака горький привкус во рту, который будет сопровождаться потерей аппетита.
Врачи того времени описывали различные типы рака, включая скрытые и очевидные, приобретенные и неприобретенные. , а также размеры опухолей, варьирующиеся от маленьких, как глазное яблоко, до больших, как дыня.Древние греки даже заметили расширение сосудов при раке.
Согласно Галену, наиболее распространенными видами рака были рак матки и груди, обнаруживаемый у женщин.
При осмотре пациента древнегреческие врачи заметили, что раковая опухоль пальпируется и несколько жесткая на ощупь, неправильной формы, прилегает к окружающей ткани с расширением вен, довольно прохладная по температуре, и иногда в области окружающая область тела.Это также вызвало отек и не сопровождалось лихорадкой. Еще одним характерным признаком рака были острая боль и кровотечение.
Что касается лечения, древнегреческие врачи давали пациенту лечебные растворы, и если они не могли помочь пациенту, они приступали к удалению опухоли хирургическим путем. Они использовали такие травы, как асклепия, лишай, аристолохия, драгонвоз, красная эритематозная болезнь, эрибумин, эллеварос, изюм и другие.
С целью удаления злокачественной черной желчи провели флеботомию.Если этого было недостаточно, они удалили опухоль хирургическим путем, если это возможно, и продолжили прижигание окружающих сосудов, чтобы остановить чрезмерное и опасное кровотечение.
После операции пациент должен был соблюдать определенную оздоровительную диету и программу упражнений, чтобы чувствовать себя лучше. Однако огромное количество используемых трав и лекарств указывает на то, что древние врачи уже знали, насколько малы шансы больного раком выжить.
Рак: историческая перспектива | SEER Training
С тех пор, как хранились самые ранние медицинские записи, рак как болезнь была описана в истории медицины.Самые ранние известные описания рака появляются в семи папирусах, обнаруженных и расшифрованных в конце XIX века. Они дали первое прямое знание египетской медицинской практики. Два из них, известные как папирусы «Эдвин Смит» и «Джордж Эберс», содержат описания рака, написанные около 1600 г. до н. Э., И, как полагают, датируются источниками еще 2500 г. до н. Э. Папирус Смита описывает хирургию, а папирус Эберса описывает фармакологические, механические и магические методы лечения.
На основании информации, записанной на папирусах и иероглифических надписях, древние египтяне смогли отличить доброкачественные опухоли от злокачественных.Они также могли использовать различные методы лечения, включая хирургическое вмешательство и другие методы лечения.
После упадка Египта следующие главы медицинской и научной истории были написаны в Греции и Риме. Великие врачи Гиппократ и Гален доминировали в медицинской мысли на протяжении 1500 лет. Они вывели медицину из области магии, суеверий и религии. Гиппократ и Гален определили болезнь как естественный процесс, лечение которого основано на наблюдениях и опыте.Были выявлены раковые заболевания с предупреждением о недопустимости лечения в более тяжелых формах. Гиппократу приписывают название «рак» как «каркинома» (карцинома), потому что опухоль выглядела как «краб» («каркинома» по-гречески означает «краб») в том смысле, что у опухоли есть центральное тело и появилось расширение опухоли. как ножки «краба».
После падения Рима Константинополь стал интеллектуальным хранилищем цивилизации. Оттуда в арабских переводах классические греческие и римские тексты вернулись через Европу.Древние учения Галена продолжали вдохновлять врачей в Константинополе, Каире, Александрии, Афинах и Антиохии в то время, когда на Западе доминировали магические заклинания и мифы. Рак продолжали объяснять как результат избытка черной желчи, излечимой только на самых ранних стадиях.
В современном мире наука и хирургия продвинулись вперед, когда врачи вернулись к непосредственному наблюдению за человеческим телом. Однако теория о том, что рак вызывается избытком черной желчи, продолжала преобладать в 16 веке.Рак считался неизлечимым, хотя для лечения его проявлений было разработано множество паст, содержащих мышьяк. В 17 веке старая теория болезни, основанная на телесных жидкостях, была отвергнута, когда Гаспаре Аселли открыл сосуды лимфатической системы и предположил, что лимфатические аномалии являются основной причиной рака.
Отвергнув теорию 17 века о причине рака, французский врач Клод Жендрон. Он пришел к выводу, что рак возникает локально в виде твердой растущей массы, не поддающейся лечению с помощью лекарств, и ее необходимо удалить со всеми ее «нитями».«
Два французских ученых 18-го века, врач Жан Астрюк и химик Бернар Пейриль, проводили эксперименты, чтобы подтвердить или опровергнуть гипотезы, связанные с раком. Их усилия, какими бы абсурдными они ни казались в ретроспективе, установили экспериментальную онкологию, науку поиска лучших диагнозов, методов лечения и понимания причин рака. В течение этого периода были зарегистрированы случаи рака в окружающей среде, и были открыты больницы, специализирующиеся на лечении рака.
В конце 19 века разработка более совершенных микроскопов не только помогла документировать и определить болезнетворные организмы, но также сделала возможным исследование клеток и клеточной активности.Изучение раковых тканей и опухолей показало, что раковые клетки заметно отличались по внешнему виду от нормальных клеток окружающей ткани или клеток, из которых они произошли. Исследователи начали сосредотачиваться на таких вопросах, как происхождение клеток и связь болезни с поведением клетки. Изобретением микроскопа была обнаружена сама раковая клетка.
В начале 20 века были достигнуты большие успехи в понимании структур, функций и химии живых организмов.Исследования рака в клеточных культурах, химические канцерогены, методы диагностики и химиотерапия прочно утвердили онкологию как науку. Исследователи преследовали различные теории происхождения рака, подвергая свои гипотезы систематическим экспериментам. Вирусная причина рака у кур была задокументирована в 1911 году, и были окончательно идентифицированы как химические, так и физические канцерогены. Хромосомные аномалии также исследовались как возможные причины рака.
В 1913 году необходимость борьбы с растущим общественным страхом и невежеством в отношении рака привела к двум значительным событиям: публикации первой известной статьи о тревожных признаках рака в популярном женском журнале и формированию общенациональной организации, посвященной просвещению населения по вопросам рака. .Рак, как болезнь, вышел на свет.
В 1937 году Конгресс США объявил борьбу с раком национальной целью, единогласно приняв Закон о Национальном институте рака. В соответствии с этим законом был создан Национальный институт рака, который должен был открыть новые теоретические основы, проводя собственные исследования, продвигая исследования в других учреждениях и координируя связанные с раком проекты и мероприятия. В 1971 году президент Ричард М. Никсон подписал Национальный закон о раке, запустив Национальную программу по борьбе с раком, управляемую Национальным институтом рака.Ключевые события в истории законодательства США о национальной политике в области рака с 1937 по 1999 годы доступны здесь.
С момента своего основания фундаментальные биомедицинские исследования, проводимые при поддержке Национального института рака, продвинули понимание рака. Используя инструменты молекулярной биологии и молекулярной генетики, ученые делают большие шаги в открытии и картировании связей между хромосомами, внутренними генами и раком. В дополнение к традиционным методам лечения рака, потенциальные решения по профилактике и лечению рака кажутся ограниченными только воображением.
Как давно мы страдаем от рака?
Как давно мы страдаем от рака?
13 августа 2012 г.
Написано приглашенным блоггером и канарским стажером Эбби Либерман, которая исследовала и написала эту краткую историю.
Хотя в последние десятилетия наблюдается резкий рост заболеваемости раком, на самом деле он поражает людей на протяжении веков.Первый задокументированный случай рака произошел в Древнем Египте. По данным Американского онкологического общества, восемь задокументированных случаев рака груди обнаружены на папирусе, датируемом 3000 годом до нашей эры. Даже термин «рак» существует на протяжении веков — Гиппократ, греческий врач, которого многие считают отцом медицины, использовал слова «рак» и «карцинома» для описания опухолей. Эти греческие термины также использовались для описания краба, потому что Гиппократ считал, что опухоли напоминают крабов.
Два изображения Клары Якоби, голландки, у которой в 1689 году удалили опухоль из ее шеи
. Включает текст, описывающий опухоль и ее удаление.
Несмотря на свою долгую историю, рак часто считается современным заболеванием, потому что его влияние на современное общество гораздо более существенное, чем на предыдущие народы. В статье Стива Шапина « Cancer World » он выражает свое мнение о том, что «рост смертности от рака — это в своем роде очень хорошая новость.«Хотя это заявление может показаться тревожным, в нем есть сильная сторона. Одна из причин, по которой рак стал основной причиной смерти в Соединенных Штатах, заключается в том, что мы живем намного дольше, чем раньше. Как общество, мы более защищены от обширных инфекционных заболеваний; мы живем достаточно долго, чтобы рак проявил себя. Шапин прослеживает нашу современную борьбу с раком с 1971 года, когда президент Никсон объявил войну раку. Несмотря на то, что Соединенным Штатам (или любой другой стране) еще предстоит выиграть «войну», эти политические усилия действительно укрепили национальные усилия по борьбе с раком.
Насколько нам известно, люди борются с раком. Древние египтяне заключили еще в 1600 году до нашей эры. что болезнь «не лечится». Хотя нам еще предстоит найти лекарство от рака, общество добилось больших успехов в лечении. В то время как в прошлом общества могли пытаться лечить только раковые образования, видимые на поверхности тела, сегодня Canary Foundation работает над технологией, которая позволит врачам обнаруживать, устранять или лечить опухоли размером с чернику! Хотя есть еще путь к борьбе с раком, прогресс, достигнутый даже за последние 50 лет, впечатляет.Благодаря достижениям в области исследований и технологий раннего обнаружения, Canary Foundation стремится вывести лечение рака на совершенно новый уровень. Благодаря борьбе с заболеванием на самых ранних стадиях, инвазивное лечение на более поздних стадиях больше не потребуется. Это всего лишь вопрос времени, когда исследователи найдут способ предотвратить рак так же, как ученые нашли способы ограничить основные причины смерти на протяжении всей истории.
Автором этого блога является Эбби Либерман , стажер-разработчик.
История рака
Изучение рака называется онкологией. Раки известны человечеству с давних времен. Рак начинается, когда клетки в какой-либо части тела начинают бесконтрольно расти. Несколько различных частей тела могут быть поражены раком.
Самые ранние упоминания о раке
Некоторые из самых ранних свидетельств рака обнаружены среди окаменелых опухолей костей у человеческих мумий в Древнем Египте, и упоминания о них были найдены в древних рукописях.Также было обнаружено разрушение костного черепа, наблюдаемое при раке головы и шеи.
Хотя слово «рак» не использовалось, самое старое описание болезни относится к Египту и датируется примерно 3000 годом до нашей эры. Он называется Папирус Эдвина Смита и является копией части древнеегипетского учебника по хирургии травм. В нем описывается 8 случаев опухолей или язв груди, которые лечили путем прижигания с помощью инструмента, называемого пожарной дрелью. В описании добавлено, что это состояние не лечится.
Происхождение слова рак
Болезнь была впервые названа раком греческим врачом Гиппократом (460–370 гг. До н.э.). Его считают «отцом медицины». Гиппократ использовал термины карциноз и карцинома для описания не язвообразующих и язвенных опухолей. По-гречески это означает краб. Описание было названо в честь краба, потому что похожие на пальцы выступы рака напоминали форму краба.
Поздний римский врач Цельс (28-50 до н.э.) перевел греческий термин на рак, латинское слово, обозначающее краб.Еще один римский врач Гален (130-200 г. н.э.) использовал термин онкос (греч. Отек) для описания опухолей. Онкос — это корневое слово для обозначения онкологии или изучения рака.
Между 15 и 18 веками
В начале 15 века ученые стали лучше понимать работу человеческого тела и его патологические процессы.
Вскрытие, проведенное Харви (1628 г.), привело к пониманию циркуляции крови в сердце и теле.
Джованни Морганьи из Падуи в 1761 году упорядочил вскрытия, чтобы найти причину болезней. Это также положило начало изучению рака.
Шотландский хирург Джон Хантер (1728–1793) предположил, что некоторые виды рака можно вылечить хирургическим путем. Почти столетие спустя развитие анестезии побудило к регулярным операциям по поводу «подвижного» рака, который не распространился на другие органы.
XIX век
Рудольф Вирхов, которого часто называют основоположником клеточной патологии, положил начало патологическому изучению рака под микроскопом.Вирхов соотносил микроскопическую патологию с болезнью.
Он также разработал исследование тканей, которые были удалены после операции. Патологоанатом также мог сказать хирургу, полностью ли удалось удалить рак.
История причин рака
На протяжении веков существовало множество теорий причин рака. Например, древние египтяне обвиняли богов в возникновении рака.
- Гиппократ считал, что в теле есть 4 жидкости (биологические жидкости): кровь, мокрота, желтая желчь и черная желчь.Он предположил, что дисбаланс этих жидкостей с избытком черной желчи в различных частях тела может вызвать рак. Это была гуморальная теория.
- После гуморальной теории появилась теория лимфы. Шталь и Хоффман предположили, что рак состоит из ферментирующей и дегенерирующей лимфы, различающейся по плотности, кислотности и щелочности. Джон Хантер, шотландский хирург 1700-х годов, согласился с тем, что опухоли растут из лимфы, постоянно выделяемой из крови.
- Закут Лузитани (1575–1642) и Николас Тулп (1593–1674), врачи из Голландии, пришли к выводу, что рак заразен.На протяжении 17-18 веков некоторые считали, что рак заразен.
- В 1838 году немецкий патолог Йоханнес Мюллер показал, что рак состоит из клеток, а не лимфы. Мюллер предположил, что раковые клетки развиваются из почкующихся элементов (бластемы) между нормальными тканями.
- Рудольф Вирхов (1821–1902) предположил, что все клетки, включая раковые, происходят из других клеток. Он предложил теорию хронического раздражения. Он считал, что рак распространяется жидкостью.В 1860-х годах немецкий хирург Карл Тирш показал, что рак метастазирует через распространение злокачественных клеток, а не через жидкость.
- До 1920-х годов считалось, что причиной рака являются травмы.
История скрининга и выявления рака
Скрининг на рак помогает в раннем выявлении. Первым скрининговым тестом, который стал широко использоваться для выявления рака, был Пап-тест. Он был разработан Джорджем Папаниколау как метод исследования менструального цикла.Затем он отметил, что этот тест может помочь в раннем обнаружении рака шейки матки, и представил свои результаты в 1923 году.
Именно тогда Американское онкологическое общество (ACS) продвигало этот тест в начале 1960-х годов, и он стал широко использоваться в качестве инструмента скрининга.
Современные методы маммографии были разработаны в конце 1960-х годов и впервые официально рекомендованы ACS для выявления рака груди в 1976 году.
Развитие онкологической хирургии
Это было довольно рано в истории изучения рака, когда хирургия считалась методом лечения рака.Римский врач Цельс заметил, что, несмотря на операцию, рак, похоже, возвращается. Гален писал о методах хирургии рака. Хирургия тогда была очень примитивной, со многими осложнениями, включая потерю крови. Хирургия рака процветала в 19-м и начале 20-го веков после развития анестезии.
Bilroth в Германии, Handley в Лондоне и Halsted в Балтиморе — пионеры хирургии рака. Уильям Стюарт Холстед, профессор хирургии Университета Джона Хопкинса, разработал радикальную мастэктомию в последнее десятилетие XIX века для лечения рака груди.Его работа была основана на В. Сэмпсоне Хэндли.
Стивен Пэджет, английский хирург того времени, обнаружил, что рак действительно распространяется через кровообращение. Это понимание метастазирования стало ключевым элементом в распознавании пациентов, которым может быть полезна хирургия рака, а может и нет.
Разработка лучевой терапии
В 1896 году немецкий профессор физики Вильгельм Конрад Рентген открыл и представил свойства рентгеновских лучей. В течение следующих нескольких месяцев рентгеновские лучи стали использоваться для диагностики, а в следующие 3 года они стали применяться для лечения рака.Лучевая терапия началась с применения радия и относительно низковольтных диагностических аппаратов.
Развитие химиотерапии
Было замечено, что во время Второй мировой войны солдаты, подвергшиеся действию горчичного газа во время военных действий, развили токсическое подавление костного мозга. Вскоре было обнаружено, что похожий химический азотный иприт действует против рака лимфатических узлов, называемого лимфомой. Это заложило основу для нескольких новых лекарств, которые можно было бы использовать против рака.
Разработка гормональной терапии
В XIX веке Томас Битсон обнаружил, что грудь кроликов перестала давать молоко после того, как он удалил яичники.Он пробовал удаление яичников (так называемая овариэктомия) при запущенном раке груди. Это было обнаружено до открытия самого гормона. Его работа заложила основу для современного использования гормональной терапии, такой как тамоксифен и ингибиторы ароматазы, для лечения или предотвращения рака груди.
Развитие иммунотерапии
С пониманием биологии раковых клеток было разработано несколько биологических агентов для лечения рака. Это называется терапией с использованием модификатора биологического ответа (BRM).Среди них следует отметить моноклональные антитела.
Первые терапевтические моноклональные антитела, ритуксимаб (Ритуксан) и трастузумаб (Герцептин), были одобрены в конце 1990-х годов для лечения лимфомы и рака груди, соответственно. Ученые также изучают вакцины, которые усиливают иммунный ответ организма на раковые клетки.
Во второй половине 20-го века также были разработаны таргетные методы лечения, такие как ингибиторы факторов роста, такие как трастузумаб (Герцептин), гефитиниб (Иресса), иматиниб (Гливек) и цетуксимаб (Эрбитукс).Другой целевой подход — это препараты против нгиогенеза или образования кровеносных сосудов, такие как бевацизумаб (Авастин).
Дополнительная литература
Перейти к основному содержанию
Поиск
Поиск
- Где угодно
Быстрый поиск где угодно
Поиск Поиск
Расширенный поиск
Войти | регистр
Пропустить основную навигацию Закрыть меню ящика Открыть меню ящика Домой
- Подписка / продление
- Учреждения
- Индивидуальные подписки
- Индивидуальные продления
- Библиотекари
- платежи Пакет для Чикаго
- Полный охват и охват содержимого
- Файлы KBART и RSS-каналы
- Разрешения и перепечатка
- Инициатива Чикаго для развивающихся стран
- Даты отправки и претензии
- Часто задаваемые вопросы библиотекарей
- Агенты,
- Расценки, заказы
- и платежи
- Полный пакет Chicago
- Полный охват и содержание
- Даты отправки и претензии
- Часто задаваемые вопросы агента
- О нас
- Публикуйте у нас
- Недавно приобретенные журналы
- tners
- Подпишитесь на уведомления eTOC
- Пресс-релизы
- СМИ
- The University of Chicago Press Books
- Распределительный центр в Чикаго
- Чикагский университет
- Положения и условия
- Заявление об издательской этике
- Уведомление о конфиденциальности
- Доступность Chicago Journals
- Доступность вузов
- Следуйте за нами на facebook
- Следуйте за нами в Twitter
- Свяжитесь с нами
- Медиа и рекламные запросы
- Открытый доступ в Чикаго
- Следуйте за нами на facebook
- Следуйте за нами в Twitter
Ученые предполагают, что рак является исключительно искусственным
Деление раковых клеток.Предоставлено: Бирмингемский университет.
(PhysOrg.com) — Рак — это современное искусственное заболевание, вызванное такими факторами окружающей среды, как загрязнение окружающей среды и диета, — убедительно показало исследование ученых из Манчестерского университета.
Изучение останков и литературы из Древнего Египта и Греции и более ранних периодов, проведенное в Манчестерском центре биомедицинской египтологии KNH и опубликованное в журнале « Nature Reviews Cancer », включает первый гистологический диагноз рака у египетской мумии.
Обнаружение только одного случая заболевания при исследовании сотен египетских мумий с небольшим количеством упоминаний рака в литературных источниках доказывает, что в древности рак был чрезвычайно редким явлением. Уровень заболеваемости резко вырос после промышленной революции, в частности онкологических заболеваний у детей, что доказывает, что рост вызван не только тем, что люди стали жить дольше.
Профессор Розали Дэвид с факультета естественных наук сказала: «В промышленно развитых странах рак является второй причиной смерти после сердечно-сосудистых заболеваний.Но в древности это было крайне редко. В окружающей среде нет ничего, что могло бы вызвать рак. Так что это должно быть искусственное заболевание, вплоть до загрязнения окружающей среды и изменений в нашем питании и образе жизни ».
Она добавила: «Важным в нашем исследовании является то, что оно дает историческую перспективу этой болезни. Мы можем сделать очень четкие заявления о заболеваемости раком в обществе, потому что у нас есть полный обзор. Мы рассмотрели тысячелетия, а не сотню лет, и накопили массу данных.”
Данные включают первый в истории гистологический диагноз рака у египетской мумии, сделанный профессором Майклом Циммерманом, приглашенным профессором Центра KNH, который базируется в Университете Вилланова в США. Он диагностировал рак прямой кишки у безымянной мумии, «обычного» человека, который жил в оазисе Дахле в период Птолемея (200-400 гг. Н. Э.).
Профессор Циммерман сказал: «В древнем обществе, где не было хирургического вмешательства, во всех случаях должны оставаться признаки рака.Фактическое отсутствие злокачественных новообразований в мумиях следует интерпретировать как указание на их редкость в древности, указывая на то, что факторы, вызывающие рак, ограничены обществами, затронутыми современной индустриализацией ».
Команда изучила как мумифицированные останки, так и литературные свидетельства Древнего Египта, но только литературные свидетельства Древней Греции, поскольку останков для этого периода нет, а также медицинские исследования останков людей и животных более ранних периодов, восходящих к эпохе Древнего Египта. динозавры.
Доказательства рака в окаменелостях животных, нечеловеческих приматах и ранних людях немногочисленны — несколько десятков, в основном спорных, примеров в окаменелостях животных, хотя метастатический рак неизвестного первичного происхождения был зарегистрирован в окаменелостях Эдмонтозавра, в то время как другое исследование перечисляет количество возможных новообразований в ископаемых останках. Сообщалось о различных злокачественных новообразованиях у нечеловеческих приматов, но они не включают многие виды рака, которые чаще всего выявляются у современных взрослых людей.
Было высказано предположение, что короткая продолжительность жизни людей в древности препятствовала развитию рака.Хотя эта статистическая конструкция верна, люди в Древнем Египте и Греции действительно жили достаточно долго, чтобы развить такие заболевания, как атеросклероз, костная болезнь Педжета и остеопороз, а в современных популяциях костные опухоли поражают в первую очередь молодых.
Другое объяснение отсутствия опухолей в древних останках заключается в том, что опухоли могут быть плохо сохранены. Доктор Циммерман провел экспериментальные исследования, показавшие, что мумификация сохраняет признаки злокачественности и что опухоли на самом деле должны сохраняться лучше, чем нормальные ткани.Несмотря на это открытие, были исследованы сотни мумий со всех уголков мира, и до сих пор есть только две публикации, демонстрирующие микроскопическое подтверждение рака. Радиологические исследования мумий из Каирского музея и европейских музеев также не выявили признаков рака.
По мере того, как команда двигалась сквозь века, только в 17 веке они нашли описания операций по поводу рака груди и других видов рака, а первые сообщения в научной литературе об отличительных опухолях появились только за последние 200 лет, таких как рак мошонки. у трубочистов в 1775 году, рака носа у наркоманов в 1761 году и болезни Ходжкина в 1832 году.
Профессор Дэвид, которую пригласили представить свой доклад королю рака Великобритании, профессору Майку Ричардсу и другим онкологам на конференции Ассоциации онкологических регистров Великобритании и Национальной сети онкологической разведки в этом году, сказала: «Где в древнем Египте есть случаи рака. остается, мы не уверены, что их вызвало. Они действительно отапливали свои дома огнем, от которого исходил дым, а в храмах курили благовония, но иногда болезни просто извергались ».
Она добавила: «Древние египетские данные содержат как физические, так и литературные свидетельства, давая уникальную возможность взглянуть на болезни, которые у них были, и методы лечения, которые они пробовали.Они были отцами фармакологии, поэтому некоторые методы лечения действительно работали
«Они были очень изобретательными, и некоторые процедуры, считавшиеся волшебными, были настоящими лечебными средствами. Например, сельдерей тогда использовался для лечения ревматизма, и сегодня он исследуется. Их хирургия и фиксация переломов были превосходными, потому что они знали свою анатомию: не было табу на работу с человеческими телами из-за мумификации. Они были очень практичны, и это дало им иной образ мышления в работе с телом, чем у греков, которым пришлось приехать в Александрию, чтобы изучать медицину.”
В заключение она пришла к выводу: «И снова обширные древнеегипетские данные, наряду с другими данными, полученными за тысячелетия, дали современному обществу четкое послание: рак создан человеком, и мы можем и должны решить эту проблему».
Международный альянс по раскрытию секретов египетских мумий
Дополнительная информация:
Копия статьи «Рак: старая болезнь, новая болезнь или что-то среднее?» Доступна на сайте www.nature.com/nrc/journal/v10… 10 / full / nrc2914.html
Предоставлено
Манчестерский университет
Ссылка :
Ученые предполагают, что рак вызван исключительно руками человека (14 октября 2010 г.)
получено 7 апреля 2021 г.
из https: // medicalxpress.ru / news / 2010-10-Schools-Cancer-pure-man-made.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Попытки оценить заболеваемость раком в древние времена
Когда около 10 лет назад раскопали скифский курган в российском регионе Тувы, археологи буквально нашли золото.На полу темного внутреннего покоя сидели два скелета, мужчина и женщина, в окружении королевской одежды 27 веков назад: головные уборы и накидки, украшенные золотыми лошадьми, пантерами и другими священными животными.
Но для палеопатологов — исследователей древних болезней — самым богатым сокровищем было обилие опухолей, пронизывающих почти каждую кость человеческого тела. Диагноз: самый старый из известных случаев метастазирующего рака простаты.
Сама простата давно распалась.Но злокачественные клетки из железы мигрировали по знакомой схеме и оставили идентифицируемые шрамы. Белки, извлеченные из кости, дали положительный результат на ПСА, специфический антиген простаты.
Рак, который часто называют современной болезнью, всегда был с нами. Ученые расходятся во мнениях относительно того, насколько это было усилено сладкими и горькими плодами цивилизации. За десятилетия археологи сделали около 200 возможных случаев обнаружения рака, относящихся к доисторическим временам. Но, учитывая трудности извлечения статистики из старых костей, это немного или много?
Недавний отчет двух египтологов в журнале Nature Reviews: Cancer проанализировал литературу и пришел к выводу, что в останках древних людей существует «поразительная редкость злокачественных новообразований».
«Редкость рака в древности предполагает, что такие факторы ограничены обществами, которые затронуты проблемами современного образа жизни, такими как употребление табака и загрязнение окружающей среды в результате индустриализации», — писали авторы А. Розали Дэвид из Манчестерского университета в Англии. и Майкл Р. Циммерман из Университета Вилланова в Пенсильвании. Также в списке будут ожирение, диетические привычки, сексуальная и репродуктивная практика и другие факторы, часто изменяемые цивилизацией.
В новостях по всему Интернету этот вопрос звучал недвусмысленно: «Рак — это рукотворное заболевание.«Лекарство от рака: живи в древние времена». Но на многих медицинских экспертов и археологов это произвело меньшее впечатление.
«Нет причин думать, что рак — это новое заболевание», — сказал Роберт А. Вайнберг, исследователь рака из Института биомедицинских исследований Уайтхеда в Кембридже, штат Массачусетс, и автор учебника «Биология рака». . » «В прежние времена это было менее распространено, потому что люди в среднем возрасте поражались другим вещам».
Еще одним соображением, по его словам, является революция в медицинских технологиях: «Сейчас мы диагностируем многие виды рака — груди и простаты, — которые в прежние времена оставались бы незамеченными и уносились бы в могилу, если бы человек умер от других, не связанных причин.”
Даже с учетом всего этого существует фундаментальная проблема с оценкой заболеваемости древними раком. Может показаться, что двести подозреваемых случаев не так уж и много. Но скудность доказательств не свидетельствует о редкости. Опухоли могут оставаться скрытыми внутри костей, а те, которые вырывают наружу, могут привести к крошению и исчезновению костей. Несмотря на все усилия археологов, была извлечена только часть груды человеческих костей, без возможности узнать, что скрыто внизу.
Энн Л.Грауэр, президент Ассоциации палеопатологов и антрополог из Чикагского университета Лойола, считает, что в остеологических коллекциях мира насчитывается около 100 000 скелетов, и подавляющее большинство из них не подвергалось рентгеновскому сканированию или изучению с помощью более современных методов.
Согласно анализу Справочного бюро по народонаселению, совокупное количество всех, кто жил и умер к 1 году нашей эры, уже приближалось к 50 миллиардам и почти удвоилось к 1750 году (анализ опровергает часто делаемое утверждение, что больше людей сегодня живы, чем когда-либо жили на земле.) Если эти цифры верны, количество скелетов в археологической базе данных будет составлять лишь одну десятитысячную от 1 процента от общего числа.
В этом крохотном образце не все останки завершены. «Долгое время археологи собирали только черепа», — сказала Хизер Дж. Х. Эдгар, куратор отдела остеологии человека в Музее антропологии Максвелла при Университете Нью-Мексико. «По большей части невозможно узнать, что остальные скелеты этих людей могли сказать о своем здоровье.
Итак, как ученые могут оценить, например, значение нескольких ископаемых примеров остеосаркомы, редкого рака костей, который в основном поражает молодых людей? (Возможно, самый старый случай был обнаружен в 1932 году антропологом Луи Лики у доисторического родственника человека.) Сегодня заболеваемость остеосаркомой среди людей моложе 20 лет составляет около пяти случаев на миллион в год.
«Чтобы найти случай, вам потребуется обследовать 10 000 человек», — сказал Мел Гривз, профессор клеточной биологии Института исследований рака в Англии и автор книги «Рак: эволюционное наследие» (Oxford, 2000). .По его словам, было изучено недостаточно подростковых останков, чтобы сделать значимый вывод.
Есть еще одно осложнение: более 99 процентов случаев рака возникают не в костях, а в более мягких органах, которые быстро разрушаются. Если они не распространятся на кости, они, скорее всего, останутся незарегистрированными.
Древние мумии кажутся исключением. Но и здесь выбор был невелик.
Лишь в редких случаях патологоанатомы могут заполучить сравнительно недавнюю мумию, такую как Ферранте I из Арагона, король Неаполя, умерший в 1494 году.Когда пять веков спустя его тело было вскрыто, было обнаружено, что аденокарцинома, которая начинается в железистых тканях, распространилась на мышцы его малого таза.
Молекулярное исследование выявило типографскую ошибку в гене, регулирующем деление клеток (буква G была заменена на A), что указывает на колоректальный рак. Авторы предположили, что причиной этого могло быть прожорливое употребление красного мяса.
За прошедшие годы сотни египетских и южноамериканских мумий обнаружили еще несколько случаев.Редкая опухоль, называемая рабдомиосаркомой, была обнаружена на лице чилийского ребенка, который жил где-то между 300 и 600 гг. 400, и он подтвердил диагноз с помощью микроскопического анализа ткани — первого, по его словам, в египетской палеопатологии.
«Факт остается фактом: существует лишь незначительное количество действительно древних мумий и скелетов, свидетельствующих о раке», — сказал он.«Мы просто не находим ничего похожего на современную заболеваемость раком».
Хотя средняя продолжительность жизни в Древнем Египте была ниже, чем сегодня, доктор Циммерман утверждает, что многие люди, особенно богатые, жили достаточно долго, чтобы заразиться другими дегенеративными заболеваниями. Так почему не рак?
Другие эксперты предположили, что большинство опухолей было уничтожено инвазивными ритуалами египетской мумификации. Но в исследовании, опубликованном в 1977 году, доктор Циммерман показал, что доказательства могут сохраниться.
В одном эксперименте он взял печень у современного пациента, который умер от метастатического рака толстой кишки, высушил ее в духовке, а затем регидратировал, продемонстрировав, по его словам, что «признаки рака хорошо сохраняются при мумификации и что мумифицированные опухоли на самом деле лучше сохранились, чем нормальные ткани ».
Но, как и в случае со скелетами, проблема остается: учитывая небольшой размер выборки, сколько рака должны ожидать ученые?
Чтобы получить приблизительное представление, Тони Уолдрон, палеопатолог из Университетского колледжа Лондона, проанализировал британские отчеты о смертности с 1901 по 1905 год — период, достаточно поздний, чтобы обеспечить достаточно хорошие записи, и достаточно ранний, чтобы избежать искажения данных, например, из-за всплеск рака легких, вызванный в последующие десятилетия популярностью сигарет.
Принимая во внимание различия в продолжительности жизни и вероятность того, что различные злокачественные новообразования распространятся на кости, он подсчитал, что в «археологическом комплексе» можно ожидать рака менее чем в 2 процентах скелетов мужчин и от 4 до 7 процентов скелетов женщин.
Андреас Г. Нерлих и его коллеги из Мюнхена опробовали предсказание на 905 скелетах из двух древних египетских некрополей. С помощью рентгеновских лучей и компьютерной томографии они диагностировали пять видов рака — точно так же, как и доктор.
