Бактерии из детского горла ответственны за инфекции, поражающие суставы — microbiology
Обнаруженная в горле детей бактерия Kingella kingae имеет связь с инфекциями костей и суставов (фото любезно предоставлено Центром по контролю и профилактике заболеваний США).
Используя чувствительную диагностику, исследователи обнаружили, что одна и та же бактерия Kingella kingae, которая присутствует в горле детей, также тесно связана с инфекцией костей и суставов.
Ранее считалось, что большинство бактериальных инфекций костей и суставов у детей вызваны бактериями типа cтафилококк (Staphylococcus), стрептококк (Streptococcus) или гемофильная палочка (Haemophilus influenzae) типа B, и лечение представляло собой продолжительный прием антибиотиков и/или выполнение хирургической операции. В последние годы новые высокочувствительные методы позволили более точно идентифицировать бактерии, ответственные за эти инфекции.
Исследование — сотрудничество между двумя педиатрическими университетскими больничными центрами в Монреале (Канада) и Женеве (Швейцария) — включало 77 детей в возрасте от 6 месяцев до 4 лет, которые были госпитализированы с подозрением на инфекцию костей и суставов, и 286 человек в контрольной группе.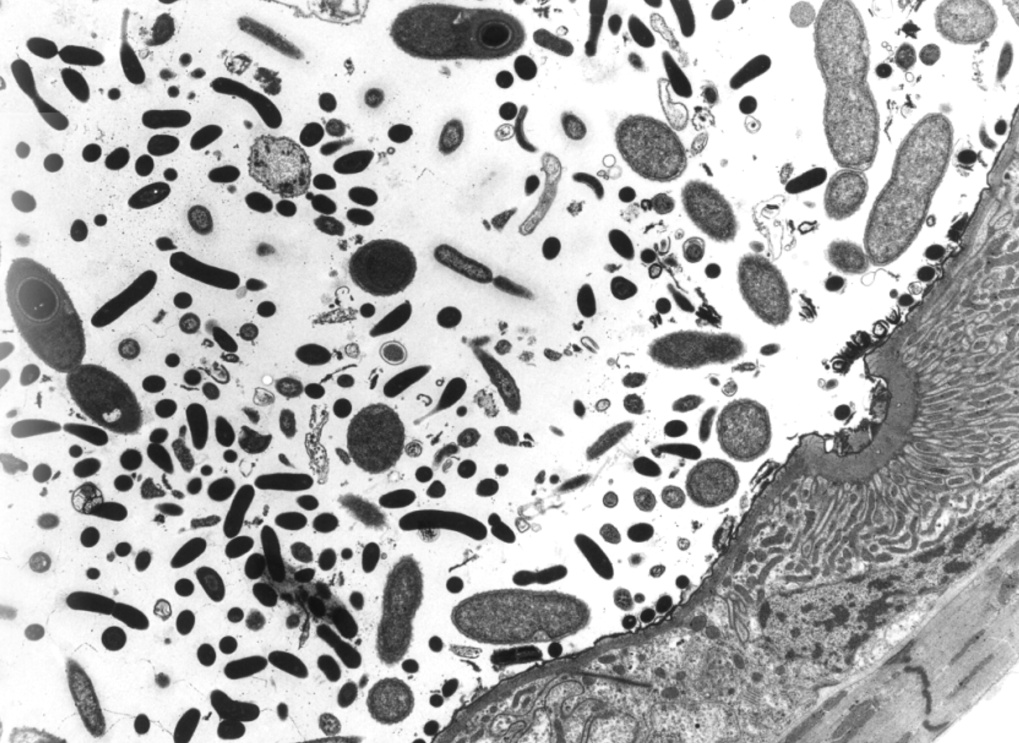 Из подозреваемых инфекций у 65 детей было подтверждено наличие инфекции костей или суставов.
Из подозреваемых инфекций у 65 детей было подтверждено наличие инфекции костей или суставов.
«С использованием улучшенных диагностических методов наше исследование показало, что подавляющее большинство детей в возрасте до 4 лет, страдающих от инфекции костей или суставов, были инфицированы бактериями Kingella kingae, — заявила доктор Джоселин Гравель (Jocelyn Gravel) из Университетского больничного центра матери и ребенка Сент-Джастин (Mother & Child University Hospital Center Sainte-Justine) при Монреальском университете (Монреаль, Квебек, Канада). — Что еще более важно, мы обнаружили, что в случае в 70% детей, у которых была обнаружена инфекция костей или суставов, эти бактерии переносились в горло, и для неинфицированных детей это было редкостью (всего 6%)».
Эти результаты особенно важны, поскольку доля неизвестного патогена была очень высокой в предыдущих исследованиях. Теперь, используя инновационные методы диагностики, это исследование показало, что K. kingae не редкость. По всей видимости, это самый распространенный патоген, отвечающий за инфекцию костей или суставов у детей.
«Основываясь на этом исследовании, мы планируем изменить способ обследования детей, которым угрожает инфекция костей или суставов, потому что идентификация K. kingae в горле ребенка с подозрением на костную инфекцию указывает на K. kingae как на виновника. Это может уменьшить количество других анализов, проведенных для идентификации патогена».
Авторы отмечают небольшой масштаб проведенного исследования, поэтому необходима дальнейшая работа над этим вопросом. В сопутствующем комментарии в CMAJ доктора Ромен Басмачи (Romain Basmaci) и Стефан Бонакорси (Stéphane Bonacorsi) из больницы Луи-Моурье (Louis-Mourier Hospital; Коломб, Франция) предостерегают, что, хотя результаты исследования показывают сильную связь между инфекцией горла K. kingae и инфекцией костей или суставов, «с темпом носительства бактерии среди здоровых детей до 10% в некоторых странах, использование обнаружения орофарингеля в качестве посредника для диагностики в случае инфекции суставов приведет к высокому проценту ложноположительного диагноза».
Исследование, проведенное Дж. Гравель и др. (Gravel J et al), а также вышеупомянутый сопутствующий комментарий были опубликованы 5 сентября 2017 года в “Журнале Канадской медицинской ассоциации” (CMAJ — Canadian Medical Association Journal).
Ссылки по теме:
Университетский больничный центр матери и ребенка Сент-Джастин
Откуда у ребенка кингелла — Вопрос инфекционисту
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.
Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 71 направлению: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.47% вопросов.
Оставайтесь с нами и будьте здоровы!
Инфекции, вызываемые Kingella: лечение, симптомы
Организмы Kingella колонизируют дыхательные пути человека.
Они вызывают опорно-двигательного аппарата, эндокардита и бактериемию и, изредка, пневмонию, эпиглоттит, менингит, абсцессы и глазные инфекции.
Kingella — короткие, неподвижные, грамотрицательные коккобациллы, которые существуют в парах или коротких цепях. Организмы растут медленно и прихотливы. Kingella обитают в человеческих дыхательных путях и являются редкой причиной болезни у человека.
Среди разновидностей Kingella — К. kingae самый частый человеческий болезнетворный микроорганизм; эти организмы часто колонизируют респираторные слизистые оболочки. У детей в возрасте от 6 мес до 4 лет самые высокие показатели колонизации и инвазивных заболеваний, вызываемых этим и другими болезнетворными микроорганизмами дыхательных путей, такими как Moraxella catarrhalis и Streptococcus pneumoniae. Инфекция имеет сезонность.
Болезни, вызванные Kingella
Наиболее распространенные проявления заболеваний К. kingae
- Костно-суставные инфекции.
- Эндокардит.
- Бактериемия.
Редкие проявления включают пневмонию, эпиглоттит, менингит, абсцессы и глазные инфекции.
Наиболее распространенная инфекция с поражением костно-мышечной системы — септический артрит, который наиболее часто поражает крупные, несущие вес суставы, особенно колено и лодыжку. Начало внезапное. Диагноз часто поздний. Может развиться гематогенная инвазия межпозвонковых дисков, по большей части в поясничной области.
Эндокардит, вызванный Kingella, регистрируется во всех возрастных группах. Эндокардит может поражать клапаны сердца, в т.ч. и после протезирования. Kingella входит в т.н. группу НАСЕК, в которую включены прихотливые грамотрицательные бактерии, способные вызвать эндокардит.
Диагноз устанавливается на основании выделения культуры возбудителя в биологических жидкостях или тканях.
Лечение Kingella
- Пенициллин или цефалоспорин.
Организмы Kingella в целом чувствительны к различным пенициллинам и цефалоспоринам. Однако необходимо определение чувствительности к антибактериальным препаратам, чтобы провести адекватную терапию. Другими эффективными препаратами являются аминогликозиды, триметоприм/сульфаметоксазол, тетрациклины, эритомицин и ципрофлоксацин.
Только ли Staphylococcus aureus является причиной остеоартикулярной инфекции у детей?
Актуальность
Остеоартикулярные инфекции являются серьёзными инфекциями, которые могут оказать влияние на развитие и функцию костной системы. Микробиологическое подтверждение диагноза необходимо для правильного подбора терапии и улучшения исходов. До настоящего времени Staphylococcus aureus являлся самым распространенным возбудителем инфекции вне зависимости от возраста. Однако в педиатрии все чаще встречаются другие возбудители.
Целью настоящего исследования было оценить эпидемиологию остеоартикулярных инфекций в одном отдельном педиатрическом госпитале в Женеве (Швейцария).
Методы
В ретроспективное исследование были включены все дети, госпитализированные в госпиталь с остеоартикулярной инфекцией на протяжении 20 лет (с 1997 по 2016 год). Все пациенты были разделены на 2 когорты, в первой для поиска возбудителя инфекции использовали стандартный метод полимеразной цепной реакции (до 2007 года), во второй, дополнительно метод амплификации нуклеиновых кислот.
Результаты
- Результаты анализа свидетельствуют, что Kingella kingae являлась наиболее часто выявленным патогеном. Данная бактерия была ответственна за 51% случаев остеоартикулярной инфекции, тогда как классические патогены были ответственны только за 39,7% случаев инфекции.
- Наблюдалось статистически значимое увеличение средней заболеваемости остеоартикулярной инфекции, а также снижение среднего возраста на момент постановки диагноза после 2007 г. После 2007 г. патоген оставался неопознанным в 21,6% при остеоартикулярной инфекции в исследуемой педиатрической популяции.
Заключение
Широкое использование анализов амплификации нуклеиновых кислот улучшило обнаружение патогенов, которые сложно обнаружить, и увеличило частоту установления возбудителя остеоартикулярной инфекции, особенно у детей в возрасте от 6 до 48 месяцев.
Источник: Eleftheria Samara, Vasiliki Spyropoulou, Anne Tabard-Fougère, et al. Kingella kingae and Osteoarticular Infections. Pediatrics November 2019, e20191509.
Ученые открыли новую связь между аутизмом и бактериями
https://ria.ru/20190531/1555159617.html
Ученые открыли новую связь между аутизмом и бактериями
Ученые открыли новую связь между аутизмом и бактериями — РИА Новости, 31.05.2019
Ученые открыли новую связь между аутизмом и бактериями
Трансплантация микрофлоры кишечника помогла ученым превратить несколько здоровых мышей в полноценных «аутистов», и затем избавить их от подобных проблем… РИА Новости, 31.05.2019
2019-05-31T18:07
2019-05-31T18:07
2019-05-31T18:07
наука
сша
калифорнийский технологический институт
открытия — риа наука
аутизм
биология
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/155515/75/1555157528_0:166:1440:976_1920x0_80_0_0_ff227b7e7a54bd4b432ee9d670fd2d37.jpg
МОСКВА, 31 мая – РИА Новости. Трансплантация микрофлоры кишечника помогла ученым превратить несколько здоровых мышей в полноценных «аутистов», и затем избавить их от подобных проблем аналогичным образом. Результаты этих экспериментов были представлены в журнале Cell.По данным органов здравоохранения США, расстройства аутистического спектра встречаются у одного из 59 детей в мире. По данным ВОЗ, ежегодно число детей с аутизмом увеличивается на 13%. За последние годы ученые открыли десятки генов, связанных с аутизмом, однако мутации в них не могут полностью объяснить ни одного случая развития этой болезни в целом и ее отдельных симптомов в частности.Три года назад американские ученые заметили, экспериментируя на мышах, что аутизм связан не только с наличием определенных мутаций в генах, управляющих работой и развитием мозга, но и с бактериями в кишечнике самих аутистов и их родителей.Как показали эти опыты, «пересадка» здоровой микрофлоры мышам-матерям снизила вероятность развития аутизма у их детенышей, а ее замена в организме самих мышат сделала их более общительными и социальными. Схожие результаты были получены в экспериментах на добровольцах.Многие ученые, как отмечают Шарон и его коллеги, сомневались в наличии подобной взаимосвязи, предполагая, что причина и следствие были перепутаны местами. Они считали, что развитие аутизма ведет к появлению характерной микрофлоры и что все удачные изменения в характере поведения мышат и добровольцев Авторы статьи проверили, так ли это на самом деле, организовав серию экспериментов на обычных лабораторных мышах, лишенных своей собственной микрофлоры. Трансплантируя микробов здоровых людей и аутистов, ученые наблюдали за изменениями в поведении грызунов и в работе их мозга, а также за аналогичными характеристиками их детенышей.Подобная процедура, как отмечают ученые, радикально изменила поведение грызунов – они начали меньше общаться с сородичами, совершать большое количество одних и тех же действий и издавали заметно меньше звуков. Все подобные симптомы сегодня считаются аналогом человеческого аутизма у мышей.Анализируя различия в их микрофлоре, ученые выделили три вида бактерий — Bacteroides ovatus, Parabacteroides merdae и Eisenbergiela tayi, чья численность была непосредственно связана с тем, насколько ярко проявляли себя симптомы аутизма. Первые два микроба почти всегда отсутствовали в кишечнике грызунов-аутистов, а последних было там необычно много.Что самое интересное, появление или исчезновение этих бактерий особым образом повлияло на работу генов, дирижирующих развитием мозга и работой его клеток, в том числе нескольких сотен участков ДНК, связанных с аутизмом.Образно выражаясь, клетки начали считывать эти участки ДНК альтернативным способом, что сказалось на структуре и характере действия белковых молекул и различных сигнальных веществ, дирижирующих работой мозга. Все эти изменения, как показали последующие опыты, исчезали, когда ученые пересаживали мышам «нормальную» микрофлору.Что порождало подобные сдвиги в работе генов? Как предполагают исследователи, они были связаны с тем, что микробы аутистов вырабатывают заметно меньше молекул двух важных веществ – таурина и 5-аминовалериановой кислоты. И то, и другое соединение похожи по структуре на некоторые сигнальные молекулы, воздействующие на так называемые ГАМК-рецепторы, главный «тормоз» нервной системы.Обнаружив это различие, биологи проверили, что произойдет, если восполнить недостаток этих двух веществ в организме мышей, генетически предрасположенных к развитию аутизма. К их большому удивлению, добавление таурина и аминовалериановой кислоты резко уменьшило остроту симптомов болезни и сделало поведение грызунов почти нормальным.»Конечно, человеческий аутизм намного сложнее и мы не можем точно повторить его на мышах. С другой стороны, наше исследование показывает, что микробиом напрямую связан с теми изменениями в работе мозга, которые ассоциируются с аутизмом. Возможно, что в будущем мы сможем подавлять его симптомы при помощи пробиотиков или выделений бактерий», — заключает Саркис Мазманян, коллега Шарона по Калтеху.
https://sn.ria.ru/20180712/1524457885.html
https://ria.ru/20180529/1521634149.html
https://ria.ru/20170123/1486285016.html
сша
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/155515/75/1555157528_0:31:1440:1111_1920x0_80_0_0_9ff56b73d9c975479ba4657b90d7bc2b.jpg
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
сша, калифорнийский технологический институт, открытия — риа наука, аутизм, биология
МОСКВА, 31 мая – РИА Новости. Трансплантация микрофлоры кишечника помогла ученым превратить несколько здоровых мышей в полноценных «аутистов», и затем избавить их от подобных проблем аналогичным образом. Результаты этих экспериментов были представлены в журнале Cell.
«Мы показали, что простой пересадки микрофлоры достаточно для того, чтобы значительно поменять работу генов в клетках мозга и вызвать аутизм. С другой стороны, надо понимать, что это не обязательно говорит о том, что именно микробы порождают этот синдром», — рассказывает Гил Шарон (Gil Sharon) из Калифорнийского технологического института в Пасадене (США).
По данным органов здравоохранения США, расстройства аутистического спектра встречаются у одного из 59 детей в мире. По данным ВОЗ, ежегодно число детей с аутизмом увеличивается на 13%. За последние годы ученые открыли десятки генов, связанных с аутизмом, однако мутации в них не могут полностью объяснить ни одного случая развития этой болезни в целом и ее отдельных симптомов в частности.
Три года назад американские ученые заметили, экспериментируя на мышах, что аутизм связан не только с наличием определенных мутаций в генах, управляющих работой и развитием мозга, но и с бактериями в кишечнике самих аутистов и их родителей.
12 июля 2018, 15:13НаукаМедики раскрыли необычную связь между аутизмом и формой мозжечка
Как показали эти опыты, «пересадка» здоровой микрофлоры мышам-матерям снизила вероятность развития аутизма у их детенышей, а ее замена в организме самих мышат сделала их более общительными и социальными. Схожие результаты были получены в экспериментах на добровольцах.
Многие ученые, как отмечают Шарон и его коллеги, сомневались в наличии подобной взаимосвязи, предполагая, что причина и следствие были перепутаны местами. Они считали, что развитие аутизма ведет к появлению характерной микрофлоры и что все удачные изменения в характере поведения мышат и добровольцев
Авторы статьи проверили, так ли это на самом деле, организовав серию экспериментов на обычных лабораторных мышах, лишенных своей собственной микрофлоры. Трансплантируя микробов здоровых людей и аутистов, ученые наблюдали за изменениями в поведении грызунов и в работе их мозга, а также за аналогичными характеристиками их детенышей.
Подобная процедура, как отмечают ученые, радикально изменила поведение грызунов – они начали меньше общаться с сородичами, совершать большое количество одних и тех же действий и издавали заметно меньше звуков. Все подобные симптомы сегодня считаются аналогом человеческого аутизма у мышей.
Анализируя различия в их микрофлоре, ученые выделили три вида бактерий — Bacteroides ovatus, Parabacteroides merdae и Eisenbergiela tayi, чья численность была непосредственно связана с тем, насколько ярко проявляли себя симптомы аутизма. Первые два микроба почти всегда отсутствовали в кишечнике грызунов-аутистов, а последних было там необычно много.
29 мая 2018, 20:00НаукаБиологи открыли бактерии, вызывающие галлюцинации и слабоумие
Что самое интересное, появление или исчезновение этих бактерий особым образом повлияло на работу генов, дирижирующих развитием мозга и работой его клеток, в том числе нескольких сотен участков ДНК, связанных с аутизмом.
Образно выражаясь, клетки начали считывать эти участки ДНК альтернативным способом, что сказалось на структуре и характере действия белковых молекул и различных сигнальных веществ, дирижирующих работой мозга. Все эти изменения, как показали последующие опыты, исчезали, когда ученые пересаживали мышам «нормальную» микрофлору.
Что порождало подобные сдвиги в работе генов? Как предполагают исследователи, они были связаны с тем, что микробы аутистов вырабатывают заметно меньше молекул двух важных веществ – таурина и 5-аминовалериановой кислоты. И то, и другое соединение похожи по структуре на некоторые сигнальные молекулы, воздействующие на так называемые ГАМК-рецепторы, главный «тормоз» нервной системы.
Обнаружив это различие, биологи проверили, что произойдет, если восполнить недостаток этих двух веществ в организме мышей, генетически предрасположенных к развитию аутизма. К их большому удивлению, добавление таурина и аминовалериановой кислоты резко уменьшило остроту симптомов болезни и сделало поведение грызунов почти нормальным.
«Конечно, человеческий аутизм намного сложнее и мы не можем точно повторить его на мышах. С другой стороны, наше исследование показывает, что микробиом напрямую связан с теми изменениями в работе мозга, которые ассоциируются с аутизмом. Возможно, что в будущем мы сможем подавлять его симптомы при помощи пробиотиков или выделений бактерий», — заключает Саркис Мазманян, коллега Шарона по Калтеху.
23 января 2017, 16:01НаукаУченые: трансплантация фекальных бактерий может вылечить аутизм
Моракселла катаралис в носу- лечение в Москве
Рейтинг статьи
5.00 (Проголосовало: 2)
Наиболее встречающимися ЛОР-заболеваниями являются средний отит и синусит. Особенно часто эти воспаления возникают в раннем возрасте. По статистике до пяти лет ими страдают до 60% детей. Одним из возбудителей этих заболеваний является бактерия моракселла. Моракселла катаралис или Moraxella catarrhalis или Branchamella catarrhalis была выделена в начале прошлого века и не считалась патогенной до 70-х годов.
Где обитает?
В норме она живет на слизистой оболочке носа, глаз и в мочеполовой системе. Обычно никаких неприятностей эта бактерия не доставляет. Но, как любая условно патогенная флора при ослаблении иммунитета, она может стать причиной заболевания. Моракселла в 50% случаев обнаруживается у детей и в десятки раз реже у взрослых. Именно поэтому чаще всего эта бактерия встречается в посеве у детей.
Для чего необходимо взять мазок?
Обычно этот микроорганизм живет у большинства людей и никаких неприятностей не доставляет, и избавляться от него заранее, в целях профилактики, смысла нет. Однако, если именно моракселла стала причиной постоянных болезней, то без антибиотиков, скорее всего, не обойтись.
Несмотря на то, что по агрессивности воспаления моракселла уступает другим возбудителям, опасна она в основном тем, что плохо распознается и часто может лечиться неправильно. Именно поэтому не стоит пренебрегать сдачей мазка на флору. Собранный материал от пациента высеивают на специальную среду и диагностируют бактерию с помощью микроскопа.
Если лечиться, то как?
Являясь бактерией, способной продуцировать фермент β-лактамазу, моракселла устойчива к определенным видам антибиотиков, которые при ЛОР-заболеваниях назначаются чаще всего. Поэтому лабораторные исследования и консультация врача необходимы для своевременного, правильного лечения и благополучного исхода заболевания.
Помимо этого, применяется и симптоматическое лечение, которое назначит врач, учитывая течение заболевания. Только врач на основе анализов сможет правильно установить возбудителя болезни и назначить тот препарат, который вам необходим.
В филиалах «ЛОР клиники №1» высококвалифицированные специалисты-оториноларингологи проведут полный осмотр ЛОР-органов, назначат необходимые обследования и лечение, соответствующее вашему заболеванию.
1.2 Этиология и патогенез / КонсультантПлюс
1.2 Этиология и патогенез
Степень вероятности возникновения септического эндокардита у лиц, пользующихся нестерильными шприцами (при наркомании) в 30 раз выше. Летальность при инфекционном эндокардите остается на высоком уровне — 24 — 30%, а у лиц пожилого возраста — более 40%.
В большинстве случаев причиной инфекционного эндокардита (ИЭ) у взрослых являются: Streptococcus viridans, S. aureus, Streptococcus bovis, Enterococci и редко встречающиеся бактерии из группы HACEK (Haemophilus, Actinobacillus, Cardiobacterium, Eikenella и Kingella) (3%). Инфицирование нативных клапанов эпидермальным стафилококком, кишечными палочками и грибами встречается крайне редко [1 — 4].
Среди редко встречающихся возбудителей ИЭ описаны сальмонеллы, дифтероиды, гемофилюс, листерия, эйкенелла. Эризипелотрикс иногда может стать причиной эндокардита. Этот микроб обитает в глотке домашних животных, в слизи и чешуе рыб, у птиц и грызунов, и поэтому эта инфекция чаще встречается у мясников, рыбаков и лиц, имеющих контакт с животными [3 — 7].
У лиц употребляющих внутривенно наркотики, причиной ИЭ чаще всего становятся микроорганизмы, населяющие кожу, это S.aureus (50 — 60%). Стрептококки и энтерококки встречаются значительно реже, примерно в 20% случаев, грамотрицательные палочки, особенно Pseudomonas и Serratia spp. — 10 — 15% случае, но, вместе с тем, Pseudomonas aeruginosa вызывает тяжелую деструкцию клапана и весьма устойчива к антибиотикотерапии. Единственным методом успешного лечения такого эндокардита остается хирургическая коррекция [1 — 4].
Примерно в 5% случаев причиной ИЭ становятся грибы. Наиболее часто эндокардит вызывают грибы рода Candida, Aspergillus и Histoplasma, реже — Blastomyces, Coccidioides, Cryptococcus, Mucor, Phodotorula и др. Нередко у этой категории пациентов одновременно на клапане встречается рост и грибов и бактерий.
Протезный эндокардит (ПЭ) составляет 10 — 20% от всех случаев заболевания ИЭ. Риск заболевания значительно выше в первые шесть месяцев после имплантации протеза, но обнаружение госпитальной флоры в крови и на удаленных протезах в течение года, переместили сроки раннего ПЭ до 12 месяцев [1 — 4].
Причиной раннего протезного эндокардита становится инфицирование во время операции или в раннем послеоперационном периоде через катетеры (в основном центральные) инфекционными агентами. Наиболее часто становятся стафилококки: S.epidermidis (25 — 30%), S. aureus (20 — 25%). Грамотрицательные бактерии встречаются реже [1 — 4].
Поздний ПЭ возникает на фоне транзиторной бактериемии, возникающей при стоматологических, гинекологических, урологических и гастоэнтерологических вмешательствах, поэтому патогенная флора обычно характерна для ИЭ нативных клапанов. Чаще встречаются стрептококки (S. viridans 25 — 35%), коагулазонегативный стафилококк встречается менее чем у 20% пациентов. В 10 — 15% случаев заболевания протезным эндокардитом причиной становятся грибы (Candida и Aspergillus) [3 — 5].
Необходимо отметить, что, грибковый протезный эндокардит значительно труднее поддается лечению и чаще становится причиной летального исхода, чем вызванный бактериальной флорой.
В патогенезе ИЭ играют роль несколько факторов. Прежде всего, это инфекционный агент — микроорганизм и измененный эндотелий клапана, важную роль играют иммунитет и адаптация. Возникновению ИЭ могут способствовать различные эндогенные и экзогенные факторы, изменяющие реактивность организма, восприимчивость и устойчивость к инфекции (операции, беременность, аборт, роды, резкое изменение условий труда и быта, переутомление, перенесенные болезни и т.д.) [8].
Первым этапом в развитии инфекционного эндокардита является прикрепление бактерий к поврежденной поверхности эндокарда клапана. Бактерии начинают активно делиться, присутствие бактерий стимулирует процесс тромбообразования, колонии бактерий чередуются со слоями фибрина. Таким образом, появляются вегетации, которые достаточно быстро увеличиваются в размерах. Вегетации размерами более 1 см становятся значительно подвижными и могут приводить к тромбоэмболиям в различные участки артериального кровотока (при эндокардите левых камер сердца). Наиболее часто это сосуды головного мозга, почки, селезенка, артерии конечностей. При ИЭ правых камер, соответственно, вегетации попадают в артерии малого круга кровообращения, вызывая развитие инфарктных пневмоний. При наличии дефектов МЖП вегетации со створок митрального клапана также могут явиться причиной тромбоэмболии легочной артерии [9].
В месте прикрепления вегетаций воспалительная реакция может быть выражена, вплоть до образования абсцесса и полного разрушения створки клапана. Формирование абсцессов — серьезное осложнение эндокардита, абсцессы могут распространяться на фиброзное кольцо и далее вглубь миокарда. Абсцессы фиброзного кольца аортального клапана и парааортального пространства могут распространяться на проводящие пути и вызывать нарушения ритма и проводимости [10].
Абсцессы фиброзного кольца при протезном эндокардите приводят к образованию фистул, при распространении процесса вплоть до отрыва протеза.
Вегетации чаще всего располагаются в местах с наиболее высоким давлением — это предсердная поверхность створок митрального клапана и желудочковая поверхность створок аортального клапана [11].
Kingella kingae: носительство, передача и болезнь
Обзор
DOI: 10.1128 / CMR.00028-14.
Принадлежности
Расширять
Принадлежность
- 1 Лаборатория клинической микробиологии, Медицинский центр Университета Сорока, Университет Бен-Гуриона в Негеве, Беэр-Шева, Израиль yagupsky @ bgu.ac.il.
Бесплатная статья PMC
Элемент в буфере обмена
Обзор
Пабло Ягупский.
Clin Microbiol Rev.
2015 Янв.
Бесплатная статья PMC
Показать детали
Показать варианты
Показать варианты
Формат
АннотацияPubMedPMID
DOI: 10.1128 / CMR.00028-14.
Принадлежность
- 1 Лаборатория клинической микробиологии, Медицинский центр Университета Сорока, Университет Бен-Гуриона в Негеве, Беэр-Шева, Израиль [email protected].
Элемент в буфере обмена
Полнотекстовые ссылки
Опции CiteDisplay
Показать варианты
Формат
АннотацияPubMedPMID
Абстрактный
Kingella kingae — распространенная этиология детской бактериемии и ведущий агент остеомиелита и септического артрита у детей в возрасте от 6 до 36 месяцев.Эта грамотрицательная бактерия бессимптомно переносится в ротоглотке и распространяется при тесном межличностном контакте. Колонизированный эпителий является источником инвазии кровотока и распространения в отдаленные участки, а некоторые клоны обнаруживают значительную связь с бактериемией, остеоартритом или эндокардитом. Kingella kingae продуцирует токсин RTX (повторяющийся в токсине) с широким спектром цитотоксичности, который, вероятно, способствует колонизации слизистой оболочки и сохранению организма в кровотоке и глубоких тканях тела.За исключением пациентов с поражением эндокарда, у детей с заболеваниями K. kingae часто наблюдаются лишь легкие симптомы и признаки, требующие клинической проницательности. Выделение K. kingae на обычных твердых средах является неоптимальным, а обнаружение бактерий значительно улучшается за счет инокуляции экссудатов во флаконы для культур крови и использования анализов на основе ПЦР. Организм обычно чувствителен к антибиотикам, которые назначают маленьким пациентам с инфекциями суставов и костей. Продукция β-лактамазы является клональной, и местная распространенность штаммов, продуцирующих β-лактамазу, варьируется.При адекватном и своевременном лечении инвазивные инфекции K. kingae без поражения эндокарда обычно имеют доброкачественное течение.
Авторские права © 2015, Американское общество микробиологии. Все права защищены.
Цифры
РИС. 1
Хронология основных исследований…
РИС. 1
Хронология важнейших исследований К.kingae.
РИСУНОК 1
Хронология важнейших исследований K. kingae.
РИС.2
(A) Типичное окрашивание по Граму…
РИС.2
(A) Типичное окрашивание по Граму K.kingae, изображающие короткие грамотрицательные коккобациллы с…
Рис 2
(A) Типичное окрашивание по Граму организмов K. kingae, показывающее короткие грамотрицательные коккобациллы с заостренными концами, расположенными парами или короткими цепочками. (B) Окраска по Граму варианта небольшой колонии K. kingae, показывающая нетипичные длинные цепи.
РИС. 3
Снимок К.…
РИС. 3
Изображение организмов K. kingae, полученное с помощью электронного микроскопа, показывающее последовательное формирование наружной мембраны…
РИС 3
Изображение организмов K. kingae, полученное с помощью электронного микроскопа, показывающее последовательное образование пузырьков наружной мембраны.
РИС. 4
Распространенность глоточной К.kingae…
РИС. 4
Распространенность колонизации глотки K. kingae среди детей в возрасте от 0 до 36 месяцев.
РИС. 4
Распространенность колонизации глотки K. kingae среди детей в возрасте от 0 до 36 месяцев.
РИС. 5
Возрастное распределение 143 пациентов…
РИС. 5
Возрастное распределение 143 пациентов с культурой K.kingae выявлены на юге…
РИС. 5
Возрастное распределение 143 пациентов с подтвержденной культурой инфекции K. kingae, выявленной на юге Израиля в период с 1988 по 2013 год.
РИС.6
Пространственное распространение K. kingae…
РИС.6
Пространственное распространение K.клоны kingae, занесенные в бедуинские районы, как определено…
РИС. 6
Пространственное распределение клонов K. kingae, переносимых в бедуинском районе, по данным PFGE с рестрикционным ферментом EagI. Каждая звезда представляет собой положительную культуру глотки, а разные цвета представляют разные клоны. Красные овалы изображают географические группы идентичных штаммов.
РИС. 7
Клинический синдром через 143…
РИС. 7
Клинический синдром у 143 последовательных пациентов с К.kingae диагностированы на юге…
РИС. 7
Клинический синдром у 143 последовательных пациентов с инфекциями K. kingae, диагностированными на юге Израиля в период с 1988 по 2013 гг. ИДП, инфекция нижних дыхательных путей; СА — септический артрит; ОМ, остеомиелит; AB — неудачный; ТС, тендовагинит.
Все фигурки (8)
Похожие статьи
Kingella kingae: новая причина инвазивных инфекций у детей раннего возраста.
Ягупский П., Даган Р.
Ягупский П. и др.
Clin Infect Dis. 1997 Май; 24 (5): 860-6. DOI: 10.1093 / Clinids / 24.5.860.
Clin Infect Dis. 1997 г.PMID: 9142783
Рассмотрение.
Производство бета-лактамазы Kingella kingae в Израиле является клональным и обычным для организмов-носителей, но редко среди инвазивных штаммов.
Ягупский П, Слоним А, Амит У, Порат Н, Даган Р.Ягупский П. и др.
Eur J Clin Microbiol Infect Dis. 2013 август; 32 (8): 1049-53. DOI: 10.1007 / s10096-013-1849-1. Epub 2013 12 марта.
Eur J Clin Microbiol Infect Dis. 2013.PMID: 23479041
Инвазивные детские инфекции Kingella kingae: общенациональное совместное исследование.
Дубнов-Раз Г., Эфрос М., Гарти Б.З., Шлезингер Ю., Мааян-Мецгер А., Хассон Дж., Кассис И., Шварц-Харари О., Ягупский П.Дубнов-Раз Г, и др.
Pediatr Infect Dis J. 2010 июл; 29 (7): 639-43. DOI: 10.1097 / INF.0b013e3181d57a6c.
Педиатр Infect Dis J. 2010.PMID: 20182400
Вспышка остеомиелита / септического артрита, вызванного Kingella kingae, среди посетителей детских учреждений.
Kiang KM, Ogunmodede F, Juni BA, Boxrud DJ, Glennen A, Bartkus JM, Cebelinski EA, Harriman K, Koop S, Faville R, Danila R, Lynfield R.Кианг К.М. и др.
Педиатрия. 2005 август; 116 (2): e206-13. DOI: 10.1542 / peds.2004-2051. Epub 2005 15 июля.
Педиатрия. 2005 г.PMID: 16024681
Обнаружение респираторной колонизации Kingella kingae и новых видов Kingella negevensis у детей: использование и методология.
Ягупский П.
Ягупский П.
J Clin Microbiol. 2018 25 сентября; 56 (10): e00633-18.DOI: 10.1128 / JCM.00633-18. Печать 2018 окт.
J Clin Microbiol. 2018.PMID: 30045866
Бесплатная статья PMC.Рассмотрение.
Процитировано
39
статей
Острый артрит у детей: как отличить септический артрит от несептического?
Гамалеро Л., Феррара Дж., Джани Т., Симас Р.Gamalero L, et al.
Дети (Базель). 2021 13 октября; 8 (10): 912. DOI: 10.3390 / children8100912.
Дети (Базель). 2021 г.PMID: 34682177
Бесплатная статья PMC.Рассмотрение.
Характеристика микробиома кишечника крупного рогатого скота на фермах с высокой и низкой распространенностью шига-токсина, продуцирующего Escherichia coli .
Васко К., Нохомович Б., Сингх П., Венегас-Варгас К., Моски Р.Э., Руст С., Бартлетт П., Норби Б., Грумс Д., Чжан Л., Мэннинг С.Д.Васко К. и др.
Микроорганизмы. 2021, 14 августа; 9 (8): 1737. DOI: 10.3390 / microorganisms37.
Микроорганизмы. 2021 г.PMID: 34442815
Бесплатная статья PMC.Диагностика и лечение детских инфекций позвоночника.
Салех Е.С., Василев С.К., Омари А.М., Халил Дж.Г.
Салех ES, et al.
Cureus. 2021 30 июля; 13 (7): e16748. DOI: 10.7759 / cureus.16748. eCollection 2021 июл.Cureus. 2021 г.PMID: 34345570
Бесплатная статья PMC.Рассмотрение.
Фульминантный инфекционный эндокардит из-за Kingella Kingae и несколько осложнений у 6-летней девочки: отчет о болезни.
Joye R, Ceroni D, Beghetti M, Aggoun Y, Sologashvili T.
Джой Р. и др.
Фронт Педиатр. 2021 5 июля; 9: 707760. DOI: 10.3389 / fped.2021.707760. Электронная коллекция 2021 г.Фронт Педиатр. 2021 г.PMID: 342
Бесплатная статья PMC.
Первое сообщение о Kingella kingae, диагностированном при инфекциях костей и суставов у детей в Марокко.
Moutaouakkil K, Oumokhtar B, Abdellaoui H, El Fakir S, Arhoune B, Mahmoud M, Atarraf K, Afifi MA.
Moutaouakkil K, et al.
BMC Infect Dis. 2021 20 июля; 21 (1): 697. DOI: 10.1186 / s12879-021-06361-8.
BMC Infect Dis.2021 г.PMID: 34284735
Бесплатная статья PMC.
Условия MeSH
- Антибактериальные агенты / фармакология
- Бактериемия / эпидемиология
- Бактериемия / микробиология
- Бактериемия / передача
- Геном, бактериальные / лекарственные эффекты
- Kingella kingae / классификация
- Kingella kingae / эффекты лекарств
- Kingella kingae / генетика
- Kingella kingae / физиология *
- Инфекции Neisseriaceae * / диагностика
- Инфекции Neisseriaceae * / эпидемиология
- Инфекции Neisseriaceae * / микробиология
- Инфекции Neisseriaceae * / патология
- Инфекции Neisseriaceae * / передача
[Икс]
цитировать
Копировать
Формат:
AMA
APA
ГНД
NLM
Инфекций Kingella kingae у детей | BMC Infectious Diseases
Предпосылки
На протяжении большей части трех десятилетий после его первого описания в 1960 году Kingella kingae считалась редкой причиной заболеваний человека, которая редко выделялась у пациентов с инфекциями скелета и эндокардитом [1].Однако с начала 1990-х годов усовершенствования методов культивирования и молекулярных методов обнаружения, а также все более широкое знакомство лабораторий клинической микробиологии с его идентификацией показали, что это значительно более важно, чем считалось ранее, особенно у младенцев и детей младшего возраста [1] . В настоящее время он признан частой причиной бактериемии и костно-суставных инфекций у детей в возрасте до четырех лет [2, 3] и связан с некоторыми случаями быстро прогрессирующего осложненного эндокардита [4] и, хотя и редко, с пневмонией. , менингит, глазные инфекции, перикардит и перитонит [5–9].Также имеются сообщения о вспышках инфекции K. kingae в детских учреждениях [1].
Однако, несмотря на это, педиатрическое сообщество в значительной степени не знает о существовании этого микроорганизма. Таким образом, цель этого обзора — обобщить современные знания об эпидемиологии, передаче, клинической картине, диагностике и лечении инфекции K. kingae у детей. PubMed использовался для поиска всех исследований, опубликованных за последние 15 лет, по ключевым словам: « Kingella kingae » и «дети» или «педиатрические».Было найдено более 200 статей, но в оценку были включены только те, которые были опубликованы на английском языке или содержали научно обоснованные данные.
Обсуждение
Возбудитель и его идентификация
K. kingae — факультативный анаэробный, β-гемолитический, грамотрицательный организм [1], который трудно идентифицировать в обычных твердых культурах крови или биологических жидкостей, таких как синовиальная жидкость или костный экссудат, так как он выделяется менее чем в 10% действительно положительных случаев. Однако сообщалось о значительно большем количестве случаев, когда экссудаты высеваются в флаконы для аэробных культур крови, особенно когда положительные образцы субкультивируются на чашке с кровяным агаром с триптиказо-соевым агаром с 5% гемоглобина овечьей крови или шоколадным агаром.Эта потребность в особых методах культивирования объясняет, почему этиология ряда инвазивных заболеваний, вызванных K. kingae (особенно септического артрита и остеомиелита у детей раннего возраста), изначально не была идентифицирована, что привело к определению «инфекций костей с отрицательным посевом. неизвестного происхождения »[1].
Еще труднее идентифицировать K. kingae в культивируемых образцах глотки из-за его относительно медленного роста и высокой плотности резидентной бактериальной флоры, хотя это можно преодолеть, используя селективную среду, состоящую из кровяного агара с добавлением ванкомицин для подавления роста конкурирующей флоры [1].
Лучшими средствами обнаружения K. kingae являются недавно разработанные анализы амплификации нуклеиновых кислот, поскольку они не только значительно более чувствительны, чем культура, но и сокращают время, необходимое для идентификации бактерий с 3-4 дней до нескольких часов. Они также позволяют использовать глоточные выделения для диагностики инвазивных инфекций K. kingae , как описано Ceroni et al. , который использовал полимеразную цепную реакцию (ПЦР) для определения этиологии K.kingae костно-суставная инфекция из мазков из глотки [10]. Они обнаружили, что метод был на 100% чувствителен и на 90,5% специфичен, поэтому отрицательного мазка было достаточно, чтобы исключить инфекцию K. kingae и побудить к более инвазивным диагностическим мерам. Однако обнаружение K. kingae в ротоглотке у ребенка с костно-суставной инфекцией не является неопровержимым доказательством этиологии заболевания, поскольку частота носительства микроорганизма среди педиатрических пациентов составляет около 10–12% [1].
Кроме того, молекулярное типирование изолятов выявило геномную гетерогенность у видов K. kingae и позволило изучить возможную связь между генетическими характеристиками различных штаммов и их склонностью вызывать инвазивные заболевания, а также взаимосвязь между устойчивостью к антибиотикам и распределением генотипов. Одним из наиболее широко используемых молекулярных методов является амплификация и секвенирование полиморфизмов гена rtx A, который участвует в производстве белка, принадлежащего к семейству токсинов RTX, который был связан с вирулентностью K.kingae , поскольку нарушение локуса RTX приводит к потере цитотоксичности для дыхательных эпителиальных, синовиальных и макрофагальных клеточных линий [11]. Кроме того, когда Chang et al. [12] инфицировали крыс штаммом K. kingae PYKK081 и его изогенным rtx A-дефицитным штаммом KKNB100, они обнаружили, что PYKK081 вызывает смертельное заболевание, характеризующееся быстрой потерей веса, бактериемией, образованием некротических поражений брюшной полости и значительная гистопатология вилочковой железы, селезенки и костного мозга, тогда как KKNB100 был менее токсичным и не вызывал потери веса, бактериемии или гистопатологических изменений.Кроме того, у животных, которым вводили KKNB100, наблюдалось значительно высокое количество циркулирующих лейкоцитов (WBC), тогда как количество крыс, которым вводили PYKK081, было таким же, как и у неинфицированных контрольных животных [12].
Использование электрофореза в импульсном поле (PFGE) позволило установить, что ряд клонов K. kingae , которые относительно часто являются изолированными бессимптомными носителями (A, C, G, J, M, R, T и U) играют незначительную роль в определении инвазивных инфекций, тогда как клоны B, H, K, N и P значительно чаще связаны с развитием болезни [13].Это говорит о том, что более инвазивные штаммы могут быстрее выводиться из дыхательных путей и что их устойчивость может потребовать другой биологической специализации. Было также обнаружено, что каждый из вирулентных клонов может быть ответственным за четко определенное заболевание, поскольку клон K был значительно связан с бактериемией, клон N — с инфекциями скелетной системы, а клон P — с бактериальным эндокардитом [13].
Первоначально было показано, что изоляты K. kingae почти всегда были чувствительны к большинству антибиотиков, которые обычно назначают детям с подозрением на бактериемию или инфекции скелетной системы, включая пенициллин, ампициллин, цефалоспорины второго и третьего поколений, макролиды. , рифампицин, ко-тримоксазол, ципрофлоксацин, тетрациклин и хлорамфеникол, тогда как оксациллин, клиндамицин и даптомицин были не очень эффективны, а триметоприм и гликопептидные антибиотики не проявляли никакой активности [14].Однако в последнее время неоднократно сообщалось о резистентности K. kingae к β-лактамным антибиотикам, хотя показатели широко варьируются от страны к стране: Basmaci et al. проверил 778 изолятов из Исландии, США, Франции, Израиля, Испании и Канады на продукцию β-лактамаз и обнаружил, что французские, испанские и канадские изоляты были отрицательными, тогда как 28,6% исландских, 25,0% американских и 11% израильских изолятов оказались положительными [15]. Распределение устойчивости к β-лактамным антибиотикам среди инвазивных и переносимых организмов еще точно не определено, но Yagupsky et al. обнаружил продукцию ферментов у 1,1% инвазивных организмов и 15,4% переносимых организмов, обнаруженных в образце из 619 изолятов K. kingae из Израиля [16]. Этот вывод, по-видимому, был подтвержден исследованиями генотипической клональности штаммов PFGE, поскольку продукция β-лактамаз была ограничена только четырьмя из 73 идентифицированных клонов (33 в инвазивных и 56 в изолятах носительства), и эти четыре были общими среди несет штаммы, но редко среди инвазивных штаммов [16].Однако Basmaci et al. обнаружил, что все их американские и исландские положительные по β-лактамазе изоляты принадлежали к основному международному инвазивному клону PFGE K / MLST ST-6 и отличались от четырех генетически неродственных израильских клонов, продуцирующих β-лактамазу [15]. Присутствие фермента в изолятах, принадлежащих к крупнейшему во всем мире инвазивному клону K. kingae , подчеркивает возможное распространение устойчивости к β-лактамам и подчеркивает важность рутинного тестирования всех K.kingae клинических изолятов для продукции β-лактамаз.
Носительство и передача
Бессимптомная колонизация верхних дыхательных путей K. kingae чрезвычайно часто встречается у детей, которые приобретают инфекционный агент через шесть месяцев жизни [1]; впоследствии частота колонизации имеет тенденцию снижаться до 10-12% до конца второго года, а затем постепенно снижается до очень низкого уровня у детей старшего возраста и взрослых (Таблица 1). Это говорит о том, что исчезновение вертикально передаваемого иммунитета и большая социализация детей в возрасте старше шести месяцев увеличивают риск колонизации, в то время как прогрессирующее иммунологическое созревание и / или кумулятивное знакомство с K.kingae в результате колонизации слизистой оболочки приводит к приобретению достаточного иммунитета, чтобы уничтожить организм из глотки у пожилых людей. Это, по-видимому, подтверждается результатами исследования, разработанного для оценки динамики уровней антител K. kingae в детском возрасте, которое показало, что средний уровень IgG высокий в возрасте двух месяцев, постепенно снижается до 6–6 лет. 7 месяцев (время наименьших концентраций), остается низким до 18 месяцев, а затем увеличивается [17].
Таблица 1 Kingella kingae носительство
Носительство может быть непрерывным в течение недель или месяцев или прерывистым, как показывают результаты 11-месячного продольного исследования детей в возрасте 19–48 месяцев, посещающих детские сады в Израиле [ 18]: около 73% переносили организм хотя бы один раз, а половина — не менее двух месяцев в течение периода наблюдения. Более того, колонизация была наибольшей в конце зимы и весной и обычно затрагивала ротоглотку, поскольку K.kingae практически никогда не находили в носоглотке [18].
Колонизированные дети являются основной причиной распространения возбудителя. Об этом свидетельствует тот факт, что уровень колонизации у детей, посещающих детские сады, значительно выше, чем в общей популяции того же возраста, и был подтвержден сравнительным генетическим анализом культивированного растения K. kingae , изолированного от колонизированных детей и их братьев и сестер. и товарищи по играм, которые четко выявили неотличимые профили генотипов штаммов, идентифицированных в обеих группах [19].Более того, хотя у подавляющего большинства детей она протекает бессимптомно, колонизация является предпосылкой для развития заболевания, и генотипически идентичные изоляты были извлечены из глотки и кровотока пациентов с инвазивной инфекцией K. kingae [20]. На основании этих данных неудивительно, что ряд вспышек болезни K. kingae был связан с центрами дневного ухода [3, 21, 22]: во всех этих случаях необычно высокий уровень K.kingae была обнаружена среди бессимптомных посетителей, и все глоточные изоляты, обнаруженные в классах, были генетически идентичны тем, которые были выявлены у пациентов [9].
Клинические проявления
Патогенез инвазивной инфекции K. kingae еще не определен, но некоторые данные, по-видимому, указывают на то, что ее проникновению способствует сопутствующая вирусная инфекция, способная повредить слизистую оболочку ротоглотки. Стоматит и симптомы респираторной инфекции часто встречаются у пациентов с К.болезнь Ингаека [23]. Патоген был выделен из крови четырех из 29 пациентов с первичным герпетическим гингивостоматитом [24], и было высказано предположение, что после проникновения он может прогрессировать в нижние дыхательные пути или проникать в кровоток и впоследствии достигать скелетной системы. сердце или другие части тела [18].
Инвазивное инфекционное заболевание K. kingae обычно развивается у более молодых и в остальном здоровых детей, и его возрастное распределение сходно с таковым у носителей.Почти 90% зарегистрированных случаев произошли у детей в возрасте до 5 лет и 60% — у детей в возрасте до 2 лет [18]. Как и в случае инвазивных инфекций Streptococcus pneumoniae и Neisseria meningitidis [25, 26], инвазивные инфекции K. kingae чаще встречаются у мужчин [2].
В большинстве случаев бактериемия K. kingae выявляется одновременно с инфекциями скелетной, сердечно-сосудистой, дыхательной или центральной нервной систем; однако скрытая бактериемия была диагностирована в ряде случаев, некоторые из которых характеризовались макулопапулезной сыпью, напоминающей те, которые наблюдаются у пациентов с диссеминированным менингококком [27].Тот факт, что K. kingae идентифицируется в крови очень небольшого числа пациентов с установленной инвазивной инфекцией даже при использовании чувствительных и специфических молекулярных методов, предполагает, что продолжительность бактериемии обычно непродолжительна [27].
Наиболее частым клиническим проявлением инвазивной инфекции K. kingae являются костно-суставные инфекции [1], а K. kingae является наиболее частой причиной таких инфекций у детей в возрасте от шести месяцев до четырех лет [28]: 1 недавнее молекулярное исследование Ceroni et al. обнаружил, что 82% аспиратов суставов или костей детей в возрасте до 4 лет с костно-суставной инфекцией были положительными [29]. В отличие от инфекций суставов или костей, вызванных другими бактериальными патогенами (в основном, Staphylococcus aureus ), которые обычно имеют тяжелую клиническую картину, костно-суставные инфекции K. kingae обычно характеризуются клиническими и радиологическими проявлениями от легких до умеренных, а также ограниченными биологическими проявлениями. воспалительный ответ [1, 2, 28, 29]. Ceroni et al. заметил, что менее 15% их детей страдали лихорадкой, 39% имели нормальный уровень С-реактивного белка (СРБ) и только 9% имели высокое количество лейкоцитов [29]; Дубноз-Раз и др. обнаружил лихорадку у 25% своих пациентов, количество лейкоцитов> 15 000 / мм 3 только у 50% и уровни CRP в пределах нормы у 22% [2]. Эти результаты привели к разработке алгоритма надежного прогнозирования этиологии костно-суставного заболевания K. kingae у детей младшего возраста, который включает температуру тела <38 ° C, уровни CRP <55 мг / л, лейкоциты. количество <14000 / мм 3 и полос <150 / мм 3 [30].Тем не менее, возможность прогнозирования костно-суставных инфекций K. kingae на основе легких клинических симптомов и реактантов острой фазы является спорной и до сих пор остается спорной.
Септический артрит в основном диагностируется в крупных суставах, несущих нагрузку, с количеством лейкоцитов в синовиальной жидкости <50 000 / мм 3 примерно у 25% пациентов, что подчеркивает их слабую воспалительную реакцию [18]. Однако ограниченные клинические данные о септическом артрите, вызванном K. kingae , могут препятствовать своевременной диагностике в некоторых случаях, что приводит к повышенному риску увеличения заболеваемости из-за несвоевременного лечения. K. kingae септический артрит тазобедренного сустава является хорошим примером, поскольку его невозможно отличить от преходящего синовита по чисто клиническим причинам. Пытаясь улучшить идентификацию септического артрита бедра, Kocher et al. разработал специальный алгоритм, основанный на клинических переменных (температура тела при поступлении и отказ нести вес) и лабораторных данных (количество лейкоцитов и скорость оседания эритроцитов [СОЭ]), который позволяет вероятное исключение септического артрита при подсчете лейкоцитов и СОЭ. находятся в пределах нормы, нет лихорадки или нет, и нет явных проблем с опорой на вес [31].Однако, хотя алгоритм может быть применим в случае септического артрита, вызванного другими бактериями [32], он не может использоваться в случае болезни K. kingae , при которой все или некоторые из переменных перекрывают те, которые обнаруживаются при преходящем синовите. и различия между лабораториями могут повлиять на результаты [33]. Остеомиелит в основном поражает длинные кости, но также часто поражает кости, которые обычно не инфицированы другими организмами, такие как пяточная кость, таранная кость, грудина и ключица [34–36].
Спондилодисцит — еще одно довольно частое клиническое проявление инфекции K. kingae [1]. Подобно остеомиелиту и септическому артриту, спондилодисцит, вызванный K. kingae , в основном диагностируется у детей в возрасте от шести месяцев до четырех лет [37]. Поясничные межпозвонковые промежутки чаще всего поражаются легкими или умеренными признаками и симптомами.
Эндокардит является наиболее тяжелым проявлением инфекции, вызванной K. kingae . Обычно это происходит у детей, которые немного старше тех, кто страдает костно-суставными инфекциями, и, в отличие от остеомиелита и септического артрита, сопровождается высокой температурой и значительным повышением уровней реагентов острой фазы [4].По состоянию на июль 2014 г. в литературе было описано в общей сложности 42 пациента с эндокардитом K. kingae [4], по крайней мере 20% из которых были в возрасте> 4 лет. На момент презентации у большинства пациентов температура тела была> 39 ° C, а средние уровни СОЭ и СРБ составляли соответственно 60,4 мм / ч и 12,5 мг / дл. Пороки клапанов сердца были относительно частыми, особенно у детей старшего возраста, хотя лишь у меньшинства ранее диагностировались врожденные пороки сердца. Однако наиболее серьезная проблема связана с К.Kingae эндокардит — это возникновение эмболических осложнений, которые могут привести к тяжелым неврологическим последствиям, которые произошли в 13 из 42 описанных случаев: наиболее частыми являются инсульт (77%) и менингит (46%), приведшие к летальному исходу. четырех пациентов (10%) [4]. К другим осложнениям эндокардита, вызванного K. kingae , относятся клапанная недостаточность, кардиогенный шок, инфаркт легкого и параклапанные абсцессы [4].
Другие инфекции, поражающие нижние дыхательные пути, центральную нервную систему и глаза, встречаются редко [5–8].В частности, менингит, по-видимому, отличается от более распространенной инфекции, вызванной K. kingae , потому что вместо того, чтобы диагностировать у детей младшего возраста, он в основном возникает у подростков [5, 38].
В таблице 2 приведены основные клинические проявления.
Таблица 2 Основные клинические проявления инфекции Kingella kingae
Прогноз и лечение
Большинство инфекций, вызываемых инфекцией, вызванной K. kingae , чувствительны к большинству пероральных и парентеральных антибиотиков, обычно назначаемых маленьким детям с лихорадкой, и, хотя некоторые инвазивные β -продуцирующие -лактамазы штаммы устойчивы к β-лактамным антибиотикам и требуют соответствующего мониторинга, они, по-видимому, не определяют окончательный прогноз K.kingae инвазивные болезни. Следовательно, хотя сравнительное контролируемое исследование не было опубликовано и невозможно установить наилучший подход к лечению антибиотиками, большинство инвазивных заболеваний, вызванных K. kingae , имеют доброкачественное клиническое течение при адекватной диагностике. Однако задержки с диагностикой и госпитализация очень распространены. Скелетные инфекции обычно выздоравливают без последствий при условии, что они немедленно и надлежащим образом вылечены, включая спондилодисцит, хотя стойкое сужение межпозвонкового пространства может сохраняться [39].Единственным исключением является эндокардит, в основном из-за его эмболических осложнений, наиболее частым из которых является инфаркт головного мозга [4]. Поэтому при подозрении или подтверждении диагноза эндокардита K. kingae органы здравоохранения рекомендуют незамедлительно использовать соответствующие лабораторные методы, чтобы как можно быстрее получить информацию о чувствительности к противомикробным препаратам [40]. Согласно клинической картине может быть рекомендована терапия первой линии, обычно используемая при остеомиелите, септическом артрите или эндокардите, а затем, если К.kingae этиология будет подтверждена, антимикробная терапия может быть оптимизирована в соответствии с результатами теста на чувствительность к противомикробным препаратам, если таковые имеются, или с использованием цефалоспоринов второго или третьего поколения.
По-прежнему нерешенной проблемой является борьба со вспышками инфекции, вызванной K. kingae , но было высказано предположение, что можно применять профилактические антибактериальные препараты для предотвращения дальнейших случаев заболевания. Было обнаружено, что рифампицин, который особенно активен против K.kingae , секретируется в слюне и достигает высоких концентраций в слизистой оболочке верхних дыхательных путей и оказался эффективным в уничтожении других инвазивных колонизаторов глотки, таких как Haemophilus influenzae типа b и Neisseria meningitidis , предполагалось, что это должно быть назначают в дозе 10 мг / кг два раза в день в течение двух дней, отдельно или в комбинации с амоксициллином 80 мг / кг / день в течение двух или четырех дней [1, 21]. Тем не менее, систематическое использование профилактики рифампицином остается предметом дискуссий, поскольку результаты не всегда были удовлетворительными в виде эрадикации K.kingae был достигнут только у некоторых из лечившихся детей, или новая колонизация тем же штаммом наблюдалась через несколько недель [22]. Это было не из-за резистентности бактерий, а, по крайней мере, частично из-за плохого соблюдения. Кроме того, использование антибиотикопрофилактики подтверждается тем фактом, что больше случаев инвазивной болезни K. kingae не было диагностировано в пораженных детских садах, даже когда несколько детей продолжают колонизировать инвазивную болезнь K.kingae [22]. Тем не менее, выявить вспышку инфекции K. kingae все еще сложно, в основном из-за низкого уровня тестирования K. kingae . Было высказано предположение, что алгоритм для исследования и лечения кластеров инвазивных инфекций K. kingae в детских садах был бы полезен [9], но многие спорные области вмешательства и включение генетического анализа в руководство делают его использование особенно сложно в географических регионах, где нет подходящего лабораторного оборудования.
Kingella Kingae Артикул
Непрерывное образование
На этом мероприятии рассматриваются микробиология, эпидемиология, патофизиология и клинические проявления инфекции Kingella kingae. В нем также освещаются последние достижения в диагностике и лечении пациентов с этим заболеванием.
Цели:
- Опишите микробиологию и эпидемиологию Kingella kingae.
- Изучите патофизиологию Kingella kingae и факторы ее вирулентности.
- Опишите различные способы клинической картины инфекций Kingella и текущие рекомендации по их ведению.
- Объяснить стратегии межпрофессиональной группы для улучшения координации помощи и коммуникации для управления осложнениями инфекций Kingella и улучшения результатов.
Введение
До недавнего развития диагностических методов считалось, что Kingella kingae — редкая бактерия. [1] Kingella kingae в настоящее время считается серьезной причиной детской бактериемии и инфекций костей у детей в возрасте от 6 до 48 месяцев. [2] [3] Это одна из причин вспышек заболеваний в дневных стационарах в США и других странах [4]. Хотя Kingella kingae является естественной флорой слизистой оболочки ротоглотки детей в возрасте от 6 до 48 месяцев, она может попасть в кровоток через поврежденную слизистую и вызвать системные инфекции.[5] За исключением случаев эндокардита и костно-суставных инфекций, инфекции K. kingae обычно проявляются легкими симптомами. [2]
Этиология
K. kingae — привередливая грамотрицательная факультативная анаэробная коккобацилла семейства Neisseriaceae . Это бета-гемолитическая бактерия, производящая слабое кольцо гемолиза. Это неподвижный и не продуцирующий споры организм. Хотя все штаммы обладают высокой оксидазной активностью, они не реагируют с каталазой, индолом и уреазой.[5] K. kingae растет на кровяном агаре, шоколадном агаре и средах на основе ГХ, но не на агаре МакКонки или Криглера. Модели роста K. kingae могут быть как раскидистыми, так и нераспространяющимися, как с бахромой, так и куполообразной без какой-либо бахромы. [2]
Эпидемиология
В США, Западной Европе и Израиле растет число случаев инвазивного заражения K. kingae , хотя глобальное влияние этого заболевания еще не полностью изучено [6] [7] [6] Kingella kingae — это чаще всего это бактериальная инфекция детей, особенно детей младше четырех лет.Уровень колонизации K. kingae у детей в возрасте от 1 до 4 лет колеблется от 10 до 28% по сравнению со скоростью колонизации менее 1% для возрастной группы от 0 до 6 месяцев и у взрослых. Считается, что это чаще встречается у мужчин, чем у женщин. Социальные факторы, такие как посещение детских садов, связаны с высоким риском инвазивной инфекции Kingella kingae .
Патофизиология
K. kingae экспрессирует различные структуры для успешной колонизации, носительства, передачи, вирулентности и патогенеза. K. kingae приобретается в результате прямого контакта от человека к человеку. Хотя механизм коммуникации не очень хорошо известен, существует высокая вероятность его распространения через капли. K. kingae продуцирует пили типа IV (T4P) под регуляцией генов rho 54, pilS и pilR [8]. Пили представляют собой липкие белковые придатки к слизистой оболочке дыхательных путей и синовиальной оболочке. Инвазия слизистой оболочки дыхательных путей бактериями почти всегда связана с предшествующей или совпадающей вирусной инфекцией [8].Обычно замешанными вирусами являются риновирус человека, вирус простого герпеса и вирус герпангины, вызывающий заболевание рук, ног и рта. [8] Инвазивная инфекция K. kingae развивается через ранее вызванное вирусом повреждение слизистой оболочки в дополнение к токсину RTA, продуцируемому организмом. Токсин RTA также оказывает цитотоксическое действие на лейкоциты, макрофаги и синовиальные клетки. Капсулы из полисахаридов на внешней мембране обеспечивают защиту от фагоцитоза бактериальных клеток.Тенденция K. kingae к образованию биопленок помогает патогену уклоняться от иммунитета и защиты хозяина. Кроме того, экзополисахариды K. kingae оказывают ингибирующее действие на производство биопленок другими микроорганизмами, а также облегчают периодическое высвобождение клеток бактерий из биопленок, тем самым способствуя более легкому распространению [2].
Исторические и физические данные
Большинство инфекций происходит у здоровых детей в возрасте до четырех лет или у детей старшего возраста и взрослых с ослабленным иммунитетом.[3] Симптомы K. kingae обычно легкие с легкой лихорадкой или без нее, за исключением случаев быстро прогрессирующего эндокардита, когда высокая температура, боли в спине и ночная потливость являются обычными явлениями. Предшествующие или текущие симптомы со стороны верхних дыхательных путей или диарея типичны и могут быть ключом к первоначальному подозрению.
Инфекции скелетной системы
K. kingae является наиболее частой этиологией инфекции скелетной системы у детей в возрасте до четырех лет [9]. Симптомы могут быть незаметными в начале, и пациент обычно присутствует в течение второй недели инфекции. из-за менее выраженной воспалительной реакции, вызываемой бактериями, в отличие от других типичных организмов, вызывающих костно-суставные инфекции.
Септический артрит
Это состояние является наиболее частой формой костно-суставного заболевания K. kingae . Инфекция, как правило, больше всего поражает нижнюю конечность, часто поражается колено. Может быть поражено более одного сустава. Пациенты могут иметь общие симптомы септического артрита, такие как локализованная боль, отек, тепло, эритема, неподвижность или излияние в суставы. Лихорадка может быть менее выраженной.
Остеомиелит
Чаще всего протекает в подострой форме и чаще всего поражает длинные кости нижних конечностей.Кости, такие как ключица, грудина и пяточная кость, могут быть вовлечены, что подчеркивает связь K. kingae с атипичными локализацией [10].
Спондилодисцит
Спондилодисцит — это инфекция межпозвонкового пространства и прилегающих позвонков, приводящая к затруднениям при ходьбе или сидении. У детей также наблюдаются боли или скованность в спине и ненормальная походка. Чаще всего поражается отдельный межречевой диск, чаще всего поясничный. Спондилодисцит К.kingae может также коррелировать с образованием межпозвонковых и спинномозговых субдуральных абсцессов.
Бактериемия
K. kingae может быть выделен из крови без какой-либо очаговой инфекции (скрытая бактериемия) или одновременно с другими инвазивными инфекциями. Скрытая бактериемия — вторая наиболее частая форма проявления у педиатрических пациентов [2]. Другие могут предъявлять жалобы на скелетную систему без каких-либо признаков инфекций костей или суставов. Многие дети могут иметь сопутствующие симптомы острых инфекций, таких как инфекции верхних дыхательных путей или желудочно-кишечного тракта.У некоторых пациентов со скрытой бактериемией может наблюдаться диссеминированная макулопапулезная сыпь, подобная таковой при менингококковой или гонококковой инфекциях. [2] Лихорадка обычно легкая.
Инфекции мягких тканей
Kingella kingae может проявляться широким спектром инфекций мягких тканей, таких как целлюлит, бурсит, теносиновит и дактилит, а также абсцессами в различных местах.
Эндокардит
Kingella kingae является важной причиной эндокардита у детей.Это один из организмов HACEK ( видов Haemophilus , видов Aggregatibacter, видов, Cardiobacterium hominis , Elkenella corrodens и видов Kingella ). Эндокардит, вызванный Kingella, обычно поражает взрослых и детей старшего возраста, в отличие от инфекций костной системы, которые возникают преимущественно у детей младшего возраста. Факторами риска эндокардита HACEK являются предшествующее здоровье зубов или процедуры. Другими предрасполагающими факторами являются сердечные аномалии и ревматическая лихорадка.Родной клапан поражается более чем в 90% случаев у маленьких детей, тогда как родной клапан и протезный клапан имеют одинаковую частоту у детей старшего возраста и взрослых [2]. Митральный клапан поражается более чем в 90% случаев. Пациенты могут иметь сердечные симптомы, такие как кардиогенный шок, застойная сердечная недостаточность или осложнение эмболии головного мозга, костей и легких.
Менингит
Менингит может быть результатом гематогенного распространения микроорганизма в мозг или септической эмболии сердца.
Другие клинические проявления
Другие симптомы инвазивной Kingella включают глазные инфекции, такие как кератит, эндофтальмит, инфекции мочевыводящих путей и перикардит.
Оценка
Для обнаружения микроорганизмов можно использовать как микробиологические культуры, так и анализы амплификации нуклеиновых кислот. Флаконы для культивирования крови (BCV) и другие твердые среды, такие как кровяной агар, допускают рост организма, хотя и с противоречивыми результатами.Бактерии можно культивировать из образцов костной системы, крови и респираторных культур. Анализы амплификации нуклеиновых кислот сейчас используются в развитых странах. Он быстрее и имеет более высокую чувствительность, чем посев крови.
Дополнительные обследования должны включать общий анализ крови, уровни С-реактивного белка (СРБ) и, при необходимости, радиологические исследования.
Трансторакальная эхокардиограмма рекомендуется всем детям с инвазивным заболеванием из-за опасений по поводу эндокардита.[11]
Лечение / менеджмент
В качестве стандартного протокола для лечения серьезных бактериальных инфекций необходимо проведение начальной эмпирической терапии до получения результатов посева; он должен состоять из внутривенного широкого введения цефалоспоринов второго / третьего поколения или стабильного к пенициллиназе бета-лактамного антибиотика. После выделения K. kingae режим следует изменить на парентеральный ампициллин, если нет штаммов, продуцирующих бета-лактамазу, или ампициллин / сульбактам, если присутствуют штаммы, продуцирующие бета-лактамазы.Другие цефалоспорины, такие как цефуроксим и цефтриаксон, также являются вариантами.
Септический артрит: Текущая рекомендация — 2–3 недели последовательного внутривенного и перорального приема антибиотиков.
Остеомиелит: Традиционное лечение составляет от 3 недель до 6 месяцев.
Спондилодисцит: Обычная антибиотикотерапия длится от 3 до 12 недель
В настоящее время текущие рекомендации по лечению костно-суставных инфекций включают более короткую продолжительность антибактериальной терапии, ранний переход на пероральные препараты и использование уровней СРБ в сыворотке для мониторинга клинического ответа.Как правило, хороший клинический ответ и снижение уровня СРБ в сыворотке до менее 20 мг / л являются показаниями для перехода на пероральные антибиотики и могут также помочь в принятии решения о прекращении лечения. Большинство инфекций поддаются лечению антибиотиками без необходимости повторных аспираций или хирургического смывания.
Дифференциальная диагностика
- Haemophilus influenza типа b
- Neisseria meningitidis
- Инфекции HACEK
- Стрептококковая пневмония
- Стафилококковый септический артрит
Прогноз
Наиболее инвазивная инфекция Kingella kingae является доброкачественной, если ее диагностировать и лечить вовремя.Большинство штаммов Kingella kingae , за исключением видов, устойчивых к бета-лактамазам, чувствительны к обычно назначаемым детям антибиотикам. Дети часто полностью выздоравливают после костно-суставных инфекций без каких-либо осложнений. Хотя внутрипозвоночный абсцесс может развиться при спондилодисците Kingella, он хорошо поддается лечению антибиотиками. Осложнения, приводящие к сужению межпозвонковых дисков, встречаются нечасто.
Эндокардит от Kingella kingae может быть опасным для жизни, со смертностью около 20%.Для благоприятного исхода часто необходимо агрессивное лечение.
Осложнения
Как обсуждалось выше, осложнения включают костно-суставные заболевания и эндокардит.
Сдерживание и обучение пациентов
Инфекция Kingella может проявляться незаметными симптомами. Все дети с лихорадкой и подозрительными проявлениями должны пройти надлежащее обследование на предмет возможного K.kingae инфекция. Родители с детьми в возрасте от 6 месяцев до 4 лет с лихорадкой и острыми проблемами суставов, сыпью или сердечно-сосудистым коллапсом должны немедленно явиться на обследование.
Улучшение результатов команды здравоохранения
Лечение осложнений инфекций Kingella требует межпрофессионального командного подхода. Такой подход может включать специалистов по инфекционным заболеваниям, фармацевта, имеющего сертификат специалиста по инфекционным заболеваниям, которые могут помочь в прямом выборе агента на основе самых последних данных антибиотикограммы.Медсестры, прошедшие обучение инфекционному контролю, также могут посоветовать родителям помощь в продвижении терапии и предотвращении повторного заражения.
Существует потребность во взаимозависимости, общении и сотрудничестве между врачами, медсестрами, фармацевтами и другими медицинскими работниками в межпрофессиональной команде, участвующей в управлении инфекцией Kingella, для улучшения ухода, ориентированного на пациента, улучшения результатов, безопасности пациентов и улучшения межпрофессионального командная производительность. [Уровень 5]
Kingella — обзор | Темы ScienceDirect
Микробиология и эпидемиология
Виды Eikenella, Pasteurella, и Chromobacterium обладают как общими, так и противоположными характеристиками лабораторных свойств, эпидемиологии и клинических проявлений.Род Eikenella содержит только один вид, Eikenella corrodens, , который принадлежит семейству Neisseriaceae вместе с родами Neisseria и Kingella. 1–4 Род Pasteurella содержит несколько видов, имеющих клиническое значение, и принадлежит семейству Pasteurellaceae вместе с родами Aggregatibacter, Actinobacillus, и Haemophilus . Род Chromobacterium содержит только один вид, имеющий значение для человека, C.violaceum, и в настоящее время также относится к семейству Neisseriaceae; ряд других Chromobacterium spp. извлечено из природных источников было предложено . Большинство этих организмов являются микроаэрофильными, факультативно анаэробными, несколько привередливыми, грамотрицательными бациллами, которые могут выглядеть плеоморфными или коккобациллярными в прямых мазках или мазках, полученных из культур. Eikenella и Pasteurella spp. неподвижны, а C. violaceum подвижен и менее требователен, чем другие.
Eikenella corrodens — это небольшой прямой стержень, который может выглядеть коккобациллярным . Организм является положительным по оксидазе и орнитиндекарбоксилазе, восстанавливает нитраты до нитритов, но не производит каталазу, уреазу или индол. 1–4 E. corrodens первоначально считалось родственником строго анаэробной бактерии Bacteroides urealyticus (ранее Bacteroides corrodens ) из-за характерной «коррозии» или «точечной коррозии» поверхности крови или шоколада. агар некоторыми изолятами, что свидетельствует о предпочтении анаэробного роста.
Большинство Pasteurella spp. положительны на оксидазу и каталазу, снижают содержание нитратов и используют глюкозу и множество других углеводов. Наиболее важные виды, имеющие значение для человека, включают P. multocida subsp . multocida, P. multocida subsp . septica, P. canis, P. dagmatis, и P. statis. 1,2,5–7 Ряд других Pasteurella spp. редко, если вообще связаны с человеческими заболеваниями. 1,2,5–7 Классификация Pasteurella spp.подвергается пересмотру на основе исследований гибридизации ДНК-ДНК и анализа последовательности рибосомной РНК, и несколько видов, включая P. pneumotropica, P.aerogenes, и P. bettyae, могут быть реклассифицированы как представители рода Actinobacillus или других родов в семействе Pasteurallaceae. 7–9 Организмы, ранее классифицированные как P. gallinarum , теперь — это Avibacterium gallinarum , а некоторые, ранее классифицированные как P. haemolytica , теперь — Mannheimia haemolytica.
Chromobacterium violaceum — длинная грамотрицательная слегка изогнутая палочка. C. violaceum является положительным по каталазе, нитратредуктазе и аргининдигидролазе; растет на овечьей крови, макконки, шоколаде и агаре Мюллера – Хинтона; и производит темно-фиолетовый пигмент (виолончель), который может привести к появлению черных колоний. Пигмент также может образовываться во время инфекции, что приводит к фиалковому целлюлиту.
Eikenella corrodens является частью нормальной флоры полости рта, верхних дыхательных путей и слизистых оболочек желудочно-кишечного тракта и мочеполовых путей человека и некоторых млекопитающих. 10,11 Как с клинической, так и с лабораторной диагностической точки зрения полезно обсудить E. corrodens в контексте организмов так называемой группы «AACEK» (ранее «HACEK»). Этот мнемонический символ обозначает Aggregatibacter aphrophilus (ранее Haemophilus aphrophilus и H. paraphrophilus ), Aggregatibacter (ранее Actinobacillus ), actinomycetemcomitans и другие бактерии Kingro185, Kingro185 и другие королевые бактерии Kingro185, Kingro185 и другие королевые бактерии. Kingella spp.Как группа, это медленнорастущие организмы нормальной флоры верхних дыхательных путей, часто требующие повышенных концентраций углекислого газа и гемина в культуральной среде для оптимального роста. 10 Организмы AACEK клинически важны при определенных синдромах заболеваний, включая диссеминированные заболевания, такие как подострый бактериальный эндокардит и гнойный артрит, а также локализованные гнойные заболевания полости рта, головы и шеи. 11 По сравнению с другими организмами группы AACEK, E.corrodens менее требователен и обычно восстанавливается в течение 24-48 часов на обычных средах с кровью и шоколадным агаром. Из-за улучшений в составе бульонных сред и методов обнаружения, посевы крови пациентов с подозрением на эндокардит из-за E. corrodens или других организмов группы AACEK обычно не нуждаются в инкубации сверх стандартных 5 дней, используемых в большинстве лабораторий. 1–3,12
Имеются ограниченные данные о потенциальных факторах вирулентности, продуцируемых E.corrodens , который может способствовать инвазии или патогенным процессам. Лектин-подобный белок и множество белков пилуса обнаруживаются на поверхности бактериальных клеток и могут способствовать прилипанию к эпителиальным клеткам слизистой оболочки. Некоторые гены, кодирующие белки пилуса, имеют общую нуклеотидную гомологию, а белки пилуса демонстрируют гомологию аминокислотной последовательности с генами и белками пилуса из Moraxella spp. и Neisseria gonorrhoeae. Другие белки клеточной поверхности обладают способностью агглютинировать эритроциты.Как и другие грамотрицательные бактерии, внешняя клеточная мембрана E. corrodens содержит уникальные белки, клеточная стенка содержит липополисахарид, и организм может синтезировать внеклеточный полисахарид или слой слизи. Трудно определить конкретный вклад каждого из этих факторов в вирулентность, но они могут играть роль в ингибировании фагоцитоза или модуляции активности макрофагов. 2
Pasteurella spp. являются комменсалами верхних дыхательных путей многих видов животных.Глоточное носительство P. multocida происходит у большинства собак и кошек, включая крупных кошек (львы, тигры, пантеры), а также у свиней, крыс, опоссумов, кроликов, птиц и, возможно, людей. 13 Pasteurella spp. являются первичными патогенами различных животных, и несколько видов могут вызывать различные инфекции человека, чаще всего связанные с укусами или царапинами животных. В одном исследовании 159 человеческих изолятов Pasteurella spp. восстановлено от укусов собак или кошек, P.multocida subsp . multocida составляла 60% изолятов, P. canis — 18%, P. multocida subsp . septica для 13%, P. стоматис для 5% и P. dogmatis для 3%. 6 Pasteurella также можно получить при вдыхании аэрозолей, и могут быть различия в склонности двух подвидов P. multocida вызывать заболевания дыхательных путей. 14 Хотя у большинства людей присутствует животный источник P.multocida , контакты с животными в 5-15% случаев неизвестны. Pasteurella spp. обычно может быть выделен из культуры на крови или шоколадном агаре в течение 24-48 часов инкубации; большинство штаммов не растут на агаре МакКонки. Мазки роста на агаре, окрашенные по Граму, выявляют мелкие грамотрицательные коккобациллы. Биохимическая идентификация P. multocida проста, особенно при наличии истории болезни; однако идентификация некоторых других видов Pasteurella может быть более сложной. 7–9
Исследования факторов вирулентности Pasteurella spp. были сосредоточены на P. multocida. Вирулентность P. multocida может быть связана с выработкой нейраминидазы и липополисахаридного эндотоксина. Дермонекротический токсин, известный фактор вирулентности у животных, может чаще обнаруживаться в штаммах, выделенных от взрослых с хроническим бронхитом, чем из других источников. Кроме того, сообщалось, что некоторые штаммы продуцируют цитотоксин. 15
Chromobacterium violaceum — обычный сапрофит почвы и воды, особенно в тропических и субтропических регионах. 16,17 Организм обычно проникает через кожу, вызывая локализованную раневую инфекцию, но кровоток и диссеминированная инфекция могут возникать у пациентов с избранной иммунной дисфункцией. С . violaceum можно легко выделить из крови, абсцессной жидкости или гнойного дренажа. Факторов, способствующих вирулентности, не выявлено.
Kingella kingae — обзор
Наиболее часто встречающиеся бактерии в некоторой степени зависят от возраста: Staphylococcus aureus преобладает во всех возрастных группах, но у детей младше 3 лет Kingella kingae становится все более признанной причиной, а также некоторые исследования преобладают. Быстрое появление внебольничного, устойчивого к метициллину стафилококка Staphylococcus (CA-MRSA) в качестве распространенного патогена в США и других странах существенно изменило подход к эмпирическому лечению AHO. Streptococcus pyogenes и Streptococcus pneumoniae также являются распространенными патогенами. С момента введения конъюгированной вакцины Haemophilus influenzae типа b (Hib) вторичный остеомиелит для этого организма встречается довольно редко.
Обычно при AHO симптомы присутствуют менее 2 недель и включают лихорадку, боль в месте инфекции и тенденцию избегать использования пораженной конечности. Реже возникает анорексия, общее недомогание или рвота.Часто в остальном дети выглядят вполне здоровыми, хотя также описан шок в связи с остеомиелитом. При физикальном осмотре наиболее частыми находками являются локализованный отек, болезненность, тепло и эритема. Диапазон движений соседних суставов обычно не вызывает сильной боли при AHO и, если он присутствует, должен вызывать подозрение на септический артрит (см. С. 718).
Стандартные маркеры воспаления (количество лейкоцитов [WBC], C-реактивный белок [CRP] и скорость оседания эритроцитов [ESR]) обычно увеличиваются при AHO.СРБ почти всегда повышен, тогда как СОЭ может отставать от 1 до 3 дней. CRP также имеет тенденцию снижаться в первую очередь в ответ на эффективную терапию. Посев крови будет положительным в 60% случаев. На простых снимках пораженного участка часто рано обнаруживается отек мягких тканей, но обычно костные изменения обнаруживаются не ранее, чем через 7 дней после начала заболевания. В определенных обстоятельствах может быть рассмотрена дополнительная визуализация, такая как сканирование костей с технецием или магнитно-резонансная томография (МРТ). Сканирование костей особенно полезно, если очаг инфекции плохо локализован или если вызывает беспокойство мультифокальный остеомиелит.МРТ особенно полезна при остеомиелите таза, позвоночника и мелких костей, а также позволяет дополнительно оценить поражение соседних мышц (миозит). Однако эти соображения необходимо сопоставить с потенциальными недостатками, которые включают стоимость и необходимость седативных средств у детей младшего возраста.
Если посев крови окажется положительным вскоре после поступления, это может устранить необходимость в аспирате костной ткани, если не выявлен абсцесс или если ребенок моложе 18 месяцев, и, таким образом, разорвется эпифиз или прилегающий сустав неизбежен.Однако в нынешнюю эпоху CA-MRSA идентификация микроорганизма имеет первостепенное значение при выборе терапии. Костный аспират даст положительную культуру примерно у 90% пациентов с AHO, если не было предварительной обработки антибиотиками. Однако предварительная обработка не должна препятствовать попыткам изолировать организм, потому что посевы часто остаются положительными. Гной, если таковой имеется, следует отправлять в микробиологическую лабораторию вместо тампонов, которые имеют более низкий микробиологический выход. Патология полезна для дифференциации острого остеомиелита от хронического и может указывать на необычные организмы или альтернативные диагнозы.
Эмпирический охват антибиотиками в ожидании результатов посева зависит от нескольких факторов: степени заболевания пациента, возраста пациента и количества изолятов MRSA в сообществе. Существуют значительные различия в рекомендациях по эмпирическому охвату, и, действительно, несколько подходов являются разумными. Поскольку S. aureus является наиболее распространенным патогеном в возрастных группах, первоначальный эмпирический охват должен включать эффективный антистафилококковый антибиотик.У детей младше 3 лет эмпирический охват для Kingella spp. также указывается. У пациентов в критическом состоянии в ожидании результатов посева требуется широкий охват, включая ванкомицин и цефалоспорин третьего поколения. Решение о том, использовать ли агент, эффективный против CA-MRSA, должно принимать во внимание частоту, с которой такие инфекции встречаются в сообществе. Многие эксперты рекомендуют такое покрытие, если процент MRSA превышает 10–15%. Ванкомицин и клиндамицин обычно считаются препаратами выбора.Однако показатели устойчивости к клиндамицину варьируются по стране от 10% до 50%. Эти антибиотики не обладают активностью против Kingella spp., И Kingella должны быть покрыты пациентами моложе 3 лет. Эмпирическая терапия ванкомицином без образца или при отрицательном посеве проблематична, поскольку нет эквивалентной пероральной альтернативы. Анаэробы необычны для AHO, за исключением случаев, когда они связаны с синдромом Лемьера. См. Таблицу 1, где представлена сводная информация о вариантах и дозах антибиотиков.
Показатели улучшения включают разрешение лихорадки, клинический прогресс и уменьшение маркеров воспаления. Отсутствие этих характеристик обычно указывает на осложнение, такое как абсцесс, или недостаточное покрытие антибиотиками; Следует рассмотреть возможность повторной визуализации, хирургического вмешательства и / или изменения эмпирической терапии. При неосложненном остеомиелите с ранними признаками улучшения целесообразен переход на пероральную терапию, когда лихорадка ушла, наблюдается клиническое улучшение и наблюдается уменьшение воспалительных параметров, что обычно занимает от 3 до 7 дней.
См. Таблицу 1 для выбора пероральных антибиотиков. Если у пациента стойкая бактериемия, обширное поражение костей, невозможность удаления абсцесса или наличие необычного микроорганизма, показана длительная внутривенная терапия. Кроме того, стойкая бактериемия или мультифокальность указывают на то, что следует рассматривать эндоваскулярный очаг инфекции.
Последующее наблюдение за пациентом с остеомиелитом включает физикальное обследование, предварительный анамнез, последующие рентгенограммы и лабораторные исследования как для отслеживания инфекции, так и для выявления побочных эффектов антибиотиков (см. Таблицу 1).Осмотр и клинические признаки должны постепенно улучшаться. СРБ обычно возвращается к норме в течение 7-10 дней после соответствующей терапии, а СОЭ — в течение 3-4 недель; если этого не происходит или состояние ухудшается, может быть показано повторное обследование для выявления абсцесса / секвестра и / или хирургическое вмешательство по поводу дебридмента и патологии. Рекомендуемая общая продолжительность терапии AHO составляет от 4 до 6 недель, но при этом следует руководствоваться клиническим сценарием, клиническим улучшением и нормализованными маркерами воспаления.
Kingella kingae, вызывающая септический артрит коленного сустава у иммунокомпетентного взрослого
Бактерия Kingella kingae — это вид грамотрицательных коккобацилл, обычно обнаруживаемых в ротоглотке. Сообщается, что это новый патоген, вызывающий бактериемию, эндокардит и костно-суставные инфекции у детей и эндокардит у взрослых с ослабленным иммунитетом. Тем не менее, у иммунокомпетентных взрослых зарегистрировано несколько случаев изолированных инфекций суставов. Из-за того, что требуются особые методы изоляции, задержка в постановке диагноза может поставить под угрозу исход для пациента.Мы сообщаем о редком случае септического артрита колена у иммунокомпетентного взрослого, вызванного K. kingae .
1. Введение
Kingella kingae — привередливая грамотрицательная β -гемолитическая коккобацилла, выделенная среди нормальной респираторной флоры в 5–12% посевов из носа и глотки [1]. Впервые описанный Кингом в 1960-х годах [2], на протяжении большей части своей ранней истории он считался редкой причиной инфекции [3]. За последние два десятилетия все больше сообщений о септическом артрите, остеомиелите и эндокардите были описаны как вторичные по отношению к K.kingae у детей [3]. В настоящее время это признано новым патогеном [3] и частой причиной инфекций скелета у детей младшего возраста [4, 5]. Совершенствование методов культивирования и знакомство с уникальными бактериологическими характеристиками этого организма увеличили частоту его обнаружения [6]. Однако у взрослых описано гораздо меньше случаев. Они обычно являются условно-патогенными и появляются почти исключительно у пациентов с ослабленным иммунитетом. Мы сообщаем о длительном случае изолированного септического артрита коленного сустава, вызванного K.kingae у иммунокомпетентного взрослого человека. Это только второй такой случай, о котором известно автору в литературе.
2. История болезни
36-летняя женщина поступила в отделение неотложной помощи с пятидневной историей прогрессирующего обострения боли в правом колене. Она отрицала какую-либо травму и не имела другой истории болезни. При физикальном обследовании обнаружен умеренный гипертермия 38,2 ° C, выпот умеренного размера, тепло в суставе, болезненность при пальпации и дуга движения 20 градусов.Ее дыхательная, сердечная, абдоминальная, урологическая и неврологическая системы были в норме. Анализы крови показали повышенное количество лейкоцитов (WCC) 17 × 10 9 / л, C-реактивный белок (CRP) 132 мг / л и скорость оседания эритроцитов (ESR) 78 мм / ч. При аспирации из коленного сустава было получено 25 мл жидкости соломенного цвета, но при микроскопии не было выделено никаких организмов или кристаллов. Посевы крови и мочи не выявили примечаний, и в тот же день пациенту было выполнено артроскопическое промывание коленного сустава. Интраоперационные образцы были отрицательными на микроорганизмы, и она была выписана без боли через 2 дня после операции без антибиотиков.
Шесть недель спустя пациент снова обратился в отделение неотложной помощи с ухудшением симптомов и повышенными маркерами воспаления. WCC снова повысился до 22,7 × 10 900 · 10 9 / л, CRP — до 184 мг / л, а СОЭ — до 83 мм / ч. Повторная аспирация из коленного сустава не выявила организмов или кристаллов. Пациенту была проведена вторая артроскопическая промывка, и ему внутривенно вводили флуклоксациллин и бензилпенициллин (1 грамм и 1,2 грамма QDS, соответственно) в течение семи дней перед выпиской на пероральный пенициллин (1 грамм QDS) в общей сложности на 6 недель.
Еще через 4 недели у нее снова появились идентичные симптомы. Маркеры воспаления не изменились с момента предыдущей госпитализации. При третьей аспирации колена было получено 85 мл мутной жидкости соломенного цвета, которая снова не была гнойной. На этот раз часть аспирата была помещена в стандартные флаконы для культур крови (аэробные и анаэробные) в дополнение к обычным стерильным контейнерам, и на всех 4 образцах была проведена микроскопия.
Инокуляция аэробной культуры крови в течение 2 недель на кровяном агаре в атмосфере, обогащенной CO 2 , позволила развить грамотрицательные коккобациллы.Он был идентифицирован как Kingella kingae (неподвижный, неферментирующий, слабо оксидаза-положительный, каталаза-отрицательный и уреазо-отрицательный организм, который производит бета-гемолиз на кровяном агаре) [7], который был чувствителен только к гентамицину и ципрофлоксацину. Пациенту была проведена открытая промывка коленного сустава, и ему начали 6 недель перорального приема ципрофлоксацина. Дальнейших острых проявлений не было. Через год после обращения пациент жалуется на небольшую остаточную боль и потерю 20 градусов сгибания сустава.
3. Обсуждение
Kingella kingae — медленно растущий, привередливый грамотрицательный член группы микроорганизмов HACEK [7–9], которые составляют часть нормального комменсала ротовой и глоточной полостей [7] . За последнее десятилетие он превратился в значительный патоген в детской возрастной группе, в первую очередь вызывающий бактериемию, эндокардит и костно-суставные инфекции. Педиатрическим костно-суставным инфекциям, вызванным K. kingae , обычно предшествует ротоглоточная инфекция, и они наиболее распространены в зимние месяцы [1, 3].Недавние данные о детях из кластеров инфекции в дневных центрах по всему миру предполагают наличие «состояния носительства» [1], и было высказано предположение, что K. kingae , присутствующее в ротоглотке, может проникать и вторгаться в кровоток через поврежденную слизистую оболочку. слой [8]. Напротив, в более позднем возрасте предрасположенность возникает почти исключительно у людей со значительными другими предрасполагающими факторами. Примеры, часто вызывающие иммуносупрессию, включают гематологические злокачественные новообразования, синдром приобретенного иммунодефицита, системную красную волчанку, сахарный диабет, ревматоидный артрит, опухоли и терминальную стадию почечной недостаточности [10].Инфекция, поражающая кость или сустав, встречается редко и чаще вызывает эндокардит, спондилодисцит или бактериемию [10].
Выделение K. kingae в качестве единственной возбудительной бактерии у здорового взрослого человека было крайне необычным. Пик распространенности инвазивной инфекции приходится на детей в возрасте 2 лет, и это показывает связь с уровнем колонизации глотки в 10–12% в этой группе. Однако с возрастом этот показатель быстро снижается, и иммунологически компетентные взрослые редко являются носителями [11].В одном 14-летнем исследовании 98,6% всех инвазивных случаев, вызванных K. kingae , произошли в возрасте до 4 лет [11]. В нашем случае пациент не имел непосредственного контакта с маленькими детьми, которые могли выступать в качестве бактериальных носителей.
После обширного обзора литературы мы выявили только 7 сообщений о случаях септического артрита у взрослых [10, 12–16]. Был зарегистрирован только один случай изолированной инфекции у взрослого человека, имеющего в остальном иммунитет; это также повлияло на колено [8]. Все остальные выявленные случаи касались пациентов со значительными предрасполагающими факторами.Elyès et al. также описали взрослого, у которого развился эндокардит в дополнение к септическому артриту коленного сустава, вторичному по отношению к K. kingae [7].
Наш случай показал рецидивирующее течение, скорее всего, из-за неадекватного и нецелевого лечения антибиотиками (у здорового пациента) после второго обращения. Важно отметить, что первичная культура на твердых средах часто не может выделить эту бактерию [17]. Первоначальное окрашивание по Граму оказалось положительным только в небольшом проценте случаев, а количество лейкоцитов <50 000 лейкоцитов / мм 3 в четверти образцов [6, 18].Загрязняющие вещества, присутствующие в гнойной синовиальной жидкости, также оказывают ингибирующее действие на восстановление K. Kingae in vitro. Эффект от этого может быть уменьшен путем разбавления бульона большими объемами для уменьшения концентрации еще не идентифицированных компонентов и обеспечения возможности восстановления [17, 19, 20]. Этого можно достичь, поместив образцы синовиальной жидкости непосредственно в бутыли для аэробных культур крови, которые затем можно высеять на культуры кровяного агара в атмосфере, обогащенной CO 2 [7].В одном исследовании, после среднего времени инкубации в 4 дня, это дало рост во всех случаях по сравнению с только 8% культивированием на традиционных твердых чашках [19].
Как новый патоген, K. kingae , как ранее считалось, был ошибочно принят за контаминант или просто неправильно идентифицирован до того, как стало известно и распознаны ключевые особенности, необходимые для правильной идентификации микробов [6, 19]. Добавление к этому K. kingae может также оказаться грамположительным при окрашивании из-за его склонности удерживать краситель кристаллического фиолетового [1].Использование анализов амплификации нуклеиновых кислот (NAAA) позволяет точную идентификацию даже после использования эмпирических антибиотиков и может сократить среднее время до постановки диагноза с 3-4 дней до менее 24 часов [1].
Лечение следует направлять в зависимости от чувствительности; однако, K. kingae обычно чувствителен к ряду антибиотиков, включая β -лактамы, такие как пенициллин, гентамицин, цефалоспорины [3], макролиды и тетрациклины. Следует отметить, что резистентность к ванкомицину может осложнять эмпирическое лечение предполагаемой стафилококковой инфекции суставов.Это подчеркивает важность раннего выявления микроорганизмов и целевой антибактериальной терапии. Сообщается также о резистентности к эритромицину, клиндамицину, триметоприму и ципрофлоксацину in vitro [6, 21, 22].
В заключение, это первый зарегистрированный случай изолированного септического артрита у иммунокомпетентного взрослого человека. Мы подчеркиваем необходимость того, чтобы хирурги-ортопеды были осведомлены о демографических характеристиках пациентов, наиболее часто поражаемых этой редкой бактерией, и о методах изоляции, необходимых для ранней диагностики и предотвращения последующего разрушения суставов.
Конфликт интересов
Авторы удостоверяют, что пациент, участвовавший в этом отчете, дал полное разрешение на публикацию своего случая. Конфликт интересов отсутствует.
Границы | Острый септический артрит колена, вызванный Kingella kingae, у 5-летнего камерунского мальчика
Фон
Kingella kingae — новый патоген, признанный основной причиной инфекций костей и суставов у детей раннего возраста из западных стран (1, 2).Распространенность ротоглоточного носительства K. kingae , бессимптомно укрывающаяся в ротоглотке у детей в возрасте 6–48 месяцев, колеблется от 8 до 23% по данным исследований, проведенных в Израиле, Швейцарии и Новой Зеландии (3–6). Поскольку эта грамотрицательная бактерия обычно отвечает за воспалительную реакцию от легкой до умеренной, и ее обнаружение при обычном культивировании, как известно, затруднено, диагностика инфекции K. kingae требует высокого индекса подозрения и использования адекватных методов обнаружения, таких как количественная полимеразная цепная реакция (КПЦР) в реальном времени (6, 7).Эти молекулярные диагностические инструменты обладают более высокой чувствительностью по сравнению с методами культивирования, сокращают время обнаружения с нескольких дней до нескольких часов и позволяют идентифицировать организм среди здоровых носителей (4–6).
Крупномасштабные эпидемиологические исследования, основанные на анализе мультилокусного типирования последовательностей (MLST) K. kingae , показали, что доминантные клоны, принадлежащие к комплексам последовательностного типа 6 (STc-6), -14, -23 и -25, составляют 72 % штаммов, распространенных во всем мире, в основном в США, Европе и Израиле, при этом ST-14 и ST-25 положительно связаны с костно-суставными инфекциями (8).На сегодняшний день инфекция и носительство K. kingae были изучены в Израиле, Европе, Северной и Южной Америке, Австралии, Новой Зеландии и Японии (5, 8–10), но в Африке еще не зарегистрировано ни одного сообщения. В настоящем документе мы сообщаем о диагностических и эпидемиологических исследованиях артрита K. kingae у молодого, ранее здорового ребенка из Камеруна и обсуждаем клинические последствия этих результатов.
Кейс-презентация
11 июля 2016 года 5-летний камерунский мальчик поступил в отделение неотложной помощи больницы Драсени в регионе Прованс-Альпы-Лазурный берег, Франция, из-за болезненной хромоты, которая появилась утром.Он жил в Камеруне, где ему сделали прививку БЦЖ при рождении, и переехал на каникулы в Юго-Восточную Францию за 4 дня до консультации. На предыдущей неделе развился ринофарингит легкой степени, но, поскольку симптомы были легкими, лечение не проводилось. В анамнезе не было травм, и у него не было какого-либо основного заболевания. При поступлении в больницу у ребенка была температура 36,7 ° C, он отказывался ходить. Клиническое обследование выявило болезненность и выпот в правом колене.Ни кожной сыпи, ни изъязвлений в полости рта не отмечалось. Лабораторные результаты показали повышенный уровень С-реактивного белка (CRP) на уровне 174 мг / л, при нормальном количестве лейкоцитов 5700 клеток / мм 3 и количестве тромбоцитов 495000 клеток / мм 3 . Ультразвуковое исследование подтвердило выпот в правом колене, тогда как обычная рентгенограмма не показала значительных отклонений. Ребенку сделали артроцентез и извлекли слегка непрозрачную жидкость желтоватого цвета, что свидетельствовало о септическом артрите правого колена.В результате ребенку немедленно ввели внутривенно амоксициллин-клавуланат 100 мг / кг 3 раза в день в течение 3 дней.
Описание лабораторных исследований и диагностических исследований
Поскольку обычные культуры, применяемые на грамположительные, грамотрицательные, микобактериальные виды и грибки из совместной жидкости и образцов крови, были отрицательными, образцы суставов были отправлены в сухом льду в лабораторию молекулярной диагностики отделения URMITE в Марселе, где бактериальные дезоксирибонуклеиновую кислоту (ДНК) экстрагировали непосредственно из суставной жидкости.Анализ полимеразной цепной реакции (ПЦР), нацеленный на бактериальный ген 16S рРНК широкого спектра действия (11), и анализы количественной ПЦР, нацеленные как на виды Mycobacterium , так и на комплекс Mycobacterium tuberculosis (12), были отрицательными. Учитывая возраст пациента, K. kingae также искали с помощью специального анализа кПЦР, нацеленного на ген K. kingae cpn60 ( groEL ) (11). Удивительно, но этот специфический анализ K. kingae был положительным, как и тесты qPCR, нацеленные на гены Kingella -специфические rtxA и rtxB (7, 13), что подтвердило диагноз септического артрита, вызванного K. .kingae . Организм также был идентифицирован с помощью многоцветной флуоресценции in situ гибридизации, специфичной для K. kingae (рисунки S1 и S2 в дополнительном материале), которая выявила присутствие большого количества жизнеспособных коккобацилл, расположенных в синовиальной жидкости (рисунок 1). Кардиологические исследования исключили эндокардит. Затем 15 июля 2016 г. был произведен переход на пероральный прием амоксициллина-клавуланата 100 мг / кг, три дозы в день, общая продолжительность которого составила 2 недели.Несмотря на эти рекомендации, в Камеруне лечение продолжалось еще 2 месяца. В течение последнего периода наблюдения через 3 месяца после операции клиническое обследование показало нормальное состояние коленного сустава с нормальным диапазоном движений.
Рисунок 1 . Многоцветная флуоресценция in situ. Анализы гибридизации проводили на патогенной синовиальной жидкости после того, как последняя была зафиксирована формалином и залита парафином. Большое количество жизнеспособных коккобацилл, представляющих штаммы Kingella kingae , являющиеся возбудителями, визуализируются красным цветом с использованием зонда, меченного родамином, нацеленного на консенсусную последовательность бактериального гена 16S рРНК (EUB388 III, вверху слева), зеленым цветом с использованием зонда, нацеленного на FITC. модель K.kingae -специфическая область V1 гена 16S рРНК (вверху справа) и синим цветом с использованием зонда DAPI для мечения дезоксирибонуклеиновой кислоты (посередине слева). Внутренний отрицательный контроль выполняли с использованием бактериального зонда, отличного от EUB388 (посередине справа). Объединенное изображение было получено суммированием четырех вышеупомянутых изображений (внизу слева).
После этого исследования MLST с использованием модифицированного протокола, специфичного для K. kingae , были выполнены на бактериальной ДНК, экстрагированной непосредственно из суставной жидкости, как описано ранее (14).Однозначно идентифицировано пять аллелей: adk-2, aroE-2, cpn60-2, zwf-13 и recA-2 . Неожиданно 14 однонуклеотидных вариантов аллеля abcZ были идентифицированы из нуклеотидов 6–447 (рисунок S3 в дополнительных материалах; таблица 1). Чтобы оценить межштаммовое родство и определить схему MLST для K. kingae , каждой отдельной последовательности в локусе был присвоен другой номер аллеля, и каждой отдельной комбинации аллелей был присвоен отдельный номер типа последовательности (ST). (15).Затем изоляты K. kingae были сгруппированы в ST-комплексы (STcs), если они отличались не более чем по одному локусу от хотя бы одного другого члена группы. Среди 70 ST для K. kingae , которые задокументированы в базе данных мультилокусных последовательностей (MLST) базы данных Institut Pasteur (http://bigsdb.pasteur.fr/perl/bigsdb/bigsdb.pl?db=pubmlst_kingella_seqdef_public&page=downloadProfiles = 1), ST-26, который принадлежит к высокоинвазивному STc-25, был ближайшим ST, разделяя четыре аллеля, а именно, adk-2, cpn60-2, gdh / zwf-13 и recA-2 с штаммами-возбудителями, которые были идентифицированы здесь (Таблица 2).Хотя анализ комбинации, продуцируемой пятью однозначными аллелями, показал, что причинный штамм K. kingae принадлежит к новому ST, наличие множественных аллелей abcZ не позволяет точно определить его. Более того, в схеме MLST K. kingae генотипы-основатели STcs были определены как ST STc с наибольшим количеством соседних ST [(15), Table 3]. Следовательно, хотя анализ комбинации, продуцируемой пятью однозначными аллелями, показал, что причинный K.kingae также относятся к новому STc, конкретное наименование пока невозможно. Более того, поскольку каждый из этих генов домашнего хозяйства присутствует в одной копии во всем геноме K. kingae , эти данные свидетельствуют о коинфекции штаммами, принадлежащими к разным ST.
Таблица 1 . Матрицы расстояний аллеля Kingella kingae abcZ, соответствующие выравниванию MAFFT, отображенному на рисунке S3 в дополнительных материалах.
Таблица 3 .Схема мультилокусного типирования последовательностей (MLST) для Kingella kingae показывает комбинацию шести аллелей, используемых для определения типов последовательностей (ST) и комплексов типов последовательностей (STcs) K. kingae .
Обсуждение
Насколько нам известно, здесь мы сообщаем о первом случае лабораторно подтвержденной инвазивной инфекции, вызванной K. kingae , у ребенка, живущего в Африке. Мало что известно об эпидемиологии детских инфекций костей и суставов на африканском континенте; тем не менее, широко признано, что Staphylococcus aureus является наиболее частым возбудителем, культивируемым у детей с септическим артритом в условиях ограниченных ресурсов (10, 16).Тем не менее, септический артрит, вызванный S. aureus , чаще всего поражает детей старшего возраста и более склонен к более сильному системному воспалительному ответу по сравнению с инфекциями K. kingae , и организм без труда восстанавливается путем посева крови и аспирация синовиальной жидкости (10, 16, 17). Хотя артрит K. kingae характеризуется повышением маркеров воспаления от нормального до умеренного, мы отмечаем, что у пациента был заметно повышенный уровень СРБ при поступлении, что соответствует инвазивной инфекции, вызванной K.kingae продолжительностью не менее нескольких дней. Несмотря на это, инфекция K. kingae вызывала серьезные подозрения, поскольку этот патоген признан первой причиной острого септического артрита с отрицательной посевом у детей раннего возраста и чаще всего поражает колено (1). Кроме того, было также продемонстрировано, что вирусные респираторные инфекции могут играть роль в патогенезе заболевания, повреждая слизистую оболочку ротовой полости, тем самым облегчая распространение микроорганизма из крови в отдаленные анатомические участки (2).
Обнаружение K. kingae в настоящее время улучшается с помощью чувствительных методов культивирования, таких как флаконы Bactec / Alert, и, прежде всего, с помощью специальных анализов количественной ПЦР (2, 7). Однако эти диагностические методы являются дорогостоящими и еще не доступны в развивающихся странах, где диагностические ресурсы, такие как посев крови или молекулярные анализы ограничены, и, следовательно, признание K. kingae в качестве возможной причины острого септического артрита в педиатрии особенно актуально. испытывающий. В регионах с низким доходом и высоким бременем туберкулеза антибиотики с соответствующим покрытием против S.aureus и классические пиогенные бактерии можно часто вводить без каких-либо культур, а в случае отсутствия реакции на лечение антибиотиками противотуберкулезные препараты можно вводить эмпирически в течение нескольких недель или месяцев.
Хотя у ребенка появился артрит, вызванный K. kingae через 4 дня после прибытия в Юго-Восточную Францию, мы подчеркиваем, что инфекция K. kingae обычно развивается через несколько дней или недель после носительства ротоглотки K. kingae и вирусных инфекций. (18).Более того, MLST-анализ инвазивных штаммов K. kingae из Юго-Восточной Франции в 2016 году показал, что штаммы, вызывающие костно-суставные инфекции, в подавляющем большинстве случаев принадлежали к ST-6 и ST-25 (14). Взятые вместе с описанным здесь новым романом K. kingae STc, эти результаты согласуются с тем фактом, что ребенок приобрел штамм K. kingae , вызывающий заболевание, в Камеруне.
Примечательно, что в неопубликованном пилотном исследовании K. kingae было идентифицировано в ротоглотке маленьких детей из Западной Африки.Это исследование проводилось в университетской больнице Донка в Конакри, Гвинея, с 2012 по 2013 год (Ceroni and Lamah, неопубликованные данные). Для определения распространенности ротоглоточного носительства K. kingae в исследование были включены 45 здоровых детей в возрасте от 6 до 48 месяцев. Были включены дети, поступившие либо на плановую операцию, либо в ортопедическую амбулаторию, либо в отделение неотложной помощи по поводу неинфекционных заболеваний, в то время как дети с инвазивным инфекционным заболеванием или приемом противомикробных препаратов в течение двух предыдущих месяцев были исключены.В недавних поездках за границу ни о одном ребенке не сообщалось. Образцы из ротоглотки были получены путем протирания ватным тампоном миндалин ребенка, которые впоследствии были протестированы с помощью молекулярных анализов, описанных ранее (13). Трое детей дали положительный результат на K. kingae , таким образом, показатель распространенности составил 6,7%, что примерно аналогично тому, что наблюдается в Европе (4). Несмотря на небольшой размер этого пилотного исследования, эти предварительные результаты свидетельствуют о том, что K. kingae циркулирует также в Западной Африке, и, как следствие, K.kingae можно рассматривать как потенциальный патоген, ответственный за септический артрит у маленьких детей, живущих в этом географическом районе. Ранний микробиологически подтвержденный диагноз инфекции K. kingae позволит провести соответствующую антибактериальную терапию амоксициллином или амоксициллин-клавуланатом и резко сократить общую продолжительность лечения до нескольких дней или недель (2, 6). Это также позволило бы избежать назначения потенциально вредных противотуберкулезных схем.
Заключительные замечания
Этот отчет демонстрирует, что K. kingae можно рассматривать как потенциальную причину острого септического артрита у детей, живущих в странах Африки к югу от Сахары. Вместе с доказательствами носительства K. kingae среди здоровых детей из Западной Африки, эти данные позволяют предположить, что K. kingae может вносить вклад в недооцененное бремя септического артрита в этой географической области. Более того, анализ MLST выявил первые K.kingae STc в Африке, это новый STc, близкий к ST-26. Необходимы дальнейшие проспективные исследования для определения распространенности инфекции и носительства K. kingae в Африке к югу от Сахары, чтобы лучше руководствоваться рациональными диагностическими и терапевтическими стратегиями.
Согласие на публикацию
Письменное согласие на публикацию было получено от родителей ребенка.
Заявление об этике
Исследование было одобрено этическим комитетом IHU Mediterranee-Infection под номером 2016-024.
Авторские взносы
Все авторы внесли существенный вклад в концепцию и дизайн работы, а также в сбор, анализ и интерпретацию данных для работы. NEH и DC разработали первоначальную версию рукописи, и все авторы критически отредактировали ее с учетом важного интеллектуального содержания. Все авторы одобрили публикацию данной версии.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарны родителям пациента, а также детям и их семьям из Конакри, Гвинея, за участие в этой работе.
Финансирование
Эта работа была поддержана фондом Mediterranee Infection Foundation (http://www.mediterranee-infection.com/article.php?larub=126&titer=la-fondation-recrute) посредством гранта на докторскую степень, присужденного NEH с 2015 по 2017 год.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу http: // www.frontiersin.org/article/10.3389/fped.2017.00230/full#supplementary-material.
Сокращения
CRP, С-реактивный белок; ДНК, дезоксирибонуклеиновая кислота; MLST, мультилокусная типизация последовательностей; ПЦР, полимеразная цепная реакция; ST, тип последовательности; STc, комплекс последовательного типа.
Список литературы
3. Амит У., Даган Р., Ягупский П. Распространенность глоточного носительства Kingella kingae у маленьких детей и факторы риска колонизации. Pediatr Infect Dis J (2013) 32: 191–3.DOI: 10.1097 / INF.0b013e3182755779
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Черони Д., Ллана Р.А., Керад О., Дюбуа-Ферьер В., Ласкомб П., Ренци Г. и др. Сравнение плотности колонизации ротоглотки Kingella kingae у бессимптомных носителей и детей с инвазивными костно-суставными инфекциями. Pediatr Infect Dis J (2013) 32: 412–4. DOI: 10.1097 / INF.0b013e3182846e8f
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5.Олийве Л., Подмор Р., Андерсон Т., Уоллс Т. Высокая частота носительства ротоглотки Kingella kingae у детей Новой Зеландии. J Paediatr Child Health (2016) 52: 1081–5. DOI: 10.1111 / jpc.13287
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Ягупский П. Kingella kingae : носительство, передача и болезнь. Clin Microbiol Rev (2015) 28: 54–79. DOI: 10.1128 / CMR.00028-14
CrossRef Полный текст | Google Scholar
7.Эль Хумами Н., Бздренга Дж., Дюран Г.А., Минодье П., Селигманн Х., Прудент Э. и др. Молекулярные тесты, нацеленные на локус RTX, не позволяют различить виды Kingella kingae и недавно описанные виды Kingella negevensis . J Clin Microbiol (2017) 55: 3113–22. DOI: 10.1128 / JCM.00736-17
CrossRef Полный текст | Google Scholar
8. Басмачи Р., Биде П., Ягупский П., Муньос-Альмагро С., Балашова Н.В., Дойт С. и др. Основные типы последовательностей Kingella kingae , распределенные между континентами, и разработка инструмента для быстрого молекулярного типирования. J Clin Microbiol (2014) 52: 3890–7. DOI: 10.1128 / JCM.01609-14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Кузумото К., Кубота Н., Сайто Ю., Фудзиока Ф., Юмото К., Хидака Р. и др. Случай остеомиелита, вызванного Kingella kingae . Kansenshogaku Zasshi (2013) 87: 207–10. DOI: 10.11150 / kansenshogakuzasshi.87.207
CrossRef Полный текст | Google Scholar
10. Осей Л., Эль Хумами Н., Минодье П., Сика А., Бассет Т., Селигманн Х. и др.Инфекции костей и суставов у детей во Французской Гвиане: ретроспективный обзор за 6 лет. J Trop Pediatr (2017) 63: 380–8. DOI: 10.1093 / tropej / fmw102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Levy PY, Fournier PE, Fenollar F, Raoult D. Систематическое обнаружение ПЦР при отрицательных посевах костно-суставных инфекций. Am J Med (2013) 126: 1143.e25–33. DOI: 10.1016 / j.amjmed.2013.04.027
CrossRef Полный текст | Google Scholar
12.Bruijnesteijn van Coppenraet ES, Lindeboom JA, Prins JM, Peeters MF, Claas EC, Kuijper EJ. Анализ ПЦР в реальном времени с использованием тонкоигольных аспиратов и биоптатов тканей для быстрой диагностики микобактериального лимфаденита у детей. J Clin Microbiol (2004) 42: 2644-50. DOI: 10.1128 / JCM.42.6.2644-2650.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Cherkaoui A, Ceroni D, Emonet S, Lefevre Y, Schrenzel J. Молекулярная диагностика костно-суставных инфекций Kingella kingae с помощью специфического анализа ПЦР в реальном времени. J Med Microbiol (2009) 58: 65–8. DOI: 10.1099 / jmm.0.47707-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Эль Хумами Н., Бздренга Дж., Понс Дж. К., Минодье П., Дюран Г. А., Обрахам А. и др. Модифицированный протокол мультилокусного типирования последовательности для генотипа Kingella kingae из ротоглоточных мазков без выделения бактерий. BMC Microbiol (2017) 17: 200. DOI: 10.1186 / s12866-017-1104-5
CrossRef Полный текст | Google Scholar
15.Basmaci R, Yagupsky P, Ilharreborde B, Guyot K, Porat N, Chomton M и др. Мультилокусное типирование последовательностей и анализ секвенирования гена токсина rtxA изолятов Kingella kingae демонстрируют генетическое разнообразие и международные клоны. PLoS One (2012) 7: e38078. DOI: 10.1371 / journal.pone.0038078
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Stoesser N, Pocock J, Moore CE, Soeng S, Hor P, Sar P, et al. Эпидемиология детских инфекций костей и суставов в Камбодже, 2007–2011 гг. J Trop Pediatr (2013) 59: 36–42. DOI: 10.1093 / tropej / fms044
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Ceroni D, Cherkaoui A, Combescure C, François P, Kaelin A, Schrenzel J. Дифференциация костно-суставных инфекций, вызываемых Kingella kingae , от инфекций, вызываемых типичными патогенами у маленьких детей. Pediatr Infect Dis J (2011) 30: 906–9. DOI: 10.1097 / INF.0b013e31821c3aee
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18.Эль Хумами Н., Минодье П., Дубург Дж., Миранд А., Джув Дж. Л., Басмачи Р. и др. Паттерны вспышек болезни Kingella kingae . Pediatr Infect Dis J (2016) 35: 340–6. DOI: 10.1097 / INF.0000000000001010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
.
