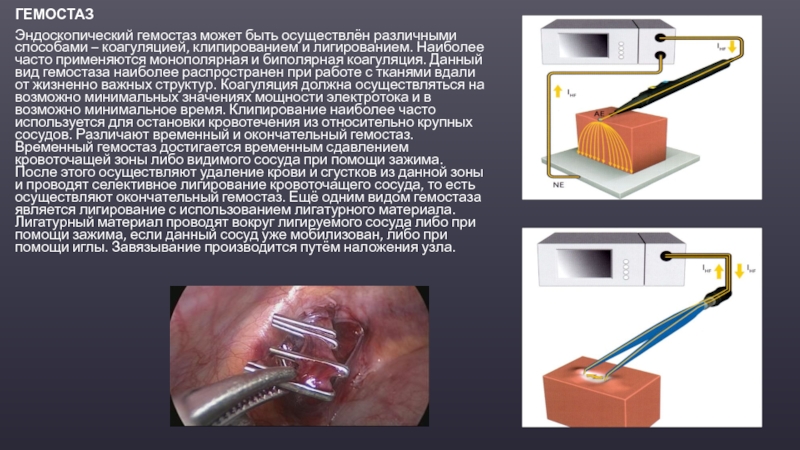
Электрохирургия: практические советы и применение
Высокочастотный хирургический аппарат применяется практически во всех областях хирургии, он входит в стандарт оснащения, как в государственных поликлиник, так и частных медицинских центров. Аппараты ЭХВЧ используются при проведении полостных и лапароскопических операций, эндоскопии, гинекологии, косметологии и пластической хирургии.
Термическое воздействие в медицине
Под воздействием тока высокой частоты в месте соприкосновении активного электрода с тканями организма происходит мгновенное испарение внутриклеточной жидкости. Это явление объясняется тепловым эффектом, который возникает при воздействии на ткани электрического тока. В результате интенсивного парообразования происходит оплавление и сварка кровеносных сосудов, что и обеспечивает гемостаз.
Электрогенератор токов высокой энергии в настоящее время является одним из основных аппаратов, применяемых в хирургии. Высокочастотную электрохирургию применяют при 85% оперативных вмешательств. Аппарат ЭХВЧ используется для:
Аппарат ЭХВЧ используется для:
• коагуляции;
• разрезания тканей;
• девитализации;
• электролигирования сосудов.
Таблица 1. Воздействие электрического тока на биологические ткани
Резание
Рассечение любых мягких тканей, в том числе жировых и мышечных, без выраженной коагуляции называется резание. Режущий эффект появляется при напряжениях более 200 В и мощности выше 8 Вт за счет образования электрических дуг. При этом происходит выпаривание внутриклеточной и внеклеточной жидкости и разрушение клеточных мембран. В результате чего образуется разрез с зоной коагуляции по краям. Гемостатический эффект незначителен.
Рисунок 1. Разрез электрокоагулятором
Выполнять данную операцию на аппарате ЭХВЧ можно в режиме монополярное или биполярное резание, при этом используются электроды в виде шпателя, иглы или петли.
Девитализация
Этот метод применяется для точечного разрушения патологических очагов или новообразований. После проведения хирургического вмешательства ткань, подвергшаяся действию высокочастотного тока с течением времени расщепляется благодаря метаболическим процессам, протекающим в теле пациента.
Рисунок 2. Удаление опухоли методом девитализации
Коагуляция
Ток высокой частоты передается от электрода на ткань организма, тем самым нагревая ее до температуры 60 – 100 С. При этом выпаривание внутриклеточной и внеклеточной жидкости происходит без нарушения структуры клеток. Коагуляция используется для обеспечения гемостаза разрезанных сосудов при хирургических вмешательствах.
Коагуляция используется для обеспечения гемостаза разрезанных сосудов при хирургических вмешательствах.
Различают несколько способов коагуляции:
• медленная контактная коагуляция;
• коагуляция с предварительным наложением зажимов на кровеносные сосуды;
• бесконтактная спрей-коагуляция.
Рисунок 3. Контактная коагуляция (электрод-пинцет)
Термолигирование сосудов
Для решения таких задач, как запаивание мелких сосудов и плавление тканевых слоев перед рассечением, используется термозапаивания (лигирование сосудов). Электролигирование сосудов признано безопасной процедурой, она позволяет не допустить вторичные кровотечения. Для проведения термолигирования используется специальный электрод в виде щипцов.
Электролигирование сосудов признано безопасной процедурой, она позволяет не допустить вторичные кровотечения. Для проведения термолигирования используется специальный электрод в виде щипцов.
Рисунок 4. Термолигирование сосудов
Факторы, влияющие на термический эффект
Свойства ткани. Сопротивление разных тканей в организме человека различается в сотни раз, например, сопротивление жировой ткани — 3000 – 20000 Ом/м, мышцы — 0,5 –1,0 Ом/м). Современный аппарат ЭХВЧ подстраивает выходное напряжение с учетом сопротивления ткани. Микропроцессорное управление выходной мощности генератора позволяет получать одинаковый эффект при одновременной работе с разными типами тканей.
Микропроцессорное управление выходной мощности генератора позволяет получать одинаковый эффект при одновременной работе с разными типами тканей.
Дозирование мощности. Для обеспечения однородного воспроизводимого эффекта резания, современные электрокоагуляторы оснащают датчиками, которые контролируют все параметры электрической дуги, а также дозируют в автоматическом режиме уровень выходной мощности. Такая система повышает безопасность при проведении операции для пациентов и врачей.
Режимы работы. В зависимости от режима работы коагуляторы подразделяются на монополярные и биполярные. При этом в современном аппарате ЭХВЧ имеется несколько режимов работы, что позволяет использовать его в разных областях медицины. Помимо этого прибор может работать сразу в нескольких режимах. Основные режимы работы электрохирургического коагулятора: мягкая коагуляция, аргонусиленная коагуляция, фульгурация, разрез с гемостазом, чистый разрез, биполярная коагуляция и биполярный разрез.
Основные режимы работы электрохирургического коагулятора: мягкая коагуляция, аргонусиленная коагуляция, фульгурация, разрез с гемостазом, чистый разрез, биполярная коагуляция и биполярный разрез.
Типы активны электродов. Для проведения монополярной коагуляции используются активные электроды различной конфигурации: петля, игла, шарик, скальпель и т.д. Биполярная коагуляция производится с помощью инструментов, имеющих 2 точки соприкосновения с тканями: щипцы, ножницы и пинцеты. Такие инструменты подходят для точечного рассечения и коагуляции всех типов мягких тканей при работе в ограниченном пространстве.
Описание основных методов коагуляции.

Электрокоагуляция
– это
электрохирургический способ удаления
тканей под воздействием электрического
тока. Кожа человека плохо проводит
электрический ток, поэтому действие
электрокоагулятора приходится на
открытые участки, представляющие собой
проводящую среду (из-за крови, которая
и проводит ток). В месте воздействия
постоянного или переменного тока высокой
частоты происходит интенсивный локальный
нагрев тканей.
Под воздействием
высокой температуры белки тканей
сворачиваются, жидкость испаряется,
сами ткани сгорают. Преобразование
электрической энергии в тепловую
позволяет нагревать ткани во время
коагуляции до температур от 60°C
до 100°C,
которые вызывают свертываемость белков.
Внутриклеточная и внеклеточная жидкости
выпариваются без разрушения клеточных
структур. Температурное воздействие
обладает коагулирующим эффектом на
сосуды, что предотвращает возможные
кровотечения и инфицирование.
Гибкие настройки
аппарата позволяют регулировать глубину
проникновения в ткань и силу тока, что
обеспечивает максимальную безопасность
и отсутствие осложнений. Так как в основе
процедуры лежит высокое температурное
воздействие, то проводят анестезию
проблемных участков кожи.
Эндовазальная
лазерная коагуляция
– воздействие лазера осуществляется
внутривенно, из-за чего стенки поврежденного
сосуда склеиваются; метод основан на
термическом воздействии тепловой
энергии на эндотелий. Суть лечения в
том, что происходит сгущение крови под
воздействием лазерных лучей. Световые
потоки поглощаются эритроцитами — лучи
преобразовываются в тепловую энергию.
Лазерное воздействие вызывает термический
ожог эндотелия, в крови появляются
пузырьки пара, образуется тромб. Сосуд
запаивается. Метод хорош тем, что после
процедуры не остаются шрамы, проводится
только местная анестезия, низкая
вероятность осложнений (таких кактромбофлебит,
парестезии – ощущение покалывания по
ходу вены, воспаление и некроз сосуда)
и возможность осуществления при наличии
трофических язв на нижних конечностях;
Эндоваскулярная
– это процедура, при которой больной
сосуд термически обрабатывается лазерным
излучением. В расширенную вену вводят
В расширенную вену вводят
тонкий лазерный световод, который,
продвигаясь по всей вене, воздействует
на нее термически, «запаивает» вену на
всем протяжении. Весь ход процедуры
контролируется с помощью аппарата
ультразвуковой диагностики.
Фотокоагуляция
– сосудистые звездочки и другие дефекты
устраняются без проникновения в сам
сосуд;
Спектор применения методики в медицинской практике.
Рассмотрим несколько
основных ветвей применения электрокоагуляции:
Стоматология:
В данной отрасли
метод электрокоагуляции сосудов
позволяет прижигать десневые ткани при
гингивите1,
удалять злокачественные опухоли
(частично при онкологии опухолей желудка
и слизистых оболочек), проводить лечение
перикоронарита(при
воспалении зуба мудрости электрокоагулятором
удаляется десневой капюшон, под которым
скапливаются остатки пищи).
Так же используется при кровотечениях,
выравнивании линии десны (удаление
гипертрофированных тканей десны),
проводят пластику уздечек (подрезание),
вестибулопластику (удаление двойной
уздечки или коррекция малого преддверия,
высушивание клеток), вскрытие абсцессов.
Косметология:
(частично дерматология):
Используют для
удаления бородавок, папиллом (частично
для ЛОР-практики, в случае сужения
просвета органов) сосудистой (капиллярной)
сетки лица, нежелательных волос
(прижигание фолликул), сведения татуировок
(выжигание кожи вместе с нанесенным
рисунком), удаления ногтевой матрицы
(после произведения серии разрезов на
ногте, электрокоагулятором или лазером
удаляется вросшая часть матрицы).
Гинекология:
Проводят локализацию
и заживление эрозивных участков шейки
матки, остроконечных кондилом и полипов
в области наружных половых органов.
Нейрохирургия:
Используют с целью
рассечения тканей, остановки кровотечения
из мелких сосудов во время операции
(прижигание для закупоривания).
Проктология:
Проводят прижигание
геморроидальных узлов.
Коагуляция | Агентство Внедрения Инновационных Технологий
Коагуляция и резание тканей
Для коагуляции и резания тканей в эндохирургии, как и в «открытой» могут использоваться различные источники энергии, например лазер (лазерная коагуляция) или высокочастотные звуковые колебания. Однако на сегодняшний день доминирующим способом борьбы с кровотечением при эндоскопических операциях является электрохирургия. Электрохирургические устройства в разное время имели различные названия, которые мы зачастую произносим, не вникая в смысл: диатермия, электронож, электрохирургический блок, электрокаутер, радионож и т.д. По сути, все это синонимы. Принцип работы этих приборов одинаковый — локальный разогрев тканей пациента за счет высокой концентрации тока на активном электроде. Это устройство давно стало атрибутом каждой операционной, и подавляющее большинство хирургов используют его практически постоянно. Однако «любовь» к коагулятору и коагуляции сочетается с известной долей недоверия, что является следствием возникающих время от времени «труднообъяснимых» осложнений, а также, периодически, недостаточной эффективностью гемостаза.
Причин неважной работы сложных приборов бывает две: неправильное использование и низкое качество. К сожалению, в подавляющем большинстве отечественных больниц установлены электрокоагуляторы, которые не только давно выработали свой ресурс, но и перестали отвечать современным требованиям безопасности таких аппаратов для пациента. Что же такое качественный коагулятор и какова область его применения? Для ответа на эти вопросы необходимо «заглянуть внутрь» прибора и, не вдаваясь в тонкости электронных схем, понять, для чего, собственно, предназначено его содержимое. Всем известно, что коагуляционный эффект возникает за счет разогрева тканей электрическим током, проходящим непосредственно через пациента (метод коагуляции). Разогрев происходит на протяжении всей цепи, однако клинически значимым он становится в области наименьшей площади проводника, а именно в месте контакта: «активный» электрод — пациент. При этом никакого вреда от прохождения тока значительной силы через пациента не наблюдается. Если так, то может быть, напрямую использовать ток, который можно получить из бытовой электрической сети? Вот здесь мы подошли к наиболее важной характеристике переменного тока — его частоте. Частота тока бытовой электросети, как известно, составляет 50Гц, т.е. 50 колебаний в секунду. При воздействии такого тока мышечная ткань успевает реагировать на электрические импульсы соответствующим количеством сокращений, что приводит к судорогам и фибрилляции, коагуляция соответственно невозможна. Чем ниже частота тока, тем выше вероятность развития такого рода осложнений. Использовать постоянный ток также не представляется возможным, в силу его однонаправленности. Такой ток вызовет электролиз тканей, и спазм всей мускулатуры организма. Таким образом, для электрохирургической коагуляции и резания можно использовать лишь высокочастотный ток.
Если так, то может быть, напрямую использовать ток, который можно получить из бытовой электрической сети? Вот здесь мы подошли к наиболее важной характеристике переменного тока — его частоте. Частота тока бытовой электросети, как известно, составляет 50Гц, т.е. 50 колебаний в секунду. При воздействии такого тока мышечная ткань успевает реагировать на электрические импульсы соответствующим количеством сокращений, что приводит к судорогам и фибрилляции, коагуляция соответственно невозможна. Чем ниже частота тока, тем выше вероятность развития такого рода осложнений. Использовать постоянный ток также не представляется возможным, в силу его однонаправленности. Такой ток вызовет электролиз тканей, и спазм всей мускулатуры организма. Таким образом, для электрохирургической коагуляции и резания можно использовать лишь высокочастотный ток.
Многолетними клиническими и экспериментальными исследованиями установлено, что приемлемой для коагуляции считается частота, начинающаяся от 20 тыс. Гц. Следовательно, чем выше частота тока, тем лучше для пациента? Это не совсем так. Дело в том, что у электрохирургического блока есть еще одна важнейшая характеристика — интенсивность утечки тока. Токи утечки, к сожалению неизбежны. Они становятся значимыми при увеличении частоты тока в колебательном контуре. Фактически высокочастотный электрокоагулятор во время работы превращается в мощный радиопередатчик, распространяя вокруг себя электромагнитные колебания — радиоволны (радиоволновая коагуляция). Чем выше частота, тем более значительна электромагнитная утечка.
Гц. Следовательно, чем выше частота тока, тем лучше для пациента? Это не совсем так. Дело в том, что у электрохирургического блока есть еще одна важнейшая характеристика — интенсивность утечки тока. Токи утечки, к сожалению неизбежны. Они становятся значимыми при увеличении частоты тока в колебательном контуре. Фактически высокочастотный электрокоагулятор во время работы превращается в мощный радиопередатчик, распространяя вокруг себя электромагнитные колебания — радиоволны (радиоволновая коагуляция). Чем выше частота, тем более значительна электромагнитная утечка.
Эфирные колебания вызывают индукционные токи во всех металлических предметах операционной, которые могут оказывать вредное воздействие на пациента при соприкосновении с ним. Например, все зажимы, удерживающие ткани в операционной ране, становятся принимающими антеннами, между ними и пассивным электродом пациента возникает электрический ток, сравнимый с током от активного электрода. Величина тока утечки зависит не только от частоты колебаний в контуре, но и от силы тока возникающего между активным и пассивным электродами. От силы тока проходящего через ткани зависит и собственно хирургический эффект, которого мы ждем от коагулятора. Чем выше разность потенциалов, которую способен воспроизвести коагулятор между электродами, тем выше сила тока протекающего через пациента. Способность прибора увеличивать разность потенциалов характеризует его мощность. Мощность электрохирургического блока должна соответствовать его назначению. Для резания тканей электродом небольшой площади при небольших вмешательствах на коже, достаточно прибора мощностью 80-100 Вт. Для эндоскопических операций, где необходим больший коагуляционный эффект, используют коагуляторы от 200 до 400 Вт. Дальнейшее наращивание мощности нецелесообразно и небезопасно, поскольку приводит к обугливанию и глубокому некрозу ткани в зоне и прогрессивному возрастанию утечки тока. В настоящее время большинство приборов для коагуляции имеет мощность 300 Вт, этого вполне достаточно для хирургических процедур, вплоть до вопаризации простаты в жидкой среде.
От силы тока проходящего через ткани зависит и собственно хирургический эффект, которого мы ждем от коагулятора. Чем выше разность потенциалов, которую способен воспроизвести коагулятор между электродами, тем выше сила тока протекающего через пациента. Способность прибора увеличивать разность потенциалов характеризует его мощность. Мощность электрохирургического блока должна соответствовать его назначению. Для резания тканей электродом небольшой площади при небольших вмешательствах на коже, достаточно прибора мощностью 80-100 Вт. Для эндоскопических операций, где необходим больший коагуляционный эффект, используют коагуляторы от 200 до 400 Вт. Дальнейшее наращивание мощности нецелесообразно и небезопасно, поскольку приводит к обугливанию и глубокому некрозу ткани в зоне и прогрессивному возрастанию утечки тока. В настоящее время большинство приборов для коагуляции имеет мощность 300 Вт, этого вполне достаточно для хирургических процедур, вплоть до вопаризации простаты в жидкой среде.
Коагуляционный и режущий эффекты зависят не только от мощности, но и от сопротивления тканей пациента. Если электронож проходит через ткани с различным электрическим сопротивлением, эффект будет различным, что приведет к неравномерности процесса и различной глубине коагуляционного повреждения. Для решения этой сложной проблемы некоторые современные электрохирургические блоки оснащаются системой компьютерного контроля и регулирования. Система компьютерного контроля и регулирования основных функций — весьма важная составляющая электрокоагулятора, обеспечивающая его эффективную и безопасную работу. Компьютер, встроенный в блок, контролирует изменение сопротивления ткани подвергаемой воздействию электроножа, и изменяет мощность прибора для сохранения достаточного эффекта. Кроме того, компьютерный процессор необходим для контроля качества соединения: пациент — электрокоагулятор. Достаточный для безопасной работы контакт пациента с пластиной, целостность изоляции проводов, отсутствие поломок прибора — вот перечень основных «обязанностей» системы компьютерного контроля. Электрокоагулятор такого класса способен самостоятельно определять неисправность, обозначая ее соответствующим кодом. Некоторые модели можно соединять по телефону через модем с сервисным центром для тестирования «не выходя из операционной». Таким образом: современный электрокоагулятор — это сложная сбалансированная эффективная хирургическая система (система коагуляции), являющаяся результатом многолетнего научного поиска, и отвечающая самым жестким критериям безопасности. При выборе прибора для своей работы необходимо руководствоваться наличием всех перечисленных составляющих, которые помогут отличить достойную технику от суррогата. Некоторые производители, давая звучные имена своей продукции, решают проблему сбыта путем создания искусственной «ниши». Например, называя приборы «радионожами», имеют в виду, что коагулятор работает на сверхвысоких частотах (принцип радиоволновой коагуляции). Такой инструмент действительно больше радиопередатчика, излучающего мощные электромагнитные потоки во всех направлениях, увеличивая риск развития осложнений и оказывая вредное воздействие.
Электрокоагулятор такого класса способен самостоятельно определять неисправность, обозначая ее соответствующим кодом. Некоторые модели можно соединять по телефону через модем с сервисным центром для тестирования «не выходя из операционной». Таким образом: современный электрокоагулятор — это сложная сбалансированная эффективная хирургическая система (система коагуляции), являющаяся результатом многолетнего научного поиска, и отвечающая самым жестким критериям безопасности. При выборе прибора для своей работы необходимо руководствоваться наличием всех перечисленных составляющих, которые помогут отличить достойную технику от суррогата. Некоторые производители, давая звучные имена своей продукции, решают проблему сбыта путем создания искусственной «ниши». Например, называя приборы «радионожами», имеют в виду, что коагулятор работает на сверхвысоких частотах (принцип радиоволновой коагуляции). Такой инструмент действительно больше радиопередатчика, излучающего мощные электромагнитные потоки во всех направлениях, увеличивая риск развития осложнений и оказывая вредное воздействие. Таким образом, рекламируемая особенность высокочастотных приборов, на самом деле является серьезным недостатком. Важно учитывать, что все разрешенные к использованию в медицинской практике электрохирургические блоки работают на радиочастоте), которая сбалансирована с другими параметрами устройства. При увеличении частоты, во избежание запредельного возрастания утечки тока, неизбежно приходится уменьшать мощность, что существенно снижает область применения такого прибора.
Таким образом, рекламируемая особенность высокочастотных приборов, на самом деле является серьезным недостатком. Важно учитывать, что все разрешенные к использованию в медицинской практике электрохирургические блоки работают на радиочастоте), которая сбалансирована с другими параметрами устройства. При увеличении частоты, во избежание запредельного возрастания утечки тока, неизбежно приходится уменьшать мощность, что существенно снижает область применения такого прибора.
Монополярная и биполярная коагуляция
Две эти разновидности электрохирургического воздействия существенно отличаются. При монополярной коагуляции и резании электрический ток проходит через все тело пациента от собственно рабочего инструмента до второго электрода — пластины, обеспечивающей широкий контакт. Рабочий электрод обычно называют «активным», а пластину «пассивным» электродом (хотя с точки зрения физики это и неправильно). Как уже отмечалось коагуляционный эффект развивается на том участке цепи, где происходит наибольшая концентрация тока. В норме это место между рабочим инструментом и тканью, но в случае изменения условий похождения тока возможно появление нежелательного коагуляционного эффекта на других участках электрической цепи, что может приводить к серьезным осложнениям после коагуляции.
В норме это место между рабочим инструментом и тканью, но в случае изменения условий похождения тока возможно появление нежелательного коагуляционного эффекта на других участках электрической цепи, что может приводить к серьезным осложнениям после коагуляции.
Например: уменьшение площади контакта на «пассивном» электроде превращает его в «активный» вызывая термическое повреждение кожи и подлежащих тканей. Известны случаи получения пациентом ожога III-IV степени вследствие неплотного прилегания пластины. Иногда на пластину кладут смоченную физиологическим раствором салфетку для улучшения контакта с неровной поверхностью, но такое решение проблемы также небезопасно поскольку, высыхая, салфетка постепенно увеличивает концентрацию тока на влажных участках и вызывает тем самым термическое повреждение.
Радикальным решением проблемы скорее всего является использование электрокоагуляторов оборудованных так называемой REM системой. Суть ее заключается в том, что прибор постоянно измеряет сопротивление на пластине пациента, которая представляет собой гибкий электрод, покрытый клейким токопроводящим слоем. Как только сопротивление возрастает до опасных величин, коагулятор подает звуковой сигнал и отключается. Электрический ток течет через организм по пути наименьшего сопротивления, поэтому, встречая на своем пути металлические предметы, ток концентрируется в них. Очень опасно в связи с этим, коагулировать, например, в непосредственной близости от механического скрепочного шва. Токи, возникающие в скрепках, вызывают коагуляционный эффект и могут привести к несостоятельности швов в послеоперационном периоде.
Как только сопротивление возрастает до опасных величин, коагулятор подает звуковой сигнал и отключается. Электрический ток течет через организм по пути наименьшего сопротивления, поэтому, встречая на своем пути металлические предметы, ток концентрируется в них. Очень опасно в связи с этим, коагулировать, например, в непосредственной близости от механического скрепочного шва. Токи, возникающие в скрепках, вызывают коагуляционный эффект и могут привести к несостоятельности швов в послеоперационном периоде.
Небезразлична монополярная электрохирургия и для пациентов с имплантированными металлическими суставами. Разогрев протеза во время операции, может вызвать денатурацию белка фиксирующей кости, что в дальнейшем способствует «разбалтыванию» сустава. Наконец существует еще одно грозное осложнение, возникновение которого не исключено при использовании электрокоагулятора низкого качества. Это емкостной пробой. Дело в том, что два электрода, имеющие разность потенциалов и разделенные слоем диэлектрика, являются электрическим конденсатором. В нашем случае между электродами находится пациент, который хотя и является токопроводящей средой, при определенных условиях может весьма затруднять прохождение электрических зарядов. Например, при длительной коагуляции одного и того же участка ткань высыхает и приобретает свойства диэлектрика. При очень высоком сопротивлении тканей происходит накопление заряда на электродах, точно также как и на пластинах конденсатора. Если отсутствие достаточного коагуляционного эффекта на высохшей ткани побуждает хирурга к неадекватному увеличению мощности электрохирургического блока, величина накопленного заряда возрастает до тех пор, пока не происходит пробой через тело пациента.
В нашем случае между электродами находится пациент, который хотя и является токопроводящей средой, при определенных условиях может весьма затруднять прохождение электрических зарядов. Например, при длительной коагуляции одного и того же участка ткань высыхает и приобретает свойства диэлектрика. При очень высоком сопротивлении тканей происходит накопление заряда на электродах, точно также как и на пластинах конденсатора. Если отсутствие достаточного коагуляционного эффекта на высохшей ткани побуждает хирурга к неадекватному увеличению мощности электрохирургического блока, величина накопленного заряда возрастает до тех пор, пока не происходит пробой через тело пациента.
Сила тока в момент пробоя достигает огромной величины, и вызывает термическое повреждение тканей на всем пути электрического разряда. Биполярная электрохирургия более безопасна в связи с тем, что ток в этом случае течет только между браншами рабочего инструмента, и такие осложнения как ожоги на пластине пациента и емкостной пробой исключены в принципе. Однако область применения биполяра довольно узкая, так как при биполярном режиме отсутствует возможность резания тканей, за исключением прибора Trimax, который разрезает ткань после коагуляции обычным лезвием. Правда, периодически появляются разработки вроде биполярных ножниц, но они до сих пор не получили большого распространения ввиду технического несовершенства. Кроме того, для получения коагуляционного эффекта необходимо захватить ткань между браншами инструмента, что не всегда возможно. Тем не менее биполярный коагулятор практически незаменим, когда необходима продолжительная и локальная коагуляция, например обработка широкой связки матки при гистерэктомии. При этой процедуре анатомическая структура целиком располагается между браншами инструмента и коагулируется на всю глубину, без распространения эффекта на окружающие ткани.
Однако область применения биполяра довольно узкая, так как при биполярном режиме отсутствует возможность резания тканей, за исключением прибора Trimax, который разрезает ткань после коагуляции обычным лезвием. Правда, периодически появляются разработки вроде биполярных ножниц, но они до сих пор не получили большого распространения ввиду технического несовершенства. Кроме того, для получения коагуляционного эффекта необходимо захватить ткань между браншами инструмента, что не всегда возможно. Тем не менее биполярный коагулятор практически незаменим, когда необходима продолжительная и локальная коагуляция, например обработка широкой связки матки при гистерэктомии. При этой процедуре анатомическая структура целиком располагается между браншами инструмента и коагулируется на всю глубину, без распространения эффекта на окружающие ткани.
Бесконтактная электрокоагуляция
Как известно, при непосредственном контакте коагулирующего электрода с тканью возникает эффект «приваривания». Образующийся струп прилипает к электроду и отрывается при удалении последнего. Для предотвращения подобного эффекта, а также для увеличения площади обрабатываемой поверхности существуют специальные режимы бесконтактной коагуляции, которые обычно называют спрей-коагуляцией, или фульгурацией. Суть метода заключается в прохождении электрического тока через небольшую (до 3 мм) воздушную постройку между рабочим электродом и тканью.
Образующийся струп прилипает к электроду и отрывается при удалении последнего. Для предотвращения подобного эффекта, а также для увеличения площади обрабатываемой поверхности существуют специальные режимы бесконтактной коагуляции, которые обычно называют спрей-коагуляцией, или фульгурацией. Суть метода заключается в прохождении электрического тока через небольшую (до 3 мм) воздушную постройку между рабочим электродом и тканью.
Однако использование спрей-коагуляции при эндоскопических операциях не всегда безопасно. Дело в том, что для получения электрической искры требуется увеличение мощности коагулятора до 100-120 Вт, что приводит к возрастанию токов утечки, кроме того, особенностью эндохирургического рабочего электрода является его непосредственное соприкосновение со стенкой операционной полости. При наличии даже незначительных дефектов изоляции инструмента в процессе использования спрей-коагуляции может произойти ее пробой, поскольку величина электрического сопротивления воздушной прослойки и изоляции инструмента сопоставимы.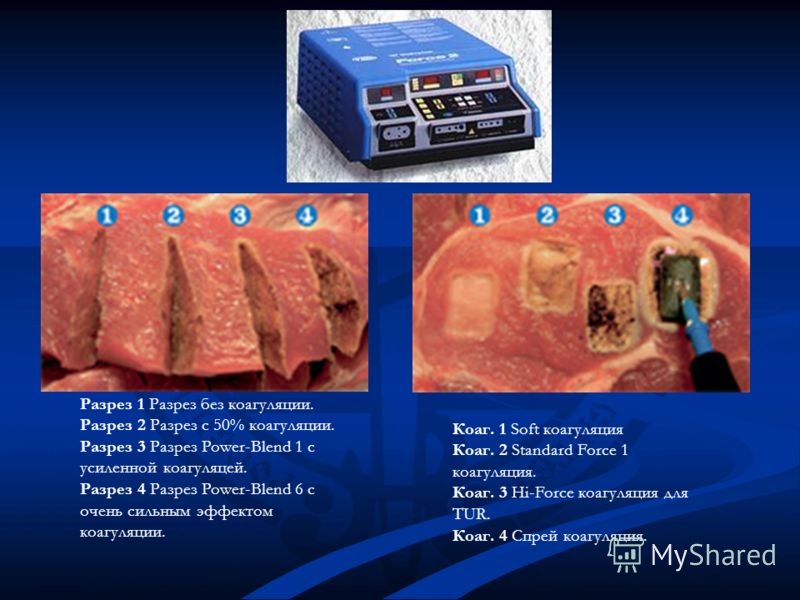 Для предотвращения осложнений при бесконтактной коагуляции мы рекомендуем использовать специальную приставку к электрохирургическому блоку подающую инертный газ аргон непосредственно к рабочему электроду. Под воздействием электрического тока аргон легко ионизируется и даже на небольшой мощности проводит коагулирующий ток. Поток аргоновой плазмы позволяет удалять рабочий электрод от коагулируемой поверхности на расстояние 1,5-2 см, что увеличивает площадь воздействия на ткани. Кроме того, аргон-усиленная коагуляция весьма поверхностна. Проникновение коагуляционного некроза в ткани не превышает десятых долей миллиметра. Учитывая это обстоятельство, этот вид бесконтактной электрокоагуляции лучше всего использовать для обработки больших поверхностей при диффузном кровотечении (например, паренхиматозные органы).
Для предотвращения осложнений при бесконтактной коагуляции мы рекомендуем использовать специальную приставку к электрохирургическому блоку подающую инертный газ аргон непосредственно к рабочему электроду. Под воздействием электрического тока аргон легко ионизируется и даже на небольшой мощности проводит коагулирующий ток. Поток аргоновой плазмы позволяет удалять рабочий электрод от коагулируемой поверхности на расстояние 1,5-2 см, что увеличивает площадь воздействия на ткани. Кроме того, аргон-усиленная коагуляция весьма поверхностна. Проникновение коагуляционного некроза в ткани не превышает десятых долей миллиметра. Учитывая это обстоятельство, этот вид бесконтактной электрокоагуляции лучше всего использовать для обработки больших поверхностей при диффузном кровотечении (например, паренхиматозные органы).
По той же причине не следует добиваться остановки кровотечения из крупного сосуда потоком аргоновой плазмы. Блок подачи аргона, предназначенный для эндохирургических операций, имеет специальный датчик контроля давления в операционной полости. Блок соединяется с троакаром дополнительной магистральной трубкой, и при превышении допустимого давления автоматика отключает подачу газа.
Блок соединяется с троакаром дополнительной магистральной трубкой, и при превышении допустимого давления автоматика отключает подачу газа.
Ультразвуковая коагуляция и резание тканей
Наличие определенных проблем и условий использования электрического тока для остановки кровотечений в ходе операции, заставляет искать альтернативные способы коагуляции и резания. Один из таких способов — воздействие на ткани ультразвуковыми колебаниями с частотой 55,5 kHz, которая специально подобрана для оказания деструктивного денатурирующего эффекта на ткани без вредного воздействия на организм в целом. Специальный ультразвуковой генератор соединяется с инструментом, выполненным в виде ножниц или шарика. Эффект ультразвукового воздействия по качеству приближается к таковому при электрохирургическом способе, что делает такой прибор незаменимым при наличии прямых противопоказаний к использованию монополярной коагуляции (например, искусственный водитель ритма).
Ультразвуковое воздействие обладает рядом неоспоримых преимуществ перед электрохирургией: во время коагуляции и резания нет дыма, и в атмосферу операционной полости не выделяются вредные продукты горения. Пар, который образуется при коагуляции, не требует эвакуации, поскольку оседает самопроизвольно за короткое время. Диаметр сосудов, которые можно закрыть при помощи ультразвукового воздействия достигает 3 мм, что ощутимо больше, чем при работе с коагулятором. Благодаря такой эффективности ультразвуковой прибор может быть использован для массивных мобилизаций (например, при гемиколэктомии), без привлечения дополнительных кровоостанавливающих средств. Кроме того, ультразвуковые ножницы позволяют сначала захватывать порцию ткани и лишь затем ее пересекать, что является дополнительной гарантией безопасности.
LigaSure™ Vessel Sealing System — генератор для электролигирования сосудов
В конце 1999 г. компания «Валлилаб» представила миру принципиально новый способ электрохирургического воздействия на ткани. Генератор и новые инструменты к нему получили название LigaSure™ Vessel Sealing System. Напомним, что электрохирургический гемостаз — это монополярная или биполярная коагуляция сосудов, диаметром до 1,5 мм. При этом сосуд с небольшим участком ткани интенсивно высушивают вместе с находящейся в нем кровью. Эта достаточно хрупкая субстанция (коагулят) не слишком прочно связана с подлежащими тканями, и часто присыхает к коагулирующему инструменту. Отрывание инструмента от ткани может приводить к продолжению кровотечения. Электрохирургическое воздействие осуществляют малыми переменными токами (десятые доли ампера), и разным электрическим напряжением (большое, несколько тысяч вольт — монополярная коагуляция; небольшое — 300-800 W при биполярной коагуляции). Первое отличие LigaSure™ от традиционной электрохирургии состоит в иных электрических характеристиках. Способ воздействия — биполярный. Сила тока очень большая — 4 ампера. Напряжение напротив очень низкое — 180 вольт. Второе — у подаваемого переменного тока нет стандартных модуляций.
Генератор и новые инструменты к нему получили название LigaSure™ Vessel Sealing System. Напомним, что электрохирургический гемостаз — это монополярная или биполярная коагуляция сосудов, диаметром до 1,5 мм. При этом сосуд с небольшим участком ткани интенсивно высушивают вместе с находящейся в нем кровью. Эта достаточно хрупкая субстанция (коагулят) не слишком прочно связана с подлежащими тканями, и часто присыхает к коагулирующему инструменту. Отрывание инструмента от ткани может приводить к продолжению кровотечения. Электрохирургическое воздействие осуществляют малыми переменными токами (десятые доли ампера), и разным электрическим напряжением (большое, несколько тысяч вольт — монополярная коагуляция; небольшое — 300-800 W при биполярной коагуляции). Первое отличие LigaSure™ от традиционной электрохирургии состоит в иных электрических характеристиках. Способ воздействия — биполярный. Сила тока очень большая — 4 ампера. Напряжение напротив очень низкое — 180 вольт. Второе — у подаваемого переменного тока нет стандартных модуляций. Они зависят от тканевого ответа. Третье и главное — изучение тканевого ответа построено на электронной системе слежения за импедансом тканей (Instant Responce™) больного под рабочим электродом (электродами), с соответствующей корректировкой выхода. Instant Responce™ позволяет 200 раз в секунду проверить сопротивление, подкорректировать подаваемую энергию, завершить подачу. Затем этот цикл повторяется. После того как постепенно изменяющиеся электрические характеристики тканей будут соответствовать «портрету» надежно запечатанного сосуда, воздействие автоматически прекращается. Каждая обработка сосуда занимает по времени от 2 до 6 с (в среднем около 5 с).
Они зависят от тканевого ответа. Третье и главное — изучение тканевого ответа построено на электронной системе слежения за импедансом тканей (Instant Responce™) больного под рабочим электродом (электродами), с соответствующей корректировкой выхода. Instant Responce™ позволяет 200 раз в секунду проверить сопротивление, подкорректировать подаваемую энергию, завершить подачу. Затем этот цикл повторяется. После того как постепенно изменяющиеся электрические характеристики тканей будут соответствовать «портрету» надежно запечатанного сосуда, воздействие автоматически прекращается. Каждая обработка сосуда занимает по времени от 2 до 6 с (в среднем около 5 с).
Не менее важной должна считаться четвертая характерная особенность LigaSure: электрическое воздействие сочетается с постоянным давлением на ткани. Оно реализуется эластичностью инструмента-зажима и обязательным защелкиванием кремальеры. Несоблюдение этого правила не только удлиняет воздействие, делает его менее качественным, но и существенно увеличивает боковое распространение тепла, повреждающего окружающие ткани. Система LigaSure™ не коагулирует, а заваривает сосуд. Ткани не пересушиваются. Коллаген и эластин сосудистой стенки превращаются в гомогенную субстанцию. Фактически они расплавляются и затвердевают в процессе воздействия. Заваренное (запечатанное, запломбированное, электролигированное) место — это тонкая полупрозрачная пластина, повторяющая по форме рабочую поверхность браншей инструмента. Прочность «заклеенной зоны», состоящей из частично денатурированного протеина, сопоставима с прочностью прошитой ткани. Эту «пластиковую» пломбу пересекают ножницами.
Система LigaSure™ не коагулирует, а заваривает сосуд. Ткани не пересушиваются. Коллаген и эластин сосудистой стенки превращаются в гомогенную субстанцию. Фактически они расплавляются и затвердевают в процессе воздействия. Заваренное (запечатанное, запломбированное, электролигированное) место — это тонкая полупрозрачная пластина, повторяющая по форме рабочую поверхность браншей инструмента. Прочность «заклеенной зоны», состоящей из частично денатурированного протеина, сопоставима с прочностью прошитой ткани. Эту «пластиковую» пломбу пересекают ножницами.
Генератор LigaSure™ получил разрешение Американского комитета по контролю качества лекарственных средств и пищевых продуктов (FDA) для использования на изолированных артериях и венах диаметром до 7 мм, а также на прядях тканей. Система позволяет свести до минимума прилипание ткани к браншам, обугливание и термическое повреждение близлежащих тканей. Возможность работать, не выделяя сосуды из окружающих тканей, позволяет существенно сократить время, необходимое для мобилизации. Компьютер Использование компьютерного контроля правильности и стабильности работы приборов, входящих в эндохирургический комплекс, — новая тенденция. Технология такого контроля пока недостаточно продуманна. Однако сама идея весьма прогрессивна.
Компьютер Использование компьютерного контроля правильности и стабильности работы приборов, входящих в эндохирургический комплекс, — новая тенденция. Технология такого контроля пока недостаточно продуманна. Однако сама идея весьма прогрессивна.
Физические методы диссекции и коагуляции тканей в торакоскопической хирургии Текст научной статьи по специальности «Клиническая медицина»
Б.Н. КОТИВ, А.П. ЧУПРИНА, Д.А. ЯСЮЧЕНЯ, Д.М. МЕЛЬНИК, Д.С. ШЕЛЕГЕТОВ, В.И. ИОНЦЕВ
ФИЗИЧЕСКИЕ МЕТОДЫ ДИССЕКЦИИ И КОАГУЛЯЦИИ ТКАНЕЙ В ТОРАКОСКОПИЧЕСКОЙ ХИРУРГИИ
ФГВОУ ВПО «Военно-медицинская академия им. С.М. Кирова» МО РФ
Российская Федерация
Цель. Изучение возможности практического использования различных физических методов дис-секции и коагуляции тканей в торакоскопической хирургии, определение показаний к их применению.
Материал и методы. В серии экспериментов на 25 беспородный собаках показана эффективность использования ультразвука, аргонусиленной и холодноплазменной коагуляции в достижении надежного аэрогемостаза при резекции ткани легкого. В клинической части исследования продемонстрирована возможность использования физических методов диссекции и коагуляции тканей при видеоторакоскопиче-ских вмешательствах у 209 пациентов с неверифицированными диссеминированными процессами и периферическими образованиями в легких, лимфаденопатией и новообразованиями средостения.
Результаты. Диссекция и коагуляция легочной ткани с помощью ультразвуковым ножниц обеспечивает надежный гемостаз и герметичность раны легкого. Из числа электрохирургических методов холод-ноплазменная коагуляция обладает наиболее поверхностным воздействием на ткани. В клинической части исследования диагностические операции выполнены у 140 пациетов, с лечебной целью — 69 вмешательств. Во всех случаях торакоскопическая резекция легкого, биопсия лимфоузлов и новообразований средостения оказались информативными. Осложнения в послеоперационном периоде развились у 15 (7%) пациентов. Летальный исходов не бышо. Средний срок пребывания в стационаре составил 6,3±0,4 суток.
Во всех случаях торакоскопическая резекция легкого, биопсия лимфоузлов и новообразований средостения оказались информативными. Осложнения в послеоперационном периоде развились у 15 (7%) пациентов. Летальный исходов не бышо. Средний срок пребывания в стационаре составил 6,3±0,4 суток.
Заключение. Ультразвуковая атипичная резекция легкого может применяться при торакоскопиче-ских операциях по поводу периферических образований легкого и диссеминированныи процессов. Препаровка анатомических образований средостения и элементов корня легкого может быть проведена с помощью ультразвукового диссектора, а использование холодноплазменной коагуляции для гемостаза вблизи крупных сосудов средостения и корня легкого является наиболее поверхностным и безопасным видом электрохирургического воздействия.
Ключевые слова: диссеминированные процессы легких, периферические образования легких, лимфаденопа-тия, новообразования средостения, торакоскопия, ультразвук, холодноплазменная коагуляция, аргонусиленная коагуляция
Objectives. To investigate the possibility of practical use of different physical methods of tissue dissection and coagulation in thoracoscopic surgery, to determine the indications for their application.
To investigate the possibility of practical use of different physical methods of tissue dissection and coagulation in thoracoscopic surgery, to determine the indications for their application.
Methods. The efficiency of ultrasound, argon enhanced and cold plasma coagulation to achieve a safe aero-haemostasis for resection of the lung tissue was demonstrated in the series of experiments on 25 mongrel dogs. The possibility of using these physical methods of tissue dissection and coagulation in video-assisted thoracic surgery was shown in 209 patients with the non-verified disseminated processes, lymphadenopathy and mediastinum neoplasms during the clinical part of this study.
Results. Ultrasonic lung tissue dissection and coagulation permit to achieve a safe aerohaemostasis and the lung wound hermeticity. Cold plasma coagulation is the most superficial mode of electrosurgical exposure. 140 patients had diagnostic surgery and 69 operations performed with curative intent during the study. Thoracoscopic lung resection, biopsy of mediastinal lymph nodes and neoplasms were informative in all cases. Postoperative complications occurred in 15 (7%) patients. There were no lethal outcomes. The average duration of hospitalization made up 6,3±0,4 days.
140 patients had diagnostic surgery and 69 operations performed with curative intent during the study. Thoracoscopic lung resection, biopsy of mediastinal lymph nodes and neoplasms were informative in all cases. Postoperative complications occurred in 15 (7%) patients. There were no lethal outcomes. The average duration of hospitalization made up 6,3±0,4 days.
Conclusions. Thoracoscopic ultrasonic atypical lung resection can be performed in patient with peripheral lung nodules and disseminated processes. Dissection of mediastinal anatomic structures and elements of the lung root should be performed with ultrasonic dissector; cold plasma coagulation for hemostasis near the large vessels of mediastinum and lung root is the most superficial and safest mode of electrosurgical exposure.
Keywords: diffuse parenchymal lung disease, periferalpulmonary lesion, lymphadenopathy, mediastinal neoplasm, thoracoscopy, ultrasound, cold plasma coagulation, argon intensified coagulation
Введение ские, так и лечебные возможности торакоско-
пического метода непосредственно связаны с
По данным ведущих торакальных стацио- внедрением в клиническую практику новых
наров сегодня в мире более 50% оперативных оперативных приемов, аппаратуры и физиче-
вмешательств на органах грудной полости вы- ских методов диссекции и коагуляции тканей.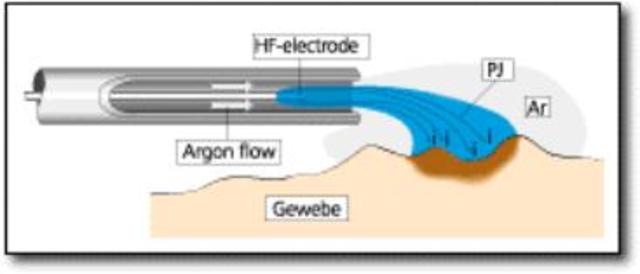
полняется с применением видеоторакоскопии По сути дела, развитие хирургической техни-
[1, 2, 3, 4, 5, 6]. При этом как диагностиче- ки в большинстве отраслей хирургии в тече-
ние многих десятилетий идет в направлении повышения надежности способов рассечения и соединения тканей, а следовательно — герметизации поверхности полого или паренхиматозного органа [7, 8]. Эндоскопический сшивающий аппарат, появление которого сыграло решающую роль в развитии торако-скопического метода, не стал универсальным способом рассечения и соединения тканей в минимально инвазивной хирургии груди. Традиционная электрокоагуляция и диссекция также не лишена недостатков. К ним относится повреждение тканей на удалении от зоны воздействия, что особенно актуально при манипуляциях вблизи крупных сосудов и нервов. Другим недостатком является низкая эффективность метода в достижении гемостаза при кровотечении из сосудов более 2 мм в диаметре [3, 9]. Поиск и внедрение в рутинную практику торакоскопии новых способов диссекции и коагуляции тканей — актуальная проблема современной торакальной хирургии.
Поиск и внедрение в рутинную практику торакоскопии новых способов диссекции и коагуляции тканей — актуальная проблема современной торакальной хирургии.
Цель исследования: изучение возможности практического использования различных физических методов диссекции и коагуляции тканей в торакоскопической хирургии, определение показаний к их применению.
Материал и методы
В серии экспериментов на 25 беспородных собаках изучена морфология раны легкого и ее герметичность при использовании стандартной электрокоагуляции (ЭК), холод-ноплазменной коагуляции (ХПК), коагуляции в среде аргона (аргонусиленная коагуляция — АУК) и ультразвуковых ножниц. Содержание и использование лабораторных животных соответствовало правилам, принятым в Военно-медицинской академии им. С.М. Кирова, рекомендациям национального совета по исследованиям, национальным законам.
Под общим обезболиванием с интубацией трахеи и искусственной вентиляцией легких у животных выполняли заднебоковую тора-котомию и резекцию участка легкого с последующей коагуляцией дефекта паренхимы с использованием холодной плазмы в первой группе (7 животных), коагуляцией в среде аргона — во второй (8 животных), в третьей группе (7 животных) резекция ткани легкого производилась с помощью ультразвуковых ножниц без дополнительных электрохирургических воздействий.
На начальном этапе эксперимента (3 животных) для остановки кровотечения из раны легкого использовали ЭК. Однако при этом
способе воздействия не удавалось достичь устойчивого аэростаза и в дальнейшем ЭК для этих целей мы не применяли. После расправления легкого производили дренирование плевральной полости и ушивание торакотом-ной раны.
У всех животных проводили макроскопическую оценку тканей легкого в зоне воздействия ХПК, АУК и ультразвуковых ножниц, а также забирали материал для морфологического исследования на 1, 7, 14, 21 сутки после операции путем выведения животных из эксперимента.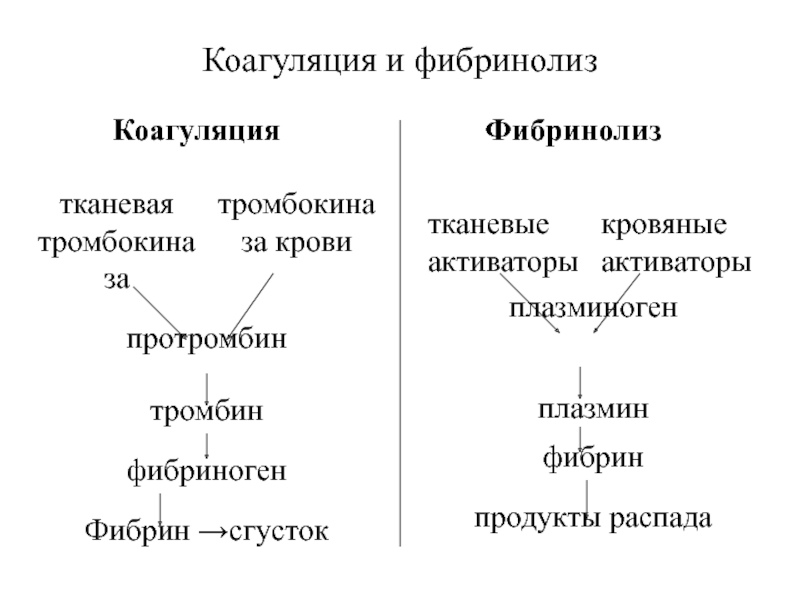 Морфологические изменения легочной ткани, степень сохранности ультраструктурных компонентов легочной паренхимы оценивали на полутонких и ультратонких срезах при различных увеличениях. Использованы фотомикроскоп «Opton» (Германия) и электронный микроскоп «Hitachi C 300» (Япония).
Морфологические изменения легочной ткани, степень сохранности ультраструктурных компонентов легочной паренхимы оценивали на полутонких и ультратонких срезах при различных увеличениях. Использованы фотомикроскоп «Opton» (Германия) и электронный микроскоп «Hitachi C 300» (Япония).
В клинической части исследования ультразвуковая диссекция и коагуляция использована в ходе видеоторакоскопических оперативных вмешательств у 209 пациентов: при энуклеации субплевральных доброкачественных опухолей у 11 человек, атипичной резекции легкого у 68 пациентов с неверифицированны-ми диссеминированными процессами (ДПЛ) и периферическими образованиями (ПОЛ) в легких — 39 и 29 случаев соответственно, биопсии лимфоузлов средостения и корня легкого у 87 пациентов с лимфаденопатией, удаления новообразований средостения у 43 пациентов. Из них диагностическими были 140 операций, с лечебной целью выполнены 34 вмешательства у пациентов с ПОЛ и 35 операций у пациентов с медиастинальными опухолями.
Среди пациентов было 150 (72%) мужчин и 59 (28%) женщин. Средний возраст пациентов составил 52,5±2,6 лет (41,6±3,8 лет у мужчин и 54,1±2,9 лет у женщин). Всем пациентам с данной патологией в предоперационном периоде проводилось обследование по общепринятой схеме, включавшей лабораторное обследование, рентгенографию, компьютерную томографию (КТ) и др. Всем пациентам выполнялась фибробронхоскопия и оценка возможности выполнения чрезбронхиальной биопсии и трансторакальной биопсии под контролем рентгеноскопии или КТ. Неинформативность или невозможность выполнения указанных малоинвазивных вмешательств считали показанием к диагностической операции из торако-скопического доступа по стандартной методике. Атипичная резекция легкого выполнялась с использованием ультразвуковых ножниц. Надежность герметизации легочной паренхимы в ходе операции контролировали с использова-
нием избыточного давления в контуре аппарата искусственной вентиляции легких до 30 мм рт. ст. Объем резецированного участка легочной ткани составил в максимальных значениях 9 см3. При новообразованиях и лимфаденопа-тиях (ЛАП) препаровка тканей средостения и анатомических образований корня легкого выполнялась с помощью ультразвукового диссектора и/или ножниц. Полученный в ходе тора-коскопической операции материал направляли для гистологического исследования: при ДПЛ, ЛАП и новообразованиях средостения — в плановом порядке, при ПОЛ — в срочном.
ст. Объем резецированного участка легочной ткани составил в максимальных значениях 9 см3. При новообразованиях и лимфаденопа-тиях (ЛАП) препаровка тканей средостения и анатомических образований корня легкого выполнялась с помощью ультразвукового диссектора и/или ножниц. Полученный в ходе тора-коскопической операции материал направляли для гистологического исследования: при ДПЛ, ЛАП и новообразованиях средостения — в плановом порядке, при ПОЛ — в срочном.
Показаниями к применению ХПК были: достижение аэрогемостаза при биопсии легочной ткани, энуклеации периферических образований в легких, остановка кровотечения при манипуляциях вблизи крупных сосудов. Аргонусиленную коагуляцию применяли для достижения гемостаза при вмешательствах на средостении вне близости крупных сосудистых структур и нервов и для остановки кровотечения из мягких тканей грудной стенки.
Эксперименты и клиническая часть работы выполнены с применением аппаратов СРС-2000, лгбо-зооо, Эопоса-400 (Ббпод, Германия).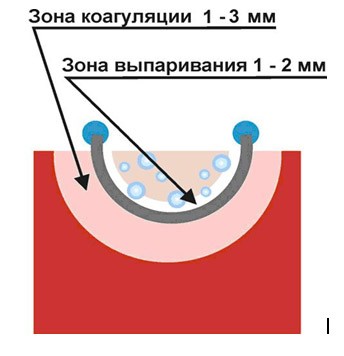
Результаты и обсуждение
Образцы легочной ткани, обработанные ХПК, характеризовались относительно небольшими по протяженности зонами струпа и некроза: от 0,1 до 0,3 мм и от 0,4 до 0,6 мм соответственно. Струп при ХПК плотно соединялся с подлежащими некротизированными тканями. Граница между струпом и зоной некроза была четко выражена (ровная и непрерывная). Обращала на себя внимание большая плотность струпа при ХПК по сравнению с АУК, особенно в его нижней части, соседствующей с зоной некроза, а также большая плотность примыкающих к нему некротизированных тканей (рис. 1 а). Толщина струпа при АУК составляла в среднем от 0,2 до 0,6 мм. Толщина зоны некроза колебалась от 0,5 до 1,2 мм. На гистологических препаратах легкого струп при АУК был представлен более фрагментарно (рис. 1 б), по сравнению с ХПК и коагуляцией ультразвуковыми ножницами (рис. 2, см. цв. вкладыш). Подлежащие некротизированные ткани при АУК не образовывали четко выраженной зоны. Они были разъединены. Граница между струпом и некрозом, таким образом, выглядела изломанной и с разрывами.
Они были разъединены. Граница между струпом и некрозом, таким образом, выглядела изломанной и с разрывами.
Как при ХПК, так и при АУК на некотором удалении от зоны некроза располагалась
особая зона геморрагического пропитывания тканей (рис. 3, см. цв. вкладыш). Отдельные локусы тканей с геморрагическим пропитыванием также встречались и на удалении от места воздействия.
Спустя 2 недели после обработки раны легкого, выявлены разрастания соединительной ткани. В зоне резорбции струпа, состоящей преимущественно из пучков коллагено-вых волокон, отмечалось незначительное содержание фибробластов. На месте некроза образовалась уплотненная зона соединительной ткани с преобладанием клеточных элементов над волокнами. На участке геморрагического пропитывания определялась уплотненная зона, в которой можно было выделить 2 слоя: с преобладанием клеточных элементов и с преобладанием коллагеновых волокон (рис. 4, см. цв. вкладыш). Более плотный струп образовывался после применения ультразвуковых ножниц и ХПК. Он резорбировался медленнее, чем струп при АУК. Через 3 недели после ХПК наиболее плотные фрагменты струпа, не рассасываясь, погружались в толщу соединительной ткани, разросшейся на месте воздействия. После АУК уже через 2 недели струп почти полностью замещался соединительной тканью, сохранялись лишь отдельные его участки, которые позднее также резорбирова-лись (рис. 5 а, б, см. цв. вкладыш).
4, см. цв. вкладыш). Более плотный струп образовывался после применения ультразвуковых ножниц и ХПК. Он резорбировался медленнее, чем струп при АУК. Через 3 недели после ХПК наиболее плотные фрагменты струпа, не рассасываясь, погружались в толщу соединительной ткани, разросшейся на месте воздействия. После АУК уже через 2 недели струп почти полностью замещался соединительной тканью, сохранялись лишь отдельные его участки, которые позднее также резорбирова-лись (рис. 5 а, б, см. цв. вкладыш).
Рис. 1. Структура струпа при различных видах коагуляции: а — ХПК; б — АУК. Полутонкий срез. Окраска метиленовым синим. Ув.*200
Рис. 2. (к статье Б.Н. Котива с соавт.)
Морфология легочной ткани после резекции ультразвуковыми ножницами. Полутонкий срез: 1 — Первая зона — струп; 2 — Вторая зона — диффузное повреждение легочной ткани; 3 — Третья зона — частично поврежденная легочная ткань. Окраска метиленовым синим. Ув.*200
Окраска метиленовым синим. Ув.*200
А
л
Я А вн
Ц м
Яр/Л1
| ■ шжЖ1
Рис. 5. (к статье Б.Н. Котива с соавт.)
Резорбция струпа через 2-3 недели после коагуляции после АУК; Б — через 3 недели после ХПК. Окраска
Рис. 3. (к статье Б.Н. Котива с соавт.)
Изменения в тканях легкого, происходящие сразу после коагуляции (ХПК): С — струп; Н — зона некроза; ГП — зона геморрагического пропитывания тканей, расположенная на некотором удалении от зоны некроза. Окраска гематоксилин-эозином. Ув.*200
Ув.*200
Рис. 4. (к статье Б.Н. Котива с соавт.)
Изменения в тканях легкого через 2 недели после коагуляции (АУК): 1 — зона резорбции струпа; С — остатки струпа; 2 — уплотненная зона на месте зоны некроза; 3 — уплотненная зона на месте участка геморрагического пропитывания: а — с преобладанием клеточных элементов; б — с преобладанием колла-геновых волокон. Окраска гематоксилин-эозином.
Ув.х200 Б
** > ‘Л «
.. ■ * 4 к < * ЛГ
(стрелками указаны фрагменты струпа): А — через 2 недели гематоксилин-эозином.
*
■I < Ш 1′ ,
Рис. 6. Ткань легкого после обработки ультразвуковыми ножницами. Зона струпа: КВ — сохраненные коллагеновые волокна; * — разрушенные клеточные элементы. Электронограмма. Ув.*5000
6. Ткань легкого после обработки ультразвуковыми ножницами. Зона струпа: КВ — сохраненные коллагеновые волокна; * — разрушенные клеточные элементы. Электронограмма. Ув.*5000
Таким образом, при коагуляции в среде аргона образуется рыхлый струп, который легко отделяется от коагулированной поверхности, приводя к потере герметичности легочной паренхимы. При ХПК образовавшийся струп имеет более плотное строение и прочно спаян с подлежащей некоагулированной легочной тканью, что обеспечивает длительный надежный аэрогемостаз. Указанные положительные качества струпа, получаемого при ХПК, сохраняются до 15 суток.
Исследование раны легкого после ультразвукового воздействия выявило ее морфологические особенности, прежде всего минимальное повреждающее действие на паренхиму. Проявленный нами интерес к данному факту реализовался в углубленном морфологическом исследовании на электронно-микроскопическом уровне. В результате выявлена
В результате выявлена
Рис. 8. Ткань легкого после обработки ультразвуковыми ножницами. Сохранные нервные волокна и кровеносный сосуд соседствуют с поврежденными участками легочной ткани: МО — миелиновая оболочка; Ак — аксоны нейронов; * — разрушенные клеточные элементы. Электронограмма. Ув.*5000
Рис. 7. Ткань легкого после обработки ультразвуковыми ножницами. Зона диффузного повреждения легочной ткани: Ал — альвеоцит; БМ — базальная мембрана; Эн — эндотелиоцит; ПК — просвет капилляра; ПА — полость альвеолы; Эр — эритроцит. Электронограмма. Ув.*5000
определенная зональность раны легкого после воздействия ультразвуковых ножниц (рис. 2). Первая зона (струп) характеризовалась отсутствием клеточных элементов. В ней были различимы только коагулированные соединительнотканные волокна (рис. 6). Во второй зоне (диффузное повреждение легочной ткани), кроме сохранения соединительнотканных волокон выявлялись единичные фибробласты. В третьей зоне (частично поврежденная легочная ткань) наблюдались как интактные участки ткани легкого, так и участки с различной степенью альтерации (рис. 7). Изменения ми-елиновых нервных волокон не отмечали (рис. 8). Струп выглядел ровным и непрерывным на всем протяжении. Гемостатический эффект ультразвуковых ножниц проявлялся тромбозом кровеносных сосудов без существенных изменений их стенки (рис. 9). Отсутствие не-
В третьей зоне (частично поврежденная легочная ткань) наблюдались как интактные участки ткани легкого, так и участки с различной степенью альтерации (рис. 7). Изменения ми-елиновых нервных волокон не отмечали (рис. 8). Струп выглядел ровным и непрерывным на всем протяжении. Гемостатический эффект ультразвуковых ножниц проявлялся тромбозом кровеносных сосудов без существенных изменений их стенки (рис. 9). Отсутствие не-
Рис. 9. Ткань легкого после обработки ультразвуковыми ножницами. Стенки капилляров не изменены: Кап — капилляр; Эр — эритроцит; Ал — альвеоцит (с признаками повреждения). Электронограмма. Ув.*5000
кроза стенки сосуда, безусловно, относится к положительным сторонам ультразвукового способа рассечения ткани легкого. В отличие от струпа, образовавшегося в результате электрохирургических воздействий (электрокоагуляция, коагуляция в среде аргона) при ультразвуковом воздействии, он прочно связан с подлежащей легочной тканью за счет сохранения неповрежденных соединительнотканных волокон.
Основным преимуществом описываемого ультразвукового воздействия, выявляемым морфологически, является отсутствие значительной по толщине зоны некроза ткани, а также надежный гемостатический эффект, проявляющийся в виде тромбоза сосудов на протяжении без некроза сосудистой стенки. Именно эта характеристика раны, образовавшейся в результате ультразвукового воздействия обеспечивает механическую прочность раневой поверхности, надежный гемостатический эффект и полноценную герметизацию легочной паренхимы (аэростаз). Изучение морфологии струпа, образовавшегося после ультразвукового воздействия, в отдаленные сроки (7-14 сут.) выявило пролиферацию фибробластов в зоне, граничащей с зоной струпа и появление там значительного количества соединительнотканных волокон.
В клинической части исследования выполнена оценка эффективности использования ультразвука, ХПК и АУК в достижении надежного аэрогемостаза при видеоторако-скопических операциях у пациентов с не-верифицированными диссеминированными процессами и периферическими образованиями в легких, при препаровке медиастиналь-ных анатомических образований и элементов корня легкого у больных с лимфаденопатией и новообразованиями средостения. Во всех
Во всех
Рис. 10. Результаты морфологического исследования после видеоторакоскопической атипичной резекции легкого по поводу ДПЛ (п=39)
случаях торакоскопическая резекция легкого, биопсия лимфоузлов и новообразований средостения оказались информативными. Среди ДПЛ в большинстве случаев выявляли сарко-идоз, остальные нозологические формы были представлены гораздо реже (рис. 10). Среди ПОЛ злокачественные опухоли выявлены в 13 (32%) случаях, доброкачественные образования отмечены в 27 (68%) наблюдениях (рис. 11). Результаты морфологического исследования биоптатов лимфоузлов у пациентов с ЛАП представлены на рис. 12.
Из 43 пациентов с новообразованиями средостения диагностическая видеоторакоскопия (ВТС) проведена 8 пациентам с опухолями тимуса с целью ревизии, оценки распространенности процесса и после констатации нерезектабельности — выполнения биопсии для гистологической верификации диагноза, 35 пациентам выполнено удаление опухолей и кист средостения из торакоскопического доступа (рис. 13).
13).
Интраоперационных осложнений не было. Конверсии (переход на торакотомный доступ) у 6 (3%) пациентов с ПОЛ во всех случаях не были связаны с техническими трудностями и обусловлены выявлением в ходе срочного гистологического исследования первичного рака легкого. Этим пациентам выполнены радикальные операции с регионарной лимфаде-нэктомией в соответствии с онкологическими принципами. В послеоперационном периоде осложнения, непосредственно связанные с хирургическим вмешательством, развились у 15 (7%) пациентов. Длительные (более 5 суток) сброс воздуха и/или нерасправление легкого отмечены у 4 пациентов. Внутриплевральное кровотечение развилось у 4 оперированных, из них у двоих гемостаз достигнут в ходе повторной ВТС, а остальным выполнена торакото-
Рис. 11. Результаты морфологического исследования операционного материала после видеоторакоскопи-ческих операций по поводу ПОЛ (п=40)
локальный пневмо фиброз 2
5% первичный рак
____— легкого б
^— 15%
Саркоидоз 24. 61%
61%
Метастазы 10 _11%
Киста тимуса 4 9%
Лимфомы 10. 11%
Туберкулез 15 18%
.Саркоидоз 52 60%
Тератома тимуса 1 2%
Лимфогранулематоз тимуса 3 7%
Невринома 8 19%
Киста ерикарда 2 5%
Кардиодиа-фрагмальная липома 1
2%
Рис. 12. Результаты морфологического исследования биоптатов лимфоузлов средостения и корня легкого (п=87)
мия. Эмпиемой плевры осложнилось течение послеоперационного периода у 3, а нагноением раны — у 4 больных. Летальных исходов не наблюдалось. Сходные показатели частоты осложнений и летальности при видеоторако-скопических операциях — 4,1-14,6% и 0-1,9% соответственно — отмечали в своих исследованиях другие авторы [10, 11, 12, 13, 14, 15, 16].
Эмпиемой плевры осложнилось течение послеоперационного периода у 3, а нагноением раны — у 4 больных. Летальных исходов не наблюдалось. Сходные показатели частоты осложнений и летальности при видеоторако-скопических операциях — 4,1-14,6% и 0-1,9% соответственно — отмечали в своих исследованиях другие авторы [10, 11, 12, 13, 14, 15, 16].
Выбор способа коагуляции при ВТС определялся с учетом результатов, полученных в ходе экспериментальной части исследования. Предпочтение отдавалось ХПК как наиболее поверхностному и безопасному методу воздействия, характеризующимся минимальным повреждением окружающих тканей и высокой прочностью струпа, обеспечивающего надежный гемостатический эффект. В ходе видео-торакоскопической атипичной резекции легкого и при энуклеации ПОЛ в качестве дополнительного гемостатического воздействия ХПК применяли у 35 (44%) пациентов. ХПК использована для достижения гемостаза при торакоскопической биопсии лимфоузлов средостения и корня легкого в 66 (76%) случаях, АУК — у 21 (24%) пациента. При вмешательствах по поводу опухолей и кист средостения наряду с ультразвуковой диссекцией и коагуляцией использовали ХПК у 38 (88%), АУК — у 5 (12%) оперированных. У 7 (3%) пациентов АУК применялась для остановки кровотечения из мягких тканей грудной стенки в местах установки торакопортов.
При вмешательствах по поводу опухолей и кист средостения наряду с ультразвуковой диссекцией и коагуляцией использовали ХПК у 38 (88%), АУК — у 5 (12%) оперированных. У 7 (3%) пациентов АУК применялась для остановки кровотечения из мягких тканей грудной стенки в местах установки торакопортов.
Одним из основных показателей, характеризующих эффективность физического метода воздействия, используемого при резекции, является герметичность раны легкого, в послеоперационном периоде определяемая по наличию или отсутствию сброса воздуха из плевральной полости по дренажам, а также рентгенологически — путем оценки динамики
Тимома 24 _
56%
Рис. 13. Результаты морфологического исследования операционного материала после видеоторакоскопи-ческих операций по поводу новообразований средостения (п=43)
расправления легкого. В нашем исследовании после атипичной резекции и энуклеации опухолей с использованием ультразвуковых ножниц у 36 (90%) пациентов удавалось добиться полного расправления в течение первых суток, и лишь у 4 пациентов сброс воздуха по дренажам и/или нерасправление легкого отмечены в более поздние сроки послеоперационного периода. У 24 (62%) пациентов с ДПЛ полное расправление легкого регистрировали на 1 сутки после операции, у 15 (38%) оперированных на 2-е сутки и более. Полученные результаты сопоставимы с данными исследований, оценивающих эффективность видеото-ракоскопических резекций с использованием сшивающих аппаратов в лечении пациентов с данной патологией. Большинство авторов отмечали расправление легкого на 1-3 сутки после оперативного вмешательства [13, 15, 16, 17, 18, 19].
В нашем исследовании после атипичной резекции и энуклеации опухолей с использованием ультразвуковых ножниц у 36 (90%) пациентов удавалось добиться полного расправления в течение первых суток, и лишь у 4 пациентов сброс воздуха по дренажам и/или нерасправление легкого отмечены в более поздние сроки послеоперационного периода. У 24 (62%) пациентов с ДПЛ полное расправление легкого регистрировали на 1 сутки после операции, у 15 (38%) оперированных на 2-е сутки и более. Полученные результаты сопоставимы с данными исследований, оценивающих эффективность видеото-ракоскопических резекций с использованием сшивающих аппаратов в лечении пациентов с данной патологией. Большинство авторов отмечали расправление легкого на 1-3 сутки после оперативного вмешательства [13, 15, 16, 17, 18, 19].
Используемый доступ и способ воздействия на органы и ткани грудной полости, наряду с объемом операции и другими факторами, определяет травматичность хирургического вмешательства, которую косвенным образом характеризуют длительность экссудации и, соответственно, дренирования плевральной полости. По данным литературных источников, при неосложненном течении послеоперационного периода дренирование плевральной полости после видеоторакоскопической аппаратной атипичной резекции легкого проводится от 2,2 до 4,1 суток, при вмешательствах на средостении — от 1,7 до 3,0 суток [10, 11, 12, 13, 14, 15, 16, 17, 18, 19]. Результаты, полученные в клинической части нашего исследования, сопоставимы с этими данными. Средняя длительность дренирования плевральной полости после видеоторакоскопических операций на легком составила 3,4±0,5 суток
По данным литературных источников, при неосложненном течении послеоперационного периода дренирование плевральной полости после видеоторакоскопической аппаратной атипичной резекции легкого проводится от 2,2 до 4,1 суток, при вмешательствах на средостении — от 1,7 до 3,0 суток [10, 11, 12, 13, 14, 15, 16, 17, 18, 19]. Результаты, полученные в клинической части нашего исследования, сопоставимы с этими данными. Средняя длительность дренирования плевральной полости после видеоторакоскопических операций на легком составила 3,4±0,5 суток
(3,7±0,4 — у пациентов с ДПЛ, 3,1+0,6 — у больных с ПОЛ), после биопсии лимфоузлов средостения и корня легкого — 2,2+0,3 суток, после удаления новообразований средостения — 2,8+0,4 суток.
Заключение
Диссекция и коагуляция легочной ткани с помощью ультразвуковых ножниц обеспечивает надежный гемостаз и герметичность раны легкого при значениях давления в трахе-обронхиальном дереве, превышающих физиологические. Характерной морфологической особенностью раны легкого, образовавшейся в результате ультразвукового воздействия, является сохранение соединительнотканных волокон во всех зонах раны и фибробластов в зоне частично поврежденной легочной ткани. Указанные морфологические особенности могут определять надежность и герметичность струпа. Ультразвуковая диссекция и коагуляция является предпочтительным способом препаровки анатомических образований средостения и корня легкого. Из числа электрохирургических методов перспективными для использования в грудной хирургии являются АУК и ХПК. При этом последняя из перечисленных, являясь по существу наиболее поверхностным методом воздействия, предпочтительна при необходимости остановки паренхиматозного кровотечения вблизи крупных сосудов.
Характерной морфологической особенностью раны легкого, образовавшейся в результате ультразвукового воздействия, является сохранение соединительнотканных волокон во всех зонах раны и фибробластов в зоне частично поврежденной легочной ткани. Указанные морфологические особенности могут определять надежность и герметичность струпа. Ультразвуковая диссекция и коагуляция является предпочтительным способом препаровки анатомических образований средостения и корня легкого. Из числа электрохирургических методов перспективными для использования в грудной хирургии являются АУК и ХПК. При этом последняя из перечисленных, являясь по существу наиболее поверхностным методом воздействия, предпочтительна при необходимости остановки паренхиматозного кровотечения вблизи крупных сосудов.
Выводы
1. Ультразвуковая атипичная резекция легкого может применяться при торакоскопи-ческих операциях по поводу периферических образований легкого и диссеминированных процессов в качестве возможной альтернативы аппаратному механическому шву в ряде клинических ситуаций.
2. Препаровка анатомических образований средостения и элементов корня легкого может быть проведена с помощью ультразвукового диссектора, а использование холодноплазмен-ной коагуляции для гемостаза вблизи крупных сосудов средостения и корня легкого является наиболее поверхностным и безопасным видом электрохирургического воздействия.
ЛИТЕРАТУРА
1. Барчук, А. С. Диагностические и лечебные возможности торакоскопии в онкологической практике на современном этапе / А. С. Барчук, К. В. Журавлев, А. М. Щербаков // Эндоскоп. хирургия. — 1995. — № 3. — С. 37-41.
2. Клименко, В. Н. Видеоторакоскопия в диагностике и лечении одиночных округлых образований легкого / В. Н. Клименко, А. С. Барчук, В. Г. Лемехов // Вопр. онкологии. — 2006. — Т. 52, № 3. — С. 349-352.
3.![]() Carus, T. Collateral tissue damage by several types of coagulation (monopolar, bipolar, cold plasma and ultrasonic) in a minimally invasive, perfused liver model / T. Carus, K. Rackebrandt // ISRN Surgery [Electronic resourse]. — 2011. — Mode of access: http://www.isrn. com/journals/surgery/2011/518924/. — Date of access: 14.01.2012.
Carus, T. Collateral tissue damage by several types of coagulation (monopolar, bipolar, cold plasma and ultrasonic) in a minimally invasive, perfused liver model / T. Carus, K. Rackebrandt // ISRN Surgery [Electronic resourse]. — 2011. — Mode of access: http://www.isrn. com/journals/surgery/2011/518924/. — Date of access: 14.01.2012.
4. Current state of minimally invasive thoracic surgery / M. J. Mack [et al.] // EACTS/ESTS joint meeting. -postgraduate courses. — 2001. — P. 81-82.
5. Toomes, H. General thoracic surgery as a monospe-ciality — a realistic vision? // Eur. j. cardiothorac. surg.
— 2002. — Vol. 21. — P. 1-4.
6. Toomes, H. The development of General Thoracic Surgery / H. Toomes, L. Swoboda // Thorac. Surg. Sci.
— 2004. — Vol. 1. — P. 2-5.
— Vol. 1. — P. 2-5.
7. История развития физических методов гемостаза в хирургии / Н. Н. Малиновский [и др.] // Хирургия. Журн. им. Н. И. Пирогова. — 2006. — № 4. — С. 75-78.
8. Юшкин, А. С. Физические способы диссекции и коагуляции в хирургии / А. С. Юшкин, Н. А. Май-стренко, А. Л. Андреев // Хирургия. Журн. им. Н. И. Пирогова. — 2003. — № 1. — С. 48-53.
9. Comparison of lateral thermal spread using monopolar and bipolar diathermy, the Harmonic Scalpel and the Ligasure / P. A. Sutton [et al.] // Br. J. Surg. -2010. — Vol. 97, N 3. — P. 428-433.
10. Опыт применения видеоторакоскопии при заболеваниях вилочковой железы / В. Н. Никишов [и др.] // Эндоскоп. хирургия. — 2010. — № 2. — С. 18-24.
11. Video-assisted thoracoscopic management of mediastinal tumors / Y. J. Cheng [et al.] // JSLS. — 2001.
J. Cheng [et al.] // JSLS. — 2001.
— Vol. 5, N 3. — P. 241-244.
12. Multicenter VATS Experience With Mediastinal Tumors / T. L. Demmy [et al.] // Ann. Thorac. Surg. -1998. — Vol. 66. — P. 187-192.
13. Comparing bipolar electrothermal device and endo-stapler in endoscopic lung wedge resection / O. Kovács [et al.] // Interact. Сardiovasc. Thorac. Surg. — 2009.-Vol. 9, N 1. — P. 11-14.
14. Videothoracoscopic approach to primary mediastinal pathology / G. Roviaro [et al.] // Chest. — 2000. — Vol. 117. — P. 1179-1183.
15. Videothoracoscopy versus thoracotomy for the diagnosis of the indeterminate solitary pulmonary nodule / L. Santambrogio [et al.] // Ann. Thorac. Surg. — 1995.
— Vol. 59, N 4. — P. 868-871.
59, N 4. — P. 868-871.
16. Video-Assisted Thoracoscopic Lobectomy Is Less Costly and Morbid Than Open Lobectomy: A Retrospective Multiinstitutional Database Analysis / S. J. Swan-son [et al.] // Ann. Thorac. Surg. [Electronic resourse].
— 2011. — Mode of access: http://dx.doi.org/10.1016/). athoracsur.2011.06.007. — Date of access: 04.02.2012.
17. In-hospital Clinical and Economic Consequences of Pulmonary Wedge Resections for Cancer Using Video-Assisted Thoracoscopic Techniques vs. Traditional Open Resections: A Retrospective Database Analysis /
J. A. Howington [et al.] // Chest [Electronic resourse]. — 2011. — Mode of access: http://chestjournal.chest-pubs.org/content/early/2011/07/20/chest.10-3013.full. pdf+html. — Date of access: 04.02.2012.
18. Video-assisted thoracoscopy for the diagnosis of diffuse parenchymal lung disease / R. T. Ishie [et al.] // Bras. pneumol. — 2009. — Vol. 35, N 3. — P. 235.
Video-assisted thoracoscopy for the diagnosis of diffuse parenchymal lung disease / R. T. Ishie [et al.] // Bras. pneumol. — 2009. — Vol. 35, N 3. — P. 235.
19. Zhang, D. Surgical lung biopsies in 418 patients with suspected interstitial lung disease in China / D. Zhang, Y. Liu // Intern. Med. — 2010. — Vol. 49, N 12. — P. 1097-1102.
Сведения
Котив Б.Н., д.м.н., профессор, полковник медицинской службы, начальник кафедры и клиники госпитальной хирургии ФГВОУ ВПО «Военно-медицинская академия им. С.М. Кирова» МО РФ. Чуприна А.П., к.м.н., доцент, полковник медицинской службы, профессор кафедры госпитальной хирургии Ф ГВОУ В ПО «Военно-медицинская академия им. С.М. Кирова» МО РФ. Ясюченя Д.А., капитан медицинской службы, адъюнкт кафедры госпитальной хирургии Ф ГВОУ В ПО «Военно-медицинская академия им. С.М. Кирова» МО РФ.
Адрес для корреспонденции
194044, Российская Федерация,
г. Санкт-Петербург,
Санкт-Петербург,
ул. Академика Лебедева, д. 6,
Военно-медицинская академия им. С.М. Кирова,
кафедра и клиника госпитальной хирургии,
тел. раб.: +7 812 292-33-27,
тел. моб.: +7 911-720-82-94,
e-mail: [email protected],
Ясюченя Денис Александрович
об авторах
Мельник Д.М., врач-хирург торакального отделения клиники госпитальной хирургии ФГВОУ ВПО «Военно-медицинская академия им. С.М. Кирова» МО РФ.
Шелегетов Д.С., капитан медицинской службы, клинический ординатор торакального отделения клиники госпитальной хирургии Ф ГВОУ В ПО «Военно-медицинская академия им. С.М. Кирова» МО РФ. Ионцев В.И., капитан медицинской службы, старший ординатор хирургического отделения кл иники госпитальной хирургии ФГВОУ ВПО «Военно-медицинская академия им. С.М. Кирова» МО РФ.
С.М. Кирова» МО РФ. Ионцев В.И., капитан медицинской службы, старший ординатор хирургического отделения кл иники госпитальной хирургии ФГВОУ ВПО «Военно-медицинская академия им. С.М. Кирова» МО РФ.
Поступила 16.01.2012 г.
Физиологические и физические основы ВЧ хирургии
Под высокочастотной хирургией понимают применение высокочастотной энергии (свыше 300 кГц) для изменения или разрушения клеток, а также для разделения или удаления тканей в сочетании с механической операционной техникой.
Тепловое действие высокочастотных токов на биоткань
Под действием электрического тока биоткань, вследствие ее омического сопротивления, нагревается. Возникшее количество тепла зависит от силы тока и сопротивления проводника. Пациент рассматривается в этом случае как электрический проводник с определенным сопротивлением.
Сопротивление проводника зависит от материала проводника и его геометрического сечения. Это обосновывает сравнение специфического сопротивления металлического проводника и сопротивления различных видов тканей. Металлы имеют меньшее сопротивление, чем биологические ткани. Поэтому в замкнутой электрической цепи, состоящей из пациента и металлического проводника с одинаковыми сечениями, биоткань нагревается значительно сильнее.
Это обосновывает сравнение специфического сопротивления металлического проводника и сопротивления различных видов тканей. Металлы имеют меньшее сопротивление, чем биологические ткани. Поэтому в замкнутой электрической цепи, состоящей из пациента и металлического проводника с одинаковыми сечениями, биоткань нагревается значительно сильнее.
На количество тепла влияют:
- состояние ткани.
- температура, т.к. для испарения тканевой жидкости используется дополнительная энергия.
Реакция ткани на локальный перегрев
Если высокочастотное напряжение (непрерывный синусоидальный сигнал) достаточно велико, возникают искровые разряды между контактной поверхностью активного электрода и тканью. Это ведет к быстрому разогреву ткани; клетки лопаются вследствие испарения клеточной жидкости, разрываются межклеточные связи и происходит резка. Низкие значения ВЧ-напряжения (менее 150V) ведут к медленному разогреву ткани без разделения ее (эффект коагуляции). Короткие ВЧ-импульсы с высоким напряжением вызывают образование искр на поверхности и ярко-выраженной поверхностной коагуляцией.
Короткие ВЧ-импульсы с высоким напряжением вызывают образование искр на поверхности и ярко-выраженной поверхностной коагуляцией.
Схематическое представление среза: в зависимости от величины электрического сопротивления и различных видов тканей, коагуляционная борозда (пораженная ткань) распространена по-разному. На роговом слое кожи шире, чем в паппилярном слое и в субкутанном слое, еще шире в жировой ткани. В мышце происходит оплавливание, достигающее соединительнотканных клеточных промежутков. В пресеченных сосудах кровь отступает назад, интима повреждается на глубине. На костях воздействие распространяется вдоль периоста, проникая под электродом на незначительную глубину.
Если вследствие большой контактной площади тепло распространяется на большом участке, то происходит испарение тканевой жидкости, связанное с денатурацией белка (эффект коагуляции). В соответствии с примененной силой тока возникает глубокая или поверхностная коагуляция с образованием ожогового струпа. Плохая теплопроводность ожогового струпа препятствует распространению тепла особенно в глубину.
Плохая теплопроводность ожогового струпа препятствует распространению тепла особенно в глубину.
Схема электрокоагуляции гомогенной ткани. Действие распространяется в глубину, оно несколько больше чем диаметр электрода и непосредственно под электродом самое сильное. Кроме того, на поверхности ткани оно захватывает и участки вокруг электрода («краевое действие»).
Схема электрокоагуляции с образованием ожогового струпа. Электрокоагуляция с использованием слишком большой силы тока приводит к быстрой коагуляции ткани под электродом, возникает струп, изолирующее свойство которого препятствует коагуляции на глубине. При этом электрод приклеивается к ткани.
Методики ВЧ-хирургии и электрические формы сигнала
Резка основана на принципе разрыва клеток и клеточных связей. Разрыв возникает вследствие стремительного, резко ограниченного подъема температуры, взрывоподобного испарения вне- и внутриклеточной жидкости. В идеальном случае в режиме резки не возникает коагуляции ткани и поверхности с типичной светлой окраской («коагуляционная борозда»).
Форма электрода в значительной мере определяет режущие свойства и виды срезов. Режущие электроды должны иметь по возможности маленькую площадь, чтобы развить высокую плотность тока в узко ограниченной зоне.
Игольчатые и проволочные электроды служат для проведения тонких срезов, если поверхность не должна коагулироваться. При слишком большой силе тока электроды приклеиваются к ткани.
Петля и ленточные электроды предназначены в основном для удаления частей ткани. Одно из важнейших применений т. н. «полый срез» при трансуретральной резекции. Параметры, определяющие качество резки: скорость резки, состояние ткани и форма тока.
Нож и ланцет похожи на операционные скальпели. Их механизм действия основывается на вышеописанных принципах, а не на механическом воздействии. С помощью этого боковых отделов электрода можно коагулировать боковые поверхности среза. Из-за относительно большой поверхности электрода-скальпеля по сравнению с игольчатым электродом необходимо повышение мощности. Нагревание этих электродов вследствие большей теплоемкости происходит в меньшей степени.
Нагревание этих электродов вследствие большей теплоемкости происходит в меньшей степени.
Гладкий разрез соответствует разрезу обычным скальпелем. Этот вид разреза происходит под действием немодулированного ВЧ-тока. При этом проведение разреза происходит очень быстро. Уменьшение скорости проведения разреза приводит к образованию коагуляционного струпа при использовании импульсно-модулированного ВЧ-тока и одинаковой мощности средних значений.
Мощность необходимая для разреза с помощью высокочастотного тока зависит от формы электрода и вида ткани (ее сопротивления). При малой мощности не происходит разрыва клеток; электрод клеится к ткани. При слишком большой ВЧ-мощности между электродом и тканью возникают искровые разряды, приводящие к карбонизации («науглероживанию») поверхностей.
Коагуляция. Ограниченное нагревание ткани приводит не к разрыву клеток, а к коагуляции ткани. Температура необходимая для коагуляции лежит выше 50С. Под действием температуры происходит свертывание внутри- и внеклеточного белка. Сосуды стягиваются и это приводит к полному гемостазу. Для достижения этого эффекта электрический ток медленно разогревает ткань; вне- и внутриклеточная жидкость испаряется не разрушая клеточных мембран. С потерей жидкости клетки притягиваются друг к другу, склеиваясь клеточными стенками. Этот вид коагуляции называется контактной коагуляцией (формы электродов: шарик, площадка). Воздействие ВЧ тока обуславливает светлую окраску ткани и выход тканевой жидкости вследствие свертывания клеточного белка.
Сосуды стягиваются и это приводит к полному гемостазу. Для достижения этого эффекта электрический ток медленно разогревает ткань; вне- и внутриклеточная жидкость испаряется не разрушая клеточных мембран. С потерей жидкости клетки притягиваются друг к другу, склеиваясь клеточными стенками. Этот вид коагуляции называется контактной коагуляцией (формы электродов: шарик, площадка). Воздействие ВЧ тока обуславливает светлую окраску ткани и выход тканевой жидкости вследствие свертывания клеточного белка.
Фульгурация – особая форма коагуляции и обозначается сегодня как «спрей-коагуляция». Под действием высокого ВЧ-напряжения возникают искровые разряды (световая дуга), прямой контакт с тканью не нужен. Искровые разряды развивают экстремальное повышение температуры на поверхности ткани и разрушают ее (поверхностная коагуляция, образование струпа, карбонизация.) В качестве электродов используются небольшие шарики и иглы. Необходимое высокое напряжение (до 9 киловольт) при небольшой ВЧ-мощности возникает из-за сильной импульсной модуляции. Этот вид коагуляции используется для гемостаза больших поверхностей (напр. при сильных каппилярных кровотечениях «сочащиеся поверхности»). Возникающий ожоговый струп часто ухудшает заживление и приводит впоследствии к кровотечениям.
Этот вид коагуляции используется для гемостаза больших поверхностей (напр. при сильных каппилярных кровотечениях «сочащиеся поверхности»). Возникающий ожоговый струп часто ухудшает заживление и приводит впоследствии к кровотечениям.
О процедуре лазерной коагуляции сетчатки
У пациентов, которым на глазном дне диагностированы дистрофические изменения с разрывами сетчатки, имеется риск возникновения одного из самых тяжелых офтальмологических заболеваний – отслойки сетчатки. Разрывы сетчатки иногда могут проявляться возникновением «вспышек», «молний» перед глазом.
Но чаще встречаются так называемые «немые» разрывы, которые пациент никак не ощущает (при этом они могут сопровождаться субклинической отслойкой сетчатки).
При этом часто данные изменения не замечаются как самим пациентом, так и врачом офтальмологом, проводящим осмотр. Это обусловлено периферическим расположением дистрофических изменений и разрывов, а также отсутствием зрительных нарушений (т.е. сужения поля и снижения остроты зрения), кроме того, для их диагностики требуется специальная аппаратура и соответствующие навыки специалиста.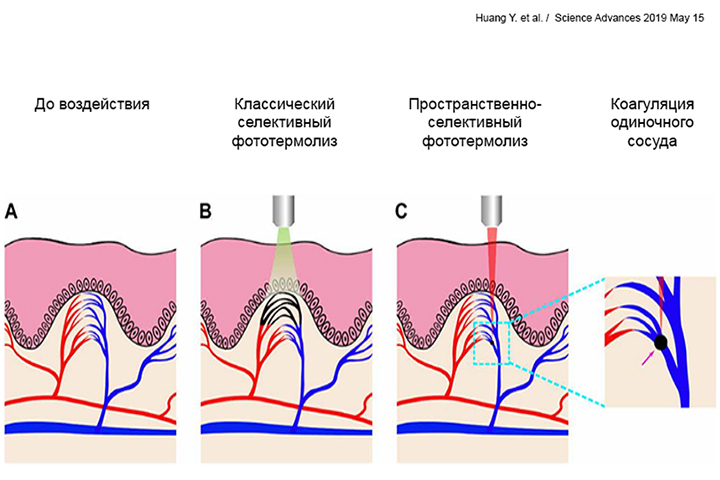 Исследование глазного дна должно проводиться в условиях максимального расширения зрачка. Проникновение внутриглазной жидкости под сетчатку через разрыв, приводящее к ее отслойке, характеризуется прогрессирующим, иногда стремительным, сужением границ поля зрения, потерей остроты зрения вплоть до наступления полной слепоты. Попыткой лечения данного заболевания является тяжёлая хирургическая операция.
Исследование глазного дна должно проводиться в условиях максимального расширения зрачка. Проникновение внутриглазной жидкости под сетчатку через разрыв, приводящее к ее отслойке, характеризуется прогрессирующим, иногда стремительным, сужением границ поля зрения, потерей остроты зрения вплоть до наступления полной слепоты. Попыткой лечения данного заболевания является тяжёлая хирургическая операция.
Ведущими факторами риска возникновения разрывов и отслойки сетчатки является наследственность, рефракция (в 70,4 % они выявляются у лиц, страдающих близорукость), физические нагрузки, травмы головы и глаза.
При планировании каких-либо офтальмологических операций, в частности, лазерных по коррекции зрения, обязательно учитывается состояние глазного дна, в том числе наличие разрывов сетчатки. При их выявлении для решения вопроса о проведении основной операции становится необходимым осуществление профилактики отслойки сетчатки, целью которой является создание спайки между сетчаткой и подлежащими оболочками в зоне разрыва, препятствующей проникновению внутриглазной жидкости под сетчатую оболочку.
Профилактическое вмешательство должно быть щадящим и надёжным.
Основным методом профилактики отслойки сетчатки является лазеркоагуляция сетчатки вокруг выявленных разрывов.
Принцип метода коагуляции заключается в использовании лазерных лучей, которые коагулируют (свертывают) ткани сетчатки, прочно соединяя ее с подлежащей сосудистой оболочкой. Перед лазерной коагуляцией в глаз закапывают анестетик и препарат, расширяющий зрачок, а затем с помощью специальной линзы выводят лазерный пучок на нужный участок глазного дна и производят точечную коагуляцию, отграничивая опасный участок.
Лазерная коагуляция является абсолютно нетравматичным и безболезненным методом, не требует нарушения целостности тканей глаза для доступа к поврежденным участкам, что исключает возможность инфекционных осложнений. Коагуляция сетчатки хорошо переносится – во время процедуры пациент может чувствовать легкое покалывание или мерцание света. Данный метод не вызывает снижения остроты зрения.
Положительным моментом лазерной коагуляции является отсутствие длительного восстановительного периода и минимальные ограничения в образе жизни (на 7-10 дней исключить подъем тяжестей, наклоны, физические нагрузки, вождение автомобиля), что позволяет пациенту практически сразу вернуться к привычной жизни.
В нашей клинике пациенты имеют возможность пройти лазеркоагуляцию сетчатки на современном лазере NIDEK «GYC-1000» (Япония), что гарантирует нашим пациентам лечение на уровне мировых стандартов.
GN300
Электрокоагуляция — это одна из основных составляющих любой хирургической операции, которая позволяет избежать перфорации сосудов, некроза и прилипание тканей.
Преимущества
- После включения аппарат автоматически проводит самотестирование.
- Во время работы постоянно проверяется надежность и безопасность работы всех сигналов, функциональных кнопок и рабочих электродов.
- В случае возникновения неисправностей, на дисплее аппарата появляется индикация и раздается звуковой сигнал, информирующие пользователя об ошибках.

Микро и макро коагуляция
- Режим MICRO: от 0,1 до 9,9 Вт, с шагом настройки 0,1 Вт.
- В этом режиме выполняется точечная прецизионная коагуляция без прилипания тканей.
- Режим MACRO: от 10 до 50 Вт, с шагом настройки 1 Вт.
- Это универсальный режим для биполярной коагуляции.
Адаптация
- Автоматическая адаптация к различному уровню сопротивления тканей, как в микро, так и в макро режимах.
Сохранение в памяти индивидуальных параметров
- Индивидуальные параметры для определенного вида операций можно сохранить в имеющихся для этих целей четырех ячейках памяти. И затем, в случае необходимости, нажатием на одну кнопку быстро вызвать их из памяти.
Функция «автоматический старт» (дополнительно)
- Если активирована функция «автоматический старт», то коагуляция автоматически включается, как только кончики пинцетов касаются тканей.

- Если функция «автоматический старт» отключена, то хирург управляет коагулятором с помощью педали.
Дистанционное управление (дополнительно)
- С помощью дистанционного управления хирург может управлять аппаратом и вызывать из ячеек памяти сохраненные параметры работы, при соблюдении условий стерильности.
Международные стандарты безопасности
- Соответствие национальным и международным нормам подтверждено контролирующими организациями.
Область применения
- Микрохирургия
- Нейрохирургия
- Пластическая и реконструктивная хирургия
- ЛОР
- Офтальмология
- Педиатрическая хирургия
- Гинекология
- Лапароскопия
Коагуляция — обзор | Темы ScienceDirect
Изменения коагуляции во время серьезной операции и кровотечения являются сложными 35 и зависят от клинического контекста, в котором происходит кровотечение. Изменения коагуляции, возникающие у хирургических пациентов, имеют некоторое сходство с теми, которые возникают после тяжелой травмы. Однако баланс патофизиологических факторов, вероятно, будет очень разным. Факторы, лежащие в основе этих изменений коагуляции, включают следующее:
Изменения коагуляции, возникающие у хирургических пациентов, имеют некоторое сходство с теми, которые возникают после тяжелой травмы. Однако баланс патофизиологических факторов, вероятно, будет очень разным. Факторы, лежащие в основе этих изменений коагуляции, включают следующее:
Разведение. Элементы свертывающей системы потеряны с пролитой кровью. Затем объем потерянной крови замещается кристаллоидом, коллоидом или продуктами крови, в которых отсутствуют эти компоненты, что приводит к постепенному снижению концентраций этих компонентов свертывания. В какой-то степени такие изменения уравновешиваются, так как также снижается концентрация ингибиторов свертывания. Кроме того, компоненты коагуляции могут продуцироваться или высвобождаться в ответ на травму, что ограничивает снижение концентрации. Чтобы усложнить эту проблему, снижение концентрации одного компонента свертывающей системы может не иметь такого же клинического эффекта, как такое же снижение концентрации другого компонента. Например, значительное снижение концентрации многих белков свертывания крови не приведет к сильному кровотечению, тогда как даже небольшое снижение количества тромбоцитов или концентрации фибриногена может вызвать клинически значимое кровотечение (см. Также главы 10 и 12).
Например, значительное снижение концентрации многих белков свертывания крови не приведет к сильному кровотечению, тогда как даже небольшое снижение количества тромбоцитов или концентрации фибриногена может вызвать клинически значимое кровотечение (см. Также главы 10 и 12).
Эффект повреждения тканей. Между воспалительным и коагуляционным путями происходит обширное взаимодействие. Воспаление после травмы тканей может быть связано с избыточной активацией фибринолитических путей (что приводит к чрезмерному кровотечению) и с активацией прокоагулянтных путей (что приводит к повышенному риску тромбоза).
Физиологическое нарушение, связанное с кровопотерей. Ацидоз, гипотермия и гипокальциемия связаны с чрезмерным кровотечением. 36 Гипотермия замедляет активность протеолитических ферментов, снижает синтез фибрина и снижает функцию тромбоцитов. Эти эффекты в значительной степени обратимы при согревании. Ацидоз заметно снижает активность белков свертывания. 37 Эти эффекты не полностью устраняются путем коррекции ацидоза. Разбавление и действие цитрата (содержащегося во многих продуктах крови) вызывают снижение концентрации кальция в плазме.Во время сильного кровотечения следует контролировать концентрацию ионов кальция и при необходимости заменять ее. Криопреципитат и свежезамороженная плазма (СЗП) содержат высокие концентрации цитрата, и быстрое введение может вызвать резкое снижение концентрации кальция в плазме (рис. 12.9).
Ацидоз заметно снижает активность белков свертывания. 37 Эти эффекты не полностью устраняются путем коррекции ацидоза. Разбавление и действие цитрата (содержащегося во многих продуктах крови) вызывают снижение концентрации кальция в плазме.Во время сильного кровотечения следует контролировать концентрацию ионов кальция и при необходимости заменять ее. Криопреципитат и свежезамороженная плазма (СЗП) содержат высокие концентрации цитрата, и быстрое введение может вызвать резкое снижение концентрации кальция в плазме (рис. 12.9).
Эффекты лечения. Использование некоторых синтетических коллоидов может ухудшить кровотечение в большей степени, чем можно было бы ожидать при разбавлении. Использование гидроксиэтилкрахмала увеличивает риск нарушений свертывания крови и острого повреждения почек по сравнению с альбумином, желатинами или кристаллоидами. 38 Спорный вопрос о том, существуют ли различия в коагуляционных эффектах разных крахмалов. 39–41 Опасения по поводу безопасности растворов крахмала ограничивают их использование у взрослых и детей.
39–41 Опасения по поводу безопасности растворов крахмала ограничивают их использование у взрослых и детей.
Использование специальных техник во время операции. Важные эффекты шунтирования сердца и антикоагуляции обсуждаются позже. Операция по пересадке печени (см. Также главу 31) и серьезную травму (см. Также главу 39) подробно обсуждаются в другом месте этой книги.
Коагуляция — Diapharma
Коагуляция (свертывание) — это процесс, при котором кровь превращается из жидкости в гель, образуя сгусток. Это потенциально приводит к гемостазу, прекращению кровопотери из поврежденного сосуда с последующим восстановлением. Механизм коагуляции включает активацию, адгезию и агрегацию тромбоцитов, а также отложение и созревание фибрина. Нарушения коагуляции могут привести к кровотечению (кровоизлияние или синяк) или обструктивному свертыванию (тромбоз).
Каскад коагуляции
Коагуляционный каскад вторичного гемостаза имеет два начальных пути, которые приводят к образованию фибрина:
- путь контактной активации (внутренний путь)
- Путь тканевого фактора (внешний путь)
Первичным путем инициирования свертывания крови является путь тканевого фактора (внешний). Как тканевой фактор, так и пути контактной активации активируют «последний общий путь» фактора X, тромбина и фибрина.
Как тканевой фактор, так и пути контактной активации активируют «последний общий путь» фактора X, тромбина и фибрина.
Пути представляют собой серию реакций, в которых зимоген (предшественник неактивного фермента) сериновой протеазы и его кофактор гликопротеина активируются, чтобы стать активными компонентами, которые затем катализируют следующую реакцию в каскаде, что в конечном итоге приводит к образованию поперечных связей. фибрин.
Факторами свертывания крови обычно являются сериновые протеазы (ферменты), которые, за некоторыми исключениями, расщепляют нижестоящие белки. FVIII и FV — гликопротеины, а фактор XIII — трансглутаминаза.Факторы свертывания крови циркулируют в виде неактивных зимогенов.
Путь тканевого фактора (внешний путь)
Основная роль пути тканевого фактора заключается в генерации «тромбинового выброса», процесса, посредством которого тромбин, наиболее важный компонент каскада свертывания с точки зрения его роли активации обратной связи, высвобождается очень быстро. FVIIa циркулирует в большем количестве, чем любой другой активированный фактор свертывания крови. Процесс включает в себя следующие шаги:
FVIIa циркулирует в большем количестве, чем любой другой активированный фактор свертывания крови. Процесс включает в себя следующие шаги:
- После повреждения кровеносного сосуда FVII покидает кровоток и вступает в контакт с тканевым фактором (TF), экспрессируемым на клетках, несущих тканевой фактор (стромальные фибробласты и лейкоциты), образуя активированный комплекс (TF-FVIIa).
- TF-FVIIa активирует FIX и FX.
- FVII сам активируется тромбином, FXIa, FXII и FXa.
- Активация FX (с образованием FXa) TF-FVIIa почти сразу подавляется ингибитором пути тканевого фактора (TFPI).
- FXa и его кофактор FVa образуют комплекс протромбиназы, который активирует протромбин в тромбин.
- Затем тромбин активирует другие компоненты каскада свертывания, включая FV и FVIII (который образует комплекс с FIX), а также активирует и высвобождает FVIII из-под связывания с vWF.
- FVIIIa является кофактором FIXa, и вместе они образуют комплекс «теназа», который активирует FX
.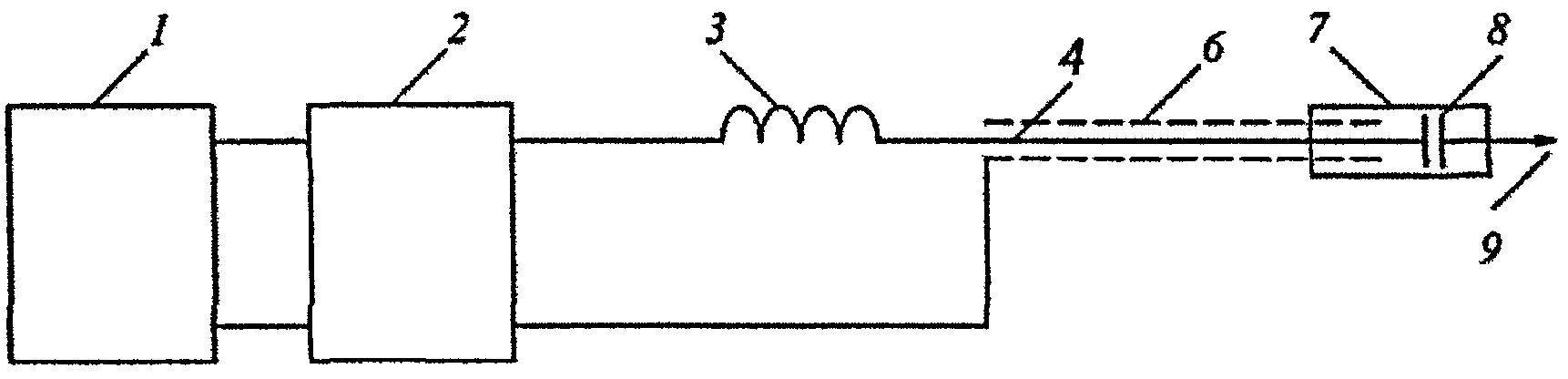
Путь контактной активации (внутренний путь)
Путь контактной активации начинается с образования первичного комплекса на коллагене с помощью высокомолекулярного кининогена (HMWK), прекалликреина и FXII (фактор Хагемана).
- Прекалликреин преобразуется в калликреин, а FXII становится FXIIa.
- FXIIa конвертирует FXI в FXIa.
- Фактор XIa активирует FIX, который вместе со своим кофактором FVIIIa формирует теназный комплекс, который активирует FX в FXa.
Незначительную роль, которую путь контактной активации играет в инициировании образования сгустка, можно проиллюстрировать тем фактом, что субъекты с серьезным дефицитом FXII, HMWK и прекалликреина не имеют нарушения свертываемости крови. Вместо этого система контактной активации, по-видимому, больше участвует в воспалении и врожденном иммунитете.
Общий путь финала
После активации контактным фактором или путями тканевого фактора каскад коагуляции поддерживается в протромботическом состоянии за счет продолжающейся активации FVIII и FIX с образованием комплекса теназы, пока он не будет подавлен антикоагулянтными путями.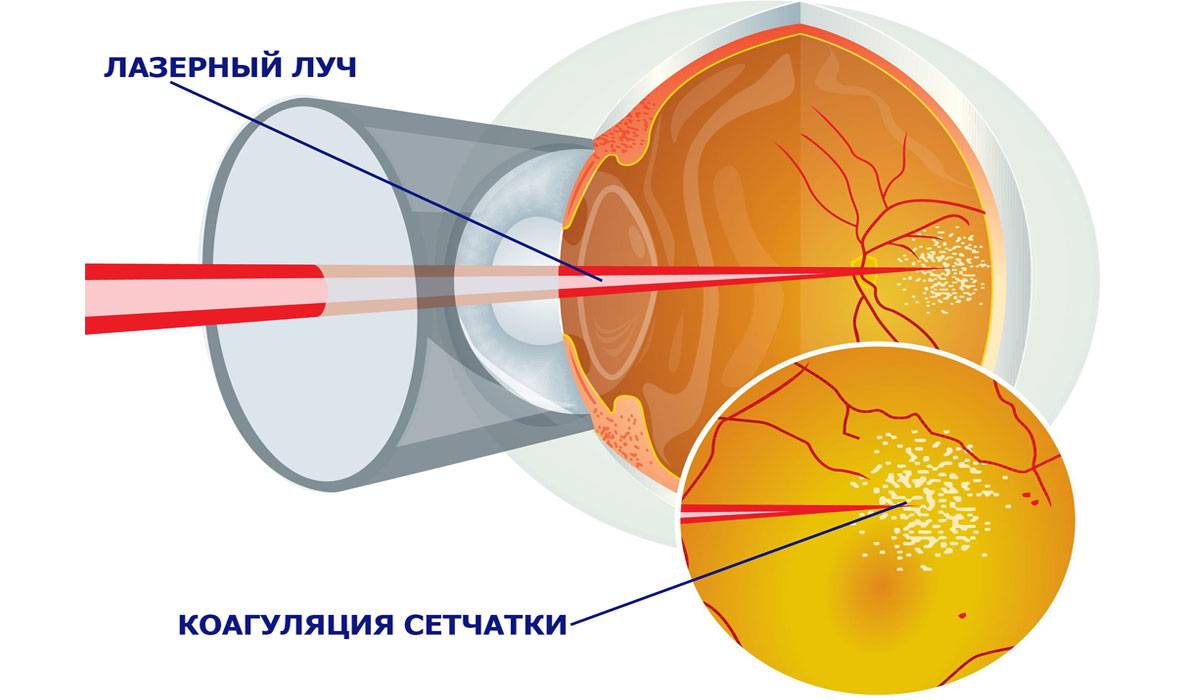
Факторы коагуляции
Фактор / название | Альтернативное имя | Функция | Ассоциированные генетические заболевания |
|---|---|---|---|
| Альфа 2-Антиплазмин | α 2 -антиплазмин, ингибитор плазмина | Ингибирует плазмин | Дефицит антиплазмина |
| Антитромбин | Антитромбин III, AT, ATIII | Ингибирует фактор IIa, Xa и другие протеазы | Недостаток антитромбина III |
| Прокоагулянт против рака | Активатор патологического фактора X | связано с тромбозом при раке | |
| Фактор I | FI, Фибриноген | Образование тромба (фибрин) | Врожденная афибриногенемия, Семейный амилоидоз почек |
| Фактор II | FII, Протромбин | Фактор IIa активирует I, X, VII, VIII, XI, XIII, протеин C, тромбоциты | Протромбин G20210A, Тромбофилия |
| Фактор III | FIII, Фактор ткани, тканевый тромбопластин | Ко-фактор VIIa (ранее известный как фактор III) | |
| Фактор IV | FIV, Кальций | Требуется для связывания факторов свертывания с фосфолипидом (ранее известный как фактор IV) | |
| Фактор V | FV, Proaccelerin, лабильный фактор | Кофактор X, с которым он образует комплекс протромбиназы | Устойчивость к активированному протеину С |
| Фактор VI | FVI, фактор Va | Не назначено | |
| Фактор VII | FVII, стабильный фактор, проконвертин | Активирует фактор IX, X | Врожденный проконвертин / дефицит фактора VII |
| Фактор VIII | FVIII, антигемофильный фактор A, AHF | Кофактор IX, с которым он образует комплекс теназы | Гемофилия A |
| Фактор IX | FIX, антигемофильный фактор B, фактор Рождества | Активирует фактор X, образует теназный комплекс с фактором VIII | Гемофилия B |
| Фактор X | FX, фактор Стюарта-Проуэра | Активирует фактор II, образует комплекс протромбиназы с фактором V | Врожденный дефицит фактора X |
| Фактор XI | FXI, предшествующий плазменный тромбопластин | Активирует фактор IX | Гемофилия C |
| Фактор XII | FXII, фактор Хагемана | Активирует фактор XI, VII и прекалликреин | Наследственный ангионевротический отек III типа |
| Фактор XIII | FXIII, Фибрин-стабилизирующий фактор | Сшивки Фибрин | Врожденный дефицит фактора XIIIa / b |
| Фибронектин | Опосредует клеточную адгезию | Гломерулопатия с отложениями фибронектина | |
| Кофактор гепарина II | HCII | Ингибирует фактор IIa, кофактор гепарина и дерматансульфата («минорный антитромбин») | Дефицит кофактора гепарина II |
| Кининоген с высокой молекулярной массой | HMWK, HK, Фактор Фитцджеральда | Поддерживает реципрокную активацию фактора XII, XI и прекалликреина | Дефицит кининогена |
| Плазминоген | PLG | Превращает в плазмин, лизирует фибрин и другие белки | Дефицит плазминогена тип I (деревянистый конъюнктивит) |
| Ингибитор-1 активатора плазминогена | PAI1, PAI-1 | Инактивирует tPA и урокиназу (эндотелиальный PAI) | Дефицит ингибитора-1 активатора плазминогена |
| Ингибитор активатора плазминогена-2 | ПАИ2, ПАИ-2 | Инактивирует tPA и урокиназу (плацентарный PAI) | |
| Прекалликрейн | Фактор Флетчера | Активирует фактор XII и прекалликреин; раскалывает HMWK | Дефицит прекалликреина / фактора Флетчера |
| Белок C | PC, автопротромбин IIA, фактор XIV | Инактивирует фактор Va и VIIIa | Дефицит протеина C |
| Белок S | PS | Кофактор активированного протеина C (APC, неактивен при связывании с C4b-связывающим белком) | Дефицит протеина S |
| Белок Z | ПЗ, ПРОЗ | Опосредует адгезию тромбина к фосфолипидам и стимулирует деградацию фактора X под действием ZPI | Дефицит белка Z |
| Ингибитор Z-связанной протеазы | ZPI | Разлагает факторы X (в присутствии протеина Z) и XI (независимо) | |
| Активатор тканевого плазминогена | тПА | Активирует плазминоген | Семейный гиперфибринолиз и тромбофилия |
| урокиназа | UK | Активирует плазминоген | Квебекское заболевание тромбоцитов |
| Фактор фон Виллебранда | vWF | Связывается с фактором VIII, опосредует адгезию тромбоцитов | Болезнь фон Виллебранда |
Кофакторы
- Кальций и фосфолипид
- Витамин К
Регуляторы
- Белок C
- Антитромбин
- Ингибитор пути тканевого фактора (TFPI)
- Плазмин
- Простациклин (PGI2)
Посмотреть презентацию по специальной коагуляции Diapharma
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Есть много причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Инфекция и воспаление и система свертывания | Сердечно-сосудистые исследования
Аннотация
Тяжелая инфекция и воспаление почти всегда приводят к нарушениям гемостаза, от незначительных лабораторных изменений до тяжелой диссеминированной внутрисосудистой коагуляции (ДВС).Системное воспаление приводит к активации коагуляции из-за образования тромбина, опосредованного тканевым фактором, подавлению физиологических механизмов антикоагулянта и ингибированию фибринолиза. Провоспалительные цитокины играют центральную роль в дифференциальных эффектах на пути свертывания и фибринолиза. И наоборот, активация системы свертывания крови может существенно влиять на воспалительные реакции с помощью прямых и косвенных механизмов. Помимо общей реакции свертывания крови на воспаление, связанное с тяжелой инфекцией, конкретные инфекции могут вызывать различные признаки, такие как геморрагическая лихорадка или тромботическая микроангиопатия.Актуальность перекрестного взаимодействия между воспалением и коагуляцией подчеркивается многообещающими результатами в лечении тяжелой системной инфекции модуляторами коагуляции и воспаления.
Помимо общей реакции свертывания крови на воспаление, связанное с тяжелой инфекцией, конкретные инфекции могут вызывать различные признаки, такие как геморрагическая лихорадка или тромботическая микроангиопатия.Актуальность перекрестного взаимодействия между воспалением и коагуляцией подчеркивается многообещающими результатами в лечении тяжелой системной инфекции модуляторами коагуляции и воспаления.
1. Введение
Актуальность взаимодействия между свертыванием и воспалением в ответ на тяжелую инфекцию, в ее наиболее экстремальной форме, проявляющейся в виде диссеминированного внутрисосудистого свертывания (ДВС) и полиорганной недостаточности, становится все более очевидной [1,2].В последние годы были выяснены различные механизмы, которые играют важную роль в этом взаимодействии, и действительно было продемонстрировано, что эти знания применимы для улучшения нашего понимания патогенеза тяжелой инфекции или сепсиса и, что еще более важно, клинических данных. ведение таких пациентов [3]. В этой статье будут рассмотрены механизмы, которые играют роль во взаимодействии воспаления и коагуляции, и будут выделены специфические особенности опосредованного инфекционным заболеванием воздействия на систему свертывания.Кроме того, будут обсуждаться перекрестные связи между активированной коагуляцией и медиаторами воспаления.
ведение таких пациентов [3]. В этой статье будут рассмотрены механизмы, которые играют роль во взаимодействии воспаления и коагуляции, и будут выделены специфические особенности опосредованного инфекционным заболеванием воздействия на систему свертывания.Кроме того, будут обсуждаться перекрестные связи между активированной коагуляцией и медиаторами воспаления.
2. Модификация свертывания крови при воспалении
Давно известно, что воспаление может приводить к активации системы свертывания крови. Острое воспаление в ответ на тяжелую инфекцию или травму приводит к системной активации свертывающей системы [3,4]. Первоначально считалось, что эта системная активация коагуляции была результатом прямой активации контактной системы коагуляции микроорганизмами или эндотоксином.Однако в 1990-х годах стало очевидно, что цитокины играют посредническую роль в активации свертывания и последующего отложения фибрина, и что точкой воздействия на систему свертывания крови был, скорее, путь тканевого фактора VIIa («внешний»), чем путь контактная система («внутренний путь») [5,6]. Более того, значение нарушения физиологических антикоагулянтных путей становилось все более очевидным [7]. Наконец, было показано, что нарушение удаления фибрина подавленной фибринолитической системой вносит важный вклад в микрососудистое отложение фибрина.
Более того, значение нарушения физиологических антикоагулянтных путей становилось все более очевидным [7]. Наконец, было показано, что нарушение удаления фибрина подавленной фибринолитической системой вносит важный вклад в микрососудистое отложение фибрина.
Эндотелиальные клетки сосудов играют центральную роль во всех механизмах, которые способствуют активации свертывания крови, вызванной воспалением. Эндотелиальные клетки отвечают на цитокины, экспрессируемые и высвобождаемые активированными лейкоцитами, но могут также выделять сами цитокины [8]. Кроме того, эндотелиальные клетки способны экспрессировать молекулы адгезии и факторы роста, которые могут не только способствовать дальнейшему воспалительному ответу, но также влиять на реакцию свертывания (рис. 1). Однако недавно стало ясно, что, помимо этих в основном косвенных эффектов эндотелия, эндотелиальные клетки напрямую вмешиваются в инициацию и регуляцию образования и удаления фибрина во время тяжелой инфекции [9,10].
Рис.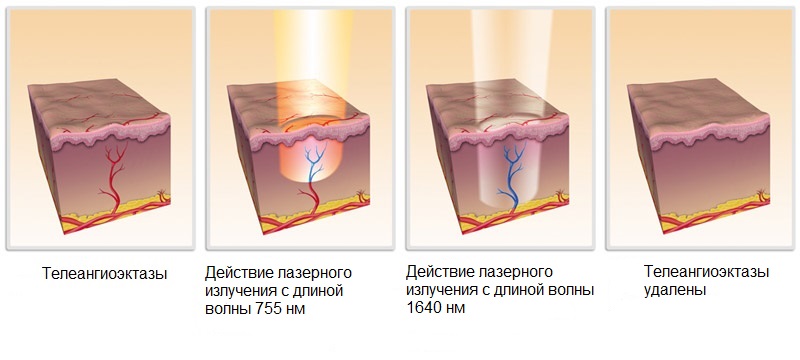 1
1
Схематическое изображение патогенетических путей диссеминированного внутрисосудистого свертывания (ДВС). Во время синдромов системного воспалительного ответа как нарушенные эндотелиальные клетки, так и активированные мононуклеарные клетки могут продуцировать провоспалительные цитокины, которые опосредуют активацию коагуляции. Активация коагуляции инициируется экспрессией тканевого фактора на активированных мононуклеарных клетках и эндотелиальных клетках. Кроме того, подавление физиологических механизмов антикоагулянта и ингибирование фибринолиза эндотелиальными клетками будет дополнительно способствовать внутрисосудистому отложению фибрина.PAI-1 указывает на ингибитор активатора плазминогена, тип 1.
Рис. 1
Схематическое изображение патогенетических путей диссеминированного внутрисосудистого свертывания (ДВС). Во время синдромов системного воспалительного ответа как нарушенные эндотелиальные клетки, так и активированные мононуклеарные клетки могут продуцировать провоспалительные цитокины, которые опосредуют активацию коагуляции. Активация коагуляции инициируется экспрессией тканевого фактора на активированных мононуклеарных клетках и эндотелиальных клетках. Кроме того, подавление физиологических механизмов антикоагулянта и ингибирование фибринолиза эндотелиальными клетками будет дополнительно способствовать внутрисосудистому отложению фибрина.PAI-1 обозначает ингибитор активатора плазминогена типа 1.
3. Механизмы индуцированной воспалением коагуляции и активации фибринолиза
Активация коагуляции, вызванная воспалением, характеризуется широко распространенным внутрисосудистым отложением фибрина, которое, по-видимому, является результатом усиленного образования фибрина и нарушения деградации фибрина [1,11]. Как указано в следующих абзацах и схематически представлено на фиг. 1, усиленное образование фибрина вызвано опосредованным тканевым фактором генерацией тромбина и одновременно происходящим угнетением тормозных механизмов, таких как системы протеинов C и S.Нарушение эндогенного тромболиза в основном происходит из-за высоких уровней циркулирующего PAI-1, основного ингибитора активации плазминогена. Эти нарушения в коагуляции и фибринолизе опосредуются различными эффектами различных провоспалительных цитокинов [5].
3.1. Фактор ткани
Инициирующие факторы включают молекулярный тканевой фактор и фактор белка плазмы VII (а) [12]. Тканевый фактор представляет собой связанный с мембраной белок массой 4,5 кДа, который конститутивно экспрессируется в ряде клеток по всему телу [13].Эти клетки в основном находятся в тканях, не находящихся в прямом контакте с кровью, таких как адвентициальный слой более крупных кровеносных сосудов. Подкожная ткань также содержит значительные количества TF, и гистологически TF, по-видимому, присутствует во всех тканевых барьерах крови [14]. При экспрессии на поверхности клетки ТФ может взаимодействовать с фактором VII либо в его зимогене, либо в активированной форме [15]. При комплексообразовании фактор VII активируется, а комплекс TF-фактор VIIa катализирует превращение обоих факторов IX и X [16,17].Факторы IXa и Xa усиливают активацию факторов X и протромбина соответственно (рис. 1). В клетках, находящихся в контакте с кровообращением, TF индуцируется действием нескольких соединений, включая цитокины, C-реактивный белок и продвинутые гликозилированные конечные продукты [14]. Индуцибельный ТФ преимущественно экспрессируется моноцитами и макрофагами. Экспрессия TF на моноцитах заметно стимулируется присутствием тромбоцитов и гранулоцитов в P-селектин-зависимой реакции [18]. Этот эффект может быть результатом активации ядерного фактора каппа B (NFkB), вызванного связыванием активированных тромбоцитов с нейтрофилами и мононуклеарными клетками.Это клеточное взаимодействие также заметно усиливает продукцию IL-1b, IL-8, MCP-1 и TNFa [19].
В условиях in vitro различные цитокины, такие как фактор некроза опухоли a (TNFa) и интерлейкин (IL) 1, индуцируют ТФ эндотелиальными клетками сосудов, но его значение для свертывания крови in vivo остается неопределенным [14,20]. TF также был локализован на полиморфно-ядерных клетках (PMN) в цельной крови и системах перфузии ex vivo, что позволяет предположить наличие дополнительного пула «переносимого с кровью» TF [21], но маловероятно, что PMN действительно синтезирует TF в обнаруживаемых количествах [22].Наконец, ТФ и связанная с ним прокоагулянтная активность in vitro была обнаружена на микровезикулах, происходящих преимущественно из тромбоцитов и гранулоцитов, у пациентов с менингококковым сепсисом [23]. Локализация на микровезикулах может означать высокоэффективный пул прокоагулянтного материала, объединяющий не только инициирующий комплекс TF-фактор VIIa, но также поверхность фосфолипидов, способствующую развитию комплексов теназы и протромбиназы. Кроме того, растворимая форма TF обнаруживается в плазме крови человека, и ее уровни повышены при ДВС-синдроме [24].Значение растворимого ТФ неизвестно. Вероятно, это результат расщепления мембраны металлопротеиназами, образующимися в условиях воспаления, и он циркулирует как в свободной, так и в комплексной формах. Остается выяснить, является ли растворимый ТФ каталитически активным и участвует ли он в индукции коагуляции. В дополнение к его влиянию на систему гемостаза тканевой фактор также обладает клеточными сигнальными и митогенными эффектами. Эти эффекты, вероятно, опосредуются рецепторами, активируемыми протеазой (PAR) 1 и 2.Другие примеры таких эффектов описаны ниже в параграфе, описывающем перекрестную связь между коагуляцией и воспалением.
У людей с инфекцией и активированной системой коагуляции были продемонстрированы моноциты, экспрессирующие повышенные уровни ТФ и прокоагулянтной активности. Экспрессия TF в тканях, по-видимому, ограничена определенными органами и сосудистыми слоями, но неясно, контролируется ли его экспрессия генетически специфическим для органа способом [9].
3.2. Контактная система
Неизвестно, играет ли какую-либо роль путь контакта у людей с тяжелой инфекцией. Отрицательно заряженные вещества, включая фосфолипиды и гликозаминогликаны, являются теоретически значимым источником контактной активации. Недавние исследования предполагают, что интактные клеточные поверхности обеспечивают сборку белков контактных факторов, которые могут инициировать этот путь активации [25]. Сборка кининогенов на мультибелковом рецепторе приводит к контролируемой активации прекалликеина.В случае эндотелиальных клеток комплекс между высокомолекулярным кининогеном (HK) и прекалликреином или фактором XI связывается с мультибелковым рецептором на этих клетках. Этот рецептор состоит из цитокератина 1, uPAR и gC1qR [25]. Цитокератин 1 также был продемонстрирован на тромбоцитах и гранулоцитах, что также может способствовать взаимодействию HK с этими клетками. На эндотелиальных клетках активация PK приводит к превращению фактора XII, усиливающему активацию PK. Активация PK вызывает расщепление HK и высвобождение брадикинина.Брадикинин индуцирует tPA, и это одно из возможных прямых эффектов контактной системы на фибринолиз [26,27,27]. Несколько линий доказательств подтверждают важную роль контактной системы в активации фибринолиза. Дополнительные исследования показывают, что кининогены содержат пептидный фрагмент, который препятствует связыванию тромбина с тромбоцитами, предотвращая высвобождение пептида из PAR1 тромбином [28]. Взятые вместе, профибринолитическая и антикоагулянтная функции контактной системы более вероятны, чем прокоагулянтная роль in vivo.
Исследования на пациентах с клиническим подозрением на ДВС-синдром показали повышенный уровень маркеров активации контактной системы. Кауфманн и др. измерили повышенные концентрации комплексов кининоген-a 1 против трипсина [29], однако исследования с использованием аналогичных методов для маркеров активации коагуляции почти никогда не выявили повышенных уровней контактной активации [30]. Исследование у пациентов с менингококковой септицемией показало отрицательную корреляцию между уровнями фактора XII в плазме и комплексами ингибиторов фактора XIIa-C1 [31].Хотя это предполагает потребление фактора XII и последующую активацию фактора XI ниже по течению, возможное альтернативное объяснение — отрицательный эффект острой фазы со сниженным синтезом фактора XII в сочетании с опосредованной тромбином активацией фактора XI [32].
Экспериментальные исследования показали, что блокада контактного пути на модели сепсиса E. coli у приматов с помощью моноклональных антител против фактора XIIa не защищает животных от нарушения свертывания крови, но снижает развитие летальной гипотензии [33].Это последнее исследование предоставило разумную поддержку существующей точке зрения о том, что путь контактной активации не способствует активации коагуляции. Контактный путь может играть важную роль в провоспалительных механизмах, связанных с проницаемостью сосудов, процессами пролиферации сосудов (роль кининогена в пролиферации гладкомышечных клеток) и стимуляцией фибринолиза [34].
3.3. Физиологические антикоагулянтные пути
Системной активации коагуляции при воспалении противодействуют несколько механизмов.Во-первых, присутствуют ингибиторы коагуляции, замедляющие механизм свертывания (рис. 2). Растворимые ингибиторы представляют собой антитромбин (AT), белки C и S и ингибитор пути тканевого фактора (TFPI) [35]. Антитромбин ингибирует протеазы свертывания крови за счет образования комплексов 1: 1, что в случае комплексов тромбин-антитромбин может быть обнаружено с помощью иммуноанализа в плазме от пациентов с ДВС [24,36]. Считается, что АТ является одним из наиболее важных ингибиторов активированной системы свертывания крови, и при сепсисе обнаруживают заметно пониженные уровни в плазме [37,38].В ходе DIC на функцию AT можно повлиять несколькими способами. Во-первых, снижение абсолютного количества ингибитора может происходить из-за снижения синтеза белка, с одной стороны, и клиренса, с другой. Клиренс может происходить либо в форме комплекса протеаза-ингибитор, либо в результате протеолитического расщепления протеолитическими ферментами, включая эластазу гранулоцитов [39]. Во-вторых, функция AT может быть нарушена из-за возможного снижения доступности гликозаминогликанов, которые могут действовать как физиологический гепариноподобный кофактор AT [40].Под влиянием цитокинов синтез гликозаминогликанов эндотелиальными клетками может снижаться, что снижает ингибирующий потенциал АТ [41]. На животных моделях экспериментальной бактериемии концентрат антитромбина продлевал выживаемость и уменьшал тяжесть ДВС-синдрома [42]. Этот защитный эффект мог отличаться от антикоагулянтного эффекта как такового, поскольку в одной из этих моделей препарат фактора Ха, блокированный активным центром, снижал тяжесть ДВС-синдрома, но не защищал животных от смерти из-за сепсиса [43].Защитный эффект антитромбина мог быть результатом противовоспалительного действия. Инфузия рекомбинантного антитромбина в очень высоких концентрациях (примерно в 10 раз выше, чем базальная концентрация в плазме) заметно снизила смертность из-за смертельной инфузии E. coli , но также вызвала значительное снижение уровней IL-6 и IL-1 в плазме. 8 [44]. Несмотря на значительно более высокие уровни TNFa и более низкие уровни IL-10, общий эффект на DIC был явно благоприятным, поскольку снижение уровня фибриногена было менее выраженным у животных, получавших AT.Неожиданным открытием стало то, что уровни tPA после первоначального небольшого повышения в обеих группах были заметно ниже у павианов, зараженных E. coli , которым вводили антитромбин. В результате не наблюдалось увеличения уровней комплексов плазмин-антиплазмин (PAP), тогда как увеличение уровней PAI-1 было несколько увеличено у животных, получавших AT.
Рис. 2
Точка воздействия трех основных физиологических антикоагулянтных путей. Антитромбин является наиболее важным ингибитором тромбина и фактора Xa, активированный протеин C способен разрушать основные кофакторы Va и VIIIa, а TFPI ингибирует комплекс тканевого фактора / фактора VIIa.Аббревиатура: TFPI, ингибитор пути тканевого фактора.
Рис. 2
Точка воздействия трех основных физиологических путей антикоагулянта. Антитромбин является наиболее важным ингибитором тромбина и фактора Xa, активированный протеин C способен разрушать основные кофакторы Va и VIIIa, а TFPI ингибирует комплекс тканевого фактора / фактора VIIa. Аббревиатура: TFPI, ингибитор пути тканевого фактора.
Поскольку TNFα является критическим медиатором фибринолиза у приматов, получавших низкие дозы эндотоксина [45], и с учетом повышенных уровней TNF-α у павианов, получавших антитромбин, можно было бы ожидать заметного увеличения комплексов tPA и PAP в модель павиана после инфузии AT.Его отсутствие предполагает, что TNF-α не является единственным наиболее важным цитокином, влияющим на фибринолиз при сепсисе. Потенциально, повышение PAI-1 в достаточной степени притупляет фибринолиз, но альтернативным объяснением может быть прямое влияние антитромбина на высвобождение tPA эндотелием, вызванное связыванием AT с гликозаминогликанами на поверхности эндотелия. Учитывая общий отрицательный эффект на фибринолиз, неполную защиту, достигаемую только при очень высоких дозах антитромбина, терапевтический потенциал антитромбина может быть ограничен.
Белок C и его кофакторный белок S образуют вторую линию защиты. Тромбин связывается с молекулой тромбомодулина, связанной с мембраной эндотелиальных клеток, и этот комплекс превращает протеин C в его активную форму, протеин Ca (PCa) (рис. 3) [46]. Кроме того, комплекс тромбин-тромбомодулин ускоряет превращение активируемого тромбином фибринолитического ингибитора (TAFI) [47]. РПЖ инактивирует факторы Va и VIIIa протеолитическим расщеплением, замедляя тем самым каскад коагуляции. Эндотелиальные клетки, в первую очередь крупных кровеносных сосудов, экспрессируют рецептор эндотелиального протеина C (EPCR), который усиливает активацию протеина C на поверхности клетки [48–50].Активированный протеин С оказывает противовоспалительное действие на мононуклеарные клетки и гранулоциты, что может отличаться от его антикоагулянтной активности. Введение РПЖ предотвращало тромбин-индуцированную тромбоэмболию у мышей, в основном за счет его антитромботического действия [51]. Противовоспалительный эффект РПЖ был продемонстрирован Hancock et al. [52], демонстрируя снижение продукции TNFα у крыс, которым вводили эндотоксин. Активированный ПК уменьшал тяжесть повреждения спинного мозга у крыс, вероятно, из-за подавления активности лейкоцитов [53].В последней модели растворимый тромбомодулин обладал аналогичным противовоспалительным действием, но это также было опосредовано РПЖ. В модели воспаления легких, индуцированной эндотоксином, тромбомодулин также снижает проницаемость сосудов через протеин С-зависимый механизм [54].
Рис. 3
Дисфункция системы протеина C при диссеминированном внутрисосудистом свертывании (ДВС) происходит из-за низкого уровня зимогенного протеина C, подавления тромбомодулина и рецептора эндотелиального протеина C и низкого уровня свободного протеина S из-за острой фазы: индуцировал высокие уровни его связывающего белка (т.е.е. C4b-связывающий белок).
Рис. 3
Дисфункция системы протеина C при диссеминированном внутрисосудистом свертывании (ДВС) происходит из-за низкого уровня зимогенного протеина C, подавления тромбомодулина и рецептора эндотелиального протеина C и низких уровней свободного протеина S из-за острой фазы -индуцированный высокий уровень его связывающего белка (то есть C4b-связывающего белка).
Напротив, дефекты в механизме протеина С повышают уязвимость к воспалительным реакциям и последующей активации коагуляции.В исследованиях пациентов пониженные уровни протеина C и протеина S связаны с повышенной смертностью. Блокада активности протеина C путем инфузии C4-связывающего протеина превращает сублетальную модель E. coli у павианов в летальную модель [55]. Блокада EPCR нейтрализующим моноклональным антителом также увеличивала смертность в модели павиана E. coli [56]. Напротив, инфузия ПК в той же модели защищена от ДВС-синдрома и умирает [57]. Таким образом, похоже, что механизм протеина C имеет большое значение в защите хозяина от сепсиса и активации свертывания крови.В ситуациях, связанных с ДВС-синдромом и системным воспалением, TNFa и интерлейкин-1 могут значительно подавлять клеточную экспрессию тромбомодулина, как предполагают эксперименты на культуре клеток [58–60]. Образование тромбина может вызвать отторжение EPCR эндотелием из-за активации металлопротеиназ тромбином. В настоящее время неизвестно, расщепляется ли тромбомодулин с помощью аналогичных механизмов.
Третий механизм ингибирования составляет TFPI. Эта молекула, которая существует в нескольких пулах, связанных либо с эндотелиальными клетками, либо связанными с липопротеинами в плазме, ингибирует комплекс TF-фактор VIIa, образуя четвертичный комплекс, в котором фактор Xa является четвертым компонентом [61].Клинические исследования у пациентов с сепсисом не показали его важности, поскольку у большинства пациентов уровни TFPI не уменьшаются по сравнению с нормальными [62]. Это может быть объяснено отсутствием подавляющего действия медиаторов воспаления на культивируемые эндотелиальные клетки [63]. Значимость TFPI для активации свертывания крови, вызванной сепсисом, иллюстрируется двумя экспериментальными линиями. Во-первых, истощение TFPI-сенсибилизированных кроликов к DIC, вызванное инфузией тканевого фактора, повышает чувствительность животных к развитию более тяжелого DIC [64].Во-вторых, инфузия TFPI защищает приматов от вредного воздействия E. coli . В этом исследовании TFPI не только блокировал ДВС-синдром, но и все павианы, зараженные смертельным количеством бактерий E. coli , показали заметное улучшение жизненно важных функций и выжили в эксперименте без видимых осложнений [65]. Благоприятные эффекты TFPI частично могут быть связаны с его способностью связывать эндотоксин и препятствовать его взаимодействию с CD14 [66], а также его ослабляющим действием на генерацию IL-6.Недавнее исследование на добровольцах подтвердило способность TFPI блокировать прокоагулянтный путь, запускаемый эндотоксином [67]. Однако в этом исследовании у здоровых субъектов не было снижения уровня цитокинов, в отличие от очевидного противовоспалительного эффекта TFPI в исследовании с павианом. Есть несколько возможных объяснений этого несоответствия, и все они связаны с заметными различиями между моделями сепсиса с эндотоксином и E. coli , в которых исследовались эффекты TFPI.В положительном влиянии TFPI на выживаемость могут быть заметными противовоспалительные эффекты, а не антитромботическая активность [65].
В целом, наличие неизменной функции и нормальных уровней ингибиторов в плазме, по-видимому, имеет важное значение для защиты от ДВС-синдрома. Однако следует отметить, что нет убедительных указаний на то, что люди с врожденной недостаточностью ингибиторов будут иметь больше шансов на развитие ДВС-синдрома, но этот вопрос еще предстоит изучить. Кроме того, дальнейшего внимания заслуживает влияние ингибиторов на изменение взаимодействия между свертыванием и воспалением.
3.4. Фибринолиз
В экспериментальных моделях тяжелой инфекции активируется фибринолиз, что демонстрируется начальной активацией плазминогена с последующим заметным нарушением, вызванным высвобождением в кровь ингибитора активатора плазминогена типа 1 (PAI-1) [45,68,69 ]. Последний ингибитор сильно подавляет фибринолиз, вызывая чистую прокоагулянтную ситуацию. Молекулярная основа — это активация эндотелиальных клеток сосудов, опосредованная цитокинами; TNFα и IL-1 уменьшали количество свободного tPA и увеличивали продукцию PAI-1, TNFa увеличивали общую продукцию uPA в эндотелиальных клетках [70,71].Эндотоксин и TNFα стимулировали продукцию PAI-1 в печени, почках, легких и надпочечниках мышей. Состояние чистого прокоагулянта иллюстрируется поздним повышением количества фрагментов распада фибрина после заражения павианов E. coli . Экспериментальные данные также указывают на то, что фибринолитический механизм активен в удалении фибрина из органов и кровообращения. Вызванное эндотоксином образование фибрина в почках и надпочечниках больше всего зависело от снижения уровня активатора плазминогена урокиназного типа (uPA) [72]. У мышей с нокаутом PAI-1, зараженных эндотоксином, не развились тромбы в почках, в отличие от животных дикого типа [71].Введение эндотоксина мышам с функционально неактивным геном тромбомодулина (мутация TMProArg) и дефектной функцией кофактора активатора протеина C вызывало образование фибриновых пробок в малом круге кровообращения, в то время как у животных дикого типа макроскопический фибрин не развивался [73]. Это явление оказалось временным: тромбы обнаруживались через 4 часа после эндотоксина, а тромбы исчезли через 24 часа у животных, умерщвленных в этот момент времени. Эти эксперименты демонстрируют, что фибринолитическое действие необходимо для уменьшения степени образования внутрисосудистого фибрина.
Фибринолитическая активность в значительной степени регулируется PAI-1, основным ингибитором этой системы. Недавние исследования показали, что функциональная мутация в гене PAI-1, полиморфизм 4G / 5G, не только влияла на уровни PAI-1 в плазме, но также была связана с клиническим исходом менингококковой септицемии. Пациенты с генотипом 4G / 4G имели значительно более высокие концентрации PAI-1 в плазме и повышенный риск смерти [74]. Дальнейшие исследования показали, что полиморфизм PAI-1 не влияет на риск заражения менингитом как таковой, но, вероятно, увеличивает вероятность развития септического шока от менингококковой инфекции [75].Эти исследования являются первым доказательством того, что генетически обусловленные различия в уровне фибринолиза влияют на риск развития осложнений грамотрицательной инфекции. В других клинических исследованиях групп пациентов с ДВС-синдромом высокие уровни PAI-1 в плазме были одним из лучших предикторов смертности [76,77]. Эти данные предполагают, что активация коагуляции способствует смертности в этой ситуации, но, как указывалось ранее, тот факт, что PAI-1 является белком острой фазы, более высокая концентрация в плазме также может быть маркером заболевания, а не причинным фактором.Интересно, что α-гранулы тромбоцитов содержат большое количество PAI-1 и высвобождают PAI-1 при их активации. Поскольку тромбоциты активируются в случае сильного воспаления и инфекции, это может еще больше повысить уровень PAI-1 и способствовать отключению фибринолиза.
3.5. Тромбоциты
В дополнение к механизмам, описанным выше, тромбоциты также могут играть роль в патогенезе активации коагуляции, вызванной воспалением. Эндотоксин может непосредственно активировать тромбоциты, и многие провоспалительные цитокины способны вызывать активацию тромбоцитов через путь сфингозина и фактор активации тромбоцитов (PAF) и его рецептор.Важность активации тромбоцитов для активации свертывания крови при тяжелой инфекции, вероятно, связана с обеспечением подходящей фосфолипидной поверхности на активированной мембране тромбоцитов для сборки комплексов активированных факторов свертывания, таких как комплекс протромбиназы, состоящий из активированных факторов X и V, протромбин и кальций. Наличие такой поверхности может в несколько раз катализировать образование тромбина и сделать систему свертывания менее чувствительной к ингибиторам протеаз в жидкой фазе.
4. Цитокины и другие медиаторные факторы
Для активации свертывания крови необходим ряд кофакторов. В частности, для развития активации коагуляции требуется ряд взаимодействующих поверхностей остатков клеток или интактных клеток, медиаторов воспаления и белков коагуляции. Стимул представлен основным заболеванием и, таким образом, может быть разнообразным: соединение бактериальной клетки, такое как эндотоксин, протеаза, индуцированная злокачественными клетками, повреждение ткани, обнажающее каталитические поверхности, и конститутивно экспрессируемый ТФ, вещество, которое может непосредственно активировать коагуляцию (жир амниотическая жидкость) неизвестными путями или другими путями.Каждый из этих триггеров взаимодействует с другими медиаторами: TF собирается на фосфолипидах, клетки обеспечивают каталитическую поверхность за счет воздействия фосфатидилсерина, цитокины взаимодействуют с рецепторами и индуцируют сигнальные пути, которые индуцируют TF и другие провоспалительные компоненты через комплекс NFκB. Чтобы проиллюстрировать эту ситуацию, мы более подробно опишем механизмы, которые приводят к вызванной эндотоксинами активации механизма свертывания крови. Эта модель представляет собой наиболее изученную модель сложной сети взаимодействий, которая включает активированную коагуляцию по типу ДВС [78].Эндотоксин — это липополисахаридное соединение грамотрицательных бактерий, вызывающее синдром сепсиса и ДВС-синдром. Грамотрицательные бактерии высвобождают эндотоксины из своей мембраны, которые взаимодействуют с клеточными поверхностями разными путями. В крови эндотоксин напрямую связывается с CD 14 в моноцитах и связывается с эндотелиальными клетками после образования комплекса с липополисахаридсвязывающим белком (LBP) и комплексом Toll-подобного рецептора 4 [79]. Посредством этих взаимодействий эндотоксин индуцирует ряд сигнальных путей, ведущих к активации системы NFkB, которая запускает транскрипцию генов провоспалительных цитокинов, ТФ и других.Эти механизмы более подробно рассматриваются в другом месте [80].
За исключением прямого положительного эффекта эндотоксина на синтез TF, образование цитокинов IL-1, TNFα и IL-6 стимулирует образование TF [14]. Ex vivo это было напрямую продемонстрировано путем демонстрации того, что продукция мРНК TF быстро индуцировалась в клетках крови после инъекции эндотоксина людям-добровольцам [81]. In vitro клетки цельной крови генерируют TF при инкубации с эндотоксином или IL-1, TNFα и IL-6. In vitro культивируемые эндотелиальные клетки человека также индуцируют TF после инкубации с TNFα и IL-1, но их роль в DIC остается неизвестной.До сих пор единственным прямым доказательством участия эндотелия в продукции TF была демонстрация экспрессии TF циркулирующих эндотелиальных клеток у пациентов с серповидно-клеточной анемией (возможное состояние, связанное с ДВС-синдромом) [82].
Исследования на приматах выявили молекулярный механизм, лежащий в основе вызванной эндотоксином активации коагуляции [68]. После внутривенного введения эндотоксина наблюдается быстрое производство и высвобождение провоспалительных цитокинов. Среди них TNFa [69] и IL-6 [83] важны для индукции фибринолитических и прокоагулянтных изменений в крови.В частности, происходит быстрое увеличение плазменных уровней тканевого активатора плазминогена (tPA) и протромбинового фрагмента F1 + 2, а также комплексов тромбин-антитромбин (TAT). Фибринолитическая активность, на которую указывают комплексы плазмин-антиплазмин, нарушается последующим повышением уровня ингибитора активатора плазминогена 1 (PAI-1), что приводит к чистому прокоагулянтному состоянию [5]. Исследования на бабуинах, зараженных смертельным количеством E. coli (модель грамотрицательной септицемии), подчеркнули важность цитокинов в опосредовании синдрома сепсиса и продемонстрировали длительное провоспалительное течение, при котором фактическое образование фибрина особенно очевидно. при> 24 ч после E.coli [84]. Фактически большая часть фибрина появляется в крови, когда образование тромбина уже снижается, и признаки активации эндотелиальных клеток становятся очевидными, о чем свидетельствуют повышенные уровни растворимого тромбомодулина. Как в модели эндотоксина шимпанзе, так и в модели E. coli , TF необходим для индукции коагуляционной активности, а ингибирование пути TF отменяет активацию свертывания [85]. IL-6 является важным медиатором прокоагулянтных эффектов, в то время как TNFa особенно участвует в фибринолитической реакции на эндотоксин [86].Напротив, ингибирование TF с помощью TFPI снижает уровень IL-6 в крови в модели бабуина [87], что позволяет предположить, что существует более обширное перекрестное взаимодействие между медиаторами воспаления и коагуляцией (см. Далее). Эти эффекты могут быть более очевидными в модели сепсиса, чем в модели эндотоксина [88]. Недавние эксперименты на людях, зараженных эндотоксином, не выявили какого-либо эффекта TFPI на IL-6 или другие цитокины, измеренные в крови [67]. Таким образом, сила триггера может определять степень вовлечения цитокиновой сети и ее взаимодействия с системой коагуляции.
Моноциты, экспрессирующие TF, напрямую связываются с фактором VII (a), выделяют TF или становятся ассоциированными с поврежденной стенкой сосуда, процесс, вероятно, происходит, когда макрофаги, экспрессирующие TF, проникают в стенку сосуда и играют прокоагулянтную роль при атеросклерозе [89]. Циркулирующие моноциты могут вызвать ДВС-синдром после взаимодействия с тромбоцитами. Микровезикулы могут ускорить этот процесс, а сложное взаимодействие между клетками, фрагментами мембран, растворимыми медиаторами и белками может вызвать полномасштабный ДВС-синдром.В модели эндотоксина тромбин является важным активатором обратной связи механизма коагуляции, поскольку тромбин-специфический ингибитор гирудин снижает прокоагулянтный ответ у людей-добровольцев [90]. Степень катализа и истощения белков коагуляции и клеточных элементов в первую очередь определяется силой триггеров и потенциалом тормозных механизмов.
5. Перекрестная связь между свертыванием и воспалением
Активация коагуляции дает протеазы, которые не только взаимодействуют с зимогенами белков свертывания, но также и со специфическими клеточными рецепторами для индукции сигнальных путей.В частности, протеазные взаимодействия, влияющие на воспалительные процессы, могут быть важны в развитии ДВС-синдрома. Фактор Ха, тромбин и комплекс тканевый фактор-фактор VIIa, как было показано, вызывают провоспалительную активность [91,92]. Фибриноген / фибрин важен для механизма защиты хозяина и, вероятно, играет дополнительную роль, которая не связана напрямую со свертыванием крови как таковой [93].
Было показано, что тромбин вызывает ряд некоагулянтных эффектов, некоторые из которых могут влиять на ДВС-синдром, влияя на уровни цитокинов в крови.Он индуцирует продукцию хемотаксического белка-1 моноцитов (MCP-1) и IL-6 в фибробластах, эпителиальных клетках и мононуклеарных клетках in vitro [94]. Стимулированная эндотоксинами цельная кровь продуцирует значительный уровень IL-8, который оказывает прокоагулянтное действие, зависящее от тканевого фактора и тромбина [95]. Тромбин также индуцирует продукцию ИЛ-6 и ИЛ-8 в эндотелиальных клетках. Эти эффекты тромбина на активацию клеток, вероятно, опосредованы рецепторами, активируемыми протеазой (PAR) 1, 3 и 4 [96]. PAR являются клеточными рецепторами для активированных протеаз, которые могут способствовать внутриклеточной передаче сигналов.Несколько исследований показали, что комплекс тканевый фактор-фактор VIIa также активирует клетки путем связывания с PAR, и, по-видимому, в этом участвует, в частности, PAR2. Связывание комплекса каталитического тканевого фактора с фактором VIIa вызывает ряд воспалительных эффектов в мононуклеарных клетках, которые могут влиять на их вклад в коагуляционную активность [97]. Прямое указание на актуальность этих явлений in vivo происходит из недавнего исследования, показывающего, что инфузия рекомбинантного фактора VIIa здоровым добровольцам вызывает повышение, хотя и небольшое, уровней IL-6 и IL-8 в плазме [98].Хотя концентрации фактора VIIa в плазме в этом эксперименте были намного выше, чем концентрации эндогенного фактора VIIa у пациентов с сепсисом, возможно, что механизм, посредством которого VIIa вызывает индукцию цитокинов (прямой или опосредованный фактором Ха / тромбином), имеет физиологическое значение.
Еще одно звено между воспалением и коагуляцией — это система протеина С. Активированный протеин С оказывает противовоспалительное действие на мононуклеарные клетки и гранулоциты, что может отличаться от его антикоагулянтной активности [99].Противовоспалительный эффект активированного протеина C был подтвержден in vivo путем демонстрации снижения продукции TNF-α у крыс, зараженных эндотоксином [52]. Кроме того, недавно мы показали, что у мышей с одноаллельной делецией гена протеина C (гетерозиготные мыши с дефицитом протеина C) не только развивается более тяжелый ДВС-синдром и повышенное отложение фибрина при системной эндотоксемии, но также значительно выше уровни циркуляции провоспалительных цитокинов по сравнению с однопометниками дикого типа [100].Эти экспериментальные данные подтверждаются наблюдениями в исследовании PROWESS, согласно которым рекомбинантный активированный протеин С человека (дротрекогин альфа [активированный]) ускорял снижение уровней IL-6 у пациентов с тяжелым сепсисом [101]. Для высоких доз антитромбина наблюдались аналогичные взаимодействия с воспалительными каскадами [44]. Взятые вместе, ряд протеаз свертывания крови может индуцировать провоспалительные медиаторы, которые обладают прокоагулянтным действием, что может усиливать каскад, приводящий к ДВС-синдрому.Эффекты на клеточном уровне будут определяться способностью ингибиторов коагуляции инактивировать эти ферменты.
6. Актуальность перекрестного взаимодействия воспаления и коагуляции при органной недостаточности
Существует множество доказательств того, что активация воспаления в сочетании с тромбозом микрососудов способствует полиорганной недостаточности у пациентов с тяжелой инфекцией и ДВС-синдромом. Во-первых, были опубликованы обширные данные о патологоанатомических исследованиях пациентов с ДВС-синдромом [102,103].Эти данные вскрытия включают диффузное кровотечение из различных участков, геморрагический некроз тканей, микротромбы в мелких кровеносных сосудах и тромбы в артериях и венах среднего и большего размера. Проявление ишемии и некроза неизменно связано с отложением фибрина в мелких и средних сосудах различных органов [104]. Важно отметить, что наличие этих внутрисосудистых тромбов явно и конкретно связано с клинической дисфункцией органа. Во-вторых, экспериментальные исследования ДВС-синдрома на животных показывают отложение фибрина в различных органах.Экспериментальная бактериемия или эндотоксемия вызывает внутри- и внесосудистое отложение фибрина в почках, легких, печени, головном мозге и различных других органах. Улучшение гемостатического дефекта с помощью различных вмешательств в этих экспериментальных моделях, по-видимому, улучшает органную недостаточность и, в некоторых, но не во всех случаях, снижает смертность [42,87]. Наконец, клинические исследования подтверждают идею коагуляции как важного знаменателя клинического исхода. Было показано, что ДВС-синдром является независимым предиктором смертности у пациентов с сепсисом и тяжелой травмой [1,105].
7. Коагуляция и сосудистые осложнения при инфекционных болезнях
Помимо общей реакции на системное воспаление, как обсуждалось выше, специфические инфекции могут приводить к тромбогеморрагическим синдромам, гемолитико-уремическому синдрому (ГУС), тромботической тромбоцитопенической пурпуре (ТТП) или васкулиту. Среди симптомов и признаков могут преобладать кровотечение, тромбоз или и то, и другое [1,79,106]. Клинически явная активация коагуляции, вызванная инфекцией, может происходить у 30–50% пациентов с грамотрицательным сепсисом [107–110].Вопреки широко распространенному мнению, это может проявляться как у пациентов с грамположительным сепсисом, так и у пациентов с грамотрицательным сепсисом [111]. Активация системы свертывания крови также была задокументирована для небактериальных патогенов, то есть вирусов [112,113], простейших (малярия) [114,115], грибов [116] и спирохет [117].
7.1. Тромбозы и кровотечения
Вирусные и бактериальные инфекции могут привести к повышенному риску местного тромбоэмболического заболевания, то есть тромбоза глубоких вен или тромбоэмболии легочной артерии.В исследовании профилактики тромбоэмболий с применением низких доз стандартного подкожного гепарина для госпитализированных пациентов с инфекционными заболеваниями заболеваемость тромбоэмболическими заболеваниями была значительно снижена в группе гепарина по сравнению с группой, не получавшей профилактики. Однако положительного влияния профилактики на смертность от тромбоэмболических осложнений не наблюдалось [118]. При хронических вирусных заболеваниях, таких как ЦМВ или ВИЧ-инфекция, риск тромбоэмболических осложнений относительно низок [119–121].
В наиболее тяжелых случаях вирусная геморрагическая лихорадка осложняется ДВС [122–126]. ДВС-синдром не часто встречается при других вирусных инфекциях, но сообщается о случаях заражения ротавирусом [127, 128], ветряной оспой, краснухой, рубеолой и гриппом [129–136]. ТТП и ГУС, вызванные вирусной или бактериальной инфекцией [137,138], часто приводят к симптомам кровотечения, но также тромбы тромбоцитов и фибрина могут образовываться в различных органах, что приводит к выраженным симптомам дисфункции органов.При определенных инфекциях, таких как вирусная геморрагическая лихорадка, очевидны кровотечения [122, 123]. При других вирусных и бактериальных инфекциях, связанных с ТТП или ГУС, кровотечение также часто является заметным и характерным симптомом (Таблица 1) [139–141].
| Вирус . | Географическое распространение . | Источник инфекции . | ||
|---|---|---|---|---|
| Денге HF | Юго-Восточная Азия, Средняя и Южная Америка, Китай | Москит | ||
| Чикунгунья | Юго-Восточная Азия | Москит | ||
| Marburg HF | Зимбабве, Кения, Уганда | Неизвестно | ||
| Лихорадка Ласса | Западная Африка | Грызун | ||
| Желтая лихорадка | Южная Америка, Африка | Южная Америка, Африка | Советский Союз | Клещ |
| Хантаан | Центральная Европа, бывший Советский Союз, Азия | Грызун |
| Вирус . | Географическое распространение . | Источник инфекции . | ||
|---|---|---|---|---|
| Денге HF | Юго-Восточная Азия, Средняя и Южная Америка, Китай | Москит | ||
| Чикунгунья | Юго-Восточная Азия | Москит | ||
| Marburg HF | Зимбабве, Кения, Уганда | Неизвестно | ||
| Лихорадка Ласса | Западная Африка | Грызун | ||
| Желтая лихорадка | Южная Америка, Африка | Южная Америка, Африка | Советский Союз | Клещ |
| Хантаан | Центральная Европа, бывший Советский Союз, Азия | Грызун |
| Вирус . | Географическое распространение . | Источник инфекции . | ||
|---|---|---|---|---|
| Денге HF | Юго-Восточная Азия, Средняя и Южная Америка, Китай | Москит | ||
| Чикунгунья | Юго-Восточная Азия | Москит | ||
| Marburg HF | Зимбабве, Кения, Уганда | Неизвестно | ||
| Лихорадка Ласса | Западная Африка | Грызун | ||
| Желтая лихорадка | Южная Америка, Африка | Южная Америка, Африка | Советский Союз | Клещ |
| Хантаан | Центральная Европа, бывший Советский Союз, Азия | Грызун |
| Вирус . | Географическое распространение . | Источник инфекции . | ||
|---|---|---|---|---|
| Денге HF | Юго-Восточная Азия, Средняя и Южная Америка, Китай | Москит | ||
| Чикунгунья | Юго-Восточная Азия | Москит | ||
| Marburg HF | Зимбабве, Кения, Уганда | Неизвестно | ||
| Лихорадка Ласса | Западная Африка | Грызун | ||
| Желтая лихорадка | Южная Америка, Африка | Южная Америка, Африка | Советский Союз | Клещ |
| Хантаан | Центральная Европа, бывший Советский Союз, Азия | Грызун |
7.2. Васкулит
Бактериальные и вирусные инфекции могут привести к васкулитоподобному синдрому с проявлениями кровотечения или ишемического повреждения [142–144]. Васкулит — это хорошо задокументированное явление при ЦМВ-инфекции [145, 146], возникающее преимущественно в сосудистой сети желудочно-кишечного тракта, где он вызывает колит [147, 148], в центральной нервной системе, где он вызывает инфаркт мозга [149, 150], и в коже, где он возникает. при петехиях, папулах пурпуры, локализованных язвах или диффузной макулопапулезной сыпи [151].ВИЧ-инфекция (вирус иммунодефицита человека) может сопровождаться синдромами васкулита, например узелковый полиартериит, пурпура Шенлейна Геноха и лейкоцитокластический васкулит [152–154]. Инфекция гепатита B и C может вызвать полиартериитоподобный васкулит [155, 156]. Было высказано предположение, что парвовирус В19 связан с васкулитоподобными синдромами, включая болезнь Кавасаки, узелковый полиартериит и гранулематоз Вегенера [157–159].
8. Особенности патогенеза нарушений свертывания крови при инфекционных заболеваниях
Большая часть наших знаний о механизмах, которые играют роль в ассоциированной с инфекцией активации коагуляции, получены из наблюдений за клиническими и экспериментальными инфекционными заболеваниями.По сути, как подробно описано в предыдущих параграфах, несколько путей, по-видимому, играют роль, включая опосредованное тканевым фактором образование тромбина, нарушение физиологических механизмов антикоагулянта и угнетение фибринолитической системы из-за повышенных уровней PAI- 1. Кроме того, можно оценить особенности активации коагуляции у больных инфекционными заболеваниями:
8.1. Активация эндотелиальных клеток
,00
Эндотелиальные клетки могут переходить в прокоагулянтное состояние либо за счет стимуляции цитокинов вместе с циркулирующими кровяными клетками, такими как лимфоциты или тромбоциты, либо путем прямого инфицирования (вирусами) эндотелиальных клеток.Роль эндотелиальных клеток кажется решающей в развитии шока и активации коагуляции [160, 161]. Повреждение эндотелиальных клеток является обычным признаком вирусной инфекции и может прямо или косвенно влиять на гемостаз. Эндотелиальная клетка может быть напрямую инфицирована различными вирусами, например HSV, аденовирус, парагрипп, полиовирус, эховирус, вирус кори, вирус эпидемического паротита, цитомегаловирус, HTLV-1 и ВИЧ [162–165]. Способность инфицировать эндотелиальные клетки также была продемонстрирована при геморрагической лихорадке, вызванной вирусом Денге, вирусом Марбург, вирусом Эбола, вирусом Хантаан и вирусом Ласса [166].Такие инфекции могут приводить к прокоагулянтному состоянию, в основном за счет индукции экспрессии тканевого фактора на эндотелиальной поверхности, вероятно, опосредованной цитокинами, такими как IL-1, TNFα и IL-6 [167–170]. Однако не все вирусные инфекции, поражающие эндотелиальные клетки, приводят к активации коагуляции, что может указывать на то, что активация эндотелия является одним из факторов многофакторного процесса.
Переход эндотелиальной клетки из состояния покоя в состояние прокоагуляции может быть связано с экспрессией молекул адгезии эндотелиальной поверхности [171].Эти молекулы, то есть ICAM, VCAM, E-селектин и фактор фон Виллебранда (vWF), играют важную роль в связывании лейкоцитов, что приводит к локальному воспалительному ответу, повреждению эндотелиальных клеток и последующей утечке плазмы и шоку [172, 173]. Обнаружение повышенных плазменных концентраций этих молекул адгезии к поверхности эндотелия считается отражением уровня активации и, возможно, повреждения эндотелиальной клетки [121].
8.2. Изменения в системе протеинов C и S
Во время сепсиса система белков C / S подавляется, как описано ранее.Некоторые вирусы обладают способностью вызывать определенные изменения в системе ингибирования свертывания. При ВИЧ-инфекции система белков C / S может быть нарушена в результате приобретенного дефицита белка S, патогенез которого еще не выяснен [174, 175]. Повышенные концентрации в плазме C4b-связывающего белка, белка острой фазы, который связывает белок S, может привести к снижению уровня свободного белка S. Антифосфолипидные антитела, которые могут присутствовать у пациентов с ВИЧ, могут влиять на комплекс белок C / белок S. и уменьшить его активность [176].У пациентов с геморрагической лихорадкой денге мы также обнаружили снижение уровня активности как протеина C, так и протеина S [177]. Как и при денге, ВИЧ может поражать эндотелиальные клетки; гипотетически это могло привести к снижению продукции белка S.
8.3. Тромбоцитопения
Тромбоцитопения наблюдается при многих вирусных инфекциях, но лишь изредка бывает достаточно серьезной, чтобы привести к нарушению гемостаза и кровотечениям. Предполагается, что тромбоцитопения в основном иммуноопосредована [178].Альтернативными механизмами являются снижение тромбопоэза, повышенное потребление тромбоцитов или их комбинация [179]. Прямое взаимодействие вируса с тромбоцитами может привести к тромбоцитопении и / или тромбоцитопатии [180, 181]. Повреждение эндотелия вирусом может привести к увеличению адгезии и потребления тромбоцитов [182].
К вирусным инфекциям, связанным с тромбоцитопенией, относятся паротит, краснуха, рубеола, ветряная оспа, диссеминированный простой герпес, ЦМВ, инфекционный мононуклеоз, вирусная инфекция Хантаан, геморрагическая лихорадка Денге, геморрагическая лихорадка Крым-Конго и геморрагическая лихорадка Марбурга188] [183–188] .
9. Коагуляция, вызванная воспалением, как точка воздействия для (поддерживающего) лечения тяжелой инфекции и сепсиса
Исходя из предположения, что дефектные физиологические механизмы антикоагулянта играют ключевую роль в патогенезе нарушения свертывания крови при сепсисе, восстановление этих путей может быть логичным подходом в (поддерживающем) лечении пациентов с тяжелым сепсисом. Фактически, для всех трех путей антикоагулянта такие варианты лечения доступны или находятся на продвинутой стадии разработки.
Восстановление пути антитромбина может быть достигнуто путем введения концентратов антитромбина. Использование концентратов антитромбина у пациентов с ДВС-синдромом изучалось относительно интенсивно. Большинство этих исследований касается пациентов с сепсисом и / или септическим шоком. Все испытания показывают некоторый положительный эффект с точки зрения улучшения лабораторных показателей, сокращения продолжительности ДВС-синдрома или даже улучшения функции органов. В более поздних клинических испытаниях для достижения супрафизиологических уровней в плазме использовались очень высокие дозы концентрата антитромбина, и положительные результаты в этих испытаниях кажутся более отчетливыми [3,189].Некоторые испытания показали умеренное снижение смертности у пациентов, получавших антитромбин, однако эффект никогда не достигал статистической значимости. Совсем недавно было завершено крупномасштабное многоцентровое рандомизированное контролируемое исследование для непосредственного решения этой проблемы [190]. Предварительные результаты, по-видимому, указывают на отсутствие значительного снижения смертности пациентов с сепсисом, которые лечились концентратом антитромбина. Анализ подгрупп показывает, что пациенты, не получающие сопутствующий гепарин, могут испытывать некоторую пользу от лечения антитромбином, но эту гипотезу еще предстоит подтвердить в проспективном исследовании.
Благоприятный эффект рекомбинантного активированного протеина С человека был продемонстрирован в двух рандомизированных контролируемых исследованиях. Во-первых, в клиническое испытание с определением дозировки был включен 131 пациент с сепсисом [101]. Включенные пациенты получали активированный протеин C путем непрерывной инфузии в дозах от 12 до 30 мкг / кг в час или плацебо. У этих пациентов было показано снижение относительного риска смерти на 40%, хотя это не было статистически значимым (из-за размера исследования).На основе этих обнадеживающих результатов исследования фазы II было проведено большое многоцентровое исследование эффективности [101]. Это испытание было преждевременно остановлено при втором промежуточном анализе из-за значительного снижения смертности у пациентов, получавших активированный протеин С. Смертность составила 24,7% в группе активированного протеина С по сравнению с 30,8% в группе плацебо (снижение относительного риска 19,4%, 95% доверительный интервал, 6,6–30,5).
Относительная недостаточность эндогенного TFPI при сепсисе и ДВС-синдроме может быть преодолена введением фармакологических доз рекомбинантного TFPI.В модели ДВС на крысах инфузия ингибитора пути рекомбинантного тканевого фактора (TFPI) сразу после введения эндотоксина значительно ингибировала потребление факторов свертывания и тромбоцитов [191]. Кроме того, уменьшенное количество фибриновых тромбов образовывалось в печени, легких, почках и селезенке. Подобные эффекты были обнаружены на кроличьей модели ДВС [64]. При эндотоксемии человека рекомбинантный TFPI дозозависимо снижает образование тромбина [67]. Клинические испытания фазы II по использованию TFPI у пациентов с сепсисом дали многообещающие результаты, но крупное многоцентровое испытание фазы III оказалось отрицательным, хотя опубликованные результаты еще не доступны.
10. Заключение
Двунаправленная связь между коагуляцией и воспалением, по-видимому, играет ключевую роль в механизмах, ведущих к органной недостаточности у пациентов с тяжелой инфекцией или сепсисом. Эндотелий играет центральную роль во всех основных путях, вовлеченных в патогенез нарушения гемостаза во время тяжелого воспаления. Эндотелиальные клетки, по-видимому, непосредственно участвуют в инициации и регуляции образования тромбина и ингибировании удаления фибрина.Провоспалительные цитокины имеют решающее значение в опосредовании этих эффектов на эндотелиальные клетки, которые сами могут также экспрессировать цитокины, тем самым усиливая коагуляционный ответ. Взаимодействие между воспалением и коагуляцией включает значительные перекрестные помехи между системами. На всех уровнях активированной системы свертывания крови при сепсисе естественные антикоагулянтные пути являются дефектными и, как следствие, неспособны сдерживать продолжающееся образование тромбина. Фармакологическое восстановление этих антикоагулянтных механизмов может быть логическим действием при (поддерживающем) лечении пациентов с сепсисом и нарушениями свертывания крови.Действительно, экспериментальные и (начальные) клинические исследования показывают положительные результаты этого типа лечения, не только ограниченные улучшением статуса коагуляции, но также и клинически значимых параметров результата, таких как функция органа и выживаемость.
Список литературы
[1]
Диссеминированная внутрисосудистая коагуляция
N Engl J Med
1999
341
586
592
[2]
Лечение пациентов с тяжелым сепсисом
N Engl J Med
1999
340
207
214
[3]
Диссеминированная внутрисосудистая коагуляция: современное состояние
Thromb Haemost
1999
82
695
705
[4]
и другие.
Воспаление, сепсис и коагуляция
Haematologica
1999
84
254
259
[5]
и другие.
Цитокин-опосредованный дисбаланс между коагулянтным и антикоагулянтным механизмами при сепсисе и эндотоксемии
евро J Clin Invest
1997
27
3
9
[6]
Путь тканевого фактора при диссеминированном внутрисосудистом свертывании
Semin Thromb Hemost
2001
27
605
617
[7]
Ответ антикоагулянтных путей при диссеминированном внутрисосудистом свертывании
Semin Thromb Hemost
2001
27
619
631
[8]
и другие.
Цитокины: триггеры клинической тромботической болезни
Thromb Haemost
1997
78
415
419
[9]
Гемостаз сосудистого русла: роль эндотелия в патогенезе сепсиса
Crit Care Med
2001
29
S28
S34
[10]
Эндотелий: граница между коагуляцией и воспалением
Crit Care Med
2002
30
С220
С224
[11]
Микротромбоз при сепсисе
Минерва Анестезиол
2001
67
298
301
[12]
Структурная биология тканевого фактора, инициатора тромбообразования in vivo
FASEB J
1994
8
385
390
[13]
и другие.
Роль пути тканевого фактора в инициации коагуляции
Фибринолиз свертывания крови
1998
9
Дополнение 1
S3
S7
[14]
Клеточная биология тканевого фактора, основного инициатора свертывания крови
Тромб Res
1996
81
1
41
[15]
и другие.
Кристаллическая структура комплекса фактора свертывания крови VIIa с растворимым тканевым фактором
Природа
1996
380
41
46
[16]
и другие.
Активация фактора X и протромбина рекомбинантным фактором VIIa in vivo опосредуется тканевым фактором
J Clin Invest
1993
92
1207
1212
[17]
и другие.
Фактор IX активируется in vivo с помощью механизма тканевого фактора
Кровь
1990
76
731
736
[18]
Экспрессия тканевого фактора моноцитами: регуляция и патофизиологические роли
Фибринолиз свертывания крови
1998
9
Дополнение 1
S9
S14
[19]
и другие.
Индукция экспрессии цитокинов в лейкоцитах путем связывания стимулированных тромбином тромбоцитов
Тираж
1997
95
2387
2394
[20]
и другие.
Клеточные иммунные и цитокиновые пути, приводящие к экспрессии тканевого фактора и влияющие на септический шок
Nouv Rev Fr Гематол
1992
34
Дополнение
S15
S27
[21]
и другие.
Тканевый фактор, передающийся с кровью: другой взгляд на тромбоз
Proc Natl Acad Sci USA
1999
96
2311
2315
[22]
Индукция экспрессии тканевого фактора в цельной крови — отсутствие доказательств наличия экспрессии тканевого фактора на гранулоцитах
Thromb Haemost
2000
83
861
867
[23]
и другие.
Клеточное происхождение и прокоагулянтные свойства микрочастиц при менингококковом сепсисе
Кровь
2000
95
930
935
[24]
и другие.
Определение антигена тканевого фактора плазмы и его клиническое значение
Br J Haematol
1994
87
343
347
[25]
Активация системы калликреин / кинин плазмы на клетках: пересмотренная гипотеза
Thromb Haemost
1999
82
226
233
[26]
Высвобождение тканевого активатора плазминогена in vivo в ответ на вазоактивные агенты
Кровь
1985
66
835
839
[27]
Селективная стимуляция тканевого активатора плазминогена (t-PA) in vivo путем инфузии брадикинина
Thromb Haemost
1997
77
522
525
[28]
Брадикинин и его метаболит, Arg-Pro-Pro-Gly-Phe, являются селективными ингибиторами активации тромбоцитов, индуцированной альфа-тромбином
Тираж
1996
94
517
528
[29]
и другие.
Комплексы альфа-2-макроглобулин-калликреин обнаруживают активацию контактной системы при наследственном ангионевротическом отеке и сепсисе человека
Кровь
1991
77
2660
2667
[30]
и другие.
Количественное определение плазменного фактора XIIa-Cl (-) — ингибитор и калликреин-Cl (-) — комплексов ингибитора при сепсисе
Кровь
1988
72
1841
1848
[31]
и другие.
Активация внутреннего пути коагуляции у детей с менингококковым септическим шоком
Thromb Haemost
1995
74
1436
1441
[32]
и другие.
Активация фактора свертывания XI без детектируемой контактной активации при экспериментальной эндотоксемии человека
Кровь
1998
92
3294
3301
[33]
и другие.
Контактная система способствует гипотонии, но не способствует диссеминированному внутрисосудистому свертыванию при летальной бактериемии. Использование in vivo моноклональных антител против фактора XII для блокирования контактной активации у павианов
J Clin Invest
1993
91
61
68
[34]
Оставайтесь на связи: роль контактной системы в инфекции и сепсисе
Crit Care Med
2000
23
3765
3766
[35]
Биохимия и физиология свертывания крови
Thromb Haemost
1999
82
165
174
[36]
и другие.
Нарушение баланса между активностью тромбина и плазмина при диссеминированном внутрисосудистом свертывании. Оценка по соотношению комплекса тромбин-антитромбин-III / комплекса плазмин-альфа-2-антиплазмин
Гемостаз
1992
22
179
186
[37]
и другие.
Активность фактора VIIa и антитромбина III при тяжелом сепсисе и септическом шоке у пациентов с нейтропенией
Кровь
1996
88
881
886
[38]
Гемангиоэндотелиома печени, ассоциированная с микроангиопатической гемолитической анемией.Протокол четырех дел
Am Med
1970
48
624
628
[39]
и другие.
Влияние гранулоцитарной эластазы человека на изолированный антитромбин III человека
Hoppe Seylers Z Physiol Chem
1981
362
103
112
[40]
Гликозаминогликаны и регуляция свертывания крови
Biochem J
1993
289
313
330
[41]
Человеческий рекомбинантный бета-интерлейкин-1 и фактор некроза опухоли альфа-опосредованное подавление гепариноподобных соединений в культивируемых эндотелиальных клетках аорты свиньи
J Cell Physiol
1990
144
383
390
[42]
и другие.
Супрафармакологические дозы концентрата антитромбина для диссеминированного внутрисосудистого свертывания крови, вызванного Staphylococcus aureus, у морских свинок: значительное снижение смертности и заболеваемости
Кровь
1997
89
4393
4401
[43]
и другие.
DEGR-фактор Ха блокирует диссеминированное внутрисосудистое свертывание крови, инициированное Escherichia coli, без предотвращения шока или повреждения органов
Кровь
1991
78
364
368
[44]
и другие.
Рекомбинантный человеческий антитромбин III улучшает выживаемость и ослабляет воспалительные реакции у павианов, смертельно зараженных Escherichia coli
Кровь
2000
95
1117
1123
[45]
и другие.
Высвобождение активатора плазминогена и ингибитора активатора плазминогена I во время экспериментальной эндотоксемии у шимпанзе: влияние вмешательств в каскады цитокинов и коагуляции
Clin Sci
1995
88
587
594
[46]
Роль протеина С и тромбомодулина в регуляции свертывания крови
J Biol Chem
1989
264
4743
4746
[47]
Фибринолиз и контактная система: роль фактора XI в подавлении фибринолиза
Thromb Haemost
1999
82
243
250
[48]
Идентификация, клонирование и регулирование нового протеина С эндотелиальных клеток / рецептора активированного протеина С
J Biol Chem
1994
269
26486
26491
[49]
и другие.
Рецептор протеина C человека присутствует в основном в эндотелии крупных кровеносных сосудов: значение для контроля пути протеина C
Тираж
1997
96
3633
3640
[50]
и другие.
Рецептор эндотелиального протеина С
Thromb Haemost
1999
82
251
258
[51]
и другие.
Активированный человеческий протеин C предотвращает тромбин-индуцированную тромбоэмболию у мышей. Доказательства того, что активированный протеин c снижает накопление внутрисосудистого фибрина за счет ингибирования дополнительного образования тромбина
J Clin Invest
1998
101
667
676
[52]
и другие.
Антикоагулянты протеин C и протеин S обладают сильным противовоспалительным и иммунодепрессивным действием, имеющим отношение к биологии и терапии трансплантата
Процедура трансплантации
1992
24
2302
2303
[53]
и другие.
Активированный протеин С снижает тяжесть повреждения спинного мозга, вызванного компрессией, у крыс за счет ингибирования активации лейкоцитов
J Neurosci
1998
18
1393
1398
[54]
и другие.
rhs-TM предотвращает вызванное ЭТ увеличение проницаемости легочных сосудов за счет активации протеина C
Am J Physiol
1997
273
L889
L894
[55]
и другие.
Роль свободного белка S и связывающего белка C4b в регуляции коагулянтного ответа на Escherichia coli
Кровь
1995
86
2642
2652
[56]
и другие.
Рецептор протеина С эндотелиальных клеток помогает в защите хозяина от сепсиса Escherichia coli
Кровь
2000
95
1680
1686
[57]
и другие.
Протеин C предотвращает коагулопатические и летальные эффекты инфузии Escherichia coli у бабуина
J Clin Invest
1987
79
918
925
[58]
Модуляция гемостатических свойств эндотелиальных клеток с помощью фактора некроза опухоли
J Exp Med
1986
163
740
745
[59]
Фактор некроза опухоли приводит к интернализации и деградации тромбомодулина с поверхности эндотелиальных клеток аорты крупного рогатого скота в культуре
Кровь
1989
73
159
165
[60]
и другие.
Протеаза, расщепляющая фактор Виллебранда, при тромботической тромбоцитопенической пурпуре и гемолитико-уремическом синдроме
N Engl J Med
1998
339
1578
1584
[61]
Ингибитор пути тканевого фактора и пересмотренная теория коагуляции
Annu Rev Med
1995
46
103
112
[62]
и другие.
Уровни антигена липопротеин-ассоциированного ингибитора свертывания крови в плазме крови пациентов
Кровь
1991
78
387
393
[63]
и другие.
Экспрессия ингибитора пути тканевого фактора культивируемыми эндотелиальными клетками в ответ на медиаторы воспаления
Кровь
1992
79
3219
3226
[64]
и другие.
Истощение ингибитора внешнего пути (EPI) повышает чувствительность кроликов к диссеминированному внутрисосудистому свертыванию крови, вызванному тканевым фактором: данные, подтверждающие физиологическую роль EPI как естественного антикоагулянта
Proc Natl Acad Sci USA
1991
88
708
712
[65]
и другие.
Ослабление тканевого тромбоза и кровотечения под действием ala-TFPI не учитывает его защиту от E. coli — сравнительное исследование обработанных и необработанных неживых павианов, зараженных LD100 E. coli
Thromb Haemost
1998
79
1048
1053
[66]
Ингибитор пути тканевого фактора блокирует клеточные эффекты эндотоксина, связываясь с эндотоксином и препятствуя переносу на CD14
Кровь
1997
89
4268
4274
[67]
и другие.
Ингибитор пути тканевого фактора (TFPI) дозозависимо подавляет активацию коагуляции, не влияя на фибринолитический и цитокиновый ответ во время эндотоксемии человека
Кровь
2000
95
1124
1129
[68]
и другие.
Ингибирование вызванной эндотоксинами активации свертывания и фибринолиза пентоксифиллином или моноклональными антителами против тканевого фактора у шимпанзе
J Clin Invest
1994
93
114
120
[69]
и другие.
Аполипопротеин (а) ослабляет эндогенный фибринолиз на модели тромбоза яремной вены кролика in vivo
Тираж
1997
96
1612
1615
[70]
и другие.
Цитокиновая активация эндотелия сосудов. Воздействие на активатор плазминогена тканевого типа и ингибитор активатора плазминогена 1 типа
J Biol Chem
1988
263
5797
5803
[71]
Регуляция экспрессии гена ингибитора активатора плазминогена 1 типа мыши in vivo.Тканевая специфичность и индукция липополисахаридом, фактором некроза опухоли альфа и трансформирующим фактором роста бета
J Clin Invest
1991
88
1346
1353
[72]
Отложение фибрина в тканях мышей, получавших эндотоксин, коррелирует со снижением экспрессии активатора плазминогена урокиназного типа, но не тканевого активатора
J Clin Invest
1996
97
2440
2451
[73]
Патофизиология диссеминированного внутрисосудистого свертывания крови при сепсисе
Crit Care Med
2000
29
S9
S11
[74]
и другие.
Полиморфизм промотора 4G / 5G в гене активатора-ингибитора плазминогена-1 и исход менингококковой инфекции. Исследовательская группа по менингококковой инфекции
Ланцет
1999
354
556
560
[75]
Вариация гена активатора-ингибитора плазминогена-1 и риск менингококкового септического шока
Ланцет
1999
354
561
563
[76]
и другие.
Уровни ингибитора активатора плазминогена 1 и 2, альфа-2-антиплазмина, плазминогена и эндотоксина при системном менингококковом заболевании
Тромб Res
1990
57
271
278
[77]
и другие.
Повышение уровня ингибитора активатора плазминогена позволяет прогнозировать исход лейкоцитопении у пациентов с сепсисом
Thromb Haemost
1996
75
902
907
[78]
и другие.
Экспериментальная эндотоксемия у людей: анализ высвобождения цитокинов и коагуляции, фибринолитические пути и пути комплемента
Кровь
1990
76
2520
2526
[79]
Toll-подобных рецепторов в индукции врожденного иммунного ответа
Природа
2000
406
782
787
[80]
и другие.
Роль NFkappaB в смертности от сепсиса
J Clin Invest
1997
100
972
985
[81]
и другие.
Кинетика экспрессии матричной РНК тканевого фактора in vivo при эндотоксемии человека: взаимосвязь с активацией коагуляции
Кровь
2000
96
554
559
[82]
и другие.
Экспрессия тканевого фактора эндотелиальными клетками при серповидно-клеточной анемии
J Clin Invest
1998
101
1899
1904
[83]
и другие.
Антитромботические эффекты BCH 2763, нового прямого ингибитора тромбина, на модели венозного тромбоза у собак
J Тромб Тромболизис
1999
7
301
306
[84]
Исследования оси воспалительный коагулянт в ответе павиана на E. coli: регуляторная роль белков C, S, C4bBP и ингибиторов тканевого фактора
Prog Clin Biol Res
1994
388
175
194
[85]
и другие.
Артериальная антитромботическая активность тиоксилозидов на модели лазерно-индуцированного тромбоза на крысах
Semin Thromb Hemost
1996
22
327
333
[86]
и другие.
Удаление интерлейкина 6 ослабляет активацию коагуляции при экспериментальной эндотоксемии у шимпанзе
J Exp Med
1994
179
1253
1259
[87]
и другие.
Ингибитор пути тканевого фактора снижает смертность от септического шока, вызванного Escherichia coli
J Clin Invest
1993
91
2850
2856
[88]
Введение: являются ли природные антикоагулянты кандидатами для модуляции воспалительной реакции на эндотоксин?
Кровь
2000
95
1113
1116
[89]
и другие.
Дифференциальная экспрессия белка тканевого фактора в образцах направленной атерэктомии от пациентов со стабильным и нестабильным коронарным синдромом
Тираж
1995
91
619
622
[90]
и другие.
Лепирудин подавляет вызванную эндотоксинами активацию свертывания крови
Кровь
2000
95
1729
1734
[91]
Молекулярное клонирование рецептора протеазы-1 эффекторных клеток, нового рецептора клеточной поверхности для фактора протеазы Ха
J Biol Chem
1994
269
3139
3142
[92]
Тканевый фактор и фактор X-зависимая активация рецептора 2, активируемого протеазой, фактором VIIa
Proc Natl Acad Sci USA
2000
97
5255
5260
[93]
Гемостатические факторы и воспалительные заболевания
Thromb Haemost
1999
82
858
864
[94]
и другие.
Возможные механизмы провоспалительного ответа сосудистых цитокинов на активацию коагуляции
Дж Иммунол
1998
160
5130
5135
[95]
и другие.
Ответ провоспалительных цитокинов на коагуляцию и эндотоксин в цельной крови
Кровь
1996
87
5051
5060
[96]
и другие.
Рецепторы 1 и 4, активируемые протеазой, опосредуют активацию тромбина человека тромбином
J Clin Invest
1999
103
879
887
[97]
и другие.
Взаимодействия тканевого фактора и фактора VIIa рецептор / лиганд вызывают провоспалительные эффекты в макрофагах
Кровь
1999
94
3413
3420
[98]
de Jonge E et al.Активация коагуляции путем введения рекомбинантного фактора VIIa вызывает высвобождение интерлейкина-6 и интерлейкина-8 у здоровых людей. J. of Clin. Лаборатория. Иммунол., 2003, в печати.
[99]
Способствует ли воспаление тромботическим явлениям?
Гемостаз
2000
30
Дополнение 2
34
40
[100]
Обоснование восстановления физиологических антикоагулянтных путей у пациентов с сепсисом и диссеминированным внутрисосудистым свертыванием
Crit Care Med
2001
7
Дополнение
S90
S94
[101]
и другие.
Эффективность и безопасность рекомбинантного активированного протеина С человека при тяжелом сепсисе
N Engl J Med
2001
344
699
709
[102]
и другие.
Патология диссеминированного внутрисосудистого свертывания (ДВС). Разбор 26 дел
Хум Патол
1972
3
327
343
[103]
и другие.
Характер распределения микротромбов при диссеминированном внутрисосудистом свертывании
Arch Pathol Lab Med
1983
107
543
547
[104]
Патология сепсиса, септического шока и полиорганной недостаточности.Перспектива сепсиса и септического шока
1986
Фуллертон, Калифорния
Общество реанимации
[105]
и другие.
Септический шок, полиорганная недостаточность и диссеминированное внутрисосудистое свертывание. Сравнивались паттерны дефицита антитромбина III, протеина C и протеина S
Сундук
1992
101
816
823
[106]
и другие.
Обзор: инфекционные болезни и нарушения свертывания крови
J Заражение Dis
1999
180
176
186
[107]
и другие.
Диссеминированная внутрисосудистая коагуляция — частое осложнение синдрома системного воспалительного ответа
Thromb Haemost
1996
75
224
228
[108]
и другие.
Нарушения коагуляции при септическом шоке
Intensive Care Med
1993
19
Дополнение 1
S8
S15
[109]
Диссеминированная внутрисосудистая коагуляция: диагностика и лечение
Br Med J
1996
312
683
687
[110]
Цитокины и ингибитор-1 активатора плазминогена при посттравматическом диссеминированном внутрисосудистом свертывании: связь с синдромом полиорганной дисфункции
Crit Care Med
1995
23
1835
1842
[111]
Грамположительные организмы и сепсис
Arch Intern Med
1994
154
26
34
[112]
Нарушения гемостаза при геморрагической лихорадке денге
Rev. Заразить Dis
1989
11
Дополнение 4
S826
S829
[113]
и другие.
Ранние маркеры активации свертывания крови и фибринолиза при аргентинской геморрагической лихорадке
Thromb Haemost
1995
73
368
373
[114]
и другие.
Фибринолиз, ингибиторы свертывания крови и коагулянтная активность моноцитов при острой малярии
Am J Hematol
1997
54
23
29
[115]
и другие.
Диагностика тампонады сердца после кардиохирургических операций: относительное значение клинических, эхокардиографических и гемодинамических признаков
Am Heart J
1994
127
913
918
[116]
и другие.
Диссеминированное внутрисосудистое свертывание, связанное с диссеминированным криптококкозом, у пациента с синдромом приобретенного иммунодефицита
Инфекция
1993
21
171
173
[117]
и другие.
Тромботическая тромбоцитопеническая пурпура (ТТП), связанная с инфекцией Borrelia burgdorferi
Am J Hematol
1995
50
72
73
[118]
Рандомизированное контролируемое исследование низких доз гепарина для профилактики фатальной тромбоэмболии легочной артерии у пациентов с инфекционными заболеваниями. Группа исследования профилактики гепарина
Ланцет
1996
347
1357
1361
[119]
Венозный тромбоз при ВИЧ-инфекции
Int J ЗППП, СПИД
1996
7
82
85
[120]
Тромбоэмболическая болезнь при СПИДе связана с цитомегаловирусной болезнью
СПИД
1991
5
1540
1542
[121]
и другие.
Диагностика средиземноморской пятнистой лихорадки с помощью непрямой иммунофлуоресценции Rickettsia conorii в циркулирующих эндотелиальных клетках, выделенных с помощью иммуномагнитных шариков, покрытых моноклональными антителами
J Заражение Dis
1992
166
660
663
[122]
Денге и геморрагическая лихорадка денге. [Отзыв] [83 ссылки]
Педиатр Infect Dis J
1992
11
311
317
[123]
и другие.
Клинические наблюдения за вирусологически подтвержденными летальными инфекциями денге в Джакарте
Индонезия. Бык ВОЗ
1983
61
693
701
[124]
и другие.
Клинические и лабораторные наблюдения за пациентами с первичной и вторичной инфекциями денге 1 типа с геморрагическими проявлениями на Фиджи
Am Trop Med Hyg
1977
26
775
783
[125]
Клинические проявления и механизм геморрагического диатеза при вирусной болезни Марбург
Болезнь, вызванная вирусом Марбург
1971
Нью-Йорк
Springer
41
48
[126]
и другие.
Вспышка болезни, вызванной вирусом Марбург, в Йоханнесбурге
Br Med J
1975
4
489
493
[127]
Диссеминированная внутрисосудистая коагуляция, связанная с ротавирусным гастроэнтеритом: отчет о двух случаях
Clin Infect Dis
1996
22
834
836
[128]
Оценка портативного монитора протромбинового времени для домашнего использования пациентами, которым требуется длительная пероральная антикоагулянтная терапия
Arch Intern Med
1993
153
1441
1447
[129]
Диссеминированная внутрисосудистая коагуляция при вирусных заболеваниях
Arch Intern Med
1967
120
129
152
[130]
и другие.
Вирусная инфекция и свертывание крови
Thromb Diath Haemorrh
1970
23
1
11
[131]
Распространенное внутрисосудистое свертывание крови, осложняющее вирусную пневмонию, вызванную гриппом
Med J Aust
1971
2
763
766
[132]
Диссеминированная внутрисосудистая коагуляция и острая почечная недостаточность при гриппе А2
Med J Aust
1974
2
196
201
[133]
Диссеминированная внутрисосудистая коагуляция, связанная с гриппом
Ohio State Med J
1900
71
541
543
[134]
и другие.
Гепатит ветряной оспы: смертельный случай у ранее здорового, иммунокомпетентного взрослого человека. Отчет о случае, вскрытие и обзор литературы
Arch Intern Med
1994
154
2101
2106
[135]
и другие.
Значение экскреции C3 с мочой при гломерулонефрите
J Clin Pathol
1976
29
601
607
[136]
и другие.
Активация каскада коагуляции при тяжелой форме малярии, вызванной falciparum, внутренним путем
Br J Haematol
1994
87
100
105
[137]
Гемолитико-уремический синдром как первичная форма ВИЧ-инфекции
Нефрон
1996
72
472
475
[138]
и другие.
Тромботическая тромбоцитопеническая пурпура и ВИЧ-инфекция [см. Комментарии]
South Med J
1995
88
82
86
[139]
Диссеминированная внутрисосудистая коагуляция
Кровь: принципы и практика гематологии
2002
Филадельфия
Дж.Б. Липпинкотт
[140]
Энтерогеморрагическая кишечная палочка. Опасный патоген пищевого происхождения
Постградская медицина
1900
103
179
180
[141]
Тромботическая тромбоцитопеническая пурпура (ТТП), осложняющая лептоспироз: ранее не описанная ассоциация
J Clin Pathol
1990
43
961
962
[142]
и другие.
Воспалительные болезни.Гистологическая диагностика воспалительных заболеваний кожи
1997
Уильямс и Уилкинс
[143]
Васкулит, связанный с инфекционными агентами
Curr Opin Rheumatol
1996
8
26
29
[144]
Спектр и лечение вирус-ассоциированных васкулитов
Curr Opin Rheumatol
1997
9
31
36
[145]
и другие.
Цитомегаловирусный васкулит.Отчеты о случаях и обзор литературы
Медицина
1994
73
246
255
[146]
и другие.
Репликация цитомегаловируса человека в эндотелиальных клетках
J Заражение Dis
1984
150
956
957
[147]
Цитомегаловирусный васкулит со смертельным кровотечением из толстой кишки
Arch Pathol Lab Med
1973
96
281
284
[148]
и другие.
Изъязвление толстой кишки при летальной цитомегаловирусной инфекции
Am Clin Pathol
1981
76
788
801
[149]
и другие.
Механизмы поражения центральной нервной системы в результате экспериментальной цитомегаловирусной инфекции
Ам Отоларингол
1990
11
313
317
[150]
и другие.
Васкулит центральной нервной системы при цитомегаловирусной инфекции
J Neurol Sci
1981
51
395
410
[151]
и другие.
Цитомегалическая инклюзивная болезнь кожи
Дерматол Arch
1981
117
282
284
[152]
Узловатый полиартериит васкулит при инфекции, вызванной вирусом иммунодефицита человека
J Ревматол
1995
22
351
355
[153]
Васкулит и инфекция, вызванная вирусом иммунодефицита человека
Rheum Dis Clin North Am
1991
17
131
147
[154]
и другие.
Спектр васкулитов у больных, инфицированных вирусом иммунодефицита человека. Клинико-патологическое обследование
Революционный артрит
1993
36
1164
1174
[155]
и другие.
Васкулит с антигенемией гепатита В: длительное наблюдение у девяти пациентов
Медицина
1976
55
1
18
[156]
и другие.
Частота и значение антител к вирусу гепатита С при узелковом полиартериите
J Ревматол
1993
20
304
309
[157]
и другие.
Узелковый полиартериит и парвовирус B19
Ланцет
1994
344
263
264
[158]
и другие.
Гранулематоз Вегенера и инфекция парвовирусом B19
Революционный артрит
1994
37
1707
1708
[159]
и другие.
Инфекция парвовируса человека B19 при болезни Кавасаки
Ланцет
1994
344
58
59
[160]
Нарушения эндотелия
Prog Гемостаз Тромб
1984
7
289
324
[161]
Эндотелиальные клетки. Не просто целлофановая обертка
Arch Intern Med
1987
147
569
573
[162]
Заражение эндотелиальных клеток обычными вирусами человека
Rev. Заразить Dis
1989
11
Дополнение 4
S700
S704
[163]
и другие.
Чувствительность эндотелиальных клеток, происходящих из разных кровеносных сосудов, к общим вирусам
In vitro Cell Dev Biol
1986
22
397
401
[164]
Инфекция эндотелиальных клеток человека вирусом Т-клеточного лейкоза человека типа I
Proc Natl Acad Sci USA
1984
81
7591
7595
[165]
и другие.
Клеточная локализация инфекции вируса иммунодефицита человека в головном мозге пациентов с синдромом приобретенного иммунодефицита
Proc Natl Acad Sci USA
1986
83
7089
7093
[166]
Вирус денге и эндотелиальные клетки: феномен, связанный с тромбоцитопенией и гранулоцитопенией при геморрагической лихорадке денге
Юго-Восточная Азия J Trop Med Public Health
1993
24
Дополнение 1
246
249
[167]
и другие.
Прокоагулянтный ответ эндотелиальных клеток, инфицированных цитомегаловирусом
Thromb Haemost
1992
68
364
370
[168]
и другие.
Вирусная активация каскада коагуляции: молекулярные взаимодействия на поверхности инфицированных эндотелиальных клеток
Ячейка
1990
61
657
662
[169]
и другие.
Цитомегаловирусная инфекция стимулирует экспрессию связанных с моноцитами медиаторных генов
Дж Иммунол
1989
143
3343
3352
[170]
и другие.
Цитомегаловирусная индукция фактора некроза опухоли альфа моноцитами человека и макрофагами слизистой оболочки
J Clin Invest
1992
90
1642
1648
[171]
GMP-140: рецептор нейтрофилов и моноцитов на активированных тромбоцитах и эндотелии
J Cell Biochem
1991
45
156
161
[172]
и другие.
Активация эндотелиальных клеток через усиленную антителами инфекцию моноцитов периферической крови вирусом денге
J Вирол
1997
71
4226
4232
[173]
и другие.
Взаимодействие моноцитов с эндотелиальными клетками индуцирует экспрессию молекул адгезии на эндотелиальных клетках пуповины человека
Cardiovasc Res
1996
32
422
429
[174]
и другие.
Приобретенный дефицит протеина S у детей, инфицированных вирусом иммунодефицита человека
Педиатр Infect Dis J
1996
15
106
111
[175]
и другие.
Дефицит белка S у мужчин с хронической инфекцией вируса иммунодефицита человека
Кровь
1993
81
1801
1807
[176]
и другие.
Корреляция антифосфолипидных антител и дефицита протеина S с тромбозом у ВИЧ-инфицированных мужчин
Фибринолиз свертывания крови
1994
5
455
462
[177]
и другие.
Активация фактора свертывания XI без детектируемой контактной активации при геморрагической лихорадке денге
Br J Haematol
2001
113
94
99
[178]
Кровотечение при инфекционном заболевании
Нарушения гемостаза
1984
Grune and Stratton
367
378
[179]
Вирус денге, флавивирус, размножается в предшественниках костного мозга человека и линиях гемопоэтических клеток
Кровь
1989
74
1235
1240
[180]
Антитела, макрофаги, инфекция, вызванная вирусом денге, шок и кровотечение: патогенетический каскад
Rev. Заразить Dis
1989
11
Дополнение 4
S830
S839
[181]
и другие.
Взаимодействие вируса гриппа с тромбоцитами крови
Кровь
1966
28
213
228
[182]
Исследования тромборезистентности in vitro: роль простациклина (PGI2) в адгезии тромбоцитов к культивированным нормальным и трансформированным вирусами эндотелиальным клеткам сосудов человека
Lab Invest
1980
42
366
374
[183]
и другие.
Взаимодействие между тромбоцитами крови человека, вирусами и антителами.IV. Тромбоцитопеническая пурпура после краснухи и агрегация тромбоцитов за счет взаимодействия антиген-антитело краснухи
Clin Exp Immunol
1969
4
323
332
[184]
Тромбоцитопеническая пурпура у детей и взрослых после заражения краснухой
Arch Intern Med
1966
117
573
579
[185]
Пурпурная ветряная оспа: отчет о случае, обзор литературы и классификация по клиническим признакам
Ann Intern Med
1961
54
745
759
[186]
Ветряная оспа с тромбоцитопенией, вызывающая смертельное внутримозговое кровоизлияние
Am Dis Детский
1972
124
577
578
[187]
Диссеминированная ветряная оспа с пневмонией, менингоэнцефалитом, тромбоцитопенией и смертельным внутричерепным кровоизлиянием
South Med J
1979
72
756
757
[188]
Тромбоцитопеническая пурпура при цитомегаловирусном мононуклеозе
Ланцет
1973
2
238
239
[189]
и другие.
Двойное слепое плацебо-контролируемое исследование концентратов антитромбина III при септическом шоке с диссеминированной внутрисосудистой коагуляцией
Сундук
1993
104
882
888
[190]
и другие.
Уход за тяжелобольным. Высокие дозы антитромбина III при тяжелом сепсисе: рандомизированное контролируемое исследование
J Am Med Assoc
2001
286
1869
1878
[191]
и другие.
Влияние рекомбинантного ингибитора пути тканевого фактора человека на образование тромба и его распределение in vivo в модели ДВС крысы
Am Clin Pathol
1996
106
574
583
Заметки автора
Авторские права © 2003, Европейское общество кардиологов
Процесс свертывания крови — Медсестра CE
Процесс свертывания крови — Медсестра CE
Процесс свертывания крови
Свертывание крови — это процесс
который превращает циркулирующие в крови вещества в нерастворимый гель.В
гель закупоривает протечки в кровеносных сосудах и останавливает потерю крови. Процесс требует
факторов свертывания , кальция и фосфолипидов .
- Факторы свертывания
(белки) производятся печенью. - Ионизированный кальций (Ca ++
) присутствует в крови и из внутриклеточных источников. - Фосфолипиды выделяются
компоненты клеточных и тромбоцитарных мембран.Они обеспечивают поверхность на
которые могут иметь место химические реакции коагуляции.
Коагуляция
может быть инициирован любым из двух различных путей.
- Внутренний
путь может быть инициирован событиями, происходящими в
просвет сосудов. Внутренний путь требует только элементов (свертывания
факторы, Ca ++, поверхность тромбоцитов и т. д.) найдено в пределах , или собственных
до сосудистой системы. - Другой путь коагуляции — это внешний путь.
Требуется тканевый фактор
(тканевый тромбопластин), вещество, которое является «внешним по отношению к»,
или нормально не циркулирует в сосуде. Фактор ткани высвобождается, когда
стенка сосуда разорвана.
независимо
вне зависимости от того, является ли внешний или внутренний
Путь запускает коагуляцию, завершение процесса происходит по общему пути.Общий путь включает активацию факторов: X, V, II, XIII и I.
Оба пути необходимы для нормального гемостаза, и есть положительная обратная связь.
петли между двумя путями, которые усиливают реакции для производства достаточного количества фибрина
чтобы сформировать спасательную пробку. Недостатки или отклонения любого одного фактора могут
замедлить общий процесс, увеличивая риск кровотечения.
Факторы коагуляции
нумеруются в порядке их открытия.Цифр 13, но только
12 факторов. Впоследствии было обнаружено, что фактор VI является частью другого фактора. В
Ниже приведены факторы коагуляции и их общие названия:
- Фактор I — фибриноген
- Фактор II — протромбин
- Фактор III — тканевый тромбопластин
(тканевый фактор) - Фактор IV — ионизированный кальций
(Ca ++) - Фактор V — лабильный фактор
или proaccelerin - Фактор VI — не назначен
- Фактор VII — стабильный фактор
или проконвертин - Фактор VIII — антигемофильный
фактор - Фактор IX — тромбопластин плазмы
компонент, фактор Рождества - Фактор X — Стюарт-Проуэр
фактор - Фактор XI — тромбопластин плазмы
предшествующий - Фактор XII — Хагеман
фактор - Фактор XIII — стабилизирующий фибрин
фактор
Печень должна уметь
используйте витамин К для производства факторов II, VII, IX и X.Диетический витамин К широко
доступны из растительных и животных источников. Он также вырабатывается нормальным кишечником.
Флора. Дефицит встречается редко, но может иметь место:
- у новорожденных, потому что они
сначала должна развиться нормальная флора, чтобы производить витамин К, или - при нарушении флоры
антибиотиками широкого спектра действия.
При рождении
и в детстве уровни фактора VIII такие же, как у взрослых. Много
уровни других факторов ниже уровня взрослого при рождении, некоторые составляют всего 10% взрослого
уровни.Эти уровни повышаются к взрослому уровню к 6 месяцам, хотя
они могут оставаться несколько ниже нормального уровня для взрослых на протяжении всего детства. Несмотря на
более низкие уровни, новорожденные и дети обычно не испытывают кровотечений. Этот
обеспечивает определенный уровень антитромболической защиты у молодежи. Фактор при беременности
XI может снижаться, но повышаться фибриноген и фактор VIII.
Мгновенно
Отзыв
Of
факторы, указанные ниже, которые не производятся в печени?
RnCeus
Домашняя страница | Курс
каталог | Скидка
цены | Авторизоваться
| Уход
вакансии | Помощь
Зависимая от тканевого фактора активация коагуляции гемом: исследование тромбоэластометрии
Abstract
Гем был охарактеризован как мощный триггер воспаления.В гемостазе, хотя было показано, что гем как индуцирует, так и ингибирует различные компоненты гемостаза, его общий эффект на гемостатический баланс и биологическая значимость этих эффектов еще предстоит определить. Здесь мы оценили влияние гема на гемостаз с помощью глобального анализа, способного генерировать клинически значимые данные при некоторых других сложных гемостатических заболеваниях. Цитрированные образцы цельной крови здоровых участников стимулировали гемом или носителем и инкубировали в течение 4 часов при 37 ° C.Немедленно была проведена ротационная тромбоэластометрия. Участие тканевого фактора в активации коагуляции оценивали с помощью ингибирующих антител. Гем был способен вызывать активацию свертывания ex vivo в цельной крови, влияя преимущественно на параметры, связанные с начальными фазами образования сгустка. Этот эффект активации, по крайней мере, частично зависел от гематопоэтического тканевого фактора, поскольку эффекты гема были частично отменены ингибированием тканевого фактора человека.В заключение, используя глобальный анализ гемостаза, наше исследование подтвердило, что гем способен активировать коагуляцию в цельной крови зависимым от тканевого фактора способом. Эти данные могут объяснить нарушение гемостатического баланса, наблюдаемое в условиях, связанных с высвобождением гема, таких как серповидно-клеточная анемия.
Образец цитирования: de Souza GR, Hounkpe BW, Fiusa MML, Colella MP, Annichino-Bizzacchi JM, Traina F, et al. (2017) Зависимая от тканевого фактора активация коагуляции гемом: исследование тромбоэластометрии.PLoS ONE 12 (4):
e0176505.
https://doi.org/10.1371/journal.pone.0176505
Редактор: Philippe Connes, Université Claude Bernard Lyon 1, FRANCE
Поступила: 14 февраля 2017 г .; Принят в печать: 11 апреля 2017 г .; Опубликован: 24 апреля 2017 г.
Авторские права: © 2017 de Souza et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе.
Финансирование: Это исследование финансировалось грантами Fapesp 2013 / 09319-0, 2014 / 00984-3 и 2015 / 24666-3; и грант CNPq-Brazil 2014/457780. Центр гематологии и гемотерапии — Hemocentro UNICAMP, является частью Национального института науки и технологий крови Бразилии (INCT do SangueCNPq / MCT / FAPESP). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Клинические и экспериментальные данные указывают на то, что гемолитические анемии связаны с состоянием гиперкоагуляции [1–4], и что активация коагуляции может быть критическим элементом в патогенезе серповидно-клеточной анемии (ВСС) [5,6]. Недавно высвобождение гема из его внутриклеточного компартмента стало одним из потенциальных кандидатов на роль посредника в активации коагуляции в этих условиях.Помимо прямого токсического воздействия на клеточные мембраны, гем может действовать как связанный с опасностью молекулярный паттерн за счет активации рецепторов TLR4 [7,8], тем самым вызывая вазокклюзию на животных моделях SCD [9]. Гем также способен сильно стимулировать экспрессию тканевого фактора в эндотелиальных клетках [10] и моноцитах [11]. У пациентов с ВСС высокий уровень свободного гема был связан с риском острого грудного синдрома и вазокклюзии [12]. С другой стороны, гем также обладает антикоагулянтным действием у пациентов с порфирией [13] и ингибирует активность специфических факторов свертывания крови в исследованиях in vitro [14,15].Соответственно, недавно была высказана гипотеза, что гем может запускать инициацию коагуляции, а также ограничивать ее распространение [16]. Возможным объяснением этих расхождений является хорошо известное ограничение исследования отдельных компартментов гемостаза для обеспечения полной оценки гемостатического баланса.
Тромбоэластометрия — это глобальный анализ гемостаза, который оценивает взаимодействие между различными компонентами гемостаза, а также общую кинетику и динамику образования тромбина.Таким образом, он может предоставить новую информацию о чистом влиянии гема на активацию свертывания цельной крови, тем самым способствуя пониманию влияния гема на гемостаз. Биологическая значимость этого анализа была подтверждена в нескольких клинических сценариях, и ранее он использовался для характеристики гиперкоагуляции при гемолитических заболеваниях [2,17]. Здесь мы исследовали влияние гема на активацию коагуляции с помощью ротационной тромбоэластометрии (Rotem).
Методы
Сбор и обработка образцов крови
Исследование было выполнено в соответствии с Хельсинкской декларацией и одобрено Комитетом по этике Государственного университета Кампинаса (CEP Unicamp, CAAE 46853115.4.0000.5404). Перед взятием образцов каждый участник предоставил письменную форму информированного согласия. Это исследование было проведено с участием 20 здоровых добровольцев, гомозиготных АА по генотипу гемоглобина, без тромбоэмболических заболеваний в анамнезе или без использования препаратов, модулирующих гемостаз. Гем разбавляли до начальной рабочей концентрации 700 мкМ в 0,1 М NaOH. PH этого раствора доводили до 7,4. Этот раствор фильтровали через фильтр 0,22 мкм и сразу использовали для стимуляции образцов цельной крови, как подробно описано ниже.Для всех разведений использовали ультрафильтрованную воду. Образцы крови отбирали в пластиковые вакуумные пробирки с антикоагулянтом с цитратом натрия (BD Vacutainer Coagulation Tube, 2,7 мл, 0,109 M забуференный цитрат натрия). Цельную кровь немедленно инкубировали со свежеприготовленным гемом до конечной концентрации 30 мкМ (Ref H651-9; Frontier Scientific, США) в течение 4 часов при 37 ° C, исходя из динамики прокоагулянтной активности тканевого фактора в моноцитах и эндотелиальных клетках. клетки [10,18]. После этого образцы были осторожно перемешаны и сразу же использованы для теста Rotem.Эта конечная концентрация гема была использована, потому что она имитирует уровни свободного гема, наблюдаемые у пациентов с серповидно-клеточной анемией [19,20].
Процедуры ротационной тромбоэластометрии (Rotem)
Rotem был выполнен с использованием прибора ROTEM ® (InnovationsGmbH, Мюнхен, Германия), который оценивает вязкоупругие свойства крови и генерирует параметры, связанные с инициированием коагуляции, кинетикой, стабильностью и склонностью к фибринолизу. Все исследования были инициированы с использованием процедуры неактивированной тромбоэластометрии (Natem).Natem — это анализ на основе Rotem, используемый для оценки образования сгустков цельной крови, в котором не используется конкретный активатор, а в плазму добавляется только кальций [21,22]. Были определены стандартные параметры различных стадий свертывания, которые были включены в статистический анализ. Время свертывания (CT) в секундах (sec) — это время от начала теста до момента, когда кривая, созданная прибором, достигнет амплитуды 2 мм. Это показатель фазы инициации коагуляции, на который в основном влияет ферментативная активность факторов свертывания, концентрация антикоагулянтов и экспрессия тканевого фактора на циркулирующих клетках [22].Время образования сгустка (CFT) в секундах определяется как время, необходимое для увеличения амплитуды кривой Rotem с 2 до 20 мм. Он в основном зависит от образования тромбина, количества и функции тромбоцитов, а также от полимеризации фибрина [22] и измеряет реакции, которые являются частью фаз амплификации и распространения коагуляции. Максимальная плотность сгустка (MCF) соответствует максимальной амплитуде кривой Rotem и отражает механическую прочность сгустка. Это зависит главным образом от количества и функции тромбоцитов, полимеризации фибрина и активности фактора XIII.В дополнение к этим стандартным параметрам мы также проанализировали влияние гема на параметры, полученные из первой производной кривой Rotem, которая соответствует сигналу скорости процесса коагуляции. Было показано, что эти параметры улучшают разрешение меньших различий в образцах, активированных минимальными концентрациями тканевого фактора [23]. Эти дополнительные параметры обычно сообщаются программой Rotem как «параметры исследования» и широко используются в исследованиях с использованием прокоагулянтов, таких как рекомбинантный фактор VIIa, рекомбинантный фактор XIII, а также в других контекстах [24–29].Время до максимальной скорости (MAXV-t) — это время от начала теста до достижения максимальной амплитуды сигнала скорости, и отражает скорость до максимальной плотности сгустка, измеренную данным методом. Площадь под кривой скорости (AUC) представляет собой площадь под этой производной кривой st (сигнал скорости) до точки, когда достигается максимальная амплитуда кривой Rotem (максимальная плотность сгустка), и косвенно отражает потенциал образования тромбина. [23,28,30]. Все анализы были выполнены с использованием парной цитратной цельной крови, предварительно инкубированной с гемом (30 мкМ, pH = 7.4) или носитель (0,1 М NaOH, pH 7,4), как описано выше. Вкратце, 300 мкл образцов цельной крови смешивали с 20 мкл CaCl 2 (0,2 М, pH = 7,4) в предварительно нагретой чашке при 37 ° C, и реакция началась не более чем за 17 секунд. Нейтрализующие антитела против тканевого фактора (Ref 4509, Sekisui Diagnostics, USA) использовали в конечной концентрации 10 мкг / мл для оценки участия тканевого фактора в индуцированной гемом активации коагуляции. Неиммунный изотип IgG1 (контрольный IgG мыши, SC-2025, Santa Cruz Biotechnology) использовали в качестве отрицательного контроля при той же концентрации.
Статистический анализ
Статистический анализ выполняли с использованием GraphPadPrism 6 (GraphPadPrism Software Inc., Сан-Диего, Калифорния, США). Двусторонний тест Вилкоксона использовали для сравнения количественных параметров, полученных для одних и тех же образцов, подвергнутых воздействию носителя или гема, с ингибированием или без него. Результаты представлены как среднее значение (± SEM). Значение p <0,05 считалось значимым.
Результаты
Гем индуцирует
ex vivo активацию коагуляции в образцах цельной крови
В неактивированной тромбоэластометрии (Natem) гем (30 мкМ) был способен вызывать активацию коагуляции в образцах цельной крови здоровых участников.После 4 часов инкубации гем значительно снижал CT (рис. 1A) и CFT (рис. 1B) по сравнению с носителем. Аналогичные результаты были получены с другим препаратом гема (Sigma, Ref 5280). Heme также снизил MAXV-t (рис. 1C). В то время как тенденция к более высокой AUC наблюдалась в образцах, инкубированных с гемом (рис. 1D), не наблюдалось никакой разницы в максимальной плотности сгустка, MCF (P = 0,054).
Рис. 1. Активация коагуляции и образования сгустка, индуцированная гемом.
Сравнения были выполнены для гема и носителя после 4 часов инкубации.Гистограммы были получены для выбранных параметров Rotem и показывают среднее значение (± SEM). Гем индуцировал значительное сокращение времени свертывания (A), времени образования сгустка (B) и времени достижения максимальной скорости (C). Для площади под кривой (D) значительных изменений не наблюдалось. Был проведен двусторонний тест Вилкоксона, и значения p <0,05 считались значимыми. CFT: время образования сгустка; MAXV-T: время максимальной скорости; AUC: площадь под кривой.
https://doi.org/10.1371/journal.pone.0176505.g001
Активация коагуляции цельной крови, вызванная гемом, зависит от тканевого фактора
Поскольку ранее было показано, что гем индуцирует экспрессию тканевого фактора в эндотелиальных клетках [31] и моноцитах [32], мы исследовали, зависели ли наблюдаемые изменения, вызванные гемом, от экспрессии тканевого фактора в нашей системе, используя ингибирующие антитела против ткани. фактор. По сравнению с изотипическим контролем, использование антитела, ингибирующего тканевой фактор, аннулировало действие гема на активацию коагуляции, что приводило к увеличению CT (рис. 2A) и уменьшению MAXV-t (рис. 2C), которые представляют два наиболее значительных эффекта гема по сравнению с носителем.Ингибирование не влияло на CFT (фиг. 2B) или на AUC (фиг. 2D). Следует отметить, что эффекты гема по сравнению с наполнителем были аналогичны эффектам, полученным в эксперименте, представленном на фиг. 1, за исключением того, что в этих экспериментах тенденция к более высокой AUC в образцах, инкубированных с гемом, достигла статистической значимости (фиг. 2D).
Рис. 2. Активация свертывания крови, вызванная гемом, зависит от тканевого фактора.
Человеческое антитело против тканевого фактора (Ref 4509 Sekisui) значительно задерживало начало коагуляции, увеличивая время свертывания (A) и время до максимальной скорости образования сгустка (C).Никаких изменений во времени образования сгустка (B) или площади под кривой (D) не наблюдалось. Был проведен двусторонний тест Вилкоксона, и значения p <0,05 считались значимыми. CFT: время образования сгустка; MAXV-T: время максимальной скорости; AUC: площадь под кривой; Anti-TF: антитело, ингибирующее тканевой фактор.
https://doi.org/10.1371/journal.pone.0176505.g002
Обсуждение
Повышенный тромботический риск является признаком нескольких состояний, связанных с внеклеточным высвобождением гема, таких как SCD [32], пароксизмальная ночная гемоглобинурия [33,34], сепсис [35] и внутримозговое кровоизлияние [36].Хотя механизмы, лежащие в основе нарушения гемостатического баланса в этих условиях, неизвестны, наблюдение того, что гем может запускать экспрессию физиологического инициатора гемостаза как в эндотелиальных клетках [10], так и в моноцитах [11], повышает вероятность того, что это могло быть участвует в патогенезе гиперкоагуляции в этих условиях. Соответственно, главный вывод нашего исследования заключается в том, что гем способен вызывать активацию свертывания в цельной крови путями, которые, по крайней мере, частично зависят от тканевого фактора.
Активация гемостаза в настоящее время считается частью врожденного иммунитета, участвующей в ответе хозяина как на патогены, так и на сигналы стерильной опасности [37]. Гем — это повсеместная молекула в организмах из всех царств жизни и в большинстве клеток, которая за последнее десятилетие, как было показано, активирует несколько путей врожденного иммунитета [7,38-40]. Таким образом, справедливо предположить, что гем может также представлять собой медиатор активации коагуляции в условиях, связанных с повышенными уровнями внеклеточного гема [8].Соответственно, было показано, что гем индуцирует экспрессию тканевого фактора, физиологического инициатора этого процесса, как в эндотелиальных клетках, так и в моноцитах [10,11]. Более того, биологическая значимость этого наблюдения была подтверждена демонстрацией зависимой от тканевого фактора активации свертывания крови у мышей, получавших гем [32]. Напротив, внутривенное введение гематина (которое очень похоже на препараты гема, использованные в предыдущих экспериментах), используемое у пациентов с порфирией, не связано с системным состоянием гиперкоагуляции и ранее было связано с удлинением времени коагуляции и снижением уровней факторов свертывания V и VIII [41,42].Более того, гем оказывает комплексное воздействие на различные компартменты гемостаза, включая активацию тромбоцитов [43] и взаимодействия с VIII [15] и фибриногеном [44], физиологическое значение которых пока неизвестно. Вместе эти результаты иллюстрируют проблемы, связанные с воздействием гема на гемостаз, и подчеркивают важность методов, позволяющих исследовать его общее глобальное влияние на этот процесс.
Тромбоэластометрия — это глобальный анализ гемостаза, способный выявить признаки гипо- и гиперкоагуляции у пациентов со сложными нарушениями гемостаза, такими как сепсис, травма и ВСС [45,46].Использование образцов цельной крови позволяет оценить гемостаз при наличии критических элементов гемостатического баланса, таких как эритроциты, тромбоциты и лейкоциты, в дополнение к белкам плазмы и тромбоцитам [17]. Следует отметить, что недавнее исследование SCD продемонстрировало, что соответствующие параметры активации коагуляции могут быть продемонстрированы только в цельной крови, но не в плазме [47]. Используя этот метод, мы продемонстрировали, что гем способен вызывать активацию коагуляции в образцах цельной крови, о чем свидетельствуют укорачивания CT, CFT и MAXV-t.Первые два параметра отражают фазы инициации и усиления коагуляции соответственно, в то время как последний отражает скорость достижения максимальной плотности сгустка, измеренную методом Ротема (ссылки Sorensen 2003 e Gorlinger 2016). Никаких значительных изменений не наблюдалось в MCF, который отражает силу сгустка, и было показано, что это единственный параметр Rotem, коррелирующий с потенциалом эндогенного тромбина [48]. Эти результаты предполагают, что эффекты гема, зависящие от тканевого фактора, могут быть более актуальными для начальных фаз образования сгустка, с меньшим влиянием на общий потенциал тромбина и на стабильность сгустка.Интересно, что аналогичная картина наблюдалась, когда анализ образования тромбина использовался в группе из 92 пациентов с серповидно-клеточной анемией [49]. Соответственно, мы предполагаем, что тот факт, что ингибирование TF только обращало действие гема на CT и MAXV-t, возможно, отражает более высокую зависимость этих параметров от начальных фаз образования сгустка по сравнению с CFT и AUC, которые в большей степени зависят от фибрина. полимеризация и стабилизация сгустка.
У мышей активация свертывания крови, индуцированная гемом, зависела от тканевого фактора как эндотелиального, так и гематопоэтического тканевого фактора [32].Используя ингибирующие антитела, которые широко использовались в исследованиях, посвященных роли тканевого фактора, мы продемонстрировали, что в образцах цельной крови человека активация свертывания крови, индуцированная гемом, по крайней мере частично зависит от экспрессии и / или активации тканевого фактора. Поскольку в наших экспериментальных условиях активация коагуляции зависит исключительно от циркулирующих клеток крови, наши результаты подтверждают, что фактор кроветворной ткани участвует в этом процессе. Соответственно, фактор кроветворной ткани считается наиболее важным источником активации коагуляции при патологических состояниях, таких как сепсис [50] и SCD [51].
Наша система не предназначена для моделирования предполагаемых эффектов гема in vivo и на активацию коагуляции, а предназначена только для рассмотрения его изолированного воздействия на клинически значимый глобальный анализ гемостаза и для подтверждения участия гематопоэтического тканевого фактора в этом процессе. Влияние свободного гема на гемостатический баланс in vivo — гораздо более сложный научный вопрос, на который влияют такие переменные, как широкая доступность акцепторов гема, таких как гемопексин и альбумин, в плазме [52], влияние гема на другие дискретные компоненты. компартменты гемостаза [16] и чрезвычайно сложная сеть клеточных путей, которые участвуют в патогенезе гемолитических анемий, таких как серповидно-клеточная анемия [53].Более того, наши результаты не исключают участия других путей, таких как лейкоциты, тромбоциты и фактор XII, в индуцированной гемом активации коагуляции in vivo .
В заключение, используя глобальный анализ гемостаза, способный обнаруживать клинически значимые изменения гемостаза, мы продемонстрировали, что гем способен вызывать активацию коагуляции цельной крови зависимым от тканевого фактора образом. Эти результаты подтверждают концепцию, что свободный внеклеточный гем может играть важную роль в активации свертывания крови у пациентов с SCD и при других патологических состояниях.Необходимы дальнейшие исследования для выяснения механизмов, с помощью которых гем индуцирует активацию тканевого фактора, а также актуальности in vivo и этих результатов.
Благодарности
Это исследование финансировалось грантами Fapesp 2013 / 09319-0, 2014 / 00984-3 и 2015 / 24666-3; и грант CNPq-Brazil 2014/457780. Центр гематологии и гемотерапии — Hemocentro UNICAMP, является частью Национального института науки и технологий крови Бразилии (INCT do SangueCNPq / MCT / FAPESP).
Вклад авторов
- Концептуализация: MPC JMA FT FFC EVDP.
- Формальный анализ: GRS MMLF BWH EVDP.
- Исследование: GRS MMLF BWH.
- Методология: GRS MMLF BWH EVDP.
- Администрация проекта: EVDP.
- Ресурсы: EVDP.
- Кураторство: EVDP.
- Проверка: GRS BWH EVDP.
- Написание — первоначальный черновик: BWH EVDP.
Ссылки
- 1.
Колелла М.П., Де Паула Е. В., Конран Н., Мачадо-Нето Дж. А., Анниччино-Биззакчи Дж. М., Коста Ф. Ф. и др. Гидроксимочевина связана со снижением маркеров гиперкоагуляции при серповидно-клеточной анемии. J Thromb Haemost. 2012; 10: 1967–70. pmid: 22817333 - 2.
Лим М.Ю., Атага К.И., Ключ Н.С. Нарушения гемостаза при серповидно-клеточной анемии. Curr Opin Hematol. 2013; 20: 472–7.pmid: 23817169 - 3.
Колелла М.П., де Паула Е. В., Мачадо-Нето Дж. А., Конран Н., Анниччино-Биззакчи Дж. М., Коста Ф. Ф. и др. Повышенные маркеры гиперкоагуляции при СК гемоглобиновой болезни. Haematologica. 2015; 100: 466–71. pmid: 25596272 - 4.
Naik RP, Streiff MB, Haywood C Jr., Segal JB, Lanzkron S. Частота венозных тромбоэмболий в совместном исследовании серповидно-клеточной болезни. J Thromb Haemost. 2014; 12: 2010–2016. pmid: 25280124 - 5.
Спаркенбо Э., Павлински Р.Взаимодействие между свертыванием и воспалением сосудов при серповидно-клеточной анемии. Британский журнал гематологии. 2013. С. 3–14. - 6.
Арумугам П.И., Маллинс Е.С., Шанмукхаппа С.К., Мония Б.П., Лоберг А., Шоу М.А. и др. Генетическое уменьшение циркулирующего протромбина улучшает полиорганные патологии у мышей с серповидно-клеточной анемией. Кровь. 2015; 126: 1844–55. pmid: 26286849 - 7.
Фигейредо Р.Т., Фернандес П.Л., Моурао-Са Д.С., Порту Б.Н., Дутра Ф.Ф., Алвес Л.С. и др. Характеристика гема как активатора Toll-подобного рецептора 4.J Biol Chem. 2007; 282: 20221–9. pmid: 17502383 - 8.
Соарес MP, Bozza MT. Красная тревога: лабильный гем — это тревожный сигнал. Curr Opin Immunol. 2016; 38: 94–100. pmid: 26741528 - 9.
Белчер Дж. Д., Чен С., Нгуен Дж., Милбауэр Л., Абдулла Ф., Алаяш А. И. и др. Гем запускает передачу сигналов TLR4, что приводит к активации эндотелиальных клеток и вазоокклюзии при серповидно-клеточной анемии мышей. Кровь. 2014; 123: 377–90. pmid: 24277079 - 10.
Сетти Б.Н.Й., Бетал С.Г., Чжан Дж., Стюарт М.Дж.Гем индуцирует экспрессию фактора эндотелиальной ткани: потенциальная роль в активации гемостаза у пациентов с гемолитической анемией. J Thromb Haemost. 2008; 6: 2202–9. pmid: 18983524 - 11.
Рехани Т., Матсон К., Белчер Дж. Д., Верчеллотти GM. Гем мощно стимулирует экспрессию тканевого фактора моноцитами периферической крови: новый механизм тромбоза при внутрисосудистых гемолитических заболеваниях. Кровь. 2013; 122: 2215. Доступно: http://www.bloodjournal.org/content/122/21/2215.abstract - 12.Адиса О.А., Ху Й., Гош С., Арье Д., Осункво И., Офори-Аква С.Ф. Связь между гемом без плазмы и частотой вазоокклюзионных эпизодов и острого грудного синдрома у детей с серповидно-клеточной анемией. Br J Haematol. 2013; 162: 702–5. pmid: 23802701
- 13.
Макколл К.Э., Мур М.Р., Томпсон Г.Г., Голдберг А. Лечение гематином при острой печеночной порфирии. Q J Med. 1981; 50: 161–174. pmid: 7302116 - 14.
Грин Д., Рейнольдс Н., Кляйн Дж., Коль Х., Ц’ао СН.Инактивация гемостатических факторов гематином. J Lab Clin Med. 1983; 102: 361–369. pmid: 6411843 - 15.
Репессе Ю., Димитров Д., Пейрон И., Фаррохи Мошай Е., Кигер Л., Дасгупта С. и др. Гем связывается с фактором VIII и подавляет его взаимодействие с активированным фактором IX. J Thromb Haemost. 2012; 10: 1062–71. pmid: 22471307 - 16.
Roumenina LT, Rayes J, Lacroix-Desmazes S, Dimitrov JD. Гем: модулятор плазменных систем при гемолитических заболеваниях. Тенденции молекулярной медицины.2016. С. 200–213. pmid: 26875449 - 17.
Ван Геффен М, Ван Херде ВЛ. Глобальные анализы гемостаза, от кабинета до постели больного. Исследование тромбоза. 2012. С. 681–687. pmid: 22221936 - 18.
Месарош К., Аберле С., Дедрик Р., Махович Р., Хорвиц А., Бирр С. и др. Индукция фактора ткани моноцитов липополисахаридом (LPS): зависимость от LPS-связывающего белка и CD14 и ингибирование рекомбинантным фрагментом бактерицидного / увеличивающего проницаемость белка. Доступно: http: // www.bloodjournal.org/content/bloodjournal/83/9/2516.full.pdf - 19.
Oh JY, Hamm J, Xu X, Genschmer K, Zhong M, Lebensburger J и др. Подходы на основе поглощения и окислительно-восстановительного потенциала для измерения свободного гема и свободного гемоглобина в биологических матрицах. Редокс Биол. 2016; 9: 167–177. pmid: 27566280 - 20.
Muller-Eberhard U, Javid J, Liem HH, Hanstein A, Hanna M. Концентрации гемопексина, гаптоглобина и гема в плазме у пациентов с различными гемолитическими заболеваниями. Кровь. 1968; 32: 811–815.pmid: 5687939 - 21.
Schoergenhofer C, Buchtele N, Schwameis M, Bartko J, Jilma B, Jilma-Stohlawetz P. Использование замороженных образцов плазмы в тромбоэластометрии. Clin Exp Med. Издательство Springer International Publishing; 2017; 1–9. - 22.
Гёрлингер К., Диркманн Д., Ханке А.А. Ротационная тромбоэластометрия (ROTEM®). Коагулопатия, вызванная травмой. Чам: издательство Springer International Publishing; 2016. С. 267–298. - 23.
Соренсен Б., Йохансен П., Кристиансен К., Вельке М., Ингерслев Дж.Тромбэластографические профили свертывания цельной крови с минимальной активацией тканевого фактора. J Thromb Haemost. 2003; 1: 551–8. pmid: 12871465 - 24.
Соренсен Б., Перссон Э., Ингерслев Дж. Аналог фактора VIIa (V158D / E296V / M298Q-FVIIa) нормализует образование сгустков в цельной крови пациентов с тяжелой гемофилией A. Br J Haematol. 2007. 137: 158–165. pmid: 173 - 25.
Tran HTT, Sørensen B, Bjørnsen S, Pripp AH, Tjønnfjord GE, Andre Holme P. Мониторинг обходной терапии — проспективное перекрестное исследование, сравнивающее тромбоэластометрию и анализ образования тромбина.Гемофилия. 2015; 21: 275–283. pmid: 25521720 - 26.
Rea CJ, Foley JH, Okaisabor O, Sørensen B. FXIII: механизмы действия при лечении гемофилии A. J Thromb Haemost. 2014; 12: 159–68. pmid: 24354581 - 27.
REA CJ, FOLEY JH, INGERSLEV J, SØRENSEN B. Фактор XIII в сочетании с рекомбинантным фактором VIIa: новое средство лечения тяжелой гемофилии A. J Thromb Haemost. Blackwell Publishing Ltd; 2011; 9: 510–516. pmid: 21155966 - 28.
Tarzia V, Bortolussi G, Buratto E, Paolini C, Dal Lin C, Rizzoli G и др.Одинарная и двойная антитромбоцитарная терапия при остром коронарном синдроме: предикторы кровотечения после аортокоронарного шунтирования. Мир J Cardiol. Baishideng Publishing Group Inc; 2015; 7: 571–8. pmid: 26413234 - 29.
Whiting D, DiNardo JA. TEG и ROTEM: Технология и клиническое применение. Am J Hematol. 2014; 89: 228–232. pmid: 24123050 - 30.
Whiting D, Dinardo JA. TEG и ROTEM: Технология и клиническое применение. Am J Hematol. 2014; 89: 228–232. pmid: 24123050 - 31.Сетти Б.Н.Й., Бетал С.Г., Чжан Дж., Стюарт М.Дж. Гем индуцирует экспрессию фактора эндотелиальной ткани: потенциальная роль в активации гемостаза у пациентов с гемолитической анемией. J Thromb Haemost. 2008. 6: 2202–2209. pmid: 18983524
- 32.
Sparkenbaugh EM, Chantrathammachart P, Wang S, Jonas W., Kirchhofer D, Gailani D, et al. Избыток гема вызывает зависимую от тканевого фактора активацию коагуляции у мышей. Haematologica. 2015; 100: 308–313. pmid: 25596265 - 33.
Хиллмен П., Льюис С.М., Бесслер М., Луццатто Л., Дейси Дж. В.Естественное течение пароксизмальной ночной гемоглобинурии. N Engl J Med. 1995; 333: 1253–8. pmid: 7566002 - 34.
Noubouossie D, Key NS, Ataga KI. Нарушения коагуляции при серповидно-клеточной анемии: взаимосвязь с клиническими результатами и эффектом терапии, изменяющей болезнь. Обзоры крови. 2015. - 35.
Каплан Д., Каспер Т.К., Эллиотт К.Г., Мэн С., Пендлтон Р.К., Крайсс Л.В. и др. Заболеваемость и факторы риска ВТЭ у пациентов с тяжелым сепсисом и септическим шоком.Грудь. Американский колледж грудных врачей; 2015; 148: 1224–30. pmid: 26111103 - 36.
Скаф Э., Штейн П.Д., Бимат А., Санчес Дж., Бустаманте М.А., Олсон Р.Э. и др. Венозная тромбоэмболия у пациентов с ишемическим и геморрагическим инсультом. Am J Cardiol. Эльзевир; 2005; 96: 1731–3. - 37.
Энгельманн Б., Массберг С. Тромбоз как внутрисосудистый эффектор врожденного иммунитета. Nat Rev Immunol. 2013; 13: 34–45. pmid: 23222502 - 38.
Дутра Ф.Ф., Алвес Л.С., Родригес Д., Фернандес П.Л., де Оливейра Р.Б., Голенбок Д.Т. и др.Летальность, вызванная гемолизом, связана с активацией инфламмасом гемом. Proc Natl Acad Sci U S. A. 2014; 111: E4110–8. pmid: 25225402 - 39.
Fernandez PL, Dutra FF, Alves L, Figueiredo RT, Mourão-Sa D, Fortes GB, et al. Гем усиливает врожденный иммунный ответ на микробные молекулы за счет генерации реактивных форм кислорода, зависимых от тирозинкиназы селезенки (Syk). J Biol Chem. 2010. 285: 32844–51. pmid: 20729208 - 40.
Vasconcellos LRC, Dutra FF, Siqueira MS, Paula-Neto HA, Dahan J, Kiarely E, et al.Агрегация белков как клеточный ответ на окислительный стресс, вызванный гемом и железом. Proc Natl Acad Sci. 2016; 201608928. - 41.
Моррис Д.Л., Дадли М.Д., Пирсон Р.Д. Коагулопатия, связанная с лечением гематином острой перемежающейся порфирии. Ann Intern Med. 1981; 95: 700–1. pmid: 7305149 - 42.
Glueck R, Green D, Cohen I, Ts’ao CH. Гематин: уникальные эффекты гемостаза. Кровь. 1983; 61: 243–9. pmid: 6821696 - 43.
Нили С.М., Гарднер Д.В., Reynolds N, Green D, Tšao C. Механизм и характеристики активации тромбоцитов гематином. Br J Haematol. Blackwell Publishing Ltd; 1984. 58: 305–316. pmid: 6383458 - 44.
Нильсен В.Г., Коэн Дж. Б., Малаяман С. Н., Новак М., Восселлер К. Фибриноген — это связанная с гемом молекула, чувствительная к монооксиду углерода: предварительный отчет. Фибринолиз свертывания крови. 2011; 22: 443–7. pmid: 21451399 - 45.
Yee DL, Edwards RM, Mueller BU, Teruya J. Тромбоэластографические и гемостатические характеристики у педиатрических пациентов с серповидно-клеточной анемией.Arch Pathol Lab Med. 2005; 129: 760–5. pmid: 154
- 46.
Ногами К. Применение тромбоэластографии при наследственных и приобретенных нарушениях свертываемости крови. Br J Haematol. 2016; 174: 503–514. pmid: 27264484 - 47.
Whelihan MF, Lim MY, Mooberry MJ, Piegore MG, Ilich A, Wogu A и др. Генерация тромбина и клеточно-зависимая гиперкоагуляция при серповидно-клеточной анемии. J Thromb Haemost. 2016; 14: 1941–1952. pmid: 27430959 - 48.
Шнайдер Т., Зигемунд Т., Зигемунд Р., Петрос С.Генерация тромбина и ротационная тромбоэластометрия у здорового взрослого населения. Hamostaseologie. Schattauer Publishers; 2014; 35: 181–186. pmid: 25529462 - 49.
Геротциафас ГТ, Ван Дреден П., Чаари М., Галеа В., Хатерчи А., Лионнет Ф. и др. Ускорение фазы распространения образования тромбина у пациентов с устойчивой серповидно-клеточной анемией связано с циркулирующими микрочастицами, происходящими из эритроцитов. Thromb Haemost. 2012; 107: 1044–52. pmid: 22535498 - 50.Павлински Р., Ван Дж. Г., Оуэнс А. П., Уильямс Дж., Антониак С., Тенкати М. и др. Гемопоэтический и негематопоэтический клеточный тканевой фактор активирует каскад коагуляции у мышей с эндотоксемией. Кровь. 2010; 116: 806–14. pmid: 20410508
- 51.
Chantrathammachart P, Mackman N, Sparkenbaugh E, Wang J-G, Parise L V, Kirchhofer D, et al. Фактор ткани способствует активации коагуляции и воспаления на мышиной модели серповидно-клеточной анемии. Кровь. 2012; 120: 636–46. pmid: 22661702 - 52.Толозано Э, Фагуни С., Морелло Н., Винчи Ф., Фиорито В. Удаление гема и другие аспекты гемопексина. Антиоксидный редокс-сигнал. 2010; 12: 305–20. pmid: 19650691
- 53.
Hounkpe BW, Fiusa MML, Colella MP, da Costa LNG, Benatti R de O, Saad STO и др. Роль путей, запускаемых врожденным иммунитетом, в патогенезе серповидноклеточной болезни: метаанализ исследований экспрессии генов. Научный доклад 2015; 5: 17822. pmid: 26648000
Какова роль тканевого фактора (ТФ) в патогенезе диссеминированного внутрисосудистого свертывания (ДВС)?
Костелло РА, Неринг СМ.Диссеминированное внутрисосудистое свертывание. 2020 Январь [Medline]. [Полный текст].
Винсент Дж. Л., Де Бакер Д. Приводит ли диссеминированное внутрисосудистое свертывание к полиорганной недостаточности ?. Клиника интенсивной терапии . 2005 21 июля (3): 469-77. [Медлайн].
Папагеоргиу С., Журди Дж., Аджамбри Е., Уолборн А., Патель П., Фарид Дж. И др. Распространенная внутрисосудистая коагуляция: обновленная информация о патогенезе, диагностике и терапевтических стратегиях. Clin Appl Thromb Hemost .2018 8 октября. 1076029618806424. [Medline].
[Рекомендации] Taylor FB Jr, Toh CH, Hoots WK, Wada H, Levi M. К определению, клиническим и лабораторным критериям и системе оценок для диссеминированной внутрисосудистой коагуляции. Тромб Хемост . 2001 ноябрь 86 (5): 1327-30. [Медлайн].
Мацуда Т. Клинические аспекты ДВС-диссеминированного внутрисосудистого свертывания. Pol J Pharmacol . 1996 Янв-Фев. 48 (1): 73-5. [Медлайн].
Levi M, de Jonge E, van der Poll T. Новые стратегии лечения диссеминированного внутрисосудистого свертывания крови, основанные на современном понимании патофизиологии. Энн Мед . 2004. 36 (1): 41-9. [Медлайн].
Иба Т, Леви М, Леви Дж. Х. Коагулопатия, индуцированная сепсисом и диссеминированная внутрисосудистая коагуляция. Семенной тромб Hemost . 2020 Февраль 46 (1): 89-95. [Медлайн].
Асакура Х., Огава Х.Коагулопатия, связанная с COVID-19, и диссеминированное внутрисосудистое свертывание. Инт Дж. Гематол . 2020 7 ноября. [Medline]. [Полный текст].
Брэнсон Х.Э., Кац Дж., Марбл Р., Гриффин Дж. Х. Унаследованный дефицит протеина C и хроническая рецидивирующая фульминантная пурпура у новорожденного ребенка. Ланцет . 19 ноября 1983 г. 2 (8360): 1165-8. [Медлайн].
Yuen P, Cheung A, Lin HJ, Ho F, Mimuro J, Yoshida N и др. Молниеносная пурпура у китайского мальчика с врожденной недостаточностью протеина С. Педиатрия . 1986 Май. 77 (5): 670-6. [Медлайн].
Ашерсон Р.А., Эспиноза Дж., Сервера Р., Гомес-Пуэрта Дж. А., Мусуруана Дж., Буччарелли С. и др. Диссеминированная внутрисосудистая коагуляция при катастрофическом антифосфолипидном синдроме: клинико-гематологическая характеристика 23 пациентов. Энн Рум Дис . 2005 июн. 64 (6): 943-6. [Медлайн]. [Полный текст].
Леви М., Сивапаларатнам С. Распространенная внутрисосудистая коагуляция: обновленная информация о патогенезе и диагностике. Эксперт Рев Гематол . 2018 11 августа (8): 663-672. [Медлайн].
Fourrier F, Chopin C, Goudemand J, Hendrycx S, Caron C, Rime A и др. Септический шок, полиорганная недостаточность и диссеминированное внутрисосудистое свертывание. Сравнивались паттерны дефицита антитромбина III, протеина C и протеина S. Сундук . 1992 Март 101 (3): 816-23. [Медлайн].
Gando S. Распространенная внутрисосудистая коагуляция у пациентов с травмами. Семенной тромб Hemost .2001 27 декабря (6): 585-92. [Медлайн].
Gando S, Nakanishi Y, Tedo I. Цитокины и ингибитор-1 активатора плазминогена в посттравматическом диссеминированном внутрисосудистом свертывании: связь с синдромом полиорганной дисфункции. Crit Care Med . 1995 23 ноября (11): 1835-42. [Медлайн].
Леви М. Диссеминированная внутрисосудистая коагуляция: что нового ?. Клиника интенсивной терапии . 2005 21 июля (3): 449-67. [Медлайн].
Franchini M, Lippi G, Manzato F.Последние достижения в патофизиологии, диагностике и лечении диссеминированного внутрисосудистого свертывания. Тромб Дж. . 2006 21 февраля, 4: 4. [Медлайн]. [Полный текст].
Леви М. Патогенез и диагностика диссеминированного внутрисосудистого свертывания. Int J Lab Гематол . 2018 май. 40 Дополнение 1: 15-20. [Медлайн].
Леви М. Коагулянтный ответ при сепсисе. Clin Chest Med . 2008 г. 29 (4): 627-42, viii. [Медлайн].
Leblebisatan G, Sasmaz I, Antmen B, Yildizdas D, Kilinc Y. Лечение опасных для жизни кровотечений и небезопасных вмешательств у негемофильных детей с помощью рекомбинантного фактора VIIa. Clin Appl Thromb Hemost . 2010 16 февраля (1): 77-82. [Медлайн].
Maczewski M, Duda M, Pawlak W., Beresewicz A. Защита эндотелия от реперфузионного повреждения за счет ишемического прекондиционирования и диазоксида включает SOD-подобный анти-O2-механизм. Дж. Физиол Фармакол . 2004 Сентябрь 55 (3): 537-50. [Медлайн].
Леви М. Поддерживать контакт: роль контактной системы в инфекциях и сепсисе. Crit Care Med . 2000 28 ноября (11): 3765-6. [Медлайн].
Sower LE, Froelich CJ, Carney DH, Fenton JW 2nd, Klimpel GR. Тромбин индуцирует продукцию IL-6 в фибробластах и эпителиальных клетках. Доказательства участия рецептора семи трансмембранных доменов (STD) для альфа-тромбина. Дж Иммунол . 1995 г. 15 июля. 155 (2): 895-901. [Медлайн].
Тейлор Ф. Б. младший, Чанг А., Руф В., Моррисси Дж. Х., Хиншоу Л., Катлетт Р. и др. Смертельный септический шок, вызванный E. coli, предотвращается блокированием тканевого фактора моноклональными антителами. Circ Shock . 1991 марта 33 (3): 127-34. [Медлайн].
Levi M, ten Cate H, Bauer KA, van der Poll T, Edgington TS, Büller HR и др. Ингибирование вызванной эндотоксином активации свертывания и фибринолиза пентоксифиллином или моноклональными антителами против тканевого фактора у шимпанзе. Дж Клин Инвест . 1994, январь 93 (1): 114-20. [Медлайн]. [Полный текст].
Кэри MJ, Роджерс GM. Диссеминированное внутрисосудистое свертывание: клинико-лабораторные аспекты. Ам Дж. Гематол . 1998 Сентябрь 59 (1): 65-73. [Медлайн].
Mesters RM, Mannucci PM, Coppola R, Keller T, Ostermann H, Kienast J. Активность фактора VIIa и антитромбина III во время тяжелого сепсиса и септического шока у пациентов с нейтропенией. Кровь .1 августа 1996 г. 88 (3): 881-6. [Медлайн].
Nawroth PP, Stern DM. Модуляция гемостатических свойств эндотелиальных клеток фактором некроза опухоли. J Exp Med . 1986, 1. 163 (3): 740-5. [Медлайн]. [Полный текст].
Novotny WF, Brown SG, Miletich JP, Rader DJ, Broze GJ Jr. Уровни антигена в плазме липопротеин-ассоциированного ингибитора свертывания крови в образцах пациентов. Кровь . 1991 15 июля. 78 (2): 387-93. [Медлайн].
Biemond BJ, Levi M, Ten Cate H, Van der Poll T., Büller HR, Hack CE и др.Активатор плазминогена и ингибитор активатора плазминогена I высвобождают во время экспериментальной эндотоксемии у шимпанзе: влияние вмешательств в каскады цитокинов и коагуляции. Клинические науки (Лондон) . 1995 Май. 88 (5): 587-94. [Медлайн].
van Hinsbergh VW, Kooistra T, van den Berg EA, Princen HM, Fiers W, Emeis JJ. Фактор некроза опухоли увеличивает продукцию ингибитора активатора плазминогена в человеческих эндотелиальных клетках in vitro и у крыс in vivo. Кровь . 1988, ноябрь 72 (5): 1467-73. [Медлайн].
Mesters RM, Flörke N, Ostermann H, Kienast J. Повышение уровней ингибитора активатора плазминогена предсказывает исход лейкоцитопенических пациентов с сепсисом. Тромб Хемост . 1996 июн. 75 (6): 902-7. [Медлайн].
Асакура Х, Онтачи Ю., Мизутани Т., Като М., Сайто М., Кумабашири И. и др. Усиленный фибринолиз предотвращает развитие полиорганной недостаточности при диссеминированном внутрисосудистом свертывании, несмотря на значительную активацию свертывания крови. Crit Care Med . 2001, 29 июня (6): 1164-8. [Медлайн].
Леви М. Распространенное внутрисосудистое свертывание у онкологических больных. Лучшая практика, Clin Haematol . 2009 22 марта (1): 129-36. [Медлайн].
Леви М., ван дер Полл Т., Бюллер HR. Двунаправленная связь между воспалением и коагуляцией. Тираж . 2004 г. 8 июня. 109 (22): 2698-704. [Медлайн].
Альтиери, округ Колумбия. Молекулярное клонирование рецептора-1 протеазы эффекторных клеток, нового рецептора клеточной поверхности для фактора протеазы Ха. Дж Биол Химия . 1994, 4 февраля, 269 (5): 3139-42. [Медлайн].
Camerer E, Huang W., Coughlin SR. Зависимая от тканевого фактора и фактора X активация протеазно-активируемого рецептора 2 фактором VIIa. Proc Natl Acad Sci U S A . 2000 May 9. 97 (10): 5255-60. [Медлайн]. [Полный текст].
Erez O, Mastrolia SA, Thachil J. Распространенная внутрисосудистая коагуляция во время беременности: понимание патофизиологии, диагностики и лечения. Am J Obstet Gynecol . 2015 Октябрь 213 (4): 452-463. [Медлайн].
[Рекомендации] Леви М., Тох С.Х., Тачил Дж., Уотсон Х.Г. Рекомендации по диагностике и лечению диссеминированного внутрисосудистого свертывания. Британский комитет стандартов в гематологии. Br J Haematol . 2009 Апрель 145 (1): 24-33. [Медлайн]. [Полный текст].
Sohn CH, Kim SR, Kim YJ, Seo DW, Ahn S, Lee YS и др. Диссеминированная внутрисосудистая коагуляция у пациентов отделения неотложной помощи с первичным послеродовым кровотечением. Ударная . 2017 Сентябрь 48 (3): 329-332. [Медлайн].
Умемура Ю., Ямакава К., Кигучи Т., Йошикава Ю., Огура Н. и др. Разработка и оценка новых унифицированных критериев диссеминированной внутрисосудистой коагуляции на основе критериев Японской ассоциации острой медицины. Clin Appl Thromb Hemost . 2015, 13 июня. [Medline].
Савамура А., Хаякава М., Гандо С., Кубота Н., Сугано М., Вада Т. и др. Распространенная внутрисосудистая коагуляция с фибринолитическим фенотипом на ранней стадии травмы предсказывает летальный исход. Тромб Рес . 2009 ноябрь 124 (5): 608-13. [Медлайн].
Sivula M, Pettilä V, Niemi TT, Varpula M, Kuitunen AH. Тромбоэластометрия у пациентов с тяжелым сепсисом и диссеминированным внутрисосудистым свертыванием. Фибринолиз свертывания крови . 2009 Сентябрь 20 (6): 419-26. [Медлайн].
Савамура А., Хаякава М., Гандо С., Кубота Н., Сугано М., Вада Т. и др. Применение Японской ассоциации неотложной медицины диссеминировало диагностические критерии внутрисосудистого свертывания крови для пациентов на ранней стадии травмы. Тромб Рес . 2009 декабрь 124 (6): 706-10. [Медлайн].
Чжу Ю.Дж., Хуан ХК. Взаимосвязь между диссеминированным внутрисосудистым свертыванием и уровнями плазменного тромбиногена сегмента 1 + 2, D-димера и тромбомодулина у пациентов с множественными повреждениями. Травматология подбородка . 2009 12 августа (4): 203-9. [Медлайн].
Duchesne JC, Islam TM, Stuke L, Timmer JR, Barbeau JM, Marr AB, et al. Гемостатическая реанимация во время операции улучшает выживаемость пациентов с коагулопатией, вызванной травмами. J Травма . 2009 июл. 67 (1): 33-7; обсуждение 37-9. [Медлайн].
Siegal T, Seligsohn U, Aghai E, Modan M. Клинические и лабораторные аспекты диссеминированного внутрисосудистого свертывания (ДВС): исследование 118 случаев. Тромб Хемост . 1978, 28 февраля. 39 (1): 122-34. [Медлайн].
Вада Х, Мацумото Т., Сузуки К., Имаи Х, Катаяма Н., Иба Т. и др. Различия и сходство между диссеминированным внутрисосудистым свертыванием и тромботической микроангиопатией. Тромб Дж. . 2018. 16:14. [Медлайн]. [Полный текст].
Wada H, Mori Y, Shimura M, Hiyoyama K, Ioka M, Nakasaki T и др. Плохой исход при диссеминированном внутрисосудистом свертывании или тромботической тромбоцитопенической пурпуре у пациентов с тяжелыми повреждениями эндотелиальных клеток сосудов. Ам Дж. Гематол . 1998 июл.58 (3): 189-94. [Медлайн].
Такашима А., Сирао К., Хирасима Ю., Такахари Д., Окита Н. Т., Накадзима Т. Е. и др. Последовательная химиотерапия метотрексатом и 5-фторурацилом при запущенном раке желудка с диссеминированным внутрисосудистым свертыванием при начальном диагнозе. J Cancer Res Clin Oncol . 2010 Февраль 136 (2): 243-8. [Медлайн].
Леви М. Коагулопатия COVID-19 в сравнении с диссеминированным внутрисосудистым свертыванием. Кровавый Совет . 2020 Июнь 23, 4 (12): 2850. [Медлайн].
Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y и др. Эпидемиологические и клинические характеристики 99 случаев новой коронавирусной пневмонии 2019 г. в Ухане, Китай: описательное исследование. Ланцет . 2020 15 февраля. 395 (10223): 507-513.[Медлайн]. [Полный текст].
Бик Р.Л. Диссеминированная внутрисосудистая коагуляция: объективная клиническая и лабораторная диагностика, лечение и оценка терапевтического ответа. Семенной тромб Hemost . 1996. 22 (1): 69-88. [Медлайн].
Хоран Дж. Т., Фрэнсис К. В.. Продукты распада фибрина, мономер фибрина и растворимый фибрин при диссеминированном внутрисосудистом свертывании. Семенной тромб Hemost . 2001 27 декабря (6): 657-66. [Медлайн].
Леунг Л. Клинические особенности, диагностика и лечение диссеминированного внутрисосудистого свертывания крови у взрослых. UpToDate [серийный онлайн]. Доступны на . Доступно на http://www.utdol.com.
Spero JA, Lewis JH, Hasiba U. Распространенная внутрисосудистая коагуляция. Находки у 346 пациентов. Тромб Хемост . 1980 29 февраля. 43 (1): 28-33. [Медлайн].
Олсон Дж. Д., Кауфман Х. Х., Моак Дж., О’Горман Т. В., Хутс К., Вагнер К. и др.Частота и значение нарушений гемостаза у пациентов с травмами головы. Нейрохирургия . 24 июня 1989 г. (6): 825-32. [Медлайн].
Конвей EM, Розенберг RD. Фактор некроза опухоли подавляет транскрипцию гена тромбомодулина в эндотелиальных клетках. Мол клетки Биол . 1988 декабря 8 (12): 5588-92. [Медлайн]. [Полный текст].
Фауст С.Н., Левин М., Харрисон О.Б., Голдин Р.Д., Локхарт М.С., Кондавити С. и др.Дисфункция активации эндотелиального протеина С при тяжелом менингококковом сепсисе. N Engl J Med . 2001, 9 августа. 345 (6): 408-16. [Медлайн].
Дауни Ц., Казми Р., То Ч. Новая и диагностически применимая информация, полученная на основе оптического волнового анализа свертывания крови при диссеминированном внутрисосудистом свертывании. Br J Haematol . 1997 июл.98 (1): 68-73. [Медлайн].
Демпфле CE. Использование растворимого фибрина для оценки острого и хронического состояния гиперкоагуляции. Тромб Хемост . 1999, август 82 (2): 673-83. [Медлайн].
Levi M, de Jonge E, van der Poll T, ten Cate H. Диссеминированная внутрисосудистая коагуляция. Тромб Хемост . 1999, август 82 (2): 695-705. [Медлайн].
Carr JM, McKinney M, McDonagh J. Диагностика диссеминированного внутрисосудистого свертывания. Роль D-димера. Ам Дж. Клин Патол . 1989 Март 91 (3): 280-7. [Медлайн].
Levi M, Meijers JC.ДВС-синдром: какие лабораторные исследования наиболее полезны. Кровь Ред. . 2011 25 января (1): 33-7. [Медлайн].
Lin SM, Wang YM, Lin HC, Lee KY, Huang CD, Liu CY и др. Уровень тромбомодулина в сыворотке крови относится к клиническому течению диссеминированного внутрисосудистого свертывания, синдрома полиорганной дисфункции и смертности у пациентов с сепсисом. Crit Care Med . 2008 марта, 36 (3): 683-9. [Медлайн].
Bakhtiari K, Meijers JC, de Jonge E, Levi M.Проспективная валидация системы балльной оценки Международного общества тромбоза и гемостаза для диссеминированного внутрисосудистого свертывания. Crit Care Med . 2004 Декабрь 32 (12): 2416-21. [Медлайн].
Гандо С., Сайто Д., Огура Х., Маюми Т., Косеки К., Икеда Т. и др. Естественный анамнез диссеминированного внутрисосудистого свертывания крови, диагностированный на основании недавно установленных диагностических критериев для пациентов в критическом состоянии: результаты многоцентрового проспективного обследования. Crit Care Med . 2008, январь, 36 (1): 145-50. [Медлайн].
[Рекомендации] Вада Х, Такахаши Х, Учияма Т., Эгути Ю., Окамото К., Кавасуги К. и др. Утверждение пересмотренных диагностических критериев ДВС Японским обществом тромбоза и гемостаза. Тромб Дж. . 2017. 15:17. [Медлайн]. [Полный текст].
[Рекомендации] Вада Х, Мацумото Т., Ямасита Ю. Диагностика и лечение диссеминированного внутрисосудистого свертывания (ДВС) в соответствии с четырьмя руководящими принципами ДВС. Дж. Интенсивная терапия . 2014. 2 (1): 15. [Медлайн]. [Полный текст].
Леви М., Скалли М. Как лечить диссеминированное внутрисосудистое свертывание. Кровь . 2018 22 февраля. 131 (8): 845-854. [Медлайн].
Shakur H, Roberts I., Bautista R, Caballero J, Coats T, Dewan Y, et al. Влияние транексамовой кислоты на смерть, сосудистые окклюзионные события и переливание крови у пациентов с травмами и значительным кровотечением (CRASH-2): рандомизированное плацебо-контролируемое исследование. Ланцет . 2010 г. 3 июля. 376 (9734): 23-32. [Медлайн].
Ducloy-Bouthors AS, Jude B, Duhamel A, Broisin F, Huissoud C, Keita-Meyer H. Высокие дозы транексамовой кислоты сокращают кровопотерю при послеродовом кровотечении. Центр внимания . 2011. 15 (2): R117. [Медлайн].
Lowes R. Препарат для лечения сепсиса Xigris изъят со всего мира. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/752169. Доступ: 14 апреля 2014 г.
[Руководство] Ди Нисио М., Баудо Ф, Косми Б., Д’Анджело А., Де Гаспери А., Малато А. и др. Диагностика и лечение диссеминированного внутрисосудистого свертывания крови: рекомендации Итальянского общества гемостаза и тромбоза (SISET). Тромб Рес . 2012 май. 129 (5): e177-84. [Медлайн].
Леви М, Опал СМ. Нарушения коагуляции у тяжелобольных. Центр внимания . 2006. 10 (4): 222. [Медлайн]. [Полный текст].
Алвинг Б., Спивак Дж., Делугери Т.Консультативная гематология: вопросы гемостаза и переливания крови в хирургии и реанимации. Гематология . 1998. 320-42.
[Рекомендации] Вада Х, Асакура Х, Окамото К., Иба Т., Учияма Т., Кавасуги К. и др. Консенсус экспертов по лечению диссеминированного внутрисосудистого свертывания в Японии. Тромб Рес . 2010 января 125 (1): 6-11. [Медлайн].
Pernerstorfer T, Jilma B, Eichler HG, Aull S, Handler S, Speiser W.Гепарин снижает уровень активированного фактора VII в плазме. Br J Haematol . 1999 июн. 105 (4): 1127-9. [Медлайн].
Feinstein DI. Диагностика и лечение диссеминированного внутрисосудистого свертывания: роль терапии гепарином. Кровь . 1982 августа 60 (2): 284-7. [Медлайн].
Сакурагава Н., Хасегава Х, Маки М., Накагава М., Накашима М. Клиническая оценка низкомолекулярного гепарина (FR-860) при диссеминированном внутрисосудистом свертывании (ДВС) — многоцентровое совместное двойное слепое исследование в сравнение с гепарином. Тромб Рес . 1993 15 декабря. 72 (6): 475-500. [Медлайн].
Pernerstorfer T, Hollenstein U, Hansen J, Knechtelsdorfer M, Stohlawetz P, Graninger W. и др. Гепарин подавляет активацию свертывания крови, вызванную эндотоксинами. Тираж . 1999, 21-28 декабря. 100 (25): 2485-90. [Медлайн].
Majumdar G. Идиопатический хронический ДВС-синдром, контролируемый низкомолекулярным гепарином. Фибринолиз свертывания крови . 1996, 7 января (1): 97-8.[Медлайн].
Леви М., Леви М., Уильямс М.Д., Дуглас И., Артигас А., Антонелли М. и др. Профилактический прием гепарина у пациентов с тяжелым сепсисом, получавших дротрекогин альфа (активированный). Am J Respir Crit Care Med . 2007 сен 1. 176 (5): 483-90. [Медлайн].
Baudo F, Caimi TM, de Cataldo F, Ravizza A, Arlati S, Casella G и др. Заместительная терапия антитромбином III (ATIII) у пациентов с сепсисом и / или послеоперационными осложнениями: контролируемое двойное слепое рандомизированное многоцентровое исследование. Мед. Интенсивной терапии . 1998 24 апреля (4): 336-42. [Медлайн].
Fourrier F, Jourdain M, Tournoys A. Результаты клинических испытаний антитромбина III при сепсисе. Crit Care Med . 2000, 28 сентября (9 доп.): S38-43. [Медлайн].
Эйзеле Б., Лами М., Тийс Л.Г., Кейнеке Х.О., Шустер Х.П., Маттиас Ф.Р. и др. Антитромбин III у пациентов с тяжелым сепсисом. Рандомизированное плацебо-контролируемое двойное слепое многоцентровое исследование плюс метаанализ всех рандомизированных плацебо-контролируемых двойных слепых исследований антитромбина III при тяжелом сепсисе. Мед. Интенсивной терапии . 1998 24 июля (7): 663-72. [Медлайн].
Савамура А., Гандо С., Хаякава М., Хосино Н., Кубота Н., Сугано М. Эффекты антитромбина III у пациентов с диссеминированным внутрисосудистым свертыванием крови, диагностированным с помощью недавно разработанных диагностических критериев критического заболевания. Clin Appl Thromb Hemost . 2009 15 октября (5): 561-6. [Медлайн].
Хаякава М., Кудо Д., Сайто С. и др. Добавки антитромбина и смертность при индуцированной сепсисом диссеминированной внутрисосудистой коагуляции: многоцентровое ретроспективное обсервационное исследование. Ударная . 19 августа 2016 г. [Medline].
Endo S, Shimazaki R, Группа изучения гамма-антитромбина. Открытое рандомизированное исследование фазы 3 эффективности и безопасности гамма-антитромбина у пациентов с синдромом диссеминированного внутрисосудистого свертывания крови, вызванным сепсисом. Дж. Интенсивная терапия . 2018. 6:75. [Медлайн]. [Полный текст].
Abraham E. Ингибирование тканевого фактора и результаты клинических испытаний ингибитора пути тканевого фактора при сепсисе. Crit Care Med . 2000, 28 сентября (9 доп.): S31-3. [Медлайн].
Abraham E, Reinhart K, Opal S, Demeyer I, Doig C, Rodriguez AL, et al. Эффективность и безопасность тифакогина (ингибитора пути рекомбинантного тканевого фактора) при тяжелом сепсисе: рандомизированное контролируемое исследование. ЯМА . 2003 г. 9 июля. 290 (2): 238-47. [Медлайн].
Ямакава К., Фудзими С., Мохри Т., Мацуда Х., Накамори Ю., Хиросе Т. и др. Эффекты лечения рекомбинантного растворимого тромбомодулина человека у пациентов с тяжелым сепсисом: историческое контрольное исследование. Центр внимания . 2011. 15 (3): R123. [Медлайн]. [Полный текст].
Сайто Х., Маруяма И., Симадзаки С., Ямамото Ю., Айкава Н., Оно Р. и др. Эффективность и безопасность рекомбинантного растворимого тромбомодулина человека (ART-123) при диссеминированном внутрисосудистом свертывании: результаты фазы III рандомизированного двойного слепого клинического исследования. J Тромб Haemost . 2007 5 (1): 31-41. [Медлайн].
Zhang C, Wang H, Yang H, Tong Z. Рекомбинантный растворимый тромбомодулин человека и краткосрочная смертность пациентов с ДВС-инфекцией: метаанализ. Am J Emerg Med . 2016 Сентябрь 34 (9): 1876-82. [Медлайн].
Yamakawa K, Aihara M, Ogura H, Yuhara H, Hamasaki T, Shimazu T. Рекомбинантный растворимый тромбомодулин человека при тяжелом сепсисе: систематический обзор и метаанализ. J Тромб Haemost . 2015 Апрель 13 (4): 508-19. [Медлайн]. [Полный текст].
Иноуэ Ю., Мацунава М., Сано Ф., Миура И. Эффективность рекомбинантного растворимого тромбомодулина человека при лечении диссеминированной внутрисосудистой коагуляции, осложняющей трансплантацию аллогенных гемопоэтических стволовых клеток. Acta Haematol . 2018 сен 18.140 (2): 121-127. [Медлайн].
.