Комплексный регионарный болевой синдром как вариант хронической нейропатической боли | Новиков А.В., Яхно Н.Н.
ММА имени И.М. Сеченова
ММА имени И.М. Сеченова
Комплексный регионарный болевой синдром (КРБС) объединяет чувствительные, двигательные и вегетативно-трофические расстройства, которые ранее описывались под названием «рефлекторная симпатическая дистрофия» и «каузалгия». Включение рефлекторной симпатической дистрофии в группу так называемых симпатически поддерживаемых болей связано с тем, что в части случаев боль при КРБС прекращается после проведения симпатической блокады. Однако в последнее время выяснилось, что большое число больных наряду с «симпатически поддерживаемой болью» имеют «симпатически независимую боль», что и побудило экспертов Международной ассоциации по изучению боли в классификации болевых синдромов в 1994 г. предложить термин «комплексный регионарный болевой синдром». Выделяют КРБС I и II типов. КРБС I типа обычно развивается после микротравмы или воздействия в форме длительной иммобилизации (наложение лонгеты, гипса, yшиб, травма мягких тканей конечности и др.), не ограниченного повреждением одного периферического нерва и явно диспропорционального последствиями величине этого воздействия. Считается, что II тип КРБС диагностируется при повреждении периферического нерва или одной из его ветвей, которое часто сопровождается явлениями каузалгии.
Основные проявления КРБС, лежащие в основе диагностических критериев, заключаются в развитии в пределах одной конечности (чаще в дистальных ее отделах) болевого синдрома: это ощущения жжения, ноющие или ломящие боли в сочетании с чувствительными нарушениями (гипо- или анестезией, гиперпатией, аллодинией, т.е. восприятием стимуляции любой модальности как болевой), вегетативно-трофическими расстройствами (отеком, изменением окраски кожных покровов, локальным изменением кожной температуры, нарушением потоотделения, изменением скорости роста ногтей и волос, локальным остеопорозом) и расстройствами движений в форме различной степени выраженности пареза. Указанные явления развиваются в различные временные отрезки, что позволяет выделять стадии в течении КРБС.
Клинические проявления КРБС
Болевой синдром при КРБС по своей природе является нейропатической болью, которая представлена двумя основными компонентами: спонтанной (стимулонезависимой) болью и вызванной (стимулозависимой) гипералгезией.
Спонтанная боль
Спонтанная боль делится на два вида: симпатически независимая боль и симпатически поддерживаемая боль. Симпатически независимая боль развивается в результате повреждения периферического нерва, как правило, носит стреляющий, ланцинирующий характер и исчезает или значительно регрессирует после местной блокады анестетиком поврежденного периферического нерва или пораженного участка кожи. Симпатически поддерживаемая боль обычно носит жгучий характер, может сочетаться с изменением кровотока, терморегуляции и потоотделения, двигательными расстройствами (повышение мышечного тонуса, дистония, усиление физиологического тремора), трофическими изменениями кожи, ее придатков, подкожных тканей, фасций и костей и регрессирует после проведения симпатической блокады.
Боль является абсолютным признаком для диагностики КРБС. Она возникает вследствие повреждающего воздействия, обычно вовлекающего ткани конечности, но по своему характеру, выраженности и распространенности превосходит инициирующее травматическое воздействие. Болевой сидром может быть представлен двумя характерными типами – жгучими болями и ноющими болями, которые встречаются с одинаковой частотой. Эти два типа различаются между собой по вербальной характеристике: жгучая боль ощущается в виде жжения, чаще поверхностная, от средней до высокой степени интенсивности, четко описывается пациентом; ноющая боль – боль ноющего, ломящего, тянущего характера, чаще ощущается, как глубинная, имеет средний или ниже среднего уровень интенсивности, пациенты не могут дать ее четкого описания. Эти два типа боли различаются также по длительности проявления – для жгучих болей в трети случаев отмечены сроки более 6 мес и в трети отмечается их трансформирование в ноющие; первично ноющие боли после 6 мес не отмечены. Более чем три четверти пациентов имеют спонтанные постоянные боли. Боль нередко следует сразу за травмой, которая обычно не связана со значительным повреждением нерва. Она может наблюдаться вслед за переломом костей, мягким тканевым повреждением или иммобилизацией, обусловленной висцеральной патологией. Боль возникает обычно в течение первого месяца после воздействия провоцирующего фактора.
Гипералгезия
Вторым компонентом нейропатической боли является гипералгезия. По локализации выделяют первичную и вторичную гипералгезию. Первичная гипералгезия локализуется в зоне иннервации поврежденного нерва или в зоне тканевого повреждения, вторичная гипералгезия имеет более широкое распространение, далеко выходя за зону тканевого повреждения или зону иннервации поврежденного нерва.
Первичная гипералгезия связана с местом повреждения тканей и возникает в основном в ответ на раздражение сенсибилизированных в результате повреждения периферических ноцицепторов. Ноцицепторы становятся чувствительными за счет биологически активных веществ, высвобождающихся или синтезирующихся в месте повреждения. Этими веществами являются: серотонин, гистамин, нейроактивные пептиды (вещество Р и кальцитонин-ген-связанный пептид), кинины, брадикинин, а также продукты метаболизма арахидоновой кислоты (простагландины и лейкотриены) и цитокины. В процесс вовлекается также категория ноцицепторов, называемых «спящими», которые в норме неактивны, но активируются вслед за тканевым повреждением. Вследствие такой активации увеличивается афферентная стимуляция нейронов заднего рога спинного мозга, что и является основой развития вторичной гипералгезии.
Увеличенная афферентная стимуляция, поступающая от сенсибилизированных и активированных «спящих» ноцицепторов, превышает болевой порог и за счет высвобождения активирующих аминокислот (аспартата и глутамата) повышает возбудимость чувствительных нейронов заднего рога, с развитием центральной сенситизации. Вследствие увеличения возбудимости чувствительных нейронов задних рогов спинного мозга, связанных с зоной иннервации поврежденного нерва, происходит сенсибилизация близлежащих интактных нейронов с расширением рецептивной зоны. В связи с этим раздражение неповрежденных сенсорных волокон, которые иннервируют окружающие зону повреждения здоровые ткани, вызывает активацию вторично сенсибилизированных нейронов, что проявляется болью – вторичной гипералгезией. Сенсибилизация нейронов задних рогов ведет к снижению болевого порога и развитию аллодинии, т.е. появлению болевых ощущений на раздражение, которое в норме ими не сопровождается (например, тактильное). Изменения возбудимости центральных отделов ноцицептивной системы, связанные с развитием вторичной гипералгезии и аллодинии, описываются термином «центральная сенситизация».
В зависимости от вида вызвавшего стимула гипералгезия может быть тепловой, холодовой, механической и химической. Первичная и вторичная гипералгезия являются неоднородными. Первичная гипералгезия представлена тремя типами – тепловая, механическая и химическая, а вторичная гипералгезия двумя – механическая и холодовая.
Тепловая гипералгезия. Как известно, тепловая гипералгезия является ведущим симптомом боли, связанной с воспалением. Этот симптом наблюдается также при нейропатии, но всегда только в зоне тканевого повреждения (первичной гипералгезии).
Механическая гипералгезия. Механическую гипералгезию принято разделять на два типа – динамическая, связанная с динамическим раздражением, и статическая, связанная со статическим раздражением.
Динамическая гипералгезия может быть вызвана легким скользящим прикосновением и в зависимости от способа вызывания подразделяется на два подвида. Первый – аллодиния, или гипералгезия, связанная с раздражением кисточкой («кисточковая гипералгезия»), легким прикосновением конским волосом, комочком ваты и т.п. Второй подвид – гипералгезия на укол иглой. Статическая гипералгезия может быть вызвана легким тупым надавливанием и поколачиванием.
Динамическая гипералгезия наблюдается в зоне первичной и вторичной гипералгезии. Холодовая гипералгезия возникает при постепенном охлаждении пораженной области и часто описывается больными, как жгучая боль. Обычно клинически исследуются виды вторичной гипералгезии – аллодиния, гипералгезия на укол иглой и холодовая гипералгезия. Механическая и температурная гипералгезия встречается у 70–80% пациентов с КРБС. Простейшая диагностика механической аллодинии – тактильное раздражение, которое также можно произвести мягкой кисточкой. Для диагностики температурной аллодинии применяют тепловую и холодовую пробы, используют пробирки с водой: для тепловой пробы температура воды около 40°С, для холодовой – 10–15°С. Проба считается положительной, если в ответ на это температурное воздействие возникает неприятное ощущение или боль. Холодовая гиперестезия встречается при КРБС в половине случаев, тепловая – в четверти. Боль, возникающая при движении в пораженной конечности, обычно обусловлена механической аллодинией. Разделение аллодинии и гипералгезии в значительной мере условно.
Вегетативно-трофические расстройства
Отек. Пациенты описывают чувство отечности в конечности раньше других проявлений КРБС, хотя объективные тесты выявляют отек менее чем в половине случаев, что подтверждает роль нарушений чувствительности в генезе этого феномена. Впоследствии отечность действительно развивается в 70% случаев.
Изменение окраски кожи. Изменение окраски кожных покровов отмечается у всех больных с КРБС. Красная и багрово-красная окраска встречается на ранней стадии у 50% больных, также, но значительно реже, отмечается синюшно-багровая и синюшная окраска. При оценке окраски кожи в зависимости от сроков выявлено, что красная и багрово-красная окраска наиболее часто встречается в сроки от 1 до 6 мес. На поздних сроках заболевания отмечаются белая и бледно-красная окраска кожи.
Изменение температуры кожи. Нарушение терморегуляции отмечается у подавляющего числа больных с КРБС. По данным термографии разница в кожной температуре между больной и здоровой конечностью колеблется в интервале от 0,8 до 3°С. В сроки до 6 мес от начала заболевания кожная температура на пораженной конечности выше, чем на здоровой, у всех больных; после 6 мес температура снижается.
Нарушение потоотделения. Нарушение функции потоотделения отмечается практически у всех больных, при этом может встречаться как гипер- так и гипогидроз. Эти изменения наблюдаются на различных сроках заболевания, обнаружена взаимосвязь функции потоотделения, изменения окраски кожи и типа терморегуляции. Для гипогидроза характерна бледно-красная окраска и пониженная кожноая температура; при гипергидрозе окраска багрово-красная и синюшно-багровая, повышена кожная температура.
Трофические изменения. Трофические нарушения характеризуются различной частотой проявления: остеопороз – 90%; артрит, артроз мелких суставов – 93%; изменение скорости роста ногтей 42,5%; изменение скорости роста волос – 27,5%; мышечные контрактуры – 67,5%.
Двигательные нарушения. Проявляются слабостью, тремором и ограничением объема движений. Особого внимания заслуживают контрактуры. Первый симптом, на который обращают внимание пациенты, – это повышение мышечного тонуса в пораженной конечности. Пациенты отмечают появление тугоподвижности в кисти или стопе, что субъективно описывается: «конечность как будто смазана клеем». Таким образом, объем пассивных движений в конечности сохранен, а активные движения затруднены. Постепенно тугоподвижность нарастает и появляются ограничения не только активных, но и пассивных движений. Ограничение активных движений в конечности нередко связано также с болевым синдромом, который появляется либо усиливается при движении, периферическим парезом, связанным с повреждением нерва, отеком. При повышении мышечного тонуса объем пассивных движений сохранен полностью, но отмечается боль и тугоподвижность при активных движенях. В нашем исследовании повышение мышечного тонуса клинически или анамнестически отмечено у всех больных с КРБС. При формировании контрактуры появляется ограничение объема пассивных движений различной степени выраженности.
Выявлено два характерных комплекса вегетативно-трофических нарушений: первый – окраска кожи багровая или красная, отек, гипертермия, гипергидроз, ускорен рост ногтей, может быть ускорен рост волос, контрактура наблюдается в среднем в 60% случаев; второй комплекс — окраска кожи белая или синюшная, гипотермия, гипо- или ангидроз, гипотрофия мягких тканей, дисхромия кожных покровов, замедлен рост ногтей и волос, контрактура характерна для всех больных. Первый комплекс встречается при длительности заболевания до 6 мес в среднем в 70% наблюдений, второй может развиться как в ранние, так и в поздние сроки.
Стадии заболевания. В течении КРБС выделяют три стадии без четкой привязанности к продолжительности каждой из них, которая индивидуально колеблется в широких пределах. Основным признаком первой (начальной) стадии является боль, описываемая пациентами как жгучая, ноющая, иногда леденящая, глубокая и пульсирующая. К боли присоединяется отек и тугоподвижность конечности. Движения могут нарушаться не только из-за боли, но и вследствие развития пареза. Для пареза характерны умеренная выраженность, усиление после введения катехоламинов и уменьшение в ответ на введение симпатолитических средств, может отмечаться мелкоамплитудный постуральный тремор пораженной конечности. Во второй (средней) стадии дистрофические изменения и отек ведут к огрублению кожи. Ее покраснение постепенно сменяется бледностью или цианотичностью, нарастает сухость и атрофия кожи и подкожной жировой клетчатки. Усиливается тугоподвижность суставов. При рентгенографии и сцинтиграфии кистей или стоп выявляется пятнистый мелкоочаговый остеопороз (остеопороз Зудека). В третьей (поздней) стадии боль носит постоянный и интенсивный характер, усиливается при малейшем движении поврежденной конечности, отечность спадает, но периартикулярные уплотнения остаются. Конечность деформируется за счет атрофии мышц и контрактур. Во второй и особенно в третьей стадии заболевания наблюдаются изменения личности больного в виде тревожно-депрессивных и ипохондрических расстройств. Разделить клиническую картину КРБС на начальную и среднюю стадии заболевания по старым классификациям, на наш взгляд, практически сложно, поэтому целесообразнее объединить их в одну и выделять начальную и позднюю стадии заболевания, но не по срокам длительности заболевания, а по функции. В основу предлагаемой классификации было положено сочетание клинических признаков и функциональных возможностей с учетом патофизиологических механизмов развития КРБС. Разделение на стадии, не привязанное к конкретным срокам, а основанное на клинических проявлениях, позволяет более точно формулировать диагноз не только с описанием клинической картины, но и с учетом фазы развития синдрома. Такое разделение позволяет осуществлять дифференцированный подход в лечении и в экспертной оценке трудоспособности. На первой стадии заболевания больные инвалидизируются из-за выраженного болевого синдрома, как основной причины, а на второй – из-за развивающихся грубых двигательных нарушений в рамках динамически формирующейся контрактуры, обратимой на начальной стадии, и выраженной социальной дезадаптации.
Патофизиологические механизмы спонтанной боли
В основе развития спонтанной (стимулнезависимой) боли лежит активация первичных С-афферентов. Потенциал действия на мембране нейронов развивается в результате функционирования ионного насоса, осуществляющего транспорт ионов натрия – натриевых каналов. В мембранах чувствительных нейронов обнаружено два типа натриевых каналов: первый тип – чувствительный к тетродотоксину и второй тип – нечувствительный к тетродотоксину (англ. «tetrodotoxin resistant» — ТТХ-R). Тетродотоксин является самым сильным из известных токсинов органического происхождения и содержится во внутренних органах рыбы-шара (она водится в морях Юго-Восточной Азии) относящейся к семейству Тетродонтов. Первый тип каналов, чувствительных к тетродотоксину, отвечает за генерирование потенциала действия и расположен во всех чувствительных нейронах. Второй тип каналов, которые нечувствительны к тетродотоксину (ТТХ-R), находится только в специфических ноцицептивных нейронах (англ. «sensory neuron-specific»- SNS). Эти каналы гораздо медленнее активируются и инактивируются по сравнению с каналами первого типа и также медленно вовлекаются в развитие патологического болевого состояния. Выделяют два вида ТТХ-R каналов: SNS1/PN3 и SNS2/NaN. У человека при повреждении периферического нерва отмечается увеличение каналов SNS1 при персистирующей боли, аллодинии и гипералгезии, а количество SNS2 не меняется. Повышение плотности SNS1 натриевых каналов ведет к развитию очагов эктопического возбуждения как в аксоне, так и в самой клетке, которые начинают генерировать усиленные разряды потенциалов действия. Кроме того, после поражения нерва и поврежденные, и интактные афференты приобретают способность генерировать эктопические разряды за счет активации тетродон-нечувствительных натриевых каналов, что и ведет к развитию патологической импульсации из аксонов и нейронов поврежденных афферентов.
В ряде случаев стимулнезависимая боль является симпатически обусловленной. Развитие симпатически обусловленной боли связано с двумя механизмами. Во-первых, после повреждения периферического нерва на мембранах поврежденных и неповрежденных аксонов С-волокон начинают появляться a-адренорецепторы (в норме на этих волокнах отсутствуют), чувствительные к циркулирующим катехоламинам, выделяющимся из терминалей постганглионарных симпатических волокон. Во-вторых, повреждение нерва также вызывает прорастание симпатических волокон в узел заднего корешка, где они оплетают в виде «корзинок» тела чувствительных нейронов, и таким образом активация симпатических терминалей провоцирует активацию чувствительных волокон. Однако не вся спонтанная боль развивается только вследствие активации первичных ноцицепторов. В основе развития спонтанной боли также участвуют механизмы, связанные с нарушением процессов торможения на уровне заднего рога. Нейроны заднего рога спинного мозга получают информацию от первичных афферентов. Активность нейронов задних рогов определяется не только возбуждающей периферической стимуляцией, но и тормозными влияниями, которые могут быть спинальными или нисходящими центральными. Таким образом, усиление тормозных влияний ведет к уменьшению активности нейронов заднего рога, что лежит в основе «воротного контроля» поступающей афферентации. Поражение периферического нерва может снижать ингибирующий контроль нейронов задних рогов различными путями. Повреждение нерва ведет к снижению концентрации g-аминомаслянной кислоты (ГАМК), которая оказывает тормозное влияние, что вызывает нарушение регуляции ГАМК-ергических и опиатных рецепторов, расположенных на пресинаптических мембранах первичных сенсорных нейронов и на постсинаптических мембранах нейронов заднего рога. Кроме того, в результате развития эксайтотоксических реакций, ведущих к развитию механизмов апаптоза или программируемой смерти клеток, связанных с поражением периферического нерва, погибают вставочные нейроны, локализованные во второй пластине клеток заднего рога, многие из которых выполняют тормозную функцию. В результате этих процессов вторичные чувствительные афференты лишаются тормозных механизмов и начинают генерировать патологическую импульсацию, передающуюся в ЦНС даже при отсутствии активности в первичных чувствительных афферентах.
Патофизиологические механизмы гипералгезии
Механическая гипералгезия является одним из наиболее общих проявлений болевой нейропатии. Динамическая гипералгезия это следствие усиленного ответа чувствительных нейронов заднего рога спинного мозга на стимуляцию проводимую по Аb-волокнам от низкопороговых механорецепторов. В норме активация низкопороговых механорецепторов не связана с болевыми ощущениями. Развитие динамической гипералгезии (аллодинии) связано с развитием центральной сенситизации. В основе центральной сенситизации лежит стойкая деполяризация мембран. Основным возбуждающим нейротрансмиттером в первичных афферентах является глутамат. Существует два типа глутаматных рецепторов на постсинаптической мембране чувствительных нейронов задних рогов спинного мозга: первый — это рецепторы амино-3-гидрокси-5-метилсоксазол-4-пропионовой кислоты (AMPA-рецепторы) и второй – это N-метил-D-аспартат рецепторы. Активация ноцицепторов ведет к высвобождению глутамата из пресинаптических мембран, и он, взаимодействуя с постсинаптическими глутаматными AMPA-рецепторами, вызывает быструю деполяризацию мембран нейронов заднего рога и при превышении порога возбуждения генерирует потенциал действия. Этот механизм лежит в основе проведения нормальных ноцицептивных стимулов. Другой тип глутаматных рецепторов – это N-метил-D-аспартат-рецепторы (NMDA-рецепторы), связанные с кальциевыми каналами клеточных мембран, находящихся в неактивном состоянии. Эти каналы неактивны, поскольку их поры, как «пробкой», блокированы ионами магния. Когда канал блокирован ионом магния, глутамат не может его активировать. Однако при развитии преходящей деполяризации мембраны, связанной с функцией ноцицепции, эти каналы открываются, обеспечивая транспорт кальция, а после восстановления полярности снова закрываются. В случае поражения периферического нерва процессы поляризации и деполяризации клеточных мембран претерпевают глубокие изменения. Субстанция Р, находящаяся вместе с глутаматом в центральных терминалях первичных афферентов, при поражении нерва выделяется и активирует нейрокинин-1-рецепторы, в результате чего увеличивается время деполяризации и возрастает внутриклеточная концентрация ионов кальция. Этот процесс активирует протеинкиназу С, которая фосфорилирует белковые фрагменты NMDA-рецепторов, а эти белки в свою очередь связываются с ионами магния и открывают каналы, по которым кальций начинает активно поступать внутрь клетки, повышая возбудимость мембраны с развитием стойкой деполяризации. Кроме того, ионы кальция, поступая в клетку, активируют внутриклеточные ферменты, в том числе нитрикоксидсинтазы (оксидазотсинтазы), что вызывает синтез оксида азота (NO). Оксид азота играет роль свободно диффундирующего нейротрансмиттера, резко усиливающего болевую передачу. Именно с нейротрансмиттерными функциями оксида азота связывают феномен «взвинчивания», который характеризуется резким увеличением амплитуды потенциалов действия на мембране чувствительных нейронов заднего рога спинного мозга. Центральная сенситизация характеризуется тремя признаками: появлением зоны вторичной гипералгезии; усилением ответа на надпороговые раздражения; появлением ответа на подпороговое раздражение. Эти изменения клинически выражаются появлением гипералгезии на болевые стимулы, распространяющейся гораздо шире в зонах повреждения, и включают эффект гипералгезии на неболевую стимуляцию. Распространение боли за пределы зоны иннервации пораженного нерва является проявлением не психогенных нарушений, а наиболее общим признаком центральной сенситизации. Холодовая и механическая гипералгезия также являются проявлениями центральной сенситизации. У части пациентов аллодиния (динамическая гипералгезия) может наблюдаться при отсутствии других признаков спонтанной боли. В этом случае активация нейронов задних рогов, связанных с Аb- волокнами, развивается не за счет раздражения низкопорговых механорецепторов, а за счет нарушения механизмов, обеспечивающих центральные тормозные влияния. Эти механизмы связаны, во-первых, с нисходящими серотонин- и норадренергическими влияниями. Серотонин действует на 5НТ-рецепторы, адренергические влияния осуществляются через спинальные a2-рецепторы, которые тормозят выделение субстанции Р из центральных терминалей первичных афферентов. Во-вторых, это феномен «прорастания» (англ. «sprouting») А-волокон в заднем роге спинного мозга. В норме центральные терминали А-волокон находятся во всех пластинах клеток заднего рога, за исключением II пластины, которая получает центральные терминали исключительно от ноцицептивных С-афферентов. Повреждение периферического нерва вызывает атрофию С-волокон и индуцирует прорастание центральных терминалей А-волокон во II пластину. Функционально значимо в этом процессе то, что в норме нейроны второй пластины получают только ноцицептивную информацию и поступление неболевой стимуляции может ошибочно расцениваться нервной системой как боль. Этот механизм является анатомическим субстратом аллодинии. В-третьих, это механизм переключения фенотипа. Его суть в том, что в результате повреждения нерва могут меняться его фенотипические свойства. Эти свойства нейрона, связанные с синтезом белков, используемых для его роста и поддержания жизнедеятельности, контролируются фактором роста нервов. Фактор роста нервов ретроградно с аксоплазматическим током транспортируется от иннервируемых тканей к телу чувствительного нейрона, где регулирует концентрацию нейропептидов, выполняющих функцию трансмиттеров. Травматическое повреждение аксона или блок аксоплазматического транспорта, вызванный применением цитостатиков, вызывает глубокие фенотипические изменения, связанные с разобщением связей, которые в норме клетка постоянно поддерживает с иннервируемыми тканями. После повреждения нерва происходит нарушение дифференциации шванновских клеток Аb-волокон, и они вместо миелина начинают синтезировать нейропептиды, такие как субстанция Р и кальцитонин-ген-высвобождающий пептид, которые в норме встречаются только в первичных афферентах С- и Аd-волокон. В результате подобных изменений фенотипических свойств стимуляция низкопороговых механорецепторов, связанных с Аb-волоконами, может вызывать выделение субстанции Р и ее последующее взаимодействие с постсинаптическими мембранами нейронов заднего рога спинного мозга с развитием их гипервозбудимости, в норме развивающейся только на ноцицептивные стимулы. Развитие первичной гипералгезии связано со снижением порога возбуждения в периферических терминалях ноцицепторов и называется периферической сенситизацией. В результате повреждения нерва развивается антидромное проведение импульсов по сенсорным волокнам. Эти антидромные импульсы стимулируют выделение из периферических терминалей субстанции Р и кальцитонин-ген-высвобождающего пептида, которые вызывают периферическую сенситизацию как поврежденных, так и неповрежденных волокон.
Патофизиологические механизмы вегетативно-трофических расстройств
При поражении периферического нерва в основном страдают толстые, хорошо миелинизированные А-волокна, тогда как мало миелинизированные Аg- и Аd- волокна и С-волокна более устойчивы к повреждению. Афферентные Аg- и Аd-волокна состоят из аксонов малых g-мотонейронов, которые вызывают сокращение интрафузальных мышечных волокон и увеличение тонуса скелетной мускулатуры. Пучки волокон на разных уровнях нерва расположены различно: или параллельно на определенном расстоянии, или образуют сложный межпучковый переплет. В результате возникновения в этих зонах за счет поражения периферического нерва феномена деполяризации может возникать переключение афферентного стимула с двигательных эфферентных волокон на эфферентные симпатические С-волокна. Это переключение вызывает возбуждение симпатических эфферентов и активный выброс нейромедиаторов (катехоламины, ацетилхолин, гистамин, серотонин), обеспечивающих вегетативно-трофическую регуляцию. Медиаторы выделяются на окончаниях нервных волокон, вступают в реакцию со специфическими рецепторами, передавая импульс от нейрона к эффекторной клетке (транссинаптический акцессорный способ передачи нервного стимула). Экстрасинаптический способ – это выделение медиаторов из синапсов в межклеточную жидкость и диффузия их к ближайшим эффекторным клеткам, не имеющим прямых контактов с нервными окончаниями. Именно внесинаптическое взаимодействие позволяет объяснить распространение вегетативно-трофических расстройств за пределы области иннервации пораженного нерва. Чрезмерное выделение нейромедиаторов обусловливает развитие вегетативно-трофических расстройств, которые характерны для первого комплекса. Постепенное истощение симпатической регуляции вызывает недостаток трофического влияния и развитие дистрофии в виде второго комплекса вегетативно-трофических растройств.
Методы клинической диагностики
Следует отметить, что диагноз КРБС ставится на основе клинических проявлений, так как не существует специфических методов инструментальной диагностики. В 1996 г. предложен алгоритм диагностики КРБС (P. Wilson, Ph. Low и соавт.). Этот алгоритм основан на субъективных и объективных клинических признаках и истории развития заболевания.
Боль:
Диагноз КРБС не может быть поставлен при отсутствии боли. Это болевой синдром! Характеристика боли может быть различной. Боль часто описывается, как жгучая и может быть спонтанной и индуцированной в рамках гипералгезии или аллодинии. Спонтанная и индуцированная боль могут быть одновременно.
История заболевания:
• развивается после повреждающего воздействия или иммобилизации;
• поражается одна конечность;
• симптомы развиваются обычно в пределах одного месяца.
Жалобы пациента:
а) боль (спонтанная или индуцированная) жгучая, глубокая, ноющая;
б) гипералгезия или аллодиния;
в) сопутствующие симптомы: отек, изменения температуры, окраски и потоотделения на пораженной конечности; трофические изменения ногтей, волос, кожи.
Клинические признаки:
односторонние гипералгезия или аллодиния, отек, вазомоторные изменения, судомоторные изменения, трофические изменения, нарушения моторной функции (могут включать дистонию и тремор).
Критерии, сочетание которых позволяет поставить диагноз КРБС I
1. История заболевания:
• плюс аллодиния, гипералгезия или гиперестезия;
• плюс два других клинических признака, приведенных выше
(Если имеется идентифицированное поражение нерва, то это КРБС II)
2. Характеристика спонтанной боли, (возможен любой из вариантов):
• симпатически обусловленная боль (СОБ)
• симпатически независимая боль (СНБ)
• комбинация СОБ+СНБ.
3. Критерии диагностики симпатической дисфункции:
а) неинвазивные тесты – поверхностная температурная асимметрия >1°С, судомоторная асимметрия в покое или вызванная,
б) инвазивные тесты – блокада симпатического ганглия, системное введение a-адреноблокаторов, плацебо–контролируемое.
Таким образом, диагноз КРБС ставится на основании характера спонтанного болевого синдрома, анамнеза заболевания в сочетании с клиническими проявлениями и наличия симпатической дисфункции.
Мы предлагаем диагностическую шкалу, созданную с учетом нашего опыта работы с больными.
Все клинические признаки развиваются в пределах 1 мес и на одной конечности.
Далее приводятся клинические признаки и данные инструментального исследования с оценкой в баллах, диагноз достоверен при сумме 10 баллов и выше.
Боль в конечности жгучая или ноющая по интенсивности и длительности не соответствующая инициирующему фактору в настоящее время или в анамнезе (на поздней стадии) – 5
Аллодиния, гипералгезия в настоящее время или в анамнезе – 3
Изменение окраски кожи – 2
Отек – 1
Изменение роста ногтей и волос – 3
Контрактура – 2
Повышение мышечного тонуса – 3
Изменение потоотделения – 1
Изменение кожной температуры – 1
Регионарный остеопороз – 1
Положительный эффект симпатической блокады – 2.
Данный диагностический алгоритм основан на том, что приведенные в нем признаки и их оценка в баллах направлены на выделение в процессе диагностики наиболее ключевых симптомов. Это прежде всего боль, не соответствующая этиологическому фактору, чувствительные аномалии и такой специфичный феномен начальной стадии, как ускорение роста ногтей и волос, повышение мышечного тонуса. Эти симптомы имеют такое же диагностическое значение при сборе анамнеза. Данные инструментальных методов исследования имеют вспомогательное диагностическое значение. Такой диагностический подход соответствует Международной классификации хронических болей, где диагноз КРБС основан на клинических критериях.
Методы инструментальной диагностики
Методы инструментальной диагностики подразделяются на условно-специфические, неинвазивные и инвазивные тесты, которые позволяют доказать участие симпатической нервной системы в развитии болевого синдрома и судомоторных изменений, и неспецифические. Неспецифические тесты, как следует из определения, позволяют обнаружить определенные изменения, развивающиеся при КРБС, но эти изменения имеют более широкое патофизиологическое значение и не являются специфичными для данного синдрома.
Условно-специфические тесты
Симпатическая блокада. Купирование боли после проведения симпатической блокады является критерием симпатически обусловленной боли.
Исследование температуры кожи
Изменения температуры кожи обусловлены особенностями регионарного кровотока, который связан с симпатической активностью. Разница кожной температуры более 1°С на симметричных участках между пораженной и здоровой конечностью свидетельствует о симпатической дисфункции (гипер- или гипоактивность). Исследование нужно проводить в помещении с комнатной температурой (200С), в спокойном положении пациента и после его акклиматизации; измерение должно проводиться неконтактной термометрией или термографией. Оценивается результат нескольких повторных измерений.
Исследование судомоторной активности
Исследование потоотделения в покое RSO и количественный тест вызванного судомоторного аксон-рефлекса (QSART)
Метод позволяет измерить количественные показатели функции потоотделения. Исследуется спонтанное, нормальное потоотделение и судомоторная активность, вызванная ионофорезом ацетилхолина.
Спонтанное потоотделение измеряется на гипотенаре, предплечье, голени и стопе, средние показатели потоотделения составляют 0,54 (0,20–1,02), 0,09 (0,04–0,15), 0,11 (0,06–0,56) и 0,14 (0,03–0,56) мл/см2 соответственно. Разница считается значимой, когда асимметрия достигает 40%.
Ионофорез 10% ацетилхолина вызывает соматосимпатический ответ, связанный со стимуляцией соматических афферентов и симпатических эфферентов (QSART). Соматосимпатический ответ не регистрируется у здоровых людей. В среднем у 75% пациентов с симпатически поддерживаемыми болями этот ответ может регистрироваться. Соматосимпатический ответ имеет латенцию около 0,1-0,2 мин и хорошо отличим от ответа на стимуляцию посганглионарного аксона, латентный период которого превышает 0,5 мин (Ph. Low и соавт., 1983; Ph. Low, 1993). Ответ с ультракоротким латентным периодом (0,2 мин) связан с аксон-рефлексом и является признаком симпатической дисфу
.
Особенности лечения комплексных регионарных болевых синдромов в ревматологии | Шостак Н.А.
Проблема боли на сегодняшний день остается одним из фундаментальных вопросов медицины. Универсальными патологическими механизмами, лежащими в основе ревматических болезней, являются боль и воспаление.
Боль – это неприятное чувствительное или эмоциональное ощущение, возникающее в момент или при угрозе повреждения тканей, либо описываемое в терминах такого повреждения.
В современной медицине рефлекторная симпатическая дистрофия (РСД) (альгонейродистрофия, синдром Зудека) как компонент этой проблемы приобретает особое значение. РСД – это болевой синдром, характеризующийся гиперфункцией регионарной симпатической нервной системы с поражением отдельных сегментов опорно–двигательного аппарата с развитием нарушения функции, остеопороза, отека и дистрофии мягких тканей, подкожной клетчатки и кожи.
Международная ассоциация изучения боли предложила заменить термины РСД и каузалгии на «комплексный региональный болевой синдромом I и II типов» (КРБС) соответственно. Новая классификация этого нарушения и новое название были предложены с тем, чтобы более точно описать его клинические особенности: к I типу относят случаи, индуцированные преимущественно повреждением кости или мягких тканей и не связанные с поражением периферического нерва, ко II типу – развитие синдрома на фоне объективно определяемого органического поражения нерва.
КРБС может развиваться вследствие разнообразных этиологических факторов: травм центральной и периферической нервной системы, артритов, туннельных невропатий, дегенеративных и аутоиммунных заболеваний нервной системы. Существенную роль в возникновении дистрофического процесса играют дополнительные этиологические компоненты, к которым относят дефекты лечения переломов костей конечностей на этапах проведения репозиции и иммобилизации (недостаточная анестезия, неправильная репозиция, тугая гипсовая повязка, продолжительная иммобилизация).
Впервые в 1864 г. американские хирурги S. Mitchell, G. Morchouse и W. Keen в книге «Огнестрельные раны и другие повреждения нервов» классически и ярко изложили описание ранее неизвестного симптомокомплекса (жгучая боль в сочетании с гиперестезией, температурные и трофические изменения в пораженной конечности), который следовал за огнестрельным повреждением конечностей у солдат во время гражданской войны в США. А в 1900 г. P. Sudeck на XXIX конгрессе Немецкого общества хирургов в Берлине доложил о вторичных изменениях в дистальных отделах верхней конечности в виде неоднородного прогрессирующего пятнистого остеопороза, обнаруженного им рентгенологически. P. Sudeck описал стадии заболевания, дав ему название «острая костная атрофия»: «Речь идет об остром воспалении суставов кисти с рано появляющейся тугоподвижностью и болезненностью суставов пальцев и очень часто – через несколько недель – с сильно выраженной атрофией всей конечности». J. Evans (1946 г.) впервые обнаружил сходство в клинической картине синдрома Зудека и каузалгии, выделил вазомоторные, вегетативные, трофические изменения, впервые употребил термин «рефлекторная симпатическая дистрофия» (reflex sympathetic dystrophy). В 1947 г. O. Steinbrocker описал особую форму заболевания – рефлекторную дистрофию верхней конечности, протекающую с одновременным поражением кисти и плечевого сустава. Эту форму заболевания он назвал «синдром плечо–кисть» (shoulder–hand syndrome). Лишь в 1991 г. P. Amadio, S. Mackinnon, W. Merrit, G. Brody и J. Terzis предложили диагностические критерии, необходимые для правомочности установления клинического диагноза РСД:
• диффузная боль в дистальном или дистальном и проксимальном отделах конечности, не соответствующая по интенсивности начальному повреждению или другому вызывающему ее фактору;
• боль носит жгучий характер и нарушает двигательные функции;
• объективные признаки вегетативной дисфункции конечности.
Клинические проявления КРБС, лежащие в основе диагностических критериев, заключаются в развитии в пределах одной конечности (чаще в дистальных ее отделах) болевого синдрома: это ощущения жжения, ноющие или ломящие боли в сочетании с чувствительными нарушениями (гипо– или анестезией, гиперпатией, аллодинией, т.е. восприятием стимуляции любой модальности как болевой), вегетативно–трофическими расстройствами (отеком, изменением окраски кожных покровов, локальным изменением кожной температуры, нарушением потоотделения, изменением скорости роста ногтей и волос, локальным остеопорозом) и расстройствами движений в форме различной степени выраженности пареза.
Болевой синдром при КРБС по своей природе является нейропатической болью, которая представлена двумя основными компонентами: спонтанной (стимулонезависимой) болью и вызванной (стимулозависимой) гипералгезией.
Боль является абсолютным признаком для диагностики КРБС. Она возникает вследствие повреждающего воздействия, обычно вовлекающего ткани конечности, но по своему характеру, выраженности и распространенности превосходит инициирующее травматическое воздействие. Болевой сидром может иметь две основные характеристики: жгучая боль – ощущается в виде жжения, чаще поверхностная, от средней до высокой степени интенсивности, четко описывается пациентом; ноющая боль – ноющего, ломящего, тянущего характера, чаще ощущается, как глубинная, имеет средний или ниже среднего уровень интенсивности, пациенты не могут дать ее четкого описания. Эти два типа боли различаются по своей длительности: жгучие боли в трети случаев сохраняются более 6 месяцев, иногда трансформируются в ноющие; первично ноющие боли после 6 месяцев от начала заболевания не отмечены. Более чем 3/4 пациентов имеют спонтанные постоянные боли. Боль нередко следует сразу за травмой, которая обычно не связана со значительным повреждением нерва. Она может наблюдаться вслед за переломом костей, мягким тканевым повреждением или иммобилизацией, обусловленной висцеральной патологией. Боль возникает обычно в течение первого месяца после воздействия провоцирующего фактора.
Развитие симпатически обусловленной боли связано с двумя механизмами. Во–первых, после повреждения периферического нерва на мембранах поврежденных и неповрежденных аксонов С–волокон начинают появляться a–адренорецепторы (в норме на этих волокнах отсутствуют), чувствительные к циркулирующим катехоламинам, выделяющимся из окончаний постганглионарных симпатических волокон. Во–вторых, повреждение нерва также вызывает прорастание симпатических волокон в узел заднего корешка, где они оплетают в виде корзинок тела чувствительных нейронов, и таким образом активация симпатических окончаний провоцирует активацию чувствительных волокон. Однако не вся спонтанная боль развивается только вследствие активации первичных ноцицепторов. В основе развития спонтанной боли также участвуют механизмы, связанные с нарушением процессов торможения на уровне заднего рога. Нейроны заднего рога спинного мозга получают информацию от первичных афферентов. Активность нейронов задних рогов определяется не только возбуждающей периферической стимуляцией, но и тормозными влияниями, которые могут быть спинальными или нисходящими центральными. Поражение периферического нерва может снижать ингибирующий контроль нейронов задних рогов различными путями. Повреждение нерва ведет к снижению концентрации g–аминомаслянной кислоты (ГАМК), которая оказывает тормозное влияние, что вызывает нарушение регуляции ГАМК–ергических и опиатных рецепторов, расположенных на пресинаптических мембранах первичных сенсорных нейронов и на постсинаптических мембранах нейронов заднего рога. В результате этих процессов вторичные чувствительные афференты лишаются тормозных механизмов и начинают генерировать патологическую импульсацию, передающуюся в ЦНС даже при отсутствии активности в первичных чувствительных афферентах.
Вторым компонентом нейропатической боли является гипералгезия. По локализации выделяют первичную и вторичную гипералгезию. Первичная гипералгезия локализуется в зоне иннервации поврежденного нерва или в зоне тканевого повреждения, вторичная гипералгезия имеет более широкое распространение, далеко выходя за зону тканевого повреждения или зону иннервации поврежденного нерва.
Первичная гипералгезия связана с местом повреждения тканей и возникает в основном в ответ на раздражение сенсибилизированных в результате повреждения периферических ноцицепторов. Ноцицепторы становятся чувствительными за счет биологически активных веществ, высвобождающихся или синтезирующихся в месте повреждения. Этими веществами являются: серотонин, гистамин, нейроактивные пептиды, кинины, брадикинин, а также продукты метаболизма арахидоновой кислоты (простагландины и лейкотриены) и цитокины. В процесс вовлекается также категория ноцицепторов, которые в норме неактивны, но активируются вслед за тканевым повреждением. Вследствие такой активации увеличивается афферентная стимуляция нейронов заднего рога спинного мозга, что и является основой развития вторичной гипералгезии.
Выделяют также два основных комплекса вегетативно–трофических нарушений: первый, когда имеется окраска багровая или красная кожи, отек, гипертермия, гипергидроз, ускорен рост ногтей, может быть ускорен рост волос, контрактура наблюдается в среднем в 60% случаев; второй — окраска кожи белая или синюшная, гипотермия, гипо– или ангидроз, гипотрофия мягких тканей, дисхромия кожных покровов, замедлен рост ногтей и волос, контрактура характерна для всех больных (рис. 1,2). Первый комплекс встречается при длительности заболевания до 6 мес в среднем в 70% наблюдений, второй может развиться как в ранние, так и в поздние сроки.
Таким образом, как правило, травма является стартовым фактором, запускающим в действие дальнейший механизм развития РСД. При РСД происходит нарушение функции вегетативных центров, желез внутренней секреции и активности местных тканевых гормонов. Это ведет к стойким расстройствам местного кровообращения, которые на ранней стадии заболевания состоят в нейрогенной вазоконстрикции сосудов, а также в дилатации прекапиллярных сфинктеров. На следующей стадии, характеризующейся функциональным истощением симпатической нервной системы, происходит нейрогенное падение тонуса микрососудов (в особенности венул). Развивающаяся сосудистая дистония ведет к нарушению проницаемости стенок капилляров. В пораженном сегменте развиваются микроциркуляторные нарушения, тканевая гипоксия и ацидоз. Изменяется ионное равновесие в экстрацеллюлярной жидкости, что, в свою очередь, приводит к функциональным нарушениям остеоцитарных агрегаций, усиленному распаду фосфорно–кальциевых соединений. Все это обусловливает развитие лакунарного рассасывания кости, что проявляется рентгенологически в виде пятнистого остеопороза, и раздражение чувствительных нервных окончаний с возникновением болевого синдрома.
В зависимости от распространенности РСД выделяют три основных клинических варианта течения: дистальный (синдром Зудека) (табл. 1, рис. 3), распространенный (синдром плечо–кисть Штейнброккера) и проксимальный (шейно–плечевой).
Клинические проявления РСД весьма демонстративны и характеризуются определенной фазностью, которую можно представить, как начало болезни (болевой синдром и вазомоторные нарушения), ее «пик» (дистрофическая стадия или стадия трофических нарушений) и исход (стадия устойчивой декомпенсации).
Единственным постоянным признаком начального периода (длится до 2–3 месяцев от момента травмы) дистрофии является болевой синдром различной степени выраженности. Вазомоторные нарушения сопровождаются массивным отеком тыльной стороны кисти и часто нижней трети предплечья, гиперемией, повышением температуры кожи. Во второй стадии (3–6 месяцев от начала заболевания) наступает постепенное уменьшение боли, характерны комбинированные контрактуры с выраженным артритогенным компонентом, кожа истончается, бледнеет и атрофируется, возникает ее глянцевитость, часто гипертрихоз и гиперкератоз. При проксимальных формах РСД происходит вовлечение в процесс мышечно–сухожильных структур с образованием очагов миоостеофиброза. На третьей стадии (от полугода до нескольких лет) наступает атрофия всех тканей с контрактурами в суставах смешанного генеза. В тяжелых случаях и при отсутствии соответствующего лечения это приводит к фиброзному анкилозу.
Диагностика РСД основывается на характерных клинических проявлениях, типичной стадийности течения заболевания и отчетливой тенденции к спонтанному выздоровлению. Большое значение придается применению довольно чувствительных и специфичных методов диагностики: рентгенологическому исследованию, радиоизотопному сканированию и магнитно–резонансной томографии. Последний метод полезен для демонстрации патологических изменений в мягких тканях у пациентов с РСД, а получаемое отображение может помочь в определении стадии процесса.
Для рентгенологической картины РСД весьма характерен пятнистый остеопороз, выявляемый обычно на 3–4–й неделе от начала заболевания у 80% больных. При этом в дистальных отделах предплечья (голени) и фаланг пальцев на фоне неизмененной костной структуры появляются множественные просветления без четких границ. При длительно протекающем процессе очаговый остеопороз сменяется диффузным.
Существенную сложность для диагностики и лечения представляет комбинация РСД с посттравматическими туннельными синдромами (компрессионно–ишемическими невропатиями). При таком сочетании характерны выраженные вегетативные расстройства и строго локальные (в зоне автономной иннервации) двигательные нарушения. В данном случае несомненную ценность представляет ряд тестов: пальцевая компрессия нерва, симптом Тиннеля, манжеточный тест и др.
Для развития компрессионно–ишемических невропатий большое значение имеют изменения нервов, а именно рубцовое спаяние с окружающими тканями, при котором они становятся менее подвижными и травмируются при движениях, рубцы также сами сдавливают нервы. Способствует также и ишемия нервных стволов, т.е. при наличии атеросклероза сосудов конечностей, диабетической ангиопатии эти синдромы развиваются чаще. Непосредственные причины возникновения таких болевых синдромов многообразны: травмы, приводящие к сдавлению содержимого каналов отломками костей или гематомами, воспалительные заболевания (такие как артриты, синовиты).
Таким образом, в этиологии компрессионно–ишемических невропатий приходится предполагать острые, подострые и хронические воздействия, как бы «проявляющие» наследственную или приобретенную узость туннелей.
1. Генетически детерминированное сужение костных каналов.
2. Приобретенное сужение естественных вместилищ нерва может быть вызвано многочисленными причинами, действующими длительно или короткое время, приводящими к стабильному и значительному уменьшению просвета туннеля и его объема или же к непродолжительному и незначительному.
К причинам нарушений нормальных объемных соотношений между содержимым и стенками канала относят общие и местные заболевания, способствующие увеличению объема периневральных тканей, травмы и их последствия, а также аномалии в строении костей, суставов, мышц и сухожилий и, наконец, профессиональные, спортивные или бытовые перенапряжения мышечно–связочного аппарата.
Большинство авторов, учитывая преобладание среди больных с туннельными синдромами женщин пожилого возраста, находящихся в климактерическом периоде, или молодых женщин с недостаточностью яичников, а также беременных женщин, придает существенное значение в этиологии компрессионных невропатий эндокринным сдвигам (табл. 2).
Клинические проявления компрессионно–ишемических невропатий складываются из сенсорных, моторных, вегетативных и трофических нарушений. В диагностике туннельных синдромов принципиальное значение имеют анализ характера и локализации, распространения боли, распределение чувствительных и двигательных нарушений, что будет отличать данные синдромы от РСД.
Лечение РСД требует значительных усилий и терпения как от лечащего врача, так и от пациента. Оно строится из двух составляющих: рекомендаций для больных и медицинских мероприятий. Первые включают практические советы, позволяющие облегчить физические страдания пациентов, снять психологическое напряжение, и содержат также комплекс рекомендуемых гимнастических упражнений. Медицинские мероприятия предусматривают применение в комплексе инфильтрационной терапии введения медикаментозных средств, физиотерапии и психотерапии.
Учитывая участие комплекса разнообразных патогенетических факторов, своеобразие клинической картины заболевания, выражающейся в упорном болевом синдроме и ярких вегетативных проявлениях, лабильность психического состояния больных, определяющей необходимость широкого применения психофармакологической коррекции, наличие практически у всех пациентов сопутствующей соматической патологии, суживающей выбор физиотерапевтических методов воздействия, лечение РСД должно быть обязательно комплексным, выбор методик лечения основывается на стадии процесса, при этом главное значение имеет выраженность болевого синдрома.
На первой стадии болевой синдром удается предотвратить только с использованием комбинированных методик лечения:
– щадящий режим для больной конечности;
– медикаментозное лечение, блокады и инфильтрационная терапия;
– физиотерапевтическое лечение;
– криотерапия;
– психофармакотерапия.
На втором этапе наиболее эффективны медикаментозная терапия, рефлексотерапия, кинезо– и гидрокинезотерапия. На конечной стадии терапия должна быть направлена на лечение остаточной ригидности, уплотнения ладонного апоневроза, грубой диффузной гипотрофии кожи, подкожной жировой клетчатки и мышц и хотя бы частичное восстановление функции кисти. В комплекс лечебного воздействия включается инфильтрационная терапия с применением протеолитических ферментных препаратов, ультразвуковая терапия, грязевые аппликации, радоновые ванны. Обосновано применение оперативных вмешательств.
При лечении РСД используются различные аналгетические средства и местные блокады, а также в комплексную терапию часто включают антиконвульсанты, антидепрессанты, блокаторы медленных кальциевых каналов. Сложность лечения состоит в необходимости воздействия как на основной, так и на собственно дистрофический процесс. В случае тяжелого болевого синдрома, помимо анальгетиков и транквилизаторов, назначают витамины группы В.
Анальгетическая и противовоспалительная терапия РСД включает назначение нестероидных противовоспалительных препаратов (НПВП) и глюкокортикоидов. Ряд авторов указывают на положительный результат применения преднизолона в суточной дозе 60 мг и более сроком на 2–4 недели с последующим уменьшением дозы (общий срок лечения 2–4 месяца). Считается, что чем раньше начато лечение, тем выраженнее его результат.
Среди множества медицинских методов лечения главная роль отводится НПВП, эффективность которых доказана в международных, многоцентровых контролируемых исследованиях. Однако не все НПВП можно рекомендовать для длительного назначения, особенно у лиц среднего и пожилого возраста, поскольку одним из частых осложнений является эрозивно–язвенное поражение желудочно–кишечного тракта.
При наличии язвенной болезни в анамнезе и выраженного болевого синдрома показано назначение трамадола в качестве анальгезирующего средства.
В настоящее время появился новый комплексный препарат Залдиар, содержащий трамадол (в виде гидрохлорида) 37,5 мг и 325 мг парацетамола.
Трамадол является синтетическим анальгетиком центрального действия, структурно родственным с кодеином, однако в отличие от последнего, анальгетическое действие которого проявляется лишь при условии метаболизма до морфина, трамадол не является пропрепаратом опиатного ряда. По общему обезболивающему эффекту он не уступает или превосходит стандартные НПВП, но является более безопасным в отношении развития осложнений со стороны желудочно–кишечного тракта. В международных исследованиях также показано, что у пожилых пациентов в возрасте до 75 лет фармакокинетика трамадола не меняется по сравнению с молодым возрастом. У больных старше 75 лет концентрация препарата повышается на 17%, так что для пожилых пациентов рекомендуется не превышать суточную дозу в 300 мг.
В экспериментальных исследованиях было высказано предположение, что добавление трамадола к растворам местных анестетиков удлиняет длительность регионарных блокад, поскольку трамадол обладает местным обезболивающим действием. В двойном слепом контролируемом исследовании M. Beayazova, E. Оsturk показали, что периневральное введение раствора трамадола вызывает электронейрографическое подтвержденное снижение амплитуды сенсорного ответа малоберцового нерва, причем интенсивность блокады прогрессивно возрастала при увеличении концентрации раствора с 0,5 до 1%.
Парацетамол – один из наиболее безопасных анальгетиков и антипиретиков, который используется в медицине с 1893 г. Обезболивающий эффект парацетамола реализуется за счет воздействия на центры боли посредством блокирования циклооксигеназы, в том числе и в центральной нервной системе. Кроме того, парацетамол оказывает также жаропонижающее и противовоспалительное действие. Благодаря парацетамолу наступает быстрое обезболивание, в то время как трамадол обеспечивает пролонгированный эффект. Обезболивающий эффект при приеме Залдиара наступает менее чем через 20 мин. и сохраняется более 5 ч. Парацетамол и трамадол в используемой комбинации доз (1:8,67) обладают синергизмом в отношении обезболивающего действия.
В обязательное лечение РСД включается длительная блокада регионарных симпатических ганглиев с помощью введения новокаина, лидокаина. Лечение быстропрогрессирующего остеопороза должно сочетать назначение кальция и витамина Д3 с бисфосфонатами или препаратами кальцитонина.
Положительное влияние в острой стадии РСД оказывает местное охлаждение. Для этого используют проточную воду, прокладки со льдом, криотерапию в виде ванн с постепенным снижением температуры воды.
На функцию конечности при альгонейродистрофии позитивно влияет рано начатая двигательная терапия. Наряду с упражнениями на релаксацию мышц больные выполняют упражнения, стимулирующие кровообращение, улучшающие отток крови, мобилизующие суставы, укрепляющие мышцы. Двигательная терапия показана на всех стадиях заболевания, однако в остром периоде воздействие осуществляется лишь на контрлатеральную конечность. При переходе во вторую стадию рекомендуется осторожная пассивная гимнастика для суставов пальцев, вышивание и плетение, что способствует восстановлению координации, с отработкой бытовых движений рукой.
Таким образом, наиболее перспективным является комплексный метод терапии болевых синдромов с учетом ведущих патогенетических механизмов, лежащих в основе формирования заболевания, и современных лекарственных средств, позволяющих в короткий срок значительно повлиять на патологический процесс и уменьшить страдания пациента.
Литература
1. Бурьянов А.А. Посттравматическая дистрофия конечностей (синдром Зудека). Вопросы патогенеза, диагностики и лечения: Автореф. дисс. канд. мед. наук.– Харьков, 1990.– 24 с.
2. Витюгов И.А., Котенко В.В. Синдром Зудека как общемедицинская проблема//Ортопед., травматол.– 1977.– N 11. – С.86–89.
3. Котенко В.В., Ланшаков В.А. Посттравматическая дистрофия руки. – М.: Медицина, 1987. – 128 с.
4. Amadio P.C., Mackinnon S., Merrit W.H., Brody G.S., Terzis J.K. Reflex sympathetic dystrophy syndrome: Consensus report of an ad hoc committee of the American Association forand Surgery on the definition of reflex sympathetic dystrophy syndrome //Plast. Reconst. Surg. 1991. – V. 87, № 2. – P. 371–375.
5. Evans J.A.: Reflex sympathetic dystrophy. Surg. Gynecol. Obstet. 82:36, 1946.
6. Field S., Warwick D., Bannister G. Features of algodystrophy after Colles’ fracture //J. Hand Surg.– 1992.– V.17B, N3.– P.318–320.
7. Geertzen J.H.B., Bruijh H., Bruijn–Kofman A.T., Arendzen J.H. Reflex sympathetic dystrophy: early treatment and psychological aspects //Arch.Phys.Med.Rehab.– 1994.– V.75, N4.–P.442– 447.
8. Kline S.C., Holder L.E. Segmental reflex sympathetic dystrophy: clinical and scintigraphic criteria //J.Hand Surg.– 1993.– V.18A, N5.– P.853–859.
9. Kozin F. et al. The reflex sympathetic dystrophy syndrome. I. Clinical and histological studies; Evidence for bilaterality, response to corticosteroids and articular involvement. Am. J. Med. 60;321, 1976.
10. Mitchell S.W., Moorehouse G.R., Keen W.W.: Gunshot Wounds and Other Injuries of Nerves. Philadelphia, J.B. Lippincott, 1864.
11. Pollock F.E., Koman L.A., Smith B.P., Poehling G.G. Patterns of microvascular response associated with reflex sympathetic dystrophy of the hand and wrist// J.Hand Surg.–1993.– V.18A, N5.– P.847–852.
12. Sudeck P.: Ueber die akute enzundiche Knochenatrophie. Arch. klin. Chir. 62:147, 1900.
13. Steinbrocker O.: The shoulder–hand syndrome. Am. J. Med. 3:402, 1947.
.
Комплексный региональный болевой синдром (КРБС)
Ранее назывался каузалгией (рефлекторная симпатическая дистрофия). Термин каузалгия (от греч. kausis – жжение, algos – боль) был предложен Виром Митчелом в 1864 г. Его использовали для описания редкого синдрома, который наблюдался в незначительном кол-ве случаев после частичного повреждения периферических нервов во время Американской гражданской войны. Триада: жгучая боль, автономная дисфункция и трофические нарушения.
В тяжелых случаях (большая каузалгия) синдром наблюдается после повреждений высокоскоростными снарядами. Менее тяжелые формы называются малой каузалгией; они наблюдаются после непроникающей травмы. Другими вариантами названий являются плече-кистевой синдром и атрофия Судека. После появления в 1916 г. понятия автономной нервной системы (введенного Рене Леришем) стали использовать термин рефлекторная симпатическая дистрофия (РСД)(однако РСД может отличаться от каузалгии).
Возникновение КРБС описано после вмешательств на карпальном канале, а также после операций на поясничноми шейном отделах позвоночника.
КРБС является скорее симптомокомплесом, а не конкретным синдромом или заболеванием. Пациенты с проявлениями КРБС представляют собой смешанную группу, в которую входят:
1. истинный КРБС (для этих случаев Мейлис предлагает использовать термин «физиогенная РСД»): комплекс нейропатических феноменов, которые могут наблюдаться в связи с травмой нерва или без нее
2.
заболевания, имеющие сходные с КРБС жалобы и проявления: сосудистые, воспалительные, неврологические и т.д.
3. в результате простой иммобилизации: при поведении больного, старающегося избегать тяжелой боли, или при психических заболеваниях
4.
как часть притворного состояния, обусловленного или психологическими причинами (напр., Munchausen’s синдром) или в надежде на какую-то выгоду (финансовую, лекарственную и т.д.), т.е. симуляция
Патогенез
Ранняя теория объясняла этот синдром наличием передачи между симпатическими и афферентными болевыми волокнами. В настоящее время эта теория упоминается редко. Более позднее объяснение строится на выделении норэпинефрина симпатическими окончаниями с гиперчувствительностью в результате денервации или прорастания. Во многих современных гипотезах участие автономной нервной системы признается не во всех случаях.
Поэтому многие изменения, которые наблюдаются при КРБС, могут быть скорее взаимонакладывающимися, чем элементами этиопатогенеза.
Клинические проявления
КРБС можно описывать как сочетание разных феноменов, т.к. это неоднородная группа больных, которые имеют различные жалобы и симптомы, а также разные причины. Не выработано никаких строгих диагностических критериев, поэтому разные авторы используют различные факторы при включении или исключении пациентов из исследований.
Жалобы
Боль: захватывает всю конечность, обычно жгучая, наиболее выражена в кисти или стопе. В большинстве случаев начинается в течение 24 ч после повреждения (если только травма не вызывает анестезии; в этом случае может пройти несколько ч или д). Однако, до развития КРБС может пройти несколько д или нед. Наиболее часто страдают срединный, локтевой и седалищный нервы. Иногда не просто определить пострадавший нерв. Практически любые чувствительные стимулы приводят к усилению боли (боль, вызванная неболевым раздражителем, называется аллодинией).
Симптомы
Клинический осмотр часто затруднен в связи с болью.
Сосудистые изменения: вазодилатация (теплая и красная кожа) или вазоконстрикция (холодная, с синими пятнами). Трофические нарушения (могут быть частично или полностью связанными с неподвижностью): сухая/шелушащаяся кожа, малоподвижные суставы, истонченные пальцы, грубые неподрезанные ногти, длинные/жесткие волосы или потеря волос, нарушения потоотделения (от ангидроза до гипергидроза).
Диагностика
При отсутствии единого мнения об этиологии и патофизиологии поражения нет и определенных тестов для диагностики. Отсутствие диагностического «золотого стандарта» делает невозможным оценку других процедур. Предлагалось множество тестов, но в конце концов все были отклонены:
1.
термография: дискредитировала себя в клинической практике
2.
трехфазное костное сканирование: типичные для КРБС изменения также наблюдаются и после симпатэктомии, которая традиционно считается методом лечения для КРБС
3.
остеопороз на рентгенограммах, особенно периартикулярная деминерализация: неспецифический признак
4.
реакция на симпатическую блокаду (когда-то считалась обязательным условием для большой и малой каузалгии; облегчение боли после симпатической блокады соответствующего столба (звездчатого для верхних конечностей, поясничного – для нижних): результаты не были подтверждены после проведения контролируемых испытаний с плацебо
5.
различные вегетативные тесты: потоотделение в покое, кожная Т в покое, сравнительный тест судомотор аксонального рефлекса
Лечение
При отсутствии установленной патофизиологии лечение строится только на субъективной оценке улучшения. Исследования КРБС показали необычно высокий уровень эффективность плацебо. Медикаментозное лечение обычно неэффективно. Предлагаемые способы лечения:
1.
трициклические антидепрессанты
2.
в 18-25% случаев удовлетворительное длительное облегчение боли наблюдается после серии симпатических блокад, хотя в одной из серий, состоящей из 30 больных, долговременного эффекта не было ни в одном случае
3.
в/в региональная симпатическая блокада, особенно при КРБС верхней конечности: для этого можно использовать гуанетидин 20 мг, резерпин, бретилиум и т.д., которые вводят в/в и раздувают манжетку для измерения АД на 10 мин. Если облегчения нет, то процедуру можно повторить через 3-4 нед. При некоторых испытаниях результаты этого метода были не лучше, чем использования плацебо
4.
хирургическая симпатэктомия некоторые авторы считают, что она дает облегчение боли у 90% больных (у некоторых остается болезненность или гиперпатия). По другой точке зрения нет оснований прибегать к симпатэктомии, т.к. симпатические блокады не показали себя эффективнее, чем плацебо
5.
стимуляция СМ: есть сообщения об успешном лечении
Гринберг. Нейрохирургия
Опубликовал Константин Моканов
Комплексный регионарный болевой синдром | Компетентно о здоровье на iLive
Под термином «комплексный регионарный болевой синдром» (КРБС) подразумевают синдром, проявляющийся выраженной хронической болью в конечности в сочетании с локальными вегетативными расстройствами и трофическими нарушениями, возникающий, как правило, после различных периферических травм. Симптомы комплексного регионарного болевого синдрома знакомы практически каждому врачу, но в то же время вопросы терминологии, классификации, патогенеза и лечения этого синдрома во многом остаются дискуссионными.
В 1855 г. Н.И. Пирогов описал интенсивные боли жгучего характера в конечностях, сопровождающиеся вегетативными и трофическими нарушениями, возникающие у солдат через некоторое время после ранения. Эти расстройства он назвал «посттравматической гиперестезией». Спустя 10 лет С. Митчелл и соавт. (Mitchell S., Morehouse G., Keen W.) описали аналогичную клиническую картину у солдат, пострадавших в гражданской войне в США. Эти состояния S. Mitchell вначале обозначил как «эритромелалгия», а затем, в 1867 г., предложил термин «каузалгия». В 1900 г. П.Г. Зудек описал подобные проявления в сочетании с остеопорозом и назвал их «дистрофией». В дальнейшем разные авторы описывали схожие клинические состояния, неизменно предлагавшие свои собственные термины («острая костная атрофия», «альгонейродистрофия», «острый трофический невроз», «посттравматический остеопороз», «посттравматическая симпаталгия» и др.). В 1947 г. О. Steinbrocker описал синдром плечо-кисть (боль, отёк, трофические расстройства в руке, возникающие после инфарктов миокарда, инсультов, травм и воспалительных заболеваний). В том же году Эванс (Evans J.) предложил термин «рефлекторная симпатическая дистрофия», который до недавнего времени был общепринятым. В 1994 г. для обозначения локальных болевых синдромов, сочетающихся с вегетативными и трофическими нарушениями, был предложен новый термин — «комплексный регионарный болевой синдром».
Классификация комплексного регионарного болевого синдрома
Выделяют 2 типа комплексного регионарного болевого синдрома. При повреждениях, не сопровождающихся поражением периферических нервов, формируется КРБС I типа. КРБС II типа диагностируют при развитии синдрома после поражения периферического нерва и рассматривают как вариант невропатической боли.
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Комплексный региональный болевой синдром — Мой доктор
Комплексный региональный болевой синдром — это состояние, связанное с развитие хронической боли. Оно возникает после перенесенной травмы и обычно поражает руки и ноги, но, в принципе, может развиться на любом участке тела.
Что такое комплексный региональный болевой синдром?
Комплексный региональный болевой синдром — это состояние, связанное с развитие хронической боли. Оно возникает после перенесенной травмы и обычно поражает руки и ноги, но, в принципе, может развиться на любом участке тела. В редких случаях синдром может проявиться вследствие операции, инфаркта или другого нарушения здоровья. Как правило, боль описывается пациентами как жжение, и обычно оно существенно превосходит по интенсивности то, что считается нормой для такого вида травмы. Иногда врачи называют этот синдром рефлекторной симпатической дистрофией или каузалгией.
Симптомы
К основным симптомам комплексного регионального болевого синдрома относятся:
- Болезненное жгущее ощущение в пораженной области тела. Как правило, речь идет о руке, ноге или ступне. Обычно это ощущение появляется уже после того, как травма должна была бы зажить.
- Пораженный участок кожи может быть болезненным к прикосновениям, отечь или быть чувствительным к высоким или низким температурам.
- Изменение цвета кожи. Обычно она приобретает красный, синий или пурпурный цвет.
- Изменения в текстуре кожи. Так, кожа на пораженном участке может стать тонкой или лоснящейся.
- Скованность и боль в суставах.
- Мышечная боль и слабость.
- Утрата подвижности на пораженном участке.
У некоторых людей симптомы носят легкий характер и в итоге проходят. У других же они могут быть тяжелыми и надолго ограничивать их активность.
Причины и факторы риска
Считается, что комплексный региональный болевой синдром развивается из-за повреждения нервной системы. Испытываемые ощущения обусловливаются именно ее неправильной работой. В большинстве случаев причиной является ранение или травма. К таковым относятся:
- переломы
- разрывы / растяжения
- ожоги, порезы или отеки
- хирургическое вмешательство
- мелкие процедуры, такие как инъекции.
Столкнуться с комплексным региональным болевым синдромом может любо человек любого возраста, но чаще он встречается среди женщин. Статистически больше всего случаев синдрома зафиксировано у людей в возрасте около 40 лет. Также синдром нетипичен для детей и редко встречается у пожилых людей.
Диагностика
Врач задаст вопросы о болевых симптомах, а также проведет осмотр. К сожалению, специального анализа или диагностической процедуры для определения комплексного регионального болевого синдрома не существует. Некоторые могут исключить другие возможные причины симптомов. Так, МРИ показывает изменения в ткани пораженной конечности.
Профилактика
К сожалению, предотвратить развитие комплексного регионального болевого синдрома невозможно. Единственным способом профилактики является избегание травм.
Лечение
Для лечения комплексного регионального болевого синдрома используется довольно большое количество методик:
- Физиотерапия. Поддержание подвижности тела увеличивает циркуляцию крови и стимулирует более быстрое выздоровление.
- Психотерапия. У людей с хронической болью может развиться расстройство психического здоровья. В частности, это могут быть депрессия или тревога. Оба состояния усугубляют боль. Психотерапия же помогает справиться с дискомфортом, а также с сопровождающими синдром нарушениями.
- Медикаментозное лечение. Врач может предложить прием нестероидных противовоспалительных препаратов для облегчения боли и снятия воспаления. К таким препаратам относятся аспирин, ибупрофен и напроксен. Они доступны к продаже без рецепта, но их прием обязательно нужно предварительно обсудить с врачом.
При сильной боли врач может назначить препараты, блокирующие определенные нервы. Стероидные средства помогают снять отек и боль. Некоторые препараты, назначаемые при депрессиях и судорогах, также эффективны и против хронической боли. А вот наркотические средства и обезболивающие препараты могут оказаться бессильными перед синдромом. Иногда требуется прием сразу нескольких препаратов.
- Блокада симпатического нерва. Заключается в инъекции анестетика (обезболивающего средства) в определенный нерв, позволяя блокировать болевые сигналы. Если инъекция облегчила боль, она может быть повторена. Однако следует понимать, что это не лечение, а лишь временное облегчение.
- Симпатэктомия поврежденного нерва. Хирург обрежет или пережмет нервную цепь. По свидетельствам многих пациентов это помогает облегчить боль от комплексного регионального болевого синдрома.
- Нервная стимуляция. Предполагает стимуляцию нервов при помощи электрических или магнитных импульсов. Некоторые разновидности, например, стимуляция спинного мозга, требуют малого хирургического вмешательства.
Важно понимать, что методика, принесшая облегчение одному человеку, вовсе необязательно поможет другому. Поэтому для каждого конкретного пациента необходимо составлять индивидуальный план лечения.
Жизнь с болевым синдромом
При раннем выявлении и лечении зачастую удается избежать усугубления комплексного регионального болевого синдрома. В некоторых случаях состояние пациента улучшается. При условии начала лечения на ранней стадии симптомы могут полностью исчезнуть. В то же время, тяжелые формы синдрома зачастую не реагируют на лечение. Таким людям могут помочь программы управления болью, направленные на контроль и преодоление хронической боли.
Вопросы, которые следует задать врачу
- Какова вероятная причина боли в моем случае?
- Почему я все еще чувствую боль после того, как травма зажила?
- Нужно ли мне сдать какие-то анализы?
- Какой вариант лечения оптимален в моем случае? Потребуется ли мне прием препаратов? А физиотерапия? Быть может, консультация у психолога?
- Когда я почувствую облегчение?
- Насколько эффективны альтернативные методики, такие как йога или акупунктура?
 Loading…
Loading…
Комплексный регионарный болевой синдром — Altermed Wiki
- Источник статьи: Неврология — национальное руководство 2018[1]
Под термином «комплексный регионарный болевой синдром» (КРБС) подразумевают синдром, проявляющийся выраженной хронической болью в конечности в сочетании с локальными вегетативными расстройствами и трофическими нарушениями, возникающий, как правило, после различных периферических травм. Клиническая картина КРБС знакома практически каждому врачу, но в то же время вопросы терминологии, классификации, патогенеза и лечения этого синдрома во многом остаются дискуссионными.
В 1855 г. Н. И. Пирогов описал интенсивные боли жгучего характера в конечностях, сопровождающиеся вегетативными и трофическими нарушениями, возникающие у солдат через некоторое время после ранения. Эти расстройства он назвал «посттравматической гиперестезией». Спустя 10 лет С. Митчелл и соавторами[2] описали аналогичную клиническую картину у солдат, пострадавших в гражданской войне в США. Эти состояния S. Mitchell вначале обозначил как «эритромелалгия», а затем, в 1867 г., предложил термин «каузалгия». В 1900 г. П. Г. Зудек описал подобные проявления в сочетании с остеопорозом и назвал их «дистрофией». В дальнейшем разные авторы описывали схожие клинические состояния, неизменно предлагавшие свои собственные термины («острая костная атрофия», «альгонейродистрофия», «острый трофический невроз», «посттравматический остеопороз», «посттравматическая симпаталгия» и др.). В 1947 г. О. Steinbrocker описал синдром плечо-кисть (боль, отёк, трофические расстройства в руке, возникающие после инфарктов миокарда, инсультов, травм и воспалительных заболеваний). В том же году Эванс (Evans J.) предложил термин «рефлекторная симпатическая дистрофия», который до недавнего времени был общепринятым. В 1994 г. для обозначения локальных болевых синдромов, сочетающихся с вегетативными и трофическими нарушениями, был предложен новый термин — «комплексный регионарный болевой синдром».
Выделяют два типа КРБС. При повреждениях, не сопровождающихся поражением периферических нервов, формируется КРБС I типа. КРБС II типа диагностируют при развитии синдрома после поражения периферического нерва и рассматривают как вариант невропатической боли.
Причинами КРБС I типа могут быть травмы мягких тканей конечности, переломы, вывихи, растяжения, фасцииты, бурситы, лигаментиты, тромбозы вен и артерий, васкулиты, герпетическая инфекция. КРБС II типа развивается при поражении нервов вследствие сдавления, при туннельных синдромах, радикулопатиях, плексопатиях и др.
Патогенез КРБС недостаточно изучен. В происхождении КРБС II типа обсуждают возможную роль аберрантной регенерации между афферентными (сенсорными) и эфферентными (вегетативными) волокнами. Постулируют, что длительная боль может фиксироваться в памяти, обусловливая более высокую чувствительность к повторным болевым стимулам. Существует точка зрения, что участки повреждения нерва становятся эктопическими пейсмекерами с резко увеличенным количеством α-адренорецепторов, которые возбуждаются спонтанно и при действии циркулирующего или освобождающегося из симпатических окончаний норадреналина. Согласно другой концепции, при КРБС особое значение имеет активация спинальных нейронов широкого диапазона, участвующих в передаче ноцицептивной информации. Полагают, что после травмы происходит интенсивное возбуждение этих нейронов, приводящее к их сенситизации. В дальнейшем даже слабые афферентные стимулы, действуя на эти нейроны, вызывают мощный ноцицептивный поток.
Вследствие расстройств микроциркуляции, приводящих к развитию гипоксии, ацидозу и накоплению в крови кислых продуктов метаболизма, происходит усиленный распад фосфорно-кальциевых соединений кости с развитием остеопороза. «Пятнистый» остеопороз, наблюдаемый обычно на первых этапах заболевания, связан с доминированием процессов лакунарного рассасывания костной ткани. Важным фактором в развитии остеопороза является иммобилизация. В одних случаях она обусловлена выраженной болью, в других — связана с основным заболеванием (например, парезом или плегией после инсульта) или лечебными манипуляциями (иммобилизация после переломов). Во всех случаях снижение физической нагрузки, длительная обездвиженность приводят к деминерализации костей и развитию остеопороза.
На сегодняшний день получены убедительные доказательства, свидетельствующие против психогенной модели развития КРБС. На основании ограниченных данных исследований в этой области можно предположить, что психологические факторы играют роль в развитии КРБС, однако точное взаимоотношение неизвестно. Несколько исследований показали, что хроническая боль является прогностическим показателем большей тяжести депрессии, тревожности и страха. Однако доказательств того, что психологические факторы вызывают боль, дисфункцию вегетативной нервной системы и нарушения движений у больных с КРБС, не получено.
Среди больных преобладают женщины (4:1). Заболевание может возникать практически в любом возрасте (от 4 до 80 лет). КРБС на нижних конечностях отмечают в 58%, на верхних — в 42% случаев. Вовлечение нескольких зон наблюдают у 69% больных. Описаны случаи КРБС на лице.
Клинические проявления КРБС всех типов идентичны и складываются из 3 групп симптомов: болей, вегетативных вазо- и судомоторных[3] нарушений, дистрофических изменений кожи, подкожной клетчатки, мышц, связок, костей.
Для КРБС типичны спонтанные интенсивные жгучие, колющие, пульсирующие боли. Весьма характерен феномен аллодинии. Как правило, зона боли выходит за рамки иннервации какого-либо нерва. Часто интенсивность боли намного превышает тяжесть повреждения. Усиление боли отмечают при эмоциональном стрессе, движении.
Вегетативные нарушения при КРБС включают вазо- и судомоторные расстройства. К первым относят отёк, выраженность которого может варьировать, а также нарушения периферического кровообращения (вазоконстрикторные и вазодилатационные реакции) и кожной температуры, изменения цвета кожи. Судомоторные расстройства проявляются симптомами локального повышенного (гипергидроз) или сниженного потоотделения (гипогидроз).
Дистрофические изменения при КРБС могут охватывать практически все ткани конечности. Отмечают снижение эластичности кожи, гиперкератоз, изменения волосяного покрова (локальный гипертрихоз) и роста ногтей, атрофию подкожной клетчатки и мышц, мышечные контрактуры, тугоподвижность суставов. Характерны для КРБС деминерализация костей и развитие остеопороза.
КРБС I типа характеризуется постоянной болью в определённой части конечности после травмы, не воздействующей на крупные нервные стволы. Боль обычно наблюдают в дистальном отделе конечности, прилежащем к травмированной области, а также в колене и бедре, в I—II пальцах кисти или стопы.
Жгучие постоянные боли, как правило, возникают через несколько недель после первоначальной травмы, усиливаются при движениях, кожной стимуляции и стрессе.
| Стадия | Клиническая характеристика |
|---|---|
| 1 (0-3 мес) | Жгучая боль и дистальный отёк конечности. Конечность тёплая, отёчная и болезненная, особенно в области суставов. Усиливаются локальная потливость и рост волос. Легкое прикосновение может вызвать боль (аллодиния), которая сохраняется и после прекращения воздействия. Суставы становятся тугоподвижными, боль присутствует как при активных, так и пассивных движениях в суставе. |
| II (через 3-6 мес) | Кожа становится тонкой, блестящей и холодной. Все остальные симптомы 1 стадии сохраняются и усиливаются. |
| III (6-12 мес) | Кожа становится атрофичной и сухой. Контрактуры мышц с деформацией кистей и стоп. |
КРБС II типа сопровождается жгучей болью, аллодинией и гиперпатией в соответствующей руке или стопе. Обычно боли возникают сразу после ранения нерва, но могут проявиться и спустя несколько месяцев после травмы. Вначале спонтанные боли локализуются в зоне иннервации повреждённого нерва, а затем могут охватывать и более обширные зоны.
| Признак | Описание |
|---|---|
| Характеристики болей | Постоянная жгучая, усиливается при лёгком дотрагивании, стрессах и эмоциях, изменении наружной температуры или движениях в поражённой конечности, визуальных и слуховых стимулах (яркий свет, внезапный громкий звук). Аллодиния/гипералгезия не ограничиваются зоной иннервации повреждённого нерва. |
| Другие проявления | Изменения температуры и цвета кожи. Наличие отёка. Нарушение моторных функций. |
С помощью термографии можно выявить изменения кожной температуры на поражённой конечности, отражающие периферические вазо- и судомоторные нарушения. Рентгенологическое исследование костей обязательно для всех больных с КРБС. На ранних этапах болезни обнаруживают «пятнистый» околосуставной остеопороз, по мере прогрессирования заболевания он становится диффузным.
Общими целями терапии для пациентов с КРБС является уменьшение боли, восстановление утерянных функций и возвращение к работе и повседневной активности. Хотя частичный лекарственный подход и может быть успешным, эти цели гораздо более достижимы путем совместного применения специально подобранных фармакологических препаратов, психологических и поведенческих техник, психической реабилитации пациента в комплексе с минимальными инвазивными вмешательствами. Все это должно проводиться в рамках всестороннего скоординированного междисциплинарного подхода, направленного на восстановление функций. Основным направлением в лечении КРБС является восстановление функций пораженной конечности. Важное значение также имеет и лечение фонового заболевания или нарушения, вызвавшего КРБС.
Для устранения боли используют повторные регионарные блокады симпатических ганглиев местными анестетиками. При устранении боли нормализуются и вегетативные функции. Используют и различные местные анестетики (например, мази, кремы и пластины с лидокаином). Хорошим эффектом обладают аппликации диметилсульфоксида, оказывающего обезболивающий эффект. Более выраженный анальгетический эффект достигается при аппликации диметилсульфоксида с новокаином. Традиционно для уменьшения боли используют иглорефлексотерапию, чрескожную электронейростимуляцию, ультразвуковую терапию и другие виды физиотерапии. Эффективна гипербарическая оксигенация. Хорошие результаты получают при назначении преднизолона (100-120 мг в сутки) на протяжении 2 недель. Для уменьшения симпатической гиперактивности применяют β-адреноблокаторы (анаприлин в дозе 80 мг в сутки). Также применяют блокаторы кальциевых каналов (нифедипин в дозе 30-90 мг в сутки), препараты, улучшающие венозный отток (троксевазин, трибенозид). С учётом патогенетической роли центральных механизмов боли рекомендуют назначение психотропных препаратов (антидепрессантов, антиконвульсантов — габапентина, прегабалина) и психотерапии.
Для лечения и профилактики остеопороза применяют бифосфонаты. Бисфосфонаты (например, памидронат, алендроновая кислота) ‒ класс препаратов, предотвращающих потерю костной массы, продемонстрировали эффективность в терапии КРБС по результатам ряда небольших открытых и плацебо-контролируемых исследований. Хотя основной механизм действия этих препаратов направлен на предотвращение развития остеопороза, имеющего место при КРБС, другие периферические центральные механизмы выглядят многообещающими и нуждаются в детальном изучении.
Оптимальное лечение КРБС включает в себя комплексный междисциплинарный подход, направленный на функциональное восстановление. Фармакотерапия, перечисленная в данном обзоре, не показала значительной эффективности во влиянии на течение КРБС и в первую очередь использовалась для поддержки пациентов в их программе реабилитации. Большая часть фармакотерапии при КРБС остается эмпирической, с небольшим количеством хорошо продуманных проспективных, контролируемых клинических исследований. Единственные препараты, прошедшие многочисленные контролируемые клинические испытания, ‒ это бисфосфонаты. Исследования же остальных препаратов демонстрировали их эффективность не в рамках КРБС, а обычно при постгерпетической невралгии и диабетической полинейропатии. И, несмотря на это, во многом пересекающиеся механизмы нейропатической боли и КРБС оправдывают назначение трициклических антидепрессантов, селективных ингибиторов обратного захвата серотонина и адреналина, опиатов и антиконвульсантов. Поскольку КРБС остается заболеванием, которое негативно влияет на жизнь пациента, необходимы новые широкомасштабные исследования с применением перечисленных выше препаратов и других средств. В частности, новые дизайны клинических исследований различных сочетаний препаратов в комплексе с активной физиотерапией могут обеспечить клиницистов лучшей информацией для принятия их решений.
- ↑ Данилов А.В. Болевые синдромы // Неврология — национальное руководство. М.: ГЭОТАР-Медиа, 2018.
- ↑ Mitchell, S., Morehouse, G., Keen, W.: Gunshot Wounds and Other Injuries. Philadelphia: J.B. Lippincott Co., 1864.
- ↑ Судомоторная функция — показатель активности симпатической нервной системы.
Болевые синдромы
В неврологии
Головная боль •
Боли при заболеваниях нервной системы :
Центральная постинсультная боль •
Боли при рассеянном склерозе •
Боли при сирингомиелии •
Боли при травмах спинного мозга •
Боли при полиневропатиях (боли при диабетической полиневропатии,
алкогольная полиневропатия,
боли при синдроме Гийена-Барре,
боли при ВИЧ-инфекции и СПИДе) •
Боль в спине •
Комплексный регионарный болевой синдром •
Постгерпетическая невралгия •
Лицевые боли
В офтальмологии
Глазная боль
Особенности лечения комплексных регионарных болевых синдромов в ревматологии | Шостак Н.А.
Проблема боли на сегодняшний день остается одним из фундаментальных вопросов медицины. Универсальными патологическими механизмами, лежащими в основе ревматических болезней, являются боль и воспаление.
Боль – это неприятное чувствительное или эмоциональное ощущение, возникающее в момент или при угрозе повреждения тканей, либо описываемое в терминах такого повреждения.
В современной медицине рефлекторная симпатическая дистрофия (РСД) (альгонейродистрофия, синдром Зудека) как компонент этой проблемы приобретает особое значение. РСД – это болевой синдром, характеризующийся гиперфункцией регионарной симпатической нервной системы с поражением отдельных сегментов опорно–двигательного аппарата с развитием нарушения функции, остеопороза, отека и дистрофии мягких тканей, подкожной клетчатки и кожи.
Международная ассоциация изучения боли предложила заменить термины РСД и каузалгии на «комплексный региональный болевой синдромом I и II типов» (КРБС) соответственно. Новая классификация этого нарушения и новое название были предложены с тем, чтобы более точно описать его клинические особенности: к I типу относят случаи, индуцированные преимущественно повреждением кости или мягких тканей и не связанные с поражением периферического нерва, ко II типу – развитие синдрома на фоне объективно определяемого органического поражения нерва.
КРБС может развиваться вследствие разнообразных этиологических факторов: травм центральной и периферической нервной системы, артритов, туннельных невропатий, дегенеративных и аутоиммунных заболеваний нервной системы. Существенную роль в возникновении дистрофического процесса играют дополнительные этиологические компоненты, к которым относят дефекты лечения переломов костей конечностей на этапах проведения репозиции и иммобилизации (недостаточная анестезия, неправильная репозиция, тугая гипсовая повязка, продолжительная иммобилизация).
Впервые в 1864 г. американские хирурги S. Mitchell, G. Morchouse и W. Keen в книге «Огнестрельные раны и другие повреждения нервов» классически и ярко изложили описание ранее неизвестного симптомокомплекса (жгучая боль в сочетании с гиперестезией, температурные и трофические изменения в пораженной конечности), который следовал за огнестрельным повреждением конечностей у солдат во время гражданской войны в США. А в 1900 г. P. Sudeck на XXIX конгрессе Немецкого общества хирургов в Берлине доложил о вторичных изменениях в дистальных отделах верхней конечности в виде неоднородного прогрессирующего пятнистого остеопороза, обнаруженного им рентгенологически. P. Sudeck описал стадии заболевания, дав ему название «острая костная атрофия»: «Речь идет об остром воспалении суставов кисти с рано появляющейся тугоподвижностью и болезненностью суставов пальцев и очень часто – через несколько недель – с сильно выраженной атрофией всей конечности». J. Evans (1946 г.) впервые обнаружил сходство в клинической картине синдрома Зудека и каузалгии, выделил вазомоторные, вегетативные, трофические изменения, впервые употребил термин «рефлекторная симпатическая дистрофия» (reflex sympathetic dystrophy). В 1947 г. O. Steinbrocker описал особую форму заболевания – рефлекторную дистрофию верхней конечности, протекающую с одновременным поражением кисти и плечевого сустава. Эту форму заболевания он назвал «синдром плечо–кисть» (shoulder–hand syndrome). Лишь в 1991 г. P. Amadio, S. Mackinnon, W. Merrit, G. Brody и J. Terzis предложили диагностические критерии, необходимые для правомочности установления клинического диагноза РСД:
• диффузная боль в дистальном или дистальном и проксимальном отделах конечности, не соответствующая по интенсивности начальному повреждению или другому вызывающему ее фактору;
• боль носит жгучий характер и нарушает двигательные функции;
• объективные признаки вегетативной дисфункции конечности.
Клинические проявления КРБС, лежащие в основе диагностических критериев, заключаются в развитии в пределах одной конечности (чаще в дистальных ее отделах) болевого синдрома: это ощущения жжения, ноющие или ломящие боли в сочетании с чувствительными нарушениями (гипо– или анестезией, гиперпатией, аллодинией, т.е. восприятием стимуляции любой модальности как болевой), вегетативно–трофическими расстройствами (отеком, изменением окраски кожных покровов, локальным изменением кожной температуры, нарушением потоотделения, изменением скорости роста ногтей и волос, локальным остеопорозом) и расстройствами движений в форме различной степени выраженности пареза.
Болевой синдром при КРБС по своей природе является нейропатической болью, которая представлена двумя основными компонентами: спонтанной (стимулонезависимой) болью и вызванной (стимулозависимой) гипералгезией.
Боль является абсолютным признаком для диагностики КРБС. Она возникает вследствие повреждающего воздействия, обычно вовлекающего ткани конечности, но по своему характеру, выраженности и распространенности превосходит инициирующее травматическое воздействие. Болевой сидром может иметь две основные характеристики: жгучая боль – ощущается в виде жжения, чаще поверхностная, от средней до высокой степени интенсивности, четко описывается пациентом; ноющая боль – ноющего, ломящего, тянущего характера, чаще ощущается, как глубинная, имеет средний или ниже среднего уровень интенсивности, пациенты не могут дать ее четкого описания. Эти два типа боли различаются по своей длительности: жгучие боли в трети случаев сохраняются более 6 месяцев, иногда трансформируются в ноющие; первично ноющие боли после 6 месяцев от начала заболевания не отмечены. Более чем 3/4 пациентов имеют спонтанные постоянные боли. Боль нередко следует сразу за травмой, которая обычно не связана со значительным повреждением нерва. Она может наблюдаться вслед за переломом костей, мягким тканевым повреждением или иммобилизацией, обусловленной висцеральной патологией. Боль возникает обычно в течение первого месяца после воздействия провоцирующего фактора.
Развитие симпатически обусловленной боли связано с двумя механизмами. Во–первых, после повреждения периферического нерва на мембранах поврежденных и неповрежденных аксонов С–волокон начинают появляться a–адренорецепторы (в норме на этих волокнах отсутствуют), чувствительные к циркулирующим катехоламинам, выделяющимся из окончаний постганглионарных симпатических волокон. Во–вторых, повреждение нерва также вызывает прорастание симпатических волокон в узел заднего корешка, где они оплетают в виде корзинок тела чувствительных нейронов, и таким образом активация симпатических окончаний провоцирует активацию чувствительных волокон. Однако не вся спонтанная боль развивается только вследствие активации первичных ноцицепторов. В основе развития спонтанной боли также участвуют механизмы, связанные с нарушением процессов торможения на уровне заднего рога. Нейроны заднего рога спинного мозга получают информацию от первичных афферентов. Активность нейронов задних рогов определяется не только возбуждающей периферической стимуляцией, но и тормозными влияниями, которые могут быть спинальными или нисходящими центральными. Поражение периферического нерва может снижать ингибирующий контроль нейронов задних рогов различными путями. Повреждение нерва ведет к снижению концентрации g–аминомаслянной кислоты (ГАМК), которая оказывает тормозное влияние, что вызывает нарушение регуляции ГАМК–ергических и опиатных рецепторов, расположенных на пресинаптических мембранах первичных сенсорных нейронов и на постсинаптических мембранах нейронов заднего рога. В результате этих процессов вторичные чувствительные афференты лишаются тормозных механизмов и начинают генерировать патологическую импульсацию, передающуюся в ЦНС даже при отсутствии активности в первичных чувствительных афферентах.
Вторым компонентом нейропатической боли является гипералгезия. По локализации выделяют первичную и вторичную гипералгезию. Первичная гипералгезия локализуется в зоне иннервации поврежденного нерва или в зоне тканевого повреждения, вторичная гипералгезия имеет более широкое распространение, далеко выходя за зону тканевого повреждения или зону иннервации поврежденного нерва.
Первичная гипералгезия связана с местом повреждения тканей и возникает в основном в ответ на раздражение сенсибилизированных в результате повреждения периферических ноцицепторов. Ноцицепторы становятся чувствительными за счет биологически активных веществ, высвобождающихся или синтезирующихся в месте повреждения. Этими веществами являются: серотонин, гистамин, нейроактивные пептиды, кинины, брадикинин, а также продукты метаболизма арахидоновой кислоты (простагландины и лейкотриены) и цитокины. В процесс вовлекается также категория ноцицепторов, которые в норме неактивны, но активируются вслед за тканевым повреждением. Вследствие такой активации увеличивается афферентная стимуляция нейронов заднего рога спинного мозга, что и является основой развития вторичной гипералгезии.
Выделяют также два основных комплекса вегетативно–трофических нарушений: первый, когда имеется окраска багровая или красная кожи, отек, гипертермия, гипергидроз, ускорен рост ногтей, может быть ускорен рост волос, контрактура наблюдается в среднем в 60% случаев; второй — окраска кожи белая или синюшная, гипотермия, гипо– или ангидроз, гипотрофия мягких тканей, дисхромия кожных покровов, замедлен рост ногтей и волос, контрактура характерна для всех больных (рис. 1,2). Первый комплекс встречается при длительности заболевания до 6 мес в среднем в 70% наблюдений, второй может развиться как в ранние, так и в поздние сроки.
Таким образом, как правило, травма является стартовым фактором, запускающим в действие дальнейший механизм развития РСД. При РСД происходит нарушение функции вегетативных центров, желез внутренней секреции и активности местных тканевых гормонов. Это ведет к стойким расстройствам местного кровообращения, которые на ранней стадии заболевания состоят в нейрогенной вазоконстрикции сосудов, а также в дилатации прекапиллярных сфинктеров. На следующей стадии, характеризующейся функциональным истощением симпатической нервной системы, происходит нейрогенное падение тонуса микрососудов (в особенности венул). Развивающаяся сосудистая дистония ведет к нарушению проницаемости стенок капилляров. В пораженном сегменте развиваются микроциркуляторные нарушения, тканевая гипоксия и ацидоз. Изменяется ионное равновесие в экстрацеллюлярной жидкости, что, в свою очередь, приводит к функциональным нарушениям остеоцитарных агрегаций, усиленному распаду фосфорно–кальциевых соединений. Все это обусловливает развитие лакунарного рассасывания кости, что проявляется рентгенологически в виде пятнистого остеопороза, и раздражение чувствительных нервных окончаний с возникновением болевого синдрома.
В зависимости от распространенности РСД выделяют три основных клинических варианта течения: дистальный (синдром Зудека) (табл. 1, рис. 3), распространенный (синдром плечо–кисть Штейнброккера) и проксимальный (шейно–плечевой).
Клинические проявления РСД весьма демонстративны и характеризуются определенной фазностью, которую можно представить, как начало болезни (болевой синдром и вазомоторные нарушения), ее «пик» (дистрофическая стадия или стадия трофических нарушений) и исход (стадия устойчивой декомпенсации).
Единственным постоянным признаком начального периода (длится до 2–3 месяцев от момента травмы) дистрофии является болевой синдром различной степени выраженности. Вазомоторные нарушения сопровождаются массивным отеком тыльной стороны кисти и часто нижней трети предплечья, гиперемией, повышением температуры кожи. Во второй стадии (3–6 месяцев от начала заболевания) наступает постепенное уменьшение боли, характерны комбинированные контрактуры с выраженным артритогенным компонентом, кожа истончается, бледнеет и атрофируется, возникает ее глянцевитость, часто гипертрихоз и гиперкератоз. При проксимальных формах РСД происходит вовлечение в процесс мышечно–сухожильных структур с образованием очагов миоостеофиброза. На третьей стадии (от полугода до нескольких лет) наступает атрофия всех тканей с контрактурами в суставах смешанного генеза. В тяжелых случаях и при отсутствии соответствующего лечения это приводит к фиброзному анкилозу.
Диагностика РСД основывается на характерных клинических проявлениях, типичной стадийности течения заболевания и отчетливой тенденции к спонтанному выздоровлению. Большое значение придается применению довольно чувствительных и специфичных методов диагностики: рентгенологическому исследованию, радиоизотопному сканированию и магнитно–резонансной томографии. Последний метод полезен для демонстрации патологических изменений в мягких тканях у пациентов с РСД, а получаемое отображение может помочь в определении стадии процесса.
Для рентгенологической картины РСД весьма характерен пятнистый остеопороз, выявляемый обычно на 3–4–й неделе от начала заболевания у 80% больных. При этом в дистальных отделах предплечья (голени) и фаланг пальцев на фоне неизмененной костной структуры появляются множественные просветления без четких границ. При длительно протекающем процессе очаговый остеопороз сменяется диффузным.
Существенную сложность для диагностики и лечения представляет комбинация РСД с посттравматическими туннельными синдромами (компрессионно–ишемическими невропатиями). При таком сочетании характерны выраженные вегетативные расстройства и строго локальные (в зоне автономной иннервации) двигательные нарушения. В данном случае несомненную ценность представляет ряд тестов: пальцевая компрессия нерва, симптом Тиннеля, манжеточный тест и др.
Для развития компрессионно–ишемических невропатий большое значение имеют изменения нервов, а именно рубцовое спаяние с окружающими тканями, при котором они становятся менее подвижными и травмируются при движениях, рубцы также сами сдавливают нервы. Способствует также и ишемия нервных стволов, т.е. при наличии атеросклероза сосудов конечностей, диабетической ангиопатии эти синдромы развиваются чаще. Непосредственные причины возникновения таких болевых синдромов многообразны: травмы, приводящие к сдавлению содержимого каналов отломками костей или гематомами, воспалительные заболевания (такие как артриты, синовиты).
Таким образом, в этиологии компрессионно–ишемических невропатий приходится предполагать острые, подострые и хронические воздействия, как бы «проявляющие» наследственную или приобретенную узость туннелей.
1. Генетически детерминированное сужение костных каналов.
2. Приобретенное сужение естественных вместилищ нерва может быть вызвано многочисленными причинами, действующими длительно или короткое время, приводящими к стабильному и значительному уменьшению просвета туннеля и его объема или же к непродолжительному и незначительному.
К причинам нарушений нормальных объемных соотношений между содержимым и стенками канала относят общие и местные заболевания, способствующие увеличению объема периневральных тканей, травмы и их последствия, а также аномалии в строении костей, суставов, мышц и сухожилий и, наконец, профессиональные, спортивные или бытовые перенапряжения мышечно–связочного аппарата.
Большинство авторов, учитывая преобладание среди больных с туннельными синдромами женщин пожилого возраста, находящихся в климактерическом периоде, или молодых женщин с недостаточностью яичников, а также беременных женщин, придает существенное значение в этиологии компрессионных невропатий эндокринным сдвигам (табл. 2).
Клинические проявления компрессионно–ишемических невропатий складываются из сенсорных, моторных, вегетативных и трофических нарушений. В диагностике туннельных синдромов принципиальное значение имеют анализ характера и локализации, распространения боли, распределение чувствительных и двигательных нарушений, что будет отличать данные синдромы от РСД.
Лечение РСД требует значительных усилий и терпения как от лечащего врача, так и от пациента. Оно строится из двух составляющих: рекомендаций для больных и медицинских мероприятий. Первые включают практические советы, позволяющие облегчить физические страдания пациентов, снять психологическое напряжение, и содержат также комплекс рекомендуемых гимнастических упражнений. Медицинские мероприятия предусматривают применение в комплексе инфильтрационной терапии введения медикаментозных средств, физиотерапии и психотерапии.
Учитывая участие комплекса разнообразных патогенетических факторов, своеобразие клинической картины заболевания, выражающейся в упорном болевом синдроме и ярких вегетативных проявлениях, лабильность психического состояния больных, определяющей необходимость широкого применения психофармакологической коррекции, наличие практически у всех пациентов сопутствующей соматической патологии, суживающей выбор физиотерапевтических методов воздействия, лечение РСД должно быть обязательно комплексным, выбор методик лечения основывается на стадии процесса, при этом главное значение имеет выраженность болевого синдрома.
На первой стадии болевой синдром удается предотвратить только с использованием комбинированных методик лечения:
– щадящий режим для больной конечности;
– медикаментозное лечение, блокады и инфильтрационная терапия;
– физиотерапевтическое лечение;
– криотерапия;
– психофармакотерапия.
На втором этапе наиболее эффективны медикаментозная терапия, рефлексотерапия, кинезо– и гидрокинезотерапия. На конечной стадии терапия должна быть направлена на лечение остаточной ригидности, уплотнения ладонного апоневроза, грубой диффузной гипотрофии кожи, подкожной жировой клетчатки и мышц и хотя бы частичное восстановление функции кисти. В комплекс лечебного воздействия включается инфильтрационная терапия с применением протеолитических ферментных препаратов, ультразвуковая терапия, грязевые аппликации, радоновые ванны. Обосновано применение оперативных вмешательств.
При лечении РСД используются различные аналгетические средства и местные блокады, а также в комплексную терапию часто включают антиконвульсанты, антидепрессанты, блокаторы медленных кальциевых каналов. Сложность лечения состоит в необходимости воздействия как на основной, так и на собственно дистрофический процесс. В случае тяжелого болевого синдрома, помимо анальгетиков и транквилизаторов, назначают витамины группы В.
Анальгетическая и противовоспалительная терапия РСД включает назначение нестероидных противовоспалительных препаратов (НПВП) и глюкокортикоидов. Ряд авторов указывают на положительный результат применения преднизолона в суточной дозе 60 мг и более сроком на 2–4 недели с последующим уменьшением дозы (общий срок лечения 2–4 месяца). Считается, что чем раньше начато лечение, тем выраженнее его результат.
Среди множества медицинских методов лечения главная роль отводится НПВП, эффективность которых доказана в международных, многоцентровых контролируемых исследованиях. Однако не все НПВП можно рекомендовать для длительного назначения, особенно у лиц среднего и пожилого возраста, поскольку одним из частых осложнений является эрозивно–язвенное поражение желудочно–кишечного тракта.
При наличии язвенной болезни в анамнезе и выраженного болевого синдрома показано назначение трамадола в качестве анальгезирующего средства.
В настоящее время появился новый комплексный препарат Залдиар, содержащий трамадол (в виде гидрохлорида) 37,5 мг и 325 мг парацетамола.
Трамадол является синтетическим анальгетиком центрального действия, структурно родственным с кодеином, однако в отличие от последнего, анальгетическое действие которого проявляется лишь при условии метаболизма до морфина, трамадол не является пропрепаратом опиатного ряда. По общему обезболивающему эффекту он не уступает или превосходит стандартные НПВП, но является более безопасным в отношении развития осложнений со стороны желудочно–кишечного тракта. В международных исследованиях также показано, что у пожилых пациентов в возрасте до 75 лет фармакокинетика трамадола не меняется по сравнению с молодым возрастом. У больных старше 75 лет концентрация препарата повышается на 17%, так что для пожилых пациентов рекомендуется не превышать суточную дозу в 300 мг.
В экспериментальных исследованиях было высказано предположение, что добавление трамадола к растворам местных анестетиков удлиняет длительность регионарных блокад, поскольку трамадол обладает местным обезболивающим действием. В двойном слепом контролируемом исследовании M. Beayazova, E. Оsturk показали, что периневральное введение раствора трамадола вызывает электронейрографическое подтвержденное снижение амплитуды сенсорного ответа малоберцового нерва, причем интенсивность блокады прогрессивно возрастала при увеличении концентрации раствора с 0,5 до 1%.
Парацетамол – один из наиболее безопасных анальгетиков и антипиретиков, который используется в медицине с 1893 г. Обезболивающий эффект парацетамола реализуется за счет воздействия на центры боли посредством блокирования циклооксигеназы, в том числе и в центральной нервной системе. Кроме того, парацетамол оказывает также жаропонижающее и противовоспалительное действие. Благодаря парацетамолу наступает быстрое обезболивание, в то время как трамадол обеспечивает пролонгированный эффект. Обезболивающий эффект при приеме Залдиара наступает менее чем через 20 мин. и сохраняется более 5 ч. Парацетамол и трамадол в используемой комбинации доз (1:8,67) обладают синергизмом в отношении обезболивающего действия.
В обязательное лечение РСД включается длительная блокада регионарных симпатических ганглиев с помощью введения новокаина, лидокаина. Лечение быстропрогрессирующего остеопороза должно сочетать назначение кальция и витамина Д3 с бисфосфонатами или препаратами кальцитонина.
Положительное влияние в острой стадии РСД оказывает местное охлаждение. Для этого используют проточную воду, прокладки со льдом, криотерапию в виде ванн с постепенным снижением температуры воды.
На функцию конечности при альгонейродистрофии позитивно влияет рано начатая двигательная терапия. Наряду с упражнениями на релаксацию мышц больные выполняют упражнения, стимулирующие кровообращение, улучшающие отток крови, мобилизующие суставы, укрепляющие мышцы. Двигательная терапия показана на всех стадиях заболевания, однако в остром периоде воздействие осуществляется лишь на контрлатеральную конечность. При переходе во вторую стадию рекомендуется осторожная пассивная гимнастика для суставов пальцев, вышивание и плетение, что способствует восстановлению координации, с отработкой бытовых движений рукой.
Таким образом, наиболее перспективным является комплексный метод терапии болевых синдромов с учетом ведущих патогенетических механизмов, лежащих в основе формирования заболевания, и современных лекарственных средств, позволяющих в короткий срок значительно повлиять на патологический процесс и уменьшить страдания пациента.
Литература
1. Бурьянов А.А. Посттравматическая дистрофия конечностей (синдром Зудека). Вопросы патогенеза, диагностики и лечения: Автореф. дисс. канд. мед. наук.– Харьков, 1990.– 24 с.
2. Витюгов И.А., Котенко В.В. Синдром Зудека как общемедицинская проблема//Ортопед., травматол.– 1977.– N 11. – С.86–89.
3. Котенко В.В., Ланшаков В.А. Посттравматическая дистрофия руки. – М.: Медицина, 1987. – 128 с.
4. Amadio P.C., Mackinnon S., Merrit W.H., Brody G.S., Terzis J.K. Reflex sympathetic dystrophy syndrome: Consensus report of an ad hoc committee of the American Association forand Surgery on the definition of reflex sympathetic dystrophy syndrome //Plast. Reconst. Surg. 1991. – V. 87, № 2. – P. 371–375.
5. Evans J.A.: Reflex sympathetic dystrophy. Surg. Gynecol. Obstet. 82:36, 1946.
6. Field S., Warwick D., Bannister G. Features of algodystrophy after Colles’ fracture //J. Hand Surg.– 1992.– V.17B, N3.– P.318–320.
7. Geertzen J.H.B., Bruijh H., Bruijn–Kofman A.T., Arendzen J.H. Reflex sympathetic dystrophy: early treatment and psychological aspects //Arch.Phys.Med.Rehab.– 1994.– V.75, N4.–P.442– 447.
8. Kline S.C., Holder L.E. Segmental reflex sympathetic dystrophy: clinical and scintigraphic criteria //J.Hand Surg.– 1993.– V.18A, N5.– P.853–859.
9. Kozin F. et al. The reflex sympathetic dystrophy syndrome. I. Clinical and histological studies; Evidence for bilaterality, response to corticosteroids and articular involvement. Am. J. Med. 60;321, 1976.
10. Mitchell S.W., Moorehouse G.R., Keen W.W.: Gunshot Wounds and Other Injuries of Nerves. Philadelphia, J.B. Lippincott, 1864.
11. Pollock F.E., Koman L.A., Smith B.P., Poehling G.G. Patterns of microvascular response associated with reflex sympathetic dystrophy of the hand and wrist// J.Hand Surg.–1993.– V.18A, N5.– P.847–852.
12. Sudeck P.: Ueber die akute enzundiche Knochenatrophie. Arch. klin. Chir. 62:147, 1900.
13. Steinbrocker O.: The shoulder–hand syndrome. Am. J. Med. 3:402, 1947.
.
Комплексный регионарный болевой синдром — Симптомы и причины
Обзор
Комплексный регионарный болевой синдром (КРБС) — это форма хронической боли, которая обычно поражает руку или ногу. CRPS обычно развивается после травмы, операции, инсульта или сердечного приступа. Боль несоразмерна тяжести первоначальной травмы.
CRPS встречается редко, и его причина точно не выяснена. Лечение наиболее эффективно, если его начать рано.В таких случаях возможно улучшение и даже ремиссия.
Продукты и услуги
Показать больше продуктов от Mayo Clinic
Симптомы
Признаки и симптомы CRPS включают:
- Постоянная жгучая или пульсирующая боль, обычно в руке, ноге, кисти или ступне
- Чувствительность к прикосновению или холоду
- Отек болезненной области
- Изменение температуры кожи — чередование потливости и холода
- Изменение цвета кожи от белого с пятнами до красного или синего
- Изменение текстуры кожи, которая может стать нежной, тонкой или блестящей в пораженной области
- Изменения роста волос и ногтей
- Скованность, припухлость и повреждение суставов
- Мышечные спазмы, тремор, слабость и потеря (атрофия)
- Снижение способности двигать пораженной частью тела
Симптомы могут со временем меняться и варьироваться от человека к человеку.Боль, отек, покраснение, заметные перепады температуры и гиперчувствительность (особенно к холоду и прикосновениям) обычно возникают первыми.
Со временем пораженная конечность может похолодеть и побледнеть. Это может привести к изменениям кожи и ногтей, а также к мышечным спазмам и стягиванию. Как только эти изменения происходят, состояние часто необратимо.
CRPS иногда может распространяться из своего источника в другие части вашего тела, например, в противоположную конечность.
У некоторых людей признаки и симптомы CRPS проходят сами по себе.В других случаях признаки и симптомы могут сохраняться от месяцев до лет. Лечение, вероятно, будет наиболее эффективным, если начнется на ранней стадии заболевания.
Когда обращаться к врачу
Если вы испытываете постоянную сильную боль, которая поражает конечность и делает прикосновение или движение этой конечностью невыносимым, обратитесь к врачу, чтобы определить причину. Очень важно лечить CRPS на ранней стадии.
Причины
Причина CRPS полностью не выяснена.Считается, что это вызвано повреждением или отклонением от нормы периферической и центральной нервной систем. CRPS обычно возникает в результате травмы или травмы.
КРБС бывает двух типов со схожими признаками и симптомами, но разными причинами:
- Тип 1. Также известный как рефлекторная симпатическая дистрофия (RSD), этот тип возникает после болезни или травмы, которая не повредила напрямую нервы пораженной конечности. Около 90% людей с CRPS имеют тип 1.
- Тип 2. Когда-то называемый каузалгией, этот тип имеет симптомы, аналогичные симптомам типа 1. Но тип 2 CRPS возникает после явного повреждения нерва.
Многие случаи CRPS возникают после сильной травмы руки или ноги. Это может быть травма или перелом.
Другие серьезные и незначительные травмы, такие как хирургия, сердечные приступы, инфекции и даже вывихи лодыжек, также могут привести к CRPS .
Не совсем понятно, почему эти травмы могут вызвать CRPS .Не у всех, у кого есть такая травма, будет развиваться CRPS . Это может быть связано с дисфункциональным взаимодействием между центральной и периферической нервными системами и несоответствующими воспалительными реакциями.
Осложнения
Если CRPS не диагностировать и не лечить на ранней стадии, болезнь может прогрессировать до более тяжелых признаков и симптомов. Сюда могут входить:
- Истощение тканей (атрофия). Ваша кожа, кости и мышцы могут начать ухудшаться и ослабевать, если вы будете избегать движения рукой или ногой или будете испытывать трудности с их перемещением из-за боли или скованности.
- Подтяжка мышц (контрактура). Вы также можете почувствовать напряжение в мышцах. Это может привести к состоянию, при котором ваша рука и пальцы или ступня и пальцы ног сжимаются в фиксированном положении.
Профилактика
Эти шаги могут помочь снизить риск развития CRPS :
- Прием витамина С после перелома запястья. Исследования показали, что люди, принимающие высокие дозы витамина С после перелома запястья, могут иметь более низкий риск CRPS по сравнению с теми, кто не принимал витамин C.
- Ранняя мобилизация после инсульта. Некоторые исследования показывают, что люди, которые встают с постели и гуляют вскоре после инсульта (ранняя мобилизация), снижают риск развития CRPS .
Опыт клиники Мэйо и истории пациентов
Наши пациенты говорят нам, что качество их взаимодействия, наше внимание к деталям и эффективность их посещений означают такое медицинское обслуживание, которого они никогда не получали.Посмотрите истории довольных пациентов клиники Мэйо.
18 февраля 2020 г.
.
Комплексный регионарный болевой синдром — виды, изображения, лечение
Определение
Комплексный регионарный болевой синдром, сокращенно называемый КРБС, относится к хроническому заболеванию, которое в основном поражает руку с отеком, скованностью, сильной жгучей болью и некоторым обесцвечиванием. КРБС также может поражать руки, ноги и ступни больного человека.
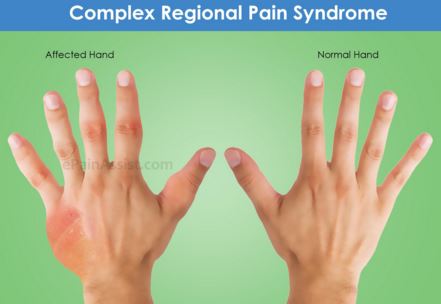
Это может произойти после любой травмы или травмы, инсульта или сердечного приступа, или после хирургических вмешательств.Другими терминами КРБС являются синдром плеча-руки, рефлекторная симпатическая дистрофия, каузалгия, атрофия Судека и рефлекторная нейроваскулярная дистрофия.
CRPS можно наблюдать среди мужчин и женщин, хотя большинство случаев у женщин. Это может случиться в любом возрасте, и у всех есть шансы получить это, обычно у тех, кому почти за 40. У пожилых людей есть редкий шанс, не замеченный среди детей до 5 лет и не часто встречающийся в группе подростков.
Симптомы комплексного регионального болевого синдрома
Триггерные факторы, приводящие к КРБС, различаются, но они имеют одинаковый набор симптомов и проходят через одни и те же стадии болезненного состояния, а именно:
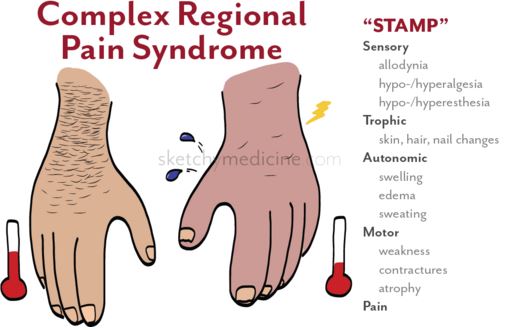
Стадия I / Острая стадия — может длиться до 3 месяцев, симптомы следующие:
- Постоянно продолжающаяся жгучая боль
- Повышенная чувствительность при касании
- Набухание и жесткость суставов
- Поражение конечности с повышенной теплотой и покраснением
- Чрезмерное потоотделение
- Рост ногтей и волос быстрее обычного
Стадия II / Дистрофическая стадия — это может наблюдаться от 3 до 12 месяцев, и симптомы следующие:
- Более постоянное набухание
- Исчезают морщины на коже
- Более низкая температура кожи
- Хрупкие ногти
- Боль становится широко распространенной
- Повышение жесткости шарниров
- Пораженная область более чувствительна к прикосновению
Стадия III / Атрофическая стадия — Это происходит через 1 год, и симптомы следующие:
- Кожа на пораженном участке бледная, выглядит сухой и блестящей, плотно растянутой
- Жесткость области с меньшей вероятностью возвращения назад
- Снижение боли
- Может распространяться на другие участки тела
Патофизиология
Точная причина CRPS конкретно не известна; однако существует два типа CRPS, которые могут гипотетически объяснить возможные причины его возникновения.
Триггерные факторы не совсем понятны относительно того, почему это может закончиться КРБС, но в некоторых исследованиях упоминалось, что это может быть связано с нарушением взаимодействия между центральной нервной системой и периферической нервной системой, а также воспалительными реакциями, которые неуместны.
Группа консенсуса среди экспертов по медицине боли, которую собирает в 1994 году Международная ассоциация по изучению боли (IASP), пришла к согласию и успешно разработала диагностические критерии для рефлекторной симпатической дистрофии (RSD) как CRPS типа I и каузалгии как КРБС типа II.
Исследователи почувствовали некоторую двусмысленность в названии критериев; тем не менее, IASP использует клинические исследования для поддержки выявленных типов CRPS.

Тип I CRPS
Ранее это называлось рефлекторной симпатической дистрофией (RSD), атрофией Судека, рефлекторной нервно-сосудистой дистрофией (RND) или альгонейродистрофией, при которой у пациентов нет наблюдаемых поражений нервов. Это происходит, когда какая-либо форма болезни или травмы не вызывает прямого повреждения нерва в пораженном участке.
Тип II CRPS
Этот тип также ранее назывался каузалгией, когда можно увидеть, что у пациента есть признаки наблюдаемого повреждения нерва. Это следует после явного повреждения нерва, поражающего участок, который подвергается любому повреждению.
Диагностика
Не существует специального единого диагностического обследования для подтверждения проблемы пациента с КРБС. Диагноз в основном ставится после тщательного сбора врачами истории болезни и выявления клинических проявлений, соответствующих определению любого типа КРБС.
Вот набор клинических диагностических критериев, предложенных и установленных IASP:
- Наличие продолжающейся боли, не пропорциональной указанной причине или событию
- По крайней мере, 1 симптом, проявленный по крайней мере из 3 указанных категорий:
- Сенсорные, такие как гиперестезия или с аллодинией
- Вазомоторный, например, изменение цвета кожи или асимметричный цвет кожи, асимметрия температуры
- Судомоторный / отек, например наличие отека, изменения потоотделения или асимметричное потоотделение
- Моторные или трофические, например трофические изменения, отмеченные в волосах, ногтях или коже; нарушение двигательной активности и уменьшение объема движений
- Наличие хотя бы 1 признака на момент оценки пациента как минимум из 2 категорий:
- Сенсорное восприятие, такое как гипералгезия при уколе иглой или аллодиния при легком прикосновении или движениях суставов
- Вазомоторные, такие как фактические доказательства, отмеченные с асимметричной температурой или с изменениями цвета кожи
- Судомоторный / отек, например наличие фактического отека или изменения потоотделения с некоторой асимметрией
- Двигательные / трофические, такие как наблюдаемые признаки двигательных дисфункций, таких как слабость или тремор; трофические изменения, обнаруженные в волосах или ногтях, и уменьшение объема выполненной двигательной активности
Лечение
Доступные методы лечения CRPS:
- Реабилитационная терапия для сохранения подвижности болезненной конечности с помощью программы упражнений
- Психотерапия для улучшения выживания и восстановления после CRPS
Лекарства, такие как:
- Антидепрессанты
- Нестероидные противовоспалительные средства от боли
- Кортикостероиды при отеках и воспалениях
- Кремы и пластыри для местного обезболивания для местного применения
Для лечения КРБС доступны следующие методы лечения боли:
- Внутривенный иммуноглобулин / (ВВИГ)
- Кетамин
- Гипербарический кислород
Код МКБ 9
Код диагноза 337 МКБ-9-CM 2013 г.22 — это оплачиваемый медицинский код, указывающий на диагноз, используемый для требований о возмещении CRPS, с датой обслуживания 30 сентября 2015 г. или ранее. Код ICD-10-CM, который представляет собой 2015/16 ICD-10-CM G90.529 , используется для требований, предъявленных 1 октября 2015 г. или позднее.
Изображения
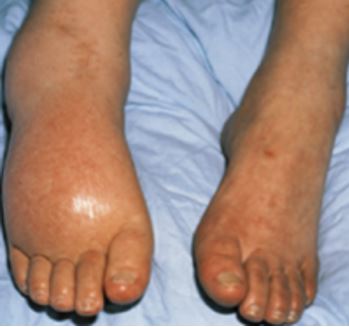
Список литературы
- Комплексные тесты на региональный болевой синдром, лечение, профилактика на http://www.mayoclinic.org/diseases-conditions/complex-regional-pain-syndrome/basics/definition/con-20022844
- Комплексные региональные болевые синдромы — обзор, презентация, DDx, обследование, лечение, лекарства, наблюдение http: // emedicine.medscape.com/article/1145318-overview
- http://www.ninds.nih.gov/disorders/reflex_sympathetic_dystrophy/detail_reflex_sympathetic_dystrophy.htm
- Варенна М, Адами С, Россини М; и другие. (Март 2013 г.). «Лечение комплексного регионального болевого синдрома I типа с помощью неридроната: рандомизированное двойное слепое плацебо-контролируемое исследование». Ревматология 52 (3): 534–42.
- Niesters, M; Мартини, C; Дахан, А (февраль 2014 г.). «Кетамин от хронической боли: риски и преимущества». Британский журнал клинической фармакологии 77 (2): 357–67.
- Brunner F, Schmid A, Kissling R, Held U, Bachmann LM (январь 2009 г.). «Бифосфонаты в терапии комплексного регионального болевого синдрома I — систематический обзор». Европейский журнал боли 13 (1): 17–21.
.
Комплексный регионарный болевой синдром (КРБС)
Комплексный региональный болевой синдром (CRPS) — это болезненное состояние руки, кисти, ноги или ступни человека, которое возникает после травмы, например перелома. Редко КРБС может поражать другие части тела, например лицо.
Симптомы могут варьироваться от легких до тяжелых и могут длиться от месяцев до лет. Мы не знаем причины КРБС, но лечение направлено на облегчение симптомов и восстановление функции конечностей (движения и активности). Большинство людей полностью выздоравливают, но состояние может рецидивировать, и у небольшой группы людей с КРБС симптомы могут быть тяжелыми и сохраняться годами.CRPS раньше был известен как рефлекторная симпатическая дистрофия (RSD).
Вероятность заболевания у женщин в три раза выше, чем у мужчин. У взрослых чаще всего поражается рука. У детей это нога. CRPS влияет на людей по-разному, и реакция одного человека на лечение будет отличаться от реакции другого человека.
Симптомы комплексного регионального болевого синдрома (КРБС)
Симптомы CRPS могут включать:
- жгучая боль в руке, кисти, ноге или стопе
- Боль, которая меняется по интенсивности, но часто ощущается намного хуже, чем можно было ожидать
- Потеря тонкой моторики
- тремор или спазмы
- жесткость
- Изменения кожи, волос и ногтей на пораженной конечности
- пораженная конечность теплее или холоднее, чем здоровая конечность
- Пораженная конечность потеет или суше, чем непораженная конечность.
Травмы, которые могут привести к CRPS
Иногда КРБС развивается у людей, перенесших травму спинного мозга, инсульт или сердечный приступ. Однако в большинстве случаев КРБС возникает после травмы руки или ноги, например:
- перелом — сломанная кость
- проникающая травма — например, глубокая рана или разрыв
- хирургия — например, артроскопия коленного сустава или операция по лечению синдрома запястного канала.
Причина CRPS
КРБС — это болевое заболевание, которое может поражать разные системы организма.Мы плохо понимаем причину. Большинство специалистов в области здравоохранения считают, что несколько различных факторов, работающих вместе, могут вызвать симптомы. То, как каждый из этих факторов способствует возникновению КРБС, может быть разным для каждого человека.
Пусковые факторы, называемые «механизмами болезни», включают:
- Дисфункция симпатической нервной системы — симпатическая нервная система — это часть вашей нервной системы, которая отвечает за «домашнее хозяйство» вашего тела. Он контролирует многие непроизвольные действия в организме, такие как выделение пота, кровоток, рост волос и ногтей.Не все люди с КРБС имеют дисфункцию симпатической нервной системы.
- Дисфункция соматической нервной системы — соматическая нервная система передает сообщения между мозгом и конечностями через спинной мозг. Человек с КРБС может испытывать такие болезненные ощущения, как нежное прикосновение, тепло или холод (аллодиния) — например, одежда прижимается к коже или воздух обдувает конечность. Человек с CRPS может также испытывать странные ощущения, такие как неуклюжесть или ощущение, что его конечность не принадлежит его телу.
- Нейрогенное воспаление — покраснение и отек при КРБС могут отличаться от обычных покраснений и отеков, которые обычно возникают после травмы. Врачи считают, что сами нервы могут выделять химические вещества, вызывающие эти изменения в пораженной конечности.
- Гипоксия — CRPS может сужать кровеносные сосуды. Ограниченный кровоток снижает содержание кислорода в тканях тела (гипоксия), что вызывает боль.
- Психологические факторы — некоторые врачи считают, что реакция человека на стрессовое событие в жизни может вызвать КРБС, в то время как другие врачи категорически не согласны с этим.Текущие исследования показывают, что психологические факторы не играют большой роли в возникновении КРБС, за исключением случаев сильного стресса. Однако психологические факторы могут играть важную роль в том, насколько хорошо человек справляется с КРБС.
Диагностика CRPS
Диагностического теста на CRPS нет. Диагноз ставится на основании истории болезни человека и его симптомов. Иногда врач может назначить анализы крови, сканирование костей, рентген, компьютерную томографию или магнитно-резонансную томографию, чтобы исключить другие состояния с похожими симптомами.
Не все медицинские работники знакомы с CRPS. Это может привести к задержке постановки диагноза или ошибочной диагностике КРБС, если у человека нет этого состояния. Важно, чтобы любой диагноз ставил специалист в области здравоохранения, который знаком с признаками и симптомами КРБС. Это может быть врач, физиотерапевт или эрготерапевт.
Лечение CRPS
Простого лекарства от CRPS не существует. Лечение часто включает несколько подходов и направлено на восстановление подвижности и функции пораженной конечности.Варианты могут включать:
- лекарства — например, обезболивающие. Лекарства, которые обычно назначают при других состояниях, таких как эпилепсия или депрессия, иногда могут помочь справиться с КРБС, хотя это не означает, что у человека эпилепсия или депрессия
- физиотерапия — такая как физиотерапия и трудотерапия. Обычно лечение начинается со стратегии уменьшения боли и отека. Затем следуют легкие движения, затем упражнения для укрепления мышц для улучшения функционирования конечностей и, наконец, упражнения для улучшения функционирования всего тела человека
- Консультации и психологическая поддержка — например, чтобы помочь человеку справиться со стрессом, депрессией и хронической болью
- интервенционная терапия — например, блокада нервов.Чаще всего используется блокада симпатического ганглия, которая включает использование местного анестетика для остановки работы некоторых нервов пораженной конечности.
- имплантационная терапия — операция по помещению устройства, такого как электрод или система доставки лекарств, в тело человека. Устройство помогает контролировать симптомы, в том числе боль. Однако имплантационная терапия считается крайней мерой, когда все другие методы лечения боли не работают.
Долгосрочная перспектива CRPS
Большинство людей выздоравливают от КРБС, но у некоторых сохраняется ряд постоянных симптомов, которые варьируются от незначительных до тяжелых.У небольшой группы людей с КРБС значительная боль и инвалидность сохраняются годами.
Примерно у одного взрослого из 10 разовьется новый приступ КРБС после того, как у него в течение некоторого времени исчезнут симптомы. У детей вероятность рецидива выше, чем у взрослых. Рецидивы могут произойти по неизвестной причине или после операции по поводу отдельной проблемы.
Современные представления предполагают, что риск рецидива можно снизить, если во время любой операции используются определенные типы анестетиков или обезболивающих.
Куда обратиться за помощью
- Ваш терапевт
- Обезболивание
- Дежурная медсестра Тел. 1300 60 60 24 — для получения медицинской информации и консультации (круглосуточно, 7 дней)
.
Комплексный регионарный болевой синдром — NHS
Комплексный регионарный болевой синдром (КРБС) — это плохо изученное состояние, при котором человек испытывает постоянную сильную и изнуряющую боль.
Хотя большинство случаев КРБС вызывается травмой, возникающая в результате боль намного более сильная и продолжительная, чем обычно.
Боль обычно поражает только одну конечность, но иногда может распространяться на другие части тела.
Кожа пораженной части тела может стать настолько чувствительной, что легкое прикосновение, удар или даже изменение температуры могут вызвать сильную боль.
Пораженные участки также могут стать опухшими, жесткими или претерпевать резкие изменения цвета или температуры.
CRPS часто со временем постепенно улучшается. Но некоторые люди с КРБС испытывают боль в течение многих лет.
Узнайте больше о симптомах CRPS.
Когда обращаться за медицинской помощью
Вам следует обратиться к терапевту, если вы испытываете постоянную боль, которая мешает вам выполнять повседневные дела.
Диагностика CRPS может быть трудной, поскольку требует проведения тестов для исключения других возможных причин.
Лучше обратиться за помощью как можно скорее, так как раннее лечение может помочь уменьшить ваши болезненные симптомы.
Узнайте больше о диагностике CRPS.
Причины КРБС
Причина КРБС неизвестна, но считается, что это результат ненормальной реакции организма на травму.
Раньше считалось, что КРБС — это психосоматическое состояние, при котором симптомы проявляются «все в уме», но исследования опровергли это.
Узнайте больше о возможных причинах CRPS.
Кто пострадал
Трудно точно оценить, насколько распространен КРБС, поскольку многие случаи могут остаться недиагностированными или ошибочно диагностированными. Но это считается довольно необычным.
CRPS может поражать людей любого возраста, включая детей. Но чаще встречается у женщин в возрасте от 60 до 70 лет.
Лечение CRPS
В настоящее время лекарства от CRPS нет, но существует ряд методов лечения, которые могут помочь справиться с симптомами.
Существует 4 основных типа лечения:
- образование и самоконтроль — получение четкой информации о вашем состоянии и советы по любым шагам, которые вы можете предпринять, чтобы справиться с ним самостоятельно
- физическая реабилитация — лечение, помогающее справиться с симптомами и снизить риск долгосрочных физических проблем, таких как лечебная физкультура
- обезболивающее — лечение, помогающее уменьшить вашу боль, например противосудорожные или антидепрессанты
- психологическая поддержка — лечение, которое поможет вам справиться с эмоциональным воздействием жизни с КРБС , например, когнитивно-поведенческая терапия (КПТ)
Из-за сложной природы КРБС к вашему лечению обычно будут привлечены различные специалисты в области здравоохранения.
Узнайте больше о лечении КРБС.
Контент сообщества от HealthUnlocked
Последняя проверка страницы: 29 апреля 2019 г.
Срок следующей проверки: 29 апреля 2022 г.
.
