| Якупов Халит Асиятович | С 09:00 до 14:00 | Стоматолог | Записаться |
| Жигарёва Ксения Юрьевна | С 10:00 до 21:00 | Стоматолог-ортопед | Записаться |
| Калёнова Евгения Эдуардовна | С 10:00 до 13:00 | Фтизиатр | Записаться |
| Посту Юлия Владиславовна | С 10:00 до 14:00 | Гинеколог+узи | Записаться |
| Меркотун Галина Анатольевна | С 10:00 до 12:00 | Терапевт | Записаться |
| Посту Юлия Владиславовна | С 10:00 до 14:00 | Акушер-гинеколог | Записаться |
| Меркотун Галина Анатольевна | С 10:00 до 12:00 | Гастроэнтеролог | Записаться |
| Жигарёва Ксения Юрьевна | С 10:00 до 21:00 | Стоматолог-хирург | Записаться |
| Калёнова Евгения Эдуардовна | С 10:00 до 13:00 | Пульмонолог | Записаться |
| Ишанова Ирина Николаевна | С 13:45 до 19:30 | Рентгенолог | Записаться |
| Быков Александр Николаевич | С 14:20 до 18:00 | Врач УЗИ-диагностики | Записаться |
| Пак Дмитрий Дингирович | С 15:00 до 18:00 | Кардиолог | Записаться |
| Боровских Анна Вячеславовна | С 15:00 до 19:00 | Косметолог | Записаться |
| Пак Дмитрий Дингирович | С 15:00 до 18:00 | Врач УЗИ-диагностики | Записаться |
| Боровских Ростислав Равильевич | С 15:00 до 19:00 | Невролог-нейрохирург | Записаться |
| Сыров Артур Михайлович | С 15:00 до 19:00 | Стоматолог | Записаться |
| Кихаял Александр Петрович | С 16:00 до 19:00 | Отоларинголог | Записаться |
| Пак Дмитрий Дингирович | С 18:00 до 20:00 | Кардиолог | Записаться |
| Пак Дмитрий Дингирович | С 18:00 до 20:00 | Врач УЗИ-диагностики | Записаться |
Автоматизированная лаборатория во Владимире
Описание
Другие исследования — Общий анализ мокроты
Сроки исполнения: 2 рабочих дня*.
Биоматериал: мокрота.
Описание:
Подготовка к исследованию: Перед откашливанием производится санация ротовой полости – чистка зубов, полоскание рта и горла, материал собирают утром натощак во время приступа кашля в стерильный контейнер. Если мокрота плохо отделяется, рекомендуется накануне принимать отхаркивающие средства, теплое питье.
Справка: Мокрота — патологическое отделяемое легких и дыхательных путей (гортани, трахеи, бронхов). Анализ мокроты включает в себя описание ее характера, общих свойств и микроскопические исследования.
Показания к назначению: комплексная диагностика и мониторинг инфекционно-воспалительных и аллергических заболеваний легких аллергических заболеваний дыхательной системы, грибковые поражения бронхо-легочной системы, контроль проведенной терапии.
Общие свойства
Количество мокроты обычно достигает до 50-100 мл в сутки. Мало мокроты отделяется при: острых бронхитах, пневмонии, застойных явлениях в легких, в начале приступа бронхиальной астмы. Большое количество выделяется при отеке легких, бронхоэктатической болезни, абсцессе, гангрене легкого, туберкулезе, в конце приступа бронхиальной астмы.
Характер. Слизистая мокрота выделяется при остром и хроническом бронхите, трахеите. Слизисто-гнойная мокрота встречается при абсцессе и гангрене легкого, гнойном бронхите, стафилококковой пневмонии. Гнойно-слизистая мокрота характерна для бронхопневмонии. Гнойная мокрота встречается при абсцессе и гангрене легкого, стафилококковой пневмонии, актиномикозе легких, бронхоэктазах. Серозная мокрота отделяется при отеке легких. Кровянистая мокрота выделяется при инфаркте легких, новообразованиях или их метастазах в легкие, актиномикозе, сифилисе.
Цвет. Чаще всего мокрота бесцветная, однако, при присоединении гнойного процесса она может приобретать зеленоватый оттенок (абсцесс, гангрена легкого, бронхоэктатическая болезнь). При появлении в мокроте примеси свежей крови приобретает оттенки красного цвета (туберкулез, актиномикоз, рак легких, отек легких). Мокрота ржавого цвета отмечается при пневмониях, туберкулезе, инфаркте легкого. Оттенки желтого цвета могут встречаться при желтухе, эозинофильной пневмонии, сидерозе легкого.
Мокрота ржавого цвета отмечается при пневмониях, туберкулезе, инфаркте легкого. Оттенки желтого цвета могут встречаться при желтухе, эозинофильной пневмонии, сидерозе легкого.
Запах. Мокрота чаще не имеет запаха. Зловонный запах мокроты зависит либо от распада ткани (гангрена, раковая опухоль) либо от разложения белков самой мокроты при задержке её в полостях (абсцесс, бронхоэктазы).
pH. Мокрота обычно имеет слабощелочную или нейтральную реакцию. При процессах, сопровождающихся распадом и разложением, мокрота приобретает кислую реакцию.
Слоистость. Гнойная мокрота обычно при стоянии разделяется на два слоя, гнилостная на три. Особенно характерно появление трехслойной мокроты для гангрены легкого, двухслойная мокрота может встретиться при абсцессе легкого и бронхоэктатической болезни.
Микроскопия мокроты
Плоский эпителий попадает в мокроту из полости рта и не имеет диагностического значения. Наличие в мокроте более 25 клеток плоского эпителия указывает на то, что данный образец мокроты загрязнен отделяемым из ротовой полости.
Цилиндрический мерцательный эпителий в небольшом количестве присутствует в любой мокроте, при поражении дыхательных путей его достаточно много. Их обнаруживают при бронхитах и трахеитах, бронхиальной астме, злокачественных новообразованиях легких и метастазах в них.
Альвеолярные макрофаги в большом количестве выделяются при хронических процессах в легких и на стадии разрешения острых процессов. Они локализуется в основном в межальвеолярных перегородках, поэтому анализ мокроты, где присутствует хотя бы 1 макрофаг, указывает на то, что поражены нижние отделы дыхательной системы. Данные клетки обнаруживаются при инфаркте легкого, отеке легких, кровоизлияниях.
Нейтрофилы в больших количествах выявляют при бронхопневмонии, абсцессе и гангрене легкого, стафилококковой пневмонии, актиномикозе легких, бронхоэктазах.
Эозинофилы встречаются в большом количестве при бронхиальной астме, эозинофильной пневмонии, инфаркте легкого, туберкулезе, раке легких.
Лимфоцитами богата мокрота при коклюше, туберкулезе (не часто).
Эритроциты появляются в мокроте при разрушении ткани легкого, пневмонии, застое в малом круге кровообращения, инфаркте легкого и т.д.
Ксантомные клетки обнаруживают при абсцессе легкого, эхинококкозе легких, актиномикозе.
Волокна появляются при распаде ткани легкого (туберкулез, абсцесс, эхинококкоз, злокачественные новообразования).
Обызвествленные эластические волокна встречаются при распаде туберкулезного петрификата.
Спирали Куршмана образуются при спастическом состоянии бронхов и наличии в них слизи. Встречаются при бронхиальной астме, бронхитах, злокачественных новообразованиях.
Кристаллы Шарко-Лейдена представляют собой продукты распада эозинофилов. Встречаются при бронхиальной астме, аллергических состояниях, эозинофильной пневмонии.
Пробки Дитриха — комочки, состоящие из детрита, жирных кислот, бактерий. Встречаются при абсцессе легкого и бронхоэктатической болезни.
Паразиты и яйца гельминтов. Мокрота в норме не содержит паразитов и яйца гельминтов. Выявление паразитов позволяет установить природу легочной инвазии, а также диагностировать кишечную инвазию и ее стадию.
Патологическая анатомия
Морфологические особенности бронхиальной
астмы долгие годы оставались мало
изученными. В последние 2—3 десятилетия,
когда участились случаи смерти больных
бронхиальной астмой, появились более
обстоятельные исследования по
патологической анатомии этого заболевания.
В клинической практике объектом
исследования служат мокрота и материал
биопсии стенки бронхов.
Исследование мокроты. Бронхиальный
секрет — продукт жизнедеятельности
серозных, бокаловидных и эпителиальных
клеток. Вследствие повышенной сосудистой
проницаемости к бронхиальному секрету
часто примешивается серозный белковый
компонент. Секрет, прошедший ротовую
полость и химически обработанный слюной,
является мокротой. Типичными элементами
Типичными элементами
астматической мокроты являются спирали
Куршманна и ди-пирамидальные кристаллы
Шарко — Лейдена. Спирали Куршманна
иногда имеют причудливую форму слепка
бронхов, отдельные спирали достигают
больших размеров. Они имеют в основном
мукозный состав, поэтому отличаются
повышенной вязкостью и стекловидной
консистенцией. Вязкость бронхиального
секрета также возрастает при пропотевании
из сосудов легких альбумина, обладающего
склеивающими особенностями. Кристаллы
Шарко — Лейдена следует рассматривать
как дериваты эозинофилов. Современный
иммунохимический анализ мокроты
позволяет определять в ней иммуноглобулины,
ферменты, электролиты, белки, липиды,
глико-протеины. При аллергической форме
бронхиальной астмы можно выделить 2
группы больных, отличающихся по характеру
мокроты. Большинство больных выделяют
мокроту, содержащую конгломераты
дегенерированных клеточных элементов
и эозинофильный детрит; у меньшей части
в мокроте содержатся немукоидные
элементы. С присоединением инфекции
мокрота становится гнойной. Исследование
биопсийного материала. Этот метод не
получил распространения, так как не
дает новой’ информации, а главное может
быть опасным. Для больных бронхиальной
астмой биопсия слизистой оболочки
стенки бронхов — это всегда травма,
ухудшающая состояние.
Результаты патологоанатомического
исследования. Смертельные исходы у
больных бронхиальной астмой участились,
Так, в Великобритании, дети в возрасте
от 10 до 14 лет от бронхиальной астмы
умирают чаще, чем от лейкозов. Описаны
посмертные изменения легких у больных
бронхиальной астмой, погибших внезапно
(автомобильная катастрофа и другие
причины).
При вскрытии грудной клетки обращают
на себя внимание перерастянутые легкие,
которые выполняют всю грудную полость.
Передняя часть перикарда также прикрыта
эмфизематозным участком легкого. Однако
могут встречаться ателектазы, особенно
в участках, прилежащих к кардиальной
области. Течение астмы может осложниться
пневмотораксом, чтэ особенно часто
встречается при проведении реанимационных
мероприятий (массаж грудной клетки,
катетеризация подключичной вены,
искусственная вентиляция легких). Однако
Однако
деструктивная эмфизема встречается
все же редко, поэтому в большинстве
случаев можно проследить ненарушенную
архитектонику легких.
Наиболее характерный признак бронхиальной
астмы — слизистые пробки. При разрезе
и последующем сдавливании легкого они
«подобно червякам» выходят на поверхность.
Серые, блестящие слизистые пробки
перекрывают продольный просвет мелких,
средних и крупных бронхов и препятствуют
поступлению формалина, поэтому консервацию
можно осуществить лишь путем наливки
сосудов. При микроскопическом исследовании
отмечают большую распространенность
слизистых пробок, доходящих иногда до
легочной паренхимы. Наличие пробок в
бронхах характерно для острого периода,
но они могут быть обнаружены и в
межприступном периоде.
Кистозные бронхоэктазы не относятся к
разряду частых находок. Наиболее типичная
их локализация -средние и верхние зоны.
Вокруг бронхоэктазов расположены
небольшие участки ателектазов.
С помощью гистохимического исследования
содержимого бронхов выявляют как
базофильный, так и эозинофильный
компоненты. Иммунофлюоресцентная
техника позволяет определять присутствие
молекул альбумина в бронхиальном
секрете, происходящее за счет дилатации
и повышенной проницаемости капилляров
подслизистого
Наблюдается обычно отек
слизистой оболочки, мерцательный
респираторный эпителий теряет реснички.
Отмечаются дегенерация клеток, их
метаплазия, в особенно тяжелых случаях
их полная гибель. В этих случаях базальная
мембрана оголяется и непосредственно
соприкасается с воздушным потоком.
Описана фиксация IgG и IgM
на поверхности эпителиальных клеток.
В условиях эксперимента установлено,
что острое повреждение эпителиальных
клеток может регенерироваться в течение
2— 3 нед. Меняется соотношение бокаловидных
желез и эпителиальных клеток в сторону
превалирования первых.
Эти .изменения, отражающие нарушение
мукоцилиар-ного барьера, не относятся
к патогномоничным признакам бронхиальной
астмы.
Подобные явления описывают
при хронических бронхитах, некоторых
профессиональных заболеваниях. Для
Для
бронхиальной астмы наиболее типичны
изменения базаль-ной мембраны. В норме
толщина базальной мембраны 7 мкм, при
бронхиальной астме она утолщается до
10— 30 мкм, гиалинизируется. В ней
откладываются IgM и
С3-компонент комплемента по гранулярному
типу.
Отмечены также определенные
изменения гладких мышц бронхов. С
уменьшением мукоцилиарного клиренса
увеличивается гипертрофия гладких
мышц. Недалеко от волокон находятся
тучные клетки (лаброциты). При бронхиальной
астме может сложиться ложное впечатление
об уменьшении числа тучных клеток. Это
связано с активным процессом их
дегрануляции. С увеличением числа
дегранулированных тучных клеток
возрастает инфильтрация эозинофильными
лейкоцитами. В последние годы медиаторам
эозинофилов стали придавать большое
значение в таких процессах, как хемотаксис,
контроль числа дегранулированных тучных
клеток. В подслизистом слое определяют
повышенное содержание IgE.
Морфологи подчеркивают гипертрофию и
дегенерацию слизистых и бокаловидных
желез у лиц, умерших от бронхиальной
астмььу
Мокрота — Микроскопическое исследование | ClinLabs.com
Эпителиальные клетки.
Встречающиеся в мокроте клетки плоского эпителия диагностического значения не имеют. Клетки цилиндрического эпителия (как единичные, так и в виде скоплений) могут быть обнаружены при бронхиальной астме, бронхите, бронхогенном раке легкого. Вместе с тем появление клеток цилиндрического эпителия в мокроте может быть обусловлено и примесью слизи из носоглотки.
Альвеолярные макрофаги
Альвеолярные макрофаги — клетки ретикулоэндотелия. Макрофаги, содержащие в протоплазме фагоцитированные частицы (так называемые пылевые клетки), встречаются в мокроте людей, находящихся в длительном контакте с пылью. Некоторое диагностическое значение имеют макрофаги, содержащие в протоплазме гемосидерин (продукт распада гемоглобина). Эти клетки называют «клетками сердечных пороков». Для подтверждения наличия в клетке гемосидерина проводят реакцию образования берлинской лазури, которая бывает положительной при наличии гемосидерина. «Клетки сердечных пороков» встречаются в мокроте при застое в легких (в частности при стенозе левого атриовентрикулярного отверстия), при инфаркте легкого.
«Клетки сердечных пороков» встречаются в мокроте при застое в легких (в частности при стенозе левого атриовентрикулярного отверстия), при инфаркте легкого.
Лейкоциты
Лейкоциты в небольшом количестве встречаются в любой мокроте.
Большое количество нейтрофилов отмечается в слизисто-гнойной и особенно в гнойной мокроте.
Эозинофилы
Эозинофилами богата мокрота при бронхиальной астме, эозинофильной пневмонии, гельминтозах легких, инфаркте легкого. Эозинофилы могут встречаться в мокроте при туберкулезе и раке легкого.
Лимфоциты
Лимфоциты встречаются в большом количестве при коклюше. Увеличение содержания лимфоцитов в мокроте возможно при туберкулезе легких.
Эритроциты.
Обнаружение единичных эритроцитов в мокроте диагностического значения не имеет. Появление большого количества эритроцитов в мокроте отмечается при состояниях, сопровождающихся кровохарканьем и легочным кровотечением. При наличии свежей крови в мокроте определяются неизмененные эритроциты, если же с мокротой отходит кровь, задержавшаяся в дыхательных путях в течение длительного времени, то обнаруживают выщелоченные эритроциты.
Опухолевые клетки
Опухолевые клетки, обнаруживаемые в мокроте в виде групп, указывают на наличие опухоли легкого. При обнаружении только единичных клеток, подозрительных на опухоль, часто возникают затруднения в их оценке, в таких случаях делают несколько повторных исследований мокроты.
Эластические волокна
Эластические волокна появляются в результате распада легочной ткани при туберкулезе, абсцессе, гангрене легкого и других патологических состояниях, сопровождающихся распадом легочцой ткани. При гангрене легкого эластические волокна обнаруживают не всегда, так как под действием ферментов, находящихся в мокроте, они мргут растворяться.
Спирали Куршманна
Спирали Куршманна — особые трубчатые тела, обнаруживаемые при микроскопическом исследовании, а иногда видимые невооруженным глазом. Обычно спирали Куршманна определяются при бронхиальной астме или астматическом бронхите. Единичные спирали Куршманна могут быть обнаружены при туберкулезе легких и пневмонии.
Обычно спирали Куршманна определяются при бронхиальной астме или астматическом бронхите. Единичные спирали Куршманна могут быть обнаружены при туберкулезе легких и пневмонии.
Кристаллы Шарко—Лейдена
Кристаллы Шарко—Лейдена обнаруживаются в мокроте, богатой эозинофилами (при бронхиальной астме, эозинофильной пневмонии и т. д.). Считают, что кристаллы Шарко — Лейдена образуются из эозинофилов. В мокроте, богатой эозинофилами, количество кристаллов Шарко — Лейдена увеличивается после того, как мокрота постоит 12—24 ч.
Коралловые волокна (волокна Колпена — Джонса)
Редко встречаются так называемые коралловые волокна (волокна Колпена — Джонса) — грубые, раздутые, с колбообразными утолщениями на концах, что является следствием отложения на эластических волокнах жирных кислот и мыл при длительно текущем деструктивном процессе (например, при вскрытии туберкулезных каверн).
Вскрытие петрифицированного туберкулезного очага в просвет бронха может сопровождаться одновременным обнаружением в мокроте обызвествленных эластических волокон, кристаллов XC, МБТ и аморфной извести (так называемая тетрада Эрлиха).
Кристаллы Шарко-Лейдена — Физико-химическое и морфологическое исследование кала
Раздел предназначен исключительно для медицинских и фармацевтических работников! Если Вы не являетесь медицинским и фармацевтическим работником — покиньте раздел! Условия использования
Кристаллы копростерина хорошо растворяются в холодном алкоголе; после высушивания копростерин кристаллизуется, образуя тонкие извивающиеся иглы.
В кале также можно нередко видеть особого рода кристаллы, которые обнаруживаются обычно в мокроте при бронхиальной астме и носят название кристаллов Шарко-Лейдена. Эти кристаллы наблюдаются при анкилостомиазе, хроническом амебиазе и при других кишечных паразитозах. Длина кристаллов колеблется в больших пределах, примерно от 3 до 70 р. ; строение их всегда одинаково и напоминает двустороннее копье или резко вытянутый геометрически точный ромб. Кристаллы Шарко-Лейдена бесцветны, легко окрашиваются эозином в розовый, а железным гематоксилином — в черный цвет. Они растворяются в горячей воде, например при подогревании препарата с водой. Смешать их с другими кристаллами очень трудно, разве только с кристаллами жирных кислот, которые чаще всего приобретают форму игл, не имеют правильного строения вытянутого ромба и с трудом растворяются даже в крепких растворах соляной кислоты. Кристаллы Шарко-Лейдена группами встречаются чаще в слизи и реже в смеси с калом. В такой слизи нередко обнаруживаются, кроме того, эозинофильные клетки, а в каловых массах — амебы и другие простейшие обитатели кишечника.
; строение их всегда одинаково и напоминает двустороннее копье или резко вытянутый геометрически точный ромб. Кристаллы Шарко-Лейдена бесцветны, легко окрашиваются эозином в розовый, а железным гематоксилином — в черный цвет. Они растворяются в горячей воде, например при подогревании препарата с водой. Смешать их с другими кристаллами очень трудно, разве только с кристаллами жирных кислот, которые чаще всего приобретают форму игл, не имеют правильного строения вытянутого ромба и с трудом растворяются даже в крепких растворах соляной кислоты. Кристаллы Шарко-Лейдена группами встречаются чаще в слизи и реже в смеси с калом. В такой слизи нередко обнаруживаются, кроме того, эозинофильные клетки, а в каловых массах — амебы и другие простейшие обитатели кишечника.
Кристаллы билирубина окрашиваются в золотисто-желтый цвет, имеют форму игл или зерен, располагаются иногда группами или кучками в слизевых комочках жидких, водянистых испражнений. Их не следует смешивать с оранжевыми кристаллами каротина, которые встречаются в частицах моркови.
При кишечных кровотечениях, когда кровь успела уже измениться до кристаллической стадии гематина или гематоидина, в кале можно обнаружить голубовато-черные или темно-коричневые пластинки, прямые палочки, глыбки или отдельные мелкие игольчатые образования; они преломляют свет, растворяются в хлороформе и аммиаке.
Следующая глава:
Бариевые соли
Предыдущая глава:
Кристаллы эндогенного происхождения
Анализы с микроскопией | МРТ Эксперт
Исследования с микроскопией широко применяются в лабораторной диагностике. Для чего они назначаются и какой подготовки требуют? Об анализах с микроскопией нам рассказала врач сети лабораторий «KDL» (партнёр «Клиники Эксперт» Пермь), руководитель медицинского отдела медицинского центра «Диапазон» Мария Васильевна Бисерова.
— Мария Васильевна, какие анализы проводятся с микроскопией?
— Посмотреть под микроскопом можно любой биологический материал: мазки со слизистых, соскобы с кожи, урогенитальные мазки. Также можно исследовать мокроту, плевральную, синовиальную жидкость, эякулят, мочу, кал, ногти, волосы. Исследования позволяют выявить признаки воспаления, определить морфотип инфекционного агента (палочковая, кокковая флора, элементы грибка, простейших). Цитологические и гистологические исследования тоже можно отнести к микроскопии. Чаще всего они используются при исследовании операционного материала или материала диагностической биопсии.
Также можно исследовать мокроту, плевральную, синовиальную жидкость, эякулят, мочу, кал, ногти, волосы. Исследования позволяют выявить признаки воспаления, определить морфотип инфекционного агента (палочковая, кокковая флора, элементы грибка, простейших). Цитологические и гистологические исследования тоже можно отнести к микроскопии. Чаще всего они используются при исследовании операционного материала или материала диагностической биопсии.
Все микроскопические тесты удобные, быстрые, но при этом субъективные, требующие профессионализма специалиста лабораторной диагностики.
Читайте материалы по теме:
Анализ мочи: часто задаваемые вопросы
Что показывает анализ мочи по Нечипоренко?
Не только колоноскопия: о чём расскажет анализ кала?
Гистология: что это за анализ?
— Что показывает общий анализ крови (ОАК) с микроскопией?
— ОАК позволяет выявить наличие воспаления в организме, оценить количество эритроцитов и тромбоцитов. Микроскопия традиционно используется для оценки лейкоцитарной формулы. По изменению состава этой формулы можно предположить наличие вирусного или бактериального процесса в организме.
Читайте материалы по теме:
Общий и клинический анализ крови: часто задаваемые вопросы
О чём расскажет гемоглобин?
Лейкоциты. О чём расскажет анализ крови?
Тромбоциты: друзья или враги?
— Выполняется ли микроскопия в общем анализе мочи (ОАМ)?
— Безусловно, микроскопия в ОАМ выполняется, и необходима для выявления воспалительного заболевания мочевыводящих путей. В современной лаборатории микроскопическое исследование мочи заменено автоматическим методом проточной цитометрии, который с большой точностью позволяет оценить клеточный состав мочи, так как прибор идентифицирует и подсчитывает до 65 000 элементов мочевого осадка. В некоторых случаях (при выявлении патологии) врачу всё же приходится самому дополнительно исследовать мочевой осадок под микроскопом.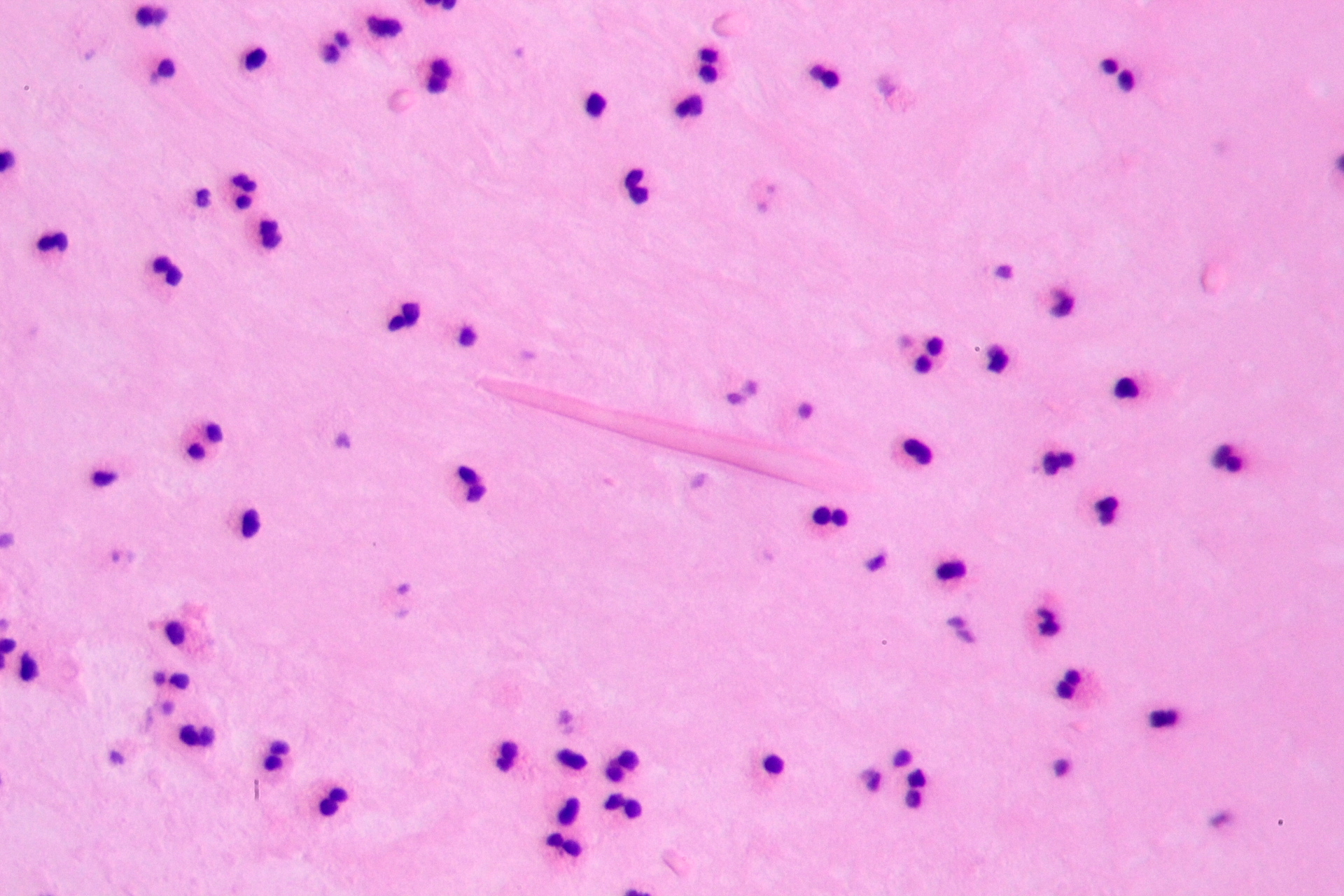
— Как подготовиться к общему анализу мочи?
— Для исследования средняя порция утренней мочи собирается в стерильный одноразовый пластиковый контейнер. Обязательно предварительное проведение гигиенических процедур.
— Кому и для чего назначают анализы мазков из зева и со слизистой носа?
— По результату риноцитограммы (микроскопии мазков из носа) мы можем предположить инфекционную или аллергическую природу воспалительного процесса. При инфекционных заболеваниях носоглотки чаще используются методы прямого выявления возбудителя – это посевы на флору и исследования методом ПЦР.
Подробнее о ПЦР читайте в нашей статье
— Какие ещё микроскопические исследования проводят при заболеваниях органов дыхания?
— Если заболевание сопровождается кашлем, важен общий анализ мокроты. При микроскопии можно выявить наличие клеток и микроорганизмов, которые в норме не должны присутствовать в мокроте (лейкоциты, макрофаги, атипичные клетки, спирали Куршмана, кристаллы Шарко-Лейдена и др.). Это также позволяет оценить степень и предположить причину воспаления (вирусное, бактериальное, аллергическое).
Для подтверждения инфекционного агента точными тестами являются бактериологические и молекулярно-генетические (ПЦР).
— Как подготовиться к такому анализу?
— Мокрота собирается в стерильный контейнер путём откашливания утром, до приёма пищи, после чистки зубов и тщательного полоскания полости рта кипячёной водой. При этом слюна из полости рта не должна попасть в контейнер.
— Вы упомянули о микроскопическом анализе синовиальной жидкости. Как и для чего его проводят?
— Общий анализ синовиальной жидкости позволяет выявить природу заболевания (воспалительную, невоспалительную). При этом оцениваются как внешние свойства (цвет, вязкость), так и химический состав. Но получить синовиальную жидкость можно только при пункции сустава, эту процедуру проводит врач. В современной диагностике при заболеваниях суставов широко используется определение маркеров воспалительных, в частности, ревматических заболеваний в крови. Это быстрый и надёжный способ правильно поставить диагноз и назначить лечение.
В современной диагностике при заболеваниях суставов широко используется определение маркеров воспалительных, в частности, ревматических заболеваний в крови. Это быстрый и надёжный способ правильно поставить диагноз и назначить лечение.
Хотите узнать больше об анализах? Читайте статьи в нашей рубрике
Записаться и сдать лабораторные анализы можно здесь
ВНИМАНИЕ: услуга доступна не во всех городах
Беседовала Дарья Ушкова
Редакция рекомендует:
Вирусы и бактерии – в чём принципиальное отличие?
Для справки:
Бисерова Мария Васильевна
Врач клинической лабораторной диагностики, руководитель медицинского отдела ООО «Медицинской центр «Диапазон»», сеть лабораторий KDL.
Бронхиальная астма
08.05.2019
Количество просмотров: 9460
Бронхиальная астма – это хроническое неинфекционное заболевание дыхательных путей воспалительного характера. Приступ бронхиальной астмы часто развивается после предвестников и характеризуется коротким резким вдохом и шумным длительным выдохом. Обычно он сопровождается кашлем с вязкой мокротой и громкими свистящими хрипами. Методы диагностики включают оценку данных спирометрии, пикфлоуметрии, аллергопроб, клинических и иммунологических анализов крови. В лечении используются аэрозольные бета-адреномиметики, м-холинолитики, АСИТ, при тяжелых формах заболевания применяются глюкокортикостероиды.
Общие сведения
За последние два десятка лет заболеваемость бронхиальной астмой (БА) выросла, и на сегодняшний день в мире около 300 миллионов астматиков. Это одно из самых распространенных хронических заболеваний, которому подверженные все люди, вне зависимости от пола и возраста. Смертность среди больных бронхиальной астмой достаточно высока. Тот факт, что в последние двадцать лет заболеваемость бронхиальной астмой у детей постоянно растет, делает бронхиальную астму не просто болезнью, а социальной проблемой, на борьбу с которой направляется максимум сил. Несмотря на сложность, бронхиальная астма хорошо поддается лечению, благодаря которому можно добиться стойкой и длительной ремиссии. Постоянный контроль над своим состоянием позволяет пациентам полностью предотвратить наступление приступов удушья, снизить или исключить прием препаратов для купирования приступов, а так же вести активный образ жизни. Это помогает поддержать функции легких и полностью исключить риск осложнений.
Тот факт, что в последние двадцать лет заболеваемость бронхиальной астмой у детей постоянно растет, делает бронхиальную астму не просто болезнью, а социальной проблемой, на борьбу с которой направляется максимум сил. Несмотря на сложность, бронхиальная астма хорошо поддается лечению, благодаря которому можно добиться стойкой и длительной ремиссии. Постоянный контроль над своим состоянием позволяет пациентам полностью предотвратить наступление приступов удушья, снизить или исключить прием препаратов для купирования приступов, а так же вести активный образ жизни. Это помогает поддержать функции легких и полностью исключить риск осложнений.
Причины
Наиболее опасными провоцирующими факторами для развития бронхиальной астмы являются экзогенные аллергены, лабораторные тесты на которые подтверждают высокий уровень чувствительности у больных БА и у лиц, которые входят в группу риска. Самыми распространенными аллергенами являются бытовые аллергены – это домашняя и книжная пыль, корм для аквариумных рыбок и перхоть животных, аллергены растительного происхождения и пищевые аллергены, которые еще называют нутритивными. У 20-40% больных бронхиальной астмой выявляется сходная реакция на лекарственные препараты, а у 2% болезнь получена вследствие работы на вредном производстве или же, например, в парфюмерных магазинах.
Инфекционные факторы тоже являются важным звеном в этиопатогенезе бронхиальной астмы, так как микроорганизмы, продукты их жизнедеятельности могут выступать в качестве аллергенов, вызывая сенсибилизацию организма. Кроме того, постоянный контакт с инфекцией поддерживает воспалительный процесс бронхиального дерева в активной фазе, что повышает чувствительность организма к экзогенным аллергенам. Так называемые гаптенные аллергены, то есть аллергены небелковой структуры, попадая в организм человека и связываясь его белками так же провоцируют аллергические приступы и увеличивают вероятность возникновения БА.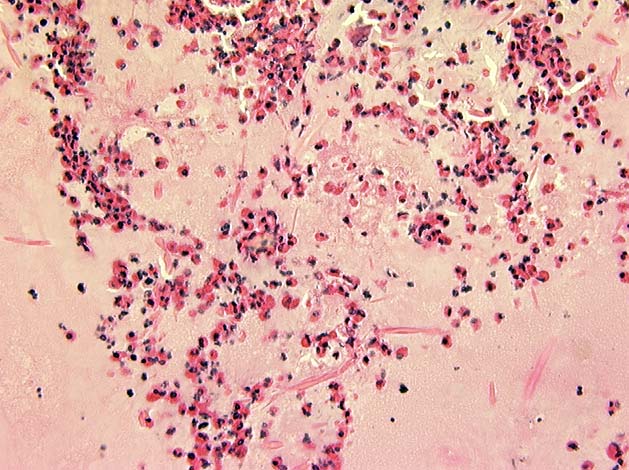 Такие факторы, как переохлаждение, отягощенная наследственность и стрессовые состояния тоже занимают одно из важных мест в этиологии бронхиальной астмы.
Такие факторы, как переохлаждение, отягощенная наследственность и стрессовые состояния тоже занимают одно из важных мест в этиологии бронхиальной астмы.
Патогенез
Хронические воспалительные процессы в органах дыхания ведут к их гиперактивности, в результате которой при контакте с аллергенами или раздражителями, мгновенно развивается обструкция бронхов, что ограничивает скорость потока воздуха и вызывает удушье. Приступы удушья наблюдаются с разной периодичностью, но даже в стадии ремиссии воспалительный процесс в дыхательных путях сохраняется. В основе нарушения проходимости потока воздуха, при бронхиальной астме лежат следующие компоненты: обструкция дыхательных путей из-за спазмов гладкой мускулатуры бронхов или вследствие отека их слизистой оболочки; закупорка бронхов секретом подслизистых желез дыхательных путей из-за их гиперфункции; замещение мышечной ткани бронхов на соединительную при длительном течении заболевания, из-за чего возникают склеротические изменения в стенке бронхов.
В основе изменений бронхов лежит сенсибилизация организма, когда при аллергических реакциях немедленного типа, протекающих в виде анафилаксий, вырабатываются антитела, а при повторной встрече с аллергеном происходит мгновенное высвобождение гистамина, что и приводит к отеку слизистой бронхов и к гиперсекреции желез. Иммунокомплексные аллергические реакции и реакции замедленной чувствительности протекают аналогично, но с менее выраженными симптомами. Повышенное количество ионов кальция в крови человека в последнее время тоже рассматривается как предрасполагающий фактор, так как избыток кальция может провоцировать спазмы, в том числе и спазмы мускулатуры бронхов.
При патологоанатомическом исследовании умерших во время приступа удушья отмечается полная или частичная закупорка бронхов вязкой густой слизью и эмфизематозное расширение легких из-за затрудненного выдоха. Микроскопия тканей чаще всего имеет сходную картину – это утолщенный мышечный слой, гипертрофированные бронхиальные железы, инфильтративные стенки бронхов с десквамацией эпителия.
Микроскопия тканей чаще всего имеет сходную картину – это утолщенный мышечный слой, гипертрофированные бронхиальные железы, инфильтративные стенки бронхов с десквамацией эпителия.
Классификация
БА подразделяется по этиологии, тяжести течения, уровню контроля и другим параметрам. По происхождению выделяют аллергическую (в т. ч. профессиональную БА), неаллергическую (в т. ч. аспириновую БА), неуточненную, смешанную бронхиальную астму. По степени тяжести различают следующие формы БА:
- Интермиттирующая (эпизодическая). Симптомы возникают реже одного раза в неделю, обострения редкие и короткие.
- Персистирующая (постоянного течения). Делится на 3 степени:
- легкая — симптомы возникают от 1 раза в неделю до 1 раза в месяц
- средняя — частота приступов ежедневная
- тяжелая — симптомы сохраняются практически постоянно.
В течении астмы выделяют обострения и ремиссию (нестабильную или стабильную). По возможности контроля над пристпуами БА может быть контролируемой, частично контролируемой и неконтролируемой. Полный диагноз пациента с бронхиальной астмой включает в себя все вышеперечисленные характеристики. Например, «Бронхиальная астма неаллергического происхождения, интермиттирующая, контролируемая, в стадии стабильной ремиссии».
Симптомы бронхиальной астмы
Приступ удушья при бронхиальной астме делится на три периода: период предвестников, период разгара и период обратного развития. Период предвестников наиболее выражен у пациентов с инфекционно-аллергической природой БА, он проявляется вазомоторными реакциями со стороны органов носоглотки (обильные водянистые выделения, непрекращающееся чихание). Второй период (он может начаться внезапно) характеризуется ощущением стесненности в грудной клетке, которое не позволяет дышать свободно. Вдох становится резким и коротким, а выдох наоборот продолжительным и шумным.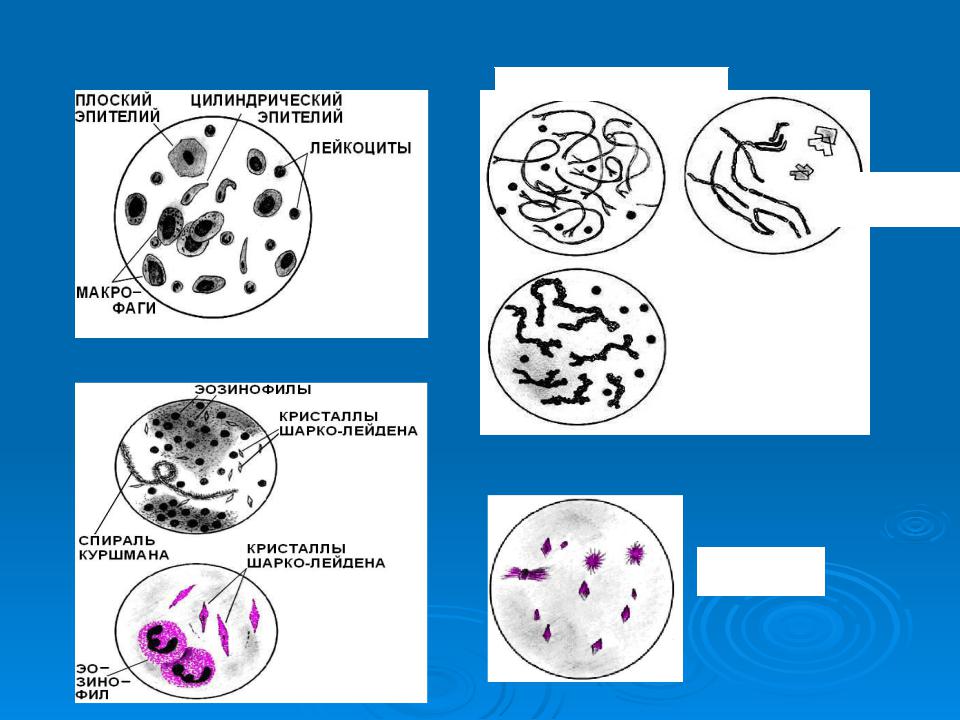 Дыхание сопровождается громкими свистящими хрипами, появляется кашель с вязкой, трудно отхаркиваемой мокротой, что делает дыхание аритмичным.
Дыхание сопровождается громкими свистящими хрипами, появляется кашель с вязкой, трудно отхаркиваемой мокротой, что делает дыхание аритмичным.
Во время приступа положение пациента вынужденное, обычно он старается принять сидячее положение с наклоненным вперед корпусом, и найти точку опоры или опирается локтями в колени. Лицо становится одутловатым, а во время выдоха шейные вены набухают. В зависимости от тяжести приступа можно наблюдать участие мышц, которые помогают преодолеть сопротивление на выдохе. В периоде обратного развития начинается постепенное отхождение мокроты, количество хрипов уменьшается, и приступ удушья постепенно угасает.
Проявления, при которых можно заподозрить наличие бронхиальной астмы.
- высокотональные свистящие хрипы при выдохе, особенно у детей.
- повторяющиеся эпизоды свистящих хрипов, затрудненного дыхания, чувства стеснения в грудной клетке и кашель, усиливающийся в ночной время.
- сезонность ухудшений самочувствия со стороны органов дыхания
- наличие экземы, аллергических заболеваний в анамнезе.
- ухудшение или возникновение симптоматики при контакте с аллергенами, приеме препаратов, при контакте с дымом, при резких изменениях температуры окружающей среды, ОРЗ, физических нагрузках и эмоциональных напряжениях.
- частые простудные заболевания «спускающиеся» в нижние отделы дыхательных путей.
- улучшение состояние после приема антигистаминных и противоастматических препаратов.
Осложнения
В зависимости от тяжести и интенсивности приступов удушья бронхиальная астма может осложняться эмфиземой легких и последующим присоединением вторичной сердечно-легочной недостаточности. Передозировка бета-адреностимуляторов или быстрое снижение дозировки глюкокортикостероидов, а так же контакт с массивной дозой аллергена могут привести к возникновению астматического статуса, когда приступы удушья идут один за другим и их практически невозможно купировать. Астматический статус может закончиться летальным исходом.
Астматический статус может закончиться летальным исходом.
Диагностика
Диагноз обычно ставится клиницистом-пульмонологом на основании жалоб и наличия характерной симптоматики. Все остальные методы исследования направлены на установление степени тяжести и этиологии заболевания. При перкуссии звук ясный коробочный из-за гипервоздушности легких, подвижность легких резко ограничена, а их границы смещены вниз. При аускультации над легкими прослушивается везикулярное дыхание, ослабленное с удлиненным выдохом и с большим количеством сухих свистящих хрипов. Из-за увеличения легких в объеме, точка абсолютной тупости сердца уменьшается, тоны сердца приглушенные с акцентом второго тона над легочной артерией. Из инструментальных исследований проводится:
- Спирометрия. Спирография помогает оценить степень обструкции бронхов, выяснить вариабельность и обратимость обструкции, а так же подтвердить диагноз. При БА форсированный выдох после ингаляции бронхолитиком за 1 секунду увеличивается на 12% (200мл) и более. Но для получения более точной информации спирометрию следует проводить несколько раз.
- Пикфлоуметрия. Измерение пиковой активности выдоха (ПСВ) позволяет проводить мониторинг состояния пациента, сравнивая показатели с полученными ранее. Увеличение ПСВ после ингаляции бронхолитика на 20% и более от ПСВ до ингаляции четко свидетельствует о наличии бронхиальной астмы.
Дополнительная диагностика включает в себя проведение тестов с аллергенами, ЭКГ, бронхоскопию и рентгенографию легких. Лабораторные исследования крови имеют большое значение в подтверждении аллергической природы бронхиальной астмы, а так же для мониторинга эффективности лечения.
- Анализа крови. Изменения в ОАК — эозинофилия и незначительное повышение СОЭ — определяются только в период обострения. Оценка газового состава крови необходима во время приступа для оценки тяжести ДН.
 Биохимический анализ крови не является основным методом диагностики, так как изменения носят общий характер и подобные исследования назначаются для мониторинга состояния пациента в период обострения.
Биохимический анализ крови не является основным методом диагностики, так как изменения носят общий характер и подобные исследования назначаются для мониторинга состояния пациента в период обострения. - Общий анализ мокроты. При микроскопии в мокроте можно обнаружить большое количество эозинофилов, кристаллы Шарко-Лейдена (блестящие прозрачные кристаллы, образующиеся после разрушения эозинофилов и имеющие форму ромбов или октаэдров), спирали Куршмана (образуются из-за мелких спастических сокращений бронхов и выглядят как слепки прозрачной слизи в форме спиралей). Нейтральные лейкоциты можно обнаружить у пациентов с инфекционно-зависимой бронхиальной астмой в стадии активного воспалительного процесса. Так же отмечено выделение телец Креола во время приступа – это округлые образования, состоящие из эпителиальных клеток.
- Исследование иммунного статуса. При бронхиальной астме количество и активность Т-супрессоров резко снижается, а количество иммуноглобулинов в крови увеличивается. Использование тестов для определения количества иммуноглобулинов Е важно в том случае, если нет возможности провести аллергологические тесты.
Лечение бронхиальной астмы
Поскольку бронхиальная астма является хроническим заболеванием вне зависимости от частоты приступов, то основополагающим моментом в терапии является исключение контакта с возможными аллергенами, соблюдение элиминационных диет и рациональное трудоустройство. Если же удается выявить аллерген, то специфическая гипосенсибилизирующая терапия помогает снизить реакцию организма на него.
Для купирования приступов удушья применяют бета-адреномиметики в форме аэрозоля, для того чтобы быстро увеличить просвет бронхов и улучшить отток мокроты. Это фенотерола гидробромид, сальбутамол, орципреналин. Доза в каждом случае подбирается индивидуально. Так же хорошо купируют приступы препараты группы м-холинолитиков – аэрозоли ипратропия бромида и его комбинации с фенотеролом.
Ксантиновые производные пользуются среди больных бронхиальной астмой большой популярностью. Они назначаются для предотвращения приступов удушья в виде таблетированных форм пролонгированного действия. В последние несколько лет препараты, которые препятствуют дегрануляции тучных клеток, дают положительный эффект при лечении бронхиальной астмы. Это кетотифен, кромогликат натрия и антагонисты ионов кальция.
При лечении тяжелых форм БА подключают гормональную терапию, в глюкокортикостероидах нуждается почти четверть пациентов, 15-20 мг Преднизолона принимают в утренние часы вместе с антацидными препаратами, которые защищают слизистую желудка. В условиях стационара гормональные препараты могут быть назначены в виде инъекций. Особенность лечения бронхиальной астмы в том, что нужно использовать лекарственные препараты в минимальной эффективной дозе и добиваться еще большего снижения дозировок. Для лучшего отхождения мокроты показаны отхаркивающие и муколитические препараты.
Прогноз и профилактика
Течение бронхиальной астмы состоит из череды обострений и ремиссий, при своевременном выявлении можно добиться устойчивой и длительной ремиссии, прогноз же зависит в большей степени от того, насколько внимательно пациент относится к своему здоровью и соблюдает предписания врача. Большое значение имеет профилактика бронхиальной астмы, которая заключается в санации очагов хронической инфекции, борьбе с курением, а так же в минимизации контактов с аллергенами. Это особенно важно для людей, которые входят в группу риска или имеют отягощенную наследственность.
Источник: https://www.krasotaimedicina.ru/diseases/zabolevanija_pulmonology/asthma
ученых (дис) раскрывают вековую тайну лечения астмы и воспаления дыхательных путей — ScienceDaily
Бельгийские исследовательские группы из VIB, Гентского университета, университетской больницы Гента и биотехнологической компании argenx решили вековую загадку о проблеме наличие кристаллов протеина при астме. Обычно белки не кристаллизуются в организме, но в некоторых случаях этот процесс действительно происходит. Кристаллы Шарко-Лейдена сделаны из белка галектина-10 и были обнаружены в дыхательных путях астматиков еще в 1853 году.Однако ученые в основном игнорировали кристаллы, и их реальная связь с болезнью осталась неизвестной. Бельгийские исследовательские группы установили, что кристаллов в слизи дыхательных путей очень много, они стимулируют иммунную систему и способствуют воспалению и изменению выработки слизи, которые часто наблюдаются в дыхательных путях у астматиков. Вместе ученые и ученые компании также разработали антитела, которые могут растворять эти кристаллы, чтобы уменьшить основные признаки астмы. Такие антитела могут стать первоклассными терапевтическими средствами, которые обращают вспять кристаллы белка и лечат астму и другие хронические воспалительные заболевания дыхательных путей.Исследование опубликовано в ведущем журнале Science .
Обычно белки не кристаллизуются в организме, но в некоторых случаях этот процесс действительно происходит. Кристаллы Шарко-Лейдена сделаны из белка галектина-10 и были обнаружены в дыхательных путях астматиков еще в 1853 году.Однако ученые в основном игнорировали кристаллы, и их реальная связь с болезнью осталась неизвестной. Бельгийские исследовательские группы установили, что кристаллов в слизи дыхательных путей очень много, они стимулируют иммунную систему и способствуют воспалению и изменению выработки слизи, которые часто наблюдаются в дыхательных путях у астматиков. Вместе ученые и ученые компании также разработали антитела, которые могут растворять эти кристаллы, чтобы уменьшить основные признаки астмы. Такие антитела могут стать первоклассными терапевтическими средствами, которые обращают вспять кристаллы белка и лечат астму и другие хронические воспалительные заболевания дыхательных путей.Исследование опубликовано в ведущем журнале Science .
Кристаллы и болезнь
В 1853 году Жан-Мартен Шарко из знаменитой больницы Сальпетриер в Париже сообщил о подробных рисунках бипирамидных кристаллов, которые он наблюдал в мокроте пациентов, страдающих астмой; это наблюдение также сделал Эрнст фон Лейден в 1872 году. Эти кристаллические отложения стали широко распространенными. в мире медицины известны как кристаллы Шарко-Лейдена (CLC). С тех пор они были описаны при широко распространенных хронических аллергических и воспалительных заболеваниях, таких как астма, бронхит, аллергический ринит и риносинусит.Однако только в течение последних двух десятилетий было подтверждено, что содержание CLC состоит из белка галектина-10, что окончательно развеяло предположения и споры, которые длились почти полтора века. Галектин-10 — один из самых распространенных белков в эозинофилах, которые помогают вызывать воспалительную реакцию у людей. Удивительно, но Gal10 остается в значительной степени растворимым в эозинофилах и образует кристаллы только после того, как высвобождается в качестве части иммунологической защиты. Функция Gal10 также оставалась неуловимой.
Функция Gal10 также оставалась неуловимой.
Причиняют ли эти кристаллы вред?
Под руководством Эммы Перссон, Кеннета Верстрете и Инес Хейндрикс группа исследователей намеревалась проверить давнюю неразрешенную гипотезу: стимулируют ли ХЛК иммунитет в легких и способствуют ли чрезмерные воспалительные реакции, ведущие к болезни?
Проф. Барт Ламбрехт (VIB-UGent): «Каждый врач узнает о кристаллах Шарко-Лейдена во время медицинского обучения, и каждый ассоциирует такие кристаллы с присутствием эозинофилов.Они очень часто обнаруживаются в мокроте у больных астмой, особенно у пациентов с тяжелым заболеванием. Тем не менее, никто не знал, что делают эти кристаллы и почему они вообще существуют. По аналогии с болезнью подагры, когда кристаллы мочевой кислоты вызывают очень болезненный приступ воспаления суставов, мы пришли к выводу, что кристаллы Шарко-Лейдена могут также причинить вред легким больных астмой »
Кристаллы по сравнению с раствором
Чтобы проверить эту идею, пришлось преодолеть множество технических проблем.Ученым пришлось найти способ производить миллионы кристаллов Gal10 в лаборатории для исследовательских целей, и они установили, что они идентичны ХПК, обнаруженным у пациентов. Исследователи использовали драгоценные кристаллы, полученные от пациентов, чтобы определить трехмерную структуру Gal10 вплоть до атомного масштаба. Это обеспечило своего рода ответ «святого Грааля», который подтвердил, что экспериментально полученные CLC идентичны CLC, полученным от пациентов.
Проф. Саввас Саввидес (VIB-UGent): «Впервые в биохимической и медицинской истории кристаллы белка, полученные от пациентов, изучаются с атомным разрешением.Совершенно замечательно, что такие микроскопические кристаллы размером всего несколько микрометров (около одной тысячной миллиметра) пережили трудоемкий и суровый экспериментальный путь, который начался в операционной больницы и закончился на специализированном рентгеновском луче Европейский центр синхротронного излучения. И в довершение всего они предоставили данные, которые привели к красивой трехмерной структуре молекул белка внутри них ».
И в довершение всего они предоставили данные, которые привели к красивой трехмерной структуре молекул белка внутри них ».
Исследователи обнаружили, что Gal10 вызывал полноценный иммунный ответ только тогда, когда находился в кристаллическом состоянии.В растворе Gal10 был безвреден. Что наиболее важно, кристаллический Gal10 в форме кристаллов Шарко-Лейдена вызывал ключевые особенности астмы, включая образование измененной слизи, что является большой проблемой для большинства астматиков. Таким образом, исследование уже привело к серьезному прорыву с кристально четкими выводами.
Ищу решение
Затем группа исследовала, может ли вмешательство в образование ХЛК быть терапевтическим вариантом для астматиков. Именно здесь на помощь пришла гентская биотехнологическая компания argenx.Объединенные бригады разработали антитела, которые могут специфично реагировать против ХЛК. Примечательно, что антитела были способны растворять CLC в течение нескольких минут в чашке Петри в лаборатории и в течение нескольких часов в слизи пациентов (также in vitro). Использование этих антител в мышиных моделях астмы приводит к сильному уменьшению воспаления легких, изменений функции легких и выработки слизи.
Профессор Саввидес: «Это было похоже на демонстрацию молекулярной магии« теперь вы видите это, а теперь нет ». Я провел 25 лет, изучая и мучаясь о том, как выращивать кристаллы белка для структурной биологии, и внезапно , Я наблюдал, как кристаллы протеина растворяются в реальном времени! И в довершение всего, мы также должны были визуализировать, как эти антитела на самом деле творит чудеса, определяя их кристаллическую структуру в комплексе со своим антигеном! »
Проф.Барт Ламбрехт: «Результаты нашего исследования были неожиданными и в то же время кристально ясными. Я был полностью поражен тем фактом, что антитела могут быстро растворять ХЛК, которые в большом количестве присутствуют в нативной слизи пациентов. Хотя необходимы дополнительные тесты, данные на моделях мышей предполагают, что использование этих антител может быть очень эффективным способом уменьшения чрезмерного воспаления и накопления слизи в легких у пациентов с астмой. Поскольку в настоящее время нет лекарств, направленных на накопление слизи в дыхательных путях, это может изменить правила игры для лечить это заболевание.«
Поскольку в настоящее время нет лекарств, направленных на накопление слизи в дыхательных путях, это может изменить правила игры для лечить это заболевание.«
Ученые разрабатывают антитела для лечения выработки слизи у пациентов с астмой
Астма — это заболевание, поражающее легкие и особенно дыхательные пути. Это вызывает воспаление и опухание внутренних дыхательных путей. В результате слизистые оболочки бронхов выделяют вязкую слизь, что приводит к резкому сужению дыхательных путей — так называемой бронхиальной обструкции — и к одышке и различным другим жалобам у пораженных людей.
По данным Немецкой службы Lungeninformationsservice, число взрослых, страдающих астмой, в Германии за последние годы увеличилось на 35 процентов.До сих пор предполагалось, что дети особенно страдают от этого заболевания — бронхиальная астма является наиболее распространенным хроническим заболеванием в детском возрасте. От семи до десяти процентов детей страдают астмой. Однако, согласно последним исследованиям, частота астмы у взрослых значительно увеличилась за период наблюдения с 2009 по 2016 год. С 4,3 процента в 2009 году до 5,9 процента в 2016 году. Исследователи отметили, что примерно на 25 процентов больше людей в крупных городах получали лечение. для астмы, чем в сельской местности.К счастью, уровень смертности от астмы довольно низкий. Тем не менее, в Германии от этой болезни по-прежнему умирают от четырех до восьми человек на 100 000 жителей. В среднем в Центральной Европе приходится от одной до восьми смертей на 100 000 жителей.
Charcot-Leyden Crytal © commons.wikimedia.org / wiki / Файл: Charcot-Leyden_crystals_in_airway-_Asthma.jpg
Кристаллы и образование слизи
Судя по всему, бельгийские исследователи нашли способ уменьшить выработку слизи. Они разработали антитело, которое растворяет кристаллы Шарко-Лейдена, которые образуются на слизистой оболочке во время бронхиальной астмы.Спустя более ста лет после их открытия эти кристаллы все еще не привлекали особого внимания и рассматривались просто как «маркеры эозинофильных воспалений, не имеющих особого значения для болезни».
Еще в 1853 году парижский врач Жан-Мартен Шарко сделал подробные наброски бипирамидных кристаллов, которые он наблюдал в мокроте пациентов, страдающих астмой. В 1872 году эти наблюдения подтвердил терапевт Эрнст Виктор фон Лейден. Отсюда и название кристаллы Шарко-Лейдена.В 1993 году ученые обнаружили, что кристаллы, по всей видимости, состоят из белка — галектина-10. Галектин-10 — один из самых распространенных белков в эозинофилах, которые помогают вызывать воспалительную реакцию у людей.
Группа под руководством профессора Барта Ламбрехта из VIB Университета Гента пересмотрела медицинское значение кристаллов. В лаборатории они получили кристаллы с той же структурой, что и кристаллы Шарко-Лейдена. Затем эти кристаллы вводили в дыхательные пути мышей.В результате возникло астматическое воспаление с повышенной выработкой слизи у животных. Животные, получавшие вариант галектина-10, не проявляли этой реакции.
© Pixabay
Успех в мышах
«Каждый врач узнает о кристаллах Шарко-Лейдена во время медицинского обучения, и каждый ассоциирует такие кристаллы с присутствием эозинофилов. Они очень часто обнаруживаются в мокроте у больных астмой, особенно у пациентов с тяжелым заболеванием. Тем не менее, никто на самом деле не знал, что делают эти кристаллы и почему они вообще существуют », — объясняет проф.Lambrecht. «По аналогии с заболеванием подагрой, когда кристаллы мочевой кислоты вызывают очень болезненный приступ воспаления суставов, мы пришли к выводу, что кристаллы Шарко-Лейдена также могут нанести вред легким больных астмой».
На следующем этапе исследователи получили антитело в чашке Петри. Он смог растворить кристаллы в лаборатории за несколько минут. Ученые объясняют, что лечение мышей, на которых моделировалось заболевание астмой у человека, привело к сильному снижению воспалительной реакции в дыхательных путях и уменьшению выработки слизи.
Основываясь на результатах экспериментов, исследователи теперь предполагают, что повышенное производство слизи могло быть попыткой организма уничтожить кристаллы Шарко-Лейдена. Если эта гипотеза окажется верной, лечение антителом может снизить выработку слизи.
Если эта гипотеза окажется верной, лечение антителом может снизить выработку слизи.
«Результаты нашего исследования были неожиданными и в то же время кристально ясными. Меня полностью поразил тот факт, что антитела могут быстро растворять ХЛК, которые в большом количестве присутствуют в нативной слизи пациентов », — говорит Ламбрехт.«Хотя необходимы дополнительные тесты, данные на моделях мышей предполагают, что использование этих антител может быть очень эффективным способом уменьшения чрезмерного воспаления и накопления слизи в легких у пациентов с астмой. Поскольку в настоящее время нет лекарств, направленных на накопление слизи в дыхательных путях, это может изменить правила игры для лечения этого заболевания ».
Отчет ученых опубликован в журнале Science.
Вам также могут понравиться:
Виноваты ли «перекормленные бактерии» в болезнях цивилизации?
Ученые раскрыли вековую загадку по лечению астмы и воспаления дыхательных путей
Кристаллы Шарко-Лейдена Авторы и права: © VIB Bioimaging Core_Amanda Concalves
Бельгийские исследовательские группы из VIB, Университета Гента, Университетской больницы Гента и биотехнологической компании Argenx решили вековую загадку о присутствии кристаллов протеина при астме.Обычно белки не кристаллизуются в организме, но в некоторых случаях этот процесс действительно происходит. Кристаллы Шарко-Лейдена состоят из белка галектина-10 и были обнаружены в дыхательных путях астматиков еще в 1853 году.
Однако ученые в основном игнорировали кристаллы, и их реальная связь с болезнью осталась неизвестной. Бельгийские исследовательские группы установили, что кристаллов в слизи дыхательных путей очень много, они стимулируют иммунную систему и способствуют воспалению и изменению выработки слизи, которые часто наблюдаются в дыхательных путях у астматиков. Вместе ученые и ученые компании также разработали антитела, которые могут растворять эти кристаллы, чтобы уменьшить основные признаки астмы. Такие антитела могут стать первоклассными терапевтическими средствами, которые обращают вспять кристаллы белка и лечат астму и другие хронические воспалительные заболевания дыхательных путей. Исследование опубликовано в ведущем журнале Science .
Вместе ученые и ученые компании также разработали антитела, которые могут растворять эти кристаллы, чтобы уменьшить основные признаки астмы. Такие антитела могут стать первоклассными терапевтическими средствами, которые обращают вспять кристаллы белка и лечат астму и другие хронические воспалительные заболевания дыхательных путей. Исследование опубликовано в ведущем журнале Science .
Кристаллы и болезнь
В 1853 году Жан-Мартен Шарко из знаменитой больницы Сальпетриер в Париже сообщил о подробных рисунках бипирамидных кристаллов, которые он наблюдал в мокроте пациентов, страдающих астмой; это наблюдение также сделал Эрнст фон Лейден в 1872 году.Эти кристаллические отложения стали широко известны в мире медицины как кристаллы Шарко-Лейдена (ХЖК).
С тех пор они были описаны при широко распространенных хронических аллергических и воспалительных заболеваниях, таких как астма, бронхит, аллергический ринит и риносинусит. Однако только в течение последних двух десятилетий ученые подтвердили, что состав CLC состоит из галектина-10, что окончательно разрешило споры, которые длились почти полтора века. Галектин-10 — один из самых распространенных белков в эозинофилах, которые помогают вызывать воспалительную реакцию у людей.Удивительно, но Gal10 остается в значительной степени растворимым в эозинофилах и образует кристаллы только после того, как высвобождается в качестве части иммунологической защиты. Функция Gal10 также оставалась неуловимой.
Причиняют ли эти кристаллы вред?
Под руководством Эммы Перссон, Кеннета Верстрете и Инес Хейндрикс группа исследователей намеревалась проверить давнюю неразрешенную гипотезу: стимулируют ли ХЛК иммунитет в легких и способствуют ли чрезмерные воспалительные реакции, ведущие к заболеванию?
Проф.Барт Ламбрехт (VIB-UGent) сказал: «Каждый врач узнает о кристаллах Шарко-Лейдена во время медицинского обучения, и каждый ассоциирует такие кристаллы с присутствием эозинофилов. Они очень часто обнаруживаются в мокроте пациентов с астмой, особенно у пациентов с тяжелое заболевание. Тем не менее, никто не знал, что делают эти кристаллы и почему они вообще существуют. По аналогии с подагрой, когда кристаллы мочевой кислоты вызывают очень болезненный приступ воспаления суставов, мы предположили, что кристаллы Шарко-Лейдена также могут вызывать вред в легких больных астмой.«
Они очень часто обнаруживаются в мокроте пациентов с астмой, особенно у пациентов с тяжелое заболевание. Тем не менее, никто не знал, что делают эти кристаллы и почему они вообще существуют. По аналогии с подагрой, когда кристаллы мочевой кислоты вызывают очень болезненный приступ воспаления суставов, мы предположили, что кристаллы Шарко-Лейдена также могут вызывать вред в легких больных астмой.«
Растворение кристаллов Шарко-Лейдена. Предоставлено: VIB Bioimaging Core_Amanda Concalves
Кристаллы по сравнению с раствором
Ученые преодолели множество технических проблем, чтобы проверить эту идею. Им нужно было найти способ произвести в лаборатории миллионы кристаллов Gal10 для исследовательских целей и установить, что они идентичны CLC, обнаруженным у пациентов. Исследователи использовали кристаллы, полученные от пациентов, чтобы определить трехмерную структуру Gal10 вплоть до атомного масштаба.Это дало долгожданный ответ, подтверждающий, что экспериментально полученные CLC идентичны CLC, полученным от пациентов.
Проф. Саввас Саввидес (VIB-UGent): «Впервые в биохимической и медицинской истории кристаллы белка, полученные от пациентов, изучаются с атомным разрешением. Совершенно замечательно, что такие микроскопические кристаллы, размер которых составляет всего несколько микрометров в Размер (около одной тысячной миллиметра) выдержал трудоемкий и тяжелый экспериментальный путь, который начался в операционной больницы и закончился на специализированном рентгеновском канале европейского центра синхротронного излучения.И в довершение всего, они предоставили данные, которые привели к красивой трехмерной структуре молекул белка внутри них ».
Исследователи обнаружили, что Gal10 вызывал полноценный иммунный ответ только тогда, когда находился в кристаллическом состоянии. В растворе Gal10 был безвреден. Что наиболее важно, кристаллический Gal10 в форме кристаллов Шарко-Лейдена вызывал ключевые особенности астмы, включая образование измененной слизи, что является большой проблемой для большинства астматиков. Таким образом, исследование уже привело к серьезному прорыву с кристально четкими выводами.
Таким образом, исследование уже привело к серьезному прорыву с кристально четкими выводами.
Ищу решение
Затем группа исследовала, может ли вмешательство в образование ХЛК быть терапевтическим вариантом для астматиков. И тут вмешалась биотехнологическая компания Argenx из Гента. Объединенные группы разработали антитела, которые могут специфично реагировать против CLC. Примечательно, что антитела были способны растворять CLC в течение нескольких минут в чашке Петри в лаборатории и в течение нескольких часов в слизи пациентов (также in vitro). Использование этих антител в мышиных моделях астмы привело к сильному уменьшению воспаления легких, изменений функции легких и выработки слизи.
Профессор Саввидес сказал: «Это было похоже на демонстрацию молекулярной магии« теперь ты видишь, а теперь нет ». Я потратил 25 лет на изучение и мучения о том, как выращивать кристаллы белка для структурной биологии, и все такое. Внезапно я увидел растворение кристаллов протеина в реальном времени. И в довершение всего, мы также должны были визуализировать, как эти антитела на самом деле творит чудеса, определяя их кристаллическую структуру в комплексе с их антигеном ».
Профессор Барт Ламбрехт сказал: «Результаты нашего исследования были неожиданными и в то же время кристально ясными.Меня полностью поразил тот факт, что антитела могут быстро растворять ХЛК, которые в большом количестве присутствуют в нативной слизи пациентов. Хотя необходимы дополнительные тесты, данные на мышах предполагают, что использование этих антител может быть очень эффективным способом уменьшения чрезмерного воспаления и накопления слизи в легких у пациентов с астмой. Поскольку в настоящее время нет лекарств, направленных на накопление слизи в дыхательных путях, это может изменить правила игры для лечения этого заболевания ».
Исследователи открыли новый метод блокирования иммуносупрессии при раке.
Дополнительная информация:
«Кристаллизация белка способствует развитию иммунитета 2 типа и обратима при лечении антителами» Science (2019).science.sciencemag.org/cgi/doi… 1126 / science.aaw4295
Предоставлено
VIB (Институт биотехнологии Фландрии)
Ссылка :
Ученые разгадывают вековую загадку по лечению астмы и воспаления дыхательных путей (2019, 23 мая)
получено 26 марта 2021 г.
из https: // medicalxpress.ru / news / 2019-05-ученые-вековой-тайна-астма-airway.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
кристаллов Шарко-Лейдена активируют инфламмасому NLRP3 и вызывают воспаление IL-1β.
РЕФЕРАТ
Кристаллы Шарко-Лейдена (CLC) представляют собой кристаллы белка галектина-10, которые могут образовываться после дегранулы эозинофилов.ХЛК могут появляться и сохраняться в тканях пациентов с эозинофильными расстройствами, такими как астма, аллергические реакции, грибковые и глистные инфекции. Несмотря на многочисленные сообщения об их возникновении при заболеваниях человека, воспалительный потенциал CLC остается неизвестным. Здесь мы показываем, что CLC индуцируют высвобождение IL-1β при их поглощении первичными человеческими макрофагами in vitro, и что они вызывают воспаление in vivo на мышиных моделях острого перитонита и бронхита. CLC-индуцированный IL-1β зависел от NLRP3 и каспазы-1, и их закапывание в мышей-репортеров инфламмасом способствовало сборке комплексов ASC и секреции IL-1β в легких.Наши результаты показывают, что CLC распознаются инфламмасомой NLRP3, которая может поддерживать воспаление, которое следует за эозинофильными воспалительными процессами.
Несмотря на многочисленные сообщения об их возникновении при заболеваниях человека, воспалительный потенциал CLC остается неизвестным. Здесь мы показываем, что CLC индуцируют высвобождение IL-1β при их поглощении первичными человеческими макрофагами in vitro, и что они вызывают воспаление in vivo на мышиных моделях острого перитонита и бронхита. CLC-индуцированный IL-1β зависел от NLRP3 и каспазы-1, и их закапывание в мышей-репортеров инфламмасом способствовало сборке комплексов ASC и секреции IL-1β в легких.Наши результаты показывают, что CLC распознаются инфламмасомой NLRP3, которая может поддерживать воспаление, которое следует за эозинофильными воспалительными процессами.
ВВЕДЕНИЕ
Модификации физико-химических свойств определенных белков, липидов или метаболитов могут привести к фазовому переходу, ведущему к образованию кристаллов или нефизиологической агрегации (Franklin et al., 2016; Mulay and Anders, 2016). Кристаллы могут образовываться в тканях при отложении эндогенного материала, такого как минералы, холестерин и мочевая кислота.Они также могут поступать из экзогенных источников путем ингаляции (диоксид кремния, асбест, взвешенные в воздухе твердые частицы) или путем инъекций (медицинские наноматериалы, адъюванты вакцин) (Franklin et al., 2016). Кристаллические или агрегированные материалы воспринимаются клетками врожденного иммунитета, которые оснащены сигнальными рецепторами распознавания образов (PRR), кодируемыми зародышевой линией. Врожденные иммунные клетки исследуют ткани и удаляют накопленный внеклеточный материал, патогены и остатки гибели клеток. Чувствительность кристаллов вызывает сильные воспалительные реакции, свойство, которое использовалось для адъювантности вакцинных композиций.В то время как несколько мембраносвязанных PRR участвуют в распознавании и поглощении кристаллов (Tsugita et al., 2017; Sheedy et al., 2013), цитозольный PRR NLRP3 воспринимает чрезмерно фагоцитированные кристаллы. Активация NLRP3 вызывает образование инфламмасомы, которая приводит к активации и высвобождению провоспалительного цитокина интерлейкина-1 бета (IL-1β) (Hornung et al. , 2008; Duewell et al., 2010; Masters et al., 2010; Halle et al., 2008; Martinon et al., 2006b; Dostert et al., 2008). IL-1β играет важную роль в воспалительных заболеваниях, вызванных кристаллами, и вместе с NLRP3 представляет собой многообещающую терапевтическую мишень для ряда заболеваний, опосредованных кристаллами (Franklin et al., 2016; Мулай и Андерс, 2016).
, 2008; Duewell et al., 2010; Masters et al., 2010; Halle et al., 2008; Martinon et al., 2006b; Dostert et al., 2008). IL-1β играет важную роль в воспалительных заболеваниях, вызванных кристаллами, и вместе с NLRP3 представляет собой многообещающую терапевтическую мишень для ряда заболеваний, опосредованных кристаллами (Franklin et al., 2016; Мулай и Андерс, 2016).
Воспаление возникает не только в результате скопления кристаллов, но и само может способствовать кристаллизации. Во время воспаления иммунные клетки привлекаются к пораженной ткани. Среди них эозинофилы и базофилы играют важную роль в аллергических реакциях, грибковых и глистных инфекциях, а также в регуляции различных аутоиммунных заболеваний. Эти клетки могут вытеснять высокоцитотоксические белки из своих секреторных гранул, которые опосредуют заметные физиологические изменения, связанные с воспалением эозинофилов и базофилов.Преобладающим белком, присутствующим в эозинофильных и базофильных гранулах, является галектин-10 (LGASL10), также известный как белок Шарко-лейдена (Golightly et al., 1992; Archer and Blackwood, 1965). Галектин-10 может кластеризоваться и образовывать кристаллы Шарко-Лейдена (ХЖК), которые представляют собой бесцветные удлиненные гексагональные бипирамидальные структуры, которые могут достигать длины до 50 мкм. Со времени их первого сообщения, более 160 лет назад, было показано, что CLC спонтанно образуют in vitro из лизатов эозинофилов (Weller et al., 1980) и базофилов (Ackerman et al., 1982), и было обнаружено, что они накапливаются в тканях пациентов с астмой (Dor et al., 1984), грибковыми аллергическими реакциями (el-Hashimi, 1971; Katzenstein et al., 1983; DeShazo et al., 1997), глистные инфекции (Kaplan et al., 2001) и миелоидный лейкоз (Nashiro et al., 2016; van de Kerkhof et al., 2015; Manny and Ellis, 2012). Несмотря на многочисленные сообщения о появлении ХЛК в тканях пациентов с эозинофильными расстройствами, эти кристаллы по-прежнему рассматриваются как инертные остатки активности эозинофилов с нераспознанной иммунной функцией. Достижениям в этой области препятствует отсутствие подходящей модели на животных для изучения образования CLC in vivo . У мышей отсутствует ген LGASL10 , который кодирует галектин-10. Следовательно, еще предстоит продемонстрировать, являются ли ХЛК воспалительными in vitro и in vivo .
Достижениям в этой области препятствует отсутствие подходящей модели на животных для изучения образования CLC in vivo . У мышей отсутствует ген LGASL10 , который кодирует галектин-10. Следовательно, еще предстоит продемонстрировать, являются ли ХЛК воспалительными in vitro и in vivo .
Здесь мы показываем, что CLC быстро фагоцитируются in vitro человеческими макрофагами, и это приводит к высвобождению провоспалительного цитокина IL-1β. CLC-индуцированный IL-1β в макрофагах происходил за счет активации каспазы-1 после сборки инфламмасомы NLRP3.Кроме того, мы показываем, что CLCs способствовали воспалению in vivo , характеризующемуся инфильтрацией нейтрофилов, фагоцитозом кристаллов и высвобождением IL-1β. Кроме того, CLC индуцировали сборку инфламмасом (пятнышек ASC) in vivo после их инстилляции в легкие мышей-трансгенных репортеров ASC-mCitrine.
Наши результаты раскрывают иммуностимулирующие свойства CLC и проливают новый свет на вероятные последствия, вызванные воспалительными последствиями, которые следуют за инфильтрацией эозинофилов в тканях.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение и характеристика кристаллов Шарко-Лейдена
Чтобы исследовать воспалительный потенциал ХЛК, мы сначала получили ХЛК из цельноклеточных лизатов клеток AML14.3D10, субклона линии клеток AML14, созданной из 68-летний пациент с острым миелоидным лейкозом FAB M2 (Baumann and Paul, 1998). И родительская клеточная линия AML14, и субклон AML14.3D10 являются признанными инструментами для изучения биологии эозинофилов (Paul et al., 1994). Мы получили CLC in vitro путем инкубации предварительно очищенных лизатов клеток AML14.3D10 при 4 ° C в течение 16 часов (фиг. 1a и фиг. S1a), как описано ранее (Ackerman et al., 1980). Полученные кристаллы имели гексагональную бипирамидальную морфологию, характерную для ХЖК (рис. 1б). Окрашивание кумасси бриллиантовым синим геля, нагруженного кристаллами, денатурированными SDS, показало, что препараты CLC содержали в основном один белок (рис. 1c и рис. S1a), а иммуноблоттинг со специфическими mAb против галецина-10 показал, что препараты CLC состояли из Галектин-10 (рис.1d и рис. S1a).
1c и рис. S1a), а иммуноблоттинг со специфическими mAb против галецина-10 показал, что препараты CLC состояли из Галектин-10 (рис.1d и рис. S1a).
Рис. 1. Получение и характеристика ХЖК.
( a ) Схема генерации CLC из ячеек AML14.3D10. ( b ) Получение изображения репрезентативной чистой фракции ХЖК в широком поле, как показано в a . Масштабные линейки: 400 мкм. Вставка — это 20-кратное увеличение области, обведенной сверху. ( c ) окрашенный Кумасси белковый гель и ( d ) иммуноблоттинг галектина-10 репрезентативных фракций лизатов клеток AML14.3D10, неочищенных CLC и чистых CLC, которые были получены, как показано в a .Данные представляют два независимых эксперимента.
Фагоцитоз CLC ведет к секреции IL-1β макрофагами человека
Далее мы создали первичные макрофаги, происходящие из моноцитов человека (hMDM), дифференцированные от моноцитов CD14 + , выделенных из мононуклеарных клеток периферической крови (PBMC) из лейкоцитов здоровых людей. доноры. Эти клетки были примированы LPS и подвергнуты воздействию CLC, и их фагоцитарный потенциал против CLC оценивали с помощью микроскопии. Мы заметили, что hMDM быстро поглощают ХЖК различного размера (рис.2а и фильм S1).
Рис. 2 Фагоцитоз кристаллов Шарко-Лейдена (CLC) вызывает секрецию IL-1β макрофагами человека in vitro .
( a ) Конфокальная визуализация LPS-примированных (2 нг / мл, в течение 3 часов) первичных макрофагов человека (hMDM), стимулированных очищенными CLC в течение 6 часов. Плазменная мембрана (красный, WGA-AF555), ядра (синий, DRAQ5) и ХЖК (зеленый, отражение лазера). Масштабные линейки (левая панель 4 мкм и правая панель 8 мкм). Данные взяты из одного представителя из трех независимых экспериментов.(b ) Измерение HTRF IL-1β и TNFα из супернатантов hMDM, которые были либо оставлены необработанными, примированными LPS, либо примированными LPS и стимулированными в течение 6 часов с указанными соотношениями CLC / макрофаг или указанными концентрациями кристаллов кремнезема, кристаллов холестерина или в течение 1,5 часов с нигерицином (Nig). Каждый символ представляет значения из hMDM, генерируемых разными донорами. Столбцы представляют собой среднее значение и SEM объединенных данных из четырех независимых экспериментов с различными препаратами CLC.( c ) Измерение HTRF IL-1β в hMDM, примированных, как в и , и стимулированных CLC (2 на ячейку) или кристаллами кремнезема (100 мкг / мл) в указанные моменты времени. Столбцы представляют собой среднее и стандартное отклонение объединенных данных двух независимых экспериментов. Каждый символ представляет значения от разных доноров. ( d ) Конфокальная визуализация hMDM, примированных LPS, которые были предварительно обработаны или не обработаны 5 мкл цитохалазина D, за 30 минут до инкубации с CLC (2 на клетку). ( e ) HTRF-измерение IL-1β из супернатантов LPS-примированных hMDM, которые были предварительно обработаны возрастающими концентрациями цитохалазина D (0, 0.3, 0,6, 1,25, 2,5 или 5 мкМ). Столбцы представляют собой среднее значение и SEM объединенных данных трех независимых экспериментов. Каждый символ представляет значения от разных доноров. ( f ) HTRF-измерение IL-1β из супернатантов LPS-примированных hMDM, которые были предварительно обработаны возрастающими концентрациями ингибитора катепсина-B CA-074 Me (0, 1,25, 2,5, 5, 10, 15 мкМ ). Столбцы представляют собой среднее значение и SEM объединенных данных трех независимых экспериментов. Каждый символ представляет значения от разных доноров.
Каждый символ представляет значения из hMDM, генерируемых разными донорами. Столбцы представляют собой среднее значение и SEM объединенных данных из четырех независимых экспериментов с различными препаратами CLC.( c ) Измерение HTRF IL-1β в hMDM, примированных, как в и , и стимулированных CLC (2 на ячейку) или кристаллами кремнезема (100 мкг / мл) в указанные моменты времени. Столбцы представляют собой среднее и стандартное отклонение объединенных данных двух независимых экспериментов. Каждый символ представляет значения от разных доноров. ( d ) Конфокальная визуализация hMDM, примированных LPS, которые были предварительно обработаны или не обработаны 5 мкл цитохалазина D, за 30 минут до инкубации с CLC (2 на клетку). ( e ) HTRF-измерение IL-1β из супернатантов LPS-примированных hMDM, которые были предварительно обработаны возрастающими концентрациями цитохалазина D (0, 0.3, 0,6, 1,25, 2,5 или 5 мкМ). Столбцы представляют собой среднее значение и SEM объединенных данных трех независимых экспериментов. Каждый символ представляет значения от разных доноров. ( f ) HTRF-измерение IL-1β из супернатантов LPS-примированных hMDM, которые были предварительно обработаны возрастающими концентрациями ингибитора катепсина-B CA-074 Me (0, 1,25, 2,5, 5, 10, 15 мкМ ). Столбцы представляют собой среднее значение и SEM объединенных данных трех независимых экспериментов. Каждый символ представляет значения от разных доноров.
Провоспалительный цитокин IL-1β является ключевым фактором индуцированного кристаллами воспаления при нескольких хронических воспалительных заболеваниях (Hornung et al., 2008; Duewell et al., 2010; Masters et al., 2010; Halle et al. , 2008; Martinon et al., 2006b; Dostert et al., 2008). Таким образом, мы исследовали, приводит ли фагоцитоз CLC к высвобождению IL-1β hMDM. Мы обнаружили, что, подобно хорошо известным активаторам инфламмасом кремнезема и кристаллам холестерина, воздействие на LPS-примированные hMDMs CLC приводило к дозозависимому и зависящему от времени высвобождению IL-1β из этих клеток (рис.2б-в). Подобно сообщениям с использованием других кристаллов, примирование LPS требовалось для высвобождения IL-1β с помощью in vitro CLC-стимулированных hMDM (таблица S1). Важно отметить, что фагоцитоз требовался для индуцированного CLCs высвобождения IL-1β с помощью hMDM in vitro , поскольку обработка клеток ингибитором полимеризации актина цитохалазином D нарушала их фагоцитарную активность и уменьшала их способность высвобождать IL-1β в ответ на стимуляцию CLC ( Рис. 2d-e). Как и ожидалось, цитохалазин D ингибировал высвобождение IL-1β, опосредованное кристаллами диоксида кремния, в то время как реакция на нигерицин, растворимый активатор инфламмасом, который действует как антипортер H + и K + , осталась неизменной.
CLCs-индуцированное высвобождение IL-1β
in vitro зависит от активации NLRP3
Фагоцитоз кристаллического материала и нерастворимых белковых агрегатов может в конечном итоге привести к повреждению лизосом и высвобождению содержимого лизосом в цитозоль клетки. Лизосомное повреждение может активировать NLRP3, который затем рекрутирует адаптерный белок ASC и каспазу-1, белковый комплекс, который делает возможным созревание про-ИЛ-1β за счет протеолиза, опосредованного каспазой-1 (Hornung et al., 2008). Чтобы выяснить, участвует ли лизосомное повреждение в индуцированной CLC активации инфламмасом, мы предварительно обработали hMDM CA-074 Me, соединением, которое ингибирует активацию NLRP3, опосредованную лизосомным повреждением (Hornung et al., 2008). Действительно, ингибирование CA-074 Me блокировало индуцированное CLC высвобождение IL-1β дозозависимым образом (рис. 2f), предполагая, что лизосомное повреждение является вероятным механизмом, с помощью которого CLC могут индуцировать секрецию IL-1β макрофагами. Сборка инфламмасом может быть визуализирована с помощью перехода ASC из диффузной цитозольной локализации в точечную структуру, называемую пятнышком ASC (Stutz et al., 2013; Hoss et al., 2017). Поэтому мы выполнили иммунофлуоресцентное окрашивание ASC в LPS-примированных hMDM, стимулированных CLC.Используя конъюгированные с флуорохромом антитела против ASC или соответствующие изотипу конъюгированные с флуорохромом IgG, мы выявили образование пятен ASC в hMDM, которые фагоцитируют CLC in vitro (рис. 3a).
Рис. 3 CLC активируют инфламмасому NLRP3 в макрофагах человека.
( a ) Конфокальная визуализация LPS-примированных (2 нг / мл, в течение 3 часов) hMDM, стимулированных CLC (2 на макрофаг) в течение 6 часов. Клетки фиксировали и окрашивали непосредственно меченным Alexa Fluor 647 (AF647) антителом против ASC или равными количествами контрольных mAb изотипа AF647-IgG.Плазменная мембрана (красный, WGA-AF555), ядро (темно-синий, Hoechst 34580), ASC (зеленый, AF647) и ХЖК (голубой, отражение лазера). Данные представляют два независимых эксперимента. (b ) Измерение HTRF IL-1β в LPS-примированных (2 нг / мл, 3 часа) макрофагах человека, которые не подвергались обработке или дополнительно стимулировались CLC (2 на макрофаг, 6 часов), кристаллами кремнезема (100 мкг / мл, 6 часов), кристаллы холестерина (250 мкг / мл, 6 часов), нигерицин (10 мкМ, 1,5 часа) или PrgI (2 мкг / мл, 3 часа) вместе с LFn-PA (0.5 мкг / мл) в присутствии возрастающих концентраций ингибитора NLRP3 CRID3 (0, 2,5, 5 или 10 мкМ) или ингибитора каспазы-1 VX-765 (0, 5, 10 или 30 мкМ). Столбцы представляют собой среднее значение и SEM объединенных данных из пяти независимых экспериментов. Каждый символ представляет значения от разных доноров. Те же самые точки данных IL-1β для обработанных CLC hMDM в отсутствие ингибиторов представлены в b и c .
В соответствии с ролью инфламмасомы NLRP3 во внутриклеточном восприятии CLC, специфическое ингибирование NLRP3 и каспазы-1 с помощью соединений CRID3 (Coll et al., 2015) и VX-765, соответственно, подавляли индуцированное CLC высвобождение IL-1β с помощью hMDMs (рис. 3b-c). Напротив, ответ на активацию инфламмасомы NAIP-NLRC4, тестируемый посредством доставки игольчатого белка системы секреции острова 1 патогенности 1 типа III (PrgI) Salmonella в цитозоль, не подвергался влиянию ингибитора NLRP3 CRID3, демонстрируя специфичность. . Эти данные показывают, что, подобно кремнезему (Hornung et al., 2008), мочевой кислоте (Martinon et al., 2006a) и кристаллам холестерина (Duewell et al., 2010), CLC индуцируют активацию IL-1β и высвобождение из hMDMs путем активации инфламмасомы NLRP3.
ХЛК индуцируют активацию инфламмасом
in vivo
Одной из основных функций цитокинов семейства IL-1 является индукция рекрутирования иммунных клеток, таких как нейтрофилы и моноциты, что ограничивает распространение инфекции и инициирует восстановление тканей (Dinarello , 2009). Активация инфламмасомы in vivo характеризуется сильной инфильтрацией нейтрофилов в ткани (Satoh et al., 2013), а тканевая нейтрофилия — отличительный признак аутовоспалительных заболеваний, вызванных IL-1 (Bonar et al., 2012; Broderick et al., 2015). Поэтому мы использовали хорошо зарекомендовавшую себя модель перитонита у мышей (Yanagida et al., 2013; Duewell et al., 2010; Hornung et al., 2008), чтобы оценить, способствуют ли также ХЛК инфильтрации нейтрофилов, что может указывать на активацию инфламмасом в vivo . Мы вводили мышам C57BL / 6 дикого типа внутрибрюшинно PBS или CLC. Кристаллы кремнезема использовали в качестве положительного контроля, поскольку сообщалось, что эти кристаллы вызывают IL-1R-зависимую нейтрофильную инфильтрацию in vivo (Hornung et al., 2008; Курода и др., 2011). ХЛК вызвали перитонит, характеризующийся массивной инфильтрацией нейтрофилов (CD11b + , Ly6G + , Ly6C int ) и воспалительных моноцитов (CD11b + , Ly6G — , Ly6C + -b) (рис. 4a ) в полость брюшины. Следует отметить, что визуализация клеток, извлеченных из PELF, выявила присутствие нейтрофилов и моноцитов, которые имели фагоцитированные CLC (фиг. 4c и фиг. S2), подтверждая, что CLC также фагоцитируются in vivo .
Рис. 4 CLC вызывают рекрутирование нейтрофилов in vivo .
( a ) Проточно-цитометрический анализ, показывающий стратегию гейтирования и точечные диаграммы, используемые для количественного определения клеток в жидкостях перитонеального лаважа (PELF) мышей C57BL / 6 через 6 часов после внутрибрюшинной инъекции 100 мкл одного PBS или PBS, содержащего 100 мкг кристаллов кремнезема, или 1⨯10 6 ХЖК. Цифры в регионах показывают процентное соотношение ячеек. (b ) Количественное определение живых (7AAD —) нейтрофилов (CD11b + Ly6G + ) и воспалительных моноцитов (CD11b + Ly6C + Ly6G — ) у мышей с помощью проточной цитометрии вводил я.п. с PBS или кристаллами. Каждый символ представляет отдельную мышь; маленькие горизонтальные линии обозначают среднее значение и стандартное отклонение. ( c ) Конфокальная микроскопия клеток в PELF мышей, которым инъецировали CLC, как описано в b . Моноциты (красный, Ly6C-AF647), нейтрофилы (зеленый, Ly6G-FITC), ХЛК (синий, отражение лазера). Стрелки указывают на CLC с их характерной морфологией, которые были фагоцитированы нейтрофилами и моноцитами. Масштабные линейки: левая панель 42 мкм, средняя и правая панели 9 мкм.
Хотя перитонеальная инъекция CLC полезна для оценки индуцированного кристаллами воспаления in vivo , она не представляет собой физиологически релевантный сайт для образования CLC. ХЛК часто обнаруживались в дыхательных путях и мокроте пациентов с различными широко распространенными респираторными заболеваниями, такими как астма (Dor et al., 1984). Чтобы подтвердить, индуцируют ли ХЛК активацию инфламмасом in vivo в легких и локально связать поглощение ХЛК с активацией инфламмасом, мы выполнили интратрахеальную инстилляцию ХЛК в легкие мышей с трансгенным репортером ASC-mCitrine (Tzeng et al., 2016). Мышам ASC-mCitrine закапывали либо PBS, либо CLC, либо кристаллы кремнезема. Через шесть часов после инстилляции мы оценивали инфильтрацию нейтрофилов, образование mCitrine-флуоресцентных пятен ASC и продукцию провоспалительных цитокинов в жидкостях бронхоальвеолярного лаважа (BALF). У мышей, которым вводили CLC, обнаруживалось большое количество нейтрофилов в ЖБАЛ (рис. 5а). Очень мало нейтрофилов или их отсутствие (CD11b + , Ly6G + , Ly6C int ) было обнаружено в ЖБАЛ мышей, которым вводили PBS.В соответствии с наблюдениями на модели перитонита, мы обнаружили, что клетки, выделенные в BALF, содержали фагоцитированные CLC. Это сопровождалось образованием пятен ASC-mCitrine, что было дополнительно подтверждено окрашиванием пятен ASC-mCitrine непосредственно конъюгированным с Alexa-647 антителом против ASC (рис. 5b и S3). Измерения IL1-β, присутствующего в BALF, показали заметное увеличение этого провоспалительного цитокина через шесть часов после инъекции кристаллов кремнезема или CLC по сравнению с животными, которым инъецировали PBS.Уровни TNF, независимого от инфламмасомы провоспалительного цитокина, также были повышены в BALF мышей, получавших CLC (фиг. 5c).
Рис. 5 ХЛК вызывают активацию инфламмасом в легких.
( a ) Количественное определение живых (7AAD —) нейтрофилов (CD11b + Ly6G + ) в жидкости бронхиального лаважа (ЖБАЛ) трансгенных мышей ASC-mCitrine через 6 часов после интратрахеального введения 60 мкл одного PBS, или 60 мкл PBS, содержащего 1 мг кристаллов диоксида кремния, или 3.5 × 10 6 CLC. Каждый символ представляет отдельную мышь; маленькие горизонтальные линии обозначают среднее значение и стандартное отклонение. (b ) Конфокальная визуализация клеток, присутствующих в ЖБАЛ трансгенных мышей ASC-mCitrine, интратрахеально инстиллированных CLC, показывающая образование агрегатов ASC в их цитозоле. Уровни цитокинов ASC (зеленый, mCitrine), нейтрофилов (пурпурный, Ly6G-A647), anti-ASC (красный, Anti-ASC A555. ( c ) IL-1β и TNF-α в ЖБАЛ трансгенных мышей ASC-mCitrine обрабатывается, как описано в и .Каждый символ представляет отдельную мышь; маленькие горизонтальные линии обозначают среднее значение и стандартное отклонение.
В целом, наши данные показывают, что ХЛК вызывают активацию воспаления in vivo и предполагают, что их накопление в тканях может быть важным фактором хронического воспаления тканей после инфильтрации эозинофилов.
Заключительные замечания
Наше исследование выявляет ранее недооцененную воспалительную способность CLC и открывает новые возможности для рассмотрения иммуногенности и потенциальной значимости этих кристаллов для лечения распространенных хронических иммунологических заболеваний, таких как астма.
ХЛК обнаружены в мокроте больных астмой с эозинофилией (Dor et al., 1984; Sakula, 1986). Хотя пациенты с астмой могут демонстрировать гетерогенные фенотипы, важным молекулярным механизмом астмы является воспаление 2 типа, которое характеризуется увеличением титров IgE, привлечением эозинофилов и преобладанием клеток T H 2, которые секретируют IL-4. , Ил-5 и Ил-13 (Fahy, 2015). Иммунитет 2 типа также может влиять на экспрессию классических провоспалительных цитокинов, таких как IL-1β, которые могут способствовать развитию хронического воспаления.В соответствии с этими наблюдениями, эндогенные молекулярные структуры, связанные с опасностью (DAMP), включая кристаллы мочевой кислоты, традиционно известные как причина воспаления при подагре, являются сильными адъювантами для иммунитета Th3 (Kool et al., 2008; 2011).
Действительно, было показано, что уровни IL-1β повышаются при астме, а количество макрофагов, экспрессирующих IL-1β, в бронхиальном эпителии пациентов с астмой выше по сравнению с контрольными субъектами (Sousa et al., 1996). Наши результаты показывают, что CLC, которые обычно обнаруживаются в жидкостях и тканях пациентов с эозинофилией, индуцируют сильное высвобождение сильно провоспалительного цитокина IL-1β.Этот результат вместе с сообщением о ХЛК, обнаруженных в фагосомах макрофагов in vivo (Lao et al., 1998; Dvorak et al., 1990), предполагает, что поглощение CLC макрофагами и последующее высвобождение IL- 1β может быть одним из сигналов, которые сохраняют и усугубляют воспаление в тканях пациентов с эозинофильными расстройствами. В этой связи сообщалось, что IL-1β является критическим цитокином для развития подтипа с преобладанием Th3 / Th27 у пациентов с астмой (Liu et al., 2017). У пациентов с астмой с преобладанием Th3 / Th27 присутствуют двойные положительные клетки Th3 / Th27 в ЖБАЛ и проявляется тяжелая форма астмы. Более того, у этих пациентов наблюдается повышенное количество эозинофилов в ЖБАЛ. Присутствуют ли ХЛК, являющиеся признаком эозинофильных заболеваний, в ЖБАЛ пациентов с астмой с преобладанием Th3 / Th27 и является ли их распознавание альвеолярными макрофагами причиной повышенных уровней IL-1β у этих пациентов — это вопрос дальнейшие исследования. В этом сценарии ингибирование образования, поглощения CLC или эффектов высвобождения IL-1β — потенциально за счет блокирования активности NLRP3 — может принести пользу пациентам с астмой.
Результаты, представленные в этом исследовании, расширяют наше текущее понимание того, как кристаллизация белка способствует иммуногенности, и подчеркивают необходимость рассмотрения новых терапевтических стратегий, которые нейтрализуют кристаллизацию белка, затянувшуюся из-за активности гранулоцитов.
ЭКСПЕРИМЕНТАЛЬНЫЕ ПРОЦЕДУРЫ
Реагенты
Сверхчистый липополисахарид (LPS) из E. Coli 0111: B4 и нигерицин были от Invitrogen, DRAQ5 от eBiosciences. Цитохалазин D был приобретен у Sigma и CA-074 Me у Enzo.Ингибитор каспазы-1 Belnacasan (VX-765) был от Selleckchem. Специфический ингибитор NLRP3 CRID3 (также известный как лекарственное средство 3, ингибирующее высвобождение цитокинов, или MCC950) был приобретен у Sigma-Aldrich. Наборы HTRF для человеческого IL-1β и TNF-α были получены от Cisbio Bioassays и использовались в соответствии с инструкциями производителя. Кристаллы холестерина получали, как описано ранее (Zimmer et al., 2016). Вкратце кристаллы получали из раствора холестерина с концентрацией 2 мг / мл в 1-пропаноле. Кристаллизацию вызывали добавлением 1.5 объемов воды без эндотоксинов. Кристаллы сушили и ресуспендировали в стерильном PBS.
Мыши
Мыши C57BL / 6 были приобретены из лаборатории Джексона (инвентарный номер 000664). Трансгенные мыши C57BL / 6 ASC-mCtrine (B6.Cg-Gt (ROSA) 26Sor tm1.1 (CAG-Pycard / mCitrine * , -CD2 * ) Dtg / J) были приобретены из лаборатории Джексона ( Инвентарный № 030744). Мышей содержали в условиях, свободных от патогенов, и с ними обращались в соответствии с Руководством по уходу и использованию лабораторных животных Национального института здравоохранения США и Институционального комитета по уходу и использованию животных (IACUC) Медицинской школы Массачусетского университета.Трансгенные мыши C57BL / 6 ASC-mCtrine (B6.Cg-Gt (ROSA) 26Sor tm1.1 (CAG-Pycard / mCitrine * , -CD2 * ) Dtg / J) были приобретены из лаборатории Джексона ( Инвентарный № 030744).
Клеточные линии
Клеточная линия AML 14.3D10 была любезно подарена Меган Шихан, Кассандрой С. Пол и Майклом А. Бауманом из Государственного университета Райта (WSU). Dayton, OH 45435. Клетки AML14.3D10 культивировали в среде RPMI 1640 (Gibco), содержащей 10% фетальной бычьей сыворотки (FBS) (Invitrogen), 1% пенициллин / стрептомицин, 1x GlutaMAX и 1x пируват натрия (оба от Life Technologies) ( полная среда).
Первичные клетки человека
Бледно-желтая оболочка от здоровых доноров была получена в соответствии с протоколами, принятыми наблюдательным советом учреждения при Университете Бонна (местные этические голосования Lfd. Nr. 075/14). Первичные макрофаги человека получали путем дифференцировки моноцитов CD14 + в среде, дополненной 500 ед / мл rhGM-CSF (Immunotools) в течение 3 дней. Вкратце, мононуклеарные клетки периферической крови человека (PBMC) были получены из лейкоцитов здоровых доноров путем центрифугирования в градиенте плотности в Ficoll-Paque PLUS (GE Healthcare).РВМС инкубировали при 4 ° C с магнитными микрошариками, конъюгированными с моноклональными антителами против CD14 человека (Miltenyi Biotec). Таким образом, моноциты CD14 + были магнитно помечены и изолированы с использованием колонки MACS, помещенной в магнитное поле, как указано производителем (Miltenyi Biotec). Макрофаги, происходящие из моноцитов, культивировали в полной среде во время всех экспериментов.
Подготовка CLC
CLC были выделены в соответствии с адаптированной версией протокола, опубликованной в другом месте (Ackerman JI 1980).Все этапы выполнялись при 4 ° C, чтобы избежать деградации белка, и в стерильных условиях с использованием шкафа биобезопасности класса II и стерильных реагентов. По меньшей мере 600 × 10 6 клеток AML14.3D10 дважды промывали фосфатно-солевым буфером (PBS) (Life Technologies) и ресуспендировали в гипотоническом (0,15% NaCl) PBS, дополненном коктейлем комплексных ингибиторов протеазы (Roche) (буфер для лизиса). На каждый мл осадка клеток использовали 1 мл буфера для лизиса для ресуспендирования клеток. Затем ресуспендированные клетки лизировали при 4 ° C с использованием измельчителя тканей Dounce.В соответствии с включением красителя трипанового синего для лизиса> 90% клеток потребовалось 30 штрихов. ДНК и большие мембраны удаляли центрифугированием лизатов при 1000 × g в течение 10 минут при 4 ° C. Осадки ресуспендировали в 500 мкл буфера для лизиса, и суспензию снова центрифугировали при 1000 × g в течение 10 минут при 4 ° C для извлечения любого растворимого белка, который мог быть захвачен в осадке мембран. Супернатанты от обеих стадий центрифугирования объединяли и дополнительно центрифугировали при 40000 × g в течение 20 минут при 4 ° C для удаления мембран органелл и клеточного мусора.Осадки отбрасывали, а супернатанты снова центрифугировали при 40000 × g в течение 30 минут при 4 ° C. Супернатанты объединяли, и их объем уменьшали до ~ 1 мл центрифугированием при 3200 × g на центробежном фильтре Amicon Ultra-15 с мембраной с NMWL 10 кДа (EMD Millipore). Этот очищенный и концентрированный белковый лизат уже содержал CLC в суспензии с остальными мембранами и белковые преципитаты, когда его наблюдали под микроскопом. CLC разделяли центрифугированием при 750 × g в течение 5 минут при 4 ° C.Супернатанты выдерживали в течение 16 часов при 4 ° C, а позже их исследовали на наличие дополнительных CLC. Этот второй набор CLC был разделен центрифугированием при 750 × g в течение 5 минут при 4 ° C и смешан с предыдущим набором. Комбинированные CLC ресуспендировали в холодном PBS и тщательно промывали (минимум 6 раз) до тех пор, пока CLC не были в основном свободны от загрязнений при наблюдении под микроскопом. После всех стадий промывки подсчитывали CLC и разбавляли полной средой, использованной для стимуляции макрофагов.
Белковые гели и вестерн-блоттинг
Образцы, обогащенные белком, в процессе генерации ХЖК смешивали с буфером для образцов NuPAGE® LDS (4X) и с восстанавливающим агентом NuPAGE® (10X) (оба от ThermoFischer Scientific) после нагревания при температуре 85 ° C в течение 10 минут, чтобы денатурализовать и уменьшить количество всех белков, присутствующих в образцах.
Денатурализованные и восстановленные белки разделяли в геле NuPAGE 12% Bis-Tris (ThermoFischer Scientific) в электрофоретических условиях в буфере MES.После электрофореза белки в геле окрашивали красителем кумасси бриллиантовый синий R-250 (ThermoFischer Scientific) в течение десяти минут. Гели обесцвечивали в обесцвечивающем растворе (15% изопропанол + 10% ацетон в воде) в течение 16 часов. В качестве альтернативы белки в геле переносили на PVDF-мембрану Immobilon-FL (Millipore). Неспецифическое связывание блокировали 3% BSA в трис-буферном солевом растворе (TBS) в течение 1 ч с последующей инкубацией в течение ночи с кроличьим моноклональным антителом против галектина-10 человека (EPR11197Abcam, разведение 1: 10000) в 3% BSA в TBS с 0.1% Твин-20 (TBS-T). Мембраны трижды промывали TBS-T и инкубировали в течение 2 часов с ослиным антителом против кролика IRDye 680RD (Licor) в TBS-T. Мембраны промывали два раза TBS-T и последний раз TBS перед измерением флуоресцентного сигнала в инфракрасном сканере Odissey, модель 9120.
Immunocytochemistry
Клетки фиксировали в PBS, содержащем 4% метанола без формальдегида (Thermo Scientific), в течение 15 минут. при комнатной температуре. После фиксации мембраны окрашивали агглютинином зародышей пшеницы (WGA) -Alexa Fluor 555 (Invitrogen) в концентрации 5 мкг / мл в PBS в течение 10 минут при комнатной температуре.Фиксированные клетки инкубировали в течение 1 часа при комнатной температуре с PBS, содержащим 10% козьей сыворотки, 1% FBS, 0,5% Triton X-100 (блокирующий / проницаемый буфер), а затем инкубировали в течение ночи при 4 ° C с 0,1 мкг / мл мыши. моноклональное антитело против ASC (клон HASC-71, Biolegend), непосредственно меченное AF647 или его соответствующий контроль изотипа, также меченное AF647. Клетки промывали трижды блокирующим / проницаемым буфером. Ядра окрашивали DRAQ5 (1: 5 000, Thermo Fischer).
Микроскопия
Конфокальная микроскопия была объединена с флуоресцентной микроскопией с использованием конфокальной системы Leica TCS SP5 SMD (Leica Microsystems, Вецлар, Германия).Изображения были получены с использованием объектива 63X с числовой апертурой 1,2 и проанализированы с помощью программного обеспечения Volocity 6.01 (PerkinElmer, Waltham, Massachusetts, USA). Для лучшей видимости в некоторых случаях были отрегулированы яркость и контраст, и все изображения в рамках одного эксперимента были применены в равной степени к контролю изотипа и условиям окрашивания.
In vivo перитонеальная инъекция CLC
Мышей C57BL / 6 подвергали воздействию кристаллов путем перитонеальной инъекции 100 мкл PBS, содержащего либо 1 × 10 6 CLC, либо 100 мкг кристаллов кремнезема, либо ничего.Через 6 часов мышей умерщвляли и 6 мл раствора для лаважа (RPMI + 3 мМ ЭДТА) вводили в брюшину мышей, как описано в другом месте (Yanagida et al., 2013). После массирования растянутой брюшной полости жидкость перитонеального лаважа (PELF) извлекали и разделяли на клеточную фракцию и жидкую фракцию центрифугированием при 350 × g при 4 ° C в течение 5 минут. Эти клетки анализировали с помощью проточной цитометрии для определения рекрутирования нейтрофилов, а также наблюдали под микроскопом (Leica SP5) для идентификации клеток, которые фагоцитировали CLC.
Интратрахеальная инстилляция кристаллов
Мышам C57BL / 6 ASC-mCitrine вводили дозу 1 мг кристаллов кремнезема или 3,5 × 10 6 ХЛК в 60 мкл PBS. Суспензию образца однократно вводили интратрахеально анестезированным изофлураном животным с помощью шприца через катетер, введенный в дыхательные пути. Контрольной группе вводили только PBS. Мышей умерщвляли через 6 часов после инстилляции и собирали 3 мл жидкости бронхоальвеолярного лаважа для определения общего количества клеток, нейтрофилов (7AAD —, CD11b + , Ly6G + ) и уровней цитокинов с помощью HTRF.
Анализы набора нейтрофилов
Клетки, выделенные в PELF или BALF, ресуспендировали в 2 мл окрашивающего раствора (PBS + 2% FCS) и подсчитывали с помощью гемоцитометра. Для идентификации нейтрофилов и моноцитов 250 мкл клеток окрашивали антителами, меченными флуорохромом, против CD11b (клон M1 / 70, Biolegend), Ly-6G (клон 1A8, BD Biosciences) и Ly-6C (клон ER-MP20, Bio- Rad) или их соответствующий меченный флуорохромом изотип Ig. После окрашивания 7AAD (BD Biosciences) для исключения мертвых клеток клетки анализировали в проточном цитометре MACSQuant Analyzer 10.
Измерение уровней цитокинов в ЖБАЛ
Жидкую фракцию ЖБАЛ концентрировали с использованием центробежных фильтров Amicon Ultra-2 мл 10K. Количества мышиного IL-1β и мышиного TNF-α в концентрированном BALF были количественно определены с использованием набора для анализа HTRF (Cisbio Bioassays) и нормализованы по объему концентрированного лаважа.
Статистический анализ
Если не указано иное, все данные объединены как минимум из 3 независимых экспериментов, проведенных на макрофагах от разных доноров.Для очистки отдельные эксперименты изображены в виде символов на графиках. Каждый символ представляет средние значения из трех технических повторений от отдельного донора. Данные представлены в виде среднего значения, полосы ошибок показывают стандартное отклонение (стандартное отклонение при объединении из двух независимых экспериментов) или ошибку среднего значения (стандартное отклонение среднего значения (стандартное отклонение при объединении из трех или более независимых экспериментов). Достоверность различий между группами оценивали с помощью одностороннего дисперсионного анализа (ANOVA) с повторными измерениями с помощью постсравнительного теста Холма-Сидака и поправки Гейссера-Гринхауса.Статистический анализ проводился с помощью Graphpad Prism (версия 6.0). Данные считались значимыми при p <0,05 (*), 0,01 (**), 0,001 (***) или 0,0001 (****).
БЛАГОДАРНОСТИ
Мы благодарим Меган Шихан, Кассандру С. Пол и Майкла А. Баумана из Государственного университета Райта (WSU) за линию клеток AML 14.3D10. Благодарим Максимилиана Рота за техническую помощь. Мы благодарим Фэн Шао (Национальный институт биологических наук, Пекин 102206, Китай) за плазмиду, кодирующую белок-конъюгат с защитным антигеном PrgI, а также Маттиаса Гейера и Дэвида Фусхёллера за очищенный белок PrgI, используемый здесь для активации воспаления NLRC4.B.S.F. поддерживается грантом Европейского исследовательского совета (PLAT-IL-1) и Немецкого исследовательского фонда (DFG, SFBTRR57). B.S.F, E.L. и Н.Г. являются членами кластера передового опыта ImmunoSensation. Н.Г. поддерживается грантами DFG (SFB704 и GRK2168). E.L. поддерживается грантами DFG (SFB645, 704, 670, 1123, TRR57, 83) и Европейского исследовательского совета (InflammAct).
Молекул | Бесплатный полнотекстовый | Краткая история исследования кристаллического протеина Шарко-Лейдена / галектина-10
1.Кристаллы Шарко-Лейдена
Кристаллы Шарко-Лейдена (CLC), имеющие как гексагональную, так и бипирамидную формы, впервые были обнаружены в 1853 году Жан-Мартеном Шарко, который обнаружил крошечные кристаллы в сердечной крови и селезенке пациента, умершего от лейкемии [1] . В 1872 году Эрнст Виктор фон Лейден также описал бесцветные кристаллы, обнаруженные в мокроте больных астмой [2]. После открытия ХЖК появилось много противоречивых сообщений о химической природе и значении этих кристаллов [3,4,5,6].В то время было неизвестно, является ли CLC кристаллизованным белком. ХЛК даже ошибочно считали тем же, что и кристаллы секрета простаты или ионные кристаллы [7,8]. В 1895 году Кон правильно пришел к выводу, что ХЛК, обнаруженные в лейкозной крови, астматической мокроте, носовых полипах и костном мозге, были одинаковыми и отличались от таковых, обнаруженных в секрете простаты [9]. В 1914 г. о взаимосвязи CLCs и эозинофилов сообщил Schwarz [6], предложение, которое облегчило изучение CLC. Ранние работы показали, что CLCs могут быть обнаружены только у людей и приматов [5,10].ХЛК не могли образовываться в эозинофилах морских свинок [11], а исследование крови лошади и кролика при различных стимулах также не дало кристаллов [5]. Однако один тип четырехгранных кристаллов наблюдался в эозинофилах мышей с пневмонией [12] и в макрофагах модели астмы у мышей [13]. Однако эти кристаллы состоят из хитиназоподобного белка Ym1, но не из белка CLC [14]. Первичные структуры белка CLC человека и приматов больше похожи друг на друга, чем на другие виды [15].Несмотря на то, что кажется, что ХЛК образуются только у людей и обезьян, любопытно, что они не встречаются у других видов, тем более что никаких надежных методов, таких как масс-спектроскопия, не использовалось для определения фактического состава кристаллов белка, обнаруженных у этих видов.
2. Неоднозначная история белка CLC / галецина-10
До того, как ген белка CLC был секвенирован, его неправильно считали лизофосфолипазой [16,17]. Хотя было обнаружено, что фермент 74 кДа представляет собой настоящую лизофосфолипазу [18], анализ методом pull-down показал, что белок CLC может взаимодействовать с этой лизофосфолипазой [19].Это указывает на то, что первоначальный ферментный анализ на белок CLC был фактически загрязнен лизофосфолипазой. Ген белка CLC был картирован на хромосоме 19 человека [20], а позже более точно сопоставлен с хромосомой 19q13.2 в рамках Human Genome Project (http: // www. .genecards.org). Интрон-экзонная архитектура гена белка CLC сходна с таковой у галектинов, с углеводсвязывающим доменом (CRD), кодируемым одним экзоном [21]. Выравнивание первичной структуры аминокислотной последовательности белка CLC с другими галектинами показало, что белок CLC гомологичен углеводсвязывающему домену (CRD) (Рисунок 1) [22].Более того, кристаллическая структура белка CLC показала, что он имеет очень похожую складку на CRD галектина [23]. Из-за этого белок CLC был переименован в галектин-10 (Gal-10) [24]. В асимметричной единице кристалла Gal-10 есть только один мономер Gal-10, псевдоморф, который неточно отображал глобальную форму Gal10. Фактически, Gal-10 представляет собой гомодимерный белок в растворе [25]. До сих пор естественные лиганды Gal-10, включая белки и углеводы, полностью не идентифицированы.Однако есть несколько противоречивых результатов относительно специфичности связывания лиганда Gal-10. Твердофазный анализ показал, что Gal-10 может слабо связываться с лактозой и н-ацетил-d-глюкозамином, конъюгированным с агарозой [23,26]. Однако три противоречивых результата показали, что слабая активность связывания углеводов может быть приписана связыванию Gal-10 дикого типа с матриксом поперечно-сшитой агарозы (или сефарозы), а не с лактозой [19,25,27], а также кристаллической структурой Gal-10 показал, что он может связывать маннозу [23].Недавно мы создали вариант Gal-10 (W127A), который существует в виде мономера и может слабо связываться с модифицированной лактозой сефарозой [28]. ХЛК, выделенные из эозинофилов человека, содержат 1,2% углеводов [29]. Масс-спектроскопия Gal-10, полученного из носовой жидкости, показала, что Gal-10 не гликозилирован, но может быть ацетилирован по Ser2 [30]. Кристаллическая структура высокого разрешения Gal-10, которая была очищена из линии миелоидных лейкозных клеток человека, также показала отсутствие гликозилирования [23]. В целом, Gal-10 не гликозилирован и может слабо связываться с углеводом в нескольких условиях, например в его мономерном состоянии.
4. Структурные сравнения Gal-10 и других прототипов галектинов
С момента открытия Gal-1 в геноме человека были обнаружены четырнадцать генов галектинов [35,36,37,38]. Хотя у галектинов человека отсутствует последовательность сигнального пептида, они могут транспортироваться из цитоплазмы неизвестным путем. Недавнее сообщение показало, что Gal-3 секретируется из цитоплазмы посредством экструзии микросом [39]. При апоптозе или некрозе галектины также высвобождаются и регулируют функции соседних клеток [38].Во внеклеточном матриксе галектины связываются с β-галактозидными единицами в полисахаридах, гликозилированных внеклеточных белках и гликозилированных липидах. Галектины также участвуют во многих физиологических функциях, таких как воспаление, иммунные ответы, миграция клеток, аутофагия и передача сигналов. Они также связаны со многими заболеваниями, такими как фиброз, рак и болезни сердца [38]. На основании структурных различий галектины подразделяются на три типа: тандемно-повторяющиеся, химерные и прототипные [37,40,41,42,43].Каждый из этих типов имеет отличительную глобальную структуру. Галектины типа тандемных повторов, включая галектин-4, -8, -9 и -12, имеют два CRD, соединенных коротким линкерным пептидом [43]. До сих пор структура любого галектина тандемно-повторяющегося типа полной длины еще не решена в первую очередь из-за присущей ему гибкости структуры. Однако варианты Gal-8 и -9 с укороченными подобными пептидами могли быть кристаллизованы, и их структуры были решены [44,45]. Gal-3, единственный галектин химерного типа, имеет длинный, богатый пролином повтор, коллаген- как N-концевой хвост [46].Несмотря на то, что сообщалось о многих кристаллических структурах Gal-3 CRD [47,48,49,50], его N-концевой хвост очень гибкий и временно взаимодействует с F-гранью CRD [51], динамическая ситуация что исключает кристаллизацию лектина полной длины. Недавно была опубликована интересная кристаллическая структура Gal-3, показывающая, что короткий пептид из N-концевого хвоста Gal-3 может расширять β-лист F-стороны CRD [52]. Хотя структуры некоторых прототипов галектинов (например, галектина-14, -16 и -17) еще не сообщены, большинство структур прототипа галектина известно [34,53,54,55,56].Кристаллографические и биохимические анализы показывают, что Gal-1, -2, -7 и -10 образуют димеры посредством нековалентных взаимодействий [34,53,54,55]. Глобальные конформации Gal-1 и Gal-2 очень похожи с β-сэндвич-структура с таким же количеством бета-тяжей [53,54]. Сайты связывания углеводов этих галектинов расположены в противоположных сайтах в каждом CRD. Кристаллическая структура Gal-1 показывает, что каждый CRD связывает одну молекулу лактозы, что указывает на ее функциональную роль. Поскольку время кристаллизации относительно велико, связывание лактозы с двумя CRD не может происходить независимо.Фактически, результаты ЯМР продемонстрировали, что связывание одной молекулы лактозы с Gal-1 CRD может негативно регулировать связывание другой [57]. В кристаллической структуре Gal-2 одна молекула лактозы связывается с одним CRD, а другой сайт, как было обнаружено, занят остатком аспартата (Asp29) [54]. Это похоже на то, как Gal-1 связывает лактозу в растворе. Однако из-за этого специфичность связывания лиганда Gal-1 отличается от таковой у Gal-2, что означает, что эти два галектина выполняют разные функции in vivo.Gal-1, очищенный из эукариотических клеток, имеет более высокую молекулярную массу, чем Gal-1, очищенный из E. coli [58]. Это означает, что Gal-1 химически модифицирован in vivo. Более того, при низкой концентрации (7 мкМ) димеры Gal-1 могут диссоциировать, при этом его специфичность связывания лиганда отличается от димеров Gal-1 [59]. Напротив, сообщалось, что Gal-1, даже при 2 мкМ, поддерживает димерное состояние [60,61], как показали структурные исследования ЯМР Gal-1 в растворе [57]. Было показано, что вариант Gal-1 с двойными мутациями (C2S / V5A) существует в виде мономера [62], причем его способность связывать сахар ниже, чем у лектина дикого типа [59].Gal-1 имеет шесть остатков цистеина, которые могут окисляться [53]. Окисленная форма Gal-1 имеет более низкую специфичность связывания сахара по сравнению с полностью восстановленным состоянием [59]. Было высказано предположение, что основная функция окисленного Gal-1 — регулировать передачу сигнала в клетках [63,64]. Более того, восстановленный Gal-1 может связываться с остатками галактозы гликанов внутри внеклеточного матрикса и, таким образом, может запускать пути передачи сигнала извне внутрь клетки [59]. Gal-7 образует димеры через свою F-грань, при этом несколько остатков образуют водород. и ионные связи, а также ван-дер-ваальсовы взаимодействия, которые способствуют его димерной структуре.Два мономера Gal-7 могут связываться с двумя молекулами галактозы [55]. Gal-10 высоко экспрессируется в эозинофилах [29]. Первая структура Gal-10, расшифрованная с использованием Gal-10, очищенного из линии миелоидных лейкозных клеток человека [23], показала, что в каждой асимметричной единице присутствует только один мономер Gal-10. Недавно мы и Kamitori использовали PISA для предсказания взаимодействий между двумя CRD Gal-10 в двух отдельных асимметричных единицах, расположенных близко друг к другу, и предположили, что Gal-10 может димеризоваться [25,40]. Эта модель Gal-10 имеет структуру от S-граней до S-граней и значительно отличается от других прототипов галектинов (Рисунок 2).Гель-фильтрация подтвердила образование димеров Gal-10 в растворе [25]. Кроме того, ключевой остаток (Trp127) помогает опосредовать димеризацию Gal-10 [28]. Фактически, мутация Trp127 в аланин отменяет образование димера Gal-10. Gal-13 является необычным прототипом галектина в том смысле, что он образует димеры за счет дисульфидных связей, образованных между двумя остатками цистеина (Cys136 и Cys138) на С-конце его CRD [56]. Вариант с двумя мутациями (C136S / C138S) существует в виде мономера в растворе [56]. Анализы гемагглютинации показали, что DTT может ингибировать этот вариант, вызывающий агглютинацию эритроцитов, указывая на то, что структура димера Gal-13 имеет решающее значение для его функции.Конструктивное устройство Гал-7, -10 и -13 отличается от Гал-1 и Гал-2 (Рисунок 2). Хотя существует консенсус, что все галектины произошли от одного белка-предка, глобальная структура этих лектинов изменилась в ходе эволюции вместе с их соответствующими функциями. Взятые вместе, это предполагает, что все галектины имеют разные глобальные формы и функции, хотя нет четкого ответа относительно того, почему и как эти прототипы галектинов получили разные структуры.
5.Специфичность связывания лиганда Gal-10
Сразу после завершения последовательности кДНК Gal-10 [22] Дайер и др. Обнаружили, что первичная структура Gal-10 очень похожа на Gal-1 и Gal-3 [26] . Таким образом, было сделано предположение, что Gal-10 является членом семейства галектинов [21]. Твердый анализ можно использовать для проверки способности связывания Gal-10 с агарозой, модифицированной лактозой. Результаты показали, что Gal-10 может только слабо связываться с этими гранулами [23,26]. Однако три других отчета опровергают этот вывод [19,25,27].Кроме того, кристаллическая структура показала, что Gal-10 может сокристаллизоваться с маннозой, но не с лактозой [23]. Однако вариант (W127A), существующий в виде мономера, может связываться с гранулами агарозы, модифицированной лактозой [28]. Изучая гомодимерную структуру Gal-10, мы обнаружили, что остаток глутамата (Glu33) с S-стороны одного мономера непосредственно занимает сайт связывания углеводов другого мономера. Этот остаток глутамата может ингибировать связывание лактозы с Gal-10. Был создан вариант с мутацией Glu33 на аланин, и его кристаллическая структура показала, что этот вариант может совместно кристаллизоваться с лактозой.В целом поведение мутантов E33A и W127A указывает на то, что Gal-10 имеет функциональный сайт связывания углеводов, тогда как димерная структура влияет на связывание Gal-10 с β-галактозидами. Gal-1 может диссоциировать на мономеры [65]. Таким образом, димеры Gal-10 также могут диссоциировать таким же образом и могут связывать углеводы. Однако это предложение требует дальнейших экспериментов для проверки.
6. Методы окрашивания ХЖК
Если размеры клеточных ХЖК достаточно велики, кристаллы можно непосредственно наблюдать с помощью световой микроскопии [66,67], фазово-контрастной микроскопии [68].Кроме того, поскольку Gal-10 в ХЖК содержит ароматические остатки, их можно непосредственно визуализировать с помощью флуоресцентной микроскопии [69]. Однако, поскольку ХЖК обычно маленькие и бесцветные, их трудно непосредственно наблюдать с помощью световой микроскопии, если они не окрашены в цвет. Первая кроличья антисыворотка к человеческому Gal-10 была разработана в 1980 году [70]; это антитело использовали для иммунофлуоресцентного окрашивания [71] и мечения иммунозолотой ТЕМ [72]. Иммунофлуоресцентное окрашивание CLC обеспечивает четкое наблюдение CLC в базофилах человека [71].Кроме того, окрашивание по Маю-Грюнвальду-Гимзе и окрашивание по папаниколау может придавать ХЛК синий и оранжевый цвет соответственно [73,74,75]. CLCs можно было четко отличить от других клеточных органелл по окрашиванию гематоксилин-основным фуксин-пикриновой кислотой [76,77]. Окрашивание гематоксилином и эозином пурпурным было использовано для идентификации ХЛК в гранулоцитарной саркоме и в костном мозге [78,79]. Окрашивание по Райту-Гимзе позволяет отличать CLC от макрофагов от других клеток [79,80,81]. Кислотно-стойкое положительное окрашивание — это новый метод, который может эффективно окрашивать ХЛК и делать их отличимыми от других клеток [69].
7. Исследования промотора гена Gal-10
Некоторые соединения могут регулировать транскрипцию Gal-10 в клетках. Бутират может активировать свою транскрипцию в клетках промиелоцитарного лейкоза HL-60 [82]. Другое исследование показало, что GC-бокс перед сайтом начала транскрипции (от -44 до -50) фактически контролирует индукцию экспрессии гена бутиратом [83]. Напротив, диметилсульфоксид ингибирует транскрипцию Gal-10 в клетках крови [84], хотя механизм этого ингибирования остается неизвестным. Сайт инициации транскрипции Gal-10 был идентифицирован на 43 п.н. выше 5′-конца последовательности кДНК.Последовательность вышестоящей кДНК (от -1 до -411) содержит консенсусные сайты связывания для нескольких факторов транскрипции, включая GATA-1, PU.1, Oct и Sp.1 [82]. Еще одно исследование показало, что область от -1 до -1504 содержит несколько других сайтов связывания факторов транскрипции, таких как EoTF, NF-1, AP-2, AML1, которые могут повышать или понижать экспрессию Gal-10. Было обнаружено, что сайты связывания GATA-1 и EoTF необходимы для полной активности промотора [85]. Более того, нарушение GC-бокса (от -44 до -50) или сайта Orc (от -255 до -261) снижает активность промотора Gal-10.Кроме того, анализ супер-сдвига продемонстрировал, что факторы транскрипции Sp1 и Oct1 могут связываться с консенсусным GC box и Oct сайтом, соответственно [83]. Биоинформатическое исследование показало, что гомозиготы по минорному аллелю однонуклеотидных полиморфизмов в промоторной области CLC могут регулировать экспрессию Gal-10 и, таким образом, могут вызывать аллергический ринит [86].
9. Исследования ХЖК с помощью просвечивающей электронной микроскопии
В 1980-х годах просвечивающая электронная микроскопия (ПЭМ) использовалась для определения распределения Gal-10 / ХЛК в лимфоцитах [72].Разрешение этих изображений было достаточным для анализа распределения Gal-10 / CLC в клеточных органеллах. Первая ПЭМ Gal-10 показала, что он был преимущественно локализован в небольшой (около 5%) субпопуляции первичных гранул эозинофилов. Эти мембраносвязанные цитоплазматические гранулы не содержат кристаллоидных включений [72]. Однако противоречивое сообщение показало, что первичные гранулы также содержат пероксидазу эозинофилов, белок, образующий кристаллоидные включения [90]. ПЭМ показала, что Gal-10 присутствует в ядерном матриксе и внеорганелларной цитоплазме зрелых эозинофилов, стимулированных интерлейкином-5 [91].Обширные количества Gal-10 также присутствовали в бедных гранулами и субплазматических мембранах цитоплазмы зрелых эозинофилов [91,92]. Другие анализы продемонстрировали, что высвобождение белков гранул эозинофилов, включая Gal-10, может быть селективным и запускается стимуляцией одного или нескольких мембранных рецепторов [93,94]. Используя TEM, Arne Egesten et al. Обнаружили, что Gal-10 присутствует в редком гранулярном компартменте как незрелых, так и зрелых эозинофилов [95]. ПЭМ также показала, что Gal-10 присутствует в фагосомах макрофагов [77,91] и поздних эндосомах [90].Gal-10 может храниться в гранулах нестимулированных базофилов человека [66]. Как положительные, так и отрицательные гранулы Gal-10 показали одну и ту же характерную подобную частицам структуру гранулярного матрикса, причем обе имеют один и тот же мембранный маркер CD63 [90]. После того, как пептид N-формилметионин (fMet) стимулировал базофилы человека, Gal-10 высвобождался через везикулы к плазматической мембране, проявляя частичную дегрануляцию (PMD). В начале PMD Gal-10 все еще может быть связан с плазматическими мембранами каналов дегрануляции [66].Во время дегрануляции поглощение базофилами высвобождает Gal-10, который быстро рециркулируется в клетки после провокации пептидом fMet [66,96]. После первых секунд дегрануляции белок CLC секретировался в виде кристаллов, которые непосредственно вытеснялись из внутригранулярных участков с морфологическими фенотипами, связанными с анафилактической дегрануляцией (AND) [66]. Помимо гранул, Gal-10 также распределяется в ядре (в эухроматине) [90], цитоплазме, плазматической мембране [97] и связанных с Гольджи гладких мембраносвязанных пузырьках [98].В целом, ПЭМ, пожалуй, лучший доступный метод для анализа распределения клеточного Gal-10. Хороший протокол использования ТЕА для базофилов и тучных клеток был обобщен Дворжаком [99].
10. Клеточное распределение CLC и Gal-10.
CLC присутствуют в ядерном хроматине, остатках клеточных мембран и многочисленных пустых и частично пустых гранулах из лизированных эозинофилов и интактных фагосом [77]. Это указывает на то, что образование CLC зависит только от концентрации Gal-10.Когда локальная концентрация Gal-10 выше, чем концентрация для кристаллизации, Gal-10 кристаллизуется. Кроме того, распределение CLC в гранулах, ядрах и фагосомах указывает на то, что должны быть некоторые ключевые транспортные системы для переноса белка в эти органеллы. Иммунофлуоресцентная микроскопия периферических эозинофилов человека показала, что в ядре сконцентрировано значительное количество Gal-10 [66]. Это исследование согласуется с исследованием Calafat et al., Которое показало, что Gal-10 в основном распределяется в ядрах эозинофилов [90].Наше недавнее исследование Gal-10 показывает, что лектин, меченный EGFP, главным образом распределяется в ядре клеток HeLa [25], указывая на то, что Gal-10 может активно транспортироваться в ядро. Это также означает, что Gal-10 может играть роль в регуляции транскрипции или трансляции посредством взаимодействий с неизвестными лигандами. Многие отчеты показали, что Gal-10 может распределяться в цитоплазме [91,92,97]. Однако функция Gal-10 в цитоплазме остается неизвестной. Кроме того, Gal-10 распределяется в областях внешней и внутренней клеточной мембраны.Gal-10 связывается с внешней мембраной Т-клеток и подавляет функцию Т-клеток [87]. Высвобождение Gal-10 из эозинофилов предполагает, что он стимулируется триггерами на внешней мембране [93,94]. При стимуляции Gal-10 секретируется путем дегрануляции или непосредственно вытесняется из цитоплазмы [66,96]. Более того, апоптоз и некроз эозинофилов также могут способствовать высвобождению Gal-10.
В целом распределение Gal-10 в клетках кажется ясным. Однако молекулярный механизм того, как функционирует Gal-10, по-прежнему практически неизвестен, и остается много открытых вопросов относительно того, с какими партнерами in vivo может связываться Gal-10, как транспортируется Gal-10, имеет ли Gal-10 роль в передаче сигнала и так далее.Чтобы ответить на эти вопросы, крайне важно идентифицировать лиганды Gal-10 in vivo с помощью различных методов, таких как pull down, co-IP и дрожжевой двугибридный.
12. Выводы и перспективы
Прошло более 160 лет с тех пор, как были зарегистрированы CLC. Изначально ХЛК были идентифицированы in vivo как кристаллы белка, которые могут спонтанно образовываться в организме человека. С момента их открытия ХЖК широко исследовались. Эозинофилы могут сверхэкспрессировать огромные количества Gal-10, а Gal-10 может иногда образовывать CLC в эозинофилах, и, образуя CLC, способность Gal-10 связывать лиганд может быть изменена.Таким образом эозинофилы могут защитить себя от чрезмерной стимуляции. При заражении эозинофилы могут реагировать на болезнетворные микроорганизмы и паразиты. Сигналы стимуляции от человеческого тела или посторонних веществ могут вызвать массовое высвобождение эозинофилов Gal-10. Более того, токсичные вещества, выделяемые патогенами и паразитами, также могут вызывать апоптоз или некроз эозинофилов. Когда взаимодействуют большие количества Gal-10, они могут образовывать ХЖК за очень короткое время. Следовательно, образование CLC связано с нарушением работы эозинофилов, что указывает на то, что CLC могут использоваться в качестве потенциального маркера этих заболеваний.
ХЛК могут быстро образовываться in vivo и in vitro. Это значительно облегчает кристаллографические исследования Гал-10. Кристаллографические и биохимические исследования показывают, что Gal-10 образует димерные структуры, которые значительно отличаются от других галектинов прототипа. Gal-10 образует свой димер через S-грани двух CRD, тогда как другие прототипы галектинов димеризуются, обнажая свои связывающие сахар S-грани. Эта уникальная димерная структура Gal-10 с S-гранью на S-грань может влиять на его специфичность связывания лиганда, хотя это мало изучено.
С развитием ПЭМ, иммунологических методов и различных методов окрашивания выяснилось распределение Gal-10 в лимфоцитах, тканях и жидкостях организма. Gal-10 может существовать в ядре, цитоплазме, гранулах и внеклеточном матриксе. Однако молекулярные механизмы действия Gal-10 in vivo остаются плохо изученными. Только недавно было обнаружено подавляющее действие Gal-10 на Т-клетки. Gal-10 может связываться с неизвестными гликанами на Т-клеточной мембране, подавляя функцию Т-клеток.Лиганды для Gal-10 в ядре, цитоплазме и гранулах неизвестны. Молекулярная масса Gal-10 составляет 16,5 кДа, что ниже порогового значения для ограничений транспортировки ядерной дыры. Это означает, что цитоплазматический Gal-10 может пассивно диффундировать в ядро. Интересно, что Гал-10, по-видимому, сконцентрирован в ядре. Накопление Gal-10 в ядре предполагает, что этот лектин может контролировать экспрессию и функцию некоторых неизвестных генов. Лиганды для Gal-10 в цитоплазме также неизвестны.В эозинофилах Gal-10 может транспортироваться в первичные гранулы. Однако пути транспортировки неясны. В целом, клеточные лиганды, включая углеводы и белки, для Gal-10 неизвестны, и идентификация этих лигандов может помочь нам понять нарушение эозинофилов и даже помочь облегчить различные болезненные состояния.
Слизистая, содержащая кристаллы Шарко-Лейдена — Aspergillus и Aspergillosis
Фильтровать по:
Наркотиками structuresAbafunginAlbaconazoleAminocandinAmphotericin В -Colloidal -Lipid комплекс -LiposomalAnidulafunginAR-12Beta-AminosaurinCaspofunginCD101 IV (Biafungin, SP325) CilofunginCS758D-0870E1210Echinocandin AEchinocandin BEchinocandin Б kernFlucytosineGenaconazoleHaemofunginHydroxyitraconazoleIsavuconazoleItraconazoleKetoconazoleKP-103L685818Manumycin AmicafunginMiconazoleNikkomycin ZNystatinPosaconazoleRavuconazoleSaperconazoleSCh307962SCh49304SCH51087SCH59884SCY-078 -GM193663 -GM222712 -GM237354SPA-S-753-SPK-843T-2307TacrolimusTAK- 187 Тербинафин ТипифарнибUR-9825VL-2397 Вориконазол
Известные люди (некрологи) Чарльз Том, 1872 — 1956 Дэвид Груби, 1810 — 1898 Дороти Феннелл, 1926 — 1977 Эдуард Друэ, 1919 — 2000 Фридрих Стаиб, 1925 — 2011 Габриэль Сегретен, 1913 — 2008 Гуидо Понтекорво, 1907-1999 ХарриСалкин, 1941-2016, Джек Пепис, 1914-1996, ДЖЕЙМС КЛАРК ГЕНТЛЕС, 1921-1997, Джон Хьюз Беннетт, 1812-1875, Джон Пейтман, 1926-2011, Джон Р.С. Финчем, 1926-2005, Кен Хейнс, 1960-2018, Кеннет Рапер, 1908-1987, Либеро Б. 1889-1976 Филипп Монтегю Д’Арси Харт, 1900-2006 Пьер Антонио Микели, 1679-1737 Пьеро Мартино, 1946-2007 Раймон Сабуро, 1864-1938 Рудольф Вирхов, 1821-1902 Уильям Эрнест Дисмукс 1939-2017
Конкретные виды A. alliaceusA. calidoustusA.Candidus A. chevalieriA. clavatusA. costaricaensisA. cretensis А. flavusA. flocculosusA. fumigatusA. иберикус А. lacticoffeatus A. lanosusA. lentulusA. neobridgeriA. nidulansA. nidulans, Emericella nidulans A. нигер А. niveusA. ochraceopetaliformisA. ochraceusA. penicilloides, A. penicillioides A. persiiA. piperisA. псевдоэлеганс А. pseudofisheriA. restrictusA. roseoglobulosus A. sclerotioniger A. steyniiA. sydowiiA. terreusA. udagawaeA. ustusA. westerdijkiaeE. herbariorum Eurotium amstelodami, A. amstelodami
Специфические пациенты -ptAB -ptAB-2 -ptAM -ptAML -ptAnB -ptAS -ptAW -ptAW-2 -ptBA -ptBF -ptBJ -ptBM -ptCA -ptCA-2 -ptCC -ptCD -ptCD-2 -ptCF -ptCH -ptCJ -ptCM -ptCR -ptDA -ptDB -ptDD -ptDF -ptDG -ptDL -ptDM -ptDP -ptDP-2 -ptDR -ptDS -ptDS2 -PtDSM -ptDT -ptDV -ptDW -ptEG -ptEW -ptFW -ptHB -ptHK -ptHW -ptIN -ptIR -ptJA -ptJA-2 -ptJB -ptJB-2 -ptJC -ptJC-2 -ptJE -ptJG -ptJH -ptJO -ptJO-2 -ptJP -ptJR -ptJSG -ptKG -ptKH -ptKO -ptLA -ptLC -PtLG -ptLM -ptLOM -ptLP -ptLS -ptLT -ptLT-2 -ptMB -ptMB-2 -ptMB-3 -ptMD -ptMD-2 -ptMD-3 -ptMK -ptMN -ptMS -ptMV -ptMW -ptNC -ptNM -ptNM-2 -ptNW -ptPC -ptPC-2 -ptPC-3 -ptPEY -ptPH -ptPS -ptPW -ptRD -ptRK -ptRL -ptRM -ptRN -ptRP -ptRP-2 -ptRR -ptRS -ptRSM -ptRT -ptRT -2 -ptRW -ptRWh -ptSA -ptSA-2 -ptSB -ptSB-2 -ptSR -ptSS -ptSV -ptSW -ptSW-2 -ptSY -ptTA -ptTB -ptTH -ptTL -ptTM -ptTS -ptVS -ptWC -ptYML -ptZY
OMIM Entry — * 153310
Акерман, С.Дж., Корретт, С. Э., Розенберг, Х. Ф., Беннет, Дж. К., Мастрианни, Д. М., Николсон-Веллер, А., Веллер, П. Ф., Чин, Д. Т., Тенен, Д. Г.
Молекулярное клонирование и характеристика кристаллического белка Шарко-Лейдена эозинофила человека (лизофосфолипаза): сходство с IgE-связывающими белками и суперсемейством животных лектинов S-типа.
J. Immun. 150: 456-468, 1993.
[PubMed: 8419478]
[Полный текст: https: // www.jimmunol.org/lookup/pmidlookup?view=long&pmid=8419478]
Шарко, Дж. М., Робин, К.
Наблюдение за лейкоцитемией.
C. R. Seances Mem. Soc. Биол. Париж 5: 44-52, 1854.
Дайер, К. Д., Хенден, Дж. С., Розенберг, Х. Ф.
Геномная структура гена кристаллического белка Шарко-Лейдена человека аналогична таковой из генов галектина.
Геномика 40: 217-221, 1997.
[PubMed: 9119387]
[Полный текст: https://linkinghub.elsevier.com/retrieve/pii/S0888-7543(96)94590-5]
Глайх, Г.Дж., Лёгеринг, Д. А., Манн, К. Г., Мальдонадо, Дж. Э.
Сравнительные свойства кристаллического белка Шарко-Лейдена и основного основного белка эозинофилов человека.
J. Clin. Вкладывать деньги. 57: 633-640, 1976.
[PubMed: 942977]
[Полный текст: https: // doi.org / 10.1172 / JCI108319]
Гомолин, Х. И., Ямагути, Ю., Полпиллаи, А. В., Дворжак, Л. А., Акерман, С. Дж., Тенен, Д. Г. Эозинофильный кристаллический белок Шарко-Лейдена человека: клонирование и характеристика промотора гена лизофосфолипазы.
Кровь 82: 1868-1874, 1993.
[PubMed: 8400237]
[Полный текст: https: // linkinghub.elsevier.com/retrieve/pii/S0006-4971(20)78363-1]
Лейден, Э.
Zur Kenntniss des Bronchial-Asthma.
Арка Вирхова. Путь. Анат. 54: 324-344, 1872.
Мастрианни, Д. М., Эдди, Р. Л., Розенберг, Х. Ф., Корретт, С. Э., Шоу, Т. Б., Тенен, Д. Г., Акерман, С. Дж.
Ген кристаллического белка Шарко-Лейдена эозинофила человека отображается на хромосоме 19 человека (Аннотация)
Cytogenet. Cell Genet. 58: только 2021, 1991.
Мастрианни, Д.М., Эдди, Р. Л., Розенберг, Х. Ф., Коррет, С. Э., Шоу, Т. Б., Тенен, Д. Г., Акерман, С. Дж.
Локализация гена кристаллического белка эозинофилов Шарко-Лейдена (лизофосфолипаза) (CLC) человека на хромосоме 19 и генов рибонуклеазы 2 (нейротоксин, полученный из эозинофилов) и рибонуклеазы 3 (катионный белок эозинофилов) (RNS2 и RNS3) на хромосоме 14.
Геномика 13: 240-242, 1992.
[PubMed: 1577491]
[Полный текст: https: // linkinghub.elsevier.com/retrieve/pii/0888-7543(92)-M]
Зикер, Л. К., Терли, С., Ле Тронг, И., Стенкамп, Р. Э., Веллер, П.Ф., Акерман, С. Дж.
Кристаллографическая характеристика кристаллов Шарко-Лейдена эозинофилов человека. (Письмо)
J. Molec. Биол. 204: 489-491, 1988.
[PubMed: 3221396]
[Полный текст: https: // linkinghub.elsevier.com/retrieve/pii/0022-2836(88)90590-6]
Веллер, П.

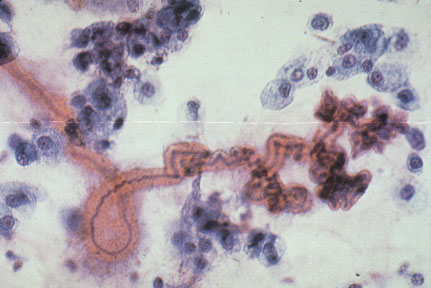 Биохимический анализ крови не является основным методом диагностики, так как изменения носят общий характер и подобные исследования назначаются для мониторинга состояния пациента в период обострения.
Биохимический анализ крови не является основным методом диагностики, так как изменения носят общий характер и подобные исследования назначаются для мониторинга состояния пациента в период обострения.