Наука: Наука и техника: Lenta.ru
Всем известно, что рак — это злокачественная опухоль, которая образуется из-за неконтролируемого деления клеток. Раковая опухоль — таинственный и сложный организм. Недавно исследователи из Массачусетского технологического института и Гарвардского университета смогли проникнуть буквально в сердце врага — в геном раковой опухоли. «Лента.ру» рассказывает о том, что им удалось узнать.
Раковую опухоль можно представить в виде сложной экосистемы, внутри которой обитают различные типы клеток, включая малигнизированные (злокачественные), иммунные и клетки соединительной ткани, например, участвующие в заживлении ран фибробласты. В своей работе исследователи поставили перед собой задачу выяснить, какие функции выполняют различные типы клеток и как они влияют на поведение раковой опухоли.
Именно из-за того, что в опухоли много разных клеток, ее так трудно лечить. Однако потенциально это могло бы служить инструментом, способным помочь справиться с болезнью, например различные по своей эффективности таргетные терапии и иммунотерапии, применяемые при лечении злокачественной меланомы.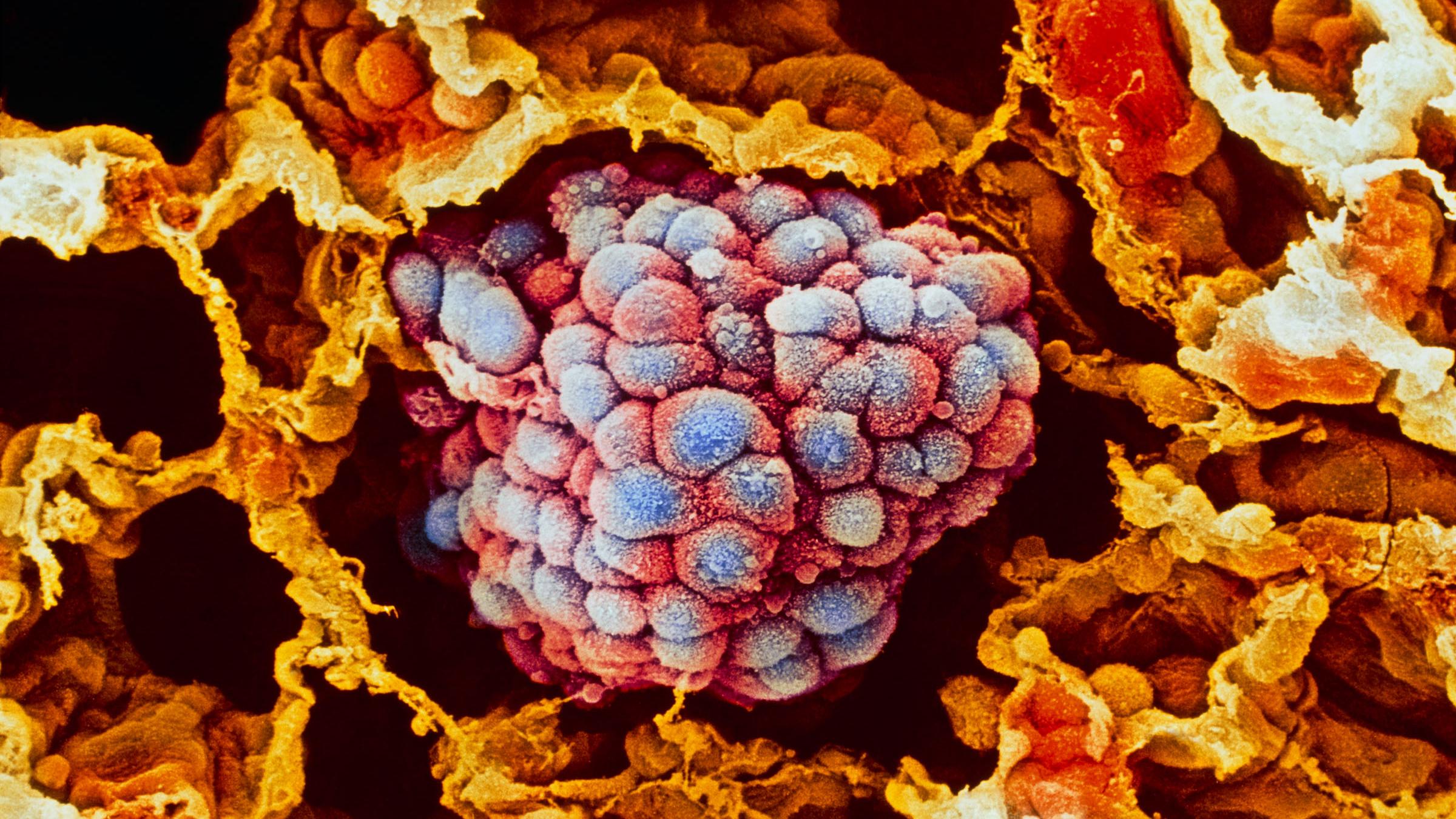 Ингибиторы иммунных контрольных точек остаются одним из самых успешных методов борьбы с метастазирующим раком.
Ингибиторы иммунных контрольных точек остаются одним из самых успешных методов борьбы с метастазирующим раком.
Ингибиторы контрольной точки взламывают защиту опухоли от иммунной системы. Т-лимфоциты патрулируют организм в поисках болезнетворных организмов или дефектных клеток. Сталкиваясь с другой клеткой, они проверяют, есть ли на ее поверхности определенные белки, свидетельствующие о том, что клетка нормальная, здоровая. Если белки характерны для инфицированной или раковой клетки, лимфоцит атакует и уничтожает ее. В то же время иммунная система производит ряд молекул — иммунных контрольных точек, призванных предотвратить нападение лимфоцитов на здоровые ткани организма.
Опухолевые клетки зачастую обладают белками, которые играют роль «красной тряпки» для иммунитета. Однако иногда они способны притворяться нормальными, здоровыми клетками, делая разоблачающие их белки недоступными для Т-лимфоцитов. Недавние исследования показали, что раковые клетки часто используют белки PD-L1 — иммунные контрольные точки, позволяющие обмануть иммунную систему и избежать ее атаки. Только специальные ингибиторы блокируют контрольные точки и позволяют лимфоцитам эффективнее сражаться со злокачественной опухолью.
Только специальные ингибиторы блокируют контрольные точки и позволяют лимфоцитам эффективнее сражаться со злокачественной опухолью.
Другой вид терапии — таргетный — основан на препаратах, нацеленных на клетки-мишени с определенными свойствами. Например, мутация V600E в гене BRAF, представляющая собой замену аминокислоты валина на глутаминовую кислоту в 600-м положении, приводит к экспрессии измененной BRAF-киназы, которая контролирует MAPK/ERK путь. Это вызывает неконтролируемый рост опухолевых клеток меланомы и активирует формирование новых кровеносных сосудов. Специальные таргетные препараты, ингибирующие активность BRAF-киназы, позволяют повысить выживаемость пациентов, однако фактически все раковые опухоли впоследствии развивают невосприимчивость к лекарствам. Кроме того, нет таргетной терапии для пациентов, чьи опухоли не обладают мутацией в гене BRAF.
Рисунок: Itay Tirosh et al. / Broad Institute of MIT and Harvard
Профили экспрессии генов, по которым можно отличить злокачественные и доброкачественные клетки раковой опухоли.
В своей статье исследователи подчеркивают, что следующее поколение лекарств против рака должно учитывать такие параметры опухоли, как, например, ее злокачественность, иммунный статус, а также экологические условия, в которых существуют ее клетки. В идеале перед лечением необходимо выяснить, из каких компонентов состоит опухоль, определить клеточные сигнальные пути, отвечающие за ее формирование и развитие, выделить популяции клеток, устойчивых к лекарствам, а также клеток, по которым можно определить, насколько действенен тот или иной вид терапии. Такую, казалось бы, неподъемную задачу могут осилить только геномные исследования, направленные на расшифровку ДНК и генных транскриптов.
Генные транскрипты — главные информаторы того, что происходит внутри клеток. Это продукты активных генов, представляющие собой молекулы РНК и участвующие либо в синтезе белка, либо в регуляции других генов. Геномный подход позволяет ученым определить, какие гены задействованы в жизни сотен и тысяч раковых клеток. Генетики проанализировали РНК-последовательности, чтобы изучить доброкачественные и злокачественные элементы опухоли, а также определить, что поддерживает существование рака.
Генетики проанализировали РНК-последовательности, чтобы изучить доброкачественные и злокачественные элементы опухоли, а также определить, что поддерживает существование рака.
Рисунок: Itay Tirosh et al. / Broad Institute of MIT and Harvard
Скорость клеточного цикла отдельных раковых клеток в различных опухолях (А), их размножение (В) и активность связанных с клеточным циклом генов.
Были получены профили экспрессии ДНК — вся совокупность генных продуктов — из 4645 злокачественных, иммунных и стромальных клеток, выделенных из 19 опухолей меланомы. Некоторые из клеток принадлежали метастазам, проникшим в такие ткани, как лимфатические узлы или селезенку, а также в мышечные, подкожные ткани и желудочно-кишечный тракт. Четыре меланомы имели мутации в BRAF-гене, пять — в другом онкогене NRAS, который также отвечает за рост и деление клеток. Восемь меланом обладали немутантными BRAF/NRAS-генами.
Образцы меланомы, извлеченные посредством биопсии, поместили в специальную суспензию, которая предотвращала разрушение РНК. Затем клетки распределили по двум категориям: иммунные и неиммунные. Из каждой клетки выделили РНК-транскрипты и с помощью фермента, называемого обратной транскриптазой, конвертировали в ДНК. Эта ДНК обрабатывалась специальным образом для получения пригодных для секвенирования последовательностей (библиотеки сиквенсов). Сама расшифровка последовательностей проводилась с использованием методов высокопроизводительного параллельного секвенирования, позволяющих прочитать миллиарды нуклеотидов в день. Всего были определены 4659 генов для злокачественных клеток и 3438 — для иммунных клеток.
Затем клетки распределили по двум категориям: иммунные и неиммунные. Из каждой клетки выделили РНК-транскрипты и с помощью фермента, называемого обратной транскриптазой, конвертировали в ДНК. Эта ДНК обрабатывалась специальным образом для получения пригодных для секвенирования последовательностей (библиотеки сиквенсов). Сама расшифровка последовательностей проводилась с использованием методов высокопроизводительного параллельного секвенирования, позволяющих прочитать миллиарды нуклеотидов в день. Всего были определены 4659 генов для злокачественных клеток и 3438 — для иммунных клеток.
Рисунок: Itay Tirosh et al. / Broad Institute of MIT and Harvard
Активность генов лекарственной устойчивости в различных опухолях.
На основе этой информации ученые определили типы клеток, присутствующих в опухоли. Обнаружили, что, во-первых, некоторые злокачественные клетки были анеуплоидными, то есть с «неправильным» числом хромосом. Во-вторых, выяснилось, что по своим генетическим характеристикам малигнизированные клетки в каждой опухоли формировали отдельные группы с различной генной активностью. В то же время нормальные клетки в различных опухолях обладали схожими ДНК-профилями и включали в себя T-клетки, B-клетки, макрофаги и фибробласты.
В то же время нормальные клетки в различных опухолях обладали схожими ДНК-профилями и включали в себя T-клетки, B-клетки, макрофаги и фибробласты.
Интересно, что раковые клетки отличались активностью генов, связанных с клеточным циклом. Из-за этого некоторые опухоли росли быстрее, другие — медленнее. В другом случае злокачественные клетки одной из меланом были разными в зависимости только от своего местоположения в ней. Одна из групп клеток представляла собой своего рода «ядро» с активными генами, участвующими во всех основных онкогенных и сопутствующих процессах, включая воспалительные реакции, стресс и сигнальные пути, провоцирующие устойчивость к лекарствам.
В целом результаты показывают, что меланома еще до применения терапии может обладать популяцией клеток, устойчивой к таргетным препаратам. Установлено, что в них активен ген MITF, который кодирует соединение, участвующее в обеспечении выживания опухоли. Кроме того, присутствовали AXL и NGFR — маркеры, указывающие на устойчивость клеток к таргетной терапии. Исследователи проверили, как эти клетки реагируют на ингибиторы, и выяснили, что после их применения гены невосприимчивости сильно увеличивают свою активность.
Исследователи проверили, как эти клетки реагируют на ингибиторы, и выяснили, что после их применения гены невосприимчивости сильно увеличивают свою активность.
Жизнь опухоли поддерживают не только злокачественные клетки, но и доброкачественные — они формируют микросреду, обеспечивающую рост и развитие всей клеточной массы. По составу «безобидных» клеток можно судить о разнообразии их «плохих» сородичей. Например, изобилие фибробластов связано с высокой долей клеток с активными AXL-маркерами. Кроме того, опухоль может быть в буквальном смысле пропитана T-лимфоцитами, по которым можно предсказать эффективность ингибиторов иммунных контрольных точек. В нормальных условиях лимфоциты должны контролировать рост меланомы, однако опухоль, как правило, оказывается невосприимчивой к ним. Чтобы обойти эту проблему, медики подавляют у T-клеток специальные рецепторы, ошибочно воспринимающие опухоль за нормальную ткань. Однако до сих пор не было маркеров, позволяющих предсказать эффективность такой терапии.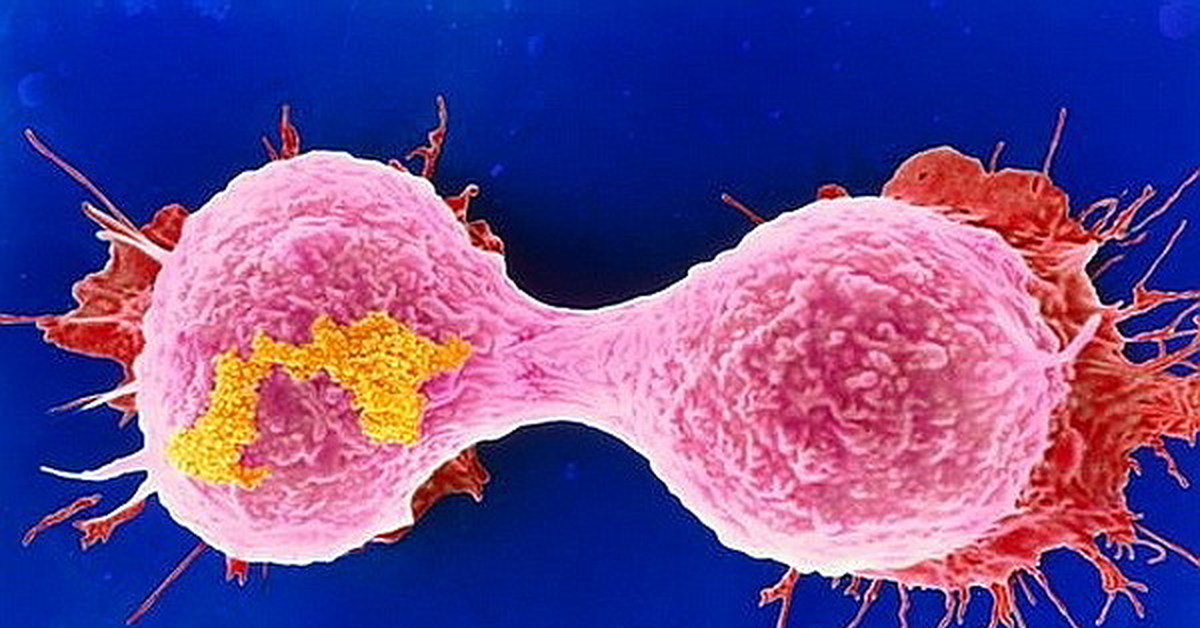
Проанализировав генные профили T-клеток, ученые выявили несколько генов, способных кодировать белки-рецепторы, устойчивые к подавлению ингибиторами. Наличие клеток с такими активными генами может служить показанием к другим видам иммунной терапии.
Исследователи подчеркивают, что полученные ими результаты — только начало обширных исследований раковых опухолей как сложных систем взаимодействующих клеток и их генов. Геномным методам при этом предстоит играть ведущую роль, поскольку они позволяют выявить генетические программы развития и устойчивости к лечению, а также разработать действенные методы, которые могут их нарушить.
Современные концепции канцерогенеза: значение недостаточности механизмов элиминации малигнизированных клеток в прогрессирующем развитии неоплазий различных локализаций
Резюме:
Обзор данных литературы отражает современные представления о механизмах индукции стадий малиг-низации, промоции и опухолевой прогрессии. Приводится анализ результатов собственных наблюдений и исследований состояния иммунологических механизмов защиты у значительного контингента пациентов с онко-патологией молочной и щитовидной желез, а также с аденокарциномой восходящего отдела ободочной кишки. Выявлены общие закономерности развития Т-зависимого, В-зависимого иммунодефицитного состояния, не зависящие от локализации неоплазий и прогрессирования и в то же время обнаруживающие прогрессирующий характер по мере развития регионарных метастазов. Авторы делают заключение о том, что недостаточность иммунологических механизмов защиты, приводящая к нарушению элиминации малигнизированных клеток, является ведущим патогенетическим фактором развития метастатических стадий опухолевого процесса.
Выявлены общие закономерности развития Т-зависимого, В-зависимого иммунодефицитного состояния, не зависящие от локализации неоплазий и прогрессирования и в то же время обнаруживающие прогрессирующий характер по мере развития регионарных метастазов. Авторы делают заключение о том, что недостаточность иммунологических механизмов защиты, приводящая к нарушению элиминации малигнизированных клеток, является ведущим патогенетическим фактором развития метастатических стадий опухолевого процесса.
Литература:
1. Абелев Г.И., Эрайзер Т.П. На пути к пониманию природы рака: обзор. Биохимия 2008; 73 (5): 605-618
2. Копнин Б.П. Современные представления о механизмах злокачественного роста. В кн.: Материалы X Российского онкологического конгресса. Издательская группа РОНЦ им. Н.Н. Блохина РАМН, 2006; с. 99-102
3. Рахимова О.Ю., Александров В.Б. Колоректальный рак — актуальная проблема внутренней медицины. Клиническая медицина 2008; (3): 7-12
4. О,Connel MJ, Laurie JA, Kahn М, et al. Prospectively randomized trial of postoperative adjuvant chemotherapy in patients with high-risk colon cancer. J Clin Oncol 1998; 16: 295-300
Prospectively randomized trial of postoperative adjuvant chemotherapy in patients with high-risk colon cancer. J Clin Oncol 1998; 16: 295-300
5. Канцерогенез: патофизиологические и клинические аспекты. Под общ. ред. В.М. Попкова, Н.П. Чесноковой, В.Ю. Барсукова. Саратов: СГМУ, 2011; 600 с.
6. Капиани В.А., Топуридзе М.Л., Нива В. и др. Возможные пути развития паранеопластического апоп-тоза. Аллергология и иммунология 2010; 11 (2): 102-104
7. Бережная, H.M. Роль клеток системы иммунитета в микроокружении опухоли Взаимодействие клеток системы иммунитета с другими компонентами микроокружения. Онкология 2009; 11 (2): 86-93
8. Кадагидзе З.Г. Цитокины. Практическая онкология 2003; 4 (3): 131 -139
9. Барамия М.Г. Канцерогенез, старение и продолжительность жизни: потенциал трансформированных клеток и торможение старения (гипотеза). Успехи современной биологии 1998; 4(118): 421-439
10. Барсуков В.Ю., Чеснокова Н.П., Плохое B.H. О роли активации процессов липопероксидации в механизмах развития метастазирования, цитолиза, аутоинтоксикации при узловой и отечно-инфильтративной формах рака молочной железы. Вестник Волгоградского государственного медицинского университета 2007; (3): 81-84
Вестник Волгоградского государственного медицинского университета 2007; (3): 81-84
11. Канцерогенез, цитокины и иммунитет: патогенетическая взаимосвязь в динамике развития неоплазий. Изд-во СГМУ, 2014; 328 с.
12. Темников P.A. Значение недостаточности иммунологических механизмов защиты в развитии послеоперационных осложнений у больных раком прямой кишки и возможности ее коррекции: автореф. дис. … канд. мед. наук. Саратов, 2000; 24 с.
13. Плохое B.H., Зяблов E.B., Чеснокова Н.П. и др. Закономерности изменений иммунного и цитокинового статусов при фолликулярной форме рака щитовидной железы в динамике распространения неоплазий. Вестник Волгоградского государственного медицинского университета 2011; (1): 97-100
14. Барсуков, В.Ю. Патогенез паранеопла-стических расстройств при раке молочной железы и патогенетическое обоснование принципов их медикаментозной коррекции: автореф. дис. … д-ра мед. наук. Саратов, 2008; 44 с.
|
Вовлечение лимфатических узлов
|
Локализуется в определенной группе лимфоузлов
|
Обычно распространяется среди > 1 групп лимфоузлов
|
|
Распространение
|
Имеет склонность распространяться упорядоченно и протяженно
|
Распространяется непоследовательно
|
|
Влияние на кольцо Вальдейера и брыжеечные лимфатические узлы
|
Как правило, не влияет
|
Часто поражает мезентериальные лимфоузлы
Может поражать кольцо Вальдейера
|
|
Экстранодальное поражение
|
|
|
|
Стадии на момент постановки диагноза
|
Обычно на ранней стадии
|
Обычно на поздней стадии
|
|
Гистологическая классификация у детей
|
Как правило, с благоприятным прогнозом
|
Обычно агрессивная форма
|
Туманян В.
 Г. — сотрудник | ИСТИНА – Интеллектуальная Система Тематического Исследования НАукометрических данных
Г. — сотрудник | ИСТИНА – Интеллектуальная Система Тематического Исследования НАукометрических данных
Туманян В.Г. — сотрудник | ИСТИНА – Интеллектуальная Система Тематического Исследования НАукометрических данных
Туманян В.Г.
Соавторы:
Намиот В.А.,
Гурский Г.В.,
Заседателев А.С.,
Zhuze A.L.,
Gottikh B.P.,
Есипова Н.Г.,
Grokhovsky S.L.,
Батяновский А.В.,
Borisova O.F.,
Grokhovsky S.L.,
Makeev V.,
Minyat E.E.,
Волотовский И.Д. показать полностью…,
Batyanovskii A.V.,
Bogush V.,
Davydova L.I.,
Debabov V.,
Gorachek P.,
Klinov D.V.,
Orchanskyi I.A.,
Sidoruk K.V.,
АНАШКИНА А.А.,
Готтих Б.
 П.,
П.,
Гроховский С.Л.,
Кирпичников М.П.,
Коган Е.А.,
Молдавер М.В.,
Неретина Т.В.,
Панченко Л.А.,
Полищук М.С.,
Соколова О.С.,
Торшин И.Ю.,
Циммер К.,
Шайтан К.В.
22 статьи, 7 докладов на конференциях, 2 диссертации
Количество цитирований статей в журналах по данным
Web of Science: 303,
Scopus: 110
IstinaResearcherID (IRID): 724535
Деятельность
Статьи в журналах
-
2015
Структурные и физико-химические характеристики конформационно-стабильных олигопептидов alfa-спирального типа
Батяновский А.
 В.,
В.,Волотовский И.Д.,
Намиот В.А.,
Филатов И.В.,
Галкин И.А.,
Гнучев Н.В.,
Туманян В.Г.,
Есипова Н.Г.
в журнале Биофизика, издательство Наука (М.), том 60, № 3, с. 437-450
-
-
2014
К вопросу об эффективной очистке in vitro клеточных суспензий, содержащих малигнизированные клетки
Намиот В.А.,
Коган Е.А.,
Филатов И.В.,
Полищук М.
 С.,
С.,Туманян В.Г.,
Есипова Н.Г.
в журнале Биофизика, издательство Наука (М.), том 59, № 6, с. 1121-1124
-
-
2013
Конформационно-стабильные сегменты в спиральных структурах полипептидных цепей белков и их роль при формировании структур высших уровней
Батяновский А.В.,
Намиот В.А.,
Филатов И.В.,
Молдавер М.В.,
Анашкина А.А.,
Туманян В.Г.,
Есипова Н.
 Г.,
Г.,Волотовский И.Д.
в журнале Биофизика, издательство Наука (М.), том 58, № 6, с. 1969-1973
-
-
2011
General theory of the long-range interactions in protein folding
Namiot V.A.,
Batyanovskii A.V.,
Filatov I.V.,
Tumanyan V.G.,
Esipova N.G.
в журнале Physics Letters, Section A: General, Atomic and Solid State Physics, издательство Elsevier BV (Netherlands), том 375, № 32, с.
 2911-2915
2911-2915DOI
-
-
2009
A novel model system for design of biomaterials based on recombinant analogs of spider silk proteins
Bogush V.G.,
Sokolova O.S.,
Davydova L.I.,
Klinov D.V.,
Sidoruk K.V.,
Esipova N.G.,
Neretina T.V.,
Orchanskyi I.A.,
Makeev V.Y.,
Tumanyan V.G.,
Shaitan K.V.,
Debabov V.G.,
Kirpichnikov M.P.
в журнале Journal of NeuroImmune Pharmacology, издательство Springer Verlag (Germany), том 4, № 1, с.
 17-27
17-27
-
-
1974
Код, управляющий специфическим связыванием регуляторных белков с ДНК, и структура стереоспецифических участков регуляторных белков
Гурский Г.В.,
Туманян В.Г.,
Заседателев А.С.,
Жузе А.Л.,
Гроховский С.Л.,
Готтих Б.П.
в журнале Молекулярная биология, том 9, № 5, с.
 635-651
635-651
-
Статьи в сборниках
Доклады на конференциях
- 2015
Конформационно- стабильные сегменты полипептидной цепи – новый класс локальных структур белка
(Устный)
- Авторы:
Батяновский 8. А В,
Торшин И.Ю.,
Намиот В.
 А.,
А.,Мильчевский Ю.В.,
Есипова Н.Г.,
Филатов И.В.,
Волотовский И.Д.,
Туманян В.Г.,
Галкин И.А.
V СЪЕЗД БИОФИЗИКОВ РОССИИ, Ростов-на-Дону , Россия, 4-10 октября 2015
- 2015
- 2013
Вода в коллагене
- Авторы:
Есипова Н.Г.,
Туманян В.Г.,
Филатов И.В.,
Намиот В.А.,
Анашкина А.А.,
Молдавер М.В.,
Мильчевский Ю.В.
 ,
,Рубин М.А.,
Айзенхабер Ф.
The structure of Water: physical and biological aspects, Санкт-Петербург, Россия, 2013
- 2013
- 2013
Особенности гидратации основных конформаций полипептидных цепей пептидов и белков, их структурная и термодинамическая стабильность
- Авторы:
Есипова Н.Г.,
Намиот В.А.,
Батяновский А.В.,
Туманян В.Г.,
Айзенхабер Ф.,
Молдавер М.В.,
Филатов И.В.
The structure of Water: physical and biological aspects, Санкт-Петербург, Россия, 2013
- 2013
Руководство диссертациями
Урология » Базально-люминальная дифференцировка эпителиальных клеток при раке предстательной железы сочетается с признаками эпителиально-мезенхимного перехода и миграции эпителия в мезенхиму
1. Ferlay J., Soerjomataram I., Dikshit R., Eser S., Mathers C., Rebelo M., Parkin D.M., Forman D., Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int. J. Cancer. 2015;136(5):E359–86. doi: 10.1002/ijc.29210.
Ferlay J., Soerjomataram I., Dikshit R., Eser S., Mathers C., Rebelo M., Parkin D.M., Forman D., Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int. J. Cancer. 2015;136(5):E359–86. doi: 10.1002/ijc.29210.
2. Howlader N., Noone A.M., Krapcho M. et al. SEER cancer statistics review, 1975–2011 (Vintage 2011 populations). Retrieved from http://www.seer.cancer.gov/csr/2014.
3. Bashir M.N. Epidemiology of Prostate Cancer. Asian Pac. J. Cancer Prev. 2015; 16(13):5137–5141.
4. Glybochko P.V., Alyaev Y.G., Amosov A.V., Krupinov G.E., Obukhov A.A., Ganzha T.M., Novichkov N.D. Histoscanning in the early diagnosis of prostate cancer. Andrology and Genital Surgery. 2014;15(2):37–43. Russian (Глыбочко П.В., Аляев Ю.Г., Амосов А.В., Крупинов Г.Е., Обухов А.А., Ганжа Т.М., Новичков Н.Д. Ранняя диагностика рака предстательной железы с помощью гистосканирования. Андрология и генитальная хирургия. 2014;15(2):37–43). DOI:10.17650/2070-9781-2014-2-37-43).
5. Abate-Shen C., Shen M.M. Molecular genetics of prostate cancer. Genes Dev. 2000;14(19):2410–2434.
6. Bethel C.R., Faith D., Li X., Guan B., Hicks J.L., Lan F., Jenkins R.B., Bieberich C.J., De Marzo A.M. Decreased NKX3.1 protein expression in focal prostatic atrophy, prostatic intraepithelial neoplasia, and adenocarcinoma: association with gleason score and chromosome 8p deletion. Cancer Res. 2006;66(22):10683–10690.
7. El-Alfy M., Pelletier G., Hermo L.S., Labrie F. Unique features of the basal cells of human prostate epithelium. Microsc. Res. Tech. 2000;51(5):436–446.
8. Vashchenko N., Abrahamsson P.A. Neuroendocrine differentiation in prostate cancer: implications for new treatment modalities. Eur. Urol. 2005;47(2):147–155.
9. Min J., Zaslavsky A., Fedele G., McLaughlin S.K., Reczek E.E., De Raedt T., Guney I., Strochlic D.E., Macconaill L.E., Beroukhim R., Bronson R.T., Ryeom S., Hahn W.C., Loda M., Cichowski K. An oncogene-tumor suppressor cascade drives metastatic prostate cancer by coordinately activating Ras and nuclear factor-kappaB. Nat. Med. 2010;16(3):286–294. doi: 10.1038/nm.2100.
Nat. Med. 2010;16(3):286–294. doi: 10.1038/nm.2100.
10. Burger P.E., Xiong X., Coetzee S., Salm S.N., Moscatelli D., Goto K., Wilson E.L. Sca-1 expression identifies stem cells in the proximal region of prostatic ducts with high capacity to reconstitute prostatic tissue. Proc. Natl. Acad. Sci. USA. 2005;102(20):7180–7185.
11. Goldstein A.S., Huang J., Guo C., Garraway I.P., Witte O.N. Identification of a cell of origin for human prostate cancer. Science. 2010;329(5991):568–571. doi:10.1126/science.1189992.
12. Tomlins S.A., Rhodes D.R., Perner S., Dhanasekaran S.M., Mehra R., Sun X.W., Varambally S., Cao X., Tchinda J., Kuefer R., Lee C., Montie J.E., Shah R.B., Pienta K.J., Rubin M.A,, Chinnaiyan A.M. Recurrent fusion of TMPRSS2 and ETS transcription factor genes in prostate cancer. Science. 2005;310(5748):644–648.
13. Carver B.S., Tran J., Gopalan A., Chen Z., Shaikh S., Carracedo A., Alimonti A., Nardella C., Varmeh S., Scardino P.T., Cordon-Cardo C., Gerald W.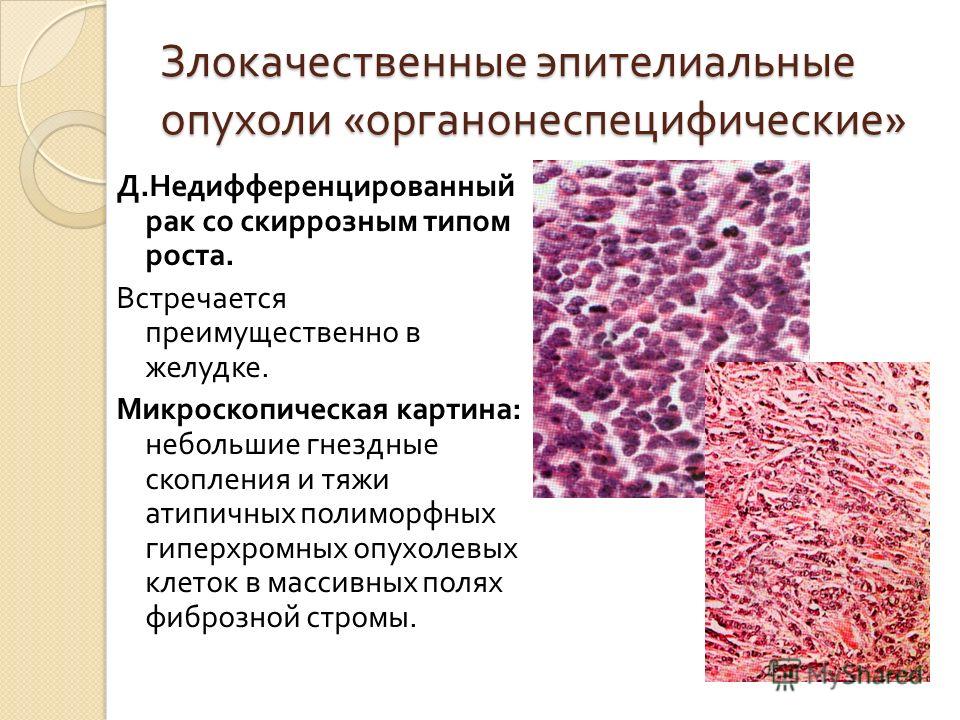 , Pandolfi P.P. Aberrant ERG expression cooperates with loss of PTEN to promote cancer progression in the prostate. Nat. Genet. 2009;41(5):619–624.
, Pandolfi P.P. Aberrant ERG expression cooperates with loss of PTEN to promote cancer progression in the prostate. Nat. Genet. 2009;41(5):619–624.
14. Zong Y., Xin L., Goldstein A.S., Lawson D.A., Teitell M.A., Witte O.N. ETS family transcription factors collaborate with alternative signaling pathways to induce carcinoma from adult murine prostate cells. Proc. Natl. Acad. Sci. USA. 2009;106(30):12465–12470. Doi: 10.1073/pnas.0905931106.
15. Reya T., Morrison S.J., Clarke M.F., Weissman I.L. Stem cells, cancer, and cancer stem cells. Nature. 2001;414:105–111.
16. Pardal R., Clarke M.F., Morrison S J. 2003. Applying the principles of stem-cell biology to cancer. Nat. Rev. Cancer. 2003;3:895–902.
17. O’Brien C.A., Pollett A., Gallinger S., Dick J.E. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature. 2007;445:106–110.
18. Thiery J.P., Acloque H., Huang R.Y., Nieto M.A. Epithelial-mesenchymal transitions in development and disease. Cell. 2009;139:871–890.
Cell. 2009;139:871–890.
19. Caramel J., Papadogeorgakis E., Hill L., Browne G.J., Richard G., Wierinckx A., Saldanha G., Osborne J., Hutchinson P., Tse G., Lachuer J., Puisieux A., Pringle J. H., Ansieau S., Tulchinsky E. 2013. A switch in the expression of embryonic EMT-inducers drives the development of malignant melanoma. Cancer Cell. 2009;24:466–480.
20. Park S.M., Gaur A.B., Lengyel E., Peter M.E. The miR-200 family determines the epithelial phenotype of cancer cells by targeting the E-cadherin repressors ZEB1 and ZEB2. Genes Dev. 2008;22(7):894–907. doi: 10.1101/gad.1640608.
21. Xin L. Cells of origin for cancer: an updated view from prostate cancer. Oncogene. 2013;32:3655–3663.
22. Shibata M., Shen M.M. Stem cells in genetically-engineered mouse models of prostate cancer. Endocr. Relat. Cancer. 2015;22(6):199–208.
23. Moll R., Divo M., Langbein L. The human keratins: biology and pathology. Histochem. Cell. Biol. 2008;129:705–733.
24. Long R. M., Morrissey C., Fitzpatrick J.M., Watson R.W. Prostate epithelial cell differentiation and its relevance to the understanding of prostate cancer therapies. Clin. Sci. (Lond). 2005;108:1–11.
M., Morrissey C., Fitzpatrick J.M., Watson R.W. Prostate epithelial cell differentiation and its relevance to the understanding of prostate cancer therapies. Clin. Sci. (Lond). 2005;108:1–11.
25. Wong A.S., Gumbiner B.M. Adhesion-independent mechanism for suppression of tumor cell invasion by E-cadherin. J. Cell Biol. 2003;161(6):1191–1203.
26. Tam W.L., Weinberg R.A. The epigenetics of epithelial-mesenchymal plasticity in cancer. Nat. Med. 2013;19:1438–1449.
27. Herranz N., Pasini D., Díaz V.M., Francí C., Gutierrez A., Dave N., Escrivà M., Hernandez-Muñoz I., Di Croce L., Helin K., García de Herreros A., Peiró S. Polycomb complex 2 is required for E-cadherin repression by the Snail1 transcription factor. Mol. Cell. Biol. 2008;28(15):4772–7781.
28. Yates C. Prostate tumor cell plasticity: a consequence of the microenvironment. Adv. Exp. Med. Biol. 2011;720:81–90.
29. Onder T.T., Gupta P.B., Mani S.A., Yang J., Lander E.S., Weinberg R.A. Loss of E-cadherin promotes metastasis via multiple downstream transcriptional pathways. Cancer Res. 2008;68(10):3645–3654. doi: 10.1158/0008-5472.CAN-07-2938.
Cancer Res. 2008;68(10):3645–3654. doi: 10.1158/0008-5472.CAN-07-2938.
30. Cao Q., Yu J., Dhanasekaran S.M., Kim J.H., Mani R.S., Tomlins S.A., Mehra R., Laxman B., Cao X., Yu J., Kleer C.G., Varambally S., Chinnaiyan A.M. Repression of E-cadherin by the polycomb group protein EZh3 in cancer. Oncogene. 2008;27(58):7274–7284.
31. Grant C.M., Kyprianou N. Epithelial mesenchymal transition (EMT) in prostate growth and tumor progression. Transl. Androl. Urol. 2013;2(3):202–211.
32. Petrov N.S., Voskresensky M.A., Grosov R.V., Korshak O.V., Zaritsky A.Y., Vereschagina N.A., Komyakov B.K., Popov B.V. Markers of the prostate basal layer cells are effective indicators of its malignant transformation. Tsitologiia. 2016;58(7):526–533. Russian (Петров Н.С., Воскресенский М.А., Грозов Р.В., Коршак О.В., Зарицкий А.Ю., Верещагина Н.А., Комяков Б.К., Попов Б.В. Маркеры клеток базального слоя эпителия предстательной железы являются эффективными индикаторами ее злокачественной трансформации. Цитология. 2016; 58(7):526–533).
Цитология. 2016; 58(7):526–533).
33. Maitland N.J., Frame F.M., Polson E.S., Lewis J.L., Collins A.T. Prostate cancer stem cells: do they have a basal or luminal phenotype? Horm. Cancer. 2011;2:47–61.
34. Humphrey P.A. Diagnosis of adenocarcinoma in prostate needle biopsy tissue. J. Clin. Pathol. 2007;60:35–42.
35. Savolainen K., Bhaumik P., Schmitz W., Kotti T.J., Conzelmann E., Wierenga R.K., Hiltunen, J.K. Alpha-methylacyl-CoA racemase from Mycobacterium tuberculosis. Mutational and structural characterization of the active site and the fold. J. Biol. Chem. 2005;280:12611–12620.
36. Bhaumik P., Schmitz W., Hassinen A., Hiltunen J. K., Conzelmann E., Wierenga R.K., Lloyd M.D. The catalysis of the 1,1-proton transfer by alpha-methyl-acyl-CoA racemase is coupled to a movement of the fatty acyl moiety over a hydrophobic, methionine-rich surface. J. Mol. Biol. 2007;367:1145–1161.
37. Lloyd M.D., Darley D.J., Wierzbicki A.S., Threadgill M.D. Alpha-methylacyl-CoA racemase – an ‘obscure’ metabolic enzyme takes centre stage, FEBS J. 2008;275:1089–1102.
2008;275:1089–1102.
38. Lloyd M.D., Yevglevskis M., Lee G.L., Wood P.J., Threadgill M.D., Woodman T. J. α-Methylacyl-CoA racemase (AMACR): metabolic enzyme, drug metabolizer and cancer marker P504S. Prog. Lipid Res. 2013;52:220–230.
39. Jiang Z., Fanger G.R., Woda B.A., Banner B.F., Algate P., Dresser K., Xu J., Chu P.G. Expression of alpha-methylacyl-CoA racemase (P504s) in various malignant neoplasms and normal tissues: a study of 761 cases. Hum. Pathol. 2003;34:792–796.
40. Baron A., Migita T., Tang D., Loda M. Fatty acid synthase: a metabolic oncogene in prostate cancer? J. Cell. Biochem. 2004;91:47–53.
Вячеслав Саввич Прокопчук (к 75-летию со дня рождения)
22 августа 2014 г. исполняется 75 лет со дня рождения и 53 года врачебной, научно-педагогической и общественной деятельности известного украинского патолога, доктора медицинских наук (1981 г.), профессора Буковинского (1982-2001 гг.), Замбийского (1989-1991 гг.) и Лундского (Швеция) (2001-2006 гг. ) медицинских университетов, действительного члена Международной академии патологии (с 1995 г.) Вячеслава Саввича Прокопчука.
) медицинских университетов, действительного члена Международной академии патологии (с 1995 г.) Вячеслава Саввича Прокопчука.
В.С. Прокопчук родился в с. Заречном Тульчинского района Винницкой области в семье учителей. Окончил Буковинский медицинский университет в 1961 г. и Черновицкий национальный университет (химический факультет) в 1968 г. С 1961 г. работал преподавателем Буковинского медицинского университета, а с 1968 по 2001 г. возглавлял кафедру патологической анатомии с курсом судебной медицины и был консультантом патологоанатомического и судебно-медицинского бюро.
Работал профессором и консультантом университетских госпиталей в Замбийском (1989-1991 гг.) и Лундском (2001-2006 гг.) медицинских университетах, с 2006 г. — консультант-патолог. Имеет высшую врачебную категорию. Награжден значком «Отличнику здравоохранения СССР» и медалью «Ветеран труда». Ему принадлежит 8 изобретений, 43 рационализаторских предложения, открытие («Явление локальной иммунной толерантности»), 158 научных публикаций, в том числе 3 монографии. Подготовил 6 кандидатов медицинских наук.
Подготовил 6 кандидатов медицинских наук.
Основные научные исследования проф. В.С. Прокопчука посвящены патологии щитовидной железы, сердца, сосудов и опухолям. Его кандидатская («Васкуляризация нормальной и зобно-измененных щитовидных желез». — Черновцы, 1965) и докторская («Морфогенез эндемического зоба». — М., 1979; консультанты: акад. В.В. Серов и О.К. Хмельницкий) диссертации внесли существенный вклад в ликвидацию Прикарпатского очага эндемического зоба.
Проф. В.С. Прокопчук показал, что причиной непрерывного роста простого эутиреоидного зоба является задержка тиреоидных гормонов в самой щитовидной железе, а не экзогенный дефицит йода. Он описал тканевую структурно-функциональную единицу щитовидной железы — тиреон и доказал, что зобной узел — это гиперплазированный тиреон. Широкое признание получили разработанные им критерии дифференциальной диагностики узлового зоба и аденом щитовидной железы. Проф. В.С. Прокопчук описал одноклеточные фолликулы щитовидной железы, что объясняет синтез гормонов тиреоидной тканью паренхиматозной структуры; доказал, что пусковым механизмом аутоиммунного тиреоидита является атрофия от истощения тиреоцитов вследствие нарушения их функционального биоритма.
В.С. Прокопчук описал тканевую структурно-функциональную единицу миокарда — виртуальный «миокардон», что в корне меняет представление о функции миокарда, подводит морфологическую основу явлению фибрилляции и современным методам лечения ишемической болезни сердца (создание искусственных сосудов Тебезия лазерным лучом).
Открытие проф. В.С. Прокопчуком явления локальной иммунной толерантности не только объяснило, каким способом малигнизированные клетки ускользают от иммунного надзора, выживают и образуют опухоль, но и легло в основу хирургических методов лечения аутоиммунного тиреоидита и сахарного диабета. Оригинальна предложенная им математическая модель ортогенеза опухолевых узлов. Она создала перспективу лечения опухолей путем ускорения их естественной регрессии, а выявленные закономерности кинетики пролиферации злокачественных клеток, которая описывается числами Фибоначчи, дала возможность определять степень опухолевой прогрессии неинвазивными методами.
Проф. В.С. Прокопчук предложил новую «унитарную» теорию атеросклероза, доказав, что причиной атероматоза является преждевременное достижение миофибробластами предела Hayflick’a — летального укорочения теломеров — в бляшках интимы. Он описал неизвестную ранее нозологическую форму — «контузию печени». Пересмотрел гистофизиологию голосообразования и создал новую теорию голоса. Доказал, что «черновицкая болезнь» (1988 г.) была эпидемией стертой формы скарлатины с алопецийным синдромом. Выяснил, что во главе неспецифических проявлений любого болезненного состояния является общий дистрофический процесс, в основе которого лежит дефицит энергии.
В.С. Прокопчук предложил новую «унитарную» теорию атеросклероза, доказав, что причиной атероматоза является преждевременное достижение миофибробластами предела Hayflick’a — летального укорочения теломеров — в бляшках интимы. Он описал неизвестную ранее нозологическую форму — «контузию печени». Пересмотрел гистофизиологию голосообразования и создал новую теорию голоса. Доказал, что «черновицкая болезнь» (1988 г.) была эпидемией стертой формы скарлатины с алопецийным синдромом. Выяснил, что во главе неспецифических проявлений любого болезненного состояния является общий дистрофический процесс, в основе которого лежит дефицит энергии.
По инициативе проф. В.С. Прокопчука впервые в Украине в 1973 г. проведена централизация патологоанатомической службы в пределах области и создано патологоанатомическое бюро. На возглавляемой им кафедре с 1991 г. внедрена международная тестовая система контроля усвоения студентами учебного материала. На базе кафедры проведены 2-й съезд патологоанатомов Украины (1974 г. ) и Всесоюзная учебно-методическая конференция (1981 г.) по вопросам преподавания патологической анатомии. Он является членом редколлегии журнала «Буковинский медицинский вестник».
) и Всесоюзная учебно-методическая конференция (1981 г.) по вопросам преподавания патологической анатомии. Он является членом редколлегии журнала «Буковинский медицинский вестник».
Лекции проф. В.С. Прокопчука привлекали внимание глубокой научностью, актуальностью обсуждаемой проблемы, педагогическим мастерством и всегда вызывали восхищение аудитории. Широкой популярностью пользовались клинико-анатомические конференции с его участием.
Свой юбилей Вячеслав Саввич встречает исполненный новыми научными идеями, энергией и вдохновением.
Коллеги и ученики сердечно поздравляют юбиляра, желают ему крепкого здоровья, долголетия и всего самого доброго.
Руженкова Юлия СергеевнаКвалификационная работа магистра: «Молекулярно-цитогенетические особенности полиморфных гетерохроматиновых районов метафазных хромосом в клетках трофобласта человека» Аннотация: Традиционно считалось, что районы конститутивного гетерохроматина (ГХР) являются конденсированными в течение всего клеточного цикла, поздно реплицирующимися, гиперметилированными и транскрипционно инертными, а также играют роль в поддержании архитектоники ядра, участвуют в процессах рекомбинации и регуляции экспрессии генов. Направление: Биология Кафедра: Генетики и Биотехнологии Научный руководитель: д.б.н. Кузнецова Т.В. Отзыв научного руководителя Рецензент: к.б.н. Дукельская А.В. Рецензия Проблема роли структурно-функциональных особенностей гетерохроматиновых районов генома в онтогенезе человека обсуждается специалистами самых разных областей медицинской генетики на протяжении почти сорока последних лет. Особый интерес для исследователей представляют крупные блоки гетерохроматина на хромосомах 1, 9, 16 и Y. Многократные попытки самых разных авторов связать полиморфизм по длине этих блоков и гетероморфизм гомологов по этим районам с пренатальной и постнатальной патологией развития у человека не привели к каким бы то ни было однозначным результатам. Дата защиты: 16-06-2015 |
Медицинское определение и характеристики злокачественных
Термин «злокачественный» можно использовать по-разному: для описания раковой опухоли или очень серьезного заболевания. Есть несколько сходств, а также различий между злокачественными и доброкачественными опухолями. Узнайте о характеристиках и поведении злокачественных опухолей, о том, чем они отличаются от доброкачественных опухолей, а также о том, почему иногда бывает трудно отличить эти две опухоли.
Изображения героев / Getty Images
Медицинское определение злокачественного
В медицине слово злокачественный — это термин, относящийся к состоянию, опасному для здоровья.Хотя он часто используется как синоним рака, этот термин также используется для описания медицинских и психологических состояний, помимо рака, которые являются опасными или зловещими.
Синонимы слова «злокачественный» в медицине включают рак, вирулентный или злокачественный. Напротив, антонимы (противоположности) злокачественного образования в медицине относятся к процессам, которые не опасны для здоровья или благополучия, и включают такие термины, как доброкачественные, незлокачественные или безвредные. Тем не менее, некоторые злокачественные заболевания хорошо поддаются лечению, тогда как некоторые доброкачественные состояния могут быть опасными для жизни.
Злокачественные опухоли
Злокачественная опухоль (раковая опухоль) является инвазивной и может распространяться на другие части тела.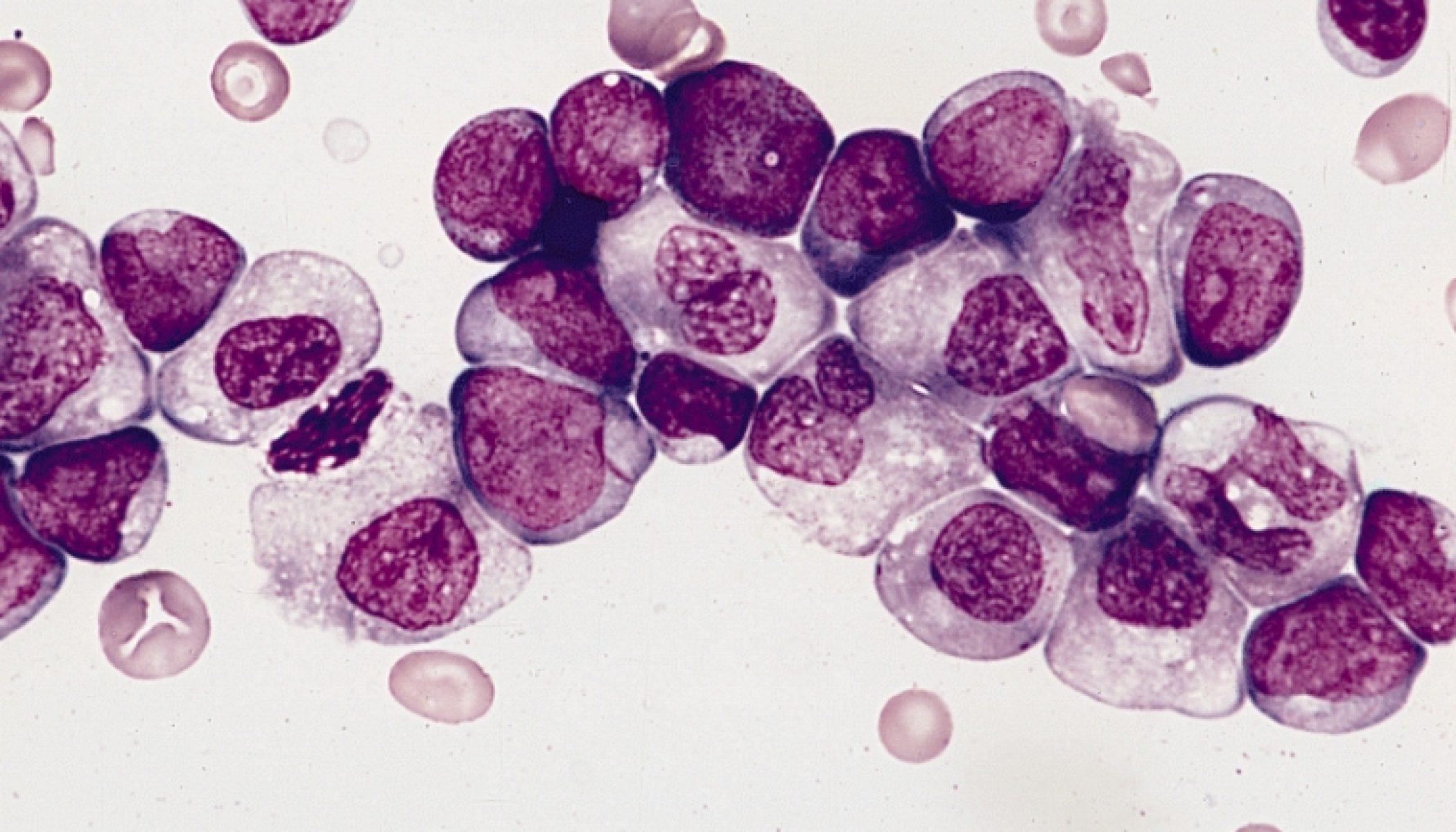 В отличие от нее, опухоли, которые остаются локализованными и не распространяются, называются доброкачественными. Доброкачественные опухоли могут вырасти довольно большими и причинить вред, но обычно они не распространяются через кровоток или лимфатические сосуды на другие части тела. Взаимодействие с другими людьми
В отличие от нее, опухоли, которые остаются локализованными и не распространяются, называются доброкачественными. Доброкачественные опухоли могут вырасти довольно большими и причинить вред, но обычно они не распространяются через кровоток или лимфатические сосуды на другие части тела. Взаимодействие с другими людьми
Злокачественные заболевания
Не все злокачественные новообразования являются злокачественными. Например, словосочетание «злокачественная гипертензия» используется для описания опасно высокого кровяного давления, но в данном контексте оно не имеет ничего общего с раком.Аналогичным образом, состояние злокачественной гипертермии описывает чрезвычайную ситуацию, при которой во время операции под общей анестезией развивается опасно высокая температура. Злокачественный наружный отит — это осложнение для уха пловца, которое было очень серьезным (а иногда и остается) до появления антибиотиков.
Злокачественные психические заболевания
Термин «злокачественный» также может использоваться при описании состояний психического здоровья, таких как побочный эффект психиатрических препаратов, называемых злокачественным нейролептическим синдромом, или при описании особенно разрушительной (для других) формы нарциссизма, называемой злокачественным нарциссизмом.
Характеристики злокачественных опухолей
При описании характеристик злокачественных или раковых опухолей проще всего сделать это, обсудив как сходства, так и различия (иногда неожиданные) между этими опухолями и доброкачественными или незлокачественными опухолями.
Сходства с доброкачественными опухолями
Некоторые признаки схожести доброкачественных и злокачественных опухолей включают:
- Размер: Как доброкачественные, так и злокачественные опухоли могут вырасти до довольно больших размеров.Например, миома матки, доброкачественная опухоль, может вырасти до размеров баскетбольного мяча.
- Способность вызывать повреждение: Когда доброкачественные опухоли возникают в закрытом пространстве головного мозга или в чувствительных областях, таких как нервы, глаза или сердце, они могут быть очень опасными, даже если они не распространяются на другие области тела. Доброкачественные опухоли также могут быть обезображивающими в зависимости от их местоположения
- Местный рецидив: Как доброкачественные, так и злокачественные опухоли могут вернуться после лечения.
 Разница в том, что злокачественные опухоли могут возвращаться в разных частях тела, в которые они распространились, тогда как доброкачественные опухоли будут повторяться только в том месте, где они были первоначально обнаружены.
Разница в том, что злокачественные опухоли могут возвращаться в разных частях тела, в которые они распространились, тогда как доброкачественные опухоли будут повторяться только в том месте, где они были первоначально обнаружены.
Чем злокачественные опухоли отличаются от доброкачественных
Злокачественные (раковые) опухоли отличаются от доброкачественных, а именно:
- Вторжение в близлежащие ткани: Злокачественные опухоли имеют плохие границы. В отличие от доброкачественных опухолей, которые могут давить на соседние структуры, злокачественные опухоли могут проникать в соседние структуры.Термин «рак» происходит от слова «краб» или «коготь», которое относится к этим пальцеобразным выступам, вторгающимся в ткани вблизи опухоли.
- Способность к распространению (метастазированию): В отличие от доброкачественных опухолей, злокачественные опухолевые клетки обладают способностью отрываться от опухоли и перемещаться (метастазировать) либо локально, либо через кровоток или лимфатическую систему.
 Многие считают, что большинство смертей от рака (примерно 90%) происходит из-за этой способности злокачественных опухолей распространяться, хотя статистика подвергается сомнению.(Узнайте больше о том, как распространяется рак.)
Многие считают, что большинство смертей от рака (примерно 90%) происходит из-за этой способности злокачественных опухолей распространяться, хотя статистика подвергается сомнению.(Узнайте больше о том, как распространяется рак.) - Вероятность и место рецидива: Доброкачественные опухоли могут рецидивировать после удаления в том регионе, где они были впервые обнаружены. Напротив, злокачественные опухоли рецидивируют чаще и могут рецидивировать локально (например, доброкачественные опухоли), регионально (например, в лимфатических узлах рядом с исходной опухолью) или удаленно (в органах или регионах, далеких от исходной опухоли).
- Клетки: Между доброкачественными и злокачественными клетками существует множество важных различий.Раковые клетки можно отличить от нормальных клеток при микроскопическом исследовании. Обычно они менее дифференцированы, чем нормальные клетки или доброкачественные опухолевые клетки. В конкретной ткани злокачественные клетки обычно проявляют характеристики быстрорастущих клеток, то есть высокое отношение ядра к цитоплазме, выраженные ядрышки, множество митозов и относительно небольшую специализированную структуру.
 Наличие инвазивных клеток в нормальном срезе ткани является наиболее диагностическим признаком злокачественного новообразования.
Наличие инвазивных клеток в нормальном срезе ткани является наиболее диагностическим признаком злокачественного новообразования.
Сложность различения доброкачественных и злокачественных опухолей
Если ваш врач не уверен, доброкачественная опухоль или злокачественная, вы можете быть удивлены. Разве это не очевидно? При сканировании, таком как компьютерная томография, МРТ или даже ПЭТ, доброкачественные и злокачественные опухоли иногда могут выглядеть очень похожими. Тем не менее, иногда бывает трудно заметить разницу даже под микроскопом. Хотя есть много различий между раковыми, предраковыми и нормальными клетками, существует также много общего.Кроме того, во многих опухолях присутствует смесь нормальных, предраковых и раковых клеток. Даже среди раковых клеток могут быть различия во внешнем виде этих клеток в разных частях опухоли (это называется «гетерогенность»).
Произношение: му-леег-нант
Примеры: Родни опечалился, узнав, что его опухоль злокачественная, и ему придется пройти курс лечения от рака.
Слово от Verywell
Хотя в целом злокачественные опухоли более серьезны и опасны для жизни, чем доброкачественные опухоли, это не всегда так.Достижения в лечении некоторых видов рака значительно улучшили выживаемость, а некоторые злокачественные новообразования очень выживаемы. В то же время некоторые доброкачественные опухоли (например, некоторые доброкачественные опухоли головного мозга или доброкачественные опухоли сердца) могут привести к серьезной инвалидности или даже смерти.
В чем разница? Доброкачественные и злокачественные опухоли
Хорошей опухоли не бывает. Эти массы мутировавших и дисфункциональных клеток могут вызывать боль и обезображивать, поражать органы и, возможно, распространяться по всему телу.Но не все опухоли являются злокачественными или злокачественными, и не все агрессивные. Доброкачественные опухоли, иногда болезненные и потенциально опасные, не представляют угрозы, которую представляют злокачественные опухоли. «Злокачественные клетки с большей вероятностью будут метастазировать [вторгаться в другие органы]», — говорит Фернандо У. Гарсия, доктор медицины, патолог нашей больницы в Филадельфии. «Они растут быстрее и с большей вероятностью вторгаются и разрушают местные органы».
Гарсия, доктор медицины, патолог нашей больницы в Филадельфии. «Они растут быстрее и с большей вероятностью вторгаются и разрушают местные органы».
«Доброкачественные опухоли обычно не прорастают.Обычно они отодвигают нормальные ткани в сторону ». — Фернандо У. Гарсия, доктор медицины, патолог
Неисправная ДНК
Опухоли растут из-за неисправности ДНК клеток, в основном генов, которые регулируют способность клеток контролировать свой рост. Некоторые поврежденные гены также могут препятствовать тому, чтобы плохие клетки убивали себя, чтобы освободить место для новых, здоровых клеток. «Регулирование гибели клеток так важно», — сказал д-р.- говорит Гарсия. «Если ваша запрограммированная гибель клеток изменена, клетка не знает, когда пора умирать, и остается. Если клетка учится блокировать это и развивает способность к размножению, опухоли растут быстрее». Некоторые из этих мутаций приводят к быстрому неконтролируемому росту, вызывая опухоли, которые могут быстро распространяться и повреждать близлежащие органы и ткани.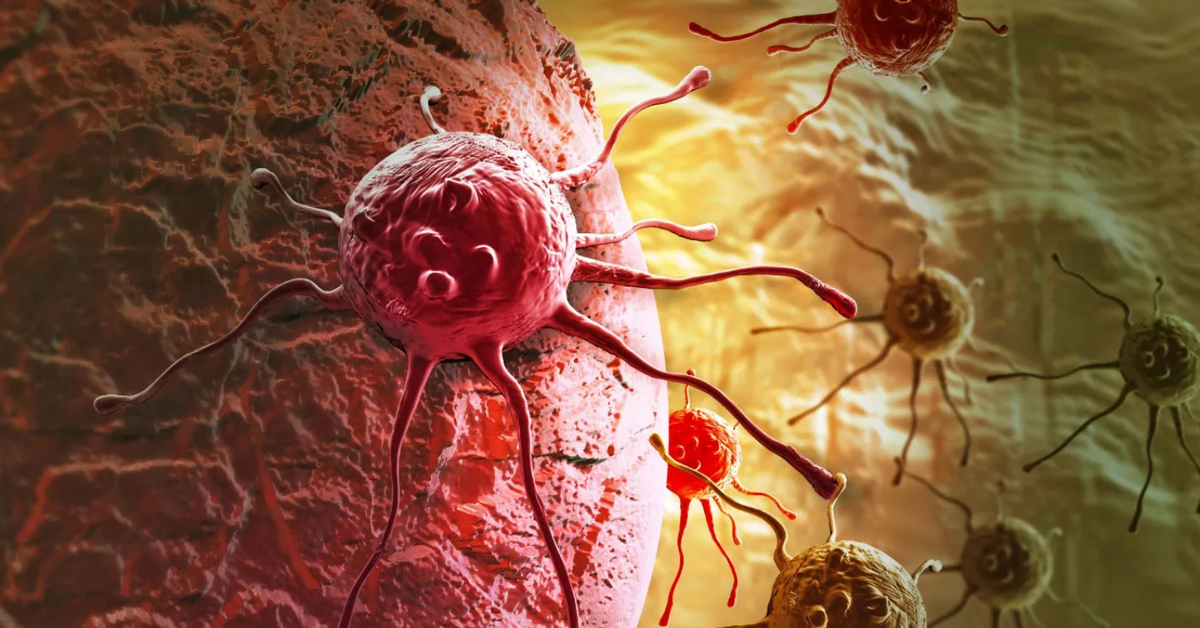 «Злокачественные клетки обладают способностью вырабатывать ферменты, растворяющие естественные ткани. Это известно как инвазивность», — говорит доктор Гарсия. Другие мутации менее агрессивны, образуя медленнорастущие опухоли, не являющиеся злокачественными.«Доброкачественные опухоли обычно не прорастают», — говорит доктор Гарсия. «Обычно они отодвигают нормальные ткани в сторону».
«Злокачественные клетки обладают способностью вырабатывать ферменты, растворяющие естественные ткани. Это известно как инвазивность», — говорит доктор Гарсия. Другие мутации менее агрессивны, образуя медленнорастущие опухоли, не являющиеся злокачественными.«Доброкачественные опухоли обычно не прорастают», — говорит доктор Гарсия. «Обычно они отодвигают нормальные ткани в сторону».
Многие люди всю жизнь носят доброкачественные опухоли. Невусы или родинки — это доброкачественные опухоли, которые могут никогда не нуждаться в лечении. К другим типам доброкачественных опухолей относятся:
- Аденомы : Эти бугорки образуются на поверхности желудочно-кишечного тракта. «Полип толстой кишки, классическая аденома, имеет лишь 1 процентный шанс стать раком в течение жизни пациента», — говорит Джеффри Вебер, доктор медицины, гастроэнтеролог в нашей больнице недалеко от Феникса.
- Фибромы : Эти опухоли соединительной ткани могут быть найдены в любом органе.
 Фиброидные опухоли названы по месту их образования в организме, например миома матки.
Фиброидные опухоли названы по месту их образования в организме, например миома матки. - Десмоидная опухоль : они часто более агрессивны, чем большинство доброкачественных опухолей, и могут поражать близлежащие ткани и органы. Но они не дают метастазов.
- Гемангиомы : Эти опухоли представляют собой скопление клеток кровеносных сосудов в коже или внутренних органах. Они могут появиться на коже в виде обесцвечивания, напоминающего родинки, и часто исчезают сами по себе.
- Липомы : Эти мягкие круглые жировые опухоли часто встречаются на шее или плечах.
- Лейомиомы : Наиболее распространенные гинекологические опухоли в Соединенных Штатах, они могут быть обнаружены в матке. Их рост поддерживается гормонами.
Как узнать, злокачественная ли опухоль?
Единственный способ узнать, является ли опухоль доброкачественной или злокачественной, — это пройти обследование на патологию.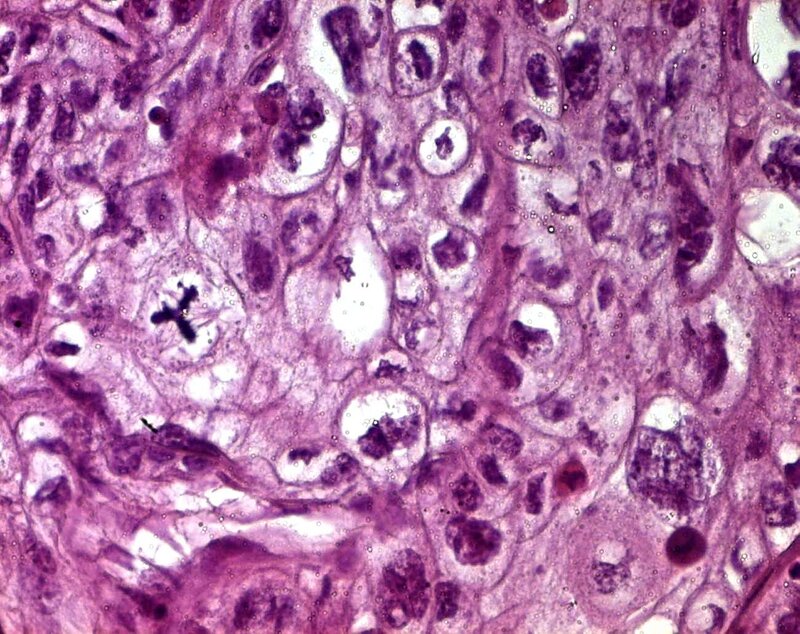 Хотя доброкачественные опухоли редко становятся злокачественными, некоторые аденомы и лейомиомы могут перерасти в рак, и их следует удалять.Десмоидные опухоли и миомы также могут вызвать повреждение, если им позволить расти, и могут потребоваться хирургическое вмешательство или полипэктомия. Но, хотя доброкачественные опухоли могут потребовать некоторого лечения, формирующие их клетки обладают некоторыми характеристиками агрессивных раковых клеток, говорит доктор Гарсиа.
Хотя доброкачественные опухоли редко становятся злокачественными, некоторые аденомы и лейомиомы могут перерасти в рак, и их следует удалять.Десмоидные опухоли и миомы также могут вызвать повреждение, если им позволить расти, и могут потребоваться хирургическое вмешательство или полипэктомия. Но, хотя доброкачественные опухоли могут потребовать некоторого лечения, формирующие их клетки обладают некоторыми характеристиками агрессивных раковых клеток, говорит доктор Гарсиа.
«Рак — это эволюция», — говорит он, добавляя, что доброкачественные опухоли не развиваются таким же образом. «Раковая клетка учится не умирать. Затем она учится размножаться. Затем она учится вторгаться. Затем она учится метастазировать.Клетки — строительные блоки рака ».
Злокачественные опухоли мягких тканей: типы, симптомы и методы лечения
Обзор
Что такое злокачественные опухоли мягких тканей?
Термин «злокачественная» указывает на то, что существует средняя или высокая вероятность того, что опухоль распространится за пределы того места, где она первоначально развивается.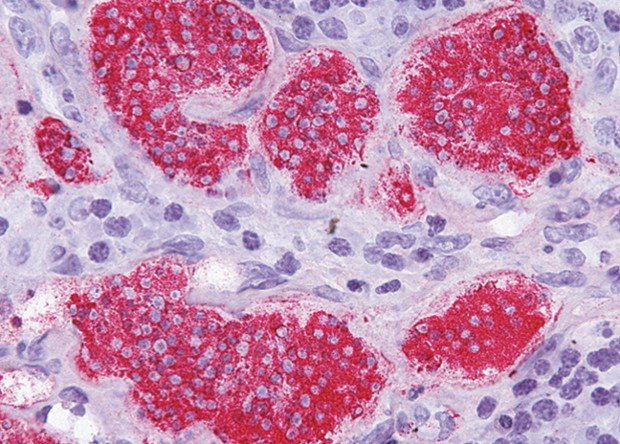 Эти клетки могут распространяться через кровоток или через лимфатические сосуды. Наиболее частые места распространения злокачественных опухолей костей — это печень и легкие. Другие кости также могут стать местами метастазирования.
Эти клетки могут распространяться через кровоток или через лимфатические сосуды. Наиболее частые места распространения злокачественных опухолей костей — это печень и легкие. Другие кости также могут стать местами метастазирования.
Злокачественные опухоли мягких тканей классифицируются как «саркомы». Считается, что эти опухоли возникают не из костей, а из «соединительных тканей», таких как мышцы, сухожилия, связки, жир и хрящи. Они редкие. Только около 8000 опухолей этого типа возникают каждый год в Соединенных Штатах, что составляет лишь около 1% всех злокачественных опухолей.Технически они отличаются от гораздо более распространенных видов рака или «карцином», которые представляют собой злокачественные опухоли, возникающие из тканей органов или желез (например, груди, простаты, толстой кишки, печени, почек, легких, щитовидной железы и т. Д.). Однако все это серьезные опухоли, к которым следует относиться с большой осторожностью.
К счастью, у более чем 90% пациентов, у которых обнаружена злокачественная опухоль, нет видимых доказательств того, что опухоль распространилась. Однако это не гарантирует, что небольшие районы распространения уже отсутствуют.Это важно, потому что, если опухоль уже распространилась, человека нельзя вылечить, просто удалив видимую опухоль на первичном участке. Теперь патологи могут исследовать многие опухоли под микроскопом и разделить опухоли на опухоли высокой степени злокачественности, вероятность распространения которых составляет 70-90%, и опухоли низкой степени злокачественности, вероятность распространения которых мала (менее 15%). ). Это позволяет нацелить дополнительную терапию на наиболее опасные опухоли и позволяет успешно лечить многие низкосортные опухоли только хирургическим путем.
Однако это не гарантирует, что небольшие районы распространения уже отсутствуют.Это важно, потому что, если опухоль уже распространилась, человека нельзя вылечить, просто удалив видимую опухоль на первичном участке. Теперь патологи могут исследовать многие опухоли под микроскопом и разделить опухоли на опухоли высокой степени злокачественности, вероятность распространения которых составляет 70-90%, и опухоли низкой степени злокачественности, вероятность распространения которых мала (менее 15%). ). Это позволяет нацелить дополнительную терапию на наиболее опасные опухоли и позволяет успешно лечить многие низкосортные опухоли только хирургическим путем.
Злокачественные опухоли мягких тканей могут возникать практически в любом возрасте, но наиболее часто встречаются у людей в возрасте от 50 до 70 лет. Злокачественная фиброзная гистиоцитома (MFH), липосаркома и синовиальная саркома, нейросаркома, рабдосаркома, фибросаркома, гемангиоперицитома и ангиосаркома являются одними из наиболее распространенных из этих опухолей, но существует множество других типов..jpg)
Симптомы и причины
Каковы симптомы злокачественных опухолей мягких тканей?
На ранних стадиях злокачественные опухоли мягких тканей редко вызывают какие-либо симптомы.Поскольку мягкие ткани очень эластичны, опухоли могут вырасти довольно большими до того, как их почувствуют. Первым симптомом обычно является безболезненная опухоль. По мере того, как опухоль растет и начинает давить на близлежащие нервы и мышцы, может возникать боль или болезненные ощущения. Любую растущую опухоль следует своевременно распознать и оценить.
Ведение и лечение
Какие есть варианты лечения злокачественных опухолей мягких тканей?
Оптимальное лечение часто требует сочетания навыков выдающегося хирурга, патолога, радиолога, радиотерапевта, медицинского онколога, а иногда и пластического хирурга.
За последние 15 лет в лечении злокачественных опухолей мягких тканей были сделаны важные улучшения.
Лечебные процедуры
Добавление химиотерапии для опухолей высшей степени злокачественности снижает скорость возвращения опухолей высокой степени злокачественности и может улучшить скорость излечения. Использование специализированных методов лучевой терапии значительно снизило вероятность повторного появления опухолей на том месте, где они были удалены. Часто, в зависимости от типа опухоли, можно использовать предоперационную лучевую терапию или химиотерапию (или их комбинацию), чтобы облегчить резекцию некоторых из этих опухолей с адекватными границами.
Хирургическое лечение
Лучевая терапия в сочетании с улучшенными методами хирургического удаления и улучшенными методами функциональной реконструкции теперь позволяет лечить 90-95% пациентов с этими агрессивными опухолями, используя методы «спасения конечностей» (то есть без ампутации).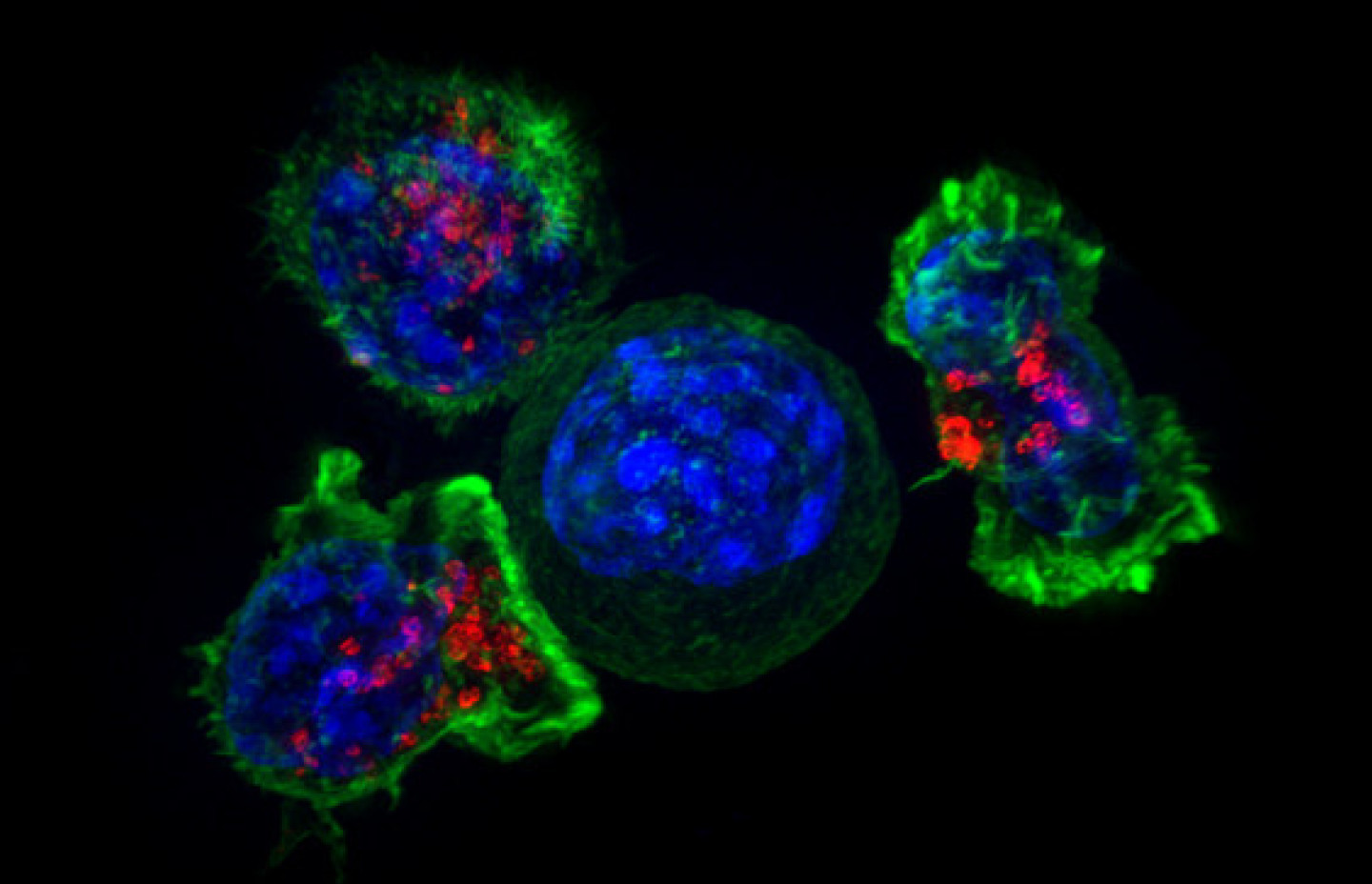
У всех ли в организме есть раковые клетки?
Типичная здоровая клетка имеет жизненный цикл роста, деления и смерти.Раковая клетка — это аномальная клетка, которая не следует этому циклу.
Вместо того, чтобы умирать должным образом, раковые клетки воспроизводят больше аномальных клеток, которые могут проникать в близлежащие ткани. Они также могут путешествовать по кровеносной и лимфатической системам в другие части тела.
Давайте подробнее рассмотрим, что нужно, чтобы нормальная клетка стала злокачественной, и что вы можете сделать, чтобы снизить вероятность развития рака.
Нет, не у всех в организме есть раковые клетки.
Наш организм постоянно производит новые клетки, некоторые из которых могут стать злокачественными.В любой момент мы можем производить клетки с поврежденной ДНК, но это не значит, что им суждено стать раком.
В большинстве случаев клетки с поврежденной ДНК либо восстанавливают себя, либо погибают в результате апоптоза. Потенциал развития рака возникает только тогда, когда ничего из этого не происходит.
Потенциал развития рака возникает только тогда, когда ничего из этого не происходит.
Вкратце, нормальные клетки подчиняются инструкциям. Раковые клетки этого не делают.
Нормальные клетки растут и делятся только по мере необходимости для замены поврежденных или стареющих клеток. Зрелые клетки выполняют особые функции.Выполнив свое предназначение, они умирают, завершая свой жизненный цикл.
Раковые клетки имеют мутировавшие гены и менее специализированы, чем нормальные клетки. Раковые клетки нарушают обычный распорядок дня. Нужны они или нет, но они растут, делятся и не умирают, когда должны. Именно этот неконтролируемый рост приводит к раку.
Раковые клетки накапливаются, образуя опухоли, и распространяются в окружающие ткани. Эти клетки также могут отделяться и перемещаться в другие части тела.
Еще больше усложняет ситуацию то, что раковые клетки могут влиять на поведение нормальных клеток.Они могут побуждать здоровые клетки вокруг себя к росту новых кровеносных сосудов, чтобы раковые опухоли снабжались питательными веществами.
Раковые клетки часто могут уклоняться от иммунной системы, не позволяя иммунным клеткам дифференцировать их от других клеток.
Есть большая разница между доброкачественными и злокачественными клетками.
Доброкачественные клетки не являются злокачественными. Иногда они чрезмерно продуцируются и образуют опухоли, но у них нет способности проникать в другие ткани. Обычно они не опасны для жизни, но могут быть опасными, если вырастают слишком большими или проникают в какой-либо орган.Например, доброкачественная опухоль головного мозга может быть опасной.
При удалении доброкачественной опухоли маловероятно, что она вырастет снова. Поскольку доброкачественные клетки не распространяются, нет необходимости в лечении, чтобы предотвратить возвращение доброкачественных клеток.
Злокачественные клетки являются злокачественными и потенциально опасными для жизни. Они обладают способностью проникать в близлежащие ткани и распространяться по всему телу.
При удалении злокачественной опухоли любые оставшиеся клетки могут привести к новому росту. Вот почему рак часто требует дополнительного лечения, такого как химиотерапия, иммунотерапия или облучение, чтобы найти и уничтожить раковые клетки по всему телу.
Вот почему рак часто требует дополнительного лечения, такого как химиотерапия, иммунотерапия или облучение, чтобы найти и уничтожить раковые клетки по всему телу.
Рак связан с поврежденной ДНК. Унаследованные генетические мутации связаны с 5-10 процентами всех видов рака. Наличие одной из этих генетических мутаций увеличивает риск развития рака, но это не является неизбежным.
Вы также можете получить генетические мутации с помощью других факторов, в том числе:
Точную причину развития рака не всегда можно определить. Сочетание факторов может способствовать возникновению рака. Как только в клетке происходит мутация, она передается каждой производящейся клетке.
Вы не можете полностью исключить риск рака, но есть шаги, которые вы можете предпринять, чтобы снизить его.
- Избегайте табака. Сюда входят сигары, сигареты, трубки и бездымные табачные изделия. В Соединенных Штатах 1 из каждых 3 смертей от рака можно отнести к курению.

- Регулярно проходите обследование на рак. Некоторые обследования, такие как мазок Папаниколау и колоноскопия, позволяют обнаружить аномальные клетки до того, как они станут злокачественными.Другие обследования, такие как маммография, могут обнаружить локализованные раковые клетки до того, как они начнут распространяться.
- Пейте алкоголь в умеренных количествах. Алкогольные напитки содержат этанол, который со временем увеличивает риск рака. Алкоголь следует ограничить одним напитком в день для женщин и двумя для мужчин.
- Защитите кожу от солнца. Избегайте попадания ультрафиолетовых лучей, покрывая кожу и используя солнцезащитный крем широкого спектра действия с SPF не менее 30. Старайтесь не проводить время под полуденным солнцем и не используйте солярии или солнечные лампы.
- Придерживайтесь здорового и сбалансированного питания. Постарайтесь включить в свой рацион много овощей, фруктов и цельнозерновых продуктов.
 Ограничьте употребление полуфабрикатов, сахара, красного мяса и мясных продуктов.
Ограничьте употребление полуфабрикатов, сахара, красного мяса и мясных продуктов. - Упражнение. Отсутствие физической активности может повысить риск рака. Старайтесь делать как минимум 150 минут умеренных упражнений или 75 минут интенсивных упражнений в неделю.
Поговорите со своим врачом о вакцинах, которые могут помочь снизить риск некоторых видов рака.
ВПЧ — это инфекция, передающаяся половым путем (ИППП), передающаяся при кожном контакте.Это может вызвать рак шейки матки, половых органов, головы и шеи. Центры по контролю и профилактике заболеваний (CDC) рекомендуют вакцину против ВПЧ для большинства людей в возрасте от 9 до 26 лет.
Существует также вакцина против гепатита В, вирусной инфекции, которая может повысить риск рака печени.
Поговорите со своим врачом о своем риске рака и о других шагах, которые вы можете предпринять, чтобы снизить этот риск.
Не у всех в организме есть раковые клетки.
Огромное количество клеток, постоянно образующихся в вашем организме, означает, что всегда существует вероятность того, что некоторые из них могут быть повреждены. Даже тогда эти поврежденные клетки не обязательно перерастут в рак.
Даже тогда эти поврежденные клетки не обязательно перерастут в рак.
Рак обычно возникает в результате повреждения ДНК в результате наследственных генетических мутаций или чего-то, с чем вы сталкиваетесь в повседневной жизни.
Вы не можете контролировать генетические мутации, но некоторые изменения в образе жизни могут помочь снизить риск развития рака, включая проведение определенных обследований на рак, чтобы остановить рак до его начала.
От А до Я: новообразование (опухоль), злокачественное (для родителей)
Также может называться: Рак; Злокачественная опухоль; Метастатическая опухоль; Карцинома
Злокачественное новообразование (NEE-oh-plaz-um) — злокачественное новообразование.
опухоль, аномальный рост, который может бесконтрольно расти и распространяться на другие части
тело.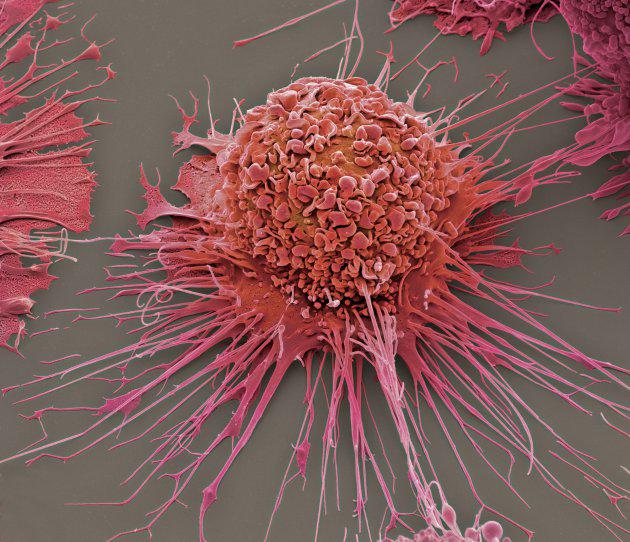
Дополнительная информация
Опухоли или новообразования — это группы аномальных клеток, которые объединяются в
образуют массу или комок. Они образуются, когда клетки делятся и чрезмерно растут, и они
может быть доброкачественным (не злокачественным) или злокачественным (злокачественным).
Раковая опухоль (злокачественное новообразование) может бесконтрольно расти, поражать здоровые ткани
и метастазировать (распространяться), или распространяться от места, где это начинается, в другие части
тела.Если не лечить и продолжает распространяться, злокачественное новообразование может
мешают функционированию органов и становятся опасными для жизни.
Лечение зависит от типа рака и степени его прогрессирования. Если рак
ограничена одной областью и не распространилась, опухоль может быть удалена хирургическим путем.
Другие распространенные методы лечения включают химиотерапию,
который убивает раковые клетки по всему телу, и радиация
терапия, которая убивает раковые клетки в определенной области тела.
Помните
Чем раньше будет обнаружено злокачественное новообразование, тем эффективнее его можно будет лечить,
поэтому ранняя диагностика важна. Многие виды рака можно вылечить. Лечение
другие типы могут позволить людям жить много лет с раком.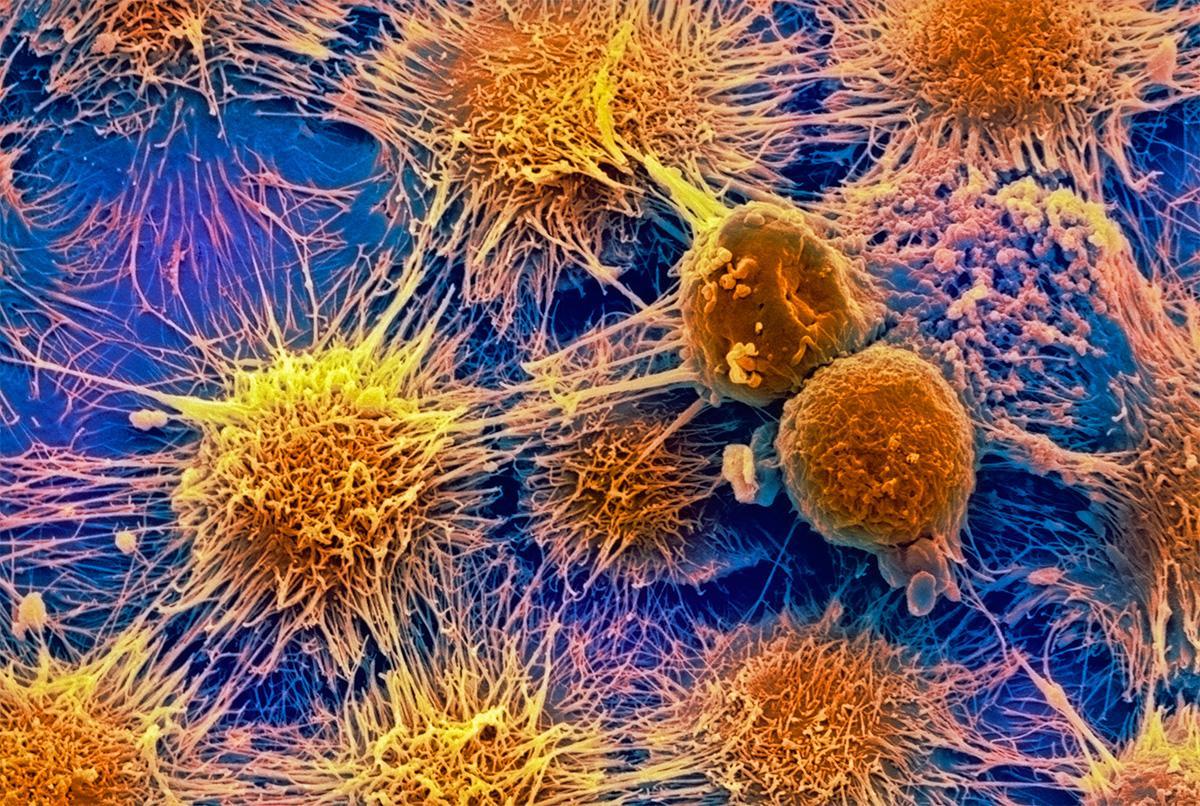
Все словарные статьи от А до Я регулярно проверяются организацией KidsHealth medical.
эксперты.
злокачественных клеток, управляющих злокачественным процессом: роль трансформирующего фактора роста-бета
Letterio JJ: Раковые модели: манипулирование трансформирующим путем фактора роста-β у мышей. В: Тейчер Б.А. (ред.) Модели опухолей в исследованиях рака. The Humana Press, Inc., Нью-Джерси, 2001
Google ученый
Letterio JJ, Bottinger EP: Нокаут TGF-бета и трансгенные мыши по доминантно-отрицательному рецептору. Майнер Электролит Metabo 24: 161–167, 1998
Google ученый
Дункер Н., Криглштейн К. Целевые мутации генов трансформирующего фактора роста бета показывают важную роль в развитии мышей и гомеостазе взрослых. Eur J Biochem 267: 6982–6988, 2000
Google ученый
Watanabe M, Whitman M: Роль факторов транскрипции, участвующих в передаче сигналов суперсемейства TGFbeta во время развития. Cell & Mol Biol 45: 537–543, 1999
Google ученый
Гранде JP: Роль трансформирующего фактора роста-β в повреждении и восстановлении тканей. Proc Soc Exp Biol Med 214: 27–40, 1997
Google ученый
Лоуренс Д.А.: Преобразование фактора роста-β: общий обзор.Eur Cytokine Netw 7: 363–374, 1996
Google ученый
Райт Дж. А., Хуанг А: Факторы роста в механизмах злокачественности: роли TGF-β и FGF. Histol Histopathol 11: 521–536, 1996
Google ученый
Пик Э., Хелдин C-H, тен Дейк П.: Специфичность, разнообразие и регуляция передачи сигналов суперсемейства TGF-β. FASEB J 13: 2105–2124, 1999
Google ученый
Padgett RW: Пути передачи сигналов TGF-β и болезни человека. Cancer Met Rev 18: 247–259, 1999
Google ученый
Золото LI: роль трансформирующего фактора роста-β (TGF-β) при раке человека. Crit Rev Oncogenesis 10: 303–360, 1999
Google ученый
Рейсс М: TGF-β и рак. Микробы заражают 1: 13278–1347, 1999
Google ученый
Piek E, Heldin C-H, ten Dijke P: Специфичность, разнообразие и регуляция передачи сигналов суперсемейства TGF-β. FASEB J 13: 2105–2124, 1999
Google ученый
Wieser R: Путь передачи сигналов трансформирующего фактора роста β в онкогенезе. Curr Opin Oncol 13: 70–77, 2001
Google ученый
Itoh S, Itoh F, Goumans M-J, ten Dijke P: Передача сигналов членов семейства трансформирующих факторов роста β через белки Smad.Eur J Biochem 267: 6954–6967, 2000
Google ученый
Буш М., Канипари Р., Мельчионна Р., Виллемс Д., Сенни М.И., Молинаро М.: Аутокринная петля TGF-β регулирует рост клеток и миогенную дифференцировку в клетках рабдомиосаркомы человека. FASEB J 14: 1147–1158, 2000
Google ученый
Массагу Дж., Уоттон Д.: Контроль транскрипции с помощью сигнальной системы TGF-β / Smad.EMBO J 19: 1745–1754, 2000
Google ученый
Norman SA, Rhodes SN, Treasurywala S, Hoelzinger DB, Shapiro JR, Scheck AC: Идентификация сверхэкспрессии белка, связывающего трансформирующий фактор роста β1, в клетках глиомы, устойчивых к кармустину, с помощью дифференциального отображения мРНК. Рак 89: 850–862, 2000
Google ученый
Лю X, Сунь Y, Эрлих М., Лу Т., Клог Y, Вайнберг Р.А., Лодиш Х.Ф., Хенис Ю.И.: Нарушение ингибирования роста TGF-β онкогенными ras связано с неправильной локализацией p27kip1.Онкоген 19: 5926–5935, 2000
Google ученый
Pasche B, Kolachana P, Nafa K, Satagopan J, Chen YG, Lo RS, Brener D, Yang D, Kirstein L, Oddoux C, Ostrer H, Vineis P, Varesco L, Jhanwar S, Luzzatto L.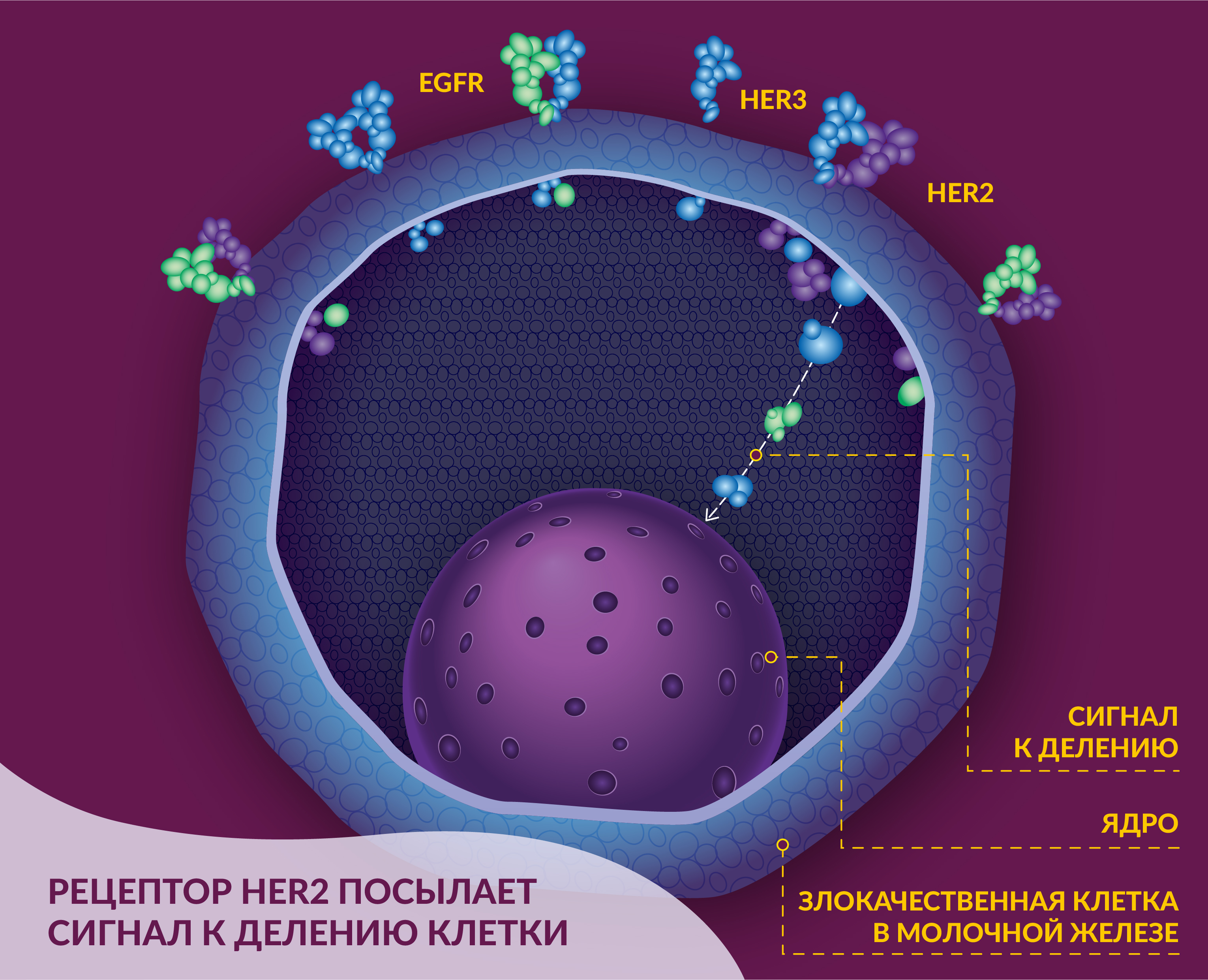 , Massague J, Offit K: TβR-1 (6A) является кандидатом аллеля предрасположенности к опухоли. Cancer Res 59: 5678–5682, 1999
, Massague J, Offit K: TβR-1 (6A) является кандидатом аллеля предрасположенности к опухоли. Cancer Res 59: 5678–5682, 1999
Google ученый
Ким И.Ю., Зелнер Д.Д., Сенсибар Дж.А., Ан Х.Дж., Парк Л., Ким Дж. Х., Ли К. Модуляция чувствительности к трансформирующему фактору роста-β1 (TGF-β1) и уровню TGF-β типа II. рецептор в клетках LNCaP дигидротестостероном.Exp Cell Res 222: 103–110, 1996
Google ученый
Киприану Н., Айзекс Дж. Т.: Идентификация клеточного рецептора для трансформации фактора роста бета в вентральной части простаты крысы и его отрицательная регуляция андрогенами. Эндокринология 123: 2124–2131, 1988
Google ученый
Merle B, Malaval L, Lawler J, Delmas P, Clezardin P: Декорин ингибирует прикрепление клеток к тромбоспондину-1 путем связывания с KKTR-зависимым клеточным адгезивным сайтом, присутствующим в N-концевом домене тромбоспондина-1 .J Cell Biochem 67: 75–83, 1997
Google ученый
Ван Т.Н., Цянь X, Граник М.С., Соломон М.П., Ротман В.Л., Бергер Д.Х., Тушинский Г.П.: Тромбоспондин-1 (TSP-1) способствует инвазивным свойствам рака груди человека. J Surg Res 63: 39–43, 1996
Google ученый
Мерфи-Ульрих Дж., Шульц-Черри С., Хук М.: Трансформация комплексов фактора роста-β с тромбоспондином.Mol Biol Cell 3: 181–188, 1992
Google ученый
Фидлер И.Дж .: Ангиогенез и метастазирование рака. Рак J 6 (Дополнение 2): S134 – S141, 2000
Google ученый
Бредоу С., Левин М., Хофманн Б., Марекос Е., Вайследер Р: Визуализация неоваскулярной сети опухоли путем нацеливания на эндоглин рецептора связывания TGF-β. Eur J Cancer 36: 675–681, 2000
Google ученый
Ли С., Гарланд Дж. М., Кумар С. Роль трансформации передачи сигналов фактора роста β при раке. J Natl Cancer Inst 93: 555–557, 2001
Google ученый
Хуанг А., Джин Х., Райт Дж. А.: Устойчивость к лекарственным средствам и потенциал амплификации гена, регулируемый трансформирующей экспрессией гена фактора роста — 1 1. Cancer Res 55: 1758–1762, 1995
Cancer Res 55: 1758–1762, 1995
Google ученый
Махара К., Като Дж., Теруи Т., Такимото Р., Хоримото М., Мураками Т., Моги И., Ватанабе Н., Кохго И., Ниитсу Ю.: Трансформирующий фактор роста β1, секретируемый скиррозными клетками рака желудка, связан с избытком отложение коллагена в ткани.Британский журнал рака, 69: 777–783, 1994
Google ученый
Тейчер Б.А., Маэхара Ю., Какеджи Ю., Ара Г., Киз С.Р., Вонг Дж., Хербст Р.: Обращение in vivo устойчивости к лекарству с помощью декорина, ингибитора трансформирующего фактора роста-β. Int J Cancer 71: 49–58, 1997
Google ученый
Kakeji Y, Maehara Y, Ikebe M, Teicher BA: Динамика оксигенации опухоли, окрашивание CD31 и уровни трансформирующего фактора роста β после лечения радиацией или циклофосфамидом в карциноме молочной железы крысы 13762.Int J Rad Oncol Biol Phys 37: 1115–1123, 1997
Google ученый
Тейчер Б.А., Холден С.А., Ара Г., Чен Г.: Преобразование фактора роста-β в резистентность in vivo к . Cancer Chemother Pharmacol 37 (6): 601–609, 1996
Google ученый
Аншер М.С., Петерс В.П., Райзенбихлер Х., Петрос В.П., Джиртл Р.Л.: Трансформирующий фактор роста-β в качестве предиктора фиброза печени и легких после трансплантации аутологичного костного мозга при распространенном раке груди.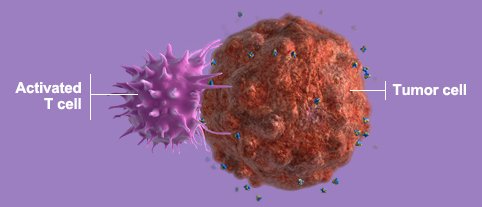 New Eng J Medicine 328: 1592–1598, 1993
New Eng J Medicine 328: 1592–1598, 1993
Google ученый
Тейчер Б.А., Чаттерджи Д., Лю Дж. Т., Холден С.А., Ара Г.: Защита гранулоцитарно-макрофагальных колониеобразующих единиц костного мозга у мышей, несущих in vivo устойчивых к алкилирующему агенту опухолей EMT-6. Cancer Chemother Pharmacol 32: 315–319, 1993
Google ученый
Чаттерджи Д., Лю Дж. Т., Норти Д., Тейкер Б. А.: Молекулярная характеристика in vivo алкилирующих агентов устойчивых опухолей карциномы молочной железы мыши EMT-6.Рак-химиотерапия. Pharmacol 35: 423–431, 1995
Google ученый
Кобаяши Х., Ман С., Грэхем С.Х., Капитайн С.Дж., Тейхер Б.А., Кербел Р.С.: Приобретенная многоклеточная устойчивость к алкилирующим агентам при раке. Proc Natl Acad Sci USA 90: 3294–3298, 1993
Google ученый
Тейчер Б.А., Холден С.А., Ара Дж., Чен Г.: Преобразование фактора роста — — в устойчивость in vivo к .Cancer Chemother Pharmacol 37: 601–609, 1996
Google ученый
Лю П., Менон К., Альварес Е., Лу К., Тейкер Б. А.: Трансформирующий фактор роста-β и ответ на противоопухолевую терапию при опухолях печени и желудка человека in vitro, и in vivo. Int J Oncol 16: 599–610, 2000
Google ученый
Тейчер Б.А., Икебе М., Ара Г., Киз С.Р., Хербст Р.: Сверхэкспрессия трансформирующего фактора роста-β вызывает лекарственную устойчивость in vivo : обращение декорином. In vivo 11: 463–472, 1997
Google ученый
Steiner MS: Трансформирующий фактор роста — â и рак простаты. Уорлд Дж Урол 13: 329–336, 1995
Google ученый
Guo Y, Jacobs SC, Kyprianou N: подавление экспрессии белка и мРНК для рецепторов трансформирующего фактора роста-β (TGF-β) типа I и типа II при раке простаты человека.Int J Cancer 71: 573–579, 1997
Google ученый
Kim IY, Ahn HJ, Zelner DJ, Shaw JW, Lang S, Kato M, Oefelein MG, Miyazono K, Nemeth JA, Kozlowski JM, Lee C: потеря экспрессии трансформирующего фактора роста β типа I и Рецепторы типа II коррелируют со степенью опухоли в тканях рака простаты человека. Clinical Cancer Res 2: 1255–1261, 1996
Google ученый
Williams RH, Stapleton AMF, Yang G, Truong LD, Rogers E, Timme TL, Wheeler TM, Scardino PT, Thompson TC: Пониженные уровни рецептора трансформирующего фактора роста β типа II при раке простаты человека: иммуногистохимический изучать.Clinical Cancer Res 2: 635–640, 1996
Google ученый
Коллеони М., О’Нил А., Голдхирш А., Гелбер Р. Д., Бонетти М., Турлиманн Б. , Прайс К. Н., Кастильоне-Герч М., Коутс А. С., Линдтнер Дж., Коллинз Дж., Сенн Х. Дж., Кавалли Ф., Forbes J, Gudgeon A, Simoncini E, Cartes-Funes H, Veronesi A, Fey M, Rudenstam CM: Выявление пациентов с раком груди с высоким риском метастазов в кости. J Clin Oncol 18: 3925-3935, 2000
, Прайс К. Н., Кастильоне-Герч М., Коутс А. С., Линдтнер Дж., Коллинз Дж., Сенн Х. Дж., Кавалли Ф., Forbes J, Gudgeon A, Simoncini E, Cartes-Funes H, Veronesi A, Fey M, Rudenstam CM: Выявление пациентов с раком груди с высоким риском метастазов в кости. J Clin Oncol 18: 3925-3935, 2000
Google ученый
McEarchern JA, Kobie JJ, Mack V, Wu RS, Meade-Tollin L, Arteaga CL, Dumont N, Besselsen D, Seftor E, Hendrix MJC, Katsanis E, Akporiaye ET: Инвазия и метазаз опухоли молочной железы включает TGF-β сигнализация. Int J Cancer 91: 76–81, 2001
Google ученый
Chua CC, Hamdy RC, Chua BHL: Механизм индуцированной трансформирующим фактором роста-β1 экспрессии фактора роста эндотелия сосудов в мышиных остеобластных клетках MC3T3-E1. Biochim Biophys Acta 1497: 69–76, 2000
Biochim Biophys Acta 1497: 69–76, 2000
Google ученый
Tumber A, Morgan HM, Meikle MC, Hill PA: Клетки рака груди человека стимулируют слияние, миграцию и резорбтивную активность остеокластов в костных эксплантатах. Int J Cancer 91: 665–672, 2001
Google ученый
Yin JJ, Selander K, Chirgwin JM, Dallas M, Grubbs BG, Wieser R, Massague J, Mundy GR, Guise TA: Блокада передачи сигналов TGF-b ингибирует секрецию PTHrP клетками рака груди и развитие метастазов в кости. J Clin Invest 103: 197–206, 1999
Google ученый
Yamada Y, Ando F: Трансформирующий полиморфизм гена фактора роста β1 и минеральная плотность костей. JAMA 285: 167–169, 2001
JAMA 285: 167–169, 2001
Google ученый
Winding B, Misander H, Sveigaard C, Therkildsen B, Jakobsen M, Overgaard T, Oursler MJ, Foged NT: клетки рака груди человека индуцируют ангиогенез, рекрутирование и активацию остеокластов в остеолитических метастазах. J Cancer Res Clin Oncol 126: 631–640, 2000
Google ученый
Зив Э., Каули Дж., Морин П.А., Саиз Р., Браунер В.С.: Связь между полиморфизмом T29-> C в гене трансформирующего фактора роста β1 и раком груди у пожилых белых женщин. JAMA 285: 2859–2863, 2001
Google ученый
Muir GH, Butta A. Shearer RJ, Fisher C, Dearnaley DP, Flanders KC, Sporn MB, Colletta AA: Индукция трансформирующего фактора роста бета при гормональном лечении рака простаты человека. Британский журнал J Cancer 69: 130–134, 1994
Shearer RJ, Fisher C, Dearnaley DP, Flanders KC, Sporn MB, Colletta AA: Индукция трансформирующего фактора роста бета при гормональном лечении рака простаты человека. Британский журнал J Cancer 69: 130–134, 1994
Google ученый
Ким И. Ю., Ан Х. Дж., Зелнер Д. Д., Шоу Дж. В., Сенсибар Дж. А., Ким Дж. Х., Като М., Ли С. Генетические изменения в гене рецептора трансформирующего фактора роста β (TGF-β) типа I коррелируют с нечувствительностью к TGF-β1 у человека. клетки рака простаты. Cancer Res 56: 44–48, 1996
Google ученый
Letterio JJ, Roberts AB: TGF-β: критический модулятор функции иммунных клеток. Clin Immunol Immunopathol. 84: 244–250, 1997
Google ученый
Arteaga C, Hurd S, Winnier A, Johnson M, Fendly B, Forbes J: Антитела против трансформирующего фактора роста (TGF) -β ингибируют онкогенность клеток рака груди и повышают активность естественных киллерных клеток селезенки мыши. J Clin Invest 92: 2569–2576, 1993
Google ученый
Левицкий HI: Усиление иммунного ответа хозяина на рак: преодоление барьера толерантности опухолевых антиген-специфичных Т-клеток. Рак J 6 (Дополнение 3): S281 – S290, 2000
Google ученый
Тада Т., Озеки С., Уцуми К., Такиучи Х., Мурамацу М., Ли XF, Симидзу Дж., Фудзивара Х., Хамаока Т.: подавление функции Т-клеток, индуцированное трансформирующим фактором роста бета. Различия в восприимчивости Т-лимфоцитов различных фенотипов и функций и их значение для иммуносупрессии в опухолевом состоянии. J Immunol 146: 1077–1082, 1991
J Immunol 146: 1077–1082, 1991
Google ученый
Torre-Amione G, Beauchamp RD, Koeppen H, Park BH, Schreiber H, Moses HL, Rowley DA: высокоиммуногенная опухоль, трансфицированная кДНК мышиного трансформирующего фактора роста типа бета 1, не подлежит иммунному надзору.Proc Natl Acad Sci USA 87: 1486–1490, 1990
Google ученый
Park JA, Wang E, Kurt RA, Schluter SF, Hersh EM, Akporiaye ET: Экспрессия трансгена антисмыслового трансформирующего фактора роста b1 снижает онкогенность опухолевых клеток молочной железы EMT6. Cancer Gene Ther 4: 42–50, 1997
Google ученый
Wojtowicz-Praga S: Отмена иммуносупрессии, вызванной опухолью: новый подход к терапии рака.J Immunother 20: 165–177, 1997
Google ученый
Мэтьюз Э., Янг Т., Янулис Л., Гудвин С., Кунду С.Д., Карпус В.Дж., Ли С. Подавление продукции TGF-b1 восстанавливает иммуногенность в клетках рака простаты. Британский журнал рака, 83: 519–525, 2000
Google ученый
Вернер Ф., Джайн М.К., Фейнберг М.В., Сибинга Е.С., Пеллакани А., Визель П., Чин М.Т., Топпер Дж. Н., Перрелла М.А., Ли М.Е.: Ингибирование активации макрофагов трансформирующим фактором роста b1 опосредуется Smad3.J Biol Chem 275: 36653–36658, 2000
Google ученый
Ахмад С., Чоудри М.А., Шанкар Р., Сайид М.М.: Преобразование фактора роста β отрицательно модулирует Т-клеточные ответы при сепсисе. FEBS Letts 402: 213–218, 1997
Google ученый
Borkowski TA, Letterio JJ, Mackall CL, Saitoh A, Wang XJ, Roop DR, Gress RE, Udey MC: Роль TGFβ1 в биологии клеток Лангерганса: дальнейшая характеристика дефекта эпидермальных клеток Лангерганса в TGFβ null мышей.J Clin Invest 100: 575–581, 1997
Google ученый
Менке А., Ямагучи Х., Гресс TM, Адлер Г.: Внеклеточный матрикс снижается за счет ингибирования трансформирующего фактора роста b1 при панкреатите у крыс. Гастроэнтерология 113: 295–303, 1997
Google ученый
Hirsch CS, Ellner JJ, Blinkhorn R, Toossi Z: In vitro восстановление Т-клеточных ответов при туберкулезе и усиление эффекторной функции моноцитов против Mycobacterium tuberculosis с помощью естественных ингибиторов трансформирующего фактора роста бета.Proc Natl Acad Sci USA 94: 3926–3931, 1997
Google ученый
Ming M, Ewen ME, Pereira ME: Инвазия трипаносом в клетки млекопитающих требует активации пути передачи сигналов TGF-бета. Ячейка 82: 287–296, 1995
Google ученый
Баррал-Нетто М., Баррал А., Браунелл С.Е., Скейки Ю.А., Эллингсворт Л.Р., Тварджик Д.Р., Рид С.Г.: Преобразование бета-фактора роста при лейшманиозной инфекции: механизм бегства от паразитов.Наука 257: 545–548, 1992
Google ученый
Гильбоа Э: Как опухоли избегают иммунного разрушения и что мы можем с этим сделать. Cancer Immunol Immunotherap 48: 382–385, 1999
Google ученый
Маэда Х., Цуру С., Шираиши А: Улучшение дисфункции макрофагов путем введения антител против трансформирующего фактора роста — в хозяева, несущих EL4.Jpn J Cancer Res 85: 1137–1143, 1994
Google ученый
Letterio JJ, Робертс AB: Регулирование иммунных ответов с помощью TGF-бета. Анну Рев Иммунол 16: 137–161, 1998
Google ученый
Jennings M, Kaariainen I, Gold L, Maciunas R, Commers P: TGFβ1 и TGFβ2 являются потенциальными регуляторами роста медуллобластом, примитивных нейроэктодермальных опухолей и эпендимом: доказательства в поддержку аутокринной гипотезы.Human Pathol 25: 464–475, 1994
Google ученый
Стандер М., Науманн У., Думитреску Л., Хенека М., Лошманн П., Гулбинс Э., Дичганс Дж., Веллер М.: Декор в опосредованном переносом гене подавлении синтеза TGF-бета отменяет экспериментальный рост глиомы in vivo . Генная терапия 5: 1187–1194, 1998
Google ученый
MacCallum J, Bartlett JMS, Thompson AM, Keen JC, Dixon JM, Miller WR: Экспрессия изоформ мРНК трансформирующего фактора роста бета при раке груди человека.Br J Cancer 69: 1006–1009, 1994
Google ученый
Wakefield L, Letterio J, Chen T, Danielpour D, Allison R, Pai L, Denicoff A, Noone M, Cowan K, O’shaughnessy J, Sporn M: трансформирующий фактор роста-β1 циркулирует у нормального человека. плазме и не изменяется при запущенном метастатическом раке груди. Clin Cancer Res 1: 129–136, 1995
Google ученый
Амоилс К., Сейюм Л., Безвода В.: Сравнение рецептора эстрогена и трансформирующего фактора роста β при раке молочной железы.Британский журнал рака, 73: 1255–1259, 1996
Google ученый
Walker RA, Dearing SJ, Gallacher B: Связь преобразования фактора роста β1 с внеклеточным матриксом и инфильтратами стромы при инвазивной карциноме молочной железы. Br J Cancer 69: 1160–1165, 1994
Google ученый
Мюррей П., Гомм Дж., Рикеттс Д., Паулс Т., Кумбс Р.: Влияние эндокринной терапии на уровни рецептора эстрогена и прогестерона и трансформирующий фактор роста — 1 при метастатическом раке груди человека: иммуноцитохимический анализ. изучать.Europ J Cancer 30A: 218–1222, 1994
Google ученый
MacCallum J, Keen J, Bartlett J, Thompson A, Dixon J, Miller W.: Изменения в экспрессии изоформ мРНК трансформирующего фактора роста бета у пациентов, проходящих терапию тамоксифеном. Британский журнал рака, 74: 474–478, 1996
Google ученый
Врана Дж., Станг М., Гранде Дж., Гетц М.: Экспрессия тканевого фактора в строме опухоли коррелирует с прогрессированием инвазивного рака груди человека: паракринная регуляция трансформирующего фактора роста β в молочной железе с помощью членов карциномы, происходящих из клеток. рак.Cancer Res 56: 5063–5070, 1996
Google ученый
Аншер М.С., Петерс В.П., Райзенбихлер Х., Петрос В.П., Джиртл Р.Л.: Трансформирующий фактор роста β как предиктор фиброза печени и легких после трансплантации аутологичного костного мозга при распространенном раке молочной железы. NewEng J Med 328: 1592–1598, 1993
Google ученый
Lafon C, Mazars P, Guerr in M, Barboule N, Charcosset JY, Valette A: Ранние генные ответы, связанные с ингибированием роста трансформирующего фактора роста β1 и аутоиндукцией в MCF-7 (трансформирующий фактор роста β1) на регуляцию клеточного цикла клеток аденокарциномы молочной железы человека (MCF-7).FEBS Lett 362: 295–300, 1995
Google ученый
Герман М.Е., Катценелленбоген Б.С.: Изменения в продукции трансформирующих факторов роста-β и-β и реакции клеток во время прогрессирования MCF-7. Cancer Res. 54: 5867–5874, 1994
Google ученый
Sun LZ, Wu G, Willson JKV, Zborowska E, Yang J, Rajkarunanayake I, Wang J, Gentry LE, Wang XF, Brattain MG: Экспрессия рецептора трансформирующего фактора роста β типа II приводит к снижению злокачественности у клетки рака груди человека MCF-7.J Biol Chem 269: 26449–26455, 1994
Google ученый
Арнольд С.Ф., Тимс Э., Блюман Э.М., МакГрат Б.Е .: Регулирование трансформирующего фактора роста β1 под действием излучения в клетках двух линий клеток рака груди человека. Radiat Res 152: 487–492, 1999
Google ученый
Arteaga C, Dugger T, Winnier A, Forbes J: Доказательства положительной роли трансформирующего фактора роста-β в онкогенезе клеток рака груди человека.J Cellular Biochem 17G: 187–193, 1993
Google ученый
Arteaga C, Carty-Dugger T, Moses H, Hurd S, Pietenpol J: Трансформирующий фактор роста β1 может индуцировать эстроген-независимую опухолегенность клеток рака груди человека у бестимусных мышей. Разница в росте клеток 4: 193–201, 1993
Google ученый
Elizalde P, Guerra F, Lanari C, Kordon E, Charreau E, Lupu R: Корреляция экспрессии TGF-β с реакцией на медроксипрогестерона ацетат в аденокарциномах молочной железы мышей.Cancer Invest 13: 173–180, 1995
Google ученый
Байль Р., Кумбс Р., Смит Дж .: Множественные формы TGF-β1 в тканях груди: биологически клетки аденокарциномы груди. Biochim Biophys Acta 1266: 288–295, 1995
Google ученый
Arnoletti J, Albo D, Granick M, Castiglioni A, Rothman V, Tuszynski G: Тромбоспондин и трансформирующий фактор роста бета 1 увеличивают экспрессию активатора плазминогена урокиназного типа и ингибитора активатора плазминогена-1 в человеческом MDA- MB-231 клетки рака груди.998, 1995
Sun LZ, Chen C: Экспрессия рецептора трансформирующего фактора роста β типа III подавляет онкогенность клеток рака молочной железы человека MDA-MB-231. J Biol Chem 272: 25367–25372, 1997
Google ученый
Bandyopadhyay A, Zhu Y, Cibull ML, Bao L, Chen C, Sun L: рецептор растворимого трансформирующего фактора роста β типа III подавляет онкогенность и метастазирование клеток MDA-MB-231 рака груди человека.Cancer Res 59: 5041–5046, 1999
Google ученый
Nash MA, Loercher AE, Freedman RS: In vitro ингибирование роста клеток рака яичников декорином: синергизм между декорином и карбоплатином. Cancer Res 59: 6192–6196, 2000
Google ученый
Kong F, Jirtle RL, Huang DH, Clough RW, Anscher MS: Уровень плазменного трансформирующего фактора роста β1 перед лучевой терапией коррелирует с долгосрочным исходом пациентов с карциномой легких.Рак 86: 1712–1719, 1999
Google ученый
Бартлетт Дж., Рабиас Дж., Лэнгдон С., Миллер Е., Миллер В.: Экспрессия мРНК трансформирующего фактора роста-β (TGF-β) и контроль роста в клеточных линиях плоскоклеточной карциномы легких человека. Int J Oncol 4: 475–479, 1994
Google ученый
Albo D, Arnoletti J, Castiglioni A, Granick M, Soloman M, Rothman V, Tuszynski G: Тромбоспондин (TSP) и трансформирующий фактор роста бета1 (TGF-β) стимулируют ингибитор активатора плазминогена клеток карциномы легких человека A549 производство типа 1 (PAI-1) и стимулирование прикрепления опухолевых клеток in vitro .Biochem Biophys Res Commun 203: 857–865, 1994
Google ученый
Norgaard P, Spang-Thomsen M, Poulsen H: Экспрессия и ауторегуляция мРНК рецептора трансформирующего фактора роста β в клеточных линиях мелкоклеточного рака легкого. Британский журнал рака, 73: 1037–1043, 1996
Google ученый
Iyer SN, Gurujeyalakshmi G, Giri SN: Эффекты пирфенидона на трансформирующую экспрессию гена фактора роста-β на уровне транскрипции в модели фиброза легких у хомяка с блеомицином.J Pharmacol Exp Therap 291: 367–373, 1999
Google ученый
Anscher M, Murase T, Prescott D, Marks L, Reisenbichler H, Bentel G, Spencer D, Sherouse G, Jirtle R: изменения уровней TGFβ в плазме во время лучевой терапии легких как предиктор риска развития радиации пневмонит. Int J Radiat Oncol Biol Phys 30: 671–676, 1994
Google ученый
Хасагава Ю., Таканаши С., Канехира Ю., Цусима Т., Имаи Т., Окумура К.: Уровень трансформирующего фактора роста β1 коррелирует с ангиогенезом, прогрессированием опухоли и прогнозом у пациентов с немелкоклеточной карциномой легких.Рак 91: 964–971, 2001
Google ученый
Ито Н., Кавата С., Тамура С., Шираи Ю., Кисо С., Цусима Х, Мацудзава Ю.: Положительная корреляция уровней плазменного трансформирующего фактора роста β1 с сосудистой системой опухоли при гепатоцеллюлярной карциноме. Cancer Letts 89: 45–48, 1995
Google ученый
Цай JF, Jeng JE, Chuang LY, Yang ML, Ho MS, Chang WY, Hsieh MY, Lin ZY, Tsai JH: Повышенный уровень трансформирующего фактора роста-β1 в моче как онкомаркер и предиктор плохой выживаемости при цирротической гепатоцеллюлярной карциноме.Британский журнал рака, 76: 244–256, 1997
Google ученый
Кастилья, Прието Дж., Фаусто Н.: Трансформирующий фактор роста β1 и a при хроническом заболевании печени. New Eng J Medicine 324: 933–940, 1991
Google ученый
Кастилья А, Прието Дж., Фаусто Н.: Трансформирующий фактор роста β1 и α при хроническом заболевании печени: эффекты терапии интерфероном-α. New Eng J Medicine 324: 993–940, 1991
Google ученый
Бедосса П., Пельтье Е., Террис Б., Франко Д., Пойнард Т.: трансформирующие рецепторы фактора роста-β1 (TGF-β1) и TGF-β1 в нормальной, цирротической и неопластической печени человека. Гепатология 21: 760–766, 1995
Google ученый
Шираи Ю., Кавата С., Тамура С., Ито Н., Цусима Х., Такаиши К., Кисо С., Мацузава Ю.: Плазменный трансформирующий фактор роста-β1 у пациентов с гепатоцеллюлярной карциномой. Рак 73: 2275–2279, 1994
Google ученый
Matsuzaki K, Date M, Furukawa F, Tahashi Y, Matsushita M, Sakitani K, Yamashiki N, Seki T., Saito H, Nishizawa M, Fujisawa J, Inoue K: Механизм автокринной стимуляции путем трансформации фактора роста β в гепатоцеллюлярной кариноме человека. Cancer Res 60: 1394–1402, 2000
Google ученый
Ито Н., Кавата С., Тамора С., Такаиши К., Шираи Ю., Кисо С., Яберчи И., Мацуда Ю., Нисиока М., Таруи С. Повышенные уровни трансформирующей матричной РНК фактора роста β и ее полипептида у человека. гепатоцеллюлярная карцинома.Cancer Res 51: 4080–4083, 1991
Google ученый
Фактор VM, Kao CY, Santoni-Rugiu E, Woitach JT, Jensen MR, Thorgeirsson SS: Конститутивная экспрессия зрелого трансформирующего фактора роста β1 в печени ускоряет гепатоканцерогенез у трансгенных мышей. Cancer Res 57: 2089–2095, 1997
Google ученый
Gressner AM, Lahme B, Mannherz HG, Polzar B: TGF-β-опосредованный гепатоцеллюлярный апоптоз клетками гепатомы крысы и человека и первичными гепатоцитами крысы.J Hepatology 26: 1079–1092, 1997
Google ученый
Sun D, Kar S, Carr BI: дифференциально экспрессируемые гены в чувствительных к TGF-β1 и устойчивых клетках гепатомы человека. Cancer Letts 89: 73–79, 1995
Google ученый
Nakatsukasa H, Evarts RP, Hsia C, Marsdaen E, Thorgeirsson SS: Экспрессия трансформирующего фактора роста β1 во время химического гепатоканцерогенеза у крыс.Лаборатория Инвестаг 65: 511–517, 1991
Google ученый
Джиртл Р.Л., Мейер С.А.: Стимуляция печени: влияние фенобарбитала на трансдукцию сигнала EGF и протеинкиназы С и трансформирующую экспрессию фактора роста-β1. Dig Dis Sci 36: 659–668, 1991
Google ученый
Jakowlew SB, Mead JE, Danielpour D, Wu J, Roberts AB, Fausto N: изоформы трансформирующего фактора роста-β (TGF-β) в регенерации печени крыс: экспрессия матричной РНК и активация латентного TGF-β .Регламент ячейки 2: 535–548, 1991
Google ученый
Джиртл Р.Л., Карр Б.И., Скотт К.Д.: Модуляция рецепторов инсулиноподобного фактора роста-II / маннозо-6-фосфата и трансформирующего фактора роста-β1 во время регенерации печени. J Biol Chem 266: 22444–22450, 1991
Google ученый
Nakatsukasa H, Nagy P, Evarts RP, Hsia CC, Marsden E, Thorgeirsson: Клеточное распределение транскриптов трансформирующего фактора роста β1 и проколлагена типов I, III и IV в индуцированном тетрахлорметаном фиброзе печени крыс.J Clin Investag 85: 1833–1843, 1990
Google ученый
Czaja MJ, Weiner FR, Flanders KC, Giambrone MA, Wind R, Biempica L, Zern MA: In vitro и in vivo ассоциация трансформирующего фактора роста-β1 с фиброзом печени. J Cell Biol 108: 2477–2482, 1989
Google ученый
Huggett AC, Ellis PA, Ford CP, Hampton LL, Rimoldi D, Thorgeirsson SS: Развитие устойчивости к эффектам подавления роста трансформирующего фактора роста β1 во время спонтанной трансформации эпителиальных клеток печени крыс.Cancer Res 51: 5929–5936, 1991
Google ученый
Джордж Дж., Руло Д., Котелянский В.Е., Бисселл Д.М.: In vivo ингибирование активации звездчатых клеток крысы рецептором растворимого трансформирующего фактора роста β типа II: новый потенциальный способ лечения фиброза печени. Proc Natl Acad Sci USA 96: 12719–12724, 1999
Google ученый
Abdel-Razzak Z, Corcos L, Fautrel A, Campoin J-P, Guillouzo A: трансформирующий фактор роста β1 подавляет базальные и полициклические ароматические углеводороды, индуцированные цитохромами P-450 1A1 и 1A2 в гепатоцитах взрослого человека в первичной культуре.Mol Pharmacol 46: 1100–1110, 1994
Google ученый
Sun D, Kar S, Carr B: дифференциально экспрессируемые гены в TGF-β1 чувствительных и устойчивых клетках гепатомы человека. Cancer Lett, 89: 73–79, 1995
Google ученый
Kayanoki Y, Fujii J, Suzuki K, Kawata S, Matsuzawa Y, Taniguchi N: Подавление экспрессии антиоксидантного фермента путем трансформации фактора роста-β1 в гепатоцитах крысы.J Biol Chem 269: 15488–15492, 1994
Google ученый
Патель Б., Халик А., Джарвис-Эванс Дж, МакЛеод Д., Макнесс М., Боултон М.: Кислородная регуляция мРНК TGF-β1 в клетках гепатомы человека (HEP G2). Biochem Moil Biol International 34: 639–644, 1994
Google ученый
Сандерсон Н., Фактор V, Надь П., Копп Дж., Кондайя П., Уэйкфилд Л., Робертс А., Спорн М., Торгейрссон С. Экспрессия в печени зрелого трансформирующего фактора роста β1 у трансгенных мышей приводит к множественным поражениям тканей.Proc. Nat. Acad Sci USA 92: 2572–2576, 1995
Google ученый
Steiner M, Wand G, Barrack E: Эффекты трансформирующего фактора роста β1 на пути аденилатциклаза-цАМФ при раке простаты. Факторы роста 11: 283-290, 1994
Google ученый
Steiner M, Barrack E: Избыточная продукция трансформирующего фактора роста β1 при раке простаты: влияние на рост in vivo и in vitro .Mol Endocrinology 6: 15–25, 1992
Google ученый
Steiner M, Zhou Z-Z, Tonb D, Barrack E: Экспрессия трансформирующего фактора роста-β1 при раке простаты. Эндокринология 135: 2240–2247, 1994
Google ученый
Ли К., Синтич С.М., Мэтьюз Е.П., Шах А.Х., Кунду С.Д., Перри К.Т., Чо Дж.С., Илио К.Й., Кронауэр М.В., Янулис Л., Сенсибар Дж.А.: Преобразование фактора роста-β в доброкачественной и злокачественной простате.Простата 39: 285–290, 1999
Google ученый
Klingler HC, Bretland AJ, Reid SV, Chapple CR, Eaton CL: Регулирование роста и функции стромальных клеток простаты путем трансформации фактора роста бета (TGFβ). Простата 41: 110–120, 1999
Google ученый
Tang B, de Castro K, Barnes HE, s WT, Stewart L, Bottinger EP, Danielpour D, Wakefield LM: потеря чувствительности к трансформирующему фактору роста β вызывает злокачественную трансформацию не канцерогенных эпителиальных клеток простаты крыс .Cancer Res 59: 4834–4842, 1999
Google ученый
Мерц В., Арнольд А., Студер У.: Дифференциальная экспрессия трансформирующих факторов роста β1 и β3, а также мРНК C-FOS в нормальной простате человека, доброкачественной гиперплазии предстательной железы и раке простаты. Уорлд Дж Урол 12: 96–98, 1994
Google ученый
Barrack ER: TGFβ при раке простаты: ингибитор роста, который может повышать онкогенность.Простата 31: 61–70, 1997
Google ученый
Muir GH, Butta A, Shearer RJ, Fisher C., Dearnaley DP, Flanders KC, Sporn MC, Coetta AA: Индукция трансформирующего фактора роста бета при гормональном лечении рака простаты человека. Брит Дж. Урол 69: 130–134, 1994
Google ученый
Киприану Н., Айзекс Дж. Т.: Экспрессия трансформирующего фактора роста-бета в вентральной части простаты крыс во время вызванной кастрацией запрограммированной гибели клеток: Mol Endocrinol 3: 1515–1522, 1989
Google ученый
Martikainen P, Kyprianou N, Isaacs JT. Влияние трансформирующего фактора роста-β1 на пролиферацию и гибель клеток простаты крысы. Эндокринология 127: 2963–2968, 1990
Google ученый
Hsing AY, Kadomatsu K, Bonham MJ, Danielpour D: Регулирование апоптоза, индуцированного трансформацией фактора роста-β1 в неканцерогенных и канцерогенных линиях эпителиальных клеток простаты крыс. Cancer Res 56: 5146–5149, 1996
Google ученый
Myeroff LL, Parsons R, Kim SJ, Hedrick L, Cho KR, Orth K, Mathis M, Kinzler KW, Lutterbaugh JL, Park K, Bang YJ, Lee HY, Park JG, Lynch HT, Roberts AB, Vogelstein B, Markowitz SD: мутация гена рецептора трансформирующего фактора роста — типа II, распространенная в толстой кишке и желудке, но редкая при раке эндометрия. Cancer Res 55: 5545–5547, 1995
Google ученый
Робертс А., Спорн М: факторы роста пептидов и их рецепторы. В: Робертс А., Спорн М.(eds) Справочник по экспериментальной фармакологии, Springer-Verlag, Heidelberg, 1990, стр. 419–472
Google ученый
Moses H, Yang E, Pietenpol J: Стимуляция TGF-β и ингибирование пролиферации клеток: новые механистические идеи. Ячейка 63: 245–247, 1990
Google ученый
Bratain M, Howell G, Sun L, Willson JKV: Баланс факторов роста и прогрессирование опухоли.Curr Opin Oncol 7: 77–81, 1994
Google ученый
Марковиц С.Д., Майерофф Л., Купер М., Трайкофф Дж., Кочера М., Латтербо Дж., Свиридук М., Уилсон Дж. К. В. Доброкачественная культивированная аденома толстой кишки несет три генетически измененных онкогена рака толстой кишки, но прогрессирует до онкогенности и трансформирующего роста независимость от фактора-β без инактивации гена-супрессора опухоли p53. J Clin Invest 93: 1005–1013, 1994
Google ученый
Filmus J, Kerbel R: Развитие механизмов устойчивости к эффектам ингибирования роста трансформирующего фактора роста-β во время прогрессирования опухоли. Curr Opin Oncol 5: 123–129, 1993
Google ученый
Эшлеман Дж. Р., Марковиц С. Д.: Нестабильность микросателлитов в наследственных и спорадических новообразованиях. Curr Opin Oncol 7: 83–89, 1995
Google ученый
Марра Г., Боланд CR: Наследственный неполипозный колоректальный рак: синдром, гены и исторические перспективы.J Natl Cancer Inst 87: 1114–1125, 1995
Google ученый
Марковиц С., Ван Дж., Майерофф Л., Парсонс Р., Сан Л., Латтербо Дж, Фан Р. С., Зборовска Е., Кинзлер К. В., Фогельштейн Б., Брайттайн М., Уилсон Дж. К. В. Инактивация TGF-β типа II рецептор в клетках рака толстой кишки с микросателлитной нестабильностью. Наука (Вашингтон, округ Колумбия) 268: 1336–1338, 1995
Google ученый
Parsons R, Myeroff L, Liu B, Willson JKV, Markowitz S, Kinzler KW, Vogelstein B: микросателлитная нестабильность и мутации гена рецептора трансформирующего фактора роста β типа II при колоректальном раке.Cancer Res 55: 5548–5550, 1995
Google ученый
Shin K-H, Park YJ, Park J-G: Мутационный анализ гена рецептора трансформирующего фактора роста β типа II у пациентов с наследственным неполиозным колоректальным раком и ранним началом колоректального рака. Clin Cancer Res 7: 537–540, 2000
Google ученый
Кай Т., Такэтазу Ф., Каваками М., Шимануки К., Ямада С., Миязоно К., Като М., Мията М.: Распределение трансформирующего фактора роста-β и его рецепторов в ткани карциномы желудка.Jpn J Cancer Res 87: 296–304, 1996
Google ученый
Махара К., Като Дж., Теруи Т., Такимото Р., Хоримото М., Мураками Т., Моги И., Ватанабе Н., Кохго И., Нийцу И.: трансформирующий фактор роста β1, секретируемый скиррозными клетками рака желудка, связан с избытком отложение коллагена в ткани. Британский журнал рака, 69: 777–783, 1994
Google ученый
Лу Л., Шен Р.Н., Лин Ж., Аукерман С.Л., Ральф П., Броксмайер Х.Э .: Противоопухолевые эффекты рекомбинантного человеческого фактора, стимулирующего колонии макрофагов, отдельно или в сочетании с местным облучением, у мышей, инокулированных Льюисом. клетки карциномы легких.Int J Cancer 47: 143–147, 1991
Google ученый
Parsons R, Myeroff L, Liu B, Willson J, Markowitz S, Kinzler K, Vogelstein B: микросателлитная нестабильность и мутации гена рецептора трансформирующего фактора роста β типа II при колоректальном раке: Cancer Res 55: 5548 –5550, 1995
Google ученый
Myeroff L, Parsons R, Kim S., Hedrick L, Cho K, Orth K, Mathis M, Kinzler K, Lutterbaugh J, Park K, Bang Y, Lee H, Park J, Lynch H, Roberts A , Йогельштейн Б., Марковиц С. Мутация гена рецептора β-рецептора атрансформирующего фактора роста типа II распространена в толстой кишке и желудке, но редко встречается при раке эндометрия с микросателлитной нестабильностью.Cancer Res 55: 5545–5547, 1995
Google ученый
Гарриг-Антар Л., Муньос-Антония Т., Антония С., Гесмонде Дж., Веллуччи В., Рейсс, М.: Миссенс-мутации рецептора трансформирующего фактора роста β типа II в клетках плоскоклеточной карциномы головы и шеи человека. Cancer Res 55: 3982–3987, 1995
Google ученый
Hsu S, Huang F, Hafez M, Winawer S, Friedman E: Клетки карциномы толстой кишки переключают свой ответ на трансформирующий фактор роста β1 по мере прогрессирования опухоли.Cell Growth Diff 5: 267–275, 1994
Google ученый
Ohue M, Tomita N, Monden T, Miyoshi Y, Ohnishi T, Izawa H, Kawabata Y, Sasaki M, Sekimoto M, Nishisho I, Shiozai H, Monden M: Мутации трансформирующего фактора роста â ген рецептора типа II и микросателлитная нестабильность при раке желудка. Int J Cancer 68: 203–206, 1996
Google ученый
Кай Т., Такетадзу Ф, Каваками М., Шимануки К., Ямада С., Миязоно К., Като М., Мията М.: Распределение трансформирующего фактора роста-β и его рецепторов в ткани карциномы желудка. Jpn J Cancer Res 87: 296–304 1996
Google ученый
Махара К., Като Дж., Теруи Т., Такимото Р., Хоримото М., Мураками Т., Моги И., Ватанабе Н., Кохго И., Ниитсу Ю. отложение коллагена в ткани.Британский журнал рака, 69: 777–783, 1994
Google ученый
Muro-Cacho CA, Rosario-Ortiz K, Livingston S, Munoz-Antonia T: Дефектный сигнальный путь трансформирующего фактора роста β в плоскоклеточной карциноме головы и шеи, о чем свидетельствует отсутствие экспрессии активированного Smad2. Clin Cancer Res 7: 1618–1626, 2001
Google ученый
Симидзу С., Нишикава Ю., Курода К., Такаги С., Козаки К., Хьюга С., Сага С., Мацуяма М.: Вовлечение трансформирующего фактора роста β1 в аутокринное усиление секреции желатиназы В мышиными метастатическими клетками карциномы толстой кишки.Cancer Res 56: 3366–3370, 1996
Google ученый
Lieubeau B, Garrigue L, Barbieux I, Meflah K, Gregoire M: роль трансформирующего фактора роста β 1 в фибробластической реакции, связанной с развитием колоректальной опухоли у крыс. Cancer Res 54: 6526–6532, 1994
Google ученый
Чаудри А., Оберг К., Гобл А., Хелдин C-H, Фуна К.: Экспрессия трансформирующего фактора роста β1, β2, β3 в нейроэндокринных опухолях пищеварительной системы.Anticancer Res 14: 2085–2092, 1994
Google ученый
Kormann M, Tangvoranuntakul P, Korc M: TGF-b1 активирует cycl в экспрессии D1 клеток COLO-357, тогда как подавление уровней циклина D1 связано с подавлением TGF-β типа 1 рецептор. Int J Cancer 83: 247–254, 1999
Google ученый
Ramp U, Jaquet K, Reinecke P, Nitsch T., Gabbert HE, Gerharz CD: Приобретение устойчивости к TGF-β1: важный фактор в почечно-клеточной карциноме человека.Lab Invest 76: 739-749, 1997
Google ученый
Gold LI, Saxena B, Mittal KR, Marmor M, Goswami S, Nactigal L, Korc M, Demopoulos RI: Повышенная экспрессия β-изоформ трансформирующего фактора роста и основного фактора роста фибробластов в сложной гиперплазии и аденокарциноме эндометрия. : доказательства паракринного и аутокринного действия. Cancer Res 54: 2347-2358, 1994
Google ученый
Брунер К., Роджерс В., Голд Л., Корк М., Харгроув Дж., Матрисиан Л., Остин К. Трансформирующий фактор роста β опосредует подавление прогестероном эпителиальной металлопротеиназы соседней стромой в эндометрии человека. Proc Nat Acad Sci USA 92: 7362–7366 1995
Google ученый
Parekh TV, DelPriore G, Schatz F, Demopoulos R, Korc M, Gold LI: Снижение реакции ингибирования роста первичных культур клеток карциномы эндометрия на TGF-beta1 сопровождается измененной реакцией на гонадные стероиды.Proc Amer Assoc Cancer Res 38: 452, 1977
Google ученый
Parekh TV, DelPriore G, Demopoulos R, Gold LI: Transforming growth factor-beta-related механизмы потери контроля роста при карциноме эндометрия. Proc Amer Assoc Cancer Res 39: 79, 1998
Google ученый
Chegini N, Williams RS: Иммуноцитохимическая локализация трансформирующих факторов роста (TGF) TGF-β и TGF-β в тканях яичников человека.J Clin Endocrinol Metab 74: 973–980, 1992
Google ученый
Agarwal C, Hembree JR, Rorke EA, Eckert RL: Регулирование продукции металлопротеиназы трансформирующим фактором роста-β1 в культивируемых клетках шейного эпителия человека. Cancer Res 54: 943–949, 1994
Google ученый
Merzak A, McCrea S, Koocheckpour S, Pilkington G: Контроль роста, миграции и инвазии клеток глиомы человека, с. in vitro путем трансформации фактора роста β1. Британский журнал J Cancer 70: 199–203, 1994
Google ученый
Fujiwara T, Mukhopadhyay T, Cai D, Morris D, Roth J, Grimm E: Ретровирусная трансдукция гена p 53 увеличивает экспрессию TGF-β в клеточной линии глиобластомы человека. Int J Cancer 56: 834-839, 1994
Google ученый
Ямада Н., Като М., Ямашита Н., Нистер М., Миязоно К., Хелдин С-Н, Фуна К.: Повышенная экспрессия трансформирующего фактора роста-β и его рецепторов типа I и типа II в глиобластоме человека.Int J Cancer 62: 386–392, 1995
Google ученый
Паулин С., Авалле О., Тарди Ф., Саез Дж., Фуско А., Фабьен Н.: Производство TGF â и HGF. Cancer Res 54: 575–581, 1994
Google ученый
Красагакис К., Гарбе С., Шриер П., Орфанос С. Паракринная и аутокринная регуляция роста меланоцитов и клеток меланомы человека путем трансформации фактора роста бета in vitro .Anticancer Res 14: 2565–2572, 1994
Google ученый
Sellheyer K, Bickenbach J, Rothnagel J, Bundman D, Longley M, Krieg T., Roche N, Roberts, A, Roop D. Ингибирование развития кожи за счет сверхэкспрессии трансформирующего фактора роста β1 в эпидермисе трансгенных мышей. Proc Nat Acad Sci USA 90: 5237–5241, 1993
Google ученый
Rodeck U, Bossler A, Graeven U, Fox F, Nowell P, Knabbe C, Kari, C: трансформирующее производство фактора роста β и реакцию в нормальных человеческих меланоцитах и клетках меланомы.Cancer Res 54: 575–581, 1994
Google ученый
Cui W, Fowlis D, Bryson S, Duffie E, Ireland, H, Balmain A, Akhurst R: TGFβ1 ингибирует образование доброкачественных опухолей кожи, но усиливает прогрессирование инвазивной карциномы веретена у трансгенных мышей. Ячейка 86: 531–542, 1996
Google ученый
Рэндалл К., Боггл Дж .: Экспрессия трансформирующего фактора роста β1 в коже мышей во время острой фазы радиационного поражения.Int J Radiat Biol 68: 301–309, 1995
Google ученый
Perlino E, Ciampollino A, Maiorano E, Pannone E, Viale G, Giorgino R, Marra E: экспрессия трансформирующего фактора роста β1 (TGFβ1) при пролиферирующем заболевании щитовидной железы. Int J Oncol 9: 83–88, 1996
Google ученый
Тейхер Б.А.: Системный подход к терапии рака (антиангиогенные средства + стандартные механизмы взаимодействия цитотоксических средств).Обзоры метастазов рака 15 (2): 247–272, 1996
Google ученый
Раковые клетки | Cancer Research UK
На этой странице представлена информация о раковых клетках и о том, чем они отличаются от нормальных клеток организма. Вы можете прочитать про
Особенности нормальных клеток
Нормальные клетки организма обладают рядом важных особенностей. Они могут:
- воспроизводить когда и где это необходимо
- склеить в нужном месте в корпусе
- самоуничтожаются, когда они становятся поврежденными или слишком старыми
- стать специализированным (зрелым).Это означает, что они должны выполнять особую роль, например, в качестве мышечных клеток или красных кровяных телец.
Раковые клетки по-разному отличаются от нормальных клеток.
Раковые клетки не перестают расти и делиться
В отличие от нормальных клеток, раковые клетки не перестают расти и делиться, когда их достаточно. Таким образом, клетки продолжают удваиваться, образуя опухоль (опухоль), которая увеличивается в размерах.
Образуется опухоль, состоящая из миллиардов копий исходной раковой клетки.
Рак клеток крови (лейкемия) не образует опухоли. Но они производят много аномальных клеток крови, которые накапливаются в крови.
Раковые клетки игнорируют сигналы от других клеток
Клетки все время посылают друг другу химические сигналы. Нормальные клетки подчиняются сигналам, которые говорят им, когда они достигли своего предела, и причинят ущерб, если они будут расти дальше. Но что-то в раковых клетках мешает нормальной работе сигнальной системы.
В этом 1-минутном видео показано, как раковые клетки отправляют сообщения, которые говорят другим клеткам расти и делиться.
Просмотрите стенограмму видео.
Раковые клетки не слипаются
Раковые клетки могут терять молекулы на своей поверхности, которые удерживают нормальные клетки в нужном месте. Так они могут оторваться от своих соседей.
Это помогает объяснить, как раковые клетки могут распространяться на другие части тела.
Вы можете прочитать о том, как рак может распространяться.
Раковые клетки не специализируются
В отличие от здоровых клеток, раковые клетки не продолжают созревать или специализироваться.Клетки созревают, чтобы они могли выполнять свои функции в организме. Этот процесс созревания называется дифференциацией.
При раке клетки часто очень быстро размножаются и не имеют возможности созреть. Поскольку клетки не созрели, они не работают должным образом. А поскольку они делятся быстрее, чем обычно, вероятность того, что они обнаружат больше ошибок в своих генах, выше. Это может сделать их еще более незрелыми, и они будут делиться и расти еще быстрее.
Раковые клетки не восстанавливаются и не умирают
Нормальные клетки могут восстанавливать себя, если их гены повреждены.Это известно как восстановление ДНК. Клетки самоуничтожаются, если повреждение слишком велико. Ученые называют этот процесс апоптозом.
В раковых клетках неисправны молекулы, которые решают, должна ли клетка восстанавливаться. Например, белок p53 обычно проверяет, может ли клетка восстанавливать свои гены или должна ли клетка умереть. Но у многих видов рака есть неисправная версия p53, поэтому они не восстанавливаются должным образом.
Это приводит к большему количеству проблем. Новые генные дефекты или мутации могут привести к образованию раковых клеток:
- расти быстрее
- распространяется на другие части тела
- устойчивая к обработке
Раковые клетки могут игнорировать сигналы, которые говорят им о самоуничтожении.Поэтому они не подвергаются апоптозу, когда должны. Ученые называют это бессмертием.
Раковые клетки выглядят иначе
Под микроскопом раковые клетки могут сильно отличаться от нормальных клеток. Раковые клетки:
- имеют разные размеры, некоторые из них могут быть больше обычных, а другие меньше
- часто имеют неправильную форму
- часто имеют ядро (центр управления), которое выглядит ненормально
Вы можете прочитать о различных типах рака в зависимости от типа клетки, из которой они возникают.

 В.,
В., С.,
С., Г.,
Г., 2911-2915
2911-2915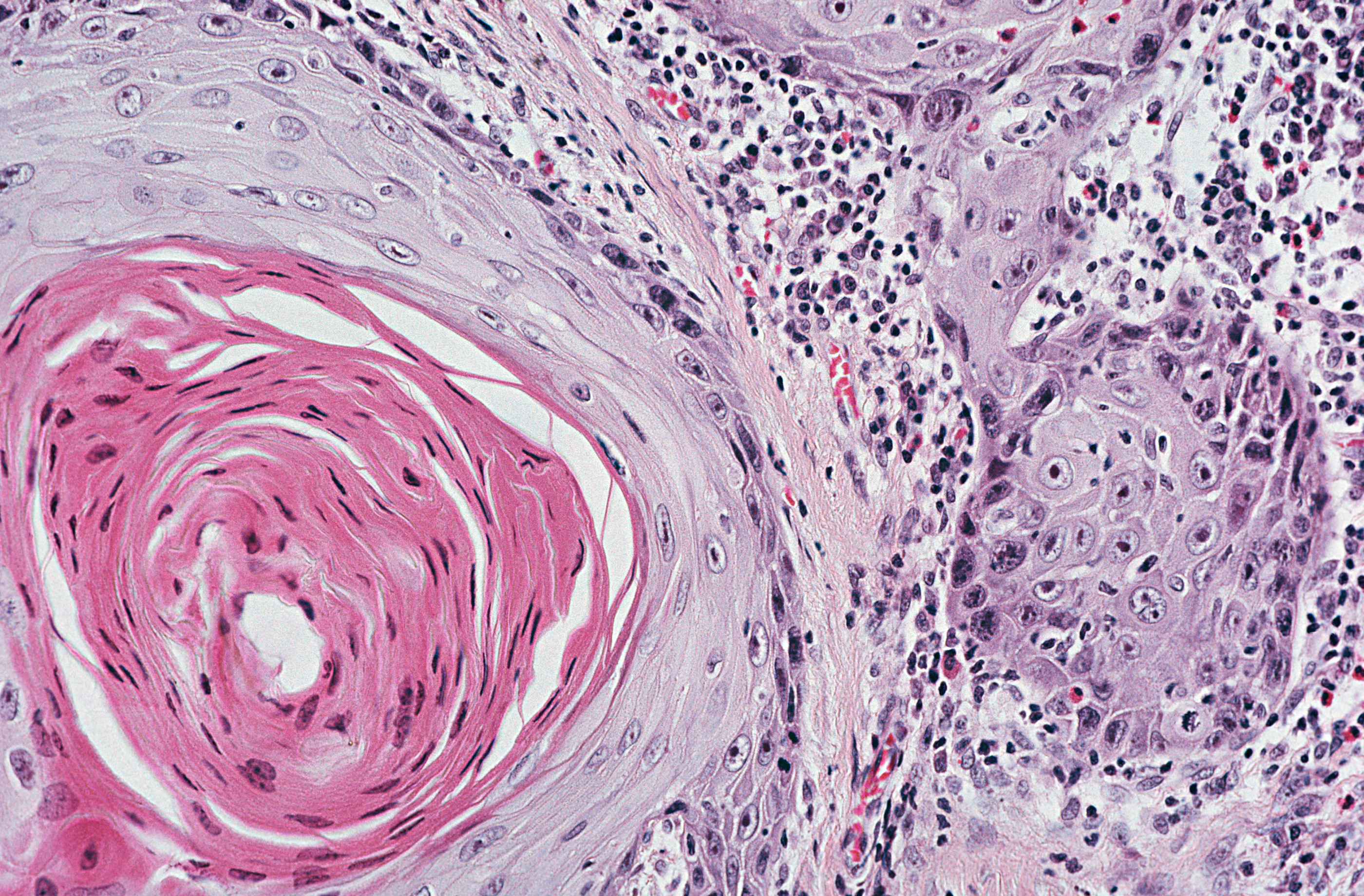 17-27
17-27 635-651
635-651 А.,
А., ,
, Однако функции гетерохроматина в эмбриогенезе человека остаются малоизученными. Особый интерес представляет сателлитные ДНК крупных гетерохроматиновых блоков хромосом 1, 9, 16 и Y человека, полиморфизм которых до сих пор пытаются связать с патологией развития, однако, однозначных результатов по этому вопросу к настоящему моменту не получено. Кроме этого, в последнее время появляется все больше данных, свидетельствующих об особой организации гетерохроматиновых районов хромосом в цитотрофобласте хориона и плаценты, при этом была обнаружена транскрипция сатДНК на ранних стадиях эмбриогенеза. В качестве перспективных моделей для изучения транскрипции можно рассматривать органные культуры хориона, а также культуры нормальных и малигнизированных клеток трофобласта, однако, недостаточно известно о характеристиках ГХР в условиях in vitro.
Однако функции гетерохроматина в эмбриогенезе человека остаются малоизученными. Особый интерес представляет сателлитные ДНК крупных гетерохроматиновых блоков хромосом 1, 9, 16 и Y человека, полиморфизм которых до сих пор пытаются связать с патологией развития, однако, однозначных результатов по этому вопросу к настоящему моменту не получено. Кроме этого, в последнее время появляется все больше данных, свидетельствующих об особой организации гетерохроматиновых районов хромосом в цитотрофобласте хориона и плаценты, при этом была обнаружена транскрипция сатДНК на ранних стадиях эмбриогенеза. В качестве перспективных моделей для изучения транскрипции можно рассматривать органные культуры хориона, а также культуры нормальных и малигнизированных клеток трофобласта, однако, недостаточно известно о характеристиках ГХР в условиях in vitro. С помощью морфометрических и иммуноцитохимических методов мы показали, что в условиях in vitro особенности конденсации и метилирования районов локализации сатДНК являются хромосомоспецифичными, а также зависят от источника клеток трофобласта – цитотрофобласта нормального хориона или постоянной клеточной линии JEG-3, полученной из хорионэпителиомы. Особого внимания заслуживает выявленная кариотипическая гетерогенность клеток JEG-3, свойственная культурам малигнизированных клеток, а также нестабильность числа хромосом, в том числе утрата хромосом, содержащих крупные блоки сатДНК (Y-хромосомы и одной из копий хромосомы 9), при длительном культивировании (к 40-му пассажу), что необходимо учитывать в дальнейших исследованиях.
С помощью морфометрических и иммуноцитохимических методов мы показали, что в условиях in vitro особенности конденсации и метилирования районов локализации сатДНК являются хромосомоспецифичными, а также зависят от источника клеток трофобласта – цитотрофобласта нормального хориона или постоянной клеточной линии JEG-3, полученной из хорионэпителиомы. Особого внимания заслуживает выявленная кариотипическая гетерогенность клеток JEG-3, свойственная культурам малигнизированных клеток, а также нестабильность числа хромосом, в том числе утрата хромосом, содержащих крупные блоки сатДНК (Y-хромосомы и одной из копий хромосомы 9), при длительном культивировании (к 40-му пассажу), что необходимо учитывать в дальнейших исследованиях.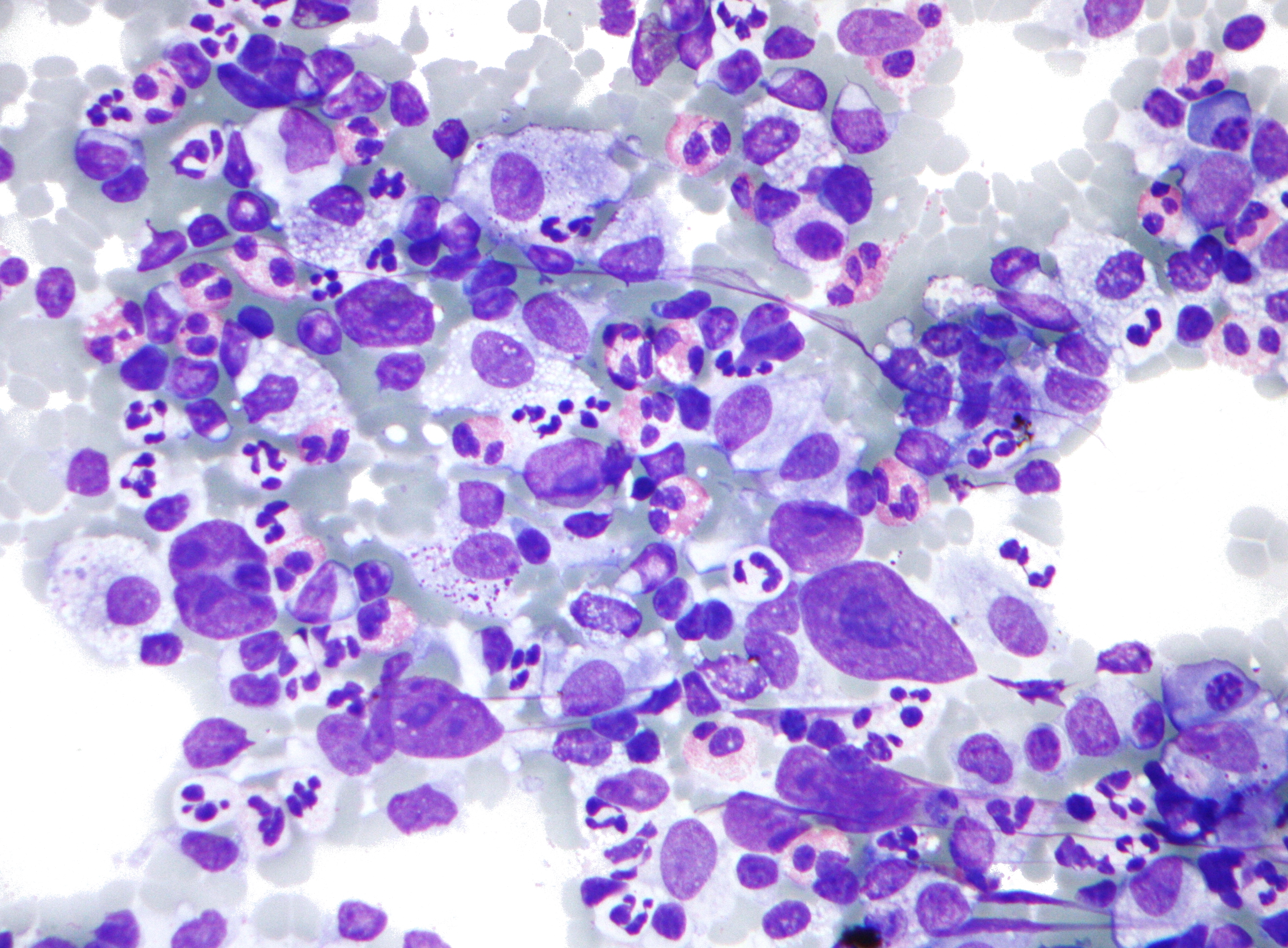 2 и Yq12. При этом ни в одном из случаев не было зарегистрировано появление в сатДНК в районах 1q12, 9q12, 16q11.2 и Yq12 5-гидроксиметилцитозина, который является промежуточным соединением при активном деметилировании.
2 и Yq12. При этом ни в одном из случаев не было зарегистрировано появление в сатДНК в районах 1q12, 9q12, 16q11.2 и Yq12 5-гидроксиметилцитозина, который является промежуточным соединением при активном деметилировании. Экспериментальную часть магистерской диссертации выполняла в лаборатории пренатальной диагностики врожденных и наследственных болезней ФГБНУ «НИИ акушерства, гинекологии и репродуктологии им.Д.О.Отта».
Экспериментальную часть магистерской диссертации выполняла в лаборатории пренатальной диагностики врожденных и наследственных болезней ФГБНУ «НИИ акушерства, гинекологии и репродуктологии им.Д.О.Отта».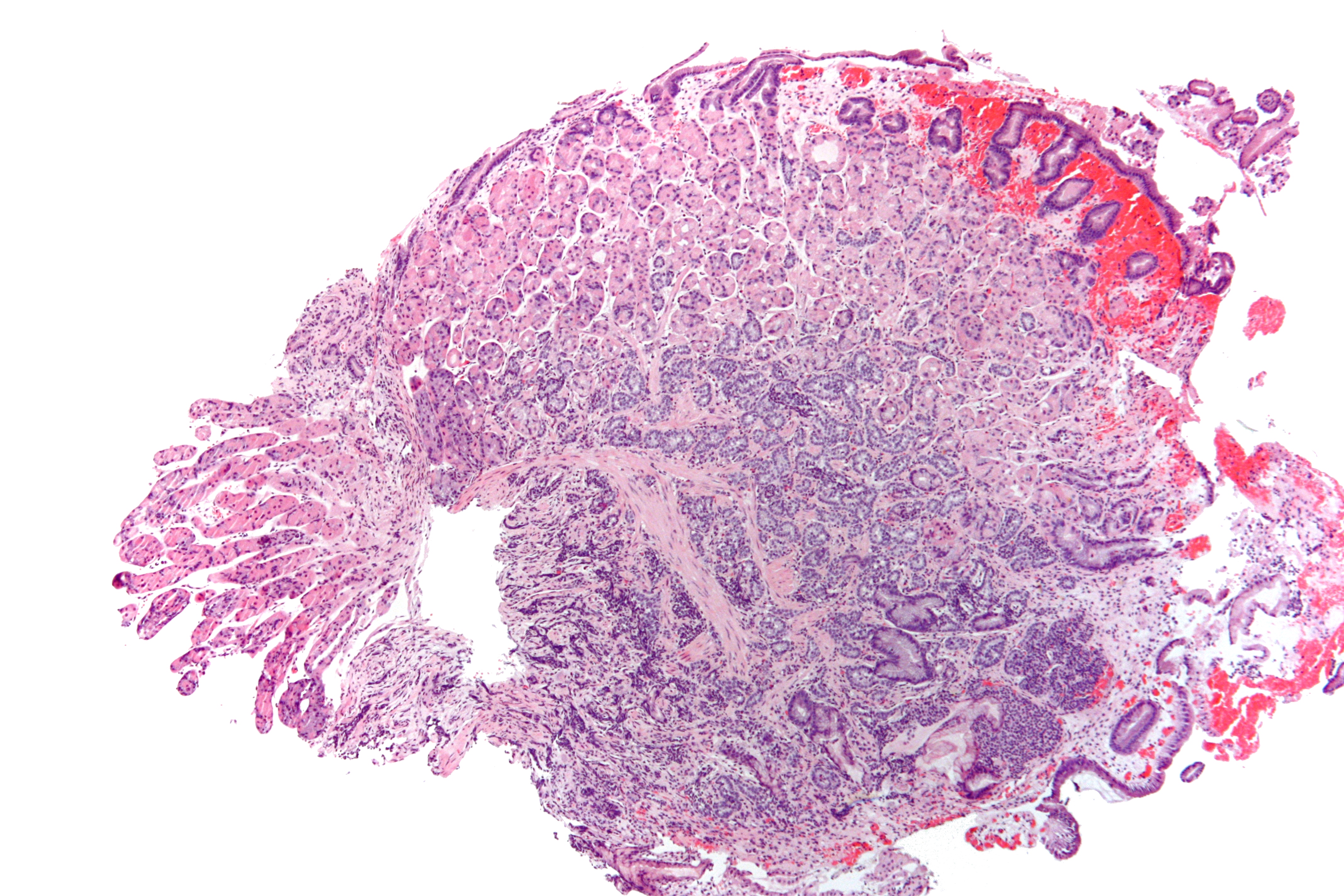

 Роль этих участков хромосом в эмбриогенезе очень плохо исследована. Появившиеся в последние годы данные о специфической морфо-функциональной организации гетерохроматиновых районов хромосом 1, 9, 16, и Y в цитотрофобласте хориона и плаценты, с одной стороны, и обнаружение транскрипции прицентромерных гетерохроматиновых районов хромосом в эмбриональных и экстраэмбриональных клетках человека – с другой, послужили стимулом для проведения данного исследования.
Роль этих участков хромосом в эмбриогенезе очень плохо исследована. Появившиеся в последние годы данные о специфической морфо-функциональной организации гетерохроматиновых районов хромосом 1, 9, 16, и Y в цитотрофобласте хориона и плаценты, с одной стороны, и обнаружение транскрипции прицентромерных гетерохроматиновых районов хромосом в эмбриональных и экстраэмбриональных клетках человека – с другой, послужили стимулом для проведения данного исследования. Автор не только анализирует широкий круг проблем, связанных с молекулярными и функциональными особенностями гетерохроматиновых районов хромосом, но и формирует собственную позицию по всем рассматриваемым вопросам. К этому разделу работы возник один частный вопрос: «чем принципиально, на взгляд автора, отличаются районы центромерного и прицентромерного гетерохроматина?»
Автор не только анализирует широкий круг проблем, связанных с молекулярными и функциональными особенностями гетерохроматиновых районов хромосом, но и формирует собственную позицию по всем рассматриваемым вопросам. К этому разделу работы возник один частный вопрос: «чем принципиально, на взгляд автора, отличаются районы центромерного и прицентромерного гетерохроматина?» Кроме того, были охарактеризованы морфо-функциональные особенности гетерохроматиновых районов метафазных хромосом 1, 9, 16 и Y из клеток трофобласта-цитотрофобласта нативных образцов и кратковременных органных культур хориона, а также клеток линии JEG-3.
Кроме того, были охарактеризованы морфо-функциональные особенности гетерохроматиновых районов метафазных хромосом 1, 9, 16 и Y из клеток трофобласта-цитотрофобласта нативных образцов и кратковременных органных культур хориона, а также клеток линии JEG-3.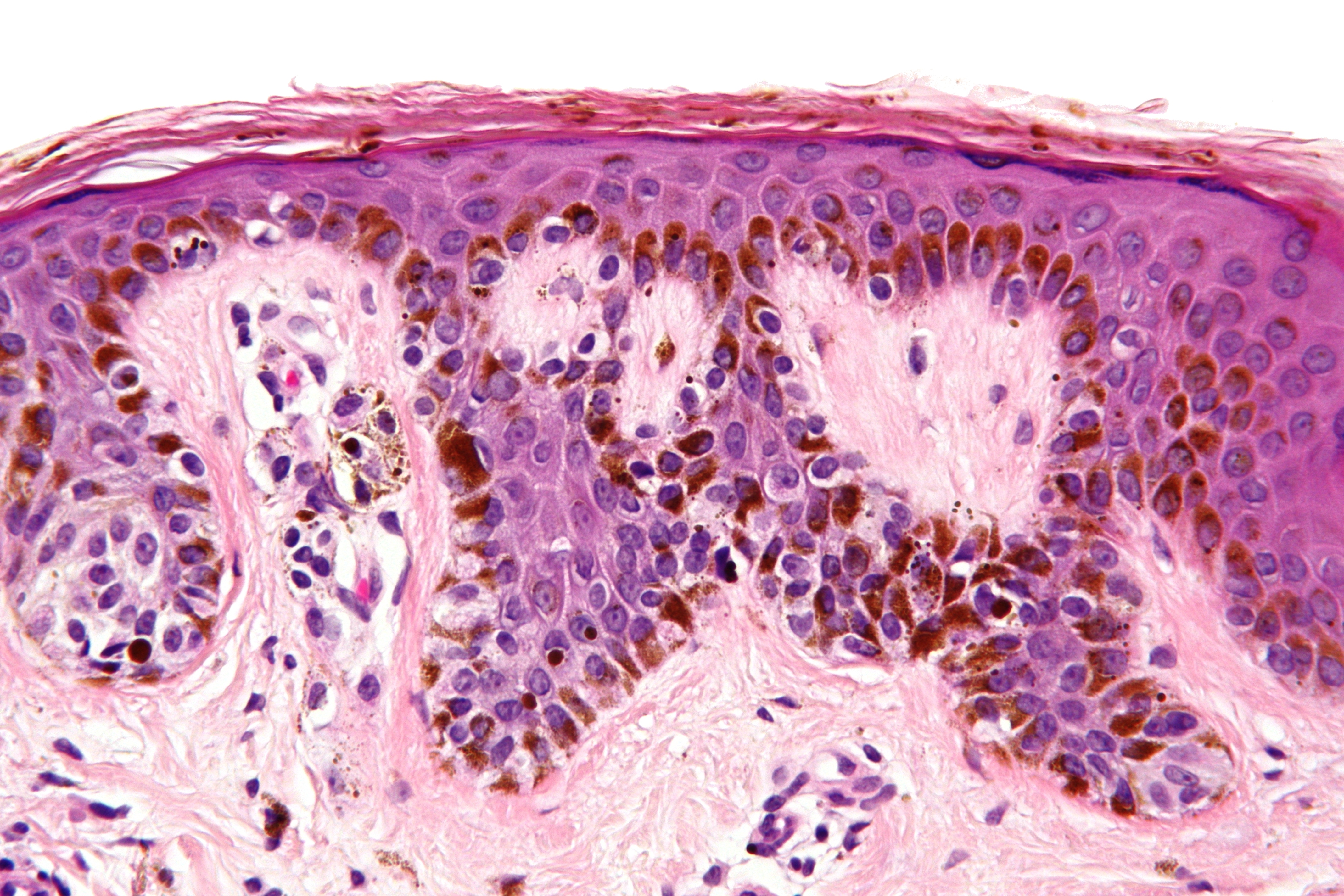 С.Руженковой производит очень хорошее впечатление. Работа хорошо сформулирована и написана грамотным русским языком. Подкупает стремление автора к выстраиванию четких причинно-следственных связей. В результате работы получен ряд приоритетных данных и освоен широкий круг современных цитогенетических методов. Работа очень хорошо оформлена и, безусловно, отвечает всем требованиям, предъявляемым к магистерским диссертациям в СПбГУ, и заслуживает оценки «отлично».
С.Руженковой производит очень хорошее впечатление. Работа хорошо сформулирована и написана грамотным русским языком. Подкупает стремление автора к выстраиванию четких причинно-следственных связей. В результате работы получен ряд приоритетных данных и освоен широкий круг современных цитогенетических методов. Работа очень хорошо оформлена и, безусловно, отвечает всем требованиям, предъявляемым к магистерским диссертациям в СПбГУ, и заслуживает оценки «отлично». Разница в том, что злокачественные опухоли могут возвращаться в разных частях тела, в которые они распространились, тогда как доброкачественные опухоли будут повторяться только в том месте, где они были первоначально обнаружены.
Разница в том, что злокачественные опухоли могут возвращаться в разных частях тела, в которые они распространились, тогда как доброкачественные опухоли будут повторяться только в том месте, где они были первоначально обнаружены. Многие считают, что большинство смертей от рака (примерно 90%) происходит из-за этой способности злокачественных опухолей распространяться, хотя статистика подвергается сомнению.(Узнайте больше о том, как распространяется рак.)
Многие считают, что большинство смертей от рака (примерно 90%) происходит из-за этой способности злокачественных опухолей распространяться, хотя статистика подвергается сомнению.(Узнайте больше о том, как распространяется рак.) Наличие инвазивных клеток в нормальном срезе ткани является наиболее диагностическим признаком злокачественного новообразования.
Наличие инвазивных клеток в нормальном срезе ткани является наиболее диагностическим признаком злокачественного новообразования. Фиброидные опухоли названы по месту их образования в организме, например миома матки.
Фиброидные опухоли названы по месту их образования в организме, например миома матки.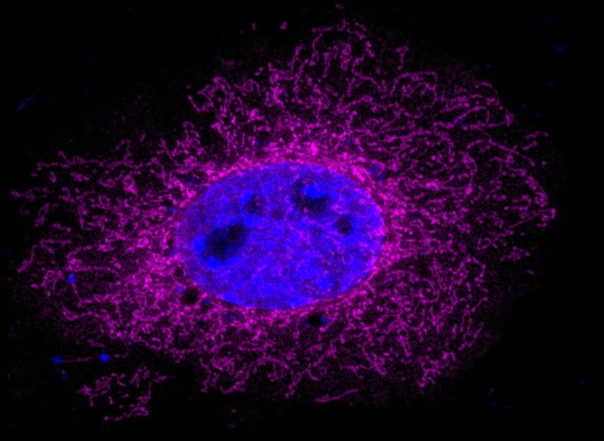
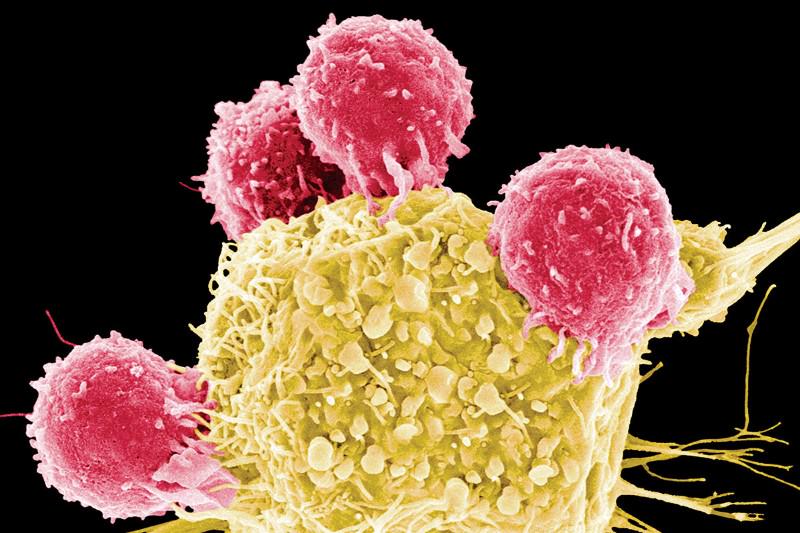 Ограничьте употребление полуфабрикатов, сахара, красного мяса и мясных продуктов.
Ограничьте употребление полуфабрикатов, сахара, красного мяса и мясных продуктов.