КОЛИЧЕСТВЕННЫЙ И КАЧЕСТВЕННЫЙ СОСТАВ МИКРОФЛОРЫ СЛИЗИСТОЙ ОБОЛОЧКИ НОСА ПРИ ПОЛИПОЗНОМ РИНОСИНУСИТЕ | Коленчукова
1. Батуро А.П., Романенко Э.E., Леонова А.Ю., Ярцева А.С., Савлевич Е.Л., Мокроносова М.А. Доминирование Staphylococcus aureus в микробиоценозе полости носа у детей и взрослых с инфекционным и аллергическим ринитом // Журнал микробиологии, эпидемиологии и иммунобиологии. 2015. № 1. С. 72–74. [Baturo A.P., Romanenko E.E., Leonova A.Yu., Yartseva A.S., Savlevich E.L., Mokronosova M.A. Domination of Staphylococcus aureus in microbiocenosis of nasal cavity in children and adults with infectious and allergic rhinitis. Zhurnal mikrobiologii, epidemiologii i immunobiologii = Journal of Microbiology, Epidemiology and Immunobiology, 2015, no. 1, pp. 72–74. (In Russ.)]
2. Бондарев Г.П., Терехова А.О. Роль инфекции в формировании полипозного риносинусита у больных бронхиальной астмой // Вестник оториноларингологии. 2010. № 3. С. 9–11. [Bondarev G.P., Terekhova A.O. The role of infection in the development of polypous rhinosinusitis in patients with bronchial asthma. Vestnik otorinolaringologii = Herald of Otorhinolaryngology, 2010, no. 3, pp. 9–11. (In Russ.)]
2010. № 3. С. 9–11. [Bondarev G.P., Terekhova A.O. The role of infection in the development of polypous rhinosinusitis in patients with bronchial asthma. Vestnik otorinolaringologii = Herald of Otorhinolaryngology, 2010, no. 3, pp. 9–11. (In Russ.)]
3. Варвянская А.В., Лопатин А.С. Эффективность длительной терапии низкими дозами макролидов при полипозном риносинусите // Вестник оториноларингологии. 2013. № 5. С. 22–27. [Varvianskaia A.V., Lopatin A.S. The effectiveness of long-term treatment of polypous rhinosinusitis with low doses of macrolides. Vestnik otorinolaringologii = Herald of Otorhinolaryngology, 2013, no. 5, pp. 22–27. (In Russ.)]
4. Долгов В.А. Сравнительная характеристика видового состава микрофлоры барабанной полости, слизистой оболочки носа и наружного уха в процессе экспериментального стафилококкового гнойного среднего отита // Вестник оториноларингологии. 2014. № 5. С. 34–36. [Dolgov V.A. The comparative characteristic of the microflora species composition in the tympanic cavity, nasal mucous membrane and external ear mucosa in the course of experimental suppurative staphylococcal otitis. Vestnik otorinolaringologii = Herald of Otorhinolaryngology, 2014, no. 5, pp. 34–36. (In Russ.)]
2014. № 5. С. 34–36. [Dolgov V.A. The comparative characteristic of the microflora species composition in the tympanic cavity, nasal mucous membrane and external ear mucosa in the course of experimental suppurative staphylococcal otitis. Vestnik otorinolaringologii = Herald of Otorhinolaryngology, 2014, no. 5, pp. 34–36. (In Russ.)]
5. Иванова М.А., Пискунов Г.З. Сравнительная характеристика микрофлоры полости носа и околоносовых пазух у пациентов с рецидивирующими воспалительными заболеваниями // Российская ринология. 2007. № 3. С. 18–21. Ivanova M.A., Piskunov G.Z. The comparative characteristic of infection of a nose and paranasal sinuses in patients with recurrent inflammatory diseases. Rossiiskaya rinologiya = Russian Rhinology, 2007, no. 3, pp. 18–21. (In Russ.)]
6. Коленчукова O.A., Акчебаш С.В., Капустина T.A., Парилова O. В., Кин T.И. Сравнительная характеристика стафилококкового пейзажа слизистой оболочки носа при синусите и рините // Вестник оториноларингологии. 2009. № 2. С. 7–9. [Kolenchukova O.A., Akchebash S.V., Kapustina T.A., Parilova O.V., Kin T.I. Comparative characteristics of the staphylococcus landscape of nasal mucosa in patients with sinusitis and rhinitis. Vestnik otorinolaringologii = Herald of Otorhinolaryngology, 2009, no. 2, pp. 7–9. (In Russ.)]
В., Кин T.И. Сравнительная характеристика стафилококкового пейзажа слизистой оболочки носа при синусите и рините // Вестник оториноларингологии. 2009. № 2. С. 7–9. [Kolenchukova O.A., Akchebash S.V., Kapustina T.A., Parilova O.V., Kin T.I. Comparative characteristics of the staphylococcus landscape of nasal mucosa in patients with sinusitis and rhinitis. Vestnik otorinolaringologii = Herald of Otorhinolaryngology, 2009, no. 2, pp. 7–9. (In Russ.)]
7. Мавзютов А.Р., Мавзютова Г.А., Бондаренко К.Р., Сендерович С.Е., Назмутдинова Р.Г., Мурзабаева Р.Т., Кузовкина О.С., Акбашева А.О., Дубровская Д.Н. Характер изменений уровня липополисахарид-связывающего белка при различных инфекционных процессах и дисбиозах // Журнал микробиологии, эпидемиологии и иммунобиологии. 2011. № 2. С. 66–72. [Mavziutov A.R., Mavziutova G.A., Bondarenko K.R., Senderovich S.E., Nazmutdinova R.G., Murzabaeva R.T., Kuzovkina O.S., Akbasheva A.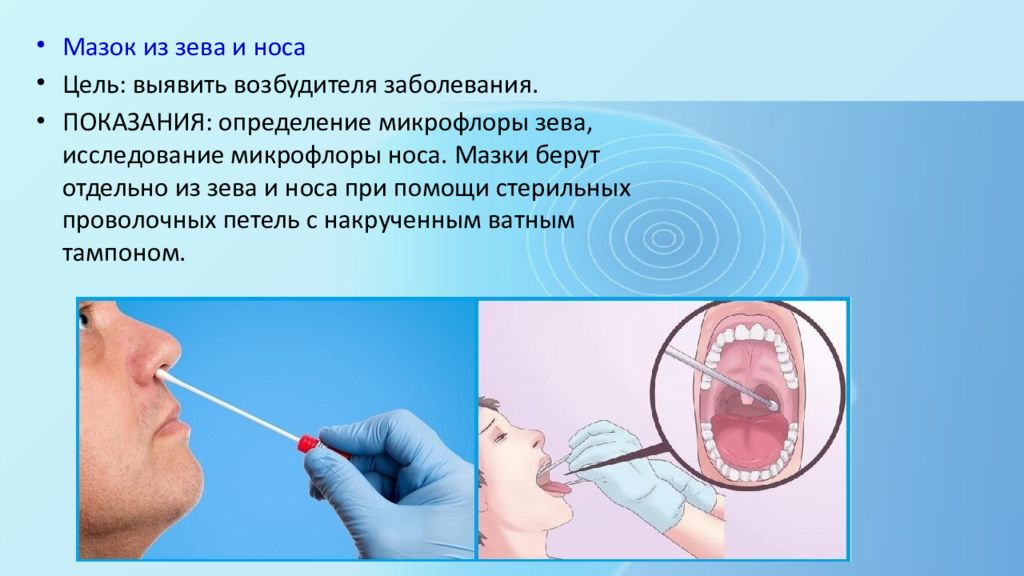 O., Dubrovskaja D.N. Character of lipopolysaccharide-binding protein level changes in different pathological conditions and dysbiosis. Zhurnal mikrobiologii, epidemiologii i immunobiologii = Journal of Microbiology, Epidemiology and Immunobiology, 2011, no. 2, pp. 66–72. (In Russ.)]
O., Dubrovskaja D.N. Character of lipopolysaccharide-binding protein level changes in different pathological conditions and dysbiosis. Zhurnal mikrobiologii, epidemiologii i immunobiologii = Journal of Microbiology, Epidemiology and Immunobiology, 2011, no. 2, pp. 66–72. (In Russ.)]
8. Мельников В.Г. К вопросу о болезнетворности условно-патогенных микроорганизмов // Тихоокеанский медицинский журнал. 2010. № 3. С. 15–18. [Melnikov V.G. On pathogenicity of opportunistic pathogens. Tikhookeanskii meditsinskii zhurnal = Pasific Medical Journal, 2010, no. 3, pp. 15–18. (In Russ.)]
9. Пащенков М.В., Попилюк С.Ф., Алхазова Б.И., Львов В.Л., Феденко Е.С., Хаитов Р.М., Пинегин Б.В. Иммуно биоло-гические свойства мурамилпептидных фрагментов пептидогликана грамотрицательных бактерий // Иммунология. 2010. № 3. С. 119–125. Pashchenkov M.V., Popilyuk S. F., Alkhazova B.I., L’vov V.L., Fedenko E.S., Khaitov R.M., Pinegin B.V. Immunobiological properties of muramylpeptide fragments of peptidoglycan from Gram-negative bacteria. Immunologiya = Immunology, 2010, no. 3, pp. 119–125. (In Russ.)]
F., Alkhazova B.I., L’vov V.L., Fedenko E.S., Khaitov R.M., Pinegin B.V. Immunobiological properties of muramylpeptide fragments of peptidoglycan from Gram-negative bacteria. Immunologiya = Immunology, 2010, no. 3, pp. 119–125. (In Russ.)]
10. Саидов М.З., Давудов Х.Ш., Магомедов И.М., Климова С.В., Будихина А.С., Назмутдинов И.И. Особенности состояния и взаимосвязи показателей системного и местного адаптивного иммунитета при полипозном риносинусите // Иммунология. 2010. № 6. С. 365–369. [Saidov M.Z., Davudov Kh.Sh., Magomedov I.M., Klimova S.V., Budikhina A.S., Nazhmudinov I.I. The informative value of correlation relationships between characteristics of congenital and adaptive immunity in frequently ill children presenting with adenotonsillar hypertrophy. Immunologiya = Immunology, 2010, no. 6, pp. 365–369. (In Russ.)]
11. Трофименко С. Л. Патогенез и клиника полипозного риносинусита // Вестник оториноларингологии. 2010. № 4. С. 94–97. [Trofimenko S.L. Pathogenesis and clinical features of polypous rhinosinusitis. Vestnik otorinolaringologii = Herald of Otorhinolaryngology, 2010, no. 4, pp. 94–97. (In Russ.)]
Л. Патогенез и клиника полипозного риносинусита // Вестник оториноларингологии. 2010. № 4. С. 94–97. [Trofimenko S.L. Pathogenesis and clinical features of polypous rhinosinusitis. Vestnik otorinolaringologii = Herald of Otorhinolaryngology, 2010, no. 4, pp. 94–97. (In Russ.)]
12. Цывкина A.A., Царев С.В. Полипозный риносинусит в рамках астматической триады // Вестник оториноларинго-логии. 2011. № 1. С. 77–80. [Tsyvkina A.A., Tsarev S.V. Polypous rhinosinusitis in the context of the asthma triad. Vestnik otorinolaringologii = Herald of Otorhinolaryngology, 2011, no. 1, pp. 77–80. (In Russ.)]
13. Haddadin R.N., Saleh S.A., Ayyash M.A., Collier P.J. Occupational exposure of pharmaceutical workers to drug actives and excipients and their effect on Staphylococcus spp. nasal carriage and antibiotic resistance. Int. J. Occup. Environ. Health, 2013, vol. 19, no. 3, pp. 207–214. doi: 10.1179/2049396713Y.0000000035
19, no. 3, pp. 207–214. doi: 10.1179/2049396713Y.0000000035
14. Huvenne W., Hellings P.W., Bachert C. Role of staphylococcal superantigens in airway disease. Int. Arch. Allergy Immunol., 2013, vol. 161, no. 4, pp. 304–314. doi: 10.1159/000350329
15. Johannessen M., Sollid J.E., Hanssen A.M. Host- and microbe determinants that may influence the success of S. aureus colonization. Front. Cell. Infect. Microbiol., 2012, no. 4, pp. 2–56. doi: 10.3389/fcimb.2012.00056
16. Seiberling K.A., Conley D.B., Tripathi A., Grammer L.C., Shuh L., Haines G.K. 3rd, Schleimer R., Kern R.C. Superantigens and chronic rhinosinusitis: detection of staphylococcal exotoxins in nasal polyps. Laryngoscope, 2005, vol. 115, no. 9, pp. 1580–1585.
Особенности микрофлоры полости носа | Biocodex Microbiote Institut
Особенности микрофлоры полости носа
Участие микробиоты дыхательных путей в развитии заболевания дыхательной системы, такого как астма, кажется логичным. .. Однако требуются доказательства. В ряде исследований предпринимаются попытки показать взаимосвязь между микробиотой полости носа и развитием бронхиальной астмы, тем самым приоткрывая завесу перед загадкой.
.. Однако требуются доказательства. В ряде исследований предпринимаются попытки показать взаимосвязь между микробиотой полости носа и развитием бронхиальной астмы, тем самым приоткрывая завесу перед загадкой.
До сих пор имеется недостаточно научных работ по вопросу влияния микробиоты полости носа на развитие астмы9 , в то время как в отношении микробиоты нижних отделов дыхательных путей (бронхи и легкие) такая связь установлена. За решение этого вопроса взялась группа американских ученых. Их целью стало изучение состава микробиоты полости носа больных астмой и сравнение ее с микробиотой здоровых людей для выявления признаков ее воздействия на болезнь. На протяжении одного года собирались образцы из носоглотки (в задней части полости носа) у людей в возрасте от 10 до 73 лет, среди которых были больные астмой в стадии обострения и ремиссии, а также здоровые люди, составившие контрольную группу10.
Особая микробиота
Гипотеза подтвердилась: микробиота полости носа существенно отличалась в разных группах. По сравнению с контрольной группой, в микрофлоре астматиков два семейства бактерий (бактероиды и протеобактерии) присутствуют в большем количестве. Четыре вида бактерий у астматиков обнаруживали в большем количестве: некоторые ассоциируются с местными воспалительными заболеваниями (но никогда – с астмой), другие встречаются при некоторых нарушениях со стороны дыхательной системы; наконец, ряд бактерий причастен к развитию вагиноза. Обнаруженные микроорганизмы также отличались в зависимости от того, было ли это стабильное течение заболевания или обострение.
По сравнению с контрольной группой, в микрофлоре астматиков два семейства бактерий (бактероиды и протеобактерии) присутствуют в большем количестве. Четыре вида бактерий у астматиков обнаруживали в большем количестве: некоторые ассоциируются с местными воспалительными заболеваниями (но никогда – с астмой), другие встречаются при некоторых нарушениях со стороны дыхательной системы; наконец, ряд бактерий причастен к развитию вагиноза. Обнаруженные микроорганизмы также отличались в зависимости от того, было ли это стабильное течение заболевания или обострение.
Биомаркеры на расстоянии руки
Данное исследование является одним из крупнейших среди проведенных в последнее время работ, посвященных изучению взаимосвязи микробиоты полости носа и бронхиальной астмы. Результаты этого исследования после должного анализа представляют собой важный шаг вперед в научном поиске и согласуются с данными, полученными в исследованиях нижних отделов дыхательных путей. На основании этого можно предположить, что изучение микробиоты полости носа, получение образцов которой осуществляется легче и менее травматично, чем с помощью внутреннего осмотра бронхов (бронхоскопия), может помочь в понимании роли микробиоты дыхательных путей в возникновении и течении астмы. Обнаруженные бактерии подлежат более детальному изучению для выяснения их роли и возможности их использования в качестве простого маркера наличия астмы и наблюдения за ее течением. Таковы многочисленные направления научного исследования данной проблемы в будущем.
Обнаруженные бактерии подлежат более детальному изучению для выяснения их роли и возможности их использования в качестве простого маркера наличия астмы и наблюдения за ее течением. Таковы многочисленные направления научного исследования данной проблемы в будущем.
9 Gilstrap DL, Kraft M. Asthma and the host-microbe interaction. Journal of Allergy and Clinical Immunology 2013; 131:1449-50.e3
10 Fazlollahi M, Lee TD, Andrade J et al. The Nasal Microbiome in Asthma. Journal of Allergy and Clinical Immunology (2018), doi: 10.1016/j.jaci.2018.02.020
Микроскопическое исследование мазка со слизистой оболочки носа
Риноцитограмма – это исследование слизи из полости носа под микроскопом. Оно позволяет определить наличие в носовой слизи клеток, характерных для аллергических или инфекционных заболеваний, вызывающих ринит – воспаление слизистой оболочки носа. При длительном насморке в некоторых случаях определение вызвавшей его причины бывает затруднено. С этой целью и проводится риноцитограмма, которая позволяет выявить увеличенное количество эозинофилов, что служит дополнительным аргументом в пользу аллергической природы насморка. Аллергический и инфекционный ринит лечатся по-разному, именно поэтому важно определить причину насморка.
С этой целью и проводится риноцитограмма, которая позволяет выявить увеличенное количество эозинофилов, что служит дополнительным аргументом в пользу аллергической природы насморка. Аллергический и инфекционный ринит лечатся по-разному, именно поэтому важно определить причину насморка.
Референсные значения не приводятся.
Результат представляет собой описание общей цитологической картины с подсчетом количества лейкоцитов, эозинофилов, нейтрофилов, эпителия мерцательного, лимфоцитов, макрофагов, слизи, эритроцитов, дрожжевых грибов, флоры. Врач интерпретирует результат (диф. диагностика ринита), оценивая соотношение количества клеток.
Синонимы русские
Риноцитограмма, цитологическое исследование секрета из полости носа, мазок на эозинофилию, исследование соскоба со слизистой оболочки полости носа, исследование назального секрета.
Синонимы английские
Cytologic study of respiratory tract, Nasal Smear, Nasal smear for eosinophils, Eosinophil smear.
Метод исследования
Микроскопия.
Какой биоматериал можно использовать для исследования?
Мазок из носа.
Как правильно подготовиться к исследованию?
Исключить использование назальных спреев, капель, содержащих кортикостероиды, в течение 24 часов до исследования.
Общая информация об исследовании
Риноцитограмма – исследование выделений из носа под микроскопом. С ее помощью можно выявить изменения, характерные для аллергических реакций организма или для инфекции. Таким образом устанавливают причину воспаления слизистой оболочки носа (ринита).
В норме все стенки полости носа покрыты слизистой оболочкой с секретом, способствующим удалению пыли и микробов. Секрет обладает таким свойством благодаря наличию мерцательного эпителия, имеющего реснички, которые способны колебаться и перемещать слизь вместе с пылью и микробами.
Тем не менее в норме в полости носа обитает большое количество микробов (некоторые виды стафилококков, стрептококков и др), не причиняющих человеку вреда из-за иммунного ответа организма. Если по каким-либо причинам местный иммунитет снижается, микробы могут приводить к воспалению, возникает острый ринит – расстройство функции носа, сопровождающееся воспалительными изменениями слизистой оболочки и насморком. Кроме того, ринит могут вызывать вирусы, передающиеся воздушно-капельным путем, в том числе возбудители ОРЗ.
Если по каким-либо причинам местный иммунитет снижается, микробы могут приводить к воспалению, возникает острый ринит – расстройство функции носа, сопровождающееся воспалительными изменениями слизистой оболочки и насморком. Кроме того, ринит могут вызывать вирусы, передающиеся воздушно-капельным путем, в том числе возбудители ОРЗ.
Снижение местного иммунитета может быть вызвано переохлаждением организма, снижением общего иммунитета человека. Развитию насморка также способствует замедление движения мерцательного эпителия.
В результате ответа иммунной системы в слизистой носа повышается количество лейкоцитов – белых кровяных телец. Существует несколько их разновидностей, при бактериальных инфекциях главную роль в защите организма играют нейтрофилы, при вирусных – лимфоциты. Также могут появляться макрофаги.
При аллергии на организм воздействует определенное вещество (аллерген), например пыльца, шерсть, пыль и т. д., к которому возникает повышенная чувствительность иммунной системы. Такая реакция приводит к выделению в слизистой оболочке носа определенных веществ (гистамина, брадикинина), вызывающих симптомы аллергии. При этом большее значение в данном процессе имеют такие клетки иммунной системы, как эозинофилы (одна из разновидностей лейкоцитов). При аллергии они могут в большом количестве появляться в крови, а также накапливаться в носовой слизи.
Такая реакция приводит к выделению в слизистой оболочке носа определенных веществ (гистамина, брадикинина), вызывающих симптомы аллергии. При этом большее значение в данном процессе имеют такие клетки иммунной системы, как эозинофилы (одна из разновидностей лейкоцитов). При аллергии они могут в большом количестве появляться в крови, а также накапливаться в носовой слизи.
Кроме того, существует вазомоторный (нейровегетативный) ринит, при котором воздействие холода, прием некоторых лекарств, воздействие других физических или психоэмоциональных факторов вызывает острое набухание слизистой оболочки носа и изменение тонуса сосудов носовой полости.
При этом во всех случаях ринита происходит образование и выделение большого количества жидкости, что мы и называем насморком.
Аллергическая природа ринита часто остается невыявленной, хотя она достаточно распространена. Риноцитограмма может помочь в диагностике: особенность эозинофилов, появляющихся при аллергическом рините, состоит в том, что при специальной окраске (по Романовскому – Гимзе) они окрашиваются в красный цвет и становятся доступными для подсчета под микроскопом.
Для чего используется исследование?
При длительном насморке в некоторых случаях определение вызвавшей его причины бывает затруднено. С этой целью и проводится риноцитограмма, которая позволяет выявить увеличенное количество эозинофилов, что служит дополнительным аргументом в пользу аллергической природы насморка. Аллергический и инфекционный ринит лечатся по-разному, именно поэтому важно определить причину насморка.
Когда назначается исследование?
При длительном насморке (несколько недель и более), сопровождающемся заложенностью носа, чиханием неустановленного происхождения.
Что означают результаты?
Референсные значения для различных видов микроорганизмов зависят от их локализации (точки взятия биологического материала).
Повышение показателей
- Эозинофилы. Значительное повышение (более 10 % от общего количества лейкоцитов в мазке и более) количества эозинофилов свидетельствует в пользу аллергического происхождения насморка.
 В то же время следует иметь в виду, что отсутствие большого количества эозинофилов в мазке не позволяет достоверно исключить аллергическую природу заболевания. Уровень эозинофилов также может быть повышен при неаллергическом эозинофильном рините – заболевании, при котором другие признаки (помимо повышения количества эозинофилов в крови и носовой слизи) аллергии отсутствуют. Заболевание часто сопровождается полипами и отсутствием реакции на противоаллергические (антигистаминные) препараты.
В то же время следует иметь в виду, что отсутствие большого количества эозинофилов в мазке не позволяет достоверно исключить аллергическую природу заболевания. Уровень эозинофилов также может быть повышен при неаллергическом эозинофильном рините – заболевании, при котором другие признаки (помимо повышения количества эозинофилов в крови и носовой слизи) аллергии отсутствуют. Заболевание часто сопровождается полипами и отсутствием реакции на противоаллергические (антигистаминные) препараты.
- Нейтрофилы. Увеличение количества данных клеток в мазке может указывать на то, что причиной насморка являются инфекционные агенты (бактерии или вирусы). Повышение уровня нейтрофилов особенно характерно для острой стадии заболевания.
- Лимфоциты. Повышенное содержание лимфоцитов может быть связано с хроническим инфекционным воспалением слизистой оболочки носа.
- Эритроциты. Появление в мазке эритроцитов может свидетельствовать о повышенной проницаемости сосудистой стенки слизистой полости носа, что характерно для некоторых видов ринита, в частности вызванных дифтерией или гриппом.

Следует отметить, что повышение уровня нейтрофилов и лимфоцитов не является специфичным в отношении инфекции.
Снижение показателей
Отсутствие в мазке эозинофилов, нейтрофилов, других видов лейкоцитов может указывать на:
- вазомоторный ринит – насморк, не связанный с аллергией или инфекцией;
- ринит, связанный со злоупотреблением сосудосуживающими назальными спреями;
- ринит, вызванный другими причинами (гормональными нарушениями, нарушениями психоэмоционального состояния, нарушениями анатомии носовых ходов и др.).
Что может влиять на результат?
Использование назальных спреев, особенно кортикостероидов, может приводить к ложноотрицательным результатам в отношении эозинофилии.
Тот же эффект иногда наблюдается при использовании таблеток, содержащих кортикостероиды, и антигистаминных (противоаллергических) препаратов.
Скачать пример результата
Важные замечания
- Следует оценивать результаты исследования, сопоставляя данные истории развития заболевания, других исследований и симптомы.

- Для повышения достоверности результатов рекомендуется повторить обследование через 1-2 недели.
Также рекомендуется
Кто назначает исследование?
Врач-терапевт, врач общей практики, врач-оториноларинголог, аллерголог-иммунолог.
Литература
- Пальчун В. Т. Оториноларингология. Национальное руководство, 2008, ГЭОТАР-медиа. 919 с.
- V Paleri, J Hill. ENT Infections: An Atlas of Investigation and Management, 2010, Atlas Medical Publishing Ltd. P. 116.
- Dan L. Longo, Dennis L. Kasper,J. Larry Jameson, Anthony S. Fauci, Harrison’s principles of internal medicine (18th ed.). New York: McGraw-Hill Medical Publishing Division, 2011.
Ученые выяснили, как микрофлора в носу человека борется с опасной инфекцией
Золотистый стафилококк (Staphylococcus aureus) является обычным колонизатором человеческого тела. Несмотря на то что некоторые люди живут с этими бактериями и не заболевают, их наличие в носовой полости создает условия для развития заболевания, степень тяжести которого может варьировать от легкой кожной инфекции до угрожающей жизни патологии, вызванной метициллинрезистентным золотистым стафилококком (methicillin-resistant Staphylococcus aureus). Исследование ученых из Института Форсайт (Forsyth Institute), США, предоставляет понимание того, как бактерии вида Corynebacterium, которые являются частью естественной микрофлоры носовой полости и кожи человека, помогают защитить его от болезней. Так, при взаимодействии бактерий коринебактерии подавляют вирулентность золотистого стафилококка.
Исследование ученых из Института Форсайт (Forsyth Institute), США, предоставляет понимание того, как бактерии вида Corynebacterium, которые являются частью естественной микрофлоры носовой полости и кожи человека, помогают защитить его от болезней. Так, при взаимодействии бактерий коринебактерии подавляют вирулентность золотистого стафилококка.
Более глубокое понимание этих взаимодействий, вероятно, поможет исследователям разработать новые методы лечения и профилактики инфекции, вызванной S. aureus. Кроме того, дальнейшее изучение взаимодействия между представителями естественной микрофлоры человека и патогенных микроорганизмов может привести к разработке новых методов лечения других заболеваний.
В последние годы появление метициллинрезистентного золотистого стафилококка считается довольно серьезной проблемой, поскольку данная бактерия устойчива к антибиотикам. По данным Центров по контролю и профилактике заболеваний (Centers for Disease Control and Prevention), США, данная бактерия стала причиной более 80 тыс. случаев инвазивного заболевания и более 10 тыс. смертей ежегодно в 2005–2011 г. Поскольку все больше и больше видов бактерий приобретают устойчивость к антибиотикам, более глубокое понимание взаимодействия между потенциально полезными и вредными бактериями в микрофлоре предлагает новые подходы для лечения заболеваний путем использования функции уже присутствующих полезных бактерий.
случаев инвазивного заболевания и более 10 тыс. смертей ежегодно в 2005–2011 г. Поскольку все больше и больше видов бактерий приобретают устойчивость к антибиотикам, более глубокое понимание взаимодействия между потенциально полезными и вредными бактериями в микрофлоре предлагает новые подходы для лечения заболеваний путем использования функции уже присутствующих полезных бактерий.
По материалам www.eurekalert.org
Сравнительная характеристика микрофлоры полости носа и зева применительно к запросам хирургии основания черепа Текст научной статьи по специальности «Клиническая медицина»
6. Ракова Т.В. Влияние иммунокорригирующей терапии на показатели местного иммунного статуса в комплексном лечении пациентов с хроническим катаральным гингивитом // Курский научнопрактический вестник «Человек и его здоровье». -2009. — № 2. — С. 99-103.
7. Рузуддинов Н.С. Применение двухслойного базиса в клинике ортопедической стоматологии // Среднеазиатский науч. -практ. журн. «Stomato-logiya». -2004. — № 3-4. — С. 88-90.
-практ. журн. «Stomato-logiya». -2004. — № 3-4. — С. 88-90.
8. Силин Д.С. К вопросу состояния слизистой оболочки полости рта у больных красным плоским лишаем // Курский научно-практический вестник «Человек и его здоровье». — 2010. — № 3. — С. 128133.
9. Сарап Л.Р., Бутакова Л.Ю., Зенкова Ю.А. и др. Профилактика патологии слизистой оболочки полости рта у пациентов со съемными зубными протезами // Клиническая стоматология. — 2007. -Т. 41, № 1. — С. 40-43.
10. Царев В.Н. Антимикробная терапия в стоматологии. — М.: МИА, 2004. — 143 с.
11. Douglas L.J. Antifungal resistance of candidal bio-filmsformed on denture acrylic in vitro // J.Dent.Res. — 2000. — Vol. 80, N 3. — P. 903-90S.
12. Qlikawa M. Microbicidal efficacy of ozonated water against Candida albicans adhering to acrylic denture plates // Oral Microbiol Immunol. — 2005. — Vol. 20, N 4. — P. 206-210.
— 2005. — Vol. 20, N 4. — P. 206-210.
УДК 616-093/-098
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА МИКРОФЛОРЫ ПОЛОСТИ НОСА И ЗЕВА ПРИМЕНИТЕЛЬНО К ЗАПРОСАМ ХИРУРГИИ ОСНОВАНИЯ ЧЕРЕПА
© Гайворонский Л.И., Сбойчаков В.Б., Андреев В.Л.
Кафедра нейрохирургии, кафедра микробиологии Военно-медицинской академии им С.М. Кирова, Санкт-Петербург
E-mail: gibdd 19S1 @yahoo. com
С целью прогнозирования возможности развития послеоперационных осложнений при трансназальном и транс -оральном нейрохирургических доступах проведены микробиологические исследования. Изучена микрофлора полости носа и зева у 57 здоровых людей. Из полости носа с различным уровнем контаминации были выделены следующие микроорганизмы: Staph. epidermidis, S. saprophyticus, S. aureus, S. viridans (group), Corinebacterium spp., Neisseria spp. Частота встречаемости данных микроорганизмов варьировала от 5,3% (S. aureus) до 98,2% (S. epidermidis). Из зева были выделены более сложные ассоциации микроорганизмов: Staph. epidermidis, S. saprophyticus, S. aureus, S. haemolyticus, S. hominis, Str. viridans (group), Str. pneumoniae, Str. agalactiae, Str. pyogenes, Neisseria spp., Corinebacterium spp., Haemophilus spp., Candida spp., Lactobacillus spp., Moraxella catarrhalis, Bacillus spp., Micrococcus spp. Состав и уровни контаминации микроорганизмами полости рта значительно превосходят аналогичные показатели из полости носа.
epidermidis, S. saprophyticus, S. aureus, S. viridans (group), Corinebacterium spp., Neisseria spp. Частота встречаемости данных микроорганизмов варьировала от 5,3% (S. aureus) до 98,2% (S. epidermidis). Из зева были выделены более сложные ассоциации микроорганизмов: Staph. epidermidis, S. saprophyticus, S. aureus, S. haemolyticus, S. hominis, Str. viridans (group), Str. pneumoniae, Str. agalactiae, Str. pyogenes, Neisseria spp., Corinebacterium spp., Haemophilus spp., Candida spp., Lactobacillus spp., Moraxella catarrhalis, Bacillus spp., Micrococcus spp. Состав и уровни контаминации микроорганизмами полости рта значительно превосходят аналогичные показатели из полости носа.
Ключевые слова: микрофлора полости рта, микрофлора полости носа, трансоральные доступы, трансназальные доступы.
COMPARATIVE CHARACTERISTICS OF THE NASAL CAVITY AND PHARYNX MICROFLORA WITH REGARD TO INQUIRY OF THE SKULL BASE SURGERY
Gayvoronsky A. I., Sboychakov V.B., Andreev V.A.
I., Sboychakov V.B., Andreev V.A.
Neurosurgery Department, Microbiology Department of S.M. Kirov Military Medical Academy, St.-Petersburg
To predict the opportunity of the development of postoperative complications during the transnasal and transoral neurosurgical approaches microbiological researches were made. We studied the microflora of nasal cavity and pharynx in 57 healthy people. From the nasal cavity with the different level of contamination the following microorganisms were isolated: Staph. epidermidis, S. saprophyticus, S. aureus, S. viridans (group), Corinebacterium spp., Neisseria spp. The rate of their popularity varied from 5.3% (S. aureus) to 98.2 % (S. epidermidis). From the pharynx more complicated associations of microorganisms were isolated: Staph. epidermidis, S. saprophyticus, S. aureus, S. haemolyticus, S. hominis, Str. viridans (group), Str. pneumoniae, Str. agalactiae, Str. pyogenes, Neisseria spp., Corinebacterium spp., Haemophilus spp., Candida spp., Lactobacillus spp., Moraxella catarrhalis, Bacillus spp., Micrococcus spp. The contamination of microorganisms from the pharynx significantly excel the similar signs in the nasal cavity.
pneumoniae, Str. agalactiae, Str. pyogenes, Neisseria spp., Corinebacterium spp., Haemophilus spp., Candida spp., Lactobacillus spp., Moraxella catarrhalis, Bacillus spp., Micrococcus spp. The contamination of microorganisms from the pharynx significantly excel the similar signs in the nasal cavity.
Keywords: microflora of nasal cavity, microflora of pharynx, transnasal approaches, transoral approaches.
По данным мировой литературы, трансназальные доступы к структурам основания черепа отличаются значительно меньшим количеством осложнений, в первую очередь инфекционных, по сравнению с трансоральными [6]. Более того, некоторые авторы не рекомендуют использовать трансоральный доступ для удаления ин-традуральных объемных образований вследствие высокого риска менингита [17].
Тем не менее благодаря современным методам профилактики инфекционных осложнений Yin Q. S. et al. (2010) отметили, что из 54 пациентов, прооперированных трансоральным доступом, нагноение послеоперационной раны было отмечено лишь у 2 [19].
S. et al. (2010) отметили, что из 54 пациентов, прооперированных трансоральным доступом, нагноение послеоперационной раны было отмечено лишь у 2 [19].
С целью прогнозирования возможности развития гнойно-воспалительных осложнений при трансназальном и трансоральном оперативных доступах к структурам основания черепа проведены микробиологические исследования.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проводилось на базе кафедры микробиологии Военно-медицинской академии им. С.М. Кирова. Изучена микрофлора полости носа и зева у 57 здоровых людей. Распределение обследованных по возрасту было следующим: 1824 года — 31 человек; 25-39 лет — 17; 40-60 лет — 9. Все обследуемые были здоровы, не имели хронических заболеваний со стороны дыхательной системы. При проведении исследований материал отбирался одновременно из полости носа и зева.
Отбор материала проводился в соответствии с МУ 4.2.2039-05 «Техника сбора и транспортирования биоматериалов в микробиологические лаборатории». Придерживались рекомендаций, изложенных в методическом пособии [2]. Забор проб проводили с помощью стандартных ватных тампонов из носа через нижний носовой ход и из
зева. Материалы помещали в транспортную среду Эймса и немедленно доставляли в лабораторию. Данная среда обеспечивает жизнеспособность требовательных микроорганизмов и в то же время препятствует быстрому размножению бактерий, сохраняя исходный количественный уровень. Посев проводили полуколичественным методом на плотные питательные среды в соответствии с Методическими рекомендациями по микробиологической диагностике раневых инфекций в лечебных учреждениях армии и флота (1999 г.). С целью выявления аэробной и факультативно -анаэробной микрофлоры использовали кровяной агар, желточно-солевой агар (для выявления стафилококков) и среду Сабуро (для выявления грибов). Для создания более подходящих условий, способствующих росту таких требовательных микроорганизмов, как гемофилы, на чашки с кровяным агаром накладывали диски с сапонином, способствующим образованию X фактора роста (гемина). У 5 человек проведены исследования на носительство анаэробных бактерий. С этой целью материал из транспорных сред засевали на анаэробный агар, обогащенный дрожжевым экстрактом, витамином К и twin 80 с последующем культивированием в анаэростате (BioMerieux, Франция). Для создания анаэробных условий при культивировании посевов использовали газогенерирующие пакеты той же фирмы.
Для создания более подходящих условий, способствующих росту таких требовательных микроорганизмов, как гемофилы, на чашки с кровяным агаром накладывали диски с сапонином, способствующим образованию X фактора роста (гемина). У 5 человек проведены исследования на носительство анаэробных бактерий. С этой целью материал из транспорных сред засевали на анаэробный агар, обогащенный дрожжевым экстрактом, витамином К и twin 80 с последующем культивированием в анаэростате (BioMerieux, Франция). Для создания анаэробных условий при культивировании посевов использовали газогенерирующие пакеты той же фирмы.
Идентификацию выделенных микроорганизмов проводили по морфологическим, культуральным и биохимическим показателям. Анаэробные бактерии после изучения морфологических свойств и пробы на аэротолерантность идентифицировали с помощью автоматизированной системы VITEK 2.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В результате проведенного микробиологического исследования выявлен качественный и количественный состав микрофлоры полости носа и зева.
Состав аэробных и факультативноанаэробных микроорганизмов, выделенных из зева, представлен в табл. 1. Как видно из таблицы, аэробная и факультативно-анаэробная микрофлора зева представлена разнообразными микроорганизмами, что объясняется благоприятными условиями для ее развития (остатки пищи, влажность, постоянная температура и др.). Значительное разнообразие видов микрофлоры ротовой полости и зева подчеркивают и другие исследователи [4, 18]. Среди бактерий преобладали грампо-ложительные кокки, представленные в большинстве стрептококками. В основном эти микроорганизмы представлены видами, постоянно обитаю-
Таблица 1
Состав аэробных и факультативно-анаэробных микроорганизмов, выделенных из зева
Уровень конта- Число находок n = 57
Микроорганизмы минации (КОЕ в 1 мл) Абс. %
%
1. Staphylococcus spp. 57 100
В том числе:
S. epidermidis 103 — 104 55 9б,5
S. saprophyticus 104 — 5×105 9 15,S
S. aureus 103 — 104 2 3,5
Прочие коагулазоотрицательные стафилококки (S. haemolyticus,
S. hominis и др.) 103 — 5×103 S 14,0
2. Streptococcus spp. 57 100
В том числе:
S. viridans (group) 104 — 5×105 57 100
S. pneumoniae 103 — 5×103 2б 45,б
S. agalactiae 103 — 5×103 11 19,3
agalactiae 103 — 5×103 11 19,3
S. pyogenes 104 2 3,5
3. Прочие каталазоположительные грампо-
ложительные кокки 103 — 104 4 7, 0
4. Neisseria spp. 104 — 5×104 57 100
5. Corinebacterium spp. 103 — 104 43 75,4
6. Haemophilus spp. 103 — 104 23 40,4
7. Candida spp. 103 12 21,0
8. Прочие: (Lactobacillus spp., Moraxella ca- 103 — 5×103 11 19,3
tarrhalis, Bacillus spp., Micrococcus spp.)
щими в ротовой полости и обнаруживаемыми у подавляющего числа людей (стрептококки группы вириданс, пневмококки, нейссерии). Эти микроорганизмы при определенных условиях в то же время способны вызывать гнойно-воспалителные заболевания.
Эти микроорганизмы при определенных условиях в то же время способны вызывать гнойно-воспалителные заболевания.
Пиогенный стрептококк был выявлен лишь в 3,5% случаев, однако в связи с его повышенной вирулентностью требует особой настороженности из-за риска развития последующих гнойновоспалительных осложнений. Другой ft-гемолитический стафилококк — S. agalactiae — вызывает преимущественно инфекции новорожденных, послеродовые инфекции и реже инфекции мочевыводящих путей [15].
Основными препаратами для лечения стрептококковых инфекций (препаратами 1 го ряда) являются пенициллины и аминопенициллины. Во вторую очередь применяются макролиды и другие альтернативные препараты — цефалоспорины, фторхинолоны, тетрациклины, хлорамфеникол, линезолид, аминогликозиды и др. [3, 14]. Причем для ft-гемолитических стрептококков, таких как S. pyogenes и S. agalactiae, достоверных сведений об устойчивости к бета-лактамным антибиотикам не описано [9]. Для лечения инфекций, вызванных пневмококками и стрептококками группы вириданс, чаще всего также используют пеницил-лины и макролиды. Вместе с тем во всем мире отмечается рост устойчивости S. pneumoniae к беталактамным антибиотикам. Основной механизм их устойчивости связан не с продукцией бета-лактамаз, а с изменением структуры пени-циллинсвязывающих белков в результате появления кодирующей их мутантной ДНК в генах. В связи с этим преодолеть такую устойчивость применением защищенных беталактамов (амок-сиклав, ампициллин/сульбактам и др.) не представляется возможным. Однако частота выделения таких пневмококков на территории РФ не превышает 12%, причем в основном регистрируются штаммы с промежуточным уровнем устойчивости 0,12 — 1 мкг/мл. Это делает возможным их использование для профилактики и лечения инфекций дыхательных путей, однако может быть недостаточным для лечения генерализованных форм пневмококковой инфекции, в том числе менингитов [3, 9].
Для лечения инфекций, вызванных пневмококками и стрептококками группы вириданс, чаще всего также используют пеницил-лины и макролиды. Вместе с тем во всем мире отмечается рост устойчивости S. pneumoniae к беталактамным антибиотикам. Основной механизм их устойчивости связан не с продукцией бета-лактамаз, а с изменением структуры пени-циллинсвязывающих белков в результате появления кодирующей их мутантной ДНК в генах. В связи с этим преодолеть такую устойчивость применением защищенных беталактамов (амок-сиклав, ампициллин/сульбактам и др.) не представляется возможным. Однако частота выделения таких пневмококков на территории РФ не превышает 12%, причем в основном регистрируются штаммы с промежуточным уровнем устойчивости 0,12 — 1 мкг/мл. Это делает возможным их использование для профилактики и лечения инфекций дыхательных путей, однако может быть недостаточным для лечения генерализованных форм пневмококковой инфекции, в том числе менингитов [3, 9].
Другими потенциальными возбудителями гнойно-воспалительных осложнений являются гемофилы, а также коринебактерии. Причем при целенаправленном исследовании, с использованием сред, специально предназначенных для выделения гемофилов (среды содержащие V и X факторы роста, шоколадный агар), процент выделения первых может быть более высоким. Кори-небактерии и гемофилы природно чувствительны
Причем при целенаправленном исследовании, с использованием сред, специально предназначенных для выделения гемофилов (среды содержащие V и X факторы роста, шоколадный агар), процент выделения первых может быть более высоким. Кори-небактерии и гемофилы природно чувствительны
к бета-лактамам, макролидам, фторхинолонам, некоторым другим антибиотикам. Вместе с тем такие препараты, как аминогликозиды, пенициллин, цефалоспорины первого поколения, а также из макролидов — эритромицин, для лечения гемо-фильных инфекций не используются из-за их низкой клинической эффективности. В последние годы в мировой практике отмечена устойчивость ряда штаммов гемофилов к бета-лактамным антибиотикам. В основном она связана с выработкой бета-лактамаз. В этом случае сохраняется их чувствительность к «защищенным» бета-лактамам, цефалоспоринам II-III поколения, кар-бапинемам. Однако, по данным Л.С. Страчунско-го с соавт. (2002), а также других авторов, проводивших исследование в период 2003 — 2010 гг. , в нашей стране частота таких штаммов не превышает 5 — 5,4%. Появились также сообщения о резистентности Haemophilus influenza к «защищенным» пенициллинам и цефалоспоринам, связанной с модификацией пенициллинсвязывающих белков клеточной стенки или выработкой бета-лактамаз, устойчивых к воздействию клавулано-вой кислоты. Но встречаются они достаточно редко (0,2%). Эффективны против гемофилов азитромицин и кларитромицин. Частота обнаружения устойчивых к этим антибиотикам штаммов не превышает 1 — 2% [3, 10, 11, 12, 13].
, в нашей стране частота таких штаммов не превышает 5 — 5,4%. Появились также сообщения о резистентности Haemophilus influenza к «защищенным» пенициллинам и цефалоспоринам, связанной с модификацией пенициллинсвязывающих белков клеточной стенки или выработкой бета-лактамаз, устойчивых к воздействию клавулано-вой кислоты. Но встречаются они достаточно редко (0,2%). Эффективны против гемофилов азитромицин и кларитромицин. Частота обнаружения устойчивых к этим антибиотикам штаммов не превышает 1 — 2% [3, 10, 11, 12, 13].
Грибы рода Candida встречались в нашем исследовании в 21,0% случаев, что даже несколько ниже литературных данных (45 — 50%). Необходимость проведения дополнительных профилактических мероприятий, предотвращающих развитие кандидоза, может возникнуть при наличии дополнительных факторов риска, таких как иммунные нарушения, эндокринные нарушения (сахарный диабет, гипертиреоз и др.), длительное или массивное употребление антибиотиков, иммунодепрессантов, кортикостероидных препаратов, цитостатиков, гормональных контрацептивов, сопутствующих истощающих хронических заболеваний, пациентов пожилого возраста и других факторов, влияющих на клеточный иммунитет или ведущих к гипергликемии тканей [1, 7].
Исследования анаэробных бактерий были проведены только у 5 человек, что связано со сложностью их выделения и идентификации. У всех обследованных были выявлены грамположи-тельные анаэробные кокки в количестве 105 — 106. Эти мироорганизмы были представлены Pepto-streptococcus spp., Peptococcus spp., Finegoldia magna, Actinomyces spp.
Грамотрицательные анаэробные бактерии, представленные кокками (Veilonella spp.), палочками (Fuzobacterium nucleatum, Bacteroides spp., Prevotella spp.) выделялись в меньшем количестве 103 — 104 КОЕ в 1мл. По литературным данным,
количество анаэробных бактерий, обитающих в ротовой полости и зеве, отличается еще большим разнообразием видов, включающим такие бактерии, как Propionebacterim spp., Eubacterium spp., Porphyromonas spp. и др. [18].
Риск развития воспалительных процессов с участием анаэробных возбудителей увеличивается при состояниях, ведущих к снижению окислительно-восстановительного потенциала в тканях (сахарный диабет и др. ), а также при длительном лечении аминогликозидами, к которым не чувствительны анаэробные бактерии [7]. Вместе с тем грамположительные анаэробные кокки, выделяемые в наибольшем количестве, остаются чувствительны к бета-лактамным антибиотикам, в том числе и к пенициллинам.
), а также при длительном лечении аминогликозидами, к которым не чувствительны анаэробные бактерии [7]. Вместе с тем грамположительные анаэробные кокки, выделяемые в наибольшем количестве, остаются чувствительны к бета-лактамным антибиотикам, в том числе и к пенициллинам.
Таким образом, с целью профилактики послеоперационных осложнений при трансоральном доступе, исходя из проведенных микробиологических исследований, следует рекомендовать предварительное обследование на такие вирулентные бактерии, как золотистый стафилококк и пиогенный стрептококк с последующей санацией в случае положительного результата. При профилактическом применении антибиотиков наиболее оптимальным будет применение цефалоспоринов 2-го поколения в комбинации с макролидами (кларитромицином или азитромицином). Применение с этой целью эритромицина из-за возможности наличия Haemophilus influenza нецелесообразно.
Состав аэробных и факультативноанаэробных микрофлоры носа представлен в табл. 2. Как видно из представленных данных, микрофлора носа характеризуется меньшим видовым разнообразием по сравнению с микрофлорой зева, что согласуется с литературными данными [18]. Вместе с тем отмечается более высокий уровень контаминации слизистой носа ста-
2. Как видно из представленных данных, микрофлора носа характеризуется меньшим видовым разнообразием по сравнению с микрофлорой зева, что согласуется с литературными данными [18]. Вместе с тем отмечается более высокий уровень контаминации слизистой носа ста-
филококками. Во всех двух случаях выделения золотистого стафилококка из зева эти же бактерии выделялись и со слизистой носа. Кроме того, в одном случае S. aureus был выделен только со слизистой носа. Все эти микроорганизмы также природно-чувствительны к бета-лактамам и мак-ролидам.
Следует отметить, что в случае длительного пребывания пациентов перед проведением оперативного вмешательства в стационаре имеется высокий риск обсеменения слизистой носа и зева полирезистентными и мультирезистентными госпитальными штаммами бактерий, в особенности стафилококков. Так, процент выделения в стационарах метициллинрезистентных штаммов стафилококков доходит до 40 и более процентов [8, 16]. Это может потребовать исследования таких лиц перед оперативным вмешательством не только на носительство золотистого стафилококка и пиогенного стрептококка, но и на выявление других видов метициллинрезистентных стафилококков с последующей санацией.
Это может потребовать исследования таких лиц перед оперативным вмешательством не только на носительство золотистого стафилококка и пиогенного стрептококка, но и на выявление других видов метициллинрезистентных стафилококков с последующей санацией.
Таким образом, в результате проведенного микробиологического исследования выявлена значительно большая обсемененность микроорганизмами зева (полости рта) по сравнению с полостью носа. Это соответствует большей частоте встречаемости в нейрохирургической практике гнойно-воспалительных осложнений после выполнения трансоральных доступов к структурам основания черепа по сравнению с трансназальными. Из-за наличия разнообразных видов условно-патогенных возбудителей в зеве наиболее целесообразно до определения антибиотикорези-стентности использовать как с профилактической целью, так и при возникновении гнойновоспалительных осложнений комбинации цефа-лоспоринов 2-го поколения с макролидами (кла-ритромицин, азитромицин).
Тяжесть простуды зависит от бактерий в слизистой носа
Светлана МасловаФото: EAST NEWS
Исследователи разделили носы жителей Земли на несколько различных типов в зависимости от состава микробиоты слизистой. В итоге ученые обнаружили, что от категории живущих в носу бактерий зависит тяжесть симптомов при простуде.
2
Микробиота полости носа состоит из смеси различных бактерий. Американские ученые решили изучить состав этих микроорганизмов и выяснили, что микробиоту носовых проходов можно разделить на шесть категорий, сообщается на сайте Виргинского университета (США).
Кроме того, микробиота слизистой оболочки носа коррелирует с типом и тяжестью симптомов простуды, которые развиваются у людей даже при заражении одинаковым вирусом.
Команда протестировала состав микробиоты более 150 участников в здоровом состоянии и после инфицирования. Вероятность, что вирус может кардинально изменить микрофлору была исключена.
Вероятность, что вирус может кардинально изменить микрофлору была исключена.
Результаты исследования показали, что люди с повышенным содержанием стафилококка имели более выраженные внешние симптомы простуды, чем другие участники с меньшей концентрацией стафилоккока в микробиоте. Важным условием эксперимента являлся идентичный штамм вируса, которым были заражены все участники.
«Результаты доказывают, что состав микробиоты влияет на реакцию человека на вирус, а также общий характер болезни. Однако пока мы говорим лишь об ассоциации микроорганизмов с этими последствиями», — подчеркивает исследователь Рональд Тернер.
Сейчас команда планирует проведение более крупного исследования, чтобы однозначно установить влияние микробиоты на склонность к повышенной симптоматике во время болезни. Кроме того, ученые исследуют потенциальный эффект пробиотика для носа, который подобно лекарственным бактериям для кишечника, может улучшить микрофлору и повысить защитный барьер.
Многие исследователи изучают влияние микроорганизмов на здоровье с разных сторон, в том числе, детально изучая микробиоту кишечника. Одно из таких исследований выявило клеточный механизм, благодаря которому бактерии защищают кишечник, а значит — всю иммунную систему.
FacebookВконтакте2WhatsAppTelegram
Нормализация слизистой оболочки полости носа как медико-социальная проблема | #08/11
Наш организм может полноценно жить и развиваться лишь в том случае, если между ним и средой обитания постоянно происходит обмен веществ. Одной из важнейших форм связи организма с окружающей средой, не прерывающейся в течение всей жизни человека, является связь через дыхательную систему. Нос, являющийся начальным отделом дыхательного тракта, представляет собой мощный защитный барьер, информирующий центры о контакте с различными агентами внешней среды, осуществляющий кондиционирование вдыхаемого воздуха, задерживающий и обезвреживающий вещества, которые могут поступить в организм с воздухом [7].
Ведущая роль в защитной функции носа принадлежит слизистой оболочке, которая покрыта псевдомногослойным эпителием, состоящим из мерцательных, бокаловидных, а также коротких и длинных вставочных эпителиоцитов. Мерцательная клетка на своем свободном конце имеет многочисленные реснички.
| Рис. Строение слизистой оболочки полости носа |
Реснитчатые клетки имеют по 250–300 ресничек длиной 7 и высотой 0,3 микрона. Каждая ресничка состоит из 9 пар микротрубочек, расположенных в виде кольца и окружающих две непарные центральные микротрубочки. Движение ресничек мерцательного эпителия слизистой оболочки носа осуществляется посредством скольжения микротрубочек. Движение ресничек строго направлено — от преддверия полости носа в сторону носоглотки. Мукоцилиарный клиренс обеспечивается назальным секретом. Источник секрета, покрывающего эпителий полости носа, — слизистые железы слизистой оболочки носа, бокаловидные клетки, транссудация из субэпителиальных капилляров, слезных желез, секрет специализированных Боумановых желез из ольфакторной зоны носа [7] (рис.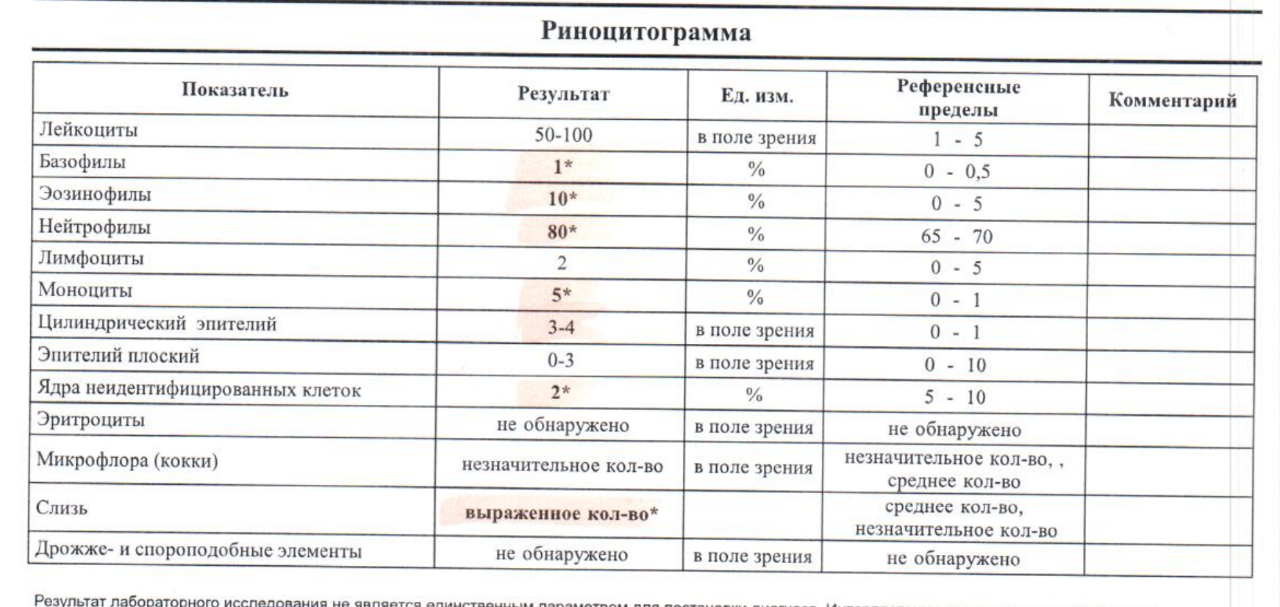 ).
).
Объем назальной секреции за 24 ч составляет от 100 мл до 1–2 л. Слизистая оболочка задних двух третей полости носа обновляется каждые 10–15 мин. Функция ресничек оптимальна при температуре 28–33 °C, достаточном количестве секрета с рН 5,5–6,5. Потеря влаги, понижение температуры до 7–10 °C, увеличение рН секрета более 6,5 вызывает прекращение колебания ресничек [8, 11].
Слизистая оболочка полости носа является первым барьером защиты дыхательных путей, поэтому на слизистой оболочке полости носа ежесекундно осаждаются тысячи микроорганизмов. Большинство из них являются представителями сапрофитной микрофлоры и не причиняют человеку никакого вреда, тогда как другие способны спровоцировать развитие инфекционного заболевания. При инфекционном рините размножение микробов на слизистой носа приводит к ее повреждению и отслаиванию верхней части эпителия. Этот процесс и объясняет все проявления насморка: чувство жжения в носу, истечение слизи (экссудата), заложенность носа, изменения голоса (гнусавость) и др. [9].
[9].
Ринит редко бывает самостоятельным заболеванием. Чаще всего насморк является симптомом какой-либо другой нозологической формы. Насморк наблюдается при различных ОРВИ или ОРЗ (грипп, парагрипп, аденовирусная инфекция, корь и др.). Острые респираторные заболевания являются наиболее распространенными в структуре инфекционных заболеваний. В России ежегодно регистрируется около 50 млн случаев инфекционных заболеваний, из них до 90% случаев приходится на острые респираторные вирусные инфекции. При патологии ЛОР-органов в первую очередь страдает слизистая оболочка с ее железистыми клетками.
Помимо инфекционных заболеваний, в индустриально развитых странах в настоящее время от 10% до 20% населения страдают острыми аллергическими заболеваниями. Кроме того, в патогенезе воспалительных заболеваний верхних дыхательных путей наряду с местным и общим воздействием возбудителя играют роль сенсибилизация организма и иммунологические сдвиги непосредственно в слизистой оболочке носа и околоносовых пазух [4].
Слизистая носа является той зоной, которая подвергается воздействию самых разнообразных инородных частиц. Молекулы аллергенов чрезвычайно быстро вызывают аллергическую реакцию, вследствие чего уже через минуту после проникновения аллергенов возникают чиханье, зуд в полости носа, ринорея [5, 6].
В качестве других этиологических факторов поражения слизистой оболочки могут быть неблагоприятная экология, профессиональные вредности, вредные привычки (табакокурение, наркомания). В городе, непосредственно у поверхности земли, обнаруживается наибольшая концентрация всех видов ксенобиотиков — свободно-радикальные соединения, канцерогены, соли тяжелых металлов, все виды аллергенов, ну и, конечно, патогенные микроорганизмы. Слизистая оболочка носа, полости рта и глотки находится в постоянном контакте с вдыхаемым воздухом и, таким образом, подвергается воздействию вредных факторов внешней среды, что приводит к ее отеку. В любом случае возникают условия, при которых слизистая носа легко инфицируется, реагируя появлением значительного отека [3].
Принимаемые при различных заболеваниях лекарственные препараты в качестве побочного действия часто дают субатрофию слизистой оболочки полости носа за счет системного действия, что особенно важно у представителей голосоречевых профессий в связи с наступающими изменениями в резонаторном тракте [1, 10].
При некоторых заболеваниях, например, при сахарном диабете, за счет нарушений в микроциркуляторном русле часто развиваются атрофические и субатрофические риниты. С учетом распространенности данного заболевания, в частности, в связи со снижением возраста впервые заболевших (трудоспособное население) проблемы увлажнения слизистой оболочки полости носа носят социальный характер.
Как показывают исследования, население планеты стареет, увеличивается средняя продолжительность жизни и соответственно возрастают требования к качеству жизни в данной группе населения. Известно, что со снижением уровня половых гормонов, обусловленных менопаузой у женщин и снижением функции половых желез у мужчин, вероятность развития субатрофических и атрофических процессов на коже и слизистых резко возрастает.
Таким образом, в нормализации функции слизистой оболочки полости носа ведущими направлениями терапии являются:
1) стимуляция кровообращения местного и общего, т. е. усиленное снабжение слизистой оболочки питательными веществами;
2) увлажнение слизистой оболочки носа и препятствование образованию корок;
3) борьба с местной патологической микрофлорой.
Таким принципам отвечают препараты топического действия, содержащие важнейшие микроэлементы, регулирующие реологические свойства слизи. Считается, что содержащиеся в изотоническом растворе микроэлементы, такие как Са, Fе, К, Мg, Сu, способствуют повышению двигательной активности ресничек, активизации репаративных процессов в клетках слизистой оболочки носа и нормализации функции ее желез [7]. Перечисленные микроэлементы содержатся в препаратах, которые готовят из морской воды, стерилизуя ее и доводя содержание солей до изотонической концентрации, и из воды минеральных источников, обладающей лечебными свойствами.
Известно, что морская вода очень полезна для человеческого организма, так как содержит много ценных микро- и макроэлементов. Морская вода активизирует все жизненные процессы организма, повышает его сопротивляемость к различным заболеваниям, она обладает местным антисептическим действием.
Целебные свойства морской воды:
- Промывание полости носа морской воды оказывает антибактериальное действие, смывая пыль, вирусы и бактерии.
- Полоскание горла теплой морской водой лечит заболевания горла и восстанавливает голосовые связки.
- Морские ванны и воздух стимулируют эндокриную систему.
- Морская вода ускоряет заживление ссадин и порезов благодаря содержанию большого количества солей и микроэлементов.
- Полоскание рта теплой морской водой укрепляет зубы и десны.
Одним из новых препаратов этой группы является Отривин Море [2], представляющий собой очищенный, деконтаминированный изотонический раствор океанической воды из Бретани, добываемой в экологически чистом районе Атлантического океана, богатой натуральными микроэлементами. Он содержит 18 минералов и микроэлементов.
Он содержит 18 минералов и микроэлементов.
Благодаря такому составу препарат Отривин Море идеально подходит для защиты слизистой оболочки носа от неблагоприятных условий города, а также для облегчения носового дыхания во время болезни. Отривин Море обеспечивает быструю элиминацию возбудителей и аллергенов, то есть многократно снижает их концентрацию и способствует механическому очищению поверхности слизистой оболочки носа. Помимо этого, Отривин Море стимулирует клетки мерцательного эпителия, способствует нормализации выработки слизи и ее разжижению, а также повышает местный иммунитет. Важным преимуществом препарата является отсутствие какого-либо системного действия на организм пациента, что крайне важно для людей, страдающих различными соматическими заболеваниями и опасающихся приема традиционных топических вазоконстрикторов из-за риска развития побочных эффектов. Кроме того, у пациента появляется возможность снизить дозировку других лекарственных средств, применяемых для комплексного лечения, и ускорить выздоровление.
Отривин Море можно использовать как в профилактических и лечебных целях, так и для ежедневной гигиены полости носа. Новинка не содержит консервантов и дополнительных химических ингредиентов. Основными показаниями для назначения препарата являются острый ринит (включая аллергический) и заложенность носа. При насморке и аллергии Отривин Море облегчает дыхание, деликатно очищая носовые ходы, а также оказывает антисептическое действие. Кроме того, средство можно использовать для гигиены полости носа перед применением других лекарственных препаратов. В целях профилактики возможно использование препарата Отривин Море в период эпидемий различных вирусных заболеваний, что препятствует развитию различных форм инфекционного процесса на слизистой носа. Препарат также может применяться с целью гигиены полости носа, эффективно очищая слизистую носа и бережно увлажняя ее. Натуральный состав Отривин Море не только обеспечит высокую безопасность проводимого лечения, но и позволяет применять препарат для промывания носа при аллергии.
Многие назальные спреи вызывают дискомфортные ощущения при их приеме, что связано с раздражением слизистой оболочки полости носа. Отривин Море в форме назального душа лишен данного побочного эффекта. Бережно промывая полость носа, препарат удаляет пыль, бактерии и секрет и предотвращает ее пересыхание, тем самым оберегая от раздражающего воздействия внешних факторов, что особенно важно людям, работающим в помещениях с чрезмерно сухим воздухом (например, там, где установлены кондиционеры или возле нагревательных приборов).
Большое значение имеет форма выпуска препарата. При использовании носовых капель большая часть введенного раствора стекает по дну полости носа в глотку. В этом случае не достигается необходимый лечебный эффект. В этом плане намного более выгодным выглядит назначение дозированных аэрозолей, так, особенностью препарата Отривин Море является выпуск в форме назального спрея.
Также Отривин Море можно использовать и для ежедневной гигиены полости носа. Эта процедура известна уже с древности и важна для нашего здоровья не менее, чем чистка зубов. В современном мире, в тесных и пыльных мегаполисах, ежедневное профилактическое промывание носа морской водой приобрело особую актуальность.
Эта процедура известна уже с древности и важна для нашего здоровья не менее, чем чистка зубов. В современном мире, в тесных и пыльных мегаполисах, ежедневное профилактическое промывание носа морской водой приобрело особую актуальность.
Для удобства пациентов Отривин Море выпускается во флакончиках оптимального объема — 50 и 100 мл, которые будут уместны и в домашней, и в дорожной аптечках. Кроме того, флакон Отривин Море снабжен универсальной насадкой, подходящей для всей семьи и может быть рекомендован детям с трехмесячного возраста. При этом распыляющий наконечник обеспечит аккуратное и равномерное увлажнение полости носа, а специальный клапан, защищающий лекарство от попадания в него микроорганизмов, гарантирует длительный срок использования после первого применения.
Таким образом, препарат Отривин Море является надежным средством, очищающим слизистую оболочку носа у взрослых и детей, восстанавливая ее физиологическую функцию, не вызывая при этом ее сухости и обладая стойким длительным эффектом, предотвращая тем самым развитие грозных осложнений и одновременно бережно воздействуя на ее структурные компоненты. Отривин Море может применяться как для лечения, так и для профилактики насморка, а также для защиты слизистой носа от раздражающего воздействия окружающей среды.
Отривин Море может применяться как для лечения, так и для профилактики насморка, а также для защиты слизистой носа от раздражающего воздействия окружающей среды.
Литература
- Волошина И. А., Туровский А. Б. Ирригационная терапия атрофического ринита. С. 1906.
- Государственный реестр лекарственных средств. М.: МЗ РФ, 2008.
- Гуров А. А. Отек слизистой оболочки верхних дыхательных путей. Как с ним бороться? 1254 с.
- Карпова Е. П., Усеня Л. И. Топические деконгестанты для терапии воспалительных заболеваний полости носа и околоносовых пазух у детей. С. 18.
- Марков Г. И. Транспортная функция мерцательного эпителия слизистой оболочки полости носа при воспалительных заболеваниях // Вестник оториноларингологии. 1985. № 4. С. 36–37.
- Пальчун В. Т., Магомедов М. М., Лучихин Л. А. Оториноларингология. М.: Медицина. 2002. 576 с.
- Пискунов Г.
 З., Пискунов С. З. Клиническая ринология. М., 2002. 390 с.
З., Пискунов С. З. Клиническая ринология. М., 2002. 390 с. - Плужников М. С., Шантуров А. Г., Лавренова Г. В., Носуля Е. В. Слизистая оболочка носа. Механизмы гомеостаза и гомокинеза. СПб. 1995. С. 5–18.
- Рязанцев С. В. Современные деконгестанты в комплексной терапии острых и хронических заболеваний ЛОР-органов // Российская оториноларингология. 2008, № 6 (19).
- Deitmer T., Scheffler R. The effect of different preparations of nasal decongestans in ciliary beat frequency in vitro // Rhinology. 1993; 31–151–3 (14).
- Satir P. How cillia move // Scientific American. 1974. Vol. 231. P. 45–46.
Н. Э. Бойкова, кандидат медицинских наук
Научно-клинический центр оториноларингологии Федерального медико-биологического агентства, Москва
Контактная информация об авторах для переписки: [email protected]
Микробиота полости носа здоровых взрослых | Microbiome
Набор субъектов и характеристики
Это исследование было одобрено Наблюдательным советом Мичиганского университета. Все субъекты предоставили письменное информированное согласие. Двенадцать взрослых пациентов были набраны из отоларингологической клиники третичного уровня (дополнительный файл1: таблица S1). Критериями исключения были пациенты с острым или хроническим синуситом и пациенты, принимавшие антибиотики или пероральные стероиды по любой причине.
Отбор проб
Тампоны с флокированной ДНК 4N6 (кат. № 3520CA, Copan Diagnostics Inc., Murrieta, CA, USA) использовали для отбора проб со всех участков. Образцы из носовой полости брали путем введения тампона в носовой проход между перегородкой и средней носовой раковиной, стараясь избежать контакта с ноздрями. С тыльной стороны языка и слизистой оболочки щеки брали отдельные мазки. Образцы переносили непосредственно в пробирки Эппендорфа, поставляемые с тампоном, и хранили на льду, а затем при -20 ° C до выделения ДНК.
Выделение ДНК
ДНК выделяли из тампонов с помощью набора для выделения ДНК PowerSoil (Mo Bio Laboratories, Inc., Карлсбад, Калифорния, США) в соответствии с инструкциями производителя, за исключением 2-минутного взбивания шариков с использованием настройки «Гомогенизация». Mini-BeadBeater-8 (Biospec Products, Bartlesville, OK, USA) вместо 10 мин встряхивания.
Первичная амплификация, объединение и секвенирование ПЦР
Мы основали наш протокол для амплификации и подготовки библиотек области V5V3 гена, кодирующего 16S рРНК, на протоколе HMP 16S версии 4.2 (http://www.hmpdacc.org/doc/16S_Sequencing_SOP_4.2.2.pdf). Каждая реакция полимеразной цепной реакции (ПЦР) на 20 мкл содержала 2 мкл буфера II для ПЦР AccuPrime (Invitrogen, Карлсбад, Калифорния, США), 0,15 мкл ДНК-полимеразы AccuPrime Taq High Fidelity (Invitrogen), 0,2 мкМ праймера A (CCATCTCATCCCTGCGATGTCTCCGACXTCAGXX900). 0,2 мкМ праймер B (CCTATCCCCTGTGTGCCTTGGCAGTCTCAG CCTACGGGAGGCAGCAG ) и 1 мкл ДНК для образцов полости рта или 15,45 мкл ДНК для образцов из носа. Выделенные жирным шрифтом части праймера A и праймера B обозначены 926R и 357 F соответственно.Область праймера A, представленная XXXXX, представляет собой последовательность штрих-кода из 5–10 нуклеотидов. Остальные от праймера A и праймера B представляют собой последовательность адаптера A и последовательность адаптера B, соответственно, необходимые для секвенирования emPCR и 454. ПЦР проводили в течение 2 минут при 95 ° C, затем 30 циклов при 95 ° C в течение 20 с, 50 ° C в течение 30 секунд и 72 ° C в течение 5 минут. Продукты ПЦР очищали с помощью AMPure XP (Agencourt Bioscience Corporation, Beckman Coulter, Inc., Беверли, Массачусетс, США) в соответствии с инструкциями производителя, за исключением 0.Для удаления большего количества мелких продуктов использовали 6-кратный объем ампликона (10,8 мкл) шариков, а не 1,2-кратный. Очищенные продукты ПЦР количественно оценивали с помощью набора дцДНК Quant-iT PicoGreen (Invitrogen) в соответствии с инструкциями производителя и объединяли в пул с равными количествами каждого ампликона. Затем пул очищали с помощью AMPure XP (Agencourt Bioscience Corporation) в соответствии с инструкциями производителя, за исключением того, что объем гранул составлял 0,6 × объем пула. Пул был количественно оценен с помощью набора для количественной оценки библиотеки для Roche 454 GS Titanium (Kapa Biosystems, Inc., Уилмингтон, Массачусетс, США). Была проведена юниорская emPCR (454 Life Sciences, Roche, Branford, CT, USA), и 454 секвенирование было выполнено на GS Junior (454 Life Sciences) в соответствии с инструкциями производителя.
Обработка последовательностей
Последовательности обрабатывались с помощью mothur v.1.28.0 согласно Schloss SOP от 27 ноября 2012 г. [15, 16]. Таким образом, файл sff был введен в sffinfo, был запущен trim.flows, позволивший допустить 1 несоответствие в штрих-коде и 2 несовпадения в области 926R праймера, а ошибка секвенирования была уменьшена с помощью shhh.потоки. С помощью trim.seqs удаляли последовательности штрих-кода и праймеров и отбрасывали все последовательности менее 200 оснований или гомополимеры длиной более восьми нуклеотидов. Последовательности выравнивали по эталонному выравниванию Silva [17, 18]. Чтобы сравнить последовательности в одной и той же области выравнивания, мы установили конечную позицию на 27659 и выбрали начальную позицию, которая соответствует 95% последовательностей. При использовании прекластера последовательности в двух парах оснований были объединены. Химеры отождествлялись с химерами.учимэ [19] и удален. Последовательности были классифицированы с использованием модифицированной формы обучающего набора RDP версии 9 (trainset9_032012.pds.tax и trainset9_032012.pds.fasta) [20]. Были удалены последовательности, классифицированные как хлоропласты, митохондрии, археи, эукариоты или неизвестное царство.
Анализ последовательностей
Для нашего первоначального анализа мы включали субъектов только в том случае, если последовательности были получены для полного набора образцов (слизистая оболочка щеки, язык и носовая полость). Поэтому, чтобы максимизировать количество субъектов, включенных в исследование, мы решили выделить 269 последовательностей из каждой выборки.Таким образом, субъекты были включены в наш первоначальный анализ только в том случае, если было получено не менее 269 последовательностей из всех трех участков (носовая полость, слизистая оболочка щеки и дорсальная сторона языка). Матрица расстояний, созданная с помощью dist.seqs, использовалась с алгоритмом среднего соседа для группировки последовательностей в операционные таксономические единицы (OTU) с помощью команды cluster. OTU, определенные как разница на 3%, были использованы для дальнейшего анализа. Команда make.shared использовалась для создания таблицы (общего файла) количества операций чтения, назначенных каждой OTU в каждой выборке.Общий файл использовался для расчета θ (1 — θ индекса сходства), показателя различия сообществ, который учитывает относительную численность как общих, так и не разделяемых OTU [21]. Анализ основных координат (PCoA) использовался для визуализации матрицы расстояний θ , а анализ молекулярной дисперсии (AMOVA) [22] использовался для проверки статистической значимости различий между бактериальными сообществами разных групп (т. Е. Сообществами носовой полости). по сравнению со слизистой оболочкой щек).
Разнообразие носовой микробиоты и ее взаимодействие с поверхностной микробиотой среди жителей медицинских учреждений
В общей сложности у участников было собрано 88 пробы из носа и 83 пробы с поверхности из трех HCI (NH, NC и SC). После демультиплексирования и проверки контроля качества было получено в общей сложности 2 002 198 считываний последовательностей из образцов поверхности со средним значением 17 303 считывания и средней длиной считывания 237 п.н. на образец поверхности. Всего 2648842 считывания последовательностей было получено из образцов из носа, со средним значением 21 822 считывания и средней длиной считывания 234 п.н. на образец из носа.После присвоения микробной таксономии было получено в среднем 23 589 считываний с картированием операционных таксономических единиц (OTU) и 1433 OTU на образец поверхности, и в среднем 21 086 считываний с картированием OTU и 1203 OTU было получено на образец из носа. OTU на уровне рода как в поверхностных, так и в назальных образцах представлена в дополнительном файле 1.
Микробный состав и разнообразие поверхностной и назальной микробиоты
На рисунке 1a показано распределение микробиоты в поверхностных образцах из трех HCI, а также в носовых образцах их жителей; Состав микробных сообществ в каждой пробе представлен на рис.S1. Как показано на рис. 1а, основными таксонами микробов в поверхностных образцах были Corynebacterium (диапазон численности: 2,88–10,43%), Dysgonomonas (1,20–53,62%), Acinetobacter (1,98–8,95%), Neisseria (1,41–2,28%), Staphylococcus (1,63–9,68%) и неклассифицированные роды в Bacillales (0,21–14,73%). Основными микробами в носовых сообществах были Corynebacterium (21,53–48,60%), Neisseria (1.11–14.80%), Staphylococcus (6,12–9,61%) и Streptococcus (5,18–6,47%). Средняя относительная численность этих основных микробных сообществ показана в Таблице S1.
Рис. 1
Распределение и разнообразие микробиоты в поверхностных и носовых образцах в трех медицинских институтах ( a ) прямоугольная диаграмма относительной доли бактериальных таксонов ( b ) для значения индекса Chao1. Примечание: NH, NC и SC — три медицинских института.Сокращения: Sur: поверхностная микробиота; Носовая: микробиота носа.
Разнообразие Chao1 поверхностной микробиоты было выше, чем носовой микробиоты (рис. 1b). Значительная разница была также обнаружена между NH и SC как в поверхностных, так и в назальных образцах, со значениями p 0,032 и 0,0051 соответственно. Что касается поверхностных микробных сообществ, Dysgonomonas были более многочисленны на NH и NC, чем на SC ( p <0,001; рис. S2). Кроме того, Corynebacterium была больше в SC, чем в NH и NC ( p <0.001) по отношению к микробным сообществам носа.
На рис. 2 показан таксон со средней долей более 1% во всех выборках и их распространенностью. За исключением Brevibacillus и Alloiococcus , этот таксон показал распространенность от 12% до 100% в двух сообществах. Dysgonomonas , Corynebacterium , Staphylococcus , Streptococcus и неклассифицированные роды в Enterobacteriaceae были не только широко распространенными (> 80%), но и относительно многочисленными (> 2%) как в носовых, так и в поверхностных микробных сообществах. .
Рис. 2
Относительно многочисленные таксоны и их преобладание в поверхностных и носовых образцах. Примечание. Отображаются только таксоны со средней численностью> 1%. NH, NC и SC — институты здравоохранения. Сокращения: Sur_Abundance: численность таксонов в поверхностной микробиоте; Sur_Prevalence: преобладание таксонов в поверхностной микробиоте; Назальный _Abundance: изобилие таксонов в носовой микробиоте; Назальный _Распространенность: преобладание таксонов в носовой микробиоте.
Анализ основных компонентов был выполнен с использованием матрицы расстояний Брея-Кертиса (расстояние BC) для определения взаимосвязей между различными бактериальными сообществами в трех HCI.График анализа главных компонентов (PCoA) на рис. 3 показывает различия между поверхностной и носовой микробиотой, но также выявляет заметную разницу между HCI (NH и NC по сравнению с SC). Результат теста анализа сходства (ANOSIM) показывает, что микробиота поверхности в SC образовала кластер, отличный от кластеров из NH (R = 0,89, p <0,001) и NC (R = 0,062, p <0,001). . Что касается носовой микробиоты жителей трех HCI, SC снова значительно отличался от NH (R = 0.39, p <0,001) и NC (R = 0,37, p <0,001). Кроме того, анализ межгрупповых расстояний был изображен на рис. S3 с использованием расстояния BC. Результаты показали более широкий разброс межгрупповых расстояний в поверхностных группах по сравнению с носовыми группами. Сообщества поверхностных бактерий показали меньшее расстояние между NH и NC и немного большее расстояние между NH и SC по сравнению с другими. Сообщества носовых бактерий располагались относительно одинаковыми расстояниями во всех местах.
Рис. 3
Анализ основных компонентов бактериальных сообществ в ( a ) образцах поверхности и носа ( b ) образцах поверхности и ( c ) образцах носа, полученных из трех медицинских институтов. Примечание: NH, NC и SC — три медицинских института. Сокращения: Sur: поверхностная микробиота; Носовая: микробиота носа.
Основная микробиота и связанные с человеком микроорганизмы в поверхностных и носовых образцах
На Рисунке 4 показано количество таксонов, общих для поверхностных и назальных образцов из трех ИСМ с более чем 0.Средняя численность 1%. Подробные пропорции числа считываний для всех пересекающихся таксонов перечислены в дополнительном файле 2. Данные показывают, что 15 таксонов (основная микробиота; включая Corynebacterium , Dysgonomonas , Staphylococcus , Streptococcus , Acinetobacter , не классифицировано). родов на Bacillales , неклассифицированные роды на Enterobacteriaceae , Pseudomonas , Propionibacterium , Lactobacillus , неклассифицированные роды на Xanthomonadaceae , Proteus , неклассифицированные на Neclassothisseri, на ) между поверхностной и носовой микробиотой и что эти таксоны составляют более 67% всех последовательностей.
Рис. 4
Таксоны как в поверхностных, так и в назальных образцах из трех медицинских институтов. Примечание. Для анализа были собраны таксоны с долей> 0,1% в любом из шести наборов на диаграмме Венна. Примечание: NH, NC и SC — три медицинских института. Сокращения: Sur: поверхностная микробиота; Носовая: микробиота носа.
Более подробное исследование керновой микробиоты представлено в таблице 1. Хотя 15 таксонов присутствовали в большинстве образцов, их численность по группам значительно различалась: от 0 до 0.От 11% до 53%. Staphylococcus , Pseudomonas , неклассифицированные роды Neisseriaceae и Rothia , не показали значительных различий в численности между сообществами поверхностных и назальных бактерий. Многочисленные таксоны имели самые высокие доли как в поверхностных, так и в назальных бактериальных сообществах. Например, Dysgonomonas не только имела самую высокую долю в поверхностных бактериальных сообществах из NH (53,62%) по сравнению с ней из NC (35,07%) и SC (1.2%), но также обладал самой высокой долей (3,16%) в сообществах носовых бактерий из NH по сравнению с NC (2,01%) и SC (1,15%). Аналогичным образом, Pseudomonas также показал самую высокую долю поверхностного (1,58%) и назального (1,25%) бактериального сообщества из NH. Кроме того, неклассифицированные роды Neisseriaceae имели самую высокую долю как в поверхностных (0,28%), так и в назальных (1,36%) бактериальных сообществах из Северной Каролины. Corynebacterium (10,43% на поверхности и 48.60% в носу), Lactobacillus (2,23% и 2,13%) и неклассифицированные роды в Bacillales (14,73% и 0,29%) имели самые высокие доли в обоих бактериальных сообществах из SC.
Таблица 1 Пятнадцать основных микробиомов, общих для образцов и носовых бактериальных сообществ из трех медицинских институтов. Примечание: NH, NC и SC — три медицинских института. Сокращения: Sur: поверхностная микробиота; Носовая: микробиота носа.
Среди всех наиболее распространенных типов микробиоты девять таксонов относятся к микроорганизмам, связанным с человеком, включая Staphylococcus , Streptococcus , Neisseria , Acinetobacter , неклассифицированные роды в Enterobacteriaceae , Propionibacterium и Pseudomonas .Сравнивая HCI, можно отметить, что Dysgonomonas , Neisseria и Proteus были более многочисленны как в поверхностных, так и в назальных образцах из NH и NC, тогда как Corynebacterium , неклассифицированные роды, были включены в Bacillales и Lactobacillus. были более многочисленными как в поверхностных, так и в назальных образцах из SC. Это говорит о том, что может существовать корреляция между поверхностной и носовой микробиотой.
Корреляционный анализ между поверхностной и носовой микробиотой
Здесь мы применили байесовский подход, SourceTracker, для оценки доли общей микробиоты между носовым образцом и его соответствующей средой.На рисунке 5 изображена прямоугольная диаграмма доли назальных микробов от каждого образца, отслеживаемого до поверхностей в качестве источника, и доли микробов на поверхности от образцов поверхности, отслеживаемых до носовых. Результаты анализа показывают, что образцы поверхности в NH и NC обладают более высокой долей прочтений, приписываемых из носовых образцов, по сравнению с таковыми в SC. Примечательно, что аналогичные наблюдения также показаны в образцах из носа, что может быть связано с различными условиями вентиляции, т.е. как NH, так и NC имеют центральный кондиционер, но SC — это место с оконной вентиляцией.Таким образом, микробиота носа и микробиота поверхности делились меньше считываний друг с другом в SC, чем в NH и NC. Настоящие результаты предполагают, что между носовыми и поверхностными сообществами бактерий может существовать двунаправленное взаимодействие.
Рис. 5
Коробчатая диаграмма доли назальных микробов из каждого образца, отслеживаемого на поверхности, и доли поверхностных микробов из образцов поверхности, отслеживаемых до носа в разных местах. Примечание: NH, NC и SC — три медицинских института.
Для дальнейшего анализа воздействия поверхностной микробиоты на образцы из носа мы разделили участников на госпитализированную группу, состоящую из людей, которые были госпитализированы в течение 1 года до исследования, и негоспитализированную группу, состоящую из людей, которые не были госпитализированы. в течение 1 года до исследования. Как показано на рис.6, образцы из носа госпитализированной группы содержали значительно более высокую долю микробов, полученных с поверхностей, со средним значением 0.21, чем в негоспитализированной группе, со средним значением 0,03 ( p = 0,0016, определено с использованием критерия суммы рангов Вилкоксона). Это показало, что микробиота носа у госпитализированных пациентов может быть более восприимчивой к микробиоте поверхности, возможно, из-за факторов хозяина, которые приводят к нарушению равновесия микробиоты носа по сравнению с теми, кто не госпитализирован.
Рис. 6
Коробчатая диаграмма доли назальных микробов из каждого образца в госпитализированных и негоспитализированных группах, отслеживаемых на поверхности.
Доли распространенных таксонов в носовых образцах госпитализированных и негоспитализированных групп представлены в Таблице 2 и на Рисунке S4. Анализ показал, что Dysgonomonas ( p <0,005), Neisseria ( p = 0,019) и Pseudomonas ( p = 0,045) были значительно больше в госпитализированной группе, чем в негоспитализированной группе. . Corynebacterium ( p <0,005) и Moraxella ( p <0.005) были более многочисленными в негоспитализированной группе. Кроме того, Streptococcus , Staphylococcus , Acinetobacter и неклассифицированные роды Enterobacteriaceae были более многочисленными в госпитализированной группе, хотя разница, определенная с помощью критерия суммы рангов Вилкоксона, была незначительной. Эти данные предполагают, что поверхностная микробиота может коррелировать не только с носовой микробиотой, но и со статусом здоровья.
Таблица 2 Пропорции и сравнение обильных таксонов носовых образцов в госпитализированных и негоспитализированных группах.
Как полезные бактерии в вашем носу борются с инфекциями — Основы здоровья от клиники Кливленда
«Хорошим бактериям» в нашем желудочно-кишечном тракте в последнее время уделяется много внимания, но кишечник — не единственное место, где содержатся полезные бактерии. Наши носы, пазухи и носовые ходы содержат аналогичные колонии полезных бактерий.
Клиника Кливленда — некоммерческий академический медицинский центр. Реклама на нашем сайте помогает поддерживать нашу миссию. Мы не поддерживаем продукты или услуги, не принадлежащие Cleveland Clinic.Политика
Бактерии в этих областях начинают перемещаться в центр внимания, поскольку проводится больше исследований положительного воздействия, которое эти бактерии могут оказывать на предотвращение колонизации вредных бактерий, и отрицательного воздействия, которое возникает, когда мы уничтожаем хорошие бактерии.
«Предполагается, что в нашем носу и горле обитает множество бактерий, которые должны там находиться», — говорит Майкл Беннингер, доктор медицины, специалист по голове и шее. «Но в первую очередь из-за чрезмерного использования антибиотиков, мы изменили колонии в нашем носу на более вредные бактерии.”
Среди них бактерии, вызывающие некоторые из распространенных стафилококков, стрептококковой пневмонии, H-гриппа, синусита и стрептококковых инфекций горла, которые регулярно поражают людей, добавляет он.
Как убедиться, что в вашем теле есть хорошие бактерии
Сохранение полезных бактерий начинается с более консервативного использования антибиотиков. Это означает, что врачи с меньшей вероятностью будут прописывать антибиотики для лечения инфекций, которые не всегда оправдывают их использование.
«Принципы терапии носовых пазух, особенно с учетом того, что многие люди лечились от вирусов, когда антибиотики в любом случае бесполезны, заключаются в том, чтобы избегать использования антибиотиков, если не совсем ясно, что это бактериальная инфекция», — объясняет доктор.Беннингер. «Это позволит нашим нормальным бактериям повторно заселить наш нос, носоглотку и горло, чтобы они могли бороться с инфекциями естественным путем».
Как предотвратить инфекции носа
На данный момент лучшие шаги, которые вы можете предпринять, связаны с профилактикой инфекций, в том числе следующие:
- Проконсультируйтесь с врачом, чтобы определить, есть ли у вас бактериальная инфекция. «Мы не должны лечить инфекции антибиотиками раньше, чем через 10–14 дней после начала», — говорит доктор.Беннингер говорит. «Если это вирусный вирус, он будет самоограничен и продолжит свое действие, поэтому, если вы лечите его антибиотиком, это просто увеличивает вероятность колонизации плохих бактерий, убивая хорошие бактерии с помощью антибиотиков».
- Самостоятельно вымойте все плохое. Используйте солевые ирригационные продукты, такие как нети-пот, чтобы избавиться от вредных бактерий и грибков в носу, которые могут вызвать воспаление.
- Используйте безрецептурные препараты, чтобы облегчить симптомы.При появлении симптомов такие продукты, как Назакорт®, стероид для интраназального введения, которые в основном отпускаются без рецепта, такие как триамцинолона ацетонид, флутиказона пропионат или будесонид, помогут уменьшить воспаление и выработку слизи, а также могут сократить продолжительность лечения. вирусная инфекция. Назальные деконгестанты, такие как оксиметазолин (Afrin®), могут помочь вам лучше дышать.
- Держите руки в чистоте. Вымойте руки или воспользуйтесь моющим средством для рук. Держите руки подальше от глаз, носа и рта.
- Примите долгосрочные профилактические меры, чтобы избежать заражения этими инфекциями. Выполняйте аэробные упражнения, много отдыхайте и получайте должное увлажнение. Люди, которые регулярно занимаются аэробикой, укрепляют свою иммунную систему. Это на треть снижает вероятность заболевания простудой, вирусным или бактериальным синуситом.
Будущее здоровье наших носов
Подобно кишечной флоре, хорошая носовая флора в конечном итоге будет содержать пробиотики, которые помогут их питать и культивировать.Некоторые из этих продуктов уже используются в Европе. Однако они еще не были одобрены в Соединенных Штатах из-за более строгих правил FDA.
«Сейчас мы находимся в профилактическом режиме», — говорит д-р Беннингер. «Но в будущем мы, вероятно, будем использовать пробиотики в носу и пазухах, подобно тому, как мы делаем это в желудочно-кишечном тракте».
границ | Сравнение здорового носа и микробиоты носоглотки показывает преемственность, а также специфичность ниши
Введение
Инфекции дыхательных путей, включая острый и хронический средний отит у детей и хронический риносинусит у взрослых, являются наиболее часто лечимыми проблемами здоровья в первичной медико-санитарной помощи (Francis et al., 2009). Дыхательные пути можно разделить на нижние и верхние дыхательные пути (ВДП), где последние включают передние ноздри, носовые ходы, придаточные пазухи носа, носоглотку и ротоглотку и, наконец, гортань над голосовыми связками (см. Man et al., 2017). В Европе на инфекции URT приходится 57% всех назначаемых антибиотиков, что существенно влияет на возникающую проблему устойчивости к антибиотикам (van der Velden et al., 2013). Без доказательств четкой причинной роли конкретных видов бактерий, отбор проб на основе посевов связывает различные условно-патогенные микроорганизмы с хроническим риносинуситом и средним отитом.Однако эти виды бактерий, по-видимому, также присутствуют у здоровых людей (Lemon, 2010; Stearns et al., 2015). Для лучшего понимания вклада микробиоты в заболевания ВДП и разработки целевых (анти) микробных подходов необходимо лучшее понимание состава и разнообразия «здоровой микробиоты ВДП».
Благодаря значительным достижениям в методах секвенирования и крупномасштабным проектам секвенирования, таким как NIH Human Microbiome Project, наше понимание состава и функциональных свойств микробиоты человека значительно улучшилось (Turnbaugh et al., 2007). В то время как многие исследования ранее были сосредоточены на микробиоте желудочно-кишечного тракта, в последние годы явно возрос интерес к резидентным микробным сообществам других ниш человеческого тела, таких как дыхательные пути.
Нос и носоглотка — ключевые ниши ВДП. Обе ниши являются хозяевами комменсалов и потенциальных патогенных видов, которые при определенных условиях могут вызывать инфекции дыхательных путей (обзор Man et al., 2017). В то время как сообщество носовых микробов составляется в рамках крупных инициатив, таких как проект NIH Human Microbiome Project (Turnbaugh et al., 2007) и других более поздних исследований (Bassis et al., 2014; Camarinha-Silva et al., 2014; Biswas et al., 2015) носоглотка менее изучена. Некоторые более крупные исследования (включающие от 50 до 234 участников) профилировали микробиоту носоглотки у детей с помощью секвенирования следующего поколения (NGS) (Bogaert et al., 2011; Biesbroek et al., 2014; Stearns et al., 2015; Teo et al., al., 2015; Bosch et al., 2017; Chonmaitree et al., 2017), но лишь в нескольких исследованиях изучалась микробиота носоглотки здорового взрослого человека (Ling et al., 2013; Cremers et al., 2014; Stearns et al., 2015). Эти исследования у взрослых были небольшими (включая менее 40 участников), с разными возрастными группами и популяциями из разных географических регионов. Кроме того, за исключением исследования Stearns et al. (2015) в этих исследованиях использовалось пиросеквенирование гена 16S рРНК , которое имеет некоторые ограничения по сравнению с более глубоким секвенированием Illumina MiSeq. Основными ограничениями являются ошибки секвенирования в гомополимерных областях и меньшая глубина секвенирования.Кроме того, во всех этих исследованиях использовался подход кластеризации, при котором последовательности были сгруппированы в операционные таксономические единицы (OTU). Хотя этот подход используется чаще всего, в настоящее время он недостаточно использует возможности высококачественных последовательностей, созданных с помощью современных технологий секвенирования, таких как Illumina MiSeq (обзор в Hugerth and Andersson, 2017). Следовательно, альтернативные алгоритмы, которые обнаруживают более мелкомасштабные вариации, такие как MED (Eren et al., 2014, 2016) и Divisive Amplicon Denoising Algorithm 2 (DADA2) (Callahan et al., 2016), что привело к повышению точности измерений разнообразия и несходства. Поскольку нос и носоглотка представляют собой микробные ниши с низкой сложностью (с точки зрения наблюдаемого богатства или общего количества присутствующих родов бактерий) и с низкой биомассой (с точки зрения общего количества бактериальных клеток) (Biesbroek et al., 2012), необходимо точное различение этих биологических вариантов. Недавно разработанный алгоритм DADA2 в сочетании с секвенированием Illumina MiSeq может улучшить чувствительность, специфичность и воспроизводимость по сравнению с методами выбора OTU.Этот алгоритм выявляет уникальные биологические варианты, называемые «вариантами последовательности ампликона» или ASV (Callahan et al., 2017), путем исправления ошибок секвенирования при считывании. Концепция ASV является альтернативой классической концепции OTU: стратегии на основе OTU выполняют кластеризацию на основе фиксированного процентного порога идентичности (например, 97%), тогда как ASV являются результатом только процедуры шумоподавления. Стратегия шумоподавления DADA2 основана на показателях качества всех считываний, а также на распределении количества уникальных последовательностей.
При реализации этого конвейера DADA2 мы исследовали здесь разнообразие и основные бактериальные элементы носа и носоглотки 100 здоровых участников, чтобы получить больше информации о комменсальных и потенциальных патогенных бактериях, колонизирующих эти ниши URT. Полученные бактериальные профили были сопоставлены с данными, доступными от наших здоровых добровольцев, такими как возраст, пол, группа крови, курение, время года и анализы крови на общий иммуноглобулин E (IgE) и уровни IgE против распространенных респираторных аллергий.
Материалы и методы
Дизайн исследования и сбор выборки
Участники в возрасте от 18 до 65 лет без острых или хронических заболеваний URT были набраны в период с июля 2015 года по октябрь 2016 года через Университет Антверпена и бельгийско-голландскую гражданско-научную платформу после одобрения исследования Этическим комитетом Антверпенского университета. Больница / Университет Антверпена (регистрационный номер B300201524257, зарегистрирован 23 марта 2015 г., идентификатор ClinicalTrials.gov: NCT02933983).От всех участников было получено письменное информированное согласие, а также образец крови и анкета с общей информацией об их истории болезни и дополнительной информацией, такой как курение. Участники, которые получали антибиотики (по самооценке) в прошлом году или страдали острыми или хроническими инфекциями дыхательных путей, были исключены из исследования. В общей сложности 90 образцов из носа и 100 образцов носоглотки были собраны стандартным способом ответственным специалистом по уху, носу и горлу (ЛОР) с помощью флокированных мазков (Copan, 503CS01) на уровне передней полости носа и носоглотки.Все образцы немедленно суспендировали в 750 мкл раствора шариков MoBio (PowerFecal ® DNA Isolation Kit; MO BIO Laboratories Inc., Карлсбад, Калифорния, США) и помещали на лед перед экстракцией ДНК. Выделение ДНК происходило в течение 4 ч после отбора пробы. Образцы ДНК хранили при -20 ° C до дальнейшего использования.
Анализ крови на общий и специфический IgE
Образцы сыворотки были собраны у всех участников, чтобы исследовать общий уровень IgE в их крови, а также некоторые специфические IgE для респираторной аллергии (пыльца деревьев, пыльца травы и клещ домашней пыли).Образцы крови были взяты в университетской больнице Антверпена ответственной медсестрой. Общий и специфический IgE количественно определяли с помощью системы ImmunoCAP (Thermo Fisher Scientific, Упсала, Швеция). Все анализы были выполнены, а результаты интерпретированы в соответствии с рекомендациями производителей. Общее количество IgE ниже 114 кЕд / л считалось неаллергическим. Для специфического количества IgE значения ниже 0,35 кЕд / л считались неаллергическими.
Экстракция ДНК
Набор для выделения ДНК PowerFecal ® (с технологией удаления ингибиторов ® ) использовался в соответствии с инструкциями производителя.Концентрации ДНК измеряли с помощью флуориметра Qubit ® 3.0 (Life Technologies, Ledeberg, Бельгия). Экстракция ДНК проводилась в лабораторном помещении, предназначенном для выделения ДНК / РНК, физически отделенном от кабинета микробиологии, чтобы минимизировать загрязнение.
Illumina MiSeq
16S рРНК Секвенирование ампликона генов
Праймеры, используемые для секвенирования Illumina MiSeq, были основаны на ранее описанных праймерах 515F-806R (Caporaso et al., 2010) и изменены для двухиндексного секвенирования парных концов, как описано ранее (Kozich et al., 2013). Вкратце, каждый образец ДНК подвергали двойной ПЦР со штрих-кодом, амплифицируя область V4 гена 16S рРНК с использованием ДНК-полимеразы Phusion High-Fidelity (New England Biolabs, США). Продукты ПЦР очищали с помощью набора для улавливания магнитных шариков Agencourt AMPure XP (Beckman Coulter, Suarlee, Бельгия) и количественно оценивали с помощью флуорометра Qubit ® 3.0. Библиотеку готовили путем объединения всех образцов ПЦР в эквимолярной концентрации и наносили на 0,8% агарозный гель для удаления оставшихся димеров праймеров из продукта.Продукт очищали экстракцией из геля с использованием геля NucleoSpin ® и ПЦР-очистки (Macherey-Nagel). Конечная концентрация библиотеки определялась с помощью флуориметра Qubit ® 3.0. Библиотеку денатурировали 0,2 н. NaOH (Illumina), разбавляли до 7 пМ и добавляли 10% контрольную ДНК PhiX (Illumina). Библиотеку загружали в проточную кювету набора реагентов MiSeq v2 Chemistry (парное секвенирование с двойным индексированием; набор 2 × 250 п.н .; Illumina, Сан-Диего, Калифорния, США) на настольном секвенсоре MiSeq (M00984, Illumina) по адресу: Центр медицинской генетики, Университет Антверпена, Бельгия.Данные секвенирования были депонированы в ENA под номером доступа PRJEB23057.
Обработка последовательности и контроль качества
Обработка и контроль качества чтения проводились с использованием пакета R dada2, версия 1.4.0 (Callahan et al., 2016). После проверки профилей контроля качества первые 35 баз всех обратных считываний были обрезаны, поскольку они часто содержали неназванные базы. Затем были удалены все чтения, содержащие оставшиеся невызванные базы или более трех ожидаемых ошибок.После этого параметры модели ошибок DADA2 были изучены из случайного подмножества из 1 миллиона чтений. Затем эту модель ошибок использовали для удаления шума из всех последовательностей; то есть, чтобы вывести ASV. Затем были объединены обезличенные чтения (ASV), и пары чтения с одной или несколькими конфликтующими базами между прямым и обратным чтением были удалены. Затем химерные последовательности были обнаружены и удалены с помощью функции «removeBimeraDenovo». Наконец, чтения (ASV) были классифицированы от уровня царства к уровню рода с использованием базы данных гена Silva reference 16S рРНК , версия 123, в результате чего была построена таблица ASV с подсчетом считываний всех ASV во всех выборках.
На следующем этапе был проведен контроль качества на уровне ASV и образцов. Были удалены ASV длиной более 251 основания, а также ASV, классифицированные как археи, хлоропласты или митохондрии. Отрицательные контроли ПЦР и экстракции ДНК были проверены, и ASV, классифицированные как известные контаминанты и / или которые были чрезмерно представлены в отрицательных холостых контролях (по сравнению с образцами), были удалены. Наконец, образцы подвергались контролю качества на основе общего количества считываний и количества считываний на объединенный объем образца.Требовалось, чтобы образцы содержали по крайней мере в пять раз больше считываний на объем, чем отрицательные контроли, а также более 1000 считываний в целом.
Биостатистический анализ
Обработка таблицы ASV, аннотаций ASV (например, классификация) и примеров аннотаций (метаданных) была выполнена с использованием внутреннего пакета R «tidyamplicons», общедоступного по адресу github.com/SWittouck/tidyamplicons. Для анализа на уровне рода подсчеты считывания ASV были агрегированы на уровне рода или, если недоступно, на самом конкретном уровне, на котором была доступна таксономическая аннотация.Альфа-разнообразие исследовали на уровне родов с использованием двух разных показателей: количества наблюдаемых родов и обратной метрики Симпсона (определяемой как обратная вероятность того, что два случайных прочтения принадлежат одному таксону). Различия в этих двух показателях между образцами носа и носоглотки были проверены с использованием критерия суммы рангов Вилкоксона. Корреляция показателей альфа-разнообразия между носом и носоглоткой оценивалась с использованием корреляции Пирсона и соответствующего теста значимости, реализованного в корреляции.тестовая функция в R. Для анализа бета-разнообразия использовалось расстояние Брея – Кертиса, определяемое как суммарные различия в количестве считываний для всех таксонов, деленные на общее количество считываний в обеих выборках. Матрица бета-разнообразия Брея – Кертиса была исследована визуально с использованием анализа главных координат (PCoA). Чтобы проверить бактериальные профили на кластеризацию структуры, мы использовали показатель силы прогноза (Tibshirani and Walther, 2005). Во-первых, все образцы (как из носа, так и из носоглотки) были сгруппированы в семь кластеров с использованием иерархической кластеризации с использованием метода невзвешенных парных групп со средним арифметическим (UPGMA) на матрице расстояний Брея – Кертиса.Кластеры, содержащие только одну или две выборки, считались выбросами и удалялись, поскольку их нельзя оценить с помощью силы прогноза. Затем были рассчитаны четыре матрицы расстояний: Брэя – Кертиса (по относительной численности, как обычно), Брея – Кертиса на уровне присутствия / отсутствия, расходимость Дженсена – Шеннона и расстояние Дженсена – Шеннона (равное квадратному корню из Дженсена – Шеннона). Расхождение Шеннона). Затем для этих матриц были выполнены два метода кластеризации: UPGMA и разделение на медоиды (PAM).Каждая комбинация метрики расстояния и алгоритма кластеризации выполнялась для разного количества кластеров (от 2 до 10). Этот подход к оценке кластеризации во многом следует Корену и др. (2013), за исключением того, что мы добавили метод кластеризации UPGMA и метрику расстояния Брея – Кертиса присутствия / отсутствия.
Связь микробиоты носоглотки с метаданными участников была проведена для всех переменных метаданных, у которых было более шести участников как минимум в двух категориях. Этими переменными были пол, возраст, группа крови, курение, время отбора проб, общий уровень IgE и специфические уровни IgE для клещей домашней пыли, пыльцы трав и пыльцы деревьев.Для каждой из этих переменных связь с микробиотой была проверена с помощью теста перманова, реализованного в функции «adonis» пакета R «vegan». В частности, функция адониса проверяет, меньше ли расстояния Брея – Кертиса внутри групп выборок, чем расстояния между группами; значимость оценивается с использованием стратегии перестановки. Связь между переменной «курение» и родами Corynebacterium , Dolosigranulum и Staphylococcus была проверена с помощью критерия суммы рангов Вилкоксона.
Для анализа на уровне ASV были взяты только образцы участников, у которых были образцы носа и носоглотки, прошедшие контроль качества. Чтобы проверить, коррелировало ли присутствие ASV между обеими нишами, для каждой ASV использовалась следующая стратегия. Сначала была построена двусторонняя таблица частот, где каждая ячейка содержала количество участников, а переменными были «наличие ASV в носу» и «присутствие ASV в носоглотке». Затем связь между двумя переменными была проверена с помощью точного критерия Фишера (реализованного в базовой функции R fisher.контрольная работа). Затем все ASV были визуализированы на диаграмме рассеяния с ожидаемой долей совпадения по оси x в предположении отсутствия корреляции, а по оси y с наблюдаемой долей совпадения. Ожидаемую долю одновременной встречаемости рассчитывали путем умножения доли встречаемости в носоглотке на долю встречаемости в носу. Чтобы проверить предпочтение ASV одной из ниш другой, был использован аналогичный подход. Сначала была построена двусторонняя таблица частот, в которой каждая ячейка содержала количество образцов, а переменными были «тип образца (нос или носоглотка)» и «присутствие / отсутствие».Затем оценивали предпочтение носа или носоглотки, проверяя связь между этими двумя переменными с помощью точного критерия Фишера. Наконец, ASV были визуализированы на диаграмме рассеяния с пропорцией встречаемости в носу по оси x и пропорцией встречаемости в носоглотке по оси y .
Контроль качества, биостатистический анализ и визуализация выполнялись в R версии 3.4.1. Все визуализации были созданы с использованием ggplot2 версии 2.2.1 (Wickham, 2009). Для анализа альфа- и бета-разнообразия использовалась веганская версия 2.4.3 (Oksanen et al., 2016).
Результаты
В носоглотке взрослого человека преобладают по крайней мере четыре типа бактериальных сообществ на уровне рода
Было собрано
образцов из «здорового» носа и носоглотки участников без признаков инфекции URT, набранных в сотрудничестве с бельгийско-голландской платформой гражданской науки. Всего было собрано 90 образцов из носа и 100 образцов из носоглотки, из которых, соответственно, 84 и 92 остались после контроля качества.В дополнительной таблице S1 представлены различные этапы контроля качества с оставшимся количеством считываний после каждого этапа.
Меры альфа- и бета-разнообразия мазков из носа и носоглотки были рассчитаны для оценки бактериального гена 16S рРНК в этих нишах URT взрослых. На рис. 1А представлено общее наблюдаемое богатство и обратный индекс Симпсона у каждого участника как для носа, так и для носоглотки. Обе ниши содержат довольно небольшое количество наблюдаемых родов (в среднем 31 в носу и 25 в носоглотке) со значительно более высоким наблюдаемым богатством в носу, чем в носоглотке ( p = 0.002). Кроме того, низкий обратный индекс Симпсона (в среднем 4,1 для носа и 4,3 для носоглотки) предполагает неравномерное распределение численности этого ограниченного количества родов, указывая на то, что и нос взрослого человека, и носоглотка взрослого являются нишами с низким разнообразием, где доминирует лишь ограниченное число родов бактерий. Наконец, корреляция альфа-различий между носом и носоглоткой была рассчитана и составила 0,19 и 0,21 для наблюдаемого богатства и обратного Симпсона, соответственно, что означает, что количество родов в носу малоинформативно для количества родов в носоглотке. и наоборот.
РИСУНОК 1. Показатели альфа- и бета-разнообразия для образцов из носа ( n = 84) и носоглотки ( n = 92) здоровых взрослых людей без острых или хронических инфекций дыхательных путей. (A) Обратный индекс Симпсона и наблюдаемое богатство образцов носа и носоглотки на уровне рода. (B) PCoA для сравнения бактериальной таксономии между образцами из одного и того же местоположения и индивидуальной вариабельностью между местоположениями. (C) Иерархическая кластеризация на уровне родов образцов носа (вверху) и носоглотки (внизу).Большинство образцов носа имеют смешанный профиль, ключевыми членами которого являются Staphylococcus , Corynebacterium и / или Dolosigranulum . В подмножестве образцов носа преобладает Moraxella . Образцы носоглотки показывают семь типов бактериальных сообществ в носоглотке в зависимости от доминирующих родов: Moraxella- , Haemophilus- , Neisseria- , Alloprevotella- , Streptococcus- или Fusobacterium- более разнообразный и смешанный тип с Staphylococcus , Corynebacterium и / или Dolosigranulum в качестве важных членов.Цветные точки указывают кластерное распределение образцов.
Затем мы исследовали микробный состав всех образцов и изучили различия между этими основными нишами ВДП, а также межличностные различия. PCoA был впервые использован для визуализации этой вариации (рис. 1B). Образцы носа и носоглотки оказались в основном смешанными, за исключением одной группы образцов, состоящей исключительно из образцов носоглотки. Затем мы визуализировали роды с наибольшей общей численностью в носу и носоглотке и выполнили иерархическую кластеризацию (рис. 1C).Основываясь на этой кластеризации, мы наблюдали семь потенциальных «типов сообществ» в носоглотке с различным таксономическим составом. Дендрограмму иерархической кластеризации можно найти на дополнительном рисунке S1. Почти половина участников продемонстрировала явное доминирование одного из следующих родов: Moraxella (19,6%), Streptococcus (13%), Fusobacterium (8,7%), Neisseria (2,2%), Alloprevotella. (1,1%) или Haemophilus (2.2%). Другие образцы носоглотки (53,3%) содержали смешанный бактериальный профиль, где Staphylococcus , Corynebacterium и Dolosigranulum , по-видимому, были важными бактериями с различной относительной численностью. В носу различия между особями на уровне рода были меньше. В носу можно было наблюдать только два типа сообществ, при этом большинство образцов (91%) показывали смешанный разнообразный профиль, а меньшее количество образцов (9%) — профиль с преобладанием Moraxella .Чтобы оценить значимость наблюдаемых кластеров, сила предсказания была рассчитана для различного количества кластеров с использованием Брея – Кертиса, а также трех альтернативных показателей расстояния (дополнительный рисунок S2, слева). Для максимум четырех кластеров (например, Streptococcus , Fusobacterium , Moraxella и смешанный тип), полученных с использованием иерархической кластеризации, на основе этого прогноза наблюдалась поддержка от сильной до умеренной. На дополнительном рисунке S3 показан график PCoA с указанием этих четырех кластеров.Значимость трех меньших кластеров ( Neisseria , Haemophilus и Alloprevotella ) должна быть дополнительно подтверждена в более крупных исследовательских группах. Для кластеров, полученных с помощью PAM, не было обнаружено практически никакой поддержки (дополнительный рисунок S2, справа). Поэтому мы считаем, что наблюдаемые типы сообществ следует рассматривать не как отдельные кластеры, а скорее как континуум, участники которого могут принадлежать к определенному типу или находиться между несколькими типами.
«Типы сообщества» носоглоточных бактерий показывают связь с поведением курения, но не с полом, возрастом, группой крови, временем отбора проб и распространенными респираторными аллергиями
Мы записали несколько переменных для каждого участвующего добровольца: возраст, пол, группа крови, курение и сезон (дата отбора проб), чтобы исследовать возможные связи с микробными профилями носоглотки (дополнительная таблица S2).Каждую из переменных визуализировали на графике PCoA для поиска потенциальных ассоциаций с бактериальным составом образцов с использованием пермановой кислоты для статистического анализа (рис. 2). Мы разделили нашу исследуемую популяцию (средний возраст = 34,78, SD, = 11,2, диапазон = 18–65) на две возрастные категории: 18–45 лет (84% исследуемой популяции) и 45–65 лет (16%), но не смогли продемонстрировать связь с этими возрастными классами и бактериальными профилями в нашей — довольно молодой — исследуемой популяции. Также не было обнаружено, что пол (34 мужчины и 58 женщин), группа крови и сезон не связаны с микробиотой носоглотки.Курение, однако, показало связь с бактериальным профилем носоглотки ( p = 0,002). Участники, которые курили или курили раньше (17% исследуемой популяции), казалось, почти все имели смешанный бактериальный профиль с высоким относительным содержанием Staphylococcus , Corynebacterium и Dolosigranulum , за исключением одного участника в исследовании Haemophilus — доминирующая группа. Поскольку курение показало положительную связь со смешанным носоглоточным «типом сообщества», мы исследовали эту связь на уровне рода.Мы обнаружили положительную связь курения с Corynebacterium (критерий суммы рангов Вилкоксона, p = 0,002) и Staphylococcus ( p = 0,02), тогда как Dolosigranulum не выявил связи (дополнительный рисунок S4).
РИСУНОК 2. Графики анализа основных координат (PCoA) для визуализации потенциальных корреляций с несколькими переменными, связанными с хостом и средой. Возраст, пол, группа крови, курение, сезон отбора проб, общий IgE и специфические IgE для пыльцы деревьев, пыльцы трав и клещей домашней пыли были исследованы в отношении бактериальных профилей в носоглотке. P -значения — основанные на пермановой шкале — показаны для всех тестируемых ковариат и окрашены в красный цвет, когда они статистически различаются (здесь только для курильщиков) ( p = 0,002).
В дополнение к этим более описательным переменным, образец крови каждого участника был проанализирован на общий IgE крови и некоторые IgE, специфичные для респираторных аллергенов, таких как клещ домашней пыли, пыльца травы и пыльца деревьев (дополнительная таблица S1). Субъекты с общим количеством IgE и специфическим IgE выше 114 kU / л и 0.35 kUA / л, соответственно, были расценены как «аллергические». В нашем исследовании 15% участников считались аллергиками на основе общего IgE, а 25, 25 и 14% имели аллергию на клещей домашней пыли, пыльцу трав и пыльцу деревьев, соответственно. Для всех участников не было обнаружено четкой связи с протестированными респираторными аллергиями и профилями численности их носоглоточной микробиоты.
Внутриродовая информация о совместной встречаемости ASV в носу и носоглотке
Чтобы иметь возможность различать разные варианты в пределах одного рода, мы применили конвейер DADA2 и обнаружили для многих из многочисленных родов несколько ASV как в носу, так и в носоглотке.Затем ASV были сопоставлены с базой данных SILVA (версия 123), чтобы получить обзор всех видов с последовательностями V4, идентичными ASV. Это дает общее представление о классификации ASV на уровне подродов. Чтобы иметь возможность визуализировать больше ASV, мы разделили грамположительные (рис. 3A) и грамотрицательные (рис. 3B) ASV. Для Corynebacterium наиболее распространенные ASV, обнаруженные в носу, можно отнести к Corynebacterium accolens / macginleyi (Corynebacterium1) и Corynebacterium propinquum / pseudodiphtheriticum (Corynebacterium2).Интересно, что эти варианты также присутствовали в носоглотке, хотя и реже (рис. 3А). Для Moraxella было обнаружено три распространенных варианта как в носу, так и в носоглотке: Moraxella porci (Moraxella1), Moraxella catarrhalis / nonliquefaciens (Moraxella2) и Moraxella bovoculi / lacunata / lacunata / Equiella 0). Вариант Moraxella2, M. catarrhalis / nonliquefaciens , был наиболее распространен в разных образцах и почти никогда не встречался вместе с другими вариантами Moraxella в том же образце.Интересно, что у двух человек, у которых в носоглотке был третий вариант Moraxella , также был этот вариант в носу. Кроме того, в носоглотке можно выделить Streptococcus ASV, из которых Streptococcus1 был дополнительно классифицирован как Streptococcus pneumoniae / pseudopneumoniae , а Streptococcus3 — как Streptococcus dentisani / tigurinus / oralis / babyoferimmentans30. Интересно, что последний вариант присутствовал в количестве 1–15% в большей части наших образцов носоглотки здоровых взрослых, в то время как ASV классифицировался как S.pneumoniae / pseudopneumoniae , который описывается в литературе как распространенный возбудитель ВДП, преобладал в образцах, если он присутствовал. Было обнаружено, что Streptococcus2 ASV одновременно встречается со Streptococcus1, и, кроме того, их последовательности отличались только одним нуклеотидом. Следовательно, вполне вероятно, что они происходят из двух разных копий гена 16S рРНК одного и того же штамма. В носоглотке был обнаружен только один массовый Haemophilus ASV ( Haemophilus haemolyticus / influenzae ).Для Dolosigranulum также был идентифицирован только один распространенный ASV, который мы могли классифицировать как как D. pigrum , и этот ASV, по-видимому, был более распространен в носу, чем в носоглотке. Наконец, в образцах носоглотки наблюдались три различных варианта Fusobacterium (Fusobacterium1; Fusobacterium nucleatum / canifenilum , Fusobacterium2; F. nucleatum и Fusobacterium3; F. nucleatum / naviforme ). В дополнение к наиболее многочисленным ASV, рассмотренным выше (рис. 3A, B), были обнаружены другие ASV, показавшие более низкую численность в пределах родов «типов сообщества», из которых некоторые присутствовали только в носоглотке, такие как Haemophilus1 и 3, Fusobacterium2 и Streptococcus1,4 и 6 (рис. 3C).Дополнительные рисунки S5a – h дают более подробное сравнение парных образцов носа и носоглотки на уровне ASV для каждого из доминантных родов типов бактериального сообщества, показывая уникальную нишевую специфичность некоторых ASV, в то время как другие ASV менее связаны с нишами и показать преемственность между обеими нишами. Совместная встречаемость и специфичность ниши для других ASV также была визуализирована и статистически проверена с использованием точного критерия Фишера (дополнительные рисунки S6, S7). Например, Streptococcus1 и Fusobacterium2 появлялись только в исследованных образцах носоглотки, тогда как Corynebacterium2 и Moraxella2 встречались в обеих нишах.Следует отметить, что ASV, представленные здесь, определены на основе количества вариаций, присутствующих в области V4 гена 16S рРНК . Это означает, что отсутствие обнаружения различных ASV в пределах рода не означает, что они не присутствуют. Поэтому, например, различие между различными видами Staphylococcus , такими как потенциальный патогенный S. aureus и более комменсальный S. epidermidis , здесь было невозможно.
РИСУНОК 3. Сравнение вариантов последовательности ампликона (ASV) в носу и носоглотке. (A) ASV грамположительных образцов в парных образцах носа (вверху) и носоглотки (внизу). Белые полоски обозначают образцы, которые были исключены во время обработки. (B) ASV грамотрицательных клеток в парных образцах носа (вверху) и носоглотки (внизу). Белые полоски обозначают образцы, которые не были учтены во время обработки. (C) Объединенный график носа и носоглотки для различных ASV, принадлежащих к доминантным родам наблюдаемых типов сообществ в этом исследовании.Были визуализированы только ASV, встречающиеся как минимум в трех образцах.
Обсуждение
Инфекции верхних дыхательных путей оказывают серьезное влияние на здоровье населения. Понимание бактериальных сообществ, колонизирующих различные ниши URT, может помочь лучше понять роль бактерий в URT для здоровья и болезней. Здесь была выделена и секвенирована микробная ДНК из парных образцов носа и носоглотки 100 здоровых взрослых участников, набранных в рамках проекта гражданской науки.После тщательного контроля качества этих образцов 84 образца носа и 92 образца носоглотки оставались для дальнейшего анализа микробного разнообразия и доминирующих таксонов, присутствующих в этих нишах.
В отличие от предыдущих исследований с использованием пиросеквенирования гена 16S рРНК для изучения бактериальных сообществ, присутствующих в носу и носоглотке (Ling et al., 2013; Biesbroek et al., 2014; Cremers et al., 2014), мы применили секвенирование Illumina MiSeq технология — в сочетании с анализом до уникального уровня ASV (Callahan et al., 2016), чтобы охватить все бактериальное разнообразие в нишах носа и носоглотки с относительно низкой биомассой. Среднее наблюдаемое богатство было значительно выше в носу (31 род) по сравнению с носоглоткой (25 родов). Хотя мы не использовали классическую кластеризацию OTU, наши наблюдения согласуются с предыдущими работами, показывая низкое наблюдаемое богатство носоглотки (Cremers et al., 2014; Stearns et al., 2015). Тот факт, что только ограниченное число родов бактерий способно колонизировать нос и носоглотку — как показывает низкий обратный индекс Симпсона — указывает на то, что эти ниши имеют определенные проблемы, к которым необходимо приспособить колонизирующие бактерии.Поскольку в нос постоянно поступают частицы воздуха и пыли (открытая экосистема), неудивительно, что он заселен более разнообразным кругом бактерий по сравнению с носоглоткой. Наряду с некоторыми доминирующими видами бактерий, нос также колонизирован рядом малочисленных таксонов, которые могут происходить из воздуха, кожи или других внешних источников, как было предложено в исследованиях по отслеживанию источников, таких как проведенные Lax et al. . (2014). С другой стороны, носоглотку можно рассматривать как полость или микробный биореактор, который более изолирован от внешней среды и для которого хозяин формирует более избирательную среду.Эти уникальные особенности в обеих экосистемах, возможно, приводят к специфическим нишевым факторам, участвующим в колонизации (обзор Man et al., 2017). По нашим данным, на уровне ASV мы могли наблюдать, что некоторые ASV Haemophilus , Fusobacterium и Streptococcus в основном присутствуют в носоглотке. Это может быть вызвано тем, что эти таксоны лучше приспособлены к условиям носоглотки, таким как многослойный плоский эпителий, более высокая температура и более низкий pH (см. Обзор Man et al., 2017) (дополнительный рисунок S7). Мы также заметили, что определенные ASV всегда одновременно возникают как в носу, так и в носоглотке (например, несколько ASV Moraxella и Corynebacterium ) (дополнительный рисунок S6). Таким образом, мы обнаружили, что экологические процессы, такие как расселение (например, перемещение организмов по пространству) и отбор, оказывают важное влияние на бактериальные сообщества, проживающие в URT, что также хорошо описано в de Steenhuijsen Piters et al. (2015).
Кроме того, мы также стремились изучить доминирование бактериальных таксонов и возможное возникновение типов сообществ, аналогично тому, как это делалось ранее в желудочно-кишечном тракте (называемых «энтеротипами») (Arumugam et al., 2011), влагалищного тракта (обзор в Petrova et al., 2015) и носоглотки новорожденных (Biesbroek et al., 2014). На основе иерархической кластеризации наши образцы можно было сгруппировать по доминантным родам, в результате чего в анализируемых здесь образцах носоглотки было выявлено не менее четырех «типов сообществ» бактерий: Moraxella- , Fusobacterium- или Streptococcus- , или еще один смешанный тип, демонстрирующий более высокое бактериальное разнообразие, где Corynebacterium , Staphylococcus и / или Dolosigranulum являются основными членами бактериального сообщества.Также наблюдались небольшие кластеры ( Haemophilus , Alloprevotella и Neisseria ), но их значимость должна быть подтверждена в более крупных исследованиях. Поскольку некоторые (хотя и исключительные) образцы показывают смесь родов из разных кластеров, эти профили не следует интерпретировать как отдельные типы сообществ, а скорее как континуум. Напротив, образцы носа в основном показали различные типы с снова Corynebacterium , Staphylococcus и Dolosigranulum в качестве основных членов.Это последнее наблюдение согласуется с предыдущими исследованиями, показавшими, что эти роды очень многочисленны в передних ноздрях (Bassis et al., 2014; Camarinha-Silva et al., 2014; Biswas et al., 2015). В меньшей части образцов носа (9%) преобладали Moraxella. Следует отметить, что биологическая значимость таких дискретных типов сообществ в других нишах человеческого тела, таких как влагалище и желудочно-кишечный тракт, все еще обсуждается и требует дальнейшего обоснования (Koren et al., 2013).Это, безусловно, будет иметь место и для носоглотки, для которой наше настоящее исследование должно рассматриваться просто как отправная точка, поскольку кластеры, наблюдаемые в этом исследовании, были подтверждены только до некоторой степени для иерархической кластеризации на метрике расстояния Брея-Кертиса.
Микробиота носоглотки у здоровых взрослых, насколько нам известно, еще не исследовалась в больших группах исследования. Однако Biesbroek et al. (2014) продемонстрировали бактериальную последовательность микробиоты носоглотки у голландских детей.Они обнаружили, что в носоглотке младенца в основном преобладают Moraxella , Haemophilus или Streptococcus . Интересно, что наши данные показывают, что эти три рода также сохраняются в носоглотке взрослых, как в возрастном классе 18–45, так и 45–65 лет. Было обнаружено, что у детей младшего возраста бактериальный профиль с преобладанием Streptococcus связан с менее стабильной микробиотой носоглотки, что потенциально увеличивает риск инфекций URT (Biesbroek et al., 2014). В том же исследовании было высказано предположение, что бактериальные профили с преобладанием Moraxella- или Dolosigranulum / Corynebacterium могут быть полезны для здоровья органов дыхания, что также предполагалось ранее (Laufer et al., 2011). Напротив, Santee et al. (2016) обнаружили, что обогащение Moraxella в носоглотке детей, в частности Moraxella nonliquefaciens , связано с острым синуситом.
Различия, наблюдаемые между исследованиями, такими как Biesbroek et al.(2014) и Santee et al. (2016) может быть вызвано различием в используемых молекулярных методах (например, филогенетический микрочип против пиросеквенирования соответственно) и ограничением методов секвенирования для различения отдельных видов в пределах рода. Поэтому мы использовали недавно описанный конвейер DADA2, который способен различать варианты последовательностей, отличающиеся всего лишь на один нуклеотид (Callahan et al., 2016), для исследования внутриродовой изменчивости, описываемой как уникальные ASV. Далее мы могли бы классифицировать наиболее распространенные ASV Moraxella и Streptococcus в нашей здоровой исследовательской группе как Moraxella nonliquefaciens / catarrhalis и S.pneumoniae / pseudopneumoniae , два вида, хорошо задокументированные в литературе, потенциально могут быть возбудителями ВДП (de Vries et al., 2009; Goldstein et al., 2009; van der Poll and Opal, 2009). В будущих исследованиях необходимо выяснить, связано ли присутствие и численность этих ASV с восприимчивостью к заболеваниям дыхательных путей, таким как хронический риносинусит. В целом, потенциальные патогенные ASV, такие как S. pneumoniae / pseudopneumoniae (van der Poll and Opal, 2009) и H. haemolyticus / influenzae (Duell et al., 2016) в большей степени присутствовали в носоглотке, чем в носу. С другой стороны, некоторые из обнаруженных нами ASV, такие как Streptococcus 3 (с совпадениями в базе данных SILVA, среди прочего, S. oralis и S. mitis ) и Dolosigranulum , показали потенциал как пробиотики для URT в других исследованиях (Roos et al., 2001; Tano et al., 2002; Laufer et al., 2011; Biesbroek et al., 2014).
Возможное существование типов носоглоточных сообществ поднимает вопрос, какой хозяин и факторы окружающей среды связаны с этими типами сообществ.Здесь были проанализированы несколько доступных переменных, полученных от нашей здоровой исследуемой популяции, включая возраст, пол, группу крови, курение, распространенные респираторные аллергии и время года. Мы не смогли наблюдать связи между нашими тестируемыми переменными и микробиотой, за исключением переменной курения, где мы наблюдали положительную корреляцию между курением и носоглоточными доминантными родами ( p = 0,002). Микробиота носоглотки курильщиков или бывших курильщиков оказалась связанной с родом Corynebacterium ( p = 0.002) и Staphylococcus ( p = 0,02). Хотя некоторые исследования предполагают возможную связь между сигаретным дымом и микробиотой ВДП (Charlson et al., 2010; Yu et al., 2017), эта связь все еще остается неясной и требует дальнейших исследований. Однако следует отметить, что идентификация переменных, связанных с микробиомом, является чрезвычайно сложной задачей, и для выявления таких ассоциаций, вероятно, необходимы большие группы исследований, что хорошо показано для микробиома кишечника (Falcony et al., 2016).
Заключение
Наши результаты показывают, что здоровые взрослые носоглотки можно сгруппировать в несколько типов бактериальных сообществ, в каждом из которых доминируют разные роды. Для четырех кластеров их значимость подтверждена оценкой силы прогнозов: Moraxella — доминирует, Streptococcus — доминирует , Fusobacterium — доминирует, или более смешанный разнообразный тип, где Corynebacterium , Staphylococcus и / или Dolosigranulum оказались ключевыми бактериальными членами.Из этих типов некоторые были сильно специфичны для носоглотки и никогда не доминировали в носу, например, преобладающий тип Fusobacterium и Streptococcus . Используя конвейер DADA2, мы смогли наблюдать внутриродовые вариации в носу и носоглотке и обнаружили как комменсальные, так и потенциальные патогенные бактерии, присутствующие в «здоровой» ВДП. Были исследованы несколько переменных, которые могли влиять на эти бактериальные профили, но положительная связь могла быть обнаружена только между курением и появлением Corynebacterium и Staphylococcus в нашей исследуемой популяции.В будущем необходимо провести исследования, чтобы определить, насколько стабильны эти бактериальные профили и связаны ли они с восприимчивостью к развитию заболеваний URT.
Авторские взносы
SL задумал исследование. IDB, StW, DV, OV и SL разработали различные аспекты протоколов исследования. О.В. был ответственным ЛОРом. Лабораторные работы выполнены ИБР и ЭО. Биоинформатический анализ был проведен StW и SaW. Анализ и интерпретация результатов проводились компаниями IDB, StW, SaW, EO, MvdB и SL.IDB, StW и SL подготовили рукопись, и все авторы прочитали и одобрили окончательную рукопись.
Финансирование
Исследование финансировалось доктором философии. грант и исследовательский грант Исследовательского фонда Фландрии (FWO; номера грантов 7103, 11A0618N и KaN 1507114N), исследовательский грант Антверпенского университета (FFB150344) и гранты Агентства инноваций и предпринимательства Фландрии [IWT-SBO Проект ProCure (IWT / 50052) и IWT-SB 141198].
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы хотят поблагодарить всю исследовательскую группу ENdEMIC Университета Антверпена, в частности Камилла Аллонсиуса, Ингмара Клаеса и лаборантов Инес Туяертс и Лин Ван Хэм. Они также хотят поблагодарить весь ЛОР-отдел университетской больницы Антверпена, Центр медицинской генетики (в частности, Шарлотту Клаас), профессора Питера Хеллингса (KU Leuven) и других партнеров проекта IWT-SBO ProCure и Eos порталу Citizen Science за помощь в наборе волонтеров.Они также хотели бы поблагодарить лабораторию профессора Дидье Эбо (Университет Антверпена) за анализы образцов крови.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fmicb.2017.02372/full#supplementary-material
Сноски
- www.IedereenWetenschapper.be
Список литературы
Арумугам, М., Раес, Дж., Пеллетье, Э., Le Paslier, D., Yamada, T., Mende, D. R., et al. (2011). Энтеротипы микробиома кишечника человека. Природа 473, 174–180. DOI: 10.1038 / nature09944
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бисбрук, Г., Сандерс, Э. А. М., Роэзлерс, Г., Ван, X., Касперс, М. П. М., Тржински, К. и др. (2012). Глубокий анализ секвенирования микробных сообществ с низкой плотностью: работа на границе точного обнаружения микробиоты PLOS ONE 7: e32942.DOI: 10.1371 / journal.pone.0032942
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бисбрук, Г., Цивцивадзе, Э., Сандерс, Э. А. М., Монтин, Р., Винховен, Р. Х., Кейсер, Б. Дж. Ф. и др. (2014). Ранний состав респираторной микробиоты определяет закономерности бактериальной сукцессии и здоровье органов дыхания у детей. Am. J. Respir. Крит. Care Med. 190, 1283–1292. DOI: 10.1164 / rccm.201407-1240OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бисвас, К., Хоггард М., Джейн Р., Тейлор М. В. и Дуглас Р. Г. (2015). Носовая микробиота при здоровье и болезни: различия внутри и между субъектами. Фронт. Microbiol. 9: 134. DOI: 10.3389 / fmicb.2015.00134
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bogaert, D., Keijser, B., Huse, S., Rossen, J., Veenhoven, R., van Gils, E., et al. (2011). Вариабельность и разнообразие микробиоты носоглотки у детей: метагеномный анализ. PLOS ONE 6: e17035.DOI: 10.1371 / journal.pone.0017035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bosch, A. A., de Steenhuijsen Piters, W. A., van Houten, M. A., Chu, M. L. J. N., Biesbroek, G., Kool, J., et al. (2017). Созревание детской респираторной микробиоты, факторы окружающей среды и последствия для здоровья: проспективное когортное исследование. Am. J. Respir. Крит. Care Med. doi: 10.1164 / rccm.201703-0554OC [Epub перед печатью].
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каллахан, Б.Дж., Мак-Мерди, П. Дж., И Холмс, С. П. (2017). Варианты точных последовательностей должны заменять рабочие таксономические единицы в анализе данных маркерных генов. ISME J. doi: 10.1038 / ismej.2017.119 [Epub перед печатью].
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каллахан, Б. Дж., Макмурди, П. Дж., Розен, М. Дж., Хан, А. В., Джонсон, А. Дж., И Холмс, С. П. (2016). DADA2: вывод образца с высоким разрешением из данных ампликона Illumina. Nat. Методы 13, 581–583.DOI: 10,1038 / нМет.3869
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Камаринья-Силва, А., Хауреги, Р., Чавес-Морено, Д., Оксли, А. П. А., Шаумбург, Ф., Беккер, К. и др. (2014). Сравнение бактериального сообщества передней части носа в двух отдельных популяциях человека с использованием секвенирования ампликонов Illumina. Environ. Microbiol. 16, 2939–2952. DOI: 10.1111 / 1462-2920.12362
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Капорасо, Дж.G., Lauber, C.L., Walters, W.A., Berg-lyons, D., Lozupone, C.A., Turnbaugh, P.J. и др. (2010). Глобальные паттерны разнообразия 16S рРНК на глубине миллионов последовательностей на образец. Proc. Natl. Акад. Sci. США 108 (Приложение 1), 4516–4522. DOI: 10.1073 / pnas.1000080107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чарлсон, Э.С., Чен, Дж., Кастерс-Аллен, Р., Биттингер, К., Ли, Х., Синха, Р. и др. (2010). Нарушенные микробные сообщества в верхних дыхательных путях курильщиков сигарет. PLOS ONE 5: e15216. DOI: 10.1371 / journal.pone.0015216
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чонмайтри, Т., Дженнингс, К., Головко, Г., Ханипов, К., Пименова, М., Патель, Дж. А. и др. (2017). Микробиота носоглотки у младенцев и изменения во время вирусной инфекции верхних дыхательных путей и острого среднего отита. PLOS ONE 12: e0180630. DOI: 10.1371 / journal.pone.0180630
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кремерс, А.J., Zomer, A. L., Gritzfeld, J. F., Ferwerda, G., van Hijum, S. A., Ferreira, D. M., et al. (2014). Микробиом носоглотки взрослого человека как детерминанта пневмококковой инфекции. Микробиом 2:44. DOI: 10.1186 / 2049-2618-2-44
PubMed Аннотация | CrossRef Полный текст | Google Scholar
де Steenhuijsen Piters, W. A. A., Sanders, E. A. M., and Bogaert, D. (2015). Роль местной микробной экосистемы в респираторном здоровье и болезнях. Philos. Пер.R. Soc. B Biol. Sci. 370: 20140294. DOI: 10.1098 / rstb.2014.0294
PubMed Аннотация | CrossRef Полный текст | Google Scholar
de Vries, S. P. W., Bootsma, H. J., Hays, J. P., and Hermans, P. W. M. (2009). Молекулярные аспекты патогенеза Moraxella catarrhalis . Microbiol. Мол. Биол. Ред. 73, 389–406. DOI: 10.1128 / MMBR.00007-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дуэлл, Б. Л., Су, Ю. К., и Рисбек, К.(2016). Взаимодействие «хозяин – патоген» нетипируемого Haemophilus influenzae : от комменсала к патогену. FEBS Lett. 590, 3840–3853. DOI: 10.1002 / 1873-3468.12351
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрен, А. М., Моррисон, Х. Г., Леско, П. Дж., Ревейо, Дж., Вине, Дж. Х. и Согин, М. Л. (2014). Минимальное разложение энтропии: неконтролируемое олиготипирование для чувствительного разделения последовательностей генов-маркеров с высокой пропускной способностью. ISME J. 9, 968–979. DOI: 10.1038 / ismej.2014.195
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрен А. М., Согин М. Л., Майньен Л. (2016). От редакции: новое понимание микробной экологии через тонкие нуклеотидные вариации. Фронт. Microbiol. 7: 1318 DOI: 10.3389 / fmicb.2016.01318
PubMed Аннотация | CrossRef Полный текст
Фалькони, Г., Йооссенс, М., Виейра-Силва, С., Ван, Дж., Дарзи, Ю., Фауст, К., и др. (2016). Популяционный анализ изменчивости микробиома кишечника. Наука 352, 560–564. DOI: 10.1126 / science.aad3503
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фрэнсис, Н. А., Батлер, К. К., Худ, К., Симпсон, С., Вуд, Ф., и Наттол, Дж. (2009). Эффект от использования интерактивного буклета об инфекциях дыхательных путей у детей в консультациях первичной медико-санитарной помощи при повторных консультациях и назначении антибиотиков: кластерное рандомизированное контролируемое исследование. BMJ 339: b2885. DOI: 10.1136 / bmj.b2885
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hugerth, L.W., и Андерссон, А. Ф. (2017). Анализ состава микробного сообщества посредством секвенирования ампликонов: от отбора проб до проверки гипотез. Фронт. Microbiol. 8: 1561. DOI: 10.3389 / fmicb.2017.01561
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корен О., Найтс Д., Гонсалес А., Уолдрон Л., Сегата Н., Найт Р. и др. (2013). Руководство по энтеротипам в организме человека: метаанализ структур микробного сообщества в наборах данных микробиома человека. PLOS Comput. Биол. 9: e1002863. DOI: 10.1371 / journal.pcbi.1002863
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Козич, Дж. Дж., Весткотт, С. Л., Бакстер, Н. Т., Хайлендер, С. К., и Шлосс, П. Д. (2013). Разработка стратегии двухиндексного секвенирования и конвейера курации для анализа данных последовательности ампликонов на платформе секвенирования MiSeq Illumina. Заявл. Environ. Microbiol. 79, 5112–5120. DOI: 10.1128 / AEM.01043-13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лауфер, А.С., Метлей, Дж. П., Гент, Дж. Ф., Фенни, К. П., Конг, Ю., и Петтигрю, М. М. (2011). Микробные сообщества верхних дыхательных путей и средний отит у детей. мБио 2: e00245-10. DOI: 10.1128 / mBio.00245-10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лакс, С., Смит, Д. П., Хэмптон-Марселл, Дж., Оуэнс, С. М., Хэндли, К. М., Скотт, Н. М. и др. (2014). Продольный анализ микробного взаимодействия между человеком и окружающей средой в помещении. Наука 345, 1048–1052. DOI: 10.1126 / science.1254529
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ling, Z., Liu, X., Luo, Y., Yuan, L., Nelson, K. E., Wang, Y., et al. (2013). Пиросеквенирование микробиоты человека здоровых китайских студентов. BMC Genomics 14: 390. DOI: 10.1186 / 1471-2164-14-390
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Man, W. H., de Steenhuijsen Piters, W.А.А., Богерт Д. (2017). Микробиота дыхательных путей: хранитель здоровья органов дыхания. Nat. Rev. Microbiol. 15, 259–270. DOI: 10.1038 / nrmicro.2017.14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оксанен, Дж., Бланше, Ф., Киндт, Р., Лежандр, П., и О’Хара, Р. (2016). Веган: Пакет «Экология сообщества». Пакет R 2.3-3. DOI: 10.4135 / 9781412971874.n145
CrossRef Полный текст | Google Scholar
Петрова, М.И., Ливенс, Э., Малик, С., Имхольц, Н., Лебир, С. (2015). Lactobacillus видов в качестве биомаркеров и агентов, которые могут способствовать различным аспектам здоровья влагалища. Фронт. Physiol. 6:81. DOI: 10.3389 / fphys.2015.00081
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роос, К., Хоканссон, Э. Г., и Холм, С. (2001). Влияние реколонизации с «мешающими» α-стрептококками на рецидивы острого и секреторного среднего отита у детей: рандомизированное плацебо-контролируемое исследование. BMJ 322, 210–212. DOI: 10.1136 / bmj.322.7280.210
CrossRef Полный текст | Google Scholar
Санти, К. А., Нагалингам, Н. А., Фаруки, А. А., ДеМури, Г. П., Герн, Дж. Э., Вальд, Э. Р. и др. (2016). Состав микробиоты носоглотки у детей связан с частотой инфекций верхних дыхательных путей и острого синусита. Микробиом 4, 34. doi: 10.1186 / s40168-016-0179-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стернс, Дж.К., Дэвидсон, К. Дж., МакКеон, С., Уилан, Ф. Дж., Фонтес, М. Е., Шрайверс, А. Б. и др. (2015). Культуральные и молекулярные профили показывают сдвиги в бактериальных сообществах верхних дыхательных путей, которые происходят с возрастом. ISME J. 9, 1246–1259. DOI: 10.1038 / ismej.2014.250
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тано, К., Гран Хоканссон, Э., Холм, С. Э., и Хеллстрём, С. (2002). Назальный спрей с альфа-гемолитическими стрептококками в качестве долгосрочной профилактики рецидивирующего среднего отита. Внутр. J. Pediatr. Оториноларингол. 62, 17–23. DOI: 10.1016 / S0165-5876 (01) 00581-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тео, С. М., Мок, Д., Фам, К., Кусел, М., Серральха, М., Трой, Н. и др. (2015). Микробиом носоглотки младенца влияет на тяжесть инфекции нижних дыхательных путей и риск развития астмы. Клеточный микроб-хозяин 17, 704–715. DOI: 10.1016 / j.chom.2015.03.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тибширани, Р.и Вальтер Г. (2005). Проверка кластера по силе прогноза. J. Comput. График. Стат. 14, 511–528. DOI: 10.1198 / 106186005X59243
CrossRef Полный текст | Google Scholar
Тернбо, П. Дж., Лей, Р. Э., Хамади, М., Фрейзер-Лиггет, К. М., Найт, Р., и Гордон, Дж. И. (2007). Проект микробиома человека. Природа 449, 804–810. DOI: 10.1038 / nature06244
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ван дер Полл, Т., и Опал, С. М. (2009). Патогенез, лечение и профилактика пневмококковой пневмонии. Ланцет 374, 1543–1556. DOI: 10.1016 / S0140-6736 (09) 61114-4
CrossRef Полный текст | Google Scholar
van der Velden, A., Duerden, M., Bell, J., Oxford, J., Altiner, A., Kozlov, R., et al. (2013). Обязанности врача и пациента при лечении острых респираторных инфекций — важны для сохранения антибиотиков. Антибиотики 2, 316–327. DOI: 10.3390 / антибиотики 2020316
CrossRef Полный текст | Google Scholar
Уикхэм, Х. (2009). ggplot2: Элегантная графика для анализа данных. Нью-Йорк, Нью-Йорк: Спрингер.
Google Scholar
Yu, G., Phillips, S., Gail, M. H., Goedert, J. J., Humphrys, M. S., Ravel, J., et al. (2017). Влияние курения сигарет на микробиоту полости рта и носа. Микробиом 5, 3. doi: 10.1186 / s40168-016-0226-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
границ | Микробиота носа при здоровье и заболевании: различия внутри и между субъектами
Введение
Хронический риносинусит (ХРС) — это стойкое воспалительное заболевание носовых ходов и придаточных пазух носа (Bhattacharyya, 2009; Soler et al., 2011). Она затрагивает примерно 5% населения Запада (Fokkens et al., 2012), и только в США на нее приходится около 8,6 млрд долларов в год прямых медицинских расходов (Ray et al., 1999; Bhattacharyya, 2003). СВК приводит к значительной заболеваемости среди людей молодого и среднего возраста, существенно влияя на качество жизни (Gliklich and Metson, 1995). Хотя при его лечении часто используются антибиотики, роль бактерий в патогенезе этого состояния остается далеко не ясной.
Роль изменений носовой микробиоты в патогенезе СВК подвергается все более пристальному изучению, и в ряде недавних исследований сравнивали состав бактерий у пациентов с СВК и здоровых субъектов (Abreu et al., 2012; Feazel et al. , 2012; Aurora et al., 2013; Boase et al., 2013). Эти исследования, в которых использовались независимые от культивирования (молекулярные) подходы для изучения разнообразия бактерий в образцах, дали ряд результатов без четко выраженных закономерностей.Например, исследование Abreu et al. (2012) использовали нацеленный на ген 16S рРНК PhyloChip (диагностический микрочип; Brodie et al., 2006) для оценки состава микробного сообщества у здоровых людей и людей, пораженных СВК. Согласно данным PhyloChip, бактерия Corynebacterium tuberculostearicum является потенциальным возбудителем СВК, особенно в сочетании с нарушением микробиоты носовых пазух. Важно отметить, что это открытие было подтверждено последующими экспериментами на мышиных моделях (Abreu et al., 2012). Другие недавние исследования связали СВК с изменениями численности или активности Staphylococcus aureus , уменьшением видов Prevotella , увеличением Corynebacterium accolens , более низким микробным разнообразием и повышенным микробным разнообразием, при отсутствии очевидного согласия между отдельными исследованиями (Feazel et al. ., 2012; Foreman et al., 2012; Boase et al., 2013; Ramakrishnan et al., 2013a; Choi et al., 2014; Cleland et al., 2014).
Принимая во внимание результаты этих недавних исследований, очевидно, что взаимосвязь между СВК и микробиотой носовых пазух является сложной.Гетерогенный характер микробной ассоциации с CRS подчеркивается заметными различиями в сообщаемых микробных сообществах между различными исследованиями, между фенотипическими (полипы или без полипов; Fokkens et al., 2012) и иммунологическими или гистологическими подгруппами CRS (эозинофильные или нейтрофильные; Kountakis et al., 2004; De Alarcón et al., 2006; Park et al., 2013; Bochenek et al., 2014) и различные ответы пациентов на лечение антибиотиками и кортикостероидами (Joe et al., 2008; Liu et al., al., 2013). Причины таких изменений плохо изучены, но могут включать различия между популяциями пациентов (например, анамнез антибиотиков, этническая принадлежность), методология, генетика, факторы окружающей среды или просто естественные различия между различными частями носовых ходов и пазух.
Относительно немного исследований изучали влияние пространственной изменчивости микробиоты носовой полости человека. Одно недавнее исследование показало, что тип эпителия в здоровых носовых ходах оказывает значительное влияние на разнообразие бактериального сообщества (Yan et al., 2013), без четких закономерностей в бактериальном составе между участками. Другое исследование продемонстрировало, что носовой микробиом отчетливо отличается от микробиома ротовой и ротовой полости у человека (Bassis et al., 2014). Поскольку оба этих исследования проводились на здоровых людях, влияние пространственной вариабельности в носовой полости пациентов с СВК до сих пор не изучено, не говоря уже о степени вариабельности между разными пациентами. Фундаментальной целью микробной экологии является описание пространственной изменчивости бактериальных сообществ (Hanson et al., 2012), но не следует упускать из виду и клиническую значимость таких исследований. Местное применение антибиотиков или стероидов или даже добавление пробиотических бактерий (Liu et al., 2013; Cleland et al., 2014) может определяться различиями в бактериальном составе и нагрузке в разных частях носовой полости. Короче говоря, лучшее понимание того, где и как изменяется носовая микробиота, должно привести к более совершенным и более персонализированным вариантам лечения в будущем.
В этом исследовании мы использовали пиросеквенирование ампликона и ПЦР в реальном времени гена 16S рРНК для описания состава и численности бактерий у субъектов с СВК и без.В отличие от многих предыдущих исследований, мы не группируем пациентов с СВК вместе, а скорее изучаем различия в бактериальных сообществах между каждым пациентом. Кроме того, мы строго охарактеризовали вариабельность носовой микробиоты у субъектов, анализируя шесть образцов на каждого пациента, что позволяет по-новому взглянуть на пространственные вариации этих бактерий.
Материалы и методы
Информация для пациентов
Пятнадцать пациентов (девять из контрольной группы CRS и шесть из контрольной группы без CRS), перенесших эндоскопическую операцию на пазухах, были отобраны для этого исследования.Контрольной группе выполнялась операция по удалению опухоли гипофиза. Пациенты с СВК были выбраны на основании оценки Лунда-Маккея> 10/24 и результатов компьютерной томографии. Информация о пациентах представлена в таблице 1. Для этого исследования было получено письменное согласие пациентов и этическое одобрение (NTX / 08/12/126 / AM01) Комитета по этике здоровья и инвалидности Новой Зеландии.
ТАБЛИЦА 1. Информация для пациентов.
Сбор проб
Операция выполнена пациентам под общим наркозом.Отбор образцов проводился сразу после индукции перед нанесением любого местного препарата на слизистую оболочку или введением внутривенных антибиотиков. Стерильные тампоны с наконечником из искусственного волокна (Copan, # 170KS01) были использованы под эндоскопическим контролем для взятия образцов поверхностной слизистой оболочки с каждого из трех участков в пределах левой и правой сторон ноздри: передних носовых ходов, нижней носовой раковины и среднего прохода. Двойные мазки были взяты из каждого из шести участков для каждого пациента, таким образом, в общей сложности было получено 12 мазков для каждого человека.Мазки отбрасывали и брали повторно, если они были загрязнены слизистой оболочкой за пределами целевой области. Сразу после сбора кончик каждого тампона в асептических условиях удаляли и помещали в стерильную полипропиленовую пробирку объемом 1,5 мл на льду. Тампоны транспортировали в лабораторию на льду в течение 2 часов и хранили при -20 ° C до дальнейшего анализа.
Экстракция ДНК
Два дублирующих мазка с каждого из шести участков размораживали на льду и помещали вместе в стерильную пробирку Lysing Matrix E (MP Biomedicals, Австралия).Геномную ДНК экстрагировали из образцов с использованием набора для выделения ДНК / РНК AllPrep (Qiagen) в соответствии с инструкциями производителя и элюировали 30 мкл воды, свободной от ДНКазы. Клетки разрывали с использованием Qiagen TissueLyser II при 25 м / с в течение 2 × 40 с. Качество и количество геномной ДНК измеряли на флуороспектрометре Nanodrop 3300 и с использованием красителя PicoGreen (Quant-iT dsDNA kit, Invitrogen).
Пиросеквенирование ампликона гена 16S рРНК
фрагментов бактериального гена 16S рРНК из выделенной геномной ДНК амплифицировали с использованием праймеров 347f и 803r, которые ранее использовались для характеристики бактериального сообщества передней кишки человека (Nossa et al., 2010). Применимость этих праймеров к микробным сообществам носовых пазух была подтверждена in silico с использованием Probe Match в базе данных RDP и базах данных SILVA. Подготовка образцов для пиросеквенирования ампликонов была описана ранее (Biswas et al., 2014) с некоторыми незначительными изменениями. Вкратце, упомянутые выше праймеры, нацеленные на ген 16S рРНК, в комплекте с адаптерами пиросеквенирования и уникальными мультиплексными идентификаторами (MID) на прямом праймере, использовали в эквимолярных концентрациях (0.2 мкМ) вместе с dNTP (0,2 мМ), буфером для ПЦР (1X), MgSO 4 (2 мМ), 0,5U Platinum Hi-fidelity Taq (Invitrogen) и водой, сертифицированной для ПЦР, до конечного объема 25 мкл. ПЦР-амплификацию проводили в аппарате для градиентной ПЦР Applied Biosystems Mastercycle с начальной стадией денатурации 94 ° C в течение 3 минут, за которой следовали 35 циклов денатурации (94 ° C в течение 30 с), отжиг (55 ° C в течение 30 с), и удлинение (70 ° C в течение 40 с) с заключительной стадией удлинения при 70 ° C в течение 3 мин. Амплифицированные продукты очищали с использованием гранул Agencourt AMPure (Beckman Coulter Inc.), количественно оценили с помощью Picogreen и качественно проверили на чипах Agilent 1200 Bioanalyzer DNA 1000 (Agilent Technologies, Санта-Клара, Калифорния, США). Подход вложенной ПЦР с использованием праймеров 616V (Spring et al., 1998) и 1492R (Polz and Cavanaugh, 1998) для начальной амплификации был принят для образцов двух образцов пациентов с CRS (2 и 3) в качестве исходных. ПЦР не дала никаких продуктов.
Эквимолярные концентрации 36 приготовленных образцов ампликонов были объединены в единую библиотеку в соответствии с инструкциями Macrogen Inc.(Сеул, Южная Корея). Каждую библиотеку ампликонов (всего три требовалось для анализа всех 90 образцов) секвенировали на 1/8 планшете платформы Roche GS FLX Titanium от Macrogen. Анализ полученных ридов пиросеквенирования проводили, как описано ранее (Schmitt et al., 2012; Biswas et al., 2014). Вкратце, комбинация mothur (Schloss et al., 2009) и пользовательских скриптов PERL использовалась для сохранения только высококачественных полезных операций чтения, которые были согласованы с базой данных SILVA (http: // www.mothur.org/wiki/Silva_reference_alignment). Операционным таксономическим единицам (OTU) было присвоено 97% сходства на основе нескорректированной попарной матрицы расстояний. Репрезентативная последовательность из каждой OTU была подвергнута таксономическому отнесению с использованием BLAST (Altschul et al., 1990) по сравнению с вручную созданной базой данных SILVA (версия 108) с использованием специально созданных сценариев PERL.
Графики многомерного масштабирования (MDS) были построены с использованием программного обеспечения Primer 6 (версия 6.1.6) состава бактериального сообщества на основе гена 16S рРНК на уровне рода бактерий.Сходство Брея-Кертиса было выбрано в качестве меры между выборками на графике MDS.
ПЦР в реальном времени
Объем полученной пробы варьировался на каждом участке. Таким образом, для стандартизации образцов для целей количественной оценки в этом исследовании были определены относительные пропорции ДНК человека и бактерий в геномном экстракте. Для этой цели гены бета-актина человека были количественно определены с использованием ранее описанных праймеров бактина-F (положение нуклеотида, 393–413) и бактина-R (622–642; Wang and Seed, 2003), нацеленных на ген ACTB .Для количественной оценки бактериального обилия гена 16S рРНК из экстрагированной геномной ДНК мы провели ПЦР в реальном времени с праймерами 8F и 341R (Juck et al., 2000; Kim et al., 2009). Общее количество копий гена 16S рРНК рассчитывали на основе доли бактериальной ДНК для каждой экстракции. Стандарты были приготовлены из библиотек клонов бактериальных генов 16S рРНК и из геномной ДНК человека (Promega) для ACTB . Была приготовлена серия 10-кратных разведений для каждого интересующего гена (10–100 000 копий-мишеней на реакцию для бактерий; 0.01–100 нг / мкл для ДНК человека). Эффективность амплификации каждого набора праймеров рассчитывали на основе соответствующей стандартной кривой с использованием формулы: E = 10 ( -1 / наклон ) -1 × 100%. Анализ кривой плавления также выполняли для проверки специфичности пар праймеров с использованием программного обеспечения «кривая диссоциации» (Applied Biosystems). Реакционная смесь состояла из 10 мкл мастер-смеси 1x QuantiTect SYBR Green (QIAGEN) с HotStar Taq, 0,5 мкл каждого праймера (10 мкМ), соответствующей матрицы геномной ДНК (10 нг для бактерий; 1 нг для человека) или подготовленного стандарта. и воду для ПЦР до конечного объема 20 мкл.Условия термоциклирования были следующими: 50 ° C в течение 2 минут, стадия активации при 95 ° C в течение 15 минут, затем 40 циклов денатурации (95 C в течение 15 с), отжиг (60 ° C в течение 1 минуты) и удлинение. (72 ° C в течение 15 с). Все образцы, включая нематричный контроль и серию разведения стандартов, были проанализированы в трех экземплярах. Результаты были проанализированы с использованием системы определения последовательности ABI Prism 7900HT (версия 2.4).
Статистика
Индексы разнообразия (включая индекс Шеннона-Винера, индекс обратного-Симпсона и кривые разрежения) были рассчитаны на основе данных о последовательности гена разреженной 16S рРНК для всех образцов при 97% сходстве с использованием mothur, а затем значения формально сравнивались с использованием критерия Стьюдента t . .Кроме того, равное количество последовательностей было отобрано для оценки значимости различий между типами образцов с использованием UniFrac (на основе филогении; Lozupone et al., 2011). Образцы были собраны в соответствии со статусом заболевания, межличностными различиями и местом отбора образцов для проверки процента вариации в образцах, приходящихся на каждую группу, согласно измерениям R 2 , с использованием пермутационного многомерного дисперсионного анализа (PERMANOVA; Anderson , 2001). Расстояния UniFrac (взвешенные и невзвешенные), рассчитанные с помощью mothur, вместе с функцией «Адонис» веганского пакета в программном обеспечении R (Oksanen et al., 2013), использовались для ПЕРМАНОВА. Полученные значения R 2 затем использовали для генерации значений значимости ( p -значение) путем сравнения с 1000 случайных перестановок набора данных.
Результаты
Основные источники изменчивости носовой микробиоты
На уровне бактериального типа микробиота носа имеет относительно низкое разнообразие (рис. 1). В большинстве образцов преобладали представители Actinobacteria (особенно род Corynebacterium ), Firmicutes (в основном Staphylococcus или Dolosigranulum ), Gammaproteobacteria (особенно Moraxella ) и, в отдельных случаях, Fusobacteria или Bacteroidetes .Другие типы в совокупности включали лишь небольшую часть присутствующих бактерий. Данные последовательности, обобщенные на рисунках 1A, B, показывают значительные различия среди микробиоты разных людей и, в меньшей степени, среди разных участков в пределах одного человека. Чтобы формально разделить эту вариацию, Адонис был использован для анализа влияния статуса болезни, межличностных различий и места отбора проб на многовидовую структуру сообщества проб. Наибольшая доля объясненных вариаций в наших данных была связана с различиями между отдельными пациентами (36.9%, p <0,001), затем следует статус болезни (3,8%, p <0,001). Также сравнивались различия между участками индивидуума, а также между левой и правой ноздрей, но эти различия не были значительными. Следует отметить, что большая часть различий между образцами (~ 59%) была необъяснимой. Анализ дисперсии с использованием Adonis на основе взвешенного и невзвешенного расстояния UniFrac показал аналогичные результаты, поэтому здесь представлены только невзвешенные значения UniFrac. Ниже обсуждается каждый из этих источников вариаций.
РИСУНОК 1. Состав бактериального сообщества на основе гена 16S рРНК (A , B) и численность (C) девяти субъектов СВК и шести здоровых людей. Показаны данные, представляющие каждый из шести участков носовой полости каждого субъекта. Порядок отображаемых образцов для каждого субъекта следующий: слева направо: левый передний носовой ход, правый передний носовой ход, левая нижняя носовая раковина, правая нижняя носовая раковина, левый средний проход, правый средний проход.Данные о последовательности бактериального сообщества отображаются на уровнях типа (A) и рода (B) , причем данные для каждого таксона выражаются как доля считываний последовательностей для данного образца. Число копий гена 16S рРНК используется в качестве показателя численности бактерий в кПЦР, столбцы показывают среднее значение ± стандартное отклонение. ( n = 3; C ).
Вариабельность микробиоты у разных пациентов
Самый большой источник различий в составе бактериального сообщества может быть связан с различиями между пациентами (36.9%). Микробиота значительно и непредсказуемо варьировалась среди пациентов с СВК, при этом менее изменчивая микробиота наблюдалась у здоровых субъектов (рис. 2). Пациенты 3 и 4 из когорты здоровых были курильщиками и демонстрировали уменьшенное количество последовательностей Actinobacteria и увеличенное количество последовательностей Firmicutes по сравнению с другими пациентами. Однако такой очевидной закономерности не наблюдалось в отношении курения среди когорты CRS. Среди здоровой когорты в сообществах доминировали представители типов Actinobacteria , Firmicutes, и, в меньшей степени, Beta — и Gammaproteobacteria , причем эти таксоны представлены в основном родом Corynebacterium и другими неклассифицированными Actinomycetales , а также Peptoniphilus , Staphylococcus, и Moraxella (рисунки 1A, B).Относительные пропорции этих основных таксонов существенно различались у разных здоровых людей. В отличие от своих здоровых сверстников, пациенты с СВК демонстрировали более изменчивую микробиоту без каких-либо устойчивых закономерностей. Пациенты с CRS 4 и 9, например, содержали высокую долю Actinobacteria (особенно Corynebacterium ), а пациент 7 также содержал Prevotella (из филума Bacteroidetes ) на некоторых участках носовых пазух. Gammaproteobacterium Moraxella доминировала в микробиоте носовых пазух пациента 1 с СВК, но не была в избытке ни у одного из других пациентов с СВК. Staphylococcus был в изобилии у нескольких пациентов с ХКБ (а также у здоровых) пациентов, тогда как Fusobacterium и Streptococcus преобладали у пациентов 3 и 5 соответственно. Анализы Unifrac (невзвешенные и взвешенные) и Adonis выявили значительные различия между людьми ( p <0,001). Численность бактерий, по оценке количественной оценки количества копий гена 16S рРНК на основе qPCR, варьировала как среди CRS, так и среди здоровых субъектов (рис. 1C).
РИСУНОК 2.Неметрический график многомерной шкалы (MDS), отображающий состав бактериального сообщества на основе гена 16S рРНК на уровне рода бактерий. Субъекты с CRS обозначены красными символами, а здоровые — синими. Каждый субъект представлен шестью разными образцами, как показано на рисунке 1. Данные последовательности сравнивали между образцами с использованием метода сходства Брея-Кертиса.
Влияние статуса заболевания на носовую микробиоту
Статус заболевания (независимо от того, имел ли субъект СВК), составлял только 3.8% вариации наблюдаются в данных о составе бактериального сообщества. Хотя не было очевидной характерной «сигнатуры» бактериального сообщества, связанной с СВК, микробиота больных СВК оказалась более изменчивой, чем у здоровых субъектов. Представители рода Corynebacterium , которые были многочисленны среди всех здоровых субъектов, достигли высокой численности только среди пациентов с СВК 4, 7 и 9, хотя они присутствовали в меньших количествах у некоторых других индивидуумов с СВК.Анализ распределения (рисунок 2) поместил бактериальные сообщества здоровых субъектов относительно близко друг к другу, в то время как сообщества, связанные с CRS, сильно различались, в некоторых случаях в значительной степени перекрываясь с микробиотой здоровых субъектов, а в других случаях отчетливо различались. Четких подгрупп микробиоты СВК не выявлено. Количество копий бактериального гена 16S рРНК существенно не отличалось между пациентами с СВК и здоровыми людьми.
Показатели разнообразия Шеннона-Винера, Инверс-Симпсона и наблюдаемых OTU (97%) значительно различались ( p <0.001) между микробными сообществами двух когорт пациентов (рис. 3). Эти инструменты анализа разнообразия показывают, что пациенты с СВК демонстрировали более низкое бактериальное разнообразие по сравнению со здоровыми сверстниками.
РИСУНОК 3. Графики в виде прямоугольников и усов для сравнения разнообразия бактериального сообщества между СВК и здоровыми субъектами. (A) Inverse-Simpson, (B) Shannon – Wiener и (C) наблюдаемые индексы OTU-97% были рассчитаны для двух групп образцов.Значимые значения ( p -значения) между двумя группами отображаются на графиках.
Вариабельность микробиоты на разных участках у одного пациента
Состав бактериального сообщества и предполагаемая численность не изменились предсказуемым образом в шести исследуемых участках в пределах одного пациента (рис. 1). Как указано выше, микробиоты пациентов с СВК были особенно разными, даже у некоторых людей. Только для пациентов 4, 6 и 9 сообщества были относительно согласованными для шести участков выборки, в двух случаях преобладали Corynebacterium , а в третьем — Staphylococcus .Среди других больных микробиота пациента 1 состояла почти исключительно из гаммапротеобактерий Moraxella , за исключением одной ноздри, в передних носовых ходах также содержалось значительное количество Corynebacterium . Напротив, бактериальные сообщества на шести участках среди шести здоровых людей оставались довольно последовательными на уровне типа и рода. Бактериальная нагрузка у пациента 1 была значительно выше по сравнению с таковой у других пяти здоровых людей, но очевидной закономерности не наблюдалось ни для одного отдельного участка в полости носа.Бактериальное разнообразие (измеренное с помощью Shannon-Wiener, Inverse-Simpson и наблюдаемых OTUs — 97%) существенно не различается между сайтами CRS и здоровыми людьми. То же самое относится и к сравнениям между ноздрями.
Обсуждение
Несмотря на то, что за последнее десятилетие был опубликован ряд молекулярных исследований носовой микробиоты, единого мнения о местах сбора проб, аналитических методах или интерпретации полученных результатов не было. Соответственно, сравнение результатов разных исследований затруднено.Известно, что бактериальные сообщества имеют различные биогеографические структуры в своей среде (Hanson et al., 2012). Тем не менее, было проведено мало исследований по изучению таких вариаций в носовых полостях человека. В этом исследовании мы исследовали пространственную изменчивость носовой микробиоты как у отдельного субъекта, так и между пациентами с СВК и здоровыми субъектами.
Большое количество необъяснимых вариаций, наблюдаемых в этом исследовании, типично для многих наборов данных экологического исследования (Borcard et al., 1992), где невозможно измерить все переменные окружающей среды, такие как биологические взаимодействия и внешние факторы окружающей среды. Параметры, которые были специально исследованы в этом исследовании, составляли только около 41% наблюдаемой изменчивости. В будущих исследованиях наряду с микробным компонентом следует учитывать и другие факторы, измеряющие взаимодействие с хозяином (например, цитокины).
Небольшие размеры когорт являются неотъемлемым ограничением изучения CRS, как отмечалось ранее в литературе (Abreu et al., 2012; Feazel et al., 2012; Choi et al., 2014). Требование к пациентам не принимать антибиотики в течение как минимум 4 недель до операции в сочетании со сложностью получения образцов (с помощью эндоскопической хирургии носовых пазух) неизбежно приводит к небольшому размеру выборки. Кроме того, получение образцов от здоровых субъектов особенно сложно, поскольку для исследования принимаются только пациенты, проходящие FESS. Когорта, использованная в этом исследовании, небольшая, но она сопоставима с когортами многих других опубликованных исследований и все же была достаточной, чтобы дать нам значимые результаты для сравнения между пациентами и статусом болезни.Вариабельность внутри пациента изучалась для каждого пациента, поэтому мы предполагаем, что большая когорта не повлияет на результат этого результата.
Вариабельность микробиоты у разных пациентов
Это исследование показывает, что на статус заболевания (СВК по сравнению со здоровым) приходилось меньше наблюдаемых вариаций, чем на различия между пациентами. Эти результаты согласуются с другими исследованиями микробиоты, связанной с человеком, в кишечнике (Turnbaugh et al., 2008), ротовой полости (Nasidze et al., 2009) и коже (Grice et al., 2009), которые сообщили о высоком уровне изменчивости среди людей. Другое подобное исследование, посвященное изучению общей микробиоты человека в различных частях тела здоровых субъектов, также показало, что персонализированная микробиота относительно стабильна у данного человека с течением времени (Costello et al., 2009) и что вариации в микробном составе в значительной степени связаны с межличностные различия. Другие исследования носовой микробиоты, связанной со здоровьем и СВК, также обнаружили большие различия между людьми (Feazel et al., 2012; Рамакришнан и др., 2013b). Результаты этого исследования основаны на формирующемся понимании СВК как гетерогенной группы заболеваний, имеющих общие клинические симптомы (Benninger et al., 2003; Van Crombruggen et al., 2011). Эти данные имеют значение для клинического лечения и профилактики СВК. Возможно, потребуется лечение, оптимизированное для конкретной микробиоты пациента.
Ранее было показано, что курение вызывает увеличение относительной доли Firmicutes и уменьшения Actinobacteria у здоровых (не страдающих СВК) людей (Ramakrishnan et al., 2013б). Небольшие вариации, наблюдаемые в когорте здоровых в рамках нашего исследования, можно объяснить курением, поскольку это явление наблюдалось у пациентов 3 и 4 (оба курили) по сравнению с некурящими. Однако из когорты CRS курильщиком был только один субъект. Таким образом, значительная вариабельность бактериального состава между индивидуумами когорты CRS все еще остается в значительной степени необъясненной.
Влияние статуса заболевания на носовую микробиоту
Численность бактерий была измерена в этом исследовании с помощью нацеленной на ген 16S рРНК кПЦР.Опять же, результаты сильно различались и не зависели от статуса болезни. Эти результаты согласуются с выводами других исследователей, использовавших аналогичную методологию (Abreu et al., 2012). Однако в других исследованиях, использующих методы, отличные от использованных в этом исследовании, сообщается о значительно большей бактериальной нагрузке (в частности, S. aureus ) у пациентов с СВК по сравнению с нормальным контролем (Foreman et al., 2009; Boase et al., 2013 ).
Эти данные указывают на большую степень различий в структуре микробного сообщества среди пациентов с СВК по сравнению со здоровыми людьми.Однако бактериальное разнообразие пациентов с СВК было снижено. Это открытие наблюдалось при нескольких других воспалительных заболеваниях (например, муковисцидозе, воспалительном заболевании кишечника; Ott et al., 2004; Guss et al., 2010). Более стабильная структура сообщества здоровых людей предполагает, что дисбактериоз (или дисбаланс) в микробном сообществе связан с возникновением СВК. Микробный дисбактериоз также может быть следствием многократных курсов антибиотиков, прописанных пациентам с СВК в течение нескольких лет до операции, что, в свою очередь, может способствовать снижению бактериального разнообразия (Liu et al., 2013).
Еще одна новая точка зрения на СВК состоит в том, что это заболевание, опосредованное в основном иммунной системой хозяина, и требует подклассификации на основе иммунологических и гистологических факторов (Akdis et al., 2013). Необходимы дальнейшие исследования для выяснения роли иммунно-опосредованных ответов хозяина в СВК и их взаимодействия с микробными сообществами.
Отбор проб из носовой полости
Структура микробного сообщества существенно не различалась между участками или между левой и правой ноздрями человека.Из четырех параметров, выбранных для исследования вариаций в образцах, эти два оказали наименьшее влияние. Незначительные изменения, наблюдаемые в бактериальной нагрузке или разнообразии, наблюдаемые у пациентов с СВК 3, 5 и 7, могут быть связаны с гетерогенной природой заболевания. Передняя часть носа считается относительно сухой средой с другим типом эпителия по сравнению с двумя другими участками, проанализированными в этом исследовании. Средний проход и нижние носовые раковины находятся глубже в носовой полости и покрыты слизистой оболочкой, которая выделяется бокаловидными клетками.Это обеспечивает идеальную среду для развития биопленок, как это наблюдалось ранее у пациентов с СВК (Cryer et al., 2004; Foreman et al., 2012). На основании выводов Yan et al. (2013) и Bassis et al. (2014) и различных микросредах участков исследования, мы могли ожидать, что микробиота носовой полости выбранных участков будет отличаться. Однако наше исследование не выявило значительных различий в бактериальном разнообразии, составе или численности между разными участками ХРС или здоровых людей.Кроме того, разные стороны носовой полости содержали по существу одну и ту же микробиоту, что является еще одним важным выводом этого исследования. Это исследование является первым в своем роде для CRS и должно быть принято во внимание при планировании будущих исследований в этой области.
Заключение
Это исследование дает некоторое представление о различиях между микробными сообществами в экосистеме носа человека. Несколько неожиданно мы заметили, что различия между пациентами объясняют больше вариаций носовой микробиоты, чем статус заболевания или разные места отбора проб в носовых полостях.Лучшее понимание причин различий в бактериальном составе, разнообразии и численности в носовой полости пациентов с СВК может помочь в разработке улучшенных клинических методов лечения в будущем.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы выражают благодарность испытуемым, принявшим участие в этом исследовании.Описанное здесь исследование финансировалось Мемориальным фондом Гарнетта Пассе и Родни Уильямса и Центром Мориса Уилкинса, а технический специалист, участвовавший в этом исследовании, финансировался Советом Фонда исследований и образования Green Lane.
Список литературы
Абреу, Н. А., Нагалингам, Н. А., Сонг, Ю., Рёдигер, Ф. К., Плетчер, С. Д., Голдберг, А. Н., и др. (2012). Истощение разнообразия микробиома синуса и обогащение Corynebacterium tuberculostearicum опосредуют риносинусит. Sci. Пер. Med. 4, 151ра124. DOI: 10.1126 / scitranslmed.3003783
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Акдис, К. А., Бахерт, К., Чинги, К., Дикевич, М. С., Хеллингс, П. В., Наклерио, Р. М. и др. (2013). Эндотипы и фенотипы хронического риносинусита: ПРАКТИЧЕСКИЙ документ Европейской академии аллергии и клинической иммунологии и Американской академии аллергии, астмы и иммунологии. J. Allergy Clin. Иммунол. 131, 1479–1490. DOI: 10.1016 / j.jaci.2013.02.036
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Альтшул, С. Ф., Гиш, В., Миллер, В., Майерс, Э. У. и Липман, Д. Дж. (1990). Базовый инструмент поиска локального выравнивания. J. Mol. Биол. 215, 403–410. DOI: 10.1016 / S0022-2836 (05) 80360-2
CrossRef Полный текст | Google Scholar
Андерсон, М. Дж. (2001). Новый метод непараметрического многомерного дисперсионного анализа. Austral. Ecol. 26, 32–46. DOI: 10.1111 / j.1442-9993.2001.01070.pp.x
CrossRef Полный текст | Google Scholar
Аврора, Р., Чаттерджи, Д., Хентцлеман, Дж., Прасад, Г., Синдвани, Р., и Сэнфорд, Т. (2013). Сравнение микробиомов здоровых добровольцев и пациентов с хроническим риносинуситом. JAMA Отоларингол. Head Neck Surg. 139, 1328–1338. DOI: 10.1001 / jamaoto.2013.5465
CrossRef Полный текст | Google Scholar
Беннингер, М.С., Фергюсон, Б. Дж., Хэдли, Дж. А., Хамилос, Д. Л., Джейкобс, М., Кеннеди, Д. В. и др. (2003). Хронический риносинусит у взрослых: определения, диагностика, эпидемиология и патофизиология. JAMA Отоларингол. Head Neck Surg. 129, S1 – S32. DOI: 10.1016 / S0091-6749 (99) 70464-1
CrossRef Полный текст | Google Scholar
Boase, S., Foreman, A., Cleland, E., Tan, L., Melton-Kreft, R., Pant, H., et al. (2013). Микробиом хронического риносинусита: посев, молекулярная диагностика и обнаружение биопленок. BMC Infect. Дис. 13: 210. DOI: 10.1186 / 1471-2334-13-210
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Боченек, Г., Кушил-Дзюрда, Дж., Шафранец, К., Плутецка, Х., Щеклик, А., и Низанковская-Могильницкая, Э. (2014). Определенные субфенотипы респираторного заболевания, обостренного аспирином, выделенные с помощью анализа латентных классов. J. Allergy Clin. Иммунол. 133, 98–103.e1-6. DOI: 10.1016 / j.jaci.2013.07.004
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Боркар, Д., Лежандр, П., и Драпо, П. (1992). Выделение пространственной составляющей экологической изменчивости. Экология 73, 1045–1055. DOI: 10.2307 / 1940179
CrossRef Полный текст | Google Scholar
Броди, Э. Л., ДеСантис, Т. З., Джойнер, Д. К., Бэк, С. М., Ларсен, Дж. Т., Андерсен, Г. Л. и др. (2006). Применение подхода микрочипов олигонуклеотидов высокой плотности для изучения динамики популяции бактерий во время восстановления и повторного окисления урана. Заявл. Environ.Микро. 72, 6288–6298. DOI: 10.1128 / AEM.00246-06
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Cleland, E.J., Drilling, A., Bassiouni, A., James, C., Vreugde, S., and Wormald, P.-J. (2014). Пробиотические манипуляции с микробиомом хронического риносинусита. Внутр. Форум Allergy Rhinol. 4, 309–314. DOI: 10.1002 / alr.21279
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Костелло, Э.К., Лаубер, К. Л., Хамади, М., Фирер, Н., Гордон, Дж. И., и Найт, Р. (2009). Изменчивость бактериального сообщества в среде обитания человеческого тела в пространстве и времени. Наука 326, 1694–1697. DOI: 10.1126 / science.1177486
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Де Аларкон, А., Стейнке, Дж. У., Каугей, Р., Барекзи, Э., Хайз, К., Гросс, К. В. и др. (2006). Экспрессия полиморфизмов промотора гена 1-го ингибитора лейкотриен-С4-синтазы и активатора плазминогена при синусите. Am. J. Rhinol. 20, 545–549. DOI: 10.2500 / ajr.2006.20.2934
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Fokkens, W., Lund, V., Mullol, J., Alobid, I., Baroody, F., Cohen, N., et al. (2012). EPOS 2012: европейский позиционный документ по риносинуситу и полипам носа 2012. Резюме для оториноларингологов. Ринология 50, 1–12. DOI: 10.4193 / Rhino50E2
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Грайс, Э.А., Конг, Х. Х., Конлан, С., Деминг, К. Б., Дэвис, Дж., Янг, А. С. и др. (2009). Топографическое и временное разнообразие микробиома кожи человека. Наука 324, 1190–1192. DOI: 10.1126 / science.1171700
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Гасс, А. М., Рёсслерс, Г., Ньютон, И. Л., Янг, К. Р., Клепак-Церадж, В., Лори, С., и др. (2010). Филогенетическое и метаболическое разнообразие бактерий, связанных с муковисцидозом. ISME J. 5, 20–29. DOI: 10.1038 / ismej.2010.88
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Джак Д., Чарльз Т., Уайт Л. и Грир К. (2000). Анализ полифазного микробного сообщества почв, загрязненных нефтяными углеводородами, из двух северных канадских сообществ. FEMS Microbiol. Ecol. 33, 241–249. DOI: 10.1111 / j.1574-6941.2000.tb00746.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Ким, Ю.М., Ан, К. К., Ву, С. Х., Юнг, Г. Ю. и Парк, Дж. М. (2009). Синергическая деградация фенантрена консорциумом недавно выделенных бактериальных штаммов. J. Biotechnol. 144, 293–298. DOI: 10.1016 / j.jbiotec.2009.09.021
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Кунтакис, С. Э., Аранго, П., Брэдли, Д., Уэйд, З. К., и Бориш, Л. (2004). Молекулярная и клеточная стадия тяжести хронического риносинусита. Ларингоскоп 114, 1895–1905.DOI: 10.1097 / 01.mlg.0000147917.43615.c0
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Лю, К. М., Солданова, К., Нордстрем, Л., Дван, М. Г., Мосс, О. Л., Контент-Куомо, Т. Л. и др. (2013). Медикаментозная терапия снижает разнообразие и равномерность микробиоты при хроническом риносинусите, не поддающемся хирургическому лечению. Внутр. Форум Allergy Rhinol. 3, 775–781. DOI: 10.1002 / alr.21195
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Лозупоне, К., Лладсер, М. Э., Найтс, Д., Стомбо, Дж., И Найт, Р. (2011). UniFrac: эффективный показатель расстояния для сравнения микробного сообщества. ISME J. 5, 169–172. DOI: 10.1038 / ismej.2010.133
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Насидзе, И., Ли, Дж., Куинк, Д., Танг, К., и Стоункинг, М. (2009). Глобальное разнообразие микробиома слюны человека. Genome Res. 19, 636–643. DOI: 10.1101 / gr.084616.108
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Носса, К.W., Oberdorf, W. E., Yang, L., Aas, J. A., Paster, B.J., DeSantis, T. Z., et al. (2010). Дизайн праймеров гена 16S рРНК для пиросеквенирования 454 микробиома передней кишки человека. World J. Gastroenterol. 16, 4135–4144. DOI: 10.3748 / wjg.v16.i33.4135
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Оксанен, Дж., Бланше, Ф. Г., Киндт, Р., Лежандр, П., Минчин, П. Р., О’Хара, Б. и др. (2013). Веган: экология сообщества. Доступно по адресу: http: // CRAN.R-project.org/package=vegan
Google Scholar
Отт, С., Мусфельдт, М., Вендерот, Д. Ф., Хамп, Дж., Брант, О., Фолш, У. Р. и др. (2004). Снижение разнообразия хронической бактериальной микрофлоры слизистой оболочки у пациентов с активным воспалительным заболеванием кишечника. Кишечник 53, 685–693. DOI: 10.1136 / gut.2003.025403
CrossRef Полный текст | Google Scholar
Park, S.J., Kim, T.H., Jun, Y.J., Lee, S.H., Ryu, H.Y., Jung, K.J., et al. (2013).Хронический риносинусит с полипами и без полипов связан с повышенной экспрессией супрессоров передачи сигналов цитокинов 1 и 3. J. Allergy Clin. Иммунол. 131, 772–780. DOI: 10.1016 / j.jaci.2012.12.671
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Польз, М. Ф., и Кавано, К. М. (1998). Смещение в соотношении шаблонов и продуктов в ПЦР с несколькими планшетами. Заявл. Environ. Microbiol. 64, 3724–3730.
Google Scholar
Рамакришнан, В.Р., Физел, Л. М., Абрасс, Л. Дж., И Фрэнк, Д. Н. (2013a). Распространенность и обилие Staphylococcus aureus в среднем проходе у пациентов с хроническим риносинуситом, полипами носа и астмой. Внутр. Форум Allergy Rhinol. 3, 267–271. DOI: 10.1002 / alr.21101
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Рамакришнан В. Р., Физел Л. М., Гитомер С. А., Ир Д., Робертсон К. Э. и Франк Д. Н. (2013b). Микробиом среднего прохода у здоровых взрослых. PLoS ONE 8: e85507. DOI: 10.1371 / journal.pone.0085507
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Рэй, Н. Ф., Баранюк, Дж. Н., Тамер, М., Райнхарт, К. С., Герген, П. Дж., Калинер, М. и др. (1999). Расходы на здравоохранение в связи с синуситом в 1996 г .: вклад астмы, ринита и других заболеваний дыхательных путей. J. Allergy Clin. Иммунол. 103, 408–414. DOI: 10.1016 / S0091-6749 (99) 70464-1
CrossRef Полный текст | Google Scholar
Schloss, P.Д., Весткотт, С. Л., Рябин, Т., Холл, Дж. Р., Хартманн, М., Холлистер, Э. Б. и др. (2009). Представляем mothur: программное обеспечение с открытым исходным кодом, независимое от платформы, поддерживаемое сообществом, для описания и сравнения сообществ микробов. Заявл. Environ. Microbiol. 75, 7537–7541. DOI: 10.1128 / AEM.01541-09
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Шмитт, С., Цай, П., Белл, Дж., Фромонт, Дж., Илан, М., Линдквист, Н. и др. (2012). Оценка сложной микробиоты губок: основные, вариабельные и видоспецифичные бактериальные сообщества морских губок. ISME J. 6, 564–576. DOI: 10.1038 / ismej.2011.116
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Солер, З. М., Виттенберг, Э., Шлоссер, Р. Дж., Мейс, Дж. К., и Смит, Т. Л. (2011). Значения полезности состояния здоровья пациентов, перенесших эндоскопическую операцию на пазухах. Ларингоскоп 121, 2672–2678. DOI: 10.1002 / lary.21847
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Весна, с., Линс, У., Аманн, Р., Шлейфер, К.-Х., Феррейра, Л.С., Эскивель, Д.М. и др. (1998). Филогенетическая принадлежность и ультраструктура некультивируемых магнитных бактерий с необычно большими магнитосомами. Arch. Microbiol. 169, 136–147. DOI: 10.1007 / s002030050553
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Тернбо, П. Дж., Хамади, М., Яцуненко, Т., Кантарел, Б. Л., Дункан, А., Лей, Р. Э. и др. (2008). Основной микробиом кишечника у тучных и худых близнецов. Природа 457, 480–484. DOI: 10.1038 / nature07540
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Ван Кромбругген, К., Чжан, Н., Геваерт, П., Томассен, П., и Бахерт, К. (2011). Патогенез хронического риносинусита: воспаление. J. Allergy Clin. Иммунол. 128, 728–732. DOI: 10.1016 / j.jaci.2011.07.049
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
Ван Х. и Сид Б.(2003). Банк праймеров ПЦР для количественного анализа экспрессии генов. Nucleic Acids Res. 31, e154 – e154. DOI: 10.1093 / nar / gng154
CrossRef Полный текст | Google Scholar
Ян М., Памп С. Дж., Фукуяма Дж., Хван П. Х., Чо Д.-Й., Холмс С. и др. (2013). Микроокружение носа и межвидовые взаимодействия влияют на сложность носовой микробиоты и носительство S. aureus . Клеточный микроб-хозяин 14, 631–640. DOI: 10.1016 / j.chom.2013.11.005
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст | Google Scholar
У вашего носа есть свой микробиом, и его можно изменить, показывает исследование
Широко известно, что микстура кишечных бактерий может оказывать прямое влияние на наше здоровье.Новое исследование указывает на аналогичную связь между нашим благополучием и микробиомом в носу.
Верно — в вашем носу, как и во всем остальном теле, обитает множество микроорганизмов. Различные типы «хороших» или «плохих» бактерий, характерных для носовых полостей, могут в конечном итоге защитить вас от определенных проблем со здоровьем или подвергнуть вас большему риску со стороны других.
Вдохновением для этого нового исследования послужила мать одного из исследователей, у которой были проблемы с головными болями и хроническим риносинуситом — заболеванием, которое вызывает боль и отек в носовых пазухах и носовой полости.
«Моя мама перепробовала множество различных методов лечения, но ни одно из них не помогло», — говорит микробиолог Сара Лебир из Университета Антверпена в Бельгии. «Мне было жаль, что я не смог посоветовать ей какие-нибудь полезные бактерии или пробиотики для носа. Никто никогда по-настоящему не изучал это».
Лебир и ее команда проанализировали носовые бактерии у 100 здоровых добровольцев и 225 человек с хроническим риносинуситом, охарактеризовав всего 30 различных семейств бактерий. Особенно выделялась одна семья: лактобациллы.
Этих бактерий было больше в группе здоровых участников исследования — в некоторых случаях до 10 раз больше. Один конкретный штамм Lacticaseibacillus , идентифицированный, по-видимому, адаптировался к носовой жизни, развив уникальные гены, регулирующие высокий уровень кислорода в полости, и использовав тонкие трубочки, называемые фимбриями, чтобы зацепиться за них.
Следующая проблема для исследователей заключалась в том, чтобы проверить, можно ли искусственно ввести присутствие этих лактобацилл в качестве пробиотиков — то, что нелегко сделать на животных моделях.
«На самом деле нет действительно хороших моделей животных или механистических моделей для изучения взаимодействия носовых бактерий и человека-хозяина», — говорит Лебир. «Микробиом носа мышей по сравнению с людьми, безусловно, отличается».
В конце концов, команда провела эксперимент, в котором один штамм лактобацилл распыляли в носы 20 здоровых добровольцев два раза в день в течение двух недель. Хотя носовая полость обычно отфильтровывает инородные тела, здесь бактерии смогли колонизировать.
Никакие потенциальные последствия этого вмешательства для здоровья не измерялись с научной точки зрения, хотя некоторые участники сообщали, что в результате им стало легче дышать. Но в качестве доказательства концепции он показывает, что нюхание пробиотиков может быть возможным.
Важно отметить, что здесь играет роль относительно небольшой размер выборки, а это означает, что еще слишком рано делать какие-либо обобщения о популяции в целом (и мы определенно не рекомендуем пока закладывать пробиотический йогурт в нос).
Тем не менее, исследование показывает достаточно доказательств того, что микробиомы в нашем носу могут повлиять на наше здоровье, так же как микробиомы в наших желудках и других частях тела.
В дальнейшем мы могли бы предложить безопасные и эффективные методы лечения, которые могут способствовать росту определенных носовых бактерий для улучшения самочувствия.
«Мы думаем, что некоторым пациентам будет полезно реконструировать свой микробиом и ввести в нос полезные бактерии для уменьшения определенных симптомов», — говорит Лебир.«Но нам еще предстоит пройти долгий путь до клинических и механистических исследований».
Исследование было опубликовано в Cell Reports .
Микробы в нашем носу меняются в зависимости от времени года
• Основные сообщества
• Микробные смены
Что уже известно по этой теме
Известно, что бактерии, населяющие нос и придаточные пазухи — заполненные воздухом пространства, окружающие полость носа, — влияют на ряд острых и хронических заболеваний, поражающих как носовые пазухи, так и носовые пазухи. .Но мало исследований отслеживают, как эти микробные сообщества меняются с течением времени.Что добавляет это исследование
Отслеживая состав микробиоты носовых пазух четырех здоровых людей в течение двух лет, исследователи обнаружили небольшое бактериальное и грибковое сообщество, которое сохранялось на протяжении всего периода отбора проб и включало Corynebacterium, Propionibacterium, а также гриб Malassezia. restricta. Команда также наблюдала общие сдвиги в разнообразии бактериального и грибкового сообществ.Заключение
Полученные данные свидетельствуют о том, что со временем микробиота носа претерпевает изменения в составе, которые определяются как климатическими факторами, так и факторами хозяина.
Согласно новому исследованию, грибки и бактерии, населяющие наш нос и области вокруг него, меняются в зависимости от времени года. . Исследование, опубликованное в журнале Scientific Reports , является первым исследованием грибкового и бактериального состава носа и придаточных пазух носа — заполненных воздухом пространств, окружающих носовую полость.
Известно, что носовые микробы влияют на ряд острых и хронических заболеваний , поражающих как носовые пазухи, так и нос. Но мало исследований отслеживают, как эти микробные сообщества меняются с течением времени.
Бретт Вагнер Маккензи и ее коллеги из Оклендского университета отслеживали состав микробиоты носовых пазух четырех здоровых людей в течение двух лет. Исследователи собирали образцы микробиоты каждый месяц в течение первого года, а затем раз в три месяца в течение второго года.Это позволило им уловить сезонные колебания в выборках.
Основные сообщества
Команда обнаружила, что микробные сообщества, обитающие в пазухах, состояли в основном из Actinobacteria и Basidiomycota , хотя различия в микробном разнообразии существовали как внутри, так и между участниками исследования.
У людей команда обнаружила небольшое бактериальное и грибковое сообщество, которое сохранялось на протяжении всего периода отбора проб. В это ядро сообщества входили бактерии Corynebacterium , Propionibacterium и Staphylococcus , а также гриб Malassezia restricta.
Микробные сдвиги
В носовых пазухах исследователи обнаружили грибов и бактерий, численность которых варьировалась в зависимости от сезона . Семь видов бактерий и 14 видов грибов продемонстрировали значительный сдвиг за период отбора проб. Например, грибок Coniochaeta fasciculata увеличивался зимой, весной и летом, а затем уменьшался осенью.
Изменения в составе микробиоты были связаны с изменениями климатических факторов, таких как температура, количество осадков, атмосферное давление и влажность.Например, снижение содержания C. fasciculata было связано с повышением атмосферного давления, тогда как уровни C. delicatulum имели тенденцию повышаться с увеличением влажности.
Высокие уровни микробной изменчивости внутри и между людьми, а также климатических изменений в составе микробиоты предполагают, что сочетание индивидуальных и сезонных изменений влияет на носовую микробиоту, говорят исследователи.
.

 В то же время следует иметь в виду, что отсутствие большого количества эозинофилов в мазке не позволяет достоверно исключить аллергическую природу заболевания. Уровень эозинофилов также может быть повышен при неаллергическом эозинофильном рините – заболевании, при котором другие признаки (помимо повышения количества эозинофилов в крови и носовой слизи) аллергии отсутствуют. Заболевание часто сопровождается полипами и отсутствием реакции на противоаллергические (антигистаминные) препараты.
В то же время следует иметь в виду, что отсутствие большого количества эозинофилов в мазке не позволяет достоверно исключить аллергическую природу заболевания. Уровень эозинофилов также может быть повышен при неаллергическом эозинофильном рините – заболевании, при котором другие признаки (помимо повышения количества эозинофилов в крови и носовой слизи) аллергии отсутствуют. Заболевание часто сопровождается полипами и отсутствием реакции на противоаллергические (антигистаминные) препараты.
 З., Пискунов С. З. Клиническая ринология. М., 2002. 390 с.
З., Пискунов С. З. Клиническая ринология. М., 2002. 390 с.