Как повысить гемоглобин?
Как повысить гемоглобин?
Такой вопрос часто задают пациенты, но ответить на него однозначно не возможно. Нужно знать причину, почему отмечается снижение гемоглобина. При уменьшении общего количества гемоглобина, чаще всего проявляющееся уменьшением его концентрации в единице объема крови, мы говорим о наличии у человека анемии, точнее малокровия. Основной причиной понижения уровня гемоглобина является дефицит железа, который может возникнуть при снижении его общего содержания в организме. Причинами дефицита железа, в свою очередь, могут быть:
- недостаточное получение его с пищей;
- нарушение всасывания железа;
- кровопотери.
Недостаточное содержание железа в рационе обычно бывает связано с преобладанием в нем растительной пищи. Так, алиментарная недостаточность железа нередко наблюдается среди вегетарианцев. Это обстоятельство дополнительно отягощается недостаточностью витамина В12, содержащегося в животных продуктах.
Железодефицитная анемия развивается при нарушении всасывания железа в кишечнике. К такому состоянию могут привести различные патологические изменения двенадцатиперстной кишки и верхних отделов тонкой кишки. Нарушение всасывания железа может возникать после операций на желудке и двенадцатиперстной кишке, удалении части тонкой кишки. В то же время, если при поражениях желудочно-кишечного тракта не страдают желудок и верхний отдел тонкого кишечника, всасывание железа обычно не нарушается. Косвенными причинами нарушения всасывания железа могут стать хронический панкреатит, атрофический гастрит. Всасывание железа может снижаться из-за избыточного содержания в пище ингибиторов всасывания железа – кальций, фосфаты, оксалаты и др.
Наиболее частой причиной железодефицитной анемии являются кровопотери, особенно длительные, постоянные, хотя и незначительные. Организм теряет больше железа, чем получает из пищи. Если при кровотечениях из носа, маточных кровотечениях к врачу обращаются до развития тяжелых анемий, то желудочно-кишечные кровотечения могут оставаться долго незамеченными и анемия более тяжелая. Причинами таких кровопотерь могут быть эрозии и язвы желудка, эрозии пищевода, варикозное расширение вен пищевода и кардиального отдела желудка, опухоли желудка и кишечника, а так же опухоли других локализаций.
Причинами таких кровопотерь могут быть эрозии и язвы желудка, эрозии пищевода, варикозное расширение вен пищевода и кардиального отдела желудка, опухоли желудка и кишечника, а так же опухоли других локализаций.
Встречаются анемии, связанные с дефицитом в организме витамина В12 или (и) фолиевой кислоты. Дефицит витамина В12 в организме может наступить в результате нарушения его всасывания:
- недостаточная секреция хлористоводородной кислоты, пепсина и внутреннего фактора: из-за атрофии слизистой желудка, оперативного удаления части желудка, токсического воздействия на слизистую оболочку желудка, например алкоголя;
- поражение тонкой кишки при таких заболеваниях: тяжелый хронический энтерит, дивертикулез, опухоли, спру, целиакия, удаление части тощей кишки;
- конкурентное поглощение большого количества витамина В12: при инвазии широким лентецом, дисбактериозе кишечника, синдроме слепой кишки (после операции на кишечнике и погрешностях в наложении анастомозов).

Снижение концентрации гемоглобина может быть вызвано преждевременной гибелью эритроцитов, увеличением скорости разрушения эритроцитов. Такое состояние наблюдается при некоторых иммунных нарушениях (ревматойдный артрит, красная волчанка и др.), длительных инфекционных заболеваниях (гепатиты, пневмонии, туберкулез, хронический пиелонефрит и другие), в результате воздействия лекарств и химических веществ окислительного действия, ядов (укусы змей, пауков, пчел), термических поражений, инфекционных факторов, и др.
Коррекцию уровня гемоглобина проводят с учетом причины развития анемии. Важной задачей лечения является устранение основного заболевания. Поэтому при определении в крови низкого гемоглобина необходимо пройти целый ряд обследований, чтобы выяснить какая именно это анемия (железодефицитная, В12-дефицитная, связанная с дефицитом фолиевой кислоты, гемолитическая и др.). Далее необходим тщательный диагностический поиск причин малокровия: фиброгастродуоденоскопия, рентгенологическое исследование желудочно-кишечного тракта, УЗИ, обследование кишечника, анализ кала на кровь и яйца гельминтов.
Лечение хронической железодефицитной анемии у людей должно быть консилиумным. Под этим мы понимаем участие в диагностике и лечении различных специалистов в зависимости от причин, вызвавших железодефицитную анемию (хирург, терапевт, проктолог, эндоскопист, диетолог, уролог и другие). Только такой подход предполагает поиск и устранение причины заболевания. Прежде всего, это касается кровопотерь. Противоанемическая терапия при не устранённых, даже необильных кровопотерях не дает стойкого эффекта.
В лечении анемии важная роль отводится питанию. Чтобы повысить уровень гемоглобина, рекомендуется употреблять в пищу печень, почки, сердце, белое мясо курицы. Из круп отдайте предпочтение гречке, фасоли, чечевице, гороху и другим бобовым. Среди овощей лучше всего есть томаты, молодой картофель, лук, тыкву, салат. Полезна любая зелень (петрушка, одуванчик, шпинат, укроп). Богатые железом фрукты: лучше зеленые сорта яблок, бананы, гранат, абрикосы, персики, сливы, хурма и айва. Обязательно нужно пить соки: гранатовый, свекольный, морковный. Полезно также есть морепродукты, орехи (особенно грецкие), сухофрукты, шоколад (черный).
Полезно также есть морепродукты, орехи (особенно грецкие), сухофрукты, шоколад (черный).
Конечно, лечение анемии всегда включает назначение лекарственных препаратов. Невозможно устранить железодефицитную анемию б
Особенности лечения железодефицитных состояний в гастроэнтерологии :: ТРУДНЫЙ ПАЦИЕНТ
О.А.Низовцева
Институт клинической фармакологии Научного центра экспертизы средств медицинского применения, Москва
Рассматриваются патогенез, диагностика и лечение железодефицитных анемий при заболеваниях желудочно-кишечного тракта. Лечение анемии является комплексным, в качестве эффективного противоанемического средства можно рекомендовать включение в этот комплекс препарата Ферро-Фольгамма®.
Ключевые слова: железодефицитные анемии, гастроэнтерология, Ферро-фольгамма®.
Features of iron deficiency treatment in gastroenterology
O.A. Nizovtseva
Clinical pharmacology institute of Medical products survey science center, Moscow
The article describes pathogenesis, diagnostics and treatment of iron deficiency caused by digestive tract diseases. Anemia treatment should be combined; Ferro-Folgamma can be recommended as an effective antianemic drug to include to anemia treatment.
Anemia treatment should be combined; Ferro-Folgamma can be recommended as an effective antianemic drug to include to anemia treatment.
Keywords: iron deficiency anemia, gastroenterology, Ferro-Folgamma.
Сведения об авторе:
Низовцева Ольга Александровна – к.м.н., научный сотрудник Института клинической фармакологии НЦ ЭСМП, врач-терапевт ГКБ №23.
Железодефицитные состояния (ЖДС) – одна из распространенных форм алиментарной недостаточности, а железодефицитная анемия (ЖДА) является наиболее частой в структуре анемий. ЖДА – это гипохромная микроцитарная анемия, возникающая вследствие снижения ресурсов железа в организме, как правило, при хронической кровопотере или недостаточном поступлении железа извне. ЖДА наблюдается у 10–30% взрослого населения. Распространенность дефицита железа среди населения зависит от пола, возраста, экономического благосостояния населения, особенностей питания и распространенности заболеваний, сопровождающихся потерей железа [1]. По данным ВОЗ, 700 млн человек страдает железодефицитными анемиями (ЖДА). В отдельных регионах их частота среди детей достигает 30-70%, среди женщин – 11–40%, а среди девочек-подростков – 9%.
По данным ВОЗ, 700 млн человек страдает железодефицитными анемиями (ЖДА). В отдельных регионах их частота среди детей достигает 30-70%, среди женщин – 11–40%, а среди девочек-подростков – 9%.
Анемии являются довольно частым вторичным синдромом при гастроэнтерологических заболеваниях. Основными видами анемий, выявляемых у гастроэнтерологических больных, являются: ЖДА, анемия хронических заболеваний, гемолитическая анемия, В12- и фолиеводефицитная анемия, гипо-, апластические анемии. ЖДА – наиболее частая форма анемий в гастроэнтерологии, и причиной ее развития являются кровотечения, нарушения всасывания железа, диетические ограничения [1, 2]. Ряд хронических заболеваний пищеварительной системы сопровождается развитием анемии различной степени тяжести. Анемия может являться первым признаком основного заболевания, в частности опухолевого процесса пищевого канала, а также быть причиной снижения качества жизни и выживаемости пациентов, развития серии тяжелых состояний, таких как инфаркт миокарда, сердечно-сосудистая недостаточность, увеличение риска осложнений медикаментозной терапии. Перечень заболеваний пищеварительного тракта, сопровождающихся развитием анемии, достаточно широк. Причиной железодефицитных состояний наиболее часто выступают болезни верхних отделов желудочно-кишечного тракта (ЖКТ) и толстой кишки.
Перечень заболеваний пищеварительного тракта, сопровождающихся развитием анемии, достаточно широк. Причиной железодефицитных состояний наиболее часто выступают болезни верхних отделов желудочно-кишечного тракта (ЖКТ) и толстой кишки.
В патогенезе анемий при заболеваниях ЖКТ ведущими механизмами выступают хроническая кровопотеря и нарушения всасывания гемопоэтических факторов. Желудочно-кишечное кровотечение является одной из наиболее частых причин развития ЖДА как у мужчин, так и у женщин [2]. Однократные обильные или повторные, даже незначительные и скрытые кровопотери ведут к массивной потере железа, истощению его запасов в организме и развитию сначала субклинически протекающего состояния дефицита железа, а в дальнейшем – хронической постгеморрагической железодефицитной анемии. При этом количество теряемой крови может быть различным. Нередко даже значительные кровопотери бывают скрытыми и не сопровождаются видимой меленой, что представляет собой особую опасность, так как, протекая длительно и постоянно, они являются причиной развития тяжелых анемий. Кровопотери из пищевого канала могут возникать при различных заболеваниях: парадонтопатиях, эрозивных и геморрагических гастритах, гастроэзофагеальной рефлюксной болезни, язвенной болезни желудка и двенадцатиперстной кишки, грыже пищеводного отверстия диафрагмы, циррозе печени, осложненном варикозным расширением вен пищевода и желудка, при раке желудка и кишечника, неспецифическом язвенном колите, болезни Крона, дивертикулезе и полипозе кишечника, геморрое, глистных инвазиях.
Кровопотери из пищевого канала могут возникать при различных заболеваниях: парадонтопатиях, эрозивных и геморрагических гастритах, гастроэзофагеальной рефлюксной болезни, язвенной болезни желудка и двенадцатиперстной кишки, грыже пищеводного отверстия диафрагмы, циррозе печени, осложненном варикозным расширением вен пищевода и желудка, при раке желудка и кишечника, неспецифическом язвенном колите, болезни Крона, дивертикулезе и полипозе кишечника, геморрое, глистных инвазиях.
Патология пищевода в качестве причины анемии выступает нечасто. Основным фактором является скрытое кровотечение из эрозий и язв при гастроэзофагеальной рефлюксной болезни, больших грыжах пищеводного отверстия диафрагмы, эзофагитах другой этиологии и раке пищевода. Необходимо помнить о кровотечениях из варикозно-расширенных вен при портальной гипертензии. Анемия алиментарного генеза может наблюдаться при стриктурах пищевода.
Причиной нарушения всасывания гемопоэтических факторов являются и заболевания тонкой кишки. К ним можно отнести целиакию (половина пациентов с неясной этиологией ЖДА, резистентной к терапии препаратами железа), резекцию участка тонкой кишки, синдром избыточного бактериального роста в тонкой кишке, диабетическую энтеропатию, амилоидоз, склеродермию, болезнь Уиппла, туберкулез, лимфому тонкой кишки, тропическое спру, паразитарные заболевания (лямблиоз) и гельминтозы (дифиллоботриоз) [3]. У лиц, перенесших гастрэктомию, дефицит железа вначале носит латентный характер, через 1–3 года после операции развивается ЖДА. Последняя бывает обусловлена нарушением всасывания, усвоения и обмена железа в пострезекционный период. Нередко агастральные и энтерогенные анемии сопровождаются дефицитом не только железа, но и витамина В12, фолиевой кислоты, белков, что придает им смешанный характер.
К ним можно отнести целиакию (половина пациентов с неясной этиологией ЖДА, резистентной к терапии препаратами железа), резекцию участка тонкой кишки, синдром избыточного бактериального роста в тонкой кишке, диабетическую энтеропатию, амилоидоз, склеродермию, болезнь Уиппла, туберкулез, лимфому тонкой кишки, тропическое спру, паразитарные заболевания (лямблиоз) и гельминтозы (дифиллоботриоз) [3]. У лиц, перенесших гастрэктомию, дефицит железа вначале носит латентный характер, через 1–3 года после операции развивается ЖДА. Последняя бывает обусловлена нарушением всасывания, усвоения и обмена железа в пострезекционный период. Нередко агастральные и энтерогенные анемии сопровождаются дефицитом не только железа, но и витамина В12, фолиевой кислоты, белков, что придает им смешанный характер.
Железодефицитные состояния могут возникнуть вследствие недостаточного поступления железа с пищей. Резкое ограничение потребления богатой железом пищи при соблюдении диеты вследствие основного гастроэнтерологического заболевания, религиозных и традиционных обычаев, вегетарианство, общее снижение социально-экономического уровня жизни пациентов – все эти факторы обусловливают развитие ЖДА.
Хронические заболевания печени, сопровождающиеся гипопротеинемией, приводят к снижению в крови уровня трансферрина – транспортного белка, осуществляющего перенос железа в молекулу гемоглобина, что в конечном итоге обусловливает развитие ЖДА. Воспалительные заболевания кишечника, прежде всего, неспецифический язвенный колит (НЯК) и болезнь Крона, часто сопровождаются развитием анемии. Частота анемии при ВЗК, по данным литературы, достаточно вариабельна и колеблется от 6% до 74%. Анемия при НЯК (обычно гипохромная, железодефицитная) имеет, как правило, сложный генез [4]. Она объясняется не только хронической кровопотерей, но и различными обменными нарушениями, связанными с воспалительно-деструктивным процессом в кишечнике, длительной интоксикацией, недостаточным поступлением белков с пищей при анорексии у тяжелобольных, при повышенной потере белка, солей и жидкости с частым жидким стулом с кровью и слизью, невозможностью употреблять овощи и фрукты, богатые солями железа, и т.д.
Диагностируется ЖДА у больных с гастроэнтерологическими заболеваниями по совокупности анамнестических данных (указания на оперативные вмешательства на желудке или кишечнике, прием нестероидных или гормональных противовоспалительных препаратов, антикоагулянтов и антиагрегантов, язвенный анамнез, наличие хронических заболеваний печени и воспалительных заболеваний кишечника и т. д.), клинических проявлений (наличие специфического сидеропенического синдрома, проявляющегося сухостью и истончением кожи, ангулярный хейлит, дисфагия, ломкость ногтей, их поперечная исчерченность, вогнутость ногтевой пластинки, извращение вкуса и обоняния, симптом «голубых склер», мышечная слабость) и лабораторных показателей. Диагностика анемии основывается главным образом на данных лабораторных исследований, в первую очередь – на результатах клинического исследования крови с определением концентрации гемоглобина. Согласно рекомендациям ВОЗ, критерием анемии для детей является снижение концентрации гемоглобина до уровня менее 110 г/л, для женщин – менее 120 г/л (во время беременности – менее 110 г/л), для мужчин – менее 130 г/л. По степени тяжести различают анемию легкую (уровень гемоглобина крови выше 90 г/л), средней тяжести (гемоглобин – 70–89 г/л) и тяжелую (гемоглобин менее 70 г/л) [5].
д.), клинических проявлений (наличие специфического сидеропенического синдрома, проявляющегося сухостью и истончением кожи, ангулярный хейлит, дисфагия, ломкость ногтей, их поперечная исчерченность, вогнутость ногтевой пластинки, извращение вкуса и обоняния, симптом «голубых склер», мышечная слабость) и лабораторных показателей. Диагностика анемии основывается главным образом на данных лабораторных исследований, в первую очередь – на результатах клинического исследования крови с определением концентрации гемоглобина. Согласно рекомендациям ВОЗ, критерием анемии для детей является снижение концентрации гемоглобина до уровня менее 110 г/л, для женщин – менее 120 г/л (во время беременности – менее 110 г/л), для мужчин – менее 130 г/л. По степени тяжести различают анемию легкую (уровень гемоглобина крови выше 90 г/л), средней тяжести (гемоглобин – 70–89 г/л) и тяжелую (гемоглобин менее 70 г/л) [5].
В лабораторной диагностике ЖДА основное практическое значение имеют три показателя: сывороточные концентрации железа, ферритина и общая железосвязывающая способность сыворотки (ОЖСС) [4]. Сывороточная концентрация железа отражает содержание железа, связанного с трансферином, важный лабораторный показатель, на основании которого возможно проведение дифференциальной диагностики анемий и определение тактики лечения. Так, если при анемии отмечается снижение уровня сывороточного железа наряду со снижением ферритина сыворотки, это свидетельствует о железодефицитной этиологии анемии. В другом случае сниженный уровень сывороточного железа сочетается с нормальным уровнем ферритина. Это встречается при железоперераспределительных анемиях, при которых развитие гипохромной анемии связано с нарушением процесса высвобождения железа из депо. Общая железосвязывающая способность сыворотки (ОЖСС) – это общее количество железа, которое может связаться с трансферрином. В норме сывороточная концентрация железа составляет 9–27 мкмоль/л (50–150 мкг%), а ОЖСС – 54–64 мкмоль/л (300–360 мкг%). При определении ОЖСС в исследуемую сыворотку добавляют определенное количество железа. Часть добавленного железа связывается в сыворотке с белками-переносчиками, а железо, которое не связалось с белками, удаляют из сыворотки и определяют его количество.
Сывороточная концентрация железа отражает содержание железа, связанного с трансферином, важный лабораторный показатель, на основании которого возможно проведение дифференциальной диагностики анемий и определение тактики лечения. Так, если при анемии отмечается снижение уровня сывороточного железа наряду со снижением ферритина сыворотки, это свидетельствует о железодефицитной этиологии анемии. В другом случае сниженный уровень сывороточного железа сочетается с нормальным уровнем ферритина. Это встречается при железоперераспределительных анемиях, при которых развитие гипохромной анемии связано с нарушением процесса высвобождения железа из депо. Общая железосвязывающая способность сыворотки (ОЖСС) – это общее количество железа, которое может связаться с трансферрином. В норме сывороточная концентрация железа составляет 9–27 мкмоль/л (50–150 мкг%), а ОЖСС – 54–64 мкмоль/л (300–360 мкг%). При определении ОЖСС в исследуемую сыворотку добавляют определенное количество железа. Часть добавленного железа связывается в сыворотке с белками-переносчиками, а железо, которое не связалось с белками, удаляют из сыворотки и определяют его количество. При железодефицитных анемиях сыворотка пациента связывает больше железа, чем в норме, регистрируется увеличение ОЖСС [5, 6].
При железодефицитных анемиях сыворотка пациента связывает больше железа, чем в норме, регистрируется увеличение ОЖСС [5, 6].
Важное значение в лечении ЖДА имеет место устранение причин ее развития (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.), а также возмещение дефицита железа в крови и тканях и достижение полной клинико-гематологической ремиссии. В ряде случаев радикальное устранение причины ЖДА невозможно и тогда основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами [7]. Для лечения тяжелых анемий со снижением уровня гемоглобина до 60 г/л и ниже, особенно вследствие кровопотери, проводится гемотрансфузия. Однако этот метод позволяет лишь временно улучшить ситуацию, к тому же он чреват развитием некоторых осложнений (риск инфицирования, сенсибилизация, перегрузка железом, гемосидероз тканей и пр.). Поэтому гемотрансфузии применяются редко и не могут быть базисным методом коррекции анемии.
В качестве заместительной терапии при ЖДА используют препараты железа. При отсутствии противопоказаний железосодержащие препараты следует назначать внутрь, поскольку при внутривенном и внутримышечном их введении, в сравнении с пероральным приемом, повышение уровня гемоглобина не происходит быстрее [8, 9]. Парентеральные препараты железа обладают большим количеством побочных эффектов (диспепсические расстройства, лихорадка, аритмии, гемосидероз, гематурия, аллергический дерматит, анафилактический шок, абсцесс в месте введения, флебиты). Поэтому парентеральные препараты (фербитол, эктофер) должны использоваться только по строгим показаниям (непереносимость при приеме внутрь, нарушение всасывания железа в кишечнике, язвенная болезнь и воспалительные заболевания кишечника в фазе обострения).
Терапия ЖДС при заболеваниях ЖКТ проводится преимущественно препаратами железа для перорального приема, за исключением случаев тяжелой мальабсорбции и состояний после резекции тонкой кишки. Рекомендуемая ВОЗ оптимальная доза составляет 120 мг элементарного железа в сутки [10]. Более высокие дозы не увеличивают эффективность, однако могут вызвать диспепсические явления вследствие раздражения ЖКТ. Лечение препаратами железа должно быть длительным. Содержание гемоглобина повышается только к концу 3-й нед терапии железодефицитной анемии. Нормализация показателей красной крови имеет место через 5–8 нед лечения. При выборе лекарственного ПЖ следует ориентироваться не только на содержание в нем общего количества, но главным образом на количество двухвалентного железа, которое всасывается только в кишечнике. Лечение железодефицитных анемий необходимо начинать сразу после верификации диагноза и установления причин дефицита железа [7]. Суточная доза для профилактики анемии и лечения легкой формы заболевания 50–60 мг Fe2+, а для лечения выраженной анемии – 100–120 мг Fe2+. Желательным требованием к железосодержащим препаратам, является наличие дополнительных компонентов, таких как аскорбиновая и фолиевая кислоты, цианокобаламин.
Более высокие дозы не увеличивают эффективность, однако могут вызвать диспепсические явления вследствие раздражения ЖКТ. Лечение препаратами железа должно быть длительным. Содержание гемоглобина повышается только к концу 3-й нед терапии железодефицитной анемии. Нормализация показателей красной крови имеет место через 5–8 нед лечения. При выборе лекарственного ПЖ следует ориентироваться не только на содержание в нем общего количества, но главным образом на количество двухвалентного железа, которое всасывается только в кишечнике. Лечение железодефицитных анемий необходимо начинать сразу после верификации диагноза и установления причин дефицита железа [7]. Суточная доза для профилактики анемии и лечения легкой формы заболевания 50–60 мг Fe2+, а для лечения выраженной анемии – 100–120 мг Fe2+. Желательным требованием к железосодержащим препаратам, является наличие дополнительных компонентов, таких как аскорбиновая и фолиевая кислоты, цианокобаламин.
При выборе препаратов железа необходимо учитывать и их состав [7, 11]. Присутствие витамина С (аскорбиновая кислота) улучшает всасываемость ионов железа в кишечнике, предотвращая переход из двухвалентной формы в трехвалентную, а также ускоряет транспортировку железа и его включение в гем. Витамин В12 необходим для образования гемоглобина, эритроцитов, метаболизма белков, жиров, углеводов, производства энергии. Фолиевая кислота требуется для синтеза ДНК и РНК, метаболизма белков и образования красных кровяных клеток. Эти вещества не только обеспечивают синтез ДНК кроветворных клеток, но и стимулируют утилизацию железа, освобождая дополнительные количества трансферрина и активируя абсорбцию железа в кишечнике. Поэтому чаще всего самым оптимальным выбором в лечении и профилактике ЖДА являются препараты, содержащие все эти компоненты [12]. Препаратом, содержащим все эти компоненты, является Ферро-Фольгамма®. В его состав входят 112,6 мг сульфата железа (37 мг двухвалентного железа), 100 мг аскорбиновой кислоты, 10 мкг цианокобаламина и 5 мг фолиевой кислоты. Необходимо учитывать, что всасывание железа может уменьшаться под влиянием некоторых содержащихся в пище веществ (фосфорная кислота, соли кальция и др.
Присутствие витамина С (аскорбиновая кислота) улучшает всасываемость ионов железа в кишечнике, предотвращая переход из двухвалентной формы в трехвалентную, а также ускоряет транспортировку железа и его включение в гем. Витамин В12 необходим для образования гемоглобина, эритроцитов, метаболизма белков, жиров, углеводов, производства энергии. Фолиевая кислота требуется для синтеза ДНК и РНК, метаболизма белков и образования красных кровяных клеток. Эти вещества не только обеспечивают синтез ДНК кроветворных клеток, но и стимулируют утилизацию железа, освобождая дополнительные количества трансферрина и активируя абсорбцию железа в кишечнике. Поэтому чаще всего самым оптимальным выбором в лечении и профилактике ЖДА являются препараты, содержащие все эти компоненты [12]. Препаратом, содержащим все эти компоненты, является Ферро-Фольгамма®. В его состав входят 112,6 мг сульфата железа (37 мг двухвалентного железа), 100 мг аскорбиновой кислоты, 10 мкг цианокобаламина и 5 мг фолиевой кислоты. Необходимо учитывать, что всасывание железа может уменьшаться под влиянием некоторых содержащихся в пище веществ (фосфорная кислота, соли кальция и др.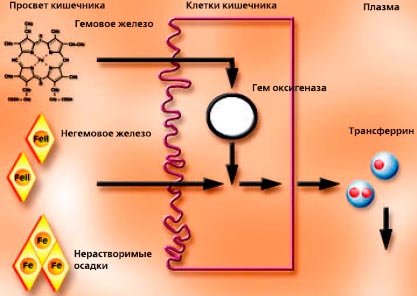 ), а также при одновременном применении ряда медикаментов (тетрациклины, соли магния). Во избежание этого Ферро-Фольгамма® производится в форме капсул, которые обеспечивают всасывание в верхнем отделе тонкой кишки. Все компоненты внутри капсулы находятся не в сухом виде, а погружены в рапсовое масло, что улучшает переносимость. Скорость всасывания лекарственных субстанций не зависит от pН и двигательной активности желудочно-кишечного тракта и позволяет поддерживать стабильную концентрацию в крови железа и витаминов, предотвращает опасность передозировки. Отсутствие раздражающего действия на слизистую оболочку желудка способствует хорошей переносимости препарата. Ферро-Фольгамма® назначается по 1 капсуле 3 раза в сутки. Продолжительность насыщающего курса терапии ЖДА составляет 1–1,5 мес, после чего необходимо продолжить поддерживающую терапию в половинной дозе в течение 3–4 мес [13].
), а также при одновременном применении ряда медикаментов (тетрациклины, соли магния). Во избежание этого Ферро-Фольгамма® производится в форме капсул, которые обеспечивают всасывание в верхнем отделе тонкой кишки. Все компоненты внутри капсулы находятся не в сухом виде, а погружены в рапсовое масло, что улучшает переносимость. Скорость всасывания лекарственных субстанций не зависит от pН и двигательной активности желудочно-кишечного тракта и позволяет поддерживать стабильную концентрацию в крови железа и витаминов, предотвращает опасность передозировки. Отсутствие раздражающего действия на слизистую оболочку желудка способствует хорошей переносимости препарата. Ферро-Фольгамма® назначается по 1 капсуле 3 раза в сутки. Продолжительность насыщающего курса терапии ЖДА составляет 1–1,5 мес, после чего необходимо продолжить поддерживающую терапию в половинной дозе в течение 3–4 мес [13].
Хороший клинический эффект препарата подтвержден данными многих исследований. В открытом контролируемом исследовании было проведено сравнение эффективности и переносимости препарата Ферро-Фольгамма® и ряда других железосодержащих препаратов (В. В.Городецкий и соавт., 2004). Было показано, что препарат действительно хорошо переносится пациентами (отсутствовали диспепсические явления или другие жалобы), и по этой характеристике он входит в группу препаратов с наименьшей частотой побочных эффектов. На фоне проводимой терапии быстро купировались субъективные и объективные клинические признаки железодефицитной анемии: общая слабость, головокружение, одышка при физической нагрузке, бледность слизистых оболочек, тахикардия [10, 11]. При этом клиническое улучшение предшествовало нормализации показателей красной крови. Наличие в препарата Ферро-Фольгамма® фолиевой кислоты и цианокобаламина является дополнительным преимуществом, так как эти компоненты влияют на разные звенья гемопоэза и эритропоэза, что значительно повышает скорость прироста гемоглобина в сравнении с препаратами содержащими только железо. Наличие аскорбиновой кислоты улучшает всасывание и усвоение железа.
В.Городецкий и соавт., 2004). Было показано, что препарат действительно хорошо переносится пациентами (отсутствовали диспепсические явления или другие жалобы), и по этой характеристике он входит в группу препаратов с наименьшей частотой побочных эффектов. На фоне проводимой терапии быстро купировались субъективные и объективные клинические признаки железодефицитной анемии: общая слабость, головокружение, одышка при физической нагрузке, бледность слизистых оболочек, тахикардия [10, 11]. При этом клиническое улучшение предшествовало нормализации показателей красной крови. Наличие в препарата Ферро-Фольгамма® фолиевой кислоты и цианокобаламина является дополнительным преимуществом, так как эти компоненты влияют на разные звенья гемопоэза и эритропоэза, что значительно повышает скорость прироста гемоглобина в сравнении с препаратами содержащими только железо. Наличие аскорбиновой кислоты улучшает всасывание и усвоение железа.
Таким образом, ЖДА достаточно часто сопровождает многие распространенные и тяжелые заболевания ЖКТ. Важным в диагностике является определение вида и причины развития анемии, а залогом успешного лечения служат своевременная терапия основного заболевания и правильная патогенетическая терапия с восполнением дефицита гемопоэтических факторов. Лечение анемии при заболеваниях ЖКТ является комплексным, в качестве эффективного противоанемического средства можно рекомендовать включение в этот комплекс препарата Ферро-Фольгамма®.
Литература
1. Дворецкий Л.И. Железодефицитные анемии. М.: Ньютиамед, 1998; 40.
2. Козловская Л.В., Рамеев В.В., Саркисова И.А. Патогенез и клиническое значение анемии хронических заболеваний. Анемия. 2005; 4: 4–10.
3. Анемия при воспалительных заболеваниях кишечника. В кн. Анемия – скрытая эпидемия. Пер. с англ. М.: МегаПро, 2004; 57–59.
4. Гликман Р.М. Воспалительные болезни кишечника: язвенный колит и болезнь Крона. В кн.: Внутренние болезни / Под ред. Т.Р. Харрисона и др.: Пер. с англ. М.: Медицина, 1996; 7:113–136.
5. Аркадьева. Диагностика и лечение железодефицитных анемий. (учебно–методическое пособие). М.: 1999; 58.
6. Долгов В.В., Луговская С.А., Морозова В.Т., Почтарь М.Е. Лабораторная диагностика анемий. М.: 2001; 84.
7. Казюкова Т.В., Самсыгина Г.А., Калашникова Г.В. и др. Новые возможности ферротерапии железодефицитной анемии. Клиническая фармакология и терапия. 2000; 2: 88–91.
8. Hugot J. P., Zouali H., Lesage S. et al. Etiology of the inflammatory bowel diseases. Int J Colorectal Dis. 1999; 14: 2–9.
9. Horina J. H., Petritsch W.Schmid C.R. et al. Treatment anemia in inflammatory bowel diseases with recombinant human erythropoietin: results in three patients. Gastroenterology.1997; 126: 1828–1831.
10. Hugot J. P., Zouali H., Lesage S. et al. Etiology of the inflammatory bowel diseases. Int J Colorectal Dis. 1999; 14: 2–9.
11. Schreiber S., Howaldt S., Schnoor M. et al. Recombinant erythropoietin for treatment of anemia in inflammatory bowel diseases. N.Engl. J.Med. 1996; 334: 619–623.
12.Provan D. Mechanisms and management of iron deficiency anaemia. Br J Haematol 1999; 105: Suppl 1: 19–26.
13. Walker A.M., Szneke P., Bianchi L.A. et al. 5-Aminosalicylates, sulfasalazine, steroid use, and complications in patients with ulcerative colitis. Am J Gastroenterol. 1997; 92: 816–820.
Эндоскопическая диагностика причин железодефицитной анемии у детей
Волерт Т. А. — зав. эндоскопическим отделением СПб ГБУЗ ДГБ №1,
Маслова Ю. А. — врач эндоскопического отделения СПб ГБУЗ ДГБ №1
г. Санкт-Петербург
Наиболее частая в популяции причина анемии — дефицит железа в организме. По данным ВОЗ железодефицитная анемия встречается среди 30 % населения планеты. Ежедневно с пищей в организм человека поступает 10—20 мг железа, из которого в норме в кишечнике всасывается около 10 %, что компенсирует суточные потери железа.
Выделяют три глобальные причины развития дефицита железа в организме:
1. Недостаточное поступление с пищей или повышенная потребность.
2. Нарушение всасывания железа в кишечнике.
3. Хронические потери крови.
Клиническими проявлениями ЖДА являются два важнейших синдрома – анемический и сидеропенический. Анемический синдром обусловлен снижением содержания гемоглобина и уменьшением количества эритроцитов. Больные жалуются на общую слабость, головокружение, шум в ушах, сердцебиения, одышку при физической нагрузке. Сидеропенический синдром (синдром гипосидероза) обусловлен тканевым дефицитом железа, что приводит к снижению активности многих ферментов (цитохромоксидаза, пероксидаза, сукцинат– дегидрогеназа и др.). Клинические проявления: извращение вкуса; извращение обоняния; дистрофические изменения кожи и ее придатков; атрофические изменения слизистой оболочки ЖКТ.
Заболевания желудочно-кишечного тракта (ЖКТ) являются одной из основных причин развития ЖДА, что обусловлено нарушением всасывания железа в кишечнике или его потерями вследствие эрозивно-язвенных, опухолевых или аутоиммунных воспалительных поражений слизистой оболочки кишечника.
Анализ кала на скрытую кровь — основной скрининговый метод выявления скрытого желудочно-кишечного кровотечения. При потере более 30 мл крови в сутки тест на скрытую кровь бывает положительным в 93 % случаев. Наиболее часто при хронической ЖДА
и особенно в случаях положительного результата кала на скрытую кровь выполняют эзофагогастродуоденоскопию (ЭФГДС) и колоноскопию. В 5-10 % случаев анемий, связанных с заболеваниями ЖКТ, при ЭФГДС и колоноскопии не удается выявить очага поражения.
В 1/4 случаев это обусловлено небольшим размером пораженного участка, который обнаруживается при повторном осмотре.
Анемия — одно из основных клинических проявлений ГЭРБ у детей раннего возраста. Кроме алиментарных причин — потери нутриентов (в том числе железа) из-за срыгивания и развития гипотрофии, в патогенезе развития анемии в этой группе детей имеет значение
развитие эрозивного эзофагита. Более высокий риск возникновения эрозивной формы ГЭРБ у детей с выраженным неврологическим дефицитом и у детей, оперированных по поводу атрезии пищевода.
При проведении эндоскопического исследования выявлено, что грыжа пищеводного отверстия диафрагмы в 65% случаев осложнена эрозивным эзофагитом, в 27% случаев – диагностировано язвенное поражение пищевода и в 8% выявлена пептическая стриктура пищевода.
В последние годы появились сообщения о том, что развитие ЖДА у детей при вскармливании коровьим молоком обусловлено микрокровопотерями из ЖКТ: оказывается, грудные дети под влиянием термолабильного белка могут терять через слизистую кишечника довольно значительные количества крови при вскармливании коровьим молоком.
Экссудативная энтеропатия и целиакия. Пониженная абсорбция алиментарного железа, как причина ЖДА, наиболее часто встречается при различных видах синдрома нарушенного кишечного всасывания. Следует иметь в виду, что при синдроме мальабсорбции генез анемии в ряде случаев может быть более сложным, его трудно считать только железодефицитным. При целиакии наряду с дефицитом железа не меньшее значение для развития малокровия приобретает дефицит белка, фолиевой кислоты, витамина В12, аминокислот и других нутриентов, необходимых для полноценного эритропоэза. Однако в наибольшей степени страдает всасывание железа, что определяет преимущественно железодефицитный характер анемии при целиакии.
При экссудативной энтеропатии, обусловленной пороками развития лимфатических сосудов кишечника, анемия также имеет преимущественно железодефицитный характер, однако причиной ее является прежде всего потеря с лимфой сывороточного железа и плазменных белков-переносчиков (трансферрин).
Кровотечение – наиболее частое осложнение дивертикула Меккеля, которое составляет примерно 20 — 30% от всех случаев ухудшения состояния. Дети до 2 лет и мужчины более склонны к кровотечениям, чем остальные пациенты.
У детей в толстой кишке встречаются так называемые ювенильные полипы (≪аденомы детского возраста≫, ≪ретенционные полипы≫). Эти опухоли растут из остатков эмбриональной ткани. Ювенильные полипы достигают в размерах 5 см, на длинных ножках, иногда гроздевидные, гладкие или дольчатые, покрыты блестящей слизистой оболочкой. Длинные ножки ювенильных
полипов часто перекручиваются и некротизируются, так что полип может самостоятельно отторгаться, обычно с небольшим кровотечением.
С возрастом ребенка увеличивается значимость для формирования ЖДА потерь железа, связанных с патологией органов пищеварения. О них необходимо думать в случае инвазии ребенка кровососущими глистами (анкилостома, некатор, власоглав), при полипозе кишечника, геморрое, трещине прямой кишки, эрозивном и язвенном процессе в желудке и двенадцатиперстной кишке, диарейном синдроме, интестинальном синдроме, сопровождающем аллергические заболевания.
Хронический Нр-ассоциированный гастрит
H. pylori-инфекция, как и любая другая, не ограничивается только местным воздействием на слизистую оболочку желудка, но способна проявить и системные эффекты (воспалительные, аутоиммунные, аллергические и др.). Helicobacter pylori так же, как и другие грамотрицательные бактерии, вступают в сложные конкурентные взаимоотношения за железо. У H. pylori-позитивных
больных имеется более низкий уровень сывороточного ферритина и железа по сравнению с H. pylori-негативными больными. Наличие H. pylori-инфекции в сочетании с железодефицитной анемией чаще сопровождается поражением всей слизистой оболочки желудка и развитием пангастрита. Проводимая пероральная ферротерапия восстанавливает и поддерживает нормальный уровень железа, однако после ее прекращения анемия вновь возвращается. Присутствие экзогенного железа приводит к усилению размножения H. pylori. Поэтому в лечении больных с железодефицитной анемией, ассоциированной с H. pylori, рекомендовано использовать эрадикационную терапию с включением ингибитора протонной помпы и 2-х антибактериальных препаратов в течение 2-х недель без дополнительного приема препаратов железа.
Язва желудка В структуре эрозивно-язвенных поражений ЖКТ у детей язвы желудка составляют, по данным разных авторов, от 6 до 15%. Язвенные поражения желудочно-кишечного тракта могут быть вторичными (симптоматическими) при различных заболеваниях
других органов (сердечно-сосудистой системы, печени, поджелудочной железы, почек с почечной недостаточностью и т. д.), а также в результате стрессовых воздействий на организм, применения ряда медикаментов (глюкокортикоиды, ацетилсалициловая кислота и т. д.).
Ангиоматоз (angiomatosis) — заболевание, морфологическим субстратом которого является избыточная пролиферация сосудов различного калибра кровеносных и лимфатических капилляров, артериол, артерий, вен. Название происходит от двух греческих слов
angeion — сосуд и ота — окончание, обозначающее опухоль. Ангиоматоз кишечника – крайне редкая патология, может проявляться рецидивирующими кровотечениями, анемией.
Язва в зоне тонкотолстокишечного анастомоза
– патология, встречающаяся у детей, перенесших в периоде новорожденности операции с резекцией илеоцекального угла. Течение заболевания рецидивирующее, сложно поддающееся терапии. При операциях у детей с ЯНЭК илеоцекальная заслонка должна быть сохранена, если это только возможно.
ВЗК У трети больных воспалительными заболеваниями кишечника (болезнь Крона, язвенный колит) выявляется анемия, имеющая сложный генез (сочетание ЖДА и анемии хронических заболеваний).
При этом дефицит железа становится следствием нескольких причин: уменьшение поступления железа вследствие отказа от приема пищи или снижения ее количества из-за опасений обострения заболевания;
хроническое кишечное кровотечение; нарушение всасывания железа в двенадцатиперстной и тощей кишке (при болезни Крона).
Хроническая кровопотеря является наиболее частым состоянием при ВЗК, причем степень ее может варьировать, достигая порой значительных масштабов, особенно при НЯК, результатом чего является развитие железодефицитной постгеморрагической анемии.
Нарушения всасывания различных нутриентов встречаются и при НЯК, и при БК, однако наибольшей выраженности они достигают у больных с БК при вовлечении в процесс тощей и подвздошной кишки или резекции последней. С позиции развития анемии особое
значение имеет нарушение всасывания железа (железодефицитная анемия), фолиевой кислоты, витамина В12 (В12-фолиеводефицитная анемия), нарушение всасывания белков с развитием белково-энергетической недостаточности, которая может приводить к гипотрансферринемии, нарушению транспорта железа и адекватного эритропоэза.
Выводы
Для исключения оккультного источника кровотечения у детей, страдающих ЖДА показано проведение ФГДС и колоноскопии.
Для исключения патологии, приводящей к нарушению всасывания железа, показана биопсия слизистой двенадцатиперстной кишки, антрального отдела и тела желудка.
Если по результатам ФГДС и колоноскопии патология не выявлена, то необходим дальнейший диагностический поиск – исследование тонкой кишки.
Анемия
Анемия – заболевание, при котором в организме нарушается синтез гемоглобина в эритроцитах, либо изменяется его форма и гемоглобин не может полноценно выполнять свои основные функции – переносить кислород к клеткам, удалять из клеток продуты обмена (процесс клеточного дыхания). Видов анемий очень много, но стоит знать, анемия всегда вторична, т.е. является симптомом другого заболевания. Лечить анемию должен врач. Сейчас очень часто среди населения встречается железодефицитная анемия – заболевание, при котором в крови гемоглобина меньше 120г/л, при норме 120-140г/л.
В народе такую анемию называют малокровием. Человек становится бледным (малокровным), быстро утомляется, начинают усиленно выпадать волосы, возможны головокружения, изменяются вкусовые ощущения, появляется потребность есть несъедобные вещи (например, мел) и другие признаки. Железодефицитная анемия может быть следствием избыточной кровопотери (послеоперационной, обильные менструации), при заболеваниях желудочно-кишечного тракта (возможно нарушение всасывания железа в кишечнике), либо повышенной потребности в ионах железа, например, при беременности. При анемии рекомендуется специальное питание, но только с его помощью с анемией не справиться. Требуется длительное лечение, направленное не только на повышение показателя гемоглобина в анализе крови, но и насыщении депо (место запаса) гемоглобина в организме.
Для лечения железодефицитной анемии используют препараты железа. Сейчас на рынке представлено много лекарственных средств — можно принимать внутрь: таблетки, покрытые оболочкой [Сорбифер дурулес], таблетки жевательные Мальтофер и Феррум Лек, капсулы Актиферрин, для детей сиропы Мальтофер, Феррум Лек, Актиферрин, для грудничков капли Актиферрин и Мальтофер, существуют также инъекционные формы: Феррум Лек, в данный момент их используют строго под контролем анализов крови. У новорожденных анемия может проявляться из-за низкого содержания гемоглобина у матери в период беременности, когда закладывается система кроветворения у ребенка. Малышу просто негде взять необходимое железо, кроме, как у мамы. Поэтому в период беременности особенно тщательно необходимо следить за показателем гемоглобина в крови. Для беременных и кормящих женщин существуют специальные формы: жевательные таблетки Мальтофер Фол, таблетки пролонгированного действия, покрытые оболочкой Тардиферон, которые в своем составе содержат не только соли железа, но и фолиевую кислоту, необходимую в период беременности в более высоких дозах.
Если Вашему малышу врач порекомендовал прием препарата железа, необходимо строго следовать совету педиатра, в зависимости от возраста ребенка выбирается форма капли или сироп (Актиферрин, Мальтофер, Феррум лек) и проводится лечение.
Анемия – заболевание, при котором возможна полноценная жизнь, главное вовремя диагностировать первичное заболевание и провести полный курс лечения под контролем врача.
Кирьянова И. Н.
Материал носит информационный характер. Лекарственные средства, биологические активные добавки и другие товары указаны в качестве примера их возможного использования и/или применения, что ни в коем случае не является рекомендацией к их применению. Перед применением лекарств, биологически-активных добавок и медицинской техники и других товаров обязательно проконсультируйтесь со специалистом.
Железодефицитная анемия как основное проявление грыжи пищеводного отверстия диафрагмы
В статье отражены проблемы диагностики и лечения железодефицитной анемии. Рассмотрен случай хронической постгеморрагической железодефицитной анемии у больного с грыжей пищеводного отверстия диафрагмы больших размеров.
Общие положения
Железодефицитная анемия (ЖДА) – это гипохромная микроцитарная анемия, возникающая из-за снижения ресурсов железа в организме. ЖДА – одно из самых частых заболеваний всех возрастных групп [1, 2].
В организме взрослого человека содержится около 3–4 г железа.
По данным Всемирной организации здравоохранения (ВОЗ), во всем мире около 1,8 млрд человек страдает ЖДА и 3,6 млрд – скрытым дефицитом железа [3]. ЖДА встречается у 10–15% взрослого населения России, среди женщин детородного возраста частота ЖДА достигает 30% [4].
Дефицит железа в организме приводит к нарушению синтеза гемоглобина и уменьшению его содержания в эритроцитах. Железо также входит в состав миоглобина, ферментов (каталаз, пероксидаз, цитохромов), отвечающих за транспорт кислорода к клеткам. Дефицит железа приводит к нарушениям окислительно-восстановительных реакций, функционирования иммунной и нервной систем [4].
Железодефицитная анемия развивается постепенно, после длительного периода латентного дефицита железа, который характеризуется уменьшением количества железа в депо (результаты анализа крови показывают сниженный уровень ферритина). Затем возникает дефицит транспортного железа (уменьшается процент насыщения трансферрина железом, возрастает железосвязывающая способность сыворотки крови). После истощения депо нарушается эритропоэз, увеличивается количество гипохромных эритроцитов и концентрация протопорфирина в эритроцитах. На всех этих этапах показатели периферической крови остаются в норме, что значительно усложняет диагностику железодефицита [5, 6].
Диагностика железодефицитной анемии основывается на клинической картине и результатах клинического анализа крови.
Согласно рекомендациям ВОЗ критерием анемии является снижение концентрации гемоглобина для женщин менее 120 г/л, для мужчин – менее 130 г/л.
По степени тяжести различают легкую анемию (гемоглобин крови выше 90 г/л), среднюю (70–89 г/л) и тяжелую (менее 70 г/л) [7].
Основные клинические симптомы анемии – слабость, повышенная утомляемость, головокружение, тахикардия.
При латентном дефиците железа отмечается снижение иммунитета за счет уменьшения количества Т-лимфоцитов, нарушения синтеза интерлейкинов [5, 8]. Из-за нарушения структуры и функции эпителиальных тканей у больных отмечается ломкость и выпадение волос, ломкость ногтей, сухость кожи, ангулярный стоматит, атрофические изменения слизистой оболочки пищевода и желудка [1, 5].
Для ЖДА характерны извращения вкуса и запаха.
При ЖДА развиваются выраженные метаболические нарушения – боли в мышцах при физической нагрузке, парестезии, гипотермия, вазомоторные расстройства. Общий анализ крови показывает снижение уровня гемоглобина, гематокрита, гипохромию, микроцитоз и анизоцитоз эритроцитов.
Ферритин сыворотки считается важнейшим показателем для оценки запасов железа в организме. Его снижение свидетельствует о дефиците железа, даже если остальные показатели в норме. Низкие значения ферритина в сочетании со сниженными показателями эритроцитов или гемоглобина указывают на железодефицитный характер анемии [9].
Процент насыщения трансферрина железом позволяет оценить состояние транспортного пула железа.
Общая железосвязывающая способность сыворотки (ОЖСС) – это потенциальная способность сыворотки крови к связыванию железа.
Железодефицитная анемия – частый симптом многих гастроэнтерологических заболеваний.
Основными причинами возникновения анемии являются кровотечения из желудочно-кишечного тракта (ЖКТ), нарушения всасывания железа, его недостаточное поступление с пищей [2, 7].
Хроническая постгеморрагическая ЖДА развивается вследствие длительных оккультных (скрытых) кровопотерь [1].
Основная задача врачей – найти причину развития анемии. Сделать это достаточно сложно, необходимо провести множество исследований.
Источниками кровопотери, особенно у лиц пожилого возраста, часто бывают кровоточащие злокачественные и доброкачественные опухоли. Другими причинами постгеморрагической ЖДА могут быть грыжа пищеводного отверстия диафрагмы, дивертикулы, варикозное расширение вен пищевода, эрозивно-язвенные поражения (язвенная болезнь желудка и двенадцатиперстной кишки, болезнь Крона, язвенный колит), сосудистые мальформации, геморрой [1, 10].
Как показали результаты проведенных в последние годы исследований, у 2,2–15,9% больных ЖДА диагностируется целиакия. Характерные при целиакии повреждения слизистой оболочки начальных отделов тонкой кишки приводят к нарушению всасывания железа [11].
Клинический случай
Больной А. 78 лет обратился в клинику с жалобами на выраженную слабость, головокружение в течение последних 2–3 лет. При обследовании в общем анализе крови отмечено снижение гемоглобина до 58 г/л.
При осмотре обращала на себя внимание бледность кожных покровов и слизистых оболочек.
С учетом того что наиболее частыми причинами развития ЖДА в пожилом и старческом возрасте являются кровотечения из ЖКТ и онкологические заболевания, больной прошел соответствующее обследование. В общем анализе крови отмечено снижение уровня гемоглобина до 62 г/л, эритроцитов до 3,98 × 106/мм3 (4,3–5,7), гематокрита до 21,8 (35,0–50,0), имелись гипохромия, микроцитоз, анизоцитоз. Биохимический анализ крови показал снижение концентрации сывороточного железа до 1,0 мкмоль/л (12,5–32,2), уровень ферритина – 120 мкг/л (20–300), трансферрина – 480 мг/дл (200–360), латентная железосвязывающая способность сыворотки – 78 мкмоль/л (2,8–53,7), ОЖСС – 75 мкмоль/л (44,8–71,6).
Онкомаркеры РЭА (раково-эмбриональный антиген), СА 19-9, СА 242, ПСА, альфа-фетопротеин в пределах референсных значений.
Анализ кала: реакция на скрытую кровь отрицательная.
При эзофагогастродуоденоскопии выявлена большая грыжа пищеводного отверстия диафрагмы (желудок вплоть до антрального отдела расположен выше диафрагмы, на слизистой оболочке имеются эрозии до 0,5 см). Взята биопсия из залуковичного отдела двенадцатиперстной кишки для исключения целиакии. По результатам морфологического исследования отмечен хронический слабо выраженный неактивный бульбит и дуоденит.
При УЗИ органов брюшной полости обнаружены признаки хронического холецистита.
По данным колоноскопии патологии не выявлено.
По данным рентгенологического исследования пищевода, желудка, тонкой кишки дистальный отдел пищевода огибает грыжевое выпячивание, в состав которого входит большая часть желудка (кардия, тело желудка и антральный отдел), при этом свод желудка расположен поддиафрагмально.
При КТ органов брюшной полости, грудной клетки выявлена грыжа пищеводного отверстия диафрагмы (ГПОД) больших размеров.
По данным УЗИ мочевого пузыря, предстательной и щитовидной желез патологии не выявлено.
Для исключения наличия источника кровопотери в тонкой кишке проведена капсульная эндоскопия. Признаков продолжающегося и состоявшегося кровотечения нет.
На основании полученных результатов можно сделать вывод, что причиной ЖДА у больного является ГПОД с пролабированием желудка в грудную полость, сопровождающимся многолетними оккультными кровотечениями.
От предложенного хирургического лечения ГПОД больной пока отказался. Пациенту назначены препараты железа (Ферро-Фольгамма по 1 таблетке 3 раза в день). На фоне приема препарата уже к концу недели отмечалась положительная динамика в виде уменьшения слабости, увеличения толерантности к физической нагрузке. Через 10 дней уровень гемоглобина возрос до 80 г/л.
Терапия железодефицитной анемии
Терапия ЖДА должна быть направлена на устранение причины развития анемии и восполнение содержания железа в организме.
Пациентам рекомендуется соблюдать диету с высоким содержанием железа (мясо, говяжья печень, гречневая крупа, яблоки, гранат и др.) и одновременно принимать аскорбиновую кислоту для улучшения всасывания железа в тонкой кишке. Кроме того, аскорбиновая кислота способствует частичной ионизации пищевого железа Fe3+ и образованию ионов Fe2+.
Однако следует помнить, что возместить дефицит железа с помощью одной диетотерапии невозможно. Необходим длительный прием препаратов железа не только до нормализации уровня гемоглобина в крови, но и до пополнения депо железа.
Предпочтение следует отдавать пероральным препаратам железа ввиду длительности их приема. Наиболее эффективными являются ионные препараты, содержащие соли двухвалентного железа (Fe2+), в частности сульфат железа (II). Они обладают хорошей растворимостью и высокой способностью к диссоциации, легко проникают в кровь путем пассивной диффузии.
Парентеральное введение железа более эффективно, но чаще сопровождается выраженными побочными действиями. Такое введение целесообразно только при нарушении всасывания железа в кишечнике, отсутствии эффекта от перорального приема, наличии противопоказаний к пероральному приему [5, 8].
В последнее время было убедительно показано, что повышение эффективности лечения ЖДА пероральными железосодержащими препаратами может быть достигнуто путем включения в их состав дополнительных компонентов, существенно облегчающих всасывание Fe2+ в тонкой кишке и способствующих его быстрому включению в процесс костномозгового кроветворения [9].
Ферро-Фольгамма: эффективность и безопасность
Ферро-Фольгамма – комбинированный антианемический препарат, содержащий двухвалентное железо в виде простой соли сульфата железа, витамин В12, фолиевую и аскорбиновую кислоту.
Аскорбиновая кислота улучшает всасывание железа в тонкой кишке.
Витамин В12 и фолиевая кислота участвуют в образовании и созревании эритроцитов.
Активные компоненты препарата находятся в специальной нейтральной оболочке, которая обеспечивает их всасывание главным образом в верхнем отделе тонкой кишки. Отсутствие местного раздражающего действия на слизистую оболочку желудка способствует хорошей переносимости препарата.
Ферро-Фольгамма назначается по 1–2 капсулы 3 раза в день после еды. Длительность приема зависит от степени тяжести ЖДА.
Высокая эффективность и безопасность применения препарата Ферро-Фольгамма у больных ЖДА подтверждена результатами многочисленных клинических исследований. Авторы, изучавшие эффективность длительного лечения Ферро-Фольгаммой больных ЖДА, отмечают исключительно хорошую переносимость препарата и крайне редкое развитие нежелательных побочных эффектов [9].
Эффективность терапии ЖДА зависит не только от устранения причин, вызвавших анемию, но и от правильного выбора эффективного комбинированного железосодержащего препарата.
Рубрика здоровье: чем опасна анемия
Каких только по происхождению анемий не бывает – гемолитическая, железодефицитная и т. д. Проблема эта не является редкостью. Железодефицитное состояние является одним из распространенных заболеваний. По данным экспертов ВОЗ на Земном шаре 700 — 800 млн человек страдают этим заболеванием с явлениями анемии или скрытым дефицитом железа. Эта наиболее часто встречается у детей, подростков и женщин. В высокоразвитых странах примерно 12% женщин страдает железодефицитным состоянием с явлениями анемии, а у четверти наблюдается скрытый дефицит железа. В странах с низким уровнем жизни и неэффективной системой медицинской помощи эти показатели значительно выше.
В силу ряда причин, о них мы расскажем ниже, анемии становятся распространенным заболеванием. Может быть, наши советы будут кому-то полезны.
Что такое анемия?
Анемия, или малокровие — болезненное состояние, характеризующееся уменьшением концентрации гемоглобина и в подавляющем большинстве случаев числа эритроцитов в единице объема крови. Анемия возникает во все периоды жизни человека не только при различных заболеваниях, но и при некоторых физиологических состояниях, например, при беременности, в период усиленного роста, кормления грудью. Важное социальное значение имеет проблема анемий у детей раннего возраста, так как анемия в этом возрасте может привести к нарушениям физического развития и обмена железа. Развитие анемии может быть связано с периодом полового созревания и климактерическим периодом, гормональными нарушениями, характером питания, заболеваниями пищеварительного тракта, печени, почек, нарушением всасывания, аутоиммунными состояниями, оперативным вмешательством и другими факторами. Нередко анемия является самостоятельным или сопутствующим симптомом многих внутренних заболеваний, инфекционных и онкологических болезней.
Общими симптомами для всех форм анемий являются бледность кожных покровов и слизистых оболочек, одышка, сердцебиение, а также жалобы на головокружение, головные боли шум в ушах, неприятные ощущения в области сердца, резкую общую слабость и быструю утомляемость.
Как можно узнать, есть ли у меня анемия?
Большое значение в диагностике анемии имеет лабораторное исследование крови — определение концентрации гемоглобина, количества эритроцитов, величины и насыщенности их гемоглобином.
Точное определение типа и причины анемии является основанием для выбора правильного лечения. Сравнительная легкость диагностики анемии часто приводит к необоснованному применению «антианемических» средств без выяснения причины и механизма развития анемии.
Такое лечение, как правило, малоэффективно, а в ряде случаев даже приносит вред больному. Несвоевременная диагностика анемии или стирание ее клинических проявлений вследствие лечения без установления причины анемии могут привести к позднему распознаванию ряда серьезных заболеваний; поэтому, в случае выявления анемического состояния необходимо придерживаться следующего правила: вначале нужно установить характер и причину анемии и только после этого назначить соответствующее лечение.
Как еще может проявляться анемия?
Другими симптомами анемии, в первую очередь вследствие недостатка железа в организме являются:
-Ломкость ногтей
Очень важным элементом, обеспечивающим нормальную жизнедеятельность различных тканей человеческого организма, является железо. Если в силу каких-либо причин запас железа организме снижается, то данное обстоятельство сразу проявляет себя повышенной ломкостью ногтей.
—Утончение и ломкость волос
Для обеспечения нормального развития и роста волос кроме витаминов необходим и такой элемент как железо. Недостаточное содержание железа в организме человека очень быстро приводит к утончению волос и развитию их повышенной ломкости.
—Необычное желание есть мел, глину, зубную пасту, сырые макароны?
При снижении в организме человека запасов железа нарушается нормальная работа особых белков, что приводит к изменению вкусового восприятия пищи и появления необычных пищевых пристрастий.
—Начинает нравиться запах масляной краски, жидкости для снятия лака с ногтей, бензина и керосина?
Для обеспечения механизма восприятия запахов необходимы особые чувствительные клетки-рецепторы. Работа этих рецепторов в значительной степени зависит от содержания в организме человека железа. Уже при незначительном снижении запаса железа работа рецепторов существенно изменяется.
Из-за чего возникает железодефицитная анемия?
Кровопотеря является важнейшей причиной развития железодефицитной анемии. Основной причиной у женщин являются менструальные кровопотери. Срок появления признаков анемии зависит от запасов железа в организме женщины.
Кровопотери из желудочно-кишечного тракта являются второй по частоте причиной железодефицитной анемии у женщин и самой частой причиной у мужчин. В развитии железодефицитной анемии наиболее значимы длительные кровотечения с небольшим объемом суточной кровопотери (10 — 20 мл/сут). Такие кровотечения могут очень длительно оставаться незаметными для пациента, поскольку лишь изменяют окраску стула на более темную.
Третьей по значимости группой причин развития железодефицитной анемии является повышенная потребность в железе. В этой группе особое внимание следует уделить повышенной потребности в железе во время беременности и кормлении грудью.
Основной запас железа человек получает во время внутриутробного развития через плаценту от своей матери и после рождения с материнским молоком. За период вынашивании беременности и лактации женщина расходует более 800 мг железа. Период беременности и лактации требует наличия адекватных запасов железа в организме женщины.
Недостаточное или однообразное питание является еще одной причиной развития анемии. В большинстве случаев отмечается недостаточное поступление в организм железа (железодефицитные анемии), белка, что нарушает образование белковой части гемоглобина (белково-дефицитные анемии). Определенное значение в развитии дефицитных анемий имеет и недостаточность таких витаминов, как В6, В12 и фолиевой кислоты (витаминодефицитные анемии), которые участвуют в синтезе гемоглобина. Нередко дефицитные анемии отмечаются при заболеваниях, сопровождающихся нарушением всасывания в кишечнике. Развитию дефицитных анемий способствуют частые заболевания, а также недоношенность.
Как лечится анемия?
Лечение заключается в устранении причин заболевания, нормализации питания и режима, назначении соответствующих препаратов: например при железодефицитной анемии — препаратов железа (сорбифер дурулеса и др).
В каких продуктах больше всего железа?
Такие продукты, как мясо, зеленые яблоки и гранаты содержат большее количество железа по сравнению с другими.
Железная диета. Как бороться с усталостью и анемией
- Доктор Майкл Мозли
- Би-би-си
Автор фото, Getty Images
Подпись к фото,
Красное мясо, зелень и зеленые овощи, орехи и семена — основные источники железа
Вы часто чувствуете усталость, страдаете от одышки и ваше сердце стучит так, будто вот-вот выпрыгнет из груди? А ваши друзья вам говорят, что вы очень бледны?
Если это так, то, вполне возможно, что у вас железодефицитная анемия, одно из самых распространенных нарушений питания и обмена веществ.
В Британии этот синдром особенно распространен среди молодых женщин. Согласно данным государственного научно-консультативного комитета по питанию, в 2011 году 21% британок в возрасте от 19 до 34 лет страдали от железодефицитной анемии.
Недавно я посоветовал своей знакомой, у которой были симптомы железодефицитной анемии, обратиться к врачу и сдать необходимые анализы. Анализ крови показал, что содержание железа было настолько низким, что врачи не понимали, как у нее хватало сил на то, чтобы подняться по лестнице. Несколько таблеток, содержащих железо, решили проблему.
Перед приемом таких препаратов следует посоветоваться с вашим лечащим врачом, потому что перечисленные выше симптомы могут быть характерны и для других заболеваний.
Какие продукты содержат железо?
Наш организм не может самостоятельно вырабатывать железо, он получает его из того, что мы едим — будь то продукты, которые богаты железом от природы, или обогащенная железом еда.
Но проблема еще заключается в том, что не все железо, которое поступает в ваш желудок с едой, одинаково хорошо усваивается.
Автор фото, Glenn Dearing
Как получить из пищи как можно больше железа:
- Ешьте зеленые листовые овощи (капусту, брокколи, щавель, латук) свежими или приготовленными на пару
- Шпинат, богатый железом, лучше немного отваривать
- Ешьте или пейте богатые витамином С продукты и напитки
- Лучше делать выбор в пользу ферментированного (кислого) хлеба
Телевизионная программа Би-би-си Trust Me I’m a Doctor решила узнать у профессора Пола Шарпа из Королевского колледжа Лондона, что необходимо есть для естественного восполнения дефицита железа.
Красное мясо особенно богато железом, которое легко усваивается организмом. Если вы не едите мясо, есть другие хорошие источники железа. В первую очередь это зеленые листовые овощи, например, шпинат и капуста, а также бобовые — например, горох и чечевица.
Но из бобовых и зеленых овощей вы получите меньше железа, чем из красного мяса.
Также железом богат ферментированный хлеб и зерновые, хотя содержащееся в этих продуктах железо не всегда хорошо усваивается организмом.
Замените кофе на апельсиновый сок
Способ приготовления этих продуктов, а также то, что вы пьете во время еды, влияет на уровень усвоения железа. Чтобы продемонстрировать это, профессор Шарп проделал ряд экспериментов, имитирующих процесс пищеварения.
Исследование Шарпа показывает, что если вы пьете апельсиновый сок с завтраком из ферментированных хлопьев, то ваш организм сможет усвоить больше железа, чем если бы вы съели этот же завтрак без апельсинового сока.
Это происходит благодаря витамину С, который способствует усвоению железа из пищи.
Если вместо сока вы выбираете на завтрак кофе, то ваш организм усвоит гораздо меньше железа, чем в случае завтрака с апельсиновым соком или просто без кофе.
Автор фото, Getty Images
Подпись к фото,
Кому сырую капусту?
Почему так происходит? По словам Шарпа, кофе богат полифенолами — химическими соединениями, которые связывают содержащееся в продуктах железо и делают его менее доступным для усвоения организмом.
Поэтому если вы выбираете на завтрак ферментированные хлопья или какой-либо другой богатый железом продукт, тогда лучше к нему добавить апельсиновый сок или свежий апельсин — это поможет повысить усваиваемость железа. Также следует подумать о том, чтобы выпить ваш утренний кофе хотя бы через полчаса после завтрака — тогда полифенолы, содержащиеся в кофе, не помешают усвоению железа.
А если вы хотите получать больше железа из овощей? Свежая капуста — очень хороший источник железа, но если вы ее пожарите или отварите, то эффект будет менее заметным.
Дело в том, что капуста сама по себе богата витамином С, но при температурной обработке, особенно если вы варите капусту, большая часть этого витамина вываривается.
Те же процессы происходят при варке и другой термической обработке и ряда других зеленых овощей, содержащих железо и витамин C: это и брокколи, и цветная капуста, и кресс-салат.
Однако есть одно исключение из этого правила — это шпинат. Как выяснилось, в отваренном шпинате на 55% больше легко усвояемого железа, чем в сыром.
Дело в том, что шпинат в большом количестве содержит оксалаты — соли щавелевой кислоты, которые связывают железо.
«Когда мы варим шпинат, оксалаты уходят в воду, а железо, содержащееся в нем, становится доступным для усвоения организмом», — поясняет профессор Шарп.
А что же с хлебом?
Мы пришли к выводу, что лучше всего выбирать хлеб, приготовленный на закваске. Дело в том, что пшеница содержит фитиновую кислоту, которая замедляет процесс усвоение железа.
При приготовлении хлеба на закваске процессы ферментации нейтрализуют действие фитиновой кислоты, за счет этого железо лучше усваивается организмом.
Абсорбция железа — обзор
60.4.1 Общие характеристики абсорбции железа
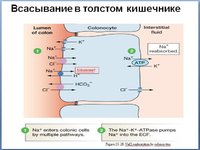
Абсорбция железа происходит через дифференцированные эпителиальные клетки (энтероциты) средней и верхней ворсинок и преимущественно в проксимальной части тонкой кишки. 17–20,22,37 Белки, участвующие в этом процессе, перечислены и кратко описаны в таблице 60.1. Незрелые энтероциты кишечных крипт обрабатывают железо совершенно иначе, чем их зрелые аналоги (как отмечалось выше).В отличие от зрелых энтероцитов, они не являются абсорбирующими по своей природе и поглощают большое количество связанного с ТФ железа из крови. 16 По мере созревания и дифференцировки клеток они приобретают свои абсорбционные характеристики, но теряют способность поглощать железо из кровотока. Метаболизм железа в клетках крипт здесь не рассматривается.
Таблица 60.1. Белки, важные для гомеостаза кишечного железа
| Белок | Функция |
|---|---|
| DCYTB a | Восстановление трехвалентного железа для абсорбции через BBM; могут существовать другие редуктазы, которые также могут играть роль в этом процессе |
| DMT1 | Котранспорт двухвалентного железа и H + в энтероциты; также транспортирует ионы марганца и, возможно, других двухвалентных металлов. |
| FLVCR | Экспорт гема через BLM в обращение |
| FPN1 | Экспортер двухвалентного железа на базолатеральной поверхности энтероцитов; рецептор гепсидина |
| Ферритин | Внутриклеточное хранение железа, в том числе внутри энтероцитов; пищевая форма железа |
| HCP1 | Возможный импортер гема на апикальной поверхности энтероцитов |
| HEPH | Окисление экспортируемого железа для связывания с трансферрином и распределения в клетках и тканях организма в крови; экспрессируется на базолатеральной поверхности энтероцитов |
| HO | Окисление молекулы гема с высвобождением двухвалентного железа в эндосомах |
| Гепцидин | Полученный из печени пептидный гормон, который ингибирует экспорт железа в кишечнике, способствуя интернализации и деградации FPN1 |
| LTF | Железо-связывающий белок грудного молока; Рецептор LTF экспрессируется на апикальной поверхности энтероцитов |
Движение железа через энтероцит обычно рассматривается с точки зрения трех фаз или стадий (рис.60.1): (1) захват железа — перемещение железа из просвета кишечника через BBM в энтероцит; (2) внутриклеточная фаза, когда железо хранится или используется внутри энтероцита или направляется в BLM для последующего экспорта; и (3) экспорт железа через BLM в интерстициальные жидкости, которые омывают серозную сторону энтероцитов, так называемая стадия переноса. Тонкий кишечник может использовать различные формы железа, и именно белки BBM должны справляться с этим разнообразием.Использование неорганического или негемового железа (которое, вероятно, связано с низкомолекулярными органическими кислотами) особенно важно и было наиболее широко изучено, но железо также может доставляться в энтероциты в виде гема, ферритина или лактоферрина (как обсуждается ниже). ). Независимо от источника питания, вероятно, что большая часть железа, поглощенного энтероцитами, попадает в общий цитозольный «лабильный» пул железа и впоследствии экспортируется через общий путь, опосредованный FPN1.
Фиг.60.1. Схема общего гомеостаза железа в организме. Изображается поглощение пищи двенадцатиперстной кишкой и проксимальным отделом тощей кишки, а также доставка железа к тканям и клеткам тела. Небольшие количества общего пищевого железа усваиваются ежедневно, и пассивные потери железа более или менее соответствуют им, хотя регулируемых выделительных процессов не существует. Каждый день во внутреннем организме перерабатывается большее количество железа, что связано с расщеплением стареющих эритроцитов макрофагами ретикулоэндотелиальной системы. Большая часть переработанного железа направляется в костный мозг для производства гемоглобина в новых эритроцитах.Печень производит регулирующий железо пептидный гормон гепсидин в ответ на увеличение запасов железа в организме, инфекцию и воспаление. Гепсидин снижает уровень железа в сыворотке за счет ингибирования экспорта железа из эпителиальных клеток кишечника, макрофагов RE и гепатоцитов.
Поглощение железа — быстрый процесс. После введения радиоактивной дозы железа в просвет проксимального отдела тонкой кишки радиоактивность обычно появляется в кровотоке в течение 15 секунд, 19 и в течение нескольких минут 60–80% от общего количества абсорбированного в конечном итоге передается в кровеносную систему. тело. 19,80 За этой начальной фазой быстрого поглощения железа следует более медленная скорость передачи, которая продолжается в течение 12–48 часов. 81 Вполне вероятно, что это железо первоначально задерживалось в энтероцитах в составе ферритина. 82–84 Однако некоторое количество железа, хранящегося в ферритине, никогда не попадает в кровоток, поскольку оно теряется, когда клетки слизистой оболочки отслаиваются в конце их жизни. 83 Во время дефицита железа не только общее количество абсорбированного железа больше, но и фракция, остающаяся внутри энтероцита, намного меньше. 85,86
Количество железа, абсорбированного кишечником, двухфазным образом связано с концентрацией железа в просвете. 19,83,87–89 При низких концентрациях железа существует прямая зависимость между концентрацией железа и абсорбцией, но с увеличением количества железа в просвете абсорбируются пропорционально меньшие количества питательного вещества, то есть процесс становится насыщаемым. . Это, в свою очередь, отражает специфические процессы поглощения железа. Однако абсорбция железа никогда не достигает полного насыщения, и при очень высоких дозах железа снова наблюдается линейная зависимость между концентрацией железа в просвете и поглощенным количеством.Эти данные предполагают, что абсорбция железа является насыщаемым, опосредованным носителем процессом при физиологических внутрипросветных концентрациях железа, но что высокопроизводительный неспецифический процесс (возможно, межклеточный поток) действует при более высоких концентрациях. То же явление было описано для поглощения других важных минералов, особенно кальция. 90,91 Очень большие дозы перорального железа могут преодолеть механизмы обратной связи, которые обычно ограничивают абсорбцию железа, 82,87 , вероятно, отражая неспецифический компонент.Процесс насыщения представляет собой то, что мы теперь называем нормальным физиологическим DMT1 / FPN1-опосредованным путем абсорбции железа, который будет подробно описан ниже.
В прошлом велись серьезные споры по вопросу о том, является ли поглощение щеточной каймой или базолатеральный отток лимитирующей ступенью в абсорбции железа (см. Ссылку 92). Телеологически имеет смысл, что этап базолатерального переноса является ограничивающим по скорости, поскольку количество железа, пересекающего BLM, не может превышать количество железа, пересекающего BBM.Кишечный эпителий по существу действует как буфер для контроля усвоения железа с пищей. Железо может перемещаться через BBM в энтероцит, но будет ли оно продвигаться дальше, зависит от экспортной способности BLM. Железо, которое не всасывается сразу, хранится в ферритине, но в конечном итоге это железо может быть использовано позже, если это необходимо для удовлетворения метаболических потребностей. Хотя ранние кинетические и физиологические исследования дали результаты, которые были несколько противоречивыми, консенсус этих исследований заключался в том, что базолатеральный перенос действительно ограничивал скорость.В последние годы с улучшенным пониманием молекулярных основ абсорбции железа и его регуляции были получены убедительные доказательства регулирующей роли базолатерального транзита железа. 93,94 Более подробно это будет рассмотрено ниже.
Анемия и дефицит железа при заболеваниях желудочно-кишечного тракта и печени
ВВЕДЕНИЕ
Железодефицитная анемия (ЖДА) — частое осложнение в повседневной клинической практике, которое часто возникает в желудочно-кишечном тракте [1-3].Поэтому пациентов с ЖДА часто направляют к гастроэнтерологам для дальнейшего обследования и / или лечения. ЖДА, связанная с расстройствами желудочно-кишечного тракта, может существенно снизить качество жизни, способствовать утомлению и даже может привести к госпитализации [4,5].
В отличие от хорошо задокументированного ЖДА, ассоциированного с воспалительным заболеванием кишечника (ВЗК) [6,7], данные о распространенности ЖДА, ассоциированного с другими патологическими состояниями желудочно-кишечного тракта, немногочисленны (Таблица 1). Рекомендации по диагностике и лечению анемии и дефицита железа доступны для ВЗК [8], но не для других состояний ЖКТ.В целом, существует три основных патологических фактора, вызывающих ЖДА, а именно хроническое кровотечение, мальабсорбцию и воспаление [9-13]. Однако другими факторами, такими как плохая или селективная диета, а также мальабсорбция железа (, например, , из-за снижения рН желудочного сока), не следует пренебрегать пациентами, направленными на оценку ЖДА. Особенно это касается пожилых пациентов [14-18].
Таблица 1 Обзор заболеваний, которые считаются связанными с железодефицитной / железодефицитной анемией.
| Состояния | Распространенность анемии или ЖДА | Преобладающие патологические факторы анемии | Ассоциация с анемией и ID | ||
| Мальквартальное кровотечение | |||||
| Неварикозное кровотечение из верхних отделов ЖКТ [33] | 80% | √ | > 80% пациентов, поступивших в больницу с неварикозным AUGIB, имели анемию на момент выписки | ||
| Целиакия [ 87-89] | 32% -69% | √ | √ | Установленная взаимосвязь между целиакией и ЖДА | |
| Наиболее часто упоминаемой причиной ЖДА является аномальное всасывание железа, но кровотечение и воспаление также являются известные сопутствующие факторы | |||||
| Кишечные паразитарные инфекции [151] | 33% -61% | √ | √ | T.инфекции trichiura и анкилостомы тесно связаны с ЖДА | |
| Рак ЖКТ [107,108,111,117,121-120] | 50% -60% | √ | √ | CRC: ЖДА связано с опухолями большего диаметра и с раком правая сторона толстой кишки | |
| Полипы: ЖДА гораздо чаще встречается у злокачественных полипов, чем у доброкачественных полипов | |||||
| ГИСО: Наиболее частым проявлением является желудочно-кишечное кровотечение, которое может привести к анемии.В педиатрической GIST анемия является наиболее частой клинической находкой | |||||
| Рак желудка: 6,8-кратный относительный риск рака желудка у пациентов с пернициозной анемией | |||||
| Злокачественные новообразования тонкой кишки: анемия среди наиболее распространенных симптомов | |||||
| Пищевода раковые заболевания: Пациенты с анемией Фанкони с повышенным риском | |||||
| Эзофагит и грыжа пищеводного отверстия диафрагмы [23-26] | 8% -42% | √ | Желудочное кровотечение из грыжи является установленной причиной ЖДА | ||
| Даже при отсутствии видимых повреждений большая грыжа может быть возможной причиной ЖДА с необъяснимой этиологией | |||||
| Бариатрическая хирургия [77,196] | 10% -40% | √ | ID и анемия являются хорошо известными рисками после бариатрических процедур, но причины многофакторны и варьируются в зависимости от конкретной процедуры и популяции пациентов. | ||
| Кишечная недостаточность [101-103] | 30% -37% | √ | √ | Кишечная недостаточность связана с ID из-за мальабсорбции, кровопотери в желудочно-кишечном тракте и множественных операций | |
| Дивертикулярная болезнь [144] | 25% | √ | Одна из наиболее частых причин кровотечения из нижних отделов ЖКТ, приводящего к ЖДА | ||
| Увеличение распространенности из-за увеличения числа пожилых людей | |||||
| Восстановительная проктоколэктомия [153] | 6% -21% | √ | √ | ЖДА из-за кровотечения через слизистые оболочки и нарушения всасывания железа у пациентов, у которых развивается симптоматический или бессимптомный поухит | |
| Потеря фекальной крови, связанная с НПВП [1] | 10% -15% | √ | Даже низкие дозы аспирина и не аспирин-НПВП увеличивают среднюю фекальную кровопотерю в 2-4 раза по сравнению с нормальной | ||
| Ангиод исплазия [1] | 5% | √ | Наиболее частая причина кровотечения из нижних отделов ЖКТ у пожилых людей | ||
| Эктазия сосудов антрального отдела желудка (GAVE) [1,48,55] | 1% -2% | √ | Хроническое медленное кровотечение обычно связано с ЖДА | ||
| Гастрит [57,66] | NA | √ | √ | H.pylori , предположительно, играет важную роль в развитии ЖДА | |
| Язвенная болезнь [197] | NA | √ | √ | Инфекция H. pylori и ЖДА, как указано выше. Кроме того, кровотечение из язвы | |
| Хронический гепатит и заболевания печени с кровотечением из ЖКТ [155] | 75% | √ | Хроническое заболевание печени может осложняться анемией, особенно из-за кровотечения | ||
| Не- алкогольная жировая болезнь печени (НАЖБП) [171] | NA | √ | Сообщается, что у одной трети взрослых пациентов с НАЖБП наблюдается дефицит железа, согласно TSAT <20% | ||
Несмотря на растущую доступность эффективных и хорошо переносимых препаратов парентерального железа для лечения ЖДА [19,20], в настоящее время отсутствует всесторонний обзор подходов к лечению ЖДА при состояниях ЖКТ.Кроме того, определения ЖДА противоречат друг другу в клинических исследованиях и публикациях, при этом термины «железодефицитная анемия», «железодефицитная анемия» и «анемия» используются почти как синонимы. Кроме того, диагностические маркеры и пороговые уровни, используемые для определения дефицита железа, сильно различаются. В то время как анемия четко определяется Всемирной организацией здравоохранения как уровень гемоглобина (Hb) <12 г / дл у женщин (<11 г / дл у беременных женщин) и <13 г / дл у мужчин, ситуация с железом неоднозначна. дефицит.Обычно уровни ферритина в сыворотке ниже 15–100 нг / мл (в зависимости от наличия сопутствующего воспаления) и насыщение трансферрина (TSAT) ниже 16–20% считаются показателями дефицита железа [1,7,8].
Эти аспекты усложняют интерпретацию и сопоставимость данных и подчеркивают необходимость стандартизации определений и надлежащей оценки статуса железа при различных заболеваниях ЖКТ и печени. В недавно опубликованных обзорах IDA обсуждается IDA в целом [21,22], но мало внимания уделяется фрагментированным, но последовательным свидетельствам того, что IDA является общей проблемой при большинстве заболеваний ЖКТ.Таким образом, цель этого обзора состоит в том, чтобы проиллюстрировать, как ЖДА представляет собой обычную сопутствующую патологию при этих расстройствах, и поощрить более унифицированный подход к лечению анемии, связанной с состоянием ЖКТ, и дефицита железа (ЖД).
Соответствующие статьи были идентифицированы путем скрининга в базе данных PubMed статей о ЖДА или ИД в контексте заболеваний желудочно-кишечного тракта или печени и связанных с ними заболеваний. Данные, представленные только в абстрактной форме, были идентифицированы путем ручного поиска по выдержкам с крупных конгрессов в этой области.Кроме того, собственные литературные базы данных авторов были проверены на наличие подходящих публикаций. Результаты были отфильтрованы для статей с информацией о распространенности анемии и / или ведении анемии. Последний поиск был проведен в июне 2015 года.
АНЕМИЯ И ИД В РАЗНЫХ СОСТОЯНИЯХ
Эзофагит и грыжа пищеводного отверстия диафрагмы
Желудочное кровотечение из очагов Кэмерона при большой диафрагмальной грыже или грыже пищеводного отверстия диафрагмы является установленной причиной ЖДА [23,24]. Однако осевая и параэзофагеальная грыжа без очагов Кэмерона также может быть связана с ЖДА [25].Сообщаемая частота ЖДА для всех типов грыж колеблется от 8% до 42%, в среднем 20% [26].
Грыжа пищеводного отверстия диафрагмы увеличивает риск ЖДА независимо от сопутствующего эзофагита [27]. Предполагаемые причины ЖДА, связанной с грыжей: механическая травма плюс эзофагит, эрозии или гастроэзофагеальный кислотный рефлюкс [25,26].
Примечательно, что отсутствие эндоскопических доказательств эрозий у большинства пациентов с ЖДА, связанной с грыжами, не исключает их причинную роль [26]. Следовательно, даже если во время эндоскопии не видно никаких повреждений, большую грыжу пищеводного отверстия диафрагмы следует рассматривать как возможную причину ЖДА необъяснимой этиологии.
Операция в сочетании с терапией ингибиторами протонной помпы (ИПП), очевидно, не лучше, чем терапия только ИПП в лечении и предупреждении рецидива ЖДА, даже в случае более крупной грыжи пищеводного отверстия диафрагмы [26].
Невариксное кровотечение из верхних отделов ЖКТ
Острое кровотечение из верхних отделов желудочно-кишечного тракта (AUGIB) — распространенное заболевание, связанное с высоким уровнем смертности от 3% до 15% [28-30]. В то время как периэндоскопическое лечение AUGIB, включая переливание крови, хорошо охарактеризовано и стандартизировано [31,32], руководящих принципов по мониторингу и лечению ЖДА у пациентов после невесаризного AUGIB все еще нет.
Недавно проведенное ретроспективное исследование показало, что более 80% пациентов, поступивших в больницу с неварикозным AUGIB, имели анемию на момент выписки [33]. Из них только 16% получили рекомендацию начать прием пероральных добавок железа, в то время как внутривенное введение железа даже не рассматривалось, что свидетельствует о том, что анемия после выписки часто игнорируется.
Исследования, анализирующие клиническое воздействие и риски, связанные с анемией после AUGIB, немногочисленны. Одно исследование показало, что пациенты со значениями гемоглобина (Hb) <10 г / дл после AUGIB имели в два раза больший риск повторного кровотечения и смертности, чем пациенты со значениями Hb ≥ 10 г / дл [34].
Двойное слепое плацебо-контролируемое исследование недавно продемонстрировало, что пациенты с ЖДА после неварикозной AUGIB явно получают пользу от добавок железа [9]. В этом исследовании пероральное и внутривенное введение железа оказалось одинаково эффективным для повышения уровня гемоглобина, вероятно, потому что у большинства пациентов не было дефицита железа при включении в исследование. Однако запасы железа (измеряемые как сывороточный ферритин) наиболее эффективно восполнялись с помощью внутривенных добавок железа.
Что касается переливания концентратов эритроцитов (эритроцитов), недавнее исследование пациентов с AUGIB (TRIGGER) [35] предполагает, что порог гемоглобина для переливания эритроцитов можно безопасно снизить без отрицательного влияния на клинические исходы.Это согласуется с результатами по другим показаниям, таким как кардиохирургия, реанимация и хирургия бедра. Соответственно, следует рассматривать ограничительные пороговые значения гемоглобина (<8,0 г / дл), за исключением пациентов с ишемической болезнью сердца как уже существующей сопутствующей патологии [35,36].
Фекальная кровопотеря, связанная с НПВП
Известно, что прием нестероидных противовоспалительных препаратов (НПВП) связан с повреждением верхних и нижних отделов ЖКТ [37–39]. Эта травма может включать кровотечение [40-42], которое может быть достаточно серьезным, чтобы привести к госпитализации [43,44].Даже низкие дозы аспирина, а также не содержащие аспирин НПВП увеличивают среднюю кровопотерю с калом примерно с 0,5 мл / день до 1-2 мл / день (, т.е. , потеря железа 0,5-1,0 мг / день) [42]. Среди пациентов, получавших аспирин в дозах ≥ 1800 мг / сутки, 31% имели кровопотерю ≥ 5 мл / сутки (, т.е. , потеря железа ≥ 2,5 мг / сутки). Хотя ингибиторы циклооксигеназы-2 (ЦОГ-2) связаны с меньшим количеством повреждений желудочно-кишечного тракта, чем традиционные НПВП, длительное использование ингибитора ЦОГ-2 также может вызывать повреждения желудочно-кишечного тракта и требует сопутствующего лечения связанной с анемией и повреждениями тонкого кишечника [45].Примечательно, что обычное эндоскопическое обследование может не выявить повреждения желудочно-кишечного тракта, вызванные приемом НПВП. Таким образом, капсульная эндоскопия рекомендуется для скрининга повреждений желудочно-кишечного тракта у пациентов, принимающих НПВП и поступающих с необъяснимой анемией или ИН [41,45,46].
Портальная гипертензивная гастропатия и сосудистая эктазия антрального отдела желудка
Портальная гипертензивная гастропатия (PHG) и эктазия сосудов антрального отдела желудка (GAVE), хотя и являются отдельными сущностями [47], могут вызывать хроническую желудочно-кишечную кровопотерю у пациентов с циррозом печени [48,49 ].Чаще всего ПГГ встречается в сочетании с циррозом печени, а также у пациентов без цирроза печени (, например, , тромбоз внутренних вен) [50]. Управление PHG основано на снижении градиентов печеночного венозного давления и заместительной терапии железом и / или переливаниях крови. В тяжелых случаях может потребоваться шунтирование [51-53].
GAVE, впервые описанный в 1953 г. [54] у пациента с хронической ЖДА, составляет до 4% всех кровотечений из верхних отделов желудочно-кишечного тракта, не связанных с варикозным расширением вен. Хотя цирроз печени обнаруживается у 30% пациентов с GAVE и встречается примерно у 2% пациентов, ожидающих трансплантации печени [49,55,56], портальная гипертензия, по-видимому, не играет важной роли в развитии GAVE.Лечение включает, как правило, эндоскопические вмешательства (, например, ., Коагуляция аргоновой плазмы, Nd: YAG-лазер) и хирургические процедуры (, например, ., Антрэктомия и анастомоз по Бильроту I) для лечения поражений, а также симптоматическую терапию с добавлением железа или крови. переливания в зависимости от степени тяжести анемии [49-52].
Аутоиммунный атрофический гастрит
Аутоиммунный гастрит (AIG) участвует в 20-30% случаев ЖДА, резистентных к пероральному железу [57,58].
AIG, впервые описанный Фабером в 1909 году как ахлоргидрическая атрофия желудка , представляет собой хроническое прогрессирующее воспалительное состояние, ведущее к уменьшению или исчезновению париетальных клеток, что приводит к снижению или отсутствию продукции кислоты (гипохлоргидрия или ахлоргидрия) [59]. Только недавно было подтверждено, что недостаточная кислотность желудочного сока является ключевым фактором нарушения всасывания железа в кишечнике [60]. ЖДА чаще ассоциируется с AIG, чем классическая злокачественная анемия, и часто предшествует дефициту витамина B 12 (по крайней мере, у фертильных женщин) [61,62].
Гастрит Helicobacter pylori
ЖДА является признанным внегастральным проявлением инфекции Helicobacter pylori ( H. pylori ) [63]. Более 50% пациентов с необъяснимой рефрактерной ЖДА имеют активную инфекцию H. pylori [57,58]. Данные, показывающие, что эрадикация H. pylori отменяет ЖДА, были подтверждены несколькими наблюдательными и интервенционными исследованиями, впоследствии обобщенными в двух метаанализах рандомизированных контролируемых исследований [57, 64, 65].Соответственно, консенсусный отчет Maastricht IV H. pylori [66] и другие национальные и международные руководства [67-69] рекомендуют эрадикацию H. pylori для лечения ЖДА неизвестного происхождения. Примечательно, что эрадикационная терапия на основе висмута более эффективна с точки зрения увеличения запасов гемоглобина и железа, чем тройная терапия на основе ИПП первого ряда у пациентов с ЖДА и инфекцией H. pylori [63].
Обсуждаются механизмы, лежащие в основе патогенеза H.pylori , связанные с ЖДА, включают скрытое хроническое желудочно-кишечное кровотечение из-за микроэрозий слизистой оболочки желудка, конкуренцию бактерий за пищевое железо, снижение концентрации аскорбиновой кислоты в желудочном соке, влияющее на абсорбцию пищевого железа и активацию провоспалительных цитокинов и гепсидина, основного регулятора гомеостаза железа (Рисунок 1) [57,70-72]. В одном исследовании штаммов H. pylori , полученных от пациентов с ЖДА, показали более быстрый железозависимый рост клеток и повышенное поглощение железа, чем штаммы от пациентов без ЖДА [73].Кроме того, H. pylori ускоряет развитие воспаления, дисплазии и аденокарциномы (опосредовано цитотоксин-ассоциированным геном фактора вирулентности H. pylori A [CagA]) в среде ID [74–76]. CagA также способствует колонизации H. pylori за счет приобретения железа, что указывает на то, что CagA обеспечивает преимущество выживания для H. pylori в этих условиях.
Рисунок 1 Патогенетические механизмы, предположительно участвующие в ассоциации железодефицитной анемии и инфекции Helicobacter pylori [63].
Бариатрическая хирургия
Появляется все больше свидетельств потенциально тяжелых, иногда даже опасных для жизни, пищевых и фармакологических последствий бариатрической хирургии [77]. ID и IDA после бариатрических процедур могут быть результатом кишечного кровотечения (, например, ., Из краевых язв) или снижения всасывания железа из-за послеоперационной непереносимости красного мяса, снижения секреции кислоты желудочного сока или исключения двенадцатиперстной кишки из пищеварительного тракта [78,79 ].
Сообщаемая частота ID у пациентов после операции желудочного обходного анастомоза колеблется от 12% до 47% [77]. Однако интерпретация зарегистрированных показателей заболеваемости осложняется различными определениями ID и IDA, периодами послеоперационного наблюдения, типами вмешательств и популяциями пациентов [80]. В большом обзоре истории болезни 959 пациентов, перенесших лапароскопическое шунтирование желудка по Ру (RYGB) в период с 2001 по 2011 год, 51,3% имели дефицит железа, а 6,7% нуждались в внутривенной терапии железом [81].Среди этих пациентов распространенность ID значительно выше у женщин в пременопаузе, чем у женщин и мужчин в постменопаузе (72% против 35% и 20%). При сравнении различных типов хирургических вмешательств в поперечном пилотном исследовании с участием 95 пациентов не было выявлено значительных различий в показателях ID после RYGB или рукавной гастрэктомии (30% против 36,4%) [82].
Поскольку было показано, что пероральное замещение железа относительно неэффективно после бариатрической хирургии, а толерантность к пероральным препаратам железа часто плохая, внутривенное лечение железом было предложено как предпочтительный вариант [77].Некоторые авторы предполагают, что могут потребоваться повторные дозы внутривенного железа в течение года [83].
Карбоксимальтоза железа (FCM) показала себя многообещающим для лечения ЖДА в пяти клинических испытаниях фазы 3 с участием 281 пациента, перенесшего бариатрическую операцию [84]. FCM продемонстрировал аналогичную или улучшенную эффективность с точки зрения увеличения значений гемоглобина, ферритина и насыщения трансферрина (TSAT) и благоприятный профиль безопасности по сравнению со стандартной медицинской помощью (сахароза железа, глюконат железа, декстран железа или пероральное железо).Кроме того, FCM дает возможность назначать более крупные однократные дозы при меньшем количестве посещений по сравнению с сахарозой железа, глюконатом железа и пероральным железом [84].
Целиакия
Целиакия — одно из наиболее распространенных хронических воспалительных состояний системы желудочно-кишечного тракта, которым страдает около 1% населения [85]. Между глютеновой болезнью и ЖДА существует хорошо известная взаимосвязь [86]. Анемия — наиболее частый симптом глютеновой болезни, обнаруживаемый у 32–69% взрослых пациентов [87–89].Примерно 80% пациентов с анемией и глютеновой болезнью также имеют дефицит железа [88,89]. У 49% пациентов с анемией и глютеновой болезнью ID оказалась единственной обнаруживаемой аномалией [87]. Напротив, среди пациентов с необъяснимой ЖДА 5% страдают гистологически подтвержденной глютеновой болезнью [57, 90, 91].
Нарушение всасывания железа (из-за атрофии ворсинок слизистой оболочки кишечника) и кровопотеря являются важными патологическими факторами анемии при целиакии [92]. Оккультное желудочно-кишечное кровотечение было обнаружено примерно у половины пациентов с глютеновой болезнью, соблюдающих безглютеновую диету [93].У некоторых пациентов недостаток питания также может быть (способствующим) причинным фактором [94]. Воспаление является основным фактором развития ЖДА, при этом интерлейкин (ИЛ) -1, ИЛ-6, ИЛ-10, интерферон (ИФН) -γ и фактор некроза опухоли (ФНО) -α являются индукторами гепсидина, основного регулятора гомеостаза железа. [92,95]. Соответственно, ЖДА, связанная с глютеновой болезнью, не поддается пероральному лечению железом [57, 92, 96], и даже после перехода на безглютеновую диету проходит 6-12 месяцев, пока большинство пациентов не выздоравливает от анемии [97]. Примечательно, что у половины пациентов сохраняется дефицит железа даже после 1-2 лет безглютеновой диеты.Медленное или недостаточное восстановление после ID может быть связано с низкой скоростью всасывания пищевого железа (1-2 мг / сут), что препятствует восполнению сильно истощенных запасов железа, и потенциально низким содержанием железа и других микроэлементов в глютене. -свободная диета [98].
Таким образом, пациенты с глютеновой болезнью явно выигрывают от немедленного внутривенного введения железа вместо перехода на внутривенное введение железа только после (предсказуемого) отсутствия ответа и / или непереносимости перорального железа [96].
Кишечная недостаточность
Кишечная недостаточность (IF) возникает в результате непроходимости, нарушения моторики, хирургической резекции, врожденного порока или связанной с заболеванием потери абсорбции и характеризуется неспособностью поддерживать баланс белково-энергетических, жидкостных, электролитных или микронутриентов [99].У пациентов, страдающих ИФ, полное парентеральное питание (ПП) является жизненно важным вмешательством до полного или частичного восстановления энтерального питания (ЭП) [100]. Тем не менее, пациенты с ИФ склонны к ИН в результате мальабсорбции, желудочно-кишечной кровопотери и многочисленных хирургических вмешательств. Соответственно, ID является наиболее распространенным дефицитом питательных микроэлементов во время и после перехода от TPN к EN, с зарегистрированными случаями 60–80% для ID и 30–37% для IDA [101–103]. Исследование, проведенное в Mayo Clinic с участием 185 пациентов, показало, что ЖДА развивалась гораздо быстрее у пациентов с фистулой и непроходимостью кишечника, чем у пациентов с синдромом короткой кишки (SBS) и нарушением моторики [104].Несмотря на высокую распространенность ИН, железо обычно не добавляют в составы для парентерального питания из-за риска анафилаксии и опасений по поводу несовместимости. Хотя данные, описывающие совместимость добавок железа с парентеральными препаратами, противоречивы [105], было обнаружено, что декстран железа совместим с растворами без содержания липидов при концентрации аминокислот> 2% [106]. Более безопасный подход будет назначать периодическое вливание терапевтических доз железа.
Рак желудочно-кишечного тракта
Анемия и ЖДА часто встречаются у пациентов с колоректальным раком (CRC) с распространенностью 50-60% [107-111].Факторами риска анемии у пациентов с CRC являются больший диаметр опухоли и рак правой части толстой кишки [108, 112]. CRC является причиной кровотечений из нижних отделов желудочно-кишечного тракта в 11–14% случаев [113], а злокачественные полипы связаны с большей кровопотерей и более частым возникновением ЖДА, чем доброкачественные полипы [114].
Анемия была также описана в контексте желудочно-кишечных стромальных опухолей (GIST), которые часто связаны с острым или хроническим кровотечением [115,116]. В педиатрической GIST анемия является наиболее частой клинической находкой (86% с симптоматической анемией) [117].Примечательно, что анемия также является одним из наиболее частых побочных эффектов иматиниба, стандартного лечения распространенного / метастатического GIST, включая рак тонкой кишки [118,119]. Помимо ЖДА, другие специфические формы анемии, такие как пернициозная анемия и анемия Фанкони, также увеличиваются у пациентов с раком желудка (относительный риск пернициозной анемии в 6,8 раза) [120], злокачественными новообразованиями тонкой кишки [121] и раком пищевода [122] ].
Примечательно, что ID (с анемией или без нее) связан с повышенным риском злокачественного новообразования желудочно-кишечного тракта через 2 года после постановки диагноза ID [123].Следовательно, необъяснимая ЖДА является важным методом выявления злокачественных новообразований ЖКТ [108]. У пациентов с запущенным CRC уровень Hb <11 г / дл является плохим прогностическим фактором [124], поэтому пациентам с CRC [124–126] и раком в целом рекомендуется быстрое направление к специалисту, а также исследование ЖДА [127]. Тем не менее, варианты лечения ЖДА не обсуждаются, так как в рекомендациях основное внимание уделяется хирургическому наблюдению при КРР.
Поскольку операция CRC может привести к значительной кровопотере, у пациентов с CRC часто используется периоперационное аллогенное переливание крови (ABT) [128,129].Однако АБТ сопряжена с определенными рисками, такими как повышенная частота инфекционных осложнений и учащение рецидивов заболевания [130–132]. Кроме того, ABT требует значительных затрат [133], а эритроциты становятся все более ограниченным ресурсом. Таким образом, были изучены альтернативные варианты, такие как периоперационное внутривенное введение железа [19,128,129,134], и продолжается многоцентровое рандомизированное контролируемое исследование по сравнению внутривенного введения карбоксимальтозы железа и перорального железа в качестве предоперационного лечения анемии у пациентов с колоректальным раком [135].Одно рандомизированное проспективное плацебо-контролируемое пилотное исследование показало, что предоперационное внутривенное введение сахарозы железа (общая доза железа 600 мг) не влияет на концентрацию гемоглобина в сыворотке или скорость переливания крови у 62 пациентов, которым назначена резекция с подозрением на колоректальный рак [128]. Тем не менее, в исследование было включено только 11 пациентов с подтвержденной анемией, 22 из которых имели нормальный гемоглобин, а у 29 пациентов не было недавних данных о статусе анемии. Более того, повышение гемоглобина на 0,5 г / дл, определяемое как первичная конечная точка, клинически несущественно и вряд ли повлияет на потребность в периоперационном переливании крови [136].В целом, испанская группа экспертов по альтернативам аллогенному переливанию крови предлагает периоперационное внутривенное введение железа пациентам с анемией, которым назначена операция на желудочно-кишечном тракте [137]; тем не менее, в целом существует лишь несколько качественных проспективных исследований достаточной мощности [138].
Дивертикулярная болезнь
Дивертикулярная болезнь, одна из наиболее частых причин кровотечений из нижних отделов ЖКТ [113, 139], составляет 30–50% случаев массивных кровотечений из нижних отделов ЖКТ [140]. Дивертикулит — серьезная проблема здравоохранения, которая часто требует хирургического вмешательства для оптимизации результатов лечения пациентов [141].Несмотря на сообщения о ЖДА, связанной с клиническими случаями дивертикулита [142, 143], информация о распространенности отсутствует. В исследовании 1124 случаев дивертикулярной болезни толстой кишки, наблюдавшихся в больничной клинике в течение 15 лет, у 44 (3,9%) было дивертикулярное кровотечение и у 25% этих пациентов была анемия (Hb <12 г / дл) [144]. Анемия чаще всего встречалась у пожилых пациентов (60 лет и старше) и у пациентов с острым кровотечением.
Ангиодисплазия
Ангиодисплазия — это плохо изученное клиническое состояние, включающее хрупкие, тонкостенные сосудистые мальформации, которые подвержены разрыву и, таким образом, могут вызывать тяжелое желудочно-кишечное кровотечение [145].Ангиодисплазия составляет до 5% случаев желудочно-кишечных кровотечений в целом и до 40% случаев неясных желудочно-кишечных кровотечений [146, 147]. Было обнаружено, что ангиодисплазия присутствует у 61% пациентов старше 60 лет, часто с сопутствующими заболеваниями [148]. Хронической ангиодисплазией может быть трудно управлять из-за частого повторного кровотечения из множественных поражений, сгруппированных в различных локализациях желудочно-кишечного тракта, и поэтому часто приводит к хронической ЖДА [149].
В прошлом пациенты с ангиодисплазией обычно получали многочисленные и частые переливания крови и страдали поражением органов-мишеней из-за рефрактерной анемии [149].Современные препараты железа для внутривенного введения могут считаться ценным вариантом лечения, если кровопотеря превышает 10 мл / сут (, т.е. , около 5 мг железа) [149].
Кишечные паразитарные инфекции
Несколько исследований показали, что паразитарные инфекции, особенно T. trichiura и анкилостомы, тесно связаны с ЖДА [150-152]. Инфекции анкилостомы связаны с повреждением слизистых оболочек и эндогенной потерей железа [151], тогда как T. trichiura и E.histolytica вызывают кровотечение и дизентерию, вторгаясь в слизистую оболочку толстой кишки. Соответственно, кишечные паразитарные инфекции считаются предикторами ЖДА.
Восстановительная проктоколэктомия
Частым осложнением восстановительной проктоколэктомии является поучит, который, в свою очередь, связан с ЖДА (6–21% пациентов с функциональными мешочками) из-за кровотечения слизистой оболочки и нарушения всасывания железа [153]. Примечательно, что поучит может протекать бессимптомно, но все же быть связан с ЖДА, как и мешочки при отсутствии поучита.У пациентов с непереносимостью или отсутствием реакции на пероральное введение железа, внутривенное введение железа и средств, стимулирующих эритропоэз (ЭСС), может исправить анемию. Другой дефицит, дефицит витамина B 12 , встречается у 25–53% получателей сумок (по сравнению с 3–40% в общей популяции), что также является частой причиной анемии. В целом, дефицит витамина B 12 может быть решен с помощью перорального цианокобаламина [153, 154], что позволяет предположить постпроцедурное изменение диетических привычек как главную причину этого дефицита.
Хронический гепатит и заболевания печени
Среди пациентов с хроническим заболеванием печени 75% страдают анемией [155], в основном из-за острого или хронического желудочно-кишечного кровотечения, которое, как следствие, может привести к дефициту железа. Острое желудочно-кишечное кровотечение — потенциально серьезное осложнение портальной гипертензии и вторая по частоте причина смертности пациентов с циррозом печени. Повышенный риск кровотечения при тяжелом гепатоцеллюлярном заболевании может быть результатом нарушения свертывания крови из-за снижения синтеза факторов свертывания крови гепатоцитами и более низкого числа тромбоцитов.Первоначальное лечение направлено на коррекцию гиповолемии и восстановление стабильной гемодинамической функции (, например, , коллоиды на основе желатина, растворы человеческого альбумина или переливание эритроцитов) [155]. Кроме того, ЖДА, вызванное хронической кровопотерей, можно лечить пероральным или внутривенным введением железа в случаях запущенного хронического заболевания печени.
Примечательно, что анемия часто ассоциируется как с пегинтерфероном (PEG-IFN), так и с рибаварином (RBV) при лечении хронической инфекции вируса гепатита C (HCV), особенно когда эти препараты вводятся в комбинации [156–158].Согласно руководящим принципам ВОЗ, анемия 1 степени (Hb 10–11 г / дл) регистрируется до 30%, а 2 степени (<10 г / дл) - 9–10% случаев. Было показано, что добавление противовирусных препаратов прямого действия (ПППД), таких как телапревир (TVR) или боцепревир (BOC), как часть более эффективной противовирусной тройной комбинированной терапии, увеличивает анемию до 20% по сравнению с PEG-IFN / RBV у пациентов, не получавших и не получавших лечения [159–163]. Поскольку эта вызванная лечением анемия в основном возникает из-за гемолиза, рекомендуется снижение дозы RBV до 50% с последующим введением рекомбинантного эритропоэтина [156, 164–166].Оценка полиморфизма инозинтрифосфатазы может помочь предсказать риск анемии и ответ на лечение [156, 167–169]. ПППД второго поколения, включая симепревир (SMV), софосбувир (SOF), даклатасвир (DCV) и ледипасвир (LDV), одобренные в комбинации (, например, ., SOF / SMV) как схемы без IFN для лечения генотипа 1 Инфекция ВГС обеспечивает значительно более высокий уровень излечения и более короткую продолжительность лечения, а также снижает уровень заболеваемости анемией, составляющей от 5% до 20% [170].
Неалкогольная жировая болезнь печени
Неалкогольная жировая болезнь печени (НАЖБП) становится наиболее распространенным заболеванием печени во всем мире (оценочная распространенность составляет 25-30%), при этом у одной трети взрослых пациентов наблюдается дефицит железа (TSAT <20%) [171]. ID был значительно связан с женским полом, ожирением, повышенным ИМТ, более низким потреблением алкоголя, небелой расой и повышенными уровнями IL-6 и IL-1ß. В отличие от пациентов с ожирением низкой степени воспаления, уровни гепсидина в сыворотке крови были низкими у пациентов с НАЖБП с ID, что отражает соответствующий ответ передачи сигналов гепсидина на ID.Авторы пришли к выводу, что изначально системное воспаление, вызванное ожирением, может повышать уровни гепсидина и вносить вклад в ID, но после установления ID гепсидин соответствующим образом подавляется [171]. Подобные результаты снижения всасывания железа в кишечнике, которые обратно пропорциональны уровням гепсидина в сыворотке и моче, были зарегистрированы при синдроме дисметаболической перегрузки железом (DIOS) [172], который связан с половиной случаев НАЖБП. Основываясь на исследованиях экспрессии генов печени у педиатрических пациентов с неалкогольным стеатогепатитом (НАСГ), предполагается, что: (1) пониженный уровень рецептора трансферрина I у пациентов с НАСГ является индикатором пониженной эритропоэтической активности в костном мозге, что является типичным особенность анемии хронического воспаления; и (2) повышенная экспрессия трансферрина и рецептора трансферрина II может привести к усилению регуляции гепсидина, что приведет к нарушению всасывания железа в двенадцатиперстной кишке.Кроме того, авторы продемонстрировали, что повышенные уровни ферритина в сыворотке не отражают увеличение запасов железа в печени у пациентов с НАСГ, а скорее являются следствием воспаления печени и / или ожирения [173].
ОБСУЖДЕНИЕ
Хотя происхождение ЖДА часто является многофакторным, была установлена тесная связь с различными состояниями ЖКТ (Таблица 1) [1,2]. Тем не менее, ведение пациентов с ЖДА часто остается неадекватным [1,4].
Даже без анемии ИН может существенно повлиять на физические и когнитивные функции и качество жизни ( e.g ., усталость) [174-177] (рисунок 2). Это подтверждает необходимость регулярной оценки статуса железа и рассмотрения клинических последствий любого нарушения статуса железа. Пациенты с типичными желудочно-кишечными симптомами, такими как боль в эпигастрии, изменение привычки кишечника, потеря веса, раннее насыщение или плохой аппетит, должны быть обследованы на ЖД и анемию, поскольку эти симптомы часто связаны с острой или хронической кровопотерей, мальабсорбцией и / или или хроническое воспаление [5]. При планировании лечения ID / IDA и выборе пути введения железа следует учитывать частоту и величину кровопотери, а также известные побочные эффекты перорального приема железа [4].
Рисунок 2 Роль железа в основных клеточных функциях [178].
Хотя хроническое желудочно-кишечное кровотечение и мальабсорбция при желудочно-кишечных состояниях являются общепризнанными причинами ID / IDA [5,12,13], следует также учитывать другие факторы, такие как возраст и хроническое воспаление, которые подавляют доступность железа за счет повышения уровня гепсидина [ 2,15,179]. Нормальный гомеостаз железа основан на двух столпах: абсорбция пищевого железа энтероцитами двенадцатиперстной кишки и верхних отделов тощей кишки (1-2 мг / сут) и рециркуляция железа через фагоцитоз стареющих эритроцитов (20-25 мг / сут. ) [179].Абсорбированное или переработанное железо временно сохраняется в моноцитах / макрофагах ретикулоэндотелиальной системы, откуда оно высвобождается через ферропортин , загружается на трансферрин и транспортируется в костный мозг для эритропоэза. Гепсидин является ключевым регулятором гомеостаза железа, блокируя опосредованное ферропортином высвобождение железа из энтероцитов и макрофагов и нарушая использование пищевого или дополнительного перорального железа. У пациентов с воспалением высвобождение железа из ретикулоэндотелиальной системы снижается до 44% от измеренного у здоровых людей [180].
Диагностика анемии и ID включает стандартные лабораторные тесты (Hb, сывороточный ферритин, TSAT) и анализ крови, при этом низкий уровень гемоглобина в сыворотке или аномальные показатели эритроцитов обычно являются первоначальным признаком рутинного общего анализа крови [5,181]. В некоторых регионах пациенты с анемией должны пройти обследование на гемоглобинопатию, чтобы исключить генетические причины анемии. Поскольку между руководящими принципами по различным состояниям желудочно-кишечного тракта относительно уровня анемии, требующего последующего наблюдения, существует мало единого мнения, было рекомендовано провести дальнейшее исследование анемии любой степени на наличие ИН (рис. 3) [1].
Рис. 3 Предлагаемый подход к оценке и лечению железодефицитной / железодефицитной анемии в клинической практике.
1 У пациентов с воспалением уровень ферритина <100 нг / мл следует рассматривать как дефицит железа; 2 Повышение гемоглобина <2 г / дл за 4 недели. Stein и др. [6]. CHr: содержание гемоглобина в ретикулоцитах; CRP: C-реактивный белок; ESA: агент, стимулирующий эритропоэз; Hb: гемоглобин; % HYPO: процент гипохромных эритроцитов; ID: дефицит железа; ЖДА: железодефицитная анемия; TSAT: насыщение трансферрина.
В клинической практике статус железа в основном оценивается на основе уровня ферритина в сыворотке [182]. Однако сывороточный ферритин подвержен гендерным различиям и ложно завышенным уровням в популяциях с воспалительными реакциями, поскольку он также является реагентом острой фазы [181]. Таким образом, диагностическое обследование пациентов с анемией (, т. Е. , мужчин с Hb <13 г / дл или небеременных женщин с Hb <12 г / дл) должно включать СРБ для выявления основных воспалительных реакций (рекомендуемое пороговое значение 5 мг / л) и TSAT (рекомендуемое пороговое значение 20%), маркера низкой доступности железа, на которую в меньшей степени влияют воспалительные реакции [181, 182].
Дополнительные маркеры ID включают процент гипохромных эритроцитов (% HYPO, рекомендуемое пороговое значение 5%) и содержание гемоглобина в ретикулоцитах (CHr, предлагаемое пороговое значение 29 пг), а также сывороточные уровни растворимых рецепторов трансферрина ( sTfR) и протопорфирин цинка (ZPP) [17,181]. Поскольку уровни sTfR отражают эритропоэтическую активность, а не статус железа, sTfR нельзя использовать у пациентов, получавших ЭСС.
Аналогично пациентам с ВЗК, заместительную терапию железом следует начинать и у пациентов, не страдающих ВЗК, если ЖДА будет четко установлено или признано вероятным на основании оцененных маркеров железа.Варианты лечения ЖДА включают пероральное и парентеральное введение железа, средства, стимулирующие эритропоэз, и переливание крови. Широко поддерживается добавка железа как для коррекции анемии, так и для восполнения запасов железа в организме [1]. В настоящее время первым подходом к лечению ЖДА является пероральный прием железа; обычно 200 мг железа вводят два раза в день, но более низкие дозы могут быть столь же эффективными и лучше переноситься [1]. Однако эффективность перорального приема железа может быть ограничена при нарушении поглощения желудочно-кишечного тракта ( e.g ., из-за хронических воспалительных состояний, целиакии или резекции двенадцатиперстной кишки) или пациенты плохо соблюдают режим лечения (, например, ., из-за побочных эффектов со стороны желудочно-кишечного тракта, таких как тошнота, метеоризм и диарея [8]). Также нельзя быстро и адекватно восполнить дефицит железа, возникающий в результате хронического или острого желудочно-кишечного кровотечения или периоперационной кровопотери, с помощью перорального приема железа. Примечательно, что пероральное введение железа может усугублять существующие симптомы желудочно-кишечного заболевания [4,7], и особенно пероральные соли двухвалентного железа приводят к окислительному стрессу, о чем свидетельствует повышенный уровень железа, не связанного с трансферрином (NTBI) [183].
Внутривенное введение железа доказало свою эффективность и переносимость в широком диапазоне терапевтических областей и рекомендовано в соответствующих руководствах по лечению [1,8,127,184-186]. В частности, парентеральное введение железа рекомендуется пациентам с желудочно-кишечными заболеваниями, которые не могут адекватно лечиться пероральными добавками железа из-за тяжелых побочных эффектов со стороны желудочно-кишечного тракта, недостаточной абсорбции или анемии, требующей срочной коррекции. Внутривенное замещение железа способствует более быстрой коррекции ЖКТ и позволяет избежать побочных эффектов со стороны ЖКТ за счет обхода желудочно-кишечного тракта.Хотя внутривенное введение железа обходится дороже, чем пероральное лечение, его введение медицинским работником обеспечивает соблюдение и более надежное восполнение запасов железа, что, в свою очередь, может предотвратить рецидив анемии и связанные с этим затраты на лечение в долгосрочной перспективе.
Недостаточное использование внутривенного железа в значительной степени основано на прошлом опыте с высокомолекулярным декстраном железа (HMWID), который связан с анафилактическими реакциями и поэтому был удален с рынка в Соединенных Штатах и Европе.В последние годы безопасность внутривенного введения железа значительно повысилась за счет новых, хорошо переносимых препаратов [57, 149, 187]. Обзор, выпущенный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), изучающий серьезные побочные реакции на различные внутривенные соединения (сахароза железа, глюконат железа и низкомолекулярный декстран железа) показал совокупную скорость только <1: 200000 [188, 189]. В 2013 году Европейское агентство по лекарственным средствам (EMA) опубликовало отчет об оценке [190], в котором был сделан вывод о том, что преимущества внутривенных железосодержащих лекарственных препаратов продолжают перевешивать риски при лечении дефицита железа, когда пероральный путь введения недостаточен или плохо переносится.Примечательно, что EMA устранило необходимость в тестовой дозе, но при этом должны быть доступны обученный персонал и реанимационные учреждения для лечения анафилактических или анафилактоидных реакций при введении любого внутривенного продукта железа.
Традиционный расчет дефицита железа (доз железа) по формуле Ганцони подвержен ошибкам, неудобен и недооценивает потребности в железе [191]. Соответственно, более простой режим фиксированных доз (карбоксимальтозы железа), основанный на гемоглобине и массе тела (таблица 2), был протестирован на пациентах с ВЗК, и было обнаружено, что он превосходит дозировку, рассчитанную по Ганцони (сахарозы железа), с точки зрения эффективности. и соблюдение [192].Эта новая схема дозирования может в равной степени использоваться в качестве простого руководства по дозировке для других групп пациентов и препаратов железа, которые можно вводить в дозах 1000 мг на прием для эффективного и быстрого восполнения запасов железа. Большинство данных клинических исследований и наблюдений по применению высоких доз железа было получено с использованием карбоксимальтозы железа и низкомолекулярного декстрана железа. В случае тяжелой анемии дозу железа следует увеличить на 500 мг.
Таблица 2 Расчетный общий дефицит железа (мг элементарного железа) на основе гемоглобина и массы тела.
| Степень дефицита железа | Уровень гемоглобина (г / дл) | Дефицит железа (мг) | |
| Масса тела | Масса тела | ≥ 70 кг | |
| Умеренная | 10-12 (женщины) | 1000 | 1500 |
| 10-13 (мужчины) | |||
| Тяжелая | 7 -10 | 1500 | 2000 |
| Критическое | <7 | 2000 | 2500 |
В ответ на парентеральное введение железа ферритин сыворотки значительно повышается в течение первых 8 недель после инфузии.Следовательно, уровень ферритина следует контролировать только через 8–12 недель, а в случае перегрузки железом (TSAT> 50%) лечение следует соответственно скорректировать.
Лечебный ответ на внутривенное замещение железа можно определить как повышение уровня гемоглобина на ≥ 2 г / дл в течение примерно 4–8 недель инфузии и восстановление соответствующей доступности железа (TSAT ≥ 30%). Пациентам, у которых наблюдается ограниченный ответ на внутривенное введение железа или отсутствует ответ, особенно с анемией или хроническим воспалением, следует рассмотреть возможность дополнительного лечения ЭСС (целевой уровень Hb ≤ 12 г / дл).В целом гастроэнтерологи все чаще рекомендуют внутривенное введение железа [1,5,8,149].
Независимо от выбранного маршрута, терапия железом должна продолжаться после разрешения анемии до тех пор, пока запасы железа не будут полностью восполнены [4]. После нормализации уровней гемоглобина и показателей эритроцитов их следует контролировать через регулярные промежутки времени [1]. Авторы рекомендаций Британского общества гастроэнтерологов предлагают обследования каждые 3 месяца в течение одного года, затем еще через год и немедленно при повторном появлении симптомов анемии [1].
Переливание крови следует использовать только в качестве последнего варианта и в качестве экстренной помощи при возникновении опасной для жизни ситуации (, например, ., В тяжелых случаях острого кровотечения) [4,5]. Существует множество данных о послеоперационной смертности и заболеваемости после переливания крови, даже после переливания одной единицы эритроцитов [193–195]. Следовательно, ограничительный подход к переливанию крови оправдан, за исключением пациентов, у которых ишемическая болезнь сердца является ранее существовавшей сопутствующей патологией [35, 36, 195].У пациентов с заболеваниями желудочно-кишечного тракта трансфузии должны быть направлены на восстановление гемоглобина до безопасного уровня, но не обязательно до нормальных значений, а затем следует назначать препараты железа для пополнения запасов [1].
Диета | Институт железных заболеваний
Достижение баланса железа с помощью диеты
Если человек страдает дефицитом железа, он или она захочет принимать в пищу вещества или продукты, которые увеличивают или улучшают усвоение железа, и избегать продуктов или веществ, ухудшающих усвоение. Если у человека аномально высокий уровень железа в организме, он или она захочет потреблять продукты или вещества, которые снижают количество всасываемого железа.Людям со сложными проблемами баланса железа, связанными с серповидно-клеточной анемией, талассемией, заболеваниями крови и раком, необходимо разработать индивидуальный план диеты, начиная с диеты для поддержания баланса железа.
Вещества, увеличивающие абсорбцию железа
Аскорбиновая кислота или витамин С естественным образом содержатся в овощах и фруктах, особенно в цитрусовых. Аскорбиновая кислота также может быть синтезирована для использования в добавках. Аскорбиновая кислота усиливает усвоение питательных веществ, таких как железо. В исследованиях влияния аскорбиновой кислоты на абсорбцию железа, 100 миллиграммов аскорбиновой кислоты увеличивали абсорбцию железа из определенного приема пищи в 4 раза.14 раз.
Алкоголь
Хотя алкоголь может улучшить усвоение железа, никого не поощряют употреблять алкоголь как средство улучшения статуса железа. Известно, что умеренное употребление алкоголя приносит пользу для здоровья, но чрезмерное употребление алкоголя или злоупотребление алкоголем, особенно в сочетании с высоким уровнем железа в организме, увеличивает риск повреждения печени, рака печени и производства клеток крови. Приблизительно 20-30% тех, кто много употребляет алкоголь, получают вдвое больше диетического железа, чем умеренно или мало пьющие, но злоупотребление алкоголем увеличивает риск заболеваний печени, таких как цирроз.Стандартный напиток определяется как 13,5 грамма алкоголя: или 12 унций пива, 5 унций вина, 1,5 унции дистиллированного спирта. Умеренное потребление определяется как два напитка в день для взрослого мужчины; один напиток в день для женщин или лиц старше 65 лет, независимо от пола.
Бета-каротин — один из более чем 100 каротиноидов, которые встречаются в природе в растениях и животных. Каротиноиды — это пигменты от желтого до красного, которые содержатся в таких продуктах, как абрикосы, свекла и зелень свеклы, морковь, зелень капусты, кукуруза, красный виноград, апельсины, персики, чернослив, красный перец, шпинат, сладкий картофель, помидоры, зелень репы и желтый давить.Бета-каротин позволяет организму вырабатывать витамин А. В исследованиях влияния витамина А и бета-каротина на абсорбцию железа витамин А не увеличивал значительно абсорбцию железа в используемых экспериментальных условиях. Однако бета-каротин значительно увеличивает абсорбцию металла. Более того, в присутствии фитатов или дубильной кислоты бета-каротин обычно преодолевает ингибирующие эффекты обоих соединений в зависимости от их концентраций. Как и витамин Е, бета-каротин является отличным антиоксидантом, но принимать любой из них следует с осторожностью.Исследования показали, что обычный прием витамина А в количестве 25000 МЕ может вызвать проблемы с печенью, а дополнительный прием бета-каротина может ускорить прогрессирование некоторых видов рака. Лучший источник этих питательных веществ — цельные продукты.
Добавка железа
EDTA + fe и Ferrochel — это добавки железа, которые становятся кандидатами на обогащение у основных производителей пищевых продуктов. Было обнаружено, что обе добавки превышают абсорбционную способность обычно используемого фортификанта сульфата железа.
Соляная кислота
Соляная кислота (HCl), присутствующая в желудке, высвобождает питательные вещества из пищи, чтобы они могли всасываться.
Мясо
В особенности красное мясо увеличивает абсорбцию негемового железа. Говядина, баранина и оленина содержат наибольшее количество гема по сравнению со свининой или курицей, которые содержат небольшое количество гема. Было подсчитано, что один грамм мяса (около 20 процентов белка) оказывает улучшающий эффект на абсорбцию негемового железа, эквивалентный таковому 1 миллиграмму аскорбиновой кислоты.Еда латиноамериканского типа (кукуруза, рис и черные бобы) с низкой биодоступностью железа имела такую же улучшенную биодоступность при добавлении 75 г мяса или 50 мг аскорбиновой кислоты
Сахар
В рамках исследования сердца Фрамингема В рамках проекта Национальных институтов здравоохранения исследователи изучали факторы, увеличивающие запасы железа, такие как диета и добавки железа. В нем приняли участие более шестисот пациентов пожилого возраста. Те, кто принимал дополнительное железо вместе с фруктами, имели более высокие запасы железа, некоторые в три раза.Никого не поощряют употреблять сахар для улучшения усвоения железа. Слишком много сахара может привести к другим проблемам со здоровьем, таким как ожирение и диабет. Белый рафинированный сахар не имеет пищевой ценности, кроме калорий. Однако употребление фруктов или добавление меда или черной патоки в такие продукты, как злаки, может повысить усвоение железа и добавить питательные вещества, которым не хватает рафинированного сахара.
Никотиновые продукты
Жевательные резинки для прекращения курения могут повысить уровень ферритина в сыворотке
Вещества, ухудшающие всасывание железа:
Лекарства , которые снижают количество кислоты в желудке, такие как антациды или ингибиторы протонной помпы, могут привести к гипохлоргидрии (низкий уровень желудка). кислота) или ахлоргидрия, то есть полное отсутствие желудочной кислоты.
Кальций (как и железо) является важным минералом, а это означает, что организм получает это питательное вещество с пищей. Кальций содержится в таких продуктах, как молоко, йогурт, сыр, сардины, консервированный лосось, тофу, брокколи, миндаль, инжир, зелень репы и ревень, и является единственным известным веществом, препятствующим абсорбции негемового и гемового железа. Если 50 миллиграммов или меньше кальция практически не влияют на абсорбцию железа, кальций в количестве 300-600 миллиграммов ингибирует абсорбцию гемового железа аналогично негемовому железу.Одна чашка обезжиренного молока содержит около 300 миллиграммов кальция. Когда врач рекомендует кальций, как это часто бывает у женщин, пытающихся предотвратить потерю костной массы, эти добавки можно принимать перед сном. Кальциевые добавки лучше всего принимать с витамином D в цитратной, а не карбонатной форме.
Яйца содержат соединение, ухудшающее усвоение железа. Фосфопротеин, называемый фосвитином, — это белок, обладающий способностью связывать железо, что может быть причиной низкой биодоступности железа из яиц.Эта характеристика яиц, ингибирующая железо, называется «яичным фактором». Фактор яиц наблюдался в нескольких отдельных исследованиях. Одно вареное яйцо может снизить всасывание железа из пищи на 28%.
Оксалаты ухудшают усвоение негемового железа. Оксалаты — это соединения, полученные из щавелевой кислоты, которые содержатся в таких продуктах, как шпинат, капуста, свекла, орехи, шоколад, чай, пшеничные отруби, ревень, клубника и травы, такие как орегано, базилик и петрушка. Присутствие оксалатов в шпинате объясняет, почему железо в шпинате не всасывается.Фактически, сообщается, что железо из шпината, которое действительно абсорбируется, скорее всего, связано с мельчайшими частицами песка или грязи, прилипшими к растению, а не с железом, содержащимся в растении.
Полифенолы являются основными ингибиторами абсорбции железа. Полифенолы или фенольные соединения включают хлорогеновую кислоту, содержащуюся в какао, кофе и некоторых травах. Фенольная кислота, содержащаяся в яблоках, перечной мяте и некоторых травяных чаях, и дубильные вещества, содержащиеся в черном чае, кофе, какао, специях, грецких орехах, фруктах, таких как яблоки, ежевика, малина и черника, обладают способностью подавлять абсорбцию железа.Из полифенолов шведское какао и некоторые чаи демонстрируют самые сильные ингибирующие способности к абсорбции железа, в некоторых случаях до 90%. Кофе с высоким содержанием танина и хлорогеновой кислоты; Одна чашка определенных видов кофе может подавить всасывание железа на целых 60%. Эти продукты или вещества не следует употреблять в течение двух часов до и после основного приема пищи, богатой железом.
Фитат — это соединение, содержащееся в соевом белке и клетчатке. Даже низкие уровни фитата (около 5 процентов от количества в цельнозерновой муке) оказывают сильное ингибирующее действие на биодоступность железа.Фитат содержится в грецких орехах, миндале, кунжуте, сушеных бобах, чечевице и горохе, а также в злаках и цельнозерновых продуктах. Фитатные соединения могут снизить абсорбцию железа на 50-65 процентов.
Планы питания, которые помогают повысить или снизить уровень железа, должны быть индивидуализированы. Два раздаточных материала, предоставленные Институтом заболеваний железа, под названием Boost Your Ferritin и Lower Your Ferritin являются хорошей отправной точкой для построения плана питания для взрослых, который помогает достичь восполнения запасов железа или снижения уровня железа.
Если железо надлежащим образом распределено по всему телу в гемоглобине, мышцах, ферритине, костном мозге и других частях тела, то диета может быть направлена на обеспечение баланса железа и профилактику заболеваний. Свежие фрукты, овощи, цельнозерновые продукты, достаточное количество белка, ограниченное количество молочных продуктов, животных жиров и обработанных сахаров составляют основу хорошего плана питания.
По возможности употребляйте цельные продукты, а не «продукты в таблетках». Наш организм не приспособлен для приема больших доз добавок, которые могут перегрузить печень, почки или нарушить баланс других питательных веществ.
Эта страница посвящена покойному доктору Джону Л. Борода , Ph.D. Профессор диетологии Университета Пенсильвании, член Института заболеваний железа (IDI) с 1998 по 2009 год и конец Мэри Фрэнсис Пиччиано, , доктор философии, старший научный сотрудник отдела диетических добавок (ODS), Национальный Институты здравоохранения (NIH),
Железо, анемия и воспалительные заболевания кишечника
- ВЗК, воспалительное заболевание кишечника
- ID, дефицит железа
- ЖДА, железодефицитная анемия
- MC TPMT, тиопуринметилтрансфераза
- Epo, эритропоэтин
- ACD, хроническая анемия
- RBC, красные кровяные тельца
- NRAMP-1, белок макрофагов, связанный с естественной резистентностью
- IFN-γ, интерферон γ
- TNF-α, опухоль фактор некроза α
- NO, оксид азота
- RES, ретикулоэндотелиальная система
, средний объем клеток
РЕЗЮМЕ
Железодефицитная анемия — одно из самых распространенных заболеваний в мире.По оценкам Всемирной организации здравоохранения, более 30% населения страдают железодефицитной анемией, но при многих гастроэнтерологических заболеваниях она остается недостаточно управляемой. Кроме того, одна треть пациентов с воспалительными заболеваниями кишечника (ВЗК) страдает рецидивирующей анемией. Анемия оказывает значительное влияние на качество жизни больных. Хроническая усталость, сам по себе частый симптом ВЗК, обычно вызывается анемией и может истощить пациентов в такой же степени, как боль в животе или диарея. И дефицит железа, и анемия при хронических заболеваниях в наибольшей степени способствуют развитию анемии при ВЗК.Дефицит кобаламина или фолиевой кислоты и различные другие причины анемии, такие как гемолиз, возникают нечасто. Обычными терапевтическими мишенями являются механизмы, лежащие в основе анемии хронических заболеваний и дефицита железа. Пероральное лечение железом ограничено из-за плохой абсорбции, непереносимости и индукции окислительного стресса в месте воспаления кишечника. Внутривенное введение сахарозы железа имеет хороший профиль безопасности и ответ на 65–75% в течение 4–8 недель, что сопровождается улучшением качества жизни. Комбинированная терапия с эритропоэтином (Epo) приводит к более быстрому и большему увеличению гемоглобина.По нашему опыту, практически всех пациентов с анемией, ассоциированной с ВЗК, можно успешно лечить комбинацией сахарозы железа и эпо, что затем может положительно повлиять на ошибочный иммунный ответ при ВЗК.
ПОТЕРЯ ЖЕЛЕЗА ПРИ ВОСПАЛИТЕЛЬНОМ ЗАБОЛЕВАНИИ КОЖИ
Железодефицитная анемия (ЖДА) может считаться гастроэнтерологическим заболеванием. Основными причинами дефицита железа (ЖД) в развитом мире являются менструация и кровопотеря, связанная с желудочно-кишечными заболеваниями.В последнем случае кровопотеря в желудке или кишечнике не может компенсироваться двенадцатиперстной абсорбцией железа, что создает отрицательный баланс железа. Этот дисбаланс часто наблюдается при ВЗК, что приводит к анемии. Хотя наше понимание ВЗК за последние десятилетия расширилось, распространенность анемии, связанной с ВЗК, изменилась лишь незначительно: у одной трети пациентов с ВЗК уровень гемоглобина по-прежнему ниже 12 г / дл. 1, 2
«Анемия — постоянный клинический признак ВЗК»
Анемия признана ключевым симптомом ВЗК.Долгое время единственным лабораторным параметром, включенным в оценки активности заболевания (например, индекс активности болезни Крона), было соотношение гематокрит / гемоглобин. Кишечное кровотечение (видимая или скрытая кровь) является основным симптомом самого заболевания, и при каждой вспышке могут исчезать эритроциты (эритроциты). В самом деле, анемия, вероятно, слишком распространена, чтобы ее можно было конкретно признать осложнением ВЗК — анемия является постоянным клиническим признаком ВЗК. Для пациентов это может быть самым изнурительным аспектом их болезни.Хотя для лечения анемии, связанной с ВЗК, были разработаны эффективные терапевтические возможности, лечение анемии часто имеет низкий приоритет для гастроэнтерологов. По сравнению с другими проявлениями заболевания, такими как артрит или остеопатия, анемии при ВЗК уделяется мало внимания. Цель этого обзора — передать текущие знания об анемии, связанной с ВЗК, в повседневное ведение пациентов с ВЗК.
АНЕМИЯ
эритроцитов циркулируют по всему телу, участвуя в газообмене, переносе кислорода и удалении углекислого газа.Эритропоэз должен поддерживать стабильные уровни циркулирующих эритроцитов и реагировать на острые проблемы. Костный мозг — очень динамичный орган, производящий от двух до трех миллионов эритроцитов каждую секунду. Эти эритроциты заполнены гемоглобином и заменяются через 75–150 дней. Этот процесс контролируется механизмом почек, чувствительным к гипоксии, который реагирует, модулируя выработку Epo, которая, в свою очередь, определяет уровень эритропоэтической активности. Когда выработка эритроцитов не соответствует деструкции эритроцитов, возникает анемия.
Клинические последствия
Долгое время считалось, что клинические симптомы анемии (такие как утомляемость, головная боль, головокружение, одышка или тахикардия) возникают только тогда, когда уровень гемоглобина резко падает. Утверждалось, что пациенты адаптируются к низкому уровню гемоглобина, если анемия развивается медленно. Это привело к концепции бессимптомной анемии. По правде говоря, бессимптомное течение отражает тот факт, что нарушения физического состояния, качества жизни и когнитивных функций могут не распознаваться как пациентами, так и их врачами.Это дилемма, не связанная с ВЗК. Нефрологи усвоили этот урок в недавнем прошлом. 3 Они показали, что процесс адаптации к хронической анемии на самом деле был адаптацией к более низкому качеству жизни и что это можно было обратить вспять.
Ключевые симптомы, такие как одышка и тахикардия, возникают из-за снижения уровня кислорода в крови и периферической гипоксии. Компенсаторный кровоток из брыжеечных артерий может ухудшить перфузию слизистой оболочки кишечника. 4 Нарушение моторики, тошнота, анорексия и даже мальабсорбция были связаны с анемией.Снижение метаболизма и энергоэффективности во время физических нагрузок также способствует снижению веса при анемии. 5 Обычная находка — меноррагия и аменорея у женщин. Мужчины могут страдать импотенцией. Потеря либидо может способствовать ухудшению качества жизни у обоих полов. 6 Центральная гипоксия может вызывать такие симптомы, как головная боль, головокружение, головокружение или шум в ушах. Несколько исследований подтвердили, что лечение анемии улучшает когнитивные функции. 7 Поскольку железо является компонентом не только гемоглобина и миоглобина, но также цитохромов и многих других ферментов, сам по себе ID может ухудшать когнитивные функции.Действительно, коррекция ID у девочек, не страдающих анемией, улучшает вербальное обучение и память. 8
Хроническая усталость
Анемия снижает способность выполнять обычные повседневные дела. Хроническая усталость — частый симптом ВЗК с анемией, а ИН является одним из основных причинных факторов. 9 Усталость связана со значительными физическими, эмоциональными, психологическими и социальными последствиями, затрагивая практически все аспекты повседневной жизни.После успешного лечения анемии с помощью Epo в большинстве исследований наблюдалось улучшение уровня энергии и активности, а также общего качества жизни. 10 Удивительно, но в диапазоне 8–14 г / дл наибольшее улучшение качества жизни произошло, когда уровень гемоглобина увеличился с 11 до 13 г / дл. 11
«Обеспокоенность по поводу утомляемости пациентов с ВЗК, вероятно, так же важна, как и беспокойство по поводу их боли в животе или диареи»
Изменения качества жизни были также изучены у пациентов с анемией, больных болезнью Крона, получавших сахарозу железа и эпо. 12 Чувство благополучия, настроение, физические возможности и социальная активность составили большую часть улучшения качества жизни. Кроме того, отдельные пациенты сообщили об облегчении нарушения сна и повышении аппетита или либидо. Используя тот же вопросник, данные о качестве жизни сравнивались с данными, которые были оценены у пациентов с анемией. 13 Примечательно, что абсолютное качество жизни при анемии, связанной с болезнью Крона, хорошо согласуется с данными, собранными у пациентов с запущенным раком. 2
Онкологи зафиксировали значительный разрыв в общении между пациентами и врачами по поводу утомляемости. 14 Обеспокоенность по поводу утомляемости пациентов с ВЗК, вероятно, так же важна, как и беспокойство по поводу их боли в животе или диареи.
ЭТИОЛОГИЯ АНЕМИИ ПРИ ВБК
Анемия при ВЗК является сложной и обычно представляет собой частный пример сочетания ЖДА и анемии хронических заболеваний (АКЗ).
Недостаток железа
У нормальных субъектов ежедневная потеря железа составляет 1-2 мг, и для этого необходимо, чтобы такое же количество было получено из рациона. Пищевое железо встречается в двух формах: гем (из мяса с миоглобином, птицы и рыбы) и негем (в основном из растений). 15 Недавно был рассмотрен молекулярный путь абсорбции железа. 16 Абсорбция негемового железа зависит от многих факторов, включая присутствие кислоты желудочного сока, аскорбиновой кислоты и ингибиторов, таких как фитиновая кислота и полифенолы (в овощах).Гемовое железо высвобождается после механического и ферментативного переваривания миоглобина. Отвращение к пище и непереносимость, о которых сообщают сами, являются обычными для IBD 17, 18 , и это влияет на количество железа, доступного в рационе (таблица 1). В различных отчетах указывалось на снижение потребления железа при ВЗК (особенно у женщин), главным образом из-за отказа от завтраков, обогащенных клетчаткой, которые могут усугублять абдоминальные симптомы. 19 Изменить рекомендации по питанию может быть непросто, особенно если рассматривать это как обострение абдоминальных симптомов.Вероятно, предпочтительнее будет принимать низкие дозы железа.
Стол 1
Потребление железа пациентами с воспалительным заболеванием кишечника (ВЗК) и контрольной группой
Единственный способ потерять железо — это менструальное и кишечное кровотечение. Хроническое кишечное кровотечение при ВЗК может превышать количество железа, которое может абсорбироваться с пищей, что приводит к отрицательному балансу железа. 20 Хотя абсорбция железа при ВЗК в целом не является аномальной, иногда она может быть нарушена при болезни Крона двенадцатиперстной кишки или верхних отделов тощей кишки. 21
Когда скорость поступления железа в развивающийся эритробласт ограничивается в результате ID, гемоглобинизация эритроцитов может быть нарушена. Эритроциты, которые затем выходят из костного мозга, являются микроцитарными и гипохромными. Реакция Epo на падение гемоглобина будет еще больше стимулировать эритропоэз, создавая еще большую потребность в железе, которую невозможно удовлетворить. В результате в этом состоянии наблюдается высокая степень неэффективного эритропоэза. 22
Железо и иммунитет
Железо необходимо для эритропоэза, но оно является активным компонентом многих ферментов, которые также важны для роста и функционирования других динамических клеточных компартментов, таких как иммунные клетки.Железо участвует в иммунных эффекторных путях нейтрофилов и макрофагов путем образования токсичных гидроксильных радикалов. Ограничение железа влияет на пролиферацию и дифференцировку лимфоцитов B и Th2, в то время как перегрузка железом приводит к дисфункции естественных клеток-киллеров, нарушению цитотоксичности нейтрофилов и изменению соотношения лимфоцитов CD4 + к CD8 + . 23, 24
Моноциты / макрофаги активировали различные пути, с помощью которых они могут приобретать железо.Следовательно, на них не так сильно влияет ограничение по железу. Макрофаги могут действовать как пул хранения железа, который может увеличиваться при ACD. 25, 26 Наличие внутриклеточного железа в макрофагах важно для борьбы с инфекцией. Макрофагальный белок, связанный с естественной устойчивостью (NRAMP-1), был идентифицирован как трансмембранный переносчик железа, который придает устойчивость к инфекции внутриклеточными патогенами. 27, 28
Дисбаланс в гомеостазе железа влияет на активность цитокинов и клеточные иммунные эффекторные механизмы макрофагов.Высокая нагрузка железом снижает чувствительность к интерферону γ (IFN-γ), что приводит к снижению экспрессии фактора некроза опухоли α (TNF-α), антигенов MHC класса II, неоптерина или молекулы межклеточной адгезии 1, а также к дисбалансу Th2 / Th3 с Ослабление эффекторной функции Th2 и увеличение продукции цитокинов, опосредованной Th3. 29– 32 Как следствие, такие макрофаги теряют способность убивать внутриклеточные патогены с помощью путей, опосредованных IFN-γ. Частично это можно объяснить ингибированием транскрипции индуцибельной синтазы оксида азота (NO), 33, 34 фермента для цитокин-индуцируемого образования NO с высоким выходом.NO — критическая молекула макрофагов для защиты от инфекционных патогенов. 35, 36
«Определенное количество железа, по-видимому, необходимо для развития лимфоцитов, но отложение железа в иммунных клетках блокирует основные иммунные функции и устойчивость хозяина к вторжению патогенов»
Такие данные in vitro подтверждаются клиническими данными. При церебральной малярии человека хелатор железа десфериоксамин улучшил клиническое течение. 37, 38 Напротив, пациенты с перегрузкой железом в Африке подвержены более высокому риску туберкулеза. 39, 40 Однако пациенты с тяжелой формой ID также подвержены инфекции. 41 Таким образом, определенное количество железа, по-видимому, необходимо для развития лимфоцитов, но отложение железа в иммунных клетках блокирует основные иммунные функции и устойчивость организма к вторжению патогенов. Возникает соблазн предположить, что ID усиливает ответ IFN-γ при воспалении, вызванном Th2, при иммуноопосредованных воспалительных заболеваниях, таких как болезнь Крона.
Анемия хронического заболевания
ACD является наиболее частой анемией у госпитализированных пациентов и развивается у субъектов, страдающих заболеваниями, которые связаны с хронической активацией клеточного иммунитета, такими как хронические инфекции, иммуноопосредованные воспалительные расстройства или злокачественные новообразования. 42 Таким образом, ACD в первую очередь является иммунным заболеванием, в котором основными участниками являются цитокины, такие как TNF-α или IFN-γ, и белки острой фазы. Несколько факторов способствуют развитию ACD.
Отвод железного трафика
Отличительной чертой ACD является гипоферремия и, соответственно, ограничения железа в эритроне, в то время как железо поглощается макрофагами и дендритными клетками ретикулоэндотелиальной системы (RES). Таким образом, ACD можно легко диагностировать по наличию гипоферриемии и повышению уровня ферритина в сыворотке крови (рис. 1).
Рисунок 1
Железо и эритропоэз при хронических заболеваниях. Когда эритропоэз подавляется, железо, которое высвобождается в конце жизненного цикла эритроцитов и которое обычно было бы переработано в новый гемоглобин, уходит в запасы железа.В результате уровень ферритина в сыворотке повышается. Всасывание железа в основном обусловлено эритропоэзом. Когда это подавляется, абсорбция железа также снижается.
Макрофаги могут приобретать железо несколькими путями, включая поглощение железа, опосредованное рецептором трансферрина, NRAMP-1, лактоферрин, рецептор гемоглобина и эритрофагоцитоз. 43 Цитокины модулируют экспрессию и активность этих путей захвата железа, а также вызывают задержку железа, подавляя экспрессию трансмембранного переносчика железа ферропортина 1. 44, 45 Белки острой фазы, такие как α 1 антитрипсин, блокируют опосредованное трансферрином поглощение железа клетками-предшественниками эритроидов, но не клетками RES. 46 Недавно обнаруженный интерлейкин 6-индуцибельный пептид гепсидин подавляет абсорбцию железа в двенадцатиперстной кишке и может препятствовать высвобождению железа из клеток RES. 47
Ингибирование пролиферации и дифференцировки эритроидных предшественников
Помимо модуляции гомеостаза железа, цитокины напрямую влияют на эритропоэз, подавляя рост эритроидных клеток-предшественников.TNF-α и интерфероны типа I и II блокируют образование колоний BFU-e и CFU-e 48 , и IFN-γ, по-видимому, является наиболее мощным ингибитором эритропоэза, напрямую блокируя пролиферацию CFU-e. 49 Последнее хорошо отражается в обратной корреляции между уровнями IFN-γ и концентрацией гемоглобина и количеством ретикулоцитов у пациентов с ACD. 50 NO может напрямую блокировать эритропоэз путем ингибирования пролиферации эритроидных клеток-предшественников и биосинтеза гема. 51, 52
Затупленный ответ Epo
Уровни Epo в сыворотке у пациентов с ACD, по-видимому, недостаточно низкие для степени анемии.Однако это верно не для всех заболеваний, лежащих в основе ACD 53 , но было показано для болезни Крона и язвенного колита. 54, 55 Фактически, цитокины могут напрямую ингибировать продукцию Epo в почках. 56 Более того, Epo-чувствительность эритроидных клеток-предшественников может быть связана с тяжестью заболевания и степенью иммунной активации. In vitro в присутствии IFN-γ или TNF-α необходимы более высокие количества Epo для восстановления образования колоний CFU-e. 57
Жизненный цикл эритроцитов
Применение сублетальных доз TNF-α или эндотоксина у мышей снижает период полужизни красных кровяных телец (эритроцитов), снижает инкорпорацию железа, вызывает гипоферремию и вызывает анемию. 58 Стимуляция эритрофагоцитоза также отражается в увеличении количества железа, полученного из эритроцитов, в макрофагах селезенки и клетках Купфера при воспалительных условиях. 59
Недостаточность витамина B12 и фолиевой кислоты
Витамин B12 (или кобаламин) и фолиевая кислота — это витамины и коферменты, участвующие в ряде сложных биохимических реакций, включая синтез ДНК.
Клинические доказательства дефицита витамина B12 проявляются поздно, так как запасы в организме должны быть истощены до менее чем 10%. Витамин B12, связанный с внутренним фактором желудка, всасывается в основном в подвздошной кишке. Хроническое воспаление или резекция подвздошной кишки, особенно при болезни Крона, может вызвать дефицит и клинические симптомы. Также была выявлена связь с желудочной болезнью Крона. 60 Фолат всасывается в двенадцатиперстной кишке и тощей кишке, и дефицит может быть вызван неправильным питанием, мальабсорбцией или лекарственными взаимодействиями (сульфасалазин, метотрексат).Клинические проявления возникают раньше, так как запасы фолиевой кислоты длятся всего 1-2 месяца.
Анемия, вызванная лечением
Помимо недостаточности фолиевой кислоты, терапия сульфасалазином или 5-аминосалициловой кислотой связана с незначительной степенью гемолиза или аплазии. 61– 64 Что еще более важно, и 6-меркаптопурин, и азатиоприн оказывают прямое миелосупрессивное действие. Риск развития лейкопении или аплазии высок у лиц с низкой активностью тиопуринметилтрансферазы (TPMT). 65 Ферментативная активность TPMT генетически детерминирована, и было предложено генотипирование как средство выявления пациентов из группы риска. 66 Однако в клинической практике высказывались опасения по поводу точности прогноза этого теста. 67, 68
Есть много других, менее распространенных причин анемии при ВЗК (обзор Schreiber and Wedel 69 ), с которыми лучше всего справляются те, кто встречается с ними чаще, например местный гематолог (таблица 2).
Стол 2
Этиология анемии, ассоциированной с воспалительными заболеваниями кишечника
ДИАГНОСТИЧЕСКИЕ ИСПЫТАНИЯ
Мониторинг пациентов с ВЗК с помощью общих анализов крови является рутинной мерой. Нижний пороговый уровень гемоглобина у женщин (12,0 г / дл против 13,5 г / дл у мужчин) может не побуждать врачей проводить адекватную терапию, когда это необходимо. Конечно, менструирующие женщины теряют больше крови, чем их коллеги-мужчины, и поэтому они подвержены более высокому риску ID.Следствием этого биологического факта должно быть повышенное внимание к гемоглобину и запасам железа у менструирующих или беременных женщин, а не более низкий пусковой механизм лечения.
«Мониторинг пациентов с ВЗК с помощью полных анализов крови является рутинной мерой»
Размер эритроцитов отражается в среднем объеме клеток (MCV) и среднем уровне гемоглобина клеток, что дает первый диагностический ключ. Гипохромия и микроцитоз указывают на ID эритроцитов с или без сопутствующей ACD.Макроцитоз указывает на дефицит витамина B12 или фолиевой кислоты. Увеличение MCV без значительной анемии полезно для мониторинга ответа на лечение или соблюдения режима терапии азатиоприном или 6-меркаптопурином. 70 Помимо общего анализа крови необходимо регулярно проверять параметры железа. Измерение сывороточного ферритина отражает уровень железа в магазинах. Когда сывороточный ферритин ниже 15 мкг / л, запасы железа определенно истощаются. Когда ферритин выше 20 мкг / л, железо есть в запасах, но его может быть недостаточно для удовлетворения потребностей пролиферирующих предшественников эритроцитов, и это верно даже до уровней 700 мкг / л. 71 C-реактивный белок полезен для оценки уровня воспаления.
Дальнейшая оценка может включать количество ретикулоцитов, витамин B12 и фолиевую кислоту. Процентное содержание гипохромных эритроцитов и ретикулоцитов гемоглобина было предложено для оценки функционального ID во время терапии Epo. 72, 73
Из-за различных терапевтических последствий важно отличать ACD от ID. Пациенты с «классической» АКД имеют повышенный уровень ферритина, в то время как концентрация трансферрина, а также насыщение трансферрина снижены.Напротив, все эти параметры снижаются у пациентов с ACD с ID. Чистый ID определяется низким уровнем ферритина и насыщения трансферрина, но повышенными концентрациями трансферрина. Отношение растворимого рецептора трансферрина / log ферритина было предложено для дифференциальной диагностики этих перекрывающихся состояний. 74 У пациентов с ВЗК высокие уровни сывороточного трансферрина, растворимого рецептора трансферрина и сывороточного Epo предсказывают ответ на внутривенное введение железа, а низкие уровни указывают на необходимость сопутствующей терапии Epo. 75
КАЧЕСТВО ЖИЗНИ: ТЕРАПЕВТИЧЕСКАЯ ЦЕЛЬ
Конечная терапевтическая цель — улучшение качества жизни, но единственная объективная мера, которую мы должны измерить, — это изменение концентрации гемоглобина. Улучшение качества жизни больных раком анемии было обнаружено при уровне гемоглобина до 14 г / дл. 11 Поскольку большинство пациентов с ВЗК молоды, у них могут быть даже более высокие физические и когнитивные потребности, чем у больных раком. Нормализация уровня гемоглобина (12.0 г / дл у женщин и 13,5 г / дл у мужчин).
Механизмы анемии, ассоциированной с IBD, включают, в частности, ID и ACD. В случае дефицита витамина B12 или фолиевой кислоты необходима соответствующая замена. Это оставляет главную проблему — направить терапию железом и улучшить эритропоэз при хронических заболеваниях.
Добавки железа
Препараты железа для перорального применения
Пероральные добавки железа обычно содержат железо в форме солей двухвалентного железа (сульфат железа, глюконат железа и фумарат железа).Все соединения двухвалентного железа окисляются в просвете кишечника или внутри слизистой оболочки с высвобождением активированных гидроксильных радикалов, которые атакуют стенку кишечника и вызывают ряд желудочно-кишечных симптомов и дискомфорта. 76, 77 Препараты железа с энтеросолюбильным покрытием пытаются избежать этого, сводя к минимуму выброс железа в желудке. В случае успеха это также предотвращает всасывание железа.
«Из-за отсутствия экскреторного пути гомеостаз железа в организмах регулируется на уровне поглощения железа»
Поскольку не существует экскреторного пути, гомеостаз железа в организмах регулируется на уровне поглощения железа.Если абсорбция железа не регулируется жестко, возникает перегрузка железом и связанная с ней токсичность, как при наследственном гемохроматозе. Другим препятствием перорального приема добавок железа, следовательно, является ограниченная способность усваивать железо. Эффективности пероральной терапии железом у пациентов с ВЗК могут дополнительно препятствовать некоторые специфические факторы ВЗК. Во-первых, желудочно-кишечные побочные эффекты перорального приема двухвалентного железа, такие как тошнота, вздутие живота, диарея или боль в верхних отделах желудочно-кишечного тракта, более выражены по сравнению с теми, которые наблюдаются у пациентов без ВЗК, принимающих пероральную терапию железом. 78 Во-вторых, при хронических воспалительных заболеваниях абсорбция железа снижается, что ограничивает рост микробов при хронических инфекциях. 79 Белок острой фазы гепсидин может играть в этом центральную роль, поскольку его избыточная экспрессия в печени приводит к снижению захвата железа двенадцатиперстной кишкой. 47 В-третьих, изменено распределение железа в организме. Большая часть абсорбированного железа направляется в РЭС, в то время как лишь незначительные количества могут достигать участков эритропоэза.
Полимальтозный комплекс трехвалентного железа, трималтол трехвалентного железа или полипептид гемового железа также доступны в некоторых странах. Трехвалентное железо обладает меньшим прооксидантным потенциалом, но нерастворимо и, как правило, биодоступно. К удивлению, в открытом исследовании было обнаружено, что пероральное введение комплексов тримальтола с железом является безопасным и эффективным. 80 Было показано, что новая неионная полимальтоза железа не обладает окислительной активностью в отношении липопротеинов у здоровых субъектов 81 и лучше поддается лечению, чем сульфат железа, но данные об эффективности отсутствуют. 82 Полипептид железа Haeme использует альтернативные пути абсорбции. Считается, что этот продукт имеет улучшенную биодоступность 83 и обещает меньшие побочные эффекты, но имеет животное происхождение, и более крупные серии еще не лечились.
Препараты железа для внутривенного введения
Ограничения пероральной терапии железом у пациентов с ВЗК означают, что необходимо рассмотреть альтернативные пути введения железа. Для прямого введения железа в кровоток требуются препараты, предотвращающие клеточную токсичность солей железа. 84 В настоящее время доступны три различных продукта:
Декстран железа — стабильный продукт железа для парентерального введения с молекулярной массой 100–500 кДа. Эти комплексы железа демонстрируют высокую структурную однородность и только медленную и конкурентную доставку к эндогенным железосвязывающим белкам. Комплексы активно фагоцитируются макрофагами RES, прежде чем они высвобождаются и становятся доступными для синтеза гемоглобина. Период полувыведения из плазмы составляет 3-4 дня. Стабильность декстранового комплекса позволяет применять высокие разовые дозы (так называемая «терапия общей дозой»).Однако эта молекула может вызывать хорошо известные анафилактические реакции, индуцированные декстраном.
Глюконат железа является лабильным типом с быстрой кинетикой разложения и прямым высвобождением в белки плазмы (апотрансферрин, апоферритин и другие). Потенциальная токсичность глюконата железа вызвана перенасыщением способности связывать трансферрин. 85 Свободное ионное железо, не связанное с трансферрином, может вызывать острое повреждение эндотелиальных клеток и синдром транзиторной утечки капилляров.Клинические симптомы в таких обстоятельствах включают тошноту, гипотензию, тахикардию, одышку (отек легких) и двусторонний отек кистей и стоп, и их не следует неправильно истолковывать как анафилаксию. Было обнаружено, что использование глюконата железа для лечения дефицита железа у пациентов на диализе является безопасным и превосходит декстран железа. 86, 87
Сахароза железа (ранее называвшаяся сахаратом железа) намного меньше декстрана железа (34–60 кДа) и не несет риска анафилактических реакций, вызванных декстраном.Сахароза железа является частично стабильным типом со средней кинетикой разложения и частичным поглощением высвобожденного железа белками плазмы, такими как (апо) -трансферрин, но также и RES. Его период полураспада относительно короткий (5–6 часов). 88
За последние несколько лет накопился опыт использования сахарозы железа в различных формах ID. 88 Разовые дозы до 300 мг безопасны. 89 Максимальная рекомендуемая доза составляет 600 мг в неделю, но это количество превышает физиологические потребности пролиферирующего эритробласта. 89 Если скорость инфузии слишком высока (более 4 мг Fe 3+ / мин) или единичная общая доза железа слишком высока (более 7 мг Fe 3+ / кг), свободное железо, не связанное с трансферрином, может вызывают преходящую гипотензию, тахикардию и одышку, как описано для глюконата железа. Повышенные уровни железа, не связанного с трансферрином, были обнаружены у бессимптомных пациентов, находящихся на гемодиализе, после инъекций сахарозы железа, что потенциально может способствовать развитию атеросклероза. 90
Более 1000 инфузий было проведено в исследованиях при анемии, ассоциированной с ВЗК, без серьезных побочных эффектов, с использованием 200 мг сахарозы железа, разведенной в 250 мл 0.9% хлорид натрия, два раза в неделю в течение первых двух недель и один раз в неделю после этого. 12, 55, 75 После 1200 мг сахарозы железа (четыре недели) примерно 65% и после 2000 мг (восемь недель) примерно 75% пациентов ответили на лечение (рис. 2). Сахароза железа также безопасно используется после первого триместра беременности и в послеродовом периоде. 91– 93
Рисунок 2
Ответ на сахарозу железа при язвенном колите и болезни Крона.Всего 2 г сахарозы железа вводили внутривенно в течение восьми недель: 400 мг / неделя в течение первых двух недель и 200 мг / неделя после этого. Ответ определялся как увеличение гемоглобина на 2 г / дл или выше. Данные были собраны из двух испытаний. 12, 55
В целом, внутримышечный или подкожный пути парентерального введения железа устарели из-за увеличения побочных эффектов и снижения эффективности.
Железная терапия и воспаление кишечника
Поскольку гомеостаз железа и клеточный иммунитет тесно связаны, можно предположить, что различные терапевтические схемы приема добавок железа могут иметь незначительные эффекты на иммунную функцию и воспаление кишечника при ВЗК.Как указано выше, железо ингибирует активность IFN-γ и, таким образом, оказывает дезактивирующее действие на функцию макрофагов и ответ Th2. Таким образом, внутривенная терапия железом может ослабить воспаление кишечника, вызванное Th2, при болезни Крона. Хотя конкретные данные по болезни Крона отсутствуют, это мнение подтверждается тем фактом, что (i) внутривенное введение железа пациентам с анемией на диализе значительно снижает уровни циркулирующего TNF-α и пероксидов 94 и (ii) комбинированное лечение анемии у субъектов. при активном ревматоидном артрите железо и эпо значительно снижают активность заболевания. 95
«Пероральное железо может вызывать окислительный стресс в просвете кишечника»
Пероральное железо может вызывать окислительный стресс в просвете кишечника. Этот механизм увеличивает продукцию провоспалительных цитокинов в кишечнике на моделях ВЗК на грызунах и был гипотезой для изучения терапии хелатированием железа при болезни Крона. 96, 97 Большая часть проглоченного двухвалентного железа не абсорбируется, а передается в подвздошную и толстую кишку, участки воспаления при болезни Крона и язвенном колите, прежде чем появиться в стуле.Когда железо прикрепляется к изъязвленной поверхности кишечника, оно может увеличивать местную продукцию активных форм кислорода и тем самым усиливать воспаление. Это было продемонстрировано на животных моделях IBD 96 , а также на пациентах с болезнью Крона. 78
Хотя в настоящее время нет данных, мы не ожидаем увеличения кишечного окислительного стресса от внутривенных препаратов железа, потому что трехвалентное железо не обладает окислительным потенциалом, а способ введения не способствует накоплению в кишечнике.
Рекомбинантный человеческий Epo
Специфические препараты для лечения ACD еще не разработаны. Противовоспалительные препараты могут подавлять выработку цитокинов, но также могут подавлять эритропоэз (например, азатиоприн). Хотя теоретически стратегии против TNF и IFN-γ, такие как инфликсимаб или натализумаб, могут специфически противодействовать эритропоэтическому ингибированию, вызванному ACD, 98 о таких эффектах не сообщалось в клинических испытаниях при ВЗК.
Супрафизиологические дозы Epo могут преодолеть ингибирование эритропоэза при ACD, что является обоснованием для терапии Epo. 57 Epo изучалась в различных типах ACD. 99, 100 Сообщалось об успешном лечении ВЗК после восстановления запасов железа. 101 Затем последовали двойные слепые контролируемые испытания с пероральным 102 или внутривенным 12 добавлением железа (рис. 3). Все испытания продемонстрировали значительный эффект Epo на повышение гемоглобина.Эпохирургическое лечение резистентных к железу случаев анемии, связанной с ВЗК, также оказалось безопасным и эффективным у детей. 103 Специфика последующих событий Epo ограничивает набор возможных нежелательных явлений. Тромбоз, артериальная гипертензия и судороги редко наблюдаются у пациентов с почечной недостаточностью и, вероятно, связаны с повышением гематокрита и общего объема крови. Аналоги Epo следующего поколения, такие как новый белок, стимулирующий эритропоэз (NESP), имеют более длительный период полужизни в сыворотке, но пониженную аффинность связывания с рецептором Epo. 104 Нам неизвестны какие-либо исследования, которые проводились при ВЗК.
Рисунок 3
Сахароза железа в сравнении с сульфатом железа при воспалительной анемии, связанной с заболеванием кишечника. Описаны два контролируемых исследования, оба из которых демонстрировали эффект эритропоэтина (Epo) при анемии, связанной с ВЗК. Исходные уровни гемоглобина и общая доза Epo были идентичны. В одном испытании (A) сульфат железа использовался для добавления железа 102 , а в другом (B) вводили сахарозу железа. 12 При использовании только сульфата двухвалентного железа, 100 мг / день, средний уровень гемоглобина снизился за 12-недельный период исследования. Напротив, сахароза железа вызвала значительное повышение гемоглобина, которое было быстрее и больше в сочетании с Epo.
Поскольку было обнаружено, что сахароза железа очень эффективна сама по себе, Epo не применяли в тех случаях, когда в первую очередь не справлялась только сахароза железа. 55 В попытке определить параметры, которые предсказывают неэффективность терапии сахарозой железом, были изучены уровни Epo в плазме, растворимый рецептор трансферрина и концентрации трансферрина. 75 Низкое Epo (ниже 100 Ед / л), растворимый рецептор трансферрина (ниже 50 нмоль / л) или уровни трансферрина (ниже 2,9 г / л) явно указывают на устойчивость к сахарозе железа. Однако, по нашему опыту, практически всех пациентов с анемией, ассоциированной с ВЗК, можно успешно лечить с помощью комбинации сахарозы железа и Epo (рис. 4).
Рисунок 4
Корректировка терапии до степени анемии. Место пероральной терапии железом — это в основном профилактика железодефицитной анемии.У пациентов с нормоцитарной или микроцитарной анемией сахароза железа демонстрирует лучшую эффективность и переносимость. Необходимое количество железа зависит от степени анемии и может быть оценено с использованием приближения, согласно которому для увеличения гемоглобина на 1 г / дл (Hb) требуется около 200 мг железа для внутривенного введения. Рекомендуется приостановить терапию железом в случае острой инфекции (например, абсцесса) или при насыщении трансферрина> 50%. * Вместо трансферрина можно использовать растворимый рецептор трансферрина (ниже 50 нмоль / л) или концентрацию эритропоэтина (ниже 100 Ед / л).
«Пока мы не вылечим ВЗК, наша главная цель — оптимизация поддерживающей терапии с целью повышения качества жизни пациента»
При работе с пациентами с ВЗК есть веские причины уделять больше внимания метаболизму железа и эритропоэзу, чем когда-либо прежде. Анемия при ВЗК по-прежнему является частым осложнением, которое влияет на способность выполнять обычные повседневные действия, но средства для эффективного предотвращения или лечения анемии определены и легко доступны.Пока мы не излечим ВЗК, нашей главной целью является оптимизация поддерживающей терапии с целью улучшения качества жизни пациента. Стремление к лечению анемии при ВЗК полезно как для пациента, так и для лечащего врача.
Благодарности
CG получила гранты Австрийского научного фонда (P15314) и Юбилейного фонда OeNB (ONB10543). MCEL поддерживается Фондом PPP и Программой НИОКР DHS.
ССЫЛКИ
- ↵
Oldenburg B , Koningsberger JC, Berge Henegouwen GP, et al. Железо и воспалительные заболевания кишечника. Aliment Pharmacol Ther2001; 15: 429–38.
- ↵
Гаше С . Анемия при ВЗК: недооцененный злодей. Воспаление кишечника 2000; 6: 142–50.
- ↵
Макдугал IC . Качество жизни и анемия: опыт нефрологии. Семин Онкол 1998; 25 (приложение 7): 39–42.
- ↵
Ватнер СФ .Влияние кровотечения на региональное распределение кровотока у собак и приматов. Дж. Клин Инвест, 1974; 54: 225–35.
- ↵
Daneryd P , Svanberg E, Korner U, et al. Защита метаболизма и работоспособности у невыбранных больных раком с потерей веса после лечения рекомбинантным эритропоэтином: рандомизированное проспективное исследование. Cancer Res1998; 58: 5374–9.
- ↵
Людвиг Х. , Штрассер К.Симптоматология анемии. Семин Онкол 2001; 28 (приложение 8): 7–14.
- ↵
Pickett JL , Theberge DC, Brown WS, и др. Нормализация гематокрита у диализных пациентов улучшает работу мозга. Am J Kidney Dis1999; 33: 1122–30.
- ↵
Bruner AB , Joffe A, Duggan AK, et al. Рандомизированное исследование когнитивных эффектов добавок железа у девочек-подростков, не страдающих железодефицитной анемией.Lancet 1996; 348: 992–6.
- ↵
Mitchell A , Guyatt G, Singer J, et al. Качество жизни пациентов с воспалительными заболеваниями кишечника. J Clin Gastroenterol 1988; 10: 306–10.
- ↵
Demetri GD , Kris M, Wade J, et al. Улучшение качества жизни у химиотерапевтических пациентов, получавших эпоэтин альфа, не зависит от реакции на заболевание или типа опухоли: результаты проспективного онкологического исследования в сообществе.Procrit Study Group. Дж. Клин Онкол, 1998; 16: 3412–25.
- ↵
Crawford J , Cella D, Cleeland CS, et al. Взаимосвязь между изменениями уровня гемоглобина и качеством жизни во время химиотерапии у больных раком анемии, получающих терапию эпоэтином альфа. Рак, 2002; 95: 888–95.
- ↵
Gasche C , Dejaco C, Waldhoer T, и др. Внутривенное введение железа и эритропоэтина при анемии, связанной с болезнью Крона.Рандомизированное контролируемое исследование. Ann Intern Med, 1997; 126: 782–7.
- ↵
Leitgeb C , Pecherstorfer M, Fritz E, et al. Качество жизни при хронической анемии рака во время лечения рекомбинантным эритропоэтином человека. Cancer1994; 73: 2535–42.
- ↵
Курт GA . Влияние переутомления на качество жизни онкологических больных. Семин Гематол 2000; 37 (приложение 6): 14–17.
- ↵
Monsen ER , Hallberg L, Layrisse M, et al. Оценка доступного пищевого железа. Am J Clin Nutr 1978; 31: 134–41.
- ↵
Parkkila S , Niemela O, Britton RS, и др. Молекулярные аспекты абсорбции железа и экспрессии HFE. Гастроэнтерология, 2001; 121: 1489–96.
- ↵
Мишкин С .Чувствительность к молочным продуктам, мальабсорбция лактозы и элиминационные диеты при воспалительном заболевании кишечника. Am J Clin Nutr 1997; 65: 564–7.
- ↵
Ballegaard M , Bjergstrom A, Brondum S, et al. Самостоятельная пищевая непереносимость при хроническом воспалительном заболевании кишечника. Scand J Gastroenterol1997; 32: 569–71.
- ↵
Lomer MC , Kodjabashia K, Hutchinson C, et al. У пациентов с болезнью Крона потребление железа с пищей низкое: исследование случай-контроль. Br J Nutr 2004; 91: 141–148.
- ↵
Чайлд JA , Brozovic B, Dyer NH, et al. Диагностика дефицита железа у пациентов с болезнью Крона. Gut1973; 14: 642–8.
- ↵
Bartels U , Pedersen NS, Jarnum S. Абсорбция железа и сывороточный ферритин при хроническом воспалительном заболевании кишечника.Scand J Gastroenterol 1978; 13: 649–56.
- ↵
Кавилл I . Эритропоэз и железо. Лучшая практика Res Clin Haematol2002; 15: 399–409.
- ↵
Селигман П.А. , Ковар Дж., Гельфанд Е.В. Пролиферация лимфоцитов контролируется как доступностью железа, так и регуляцией путей поглощения железа. Патобиология 1992; 60: 19–26.
- ↵
де Соуза M .Функции иммунных клеток при перегрузке железом. Clin Exp Immunol1989; 75: 1–6.
- ↵
Брок JH . Железо при инфекциях, иммунитете, воспалениях и новообразованиях. В: Brock JH, Halliday JW, Pippard MJ, et al , eds. Метаболизм железа в здоровье и болезни. Филадельфия: WB Saunders Co Ltd, 1994: 353–91.
- ↵
Weiss G . Приобретение железа ретикулоэндотелиальной системой.В: Темплтон Д., изд. Транспорт молекулярного и клеточного железа. Нью-Йорк: Марсель Декер Инк, 2002: 468–87.
- ↵
Forbes JR , Gros P. Транспорт двухвалентных металлов белками NRAMP на границе взаимодействий хозяин-патоген. Тенденции Microbiol2001; 9: 397-403.
- ↵
Blackwell JM , Searle S, Goswami T, et al. Понимание множества функций Nramp1.Микробы Infect2000; 2: 317–21.
- ↵
Weiss G , Fuchs D, Hausen A, et al. Железо модулирует эффекты гамма-интерферона в линии миеломоноцитарных клеток человека THP-1. Exp Hematol1992; 20: 605–10.
Recalcati S , Pometta R, Levi S, и др. Ответ активности регуляторного белка железа моноцитов на воспаление: аномальное поведение при генетическом гемохроматозе.Blood1998; 91: 2565–72.
Oexle H , Kaser A, Most J, et al. Пути регуляции генов, индуцируемых гамма-интерфероном, железом в моноцитарных клетках человека. J Leukoc Biol, 2003; 74: 287–94.
- ↵
Mencacci A , Cenci E, Boelaert JR, et al. Перегрузка железом изменяет врожденные реакции и ответы Т-хелперов на Candida albicans у мышей. J. Infect Dis, 1997; 175: 1467–76.
- ↵
Weiss G , Werner-Felmayer G, Werner ER, et al. Железо регулирует активность синтазы оксида азота, контролируя ядерную транскрипцию. J Exp Med1994; 180: 969–76.
- ↵
Melillo G , Taylor LS, Brooks A, et al. Функциональная потребность элемента, чувствительного к гипоксии, в активации индуцибельного промотора синтазы оксида азота хелатором железа десфериоксамином.J Biol Chem1997; 272: 12236–43.
- ↵
MacMicking J , Xie QW, Nathan C. Оксид азота и функция макрофагов. Анну Рев Иммунол, 1997; 15: 323–50.
- ↵
Богдан С . Оксид азота и иммунный ответ. Нат Иммунол, 2001; 2: 907–16.
- ↵
Fritsche G , Larcher C, Schennach H, et al. Регуляторные взаимодействия между метаболизмом железа и оксида азота для иммунной защиты от инфекции Plasmodium falciparum. J Infect Dis2001; 183: 1388–94.
- ↵
Gordeuk V , Thuma P, Brittenham G, et al. Влияние хелатотерапии железа на выздоровление из глубокой комы у детей с церебральной малярией. N Engl J Med1992; 327: 1473–7.
- ↵
Gomes MS , Boelaert JR, Appelberg R.Роль железа в экспериментальной инфекции Mycobacterium avium. Дж. Клин Вирол, 2001; 20: 117–22.
- ↵
Gordeuk VR , McLaren CE, MacPhail AP, и др. Связь перегрузки железом в Африке с гепатоцеллюлярной карциномой и туберкулезом: пересмотр диссертации Страчана 1929 года. Blood1996; 87: 3470–6.
- ↵
Джейсон Дж. , Арчибальд Л.К., Нваньянву О.К., и др. Влияние дефицита железа на продукцию и активацию цитокинов лимфоцитов: сохранение печеночного железа, но не любой ценой. Clin Exp Immunol, 2001; 126: 466–73.
- ↵
Weiss G . Патогенез и лечение анемии хронического заболевания. Кровь Rev2002; 16: 87–96.
- ↵
Moura E , Verheul AF, Marx JJ. Функциональный дефект в наследственных моноцитах гемохроматоза и полученных из моноцитов макрофагах.Eur J Clin Invest1998; 28: 164–73.
- ↵
Ludwiczek S , Aigner E, Theurl I, et al. Цитокин-опосредованная регуляция транспорта железа в моноцитарных клетках человека. Blood2003; 101: 4148–54.
- ↵
Ян Ф , Лю XB, Quinones M, и др. Регулирование ретикулоэндотелиального транспортера железа MTP1 (Slc11a3) посредством воспаления. J Biol Chem, 2002; 277: 39786–91.
- ↵
Graziadei I , Gaggl S, Kaserbacher R, et al. Белок острой фазы альфа-1-антитрипсин ингибирует рост и пролиферацию человеческих ранних эритроидных клеток-предшественников (эритроидных единиц, образующих взрыв) и человеческих эритролейкемических клеток (K562) in vitro, препятствуя усвоению трансферрина железа. Blood1994; 83: 260–8.
- ↵
Ганц Т . Гепсидин, ключевой регулятор метаболизма железа и медиатор анемии воспаления.Blood2003; 102: 783–8.
- ↵
Означает RTJ , Krantz SB. Прогресс в понимании патогенеза анемии хронического заболевания. Blood1992; 80: 1639–47.
- ↵
Ван CQ , Удупа КБ, Липшиц DA. Гамма-интерферон оказывает свое негативное регулирующее действие в первую очередь на самых ранних стадиях развития клеток-предшественников эритроидных клеток мыши. J. Cell Physiol, 1995; 162: 134–8.
- ↵
Fuchs D , Hausen A, Reibnegger G, et al. Активация иммунитета и анемия, связанная с хроническими воспалительными заболеваниями. Eur J Haematol1991; 46: 65–70.
- ↵
Maciejewski JP , Selleri C, Sato T, et al. Подавление оксидом азота кроветворения человека in vitro. Вклад в ингибирующее действие интерферона-гамма и фактора некроза опухоли-альфа.Дж. Клин Инвест, 1995; 96: 1085–92.
- ↵
Rafferty SP , Domachowske JB, Malech HL. Подавление экспрессии гемоглобина путем гетерологичного производства синтазы оксида азота в линии эритролейкозных клеток K562. Blood1996; 88: 1070–8.
- ↵
Cazzola M , Ponchio L, de Benedetti F, et al. Дефицит железа для эритропоэза и адекватное производство эндогенного эритропоэтина при анемии, связанной с системным юношеским хроническим артритом.Blood1996; 87: 4824–30.
- ↵
Gasche C , Reinisch W, Lochs H, et al. Анемия при болезни Крона. Важность недостаточного производства эритропоэтина и дефицита железа. Dig Dis Sci1994; 39: 1930–4.
- ↵
Gasche C , Dejaco C, Reinisch W, и др. Последовательное лечение анемии при язвенном колите внутривенным введением железа и эритропоэтина.Пищеварение, 1999; 60: 262–7.
- ↵
Faquin WC , Schneider TJ, Goldberg MA. Влияние воспалительных цитокинов на продукцию эритропоэтина, вызванную гипоксией. Blood1992; 79: 1987–94.
- ↵
Означает RTJ , Krantz SB. Ингибирование колониеобразующих единиц человеческого эритроида гамма-интерфероном может быть скорректировано рекомбинантным человеческим эритропоэтином. Blood1991; 78: 2564–7.
- ↵
Moldawer LL , Marano MA, Wei H, et al. Кахектин / фактор некроза опухоли альфа изменяет кинетику эритроцитов и вызывает анемию in vivo. FASEB J1989; 3: 1637–43.
- ↵
Fillet G , Beguin Y, Baldelli L. Модель ретикулоэндотелиального метаболизма железа у людей: аномальное поведение при идиопатическом гемохроматозе и воспалении. Blood1989; 74: 844–51.
- ↵
Kraus J , Schneider R. Пагубная анемия, вызванная болезнью желудка Крона.Am J Gastroenterol1979; 71: 202–5.
- ↵
Laidlaw ST , Reilly JT. Антилимфоцитарный глобулин при апластической анемии, связанной с месалазином. Lancet1994; 343: 981–2.
Anttila PM , Valimaki M, Pentikainen PJ. Аплазия чистых эритроцитов, связанная с сульфасалазином, но не с 5-аминосалициловой кислотой. Ланцет1985; 2: 1006.
van Hees PA , van Elferen LW, van Rossum JM, et al. Гемолиз во время терапии салицилазосульфапиридином. Am J Gastroenterol 1978; 70: 501–5.
- ↵
Bernstein CN , Artinian L, Anton PA, et al. Низкие дозы 6-меркаптопурина при воспалительном заболевании кишечника связаны с минимальной гематологической токсичностью. Dig Dis Sci1994; 39: 1638–41.
- ↵
Черный AJ , McLeod HL, Capell HA, et al. Генотип тиопуринметилтрансферазы предсказывает ограничивающую терапию тяжелую токсичность азатиоприна.Ann Intern Med, 1998; 129: 716–18.
- ↵
Colombel JF , Ferrari N, Debuysere H, et al. Генотипический анализ тиопурин-S-метилтрансферазы у пациентов с болезнью Крона и тяжелой миелосупрессией во время терапии азатиоприном. Гастроэнтерология 2000; 118: 1025–30.
- ↵
Gearry RB , Barclay ML, Burt MJ, и др. Генотип тиопурин-S-метилтрансферазы (TPMT) не позволяет прогнозировать побочные реакции на тиопуриновые препараты у пациентов с воспалительным заболеванием кишечника.Алимент Pharmacol Ther2003; 18: 395–400.
- ↵
Леннард Л . TPMT в лечении болезни Крона азатиоприном. Gut2002; 51: 143–6.
- ↵
Schreiber S , Wedel S. Диагностика и лечение анемии при воспалительном заболевании кишечника. Воспаление кишечника, 1997; 3: 204–16.
- ↵
Decaux G , Prospert F, Horsmans Y, et al. Связь между средним корпускулярным объемом эритроцитов и нуклеотидами 6-тиогуанина у пациентов, получавших азатиоприн. J Lab Clin Med2000; 135: 256–62.
- ↵
Eschbach JW , Downing MR, Egrie JC, et al. Многоцентровое клиническое испытание рекомбинантного человеческого эритропоэтина (Amgen) в США. Результаты у гемодиализных больных. Contrib Nephrol1989; 76: 160–5.
- ↵
Fishbane S , Galgano C, Langley RC jr.и другие. Содержание гемоглобина ретикулоцитов в оценке статуса железа у пациентов, находящихся на гемодиализе. Почки Int1997; 52: 217–22.
- ↵
Fishbane S , Шапиро В., Дутка П., и др. Рандомизированное исследование стратегий тестирования железодефицитной группы у пациентов, находящихся на гемодиализе. Почки Int2001; 60: 2406–11.
- ↵
Пуннонен К. , Ирьяла К., Раджамаки А. Рецептор трансферрина сыворотки и его соотношение к ферритину сыворотки при диагностике дефицита железа.Blood1997; 89: 1052–7.
- ↵
Gasche C , Waldhoer T, Feichtenschlager T, et al. Прогнозирование ответа на сахарозу железа при анемии, связанной с воспалительными заболеваниями кишечника. Am J Gastroenterol, 2001; 96: 2382–7.
- ↵
Бэббс CF . Кислородные радикалы при язвенном колите. Free Radic Biol Med, 1992; 13: 169–81.
- ↵
Миллар AD , Рэмптон Д.С., Блейк Д.Влияние железа и хелатирования железа in vitro на оксидантную активность слизистых оболочек при язвенном колите. Алимент Pharmacol Ther2000; 14: 1163–8.
- ↵
Эриксен К , Хаускен Т., Ульвик Р.Дж., и др. Фумарат железа ухудшает антиоксидантный статус плазмы у пациентов с болезнью Крона. Сканд Дж. Гастроэнтерол, 2003; 38: 543–8.
- ↵
Naveh Y , Shalata A, Shenker L, et al. Поглощение железа у крыс с экспериментальным энтеритом. Биометаллы 2000; 13: 29–35.
- ↵
Harvey RS , Reffitt DM, Doig LA, et al. Тримальтол железа корректирует железодефицитную анемию у пациентов с непереносимостью железа. Алимент Pharmacol Ther1998; 12: 845-8.
- ↵
Tuomainen T , Nyyssonen K, Porkkala-Sarataho E, et al. Пероральные добавки с сульфатом железа, но не с неионным комплексом полимальтозы железа, повышают восприимчивость липопротеинов плазмы к окислению.Nutr Res1999; 19: 1121–32.
- ↵
Jacobs P , Wood L, Bird AR. Эритроциты: лучшая переносимость комплекса полимальтозы железа по сравнению с сульфатом железа при лечении анемии. Гематология 2000; 5: 77–83.
- ↵
Seligman PA , Moore GM, Schleicher RB. Клинические исследования HIP: пероральный продукт с гемовым железом. Nutr Res2000; 20: 1279–86.
- ↵
Geisser P , Baer M, Schaub E.Взаимосвязь структура / гистотоксичность парентеральных препаратов железа. Arzneimittelforschung1992; 42: 1439–52.
- ↵
Занен А.Л. , Адриаансен Х.Дж., ван Боммель Э.Ф., и др. «Перенасыщение» трансферрина после внутривенного введения глюконата железа (Ferrlecit®) у пациентов, находящихся на гемодиализе. Трансплантация циферблата нефрола 1996; 11: 820–4.
- ↵
Fishbane S , Wagner J.Комплекс натрия и глюконата железа в лечении дефицита железа у пациентов на диализе. Am J Kidney Dis2001; 37: 879–83.
- ↵
Майкл Б. , Койн Д.В., Фишбейн S, и др. Комплекс глюконата натрия и железа у гемодиализных пациентов: побочные реакции по сравнению с плацебо и декстраном железа. Почки Int2002; 61: 1830–9.
- ↵
Yee J , Бессараб А.Железо-сахароза: старейшая терапия железом становится новой. Am J Kidney Dis2002; 40: 1111–21.
- ↵
Chandler G , Harchowal J, Macdougall IC. Внутривенное введение сахарозы железа: определение безопасной дозы. Am J Kidney Dis2001; 38: 988–91.
- ↵
Kooistra MP , Kersting S, Gosriwatana I, et al. Нетрансферрин-связанное железо в плазме гемодиализных пациентов после внутривенной инфузии сахарата железа.Eur J Clin Invest2002; 32 (приложение 1): 36–41.
- ↵
Breymann C , Visca E, Huch R, и др. Эффективность и безопасность внутривенного введения сахарозы железа с адъювантом рекомбинантного человеческого эритропоэтина и без него для лечения резистентной железодефицитной анемии во время беременности. Am J Obstet Gynecol, 2001; 184: 662–7.
Брейманн С , Рихтер С, Хаттнер С, и др. Эффективность рекомбинантного эритропоэтина и сахарозы железа по сравнению только с терапией препаратом железа у пациентов с послеродовой анемией и притуплением эритропоэза. Eur J Clin Invest 2000; 30: 154–61.
- ↵
Krafft A , Breymann C, Huch R, et al. Внутривенное введение сахарозы железа двум беременным женщинам с воспалительным заболеванием кишечника и тяжелой железодефицитной анемией. Acta Obstet Gynecol Scand2000; 79: 720–2.
- ↵
Weiss G , Meusburger E, Radacher G, et al. Влияние лечения железом на уровни циркулирующих цитокинов у пациентов с ТПН, получающих рекомбинантный эритропоэтин человека. Почки Int2003; 64: 572–8.
- ↵
Kaltwasser JP , Kessler U, Gottschalk R, et al. Влияние рекомбинантного человеческого эритропоэтина и внутривенного железа на анемию и активность заболевания при ревматоидном артрите. J Rheumatol, 2001; 28: 2430–6.
- ↵
Oldenburg B , Berge Henegouwen GP, Rennick D, et al. Добавки железа влияют на выработку провоспалительных цитокинов у мышей с дефицитом IL-10. Eur J Clin Invest2000; 30: 505–10.
- ↵
Emerit J , Pelletier S, Likforman J, et al. Испытание фазы II супероксиддисмутазы меди и цинка (CuZn SOD) в лечении болезни Крона. Free Radic Res Commun1991; 12–13 (Pt 2): 563–9.
- ↵
Papadaki HA , Kritikos HD, Valatas V, et al. Анемия хронического заболевания при ревматоидном артрите связана с повышенным апоптозом эритроидных клеток костного мозга: улучшение после терапии антителами против фактора некроза опухоли альфа. Кровь 2002; 100: 474–82.
- ↵
Pincus T , Olsen NJ, Russell IJ, et al. Многоцентровое исследование рекомбинантного эритропоэтина человека в коррекции анемии при ревматоидном артрите. Am J Med1990; 89: 161–8.
- ↵
Glaspy J , Bukowski R, Steinberg D, et al. Влияние терапии эпоэтином альфа на клинические исходы у пациентов с немиелоидными злокачественными новообразованиями во время химиотерапии рака в онкологической практике. Procrit Study Group. Дж. Клин Онкол, 1997; 15: 1218–34.
- ↵
Хорина JH , Петрич В., Шмид CR, и др. Лечение анемии при воспалительном заболевании кишечника рекомбинантным эритропоэтином человека: результаты у трех пациентов. Гастроэнтерология 1993; 104: 1828–31.
- ↵
Schreiber S , Howaldt S, Schnoor M, и др. Рекомбинантный эритропоэтин для лечения анемии при воспалительном заболевании кишечника. N Engl J Med1996; 334: 619–23.
- ↵
Dohil R , Hassall E, Wadsworth LD, et al. Рекомбинантный эритропоэтин человека для лечения хронической анемии у детей с болезнью Крона. J Pediatr1998; 132: 155–9.
- ↵
Smith RE jr , Jaiyesimi IA, Meza LA. и другие. Новый стимулирующий эритропоэз белок (NESP) для лечения анемии хронического заболевания, связанного с раком. Br J Cancer2001; 84 (приложение 1): 24–30.
- ↵
Hodges P , Gee M, Grace M, et al. Потребление витаминов и железа у пациентов с болезнью Крона. J Am Diet Assoc 1984; 84: 52–8.
- ↵
Gee MI , Grace MG, Wensel RH, и др. Состояние питания амбулаторных гастроэнтерологических больных: сравнение воспалительного заболевания кишечника с функциональными нарушениями. J Am Diet Assoc, 1985; 85: 1591–9.
- ↵
Imes S , Pinchbeck BR, Thomson AB. Консультации по диете изменяют потребление питательных веществ пациентами с болезнью Крона. J Am Diet Assoc 1987; 87: 457–62.
- ↵
Geerling BJ , Badart-Smook A, Stockbrugger RW, et al. Комплексный нутритивный статус у пациентов с давней болезнью Крона, в настоящее время находящейся в стадии ремиссии. Am J Clin Nutr 1998; 67: 919–26.
Что может заставить тонкий кишечник не поглощать железо? | Live Healthy
Элемент железо необходим для выживания большинства живых организмов. Сотни белков в организме человека, в том числе многие ферменты, необходимые для клеточного метаболизма, не могли бы функционировать без железа. Единственный способ получить железо — это абсорбировать его из продуктов, которые вы едите, поэтому любой процесс, препятствующий всасыванию железа в кишечнике, может привести к проблемам со здоровьем.В частности, дефицит железа считается наиболее частой причиной анемии во всем мире.
Источники железа
Железо присутствует в пище в двух формах. Гемовое железо, получаемое из мяса и других источников животного происхождения, усваивается легче, чем негемовое железо, которое содержится в растительной пище. Исследования показывают, что в западных культурах гемовое железо составляет около 2/3 запасов железа в организме среднего человека, в то время как оно составляет лишь 1/3 потребляемого железа. Кроме того, многие вещества, содержащиеся в продуктах растительного происхождения, которых нет в продуктах животного происхождения, например, фитаты, связывают железо в кишечнике и препятствуют его всасыванию.Эти факторы могут объяснить более высокую распространенность железодефицитной анемии среди вегетарианцев.
Кислотный дефицит
Соляная кислота в желудке играет важную роль в усвоении железа, особенно негемового железа. Желудочная кислота помогает высвободить железо из пищи и преобразовать его в химическое состояние, которое легче усваивается. Любое состояние, которое снижает секрецию желудочного сока или снижает воздействие желудочной кислоты на принятую пищу, может ограничить всасывание железа в кишечнике.Пагубная анемия, препараты, блокирующие кислоту, и операция желудочного анастомоза — все это снижает всасывание железа в кишечнике за счет этого механизма.
Кишечное заболевание
В тонком кишечнике имеется около 250 квадратных ярдов поглощающей поверхности, поэтому его способность переносить витамины, минералы и другие питательные вещества в кровоток весьма значительна. Некоторые заболевания, поражающие обширные участки слизистой оболочки кишечника, могут нарушить всасывание железа. Люди с воспалительными заболеваниями кишечника, включая болезнь Крона и язвенный колит, часто страдают дефицитом железа.Хотя дефицит железа у людей с воспалительным заболеванием кишечника частично связан с кровопотерей из слизистой оболочки кишечника, всасывание железа также ограничивается воспалением слизистой оболочки верхнего отдела тонкой кишки, где абсорбируется большая часть железа. Точно так же глютеновая болезнь — заболевание кишечника, вызванное иммунной реакцией на глютен, — может препятствовать всасыванию железа в тонком кишечнике. В обзоре, опубликованном в декабре 2007 года в журнале «American Family Physician», сообщается, что от 10 до 15 процентов людей с глютеновой болезнью заболевают железодефицитной анемией.
Рекомендации
Нарушение всасывания железа в кишечнике может способствовать дефициту железа. Поскольку на всасывание железа в кишечнике может влиять множество факторов, вам нужно будет обсудить с врачом, вызван ли ваш дефицит железа основным заболеванием, например глютеновой болезнью.
Если вы принимаете добавку железа для лечения дефицита железа, вы можете улучшить всасывание железа в кишечнике, приняв добавку с витамином С. Врач назначит вам подходящие дозы железа и витамина С.
Ссылки
Биография писателя
Стивен Кристенсен начал писать статьи, связанные со здоровьем, в 1976 году, и его работы публиковались в различных публикациях, включая профессиональные журналы, журнал «Birds and Blooms», поэтические сборники и детские книги. Он получил медицинскую степень в Медицинской школе Университета штата Юта и закончил трехлетнюю резидентуру по семейной медицине в больничном центре Маккей-Ди в Огдене, штат Юта.
Этикетка с мифом о пищевой ценности — опровержение абсорбции железа
Железо — это микроэлемент, который необходим нашему организму.Он играет важную роль в формировании здоровых эритроцитов, помогает транспортировать кислород в крови и доставлять его к мышцам и составляет важнейший компонент нашей мышечной ткани. 1 Дефицит железа также является наиболее распространенным дефицитом питания во всем мире и, если его не лечить, может привести к различным проблемам со здоровьем, таким как усталость и анемия. 2 Поскольку железо жизненно важно для нашего тела, физической формы и общего самочувствия, команда InsideTracker готова помочь раскрыть некоторые секреты поглощения железа и способы его оптимизации.
Вставайте, возьмите еду из кладовой и взгляните на панель с сведениями о питании. Внизу этикетки найдите железо и процентное содержание железа в пище.
Хотя может показаться, что это позволит легко узнать, удовлетворяете ли вы свои ежедневные потребности в железе, это, к сожалению, не так просто. Хорошие новости? Вооружившись некоторыми важными знаниями о железе, вы сможете достичь своих железных целей!
В пище железо присутствует в двух различных формах: гемовое железо и негемовое железо. Гемовое железо , связанное с гемоглобином и миоглобином, содержится в мясе, рыбе и птице. 3 Гемовое железо содержится только в продуктах, полученных из мяса животных (хотя они также содержат негемовое железо). Негемовое железо , с другой стороны, присутствует в овощах, зернах, обогащенных продуктах и добавках. 4
Хотя точное усвоение гемового железа неизвестно (по оценкам, около 15-35%), мы знаем, что гемовое железо усваивается организмом легче, чем негемовое железо (около 3-20%). 5 Однако, несмотря на то, что гем лучше усваивается, большая часть железа в нашем рационе поступает из негемовых источников. Поэтому важно понимать некоторые факторы, которые усиливают или препятствуют усвоению негемовой пищи.
Простое планирование приема пищи поможет вам получить максимальную отдачу от продуктов, не содержащих гема железа. Учтите следующие факторы, которые могут усилить абсорбцию негема:
Мясо, рыба или птица (a.к.а. «Фактор MFP»)
Сочетайте ваши негемовые продукты, такие как овощи, зерновые, обогащенные продукты или добавки, с продуктами, богатыми гемом. 6 Гем, присутствующий в МФУ, улучшает усвоение негемового железа.
Кислоты
Употребляйте негемовые продукты вместе с кислыми продуктами. Подумайте о продуктах, богатых витамином С, лимонной или молочной кислотой. 7 Например, если вы готовите чечевичный суп, добавьте в него помидоры или томатный соус. Витамин С из помидоров поможет вашему организму усвоить негемовое железо из чечевицы. 8
Фруктоза (* примечание редактора: это , а не оправдание без сахара!)
Придерживайтесь растительных источников фруктозы, таких как мед, сушеный инжир, виноград, яблоки или груши и ешьте их с негемовой пищей. Например, свежие нарезанные яблоки и мед улучшают усвоение и обладают восхитительным вкусом на тарелке с овсянкой, которая, помимо множества других преимуществ, является хорошим источником негемового железа. 9
Не менее важно учитывать многие факторы, которые могут ингибировать абсорбцию негемового железа.Подойдите к вопросу творчески и подумайте, как отделить потребление негемовых продуктов от следующих:
Фитаты, волокна и оксалаты
Фитаты и клетчатка содержатся в таких продуктах, как цельнозерновые, соя, орехи и бобовые, и могут снизить количество негемового железа, которое усваивается из еды. 10 Важно отметить, что некоторые продукты с высоким содержанием фитатов, такие как овсянка, по-прежнему являются хорошими источниками негемового железа. 11 Вряд ли будет выгодно избегать употребления этих здоровых продуктов, но если вы едите продукты с высоким содержанием фитатов и клетчатки (например, шпинат, свеклу, ревень или листовые овощи), обязательно употребляйте продукты, которые улучшают усвоение негема. ! Например, шпинат — отличный негемовый источник железа, который также богат фитатами и волокнами.Заправьте зелень домашней заправкой на основе апельсинового сока, чтобы улучшить усвоение негемовых веществ.
Оксалаты
Оксалаты — распространенные, встречающиеся в природе пищевые химические вещества, обнаруженные во многих источниках пищи, таких как фрукты, овощи, орехи и семена, зерно и черный чай. 12 Они могут препятствовать усвоению железа организмом, соединяясь с железом с образованием соединения, называемого оксидом железа. Хотя некоторые исследования показывают, что определенные оксалатсодержащие продукты, такие как шпинат и фрукты, могут иметь минимальное влияние на абсорбцию негемового железа, нет никакого вреда в сочетании этих здоровых продуктов с негемовыми продуктами. 13
Кальций и фосфор
Кальций и фосфор могут значительно повлиять на абсорбцию железа. Постарайтесь увеличить промежуток времени между закусками, богатыми кальцием и фосфором (например, молоком, йогуртом или сыром), и негемовой пищей. 14 Чтобы получить максимальную пользу от продуктов, богатых кальцием и железом, подумайте о том, чтобы выпить стакан молока за пару часов до или после негемовой еды.
Танины и полифенолы
Танины и полифенол s — это биологические соединения, присутствующие в чае и кофе, которые могут оказывать ингибирующее действие на всасывание железа. 15 Эти соединения могут связываться с железом, что делает негемовое железо нерастворимым. Хотя исследования показывают, что некоторые напитки и продукты, богатые полифенолами, такие как красное вино, могут не значительно снижать абсорбцию железа, если у вас дефицит железа, обязательно оставьте пару часов между обедом, не содержащим гема, богатым железом, и послеобеденным чаем. 16
Избыточное потребление других минералов
Избыточное потребление других минералов может препятствовать всасыванию негемового железа.Как и железо, положительно заряжены цинк, кальций, магний и медь. Это означает, что эти минералы конкурируют за те же участки связывания, что и железо, и могут препятствовать его связыванию и всасыванию. 17 Если вы принимаете поливитамины, которые часто содержат эти положительно заряженные минералы, обязательно принимайте их за несколько часов до еды.
Низкое содержание кислоты в желудке
Кислотность желудка может значительно снизить количество железа, всасываемого в желудке. 18 Пожилые люди часто имеют менее кислый желудок, и частое употребление антацидов может повлиять на всасывание железа в желудке.Так что не переусердствуйте с Tums!
Яйца
Яйца содержат фосфопротеин, соединение, обладающее железосвязывающей способностью, которое может ухудшать усвоение железа. Некоторые исследования показали, что одно сваренное вкрутую яйцо может снизить всасывание железа из еды на целых 28%. 19 Для максимального усвоения железа рассмотрите возможность употребления яйца в качестве самостоятельного перекуса.
Когда организм имеет повышенные потребности, например, в периоды быстрого роста (у младенцев и детей ясельного возраста), беременности или кровопотери, важно соответственно увеличить потребление железа.Также знайте, что ваше тело протягивает вам руку помощи; Когда ваши запасы железа низки или у вас повышенные потребности, ваше тело реагирует соответствующим образом и помогает увеличить усвоение железа. Однако совершенно необходимо, чтобы вы помогали себе дальше, зная о негемовых усиливающих и сдерживающих факторах.
Дефицит железа — это тихая эпидемия, бессознательно поражающая миллионы людей во всем мире. Поэтому крайне важно использовать такие инструменты, как InsideTracker, для отслеживания и изменения уровней железа.Нажмите ниже, чтобы начать мониторинг и оптимизацию уровня железа сегодня и встать на путь улучшения самочувствия!
Ссылки
[1] Росс А. (2014). Современное питание в здоровье и болезни (11-е изд.). Филадельфия: Wolters Kluwer Health / Lippincott Williams & Wilkins.
[2] ВОЗ. Доклад о состоянии здравоохранения в мире, 2000 г. Женева: Всемирная организация здравоохранения, 2000 г.
[3] Диетические рекомендации для американцев, 2010 г.(2011, 31 января). Получено 11 декабря 2014 г. с веб-сайта http://www.health.gov/dietaryguidelines/2010.asp
.
[4] Там же.
[5] Roughead, Z. K. F., Zito, C. A., & Hunt, J. R. (2002). На начальное поглощение и абсорбцию негемового железа и абсорбцию гемового железа у людей не влияет добавление кальция в виде сыра к еде с высокой биодоступностью железа. Американский журнал клинического питания , 76 (2), 419-425.
[6] Zijp, I.M., Korver, O., & Тихбург, Л. Б. (2000). Влияние чая и других диетических факторов на усвоение железа. Критические обзоры в области пищевой науки и питания , 40 (5), 371-398.
[7] Hurrell, R., & Egli, I. (2010). Биодоступность железа и диетические контрольные значения. Американский журнал клинического питания , 91 (5), 1461S-1467S.
[8] Браун, Дж. К., и Эмблер, Дж. Э. (1974). Реакция на железо-стресс у томатов (Lycopersicon esculentum) 1. Участки восстановления, абсорбции и транспорта Fe. Physiologia Plantarum , 31 (3), 221-224.
[9] Hallberg, L. (1987). Пшеничная клетчатка, фитаты и абсорбция железа. Скандинавский гастроэнтерологический журнал , 22 (S129), 73-79.
[10] Sandberg, A. S., & Svanberg, U. (1991). Гидролиз фитата фитазой в зерновых; влияние на оценку доступности железа in vitro. Журнал пищевой науки , 56 (5), 1330-1333.
[11] Беринг, С., Сучдев, С., Шёлтов, Л., Берггрен, А., Тетенс, И., и Бухаве, К. (2006). Овсяная каша, ферментированная молочной кислотой, увеличивает абсорбцию негемного железа из пищи, богатой фитатами, у здоровых женщин детородного возраста. Британский журнал питания , 96 (01), 80-85.
[12] Росс А. (2014). Современное питание в здоровье и болезни (11-е изд.).
[13] Бонсманн, С., Валчик, Т., Ренггли, С., и Харрелл, Р. (2007). Щавелевая кислота не влияет на всасывание негемного железа у людей: сравнение блюд из капусты и шпината. Европейский журнал клинического питания, 336-341.
[14] Hallberg, L. (1987). Пшеничная клетчатка, фитаты и абсорбция железа.
[15] Дислер, П., Линч, С. Р., Чарльтон, Р. У., Торранс, Дж. Д., Ботвелл, Т. Х., Уокер, Р. Б., и Мэйет, Ф. (1975). Влияние чая на усвоение железа. Кишечник , 16 (3), 193-200.
[16] Hallberg, L. (1987). Пшеничная клетчатка, фитаты и абсорбция железа.
[17] Кук, Дж. Д., Редди, М. Б., и Харрелл, Р.Ф. (1995). Влияние красных и белых вин на абсорбцию негемового железа у человека. Американский журнал клинического питания , 61 (4), 800-804.
[18] Джейкобс А. и Майлз П. М. (1969). Роль желудочного секрета в абсорбции железа. Кишечник , 10 (3), 226-229.
[19] Hallberg, L. (1987). Пшеничная клетчатка, фитаты и абсорбция железа.
% PDF-1.5
%
1 0 объект
> / OCGs [8 0 R] >> / Страницы 2 0 R / Тип / Каталог >>
эндобдж
48 0 объект
> / Шрифт >>> / Поля [] >>
эндобдж
52 0 объект
> поток
2021-04-27T14: 58: 42-07: 002006-09-27T11: 54: 18-07: 002021-04-27T14: 58: 42-07: 00uuid: 54b67db5-d4fe-471f-bcc5-0b63820076ceuuid: 69a9057f- 1dd2-11b2-0a00-aa008831a3ffapplication / pdf
конечный поток
эндобдж
2 0 obj
>
эндобдж
43 0 объект
> / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3> / T1_4 56 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >>
эндобдж
38 0 объект
> / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5 56 0 R >> / ProcSet [/ PDF / Text / ImageB] / Свойства> / XObject >>> / Type / Page >>
эндобдж
33 0 объект
> / Resources> / Font> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5> / T1_6 56 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Страница >>
эндобдж
28 0 объект
> / Resources> / Font> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5> / T1_6 56 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Страница >>
эндобдж
23 0 объект
> / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3 56 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >>
эндобдж
18 0 объект
> / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5> / T1_6> / T1_7 56 0 R >> / ProcSet [/ PDF / Text / ImageB] / Свойства> / XObject >>> / Тип / Страница >>
эндобдж
13 0 объект
> / Resources> / Font> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5> / T1_6 56 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Страница >>
эндобдж
5 0 obj
> / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5 56 0 R >> / ProcSet [/ PDF / Text / ImageB] / Свойства> / XObject >>> / Type / Page >>
эндобдж
53 0 объект
> / ProcSet [/ PDF / Text / ImageC] / XObject >>> / Type / Page >>
эндобдж
71 0 объект
[77 0 R 78 0 R 79 0 R 80 0 R 81 0 R]
эндобдж
72 0 объект
> поток
q
540.0594177 0 0 68.6011963 35.9702911 675.3988037 см
/ Im0 Do
Q
BT
/ T1_0 1 Тс
10 0 0 10 85,56995 576,99985 тм
(1977; 37: 2379-2386.) Tj
/ T1_1 1 Тс
-5.55699 0 Тд
(Рак Res \ 240) Tj
/ T1_0 1 Тс
0 1 ТД
(\ 240) Tj
0 1.00001 TD
(Уолтер Лоуренс младший) Tj
/ T1_2 1 Тс
0 1 ТД
(\ 240) Tj
/ T1_3 1 Тс
18 0 0 18 30 616,99997 тм
(Желудочно-кишечный тракт при раке) Tj
Т *
(Пищевые последствия хирургической резекции) Tj
ET
30 522 552 35 рэ
0 0 мес.
S
BT
/ T1_0 1 Тс
11 0 0 11 120.94202 529.99997 тм
(\ 240) Tj
/ T1_3 1 Тс
-7.55696 1 тд
(Обновленная версия) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 141 521,99994 тм
(\ 240) Tj
/ T1_0 1 Тс
26.12495 1 тд
() Tj
0 0 1 рг
-26.12495 0 Тд
(http://cancerres.aacrjournals.org/content/37/7_Part_2/2379)Tj
0 г
0 1.00001 TD
(См. Самую последнюю версию этой статьи по адресу:) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 30 501,99997 тм
(\ 240) Tj
0 1 ТД
(\ 240) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 30 481,99997 тм
(\ 240) Tj
Т *
(\ 240) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 30 461,99997 тм
(\ 240) Tj
Т *
(\ 240) Tj
ET
30 347 552 115 рэ
0 0 мес.
S
BT
/ T1_0 1 Тс
11 0 0 11 120.94202 429,99997 тм
(\ 240) Tj
/ T1_3 1 Тс
-5.66901 1 тд
(Оповещения по электронной почте) Tj
ET
BT
/ T1_0 1 Тс
10 0 0 10 295,4996 442 тм
(относится к этой статье или журналу.) Tj
0 0 1 рг
-15.44996 0 Тд
(Зарегистрируйтесь, чтобы получать бесплатные уведомления по электронной почте) Tj
ET
BT
0 г
/ T1_0 1 Тс
11 0 0 11 120.94202 396.99994 тм
(\ 240) Tj
/ T1_3 1 Тс
-6.38997 1 тд
(Подписки) Tj
0,556 1,00001 тд
(Отпечатки и) Tj
ET
BT
/ T1_0 1 Тс
10 0 0 10 141 399,99994 тм
(\ 240) Tj
13,46496 1 тд
(.) Tj
0 0 1 рг
-6.85098 0 Тд
([email protected]) Tj
0 г
-6.61398 0 Тд
(Отделение) Tj
0 1.00001 TD
(Чтобы заказать перепечатку статьи или подписаться на журнал, свяжитесь с нами \
t Публикации AACR) Tj
ET
BT
/ T1_0 1 Тс
11 0 0 11 120,94 202 374,99997 тм
(\ 240) Tj
/ T1_3 1 Тс
-5.66901 1 тд
(Разрешения) Tj
ET
BT
/ T1_0 1 Тс
10 0 0 10 141 346,99988 тм
(\ 240) Tj
0 1 ТД
(Сайт Rightlink.) Tj
0 1.00001 TD
(Нажмите «Запросить разрешения», чтобы перейти на страницу Copyright Clea \
Центр Рэнсиса \ (CCC \)) Tj
26.