АНГИОГЕНЕЗ
М.В. Спринджук 1, 2
Национальная Академия Наук Беларуси
Объединенный Институт Проблем Информатики
1 Объединенный институт проблем информатики Национальной академии наук Беларуси
ул. Сурганова, 6, 220012, г. Минск, Беларусь
2 Автор для связи: Беларусь, 220040, Минск, Ул. Богдановича 112/38.
Электронная почта:
Резюме
Тема ангиогенеза – образования сосудов из уже существующих – сегодня является наиболее финансируемой и изучаемой медицинской научной темой в мире. Это связано с тем, что приблизительно 500 млн. жителей планеты нуждается в терапевтической коррекции патологических процессов ангиогенеза. В статье – обзоре литературы систематизированы только наиболее яркие источники литературы, намеренно преимущественно отечественных авторов. Работа проиллюстрирована для доступного понимания. В статье рассматриваются вопросы биохимии и патологической физиологии ангиогенеза в непосредственной связи с современной фармакотерапией. Целью литобзора является предоставление читателю возможности ознакомиться с современной медицинской проблемой 21 века: патологическим кровоснабжением и связанными с этим феноменом вопросами.
Целью литобзора является предоставление читателю возможности ознакомиться с современной медицинской проблемой 21 века: патологическим кровоснабжением и связанными с этим феноменом вопросами.
Ключевые слова: ангиогенез, неоваскуляризация, фактор роста эндотелия сосудов, метастазированиe, рак, злокачественные опухоли, антиангиогенная фармакотерапия.
Angiogenesis in thyroid gland
Review article
M.V. Sprindzuk 1, 2
1 United Institute of Informatics Problems, National Academy of Sciences of Belarus
Surganov str., 6, 220012, Minsk, Belarus
Tel: +375-17-274-21-71
Fax: +375-17-331-84-03
2 Corresponding author: Belarus, 220040, Minsk, Bogdanovicha lane 112/38.
Email:
Abstract
The research theme of angiogenesis – the development of blood vessels from the already existing, is one of the most financially supported medical scientific activities in the world. This is so, because 500 000000 citizen need the therapeutic correction of the pathologic angiogenesis processes. The review article is an assembly of the brightest research articles written in and translated into Russian. The paper has several figures, prepared in an attempt to provide the understandable educational resource. The biochemical and pathophysiological questions of angiogenesis are discussed in close relation to the modern angiogenic pharmacotherapy. The objective of the article is to present the reader an opportunity to discover the biomedical research challenge of the 21 century: the pathologic blood supply, vascularization and the associated phenomena.
This is so, because 500 000000 citizen need the therapeutic correction of the pathologic angiogenesis processes. The review article is an assembly of the brightest research articles written in and translated into Russian. The paper has several figures, prepared in an attempt to provide the understandable educational resource. The biochemical and pathophysiological questions of angiogenesis are discussed in close relation to the modern angiogenic pharmacotherapy. The objective of the article is to present the reader an opportunity to discover the biomedical research challenge of the 21 century: the pathologic blood supply, vascularization and the associated phenomena.
Key words: angiogenesis, neovascularization, vascular endothelial growth factor, metastasis, cancer, malignant tumors, antiangiogenic pharmacotherapy.
Содержание
Определение ангиогенеза
Ангиогенез (A.) – процесс образования новых кровеносных сосудов в органе или ткани. В норме в организме процессы ангиогенеза протекают с умеренной интенсивностью и только при регенерации поврежденных тканей, канализации тромбов, ликвидации очагов воспаления, образовании рубца и тому подобных процессах восстановления, а также при росте и развитии организма [1]. Отдельной областью изучения физиологического ангиогенеза является гинекология, так как А. является неотъемлемой частью циклических превращений в яичниках. Ангиогенез необходим для нормального роста эмбриональных и постнатальных тканей, пролиферации эндометрия, созревания в яичнике фолликула и желтого тела, заживления ран, коллатерализации, стимулированной ишемией [2]. Установлено, что эндотелиальные клетки вырабатывают цитокины, которые стимулируют не только пролиферацию и миграцию самих эндотелиальных клеток, но и пролиферацию опухолевых клеток. Иногда эти аутокринные и паракринные факторы секретирует сама опухоль [3-5].
В норме в организме процессы ангиогенеза протекают с умеренной интенсивностью и только при регенерации поврежденных тканей, канализации тромбов, ликвидации очагов воспаления, образовании рубца и тому подобных процессах восстановления, а также при росте и развитии организма [1]. Отдельной областью изучения физиологического ангиогенеза является гинекология, так как А. является неотъемлемой частью циклических превращений в яичниках. Ангиогенез необходим для нормального роста эмбриональных и постнатальных тканей, пролиферации эндометрия, созревания в яичнике фолликула и желтого тела, заживления ран, коллатерализации, стимулированной ишемией [2]. Установлено, что эндотелиальные клетки вырабатывают цитокины, которые стимулируют не только пролиферацию и миграцию самих эндотелиальных клеток, но и пролиферацию опухолевых клеток. Иногда эти аутокринные и паракринные факторы секретирует сама опухоль [3-5].
Рис.1 [23].
Особенности физиологического ангиогенеза
Физиологический ангиогенез представляет собой тканевый ответ либо на гормональную стимуляцию (ангиогенез в репродуктивной системе), либо на изменение окружающей среды (ткань способна расширять сосудистую сеть в ответ на ишемию).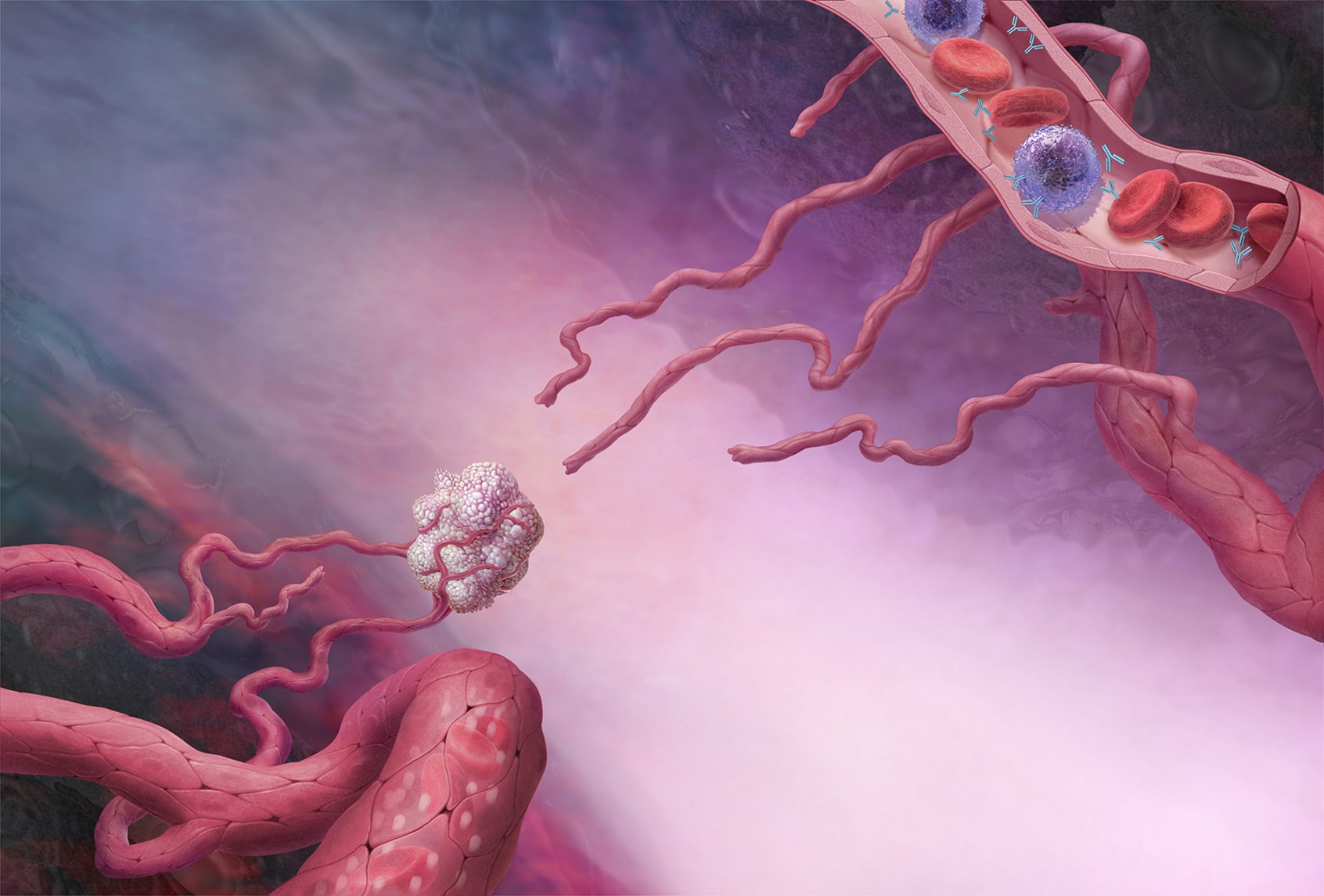 Учитывая, что фактор роста эндотелия сосудов (endothelial growth factor = VEGF) – это стрессиндуцированный белок, его регуляция сравнивается с другими кислород- и глюкозорегулируемыми белками, поэтому физиологический и ростовой ангиогенез можно рассматривать как адаптационный ответ на дефицит кислорода. Для того чтобы кислород и питательные вещества поступали в достаточном количестве, каждая клетка макроорганизма должна быть близко расположена к капилляру [2].
Учитывая, что фактор роста эндотелия сосудов (endothelial growth factor = VEGF) – это стрессиндуцированный белок, его регуляция сравнивается с другими кислород- и глюкозорегулируемыми белками, поэтому физиологический и ростовой ангиогенез можно рассматривать как адаптационный ответ на дефицит кислорода. Для того чтобы кислород и питательные вещества поступали в достаточном количестве, каждая клетка макроорганизма должна быть близко расположена к капилляру [2].
Особенности патологического и опухолевого ангиогенеза
В последние годы благодаря достижениям в области молекулярной онкологии удалось расшифровать некоторые механизмы канцерогенеза и определить признаки злокачественного фенотипа: самодостаточность в отношении ростовых сигналов, нечувствительность к рост-игибиторным сигналам, уклонение от программированной клеточной смерти (апоптоза), неограниченность репликативного потенциала, ангиогенез, тканевая инвазия и метастазирование.
Злокачественной опухоли требуются питательные вещества. Опухоль объемом более 1-2 мм3 для продолжения своего роста нуждается в собственной системе кровоснабжения. Эта фраза цитируется во многих сотнях статей и книжных главах. Патологический ангиогенез наблюдается при ангиогенных заболеваниях, к которым, помимо опухолевого роста, метастазирования, атеросклероза, диабетической ретинопатии, эндометриоза, меноррагий, псориаза, относится и плоский лишай [2,6,7, 15-18, 20-22].
Опухоль объемом более 1-2 мм3 для продолжения своего роста нуждается в собственной системе кровоснабжения. Эта фраза цитируется во многих сотнях статей и книжных главах. Патологический ангиогенез наблюдается при ангиогенных заболеваниях, к которым, помимо опухолевого роста, метастазирования, атеросклероза, диабетической ретинопатии, эндометриоза, меноррагий, псориаза, относится и плоский лишай [2,6,7, 15-18, 20-22].
Наиболее яркими примерами патологий, связанных с ангиогенезом, являются атеросклероз (Koch et al., 1994), язвенная болезнь (Folkman et al., 1987) и некоторые аутоиммунные заболевания. Существуют косвенные указания на нарушения нормальных процессов А. при ряде патологий развития (Jackson et al., 1995) и при опухолеобразовании [8].
Метастазирование и ангиогенез
Метастазирование
- Метастазирование – это процесс, при помощи которого раковые клетки могут менять свое положение в организме.

- Большинство связанных с раком смертей вызвано метастазированием первоначальных раковых клеток.
- Для того чтобы разрушать в организме барьеры, метастазирующие раковые клетки должны секретировать смесь переваривающих ферментов.
- Для перемещения и осаждения в подходящей части тела раковые клетки могут использовать кровеносную систему.
- Метастазирование – это очень неэффективный процесс. Большинство раковых клеток гибнет после того, как они покидают первоначальную опухоль. Усиленный А. в опухоли является одним из механизмов ее быстрого метастазирования, так как опухолевые клетки имеют свойство метастазировать по ходу кровеносных сосудов (вдоль стенок) или разносятся по всему организму с током крови [1].
Сосуды питают опухоль и позволяют ей метастазировать [8].
Иногда уже на самых ранних стадиях развития опухоли в ней появляются субпопуляции клеток с высокой способностью к метастазированию.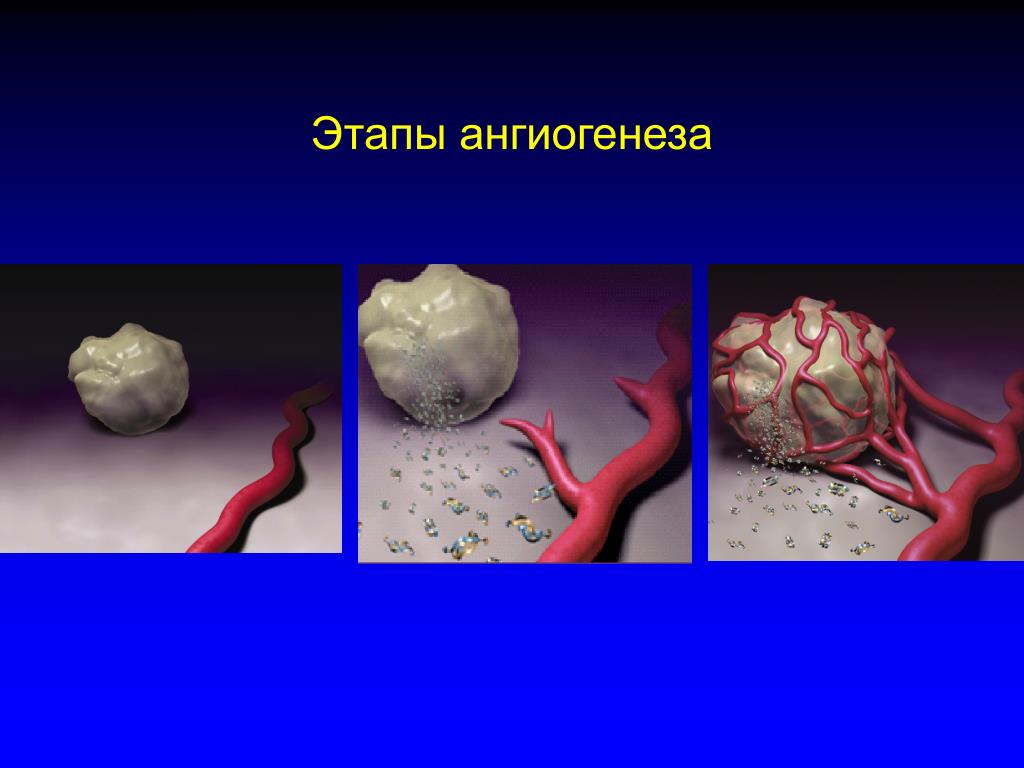 Установлено, что рак молочной железы способен метастазировать сразу после разрастания в опухоли сосудов, когда ее размеры еще не превышают 0,125 см2. Полагают, что поздно метастазирующие опухоли недостаточно васкуляризованы [8].
Установлено, что рак молочной железы способен метастазировать сразу после разрастания в опухоли сосудов, когда ее размеры еще не превышают 0,125 см2. Полагают, что поздно метастазирующие опухоли недостаточно васкуляризованы [8].
Лимфатическое метастазирование
- Для метастазирования раковые клетки могут использовать как кровеносную, так и лимфатическую систему.
- Перемещение раковых клеток в лимфатические узлы посредством лимфатической системы используется при определении метастатического заболевания и стадии опухоли.
Метастазы опухолей в местные и регионарные лимфоузлы, куда опухолевые клетки попадают по лимфатическим сосудам, представляют собой ранний этап метастазирования (см. рис.2). В ряде исследований было показано, что VEGF индуцирует как лимфангиогенез, так и распространение опухолевых клеток в регионарные лимфатические узлы. Экспрессия ростовых факторов типа VEGF может определять способность опухоли к метастазированию. VEGF оказывает более широкие эффекты на другие клетки, помимо эндотелия сосудов, и на другие процессы, помимо А.:
VEGF оказывает более широкие эффекты на другие клетки, помимо эндотелия сосудов, и на другие процессы, помимо А.:
- Связываясь с рецептором-2 VEGF и стимулируя его, VEGF способствует формированию лимфатических сосудов.
- VEGF оказывает не полностью изученное действие на иммунные функции, в том числе:
- подавляет образование дендритных клеток, необходимых для осуществления клеточного иммунного ответа;
- стимулирует хемотаксис моноцитов [9].
Рис.2. Ангиогенез и развитие злокачественной опухоли [19].
Фактор роста эндотелия сосудов
Фактор роста эндотелия сосудов (или фактор проницаемости сосудов) является основным регулятором А. Его важнейшая роль подтверждается тем, что мыши, имеющие всего один аллель нормального VEGF-A, погибают внутриутробно. В большинстве опухолей человека концентрация VEGF повышается, что сопровождается усилением инвазивности, склонностью к рецидивам и худшим прогнозом [6].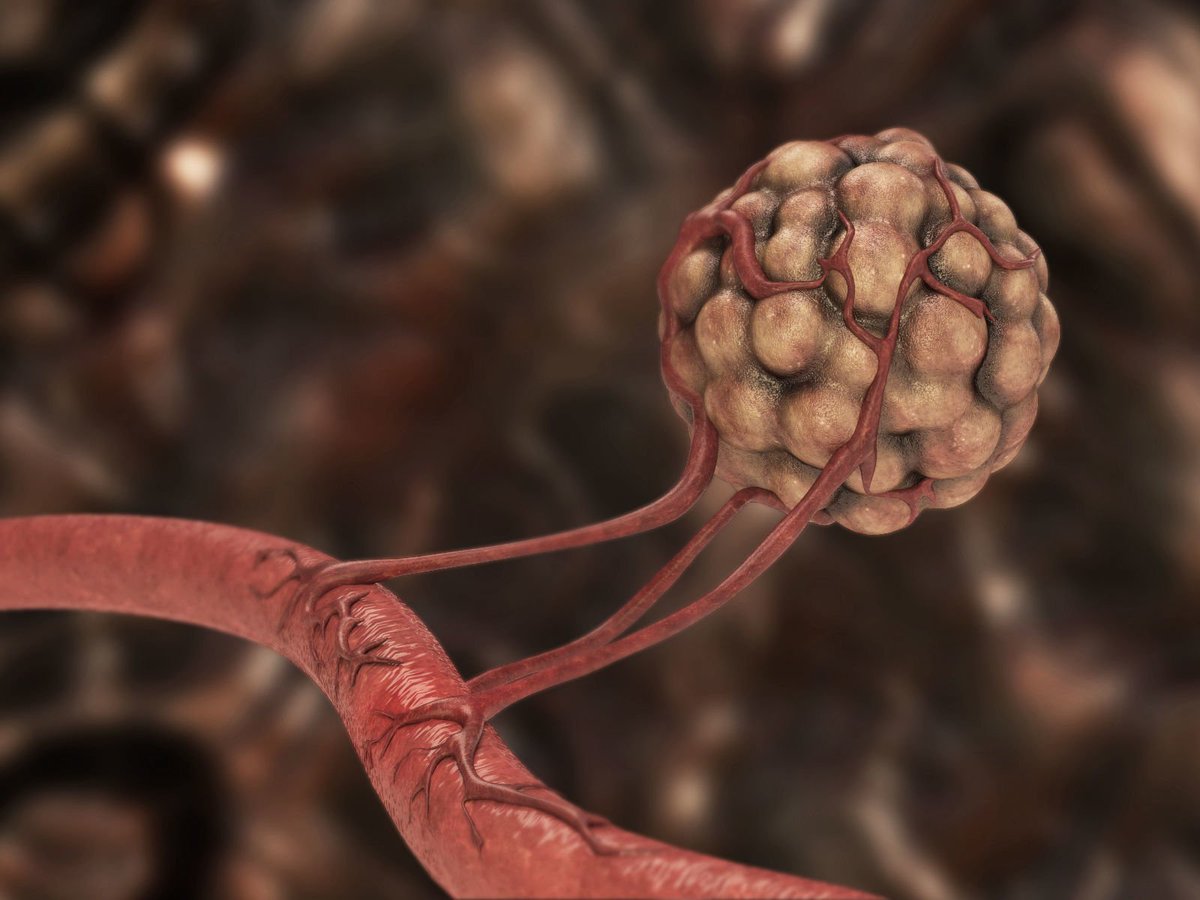
VEGF – гомодимерный, сильно гликолизированный белок, митогенный только для эндотелиальных клеток, уровень его повышается в тканях, где активно идет А., его рецепторы экспрессируются на эндотелиальных клетках-мишенях в близлежащих кровеносных сосудах. Основными биологически активными формами являются молекулы размером 121 и 165 аминокислотных остатков. В 1989 г. несколько независимых групп ученых получили данные в пользу индукции VEGF гипоксией и гипогликемией. По данным ряда авторов, А. функционирует в динамическом сочетании с цитокинами, их растворимыми рецепторами и антагонистами, протеолитическими ферментами, регулирующими их освобождение из внеклеточного матрикса [2].
Семейство VEGF
Семейство VEGF включает прототипную молекулу VEGF-A, а также VEGF-B, VEGF-C, VEGF-D, вирусный гомолог VEGF-E и плацентарный ростовой фактор (PLGF). VEGF-A повышает сосудистую проницаемость и способствует А., VEGF-B, как полагают, играет роль в регуляции деградации внеклеточного матрикса, клеточной адгезии и миграции, а VEGF-C и VEGF-D участвуют, главным образом, в лимфангиогенезе. PLGF в большом количестве экспрессируется тромбобластом, модулируя развитие сосудистой сети в плаценте (см. рис.3).
PLGF в большом количестве экспрессируется тромбобластом, модулируя развитие сосудистой сети в плаценте (см. рис.3).
Рис.3. Семейство молекул и рецепторов VEGF (более подробные объяснения см. в тексте).
Cвязывание VEGF с рецептором VEGFR-2 ведет к активации каскада различных сигнальных путей. Примеры двух из них изображены на рисунке 3. Такое взаимодействие приводит к включению генов, вовлекаемых в опосредование процессов пролиферации и миграции клеток эндотелия, и обеспечивает клеточное выживание, а также сосудистую проницаемость. Например, связывание VEGF с рецептором VEGFR-2 приводит к димеризации рецептора, за которым следует активация PLC–PKC–Raf киназа–MEK–митоген-активированной протеин киназы (MAPK) и последующая инициация синтеза ДНК и роста клеток, тогда как активация фосфатидилинозитол 3’–киназа (PI3K)–Akt пути приводит к увеличению роста выживания эндотелиальных клеток. Активация гена src может повлечь изменения актина цитоскелета и индуцировать миграцию клеток. Рецепторы VEGF локализованы на поверхности клеток эндотелия, однако могут присутствовать также и внутриклеточные («интракринные») VEGF-сигнальные рецепторы (VEGFR-2). Они вовлекаются в процессы обеспечения выживания эндотелиальных клеток. Детальная структура внутриклеточного VEGFR-2 до сих пор неизвестна, но на рисунке он показан как полноразмерный рецептор, который в норме прикреплен к поверхности клетки. Cвязывание VEGF-C c VEGFR-3 опосредует лимфангиогенез. VEGF может присоединяться к рецепторам нейропилина (NRP), которые могут действовать как корецепторы с VEGFR-2 (горизонтальная стрелка) и осуществлять регуляцию А.
Рецепторы VEGF локализованы на поверхности клеток эндотелия, однако могут присутствовать также и внутриклеточные («интракринные») VEGF-сигнальные рецепторы (VEGFR-2). Они вовлекаются в процессы обеспечения выживания эндотелиальных клеток. Детальная структура внутриклеточного VEGFR-2 до сих пор неизвестна, но на рисунке он показан как полноразмерный рецептор, который в норме прикреплен к поверхности клетки. Cвязывание VEGF-C c VEGFR-3 опосредует лимфангиогенез. VEGF может присоединяться к рецепторам нейропилина (NRP), которые могут действовать как корецепторы с VEGFR-2 (горизонтальная стрелка) и осуществлять регуляцию А.
KDR – kinase-insert domain–containing receptor – рецептор, имеющий в составе домен, содержащий киназу.
flk-1 – fetal liver kinase 1 – киназа печени плода.
EGFR – фактор роста эпидермиса, epidermal growth factor receptor.
PLGF – плацентарный фактор роста, placental growth factor.
PTEN – гомолог фосфатазы и тензина, phosphatase and tensin homologue.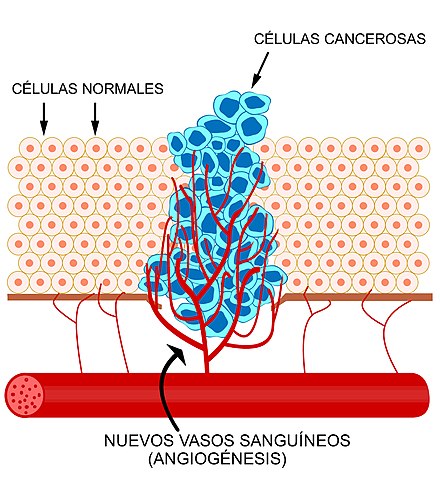
S–S – дисульфидная связь, disulfide bond.
VHL – вон Гиппель-Ландау, von Hippel–Lindau.
(рисунок из NEMJ, google images)
Изоформы VEGF
У человека выделены 4 изоформы VEGF-A – VEGF121, VEGF165, VEGF189 и VEGF206, которые образуются в результате альтернативного сплайсинга мРНК VEGF.
Изоформы, которые имеют сходную биологическую активность, но сильно различаются по биодоступности, определяющейся размером молекулы и регулирующейся на генетическом уровне при альтернативном сплайсинге мРНК [cплайсинг протеинов – это внутримолекулярная реакция отдельного протеина, при которой внутренний сегмент протеина (называемый интеин) удаляется из протеина-предшественника одновременно с лигацией – отщеплением С-терминальных и Т-терминальных наружных протеинов (называемых экстеинами) с обеих сторон] [10] и протеолитическом расщеплении синтезированных молекул с участием системы активации плазминогена [2].
Более крупные формы VEGF связаны с матриксом через гепаринсвязывающие домены, в то время как VEGF165 (наиболее распространенная и значимая изоформа) и VEGF121 находятся в состоянии, способном к диффузии. Более крупные изоформы находятся в латентном состоянии во внеклеточном матриксе до того момента, как они высвобождаются под действием протеолитических ферментов, таких как плазмин или ММП-9 (матричная металлопротеаза). Этот процесс повышает местные концентрации VEGF-A в процессе роста и перестройки тканей и участвует в активации ангиогенного включения в некоторых опухолях. Как описывалось выше, VEGF-A также играет важную роль в удержании эндотелиальных клеток новообразованных кровеносных сосудов до момента присоединения к ним перицитов. Новообразованные сосуды, у которых еще нет перицитов, зависят от VEGF-A, препятствующего апоптозу эндотелиальных клеток и обратному развитию незрелых сосудов [6].
Более крупные изоформы находятся в латентном состоянии во внеклеточном матриксе до того момента, как они высвобождаются под действием протеолитических ферментов, таких как плазмин или ММП-9 (матричная металлопротеаза). Этот процесс повышает местные концентрации VEGF-A в процессе роста и перестройки тканей и участвует в активации ангиогенного включения в некоторых опухолях. Как описывалось выше, VEGF-A также играет важную роль в удержании эндотелиальных клеток новообразованных кровеносных сосудов до момента присоединения к ним перицитов. Новообразованные сосуды, у которых еще нет перицитов, зависят от VEGF-A, препятствующего апоптозу эндотелиальных клеток и обратному развитию незрелых сосудов [6].
Лиганд VEGF
VEGF – один из членов семейства структурно близких между собой белков, которые являются лигандами для семейства рецепторов VEGF (лиганд – ион, молекула или их группа, которые сывязываются с другой химической структурой, формируя более крупный комплекс) [11]. VEGF влияет на развитие новых кровеносных сосудов (А.) и выживание незрелых кровеносных сосудов (сосудистая поддержка), связываясь с двумя близкими по строению мембранными тирозинкиназными рецепторами (рецептором-1 VEGF и рецептором-2 VEGF) и активируя их (рецептор – молекула белка, которая получает сигнал: нейропередатчик, гормон или другой, и отвечает на него) [12]. Эти рецепторы экспрессируются клетками эндотелия стенки кровеносных сосудов.
VEGF влияет на развитие новых кровеносных сосудов (А.) и выживание незрелых кровеносных сосудов (сосудистая поддержка), связываясь с двумя близкими по строению мембранными тирозинкиназными рецепторами (рецептором-1 VEGF и рецептором-2 VEGF) и активируя их (рецептор – молекула белка, которая получает сигнал: нейропередатчик, гормон или другой, и отвечает на него) [12]. Эти рецепторы экспрессируются клетками эндотелия стенки кровеносных сосудов.
VEGF лиганд запускает сигнальный каскад, который в конечном итоге стимулирует рост эндотелиальных клеток сосуда, их выживание и пролиферацию. Эндотелиальные клетки участвуют в таких разнообразных процессах, как вазоконстрикция и вазодилатация, презентация антигенов, а также служат очень важными элементами всех кровеносных сосудов – как капилляров, так и вен или артерий. Таким образом, стимулируя эндотелиальные клетки, VEGF играет центральную роль в процессе А. [7,13].
Таблица 1. Рецепторная специфичность лигандов VEGF и их биологические эффекты [13].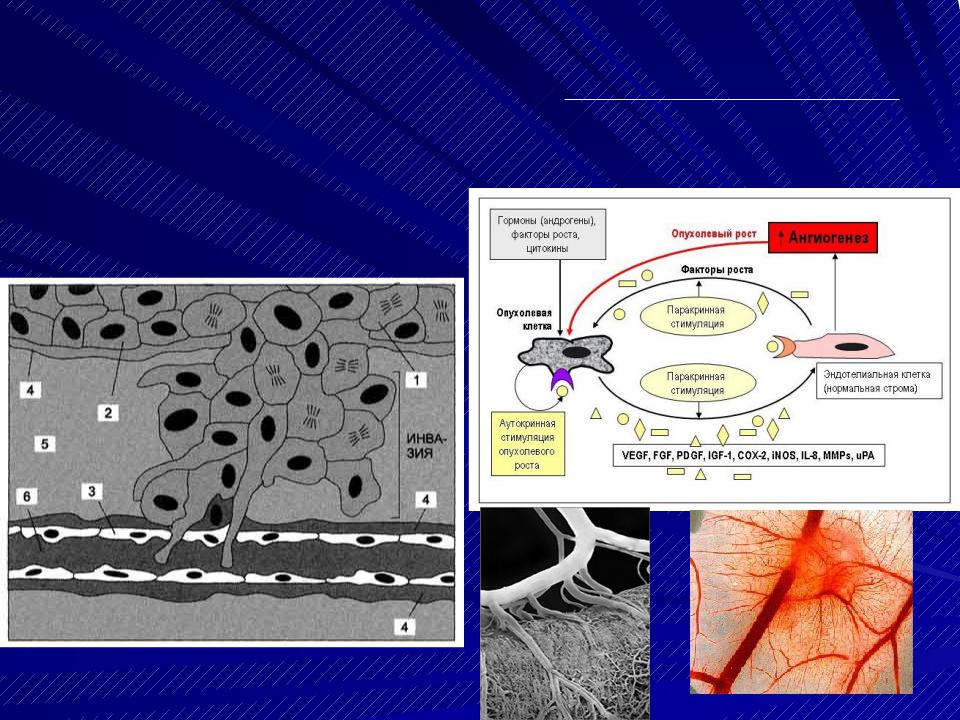
| Лиганд | Рецептор | Функция |
|---|---|---|
| VEGF (VEGF-A) | Рецепторы-1, -2, VEGFR, нейропилин-1 | Ангиогенез, сосудистая поддержка |
| VEGF-B | VEGFR-1 | Неизвестна |
| VEGF-C | VEGFR-2, VEGFR-3 | Лимфангиогенез |
| VEGF-D | VEGFR-2, VEGFR-3 | Лимфангиогенез |
| VEGF-E (Вирусный фактор) | VEGFR-2 | Ангиогенез |
| ПлРФ | VEGFR-1, нейропилин-1 | Ангиогенез и воспаление |
ПлРФ – плацентарный ростовой фактор.
Рецепторы VEGF
Точка приложения действия бевацизумаба (медикамент, который рассматривается в последней части статьи) – VEGF-A – связывается с соответствующими тирозинкиназными рецепторами VEGF 1 (flt-1) и 2 (flk-1).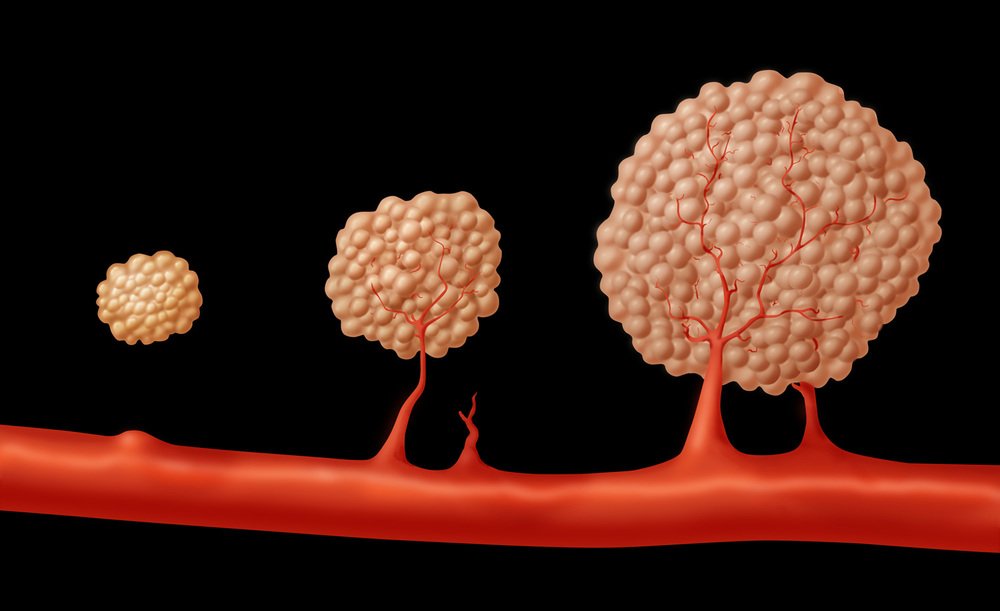 Гипоксия в сочетании с возросшими местными концентрациями VEGF-A усиливает экспрессию как VEGF рецептора-1, так и VEGF рецептора-2 на эндотелиальных клетках опухоли. Интересно, что рецепторы VEGF также экспрессируются опухолевыми клетками, в том числе VEGF рецептор-1 обнаруживается в раковых клетках. Это позволяет предположить, что анти-VEGF-терапия может оказывать и другие эффекты, помимо подавления А.
Гипоксия в сочетании с возросшими местными концентрациями VEGF-A усиливает экспрессию как VEGF рецептора-1, так и VEGF рецептора-2 на эндотелиальных клетках опухоли. Интересно, что рецепторы VEGF также экспрессируются опухолевыми клетками, в том числе VEGF рецептор-1 обнаруживается в раковых клетках. Это позволяет предположить, что анти-VEGF-терапия может оказывать и другие эффекты, помимо подавления А.
Связывание VEGF-A с VEGF рецептором-2 необходимо для нормального А. и гемопоэза, и основные эффекты VEGF-A опосредованы через этот рецептор (рис.1). Связывание VEGF-A ведет к образованию димеров VEGF рецепторов-2, что запускает процесс фосфорилирования тирозинкиназы. Это, в свою очередь, индуцирует фосфорилирование нескольких цитоплазматических сигнальных белков и начало соответствующих сигнальных каскадов, таких как каскад фосфолипазы С, фосфоинозитол-3-киназы, Ras и Src [24,25]. VEGF-C и VEGF-D тоже связываются с VEGF рецептором-2, а также с VEGF рецептором-3 (flt-4). Следовательно, если VEGF-A, доминирующий внутри опухоли, будет нейтрализован действием бевацизумаба, сигнальные пути, опосредованные VEGF рецептором-2, могут быть активными в том случае, если опухоль продуцирует значительное количество VEGF-C и VEGF-D. Действительно, уровни экспрессии VEGF-C и VEGF рецептора-2 в первичных опухолях ободочной кишки и метастазах в лимфатические узлы позволяют предположить наличие сигнального пути VEGF-C [6].
Следовательно, если VEGF-A, доминирующий внутри опухоли, будет нейтрализован действием бевацизумаба, сигнальные пути, опосредованные VEGF рецептором-2, могут быть активными в том случае, если опухоль продуцирует значительное количество VEGF-C и VEGF-D. Действительно, уровни экспрессии VEGF-C и VEGF рецептора-2 в первичных опухолях ободочной кишки и метастазах в лимфатические узлы позволяют предположить наличие сигнального пути VEGF-C [6].
Препараты, точкой приложения действия которых являются все эти три члена семейства VEGF (VEGF-A, -C и -D) или рецепторы VEGF (в частности, VEGF рецептор-2), также могут быть эффективными средствами лечения. VEGF рецептор-1 связывается с VEGF-A, VEGF-B и PIGF, но его точные функции неясны. Помимо мембранно-связанной формы, существуют также четыре растворимые изоформы, блокирующие VEGF-A путем конкурентного связывания и тем самым предотвращающие взаимодействие с VEGF рецептором-1 и VEGF рецептором-2. Лиганд, связывающийся с мембрано-связанной формой VEGF рецептора-1, вызывает лишь слабое аутофосфорилирование тирозинкиназы. По этой причине предположили, что VEGF рецептор-1 является decoy-рецептором, участвующим в отрицательной регуляции митогенного сигнала как в мембрано-связанной, так и в растворимой формах. Дальнейшие доказательства такой роли были получены при добавлении PLGF, который конкурирует с VEGF-A за VEGF рецептор-1 и потенцирует эффекты VEGF-A. Присутствие PLGF повышает доступность VEGF-A для связывания с VEGF рецептором-2, в результате чего возникает сильный митогенный сигнал. Однако для опосредованной VEGF миграции моноцитов, активации предшественников эндотелиальных клеток и индукции активности ММП необходим интактный сигнальный каскад VEGF рецептора-1. Другие данные указывают на роль сигнального пути VEGF рецептора-1 в перицитах.
По этой причине предположили, что VEGF рецептор-1 является decoy-рецептором, участвующим в отрицательной регуляции митогенного сигнала как в мембрано-связанной, так и в растворимой формах. Дальнейшие доказательства такой роли были получены при добавлении PLGF, который конкурирует с VEGF-A за VEGF рецептор-1 и потенцирует эффекты VEGF-A. Присутствие PLGF повышает доступность VEGF-A для связывания с VEGF рецептором-2, в результате чего возникает сильный митогенный сигнал. Однако для опосредованной VEGF миграции моноцитов, активации предшественников эндотелиальных клеток и индукции активности ММП необходим интактный сигнальный каскад VEGF рецептора-1. Другие данные указывают на роль сигнального пути VEGF рецептора-1 в перицитах.
Третий рецептор VEGF – VEGF рецептор-3, не связывается с VEGF-A и обнаруживается, главным образом, в лимфатическом эндотелии. VEGF рецептор-3 связывается с VEGF-C и VEGF-D и участвует в основном в лимфангиогенезе [6].
Значение VEGF для онтогенеза
VEGF чрезвычайно важен для формирования адекватной функционирующей сосудистой системы в ходе эмбриогенеза и в раннем постнатальном периоде, однако у взрослых его физиологическая активность ограничена. Эксперименты на мышах показали следующее:
Эксперименты на мышах показали следующее:
- Целенаправленное повреждение одной или двух аллелей гена VEGF приводит к гибели эмбриона.
- Инактивация VEGF в период раннего постнатального развития также ведет к летальному исходу.
- Повреждение VEGF у взрослых мышей не сопровождается какими-либо явными аномалиями, поскольку его роль ограничена развитием фолликулов, заживлением ран и репродуктивном циклом у самок.
Ограниченное значение А. у взрослых означает, что подавление активности VEGF представляет собой выполнимую терапевтическую задачу [9].
Воздействие VEGF на незрелые сосуды
Незрелые кровеносные сосуды существуют преимущественно на этапе развития, а у взрослых индивидуумов – лишь в некоторых ситуациях, например, в процессе заживления ран или заболеваний, характеризующихся аномальным А., таких как онкологические. В отсутствие ростовых сигналов эндотелиальные клетки этих незрелых кровеносных сосудов подвергаются программированной клеточной гибели (апоптозу).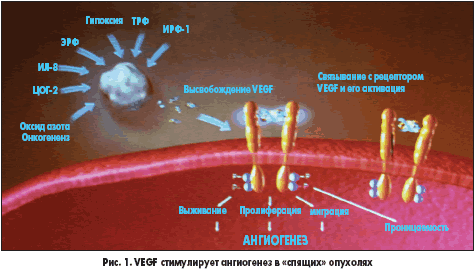 VEGF препятствует апоптозу эндотелиальных клеток в незрелых кровеносных сосудах, тем самым сохраняя их жизнеспособность. В отличие от этого зрелые кровеносные сосуды, из которых сформирована сосудистая система взрослого, больше не нуждаются в VEGF для своего выживания и поэтому вряд ли будут страдать от подавления активности VEGF [9].
VEGF препятствует апоптозу эндотелиальных клеток в незрелых кровеносных сосудах, тем самым сохраняя их жизнеспособность. В отличие от этого зрелые кровеносные сосуды, из которых сформирована сосудистая система взрослого, больше не нуждаются в VEGF для своего выживания и поэтому вряд ли будут страдать от подавления активности VEGF [9].
Влияние VEGF на иммунный ответ
Опухоли обладают рядом механизмов, которые позволяют им избежать иммунного ответа организма хозяина. Один из этих механизмов подразумевает ингибирование дендритных клеток – антиген-презентирующих клеток, которые стимулируют В- и Т-лимфоциты. VEGF препятствует функциональному созреванию дендритных клеток из их гемопоэтических клеток-предшественников. Таким образом, секреция VEGF опухолью может иметь важное значение в подавлении иммунного противоопухолевого ответа [9].
Корреляция степени экспрессии VEGF опухолью с неблагоприятным прогнозом
При целом ряде онкологических заболеваний у человека экспрессия VEGF усиливается (табл. 2). Несколько исследований также продемонстрировали усиление экспрессии VEGF в стромальных клетках, ассоциированных с опухолью; возможно, в них экспрессия усиливается под влиянием факторов окружающей микросреды, созданных самой опухолью.
2). Несколько исследований также продемонстрировали усиление экспрессии VEGF в стромальных клетках, ассоциированных с опухолью; возможно, в них экспрессия усиливается под влиянием факторов окружающей микросреды, созданных самой опухолью.
Таблица 2. В опухолях усиливается экспрессия VEGF, что коррелирует с прогнозом.
| Тип опухоли | % опухолей с избыточной экспрессией | Корреляция |
|---|---|---|
| Немелкоклеточный рак легкого | 45-90 | Рецидивы, выживаемость |
| Колоректальный рак | 40-60 | Рецидивы/выживаемость |
| Рак молочной железы | 30-60 | Плотность сосудов, выживаемость |
| Почечноклеточная карцинома | 30-100 | Плотность сосудов, стадия опухоли, степень, злокачественности |
| Рак поджелудочной железы | 75-90 | Выживаемость |
| Мультиформная глиобластома | 65-85 | Выживаемость |
| Рак предстательной железы | 30-80 | Плотность сосудов, безрецидивная выживаемость |
При многих видах опухолей усиление экспрессии VEGF коррелирует с неблагоприятным прогнозом, в том числе с агрессивным ростом опухоли, рецидивами, метастазированием и уменьшением выживаемости. Кроме того, экспрессия VEGF коррелирует с повышением плотности микрососудистой сети в опухоли, что само по себе служит индикатором прогноза при различных онкологических заболеваниях [9,13].
Кроме того, экспрессия VEGF коррелирует с повышением плотности микрососудистой сети в опухоли, что само по себе служит индикатором прогноза при различных онкологических заболеваниях [9,13].
Этапы ангиогенеза
А. был впервые описан Hunter в конце 18 века [24], является комплексным процессом, включающим четыре стадии: протеолитическое разрушение базальной мембраны сосудов и межклеточного матрикса, миграцию и прикрепление эндотелиальных клеток, их пролиферацию и, наконец, формирование тубулярных структур [2].
Включение ангиогенеза
Недостаточное кровоснабжение ведет к гипоксии вследствие уменьшения диффузии кислорода. Гипоксия – главный стимул А. Происходит активация метаболических путей, регулируемых такими белками, как индуцируемый гипоксией фактор 1, что ведет к увеличению экспрессии проангиогенных факторов, включая VEGF и факторы роста фибробластов. Опухоли также снижают экспрессию антиангиогенных факторов, таких как тромбоспондин-1. В тот момент, когда действие проангиогенных факторов превышает действие антиангиогенных, эндотелиальные клетки переходят из обычного дремлющего состояния в активное. Этот момент называется «включением ангиогенеза».
В тот момент, когда действие проангиогенных факторов превышает действие антиангиогенных, эндотелиальные клетки переходят из обычного дремлющего состояния в активное. Этот момент называется «включением ангиогенеза».
После включения А. происходит разрыв базальных мембран и внеклеточного матрикса (ВКМ), главным образом, в результате повышения активности матричных металлопротеаз. Эти изменения матрикса способствуют миграции эндотелиальных клеток во внесосудистое пространство, где они начинают размножаться. Затем клетки организуются в трубочки с просветом, образуя новую капиллярную сеть. По ходу этого процесса привлекаются перициты, которые прикрепляются к новым сосудам и стабилизируют их. До этой точки созревания целостность и выживание эндотелиальных клеток зависят от VEGF. Несмотря на сходство процессов А., в опухоли образуется сосудистая сеть, которая сильно отличается от сосудов здоровых тканей. Сосудистое русло опухоли с морфологической точки зрения является крайне атипичным и составляет значительную часть опухолевой стромы. Системы артериол, капилляров и венул, присущей большинству здоровых органов, там нет. Макроскопически обнаруживаются два общих типа периферической и центральной сосудистой перфузии. В центре опухолей с периферической сосудистой сетью имеются крупные участки некроза, в опухолях с центральным типом сосудистого русла – наоборот. Однако эти фенотипы внутри опухоли во многом перекрываются, причем в одной части опухоли может быть любой из этих двух типов кровоснабжения. Кроме того, многие сосуды опухоли находятся в спавшемся состоянии из-за недостаточной механической поддержки окружающей их стромы. Микроскопически сосуды выглядят расширенными, извитыми, выявляется наличие слепых петель и выростов, шунтов и немногочисленных анастомозов. Эти структурные различия влияют на внутриопухолевый кровоток; кровь проходит через опухоли непредсказуемым образом, что оказывает неотвратимое отрицательное влияние на доставку лекарственных препаратов [6,14].
Системы артериол, капилляров и венул, присущей большинству здоровых органов, там нет. Макроскопически обнаруживаются два общих типа периферической и центральной сосудистой перфузии. В центре опухолей с периферической сосудистой сетью имеются крупные участки некроза, в опухолях с центральным типом сосудистого русла – наоборот. Однако эти фенотипы внутри опухоли во многом перекрываются, причем в одной части опухоли может быть любой из этих двух типов кровоснабжения. Кроме того, многие сосуды опухоли находятся в спавшемся состоянии из-за недостаточной механической поддержки окружающей их стромы. Микроскопически сосуды выглядят расширенными, извитыми, выявляется наличие слепых петель и выростов, шунтов и немногочисленных анастомозов. Эти структурные различия влияют на внутриопухолевый кровоток; кровь проходит через опухоли непредсказуемым образом, что оказывает неотвратимое отрицательное влияние на доставку лекарственных препаратов [6,14].
Опухолевые кровеносные сосуды не выстланы обычным монослоем эндотелиальных клеток, являются дезорганизованными, рыхлыми и беспорядочно связанными друг с другом. Во многих кровеносных сосудах опухоли также имеются эндотелиальные выросты из просвета, которые проникают глубоко в периваскулярную строму. Поскольку клетки эндотелия не образуют нормального монослоя, они не могут выполнять обычную барьерную функцию эндотелия, что играет роль в аномально высокой проницаемости этой сосудистой сети и ее склонности к кровотечениям. Далее стабилизирующая связь перицитов с эндотелием слабеет, а большие концентрации VEGF являются мощным фактором, повышающим проницаемость [6].
Во многих кровеносных сосудах опухоли также имеются эндотелиальные выросты из просвета, которые проникают глубоко в периваскулярную строму. Поскольку клетки эндотелия не образуют нормального монослоя, они не могут выполнять обычную барьерную функцию эндотелия, что играет роль в аномально высокой проницаемости этой сосудистой сети и ее склонности к кровотечениям. Далее стабилизирующая связь перицитов с эндотелием слабеет, а большие концентрации VEGF являются мощным фактором, повышающим проницаемость [6].
Вопросы контроля баланса регуляции ангиогенеза
Еще совсем недавно основным показателем активности А. в опухолях являлась микроскопическая оценка плотности сосудов в ткани самой опухоли, но за последнее десятилетие в результате исследования молекулярных механизмов опухолевого А. была выявлена группа регуляторных ангиогенных и антиангиогенных факторов, обеспечивающих формирование новых сосудов внутри опухоли [6]. Имеется необходимость отметить, что измерение площади и плотности капилляров опухоли – это морфометрический метод исследования, и равноценно сравнивать его с биохимическими методами, основанными на выявлении РНК и ДНК в тканях и клетках неадекватно. Еще один путь экспрессии А. происходит через вовлечение воспалительных клеток, секретирующих цитокины ФНО-α (альфа фактор некроза опухолей) и ИЛ-1, которые в свою очередь индуцируют продукцию – нормальными клетками. Процесс роста капилляров продолжается, пока не будет достигнута достаточная близость с клеткой. Затем А. вступает в фазу покоя (за исключением ангиогенных циклов в женской репродуктивной системе). Каждое увеличение тканевой массы сопровождается неоваскуляризацией, что поддерживает адекватную сосудистую плотность. Таким образом, А. индуцируется тогда, когда метаболические потребности превышают перфузионную способность существующих сосудов. По-видимому, механизм этого адаптивного ответа в том, что относительный недостаток кислорода приводит к повышению ангиогенных стимулов. Паракринный механизм влияния А. заключается в действии на рост сосудов в тканях с низким уровнем перфузии. Существует ряд клеток, способных повышать уровень VEGF in vitro во время гипоксии, к которым относятся фибробласты, миоциты гладкой и поперечнополосатой мускулатуры, пигментный эпителий сетчатки, астроциты и эндотелиальные клетки, а также некоторые опухолевые клетки.
Еще один путь экспрессии А. происходит через вовлечение воспалительных клеток, секретирующих цитокины ФНО-α (альфа фактор некроза опухолей) и ИЛ-1, которые в свою очередь индуцируют продукцию – нормальными клетками. Процесс роста капилляров продолжается, пока не будет достигнута достаточная близость с клеткой. Затем А. вступает в фазу покоя (за исключением ангиогенных циклов в женской репродуктивной системе). Каждое увеличение тканевой массы сопровождается неоваскуляризацией, что поддерживает адекватную сосудистую плотность. Таким образом, А. индуцируется тогда, когда метаболические потребности превышают перфузионную способность существующих сосудов. По-видимому, механизм этого адаптивного ответа в том, что относительный недостаток кислорода приводит к повышению ангиогенных стимулов. Паракринный механизм влияния А. заключается в действии на рост сосудов в тканях с низким уровнем перфузии. Существует ряд клеток, способных повышать уровень VEGF in vitro во время гипоксии, к которым относятся фибробласты, миоциты гладкой и поперечнополосатой мускулатуры, пигментный эпителий сетчатки, астроциты и эндотелиальные клетки, а также некоторые опухолевые клетки. Таким образом, А. VEGF индуцируется гипоксией в большинстве, если не во всех, клеток in vitro. Гипоглиекмия также активирует экспрессию VEGF. Эксперименты, проведенные в клеточных монослоях, показали, что А. может быть независимо индуцирован гипоксией или гипогликемией. Интересен факт, что не происходит индукции VEGF в культивируемых клетках глиомы, лишенных и кислорода, и глюкозы. Повышение экспрессии VEGF требует синтеза белка, который не может идти при двойном стрессе. Способность реагировать на гипоксию и гипогликемию дает преимущество в ситуации, когда существует дефицит только одного из метаболитов. Неясно, однако, проходят ли эти два ответа через два разных пути или они вырабатывают общий медиатор, действующий как проксимальный индуктор VEGF. Исследования разных метаболитов, накапливаемых во время гипоксии и гипогликемии, по отношению к их способности непосредственно индуцировать VEGF не дали убедительных результатов. Показано, что VEGF индуцируется аденозином, а также ионами кобальта.
Таким образом, А. VEGF индуцируется гипоксией в большинстве, если не во всех, клеток in vitro. Гипоглиекмия также активирует экспрессию VEGF. Эксперименты, проведенные в клеточных монослоях, показали, что А. может быть независимо индуцирован гипоксией или гипогликемией. Интересен факт, что не происходит индукции VEGF в культивируемых клетках глиомы, лишенных и кислорода, и глюкозы. Повышение экспрессии VEGF требует синтеза белка, который не может идти при двойном стрессе. Способность реагировать на гипоксию и гипогликемию дает преимущество в ситуации, когда существует дефицит только одного из метаболитов. Неясно, однако, проходят ли эти два ответа через два разных пути или они вырабатывают общий медиатор, действующий как проксимальный индуктор VEGF. Исследования разных метаболитов, накапливаемых во время гипоксии и гипогликемии, по отношению к их способности непосредственно индуцировать VEGF не дали убедительных результатов. Показано, что VEGF индуцируется аденозином, а также ионами кобальта. Это свидетельствует о том, что белок гема может быть вовлечен в этот процесс [6].
Это свидетельствует о том, что белок гема может быть вовлечен в этот процесс [6].
Рис.4. Cхема факторов развития А. [23].
Роль стромы в патогенезе ангиогенеза
Наряду с факторами роста в процессе А. имеет большое значение состав экстрацеллюлярного матрикса стромы опухоли. Благоприятным является содержание в нем компонентов базальных мембран – ламинина, фибронектина и коллагена IV типа [4].
Формирование сосудов в опухолях происходит на фоне извращенной митогенетической стимуляции и измененного экстрацеллюлярного матрикса. Это приводит к развитию неполноценных сосудов преимущественно капиллярного типа, имеющих нередко прерывистую базальную мембрану и нарушенную эндотелиальную выстилку. Эндотелий может замещаться опухолевыми клетками, а иногда и вовсе отсутствовать [4].
Роль эфринов в патогенезе ангиогенеза
Роль эфринов в А. была впервые продемонстрирована Pandey A. с соавторами (Pandey et al., 1995). Исследователи обнаружили, что эфрин А1 принимает участие в развитии кровеносных сосудов роговицы глаза, он стимулирует А. in vivo и способствует хемотаксису эндотелиальных клеток in vitro. В дальнейшем в экспериментах in vitro было показано, что и другие белки семейства эфринов (эфрин B1, эфрин B2, эфрин B3) способствуют росту капилляров и «сборке» эндотелиальных клеток внутри сосуда, т.е. стимулируют морфо- и А., а также участвуют в процессах ремоделирования сосудов (Adams et al., 1999; Daniel et al., 1996; Stein et al., 1998) [8].
с соавторами (Pandey et al., 1995). Исследователи обнаружили, что эфрин А1 принимает участие в развитии кровеносных сосудов роговицы глаза, он стимулирует А. in vivo и способствует хемотаксису эндотелиальных клеток in vitro. В дальнейшем в экспериментах in vitro было показано, что и другие белки семейства эфринов (эфрин B1, эфрин B2, эфрин B3) способствуют росту капилляров и «сборке» эндотелиальных клеток внутри сосуда, т.е. стимулируют морфо- и А., а также участвуют в процессах ремоделирования сосудов (Adams et al., 1999; Daniel et al., 1996; Stein et al., 1998) [8].
Полученные результаты были подтверждены исследованиями in vivo в экспериментах на животных (Wang et al., 1998). У эмбрионов мыши с «выключением» гена EFNB2 эфрина B2 наблюдается нарушение кровоснабжения формирующихся органов и тканей, вызванное повреждением кровеносных сосудов (Wang et al., 1998). В исследовании Adams R.H. с соавторами была также показана роль эфрина В3 в процессах А. и ремоделирования сосудов (Adams et al., 1999) [8].
и ремоделирования сосудов (Adams et al., 1999) [8].
Антиангиогенная фармакотерапия
Способность индуцировать и поддерживать А. – важнейший этап развития опухоли. А. лежит в основе разработки методов целенаправленного воздействия на этот процесс как средства терапии рака. В плане возможной разработки препаратов идентифицировано несколько молекулярных мишеней и клеточных путей. Одной из таких мишеней является VEGF [6].
Благодаря расшифровке некоторых молекулярных механизмов канцерогенеза лечение онкологических больных переходит на принципиально новый уровень – воздействие на молекулярные мишени, ответственные за процесс пролиферации злокачественной клетки, гиперэкспрессирующиеся преимущественно в опухоли и являющиеся доступными для идентификации рутинными способами. Результаты внедрения в клиническую практику первых таргетных препаратов, блокирующих ростовые факторы, доказало перспективность данного направления, способного значительно повысить эффективность медикаментозного лечения злокачественных опухолей.
Ингибиторы А. имеют два преимущества над другими лекарствами:
- они должны быть менее токсичны, чем используемые при обычной химиотерапии лекарства;
- так как их мишенью являются нормальные клетки, а не непосредственно раковые клетки, гораздо меньше вероятность, что они приведут к отбору устойчивых к лекарству опухолей.
С учетом вышеописанных характеристик VEGF становится ясно, что ингибирование VEGF представляет собой новаторский подход к противоопухолевой терапии, который может:
- привести к обратному развитию незрелых кровеносных сосудов, типичных для опухолей;
- снизить проницаемость сосудов и, тем самым, внутриопухолевое давление;
- уменьшить вероятность метастазирования опухоли [9,13].
Можно ожидать, что эти эффекты блокады VEGF на сосудистую сеть опухоли не повлияют на нормальные, зрелые сосуды, выживание которых не зависит от VEGF. Кроме того, ингибирование VEGF дополнило бы современные методы лечения, в частности, химиотерапию и противоопухолевую биотерапию, увеличив проникновение препаратов в опухолевые клетки благодаря обратному развитию аномального сосудистого русла опухоли и снижению внутриопухолевого давления. Эти наблюдения позволяют предполагать, что подавление активности VEGF может стать обоснованным принципом терапии целого ряда опухолей [9].
Кроме того, ингибирование VEGF дополнило бы современные методы лечения, в частности, химиотерапию и противоопухолевую биотерапию, увеличив проникновение препаратов в опухолевые клетки благодаря обратному развитию аномального сосудистого русла опухоли и снижению внутриопухолевого давления. Эти наблюдения позволяют предполагать, что подавление активности VEGF может стать обоснованным принципом терапии целого ряда опухолей [9].
Целенаправленное воздействие на VEGF препаратом бевацизумаб (Авастин, Ф. Хоффманн-Ля Рош Лтд., Базель, Швейцария), гуманизированным моноклональным антителом класса IgG, в комбинации с известными режимами химиотерапии показало эффективность при лечении раков различной локализации.
Как уже упоминалось, А. играет важную роль в процессе заживления ран, поэтому высказываются опасения, что бевацизумаб может вызвать увеличение осложнений у пациентов, требующих оперативного лечения. Хотя в целом препарат хорошо переносится, примерно у 2% больных описаны серьезные проявления токсичности, включая перфорацию желудочно-кишечного тракта и ухудшение заживления ран, несмотря на то, что после операции препарат вводили с отсрочкой не менее 28 дней. Эти осложнения чаще возникают у тех пациентов, которые были оперированы на фоне терапии бевацизумабом, что имеет очевидные последствия для хирургической практики. Тем не менее, значительное улучшение выживаемости, которое можно получить с помощью бевацизумаба, означает высокую вероятность его широкого применения [6].
Эти осложнения чаще возникают у тех пациентов, которые были оперированы на фоне терапии бевацизумабом, что имеет очевидные последствия для хирургической практики. Тем не менее, значительное улучшение выживаемости, которое можно получить с помощью бевацизумаба, означает высокую вероятность его широкого применения [6].
Заключение
Тема нуждается в дальнейших исследованиях, так как абсолютно эффективная ангиогенная терапия рака еще не разработана, а количество людей, в ней нуждающихся, не уменьшается.
Список литературы
- Ангиогенез. Википедия. 2009.
- Петрова Л.В., Кушлинский Н.Е., Ильина Л.В. Фактор роста эндотелия сосудов как показатель гипоксии тканей, его возможная роль в патогенезе плоского лишая слизистой оболочки рта. Вестник дерматологии и венерологии. 2004, №5.
- Соколов Д.И., Кондратьева П.Г., Розломий В.Л., Крамарева Н.Л., Сельков С.А. Роль ангиогенеза в развитии наружного генитального эндометриоза. Журнал «Цитокины и воспаление».
 2007, Т.6, №2. С.10-17.
2007, Т.6, №2. С.10-17. - Автономный рост и прогрессия опухолей. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2002, №4, Т.12, С.45-49.
- Махачев С.М., Османов А.О., Рамазанов М.Р. Механическое стимулирование ангиогенеза. Издательство «Медицина». 2003, 160 с.
- A.D. Thornton, P. Ravn, M. Winslet, K. Chester. Angiogenesis inhibition with bevacizumab and the surgical management of colorectal cancer. British Journal of Surgery Society Ltd. 2006, Vol.93, Issue 12, P.1456-63.
- В. Прозоровский. Кровеносные сосуды и рак. Журнал «Наука и жизнь». 2006, №9.
- Ангиогенез: общие сведения. Биология и медицина. 2009.
- VEGF – фактор роста эндотелия сосудов. MEDI.RU. 2009.
- Protein splicing. Encyclopedia article about Protein splicing. 2009.
- Ligand (biochemistry). Encyclopedia article about Ligand (biochemistry). 2009.
- Receptor. Encyclopedia article about Receptor. 2009.

- Инновации в онкологии. Рош – Швейцарская фармацевтическая компания. 2009.
- Шадеркина В.А. Таргетная терапия в онкоурологии. UroWeb.ru. 2007.
- Carmeliet P. Mechanisms of angiogenesis and arteriogenesis. Nature medicine. 2000, Vol.6, №4, P.389-395.
- Carmeliet P. Angiogenesis in health and disease. Nature medicine. 2003, Vol.9, P.653-660.
- Carmeliet P. Angiogenesis in life, disease and medicine. Nature. 2005, Vol.438, №7070, PP.932-936.
- Carmeliet P., Jain R. Angiogenesis in cancer and other diseases. Nature. 2000, Vol.407, №6801, P.249-257.
- Figg W.D., Folman J.E. Angiogenesis: An Integrative Approach From Science To Medicine. Edited by New York, Random House. 2008, P.601.
- Folkman J. What is the evidence that tumors are angiogenesis dependent? Edited by © Oxford University Press. 1990, P.4-7.
- Folkman J. Clinical applications of research on angiogenesis. New England Journal of Medicine.
 1995, Vol.333, №26, P.1757-1763.
1995, Vol.333, №26, P.1757-1763. - Folkman J. A new link in ovarian cancer angiogenesis: lysophosphatidic acid and vascular endothelial growth factor expression. J Natl Cancer Inst. 2001, Vol.93, №10, P.734-735.
- Forough R., SpringerLink (Online service). New Frontiers in Angiogenesis. Edited by Dordrecht, Springer. 2006, P.344.
- Ribatti D., ebrary Inc. History of research on tumor angiogenesis. Edited by Dordrecht, Springer Netherlands.2009, P.125.
Работа выполнена в рамках проектов CRDF-4028 и МНТЦ-1682.
НЕОАНГИОГЕНЕЗ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ: ОТ ТЕОРИИ К ПРАКТИКЕ — Доклады студентов — кружковцев — Каталог статей
Антиангиогенная
терапия:
—
терапия, направленная прямо на ингибирование
процесса ангиогенеза.
Неоангиогенез – формирование сети капилляров из эндотелиальных
клеток, выстилающих мелкие венулы — необходимое условие для дальнейшего роста
опухолевого узелка, достигшего в диаметре 2-4 мм
— строго регулируемый процесс, сбалансированный действием
ряда про- и антиангиогенных факторов, ведущий к формированию новой обширной
сосудистой сети там, где ее раньше не было.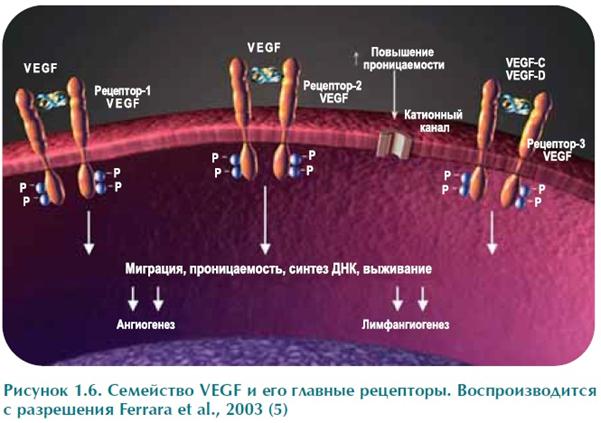
Нормальное сосудистое русло и опухоли.
Vascular
endothelial growth factor (VEGF) – ключевой медиатор ангиогенеза
один из членов семейства структурно близких между собой
белков, которые являются лигандами для семейства рецепторов VEGF . VEGF
влияет на развитие новых кровеносных сосудов (ангиогенез) и выживание незрелых
кровеносных сосудов (сосудистая поддержка), связываясь с двумя близкими по
строению мембранными тирозинкиназными рецепторами (рецептором-1 VEGF и
рецептором-2 VEGF ) и активируя их. Эти рецепторы экспрессируются
клетками эндотелия стенки кровеносных сосудов . Связывание VEGF с
этими рецепторами запускает сигнальный каскад, который в конечном итоге
стимулирует рост эндотелиальных клеток сосуда, их выживание и пролиферацию.
Эндотелиальные клетки участвуют в таких разнообразных процессах, как вазоконстрикция
и вазодилатация, презентация антигенов, а также служат очень важными элементами
всех кровеносных сосудов — как капилляров, так и вен или артерий.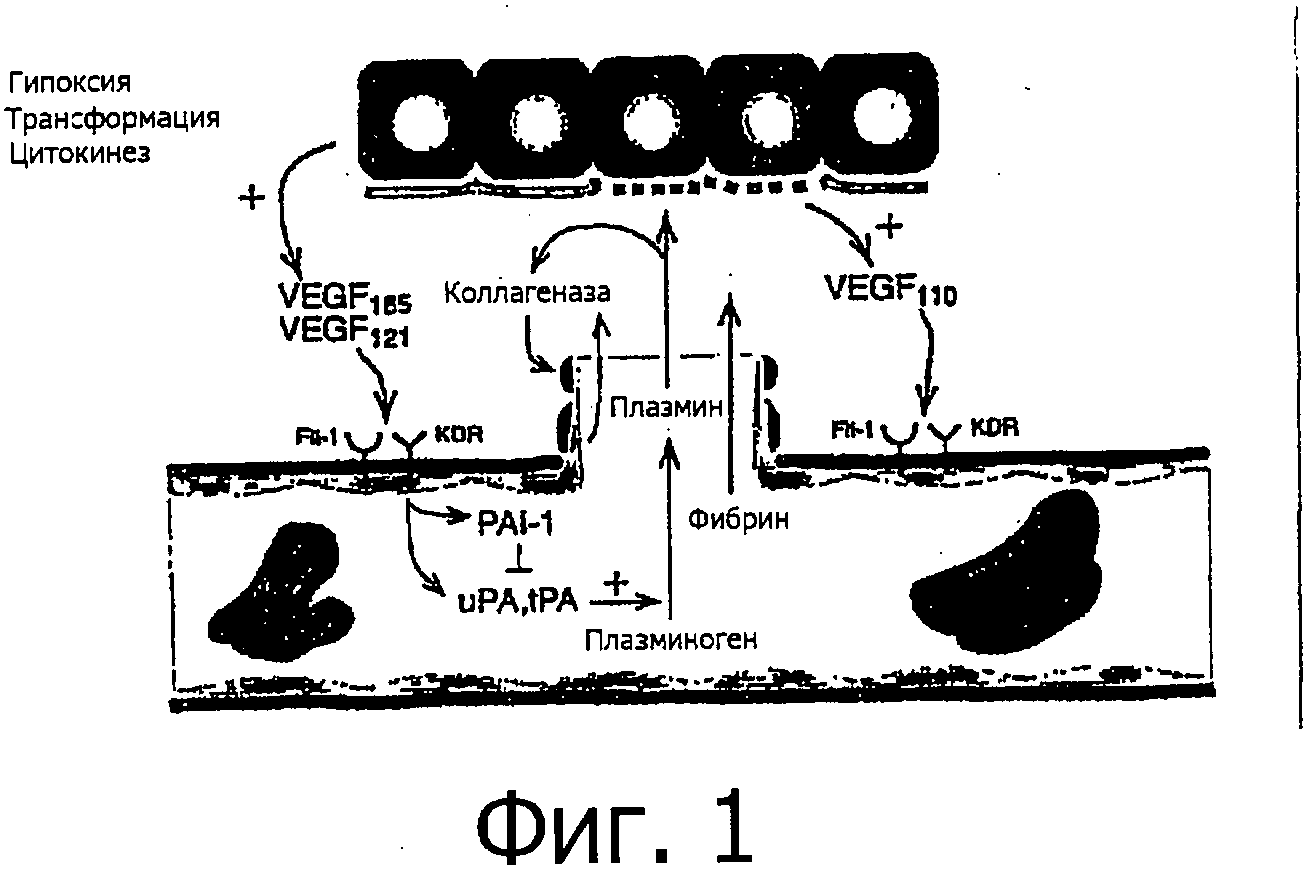 Таким
Таким
образом, стимулируя эндотелиальные клетки, VEGF играет центральную
роль в процессе ангиогенеза.
VEGF крайне важен в процессе развития
VEGF чрезвычайно важен для формирования адекватной функционирующей
сосудистой системы в ходе эмбриогенеза и в раннем постнатальном периоде, однако
у взрослых его физиологическая активность ограничена. Эксперименты на мышах
показали следующее:
- Целенаправленное
повреждение одной или двух аллелей гена VEGF приводит к гибели эмбриона - Инактивация VEGF в период
раннего постнатального развития также ведет к летальному исходу - Повреждение VEGF у взрослых
мышей не сопровождается какими-либо явными аномалиями, поскольку его роль
ограничена развитием фолликулов, заживлением ран и репродуктивном циклом у
самок.
Экспрессия VEGF стимулируется множеством проангиогенных факторов, включая
эпидермальный ростовой фактор, основной фибробластный ростовой фактор,
тромбоцитарный ростовой фактор и интерлейкин-1 б. Кроме того, уровни VEGF
Кроме того, уровни VEGF
непосредственно регулируются такими факторами окружающей среды, как рН,
давление и концентрации кислорода. Общее влияние этих различных факторов
заключается в опосредованной через VEGF стимуляции важных для ангиогенеза
факторов, включая антиапоптотические белки, молекулы клеточной адгезии и металлопротеиназы
(ММР).
VEGF представляет собой выполнимую терапевтическую задачу.
VEGF поддерживает незрелые сосуды
Незрелые кровеносные сосуды существуют преимущественно на этапе развития, а
у взрослых индивидуумов — лишь в некоторых ситуациях, например, в процессе
заживления ран или заболеваний, характеризующихся аномальным ангиогенезом,
таких как онкологические. В отсутствие ростовых сигналов эндотелиальные клетки
этих незрелых кровеносных сосудов подвергаются программированной клеточной
гибели (апоптозу). VEGF препятствует апоптозу эндотелиальных клеток в незрелых
кровеносных сосудах, тем самым сохраняя их жизнеспособность. В отличие от
этого, зрелые кровеносные сосуды, из которых сформирована сосудистая система
взрослого, больше не нуждаются в VEGF для своего выживания и поэтому вряд ли
будут страдать от подавления активности VEGF.
VEGF стимулирует проницаемость мелких кровеносных сосудов. Повышенная
проницаемость ведет к подтеканию белков плазмы через стенку сосуда и
формированию экстравазального фибринового геля. Этот гель представляет собой
подходящую среду для роста клеток эндотелия. В присутствии высоких концентраций
VEGF, характерных для онкологических заболеваний, сосуды приобретают
чрезвычайно высокую проницаемость и склонность к подтеканию. Следствием этого
является высокое интерстициальное давление в опухоли и неравномерная доставка в
опухоль питательных веществ, кислорода и лекарственных препаратов. Эти
нарушения можно устранить с помощью анти-VEGF терапии.
VEGF стимулирует опухолевый ангиогенез
В отсутствие сосудистой сети опухоли остаются мелкими (1-2 мм). Злокачественные опухоли
подвергаются «ангиогенному переключению», что нарушает баланс между про- и
антиангиогенными факторами, обычно благодаря усилению секреции ростовых факторов.
Многие ростовые факторы, а также низкий рН и низкие концентрации кислорода,
обнаруживающиеся в опухоли, стимулируют экспрессию VEGF, который затем
активирует экспрессию других звеньев ангиогенеза, таких как металлопротеиназы и
молекулы клеточной адгезии. Тем самым VEGF действует как ключевой медиатор
Тем самым VEGF действует как ключевой медиатор
опухолевого ангиогенеза, стимулируя рост новых кровеносных сосудов из
близлежащих капилляров и давая опухоли доступ к кислороду и питательным
веществам, в которых она нуждается для своего роста и метастазирования.
Продукция VEGF стимулируется несколькими внешними факторами.
Каскад VEGF
состоит из ряда сложных и взаимосвязанных сигналов и процессов, которые
запускают ангиогенез. Продукция VEGF
может индуцироваться множественными факторами окружающей среды ( например,
гипоксией и активацией HIV
1 альфа). Важными пусковыми факторами для усиления продукции VEGF опухолью служат также онкогены
(такие как ras, VHL, bcl-2).
VEGF
включает множественные пострецепторные сигналы способствующие процессу
ангиогенеза. Существуют два разных, но структурно близких, рецептора VEGF, расположенных на
поверхности эндотелиальных клеток сосудов. Эти рецепторы, известные как
рецептор VEGF 1 типа и рецептор VEGF 2 типа представляют собой рецепторные тирозинкиназы, которые
после связывания с лигандом VEGF подвергаются
фосфорилированию. Активация этих рецепторов ведет к включению многочисленных
Активация этих рецепторов ведет к включению многочисленных
внутриклеточных пост-рецепторных сигнальных каскадов, запускающих опухолевый
ангиогенез.
Прерывание
сигнального каскада VEGF.
Два основных подхода к анти – VEGF терапии включают блокаду либо
лиганда, либо рецептора. Препараты, целенаправленно действующие на лиганд,
связываются непосредственно с VEGF,
продуцируемым опухолью и нейтрализуя его. К препаратам целенаправленного
действия на лиганд относятся антитела к VEGF и растворимые рецепторы, такие как фузионные белки.
Препараты, целенаправленно действующие на рецепторы, связываются с рецепторами VEGF в кровеносных сосудах,
блокируя активацию рецепторов. К этим препаратам относятся антитела к
рецепторам, рибозимы и низкомолекулярные ингибиторы тирозинкиназы.
Основные вехи в развитии антиангиогенной терапии:
- 1971 – Фолкмен публикует гипотезу ангиогенеза
- 1983 – Дворак демонстрирует, что опухоли
секретируют фактор сосудистой проницаемости - 1989 – Феррара из компании «Genentech» очищает и клонирует VEGF
- 1990-e – начинаются первые клинические испытания специфической
антиангиогенной терапии у онкологических больных - 2001 — настоящее время – завершены клинические
исследования III фазы
Авастин (бевацизумаб)
— это рекомбинантное гуманизированное моноклональное
антитело (мАТ) к васкулярному эндотелиальному фактору роста (VEGF), который является ключевым
регулятором ангиогенеза опухоли.
Противоопухолевый препарат, представляет собой рекомбинантные гиперхимерные
(гуманизированные, приближенные к человеческим) моноклональные антитела,
которые избирательно связываются с биологически активным фактором роста
эндотелия сосудов (VEGF) и нейтрализуют его. Авастин ингибирует связывание VEGF
с его рецепторами на поверхности эндотелиальных клеток, что приводит к снижению
васкуляризации и угнетению роста опухоли.
Бевацизумаб содержит полностью человеческие каркасные участки с
определяющими комплементарность участками гиперхимерного антитела мыши, которые
связываются с VEGF. Бевацизумаб получают по технологии рекомбинантной ДНК в
системе для экспрессии, представленной клетками яичников китайского хомячка.
Бевацизумаб состоит из 214 аминокислот и имеет молекулярный вес около 149 000
дальтон.
Введение бевацизумаба приводит к подавлению метастатического
прогрессирования заболевания и снижению микрососудистой проницаемости при
различных опухолях человека, включая рак ободочной кишки, молочной железы,
поджелудочной железы и предстательной железы.
Моноклональные антитела
– это иммуноглобулины, полученные на основе гибридомной
технологии, содержащие в структуре домен к соответствующему антигену.
1. По строению: | |
нативные | мышиные |
модифицированные | химерные гуманизированные |
конъюгированные | радиоиммуноконъюганты иммунотоксины иммуноферменты конъюганты с цитостатиками иммунолипосомы |
антиидиотипические | вакцины |
2. По механизму действия: | |
мАТ, взаимодействующие с АГ опухолевой клетки (прямое | |
мАТ, взаимодействующие с АГ сосудов опухоли | |
3. | |
Простые мАТ | |
Нативные МКА –
это мышиные иммуноглобулины. Единственным препаратом на основе нативного МКА
17-1А является «панорекс», разрешенный для лечения колоректального рака 2В и 2С
стадий в профилактическом режиме. Эффективность нативных МКА изучалась в
профилактическом режиме при колоректальном раке. Нативные МКА просты в
получении, но являются высокотоксичными, способными к индукции нейтрализующих
антител. В связи с этим они были вытеснены модифицированными
МКА, основное отличие которых заключается в комбинации человеческого и
мышиного белков, в меньшей степени вызывающей образование нейтрализующих АТ.
Так химерные МКА содержат 30-35%
мышиного и 65-70% человеческого иммуноглобулина, гуманизированные — 10% мышиного, и 90% — человеческого
белка. Иммуноконьюгаты представляют
собой комплекс «АТ +дополнительный агент».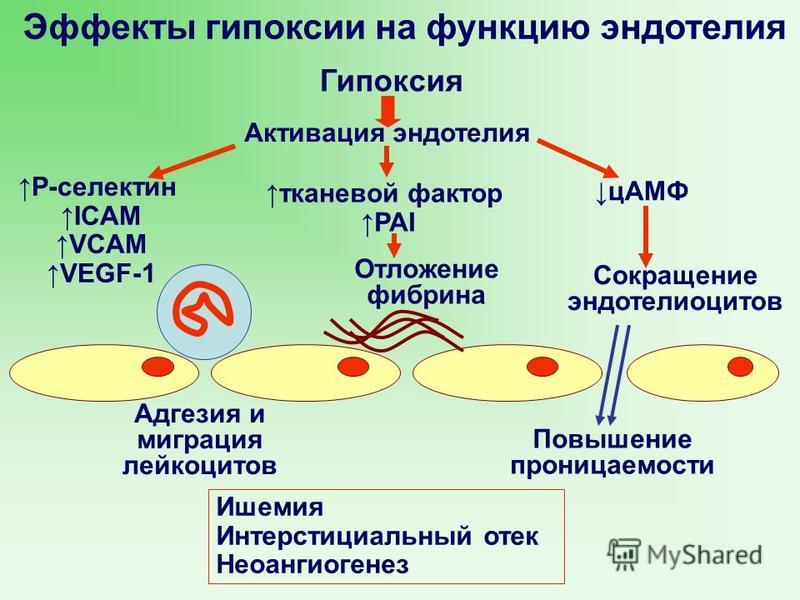 Они действуют на опухолевые клетки
Они действуют на опухолевые клетки
за счет дополнительного агента комплекса – токсина, цитостатика и тд. Антитело
находит опухолевый антиген, тем самым, доставляя действующее вещество к клетке-мишени.
Поэтому в случае коньюгатов МКА играют роль транспортера. Одним из
распространенных видов коньюгирования является
сочетание радиоактивных изотопов и МКА.
В последнее время спектр препаратов, полученных на основе
коньюгирования, значительно расширился. Появились иммуноферменты ( фермент
транспортируется к опухолевой клетке, на поверхности которой расщепляет
введенный заранее химиопрепарат на активные метаболиты), иммунотоксины
растительного происхождения, конъюгаты цитостатиков и антител (удобный способ
целенаправленной доставки цитостатика к опухоли без влияния на здоровые клетки
организма), разрабатываются методы слияния липосом с цитостатиком и МКА.
Для повышения иммуногенности и эффективности синтезированы биспецифичные и триспецифичные МКА. Биспецифичное
АТ – одним доменом соединяется с опухолевой клеткой, а другим – с
Т-лимфоцитом, сближая расстояние между эффектором и клеткой мишенью. Триспецифичные АТ – участвуют во
Триспецифичные АТ – участвуют во
взаимодействии опухолевой клетки, Т-лимфоцита и
антиген-презентирующей клетки, тем самым осуществляя контакт между тремя
компонентами одной цепи.
Анти – VEGF терапия оказывает важные эффекты как на новые, так и на
недавно образовавшиеся сосуды.
Анти – VEGF
терапия препятствует пролиферации и миграции клеток эндотелия. Это означает
истинную антиангиогенную активность – подавление роста новых опухолевых сосудов
и развития метастазов. Кроме того, анти – VEGF терапия оказывает существенный эффект на недавно
образовавшиеся кровеносные сосуды опухоли, вызывая апоптоз клеток эндотелия
сосудов, что ведет к снижению сосудистой проницаемости и внутриопухолевого
давления. Эти временные изменения существующего сосудистого русла опухоли ( до
их окончательной деструкции) могут повысить эффективность доставки
цитотоксических препаратов по сосудистой сети в опухоль.
Изменения окружающего сосудистого русла могут сразу же
отразиться на состоянии опухоли.
Редукция кровоснабжения опухоли вследствие обратного
развития опухолевого сосудистого русла приводит к существенному падению
поступления в опухоль кислорода и других питательных веществ. Это, в свою
очередь, уменьшает способность опухоли к росту и метастазированию.
Блокада VEGF и подавление неоангиогенеза злокачественных опухолей:
- Анти — VEGF терапия подавляет рост новых
опухолевых сосудов и вызывает обратное развитие недавно сформировавшегося
сосудистого русла - Анти — VEGF терапия уменьшает сосудистую проницаемость и
внутриопухолевое давление, что может сделать опухоль более чувствительной к химиотерапии - Нарушение кровоснабжения опухоли может подавить
ее последующий рост
«Терапевтический ангиогенез» и лечение поражений сосудов нижних конечностей
«Терапевтический ангиогенез» и лечение поражений сосудов нижних конечностей
В связи с тем, что настоящий выпуск журнала посвящен перспективному направлению фундаментальной и клинической ангиологии – терапевтическому ангиогенезу, редакция обратилась к практикующим хирургам со следующим вопросом: удовлетворены ли Вы как врач-клиницист имеющимся арсеналом хирургических и фармацевтических средств лечения поражений сосудов нижних конечностей? Какие пути достижения прогресса в этой области — продления жизни пациентов, уменьшения инвалидизации, повышения качества жизни Вы видите и каково среди них место методов «терапевтического ангиогенеза»?
В.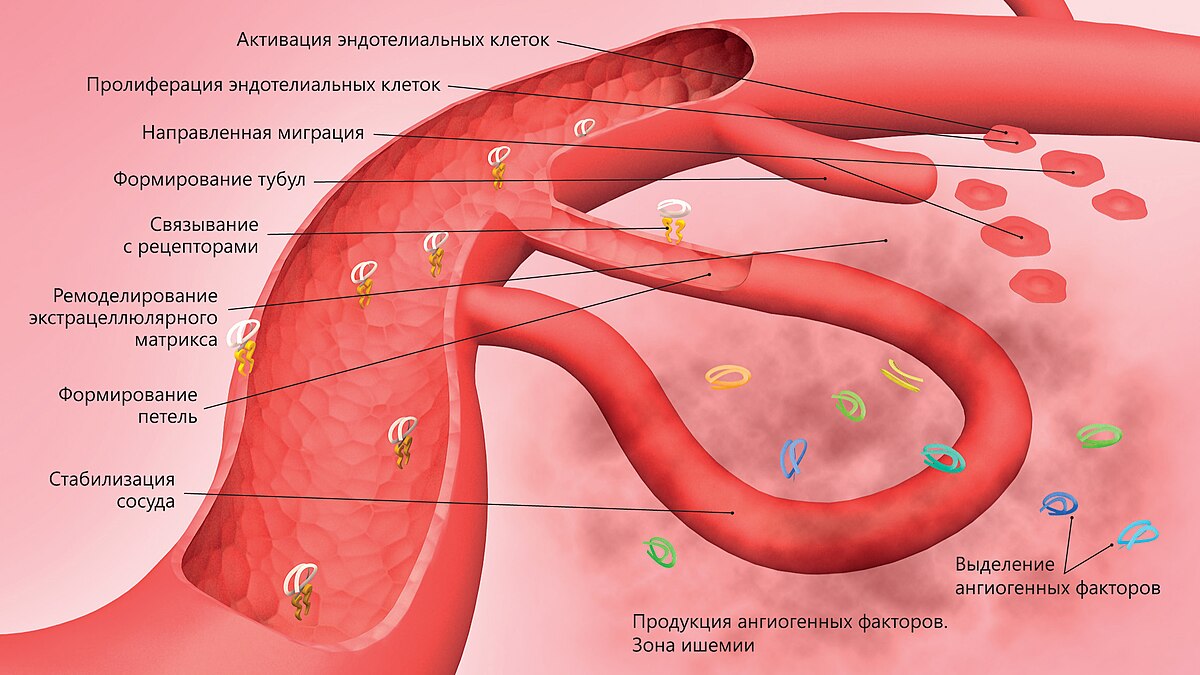 А. Аракелян
А. Аракелян
Хронические облитерирующие заболевания артерий нижних конечностей составляют более 20% от всех видов сердечно-сосудистой патологии, что соответствует 2-3% общей численности населения. Число таких больных увеличивается с возрастом и к 60-70 годам составляет уже 5-7%. В течение пяти лет 5% больных с перемежающейся хромотой переходят в стадию критической ишемии нижних конечностей (КИНК). В отличие от перемежающемся хромоты, критическая ишемия таит в себе угрозу потери конечности и часто приводит к длительному жизненному дискомфорту из-за болей в ногах. По статистике Европейских кооперированных исследований критическая ишемия встречается у 500-1000 пациентов на миллион человек населения в год, при этом в скандинавских странах — у 600-800 человек на миллион населения, в Британии и Ирландии — у 400 пациентов. У больных с облитерирующими заболеваниями артерий нижних конечностей тяжелая ишемия встречается в 33-75% случаев. Ежегодно в развитых странах мира выполняется 12-30 ампутации нижних конечностей на 100 000 человек населения в год, причем частота их при хронической КИНК 4-28 %, а при трофических нарушениях – до 40 %. Через год после развития КИНК у 25% пациентов выполняется большая ампутация, лишь у 55% конечности сохраняются, а 20% — умирают от различных причин. Причем, прогноз после ампутации крайне неблагоприятен: периоперационная летальность при ампутациях ниже коленного сустава составляет 5-10%, а при ампутациях выше колена — 15-20 % . Отдаленная летальность у этих больных колеблется в пределах 25-30% в течение 2 лет после ампутации и 50-75% — через 5 лет. Таким образом, «критическая ишемия» — это состояние, угрожающее не только сохранению конечности, но и жизни больного. Следовательно, вследствие широкой распространённости данной патологии, неуклонно прогрессирующего течения, высокой степени инвалидизации, значительного веса в структуре летальности лечение хронической артериальной недостаточности нижних конечностей является одной из центральных в ангиологии и сосудистой хирургии.
Через год после развития КИНК у 25% пациентов выполняется большая ампутация, лишь у 55% конечности сохраняются, а 20% — умирают от различных причин. Причем, прогноз после ампутации крайне неблагоприятен: периоперационная летальность при ампутациях ниже коленного сустава составляет 5-10%, а при ампутациях выше колена — 15-20 % . Отдаленная летальность у этих больных колеблется в пределах 25-30% в течение 2 лет после ампутации и 50-75% — через 5 лет. Таким образом, «критическая ишемия» — это состояние, угрожающее не только сохранению конечности, но и жизни больного. Следовательно, вследствие широкой распространённости данной патологии, неуклонно прогрессирующего течения, высокой степени инвалидизации, значительного веса в структуре летальности лечение хронической артериальной недостаточности нижних конечностей является одной из центральных в ангиологии и сосудистой хирургии.
Своевременное выявление и коррекция патологического процесса позволяет не только повысить эффективность лечения данных больных, но и дает возможность в ряде случаев прервать дальнейшее прогрессирование заболевания. Проблема реваскуляризации сегодня рассматривается не только с хирургических позиций – протезирование сосудов и их шунтирование используется во многих случаях борьбы с нарушением кровотока по крупным сосудистым коммуникациям. Несмотря на успехи реконструктивной хирургии при окклюзирующих поражениях брюшной аорты и артерий нижних конечностей, результаты лечения больных с КИНК не столь утешительны и вышеприведенная статистика является тому свидетельством.
Проблема реваскуляризации сегодня рассматривается не только с хирургических позиций – протезирование сосудов и их шунтирование используется во многих случаях борьбы с нарушением кровотока по крупным сосудистым коммуникациям. Несмотря на успехи реконструктивной хирургии при окклюзирующих поражениях брюшной аорты и артерий нижних конечностей, результаты лечения больных с КИНК не столь утешительны и вышеприведенная статистика является тому свидетельством.
В последние 30-40 лет активно разрабатывается концепция коррекции артериальной недостаточности нижних конечностей путем стимуляции ангиогенеза, т. е. развития сосудов (капиллярной сети) от уже существующих функционирующих сосудов. Основными стимулами ангиогенеза являются ишемия, гипоксия и воспаление. Необходимым условием для ангиогенеза и последующего артериогенеза является присутствие проангиогенных факторов в достаточном количестве для образования функционально полноценной сосудистой сети. Так как эндогенной экспрессии проангиогенных факторов при ишемии, как правило, бывает недостаточно для развития коллатерального кровотока, необходима экзогенная стимуляция, что и является задачей «терапевтического ангиогенеза». С этой целью используются собственно ангиогенные факторы, гены, их кодирующие и клетки-предшественницы. Применение генных технологий более предпочтительно по сравнению с введением собственно белков (проангиогенных факторов), так как введение генов поддерживает более длительную и стабильную экспрессию факторов.
С этой целью используются собственно ангиогенные факторы, гены, их кодирующие и клетки-предшественницы. Применение генных технологий более предпочтительно по сравнению с введением собственно белков (проангиогенных факторов), так как введение генов поддерживает более длительную и стабильную экспрессию факторов.
При ишемии нижних конечностей в генной терапии с целью стимуляции ангиогенеза используются многие факторы роста, обладающие проангиогенной активностью; эндотелиальный сосудистый фактор роста (Vascular endothelial growth factor, VEGF), в частности, связываясь с рецепторами на эндотелиальных клетках, вызывает рост, пролиферацию и миграцию последних, стимулируя, таким образом, рост новых капилляров, регулирует (стимулирует при ишемии) синтез и высвобождение оксида азота (NO) эндотелием сосудов, обеспечивая вазодилятирующий эффект, повышение сосудистой проницаемости. В условиях гипоксии и ишемии усиливается экспрессия ангиогенных факторов и их рецепторов, запуская целенаправленный терапевтический ответ и ограничивая возможности патологического ангиогенеза. Данные литературы демонстрируют, что благодаря генной терапии улучшился прогноз сохранения конечности у пациентов с КИНК. Быстрый прогресс во внедрении генных технологий в лечение хронической ишемии нижних конечностей и первые их позитивные непосредственные и отдаленные результаты выдвигают методику применения генных препаратов в лечении хронической ишемии нижних конечностей в разряд наиболее перспективных.
Данные литературы демонстрируют, что благодаря генной терапии улучшился прогноз сохранения конечности у пациентов с КИНК. Быстрый прогресс во внедрении генных технологий в лечение хронической ишемии нижних конечностей и первые их позитивные непосредственные и отдаленные результаты выдвигают методику применения генных препаратов в лечении хронической ишемии нижних конечностей в разряд наиболее перспективных.
В.А. Батрашов
В настоящее время, не смотря на наличие ряда лекарственных средств, которые улучшают реологические свойства крови, воздействуют на периферическое артериальное русло и на липидный обмен, следует признать, что эффективность их воздействия на течение хронической ишемии нижних конечностей желает оставаться лучше.
Необходимость в выполнении реконструктивных операций на аорте и магистральных артериях нижних конечностей возникает только у 20-50% больных с хронической ишемией нижних конечностей. Данное обстоятельство связано с отсутствием адекватных путей оттока, характером множественной сопутствующей патологии (особая группа – это больные с сахарным диабетом, с болезнью Бюргера). В силу указанных факторов, риск оперативного вмешательства иногда превышает пользу, которое порой может закончиться высокой ампутацией или летальным исходом. Успешная реконструктивная операция на аорто-подвздошном сегменте приводит к купированию ишемии. Но наиболее неблагодарной областью в сосудистой хирургии является окклюзия бедренно-подколенно-берцового сегмента. Данная локализация окклюзионно-стенотического является самым распространенным видом поражения артерий нижних конечностей и является причиной критической ишемии нижних конечностей (КИНК). Распространенность КИНК среди населения в целом составляет 2-6%, а для возрастной группы 60-64 лет – 7,5% [Trans Atlantic Inter – Society Consensus, 2000]. При критической ишемии очень высока частота высоких ампутаций. Данное положение не может устраивать сосудистых хирургов, что заставляет искать новые пути решения данной проблемы.
В силу указанных факторов, риск оперативного вмешательства иногда превышает пользу, которое порой может закончиться высокой ампутацией или летальным исходом. Успешная реконструктивная операция на аорто-подвздошном сегменте приводит к купированию ишемии. Но наиболее неблагодарной областью в сосудистой хирургии является окклюзия бедренно-подколенно-берцового сегмента. Данная локализация окклюзионно-стенотического является самым распространенным видом поражения артерий нижних конечностей и является причиной критической ишемии нижних конечностей (КИНК). Распространенность КИНК среди населения в целом составляет 2-6%, а для возрастной группы 60-64 лет – 7,5% [Trans Atlantic Inter – Society Consensus, 2000]. При критической ишемии очень высока частота высоких ампутаций. Данное положение не может устраивать сосудистых хирургов, что заставляет искать новые пути решения данной проблемы.
Как известно, у пациентов с облитерирующим атеросклерозом нижних конечностей развивается коллатеральное артериальное кровообращение, которое в течение длительного времени может компенсировать кровоток, но по мере прогрессирования атеросклероза сеть коллатералей не способна компенсировать потребность тканей в кислороде. Дисбаланс потребности и доставки крови в дистальные отделы нижней конечности приводит к трагическим последствиям, итогом которого является ампутация.
Дисбаланс потребности и доставки крови в дистальные отделы нижней конечности приводит к трагическим последствиям, итогом которого является ампутация.
Основная цель лечения пациентов с хронической ишемией нижних конечностей – это улучшение качества жизни. Поэтому, в последние годы большие надежды возлагаются на новые медикаментозные препараты. Поэтому, с целью улучшения качества жизни, уменьшения количества инвалидизирующих операций, в настоящее время большое значение придается новому направлению в изучении формирования кровеносных сосудов – «терапевтического ангиогенеза». Данные методики преимущественно связаны с введением ангиогенных факторов, таких как фактор роста фибробластов и сосудистого эндотелиального фактора роста. Следует отметить, что в настоящее время «терапевтический ангиогенез» находится в начальной точке своего развития и только титаническая работа в этом направлении позволит добиться значительных результатов. По мере совершенствования методик «терапевтического ангиогенеза» появятся новые лекарственные средства, которые дадут новый виток в лечении ишемии нижних конечностей.
Н.П. Бочков
Методы «терапевтического ангиогенеза» постепенно входят в практику лечения больных с хронической ишемией нижних конечностей (ХИНК). На протяжении последних 15 лет проведены многочисленные экспериментальные и клинические исследования по индукции неоангиогенеза генными конструкциями и стволовыми клетками. Показана его безопасность и эффективность. В литературе все чаще встречается термин «терапевтический ангиогенез».
Как показывает анализ литературы и тематика профильных конгрессов, конференций и симпозиумов в лечении ХИНК все чаще используются методы индукции ангиогенеза, потому что в хирургическом и фармакологическом лечении поражений сосудов нижних конечностей достигнут определенный предел. Некоторые формы течения ХИНК не поддаются ни хирургическому, ни фармакологическому лечению. Согласно сложившейся практике с целью терапевтического ангиогенеза применяют либо введение генных конструкций (гены VEGF, ANG, FGF), с разными векторами, либо стволовые и (или) прогениторные ауто- или аллогенные клетки из разных источников. При этом применение белковых факторов оставлено как неперспективное направление.
При этом применение белковых факторов оставлено как неперспективное направление.
Эффект терапевтического ангиогенеза выражен умеренно. Улучшение регистрируемых показателей ишемии колеблется в пределах 5-10%.Однако улучшение качества жизни пациентов не вызывает сомнений, продляется жизнь пациентов, уменьшается степень инвалидизации.
Оценивая место методов «терапевтического ангиогенеза» в лечении больных с ХИНК без сомнения можно утверждать, что они являются дополнительными методами к хирургическому и фармакологическому методам. Необходимо своевременно начинать индукцию неоангиогенеза, когда еще есть резервы улучшения ангиогенеза и развития коллатерального кровообращения.
Как известно, процесс ангиогенеза многоэтапный и сложный. Он контролируется многими взаимодействующими между собой факторами (более 10). Ответить на вопрос, какой способ терапевтического ангиогенеза, более эффективный, пока трудно. Во-первых, потому, что эффект от лечения может быть выражен не сильно, а, во-вторых, сравнивать эффекты в разных клинических протоколах вряд ли правомерно, с позиций доказательной медицины, потому что каждое исследование отличается от других по нескольким параметрам: индукторам ангиогенеза (разные генные и клеточные препараты), способом введения (внутримышечно, внутривенно, внутриартериально), дозой препарата, интервалами при повторном введении и т.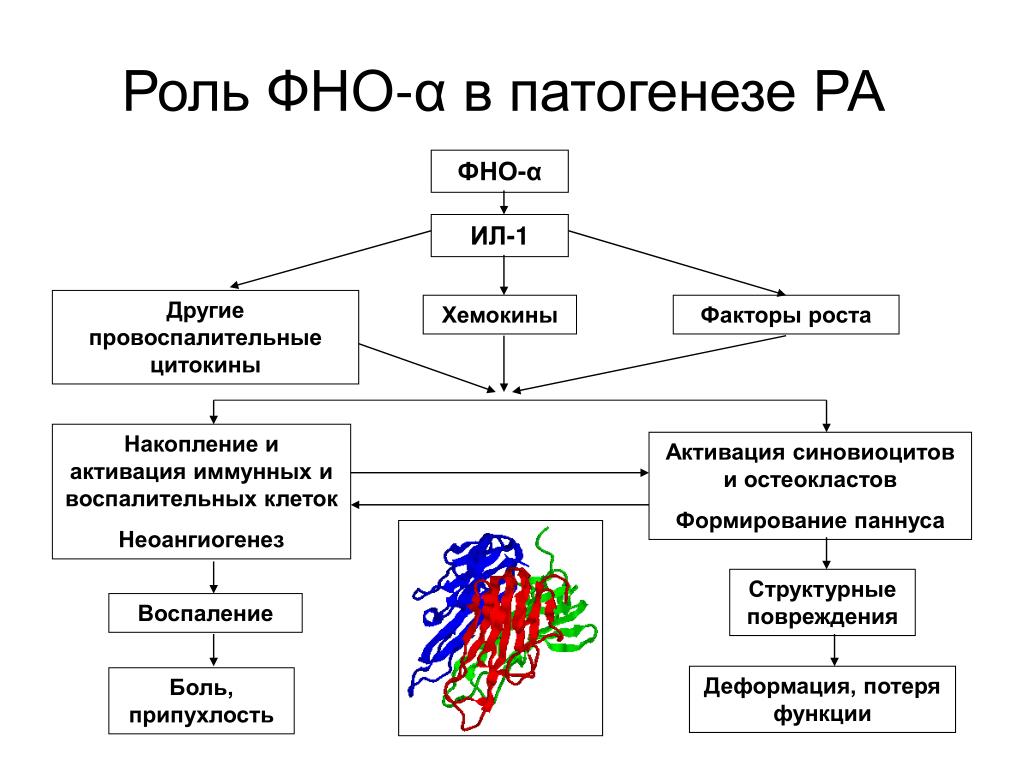 д.
д.
Дальнейший прогресс лечебных эффектов методов «терапевтического ангиогенеза» зависит от расшифровки их механизмов и унификации клинических протоколов. Заранее спланированные клинические протоколы позволили бы объединить однородные материалы и сделать выводы о наиболее эффективных схемах лечения.
А.В. Гавриленко
В настоящее время в арсенале сосудистых хирургов и ангиологов имеется значительное количество хирургических и фармацевтических средств лечения поражений сосудов нижних конечностей. Что касается фармакологических средств лечения, то их следует признать достаточно эффективными только на ранних стадиях заболевания, как средства профилактики осложнений, а также как необходимое дополнение к хирургическому лечению в ближайшем и отдаленном послеоперационном периодах. Следует подчеркнуть, что в отношении лечения развернутых стадий заболеваний и выраженной ишемии конечностей, в настоящее время эффективных средств консервативной терапии не существует. В этих случаях наиболее эффективным является хирургическое лечение (выполнение реконструктивных сосудистых операций). На сегодняшний день имеется значительное количество эффективных высокотехнологичных методик лечения поражений сосудов. Разработанные новые методики операций (в частности, операция артериализации венозного кровотока голени и стопы) позволяют сохранить конечность у пациентов, ранее считавшихся неоперабельными. Однако, результаты реконструктивных сосудистых операций во многом определяются состоянием дистального артериального русла конечностей: их эффективность значительно снижается при распространенном поражении артерий голени.
В этих случаях наиболее эффективным является хирургическое лечение (выполнение реконструктивных сосудистых операций). На сегодняшний день имеется значительное количество эффективных высокотехнологичных методик лечения поражений сосудов. Разработанные новые методики операций (в частности, операция артериализации венозного кровотока голени и стопы) позволяют сохранить конечность у пациентов, ранее считавшихся неоперабельными. Однако, результаты реконструктивных сосудистых операций во многом определяются состоянием дистального артериального русла конечностей: их эффективность значительно снижается при распространенном поражении артерий голени.
На сегодняшний день сосудистая хирургия, особенно в отношении пациентов с т. н. «дистальными» формами поражения артерий конечностей, достигла определенного предела. Существующие на сегодняшний день общепринятые технологии лечения не позволяют добиться значимого улучшения результатов лечения. В этой связи дальнейший прогресс возможен только при использовании новых инновационных подходов, в качестве одного из которых следует рассматривать генноинженерные технологии стимуляции ангиогенеза. Именно сочетание различных методов лечения (хирургического, традиционного лекарственного и методик «терапевтического ангиогенеза») позволит добиться значимого улучшения результатов комплексного лечения у пациентов с хронической ишемией нижних конечностей (в том числе, и отдаленных результатов реконструктивных сосудистых операций) и повысить качество жизни пациентов с сосудистой патологией.
Именно сочетание различных методов лечения (хирургического, традиционного лекарственного и методик «терапевтического ангиогенеза») позволит добиться значимого улучшения результатов комплексного лечения у пациентов с хронической ишемией нижних конечностей (в том числе, и отдаленных результатов реконструктивных сосудистых операций) и повысить качество жизни пациентов с сосудистой патологией.
И.И. Кательницкий
В последние годы достигнуто улучшение результатов реваскуляризации нижних конечностей за счет внедрения современных пластических материалов и эндоваскулярных и гибридных методик. С успехом выполняются реканализации окклюзированных артерий голеней и стоп. Появились новые направления медикаментозной терапии (системный тромболизис). Однако удручающая статистика выполняемых ампутаций конечностей при этой патологии не позволяет говорить об удовлетворенности клиницистов имеющимся набором лечебных методов.
У большинства пациентов с критической ишемией исчерпан локальный резерв для ангиогенеза, и реваскуляризация зачастую оказывается неэффективной.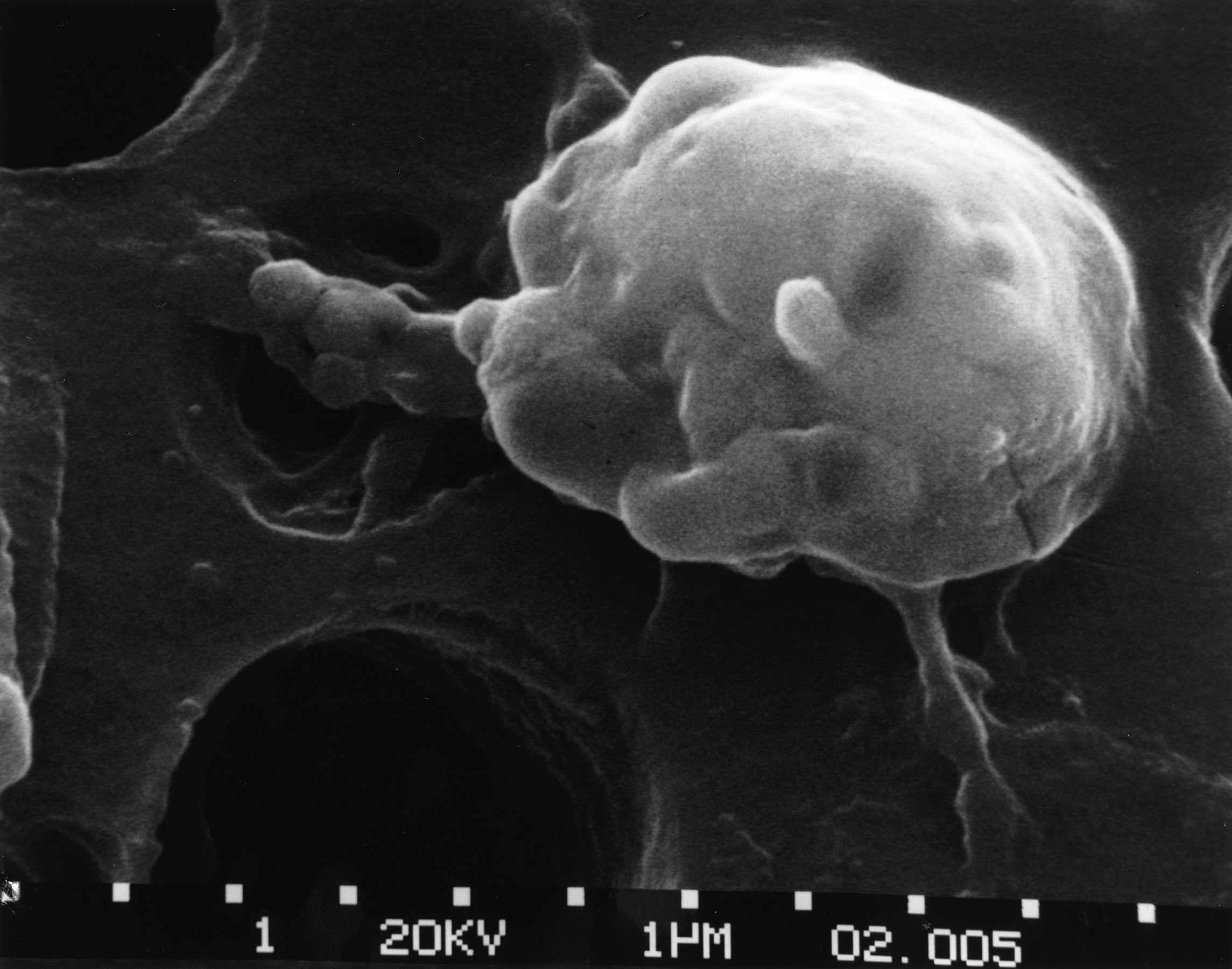 Появление методов «терапевтического ангиогенеза» является, на мой взгляд, перспективным именно в сочетании клеточных и генных методик с хирургической реваскуляризацией. Проще говоря – необходимо не просто улучшить кровоток, но и доставить в зону ишемии клетки, «закодированные» на ангиогенез, или найти пути воздействия на них после трансплантации.
Появление методов «терапевтического ангиогенеза» является, на мой взгляд, перспективным именно в сочетании клеточных и генных методик с хирургической реваскуляризацией. Проще говоря – необходимо не просто улучшить кровоток, но и доставить в зону ишемии клетки, «закодированные» на ангиогенез, или найти пути воздействия на них после трансплантации.
Именно этот путь решения проблемы лечения больных с критической ишемией мне кажется оптимальным и позволяет надеяться на успех.
Ю.В. Карабач
Приходится констатировать недостаточный набор в первую очередь терапевтических средств лечения облитерирующих заболеваний артерий нижних конечностей. На данный момент терапия хронической ишемии ограничивается применением препаратов, улучшающих реологические свойства крови, простагландинов, низкая эффективность которых доказана масштабными зарубежными исследованиями. Вместе с тем, арсенал хирургических методов лечения на данный момент достаточно разнообразен и с развитием рентгенхирургии возможности хирургов растут. Однако, что касается нашей страны, по-моему, до сих пор не решен вопрос доступности этой помощи для населения. Многократно завышенная в России стоимость расходных материалов в рентгенхирургии тормозит расвитие этого (в западных странах уже давно не нового) направления ангиохирургии. В первую очередь, путь достижения прогресса в этой области лежит через решение организационных проблем современного отечественного здравоохранения. Развитие ангиохирургии по всей стране (а не только в Москве и Санкт-Петербурге) — один из путей достижения прогресса в увеличении продолжительности жизни пациентов и снижении инвалидизации. Не секрет, что единицы больных после ампутации имеют возможность «встать на ноги».
Однако, что касается нашей страны, по-моему, до сих пор не решен вопрос доступности этой помощи для населения. Многократно завышенная в России стоимость расходных материалов в рентгенхирургии тормозит расвитие этого (в западных странах уже давно не нового) направления ангиохирургии. В первую очередь, путь достижения прогресса в этой области лежит через решение организационных проблем современного отечественного здравоохранения. Развитие ангиохирургии по всей стране (а не только в Москве и Санкт-Петербурге) — один из путей достижения прогресса в увеличении продолжительности жизни пациентов и снижении инвалидизации. Не секрет, что единицы больных после ампутации имеют возможность «встать на ноги».
Очевидно, что решение этой проблемы – задача на годы, поэтому отсутствие в России эффективных фармацевтических препаратов для лечения атеросклероза артерий нижних конечностей, позволивших бы продлить жизнь и полноценное существование таких пациентов архиважно! Развитие методов «терапевтического ангиогенеза» в свете этих проблем важно, но следует учесть, что активное введение их в широкую медицинскую практику является лишь одним элементом комплексного подхода к сохранению здоровья населения.
С.А. Матвеев
Еще в конце 80-х годов выдающийся хирург Военно-медицинской академии Михаил Иванович Лыткин пришел к выводу что «будущее в развитии хирургии – это восстановление кровообращения в том или ином органе, причем на уровне микроциркуляции». Его опыт позволил заключить, что в основе массы заболеваний лежит нарушение кровоснабжения и соответственно нарушение функции органа.
Данные отечественной и зарубежной литературы свидетельствуют о возросшем интересе к «терапевтическому ангиогенезу» вообще и биологии сосудистого эндотелия – в частности. Сегодня уже очевидно, что хирургические методы имеют определенные ограничения, особенно в зоне микроциркуляции, и яркий пример этого – Х-синдром в коронарной патологии, когда при сохранении магистрального кровотока нет возможности скорректировать кровообращение в зоне микроциркуляции. В данной ситуации надежда только на «терапевтический ангиогенез».
Количество больных с облитерирующими заболеваниями артерий нижних конечностей с каждым годом увеличивается. Обеспечение эффективного лечения данной категории больных является одной из первоочередных задач, поскольку заболевания сосудов чреваты большим процентом инвалидности и длительной нетрудоспособности. При тяжелой хронической ишемии успешная реконструктивная операция на сосудах является единственным средством сохранения конечности, а нередко и спасения жизни больного. Однако основной причиной неудачных реконструкций остается ранний послеоперационный тромбоз шунтов и протезов. Несмотря на предложенные многочисленные способы профилактики этого грозного осложнения, частота его, по данным разных авторов, колеблется в пределах от 2,6-29,5%. Ранний послеоперационный тромбоз не только увеличивает сроки лечения, но и нередко приводит к инвалидизации пациентов, вплоть до летальных исходов, так как повторные операции по поводу реокклюзий не всегда заканчиваются успехом. Одной из причин развития раннего тромбоза является несостоятельность периферического сосудистого русла при резко увеличивающемся притоке крови после операции.
Обеспечение эффективного лечения данной категории больных является одной из первоочередных задач, поскольку заболевания сосудов чреваты большим процентом инвалидности и длительной нетрудоспособности. При тяжелой хронической ишемии успешная реконструктивная операция на сосудах является единственным средством сохранения конечности, а нередко и спасения жизни больного. Однако основной причиной неудачных реконструкций остается ранний послеоперационный тромбоз шунтов и протезов. Несмотря на предложенные многочисленные способы профилактики этого грозного осложнения, частота его, по данным разных авторов, колеблется в пределах от 2,6-29,5%. Ранний послеоперационный тромбоз не только увеличивает сроки лечения, но и нередко приводит к инвалидизации пациентов, вплоть до летальных исходов, так как повторные операции по поводу реокклюзий не всегда заканчиваются успехом. Одной из причин развития раннего тромбоза является несостоятельность периферического сосудистого русла при резко увеличивающемся притоке крови после операции.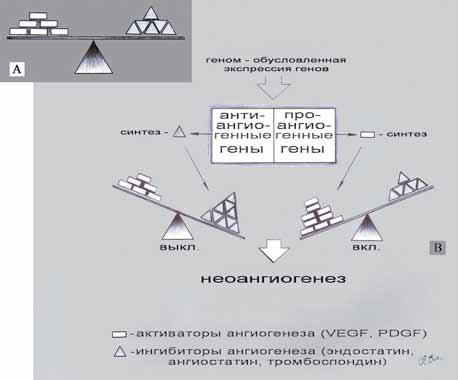 Основным принципом ангиореконструкции является восстановление магистрального кровотока, в то время как стимуляция ангиогенеза позволяет воздействовать на уровне микроциркуляторного русла и способствует росту компенсаторных возможностей периферического сосудистого русла.
Основным принципом ангиореконструкции является восстановление магистрального кровотока, в то время как стимуляция ангиогенеза позволяет воздействовать на уровне микроциркуляторного русла и способствует росту компенсаторных возможностей периферического сосудистого русла.
Поэтому «терапевтический ангиогенез» следует рассматривать, в перспективе, как высокоэффективное средство, но в комплексном лечении. Что именно привлекает клиницистов в «терапевтическом ангиогенезе»? Это направленность метода на разрешение проблем этиопатогенеза заболеваний.
В.Г. Мишалов
При системном характере атеросклероза, разные сосудистые бассейны поражаются неодновременно и неравномерно. По распространенности и медико-социальной значимости первое место занимает атеросклероз коронарных артерий, облитерирующий атеросклероз сосудов нижних конечностей (ОАСНК) занимает третье место.
Несмотря на достигнутые успехи в производстве протезов артериальных сосудов и улучшение техники их наложения, остается актуальной проблема тромбирования шунтов (недостаточность дистального кровотока в нижней конечности, трудности с подбором антикоагулянтной терапии, неудовлетворительное ведение таких больных в амбулаторном периоде, бепечность самих больных) и почти неразрешаемой остается проблема неоинтимальной гиперплазии, которая ведет к непроходимости шунта. Повторное шунтирование, тромбэктомия из шунта, удаление неоинтимы увеличивает риск интраоперационных осложнений для пациента и ухудшает, как правило, результат операции реваскуляризации. Серьезно ограничивает возможность хирургического вмешательства и диаметр участка сосуда, на который накладывается дистальный анастомоз с шунтом. При малом диаметре технически трудно, а зачастую и невозможно наложить анастомоз без сужения диаметра, что угрожает созданием условий для последующего тромбоза. В большинстве клиник трехлетняя проходимость шунтов составляет 85% для аутовены и всего 40% для синтетических протезов. Применение черескожных эндоваскулярных вмешательств при критической ишемии нижних конечностей (КИНК) существенно ограничивается мутьтифокальным характером поражения сосудов.
Повторное шунтирование, тромбэктомия из шунта, удаление неоинтимы увеличивает риск интраоперационных осложнений для пациента и ухудшает, как правило, результат операции реваскуляризации. Серьезно ограничивает возможность хирургического вмешательства и диаметр участка сосуда, на который накладывается дистальный анастомоз с шунтом. При малом диаметре технически трудно, а зачастую и невозможно наложить анастомоз без сужения диаметра, что угрожает созданием условий для последующего тромбоза. В большинстве клиник трехлетняя проходимость шунтов составляет 85% для аутовены и всего 40% для синтетических протезов. Применение черескожных эндоваскулярных вмешательств при критической ишемии нижних конечностей (КИНК) существенно ограничивается мутьтифокальным характером поражения сосудов.
Все внедренные в медицинскую практику препараты для медикаментозного лечения КИНК не могут предовратитить последующую ампутацию у пациентов с этим заболеванием, а лишь отдалить ее, посольку не решают главную проблему- отсутсвие адекватного кровоснабжения в дистальных тканях пораженной конечности.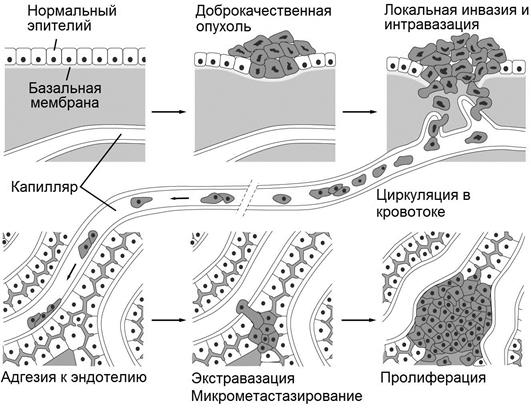 Большинство из них направлено на улучшение микроциркуляции, реологических свойств крови, снижение воспалительных явлений в тканях. Остальные препараты направлены на устранение симптоматических явлений. Успех консервантивной терапии наблюдается всего в 25-49% при наличии незаживающих язв и в 50-70% при болях покоя.
Большинство из них направлено на улучшение микроциркуляции, реологических свойств крови, снижение воспалительных явлений в тканях. Остальные препараты направлены на устранение симптоматических явлений. Успех консервантивной терапии наблюдается всего в 25-49% при наличии незаживающих язв и в 50-70% при болях покоя.
Прогноз при КИНК зависит от количества вовлеченных в патологический процесс бассейнов и степени их поражения. Все вышеизложенное убедительно свидетельствует о целесообразности активного использования существующих и разработки новых методов реваскуляризации при КИНК.
В настоящее время интересы ангиологии сосредоточены на «терапевтическом ангиогенезе», который еще называют биологическим шунтированием. Его цель — обеспечение реваскуляризации ишемизированных тканей за счет стимуляции естественных процессов образования и роста сосудов. Стратегия ангиогенной терапии включает в себя снабжение ишемизированых тканей экзогенными факторами роста в виде рекомбинантных белков или генетических конструкций, стволовыми или прогениторными клетками, мобилизацию эндогенных стволовых и прогениторных клеток из костного мозга или тканевых депо, а также сочетание этих воздействий.
Медикаментозная коррекция неоангиогенеза является перспективным направлением в терапии ИБС, КИНК, цереброваскулярных нарушений, раневой и ожоговой хирургии.
Разработке тактики ангиогенной терапии способствовало развитие современных представлений о молекулярных и клеточных механизмах регуляции роста и ремоделирования кровеносных сосудов. Потребовалось около 20 лет, чтобы изучить молекулярные механизмы, регулирующие рост сосудов, выделить основные ангиогенные факторы роста, выяснить их структуру, получить рекомбинантные факторы и генетические конструкции с их генами. Огромный энтузиазм и надежды, вызванные многообещающими данными экспериментальных клинических исследований применения белковых факторов, сменились осторожностью после получения результатов относительно больших двойных слепых плацебо-контролируемых клинических исследований (REPAIR-AMI, ASTEMI, BOOST, TOPCARE-CHD, STEMMI, REVIVAL-2, FIRSTLINE-AMI) не подтвердивших однозначно эффективность этой тактики.
В последние годы новые надежды связаны с использованием для неоангиогенеза стволовых клеток и с данными экспериментальных исследований, свидетельствующими об ангиогенной эффективности различных факторов роста и их сочетаний, а также генетически модифицированных прогениторных клеток. Большой интерес представляют результаты недавно завершившегося исследования TRAFFIC, в котором было показано, что однократная инфузия FGF-ІІ больным с периферическим атеросклерозом существенно увеличивает дистанцию безболевой ходьбы.
Большой интерес представляют результаты недавно завершившегося исследования TRAFFIC, в котором было показано, что однократная инфузия FGF-ІІ больным с периферическим атеросклерозом существенно увеличивает дистанцию безболевой ходьбы.
Основным фактором активации ангиогенеза является хроническое гипоксическое состояние. В настоящее время выделено большое количество стимуляторов неоангиогенеза – это фактор роста эндотелия сосудов, фактор роста фибробластов, фактор роста гепатоцитов, ангиогенин, ангиопоэтины. Также выделены неспецифические стимуляторы роста сосудов, такие как инсулиноподобный фактор роста 1, трансформирующий фактор роста, фактор некроза опухоли, оксид азота, интерлейкин-8, матриксные металлопротеиназы. Важным и наиболее изученным является фактор роста эндотелия сосудов. Синергическим действием с ним обладает фактор роста фибробластов, который может и самостоятельно стимулировать неоангиогенез.
Последние годы показано, что у мультипотентных мезенхимальных стромальных клеток (MМСК) есть способность к самообновлению, пролиферации, и дифференцирования в зрелую ткань в зависимости от микросреды, которой они окружены. Такие особенности, которые определяют их как стволовые клетки, делают их перспективными для их использования в регенеративной медицине. Первоначально считалось, что ММСК находятся исключительно в костном мозге, но клетки с подобными характеристиками были найдены и в других дифенитивных тканях (в жировой ткани, периферической крови и др.). Лечение КИНК введением таких клеток основано на использовании способности стволовых клеток вырабатывать факторы, стимулирующе ангиогенез и васкулогенез.
Такие особенности, которые определяют их как стволовые клетки, делают их перспективными для их использования в регенеративной медицине. Первоначально считалось, что ММСК находятся исключительно в костном мозге, но клетки с подобными характеристиками были найдены и в других дифенитивных тканях (в жировой ткани, периферической крови и др.). Лечение КИНК введением таких клеток основано на использовании способности стволовых клеток вырабатывать факторы, стимулирующе ангиогенез и васкулогенез.
Уже выполнены успешные клинические испытания клеточной терапии при КИНК. Корпорация Aldagen (USA) показала, что все пациенты хорошо перенесли лечение без серьезных неблагоприятных последствий, было отмечено существенное улучшение клинического статуса по шкале Rutherford на протяжении 3 месяцев. Ученые пришли к выводу, что использование стволовых клеток в лечении хронической ишемии нижних конечностей безопасно, у значительной части пациентов позволяет сохранить конечность, улучшает клиническую симптоматику заболевания, способствует заживлению ран.
Таким образом, «терапевтический ангиогенеза» сегодня рассматривается как многообещающая стратегия в лечении пациентов с хронической ишемией нижних конечностей. После десятилетия доклинических исследований и недавних клинических исследований, клеточная терапия была признана многообещающим терапевтическим методом стимулирования ангиогенеза у пациентов с атеросеротическими заболеваниями сосудов. Однако, оценка реальной эффективности в клинических условиях требует проведения дальнейших исследований. Разработка этих методов и внедрение их в клиническую практику позволят добиться значительного улучшения результатов лечения наиболее тяжелой группы пациентов сосудистых отделений — с хронической критической ишемией, в отношении которых фармакотерапия неэффективна, а выполнение реконструктивных сосудистых операций невозможно или сопряжено с высоким риском.
И.Н. Староверов
В последнее время технологии хирургического и фармакологического лечения пациентов с окклюзионными заболеваниями магистральных артерий шагнули далеко вперёд. Бурными темпами развивается эндоваскулярная хирургия, вытесняющая открытые вмешательства из арсенала сердечно-сосудистых хирургов. Появились новые современные препараты, влияющие на реологию крови и состояние сосудистой стенки. Но, к сожалению, все эти высокотехнологичные методы являются лишь паллиативным способом воздействия на атеросклероз. Поэтому и сохраняются на высоких цифрах показатели летальности и тромботических осложнений при атеросклерозе. В связи с этим, любое новое направление в изучении альтернативных способов кровоснабжения ишемизированных органов представляется актуальным и перспекивным.
Бурными темпами развивается эндоваскулярная хирургия, вытесняющая открытые вмешательства из арсенала сердечно-сосудистых хирургов. Появились новые современные препараты, влияющие на реологию крови и состояние сосудистой стенки. Но, к сожалению, все эти высокотехнологичные методы являются лишь паллиативным способом воздействия на атеросклероз. Поэтому и сохраняются на высоких цифрах показатели летальности и тромботических осложнений при атеросклерозе. В связи с этим, любое новое направление в изучении альтернативных способов кровоснабжения ишемизированных органов представляется актуальным и перспекивным.
Возможность влияния на ангиогенез долгие годы считалось мечтой любого специалиста, занимающегося лечением атеросклероза. На сегодняшний день показано, что это становится реальностью. Первые результаты исследований продемонстрировали эффективность использования генноинженерных технологий в лечении облитерирующих заболеваний артерий. Надеюсь, дальнейшие исследования в этом направлении позволят создать наиболее оптимальную лечебную конструкцию, максимально качественно и достоверно влияющую на конечный результат. Несомненно, это перспективное направление современной ангиологии и кардиологии.
Несомненно, это перспективное направление современной ангиологии и кардиологии.
Мезопилинг в Калининграде в Медицинском центре «Идеал Клиник», цены от 1500 рублей | «Идеал Клиник»
Терапевтический эффект применяемой косметики основан на стимуляции пролиферативной активности в клетках кожи. Результатом такого воздействия становится обновление эпидермиса, которое является следствием усиления синтеза коллагена кожи и других компонентов дермы. Помимо этого, препараты обладают противовоспалительным и антиоксидантным действием (они блокируют образование в клетках свободных радикалов). Необходимо отметить, что применение этой косметики помогает устранить ощущения дискомфорта , которые возникают в период проведения курса пилинга( например, сухость и стянутость кожи). Данный эффект – это результат глубокой и длительной гидратации кожи.
Метод безинъекционной мезотерапии основан на защитной реакции кожи при микровоздействии. Стимуляция кожи приводит к многократному делению недифференцированных клеток (это клетки, не имеющие никаких специфических черт строения, и не являющиеся ни нервными, ни мышечными, ни какими другими). Деление клеток выражается в возникновении таких процессов, как неоангиогенез и неоколлагеногенез. Фактически это означает зарождение новых эластических и коллагеновых волокон, а также капилляров . Новые клетки входят в вышележащие слои дермы, не образуя при этом соединительной фиброзной ткани.
Деление клеток выражается в возникновении таких процессов, как неоангиогенез и неоколлагеногенез. Фактически это означает зарождение новых эластических и коллагеновых волокон, а также капилляров . Новые клетки входят в вышележащие слои дермы, не образуя при этом соединительной фиброзной ткани.
Все перечисленные процессы ведут к генерации новой ткани, которая способна заполнить атрофические рубцы. Новые капилляры улучшают локальный кровоток и способствуют исчезновению пигментации.
Курс мезопилинга составляет обычно 6 процедур.
Цены на услугу
| Пилинги поверхностные: 1 раз в неделю | ||
| 5.1 | Салициловый (салициловая кислота 15%) | 1500,00 |
| 5.2 | Салициловый (салициловая кислота %) | 1500,00 |
| 5.3 | Гликолевый (гликолевая кислота 20%) | 1500,00 |
| 5.4 | Гликолевый (гликолевая кислота 50%) | 1500,00 |
5. 5 5 | Молочный (молочная кислота 70%) | 1500,00 |
| 5.6 | Пилинг Джесснера | 2000,00 |
| 5.7 | Жёлтый (ретиноевый) пилинг Yellow Peel | 3500,00 |
| 5.8 | ||
| 5.9 | ||
| Срединные пилинги: 1 раз в месяц | ||
| 5.9 | TCA 15% | 2500,00 |
| 5.10 | TCA 20% | 2500,00 |
| 5.11 | TCA 30% | 2500,00 |
| 5.12 | Пилинг PRX-T33 | 3000,00 |
| 5.13 | Пилинг (Биорепил) | 3000,00 |
Показания для мезопилинга:
- Возрастное старение кожи
- Гиперпигментация
- Постакне
Результаты:
- Кожа обновляется, становится более молодой и выглядит свежей
- Значительно уменьшаются морщины ,и их рельеф становится менее выраженным.
- Пигментные пятна становятся менее заметными и, в зависимости от степени их проявления, могут исчезнуть вовсе.

- Пост-акне и атрофические рубцы становятся менее заметны.
Компания BIOCAD будет производить инновационный антиангиогенный препарат
Компания BIOCAD одержала победу в конкурсе Министерства промышленности и торговли Российской Федерации на трансфер зарубежной технологии производства инновационного биологического препарата для лечения онкологических заболеваний. Начальные стадии создания препарата осуществлены учеными крупнейшего онкологического научного центра США – MD Anderson Cancer Center. Компанией BIOCAD заключено лицензионное соглашение на разработку, клинические исследования и последующее производство препарата. В основе препарата используется слитой белок, состоящий из фактора роста эндотелия сосудов (Vascular Endothelium growth factor, VEGF) и растительного токсина гелонина. VEGF –белок, который связывается с рецепторами клеток, выстилающих сосуды человека (эндотелиоциты), и запускает неоангиогенез — активный рост новых кровеносных сосудов. Именно образование новых сосудов является одним из основных условий прогрессирования опухоли, поэтому последнее десятилетие VEGF рассматривается учеными всего мира как одна из лучших мишеней для направленного подавления роста и метастазирования солидных опухолей. На сегодняшний день существуют несколько биологических препаратов, не позволяющих VEGF соединиться с рецепторами и запустить неоангиогенез (в том числе и биоаналог бевацизумаба производства компании BIOCAD). Гелонин – это растительный токсин, действие которого направлено на необратимую блокаду процессов биосинтеза белка и, соответственно, остановку жизнедеятельности клетки. Используемая в инновационном препарате комбинация позволяет осуществлять направленное цитотоксическое действие в отношении именно опухолевой сосудистой сети. По словам Вице-президента по разработкам и исследованиям компании BIOCAD Романа Иванова: «Препарат не имеет прямых аналогов и позволяет преодолеть основные механизмы устойчивости солидной опухоли к действию антиангиогенных лекарственных средств. Предполагается, что он будет высокоэффективен при использовании в сочетании со стандартными схемами химиотерапии метастатических форм рака, возможно, также будет доказана его эффективность и при использовании в качестве монотерапии».
На сегодняшний день существуют несколько биологических препаратов, не позволяющих VEGF соединиться с рецепторами и запустить неоангиогенез (в том числе и биоаналог бевацизумаба производства компании BIOCAD). Гелонин – это растительный токсин, действие которого направлено на необратимую блокаду процессов биосинтеза белка и, соответственно, остановку жизнедеятельности клетки. Используемая в инновационном препарате комбинация позволяет осуществлять направленное цитотоксическое действие в отношении именно опухолевой сосудистой сети. По словам Вице-президента по разработкам и исследованиям компании BIOCAD Романа Иванова: «Препарат не имеет прямых аналогов и позволяет преодолеть основные механизмы устойчивости солидной опухоли к действию антиангиогенных лекарственных средств. Предполагается, что он будет высокоэффективен при использовании в сочетании со стандартными схемами химиотерапии метастатических форм рака, возможно, также будет доказана его эффективность и при использовании в качестве монотерапии».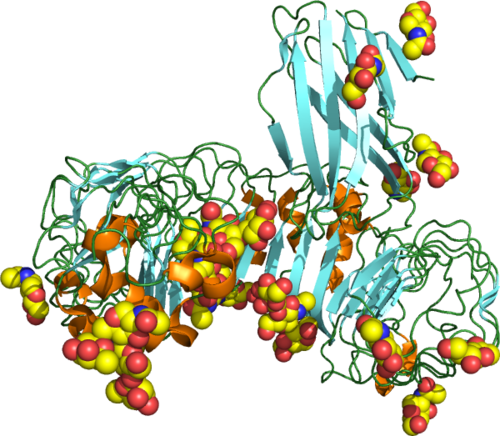 На сегодняшний день завершена большая часть доклинических испытаний, результаты которых подтверждают наличие у препарата направленного действия в отношении исключительно опухолевых кровеносных сосудов, его способность значимо подавлять рост и распространение опухоли, уменьшать размеры метастазов. Доказано, что препарат не токсичен в отношении сосудов здоровых тканей. В рамках реализации проекта по доклинической и клинической разработке инновационного антиангиогенного препарата будут осуществлены дополнительные доклинические испытания, а также осуществлены все этапы клинического изучения нового лекарственного средства у онкологических больных.
На сегодняшний день завершена большая часть доклинических испытаний, результаты которых подтверждают наличие у препарата направленного действия в отношении исключительно опухолевых кровеносных сосудов, его способность значимо подавлять рост и распространение опухоли, уменьшать размеры метастазов. Доказано, что препарат не токсичен в отношении сосудов здоровых тканей. В рамках реализации проекта по доклинической и клинической разработке инновационного антиангиогенного препарата будут осуществлены дополнительные доклинические испытания, а также осуществлены все этапы клинического изучения нового лекарственного средства у онкологических больных.
МЕТАСТАЗИРОВАНИЕ — QUO VADIS? — Онкология
Развитие метастазов — это клинически важный последний шаг прогрессииопухоли. Метастаз— конечный продукт процесса, при котором генетическаянестабильность опухолевых клеток, гетерогенность их популяции, разнообразные взаимодействия между опухолевыми клетками и их микроокружением при-
водят к изменениям, позволяющим злокачественной опухоли преодолевать физические границы первичнопораженного органа или ткани, диссеминировать и колонизировать отдаленные органы. Метастазирование — чрезвычайно сложный ряд молекулярноклеточных и биохимических процессов на генетическом и эпигенетическом уровне, которые обеспечиваются дисрегуляцией генов, изменением экспрессии и взаимодействия белков и других макромолекул, контролирующих инвазию, неоангиогенез в опухоли, циркуляцию опухолевых клеток в кровеносных и лимфатических сосудах, экстравазацию, «колонизацию новых территорий» с преодолением их местного иммунитета и, наконец, формирование вторичного очага опухолевого роста. Приобретение метастатических свойств начинается еще до того, как клетки мигрируют из первичной массы опухоли.
Метастазирование — чрезвычайно сложный ряд молекулярноклеточных и биохимических процессов на генетическом и эпигенетическом уровне, которые обеспечиваются дисрегуляцией генов, изменением экспрессии и взаимодействия белков и других макромолекул, контролирующих инвазию, неоангиогенез в опухоли, циркуляцию опухолевых клеток в кровеносных и лимфатических сосудах, экстравазацию, «колонизацию новых территорий» с преодолением их местного иммунитета и, наконец, формирование вторичного очага опухолевого роста. Приобретение метастатических свойств начинается еще до того, как клетки мигрируют из первичной массы опухоли.
Не все опухоли являются метастазирующими, а в пределах метастазирующей опухоли не все клетки способны к метастазированию. Опухоли сопоставимого гистологического типа и размера могут иметь очень различный метастатический потенциал в зависимости от их генотипа и влияния факторов микроокружения — его клеточных элементов, экстрацелюллярного матрикса, биологически активных растворимых веществ (факторов, регулирующих межклеточную адгезию и подвижность опухолевых клеток; протеолитических ферментов, их активаторов и ингибиторов; факторов, регулирующих ангиогенез; цитокинов и других макромолекул, влияющих на реакции неспецифического и специфического противоопухолевого иммунитета и развитие местной толерантности и иммуносупрессии). Метастатическое распространение опухолевых клеток — очень неэффективный процесс (< 0,05% циркулирующих в крови или лимфе опухолевых клеток развиваются в метастатические колонии), тем не менее, именно успешное предотвращение развития метастазов является залогом излечения онкологических больных.
Метастатическое распространение опухолевых клеток — очень неэффективный процесс (< 0,05% циркулирующих в крови или лимфе опухолевых клеток развиваются в метастатические колонии), тем не менее, именно успешное предотвращение развития метастазов является залогом излечения онкологических больных.
Несмотря на всестороннее изучение опухолевых клеток, причины метастазирования остаются
не до конца ясными. В значительной степени это обусловлено недостаточной изученностью роли «второго участника процесса» — микроокружения первичной опухоли и/или ткани-мишени метастазирования. Иными словами, для решения проблемы метастазирования злокачественных опухолей необходимо проведение на современном (молекулярноклеточном) методическом уровне фундаментальных исследований в рамках проблемы «опухоль — организм», сформулированной в ХХ ст. академиком Р.Е. Кавецким и его школой.
Важным этапом метастазирования является стимуляция ангиои лимфангиогенеза. Около 80% солидных опухолей формируют метастазы преимущественно путем проникновения опухолевых клеток в лимфатическую систему, 20% — через кровеносную систему. Эпителиальные злокачественные опухоли чаще метастазируют лимфогенным путем, саркомы — главным образом через кровеносные сосуды. Образование и рост кровеносных и лимфатических сосудов могут регулировать одни и те же молекулы, например, представители семейства VEGF (фактора роста эндотелия сосудов) или семейства матриксных металлопротеиназ (в частности MMP-2), продуцируемые как опухолевыми клетками, так и клетками опухолевого микроокружения. В последнее время привлекает внимание исследователей семейство рецепторных тирозинкиназ EphA/EphB (описано 16 его членов) и их лиганды (эфрины — EFNA1-5, EFNB1-3). Eph-рецепторы впервые были выявлены в культуре клеток эритропоэтин-продуцирующей гепатоцеллюлярной карциномы (erythropoietin-producing hepatocellular carcinoma). Гиперэкспрессию этих рецепторов выявляют в агрессивных высокозлокачественных опухолях, при распространенных стадиях рака, а также в метастатических узлах. Полагают, что следствием повышенного уровня EphA/B и эфринов является ряд эффектов, способствующих метастазированию.
Эпителиальные злокачественные опухоли чаще метастазируют лимфогенным путем, саркомы — главным образом через кровеносные сосуды. Образование и рост кровеносных и лимфатических сосудов могут регулировать одни и те же молекулы, например, представители семейства VEGF (фактора роста эндотелия сосудов) или семейства матриксных металлопротеиназ (в частности MMP-2), продуцируемые как опухолевыми клетками, так и клетками опухолевого микроокружения. В последнее время привлекает внимание исследователей семейство рецепторных тирозинкиназ EphA/EphB (описано 16 его членов) и их лиганды (эфрины — EFNA1-5, EFNB1-3). Eph-рецепторы впервые были выявлены в культуре клеток эритропоэтин-продуцирующей гепатоцеллюлярной карциномы (erythropoietin-producing hepatocellular carcinoma). Гиперэкспрессию этих рецепторов выявляют в агрессивных высокозлокачественных опухолях, при распространенных стадиях рака, а также в метастатических узлах. Полагают, что следствием повышенного уровня EphA/B и эфринов является ряд эффектов, способствующих метастазированию. Это, во-первых, стимуляция ангиогенеза, во-вторых, нарушение адгезивных взаимодействий клетка — клетка (с участием кадгерина), в-третьих, возможное нарушение взаимодействия опухолевых клеток с элементами внеклеточного матрикса (с вовлечением интегринов). В последние годы показано, что антигенные эпитопы EphA (EphA2) способны индуцировать антигенспецифический Т-клеточный иммунный ответ, что делает их перспективной мишенью при разработке методов иммунотерапии опухолей и их метастазов.
Это, во-первых, стимуляция ангиогенеза, во-вторых, нарушение адгезивных взаимодействий клетка — клетка (с участием кадгерина), в-третьих, возможное нарушение взаимодействия опухолевых клеток с элементами внеклеточного матрикса (с вовлечением интегринов). В последние годы показано, что антигенные эпитопы EphA (EphA2) способны индуцировать антигенспецифический Т-клеточный иммунный ответ, что делает их перспективной мишенью при разработке методов иммунотерапии опухолей и их метастазов.
Возможности суперселективной эмболизации ветвей подколенной артерии при лечении остеоартроза коленного сустава на ранних стадиях. Обзор современной литературы, анализ мирового опыта
Аннотация
Остеоартроз (ОА) — это наиболее распространенное, постоянно прогрессирующее дегенеративное заболевание суставов, ведущее к повреждению суставного хряща и нарушению опороспособности и функции сустава. ОА является основной причиной хронической боли и физических нарушений у взрослых людей. Не смотря на широкое применение консервативных и оперативных методов, эффективное лечение стойкого болевого синдрома при легкой и умеренной степени ОА, резистентного к консервативной терапии, часто затруднено и существует потребность в разработке нового, минимально инвазивного и эффективного метода лечения. Недавние экспериментальные исследования обнаружили, что воспаление может приводить к развитию остеоартроза, повреждению хрящевой ткани и боли посредством стимуляции патологического неоангиогенеза. Было открыто, что снижение воспаления уменьшает повреждение суставов и уровень боли, и что ингибирование роста кровеносных сосудов может быть использовано для уменьшения боли при ОА. Предполагается, что путем эмболизации аномальных сосудов в воспаленной синовиальной оболочке, сложная взаимосвязь между ангиогенезом, хроническим воспалением и болью нарушается, тем самым уменьшая симптомы, снижая воспаление и тормозя прогрессирование заболевания. Описание отдельных клинических случаев и проведенный анализ доклинических исследований дают основания предполагать, что суперселективная транскатетерная артериальная эмболизация — безопасная минимально инвазивная методика, которая значительно улучшает функцию сустава и значительно уменьшает болевой синдром у пациентов с легкой и умеренной стадией ОА коленного сустава, устойчивого к консервативному лечению.
Не смотря на широкое применение консервативных и оперативных методов, эффективное лечение стойкого болевого синдрома при легкой и умеренной степени ОА, резистентного к консервативной терапии, часто затруднено и существует потребность в разработке нового, минимально инвазивного и эффективного метода лечения. Недавние экспериментальные исследования обнаружили, что воспаление может приводить к развитию остеоартроза, повреждению хрящевой ткани и боли посредством стимуляции патологического неоангиогенеза. Было открыто, что снижение воспаления уменьшает повреждение суставов и уровень боли, и что ингибирование роста кровеносных сосудов может быть использовано для уменьшения боли при ОА. Предполагается, что путем эмболизации аномальных сосудов в воспаленной синовиальной оболочке, сложная взаимосвязь между ангиогенезом, хроническим воспалением и болью нарушается, тем самым уменьшая симптомы, снижая воспаление и тормозя прогрессирование заболевания. Описание отдельных клинических случаев и проведенный анализ доклинических исследований дают основания предполагать, что суперселективная транскатетерная артериальная эмболизация — безопасная минимально инвазивная методика, которая значительно улучшает функцию сустава и значительно уменьшает болевой синдром у пациентов с легкой и умеренной стадией ОА коленного сустава, устойчивого к консервативному лечению.
Литература
1. Neogi T. The epidemiology and impact of pain in osteoarthritis. Osteoarthritis Cartilage. 2013; 21:1145–1153. doi: 10.1016/j.joca.2013.03.018.
2. Dominick KL, Ahern FM, Gold CH, Heller DA. Health-related quality of life and health service use among older adults with osteoarthritis. Arthritis Rheum. 2004; 51:326–331. doi: 10.1002/art.20390.
3. Ayis S, Dieppe P. The natural history of disability and its determinants in adults with lower limb musculoskeletal pain. J Rheumatol. 2009; 36(3):583-91 doi: 10.3899/jrheum.080455.
4. Kapoor M, Martel-Pelletier J, Lajeunesse D, Pelletier J-P, Fahmi H. Role of proinflammatory cytokines in the pathophysiology of osteoarthritis. Nat Rev Rheumatol. 2011; 7(1):33-42. doi: 10.1038/nrrheum.2010.196.
5. Loeser RF, Goldring SR, Scanzello CR, Goldring MB. Osteoarthritis: a disease of the joint as an organ. Arthritis Rheum. 2012; 64(6): 1697-1707. DOI: 10.1002/art.34453.
6. Goldring MB, Otero M. Inflammation in osteoarthritis. Curr Opin Rheumatol. 2011 ; 23(5):471-478. doi: 10.1097/BOR.0b013e328349c2b1.
7. Schianchi PM, Sluijter ME, Balogh SE. The treatment of joint pain with intra-articular pulsed radiofrequency. Anesth Pain Med. 2013; 3(2): 250–255. doi: 10.5812/aapm.10259.
8. Ashraf S, Mapp PI, Walsh DA. Contributions of angiogenesis to inflammation, joint damage, and pain in a rat model of osteoarthritis. Arthritis & Rheumatism. 2011; 63(9): 2700-2710. doi:: 10.1002/art.30422.
9. Bonnet CS, Walsh DA. Osteoarthritis, angiogenesis and inflammation. Rheumatology (Oxford). 2005; 44: 7-16. doi: 10.1093/rheumatology/keh444.
10. Pap T, Distler O. Linking angiogenesis to bone destruction in arthritis. Arthritis Rheum. 2005; 52:1346-1348. doi: 10.1002/art.21015.
11. Walsh DA, Bonnet CS, Turner EL, Wilson D, Situ M, McWilliams DF. Angiogenesis in the synovium and at the osteochondral junction in osteoarthritis. Osteoarthritis Cartilage. 2007; 15:743-751. doi: 10.1016/j.joca.2007.01.020.
12. Ashraf S, Wibberley H, Mapp PI, Hill R, Wilson D, Walsh DA. Increased
vascular penetration and nerve growth in the meniscus: a potential source of pain in osteoarthritis. AnnRheumDis. 2011; 70: 523-529. doi: 10.1136/ard.2010.137844.
13. Suri S, Gill SE, Massena de Camin S, Wilson D, McWilliams DF, Walsh DA. Neurovascular invasion at the osteochondral junction and in osteophytes in osteoarthritis. Ann Rheum Dis. 2007; 66: 1423-1428. doi: 10.1136/ard.2006.063354.
14. Mapp PI, Avery PS, McWilliams DF, Bowyer J, Day C, Moores S, et al. Angiogenesis in two animal models of osteoarthritis. Osteoarthritis Cartilage 2008; 16: 61-69. doi: 10.1016/j.joca.2007.05.017
15. Roemer FW, Jarraya M, Kwoh CK, Hannon MJ, Boudreau RM, Green SM et al. Brief report: symmetricity of radiographic and MRI-detected structural joint damage in persons with knee pain–the Joints on Glucosamine (JOG) Study. Osteoarthritis Cartilage. 2015; 23: 1343-1347. doi: 10.1016/j.joca.2015.02.169.
16. Fagiani E, Christofori G. Angiopoietins in angiogenesis. Cancer Lett. 2013; 328 (1):18-26. doi: 10.1016/j.canlet.2012.08.018.
17. Shukunami C, Oshima Y, Hiraki Y. Chondromodulin-I and tenomodulin: a new class of tissue-specific angiogenesis inhibitors found in hypovascular connective tissues. Biochem Biophys Res Commun. 2005; 333: 299–307. doi: 10.1016/j.bbrc.2005.05.133.
18. Hashimoto S, Creighton-Achermann L, Takahashi K, Amiel D, Coutts RD, Lotz M. Development and regulation of osteophyte formation during experimental osteoarthritis. Osteoarthritis Cartilage. 2002; 10: 180-187. doi: 10.1053/joca.2001.0505.
19. Zoricic S, Maric I, Bobinac D, Vukicevic S. Expression of bone morphogenetic proteins and cartilage-derived morphogenetic proteins during osteophyte formation in humans. J Anat. 2003; 202 (3):269–277.
20.Van Lent PL, Blom AB, van der Kraan P, Holthuysen AE, Vitters E, van Rooijen N et al. Crucial role of synovial lining macrophages in the promotion of transforming growth factor beta-mediated osteophyte formation. Arthritis Rheum. 2004; 50:103-111. doi: 10.1002/art.11422.
21. Murata M, Yudoh K, Masuko K. The potential role of vascular endothelial growth factor (VEGF) in cartilage. How the angiogenic factor could be involved in the pathogenesis of osteoarthritis? Osteoarthritis Cartilage. 2008; 16: 279-286. doi: 10.1016/j.joca.2007.09.003
22. Enomoto H, Inoki I, Komiya K, Shiomi T, Ikeda E, Obata K et al. Vascular endothelial growth factor isoforms and their receptors are expressed in human osteoarthritic cartilage. Am J Pathol. 2003; 162: 171-181.
23. Pufe T, Lemke A, Kurz B, Petersen W, Tillmann B, Grodzinsky AJ et al. Mechanical overload induces VEGF in cartilage discs via hypoxia-inducible factor. Am J Pathol . 2004; 164: 185-192.
24. Pfander D, Cramer T, Swoboda B. Hypoxia and HIF-1alpha in osteoarthritis. Int Orthop. 2005; 29:6–9. doi: 10.1007/s00264-004-0618-2.
25. Murata M, Yudoh K, Nakamura H, Kato T, Inoue K, Chiba J et al. Distinct signaling pathways are involved in hypoxia- and IL-1-induced VEGF expression in human articular chondrocytes. J Orthop Res. 2006; 24: 1544-1554.
26. Tanaka E, Aoyama J, Miyauchi M, Takata T, Hanaoka K, Iwabe T et al. Vascular endothelial growth factor plays an important autocrine/paracrine role in the progression of osteoarthritis. Histochem Cell Biol. 2005; 123: 275-281. doi: 10.1007/s00418-005-0773-6.
27. Carmeliet P. Angiogenesis in health and disease. Nat Med. 2003; 9:653–660. doi: 10.1038/nm0603-653.
28. Polverini PJ. Angiogenesis in health and disease: insights into basic mechanisms and therapeutic opportunities. J Dent Educ. 2002; 66: 962-975.
29. Horner A, Bord S, Kelsall AW, Coleman N, Compston JE. Tie2 ligands angiopoietin-1 and angiopoietin-2 are coexpressed with vascular endothelial cell growth factor in growing human bone. Bone. 2001; 28:65-71.
30. Kasama T, Isozaki T, Odai T, Matsunawa M, Wakabayashi K, Takeuchi HT et al. Expression of angiopoietin-1 in osteoblasts and its inhibition by tumor necrosis factor-alpha and interferon-gamma. Transl Res. 2007; 149:265-273. doi: 10.1111/j.1582-4934.2008.00254.x.
31. Scott BB, Zaratin PF, Gilmartin AG, Hansbury MJ, Colombo A, Belpasso C et al. TNF-alpha modulates angiopoietin-1 expression in rheumatoid synovial fibroblasts via the NF-kappa B signaling pathway. Biochem Biophys Res Commun. 2005; 328:409-414.
2. Fiedler U, Reiss Y, Scharpfenecker M, Grunow V, Koidl S, Thurston G et al. Angiopoietin-2 sensitizes endothelial cells to TNF-alpha and has a crucial role in the induction of inflammation. Nat Med. 2006; 12: 235-239. doi: 10.1038/nm1351
33. Guevara CJ, Lee KA, Barrack R, Darcy MD. Technically Successful Geniculate Artery Embolization Does Not Equate Clinical Success for Treatment of Recurrent Knee Hemarthrosis after Knee Surgery. J Vasc Interv Radiol. 2016; 27(3):383-7. doi: 10.1016/j.jvir.2015.11.056.
34.Okuno Y., Korchi AM, Shinjo T, Kato S, Kaneko T. Midterm Clinical Outcomes and MR Imaging Changes after Transcatheter Arterial Embolization as a Treatment for Mild to Moderate Radiographic Knee Osteoarthritis Resistant to Conservative Treatment. J Vasc Interv Radiol. 2017; 28(7): 995-1002. doi: 10.1016/j.jvir.2017.02.033.
35. Kulkarni K, Karssiens T, Kumar V, Pandit H. Obesity and osteoarthritis. Maturitas. 2016; 89: 22-28. doi: 10.1016/j.maturitas.2016.04.006.
Кристаллические ультраструктуры, воспалительные элементы и неоангиогенез присутствуют в незаметной ткани аортального клапана
Заболеваемость кальцинозной болезнью аортального клапана (CAVD) увеличивается. Недавние исследования предполагают ранние обратимые изменения, связанные с воспалением и неоангиогенезом. Мы предположили, что микрокальцификаты, хемокины и факторы роста присутствуют в непораженных участках кальцифицированных клапанов аорты.
Мы изучили аортальные клапаны у 4 пациентов с CAVD и у 1 контрольной группы с помощью иммуногистохимии, сканирующей электронной микроскопии и инфракрасной спектрографии.Мы выявили скопления новообразований капилляров в кальцифицированных (ECC) областях, в меньшей степени в некальцифицированных (ECN) областях. Эндотелиальные клетки доказали постоянную экспрессию SDF-1 в ECC, ECN и эндотелиальных клетках с клапанной поверхности (ECS). Его рецептор CXCR4 экспрессировался в ECC. Экспрессия IL-6 коррелировала с окрашиванием CXCR4 и присутствием лимфоцитов. VEGF экспрессируется ECS, его рецептор — ECC и ECN. На поверхности гистологически некальцинированных участков (HNCA) обнаружены кристаллические ультраструктуры, спектрография выявила гидроксилапатит кальция.Наши результаты демонстрируют, что кристаллические ультраструктуры присутствуют в HNCA, подвергающихся неоангиогенезу в воспалительном контексте. Эти изменения могут быть ранним свидетельством болезни и открытием для терапии.
1. Введение
Кальцифицирующая болезнь аортального клапана (CAVD) является наиболее частым поражением клапана в западных странах и основной причиной замены аортального клапана. Это связано с более высоким риском смерти от сердечно-сосудистых причин, который увеличивается до 50% даже при отсутствии гемодинамически значимой обструкции [1, 2].По мере старения населения CAVD становится важной проблемой общественного здравоохранения. До сих пор лечение симптоматической кальцифицированной болезни аортального клапана полностью зависело от хирургических процедур с заменой клапана. До недавнего времени было общепринятым представление о том, что CAVD является дегенеративным и немодифицируемым процессом, в основном вызываемым длительным механическим напряжением [3, 4]. Интересно, что недавние исследования предполагают, что клапанные изменения могут быть не неизменяемым дегенеративным заболеванием, а скорее динамическим процессом, включающим воспаление, липидную инфильтрацию, дистрофическую кальцификацию и эндотелиальную дисфункцию [5–7].
Хемокины и факторы роста играют важную роль в нескольких патофизиологических процессах, таких как воспаление и иммунитет. Хемокиновый рецептор CXCR4 экспрессируется на моноцитах, В-лимфоцитах и большинстве Т-клеток [8–10]. Было определено, что CXCR4, который присутствует во многих различных типах клеток, активируется только одним лигандом, фактором 1 стромального происхождения (SDF-1) и опосредует несколько различных активностей, таких как хемотаксис, адгезия, пролиферация, выживание и, в некоторых клетках — апоптоз [11–13].Активация CXCR4 на лимфоцитах и моноцитах стимулирует хемотаксис, что приводит к привлечению к участкам иммунных и воспалительных реакций. Гемопоэтические и эндотелиальные клетки-предшественники экспрессируют CXCR4, а высвобождение SDF-1 стромальными клетками костного мозга опосредует секвестрацию и возвращение этих клеток-предшественников в костный мозг [14, 15]. Напротив, SDF-1 также вовлечен в реваскуляризацию ишемизированных задних конечностей посредством рекрутирования гемангиоцитов CXCR4 + [16, 17], а недавно было показано, что SDF-1 и его рецептор CXCR4 поддерживают развитие кровоснабжения сосудов в воспалительных процессах. атеросклеротические бляшки [18].С другой стороны, известно, что некоторые факторы роста сосудов, в частности VEGF и его рецепторы (VEGFR1 и 2), участвуют в развитии злокачественных новообразований, внутриглазных неоваскулярных расстройствах и образовании атеросклеротических бляшек [19]. Патологический неоангиогенез — будь то в контексте воспаления или рака — частично объясняется передачей сигналов VEGF / VEGFR [20]. Мы предположили, что SDF-1 и VEGF могут действовать как регуляторы ангиогенеза внутри пораженных прежде всего клапанов, в зависимости от их экспрессии и присутствия соответствующих рецепторов на эндотелиальных клетках.
Благодаря рутинному опыту с минимальными изменениями клапанов, включая дискретную кальцификацию и связанные с ними капиллярно-подобные новообразования, мы были заинтересованы в возможных изменениях на ранних стадиях клинически незаметных и макроскопически незаметных областей клапана / клапанов. Таким образом, мы предположили, что раннее фиброзное ремоделирование и неоангиогенез в аортальных клапанах могут быть инициированы ультраструктурными кальцификационными изменениями.
2. Методы
Образцы тканей, соответствующие резекции аортального клапана, были собраны у пациентов, подвергшихся хирургическому лечению по поводу CAVD () и аортальной недостаточности из-за аневризмы дуги аорты () в отделении кардиохирургии (Hôpital de la Pitié-Salpêtrière, Париж) ).После резекции образцы фиксировали в формалине и препарировали. Половина образцов была переработана в парафиновые блоки и серийно разрезана на толщину 3 мкм м. Слайды окрашивали гематоксилином, эозином и шафраном. Другая половина была разделена на кальцифицированные и некальцинированные области и в конечном итоге вставлена в проницаемую для рентгеновских лучей каптонную пленку для проведения экспериментов по рентгеновской флуоресценции и дифракции рентгеновских лучей.
Каждый образец исследовали методом FT-IR с использованием инфракрасного спектрометра с преобразованием Фурье Bruker IFS25 (Bruker Spectrospin, Wissembourg, Франция) между 4000 и 400 см -1 с разрешением 4 см -1 [21].Для наблюдения микроструктуры использовали сканирующий электронный микроскоп (SEM) типа Zeiss SUPRA55-VP. Чтобы сохранить целостность аортального клапана, измерения проводили при низком напряжении (1,4 кВ) и без обычных отложений углерода на поверхности образца. Иммуногистохимические анализы проводили на образцах, фиксированных формалином. Залитые в парафин срезы окрашивали моноклональными мышиными первичными антителами против человека против фактора фон Виллебранда (ссылка Dako A0082; разведение 1: 200), CD3 (ссылка Dako F7.2,38; разведение 1: 100), CXCL12 / SDF-1 (система RD; клон 79018, разведение 1/30), CXCR4 (система RD; клон 12G5, разведение 1/100) и поликлональные кроличьи антитела против человека против CD117 (ссылка Dako K0678; разведение 1: 200), IL-6 (ссылка Abcam ab6672; разведение 1: 400). В соответствии с рекомендациями производителя для первичного обнаружения антител использовали набор DAKO LSAB k0673, а в качестве хромогена использовалась субстратная система Fast Red TR. Мы оценили иммуногистохимическое окрашивание эндотелиальных клеток (ЭК) в трех анатомических компартментах: ЭК поверхности створки (ECS), EC новообразований вблизи кальцифицированных областей (ECC) и EC новообразований, удаленных от кальцифицированных областей (ECN).
Исследование было одобрено и проведено в соответствии с институциональным наблюдательным советом больницы Питье-Сальпетриер, и все субъекты дали информированное согласие на использование ткани.
3. Результаты
3.1. Гистопатология
Морфологическими признаками CAVD были скопления кальцифицированных масс внутри створок аорты, которые выступали на поверхности оттока. Кальцинированные отложения исказили архитектуру куспида, в первую очередь в его основаниях. Свободные края бугров обычно не вовлекались.На профиле створки кальцификаты располагались внутри клапанной фиброзы, в точке максимального сгибания створки. Бугорки были сильно фиброзированы и часто представляли хронический воспалительный инфильтрат, в основном состоящий из лимфоцитов, макрофагов и тучных клеток. Иногда гранулемы инородного тела с гигантскими клетками присутствовали рядом с кальцификациями. Многочисленные микрососуды крови в кальцифицированных областях наблюдались в тесной связи с воспалительными инфильтратами и часто располагались в виде гнезд (рис. 1 (а)).Микрососуды выявили различные фенотипы с тонкостенными капиллярно-подобными проявлениями или утолщенной структурой стенок артериол. Внутриклеточные или внеклеточные отложения липидов, наблюдаемые при атероматозных поражениях артерий, не наблюдались. Архитектура гистологического клапана вдали от кальцинированных участков сохранилась. Гистоморфологические корреляты кальцификации или микрокальцификации на этом участке не наблюдались. Однако бугорки показали некоторое фиброзное ремоделирование, и присутствовало несколько тонкостенных капиллярных новообразований.Контрольный образец (хирургия Бенталла) примерно соответствовал нормальной анатомии створки клапана с одним слоем эндотелиальных клеток, выстилающих слой спонгиозы на стороне аорты с плохо организованной соединительной тканью и богатым эластином слоем желудочков на стороне желудочка. Хотя аортальные клапаны считаются неваскуляризованными тканями, в контрольном образце присутствовало несколько капиллярных новообразований, но не было воспалительных инфильтратов. Кальцификации или серьезного фиброзного ремоделирования не наблюдалось.
3.2. Иммуногистохимия
ЭК из всех образцов и из всех компартментов экспрессировали vWF и CXCL12. Экспрессия CXCR4 наблюдалась в ECC, тогда как ECN и ECS были спорадически окрашены или полностью отрицательны. IL-6 экспрессировался в ECC и ECS, в то время как в основном отрицательный в ECN. Контрольный образец был представлен с другим профилем экспрессии: по определению присутствовали только ECN и ECS; в то время как обе подгруппы EC легко определялись по экспрессии vWF и окрашивались на CXCL12, ECN были отрицательными для IL-6, тогда как ECS окрашивались умеренно.
VEGF постоянно выражался в ECS всех клапанов и, в меньшей степени, в ECC. VEGFR1 экспрессировался как в ECC, так и в ECN, тогда как ECS был отрицательным. ECN в контрольном образце выявили экспрессию VEGFR1.
Воспалительный инфильтрат в области новообразований выявлял в основном CD3 + лимфоциты и CD117 + тучные клетки. В попытке дифференцировать тучные клетки от клеток-предшественников CD117 + костного мозга, предметные стекла вторично контрастно окрашивали толуидином-синим; CD117-положительные / толуидин-отрицательные клетки не наблюдались.Иммуногистохимические результаты представлены на рисунках 1 (б) –1 (л)
3.3. Сканирующая электронная микроскопия
Анализ сканирующей электронной микроскопии (СЭМ) поверхности створок в некальцинированных областях выявил наличие двух типов трехмерных кристаллических структур: мы дифференцировали пластинчатые граненые микростержни, которые вертикально вставляли в эндотелиальную поверхность, измеряя примерно 10 мкм м. Эти неоднородно распределенные структуры связаны с 5-8 мкм м крупными сферическими или узелковидными структурами, локально покрывающими поверхность створки.Такие же ультраструктурные модификации были — в меньшей степени — присутствовали в контрольном образце (Рисунки 2 (а) и 2 (б)). Напротив, кальцинированные области массово отображали большие скопления кристаллов размером 100 мкм и более м и более, широко покрывая проанализированные области клапанов.
3.4. EDX-анализ
Рентгеновское флуоресцентное излучение выявило значительный пик люминофора в кальцинированных областях и небольшое повышение люминофора в некальцинированных областях. Пик кальция не был заметен для некальцинированных областей, тогда как присутствовал в кальцинированных областях.Легкие элементы, такие как карбонат, кислород и натрий, присутствовали в обоих регионах (рис. 3).
3.5. FT-IR-спектроскопия
Апатит кальция и аморфный карбонизированный фосфат кальция были основными компонентами в сильно кальцинированных областях. Незаметные участки с кристаллическими ультраструктурами содержали только апатит кальция. Примерно 80% материала в сильно кальцинированных областях соответствовало апатиту кальция, а 10% кальциевого апатита было обнаружено в сильно некальцинированных областях.Апатит кальция также присутствовал в контрольном образце (хирургия Бенталла). Более высокие количества триглицеридов были извлечены в незаметных областях клапана по сравнению с известковыми поражениями (Таблица 1).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4.Обсуждение
Для выявления ультраструктурных патологических преобразований в структуре клапана мы проанализировали некальцинированные и кальцинированные участки аортальных клапанов человека, которые были удалены хирургическим путем из-за симптоматического кальцифицирующего стеноза, а также один совершенно незаметный клапан, иссеченный в контексте хирургии Бенталла в г. пациент с неатеросклеротической аневризмой аорты. После гистологического исследования образцов мы подвергли их сканирующей электронной микроскопии и инфракрасной спектроскопии с преобразованием Фурье в попытке в конечном итоге определить элементарный профиль, указывающий на начальное изменение структурной организации, возможно, предшествующее явному ремоделированию.
Наши снимки, сделанные с помощью сканирующего электронного микроскопа, показывают, что на поверхности гистологически незаметной ткани клапана присутствуют кристаллические ультраструктуры различного вида. СЭМ-анализ позволил нам различить два типа кристаллических ультраструктур в некальцинированных областях: мы различили более мелкие, сферические или узелковые структуры, частично покрывающие поверхность, и скопления более крупных пластинчатых граненых микростержней, радиально вставленных в створку клапана. Наши наблюдения совпадают с ультраструктурным аспектом типичных биологических апатитов в кальцинированных поражениях аортальных клапанов человека: физико-химическое и ультраструктурное исследование, проведенное Микроулисом и его коллегами по естественным аортальным клапанам и биопротезам аорты свиньи, выявило два типа сосуществующих отложений клапанов, а именно большие (> 20 мкм) и средних (5–20 мкм) пластинчатых кристаллов, а также микрокристаллических (<5 мкм) минеральных образований фосфата кальция [22].Их результаты предполагают, что минеральная соль кальцифицированных клапанов представляет собой смесь фаз фосфата кальция, таких как дигидрат дикальцийфосфата (DCPD), октакальцийфосфат (OCP) и гидроксиапатит (HAP). Предполагается, что DCPD и OCP являются фазами-предшественниками, преобразованными в HAP путем гидролиза. Важно отметить, что авторы обнаружили более низкое значение молярного отношения Ca / P в биопротезах по сравнению с нативными клапанами. Это различие было приписано более высокому содержанию фаз-предшественников, таких как DCPD и OCP, в биопротезных клапанах, впоследствии преобразованных в HAP.Что касается ультраструктурной морфологии и химического состава, мы обнаружили сходный узор в макроскопически незаметных областях клапана. Примечательно, что соотношение Са / Р было значительно ниже в макроскопически некальцифицированных областях по сравнению с сильно кальцинированными поражениями. Результаты FT-IR для кальцифицированных образцов показали, что апатит кальция и аморфный карбонизированный фосфат кальция являются основными компонентами в сильно кальцинированных областях. Напротив, незаметные области с кристаллической ультраструктурой содержат только апатит кальция, хотя и в разных пропорциях: в то время как примерно 80% материала в сильно кальцинированных областях состоит из апатита кальция, 10% апатита кальция находится в незаметных областях.Следует отметить, что апатит кальция также присутствует в контрольном образце (хирургия Bentall). Кроме того, мы наблюдали, по крайней мере, сопоставимое, если не немного большее, количество триглицеридов в незаметных областях клапана по сравнению с кальцифицированными поражениями. Примечательно, что несколько исследований, посвященных морфологии кристаллов триглицеридов [23, 24], указывают на то, что эти ультраструктуры представляют собой сферическую или слоистую структуру, подобную нашей листочке, покрывающей микронодули. Наконец, наши EDX-спектры показывают присутствие натрия в кальцинированных и незаметных областях, что, возможно, указывает на дополнительное участие кристаллов урата натрия.Как и ожидалось, анализ сильно кальцинированных областей аортального клапана показал важные ультраструктурные модификации с большими кристаллическими отложениями кальцийапатита, связанными с фиброзным ремоделированием. Однако гистологическая и ультраструктурная морфология кажется несовместимой в незаметных, сильно не кальцинированных областях клапана. Как указано выше, наш СЭМ-анализ выявил наличие фасеточных кристаллических микростержней и слоистых микронодулей на поверхности створок. Эти структуры морфологически демонстрируют плотное прилегание к поверхности эндотелия и могут с точки зрения динамики потока представлять критический источник механического и / или окислительного стресса из-за турбулентности потока.В недавнем исследовании Миллер и его коллеги сообщили о значительном увеличении окислительного стресса и изменении антиоксидантных механизмов в стенозированных аортальных клапанах сердца по сравнению с нормальными сердечными клапанами [25]. Интересно, что они дифференцировали кальцинированные и некальцифицированные области стенотических клапанов и обнаружили значительное нарушение регуляции антиоксидантных ферментов супероксиддисмутазы (SOD) 1 и 3 в некальцинированных областях, предполагая, что нарушение механизмов активации SOD может способствовать повреждающему повреждению тканям повышению уровней супероксида.Следует отметить, что повреждение эндотелия рассматривается как раннее событие в формировании патологического кальциноза, особенно в слое спонгиоза на аортальной стороне клапана [26–28]. Кроме того, в предыдущих исследованиях сообщалось о дисфункции эндотелиальных клеток в очевидно кальцинированных аортальных клапанах с нарушением регуляции маркеров эндотелиальных клеток, таких как ICAM-1, VCAM-1, IL-6 и FVIII, предполагая, что дисфункция эндотелиальных клеток может в некоторой степени присутствовать на ранних стадиях. стадии развития болезни [29–32].Интересно, что Юенс и его коллеги сообщают о потенциально большем риске для микро- и наночастиц фосфата кальция на ранних стадиях атеросклероза по сравнению с более крупными, рентгенологически видимыми отложениями в более запущенных поражениях за счет эффективной индукции различных воспалительных путей [33], и это можно предположить. что эти медиаторы воспаления экспрессируются в присутствии субмикроскопических кальцификатов клапанов. Однако наши иммуногистохимические эксперименты выявили различные фенотипы ЭК, в зависимости от площади клапана и его патологического ремоделирования: мы наблюдали постоянную экспрессию SDF-1 в ЭК из всех отделов кальцифицированных аортальных клапанов человека.Напротив, его рецептор CXCR4 в основном экспрессируется в скоплениях микрососудов около кальцинированных узелков и в меньшей степени в эндотелии выстилки створок. Окрашивание обратно коррелировало с расстоянием до кальцинированных участков. Интересно, что аналогичная картина наблюдалась в экспрессии провоспалительного цитокина IL-6 с заметным окрашиванием в ЭК вблизи сильно поврежденных областей клапана. Было высказано предположение, что усиление передачи сигналов CXCR4 в кровеносных сосудах вблизи кальцификатов индуцирует пролиферацию новообразований и способствует рекрутированию воспалительных клеток из крови [13-17].Взаимодействие хронического воспаления и ткань кальцификации имеет много общего с атеросклерозом системных артерий: возникновение и роль неоангиогенеза в кальцифицированных атеромах были в основном описаны и до сих пор спорно обсуждаются несколько группами [34-36]. Формирование новообразований внутри первичного воспалительного поражения рассматривается как раннее событие при CAVD и может способствовать прогрессированию поражения за счет прямого перемещения воспалительных клеток к градиенту хемокинов [18, 37].Патомеханизмы рекрутирования эндотелиальных клеток и организации новых сосудов в первичных поражениях еще предстоит выяснить. Некоторые исследователи обнаружили значительное количество эндотелиальных клеток-предшественников, преимущественно локализованных в клапанной фиброзе кальцифицированных клапанов, что позволяет предположить, что клетки внеклапанного происхождения вносят вклад в дегенерацию аортального клапана [38]. Другие предположили, что рекрутирование циркулирующих клеток-предшественников в месте повреждения тканей способствует неоваскуляризации через систему VEGF / SDF-1, которые являются мощными ангиогенными факторами [39].Фактически, было показано, что экспрессия VEGF повышена в сильно кальцифицированной ткани аортального клапана и связана с неоваскуляризацией, а также с экспрессией белков костного субстрата, таких как остеопонтин и остеокальцин [33]. Наши результаты подтверждают, что VEGF в основном экспрессируется в эндотелиальных клетках поверхности листка. Важно отметить, что мы обнаружили, что его рецептор VEGFR1 экспрессируется в ЭК новых сосудов вблизи кальцифицированных областей, а также в некальцинированных областях, что свидетельствует о продолжающейся ангиогенетической петле в макроскопически мягких областях с ультраструктурными кристаллическими отложениями.Что касается возможного присутствия клеток-предшественников, наши иммуногистохимические эксперименты выявили только гранулированные CD117-положительные клетки, которые также являются толуидин-положительными и, следовательно, наиболее вероятно соответствуют тучным клеткам, а не клеткам-предшественникам. Тем не менее, явное ремоделирование кальцифицированного клапана может быть инициировано после первичного ультраструктурного события посредством запуска воспалительных каскадов, управляемых цитокинами, такими как IL-6, и последующего патологического ангиогенеза через паракринную активность VEGF / SDF-1, что в конечном итоге делает участок поражения «активным». .”
Механизм CAVD остается в значительной степени неизвестным по сравнению с нашим пониманием механизмов, лежащих в основе атеросклеротических заболеваний. Мы предполагаем, что SDF-1 / CXCR4 и система VEGF / VEGFR могут играть ключевую роль в инициации и развитии CAVD. Наши наблюдения демонстрируют, что экспрессия SDF-1 и его рецептора CXCR4 присутствует в ЭК патологических микрососудов. Более того, экспрессия CXCR4, по-видимому, коррелирует с экспрессией IL-6, цитокина с сильной провоспалительной активностью в контексте воспаления.Более того, мы показываем, что постоянная экспрессия VEGF ЭК на поверхности створки связана с экспрессией ЭК VEGFR1 в патологических новообразованиях, и что эти новообразования не ограничиваются исключительно кальцинированными областями с воспалительным инфильтратом, но — даже если они распределены в разреженном виде — могут иметь место. наблюдается в некальцинированных областях пораженных клапанов, а также в бессимптомных клапанах, не имеющих явной кальцификации при световой микроскопии, но выявляющих прилипшие к эндотелию кристаллические ультраструктуры при СЭМ и ИК-спектрографии.
Разработка новых фармакологических методов лечения этого заболевания требует более четкого понимания механизмов начала заболевания. Присутствуют ангиогенные факторы и провоспалительные цитокины, которые могут быть ранним свидетельством последующей воспалительной активности, что в конечном итоге приводит к фиброзному ремоделированию и симптоматической вальвулопатии.
Вклад авторов
П. Дорфмюллер и Д. Базин внесли равный вклад в это исследование.
Неоангиогенез мезенхимальных стволовых клеток человека, трансфицированных нагруженными пептидами и покрытыми генами наночастицами PLGA
Специфические факторы важны для строительства кровеносных сосудов [1], [2].Кровеносные сосуды образованы циркулирующими эндотелиальными клетками-предшественниками (EPC) [3], [4]. Во время циркуляции эти клетки перемещаются к раненым сосудам, образуют сеть, вызванную микроклиматическими условиями, и развиваются в эндотелиальные клетки (ЭК) [5], [6]. Таким образом, многие исследователи сосредоточились на трансплантации EPC для неоангиогенеза при ишемических заболеваниях [7], [8], [9]. Сообщается, что трансплантация изолированных EPC стимулирует клетки-хозяева паракринным образом и способствует ангиогенезу в экспериментальных моделях ишемии конечностей [10], [11].Однако различные препятствия препятствуют использованию EPC для стимуляции ангиогенеза или васкуляризации на участках раны, включая трудность индукции дифференцировки трансплантированных EPC [12], [13]. Модуляция конкретных генов может влиять на дифференцировку клеток [14]. Чтобы вызвать специфические клеточные микроокружения, гены или лекарства могут быть введены в клетки прямо или косвенно, если они инкапсулированы в транспортных средствах [15], [16]. Несколько типов материалов были использованы в качестве носителей для обеспечения безопасной доставки генов, участвующих в дифференцировке клеток.Биоразлагаемые полимеры могут инкапсулировать некоторые гидрофобные или гидрофильные лекарства, и их поверхностный заряд может быть изменен, чтобы способствовать связыванию с конкретными генами или лекарствами [17], [18].
В ангиогенезе участвует множество факторов [19]. Среди них фактор роста эндотелия сосудов (VEGF) участвует в формировании кровеносных сосудов, усиливая проникновение циркулирующих зрелых ЭК в участки ранения посредством модуляции проницаемости сосудов [20]. Гликозилированный VEGF , 165, , одна из изоформ VEGF, обнаруженных в кровеносных сосудах, оказывает клинически полезные эффекты in vitro и in vivo [21], [22].
Белковые и пептидные формы апелина, которые помогают VEGF формировать сосудистые сети (т.е. неоваскуляризацию), стимулируют образование сердечно-сосудистых и периферических кровеносных сосудов [23]. Препропротеин из 77 аминокислот гена апелина легко расщепляется с образованием более коротких активных пептидов [24]. Следовательно, апелин-36, который содержится в синтетических С-концевых фрагментах, включая апелин-19, апелин-17, апелин-16 и апелин-12, может, возможно, индуцировать экспрессию рецептора апелина (APJR) [25], [26 ]. Этот каскад вызовет лучший ангиогенез при формировании кровеносных сосудов в месте раны.
Мезенхимальные стволовые клетки (МСК) стали потенциальным источником клеток для клеточной терапии и тканевой инженерии, поскольку они обладают потенциалом множественной дифференцировки [27], [28], [29]. Хотя МСК широко используются в области исследования скелетных мышечных тканей (например, для генерации хондроцитов и остеобластов), они не используются для создания энтодермального клона [30]. Однако клинические подходы с участием МСК использовались в нескольких областях, включая ангиогенез [31].
При образовании комплексов с полимерными носителями катионные полимеры могут объединяться с отрицательно заряженной плазмидной ДНК (пДНК). Полиэтиленимин (PEI), типичный катионный полимер, был использован для трансфекции генов в соматические и стволовые клетки как in vitro, , так и in vivo [32]. Цитотоксичность, связанная с использованием PEI, может быть устранена путем образования наночастиц (НЧ) [33], [34], [35]. НЧ, покрытые PEI, могут легко доставлять гены в клетки как in vitro, , так и in vivo [35].
Целью данного исследования было изучение покрытых PEI НЧ поли (DL) -молочной и гликолевой кислоты (PLGA), инкапсулирующих апелиновый пептид (апелин-17) и несущих пДНК, кодирующую VEGF 165 . Поверхность PLGA NP, предварительно покрытых PEI, может быть образована комплексом с пДНК, кодирующей VEGF 165 , с образованием модифицированных MSCS человека (hMSC), которые дифференцировались в EC в модели ишемической задней конечности мыши. Более того, инкапсулированный пептид апелина усиливал ангиогенез модифицированных hMSC. Поглощение и экспрессия генов этих модифицированных hMSC были протестированы in vitro, и на модели животных.Процедуры исследования показаны на схеме 1.
Активная роль дисфункционального эндотелия сосудов в развитии фиброза и рака | Journal of Biomedical Science
Эндотелиальные клетки (ЭК) — это специализированные клетки, выстилающие как крупные, так и мелкие кровеносные сосуды по всему телу. Они играют важную роль в каскаде коагуляции, воспалении, поддержании кровяного давления и ангиогенезе. Наиболее узнаваемая функция эндотелия — поддерживать барьер между кровотоком и тканью, обеспечивая при этом ограниченный обмен клеточными и молекулярными материалами.Такая функция жизненно важна для его роли в доставке кислорода и питательных веществ во внутренние органы и в транспортировке метаболических отходов. При нарушении барьерной функции эндотелий способствует тромбозу и фибринолизу; то есть образование тромбов. Таким образом, образование новых кровеносных сосудов (неоангиогенез) имеет решающее значение во время развития эмбриональных органов, а также для восстановления тканей и заживления ран [1]. Неоангиогенез — это слаженный комплексный процесс, в результате которого формируются функциональные сосуды.Неконтролируемый чрезмерный ангиогенез способствует развитию воспалительных заболеваний, включая ревматоидный артрит (РА), псориаз, атопический дерматит и воспалительное заболевание кишечника (ВЗК), а также образованию опухолей [2]. Напротив, заболевания, связанные с фиброзом тканей, которые часто считают результатом хронического воспаления, сопровождаются потерей сосудистой сети. Поэтому важно учитывать, является ли сосудистая сеть пассивным ответчиком или играет важную эффекторную роль в воспалительных и фиброзных заболеваниях.
Фактически, накопленные данные указывают на то, что дисфункциональный или активированный эндотелий является причиной многих заболеваний, связанных с иммунной системой. Дисфункциональный эндотелий в широком смысле определяется как эндотелиальные клетки, демонстрирующие функциональные изменения, которые приводят к сдвигу от гомеостаза к провоспалительному ответу, снижению вазодилатации, а также пролиферативным и протромботическим свойствам. В следующих разделах мы обсудим патогенетические особенности этих заболеваний и участие эндотелия сосудов.Следует отметить, что лимфатический эндотелий, вероятно, также играет важную роль в воспалении, но здесь мы сосредоточимся на эндотелии сосудов, функция которого лучше выяснена. Затем мы обсудим реакцию эндотелиальных клеток во время хронического воспаления на клеточном и молекулярном уровнях и обсудим, имеют ли эти события отношение к образованию рака, который сейчас считается иммунным заболеванием.
Восстановление ран
Нормальный ответ организма на повреждение ткани, который лучше всего изучен на коже, включает быстрый приток воспалительных клеток, пролиферацию и миграцию эпителиальных клеток, рост фибробластов и популяций эндотелиальных клеток, образование грануляционной ткани с последующим отложение внеклеточного матрикса (ЕСМ), а на заключительной фазе ремоделирование матрикса и образование рубцов [3].Первоначальное повреждение ткани приводит к немедленной активации каскада свертывания, который посредством сборки фибринового сгустка обеспечивает гемостаз и обеспечивает основную матричную архитектуру для инициации инвазии и рекрутирования воспалительных и других клеток. В этом процессе образование новых кровеносных сосудов необходимо для правильного восстановления и включает в себя как прорастание капилляров из существующих сосудов, так и мобилизацию эндотелиальных клеток-предшественников костного мозга. При хорошо контролируемом заживлении ран воспаление быстро проходит, и клетки, которые способствуют восстановлению тканей, но больше не нужны, подвергаются апоптозу.Многие патологические состояния, такие как воспалительные и фиброзные заболевания, часто сравнивают с постоянным заживлением ран, при этом первое характеризуется не разрешающейся ранней фазой воспаления, а второе — фазой чрезмерной репарации. Анализ ткани хронической раны показал постоянную конкуренцию между воспалительными и противовоспалительными сигналами, ведущую к постоянно нестабильной микросреде, неблагоприятной для правильного заживления ран [4]. Было показано, что повышенная инфильтрация провоспалительных лейкоцитов, таких как нейтрофилы и макрофаги, способствует замедлению заживления хронических язв [5, 6] за счет секреции интерлейкина (ИЛ) -1β и фактора некроза опухоли-α (TNF-α) [7].
Необходимость неоангиогенеза при заживлении ран подтверждается наблюдениями, что патологические состояния, связанные с недостаточным ангиогенезом, такие как сахарный диабет или системный склероз (склеродермия или SSc), являются дефектными при заживлении ран с меньшей грануляцией тканей и неэффективным созреванием раны [8]. При нормальном заживлении ран после травмы уровни проангиогенных факторов, таких как VEGF-A, TGF-β и FGF2, увеличиваются, что совпадает с максимальным содержанием капилляров, а затем снижается до почти неопределяемых уровней во время заключительной фазы заживления ран.Таким образом, неоангиогенез при заживлении ран — это динамический процесс, который, по крайней мере, частично находится ниже по течению от тканевого воспаления, поскольку макрофаги, как было показано, являются основным индуктором ангиогенности [9, 10]. На последней стадии заживления раны новообразования подвергаются обрезке сосудов до тех пор, пока большинство вновь образованных сосудов не регрессируют до плотности сосудов, сравнимой с плотностью нормальной неповрежденной кожи. Этот процесс включает избирательный апоптоз многих новообразованных капилляров с последующим созреванием остальных, включая покрытие перицитами [11].Во время этого сложного процесса очевидно, что эндотелиальные клетки могут реагировать на многие сигнальные факторы и подвергаться физиологической трансформации, включая пролиферацию, изменение формы клеток, повышенную подвижность, измененную способность к адгезии, взаимодействие с лейкоцитами, гибель клеток и другие. Однако не все эти изменения можно отнести к категории разветвлений и прорастаний, которые обычно описывают как ангиогенный ответ. Основные механизмы, которые регулируют эти клеточные события, и их отношение к воспалению тканей будут обсуждаться в последних разделах.
Воспалительные заболевания
Хронические воспалительные заболевания, такие как РА, псориаз, ВЗК и некоторые другие, обычно связаны с чрезмерным ангиогенезом [12,13,14,15]. Несмотря на разную этиологию, все эти расстройства характеризуются стойкими травмами, ведущими к непрерывной ранней фазе процесса восстановления тканей и неконтролируемому воспалению. Причина стойкой травмы может быть результатом стойкой инфекции, постоянного физического повреждения или аутоиммунитета. Ниже РА используется как репрезентативное воспалительное заболевание для более подробного описания патогенных процессов, характеризующих эту группу заболеваний.
При РА, прототипическом иммуноопосредованном воспалительном заболевании, синовиальная оболочка является первичным местом повреждения [16]. Здоровая синовиальная оболочка состоит из выстилающего слоя, состоящего из фибробластоподобных синовиоцитов с вкраплениями макрофагоподобных синовиоцитов и сети сосудистых капилляров, встроенных в соединительную ткань, расположенную под ними. Остеокласты, клетки первичной резорбции кости, расположены в синовиальной оболочке на участках, прилегающих к кости [17]. Остеокласты вместе с остеобластами ответственны за ремоделирование кости во время физиологических процессов восстановления кости.
Триггеры заболевания в настоящее время четко не определены, но иммунологические нарушения, например, наличие антител к антицитруллинированному белку, предшествуют развитию RA [16]. Ранние стадии заболевания характеризуются повышенной пролиферацией клеток синовиальной оболочки, усилением ангиогенеза и инфильтрацией иммунных клеток. Ключевые цитокины, управляющие воспалительным процессом при РА, включают TNF-α, IL-1β, IL-6, IL-17 и GM-CSF [18]. Среди этих цитокинов TNF-α играет центральную роль в распространении воспаления суставов и разрушении костей.TNF-α стимулирует остеокластогенез и способствует выживанию остеокластов, ингибируя дифференцировку остеобластов. Активированные макрофаги и фибробласты являются основными продуцентами TNF-α, но другие типы клеток, включая Т- и В-клетки, остеобласты и остеокласты, являются дополнительным источником [19]. Активированные фибробласты также способствуют разрушению хряща, продуцируя чрезмерное количество ферментов, разрушающих матрикс, таких как MMP1, -3 и -13, а также катепсин K и L [19]. Помимо иммунных клеток, различные подгруппы фибробластов также выполняют различные иммунные и эффекторные функции костей, которые вносят вклад в различные характеристики заболевания при РА [20, 21].Роль фибробластов при RA была подробно рассмотрена в другом месте [22, 23] и не будет здесь рассматриваться.
Макрофаги составляют доминирующую популяцию иммунных клеток в воспаленном суставе и являются основным продуцентом воспалительных цитокинов, включая TNF-α, IL-6 и IL-1β. При РА макрофаги подвергаются метаболическому переключению с окислительного фосфорилирования на гликолиз, что приводит к активации провоспалительных факторов транскрипции, таких как HIF-1α, STAT3 и NF-kB, и увеличению продукции воспалительных цитокинов [24,25,26].Недавно был описан важный двусторонний перекрестный диалог между синовиальными фибробластами и макрофагами, вносящий вклад в патогенез заболевания [27]. Авторы использовали секвенирование одноклеточной РНК для характеристики макрофагов в синовиальной оболочке RA. Преобладающая подгруппа макрофагов, названная «кластер 1 HBEGF +», проявляет характеристики, отличные от классических фенотипов M1 / M2 с экспрессией NR4A3, PLAUR, CXCL2, HBEGF и эпирегулина (EREG). Уникальный фенотип этих макрофагов зависел от факторов, секретируемых фибробластами RA, в первую очередь простагландинов и TNF-α.В свою очередь, макрофаги HBEGF +, которые продуцируют лиганды рецептора EGF, HB-EGF и эпирегулин, индуцируют инвазивный фенотип в фибробластах.
Дисфункциональные эндотелиальные клетки наблюдались у пациентов с РА более десяти лет назад и были связаны с повышенным риском атеросклероза у этих пациентов [28,29,30]. Недавно Totoson et al. продемонстрировали, что активация эндотелия и восстановление гомеостатического эндотелия тесно связаны с прогрессированием и выздоровлением артрита в экспериментальном режиме на мышах; активация эндотелия опосредуется путем ЦОГ-2 и индуцируется воспалительными цитокинами, такими как TNF-α, IL-1β и MIP-1α [31].
Таким образом, во время воспалительного ответа при РА воспалительные цитокины, такие как TNFα, IL-1β и IL-6, по-видимому, играют решающую роль. Интересно, что рецепторы или корецепторы для этих цитокинов высоко экспрессируются в ЭК [32,33,34], что указывает на то, что воспалительный ответ также может быть индуцирован в ЭК.
Фиброзные расстройства
Патологический фиброз, определяемый как чрезмерное отложение коллагена и других белков внеклеточного матрикса, обычно характеризуется процессом дезадаптивного восстановления в ответ на повреждение ткани.Хотя молекулярный и клеточный механизм фиброза еще полностью не выяснен и может варьироваться в зависимости от триггера и анатомии пораженного органа, иммунные клетки, эндотелиальные или эпителиальные клетки и фибробласты / миофибробласты являются основными участниками этого процесса в различных органы. В целях этого обзора мы обсудим фиброзные расстройства, вызванные повреждением ЭК, например склеродермию.
При склеродермии (системный склероз, SSc) главным очагом повреждения является микрососудистая сеть.Разнообразные триггеры, участвующие в индукции повреждения ЭК, включают инфекцию, иммуноопосредованную цитотоксичность, антиэндотелиальные аутоантитела (AECAs) и ишемию-реперфузию [35]. Прогрессирующее структурное повреждение капилляров при отсутствии компенсаторного ангиогенеза и васкулогенеза приводит к системному разрежению микрососудов и гипоксии тканей. Хотя факторы, способствующие разрежению сосудов при склеродермии, полностью не изучены, одной из предполагаемых причин является дисбаланс между ангиогенными и ангиостатическими факторами [36].Например, хотя уровни ключевого ангиогенного фактора роста VEGF-A повышены в SSc, баланс между проангиогенным VEGF 165 и его антиангиогенным вариантом сплайсинга VEGF 165b смещен в сторону VEGF 165b [37]. Более того, CXCL4, один из самых мощных антиангиогенных хемокинов, сильно повышен при склеродермии [38]. Антиангиогенные эффекты CXCL4 опосредуются подавлением транскрипционного фактора Fli1. Fli1 и его близкий гомолог ERG считаются центральными регуляторами ангиогенеза, и экспрессия обоих факторов снижена в сосудистой сети SSc [39, 40].Другие медиаторы, повышенные в SSc и участвующие в подавлении Fli1, включают IFN-α и TGF-β [41, 42]. Лиганды Toll-подобных рецепторов индуцируют свой антиангиогенный ответ посредством опосредованного TGF-β и IFN-α ингибирования уровней Fli1 [42]. Fli1 и ERG также играют критическую роль в подавлении воспаления в ЭК, а их дефицит приводит к устойчивой продукции воспалительных цитокинов, включая IFN-β, IL-8, CXCL10, CX3CL1 и другие [40]. Более того, поврежденные эндотелиальные клетки экспрессируют повышенные уровни молекул адгезии, включая молекулу межклеточной адгезии-1 (ICAM-1), молекулу-1 адгезии зависимых от гликозилирования клеток (GLYCAM-1), молекулу адгезии сосудистых клеток-1 (VCAM-1), и E- и P-селектины (SELE и SELP) [35, 43], которые облегчают рекрутирование иммунных клеток (см. ниже).В свою очередь, проникающие иммунные клетки продуцируют цитокины, которые дополнительно усиливают воспалительный фенотип ЭК, включая членов семейства IL-6, таких как IL-6 и онкостатин M (OSM). Эти цитокины являются мощными индукторами других воспалительных цитокинов в ЭК через активацию пути передачи сигналов JAK / STAT3 (неопубликованные наблюдения).
Следовательно, при SSc ЭК являются первичным очагом воспаления, которое распространяет последующие проявления фиброза. При других фиброзных заболеваниях, таких как терминальная стадия заболевания почек и цирроз печени, начальные повреждения тканей могут происходить в паренхиме органа, которая обеспечивает начальную волну воспалительных цитокинов, но дисфункциональная сосудистая сеть является основным компонентом проявления заболевания.При заболевании почек поражение почек вызывает переход эндотелия из состояния покоя в активированное состояние, что приводит к каскаду путей, способствующих фиброзу [44, 45]. Эти клеточные изменения могут быть воспроизведены в экспериментальной системе, в которой эндотелиальные клетки коронарных артерий человека размножаются и обрабатываются рекомбинантным человеческим IL-1β [46]. Анализ транскриптома обработанных эндотелиальных клеток с помощью микроматрицы показывает активацию генов, ранее наблюдавшуюся в других фиброзных системах, включая COX-2, TNF-α, IL-6, IL-1β, MMP-1, GM-CSF, NF-kB, c- Rel, VCAM-1, ICAM-1, SELE и др.Среди них VCAM-1, ICAM-1 и SELE представляют собой молекулы адгезии лейкоцитов, которые способствуют захвату лейкоцитов и их экстравазации. Эти молекулы способствуют адгезии воспалительных клеток, таких как моноциты, нейтрофилы, лимфоциты и макрофаги, которые вносят вклад в дополнительные цитокины, факторы роста и матриксные металлопротеиназы (MMP). Экспрессия этих молекул адгезии и цитокинов предполагает, что активация ЭК играет неотъемлемую роль в нахождении макрофагов и других воспалительных клеток, способствуя воспалению тканей.Активированные ЭК могут также вызывать отслоение или активацию периваскулярных клеток, таких как перициты, которые могут переходить в миофибробласты, дополнительно способствуя фиброзу и дестабилизации сосудистой сети [47].
Роль дисфункциональных ECs в фиброзе
Как описано выше, ECs могут управлять тканевым ответом на повреждение посредством секреции провоспалительных и профибротических цитокинов [48, 49]. Кроме того, недавние исследования показывают, что ЭК могут также вносить вклад в периваскулярное ремоделирование ВКМ, переходя в мезенхимальные клетки в процессе эндотелиально-мезенхимального перехода (EndoMT).EndoMT был впервые обнаружен в развивающемся эмбрионе, у которого ECs в эндокарде подвергаются EndoMT для проникновения в сердечное желе и образования сердечных подушек [50,51,52]. Подобно эпителиально-мезенхимальному переходу (EMT), EndoMT может запускаться во взрослых тканях при определенных патологических состояниях, таких как воспаление, приводящее к образованию миофибробластов и способствующее фиброзу [53]. О присутствии EndoMT сообщалось на нескольких животных моделях индуцибельного фиброза [53], а также на коже и легких пациентов со склеродермией [54].Тем не менее, степень вклада EndoMT в патогенез фибропролиферативных заболеваний человека остается спорной. TGF-β считается основным индуктором EndoMT, но также сообщалось об участии других агонистов. Например, во время инфаркта миокарда было показано, что активация пути Wnt / β-catenin индуцирует переход ECs в α-SMA-положительные клетки [55]. Путь Wnt / β-catenin также участвует в индукции EndoMT фрагментами комплемента C3a / C5a в модели диабетической болезни почек [56].В ряде исследований обращалось внимание на воспалительные цитокины, которые могут быть индукторами EndoMT. Например, кратковременное воздействие на эндотелиальные клетки клапана IL-1β или TNF-α индуцировало временный EndoMT, тогда как более длительное воздействие индуцировало постоянную трансформацию в миофибробласты [57]. Сходным образом, IL-1β в значительной степени усиливал TGF-β-индуцированный EndoMT в HUVECs [58]. В эндотелиальных клетках сердечных клапанов TNF-α или IL-6-индуцированный EndoMT опосредован активацией путей Akt и NFκB [59]. TGF-β способствует EndoMT посредством сложного механизма, который включает как Smad-зависимые, так и Smad-независимые пути [60].Примечательно, что Jimenez с коллегами показали, что c-Abl и PKCδ опосредуют EndoMT в легочных ЭК мыши [61]. Этот путь передачи сигналов профиброза, как известно, подавляет фактор транскрипции Fli1 в дермальных фибробластах и ЭК [62, 63]. Недавние исследования показали, что комбинированный нокдаун ERG и Fli1 в HUVEC индуцировал EndoMT [40, 64]. Интересно, что авторы последнего исследования также обнаружили подавление эндотелиальной ERG и Fli1 в строме опухоли, вероятно, вызванное факторами, секретируемыми опухолью.
Таким образом, при некоторых фиброзных заболеваниях, таких как SSc, EC являются первичным местом повреждения и могут вызывать последующие воспалительные реакции. В других случаях воспалительные цитокины могут действовать на ЭК, а ЭК, в свою очередь, отвечают, секретируя дополнительные цитокины и экспрессируя молекулы адгезии, которые дополнительно привлекают иммунные клетки. Кроме того, они также могут трансформироваться в мезенхимальные клетки и модифицировать ECM, что в конечном итоге приводит к фиброзу.
Противоположные воспалительные реакции при воспалительном заболевании и фиброзном заболевании, опосредованном дисфункциональными ЭК, суммированы на рис.1.
Рис. 1
Предлагаемая взаимосвязь между активированными сосудистыми сетями, обнаруженными в поврежденной ткани, воспалительным заболеванием, фиброзным заболеванием и раком. Поврежденная ткань активирует эндотелий, который претерпевает воспалительные реакции и структурные изменения, включая пролиферацию, потерю перицитов, уменьшение компонентов соединения и повышенную адгезию иммунных клеток, что способствует неоангиогенезу (показан в виде отростка) и экстравазации. При нормальном заживлении ран неоангиогенез, вызванный воспалением, в конечном итоге прекращается, сосуд подвергается обрезке, а ткань возвращается к гомеостазу.При хронических воспалительных состояниях либо повреждение не разрешается, что приводит к продолжающемуся ангиогенезу и хроническому воспалительному заболеванию, либо эндотелий подвергается разрежению и EndoMT, что приводит к чрезмерному восстановлению и фиброзному заболеванию. Раковая сосудистая сеть, хотя и считается результатом хронического воспаления, проявляет характеристики, обнаруживаемые как при воспалительном заболевании, так и при фиброзе
Активация сосудов и онкогенез
Агрессивный рост популяции неопластических клеток может привести к гипоксическим очагам и сверхэкспрессии проангиогенных факторов, которые приводят к развитию неорганизованных сетей кровеносных сосудов, которые функционально и структурно отличаются от нормальной сосудистой сети.Они извилистые, непроницаемые и пролиферирующие [65,66,67]. Существенная роль неоангиогенеза в прогрессировании опухоли побудила к разработке антиангиогенных целевых терапевтических средств, которые остаются наиболее важными средствами лечения первой линии многих видов рака, таких как почечно-клеточная карцинома. Однако эти методы лечения показали смешанные результаты с первоначальным снижением опухолевой нагрузки, но часто без улучшения долгосрочной выживаемости пациентов и в худшем случае, приводящем к увеличению метастазов [68, 69].
Некоторые из этих неудовлетворительных результатов объясняются парадоксальным успехом лечения: уменьшение сосудистой сети в собственно опухоли также препятствует доставке лекарств к поражению и может снизить инфильтрацию противоопухолевых иммунных клеток. В других случаях антиангиогенная терапия может вызвать ответ лекарственной устойчивости, такой как снижение экспрессии рецептора VEGF (см. Ниже). Поэтому необходимо лучшее понимание сосудистой сети, связанной с опухолью. Недавно была предложена более сложная роль сосудистой сети опухоли.Поскольку иммунитет хозяина может быть как анти-, так и про-онкогенным, сосудистая сеть как главный игрок в воспалении тканей потенциально также может участвовать в дихотомии модуляции онкогенности. Хотя причинная связь между воспалением и раком хорошо известна [70, 71], окончательные данные о том, играет ли активированная воспалением сосудистая сеть какую-либо роль в прогрессировании рака, все еще отсутствуют. Здесь мы рассматриваем текущие знания о сосудистой сети, активируемой воспалением, и обсуждаем, как это может влиять на прогрессирование опухоли.
Связь опухоли с воспалением была предложена в середине девятнадцатого века Рудольфом Вирховым, и эта концепция была вновь введена Х. Ф. Дворжаком более века спустя [72]. С тех пор накопленные данные действительно указывают на причастность воспаления к развитию различных видов рака [73, 74]. В частности, развитие почечно-клеточной карциномы (ПКР) недавно было связано с воспалением тканей [75,76,77,78]. Появляются новые данные, которые рассматривают хроническое заболевание почек (ХБП) и карциному почек как взаимосвязанные: 26–44% случаев ПКР имеют сопутствующую ХБП средней или более высокой степени на момент постановки диагноза.В одном крупномасштабном исследовании с участием более одного миллиона человек ухудшение функции почек у пациентов с ХБП значительно коррелирует с повышенным риском развития ПКР [79]. Кроме того, пациенты, страдающие раком почек, более предрасположены к ХБП, чем население в целом [80]. Следовательно, противовоспалительная терапия также может работать при ПКР.
Сигнальный путь
Как обсуждалось выше, во время воспаления и заживления ран начальные волны провоспалительных цитокинов стимулируют эндотелиальные клетки, чтобы активировать молекулы адгезии и цитокины, которые вместе привлекают дополнительные иммунные клетки и опосредуют их захват и экстравазацию из кровеносных сосудов в поврежденную ткань.TNF-α является основным медиатором воспаления в микроокружении опухоли во время раннего туморогенеза [81], контролируя каскад цитокинов, хемокинов, молекул адгезии и проангиогенную активность [81, 82]. Роль передачи сигналов TNF-α в прогрессировании опухоли была продемонстрирована путем сравнения роста ксенотрансплантата мышиной меланомы B16-F1 у мышей дикого типа (WT) и мышей с делециями зародышевой линии обоих рецепторов TNF-α (TNFR 1 и 2) [82 ]. Рост опухоли B16-F1 был более чем в два раза медленнее при нокауте TNFR, чем при опухоли дикого типа.Профилирование генов, проведенное на эндотелиальных клетках, выделенных из опухолей B16-F1, показало, что большинство обогащенных генов ЭК из стромы дикого типа участвует в иммунном ответе. Анализ путей показал, что они регулируются передачей сигналов TNF-α, опосредованной NF-κB и интерферонами.
Наиболее хорошо изученное действие TNF-α, происходящего из злокачественных клеток, относится к эндотелиальным клеткам сосудов. Franses et al. показал, что TNF-α вместе с ангиогенными факторами VEGF и FGF2 может вызывать дисфункциональный фенотип эндотелиальных клеток, включая повышенную пролиферацию, проницаемость монослоя и адгезию моноцитов [83].Эти эндотелиальные клетки также демонстрируют значительное увеличение ядерной локализации NF-κB-p65 и pSTAT3, что указывает на устойчивое провоспалительное состояние. Воспалительный фенотип также был подтвержден в общем паттерне экспрессии генов, включая повышающую регуляцию GM-CSF, IL-8, IL-6 и SELE, в то время как экспрессия способствующих покою, противовоспалительных генов, таких как eNOS, VE- кадгерин, а Ang1 уменьшился. Одновременно повышалась экспрессия молекул адгезии лейкоцитов VCAM-1 и ICAM-1.
Было показано, что помимо TNF-α, другие цитокины, такие как IL-1β, IL-6 и IL-17, также вызывают активацию сосудов [84]. Важно отметить, что IL-1β, IL-6 и TNF-α постоянно проявляют избыточную экспрессию в клинических образцах светлоклеточного ПКР (ccRCC) и на моделях животных [85,86,87,88,89]. Следовательно, раковые клетки в целом и клетки ccRCC, в частности, могут продуцировать цитокины, которые вызывают активацию сосудов.
Передача сигналов TNF-α опосредуется активацией NF-κB и N-концевой киназы c-Jun (JNK).Связывание лиганда TNF с рецептором вызывает диссоциацию ингибирующего белка SODD от внутриклеточного домена гибели с последующим связыванием адаптерного белка TRADD, который служит платформой для рекрутирования другого белка TRAF2. TRAF2 затем связывается с киназами, такими как IKK, ASK и MEKK1, что приводит к активации киназы NF-κB, JNK и p38 MAP. Активированные NF-κB и JNK являются двумя основными индукторами генов воспалительного ответа.
Каноническая передача сигналов IL-6 включает связывание лиганда с рецепторным комплексом цитокинов I типа, состоящим из цепи IL-6Rα и передающего сигнал компонента gp130 [90].Gp130 также является обычным преобразователем сигнала для нескольких цитокинов семейства IL-6, включая фактор ингибирования лейкемии (LIF), цилиарный нейротропный фактор, онкостатин M, IL-11 и кардиотропин-1. Связывание IL-6 запускает димеризацию gp130 и IL-6R, активируя рецептор. Активированный комплекс IL-6R-gp130 инициирует каскад передачи сигнала через активацию киназ Януса (JAK) и сигнальных преобразователей и активаторов транскрипции (STAT) факторов транскрипции [91]. Активированные JAK фосфорилируют себя и рецептор.Фосфорилированные сайты на рецепторе и JAK служат в качестве стыковочных сайтов для Sh3-содержащих STAT, таких как STAT3, и для других Sh3-содержащих белков и адаптеров, которые связывают рецептор с киназой MAP, PI3K / Akt и другими клеточными путями.
Gp130 повсеместно экспрессируется в большинстве тканей. Напротив, экспрессия IL-6Rα более ограничена. Например, ЭК не экспрессируют мембраносвязанный рецептор IL-6; вместо этого, передача сигналов IL-6 в ECs требует механизма, называемого транс-сигнализацией [92,93,94].Растворимая форма IL-6R (sIL-6R), содержащая внеклеточную часть рецептора, может связывать IL-6 со сродством, аналогичным связывающемуся с мембраной IL-6R. Комплекс IL-6 и sIL-6R может затем связываться с gp130 на EC и инициировать передачу сигналов. Одним из важных поставщиков sIL-6R являются нейтрофилы во время начальной фазы иммунного ответа [95]. Активированные CD4 Т-клетки также являются потенциальным продуцентом sIL-6R [96]. Пока не ясно, какие типы клеток продуцируют sIL-6R в контексте активации сосудов при раке.
Другой воспалительный цитокин Онкостатин М (OSM) был признан важным активатором ЭК [97, 98]. OSM является членом семейства цитокинов, связанных с IL-6, которые имеют общие рецепторные компоненты [99]. Предполагается, что эндотелиальные клетки, вероятно, являются основной мишенью OSM in vivo, поскольку эндотелиальные клетки экспрессируют самые высокие уровни рецепторов OSM (в 10-20 раз выше) по сравнению со всеми другими типами клеток. Уровень рецепторов OSM также намного выше, чем у рецепторов TNF-α на ЭК [100, 101].Анализ набора данных Атласа генома рака (TCGA) показывает, что OSMR сильно экспрессируется при многих раковых заболеваниях, включая рак почек, груди, легких и печени, и связан с уменьшением выживаемости (https://www.proteinatlas.org/ ENSG00000145623-OSMR / патология).
OSM может продуцироваться стимулированными Т-клетками, моноцитами и катящимися нейтрофилами [102, 103]. Эффекты OSM на EC предполагают провоспалительную роль OSM; например, стимуляция культивируемых эндотелиальных клеток HUVEC с помощью OSM человека приводит к длительной активации P-селектина [104], что способствует адгезии и скатыванию лейкоцитов.OSM также способствует продукции IL-6 из этих клеток [102]. Интересно, что как SELE, так и SELP могут способствовать метастазированию клеток рака толстой кишки [105].
Маркеры сосудистой сети, активированной воспалением
Активированные ЭК в воспаленной ткани экспрессируют и секретируют спектр воспалительных цитокинов и хемокинов, которые дополнительно усиливают воспалительное микроокружение [82]. В одном исследовании MCP-1, IL-6, GRO, IL-8, RANTES и GM-CSF были идентифицированы в кондиционированной среде эндотелиальных клеток (HUVEC), индуцированных TNF-α и ангиогенными факторами [83].Wang et al. также обнаружили, что в модели глиобластомы мышей ECs являются основным источником IL-6, который индуцирует поляризацию макрофагов M1-M2 [106]. Важно отметить, что эти активированные ЭК также демонстрируют различные клеточные фенотипы, которые способствуют воспалению ткани, включая увеличение экспрессии молекул адгезии, таких как селектины, VCAM-1 и ICAM-1, как описано выше. Эти ЭК также демонстрируют пониженную экспрессию VE-кадгерина и CD31, что способствует экстравазации катящихся лейкоцитов [83, 107, 108].Важно отметить, что эти молекулярные и клеточные особенности, вероятно, также могут способствовать распространению и метастазированию раковых клеток.
В поддержку идеи, что активированная воспалением или дисфункциональная сосудистая сеть возникает при прогрессировании рака, циркулирующие уровни IL-6 и TNF-α коррелировали с риском развития рака и с увеличением смертности от рака среди пожилых людей [109]. Кроме того, активированные маркеры EC SELE, ICAM-1 и VCAM-1 коррелировали со снижением выживаемости ccRCC (Human Protein Atlas).
Потенциальная роль дисфункциональной сосудистой сети в прогрессировании опухоли
Неотъемлемой технической проблемой изучения микросреды опухоли является ограниченный выбор моделей на животных. Традиционная модель ксенотрансплантата с использованием мышей с ослабленным иммунитетом неадекватна для изучения влияния иммунных компонентов на прогрессирование рака. Таким образом, в большинстве исследований связанной с опухолью, вызванной воспалением дисфункциональной сосудистой сети использовались модели конгенных мышей или манипулируемые эндотелиальные клетки вместе с раковыми клетками человека в одном ксенотрансплантате.У человека оценивали онкогенез в контексте соответствующих сосудистых заболеваний.
В исследовании Pitroda et al. Клетки злокачественного рака толстой кишки человека были заделаны кондиционированной средой из TNF-α и IFN-обработанных или необработанных HUVEC и ксенотрансплантированы бестимусным мышам. Активированные кондиционированные среды HUVEC способствовали росту опухоли в 2,3 раза быстрее, чем контрольные HUVEC [82].
Взаимосвязь между ЭК и опухолью на самом деле сложна. Было показано, что неповрежденная или здоровая сосудистая сеть ингибирует пролиферацию раковых клеток, инвазивность и реакцию на медиаторы воспаления in vitro, а также рост опухоли и метастазирование in vivo.Такая регуляторная цепь опосредуется паракринными действиями, исходящими от ECs, что указывает на активную роль этих здоровых ECs [110]. Интересно, что эти авторы впоследствии показали, что пролиферация и инвазия раковых клеток in vitro также может ингибироваться дисфункциональными ECs (активируемыми TNF-α, VEGFA и FGF2) в большей степени, чем покоящимися ECs [83]. Кроме того, с использованием модели имплантации-резекции-метастазирования конгенной карциномы легкого Льюиса (LLC) было продемонстрировано, что покоящиеся и дисфункциональные ЭК, внедренные в матрикс, могут подавлять рост соседней внедренной первичной опухоли; тогда как только дисфункциональные ЭК могут стимулировать спонтанные метастазы [83].
Приведенные выше данные подняли вопрос о том, связано ли известное заболевание системного воспаления сосудов, васкулит [111, 112], с более высоким риском злокачественных новообразований. Осложняющим фактором таких исследований является то, что потенциальная связь между васкулитом и раком может быть результатом основного аутоиммунного расстройства и методов лечения (часто цитотоксических) против таких аномалий, или может быть просто из-за более интенсивного режима обследования, применяемого к этим пациентам. [113]. Однако накопленные данные указывают на такую ассоциацию коморбидности.В 10-летнем (1992–2002) французском ретроспективном исследовании у 60 (возраст 22–89) из 557 пациентов с васкулитом (> 10%) одновременно были диагностированы злокачественные новообразования (за исключением злокачественных новообразований, вторичных после терапии васкулита), по сравнению с заболеваемостью раком. французского населения в целом в 2000 г. (0,5–0,6%) [114]. Среди этих 60 пациентов у 22 (36,7%) развились васкулиты и злокачественные новообразования в течение 1 года.
И наоборот, васкулит как проявление злокачественного новообразования. Наиболее частым васкулитным проявлением злокачественной опухоли является кожный васкулит, например лейкоцитокластический васкулит.В обзоре 2800 пациентов с васкулитом в течение 18,5 лет, проведенном в одном учреждении, у 12 пациентов (0,4%) был диагностирован васкулит и рак в течение 1 года [115]. Наиболее частым васкулитом, связанным с раком, был лейкоцитокластический васкулит (7 из 12 случаев), который системно проявлялся на коже. Важно отметить, что 8 из 10 случаев с периодом наблюдения> 2 месяцев показали соответствие ответа на лечение как при раке, так и при васкулите, включая несколько случаев лейкоцитокластического васкулита, обычно чувствительного к стероидам, которые не реагировали на преднизон, пока не было начато лечение основного рака. .Такое клиническое совпадение поддерживает идею о взаимосвязи этих двух заболеваний. Клиническое соответствие также было зарегистрировано в другом исследовании [116], в котором наблюдались 15 пациентов с васкулитом и сопутствующими солидными опухолями (в течение 1 года). В 13 из этих 15 случаев васкулит прошел после лечения рака.
Неудивительно, что гематологические раковые заболевания, такие как лимфомы и лейкемии, являются наиболее частыми злокачественными новообразованиями, связанными с лейкоцитокластическим васкулитом. Тем не менее, органоспецифическая ассоциация, например, почечного васкулита и почечно-клеточной карциномы, также наблюдалась в различных отчетах [117, 118], а также частота лейкоцитокластического васкулита, который разрешился после лечения ПКР [119] .
Таким образом, васкулит, по-видимому, связан со злокачественными новообразованиями, хотя такая корреляция требует дополнительных клинических доказательств и механистического объяснения.
EndoMT — играет ли он роль в онкогенезе?
EndoMT был продемонстрирован при заживлении ран [120], атеросклерозе [121], легочной артериальной гипертензии (ЛАГ) [122], сердечном и почечном фиброзе [53, 120, 123], склеродермии [124] и прогрессировании рака [125] ]. Совсем недавно Xiao et al. показали, что субпопуляция опухолевых эндотелиальных клеток из спонтанной опухоли молочной железы мышей может подвергаться EndoMT после лечения TGF-β, тогда как нормальные ECs молочной железы не могут, предполагая, что связанные с опухолью ECs могут быть по своей природе чувствительны к индукции мезенхимального перехода [126].В модели глиобластомы мыши связанные с опухолью ЭК могут быть индуцированы к прохождению EndoMT с помощью среды, кондиционированной клетками глиобластомы человека, или PDGF-AB, что сопровождается сниженной экспрессией VEGFR2 [127]. Авторы утверждали, что эти трансформированные ЭК могут объяснять устойчивость к терапии анти-VEGF.
Тем не менее, патологическая роль EMT и EndoMT остается спорной. Одна из основных причин — сложность демонстрации этого события in vivo [123, 124]. Большие усилия были предприняты в моделях животных с использованием генетических манипуляций и отслеживания происхождения.Однако результаты были противоречивыми. Например, что касается источника миофибробластов при фиброзе почек, эпителиальные клетки канальцев, перициты, эндотелиальные клетки, резидентные фибробласты и клетки, происходящие из костного мозга, были определены в различных исследованиях в качестве источника либо исключительно, либо с различным процентным вкладом [123] . Методы выбора маркера и окрашивания, вероятно, способствуют несогласованности. Например, линия, управляемая Tie-2, может включать моноциты, а не исключительно эндотелиальные клетки, в то время как линия, управляемая PDGFR, может включать эндотелиальные клетки, а не только перициты.Что касается EndoMT, одним из важных критериев является потеря маркеров эндотелиальных клеток, таких как CD31 и VE-кадгерин. Но без таких маркеров было бы трудно подтвердить двойные характеристики мезенхимальных и эндотелиальных клеток вне эндотелия. Это особенно проблематично в клинических образцах человека, где невозможно отследить происхождение.
Таким образом, недавно отмеченный феномен частичного EndoMT представляет собой альтернативу, которую легче проверить [128, 129]. То есть во время ангиогенных и / или воспалительных реакций ЭК сохраняют межклеточные соединительные молекулы, такие как CD31 и VE-кадгерин, при экспрессии многих мезенхимальных продуцентов, таких как виментин или α-актин гладких мышц.Такое состояние действительно можно наблюдать на концах прорастающих капилляров, в которых концевые клетки остаются прикрепленными к эндотелию, демонстрируя при этом способность к подвижности и разрушению матрикса. Было бы интересно оценить, является ли частичный EndoMT исключительно результатом неоангиогенеза или может быть частично вызван воспалительными сигналами.
Сосудистая сеть опухоли: неоангиогенез в сравнении с активацией сосудов, вызванной воспалением
Хорошо известно, что дисфункциональная сосудистая сеть является важным компонентом фиброза тканей.Если также принять представление о том, что активация сосудов, вызванная воспалением, является частью туморогенеза, было бы важно согласовать очевидные сосудистые фенотипы при фиброзе и опухоли. При фиброзе сосудистая сеть характеризуется, по крайней мере, в болезненном состоянии, разрежением, что означает потерю сосудистой сети; тогда как в опухоли наблюдаемым фенотипом является неоангиогенез. Действительно, было показано, что активированная воспалением сосудистая сеть не является пролиферативной. Как же тогда связанная с опухолью сосудистая сеть может быть одновременно пролиферативной и ответной на воспаление? Есть несколько возможностей:
Во-первых, неоангиогенные и воспаленные ЭК могут сосуществовать в разных областях (например,g., гипоксический против нормоксического) микроокружения опухоли. Это может объяснить тот факт, что воспаленная сосудистая сеть не является пролиферативной.
Во-вторых, два типа сосудистой сети опухоли могут появляться последовательно во время прогрессирования рака; то есть возможно, что ангиогенез, индуцированный опухолью, происходит раньше, а воспаление инициируется позже для отсечения сосудов, связанных с опухолью, и облегчения метастазирования. Сообщение о том, что воспаленные ЭК подавляют рост первичной опухоли, но способствуют метастазированию, подтверждает это мнение [110].Однако возможна и обратная временная последовательность, поскольку при заживлении ран воспаление обычно предшествует пролиферации (противоинфекция с последующим заживлением ран) [130]. Интересно, что в модели перитонеального воспаления IL-6 вместе с sIL-6R обработкой мезотелиальных клеток брюшины может индуцировать экспрессию VEGF и способствовать ангиогенезу [131].
В-третьих, сосуды, индуцированные опухолью, по своей сути отличаются от сосудов, активируемых воспалением; первый может быть пролиферативным и воспалительным.В отчете, который показал, что активированные HUVECs могут стимулировать злокачественные новообразования, HUVEC фактически требовали стимуляции как TNF-α, так и ангиогенных факторов, таких как VEGF и FGF2 [83]. Фактически, неоангиогенные ECs и воспаленные ECs обладают, по крайней мере, одними и теми же характеристиками пониженной экспрессии компонентов межклеточного соединения. Это также может объяснить частичный фенотип EndoMT и может объединить потребность как в неоангиогенезе, так и в сосудистой сети, активируемой воспалением, при прогрессировании рака.
Ангиогенез в нормальной и патологической коре надпочечников человека | Журнал клинической эндокринологии и метаболизма
Аннотация
Был исследован ангиогенный фенотип 13 нормальных аденом надпочечников (N), 13 аденом, продуцирующих альдостерон (APA), 12 аденом, продуцирующих кортизол (CPA), 13 нефункционирующих аденом коры надпочечников (NFA) и 13 карцином коры надпочечников (CA). .Внутриопухолевую плотность сосудов исследовали с помощью CD34, маркера эндотелиальных клеток, а ангиогенный статус исследовали по экспрессии фактора роста эндотелия сосудов (VEGF), важного ангиогенного фактора, экспрессируемого опухолевыми клетками. Плотность сосудов, определяемая количественно как количество сосудов на квадратный миллиметр, была значительно ниже ( P <0,0001) у CA (110,3 ± 27,8), чем у N (336,6 ± 14,5), APA (322,8 ± 19,1), CPA ( 288,5 ± 14,3) и NFA (274,2 ± 19,8). Экспрессия VEGF, рассчитанная как процент положительных клеток, была значительно выше ( P <0.0001) в CA (85,3 ± 2,1), чем в APA (56,5 ± 7,5), CPA (38,5 ± 7,0), N (33,1 ± 6,1) и NFA (0,76 ± 0,6). В APA была обнаружена отрицательная связь между CD34 и активностью ренина плазмы ( P <0,0002) и положительная связь между CD34 и уровнями альдостерона ( P <0,05).
В заключение, ангиогенный фенотип СА характеризуется сверхэкспрессией VEGF, но низкой васкуляризацией, это открытие указывает на диссоциацию между ангиогенным потенциалом и неоангиогенными возможностями этих опухолей.Отсутствие экспрессии VEGF в NFA и тесная связь между ангиогенезом и функциональным статусом в APA также предполагают возможное влияние ангиогенного фенотипа на гормональную секрецию этих эндокринных опухолей.
НЕСКОЛЬКО ЭКСПЕРИМЕНТАЛЬНЫХ И клинических исследований показывают, что рост рака и его метастатическое распространение тесно связаны с ангиогенезом (1–3). Соответственно, о значительной взаимосвязи между агрессивностью опухоли и ангиогенезом сообщалось (4-7) при различных формах рака человека.Эта ассоциация вытекает из исследований, в которых оценивали ангиогенный фенотип опухоли, включая плотность сосудов (VD) и экспрессию ангиогенных факторов. Для количественной оценки васкуляризации использовались маркеры эндотелиальных клеток, такие как фактор VIII, CD31 и недавно CD34 (8–11). Для изучения ангиогенного статуса опухолей был оценен уровень экспрессии фактора роста эндотелия сосудов (VEGF) (12-15), важного ангиогенного соединения (12, 16). Однако истинное влияние ангиогенеза на агрессивность опухоли известно лишь частично.Действительно, описанная выше взаимосвязь не является правилом для всех злокачественных опухолей (17), в соответствии с тем фактом, что образование новых сосудов из существующей сосудистой сети является только одним из аспектов метастатической силы и роста рака (8 ).
Другой проблемой является влияние ангиогенеза на функциональную активность эндокринных опухолей. Вполне вероятно, что эндокринным органам требуется адекватная сосудистая сеть для облегчения доступа продуктов гормона в кровоток. Таким образом, другой ангиогенный паттерн может также обусловливать секреторный статус некоторых эндокринных опухолей.
Опухоли, возникающие из коры надпочечников человека, представляют собой группу поражений, неоднородных как по биологическому поведению (доброкачественные или злокачественные), так и по функциональному статусу (гиперсекреторные или гормонально неактивные). На сегодняшний день эти опухоли не получили адекватных исследований в том, что касается ангиогенеза, так что ангиогенный фенотип этих поражений все еще неизвестен. Немногочисленные данные, представленные в литературе, не подтверждают связь между васкуляризацией и злокачественными новообразованиями, поскольку адренокортикальные карциномы, по-видимому, не показывают увеличения ВД (18), несмотря на их хорошо известные инвазивные и метастатические возможности (19, 20).Кроме того, эти данные (18) показывают, что в кортикальных аденомах ВД также не усиливается и нет разницы в васкуляризации между нефункционирующими и функционирующими (альдостерон и кортизол) аденомами.
Здесь мы оценили с помощью иммуногистохимии ангиогенный фенотип нормальной и патологической коры надпочечников человека, включая функционирующие и нефункционирующие аденомы и карциномы. CD34 использовали для исследования ВД, а VEGF использовали для исследования ангиогенного статуса этих новообразований.
Пациенты и методы
Пациенты и патология
В исследовании, одобренном местным этическим комитетом, участвовали 64 пациента с нефункционирующими корковыми аденомами (NFA; n = 13), аденомами, продуцирующими альдостерон (APA; n = 13), аденомами, продуцирующими кортизол (CPA; n = 12), и карциномы коры надпочечников (CA; n = 13). Случайно были обнаружены NFA, и эндокринологическое исследование показало нормальные катехоламины, глюкокортикоиды, андрогены и минеральные кортикоиды во всех случаях.У пациентов с АПА наблюдались типичные признаки гиперальдостеронизма с артериальной гипертензией (систолическое артериальное давление 174 ± 7,0 мм рт. Ст., Среднее значение ± стандартная ошибка; диастолическое артериальное давление 107 ± 3,5 мм рт. уровень активности (PRA) (0,050 ± 0,016 нг / л) и высокий уровень альдостерона в плазме (1298,23 ± 171,98 пмоль / л). У пациентов с синдромом Кушинга наблюдались стигматы болезни и гормональная картина, характеризующаяся повышением уровня кортизола в плазме (894,2 ± 40,5 нмоль / л) и снижением уровня АКТГ (1.87 ± 0,09 пмоль / литр). Кроме того, все пациенты не ответили на тесты подавления дексаметазона низким (1 мг) и высоким (8 мг). Пациенты с СА были исследованы на предмет боли в животе в 10 случаях и на гирсутизм в 3 случаях; последний показал высокий уровень андрогенов с нормальным уровнем кортизола, но 2 пациента не ответили на введение дексаметазона (1 мг). В качестве контроля изучались 13 нормальных надпочечников (N) после удаления у пациентов с карциномами почек. Клинические данные о нашей популяции представлены в таблице 1.
Таблица 1.
Клинические данные здоровых субъектов (N) и пациентов с APA, CPA, NFA и CA
| . | N . | APA . | CPA . | NFA . | CA . |
|---|---|---|---|---|---|
| Возраст (диапазон) (лет) | 59,8 ± 3,0 (38–70) | 47,4 ± 2,6 b (27–59) | 51.2 ± 3,1 a (32–56) | 49,9 ± 2,9 a (30–72) | 54,4 ± 5,2 (19–77) |
| Мужчина / женщина | 9/4 | 8 / 5 | 4/8 | 6/7 | 8/5 |
| Сторона (правая / левая) | 4/9 | 7/5 | 6/7 | 7/6 | |
| Размер опухоли (диапазон) (мм) | 20,0 ± 2,2 (5–30) | 38,0 ± 1,8 c (26–56) | 41.1 ± 3,2 в (25–60) | 121,7 ± 15,9 в г (60–250) |
| . | N . | APA . | CPA . | NFA . | CA . |
|---|---|---|---|---|---|
| Возраст (диапазон) (лет) | 59,8 ± 3,0 (38–70) | 47,4 ± 2,6 b (27–59) | 51.2 ± 3,1 a (32–56) | 49,9 ± 2,9 a (30–72) | 54,4 ± 5,2 (19–77) |
| Мужчина / женщина | 9/4 | 8 / 5 | 4/8 | 6/7 | 8/5 |
| Сторона (правая / левая) | 4/9 | 7/5 | 6/7 | 7/6 | |
| Размер опухоли (диапазон) (мм) | 20,0 ± 2,2 (5–30) | 38,0 ± 1,8 c (26–56) | 41.1 ± 3,2 c (25–60) | 121,7 ± 15,9 c d (60–250) |
Таблица 1.
Клинические данные здоровых субъектов (N) и пациентов с APA, CPA , NFA и CA
| . | N . | APA . | CPA . | NFA . | CA . |
|---|---|---|---|---|---|
| Возраст (диапазон) (лет) | 59.8 ± 3,0 (38–70) | 47,4 ± 2,6 б (27–59) | 51,2 ± 3,1 а (32–56) | 49,9 ± 2,9 а (30–72) | 54,4 ± 5,2 (19–77) |
| Мужчина / женщина | 9/4 | 8/5 | 4/8 | 6/7 | 8/5 |
| Сторона (правая / левая) | 4/9 | 7/5 | 6/7 | 7/6 | |
| Размер опухоли (диапазон) (мм) | 20.0 ± 2,2 (5–30) | 38,0 ± 1,8 c (26–56) | 41,1 ± 3,2 c (25–60) | 121,7 ± 15,9 c d (60–250) |
| . | N . | APA . | CPA . | NFA . | CA . |
|---|---|---|---|---|---|
| Возраст (диапазон) (лет) | 59.8 ± 3,0 (38–70) | 47,4 ± 2,6 б (27–59) | 51,2 ± 3,1 а (32–56) | 49,9 ± 2,9 а (30–72) | 54,4 ± 5,2 (19–77) |
| Мужчина / женщина | 9/4 | 8/5 | 4/8 | 6/7 | 8/5 |
| Сторона (правая / левая) | 4/9 | 7/5 | 6/7 | 7/6 | |
| Размер опухоли (диапазон) (мм) | 20.0 ± 2,2 (5–30) | 38,0 ± 1,8 c (26–56) | 41,1 ± 3,2 c (25–60) | 121,7 ± 15,9 c d (60–250) |
Образцы
Всего было исследовано 64 фиксированных формалином, залитых парафином блока ткани надпочечников. Чтобы избежать возможных расхождений в результатах, с образцами обращались и обрабатывали таким же образом до фиксации формалином. Пятимикронные срезы окрашивали гематоксилин-эозином для гистологической оценки.Дополнительные срезы размером 5 мкм использовали для иммуногистохимии.
Иммуногистохимия
Антитела.
Срезы инкубировали со следующими первичными антителами: 1) мышиные антитела против человеческого CD34 (QB-END10, DAKO Corp., Милан, Италия; разведение 1: 100) и 2) кроличьи антитела против человеческого VEGF (Oncogen Research Products, Кембридж, Массачусетс); разведение 1: 100). Для обоих время инкубации составляло 12 ч при 4 ° С.
Метод.
Срезы размером 5 микрометров депарафинизировали в ксилоле и регидратировали в спиртах.Эндогенную пероксидную активность блокировали инкубированием слайдов в 1% перекиси водорода в метаноле в течение 10 мин. Чтобы демаскировать антигены, предметные стекла обрабатывали микроволнами в 10 мм цитратном буфере (pH 6) в течение всего 10 мин. После блокирования неспецифического окрашивания нормальной сывороткой срезы инкубировали с первичными антителами. Затем срезы CD34 и VEGF инкубировали в течение 30 мин с меченным биотином вторичным антителом (разведение 1: 500) и комплексом авидин-биотин (Vector Laboratories, Inc., Burlingame, CA) соответственно.В качестве хромогена использовали 3-3′-тетрагидрохлорид диаминобензидина. Наконец, срезы контрастировали гематоксилином, обезвоживали и закрепляли.
Органы управления.
Сосудистые эндотелиальные клетки и нормальные кератиноциты использовали в качестве положительного контроля для CD34 и VEGF, соответственно. Отрицательный контроль был получен путем исключения первичных антител.
Оценка параметров
VD.
Количественную оценку ангиогенеза (окрашивание и подсчет микрососудов) оценивали следующим образом:
1) В патологических тканях три наиболее сосудистые области опухоли были идентифицированы при малом увеличении как горячие точки.В каждой горячей точке подсчитывали сосуды на одном поле × 250 (окулярная линза × 10; линза объектива × 25; площадь поля 0,74 мм 2 ), и записывали среднее значение подсчета этих областей. Поскольку наша СА показала значительную неоднородность, горячие точки были тщательно выбраны с твердой структурой, независимо от расстояния от некротических областей. С помощью этой процедуры мы получили довольно репрезентативную картину всей опухоли.
Отдельный микрососуд был определен как дискретные кластеры или отдельные клетки, окрашенные на CD34, четко отделенные от соседних сосудов, опухолевых клеток и других элементов соединительной ткани; наличие просвета не требовалось для оценки микрососудов.
2) В нормальных железах подсчет микрососудов выполняли при × 250 в трех областях клубочковой, фасцикулярной и ретикулярной зон соответственно. Затем было рассчитано среднее значение.
Экспрессия VEGF.
Этот параметр оценивался полуколичественным способом. Индекс положительности был получен путем подсчета почти 500 клеток поражений и нормальной коры и расчета процента клеток с цитоплазматической иммунореактивностью VEGF.
Оценка обоих маркеров проводилась на смежных (5 мкм) срезах.Область интереса в секции, используемой для подсчета VD (CD34), была тщательно выделена. Смежный участок, иммуноокрашенный анти-VEGF, затем перекрывали для идентификации того же поля. Когда он был получен, была проведена оценка CD34 и VEGF.
Все параметры были определены независимо двумя патологами (P.V. и A.G.B.), а противоречивые случаи были разрешены путем одновременного рассмотрения обоими патологами.
Последующая деятельность
После операции все NFA, APA и CPA были излечены, тогда как среди CA 12 пациентов умерли от местных и / или диффузных метастазов, и 1 пациент был жив на момент написания этой рукописи (Таблица 2).
Таблица 2.
Клинические данные пациентов с карциномой надпочечников
| № пациента. . | Размер (мм) . | Некроз опухоли . | Стадия заболевания . | Выживаемость (мес.) . |
|---|---|---|---|---|
| 1 | 90 | Низкий | 3 | 12 |
| 2 | 60 | Отсутствует | 2 | 18 |
| 3 | 77 | Умеренный | 3 | 3 |
| 4 | 140 | Низкий | 2 | 100 |
| 5 | 160 | Широкий | 3 | 72 |
| 6 | 220 | Отсутствует | 2 | a |
| 7 | 84 | Умеренный | 4 | 9 |
| 8 | 130 | Широкий | 2 | 6 |
| 9 | 92 | Умеренный | 2 | 8 |
| 10 | 100 | Широкий | 4 | 3 |
| 11 | 100 | Широкий | 3 | 10 |
| 12 | 250 | Умеренный | 3 | 16 |
| 13 | 80 | Широкий | 2 | 37 |
| № пациента.. | Размер (мм) . | Некроз опухоли . | Стадия заболевания . | Выживаемость (мес.) . |
|---|---|---|---|---|
| 1 | 90 | Низкий | 3 | 12 |
| 2 | 60 | Отсутствует | 2 | 18 |
| 3 | 77 | Умеренный | 3 | 3 |
| 4 | 140 | Низкий | 2 | 100 |
| 5 | 160 | Широкий | 3 | 72 |
| 6 | 220 | Отсутствует | 2 | a |
| 7 | 84 | Умеренный | 4 | 9 |
| 8 | 130 | Широкий | 2 | 6 |
| 9 | 92 | Умеренный | 2 | 8 |
| 10 | 100 | Широкий | 4 | 3 |
| 11 | 100 | Широкий | 3 | 10 |
| 12 | 250 | Умеренный | 3 | 16 |
| 13 | 80 | Широкий | 2 | 37 |
Таблица 2.
Клинические данные пациентов с карциномой надпочечников
| № пациента. . | Размер (мм) . | Некроз опухоли . | Стадия заболевания . | Выживаемость (мес.) . |
|---|---|---|---|---|
| 1 | 90 | Низкий | 3 | 12 |
| 2 | 60 | Отсутствует | 2 | 18 |
| 3 | 77 | Умеренный | 3 | 3 |
| 4 | 140 | Низкий | 2 | 100 |
| 5 | 160 | Широкий | 3 | 72 |
| 6 | 220 | Отсутствует | 2 | a |
| 7 | 84 | Умеренный | 4 | 9 |
| 8 | 130 | Широкий | 2 | 6 |
| 9 | 92 | Умеренный | 2 | 8 |
| 10 | 100 | Широкий | 4 | 3 |
| 11 | 100 | Широкий | 3 | 10 |
| 12 | 250 | Умеренный | 3 | 16 |
| 13 | 80 | Широкий | 2 | 37 |
| № пациента.. | Размер (мм) . | Некроз опухоли . | Стадия заболевания . | Выживаемость (мес.) . |
|---|---|---|---|---|
| 1 | 90 | Низкий | 3 | 12 |
| 2 | 60 | Отсутствует | 2 | 18 |
| 3 | 77 | Умеренный | 3 | 3 |
| 4 | 140 | Низкий | 2 | 100 |
| 5 | 160 | Широкий | 3 | 72 |
| 6 | 220 | Отсутствует | 2 | a |
| 7 | 84 | Умеренный | 4 | 9 |
| 8 | 130 | Широкий | 2 | 6 |
| 9 | 92 | Умеренный | 2 | 8 |
| 10 | 100 | Широкий | 4 | 3 |
| 11 | 100 | Широкий | 3 | 10 |
| 12 | 250 | Умеренный | 3 | 16 |
| 13 | 80 | Широкий | 2 | 37 |
Статистика
Все данные выражены как среднее ± средн.Значения, полученные для каждой переменной для сравнения групп, были проанализированы с использованием непарного теста t (для сравнения возраста) и критерия Вилкоксона. В качестве параметров ассоциации использовались коэффициенты корреляции Спирмена (r). Статистическая разница была принята на уровне , значение P менее 0,05.
Результаты
Клинические данные всех групп (Таблица 1)
Возраст оказался значительно выше у пациентов, взятых в качестве контроля (которые были пациентами с карциномами почек, но нормальными надпочечниками), чем у пациентов с функционирующими и нефункционирующими аденомами.Статистической разницы в возрасте между CA, APA, CPA или NFA не было. Наименьший размер опухоли наблюдался при АРА, тогда как наибольший размер был обнаружен при СА.
Клинические данные пациентов с КА (таблица 2)
Размер опухоли у пациентов с ХА составлял от 60 до 250 мм. Четыре опухоли не показали некроза или слабого некроза, тогда как девять имели умеренные или широкие некротические области. Большинство опухолей относились ко II-III стадиям, а время выживания варьировалось от 3 до 100 месяцев (в среднем 24.5 месяцев).
VD
Среднее (± стандартная ошибка) VD, выраженное количественно как количество сосудов на квадратный миллиметр, было значительно ниже ( P <0,0001) в CA (110,3 ± 27,8), чем в N (336,6 ± 14,5), APA (322,8 ± 19,1) , CPA (288,5 ± 14,3) и NFA (274,2 ± 19,8). ВД не различалась по N и APA, тогда как в NFA ( P <0,01) и CPA ( P <0,02) она была ниже, чем в N (рис. 1, вверху ). Аналитические данные показали, что 12 из 13 CA, 6 из 13 NFA и 4 из 12 CPA имели значения CD34 ниже нижнего предела (270 количество сосудов / мм 2 ) нормы, установленного на 10-м процентиле распределения, рассчитанном в наша контрольная группа (рис.1, нижний ).
Рис. 1.
VD (среднее ± стандартное значение CD34) в N, APA, CPA, NFA и CA. Показана статистическая разница ( верхних ). Индивидуальные данные ВД в APA, CPA, NFA и CA. Пунктирные линии представляют верхний и нижний предел нормы, рассчитанный как 90-й и 10-й процентили, соответственно, для нашей контрольной группы ( нижний ).
Рисунок 1.
VD (среднее ± стандартное значение CD34) в N, APA, CPA, NFA и CA.Показана статистическая разница ( верхних ). Индивидуальные данные ВД в APA, CPA, NFA и CA. Пунктирные линии представляют верхний и нижний предел нормы, рассчитанный как 90-й и 10-й процентили, соответственно, для нашей контрольной группы ( нижний ).
На рис. 2 показано явное различие иммуноокрашивания между СА и нормальными образцами. В первом случае количество микрососудов было меньше, чем во втором.
Рисунок 2.
Иммуногистохимическое окрашивание микрососудов на CD34 в нормальной коре ( вверху, ) и адренокортикальной карциноме ( внизу, ).Количество сосудов в первом больше, чем во втором. Иммунопероксидаза-моноклональное антитело анти-CD34; увеличение, × 100.
Рисунок 2.
Иммуногистохимическое окрашивание микрососудов на CD34 в нормальной коре ( вверху, ) и адренокортикальной карциноме ( внизу, ). Количество сосудов в первом больше, чем во втором. Иммунопероксидаза-моноклональное антитело анти-CD34; увеличение, × 100.
Экспрессия VEGF
Уровень экспрессии VEGF, рассчитанный как процент положительных клеток, был значительно выше ( P <0.0001) в CA (85,3 ± 2,1%), чем в N (33,1 ± 6,1%), CPA (38,5 ± 7,0%), APA (56,5 ± 7,5%) и NFA (0,76 ± 0,6%). Окрашивание VEGF в APA, но не в CPA, было больше, чем в N ( P <0,02). APA и CPA экспрессировали больше VEGF ( P <0,0001), чем NFA. NFA показала самую низкую экспрессию VEGF, и поэтому уровень экспрессии оказался ниже ( P <0,0001), чем в других группах (фиг. 3, top ). Аналитические данные показали, что все CA имели значения экспрессии VEGF, равные (n = 2) или выше (n = 11) верхнему пределу (70%) для нормы, установленному на 90-м процентиле наших контролей, тогда как все NFA имели одинаковые значения экспрессии до (n = 2) или ниже (n = 11) нижнего предела (5%) для нормального VEGF (10-й процентиль наших контролей).У большинства APA (9 из 13) и CPA (10 из 12) уровни VEGF были в пределах нормы (рис. 3, , нижний ).
Рис. 3.
Среднее ± sem от значений VEGF (процент положительных клеток) в N, APA, CPA, NFA и CA. Показана статистическая разница ( верхних ). Индивидуальные данные VEGF в APA, CPA, NFA и CA. Пунктирные линии представляют верхнюю и нижнюю границу нормы, рассчитанную как 90-й и 10-й процентили, соответственно, для нашей контрольной группы ( нижний ).
Рисунок 3.
Среднее ± средн. Значение VEGF (процент положительных клеток) в N, APA, CPA, NFA и CA. Показана статистическая разница ( верхних ). Индивидуальные данные VEGF в APA, CPA, NFA и CA. Пунктирные линии представляют верхнюю и нижнюю границу нормы, рассчитанную как 90-й и 10-й процентили, соответственно, для нашей контрольной группы ( нижний ).
На фиг. 4 показано, что адренокортикальные клетки CA проявляли интенсивное цитоплазматическое окрашивание VEGF, в то время как это не имело место для адренокортикальных клеток NFA.
Рисунок 4.
Было обнаружено, что
VEGF редко экспрессируется в нефункционирующей аденоме ( top ). Напротив, карцинома коры надпочечников продемонстрировала многочисленные неопластические клетки, положительные по VEGF (, ). Иммунопероксидаза-поликлональные антитела против VEGF; увеличение, × 100.
Рис. 4.
Было обнаружено, что
VEGF редко экспрессируется в нефункционирующей аденоме ( top ). Напротив, адренокортикальная карцинома продемонстрировала многочисленные неопластические клетки, положительные по VEGF (, ).Иммунопероксидаза-поликлональные антитела против VEGF; увеличение, × 100.
Корреляции
В APA была обнаружена отрицательная связь между VD и PRA (r = 0,852; P <0,0002) и положительная связь между VD и уровнями альдостерона (r = 0,521; P <0,05). В APA и NFA VD и VEGF не коррелировали с возрастом, индексом массы тела, артериальным давлением, размером массы, калием или гормонами. При CPA не было обнаружено ассоциации между гормонами и ангиогенными маркерами.При СА ни один иммуногистохимический маркер не коррелировал с возрастом, размером массы, некрозом опухоли, стадией заболевания и выживаемостью пациента. Наконец, ни в одной группе не было обнаружено корреляций между VD и VEGF.
Обсуждение
В литературе немного исследований, посвященных оценке ангиогенеза в патологической коре надпочечников человека. Сюда мы включили относительно большое количество образцов, в частности карцином, которые представляют собой нечастую форму рака человека.
Наши результаты показывают явно различный ангиогенный паттерн между карциномами и аденомами или нормальной корой.Различия выявлялись как по маркеру VD (CD34), так и по индексу ангиогенного статуса (VEGF).
В наших экспериментальных условиях карциномы надпочечников, по-видимому, обладают высоким ангиогенным потенциалом, поскольку они показывают повышенную экспрессию VEGF по сравнению с экспрессией, наблюдаемой в нормальной ткани и в аденомах. Наши данные полностью согласуются с недавним исследованием, в котором средняя цитозольная концентрация VEGF в 13 КА надпочечников была выше, чем в аденомах и переходных опухолях (21). Настоящие данные также косвенно подтверждают отчет (22), демонстрирующий, что у пациентов с карциномами надпочечников уровни VEGF в сыворотке значительно выше, чем у пациентов с аденомами и здоровых субъектов.Наше исследование не планировалось для оценки того, была ли избыточная экспрессия VEGF первичной или вторичной по отношению к наличию обширных некротических областей, обнаруженных в наших опухолях. Первая гипотеза, однако, вероятна, потому что VEGF в опухолевых клетках, по-видимому, конститутивно экспрессируется на высоких уровнях независимо от внешнего напряжения O 2 (12), тогда как в нормальных тканях VEGF активируется, а его мРНК стабилизируется в условиях гипоксия (23).
В любом случае VEGF представляет собой основную молекулу в ангиогенезе, и его сверхэкспрессия наделяет опухоль потенциалом синтезировать новые сосуды и, следовательно, индуцировать рост опухоли и образование метастазов (24, 25).Однако, несмотря на высокий уровень VEGF, наши карциномы, по-видимому, имели более низкую васкуляризацию, чем аденомы и нормальная кора. Подобные результаты были обнаружены в другой серии адренокортикальных карцином (18), а в недавнем отчете (26) также наблюдалась низкая васкуляризация аденом гипофиза по сравнению с нормальной тканью. Обнаруженная нами низкая васкуляризация имеет несколько объяснений. Во-первых, VEGF, экспрессируемый в карциномах надпочечников, может быть функционально неактивным или противодействовать другим ангиогенным ингибиторам.Во-вторых, роль, которую играет VEGF в коре надпочечников, может быть вторичной, учитывая недавнюю идентификацию EG-VEGF (27), молекулы, экспрессируемой только в ткани надпочечников, с структурой, отличной от VEGF, и почти идентичной функциональной активностью. Этот белок может иметь низкое содержание КА надпочечников и может объяснить наши данные.
Несмотря на низкую васкуляризацию, время выживания наших пациентов с карциномами было очень коротким. Это открытие явно не согласуется с демонстрацией того, что неоангиогенез связан со злокачественными новообразованиями и что ВД является независимым прогностическим индикатором риска будущих метастазов и смерти при нескольких раковых заболеваниях человека (4–7, 28, 29).Однако даже при низком уровне ВД злокачественные опухоли могут сохранять свою агрессивность. В самом деле, неоангиогенез — это только один из аспектов метастатической силы рака (8), и опухолевые сосуды, даже если они скудные, могут иметь эффективную реологию, позволяющую локальную диффузию и метастазы. Также нельзя исключить, что распространение наших опухолей не было гематогенным, а происходило через лимфатические пути, не обнаруженные в ходе иммуногистохимического исследования, которое мы использовали (только VEGF-C, конкретная изоформа VEGF, по-видимому, является специфическим фактором лимфангиогенеза; Refs.30 и 31).
В нашем исследовании также участвовала группа функционирующих аденом. CPA показал ангиогенный фенотип, сопоставимый с нормальными образцами, без корреляции с уровнями кортизола и АКТГ. В APA васкуляризация опухоли была количественно подобна нормальной, но была отрицательно связана с PRA и положительно связана с альдостероном. Кроме того, ангиогенный потенциал APA оказался повышенным, поскольку уровни экспрессии VEGF были значительно выше, чем в нормальной коре головного мозга. Таким образом, в APA, по-видимому, присутствует связь между ангиогенезом и функциональным статусом.Соответственно, мы обнаружили, что нефункционирующие аденомы имеют VD ниже, чем нормальная кора головного мозга, и экспрессируют очень низкие уровни VEGF. Хотя мы изучили только 13 образцов, этот результат вряд ли был вызван случайностью или техническими проблемами, потому что он наблюдался практически во всех случаях, по крайней мере, в том, что касается экспрессии VEGF. Таким образом, связь между низкой ангиогенной способностью и отсутствием гормональной активности, по-видимому, существует в нефункционирующих аденомах.
В заключение, наши результаты показывают, что ангиогенный фенотип адренокортикальных карцином человека характеризуется сверхэкспрессией VEGF, но низкой васкуляризацией, это открытие предполагает диссоциацию между ангиогенным статусом и неоангиогенными возможностями этих опухолей.Кроме того, мы наблюдали отсутствие экспрессии VEGF в нефункционирующих кортикальных аденомах и тесную связь между ангиогенезом и функциональным статусом в аденомах, продуцирующих альдостерон, что указывает на возможное влияние ангиогенного фенотипа на гормональную секрецию этих эндокринных опухолей.
Благодарности
Мы благодарны доктору Джанфранко Ардженио за его критическую редакцию этой рукописи.
Сокращения:
APA,
Аденомы, продуцирующие альдостерон;
CA,
карциномы коры надпочечников;
CPA,
аденомы, продуцирующие кортизол;
N,
NFA,
нефункционирующие аденомы коры надпочечников;
PRA,
VD,
VEGF,
фактор роста эндотелия сосудов.
1
Folkman
J
,
Shing
Y
1992
Ангиогенез.
J Biol Chem
267
:
10931
—
10934
2
Folkman
J
1992
Роль ангиогенеза в росте опухоли.
Semin Cancer Biol
3
:
65
—
71
3
Ellis
LM
,
Fidler
IJ
1996
Ангиогенез и метастаз 3.
Eur J Cancer
32A
:
2451
—
2460
4
Weidner
N
1998
Опухолевая васкуляризация как прогностический фактор у онкологических больных: доказательства продолжают расти.
J Pathol
184
:
119
—
122
5
Fallowfield
ME
,
Cook
MG
1991
Васкуляризация первичной кожной меланомы.
J Pathol
164
:
241
—
244
6
Maeda
K
,
Chung
YS
,
Takatsuka
S
,
S
N
,
Sawada
T
,
Kato
Y
,
Nitta
A
,
Arimoto
Y
,
Kondo
Y
ангиогенез опухоли
1995 показатели при карциноме желудка.
Br J Рак
72
:
319
—
323
7
Fontanini
G
,
Lucchi
M
,
Vignati
S
0003
F
,
De Laurentiis
M
,
De Placido
S
,
Basolo
F
,
Angeletti
CA
,
Bevilacqua
Pro выживаемости при немелкоклеточной карциноме легкого: проспективное исследование.
J Natl Cancer Inst
89
:
881
—
886
8
Fox
SB
1997
Ангиогенез опухоли и прогноз.
Гистопатология
30
:
294
—
301
9
Тои
M
,
Инада
K
,
Suzuki
H
,
000
000
000
000
000
000
000
000
000
000
000 ангиогенез при раке молочной железы: его важность как прогностический индикатор и связь с экспрессией фактора роста эндотелия сосудов.
Лечение рака молочной железы
36
:
193
—
204
10
Гиатроманолаки
A
,
Кукуракис
M
,
O’Byrne 9000
O’Byrne 9000
Whitehouse
R
,
Talbot
DC
,
Harris
AL
,
Gatter
KC
1996
Прогностическое значение ангиогенеза при операбельном немелкоклеточном раке легкого.
J Pathol
179
:
80
—
88
11
Ramani
P
,
Bradley
NJ
,
Fletcher
CDM
антитела к эндотелию: оценка его диагностической ценности в парафиновых срезах.
Гистопатология
17
:
237
—
241
12
Дворак
HF
,
Коричневый
LF
,
Детмар
000 AM3
000
000
000
000 Dvorak
000 Dvorak
000 фактор проницаемости / рост эндотелия сосудов, повышенная проницаемость микрососудов и ангиогенез.
Am J Pathol
146
:
1029
—
1039
13
Obermair
A
,
Kucera
E
,
Mayerhofer 9000 P3
000
K
iser
M
,
Czerwenka
K
,
Kaider
A
,
Leodolter
S
,
Kainz
C
,
Zeillinger
end
R
R
9 рак: корреляция с выживаемостью без болезней.
Int J Cancer
74
:
455
—
458
14
Экипаж
JP
,
О’Брайен
T
,
Брэдберн
M
,
,
Bicknell
R
,
Cranston
D
,
Harris
AL
1997
Фактор роста эндотелия сосудов является предиктором рецидива и прогрессирования стадии поверхностного рака мочевого пузыря.
Cancer Res
57
:
5281
—
5285
15
Shibusa
T
,
Shijubo
N
,
Abe
S
сосудистый фактор роста
сосудистый рост
экспрессия при раке легких I стадии.
Clin Cancer Res
4
:
1483
—
1487
16
Феррара
N
,
Houck
K
,
Jakeman 9000 DW3
L
Молекулярные и биологические свойства белков семейства факторов роста эндотелия сосудов.
Endocr Ред.
13
:
18
—
32
17
Decaussin
M
,
Sartelet
H
,
Robert
C
000
Moro
C
,
Brambilla
C
,
Brambilla
E
1999
Экспрессия фактора роста эндотелия сосудов (VEGF) и двух его рецепторов (VEGF-R1-Flt1 и VEGF-R2-Flk1 / KDR) немелкоклеточные карциномы легких (НМРЛ): корреляция с ангиогенезом и выживаемостью.
J Pathol
188
:
369
—
377
18
Sasano
H
,
Ohashi
Y
,
Suzuki
000
000
000
000
000 T
000
000
000
000 T
000
000 Васкуляризация коры надпочечников человека.
Mod Pathol
11
:
329
—
333
19
Weiss
LM
1984
Сравнительное гистологическое исследование 43 метастазирующих и неметастазирующих опухолей коры надпочечников.
Am J Surg Pathol
8
:
163
—
169
20
Wooten
MD
,
King
DK
1993
Каркас коры надпочечников
Рак
72
:
3145
—
3155
21
Де Фрайпон
F
,
Эль-Атифи
M
,
Gicquel
C
000
X
000
000 X
EM
,
Feige
JJ
2000
Экспрессия маркеров ангиогенеза фактора роста сосудистого эндотелия-A, тромбоспондина-1 и фактора роста эндотелиальных клеток, происходящих от тромбоцитов, в спорадических адренокортикальных генотипах человека: корреляция с генотипом.
J Clin Endocrinol Metab
85
:
4734
—
4741
22
Kolomecki
K
,
Stepien
H
,
Bartos
M
M
Полезность оценки сывороточного уровня VEGF, MMP-2, MMP-3 и TIMP-2 у пациентов с опухолями надпочечников.
Endocr Regul
35
:
9
—
16
23
Shima
DT
,
Adamis
AP
,
Ferrara
N
,
000
000
,
0009 Yeo TK
,
Allende
R
,
Folkman
J
,
D’Amore
PA
1995
Гипоксическая индукция факторов роста эндотелиальных клеток в клетках сетчатки: идентификация и характеристика эндотелиального фактора роста сосудов VEGF) в качестве митогена.
Mol Med
1
:
182
—
193
24
Hanahan
D
,
Folkman
J
1996
Паттерны и возникающие механизмы ангиогенеза.
Cell
86
:
353
—
364
25
Fidler
IJ
,
Ellis
LM
1994
Влияние ангиогенеза на ангиогенез в терапии рака.
Ячейка
79
:
185
—
188
26
Тернер
HE
,
Nagy
Z
,
Gatter
KC
,
AL
000
,
AL
MM
,
Wass
JAH
2000
Ангиогенез в аденомах гипофиза и нормальном гипофизе.
J Clin Endocrinol Metab
85
:
1159
—
1162
27
LeCouter
J
,
Ковальски
J
,
Foster
J
Z
,
Dillard-Telm
L
,
Frantz
G
,
Rangell
L
,
DeGuzman
L
,
Keller
GA20003
GA2000 Gurney
A
,
Hillan
KJ
,
Ferrara
N
2001
Идентификация ангиогенного митогена, селективного для эндотелия эндокринных желез.
Nature
412
:
877
—
884
28
Ли
CN
,
Cheng
WF
,
Chen
CA
,
000 Chen
s
0002
0002 Chu
,
Hsieh
FJ
2000
Ангиогенез карциномы эндометрия оценивается путем измерения внутриопухолевого кровотока, плотности микрососудов и уровней фактора роста эндотелия сосудов.
Obstet Gynecol
96
:
615
—
621
29
Weidner
N
,
Semple
JP
,
Welch
WR
k
WR
1991 Ангиогенез опухоли и корреляция метастазов при инвазивной карциноме молочной железы.
N Engl J Med
324
:
1
—
8
30
Kaipainen
A
,
Korhonen
J
,
Mustonen
T
,
, Mustonen
T
,
Fang
GH
,
Dumont
D
,
Breitman
M
,
Alitalo
K
1995
Экспрессия fms-подобной тирозинкиназы 4 во время развития гена лимфатической линии ограничивается концом.
Proc Natl Acad Sci USA
92
:
3566
—
3570
31
Akagi
K
,
Ikeda
Y
,
Miyazaki
0003
Miyazaki
M Kinoshita
J
,
Maehara
Y
,
Sugimachi
K
2000
Экспрессия фактора роста эндотелия сосудов-C (VEGF-C) в тканях колоректального рака человека.
Br J Рак
83
:
887
—
891
Авторские права © 2002 Общество эндокринологов
df050001611p
% PDF-1.4
%
15 0 объект
>
endobj
17 0 объект
> поток
2000-04-27T17: 56: 50ZParlance Publisher 5.0 / (Xyvision Postscript Formatter) 3.0 32021-02-12T06: 35: 24-08: 002021-02-12T06: 35: 24-08: 00 Acrobat Distiller Command 3.02b для Solaris 2.3 и более поздние (SPARC) приложение / pdf
uuid: ee4ccfc0-1dd1-11b2-0a00-b809271d5700uuid: ee4ccfc5-1dd1-11b2-0a00-bf0000000000
конечный поток
endobj
9 0 объект
>
endobj
1 0 obj
> / Font> / ProcSet [/ PDF / Text] >> / Type / Page >>
endobj
10 0 obj
> / Font> / ProcSet [/ PDF / Text] >> / Type / Page >>
endobj
18 0 объект
> / ProcSet [/ PDF / Text / ImageC] / XObject >>> / Type / Page >>
endobj
26 0 объект
[32 0 R 33 0 R 34 0 R 35 0 R 36 0 R 37 0 R 38 0 R]
endobj
27 0 объект
> поток
q
539.3594055 0 0 83.3014526 31.8202972 651.6985474 см
/ Im0 Do
Q
BT
/ T1_0 1 Тс
10 0 0 10 105,56989 553,99985 тм
(2000; 6: 1611-1612.) Tj
/ T1_1 1 Тс
-7.55699 0 Тд
(Clin Cancer Res \ 240) Tj
/ T1_0 1 Тс
0 1 TD
(\ 240) Tj
0 1.00001 TD
(Ади Ф. Газдар и Джон Д. Минна) Tj
/ T1_2 1 Тс
0 1 TD
(\ 240) Tj
/ T1_3 1 Тс
18 0 0 18 30 593,99997 тм
(Раки) Tj
Т *
(Ангиогенез и многоступенчатое развитие легких) Tj
ET
30 499 543 35 рэ
0 0 мес.
S
BT
/ T1_0 1 Тс
11 0 0 11 120.94202 506.99997 тм
(\ 240) Tj
/ T1_3 1 Тс
-7,55696 1 тд
(Обновленная версия) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 141 498.99994 Тм
(\ 240) Tj
/ T1_0 1 Тс
23,56696 1 тд
() Tj
0 0 1 рг
-23,56696 0 тд
(http://clincancerres.aacrjournals.org/content/6/5/1611)Tj
0 г
0 1.00001 TD
(См. Самую последнюю версию этой статьи по адресу:) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 30 478,99997 тм
(\ 240) Tj
0 1 TD
(\ 240) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 30 458,99997 тм
(\ 240) Tj
Т *
(\ 240) Tj
ET
30 389 543 70 рэ
0 0 мес.
S
BT
/ T1_0 1 Тс
11 0 0 11 120.94202 426.99997 тм
(\ 240) Tj
/ T1_3 1 Тс
-6.00198 1 тд
(Цитированные статьи) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 141 418.99994 Тм
(\ 240) Tj
/ T1_0 1 Тс
29.28994 1 Td
() Tj
0 0 1 рг
-29.28994 0 Тд
(http://clincancerres.aacrjournals.org/content/6/5/1611.full#ref-list-1)Tj
0 г
0 1.00001 TD
(Эта статья содержит 18 статей, 3 из которых вы можете получить бесплатно по адресу:) Tj
ET
BT
/ T1_0 1 Тс
11 0 0 11 120.94202 396.99997 тм
(\ 240) Tj
/ T1_3 1 Тс
-6,33498 1 тд
(Цитирование статей) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 141 388,99994 тм
(\ 240) Tj
/ T1_0 1 Тс
30.67993 1 тд
() Tj
0 0 1 рг
-30.67993 0 Тд
(http://clincancerres.aacrjournals.org/content/6/5/1611.full # related-urls \
) Tj
0 г
Т *
(Эта статья процитирована в 5 статьях, размещенных на HighWire. Перейдите к ar \
ticles at:) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 30 368,99997 тм
(\ 240) Tj
0 1 TD
(\ 240) Tj
ET
30 254 543 115 рэ
0 0 мес.
S
BT
/ T1_0 1 Тс
11 0 0 11 120.94202 336.99997 тм
(\ 240) Tj
/ T1_3 1 Тс
-5.66901 1 тд
(Оповещения по электронной почте) Tj
ET
BT
/ T1_0 1 Тс
10 0 0 10 295,49969 349 тм
(относится к этой статье или журналу.) Tj
0 0 1 рг
-15.44997 0 Тд
(Зарегистрируйтесь, чтобы получать бесплатные уведомления по электронной почте) Tj
ET
BT
0 г
/ T1_0 1 Тс
11 0 0 11 120.94202 303,99994 тм
(\ 240) Tj
/ T1_3 1 Тс
-6.38997 1 тд
(Подписки) Tj
0,556 1,00001 тд
(Отпечатки и) Tj
ET
BT
/ T1_0 1 Тс
10 0 0 10 141 306,99994 тм
(\ 240) Tj
13.46497 1 тд
(.) Tj
0 0 1 рг
-6.85098 0 Тд
([email protected]) Tj
0 г
-6.61399 0 Тд
(Отделение) Tj
0 1.00001 TD
(Чтобы заказать перепечатку статьи или подписаться на журнал, свяжитесь с \
t Публикации AACR) Tj
ET
BT
/ T1_0 1 Тс
11 0 0 11 120,94 202 281,99997 тм
(\ 240) Tj
/ T1_3 1 Тс
-5.66901 1 тд
(Разрешения) Tj
ET
BT
/ T1_0 1 Тс
10 0 0 10 141 253.99988 Тм
(\ 240) Tj
0 1 TD
(Сайт Rightlink.) Tj
0 1.00001 TD
(Нажмите «Запросить разрешения», чтобы перейти на страницу защиты авторских прав \
Центр Рэнсиса \ (CCC \)) Tj
23,56696 1 тд
(.) Tj
0 0 1 рг
-23,56696 0 тд
(http://clincancerres.aacrjournals.org/content/6/5/1611)Tj
0 г
0 1 TD
(Чтобы запросить разрешение на повторное использование всей или части этой статьи, используйте этот li \
nk) Tj
ET
BT
/ T1_0 1 Тс
9 0 0 9 278.74257 1.99997 тм
(Исследования.) Tj
-0,81502 1 тд
(12 февраля 2021 г. \ 251 2000 Американская ассоциация рака) Tj
0 0 1 рг
-13.61496 0 тд
(Clincancerres.aacrjournals.org) Tj
0 г
-8.11397 0 Td
(Загружено с) Tj
ET
конечный поток
endobj
31 0 объект
> / Filter / FlateDecode / Height 238 / Length 73913 / Name / X / Subtype / Image / Type / XObject / Width 1541 >> stream
HϏn`’G6R0 «#AKH» 9 \ C |
Альтметрический — VEGF-индуцированный неоангиогенез опосредуется NAADP и двухпоровым каналом-2-зависимой передачей сигналов Ca2 +
Фактор роста эндотелия сосудов (VEGF) и его рецепторы VEGFR1 / VEGFR2 играют важную роль в контроле ангиогенеза, включая васкуляризацию солидных опухолей.Здесь мы описываем специфический сигнальный путь Ca (2+), связанный с подтипом рецептора VEGFR2, контролирующий критические ангиогенные ответы эндотелиальных клеток (ЭК) на VEGF. Ключевыми этапами этого пути являются участие мощного мобилизующего Ca (2+) мессенджера, аденин-динуклеотидфосфата никотиновой кислоты (NAADP) и специфическое участие подтипа TPC2 с двумя поровыми каналами в кислых внутриклеточных хранилищах Ca (2+) , что приводит к высвобождению Ca (2+) и ангиогенным ответам. Было обнаружено, что нацеливание на этот внутриклеточный путь фармакологически с использованием антагониста NAADP Ned-19 или генетически с использованием мышей Tpcn2 (- / -) ингибирует ангиогенные ответы на VEGF in vitro и in vivo.В эндотелиальных клетках пупочной вены человека (HUVECs) Ned-19 отменяет VEGF-индуцированное высвобождение Ca (2+), нарушая фосфорилирование ERK1 / 2, Akt, eNOS, JNK, пролиферацию клеток, миграцию клеток и образование капиллярных трубок. Интересно, что обработка shРНК Tpcn2 отменяет VEGF-индуцированное высвобождение Ca (2+) и образование капиллярных трубок. Важно отметить, что in vivo VEGF-индуцированное образование сосудов в пробках матригеля у мышей устранялось Ned-19 и, в первую очередь, не происходило у мышей Tpcn2 (- / -), но не затрагивалось у животных Tpcn1 (- / -).Эти результаты показывают, что сигнальный путь VEGFR2 / NAADP / TPC2 / Ca (2+) является критическим для VEGF-индуцированного ангиогенеза in vitro и in vivo. Учитывая, что VEGF может вызывать как про-, так и антиангиогенные ответы в зависимости от баланса активированных путей передачи сигналов, нацеливание на специфические VEGFR2 нижестоящие сигнальные пути может изменить этот баланс, потенциально приводя к более точным терапевтическим стратегиям.
Ангиогенез | CancerQuest
Все клетки нуждаются в постоянном источнике кислорода и питательных веществ, таких как глюкоза (сахар).Наши клетки получают питательные вещества через кровь. Питательные вещества и кислород прокачиваются через тело через систему кровообращения. Попадая в ткани, питательные вещества проникают через стенки кровеносных сосудов и попадают в пространства вокруг клеток. Клетки постоянно нуждаются в питательных веществах, и процесс их доставки к клеткам требует времени. Чтобы гарантировать, что все клетки получают достаточно питательных веществ, наши ткани заполнены множеством мелких кровеносных сосудов (капилляров), которые могут доставлять пищу на очень короткое расстояние от любой клетки.Дополнительную информацию по темам на этой странице также можно найти в большинстве вводных учебников по биологии, мы рекомендуем «Биология Кэмпбелла», 11-е издание.
Введение в ангиогенез
Несмотря на то, что раковые клетки ненормальны, они все равно нуждаются в кислороде и питательных веществах. Развитие кровеносных сосудов — важный этап роста опухоли. Без сосудов опухоли не могут вырасти более чем на небольшую долю дюйма. Когда область вокруг клеток в опухоли начинает удаляться слишком далеко от кровеносного сосуда, уровни кислорода и питательных веществ начинают снижаться.Уменьшение кислорода еще называют гипоксией. Гипоксия вызывает изменения в поведении опухолевых клеток.
Опухолевые клетки производят (или заставляют соседние клетки производить) факторы роста, которые стимулируют образование кровеносных сосудов. Опухоли, которые не производят (или не вызывают выработку другими клетками) факторов ангиогенеза, не могут расти. Один из наиболее хорошо изученных факторов ангиогенеза называется фактором роста сосудистого эндотелия (VEGF). VEGF или другие факторы ангиогенеза, продуцируемые опухолевыми клетками или соседними клетками, могут вызывать развитие кровеносных сосудов, которые питают растущую опухоль.Поскольку VEGF является нормальным сигналом для клеток, образующих кровеносные сосуды, они на самом деле просто выполняют свою работу. Опухоль «обманом» заставляет организм создавать новые кровеносные сосуды. Созданные таким образом кровеносные сосуды не совсем такие же, как нормальные кровеносные сосуды. Часто они менее организованы и более негерметичны, чем обычные сосуды.
Аномальный ангиогенез не ограничивается раком. Другие заболевания, в том числе дегенерация желтого пятна, прогрессирующее заболевание глаз, связаны с аномальным развитием кровеносных сосудов.Процесс ангиогенеза при раке показан на анимации ниже.
Ангиогенез как лекарственная мишень
Как и все клетки, раковые клетки нуждаются в постоянном поступлении питательных веществ и кислорода для роста и деления. Без адекватного кровоснабжения опухоли не будут расти. Опухоли вырабатывают факторы, которые стимулируют формирование кровеносных сосудов, чтобы обеспечить их необходимой пищей и кислородом.
Процесс образования кровеносных сосудов называется ангиогенезом.Этот процесс является очень активной областью исследований в лечении рака по нескольким причинам. 1. Лечение должно иметь низкую токсичность. Ангиогенез происходит на высоком уровне во время внутриутробного развития, менструального цикла и заживления ран. Можно ожидать, что лечение будет мешать этим процессам, но не должно повредить большинство нормальных делящихся клеток. 2. Лечение не предназначено для прямого воздействия на раковые клетки. Целями некоторых из этих методов лечения являются нормальные процессы, контролируемые нормальными клетками (такими как клетки, которые образуют кровеносные сосуды), , а не самими опухолевыми клетками.Высокий уровень мутации раковых клеток, который часто делает химиотерапию неэффективной, не влияет на действие этих препаратов.
Ангиостатин
Этот препарат на самом деле является белком природного происхождения, который образуется в результате расщепления более крупного белка, плазминогена. Ангиостатин подавляет рост кровеносных сосудов в опухолях и, как было показано, подавляет метастазирование опухолей на животных моделях. Этот препарат больше не проходит клинических испытаний
Эндостатин / Эндостар
Подобно ангиостатину, это лекарство является белком природного происхождения.Эндостатин является производным коллагена, структурного белка соединительной ткани.
В ранних исследованиях было показано, что эндостатин безопасен и обладает низкой токсичностью. Совсем недавно исследователи в Китае разработали слегка модифицированную версию эндостатина, которая более стабильна, проста в производстве и более эффективна. Препарат по-прежнему действует, подавляя ангиогенез. Новая версия Endostar в настоящее время проходит клинические испытания.
Поиск текущих клинических испытаний с участием Endostar.
Разработкой и маркетингом эндостатина в настоящее время занимается Alchemgen и Корпорация детского медицинского центра
Рост кровеносных сосудов в опухоли — это только половина дела. Еще в 1971 году доктор Джуда Фолкман постулировал, что предотвращение ангиогенеза может подавлять рост опухолей, лишая их жизненно важных питательных веществ. На существование естественных ингибиторов ангиогенеза намекнули любопытные наблюдения хирургов. Они обнаружили, что хирургическое удаление большой первичной опухоли часто приводит к быстрому развитию метастатических разрастаний.Это наблюдение показало, что первичная опухоль вырабатывала что-то, что препятствовало развитию небольших метастатических опухолей. Когда большая опухоль была удалена, меньшие опухоли могли свободно расти.
Первым обнаруженным ингибитором природного происхождения был тромбоспондин, идентифицированный в 1989 году доктором Ноэлем Буком. Еще два естественных ингибитора были открыты доктором Майклом О’Рейли в лаборатории доктора Фолкмана: ангиостатин в 1994 году и эндостатин в 1997 году. Обе молекулы представляют собой небольшие белки, которые происходят из более крупных белков, которые, что примечательно, выполняют разные функции в организме.
В качестве лечебных средств первые два обнаруженных ингибитора обладают двумя очень интересными особенностями: 1) поскольку они являются естественными продуктами организма, они должны быть намного менее токсичными, чем обычные химиотерапевтические препараты. 2) Поскольку они действуют на нормальные клетки (кровеносные сосуды) вместо того, чтобы напрямую атаковать опухоли, вероятность того, что они приведут к отбору устойчивых к лекарственным средствам опухолей, значительно ниже.
Ангиостатин больше не рассматривается как лекарство от рака. Эндостатин в форме Endostar® проходит клинические испытания.
Поскольку образование кровеносных сосудов или его отсутствие лежит в основе многих заболеваний человека, контроль над этим процессом может иметь место при некоторых заболеваниях, помимо рака. История поиска Джуды Фолкмана была предметом специального выпуска NOVA, который можно посмотреть в Интернете.
Поскольку этот процесс является ключом к росту опухолей, многие лекарственные препараты в настоящее время исследуются на предмет их способности ингибировать ангиогенез и рост опухолей, и несколько лекарств с антиангиогенезной активностью были одобрены для лечения рака.
Узнайте больше об ингибиторах ангиогенеза в разделе сайта, посвященном лечению рака.
Сводка по ангиогенезу
Ангиогенез опухоли
- Раковые клетки нуждаются в достаточном питании и кислороде.
- Опухоли не могут увеличиваться более чем на долю дюйма, если в них не разовьется кровоснабжение.
- Когда уровень кислорода становится низким, опухолевые клетки могут продуцировать факторы, включая VEGF, которые вызывают ангиогенез.
- Клетки, производящие сосуды, нормальные, не злокачественные.
- Произведенные кровеносные сосуды не совсем нормальные.
Ингибиторы ангиогенеза
- Первыми открытыми ингибиторами ангиогенеза были белки, которые естественным образом встречаются в организме.
- Ангиогенез — общая черта многих видов рака, поэтому лекарственные препараты, разработанные для его подавления, должны действовать на различные типы рака.


 2007, Т.6, №2. С.10-17.
2007, Т.6, №2. С.10-17.
 1995, Vol.333, №26, P.1757-1763.
1995, Vol.333, №26, P.1757-1763. По биологическому взаимодействию:
По биологическому взаимодействию: