симптомы и признаки, стадии, диагностика, прогноз лечения – Клиника ЦКБ РАН в Москве
Энцефаломиелит – подострый или острый процесс воспаления, поражающий спинной и головной мозг. Очаги заболевания могут располагаться в любых отделах нервной системы. Наиболее распространенная форма – диссеминирующий, или рассеянный энцефаломиелит. Симптомы, по которым можно распознать заболевание, зависят от его локализации. В основе патологического процесса – белки, которые иммунная система вырабатывает против собственных клеток нервной ткани.
Причины развития
Основная причина остается не выясненной по сей день. Специалисты отмечают несколько основных факторов, которые могут оказаться решающими для появления заболевания:
- Вирусныеи инфекционные заболевания, особенно те, которые предполагают появления сыпи. Это ветряная оспа, герпес, корь, краснуха и другие.
- Вакцинация.
- Аутоиммунные нарушения.

- Простуда, пневмония, грипп.
- Травмы в области черепно-мозговой системы.
- Аллергия.
- Снижение иммунитета по различным причинам.
Симптомы
Наиболее агрессивно начинается острый диссеминированный энцефаломиелит. Первыми проявлениями заболевания являются:
- Резкое повышение температуры тела.
- Головная боль.
- Парестезия.
- Возбужденное состояние.
- Сонливость.
- Расстройства ЖКТ.
Дальнейшее развитие симптомов затрагивает неврологическую систему:
- Поражается все отделы ЦНС.
- Появляются грозные симптомы, которые могут угрожать жизни – дыхательные и глотательные сбои.
- Нарушение чувствительности.
- Трудности и задержка мочеиспускания.
- Синдром Броун-Секара.
- Снижение или выпадение рефлексов сухожилий.

Особенности заболевания
Разделяют первичную и вторичную форму. Острый энцефаломиелит (первичный) зачастую имеет вирусную природу. Вторичная форма – развитие болезни как следствие других факторов и патологий. Самым новым видом является миалгический энцефаломиелит, который также называют синдромом послевирусной усталости. В зависимости от локализации заболевание может вызывать поражение все нервной системы или ее отдельных частей.
Чем опасно заболевание
Опасность, которую может нести заболевание, зависит от его локализации, типа, серьезности поражения. Даже при наличии адекватного лечения пациенты, излечившись, сталкиваются со следующими проблемами:
- Параличи и парезы.
- Снижение кожной чувствительности.
- Изменение координации движений.
- Психические патологи.
- Судороги.
- Расстройства вегетативной нервной системы.
- Пиелонефрит.

Некоторые формы заболевания не проходят бесследно и могут перейти в хроническое состояние. Чем раньше будет начато лечение – тем больше шансов выздороветь полностью. Если терапия начинается через неделю-две после начала болезни, необратимых последствий не избежать. Если лечение не поступает, прогноз крайне неблагоприятный.
Диагностика
Процесс диагностики начинается со сбора анамнеза, осмотра пациента и выделения основных провоцирующих факторов в процессе консультации невролога. Также обязательным элементом является МРТ обследование. В качестве дополнительных исследований назначают анализ крови, мочи, при необходимости – кала.
Лечение
Зависит от особенностей патологии. В основном это антибиотики, противовирусные, поддерживающие препараты.
- Рассеянный энцефалит требует применения стероидных противовоспалительных в сочетании с иммуномодуляторами и иммуноглобулином.
- Если концентрация антител, вырабатываемых иммунной системой, слишком велика, назначается плазмаферез – очистка плазмы.

- Если поражены ядра черепных нервов, проводится реанимация с искусственной вентиляцией легких.
Консультация невролога
|
Наименование услуги |
Цена |
|
|
1500 |
|
|
5000 |
|
|
1000 |
|
|
1300 |
Где получить консультацию?
Запись на прием к неврологу необходима в случае обнаружения любых тревожных симптомов из описанных выше. Специалист ЦКБ РАН проведет консультацию, даст рекомендации, назначит диагностику и лечение, если это будет необходимо. Запись на прием доступна по номерам, указанным на сайте.
Специалист ЦКБ РАН проведет консультацию, даст рекомендации, назначит диагностику и лечение, если это будет необходимо. Запись на прием доступна по номерам, указанным на сайте.
Особенности течения у детей острого рассеянного энцефаломиелита
Т.И. Стеценко, Национальная медицинская академия последипломного
образования имени П.Л. Шупика, г. Киев
Острый рассеянный энцефаломиелит (ОРЭМ) – самостоятельное аутоиммунное
демиелинизирующее заболевание ЦНС [1]. Эта особая форма демиелинизирующего
заболевания головного и спинного мозга развивается в течение нескольких часов
или дней после перенесенной вирусной инфекции (реже микоплазменной или
бактериальной) или применения вакцин, но иногда возникает без явных причин
(идиопатическая форма) [1].
Этиопатогенез. У детей ОРЭМ в 70% случаев вызывается вирусами, в 21% –
бактериями, в 9% – как поствакцинальное осложнение [2]. Чаще идентифицируют
вирусы герпеса I, VI типов – до 50%, вирус Эпштейна–Барр – до 24%,
цитомегаловирус – до 17%, нейроборрелиоз – до 3% и другие [2, 3]. В последнее
В последнее
время высказываются предположения о том, что в качестве этиологического фактора
ОРЭМ могут выступать некоторые бактериальные инфекции (β-гемолитический
стрептококк группы А, легионелла, лептоспира, риккетсия, микоплазма, боррелия)
[4, 5]. Реже ОРЭМ диагностируют после краснухи, при эпидемическом паротите,
гриппе, парагриппе, инфекцион-ном мононуклеозе. Наиболее часто в детском
возрасте ОРЭМ предшествуют корь (1 : 1000), ветряная оспа (1 : 10 000) и
краснуха (1 : 20 000) [6]. У отдельных больных ОРЭМ возникает после
неспецифических инфекций верхних дыхательных путей или без видимой причины.
Доказать прямое воздействие вируса на ЦНС до сих пор не удалось. Механизмы
аутоиммунной реакции на основной белок миелина, запускаемой вирусом, неизвестны.
Возможно, она обусловлена молекулярной мимикрией (сходством между антигенами
вируса и ЦНС) либо сенсибилизацией к основному белку миелина, вызванной вирусным
поражением ЦНС. Восприимчивость или другие условия возникновения данной болезни,
скорее всего, результат сочетания нескольких факторов, в том числе генетических
и инфекционных агентов и, возможно, других экологических факторов [7]. Острый
Острый
рассеянный энцефаломиелит, развившийся после инфекционного процесса,
диагностируют как постинфекционный. Ранее поствакцинальный ОРЭМ наблюдали при
вакцинации против бешенства вакциной Семпла, которую получают из головного мозга
взрослых животных, обработанного фенолом. Однако в большинстве стран (но не во
всех) данную вакцину уже не применяют. В отдельных случаях (1-2 случая на 1 млн
привитых) живая вакцина против кори вызывает поражение ЦНС, сходное с ОРЭМ.
Кроме того, в литературе имеются данные, что вакцины против гепатита, коклюша,
дифтерии, эпидемического паротита, краснухи, пневмококка, ветряной оспы, гриппа,
японского энцефалита и полиомиелита также могут приводить к возникновению ОРЭМ
[7, 8]. Таким образом,
поствакцинальный энцефаломиелит в большинстве случаев развивается при
использовании вакцины, загрязненной тканями мозга. Необходимо подчеркнуть, что
риск возникновения ОРЭМ у детей в ответ на вакцинацию против кори составляет 1-2
случая на 1 млн привитых [8], что значительно ниже, чем риск развития болезни от
фактического заражения корью, которая составляет 1 случай на 1 тыс. больных
больных
корью (и 1 случай на 5 тыс. больных краснухой) [9]. Поствакцинальный ОРЭМ
возникает на 10-15-й день после вакцинации.
ОРЭМ (в отличие от рассеянного склероза, РС) – однофазное заболевание.
Отмечается сезонность заболеваемости, чаще диагностируют случаи ОРЭМ в холодное
время года – с октября по март. Среди детей несколько чаще болеют мальчики (1,3
: 1), 80% детей, переболевших ОРЭМ, были в возрасте до 10 лет. В зарубежной
литературе можно встретить такое описание данной болезни, как монофазная болезнь
детей препубертатного возраста [7]. Поствакцинальный и постинфекционный ОРЭМ
кодируются
в МКБ-10 в подрубриках G04.0 в блоке G00-G09
«Воспалительные болезни центральной нервной
системы».
Единой классификации ОРЭМ не существует, однако выделяют его особые варианты:
• острый геморрагический лейкоэнцефалит;
• острый поперечный миелит;
• неврит зрительного нерва;
• оптикомиелит;
• церебеллит;
• стволовой энцефалит.
Данные формы заболевания могут быть связаны с инфекцией, вакцинацией, РС,
васкулитами и другими причинами, которые в значительной части случаев остаются
неизвестными (идиопатическая форма) – именно они кодируются в блоке G35-G37 как
демиелинизирующие болезни ЦНС [1].
Патоморфологически поражаются преимущественно белое вещество головного и
спинного мозга, периферические нервы, а также мозговые оболочки. Основное
проявление заболевания – множественные очаги демиелинизации, разнообразные по
величине и характеру клеточной реакции вокруг них, главным образом, в
периваскулярных и субэпендимальных отделах мозга. В участках демиелинизации
обнаруживают грубые изменения не только миелиновых оболочек, но и осевых
цилиндров. Определяются дистрофические изменения и дисциркуляторные явления,
измененная проницаемость сосудистых стенок и клеточных мембран. Топография
демиелинизации соответствует расположению воспалительных инфильтратов [1].
Патоморфологически напоминает экспериментальный аллергический энцефаломиелит.
Клиническая картина. Рассеянный энцефаломиелит у детей характеризуется острым
развитием. Развернутой клинической картине предшествует короткий продромальный
период. Наблюдаются общеинфекционные симптомы: недомогание, катаральные явления
со стороны верхних дыхательных путей, повышение температуры, озноб. Максимальная
Максимальная
выраженность клинической картины приходится на 4-5-й день манифестации
заболевания. Лихорадка имеет важное дифференциально-диагностическое значение, после нее чаще возникают неврологические симптомы.
Примерно у половины больных, особенно у детей раннего возраста, на фоне
продромальных явлений появляются выраженные общемозговые симптомы: головная
боль, рвота, психомоторное возбуждение, судороги
(в 60% случаев) [2], в тяжелых случаях – расстройства сознания, вплоть до комы.
На фоне общемозговых симптомов на 2-7-й день заболевания наблюдается отчетливая
неврологическая симптоматика. Поражение черепных нервов довольно часто, в ряде
случаев оно является ведущим симптомом. Обычно в патологический процесс
вовлекаются бульбарная группа черепных нервов (IX, X, XII), лицевой нерв, реже
глазодвигательные нервы (III, IV, VI). Часто у детей поражаются зрительные нервы
(в большинстве случаев по типу ретробульбарного неврита), реже отмечаются
явления застойных сосков. Двигательные расстройства чаще бывают в виде пара- или
тетраплегии. Парезы и параличи обычно развиваются в ногах, более чем в половине
Парезы и параличи обычно развиваются в ногах, более чем в половине
случаев они носят спастический характер, реже сочетаются с симптомами вялого и
спастического паралича. Определяются парестезии, выпадения поверхностной
чувствительности при относительной сохранности глубокой чувствительности. В
остром периоде выявляются болезненность при пальпации нервных стволов, симптомы
натяжения (Ласега, Вассермана, Мацкевича), в клинически выраженных случаях –
менингеальные симптомы Кернига, Брудзинского,
ригидность мышц затылка. Отмечаются расстройства тазовых функций, чаще –
задержка мочи и кала,
реже – недержание, иногда – трофические нарушения, пролежни. При ОРЭМ на фоне
бактериальной инфекции поражение нервной системы сочетается с поражением других
органов и систем. Так, β-гемолитический стрептококк группы А одновременно
поражает базальные ганглии переднего мозга и клубочкового аппарата почек (острый
гломерулонефрит).
В цереброспинальной жидкости может обнаруживаться цитоз лимфоцитарного характера
в пределах от 20 до 100 клеток в 1 мкл. Одновременно с умеренно выраженным
Одновременно с умеренно выраженным
цитозом может быть небольшое увеличение содержания белка. В острой фазе СОЭ
повышена до 30-40 мм/ч, наблюдаются умеренный лейкоцитоз, эозинофилия [11, 12].
Регресс симптоматики начинается с 14-го дня при адекватно проводимой терапии.
В зависимости от преимущественного поражения различных отделов нервной системы
(головной и спинной мозг, оболочки, корешки и периферические нервы) развиваются
различные симптомокомплексы, в детском возрасте чаще наблюдаются синдромы
энцефаломиелополирадикулоневрита и диссеминированного миелита, реже –
оптикоэнцефаломиелит, полиоэнцефаломиелит.
При энцефаломиелополирадикулоневрите выявляется диффузное поражение мозга.
Оптикоэнцефаломиелит характеризуется поражением головного и спинного мозга,
зрительного нерва, последнее у некоторых больных приводит к слепоте в остром
периоде заболевания.
При полиоэнцефаломиелите в патологический процесс вовлекаются ядра черепных
нервов, реже передних рогов спинного мозга, наблюдается клиника бульбарных
параличей.
При диссеминированном миелите отмечаются нижний спастический парапарез, реже
тетрапарез.
Течение ОРЭМ у детей обычно благоприятное. Восстановительный период длится в
среднем три месяца, в 15-20% случаев у реконвалесцентов сохраняются парезы,
расстройства чувствительности, снижение зрения.
Среди особых вариантов ОРЭМ у детей очень редко (в медицинской литературе до
2006 г. описано менее 100 случаев) встречается острый и подострый
геморрагический лейкоэнцефалит (по МКБ-10 – болезнь Харста – G36.1) [13]. Это
заболевание рассматривается как злокачественный вариант ОРЭМ, при котором
происходит массивное поражение белого вещества больших полушарий и ствола,
сопровождающееся некрозом мелких сосудов и множественными мелкими
кровоизлияниями, он обычно развивается через 1-14 дней после инфекции или без
явных причин и часто заканчивается летальным исходом [1, 3].
Острый рассеянный энцефаломиелит следует дифференцировать от энцефалита при
кори, ветряной оспе, гриппе, от энцефаломиелитической формы полиомиелита, РС.
Трудно отличить ОРЭМ от РС, поскольку оба являются воспалительными
демиелинизирующими заболеваниями ЦНС и могут проявляться в виде полисимптоматики
после перенесенной вирусной инфекции или вакцинации. В помощь клинической
диагностике заболевания используют МРТ. В Т2-режиме и режиме FLAIR изменения при
ОРЭМ практически идентичны таковым при РС и отличаются только тем, что очаги
демиелинизации более мелкие и более диффузно распространены. Регистрируются
гиперинтенсивные билатеральные асимметричные очаги разного размера, часто
сливные, накапливающие гадолиниевый контраст (узловое, пятнистое, кольцевидное,
гетерогенное накопления) [14, 15]. Дифференцировать ОРЭМ, который является
однофазным заболеванием, от РС иногда
позволяет МРТ с контрастированием. При РС МРТ может выявить очаги как
накапливающие, так и не накапливающие контраст, что указывает на «рассеянность
процесса во времени», то есть в динамике новые повреждения белого вещества
отмечаются при РС, а при ОРЭМ их нет [16, 17]. При исследовании ликвора, как и
При исследовании ликвора, как и
при РС, иногда можно обнаружить олигоклональные антитела. Однако их выявляют при
ОРЭМ менее чем в 50% случаев, после стихания процесса они исчезают, при РС
обнаруживаются в
95% случаев и, появившись однажды, присутствуют
в цереброспинальной жидкости постоянно.
Лечение ОРЭМ, как аутоиммунного воспалительного заболевания, должно быть
направлено на подавление избыточного ответа иммунной системы, но до настоящего
времени проведено очень мало полноценных двойных слепых контролируемых плацебо
исследований по доказательной терапии данного заболевания теми или иными
препаратами. Тем не менее, лечение, направленное на резкое снижение воспаления
ЦНС, является стандартным во всем мире. Препаратами первой линии считаются
высокие дозы внутривенных кортикостероидов [18], такие как метилпреднизолон
(предпочтительнее) или дексаметазон. Метилпреднизолон вводят в дозах до 1000 мг/сут
в течение 3-5 дней [6]. Затем
3-6 недель назначают пероральный прием данных препаратов (преднизолон вводят
внутрь в дозе
60-80 мг/сут в течение 7 суток, затем каждую неделю дозу снижают на 20 мг) [10].
Прием лекарств менее трех недель часто приводит к рецидиву. В некоторых случаях
целесообразно дополнительное проведение противоотечной терапии с использованием
осмотических диуретиков. При эпилептических припадках следует назначать
противоэпилептические препараты в зависимости от типа припадка. Альтернативной
терапией при отсутствии эффекта от кортикостероидов или невозможности их
применения выступают плазмаферез через день в течение 2 недель [19], высокие
дозы иммуноглобулинов (внутривенное введение) и циклофосфамид. При
неэффективности монотерапии можно использовать комбинацию метилпреднизолона и
иммуноглобулина [20, 21]. Учитывая аллергический компонент в патогенезе
заболевания необходимо назначение антигистаминных средств. При наличии
бактериальной инфекции применяют антибиотики. В подостром и восстановительном
периодах необходима активная нейрореабилитация, включающая лечебную физкультуру,
массаж, физио- и бальнеопро-цедуры. Особое внимание следует обращать на состояния, ухудшающие общий прогноз
заболевания: наличие у пациента дыхательных расстройств, требующих
своевременного перевода на искусственную вентиляцию легких, инфекций
мочевыводящих путей, при которых назначают уросептики.
Исход с полным выздоровлением наблюдается в 75% случаев, в 15-20% случаев
сохраняются парезы, нарушение чувствительности, снижение зрения [11]. В связи с
этим актуальными вопросами остаются правильная диагностика и назначение в
максимально кратчайшие сроки адекватной терапии, которые позволят снизить
инвалидизацию детей.
Литература
1. Справочник по формулированию клинического диагноза болезней нервной системы /
Под ред. В.Н. Штока, О.С. Левина. – М.: ООО «Медицинское информационное
агентство», 2006. – 520 с.
2. Евтушенко С.К. Рассеянный склероз у детей: 25-летний опыт диагностики и
лечения // Международный неврологический журнал. – 2006. – № 3 (7).
3. Руководство по неврологии по Адамсу и Виктору / Морис Виктор, Алан Х.Роппер.
– М.: ООО «Медицинское информационное агентство», 2006. – 680 с.
4. Fenichel G.M. Neurological complications of immunization // Ann Neurol. –
1982. – Vol. 12. – P. 119-28.
5. Griffin D.E., Giffles D. et al. Myelin basic protein as an encephalitogen in
encephalomyelitis and neuritis following rabies vaccination // N Eng J Med. –
–
1987. – Vol. 316. – P. 369-74.
6. Спирин Н.Н., Степанов И.О., Касаткин Д.С., Шипова Е.Г. Диагностика,
дифференциальная диагностика и принципы терапии острого рассеянного
энцефаломиелита // Неврология. – 2008. – № 2.
7. Leake J.A., Albani S., Kao A.S. et al. Acute disseminated encephalomyelitis
in childhood: epidemiologic, clinical and laboratory features // Pediatr Infect
Dis. – 2004. – Vol. 23 (8). – P. 756-764.
8. Murthy J.M. Acute disseminated encephalomyelitis // Neurol India. – 2002. –
Vol. 50 (3). – P. 238-243.
9. Fenichel G.M. Neurological complications of immunization // Ann Neurol. –
1982. – Vol. 12 (2). – P. 119-128.
10. Неврология / Под ред. М. Самуэльса. – М.: Практика, 1997. – 640 с.
11. Бадалян Л.О. Детская неврология / Учебн. пособие. – М.: ООО «МЕДпресс»,
1998. – 576 с.
12. Гузева В.И., Михайлов И.Б. Фармакотерапия нервных болезней у взрослых и
детей / Руководство для врачей. – СПб: ООО «Издательство ФОЛИАНТ», 2002. – 400
с.
13. Davies N.W., Sharief M.K., Howard R.S. Infection-associated encephalopathies:
Davies N.W., Sharief M.K., Howard R.S. Infection-associated encephalopathies:
their investigation, diagnosis, and treatment //
J Neurol. – 2006. – Vol. 253 (7). – P. 833-845.
14. Bizzi A., Ulug A.M., Crawford T.O. et al. Quantitative proton MR
spectroscopic imaging in acute disseminated encephalomyelitis // Am J
Neuroradiol. – 2001. – Vol. 22. – P. 1125-1130.
15. Hynson J.L., Kornberg A.J., Coleman L.T. et al. Clinical and neuroradiologic
features of acute disseminated encephalomyelitis in children // Neurology. –
2001. – Vol. 56. – P. 1308-1312.
16. Черний В.И, Шраменко Е.К., Бувайло И.В., Островая Т.В. Демиелинизирующие
заболевания нервной системы и возможности дифференцированной терапии в остром и
подостром периодах // Международный неврологический журнал. – 2007. – №3 (13).
17. Sevon M., Sumelahti M.-L. et al. Рассеянный склероз в детском возрасте и его
прогноз // Международный неврологический журнал. – 2007. – №2 (12).
18. Tenembaum S., Chamoles N. , Fejerman N. Acute disseminated encephalomyelitis:
, Fejerman N. Acute disseminated encephalomyelitis:
a long-term follow-up study of 84 pediatric patients // Neurology. – 2002. –
Vol. 59 (8). – P. 1224-1231.
19. Keegan M., Pineda A.A., McClelland .RL. et al. Plasma exchange for severe
attacks of CNS demyelination: predictors of response // Neurology. – 2002. –
Vol. 58. – P. 143-146.
20. Feasby T., Banwell B., Benstead T. et al. Guidelines on the use of
intravenous immune globulin for neurologic conditions // Transfus Med Rev. –
2007. – Vol. 21 (Suppl 1). – P. 57-107.
21. Ravaglia S., Piccolo G., Ceroni M. et al. Severe steroid-resistant
post-infectious encephalomyelitis: general features and effects of IVIg // J
Neurol. – 2007. – Vol. 254 (11).
Симптомы рассеянного склероза — особенности клинической картины и диагностические “ловушки”
Рассеянный склероз часто становится диагнозом исключения. Почему? Во-первых, это редко встречающееся заболевание, о котором врач не всегда задумывается сразу же. Во-вторых, так как область поражения — ЦНС (центральная нервная система), возникает широкий разброс симптоматики: от упорной слабости и проблем со зрением до нарушений походки и недержания мочи. Рассказываем, с чем можно спутать рассеянный склероз и в чем особенности его клинической картины.
Рассказываем, с чем можно спутать рассеянный склероз и в чем особенности его клинической картины.
Кратко о важном
При рассеянном склерозе затрагиваются особые структуры ЦНС — миелиновые нервные волокна. Они отвечают за проведение нервных импульсов — и в зависимости от того, в какой области ЦНС локализованы повреждения, возникают расстройства чувствительности (к холоду, теплу, боли, вибрации), подвижности тела, а также нарушения в эмоционально-психической сфере.
Рассеянный склероз — хроническое заболевание с неуклонным прогрессированием, но если начать терапию на ранней стадии, его течение замедляется, пациент получает шанс избежать инвалидности.
На поздних стадиях, как правило, существенного улучшения ждать не приходится, хотя современные возможности реабилитации позволяют повысить качество жизни, частично восстановить утраченные функции тела.
Симптомы с вопросительным знаком
При демиелинизирующих заболеваниях (а рассеянный склероз относится именно к этой группе патологий) старт симптоматики может быть размытым:
- слабость в руках и ногах, общее недомогание
- быстрая утомляемость
- головокружение
- головная боль
- онемение конечностей, лица, ощущение покалывания, «ползания мурашек» по телу, сниженная или, наоборот, повышенная чувствительность к холоду, теплу, иным раздражителям
- болевые ощущения — в глазах при движении глазных яблок, в области лица, шеи, ног (стреляющего, жгучего, распирающего характера, иногда даже с появлением красноты и отечности кожи)
- внезапное ухудшение или потеря зрения (как правило, с одной стороны)
- недержание мочи
Стоит отметить, что далеко не всегда перечисленные признаки появляются одновременно. Может доминировать один или два, что более характерно.
Может доминировать один или два, что более характерно.
Из-за этого пациенты или не обращаются к врачу сразу (списывая слабость на усталость, а «мурашки» и онемение, например, руки — на остеохондроз), или идут к тому специалисту, чей профиль наиболее соответствует симптому (офтальмологу при расстройстве зрения, урологу при проблемах с мочеиспусканием).
Как скоро они попадут на прием к неврологу и будет ли сразу же заподозрен рассеянный склероз? Увы, часто драгоценное время теряется впустую — с ожиданием в очередях, с задержкой выполнения исследования МРТ (магнитно-резонансная томография) или по причине того, что диагностический поиск ушел в сторону и предполагается совсем другая болезнь.
«Маски» рассеянного склероза
Ошибки в диагностике для неврологических заболеваний — не редкость, поскольку одна и та же патология у разных пациентов может проявляться по-разному. Сказываются индивидуальные особенности организма, перенесенные инфекции, хронические болезни, возраст, пол… На клиническую картину, ее яркость влияют десятки факторов — и врачу иногда приходится двигаться буквально вслепую, чтобы найти четкие доказательства тех или иных нарушений.
Рассеянный склероз может быть принят за:
Кабинет рассеянного склероза | Научно-практический центр детской психоневрологии
На основании приказа Департамента здравоохранения города Москвы №5 от 10.01.2007 «Об организации специализированного кабинета для лечения детей и подростков, страдающих рассеянным склерозом, в Детской психоневрологической больнице №18» на базе поликлинического отделения больницы (сегодня — Научно-практический центр детской психоневрологии) был создан Кабинет по лечению детей и подростков с рассеянным склерозом и другими демиелинизирующими заболеваниями.
Только за последние пять лет в рамках работы Кабинета было проконсультировано более 600 пациентов и подтверждено 76 новых случая рассеянного склероза только у Московских детей и подростков.
Адекватное лечение, назначенное на ранних этапах заболевания, позволяет достоверно замедлить темпы его прогрессирования и достичь стойкой и продолжительной ремиссии.
Специалисты кабинета РС:
- Нанкина Ирина Аркадьевна, врач-невролог, к.м.н.
- Быкова Ольга Владимировна, врач-невролог, д.м.н.
- Платонова Анна Николаевна, врач-невролог, к.м.н.
В кабинете РС проводятся консультации пациентов с подозрением на демиелинизирующий процесс на основании клинических проявлений (преходящие нарушения зрения и глазодвигательные расстройства, парезы и пароксизмальные состояния, чувствительные и координаторные расстройства, дизартрию, гиперкинезы и дистонии, нейрогенную дисфункцию мочевыводящих путей) и/или изменений на МРТ головного или спинного мозга.
В случае необходимости уточнения диагноза пациенты проходят амбулаторное, или стационарное обследование на базе НПЦ. Зачастую, перечисленные выше жалобы не имеют никакого отношения к рассеянному склерозу и обусловлены другими заболеваниями. В этом случае только слаженная работа мультидисциплинарной бригады высококвалифицированных специалистов профильного ЛПУ способна оказать пациенту необходимую профессиональную помощь.
В кабинете РС специалисты консультируют и динамически наблюдают пациентов с диагнозами:
- рассеянный склероз
- демиелинизирующее заболевание ЦНС
- энцефаломиелит
- миелит
- демиелинизирующая полинейропатия
- оптический неврит
Маршрутизация, внесение в регистр и лекарственное обеспечение педиатрических пациентов с рассеянным склерозом сотрудниками кабинета осуществляется в соответствии с приказом Департамента здравоохранения города Москвы от 14.06.2016года № 506 «О Порядке обеспечения лекарственными препаратами лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, лиц после трансплантации органов и (или) тканей в городе Москве» и, согласно приказу контролируется лично главным внештатным детским специалистом неврологом Департамента здравоохранения города Москвы – Батышевой Татьяной Тимофеевной. Включение сведений о первичных больных рассеянным склерозом предоставляются в ГБУЗ «ЦЛО ДЗМ» и в Федеральный регистр (или извещение об исключении сведений о больном из Федерального регистра) по формам, утвержденным Министерством здравоохранения Российской Федерации.
Включение сведений о первичных больных рассеянным склерозом предоставляются в ГБУЗ «ЦЛО ДЗМ» и в Федеральный регистр (или извещение об исключении сведений о больном из Федерального регистра) по формам, утвержденным Министерством здравоохранения Российской Федерации.
Для записи на консультацию в кабинет РС необходимо иметь:
- Направление на консультацию из поликлиники по месту прикрепления
- Паспорт одного из родителей
- Свидетельство о рождении ребенка или паспорт ребенка при достижении 14 лет
- Страховой полис ребенка.
Уважаемые пациенты и их родители
В настоящее время, согласно рекомендациям МАВРС (Медицинской ассоциации врачей и центров рассеянного склероза и других нейроиммунологических заболеваний) будут изменены подходы к срокам проведения иммуномодулирующей терапии ПИТРС.
Изменения, в основном, коснутся препаратов цитостатического действия и препаратов для биологической терапии.
https://centrems. com/specialists/recomendations/
com/specialists/recomendations/
По всем вопросам Вы можете обратиться по электронной почте [email protected]
Для консультации необходима предварительная запись по телефону регистратуры поликлиники +7 (495)430-02-29.
Консультация иногородних пациентов осуществляется на платной основе. Запись по телефону регистратуры платного консультативного отделения:
+7(495) 437 97 29 , +7 (968) 786 45 44.
Областной центр рассеянного склероза. Платные услуги — Новосибирская областная больница
Областной центр рассеянного склероза организован в мае 2000 года по приказу Областного управления здравоохранения (№ 62 от 15.02.1999 г.). До этого в течение 20 лет (с декабря 1980 года) специализированный прием больных рассеянным склерозом (РС) обеспечивался сотрудниками кафедры неврологии медицинского института. С первых дней эту работу начала Малкова Надежда Алексеевна, будучи тогда младшим научным сотрудником ЦНИЛа НГМИ. Сегодня Новосибирский областной центр рассеянного склероза является одним из старейших и уважаемых в России. С момента организации Центра Н. А. Малкова является его руководителем.
С момента организации Центра Н. А. Малкова является его руководителем.
Основными задачами Центра РС являются:
— консультативный прием с целью диагностики, решения вопросов о назначении патогенетической терапии, её мониторинга и оценки её эффективности и переносимости;
— проведение обследования и лечения по показаниям в условиях неврологической клиники;
— ведение областного регистра РС;
— проведение обучающих семинаров, конференций, чтение лекций;
— научно-исследовательская работа.
В последние несколько лет ситуация с рассеянным склерозом существенно изменилась:
— значительно увеличилось число болеющих (за 30 лет нашей работы количество практически удвоилось), на учете состоит более 2000 человек;
— принятие федеральной программы » 7 нозологий» в 2007 году потребовало ведения областного сегмента Федерального регистра РС, определения потребности, составления годовых заявок на дорогостоящие препараты, а также — ежемесячные разнарядки и контроль использования этих лекарственных средств (отслеживание остатков). К сожалению федеральная программа не предусматривала организацию системы ведения больных с высоко затратными нозологиями (создание специализированных кабинетов, центров). Практически вся нагрузка по выполнению программы в большинстве регионов легла на внештатных главных специалистов. За прошедшие 9 лет по всей России постепенно возникли необходимые структуры, но без единых принципов, нормативов;
К сожалению федеральная программа не предусматривала организацию системы ведения больных с высоко затратными нозологиями (создание специализированных кабинетов, центров). Практически вся нагрузка по выполнению программы в большинстве регионов легла на внештатных главных специалистов. За прошедшие 9 лет по всей России постепенно возникли необходимые структуры, но без единых принципов, нормативов;
— благодаря программе «7 нозологий» стали доступны современные эффективные дорогостоящие препараты для патогенетической терапии РС, что требует очень тщательного подхода как к постановке диагноза, так и к постоянному мониторингу состояния больных с оценкой переносимости и эффективности получаемой терапии (клинически и по МРТ — картине). На 2016 г. около 800 больных Новосибирска и области получают это лечение, что составляет примерно 30% от общего количества пациентов, состоящих на учёте.
— с 2006 года Центр активно участвует в международных многоцентровых клинических исследованиях новых лекарственных средств лечения РС, проводимых на договорной основе в ГНОКБ. Это даёт возможность неврологам Центра приобретать опыт работы с новыми, более мощными препаратами, а для больных — это возможность более эффективной терапии.
Это даёт возможность неврологам Центра приобретать опыт работы с новыми, более мощными препаратами, а для больных — это возможность более эффективной терапии.
Годы работы показали, что существует целый ряд нозологий близких по патогенезу, клинике, принципам диагностики и тактике ведения больных. Это спектр аутоиммунных заболеваний нервной системы, количество которых в последние годы стремительно увеличивается. В этой связи появилась насущная необходимость расширить задачи Центра РС за счет включения больных с этими заболеваниями. В первую очередь это — сложная в диагностике и терапии, часто угрожающая жизни больных, миастения гравис, а также — острые и хронические воспалительные полинейропатии, острый рассеянный энцефаломиелит, спектр оптикомиелитассоциированных расстройств, первичные и вторичные васкулиты ЦНС и другие, более редкие, формы.
В 2012 году проведена реорганизация Центра. С сентября 2012 года он носит название Областной центр рассеянного склероза и других аутоиммунных заболеваний нервной системы.
Центр РС и других АИЗ НС функционирует в Областной больнице как самостоятельное подразделение и включает в себя 2 консультативных кабинета неврологов, кабинет психолога и психотерапевта, кабинет регистра в Областной поликлинике (ОП), 10 коек в 8-ом неврологическом отделении стационара.
Сибирские ученые приблизились к пониманию механизмов рассеянного склероза
Сотрудники лаборатории ферментов репарации Института химической биологии и фундаментальной медицины СО РАН под руководством заведующего лабораторией доктора химических наук Георгия Александровича Невинского совместно с коллегами из НИИ фундаментальной и клинической иммунологии изучают экспериментальный аутоиммунный энцефаломиелит (ЭАЭ) у мышей, который является моделью рассеянного склероза человека (РС).
При рассеянном склерозе иммунная система по ошибке разрушает миелин (вещество, образующее оболочку нервных волокон) в головном и спинном мозге. В результате организм начинает бороться сам с собой, вырабатывая антитела или агрессивные клоны лимфоцитов.2008/23/16.jpg) Так как этот процесс происходит постепенно, болезнь может долго не проявляться, к тому же в настоящее время не существует надежных методов ее прогнозирования и лечения.
Так как этот процесс происходит постепенно, болезнь может долго не проявляться, к тому же в настоящее время не существует надежных методов ее прогнозирования и лечения.
«Рассеянный склероз у человека и экспериментальный энцефаломиелит у мышей имеют сходные признаки, — комментирует сотрудница ИХБФМ СО РАН и аспирантка Новосибирского государственного университета Ксения Сергеевна Аулова. — И в том и в другом случае наблюдается повышение в крови уровня антител к белкам миелина. Также при обоих заболеваниях в сыворотке крови обнаруживаются антитела, обладающие необычными каталитическими свойствами: подобно ферментам, они могут расщеплять различные молекулы — например, фрагменты собственной ДНК, попавшие во внеклеточное пространство при гибели клеток. ДНК присутствует и в крови здоровых доноров, и при различных инфекциях и аутоиммунных патологиях. Однако антитела, расщепляющие ДНК, отсутствуют в крови здоровых пациентов и являются маркерами патологических процессов».
Для «запуска» заболевания у лабораторных животных им обычно вводят белок миелина, провоцирующий иммунный ответ. Ученые активировали ЭАЭ у мышей с помощью трех различных антигенов (веществ, которые организм рассматривает как чужеродные или потенциально опасные. — Прим. ред.), предположительно участвующих в развитии РС: белка миелин-олигодендроцитарного гликопротеина (МОГ), а также фрагмент ДНК из тимуса теленка в комплексе с двумя различными видами белков (бычьим сывороточным альбумином и гистонами).
Эксперимент проводили в течение 60 дней. Каждые две недели после введения чужеродных веществ ученые анализировали у мышей различные параметры заболевания, такие как вес, протеинурию (уровень белка в моче), уровень антител к белкам миелина и ДНК, а также уровень апоптоза (гибели) и пролиферации (деления) лимфоцитов, выделенных из органов животных: тимуса, селезенки, костного мозга, лимфоузлов. У контрольных (неиммунизированных) мышей те же параметры изучались на протяжении всего срока эксперимента.
Также ученые исследовали у животных гемопоэтические стволовые клетки костного мозга, отвечающие за образование всех видов клеток крови.
«Считается, что различные патологии и аномалии при аутоиммунных заболеваниях берут начало именно в костном мозге. Различные нарушения в процессах образования элементов крови могут привести к образованию “вредных” лимфоцитов, приводящих к разрушению миелина, и другим нежелательным реакциям в иммунной системе», — поясняет Ксения Аулова.
Лимфоциты всегда присутствуют в организме здоровых людей, но находятся под строгим контролем иммунной системы. В железе под названием тимус эти клетки проходят «обучение», нацеленное на предотвращение аутоиммунных реакций. Но иногда в механизмах обучения происходят сбои. Это может привести к тому, что часть лимфоцитов, считающих «врагами» собственные ткани организма, становится причиной заболеваний.
Исследование показало, что все три антигена способствовали развитию экспериментального энцефаломиелита, но при этом для двух антигенов из трех иммунизация привела к замедленному проявлению признаков заболевания.
«Появление антител с каталитической активностью, которые расщепляют ДНК, являются одним из ранних симптомов аутоиммунного заболевания. При введении МОГ эта активность у мышей возникает на ранних этапах: спустя 6—8 дней. А при использовании комплексов ДНК — гораздо позднее: через 22 дня, то есть фактически уже после острой фазы заболевания», — рассказывает Ксения Аулова.
Сотрудники ИХБФМ СО РАН планируют продолжить исследования на трансгенных линиях мышей, у которых некоторые параметры иммунной системы генетически располагают к развитию ЭАЭ.
«Работа была поддержана грантом РНФ (№ 16-15-10103). Проводя такой эксперимент, мы можем понять, что инициировать заболевание способна реакция клеток иммунной системы не только на белки миелина (в норме они не должны на них реагировать), но и на собственную ДНК, которая также может играть значительную роль в развитии таких аутоиммунных патологий, как ЭАЭ и РС.Таким образом, впервые изучен вклад ДНК в формирование энцефаломиелита у мышей и, вероятно, РС у человека. Эта фундаментальная работа, возможно, приведет к тому, что мы лучше поймем механизм зарождения этого коварного заболевания», — говорит Ксения Аулова.
Новости центра — МЕДЭКСПЕРТ
04.07.2016
МРТ с контрастом при рассеянном склерозе
Магнитно-резонансная томография (МРТ) при рассеянном склерозе дает уникальные диагностические возможности. C помощью МРТ можно уверенно дифференцировать это заболевание от множества других со схожей симптоматикой.
Зачастую МРТ выявляет ошибочность ранее поставленного диагноза и неправильность проводимого лечения. И это не удивительно. Ведь рассеянный склероз – «заболевание-хамелеон», неврологические признаки которого легко спутать с другими заболеваниями. К ним относятся воспалительные аутоиммунные процессы – системная красная волчанка (СКВ), синдром Шенгрена, рассеянный энцефаломиелит, гранулематоз. Рассеянный склероз можно спутать также с сосудистыми заболеваниями головного и спинного мозга, опухолями, инфекционными заболеваниями (бруцеллез, клещевой боррелиоз и др.), дегенеративными процессами (фуникулярный миелоз и др.). Особо важную роль играет МРТ с контрастом при диагностике рассеянного склероза спинного мозга, позволяя дифференцировать его от стеноза вследствие межпозвоночной грыжи или протрузии диска, травмы позвоночника, опухоли.
К ним относятся воспалительные аутоиммунные процессы – системная красная волчанка (СКВ), синдром Шенгрена, рассеянный энцефаломиелит, гранулематоз. Рассеянный склероз можно спутать также с сосудистыми заболеваниями головного и спинного мозга, опухолями, инфекционными заболеваниями (бруцеллез, клещевой боррелиоз и др.), дегенеративными процессами (фуникулярный миелоз и др.). Особо важную роль играет МРТ с контрастом при диагностике рассеянного склероза спинного мозга, позволяя дифференцировать его от стеноза вследствие межпозвоночной грыжи или протрузии диска, травмы позвоночника, опухоли.
МРТ с контрастом при рассеянном склерозе значительно повышает точность диагностики. Внутривенное введение контрастного вещества на основе гадолиния приводит к его накоплению в очагах демиелинизации – бляшках, которые образуются при рассеянном склерозе. МРТ с контрастом позволяет выявить бляшки даже самого малого размера и отслеживать динамику их роста. Полная безопасность МРТ позволяет проводить обследование многократно. Это дает возможность не только контролировать развитие заболевания, но и оценить эффективность проводимого лечения.
Это дает возможность не только контролировать развитие заболевания, но и оценить эффективность проводимого лечения.
МРТ с контрастом выявляет очаги поражения, не видимые при обычном обследовании (особенно в коре и подкорковом сером веществе), а также повторное образование ранее исчезнувших очагов или активизацию старых очагов. Очень важно, что МРТ помогает выявить обострение заболевание, которое не всегда проявляется явными симптомами, что повышает точность диагностики в 5-10 раз.
Одно из последних исследований, проведенное в Университете Альберты (University of Alberta), Эдмонтон, Канада, раскрывает принципиально новые возможности МРТ для контроля развития рассеянного склероза. Этот метод основан на обнаружении очагов накопления железа в сером веществе головного мозга с помощью томографа повышенной мощности. По словам руководителей исследования, Алана Вилмана (Alan Wilman) и Грегга Блевинса (Gregg Blevins), мониторинг содержания железа в мозге позволит с большей точностью оценить эффективность проводимого лечения.
Острый диссеминированный энцефаломиелит (ADEM) | Национальное общество рассеянного склероза
ADEM — это кратковременный, но интенсивный приступ воспаления головного и спинного мозга, а иногда и зрительного нерва, который вызывает повреждение миелина.
- Симптомы ADEM возникают быстро, обычно начинаются с энцефалопатии, включая поведенческие изменения, такие как спутанность сознания или чрезмерная раздражительность, а также изменение сознания (например, летаргия, кома).
- Повреждение миелина может также вызывать неврологические симптомы, аналогичные наблюдаемым при рассеянном склерозе, такие как потеря зрения на один или оба глаза, вызванные невритом зрительного нерва, слабостью и потерей координации.
- ADEM может возникать в связи с вирусной или бактериальной инфекцией, как осложнение вакцинации или вакцинации или без предшествующей причины.
- Дети чаще взрослых болеют АДЕМ.
ADEM иногда ошибочно принимают за тяжелую первую атаку рассеянного склероза, поскольку некоторые из симптомов этих двух расстройств могут быть схожими. Однако ADEM обычно — но не всегда — состоит из одного эпизода или атаки, длящейся недели или месяцы, в то время как MS проявляет множество атак с течением времени.
Однако ADEM обычно — но не всегда — состоит из одного эпизода или атаки, длящейся недели или месяцы, в то время как MS проявляет множество атак с течением времени.
- Доктора часто используют магнитно-резонансную томографию (МРТ) для поиска старых и новых поражений головного и спинного мозга; старые участки повреждения предполагают, что состояние продолжается и может быть рассеянным склерозом, а не ADEM.
- При отсутствии старых поражений трудно отличить тяжелые первые приступы от того, что в конечном итоге будет диагностировано как РС от ADEM.
- По этой причине врач внимательно наблюдает за пациентом с ADEM, чтобы определить, не предполагает ли рецидив или прогрессирование РС.
Дифференцировать ADEM от MS важно, потому что рекомендации по лечению значительно отличаются; Людям с рассеянным склерозом обычно требуется какая-либо форма продолжения лечения лекарствами, модифицирующими болезнь, в то время как людям с ADEM этого не требуется.
Узнайте больше об ADEM через Национальный институт неврологических расстройств и инсульта или Ассоциацию поперечного миелита.
Острый диссеминированный энцефаломиелит или рассеянный склероз: может ли первоначальное проявление помочь в постановке правильного диагноза?
Диагностическое различие между острым диссеминированным энцефаломиелитом (ОДЭМ) и рассеянным склерозом (РС) важно в основном по прогностическим причинам.Ожидается, что у детей с ADEM все будет хорошо, тогда как у детей с РС больше шансов разовьется значительная инвалидность. Способность замедлить прогрессирование рассеянного склероза с помощью иммуномодулирующих препаратов еще раз подчеркивает важность своевременного и точного диагноза. За последние пять лет было опубликовано несколько больших серий сообщений о клинических особенностях детской ADEM, MS и различиях между ними. 3– 8 Большая серия наблюдений у детей с первым эпизодом воспалительной демиелинизации центральной нервной системы (ЦНС) показала гораздо более высокую скорость прогрессирования рассеянного склероза, чем сообщалось ранее. 8 Клинические признаки этих излечимых расстройств являются предметом настоящего обзора. С самого начала необходимо указать, что клинические и лабораторные различия между ADEM и MS являются только тенденциями и не обеспечивают жестких диагностических критериев.
8 Клинические признаки этих излечимых расстройств являются предметом настоящего обзора. С самого начала необходимо указать, что клинические и лабораторные различия между ADEM и MS являются только тенденциями и не обеспечивают жестких диагностических критериев.
ДИАГНОСТИЧЕСКАЯ ДИЛЕММА
Целью исследования данного обзора является решение диагностической дилеммы, представленной на рис. 1. Являются ли ADEM и MS отдельными клиническими расстройствами или частью спектра заболеваний? По определению, оба случая ADEM и MS должны демонстрировать диссеминированное заболевание ЦНС (более одного клинического или радиологического центра).Заболевания, изолированные в определенных областях ЦНС (изолированный неврит зрительного нерва, поперечный миелит и дисфункция ствола мозга), считаются отличными от ADEM и MS (клинически и прогностически) и не будут обсуждаться в этом обзоре. 8, 9
Рисунок 1
Диагностическая дилемма: являются ли ADEM и MS отдельными клиническими образованиями или частью одного и того же демиелинизирующего спектра?
ДЕМОГРАФИЯ
Монофазный ADEM чаще встречается у детей, тогда как MS чаще встречается у взрослых.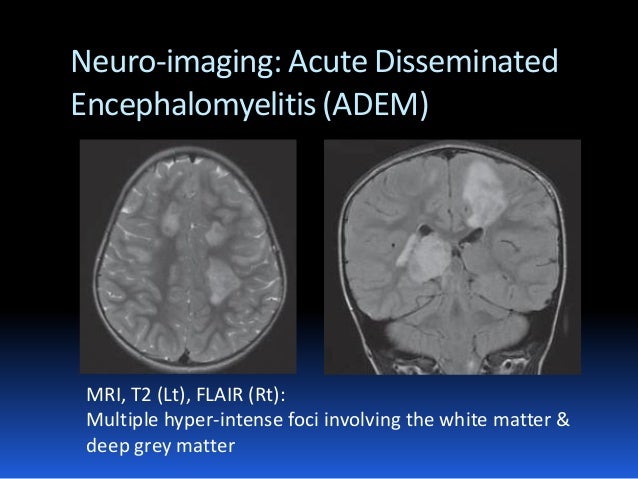 От 2,7% до 4,4% случаев РС возникают у детей младше 16 лет. 8 Mikaeloff et al показали средний возраст 7,1 и 12,0 лет у детей с ADEM и MS, соответственно. 8 В большинстве отчетов ADEM описывается пиковая заболеваемость у детей 3–10 лет. 3– 6 Подросток с первым демиелинизирующим событием с большей вероятностью разовьется рассеянным склерозом, чем ребенок младшего возраста. 3, 8 В большинстве серий ADEM не удалось показать преобладание пола, хотя некоторые серии показывают умеренное преобладание мужчин. 3, 5, 8 Напротив, женщины более предрасположены к развитию рассеянного склероза, особенно в подростковом и взрослом возрасте. 8
От 2,7% до 4,4% случаев РС возникают у детей младше 16 лет. 8 Mikaeloff et al показали средний возраст 7,1 и 12,0 лет у детей с ADEM и MS, соответственно. 8 В большинстве отчетов ADEM описывается пиковая заболеваемость у детей 3–10 лет. 3– 6 Подросток с первым демиелинизирующим событием с большей вероятностью разовьется рассеянным склерозом, чем ребенок младшего возраста. 3, 8 В большинстве серий ADEM не удалось показать преобладание пола, хотя некоторые серии показывают умеренное преобладание мужчин. 3, 5, 8 Напротив, женщины более предрасположены к развитию рассеянного склероза, особенно в подростковом и взрослом возрасте. 8
ОСАДИТЕЛЬНАЯ ИНФЕКЦИЯ И СЕЗОННОСТЬ
Как и следовало ожидать от опосредованного инфекцией синдрома, ADEM чаще всего проявляется зимой и весной. 3, 4 От 51% до 74% пациентов с ADEM имели в анамнезе провоцирующую инфекцию со средней латентностью примерно две недели. 3– 6, 8 Большое количество инфекций может вызвать ADEM, хотя выделение конкретного возбудителя встречается редко (классические инфекционные преципитенты включают корь, вирус Эпштейна-Барра, микоплазмы и стрептококки группы A). 1, 10 Хотя инфекции могут спровоцировать рецидив рассеянного склероза, связь с инфекциями и сезонностью менее выражена (только 16% пациентов имеют инфекцию в предыдущем месяце 8 ).
3– 6, 8 Большое количество инфекций может вызвать ADEM, хотя выделение конкретного возбудителя встречается редко (классические инфекционные преципитенты включают корь, вирус Эпштейна-Барра, микоплазмы и стрептококки группы A). 1, 10 Хотя инфекции могут спровоцировать рецидив рассеянного склероза, связь с инфекциями и сезонностью менее выражена (только 16% пациентов имеют инфекцию в предыдущем месяце 8 ).
НЕВРОЛОГИЧЕСКИЕ СИМПТОМЫ И ПРИЗНАКИ
Пациенты с ADEM с большей вероятностью будут иметь энцефалопатию, и им может быть первоначально поставлен диагноз вирусного энцефалита. 3, 8 Пациенты с ADEM обычно страдают головной болью, рвотой, сонливостью и менингизмом. Эти симптомы не характерны для рассеянного склероза. 3, 6, 8 Судорожные припадки возникают у 13–35% пациентов с ADEM, хотя они редко бывают такими проблемными, как при вирусном энцефалите, который с большей вероятностью затрагивает серое вещество коры. 3– 6 Напротив, при рассеянном склерозе судороги считаются редкостью. 11
3– 6 Напротив, при рассеянном склерозе судороги считаются редкостью. 11
Поскольку и ADEM, и MS являются диссеминированными заболеваниями ЦНС, возможен широкий спектр неврологических признаков.При обоих заболеваниях часто встречаются пирамидные, мозжечковые и стволовые признаки. 3, 8 Энцефалопатия с подавленным сознанием и измененной сенсорией чаще встречается при ADEM (45–75%) 3– 6, 8 , чем при MS (13–15%). 3, 8 Неврит зрительного нерва (ON) встречается как при ADEM, так и при MS. ON часто бывает двусторонним при ADEM, тогда как при РС он обычно односторонний. 1, 3, 12, 13 Исследование Моррисси также отметило важность рассмотрения наследственной оптической невропатии Лебера (митохондриальная мутация) у детей с двусторонним оптическим невритом / невропатией. 13 Поскольку ADEM имеет тенденцию быть более ярким, часто наблюдается множество симптомов и признаков (полисимптоматическое проявление), тогда как симптомы и признаки обычно изолированы (моносимптоматичны) при РС. 3, 8
3, 8
ХАРАКТЕРИСТИКИ КРОВИ И ЦСЖ
В соответствии с взрывным постинфекционным феноменом у пациентов с ADEM часто наблюдаются повышенные маркеры воспаления (количество лейкоцитов, скорость оседания эритроцитов) и лимфопения. 3, 4, 6 Напротив, в MS они часто нормальны. 3 CSF чаще показывает повышенное количество белка и клеток (лимфоцитоз) при ADEM, хотя нормальные и ненормальные признаки CSF встречаются как при ADEM, так и при MS. 3– 6, 8 Одним из наиболее различающих выводов СМЖ является наличие интратекального синтеза олигоклональных полос (олигоклональный IgG в СМЖ, но не в сыворотке), который встречается у 40–95% пациентов с РС, но только 0–29% пациентов с ADEM. 3, 5, 6, 8 В самом деле, некоторые авторитеты серьезно поставили бы под сомнение диагноз РС, если бы не было интратекального синтеза олигоклонального IgG.
МАГНИТНО-РЕЗОНАНСНЫЙ НЕЙРОИЗАЙД
MRI является важной частью исследования ADEM и MS. И ADEM, и MS показывают диссеминированные воспалительные поражения по всей ЦНС (хотя преимущественно в белом веществе). Иногда возникают большие новообразования, которые могут потребовать биопсии. 5, 6, 14 В ряде исследований сообщалось о различиях в визуализации между детским ADEM и MS. Поражения в ADEM часто имеют плохо очерченные края, 3– 6, 15 , тогда как поражения MS имеют четко определенные «бляшкообразные» края. 16 Есть различия и в местах поражения. Поражения периакведукта, мозолистого тела и перивентрикулярного белого вещества характерны для рассеянного склероза. 3, 15 Напротив, при ADEM поражения, как правило, находятся в более глубоком белом веществе с сохранением перивентрикулярности (только 29–60% пациентов с ADEM имеют перивентрикулярные поражения) (рис. 2). 3, 4, 6 Когда спинной мозг вовлечен в ADEM, поражение обычно бывает большим, опухшим и грудным.Поражения спинного мозга при РС обычно меньше по размеру, более дискретны и имеют шейный отдел. Кроме того, хотя белое вещество классически вовлечено в оба расстройства, серое вещество (как корковое, так и глубокие серые / базальные ганглии) часто участвует в ADEM (в отличие от MS). 3– 5, 15, 17, 18 Постстрептококковая ADEM проявляет особую предрасположенность к поражению базальных ганглиев. 19 Недавнее МРТ-исследование 116 детей с первым эпизодом воспалительной демиелинизации показало, что перпендикулярные поражения мозолистого тела и единственное наличие четко определенных повреждений были наиболее специфическими прогностическими факторами рецидива (хотя они имели низкую чувствительность). 20
2). 3, 4, 6 Когда спинной мозг вовлечен в ADEM, поражение обычно бывает большим, опухшим и грудным.Поражения спинного мозга при РС обычно меньше по размеру, более дискретны и имеют шейный отдел. Кроме того, хотя белое вещество классически вовлечено в оба расстройства, серое вещество (как корковое, так и глубокие серые / базальные ганглии) часто участвует в ADEM (в отличие от MS). 3– 5, 15, 17, 18 Постстрептококковая ADEM проявляет особую предрасположенность к поражению базальных ганглиев. 19 Недавнее МРТ-исследование 116 детей с первым эпизодом воспалительной демиелинизации показало, что перпендикулярные поражения мозолистого тела и единственное наличие четко определенных повреждений были наиболее специфическими прогностическими факторами рецидива (хотя они имели низкую чувствительность). 20
Рисунок 2
(A) МРТ головного мозга (взвешенное по Т2) при РС, показывающее хорошо разграниченные поражения в области перивентрикулярного белого вещества. (B) МРТ головного мозга (взвешенное по T2) в ADEM, показывающее большое новообразование в белом веществе. (C) МРТ головного мозга в ADEM, показывающая множественные большие поражения с плохо очерченными краями и относительной перивентрикулярной щадью.
(B) МРТ головного мозга (взвешенное по T2) в ADEM, показывающее большое новообразование в белом веществе. (C) МРТ головного мозга в ADEM, показывающая множественные большие поражения с плохо очерченными краями и относительной перивентрикулярной щадью.
Последующая МРТ полезна для дифференциации ADEM / MS. Как и следовало ожидать, новые поражения не должны возникать при ADEM (0–9% пациентов с ADEM имеют новые поражения при последующем наблюдении). 3, 5, 21, 22 Исходные поражения ADEM полностью разрешаются у 27–55% пациентов с ADEM, хотя чаще (45–64%) поражения рассасываются только частично. 3, 20, 21 Напротив, ожидается появление новых поражений при РС. 17 Время повторного сканирования очень важно, так как слишком поспешное повторное сканирование может вызвать путаницу, если пациент все еще находится в острой / подострой фазе. Время задержки в шесть месяцев после презентации было бы целесообразным для повторного сканирования (при наличии клинических показаний).
СРАВНЕНИЕ С ИССЛЕДОВАНИЯМИ ДЛЯ ВЗРОСЛЫХ
Поскольку рассеянный склероз у взрослых является обычным явлением, клинические, лабораторные и визуальные особенности хорошо документированы. Напротив, ADEM у взрослых встречается редко, и часто пациенты, у которых изначально был диагностирован рецидив ADEM, переклассифицируются как MS. Одно исследование ADEM у взрослых показало, что из 40 пациентов у 14 развился рассеянный склероз в среднем через 38 месяцев. 23 Вероятность того, что эта взрослая когорта ADEM все еще «заражена» РС, возможна. 18 Тем не менее, исследование взрослых действительно выявило различия между ADEM и MS, аналогичные тем, которые описаны в педиатрических когортах: а именно, предшествующая инфекция, лихорадка, менингизм, снижение сознания, лимфоцитоз CSF и поражения MR серого вещества были более распространены в ADEM. Интратекальный синтез олигоклональных полос, перивентрикулярные / мозолистые поражения белого вещества чаще встречались при РС. 23 Однако различия были менее выражены у взрослых, чем у детей, и с меньшей вероятностью отличили ADEM от MS при обращении. 18, 23
23 Однако различия были менее выражены у взрослых, чем у детей, и с меньшей вероятностью отличили ADEM от MS при обращении. 18, 23
ЛЕЧЕНИЕ
Контролируемых испытаний по определению эффективности иммуномодулирующих препаратов при детском РС или ADEM не проводилось. Однако большинство пациентов с подозрением на воспалительные демиелинизирующие заболевания ЦНС получают стероиды. Обычной практикой является внутривенное введение 10–30 мг / кг / сут метилпреднизолона (максимум 1 г) в течение трех дней, хотя некоторые врачи применяют преднизолон внутрь или даже откладывают лечение, если состояние пациента спонтанно улучшается. 3– 6 Исследования показали, что постепенный курс перорального приема преднизолона (более 2–6 недель) снижает вероятность раннего рецидива, то есть MDEM (хотя эти исследования были ретроспективными). 3, 22 Профилактическая иммуномодуляция для предотвращения рецидивов рассеянного склероза не была тщательно протестирована при детском рассеянном склерозе. Для пациентов разумно продолжать принимать противовирусные препараты и антибиотики до тех пор, пока не будет исключен вирусный / бактериальный энцефалит. 5, 10
Для пациентов разумно продолжать принимать противовирусные препараты и антибиотики до тех пор, пока не будет исключен вирусный / бактериальный энцефалит. 5, 10
РЕЗУЛЬТАТ
Недавнее важное исследование французских детей (n = 296), перенесших один эпизод острой воспалительной демиелинизации ЦНС, выявило более высокий риск прогрессирования рассеянного склероза, чем сообщалось ранее (57%). 8 Это исследование подчеркнуло необходимость осторожности при консультировании родителей относительно риска дальнейших событий.
Результаты ADEM часто хорошие: 57–81% пациентов полностью выздоравливают. 3– 5, 21 У детей, перенесших один эпизод воспалительной демиелинизации, неблагоприятные прогностические факторы необратимой инвалидности включают: последствия после первого эпизода, полисимптоматические проявления, прогрессирующее развитие и количество рецидивов в первые два года. 8, 24, 25
8, 24, 25
ЗАКЛЮЧЕНИЕ
В недавно опубликованных отчетах о ADEM и MS у детей были выявлены некоторые различия между этими двумя состояниями, которые рассмотрены на рис. 3. Следует повторить, что эти особенности являются только тенденциями, и диагностического теста на рассеянный склероз не существует. Несмотря на значительные успехи в нашем понимании патогенеза воспалительных демиелинизирующих заболеваний ЦНС, единственным действительно надежным диагностическим тестом остается время.
Рисунок 3
Различия между клиническими исследованиями и исследованиями между ADEM и MS (только тенденции). * МРТ поражения, кроме белого вещества.
Благодарности
RCD имеет стипендию для обучения, присужденную Action Medical Research и трастом Barnwood House. Мы хотели бы поблагодарить Гэвина Джованнони за его поддержку.
ССЫЛКИ
- ↵
Целис АЦ , Лисак РП.
 Острый диссеминированный энцефаломиелит. В: Antel J, Birnbaum G, Hartung HP, eds. Клиническая нейроиммунология. Blackwell Science 1998: 116–146.
Острый диссеминированный энцефаломиелит. В: Antel J, Birnbaum G, Hartung HP, eds. Клиническая нейроиммунология. Blackwell Science 1998: 116–146. - ↵
McDonald WI , Compston A, Edan G, et al. Рекомендуемые диагностические критерии рассеянного склероза: рекомендации Международной группы экспертов по диагностике рассеянного склероза. Энн Нейрол, 2001; 50: 121–7.
- ↵
Dale RC , de Sousa C, Chong WK, et al. Острый диссеминированный энцефаломиелит, многофазный диссеминированный энцефаломиелит и рассеянный склероз у детей. Brain2000; 123 (pt 12): 2407–22.
- ↵
Murthy SN , Faden HS, Cohen ME, et al. Острый диссеминированный энцефаломиелит у детей. Педиатрия 2002; 110 (2 п.1): e21.
- ↵
Tenembaum S , Chamoles N, Fejerman N.
 Острый диссеминированный энцефаломиелит: долгосрочное наблюдение с участием 84 педиатрических пациентов.Неврология, 2002; 59: 1224–31.
Острый диссеминированный энцефаломиелит: долгосрочное наблюдение с участием 84 педиатрических пациентов.Неврология, 2002; 59: 1224–31. - ↵
Hynson JL , Kornberg AJ, Coleman LT, et al. Клинические и нейрорадиологические особенности острого диссеминированного энцефаломиелита у детей. Неврология, 2001; 56: 1308–12.
Gupte G , Stonehouse M, Wassmer E, et al. Острый диссеминированный энцефаломиелит: обзор 18 случаев в детстве. J Paediatr Child Health 3003; 39: 336–42.
- ↵
Mikaeloff Y , Suissa S, Vallee L, et al. Первый эпизод острой воспалительной демиелинизации ЦНС в детстве: прогностические факторы рассеянного склероза и инвалидности. Журнал Педиатр, 2004; 144: 246–52.
- ↵
Brex PA , Miszkiel KA, O’Riordan JI, et al.
 Оценка риска раннего рассеянного склероза у пациентов с клинически изолированными синдромами: роль последующей МРТ.Журнал Neurol Neurosurg Psychiatry, 2001; 70: 390–3.
Оценка риска раннего рассеянного склероза у пациентов с клинически изолированными синдромами: роль последующей МРТ.Журнал Neurol Neurosurg Psychiatry, 2001; 70: 390–3. - ↵
Stonehouse M , Gupte G, Wassmer E, et al. Острый диссеминированный энцефаломиелит: признание в руках педиатров общего профиля. Arch Dis Child 2003; 88: 122–4.
- ↵
Позер CM . Патогенез рассеянного склероза: комментарий. Clin Neurol Neurosurg2000; 102: 191–4.
- ↵
Parkin PJ , Hierons R, McDonald WI.Двусторонний неврит зрительного нерва. Долгосрочное наблюдение. Brain1984; 107 (pt 3): 951–64.
- ↵
Morrissey SP , Borruat FX, Miller DH, и др. Двусторонняя одновременная оптическая нейропатия у взрослых: клинические, визуализирующие, серологические и генетические исследования.
 J Neurol Neurosurg Psychiatry, 1995; 58: 70–4.
J Neurol Neurosurg Psychiatry, 1995; 58: 70–4. - ↵
Кепес Дж. Дж. . Крупные очаговые опухолевидные демиелинизирующие поражения головного мозга: промежуточное звено между рассеянным склерозом и острым диссеминированным энцефаломиелитом? Исследование 31 пациента.Энн Нейрол, 1993; 33: 18–27.
- ↵
Сингх С. , Прабхакар С., Кора И. П., и др. Острый диссеминированный энцефаломиелит и рассеянный склероз: дифференциация с помощью магнитно-резонансной томографии. Австралас Радиол 2000; 44: 404–11.
- ↵
Пати DW , Огер Дж. Дж., Каструков Л.Ф., и др. МРТ в диагностике РС: проспективное исследование со сравнением клинической оценки, вызванных потенциалов, олигоклональных полос и КТ.Неврология 1988; 38: 180–5.
- ↵
Кессельринг Дж.
 , Миллер Д.Х., Робб С.А., и др. Острый диссеминированный энцефаломиелит. Результаты МРТ и отличия от рассеянного склероза. Brain1990; 113 (часть 2): 291–302.
, Миллер Д.Х., Робб С.А., и др. Острый диссеминированный энцефаломиелит. Результаты МРТ и отличия от рассеянного склероза. Brain1990; 113 (часть 2): 291–302. - ↵
Hartung HP , Grossman RI. ADEM: отдельное заболевание или часть спектра рассеянного склероза? Неврология, 2001; 56: 1257–60.
- ↵
Dale RC , Church AJ, Cardoso F, et al. Острый постстрептококковый диссеминированный энцефаломиелит с поражением базальных ганглиев и аутореактивными антителами против базальных ганглиев. Энн Нейрол, 2001; 50: 588–95.
- ↵
Mikaeloff Y , Adamsbaum C, Husson B, et al. Прогностические факторы МРТ для рецидива после острой воспалительной демиелинизации ЦНС в детстве. Brain2004; 127: 1942–7.
- ↵
O’Riordan JI , Gomez-Anson B, Moseley IF, et al.
 Долгосрочное наблюдение с помощью МРТ пациентов с постинфекционным энцефаломиелитом: доказательства монофазного заболевания. J Neurol Sci1999; 167: 132–6.
Долгосрочное наблюдение с помощью МРТ пациентов с постинфекционным энцефаломиелитом: доказательства монофазного заболевания. J Neurol Sci1999; 167: 132–6. - ↵
Anlar B , Basaran C, Kose G, et al. Острый диссеминированный энцефаломиелит у детей: исходы и прогноз. Нейропедиатрия, 2003; 34: 194–9.
- ↵
Schwarz S , Mohr A, Knauth M, et al. Острый диссеминированный энцефаломиелит: повторное исследование с участием 40 взрослых пациентов. Неврология, 2001; 56: 1313–18.
- ↵
Бойко А , Воробейчик Г, Пати Д, и др. Рассеянный склероз с ранним началом: продольное исследование. Неврология, 2002; 59: 1006–10.
- ↵
Simone IL , Carrara D, Tortorella C, et al. Течение и прогноз при РС с ранним началом: сравнение с формами с ранним началом.
 Неврология, 2002; 59: 1922–8.
Неврология, 2002; 59: 1922–8.
Отличие ADEM от MS
На МРТ поражения рассеянного склероза проявляются в виде ярких пятен, демонстрирующих демиелинизацию и текущую активность заболевания, даже когда пациент находится в ремиссии.
Резидент отделения детской неврологии Сара Аминофф Келли видела достаточно детей, переживших демиелинизирующее событие, не зная наверняка, был ли это острый диссеминированный энцефаломиелит (ADEM) или рассеянный склероз (MS). Лечение такого начального приступа может предотвратить будущие рецидивы и снизить риск инвалидности у пациентов с рассеянным склерозом, отметила она на недавних больших раундах педиатрической неврологии, но исследований у детей для выявления пациентов с наибольшей вероятностью развития рассеянного склероза не проводилось.
«Мы всегда говорим родителям, что рассеянный склероз возможен, но у нас нет хорошего способа дать им более точный ответ относительно того, насколько это вероятно», — говорит Келли. «Затем мы наблюдаем за этими детьми с помощью серийных МРТ с течением времени, но трудно сказать, когда мы должны прекратить наблюдение за ними или кого мы должны контролировать в течение более длительного периода времени».
«Затем мы наблюдаем за этими детьми с помощью серийных МРТ с течением времени, но трудно сказать, когда мы должны прекратить наблюдение за ними или кого мы должны контролировать в течение более длительного периода времени».
Хотя ADEM обычно является изолированным явлением, клиническая картина, соответствующая ADEM, может быть первым проявлением рассеянного склероза у детей.Около 45 процентов детей с демиелинизирующим событием будут иметь второе событие, а у 20 процентов детей с диагнозом ADEM будет развиваться РС. Что еще больше сбивает с толку, 18 процентов детей с диагнозом РС испытывают клиническое событие, соответствующее ADEM или РС. Само собой разумеется, отметил Келли, ничто из этого не облегчает прогнозирование после начального события. Но благодаря новым критериям, использующим технологию МРТ, детские неврологи могут иметь повышенную способность обнаруживать демиелинизирующие поражения, вызванные рассеянным склерозом — шаг ближе к различению этих двух состояний после начального события.
На МРТ, пояснил Келли, поражения рассеянного склероза проявляются в виде ярких пятен, демонстрирующих демиелинизацию и текущую активность заболевания, даже когда пациент находится в стадии ремиссии. Поражения можно подсчитать, измерить и даже связать с когнитивными проблемами с памятью, такими как поиск слов или решение проблем. Черные дыры на МРТ показывают более обширную потерю тканей там, где раньше была демиелинизация, и были связаны с постоянной инвалидностью. Однако большинство результатов относится к критериям взрослых, которые не столь чувствительны (правильное определение людей с заболеванием) или специфическим (правильное определение тех, у кого нет заболевания) у детей.Келли сообщил, что рассеянный склероз более агрессивен у детей на МРТ, но не обязательно клинически, с более ранним появлением более интенсивных поражений Т2.
Итак, каковы наилучшие диагностические критерии, выявленные в нескольких педиатрических исследованиях по этому вопросу? Ссылаясь на голландское исследование 49 детей, сравнивающее четыре набора критериев МРТ для диагностики детской ADEM и MS ( Neurology 2010; 74: 1412-1415), Келли отметил, что так называемые критерии Callen MS-ADEM — два или более из ( 1) отсутствие диффузного двустороннего паттерна поражения, (2) присутствие черных дыр и (3) наличие двух или более перивентрикулярных поражений — показали наилучшее сочетание чувствительности (75 процентов) и специфичности (95 процентов).
Хотя критерии полезны, сказал Келли, они не являются окончательными. Для проверки критериев необходимо провести более масштабные исследования с большим количеством пациентов и контрольной группы. «Самый большой сюрприз, — сказал Келли, — это то, что у нас нет достаточно хорошо спланированных исследований, чтобы действительно определить лучший подход к диагностике и лечению этих детей».
Выводы для общественных педиатров?
«Им важно знать, что на данный момент у нас все еще нет хороших инструментов, чтобы узнать, у каких пациентов разовьется РС после первого демиелинизирующего события, даже если он диагностирован как ADEM», — говорит Келли.«Таким образом, они должны контролировать своих пациентов, которым был поставлен диагноз ADEM, на предмет других неврологических проблем и временных неврологических симптомов, таких как глаз, который становится размытым в течение нескольких дней, а затем становится лучше, или нога, которая немеет на несколько дней, а затем становится лучше. Если спросить об этом во время регулярных посещений клиники, это может помочь подобрать детей, у которых может развиться рассеянный склероз ».
Если спросить об этом во время регулярных посещений клиники, это может помочь подобрать детей, у которых может развиться рассеянный склероз ».
Медицинский консьерж
Johns Hopkins предлагает бесплатную помощь в записи на прием и в планировании поездки.Запросить бесплатную помощь:
Все поля обязательны *
Острый диссеминированный энцефаломиелит — NORD (Национальная организация редких заболеваний)
СТАТЬИ В ЖУРНАЛЕ
Поль Д., Тенембаум С. Лечение острого диссеминированного энцефаломиелита. Варианты лечения Curr Neurol.2012; 14: 264-275. http://www.ncbi.nlm.nih.gov/pubmed/22476745
Альпер Дж. Острый диссеминированный энцефаломиелит. J Child Neurol. 2012; [Epub перед печатью]. http://www.ncbi.nlm.nih.gov/pubmed/224
J Child Neurol. 2012; [Epub перед печатью]. http://www.ncbi.nlm.nih.gov/pubmed/224
Лассманн Х. Острый диссеминированный энцефаломиелит и рассеянный склероз. Мозг. 2010; 133: 317-319. http://brain.oxfordjournals.org/content/133/2/317
Behan PO. Острый диссеминированный энцефаломиелит: постинфекционная, постиммунизационная и вариантные формы. Эксперт Rev Neurother.2009; 9: 1321-1329. http://www.ncbi.nlm.nih.gov/pubmed/19769447
Tenembaum SN. Диссеминированный энцефаломиелит у детей. Clin Neurol Neurosurg. 2008; 110: 928-938. http://www.ncbi.nlm.nih.gov/pubmed/18272282
Young NP, Weinshenker BG, Lucchinetti CF. Острый диссеминированный энцефаломиелит: современное понимание и противоречия. Semin Neurol. 2008; 28: 84-94. http://www.ncbi.nlm.nih.gov/pubmed/18256989
Krupp LB, Banwell B, Tenembaum S. Консенсусные определения, предложенные для детского рассеянного склероза и родственных заболеваний.Неврология. 2007; 68: S7-S22. http://www.ncbi.nlm.nih. gov/pubmed/17438241
gov/pubmed/17438241
Тенембаум С., Читнис Т., Несс Дж., Хан Дж. С.. Острый диссеминированный энцефаломиелит. Неврология. 2007; 68: S23-S36. http://www.ncbi.nlm.nih.gov/pubmed/17438235
Лав С. Демиелинизирующие заболевания. J Clin Pathol. 2006; 59: 1151-1159. http://www.ncbi.nlm.nih.gov/pubmed/17071802
Хурана Д.С., Мелвин Дж. Дж., Котар С. В. и др. Острый диссеминированный энцефаломиелит у детей: дискордантные неврологические и нейровизуализационные аномалии и реакция на плазмаферез.Педиатрия. 2005; 116: 431-436. http://www.ncbi.nlm.nih.gov/pubmed/16061599
Leake JA, Albani S, Kao AS, et al. Острый диссеминированный энцефаломиелит в детском возрасте: эпидемиологические, клинико-лабораторные особенности. Pediatr Infect Dis J. 2004; 23: 756-764. http://www.ncbi.nlm.nih.gov/pubmed/15295226
Tenembaum S, Chamoles N, Fejerman N. Острый диссеминированный энцефаломиелит: долгосрочное исследование с участием 84 педиатрических пациентов. Неврология. 2002; 59: 1224-1231. http: //www.ncbi.nlm.nih.gov / pubmed / 123
http: //www.ncbi.nlm.nih.gov / pubmed / 123
Мурти С.Н., Фаден Х.С., Коэн М.Э., Бакши Р. Острый диссеминированный энцефаломиелит у детей. Педиатрия. 2002; 110: e21. http://www.ncbi.nlm.nih.gov/pubmed/12165620
Dale RC, de Sousa C, Chong WK, et al. Острый диссеминированный энцефаломиелит, многофазный диссеминированный энцефаломиелит и рассеянный склероз у детей. Мозг. 2000; 123: 2407-2422. http://www.ncbi.nlm.nih.gov/pubmed/11099444
ИНТЕРНЕТ
Национальный институт неврологических расстройств и Сток.Острый диссеминированный энцефаломиелит. 10 января 2012 г. Доступно по адресу: http://www.ninds.nih.gov/disorders/acute_encephalomyelitis/acute_encephalomyelitis.htm Дата обращения: 30 сентября 2012 г.
Rust RS. Острый диссеминированный энцефаломиелит. Emedicine Journal, 18 ноября 2010 г. Доступно по адресу: http://emedicine.medscape.com/article/1147044-overview Дата обращения: 4 декабря 2010 г.
Заболевания, связанные с рассеянным склерозом
Что такое синдром Сусака? Синдром Сюзака — редкое заболевание, при котором иммунная система организма атакует внутреннюю оболочку мелких кровеносных сосудов в головном мозге, глазах и внутреннем ухе. Атака вызывает отек, который блокирует или частично блокирует кровеносные сосуды, нарушая приток кислорода и питательных веществ.
Атака вызывает отек, который блокирует или частично блокирует кровеносные сосуды, нарушая приток кислорода и питательных веществ.
Синдром Сузака может вызывать проблемы в работе мозга, глаз и внутреннего уха. У людей с синдромом Сусака может быть один приступ или приступы, которые приходят и уходят. В зависимости от типа болезнь может длиться от одного до трех лет или от трех до 10 и более лет
Выздоровление: Большинство людей выздоравливают, и у многих не наблюдается долгосрочных эффектов. У некоторых людей наблюдаются необратимые изменения, такие как потеря слуха или проблемы с мышлением.
Кто заболевает синдромом Сусака? Синдром Сусака встречается у женщин вдвое чаще. Чаще всего поражаются люди в возрасте от 20 до 40 лет.
Симптомы: Признаки синдрома Сусака возникают из-за проблем с мозгом, глазами и внутренним ухом. У некоторых людей симптомы проявляются только в одной или двух областях. У других симптомы проявляются во всех трех областях, но не одновременно.
- Симптомы, связанные с мозгом, включают:
- Кратковременная потеря памяти
- Путаница
- Медленное мышление
- Невнятная речь
- Изменения личности
- Сильные головные боли, часто со рвотой.
- Симптомы, связанные со зрением, включают:
- Темная область в одной части поля зрения
- Зрительные расстройства, такие как потеря бокового зрения или темная тень, закрывающая часть вашего зрения
- Симптомы внутреннего уха включают:
- Потеря слуха
- Головокружение
- Звон в ушах
Лечение: Обычные лекарства от синдрома Сусака подавляют иммунную систему. Эти лекарства, называемые иммунодепрессантами, могут включать кортикостероиды и химиотерапевтический препарат под названием циклофосфамид.
Синдром Сюзака и MS: Синдром Сузака иногда ошибочно принимают за атипичный РС. Сканирование мозга может быть похоже на сканирование пациентов с рассеянным склерозом. Важно увидеть такую команду, как наша, которая может быстро определить разницу. Пациенты с Susac могут увидеть почти полное выздоровление, если их лечить достаточно рано.
Важно увидеть такую команду, как наша, которая может быстро определить разницу. Пациенты с Susac могут увидеть почти полное выздоровление, если их лечить достаточно рано.
Подробнее:
Идентификация паттернов экспрессии генов, имеющих решающее значение для экспериментального аутоиммунного энцефаломиелита и рассеянного склероза
РЕФЕРАТ
После встречи с аутоантигеном, производным от центральной нервной системы (ЦНС), лимфоциты покидают лимфатические узлы и попадают в ЦНС.Это событие редко приводит к последующему повреждению тканей. Гены, имеющие отношение к патологии ЦНС после клеточной инфильтрации, в значительной степени не определены. Экспериментальный аутоиммунный энцефаломиелит (EAE), индуцированный миелин-олигодендроцитами-гликопротеином (MOG), представляет собой животную модель рассеянного склероза (MS), хронического аутоиммунного заболевания ЦНС, которое приводит к инвалидности. Чтобы оценить гены, которые участвуют в энцефалитогенности и последующем повреждении тканей, опосредованном инфильтрирующими клетками ЦНС, мы выполнили анализ микроматрицы ДНК из клеток, полученных из лимфатических узлов и элюированных из ЦНС в LEW. 1AV1 ( RT1 av1 ) крысы, иммунизированные MOG 91-108. Данные сравнивали с иммунизацией одним адъювантом или наивными крысами и с иммунизациями иммуногенным, но не энцефалитогенным пептидом MOG 73-90. Здесь мы демонстрируем участие Cd38 , Cxcr4 и Akt и подтверждаем эти результаты с помощью мышей Cd38 -нокаут (B6.129P2- Cd38 tm1Lnd / J), модуляции S1P-рецептора. во время EAE и количественного анализа экспрессии у лиц с MS.Определенные таким образом основные пути указывают на клеточную активацию и пути миграции, опосредованные рецепторами, сопряженными с G-белком, как решающие события при повреждении ткани ЦНС. Эти пути могут быть дополнительно исследованы для новых терапевтических вмешательств.
1AV1 ( RT1 av1 ) крысы, иммунизированные MOG 91-108. Данные сравнивали с иммунизацией одним адъювантом или наивными крысами и с иммунизациями иммуногенным, но не энцефалитогенным пептидом MOG 73-90. Здесь мы демонстрируем участие Cd38 , Cxcr4 и Akt и подтверждаем эти результаты с помощью мышей Cd38 -нокаут (B6.129P2- Cd38 tm1Lnd / J), модуляции S1P-рецептора. во время EAE и количественного анализа экспрессии у лиц с MS.Определенные таким образом основные пути указывают на клеточную активацию и пути миграции, опосредованные рецепторами, сопряженными с G-белком, как решающие события при повреждении ткани ЦНС. Эти пути могут быть дополнительно исследованы для новых терапевтических вмешательств.
ВВЕДЕНИЕ
Рассеянный склероз (РС) — это заболевание центральной нервной системы (ЦНС), которое приводит к хроническому воспалению, демиелинизации, потере аксонов и нейронов, что приводит к инвалидности (Noseworthy et al. , 2000; Weissert, 2013) .Экспериментальный аутоиммунный энцефаломиелит (EAE), индуцированный миелин-олигодендроцитами-гликопротеинами (MOG) у крыс, воспроизводит основные аспекты патологии человека (Weissert et al., 1998b; Storch et al., 1998; Kornek et al., 2000; Weissert, 2016 ). MOG экспрессируется на внешней поверхности миелиновой оболочки. В отличие от просто опосредованных T-клетками животных моделей, патогенез MOG-индуцированного EAE у крыс включает комбинированное действие T- и B-клеток, антител и макрофагов, имитирующих поражения типа II при РС (Genain et al., 1995; Mathey et al., 2004; Lucchinetti et al., 2000).
, 2000; Weissert, 2013) .Экспериментальный аутоиммунный энцефаломиелит (EAE), индуцированный миелин-олигодендроцитами-гликопротеинами (MOG) у крыс, воспроизводит основные аспекты патологии человека (Weissert et al., 1998b; Storch et al., 1998; Kornek et al., 2000; Weissert, 2016 ). MOG экспрессируется на внешней поверхности миелиновой оболочки. В отличие от просто опосредованных T-клетками животных моделей, патогенез MOG-индуцированного EAE у крыс включает комбинированное действие T- и B-клеток, антител и макрофагов, имитирующих поражения типа II при РС (Genain et al., 1995; Mathey et al., 2004; Lucchinetti et al., 2000).
Энцефалитогенные пептиды, представленные на молекулах MHC класса II Т-клеткам, приводят к программе, которая заставляет лимфоциты активироваться и мигрировать к ЦНС (Riedhammer and Weissert, 2015). Адъювант вносит свой вклад, влияя на множественные сигнальные пути в лимфоцитах, а также в органах-резидентных клетках, таких как ЦНС. Ранее мы продемонстрировали, что MOG 91-108 является основным детерминантом для запуска заболевания у крыс, экспрессирующих гаплотипы RT1 av1 или RT1 n (Weissert et al. , 2001). Интересно, что способность MOG 91-108 индуцировать ЕАЕ была диссоциирована в отношении экспрессии цитокинов Th2 или Th3 в лимфоидной ткани по сравнению с ЦНС. Более того, различные пептиды, производные от MOG 1-125, такие как MOG 73-90, были иммуногенными, показывая сильные ответы Th2, но не были энцефалитогенными. Для индукции активного EAE у конгенных линий крыс LEW MHC и крыс Dark Agouti (DA) ( RT1 av1 ) не требуется применение коклюшного токсина, как у мышей. Это преимущество, поскольку точная роль токсина коклюша в индукции EAE до сих пор не ясна.Токсин коклюша подавляет белки Gi и тем самым влияет на множество клеточных процессов и путей (Dumas et al., 2014). Активный EAE у чувствительных линий крыс индуцируется иммунизацией энцефалитогенным пептидом, смешанным с минеральным маслом [неполный адъювант Фрейнда (IFA)], с добавлением инактивированной нагреванием микобактерии туберкулеза (MT) в качестве адъюванта [полный адъювант Фрейнда (CFA)]. МТ ведет путем связывания и передачи сигналов через Toll-подобные рецепторы (TLR) к программе активации в ряде типов клеток и также является системным «сигналом опасности» (Mills, 2011).
, 2001). Интересно, что способность MOG 91-108 индуцировать ЕАЕ была диссоциирована в отношении экспрессии цитокинов Th2 или Th3 в лимфоидной ткани по сравнению с ЦНС. Более того, различные пептиды, производные от MOG 1-125, такие как MOG 73-90, были иммуногенными, показывая сильные ответы Th2, но не были энцефалитогенными. Для индукции активного EAE у конгенных линий крыс LEW MHC и крыс Dark Agouti (DA) ( RT1 av1 ) не требуется применение коклюшного токсина, как у мышей. Это преимущество, поскольку точная роль токсина коклюша в индукции EAE до сих пор не ясна.Токсин коклюша подавляет белки Gi и тем самым влияет на множество клеточных процессов и путей (Dumas et al., 2014). Активный EAE у чувствительных линий крыс индуцируется иммунизацией энцефалитогенным пептидом, смешанным с минеральным маслом [неполный адъювант Фрейнда (IFA)], с добавлением инактивированной нагреванием микобактерии туберкулеза (MT) в качестве адъюванта [полный адъювант Фрейнда (CFA)]. МТ ведет путем связывания и передачи сигналов через Toll-подобные рецепторы (TLR) к программе активации в ряде типов клеток и также является системным «сигналом опасности» (Mills, 2011).![]()
Что касается предрасположенности к EAE и MS, исследования профилей экспрессии генов были выполнены для выяснения генов, участвующих в патогенезе заболевания. Был описан ряд интересных генов, таких как остеопонтин (Hur et al., 2007). Ни в одном исследовании не проводилось систематического сравнения профилей экспрессии генов при EAE, в котором систематически сравнивалось влияние адъюванта и антигена на профиль экспрессии клеток, производных лимфатических узлов (LN), или клеток, элюированных из ЦНС больных животных.В настоящем исследовании мы систематически сравнивали профили экспрессии генов клеток из дренирующих LN и клеток, инфильтрирующих ЦНС, которые были элюированы у крыс LEW.1AV1 ( RT1 av1 ), иммунизированных MOG 91-108 в CFA, только CFA и у наивных крыс. Кроме того, мы сравнили профиль экспрессии генов крыс, иммунизированных энцефалитогенным пептидом MOG 91-108, с крысами, иммунизированными неэнцефалитогенным пептидом MOG 73-90. Мы обнаружили дифференциально экспрессируемые гены, которые имеют большое значение для энцефалитогенности. Впоследствии влияние этих генов было проверено разными способами.
Впоследствии влияние этих генов было проверено разными способами.
РЕЗУЛЬТАТЫ
Экспрессия гена после иммунизации энцефалитогенными и неэнцефалитогенными пептидами
Одним из важных вопросов при РС и других воспалительных заболеваниях ЦНС является понимание того, какие аутоантигенные пептиды необходимы для индукции воспаления ЦНС (Riedhammer and Weissert, 2015) . Помимо представления пептидов, производных от аутоантигена, на молекулах MHC и доступности реактивных репертуаров Т-клеток и В-клеток, а также присутствия целевого антигена в ЦНС, существуют пути клеточной активации, которые способствуют развитию заболевания.Эти пути в настоящее время выяснены лишь частично. Мы использовали MOG-индуцированный EAE у крыс LEW.1AV1 ( RT1 av1 ) в качестве модельной системы для воспаления ЦНС. В этой модели EAE детерминанта MOG 91-108 является иммуногенной и энцефалитогенной. Напротив, детерминанта MOG 73-90 является иммуногенной, но не энцефалитогенной. Мы оценили профили экспрессии генов по массивам генов лимфоцитов из дренирующих ЛУ и из лимфоцитов, элюированных из ЦНС.
Мы оценили профили экспрессии генов по массивам генов лимфоцитов из дренирующих ЛУ и из лимфоцитов, элюированных из ЦНС.
Чтобы сосредоточиться на генах, которые действительно имеют отношение к энцефалитогенности, а не просто участвуют в общих воспалительных реакциях, мы сравнили массивы генов LEW.1AV1 ( RT1 av1 ) крыс, иммунизированных энцефалитогенным отрезком MOG MOG 91-108, в наивных крысах LEW.1AV1 ( RT1 av1 ) и крыс, иммунизированных одним адъювантом CFA, а также крыс, иммунизированных не -энцефалитогенный детерминант МОГ 73-90. Мы проанализировали десять сравнений для каждой из наивных групп и групп CFA с MOG 91-108 и пять сравнений для MOG 73-90 с MOG 91-108. Подсчитывали количество сравнений, в которых данный ген имел коэффициент логарифмического сигнала (SLR) выше 1.В таблице 1 мы показываем гены, которые активированы по крайней мере в половине сравнений (= 50%). Помимо Cxcr4 и Cd38 , которые впоследствии были проанализированы более подробно, было обнаружено, что многие гены с известной функцией при патологии EAE и MS имеют повышенную экспрессию у крыс, иммунизированных MOG 91-108, по сравнению с контролем. Это подтверждает наш список генов и подтверждает актуальность генов, ранее не описанных в EAE. В таблице S1 перечислены гены со сниженной экспрессией при EAE.В этом анализе вариабельность между массивами генов была намного выше, и было обнаружено, что меньше генов регулируется с четким паттерном в соответствии с нашими критериями.
Это подтверждает наш список генов и подтверждает актуальность генов, ранее не описанных в EAE. В таблице S1 перечислены гены со сниженной экспрессией при EAE.В этом анализе вариабельность между массивами генов была намного выше, и было обнаружено, что меньше генов регулируется с четким паттерном в соответствии с нашими критериями.
Таблица 1.
Гены с повышенной экспрессией в клетках лимфатических узлов крыс LEW.1AV1 ( RT1 av1 )
Сравнение микрочипов инфильтрирующих ЦНС лимфоцитов, полученных из LEW.1AV1 ( RT1 av1 ) крыс после иммунизации только MOG 91-108, MOG 73-90 и CFA приводили к дифференцированной экспрессии гораздо большего числа генов по сравнению с анализом клеток LN (таблицы S2 и S3).Это может отражать приток различных популяций клеток в ЦНС во время воспалительной атаки. Подобно анализу клеток LN, мы обнаружили, что мРНК Cd38 и Cxcr4 сильно увеличивалась в клетках, инфильтрирующих ЦНС.
Затем мы проанализировали очищенные клетки CD4 + из LN и ЦНС крыс, иммунизированных MOG 91-108 и MOG 73-90. В некоторой степени аналогичные профили экспрессии генов были обнаружены в очищенной популяции клеток CD4 + по сравнению с неотделенными клетками LN (таблица 1, таблицы S4 и S5).
Благодаря их сильной экспрессии у крыс, иммунизированных MOG 91-108, по сравнению с наивными, иммунизированными CFA и MOG 73-90 крысами, мы выбрали Cxcr4 и Cd38 для дальнейшего анализа.
Cxcr4 и Cd38 в EAE у крыс LEW.1AV1 ( RT1 av1 )
Подтвердив наши результаты с помощью количественной ПЦР, мы обнаружили значительную активацию экспрессии Cxcr4 в LN-клетках MOG 91 -108-иммунизированных крыс ( n = 8) по сравнению с иммунизированными CFA ( n = 8, ANOVA, P <0.0001) и наивных ( n = 6, ANOVA, P <0,0001) крыс LEW.1AV1 ( RT1 av1 ) (рис. 1A). Также была измерена повышенная экспрессия Cd38 [крысы, иммунизированные MOG 91-108 ( n = 8) по сравнению с иммунизированными CFA ( n = 8, ANOVA, P <0,05) и наивными ( n = 6, ANOVA, P <0,05) LEW.1AV1 ( RT1 av1 ) крысы].
1A). Также была измерена повышенная экспрессия Cd38 [крысы, иммунизированные MOG 91-108 ( n = 8) по сравнению с иммунизированными CFA ( n = 8, ANOVA, P <0,05) и наивными ( n = 6, ANOVA, P <0,05) LEW.1AV1 ( RT1 av1 ) крысы].
Рис. 1. Экспрессия
Cxcr4 и Cd38 в клетках лимфатических узлов и ЦНС. (A) Количественная ПЦР SYBR-зеленого в реальном времени была проведена для Cxcr4 и Cd38 в лимфатических узлах (LN) от наивных крыс LEW.1AV1 ( RT1 av1 ) (черные полосы, n = 6), или иммунизированные CFA (серые столбцы, n = 8) или MOG 91-108 в CFA (белые столбцы, n = 8), на 12-й день. Повышенная экспрессия Cxcr4 (ANOVA, * P <0,0001) и Cd38 (ANOVA, * P <0,05) была обнаружена в MOG 91-108 у крыс, иммунизированных CFA, по сравнению с наивными и иммунизированными только CFA крысы. (B) Количественная экспрессия Cxcr4 в клетках, элюированных из ЦНС CFA (белые столбцы, n = 6) -, MOG 73-90 в CFA (серые столбцы, n = 6) — и MOG 91- 108 у крыс, иммунизированных CFA ( n = 6) LEW.1AV1 ( RT1 av1 ). У Cxcr4 была повышенная регуляция MOG 91-108 у крыс, иммунизированных CFA, по сравнению с другими группами (ANOVA, * P <0,001) на 12 день p.i. (C) Количественная экспрессия Cd38 лимфоцитов, элюированных из ЦНС CFA (белые столбцы, n = 6) -, MOG 73-90 в CFA (серые столбцы, n = 6) — и MOG 91- 108 в CFA ( n = 6) -иммунизированных LEW.1AV1 ( RT1 av1 ) крысы на 12 сутки p.i. Cd38 был активирован в MOG 91-108 у крыс, иммунизированных CFA, по сравнению с другими группами (ANOVA, * P <0,001). Результаты выражаются в виде значений 2 — ΔΔ CT . Числа средние ± s.e.m.
(B) Количественная экспрессия Cxcr4 в клетках, элюированных из ЦНС CFA (белые столбцы, n = 6) -, MOG 73-90 в CFA (серые столбцы, n = 6) — и MOG 91- 108 у крыс, иммунизированных CFA ( n = 6) LEW.1AV1 ( RT1 av1 ). У Cxcr4 была повышенная регуляция MOG 91-108 у крыс, иммунизированных CFA, по сравнению с другими группами (ANOVA, * P <0,001) на 12 день p.i. (C) Количественная экспрессия Cd38 лимфоцитов, элюированных из ЦНС CFA (белые столбцы, n = 6) -, MOG 73-90 в CFA (серые столбцы, n = 6) — и MOG 91- 108 в CFA ( n = 6) -иммунизированных LEW.1AV1 ( RT1 av1 ) крысы на 12 сутки p.i. Cd38 был активирован в MOG 91-108 у крыс, иммунизированных CFA, по сравнению с другими группами (ANOVA, * P <0,001). Результаты выражаются в виде значений 2 — ΔΔ CT . Числа средние ± s.e.m.
В клетках, элюированных из ЦНС, мы обнаружили повышенную регуляцию Cxcr4 (фиг. 1B) и Cd38 (фиг. 1C) у MOG 91-108-иммунизированных LEW.1AV1 ( RT1 av1 ) крыс ( n = 6) по сравнению с крысами, иммунизированными MOG 73-90 ( n = 6, ANOVA, Cxcr4 и Cd38 , каждая P <0.001) или только CFA ( n = 6, ANOVA, Cxcr4 и Cd38 каждый, P <0,001).
1B) и Cd38 (фиг. 1C) у MOG 91-108-иммунизированных LEW.1AV1 ( RT1 av1 ) крыс ( n = 6) по сравнению с крысами, иммунизированными MOG 73-90 ( n = 6, ANOVA, Cxcr4 и Cd38 , каждая P <0.001) или только CFA ( n = 6, ANOVA, Cxcr4 и Cd38 каждый, P <0,001).
Экспрессия Cxcr4 и Cxcl12 в спинном мозге крыс DA ( RT1 av1 )
Затем мы оценили экспрессию мРНК Cxcr4 (рис. 2A) и его лиганда Cxcl12 (рис. 2B) в спинном мозге либо наивных крыс DA ( RT1 av1 ), либо крыс DA ( RT1 av1 ), иммунизированных только IFA или CFA, или MOG 1-125 в IFA или MOG 1-125 в CFA (каждый n = 4).Повышенная регуляция экспрессии мРНК Cxcl12 и Cxcr4 наблюдалась в CFA- и MOG 1-125 у крыс DA ( RT1 av1 ), иммунизированных CFA, в спинном мозге по сравнению с наивными крысами, которым инъецировали IFA или MOG 1. -125 у крыс DA ( RT1 av1 ), иммунизированных IFA (ANOVA, P <0,001). Повышенная экспрессия мРНК Cxcl12 и Cxcr4 наблюдалась в MOG 1-125 в CFA- по сравнению с иммунизированными CFA DA ( RT1 av1 ) крысами (ANOVA, P <0.01).
-125 у крыс DA ( RT1 av1 ), иммунизированных IFA (ANOVA, P <0,001). Повышенная экспрессия мРНК Cxcl12 и Cxcr4 наблюдалась в MOG 1-125 в CFA- по сравнению с иммунизированными CFA DA ( RT1 av1 ) крысами (ANOVA, P <0.01).
Рис. 2. Экспрессия
Cxr4 и Cxcl12 в спинном мозге крыс DA ( RT1 av1 ). Количественная ПЦР SYBR green в реальном времени была проведена для Cxcr4 (A) и Cxcl12 (B) из ткани спинного мозга, перфузированной PBS, у наивных крыс DA ( RT1 av1 ) ( n = 4) крысы, иммунизированные IFA ( n = 4) или только CFA ( n = 4) и крысы DA, иммунизированные MOG 1-125 в IFA ( n = 4) или MOG 1-125 в CFA ( n = 4) в 12 день р.я. Повышенная экспрессия Cxcr4 и Cxcl12 наблюдалась в спинном мозге крыс DA ( RT1 av1 ), иммунизированных CFA и MOG 1-125 в CFA (ANOVA, * P <0,001). Наблюдалась повышенная регуляция мРНК Cxcr4 и Cxcl12 у крыс DA ( RT1 av1 ), иммунизированных MOG 1-125 в CFA, по сравнению с крысами DA ( RT1 av1 ), иммунизированных только CFA (ANOVA , * P <0,01). Количественные результаты ПЦР выражены в виде значений 2 — ΔΔCT .Числа средние ± s.e.m.
Наблюдалась повышенная регуляция мРНК Cxcr4 и Cxcl12 у крыс DA ( RT1 av1 ), иммунизированных MOG 1-125 в CFA, по сравнению с крысами DA ( RT1 av1 ), иммунизированных только CFA (ANOVA , * P <0,01). Количественные результаты ПЦР выражены в виде значений 2 — ΔΔCT .Числа средние ± s.e.m.
Cxcr4 и CXCL12 у лиц с РС
Повышенная регуляция мРНК CXCR4 также наблюдалась в лейкоцитах у лиц с РС с рецидивирующе-ремиттирующим течением заболевания (RRMS; n = 32) и вторичным хроническим заболеванием. прогрессирующее течение заболевания (SPMS; n = 22) и по сравнению с контролем ( n = 25, ANOVA, RRMS и SPMS каждый P <0,05) (рис. 3A, таблицы S6 и S7). Кроме того, мы обнаружили повышенные уровни белка CXCL12 в сыворотке крови у лиц с RRMS ( n = 24) и SPMS ( n = 28) по сравнению с контролем ( n = 21, ANOVA, RRMS и SPMS каждый P < 0. 05) (рис. 3B, таблицы S6 и S7).
05) (рис. 3B, таблицы S6 и S7).
Рис. 3. Экспрессия
Cxcr4 в лейкоцитах и белок CXCL12 в сыворотке крови пациентов с РС. (A) Cxcr4 мРНК была количественно определена с помощью ПЦР в реальном времени из лейкоцитов людей с ремиттирующим РС (RR-MS; серые столбцы, n = 32), вторичным хронически-прогрессирующим РС (SP-MS ; черные полосы, n = 22) и элементы управления (белые полосы, n = 25). Наблюдалась повышающая регуляция Cxcr4 в обеих группах пациентов по сравнению с контролем (ANOVA, * P <0.05). (B) Уровни CXCL12 в сыворотке оценивались с помощью ELISA у лиц с RR-MS (серые столбцы, n = 24), SP-MS (черные столбцы, n = 28) и контрольной группой (белые столбцы, n = 21). Повышенные уровни CXCL12 в сыворотке были измерены в обеих группах MS по сравнению с контролем (ANOVA, * P <0,05). Количественные результаты ПЦР выражены в виде значений 2 — ΔΔCT . Числа средние ± s.e.m.
Числа средние ± s.e.m.
EAE в B6.129P2-
Cd38 tm1Lnd / J мышей
Cd38 был сильно активирован в энцефалитогенных LN клетках.Чтобы функционально подтвердить наши данные и выяснить роль CD38 в EAE, мы индуцировали заболевание внеклеточным доменом MOG (MOG 1-125) в нокауте Cd38 (B6.129P2- Cd38 tm1Lnd / J). мыши и соответствующие контроли. Мы обнаружили снижение тяжести заболевания у мышей B6.129P2- Cd38 tm1Lnd / J ( n = 22), иммунизированных MOG 1-125, по сравнению с контрольными мышами дикого типа ( n = 21, t — тест, совокупный балл по болезни P <0.01) (рис. 4А). Затем мы определили высоту ответа антител на MOG 1-125. Снижение ответов аутоантител IgG к MOG у мышей B6.129P2- Cd38 tm1Lnd / J ( n = 4) по сравнению с контрольными мышами дикого типа ( n = 4, ANOVA, P <0,05) после иммунизации MOG 1-125 наблюдались (фиг. 4B) на 12 день после иммунизации (pi). Кроме того, у мышей B6.129P2- Cd38 tm1Lnd / J ( n = 4) на 12-й день были снижены также Т-клеточные ответы при рестимуляции MOG 1-125.я. по сравнению с контрольными мышами ( n = 4, t -тест на стимуляцию 50 мкг / мл MOG 1-125, P <0,05), как измерено в анализе пролиферации, что, кроме того, указывает на примирование Т-клеток или дефект экспансии у мышей B6.129P2- Cd38 tm1Lnd / J (рис. 4C).
4B) на 12 день после иммунизации (pi). Кроме того, у мышей B6.129P2- Cd38 tm1Lnd / J ( n = 4) на 12-й день были снижены также Т-клеточные ответы при рестимуляции MOG 1-125.я. по сравнению с контрольными мышами ( n = 4, t -тест на стимуляцию 50 мкг / мл MOG 1-125, P <0,05), как измерено в анализе пролиферации, что, кроме того, указывает на примирование Т-клеток или дефект экспансии у мышей B6.129P2- Cd38 tm1Lnd / J (рис. 4C).
Рис. 4.
EAE у мышей B6.129P2- Cd38 tm1Lnd / J. (A) EAE был индуцирован у самок мышей B6.129P2- Cd38 tm1Lnd / J (белые треугольники) и контроля C57BL / 6J 000664 (черные треугольники) с MOG 1-125 в CFA.В дни 0 и 2 р.и. мышам внутривенно вводили 150 нг коклюшного токсина. ЕАЕ оценивался следующим образом: 0 — нет заболевания; 1 — паралич хвоста; 2 — парапарез; 3 — параплегия; 4 — тетрапаралич; 5, умирающий или мертвый. Иммунизация внеклеточным доменом MOG 1-125 привела к мышам B6.129P2- Cd38 tm1Lnd / J ( n = 22) с более низкой тяжестью заболевания по сравнению с мышами C57BL / 6J 000664 ( n = 21) ( t -тест, совокупный балл болезни, P = 0.01). (B) Антитела против MOG 1-125 измеряли с помощью ELISA, как описано (Weissert et al., 2001). Мыши B6.129P2- Cd38 tm1Lnd / J (белые столбцы, n = 4) имели сниженные антитела IgG и IgG1 по сравнению с мышами C57BL / 6J 000664 (черные столбцы, n = 4) (ANOVA, * P <0,05) на 12 день пи (C) Т-клеточные ответы на рестимуляцию против MOG 1-125 из дренирующих лимфатических узлов (LN) на день 12 p.i. были снижены у мышей B6.129P2- Cd38 tm1Lnd / J (белые треугольники, n = 4) по сравнению с мышами C57BL / 6J 000664 (черные треугольники, n = 4) ( t -тест для стимуляции с 50 мкг / мл MOG 1-125, * P = 0.
Иммунизация внеклеточным доменом MOG 1-125 привела к мышам B6.129P2- Cd38 tm1Lnd / J ( n = 22) с более низкой тяжестью заболевания по сравнению с мышами C57BL / 6J 000664 ( n = 21) ( t -тест, совокупный балл болезни, P = 0.01). (B) Антитела против MOG 1-125 измеряли с помощью ELISA, как описано (Weissert et al., 2001). Мыши B6.129P2- Cd38 tm1Lnd / J (белые столбцы, n = 4) имели сниженные антитела IgG и IgG1 по сравнению с мышами C57BL / 6J 000664 (черные столбцы, n = 4) (ANOVA, * P <0,05) на 12 день пи (C) Т-клеточные ответы на рестимуляцию против MOG 1-125 из дренирующих лимфатических узлов (LN) на день 12 p.i. были снижены у мышей B6.129P2- Cd38 tm1Lnd / J (белые треугольники, n = 4) по сравнению с мышами C57BL / 6J 000664 (черные треугольники, n = 4) ( t -тест для стимуляции с 50 мкг / мл MOG 1-125, * P = 0. 05). Числа средние ± s.e.m.
05). Числа средние ± s.e.m.
Нацеливание на миграцию клеток с помощью FTY720
Мы обнаружили повышенную регуляцию Akt в наших исследованиях дифференциальной экспрессии генов (таблица 1). FTY720 является модулятором рецептора S1P, который, как известно, влияет на транспорт Т-клеток посредством механизма, зависимого от Akt , как и CXCR4 (Mandala et al., 2002; Cyster, 2005; Lee et al., 2001; Brinkmann et al., 2002; Matloubian et al., 2004). Мы оценили ингибирование Akt -зависимого переноса клеток в LEW, иммунизированных MOG 91-108.1AV1 ( RT1 av1 ) крысы. Заболевание полностью подавлялось у крыс, получавших лечение с 0 дня p.i. с FTY720 ( n = 10) по сравнению с контрольными группами, обработанными носителем ( n = 10, t -тест, совокупная оценка болезни P <0,0001) (фиг. 5A). Затем мы проверили эффективность FTY720 для лечения установленного рецидивирующего ремиттирующего MOG 1-125-индуцированного EAE у крыс DA ( RT1 av1 ). Лечение FTY720 было начато на 21 день после первого приступа заболевания ( n = 8) и показало значительное влияние на течение заболевания по сравнению с лечением носителем ( n = 8, t -тест, совокупный балл болезни 21-44 день р.i., P <0,01) (рис. 5B). Для дальнейшего изучения положительного эффекта лечения FTY720 на EAE мы увеличили крыс с помощью MOG 1-125 на 44 день после первой иммунизации. Хотя рецидив был индуцирован в обеих группах, крысы DA, получавшие лечение FTY720, имели лучший клинический результат по сравнению с животными, получавшими носитель ( t -тест, совокупная оценка заболевания на 45-56 день, P <0,0001). На 14 день p.i. обработка FTY720 привела к увеличению относительного размера компартмента CD4 Т-клеток (ANOVA, P <0.01) у обработанных крыс LEW.1AV1 ( RT1 av1 ) ( n = 10) по сравнению с контрольными ( n = 9) одновременно с уменьшением Т-лимфоцитов CD8 (ANOVA, P <0,01) и отсек B-клеток (ANOVA, P <0,01) (фиг.
Лечение FTY720 было начато на 21 день после первого приступа заболевания ( n = 8) и показало значительное влияние на течение заболевания по сравнению с лечением носителем ( n = 8, t -тест, совокупный балл болезни 21-44 день р.i., P <0,01) (рис. 5B). Для дальнейшего изучения положительного эффекта лечения FTY720 на EAE мы увеличили крыс с помощью MOG 1-125 на 44 день после первой иммунизации. Хотя рецидив был индуцирован в обеих группах, крысы DA, получавшие лечение FTY720, имели лучший клинический результат по сравнению с животными, получавшими носитель ( t -тест, совокупная оценка заболевания на 45-56 день, P <0,0001). На 14 день p.i. обработка FTY720 привела к увеличению относительного размера компартмента CD4 Т-клеток (ANOVA, P <0.01) у обработанных крыс LEW.1AV1 ( RT1 av1 ) ( n = 10) по сравнению с контрольными ( n = 9) одновременно с уменьшением Т-лимфоцитов CD8 (ANOVA, P <0,01) и отсек B-клеток (ANOVA, P <0,01) (фиг. 5C; фиг. S1). Обработка FTY720 ( n = 9) по сравнению с контролем ( n = 9) привела к подавлению экспрессии мРНК его рецептора, S1p1 (ANOVA, P <0,0001) и Akt2 (ANOVA , P <0.0001), один из генов, участвующих во внутриклеточном сигнальном каскаде, связанный с S1P1 и CXCR4, на 14 день p.i. Обработка также оказала отрицательный эффект на уровни экспрессии Cd38 (ANOVA, P <0,0001). Напротив, экспрессия Cxcr4 не изменилась (ANOVA, несущественно) (фиг. 5D).
5C; фиг. S1). Обработка FTY720 ( n = 9) по сравнению с контролем ( n = 9) привела к подавлению экспрессии мРНК его рецептора, S1p1 (ANOVA, P <0,0001) и Akt2 (ANOVA , P <0.0001), один из генов, участвующих во внутриклеточном сигнальном каскаде, связанный с S1P1 и CXCR4, на 14 день p.i. Обработка также оказала отрицательный эффект на уровни экспрессии Cd38 (ANOVA, P <0,0001). Напротив, экспрессия Cxcr4 не изменилась (ANOVA, несущественно) (фиг. 5D).
Рис. 5.
Влияние FTY720 на EAE. (A) Самок крыс LEW.1AV1 ( RT1 av1 ) иммунизировали MOG 1-125 в CFA.ЕАЕ оценивался следующим образом: 0 — нет заболевания; 1 — паралич хвоста; 2 — парапарез; 3 — параплегия; 4 — тетрапаралич; 5, умирающий или мертвый. FTY720 полностью ингибировал ЕАЕ у крыс, получавших перорально 0,4 мг / кг массы тела с 0 дня p.i. ежедневно (белые треугольники, n = 10) по сравнению с контролем, обработанным носителем (PBS) (черные треугольники, n = 10) ( t -тест, совокупный балл болезни, P <0,0001). (B) Самки крыс DA ( RT1 av1 ), получавшие перорально 0.4 мг / кг массы тела FTY720 ежедневно, начиная с 21 дня p.i. после первого приступа заболевания (белые треугольники, n = 8) показали снижение курса заболевания по сравнению с контрольными группами, обработанными носителем (PBS) (черные треугольники, n = 8) ( t -тест, совокупный балл болезни день 21-44 пи, Р = 0,01). На 44 день p.i. крысам вводили MOG 1-125 в CFA. Обе группы имели рецидив, но с лучшим исходом для группы, получавшей FTY720 ( t -тест, совокупная оценка болезни на 45-56 день p.i., P <0,0001). (C) FACS-анализ клеток дренирующих лимфатических узлов (LN) продемонстрировал увеличение относительного размера компартмента Т-лимфоцитов CD4 и уменьшение размера компартмента CD8 и В-клеток у обработанных FTY720 (белые столбцы, n = 10) крыс по сравнению с контрольной группой (черные полосы, n = 9) (ANOVA, * P <0,01) на 14 день после исследования.
(B) Самки крыс DA ( RT1 av1 ), получавшие перорально 0.4 мг / кг массы тела FTY720 ежедневно, начиная с 21 дня p.i. после первого приступа заболевания (белые треугольники, n = 8) показали снижение курса заболевания по сравнению с контрольными группами, обработанными носителем (PBS) (черные треугольники, n = 8) ( t -тест, совокупный балл болезни день 21-44 пи, Р = 0,01). На 44 день p.i. крысам вводили MOG 1-125 в CFA. Обе группы имели рецидив, но с лучшим исходом для группы, получавшей FTY720 ( t -тест, совокупная оценка болезни на 45-56 день p.i., P <0,0001). (C) FACS-анализ клеток дренирующих лимфатических узлов (LN) продемонстрировал увеличение относительного размера компартмента Т-лимфоцитов CD4 и уменьшение размера компартмента CD8 и В-клеток у обработанных FTY720 (белые столбцы, n = 10) крыс по сравнению с контрольной группой (черные полосы, n = 9) (ANOVA, * P <0,01) на 14 день после исследования.2007/original_issl/kopakson%20betaferon/IMAGES/MOZG1.jpg) (D) Экспрессия S1p1 ( Edg1 ), Akt2 , Cxcr4 и Cd38 была оценена у крыс, получавших FTY720 (белые столбцы, n = 9), по сравнению с контрольными животными, обработанными носителем (черные столбцы, n = 9) методом количественной ПЦР.Обработка FTY720 привела к подавлению активности S1p1 и Akt2 , а также Cd38 , но не Cxcr4 (ANOVA для всех, кроме Cxcr4 , * P <0,0001) на 14-й день. из клеток, полученных из LN. Результаты выражаются в виде значений 2 — ΔΔCT . Числа средние ± s.e.m.
(D) Экспрессия S1p1 ( Edg1 ), Akt2 , Cxcr4 и Cd38 была оценена у крыс, получавших FTY720 (белые столбцы, n = 9), по сравнению с контрольными животными, обработанными носителем (черные столбцы, n = 9) методом количественной ПЦР.Обработка FTY720 привела к подавлению активности S1p1 и Akt2 , а также Cd38 , но не Cxcr4 (ANOVA для всех, кроме Cxcr4 , * P <0,0001) на 14-й день. из клеток, полученных из LN. Результаты выражаются в виде значений 2 — ΔΔCT . Числа средние ± s.e.m.
ОБСУЖДЕНИЕ
В этом исследовании мы определили генные сети, которые играют решающую роль не только в повышении аутоантиген-специфического иммунного ответа, но и в формировании энцефалитогенности.Мы проанализировали экспрессию и функциональную значимость генов и их продуктов, экспрессируемых на лимфоцитах после иммунизации энцефалитогенным пептидом MOG 91-108 в адъюванте, неэнцефалитогенным пептидом MOG 73-90 в адъюванте, только адъювантом или наивными крысами. Наиболее интересно то, что при сравнении MOG 91-108 в адъюванте с MOG 73-90 у крыс, иммунизированных адъювантом, по сравнению с другими анализами дифференциально экспрессировалось только небольшое количество генов. Эти гены, по-видимому, имеют большое значение, поскольку они участвуют в энцефалитогенном ответе, ведущем к проявлению заболевания.Из общих данных экспрессии мы выбрали три гена, которые были активированы во многих сравнениях: Cxcr4 , Cd38 и Akt . Мы провели функциональные исследования этих генов при EAE и проанализировали образцы тканей людей с РС.
CXCR4 (CD184) представляет собой семи-трансмембранный G-связанный рецептор, экспрессируемый рядом тканей, включая клетки иммунной системы (Campbell et al., 2003). Cxcr4 -нокаутные мыши погибают in utero или перинатально и не только имеют дефекты кроветворной системы (нарушение генерации миелоидов и B-клеток, снижение пролиферации трижды отрицательных и дважды положительных лимфоцитов), но и системы кровообращения и ЦНС (Zou et al., 1998; Tachibana et al., 1998). Сверхэкспрессия CXCR4 на Т-клетках вызывает их накопление в костном мозге и уменьшение этих клеток в периферической крови. Передача сигналов CXCR4 приводит к пролонгированной активации протеинкиназы B (AKT) и регулируемой внеклеточными сигналами киназы 2 в Т-клетках. Активация AKT способствует выживанию клеток и может действовать как костимуляция активации Т-клеток (Tilton et al., 2000). CXCR4 имеет только один известный родственный лиганд, которым является CXCL12. CXCL12 постоянно продуцируется стромальными и эндотелиальными клетками.CXCL12 активирует многочисленные сигнальные пути, такие как ассоциированные с рецептором тримерные G-белки, фосфолипаза Cγ, PI3K и малые G-белки (Pawig et al., 2015). Передача сигналов через эти рецепторы приводит к увеличению внутриклеточной концентрации кальция, реорганизации цитоскелета и миграции клеток. Некоторые модулирующие факторы, такие как фосфатазы, регулятор передачи сигналов G-белка, адаптерные белки и убиквитин, могут влиять на передачу сигналов и / или хемотаксический ответ CXCR4 на его лиганд (CXCL12).Важной функцией CXCR4 / CXCL12 является регуляция гомеостаза костного мозга и перемещения лимфоцитов. Хемотаксис и опосредованная интегрином адгезия являются основными клеточными ответами на CXCL12. Мыши с нокаутом Cxcr4 обнаруживают тот же фенотип, что и мыши с нокаутом Cxcr4 (Nagasawa et al., 1996).
Есть признаки того, что взаимодействие CXCR4 и CXCL12 может быть важным при аутоиммунных заболеваниях. CXCL12 рекрутирует В-клетки в воспаленные клубочки, в которых эти клетки могут продуцировать аутоантитела (Balabanian et al., 2003). Кроме того, при ревматоидном артрите CXCR4 и CXCL12, как предполагается, играют важную роль в преждевременном возникновении болезни (Zhang et al., 2005). Роль CXCR4 и CXCL12 при EAE (Meiron et al., 2008; Kohler et al., 2008; McCandless et al., 2006), а также при РС (Azin et al., 2012; Krumbholz et al., 2006) был описан.
Наши данные показывают, что также при MOG-индуцированном EAE и, возможно, при MS, взаимодействие CXCR4 и CXCL12 имеет первостепенное значение для развития заболевания. Мы обнаружили специфическую повышающую регуляцию Cxcr4 на клетках, полученных из LN и элюированных из ЦНС крыс, иммунизированных энцефалитогенным пептидом MOG 91-108, по сравнению с контролем.Кроме того, мы измерили повышающую регуляцию Cxcl12 и Cxcr4 в спинном мозге у крыс с EAE по сравнению с контролем. CXCL12 активируется в ЦНС людей с РС (Krumbholz et al., 2006 и наши собственные неопубликованные наблюдения). Вместе представленные данные могут служить аргументом в пользу сценария, в котором клетки, происходящие из LN, в контексте встречи с энцефалитогенным антигеном активируются и мигрируют к CXCL12 в ЦНС. Это дополнительно подтверждается тем фактом, что оксид азота усиливает индуцированную липополисахаридом (ЛПС) экспрессию CXCR4 и миграцию к CXCL12 (Giordano et al., 2006).
CD38 представляет собой связанный с мембраной гликопротеин типа II, который действует как рецептор, так и как фермент (Cockayne et al., 1998; Kato et al., 1999; Salmi and Jalkanen, 2005). Как фермент, он катализирует НАД + в циклическую АДФ-рибозу и далее в АДФ-рибозу. Он также регулирует уровни Ca 2+ из хранилищ рианодиновых рецепторов. CD38 экспрессируется на множестве миелоидных и лимфоидных клеток. Лигирование CD38 в В-клетках приводит к фосфорилированию тирозина нескольких внутриклеточных белков, таких как Syk, p85 фосфатидилинозитол-3-киназы и фосфолипазы C-γ (Silvennoinen et al., 1996). Лигирование CD38 в Т-клетках приводит к фосфорилированию киназы Raf-1 / MAP и сигнального пути CD3-ζ / ZAP-70 (Zubiaur et al., 1997). Кроме того, он участвует в миграции дендритных клеток и адгезии между лимфоцитами и эндотелиальными клетками (Partida-Sanchez et al., 2004). Мыши B6.129P2- Cd38 tm1Lnd / J демонстрируют небольшое снижение титров антител к Т-клеточно-зависимым антигенам (Cockayne et al., 1998). Кроме того, у этих мышей была повышенная восприимчивость к бактериальным инфекциям, что, как полагают, вызвано дефектным хемотаксическим ответом нейтрофилов на бактерии, что также подчеркивает их роль во врожденном иммунитете (Partida-Sanchez et al., 2001).
Мы индуцировали ЕАЕ у мышей с нокаутом Cd38 (B6.129P2- Cd38 tm1Lnd / J) и контрольной группы. Мыши с нокаутом Cd38 и имели меньшую тяжесть заболевания и более низкие ответы аутоантител и Т-клеток по сравнению с контролем. Эти данные показывают важность CD38 при EAE и, возможно, MS. Эта работа является основой для дальнейшего анализа вовлеченных клеточных компартментов и регуляции заболеваний человека (Mayo et al., 2008; Lischke et al., 2013).
FTY720 — это сильнодействующее лекарство, которое влияет на перемещение и перемещение лимфоцитов. Наши и другие исследования (Brinkmann et al., 2002; Balatoni et al., 2007) показали сильное положительное влияние FTY720 на EAE в различных экспериментальных условиях. Препарат одобрен для лечения РС (Kappos et al., 2010). Мы демонстрируем, что обработка MOG-индуцированного EAE с помощью FTY720 влияет на экспрессию генов, которые участвуют в энцефалитогенных иммунных ответах. Это еще раз подтверждает наш подход.Мы измерили изменения в экспрессии S1P1 , Akt2 и Cd38 . Интересно, что никаких изменений в экспрессии Cxcr4 не наблюдалось. Причина этого до конца не изучена и заслуживает дальнейшего исследования.
В заключение, в этом исследовании мы идентифицировали гены, которые участвуют не только в повышении аутоантиген-специфических иммунных ответов, но и определяют энцефалитогенность. Иммунизация энцефалитогенными пептидами индуцирует сеть генов, участвующих в активации и миграции лимфоцитов.На основе этой платформы мы установили первостепенное значение G-связанных белков в энцефалитогенности адаптивных иммунных ответов. Мы предполагаем, что подобное поражение может действовать и при других аутоиммунных заболеваниях и, возможно, при отторжении трансплантата, тем самым устанавливая общие механизмы. Эти пути могут быть ценными мишенями терапевтических подходов, поскольку мы показали ослабление EAE после лечения FTY720 или снижение тяжести EAE у мышей с дефицитом CD38. Эти результаты не только подтверждают наши данные об экспрессии генов, но и подчеркивают важность модели EAE крысы в трансляционной медицине.
МАТЕРИАЛЫ И МЕТОДЫ
Животные и индукция EAE
Во всех экспериментах использовали самок крыс или мышей в возрасте 10-14 недель. Крысы LEW.1AV1 ( RT1 av1 ) были получены от Hans Hedrich (Центральная лаборатория животных, Ганноверская медицинская школа, Ганновер, Германия), а крысы DA ( RT1 av1 ) были получены от Harlan Winkelmann (Borchen, Германия). ). Самки мышей B6.129P2- Cd38 tm1Lnd / J и соответствующие контрольные образцы (C57BL / 6J 000664) были приобретены в лаборатории Джексона (Бар-Харбор, США).
Животных выращивали и содержали в определенных условиях, свободных от патогенов. Животным вводили внутрикожно в основание хвоста (крысы) или в оба бока (мыши) 100 мкг MOG 91-108 (крысы) или 50 мкг рекомбинантного MOG 1-125 крыс (крысы) или 100 мкг MOG 35-55. (мыши) или 20 мкг рекомбинантного MOG 1-125 крысы (мыши). Антигены в общем объеме 100 мкл смешивали со 100 мкл CFA (1: 1). Всего 100 мкл CFA состояло из IFA (Sigma-Aldrich, Сент-Луис, Миссури) и 500 мкг для крыс или 400 мкг для мышей, инактивированных нагреванием Mycobacterium tuberculosis (штамм h47 RA; Difco Laboratories, Детройт, Мичиган) (Вайссерт, 2016).Мышам дополнительно вводили 100 нг токсина коклюша (Calbiochem, Дармштадт, Германия) на 0 и 2 день внутривенно. Некоторым группам крыс также вводили 100 мкл IFA, смешанные со 100 мкл MOG 1-125 в PBS (50 мкг) без добавления Mycobacterium tuberculosis или только с IFA или CFA. Клиническая оценка была следующей: 0 = отсутствие болезни; 1 = слабость или паралич хвоста; 2 = парапарез или гемипарез задних ног; 3 = паралич или гемипаралич задних ног; 4 = тетрапарез или умирающий. Все эксперименты были одобрены региональным советом в Тюбингене, Германия.
Образцы человека
Образцы крови были получены после согласия людей с РС и контрольной группы. Характеристики индивидуумов с РС и контроля указаны в таблицах S6 и S7. Исследование было одобрено этическим комитетом Тюбингенского университета в Германии (разрешение 125/2001).
Выделение инфильтрирующих клеток ЦНС
Проникающих из ЦНС клеток получали, как описано ранее (Weissert et al., 1998a, 2001). Вкратце, крыс перфузировали холодным PBS и вырезали мозг и спинной мозг на 12 день p.я. Впоследствии мозг и спинной мозг гомогенизировали в 10 мл 50% перколла / 0,1% BSA / 1% глюкозы (Amersham Pharmacia Biotech), содержащих 500 ед. ДНКазы типа I (Life Technologies). После гомогенизации к каждому образцу добавляли десять мл 50% перколла. Прерывистый градиент перколла получали добавлением 7 мл 63% перколла ниже и 20 мл 30% перколла выше образца. Образцы центрифугировали 40 мин при 1000 g при 4 ° C. Лимфоциты собирали с интерфейса 63/50% Percoll.Затем клетки дважды промывали в 15-25 мл PBS с центрифугированием при 600 g в течение 15 минут при 4 ° C.
Выделение мононуклеарных клеток из лимфатических узлов и селезенки
Дренирующие паховые ЛУ и селезенки иссекали под глубокой анестезией. LN были разрушены, и мононуклеарные клетки (MNC) дважды промыли в среде Игла, модифицированной Дульбекко (DMEM; Life Technologies, Пейсли, Великобритания), ресуспендировали в полной среде (CM), содержащей DMEM с добавлением 5% фетальной телячьей сыворотки (PAA Laboratories Linz, Австрия). , 1% пенициллин / стрептомицин (Life Technologies), 1% глутамин (Life Technologies) и 50 мкМ 2-меркаптоэтанол (Life Technologies) и пропущены через 70-мкм пластиковый фильтр (Falcon; BD Biosciences, Франклин Лейкс, Нью-Джерси).МНК из селезенки получали таким же образом, как и из LN, с той разницей, что эритроциты лизировали буфером для лизиса, состоящим из 0,15 М NH 4 Cl, 10 мМ KHCO 3 и 0,1 мМ Na 2 EDTA, доведенных до pH 7,4. Клетки CD4 + выделяли с помощью микрогранул против CD4 крысы с использованием технологии MACS (Miltenyi Biotech, Bergisch Gladbach, Германия) в соответствии с инструкциями производителя.
Очистка клеток CD4
+
Клетки CD4 + из LN были очищены с помощью MACS (Miltenyi Biotech, Bergisch Gladbach, Германия) и затем проанализированы с помощью массива генов Affymetrix на предмет дифференциальной экспрессии генов.
Ткань спинного мозга
От перфузированных PBS крыс, ранее не подвергавшихся перфузии, или крыс DA, иммунизированных IFA, CFA, MOG 1-125 в IFA или MOG 1-125 в CFA, ткань спинного мозга препарировали и гомогенизировали, а затем оценивали на мРНК. выражение.
Препарат РНК
Суммарную РНК инфильтрирующих головной мозг лейкоцитов или лимфоцитов или ткани спинного мозга выделяли с использованием набора RNeasy (Qiagen, Hilden, Германия) в соответствии с инструкциями производителя. Качество РНК анализировали с помощью Bioanalyser 2100 (Agilent, Palo Alto, CA).
Microarrays
Affymetrix были использованы микрочипы типа RG U34 A (Affymetrix Inc., Санта-Клара, Калифорния), представляющие приблизительно 7000 полноразмерных генов и 1000 кластеров меток экспрессированной последовательности (EST). Для очищенных клеток CD4 + использовали набор экспрессии крысы 230A (Affymetrix), содержащий около 30 000 признаков. Для каждого массива объединяли образцы, по крайней мере, от трех крыс. Меченную биотином кРНК получали и гибридизировали с массивами. Вкратце, двунитевую кДНК синтезировали из цельной РНК с использованием набора для выбора надстрочного индекса (Invitrogen) с праймером T7- (dT) 24 (Metabion) и in vitro, транскрибировав в меченную биотином кРНК.После гибридизации массивы генов промывали и окрашивали с помощью жидкостной станции (Affymetrix) и сканировали с помощью конфокального лазерного сканирующего микроскопа (Agilent).
Данные были проанализированы с использованием программного обеспечения микроматрицы, микро-БД и инструмента анализа данных (Affymetrix). В дальнейший анализ были включены только гены и EST, которые «присутствовали» и давали различие «увеличение» или «уменьшение» в соответствии с программным обеспечением Affymetrix. Степень дифференциальной экспрессии выражается как SLR.Для таблиц было установлено значение SLR, равное 1, что означает двукратное изменение выражения. Двойники, EST и последовательности, не соответствующие гену, не были включены в таблицы.
ПЦР в реальном времени
Чтобы избежать амплификации / обнаружения контаминирующей геномной ДНК, экстрагированную РНК обрабатывали ДНКазой, не содержащей РНКаз (Promega, Madison, WI). Впоследствии кДНК синтезировали обратной транскрипцией с использованием обратной транскриптазы вируса мышиного лейкоза Молони и случайных праймеров pdN6 в присутствии ингибитора РНКазы (Promega).Амплификацию выполняли на системе обнаружения последовательностей Applied Biosystems Prism 7000 (Applied Biosystems, Foster City, CA) с использованием зеленого протокола SYBR. Результаты были выражены в виде значений 2 -ΔΔCT . Последовательности праймеров от 5 ‘до 3’ были следующими:
Крысиные праймеры
- Gapdh :
- вперед: GGTTGTCTCCTGTGACTTCAA
- обратный: CATACCAGGAAATGAGCTTCA
CAG56
CAG56
CAG56
CAG56
GCAG56
- CAG56
- S1pAGCC1
S1pAG56
- CXCR4 :
- вперед: GATGGTGGTGTTCCAGTTCC
- обратное: CAGCTTGGAGATGATGATGC
- CXCL12 :
- вперед: CGATTCTTTGAGAGCCATGT
- обратное: AGGGCACAGTTTGGAGTGTT
- CD38 :
- вперед: AGGACACACTGCTGGGCTAT
- обратное: CAGGGTTGTTGGGACAATTT
- Akt2 :
- вперед: GAAGACTGAGAGGCCACGAC
- обратное: GGGAGCCACACTTGTAATCC
Человеческие праймеры
- h28s :
- вперед: CGGCTACCACATCC14G14GGAA
- вперед: CGGCTACCACATCC14G1456GGAA
- 6 1455 вперед: CATCAGTCTGGACCGCTACC
- назад: GGATCCAGACGCCAACATAG.
FACS
FITC-конъюгированные моноклональные антитела (mAb) против CD45RA (OX-33) и TCRAB (R73) и конъюгированные с фикоэритрином (PE) mAb против CD4 (OX-35) и MHC II (OX-6) и соответствующие контроли изотипа были приобретены у Becton Dickinson (Гейдельберг, Германия). Проточную цитометрию выполняли на FACScalibur с программным обеспечением Cellquest (Becton Dickinson). Клетки были привязаны к популяции лимфоцитов на точечной диаграмме прямого рассеяния (FSC) и бокового рассеяния (SSC). Для анализа данных Flowing Software 2.5.1 (Центр биотехнологии Турку, Финляндия).
ELISA
Сыворотка, взятая во время эвтаназии, подвергалась анализу ELISA аутоантител против MOG. Планшеты для ELISA (96-луночные; Nunc, Роскилле, Дания) покрывали 2,5 мкг / мл (100 мкл / лунку) MOG 1-125 в течение ночи при 4 ° C. Планшеты промывали PBS / 0,05% Tween 20 и блокировали сухим молоком в течение 1 ч при комнатной температуре. После промывки добавляли разбавленные образцы сыворотки и инкубировали планшеты в течение 1 ч при комнатной температуре. Затем планшеты промывали и добавляли кроличью антисыворотку против мыши (IgG, IgG1, IgG2a, IgG2b, IgG3, IgM; Nordic, Тилбург, Нидерланды) и инкубировали в течение 1 ч при комнатной температуре.Планшеты промывали перед добавлением конъюгированной с пероксидазой козьей антикроличьей антисыворотки (Nordic), разведенной в PBS / 0,05% твин 20. После 30 мин инкубации планшеты промывали и связанные антитела визуализировали добавлением 2,2’азино- бис (3-этилбензотиазолин-6-сульфоновая кислота) (ABTS) (Roche Diagnostics, Мангейм, Германия). После 15 мин инкубации считывали оптическую плотность при 405 нм.
ELISA с человеческой сывороткой выполняли в соответствии с инструкциями производителя [Иммуноанализ Quantikine human SDF1alpha (R&D Systems, Миннеаполис, Миннесота)].
Анализ пролиферации
Клетки из дренирующих LN получали, как описано выше, и культивировали в присутствии rrMOG в 96-луночных планшетах, как описано Weissert et al. (1998b). Клетки культивировали в течение 48 часов и обрабатывали тимидином 1 мкКи [ 3 H] в течение последних 18 часов. Включение [ 3 H] тимидина измеряли с помощью бета-сцинтилляционного счетчика.
Обработка FTY720
Крыс лечили FTY720 (щедрый подарок Novartis AG, Швейцария) и получали суточную дозу 0.4 мг / кг веса тела в стерильной воде через желудочный зонд, как описано (Balatoni et al., 2007).
Благодарности
Мы благодарим Томаса Вайса и Керстин Штук за отличную техническую помощь.
Сноски
Эта статья является частью специальной тематической подборки «В центре внимания на крысе: трансляционное влияние», редактируемой Тимом Эйтманом и Ароном Гертсом. См. Статьи по теме в этой коллекции по адресу http://dmm.biologies.org/collection/rat-disease-model.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих или финансовых интересов.
Вклад авторов
M.M.H. выполнил массивы генов, анализ данных, проверку целей на крысах и отредактировал статью. С.Б. выполнил массивы генов, анализ данных и целевую проверку. Б.Г. проделал работу с CD38 на мышах. К.М.С. провели целевые валидационные исследования на крысах и проанализировали данные. А.Б. провели исследования у лиц с РС и контрольной группы. R.W. разработал исследование, собрал финансирование, провел анализ данных, написал и отредактировал статью.
Финансирование
Это исследование было поддержано грантами Междисциплинарного центра клинических исследований (Bundesministerium für Bildung und Forschung) (Fö. 01KS9602) и Немецкого исследовательского фонда (Deutsche Forschungsgemeinschaft) для RW. .
Дополнительная информация
Дополнительная информация доступна в Интернете по адресу http://dmm.biologies.org/lookup/doi/10.1242/dmm.025536.supplemental
- Поступила 29 марта 2016 г.
- Принято 9 августа 2016 г.
- © 2016. Опубликовано компанией «Компания биологов»
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/) licenses / by / 3.0), что разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащей атрибуции оригинальной работы.
Роль тучных клеток в патогенезе рассеянного склероза и экспериментального аутоиммунного энцефаломиелита
Ransohoff RM, Hafler DA, Lucchinetti CF (2015) Рассеянный склероз — тихая революция. Nat Rev Neurol 11 (3): 134–142
Статья
PubMed
PubMed Central
Google ученый
Vermersch P et al (2012) Лечение маситинибом пациентов с прогрессирующим рассеянным склерозом: рандомизированное пилотное исследование. BMC Neurol 12:36
CAS
Статья
PubMed
PubMed Central
Google ученый
Gandhi R, Laroni A, Weiner HL (2010) Роль врожденной иммунной системы в патогенезе рассеянного склероза. J Neuroimmunol 221 (1-2): 7-14
CAS
Статья
PubMed
PubMed Central
Google ученый
Эрнандес-Педро Нью-Йорк и др. (2013) Первоначальный иммунопатогенез рассеянного склероза: врожденный иммунный ответ. Clin Dev Immunol 2013: 413465
Статья
PubMed
PubMed Central
Google ученый
Mahad DH, Trapp BD, Lassmann H (2015) Патологические механизмы прогрессирующего рассеянного склероза. Lancet Neurol 14 (2): 183–193
CAS
Статья
PubMed
Google ученый
Piconese S et al (2011) Обострение экспериментального аутоиммунного энцефаломиелита у мышей Kit W-sh / W-sh с дефицитом тучных клеток. Лабораторное исследование 91 (4): 627–641
CAS
Статья
PubMed
Google ученый
Кристи А.Л., Браун М.А. (2007) Многозадачная тучная клетка: положительные и отрицательные роли в развитии аутоиммунитета. J Immunol 179 (5): 2673–2679
CAS
Статья
PubMed
Google ученый
Mallucci G et al (2015) Роль иммунных клеток, глии и нейронов в патологии белого и серого вещества при рассеянном склерозе. Прог Нейробиол 127-128: 1–22
CAS
Статья
PubMed
Google ученый
Bennett JL et al (2009) Тучные клетки, полученные из костного мозга, накапливаются в центральной нервной системе во время воспаления, но не обязательны для экспериментального патогенеза аутоиммунного энцефаломиелита. J Immunol 182 (9): 5507–5514
CAS
Статья
PubMed
Google ученый
Yu X, Kasprick A, Petersen F (2015) Возвращаясь к роли тучных клеток в аутоиммунитете. Аутоиммунная версия 14 (9): 751–759
CAS
Статья
PubMed
Google ученый
Костанза М., Коломбо М. П., Педотти Р. (2012) Тучные клетки в патогенезе рассеянного склероза и экспериментального аутоиммунного энцефаломиелита. Int J Mol Sci 13 (11): 15107–15125
CAS
Статья
PubMed
PubMed Central
Google ученый
Соспедра М., Мартин Р. (2016) Иммунология рассеянного склероза. Semin Neurol 36 (2): 115–127
Статья
PubMed
Google ученый
Xu Y, Chen G (2015) Тучные клетки и аутоиммунные заболевания. Mediat Inflamm 2015: 246126
Google ученый
Barry A et al (2016) Влияние физических упражнений на врожденный иммунитет при прогрессировании рассеянного склероза и симптоматике. Front Physiol 7: 194
Артикул
PubMed
PubMed Central
Google ученый
Bruck W (2005) Патология рассеянного склероза является результатом очаговой воспалительной демиелинизации с повреждением аксонов.J Neurol 252 (Приложение 5): v3 – v9
Статья
PubMed
Google ученый
Brown MA, Tanzola MB, Robbie-Ryan M (2002) Механизмы, лежащие в основе влияния тучных клеток на течение заболевания EAE. Mol Immunol 38 (16–18): 1373–1378
CAS
Статья
PubMed
Google ученый
Dendrou CA, Fugger L, Friese MA (2015) Иммунопатология рассеянного склероза. Nat Rev Immunol 15 (9): 545–558
CAS
Статья
PubMed
Google ученый
Segal BM (2014) Стадия-специфическая иммунная дисрегуляция при рассеянном склерозе. J Interf Cytokine Res 34 (8): 633-640
CAS
Статья
Google ученый
Lock C et al (2002) Генный микроматричный анализ поражений при рассеянном склерозе дает новые цели, подтвержденные при аутоиммунном энцефаломиелите. Nat Med 8 (5): 500–508
CAS
Статья
PubMed
Google ученый
Юань Х. и др. (2010) Роль активации тучных клеток в индукции высвобождения нейротрофина микроглиальными клетками. J Neurosci Res 88 (6): 1348–1354
CAS
PubMed
Google ученый
Hemmer B et al (2006) Иммунопатогенез и иммунотерапия рассеянного склероза. Nat Clin Pract Neurol 2 (4): 201–211
CAS
Статья
PubMed
Google ученый
Friese MA, Schattling B, Fugger L (2014) Механизмы нейродегенерации и дисфункции аксонов при рассеянном склерозе.Nat Rev Neurol 10 (4): 225–238
CAS
Статья
PubMed
Google ученый
Dong H, Zhang X, Qian Y (2014) Тучные клетки и нейровоспаление. Med Sci Monit Basic Res 20: 200–206
Статья
PubMed
PubMed Central
Google ученый
Walker ME, Hatfield JK, Brown MA (2012) Новое понимание роли тучных клеток в аутоиммунитете: доказательства общего механизма действия? Biochim Biophys Acta 1822 (1): 57–65
CAS
Статья
PubMed
Google ученый
Zappulla JP et al (2002) Тучные клетки: новые мишени для терапии рассеянного склероза? J Neuroimmunol 131 (1-2): 5-20
CAS
Статья
PubMed
Google ученый
Ривера Дж. И др. (2008) Новые взгляды на активацию тучных клеток через высокоаффинный рецептор для IgE. Adv Immunol 98: 85–120
CAS
Статья
PubMed
PubMed Central
Google ученый
Theoharides TC et al (2007) Дифференциальное высвобождение медиаторов тучных клеток и патогенез воспаления. Immunol Rev 217: 65–78
CAS
Статья
PubMed
Google ученый
Gregory GD et al (2005) Тучные клетки необходимы для оптимальных аутореактивных Т-клеточных ответов в мышиной модели рассеянного склероза. Eur J Immunol 35 (12): 3478–3486
CAS
Статья
PubMed
Google ученый
Johnson D, Seeldrayers PA, Weiner HL (1988) Роль тучных клеток в демиелинизации. 1. Белки миелина расщепляются протеазами тучных клеток и основным белком миелина, и P2 может стимулировать дегрануляцию тучных клеток. Brain Res 444 (1): 195–198
CAS
Статья
PubMed
Google ученый
Rozniecki JJ et al (1995) Повышение уровня триптазы тучных клеток в спинномозговой жидкости пациентов с рассеянным склерозом. Энн Нейрол 37 (1): 63–66
CAS
Статья
PubMed
Google ученый
Larochelle C, Alvarez JI, Prat A (2011) Как иммунные клетки преодолевают гематоэнцефалический барьер при рассеянном склерозе? FEBS Lett 585 (23): 3770–3780
CAS
Статья
PubMed
Google ученый
Ананд П., Сингх Б., Джагги А.С., Сингх Н. (2012) Тучные клетки: возрастающая патофизиологическая роль от аллергии к другим расстройствам. Arch Pharmacol Наунин Шмидеберг, 385 (7): 657–670
CAS
Статья
Google ученый
Sayed BA et al (2010) Менингеальные тучные клетки влияют на раннюю инфильтрацию центральной нервной системы Т-клетками и целостность гематоэнцефалического барьера через TNF: роль в рекрутировании нейтрофилов? J Immunol 184 (12): 6891–6900
CAS
Статья
PubMed
Google ученый
Skaper SD, Giusti P, Facci L (2012) Микроглия и тучные клетки: два пути на пути к нейровоспалению. FASEB J 26 (8): 3103–3117
CAS
Статья
PubMed
Google ученый
Dietsch GN, Hinrichs DJ (1991) Протеазы тучных клеток высвобождают стабильные энцефалитогенные фрагменты из интактного миелина. Cell Immunol 135 (2): 541–548
CAS
Статья
PubMed
Google ученый
Медик Н. и др. (2008) Активация тучных клеток миелином через рецептор скавенджера. J Neuroimmunol 200 (1-2): 27-40
CAS
Статья
PubMed
Google ученый
Gregory GD et al (2006) Экспрессия IL-4 тучных клеток регулируется Ikaros и влияет на энцефалитогенные ответы Th2 при EAE. J Clin Invest 116 (5): 1327–1336
CAS
Статья
PubMed
PubMed Central
Google ученый
Tanzola MB et al (2003) Тучные клетки оказывают влияние за пределами центральной нервной системы, влияя на течение экспериментального аллергического энцефаломиелита. J Immunol 171 (8): 4385–4391
CAS
Статья
PubMed
Google ученый
Sheng J, Xu Z (2016) Три десятилетия исследований ангиогенина: обзор и перспектива. Acta Biochim Biophys Sin Shanghai 48 (5): 399–410
Статья
PubMed
Google ученый
Russi AE, Walker-Caulfield ME, Brown MA (2016) Активность инфламмасомы тучных клеток в мозговых оболочках регулирует тяжесть заболевания EAE. Clin Immunol. pii: S1521-6616 (16) 30068-7
Rozniecki JJ et al (1999) Морфологическая и функциональная демонстрация взаимодействий тучных клеток твердой мозговой оболочки крысы и нейронов in vitro и in vivo.Brain Res 849 (1-2): 1-15
CAS
Статья
PubMed
Google ученый
Christy AL et al (2013) Активация тучных клеток и рекрутирование нейтрофилов способствует раннему и стойкому воспалению мозговых оболочек при EAE. J Autoimmun 42: 50–61
CAS
Статья
PubMed
Google ученый
Ribatti D (2015) Решающая роль тучных клеток в изменениях гематоэнцефалического барьера.Exp Cell Res 338 (1): 119–125
CAS
Статья
PubMed
Google ученый
Karagkouni A, Alevizos M, Theoharides TC (2013) Влияние стресса на воспаление мозга и рассеянный склероз. Аутоиммунная версия 12 (10): 947–953
CAS
Статья
PubMed
Google ученый
Secor VH et al. (2000) Тучные клетки необходимы для раннего начала и тяжелого заболевания в мышиной модели рассеянного склероза.J Exp Med 191 (5): 813–822
CAS
Статья
PubMed
PubMed Central
Google ученый
Li H et al (2011) мыши Kit (W-sh) заболевают более ранним и более тяжелым экспериментальным аутоиммунным энцефаломиелитом из-за отсутствия подавления иммунитета. J Immunol 187 (1): 274–282
CAS
Статья
PubMed
PubMed Central
Google ученый
Сайед Б.А., Уокер М.Э., Браун М.А. (2011) Передовая кромка: тучные клетки регулируют тяжесть заболевания в модели ремиттирующего рецидива рассеянного склероза.J Immunol 186 (6): 3294–3298
CAS
Статья
PubMed
Google ученый
Brown MA, Hatfield JK (2012) Тучные клетки являются важными модификаторами аутоиммунного заболевания: почему при таком большом количестве доказательств до сих пор возникают споры? Фронт Иммунол 3: 147
Артикул
PubMed
PubMed Central
Google ученый
Medic N et al (2010) Адгезия тучных клеток вызывает модификации цитоскелета и программируемую гибель клеток в олигодендроцитах.J Neuroimmunol 218 (1-2): 57–66
CAS
Статья
PubMed
Google ученый
Hemmer B, Kerschensteiner M, Korn T (2015) Роль врожденных и адаптивных иммунных ответов в ходе рассеянного склероза. Lancet Neurol 14 (4): 406–419
CAS
Статья
PubMed
Google ученый
Франклин Р.Дж. и др. (2012) Нейропротекция и восстановление при рассеянном склерозе.Nat Rev Neurol 8 (11): 624–634
Артикул
PubMed
Google ученый
Kritas SK et al (2014) Влияние тучных клеток на рассеянный склероз: ингибирующий эффект натализумаба. Int J Immunopathol Pharmacol 27 (3): 331–335
CAS
Статья
PubMed
Google ученый
Conti P, Kempuraj D (2016) Важная роль тучных клеток в рассеянном склерозе.Mult Scler Relat Disord 5: 77–80
CAS
Статья
PubMed
Google ученый
McFarland HF, Martin R (2007) Рассеянный склероз: сложная картина аутоиммунитета. Nat Immunol 8 (9): 913–919
CAS
Статья
PubMed
Google ученый
Mayo L, Quintana FJ, Weiner HL (2012) Врожденная иммунная система при демиелинизирующем заболевании. Immunol Rev 248 (1): 170–187
Статья
PubMed
PubMed Central
Google ученый
Каур Г., Троусдейл Дж, Фуггер Л. (2013) Естественные клетки-киллеры и их рецепторы при рассеянном склерозе. Brain 136 (Pt 9): 2657–2676
Статья
PubMed
Google ученый
Gonzalez-Navajas JM et al (2012) Иммуномодулирующие функции интерферонов типа I. Nat Rev Immunol 12 (2): 125–135
CAS
PubMed
PubMed Central
Google ученый
Lopez-Diego RS, Weiner HL (2008) Новые терапевтические стратегии при рассеянном склерозе — многогранном противнике.Nat Rev Drug Discov 7 (11): 909–925
CAS
Статья
PubMed
Google ученый
Prendergast CT, Anderton SM (2009) Вход иммунных клеток в центральную нервную систему — текущее понимание и предполагаемые терапевтические цели. Цели препаратов для лечения иммунных расстройств Endocr Metab 9 (4): 315–327
CAS
Статья
PubMed
Google ученый
Calabrese M et al (2015) Изучение причин повреждения серого вещества при рассеянном склерозе.Nat Rev Neurosci 16 (3): 147–158
CAS
Статья
PubMed
Google ученый
Betto E, et al. (2015) Тучные клетки способствуют развитию аутоиммунного диабета, высвобождая интерлейкин-6 и не приобретая толерогенного фенотипа IL-10 +. Clin Immunol
Suurmond J, van der Velden D, Kuiper J, Bot I, Toes RE (2016) Тучные клетки при ревматическом заболевании. Euro J Pharmacol 778: 116–124
CAS
Статья
Google ученый
Martino L et al (2016) Тучные клетки инфильтрируют островки поджелудочной железы при диабете 1 типа у человека. Диабетология 58 (11): 2554–2562
Статья
Google ученый
Джеффри Р и др. (2016) Доказательства функциональной роли тучных клеток в развитии сахарного диабета 1 типа у крыс BioBreeding.






 Таким образом, впервые изучен вклад ДНК в формирование энцефаломиелита у мышей и, вероятно, РС у человека. Эта фундаментальная работа, возможно, приведет к тому, что мы лучше поймем механизм зарождения этого коварного заболевания», — говорит Ксения Аулова.
Таким образом, впервые изучен вклад ДНК в формирование энцефаломиелита у мышей и, вероятно, РС у человека. Эта фундаментальная работа, возможно, приведет к тому, что мы лучше поймем механизм зарождения этого коварного заболевания», — говорит Ксения Аулова.
 Острый диссеминированный энцефаломиелит: долгосрочное наблюдение с участием 84 педиатрических пациентов.Неврология, 2002; 59: 1224–31.
Острый диссеминированный энцефаломиелит: долгосрочное наблюдение с участием 84 педиатрических пациентов.Неврология, 2002; 59: 1224–31.  Оценка риска раннего рассеянного склероза у пациентов с клинически изолированными синдромами: роль последующей МРТ.Журнал Neurol Neurosurg Psychiatry, 2001; 70: 390–3.
Оценка риска раннего рассеянного склероза у пациентов с клинически изолированными синдромами: роль последующей МРТ.Журнал Neurol Neurosurg Psychiatry, 2001; 70: 390–3.  J Neurol Neurosurg Psychiatry, 1995; 58: 70–4.
J Neurol Neurosurg Psychiatry, 1995; 58: 70–4.  , Миллер Д.Х., Робб С.А., и др. Острый диссеминированный энцефаломиелит. Результаты МРТ и отличия от рассеянного склероза. Brain1990; 113 (часть 2): 291–302.
, Миллер Д.Х., Робб С.А., и др. Острый диссеминированный энцефаломиелит. Результаты МРТ и отличия от рассеянного склероза. Brain1990; 113 (часть 2): 291–302.  Долгосрочное наблюдение с помощью МРТ пациентов с постинфекционным энцефаломиелитом: доказательства монофазного заболевания. J Neurol Sci1999; 167: 132–6.
Долгосрочное наблюдение с помощью МРТ пациентов с постинфекционным энцефаломиелитом: доказательства монофазного заболевания. J Neurol Sci1999; 167: 132–6.  Неврология, 2002; 59: 1922–8.
Неврология, 2002; 59: 1922–8.