Фенилкетонурия (ФКУ) Фенилкетонурия (ФКУ) — это аутосомно-рецессивное генетическое заболевание, связанное с нарушением метаболизма аминокислот. Эта болезнь характеризуется дефицитом печеночного фермента фенилаланин гидроксилазы (другое название которого фенилаланин-4-монооксигеназы). Этот фермент катализирует превращение аминокислоты фенилаланина (‘Phe) на тирозин. При дефиците фенилаланин гидроксилазы, фенилаланин не расщепляется, а накапливается и превращается в фенилпировиноградную кислоту, которая, при этом заболевании обнаруживается в моче. С момента первого описания заболевания появилось много новых методов лечения и сегодня болезнь можно контролировать практически без возникновения каких либо побочных эффектов и неудобств, связанных с лечением. Ранее, лечение ФКУ осуществлялось путем ограничения употребления фенилаланина. Однако, согласно последним исследованиям, только диетического питания может быть недостаточно, для преодоления всех негативных последствий заболевания. Оптимальное лечение заключается в снижении уровня фенилаланина до безопасного уровня и включает постоянный контроль за питанием, и когнитивным развитием. Снижение уровня фенилаланина может быть достигнуто за счет комбинированного применения продуктов с низким содержанием фенилаланина и белковых добавок. На современном этапе нет никаких эффективных лекарств от этого заболевания, однако существуют определенные препараты, предназначенные для устранения симптомов, но положительное влияние от их использования является индивидуальным в каждом отдельном случае. Обычно фенилкетонурию определяют в процессе скрининга новорожденных и при генетических исследованиях. Специализированные клиники для больных фенилкетонурией существуют во всем мире, именно в них обеспечивается постоянный уход за больными, контролируется уровень фенилаланина, умственное развитие пациентов и обеспечивается оптимальное питание. История
Патофизиология Классическая ФКУ ФКУ — это аутосомно-рецессивное генетическое расстройство. Это означает, что для того, чтобы ребенок унаследовал заболевание ей необходимо, унаследовать по одной мутированой копии гена от каждого из родителей. То есть родители, должны быть носителями этих дефектных генов. Однако, если только один из родителей является носителем, а у другого обе копии гена — нормальные, вероятно, что ребенок может родиться полностью здоровой. Фенилкетонурия может возникать и у мышей, которые широко используются при исследованиях разнообразных препаратов для лечения ФКУ. Недавно было установлено последовательность генома макаки,при исследовании которой ученые обнаружили, что ген, кодирующий фенилаланин гидроксилазы имеет ту же последовательность, что и ген, который у людей отвечает за возникновение ФКУ. Гиперфенилаланинемия, которая связана с дефицитом тетрагидробиоптерину Для того чтобы установить различия между двумя выше описанными расстройствами необходимо определить уровень дофамина в организме. Как уже было отмечено, тетрагидробиоптерин необходим для превращения фенилаланина в тирозин, однако помимо этого он играет очень важную роль при преобразовании тирозина в дигидроксифенилаланин (сокращение допа, который катализируется ферментом тирозин гидроскилазой), которий в свою очередь является предшественником дофамина. Фенилаланин — это большая, нейтральная аминокислота (LNAA). Эти аминокислоты «конкурируют» между собой за транспортировку через гематоэнцефалический барьер (ГЭБ) с помощью системы активного транспорта больших нейтральных аминокислот (нейтрального транспортера) (large neutral amino acid transporter, LNAAT). Повышенный уровень фенилаланина в крови, соответственно, увеличивает количество его в транспортере. Что, в свою очередь, приводит к тому, что уровень других нейтральных крупных аминокислот в мозге — снижается. Но, как известно, все эти аминокислоты необходимы для синтеза белков и нейротрансмиттеров (нейромедиаторов), именно поэтому, накопление фенилаланина нарушает процесс развития мозга, вызывая умственную отсталость. Лечение
Фенилкетонурия и материнство В большинстве стран, женщинам с ФКУ, которые планируют заводить детей, рекомендуется снизить уровень фенилаланина (как правило до 2-6 мкмоль / л), еще до беременности и контролировать его на протяжении всего периода вынашивания ребенка. Это достигается путем проведения регулярных анализов крови и соблюдения строгой диеты, и постоянным наблюдением врача-диетолога. Во многих случаях, как только печень плода начинает нормально производить PAH, уровень фенилаланина в крови матери падает, соответсвенно «необходимо» увеличить его, для удержания безопасного уровня — 2-6 мкмоль / л. Именно поэтому, ежедневное количество потребленного матерью фенилаланина может удвоиться или даже утроиться к концу беременности. Если же уровень фенилаланина в крови матери ниже 2 мкмоль / л, то иногда, у женщин могут возникать различные осложнения, связанные с дефицитом этой аминокислоты, такие как головная боль, тошнота, выпадение волос и общее недомогание. Если низкий уровень фенилаланина у больных ФКУ поддерживается в течение всей беременности, то риск родить больного ребенка не выше, чем у тех женщин, которые не больны ФКУ. Дети с ФКУ могут питаться грудным молоко в сочетании с их специальными метаболическими добавками. Согласно результатам исследований, питание новорожденных, (больных ФКУ) только грудным молоком может изменить (облегчить) последствия дефицита нужных веществ, но только в том случае, когда во время кормления грудью мать придерживается строгой диеты, для удержания низкого уровня фенилаланина в организме. Однако для подтверждения этих данных, необходимы дополнительные исследования. В июне 2010 года, американские ученые заявили, что они будут проводить детальное исследование для выявления мутаций генов в геноме человека. Их основной задачей является изучение природы фенилкетонурии, которая на сегодня, встречается все чаще. Распространение заболевания связано также с тем, что больные ФКУ часто живут более 60 лет и, соответственно, часто рожают детей, которые тоже могут быть поражены этой болезнью, или быть ее носителями. Распространенность Фенилкетонурия встречается примерно у 1 человека на 15000 новорожденных. Но частота заболеваемости в разных популяций — отличается. Так, 1 больной ребенок среди 4500 новорожденных среди населения Ирландии, в Норвегии это соотношение составляет 1:13000, в Финляндии этот показатель еще ниже — менее чем одно лицо на 100.000 новорожденных. Чаще заболевание встречается в Турции, ведь им болеет каждый ребенок из 2600 рожденных. Болезнь также более распространена в Италии, Китае, и среди населения Йемена.
|
Углеводная недостаточность
Углеводная недостаточность
Углеводная недостаточность – болезненное состояние, связанное с недостаточным поступлением и усвоением углеводов либо с их интенсивным расходованием.
Так как углеводы играют роль быстрого источника энергии, относительный углеводный дефицит может сопровождать любое физическое перенапряжение и считается вариантом нормы. Уровень углеводов в этом случае быстро восполняется за счет резервов организма без негативных последствий. При длительном дефиците питания, а также при некоторых заболеваниях может развиваться хроническая углеводная недостаточность, последствия которой бывают необратимыми. Наиболее чувствительны к дефициту углеводов клетки нервной и мышечной ткани, которые являются основными потребителями энергии. При нехватке углеводов для восполнения энергии начинают использоваться жиры и даже белок, что может вызывать серьезные изменения в обмене веществ и влиять на работу печени и почек.
Синонимы русские
Дефицит углеводов, гипогликемия.
Синонимы английские
A Carbohydrate Deficiency, Deficiency Of Carbohydrates.
Симптомы
Симптомы углеводной недостаточности во многом зависят от ее длительности и степени выраженности. При кратковременном падении уровня сахара в крови в периоды физического или умственного перенапряжения могут отмечаться легкая слабость и усиленное чувство голода. Длительный дефицит углеводов, сопровождающийся истощением их запаса в печени, может приводить к нарушению ее функций и развитию дистрофии (нарушению питания тканей).
Основные проявления углеводной недостаточности:
- общая слабость,
- головокружение,
- головная боль,
- голод,
- тошнота,
- обильная потливость,
- дрожь в руках,
- сонливость.
- потеря веса.
Кто в группе риска?
- Население стран с низким уровнем жизни.
- Те, кто голодает с целью снизить вес или долго придерживается низкокалорийных диет.
- Пациенты с заболеваниями поджелудочной железы, печени и почек.
- Инсулинозависимые пациенты.
- Лица, родственники которых страдают наследственными формами нарушений углеводного обмена.
Общая информация о заболевании
Наряду с жирами и белком углеводы относятся к основным компонентам пищевого рациона. Они удовлетворяют потребность организма в энергии, участвуют в расщеплении жиров и белка.
Многие люди, пытаясь сбросить вес, ошибочно урезают количество углеводов в рационе до минимума, однако полноценная утилизация жиров возможна только при достаточном количестве углеводов.
Основные функции углеводов
- Энергетическая. При расщеплении углеводов образуется значительное количество энергии, обеспечивающей практически все процессы жизнедеятельности.
- Питание мозга. Головной мозг является основным потребителем глюкозы.
- Синтетическая. Углеводы участвуют в образовании многих необходимых организму веществ. Совместно с белками они образуют некоторые ферменты, гормоны, входят в состав слюны и пищеварительных соков.
- Регуляторная. Углеводы участвуют в процессе расщепления жиров и белка.
- Пищеварительная. Стимулируют процесс пищеварения, создавая объем пищевого комка.
- Сорбирующая. Способствуют выведению из организма избытков холестерина и вредных веществ.
Разнообразие выполняемых функций обеспечивается за счет особенностей химического строения углеводов. Принято различать следующие их виды.
- Простые сахара: глюкоза, фруктоза, лактоза, сахароза. Выполняют функцию источников «быстрой» энергии, главным из которых является глюкоза. Именно она используется клетками в первую очередь и является основой питания мозга. Уровень глюкозы в крови регулируется с помощью инсулина – особого белка (гормона), вырабатываемого поджелудочной железой, – и в норме относительно постоянен. При значительном поступлении углеводов с пищей часть их используется на поддержание уровня глюкозы, а остальные резервируются в печени и мышечной ткани.
- Сложные сахара: крахмал, гликоген клетчатка и пектины.
- Крахмал – основной углевод, поступающий с пищей. Содержится в крупах, картофеле, хлебе. В процессе переваривания расщепляется до глюкозы.
- Гликоген, или «животный крахмал», является формой хранения углеводов в организме. Основная масса гликогена содержится в печени, где и происходит его расщепление до глюкозы при необходимости восстановления ее уровня в крови.
- Клетчатка (целлюлоза) – практически неперевариваемый углевод, образующий оболочки семян и плодов. Клетчатка практически не участвует в углеводном обмене, но необходима организму для нормального пищеварения: создавая объем пищевого комка, она способствует насыщению и, кроме того, выведению холестерина и вредных веществ.
Таким образом, для обеспечения потребностей организма в первую очередь расходуются простые углеводы (глюкоза), уровень которых восполняется либо за счет поступления с пищей, либо за счет собственных запасов при расщеплении гликогена. Если же собственный углеводный резерв исчерпан, организм начинает использовать имеющийся жир и белки, поэтому длительная нехватка углеводов приводит к серьезным нарушениям обмена и образованию целого ряда вредных веществ, постепенно накапливающихся в крови. К числу таких веществ относятся продукты неполного расщепления жира: кетоновые тела и ацетон. Этот процесс представляет серьезную опасность и даже может привести к коме. Избыточный расход белка вызывает уменьшение мышечной массы, нарушение целого ряда жизненно важных процессов, таких как продукция гормонов, основных белков крови, пищеварительных ферментов, что чревато тяжелыми формами дистрофии, снижением работоспособности и интеллекта.
Главное проявление углеводного дефицита – это гипогликемия – низкий уровень глюкозы в крови.
Основные причины углеводной недостаточности
- Сахарный диабет – основная причина гипогликемии. Падение уровня глюкозы чаще всего связано с передозировкой инсулина (гормона, регулирующего уровень глюкозы), таблетированных сахароснижающих препаратов или же может явиться следствием нарушений режима питания, стресса или физического перенапряжения у этих пациентов.
- Физиологическая гипогликемия представляет собой незначительное кратковременное падение сахара в крови у лиц, занимающихся тяжелым физическим трудом, спортсменов в период максимальных нагрузок, а также при стрессовых ситуациях.
- Алиментарная (пищевая) углеводная недостаточность развивается при длительном голодании, например с целью снизить вес, при избыточном приеме алкоголя. Кроме того, сахар может падать из-за значительного перерыва между приемами пищи. Обычно это проявляется слабостью чувством голода.
- Инсулинома – опухоль поджелудочной железы, затрагивающая клетки, продуцирующие инсулин. По мере роста опухоли содержание инсулина в крови увеличивается и падения уровня глюкозы могут быть весьма значительными.
- Злокачественные опухоли могут стать причиной углеводной недостаточности за счет потребления глюкозы опухолевой тканью, а также при развитии синдрома опухолевой интоксикации. При распаде опухоли в кровь попадают чужеродные белки, вызывающие отравление организма. Это может приводить к снижению аппетита и к алиментарной углеводной недостаточности. Кроме того, некоторые опухоли способны производить вещества, воспринимаемые организмом как инсулин.
- Надпочечниковая недостаточность. Одной из функций гормонов, вырабатываемых надпочечниками (в основном кортизола и адреналина), является регуляция углеводного обмена, в частности образования гликогена и его обратного расщепления до глюкозы. Поэтому недостаточная функция надпочечников, а также регулирующего их работу гипофиза иногда сопровождается гипогликемией.
- Почечная недостаточность. Приводит к падению уровня глюкозы как из-за снижения аппетита (почечная интоксикация), так и из-за более длительной циркуляции инсулина в крови вследствие нарушенной почечной фильтрации.
- Заболевания печени – нарушение образования и распада гликогена в клетках печени. Например, гепатиты, цирроз печени, жировая дистрофия.
- Пищеварительные нарушения углеводного обмена объединяют врождённые и приобретенные состояния, при которых нарушается расщепление и всасывание углеводов в пищеварительном тракте.
а) Приобретенные нарушения чаще всего носят временный характер и устраняются лечением. Наиболее распространенными являются:
- снижение уровня амилазы (основной фермент пищеварительного сока, ответственный за расщепление углеводов) у пациентов с хроническим панкреатитом и опухолями поджелудочной железы;
- снижение ферментативной активности кишечного содержимого при острых и хронических кишечных инфекциях, а также после операций на тонкой кишке.
б) Врождённые ферментопатии характеризуются отсутствием или низким уровнем отдельных ферментов, отвечающих за расщепление сложных углеводов. Наиболее известным примером является врождённая недостаточность лактазы – фермента, отвечающего за усвоение молочного сахара. Заболевание выявляется у новорождённых и характеризуется вздутием живота, жидким стулом, потерей веса. В качестве лечения предлагается переход на смеси, не содержащие лактозу.
Диагностика
Углеводная недостаточность может быть заподозрена у пациентов с дефицитом массы тела, а также у лиц, входящих в группу риска: страдающих сахарным диабетом, заболеваниями печени, почек, поджелудочной железы. Для подтверждения диагноза назначаются следующие исследования.
Лабораторные исследования
- Общий анализ крови относится к числу базовых исследований, позволяющих получить представление об общем состоянии организма. Так как нарушения углеводного обмена не оказывают непосредственного влияния на клеточный состав крови, возможные изменения будут являться следствием основного процесса. Эритроциты и гемоглобин могут быть понижены. Лейкоциты. Изменение числа лейкоцитов для углеводной недостаточности нехарактерно, их количество может уменьшаться на фоне общего истощения.
- Скорость оседания эритроцитов (СОЭ). Значительное повышение СОЭ в сочетании с гипогликемией может указывать на наличие опухоли.
- Глюкоза (сахар крови). Определение уровня глюкозы является базовым исследованием в диагностике углеводной недостаточности. Стабильно низкие показатели глюкозы бывают вызваны врождённым гиперинсулинизмом и опухолями поджелудочной железы. При сахарном диабете и передозировке сахароснижающих препаратов уровень сахара при повторных исследованиях будет повышен.
- Инсулин в крови. Инсулин является одним из основных регуляторов углеводного обмена, отвечающим за уровень сахара в крови и обеспечивающим накопление гликогена в клетках печени. Повышенный уровень инсулина как причина низкого сахара крови может наблюдаться у пациентов с инсулиномой (злокачественной инсулинпродуцирующей опухолью поджелудочной железы) и с врождённым гиперинсулинизмом, а также при передозировке инсулина у пациентов с сахарным диабетом.
- Определение уровня проинсулина в крови может назначаться при подозрении на инсулинпродуцирующую опухоль поджелудочной железы. Проинсулин – белок – предшественник инсулина и в значительном количестве может определяться в крови пациентов с инсулиномой, гипогликемией, почечной и печеночной недостаточностью.
- С-пептид. Представляет собой фрагмент белка – предшественника инсулина. Количество его пропорционально количеству образующегося инсулина, но так как С-пептид не участвует в обменных процессах, то его определение дает более достоверную информацию об уровне секреции этого гормона поджелудочной железой. Повышенный уровень С-пептида у пациентов после удаления гормонально активных опухолей поджелудочной железы может указывать на рецидив.
- Глюкозотолерантный тест. Определение уровня глюкозы крови до приема раствора глюкозы и через полчаса, 1 час и через 2 часа после него назначается пациентам при подозрении на нарушенное усвоение углеводов.
- Белок в сыворотке крови бывает понижен при углеводной недостаточности из-за использования белка в качестве источника энергии.
- Белковые фракции сыворотки крови. Исследование количественного состава и соотношения различных видов белка в сыворотке крови. Общий белок сыворотки представлен альбуминами и глобулинами, выполняющими в организме различные функции. Основную часть составляет альбумин – основной строительный белок организма. Так как при углеводной недостаточности альбумины начинают использоваться для восполнения энергозатрат, уровень их в плазме может снижаться при сохраненном показателе глобулинов.
- Мочевина и креатинин в сыворотке крови. Мочевина и креатинин являются веществами, образующимися в процессе распада белков. При выраженной углеводной недостаточности, сопровождающейся разрушением белка, их количество в крови может увеличиваться. Показатель следует оценивать вместе с уровнем мочевины в суточной моче.
- Мочевина в суточной моче отражает эффективность работы почек. При интенсивном распаде белка и сохраненной почечной функции может существенно повышаться.
- Лактаза (LCT). Выявление мутации C(-13910)T (регуляторная область гена). Исследование может быть назначено при подозрении на врождённый недостаток лактазы – пищеварительного фермента, обеспечивающего усвоение молочного сахара в желудочно-кишечном тракте. Представляет собой генетический анализ на измененные гены в соскобе щечной области. Положительный тест позволяет отличить врождённый дефицит фермента от приобретенных нарушений усвоения углеводов, как, например, при дисбактериозе.
- Кортизол. Гормон коры надпочечников, при недостаточной продукции которого уровень глюкозы в крови может снижаться. Исследование назначается при подозрении на надпочечниковую недостаточность как причину гипогликемии.
- Общий анализ мочи с микроскопией осадка при углеводной недостаточности назначают для определения уровня ацетона в моче. При углеводном дефиците организм начинает использовать запасы жира для восполнения энергозатрат. Так как расщепление жира при этом механизме происходит не полностью, в крови накапливаются промежуточные вещества, в том числе и ацетон, в дальнейшем выделяемый с мочой.
- Копрограмма – исследование кала, позволяющее выявить возможные нарушения основных этапов переваривания углеводов. Оценивается химический состав каловых масс, его цвет, запах консистенция, наличие отдельных видов микроорганизмов (дисбактериоз). Исследование позволяет оценить работу основных ферментов печени, желудочного и кишечного сока, поджелудочной железы. При углеводной недостаточности, вызванной нарушенным усвоением углеводов, в каловых массах могут определяться зерна крахмала.
Дополнительные (инструментальные) методы исследования
Объем диагностических исследований зависит от предполагаемой причины углеводной недостаточности и должен определяться лечащим врачом.
- Ультразвуковое исследование печени, почек, надпочечников и поджелудочной железы относится к базовым методикам, позволяющим оценить состояние этих органов. В отличие от рентгенологических методов исследования оно не сопряжено с лучевой нагрузкой и безопасно для пациента. Ультразвук проходит сквозь мягкие ткани до исследуемого органа и, отразившись, возвращается обратно. Полученное изображение передается на монитор. Исследование позволяет оценить размеры указанных органов, структуру тканей, выявить опухолевое поражение или кисту, исключить наличие жидкости в брюшной полости. При необходимости исследование может быть дополнено взятием биопсии под УЗИ-контролем.
- Эзофагогастродуоденоскопия – непосредственный осмотр пищевода, желудка и двенадцатиперстной кишки с помощью специального зонда, на дистальном конце которого размещена видеокамера. Оценивается проходимость верхних отделов пищеварительного тракта, состояние слизистой оболочки, степень ее воспаления или атрофии. В процессе исследования может быть взят фрагмент ткани на анализ (биопсия). Наряду с ультразвуковым исследованием гастроскопия является обязательной при подозрении на алиментарный характер углеводной недостаточности.
- Энтероскопия (интестиноскопия). Осмотр тонкой кишки. Исследование по своим возможностям аналогично гастроскопии, но технически более сложно, так как предусматривает осмотр всей тонкой кишки. Оно позволяет оценить состояние слизистой оболочки, исключить эрозивное поражение, а также взять содержимое для исключения инфекционного процесса или определения уровня отдельных ферментов, например амилазы – основного фермента, участвующего в расщеплении углеводов.
- Эндосонография поджелудочной железы (эндоскопическое УЗИ) представляет собой разновидность ультразвукового исследования поджелудочной железы. Выполняется с помощью специального датчика, размещенного на конце эндоскопа. Считается «золотым стандартом» в диагностике гормонпродуцирующих опухолей, так как с его помощью можно диагностировать образования менее 1 сантиметра, не выявляемые другими методами.
- Компьютерная томография органов брюшной полости позволяет получить послойные срезы поджелудочной железы и может быть назначена пациентам с подозрением на опухоль этого органа.
- Рентгенологическое исследование может быть назначено пациентам, перенесшим операцию на тонкой кишке, для оценки ее длины и просвета. Удаление значительной части тонкого кишечника способно явиться причиной тяжелых расстройств пищеварения, в том числе и углеводной недостаточности.
Лечение
Лечение углеводной недостаточности направлено на восстановление уровня углеводов, а в более тяжелых случаях на нормализацию белкового и жирового обмена.
- Сбалансированное питание, обеспечивающее суточную потребность в углеводах. В рационе должно быть достаточное количество овощей, фруктов, зерновых продуктов (хлеба, круп). Пациенты с углеводной недостаточностью, обусловленной избыточной продукцией инсулина, должны носить с собой содержащие глюкозу таблетки, конфеты или обычный сахар. Такая коррекция режима питания может оказаться единственной необходимой мерой у пациентов с легкими формами гипогликемии. При углеводной недостаточности, обусловленной заболеваниями печени и почек, врождёнными ферментативными нарушениями, диета должна подбираться лечащим врачом с учетом особенностей течения основного заболевания.
- Медикаментозные средства:
- Отдельные пищеварительные ферменты или комплексные ферментные препараты могут быть назначены пациентам с приобретенным ферментным дефицитом.
- Специальные смеси для питания со строго подобранным углеводным составом могут назначаться пациентам с врождённым и приобретенным нарушением усвояемости отдельных углеводов. При углеводной недостаточности, сопровождающейся потерей белка, могут быть рекомендованы соответствующие белково-углеводные смеси.
- Внутривенное введение глюкозы иногда требуется пациентам с тяжелой степенью гипогликемии, особенно при наличии инсулинпродуцирующей опухоли.
- Хирургическое лечение бывает необходимо пациентам, у которых углеводная недостаточность обусловлена опухолевым процессом
Профилактика
- Полноценное питание с включением в рацион достаточного количества углеводной пищи (свежие фрукты и овощи более предпочтительны, бобовые продукты и зерновые).
- Обязательный врачебный контроль при подборе ограничительной диеты или проведении курсов лечебного голодания.
- Своевременное выявление и лечение заболеваний, увеличивающих риск нарушений углеводного обмена.
Рекомендуемые анализы
- Общий анализ крови
- Лейкоцитарная формула
- Скорость оседания эритроцитов (СОЭ)
- Глюкоза в плазме
- Инсулин
- Проинсулин
- С-пептид в сыворотке
- Глюкозотолерантный тест
- Кортизол
- Лактозная непереносимость у взрослых
- Мочевина в суточной моче
- Белок общий в сыворотке
- Белковые фракции в сыворотке
- Общий анализ мочи с микроскопией осадка
- Копрограмма
Белково энергетическая недостаточность, недостаток белка в организме: симптомы у взрослых
Белковая недостаточность — патологическое состояние организма, причиной которого становится дефицит аминокислот. Белковый дефицит частый клинический эпизод в жизни онкологического больного, к которому приводит противоопухолевое лечение и само заболевание.
При неадекватном питании недостает организму не только белковых молекул, но и остальных нутриентов — жиров, углеводов, микроэлементов, — таких же равноправных источников энергии и «стройматериалов», поэтому устаревшее название состояния «алиментарная дистрофия», а современное — белково-энергетическая (БЭН) или нутритивная недостаточность.
Причины белковой недостаточности
Поводов для недостаточного питания у онкопациента предостаточно:
- отвращение к еде во время химиотерапии и токсические последствия воздействия лекарственных средств на слизистые оболочки, кровь и железы внутренней секреции;
- болезненные локальные осложнения облучения, особенно ротовой полости, органов брюшной полости и прямой кишки;
- тяжелые комбинированные операции с удалением нескольких органов и длительным периодом восстановления с неизбежными диетическими ограничениями;
- повышающаяся потребность растущей опухоли в строительном и энергетическом материале с обкрадыванием всех здоровых органов, что неминуемо снижает их функциональные возможности;
- активизация распада циркулирующих в крови белковых молекул под влиянием агрессивных продуктов и токсинов опухолевых клеток;
- невозможность достаточного питания при поражении органов желудочно-кишечного тракта.
Особый случай белковой недостаточности — потери белковых молекул вместе с удаляемой из брюшной полости асцитической жидкостью при канцероматозе брюшины.
Для запуска БЭН достаточно на несколько дней ограничить поступление продуктовых нутриентов, остальное сделает опухоль и создаваемые ею особенности организма больного: потенцируется быстрое разрушение белков при невозможности синтеза незаменимых аминокислот и постоянно растущей потребности злокачественных клеток в строительных материалах и энергии.
Последствия белковой энергетической недостаточности
Неадекватность питания — не менее недели снижение поступления аминокислотных субстратов более 60% от нормы. В реальной жизни онкологического пациента период ограниченного потребления пищи может достигать нескольких недель, а восстановление естественного питания не гарантирует достаточного поступления нутриентов, в том числе из-за соблюдения диетических ограничений.
Осложнения недостаточного поступления зависят от объема белковых потерь и химического состава поступающих аминокислот, особенно тяжко организму без не синтезируемых им самим белков. Для продолжения функционирования организма недостаточное поступление компенсируется забором белковых субстратов из собственных тканей, особенно быстро уходят аминокислоты из печени, мышц и кожи. Истощение печеночной паренхимы нарушает обмен множества веществ. Потеря мышечного массива при активном злокачественном процессе — это кахексия, которая может протекать и без видимого снижения объёма жировой клетчатки. Сочетание распада белков мышц с нарушением аппетита у онкологического пациента получило название «синдром анорексии-кахексии».
Симптомы белковой недостаточности
В первую очередь недостаточное питание вызывает слабость и быстрое утомление. При любой причине голодания в крови циркулирует меньше нужного белковых субстанций, главный образом, альбуминов, чуть позже снижается концентрация глобулинов. Когда содержание протеинов в литре плазмы крови доходит до 50-60 граммов, параллельно падает уровень сахара, все обменные процессы в организме замедляются — интенсивность общего обмена снижается на одну пятую часть. Нарушаются процессы кроветворения, снижается функция всех систем органов, понижается температура тела, выпадают волосы, неадекватна иммунная защита. Особенно сильно страдает образование ферментов пищеварительного тракта, что нарушает и без того неважный аппетит.
При снижении белковых субстанций до 30-40 граммов в литре плазмы появляются отёки, маскирующие мышечное истощение. В режиме хронического ограничения питательных веществ усугубляются нарушения функций внутренних органов, клетки головного мозга не в состоянии поддерживать свою работу — страдает интеллектуальная деятельность, сознание пациента заторможено. Основной обмен падает до 50-60% от нормы. Недостаток белков, из которых строится любая клетка, сказывается на всём — нормальные клетки органов и тканей отмирают, новые не появляются. Большую часть дня пациент проводит в постели, часто не имея силы обслужить себя.
Диагностика
Диагностика белковой недостаточности разной степени не представляет большой сложности. Диагностические признаки белково-энергетической недостаточности у онкологического пациента:
- снижение веса за месяц на 5% или десятой части за полгода;
- уменьшение мышечной массы, определяемое по уменьшению окружности верхней трети плеча;
- снижение толщины складки кожи с жировой клетчаткой на плече;
- изменение таких показателей крови, как общий белок, альбумин, трансферрин, общего числа лимфоцитов.
У большинства онкобольных для констатации БЭН достаточно проследить динамику снижения веса за последние несколько месяцев. У пациентов с исходным ожирением, когда жировая клетчатка маскирует мышечную атрофию, всё по своим местам расставит анализ крови: в клиническом анализе отмечается снижение числа (не процента) лимфоцитов; в биохимическом — уменьшение концентрации белковых фракций и общего белка, недостаточно ферритина.
Лечение
Минимально за сутки онкологический пациент с едой должен получать 1 грамм белка на каждый килограмм собственного веса, но учитывая активность злокачественной опухоли по «отъему» аминокислот от нормальных тканей, целесообразно потреблять полтора грамма. Исключение — пациенты с недостаточностью почек, у них максимальная доза белковых продуктов не может быть выше 1.2 граммов.
Поскольку у онкобольного белковая недостаточность всегда следствие неадекватного потребления или потери белков при эвакуации асцитической жидкости, маловероятно купировать патологическое состояние естественным путём — увеличением объемов пищи.
Констатация потери 5% веса при исходном ИМТ ниже 20, снижение общего белка в литре плазмы до 60 г и глобулина до 30 г при невозможности нормального питания — основание для срочного назначения специализированных белковых смесей.
При худших показателях или невозможности питания через рот — энтерально, например, при раке пищевода или желудка, ставится вопрос о зондовом или внутривенном питании. Во всех случаях предпочтительно энтеральное питание, а не внутривенное, потому что по составу элементов пищевой продукт всегда разнообразнее раствора кристаллических аминокислот.
Снижение токсичности лечения и симптоматическая терапия — настоятельная необходимость, но без качественной нутритивной поддержкой невозможно улучшить качество жизни и ускорить реабилитацию онкологического больного. Пациенты на всех этапах лечения нуждаются в разной нутритивной поддержке и обязательно под контролем специалиста.
Профессиональное купирование белковой недостаточности не дополнительная опция противоопухолевой терапия, а неотъемлемый её компонент. Для пациентов нашей клинике нутритивная поддержка также обязательна, как химиотерапия, облучение и операции.
Список литературы:
- Аничков Н.М. /Биологические и клинико-морфологические аспекты учения о метастазировании злокачественных опухолей // Мед.Акад.Журн.;2003; № 1.
- Баркаган З.С., Момот А.П. /Диагностика и контролируемая терапия нарушений гемостаза// — М.: Ньюдиамед; 2001.
- Долгов В.В., Свирин П.В. /Лабораторная диагностика нарушений гемостаза// — М.: Триада; 2005.
- Патофизиология/ под ред. Новицкого В.В., Гольдберга Е.Д., Уразовой О.И.// Изд. 4; ГЭОТАР-Медиа, 2009.
Белково-энергетическая недостаточность — причины, симптомы, диагностика и лечение
Белково-энергетическая недостаточность (БЭН) — это патологическое состояние, которое характеризуется дефицитом нутриентов, энергии и негативно влияет на работу всех систем организма. Основные признаки патологии — потеря более 10% исходного веса за короткий срок, астеновегетативный синдром, сухость и бледность кожных покровов. Диагностический поиск предполагает выполнение физикального исследования и лабораторных анализов для оценки состояния пациента, инструментальных методов для установления первопричины нутритивного дефицита. Лечение состоит в назначении высокобелкового и высококалорийного энтерального, зондового или парентерального питания.
Общие сведения
Нутритивная недостаточность — глобальная медицинская проблема. Самые незащищенные категории населения — дети и пожилые люди. По данным ВОЗ, более 17% детей младше 5 лет страдают от различных степеней БЭН, основная масса из них проживает в Африке, островных государствах Тихоокеанского региона. Около 50% пожилых пациентов, которых госпитализируют в стационар, имеют признаки хронического недоедания. Установлено, что 25% населения России испытывают нутритивный дефицит, а у 85% выявлены различные проявления гиповитаминозов.
Белково-энергетическая недостаточность
Причины
Широкое распространение нутритивной и энергетической неполноценности питания обусловлено в первую очередь социально-экономическими факторами. Патология характерна для жителей стран с низким уровнем дохода, которые не могут позволить себе достаточную по калорийности и витаминному содержанию пищу. Рост белково-энергетической недостаточности наблюдается в регионах с частыми природными катаклизмами, зонах военных действий. Установлен ряд медицинских причин заболевания:
- Недостаточное потребление нутриентов. К этой категории относят ятрогенные факторы голодания: строгие диеты при гастроэнтерологических и метаболических болезнях, переход на парентеральное питание при тяжелом состоянии пациента. Зачастую причиной нутритивного дефицита служат нервная анорексия, психозы.
- Повышение катаболических процессов. Симптомы белково-энергетической недостаточности развиваются на фоне нормального по калорийности питания. Нарушение метаболизма вызвано повышенным распадом нутриентов, который обусловлен тиреотоксикозом, сахарным диабетом 1 типа, онкологическими заболеваниями.
- Расстройства пищеварения. Нутритивная недостаточность формируется при мальабсорбции и мальдигестии различного генеза. Часто ее причинами становятся хронические гастроэнтериты, снижение внешнесекреторной функции поджелудочной железы (панкреатическая стеаторея), нарушения желчевыделения.
- Интоксикации. Расстройство метаболизма возникает у больных, которые вынуждены длительно принимать сильнодействующие лекарственные препараты. Ситуация усугубляется при полипрагмазии, особенно в гериатрической практике. Нарушение выявляется практически у всех страдающих хроническим алкоголизмом.
Для пожилых основным предрасполагающим фактором являются нейродегенеративные процессы — болезнь Альцгеймера, паркинсонизм. В структуре этиологии белково-энергетической недостаточности у детей преобладают врожденные причины:
- пороки развития;
- нейромышечные патологии;
- генетически обусловленные проблемы — муковисцидоз, расстройства обмена веществ.
К факторам риска БЭН у детей относят недоношенность, внутриутробную гипоксию, употребление беременной женщиной алкоголя и наркотических веществ.
Патогенез
При нутритивной недостаточности в патологический процесс вовлекаются все органы и системы. Степень нарушений зависит от длительности и тяжести недоедания. При небольшом недостатке калорий наблюдается распад гликогена в печени, за счет чего организм получает достаточное количество энергии. Происходит мобилизация жировых запасов, повышение уровня аминокислот в крови.
Ткани и органы, которые выступали в роли депо углеводов и липидов, уменьшаются в объеме. При нутритивной несостоятельности рациона масса печени снижается в среднем на 50%, другие пищеварительные органы теряют от 30% до 60% веса. Больше всего страдают мышцы — они атрофируются первыми, при длительном голодании остается всего 25-30% от исходной мускулатуры. Характерна дистрофия костной ткани, обусловленная дефицитом кальция и витаминов.
Резко снижается сократительная способность сердечной мышцы, падает выброс крови. Со временем развивается атрофия миокарда, тяжелая сердечная недостаточность. Поражение дыхательной системы характеризуется снижением жизненной емкости легких, минутного объема дыхания, нарушением функции мерцательного эпителия. В результате недостатка витаминов и белка снижается функциональная активность лимфоцитов.
Классификация
В зависимости от преобладающей симптоматики клиницисты выделяют 3 синдрома дефицитной нутритивной патологии: маразм (или «сухая» форма), квашиоркор («влажная» форма) и смешанный вариант. Легкая степень тяжести устанавливается при дефиците веса до 20%, средняя —21-30%, тяжелая степень — недостаток веса более 30% от нормы. В практике широко используется систематизация белково-энергетического дефицита по этиологии, согласно которой существует 3 вида БЭН:
- Первичная. Возникает при отсутствии достаточного количества пищи надлежащего качества и нормальной работе ЖКТ. Типична для развивающихся стран, в основном формируется у детей и стариков.
- Вторичная. Вызвана поражением пищеварительной системы, другими заболеваниями онкологического, эндокринного или инфекционного профиля. Может начаться в любом возрасте.
- Комбинированная. Самый тяжелый вариант болезни, предполагающий сочетание двух вышеперечисленных форм. Комбинированная форма патологии обычно имеет тяжелое течение, является прогностически неблагоприятной.
Симптомы нутритивной недостаточности
Главное проявление энергетической недостаточности питания — быстрая потеря массы больше 10% от исходного значения. Уменьшается толщина подкожно-жировой клетчатки, ребра и тазовые кости хорошо контурируются. Постепенно происходит атрофия мышц. Кожа становится бледной и холодной на ощупь, иногда появляются коричневые пигментные пятна. На поздней стадии формируются отеки. Волосы ломкие и тусклые, наблюдается диффузная алопеция.
При белково-энергетической недостаточности нарастают слабость, апатия. Иногда вследствие упадка сил человек даже не может подняться с постели. Повышается чувствительность к холоду, из-за нарушений микроциркуляции конечности остаются холодными даже в теплом помещении. Вследствие нутритивной неполноценности диеты у женщин прекращаются менструации, у мужчин развивается импотенция.
Характерны резкие нарушения пищеварения. Постепенно снижается аппетит, может быть тошнота и рвота. Возникают нарушения стула по типу чередования поносов и запоров. В каловых массах содержится большое количество непереваренных частиц пищи, нейтрального жира. Для нутритивной дефицитной патологии, начавшейся в детском возрасте, характерно сочетание этих проявлений с нарушением нервно-психического развития.
Осложнения
У всех больных с нутритивной недостаточностью наблюдаются тяжелые гиповитаминозы. При БЭН чаще встречается дефицит ретинола, витаминов группы В. Появляются состояния, вызванные нехваткой витаминов, — фолиеводефицитная или В12-дефицитная анемия, периферические полиневриты, нарушения сумеречного зрения. На фоне дефицита кальция происходят патологические переломы костей, мышечные судороги.
Частое последствие белково-энергетической недостаточности — инфекционные процессы, которые возникают у 70-80% пациентов. Осложнение обусловлено иммунологическими нарушениями — недостаточностью Т-лимфоцитов и снижением продукции иммуноглобулинов. Инфекции протекают крайне тяжело с высоким риском перехода локального воспаления в сепсис. У хирургических больных снижение калоража на 10 ккал/кг в день повышает риск летального исхода на 30%.
Диагностика
С проявлениями белково-энергетической недостаточности сталкиваются врачи всех специальностей, но выявлением начальных форм патологии чаще всего занимается врач-терапевт. Для диагностики очень важно собрать сведения о характере питания человека, материально-бытовых условиях. Для верификации диагноза нутритивной недостаточности проводятся следующие исследования:
- Оценка антропометрических показателей. Измеряются рост и масса тела, высчитывается ИМТ. Если вес за последние 2 месяца снизился более, чем на 10%, врач с высокой вероятностью подозревает белково-энергетический дефицит. Чтобы оценить количество жира в организме, измеряют толщину кожно-жировой складки на животе или над трицепсом.
- Анализы крови. В клиническом анализе снижен уровень гемоглобина, уменьшено число эритроцитов, изменены их форма и размер. При биохимическом исследовании крови наблюдается резкая гипопротеинемия, гипокалиемия, гипокальциемия.
- Специальные лабораторные методы. Обязательно назначается иммунологическое исследование: при маразме преимущественно снижаются Т-лимфоциты, при квашиоркоре наблюдается дефицит Т- и В-лимфоцитов. Диагностическим критерием белково-энергетической недостаточности является падение абсолютного количества лейкоцитов менее 2000 клеток в 1 мкл.
- УЗИ брюшной полости. Простой неинвазивный метод рекомендован при подозрении на вторичную форму заболевания и позволяет выявить проблемы с ЖКТ. При обнаружении патологических изменений на УЗИ показана рентгенография пассажа бария, ЭРХПГ и другие методы диагностики, используемые в клинической гастроэнтерологии.
Лечение белково-энергетической недостаточности
Подходы к лечению определяются с учетом стадии нутритивной недостаточности. При легкой и средней степени тяжести, если больные могут самостоятельно принимать пищу, терапия заключается в подборе рационального питания. В диете увеличивают содержание белка до 1,5-2 г/кг веса, повышают общую калорийность рациона. При резко сниженном аппетите, нарушении процессов пережевывания или глотания назначаются жидкие питательные смеси.
Более серьезную задачу представляет собой лечение тяжелой БЭН. Как правило, пациенты не способны употреблять пищу самостоятельно, поэтому требуется зондовое кормление сбалансированными смесями либо парентеральное питание. Помимо восполнения энергетического дефицита вводятся водно-электролитные смеси для коррекции нарушений гомеостаза. При вторичной форме белково-энергетической недостаточности гастроэнтеролог подбирает схему терапии основного заболевания.
Прогноз и профилактика
При ранней диагностике и своевременном лечении белково-энергетической недостаточности удается добиться регресса симптоматики, восстановления функциональной активности органов. Менее благоприятен прогноз для маленьких детей и пожилых людей, которые страдают тяжелой степенью нутритивного дефицита. Интеллектуальные нарушения, возникшие у детей раннего возраста, в редких случаях остаются на всю жизнь.
Профилактика предполагает повышение социально-экономических условий жизни населения, обеспечение едой и витаминными добавками людей, находящихся за чертой бедности. Медицинские профилактические меры направлены на выявление и лечение гастроэнтерологических заболеваний, устранение патологий, которые сопровождаются ускоренным метаболизмом.
5 причин, по которым белок у вас может не усваиваться
Вы уже знаете практически всё о пользе белка, но кое о чём мы ещё не рассказывали. Вы получите пользу от белка, только если он должным образом переварится и дойдёт до пункта назначения.
Очевидно, когда белок плохо усваивается, в организме нарушаются те же процессы, что и при его недостатке. Более того, начинается интоксикация, снижается иммунитет из-за хронического противостояния пищевому белку, проявляются аллергии и аутоиммунные заболевания.
Начнём с того почему белок может плохо перевариваться.
Переваривание белка начинается в желудке. Необходимые для этого условия – достаточная кислотность и отличное состояние слизистой желудка, вырабатывающей ферменты. Поджелудочная железа тоже выделяет ферменты, но прежде пища обрабатывается в желудке. Кстати, к 25 годам активность поджелудочной снижается, и с каждым годом она выделяет всё меньше ферментов.
Завершается расщепление белка в кишечнике, там же происходит и его усвоение. Поэтому здоровье кишечника важно не меньше, чем здоровье желудка.
Что делать: следите за здоровьем ЖКТ.
- 2Недостаток клетчатки (пищевых волокон), сопровождающей белок.
Необходимые ферменты содержатся и в клетчатке из овощей. Поэтому мы рекомендуем к основному белковому блюду добавлять овощной гарнир, чтобы облегчить организму задачу.
Что делать: съедайте 2 порции овощей и зелени на одну порцию белка.
- У каждого типа белка есть коэффициент усвоения, принятый ВОЗ. Например, коэффициент усвоения говядины – 0,9. Это значит, что из 20 г белка в идеальных условиях усвоится 18 г.
Поджелудочная железа спроектирована выделять примерно одинаковое количество ферментов 4-5 раз в день на усваивание около 35 г белка за один приём. Так что нет смысла съедать за присест половину дневной порции протеинов и радоваться перевыполнению плана.
Преизбыток белков негативно отражается на пищеварении и здоровье в целом, так как непереваренные белки начинают гнить в кишечнике. Как следствие возникают запоры, повышение уровня ацетона в крови, регулярная тяжесть, тошнота и другие неприятные ощущения.
- 4Несоблюдение водного баланса.
И в момент расщепления белка до аминокислот в желудке, и во время продвижения пищи в кишечнике, организм активно использует воду. Если воды недостаточно, пищеварение затрудняется. Только во время еды старайтесь не пить – разбавите желудочный сок и снизите кислотность, которая необходима для обработки белка.
Что делать: выпивайте примерно 30 мл воды на каждый кг веса тела. А лучше просчитайте точную норму потребления воды тут.
- 5Чрезмерная обработка продуктов.
В 100 г куриной грудки 20 г белка. Вы уже знаете, что немного белка вы потеряете, потому что он усваивается не целиком. Но вы потеряете намного больше, если обжарите мясо в большом количестве масла или кляра – ферментам просто будет трудно добраться до белка. Зато если вы измельчите продукт, например, сделаете фарш – такой приём переварится быстрее. Особенно если котлеты не пожарить, а запечь или приготовить на пару.
Что делать: готовьте простые блюда, больше запекайте и готовьте на пару.
А теперь самое интересное. Переваривание и усвоение – это разные процессы. Допустим, в вашем рационе достаточно ферментов для переваривания белка. Но качественно ли он усваивается в кишечнике?
Качество усвоения зависит от здоровья слизистой кишечника и наличия ворсинок, через которые расщеплённые до аминокислот белки попадают в кровь. Если на поверхности ворсинок много слизи, налёта, каловых отложений, или если они повреждены из-за избыточного потребления сахара, то усвоение ухудшается. Чтобы восстановить здоровье кишечника – займитесь его микрофлорой. Подробное руководство у нас тут.
- Показатели перевариваемости и усвоения пищи иногда не совпадают. Например, яйца, сваренные вкрутую, усваиваются лучше, чем сваренные всмятку, а перевариваются тяжелее.
Теперь вы знаете основные причины, по которым белок может не усваиваться. И знаете, как от них избавиться. Избавляйтесь!
Много белковых блюд будет 23 сентября на Cheat Meal Fest, приходите!
(50957)
comments powered by HyperComments
Белково-энергетическая недостаточность — симптомы болезни, профилактика и лечение Белково-энергетической недостаточности, причины заболевания и его диагностика на EUROLAB
Что такое Белково-энергетическая недостаточность —
При недостаточном поступлении белков и энергии уменьшаются безжировая масса тела и количество жировой ткани, причем одно из этих изменений может быть более выраженным.
Белковая недостаточность — патологическое состояние, развивающееся вследствие сокращения или прекращения поступления в организм белков. Может быть обусловлена также усиленныи распадом белка в организме, например при ожоговой болезни, тяжелой травме, гнойно-септического заболевания.
В развивающихся странах белково-энергетическая недостаточность встречается часто; в периоды голода ее распространенность может достигать 25%.
Первичная белково-энергетическая недостаточность возникает в тех случаях, когда социально-экономические факторы не позволяют обеспечить достаточное количество и качество пищи — в частности, если в пищу употребляются в основном растительные белки с низкой биологической ценностью. Играет роль и высокая распространенность инфекций.
Белковая недостаточность усугубляется при недостаточном поступлении энергии, поскольку в этом случае аминокислоты пищи используются не для синтеза белка, а окисляются для получения энергии.
В развивающихся странах у детей встречаются 2 формы белково- энергетической недостаточности — маразм и квашиоркор.
Маразм характеризуется задержкой роста, атрофией мышц (вследствие утилизации белка) и подкожной клетчатки; отеки отсутствуют. Заболевание обусловлено недостаточным поступлением и белков, и энергии.
При квашиоркоре (изолированная белковая недостаточность) наблюдаются задержка роста, отеки, гипоальбуминемия, жировая дистрофия печени . Подкожная клетчатка сохранена.
И у взрослых, и у детей могут встречаться смешанные формы; различия между белково-энергетической и изолированной белковой недостаточностью не имеют большого клинического значения.
В развитых странах чаще всего наблюдается вторичная белково- энергетическая недостаточность, развивающаяся на фоне острых или хронических заболеваний. Причинами служат снижение аппетита, повышение основного обмена, нарушение всасывания, алкоголизм и наркомания; у пожилых — депрессия , одиночество, бедность. У половины госпитализированных пожилых истощение уже имеется на момент поступления в стационар или развивается в период госпитализации.
Первичная и вторичная белково-энергетическая недостаточность могут сочетаться. Так, при недостаточном питании характерные для инфекций повышение основного обмена и снижение аппетита быстрее приводят к появлению клинических признаков истощения, чем при нормальном питательном статусе.
Изолированная белково-энергетическая недостаточность встречается редко. Обычно она сопровождается дефицитом других компонентов пищи — фолиевой кислоты , витамина В1, витамина В2 и витамина В6, никотиновой кислоты, витамина A. При белково-энергетической недостаточности у детей особенно опасен авитаминоз A. При прогрессировании заболевания и утилизации клеточных белков происходит потеря внутриклеточных калия, фосфора и магния, причем эта потеря пропорциональна экскреции азота. Поэтому на фоне восстановления питательного статуса могут проявиться симптомы дефицита этих веществ.
Патогенез (что происходит?) во время Белково-энергетической недостаточности:
Адаптация организма к энергетической недостаточности, при которой поступление калорий не обеспечивает минимальной потребности в энергии, включает гормональные изменения. Эти изменения способствуют мобилизации свободных жирных кислот из жировой ткани и аминокислот из мышц. Глюконеогенез и окисление аминокислот обеспечивают образование энергии, необходимой для других органов, особенно головного мозга. В результате снижается синтез белка, замедляется метаболизм, уменьшается безжировая масса тела и снижается количество жировой ткани. В первую неделю голодания потеря веса составляет 4-5 кг (25% приходится на жировую ткань, 35% — на внеклеточную жидкость, 40% — на белки). В дальнейшем снижение веса замедляется. Различные компоненты тела утилизируются с разной скоростью: скелетные мышцы — быстрее сердечной мышцы, органы ЖКТ и печень — быстрее почек. Белки скелетных мышц используются для синтеза альбумина, поэтому гипоальбуминемия развивается позднее.
При употреблении в пищу в основном растительных белков с низкой биологической ценностью, а также в тех случаях, когда для парентерального питания используется только раствор глюкозы, может развиться белковая недостаточность. При этом усиливается секреция инсулина, который тормозит липолиз и мобилизацию белков скелетных мышц. Уровень аминокислот в крови падает, снижается синтез альбумина и других белков. В результате развиваются гипоальбуминемия, отеки и жировая дистрофия печени, характерные для квашиоркора.
Дефицит минеральных веществ частично обусловлен снижением веса и потерей внеклеточной жидкости. Потери калия и магния могут быть непропорционально высокими из-за мобилизации внутриклеточных запасов этих веществ. Дефицит усугубляется при недостаточном потреблении минеральных веществ (например, парентеральное питание с использованием в качестве источника энергии только глюкозы) и увеличении их потерь (усиление диуреза, понос, свищ).
Голодание обычно не приводит к быстрому летальному исходу. Адаптация организма к энергетической недостаточности включает удовлетворение энергетических потребностей ЦНС за счет окисления жирных кислот и кетоновых тел, замедление метаболизма, способствующее сохранению запасов белка. Более опасно голодание при острых или хронических заболеваниях. Они способствуют повышению основного обмена, ускоряют снижение веса, а также потерю азота и незаменимых компонентов пищи. Обусловлен ли этот эффект непосредственными метаболическими последствиями воспаления, инфекции, лихорадки и заживления ран либо опосредован действием медиаторов воспаления, таких, как ФО альфа , ИЛ-2и ИЛ-6, не вполне ясно.
Таким образом, тяжелая белково-энергетическая недостаточность развивается при недостаточном питании на фоне острых или хронических заболеваний. Так, она часто наблюдается при СПИД е (вероятно, вследствие снижения аппетита, лихорадки и поноса).
Симптомы Белково-энергетической недостаточности:
Легкая и умеренная белково-энергетическая недостаточность. У детей отсутствует прибавка веса и роста. У взрослых отмечается сниение веса, хотя при отеках или ожирении оно может быть не столь заметным. Уменьшаются толщина кожной складки над трехглавой мышцей плеча и мышечная масса в области плеча.
В отсутствие болезней почек чувствительным показателем белковой недостаточности служит отношение суточной экскреции креатинина к росту (показатель измеряют еженедельно). Снижаются уровни альбумина, трансферрина и транстиретина (преальбумина) в крови. Уровень Т3 снижается, а реверсивного Т3 — повышается. Замедляется метаболизм. Возможны лимфопения и нарушение толерантности к глюкозе . Размеры сердца уменьшены .
Тяжелая белково-энергетическая недостаточность. Тяжелая белково- энергетическая недостаточность сопровождается более выраженными изменениями клинических и лабораторных показателей. При физикальном исследовании обнаруживают западение межреберий, атрофию височных мышц и атрофию мышц конечностей. Подкожная клетчатка атрофирована или отсутствует. Характерны апатия, быстрая утомляемость, чувство холода, депигментация кожи и депигментация волос, заострившиеся черты лица; кожа сухая, покрыта трещинами. В запущенных случаях образуются пролежни, кожа изъязвляется. АД снижено, также как и температура тела, пульс ослаблен. Нарушаются функции всех органов и систем.
Сердечно-сосудистая система, дыхательная система и почки. Вентиляторная реакция на гипоксию ослаблена. Масса сердца и почек снижается в соответствии со снижением безжировой массы тела и замедлением метаболизма, и поэтому сердечный выброс и СКФ хотя и уменьшаются, но все же соответствуют потребностям организма. Однако при инфекции, стрессе, а также при быстром восстановлении ОЦК и питательного статуса возможна сердечная недостаточность.
Кровь. ОЦК, гематокрит, уровни альбумина и трансферрина, а также число лимфоцитов в крови снижены. Развивается нормоцитарная нормохромная анемия — обычно вследствие уменьшения эритропоэза, обусловленного снижением синтеза белка. Анемию усугубляет дефицит железа, фолиевой кислоты и витамина В6.
Метаболизм. Основной обмен и температура тела понижены, по-видимому, вследствие падения уровня Т3 и утраты теплоизолирующей функции подкожной клетчатки. В терминальной стадии развивается гипогликемия.
ЖКТ и поджелудочная железа. Наблюдаются атрофия кишечных ворсинок, усиленный рост микрофлоры в тонкой кишке; нарушаются экзокринная и эндокринная функции поджелудочной железы. Встречаются нарушение всасывания и непереносимость лактозы. Указанные симптомы могут быть обусловлены не собственно голоданием, а атрофией ЖКТ от бездействия, поскольку сходные изменения отмечаются при полном парентеральном питании.
Иммунная система. Гуморальный иммунитет обычно сохранен; лабораторные исследования выявляют нарушение клеточного иммунитета. Часто развиваются пневмония и другие инфекции, в том числе оппортунистические.
Заживление ран. Заживление ран (в том числе операционных) замедлено. Края раны часто расходятся.
Репродуктивная система. Нарушаются имплантация яйцеклетки, рост и развитие плода. Роды протекают с осложнениями, снижается лактация. У новорожденного отмечается задержка роста; у выживших детей в дальнейшем возможны когнитивные нарушения.
Лечение Белково-энергетической недостаточности:
При легкой и умеренной белково-энергетической недостаточности следует устранить возможные причины этого состояния. Суточный приход белков и энергии увеличивают (в соответствии с идеальным весом) для ликвидации их дефицита. Всем больным назначают поливитамины. Проводят также лечение и профилактику дефицита минеральных веществ (в том числе микроэлементов) для предупреждения угрожающих жизни гипокалиемии, гипомагниемии, гипофосфатемии и т. д. Если больной способен принимать пищу и глотать, достаточно самостоятельного питания. При снижении аппетита или в отсутствие зубов дополнительно назначают жидкие питательные смеси для самостоятельного или зондового питания.
При тяжелой белково-энергетической недостаточности требуется более срочное вмешательство. Лечение таких больных затруднено по нескольким причинам:
- Заболевания, вызвавшие белково-энергетическую недостаточность, протекают тяжело, их труднее лечить. Иногда азотистый баланс можно восстановить только после излечения инфекции и устранения лихорадки.
- Белково-энергетическая недостаточность сама по себе может препятствовать излечению вызвавшего ее тяжелого заболевания. В таких случаях необходимо как можно раньше начать зондовое или парентеральное питание.
- Поступление пищи через ЖКТ способствует поносу из-за атрофии слизистой и дефицита ферментов кишечника и поджелудочной железы. При этом может быть показано полное парентеральное питание.
- Следует устранить сопутствующий дефицит других компонентов пищи (витаминов, незаменимых минеральных веществ, микроэлементов).
У взрослых восстановление питательного статуса наступает медленно и не всегда полностью; у детей выздоровление происходит в течение 3-4 мес. Во всех случаях необходимы образовательные и реабилитационные программы, а также меры психологической и социальной поддержки.
К каким докторам следует обращаться если у Вас Белково-энергетическая недостаточность:
Диетолог
Терапевт
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Белково-энергетической недостаточности, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Eurolab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют Вас и окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Eurolab открыта для Вас круглосуточно.
Как обратиться в клинику:
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу.
Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
У Вас ? Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Люди уделяют недостаточно внимания симптомам заболеваний и не осознают, что эти болезни могут быть жизненно опасными. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Eurolab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Другие заболевания из группы Болезни эндокринной системы, расстройства питания и нарушения обмена веществ:
| Аддисонический криз (острая недостаточность коры надпочечников) |
| Аденома молочной железы |
| Адипозогенитальная дистрофия (болезнь Перхкранца — Бабинского — Фрелиха) |
| Адреногенитальный синдром |
| Акромегалия |
| Алиментарный маразм (алиментарная дистрофия) |
| Алкалоз |
| Алкаптонурия |
| Амилоидоз (амилоидная дистрофия) |
| Амилоидоз желудка |
| Амилоидоз кишечника |
| Амилоидоз островков поджелудочной железы |
| Амилоидоз печени |
| Амилоидоз пищевода |
| Ацидоз |
| Болезнь I-клеток (муколипидоз типа II) |
| Болезнь Вильсона-Коновалова (гепатоцеребральная дистрофия) |
| Болезнь Гоше (глюкоцереброзидный липидоз, глюкоцереброзидоз) |
| Болезнь Иценко-Кушинга |
| Болезнь Краббе (глобоидно-клеточная лейкодистрофия) |
| Болезнь Нимана — Пика (сфингомиелиноз) |
| Болезнь Фабри |
| Ганглиозидоз GM1 тип I |
| Ганглиозидоз GM1 тип II |
| Ганглиозидоз GM1 тип III |
| Ганглиозидоз GM2 |
| Ганглиозидоз GM2 тип I (амавротическая идиотия Тея — Сакса, болезнь Тея — Сакса) |
| Ганглиозидоз GM2 тип II (болезнь Сандхоффа, амавротическая идиотия Сандхоффа) |
| Ганглиозидоз GM2 ювенильный |
| Гигантизм |
| Гиперальдостеронизм |
| Гиперальдостеронизм вторичный |
| Гиперальдостеронизм первичный (синдром Конна) |
| Гипервитаминоз D |
| Гипервитаминоз А |
| Гипервитаминоз Е |
| Гиперволемия |
| Гипергликемическая (диабетическая) кома |
| Гиперкалиемия |
| Гиперкальциемия |
| Гиперлипопротеинемия I типа |
| Гиперлипопротеинемия II типа |
| Гиперлипопротеинемия III типа |
| Гиперлипопротеинемия IV типа |
| Гиперлипопротеинемия V типа |
| Гиперосмолярная кома |
| Гиперпаратиреоз вторичный |
| Гиперпаратиреоз первичный |
| Гиперплазия тимуса (вилочковой железы) |
| Гиперпролактинемия |
| Гиперфункция яичек |
| Гиперхолестеринемия |
| Гиповолемия |
| Гипогликемическая кома |
| Гипогонадизм |
| Гипогонадизм гиперпролактинемический |
| Гипогонадизм изолированный (идиопатический) |
| Гипогонадизм первичный врожденный (анорхизм) |
| Гипогонадизм первичный приобретенный |
| Гипокалиемия |
| Гипопаратиреоз |
| Гипопитуитаризм |
| Гипотиреоз |
| Гликогеноз 0 типа (агликогеноз) |
| Гликогеноз I типа (болезнь Гирке) |
| Гликогеноз II типа (болезнь Помпе) |
| Гликогеноз III типа (болезнь Кори, болезнь Форбса, лимитдекстриноз) |
| Гликогеноз IV типа (болезнь Андерсена, амилопектиноз, диффузный гликогеноз с циррозом печени) |
| Гликогеноз IX типа (болезнь Хага) |
| Гликогеноз V типа (болезнь Мак-Ардла, миофосфорилазная недостаточность) |
| Гликогеноз VI типа (болезнь Герса, гепатофосфорилазная недостаточность) |
| Гликогеноз VII типа (болезнь Таруи, миофосфофруктокиназная недостаточность) |
| Гликогеноз VIII типа (болезнь Томсона) |
| Гликогеноз XI типа |
| Гликогеноз Х типа |
| Дефицит (недостаточность) ванадия |
| Дефицит (недостаточность) магния |
| Дефицит (недостаточность) марганца |
| Дефицит (недостаточность) меди |
| Дефицит (недостаточность) молибдена |
| Дефицит (недостаточность) хрома |
| Дефицит железа |
| Дефицит кальция (алиментарная недостаточность кальция) |
| Дефицит цинка (алиментарная недостаточность цинка) |
| Диабетическая кетоацидотическая кома |
| Дисфункция яичников |
| Диффузный (эндемический) зоб |
| Задержка полового созревания |
| Избыток эстрогенов |
| Инволюция молочных желез |
| Карликовость (низкорослость) |
| Квашиоркор |
| Кистозная мастопатия |
| Ксантинурия |
| Лактацидемическая кома |
| Лейциноз (болезнь кленового сиропа) |
| Липидозы |
| Липогранулематоз Фарбера |
| Липодистрофия (жировая дистрофия) |
| Липодистрофия врожденная генерализованная (синдром Сейпа-Лоуренса) |
| Липодистрофия гипермускулярная |
| Липодистрофия постинъекционная |
| Липодистрофия прогрессирующая сегментарная |
| Липоматоз |
| Липоматоз болезненный |
| Метахроматическая лейкодистрофия |
| Микседематозная кома |
| Муковисцидоз (кистозный фиброз) |
| Мукополисахаридоз |
| Мукополисахаридоз типа I-S (болезнь Шейе; поздний синдром Гурлер) |
| Мукополисахаридоз типа I-Н (синдром Гурлер) |
| Мукополисахаридоз типа II (синдром Гунтера) |
| Мукополисахаридоз типа III (синдром Санфилиппо, болезнь Санфилиппо) |
| Мукополисахаридоз типа IV (снидром Моркио, болезнь Моркио). |
| Мукополисахаридоз типа VI (синдром Марото-Лами, болезнь Марото-Лами) |
| Мукополисахаридоз типа VII (синдром Слая) |
| Мукополисахаридоз типа VIII (синдром Ди Ферранте) |
| Надпочечниковая гиперандрогения |
| Нарушение обмена тирозина |
| Недостаточность аскорбиновой кислоты ( гиповитаминоз С) |
| Недостаточность витамина B1 (тиамина) |
| Недостаточность витамина D |
| Недостаточность витамина А |
| Недостаточность витамина В12 (цианокобаламина) |
| Недостаточность витамина В6 (пиридоксина) |
| Недостаточность витамина Е |
| Недостаточность витамина К |
| Недостаточность никотиновой кислоты (ниацина, витамина РР, витамина В3) |
| Недостаточность селена (дефицит селена) |
| Нейрональный цероид-липофусциноз |
| Непереносимость лактозы |
| Несахарный диабет |
| Ожирение |
| Острый гнойный тироидит (струмит) |
| Острый негнойный тиреоидит |
| Острый тиреоидит |
| Подагра |
| Подострый тиреоидит (тиреоидит де Кервена) |
| Преждевременное половое созревание |
| Псевдогипопаратиреоз |
| Псевдогурлеровская полидистрофия (муколипидоз тип III) |
| Рахит |
| Сахарный диабет 1 типа |
| Сахарный диабет 2 типа |
| Синдром Видемана-Беквита |
| Синдром Грама |
| Синдром Дабина-Джонсона |
| Синдром Деркума |
| Синдром Жильбера |
| Синдром Криглера — Найяра |
| Синдром Лёша-Нихана |
| Синдром Маделунга |
| Синдром монорхизма |
| Синдром поликистозных яичников |
| Синдром Ротора |
| Тиреотоксикоз (гипертиреоз) |
| Тиреотоксический криз (тиреоидный криз) |
| Тирозиноз |
| Фенилкетонурия (фенилпировиноградная олигофрения) |
| Фиброзный тиреоидит (тиреоидит Риделя) |
| Хронический аутоиммунный тиреоидит |
| Энцефалопатия Вернике |
заболеваний, связанных с белковой недостаточностью
Белки — это элементы построения тела, необходимые человеческому организму. Они обеспечивают организм необходимой энергией для правильного функционирования и имеют решающее значение для развития мышц. Белки также способствуют развитию ногтей, здоровой кожи и росту волос. Дефицит белка имеет побочные эффекты и может привести к заболеваниям.
Болезни, связанные с дефицитом белка
1. Маразм
Маленькие дети и младенцы уязвимы перед последствиями нехватки белка.Маразм — это острая нехватка важных питательных веществ. Food4Africa отмечает, что люди, страдающие маразмом, выглядят хилыми и худыми. Это смертельное заболевание, вызывающее потерю веса и обезвоживание.
2. Квашиоркор
Недостаток белков из источников углеводов, таких как рис, ямс и бананы, вызывает квашиоркор. Это серьезное заболевание, связанное с недоеданием, часто встречается у детей старшего возраста. В Медицинском центре Университета Мэриленда объясняют, что симптомы болезни включают вздутие живота из-за задержки жидкости.У него также есть симптомы, общие для маразма, такие как раздражительность, диарея, утомляемость, ограниченный рост и когнитивное развитие, а также психическое здоровье.
3. Дефицит белков C и S
Исследования показывают, что 1 из каждых 300 человек страдает от недостатка протеина C. Точно так же дефицит протеина S встречается у 1 из 20 000 человек. Medline Plus утверждает, что дефицит протеина C&S является наследственным заболеванием, приводящим к свертыванию крови. Такие недостатки характеризуются болью, покраснением, припухлостью и болезненностью в пораженной области.В исследовании А. Худейна, проведенном в 2009 году под названием «Анналы Индийской академии неврологии», говорится, что дефицит протеина S вызывает ишемический инсульт. Любой, кто страдает от белковых заболеваний, должен избегать действий, которые приводят к свертыванию крови. К ним относятся постельный режим, длительное сидение в автомобилях, самолетах и транспортных системах.
4. Кахексия
Исследование 2000 года, проведенное Котлером Д. П. в «Анналах внутренней медицины», объясняет, что кахексия — это заболевание, которое вызывает ослабление скелетных мышц и уменьшение количества белка.В статье Дж. Э. Морли в American Journal of Clinical Nutrition говорится, что это состояние может быть фатальным. Это связано с хроническими заболеваниями, такими как СПИД, рак, хроническая почечная недостаточность, хроническая обструктивная болезнь легких и ревматоидный артрит. Это приводит к потере веса, а также может привести к смерти. Уменьшение потребления белка часто встречается у пациентов, страдающих раком толстой кишки, желудка, печени, поджелудочной железы и желчевыводящих путей. Уменьшение количества калорий и микроэлементов приводит к усталости и отрицательному азотному балансу.Дж. Окенга в своей статье 2005 года в «Пищевая фармакология и терапия» подчеркивает, что потеря мышц при кахексии происходит из-за снижения потребления белка.
Симптомы белковой недостаточности
«Недостаток белка» имеет признаки и симптомы, отражающие изменения в организме. Если вы испытываете какие-либо симптомы или заметили кого-то с такими признаками, рекомендуется немедленно обратиться за медицинской помощью. Некоторые из этих симптомов включают:
|
|
Средства для лечения дефицита белка
1.Белковые добавки
Использование добавок зависит от степени заболевания, а также от степени их дефицита. Дополнительное питание — это дополнение к приему пищи, которое увеличивает ее количество. Эти элементы имеют решающее значение для эффективного снабжения организма белком.
Однако потребление белка не должно быть слишком большим; скорее, оно должно быть в нужном количестве. Вегетарианцам и веганам необходимы белковые добавки, чтобы повысить содержание питательных веществ в организме. Пренебрежение телом вредно для здоровья и имеет медицинские последствия.Найти правильный баланс белка сложно, поэтому добавки помогают повысить уровень питательных веществ, создавая правильный баланс.
2. Продукты, богатые белком
Потребление продуктов, обогащенных белком, имеет важное значение. Они бывают разных сортов и должны приниматься ежедневно для здорового, хорошо сложенного тела. Суточное потребление белка зависит от потребностей организма и варьируется от взрослых, детей и больных.
В острых случаях белковой недостаточности рекомендуются диеты с высоким содержанием белка.Это эффективный способ восстановить мышцы, а также эффективное решение для программ по снижению веса.
- Диеты с высоким содержанием белка включают блюда, обогащенные такими продуктами, как яйца, мясо, арахис, молоко, курица, морепродукты, соевые продукты и рыба.
- Для вегетарианцев идеально подходят белки из овощей, таких как бобовые и орехи.
- Существуют закуски, богатые белком, которые можно использовать для обеспечения необходимого количества белка. К ним относятся вкусный бутерброд с тунцом, салаты из проростков и соевые продукты.
Невегетарианские белковые продукты | Вегетарианские протеиновые продукты |
|---|---|
|
Семена |
Переваривание белков в желудке и тонком кишечнике
Организму необходимы белки, в особенности содержащиеся в них незаменимые аминокислоты.Рекомендуемая суточная доза для здорового взрослого человека составляет 0,85 г / кг массы тела, поэтому для человека с массой тела 70 кг — около 60 г, но часто в типичной западной диете потребление превышает 100 г / день.
Помимо пищевых белков, организм также переваривает 50-100 г эндогенных белков, которые выделяются или теряются в просвете желудочно-кишечного тракта, в результате чего:
- слюна;
- желудочный сок;
- ферментов поджелудочной железы и других секретов;
- отслаивающихся кишечных клеток;
- белков, которые попадают в просвет кишечника из кровотока.
Рис. 1 — Тонкий кишечник
Эта смесь эффективно переваривается и всасывается в двенадцатиперстной кишке, первой и самой короткой части тонкой кишки, с ежедневной потерей с фекалиями около 1,6 г азота, что эквивалентно 10 г белка. . Большая часть потерянного азота используется микрофлорой толстой кишки для ее роста и, таким образом, обнаруживается в фекалиях как часть бактериальной массы.
СОДЕРЖАНИЕ
Пищеварительные ферменты
Переваривание белка происходит в результате гидролиза пептидных связей, которые связывают отдельные аминокислоты в полипептидной цепи.Эти реакции катализируются ферментами, называемыми протеазами .
Кишечные протеазы, специфичные для боковой цепи аминокислоты, представляют собой гидролазы, которые можно разделить на два класса:
- эндопептидазы, которые гидролизуют пептидные связи в полипептидной цепи и продуцируются желудком и экзокринной поджелудочной железой;
- экзопептидаз, которые можно разделить на две группы:
карбоксипептидаза, которая удаляет аминокислоты с С-конца и продуцируется экзокринной поджелудочной железой;
аминопептидазы, которые действуют на N-конце и продуцируются энтероцитами.
Рис. 2 — Зимогены желудка и поджелудочной железы
Эти ферменты синтезируются и секретируются в неактивной форме, называемой зимогенами или проферментами .
Внутри клетки зимогены хранятся внутри мембранных гранул, называемых гранулами зимогена. Когда клетка стимулируется специфическим сигналом, мембрана гранул сливается с плазматической мембраной, и зимогены высвобождаются путем экзоцитоза.
Эти протеазы синтезируются в неактивной форме, чтобы избежать того, что перед секрецией они переваривают себя и / или тканевые белки.Происходит то, что активный центр фермента «замаскирован», и только после активации белок может воздействовать на субстрат. Активация является результатом катализируемого определенным ферментом расщепления одной или нескольких конкретных пептидных связей с высвобождением одного или нескольких сегментов полипептидной цепи. Это позволяет молекуле принимать трехмерную конформацию, в которой активный сайт свободен и правильно настроен.
Даже их накопление в гранулах является защитной системой: оно изолирует их от других молекул, присутствующих в клетке.
Большинство белков в своей нативной конформации устойчивы к действию протеаз. Это является следствием их вторичной, третичной или нативной структуры, которая маскирует многие связи для действия ферментов. Эти структуры стабилизируются ковалентными связями, такими как дисульфидные мостики между остатками цистеина, и нековалентными силами, такими как ионные взаимодействия, водородные связи и силы Ван-дер-Ваальса.
Поэтому для адекватного переваривания белков важно, чтобы пептидные связи были как можно более доступными для действия протеаз кишечника.Это достигается вне тела за счет приготовления пищи и внутри организма за счет кислой среды в желудке.
Роль приготовления и пережевывания пищи
Приготовление пищи, если оно не является чрезмерным, облегчает переваривание белков.
Каким образом?
Как и все молекулы, белки не неподвижны, а колеблются. С повышением температуры белки колеблются с большей амплитудой, вплоть до разрушения нековалентных связей, которые способствуют сохранению нативной структуры.Следовательно, происходит конформационное изменение белка, то есть молекула денатурируется. Это может сделать внутренние пептидные связи более доступными для действия пищеварительных ферментов.
Даже пережевывание и инсаливация пищи гомогенизируют и увлажняют твердые компоненты самой пищи, облегчая пищеварение в желудке и тонком кишечнике.
Этапы переваривания белков
В переваривании белков участвуют две стадии: первая происходит в желудке, а вторая — в двенадцатиперстной кишке, первой части тонкой кишки.
Желудок и переваривание белков
Переваривание белка начинается в желудке, и это «подготовительный этап» по сравнению с событиями, происходящими в двенадцатиперстной кишке.
Присутствие пищи в желудке стимулирует G-клетки слизистой оболочки антрального отдела желудка и проксимального отдела двенадцатиперстной кишки для выработки и высвобождения гормона гастрина в кровоток. Гормон стимулирует париетальные клетки соответствующих желез желудка, локализованные в основном в нижней части органа, для производства и секреции соляной кислоты в желудок (париетальные клетки также производят внутренний фактор, белок, который связывает витамин B 12 , предотвращая его разрушение и поглощение).
В соответствующих желудочных железах вы также нашли:
- клетки слизистой шеи, продуцирующие слизь;
- главных клеток, выделяющих пепсиногена .
Все эти вещества, вместе с другими, такими как ионы калия и желудочная липаза, присутствуют в желудочном соке, pH которого находится в диапазоне от 1 до 2,5.
Благодаря низкому pH желудочный сок обладает антисептическим действием, убивая большинство бактерий и других чужеродных клеток, а также денатурирующий эффект, поскольку он разрушает нековалентные связи, которые поддерживают естественную структуру белков.Этот денатурирующий эффект облегчает доступ протеазы кишечника к пептидным связям, как нагрев во время приготовления. Некоторые белки, богатые дисульфидными связями, например кератины, устойчивы к денатурации из-за низкого pH и, следовательно, трудны для переваривания. Напротив, большинство глобулярных белков почти полностью гидролизуются до составляющих аминокислот.
Наконец, низкий рН желудочного сока активирует пепсиноген, зимоген, до пепсина , первого фермента, участвующего в переваривании белка.
Расщепление белков и пепсин
Существуют различные изоферменты пепсиногена, такие как тип I, синтезируемый клетками тела и дна желудка, и тип II, который продуцируется во всех областях органа. Все изоферменты превращаются в активный фермент. Активация происходит посредством автокатализа при значениях pH ниже 5 посредством внутримолекулярного процесса, состоящего в гидролизе конкретной пептидной связи и высвобождении небольшого пептида с N-концевого конца профермента.Этот пептид остается связанным с ферментом и продолжает действовать как ингибитор до тех пор, пока pH не упадет ниже 2, или пока он не подвергнется дальнейшему разложению самим пепсином. Итак, как только образуется некоторое количество пепсина, он быстро активирует другие молекулы пепсиногена.
Пепсин, эндопептидаза с оптимальным pH активности 1,6, гидролизует 10-20% белков пищи. Многие пищеварительные ферменты способны действовать на широкий спектр субстратов, и пепсин не является исключением, катализируя расщепление пептидных связей, прилегающих к аминокислотным остаткам, таким как лейцин и фенилаланин, тирозин и триптофан (ароматические аминокислоты).Производится смесь пептидов большого размера и нескольких свободных аминокислот.
Действие пепсина важно не столько из-за его непосредственного вклада в переваривание белков, что является умеренным, сколько для высвобождения пептидов и аминокислот, которые на уровне двенадцатиперстной кишки стимулируют секрецию холецистокинина и, следовательно, дуоденальную / панкреатическую фазу переваривание белков (см. ниже).
Следует отметить, что действие пепсина на коллаген, семейство белков, которые окружают и удерживают вместе мышечные клетки, облегчает доступ протеазы поджелудочной железы к белкам пищи.
Двусторонняя кишка и переваривание белков
Когда содержимое желудка переходит в двенадцатиперстную кишку, его кислотность стимулирует S-клетки, локализованные в слизистой оболочке двенадцатиперстной кишки и в проксимальной части тощей кишки (следующая часть тонкой кишки), для производства и высвобождения гормона секретина в кишечник. кровоток. Гормон вызывает секрецию щелочного панкреатического сока, богатого ионами бикарбоната, но бедного ферментами, который проходит в двенадцатиперстную кишку через проток поджелудочной железы.В двенадцатиперстной кишке он нейтрализует соляную кислоту, вырабатываемую желудком, повышая pH примерно до 7 (нейтральный уровень). Секретин также стимулирует секрецию желчи и снижает выброс гастрина.
Присутствие аминокислот в двенадцатиперстной кишке стимулирует, как упоминалось выше, эндокринные клетки двенадцатиперстной кишки и тощей кишки производить и высвобождать холецистокинин (CKK) в кровоток. Гормон, помимо других функций, стимулирует экзокринную поджелудочную железу выделять сок, богатый ферментами (присутствующими в виде зимогенов), то есть:
- трипсиноген, химотрипсиноген и проэластаза, эндопептидазы с другой субстратной специфичностью по сравнению с пепсином, но также и среди них;
- прокарбоксипептидаза А и В, экзопептидазы, которые удаляют аминокислоты с С-концевого конца пептидов.
Таким образом, в двенадцатиперстной кишке существует нейтральная среда, богатая ферментами, способными продолжать, после активации , переваривание белков. Более того, поскольку протеазы имеют различную субстратную специфичность, каждый пептид, продуцируемый одним ферментом, может быть субстратом другого фермента.
В соке поджелудочной железы также присутствуют амилаза, липаза и нуклеаза.
Активация зимогенов поджелудочной железы
Первым и главным этапом их активации является превращение трипсиногена в трипсин с помощью энтеропептидазы (также называемой энтерокиназой), эндопептидазы, продуцируемой клетками двенадцатиперстной кишки после стимуляции холецистокинином.Энтеропептидаза катализирует расщепление специфической пептидной связи между остатком лизина и остатком изолейцина трипсиногена с высвобождением гексапептида. Это вызывает конформационную перестройку активирующего его белка, то есть образуется трипсин.
Фермент расщепляет пептидные связи, прилегающие к остаткам лизина и аргинина белка, чтобы переварить; кроме того, он может активировать химотрипсиноген, проэластазу и прокарбоксипептидазу A и B, а также другие молекулы трипсиногена, такие как пепсин (автокатализ).
Рис. 3 — Активация зимогенов поджелудочной железы
Таким образом, способность двенадцатиперстной кишки переваривать белки возрастает по мере активации зимогенов поджелудочной железы, и все это запускается небольшим количеством энтеропептидазы.
- Активация химотрипсиногена в химотрипсин происходит посредством различных стадий, в которых принимают участие трипсин и сам активированный химотрипсин.
На первом этапе трипсин катализирует расщепление определенной пептидной связи, и это вызывает активацию химотрипсиногена до π-химотрипсина, который полностью активен.Затем сам π-химотрипсин катализирует высвобождение двух дипептидов с образованием δ-химотрипсина, более стабильной формы фермента. δ-Химотрипсин претерпевает два конформационных изменения, первое из которых приводит к образованию κ-химотрипсина, а второе — α-химотрипсина, последней активной формы фермента.
Рис. 4 — Активация химотрипсиногенаХимотрипсин действует на пептидные связи, прилегающие к остаткам фенилаланина, триптофана, метионина, тирозина и лейцина.
- Проэластаза активируется до эластазы путем удаления небольшого пептида с N-конца.
Эластаза, которая менее специфична, чем другие гидролазы пищеварения, катализирует расщепление пептидных связей, прилегающих к аминокислотам, таким как глицин, аланин и серин. - Прокарбоксипептидаза
Прокарбоксипептидаза A активируется до карбоксипептидазы A; протеаза расщепляет пептидные связи, прилегающие к аминокислотам с разветвленными или ароматическими боковыми цепями, такие как фенилаланин и валин.
Прокарбоксипептидаза B активируется до карбоксипептидазы B, специфичной для аминокислот с основными боковыми цепями, таких как лизин и аргинин.
Вышеупомянутые протеазы, в отличие от пепсина, имеют оптимальное значение pH действия от 7 до 8, то есть нейтральное или слабощелочное.
Ингибитор трипсина поджелудочной железы
Существует «дополнительная» система защиты от активности трипсина внутри поджелудочной железы: синтез ингибитора, называемого «ингибитор панкреатического трипсина». Молекула, присутствующая в гранулах зимогена поджелудочной железы, способна очень прочно связывать активный центр фермента, инактивируя его.Таким образом блокируется активность любого трипсина, возникающая в результате преждевременной активации трипсиногена, предотвращая ситуацию, в которой несколько активированных молекул активируют все зимогены поджелудочной железы.
В растениях есть много молекул с аналогичной активностью. Примером может служить ингибитор трипсина Кунитца, белок, в основном содержащийся в соевых бобах, который образует очень стабильный комплекс с активным центром трипсина.
Поскольку вышеупомянутые протеазы обладают особой субстратной специфичностью, действуя на пептидные связи, прилегающие к разным аминокислотам, каждый пептид, генерируемый протеазой, может быть субстратом другого.Таким образом, частично переваренные белки, попадающие в двенадцатиперстную кишку, эффективно гидролизуются до свободных аминокислот и пептидов из 2-8 остатков. Эти пептиды являются субстратами аминопептидаз, секретируемых энтероцитами и связанных с их микроворсинками. Также присутствует
дипептидаза.
Следует отметить, что те же протеазы окончательно перевариваются, завершая процесс.
На этом примере можно понять важность и эффективность протеолитических ферментов в переваривании белков в кишечнике.Если in vitro необходимо гидролизовать белок до составляющих его аминокислот, необходимо использовать сильную и концентрированную кислоту в качестве катализатора и нагреть образец до 105 ° C в течение ночи. В кишечнике такой же результат достигается в течение нескольких часов, работая сначала в относительно кислой среде желудка, а затем в мягких щелочных условиях двенадцатиперстной кишки при 37 ° C.
Высвободившиеся аминокислоты вместе с ди- и трипептидами абсорбируются энтероцитами.Ди- и три-пептиды обычно гидролизуются до составляющих аминокислот внутри энтероцитов, и это объясняет, почему практически только свободные аминокислоты присутствуют в портальном кровотоке.
Список литературы
Бендер Д.А. Словарь Бендера по питанию и пищевой технологии. 8-е издание. Издательство Вудхед. Оксфорд, 2006 г.
Бендер Д.А. Введение в питание и обмен веществ. 3-е издание. Тейлор и Фрэнсис, 2004 г.
Берг Дж. М., Тимочко Ю. Л., Страйер Л.Биохимия. 5-е издание. У. Х. Фриман и компания, 2002 г.
Бхагаван Н.В., Ха К-Э. Основы медицинской биохимии: с клиническими случаями. 4-е издание. Academic Press, 2015 [Электронные книги Google]
Коццани И. и Дайнес Э. Biochimica degli alimenti e della nutrizione. Piccin Editore, 2006
Нельсон Д.Л., Кокс М.М. Ленингер. Основы биохимии. 4-е издание. W.H. Фримен и компания, 2004 г.
Rawn J.D. Biochimica. Мак Гроу-Хилл, Нил Паттерсон Паблишерс, 1990 г.
Розенталь М.Д., Глю Р.Х. Медицинская биохимия: метаболизм человека в условиях здоровья и болезней. John Wiley & Sons, INC., Публикация, 2009 г.
Стипанук М.Х., Кодилл М.А. Биохимические, физиологические и молекулярные аспекты питания человека. 3-е издание. Elsevier Health Sciences, 2013 [Электронные книги Google]
Диетический белок и хроническая болезнь почек — Белковые и фосфорные продукты
Без белка наши тела не смогли бы излечиться от травм, остановить кровотечение или бороться с инфекцией.Вот почему употребление белка так важно для поддержания здоровья. В среднем человеку требуется от 40 до 65 граммов белка каждый день.
Однако белок может быть непростой задачей для людей с хронической болезнью почек (ХБП). Хотя белок является необходимым питательным веществом, пациенты часто сталкиваются с дилеммой ограничения потребления белка.
Белок и пациент с ХБП
Когда белок попадает в организм, образуются белковые отходы.В здоровых почках есть миллионы нефронов, которые фильтруют эти отходы. Затем он выводится из организма с мочой.
Нездоровые почки теряют способность выводить белковые отходы, и они начинают накапливаться в крови. Потребление белка с пищей для пациентов с ХБП зависит от стадии заболевания почек, статуса питания и размера тела. Консультации с дипломированным диетологом рекомендуются для планирования и контроля диеты с низким или высоким содержанием белка.
Белок и стадии CKD
Пять стадий ХЗП определяются скоростью клубочковой фильтрации (СКФ), показателем того, насколько хорошо функционируют ваши почки.
На стадии 1 ХЗП СКФ составляет 90 или выше, что является нормальным явлением. Однако в моче обнаруживаются аномальные уровни белка. На 2 стадии СКФ составляет 60-89. На 3 этапе СКФ до 30-59. На стадии 4 СКФ резко снижается до 15-29.
Стадия 5, последняя стадия заболевания почек, известная как терминальная стадия почечной недостаточности или ТПН, возникает, когда СКФ падает ниже 15, а функции почек практически отсутствуют.
Хотя стадия 4 указывает на серьезное снижение функции почек, вы все равно можете жить без диализа.Поскольку от болезни почек нет лекарства, основное внимание уделяется поддержанию вашего питания и сокращению накопления белковых отходов. Избыток белка может вызвать тошноту, потерю аппетита, рвоту, слабость, изменение вкуса и зуд.
Если вы находитесь на этапах 1, 2 или 3, потребление белка может быть ограничено до 12–15 процентов от ежедневного потребления калорий. Это тот же уровень, который рекомендован Нормами диетического потребления (DRI) для здорового питания нормальных взрослых.Если вы находитесь на 4 стадии ХБП, диетолог может посоветовать вам снизить потребление белка до 10 процентов от суточной нормы калорий.
Белок и ESRD
Пациентам, находящимся на стадии 5 и у которых почки работают менее чем на 10 процентов, необходим диализ, чтобы заменить отказавшие почки или пока не станет возможна трансплантация почки.
Диализ удаляет белковые отходы из крови, и диета с низким содержанием белка больше не требуется.К сожалению, некоторые аминокислоты удаляются во время диализа. Для восполнения потери белка необходимо более высокое потребление белка.
Диабет, ХБП и белок
Если у вас ХБП в результате диабета, ваш диетолог и врач помогут вам управлять диабетом. Хороший контроль уровня глюкозы и артериального давления может помочь замедлить прогрессирование заболевания почек у людей с диабетом. Ваш диетолог определит необходимый вам уровень ограничения белка.
Некоторые белки лучше других?
Продукты с высоким содержанием белка, такие как мясо, молоко и яйца, могут быть с высоким содержанием жира и холестерина. Если у вас высокий уровень холестерина или сердечно-сосудистые заболевания, ваш врач и диетолог могут порекомендовать есть больше полезных для сердца белков. Хороший выбор — рыба, куриная грудка, нежирные соевые продукты, а также нежирные молочные продукты.
Фосфор — это минерал, который накапливается в крови по мере прогрессирования почечной недостаточности.Вам могут посоветовать отказаться от продуктов с высоким содержанием белка и фосфора, если ваш уровень превышает нормальный. Молоко, йогурт, сыр, сушеные бобы и горох, орехи и семена, арахисовое масло и некоторые соевые продукты содержат большое количество белка и фосфора.
Как регулируется белок?
Чтобы убедиться, что вы получаете необходимое количество белка для вашего состояния, сначала поговорите со своим диетологом, чтобы получить конкретные рекомендации относительно потребления белка.Это число будет зависеть от вашей стадии ХБП, результатов лабораторных исследований, размера тела и других состояний здоровья.
Если вам назначена диета с низким содержанием белка, порции белковой пищи будут меньше, чем обычно. Для человека среднего роста потребление мяса, птицы или рыбы ограничено от 4 до 6 унций в день.
Если я не могу есть белок, что мне есть?
Хотя ваш рацион может быть ограничен продуктами с высоким содержанием белка, вы по-прежнему будете есть различные продукты, такие как яйца, молоко, мясо, птицу, рыбу, фрукты, овощи и зерновые.Достаточное количество калорий важно для предотвращения разрушения мышц и потери веса. Вам могут посоветовать есть больше полезных жиров, таких как оливковое масло, или принимать добавки, которые помогут получить достаточно калорий.
В зависимости от вашего состояния вам также может потребоваться ограничить потребление натрия, калия или фосфора. Это определяется вашим кровяным давлением и вашими лабораторными показателями. Вас проконсультирует врач-диетолог.
Усвояемость
белков — Большая химическая энциклопедия
ФИГУРА 2.16 pH в зависимости от ферментативной активности. Активность ферментов очень чувствительна к pH. Оптимум pH фермента — одна из его наиболее важных характеристик. Пепсин — это фермент, переваривающий белок, активный в желудочной жидкости. Трипсин также является протеолитическим ферментом, но действует в более щелочной среде тонкой кишки. Лизоцим переваривает клеточные стенки бактерий, обнаруженных в слезах. [Стр.50]
Помимо чувствительных методов анализа белков, биоинформатика является одним из ключевых компонентов протеомных исследований.Сюда входит программное обеспечение для мониторинга и количественной оценки разделения сложных образцов, например, для анализа изображений 2DE. Для сравнения экспериментально измеренных масс пептидов или последовательности ионов перевариваемых белков с теоретическими значениями пептидов, полученных из последовательностей белков, доступны поисковые машины по базам данных в Интернете. Веб-сайты для поиска в базе данных с масс-спектрометрическими данными можно найти по адресу http //www.expasy.ch/tools, http //prospector.ucsf. edu / и http //www.matrixscience.com. [Pg.1029]
Секреция поджелудочной железы для многих, если не для большинства, видов регулируется, чтобы гарантировать адекватное переваривание белков.Соответственно, ингибиторы протеазы оказывают большее влияние на секрецию поджелудочной железы, чем ингибиторы амилазы и липазы (Toskes, 1986). Секреторный ответ экзокринной поджелудочной железы на ингибиторы протеазы может быть быстрым (сигнальный путь (см. Ниже). [Pg.166]
РИСУНОК 98-1. Схематическое изображение переваривания углеводов, жиров и белков (от KumpfVJ, Chessman KH). Энтеральное питание. В DiPiro JT, Talbert RL, Yee GC и др. (Ред.) Фармакотерапия Патофизиологический подход.6-е изд. Нью-Йорк Макгроу-Хилл 2005 2616.) … [Стр.1513]
М. Йошиока, Р. Х. Эриксон, Дж. Ф. Вудли, Р. Гулб, Д. Гуам, Ю. С. Ким. Роль ангиотензин-превращающего фермента мембраны щеточной каймы кишечника крысы в пищеварении белка. Am J Physiol 253 G-781-G-786, 1987. [Pg.234]
Холецистокинин Эндокринные клетки слизистой оболочки двенадцатиперстной кишки Продукты распада липидов и, в небольшой степени, переваривания белков в двенадцатиперстной кишке. Подавляет опорожнение желудка и стимулирует желудочную секрецию. сокращение желчного пузыря стимулирует секрецию пищеварительных ферментов поджелудочной железой… [Стр.284]
Пепсиноген вырабатывается главными клетками. В просвете желудка эта молекула-предшественник расщепляется HCl с образованием активного фермента пепсина. Оптимально активный при кислом pH (pH = 2), пепсин начинает переваривание белков, фрагментируя белки на более мелкие пептидные цепи. [Стр.292]
Дипептиды и трипептиды также присутствуют на щеточной границе абсорбирующих клеток. По мере всасывания молекул питательных веществ аминопептидазы расщепляют их на составляющие их аминокислоты.На активность аминопептидаз приходится примерно 60% переваривания белков. Затем молекулы аминокислот покидают абсорбирующие клетки путем облегченной диффузии и попадают в кровеносные капилляры. [Стр.302]
Хиломикроны покидают абсорбирующую клетку посредством экзоцитоза. Поскольку они не могут пересечь базальную мембрану кровеносных капилляров, хиломикроны попадают в молочные железы, которые являются частью лимфатической системы. Сосуды лимфатической системы сходятся, образуя грудной проток, который впадает в венозную систему рядом с сердцем.Следовательно, в отличие от продуктов переваривания углеводов и белков, которые транспортируются непосредственно в печень через печеночную воротную вену, абсорбированные липиды разбавляются в крови … [Pg.302]
Ramsey, JD, Jacobson, SC, Culbertson , CT, Рэмси, JM (2003). Высокоэффективное двухмерное разделение перевариваемых белков на микрофлюидных устройствах. Анальный. Chem. 75, 3758-3764. [Стр.33]
В Таблице 5.1 перечислены несколько комплексных методик резекции сердца. Двумерная жидкостная хроматография с вырезом в виде сердца очень распространена и отлично подходит для увеличения разрешения одного или нескольких компонентов из первого измерения (Augenstein and Stickler, 1990 Majors, 1980 Pasch et al., 1992 и Диксон и др., 2006). Двухмерная жидкостная хроматография с вырезом в виде сердца для анализа полимеров часто называется перекрестным фракционированием (Balke and Patel, 1980). Анализ переваривания белка с идентификацией MS / MS был назван технологией многомерной идентификации белка или MUDPIT. Это подробно описано в главе 11. [Pg.96]
AEC RPLC LIF Protein digest 6-port Holland and Jorgenson (1995) … [Pg.100]
CEC RPLC UV Protein digest 10-портовый Stoll и Карр (2005) … [Pg.100]
Issaq, H.Дж., Чан, К.С., Ченг, С.Л., Цинхо, Л. (2001). Обновленная многомерная высокоэффективная жидкостная хроматография-капиллярный электрофорез для разделения гидролизата белка. Электрофорез 22, 1133-1135. [Pg.382]
Y. Ma, Y. Lu, H. Zeng, D. Ron, W. Mo, TA Neubert, Характеристика фосфопептидов из перевариваемых белков с использованием матричной лазерной десорбции / ионизации, время пролета, масс-спектрометрия и квадрупольная времяпролетная масс-спектрометрия nanoelectrospray, Rapid Commun. Масс-спектрометрия., 15, 1693 1700 (2001). [Стр.186]
Делькруа, М., Саджид, М., Кэффри, С.Р., Лим, К.-К., Дворжак, Дж., Сие, И., Бахгат, М., Диссоус, К., и МакКерроу, JH (2006) Мультиферментная сеть участвует в переваривании кишечного белка паразитом платинового гельминта. /. Биол. Chem. 281, 39316-39329. [Стр.1058]
Дж. Гао, Дж. Д. Сюй, Л. Э. Locascio и C.S. Lee, Интегрированная микрофлюидная система, обеспечивающая переваривание белков, разделение пептидов и идентификацию белков. Анальный. Chem. 73, 2648-2655 (2001).[Pg.404]
Гликемический индекс, крахмал и усвояемость белков в печенье Tempeh Gembus
Сахарный диабет напрямую связан с диетой и образом жизни. Для снижения риска осложнений необходим контроль уровня глюкозы в крови, и один из способов — выбирать продукты с низким гликемическим индексом. Печенье, приготовленное из муки tempeh gembus / tempeh gembus , предназначено для употребления в качестве закуски и безопасно для людей с диабетом. Целью этого исследования был анализ гликемического индекса (GI), гликемической нагрузки (GL), пищевых волокон, in vitro крахмала и усвояемости белков печенья с заменой муки tempeh gembus .В полностью рандомизированном исследовании дизайна с одним основным фактором использовалось печенье с вариациями замены муки 0%, 25% и 50% tempeh gembus . GI рассчитывали с использованием метода увеличения площади под кривой ответа на уровень глюкозы в крови (IAUC). Анализ концентрации пищевых волокон проводился ферментативными методами. Скорости переваривания крахмала и белка рассчитывали с использованием метода in vitro. Данные о GI, GL, пищевых волокнах, скорости переваривания крахмала и скорости переваривания белка анализировали с помощью описательных методов.Печенье с самым низким GI (47,01 ± 11,08%) и GL (6,90 ± 1,63) было обнаружено в печенье с 50% заменой муки tempeh gembus . Самое высокое содержание пищевых волокон (24,61 ± 0,41%), усвояемость крахмала (48,07 ± 0,01%) и белка (20,27 ± 0,43%) в печенье с 50% заменой муки tempeh gembus . Более высокая замена муки tempeh gembus давала низкий ГИ и ГЛ, в то время как ее диетическая клетчатка, крахмал in vitro и усвояемость белка были самыми высокими.
1. Введение
Сахарный диабет (СД) — это группа метаболических нарушений, характеризующихся гипергликемией, которая вызвана нарушением секреции инсулина и / или нарушением функции инсулина. Гипергликемия — это заболевание, при котором уровень глюкозы в крови превышает нормальный уровень [1]. Всемирная организация здравоохранения (ВОЗ) предсказала, что заболеваемость СД в Индонезии увеличится с 8,4 миллиона человек в 2000 году до 14 миллионов человек в 2006 году, и эта цифра увеличится примерно до 21.3 миллиона человек в 2030 году, что указывает на увеличение в 2-3 раза в 2035 году. Международная диабетическая федерация (IDF) аналогично предсказала, что DM в Индонезии увеличится с 9,1 миллиона в 2014 году до 14,1 миллиона в 2035 году [2].
Закуски могут помочь стабилизировать уровень глюкозы в крови. Одна из лучших стратегий корректировки графика приема пищи для контроля уровня глюкозы в крови — это выбор продуктов с низким гликемическим индексом (ГИ). Продукты с низким ГИ не повышают быстро уровень глюкозы в крови, поэтому их потребление преодолевает чувствительность к инсулину и полезно для контроля уровня глюкозы в крови [3].Гликемическая нагрузка (ГН) предоставит более подробную информацию о влиянии потребления пищи на уровень глюкозы в крови и обеспечит лучшую оценку количества углеводов в пище.
Пищевые волокна могут влиять на концентрацию глюкозы в крови [4]. Продукты с высоким содержанием пищевых волокон имеют большой вклад в снижение уровня ГИ. Клетчатка замедлит движение пищи в пищеварительном тракте и замедлит активность ферментов, так что пищеварительный процесс, особенно крахмал, будет замедлен, а реакция глюкозы в крови будет медленнее.Следовательно, показатель GI будет ниже [5]. Высокий уровень протеина будет стимулировать секрецию инсулина, поэтому уровень глюкозы в крови не станет чрезмерным и будет контролироваться [6]. Качество протеина в пище определяется уровнем аминокислот, имеющих полную последовательность, подходящим составом для потребностей организма и высокой скоростью переваривания протеина. Низкая скорость переваривания крахмала означает более низкий уровень гидролиза крахмала пищеварительными ферментами за определенный период времени. Следовательно, уровень глюкозы в крови не будет резко увеличиваться после того, как пища переваривается и метаболизируется организмом.Продукты с высокой скоростью переваривания крахмала будут генерировать высокий уровень ГИ.
Tempeh gembus — популярная традиционная еда, которую потребляют малообеспеченные граждане. Tempeh gembus производится из остатков тофу и проходит процесс ферментации Rhizopus oligosporus [7]. Предыдущее исследование показало, что tempeh gembus имеет преимущества для здоровья, включая антиоксиданты [8], антимикробную активность [9], способность уменьшать воспалительную реакцию [10-15], а также снижать уровень ХС-ЛПНП и общего холестерина. Tempeh gembus содержит на 50% меньше энергии по сравнению с обычным tempeh , в 3 раза больше пищевых волокон и имеет полный аминокислотный состав [16, 17].
Одним из способов увеличения разнообразия перекусов для диабетиков является использование продуктов с высоким содержанием клетчатки и низким гликемическим индексом tempeh gembus в виде закусок, таких как крекеры ( kerupuk ) и печенье [18]. Печенье выбрано в качестве полезной закуски, потому что оно может храниться в течение длительного периода времени, его легко носить с собой и приемлемо для людей любого возраста и социально-экономического уровня.
Закуски для диабетиков пока недоступны в Индонезии, поэтому авторы заинтересованы в изучении продуктов, таких как печенье с высоким содержанием клетчатки, белка и ингредиентами с низким ГИ, которые можно употреблять в качестве здоровых закусок и которые безопасны для употребления. диабетики. Это исследование было направлено на определение уровня GI, GL, пищевых волокон, крахмала и скорости переваривания белков печенья tempeh gembus .
2. Материалы и методы
Пищевые волокна, скорость переваривания крахмала и скорость переваривания белка были измерены в Laboratorium Chemix, Джокьякарта.Экзамены GI и GL проводились в Universitas Diponegoro, Индонезия.
В данном исследовании использовался полностью рандомизированный дизайн исследования с одним основным фактором. Tempeh gembus были использованы заменители муки: 0%, 25% и 50%. Для каждого лечения делали по три повтора. Следующая таблица содержит рецептуру печенья с заменой муки tempeh gembus (таблица 1).
0 Процесс выпечки печенья начался с приготовления муки tempeh gembus . Tempeh gembus нарезали тонкими ломтиками и сушили при 110 ° C в печи в течение 30 минут. Высушенный tempeh gembus измельчали с помощью блендера, а затем просеивали через сито.Другие ингредиенты для печенья: 40 г маргарина, 30 г обезжиренного молока, 20 г сахара стевии, 0,1 г разрыхлителя, 10 г кукурузного крахмала и 15 г яичного желтка. Печенье готовили путем гомогенизации маргарина и сахара стевии с помощью миксера, добавления яичного желтка, затем добавления остальных ингредиентов и перемешивания до полного объединения.В ходе этого исследования были собраны следующие данные: GI, GL, пищевые волокна, скорость переваривания крахмала и скорость переваривания белка. Для расчета GI использовали метод увеличения площади под кривой ответа на уровень глюкозы в крови (IAUC).Исследование желудочно-кишечного тракта проводилось на 28 пациентах со следующими критериями включения: мужчина или женщина в возрасте от 18 до 30 лет, нормальный индекс массы тела (ИМТ) (18,5–22,9 кг / м 2 ), нормальная концентрация глюкозы в крови натощак. (70–100 мг / дл), некурящие и непьющие, отсутствие заболевания СД в семейном анамнезе и заполненное информированное согласие с заявлением о готовности стать объектом исследования. Критерии исключения были следующими: употребление лекарств и добавок во время вмешательства, отсутствие во время отбора пробы и / или заболевание во время вмешательства.За день до вмешательства субъект должен был голодать (кроме воды) в течение 10 часов с 22:00 до 08:00 до следующего дня. Затем у пациента брали капиллярную кровь для расчета концентрации глюкозы в крови натощак. Затем испытуемого попросили съесть тестовую пищу (чистую глюкозу) и мучное печенье tempeh gembus с долей 0%, 25% и 50%, которое содержит 50 граммов доступных углеводов. Уровень глюкозы в крови проверялся каждые 30 минут (отметки 30, 60, 90 и 120 минут) после употребления тестируемой пищи каждые два часа.GI-тест проводился с использованием глюкометра марки EasyTouch GCU. Анализ содержания пищевых волокон проводился ферментативными методами. Скорости переваривания крахмала и белка измеряли с помощью методов in vitro . Это исследование получило этическое разрешение от соответствующего институционального наблюдательного совета под номером. 625 / EC / FK-UNDIPXI / 2018. Собранные данные были протестированы описательно, чтобы описать уровень гликемического индекса печенья, гликемическую нагрузку, пищевые волокна, скорость переваривания крахмала и скорость переваривания белка. 3. Результаты3.1. Характеристики субъектовФорму информированного согласия подписали 28 субъектов женского пола с возрастным диапазоном от 18 до 22 лет, ИМТ от 18,5 до 22,9 кг / м 2 и нормальным показателем ФБР (70–100 мг / дл). Характеристики субъектов исследования представлены в таблице 2.
Белок и аминокислоты | Рекомендуемые диетические нормы: 10-е издание,стр. 74 Фомон, С.J. 1974. 74. Детское питание, , 2-е изд., . W.B. Сондерс, Филадельфия. 575 с. Fomon, S.J. 1986. Потребность в белке доношенных детей. Стр. 55-68 в S.J. Фомон и У. Heiod, eds. Потребности в энергии и белке в младенчестве. Академическая пресса. Нью-Йорк. Фомон, С.Дж., и Л.Дж. Filer, Jr. 1967. Потребность в аминокислотах для нормального роста. Стр. 391-101 в W.I .. Nyhan ,. изд. Аминокислотный метаболизм и генетическая изменчивость. Макгроу-Хилл, Нью-Йорк. Гарза, К., Н.С. Скримшоу, В. Молодой. 1977 г. Потребности человека в белке: долгосрочное исследование метаболического баланса азота у молодых мужчин с целью оценки безопасного уровня потребления яичного белка, установленного ФАО / ВОЗ в 1973 году. J. Nutr. 107: 335-352. Герсовиц М., Х.Н. Манро, Дж. Удалл и В. Молодой. 1980. Синтез альбумина у молодых и пожилых людей с использованием новой методологии стабильных изотопов: реакция на уровень потребления белка. Метаболизм 29: 1075-1086. Герсовиц, М., К. Мотил, Х.Н. Манро, Н.С. Скримшоу, В.Р. Янг. 1982. Потребности в человеческом белке: оценка адекватности действующей Рекомендуемой диетической нормы пищевого белка для пожилых мужчин и женщин. Am. J. Clin. Nutr. 35: 6-14. Hegsted, D.M. 1976. Балансовые исследования. J. Nutl. 106: 307-311. Hegsted, D.M., S.A. Schuette, M.B. Земель, Х. Linkswiler. 1981. Кальций и баланс кальция в моче у молодых мужчин в зависимости от уровня потребления белка и фосфора. J. Nutr. 111: 553-562. Heird, W.К., Дж. Ф. Николсон, Дж. М. Дрисколл, младший, Н. Дж. Шуллингер и Р. В. Винтерс. 1972. Гипераммонемия в результате внутривенного введения смеси синтетических l-аминокислот: предварительный отчет. J. Pediatr. 81: 162-165. Хиггинс А.К., Ф. В. Крэмптон и Дж. Ф. Моксли. 1973. Питание и исход беременности. Стр. 1071-1077 в Р.О. Scow, изд. Эндокринология. Труды Четвертого Международного конгресса эндокринологов, Вашингтон, округ Колумбия, 18-24 июня 1972 года. Excerpta Medica, Амстердам. Хопкинс, Д. Т. 1981. Влияние вариации усвояемости протеина. Стр. 169-193 в C.F. Бодвелл, Дж. Адкинс, Д.Т. Хопкинс, ред. Качество белка у людей: оценка и оценка in vitro. Издательство AVI, Вестпорт, штат Коннектикут, Horowitz, J.H., F.B. Рыпинс, Дж.М. Хендерсон, С. Хеймсфилд, С. Моффитт, Р.П. Бейн, Р.К. Чавла, Дж. К. Блейер и Д. Рудман. 1981. Доказательства нарушения пути транссульфурации при циррозе печени. Гастроэнтерология 81: 668-675. Hytten, F.Э. и И. Лейтч. 1971. Физиология беременности человека, 2-е изд. Научные публикации Блэквелла, Оксфорд. 599 с. Inone, G.T., Komatsu, K. Kishi, and Y. Fujita. 1988. Аминокислотные потребности японских юношей. Стр. 55-62 в издании G.L. Blackburn, J.P. Grant и V.R. Янг, ред. Аминокислоты: метаболизм и медицинское применение. Джон Райт, Бостон. Ирвин, M.I., and D.M. Хегстед. 1971. Обзор исследований потребности человека в белке. J. Nutr. 101: 387-429. Джексон, А.А. 1987. Измерение белкового обмена во время беременности. Human Nutr. Clin. Nutr. 4IC: 497-498. Джонстон, F.D., D.M. Кэмпбелл и И. Макгилливрей. 1981. Исследования баланса азота при беременности человека. J. Nutr. 111: 1884–1893. Kindt, F., and S. Halvorsen. 1980. Потребность в незаменимых аминокислотах у детей. Оценка, основанная на потреблении фенилаланина, тирозина, лейцина, изолейцина и валина у детей с фенилкетонурией, дефектом тирозин-аминотрансферазы и болезнью мочи кленового сиропа. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Однако, если расстройство не лечить, то его прогрессирования может привести к возникновению различных проблем, особенно с нервной системой и мозгом в частности, что в свою очередь ведет к умственной отсталости, повреждению головного мозга и вызывает появление эпилептических припадков.
Однако, если расстройство не лечить, то его прогрессирования может привести к возникновению различных проблем, особенно с нервной системой и мозгом в частности, что в свою очередь ведет к умственной отсталости, повреждению головного мозга и вызывает появление эпилептических припадков.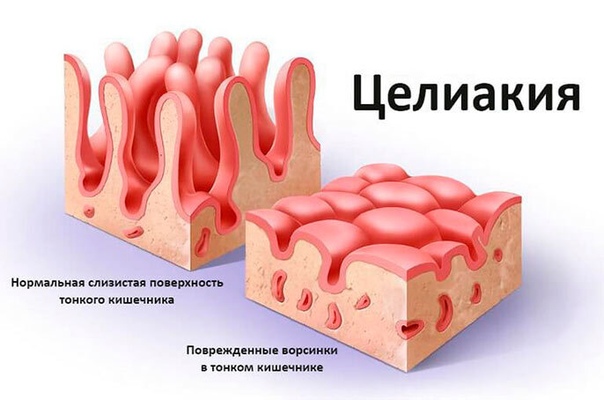
 При проведении этих исследований, он обнаружил в моче восьми пациентов одно и то же вещество. Для анализа найденного вещества необходимым было проведение более основательного исследования и элементарного химического анализа. Проведя различные опыты, Феллинг выявил наличие реакций, характерных для бензальдегида и бензойной кислоты, что позволило ему предположить, что исследуемое вещество содержит бензольное кольцо. Дальнейшая проверка показала, что температура плавления исследуемого вещества — такая же как у фенилпировиноградной кислоты, что указывало именно на ее наличие в моче. Так, тщательные исследования этого ученого вдохновили многих других исследователей проводить аналогичные детальные исследования при изучении других расстройств.
При проведении этих исследований, он обнаружил в моче восьми пациентов одно и то же вещество. Для анализа найденного вещества необходимым было проведение более основательного исследования и элементарного химического анализа. Проведя различные опыты, Феллинг выявил наличие реакций, характерных для бензальдегида и бензойной кислоты, что позволило ему предположить, что исследуемое вещество содержит бензольное кольцо. Дальнейшая проверка показала, что температура плавления исследуемого вещества — такая же как у фенилпировиноградной кислоты, что указывало именно на ее наличие в моче. Так, тщательные исследования этого ученого вдохновили многих других исследователей проводить аналогичные детальные исследования при изучении других расстройств.  В развитых странах исследования на ФКУ проводят детям, сразу после рождения.
В развитых странах исследования на ФКУ проводят детям, сразу после рождения. Запах кожи, волос, пота и мочи (через накопление фенилацетату) — напоминает мышиный (затхлый) запах. Кроме того, у многих больных наблюдается гипопигментация и часто возникает экзема.
Запах кожи, волос, пота и мочи (через накопление фенилацетату) — напоминает мышиный (затхлый) запах. Кроме того, у многих больных наблюдается гипопигментация и часто возникает экзема.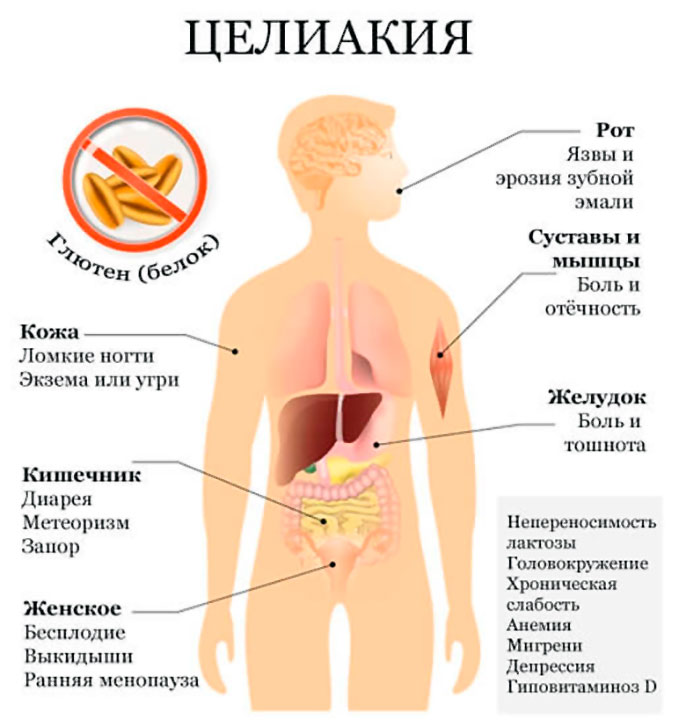 1). Известно более 400 мутаций этого гена, которые вызывают появление различных заболеваний. Нарушение деятельности PAH является одной из основных причин для целого спектра заболеваний, включая классическую фенилкетонурию (ФКУ) и гиперфенилаланинемию (менее тяжелое заболевание, обусловленное накоплением фенилаланина).
1). Известно более 400 мутаций этого гена, которые вызывают появление различных заболеваний. Нарушение деятельности PAH является одной из основных причин для целого спектра заболеваний, включая классическую фенилкетонурию (ФКУ) и гиперфенилаланинемию (менее тяжелое заболевание, обусловленное накоплением фенилаланина).
 Если в организме низкий уровень дофамина, то уровень пролактина — растет. Именно такой процесс характерен для гиперфенилаланинемия, связанной с дефицитом тетрагидробиоптерину, тогда как при классической ФКУ, уровень пролактина остается нормальным. Дефицит тетрагидробиоптерину может быть вызван мутациями в четырех разных генах. Согласно названия которых, именуются типы заболевания. Это: HPABh5A, HPABh5B, HPABh5C и HPABh5D.
Если в организме низкий уровень дофамина, то уровень пролактина — растет. Именно такой процесс характерен для гиперфенилаланинемия, связанной с дефицитом тетрагидробиоптерину, тогда как при классической ФКУ, уровень пролактина остается нормальным. Дефицит тетрагидробиоптерину может быть вызван мутациями в четырех разных генах. Согласно названия которых, именуются типы заболевания. Это: HPABh5A, HPABh5B, HPABh5C и HPABh5D.  Именно поэтому для правильной диагностики фенилкетонурии, необходимо определить уровень фенилаланина в крови, если же он повышен, а в моче имеющиеся фенилкетоны, то диагноз ясен.
Именно поэтому для правильной диагностики фенилкетонурии, необходимо определить уровень фенилаланина в крови, если же он повышен, а в моче имеющиеся фенилкетоны, то диагноз ясен. Этот процесс осуществляется с помощью особой диеты, или же путем сочетания диетического питания и употребления медицинских препаратов. Как было сказано выше, когда фенилаланин не усваивается нормально организмом, то его накопление в крови токсично для мозга. Если ФКУ не лечить, то заболевание может вызвать появление следующих осложнений: тяжелую умственную отсталость, нарушение функций мозга, микроцефалию, частые смены настроения, нарушение функций моторно-двигательного аппарата и такие неврологические расстройства поведения, как СДВГ (синдром дефицита внимания и гиперактивности).
Этот процесс осуществляется с помощью особой диеты, или же путем сочетания диетического питания и употребления медицинских препаратов. Как было сказано выше, когда фенилаланин не усваивается нормально организмом, то его накопление в крови токсично для мозга. Если ФКУ не лечить, то заболевание может вызвать появление следующих осложнений: тяжелую умственную отсталость, нарушение функций мозга, микроцефалию, частые смены настроения, нарушение функций моторно-двигательного аппарата и такие неврологические расстройства поведения, как СДВГ (синдром дефицита внимания и гиперактивности).  Употребление продуктов с высоким уровнем крахмала, таких как картофель, хлеб, макаронные изделия, кукуруза, тоже должно контролироваться. Маленькие дети могут продолжать употреблять грудное молоко (для получения всех полезных веществ и преимущества от грудного питания), однако его количество нужно контролировать и, кроме того, ребенку необходимо обеспечить поступление в организм всех отсутствующих питательных веществ, с помощью разнообразных пищевых добавок. Стоит отметить, что употребление многих диетических продуктов питания и диетических напитков, содержащих подсластитель аспартам, тоже следует избегать, ведь аспартам состоит из двух аминокислот: фенилаланина и аспарагиновой кислоты.
Употребление продуктов с высоким уровнем крахмала, таких как картофель, хлеб, макаронные изделия, кукуруза, тоже должно контролироваться. Маленькие дети могут продолжать употреблять грудное молоко (для получения всех полезных веществ и преимущества от грудного питания), однако его количество нужно контролировать и, кроме того, ребенку необходимо обеспечить поступление в организм всех отсутствующих питательных веществ, с помощью разнообразных пищевых добавок. Стоит отметить, что употребление многих диетических продуктов питания и диетических напитков, содержащих подсластитель аспартам, тоже следует избегать, ведь аспартам состоит из двух аминокислот: фенилаланина и аспарагиновой кислоты. Когда ребенок подрастает, то эти специальные добавки могут быть заменены таблетками и специально разработанным рационом, в котором будут учитываться все особенности больного.
Когда ребенок подрастает, то эти специальные добавки могут быть заменены таблетками и специально разработанным рационом, в котором будут учитываться все особенности больного. При сотрудничестве с диетологом, некоторые лица, больные фенилкетонурией (те, организм которых реагирует на лечение Kuvan) могут увеличить уровень различных природных белков в своем рационе. После больших клинических исследований, Kuvan был одобрен FDA для использования при лечении ФКУ. Некоторые исследователи и врачи, работающие с больными фенилкетонурией считают Kuvan безопасным и эффективным дополнением к диетическому питанию и, соответственно, полезным для пациентов с ФКУ.
При сотрудничестве с диетологом, некоторые лица, больные фенилкетонурией (те, организм которых реагирует на лечение Kuvan) могут увеличить уровень различных природных белков в своем рационе. После больших клинических исследований, Kuvan был одобрен FDA для использования при лечении ФКУ. Некоторые исследователи и врачи, работающие с больными фенилкетонурией считают Kuvan безопасным и эффективным дополнением к диетическому питанию и, соответственно, полезным для пациентов с ФКУ.