Стерилизация паровым методом (водяной насыщенный пар под избыточным давлением)
Паровой
метод стерилизации
При паровом методе стерилизации
стерилизующим средством является
водяной насыщенный пар под избыточным
давлением 0,05 МПа (0,5 кгс/см2) — 0,21
МПа (2,1 кгс/см2) температурой
110-135’С. Стерилизацию осуществляют в
паровых стерилизаторах (автоклавах).
Паровым методом стерилизуют
общие хирургические и специальные
инструменты, детали приборов и аппаратов
из коррозионностойких металлов, стекла,
шприцы с пометкой 200 °С, хирургическое
бельё, перевязочный и шовный материал,
изделия из резин (перчатки, трубки,
катетеры, зонды и т.д.), латекса, отдельных
видов пластмасс.
Стерилизация
паровым методом (водяной насыщенный
пар под избыточным давлением)
Режим | Вид изделий, | |||||
Давление | Температура | Время | ||||
номинальное | предельное | номинальное | предельное | номинальное | предельное | |
0,20 | ±0,02 (±0. | 132 | +—2 | 20 | +2 | Изделия из |
0,11 (1,1) | ±0,02 (±0.2) | 120 | +—2 | 45 | +3 | Изделия из |
0,05 (0,5) | ±0,02 (±0.2) | 110 | +—2 | 180 | +5 | Изделия из |
ОСТ 42-21-2-85 регламентирует первые
2 метода стерилизации
(основной и щадящий),
однако, в особых случаях допускается
применение 3-го (суперщадящего) метода.
В качестве упаковки для стерилизации
паровым методом используются:
Стерилизационная коробка (бикс)
с фильтром или без фильтра.Двойная мягкая упаковка из бязи.

Пергамент.
Бумага мешочная непропитанная.
Бумага мешочная влагопрочная.
Бумага упаковочная высокопрочная.
Бумага двухслойная крепированная.
Бумага упаковочная марки “Е”.
Стерилизационные коробки
(биксы) не являются упаковкой для хранения
простерилизованных изделий, но если
эти изделия хранятся в коробках в течение
установленного времени, допускается
использовать такие изделия по назначению.
Сроки сохранения стерильности
В
биксах с фабричными фильтрами (если
срок годности фильтра не истёк) – 20
суток.В
биксах после замены фильтра и во всех
остальных упаковках – 3 суток.
Биксы без
фильтра изнутри выстилаются салфеткой.
Бельё закладывается в сухом и чистом
виде. Бельё и перевязочный материал
укладываются рыхло, свободно, параллельно
движению пара.
Необходимо вести учет сроков
хранения стерильных изделий. Для этого
должны фиксироваться дата и время
стерилизации (надпись на упаковке со
стерильным инструментом и в журнале).
В качестве контроля работы
стерилизатора используются термо-временные
индикаторы ИС-132, максимальные термометры
и бактериологические тесты.
Петритест — микробиологические экспресс-тесты — 4.3. Виды стерилизации
Стерилизация кипячением. Кипячение является наиболее простым и легкодоступным способом стерилизации, пригодным для устранения вегетативной формы микробов. Для уничтожения спороносной микрофлоры оно неприемлемо.
Стерилизацию кипячением проводят в стерилизаторе. В него наливают холодную дистиллированную воду, так как водопроводная вода образует накипь. Стеклянные предметы погружают в холодную, металлические предметы – в горячую воду с добавлением соды. Стерилизуемые предметы кипятят на слабом огне. По окончании кипячения воду сливают, инструменты берут стерильным пинцетом, который кипятят вместе с остальными предметами.
Стеклянные предметы погружают в холодную, металлические предметы – в горячую воду с добавлением соды. Стерилизуемые предметы кипятят на слабом огне. По окончании кипячения воду сливают, инструменты берут стерильным пинцетом, который кипятят вместе с остальными предметами.
Стерилизация прокаливанием. Бактериологические петли, сделанные из платиновой или нихромовой проволоки, стерилизуют в пламени спиртовой или газовой горелки. Такой способ стерилизации получил название прокаливания или фламбирования.
Петлю в горизонтальном положении вносят в нижнюю, наиболее холодную часть пламени, чтобы не произошло разбрызгивания находящегося на ней сжигаемого инфицированного материала. После того как он сгорит, петлю переводят в вертикальное положение, накаливают докрасна вначале нижнюю, а затем верхнюю часть проволоки и прожигают петле-держатель. Прокаливание в целом занимает 5–7 с.
Стерилизацию сухим жаром проводят в так называемых воздушных стерилизаторах – ВС (прежнее название – сухожаровая печь или печь Пастера).
Современная промышленность выпускает несколько модификаций ВС, основным различием которых является принцип устройства периодического и непрерывного действия. По форме они могут быть горизонтальными, вертикальными, круглыми, стационарными и переносными. Тем не менее каждый ВС состоит из корпуса, в котором расположены нагревательные элементы, стерилизационной (рабочей) камеры с решетчатыми полками для размещения на них стерилизуемых объектов.
Заданную температуру в рабочей камере поддерживают с помощью специальных терморегуляторов с пультом управления, который регулирует режим обработки изделий в зависимости от заданной температуры: 180 °С – 60 мин; 160 °С – 150 мин, после чего нагревательные элементы автоматически отключаются.
Упакованные соответствующим образом подлежащие стерилизации изделия загружают так, чтобы они лежали поперек пазов полок, не перекрывая продувочные окна и решетки вентиляции. Объемные изделия кладут на верхнюю металлическую решетку, чтобы они не препятствовали потоку горячего воздуха.
Объемные изделия кладут на верхнюю металлическую решетку, чтобы они не препятствовали потоку горячего воздуха.
Правильная загрузка стерилизуемого материала в том количестве, которое допускает свободную подачу воздуха к нему, обеспечивает равномерное распределение горячего воздуха во всем объеме камеры.
Преимущества сухожарового метода стерилизации заключаются в том, что при его применении не наблюдается коррозии металлов и инструментов, не повреждаются стеклянные поверхности, равномерно нагреваются все объекты.
К недостаткам метода относится продолжительность цикла стерилизации, составляющая 2–4 ч в зависимости от объема стерилизационной камеры, количества стерилизуемых объектов и заданной температуры.
Стерилизация паром под давлением (автоклавирование). Наиболее часто используемым методом стерилизации является стерилизация паром под давлением в паровом стерилизаторе (автоклав).
При паровом методе стерилизации стерилизующим средством является насыщенный пар с давлением в стерилизационной камере 0,5–2,1 кгс/см2 и соответствующей температурой 110-135 °С.
Паровой стерилизатор состоит из двух котлов, вставленных друг в друга, конуса и герметически закрывающейся крышки. В зависимости от конструкции различают паровые стерилизаторы со встроенным или внешним парогенератором.
Из множества отечественных паровых стерилизаторов наиболее широко распространены в лабораториях страны вертикальные электрические автоклавы ВК-75 и ГК-100, выпускаемые Тюменским заводом медицинского оборудования. Поскольку они являются приборами повышенной опасности, их установка и эксплуатация должны строго подчиняться правилам техники безопасности, обеспечиваться регулярным техническим обслуживанием с ежегодной проверкой и клеймением манометра.
При работе с паровым стерилизатором очень большое значение имеет строгое соблюдение правил эксплуатации аппарата, имеющихся в паспорте прибора. Поэтому к работе на паровых стерилизаторах допускаются только лица, прошедшие специальное обучение, выдержавшие испытания перед квалификационной комиссией и получившие соответствующее удостоверение на право работы с паровым стерилизатором определенного образца.
Принципы этих правил являются общими для всех моделей паровых стерилизаторов, различия заключаются только в технике их исполнения, поэтому они могут быть освещены в нескольких основных положениях.
- Стерилизационную камеру парового стерилизатора загружают стерилизуемым материалом.
- Водопаровое пространство (между котлами) заполняют водой до отметки на водомерной трубке.
- Плотно закрывают крышку стерилизатора.
Для удаления воздуха из стерилизационной камеры используют различные приемы. В некоторых современных паровых стерилизаторах для этой цели предусмотрены вакуумные насосы, создающие высокий вакуум (вакуумные автоклавы).
Если паровой стерилизатор не имеет специального устройства для снижения давления, то, как в старых конструкциях, в начале работы воздух вытесняют, устанавливая автоклав на режим «текучего пара» (с открытым выпускным краном). При закипании воды из выпускного воздушного крана начинает выходить вытесняемый паром воздух, вначале отдельными порциями, затем непрерывной струей, что означает полное вытеснение из стерилизационной камеры воздуха. После этого кран закрывают, и в котле начинается постепенное повышение давления.
- • Началом стерилизации считается тот момент, когда стрелка манометра показывает заданное давление. После этого интенсивность подогрева уменьшается, для того чтобы давление в паровом стерилизаторе оставалось в течение нужного времени на одном уровне (табл. 4.4).
Таблица 4.4. Соотношение показаний манометра и температуры кипения воды
|
Показания манометра, кгс/см2
|
Температура кипения воды, °С
|
Показания манометра, кгс/см2
|
Температура кипения воды, °С
|
|
0
|
100
|
0,7
|
116
|
|
0,2
|
105
|
0,8
|
117
|
|
0,4
|
110
|
1
|
121
|
|
0,5
|
112
|
1,5
|
127
|
|
0,6
|
114
|
2
|
134
|
- По окончании срока стерилизации прекращают подогревание и продолжают наблюдать за стрелкой манометра, пока стрелка не упадет до нуля.

- Открывают пароотводный кран для выхода остатков пара и воды.
- После снижения давления в стерилизационной камере до нуля, открывают крышку стерилизатора и приступают к разгрузке стерилизационной камеры.
Температура и продолжительность стерилизации определяются качеством стерилизуемого материала и свойствами тех микроорганизмов, которыми он заражен (табл. 4.5).
Таблица 4.5. Режимы стерилизации, наиболее часто употребляемые в лабораторной практике
|
Объект
|
Давление (кгс/см2)
|
Температура (°С)
|
Время (мин)
|
Нормативный документ
|
|
Изделия из коррозиестойкого металла, стекла, текстильных материалов, резины
|
2±0,2
|
132
|
20±2
|
ОСТ 42-21-2-85
|
|
Изделия из резины, латекса и отдельных полимерных материалов
|
1,1±0,2
|
120
|
45±3
|
ОСТ 42-21-2-85
|
|
Бактериальные культуры неспорообразующих бактерий I–II групп опасности
|
1,5±0,2
|
126
|
60
|
СП 1.2.011-94
|
|
То же для спорообразующих бактерий
|
2,0
|
132
|
90
|
СП 1.2.011-94
|
|
Питательные среды, растворы
|
0,5-1,1
|
110–120
|
15-30
|
В соответствии с рецептами сред и растворов
|
Примечание. Таблица из книги: Медицинские лабораторные технологии/Справочник. – СПб.: Интермедика, 2002.
Таблица из книги: Медицинские лабораторные технологии/Справочник. – СПб.: Интермедика, 2002.
Контроль температуры в стерилизационных камерах паровых и воздушных стерилизаторов осуществляется большей частью с помощью порошкообразных химических веществ – индикаторов, имеющих определенную температуру плавления (табл. 4.6). Запаянные ампулы с порошками, смешанными с небольшим количеством краски, помещаются в камеру со стерилизуемым материалом. Количество тестов и схемы расположения зависят от формы и размеров стерилизационной камеры.
Таблица 4.6. Показатели температуры плавления порошков-индикаторов
|
Химическое вещество – индикатор
|
Температура, °С
|
Примечание
|
|
Бензонафтол
|
110
|
На 100 г порошка-индикатора прибавляют 0,01 г сафранина, 0,005 г фуксина или метиленового синего
|
|
Антипирин
|
115
| |
|
Серный цвет
|
115
| |
|
Резорцин чистый
|
116
| |
|
Бензойная кислота
|
121
|
При достижении в камере определенной температуры порошки плавятся, образуя сплавы, окрашенные в цвет добавленной краски.
Недостаток химических тестов состоит в том, что цвет индикатора появляется даже при кратковременном воздействии температуры плавления на соответствующий химический индикатор.
Научно-производственной фирмой «ВИНАР» (Россия) создана комплексная система контроля критических параметров паровой (время, температура, насыщенный пар) и воздушной (время, температура) стерилизации, как в камере стерилизатора, так и внутри стерилизуемых упаковок и изделий.
Основой системы являются химические индикаторы. Они наносятся на прямоугольную полоску бумаги и представляют собой две цветные метки – индикаторную и эталон сравнения. Цвет индикаторной метки необратимо меняется при соблюдении требуемых условий стерилизации, приобретая темно-фиолетовый цвет (паровая стерилизация) или коричневый цвет (воздушная стерилизация) (рис. 4.1, а, б – см. вклейку).
Стерилизация текучим паром производится в текучепаровом аппарате Коха или в паровом стерилизаторе при незавинченной крышке и открытом выпускном кране.
Аппарат Коха представляет собой металлический полый цилиндр с двойным дном. Пространство между верхней и нижней пластинками дна заполняют на 2/3 водой (для спуска оставшейся после стерилизации воды имеется кран). Крышка аппарата имеет вмонтированный в центре термометр и несколько небольших отверстий для выхода пара.
Стерилизуемый материал загружают в камеру аппарата неплотно, чтобы обеспечить наибольшую возможность контакта с паром.
Началом стерилизации считается время закипания воды и поступления пара в стерилизационную камеру.
В текучепаровом аппарате стерилизуют главным образом питательные среды, свойства которых изменяются при температуре выше 100 °С. Стерилизацию текучим паром следует проводить повторно, так как однократное прогревание при 100 °С не обеспечивает полного обеспложивания стерилизуемого объекта.
Такой метод стерилизации получил название дробной стерилизации: обработку стерилизуемого материала текучим паром проводят по 30 мин ежедневно в течение 3 дней.
В промежутках между стерилизациями материал выдерживают при комнатной температуре для прорастания спор в вегетативные формы, которые погибают при последующих прогреваниях.
Тиндализация – дробная стерилизация с применением температуры ниже 100 °С, предложена Тиндалем.
Прогревание стерилизуемого материала производят в водяной бане, снабженной терморегулятором, по часу, при 60–65 °С в течение 5 дней или при 70–80 °С в течение 3 дней. В промежутках между прогреваниями обрабатываемый материал выдерживают при 25–37 °С для прорастания спор в вегетативные формы, которые погибают, при последующих прогреваниях.
В промежутках между прогреваниями обрабатываемый материал выдерживают при 25–37 °С для прорастания спор в вегетативные формы, которые погибают, при последующих прогреваниях.
В микробиологических лабораториях тиндализацией пользуются для обеспложивания питательных сред, свойства которых изменяются под действием высокой температуры, например жидкостей, содержащих в своем составе белок.
Механическая фильтрация с помощью бактериальных фильтров. Мембранные ультрафильтры из органического вещества нитроклетчатки представляют собой диски белого цвета диаметром 35 мм и толщиной 0,1 мм.
Бактериальные фильтры различаются между собой величиной пор и обозначаются порядковым номером (табл. 4.7).
Таблица 4.7. Бактериальные фильтры
|
Номер фильтра
|
Средний диаметр пор, мкм
|
|
1
|
0,3
|
|
2
|
0,5
|
|
3
|
0,7
|
|
4
|
0,9
|
|
5
|
1,2
|
Непосредственно перед употреблением мембранные фильтры стерилизуют кипячением. Фильтры помещают в дистиллированную воду, подогретую до температуры 50–60 °С, чтобы предупредить их скручивание, кипятят на слабом огне в течение 30 мин, меняя 2–3 раза воду. Простерилизованные фильтры осторожно, чтобы избежать их повреждения, вынимают из стерилизатора фламбированным и остуженным пинцетом с гладкими кончиками.
Мембранные фильтры используют для фильтрации жидкостей в специальном фильтровальном приборе (Зейтца или Рублевской водопроводной станции). Каждый из указанных выше приборов состоит из двух частей: верхней части, имеющей форму цилиндра или воронки, и нижней – опорной части аппарата, с так называемым фильтровальным столиком из металлической сетки или керамической пластинки, на которые помещают мембранный фильтр (рис. 4.2).
4.2).
Рис. 4.2. Прибор Зейтца с воронкой.
Опорная часть аппарата имеет форму воронки, суживающаяся часть которой укрепляется в резиновой пробке горлышка колбы Бунзена.
В рабочем состоянии верхнюю часть прибора фиксируют на нижней с помощью винтов (в приборе Зейтца) или специального металлического кольца с двумя пазами, надетого на шейку воронки (в приборе Рублевской водопроводной станции).
Перед началом фильтрации места соединения разных частей установки для создания герметичности заливают парафином. Отводную трубку колбы присоединяют толстостенной резиновой трубкой к водоструйному, масляному или велосипедному насосу. После этого в цилиндр или воронку аппарата наливают фильтруемую жидкость и включают в действие насос, создающий вакуум в колбе Бунзена.
В результате образующейся разности давлений фильтруемая жидкость проходит через поры фильтра в приемник. Микробы остаются на поверхности фильтра.
Квалификационные тесты по специальности «Дезинфектология» (2019 год) с ответами
содержание ..
1
2
3
4 ..
200.
Укажите
сроки сохранения стерильности медицинских инструментов в стерилизационных
коробках при паровом способе стерилизации
а)
24 часа
б)
3 суток
в)
в таких условиях стерилизация не проводится
г)
10 суток
д)
20 суток
201.
Укажите
сроки сохранения стерильности медицинских инструментов при паровом способе
стерилизации в стерилизационных коробках с фильтром:
а)
24 часа
б)
3 суток
в)
в таких условиях стерилизация не проводится
г)
10 суток
д)
20 суток
202.
Укажите
сроки сохранения стерильности медицинских инструментов при паровом способе
стерилизации в двойной мягкой упаковке из бязи:
а)
24 часа
б)
3 суток
в)
в таких условиях стерилизация не проводится
г)
10 суток
д)
20 суток
203.
Укажите
сроки сохранения стерильности медицинских инструментов при паровом способе
стерилизации в пергаменте:
а)
24 часа
б)
3 суток
в)
в таких условиях стерилизация не проводится
г)
10 суток
д)
20 суток
204.
Укажите
сроки сохранения стерильности медицинских инструментов при паровом способе
стерилизации без упаковки:
а)
24 часа
б)
3 суток
в)
в таких условиях стерилизация не проводится
г)
10 суток
д)
20 суток
205.
Укажите
сроки сохранения стерильности медицинских инструментов в двухслойной
полиэтиленовой пленке при воздушном способе стерилизации:
а)
24 часа
б)
3 суток
в)
изделие должны быть использованы непосредственно после стерилизации
г)
в таких условиях стерилизация не проводится
д)
6 месяцев
206.
Укажите
сроки сохранения стерильности медицинских инструментов в пергаменте при
воздушном способе стерилизации:
а)
24 часа
б)
3 суток
в)
изделие должны быть использованы непосредственно после стерилизации
г)
в таких условиях стерилизация не проводится
д)
6 месяцев
207.
Укажите
сроки сохранения стерильности медицинских инструментов в стерилизационной
коробке при воздушном способе стерилизации:
а)
24 часа
б)
3 суток
в)
изделие должны быть использованы непосредственно после стерилизации
г)
в таких условиях стерилизация не проводится
д)
6 месяцев
208.
Укажите
сроки сохранения стерильности медицинских инструментов без упаковки при
воздушном способе стерилизации:
а)
24 часа
б)
3 суток
в)
изделие должны быть использованы непосредственно после стерилизации
г)
в таких условиях стерилизация не проводится
д)
6 месяцев
209.
Укажите
сроки сохранения стерильности медицинских инструментов в бумаге мешочной
влагопрочной при воздушном способе стерилизации:
а)
24 часа
б)
3 суток
в)
изделие должны быть использованы непосредственно после стерилизации
г)
в таких условиях стерилизация не проводится
д)
6 месяцев
210.
Укажите
недостатки паровой стерилизации
а)
длительная экспозиция
б)
может вызвать повреждение термолабильных инструментов
в)
коррозионное воздействие
г)
нельзя использовать для стерилизации перевязочного материала
д)
всегда необходима упаковка изделий
211.
Укажите
недостатки воздушной стерилизации
а)
длительная экспозиция
б)
может вызвать повреждение термолабильных инструментов
в)
коррозионное воздействие
г)
нельзя использовать для стерилизации перевязочного материала
д)
всегда необходима упаковка изделий
212.
Установите
принадлежность различных видов изделий медицинского назначения к критической
категории
а)
инструменты, используемые при операциях на стерильных тканях, полостях, сосудистой
системе
б)
предметы, контактирующие с неинтактной кожей
в)
предметы, контактирующие только с интактной кожей
г)
предметы, контактирующие со слизистыми оболочками
д)
предметы окружающей обстановки
213.
Установите
принадлежность различных видов изделий медицинского назначения к
полукритической категории
а)
инструменты, используемые при операциях на стерильных тканях, полостях,
сосудистой системе
б)
предметы, контактирующие с неинтактной кожей
в)
предметы, контактирующие только с интактной кожей
г)
предметы, контактирующие со слизистыми оболочками
д)
предметы окружающей обстановки
214.
Установите
принадлежность различных видов изделий медицинского назначения к некритической
категории
а)
инструменты, используемые при операциях на стерильных тканях, полостях, сосудистой
системе
б)
предметы, контактирующие с неинтактной кожей
в)
предметы, контактирующие только с интактной кожей
г)
предметы, контактирующие со слизистыми оболочками
д)
предметы окружающей обстановки
215.
К
какой категории изделий медицинского назначения принадлежат хирургические
инструменты
а)
критические
б)
полукритические
в)
некритические
216.
Каковы
способы применения ратицидов
а)
химический
б)
механический
в)
биологический
217.
Перечислите,
ратициды, относящиеся к антикоагулятам:
а)
зоокумарин
б)
ратиндан
в) этилфеноцан
г) барий
углекислый
д) красный
морской лук
218.
Укажите
способы и условия применения антикоагулянтов
а)
приманочный способ
б)
опыление
в)
бесприманочный способ, путем создания ядовитых покрытий
г) газация
219.
Какие
вещества вызывают гибель грызунов и одновременно приводят к гибели находящихся
на ней насекомых
А) крысид
б) нильс
в)
фторацетамид
г)
сахарная пудра
220.
Назовите
способы биологической дератизации
а)
использование естественных врагов
б)
применение заразных для грызунов приманок с бактериальной культурой
в) все
вышеперечисленное
221.
В
образовательных учреждениях для детей и подростков применяют:
а)
инсектициды iv класса опасности
б)
дезинфицирующие средства I и II класса опасности
222.
Укажите,
какие требования необходимо соблюдать при проведении дератизации в детских
учреждениях
а)
приманки размещать в местах, исключающих доступ для детей
б)
приманки раскладывают на подложки
в) емкости
с приманкой нумеруют
г) по
окончании работ емкости с остатками приманки собирают в полиэтиленовые пакеты и
утилизируют
д) все вышеперечисленное
верно
223.
Методы
борьбы с грызунами на предприятиях общественного питания
а) места
для раскладки приманок оборудуют вдоль стен
б)
приманку раскладывают по всему помещению
в)
приманку готовят из муки с сахарным песком и зоокумарином
224.
На
предприятиях с низкой влажностью по переработке и хранению муки, крупы,
основным средством борьбы с грызунами служат:
а) влажные
приманки с зоокумарином
б) влажные
приманки с фосфидом цинка
в)
создание ядовитых покрытий пастой на основе дифенацина
225.
На
предприятиях для хранения и переработки овощей и фруктов
а)
применение фосфида цинка запрещено
б) на
открытой территории в норы раскладывают отравленную приманку с ратинданом и
фосфидом цинка
в) вдоль
стен устанавливают искусственные гнездовья с приманкой, пропитанной ратинданом
226.
Укажите,
на какую стадию развития членистоного направлено действие ларвицидов:
а) яйца
б) имаго
в) личинка
г) нимфа
227.
К
какой категории изделий медицинского назначения принадлежат иглы
а)
критические
б)
полукритические
в)
некритические
228.
К
какой категории изделий медицинского назначения принадлежат эндоскопы
а)
критические
б)
полукритические
в)
некритические
229.
К
какой категории изделий медицинского назначения принадлежит дыхательное
оборудование для анестезии
а)
критические
б)
полукритические
в)
некритические
230.
К
какой категории изделий медицинского назначения принадлежат сердечные и
сосудистые катетеры
а)
критические
б)
полукритические
в)
некритические
231.
К
какой категории изделий медицинского назначения принадлежат мочевые катетеры
а)
критические
б)
полукритические
в)
некритические
232.
К
какой категории изделий медицинского назначения принадлежат ректальные
термометры
а)
критические
б)
полукритические
в)
некритические
233.
К
какой категории изделий медицинского назначения принадлежат внутриматочные
устройства
а)
критические
б)
полукритические
в)
некритические
234.
К
какой категории изделий медицинского назначения принадлежат приборы для
измерения артериального давления
а)
критические
б)
полукритические
в)
некритические
235.
К
какой категории изделий медицинского назначения принадлежат подмышечные
термометры
а)
критические
б)
полукритические
в)
некритические
236.
К
какой категории изделий медицинского назначения принадлежат подмышечные
термометры
а)
критические
б)
полукритические
в)
некритические
237.
К
какой категории изделий медицинского назначения принадлежит постельное белье
а)
критические
б)
полукритические
в)
некритические
238.
Профилактическую
и очаговую дезинфекцию проводят с целью…
а)
предупреждения возможного рассеивания возбудителя и осуществления своевременного
уничтожения его во внешней среде
б) с целью
ликвидации очага инфекционного заболевания при выявленном источнике инфекции
239.
Профилактическую
и очаговую дезинфекцию проводят с целью…
а)
предупреждения возможного рассеивания возбудителя и осуществления своевременного
уничтожения его во внешней среде
б) с целью
ликвидации очага инфекционного заболевания при выявленном источнике инфекции
240.
Профилактическую
дезинфекцию проводят
а) члены
семьи больного
б)
медицинский персонал отделения инфекционной больницы
в)
медицинский персонал поликлиники
г)
работники санитарной службы
д)
работники дезинфекционной службы
е)
персонал кафе.
241.
Заключительную
дезинфекцию проводят
а) члены
семьи больного
б)
медицинский персонал отделения инфекционной больницы
в)
медицинский персонал поликлиники
г)
работники санитарной службы
д)
работники дезинфекционной службы
е)
персонал кафе.
242.
Текущую
дезинфекцию проводят
а) члены
семьи больного
б)
медицинский персонал отделения инфекционной больницы
в)
медицинский персонал поликлиники
г) работники
санитарной службы
д)
работники дезинфекционной службы
е)
персонал кафе
243.
В
каком случае проводят профилактическую дезинфекцию:
а)
общежитие, из которого госпитализирован больной дизентерией
б)
терапевтическое отделение, из которого больной брюшным тифом
(госпитализированный с диагнозом «пневмония») переведен в
инфекционную больницу
в)
казарма, в которой предстоит разместить воинскую часть
г)
общественный туалет
д)
сельскохозяйственная теплица
е)
железнодорожный состав?
244.
В
каком случае проводят очаговую дезинфекцию:
а)
общежитие, из которого госпитализирован больной дизентерией
б)
терапевтическое отделение, из которого больной брюшным тифом
(госпитализированный с диагнозом «пневмония») переведен в
инфекционную больницу
в)
казарма, в которой предстоит разместить воинскую часть
г)
общественный туалет
д)
сельскохозяйственная теплица
е)
железнодорожный состав?
245.
Текущую
дезинфекцию в квартире больного дизентерией, оставленного дома, назначает:
а)
эпидемиолог
б)
участковый терапевт
в)
врач-инфекционист
г) врач дезинфекционной
станции.
246.
Необходимость
проведения дезинфекции определяется:
а)
инвазивностью возбудителя
б)
фагорезистентностью возбудителя
в)
множественной лекарственной устойчивостью возбудителя
г)
устойчивостью возбудителя во внешней среде
д)
патогенностью возбудителя.
247.
Проведение
заключительной дезинфекции в эпидемическом очаге показано в следующих случаях:
а) больной
корью переведен из палаты терапевтического отделения в изолятор
б) в связи
с изменением эпидемиологической обстановки отделение для больных сальмонеллезом
перепрофилируется для приема больных гриппом
в)
отделение для больных вирусными гепатитами перепрофилируется для больных
дизентерией
г)
больной туляремией переведен из бокса в отделение
д) больной
брюшным тифом госпитализирован в инфекционную больницу из отдельной квартиры.
248.
Какие
приемы физического метода дезинфекции следует рекомендовать при текущей
дезинфекции в квартире больного острой кишечной инфекцией?
а)
кипячение посуды, белья
б)
обработка игрушек кипящей водой
в) мытье
поверхностей горячей водой с содой и мылом
г) мытье
рук с мылом
д) все
вышеперечисленное
249.
Каким
требованиям должны удовлетворять химические дезинфекционные средства?
а)
растворяться в воде
б)
действовать в малых концентрациях
в)
стойкость при хранении
г) не
обладать токсическими действиями
д) верно
все вышеперечисленное
250.
Хлорсодержащие
вещества следует хранить:
а) на
свету
б) в
хорошо отапливаемом помещении
в) в
прохладном помещении
г) в
темноте
д) в
открытой таре
е) в
закрытой таре
251.
.
Способами повышения антимикробной активности хлорсодержащих препаратов являются
а)
подогрев «маточного раствора»
б)
подкисление рабочего раствора
в) защелачивание
рабочего раствора
г)
аммонизация рабочего раствора.
252.
Хлорсодержащими
препаратами, рекомендованными для обработки жилых помещений, являются:
а)
«Гипохлорит кальция»
б) хлорная
известь
в)
«Хлорамин»
г)
«Дихлорантин»
д)
«Сульфохлорантин»
253.
Для
стирки, дезинфекции белья и мытья посуды не рекомендованы:
а) хлорная
известь
б) ДТС ГК
в)
дихлор-1
г)
хлордезин
д)
дезоксон
е) виркон
254.
Сухую
хлорную известь используют для обработки:
а) рвотных
масс
б) жидких
испражнений
в) рук
г) мокроты
д) жилых
помещений.
255.
Хлорноизвестковое
молоко используют для:
а)
дезинфекции жилых помещений
б)
дезинфекции жидких выделений
в)
обработки туалетов
г) побелки
и обработки выгребных уборных
256.
Укажите
оптимальный срок сохранения активности 1 % раствора хлорной извести:
а) в
течение 1 ч после приготовления
б) в
течение рабочего дня
в) 2—3 дня
г) до 5
дней
д) в
течение 1 мес
257.
Укажите
оптимальный срок сохранения активности 10 % раствора хлорной извести:
а) в
течение 1 ч после приготовления
б) в
течение рабочего дня
в) 2—3 дня
г) до 5
дней
д) в
течение 1 мес
258.
Для
обработки плохо проветриваемого помещения следует использовать:
а) ДТС ГК
б)
хлорамин
в)
перекись водорода
г) лизол.
259.
Как
можно повысить дезинфицирующую активность растворов перекиси водорода:
а) нагреть
б)
добавить аммонийные соединения
в)
добавить поверхностно-активные вещества
260.
Обувь
при грибковых заболеваниях кожи следует обрабатывать:
а) в
паровой камере
б) в
пароформалиновой камере
в)
раствором формалина
г)
раствором хлорамина.
261.
Активированные
растворы хлорсодержащих препаратов используют в следующие сроки:
а)
немедленно после приготовления
б) в
течение рабочего дня
в) в
течение 5— 7 дней
г) в течение
1 мес
262.
Полированную
мебель в очаге туберкулеза следует обрабатывать:
а)
химическими средствами дезинфекции
б)
механической очисткой поверхности
263.
Какие
растворы можно ли использовать для дезинфекции:
а) 1 %
раствор хлорамина, приготовлен 2 дня назад
б) 1 %
раствор хлорной извести
в) 0,5 %
раствор хлорной извести, приготовлен в день обработки
г) 10 %
раствор хлорной извести, приготовлен 4 дня назад
264.
Типы
дезинфекционных камер по характеру действующего агента
а) паровые
и парофармалиновые
б) для
дезинсекции и дезинфекции
265.
Типы
дезинфекционных камер по направленности действия
а) паровые
и парофармалиновые
б) для
дезинсекции и дезинфекции
266.
Как
подается пар в паровую камеру
а) сверху
б) снизу
267.
Как
подается пар в пароформалиновую камеру
а) сверху
б) снизу
268.
Какое
вещество используют для нейтрализации паров формалина в пароформалиновой
камере?
а)
перекись водорода
б)
нашатырный спирт
269.
При
каком режиме обработки проводят дезинсекцию в пароформалиновой камере:
а) парами
формалина
б)
паровоздушной смесью
270.
В
паровую камеру следует направлять следующие вещи:
а) тюфяки
и подушки после выписки больных из дизентерийного отделения
б) верхнюю
одежду госпитализированного больного брюшным тифом
в)
постельные принадлежности родильниц в родильном доме
г)
постельные принадлежности выписанных больных терапевтического г отделения
д) шубу из
натурального меха, принадлежащую госпитализированному больному туберкулезом
е) кожаную
обувь больных грибковым заболеванием стоп
271.
В
пароформалиновую камеру следует направлять следующие вещи:
а) тюфяки
и подушки после выписки больных из дизентерийного отделения
б) верхнюю
одежду госпитализированного больного брюшным тифом
в)
постельные принадлежности родильниц в родильном доме
г)
постельные принадлежности выписанных больных терапевтического г отделения
д) шубу из
натурального меха, принадлежащую госпитализированному больному туберкулезом
е) кожаную
обувь больных грибковым заболеванием стоп
272.
Как
обработать загрязненное испражнениями постельное белье больных дизентерией:
а)
отправить в камеру для дезинфекции
б)
кипятить
в)
замочить в дезинфицирующем растворе, затем стирать
273.
В
лечебно-профилактическом учреждении (ЛПУ) за организацию противоэпидемических
мероприятий несет ответственность
а)
врач-ординатор
б) главный
врач
в) старшая
медицинская сестра
г)
работники санитарно — эпидемиологической службы
д)
работники дезинфекционной службы
274.
В
ЛПУ персонал по проведению противоэпидемических мероприятий инструктирует
а)
врач-ординатор
б) главный
врач
в) старшая
медицинская сестра
г) работники
санитарно — эпидемиологической службы
д)
работники дезинфекционной службы
275.
В
ЛПУ выполнение противоэпидемических мероприятий контролирует
а)
врач-ординатор
б) главный
врач
в) старшая
медицинская сестра
г)
работники санитарно — эпидемиологической службы
д)
работники дезинфекционной службы
276.
Обработка
посуды в пищеблоке
а)
освободить от остатков пищи
б) вымыть
моющим раствором
в)
кипятить
г)
замочить в растворе фенола
д)
замочить в растворе хлорамина
е) вымыть,
удалив дезинфектанты
277.
Средство,
не применяющееся для обработки хирургического инструментария:
а) моющие
средства
б)
хлорамин
в) пар
г) горячий
воздух
д)
перекись водорода
е) пары
формалина
ж) оксид
этилена с бромистым метилом
з) анолит
нейтральный
278.
Эффективность
стерилизации растворами дезинфектантов определяется…
а)
концентрацией раствора
б)
температурой
в)
рН
г)
временем стерилизационной выдержки
279.
Стерилизация
медицинская — это
а)
уничтожение только вегетативных патогенных микроорганизмов
б)
уничтожение только споровых патогенных форм
в) полное
освобождение объекта от всех микроорганизмов
280.
Какой
тест используют для экспресс-метода контроля хлорсодержащих дезинфектантов
медицинского инструментария
а)
пероксид-тест
б)
ЧАС-тест
в)
миллихлор-тест
г)
хлор-тест
281.
Какой
тест используют для экспресс-метода следов перекиси водорода на медицинском
инструментарии
а)
пероксид-тест
б)
ЧАС-тест
в)
миллихлор-тест
г)
хлор-тест
282.
Какой
тест используют для экспресс-метода следов хлоргексидина биглюконата (гебитана)
на медицинском инструментарии
а)
пероксид-тест
б)
ЧАС-тест
в)
миллихлор-тест
г)
хлор-тест
283.
Какой
тест используют для экспресс-метода следов нейтрального анолита на медицинском
инструментарии
а)
пероксид-тест
б)
ЧАС-тест
в)
миллихлор-тест
г)
хлор-тест
284.
Предстерилизационная
обработка медицинского инструментария имеет целью удаление:
а)
белковых загрязнений
б) жировых
компонентов
в)
лекарственных средств
г)
механических загрязнений
д) все
вышеперечисленное
285.
Для
обнаружения следов крови на медицинском инструментарии используют пробы:
а)
азопирамовую
б) фенолфталеиновую
в) с
Суданом III
г)
амидопириновую
286.
Медицинский
инструментарий из коррозионно-неустойчивых материалов стерилизуют методом:
а)
паровым
б)
воздушным
в)
газовым.
287.
При
обработке процедурного кабинета УФ-облучение включают:
а) до
проведения дезинфекции помещения
б) после
проведения дезинфекции помещения
в)
независимо от времени уборки и обработки помещения.
288.
На
какой срок накрывается стерильный стол в процедурном кабинете
а) 6 часов
б) 24 часа
в) 48
часов
289.
Как
часто проводят генеральную уборку процедурного кабинета?
а)
1 раз в месяц
б)
1 раз в две недели
в)
1 раз в неделю
290.
Кто
проводит предстерилизационную обработку медицинского инструментария в
отделении:
а) любые
медицинские сестры
б)
дежурные медицинские сестры
в)
специально выделенные лица
291.
Каковы
пути проникновения инсектицидов в организм насекомых?
а)
через наружные покровы
б)
дыхательные пути
в)
кишечник
г)
все вышеперечисленное
292.
Малотоксичными
для людей инсектицидами являются:
а)
«Карбофос»
б) фторид
натрия
в) бура
г)
«Пиретрум»
д)
«Неопин»
е)
«Дикрезил»
ж)
«Дихлорэтан»
з)
сернистый ангидрид
293.
Инсектициды
должны:
а)
длительно сохраняться во внешней среде
б) быстро
разрушаться во внешней среде
в) мед
ленно действовать на насекомых
г)
вызывать быструю гибель насекомых
д) проникать
в организм через наружные покровы
е)
проникать через дыхательные пути
ж)
проникать через кишечник
з) быть
токсичными для имаго
и) быть
токсичными для личинок
к)
быть токсичным для яиц насекомых
294.
Препараты,
обладающие не только инсектицидным, но и овицидным действием — это:
а)
«Пиретрум»
б)
«Лизол»
в)
«Карбофос»
г) бура
д)
«Сульфолан»
е) керосин
ж) 20 %
водно-мыльная суспензия бензил-бензоата
з) 5 %
борная мазь
295.
Что
такое ларвициды?
а)
вещества, применяемые для уничтожения личинок членистоногих
б)
вещества, применяемые для имаго членистоногих
296.
С
какой целью применяются инсектициды
а)
уничтожение насекомых
б)
задерживание развития насекомых
в)
привлечение насекомых
г)
отпугивание насекомых
297.
С
какой целью применяются репелленты
а)
уничтожение насекомых
б)
задерживание развития насекомых
в)
привлечение насекомых
г)
отпугивание насекомых
298.
С
какой целью применяются репелленты
а)
уничтожение насекомых
б)
задерживание развития насекомых
в)
привлечение насекомых
г)
отпугивание насекомых
299.
Какие
средства являются репеллентами
а)
«Пиретрум»
б)
«Карбофос»
в)
«Гвоздичное масло»
г)
«Перекись водорода»
д)
«ДЭКСА»
е)
«Сульфидофос» («Байтекс»)
ж)
«Уксусная кислота»
з)
«Диметилфталат»
и)
«Медифокс»
ответы
200.а
201.д
202.б
203.б
204.в
205.д
206.г
207.б
208.в
209.б
210.в,г,д
211.а,б
212.а
213.б,г
214.в,д
215.а
216.а
217.а,б,в
218.а,б
219.в
220.в
221.а
222.д
223.а,в
224.а
225.б,в
226.в
227.а
228.б
229.б
230.а
231.а
232.б
233.а
234.в
235.в
236.в
237.в
238.а
239.б
240.в,д,е
241.а,б,в,д
242.а,б
243.в,г,е
244.а,б
245.б,в
246.г
247. б,в,д
б,в,д
248.д
249.д
250.в,г,е
251.б,г
252.в,г,д
253.а
254.а,б,г
255.б,г
256.б
257.г
258.в
259.б
260.б,в
261.а
262.б
263.в,г
264.а
265.б
266.а
267.б
268.б
269.б
270.а,в,г
271.б,д,е
272.б,в
273.б
274.в
275.г,д
276.а,б,в,д,е
277.б,е
278.а,г
279.в
280.г
281.а
282.б
283.в
284.д
285.а,г
286.а
287.б
288.а
289.в
290.в
291.г
292.в,г,д
293.б,г,д,ж,з,и,к
294.в,ж
295.а
296.а
297.г
298.в
299.в,д,з
содержание ..
1
2
3
4 ..
Стерилизация — это… Что такое Стерилизация?
полноте уничтожение всех видов микроорганизмов и их спор на поверхности и внутри различных предметов, а также в жидкостях и воздухе. Применяется в медицине, микробиологии, гнотобиологии, пищевой промышленности и в других областях. С. является основой асептики (Асептика), имеет большое значение в борьбе с госпитальной инфекцией, а также в профилактике возникновения послеоперационных гнойных осложнений, гепатита В, ВИЧ-инфекции и гнойных заболеваний. Стерилизуются все инструменты, дренажи, шприцы, перевязочный материал, контактирующие с раневой поверхностью, кровью или инъекционными препаратами, а также медицинские инструменты и приборы, которые в процессе эксплуатации соприкасаются со слизистой оболочкой и могут вызвать ее повреждение. Обеззараживаются воздух в операционной (см. Операционный блок), руки хирурга и операционной сестры (см. Обработка рук).
Обеззараживаются воздух в операционной (см. Операционный блок), руки хирурга и операционной сестры (см. Обработка рук).
Современные методы С. подразделяют на физические и химические. К физическим методам относятся паровой, воздушный, радиационный. ультразвуковой. Химическая С. бывает газовой и растворами химических препаратов. С. при высоких температурах (паровая, воздушная) называют термической, а при температуре ниже 100° (радиационная, ультразвуковая и др.) — холодной. Стерилизация радиационным, ультразвуковым и некоторыми другими методами технически сложна и может осуществляться только в особых условиях. Выбор того или иного метода С. зависит от особенностей стерилизуемого объекта и самого метода. При этом в течение установленного времени (стерилизационной выдержки) обязательно должны погибнуть все микроорганизмы, как патогенные, так и сапрофиты, в т.ч. спороносные формы. Кроме того, выбранные методы, средства и режимы С. не должны вызывать изменений внешнего вида, прочности, эксплуатационных качеств и других свойств стерилизуемых изделий. После С. химическим методом изделия не должны становиться токсичными для организма. Термонестойкие изделия стерилизуют холодными методами, а портящиеся под действием влаги — газовым или воздушным. При всех равных условиях предпочтение обычно отдают термическим методам стерилизации. При паровом методе стерилизационная выдержка короче, а температура ниже, чем при стерилизации сухим горячим воздухом.
Эффективность С. зависит не только от того, насколько правильно применен избранный метод, но и от степени чистоты стерилизуемых изделий, массивности их микробного обсеменения. Инструменты, использованные при гнойных операциях, диагностических и лечебных манипуляциях у инфекционных больных, перенесших в прошлом гепатит В или гепатит, диагноз которого не уточнен, а также являющихся носителем НВ-антигена, подлежат предварительной дезинфекции (Дезинфекция). Она осуществляется кипячением, а также воздействием водяного насыщенного пара под избыточным давлением, сухого горячего воздуха, растворами хлорамина, перекиси водорода, формалина, дезоксона-1, хлоргексидина биглюконата, дихлора-1, сульфолхлорантина и др. После дезинфекции химическим способом изделие должно быть промыто в проточной воде до полного удаления запаха дезинфицирующего средства.
После дезинфекции химическим способом изделие должно быть промыто в проточной воде до полного удаления запаха дезинфицирующего средства.
Все изделия после дезинфекции, а также изделия, использующиеся впервые или после «чистых» операций, должны пройти предстерилизационную очистку с целью удаления белковых, жировых и механических загрязнений, а также лекарственных препаратов. Разъемные изделия разбирают на составные части. Новые изделия очищают сжатым воздухом от пыли, затем моют. Инструменты и другие изделия, использованные во время операций и различных манипуляций, тщательно промывают проточной водой, освобождают от слизи, крови, гноя и других загрязнений. Когда предстерилизационная очистка инструментов, загрязненных кровью, выполняется не сразу после их использования, то они предварительно должны быть погружены в 1% раствор бензоата натрия, являющегося ингибитором коррозии металла. После промывания водой изделия погружают на 15 мин в 0,5% раствор Биолота, подогретый до 40°, или в комплексный раствор, состоящий из 17 мл 27,5% раствора перекиси водорода, 5 г синтетического моющего средства (Лотос, Прогресс, Айна, Астра) и 978 мл питьевой воды при температуре 50°. Затем каждое изделие моют в том же растворе с помощью ерша или ватного тампона, а затем повторно промывают в проточной воде в течение 5—10 мин при использовании одного из моющих средств. Моющий раствор можно применять многократно до его загрязнения в течение 1 сут. с момента приготовления Предстерилизационная очистка заканчивается сушкой изделий в сушильных шкафах при температуре 85° до полного исчезновения влаги. Качество очистки хирургических инструментов и других изделий от крови определяется путем постановки бензидиновой, ортотолиновой или амидопириновой проб.
Сухие изделия группируют по назначению и в зависимости от их особенностей и метода стерилизации укладывают в стерилизационные коробки (биксы), упаковочный материал или открытые емкости. С. осуществляется в специально оборудованном помещении — стерилизационной или в центральных стерилизационных отделениях, где изделия стерилизуются для нескольких отделений больницы (поликлиники) или нескольких лечебных учреждений.
При стерилизации паровым методом стерилизующим агентом является водяной насыщенный пар под избыточным давлением. С. производят в паровых стерилизаторах (см. Стерилизационное оборудование) в течение 20—22 мин при давлении пара в стерилизационной камере 2 ± 0,2 кгс/см2 (0,2 ± 0,02 МПа) и температуре 132 ± 2°. Паровым методом стерилизуют изделия из текстильных материалов, стекла, коррозионно-устойчивого металла, резины. Стерилизуемые объекты укладывают в стерилизационные коробки с фильтром или без него, в качестве упаковки используют также влагопрочную бумагу, например пергамент, и двойной слой бязи. Стерилизационные коробки без фильтра должны быть выстланы изнутри одним слоем хлопчатобумажной ткани. Для эффективности С. и достижения необходимого прогрева необходимо полное удаление воздуха из стерилизационной камеры и стерилизуемых объектов. В паровых стерилизаторах, не имеющих вакуум-насосов и управляемых вручную, необходимо вытеснить воздух паром (продувка) в течение 10 мин. На качество удаления воздуха оказывают влияние плотность и равномерность загрузки стерилизационной камеры, вид упаковки и плотность расположения в ней стерилизуемых объектов. Достоинствами парового метода являются его высокая надежность, обеспечение стерильности не только на поверхности изделий, но и в их толще, возможность стерилизовать материалы, разрушающиеся под действием горячего сухого воздуха. Однако он не пригоден для С. изделий, неустойчивых к воздействию тепла или влаги. Недостатком метода является также вероятность вторичного инфицирования простерилизованных объектов. Оно происходит непосредственно после окончания С. и обусловлено тем, что при охлаждении вместе с воздухом внутрь упаковки (кроме стерилизационных коробок с фильтром) поступает и микрофлора. В связи с этим после С. упаковки складывают на специальных столах, покрытых стерильной простыней, и накрывают второй стерильной простыней до полного охлаждения стерилизуемых объектов. Боковые отверстия стерилизационных коробок должны быть закрыты. Категорически запрещается выдавать в отделения стерилизованные изделия до их полного остывания.
Боковые отверстия стерилизационных коробок должны быть закрыты. Категорически запрещается выдавать в отделения стерилизованные изделия до их полного остывания.
Стерилизация воздушным методом осуществляется сухим горячим воздухом в воздушных стерилизаторах (см. Стерилизационное оборудование) при температуре 180° в течение 60—65 мин или при температуре 160° в течение 150 мин. Стерилизуют изделия из металла, стекла и силиконовой резины, а также разрушающиеся под действием влаги. Их укладывают в пакеты из крафт-бумаги (сильфитно-оберточная бумага) или в открытые емкости. Пакеты склеивают 10% раствором поливинилового спирта или 5% крахмальным клеем. После укладки стерилизуемого материала свободный край пакета трижды перегибают и закрепляют металлической скрепкой. В камере стерилизатора могут образоваться участки со значительной разницей температур. Поэтому лучше использовать стерилизаторы, оборудованные механическими устройствами, усиливающими циркуляцию воздуха в стерилизационной камере. Необходимо следить за тем, чтобы между предметами, а также между ними и стенками камеры оставались промежутки. Воздушный метод нельзя применять при стерилизации термолабильных материалов (изделий из текстиля, полимеров, резины).
Химические методы позволяют стерилизовать оптические изделия, радио- и электронную аппаратуру, а также изделия из термонестойких материалов, металла, стекла. Стерилизация эффективна в том случае, когда химическое средство поглощается стерилизуемым объектом. Химические вещества в растворенном и особенно в газообразном состоянии обладают незначительной скоростью проникновения в стерилизуемый объект, что требует более длительной стерилизационной выдержки и очень тщательной предстерилизационной очистки пористых материалов. Недостатком метода является также необходимость нейтрализации или дегазации химических веществ, оставшихся в стерилизуемых объектах. Растворами химических препаратов нельзя стерилизовать изделия из влагонестойких материалов.
Пары окиси этилена обладают высокими бактерицидными свойствами, легко проникают через различные ткани и материалы, не портят их, но являются взрывоопасными. Стерилизация окисью этилена осуществляется в течение 960 ± 5 мин. Взрывоопасность окиси этилена значительно уменьшается в смеси ее с бромистым метилом в весовом соотношении 1:2,5 (смесь ОБ). Бромистый метил не горит, но также обладает высокими бактерицидными свойствами. Смесь ОБ в 5 раз эффективнее каждого из компонентов, входящих в ее состав. Для стерилизации формальдегидом используют 16% раствор формалина (по формальдегиду). С. осуществляют в течение 300 ± 5 мин при температуре 75 ± 5° и относительной влажности воздуха 96 ± 2%. С. окисью этилена и смесью ОБ выполняется в стационарных газовых стерилизаторах и микроанаэростате, формальдегидом — в стационарном формалиновом стерилизаторе. В качестве упаковочного материала используют полиэтиленовую пленку, пергамент, мешочную влагопрочную бумагу. Изделия, простерилизованные газовым методом, применяются после их выдержки в вентилируемом помещении (при скорости движения воздуха 20 м/с) в течение 1 сут. (изделия из стекла и металла), 5—13 сут. (изделия из полимерных материалов), 14 сут. (изделия, имеющие длительный, более 30 мин контакт с тканями, слизистой оболочкой и кровью), 21 сут. (изделия из полимерных материалов, используемые у детей). Для нейтрализации формальдегида изделия перед применением погружают на 1 ч в 23—25% раствор аммиака.
Стерилизация растворами химических препаратов выполняется в закрытых емкостях, покрытых неповрежденной эмалью, а также сделанных из стекла или пластмассы. Стерилизуемые объекты погружают в раствор при температуре 18 ± 2°. Время стерилизационной выдержки в 6% растворе перекиси водорода — 60 ± 5 мин, дезоксоне-1 — 45—50 мин. После С. изделия промывают стерильной водой в асептических условиях.
Контроль за качеством С. осуществляют с помощью физических, химических и бактериологических методов. Манометры, термометры, мановакуумметры и др. позволяют наблюдать за температурой, давлением пара или газа, временем стерилизационной выдержки и другими параметрами. Химический метод контроля С. основан на свойстве некоторых веществ плавиться или изменять цвет при определенной температуре. В качестве индикаторов при термических методах С. можно применять бензойную кислоту (t° 122,36°), мочевину (132,7°), тиомочевину (187—182°), аскорбиновую кислоту (187—192°) и др. Используют также термоиндикаторы в виде окрашенных марлевых лент, которые при нагреве изменяют свой цвет и с точностью до 1—2° указывают уровень температуры в пределах от 111 ± 2° до 212 ± 1°. Бактериологический метод контроля эффективности С. является наиболее специфичным и точным, позволяет констатировать достижение необходимой температуры и экспозиции С. на основании гибели спор высокорезистентных тест-микроорганизмов. Однако этот метод трудоемкий. При стерилизации паровым методом в качестве биотеста применяют пробы почвы (садовой земли), содержащей сапрофиты, которые выдерживают воздействие водяного насыщенного пара при температуре 120° в течение 3—5 мин. Для контроля воздушного метода С. используют бактериологические пробирки, инфицированные споровой суспензией сенной палочки, погибающей через 5 мин при температуре не ниже 180°. Контроль С. осуществляется также посевами микрофлоры с простерилизованных изделий.
Манометры, термометры, мановакуумметры и др. позволяют наблюдать за температурой, давлением пара или газа, временем стерилизационной выдержки и другими параметрами. Химический метод контроля С. основан на свойстве некоторых веществ плавиться или изменять цвет при определенной температуре. В качестве индикаторов при термических методах С. можно применять бензойную кислоту (t° 122,36°), мочевину (132,7°), тиомочевину (187—182°), аскорбиновую кислоту (187—192°) и др. Используют также термоиндикаторы в виде окрашенных марлевых лент, которые при нагреве изменяют свой цвет и с точностью до 1—2° указывают уровень температуры в пределах от 111 ± 2° до 212 ± 1°. Бактериологический метод контроля эффективности С. является наиболее специфичным и точным, позволяет констатировать достижение необходимой температуры и экспозиции С. на основании гибели спор высокорезистентных тест-микроорганизмов. Однако этот метод трудоемкий. При стерилизации паровым методом в качестве биотеста применяют пробы почвы (садовой земли), содержащей сапрофиты, которые выдерживают воздействие водяного насыщенного пара при температуре 120° в течение 3—5 мин. Для контроля воздушного метода С. используют бактериологические пробирки, инфицированные споровой суспензией сенной палочки, погибающей через 5 мин при температуре не ниже 180°. Контроль С. осуществляется также посевами микрофлоры с простерилизованных изделий.
Библиогр.: Вашков В.И. Средства и методы стеризации, применяемые в медицине, М., 1973, библиогр.; Тимофеев Н.С. и Тимофеев Н.Н. Асептика и антисептика, с. 14, М., 1980.
Методы стерилизации. Физические методы стерилизации
Виды | Методы | Действующий |
Физический | паровой | пар под (120 0 С, (132 0 С, |
воздушный | сухой | |
гласперленовый | нагретые | |
инфракрасный | инфракрасное | |
ионизирующее | ||
ультразвуковой | механические | |
Химический | жидкостной | растворы |
окись этилена | ||
плазменный | пары 20 % пероксида |
Паровой метод
стерилизации (автоклавирование)
Впервые
стерилизация паром под повышенным
давлением в автоклаве осуществлена в
1884 году Л.Л. Гендейрейхом.
При
этом способе стерилизации действующим
агентом является горячий пар. В автоклаве
возможно нагревание воды под повышенным
давлением, что приводит к по-вышению
точки кипения воды и соответственно
пара до 132 0 С
(при давлении 2 атм.).
Паровым
методом стерилизуют общие хирургические
и специальные инструменты, детали
приборов и аппаратов из коррозионно-стойких
металлов, стекла, шприцы с пометкой 200
0 С,
хирургическое белье, перевязочный и
шовный материал, изделия из резин
(перчатки, трубки, катетеры, зонды и
т.д.), латекса, отдельных видов пластмасс.
Режимы стерилизации некоторых медицинских инструментов
Способ | Температура, | Давление, | Время | |
Водяным | Изделия | |||
Изделия | ||||
Сухим горячим | Изделия |
Материал
для стерилизации помещают в специальные
биксы Шиммельбуша, пергамент, бумагу
мешочную, упаковочную, крепированную,
стерилизационные коробки с фильтром.
Одним
из основных условий проведения
качественной стерилизации является
загрузка автоклава в точном соответствии
с рекомендациями производителя. Это
означает правильное расположение и
количество загружаемых предметов.
Водяной пар должен свободно циркулировать,
а конденсат своевременно выводиться.
При загрузке автоклава обращают внимание
на то, чтобы тяжелые инструменты
располагались на нижних поддонах, а
легкие – на верхних.
Изделия
загружают в таком количестве, которое
допускает свободную подачу воздуха к
стерилизуемым изделиям. Не допускается
перекрывать продувочные окна и решетки
вентиляции. Загрузку и выгрузку изделий
проводят при температуре не выше 40-50°С.
Срок
хранения простерилизованных изделий:
в биксах без фильтра, в двойной мягкой
упаковке – 3 суток; в пергаменте, бумаге
мешочной непропитанной, мешочной
влагопрочной, бумаге упаковочной
высокопрочной, бумаге крепированной,
стерилизационной коробке с фильтром –
20 суток.
Воздушный метод
стерилизации
При
воздушном методе стерилизации
стерилизующим средством является сухой
горячий воздух температурой 160 0 С
и 180 0 С;
стерилизацию осуществляют в суховоздушных
стерилизаторах.
Воздушным
методом стерилизуют хирургические,
гинекологические, стоматологические
инструменты, детали приборов и аппаратов,
в том числе изготовленные из
коррозионно-нестойких металлов, шприцы
с пометкой 200 0 С,
инъекционные иглы, изделия из силиконовой
резины.
Перед
стерилизацией воздушным методом изделия
после предстерилизационной очистки
обязательно высушивают в сушильном
шкафу при температуре 85 °C до исчезновения
видимой влаги.
Качество
стерилизации воздушным методом зависит
от равномерности распределения горячего
воздуха в стерилизационной камере, что
достигается правильной загрузкой
стерилизатора. Изделия загружают в
таком количестве, которое допускает
свободную подачу воздуха к стерилизуемому
изделию.
Изделия
стерилизуют завернутыми в стерилизационные
упаковочные материалы. Шприцы стерилизуют
Шприцы стерилизуют
в разобранном виде.
Во
время стерилизации металлических
инструментов без упаковки их располагают
так, чтобы они не касались друг друга.
Стерилизация в
среде нагретых стеклянных шариков
(гласперленовая)
В
стерилизаторах, стерилизующим средством
в которых является среда нагретых
стеклянных шариков (гласперленовые
шариковые стерилизаторы), стерилизуют
изделия, применяемые в стоматологии
(боры зубные, головки алмазные, дрильборы,
а также рабочие части гладилок,
экскаваторов, зондов и др.). При стерилизации
стеклянные шарики нагреваются до
температуры 190-240 0 С.
Стерилизация проводится в течение 5 —
15 секунд.
Недостатком
метода является возможность стерилизации
только мелких инструментов. У более
крупных инструментов для такой обработки
доступна только рабочая часть. А полная
их стерилизация даже при увеличении
экспозиции не удается. Проблемы возникают
и со средствами контроля работы этих
стерилизаторов.
Инфракрасная
стерилизация
Существуют
стерилизаторы, в которых используется
метод, основанный на применении
кратковременного импульсного инфракрасного
излучения, создающего в рабочей камере
температуру 200±3 0 С.
Время инфракрасной стерилизации
инструментария в неупакованном виде
составляет от 10 до 25 минут. Недостатками
данного метода стерилизации являются
отсутствие упаковки инструментов,
повреждающее воздействие на полимерные
материалы и резину, отсутствие
контролирующих индикаторов.
Лучевая
стерилизация
.
Используют
гамма и бета — частицы и относительно
тяжелые нейтроны, протоны и т. д. Разница
вызываемых ими биологических изменений
почти незаметна. Радиоактивное излучение,
проходя через среду, вызывает ионизацию
последней, в связи с чем его называют
ионизирующим излучением. Бактерицидный
эффект ионизирующего излучения обусловлен
воздействием на метаболические процессы
бактериальной клетки. Наибольшее
применение получила стерилизация
гамма-лучами. Используются изотопы Co 60
и Cs 138 .
Доза проникающей радиации значительна
и составляет 2-2,5 Мрад. В связи с этим
лучевая стерилизация в стационарах не
производится и применяется в промышленных
условиях.
Метод
применяется для стерилизации одноразовых
инструментов (шприцы, шовный материал,
катетеры, зонды, системы для переливания
крови, перчатки и др.). При сохранении
целостности упаковки стерильные свойства
предметов сохраняются в течение 5 лет.
Ультразвуковая
стерилизация
Механические
колебания с частотой от 2х10 4
до 2х10 8
колебаний в
1 секунду не воспринимаются ухом человека
и называются ультразвуком. Для
искусственного получения ультразвука
служат специальные приборы. Источником
ультразвука являются кристаллы кварца,
турмалина, обладающие пьезоэлектрическими
свойствами. Пьезоэлектрический эффект
обусловлен явлением электрической
поляризации кристаллов.
При
воздействии на ткани ультразвуковой
волны происходит образование
микроскопических полостей, которые
быстро закрываются под воздействием
последующего сжатия. Такое явление
называется кавитацией. Ультразвуковая
кавитация приводит к образованию
свободных радикалов, диссоциации молекул
воды на ионы Н +
и ОН — ,
что приводит к нарушению
окислительно-восстановительных процессов
в микробной клетке.
Ультразвуковые
волны используются для стерилизации
инструментов, подготовки рук медицинского
персонала к операции. Для этого руки
(инструменты) погружают в специальную
ванну с дезинфицирующим раствором,
через который пропускают ультразвуковые
волны.
Стерилизация
растворами химических средств
Стерилизация
изделий растворами химических средств
является вспомогательным методом,
поскольку изделия нельзя простерилизовать
в упаковке, а по окончании стерилизации
их необходимо промыть стерильной
жидкостью (питьевая вода, 0,9 % раствор
натрия хлорида), что при нарушении правил
асептики может привести к вторичному
обсеменению простерилизованных изделий
микроорганизмами.
Данный
метод следует применять для стерилизации
изделий, в конструкцию которых входят
термолабильные материалы, то есть в тех
случаях, когда особенности материалов
изделий не позволяют использовать
другие официально рекомендуемые методы
стерилизации.
Для
стерилизации растворами химических
средств используют такие средства, как
первомур,
перекись водорода, дезоксон — 1, 4, стераниос
20%, сайдекс, лизоформин-3000, глютарал
и др.
При
стерилизации растворами химических
средств используют стерильные емкости
из стекла, металлов, термостойких
пластмасс, выдерживающих стерилизацию
паровым методом, или покрытые эмалью
(эмаль без повреждений).
Температура
растворов, за исключением специальных
режимов применения перекиси водорода
и средства Лизоформин 3000, должна
составлять не менее 20 0 С
для альдегидсодержащих средств и не
менее 18 0 С
– для остальных средств.
Стерилизацию
проводят при полном погружении изделий
в раствор, свободно их раскладывая. При
большой длине изделия его укладывают
по спирали. Разъемные изделия стерилизуют
в разобранном виде. Каналы и полости
заполняют раствором.
После
стерилизации все манипуляции проводят,
строго соблюдая правила асептики.
Изделия извлекают из раствора с помощью
стерильных пинцетов (корнцангов), удаляют
раствор из каналов и полостей, а затем
промывают в стерильной жидкости, налитой
в стерильные емкости, согласно
рекомендациям методического документа
по применению конкретного средства.
При каждом переносе из одной емкости в
другую освобождение каналов и полостей
и их заполнение свежей жидкостью
осуществляют с помощью стерильного
шприца, пипетки или иного приспособления.
Промытые
стерильные изделия после удаления
остатков жидкости из каналов и полостей
используют сразу по назначению или
помешают (с помощью стерильных пинцетов,
корнцангов) на хранение в стерильную
стерилизационную коробку, выложенную
стерильной простыней, на срок не более
3 суток.
Газовая стерилизация
Для
газового метода стерилизации используют
смесь ОБ (смесь
окиси этилена и бромистого метила в
весовом соотношении 1:2,5 соответственно),
окись этилена, пары раствора формальдегида
в этиловом спирте
,
а также озон
(табл. 4)
.
Стерилизацию
смесью ОБ и окисью этилена проводят при
комнатной температуре (не менее 18 0 С),
при температуре 35 0 С
и 55 0 С,
парами раствора формальдегида в этиловом
спирте при температуре 80 0 С.
Стерилизация — это процесс уничтожения всех видов микробной флоры, в том числе их споровых форм, и вирусов с помощью физических или химических воздействий. Принято считать медицинское изделие стерильным, если вероятность его бионагрузки равна или менее 10 в степени -6. Стерилизации должны подвергаться медицинские изделия, контактирующие с кровью пациента, контактирующие с раневой поверхностью и соприкасающиеся со слизистой оболочкой и могущие вызвать нарушение ее целостности. Стерилизация -сложный процесс, для успешной реализации которого необходимы следующие требования:
Эффективная очистка;
Соответствующие упаковочные материалы;
Соблюдение правил упаковки медицинских изделий;
Соблюдение правил по загрузке стерилизатора упаковками с медицинскими изделиями;
Адекватное качество и количество стерилизуемого материала; соответствующая работа оборудования;
Соблюдение правил хранения, обращения и транспортировки простерилизованного материала.
Процесс стерилизации медицинских инструментов и изделий от момента окончания операции и до стерильного хранения или следующего применения включает в себя выполнение мероприятий в определенной последовательности. Все этапы должны быть строго соблюдены для обеспечения стерильности и длительного срока жизни инструментов. Схематично это можно представить следующим образом:
Отложить инструменты после использования Дезинфекция -> Механическая очистка инструмента -> Проверить на повреждения -> Промыть инструменты Сушка -> Упаковать в стерилизационную упаковку -> Стерилизация -> Стерильное хранение/применение. При применении стерилизационной упаковки (бумага, фольга или стерилизационные контейнеры) инструменты могут храниться в стерильном виде и позднее использоваться от 24 часов до 6 месяцев.
В лечебно-профилактических учреждениях применяется несколько форм организации стерилизации: децентрализованная, централизованная, осуществляемая в ЦСО, и смешанная. В амбулаторной стоматологической практике чаще применяется децентрализованная стерилизация (особенно в частных клиниках). Централизованная стерилизация характерна для районных стоматологических поликлиник и больших частных клиник. Децентрализованная стерилизация имеет ряд существенных недостатков, влияющих на ее эффективность. Предстерилизационная обработка изделий выполняется чаще всего вручную и при этом качество очистки изделий оказывается низким. Контроль за соблюдением технологии проведения стерилизации, правил упаковки, загрузки изделий в стерилизаторы и за эффективностью работы оборудования в условиях децентрализованной стерилизации затруднен. Все это приводит к снижению качества стерилизации. При применении централизованной формы стерилизации удается достичь более высоких результатов стерилизации за счет совершенствования существующих и внедрению новейших методов стерилизации (механизация мойки инструментов и медицинских изделий, облегчение работы среднего медицинского персонала и др.). В централизованном стерилизационном отделении выделяют: моечную, дезинфекционную, упаковочную и подразделение для стерилизации и раздельного хранения стерильных предметов. Температура воздуха во всех подразделениях должна быть от 18°С до 22°С, относительная влажность — 35-70%, направление потока воздуха — от чистых к относительно загрязненным зонам.
Централизованная стерилизация характерна для районных стоматологических поликлиник и больших частных клиник. Децентрализованная стерилизация имеет ряд существенных недостатков, влияющих на ее эффективность. Предстерилизационная обработка изделий выполняется чаще всего вручную и при этом качество очистки изделий оказывается низким. Контроль за соблюдением технологии проведения стерилизации, правил упаковки, загрузки изделий в стерилизаторы и за эффективностью работы оборудования в условиях децентрализованной стерилизации затруднен. Все это приводит к снижению качества стерилизации. При применении централизованной формы стерилизации удается достичь более высоких результатов стерилизации за счет совершенствования существующих и внедрению новейших методов стерилизации (механизация мойки инструментов и медицинских изделий, облегчение работы среднего медицинского персонала и др.). В централизованном стерилизационном отделении выделяют: моечную, дезинфекционную, упаковочную и подразделение для стерилизации и раздельного хранения стерильных предметов. Температура воздуха во всех подразделениях должна быть от 18°С до 22°С, относительная влажность — 35-70%, направление потока воздуха — от чистых к относительно загрязненным зонам.
Методы стерилизации
Стерилизация осуществляется физическими методами: паровая, воздушная, гласперленовая (в среде нагретых стеклянных шариков), радиационная, с применением инфракрасного излучения, и химическими методами: растворы химических средств и газы (табл. 3). В последние годы применяется озоновая (стерилизатор С0-01-СПБ) и плазменная стерилизация (установка «Стеррад»), используются установки на основе окиси этилена, паров формальдегида. Выбор метода стерилизации изделий зависит от их устойчивости к методам стерилизационного воздействия.
Преимущества и недостатки различных методов стерилизации представлены в таблице.
Таблица.
Все изделия перед стерилизацией подвергаются предстерилизационной очистке .
При стерилизации физическими методами (паровым, воздушным) изделия, как правило, стерилизуют упакованными в упаковочные материалы, разрешенные в установленном порядке к промышленному выпуску и применению в России. При паровом методе могут применяться стерилизационные коробки без фильтров и с фильтром. При воздушном методе, а также при паровом и газовом методах допускается стерилизация инструментов в неупакованном виде.
При паровом методе могут применяться стерилизационные коробки без фильтров и с фильтром. При воздушном методе, а также при паровом и газовом методах допускается стерилизация инструментов в неупакованном виде.
Паровой метод стерилизации
Паровым методом стерилизуют медицинские изделия, детали приборов и аппаратов из коррозионностойких металлов, стекла, хирургическое белье, перевязочный и шовный материал, изделия из резины (катетеры, зонды, трубки), из латекса, пластмасс. При паровом методе стерилизующим средством является водяной насыщенный пар под избыточным давлением 0,05 МПа (0,5 кгс/см2) — 0,21 МПа (2,1 кгс/см2) (1,1-2,0 бар) температурой 110-134°С. Процесс стерилизации происходит в стерилизаторах (автоклавах). Полный цикл составляет от 5 до 180 минут (табл.). Согласно ГОСТ 17726-81, название данного класса устройств: «Стерилизатор паровой». Несмотря на то, что обработка паром достаточно эффективна, она не всегда может обеспечить стерилизацию инструмента. Причина этого состоит в том, что воздушные полости в стерилизуемых объектах могут послужить тепловым изолятором, как например, стоматологические турбинные наконечники. Для решения этой проблемы в автоклавах используется функция создания предварительного вакуума в импульсном режиме. Преимущества метода — короткий цикл, возможность стерилизации нетермостойких изделий, применение различных типов упаковки. Недостатком является высокая стоимость оборудования.
Таблица.
Воздушный метод стерилизации
Стерилизация при воздушном методе осуществляется сухим горячим воздухом температурой 160°, 180° и 200°С (табл.).
Таблица.
Воздушным методом стерилизуют медицинские изделия, детали приборов и аппаратов из коррозионностойких металлов, стекла с пометкой 200°С, изделия из силиконовой резины. Перед стерилизацией воздушным методом изделия подвергаются предстерилизационной очистке и обязательно высушиваются в сушильном шкафу при температуре 85°С до исчезновения видимой влаги. Полный цикл составляет до 150 минут. Преимущество стерилизации горячим воздухом по сравнению с паровым методом состоит в низкой себестоимости оборудования. Недостатками являются: длинный полный цикл стерилизации (не менее 30 мин), опасность повреждения инструментов высокими температурами, невозможность стерилизации тканей и пластмасс, только один контрольный параметр — температура, высокие энергозатраты.
Полный цикл составляет до 150 минут. Преимущество стерилизации горячим воздухом по сравнению с паровым методом состоит в низкой себестоимости оборудования. Недостатками являются: длинный полный цикл стерилизации (не менее 30 мин), опасность повреждения инструментов высокими температурами, невозможность стерилизации тканей и пластмасс, только один контрольный параметр — температура, высокие энергозатраты.
Гласперленовая стерилизация
Гласперленовая стерилизация осуществляется в стерилизаторах, стерилизующим средством в которых является среда нагретых стеклянных шариков при рабочей температуре 190-330°С. При стерилизации сухие инструменты помещают в среду раскаленных стеклянных гранул на глубину более 15 мм. Этим методом могут быть простерилизованы только инструменты, размер которых не превышает 52 мм, они должны быть целиком погружены в камеру на 20-180 с в зависимости от размера. После стерилизации изделия используются сразу по назначению. Высокая рабочая температура и невозможность полного погружения инструментов в стерилизующую среду ограничивают возможность стерилизации широкого ассортимента медицинских изделий.
Стерилизация газовым методом
Для газового метода стерилизации применяют смесь окиси этилена и бромистого метила в весовом соотношении 1: 2,5 соответственно (ОБ), окись этилена, пары раствора формальдегида в этиловом спирте, озон. Стерилизацию смесью ОБ и окисью этилена осуществляют при температуре не менее 18°С, 35°С и 55°С, парами раствора формальдегида в этиловом спирте при температуре 80°С. Перед газовой стерилизацией изделия после предстерилизационной очистки подсушивают до исчезновения видимой влаги. Удаление влаги из полостей изделий производят с использованием централизованного вакуума, а при его отсутствии с помощью водоструйного насоса, подсоединенного к водопроводному крану. При стерилизации ОБ и окисью этилена удаляют воздух до давления 0,9 кгс/см2. При использовании портативного аппарата после окончания стерилизации его выдерживают в вытяжном шкафу на протяжении 5 часов.
Озоном, вырабатываемым в озоновом стерилизаторе С0-01 -СПБ, стерилизуют изделия простой конфигурации из коррозионностойких сталей и сплавов, в неупакованном виде при температуре не более 40°С. Цикл стерилизации (выход на режим, стерилизация, дезактивация) составляет 90 минут. После стерилизации инструменты используют по назначению сразу без дополнительного проветривания. Срок сохранения стерильности изделий 6 часов, при соблюдении правил асептики. При упаковке в стерильную двухслойную х/б ткань срок стерильности составляет 3 суток, а при содержании в камере с бактерицидными облучателями — 7 суток.
В России имеет регистрацию единственная установка — стерилизатор газовый компании «Мюнхенер Медицин Механик ГмбХ» с использованием паров формальдегида, рекомендованный для стерилизации проблемной техники.
Инфракрасное воздействие
Новые методы стерилизации нашли свое отражение в стерилизаторе инфракрасной стерилизации, предназначенном для стерилизационной обработки металлических медицинских инструментов в стоматологии, микрохирургии, офтальмологии и других областях медицины.
Высокая эффективность ИК-стерилизующего воздействия обеспечивает полное уничтожение всех исследованных микроорганизмов, в том числе таких как: S. epidermidis, S. aureus, S. sarina flava, Citrobacter diversus, Str. pneumonia, Bacillus cereus.
Быстрый, в течение 30 секунд, выход на режим 200±3°С, короткий цикл стерилизационной обработки — от 1 до 10 минут, в зависимости от выбранного режима, наряду с низкой энергоемкостью, несравнимы по эффективности ни с одним из применяемых до настоящего времени методов стерилизации. Стерилизатор ИК-стерилизации прост в эксплуатации, не требует специально обученных операторов, а сам метод относится к экологически чистым технологиям. В отличие от паровой, воздушной или гласперленовой стерилизации, при ИК-стерилизации отсутствует агрессивное воздействие стерилизующего агента (инфракрасного излучения) на режущий инструмент.
Ионизирующее излучение
Активно действующими агентами являются гамма-лучи. В ЛПУ ионизирующее излучение не используется для дезинфекции. Его используют для стерилизации изделий однократного применения при производстве в заводских условиях.
В ЛПУ ионизирующее излучение не используется для дезинфекции. Его используют для стерилизации изделий однократного применения при производстве в заводских условиях.
Данный метод применяют для стерилизации изделий, материалы которых не являются термоустойчивыми, и применение других официально рекомендуемых методов невозможно. Недостатком данного метода является то, что изделия нельзя стерилизовать в упаковке и по окончании стерилизации их необходимо промыть стерильной жидкостью (водой или 0,9% раствором натрия хлорида), что при нарушении правил асептики может привести к вторичному обсеменению микроорганизмами простерилизованных изделий. Для химических средств применяют стерильные емкости из стекла, термостойких пластмасс, выдерживающих стерилизацию паровым методом, металлов, покрытых эмалью. Температура растворов, за исключением специальных режимов применения перекиси водорода и средства Лизоформин 3000, должна быть не менее 20°С для альдегидсодержащих средств и не менее 18°С для остальных средств (табл.).
Таблица.
Химический метод стерилизации достаточно широко применяется для обработки «проблемной техники», например, для аппаратуры с волоконной оптикой, наркозной аппаратуры, кардиостимуляторов, стоматологического инструментария. Используются такие современные стерилизующие агенты, как глутаровый альдегид, производные ортофталевой и янтарной кислот, кислородосодержащие соединения и производные надуксусной кислоты в режиме экспресс-стерилизации и «Классической стерилизации». Перспективными считаются препараты, полученные на их основе — «Эригид форте», «Лизоформин-3000», «Сайдекс», «НУ Сайдекс», «Сайдекс ОПА», «Гигасепт», «Стераниос», «Секусепт актив», «Секусепт пульвер», «Аниоксид 1000», «Клиндезин форте», «Клиндезин окси», причем подводя экономическое обоснование использования этих препаратов, следует сделать вывод об их неравнозначности, которая определяется сроками использования рабочих растворов (например, из всех препаратов только «Эригид форте» имеет возможность использования рабочего раствора в течение 30 дней для «классической» стерилизации).
Разъемные изделия стерилизуют в разобранном виде. Во избежание нарушения концентрации стерилизационных растворов, погружаемые в них изделия должны быть сухими. Цикл обработки составляет 240-300 минут, что является существенным недостатком метода. Кроме того, недостатком является высокая стоимость дезинфектантов. Преимущество — нет специального оборудования. Промытые стерильные изделия после удаления жидкости из каналов и полостей используют сразу по назначению или после упаковки в двухслойную стерильную х/б бязь, помещают в стерильную коробку, выложенную стерильной простыней, на срок не более 3 суток.
Все работы по стерилизации изделий проводятся в асептических условиях в специальных помещениях, подготавливаемых как операционный блок (квар-цевание, генеральная уборка). Персонал использует стерильную спецодежду, перчатки, очки. Ополаскивание изделий проводится в 2-3 сменах стерильной воды, по 5 минут в каждой.
Контроль эффективности стерилизации
Контроль эффективности стерилизации осуществляется физическими, химическими и бактериологическими методами.
К физическим методам контроля относятся: измерение температуры, давления и времени применения стерилизации.
Для проведения химического контроля на протяжении десятилетий применялись химические вещества, имеющие температуру плавления, близкую к температуре стерилизации. Такими веществами были: бензойная кислота — для паровой стерилизации; сахароза, гидрохинон и некоторые другие -для контроля воздушной стерилизации. Если происходило расплавление и изменение цвета указанных веществ, то результат стерилизации признавался удовлетворительным. Поскольку применение вышеуказанных индикаторов является недостаточно достоверным, в настоящее время внедрены в практику контроля термических методов стерилизации химические индикаторы, цвет которых изменяется под воздействием температуры, адекватной для конкретного режима, для определенного времени, необходимого для реализации данного режима. По изменению окраски индикаторов судят об основных параметрах стерилизации — температуре и продолжительности стерилизации. С 2002 года в России введен в действие ГОСТ РИСО 11140-1 «Стерилизация медицинской продукции. Химические индикаторы. Общие требования», в котором химические индикаторы распределены на шесть классов:
С 2002 года в России введен в действие ГОСТ РИСО 11140-1 «Стерилизация медицинской продукции. Химические индикаторы. Общие требования», в котором химические индикаторы распределены на шесть классов:
К 1 классу
отнесены индикаторы внешнего и внутреннего процесса, которые размещаются на наружной поверхности упаковки с медицинскими изделиями или внутри наборов инструментов и операционного белья. Изменение цвета индикатора указывает на то, что упаковка подверглась процессу стерилизации.
Ко 2 классу
относят индикаторы, которые не контролируют параметры стерилизации, а предназначенные для применения в специальных тестах, например, на основании таких индикаторов оценивают эффективность работы вакуумного насоса и наличие воздуха в камере парового стерилизатора.
К 3 классу
относятся индикаторы, при помощи которых определяется один параметр стерилизации, например, минимальная температура. Однако они не дают информации о времени воздействия температуры.
К 4 классу
относят многопараметровые индикаторы, изменяющие цвет при воздействии нескольких параметров стерилизации. Примером таких индикаторов являются индикаторы паровой и воздушной стерилизации одноразового применения ИКПВС-«Медтест».
К 5 классу
относят интегрирующие индикаторы, реагирующие на все критические параметры метода стерилизации.
К 6 классу
относят индикаторы-эмуляторы. Индикаторы откалиброваны по параметрам режимов стерилизации, при которых они применяются. Эти индикаторы реагируют на все критические параметры метода стерилизации. Эмулирующие индикаторы являются наиболее современными. Они четко регистрируют качество стерилизации при правильном соотношении всех параметров — температуры, насыщенного пара, времени. При несоблюдении одного из критических параметров индикатр не срабатывает. Среди отечественных термовременных индикаторов используются индикаторы «ИС-120», «ИС-132», «ИС-160», «ИС-180» фирмы «Винар» или индикаторы паровой («ИКПС-120/45», «ИКПС-132/20») и воздушной («ИКПВС-180/60» и «ИКВС-160/150») стерилизации одноразового применения ИКВС фирмы «Медтест».
Основные правила использования индикаторов паровой и воздушной стерилизации одноразового применения ИКПВС-«Медтест»
Все операции с индикаторами — выемка, оценка результатов — осуществляются персоналом, проводящим стерилизацию.
Оценку и учет результатов контроля проводят, оценивая изменения цвета начального состояния термоиндикаторной метки каждого индикатора, сравнивая с цветовой меткой Эталона сравнения.
Если цвет конечного состояния термоиндикаторной метки всех индикаторов соответствует цветовой метке Эталона сравнения, это свидетельствует о соблюдении требуемых значений параметров режимов стерилизации в стерилизационной камере.
Допускаются различия в интенсивности глубины окраски термоиндикаторной метки индикаторов, обусловленные неравномерностью допустимых значений температуры в различных зонах стерилизационной камеры. Если термоиндикаторная метка хотя бы одного индикатора полностью или частично сохранила цвет, легко отличимый от цвета эталонного состояния, это свидетельствует о несоблюдении требуемых значений параметров режимов стерилизации в стерилизационной камере.
Индикаторы и Эталоны сравнения должны совпадать по номерам партий. Запрещается оценивать результаты контроля стерилизации, используя индикаторы разных партий.
Оценку соответствия изменения цвета термоиндикаторной метки в сравнении с Эталоном проводят при освещенности не менее 215 лк, что соответствует матовой лампе накаливания 40 Вт, с расстояния не более 25 см. Для проведения бактериологического контроля в настоящее время применяются биотесты, имеющие дозированное количество спор тест-культуры. Существующая методика позволяет оценивать эффективность стерилизации не ранее чем через 48 часов, что не позволяет применять уже простерилизованные изделия до получения результатов бактериологического контроля.
Биологический индикатор представляет собой препарат из патогенных споро-образующих микроорганизмов с известной высокой устойчивостью к данному типу стерилизационного процесса. Задачей биологических индикаторов является подтверждение способности стерилизационного процесса убивать устойчивые микробные споры. Это наиболее критичный и достоверный тест стерилизационного процесса. Применяются биологические индикаторы в качестве контроля загрузки: если результат положительный (микробный рост), то использовать данную загрузку нельзя и необходимо отозвать все предыдущие загрузки до последнего отрицательного результата. Для получения достоверного биологического ответа следует использовать только те биологические индикаторы, которые соответствуют международным стандартам ЕК 866 и ISO 11138/11135. При использовании биологических индикаторов возникают определенные трудности — необходимость наличия микробиологической лаборатории, обученного персонала, продолжительность инкубации многократно превышает длительность стерилизации, необходимость карантина (невозможность использования) простерилизованных изделий до получения результатов. Из-за указанных выше трудностей в применении биологического метода в амбулаторной стоматологической практике обычно используется физический и химический метод контроля эффективности стерилизации.
Задачей биологических индикаторов является подтверждение способности стерилизационного процесса убивать устойчивые микробные споры. Это наиболее критичный и достоверный тест стерилизационного процесса. Применяются биологические индикаторы в качестве контроля загрузки: если результат положительный (микробный рост), то использовать данную загрузку нельзя и необходимо отозвать все предыдущие загрузки до последнего отрицательного результата. Для получения достоверного биологического ответа следует использовать только те биологические индикаторы, которые соответствуют международным стандартам ЕК 866 и ISO 11138/11135. При использовании биологических индикаторов возникают определенные трудности — необходимость наличия микробиологической лаборатории, обученного персонала, продолжительность инкубации многократно превышает длительность стерилизации, необходимость карантина (невозможность использования) простерилизованных изделий до получения результатов. Из-за указанных выше трудностей в применении биологического метода в амбулаторной стоматологической практике обычно используется физический и химический метод контроля эффективности стерилизации.
К физическим методам стерилизации относится воздействие высокой температуры на стерилизуемые объекты (тепловая стерилизация).
А также воздействие ультрафиолетовым, излучением, токами высокой частоты, ультразвуковыми колебаниями, радиоактивным излучением, инфракрасными лучами, и т. д.
В аптечной практике для стерилизации посуды и лекарств пользуются исключительно способами, основанными на воздействии высоких температур. Ультрафиолетовое облучение находит применение главным образом для обеззараживания воздуха аптечных помещений, тары и поступающих в аптеку рецептов.
Использование высокой температуры для стерилизации основано на необратимой коагуляции протоплазмы, пирогенетическом ее разрушении и на повреждении ферментных систем микробной клетки. Температура и длительность нагревания, необходимые для достижения стерильности, могут изменяться в зависимости от вида микрофлоры и других условий.
Большинство патогенных микроорганизмов погибают при температуре около 60°, но их споры выдерживают значительно более высокую температуру. Текучий пар и кипящая вода убивают микроорганизмы значительно быстрее, но многие споры и в этих условиях сохраняются в течение нескольких часов (особенно в вязких средах). Чистый водяной пар действует сильнее, чем в смеси с воздухом.
Пар под давлением (при температуре выше 100°) убивает микроорганизмы быстрее. Сухой горячий воздух убивает бактерии и их споры при более высокой температуре по сравнению с водяным паром. Выбор метода зависит от свойств стерилизуемого объекта. Выбирая метод стерилизации, стремятся к полной ликвидации живой микрофлоры и спор, сохраняя в то же время в неизменности лекарственное вещество.
В практике находят применение следующие физические методы стерилизации.
Прокаливание является одним из наиболее надежных видов стерилизации. Осуществляется в муфельных или тигельных печах нагреванием объекта до 500-800° или же его прокаливанием на голом огне. Применяется для стерилизации платиновых игл для шприцев, фарфоровых фильтров и других фарфоровых предметов. Стальные предметы стерилизовать этим способом не рекомендуется, так как они ржавеют и теряют закалку.
Стерилизация сухим жаром. Стерилизуемый объект нагревают в сушильном шкафу при температуре 180° в течение 20-40 мин или при 200° в течение 10-20 мин. Сухим жаром стерилизуют стеклянную и фарфоровую посуду, жиры, вазелин, глицерин, термоустойчивые порошки (каолин, стрептоцид, тальк, кальция сульфат, цинка окись и др.).
В сушильных шкафах нельзя стерилизовать водные растворы в склянках, так как вода при высоких температурах превращается в пар и склянка может быть разорвана.
Стерилизация влажным жаром. При использовании этого способа стерилизации комбинируются воздействие высокой температуры и влажности. Если сухой жар вызывает главным образом пирогенетическое разрушение микроорганизмов, то влажный жар — коагуляцию белка, требующую участия воды.
На практике стерилизация влажным жаром проводится при температуре 50-150° и осуществляется следующими путями.
Кипячение. Этим способом стерилизуют резиновые предметы, хирургический инструментарий, стеклянную посуду. Применять кипячение для стерилизации инъекционных растворов не рекомендуется, так как по эффективности оно значительно уступает стерилизации паром.
Стерилизация текучим паром. Текучим называется насыщенный водяной пар (без примеси воздуха), имеющий давление 760 мм рт. ст. и температуру 100°. Стерилизацию текучим паром осуществляют в паровом стерилизаторе или автоклаве при 100° в течение 15-60 мин в зависимости от объема раствора. Это один из распространенных методов стерилизации инъекционных растворов в аптеках.
Стерилизация паром под давлением (автоклавирование). Осуществляется в различной конструкции автоклавах. Автоклав представляет собой герметически закрывающийся сосуд, состоящий из толстостенной стерилизационной камеры и кожуха. На автоклаве имеется предохранительный клапан, обеспечивающий выход пара при избыточном давлении, и манометр. При каждом автоклаве должны быть инструкция по его эксплуатации и уходу, а также паспорт котлонадзора.
Стерилизуемый объект помещают внутрь паровой камеры. Водяную камеру подвергают нагреванию. Вначале автоклав нагревают при открытом кране до тех пор, пока пар не пойдет сильной сплошной струей и не вытеснит находящийся в автоклаве воздух, который значительно снижает теплопроводность водяного пара (при содержании в водяном паре 5%- воздуха она уменьшается на 50%).
Во время нагревания автоклава после закрывания крана необходимо следить за давлением, параллельно с возрастанием которого увеличивается температура пара.
Автоклавирование является наиболее надежным способом стерилизации. Обычно стерилизация в автоклаве производится при 119-121° в течение 5-30 мин в зависимости от объема раствора. Этим гарантируется достаточно полная стерилизация независимо от вида микроорганизма. Таким образом, стерилизуют посуду, бумажные и стеклянные фильтры, инструменты, водные растворы устойчивых к воздействию высокой температуры лекарственных веществ, перевязочный материал.
Таким образом, стерилизуют посуду, бумажные и стеклянные фильтры, инструменты, водные растворы устойчивых к воздействию высокой температуры лекарственных веществ, перевязочный материал.
Дробная стерилизация. При дробной стерилизации объект (обычно водный раствор) нагревают текучим паром при 100° в течение 30 мин, затем раствор выдерживают при комнатной температуре в течение 24 ч, после чего снова стерилизуют в тех же условиях (30 мин при 100°). Описанный цикл повторяют 3-5 раз. При первом нагревании погибают вегетативные формы микроорганизмов, при последующих — вновь появившиеся вегетативные формы. Вследствие длительности этот способ в аптеках применяется редко.
Пастеризация — однократное нагревание объекта при температуре 60° в течение 1 ч или при температуре 70-80° в течение 30 мин. Позволяет уничтожить вегетативные формы микробов (кроме термофильных), но не споры.
Тиндализация (дробная пастеризация). При тиндализации объект нагревают при температуре 60-65° по 1 ч ежедневно в течение 5 дней или при 70-80° в течение 3 дней. Это надежный и бережный способ стерилизации термолабильных лекарственных веществ. Однако вследствие длительности он мало пригоден для аптек и в последних почти не используется.
Дезинфекция – это уничтожение в окружающей человека среде вегетативных форм патогенных и условно-патогенных микроорганизмов.
Уничтожить микроорганизмы можно путём воздействия, как физических факторов, так и химических средств, причём в зависимости от продолжительности воздействия (экспозиции) и интенсивности (концентрации) дезинфицирующих средств.
Виды дезинфекции:
1. Профилактическая дезинфекция проводится с целью предупреждения ВБИ.
2. Очаговая дезинфекция проводится в очаге инфекции.
Очаговая дезинфекция делится:
На очаговую текущую дезинфекцию, осуществляемую в очаге инфекции, у постели инфекционного больного, проводится многократно;
Очаговую заключительную дезинфекцию, проводимую однократно но после изоляции, госпитализации в инфекционное отделение, выздоровления или смерти больного с целью полного освобождения инфекционного очага от возбудителей заболевания в первые 6-12 часов. В ЛПУ выполнение дезинфекционных мероприятий возлагается в основном на средний медицинский персонал, который должен руководствоваться инструктивно-методическими документами:
В ЛПУ выполнение дезинфекционных мероприятий возлагается в основном на средний медицинский персонал, который должен руководствоваться инструктивно-методическими документами:
Приказами МЗ РБ в проведении дезинфекционных мероприятий в ЛПУ определённого профиля;
| Этапы контроля | Цель | Используемые методы контроля | Кто проводит |
| Контроль работы оборудования | Оценить качество работы оборудования | Физический | |
| Контро-ль качества стерилизации всей загрузки | Оценить качество стерилизации всего объема стерилизуемых материа-лов, используется тестовая упаковка | Химический, биологический | Персонал, обслуживающий стерилизационное оборудование |
| Контро-ль качества стерилизации и упаковки с материалами | Оценить достижение параметров стерилизации внутри каждой упаковки в момент ее вскрытия непосредственно перед применением | Химический, биологический | Персонал отделений при использовании стерильных материалов |
| Протоколирование полученных результатов | Письмен-но подтвердить качество стерилизационного процесса | Физиче-ский | Вышеуказанные персонала |
- тестовая упаковка должна соответствовать стерилизуемым по плотности, размерам и качеству содержимого;
- место размещения тестовой упаковки должно быть наиболее трудно доступным для стерилизующих факторов.
 Принцип размещения тестовой упаковки представлен в табл. 5;
Принцип размещения тестовой упаковки представлен в табл. 5; - маркировка даты стерилизации проводится перед началом стерилизации;
после окончания цикла стерилизации тестовая упаковка вскрывается
Оператор составляет протокол проведения стерилизации данной партии материала в специальном журнале учета параметров стерилизации (рис. 3).
Таблица 5
Размещение тестовой упаковки в зависимости от метода стерилизации
Если стерилизатор содержит принтерное устройство, протоколирующее параметры стерилизационного цикла, то полученные диаграммы после окончания каждого цикла вклеиваются в журнал или помещаются в конверт.
По результатам расшифровки индикаторов, размещаемых внутри тестовой упаковки, оператор делает заключение о качестве обработки всей партии стерилизуемых объектов и возможности (невозможности) дальнейшего использования материалов.
Качество обработки каждой конкретной упаковки с. материалами проверяется в отделениях, применяющих стерильные материалы данной партии. Правильность протоколирования результатов контролируется ответственным персоналом (старшая медсестра ЦСО, старшая медсестра отделения).
Упаковка материалов. Применяемые упаковочные материалы для любого метода стерилизации должны обладать следующими характеристиками:
- не влиять на качество стерилизуемых объектов;
- быть проницаемыми для стерилизующих агентов; обеспечивать герметичность вплоть до вскрытия упаковки;
- легко вскрываться без нарушения асептики содержимого.
Различают следующие виды упаковочного материала, которые могут применяться отдельно или в сочетании друг с другом: бумага, металл, стекло, ткань, пластмасса.
Упаковочные материалы делятся на две категории: одноразового использования (бумага, бумажно-пластиковые материалы) и многоразового использования (контейнеры).
Используются физические
и химические методы стерилизации
.
К физическим методам стерилизации
относятся стерилизация паром под давлением (автоклавирование), стерилизация горячим воздухом (сухожаровый шкаф) и лучевая стерилизация.
К химическим методам стерилизации
относятся газовая стерилизация и стерилизация растворами химических препаратов.
Стерилизацией паром под давлением
(автоклавированием) обрабатываются хирургические инструменты, перевязочный материал, операционное белье и одежда, резиновые медицинские
изделия. Все стерилизуется в стерилизационных биксах. При этом боковые отверстия в них открывают перед стерилизацией, а крышку плотно закрывают. Существует .
Для контроля стерильности
в бикс кладут 3 запаянных индикатора стерильности или бензойную кислоту с фуксином во флаконе. После загрузки биксов автоклав закрывают герметичной крышкой. Стерилизация паром под давлением — сложная процедура, при которой существует опасность взрыва аппарата. Поэтому в стерилизационной должен работать специально обученный
персонал.
Существует три основных режима стерилизации
:
1. При давлении 1 атм., температура 120 °С — 1 час.
2. При давлении 1,5 атм., температура до 127°С — 45 минут.
3. При давлении 2 атм., температура до 134 °С — 30 минут.
По окончании стерилизации биксы некоторое время находятся в горячем автоклаве с приоткрытой дверцей. При извлечении биксов из автоклава боковые отверстия в биксе закрывают
и отмечают дату стерилизации на кусочке клеенки, прикрепленном к биксу. Закрытый бикс без фильтров сохраняет стерильность находящихся в нем предметов в течение 72 часов (3 суток), а бикс с фильтрами — 20 суток. Открытая стерилизационная коробка сохраняет стерильность до 6 часов.
Стерилизация горячим воздухом
осуществляется в специальных сухожаровых шкафах. Стерилизуют металлический инструментарий, многоразовые шприцы, стеклянную посуду. Все это укладывают на металлические сетки шкафа. Стерилизация проводится при закрытой дверце шкафа в течение 1 часа при температуре 180 °С. В виде контроля в сухожаровый шкаф на сетку во флаконах кладут сахарозу, тиомочевину или промышленный запаянный индикатор. Сухожаровые шкафы обычно находятся в стерилизационных комнатах отделений.
Сухожаровые шкафы обычно находятся в стерилизационных комнатах отделений.
При лучевой стерилизации
антимикробная обработка осуществляется с помощью ионизирующего излучения (у-лучи), ультрафиолетовых лучей и ультразвука. При работе с ионизирующим излучением требуется соблюдение особо строгих мер безопасности. Поэтому лучевая стерилизация является заводским методом стерилизации. Стерильные медицинские материалы, инструменты, перчатки, шприцы и др. выпускаются в герметических упаковках и сохраняются до 5 лет.
Газовая стерилизация
осуществляется в специальных герметических камерах. Стерилизация проводится с помощью паров формалина (на дно камеры кладут таблетку формальдегида) или окиси этилена. Такой стерилизации подвергаются оптические части приборов, шовный материал, пластмасса, резиновые предметы. В зависимости от компонентов газовой смеси и температуры в камере стерилизация длится от 6 до 48 часов. Метод может быть использован в больничных условиях.
Стерилизация растворами химических
— это холодный способ стерилизации. Стерилизации могут подвергаться резиновые медицинские предметы, эндоскопические части аппаратов, металлические инструменты. Для этого применяются: 6% раствор перекиси водорода, 3 часа при температуре 50 °С и 6 часов при температуре 18-20 °С, 1% раствор дезоксона 45 мин. при температуре 18°С; 8% раствор первомура или 2% раствор хлоргексидина, 5 минут при температуре 20 °С; 70° спирт этиловый. Для стерилизации используется стеклянная, пластмассовая или эмалированная посуда с плотно закрывающейся крышкой. Все растворы используют однократно. После стерилизации все предметы промываются двукратно стерильным изотоническим раствором с помощью стерильного корнцанга и хранятся на стерильном столе. Контроль этого метода — бактериологический.
Проведение дезинфекции и стерилизации изделий медицинского назначения. (ИМН)
7,1. Подготовка изделий медицинского назначения (далее- изделия) к применению включает три этапа: дезинфекцию, предстерилизационную очистку, стерилизацию.
7,2. Дезинфекцию изделий проводят с целью уничтожения вегетативных форм патогенных и условно – патогенных микроорганизмов – вирусов ( в том числе возбудителей парентеральных вирусных гепатитов, ВИЧ – инфекции), бактерий,( включая микобактерии туберкулёза), грибов (включая грибы рода Кандида) на ИМН, а также в их каналах и полостях.
7,3.Предстерилизационную очистку ИМН проводят с целью удаления с них белковых, жировых и механических загрязнений, а также остатков лекарственных препаратов.
7,4. Стерилизацию проводят с целью уничтожения всех патогенных и непатогенных микроорганизмов, включая их споровые формы.
7,5. Дезинфекцию, предстерилизационную очистку и стерилизацию изделий осуществляют в соответствии с требованиями действующих руководящих и нормативно – методических документов (ОСТ 42-21-2-85 «Стерилизация и дезинфекция ИМН. Методы, средства, режимы»; Методические указания по дезинфекции, предстерилизационной очистке и стерилизации ИМН» от 30,12,98. №МУ – 287-113 и др).
7,6. При использовании средств, обладающих одновременно дезинфецирующими и моющими свойствами, дезинфекция изделий может быть совмещена с их предстерилизационной очисткой в одном процессе.
7,7. Дезинфекция ИМН.
7,7,1.Дезинфекция ИМН направлена на профилактику внутрибольничного инфицирования пациентов и медицинских работников.
7,7,2. Дезинфекции подлежат все ИМН после контакта с пациентом.
.7,7,3. Дезинфекцию ИМН осуществляют непосредственно в отделениях — физическим (кипячение, паровой, воздушный) и химическим ( растворами химических средств) методами.
7,7,4. Дезинфекция с использованием химических средств производится способом погружения изделия в раствор дезинфектанта в специальных ёмкостях из стекла, пластмасс, или покрытых эмалью без повреждений. Ёмкости должны быть снабжены крышками, потопителями, иметь чёткие надписи с указанием названия средства, его концентрации, назначения, даты приготовления.
7,7,5. После дезинфекции ИМН тщательно промываются в проточной воде, после чего высушиваются, упаковываются и направляются для стерилизации.
7,8. Предстерилизационная очистка ИМН.
7,8,1.Предстеридизационной очистке подвергаются ИМН многократного применения, подлежащие стерилизации. Предстерилизационную очистку проводят механизированным или ручным способом.
7,8,2. При наличии у средства наряду с моющими также и антимикробных свойств, предстерилизационная очистка может быть совмещена с их дезинфекцией.
7,8,3. Контроль качества предстерилизационной очистки в отделениях проводится в порядке самоконтроля ежедневно. Контролю подвергают 1% одновременно обработанных изделий каждого наименования, но не менее трёх единиц.
7,8,4. Качество очистки ИМН проверяется путём постановки Азопирамовой пробы на наличие остаточных количеств крови, а также Фенолфталеиновой пробы на наличие остаточных количеств щелочных компонентов, моющих средств. В случае положительной пробы на кровь или щелочные компоненты моющих средств всю партию изделия , из которых отбирали контроль, подвергают повторной очистке до получения отрицательных результатов.
7,8,5. Результаты контроля отражают в специальном журнале. ( Журнал учёта качества предстерилизационной обработки).
7,9. Стерилизация ИМН.
7,9,1.Стерилизации подвергаются все изделия, соприкасающиеся с раневой поверхностью, контактирующие с кровью, другими биологическими жидкостями пациента и инъекционными препаратами. А также изделия, которые в процессе лечебно – диагностического процесса соприкасались со слизистой оболочкой и могут вызвать её повреждение.
7,9,10. Стерилизацию осуществляют физическими (паровой, воздушный), химическими ( применение растворов химических средств) и газовым методами.
7,9,11. При паровом, воздушном, газовом методах изделия стерилизуют в упакованном виде, используя упаковочные материалы ( бумажные, пластиковые материалы, пергамент, бязь), используют, как правило однократно.
При паровом методе используют стерилизационные коробки (биксы) с фильтрами и без фильтра.
7,9,12. Паровым методом стерилизуют общие хирургические и специальные инструменты, хирургическое бельё, перевязочный материал, изделия из резин (перчатки, трубки, катетеры, зонды). Используется насыщенный пар под избыточным давлением. Температура 110-135 гр С.
Используется насыщенный пар под избыточным давлением. Температура 110-135 гр С.
7,9,13.Воздушным методом стерилизуют хирургические, гинекологические, стоматологические инструменты. Перед стерилизацией инструменты обязательно высушивают в сухожаровом шкафу при температуре 85 г С до исчезновения видимой влаги. При воздушном методе стерилизующим средством является сухой горячий воздух с температурой 160-180 градусов С. При этом объекты стерилизации могут быть завёрнуты в крафт – пакеты, крепированную бумагу или стерилизоваться без упаковки, в открытых лотках, но тогда сразу используются по назначению. Время стерилизации: при температуре 180гр С – 60минут, при температуре 160гр С – 150 минут.
Сроки годности стерильности не вскрытых биксов: с фильтрами до 30 суток. Простые биксы до 3х суток. Крафт-пакеты до 20 дней. В бумаге или тканевой бязе — 3суток.
7,9,14. Химический метод стерилизации, применяют как правило только для термолабильных материалов. Используют специальные ёмкости с крышкой. Во избежание разбавления рабочих растворов, особенно используемых многократно, погружаемые в них изделия не должны содержать видимой влаги. После стерилизации все манипуляции проводят, строго соблюдая все правила асептики. Изделия промывают все стерильной жидкостью (питьевая вода, 0,9% раствор Натрия Хлорида), налитой в стерильные ёмкости. Промытые стерильные изделия используют сразу по назначению или помещают на хранение в стерильный бикс, выложенную стерильной простынёй, на срок не более 3 суток.
7,9,15. Контроль качества стерилизации в паровых и воздушных стерилизаторах контролируется с помощью индикаторов СТЕРИКОНТ, Количество индикаторов закладываемых в стерилизатор, зависит от объёма камеры. До 80 литров 5шт. Свыше 80 литров-однеокамерные 15. Пользоваться согласно инструкции. От листа с индикаторами отрывают необходимое количество индикаторов и нумеруют их. ( ПОКАЗАТЬ НА РИСУНКЕ) Индикаторв приклеивают цветовыми метками с внешней стороны упаковок. На бикс — к бирке на бумажную или плёночную упаковку. Индикаторы СТЕРИКОНТ не допускается размещать внутри стерилизуемых изделий. Для этого используют только индикаторы СТЕРИТЕСТ – В.
На бикс — к бирке на бумажную или плёночную упаковку. Индикаторы СТЕРИКОНТ не допускается размещать внутри стерилизуемых изделий. Для этого используют только индикаторы СТЕРИТЕСТ – В.
Бактериологический контроль за качеством стерилизации с помощью биотестов, проводится в плановом порядке не реже 2х раз в год.
Результаты контроля работы паровых и воздушных стерилизаторов заносятся в журнал «Учёта результатов контроля работы паровых и воздушных стерилизаторов».
7,10. Порядок проведения стерилизации в воздушном стерилизаторе.
7,10,1. Медицинские инструменты стерилизуются в открытом виде на расстоянии 2-3 см друг от друга в один ряд. В зависимости от объёма камеры, раскладываются индикаторные наклейки СТЕРИКОНТ в 5-15 точках. ( по инструкции СТЕРИКОНТа).
7,10,2. Делается запись в журнале стерилизации: вид инструментария и его количество; Время, когда температура внутри шкафа достигла заданной – 180гр или 160 гр ( начало), и время отключения ( конец).
7,10,3. После проведённого цикла стерилизации перед открытием сухожарового шкафа его ручка протирается дезинфицирующим раствором.
7,10,4. Открывается шкаф, когда температура в камере снизится до 50гр.
7,10,5. Термоиндикаторы сравниваются с эталонами: после чего они приклеиваются в графе «химический контроль», журнала учёта качества работы паровых и воздушных стерилизаторов.
Промышленные способы стерилизации и контроля чистоты оборудования и коммуникаций
Введение
Стерилизация — полное уничтожение всех видов микроорганизмов.
Микроорганизмы отличаются друг от друга устойчивостью к различным воздействиям (высушиванию, свету, облучению, вакууму, давлению, холоду, нагреванию, химическим веществам). Как правило все микроорганизмы более чувствительны к влажному теплу, чем к сухому. Очень важным фактором, оказывающим влияние на термостойкость микроорганизмов, является среда, в которой они находятся. Например, терморезистентность особенно высока в масляных продуктах, молодые споры менее устойчивы, чем старые.
Например, терморезистентность особенно высока в масляных продуктах, молодые споры менее устойчивы, чем старые.
Таким образом, методы стерилизации должны быть дифференцированными и они не должны изменять свойств обрабатываемого материала. Во всех случаях надо стремиться, чтобы время стерилизации по возможности было непродолжительным.
Условно методы стерилизации можно разделить на:
— термические (паровые и сухожаровые),
— на физические (с помощью лучистой энергии) ,
— химические ( с использованием химических агентов в виде газов или растворов),
— мембранные (фильтрованием).
1.Термические методы стерилизации
Преимущества термических методов стерилизации:
— надёжность,
— отсутствие необходимости удаления стериизующих агентов из стерилизуемых объектов,
— технологическая простота,
— возможность стерилизации объектов в упаковке, что позволяет сохранять стерильность определённый период времени.
К этому виду обработки относятся прокаливание на огне, фломбирование, кипячение, стерилизация текучим паром, паром под давлением и при разряжении (низкотемпературный пар), пастеризация, тиндализация.
Кипячение — процесс доведения воды до кипения.
При кипячении погибает большинство вегетативных форм микроорганизмов, поэтому его широко используют при стерилизации предметов и материалов, не портящихся при такой обработке. Добавление бактерицидных веществ увеличивает скорость и надежность стерилизации кипячением. Недостатком метода является то, что при этом споры погибают не всегда.
Пастеризация это однократное нагревание жидкостей при температуре около 60 град. C в течение 60 мин. или 70-80 град в теч. 30 мин. Пастеризация проводится с целью уничтожения вегетативных форм микроорганизмов, споровые формы при этом методе теплового воздействия сохраняют жизнеспособность. Поэтому пастеризованные объекты хранят непродолжительный период времени при пониженных температурах. Пастеризация применима для термочувствительных биологических жидкостей. Считается , что все биологически значимые соединения при этом методе воздействия сохраняются в неизменном виде.
Считается , что все биологически значимые соединения при этом методе воздействия сохраняются в неизменном виде.
Технология предложена в 19 веке Луи Пастером
Тиндализация- способ стерилизации, предложенный Дж. Тиндалем
Её чаще всего проводят при 3-6 кратном нагревании (дробная стерилизация) в теченние 20-60 мин при 100 град. С с интервалом в 24 ч. В промежутках между нагреванием стерилизуемый материал выдерживают при 24-37 град С для возможности прорастания спор с целью их уничтожения при очередной стерилизации.
С помощью тиндализации стерилизуют биологические жидкости, содержащие кровь, сыворотку. Метод достигает цели, когда споры находятся в среде пригодной для их прорастания, и среда не содержит ингибиторов роста, а также при условии, если инкубация между циклами стерилизации проводится при благоприятных для прорастания спор температуре и других условиях.
Метод не пригоден в случаях, когда оптимальная температура роста микроорганизмов выше температуры прогревания или инкубации (например у некоторых термофилов), а также для культур у которых споры в промежутках стерилизации не прорастут, если стерилизуемая среда непригодна для прорастания спор или содержит ингибиторы, если в ней имеются споры облигатных анаэробов, которые в аэробных условиях не прорастут и следовательно не погибнут. Кроме того, при повторном и продолжительном нагревании сред, содержащих углеводы и фосфаты, могут видоизмениться полисахариды и сахара и образоваться нежелательные продукты. Агар и желатина, например, могут потерять гелеобразующие свойства особенно, если среда сильнокислая или сильнощелочная.
Общим недостатком методов дробной стерилизации является большие затраты времени, а достоинством то, что не требуется специальная аппаратура и возможность проводить процесс стерилизации в щадящих условиях.
Паровая стерилизация осуществляется с помощью насыщенного водяного пара без и под давлением. Сочетанное воздействие на микроорганизмы влажностью и высокой температурой является основой парового метода стерилизации.
Стерилизующий эффект пара связан с прогреванием объекта в процессе конденсации пара на поверхности и внутри объекта. Эффект конденсации оптимален у насыщенного пара, содержанием 3% воды. Перегретый пар, содержващий менее 2 % воды может сжечь объект, а влажный пар с содержание влаги более 3% сильно увлажняет стерилизуемые объекты.
Стерилизация текучим паром
Текучим называется насыщенный водяной пар (без примеси воздуха), имеющий давление 760 мм рт. ст. и температуру 100 °С. Стерилизацию текучим паром осуществляют в паровом стерилизаторе при 100 °С в течение 30-60 мин в зависимости от объема раствора. Это один из распространенных методов стерилизации инъекционных растворов в аптеках. Если пар поступает централизовано из котельной, то перед вводом его в камеру сосуда должны иметься специальные устройства (ловушки пара), удаляющие конденсат, образующийся в коммуникациях при движении от источника пара до автоклава.
Стерилизуемый материал, как и в других случаях тепловой обработки, располагают так, чтобы между объектами оставалось пространство для свободной циркуляции пара. Длительность стерилизации после достижения в аппарате 100 град С и выхода из камеры полной и непрерывной струи пара может быть различной — от нескольких минут до 1-1,5ч в зависимости от вида, массы, объёма, плотности упаковки и свойств материала, его термостабильности, загруженности камеры.
Текучим паром стерилизуют питательные среды, растворы сахаров, аммиачные соли, мочевину, молоко, картофель, некоторые соли и реактивы, а также лабораторную продукцию и материалы, разрушающиеся при нагревании под давлением.
Стерилизацию обычно проводят 3 сут. подряд, по 30 мин ежедневно (дробная стерилизация). В промежутках между стерилизациями материал, как и при других методах дробной стерилизации, выдерживают при температуре 24- 37 град С. Этот метод обеспечивает гибель только вегетативных форм микроорганизмов, споры же в промежутках между циклами стерилизации прорастают и погибают только при повторной стерилизации.
Стерилизация паром под давлением
Такой способ наиболее надежен при уничтожении микроорганизмов и спор. Его проводят в автоклавах разнообразных по размерам, рабочему давлению, конструкциям, степени автоматизации и другим показателям. Повышение давления повышает точку кипения воды и соответственно температуру пара.
Для стерилизации в автоклаве используют насыщенный пар, который соприкасается с холодными предметами и при этом происходит быстрая конденсация и нагревание. Из стерилизуемого объекта вода не испаряется. Благодаря этому удаётся избежать обезвоживания таких материалов как резина, ткани, бумага, разрушающиеся в процессе нагревания при той же температуре сухим жаром.
Считается что при 121градС живые клетки погибают в течении 10 мин, большинство спор — после 5 мин экспозиции. Споры термофильных видов при таком воздействие погибают лишь через 23 мин, а споры, содержащиеся в земле — через 25 мин.
При изучение влияния различных режимов тепловой стерилизации в автоклавах на питательные среды, используемые для биосинтеза пенициллина и эритромицина, и изменения биохимических свойств компонентов этих сред, установлено, что оптимальных для достижения высоких показателей активности и надежности стерильности является режим: Т=120град С±1, время= 25мин.
Описаны бактерии выдерживающие температуру 350 град С и давление 265 атм.
Стерилизация при пониженном давлении (низкотемпературный пар)
Пар нагретый до 80 град С рекомендуется для дезинфекции пластмассовых, а также сложных и чувствительных к нагреванию материалов. Метод основан на том, что воздух из автоклава тщательно удаляется при помощи вакуума после чего камера заполняются паром и формалином. При пониженном давлении легколетучие соединения переходят в пар. Количество используемого формалина и способ его введения зависит от типа стерилизатора. На этот метод нет тестов контроля с использованием химических индикаторов.
Суховоздушная стерилизация
Этот метод рекомендуется для материалов, портящихся от воздействия пара (коррозия и др. ) и непроницаемых для пара: стеклянная посуда, пипетки завернутые в бумагу, пергамент или подпергамент, вата, пробирки, колбы, флаконы, металлические предметы и другие термоустойчивые материалы.
) и непроницаемых для пара: стеклянная посуда, пипетки завернутые в бумагу, пергамент или подпергамент, вата, пробирки, колбы, флаконы, металлические предметы и другие термоустойчивые материалы.
Растворы, содержащие воду и органические вещества, при таком методе стерилизации могут стать непригодными. Следует также избегать стерилизации этим методом масел, если в них содержится много воды, а также органических веществ, животных и растительных тканей и волокон. В первом случае может произойти закипание, выброс и воззагорание, а во втором — изменение и порча среды.
При суховоздушной, и при автоклавировании действующим фактором является теплота, однако стерилизация происходит в воздушной среде, что существенно изменяет характер прогрева и его действие на микроорганизмы. При этом методе стерилизации происходит перенос теплоты путем теплопроводности, конвекции и лучистой энергии. Трудности расчета и регулирования суховоздушной стерилизации связаны со сложным распределением температуры по отдельным точкам по зонам камеры.
Суховоздушная стерилизация наиболее эффективна при свободном размещении стерилизуемого материала на решетчатых полках и при принудительной циркуляции воздуха в печи. Следует иметь в виду, что даже при правильном размещении стерилизуемого материала в камере трудно достичь его равномерного прогревания.
Недостаток суховоздушной стерилизации — медленное прогревание. Скорость прогревания зависит от ряда факторов (плохая передача тепла от воздуха к стерилизуемому предмету, масса предмета и его поверхность, вид и теплопроводимость стерилизуемого материала, конструкция стерилизатора, количество полок). Имеют значение также способ размещения стерилизуемого материала, объем и упаковка стерилизуемых предметов, характеристика циркуляции воздуха, т.к. при недостаточной циркуляции воздуха могут возникать большие перепады температуры в различных участках камеры и воздушных карманах с разницей до 30 град С.
Другой недостаток суховоздушной стерилизации слабая и неравномерная проницаемость жара и вредное действие его на некоторые материалы (ткани, кожа, бумаги).
Однако в целом суховоздушная стерилизация — достаточно надежный метод для обработки материалов, в которые пар трудно проникает (например воска масла). Резистентные микроорганизмы, находящиеся в глубине этих веществ не погибают при паровой стерилизации, несмотря на то, что температура при автоклавировании может достигнуть 121 град С.
Гибель микроорганизмов при стерилизации сухим воздухом, по мнению большинства исследователей, связана с инактивацией клеточных белков и ферментов. Бактерицидное действие сухого горячего воздуха значительно слабее чем влажного пара при одной и тойже температуре. Так вегетативные формы микроорганизмов при температуре сухого воздуха 100 град С погибают через 1,5 ч, споры при 140 град С через 2 -3ч, а отдельные виды спор — при 170- 200 град С через 2ч. При воздействии пара они погибали значительно быстрее.
Резистентность микроорганизмов к суховоздушной стерилизации зависит от ряда факторов: вида культуры, характера стерилизуемого материала, массы упаковки, содержания влаги в стерилизуемом материале. Так при содержании влаги 50% яичный альбумин коагулирует при 56 град, при полном отсутствии влаги — при 160-170 град С. Чаще всего суховоздушную стерилизацию проводят при температуре 160-170 град С в течение 1-4ч
Зарегистрируйся, чтобы продолжить изучение работы
. Описаны культуры, споры которых погибают через 139 ч суховоздушной стерилизации.
Продолжительность суховоздушной стерилизации зависит и от физико- химических свойств материала, теплоемкости и теплопроводимости, массы, формы и плотности упаковки и т.д. Существует зависимость температуры и длительности стерилизации: при 170 град С-1ч; при 160 градС-2ч; при 150 град С-2,5ч; при 140 град С-3ч, при 120 град С-6ч. Однако по мнению некоторых исследователей температуру лучше не поднимать выше 160 град С. В противном случае из ваты и некоторых сортов бумаги выделяются ингибирующие рост микроорганизмов соединения. Эти вещества могут выделяться и при более мягком режиме стерилизации, но в значительно меньших количествах.
Однако по мнению некоторых исследователей температуру лучше не поднимать выше 160 град С. В противном случае из ваты и некоторых сортов бумаги выделяются ингибирующие рост микроорганизмов соединения. Эти вещества могут выделяться и при более мягком режиме стерилизации, но в значительно меньших количествах.
При охлаждение камеры они конденсируются, поэтому стенки камеры периодически следует очищать. При стерилизации в суховоздушных шкафах открывать камеру можно только после ее охлаждения иначе при резкой перемене температуры стеклянная посуда может лопнуть, а в результате притока кислорода некоторые соединения способны к возгоранию.
2. Стерилизация фильтрованием
Стерилизацию фильтрованием проводят главным образом для термолабильных растворов — сывороток, токсинов, анатоксинов, некоторых питательных сред, лекарственных препаратов, т.е. когда при нагревании или других методах стерилизации свойства обрабатываемого продукта могут значительно измениться. Этот метод используют и в случаях, когда возможна тепловая стерилизация, но кроме микроорганизмов нужно удалить и субмелкие частицы. Фильтрование можно применить при очистке от микроорганизмов и частиц пыли различных растворов, аэрозолей, эмульсий и воздуха. В отличие от других методов, когда умерщвленные микроорганизмы остаются в стерилизуемом продукте и могут быть причиной различных не желательных явлений (в частности пирогенности), при фильтровании клетки м.о. удаляются из стерилизуемого продукта.
Эффективность фильтрации зависит главным образом от размера пор фильтров, структуры и поверхности фильтра, скорости фильтрования, размера частиц фильтруемой жидкости, ее химических свойств (она должна быть инертна по отношению к материалу фильтра), рН (щелочные жидкости с рН 7,2- 8,0 фильтруются легче), давления.
Материалы, понижающие поверхностное натяжение (сыворотки, желчь, кислоты, мыла и лаурилсульфат натрия) способствуют проникновению микроорганизмов через фильтр содержащий кремний. Скорость фильтрования повышается с повышением температуры. Необходимо иметь в виду, что некоторые виды м.о. могут быть фильтрующимися или находится в L-форме, что нарушит эффективность стерилизации.
Необходимо иметь в виду, что некоторые виды м.о. могут быть фильтрующимися или находится в L-форме, что нарушит эффективность стерилизации.
В некоторых случаях перед фильтрованием жидкость центрифугируют или предварительно фильтруют для отделения грубых частиц, снижающих скорость и эффективность стерилизации фильтрованием.
2.1. Фильтрующие материалы и устройства
Для стерилизации используют фильтры изготовленные из материалов с различными физическими и химическими свойствами, пропускной и адсорбционной способностями. Так фильтры из нитрата целлюлозы неустойчивы к кетонам, сложным эфирам, низкомолекулярным спиртам. Они пригодны для работы в пределах рН 1-10. Фильты из поликриамида пригодны для работы при рН 5-12 и устойчивы ко многим органическим растворителям. Устойчивы почти ко всем органическим растворителям и концентрированным кислотам и щелочные фильтры из политетрафторэтилена (фторопласта).
Для стерилизации фильтрованием применяют такие фильтры-свечи различных конструкций (Шамберлана, Беркефельда), фильтры Зейтца.
2.2. Стеклянные фильтры
Фильтрующим элементом являются пластины из мелкопористого стекла. Наибольшая пористость 250-100мкм (фильтр ОО) наименьшая 1-1,5мкм. Для стерилизации используют фильтры с диаметром пор менее 2 мкм.
Стеклянные фильтры имеют отрицательный заряд, слабее адсорбируют растворенные вещества при фильтрации, не загрезняют фильтрат. Их можно стерилизовать теплом и обрабатывать кислотами. Скорость фильтрования через стеклянные фильтры относительно низкая.
После употребления стеклянные фильтры обеззараживают, затем промывают дистиллированой водой, пропуская ее в обратном фильтрованию направлении. После этого фильтр заливают на 10-12 ч концентрированной серной кислотой с небольшим количеством нитрита натрия и хлорида кальция, промывают многократно дистиллированной водой и кипятят. Нельзя допускать засорения пор стеклянных фильтров.
Широко распространены фильтры Нутча и воронки Бюхнера. в которые впаяны пластины из мелкопористого стекла с порами 30-120мкм.
2.3. Мембранные фильтры и ультрафильтры
Обычно это диски толщиной 0,1мм и диаметром до 50 мм, изготовленные из ацетата целлюлозы и нитроцеллюлозы, ацетилцеллюлозы, полиамида, политетрафторэтилена.
Мембранные фильтры пронизаны множеством лабиринтных отверстий, соединяющих верхнюю часть диска с нижней. Поверхность их с одной стороны гладкая с другой шероховатая. Мембранные фильтры и ультрафильтры различаются в основном величиной и многослойностью структуры пор (у ультрафильтров диаметр пор 100мкм и меньше). Мембранные фильтры чаще используют для отделения или удаления бактерий, а ультрафильтры — для выделения вирусов и высокомолекулярных белков, поэтому их еще называют коллоидными .
У нас в стране в микробиологии используют химически стойкии мембранные фильтры » Владипор» микрофильтрационные ацетатные МФА-АА и МФА-А и ультафильтрационные ацетатные мембраны (УАМ)(таб.1.)
Таблица 1
Характеристика фильтров «Владипор»
Марка фильтра средний диаметр пор мкм
УАМ-50 неболее 0,005
УАМ-100 0,005-0,01
УАМ-300 0,02-0,03
УАМ-500 более 0,03
МФА-МА№1 0,05-0,15
МФА-МА№3 0,251-0,35
МФА-МА№5 0,451-0,55
Эти фильтры разработанны на основе ацетата целлюлозы. Они обладают слабой сорбционной способностью не горючи не токсичны для животных пригодны для работы в диапазоне рН от 1до10,0 и в присутствии спирта.
Мембранные фильтры широко применяются в лабораториях при бактериологических исследованиях воздуха, воды и различных жидкостей, а также антибиотиков и других веществ на присутствие в них бактерий. Для этих целей можно использовать отечественные фильтры марок МФА-МА и МФА-А с размерами пор 0,45-0,2мкм или фильтры «Миллипор» марки НА.
За рубежом мембранные фильтры производят фирмы «Millipore Intertech» (США) «Sartorius Werke GmbH»(ФРГ) «Full Europe Ltd» (Великобритания) «Synpor» (Чехо-Словакия). Сравнительно недавно фирма «Micron Separation Inc» собщила о производстве новых мембранных фильтров из ацеттата целлюлозы имеющих размер пор от 0,2 до 10мкм. Эти фильтры связывают незначительное количества белка и предназначены для использования в диагностических иследованиях при проведении которых нужно исключить потери белка.
Эти фильтры связывают незначительное количества белка и предназначены для использования в диагностических иследованиях при проведении которых нужно исключить потери белка.
Мембранные фильтры непригодные для длительного фильтрования, поскольку их поры закупориваются.
Некоторые микроорганизмы (стрептомицеты) могут прорастать через поры некоторых мембранных фильтров.
Достоинства мембранных фильтров — сравнительно большая скорость фильтрования, малая адсорбционная способность. Кроме того, все клетки микроорганизмов из большого количества фильтруемой жидкости (воды мочи молока разведенной крови) накапливаются на маленьком участке- диске и можно исследовать стерильность фильтратов по количеству проросших на диске колоний.
Стерилизовать мембранные фильтры можно при автоклавировании, а также при помощи оксида этилена в смеси с диоксидом углерода (время экспозиции 6ч) или 2%-го раствора формальдегида (экспозиция 24ч). После этого фильтры необходимо проветрить в стерильных условиях.
При фильтровании растворов на мембранных фильтрах могут адсорбироваться токсичные катионы. В результате высокой концентрации этих катионов на поверхности фильтров уменьшается количество колоний вырастающих на них. Поэтому их, по завершении процесса фильтрации, в случае изучения общего количества микробных клеток, содержащихся в исследуемой жидкости, промывают стерильной водой.
Мембранные фильтры применяют для удаления пирогенных веществ из лекарственных препаратов, используемых для парентерального введения.
3. Стерилизация облучением
Этод метод относится к физическим методам. Бактерицидный и стерилизующий эфекты достигаются различными видами облучения инфракрасными (ИК), ультрафиолетовым (УФ), рентгеновскими лучами, альфа, бета и гамма лучами радиоактивных элементов, катодными лучами генерируемыми на ускорителях частиц.
3.1. Инфракрасные и ультрафиолетовые лучи
Бактерицидное действие ИК-лучей на микроорганизмы зависит от длины волны, интенсивности и длительности облучения объекта. При длине волны 0,7- 1,4 мкм они глубоко проникают в ткани человека, а более длинные лучи оказывают лишь тепловой эфект. ИК лучи используют для стерилизации хирургических инструментов и некоторых материалов.
При длине волны 0,7- 1,4 мкм они глубоко проникают в ткани человека, а более длинные лучи оказывают лишь тепловой эфект. ИК лучи используют для стерилизации хирургических инструментов и некоторых материалов.
УФ лучи можно использовать от любых источников и обрабатывать продукты питания, воздух в закрытых помещениях, поверхности лабораторного оборудования, биологические жидкости и воду в тонком слое. Мощность УФ лучей измеряется в бактак (единица бактерицидного потока частиц с длиной волны 0,254мкм, мощностью 1Вт приходящаяся на площадь 1м2 ) и выражается соответствующими единицами измерения б/м2 или мкб/м2 .
Доза УФ излучения губительная для различных видов микроорганизмов (кроме спор) составляет 5 мкб/см2 . 90% патогенных микроорганизмов погибают при интенсивности УФ облучения 1,5-5мкб/см2 .Губительное действие УФ лучей обусловлено изменением колоидной системы микробной клетки. Чувствительность микроорганизмов к этому облучению зависит от множества факторов: вида культуры и ее физиологического состояния; состава среды в которой они находятся, источника излучения, экспозиции, упаковки стерилизуемого материала и др. Более чувствительным к обработке УФ лучами грамотрицательные микроорганизмы, в лаг фазе роста, кислой среде, при наличии в облученном объекте паров бактерицидных, химических и других веществ и тд. Более устойчивы к облучению споры бактерий и плесеней, туберкулезная палочка, старые культуры и культуры в щелочных условиях при наличии в облучаемом объеме взвешенных частиц пыли и др.
3.2. Радиационная стерилизация
Кобальт-60, цезий-137, уран, торий, радий и некоторые другие элементы самопроизвольно непрерывно испускают невидимые лучи, которые подобно рентгеновским, способны проникать через плотные материалы и вызывать ионизацию с образованием активных ионов-радикалов. В магнитном поле пучек радиоактивных лучей разделяется на три части: положительно заряженные альфа- частицы, отрицательно заряженные бета- частицы и нейтральные гамма- лучи. Последние обладают способностью проникать через бумагу, дерево, стекло, метал и другие материалы и вызывать ионизацию субстрата жизнедеятельного микроорганизма с образованием активных ионов (радикалов), что нарушает обмен веществ в клетке и приводит к ее гибели.
Достоинством источников гамма излучения для стерилизации продуктов питания и медикаментов (выдерживающих и не выдерживающих тепловую обработку) является то, что они обладают высокой проникающей способностью, достаточной мощностью и обеспечивают бактерицидное и стерилизуюшее действие в течении короткого промежутка времени. При этом не возникает наведенной радиоактивности и температура объекта почти не повышается. Это позволяет использовать гамма лучи для стерилизации термолабильных лекарственных и других медицинских препаратов, различных биологически активных веществ. Кроме того точное измерение поглощенной энергии с помощью дозиметров позволяют исключить необходимость проверки на стерильность дорогостоящими микробиологическими методами.
Достоинства ионизирующего излучения и наличие мощных установок позволяют осуществлять стерилизацию различных продуктов, в том числе медицинского назначения, и материалов в товарной упаковке, создать конвейрный метод, а также механизировать и автоматизировать процесс.
Для радиационной стерилизации принято пользоваться единицей поглощенной энергии радиан (радиационная абсорбционная доза, рад) равной 100 эрг/г вещества или мегарадиан (Мрад)
iso17665 Паровая стерилизация — услуги по стерилизации и валидации
Паровая стерилизация — простой, но очень эффективный метод обеззараживания. Стерилизация достигается путем воздействия на продукты насыщенного пара при высоких температурах (от 121 ° C до 134 ° C). Продукт (-ы) помещают в устройство, называемое автоклавом, и нагревают паром под давлением для уничтожения всех микроорганизмов, включая споры. Время воздействия пара на устройство составляет от 3 до 15 минут, в зависимости от выделяемого тепла.
Процесс паровой стерилизации не подходит для многих материалов из-за высоких температур. После стерилизации продуктов требуется некоторое время на карантин / простой. Стерилизованным упаковкам необходимо дать высохнуть перед извлечением из автоклава, чтобы предотвратить загрязнение. После снятия им необходимо дать остыть до температуры окружающей среды, что может занять несколько часов.
После снятия им необходимо дать остыть до температуры окружающей среды, что может занять несколько часов.
Для эффективной стерилизации очень важно, чтобы пар покрыл все поверхности устройства.Чтобы обеспечить оптимальные условия, многие автоклавы имеют встроенные измерители, отображающие температуру и давление в зависимости от времени. Биологические индикаторные устройства и индикаторная лента, меняющая цвет, также используются для измерения производительности автоклава. Химическая лента помещается как внутри, так и снаружи стерилизованных упаковок, тогда как устройства биоиндикатора выделяют споры внутри автоклава. Споры инкубируют в течение 24 часов, по истечении которых измеряют скорость их роста. Если споры были уничтожены, это означает, что процесс стерилизации был эффективным.
ISO 17665:
ISO 17665 определяет требования к разработке, валидации и текущему контролю процесса стерилизации влажным теплом медицинских изделий. Процессы стерилизации влажным теплом, охватываемые ISO 17665-1: 2006, включают, но не ограничиваются:
- Системы отвода насыщенного пара
- Системы активного удаления насыщенного пара
- Паровоздушные смеси
- Водяной спрей
- Погружение в воду
ISO 17665 охватывает стерилизацию твердых, а также жидких медицинских изделий.В соответствии со стандартом ответственность за разработку процесса и предоставление руководящих принципов / инструкций по эксплуатации и валидации процесса возлагается на производителя. Стандарт также требует подробной документации всех условий, которые влияют на производительность процесса сейчас и в будущем. ISO 17665-1 предоставляет только очень общие рекомендации по требованиям и операциям паровой стерилизации. ISO 17665-2 пытается описать эти руководящие принципы более конкретно с помощью примеров и дополнительных объяснений.
ЧТО МЫ ПРЕДЛАГАЕМ
LSO предоставляет услуги паровой стерилизации по контракту для любого продукта, способного выдержать высокотемпературную стерилизацию. Наш стерилизатор имеет камеру большой емкости размером 19 кубических футов. Мы можем запрограммировать любые желаемые параметры цикла и продублировать существующий цикл стерилизации или разработать цикл для специальных требований.
Наш стерилизатор имеет камеру большой емкости размером 19 кубических футов. Мы можем запрограммировать любые желаемые параметры цикла и продублировать существующий цикл стерилизации или разработать цикл для специальных требований.
Валидация стерилизации выполняется в соответствии с директивами ANSI / AAMI / ISO. Наши сотрудники подготовят протокол, выполнят все необходимые циклы стерилизации, проведут все испытания и сформируют полный окончательный отчет.Клиенты просматривают и утверждают протокол до начала процесса проверки
Стерилизация жидкостей, твердых веществ, отходов. Как правильно стерилизовать?
Процесс стерилизации
Как правильно стерилизовать?
Простая, безопасная, точная, воспроизводимая и проверяемая стерилизация.
Процесс стерилизации в автоклаве может быть довольно сложным. Например, при стерилизации жидкостей или твердых веществ (инструменты, стеклянная посуда, фильтры или текстильные изделия) для последующего использования в лаборатории процесс стерилизации должен обеспечивать получение стерильного продукта, воспроизводимого в любое время.Продукты, стерилизованные для использования в лабораториях, не могут быть проверены на стерильность, так как это может привести к их повторному загрязнению и, следовательно, их нельзя больше использовать в лаборатории. Валидация процессов паровой стерилизации становится все более важной проблемой для обеспечения воспроизводимых результатов, которые можно проверить. Кроме того, при автоклавировании, в частности, при стерилизации жидкостей, как правило, следует учитывать аспекты безопасности. Стерилизация обычно проводится при температуре 121 ° C. Это соответствует давлению пара прибл.2 бар. Такие высокие температуры и соответствующее давление могут представлять значительный риск для оператора, если процесс автоклавирования имеет конструктивные недостатки или не выполняется должным образом.
Стерилизация жидкостей и жидких отходов в бутылях
Стерилизация жидкостей — одна из самых сложных задач в лаборатории.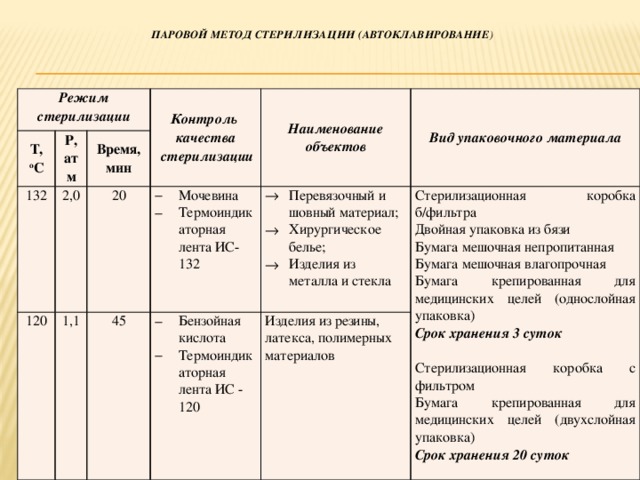 Процессы стерилизации могут занимать очень много времени, бутылки должны быть открыты или, по крайней мере, вентилироваться, часть жидкости выкипит, жидкости могут вскипеть, а бутылки могут даже лопнуть.Другой вопрос, который необходимо решить, заключается в том, достигают ли жидкости внутри бутылок даже требуемой температуры стерилизации (например, 121 ° C) и когда их можно безопасно вынуть из автоклава после завершения процесса стерилизации.
Процессы стерилизации могут занимать очень много времени, бутылки должны быть открыты или, по крайней мере, вентилироваться, часть жидкости выкипит, жидкости могут вскипеть, а бутылки могут даже лопнуть.Другой вопрос, который необходимо решить, заключается в том, достигают ли жидкости внутри бутылок даже требуемой температуры стерилизации (например, 121 ° C) и когда их можно безопасно вынуть из автоклава после завершения процесса стерилизации.
Процесс стерилизации жидкостей делится на три этапа:
1. Фаза нагрева и время уравновешивания (H)
2. Фаза стерилизации, например, 121⁰C в течение 20 минут (S)
3. Фаза охлаждения до безопасной температуры удаления (C)
Рисунок 1:
Синяя линия: Температура внутри камеры (резервуара высокого давления) автоклава
Красная линия: Температура, измеренная внутри жидкости
Больной.1 — Процесс стерилизации / фазы
На рисунке 1 показаны отдельные фазы с помощью графического дисплея. Синяя линия представляет собой температуру внутри сосуда под давлением автоклава, красная линия — температура внутри жидкости. Хорошо видно, что температура внутри сосуда под давлением автоклава быстро достигает требуемой температуры 121 ° C, тогда как жидкостям внутри бутылок требуется гораздо больше времени для достижения температуры стерилизации. Во время нагрева тепловая энергия пара передается бутылкам за счет конденсации пара.Этот процесс конденсации и связанная с ним теплопередача требуют некоторого времени, что объясняет временную задержку между простым нагревом сосуда высокого давления и нагревом самой жидкости. Время, необходимое для достижения одинаковых температур внутри сосуда высокого давления автоклава и внутри жидкостей, называется временем уравновешивания.
Многие автоклавы, используемые сегодня в лабораториях, до сих пор не оснащены устройством измерения температуры внутри эталонного сосуда. Таким образом, точная температура жидкости, подлежащей стерилизации, не измеряется и не может использоваться для регулирования процесса стерилизации. Эти автоклавы начинают фазу стерилизации после достижения необходимой температуры внутри сосуда высокого давления автоклава. Время уравновешивания, необходимое для того, чтобы жидкость также достигла требуемой температуры, не принимается во внимание. Таким образом, жидкости никогда не достигают температуры стерилизации, например 121 ° C и, следовательно, биологическая эффективность процесса стерилизации больше не гарантируется. В зависимости от устойчивости микроорганизмов, подлежащих деактивации, они деактивируются только частично или совсем не деактивируются.
Эти автоклавы начинают фазу стерилизации после достижения необходимой температуры внутри сосуда высокого давления автоклава. Время уравновешивания, необходимое для того, чтобы жидкость также достигла требуемой температуры, не принимается во внимание. Таким образом, жидкости никогда не достигают температуры стерилизации, например 121 ° C и, следовательно, биологическая эффективность процесса стерилизации больше не гарантируется. В зависимости от устойчивости микроорганизмов, подлежащих деактивации, они деактивируются только частично или совсем не деактивируются.
Измерение температуры внутри эталонного сосуда
Измеряя температуру внутри эталонного сосуда с помощью датчика температуры, можно определить точную температуру стерилизуемой жидкости и затем использовать ее для регулирования процесса стерилизации. Время стерилизации начинается только после достижения необходимой температуры стерилизации внутри жидкости.
Эталонный сосуд заполняется водой. Очень важно, чтобы размер и уровень наполнения эталонного сосуда соответствовали самому большому сосуду, заполненному жидкостью, подлежащей стерилизации.
Рис. 2 — Измерение температуры
Температура безопасного снятия
Датчик температуры для измерения внутри эталонного сосуда необходим для обеспечения достижения температуры стерилизации внутри жидкости. Также необходимо обеспечить безопасную температуру удаления после проведения стерилизации. Внутри автоклава жидкости нагреваются до температур, значительно превышающих обычную точку кипения (100 ° C). Тепловое тепло, передаваемое жидкости в связи с избыточным давлением, может представлять значительную опасность для оператора автоклава.Например, может произойти замедленное кипение, что означает, что жидкость самопроизвольно начнет кипеть при открытии автоклава. Это мгновенное закипание вызовет волну давления, состоящую из пара и горячей жидкости, извергающихся — как гейзер — из сосудов. Из 1 литра воды будет производиться 1000 литров пара! Исходя из этого значительного потенциального риска, автоклавы, используемые для стерилизации жидкостей, подпадают под действие соответствующих правил. DIN EN 61010-2-040 предусматривает, что автоклавы, используемые для стерилизации жидкостей, должны быть оборудованы предохранительными устройствами, предотвращающими открытие автоклава до того, как жидкости не остынут до температуры удаления, безопасной для оператора.В стандарте определена безопасная температура удаления, которая должна быть на 20 К ниже точки кипения воды при атмосферном давлении окружающей среды. Это соответствует температуре безопасного удаления 80 ° C. Современные автоклавы оснащены дверным замком, зависящим от температуры и давления. Это предотвращает открытие автоклава, когда сосуд высокого давления находится под давлением и до тех пор, пока температура, измеренная внутри жидкости, превышает предусмотренные 80 ° C.
DIN EN 61010-2-040 предусматривает, что автоклавы, используемые для стерилизации жидкостей, должны быть оборудованы предохранительными устройствами, предотвращающими открытие автоклава до того, как жидкости не остынут до температуры удаления, безопасной для оператора.В стандарте определена безопасная температура удаления, которая должна быть на 20 К ниже точки кипения воды при атмосферном давлении окружающей среды. Это соответствует температуре безопасного удаления 80 ° C. Современные автоклавы оснащены дверным замком, зависящим от температуры и давления. Это предотвращает открытие автоклава, когда сосуд высокого давления находится под давлением и до тех пор, пока температура, измеренная внутри жидкости, превышает предусмотренные 80 ° C.
ll. 3 — Охлаждение с поддерживающим давлением
Охлаждение жидкости до безопасной температуры удаления может занять довольно много времени.Размер, часто используемый для автоклавов в лабораториях, — это автоклав с емкостью сосуда под давлением прибл. 150 л. Если такой автоклав заполнен бутылками, содержащими стерилизуемую жидкость, полный цикл стерилизации может занять до 10 часов. То есть в течение одного рабочего дня не может быть завершен даже один процесс стерилизации. Таким образом, рекомендуется оборудовать автоклав системой обратного охлаждения, что значительно сократит общее время, необходимое для стерилизации партии, и предотвратит дальнейшие опасности и недостатки при стерилизации жидкостей.
Быстрое обратное охлаждение — максимальная производительность и безопасность
Системы обратного охлаждения, доступные для автоклавов, в основном различают два типа систем охлаждения:
1. Охлаждение испарением — кипение жидкости во время фазы охлаждения
2. Охлаждение излучением — тепло, исходящее от жидкости, отсутствие кипения жидкости с этой системой охлаждения
Охлаждение испарением — наиболее часто используемый вид охлаждения внутри автоклава. Это может быть:
— Самоохлаждение за счет медленного выпуска пара
— Вентиляционное охлаждение — холодный окружающий воздух подается в сосуд высокого давления снаружи
— Водяное охлаждение без поддерживающего давления
Все указанные выше типы охлаждения имеют серьезные недостатки при стерилизации жидкостей и могут содержать значительную потенциальную опасность, если процесс стерилизации не выполняется должным образом, поскольку этот тип охлаждения требует охлаждения жидкости до кипения.
1. Когда жидкость закипает во время фазы охлаждения, часть жидкости теряется. Ожидаемая потеря жидкости обычно составляет от 3 до 10%, но может быть значительно выше — в зависимости от содержания жидкости. Особенно, если содержание белка в жидкости высокое, она имеет тенденцию к еще большему кипению, что снова увеличивает потери жидкости.
2. Поскольку жидкости должны закипеть, чтобы остыть, вероятность их выкипания высока. Поэтому бутылки наполняются только наполовину или даже только на треть, чтобы не допустить перекипания.С одной стороны, это значительная потеря производительности, поскольку теряется 50-70% доступной емкости (внутри бутылок). С другой стороны, надежно предотвратить выкипание невозможно. Если жидкости выкипят, автоклав необходимо очистить, и, например, жидкости на основе агара могут течь в систему труб (слив) автоклава и блокировать его, когда агар остынет и там затвердеет. Очистка системы трубопроводов часто требует больших затрат и возможна только для производителя автоклава.
3. Жидкости можно кипятить только из открытых бутылок. Поэтому бутылки должны быть открытыми или хотя бы вентилируемыми (крышка должна быть приоткрыта). Если вентиляция бутылок забыта или сделана неправильно, жидкость внутри не может закипеть во время фазы обратного охлаждения и, следовательно, не будет охлаждаться. После того, как эталонный сосуд достигнет температуры охлаждения 80 ° C и, таким образом, позволит открыть автоклав, герметично закрытые бутылки все еще будут находиться при температуре стерилизации с соответствующим давлением e.грамм. 121⁰C, 2 бар. Это представляет значительную опасность, поскольку эти бутылки могут взорваться при извлечении из автоклава, а содержащаяся в них жидкость может самопроизвольно испаряться — подобно замедленному кипячению. Из 1 литра воды получается 1000 литров пара!
Рис. 4 — Ultracooler
Поэтому рекомендуется при покупке автоклава точно определить, для каких приложений он будет использоваться и как он должен быть оборудован с точки зрения производительности и безопасности.
Охлаждение излучением (быстрое охлаждение с опорным давлением)
Охлаждение излучением имеет значительные преимущества по сравнению с охлаждением испарением.Во время быстрого охлаждения с опорным давлением сосуд высокого давления охлаждается по всей его поверхности с помощью прикрепленных снаружи охлаждающих змеевиков, содержащих холодную воду. Перед включением охлаждения после фазы стерилизации пар внутри сосуда высокого давления заменяется стерильно отфильтрованным сжатым воздухом. Этот сжатый воздух надежно предотвращает закипание жидкости во время фазы охлаждения. Тепло передается от жидкости к холодным стенкам сосуда высокого давления посредством излучения, и жидкости, таким образом, охлаждаются.
Быстрое охлаждение с поддерживающим давлением позволяет значительно повысить производительность, поскольку время процесса по сравнению с самоохлаждением значительно сокращается. В то время как самоохлаждение требует до 10 часов для всего процесса автоклавирования, время повторного охлаждения за счет быстрого охлаждения с поддерживающим давлением может быть сокращено до 60% — в зависимости от количества обрабатываемых жидкостей.
Кроме того, все опасности и недостатки, описанные для охлаждения испарением (замедленное кипение, потеря жидкости, чрезмерное кипение, отсутствие охлаждения герметично закрытых бутылок), надежно устранены, поскольку жидкость больше не кипит.Этот тип охлаждения позволяет наполнять бутылки до максимального уровня (повышение производительности от 50 до 70%) — можно использовать даже герметично закрытые бутылки. Открытие или удаление воздуха из бутылок больше не требуется.
Дальнейшая оптимизация технологических циклов
Современные автоклавы позволяют дополнительно оптимизировать охлаждение жидкостей в модулях. Это дополнительно увеличивает производительность, но также влияет на качество стерилизуемых жидкостей. Многие жидкости содержат ингредиенты, которые не очень термостойкие. Жидкости необходимо стерилизовать, но время, в течение которого они будут подвергаться тепловому воздействию, должно быть как можно короче, чтобы термолабильные ингредиенты не подвергались отрицательному воздействию.
Жидкости необходимо стерилизовать, но время, в течение которого они будут подвергаться тепловому воздействию, должно быть как можно короче, чтобы термолабильные ингредиенты не подвергались отрицательному воздействию.
Модуль 1 — Радиальный вентилятор
Радиальный вентилятор генерирует воздушный поток внутри сосуда высокого давления автоклава во время фазы охлаждения. Этот воздушный поток направляет тепло от бутылок на стенки сосуда высокого давления, охлаждаемого быстрым охлаждением с поддерживающим давлением. Этот процесс сократит время охлаждения до 70% по сравнению с самоохлаждением.
Модуль 2 — Ультракулер
Ультракулер — это дополнительный теплообменник с водяным охлаждением, встроенный непосредственно в сосуд высокого давления автоклава. Это позволяет отводить тепло от бутылки именно там, где оно есть. Внутри сосуда высокого давления. За счет существенно улучшенной теплопередачи время охлаждения может быть сокращено до 90% по сравнению с самоохлаждением.
Примечание : Поскольку радиальный вентилятор и ультракулер устанавливаются внутри сосуда высокого давления, позаботьтесь о том, чтобы они не уменьшили полезное пространство, доступное внутри автоклава.
Стерилизация твердых частиц и отходов в мешках для уничтожения
При стерилизации твердых веществ (например, инструментов, пустой стеклянной посуды, наконечников пипеток в коробках, фильтров и текстильных изделий), а также при обеззараживании отходов в мешках для уничтожения необходимо обеспечить создание паровой атмосферы именно там, где это требуется. А именно на всех внутренних и внешних поверхностях стерилизуемого продукта. Многие автоклавы ненадежно удаляют воздух из автоклава и продукта. Если внутри автоклава и продукта остается воздух, стерилизующий эффект невозможен, поскольку только пар переносит тепловую энергию, необходимую для надежной дезактивации микроорганизмов.
Неэффективное удаление воздуха
На иллюстрациях 5 и 6 показано неэффективное удаление воздуха на примере коробки с наконечниками пипеток, а также мешков для уничтожения. Если автоклав просто нагревают, воздух вытесняется, и внутри сосуда под давлением автоклава образуется паровая атмосфера, но воздух остается внутри продукта, подлежащего стерилизации. Однако воздух, остающийся внутри продукта, препятствует проникновению пара туда, где его тепловая энергия необходима для достижения стерилизующего эффекта.
Если автоклав просто нагревают, воздух вытесняется, и внутри сосуда под давлением автоклава образуется паровая атмосфера, но воздух остается внутри продукта, подлежащего стерилизации. Однако воздух, остающийся внутри продукта, препятствует проникновению пара туда, где его тепловая энергия необходима для достижения стерилизующего эффекта.
Рис. 5 — Неэффективное удаление воздуха
При той же температуре, что и пар (например, 121 ° C), воздух содержит только часть необходимой тепловой энергии. Для продуктов, которые нельзя стерилизовать в атмосфере пара, существуют стерилизаторы горячим воздухом, однако они стерилизуются при более высоких температурах (180–250 ° C), что требует гораздо большего времени (до нескольких часов стерилизации). Поэтому стерилизующий эффект воздуха при температуре 121 ° C — 134 ° C и времени стерилизации 3-20 минут, который обычно используется внутри парового стерилизатора, на практике не применяется.
Рис. 6 — Неэффективное удаление воздуха из пакетов для уничтожения
Эффективное удаление воздуха
Для полного и воспроизводимого удаления воздуха из автоклава и продукта, подлежащего стерилизации, необходимо использовать фракционированный предварительный вакуум. Поэтому автоклав оборудован вакуумной системой. Во время фазы нагрева выполняются циклы вакуумирования для эффективного удаления воздуха с последующим впрыском пара. Обычно применяется трехкратный фракционированный предварительный вакуум — однако в зависимости от продукта может потребоваться еще большее количество фракций.
Рис.7 — Полное удаление воздуха
Сушка твердых предметов — Superdry
Твердые предметы, такие как инструменты или пустая стеклянная посуда, обычно помещаются в сушильный шкаф после процесса стерилизации. Современные автоклавы позволяют сушить твердые частицы сразу после процесса стерилизации. Стерилизация и сушка в одном процессе. Дальнейшее обращение со стерилизационным материалом, которое может вызвать повторное загрязнение, не требуется.
Стерилизация биологически опасных веществ
Стерилизация биологически опасных веществ представляет собой особую задачу. Во время фазы нагрева воздух внутри автоклава заменяется паром. Воздух вытесняется из автоклава и выпускается в помещение, где установлен автоклав. TRBA 100 — Технический регламент для биологических рабочих материалов. требует, чтобы в лабораториях с уровнем безопасности BSL2 технологический отработанный воздух из автоклава обрабатывался, поскольку отработанный воздух может быть загрязнен микроорганизмами из продукта, подлежащего стерилизации.Необходимо использовать соответствующий процесс. В случае автоклавов это обычно фильтрация. Поэтому автоклав может быть оборудован фильтром для выпуска воздуха. Весь воздух, вытесняемый из автоклава, проходит через фильтр с задерживаемыми в нем микроорганизмами. Фильтр стерилизуется «на линии» во время процесса стерилизации для деактивации задержанных в нем микроорганизмов.
TRBA 100 работает только с отработанным воздухом, выходящим из автоклава, но не с собранным конденсатом. В процессе стерилизации пар конденсируется на продукте и, таким образом, снова превращается в воду (конденсат).Эта вода также может быть загрязнена микроорганизмами. Следовательно, конденсат должен оставаться внутри автоклава во время процесса стерилизации, а также его необходимо стерилизовать «на линии», прежде чем сливать после успешной стерилизации.
Квалификация и проверка
В ходе аттестации проверяется, подходит ли устройство для использования по назначению и соответствует ли процесс — например, процесс стерилизации — может выполняться с учетом стерилизации продукта с постоянным (воспроизводимым) результатом, стерильным продуктом.Обычно процесс квалификации делится на три основных части:
1. IQ — Квалификация установки
Проверка того, было ли устройство изготовлено и установлено в соответствии со спецификациями.
2. OQ — Operational Qualification
Проверка, работает ли устройство в целом в соответствии с заданными функциями.
3. PQ — Квалификация производительности
Проверка того, работает ли устройство с обрабатываемым продуктом в соответствии со спецификациями Цель аттестации и валидации, является документированным доказательством того, что устройство подходит для предполагаемого использования.
Target of Qualification and Validation — это задокументированное доказательство того, что устройство подходит для предполагаемого использования.
Стерилизующий эффект процесса автоклава подтверждается во время OQ (пустая камера) и PQ (с продуктом) с помощью внешних регистраторов данных температуры и давления, а также с использованием биоиндикаторов на основе Bacillus Stearothermophilus. В то время как внешние регистраторы данных температуры и давления предоставляют доказательства того, что управление автоклавом отображает и документирует достоверные значения, а также выполняет процесс стерилизации в пределах определенных допусков, биоиндикаторы предоставляют доказательства биологической эффективности.Чтобы разместить биоиндикаторы, необходимо определить, на каких участках продукта, подлежащих стерилизации, сложнее всего достичь биологической эффективности. Точно в этих областях должны быть размещены биоиндикаторы, чтобы охватить «наихудший сценарий». Все этапы IQ, OQ и PQ должны быть подробно задокументированы. В каждом случае проведения IQ, OQ и PQ требуется тесное сотрудничество между пользователем и производителем.
Статья также опубликована в лабораторном журнале GIT Labor-Fachzeitschrift, 7/2016, стр. 14-18.
Дополнительная информация об автоклавах здесь:
Стерилизация (микробиология) — wikidoc
Обзор
Стерилизация (или стерилизация ) относится к любому процессу, который эффективно убивает или устраняет передающиеся агенты (такие как грибы, бактерии, вирусы, прионы и формы спор и т. Д.) С поверхности, оборудования, продуктов питания, лекарств или биологических культур. средний. Стерилизация может быть достигнута путем применения тепла, химикатов, облучения или фильтрации.
средний. Стерилизация может быть достигнута путем применения тепла, химикатов, облучения или фильтрации.
Приложения
Продукты питания
Первым применением стерилизации было тщательное приготовление пищи для частичной тепловой стерилизации пищевых продуктов и воды. Культуры, практикующие тепловую стерилизацию пищи и воды, имеют более продолжительную продолжительность жизни и более низкий уровень инвалидности. Консервирование продуктов путем тепловой стерилизации было продолжением того же принципа. Проглатывание зараженных продуктов питания и воды остается основной причиной болезней и смерти в развивающихся странах, особенно среди детей.
Медицина и хирургия
В общем, хирургические инструменты и лекарства, которые попадают в уже стерильную часть тела (например, кровь или под кожу), должны иметь высокий уровень гарантии стерильности. Примеры таких инструментов включают скальпели, иглы для подкожных инъекций и искусственные кардиостимуляторы. Это также важно при производстве парентеральных фармацевтических препаратов.
Известно, что тепловая стерилизация медицинских инструментов применялась в Древнем Риме, но в Средние века она в основном исчезла, что привело к значительному увеличению инвалидности и смертности после хирургических вмешательств.
Приготовление инъекционных препаратов и растворов для внутривенного введения для заместительной инфузионной терапии требует не только высокого уровня обеспечения стерильности, но и хорошо спроектированных контейнеров для предотвращения попадания посторонних агентов после первоначальной стерилизации.
Тепловая стерилизация
Стерилизация паром
Автоклавы с фронтальной загрузкой очень распространены.
Автоклав — широко используемый метод тепловой стерилизации. В автоклавах обычно используется пар, нагретый до 121 ° C (250 ° F) при давлении на 103 кПа (15 фунтов на кв. Дюйм) выше атмосферного.Твердые поверхности эффективно стерилизуются при нагревании до этой температуры не менее 15 минут или до 134 ° C не менее 3 минут. Однако жидкостям и инструментам, упакованным слоями ткани, требуется гораздо больше времени для достижения температуры стерилизации. После стерилизации автоклавированные жидкости необходимо медленно охладить, чтобы избежать их выкипания при сбросе давления.
Однако жидкостям и инструментам, упакованным слоями ткани, требуется гораздо больше времени для достижения температуры стерилизации. После стерилизации автоклавированные жидкости необходимо медленно охладить, чтобы избежать их выкипания при сбросе давления.
Правильная обработка в автоклаве инактивирует все грибки, бактерии, вирусы, а также споры бактерий, которые могут быть достаточно устойчивыми.Это не обязательно устранит все прионы.
Для удаления прионов различные рекомендации гласят 121–132 ° C (270 ° F) в течение 60 минут или 134 ° C (273 ° F) в течение как минимум 18 минут. Прион, вызывающий скрепи (штамм 263K), относительно быстро инактивируется такими процедурами стерилизации; однако другие штаммы скрепи, а также штаммы CJD и BSE более устойчивы. Один эксперимент с использованием мышей в качестве подопытных животных показал, что нагревание ткани мозга с положительной реакцией на BSE при 134–138 ° C (273–280 ° F) в течение 18 минут дало только 2 балла.5 log снижение инфекционности прионов. (Первоначальная концентрация BSE в ткани была относительно низкой). Для значительного запаса безопасности очистка должна снизить инфекционность на 4 журнала, а метод стерилизации должен снизить ее еще на 5 журналов.
Чтобы гарантировать, что процесс автоклавирования может вызвать стерилизацию, в большинстве автоклавов есть измерители и диаграммы, которые записывают или отображают соответствующую информацию, такую как температура и давление, как функция времени. Индикаторная лента часто наклеивается на упаковки продуктов перед автоклавированием.Химическое вещество на ленте изменит цвет при соблюдении соответствующих условий. На некоторых типах упаковки есть встроенные индикаторы.
Биологические индикаторы («биоиндикаторы») также могут использоваться для независимого подтверждения работы автоклава. Коммерчески доступны простые биоиндикаторы на основе спор микробов. Большинство из них содержат споры термостойкого микроба Bacillus stearothermophilus , одного из самых сложных организмов для уничтожения в автоклаве. Обычно эти устройства имеют автономную жидкую питательную среду и индикатор роста.После автоклавирования внутренняя стеклянная ампула разбивается, высвобождая споры в питательную среду. Затем флакон инкубируют (обычно при 56 ° C (132 ° F)) в течение 48 часов. Если автоклав уничтожил споры, среда сохранит свой первоначальный цвет. Если автоклавирование было безуспешным, B. sterothermophilus будет метаболизировать во время инкубации, вызывая изменение цвета во время инкубации.
Для эффективной стерилизации пар должен равномерно проникать в загрузку автоклава, поэтому автоклав не должен быть переполнен, а крышки бутылок и контейнеров должны оставаться приоткрытыми.Во время первоначального нагрева камеры необходимо дать возможность остаточному воздуху выйти, поскольку пар входит в камеру автоклава; в противном случае конечная температура будет ниже, чем у входящего пара. Индикаторы следует размещать в наиболее труднодоступных для пара местах, чтобы гарантировать, что пар действительно проникает туда.
Для автоклавирования, как и для всех методов дезинфекции стерилизации, очистка имеет решающее значение. Посторонние биологические вещества или грязь могут защищать организмы от собственности, предназначенной для их уничтожения, будь то физическая или химическая.Очистка также может удалить большое количество организмов. Правильная очистка может быть достигнута путем физической чистки. Для достижения наилучшего результата это следует делать с моющим средством и теплой водой. Для очистки инструментов или посуды органическими веществами необходимо использовать прохладную воду, так как теплая или горячая вода может вызвать коагуляцию органических остатков. Для удаления мусора также можно использовать обработку ультразвуком или импульсным воздухом.
Еда
Варка и консервирование, хотя и несовершенные, являются наиболее распространенными применениями тепловой стерилизации.Кипяток убивает все обычные микробы на вегетативной стадии. Запекание мяса до тех пор, пока оно не будет хорошо прожарено, обычно полностью стерилизует поверхность. Поскольку поверхность также является частью пищи, наиболее подверженной загрязнению микробами, жарка обычно предотвращает пищевое отравление. Обратите внимание, что обычные методы приготовления пищи не стерилизуют продукты — они просто уменьшают количество болезнетворных микроорганизмов до уровня, который не опасен для людей с нормальной пищеварительной и иммунной системами.Приготовление под давлением аналогично автоклавированию, и при правильном выполнении пища становится стерильной. Однако, как известно, некоторые продукты трудно стерилизовать с помощью оборудования для домашнего консервирования, поэтому следует соблюдать рекомендации экспертов по обработке в домашних условиях, чтобы избежать пищевого отравления.
Пищевые принадлежности
Посудомоечные машины часто используют только горячую воду из-под крана или нагревают воду до температуры от 49 до 60 ° C (от 120 до 140 ° F) и, таким образом, обеспечивают температуру, которая может способствовать росту бактерий. То есть они не стерилизуют посуду эффективно.Некоторые посудомоечные машины действительно нагревают воду до 74 ° C (165 ° F) или выше; они часто специально описываются как имеющие какие-то режимы стерилизации, но это не заменяет автоклавирование.
Обратите внимание, что посудомоечные машины удаляют следы еды с посуды за счет комбинации механического воздействия (действие воды, попадающей на тарелки и столовые приборы) и действия моющих средств и ферментов на жиры и белки. Таким образом, удаление частиц пищи устраняет один из факторов, необходимых для роста бактерий (пища), и объясняет, почему предметы с трещинами и щелями следует мыть вручную или утилизировать: если вода не может попасть в зону, нуждающуюся в очистке, теплая влажные и темные условия в посудомоечной машине могут способствовать росту бактерий.
Купание
Купание и стирка недостаточно горячие, чтобы стерилизовать бактерии и не обжечь кожу. Температура горячей воды из-под крана в большинстве случаев составляет от 43 до 49 ° C (от 110 до 120 ° F), хотя некоторые люди устанавливают свою температуру до 55 ° C (130 ° F). Люди начинают находить воду болезненной при температуре от 41 до 42 ° C (от 106 до 108 ° F), что для многих бактерий только начинает нагреваться достаточно для быстрого роста; они будут расти быстрее, чем погибнут при температуре до 55 ° C (130 ° F) или выше.
Другие методы
Другие методы нагрева включают в себя пламя, сжигание, кипячение, тиндализацию и использование сухого тепла.
Flaming применяется для петель и прямых проводов в микробиологических лабораториях. Если оставить петлю в пламени горелки Бунзена или спиртовой лампы, пока она не загорится красным, то любой инфекционный агент будет инактивирован. Обычно это используется для небольших металлических или стеклянных предметов, но не для больших предметов (см. Сжигание ниже). Однако во время первоначального нагрева инфекционный материал может «разбрызгиваться» с поверхности проволоки до того, как он погибнет, загрязняя близлежащие поверхности и предметы. Поэтому были разработаны специальные нагреватели, которые окружают инокуляционный контур нагретой клеткой, гарантируя, что такой распыляемый материал не будет дополнительно загрязнять область.
Сжигание также сожжет любой организм дотла. Он используется для дезинфекции медицинских и других биологически опасных отходов перед их утилизацией вместе с неопасными отходами.
Кипячение в воде в течение 15 минут убьет большинство вегетативных бактерий и вирусов, но кипячение неэффективно против прионов и многих спор бактерий и грибов; поэтому кипячение не подходит для стерилизации. Однако, поскольку кипячение действительно убивает большинство вегетативных микробов и вирусов, оно полезно для снижения жизнеспособных уровней, если нет лучшего метода.Кипячение — это простой процесс, доступный большинству в любом месте, где требуется только вода, достаточное количество тепла и емкость, способная выдержать высокую температуру; однако кипячение может быть опасным и обременительным.
Тиндализация [1]
/ Tyndallization [2] , названный в честь Джона Тиндалла, — это длительный процесс, предназначенный для снижения уровня активности спорообразующих бактерий, которые остаются после простого кипячения воды. Процесс включает кипячение в течение периода (обычно 20 минут) при атмосферном давлении, охлаждение, инкубацию в течение дня, кипячение, охлаждение, инкубацию в течение дня, кипячение, охлаждение, инкубацию в течение дня и, наконец, повторное кипячение.Три периода инкубации позволяют термостойким спорам, пережившим предыдущий период кипячения, прорасти и сформировать чувствительную к нагреванию вегетативную (растущую) стадию, которая может быть уничтожена на следующем этапе кипячения. Это эффективно, потому что тепловой шок стимулирует рост многих спор. Процедура работает только для сред, которые могут поддерживать рост бактерий — простую воду она не стерилизует. Тиндализация / тиндализация неэффективна против прионов.
Сухой жар можно использовать для стерилизации предметов, но поскольку тепло занимает гораздо больше времени, чтобы передать его организму, время и температуру обычно следует увеличивать, если не используется принудительная вентиляция горячим воздухом.Стандартная настройка духовки с горячим воздухом составляет не менее двух часов при 160 ° C (320 ° F). С помощью быстрого метода воздух нагревается до 190 ° C (374 ° F) в течение 6 минут для неупакованных предметов и 12 минут для завернутых. [1] [2] Преимущество сухого тепла состоит в том, что его можно использовать для порошков и других термостойких предметов, на которые неблагоприятно воздействует пар (например, он не вызывает коррозии стальных предметов).
Прионы можно инактивировать погружением в гидроксид натрия (0,09 н. NaOH) на два часа плюс один час автоклавирования (121 ° C / 250 ° F).Несколько исследователей показали полную (> 7,4 log) инактивацию при таком комбинированном лечении. Однако гидроксид натрия может разъедать хирургические инструменты, особенно при повышенных температурах автоклава.
Химическая стерилизация
Для стерилизации также используются химические вещества. Хотя нагрев является наиболее надежным способом избавления объектов от всех передающихся агентов, он не всегда уместен, поскольку может повредить термочувствительные материалы, такие как биологические материалы, оптоволокно, электронику и многие пластмассы.
Оксид этилена (EO или EtO) обычно используется для стерилизации предметов, чувствительных к температурам выше 60 ° C, таких как пластмассы, оптика и электрика. Обработку оксидом этилена обычно проводят при температуре от 30 ° C до 60 ° C, относительной влажности выше 30% и концентрации газа от 200 до 800 мг / л в течение не менее трех часов. Оксид этилена хорошо проникает через бумагу, ткань и некоторые пластиковые пленки и очень эффективен. Стерилизаторы на основе оксида этилена используются для обработки чувствительных инструментов, которые нельзя стерилизовать должным образом другими методами.EtO может убивать все известные вирусы, бактерии и грибки, включая споры бактерий, и подходит для большинства медицинских материалов даже при многократном использовании. Однако он легко воспламеняется, и для его стерилизации требуется больше времени, чем при любой термообработке. Процесс также требует периода аэрации после стерилизации для удаления токсичных остатков. Окись этилена — наиболее распространенный метод стерилизации, используемый более чем для 70% всех стерилизаций и для 50% всех одноразовых медицинских устройств.
Двумя наиболее важными методами стерилизации оксидом этилена являются: (1) метод газовой камеры и (2) метод микродоз.Чтобы получить выгоду от экономии на масштабе, EtO традиционно подавали путем заполнения большой камеры смесью EtO и других газов, используемых в качестве разбавителей (обычно CFC или диоксид углерода). Этот метод имеет недостатки, присущие использованию больших количеств стерилизующего средства, выбрасываемого в большое пространство, включая загрязнение воздуха, производимое ХФУ и / или большими количествами остатков EtO, воспламеняемость и проблемы хранения, требующие особого обращения и хранения, риск воздействия на оператора и затраты на обучение.Из-за этих проблем в конце 1950-х годов был разработан метод стерилизации микродозами, в котором использовался специально разработанный мешок, чтобы исключить необходимость заливать большую камеру EtO. Этот метод также известен как газодиффузионная стерилизация или стерилизация пакетов. Этот метод сводит к минимуму использование газа. [3]
Bacillus subtilis, очень устойчивый организм, используется в качестве быстрого биологического индикатора для стерилизаторов ЭО. Если стерилизация не удалась, инкубация при 37 ° C вызывает изменение флуоресценции в течение четырех часов, которое считывается автоматическим считывателем.Через 96 часов происходит видимое изменение цвета. Флуоресценция излучается, если присутствует определенный (устойчивый к ЭО) фермент, что означает, что споры все еще активны. Изменение цвета указывает на изменение pH из-за метаболизма бактерий. Быстрые результаты означают, что обработанные объекты могут быть помещены в карантин до получения результатов тестирования.
Озон используется в промышленных условиях для стерилизации воды и воздуха, а также в качестве дезинфицирующего средства для поверхностей. Он способен окислять большую часть органических веществ.С другой стороны, это токсичный и нестабильный газ, который должен производиться на месте, поэтому его нецелесообразно использовать во многих условиях.
Хлорный отбеливатель — еще один общепринятый жидкий стерилизующий агент. Бытовой отбеливатель состоит из 5,25% гипохлорита натрия. Обычно его разводят до 1/10 непосредственно перед использованием; однако, чтобы убить Mycobacterium tuberculosis , его следует разбавить только 1/5. Коэффициент разбавления должен учитывать объем любых жидких отходов, которые он используется для стерилизации. [4] Отбеливатель немедленно убивает многие организмы, но для полной стерилизации ему нужно дать реагировать в течение 20 минут. Отбеливатель убивает многие, но не все споры. Он очень агрессивен и может вызвать коррозию даже хирургических инструментов из нержавеющей стали.
Растворы глутаральдегида и формальдегида (также используемые в качестве фиксаторов) являются приемлемыми жидкими стерилизующими агентами при условии, что время погружения достаточно длительное. Чтобы убить все споры в прозрачной жидкости, может потребоваться до 12 часов с глутаровым альдегидом и даже больше с формальдегидом.Наличие твердых частиц может продлить необходимый период или сделать лечение неэффективным. Стерилизация блоков ткани может занять намного больше времени из-за времени, необходимого для проникновения фиксатора. Глутаральдегид и формальдегид летучие и токсичные при контакте с кожей и при вдыхании. Глутаральдегид имеет короткий срок хранения (<2 недель) и стоит дорого. Формальдегид дешевле и имеет гораздо более длительный срок хранения, если добавить немного метанола для ингибирования полимеризации до параформальдегида, но он гораздо более летуч.Формальдегид также используется как газообразный стерилизующий агент; в этом случае его получают на месте путем деполимеризации твердого параформальдегида. Многие вакцины, такие как оригинальная вакцина от полиомиелита Солка, стерилизованы формальдегидом.
Ортофталевый альдегид (OPA) — это химический стерилизующий агент, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в конце 1999 года. Обычно используемый в 0,55% растворе, OPA проявляет лучшую микобактерицидную активность, чем глутаральдегид. Он также эффективен против устойчивых к глутаральдегиду спор.ОРА обладает превосходной стабильностью, менее летучим, не раздражает кожу или глаза и действует быстрее, чем глутаровый альдегид. С другой стороны, он более дорогой и окрашивает белки (в том числе кожу) в серый цвет.
Перекись водорода — еще один химический стерилизующий агент. Он относительно нетоксичен при разбавлении до низких концентраций (хотя и является опасным окислителем при высоких концентрациях) и не оставляет следов.
В стерилизационных камерах Sterrad пары перекиси водорода используются для стерилизации термочувствительного оборудования, такого как жесткие эндоскопы.Последняя модель может стерилизовать большинство больничных грузов всего за 20 минут. Sterrad имеет ограничения при обработке определенных материалов, таких как бумага / лен и длинные тонкие просветы. Бумажные изделия нельзя стерилизовать в системе Sterrad из-за процесса, называемого целлюлозой, при котором перекись водорода полностью абсорбируется бумажным изделием.
Перекись водорода и муравьиная кислота при необходимости смешиваются в устройстве Endoclens для стерилизации эндоскопов.Это устройство имеет два независимых асинхронных отсека и автоматически очищает (в теплом моющем средстве с импульсным воздухом), стерилизует и сушит эндоскопы за 30 минут. Исследования с синтетической почвой со спорами бактерий показали эффективность этого устройства.
В процессе сухой стерилизации (DSP) используется перекись водорода с концентрацией 30-35% в условиях низкого давления. В результате этого процесса достигается уменьшение количества бактерий на 10 -6 … 10 -8 . Время полного технологического цикла составляет всего 6 секунд, а температура поверхности увеличивается всего на 10-15 ° C.Первоначально разработанный для стерилизации пластиковых бутылок в производстве напитков, из-за значительного уменьшения количества микробов и небольшого повышения температуры процесс сухой стерилизации также полезен для медицинских и фармацевтических применений.
Перуксусная кислота (0,2%) используется для стерилизации инструментов в системе Steris.
Прионы обладают высокой устойчивостью к химической стерилизации. Фактически было показано, что обработка альдегидами (например, формальдегидом) увеличивает устойчивость к прионам.Было показано, что перекись водорода (3%) в течение одного часа неэффективна, обеспечивая снижение загрязнения менее чем на 3 log (10 -3 ). Йод, формальдегид, глутаральдегид и перуксусная кислота также не прошли этот тест (лечение в течение одного часа). Только хлор, фенольное соединение, тиоцианат гуанидиния и гидроксид натрия (NaOH) снижают уровни прионов более чем на 4 log. Хлор и NaOH являются наиболее стойкими агентами для прионов. Хлор слишком агрессивен для обработки определенных предметов. Многочисленные исследования гидроксида натрия показали его эффективность.
Радиационная стерилизация
Существуют методы стерилизации с использованием излучения, такого как рентгеновские лучи, гамма-лучи или субатомные частицы.
- Гамма-лучи очень проникающие и обычно используются для стерилизации одноразового медицинского оборудования, такого как шприцы, иглы, канюли и наборы для внутривенных вливаний. Гамма-излучение требует громоздкой защиты для безопасности операторов; они также требуют хранения радиоизотопа (обычно кобальта-60), который постоянно испускает гамма-лучи (его нельзя выключить, и поэтому он всегда представляет опасность в районе установки).
- Рентгеновские лучи менее проникающие, чем гамма-лучи, и, как правило, требуют более длительного времени экспозиции, но требуют меньшего экранирования и генерируются рентгеновским аппаратом, который можно отключить для обслуживания и когда он не используется.
- Облучение ультрафиолетовым светом (УФ, от бактерицидной лампы) полезно только для стерилизации поверхностей и некоторых прозрачных предметов. Многие объекты, прозрачные для видимого света, поглощают УФ. Ультрафиолетовое облучение обычно используется для стерилизации внутренней части боксов биологической безопасности между применениями, но оно неэффективно в затененных областях, включая участки под грязью (которая может полимеризоваться после длительного облучения, поэтому ее очень трудно удалить).Он также повреждает многие пластмассы, например пенополистирол.
- Субатомные частицы могут быть более или менее проникающими и могут генерироваться радиоизотопом или устройством, в зависимости от типа частицы.
Облучение рентгеновскими или гамма-лучами не делает материалы радиоактивными. Облучение частицами может сделать материалы радиоактивными, в зависимости от типа частиц и их энергии, а также от типа материала мишени: нейтроны и частицы очень высоких энергий могут сделать материалы радиоактивными, но имеют хорошее проникновение, тогда как частицы с более низкой энергией (кроме нейтронов ) не может сделать материалы радиоактивными, но имеет меньшую проницаемость.
Облучение используется Почтовой службой США для стерилизации почты в Вашингтоне, округ Колумбия. Некоторые продукты (например, специи, мясной фарш) подвергаются облучению для стерилизации (см. Облучение пищевых продуктов).
Стерильная фильтрация
Прозрачные жидкости, которые могут быть повреждены нагреванием, облучением или химической стерилизацией, можно стерилизовать механической фильтрацией. Этот метод обычно используется для чувствительных фармацевтических препаратов и белковых растворов в биологических исследованиях. Фильтр с размером пор 0.2 мкм эффективно удаляют бактерии. Если вирусы также должны быть удалены, требуется гораздо меньший размер пор — около 20 нм. Растворы медленно фильтруются через мембраны с меньшим диаметром пор. Прионы не удаляются фильтрацией. Фильтровальное оборудование и сами фильтры могут быть приобретены в виде предварительно стерилизованных одноразовых единиц в запечатанной упаковке или должны быть стерилизованы пользователем, как правило, путем автоклавирования при температуре, которая не повреждает хрупкие мембраны фильтра. Для обеспечения стерильности систему фильтрации необходимо протестировать, чтобы убедиться, что мембраны не были проколоты до или во время использования.
Для обеспечения наилучших результатов фармацевтическая стерильная фильтрация выполняется в помещении с сильно отфильтрованным воздухом (HEPA-фильтрация) или в шкафу с ламинарным потоком или «проточной коробке», устройстве, которое производит ламинарный поток воздуха, отфильтрованного HEPA.
Банкноты
Общие ссылки
- Техническое руководство по центральному обслуживанию, 6-е издание, Джек Нинемайер, доктор философии, редактор, Международная ассоциация управления материальными ресурсами централизованного обслуживания здравоохранения
- Борьба с микробами
- Раджу, Г.К. и Куни, C.L., 1993. Среда и стерилизация воздуха. в биотехнологии, изд. Стефанопулос, Г., том 3., стр. 157-184.
Внешние ссылки
бс: Стерилизация
cs: Sterilizace (микробиология)
de: Стерилизация
он: עיקור (מיקרוביולוגיה)
это: Sterilizzazione (игиене)
нл: стерилизация (микроорганизмы)
Шаблон: WH
Шаблон: WS
Методы стерилизации — Теория Лабстера
Стерилизация — это тип обеззараживания, при котором на предмете не остается микробной нагрузки.Отсутствуют бактерии, грибки, споры или даже белки, передающие инфекцию. Стерилизация — это наивысший уровень обеззараживания, который может получить объект. В медицинских учреждениях рекомендуется стерилизовать все критические и полукритические предметы.
Важно отметить, что, хотя все процессы дезактивации направлены на снижение микробной нагрузки, не все из них приводят к полной стерилизации. Ниже приводится краткое изложение наиболее распространенных методов стерилизации, с которыми вы можете столкнуться.
Влажное тепло (пар)
Стерилизация паром с использованием автоклава — золотой стандарт метода инактивации всех органических патогенов, включая споры и прионные белки. Некоторые предметы чувствительны к нагреванию или давлению, и их следует стерилизовать с использованием альтернативной подходящей методики. Этот метод обычно используется для металлических инструментов и термостойких пластиков.
Сухой жар
Запекание предметов в духовке — это альтернатива стерилизации влажным теплом, когда предмет может быть нетерпимым к влажным условиям (например, из-за коррозии).Температура и время цикла выше, чем в автоклаве (160-190 ℃ до двух часов).
Химическая промышленность
Химические стерилизаторы вступают в реакцию с белками и мембранами, уничтожая органические патогены. Жидкие стерилизаторы также можно использовать для дезинфекции высокого уровня. Эти методы устраняют необходимость в высокой температуре, поэтому могут быть полезной альтернативой методам влажного и сухого нагрева.
В камерах с оксидом этилена используется токсичный газ оксид этилена для уничтожения органических патогенов.Хотя побочные продукты этого процесса полезны для влажных и термочувствительных объектов, они очень опасны для окружающей среды, являются канцерогенными и взрывоопасными. Длительное время дегазации (<24 часов) наряду с проблемами токсичности означает, что этот метод предназначен для объектов, где нельзя использовать другие методы.
Жидкие стерилизаторы, такие как перуксусная кислота и глутаровый альдегид , требуют, чтобы предметы были полностью погружены в воду на проверенный период времени для достижения стерилизации. Погружение металлов в кислоту на длительное время может вызвать коррозию, в то время как глутаральдегид необратимо связывает кровь и белки с поверхностью обрабатываемого объекта.
Поскольку такая тщательная обработка необходима перед использованием жидкого стерилизатора, наряду с тщательной обработкой перед очисткой.
Облучение
Обе формы стерилизации облучением инактивируют микроорганизмы, прямо или косвенно повреждая их ДНК.
Неионизирующее излучение с использованием ультрафиолетового (УФ) света — это процесс с меньшей энергией, чем методы высокоэнергетического ионизирующего излучения с использованием гамма-лучей или рентгеновских лучей .Таким образом, неионизирующее УФ-излучение не может проникать сквозь предметы и может использоваться только для стерилизации поверхностей. Любые микробы в прямой видимости УФ-лампы будут инактивированы из-за повреждения ДНК. Это то, что делает ультрафиолетовый свет канцерогеном для людей и других животных; Повреждение ДНК клеток кожи солнечным УФ-излучением связано с развитием рака кожи.
Методы облучения работают при низких температурах, что означает, что они могут быть полезны для термочувствительных предметов.
Как узнать, прошла ли стерилизация успешно?
Есть два типа индикаторов, используемых для определения правильности выполнения метода стерилизации.Это биологических и химических индикаторов.
Биологические индикаторы часто представляют собой небольшие образцы спор микроорганизмов, которые следует инактивировать, если метод стерилизации оказался успешным. После цикла споры высевают на питательную среду и проверяют, производят ли они новые клетки. Отсутствие роста — показатель хорошего процесса.
Химические индикаторы представляют собой изменяющие цвет соединения, которые вступают в реакцию при соблюдении условий стерилизации в течение нужного периода времени.Это могут быть чернильные пятна на стерилизационных пакетах, которые меняют цвет с розового / желтого на коричневый / черный, или липкую ленту, которая делает то же самое и может быть нанесена на бутылки и пакеты, обернутые бумагой.
Руководство по процессу стерилизации автоклавов
| Tuttnauer
Производство пара и качество пара
Пар является средством стерилизации автоклава. В нашей серии «Методы стерилизации» мы объяснили физику пара и почему он идеально подходит для уничтожения таких микроорганизмов, как бактерии и споры.В первой части этого поста будет объяснено, как генерируется пар для автоклавирования. Во второй части этой серии будут обсуждаться различные типы подачи и генерации пара в автоклаве, а также их использование.
Назад к истокам
Стандарт стерилизации ANSI / AAMI гласит:
Существует два распространенных источника пара, используемых для стерильной обработки: больничные паровые котельные и автономные электрические котлы. В обоих случаях необходима подача очищенной воды для удаления всех растворенных твердых частиц (TDS).Каждую систему следует проектировать, контролировать и поддерживать, чтобы гарантировать, что качество, чистота и количество подаваемого пара соответствуют эффективной стерильной обработке (см. Https://www.health.qld.gov.au/chrisp/sterilising /large_document.pdf)
Tuttnauer предлагает автоклавы, которые подключаются к системе подачи пара в здание или больницу, а также модели, оборудованные автономными электрическими парогенераторами. Другие автоклавы Tuttnauer оснащены опцией двойного пара (с возможностью изменения источника подачи пара в зависимости от наличия пара в здании), приспособленной к требованиям пользователя.Парогенератор автоклава может быть встроенным или автономным, в зависимости от размера камеры.
Качество пара для автоклава
Когда дело доходит до передачи большого количества энергии объекту, требующему стерилизации, нет ничего более мощного, чем пар. В конце концов, паровые машины приводят в движение корабли и поезда. Даже Титаник работал от пара.
Мы обсуждали качество пара в подробном посте о методах стерилизации, но давайте рассмотрим факторы, которые определяют это качество, потому что оно имеет решающее значение для правильной работы автоклава и процесса стерилизации в целом.Наиболее важны два параметра:
- уровень неконденсируемых газов
- уровень влажности
Оптимальный состав пара в автоклаве: 3% жидкости и 97% газа. Любое изменение процентного содержания влаги увеличивает или уменьшает время стерилизации. На практике время стерилизации рассчитывается в соответствии с оптимальными условиями пара и способностью пара передавать энергию нестерильной загрузке до стерилизации. В конце концов, одним из наиболее важных преимуществ стерилизации в автоклаве паром является то, что она требует значительно меньше времени и тепла, чем стерилизатор сухого нагрева, из-за способности пара передавать энергию.
Сухой пар? Влажный пар? Нет в автоклаве
При влажности менее 3% образуется так называемый сухой или перегретый пар. Этот пар увеличивает время стерилизации, поскольку снижает возможность передачи энергии. Перегретый пар снижает влажность примерно до 0%, превращая автоклав в сушильный шкаф. Передача энергии снижается, и то, что занимает три минуты в автоклаве при 134 ° C, занимает двух часов, при 160 ° C и тридцать минут при 180 ° C !!
Однако при влажности выше 3% образуется насыщенный или влажный пар, что требует более высокого давления и температуры стерилизации.Влажный пар также увеличивает время сушки в конце процесса стерилизации. Сухая загрузка требуется в конце процесса, когда загрузка завернута и не предназначена для немедленного использования.
Стандарты и директивы стерилизации для автоклавов допускают некоторую гибкость в уровнях влажности пара, поскольку практически невозможно подавать идеальный пар при стабильном потоке. Даже если условия почти оптимальны, многие переменные влияют на пар, передаваемый в автоклав. Главные из них: погодные условия и температура; качество, длина и конструкция трубопроводов; дренажные станции; и наличие качественных конденсатоотводчиков.
Подбор пара
Теперь, когда мы понимаем, как работает пар, мы можем изучить, как он генерируется и подается в автоклав. В следующем посте мы поговорим о парогенераторе в автоклаве и расскажем о его различных типах и назначении. Ждите продолжения.
Подробнее о стерилизаторах для автоклавов Tuttnauer
:
Тепловая стерилизация | Painfulpleasures Inc
Микроорганизмы — злейшие враги татуировщиков и пирсинговых магазинов. Предоставленные самим себе, они укоренились бы у клиентов, делающих татуировки и пирсинг, и потенциально могли бы вызвать у них множество проблем, от раздражения до инфекций и того хуже.Как владелец магазина, татуировщик и / или мастер пирсинга, вы обязаны защищать своих клиентов от вредных микроорганизмов. Для этого вы должны постоянно обеспечивать надлежащую стерилизацию рабочего места.
В разделе Методы стерилизации , наше введение в различные способы уничтожения микроорганизмов, мы перечислили наиболее распространенные методы стерилизации и объяснили, как все они попадают в одну из двух основных категорий: методы стерилизации на основе тепла и методы стерилизации без нагрева.Поскольку тепловая стерилизация является более практичным вариантом для использования в салонах татуировок и пирсинга, мы рассмотрим преимущества и недостатки каждого типа тепловой стерилизации и определим наиболее эффективные и действенные в следующих параграфах.
Способы стерилизации теплом
Существует пять основных методов стерилизации, основанных на нагревании, которые можно использовать для уничтожения микроорганизмов, размножающихся при нормальной температуре:
- Пылающий
- Сжигание
- Кипячение
- Применение сухого тепла
- Варка
Первые три варианта являются эффективными методами стерилизации только в некоторых случаях и никогда не применяются в салонах татуировок и пирсинга.Когда дело доходит до стерилизации украшений для тела, инструментов для пирсинга и татуировок, только стерилизация сухим теплом и паром оказывается на 100% эффективным средством стерилизации.
Стерилизация пламенем
Пламя — это старейший известный метод стерилизации, благодаря которому наши предки были живы и здоровы, чтобы рожать и растить детей в течение нескольких поколений, опередив науку и современную медицину. В те дни никто не знал о микроорганизмах и о том, как они могут проникнуть в здоровую иммунную систему и разрушить ее.Однако они обнаружили, что мясо, приготовленное на открытом огне, вкуснее, и со временем пришли к выводу, что меньше людей заболевают, когда едят приготовленное мясо.
Обжигание пламенем может быть эффективным способом, например, стерилизации иглы в домашних условиях перед удалением занозы. Однако это не лучший способ стерилизовать иглу перед пирсингом или татуировкой. Даже если вам удастся убить пламенем все организмы, цепляющиеся за иглу, вам придется поджигать на открытом воздухе, а не в замкнутой среде.Это означает, что игла может улавливать новые микроорганизмы между моментом ее поджигания и использованием, даже если этот промежуток времени составляет всего несколько секунд.
Лучше всего покупать стерилизованные газом иглы для пирсинга и иглы для тату. Газ EO или газообразный оксид этилена — это метод стерилизации без нагрева, используемый для стерилизации продуктов после их упаковки. Бумажная основа каждой блистерной упаковки с иглой достаточно пористая, чтобы позволить газу проникнуть в нее и стерилизовать содержащуюся внутри иглу.Если процесс стерилизации прошел успешно, точка на упаковке станет синей. Затем иглу хранят стерильной до тех пор, пока упаковка не будет открыта или пока не истечет срок годности, указанный на упаковке.
- Преимущества: Пламя — это удобный способ уничтожения многих, но не обязательно всех, микроорганизмов, цепляющихся за небольшие металлические предметы, и его можно использовать для уничтожения всех микроорганизмов в мясе.
- Недостатки: Невозможно узнать, уничтожено ли 100% микроорганизмов, когда вы зажигаете что-то вроде иглы.Кроме того, не все, что вам нужно стерилизовать в салоне татуировки и пирсинга, можно воспламенить (например, украшения для тела из акрила и ПТФЭ, а также резинки могут расплавиться).
Сжигание
Когда вы сжигаете объект, вы полностью уничтожаете его вместе со всеми прилипшими к нему микроорганизмами. Сжигание — хороший способ избавиться от определенных типов медицинских отходов и некоторых одноразовых вещей, например, загрязненной бумажной одноразовой бумаги. Однако вы не можете безопасно сжигать одноразовые предметы или что-либо еще в магазине татуировок и пирсинга.
Установки для сжигания отходов
могут быть очень дорогими, и только высококвалифицированный персонал может ими управлять. Они тоже требуют особого ухода; неправильное обслуживание мусоросжигательной установки может привести к проблемам, начиная от неполных циклов до рассеивания ядовитых газов. По этим причинам даже больницы и лаборатории обычно отправляют отходы на сжигание за пределами помещения, в надлежащем центре сжигания.
- Преимущества: Сжигание уничтожает 100% микроорганизмов и значительно уменьшает объем отходов.Это также идеальный способ предотвратить повторное использование загрязненных предметов.
- Недостатки: Если вы сжигаете объект, вы его полностью уничтожаете. Мусоросжигательные заводы также дороги, и не каждый может ими управлять. Вы должны заправить мусоросжигательный завод, чтобы использовать его, что увеличивает стоимость. Мусоросжигательные заводы также необходимо часто ремонтировать и постоянно обслуживать.
Кипячение как метод стерилизации
Есть множество материалов, которые выдерживают кипячение.Таким способом можно частично стерилизовать металлы и ПТФЭ, но это не 100% эффективный метод стерилизации. Возможно, это единственный метод, который человек может использовать дома для стерилизации украшений для тела, но это не подходящий способ стерилизации инструментов и украшений в салоне татуировки и пирсинга.
Кипячение воздействует на микроорганизмы, изменяя физические свойства белков, заставляя их коагулировать и прекращать функционирование. Подумайте о яйце, которое было погружено в кипящую воду — как внутренности коагулируют, чтобы сформировать вкусное сваренное вкрутую яйцо, которое безопасно есть, в отличие от того, что было до кипячения.
Использование кипячения в качестве метода стерилизации требует регулировки температуры по высоте, добавления стиральной соды в нужной концентрации, закрытия емкости, в которой кипятится вода, и кипячения объекта (ов) в течение минимум 30 минут. Даже в этом случае нельзя быть уверенным, что вы уничтожили 100% микроорганизмов, цепляющихся за объект (ы), которые вы варите. Некоторые микроорганизмы термостойки, например эндоспоры, для полного уничтожения которых может потребоваться 20 или более часов кипячения.Есть также множество микроорганизмов, которые еще не были достаточно исследованы, чтобы знать, сколько времени потребуется, чтобы убить их кипящей водой, или убьет ли их вообще кипящая вода. Это делает кипячение совершенно неэффективным и неподходящим методом стерилизации инструментов для пирсинга, татуировок и украшений для тела.
- Преимущества: При кипячении используется влажное тепло, которое проникает в материалы быстрее, чем сухое тепло, поскольку воздух не проводит тепло так же хорошо, как вода.Также требуется более низкая температура и меньше времени для кипячения предмета, чем для его стерилизации с помощью сухого тепла.
- Недостатки: Вы никогда не узнаете, уничтожили ли вы 100% микроорганизмов, цепляющихся за объект, который вы кипятили, даже если кипятите его более 20 часов. Это просто не практичный и безопасный метод стерилизации для салона татуировок и пирсинга.
Применение сухого тепла
Стерилизация сухим жаром требует повышения температуры объекта до контролируемых 170 ° Цельсия (338 ° Фаренгейта) не менее чем на один час, чтобы убить все прилипшие к нему микроорганизмы.Сухой жар — идеальный способ убить микроорганизмы, прикрепленные к жирам, маслам и порошкам, которые нельзя стерилизовать в автоклаве, потому что они либо сопротивляются воде, либо разрушаются ею. Вот почему духовка — идеальное место для приготовления мяса, которое содержит жиры и масла, которые могут проникнуть через сухой жар, излучаемый духовкой.
Вы можете приобрести электрический стерилизатор сухого тепла для салона татуировок и пирсинга. Однако это может быть не идеальный способ стерилизации украшений для тела, татуировок и инструментов для пирсинга по нескольким причинам.Во-первых, стерилизаторы сухого нагрева должны проработать не менее часа, чтобы убить все микроорганизмы, что слишком много, когда у вас есть клиент, ожидающий татуировки или пирсинга. Во-вторых, вы не можете эффективно стерилизовать вещи навалом в стерилизаторе сухого нагрева, поскольку скопление предметов может помешать потоку воздуха вокруг каждого предмета таким образом, чтобы его внутренняя температура достигла постоянной 170 ° C. Наконец, сухой жар менее эффективен, чем влажный с точки зрения энергии.
Стерилизация паром
Автоклав — самый эффективный инструмент для стерилизации принадлежностей для татуировок, инструментов для пирсинга и украшений для тела.Он использует пар под давлением для быстрого и эффективного уничтожения микроорганизмов на различных поверхностях, от металла до ПТФЭ. Автоклавы требуют меньше времени и энергии для работы, чем стерилизаторы сухого нагрева, что делает их идеальным инструментом для крупных магазинов татуировок и пирсинга, которым необходимо перемещать клиентов с максимально возможной скоростью.
Паровой автоклав, работающий при 121 ° C, убивает все микроорганизмы в течение 15 минут. Это возможно, потому что пар передает тепло более эффективно, чем что-либо еще, включая сухой нагретый воздух и кипящую воду.Вода в целом более эффективна для передачи тепла, чем что-либо еще, но пар является наиболее эффективной формой воды для передачи энергии. Вот почему:
В замкнутой среде автоклава пар глубоко проникает в стерилизуемые объекты благодаря своей способности конденсироваться. Что бы вы ни стерилизовали, оно изначально имеет более низкую температуру, чем окружающий пар, поэтому он притягивает и собирает конденсат при выпуске пара. Когда пар конденсируется, он сжимается в объеме, создавая эффект всасывания, который притягивает еще больше пара к стерилизуемым объектам.Во время этого процесса пар проникает в любые микроорганизмы, цепляющиеся за стерилизуемый объект (объекты). Когда микроорганизмы полностью насыщаются, их внутренняя температура повышается, готовясь, а затем уничтожая их.
- Преимущества: Пар — самый быстрый и эффективный способ стерилизации украшений для тела, татуировок и пирсинга. Для работы парового стерилизатора в автоклаве требуется меньше энергии, чем для работы стерилизатора сухого нагрева, он может стерилизовать больше предметов за раз, а в автоклав можно помещать более широкий спектр материалов, не опасаясь их плавления, поскольку пар стерилизует предметы при более низкой температуре, чем сухой жар.
- Недостатки: Автоклавы обычно требуют более значительных начальных вложений, чем стерилизаторы сухого тепла. Однако они компенсируют эту первоначальную более высокую стоимость за счет экономии денег с течением времени. Ваши счета за электроэнергию будут ниже, чем если бы у вас был стерилизатор сухого тепла, нагревательные элементы, вероятно, прослужат дольше, и вы сможете увидеть больше клиентов за день, поскольку на стерилизацию принадлежностей для пирсинга, тату-инструментов и украшений для тела в помещении требуется меньше времени. автоклав.
Без жарких дебатов
Из всех методов стерилизации, основанных на нагревании, стерилизация паром — безусловно, лучший вариант для салонов татуировок и пирсинга. Альтернативой всегда является сухой жар, но в долгосрочной перспективе он, скорее всего, будет стоить вам денег. Вы потратите больше на счета за электроэнергию, вы не сможете увидеть столько клиентов за день, вам, вероятно, придется отремонтировать или заменить его раньше, чем автоклав, вы не сможете стерилизовать предметы в таком же количестве материалов, и вы с большей вероятностью повредите инструменты в стерилизаторе сухого нагрева.Не требуется жарких дебатов, чтобы объявить победителем метод тепловой стерилизации; стерилизация паром каждый раз получает голубую ленту.
Дополнительная информация о стерилизации
Эта статья о стерилизации с помощью тепла является частью серии по стерилизации, состоящей из 6 частей. Вы можете получить обзор всех методов стерилизации, узнать больше о стерилизации паром, лучше понять различные классы стерилизации или узнать о доступных альтернативах стерилизации для небольших салонов татуировок и пирсинга, прочитав наши другие статьи из серии статей о стерилизации ниже.
Артикул:
http://www.priorclavena.com/steam-autoclaves-steam-sterilizers/dry-heat-sterilizers-vs-steam-autoclaves/
http://microbiologyon-line.blogspot.com/2009/08/physical- control-of-microorganisms.html
http://www.tuttnauer.com/blog/sterilization-heat
http://www.tuttnauer.com/blog/steam
https://info.painfulpleasures.com/help- центр / безопасность магазина / методы стерилизации-0
5 основных причин неудачной стерилизации паром
Опубликовано автор: Мередит
Автоклавы
— ценные инструменты, которые используются во многих отраслях промышленности.В медицинских учреждениях автоклавы защищают пациентов, устраняя патогены из инструментов и оборудования. В лаборатории автоклавы дают ученым уверенность в том, что они устранили биологические факторы, которые могут повлиять на их результаты. На производственных предприятиях автоклавы используются множеством инновационных способов для создания новых продуктов и материалов, таких как газобетон.
Однако, когда автоклавы не работают должным образом, они никому не приносят пользы. Вот некоторые из наиболее распространенных причин сбоя цикла стерилизации в автоклаве паром:
Выбор неправильного цикла для содержимого автоклава
Никто не хочет слышать, что проблема в них, но человеческий фактор лежит в основе многих случаев неудачной стерилизации.
Хотя паровой автоклав может обрабатывать множество различных объектов, не все материалы можно стерилизовать одинаково. Например, если вы стерилизуете обернутые медицинские инструменты с помощью гравитационного цикла автоклава, стерилизующий пар может попасть не во все части ваших инструментов.
Если вы столкнулись с неудачной стерилизацией, сначала посмотрите, с чего вы начали, и подумайте, правильно ли вы выбрали цикл для содержимого автоклава. Вы можете узнать больше о том, какие циклы стерилизации подходят для различных материалов, ознакомившись с нашей статьей «Какой цикл автоклавирования мне нужен для моей работы?» Почта.
Несоответствующая упаковка или загрузка
Хотя некоторые предметы, например, большая стеклянная посуда, могут попасть в автоклав полностью открытыми, многие более мелкие предметы необходимо упаковать или обернуть перед стерилизацией. Обертывание гарантирует, что стерилизационный пар равномерно достигает всех материалов.
Однако неправильная упаковка пакета материалов может помешать стерилизации автоклава. Это еще один пример того, как человеческая ошибка может повлиять на ваш цикл стерилизации.
Кроме того, при загрузке камеры автоклава технические специалисты должны размещать материалы в соответствии с инструкциями производителя оборудования. Если ваш автоклав загружен не так, как задумал производитель, он может работать неправильно.
Надлежащие протоколы упаковки и загрузки должны быть частью обучения помощников врачей и стоматологов, инженеров по стерилизации, лаборантов или любых других специалистов, которые могут нести ответственность за подготовку материалов для помещения в автоклав.
Низкое качество пара
Если после цикла стерилизации вы видите влажные пакеты и материалы, возможно, в вашем автоклаве пар низкого качества.
Низкое качество пара может быть вызвано множеством факторов. Если «вес» (содержание воды) пара выходит за рамки желаемых параметров, это может повлиять на способность автоклава функционировать должным образом. Перегретый пар — пар, нагретый выше точки, в которой вся жидкость испарилась, — также считается некачественным для стерилизации.
Чтобы понять, как вы производите пар, важно иметь четкое представление о температуре и давлении в камере автоклава. Для создания этих профилей полезны измерительные устройства, такие как регистраторы данных.
Отказ вакуума
Если вы стерилизуете небольшие пористые материалы или материалы неправильной формы, вам необходимо использовать цикл вакуумной стерилизации. В вакуумном цикле весь воздух принудительно удаляется из автоклава во время предварительного кондиционирования.Это позволяет стерильному пару проникать в каждый уголок вашего содержимого.
Если ваш автоклав не может создать адекватные условия вакуума, цикл стерилизации не удастся. Самый простой способ узнать, есть ли у вас отказ вакуума, — это использовать тест Боуи-Дика. Тест Боуи-Дика — это специализированный тестовый лист, в котором используются паровые и воздушные барьеры, чтобы подтвердить, что ваш автоклав создает надлежащую вакуумную среду для производства пара и стерилизации.
Чтобы узнать больше о пользе теста Боуи-Дика для владельцев автоклавов, загрузите бесплатную копию нашего Руководства по валидации автоклавов!
Неадекватные температуры
Стерилизация паром просто невозможна без высоких температур.Конкретная температура, при которой вы будете стерилизовать, будет зависеть от множества факторов, таких как стерилизуемые материалы, характер вашей работы и надлежащая производственная или лабораторная практика.
Температуру в автоклаве можно дважды проверить или подтвердить с помощью регистратора данных температуры или аналогичного устройства. Если температура вашего автоклава не достигает 100 ° C, он вообще не может производить пар! Если она не достигает 121 ° C, значит, она не достигает порога, необходимого для стерилизации.
Проведите исследование температур автоклава на протяжении всего цикла стерилизации, чтобы определить, достигаются ли вы подходящие условия для стерилизации.
Неудачная стерилизация может стоить компаниям и лабораториям драгоценного времени и денег, будь то человеческая ошибка или неисправность оборудования. Чтобы этого не случилось с вами, убедитесь, что у вас есть план проверки автоклава, и обучите всех пользователей автоклава правильной подготовке и использованию устройства.
Чтобы узнать больше, скачайте бесплатное руководство!
О Мередит:
Мередит присоединилась к MadgeTech в мае 2014 года в качестве менеджера по маркетинговым исследованиям и контенту.

 2)
2)


 Принцип размещения тестовой упаковки представлен в табл. 5;
Принцип размещения тестовой упаковки представлен в табл. 5;