Острый некроз скелетных мышц — 1001 салат
Posted on

Koppel отличает первичный индуцированный токсинами острый некроз скелетных мышц (их болезнь, вызванную непосредственным токсическим действием лекарства или токсина) от вторичного, обусловленного ишемией мышц после передозировки лекарств, что может быть связано с местным сдавлением мускулатуры при коме, продолжительными эпилептическими припадками и миоклонией, а также гипокалиемией, вызванной хроническим приемом медикаментов.
Факторы, предрасполагающие к развитию острого некроза скелетных мышц, схема его дифференциальной диагностики представлены ниже. Обзор этиологии индуцированного лекарствами и токсинами острого некроза скелетных мышц можно найти в работе Curry и соавт..
Факторы, предрасполагающие к острому некрозу скелетных мышц:
— Дегидратация
— Гипокалиемия, гипофосфатемия, неполноценное питание
— Психическая болезнь
— Возбуждение, спутанность сознания, делирий
— Эндокринопатии (например, гипотиреоз, диабетический кетоацидоз)
— Шок, гипотензия
— Гипоксия, ацидоз
Дифференциальная диагностика острого некроза скелетных мышц:
а) Фармакогенный острый некроз скелетных мышц:
Индуцированный токсином острый некроз скелетных мышц
Вторичный острый некроз скелетных мышц в результате мышечной ишемии при передозировке лекарств
Злокачественная гипертермия
Злокачественный нейролептический синдром
Центральный антихолинергический синдром
Фармакогенный полимиозит/дерматомиозит
б) Мышечная ишемия:
Краш-синдром, повышение внутримышечного давления, шок от наложения жгута
Серповидно-клеточная анемия
Шок и кома
Окклюзионная болезнь артерий
в) Перегрузка мышц:
Марафонский бег, военная тренировка
Эпилептический статус, продолжительные миоклонус или дистония
Возбуждение, делирий
г) Физическое повреждение:
Тепловой удар Ожоги
Инфекции
Вирусные (Коксаки, герпес, ECHO, грипп)
Бактериальные (клостридии, легионелла, брюшной тиф, стафилококки)
д) Нарушение электролитного и водного баланса:
Гипокалиемия, гипернатриемия, гипофосфатемия
Гиперосмотические состояния
Эндокринная дисфункция
Генетические дефекты
Дефицит гликолитических ферментов
Дефицит карнитин-пальмитоилтрансферазы
е) Невропатии:
Полиневропатия
Болезнь двигательных нейронов
Миоглобин. Миоглобин представляет собой глобулярный гемопротеин с молекулярной массой 17 500 Д, содержащий такую же гем-группу, что гемоглобин и цитохромы. Он связывает только одну молекулу кислорода и служит для создания его запаса, расходуемого при кислородном голодании мышцы.
Нормальный уровень сывороточного миоглобина составляет 3—80 мкг/л, а его объем распределения — около 0,4 л/кг. В кровотоке миоглобин связан с а2-глобулином. Его период полужизни составляет примерно 1—3 ч. При остром некрозе скелетных мыши и инфаркте миокарда подъем сывороточного уровня миоглобина происходит раньше, чем креатинкиназы. Когда он превышает 2000 мкг/л, нарушается работа почек.
Когда моча очень концентрированная, особенно при низком ее рН, вливание миоглобина неизменно приводит к острой почечной недостаточности.
При рН 5,6 и ниже миоглобин диссоциирует на ферригемат и глобулин. Ферригемат приводит к нарушению почечной функции и выводится с мочой. При высокой концентрации в моче миоглобина (более 1000 мкг/мл) наблюдается покраснение ее или плазмы. Миоглобин в моче можно обнаружить с помощью индикаторной палочки на кровь (гемоглобин) даже в такой низкой концентрации, как 5—10 мкг/мл.
Отрицательный результат такого теста не исключает возможности острого некроза скелетных мышц. Розовая плазма при ортотолуидин-положительной моче говорит о гемолизе и по крайней мере некоторой гемоглобинемии. Ортотолуидин-положительная на кровь моча без розового окрашивания плазмы обусловлена миоглобинурией (если в моче нет большого количества эритроцитов, связанного с кровотечением в мочевыводящих путях).
Уход из костей, мышц и суставов необходимо, чтобы оставаться активным и сильным на всю жизнь. Можете ли вы представить, что участие в марафоне или невинных смешивания сока грейпфрута с наркотиками, которые снижают уровень холестери
Острый некроз скелетных мышц • ru.knowledgr.com
Острый некроз скелетных мышц — условие в который поврежденная ткань скелетной мышцы (греческий язык: rhabdo-полосатый μυς myo-мышца), ломается (греческий язык: –lysis) быстро. Продукты распада поврежденных мышечных клеток выпущены в кровоток; некоторые из них, такие как миоглобин белка, вредны для почек и могут привести к почечной недостаточности. Серьезность признаков, которые могут включать боли в мышцах, рвоту и беспорядок, зависит от степени повреждения мускула и развивается ли почечная недостаточность. Повреждение мускула может быть вызвано физическими факторами (например, рана давки, напряженное осуществление, лекарства, злоупотребление наркотиками и инфекции). У некоторых людей есть наследственное заболевание мышц, которое увеличивает риск острого некроза скелетных мышц. Диагноз обычно ставится с анализами крови и urinalysis. Оплот лечения — щедрые количества внутривенных жидкостей, но может включать диализ или hemofiltration в более серьезных случаях.
Острый некроз скелетных мышц и его осложнения — значительные проблемы для раненных в бедствиях, таких как землетрясения и бомбежки. Усилия по оказанию помощи в областях, пораженных землетрясениями часто, включают бригады врачей с навыками и оборудованием, чтобы рассматривать оставшихся в живых с острым некрозом скелетных мышц. Болезнь была сначала описана в 20-м веке, и важные открытия относительно ее механизма были сделаны во время Блица Лондона в 1941. Лошади могут также страдать от острого некроза скелетных мышц от множества причин.
Знаки и признаки
Симптомы острого некроза скелетных мышц зависят от его серьезности и развивается ли почечная недостаточность. Более умеренные формы могут не вызвать признаки мышц, и диагноз основан на неправильных анализах крови в контексте других проблем. Более тяжелый острый некроз скелетных мышц характеризуется болью в мышцах, нежностью, слабостью и опухолью затронутых мышц. Если опухоль очень быстра, как это может произойти после того, как кто-то освобожден из-под разрушенного здания, движение жидкости от кровотока в поврежденную мышцу может вызвать пониженное давление и шок. Другие признаки неопределенные и происходят или от последствий расстройства мышечной ткани или от условия, которое первоначально привело к расстройству мышц. Выпуск компонентов мышечной ткани в кровоток вызывает беспорядки электролита, которые могут привести к тошноте, рвоте, беспорядку, коме или неправильному сердечному ритму и ритму. Моча может быть темной, часто описываемая как «цвета чая», из-за присутствия миоглобина. Повреждение почек может дать начало уменьшенному или отсутствующему производству мочи, обычно спустя 12 — 24 часа после начального повреждения мускула.
Опухоль поврежденной мышцы иногда приводит к синдрому отделения — сжатию окружающих тканей, таких как нервы и кровеносные сосуды, в том же самом фасциальном отделении — приведение к потере кровоснабжения и повреждения или потере функции в части (ях) тела, поставляемого этими структурами. Признаки этого осложнения включают боль или уменьшенную сенсацию в затронутой конечности. Второе признанное осложнение — диссеминированное внутрисосудистое свертывание (DIC), серьезное разрушение в свертывании крови, которое может привести к кровотечению не поддающемуся контролю.
Причины
Любая форма повреждения мускула достаточной серьезности может вызвать острый некроз скелетных мышц. Многократные причины могут присутствовать одновременно в одном человеке. У некоторых есть основное заболевание мышц, обычно наследственное в природе, которая делает их более подверженными острому некрозу скелетных мышц.
Общие и важные причины
Генетическая предрасположенность
Рецидивирующий острый некроз скелетных мышц может следовать из внутренних дефицитов фермента мышц, которые обычно наследуются и часто появляются во время детства. Много структурных мышечных патологий показывают эпизоды острого некроза скелетных мышц, которые вызваны осуществлением, общим наркозом или любой из других причин упомянутого выше острого некроза скелетных мышц. Унаследованные заболевания мышц и инфекции вместе вызывают большинство острого некроза скелетных мышц в детях.
Следующие наследственные заболевания энергоснабжения мышц могут вызвать текущий и обычно exertional острый некроз скелетных мышц:
- Glycolysis и дефекты glycogenolysis: болезнь Макардла, phosphofructokinase дефицит, гликогенозы VIII, IX, X и XI
- Дефекты метаболизма липида: карнитин palmitoyltransferase I и II дефицитов, дефицит подтипов дегидрогеназы acyl CoA (LCAD, СТАВРИДА, MCAD, VLCAD, 3-hydroxyacyl-coenzyme дефицит дегидрогеназы), thiolase дефицит
- Хромосомные миопатии: дефицит succinate дегидрогеназы, цитохром c оксидаза и
коэнзим Q10
- Другие: дефицит дегидрогеназы glucose-6-phosphate, myoadenylate deaminase дефицит и мышечные дистрофии
Механизм
Повреждение скелетной мышцы может принять различные формы. Давка и другие телесные повреждения наносят вред мышечным клеткам непосредственно или вмешиваются в кровоснабжение, в то время как нефизические причины вмешиваются в метаболизм мышечной клетки. Когда поврежденный, мышечная ткань быстро заполняется жидкостью от кровотока, включая ионы натрия. Опухоль себя может привести к разрушению мышечных клеток, но те клетки, которые выживают, подвергаются различным разрушениям, которые ведут, чтобы повыситься во внутриклеточных ионах кальция; накопление кальция вне sarcoplasmic сеточки приводит к непрерывному сокращению мышц и истощению ATP, главному перевозчику энергии в клетке. Истощение ATP может самостоятельно привести к безудержному притоку кальция. Постоянное сокращение мышечной клетки приводит к расстройству внутриклеточных белков и распаду клетки.
Гранулоциты нейтрофила — самый богатый тип лейкоцита — входит в мышечную ткань, производя подстрекательскую реакцию и выпуская реактивные кислородные разновидности, особенно после раны давки. Синдром давки может также нанести повреждения реперфузии, когда кровоток к развернутой мышце внезапно восстановлен.
Раздутая, воспламененная мышца может непосредственно сжать структуры в том же самом фасциальном отделении, вызвав синдром отделения. Опухоль может также далее поставить под угрозу кровоснабжение в область. Наконец, разрушенные мышечные клетки выпускают ионы калия, ионы фосфата, heme-содержание миоглобина белка, киназы креатина фермента и мочевой кислоты (продукт распада пуринов от ДНК) в кровь. Активация системы коагуляции может ускорить диссеминированное внутрисосудистое свертывание. Высокие уровни калия могут привести к потенциально фатальным разрушениям в сердечном ритме. Фосфат связывает с кальцием от обращения, приводя к низким уровням кальция в крови.
Острый некроз скелетных мышц может вызвать почечную недостаточность несколькими механизмами. Самым важным является накопление миоглобина в почечных трубочках. Обычно, белок крови haptoglobin связывает обращающийся миоглобин и другой heme-содержащий вещества, но при остром некрозе скелетных мышц количество миоглобина превышает связывающую способность haptoglobin. Myoglobinuria, присутствие миоглобина в моче, происходит, когда уровень в плазме превышает 0.5-1.5 мг/дл; как только плазменные уровни достигают 100 мг/дл, концентрация в моче становится достаточной для него, чтобы быть явно обесцвеченной и соответствует разрушению приблизительно 200 граммов мышцы. Поскольку почки повторно поглощают больше воды от, миоглобин взаимодействует с белком Тамма-Хорсфола в nephron, чтобы сформировать броски (твердые совокупности), которые затрудняют нормальный поток жидкости; условие ухудшено далее высокими уровнями мочевой кислоты и окислением фильтрата, которые увеличивают формирование броска. Железо, выпущенное от heme, производит реактивные кислородные разновидности, повреждая почечные клетки. В дополнение к myoglobinuria два других механизма способствуют почечному ухудшению: пониженное давление приводит к сжатию кровеносных сосудов и поэтому относительного отсутствия кровотока к почке, и наконец мочевая кислота может сформировать кристаллы в трубочках почек, вызвав преграду. Вместе, эти процессы приводят к острому трубчатому некрозу, разрушению клеток трубочек. Клубочковые падения уровня фильтрации и почка неспособны выполнить ее нормальные выделительные функции. Это вызывает разрушение регулирования электролита, приводя к дальнейшему повышению уровней калия, и вмешивается в обработку витамина D, далее ухудшая низкие уровни кальция.
Диагноз
Диагноз острого некроза скелетных мышц может подозреваться в любом, кто получил травму, рану давки или продлил иммобилизацию, но это может также быть определено на более поздней стадии из-за ухудшения почечной функции (неправильно поднятый или увеличивающийся креатинин и уровни мочевины, падающая добыча мочи) или красновато-коричневое обесцвечивание мочи.
Общие расследования
Самый надежный тест в диагнозе острого некроза скелетных мышц — уровень киназы креатина (CK) в крови. Этот фермент выпущен поврежденной мышцей, и уровни выше 5 раз верхнего предела нормальных (ULN) указывают на острый некроз скелетных мышц. В зависимости от степени острого некроза скелетных мышц концентрации до 100 000 U/l весьма обычны. Концентрации CK постоянно повышаются в течение 12 часов после оригинальной травмы мышцы, остаются поднятыми в течение 1–3 дней и затем постепенно падают. У начальной буквы и пиковых уровней CK есть линейное соотношение с риском острой почечной недостаточности: чем выше CK, тем более вероятно случается так, что почечное повреждение произойдет. Нет никакой определенной концентрации CK, выше которого определенно происходит почечное ухудшение; концентрации ниже 20,000 U/l вряд ли будут связаны с риском почечного ухудшения, если не будут другие факторы риска содействия. Умеренные повышения без почечного ухудшения упоминаются как «hyperCKemia». Myoglobin имеет короткую полужизнь и поэтому менее полезен как диагностический тест на более поздних стадиях. Его обнаружение в крови или моче связано с более высоким риском почечного ухудшения. Несмотря на это, использование измерения миоглобина мочи не поддержано доказательствами, поскольку это испытывает недостаток в специфике, и исследование, изучающее его полезность, имеет низкое качество.
Могут быть обнаружены поднятые концентрации молочнокислой дегидрогеназы фермента (LDH). Другие маркеры повреждения мускула, такие как aldolase, тропонин, углеродистый anhydrase тип 3 и жирный белок связывания кислоты (FABP), главным образом используются при хронических мышечных патологиях. Трансаминазы, ферменты, изобилующие и печенью и мышечной тканью, также обычно увеличиваются; это может привести к условию, перепутанному с острым повреждением печени, по крайней мере на ранних стадиях. Заболеваемость фактическим острым повреждением печени составляет 25% у людей с нетравмирующим острым некрозом скелетных мышц; механизм для этого сомнителен.
Высокие уровни калия имеют тенденцию быть особенностью тяжелого острого некроза скелетных мышц. Электрокардиография (кардиограмма) может показать, затрагивают ли поднятые уровни калия систему проводимости сердца, как предложено присутствием изменений волны T или расширяются комплекса QRS. Низкие уровни кальция могут присутствовать в начальной стадии из-за закрепления бесплатного кальция к поврежденным мышечным клеткам.
Urinalysis испытательной полосой мочи может показать положительный результат для «крови», даже при том, что никакие эритроциты не могут быть определены на микроскопии мочи; это происходит, потому что реактив на испытательной полосе реагирует с миоглобином. То же самое явление может произойти в условиях, которые приводят к гемолизу, разрушению эритроцитов; при гемолизе также явно обесцвечена сыворотка крови, в то время как при остром некрозе скелетных мышц это нормально. Если почечное повреждение произошло, микроскопия мочи также показывает мочевые броски, которые кажутся пигментированными и гранулированными.
Осложнения
Синдром отделения — клинический диагноз, т.е., никакой диагностический тест окончательно не доказывает свое присутствие или отсутствие, но прямое измерение давления в фасциальном отделении и различие между этим давлением и кровяным давлением, могут использоваться, чтобы оценить его серьезность. Высокое давление в отделении и небольшой разнице между давлением отделения и кровяным давлением указывает, что кровоснабжение, вероятно, будет недостаточно, и что хирургическое вмешательство может быть необходимо.
Диссеминированное внутрисосудистое свертывание, другое осложнение острого некроза скелетных мышц и другие формы критической болезни, может подозреваться на основе неожиданного кровотечения или отклонений в гематологических тестах, таких как уменьшающееся количество тромбоцитов или продление времени протромбина. Диагноз может быть подтвержден со стандартными анализами крови на DIC, такими как D-dimer.
Лежание в основе беспорядков
Если основная мышечная патология подозревается, например если нет никакого очевидного объяснения или были многократные эпизоды, может быть необходимо выполнить дальнейшие расследования. Во время нападения низкие уровни карнитина в уровнях в крови и высоких уровнях acylcarnitine в крови и моче могут указать на дефект метаболизма липида, но эти отклонения возвращаются к нормальному во время выздоровления. Другие тесты могут использоваться на той стадии, чтобы продемонстрировать эти беспорядки. Беспорядки glycolysis могут быть обнаружены различными средствами, включая измерение лактата после осуществления; отказ лактата повыситься может быть показательным из беспорядка в glycolysis, в то время как преувеличенный ответ типичен для митохондриальных болезней. Electromyography (EMG) может показать особые образцы при определенных мышечных патологиях; например, болезнь Макардла и phosphofructokinase дефицит показывают явление, названное подобной судороге контрактурой. Есть генетические тесты, доступные для многих наследственных заболеваний мышц, которые предрасполагают к myoglobinuria и острому некрозу скелетных мышц.
Биопсия мышц может быть полезной, если эпизод острого некроза скелетных мышц, как думают, является результатом основного заболевания мышц. Образец биопсии, взятый во время эпизода, часто неинформативен, поскольку он приведет только доказательство некроза клеток или может казаться нормальным. Взятие образца поэтому отсрочено на несколько недель или месяцев. Гистопатологическое появление на биопсии указывает на природу основного беспорядка. Например, митохондриальные болезни характеризуются рваными красными волокнами. Места биопсии могут быть определены медицинским отображением, таким как магнитно-резонансная томография, поскольку мышцы не могут быть однородно затронуты.
Лечение
Главная цель лечения состоит в том, чтобы лечить шок и сохранить почечную функцию. Первоначально это сделано администрацией щедрых количеств внутривенных жидкостей, обычно изотонический солончак (вес на 0,9% за раствор поваренной соли объема). В жертвах синдрома давки рекомендуется управлять внутривенными жидкостями даже, прежде чем они будут извлечены из разрушенных структур. Это гарантирует достаточный обращающийся объем, чтобы иметь дело с опухолью мышечной клетки (который, как правило, начинается, когда кровоснабжение восстановлено), и предотвратить смещение миоглобина в почках. Суммы 6 — 12 литров более чем 24 часа рекомендуются. Уровень жидкой администрации может быть изменен, чтобы достигнуть высокой добычи мочи (200-300 мл/ч во взрослых), если нет другие причины, почему это могло бы привести к осложнениям, таким как история сердечной недостаточности.
В то время как много источников рекомендуют дополнительным внутривенным агентам уменьшить повреждение почки, большинство доказательств, поддерживающих эту практику, прибывает из исследований на животных, и непоследовательно и противоречиво. Маннит действует по осмосу, чтобы увеличить производство мочи и, как думают, предотвращает смещение миоглобина в почке, но ее эффективность не показали в исследованиях и есть риск ухудшения почечной функции. Добавление бикарбоната к внутривенным жидкостям может облегчить ацидоз (высокий кислотный уровень крови) и сделать мочу более щелочной, чтобы предотвратить формирование броска в почках, но есть ограниченные доказательства, что это обладает преимуществами выше одного только солончака, и это может ухудшить гипокальцемию, увеличив смещение кальция и фосфата в тканях. Если подщелачивание мочи используется, pH фактор мочи сохранен в 6,5 или выше. Фуросемид, мочегонное средство петли, часто используется, чтобы гарантировать достаточное производство мочи, но доказательствам, что это предотвращает почечную недостаточность, недостает.
Электролиты
В начальных стадиях уровни электролита часто неправильны и требуют исправления. Высокие уровни калия могут быть опасными для жизни, и ответить на увеличенное производство мочи и почечную заместительную терапию (см. ниже). Временные меры включают администрацию кальция, чтобы защитить от сердечных осложнений, инсулина или salbutamol, чтобы перераспределить калий в клетки и вливания решения для бикарбоната.
Уровни кальция первоначально имеют тенденцию быть низкими, но поскольку ситуация улучшается, кальций выпущен от того, где это ускорило с фосфатом и производственными резюме витамина D, приведя к гиперкальцемии (аномально высокие уровни кальция). Это «проскакивание» происходит у 20-30% тех людей, которые заболели почечной недостаточностью.
Острое почечное ухудшение
Почечная дисфункция, как правило, развивается спустя 1-2 дня после начального повреждения мускула. Если поддерживающее лечение несоответствующее, чтобы управлять этим, почечная заместительная терапия (RRT) может требоваться. RRT удаляет избыточный калий, кислоту и фосфат, которые накапливаются, когда почки неспособны функционировать обычно и требуются, пока почечная функция не возвращена.
Три главных метода RRT доступны: гемодиализ, непрерывный hemofiltration и брюшинный диализ. Прежние два требуют доступа к кровотоку (катетер диализа), в то время как брюшинный диализ достигнут жидкостью прививания в брюшную полость и более позднее иссушение его. Гемодиализ, который обычно делается несколько раз в неделю при хронической болезни почек, часто требуется ежедневно при остром некрозе скелетных мышц. Его преимущество перед непрерывным hemofiltration состоит в том, что одна машина может использоваться многократно в день, и что непрерывное применение наркотиков антикоагулянта не необходимо. Hemofiltration более эффективный при удалении больших молекул от кровотока, такой как миоглобин, но это, кажется, не приносит особой пользы. Брюшинным диализом может быть трудно управлять в ком-то с тяжелой раной брюшной полости, и это может быть менее эффективно, чем другие методы.
Другие осложнения
Синдром отделения рассматривают с хирургией, чтобы уменьшить давление в отделении мышц и снизить риск сжатия на кровеносных сосудах и нервах в той области. Fasciotomy — разрез затронутого отделения. Часто, многократные разрезы сделаны и оставлены открытые, пока опухоль не уменьшила. В том пункте разрезы закрыты, часто требуя хирургической обработки (удаление нежизнеспособной ткани) и прививание кожи в процессе. Потребность в fasciotomy может быть уменьшена, если маннит используется, поскольку это может уменьшить мышцу, раздувающуюся непосредственно.
Диссеминированное внутрисосудистое свертывание обычно решает, когда первопричины рассматривают, но поддерживающие меры часто требуются. Например, если количество тромбоцитов понижается значительно и есть проистекающее кровотечение, пластинками можно управлять.
Прогноз
Прогноз зависит от первопричины и происходят ли какие-либо осложнения. У острого некроза скелетных мышц, осложненного острым почечным ухудшением в пациентах с травматическим повреждением, может быть смертность 20%. Допуск к отделению интенсивной терапии связан со смертностью 22% в отсутствие острого повреждения почки и 59%, если почечное ухудшение происходит. Большинство людей, которые выдержали почечное ухудшение из-за острого некроза скелетных мышц полностью, возвращает свою почечную функцию.
Эпидемиология
Точную заболеваемость острым некрозом скелетных мышц трудно установить, потому что использовались различные определения. В 1995 больницы в США сообщили о 26 000 случаев острого некроза скелетных мышц. До 85% людей с серьезными травматическими повреждениями испытают определенную степень острого некроза скелетных мышц. Из тех с острым некрозом скелетных мышц 10-50% заболевают острым повреждением почки. Риск выше у людей с историей незаконного употребления наркотиков, неправильного употребления алкоголя или травмы, когда по сравнению с мышечными патологиями, и это особенно высоко, если многократные факторы содействия происходят вместе. Острый некроз скелетных мышц составляет 7-10% всех случаев острого повреждения почки в американском
Раны давки распространены в крупных катастрофах, но особенно так в землетрясениях. Последствие 1988 землетрясение Спитака вызвало учреждение, в 1995, Почечной Рабочей группы по Помощи при бедствиях, рабочей группы международного общества Нефрологии (международная организация почечных экспертов). Его волонтерские врачи и медсестры помогли впервые в 1999 İzmit землетрясению в Турции, где 462 человека получили диализ с положительными результатами. Единицы лечения обычно устанавливаются за пределами непосредственной зоны бедствия, поскольку толчки могли потенциально ранить или убить штат и сделать оборудование непригодным.
История
Библия может содержать ранний счет острого некроза скелетных мышц. В, Пятикнижие говорит, что евреи потребовали мясо, путешествуя в пустыне; Бог послал перепела в ответ на жалобы, и люди съели большие количества мяса перепела. Чума тогда вспыхнула, убив многочисленных людей. Острый некроз скелетных мышц после потребления перепела был описан в более свежие времена и назвал coturnism (после того, как Coturnix, главный род перепела). Мигрирующий перепел потребляет большие количества болиголова, известную причину острого некроза скелетных мышц.
В современные времена, прежние доклады с 1908 землетрясение Мессины и Первая мировая война на почечной недостаточности после раны сопровождались исследованиями лондонскими врачами Эриком Биуотерсом и Десмондом Беолом, работающим в Королевской Медицинской школе Последипломного образования и Национальном Институте Медицинского Исследования, на четырех жертвах Блица в 1941. Myoglobin был продемонстрирован в моче жертв спектроскопией, и было отмечено, что почки жертв напомнили те из пациентов, у которых был hemoglobinuria (гемоглобин, а не миоглобин, являющийся причиной почечного повреждения). В 1944 Биуотерс продемонстрировал экспериментально, что почечная недостаточность была, главным образом, вызвана миоглобином. Уже во время войны, бригады докторов поехали в разбомбленные области, чтобы оказать медицинскую поддержку, в основном с внутривенными жидкостями, поскольку диализ еще не был доступен. Прогноз острой почечной недостаточности улучшился заметно, когда диализ был добавлен к поддерживающему лечению, которое сначала произошло во время 1950–1953 Корейских войн.
Другие животные
Острый некроз скелетных мышц признан у лошадей. Лошади могут заболеть многими заболеваниями мышц, многие из которых могут прогрессировать до острого некроза скелетных мышц. Из них некоторая причина изолировала приступы острого некроза скелетных мышц (например, диетический дефицит в витамине Е и селене, отравляя связанный с пастбищем или сельскохозяйственными ядами, такими как органофосфаты), в то время как другие предрасполагают к exertional острому некрозу скелетных мышц (например, наследственная миопатия хранения полисахарида лошади условия). 5-10% чистокровных лошадей и некоторых отвечающих стандартам лошадей болеет от лошади условия exertional острым некрозом скелетных мышц; никакая определенная причина не была определена, но подозревается основной беспорядок регулирования кальция мышц.
Лошади воздействия острого некроза скелетных мышц могут также произойти при вспышках; о них сообщили во многих европейских странах, и позже в Канаде, Австралии и Соединенных Штатах. Это упоминалось как «нетипичная миопатия» или «myoglobinuria неизвестной этиологии». Никакая единственная причина еще не была найдена, но были предложены различные механизмы, и наблюдался сезонный образец. Обнаружены очень высокие уровни киназы креатина, и смертность от этого условия составляет 89%.
Некроз скелетных мышц. Рабдомиолиз – острый некроз скелетных мышц
У молодых к развитию состояния приводят, чаще всего, наследственные заболевания, а у людей в возрасте от 30 лет — причины заболевания разнообразны и полиморфичны.
Причины
Патогенетическая причина мышечного некроза — разрушение клеток мышечной ткани, что приводит к выходу миоглобина в кровь (миоглобинурия). В кислой среде почек миоглобин переходит в гематин и фактически забивает почечные канальцы, что приводит к развитию острой почечной недостаточности.
Погибшие клетки мышечной ткани не нуждаются в креатине, который буквально выбрасывается в кровь, где трансформируется в креатинин. Чтобы устранить креатининемию, организм вынужден вырабатывать повышенные объемы креатинфосфокиназы, нарушая тем самым гомеостаз.
Сам миоглобин токсичен для организма, особенно в условиях массивного его выброса в кровь, это ухудшает метаболизм практически во всех тканях организма и приводит к развитию угрожающих жизни состояний.
Причин развития некроза много. Среди них: наследственно-генетические причины, синдром длительного сдавливания, нелеченная миопатия и другие заболевания мышц. Частая причина — вирусные и инфекционные заболевания, особенно протекающие с высокой температурой, прием некоторых лекарственных средств, обширные ожоги. Нередко к некрозу мышц приводит значительное мышечное усилие, в том числе травматическое, или хронические чрезмерные физические нагрузки.
У лиц, злоупотребляющих алкоголем, а также у курильщиков, выкуривающих более 20 сигарет в день, риск развития миоглобинемии чрезвычайно высок. В данном случае к нему приводят токсические эффекты этанола, угарного газа и других продуктов горения, а также некоторых веществ, содержащихся в никотине. Рабдомиолиз часто развивается у «поклонников» героина, амфетаминов, кокаина.
Отравление змеиным ядом, ядом скорпиона, «черной вдовы», ядовитых грибов — тоже частые причины мышечного некроза.
Симптомы
Чем обширнее очаг распада — тем больше выражены симптомы. В самом начале заболевания больные жалуются на локальный отек — он, как правило, соответствует пораженной мышце. Практически сразу же вслед за отеком появляются боли в мышцах, которые сначала ограничивают движения толь
РАБДОМИОЛИЗ — Справочник по болезням
мед.
Рабдомиолиз — синдром, развивающийся вследствие повреждения скелетной мышцы с появлением в результате этого в крови свободного миоглобина (миоглобинемия). Миоглобин крови фильтруется клубочками почек и появляется в моче (миоглобинурия), что может привести к развитию ОПН. Генетические аспекты
● Рабдомиолиз острый рецидивирующий (миоглобинурия семейная пароксизмальная,
● 268200, р)
● Гипогликемия гипокетотическая (#255120, llq, ген карнитин пальмитоил транс-феразы I CPT1,
● 600528, р)
● Миопатия с недостаточностью карнитин пальмитоил трансферазы II (-#255110, ген карнитин пальмитоил трансферазы II СРТ2, 600650, р).
.
❐ Преобладающий возраст
● Зависит от этиологии острого некроза скелетных мышц
● В более молодом возрасте к острому некрозу скелетных мышц ведут наследственные нарушения
● Другие причины (травма, инфекция) могут вызвать рабдомиолиз в любом возрасте. Этиология
● Наследственные нарушения метаболизма (см. Генетические аспекты)
● Электролитные нарушения (гипокалиемия, гипо-фосфатемия)
● Миопатии
● Полимиозит, дерматомиозит
● Злокачественная гипертермия
● Злокачественный синдром при приёме некоторых ЛС (анестетики, фенотиазины, ингибиторы МАО)
● Мышечное напряжение (физическое, вторичное при спастичности или тепловом ударе)
● Травма
● Ишемия мышц при окклюзии артерий или сердечно-сосудистой недостаточности
● Ожоги
● Повторные повреждения мышц (например, при занятиях спортом), длительное давление на мышцы
● Эпилептический статус
● Инфекционные заболевания
● Вирусы (гриппа А, Эпстшна-Барр, ветряной оспы)
● Бактерии
● Токсические повреждения мышц
● Алкоголь
● Яд змей (при укусах)
● Монооксид углерода (угарный газ)
● Кокаин, героин, амфетамин
● Передозировка ЛС
● Теофиллин
● Изониазид
● Злокачественные новообразования (острая некротическая миопатия опухолей)
● Сахарный диабет.
.
❐ Патоморфология
● Некроз мышц
● Картина поражения почек миоглобином напоминает острый канальцевый некроз другой этиологии.
✎ Клиническая картина. В начале заболевания возможны боль, мышечная слабость, отёчность мышц (физикальное обследование может не выявить патологию со стороны мышц, несмотря на миоглобинурию)
● Симптомы и признаки почечной недостаточности аналогичны таковым при ОПН другой этиологии.
.
❐ Дифференциальная диагностика
● Заболевания, вызывающие некротические изменения канальцев почек
● Почечное повреждение гемоглобиновыми пигментами.
.
❐ Лабораторные исследования
● Повышение уровня в крови ферментов мышц (КФК, альдолаза, ЛДГ)
● Повышение уровней калия и фосфора вследствие повреждения мышц
● Гипокальциемия во время олигурии, иногда гиперкальциемия в период восстановления после острого канальцевого некроза
● Анализ мочи — положительный результат исследования мочи на кровь без обнаружения эритроцитов в осадке
● Может наблюдаться высокая гиперурикемия, способная вызвать острую мочекислую нефропатию
● Уровень витамина D бывает уменьшен в период олигурии
● Иногда встречается обратимая дисфункция печени. Специальные исследования
● Гипокальциемия в период олигурии служит полезным диагностическим признаком, но не даёт возможности установить диагноз острого некроза скелетных мышц
● Высокие гиперкалиемия, гиперфосфатемия и гиперурикемия — весомый аргумент в пользу острого некроза скелетных мышц.
.
❐ Лечение:
Тактика ведения
● Обязательная госпитализация (см. также Недостаточность почечная острая)
● При некрозе скелетных мышц, вызванном ущемлением, иногда показано хирургическое вмешательство
● При тяжёлой почечной недостаточности необходим диализ
● Лечение гипокальциемии — см. Гипокальциемия
Физическая активность — физическая нагрузка может привести к острому некрозу скелетных мышц, особенно у лиц с метаболическими миопатиями.
✎ Диета: — при острой почечной недостаточности необходимо ограничение в пище белков (для снижения уровня азота мочевины в крови) и калийсодержащих продуктов.
✎ Лекарственная терапия:
● При остром некрозе скелетных мышц для предупреждения развития почечной недостаточности — увеличение выделения мочи до 150 мл/ч (3 мл/кг/ч)
● Маннитол (маннит) 12,5-25 г в/в
● Инфузия натрия гидрокарбоната (до рН мочи 7-7,5) для уменьшения миоглобиново-го повреждения канальцев
● При тяжёлой гиперкалиемии -см. Гиперкалиемия.
.
❐ Наблюдение
● Болезнь может начаться спонтанно
● Некоторые случаи (повреждение с размозжением тканей) случайны, не рецидивируют и не требуют после излечения дальнейшего длительного наблюдения. Профилактика
● Предотвращение воздействия некоторых этиологических факторов до наступления острого некроза скелетных мышц
● Предотвращение метаболических нарушений (гипокалиемия) и комбинаций лекарственных средств, приводящих к острому некрозу скелетных мышц.
✎ Прогноз
● Неблагоприятный, смерть часто наступает вследствие гиперкалиемии или почечной недостаточности
● Прогноз улучшается при проведении диализа и заместительной терапии.
✎ Синоним: Миоглобинурия с почечной недостаточностью См. также Недостаточность почечная острая, Полимиозит и дерматомиозит, Гликогенозы, Миоглобинурия МКБ. R82.1 Миоглобинурия
✎ МШ:
● 232600 болезнь МакАрдла
● 255110 Миопатия с недостаточностью карнитин пальмитоил трансферазы II
● 255120 Гипогликемия гипокетотическая
● 268200 Рабдомиолиз острый рецидивирующий
Источник:
Справочник-путеводитель практикующего врача
на Gufo.me
Значения в других словарях
- рабдомиолиз —
орф. доб. рабдомиолиз, -а (мед.)
Орфографический словарь Лопатина - рабдомиолиз —
Рабдомиолиз — синдром, развивающийся вследствие повреждения скелетной мышцы с появлением в результате этого в крови свободного миоглобина (миоглобинемия).
Медицинский словарь
Рабдомиолиз — Rhabdomyolysis — qwe.wiki
Заболевание (состояние) человека, при котором поврежденные скелетные мышцы быстро разрушаются
| Рабдомиолиз | |
|---|---|
| Моча человека с рабдомиолизом показывает характерное коричневое изменение цвета в результате миоглобинурии. | |
| Произношение | |
| Специальность | Реаниматология , нефрология |
| Симптомы | Мышечные боли , слабость, рвота , спутанность сознания , моча цвета чая, нерегулярное сердцебиение |
| Осложнения | Почечная недостаточность , высокий уровень калия в крови , низкий уровень кальция в крови , диссеминированное внутрисосудистое свертывание , синдром компартмента |
| Причины | Раздавливание , тяжелые упражнения, лекарства , злоупотребление наркотиками , некоторые инфекции |
| Диагностический метод | Анализ крови ( креатинкиназа ), тест-полоска мочи |
| лечение | Внутривенное введение жидкости, диализ , гемофильтрация |
| Частота | 26000 в год (США) |
Рабдомиолиз — это состояние, при котором поврежденные скелетные мышцы быстро разрушаются. Симптомы могут включать мышечные боли , слабость, рвоту и спутанность сознания . Может быть моча чайного цвета или нерегулярное сердцебиение . Некоторые продукты распада мышц, такие как миоглобин , вредны для почек и могут привести к почечной недостаточности .
Повреждение мышц чаще всего является результатом раздавливания , физических упражнений, приема лекарств или злоупотребления наркотиками . Другие причины включают инфекции , электрические травмы , тепловой удар , длительную иммобилизацию, отсутствие кровотока в конечностях или укусы змей . Некоторые люди унаследовали мышечные состояния, повышающие риск рабдомиолиза. Диагноз подтверждается тест-полоской мочи, которая дает положительный результат на «кровь», но при исследовании под микроскопом моча не содержит эритроцитов . Анализы крови показывают, что креатинкиназа превышает 1000 Ед / л, при тяжелом заболевании — выше 5000 Ед / л.
Основа лечения — большие количества внутривенных жидкостей. Другие методы лечения могут включать диализ или гемофильтрацию в более тяжелых случаях. После установления диуреза обычно используются бикарбонат натрия и маннит , но они плохо подтверждаются доказательствами. При раннем лечении результаты обычно хорошие. Осложнения могут включать высокий уровень калия в крови , низкий уровень кальция в крови , диссеминированное внутрисосудистое свертывание и синдром компартмента .
Рабдомиолиз в США встречается примерно у 26 000 человек в год. В то время как условие прокомментированы на протяжении всей истории, первое современное описание было после землетрясения в 1908. Важные открытия в отношении его механизма были сделаны в ходе блицкрига в Лондоне в 1941 году является серьезной проблемой для тех , кто пострадал в землетрясениях , и рельеф усилия по борьбе с такими бедствиями часто включают медицинские бригады, оборудованные для лечения выживших с рабдомиолизом.
Признаки и симптомы
Симптомы рабдомиолиза зависят от его степени тяжести и развития почечной недостаточности. Более легкие формы могут не вызывать никаких мышечных симптомов, и диагноз ставится на основании отклонений в анализах крови в контексте других проблем. Более тяжелый рабдомиолиз характеризуется болью в мышцах , болезненностью, слабостью и отеком пораженных мышц. Если отек происходит очень быстро, как это может произойти при раздавливании после того, как кто-то вышел из-под тяжелых обломков, движение жидкости из кровотока в поврежденную мышцу может вызвать низкое кровяное давление и шок . Другие симптомы неспецифичны и являются результатом либо последствий разрушения мышечной ткани, либо состояния, которое изначально привело к разрушению мышц. Выброс компонентов мышечной ткани в кровоток вызывает нарушение электролитного баланса, что может привести к тошноте , рвоте , спутанности сознания , коме или нарушению частоты сердечных сокращений и ритма . Моча может быть темной, часто описываемой как «чайного цвета», из-за присутствия миоглобина . Повреждение почек может привести к снижению или отсутствию выработки мочи , обычно через 12-24 часа после первоначального повреждения мышц.
Отек поврежденной мышцы иногда приводит к синдрому компартмента — сдавлению окружающих тканей, таких как нервы и кровеносные сосуды , в том же фасциальном компартменте, — что приводит к потере кровоснабжения и повреждению или потере функции части (частей) тела. поставляются этими структурами. Симптомы этого осложнения включают боль или снижение чувствительности в пораженной конечности. Вторым признанным осложнением является диссеминированное внутрисосудистое свертывание (ДВС-синдром), серьезное нарушение свертывания крови, которое может привести к неконтролируемому кровотечению.
Причины
Любая форма мышечного повреждения достаточной степени тяжести может вызвать рабдомиолиз. У одного человека может быть одновременно несколько причин. У некоторых есть основное заболевание мышц, обычно наследственное по природе, что делает их более склонными к рабдомиолизу.
Некоторые формы отравления грибами приводят к рабдомиолизу.
| Тип | Причины |
|---|---|
| Связанные с упражнениями | Экстремальные физические нагрузки (особенно при недостаточной гидратации), белая горячка (алкогольная абстиненция), столбняк , затяжные припадки или эпилептический статус |
| Раздавить | Синдром раздавливания , взрывная травма , автомобильная авария, физические пытки или жестокое обращение или заключение в фиксированном положении, например, после инсульта , из-за алкогольного опьянения или в результате длительной операции |
| Кровоснабжение | Артериальный тромбоз (сгустки крови, образующиеся локально) или эмболия (сгустки или другой мусор из других частей тела), пережатие артерии во время операции |
| Метаболизм | Гипергликемическое гиперосмолярное состояние , гипер- и гипонатриемия (повышенный или пониженный уровень натрия в крови), гипокалиемия (низкий уровень калия), гипокальциемия (низкий уровень кальция), гипофосфатемия (низкий уровень фосфата), кетоацидоз (например, при диабетическом кетоацидозе ) или гипотиреоз (аномальный низкая функция щитовидной железы) |
| Температура тела | Гипертермия (высокая температура тела) и тепловая болезнь , переохлаждение (очень низкая температура тела) |
| Лекарства и токсины | Многие лекарства увеличивают риск рабдомиолиза. Наиболее важные из них:
Яды, связанные с рабдомиолизом, — это тяжелые металлы и яд насекомых или змей. Болиголов может вызвать рабдомиолиз сразу или после употребления в пищу перепелов , которые им поели . Известно, что такие грибы, как Russula subnigricans и Tricholoma equestre , вызывают рабдомиолиз. Болезнь Хаффа — рабдомиолиз после употребления рыбы; подозревается токсическая причина, но не доказана. Наркотики, используемые в рекреационных целях, в том числе: алкоголь , амфетамин , кокаин , героин , кетамин и МДМА (экстази). |
| Инфекция | Вирус Коксаки , вирус гриппа А и вирус гриппа B , вирус Эпштейна-Барр , первичная ВИЧ — инфекция , малярийного плазмодия ( малярия ), вирусы герпеса , легионелл и сальмонеллы |
| Воспаление | Аутоиммунное поражение мышц: полимиозит , дерматомиозит. |
Генетическая предрасположенность
Рецидивирующий рабдомиолиз может быть следствием внутреннего дефицита мышечных ферментов, который обычно передается по наследству и часто проявляется в детстве. Многие структурные мышечные заболевания характеризуются эпизодами рабдомиолиза, которые провоцируются физическими упражнениями, общей анестезией или любой другой причиной рабдомиолиза, перечисленной выше. Унаследованные мышечные расстройства и инфекции вместе вызывают большую часть рабдомиолиза у детей.
Следующие наследственные нарушения энергообеспечения мышц могут вызывать рецидивирующий и обычно связанный с физической нагрузкой рабдомиолиз:
- Гликолиз и гликогенолиз дефекты: болезнь Макардла , дефицит фосфофруктокиназы , болезнь накопления гликогена VIII, IX, X и XI
- Нарушения липидного обмена : дефицит карнитин-пальмитоилтрансферазы I и II , дефицит подтипов ацил-КоА-дегидрогеназы ( LCAD , SCAD , MCAD , VLCAD , дефицит 3-гидроксиацил-коэнзим A-дегидрогеназы ), дефицит тиолазы
- Митохондриальные миопатии : дефицит сукцинатдегидрогеназы , цитохром с оксидазы и кофермента Q10
- Другие: глюкозо-6-фосфат — дегидрогеназа , myoadenylate дефицита дезаминазного и мышечная дистрофия
Механизм
Схематическая диаграмма миоглобина , гем-содержащего белка, который участвует в хранении кислорода в нормальных мышцах, но отвечает за повреждение почек при рабдомиолизе
Повреждение скелетных мышц может принимать различные формы. Раздавливание и другие физические травмы вызывают прямое повреждение мышечных клеток или нарушают кровоснабжение, в то время как нефизические причины влияют на метаболизм мышечных клеток . При повреждении мышечная ткань быстро наполняется жидкостью из кровотока, включая ионы натрия . Само набухание может привести к разрушению мышечных клеток, но те клетки, которые выживают, подвергаются различным нарушениям, которые приводят к повышению содержания внутриклеточных ионов кальция; Накопление кальция за пределами саркоплазматического ретикулума приводит к постоянному сокращению мышц и истощению АТФ , основного переносчика энергии в клетке. Истощение запасов АТФ само по себе может привести к неконтролируемому притоку кальция. Постоянное сокращение мышечной клетки приводит к разрушению внутриклеточных белков и распаду клетки.
Нейтрофильные гранулоциты — наиболее распространенный тип белых кровяных телец — проникают в мышечную ткань, вызывая воспалительную реакцию и высвобождая активные формы кислорода , особенно после травм. Синдром раздавливания также может вызвать реперфузионное повреждение, когда кровоток к декомпрессированной мышце внезапно восстанавливается.
Набухшая воспаленная мышца может непосредственно сдавливать структуры в том же фасциальном отделе , вызывая синдром компартмента . Отек также может ухудшить кровоснабжение этой области. Наконец, разрушенные мышечные клетки выделяют в кровь ионы калия, ионы фосфата , гем- содержащий белок миоглобин , фермент креатинкиназу и мочевую кислоту (продукт распада пуринов из ДНК ). Активация системы коагуляции может вызвать диссеминированное внутрисосудистое свертывание . Высокий уровень калия может привести к потенциально смертельным нарушениям сердечного ритма . Фосфат связывается с кальцием из кровотока, что приводит к низкому уровню кальция в крови .
Рабдомиолиз может вызывать почечную недостаточность по нескольким причинам. Наиболее важным является накопление миоглобина в канальцах почек . Обычно белок крови гаптоглобин связывает циркулирующий миоглобин и другие гемсодержащие вещества, но при рабдомиолизе количество миоглобина превышает связывающую способность гаптоглобина. Миоглобинурия , присутствие миоглобина в моче, возникает, когда его уровень в плазме превышает 0,5–1,5 мг / дл ; как только уровни в плазме достигают 100 мг / дл, концентрация в моче становится достаточной для заметного обесцвечивания и соответствует разрушению примерно 200 граммов мышц. По мере того, как почки реабсорбируют больше воды из фильтрата , миоглобин взаимодействует с белком Тамма-Хорсфалла в нефроне, образуя цилиндры (твердые агрегаты), которые препятствуют нормальному току жидкости; состояние еще больше ухудшается из-за высокого уровня мочевой кислоты и подкисления фильтрата, что увеличивает образование гипса. Железо, высвобождаемое из гема, генерирует активные формы кислорода, повреждая клетки почек. Помимо миоглобинурии, два других механизма способствуют поражению почек: низкое кровяное давление приводит к сужению кровеносных сосудов и, следовательно, к относительному недостатку кровотока в почках, и, наконец, мочевая кислота может образовывать кристаллы в канальцах почек. вызывая препятствие. В совокупности эти процессы приводят к острому некрозу канальцев , разрушению клеток канальцев. Скорость клубочковой фильтрации падает, и почка не может выполнять свои нормальные выделительные функции. Это вызывает нарушение регуляции электролитов, что приводит к дальнейшему повышению уровня калия и препятствует переработке витамина D , что еще больше ухудшает низкий уровень кальция.
Диагностика
М-субъединица из креатинкиназы . В скелетных мышцах креатинкиназа существует преимущественно в димерах, содержащих две М-субъединицы, также называемых «СК-ММ».
Диагноз рабдомиолиза можно заподозрить у любого, кто перенес травму, раздавливание или длительную иммобилизацию, но он также может быть выявлен на более поздней стадии из-за ухудшения функции почек (аномально повышенный или повышенный уровень креатинина и мочевины , падение диуреза) или красновато-коричневое изменение цвета мочи.
Общие расследования
Самый надежный тест при диагностике рабдомиолиза — это уровень креатинкиназы (КК) в крови. Этот фермент выделяется поврежденными мышцами, а его уровни выше 1000 Ед / л (в 5 раз выше верхнего предела нормы (ULN)) указывают на рабдомиолиз. Более 5000 Ед / л указывает на тяжелое заболевание, но в зависимости от степени рабдомиолиза концентрации до 100000 Ед / л не являются необычными. Концентрации КК неуклонно повышаются в течение 12 часов после исходного мышечного повреждения, остаются повышенными в течение 1-3 дней, а затем постепенно снижаются. Начальный и пиковый уровни КК имеют линейную зависимость с риском острой почечной недостаточности: чем выше КК, тем больше вероятность повреждения почек. Не существует конкретной концентрации CK, выше которой определенно возникает поражение почек; концентрации ниже 20 000 Ед / л вряд ли связаны с риском почечной недостаточности, если нет других факторов риска. Легкие подъемы без почечной недостаточности называются «гиперкемией». Миоглобин имеет короткий период полураспада и поэтому менее полезен в качестве диагностического теста на более поздних стадиях. Его обнаружение в крови или моче связано с более высоким риском поражения почек. Несмотря на это, использование измерения миоглобина в моче не подтверждено доказательствами, поскольку ему не хватает специфичности, а исследования, изучающие его полезность, имеют низкое качество.
Могут быть обнаружены повышенные концентрации фермента лактатдегидрогеназы (ЛДГ). Другие маркеры повреждения мышц, такие как альдолаза , тропонин , карбоангидраза типа 3 и белок, связывающий жирные кислоты (FABP), в основном используются при хронических заболеваниях мышц. В трансаминазы , ферменты , обильные как в печени и мышечной ткани, также , как правило , увеличивается; это может привести к тому, что это состояние можно спутать с острым повреждением печени, по крайней мере, на ранних стадиях. Частота актуального острого повреждения печени составляет 25% у людей с нетравматическим рабдомиолизом; механизм этого неясен.
Высокий уровень калия, как правило, является признаком тяжелого рабдомиолиза. Электрокардиография (ЭКГ) может показать, влияет ли повышенный уровень калия на проводящую систему сердца, о чем свидетельствует наличие изменений зубца Т или расширение комплекса QRS . Низкий уровень кальция может присутствовать на начальной стадии из-за связывания свободного кальция с поврежденными мышечными клетками.
При обнаружении миоглобинемии и миоглобинурии , анализы крови и мочи могут показать повышенный уровень миоглобина. Например, тест-полоска мочи может показать положительный результат на «кровь», даже если при микроскопии мочи нельзя идентифицировать эритроциты ; это происходит из-за того, что реагент на тест-полоске вступает в реакцию с миоглобином. То же явление может произойти в условиях, которые приводят к гемолизу , разрушению красных кровяных телец; при гемолизе сыворотка крови также заметно обесцвечивается, тогда как при рабдомиолизе это нормально. Если произошло повреждение почек, микроскопия мочи также выявляет пигментированные и зернистые цилиндры из мочевыводящих путей .
Осложнения
Компартмент-синдром — это клинический диагноз, т. Е. Ни один диагностический тест не доказывает его наличие или отсутствие, но прямое измерение давления в фасциальном компартменте и разницы между этим давлением и артериальным давлением можно использовать для оценки его тяжести. Высокое давление в отсеке и небольшая разница между давлением в отсеке и артериальным давлением указывают на то, что кровоснабжение, вероятно, будет недостаточным и что может потребоваться хирургическое вмешательство.
Распространенное внутрисосудистое свертывание крови , еще одно осложнение рабдомиолиза и других форм критического заболевания, можно заподозрить на основании неожиданного кровотечения или отклонений в гематологических тестах, таких как уменьшение количества тромбоцитов или удлинение протромбинового времени . Диагноз можно подтвердить стандартными анализами крови на ДВС-синдром, например, на D-димер .
Основные расстройства
Если есть подозрение на основное мышечное заболевание, например, если нет очевидного объяснения или было несколько эпизодов, может потребоваться проведение дополнительных исследований. Во время приступа низкий уровень карнитина в крови и высокий уровень ацилкарнитина в крови и моче могут указывать на нарушение липидного обмена, но эти нарушения возвращаются к норме во время выздоровления. На этом этапе можно использовать другие тесты, чтобы продемонстрировать эти нарушения. Нарушения гликолиза можно обнаружить различными способами, включая измерение лактата после тренировки; отсутствие повышения уровня лактата может указывать на нарушение гликолиза, тогда как повышенная реакция типична для митохондриальных заболеваний . Электромиография (ЭМГ) может показать определенные закономерности при определенных мышечных заболеваниях; например, болезнь Макардла и фосфофруктокиназу дефицит показывает явление , называемое скатом как контрактуры . Существуют генетические тесты для многих наследственных заболеваний мышц, которые предрасполагают к миоглобинурии и рабдомиолизу.
Биопсия мышц может быть полезна, если предполагается, что эпизод рабдомиолиза является результатом основного мышечного расстройства. Образец биопсии, взятый во время эпизода, часто неинформативен, так как он показывает только доказательства гибели клеток или может казаться нормальным. Поэтому взятие пробы откладывается на несколько недель или месяцев. Гистологическое появление на биопсии указывает на природу основного расстройства. Например, митохондриальные заболевания характеризуются рваными красными волокнами . Места биопсии могут быть идентифицированы с помощью медицинской визуализации , такой как магнитно-резонансная томография , поскольку мышцы могут быть поражены неравномерно.
лечение
Основная цель лечения — вылечить шок и сохранить функцию почек. Первоначально это делается путем введения большого количества внутривенных жидкостей , обычно изотонического солевого раствора (0,9% веса на объем раствора хлорида натрия). У жертв синдрома раздавливания рекомендуется вводить жидкости внутривенно еще до того, как они будут извлечены из разрушенных структур. Это обеспечит достаточный циркулирующий объем, чтобы справиться с набуханием мышечных клеток (которое обычно начинается при восстановлении кровоснабжения) и предотвратить отложение миоглобина в почках. Рекомендуется количество от 6 до 12 литров в течение 24 часов. Скорость введения жидкости может быть изменена для достижения высокого диуреза (200–300 мл / ч у взрослых), если нет других причин, по которым это может привести к осложнениям, например сердечной недостаточности в анамнезе .
Хотя многие источники рекомендуют дополнительные внутривенные препараты для уменьшения повреждения почек, большая часть доказательств, подтверждающих эту практику, поступает из исследований на животных, и они непоследовательны и противоречивы. Маннитол действует путем осмоса, увеличивая выработку мочи и, как считается, предотвращает отложение миоглобина в почках, но его эффективность не была показана в исследованиях, и существует риск ухудшения функции почек. Добавление бикарбоната к внутривенным жидкостям может облегчить ацидоз (высокий уровень кислоты в крови) и сделать мочу более щелочной, чтобы предотвратить образование гипса в почках; Данные, свидетельствующие о том, что бикарбонат обладает преимуществами по сравнению с одним физиологическим раствором, ограничены, и он может усугубить гипокальциемию за счет увеличения отложения кальция и фосфата в тканях. Если используется подщелачивание мочи, pH мочи поддерживается на уровне 6,5 или выше. Фуросемид , петлевой диуретик , часто используется для обеспечения достаточного образования мочи, но доказательств того, что он предотвращает почечную недостаточность, нет.
Электролиты
На начальных этапах уровень электролитов часто бывает аномальным и требует коррекции. Высокий уровень калия может быть опасным для жизни и реагировать на повышенную выработку мочи и заместительную почечную терапию (см. Ниже). Временные меры включают введение кальция для защиты от сердечных осложнений, инсулина или сальбутамола для перераспределения калия в клетки и инфузии раствора бикарбоната.
Первоначально уровни кальция обычно низкие, но по мере улучшения ситуации кальций высвобождается там, где он осаждался с фосфатом, и возобновляется выработка витамина D, что приводит к гиперкальциемии (аномально высокому уровню кальция). Этот «выброс» происходит у 20–30% людей, у которых развилась почечная недостаточность.
Острая почечная недостаточность
Дисфункция почек обычно развивается через 1-2 дня после первоначального повреждения мышц. Если поддерживающее лечение не позволяет справиться с этим, может потребоваться заместительная почечная терапия (ЗПТ). ЗПТ удаляет избыток калия, кислоты и фосфата, который накапливается, когда почки не могут нормально функционировать, и требуется до тех пор, пока функция почек не восстановится.
Доступны три основных метода ЗПТ: гемодиализ , непрерывная гемофильтрация и перитонеальный диализ . Первые два требуют доступа к кровотоку ( диализный катетер ), тогда как перитонеальный диализ достигается путем закапывания жидкости в брюшную полость и последующего ее дренирования. Гемодиализ, который обычно проводится несколько раз в неделю при хроническом заболевании почек , часто требуется ежедневно при рабдомиолизе. Его преимущество перед непрерывной гемофильтрацией состоит в том, что одну машину можно использовать несколько раз в день, и нет необходимости в постоянном введении антикоагулянтов . Гемофильтрация более эффективна при удалении из кровотока крупных молекул, таких как миоглобин, но, похоже, это не приносит особой пользы. Перитонеальный диализ может быть затруднен при тяжелой травме живота, и он может быть менее эффективным, чем другие методы.
Прочие осложнения
Компартмент-синдром лечится хирургическим путем, чтобы снизить давление внутри мышечного отсека и снизить риск сдавления кровеносных сосудов и нервов в этой области. Фасциотомия — это разрез пораженного отдела. Часто делают несколько разрезов и оставляют открытыми, пока опухоль не уменьшится. На этом этапе разрезы закрываются, что часто требует хирургической обработки (удаления нежизнеспособной ткани) и пересадки кожи в процессе. Потребность в фасциотомии может быть уменьшена, если использовать маннит, поскольку он может непосредственно уменьшить отек мышц.
Диссеминированная внутрисосудистая коагуляция обычно проходит после лечения основных причин, но часто требуются поддерживающие меры . Например, если количество тромбоцитов значительно падает и возникает кровотечение, можно вводить тромбоциты.
Прогноз
Прогноз зависит от основной причины и наличия каких-либо осложнений. При рабдомиолизе, осложненном острой почечной недостаточностью, у пациентов с травматическим повреждением смертность может составлять 20%. При поступлении в отделение интенсивной терапии летальность составляет 22% при отсутствии острого повреждения почек и 59% при поражении почек. У большинства людей, перенесших поражение почек из-за рабдомиолиза, функция почек полностью восстанавливается.
Эпидемиология
Точное количество случаев рабдомиолиза установить трудно, поскольку используются разные определения. В 1995 г. в больницах США было зарегистрировано 26 000 случаев рабдомиолиза. До 85% людей с серьезными травматическими повреждениями в той или иной степени страдают от рабдомиолиза. У 10–50% больных рабдомиолизом развивается острое повреждение почек. Риск выше у людей с историей употребления запрещенных наркотиков, злоупотребления алкоголем или травм по сравнению с мышечными заболеваниями, и он особенно высок, если одновременно действуют несколько факторов. На рабдомиолиз приходится 7–10% всех случаев острого повреждения почек в США.
При крупных стихийных бедствиях, особенно при землетрясениях, часто случаются переломы. Последствия землетрясения в Спитаке 1988 г. побудили к созданию в 1995 г. Целевой группы по оказанию помощи при заболеваниях почек , рабочей группы Международного общества нефрологов (всемирного объединения экспертов по почкам). Его врачи-добровольцы и медсестры впервые оказали помощь во время землетрясения в Измите в Турции в 1999 году , когда погибли 17 480 человек, 5392 были госпитализированы и 477 получили диализ с положительными результатами. Лечебные отделения обычно создаются за пределами непосредственной зоны бедствия, поскольку афтершоки могут потенциально травмировать или убить персонал и вывести оборудование из строя.
Острый рабдомиолиз при физической нагрузке встречается у 2–40% людей, проходящих базовую подготовку для вооруженных сил США. В 2012 году военные США сообщили о 402 случаях. Еще одна группа повышенного риска — пожарные.
История
Расследования людей, получивших травмы в рухнувших зданиях во время лондонского блица, привели к многочисленным открытиям в механизмах, лежащих в основе поражения почек при рабдомиолизе.
Библия может содержать раннее описание рабдомиолиза. В Числах 11: 4–6,31–33 Пятикнижие говорит, что евреи требовали мяса, путешествуя по пустыне; Бог послал перепелов в ответ на жалобы, и люди ели перепелиное мясо в больших количествах. Затем разразилась чума, убившая множество людей. Рабдомиолиз после употребления в пищу перепелов был описан позднее и назван котурнизмом (по названию Coturnix , основного рода перепелов). Мигрирующие перепела потребляют большое количество болиголова — известной причины рабдомиолиза.
В наше время, ранние сообщения от 1908 Мессины землетрясения и Первой мировой войны на почечной недостаточности после травмы последовала исследования по Лондону врачи Eric байуотерс и Десмонд Beall , работая в Королевской послевузовской медицинской школе и Национальный институте медицинских исследований , на четыре жертвы Блица в 1941 году. Миоглобин был продемонстрирован в моче жертв с помощью спектроскопии , и было отмечено, что почки жертв напоминали почки пациентов с гемоглобинурией (гемоглобин, а не миоглобин, являлся причиной повреждения почек). В 1944 году Байуотерс экспериментально продемонстрировал, что почечная недостаточность в основном вызвана миоглобином. Уже во время войны группы врачей выезжали в районы, подвергшиеся бомбардировкам, для оказания медицинской помощи, в основном с помощью внутривенных жидкостей, поскольку диализ еще не был доступен. Прогноз острой почечной недостаточности заметно улучшился, когда диализ был добавлен к поддерживающему лечению, что впервые произошло во время Корейской войны 1950–1953 годов .
Этимология и произношение
Слово рабдомиолиз ( ) использует сочетающие формы рабдо- + мио- + -lysis , что приводит к «исчерченную распад мышц».
Другие животные
Рабдомиолиз распознается у лошадей. У лошадей может развиться ряд мышечных заболеваний, многие из которых могут прогрессировать до рабдомиолиза. Некоторые из них вызывают отдельные приступы рабдомиолиза (например, диетический дефицит витамина Е и селена , отравление, связанное с пастбищными или сельскохозяйственными ядами, такими как органофосфаты ), в то время как другие предрасполагают к рабдомиолизу при физической нагрузке (например, наследственная миопатия накопления полисахаридов лошадей ). 5-10% породистых лошадей и некоторых Стандардбред лошадей страдают от состояния лошадиного физической нагрузке рабдомиолиз ; конкретная причина не установлена, но подозревается лежащее в основе нарушение регуляции кальция в мышцах.
Рабдомиолиз, поражающий лошадей, также может возникать во время вспышек; о них сообщили во многих европейских странах, а затем в Канаде, Австралии и США. Это получило название «атипичная миопатия» или «миоглобинурия неустановленной этиологии». Пока не было найдено единой причины, но были предложены различные механизмы и наблюдалась сезонная закономерность. Обнаружен очень высокий уровень креатинкиназы, и смертность от этого состояния составляет 89%.
Ссылки
внешние ссылки
Некроз мышц симптомы. Острый некроз скелетных мышц (рабдомиолиз) при отравлении
rusvoin.ru
- Детские праздники
- Заготовки на зиму
- Цветы
- Кулинарные рецепты
- Дачный сад
- Дети на даче
- Ландшафтный дизайн
- Фрукты-ягоды
- Грибы
- Животноводство
- Удобрения
- Своими руками
- Пчеловодство
- Болезни и вредители
- Овощные грядки
- Садовые
- Детская площадка
- Советы для дачников
…
- Детские праздники
- Заготовки на зиму
- Цветы
- Кулинарные рецепты
- Дачный сад
- Дети на даче
- Ландшафтный дизайн
- Фрукты-ягоды
- Грибы
- Животноводство
- Удобрения
- Своими руками
- Пчеловодство
- Болезни и вредители
- Овощные грядки
- Садовые
- Детская площадка
- Советы для дачников
Некроз мышц симптомы. Острый некроз скелетных мышц (рабдомиолиз) при отравлении — причины
острый некроз скелетных мышц — это… Что такое острый некроз скелетных мышц?
- острый некроз скелетных мышц
Medicine: rhabdomyolysis
Универсальный русско-английский словарь.
Академик.ру.
2011.
- острый некроз сетчатки
- острый некротизирующий геморрагический энцефаломиелит
Смотреть что такое «острый некроз скелетных мышц» в других словарях:
Биноклар — Действующее вещество ›› Кларитромицин* (Clarithromycin*) Латинское название Binoclar АТХ: ›› J01FA09 Кларитромицин Фармакологическая группа: Макролиды и азалиды Нозологическая классификация (МКБ 10) ›› H60 Наружный отит ›› H66 Гнойный и… … Словарь медицинских препаратов
Трайкор — Действующее вещество ›› Фенофибрат* (Fenofibrate*) Латинское название Tricor АТХ: ›› C10AB05 Фенофибрат Фармакологическая группа: Фибраты Нозологическая классификация (МКБ 10) ›› E78.0 Чистая гиперхолестеринемия ›› E78.1 Чистая гиперглицеридемия… … Словарь медицинских препаратов
Bayer — AG Тип Акционерное общество … Википедия
Энтомозы — Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей … Википедия
ГИПОФОСФАТЕМИЯ — мед. Гипофосфатемия снижение уровня фосфатов в крови ниже 2,5 мг% (в норме 2,5 4,5 мг%). Этиология Гипофосфатемия может развиться в результате внепочечных или почечных потерь фосфата. • Внепочечные причины. • Дефицит в пише и потери через ЖКТ •… … Справочник по болезням
ПСИХОАКТИВНЫХ ВЕЩЕСТВ — мед. Наркомания (токсикомания) болезнь (зависимость), вызванная систематическим употреблением психоактивных веществ и проявляющаяся психической, а иногда и физической зависимостью от этих веществ. • Психоактивное вещество любое химическое… … Справочник по болезням
РАБДОМИОЛИЗ — мед. Рабдомиолиз синдром, развивающийся вследствие повреждения скелетной мышцы с появлением в результате этого в крови свободного миоглобина (миоглобинемия). Миоглобин крови фильтруется клубочками почек и появляется в моче (миоглобинурия), что… … Справочник по болезням
Рабдомиолиз — Эта страница требует существенной переработки. Возможно, её необходимо викифицировать, дополнить или переписать. Пояснение причин и обсуждение на странице Википедия:К улучшению/22 марта 2012. Дата постановки к улучшению 22 марта 2012 … Википедия
Патологическая анатомия эндокринной системы — Эндокринная система человека состоит из желёз внутренней секреции (эндокринных желёз) и так называемой диффузной эндокринной системы (APUD системы). Функция эндокринной системы заключается в продукции гормонов. К железам внутренней секреции… … Википедия
СЕРДЦЕ — СЕРДЦЕ. Содержание: I. Сравнительная анатомия……….. 162 II. Анатомия и гистология……….. 167 III. Сравнительная физиология………. 183 IV. Физиология………………. 188 V. Патофизиология……………. 207 VІ. Физиология, пат.… … Большая медицинская энциклопедия
РОДЫ — РОДЫ. Содержание: I. Определение понятия. Изменения в организме во время Р. Причины наступления Р………………… 109 II. Клиническое течение физиологических Р. . 132 Ш. Механика Р. …………….. 152 IV. Ведение Р……………… 169 V … Большая медицинская энциклопедия
Скелетные мышцы и хромота | Ключ ветеринара
Анамнез и клиническое обследование
Важно установить, было ли в анамнезе падение или другое травматическое событие, продолжительность клинических признаков, отмечался ли отек и была ли лошадь хромой или выполнялась плохо.
Для обнаружения отека мышц в результате недавней травмы или потери мышечной массы в результате фиброза, хронической травмы или атрофии лошадь должна стоять прямо, равномерно распределяя вес на всех конечностях и глядя прямо вперед.Лошадь следует оценивать визуально и путем тщательной систематической пальпации, выявляя дефекты мышц, отек мышц, области аномальной прочности мышц из-за фиброза, мышечного напряжения или спазма, а также области боли.
При острой травме, приводящей к разрыву или разрыву мышцы, дефект можно будет пальпировать на самых ранних стадиях, но он заполнится кровоизлиянием, воспалительным экссудатом и отеком. Тщательная пальпация должна позволить выявить наиболее острые поверхностные мышечные повреждения, но локализация более глубоких мышечных травм может быть более сложной.Выявить хроническое растяжение мышц сложнее, потому что клинические признаки менее заметны. Лошадь должна быть как можно более расслабленной, чтобы правильно оценить реакцию на твердую и глубокую пальпацию. Если мышца болит, лошадь может отреагировать увеличением напряжения в ожидании боли или отстранением. В области поврежденной мышцы могут быть «узлы».
Шею, конечности и грудопоясничную область следует двигать пассивно, чтобы обнаружить любые ограничения движения или боль, вызванную движением.Необходимо наблюдать за лошадью, движущейся как на шагу, так и на рыси, чтобы определить любые характерные аномалии походки, такие как неправильное положение задней лапы из-за фиброзной миопатии (см. Главу 48) или опускание переднего пальца в результате разрыва сухожильно-мышечного соединения. поверхностного сгибателя пальца (см. главу 13). Однако следует иметь в виду, что болезненность мышц, приводящая к снижению работоспособности, не может привести к явной хромоте, потому что боль может возникать только тогда, когда мышца сильно сокращается или максимально растягивается.Боль, связанная с брахиоцефалической мышцей у выездковой лошади, может быть очевидна только при определенных движениях, таких как полупасс (см. Рис. 83-3). У выставочного прыгуна с болезненными ягодичными мышцами может не так сильно отталкиваться пораженная конечность, что приведет к смещению задних конечностей в ипсилатеральную сторону, как лошадь прыгает.
.
границ | Важность биофизических и биохимических стимулов в динамических моделях скелетных мышц
Введение
Область регенеративной медицины и тканевой инженерии (ТЕ) по-прежнему остается одной из самых быстрорастущих областей исследований в биомедицине. Предыдущие попытки TE основном сосредоточены на тканях и органах, которые связаны с заболеваниями, происходящих при высоких частотах в 1 ул стран мира, таких как сердце и опорно-двигательного аппарата с сильным акцентом на кости, хрящи и связки.Мышечная ткань, которой долгое время не уделялось должного внимания, в последнее время привлекла больше внимания в сообществе TE. Представление о мышцах эволюционировало от ткани, в основном ответственной за движение, термогенез и постуральную поддержку, до эндокринного органа, способного секретировать цитокины (называемые миокинами), которые оказывают благотворное влияние на окружающие ткани (Pedersen, 2011).
Тканеспецифические стволовые клетки, называемые сателлитными клетками (Beauchamp et al., 2000; Zammit et al., 2004; Yin et al., 2013; Han et al., 2016) отвечают за поддержание регенеративной способности скелетных мышц. При повреждении сателлитные клетки могут повторно входить в клеточный цикл, пролиферировать и либо сливаться с существующими миофибриллами, либо генерировать миофибриллы de novo . С момента их открытия в 1961 году (Katz, 1961; Mauro, 1961) были проведены обширные исследования регуляторных механизмов, управляющих активностью сателлитных клеток, и их роли в здоровых и пораженных мышцах (Seale and Rudnicki, 2000; Zammit et al., 2004, 2006; Инь и др., 2013).
Патологические состояния мышц и их потеря
TE скелетных мышц (SMTE) направлен на функциональное восстановление утраченной, атрофической или поврежденной мышечной ткани. В последнее время особое внимание в данной области уделяется использованию клеточных и бесклеточных терапевтических подходов для лечения патологических состояний мышц, таких как мышечные дистрофии, саркопения или травматическая потеря объема мышц. У молодых регенерация обычно происходит эффективно, поскольку скелетные мышцы могут справиться с легкими травмами из-за своего высокого регенеративного потенциала.Однако регенерация неэффективна, когда травма вызывает обширное повреждение или когда мышца поражена хронической патологией. Это особенно тяжело у пожилых людей, у которых регенерационная способность мышц снижается из-за уменьшения пула мышечных стволовых клеток. Это приводит к постепенному замещению мышц рубцами и жировой тканью, вызывая существенное ухудшение функции и подвижности мышц и, следовательно, качества жизни. Кроме того, потеря мышечной массы, связанная со старением (саркопения), затрагивает все большее число пациентов, поскольку глобальное увеличение продолжительности жизни приводит к старению населения.Таким образом, существует неудовлетворенная клиническая потребность в подходах к восстановлению или поддержанию мышечной функции, особенно у пожилых людей, которые сильно страдают от истощения и атрофии мышц (Chargé and Rudnicki, 2004; Ryall et al., 2008; Carosio et al., 2011). ; Blau et al., 2015). В отличие от саркопении, генетические заболевания мышц, такие как мышечные дистрофии (МД), приводят к прогрессирующему ослаблению и разрушению мышц, которое начинается уже в детстве или в среднем возрасте. MD представляют собой группу из более чем 30 редких наследственных заболеваний, вызванных мутациями, ведущими либо к дисфункции, либо к недостатку белков, необходимых для стабильности мышц (Theadom et al., 2014; Смит и др., 2016). МД сильно различаются по типу пораженных мышц (некоторые формы МД могут поражать сердечную мышцу), степени мышечной слабости, возрасту начала, скорости прогрессирования и типу наследования (Theadom et al., 2014).
Мышечная дистрофия Дюшенна (МДД) является наиболее распространенной БМ, поражающей примерно 1 из 5000 мужчин (Goyenvalle et al., 2011; Mah et al., 2014; Romitti et al., 2015; Stark, 2015; Yiu and Kornberg, 2015). . МДД вызывается отсутствием функционального дистрофина в результате делеции, точечных мутаций, вставок или дупликации.Дистрофин — это структурный белок, который действует как линкер между цитоскелетом (через комплекс дистрогликана) и окружающим внеклеточным матриксом (ЕСМ). Дистрофин стабилизирует мышечные клетки при механической нагрузке и необходим для поддержания внутриклеточной структурной организации белков мышечного цитоскелета в сократительном аппарате (Ervasti and Sonnemann, 2008; Constantin, 2014; Gawlik et al., 2014). Таким образом, недостаток дистрофина предрасполагает мышечные волокна к хрупкости в ответ на механические силы, что приводит к непрерывным циклам де- и регенерации мышц (Serrano et al., 2011). Недавние данные дополнительно предполагают, что дистрофин непосредственно участвует в регуляции поведения сателлитных клеток и что сателлитные клетки от животных с нокаутом дистрофина демонстрируют более низкие темпы пролиферации, а также функциональные нарушения (Sacco et al., 2010; Dumont et al., 2015b; Almada and Wagers , 2016; Дюмон, Рудницки, 2016). В результате пул мышечных стволовых клеток (сателлитных клеток) преждевременно исчерпывается, что в некоторой степени аналогично старению (Webster and Blau, 1990), что в конечном итоге приводит к мышечной слабости, потере подвижности и, в худшем случае, к преждевременной смерти. (Эмери, 1993).Другие типы MD включают Becker MD, менее тяжелый вариант DMD, Emery-Dreifuss MD, Facioscapulohumeral MD, врожденный MD, конечностно-поясной MD или миотонический MD (Theadom et al., 2014).
На сегодняшний день лекарства от МД не существует. Хотя для замедления прогрессирования заболевания используются симптоматические методы лечения, такие как физиотерапия или лекарственная терапия, прогноз для людей с хроническими мышечными патологиями плохой. Это создает значительное социально-экономическое бремя во всем мире для систем здравоохранения, пациентов и лиц, осуществляющих уход.Саркопения составляет около 18,5 млрд долларов в год прямых затрат на здравоохранение в США (Janssen et al., 2004; Beaudart et al., 2014). В перекрестном исследовании 2014 года сообщалось, что средние годовые прямые затраты на одного пациента с МДД в Европе и США колеблются от 23 920 до 54 270 долларов, что в 7-16 раз превышает среднегодовые расходы на здравоохранение на душу населения в этих странах (Landfeldt и др., 2014). Более недавнее исследование, посвященное европейским пациентам с МДД и лицам, ухаживающим за ними, предоставило аналогичные цифры, но определило прямые немедицинские расходы как основную часть общих годовых затрат (Cavazza et al., 2016).
В прошлом исследования регенеративных методов лечения пораженных скелетных мышц в основном были сосредоточены на методах доставки здоровых миогенных клеток или восстановления эндогенного миогенного потенциала сателлитных клеток (Dumont et al., 2015a). Хотя трансплантация сателлитных клеток обладает большим терапевтическим потенциалом для лечения MD, огромное количество клеток, необходимых для лечения, и их фенотипические изменения после продолжительного культивирования in vitro ограничивают этот подход. Помимо восстановления пула стволовых клеток и репарации миофибрилл хозяина, здоровые миогенные донорские клетки также могут действовать как векторы для (восстановления) экспрессии нормальных (дикого типа) аллелей в мышечных волокнах, с которыми они сливаются (Partridge et al., 1989). Однако патомеханизмы, приводящие к фенотипам MD, истощению мышц и атрофии, до сих пор полностью не изучены. Кроме того, тот факт, что некоторые модели животных MD не точно воспроизводят соответствующее заболевание, создает еще одно бремя для внедрения новых методов лечения в клиники. Таким образом, тканевая инженерия in vitro с модельными моделями мышц (заболеваний) может служить альтернативным доклиническим подходом для более глубокого понимания молекулярных причин и потенциальных методов лечения хронических патологических состояний мышц.
Скелетная мышца TE
Современные клинические стратегии восстановления мышечной функции ограничиваются симптоматическим лечением, и, следовательно, расходы на здравоохранение постоянно растут; например, расходы на здравоохранение в связи с прямыми и косвенными травмами в 2000 году в США превысили 400 миллиардов долларов (Corso et al., 2006). SMTE представляет собой многообещающий инструмент для снижения этого огромного социально-экономического бремени, поскольку он позволяет создавать новые мышцы для замены утраченных тканей без необходимости использования донорских тканей.Кроме того, SMTE можно использовать для изучения развития мышц, а также влияния биоматериалов и механических сигналов на миогенез и мышечные нарушения в моделях in vitro (болезнь) (Juhas et al., 2015). Проведение традиционных исследований биологии мышц в трехмерных условиях, которые более точно имитируют физиологическую микросреду всего органа (Bursac et al., 2015), — это новый уровень техники в этой быстро развивающейся области (рис. 1). Однако до сих пор TE успешно поступала в клиники только тогда, когда речь шла о замене и регенерации кожи, костей или хрящей (Horch et al., 2000; Чанг и др., 2003; Кодзима и др., 2003; Копп и др., 2004; Оукс, 2004; Vangsness et al., 2004).
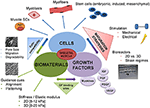
Рисунок 1 . Достижения в инженерии тканей скелетных мышц — от классических к функциональным подходам. До недавнего времени классический подход тканевой инженерии представлял собой комбинацию следующих компонентов: биоматериалов, клеток и факторов роста. В последние годы эта классическая триада была объединена с новыми методологиями, позволяющими использовать больше биомиметических подходов.Достижения в химии сшивания сделали возможным связать факторы роста с биоматериалом или предоставить сайты связывания факторов роста. Кроме того, было продемонстрировано, что управляющие сигналы, такие как формирование рисунка или выравнивание биоматериала, а также механические свойства, значительно влияют на поведение клеток, такое как адгезия, миграция и созревание. Аналогичным образом, число типов клеток, которые потенциально могут быть использованы, увеличилось, начиная от клеточных линий и первичных клеток до мышечных стволовых клеток и клеток с характеристиками мезенхимальных стволовых клеток.Одним из основных достижений прошлого было включение динамических систем культивирования в существующие подходы SMTE для улучшения созревания тканей. В этом отношении наиболее часто используемыми методами являются электрическая или механическая стимуляция с помощью сложных биореакторных систем. Эти биореакторы позволяют управлять различными механическими или электрическими стимулами, чтобы управлять как ранним миогенезом, так и функциональным созреванием. GF, фактор роста; 2D, 2-х мерный; 3D, 3-х мерный; СК, стволовые клетки; IGF, фактор роста инсулина; FGF, фактор роста фибробластов; PDGF, фактор роста тромбоцитов; VEGF, фактор роста эндотелия сосудов.
Современные клинические подходы к компенсации утраченной ткани скелетных мышц состоят в переносе ткани скелетных мышц с других участков тела в область повреждения (свободный функциональный перенос мышц). Однако это вызывает заболеваемость донорским участком и дополнительную хирургическую процедуру, что создает дополнительный стресс для пациента (Qazi et al., 2015). Золотым стандартом является использование отдельно стоящих лоскутов, которые включают функциональные сосуды в качестве тканевых трансплантатов. Хотя свободный функциональный перенос мышц по-прежнему считается лучшим вариантом для восстановления функции в других не реконструируемых мышцах, возврат к уровням мышечной силы и функциональности до травм обычно не происходит.Таким образом, многие исследовательские группы сейчас сосредоточены на in vitro SMTE, предоставляя новые замечательные данные для этой области, некоторые из которых будут обсуждаться более подробно в следующих разделах (Engler et al., 2004; Huang et al., 2004 ; Matsumoto et al., 2007; Lam et al., 2009; van der Schaft et al., 2013; Kurth et al., 2015; Bersini et al., 2016). На сегодняшний день большинство стратегий in vitro SMTE нацелены на создание функциональной скелетной мышечной ткани в лаборатории, чтобы предложить новые терапевтические возможности для пациентов, страдающих от объемной потери мышц, саркопении или генетических мышечных нарушений (Law et al., 1993; Guettier-Sigrist et al., 1998). Учитывая текущие ограничения клинического лечения и растущую распространенность патологических состояний мышц (особенно саркопении), эти пациенты получат большую пользу от дальнейших исследований альтернативных терапевтических подходов.
Другой подход — in vivo SMTE, который включает введение клеток с миогенным потенциалом (Bach et al., 2004) либо в виде болюсных инъекций, либо в сочетании с биоматериалом каркаса, в место повреждения для формирования и регенерации новой мышечной ткани ( McCullen et al., 2011). Однако эта стратегия ограничена огромным количеством необходимых клеток (Bach et al., 2004). В качестве альтернативы был введен бесклеточный подход in situ SMTE (Jana et al., 2013; Wang et al., 2014), при котором инструктивные биоматериалы вживляются в мышечный дефект, чтобы запустить эндогенный регенеративный потенциал и регенерировать пораженная ткань путем высвобождения биоактивных сигнальных молекул из биоматериала, имплантированного пациенту (Qazi et al., 2015). Ex vivo SMTE демонстрирует стратегию, альтернативную in vivo подходам, где аутологичные клетки заранее размножаются в культуре клеток и в конечном итоге повторно вводятся в место дефекта для регенерации (Barrilleaux et al., 2006; Stern et al., 2009).
В этом обзоре мы хотели бы выделить современное состояние SMTE, инициировать идеи для усовершенствований и предоставить научному сообществу предполагаемые стратегии и критерии для повышения производительности и зрелости мышц, созданных с помощью тканевой инженерии. Кроме того, мы даем взгляд на будущие проблемы и общие соображения по применению SMTE для здоровых и больных мышц.
Факторы, влияющие на миогенный исход ( in vitro, и in vivo)
In vitro SMTE полагается на эффективные стратегии созревания для создания функциональных трехмерных конструкций скелетных мышц, для чего в первую очередь требуются биоматериалы в качестве каркасов.Эти матрицы каркасов должны обладать адекватными физико-химическими свойствами, а также биоактивными сигналами, такими как встроенные факторы роста, для усиления миогенной дифференцировки или мотивов клеточной адгезии для улучшения клеточного прикрепления. Кроме того, необходимым условием являются мощные миогенные клетки, которые способны дифференцироваться в зрелые мышечные трубочки в соответствующих условиях окружающей среды (Bursac et al., 2015). Наконец, необходимы эффективные стратегии стимуляции в виде механической, электрической или электромеханической стимуляции для запуска выравнивания, слияния и дифференцировки клеток (рис. 2).После создания плотно упакованных массивов выровненных миотрубок конечной целью является реализация методов (предварительной) васкуляризации и иннервации таких мышечных конструкций, прежде чем они смогут служить функциональными трансплантатами.
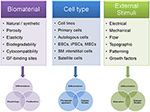
Рисунок 2 . Различия в экспериментальном дизайне подходов к инженерии ткани скелетных мышц влияют на результат. Выбор биоматериала и его биофизические свойства влияют на конструкцию ТЕ с точки зрения клеточной адгезии, миграции, морфологии, пролиферации и дифференцировки.Примечательно, что дифференциация мышечных клеток в сократительные миофибриллы в значительной степени зависит от таких факторов, как эластичность матрикса, пористость или наличие факторов роста в конструкции. Выбор соответствующего типа ячейки не менее важен, поскольку он частично предопределяет, на какие научные вопросы можно ответить, используя данный подход SMTE. Таким образом, изменение типов клеток в рамках одной и той же установки SMTE может расширить диапазон ее применения, от исследований на разных этапах миогенеза или моделирования заболеваний до трансплантации или клеточной генной терапии.Наконец, приложение внешних стимулов к клеткам, встроенным в биоматериалы, значительно увеличивает миогенное созревание. Формирование паттерна биоматериала посредством предоставления определенных топографических сигналов может управлять дифференцировкой клеток и, кроме того, позволяет контролировать расположение клеток / миофибрилл. Поскольку сконструированные мышцы необходимы для создания достаточно больших сократительных сил при трансплантации, важность динамических систем культивирования, использующих такие стратегии стимуляции, была однозначно показана. GF, факторы роста; ЭСК, эмбриональные стволовые клетки; ИПСК, индуцированные плюрипотентные стволовые клетки; МСК, мезенхимальные стволовые клетки; Интерстициальные клетки SM, интерстициальные клетки скелетных мышц.
Биоматериалы в SMTE
Природные биоматериалы являются биосовместимыми и биоразлагаемыми и, таким образом, представляют собой благоприятные биоматериалы для SMTE. Они обладают настраиваемыми механическими и структурными свойствами, такими как пористость, топографические признаки и возможность функционализации с помощью факторов роста и / или мотивов клеточной адгезии. Кроме того, натуральным гидрогелевым материалам можно придавать различные формы, что полезно для восстановления объемных мышечных дефектов, которые обычно имеют неправильную форму.Однако природные биоматериалы обладают потенциальной иммуногенностью и иногда не обладают механической прочностью (ASM International, 2003; Qazi et al., 2015). Наиболее часто используемые природные биоматериалы в SMTE — это коллаген (Vandenburgh et al., 1988; Shansky et al., 1997; Okano and Matsuda, 1998a, b; Powell et al., 2002; Cheema et al., 2003; Kroehne). et al., 2008; Bian, Bursac, 2009; Rhim et al., 2010; Hinds et al., 2011; Ma et al., 2011; Smith et al., 2012), фибрин (Huang et al., 2004; Байер и др., 2006; Боршель и др., 2006; Мацумото и др., 2007; Биан и Бурзак, 2009, 2012; Лам и др., 2009; Hinds et al., 2011; Page et al., 2011; Лю и др., 2012, 2013; Heher et al., 2015), альгинат (Shapiro, Cohen, 1997; Hill et al., 2006a, b; Borselli et al., 2010, 2011; Liu et al., 2012; Wang et al., 2014) , Matrigel ® (Grefte et al., 2012; Juhas and Bursac, 2014), гиалуроновая кислота (HA) (Wang et al., 2009; Rossi et al., 2011; Monge et al., 2012), желатина (Hosseini et al., 2012; Yang et al., 2014), фиброина шелка (Mandal and Kundu, 2009), хитозана (Jana et al., 2013) и децеллюляризованного тканей (Borschel et al., 2004; Conconi et al., 2005; De Coppi et al., 2006; Mase et al., 2010; Merritt et al., 2010; Machingal et al., 2011; Perniconi et al. , 2011; DeQuach et al., 2012; Wolf et al., 2012; Corona et al., 2014; Sicari et al., 2014). Обычные синтетические биоматериалы производятся из биоразлагаемых полиэфиров полигликолевой кислоты , полиэтиленгликоля (PEG) , поликапролактона , поли (молочно-гликолевой кислоты) и поли-l-молочной кислоты (Huang et al. al., 2006a; Choi et al., 2008; Jun et al., 2009; Aviss et al., 2010; Ким и др., 2010а, б; Ку и др., 2012; Чен и др., 2013; Ян и др., 2014). Эти синтетические биоматериалы универсальны в использовании, поскольку они разлагаются (от нескольких недель до лет, в зависимости от состава и степени поперечного сшивания), что позволяет точно контролировать их физико-химические свойства (например, скорость разложения, жесткость / эластичность или присутствие топографические или биохимические подсказки) и обычно значительно дешевле натуральных биоматериалов.Кроме того, их можно использовать в форме гидрогелей (Grizzi et al., 1995). Однако они не всегда поддерживают прикрепление и адгезию клеток, потенциально могут вызывать воспалительные реакции (после деградации или через длительное сохранение в месте повреждения in vivo ) и не обладают биомимикрией нативного ECM (Kim et al., 2010b). Поэтому их часто комбинируют или покрывают натуральными биоматериалами для представления сигналов биологического распознавания, например интегрин-связывающие мотивы, такие как Arg-Gly-Asp, для увеличения прикрепления клеток (Qazi et al., 2015). Обзор широко используемых биоматериалов для SMTE, их преимуществ и недостатков представлен в таблице 1.
Таблица 1 . Часто используемые биоматериалы и их полезные свойства для SMTE.
Гидрогели
Гидрогели
особенно популярны в SMTE из-за их настраиваемости в отношении структуры, формы и механической стабильности, а также их способности включать контактное руководство и биохимические сигналы. Кроме того, гидрогели могут быть функционализированы факторами роста или другими биоактивными молекулами для улучшения регенерации (Hill et al., 2006a; Островидов и др., 2014; Qazi et al., 2015). Трехмерные гидрогели способствуют пространственно-однородному распределению клеток после инкапсуляции, позволяя создавать плотные тканевые конструкции за счет высокой начальной плотности посева клеток и уплотнения гидрогеля клетками с течением времени. Большое количество межклеточных контактов способствует и усиливает миогенное слияние и увеличивает длину и толщину миофибрилл (Heher et al., 2015). Кроме того, трехмерная среда более точно имитирует физиологические условия ткани, чем двумерные культуры.Использование биоматериалов на основе гидрогеля является многообещающей стратегией для введения терапевтических миогенных клеток-предшественников в дефект для последующего образования новой мышечной ткани in vivo (Han et al., 2016). Примечательно, что гидрогели можно вводить минимально инвазивным способом, чтобы поддерживать или заполнять пустоты после мышечной травмы или заболевания (Qazi et al., 2015).
Коллаген является наиболее распространенным белком в организме человека и основным компонентом естественного внеклеточного матрикса, поэтому он используется во множестве приложений TE (Lee et al., 2001). Однако, если используются мышечные сателлитные клетки (MuSCs), необходимо добавить ламинин, чтобы соответствовать специфическому комплексу интегрина, образованному изоформами α7 и β1 (Blanco-Bose et al., 2001). В новаторском исследовании Vandenburgh et al. Использовали коллагеновые гели для включения и дифференциации птичьих миобластов в сократительные миотрубки со структурными характеристиками, сходными с неонатальными миофибриллами (Vandenburgh et al., 1988). С тех пор многие другие группы использовали миогенные клетки-предшественники в сочетании с гидрогелями коллагена (Cheema et al., 2003; Рим и др., 2007; Ma et al., 2011; Smith et al., 2012). Окано и др. подчеркнули, что миобласты C2C12 в сочетании с 3D коллагеновыми гелями приводят к дифференцировке в многоядерные выровненные мышечные трубочки, успешной капиллярной инфильтрации in vivo и ремоделированию после имплантации (Okano and Matsuda, 1998b).
Еще одним природным биоматериалом для производства гидрогеля является альгинат, полисахарид, содержащийся в морских водорослях, что делает его доступным и дешевым источником гидрогеля (Boontheekul et al., 2005; Андреецск и др., 2013). Преимуществом альгинатных гидрогелей является возможность их модификации, например, путем введения клеточных адгезивных лигандов или регулирования жесткости и способности к разложению (Shapiro and Cohen, 1997; Hill et al., 2006a, b; Borselli et al., 2010; Liu et al. ., 2012). Альгинатные гидрогели используются во многих медицинских целях, включая лечение ран или доставку биоактивных молекул из-за их низкой токсичности и хорошей биосовместимости (Lee and Mooney, 2012).
Компонент HA ECM также используется для изготовления гидрогелей путем фото-сшивки с помощью УФ-обработки (Han et al., 2016) или путем химического сшивания (Luo et al., 2000; Collinsworth et al., 2002; Zhang et al., 2016). ГК усиливает пролиферацию и дифференцировку миобластов. Однако деградацию гиалуронидазами in vivo трудно контролировать, что может привести к апоптозу введенных клеток из-за потери прикрепления к материалу (Han et al., 2016).
Фибрин — предпочтительный биоматериал для производства гидрогелей. Это конечный продукт каскада свертывания крови, образующегося при расщеплении фибриногена тромбином (Helgerson et al., 2004). Поскольку фибрин является естественным компонентом человеческого тела, таким как коллаген и ГК, он обладает привлекательными свойствами, включая биосовместимость, биоразлагаемость и нетоксичность. Инкапсуляция миогенных клеток в гидрогели фибрина дает сигналы для запуска роста и дифференцировки в мышечные трубки и, в конечном итоге, в миофибриллы (Juhas et al., 2015). Другие полезные особенности включают возможность настройки его структурной сети, модифицируемую полимеризацию (Han et al., 2016) и возможность включения факторов роста (Ahmed et al., 2008). Некоторые исследования утверждают, что фибрин превосходит другие биоматериалы (например, коллаген I) из-за сильного связывания интегрина (интегрин α7 и α5) мышечных трубок с фибрином (Morishima-Kawashima et al., 1995; Papers and Mayer, 2003). Этот эффект более выражен в фибрине, поскольку миотрубки не имеют рецептора интегрина α2, специфичного для коллагена I. Следовательно, фибриновая среда более способствует распределению сократительных сил от миоцитов (Juhas et al., 2015). Основным недостатком фибрина является поиск подходящей плотности материала, который уравновешивает требуемую целостность материала для имитации естественной жесткости и достаточной пористости для транспорта питательных веществ и миграции клеток (Helgerson et al., 2004; Браун и Баркер, 2014). Фибриновые гидрогели успешно использовались во многих подходах SMTE с использованием различных стимулов для усиления дифференцировки (Huang et al., 2004; Borschel et al., 2006; Matsumoto et al.,
.
Пластичность макрофагов при восстановлении скелетных мышц
Макрофаги являются одним из первых барьеров, препятствующих защите хозяина от патогенов. Помимо своей роли в врожденном иммунитете, макрофаги играют все более определенную роль в организации заживления различных поврежденных тканей. Нарушения функции и / или активации макрофагов могут привести к нарушению регенерации и отложению фиброза, как описано при нескольких хронических патологических заболеваниях. Было продемонстрировано, что неоднородность и пластичность являются отличительными чертами макрофагов.В ответ на сигналы окружающей среды они проявляют провоспалительный (M1) или альтернативный противовоспалительный (M2) фенотип. Многие данные продемонстрировали, что после острого повреждения макрофаги M1 инфильтрируют раньше, способствуя удалению некротического мусора, тогда как макрофаги M2, по-видимому, позже поддерживают заживление тканей. Является ли последовательное присутствие двух разных популяций макрофагов результатом динамического сдвига поляризации макрофагов или рекрутирования новых циркулирующих моноцитов, является предметом постоянных дебатов.В этой статье мы обсуждаем имеющуюся в настоящее время информацию о роли, которую различные фенотипы макрофагов играют после травмы и во время фазы ремоделирования в разных типах тканей, с особым вниманием к скелетным мышцам.
1. Роль макрофагов в разрешении воспаления и ремоделировании тканей
Макрофаги необходимы для эффективного заживления многих тканей. Они вносят вклад в гомеостатическое ремоделирование тканей во время жизни плода [1, 2] и в некоторых тканях взрослого человека.Процесс заживления состоит из перекрывающихся фаз воспаления, формирования ткани и ремоделирования с реорганизацией сосудистой сети и внеклеточного матрикса. Макрофаги участвуют во всех различных фазах восстановления тканей: они могут способствовать фагоцитозу клеточного мусора и апоптотических нейтрофилов, а также продуцировать цитокины, которые могут помочь в организации реакции заживления. Однако из-за высвобождения провоспалительных цитокинов и видов цитотоксических радикалов неконтролируемая активность макрофагов также может быть вредной для восстановления тканей.Действительно, некоторые заболевания человека характеризуются ослабленными репарационными реакциями и дисбалансом воспалительного ответа с увеличением числа инфильтрирующих макрофагов [3-5]. Гетерогенность и пластичность макрофагов могут объяснить эти явно противоположные роли в заживлении тканей. Все макрофаги экспрессируют общие маркеры, такие как CD11b (Mac1 или CR3), CD68 и CD115 (рецептор M-CSF). Однако были идентифицированы по крайней мере две различные популяции макрофагов: классически активированный фенотип M1 и альтернативный активированный фенотип M2 [6].Классически активированные макрофаги M1 индуцируются in vitro с помощью IFN γ , отдельно или совместно с микробными стимулами (например, LPS) или выбранными цитокинами (например, TNF и GM-CSF). У них есть провоспалительные функции: они продуцируют эффекторные молекулы (реактивные промежуточные соединения кислорода и азота) и воспалительные цитокины (IL-1 β , TNF α и IL-6) и участвуют в качестве индукторов и эффекторных клеток в поляризованных ответах Th2. Альтернативно активированные макрофаги M2 включают клетки, подвергшиеся воздействию низких концентраций M-CSF в присутствии IL-4, IL-13 или IL-10.Они участвуют в поляризованных реакциях Th3, очищении от паразитов, подавлении воспаления и ускорении ангиогенеза и ремоделирования тканей [7, 8]. In vivo , идентификация фенотипа макрофагов затруднена, поскольку макрофаги, очевидно, подвергаются воздействию микросреды, которая является более сложной по отношению к условиям культивирования клеток, и они обладают характеристиками, которые не соответствуют определенным фенотипическим категориям in vitro . Таким образом, классификация in vivo макрофагов в двух поляризованных состояниях (M1 по сравнению с M2) звучит как чрезмерное упрощение.Поэтому в последние годы характеристика фенотипа макрофагов in vivo при восстановлении тканей является предметом активных исследований. Активация макрофагов описывается как динамический процесс: одна и та же клетка может сначала вызывать провоспалительные и цитотоксические реакции, а затем может участвовать в разрешении воспаления и заживлении ран [9]. Возникает распространенный сценарий, при котором вскоре после травмы инфильтрирующие макрофаги являются в основном провоспалительными макрофагами M1, тогда как макрофаги M2 являются первичными эффекторами более поздних стадий восстановления или ремоделирования тканей [10–12].Недавние данные также пролили свет на функциональные перекрестные связи между макрофагами и стволовыми / предшественниками, которые могут вносить вклад в восстановление и ремоделирование в разных тканях / органах [13-15].
Конкретные примеры происхождения и функций макрофагов во время заживления различных тканей проиллюстрированы ниже, с особым акцентом на скелетных мышцах.
Макрофаги играют решающую роль в восстановлении целостности и гомеостаза кожи и выполняют различные функции во время нескольких фаз восстановления кожи, несмотря на то, что лежащие в основе молекулярные механизмы остаются частично неясными [16, 17].Было показано, что трансгенные мыши, экспрессирующие рецептор дифтерийного токсина человека (DTR) под контролем промотора CD11b, допускают условное истощение макрофагов [18]. Используя этих трансгенных мышей, Mirza et al. продемонстрировали, что истощение макрофагов во время заживления ран приводит к замедленной реэпителизации, уменьшению отложения коллагена, нарушению ангиогенеза и, наконец, к закрытию раны [17]. Интересно, что Лукас и др. показали, что на ранних этапах восстановления кожи инфильтрирующие макрофаги альтернативно активируются и экспрессируют высокие уровни факторов роста, VEGF α и TGF β , которые вносят свой вклад, соответственно
.
Структура мышц — мышцы под микроскопом — Science Learning Hub
Все мышцы выглядят одинаково? Если вы посмотрите на скелетные, гладкие и сердечные мышцы с помощью микроскопа, вы увидите различия в их структуре.
Скелетная мышца
Скелетная мышца выглядит полосатой или «полосатой» — волокна содержат чередующиеся светлые и темные полосы (полосы), похожие на горизонтальные полосы на рубашке для регби. В скелетных мышцах волокна собраны в правильные параллельные пучки.
Сердечная мышца
Сердечная мышечная ткань, как и ткань скелетных мышц, выглядит полосатой или полосатой. Пучки разветвленные, как у дерева, но соединенные с обоих концов. В отличие от ткани скелетных мышц, сокращение ткани сердечной мышцы обычно не контролируется сознанием, поэтому оно называется непроизвольным.
Гладкая мышца
По сравнению со скелетной мышцей гладкомышечные клетки меньше. Они имеют веретеновидную форму и не имеют бороздок. Вместо этого у них есть пучки тонких и толстых нитей.
Присмотритесь к скелетным мышцам
Все волокна скелетных мышц не одинаковы. Они различаются по структуре и функциям, например, по скорости сжатия.
Волокна скелетных мышц сокращаются с разной скоростью в зависимости от:
- их способности расщеплять АТФ (химическое высвобождение энергии)
- способа, которым они производят АТФ
- насколько быстро они устают
Итак, скелетные мышцы классифицируются на два широких типа — быстрые сокращения и медленные сокращения.
Медленное сокращение (также называемое Типом I):
- имеет множество крошечных кровеносных сосудов, называемых капиллярами (и поэтому выглядит красным)
- имеет много митохондрий (участков производства энергии) запасной белок в мышцах)
- переносит больше кислорода
- не устает быстро (может выдерживать аэробную активность)
- может сокращаться медленно
- в большом количестве обнаруживается в постуральных мышцах шеи
Природа науки
Заметили ли вы, что когда вы смотрите на что-то под микроскопом, это может сбивать с толку, но если вы посмотрите на контрольную диаграмму или изображение, вы сможете увидеть под микроскопом гораздо больше деталей? Когда ученые наблюдают, они уже имеют некоторое представление о том, на что смотрят.На их наблюдения влияют их опыт, знания и понимание существующих теорий.
Быстрое сокращение (также называемое Типом II):
Тип IIa
- аэробно, как и медленные мышцы
- богато примерно
.
