Дисбактериоз
24.03.2020
Дисбактериоз кишечника – это клинико – лабораторный синдром, возникающий вследствие воздействия неблагоприятных факторов и служащий впоследствии фоном для возникновения функциональных, метаболических, воспалительных и иммунологических нарушений. Дисбактериоз кишечника не является самостоятельным заболеванием.
Степень изменения микрофлоры кишечника при дисбактериозе:
• Первая степень – снижение уровня бифидо – и лактобактерий
• Вторая степень – нарушение качественного и количественного состава эшерихий
• Третья степень – появление условно – патогенных микроорганизмов в концентрациях, превышающих допустимые
Показания к проведению исследования на дисбактериоз:
• Обследование пациентов после длительного лечения антибиотиками
• Обследование пациентов с нарушением всасывания веществ в кишечнике, то есть с синдромом мальабсорбции, например, при хроническом панкреатите
• При наличии хронической диареи
• При наличии у пациента аллергических заболеваний, плохо поддающихся лечению, в частности, при атопическом дерматите
• При длительном выздоровлении после перенесенных острых кишечных инфекций
Правила подготовки к анализу и правила сбора кала:
• Кал собирается в стерильный пластиковый контейнер в небольшом объеме (не более 1/3 контейнера) из различных мест фекальной массы. Стул должен быть самостоятельным и собран с невпитывающих материалов. Кал рекомендовано доставить в лабораторию в течение 2-х часов после сбора.
При отсутствии стула не допускается использование клизмы и прием слабительных средств.
• Анализ рекомендовано сдавать минимум через 14 дней после окончания курса приема антибиотиков или иных антибактериальных препаратов
Состав микрофлоры толстого кишечника в норме:
• Бифидобактерии – облигатные анаэробы, для жизнедеятельности им не требуется кислород, более того, он для них токсичен. Бифидобактерии заселяют кишечник с первых дней жизни. В составе нормальной микрофлоры здоровых взрослых людей бифидобактерии – преобладающие микроорганизмы. Резкое снижение уровня бифидобактерий – причина нарушения функций кишечника как у детей, так и у взрослых. Эти бактерии выполняют ряд полезных функций, в частности синтезируют некоторые витамины, улучшают всасывание питательных веществ, препятствуют колонизации кишечника патогенными микроорганизмами, а также формируют местный иммунитет кишечника.
В составе нормальной микрофлоры здоровых взрослых людей бифидобактерии – преобладающие микроорганизмы. Резкое снижение уровня бифидобактерий – причина нарушения функций кишечника как у детей, так и у взрослых. Эти бактерии выполняют ряд полезных функций, в частности синтезируют некоторые витамины, улучшают всасывание питательных веществ, препятствуют колонизации кишечника патогенными микроорганизмами, а также формируют местный иммунитет кишечника.
• Лактобактерии – также, как и бифидобактерии, являются анаэробными микроорганизмами. Выполняют ряд полезных функций в кишечнике, а именно подавляют размножение вредных микроорганизмов и вырабатывают полезные вещества, такие как антибактериальный белок лизоцим.
• Эшерихии – представляют собой группу бактерий, в состав которой входят как условно – патогенные, так и патогенные виды. Условно – патогенные виды эшерихий формируют кишечную микрофлору. Физиологическая роль кишечной палочки очень важна. Она участвует в образовании витаминов и аминокислот, а также препятствует колонизации кишечника опасными бактериями. При неблагоприятных условиях кишечные палочки как условно-патогенные бактерии могут вызывать гнойно-воспалительные процессы в различных органах, в частности в почках, мочевом и желчном пузыре. Патогенные кишечные палочки вызывают острые кишечные инфекции.
• Клостридии – группа анаэробных бактерий. В кишечнике клостридии обитают постоянно. Клостридии вызывают процессы брожения и гниения в кишечнике. Некоторые виды клостридий являются причиной развития диареи, ассоциированной с антибиотиками, а некоторые могут вызывать пищевые токсикоинфекции.
• Стафилококки – условно – патогенные бактерии, то есть они способны вызывать различные заболевания при определенных условиях, а именно при нарушении работы иммунной системы, обусловленной иммунодефицитными состояниями (как врожденными заболеваниями, так и приобретенными, например, при СПИДе), при длительном лечении кортикостероидами (преднизолоном), при проведении химиотерапии для лечения онкологических заболеваний.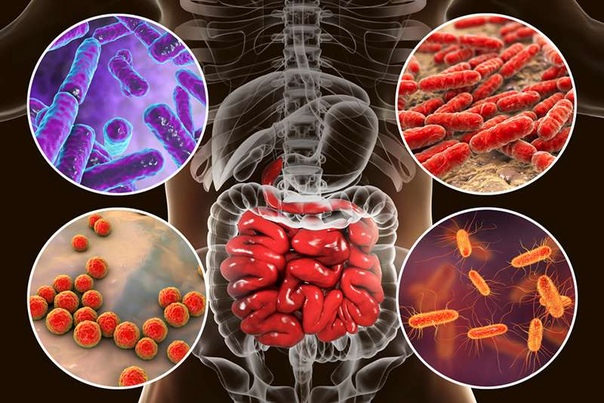
В организме человека наиболее распространены 3 вида стафилококков:
— Золотистый стафилококк – наиболее патогенный вид стафилококков. Является возбудителем таких заболеваний, как локальные гнойно – воспалительные процессы (флегмоны, фурункулы), пищевые токсикоинфекции, а также, в тяжелых случаях, сепсиса.
— Эпидермальный стафилококк – входят в состав нормальной микрофлоры кожи, слизистых оболочек и кишечника. Способны вызывать раневые и другие инфекции на фоне снижения иммунного статуса.
— Сапрофитные стафилококки – наименее патогенные стафилококки, вызывают заболевания только при резком снижении неспецифической защиты организма, а также при наличии выраженных иммунодефицитных состояний.
Основная масса стафилококков кишечника представлена непатогенными видами, то есть эпидермальными и сапрофитными, и лишь 20% всех стафилококков кишечника составляют виды, способные вызывать заболевания.
• Грибы рода Кандида – являются представителем условно – патогенной флоры. Попадая в желудочно – кишечный тракт здоровых людей, они либо не задерживаются в кишечнике, либо становятся представителем нормальной микрофлоры кишечника. У некоторых людей формируется кандидоносительство, а у больных с ослабленным иммунитетом может развиться кандидоз. Выделение грибов в количестве более 10 в 4 степени в 1 г фекалий должно настораживать в отношении возможного формирования кандидоза.
• Клебсиеллы – относятся к группе условно – патогенных энтеробактерий. Клебсиеллы входят не только в состав кишечного биоценоза, но и обнаруживаются на коже и слизистых оболочках дыхательных путей. У лиц с нарушенным иммунным статусом клебсиеллы могут вызывать острые кишечные инфекции, инфекции мочеполовых путей и пневмонию.
Симптомы дисбактериоза кишечника:
• Ранними и наиболее заметными симптомами кишечного дисбактериоза можно считать повышенное газообразование, нарушение переваривания пищи, изменение характера стула
• При присоединении воспалительного процесса появляется болевой синдром и патологические примеси в кале
• В более выраженных случаях развивается снижение массы тела, обезвоживание и интоксикация
• Для дисбактериоза характерны также вторичные внекишечные проявления – дефицит витаминов группы В, возникновение хронической крапивницы и другие нарушения
Выраженность симптомов дисбактериоза не всегда тесно связана со степенью нарушений микрофлоры. Нередко при значительных сдвигах в микрофлоре симптомы минимальны, или вовсе отсутствуют. С другой стороны, при наличии хронических заболеваний желудочно – кишечного тракта даже минимальные отклонения микрофлоры кишечника от нормы могут сопровождаться значительными клиническими проявлениями.
Нередко при значительных сдвигах в микрофлоре симптомы минимальны, или вовсе отсутствуют. С другой стороны, при наличии хронических заболеваний желудочно – кишечного тракта даже минимальные отклонения микрофлоры кишечника от нормы могут сопровождаться значительными клиническими проявлениями.
Интерпретацию результатов данного анализа осуществляет гастроэнтеролог, инфекционист, или педиатр.
Лаборатория Диалайн предлагает тест:
• ПБ6 Исследование микробиоценоза кишечника (дисбактериоз).
Возникли вопросы?
Заполните форму обратной связи, наши менеджеры свяжутся с вами!
Как бактерии кишечника защищают организм
С детства нас учат, что бактерии опасны. Но из всех бактерий это лишь 1% — остальные приносят организму пользу, либо никак на него не влияют.
Сегодня мы расскажем об истории открытия бактерий, в каких случаях они опасны, и чем они полезны.
Хорошие и плохие бактерии
Бактерии — неотъемлемая часть нашей жизни. Они обитают на поверхности кожи, в ротовой полости, на гениталиях, в кишечнике и глазах, хотя ранее ученые думали, что глаза стерильны. Эти микроорганизмы появились задолго до нас, и в процессе эволюции человеческому организму пришлось научиться с ними сосуществовать.
Любое бактериальное сообщество или экосистема бактерий называется микробиотой. Микробиота кишечника состоит из триллионов микроорганизмов.
Бактерии условно делятся на три типа: комменсальные, патогенные и оппортунистические. Комменсальные бактерии помогают иммунной системе распознавать болезнетворные микроорганизмы. Из-за этого они считаются хорошими.
Патогенные бактерии при попадании в организм способны вызывать заболевания. Эти бактерии могут распространяться через воду, воздух, почву, а также при физическом контакте. Сами по себе патогенные бактерии не представляют угрозу. Опасность возникает, когда их количество превышает норму, или если они оказываются не на своем месте.
Оппортунистические бактерии в условиях здоровой микробиоты не приносят ни пользу, ни вред. Однако они начинают активно размножаться при нарушениях в работе иммунной системы, заболеваниях, резких изменениях в составе микробиоты и травмах.
Staphylococcus aureus — типичные представители бактериального сообщества, носа и кожи. Но если они попадают в кровь, то способны спровоцировать инфекции.
Escherichia coli (E.coli) имеет плохую репутацию, связанную с пищевыми отравлениями. На самом деле, всего несколько представителей этого рода ответственны за это. Представленность E.coli в небольших количествах в кишечнике — норма. Однако, если они окажутся в мочевыводящих путях, это может стать причиной цистита.
Открытие хороших бактерий
Люди уже несколько столетий занимаются изучением бактерий — первые упоминания о них появились в 1683 году.
Бактерии микробиоты кишечника вне привычной среды быстро погибают. Из-за этого было сложно оценить сообщество микроорганизмов и его функции в Чашке Петри. Но с появлением доступных генетических исследований все изменилось — сегодня с помощью анализа ДНК можно изучать все бактерии в образце, даже погибшие.
Тесты Атлас основаны на технологии секвенирования гена бактерий 16S rRNA, которая позволяет идентифицировать все бактерии в образце.
Знакомство человека с бактериями при рождении
Результаты некоторых исследований показывают, что у детей, которые родились с помощью кесарева сечения, выше риск дисбиоза — нарушения баланса микроорганизмов кишечника, и развития метаболических и аутоиммунных заболеваний по мере взросления. К таким заболеваниям относится сахарный диабет I типа, ожирение, астма и целиакия — непереносимость глютена.
Дети же, рожденные естественным путем, во время прохождения через родовые пути встречаются с микробами, которые формируют иммунитет. Благодаря этому они менее склонны к развитию заболеваний, связанных с работой иммунной системы.
Дисбиоз (дисбактериоз) свидетельствует об изменениях в составе микробиоты. У детей, рожденных с помощью кесарева сечения, соотношение микробов отличается от микробиоты детей, которые рождаются естественным путем.
В России по данным 2018-2019 гг. четверть родов проводится с помощью кесарева сечения.
Однако, не все ученые согласны с тем, что вид родов играет определяющую роль в дисбиозе у новорожденных. В 2018 году Университет Западной Австралии опубликовал результаты научного исследования под названием «Критический взгляд на теорию крещения микробами и влияния кесарева сечения на микробиоту новорожденных».
Ученые считают, что дисбиоз новорожденных зависит не только от вида родов, но и от таких факторов, как послеродовое применение антибиотиков, отсутствие схваток, различия в кормлении грудью, избыточный вес матери и срок беременности.
Роль бактерий в здоровье микробиоты
Бактерии во многом похожи на нас: им необходимы комфорт и пища, они болеют, воюют, заботятся друг о друге, рождаются и умирают. Когда их потребности удовлетворены, они заботятся и о нашем здоровье.
Одна из приоритетных задач бактерий кишечника — расщеплять пищу на простые молекулы, чтобы они могли всасываться в кровь. Человеческий организм не может переваривать сложные углеводы самостоятельно, так как не вырабатывает ферменты для их расщепления. Но это не значит, что они не нужны.
Сложные углеводы — пищевые волокна, или клетчатка, которая содержится в продуктах растительного происхождения, например, цельнозерновых и бобовых. Клетчатка — основной источник питания бактерий кишечника. Они используют ее для синтеза витаминов и короткоцепочечных жирных кислот, в том числе масляной кислоты.
Но не все так просто. Недостаточно просто начать есть клетчатку в большом количестве, чтобы микробиота была здоровой. Чтобы расщеплять поступающие волокна нужны разные виды микробов. Сообществу с низким разнообразием бактерий сложно справляться со всеми функциями.
Видео о важности разнообразия микробного сообщества
Различные пре- и пробиотики в рационе увеличивают разнообразие и улучшают здоровье микробиоты. Пребиотики — продукты, которые любят полезные бактерии. Они содержатся в овощах, фруктах, злаковых, грибах и бобовых. Пробиотики — продукты, содержащие полезные бактерии, например кефир, йогурт и ферментированные овощи.
Другая не менее важная задача микробов — поддерживать баланс бактериального сообщества микробиоты. Микробиоту можно сравнить со страной, некоторые жители которой трудятся на благо общества и следят за порядком; другие — простые наблюдатели, которые не приносят пользу, но и не создают проблемы; а третьи в любой момент могут устроить бунт.
Комменсальные бактерии поддерживают порядок. Для их благополучия нужны сложные углеводы, в том числе пребиотики. Из волокон бактерии производят специальные вещества, которые затем используют в качестве оружия для защиты от патогенных бактерий. Например, не дают им закрепиться на стенках кишечника и тем самым спровоцировать заболевание.
Некоторые микроорганизмы ферментируют нутриенты и делают их более усваиваемыми для собратьев. А бактерии типа Firmicutes синтезируют из пищевых волокон масляную кислоту — главный источник энергии клеток кишечника (колоноцитов).
Колоноцитам нужно питание, чтобы предотвращать воспалительные заболевания кишечника, поддерживать иммунитет и предупреждать появление раковых клеток. Здоровый кишечник препятствует распространению по организму токсинов, вредных органических соединений и патогенных бактерий.
Как узнать, что микробиота плохо справляется со своими функциями
Дисбиоз может проходить бессимптомно, но если наблюдаются проблемы со стулом и боли в животе, следует обратиться к врачу.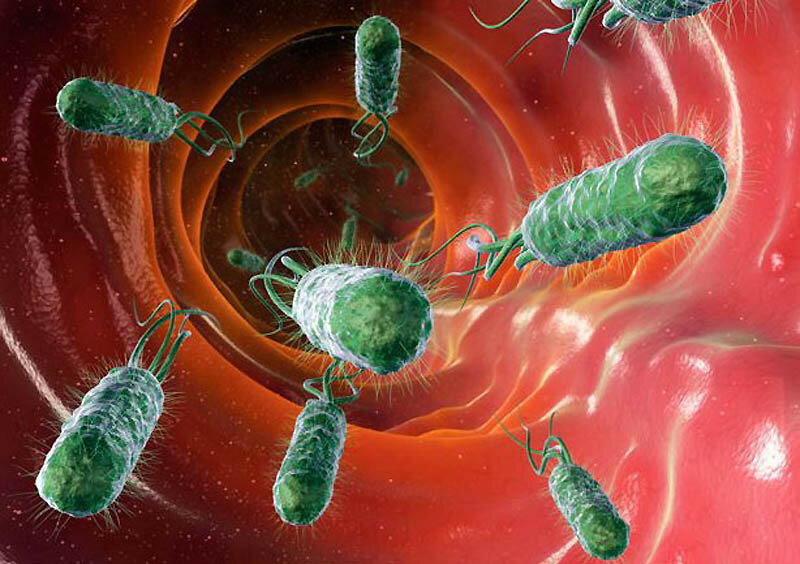
Показатели из Теста микробиоты Атлас, которые могут указать на дисбаланс сообщества бактерий кишечника:
Разнообразие — ключевой показатель здоровья и защищенности от заболеваний. Низкое разнообразие ассоциируется с повышенными рисками хронических заболеваний — болезни Крона или сахарного диабета 2 типа.
Защита от заболеваний. Состав бактерий микробиоты влияет на защиту от хронических заболеваний. Если снижена представленность бактерий, отвечающих за защиту, риск того, что болезнь проявится, возрастает. Результаты Теста микробиоты Атлас помогают оценить, как хорошо микробиота защищает от пяти заболеваний:
- Ожирение
- Сахарного диабета 2 типа
- Ишемической болезни сердца
- Болезни Крона
- Язвенного колита
Пробиотические и другие полезные бактерий. Роды бактерий Bifidobacterium и Lactobacillus подавляют рост патогенов, помогают укреплять стенки кишечника и препятствуют воспалению. Даже если эти бактерии не представлены в микробиоте, но проходят через желудочно-кишечный тракт, например, при употреблении йогурта или комбучи — они приносят пользу.
Бактерии типа Firmicutes, в том числе Faecalibacterium prausnitzii, отвечают за производство бутирата. Их представленность в микробиоте обычно снижена при ожирении, сахарном диабете и болезни Крона.
Akkermansia muciniphila стимулирует клетки кишечника производить муцин — белок, который в большом количестве содержится в слизистом слое и защищает от инфекций. Сниженная представленность этого вида бактерий повышает риски развития язвенного колита, болезни Крона и сахарного диабета 2 типа.
Широкомасштабные исследования тысяч образцов микробиоты со всего мира позволили описать энтеротипы — устойчивые сочетания бактерий, которые соответствуют определенным стилям питания. Их условно разделили на три типа: житель большого города, который употребляет много мясных продуктов и сахара; деревенский крестьянин, в рационе которого преобладают зерновые продукты и устойчивый крахмал; и обитатель джунглей — чаще встречается у вегетарианцев.
С помощью Теста микробиоты Атлас можно узнать, относится ли ваша микробиота к типу «житель большого города». Такой тип говорит о преобладании Bacteroides, которые связаны с высоким потреблением животных белков и жиров, а также рафинированного сахара. Повышенная представленность Bacteroides указывает на низкое разнообразие.
Как улучшить показатели микробиоты
Когда мы говорим о главных органах, которые влияют на здоровье, первое, что приходит на ум — сердце, легкие, печень, мозг. О кишечнике часто думают в последнюю очередь. Но все больше исследований говорит о том, что этот орган отнюдь не второстепенный, и может даже влиять на настроение и качество сна. На здоровье микробиоты влияет несколько факторов.
Питайтесь с заботой о бактериях кишечника
Ключевые слова, которые связывают здоровье микробиоты и питание — разнообразие и умеренность. Следующие продукты помогут поддерживать здоровье микробиоты:
- Продукты растительного происхождения: овощи, зелень, цельнозерновые продукты, орехи, семена, фрукты, растительные масла. Это богатые источники клетчатки, пребиотиков и ненасыщенных жирных кислот.
- Жирная рыба и морепродукты: источники белка, ненасыщенных жирных кислот.
- Пробиотики: кефир, йогурт, комбуча, квашеная капуста. Содержат полезные бактерии и увеличивают разнообразие микробиоты.
На здоровье пищеварения влияет не только тип еды. Количество еды, частота и время приема пищи тоже отражаются на состоянии ЖКТ. Старайтесь не переедать, избегайте снеков, особенно полуфабрикатов, не ешьте на ночь. Ваш кишечник тоже должен отдыхать и успевать справляться с поступающей пищей.
Больше двигайтесь
Доказано, что занятия спортом положительно влияют на бактериальный состав микробиоты. И наоборот, при сидячем образе жизни, разнообразие снижено. Это может вызывать дисбиоз и снижение иммунитета. Исследования показывают, что даже 20-минутная прогулка после приема пищи улучшает пищеварение.
Избегайте стресс
Когда вы испытываете стресс, страдает и микробиота вашего кишечника. И наоборот, скудный состав микробиоты может вызвать негативные изменения в вашем психологическом состоянии. Высыпайтесь, занимайтесь йогой или медитацией, гуляйте на свежем воздухе, уделяйте время любимому хобби.
Результаты Теста микробиоты Атлас помогут узнать, какие виды бактерий населяют кишечник, как микробиота справляется с синтезом витаминов или масляной кислоты, а также степень защиты от заболеваний. Используйте промокод blog10, чтобы получить скидку 10% на исследование.
Запомнить:
- Кишечные бактерии учат иммунитет распознавать патогены.
- Сбалансированное бактериальное сообщество защищает организм от развития некоторых хронических заболеваний.
- Дисбиоз — негативные изменения в микробиоте, которые могут вызвать воспаление.
- Естественные роды могут способствовать знакомству ребенка с бактериями и улучшать иммунитет.
- Тестирование микробиоты кишечника помогает оценить состояние микробиоты.
- C Mueller and A J Macpherson. Layers of mutualism with commensal bacteria protect us from intestinal inflammation. Gut, 2006.
- Fabien Magne, Alexa Puchi Silva, Bielka Carvajal, and Martin Gotteland. The Elevated Rate of Cesarean Section and Its Contribution to Non-Communicable Chronic Diseases in Latin America: The Growing Involvement of the Microbiota. Frontiers in Pediatrics, 2017.
- LF Stinson et al, A Critical Review of the Bacterial Baptism Hypothesis and the Impact of Cesarean Delivery on the Infant Microbiome, 2018
- S. Banquera et al., Global Overview of the Epidemiology of Atherosclerotic Cardiovascular Disease, 2015
- J. Zhuye et al., The gut microbiome in atherosclerotic cardiovascular disease, 2017
- C. Bogiatzi et al., Metabolic products of the intestinal microbiome and extremes of atherosclerosis, 2018
- NA. Molodecky et al. Environmental Risk Factors for Inflammatory Bowel Disease
- The Lancet Crohn’s Disease Review
- J E Mawdsley and D S Rampton, Psychological stress in IBD, 2005
- S.
 Khanna & LEH Raffals, The Microbiome in Crohn’s Disease. Role in Pathogenesis and Role of Microbiome Replacement Therapies, 2017
Khanna & LEH Raffals, The Microbiome in Crohn’s Disease. Role in Pathogenesis and Role of Microbiome Replacement Therapies, 2017 - V. Pascal et al., A microbial signature for Crohn’s disease, 2017
- Ting-Ting Huang et al, Current Understanding of Gut Microbiota in Mood Disorders: An Update of Human Studies, 2019
Страница не найдена |
Страница не найдена |
404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
293031
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Апр
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Немного о роли микрофлоры кишечника в жизни человека
Кудин А. П., к.м.н., доцент, зав. инфекционным отделением № 5 УЗ «Городская детская инфекционная больница г. Минска»
П., к.м.н., доцент, зав. инфекционным отделением № 5 УЗ «Городская детская инфекционная больница г. Минска»
Организм человека населяет большое количество микроорганизмов (по приблизительным подсчетам — около 1000 видов), основную массу которых составляют бактерии. В значительно меньшем количестве представлены другие микроорганизмы (вирусы, археи, простейшие). В норме все они находятся в состоянии равновесия между собой и с организмом человека.
Микроорганизмы попадают к человеку из внешней среды и заселяют (с рождения и пожизненно) те области, которые непосредственно контактируют с внешней средой: кожа, дыхательные пути, мочевыводящие пути, желудочно-кишечный тракт (ЖКТ). Внутренняя среда макроорганизма, а также альвеолы, внутреннее и среднее ухо, матка, почки и мочеточники в норме стерильны. Очевидно, самые благоприятные условия для пребывания микробов в организме человека создаются в ЖКТ.
Заселение кишечника ребенка начинается примерно с середины периода внутриутробного развития (единичные микробы), но основное заселение происходит с момента рождения. При прохождении через родовые пути начинается интенсивная колонизация кожных покровов и слизистых оболочек, соприкасающихся с внешней средой. Эпидермальные стафилококки заселяют кожу α-стрептококки – носоглотку. Массивная колонизация кишечника здорового новорожденного происходит гетерогенной флорой (аэробной и анаэробной) в первые сутки. Однако с 3-5 дня основной (резидентной) флорой становятся бифидобактерии, которые вытесняют другие микроорганизмы из местного биотопа. Это связано с тем, что лактоза грудного молока активно метаболизируется в первую очередь бифидо- и лактобактериями. Кроме того, содержащийся в женском (но не коровьем) молоке N-ацетилглюкозамин стимулирует рост бифидобактерий.
При родоразрешении путем кесарева сечения состав микробов, колонизирующих организм новорожденного, отличается в сторону дефицита лактобацилл, энтеробактерий и дифтероидов.
Некоторые факторы (течение беременности, способ родоразрешения, особенности выхаживания ребенка после рождения и др. ) могут нарушать этапность заселения и видовой состав микрофлоры кишечника.
) могут нарушать этапность заселения и видовой состав микрофлоры кишечника.
Состав микробного пейзажа во многом определяется характером питания. У грудных детей, находящихся на естественном вскамливании, доминируют бифидо- и лактобактерии. У грудных детей на искусственном вскармливании микрофлора кишечника более гетерогенна, и преобладание молочно-кислых микробов над другими выражено в значительно меньшей степени. У более старших детей по мере уменьшения в питании доли молочных продуктов и включения мяса и мясных продуктов увеличивается удельный вес протеолитических микробов.
Нормальная микрофлора человека представлена облигатными микроорганизмами (которые присутствуют, практически, постоянно) и транзиторными (факультативными), на долю которых приходится не более 1-2%.
В зависимости от особенностей метаболизма все микробы кишечника можно условно разделить на протеолитические (кишечная палочка и другие грамм-отрицательные энтеробактерии, бакероиды, клостридии) и сахаролитические (бифидо- и лактобактерии, энтерококки).
По отношению к кислороду бактерии делят на облигатные аэробы, растущие только в присутствии кислорода, облигатные анаэробы рост которых подавляется кислородом (бактероиды, бифидобактерии, клостридии) и факультативные анаэробы, способные к росту как в присутствии кислорода, так и без него (лактобактерии, кишечная палочка и др. грамм-отрицательные энтеробактерии, стафилококки, стрептококки, энтерококки). На долю облигатных анаэробов (бактероиды и бифидобактерии) приходится 95-99% всех микробов кишечника (причем, бактероидов больше).
По локализации в кишечнике выделяют пристеночную и полостную микрофлору. В тонкой кишке содержание пристеночной флоры на несколько порядков превышает численность полостной. В толстой кишке это соотношение меняется на противоположное.
Общее колическтво микробных клеток в организме человека по расчетам составляет около 1014, что превышает число собственных клеток человека.
Распределение нормальной микрофлоры вдоль желудочно-кишечного тракта (ЖКТ) неоднородно по качественному и количественному составу.
В ротовой полости анаэробов примерно на порядок больше, чем аэробов, т.к. первые, находясь в труднодоступных местах (десневые карманы, щели между зубами и т.д.), лучше защищены от действия лизоцима и других протективных факторов слюны. Среди бактерий здесь преобладают стрептококки (до 60% всех микробов ротовой полости). Из других частых представителей микрофлоры следует упомянуть фузобактерии, вейонеллы, бактероиды, спирохеты, актиномицеты. Здесь же обитают микоплазмы (M.salivarium), грибы рода Candida, простейшие (Entamoeba buccalis, Entamoeba dentalis, Trichomonas buccalis). Данная микробиота представляет собой первый барьер, препятствующий проникновению болезнетворных микроорганизмов, попадающих в полость рта из внешней среды, дальше в ЖКТ.
В желудке здорового человека микробов, практически, нет из-за действия желудочного сока, имеющего низкое значение рН. В небольшом количестве здесь могут существовать некоторые лактобактерии и грамотрицательные энтеробактерии. Содержание Helicobacter pylori обычно не превышает 103 бактерий в 1 мл содержимого желудка.
Верхние отделы тонкой кишки относительно мало заселены микроорганизмами. В физиологических условиях в тощей кишке содержится 104-5/мл микробов (в основном, лакто- и бифидобактерии), и по мере приближения к илеоцекальному клапану количество микробов в подвздошной кишке увеличивается до 107/мл (в основном за счет бактероидов, энтерококков, кишечной палочки).
Толстая кишка отличается самой высокой плотностью заселения микроорганизмами, количество которых достигает 109-1012/мл, из которых анаэробы составляют 95-99%. К ним относятся грамположительные палочки (бифидо-, лакто- и эубактерии), грамотрицательные палочки (бактероиды), грамположительные спорообразующие палочки (клостридии). Из других частых представителей нормальной микрофлоры следует назвать энтерококки, грамотрицательные факультативно-анаэробные палочки (кишечная палочка, клебсиелла, энтеробактер и др. ). в меньших количествах обнаруживаются стафилококки, дрожжевые грибы, простейшие и вирусы.
). в меньших количествах обнаруживаются стафилококки, дрожжевые грибы, простейшие и вирусы.
Сохранению относительного постоянства нормальной микрофлоры способствуют различные факторы, к которым относятся нормальная перистальтика кишечника (прежде всего, тонкой кишки), герметичность эпителиального слоя, компоненты пищеварительных соков (соляная кислота, желчные кислоты, протеолитические ферменты и т.д.), сохранная функция илеоцекального клапана, факторы местного иммунитета (секреторные IgA, лизоцим, лимфоидные образования кишечника, состояние перманентного физиологического воспаления в стенке кишки).
Значение кишечной микробиоты для организма человека трудно переоценить. К основным функциям нормальной микрофлоры относятся:
- Защитная функция, суть которой заключается в обеспечении колонизационной резистентности, т.е. предотвращении колонизации ЖКТ патогенными микроорганизмами. Это осуществляется за счет конкуренции за питательные вещества, за места адгезии (рецепторы), за счет выработки бактериоцинов, короткоцепочечных жирных кислот, а также за счет стимуляции местных защитных факторов (в виде состояния легкого воспаления).
- Пищеварительная функция. Микрофлора обеспечивает конечный гидролиз белков, омыление жиров, сбраживание высокомолекулрных углеводов, которые не метаболизировались в тонкой кишке. Кроме того, некоторые вещества, поступающие с пищей, могут расщепляться только кишечной микрофлорой (например, целлюлоза). Под действием нормальной микрофлоры в подвздошной кишке происходит деконъюгация 90% желчный кислот с последующим обратным всасыванием и повторным участием в пищеварении. Оставшиеся в кале желчные кислоты обеспечивают нормальную гидратацию каловых масс.
- Двигательная функция. На перистальтику кишечника микрофлора может влиять по-разному. С одной стороны, за счет стимуляции синтеза окиси азота и активации L-клеток кишечника может замедлять моторику в тонкой кишке и проксимальных отделах толстой кишки. С другой стороны, короткоцепочечные жирные кислоты, синтезирующиеся микрофлорой, в дистальных отделах толстой кишки стимулируют усиление моторики.

- Способствует всасыванию воды (с помощью некоторых продуктов микробного метаболизма).
- Нормальная микрофлора способна обезвреживать многие токсические вещества как путем их химической обработки, так и за счет сорбции на своей поверхности и выведения с каловыми массами. По антитоксической функции некоторые авторы приравнивают кишечных микробов к печени.
- Участвуют в синтезе некоторых необходимых веществ: витаминов группы В (В1,В2,В6,В12), фолиевой кислоты, витамина К и др. и хотя большинство из этих синтезирующихся веществ не всасываются, они могут оказаться важными и полезными для собственно слизистой кишечника. Например, было показано, что недостаточное поступление к эпителию слизистой толстой кишки витаминов В6, В12 и фолиевой кислоты связано с повышенным риском развития рака толстой кишки.
Стоит отметить, что геном человека содержит около 23 тыс генов, а количество генов микробов и вирусов, содержащихся только в ЖКТ, составляет более 3 млн, и, возможно, часть из них участвует в синтезе необходимых человеку веществ. В эксперименте показано, например, что у стерильных («гнотобиологических») животных отмечается недоразвитие лимфоидной и гемопоэтической ткани, отмечаются нарушения со стороны головного мозга, истончается стенка кишечника, ослабляется реактивность фагоцитов, развивается гипогаммаглобулинемия.
- Иммуномодулирующая функция связана с воздействием на факторы врожденного и адаптивного иммунитета как на местном, так и на системном уровне. И это влияние, возможно, является главным во взаимодействии микрофлоры и макроорганизма. Влияние нормальной микрофлоры на систему иммунитета складывается из нескольких моментов. Во-первых, слизистая кишечника, особенно толстой кишки (вследствие наиболее массивного заселения бактериями), обильно инфильтрирована макрофагами, лимфоцитами, плазматическими клетками, т.е., фактически, находится в состоянии постоянного хронического воспаления.
 Это перманентное воспаление обеспечивает пребывание иммунокомпетентных клеток в состоянии субактивации и, как следствие, — более быстрый и эффективный ответ на попадание агрессивной (патогенной) флоры. Во-вторых, под действием нормальной микрофлоры синтезируются «естественные» («нормальные») антитела, реагирующие на наиболее распространенные в природе антигенные детерминанты (паттерны). Это обеспечивает протективную функцию в отношении многих патогенов. И наконец, в-третьих, не вдаваясь в подробности, следует напомнить, что в кишечнике постоянно находится около 60-70% всех лимфоцитов человека, которые рециркулируют по всему организму. Контакт с микробами кишечника может приводить к активации различных клонов лимфоцитов. Это влияние сохраняется при попадании этих лимфоцитов в кровеносное русло. И в зависимости от того, какие свойства приобрели иммунные клетки, будет определяться их влияние на весь организм. Кроме того, системное действие могут оказывать и вырабатывающиеся в кишечнике под действием микрофлоры различные биологически активные вещества, прежде всего, цитокины. Итогом такого влияния может оказаться как иммуностимуляция, так и иммуносупрессия. Эти процессы могут лежать в основе развития различных заболеваний, в т.ч. и аутоиммунных.
Это перманентное воспаление обеспечивает пребывание иммунокомпетентных клеток в состоянии субактивации и, как следствие, — более быстрый и эффективный ответ на попадание агрессивной (патогенной) флоры. Во-вторых, под действием нормальной микрофлоры синтезируются «естественные» («нормальные») антитела, реагирующие на наиболее распространенные в природе антигенные детерминанты (паттерны). Это обеспечивает протективную функцию в отношении многих патогенов. И наконец, в-третьих, не вдаваясь в подробности, следует напомнить, что в кишечнике постоянно находится около 60-70% всех лимфоцитов человека, которые рециркулируют по всему организму. Контакт с микробами кишечника может приводить к активации различных клонов лимфоцитов. Это влияние сохраняется при попадании этих лимфоцитов в кровеносное русло. И в зависимости от того, какие свойства приобрели иммунные клетки, будет определяться их влияние на весь организм. Кроме того, системное действие могут оказывать и вырабатывающиеся в кишечнике под действием микрофлоры различные биологически активные вещества, прежде всего, цитокины. Итогом такого влияния может оказаться как иммуностимуляция, так и иммуносупрессия. Эти процессы могут лежать в основе развития различных заболеваний, в т.ч. и аутоиммунных.
Различные виды и штаммы представителей нормальной микрофлоры слизистых могут оказывать разнонаправленное влияние на активность иммунной системы. Поэтому существует потенциальная возможность целенаправленно влиять на функционирование иммунной системы человека посредством воздействия с помощью микроорганизмов на факторы врожденного и адаптивного иммунитета. Здесь будет уместно процитировать статью Андреевой И.В. и Стецюк О.У., в которой суммированы данные литературы о влиянии различных пробиотиков на организм человека (табл.).
Влияние пробиотиков на макроорганизм (И.В. Андреева и О.У. Стецюк, 2010),
|
Штамм пробиотика
|
Положительное влияние на макроорганизм
|
|
L.
|
Усиление иммунного ответа, профилактика и лечение инфекций дыхательных путей у детей, профилактика и лечение инфекционной диареи у детей, профилактика антибиотик-ассоциированной диареи, профилактика возникновения атопического дерматита у детей, улучшение эрадикации H.pylori
|
|
L.reuteri SD2112
|
Усиление иммунного ответа, профилактика инфекций дыхательных путей у взрослых, лечение ротавирусной диареи
|
|
L.casei DN-114001
|
Усиление иммунного ответа, лечение диареи
|
|
L.acidophilus NCFM
|
Снижение непереносимости лактозы, уменьшение выраженности синдрома избыточного бактериального роста, лечение и профилактика урогенитальных инфекций у женщин, лечение инфекций дыхательных путей у детей, лечение диареи у детей, улучшение эрадикации H.pylori
|
|
L.plantarum 299V
|
Нейтрализация проявлений синдрома раздраженного кишечника, применяется в восстановительном периоде после хирургических вмешательств
|
|
L.casei Shirota YIT9029
|
Профилактика рецидивов поверхностного рака мочевого пузыря, усиление иммунного ответа
|
|
L.salivarius UCC118
|
Нейтрализация проявлений воспалительных заболеваний кишечника
|
|
B.lactis BB-12
|
Профилактика инфекций дыхательных путей у детей, профилактика и лечение инфекционной диареи и желудочно-кишечных расстройств у детей, профилактика антибиотик-ассоциированной диареи
|
|
B.infantis 35624
|
Нейтрализация проявлений синдрома раздраженного кишечника
|
|
B.
|
Лечение атопической экземы, улучшение эрадикации H.pylori, лечение язвенного колита
|
|
B.lactis HN019 (DR10)
|
Усиление иммунного ответа, особенного у пожилых
|
|
B.animalis DN173-010
|
Нормализация времени прохождения пищи по кишечнику
|
|
L.johnsonii La1 (Lj1)
|
Улучшение эрадикации H.pylori, усиление иммунного ответа
|
|
S.boulardii
|
Профилактика антибиотик-ассоциированной диареи
|
|
S.thermophilus (большинство штаммов)
|
Профилактика проявлений лактазной недостаточности
|
Взаимодействие макроорганизма с кишечной микрофлорой может осуществляться несколькими путями: в виде комменсализма, паразитизма, симбиоза.
По современным представлениям, провести четкую границу между комменсалами и условно-патогенной микрофлорой невозможно. В определенных случаях заболевание могут вызвать различные микробы, входящие в состав нормальной микрофлоры.
В настоящее время в печати (в том числе, и медицинской) нередко говорится о дисбактериозе, как о несуществующей проблеме. Аргументируется это разными доводами.
- Под «дисбактериозом» обычно обозначают изменения соотношений и состава нормальной микрофлоры организма, а также места их обитания. Однако до настоящего времени во всем мире нет понятия нормы кишечного биоценоза. И нет «золотого стандарта» диагностики дисбактериоза.
- Наиболее часто для диагностики дисбактериоза используют посев кала. Однако результаты этого анализа непоказательны. Во-первых, анализ показывает состояние микробов, обитающих только в просвете толстой кишки, причем в ее дистальном (конечном) отделе.
 Состав микробиоты тонкой кишки остается неизвестным. Во-вторых, при таком исследовании выделяют 8-12 видов микробов, в то время как их количество в кишечнике более 1000 (причем не учитывается содержание даже бактериодов, которые составляют более 50% массы всех кишечных микробов). В-третьих, для достоверной диагностики требуется собрать содержимое кишечника в стерильных условиях, транспортировать материал при определенной температуре и доставить его в лабораторию в течение 2 часов. Иначе результаты будут искажены.
Состав микробиоты тонкой кишки остается неизвестным. Во-вторых, при таком исследовании выделяют 8-12 видов микробов, в то время как их количество в кишечнике более 1000 (причем не учитывается содержание даже бактериодов, которые составляют более 50% массы всех кишечных микробов). В-третьих, для достоверной диагностики требуется собрать содержимое кишечника в стерильных условиях, транспортировать материал при определенной температуре и доставить его в лабораторию в течение 2 часов. Иначе результаты будут искажены.
Существует другая методика: посев аспирата тонкокишечного содержимого или биоптата стенки тонкой кишки. В этом случае мы получаем данные о состоянии флоры в тонком кишечнике. Но такая диагностика применяется крайне редко.
Есть также косвенные методы, которые позволяют судить о состоянии микрофлоры кишечника. К ним относятся химические методы: газожидкостная хроматография и масс-спектрометрия.
Для анализа используется содержимое кишечника, в котором определяется концентрация веществ — продуктов жизнедеятельности микрофлоры, а затем делается вывод о ее качественном и количественном составе.
Используются также дыхательные тесты, когда продукты жизнедеятельности бактерий определяют в выдыхаемом воздухе. Однако эти методы можно использовать только в качестве предварительной диагностики, так как велика доля ложных результатов.
- Даже современные молекулярные методики не дают исчерпывающего результата: до 75% разновидностей микробов остаются не классифицируемыми. Содержание микробов в кале не отражает реальной ситуации в просвете тонкой и толстой кишок, а тем более в пристеночных биотопах, где состав микробов может заметно отличаться от состава просветной флоры.
- И, кроме того, диагноз «дисбактериоз кишечника» не имеет четкой клинической составляющей — иными словами, такой болезни просто не существует.
Все перечисленное верно. Однако говорить об отсутствии проблемы нарушенного, аномального, избыточного и т.д. роста кишечных микробов, очевидно, неверно. Небольшие возможности современной диагностики этого состояния не исключают существование самой проблемы. В зарубежной литературе вместо термина «дисбактериоз кишечника» для обозначения нарушений качественного и количественного состава кишечной микрофлоры применяют термин «синдром избыточного роста бактерий» в тонкой кишке (bacterial overgrowth syndrome). Под этим синдромом понимают клинически и/или лабораторно подтвержденный синдром мальдигестии/мальабсорбции, связанный с качественными или количественными изменениями микробиоты тонкой кишки.
В этой статье, говоря о проблеме влияния измененноймикробиоты на организм человека, мы будем пользоваться привычным нам термином «дисбактериоз».
При дисбактериозе происходит перераспределение флоры на протяжении кишечника: малонаселенная в норме тонкая кишка оказывается заполненной огромным количеством бактерий, а в толстой кишке меняется их видовой состав. Вместо полезных и привычных видов появляются патогенные (чаще это условно-патогенные микробы, которые при определенных условиях начинают проявлять свойства патогенных).
Причин нарушения видового состава и количества микроорганизмов в кишечнике очень много, и обычно действуют они в комплексе.
«Полезные» бактерии гибнут:
- если им нечего есть. Такое случается, когда рацион несбалансирован, беден растительной клетчаткой и кисломолочными продуктами.
- если им некомфортно. При различных заболеваниях (колит, панкреатит, холецистит, гастрит, гепатит и др.) в кишечнике меняется pH. В изменившихся условиях нарушается обмен веществ и целостность клеток кишечных микробов.
- если их место занимают агрессивные «собратья» — патогенные бактерии, микроорганизмы, гельминты, грибы.
Не секрет, что облигатнопатогенные микробы (сальмонеллы, шигеллы, иерсинии, кампилобактерии и др.) вызывают соответствующие заболевания. При дисбактериозе же часто обнаруживаются, так называемые, условно-патогенные микробы, но в большом количестве. И здесь будет уместно напомнить о таком феномене, как «чувство кворума» (quorum sensing) – способность ощущать плотность собствнной популяции микробов. Оказалось, что микроорганизмы обладают способностью к самостимуляции собственного размножения. При благоприятных условиях они начинают продуцировать специальные автоиндукторы, стимулирующие соседние и недалеко расположенные микробные клетки данного вида. При превышении определенной пороговой концентрации биологические свойства этих микробов изменяются: у них экспрессируются заторможенные до этого гены, в которых закодированы биологически активные вещества, повышающие патогенность микробов (различные токсины, ферменты и т.д.). Таким образом, вроде бы безобидные микроорганизмы приобретают свойства патогенных. И в этом случае они уже способны оказывать повреждающее действие на организм человека и вызывать заболевание. (Если немного отвлечься от микробов, то можно сказать, что этот феномен, наверное, имеет универсальное действие. Например, люди в офисе, на стройке или производстве обычно ведут себя адекватно, но собираясь большой группой, например, на стадионе могут становиться агрессивными). Следует отметить, что предпринимаются попытки использовать «чувство кворума» в лечебных целях для увеличения метаболической и антагонистической активности представителей нормальной микрофлоры с целью защиты макроорганизма от действия патогенных агентов.
Поэтому лечение дисбактериоза может потребовать применения антимикробных препаратов, включая антибиотики. Однако следует помнить, что принципиально важным является то, что нужно лечить не плохой анализ на дисбактериоз, а клинически выраженное патологическое состояние, в основе которого лежит дисбактериоз. В немногочисленных данных содержимого тонкой кишки было показано, что до 20% здоровых людей могут иметь отклонения в микробном пейзаже (при патологии этот показатель составляет до 64%).
И, конечно же, говоря о лечении дисбактериоза, нельзя не сказать о применении биопрепаратов. Все они делятся на:
- Пребиотики (лаклулоза, инулин, фруктозо- и галактозоолигосахариды и др.) — это препараты, которые подготавливают кишечник к заселению нормальной микрофлорой, создают для нее комфортные условия. К пребиотикам относятся также продукты питания, такие как: кукурузные, овсяные каши, ржаной хлеб, бобовые, соки с мякотью, отруби, молочные продукты и др.
- Пробиотики (эубиотики) — это препараты, содержащие нормальную микрофлору кишечника и способные благоприятно воздействовать на кишечную микробиоту и общее состояние огранизма. Свойствами пробиотиков также обладают кисломолочные продукты, обогащенные лакто- и бифидобактериями.
- Синбиотики— комбинированные препараты про- и пребиотиков.
Практика показывает, что хорошо работающие «в пробирке» препараты не всегда оказывают должный эффект в организме. Введенная с пробиотиками флора часто пропадает после окончания курса терапии. Дело в том, что дисбактериоз — это скорее следствие, нежели причина болезней. В больном организме «полезные» бактерии просто не приживаются, сколько их не «сажай». Дисбактериоз развивается под влиянием множества факторов. И вылечить его только лишь приемом лекарств невозможно.
Отдельно необходимо сказать о применении биопреаратов после приема антибиотиков. Многие считают, что это является обязательным. На самом деле, при отсутствии каких-либо клинических проявлений антибиотик-ассоциированной диареи в применении биопрепаратов нет необходимости. (Так же, как и при наличии изменений в анализе на дисбактериоз при отсутствии соответствующей симптоматики).
Прежде чем заниматься микрофлорой, необходимо лечение хронических заболеваний, особенно желудочно-кишечного тракта. Важно избавиться от очагов инфекции во рту, ЛОР-органах. Огромное значение имеет сбалансированный рацион питания. То есть, нужно создать самые благоприятные условия для колонизации кишечника, и только после этого рассчитывать на благоприятный эффект от лечения.
И наконец, следует сказать о еще одном заблуждении, которое довольно широко распространено. Многие считают что живые пробиотики колонизируют кишечник и, тем самым, излечивают дисбактериоз. Однако оказалось, что профилактические и лечебные эффекты пробиотиков могут быть воспроизведены с убитыми бактериями и продуктами их разрушения. Это служит подтверждением мысли о том, что основной механизм действия биопрепаратов связан с их влиянием на систему местной защиты организма ребенка (местного врожденного и адаптивного иммунитета кишечника).
Использование пробиотиков в медицине теоретически имеет большие перспективы. К настоящему времени доказана их эффективность при различных заболеваниях ЖКТ как инфекционных (ротавирусная инфекция, диарея путешественников, хеликобактерных хронических гастритах), так и – неинфекционных (некротизирующий энтероколит, неспецифический язвенный колит). Кроме того, показана терапевтическая эффективность пробиотиков при атопических заболеваниях, снижение частоты и тяжести эпизодов ОРИ у детей на фоне применения пробиотиков, и даже – усиление иммунного ответа на вакцинацию. Существуют работы, в которых показана возможная эффективность определенных пробиотиков в лечении воспалительных заболеваний кишечника (болезни Крона, неспецифического язвенного колита).
Если пофантазировать, то при определенном уровне знаний можно с помощью пробиотиков вызывать вполне определенные, необходимые данному конкретному пациенту иммунные реакции, способные помочь человеку справиться с различными по патогенезу заболеваниями (инфекционными, иммунными, неоплазменными). Но, как легко понять, это дело не близкого будущего.
И, в заключение, несколько ключевых моментов этой статьи:
- При отсутствии клинических признаков поражения ЖКТ (неустойчивый стул, боли в животе, беспокойство, плохая прибавка массы тела и т.д.) обнаруженные в анализе кала признаки дисбактериоза не требуют лечения (!),
- Проведение АБ-терапии не означает, что детям обязательно необходимо назначать биопрепараты. В подавляющем большинстве случаев достаточно правильного полноценного питания, с включением продуктов, содержащих растительную клетчатку, и, если нет противопоказаний в виде лактазной недостаточности или непереносимости белка коровьего молока, — кисломолочных продуктов.
- Развитие АБ-ассоциированной диареи обычно купируется после отмены причинно-значимого препарата. Хотя в этом случае может возникнуть потребность в медикаментозном лечении, что в каждом случае решается индивидуально. Однако роль правильного питания и в этом случае также является решающей. (Исключением является псевдомембранозный колит клостридиозной этиологии, лечение которого довольно сложное и может быть не всегда эффективным).
- У детей первых 4-6 месяцев жизни расстройство стула часто трудно поддаются лечению, но в большинстве случаев быстро исчезают после введения прикорма (в первую очередь, фруктов и овощей).
- Необходимо понимать, что проблема дисбактериоза – это проблема местной защиты. Поэтому, даже если путем героических усилий добиться нормализации состава микрофлоры кишечника (по анализу кала на дисбактериоз, что само по себе ни о чемне говорит, как уже упоминалось ранее), то при сохранении плохой местной защиты попадание в кишечник достаточно агрессивных возбудителей вновь приведет развитию дисбактериоза.
- Микробы, содержащиеся в биопрепаратах, хоть и могут участвовать в заселении кишечника, но их роль в этом процессе невелика. Основная их функции – стимуляция местного иммунитета. (Косвенным подтверждением этого тезиса является убедительно доказанный факт защитного действия L.rhamnosus GG при ротавирусном энтерите).
Дисбактериоз кишечника — Клиника Здоровье 365 г. Екатеринбург
Микробиоцеоз – это сообщество микроорганизмов, обитающих на территориально ограниченном участке с однородными условиями жизни. Бактерии нормальной кишечной флоры живут, прикрепляясь к кишечной стенке и образуя пленку, покрывающую кишечник изнутри. Через эту пленку происходит все всасывание в кишечнике. Бактерии нормальной кишечной микрофлоры обеспечивают по совокупности 50 – 80% всего пищеварения, а также выполняют защитные функции, нейтрализуют действие чужеродных и гнилостных бактерий. Бифидобактерии. Это основные представители нормальной кишечной микрофлоры, количество которых в кишечнике должно быть 95 – 99%. Бифидобактерии выполняют важную работу по расщеплению, перевариванию и всасыванию различных компонентов пищи, например, углеводов; они сами синтезируют витамины, а также способствуют усвоению их из пищи. При участии бифидобактерий происходит всасывание в кишечнике железа, кальция и других важных микроэлементов; нейтрализуют различные токсические вещества. В бланке анализа указывается титр бифидобактерий, который должен быть не меньше 107 – 108. Существенное снижение количества бифидобактерий – признак выраженного дисбактериоза.
Лактобактерии (лактобациллы, молочнокислые микробы, молочнокислые стрептококки).
Второй по представительству (5% в совокупности микроорганизмов кишечника) и по значимости представитель нормальной флоры. Лактобактерии или молочнокислые микробы вырабатывают молочную кислоту – важнейший компонент для нормальной работы кишечника. В результатах исследования их количество должно быть не меньше 106 – 107. Дефицит лактобактерий может привести к развитию аллергических заболеваний, запоров, лактазной недостаточности.
Кишечная палочка с нормальной ферментативной активностью (эшерихии).
Третий представитель нормальной флоры. Количество кишечной палочки среди других бактерий не превышает 1%, но роль ее очень важна. Во-первых, кишечная палочка является главным конкурентом условно-патогенной флоры, препятствуя заселению чужеродными микробами кишечной стенки; во-вторых, кишечная палочка забирает из просвета кишечника кислород, который является ядом для бифидобактерий и лактобактерий. Снижение общего количества кишечной палочки может быть признаком присутствия в кишечнике небактериальных паразитов (глистов, простейших, которые также нуждаются в кислороде, обделяя им кишечную палочку). Кишечная палочка со сниженной ферментативной активностью. Это неполноценная кишечная палочка, которая не представляет никакого вреда, но при этом не выполняет своих полезных функций. Присутствие данного показателя в анализе является признаком начинающегося дисбактериоза, а также как и снижение общего количества может быть косвенным признаком присутствия в кишечнике глистов или простейших.
В некоторых анализах описываются бактероиды, роль которых неясна, но известно, что это – не вредные бактерии, обычно их количество не имеет практического значения. Все остальные показатели микрофлоры являются условно-патогенной флорой. Они становятся патогенными (нарушающими нормальные функции кишечника) при определенных условиях: повышение их абсолютного количества или снижении функции иммунной системы.
Условно-патогенная флора – это лактозонегативные энтеробактерии (клебсиелла, протей, цитробактеры, энтеробактеры, гафнии, серрации), гемолизирующая кишечная палочка и различные кокки (энтерококки, эпидермальные или сапрофитные стафилококки, золотистый стафилококк). Кроме того, к условно-патогенным относятся клостридии, которые высеваются не во всех лабораториях. Условно-патогенная флора внедряется, конкурируя с полезными бактериями, в микробную пленку кишечника, заселяет кишечную стенку и вызывает нарушения работы всего желудочно-кишечного тракта. Дисбактериоз кишечника с повышенным содержанием условно-патогенной флоры может сопровождаться аллергическими кожными реакциями, нарушениями стула (запоры, поносы, зелень и слизь в кале), болями в животе, вздутиями живота, срыгиваниями, рвотами.
Кокковые формы в общей сумме микробов.
Самыми безобидными представителями условно-патогенной флоры являются энтерококки. Они наиболее часто встречаются в кишечнике у здоровых людей, их количество до 106 — 107 не представляет угрозы здоровью. Если количество превышает 25% (более 107), это чаще всего связано со снижением нормальной флоры. Эпидермальный (или сапрофитный) стафилококк (S. epidermidis, S. saprophyticus). Эти виды стафилококков могут вызывать нарушения, но их количество до 104 является допустимым. Золотистый стафилококк (S. aureus). Один из самых неприятных (наряду с гемолизирующей кишечной палочкой, протеем и клебсиеллой) представителей условно-патогенной флоры. Даже небольшие его количества могут вызвать выраженные клинические проявления, особенно у детей первых месяцев жизни. Поэтому обычно в нормах, приведенных в бланке анализа, указывается, что его быть не должно (на самом деле допустимы количества, не превышающие 103). Патогенность золотистого стафилококка напрямую зависит от состояния нормальной флоры: чем больше бифидобактерий, лактобактерий и нормальной кишечной палочки, тем меньше вреда от стафилококка. Гемолизирующая кишечная палочка. Является представителем лактозонегативных энтеробактерий, но выделяется отдельно в связи с распространенностью и значимостью. В норме должна отсутствовать. К данному микробу применимо практически все, сказанное про золотистый стафилококк. То есть, она может вызывать аллергические и кишечные проблемы, очень распространена в окружающей среде (правда, практически никогда не встречается в грудном молоке), вызывает проблемы у ослабленных детей, требует иммунокоррекции. Следует отметить, что термин “гемолизирующая” не означает, что имеется какое-то влияние на кровь. Лактозонегативные энтеробактерии. Большая группа условно-патогенных бактерий большей или меньшей степени патогенности. Их количество не должно превышать (в титрах: 103 – 106 ). Наиболее неприятными бактериями из этой группы являются протей (чаще всего с ними связаны запоры) и клебсиеллы (являются прямыми антагонистами (конкурентами) лактобактерий, что приводит к развитию аллергии и запоров, а также к проявлениям лактазной недостаточности). Часто в бланке анализа указывается общее количество лактозонегативных энтеробактерий (наиболее информативно процентное соотношение), а затем идет расшифровка: клебсиеллы, протей, хафнии, серрации, энтеробактерии и цитробактерии. Обычно какие-то количества этих бактерий постоянно живут в кишечнике, не вызывая проблем. В нормах могут быть указаны цифры от 104 до 105, являющиеся допустимыми.
Грибы рода Candida.
Допустимо присутствие до 103. Повышение этого параметра может быть после применения антибиотиков. Если количество грибов повышено, а количество нормальной кишечной флоры резко снижено, при этом отмечается кандидоз (молочница) видимых слизистых оболочек (ротовая полость, половые органы) – это проявления системного кандидоза, то есть имеется инфицирование грибами кишечника. Если же количество грибов в анализе на дисбактериоз увеличено, но нет снижения нормальной кишечной флоры, это свидетельствует о том, что грибы живут на коже вокруг заднего прохода, а не в кишечнике, в этом случае достаточно наружной терапии с использованием противогрибковых мазей или кремов.
Клостридии. Допустимое количество до 105. Проявляют патогенность обычно в комплексе с другой условно-патогенной флорой, редко изолированно вызывают проблемы (чаще всего – разжижение стула, понос). Их количество зависит от функции местного иммунитета кишечника.
Прочие микроорганизмы.
В данном параметре описываются редко встречающиеся виды бактерий, самым опасным из которых является синегнойная палочка (Pseudomonas aerugenosa). Чаще всего, микроорганизмы, описанные в этой позиции, не имеют практического значения. Термин “abs” обозначает отсутствие данного микроорганизма, также употребляется “не обнаружено”.
Микробиота кишечника | Biocodex Microbiote Institut
Микроорганизмы в вашем кишечнике, в первую очередь бактерии, образуют с ним «партнерство», которое начинается с самого рождения. Для полноценного формирования микробиоты желудочно-кишечного тракта требуется около трех лет – с рождения до периода относительной стабильности, который затем продолжается до старости, когда микробиота снова претерпевает глубокие изменения.
Пищеварительная система новорожденного быстро колонизируется «простой» микробиотой, происходящей из вагинальных и фекальных бактерий его матери. Развитие полезных бактерий, таких как бифидобактерии, быстрее осуществляется при грудном вскармливании, но стабилизация микробиоты кишечника длится около трех лет. Эта стабилизация зависит от множества факторов. Например, анаэробные бактерии, которые не нуждаются в кислороде для выживания, находятся в меньшинстве у младенцев, но доминируют у взрослых. Развитие этих анаэробных бактерий происходит медленнее в случае родоразрешения путем кесарева сечения или в случае преждевременных родов, при этом микробиота у таких детей менее разнообразна, чем у младенцев, рожденных естественным путем и в срок. Разнообразие микробиоты также зависит от окружающей среды в раннем детстве: у детей, живущих в западных странах, наблюдается меньшее разнообразие, которое может быть связано с чрезмерной гигиеной. Желудочно-кишечная микробиота наращивается с годами, при этом она всегда сохраняет отпечаток профиля раннего детства. Меньшее микробиологическое разнообразие может привести в дальнейшем к развитию заболеваний.
Утрата разнообразия в пожилом возрасте
В зрелом возрасте немногие факторы могут радикально изменить доминантную микробиоту в отличие от гормональных изменений во время полового созревания, беременности и менопаузы. Но именно в старости изменения становятся более выраженными. Микробиота становится менее разнообразной из-за физиологических изменений, таких как снижение иммунитета, скудный рацион питания, прием многочисленных лекарств, включая антибиотики, и особенно образ жизни, когда люди становятся более зависимыми. Действительно, у пожилых людей, живущих в домах престарелых, микробиота беднее, чем у тех, кто живет дома и соблюдает свой обычный рацион. Это глубокое изменение равновесия микробиоты может привести к заболеваниям, таким как воспаление кишечника и повышенная восприимчивость к инфекции.
Источники
Yatsunenko T, Rey FE, Manary MJ, et al. Human gut microbiome viewed across age and geography. Nature 2012 ; 486 : 222-7.
Guaraldi F, Salvatori G. Effect of breast and formula feeding on gut microbiota shaping in newborns. Front Cell Infect Microbiol 2012 ; 2 : 94.
Campeotto F, Waligora-Dupriet AJ, Doucet-Populaire F, et al. Establishment of the intestinal microflora in neonates. Gastroenterol Clin Biol 2007 ; 31 : 533-42.
Biasucci G, Rubini M, RiboniS et al. Mode of delivery affects the bacterial community in the newborn gut. Early Hum Dev 2010 ; 86 (Suppl 1) : 13-5.
Okada H, Kuhn C, Feillet H, Bach JF. The ‘hygiene hypothesis’ for autoimmune and allergic diseases: an update. Clin Exp Immunol. 2010;160(1):1-9.
Koren O, Goodrich JK, Cullender TC, et al. Host remodeling of the gut microbiome and metabolic changes during pregnancy. Cell 2012 ; 150 : 470-80
Biagi E, Candela M, Turroni S, et al. Ageing and gut microbes : perspectives for health maintenance and longevity. Pharmacol Res 2013 ; 69 : 11-20.
Claesson MJ, Jeffery IB, Conde S, et al. Gut microbiota composition correlates with diet and health in the elderly. Nature 2012 ; 488 : 178-84.
Наука: Наука и техника: Lenta.ru
В последнее время многие ученые приходят к выводу, что бактерии в кишечнике могут влиять на мозг человека. Микробы нашей пищеварительной системы провоцируют неврологические расстройства, повышают риск инсультов и даже влияют на психическое состояние, вызывая тревогу и депрессию. «Лента.ру» рассказывает, как микрофлора действует на центральную нервную систему.
В журнале Microbiome недавно была опубликована статья о корреляции изменений в микрофлоре кишечника с синдромом хронической усталости. Другие работы продемонстрировали зависимость симптомов болезни Паркинсона от видового состава бактерий, обитающих в желудочно-кишечном тракте.
Материалы по теме
00:01 — 8 апреля 2017
На первый взгляд, такая связь кажется противоречащей здравому смыслу. Как могут микроорганизмы в кишечнике влиять на мозг? На самом деле ученые только начинают постигать природу этого влияния, но уже давно не сомневаются, что микрофлора играет важную роль в обеспечении благополучия всего организма, в том числе центральной нервной системы. Стоит каким-либо образом изменить состав бактерий — и человек окажется подвержен различным заболеваниям.
На каждое живое существо непрерывно воздействует внешняя среда. В наш организм через желудочно-кишечный тракт попадают различные вещества, в том числе ксенобиотики, к которым относятся пестициды, бытовые химикаты и лекарственные препараты. Бактерии, живущие внутри нас, выполняют защитную функцию, разрушая эти соединения. Однако ксенобиотики могут воздействовать на микроорганизмы, изменяя их состав и делая нас более уязвимыми к внешним факторам. Более того, из-за них могут начать размножаться вредные бактерии, которые выделяют вещества, способствующие неврологическим расстройствам.
Кишечная палочка Escherichia coli
Изображение: Rocky Mountain Laboratories, NIAID, NIH — NIAID
В прошлом году исследователи из Калтека (Калифорнийского технологического института) провели интересный эксперимент на мышах: вывели генетически модифицированных грызунов, которые страдали от симптомов, похожих на болезнь Паркинсона. Оказалось, что если мыши росли в стерильных условиях, их состояние в итоге было не таким тяжелым, как у тех, что содержались в обычных клетках. Однако когда им вводили бактерии, выделенные из кишечника людей с болезнью Паркинсона, здоровье животных резко ухудшилось.
В новом исследовании, опубликованном в журнале Nature, американские ученые рисуют еще более пугающую картину. Оказывается, бактерии способны поместить в мозг человека «бомбу замедленного действия». Речь идет о возникновении церебральных кавернозных мальформаций (ЦКМ) — дефектов капиллярных сосудов, которые могут быть причиной разнообразных симптомов: головные боли, судороги, паралич, потеря зрения или слуха. Иногда они приводят к кровоизлияниям и смерти. Если опасную мальформацию нельзя удалить хирургически, единственное, что могут сделать врачи, — обеспечить паллиативный уход за больным. Эффективной терапии этого состояния пока не существует.
Однако если знать причину возникновения мальформаций, можно предупредить их развитие. Предыдущие исследования показали, что склонность к ним может передаваться по наследству. В этом случае главным фактором являются мутации в генах, способствующих росту стенок кровеносных сосудов. При этом, несмотря на наличие одинаковых мутаций, у разных людей ЦКМ проявляются по-разному, что указывает на наличие еще одного фактора.
Появление мальформаций у мутантных мышей
Изображение: Mark L. Kahn / Nature
В своих экспериментах биологи из Пенсильванского университета тоже использовали генетически модифицированных мышей, но на этот раз — склонных к развитию сосудистых дефектов в мозге. Ученые позволили им скрещиваться между собой и наблюдали за состоянием нескольких поколений. В конечном итоге были обнаружены резистентные индивиды, у которых не было ни следа мальформаций, хотя мутации не исчезали. Исследователи заметили, что если в кишечнике у таких животных присутствовали патогенные бактерии Bacteroides fragilis, вызывающие нагноения, то мальформации вновь проявлялись. Чтобы проверить, действительно ли микроорганизмы стали причиной ЦКМ, биологи ввели бактерии в брюшную полость 16 резистентных мышей. В результате у девяти животных развились воспаление селезенки и сосудистые дефекты.
Когда иммунная система атакует Bacteroides fragilis, погибшие бактерии выделяют вещество, называемое липополисахаридом. Оно провоцирует чрезмерное усиление воспалительных реакций и может привести к полиорганной недостаточности. Ученые ввели липополисахарид, выделенный из микроорганизмов, в организм генетически модифицированных и обычных мышей. У животных с мутациями вещество вызывало появление сосудистых повреждение в мозге.
Bacteroides fragilis
Изображение: CDC/Dr. V.R. Dowell, Jr.
Чтобы попасть в мозг, соединение должно пройти гемато-энцефалический барьер — физиологический барьер между кровеносной системой и центральной нервной системой. Он предохраняет мозг от попадания в него микроорганизмов и токсинов. Исследователи считают, что липополисахарид оказывает влияние на нервную систему, активируя рецепторы TLR4, расположенные в кровеносных сосудах. TLR4, в свою очередь, способствуют ненормальному росту клеток, что приводит к образованию мальформаций.
Таким образом выяснилось, что можно предотвратить формирование ЦКМ, если избавиться от патогенных бактерий. По наблюдениям биологов, если вводить антибиотики в организм беременной мыши, у ее детенышей риск появления сосудистых дефектов значительно снижается.
Кишечные бактерии могут влиять и на психическое состояние. В 2000 году наводнение в канадском городе Уокертон привело к заражение питьевой воды микроорганизмами. Более двух тысяч человек пострадали от острых желудочно-кишечных инфекций, у многих развился синдром раздраженного кишечника (СРК). Для людей с СРК характерно тревожное и депрессивное состояние.
Конечно, хроническое заболевание само по себе может вызвать депрессию, однако ученые выяснили, что определенные психические состояния могут передаваться со штаммами микроорганизмов. Эксперименты на мышах, в ходе которых специалисты пересаживали кишечную микрофлору от одного животного другому, показали, что таким образом можно «трансплантировать» более смелое или трусливое поведение.
Множество доказательств связи мозга и кишечных бактерий получено с использованием животной модели, однако нельзя отрицать, что эта зависимость имеется и у человека. Ученые считают, что исследование микрофлоры и ее влияния на нервную систему поможет в лечении неврологических заболеваний и даже психических расстройств.
Микробиология желудочно-кишечного тракта — Медицинская микробиология
Общие концепции
Состав и распределение микрофлоры кишечника
Микрофлора кишечника представляет собой сложную экосистему, содержащую более 400 бактерий.
разновидность. Количество анаэробов превышает количество факультативных анаэробов. Флора в
желудок и верхний отдел кишечника, но больше в нижнем отделе кишечника. Бактерии встречаются
как в просвете, так и прикрепляются к слизистой оболочке, но обычно не проникают в
стенка кишечника.
Метаболическая активность
Кишечные бактерии являются важным компонентом энтерогепатической циркуляции в
какие метаболиты конъюгированы в печени и выводятся с желчью:
деконъюгируется в кишечнике бактериальными ферментами, затем всасывается через
слизистая оболочка и вернулась в печень в портальный кровоток. Многие лекарства и
эндогенные соединения подвергаются энтерогепатической циркуляции. Антибиотики, которые
подавление флоры может изменить фекальное выделение и, следовательно, уровень в крови
эти соединения.Флора также играет роль в переваривании клетчатки и синтезирует
определенные витамины.
Кишечная микрофлора
Кишечная микрофлора может предотвратить инфекцию, взаимодействуя с патогенами.
Флора включает небольшие популяции потенциально патогенных организмов, таких как
Clostridium difficile . Антибиотики, нарушающие баланс
нормальной флоры может способствовать как заражению экзогенными патогенами, так и
разрастание эндогенными патогенами. Если стенка кишечника нарушена, кишечная
бактерии могут проникать в брюшину и вызывать перитонит и абсцессы.
Бактериальные диареи
Диареи, опосредованные энтеротоксинами : Энтеротоксигенные бактерии, такие как
Холерный вибрион и энтеротоксигенный Escherichia
coli , колонизируют верхнюю часть кишечника и вызывают водянистую диарею путем
вырабатывает энтеротоксин, который стимулирует клетки слизистой оболочки выделять жидкость через
повышение внутриклеточного АМФ.
Инвазивная диарея : Инвазивные бактерии, такие как
Shigella и Campylobacter , проникают через
слизистая кишечника.Кровянистый слизистый диарейный стул с воспалительным экссудатом
произведено.
Вирусные диареи
Ротавирус и калицивирус (ранее вирус Норуолк) являются основными причинами диареи
болезнь. Ротавирусная диарея поражает в основном детей раннего возраста; Калицивирус причины
болезнь во всех возрастных группах
Паразитарные диареи
Некоторые простейшие (особенно Entamoeba histolytica и
Giardia lamblia ), а также некоторые кишечные гельминты могут
вызвать диарейное заболевание.
Клинический диагноз
Обычно энтеротоксигенные бактерии и вирусы поражают верхний отдел кишечника, вызывая
водянистый понос и околопупочная боль. Инвазивные бактерии действуют в основном в
толстой кишки ( Shigella и Campylobacter ) или
нижняя подвздошная кишка ( Salmonella ). Стул при этих заболеваниях может
содержат кровь. Колит характеризуется болезненным натуживанием во время стула (тенезмами).
Состав и распределение микрофлоры
Бактериальные обитатели желудочно-кишечного тракта человека составляют комплекс
экосистема.Более 400 видов бактерий были идентифицированы в фекалиях
один человек. Преобладают анаэробные бактерии. Верхний отдел желудочно-кишечного тракта (
желудок, двенадцатиперстная кишка, тощая кишка и верхняя подвздошная кишка) обычно содержат редкую микрофлору;
концентрация бактерий менее 10 4 организмов / мл кишечного
выделения (). Большинство из них
организмы происходят из ротоглотки и проходят через кишечник с каждым приемом пищи.
Колонизация верхнего отдела кишечника бактериями группы кишечной палочки является аномальным явлением и
характерен для некоторых инфекционных патогенов, таких как Vibrio
cholerae и энтеротоксигенный Escherichia coli .В
напротив, толстый кишечник обычно содержит пышную микрофлору с общим
концентрации 10 11 бактерий / г стула (). Анаэробы, такие как Bacteroides ,
анаэробных стрептококков и клостридий больше, чем факультативных анаэробов, таких как
E coli в 1000 раз.
Рисунок 95-1
Концентрация бактериальной флоры в регионах
желудочно-кишечный тракт.
Характер бактериальной флоры меняется не только по длине
желудочно-кишечный тракт, а также в разрезе слизистой оболочки
поверхность.Бактерии занимают просвет, покрывают эпителиальные клетки и прикрепляются к
слизистая оболочка. Проникновение бактерий через поверхность слизистой оболочки является ненормальным явлением;
патогены, такие как Shigella , Salmonella и
Campylobacter вторгаются таким образом.
Те же механизмы, которые контролируют нормальную флору, также защищают кишечник от
вторжение болезнетворными микроорганизмами. Желудочная кислота в желудке убивает большинство организмов, которые
проглотил. Люди с пониженным содержанием желудочного сока или его отсутствием имеют высокую частоту:
бактериальная колонизация в верхних отделах тонкой кишки и более восприимчива к
бактериальная диарейная болезнь.Желчь обладает антибактериальными свойствами и поэтому может быть
еще один фактор контроля флоры. Прямая пропульсивная моторика (перистальтика)
является ключевым элементом подавления флоры верхнего отдела кишечника. Наконец,
микрофлора, производя собственные антибактериальные вещества (например, бактериоцины
и жирные кислоты), стабилизирует нормальные популяции и предотвращает имплантацию
возбудители.
Метаболические активности микрофлоры
Метаболические возможности кишечных бактерий чрезвычайно разнообразны.Бактериальный
ферменты могут использовать в качестве субстрата практически любое соединение в просвете кишечника, будь то
принимается перорально или попадает в кишечник путем секреции через желчные пути или
непосредственно через слизистую.
Энтерогепатическое кровообращение
Ферменты, продуцируемые кишечными бактериями, играют центральную роль в энтерогепатическом кровотоке.
тираж. Вещества, которые подвергаются энтерогепатической циркуляции, метаболизируются.
в печени, выводится с желчью и попадает в просвет кишечника, где
они реабсорбируются слизистой оболочкой кишечника и возвращаются в печень через
портальное обращение.Энтерогепатическая циркуляция обычно включает:
соединения, которые конъюгированы в печени с полярной группой, такой как глюкуроновая
кислота, сульфат, таурин, глицин или глутатион. Конъюгация увеличивает
растворимость метаболита в желчи, но конъюгированные соединения плохо
всасывается слизистой оболочкой кишечника. Ферменты, вырабатываемые кишечником
бактерии, такие как ß-глюкуронидаза, сульфатаза и различные
гликозидазы — деконъюгируют эти соединения, высвобождая родительские
соединения, которые легко всасываются через стенку кишечника.Многие эндогенные
соединения подвергаются энтерогепатической циркуляции, включая билирубин, желчные кислоты,
холестерин, эстрогены и метаболиты витамина D. Кроме того, многие лекарства
которые выводятся печенью, включая наперстянку, диэтилстильбестрол,
морфин, колхицин, рифампицин и хлорамфеникол входят в этот путь.
Антибиотики блокируют энтерогепатическое кровообращение, подавляя кишечную
флора и тем самым снижая уровень деконъюгированных ферментов. Если антибиотик
назначается пациенту, который также принимает препарат, вызывающий энтерогепатический
кровообращение, в результате угнетение энтерогепатического кровообращения будет
увеличить фекальную экскрецию препарата и тем самым снизить его уровень в плазме и
период полураспада.Например, уровень эстрогена в крови и период полураспада при рождении
количество противозачаточных таблеток уменьшается при приеме антибиотиков.
Микрофлора и питание
Ферменты, вырабатываемые кишечными бактериями, играют важную роль в метаболизме
несколько витаминов. Микрофлора кишечника синтезирует витамин К, который является
необходимый кофактор при производстве протромбина и др. свертывания крови
факторы. Лечение антибиотиками, особенно у людей, соблюдающих диету.
низкое содержание витамина К, может привести к снижению уровня протромбина в плазме и склонности к
кровоточить.Кишечные бактерии также синтезируют биотин, витамин B 12 , фолиевую кислоту.
кислота и тиамин.
Кишечная флора способна сбраживать неперевариваемые углеводы (диетические
волокна) до короткоцепочечных жирных кислот, таких как ацетат, пропионат и бутират. В
основным источником таких ферментируемых углеводов в толстой кишке человека являются растительные клетки.
полисахариды стенок, такие как пектины, целлюлоза и гемицеллюлоза. Кислоты
производимые из этих волокнистых субстратов бактериями, могут быть важным источником энергии
источник для хоста.
У некоторых людей наблюдается дефицит кишечной лактазы, фермента слизистой оболочки.
для гидролиза дисахарида лактозы в молоке. У этих людей лактоза
не переваривается и не всасывается в кишечнике. Лактоза, которая достигает
толстый кишечник подвергается интенсивной бактериальной ферментации. Результат может быть
вздутие живота, газы и диарея.
Микрофлора кишечника и инфекции
Защитные действия флоры
Как и другие сложные экосистемы, микрофлора кишечника относительно стабильна
со временем поддерживая примерно постоянное количество и типы бактерий в каждом
область кишечника.Стабильность нормальной флоры препятствует инфицированию
экзогенных патогенов и предотвращает чрезмерный рост потенциально патогенных членов.
Новые организмы, попадающие в систему с зараженной пищей или водой, как правило,
подавляется установившейся флорой. Это подавление связано с производством
представителями местной флоры противомикробных веществ, таких как
бактериоцины или короткоцепочечные жирные кислоты, которые подавляют рост чужеродных
микроорганизмы. Антибиотики, убивающие часть кишечной флоры, могут расстроить
его баланс и может открыть дверь для инфекции или патологического разрастания.
Патогенез пищевого отравления Salmonella иллюстрирует это.
явление. Нормальные люди довольно устойчивы к
Salmonella , и для
инициировать заражение. Если кишечная флора подавляется антибиотиками,
однако человек становится гораздо более восприимчивым и может заразиться
относительно небольшой посевной материал.
Заболевания, вызванные чрезмерным ростом потенциальных патогенов
Нормальная кишечная флора включает небольшие популяции организмов, вызывающих
болезнь, если они зарастают.Например, разрастание Clostridium
difficile вызывает тяжелое воспаление толстой кишки с диареей
(псевдомембранозный колит). Введение антибиотиков запускает процесс
подавляя нормальную флору.
Перитонит
Бактерии кишечной флоры являются основной причиной инфекции в
брюшная полость при нарушении нормальных барьеров стенки кишечника.
Стенка кишечника может быть перфорирована травмой (ножевые ранения, огнестрельные ранения,
тупая травма), заболеванием (аппендицит, проникающий рак кишечника) или
хирургические процедуры.Как только барьер слизистой оболочки нарушен, бактерии проникают
через стенку кишечника в обычно стерильную брюшную полость и ее
окружающие конструкции. Плохое кровообращение, снижение подачи кислорода и отмершие ткани
в непосредственной близости от перфорации способствуют образованию абсцесса и
особенно благоприятствуют росту анаэробных бактерий. Культуры брюшины
абсцесс обычно выводит несколько типов бактерий из кишечника.
микрофлора, особенно виды Bacteroides ,
Clostridium и Peptostreptococcus и
E. coli .
Бактериальные диареи
Диарейные заболевания, опосредованные энтеротоксинами
Некоторые бактерии, продуцирующие энтеротоксины, вызывают диарейные заболевания (). Диарейное заболевание
вызванные Vibrio cholerae и энтеротоксигенными штаммами
E coli имеет три основных характеристики. Во-первых, есть
потеря кишечной жидкости, связанная с действием энтеротоксина на
эпителиальные клетки тонкой кишки. Во-вторых, сам организм не вторгается в
поверхность слизистой оболочки; скорее, он колонизирует верхнюю часть тонкой кишки, прилипая к
эпителиальные клетки и вырабатывающие энтеротоксин.Архитектура слизистой оболочки
остается нетронутым без признаков разрушения клеток. Бактериемия не
происходить. В-третьих, фекальные стоки водянистые и часто объемные, так что
диарея может привести к клиническому обезвоживанию. Жидкость берет начало в верхнем
тонкий кишечник. где энтеротоксин наиболее активен.
Таблица 95-1
Бактерии, продуцирующие токсины, связанные с диарейными заболеваниями.
Холера
Парадигма энтеротоксигенных диарейных болезней — холера (см. Гл.24), при котором объем стула может
превышают 1 л / ч, с ежедневным выходом фекалий от 15 до 20 л, если пациент находится
гидратированный. Холера вызывается V cholerae , которая обычно
попадает в загрязненную воду. Вибрионы, которые выживают при прохождении через желудок
колонизировать поверхность тонкой кишки, размножаться и разрабатывать
энтеротоксин. Токсин холеры действует через аденилатциклазу, стимулируя секрецию
вода и электролиты из клеток эпителия попадают в просвет кишечника. В
двенадцатиперстная кишка и верхняя часть тощей кишки более чувствительны к токсину, чем подвздошная кишка.Толстая кишка относительно нечувствительна к токсину и может все еще поглощать воду и
электролиты в норме. Таким образом, холера — это «переполнение.
диарея », при которой большие объемы жидкости производятся в верхних
Кишечник подавляет резорбтивную способность нижнего отдела кишечника.
Стул холеры напоминает рисовую воду — прозрачную жидкость.
покрыт слизью и изотоничен плазме. Микроскопия не выявляет
воспалительные клетки в сточных водах; все, что можно увидеть, это маленькие числа
сброшенных клеток слизистой оболочки.
Энтеротоксигенная кишечная палочка Диарея
Определенные штаммы кишечной палочки вызывают диарейное заболевание, вызывая
энтеротоксины (см. гл. 25). Эти
штаммы продуцируют два типа энтеротоксина. Один из них, называемый термолабильным токсином, — это
сходен по структуре и механизму действия с холерным токсином. Другой,
называемый термостабильным токсином, по-видимому, действует через гуанилатциклазу. Энтеротоксигенный
Штаммы кишечной палочки являются наиболее частой причиной болезней путешественников.
диарея
Другие токсины, вызывающие диарею
Многие штаммы Shigella продуцируют энтеротоксин, называемый Shiga
токсин, вызывающий секрецию жидкости из тонкой кишки (см. гл.22). Токсин шига имеет
деструктивное, цитотоксическое действие на эпителий тонкой кишки, вызывая грубое
травма поверхности кишечника. Он не активирует аденилатциклазу. E
coli 0157: H7, организм, связанный с потреблением
недоваренное рубленое мясо также производит токсин, подобный шиге; это вызывает кровавый
диарея и колит. Организм, вырабатывающий другой тип цитотоксина, — это
Vibrio parahaemolyticus , бактерия, связанная с
морепродукты. Штаммы пищевого отравления Staphylococcus aureus и
Clostridium perfringens вырабатывают энтеротоксины, которые
цитотоксический.Стафилококковый энтеротоксин также оказывает прямое влияние на
рвотный центр в головном мозге.
Заболевания желудочно-кишечного тракта, вызванные инвазивными бактериями
В отличие от энтеротоксигенных организмов, инвазивные бактерии оказывают основное влияние
на хозяине, вызывая серьезное разрушение эпителиальной архитектуры;
гистологические данные включают изъязвление слизистой оболочки и воспалительную реакцию в
собственная пластинка. Основными возбудителями этой группы являются:
Salmonella, Shigella, Campylobacter , инвазивные E
coli и Yersinia .Кишечные вирусы также
вторгаются в эпителиальные клетки кишечника, но степень разрушения слизистой оболочки
значительно меньше, чем вызвано инвазивными бактериальными патогенами.
Salmonella Enteritis
Salmonella видов являются частой причиной пищевых отравлений. В
Основным местом поражения является нижняя подвздошная кишка, где сальмонеллы вызывают слизистую оболочку.
изъязвление. Они быстро пробиваются через эпителиальную поверхность в
lamina propria и попадают в лимфатические сосуды и кровоток.Как минимум две вирулентности
факторы, связанные с кишечной инфекцией: один отвечает за слизистую оболочку
вторжение, а другой вызывает секрецию жидкости и электролитов в
кишечник.
Shigella Dysentery
Shigella Микроорганизмы вызывают бактериальную дизентерию, инвазивную
диарейное заболевание нижнего отдела кишечника, при котором стул содержит воспалительный
экссудат, состоящий из полиморфноядерных лейкоцитов. Бациллы вторгаются в
эпителий толстой кишки и вызывают поверхностные изъязвления.Этот инвазивный процесс
зависит от наличия двух факторов вирулентности. Первый опосредует начальный
проникновение на поверхность слизистой оболочки за счет разрушения щеточной каймы; бактерии
впоследствии поглощаются инвагинацией плазматической мембраны. Секунда
Фактор вирулентности позволяет организму размножаться в ткани слизистой оболочки.
В результате появляются изъязвления слизистой, сопровождающиеся интенсивным воспалительным ответом
собственная пластинка. Инфекция обычно ограничивается слизистой оболочкой; лимфа
поражение узлов и бактериемия встречаются редко.
Производство жидкости при инвазивных диарейных заболеваниях
Механизм (ы), посредством которых жидкость, вызывающая водянистую диарею, образуется в
инвазивные диарейные заболевания обсуждаются. Были задействованы три механизма
предложенный. Во-первых, Shigella и, возможно,
Штаммы Salmonella , по-видимому, продуцируют энтеротоксин, который
стимулирует слизистую оболочку выделять воду и электролиты. Во-вторых, есть
доказательства того, что инвазивные организмы стимулируют синтез простагландинов на месте
воспаления и простагландины вызывают секрецию жидкости.В
экспериментальные животные, секреция жидкости может быть заблокирована ингибиторами простагландинов
такие как индометацин и аспирин. В-третьих, некоторые данные свидетельствуют о том, что повреждение
эпителий толстой кишки вызывает диарею, предотвращая нормальную резорбцию
жидкость.
Вирусные диареи
Два вируса — ротавирус (см. Гл.
63) и калицивирус (вирус Норуолк) (см. Главу 65) — были определены как основные кишечные
патогены у человека. Ротавирусы — очень важная причина младенческого
диарея, которая в неразвитых странах может привести к летальному исходу.Взрослые могут быть инфицированы и
распространение вируса, но клиническое заболевание проявляется почти исключительно у детей младше
2 года. Калицивирус, напротив, может вызывать гастроэнтерит во всех возрастных группах и
является причиной крупных эпидемий. Первоначальное поражение формируется в проксимальном отделе тонкой кишки.
Архитектура слизистой оболочки повреждена с укорочением ворсинок и гиперплазией
склепы. Воспалительный экссудат затем появляется в собственной пластинке.
Механизмы, ответственные за секрецию жидкости при вирусных диареях, не изучены.
выяснил.Известно, что заражение калицивирусом может вызвать стеаторею и
нарушение всасывания ксилозы и прямое повреждение ферментов щеточной каймы. Активность
аденилатциклазы в эпителиальных клетках не изменяется в остром
болезнь.
Паразитарные диареи
Некоторые виды простейших и гельминтов могут вызывать диарейные заболевания. Что-нибудь из этого
инфекции могут быть переданы в Соединенных Штатах, хотя воздействие кишечных
паразиты гораздо чаще встречаются в тропических и развивающихся странах.Некоторые из более
частыми причинами паразитарной диареи являются Entamoeba histolytica ,
Giardia lamblia , Strongyloides stercoralis ,
и кишечные сосальщики.
Клиническая диагностика диарейного заболевания
Понимание патофизиологии может быть использовано для постановки предположительного диагноза в
пациенты с инфекционной диареей (). Пожалуй, самый удобный подход — разделить патогены, которые
вовлекают тонкую кишку из тех, которые атакуют толстую кишку.Энтеротоксигенный
бактерии ( E coli, V cholerae ), вирусы и паразиты
Лямблии являются примерами патогенов тонкой кишки. Эти организмы
вызывают водянистый понос, который может привести к обезвоживанию. Боль в животе, хотя
часто диффузная и плохо выраженная, обычно околопупочная. Микроскопический
исследование стула не позволяет выявить сформированные клеточные элементы, такие как
эритроциты и лейкоциты.
Таблица 95-2
Клинические признаки диарейных заболеваний.
Патогены толстой кишки (основными из которых являются Shigella и
Campylobacter ) являются инвазивными организмами и вызывают клинические
синдром, известный как дизентерия.Вовлечение толстой кишки настоятельно рекомендуется
характерная ректальная боль, известная как тенезмы. Хотя фекальные стоки могут быть
сначала водянистый, ко второму-третьему дню болезни стул скудный и часто
кровянистый или слизистый. Микроскопическое исследование почти всегда выявляет обильные
эритроциты и лейкоциты. Проктоскопия показывает диффузно изъязвленный, геморрагический,
и рыхлая слизистая ободочной кишки.
Пищевое отравление сальмонеллой не укладывается в эту простую схему, потому что болезнь
может отображать черты, характерные для заболеваний как тонкой, так и толстой кишки.Организм
инвазивно поражает слизистую оболочку тонкой кишки, особенно нижнюю подвздошную кишку, и
может вызвать обильную секрецию жидкости. Кроме того, сепсис и метастатический
Иногда происходит распространение возбудителя на другие органы.
Ссылки
- Finegold S (ed): Столетний симпозиум по анаэробам:
Памятник Андре Вейону. Clin Infect Dis 18: 5–245, 1994
. [PubMed: 8086570] Голдин Б.Р., Лихтенштейн А.Х., Горбач С.Л.: роль
кишечная флора.п. 500. В Shils ME, Young VR (eds): Modern Nutrition in
Здоровье и болезнь. Леа и Фебригер, Филадельфия, 1994.Горбач С.Л.: Инфекционная диарея и бактериальная пища.
отравление. п. 1128 In Sleisenger MH, Fordtran JS (ред.): Желудочно-кишечный тракт.
Болезни. WB Saunders, Philadelphia, 1993.Simon GL, Gorbach SL: Нормальный пищеварительный тракт.
микрофлора. п. 53. In Blaser MJ, Smith PD, Ravdin JI, Greenberg HB, Guerrant RL.
(ред.): Инфекции желудочно-кишечного тракта, Raven Press, Нью-Йорк, 1995
.
Когда патогенные бактерии встречаются с кишечной микробиотой
Philos Trans R Soc Lond B Biol Sci. 2016 5 ноября; 371 (1707): 20150504.
Натали Ролион
1 Institut Pasteur, Unité des Interactions Bactéries-Cellules, 75015 Paris, France
2 Inserm, U604, 75015 Paris, France
, 3 INRA Unité sous contrat 2020, 75015 Paris, France
Benoit Chassaing
4 Институт биомедицинских наук, Центр воспаления, иммунитета и инфекции, Университет штата Джорджия, Атланта, Джорджия 30303, США
1 Institut Pasteur, Unité des Interactions Bactéries-Cellules, 75015 Paris, France
2 Inserm, U604, 75015 Paris, France
3 INRA, Unité sous contrat 2020, 75015 Paris, France
4 Институт биомедицинских наук, Центр воспаления, иммунитета и инфекций, Государственный университет Джорджии, Атланта, Джорджия 30303, США
Опубликовано Королевским обществом.Все права защищены.
Эта статья цитируется в других статьях в PMC.
Abstract
Кишечная микробиота — это большое и разнообразное микробное сообщество, обитающее в кишечном тракте, содержащее около 100 триллионов бактерий 500–1000 различных видов, которые в совокупности обеспечивают хозяину множество преимуществ. Микробиота кишечника способствует усвоению питательных веществ и созреванию иммунной системы, а также играет центральную роль в защите хозяина от кишечной бактериальной инфекции.С другой стороны, многие кишечные патогены разработали стратегии, позволяющие преодолеть конкуренцию кишечному сообществу, что приводит к инфекции и / или хроническим заболеваниям. В этом обзоре будут обобщены результаты, описывающие сложную взаимосвязь между кишечной микробиотой и кишечными патогенами, а также то, как будущие методы лечения могут в конечном итоге извлечь выгоду из таких открытий.
Эта статья является частью тематического выпуска «Новая бактериология».
Ключевые слова: кишечная микробиота, воспаление, нутриент, патогенные бактерии, вирулентность
1.Введение
Кишечная микробиота — это собирательный термин, описывающий большое и разнообразное микробное сообщество, населяющее наш кишечник. Микробиота человека содержит около 100 триллионов бактерий 500–1000 различных видов, которые обеспечивают хозяину множество преимуществ. Среди этих полезных функций кишечная микробиота играет центральную роль в (i) формировании иммунной системы кишечника [1], способствуя развитию и созреванию иммунной системы, и (ii) приобретению питательных веществ, значительно увеличивая метаболические возможности кишечника, таким образом обеспечивая хозяина ряд необходимых питательных веществ [2].Другим важным преимуществом кишечной микробиоты для кишечника хозяина является защита от колонизации экзогенными патогенами — феномена, ныне называемого резистентностью к колонизации, — и от чрезмерного роста местных патобионтов (потенциальных патогенных симбионтов микробиоты) [3–5]. Устойчивость к колонизации, названная «микробным барьером» в начале 1980-х годов [6], представляет собой механизм, посредством которого кишечные бактерии образуют барьер для предотвращения вторжения новых бактерий других видов или других штаммов того же вида.Это понятие хорошо иллюстрируется рядом инфекций, возникающих в результате использования антибиотиков, таких как инфекция Clostridium difficile [7], а также наблюдением, что многие кишечные патогены вызывают более сильное заболевание у мышей в условиях отсутствия микробов (в отсутствие кишечной микробиоты) или после лечения антибиотиками [8–12] (). Механизмы, регулирующие способность микробиоты сдерживать рост патогенов, сложны и включают конкурентные метаболические взаимодействия, локализацию в кишечных нишах и индукцию иммунных ответов хозяина [4].Патогены, в свою очередь, разработали стратегии, позволяющие избежать устойчивости к колонизации, создаваемой комменсальным сообществом. Неожиданно кишечная микробиота также может играть роль в обеспечении питательными веществами некоторых кишечных патогенов или может играть прямую роль в активации вирулентности патогенных бактерий, которые в противном случае останутся авирулентными. Кроме того, в некоторых конкретных условиях кишечная микробиота может фактически приводить к заболеванию, как, например, в случае воспалительных заболеваний кишечника.В этом обзоре будут обобщены эти концепции и описаны самые последние результаты, проливающие свет на интригующую взаимосвязь между кишечной микробиотой и кишечными патогенами. Мы обсудим, как понимание взаимодействий микробиоты и патогенов может в конечном итоге привести к новым терапевтическим подходам к лечению инфекционных заболеваний.
Гомеостаз микробиоты / хозяина в кишечнике. ( a ) Кишечная микробиота играет центральную роль в поддержании кишечного барьера (производство слизи и поддержание плотных контактов кишечника) и созревании иммунной системы (развитие лимфоцитов, выработка IgA и антимикробных пептидов).( b ) В отсутствие кишечной микробиоты кишечные патогены могут вызывать повреждение эпителия и потенциально распространяться. AMP, антимикробный пептид; IgA, иммуноглобулин А.
2. Роль кишечной микробиоты в устойчивости к колонизации
Кишечная микробиота играет центральную роль посредством множества механизмов в защите кишечника хозяина от колонизации патогенами (рисунки и).
Устойчивость к колонизации, опосредованная кишечной микробиотой.Примеры опосредованного микробиотой прямого подавления колонизации кишечника кишечными патогенами. Кишечная микробиота предотвращает колонизацию кишечными патогенами, конкурируя за питательные вещества ( a ) или производя ингибирующие вещества, такие как бактериоцин ( b ), вторичные желчные кислоты ( c ) и короткоцепочечные жирные кислоты ( d ). EHEC, энтерогеморрагический , Escherichia coli ; SCFAs, короткоцепочечные жирные кислоты.
(a) Прямое ингибирование колонизации кишечными патогенами
Концепция защиты кишечника хозяина от патогенов с помощью комменсальных бактерий, также называемая устойчивостью к колонизации, была впервые описана как результат прямого подавления, опосредованного микроорганизмами [13].Действительно, многие бактерии напрямую подавляют кишечные патогены, конкурируя за питательные вещества или индуцируя производство ингибирующих веществ. Одним из примеров, подчеркивающих первое, является открытие, что комменсал Bacteroidetes thetaiotaomicron потребляет углеводы, используемые патогеном Citrobacter rodentium , что приводит к конкурентному исключению патогена из кишечника [14] (). Потребляя общие ограниченные ресурсы, микробиота кишечника вызывает голодание конкурирующих патогенов [4].Путем производства определенных метаболитов кишечная микробиота также может изменять условия окружающей среды хозяина, тем самым ставя под угрозу рост патогенов и / или вирулентность. Бутират, короткоцепочечная жирная кислота (SCFA), продуцируемая кишечной микробиотой, может подавлять экспрессию нескольких генов вирулентности Salmonella enterica серовара Enteritidis ( S. Enteritidis) и Typhimurium ( S . Typhimurium) [15 ] и было показано, что он подавляет рост энтерогеморрагической Escherichia coli (EHEC) [16].Некоторые штаммы Bifidobacteria также могут защищать от инфекции EHEC за счет продукции ацетата [10].
Сообщество кишечной микробиоты также способно производить большое количество широко биоактивных малых молекул, которые действуют на других членов кишечной микробиоты и / или на кишечные патогены. Бактериоцины, например, представляют собой антимикробные пептиды, которые могут иметь спектр активности от узкого до широкого и могут избирательно убивать и / или подавлять рост конкурирующих бактерий [17].Например, Bacteroides thuringiensis способен секретировать бактериоцин (турицин CD), который непосредственно нацелен на спорообразующие бациллы и клостридии, включая C. difficile [18]. Точно так же некоторые штаммы E. coli способны продуцировать бактериоцин, который может напрямую ингибировать рост кишечного патогена EHEC [19], и было обнаружено, что бактериоцины против Listeria экспрессируются Enterococcus faecium и Pediococcus pentosaceus [20,21].Недавно компьютерное предсказание кластеров биосинтетических генов, которые кодируют небольшие молекулы в микробиоте кишечника человека, выявило почти 600 кластеров-кандидатов, в том числе многие недавно аннотированные антимикробные пептиды, предполагая, что эти небольшие молекулы могут опосредовать взаимодействия комменсал-комменсал и комменсал-патоген [22]. Другое исследование in silico выявило 74 предположительно кодирующих кластера бактериоцина в желудочно-кишечном тракте на основе базы данных эталонного генома проекта микробиома человека [23,24].
Другой в некоторой степени прямой ингибирующий эффект кишечной микробиоты по отношению к патогенам осуществляется через механизм с участием желчных кислот. Вырабатываемые печенью и доставляемые в двенадцатиперстную кишку, желчные кислоты впоследствии модифицируются микробиотой кишечника в бесчисленное множество вторичных желчных кислот, которые могут действовать как антибактериальные факторы. Роль кишечной микробиоты во вторичном производстве желчных кислот подчеркивается наблюдением очень низких или неопределяемых уровней у стерильных животных [25] и резкого снижения выработки после лечения антибиотиками [26].Лучшим примером защитного механизма, обеспечиваемого вторичными желчными кислотами микробиоты, является наблюдение, что истощение микробных членов, участвующих в превращении первичных желчных кислот во вторичные желчные кислоты, способствует колонизации желудочно-кишечного тракта C. difficile , наиболее видный патоген, использующий изменения микробиоты, опосредованные антибиотиками [7,26–30]. Важно отметить, что введения Clostridium scindens (7α-дегидроксилирующая бактерия желчной кислоты) достаточно для придания устойчивости к C.difficile вторичным образом, зависимым от желчных кислот. В недавних работах было описано, что кишечная микробиота также может косвенно контролировать кишечные патогены с помощью других механизмов, таких как формирование иммунной системы и воспалительный ответ (иммунная устойчивость к колонизации).
(b) Созревание иммунной системы и процесс воспаления
Микробиота играет первостепенную роль в созревании кишечной иммунной системы, что продемонстрировано наблюдением, что мыши без микробов имеют тяжелую иммунную депрессию.Действительно, в кишечнике стерильных животных отсутствуют пейеровы пятна и снижена экспрессия как антимикробных пептидов, так и иммуноглобулина А (IgA), молекул, участвующих в кишечном иммунитете [31–36]. Примером члена микробиоты, который вносит вклад в развитие иммунной системы, является Bacteroides fragilis , демонстрирующий, что моноколонизация стерильных мышей этой бактерией достаточна для стимулирования развития лимфоцитов CD4T [37]. Точно так же было описано, что сегментированных нитчатых бактерий достаточно для дифференциации клеток CD4T в клетки Th27, что важно для защиты от кишечного патогена C.rodentium [38–41].
Микробиота кишечника также является неисчерпаемым источником лигандов для врожденной иммунной системы. Лечение антибиотиками является достаточным для повышения восприимчивости мышей к колиту, опосредованному декстрансульфатом натрия (DSS) — феномену, который может быть устранен введением лигандов Toll-подобных рецепторов [42]. Такое открытие положило начало концепции, согласно которой передача сигналов рецептора распознавания образов, исходящая от кишечной микробиоты, необходима для устойчивой защиты кишечника [42,43].Это также было проиллюстрировано открытием того факта, что бактериальный флагеллин из кишечной микробиоты способен предотвращать и лечить ротавирусную инфекцию с помощью механизма, требующего рецепторов флагеллина Toll-подобного рецептора 5 (TLR5) и NOD-подобного рецептора C4 (NLRC4) и с участием интерлейкинов. 22 и продукция интерлейкина-18 [44]. Бактерии, принадлежащие к кластеру XIVa группы Clostridium , способны индуцировать развитие противовоспалительных Т-регуляторных клеток [45], а SCFAs, происходящие из кишечной микробиоты, играют центральную роль в поддержании баланса воспалительных и противовоспалительных Т-клеток. подмножества [46–49].Важно отметить, что некоторые лиганды TLR, такие как LPS, модифицируются хозяином, чтобы быть менее биологически активными, что указывает на существование механизмов детоксикации таких провоспалительных молекул, что позволяет избежать чрезмерной активации кишечной иммунной системы в ответ на комменсал. бактериальная популяция [50–52]. Все эти отчеты являются хорошими примерами роли, которую играет микробиота в созревании кишечной иммунной системы, где кишечная бактериальная популяция может генерировать провоспалительные или противовоспалительные реакции, которые имеют центральное значение для предотвращения чрезмерной активации кишечной иммунной системы. но обеспечивая защиту от кишечных патогенов.
(c) Поддержание кишечного барьера
Другой механизм, с помощью которого кишечная микробиота защищает кишечник от инфекции кишечными патогенами, заключается в воздействии на «силу» кишечного барьера, например толщину и состав слизистого слоя. как поддержание плотных контактов кишечника. Для хозяина действительно изначально важно держать кишечную микробиоту на безопасном расстоянии от кишечного эпителия, чтобы свести к минимуму появление повреждения тканей и воспаления [53].Микробиота кишечника ограничена просветом кишечника слоем слизи, который покрывает эпителий. Лечение мышей антибиотиками уменьшает толщину слоя слизи и приводит к усилению контакта бактерий с монослоем кишечного эпителия, что может быть очень вредным в контексте инфекции кишечного патогена, как показано на примере C. rodentium [54]. Кроме того, кишечная микробиота поддерживает кишечный барьер за счет продукции SCFAs, которые являются основным питательным веществом для эпителия толстой кишки и способствуют контролю продукции муцина [55,56].Таким образом, снижение продукции SCFAs может привести к уменьшению толщины слизи / разрушению слизистого барьера.
3. Когда кишечная микробиота приводит к вирулентности кишечных патогенов
Хотя все описанные выше механизмы являются центральными для защиты кишечника от бактериальной инфекции и патогенов, микробиота также может запускать бактериальную вирулентность. Например, кишечная микробиота может также продуцировать метаболиты, которые могут неожиданно усилить экспрессию патогенов и их колонизацию в кишечнике [57–61] ( a ). Bacteroidetes thetaiotaomicron , приводящий к конкурентному исключению C. rodentium за счет потребления аналогичных углеводов [14], также может отщеплять части сиаловой кислоты от муцина и производить высокие уровни сукцината, что может привести к усиленной колонизации C. difficile [58,59]. Производство фукозы или сукцината из муцина хозяина комменсальными бактериями также может модулировать экспрессию фактора вирулентности ler, главного регулятора локуса генов сглаживания энтероцитов (LEE) в EHEC [60,62], тем самым способствуя вирулентности EHEC. .Другие примеры патогенов, которые используют кишечную микробиоту для облегчения своей собственной инфекции, включают C. difficile , споры которых требуют для прорастания побочных продуктов микробиоты, таких как соли желчных кислот [63], и S . Typhimurium, который использует дигидрид, вырабатываемый микробиотой, для своего роста в просвете [64]. Более того, производимый микробиотой этаноламин используется в качестве источника азота и регулятора генов вирулентности посредством EHEC, S. Typhimurium и Listeria monocytogenes [65–68]. Akkermansia muciniphila , разлагающая муцин комменсальная бактерия, которая находится в слое слизи и может обеспечивать защиту от ожирения и метаболических нарушений [69,70], также способна усугубить воспаление кишечника, вызванное тифимурием S. нарушают гомеостаз слизи хозяина [71].
Патогенетические стратегии преодоления устойчивости к колонизации, опосредованной микробиотой. ( a ) Продукция метаболитов комменсальными бактериями может модулировать рост и экспрессию генов вирулентности кишечными патогенами.( b ) Кишечные патогены могут конкурировать с микробиотой, используя альтернативные питательные вещества и / или ниши. ( c ) Стимуляция кишечного воспаления кишечными патогенами подавляет рост комменсальных бактерий, что дает преимущество кишечным патогенам. ( d ) Кишечные патогены продуцируют токсины, которые могут непосредственно и конкретно воздействовать на комменсалов. EHEC, энтерогеморрагическая Escherichia coli .
4. Когда изменение кишечной микробиоты патогеном приводит к хроническим заболеваниям
Хотя предыдущие примеры иллюстрируют, как кишечная микробиота может способствовать инфицированию кишечными патогенами, некоторые результаты также показали, что изменение кишечной микробиоты патогеном или патобионтом может привести к хроническим заболеваниям. болезни.В качестве примера было показано, что колонизация адгезивно-инвазивной E. coli (AIEC, патоген E. coli , участвующий в патогенезе болезни Крона) во время приобретения микробиоты вызвала хронический колит у мышей, лишенных рецептора флагеллина TLR5 [72 ]. Наблюдение за тем, что такой колит сохраняется далеко за пределами клиренса AIEC, приводит к заключению, что бактерии AIEC вызывают хроническое воспаление, изменяя состав кишечной микробиоты таким образом, что увеличивает ее провоспалительный потенциал [73].Эти данные предполагают, что AIEC и, возможно, другие патобионты могут спровоцировать хроническое воспаление у восприимчивых хозяев, изменяя состав микробиоты кишечника, чтобы придать ей изначально большую способность активировать врожденный иммунитет / экспрессию провоспалительных генов [73], что приводит к понятие патобиома [74]. Точно так же инфекция Yersinia enterolitica мышей, лишенных рецептора TLR1, приводит к изменению состава микробиоты и возникновению антикомменсального иммунитета, что в конечном итоге приводит к развитию хронического воспаления кишечника [75].Таким образом, эти два открытия описывают, что острая инфекция может вызывать долгосрочные изменения иммунной системы и микробиоты, что приводит к хроническому воспалительному заболеванию у генетически предрасположенного хозяина.
5. Как бактериальные патогены высвобождаются из кишечной микробиоты
Как обсуждалось выше, кишечная микробиота играет центральную роль, посредством множества механизмов, в устойчивости к колонизации патогенами. Однако, в свою очередь, патогены выработали стратегии, позволяющие избежать некоторых из этих механизмов ( b — d ).
(a) Использование альтернативных питательных веществ или ниш
Даже если кишечная среда качественно и количественно богата питательными веществами, большое количество бактерий в конечном итоге приводит к конкуренции. Одним из механизмов, с помощью которого кишечные патогены могут конкурировать с микробиотой, является использование особого метаболического репертуара. Этаноламин, который выделяется в кишечник во время обновления эпителиальных клеток, например, используется некоторыми патогенами [76], а гены, участвующие в использовании этаноламина, преимущественно обнаруживаются в геномах кишечных патогенов [77].Возбудитель болезней пищевого происхождения EHEC может использовать галактозу, гексуронат, маннозу и рибозу в качестве источников углерода, в то время как комменсал E. coli не может использовать такие сахара [78,79]. Кроме того, некоторые патогены более эффективно используют общие ресурсы, например железо. Железо необходимо для роста бактерий, и многие бактерии вырабатывают сидерофоры для приобретения трехвалентного железа [80]. В качестве защитного механизма клетки-хозяева секретируют липокалин-2, который способен блокировать сидерофор энтеробактин в E.coli , предотвращая приобретение железа и пролиферацию комменсальной E. coli в кишечнике [81,82]. Однако Salmonella и некоторые патогенные E. coli экспрессируют модифицированные энтеробактины, называемые сальмохелинами, которые устойчивы к липокалину-2, обеспечивая важное преимущество патогенов перед комменсалами [4,81,82]. Патогены также могут находиться в отдельной от микробиоты нише. Патогенная E. coli может, например, локализоваться близко к поверхности эпителия кишечника, обычно лишенной комменсальной микробиоты, за счет экспрессии таких молекул, как интимин, молекула адгезии, кодируемая LEE [14].
Хемотаксис и подвижность, обеспечиваемые жгутиками, позволяют Salmonella идентифицировать и плавать в полезные для питания ниши. Действительно, рецепторы хемотаксиса, принимающие метил, Aer и Tsr, как наблюдали, реагировали in vivo на тетратионат или нитрат, соответственно, чтобы придать преимущество пригодности S. Typhimurium во время воспаления, позволяя бактериям искать благоприятные пространственные условия. ниши, содержащие акцепторы электронов, производные от хозяина, которые ускоряют его рост в просвете [83].Патогенные бактерии также могут получать пользу от воспаления кишечника и / или побочных продуктов воспалительного ответа. Например, активные формы кислорода, продуцируемые нейтрофилами во время воспаления, реагируют с соединениями серы в просвете (тиосульфатом) с образованием нового акцептора респираторных электронов, тетратионата (). В отличие от комменсалов Salmonella содержит оперон ttrSR ttrBCA , который позволяет использовать, обеспечивая преимущество роста Salmonella над комменсальными микробами в воспаленной среде [84].Точно так же нитрат, образующийся как побочный продукт воспалительной реакции, давал преимущество в росте комменсальной бактерии E. coli по сравнению с Firmicutes и Bacteroidetes в толстом кишечнике мышей [85]. Хотя этот механизм чрезмерного роста E. coli в воспаленном кишечнике включает комменсально-комменсальную конкуренцию, патогенные штаммы E. coli , в геноме которых есть гены нитратредуктазы, такие как NarZ , могут использовать аналогичный механизм для приобретения преимущество в росте над конкурентным комменсальным сообществом.
(b) Стимулирование воспаления хозяина
Другой механизм, с помощью которого кишечные патогены приобретают преимущество в росте по сравнению с популяцией комменсалов, заключается в стимулировании воспаления кишечника, которое изменяет выживаемость комменсалов. Действительно, экспрессия факторов вирулентности патогенными бактериями, такими как токсины, приводит к воспалению кишечника, которое, в свою очередь, резко меняет состав и богатство микробиоты кишечника [86]. Например, во время воспаления кишечника рекрутируются нейтрофилы и макрофаги, экспрессирующие индуцибельную синтетазу оксида азота (iNOS), что приводит к повышенной концентрации нитрата в кишечнике, что дает преимущество Enterobacteriaceae по сравнению с облигатными анаэробами, такими как Bacteroidetes или Firmicutes [ 85].Многие патовары E. coli действительно способны использовать нитрат в качестве акцептора электронов, например AIEC, связанный с воспалительным заболеванием кишечника, и могут извлечь выгоду из такого преимущества роста по сравнению с популяцией комменсалов для более эффективной колонизации кишечника [87–90] .
Кроме того, воспалительная среда хозяина может усиливать экспрессию факторов вирулентности, способствуя росту патогенных бактерий в тканях хозяина. Например, интерферон-β увеличивал экспрессию лектина типа I на Pseudomonas aeruginosa , обеспечивая адгезию бактерий к эпителиальным клеткам легких [91].Следовательно, воспалительная среда кишечника может также способствовать экспрессии фактора вирулентности кишечными бактериями.
(c) Производство токсинов
Патогены способны продуцировать ингибирующие вещества / токсины, которые могут напрямую воздействовать на микробиоту кишечника. Через свою систему секреции типа VI Vibrio cholerae может доставлять токсичные эффекторы непосредственно в E. coli [92,93]. Кроме того, сообщалось о продукции бактериоцина для штаммов Salmonella [94] и патогенных штаммов Shigella [95–99], но его роль в вирулентности или в качестве механизма вытеснения микробиоты еще не известна.
Принимая во внимание, что бактериоцины играют важную роль в бактериальных взаимоотношениях, весьма вероятно, что они могут способствовать успешной колонизации кишечника патогенными бактериями, воздействуя на определенные комменсалы и, следовательно, изменяя поддержание барьера, изменяя иммунный надзор и / или метаболизм кишечника, способствующий их колонизации. Изучение роли бактериоцинов, продуцируемых патогенными штаммами, на микробиоту и вирулентность, может выявить новые механизмы патогенности и поможет расшифровать сложную взаимосвязь между кишечной микробиотой и некоторыми кишечными патогенами.
6. Заключение и перспективы
В связи с недавним признанием важной роли кишечной микробиоты в здоровье и болезнях, в ряде исследований была подчеркнута ее особая роль в защите от инфекций, вызываемых кишечными патогенами. Здесь важно отметить, что большинство механизмов, представленных в этом обзоре, было обнаружено на животных моделях и / или in vitro работ. Экстраполяцию на ситуацию с человеком следует рассматривать с осторожностью в контексте различных пищевых привычек, архитектуры кишечника, состава микробиоты, окружающей среды, иммунной системы и генетического фона.Однако новые терапевтические подходы могут в конечном итоге выиграть от понимания важной ингибирующей роли кишечной микробиоты в отношении вирулентности патогенов [100], что подтверждается недавним использованием трансплантата фекальной микробиоты для лечения рецидивирующей инфекции C. difficile , которая имеет больше эффективность более 90% по сравнению с 30% при лечении антибиотиками [101]. Целенаправленное манипулирование кишечной микробиотой бактериоцинами и / или другими противомикробными препаратами может стать терапевтическим инструментом для профилактики или лечения заболеваний, связанных с дисбактериозом [102].Основываясь на их очень высокой специфичности (по крайней мере, для некоторых из них), бактериоцины могут представлять собой идеальных кандидатов в отношении воздействия только на нежелательные группы населения. Важно отметить, что уже есть некоторые доказательства концептуальных исследований, таких как использование турицина CD для специфического ингибирования C. difficile в модели дистального отдела толстой кишки [103]. Аналогичным образом, продукция бактериоцина пробиотиком Lactobacillus salivarius UCC118, как было показано, значительно защищает мышей от L.monocytogenes [104]. Более того, недавно было показано, что колонизация кишечника продуцирующим бактериоцин Enteroccocus faecalis приводит к исчезновению устойчивых к ванкомицину энтерококков, укрепляя концепцию, что бактериоцины могут быть эффективным терапевтическим подходом для специфического устранения кишечной колонизации бактериями с множественной устойчивостью без глубокое нарушение комменсальной популяции [104]. Однако при выявлении или выборе бактериоцина в качестве терапевтического подхода следует принимать во внимание предполагаемое широкое воздействие на микробиоту кишечника, даже если оно менее сильное, чем использование антибиотиков.Например, было обнаружено, что CD турицина сильно ингибирует Lactobacillus fermentum [18].
Кроме того, фаговая терапия потенциально может иметь положительное влияние на микробиоту человека и связанное с ним здоровье хозяина [105]. Бактериофаги — это вирусные частицы, которые естественным образом инфицируют бактерии с высокой специфичностью, и фаговая терапия заключается в использовании этих бактериофагов в качестве противомикробных агентов [106,107]. Некоторые группы в настоящее время исследуют их пригодность в качестве терапевтической стратегии против некоторых кишечных патогенов, например против AIEC, связанного с воспалительным заболеванием кишечника [108].
Наконец, бактерии (как непатогенные, так и патогенные) синтезируют небольшие диффузные сигнальные молекулы, называемые аутоиндукторами, чтобы они скоординированно контролировали экспрессию генов всего сообщества в ответ на изменения плотности клеток [109]. Этот процесс, называемый зондированием кворума, может быть универсальным или высокоспецифичным, позволяя бактериям общаться внутри и между видами. Следовательно, определение кворума может иметь большое влияние на состав микробных сообществ, а также участвует в регуляции экспрессии генов вирулентности многими патогенными бактериями [110].Следовательно, идентификация химических сигналов, рецепторов и генов-мишеней будет иметь важное значение для нашего понимания того, как взаимодействие бактерий и бактерий может быть использовано для предотвращения колонизации патогенными бактериями [100].
Необходимы дополнительные исследования для расшифровки сложной взаимосвязи между кишечной микробиотой и патогенными бактериями, которые в конечном итоге помогут определить и, возможно, спроектировать «здоровый» микробиом.
Благодарности
Эта статья посвящена нашему уважаемому наставнику, Арлетт Дарфей-Мишо, которая положила начало нашей научной карьере.Мы благодарны Эндрю Гевирцу и Паскалю Коссарту за критическую рецензию рукописи.
Вклад авторов
Н.Р. и B.C. написал рукопись.
Конкурирующие интересы
У нас нет конкурирующих интересов.
Финансирование
до н.э. является лауреатом премии за развитие карьеры Американского фонда Крона и колита (CCFA).
Список литературы
1. Round JL, Mazmanian SK.
2009 г.
Микробиота кишечника формирует иммунные реакции кишечника во время здоровья и болезни.Nat. Rev. Immunol.
9, 313–323. (10.1038 / nri2515) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 2. Флинт HJ, Скотт КП, Луи П., Дункан Ш.
2012 г.
Роль микробиоты кишечника в питании и здоровье. Nat. Преподобный Гастроэнтерол. Гепатол.
9, 577–589. (10.1038 / nrgastro.2012.156) [PubMed] [CrossRef] [Google Scholar] 5. Чоу Дж, Тан Х, Мазманян СК.
2011 г.
Патобионты микробиоты желудочно-кишечного тракта и воспалительных заболеваний. Curr. Opin. Иммунол.
23, 473–480. (10.1016 / j.coi.2011.07.010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6.Дюклузо Р., Рейльбо П.
1989 г.
Бактериальные взаимодействия в пищеварительном тракте. Rev. Sci. Tech. Выключенный. Int. Epiz. 8, 313–332. (10.20506 / rst.8.2.410) [CrossRef] [Google Scholar] 7. Териот CM, Янг В.Б.
2015 г.
Взаимодействие между микробиомом желудочно-кишечного тракта и Clostridium difficile . Анну. Rev. Microbiol.
69, 445–461. (10.1146 / annurev-micro-0-104115) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Осава Н., Мицухаси С.
1964 г.
Заражение мышей-нематод Shigella Flexneri 3a.Jpn. J. Exp. Med.
34, 77–80. [PubMed] [Google Scholar] 9. Фукуда С., То Х, Тейлор Т. Д., Оно Х, Хаттори М.
2012 г.
Бифидобактерии, продуцирующие ацетат, защищают хозяина от энтеропатогенной инфекции через переносчики углеводов. Кишечные микробы
3, 449–454. (10.4161 / gmic.21214) [PubMed] [CrossRef] [Google Scholar] 10. Fukuda S, et al.
2011 г.
Бифидобактерии могут защитить от энтеропатогенной инфекции за счет выработки ацетата. Природа
469, 543–547. (10.1038 / nature09646) [PubMed] [CrossRef] [Google Scholar] 11.Бонхофф М, Дрейк Б.Л., Миллер С.П.
1954 г.
Влияние стрептомицина на восприимчивость кишечного тракта к экспериментальной сальмонеллезной инфекции. Proc. Soc. Exp. Биол. Med.
86, 132–137. (10.3181 / 00379727-86-21030) [PubMed] [CrossRef] [Google Scholar] 12. Лоули Т.Д. и др.
2009 г.
Лечение антибиотиками мышей-носителей Clostridium difficile вызывает состояние суперседдера, опосредованную спорами передачу и тяжелое заболевание у хозяев с ослабленным иммунитетом. Заразить. Иммун.
77, 3661–3669. (10.1128 / IAI.00558-09) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14.Камада Н, Ким Ю.Г., Шам ХП, Валланс Б.А., Пуэнте Дж.Л., Мартенс Э.С., Нуньес Г.
2012 г.
Регулируемая вирулентность контролирует способность патогена конкурировать с кишечной микробиотой. Наука
336, 1325–1329. (10.1126 / science.1222195) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15. Gantois I, Ducatelle R, Pasmans F, Haesebrouck F, Hautefort I, Thompson A, Hinton JC, Van Immerseel F.
2006 г.
Бутират специфически подавляет экспрессию гена острова 1 патогенности Salmonella . Прил. Environ.Microbiol.
72, 946–949. (10.1128 / AEM.72.1.946-949.2006) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Шин Р., Сузуки М., Моришита Ю.
2002 г.
Влияние кишечных анаэробов и органических кислот на рост энтерогеморрагической инфекции Escherichia coli O157: H7. J. Med. Microbiol.
51, 201–206. (10.1099 / 0022-1317-51-3-201) [PubMed] [CrossRef] [Google Scholar] 17. Kommineni S, et al.
2015 г.
Продукция бактериоцина усиливает нишевую конкуренцию энтерококков в желудочно-кишечном тракте млекопитающих.Природа
526, 719–722. (10.1038 / nature15524) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 18. Rea MC, Sit CS, Clayton E, O’Connor PM, Whittal RM, Zheng J, Vederas JC, Ross RP, Hill C.
2010 г.
Турицин CD, посттрансляционно модифицированный бактериоцин с узким спектром активности против Clostridium difficile . Proc. Natl Acad. Sci. США
107, 9352–9357. (10.1073 / pnas.0
4107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 19. Шамбергер Г.П., Диез-Гонсалес Ф.
2002 г.Отбор недавно выделенных колициногенных штаммов Escherichia coli , ингибирующих Escherichia coli O157: H7. J. Food Prot.
65, 1381–1387. [PubMed] [Google Scholar] 20. Пинто А.Л., Фернандес М., Пинто С., Альбано Х., Кастильо Ф., Тейшейра П., Гиббс П.А.
2009 г.
Характеристика бактериоцинов против Listeria , выделенных из моллюсков: потенциальные противомикробные средства для контроля неферментированных морепродуктов. Int. J. Food Microbiol.
129, 50–58. (10.1016 / j.ijfoodmicro.2008.11.005) [PubMed] [CrossRef] [Google Scholar] 21.Чанос П., Уильямс ДР.
2011 г.
Anti- Listeria Бактерии, продуцирующие бактериоцин, из сырого овечьего молока в северной Греции. J. Appl. Microbiol.
110, 757–768. (10.1111 / j.1365-2672.2010.04932.x) [PubMed] [CrossRef] [Google Scholar] 22. Дония М.С., Цимерманчич П., Шульце С.Дж., Виланд Браун Л.С., Мартин Дж., Митрева М., Кларди Дж., Линингтон Р.Г., Фишбах М.А.
2014 г.
Систематический анализ кластеров биосинтетических генов в микробиоме человека показывает общее семейство антибиотиков. Клетка
158, 1402–1414. (10.1016 / j.cell.2014.08.032) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Уолш CJ, Guinane CM, Hill C, Росс RP, O’Toole PW, Коттер PD.
2015 г.
Идентификация in silico кластеров генов бактериоцина в желудочно-кишечном тракте на основе базы данных эталонных геномов проекта Human Microbiome Project. BMC Microbiol.
15, 183 (10.1186 / s12866-015-0515-4) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 25. Chassaing B, Koren O, Goodrich JK, Poole AC, Srinivasan S, Ley RE, Gewirtz AT.
2015 г.Пищевые эмульгаторы воздействуют на микробиоту кишечника мышей, вызывая колит и метаболический синдром. Природа
519, 92–96. (10.1038 / nature14232) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 26. Териот CM, Боуман А.А., Янг В.Б.
2016 г.
Вызванные антибиотиками изменения микробиоты кишечника изменяют вторичную продукцию желчных кислот и позволяют спорам Clostridium difficile прорастать и разрастаться в толстом кишечнике. мСфера
1, e00045-15. (10.1128 / mSphere.00045-15) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 27.Бриттон Р.А., Янг В.Б.
2014 г.
Роль кишечной микробиоты в устойчивости к колонизации Clostridium difficile . Гастроэнтерология
146, 1547–1553. (10.1053 / j.gastro.2014.01.059) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 28. Sorg JA, Sonenshein AL.
2010 г.
Подавление инициации прорастания спор Clostridium difficile с использованием аналогов хенодезоксихолевой кислоты, желчной кислоты. J. Bacteriol.
192, 4983–4990. (10.1128 / JB.00610-10) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 29.Buffie CG, et al.
2015 г.
Прецизионное восстановление микробиома восстанавливает опосредованную желчной кислотой устойчивость к Clostridium difficile . Природа
517, 205–208. (10.1038 / nature13828) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 30. Weingarden AR, Chen C, Bobr A, Yao D, Lu Y, Nelson VM, Sadowsky MJ, Khoruts A.
2014 г.
Трансплантация микробиоты восстанавливает нормальный состав фекальных желчных кислот при рецидивирующей инфекции Clostridium difficile . Являюсь. J. Physiol. Гастроинтест. Liver Physiol.306, G310 – G319. (10.1152 / ajpgi.00282.2013) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 31. Карлссон Дж., Пуцеп К., Чу Х., Кейс Р.Дж., Бевинс К.Л., Андерссон М.
2008 г.
Региональные вариации экспрессии антимикробного пептида клеток Панета в кишечном тракте мышей. BMC Immunol.
9, 37 (10.1186 / 1471-2172-9-37) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 32. Риос Д., Вуд М.Б., Ли Дж., Чассен Б., Гевиртц А.Т., Уильямс И.Р.
2015 г.
Отбор образцов антигена кишечными М-клетками является основным путем, инициирующим продукцию IgA слизистой оболочки для комменсальных кишечных бактерий.Mucosal Immunol. 9, 907–916. (10.1038 / mi.2015.121) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 33. Bevins CL, Salzman NH.
2011 г.
Клетки Панета, антимикробные пептиды и поддержание гомеостаза кишечника. Nat. Rev. Microbiol.
9, 356–368. (10.1038 / nrmicro2546) [PubMed] [CrossRef] [Google Scholar] 34. Cash HL, Whitham CV, Behrendt CL, Hooper LV.
2006 г.
Симбиотические бактерии направляют экспрессию кишечного бактерицидного лектина. Наука
313, 1126–1130. (10.1126 / science.1127119) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 35.Fransen F, et al.
2015 г.
Мыши BALB / c и C57BL / 6 различаются по содержанию полиреактивного IgA, что влияет на образование антиген-специфических IgA и разнообразие микробиоты. Иммунитет
43, 527–540. (10.1016 / j.immuni.2015.08.011) [PubMed] [CrossRef] [Google Scholar] 37. Мазманян СК, Лю СН, Цианабос А.О., Каспер ДЛ.
2005 г.
Иммуномодулирующая молекула симбиотических бактерий направляет созревание иммунной системы хозяина. Клетка
122, 107–118. (10.1016 / j.cell.2005.05.007) [PubMed] [CrossRef] [Google Scholar] 38. Иванов И.И., Фрутос Р.Д., Манель Н., Йошинага К., Рифкин Д.Б., Сартор РБ, Финлей Б.Б., Литтман Д.Р.2008 г.
Специфическая микробиота направляет дифференцировку Т-хелперных клеток, продуцирующих ИЛ-17, в слизистой оболочке тонкой кишки. Клеточный микроб-хозяин
4, 337–349. (10.1016 / j.chom.2008.09.009) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 40. Gaboriau-Routhiau V, et al.
2009 г.
Ключевая роль сегментированных нитчатых бактерий в скоординированном созревании ответов Т-хелперных клеток кишечника. Иммунитет
31, 677–689. (10.1016 / j.immuni.2009.08.020) [PubMed] [CrossRef] [Google Scholar] 41. Lecuyer E, et al.2014 г.
Сегментированные нитчатые бактерии используют вторичные и третичные лимфоидные ткани для индукции ответа кишечных IgA и специфических Т-хелперных 17 клеток. Иммунитет
40, 608–620. (10.1016 / j.immuni.2014.03.009) [PubMed] [CrossRef] [Google Scholar] 42. Ракофф-Нахум С., Паглино Дж., Эслами-Варзане Ф., Эдберг С., Меджитов Р.
2004 г.
Распознавание комменсальной микрофлоры толл-подобными рецепторами необходимо для гомеостаза кишечника. Клетка
118, 229–241. (10.1016 / j.cell.2004.07.002) [PubMed] [CrossRef] [Google Scholar] 43.Араки А. и др.
2005 г.
У мышей с дефицитом MyD88 развивается тяжелое воспаление кишечника при колите, вызванном декстрановым сульфатом натрия. J. Gastroenterol.
40, 16–23. (10.1007 / s00535-004-1492-9) [PubMed] [CrossRef] [Google Scholar] 44. Чжан Б. и др.
2014 г.
Вирусная инфекция. Профилактика и лечение ротавирусной инфекции посредством TLR5 / NLRC4-опосредованной продукции IL-22 и IL-18. Наука
346, 861–865. (10.1126 / science.1256999) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Атараши К. и др.
2013.
Индукция Treg рационально подобранной смесью штаммов Clostridia из микробиоты человека.Природа
500, 232–236. (10.1038 / nature12331) [PubMed] [CrossRef] [Google Scholar] 47. Ким СН, Пак Дж., Ким М.
2014 г.
Короткоцепочечные жирные кислоты кишечной микробиоты, Т-клетки и воспаление. Иммунная сеть
14, 277–288. (10.4110 / in.2014.14.6.277) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 48. Furusawa Y, et al.
2013.
Бутират комменсального микроба индуцирует дифференцировку регуляторных Т-клеток толстой кишки. Природа
504, 446–450. (10.1038 / nature12721) [PubMed] [CrossRef] [Google Scholar] 49.Смит П.М., Ховитт М.Р., Паников Н., Мишо М., Галлини К.А., Бохлули Ю.М., Гликман Дж. Н., Гарретт В.С.
2013.
Микробные метаболиты, короткоцепочечные жирные кислоты, регулируют гомеостаз Treg-клеток толстой кишки. Наука
341, 569–573. (10.1126 / science.1241165) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 50. Бейтс Дж. М., Акерлунд Дж., Миттдж Э., Гийемин К.
2007 г.
Щелочная фосфатаза кишечника выводит токсины из липополисахаридов и предотвращает воспаление у рыбок данио в ответ на кишечную микробиоту. Клеточный микроб-хозяин
2, 371–382.(10.1016 / j.chom.2007.10.010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Боймер С., Вульферинк М., Раабен В., Фихтер Д., Брэндс Р., Сейнен В.
2003 г.
Щелочная фосфатаза из кишечника теленка, новый терапевтический препарат для лечения заболеваний, опосредованных липополисахаридами (ЛПС), снижает токсичность ЛПС у мышей и поросят. J. Pharmacol. Exp. Ther.
307, 737–744. (10.1124 / jpet.103.056606) [PubMed] [CrossRef] [Google Scholar] 52. Кояма И., Мацунага Т., Харада Т., Хокари С., Комода Т.
2002 г.
Щелочные фосфатазы снижают токсичность липополисахаридов in vivo и in vitro посредством дефосфорилирования.Clin. Биохим.
35, 455–461. (10.1016 / S0009-9120 (02) 00330-2) [PubMed] [CrossRef] [Google Scholar] 53. Chassaing B, Gewirtz AT.
2016 г.
Спровоцировала ли агрессия микробиоты развитие эпидемии ожирения?
Биологические исследования
38, 122–128. (10.1002 / bies.201500116) [PubMed] [CrossRef] [Google Scholar] 54. Влодарска М., Уиллинг Б., Кини К.М., Менендес А., Бергстром К.С., Гилл Н., Рассел С.Л., Валланс Б.А., Финли Б.Б.
2011 г.
Лечение антибиотиками изменяет слой слизи толстой кишки и предрасполагает хозяина к обострению колита, вызванного Citrobacter rodentium .Заразить. Иммун.
79, 1536–1545. (10.1128 / IAI.01104-10) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 55. Виллемсен Л.Е., Кетсиер М.А., ван Девентер С.Дж., ван Тол Е.А.
2003 г.
Короткоцепочечные жирные кислоты стимулируют экспрессию муцина 2 в эпителии за счет различных эффектов на продукцию простагландинов E (1) и E (2) кишечными миофибробластами. Кишечник
52, 1442–1447. (10.1136 / gut.52.10.1442) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 56. Симотоёдомэ А, Мегуро С., Хасэ Т, Токимицу И, Саката Т.2000 г.
Короткоцепочечные жирные кислоты, но не лактат или сукцинат, стимулируют выделение слизи в толстой кишке крысы. Комп. Биохим. Physiol. Мол. Интегр. Physiol.
125, 525–531. (10.1016 / S1095-6433 (00) 00183-5) [PubMed] [CrossRef] [Google Scholar] 57. Камерон Э.А., Сперандио В.
2015 г.
Заклятые враги: сигнализация и интеграция питания во взаимодействиях патоген-микробиота-хозяин. Клеточный микроб-хозяин
18, 275–284. (10.1016 / j.chom.2015.08.007) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Феррейра Дж. А., Ву К. Дж., Грицковиан А. Дж., Були Д. М., Веймер Британская Колумбия, Зонненбург Дж. Л..2014 г.
Сукцинат, продуцируемый кишечной микробиотой, способствует инфицированию C. difficile после лечения антибиотиками или нарушения моторики. Клеточный микроб-хозяин
16, 770–777. (10.1016 / j.chom.2014.11.003) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 60. Кертис М.М., Ху З., Климко С., Нараянан С., Деберардинис Р., Сперандио В.
2014 г.
Комменсал кишечника Bacteroides thetaiotaomicron обостряет кишечную инфекцию за счет изменения метаболического ландшафта. Клеточный микроб-хозяин
16, 759–769.(10.1016 / j.chom.2014.11.005) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 61. Pham NT, Lawley TD.
2014 г.
Использование патогенами пищевой сети кишечника. Клеточный микроб-хозяин
16, 703–705. (10.1016 / j.chom.2014.11.012) [PubMed] [CrossRef] [Google Scholar] 62. Пачеко А.Р., Кертис М.М., Ричи Дж.М., Мунера Д., Уолдор М.К., Морейра К.Г., Сперандио В.
2012 г.
Чувствительность к фукозе регулирует бактериальную колонизацию кишечника. Природа
492, 113–117. (10.1038 / nature11623) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 63.Гиль Дж. Л., Сорг Дж. А., Соненшейн А. Л., Чжу Дж.
2010 г.
Метаболизм солей желчных кислот у мышей влияет на прорастание спор Clostridium difficile . PLoS ONE
5, e8740 (10.1371 / journal.pone.0008740) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 64. Майер Л., Бартель М., Стечер Б., Майер Р. Дж., Ганн Дж. С., Хардт В. Д..
2014 г.
Salmonella Штамм Typhimurium ATCC14028 требует h3-гидрогеназ для роста в кишечнике, но не в системных участках. PLoS ONE
9, e110187 (10.1371 / journal.pone.0110187) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 65.Bertin Y, Girardeau JP, Chaucheyras-Durand F, Lyan B, Pujos-Guillot E, Harel J, Martin C.
2011 г.
Энтерогеморрагический Escherichia coli получает конкурентное преимущество за счет использования этаноламина в качестве источника азота в содержимом кишечника крупного рогатого скота. Environ. Microbiol.
13, 365–377. (10.1111 / j.1462-2920.2010.02334.x) [PubMed] [CrossRef] [Google Scholar] 66. Кендалл М.М., Грубер С.К., Паркер К.Т., Сперандио В.
2012 г.
Этаноламин контролирует экспрессию генов, кодирующих компоненты, участвующие в межцерковной передаче сигналов и вирулентности в энтерогеморрагической Escherichia coli O157: H7.мБио
3, е00050-12. (10.1128 / mBio.00050-12) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 67. Thiennimitr P, et al.
2011 г.
Воспаление кишечника позволяет Salmonella использовать этаноламин для конкуренции с микробиотой. Proc. Natl Acad. Sci. США
108, 17 480–17 485. (10.1073 / pnas.1107857108) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 68. Joseph B, Przybilla K, Stuhler C, Schauer K, Slaghuis J, Fuchs TM, Goebel W.
2006 г.
Идентификация генов Listeria monocytogenes , участвующих во внутриклеточной репликации, путем профилирования экспрессии и скрининга мутантов.J. Bacteriol.
188, 556–568. (10.1128 / JB.188.2.556-568.2006) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 69. Эверард А. и др.
2013.
Перекрестное взаимодействие между Akkermansia muciniphila и кишечным эпителием контролирует ожирение, вызванное диетой. Proc. Natl Acad. Sci. США
110, 9066–9071. (10.1073 / pnas.1219451110) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 70. Schneeberger M, Everard A, Gomez-Valades AG, Matamoros S, Ramirez S, Delzenne NM, Gomis R, Claret M, Cani PD.
2015 г. Akkermansia muciniphila обратно коррелирует с началом воспаления, изменением метаболизма жировой ткани и метаболическими нарушениями во время ожирения у мышей. Sci. Rep.
5, 16643 (10.1038 / srep16643) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 71. Ганеш Б.П., Клопфляйш Р., Лох Г., Блаут М.
2013.
Commensal Akkermansia muciniphila обостряет воспаление кишечника у Salmonella Typhimurium-инфицированных гнотобиотических мышей. PLoS ONE
8, e74963 (10.1371 / journal.pone.0074963) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 72. Карвалью Ф.А. и др.
2012 г.
Временная неспособность управлять протеобактериями способствует хроническому воспалению кишечника у мышей с дефицитом TLR5. Клеточный микроб-хозяин
12, 139–152. (10.1016 / j.chom.2012.07.004) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 73. Chassaing B, Корен O, Карвалью FA, Ley RE, Gewirtz AT.
2014 г.
Патобионт AIEC вызывает хронический колит у восприимчивых хозяев, изменяя состав микробиоты. Кишечник
63, 1069–1080.(10.1136 / gutjnl-2013-304909) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 74. Vayssier-Taussat M, et al.
2014 г.
Сдвиг парадигмы с патогенов на патобиом: новые концепции в свете мета-омики. Фронт. Cell Infect. Microbiol.
4, 29 (10.3389 / fcimb.2014.00029) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 75. Камдар К. и др.
2016 г.
Генетические и метаболические сигналы во время острой кишечной бактериальной инфекции изменяют микробиоту и приводят к развитию хронического воспалительного заболевания.Клеточный микроб-хозяин
19, 21–31. (10.1016 / j.chom.2015.12.006) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 77. Корбель Дж.О., Дёркс Т., Йенсен Л.Дж., Перес-Иратхета К., Качановски С., Хупер С.Д., Андраде М.А., Борк П.
2005 г.
Систематическая ассоциация генов с фенотипами путем анализа генома и литературы. PLoS Biol.
3, e134 (10.1371 / journal.pbio.0030134) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 78. Fabich AJ, et al.
2008 г.
Сравнение углеродного питания патогенных и комменсальных штаммов Escherichia coli в кишечнике мышей.Заразить. Иммун.
76, 1143–1152. (10.1128 / IAI.01386-07) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 79. Ле Бугенек К., Шулер К.
2011 г.
Обмен сахара, дополнительный фактор вирулентности энтеробактерий. Int. J. Med. Microbiol.
301, 1–6. (10.1016 / j.ijmm.2010.04.021) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 80. Саха Р., Саха Н., Донофрио Р.С., Бестервельт LL.
2013.
Микробные сидерофоры: мини-обзор. J. Basic Microbiol.
53, 303–317. (10.1002 / jobm.201100552) [PubMed] [CrossRef] [Google Scholar] 81.Фишбах М.А., Линь Х., Лю Д.Р., Уолш К.Т.
2006 г.
Как патогенные бактерии избегают саботажа млекопитающих в битве за железо. Nat. Chem. Биол.
2, 132–138. (10.1038 / nchembio771) [PubMed] [CrossRef] [Google Scholar] 82. Сингх В., Йео Б.С., Сяо Икс, Кумар М., Бахман М., Боррегаард Н., Джо Б., Виджай-Кумар М.
2015 г.
Взаимодействие между энтеробактином, миелопероксидазой и липокалином 2 регулирует выживание E. coli в воспаленном кишечнике. Nat. Commun.
6, 7113 (10.1038 / ncomms8113) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 86.Лупп С., Робертсон М.Л., Викхэм М.Э., Секиров И., Чемпион О.Л., Гейнор Е.К., Финли ББ.
2007 г.
Опосредованное хозяином воспаление нарушает микробиоту кишечника и способствует чрезмерному росту энтеробактерий. Клеточный микроб-хозяин
2, 204 (10.1016 / j.chom.2007.08.002) [PubMed] [CrossRef] [Google Scholar] 87. Darfeuille-Michaud A, et al.
2004 г.
Высокая распространенность адгезивно-инвазивной инфекции Escherichia coli , связанной со слизистой оболочкой подвздошной кишки, при болезни Крона. Гастроэнтерология
127, 412–421. (10.1053 / j.gastro.2004.04.061) [PubMed] [CrossRef] [Google Scholar] 88. Шассен Б., Дарфёй-Мишо А.
2011 г.
Комменсальная микробиота и энтеропатогены в патогенезе воспалительных заболеваний кишечника. Гастроэнтерология
140, 1720–1728. (10.1053 / j.gastro.2011.01.054) [PubMed] [CrossRef] [Google Scholar] 89. Нэш Дж. Х. и др.
2010 г.
Последовательность генома адгезивно-инвазивной Escherichia coli и сравнительный геномный анализ с другими патотипами E. coli . BMC Genomics
11, 667 (10.1186 / 1471-2164-11-667) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 90.Miquel S, et al.
2010 г.
Полная последовательность генома ассоциированного с болезнью Крона адгезивно-инвазивного штамма E. coli LF82. PLoS ONE
5, e12714 (10.1371 / journal.pone.0012714) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 91. Wu L, et al.
2005 г.
Распознавание активации иммунной системы хозяина с помощью Pseudomonas aeruginosa . Наука
309, 774–777. (10.1126 / science.1112422) [PubMed] [CrossRef] [Google Scholar] 92. Унтервегер Д., Мията С.Т., Бахманн В., Брукс Т.М., Маллинс Т., Костюк Б., Провенцано Д., Пукацки С.2014 г.
Система секреции Vibrio cholerae типа VI использует различные эффекторные модули для внутривидовой конкуренции. Nat. Commun.
5, 3549 (10.1038 / ncomms4549) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 93. Макинтайр Д.Л., Мията СТ, Китаока М., Пукацки С.
2010 г.
Система секреции Vibrio cholerae типа VI проявляет антимикробные свойства. Proc. Natl Acad. Sci. США
107, 19 520–19 524. (10.1073 / pnas.1012931107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 94.Патанкар CV, Джоши Л.М.
1985 г.
Производство бактериоцина Salmonella . J. Postgrad. Med.
31, 46–51. [PubMed] [Google Scholar] 95. Соуза М.А., Мендес Э.Н., Аполлонио А.С., Фариас Лде М., Магалхаес П.П.
2010 г.
Продукция бактериоцина Shigella sonnei , выделенная из фекалий детей с острой диареей. APMIS
118, 125–135. (10.1111 / j.1600-0463.2009.02570.x) [PubMed] [CrossRef] [Google Scholar] 96. Горак В.
1994 г.
Семьдесят типов колицина Shigella sonnei и индикаторная система для их определения.Zentralbl. Бактериол.
281, 24–29. (10.1016 / S0934-8840 (11) 80633-X) [PubMed] [CrossRef] [Google Scholar] 97. Kaewklom S, Samosornsuk S, Pipatsatitpong D, Aunpad R.
2013.
Колицин типа 7 продуцируется большинством из Shigella sonnei , выделенных от тайских пациентов с диареей. Braz. J. Microbiol.
44, 731–736. (10.1590 / S1517-83822013000300010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 99. Падилья К., Лобос О., Бревис П., Абака П., Хуберт Э.
2006 г.
Опосредованная плазмидой продукция бактериоцина Shigella flexneri , выделенная из дизентерийной диареи, и их трансформация в Escherichia coli .Lett. Прил. Microbiol.
42, 300–303. (10.1111 / j.1472-765X.2005.01829.x) [PubMed] [CrossRef] [Google Scholar] 100. Белисарио Дж. Э., Наполитано М.
2015 г.
Микробиомы человека и их роль в дисбактериозе, распространенных заболеваниях и новых терапевтических подходах. Фронт. Microbiol.
6, 1050 (10.3389 / fmicb.2015.01050) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 101. van Nood E, et al.
2013.
Дуоденальная инфузия донорских фекалий при рецидиве Clostridium difficile . N. Engl. J. Med.
368, 407–415.(10.1056 / NEJMoa1205037) [PubMed] [CrossRef] [Google Scholar] 102. Коттер П.Д., Росс Р.П., Хилл К.
2013.
Бактериоцины — жизнеспособная альтернатива антибиотикам?
Nat. Rev. Microbiol.
11, 95–105. (10.1038 / nrmicro2937) [PubMed] [CrossRef] [Google Scholar] 103. Rea MC, et al.
2011 г.
Влияние противомикробных препаратов широкого и узкого спектра действия на Clostridium difficile и микробное разнообразие в модели дистального отдела толстой кишки. Proc. Natl Acad. Sci. США
108 (Дополнение 1), 4639–4644. (10.1073 / pnas.1001224107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 104.Корр С.К., Ли И, Ридель К.Ю., О’Тул П.В., Хилл С., Гахан К.Г.
2007 г.
Продукция бактериоцина как механизм противоинфекционной активности Lactobacillus salivarius UCC118. Proc. Natl Acad. Sci. США
104, 7617–7621. (10.1073 / pnas.0700440104) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
108. Цуй Дж., Джейкобс Дж., Браун Дж.
2014 г.
Бактериофаги как терапевтическая стратегия для нацеливания на прилипшую, инвазивную Escherichia coli , связанную с воспалительным заболеванием кишечника. Национальная конференция SACNAS, 16–18 октября, Лос-Анджелес, Калифорния .
109. Шаудер С, Басслер БЛ.
2001 г.
Языки бактерий. Genes Dev.
15, 1468–1480. (10.1101 / gad.899601) [PubMed] [CrossRef] [Google Scholar] 110. Резерфорд С.Т., Басслер Б.Л.
2012 г.
Определение бактериального кворума: его роль в вирулентности и возможности борьбы с ней. Харб Холодного источника. Перспектива. Med.
2, a012427 (10.1101 / cshperspect.a012427) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Когда патогенные бактерии встречаются с кишечной микробиотой
Philos Trans R Soc Lond B Biol Sci.2016 5 ноября; 371 (1707): 20150504.
Натали Ролион
1 Institut Pasteur, Unité des Interactions Bactéries-Cellules, 75015 Paris, France
2 Inserm, U604, 75015 Paris, France
, 3 INRA Unité sous contrat 2020, 75015 Paris, France
Benoit Chassaing
4 Институт биомедицинских наук, Центр воспаления, иммунитета и инфекции, Университет штата Джорджия, Атланта, Джорджия 30303, США
1 Institut Pasteur, Unité des Interactions Bactéries-Cellules, 75015 Paris, France
2 Inserm, U604, 75015 Paris, France
3 INRA, Unité sous contrat 2020, 75015 Paris, France
4 Институт биомедицинских наук, Центр воспаления, иммунитета и инфекций, Государственный университет Джорджии, Атланта, Джорджия 30303, США
Опубликовано Королевским обществом.Все права защищены.
Эта статья цитируется в других статьях в PMC.
Abstract
Кишечная микробиота — это большое и разнообразное микробное сообщество, обитающее в кишечном тракте, содержащее около 100 триллионов бактерий 500–1000 различных видов, которые в совокупности обеспечивают хозяину множество преимуществ. Микробиота кишечника способствует усвоению питательных веществ и созреванию иммунной системы, а также играет центральную роль в защите хозяина от кишечной бактериальной инфекции.С другой стороны, многие кишечные патогены разработали стратегии, позволяющие преодолеть конкуренцию кишечному сообществу, что приводит к инфекции и / или хроническим заболеваниям. В этом обзоре будут обобщены результаты, описывающие сложную взаимосвязь между кишечной микробиотой и кишечными патогенами, а также то, как будущие методы лечения могут в конечном итоге извлечь выгоду из таких открытий.
Эта статья является частью тематического выпуска «Новая бактериология».
Ключевые слова: кишечная микробиота, воспаление, нутриент, патогенные бактерии, вирулентность
1.Введение
Кишечная микробиота — это собирательный термин, описывающий большое и разнообразное микробное сообщество, населяющее наш кишечник. Микробиота человека содержит около 100 триллионов бактерий 500–1000 различных видов, которые обеспечивают хозяину множество преимуществ. Среди этих полезных функций кишечная микробиота играет центральную роль в (i) формировании иммунной системы кишечника [1], способствуя развитию и созреванию иммунной системы, и (ii) приобретению питательных веществ, значительно увеличивая метаболические возможности кишечника, таким образом обеспечивая хозяина ряд необходимых питательных веществ [2].Другим важным преимуществом кишечной микробиоты для кишечника хозяина является защита от колонизации экзогенными патогенами — феномена, ныне называемого резистентностью к колонизации, — и от чрезмерного роста местных патобионтов (потенциальных патогенных симбионтов микробиоты) [3–5]. Устойчивость к колонизации, названная «микробным барьером» в начале 1980-х годов [6], представляет собой механизм, посредством которого кишечные бактерии образуют барьер для предотвращения вторжения новых бактерий других видов или других штаммов того же вида.Это понятие хорошо иллюстрируется рядом инфекций, возникающих в результате использования антибиотиков, таких как инфекция Clostridium difficile [7], а также наблюдением, что многие кишечные патогены вызывают более сильное заболевание у мышей в условиях отсутствия микробов (в отсутствие кишечной микробиоты) или после лечения антибиотиками [8–12] (). Механизмы, регулирующие способность микробиоты сдерживать рост патогенов, сложны и включают конкурентные метаболические взаимодействия, локализацию в кишечных нишах и индукцию иммунных ответов хозяина [4].Патогены, в свою очередь, разработали стратегии, позволяющие избежать устойчивости к колонизации, создаваемой комменсальным сообществом. Неожиданно кишечная микробиота также может играть роль в обеспечении питательными веществами некоторых кишечных патогенов или может играть прямую роль в активации вирулентности патогенных бактерий, которые в противном случае останутся авирулентными. Кроме того, в некоторых конкретных условиях кишечная микробиота может фактически приводить к заболеванию, как, например, в случае воспалительных заболеваний кишечника.В этом обзоре будут обобщены эти концепции и описаны самые последние результаты, проливающие свет на интригующую взаимосвязь между кишечной микробиотой и кишечными патогенами. Мы обсудим, как понимание взаимодействий микробиоты и патогенов может в конечном итоге привести к новым терапевтическим подходам к лечению инфекционных заболеваний.
Гомеостаз микробиоты / хозяина в кишечнике. ( a ) Кишечная микробиота играет центральную роль в поддержании кишечного барьера (производство слизи и поддержание плотных контактов кишечника) и созревании иммунной системы (развитие лимфоцитов, выработка IgA и антимикробных пептидов).( b ) В отсутствие кишечной микробиоты кишечные патогены могут вызывать повреждение эпителия и потенциально распространяться. AMP, антимикробный пептид; IgA, иммуноглобулин А.
2. Роль кишечной микробиоты в устойчивости к колонизации
Кишечная микробиота играет центральную роль посредством множества механизмов в защите кишечника хозяина от колонизации патогенами (рисунки и).
Устойчивость к колонизации, опосредованная кишечной микробиотой.Примеры опосредованного микробиотой прямого подавления колонизации кишечника кишечными патогенами. Кишечная микробиота предотвращает колонизацию кишечными патогенами, конкурируя за питательные вещества ( a ) или производя ингибирующие вещества, такие как бактериоцин ( b ), вторичные желчные кислоты ( c ) и короткоцепочечные жирные кислоты ( d ). EHEC, энтерогеморрагический , Escherichia coli ; SCFAs, короткоцепочечные жирные кислоты.
(a) Прямое ингибирование колонизации кишечными патогенами
Концепция защиты кишечника хозяина от патогенов с помощью комменсальных бактерий, также называемая устойчивостью к колонизации, была впервые описана как результат прямого подавления, опосредованного микроорганизмами [13].Действительно, многие бактерии напрямую подавляют кишечные патогены, конкурируя за питательные вещества или индуцируя производство ингибирующих веществ. Одним из примеров, подчеркивающих первое, является открытие, что комменсал Bacteroidetes thetaiotaomicron потребляет углеводы, используемые патогеном Citrobacter rodentium , что приводит к конкурентному исключению патогена из кишечника [14] (). Потребляя общие ограниченные ресурсы, микробиота кишечника вызывает голодание конкурирующих патогенов [4].Путем производства определенных метаболитов кишечная микробиота также может изменять условия окружающей среды хозяина, тем самым ставя под угрозу рост патогенов и / или вирулентность. Бутират, короткоцепочечная жирная кислота (SCFA), продуцируемая кишечной микробиотой, может подавлять экспрессию нескольких генов вирулентности Salmonella enterica серовара Enteritidis ( S. Enteritidis) и Typhimurium ( S . Typhimurium) [15 ] и было показано, что он подавляет рост энтерогеморрагической Escherichia coli (EHEC) [16].Некоторые штаммы Bifidobacteria также могут защищать от инфекции EHEC за счет продукции ацетата [10].
Сообщество кишечной микробиоты также способно производить большое количество широко биоактивных малых молекул, которые действуют на других членов кишечной микробиоты и / или на кишечные патогены. Бактериоцины, например, представляют собой антимикробные пептиды, которые могут иметь спектр активности от узкого до широкого и могут избирательно убивать и / или подавлять рост конкурирующих бактерий [17].Например, Bacteroides thuringiensis способен секретировать бактериоцин (турицин CD), который непосредственно нацелен на спорообразующие бациллы и клостридии, включая C. difficile [18]. Точно так же некоторые штаммы E. coli способны продуцировать бактериоцин, который может напрямую ингибировать рост кишечного патогена EHEC [19], и было обнаружено, что бактериоцины против Listeria экспрессируются Enterococcus faecium и Pediococcus pentosaceus [20,21].Недавно компьютерное предсказание кластеров биосинтетических генов, которые кодируют небольшие молекулы в микробиоте кишечника человека, выявило почти 600 кластеров-кандидатов, в том числе многие недавно аннотированные антимикробные пептиды, предполагая, что эти небольшие молекулы могут опосредовать взаимодействия комменсал-комменсал и комменсал-патоген [22]. Другое исследование in silico выявило 74 предположительно кодирующих кластера бактериоцина в желудочно-кишечном тракте на основе базы данных эталонного генома проекта микробиома человека [23,24].
Другой в некоторой степени прямой ингибирующий эффект кишечной микробиоты по отношению к патогенам осуществляется через механизм с участием желчных кислот. Вырабатываемые печенью и доставляемые в двенадцатиперстную кишку, желчные кислоты впоследствии модифицируются микробиотой кишечника в бесчисленное множество вторичных желчных кислот, которые могут действовать как антибактериальные факторы. Роль кишечной микробиоты во вторичном производстве желчных кислот подчеркивается наблюдением очень низких или неопределяемых уровней у стерильных животных [25] и резкого снижения выработки после лечения антибиотиками [26].Лучшим примером защитного механизма, обеспечиваемого вторичными желчными кислотами микробиоты, является наблюдение, что истощение микробных членов, участвующих в превращении первичных желчных кислот во вторичные желчные кислоты, способствует колонизации желудочно-кишечного тракта C. difficile , наиболее видный патоген, использующий изменения микробиоты, опосредованные антибиотиками [7,26–30]. Важно отметить, что введения Clostridium scindens (7α-дегидроксилирующая бактерия желчной кислоты) достаточно для придания устойчивости к C.difficile вторичным образом, зависимым от желчных кислот. В недавних работах было описано, что кишечная микробиота также может косвенно контролировать кишечные патогены с помощью других механизмов, таких как формирование иммунной системы и воспалительный ответ (иммунная устойчивость к колонизации).
(b) Созревание иммунной системы и процесс воспаления
Микробиота играет первостепенную роль в созревании кишечной иммунной системы, что продемонстрировано наблюдением, что мыши без микробов имеют тяжелую иммунную депрессию.Действительно, в кишечнике стерильных животных отсутствуют пейеровы пятна и снижена экспрессия как антимикробных пептидов, так и иммуноглобулина А (IgA), молекул, участвующих в кишечном иммунитете [31–36]. Примером члена микробиоты, который вносит вклад в развитие иммунной системы, является Bacteroides fragilis , демонстрирующий, что моноколонизация стерильных мышей этой бактерией достаточна для стимулирования развития лимфоцитов CD4T [37]. Точно так же было описано, что сегментированных нитчатых бактерий достаточно для дифференциации клеток CD4T в клетки Th27, что важно для защиты от кишечного патогена C.rodentium [38–41].
Микробиота кишечника также является неисчерпаемым источником лигандов для врожденной иммунной системы. Лечение антибиотиками является достаточным для повышения восприимчивости мышей к колиту, опосредованному декстрансульфатом натрия (DSS) — феномену, который может быть устранен введением лигандов Toll-подобных рецепторов [42]. Такое открытие положило начало концепции, согласно которой передача сигналов рецептора распознавания образов, исходящая от кишечной микробиоты, необходима для устойчивой защиты кишечника [42,43].Это также было проиллюстрировано открытием того факта, что бактериальный флагеллин из кишечной микробиоты способен предотвращать и лечить ротавирусную инфекцию с помощью механизма, требующего рецепторов флагеллина Toll-подобного рецептора 5 (TLR5) и NOD-подобного рецептора C4 (NLRC4) и с участием интерлейкинов. 22 и продукция интерлейкина-18 [44]. Бактерии, принадлежащие к кластеру XIVa группы Clostridium , способны индуцировать развитие противовоспалительных Т-регуляторных клеток [45], а SCFAs, происходящие из кишечной микробиоты, играют центральную роль в поддержании баланса воспалительных и противовоспалительных Т-клеток. подмножества [46–49].Важно отметить, что некоторые лиганды TLR, такие как LPS, модифицируются хозяином, чтобы быть менее биологически активными, что указывает на существование механизмов детоксикации таких провоспалительных молекул, что позволяет избежать чрезмерной активации кишечной иммунной системы в ответ на комменсал. бактериальная популяция [50–52]. Все эти отчеты являются хорошими примерами роли, которую играет микробиота в созревании кишечной иммунной системы, где кишечная бактериальная популяция может генерировать провоспалительные или противовоспалительные реакции, которые имеют центральное значение для предотвращения чрезмерной активации кишечной иммунной системы. но обеспечивая защиту от кишечных патогенов.
(c) Поддержание кишечного барьера
Другой механизм, с помощью которого кишечная микробиота защищает кишечник от инфекции кишечными патогенами, заключается в воздействии на «силу» кишечного барьера, например толщину и состав слизистого слоя. как поддержание плотных контактов кишечника. Для хозяина действительно изначально важно держать кишечную микробиоту на безопасном расстоянии от кишечного эпителия, чтобы свести к минимуму появление повреждения тканей и воспаления [53].Микробиота кишечника ограничена просветом кишечника слоем слизи, который покрывает эпителий. Лечение мышей антибиотиками уменьшает толщину слоя слизи и приводит к усилению контакта бактерий с монослоем кишечного эпителия, что может быть очень вредным в контексте инфекции кишечного патогена, как показано на примере C. rodentium [54]. Кроме того, кишечная микробиота поддерживает кишечный барьер за счет продукции SCFAs, которые являются основным питательным веществом для эпителия толстой кишки и способствуют контролю продукции муцина [55,56].Таким образом, снижение продукции SCFAs может привести к уменьшению толщины слизи / разрушению слизистого барьера.
3. Когда кишечная микробиота приводит к вирулентности кишечных патогенов
Хотя все описанные выше механизмы являются центральными для защиты кишечника от бактериальной инфекции и патогенов, микробиота также может запускать бактериальную вирулентность. Например, кишечная микробиота может также продуцировать метаболиты, которые могут неожиданно усилить экспрессию патогенов и их колонизацию в кишечнике [57–61] ( a ). Bacteroidetes thetaiotaomicron , приводящий к конкурентному исключению C. rodentium за счет потребления аналогичных углеводов [14], также может отщеплять части сиаловой кислоты от муцина и производить высокие уровни сукцината, что может привести к усиленной колонизации C. difficile [58,59]. Производство фукозы или сукцината из муцина хозяина комменсальными бактериями также может модулировать экспрессию фактора вирулентности ler, главного регулятора локуса генов сглаживания энтероцитов (LEE) в EHEC [60,62], тем самым способствуя вирулентности EHEC. .Другие примеры патогенов, которые используют кишечную микробиоту для облегчения своей собственной инфекции, включают C. difficile , споры которых требуют для прорастания побочных продуктов микробиоты, таких как соли желчных кислот [63], и S . Typhimurium, который использует дигидрид, вырабатываемый микробиотой, для своего роста в просвете [64]. Более того, производимый микробиотой этаноламин используется в качестве источника азота и регулятора генов вирулентности посредством EHEC, S. Typhimurium и Listeria monocytogenes [65–68]. Akkermansia muciniphila , разлагающая муцин комменсальная бактерия, которая находится в слое слизи и может обеспечивать защиту от ожирения и метаболических нарушений [69,70], также способна усугубить воспаление кишечника, вызванное тифимурием S. нарушают гомеостаз слизи хозяина [71].
Патогенетические стратегии преодоления устойчивости к колонизации, опосредованной микробиотой. ( a ) Продукция метаболитов комменсальными бактериями может модулировать рост и экспрессию генов вирулентности кишечными патогенами.( b ) Кишечные патогены могут конкурировать с микробиотой, используя альтернативные питательные вещества и / или ниши. ( c ) Стимуляция кишечного воспаления кишечными патогенами подавляет рост комменсальных бактерий, что дает преимущество кишечным патогенам. ( d ) Кишечные патогены продуцируют токсины, которые могут непосредственно и конкретно воздействовать на комменсалов. EHEC, энтерогеморрагическая Escherichia coli .
4. Когда изменение кишечной микробиоты патогеном приводит к хроническим заболеваниям
Хотя предыдущие примеры иллюстрируют, как кишечная микробиота может способствовать инфицированию кишечными патогенами, некоторые результаты также показали, что изменение кишечной микробиоты патогеном или патобионтом может привести к хроническим заболеваниям. болезни.В качестве примера было показано, что колонизация адгезивно-инвазивной E. coli (AIEC, патоген E. coli , участвующий в патогенезе болезни Крона) во время приобретения микробиоты вызвала хронический колит у мышей, лишенных рецептора флагеллина TLR5 [72 ]. Наблюдение за тем, что такой колит сохраняется далеко за пределами клиренса AIEC, приводит к заключению, что бактерии AIEC вызывают хроническое воспаление, изменяя состав кишечной микробиоты таким образом, что увеличивает ее провоспалительный потенциал [73].Эти данные предполагают, что AIEC и, возможно, другие патобионты могут спровоцировать хроническое воспаление у восприимчивых хозяев, изменяя состав микробиоты кишечника, чтобы придать ей изначально большую способность активировать врожденный иммунитет / экспрессию провоспалительных генов [73], что приводит к понятие патобиома [74]. Точно так же инфекция Yersinia enterolitica мышей, лишенных рецептора TLR1, приводит к изменению состава микробиоты и возникновению антикомменсального иммунитета, что в конечном итоге приводит к развитию хронического воспаления кишечника [75].Таким образом, эти два открытия описывают, что острая инфекция может вызывать долгосрочные изменения иммунной системы и микробиоты, что приводит к хроническому воспалительному заболеванию у генетически предрасположенного хозяина.
5. Как бактериальные патогены высвобождаются из кишечной микробиоты
Как обсуждалось выше, кишечная микробиота играет центральную роль, посредством множества механизмов, в устойчивости к колонизации патогенами. Однако, в свою очередь, патогены выработали стратегии, позволяющие избежать некоторых из этих механизмов ( b — d ).
(a) Использование альтернативных питательных веществ или ниш
Даже если кишечная среда качественно и количественно богата питательными веществами, большое количество бактерий в конечном итоге приводит к конкуренции. Одним из механизмов, с помощью которого кишечные патогены могут конкурировать с микробиотой, является использование особого метаболического репертуара. Этаноламин, который выделяется в кишечник во время обновления эпителиальных клеток, например, используется некоторыми патогенами [76], а гены, участвующие в использовании этаноламина, преимущественно обнаруживаются в геномах кишечных патогенов [77].Возбудитель болезней пищевого происхождения EHEC может использовать галактозу, гексуронат, маннозу и рибозу в качестве источников углерода, в то время как комменсал E. coli не может использовать такие сахара [78,79]. Кроме того, некоторые патогены более эффективно используют общие ресурсы, например железо. Железо необходимо для роста бактерий, и многие бактерии вырабатывают сидерофоры для приобретения трехвалентного железа [80]. В качестве защитного механизма клетки-хозяева секретируют липокалин-2, который способен блокировать сидерофор энтеробактин в E.coli , предотвращая приобретение железа и пролиферацию комменсальной E. coli в кишечнике [81,82]. Однако Salmonella и некоторые патогенные E. coli экспрессируют модифицированные энтеробактины, называемые сальмохелинами, которые устойчивы к липокалину-2, обеспечивая важное преимущество патогенов перед комменсалами [4,81,82]. Патогены также могут находиться в отдельной от микробиоты нише. Патогенная E. coli может, например, локализоваться близко к поверхности эпителия кишечника, обычно лишенной комменсальной микробиоты, за счет экспрессии таких молекул, как интимин, молекула адгезии, кодируемая LEE [14].
Хемотаксис и подвижность, обеспечиваемые жгутиками, позволяют Salmonella идентифицировать и плавать в полезные для питания ниши. Действительно, рецепторы хемотаксиса, принимающие метил, Aer и Tsr, как наблюдали, реагировали in vivo на тетратионат или нитрат, соответственно, чтобы придать преимущество пригодности S. Typhimurium во время воспаления, позволяя бактериям искать благоприятные пространственные условия. ниши, содержащие акцепторы электронов, производные от хозяина, которые ускоряют его рост в просвете [83].Патогенные бактерии также могут получать пользу от воспаления кишечника и / или побочных продуктов воспалительного ответа. Например, активные формы кислорода, продуцируемые нейтрофилами во время воспаления, реагируют с соединениями серы в просвете (тиосульфатом) с образованием нового акцептора респираторных электронов, тетратионата (). В отличие от комменсалов Salmonella содержит оперон ttrSR ttrBCA , который позволяет использовать, обеспечивая преимущество роста Salmonella над комменсальными микробами в воспаленной среде [84].Точно так же нитрат, образующийся как побочный продукт воспалительной реакции, давал преимущество в росте комменсальной бактерии E. coli по сравнению с Firmicutes и Bacteroidetes в толстом кишечнике мышей [85]. Хотя этот механизм чрезмерного роста E. coli в воспаленном кишечнике включает комменсально-комменсальную конкуренцию, патогенные штаммы E. coli , в геноме которых есть гены нитратредуктазы, такие как NarZ , могут использовать аналогичный механизм для приобретения преимущество в росте над конкурентным комменсальным сообществом.
(b) Стимулирование воспаления хозяина
Другой механизм, с помощью которого кишечные патогены приобретают преимущество в росте по сравнению с популяцией комменсалов, заключается в стимулировании воспаления кишечника, которое изменяет выживаемость комменсалов. Действительно, экспрессия факторов вирулентности патогенными бактериями, такими как токсины, приводит к воспалению кишечника, которое, в свою очередь, резко меняет состав и богатство микробиоты кишечника [86]. Например, во время воспаления кишечника рекрутируются нейтрофилы и макрофаги, экспрессирующие индуцибельную синтетазу оксида азота (iNOS), что приводит к повышенной концентрации нитрата в кишечнике, что дает преимущество Enterobacteriaceae по сравнению с облигатными анаэробами, такими как Bacteroidetes или Firmicutes [ 85].Многие патовары E. coli действительно способны использовать нитрат в качестве акцептора электронов, например AIEC, связанный с воспалительным заболеванием кишечника, и могут извлечь выгоду из такого преимущества роста по сравнению с популяцией комменсалов для более эффективной колонизации кишечника [87–90] .
Кроме того, воспалительная среда хозяина может усиливать экспрессию факторов вирулентности, способствуя росту патогенных бактерий в тканях хозяина. Например, интерферон-β увеличивал экспрессию лектина типа I на Pseudomonas aeruginosa , обеспечивая адгезию бактерий к эпителиальным клеткам легких [91].Следовательно, воспалительная среда кишечника может также способствовать экспрессии фактора вирулентности кишечными бактериями.
(c) Производство токсинов
Патогены способны продуцировать ингибирующие вещества / токсины, которые могут напрямую воздействовать на микробиоту кишечника. Через свою систему секреции типа VI Vibrio cholerae может доставлять токсичные эффекторы непосредственно в E. coli [92,93]. Кроме того, сообщалось о продукции бактериоцина для штаммов Salmonella [94] и патогенных штаммов Shigella [95–99], но его роль в вирулентности или в качестве механизма вытеснения микробиоты еще не известна.
Принимая во внимание, что бактериоцины играют важную роль в бактериальных взаимоотношениях, весьма вероятно, что они могут способствовать успешной колонизации кишечника патогенными бактериями, воздействуя на определенные комменсалы и, следовательно, изменяя поддержание барьера, изменяя иммунный надзор и / или метаболизм кишечника, способствующий их колонизации. Изучение роли бактериоцинов, продуцируемых патогенными штаммами, на микробиоту и вирулентность, может выявить новые механизмы патогенности и поможет расшифровать сложную взаимосвязь между кишечной микробиотой и некоторыми кишечными патогенами.
6. Заключение и перспективы
В связи с недавним признанием важной роли кишечной микробиоты в здоровье и болезнях, в ряде исследований была подчеркнута ее особая роль в защите от инфекций, вызываемых кишечными патогенами. Здесь важно отметить, что большинство механизмов, представленных в этом обзоре, было обнаружено на животных моделях и / или in vitro работ. Экстраполяцию на ситуацию с человеком следует рассматривать с осторожностью в контексте различных пищевых привычек, архитектуры кишечника, состава микробиоты, окружающей среды, иммунной системы и генетического фона.Однако новые терапевтические подходы могут в конечном итоге выиграть от понимания важной ингибирующей роли кишечной микробиоты в отношении вирулентности патогенов [100], что подтверждается недавним использованием трансплантата фекальной микробиоты для лечения рецидивирующей инфекции C. difficile , которая имеет больше эффективность более 90% по сравнению с 30% при лечении антибиотиками [101]. Целенаправленное манипулирование кишечной микробиотой бактериоцинами и / или другими противомикробными препаратами может стать терапевтическим инструментом для профилактики или лечения заболеваний, связанных с дисбактериозом [102].Основываясь на их очень высокой специфичности (по крайней мере, для некоторых из них), бактериоцины могут представлять собой идеальных кандидатов в отношении воздействия только на нежелательные группы населения. Важно отметить, что уже есть некоторые доказательства концептуальных исследований, таких как использование турицина CD для специфического ингибирования C. difficile в модели дистального отдела толстой кишки [103]. Аналогичным образом, продукция бактериоцина пробиотиком Lactobacillus salivarius UCC118, как было показано, значительно защищает мышей от L.monocytogenes [104]. Более того, недавно было показано, что колонизация кишечника продуцирующим бактериоцин Enteroccocus faecalis приводит к исчезновению устойчивых к ванкомицину энтерококков, укрепляя концепцию, что бактериоцины могут быть эффективным терапевтическим подходом для специфического устранения кишечной колонизации бактериями с множественной устойчивостью без глубокое нарушение комменсальной популяции [104]. Однако при выявлении или выборе бактериоцина в качестве терапевтического подхода следует принимать во внимание предполагаемое широкое воздействие на микробиоту кишечника, даже если оно менее сильное, чем использование антибиотиков.Например, было обнаружено, что CD турицина сильно ингибирует Lactobacillus fermentum [18].
Кроме того, фаговая терапия потенциально может иметь положительное влияние на микробиоту человека и связанное с ним здоровье хозяина [105]. Бактериофаги — это вирусные частицы, которые естественным образом инфицируют бактерии с высокой специфичностью, и фаговая терапия заключается в использовании этих бактериофагов в качестве противомикробных агентов [106,107]. Некоторые группы в настоящее время исследуют их пригодность в качестве терапевтической стратегии против некоторых кишечных патогенов, например против AIEC, связанного с воспалительным заболеванием кишечника [108].
Наконец, бактерии (как непатогенные, так и патогенные) синтезируют небольшие диффузные сигнальные молекулы, называемые аутоиндукторами, чтобы они скоординированно контролировали экспрессию генов всего сообщества в ответ на изменения плотности клеток [109]. Этот процесс, называемый зондированием кворума, может быть универсальным или высокоспецифичным, позволяя бактериям общаться внутри и между видами. Следовательно, определение кворума может иметь большое влияние на состав микробных сообществ, а также участвует в регуляции экспрессии генов вирулентности многими патогенными бактериями [110].Следовательно, идентификация химических сигналов, рецепторов и генов-мишеней будет иметь важное значение для нашего понимания того, как взаимодействие бактерий и бактерий может быть использовано для предотвращения колонизации патогенными бактериями [100].
Необходимы дополнительные исследования для расшифровки сложной взаимосвязи между кишечной микробиотой и патогенными бактериями, которые в конечном итоге помогут определить и, возможно, спроектировать «здоровый» микробиом.
Благодарности
Эта статья посвящена нашему уважаемому наставнику, Арлетт Дарфей-Мишо, которая положила начало нашей научной карьере.Мы благодарны Эндрю Гевирцу и Паскалю Коссарту за критическую рецензию рукописи.
Вклад авторов
Н.Р. и B.C. написал рукопись.
Конкурирующие интересы
У нас нет конкурирующих интересов.
Финансирование
до н.э. является лауреатом премии за развитие карьеры Американского фонда Крона и колита (CCFA).
Список литературы
1. Round JL, Mazmanian SK.
2009 г.
Микробиота кишечника формирует иммунные реакции кишечника во время здоровья и болезни.Nat. Rev. Immunol.
9, 313–323. (10.1038 / nri2515) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 2. Флинт HJ, Скотт КП, Луи П., Дункан Ш.
2012 г.
Роль микробиоты кишечника в питании и здоровье. Nat. Преподобный Гастроэнтерол. Гепатол.
9, 577–589. (10.1038 / nrgastro.2012.156) [PubMed] [CrossRef] [Google Scholar] 5. Чоу Дж, Тан Х, Мазманян СК.
2011 г.
Патобионты микробиоты желудочно-кишечного тракта и воспалительных заболеваний. Curr. Opin. Иммунол.
23, 473–480. (10.1016 / j.coi.2011.07.010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6.Дюклузо Р., Рейльбо П.
1989 г.
Бактериальные взаимодействия в пищеварительном тракте. Rev. Sci. Tech. Выключенный. Int. Epiz. 8, 313–332. (10.20506 / rst.8.2.410) [CrossRef] [Google Scholar] 7. Териот CM, Янг В.Б.
2015 г.
Взаимодействие между микробиомом желудочно-кишечного тракта и Clostridium difficile . Анну. Rev. Microbiol.
69, 445–461. (10.1146 / annurev-micro-0-104115) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Осава Н., Мицухаси С.
1964 г.
Заражение мышей-нематод Shigella Flexneri 3a.Jpn. J. Exp. Med.
34, 77–80. [PubMed] [Google Scholar] 9. Фукуда С., То Х, Тейлор Т. Д., Оно Х, Хаттори М.
2012 г.
Бифидобактерии, продуцирующие ацетат, защищают хозяина от энтеропатогенной инфекции через переносчики углеводов. Кишечные микробы
3, 449–454. (10.4161 / gmic.21214) [PubMed] [CrossRef] [Google Scholar] 10. Fukuda S, et al.
2011 г.
Бифидобактерии могут защитить от энтеропатогенной инфекции за счет выработки ацетата. Природа
469, 543–547. (10.1038 / nature09646) [PubMed] [CrossRef] [Google Scholar] 11.Бонхофф М, Дрейк Б.Л., Миллер С.П.
1954 г.
Влияние стрептомицина на восприимчивость кишечного тракта к экспериментальной сальмонеллезной инфекции. Proc. Soc. Exp. Биол. Med.
86, 132–137. (10.3181 / 00379727-86-21030) [PubMed] [CrossRef] [Google Scholar] 12. Лоули Т.Д. и др.
2009 г.
Лечение антибиотиками мышей-носителей Clostridium difficile вызывает состояние суперседдера, опосредованную спорами передачу и тяжелое заболевание у хозяев с ослабленным иммунитетом. Заразить. Иммун.
77, 3661–3669. (10.1128 / IAI.00558-09) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14.Камада Н, Ким Ю.Г., Шам ХП, Валланс Б.А., Пуэнте Дж.Л., Мартенс Э.С., Нуньес Г.
2012 г.
Регулируемая вирулентность контролирует способность патогена конкурировать с кишечной микробиотой. Наука
336, 1325–1329. (10.1126 / science.1222195) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15. Gantois I, Ducatelle R, Pasmans F, Haesebrouck F, Hautefort I, Thompson A, Hinton JC, Van Immerseel F.
2006 г.
Бутират специфически подавляет экспрессию гена острова 1 патогенности Salmonella . Прил. Environ.Microbiol.
72, 946–949. (10.1128 / AEM.72.1.946-949.2006) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Шин Р., Сузуки М., Моришита Ю.
2002 г.
Влияние кишечных анаэробов и органических кислот на рост энтерогеморрагической инфекции Escherichia coli O157: H7. J. Med. Microbiol.
51, 201–206. (10.1099 / 0022-1317-51-3-201) [PubMed] [CrossRef] [Google Scholar] 17. Kommineni S, et al.
2015 г.
Продукция бактериоцина усиливает нишевую конкуренцию энтерококков в желудочно-кишечном тракте млекопитающих.Природа
526, 719–722. (10.1038 / nature15524) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 18. Rea MC, Sit CS, Clayton E, O’Connor PM, Whittal RM, Zheng J, Vederas JC, Ross RP, Hill C.
2010 г.
Турицин CD, посттрансляционно модифицированный бактериоцин с узким спектром активности против Clostridium difficile . Proc. Natl Acad. Sci. США
107, 9352–9357. (10.1073 / pnas.0
4107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 19. Шамбергер Г.П., Диез-Гонсалес Ф.
2002 г.Отбор недавно выделенных колициногенных штаммов Escherichia coli , ингибирующих Escherichia coli O157: H7. J. Food Prot.
65, 1381–1387. [PubMed] [Google Scholar] 20. Пинто А.Л., Фернандес М., Пинто С., Альбано Х., Кастильо Ф., Тейшейра П., Гиббс П.А.
2009 г.
Характеристика бактериоцинов против Listeria , выделенных из моллюсков: потенциальные противомикробные средства для контроля неферментированных морепродуктов. Int. J. Food Microbiol.
129, 50–58. (10.1016 / j.ijfoodmicro.2008.11.005) [PubMed] [CrossRef] [Google Scholar] 21.Чанос П., Уильямс ДР.
2011 г.
Anti- Listeria Бактерии, продуцирующие бактериоцин, из сырого овечьего молока в северной Греции. J. Appl. Microbiol.
110, 757–768. (10.1111 / j.1365-2672.2010.04932.x) [PubMed] [CrossRef] [Google Scholar] 22. Дония М.С., Цимерманчич П., Шульце С.Дж., Виланд Браун Л.С., Мартин Дж., Митрева М., Кларди Дж., Линингтон Р.Г., Фишбах М.А.
2014 г.
Систематический анализ кластеров биосинтетических генов в микробиоме человека показывает общее семейство антибиотиков. Клетка
158, 1402–1414. (10.1016 / j.cell.2014.08.032) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Уолш CJ, Guinane CM, Hill C, Росс RP, O’Toole PW, Коттер PD.
2015 г.
Идентификация in silico кластеров генов бактериоцина в желудочно-кишечном тракте на основе базы данных эталонных геномов проекта Human Microbiome Project. BMC Microbiol.
15, 183 (10.1186 / s12866-015-0515-4) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 25. Chassaing B, Koren O, Goodrich JK, Poole AC, Srinivasan S, Ley RE, Gewirtz AT.
2015 г.Пищевые эмульгаторы воздействуют на микробиоту кишечника мышей, вызывая колит и метаболический синдром. Природа
519, 92–96. (10.1038 / nature14232) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 26. Териот CM, Боуман А.А., Янг В.Б.
2016 г.
Вызванные антибиотиками изменения микробиоты кишечника изменяют вторичную продукцию желчных кислот и позволяют спорам Clostridium difficile прорастать и разрастаться в толстом кишечнике. мСфера
1, e00045-15. (10.1128 / mSphere.00045-15) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 27.Бриттон Р.А., Янг В.Б.
2014 г.
Роль кишечной микробиоты в устойчивости к колонизации Clostridium difficile . Гастроэнтерология
146, 1547–1553. (10.1053 / j.gastro.2014.01.059) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 28. Sorg JA, Sonenshein AL.
2010 г.
Подавление инициации прорастания спор Clostridium difficile с использованием аналогов хенодезоксихолевой кислоты, желчной кислоты. J. Bacteriol.
192, 4983–4990. (10.1128 / JB.00610-10) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 29.Buffie CG, et al.
2015 г.
Прецизионное восстановление микробиома восстанавливает опосредованную желчной кислотой устойчивость к Clostridium difficile . Природа
517, 205–208. (10.1038 / nature13828) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 30. Weingarden AR, Chen C, Bobr A, Yao D, Lu Y, Nelson VM, Sadowsky MJ, Khoruts A.
2014 г.
Трансплантация микробиоты восстанавливает нормальный состав фекальных желчных кислот при рецидивирующей инфекции Clostridium difficile . Являюсь. J. Physiol. Гастроинтест. Liver Physiol.306, G310 – G319. (10.1152 / ajpgi.00282.2013) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 31. Карлссон Дж., Пуцеп К., Чу Х., Кейс Р.Дж., Бевинс К.Л., Андерссон М.
2008 г.
Региональные вариации экспрессии антимикробного пептида клеток Панета в кишечном тракте мышей. BMC Immunol.
9, 37 (10.1186 / 1471-2172-9-37) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 32. Риос Д., Вуд М.Б., Ли Дж., Чассен Б., Гевиртц А.Т., Уильямс И.Р.
2015 г.
Отбор образцов антигена кишечными М-клетками является основным путем, инициирующим продукцию IgA слизистой оболочки для комменсальных кишечных бактерий.Mucosal Immunol. 9, 907–916. (10.1038 / mi.2015.121) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 33. Bevins CL, Salzman NH.
2011 г.
Клетки Панета, антимикробные пептиды и поддержание гомеостаза кишечника. Nat. Rev. Microbiol.
9, 356–368. (10.1038 / nrmicro2546) [PubMed] [CrossRef] [Google Scholar] 34. Cash HL, Whitham CV, Behrendt CL, Hooper LV.
2006 г.
Симбиотические бактерии направляют экспрессию кишечного бактерицидного лектина. Наука
313, 1126–1130. (10.1126 / science.1127119) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 35.Fransen F, et al.
2015 г.
Мыши BALB / c и C57BL / 6 различаются по содержанию полиреактивного IgA, что влияет на образование антиген-специфических IgA и разнообразие микробиоты. Иммунитет
43, 527–540. (10.1016 / j.immuni.2015.08.011) [PubMed] [CrossRef] [Google Scholar] 37. Мазманян СК, Лю СН, Цианабос А.О., Каспер ДЛ.
2005 г.
Иммуномодулирующая молекула симбиотических бактерий направляет созревание иммунной системы хозяина. Клетка
122, 107–118. (10.1016 / j.cell.2005.05.007) [PubMed] [CrossRef] [Google Scholar] 38. Иванов И.И., Фрутос Р.Д., Манель Н., Йошинага К., Рифкин Д.Б., Сартор РБ, Финлей Б.Б., Литтман Д.Р.2008 г.
Специфическая микробиота направляет дифференцировку Т-хелперных клеток, продуцирующих ИЛ-17, в слизистой оболочке тонкой кишки. Клеточный микроб-хозяин
4, 337–349. (10.1016 / j.chom.2008.09.009) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 40. Gaboriau-Routhiau V, et al.
2009 г.
Ключевая роль сегментированных нитчатых бактерий в скоординированном созревании ответов Т-хелперных клеток кишечника. Иммунитет
31, 677–689. (10.1016 / j.immuni.2009.08.020) [PubMed] [CrossRef] [Google Scholar] 41. Lecuyer E, et al.2014 г.
Сегментированные нитчатые бактерии используют вторичные и третичные лимфоидные ткани для индукции ответа кишечных IgA и специфических Т-хелперных 17 клеток. Иммунитет
40, 608–620. (10.1016 / j.immuni.2014.03.009) [PubMed] [CrossRef] [Google Scholar] 42. Ракофф-Нахум С., Паглино Дж., Эслами-Варзане Ф., Эдберг С., Меджитов Р.
2004 г.
Распознавание комменсальной микрофлоры толл-подобными рецепторами необходимо для гомеостаза кишечника. Клетка
118, 229–241. (10.1016 / j.cell.2004.07.002) [PubMed] [CrossRef] [Google Scholar] 43.Араки А. и др.
2005 г.
У мышей с дефицитом MyD88 развивается тяжелое воспаление кишечника при колите, вызванном декстрановым сульфатом натрия. J. Gastroenterol.
40, 16–23. (10.1007 / s00535-004-1492-9) [PubMed] [CrossRef] [Google Scholar] 44. Чжан Б. и др.
2014 г.
Вирусная инфекция. Профилактика и лечение ротавирусной инфекции посредством TLR5 / NLRC4-опосредованной продукции IL-22 и IL-18. Наука
346, 861–865. (10.1126 / science.1256999) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Атараши К. и др.
2013.
Индукция Treg рационально подобранной смесью штаммов Clostridia из микробиоты человека.Природа
500, 232–236. (10.1038 / nature12331) [PubMed] [CrossRef] [Google Scholar] 47. Ким СН, Пак Дж., Ким М.
2014 г.
Короткоцепочечные жирные кислоты кишечной микробиоты, Т-клетки и воспаление. Иммунная сеть
14, 277–288. (10.4110 / in.2014.14.6.277) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 48. Furusawa Y, et al.
2013.
Бутират комменсального микроба индуцирует дифференцировку регуляторных Т-клеток толстой кишки. Природа
504, 446–450. (10.1038 / nature12721) [PubMed] [CrossRef] [Google Scholar] 49.Смит П.М., Ховитт М.Р., Паников Н., Мишо М., Галлини К.А., Бохлули Ю.М., Гликман Дж. Н., Гарретт В.С.
2013.
Микробные метаболиты, короткоцепочечные жирные кислоты, регулируют гомеостаз Treg-клеток толстой кишки. Наука
341, 569–573. (10.1126 / science.1241165) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 50. Бейтс Дж. М., Акерлунд Дж., Миттдж Э., Гийемин К.
2007 г.
Щелочная фосфатаза кишечника выводит токсины из липополисахаридов и предотвращает воспаление у рыбок данио в ответ на кишечную микробиоту. Клеточный микроб-хозяин
2, 371–382.(10.1016 / j.chom.2007.10.010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Боймер С., Вульферинк М., Раабен В., Фихтер Д., Брэндс Р., Сейнен В.
2003 г.
Щелочная фосфатаза из кишечника теленка, новый терапевтический препарат для лечения заболеваний, опосредованных липополисахаридами (ЛПС), снижает токсичность ЛПС у мышей и поросят. J. Pharmacol. Exp. Ther.
307, 737–744. (10.1124 / jpet.103.056606) [PubMed] [CrossRef] [Google Scholar] 52. Кояма И., Мацунага Т., Харада Т., Хокари С., Комода Т.
2002 г.
Щелочные фосфатазы снижают токсичность липополисахаридов in vivo и in vitro посредством дефосфорилирования.Clin. Биохим.
35, 455–461. (10.1016 / S0009-9120 (02) 00330-2) [PubMed] [CrossRef] [Google Scholar] 53. Chassaing B, Gewirtz AT.
2016 г.
Спровоцировала ли агрессия микробиоты развитие эпидемии ожирения?
Биологические исследования
38, 122–128. (10.1002 / bies.201500116) [PubMed] [CrossRef] [Google Scholar] 54. Влодарска М., Уиллинг Б., Кини К.М., Менендес А., Бергстром К.С., Гилл Н., Рассел С.Л., Валланс Б.А., Финли Б.Б.
2011 г.
Лечение антибиотиками изменяет слой слизи толстой кишки и предрасполагает хозяина к обострению колита, вызванного Citrobacter rodentium .Заразить. Иммун.
79, 1536–1545. (10.1128 / IAI.01104-10) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 55. Виллемсен Л.Е., Кетсиер М.А., ван Девентер С.Дж., ван Тол Е.А.
2003 г.
Короткоцепочечные жирные кислоты стимулируют экспрессию муцина 2 в эпителии за счет различных эффектов на продукцию простагландинов E (1) и E (2) кишечными миофибробластами. Кишечник
52, 1442–1447. (10.1136 / gut.52.10.1442) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 56. Симотоёдомэ А, Мегуро С., Хасэ Т, Токимицу И, Саката Т.2000 г.
Короткоцепочечные жирные кислоты, но не лактат или сукцинат, стимулируют выделение слизи в толстой кишке крысы. Комп. Биохим. Physiol. Мол. Интегр. Physiol.
125, 525–531. (10.1016 / S1095-6433 (00) 00183-5) [PubMed] [CrossRef] [Google Scholar] 57. Камерон Э.А., Сперандио В.
2015 г.
Заклятые враги: сигнализация и интеграция питания во взаимодействиях патоген-микробиота-хозяин. Клеточный микроб-хозяин
18, 275–284. (10.1016 / j.chom.2015.08.007) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Феррейра Дж. А., Ву К. Дж., Грицковиан А. Дж., Були Д. М., Веймер Британская Колумбия, Зонненбург Дж. Л..2014 г.
Сукцинат, продуцируемый кишечной микробиотой, способствует инфицированию C. difficile после лечения антибиотиками или нарушения моторики. Клеточный микроб-хозяин
16, 770–777. (10.1016 / j.chom.2014.11.003) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 60. Кертис М.М., Ху З., Климко С., Нараянан С., Деберардинис Р., Сперандио В.
2014 г.
Комменсал кишечника Bacteroides thetaiotaomicron обостряет кишечную инфекцию за счет изменения метаболического ландшафта. Клеточный микроб-хозяин
16, 759–769.(10.1016 / j.chom.2014.11.005) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 61. Pham NT, Lawley TD.
2014 г.
Использование патогенами пищевой сети кишечника. Клеточный микроб-хозяин
16, 703–705. (10.1016 / j.chom.2014.11.012) [PubMed] [CrossRef] [Google Scholar] 62. Пачеко А.Р., Кертис М.М., Ричи Дж.М., Мунера Д., Уолдор М.К., Морейра К.Г., Сперандио В.
2012 г.
Чувствительность к фукозе регулирует бактериальную колонизацию кишечника. Природа
492, 113–117. (10.1038 / nature11623) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 63.Гиль Дж. Л., Сорг Дж. А., Соненшейн А. Л., Чжу Дж.
2010 г.
Метаболизм солей желчных кислот у мышей влияет на прорастание спор Clostridium difficile . PLoS ONE
5, e8740 (10.1371 / journal.pone.0008740) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 64. Майер Л., Бартель М., Стечер Б., Майер Р. Дж., Ганн Дж. С., Хардт В. Д..
2014 г.
Salmonella Штамм Typhimurium ATCC14028 требует h3-гидрогеназ для роста в кишечнике, но не в системных участках. PLoS ONE
9, e110187 (10.1371 / journal.pone.0110187) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 65.Bertin Y, Girardeau JP, Chaucheyras-Durand F, Lyan B, Pujos-Guillot E, Harel J, Martin C.
2011 г.
Энтерогеморрагический Escherichia coli получает конкурентное преимущество за счет использования этаноламина в качестве источника азота в содержимом кишечника крупного рогатого скота. Environ. Microbiol.
13, 365–377. (10.1111 / j.1462-2920.2010.02334.x) [PubMed] [CrossRef] [Google Scholar] 66. Кендалл М.М., Грубер С.К., Паркер К.Т., Сперандио В.
2012 г.
Этаноламин контролирует экспрессию генов, кодирующих компоненты, участвующие в межцерковной передаче сигналов и вирулентности в энтерогеморрагической Escherichia coli O157: H7.мБио
3, е00050-12. (10.1128 / mBio.00050-12) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 67. Thiennimitr P, et al.
2011 г.
Воспаление кишечника позволяет Salmonella использовать этаноламин для конкуренции с микробиотой. Proc. Natl Acad. Sci. США
108, 17 480–17 485. (10.1073 / pnas.1107857108) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 68. Joseph B, Przybilla K, Stuhler C, Schauer K, Slaghuis J, Fuchs TM, Goebel W.
2006 г.
Идентификация генов Listeria monocytogenes , участвующих во внутриклеточной репликации, путем профилирования экспрессии и скрининга мутантов.J. Bacteriol.
188, 556–568. (10.1128 / JB.188.2.556-568.2006) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 69. Эверард А. и др.
2013.
Перекрестное взаимодействие между Akkermansia muciniphila и кишечным эпителием контролирует ожирение, вызванное диетой. Proc. Natl Acad. Sci. США
110, 9066–9071. (10.1073 / pnas.1219451110) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 70. Schneeberger M, Everard A, Gomez-Valades AG, Matamoros S, Ramirez S, Delzenne NM, Gomis R, Claret M, Cani PD.
2015 г. Akkermansia muciniphila обратно коррелирует с началом воспаления, изменением метаболизма жировой ткани и метаболическими нарушениями во время ожирения у мышей. Sci. Rep.
5, 16643 (10.1038 / srep16643) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 71. Ганеш Б.П., Клопфляйш Р., Лох Г., Блаут М.
2013.
Commensal Akkermansia muciniphila обостряет воспаление кишечника у Salmonella Typhimurium-инфицированных гнотобиотических мышей. PLoS ONE
8, e74963 (10.1371 / journal.pone.0074963) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 72. Карвалью Ф.А. и др.
2012 г.
Временная неспособность управлять протеобактериями способствует хроническому воспалению кишечника у мышей с дефицитом TLR5. Клеточный микроб-хозяин
12, 139–152. (10.1016 / j.chom.2012.07.004) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 73. Chassaing B, Корен O, Карвалью FA, Ley RE, Gewirtz AT.
2014 г.
Патобионт AIEC вызывает хронический колит у восприимчивых хозяев, изменяя состав микробиоты. Кишечник
63, 1069–1080.(10.1136 / gutjnl-2013-304909) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 74. Vayssier-Taussat M, et al.
2014 г.
Сдвиг парадигмы с патогенов на патобиом: новые концепции в свете мета-омики. Фронт. Cell Infect. Microbiol.
4, 29 (10.3389 / fcimb.2014.00029) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 75. Камдар К. и др.
2016 г.
Генетические и метаболические сигналы во время острой кишечной бактериальной инфекции изменяют микробиоту и приводят к развитию хронического воспалительного заболевания.Клеточный микроб-хозяин
19, 21–31. (10.1016 / j.chom.2015.12.006) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 77. Корбель Дж.О., Дёркс Т., Йенсен Л.Дж., Перес-Иратхета К., Качановски С., Хупер С.Д., Андраде М.А., Борк П.
2005 г.
Систематическая ассоциация генов с фенотипами путем анализа генома и литературы. PLoS Biol.
3, e134 (10.1371 / journal.pbio.0030134) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 78. Fabich AJ, et al.
2008 г.
Сравнение углеродного питания патогенных и комменсальных штаммов Escherichia coli в кишечнике мышей.Заразить. Иммун.
76, 1143–1152. (10.1128 / IAI.01386-07) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 79. Ле Бугенек К., Шулер К.
2011 г.
Обмен сахара, дополнительный фактор вирулентности энтеробактерий. Int. J. Med. Microbiol.
301, 1–6. (10.1016 / j.ijmm.2010.04.021) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 80. Саха Р., Саха Н., Донофрио Р.С., Бестервельт LL.
2013.
Микробные сидерофоры: мини-обзор. J. Basic Microbiol.
53, 303–317. (10.1002 / jobm.201100552) [PubMed] [CrossRef] [Google Scholar] 81.Фишбах М.А., Линь Х., Лю Д.Р., Уолш К.Т.
2006 г.
Как патогенные бактерии избегают саботажа млекопитающих в битве за железо. Nat. Chem. Биол.
2, 132–138. (10.1038 / nchembio771) [PubMed] [CrossRef] [Google Scholar] 82. Сингх В., Йео Б.С., Сяо Икс, Кумар М., Бахман М., Боррегаард Н., Джо Б., Виджай-Кумар М.
2015 г.
Взаимодействие между энтеробактином, миелопероксидазой и липокалином 2 регулирует выживание E. coli в воспаленном кишечнике. Nat. Commun.
6, 7113 (10.1038 / ncomms8113) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 86.Лупп С., Робертсон М.Л., Викхэм М.Э., Секиров И., Чемпион О.Л., Гейнор Е.К., Финли ББ.
2007 г.
Опосредованное хозяином воспаление нарушает микробиоту кишечника и способствует чрезмерному росту энтеробактерий. Клеточный микроб-хозяин
2, 204 (10.1016 / j.chom.2007.08.002) [PubMed] [CrossRef] [Google Scholar] 87. Darfeuille-Michaud A, et al.
2004 г.
Высокая распространенность адгезивно-инвазивной инфекции Escherichia coli , связанной со слизистой оболочкой подвздошной кишки, при болезни Крона. Гастроэнтерология
127, 412–421. (10.1053 / j.gastro.2004.04.061) [PubMed] [CrossRef] [Google Scholar] 88. Шассен Б., Дарфёй-Мишо А.
2011 г.
Комменсальная микробиота и энтеропатогены в патогенезе воспалительных заболеваний кишечника. Гастроэнтерология
140, 1720–1728. (10.1053 / j.gastro.2011.01.054) [PubMed] [CrossRef] [Google Scholar] 89. Нэш Дж. Х. и др.
2010 г.
Последовательность генома адгезивно-инвазивной Escherichia coli и сравнительный геномный анализ с другими патотипами E. coli . BMC Genomics
11, 667 (10.1186 / 1471-2164-11-667) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 90.Miquel S, et al.
2010 г.
Полная последовательность генома ассоциированного с болезнью Крона адгезивно-инвазивного штамма E. coli LF82. PLoS ONE
5, e12714 (10.1371 / journal.pone.0012714) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 91. Wu L, et al.
2005 г.
Распознавание активации иммунной системы хозяина с помощью Pseudomonas aeruginosa . Наука
309, 774–777. (10.1126 / science.1112422) [PubMed] [CrossRef] [Google Scholar] 92. Унтервегер Д., Мията С.Т., Бахманн В., Брукс Т.М., Маллинс Т., Костюк Б., Провенцано Д., Пукацки С.2014 г.
Система секреции Vibrio cholerae типа VI использует различные эффекторные модули для внутривидовой конкуренции. Nat. Commun.
5, 3549 (10.1038 / ncomms4549) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 93. Макинтайр Д.Л., Мията СТ, Китаока М., Пукацки С.
2010 г.
Система секреции Vibrio cholerae типа VI проявляет антимикробные свойства. Proc. Natl Acad. Sci. США
107, 19 520–19 524. (10.1073 / pnas.1012931107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 94.Патанкар CV, Джоши Л.М.
1985 г.
Производство бактериоцина Salmonella . J. Postgrad. Med.
31, 46–51. [PubMed] [Google Scholar] 95. Соуза М.А., Мендес Э.Н., Аполлонио А.С., Фариас Лде М., Магалхаес П.П.
2010 г.
Продукция бактериоцина Shigella sonnei , выделенная из фекалий детей с острой диареей. APMIS
118, 125–135. (10.1111 / j.1600-0463.2009.02570.x) [PubMed] [CrossRef] [Google Scholar] 96. Горак В.
1994 г.
Семьдесят типов колицина Shigella sonnei и индикаторная система для их определения.Zentralbl. Бактериол.
281, 24–29. (10.1016 / S0934-8840 (11) 80633-X) [PubMed] [CrossRef] [Google Scholar] 97. Kaewklom S, Samosornsuk S, Pipatsatitpong D, Aunpad R.
2013.
Колицин типа 7 продуцируется большинством из Shigella sonnei , выделенных от тайских пациентов с диареей. Braz. J. Microbiol.
44, 731–736. (10.1590 / S1517-83822013000300010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 99. Падилья К., Лобос О., Бревис П., Абака П., Хуберт Э.
2006 г.
Опосредованная плазмидой продукция бактериоцина Shigella flexneri , выделенная из дизентерийной диареи, и их трансформация в Escherichia coli .Lett. Прил. Microbiol.
42, 300–303. (10.1111 / j.1472-765X.2005.01829.x) [PubMed] [CrossRef] [Google Scholar] 100. Белисарио Дж. Э., Наполитано М.
2015 г.
Микробиомы человека и их роль в дисбактериозе, распространенных заболеваниях и новых терапевтических подходах. Фронт. Microbiol.
6, 1050 (10.3389 / fmicb.2015.01050) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 101. van Nood E, et al.
2013.
Дуоденальная инфузия донорских фекалий при рецидиве Clostridium difficile . N. Engl. J. Med.
368, 407–415.(10.1056 / NEJMoa1205037) [PubMed] [CrossRef] [Google Scholar] 102. Коттер П.Д., Росс Р.П., Хилл К.
2013.
Бактериоцины — жизнеспособная альтернатива антибиотикам?
Nat. Rev. Microbiol.
11, 95–105. (10.1038 / nrmicro2937) [PubMed] [CrossRef] [Google Scholar] 103. Rea MC, et al.
2011 г.
Влияние противомикробных препаратов широкого и узкого спектра действия на Clostridium difficile и микробное разнообразие в модели дистального отдела толстой кишки. Proc. Natl Acad. Sci. США
108 (Дополнение 1), 4639–4644. (10.1073 / pnas.1001224107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 104.Корр С.К., Ли И, Ридель К.Ю., О’Тул П.В., Хилл С., Гахан К.Г.
2007 г.
Продукция бактериоцина как механизм противоинфекционной активности Lactobacillus salivarius UCC118. Proc. Natl Acad. Sci. США
104, 7617–7621. (10.1073 / pnas.0700440104) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
108. Цуй Дж., Джейкобс Дж., Браун Дж.
2014 г.
Бактериофаги как терапевтическая стратегия для нацеливания на прилипшую, инвазивную Escherichia coli , связанную с воспалительным заболеванием кишечника. Национальная конференция SACNAS, 16–18 октября, Лос-Анджелес, Калифорния .
109. Шаудер С, Басслер БЛ.
2001 г.
Языки бактерий. Genes Dev.
15, 1468–1480. (10.1101 / gad.899601) [PubMed] [CrossRef] [Google Scholar] 110. Резерфорд С.Т., Басслер Б.Л.
2012 г.
Определение бактериального кворума: его роль в вирулентности и возможности борьбы с ней. Харб Холодного источника. Перспектива. Med.
2, a012427 (10.1101 / cshperspect.a012427) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Когда патогенные бактерии встречаются с кишечной микробиотой
Philos Trans R Soc Lond B Biol Sci.2016 5 ноября; 371 (1707): 20150504.
Натали Ролион
1 Institut Pasteur, Unité des Interactions Bactéries-Cellules, 75015 Paris, France
2 Inserm, U604, 75015 Paris, France
, 3 INRA Unité sous contrat 2020, 75015 Paris, France
Benoit Chassaing
4 Институт биомедицинских наук, Центр воспаления, иммунитета и инфекции, Университет штата Джорджия, Атланта, Джорджия 30303, США
1 Institut Pasteur, Unité des Interactions Bactéries-Cellules, 75015 Paris, France
2 Inserm, U604, 75015 Paris, France
3 INRA, Unité sous contrat 2020, 75015 Paris, France
4 Институт биомедицинских наук, Центр воспаления, иммунитета и инфекций, Государственный университет Джорджии, Атланта, Джорджия 30303, США
Опубликовано Королевским обществом.Все права защищены.
Эта статья цитируется в других статьях в PMC.
Abstract
Кишечная микробиота — это большое и разнообразное микробное сообщество, обитающее в кишечном тракте, содержащее около 100 триллионов бактерий 500–1000 различных видов, которые в совокупности обеспечивают хозяину множество преимуществ. Микробиота кишечника способствует усвоению питательных веществ и созреванию иммунной системы, а также играет центральную роль в защите хозяина от кишечной бактериальной инфекции.С другой стороны, многие кишечные патогены разработали стратегии, позволяющие преодолеть конкуренцию кишечному сообществу, что приводит к инфекции и / или хроническим заболеваниям. В этом обзоре будут обобщены результаты, описывающие сложную взаимосвязь между кишечной микробиотой и кишечными патогенами, а также то, как будущие методы лечения могут в конечном итоге извлечь выгоду из таких открытий.
Эта статья является частью тематического выпуска «Новая бактериология».
Ключевые слова: кишечная микробиота, воспаление, нутриент, патогенные бактерии, вирулентность
1.Введение
Кишечная микробиота — это собирательный термин, описывающий большое и разнообразное микробное сообщество, населяющее наш кишечник. Микробиота человека содержит около 100 триллионов бактерий 500–1000 различных видов, которые обеспечивают хозяину множество преимуществ. Среди этих полезных функций кишечная микробиота играет центральную роль в (i) формировании иммунной системы кишечника [1], способствуя развитию и созреванию иммунной системы, и (ii) приобретению питательных веществ, значительно увеличивая метаболические возможности кишечника, таким образом обеспечивая хозяина ряд необходимых питательных веществ [2].Другим важным преимуществом кишечной микробиоты для кишечника хозяина является защита от колонизации экзогенными патогенами — феномена, ныне называемого резистентностью к колонизации, — и от чрезмерного роста местных патобионтов (потенциальных патогенных симбионтов микробиоты) [3–5]. Устойчивость к колонизации, названная «микробным барьером» в начале 1980-х годов [6], представляет собой механизм, посредством которого кишечные бактерии образуют барьер для предотвращения вторжения новых бактерий других видов или других штаммов того же вида.Это понятие хорошо иллюстрируется рядом инфекций, возникающих в результате использования антибиотиков, таких как инфекция Clostridium difficile [7], а также наблюдением, что многие кишечные патогены вызывают более сильное заболевание у мышей в условиях отсутствия микробов (в отсутствие кишечной микробиоты) или после лечения антибиотиками [8–12] (). Механизмы, регулирующие способность микробиоты сдерживать рост патогенов, сложны и включают конкурентные метаболические взаимодействия, локализацию в кишечных нишах и индукцию иммунных ответов хозяина [4].Патогены, в свою очередь, разработали стратегии, позволяющие избежать устойчивости к колонизации, создаваемой комменсальным сообществом. Неожиданно кишечная микробиота также может играть роль в обеспечении питательными веществами некоторых кишечных патогенов или может играть прямую роль в активации вирулентности патогенных бактерий, которые в противном случае останутся авирулентными. Кроме того, в некоторых конкретных условиях кишечная микробиота может фактически приводить к заболеванию, как, например, в случае воспалительных заболеваний кишечника.В этом обзоре будут обобщены эти концепции и описаны самые последние результаты, проливающие свет на интригующую взаимосвязь между кишечной микробиотой и кишечными патогенами. Мы обсудим, как понимание взаимодействий микробиоты и патогенов может в конечном итоге привести к новым терапевтическим подходам к лечению инфекционных заболеваний.
Гомеостаз микробиоты / хозяина в кишечнике. ( a ) Кишечная микробиота играет центральную роль в поддержании кишечного барьера (производство слизи и поддержание плотных контактов кишечника) и созревании иммунной системы (развитие лимфоцитов, выработка IgA и антимикробных пептидов).( b ) В отсутствие кишечной микробиоты кишечные патогены могут вызывать повреждение эпителия и потенциально распространяться. AMP, антимикробный пептид; IgA, иммуноглобулин А.
2. Роль кишечной микробиоты в устойчивости к колонизации
Кишечная микробиота играет центральную роль посредством множества механизмов в защите кишечника хозяина от колонизации патогенами (рисунки и).
Устойчивость к колонизации, опосредованная кишечной микробиотой.Примеры опосредованного микробиотой прямого подавления колонизации кишечника кишечными патогенами. Кишечная микробиота предотвращает колонизацию кишечными патогенами, конкурируя за питательные вещества ( a ) или производя ингибирующие вещества, такие как бактериоцин ( b ), вторичные желчные кислоты ( c ) и короткоцепочечные жирные кислоты ( d ). EHEC, энтерогеморрагический , Escherichia coli ; SCFAs, короткоцепочечные жирные кислоты.
(a) Прямое ингибирование колонизации кишечными патогенами
Концепция защиты кишечника хозяина от патогенов с помощью комменсальных бактерий, также называемая устойчивостью к колонизации, была впервые описана как результат прямого подавления, опосредованного микроорганизмами [13].Действительно, многие бактерии напрямую подавляют кишечные патогены, конкурируя за питательные вещества или индуцируя производство ингибирующих веществ. Одним из примеров, подчеркивающих первое, является открытие, что комменсал Bacteroidetes thetaiotaomicron потребляет углеводы, используемые патогеном Citrobacter rodentium , что приводит к конкурентному исключению патогена из кишечника [14] (). Потребляя общие ограниченные ресурсы, микробиота кишечника вызывает голодание конкурирующих патогенов [4].Путем производства определенных метаболитов кишечная микробиота также может изменять условия окружающей среды хозяина, тем самым ставя под угрозу рост патогенов и / или вирулентность. Бутират, короткоцепочечная жирная кислота (SCFA), продуцируемая кишечной микробиотой, может подавлять экспрессию нескольких генов вирулентности Salmonella enterica серовара Enteritidis ( S. Enteritidis) и Typhimurium ( S . Typhimurium) [15 ] и было показано, что он подавляет рост энтерогеморрагической Escherichia coli (EHEC) [16].Некоторые штаммы Bifidobacteria также могут защищать от инфекции EHEC за счет продукции ацетата [10].
Сообщество кишечной микробиоты также способно производить большое количество широко биоактивных малых молекул, которые действуют на других членов кишечной микробиоты и / или на кишечные патогены. Бактериоцины, например, представляют собой антимикробные пептиды, которые могут иметь спектр активности от узкого до широкого и могут избирательно убивать и / или подавлять рост конкурирующих бактерий [17].Например, Bacteroides thuringiensis способен секретировать бактериоцин (турицин CD), который непосредственно нацелен на спорообразующие бациллы и клостридии, включая C. difficile [18]. Точно так же некоторые штаммы E. coli способны продуцировать бактериоцин, который может напрямую ингибировать рост кишечного патогена EHEC [19], и было обнаружено, что бактериоцины против Listeria экспрессируются Enterococcus faecium и Pediococcus pentosaceus [20,21].Недавно компьютерное предсказание кластеров биосинтетических генов, которые кодируют небольшие молекулы в микробиоте кишечника человека, выявило почти 600 кластеров-кандидатов, в том числе многие недавно аннотированные антимикробные пептиды, предполагая, что эти небольшие молекулы могут опосредовать взаимодействия комменсал-комменсал и комменсал-патоген [22]. Другое исследование in silico выявило 74 предположительно кодирующих кластера бактериоцина в желудочно-кишечном тракте на основе базы данных эталонного генома проекта микробиома человека [23,24].
Другой в некоторой степени прямой ингибирующий эффект кишечной микробиоты по отношению к патогенам осуществляется через механизм с участием желчных кислот. Вырабатываемые печенью и доставляемые в двенадцатиперстную кишку, желчные кислоты впоследствии модифицируются микробиотой кишечника в бесчисленное множество вторичных желчных кислот, которые могут действовать как антибактериальные факторы. Роль кишечной микробиоты во вторичном производстве желчных кислот подчеркивается наблюдением очень низких или неопределяемых уровней у стерильных животных [25] и резкого снижения выработки после лечения антибиотиками [26].Лучшим примером защитного механизма, обеспечиваемого вторичными желчными кислотами микробиоты, является наблюдение, что истощение микробных членов, участвующих в превращении первичных желчных кислот во вторичные желчные кислоты, способствует колонизации желудочно-кишечного тракта C. difficile , наиболее видный патоген, использующий изменения микробиоты, опосредованные антибиотиками [7,26–30]. Важно отметить, что введения Clostridium scindens (7α-дегидроксилирующая бактерия желчной кислоты) достаточно для придания устойчивости к C.difficile вторичным образом, зависимым от желчных кислот. В недавних работах было описано, что кишечная микробиота также может косвенно контролировать кишечные патогены с помощью других механизмов, таких как формирование иммунной системы и воспалительный ответ (иммунная устойчивость к колонизации).
(b) Созревание иммунной системы и процесс воспаления
Микробиота играет первостепенную роль в созревании кишечной иммунной системы, что продемонстрировано наблюдением, что мыши без микробов имеют тяжелую иммунную депрессию.Действительно, в кишечнике стерильных животных отсутствуют пейеровы пятна и снижена экспрессия как антимикробных пептидов, так и иммуноглобулина А (IgA), молекул, участвующих в кишечном иммунитете [31–36]. Примером члена микробиоты, который вносит вклад в развитие иммунной системы, является Bacteroides fragilis , демонстрирующий, что моноколонизация стерильных мышей этой бактерией достаточна для стимулирования развития лимфоцитов CD4T [37]. Точно так же было описано, что сегментированных нитчатых бактерий достаточно для дифференциации клеток CD4T в клетки Th27, что важно для защиты от кишечного патогена C.rodentium [38–41].
Микробиота кишечника также является неисчерпаемым источником лигандов для врожденной иммунной системы. Лечение антибиотиками является достаточным для повышения восприимчивости мышей к колиту, опосредованному декстрансульфатом натрия (DSS) — феномену, который может быть устранен введением лигандов Toll-подобных рецепторов [42]. Такое открытие положило начало концепции, согласно которой передача сигналов рецептора распознавания образов, исходящая от кишечной микробиоты, необходима для устойчивой защиты кишечника [42,43].Это также было проиллюстрировано открытием того факта, что бактериальный флагеллин из кишечной микробиоты способен предотвращать и лечить ротавирусную инфекцию с помощью механизма, требующего рецепторов флагеллина Toll-подобного рецептора 5 (TLR5) и NOD-подобного рецептора C4 (NLRC4) и с участием интерлейкинов. 22 и продукция интерлейкина-18 [44]. Бактерии, принадлежащие к кластеру XIVa группы Clostridium , способны индуцировать развитие противовоспалительных Т-регуляторных клеток [45], а SCFAs, происходящие из кишечной микробиоты, играют центральную роль в поддержании баланса воспалительных и противовоспалительных Т-клеток. подмножества [46–49].Важно отметить, что некоторые лиганды TLR, такие как LPS, модифицируются хозяином, чтобы быть менее биологически активными, что указывает на существование механизмов детоксикации таких провоспалительных молекул, что позволяет избежать чрезмерной активации кишечной иммунной системы в ответ на комменсал. бактериальная популяция [50–52]. Все эти отчеты являются хорошими примерами роли, которую играет микробиота в созревании кишечной иммунной системы, где кишечная бактериальная популяция может генерировать провоспалительные или противовоспалительные реакции, которые имеют центральное значение для предотвращения чрезмерной активации кишечной иммунной системы. но обеспечивая защиту от кишечных патогенов.
(c) Поддержание кишечного барьера
Другой механизм, с помощью которого кишечная микробиота защищает кишечник от инфекции кишечными патогенами, заключается в воздействии на «силу» кишечного барьера, например толщину и состав слизистого слоя. как поддержание плотных контактов кишечника. Для хозяина действительно изначально важно держать кишечную микробиоту на безопасном расстоянии от кишечного эпителия, чтобы свести к минимуму появление повреждения тканей и воспаления [53].Микробиота кишечника ограничена просветом кишечника слоем слизи, который покрывает эпителий. Лечение мышей антибиотиками уменьшает толщину слоя слизи и приводит к усилению контакта бактерий с монослоем кишечного эпителия, что может быть очень вредным в контексте инфекции кишечного патогена, как показано на примере C. rodentium [54]. Кроме того, кишечная микробиота поддерживает кишечный барьер за счет продукции SCFAs, которые являются основным питательным веществом для эпителия толстой кишки и способствуют контролю продукции муцина [55,56].Таким образом, снижение продукции SCFAs может привести к уменьшению толщины слизи / разрушению слизистого барьера.
3. Когда кишечная микробиота приводит к вирулентности кишечных патогенов
Хотя все описанные выше механизмы являются центральными для защиты кишечника от бактериальной инфекции и патогенов, микробиота также может запускать бактериальную вирулентность. Например, кишечная микробиота может также продуцировать метаболиты, которые могут неожиданно усилить экспрессию патогенов и их колонизацию в кишечнике [57–61] ( a ). Bacteroidetes thetaiotaomicron , приводящий к конкурентному исключению C. rodentium за счет потребления аналогичных углеводов [14], также может отщеплять части сиаловой кислоты от муцина и производить высокие уровни сукцината, что может привести к усиленной колонизации C. difficile [58,59]. Производство фукозы или сукцината из муцина хозяина комменсальными бактериями также может модулировать экспрессию фактора вирулентности ler, главного регулятора локуса генов сглаживания энтероцитов (LEE) в EHEC [60,62], тем самым способствуя вирулентности EHEC. .Другие примеры патогенов, которые используют кишечную микробиоту для облегчения своей собственной инфекции, включают C. difficile , споры которых требуют для прорастания побочных продуктов микробиоты, таких как соли желчных кислот [63], и S . Typhimurium, который использует дигидрид, вырабатываемый микробиотой, для своего роста в просвете [64]. Более того, производимый микробиотой этаноламин используется в качестве источника азота и регулятора генов вирулентности посредством EHEC, S. Typhimurium и Listeria monocytogenes [65–68]. Akkermansia muciniphila , разлагающая муцин комменсальная бактерия, которая находится в слое слизи и может обеспечивать защиту от ожирения и метаболических нарушений [69,70], также способна усугубить воспаление кишечника, вызванное тифимурием S. нарушают гомеостаз слизи хозяина [71].
Патогенетические стратегии преодоления устойчивости к колонизации, опосредованной микробиотой. ( a ) Продукция метаболитов комменсальными бактериями может модулировать рост и экспрессию генов вирулентности кишечными патогенами.( b ) Кишечные патогены могут конкурировать с микробиотой, используя альтернативные питательные вещества и / или ниши. ( c ) Стимуляция кишечного воспаления кишечными патогенами подавляет рост комменсальных бактерий, что дает преимущество кишечным патогенам. ( d ) Кишечные патогены продуцируют токсины, которые могут непосредственно и конкретно воздействовать на комменсалов. EHEC, энтерогеморрагическая Escherichia coli .
4. Когда изменение кишечной микробиоты патогеном приводит к хроническим заболеваниям
Хотя предыдущие примеры иллюстрируют, как кишечная микробиота может способствовать инфицированию кишечными патогенами, некоторые результаты также показали, что изменение кишечной микробиоты патогеном или патобионтом может привести к хроническим заболеваниям. болезни.В качестве примера было показано, что колонизация адгезивно-инвазивной E. coli (AIEC, патоген E. coli , участвующий в патогенезе болезни Крона) во время приобретения микробиоты вызвала хронический колит у мышей, лишенных рецептора флагеллина TLR5 [72 ]. Наблюдение за тем, что такой колит сохраняется далеко за пределами клиренса AIEC, приводит к заключению, что бактерии AIEC вызывают хроническое воспаление, изменяя состав кишечной микробиоты таким образом, что увеличивает ее провоспалительный потенциал [73].Эти данные предполагают, что AIEC и, возможно, другие патобионты могут спровоцировать хроническое воспаление у восприимчивых хозяев, изменяя состав микробиоты кишечника, чтобы придать ей изначально большую способность активировать врожденный иммунитет / экспрессию провоспалительных генов [73], что приводит к понятие патобиома [74]. Точно так же инфекция Yersinia enterolitica мышей, лишенных рецептора TLR1, приводит к изменению состава микробиоты и возникновению антикомменсального иммунитета, что в конечном итоге приводит к развитию хронического воспаления кишечника [75].Таким образом, эти два открытия описывают, что острая инфекция может вызывать долгосрочные изменения иммунной системы и микробиоты, что приводит к хроническому воспалительному заболеванию у генетически предрасположенного хозяина.
5. Как бактериальные патогены высвобождаются из кишечной микробиоты
Как обсуждалось выше, кишечная микробиота играет центральную роль, посредством множества механизмов, в устойчивости к колонизации патогенами. Однако, в свою очередь, патогены выработали стратегии, позволяющие избежать некоторых из этих механизмов ( b — d ).
(a) Использование альтернативных питательных веществ или ниш
Даже если кишечная среда качественно и количественно богата питательными веществами, большое количество бактерий в конечном итоге приводит к конкуренции. Одним из механизмов, с помощью которого кишечные патогены могут конкурировать с микробиотой, является использование особого метаболического репертуара. Этаноламин, который выделяется в кишечник во время обновления эпителиальных клеток, например, используется некоторыми патогенами [76], а гены, участвующие в использовании этаноламина, преимущественно обнаруживаются в геномах кишечных патогенов [77].Возбудитель болезней пищевого происхождения EHEC может использовать галактозу, гексуронат, маннозу и рибозу в качестве источников углерода, в то время как комменсал E. coli не может использовать такие сахара [78,79]. Кроме того, некоторые патогены более эффективно используют общие ресурсы, например железо. Железо необходимо для роста бактерий, и многие бактерии вырабатывают сидерофоры для приобретения трехвалентного железа [80]. В качестве защитного механизма клетки-хозяева секретируют липокалин-2, который способен блокировать сидерофор энтеробактин в E.coli , предотвращая приобретение железа и пролиферацию комменсальной E. coli в кишечнике [81,82]. Однако Salmonella и некоторые патогенные E. coli экспрессируют модифицированные энтеробактины, называемые сальмохелинами, которые устойчивы к липокалину-2, обеспечивая важное преимущество патогенов перед комменсалами [4,81,82]. Патогены также могут находиться в отдельной от микробиоты нише. Патогенная E. coli может, например, локализоваться близко к поверхности эпителия кишечника, обычно лишенной комменсальной микробиоты, за счет экспрессии таких молекул, как интимин, молекула адгезии, кодируемая LEE [14].
Хемотаксис и подвижность, обеспечиваемые жгутиками, позволяют Salmonella идентифицировать и плавать в полезные для питания ниши. Действительно, рецепторы хемотаксиса, принимающие метил, Aer и Tsr, как наблюдали, реагировали in vivo на тетратионат или нитрат, соответственно, чтобы придать преимущество пригодности S. Typhimurium во время воспаления, позволяя бактериям искать благоприятные пространственные условия. ниши, содержащие акцепторы электронов, производные от хозяина, которые ускоряют его рост в просвете [83].Патогенные бактерии также могут получать пользу от воспаления кишечника и / или побочных продуктов воспалительного ответа. Например, активные формы кислорода, продуцируемые нейтрофилами во время воспаления, реагируют с соединениями серы в просвете (тиосульфатом) с образованием нового акцептора респираторных электронов, тетратионата (). В отличие от комменсалов Salmonella содержит оперон ttrSR ttrBCA , который позволяет использовать, обеспечивая преимущество роста Salmonella над комменсальными микробами в воспаленной среде [84].Точно так же нитрат, образующийся как побочный продукт воспалительной реакции, давал преимущество в росте комменсальной бактерии E. coli по сравнению с Firmicutes и Bacteroidetes в толстом кишечнике мышей [85]. Хотя этот механизм чрезмерного роста E. coli в воспаленном кишечнике включает комменсально-комменсальную конкуренцию, патогенные штаммы E. coli , в геноме которых есть гены нитратредуктазы, такие как NarZ , могут использовать аналогичный механизм для приобретения преимущество в росте над конкурентным комменсальным сообществом.
(b) Стимулирование воспаления хозяина
Другой механизм, с помощью которого кишечные патогены приобретают преимущество в росте по сравнению с популяцией комменсалов, заключается в стимулировании воспаления кишечника, которое изменяет выживаемость комменсалов. Действительно, экспрессия факторов вирулентности патогенными бактериями, такими как токсины, приводит к воспалению кишечника, которое, в свою очередь, резко меняет состав и богатство микробиоты кишечника [86]. Например, во время воспаления кишечника рекрутируются нейтрофилы и макрофаги, экспрессирующие индуцибельную синтетазу оксида азота (iNOS), что приводит к повышенной концентрации нитрата в кишечнике, что дает преимущество Enterobacteriaceae по сравнению с облигатными анаэробами, такими как Bacteroidetes или Firmicutes [ 85].Многие патовары E. coli действительно способны использовать нитрат в качестве акцептора электронов, например AIEC, связанный с воспалительным заболеванием кишечника, и могут извлечь выгоду из такого преимущества роста по сравнению с популяцией комменсалов для более эффективной колонизации кишечника [87–90] .
Кроме того, воспалительная среда хозяина может усиливать экспрессию факторов вирулентности, способствуя росту патогенных бактерий в тканях хозяина. Например, интерферон-β увеличивал экспрессию лектина типа I на Pseudomonas aeruginosa , обеспечивая адгезию бактерий к эпителиальным клеткам легких [91].Следовательно, воспалительная среда кишечника может также способствовать экспрессии фактора вирулентности кишечными бактериями.
(c) Производство токсинов
Патогены способны продуцировать ингибирующие вещества / токсины, которые могут напрямую воздействовать на микробиоту кишечника. Через свою систему секреции типа VI Vibrio cholerae может доставлять токсичные эффекторы непосредственно в E. coli [92,93]. Кроме того, сообщалось о продукции бактериоцина для штаммов Salmonella [94] и патогенных штаммов Shigella [95–99], но его роль в вирулентности или в качестве механизма вытеснения микробиоты еще не известна.
Принимая во внимание, что бактериоцины играют важную роль в бактериальных взаимоотношениях, весьма вероятно, что они могут способствовать успешной колонизации кишечника патогенными бактериями, воздействуя на определенные комменсалы и, следовательно, изменяя поддержание барьера, изменяя иммунный надзор и / или метаболизм кишечника, способствующий их колонизации. Изучение роли бактериоцинов, продуцируемых патогенными штаммами, на микробиоту и вирулентность, может выявить новые механизмы патогенности и поможет расшифровать сложную взаимосвязь между кишечной микробиотой и некоторыми кишечными патогенами.
6. Заключение и перспективы
В связи с недавним признанием важной роли кишечной микробиоты в здоровье и болезнях, в ряде исследований была подчеркнута ее особая роль в защите от инфекций, вызываемых кишечными патогенами. Здесь важно отметить, что большинство механизмов, представленных в этом обзоре, было обнаружено на животных моделях и / или in vitro работ. Экстраполяцию на ситуацию с человеком следует рассматривать с осторожностью в контексте различных пищевых привычек, архитектуры кишечника, состава микробиоты, окружающей среды, иммунной системы и генетического фона.Однако новые терапевтические подходы могут в конечном итоге выиграть от понимания важной ингибирующей роли кишечной микробиоты в отношении вирулентности патогенов [100], что подтверждается недавним использованием трансплантата фекальной микробиоты для лечения рецидивирующей инфекции C. difficile , которая имеет больше эффективность более 90% по сравнению с 30% при лечении антибиотиками [101]. Целенаправленное манипулирование кишечной микробиотой бактериоцинами и / или другими противомикробными препаратами может стать терапевтическим инструментом для профилактики или лечения заболеваний, связанных с дисбактериозом [102].Основываясь на их очень высокой специфичности (по крайней мере, для некоторых из них), бактериоцины могут представлять собой идеальных кандидатов в отношении воздействия только на нежелательные группы населения. Важно отметить, что уже есть некоторые доказательства концептуальных исследований, таких как использование турицина CD для специфического ингибирования C. difficile в модели дистального отдела толстой кишки [103]. Аналогичным образом, продукция бактериоцина пробиотиком Lactobacillus salivarius UCC118, как было показано, значительно защищает мышей от L.monocytogenes [104]. Более того, недавно было показано, что колонизация кишечника продуцирующим бактериоцин Enteroccocus faecalis приводит к исчезновению устойчивых к ванкомицину энтерококков, укрепляя концепцию, что бактериоцины могут быть эффективным терапевтическим подходом для специфического устранения кишечной колонизации бактериями с множественной устойчивостью без глубокое нарушение комменсальной популяции [104]. Однако при выявлении или выборе бактериоцина в качестве терапевтического подхода следует принимать во внимание предполагаемое широкое воздействие на микробиоту кишечника, даже если оно менее сильное, чем использование антибиотиков.Например, было обнаружено, что CD турицина сильно ингибирует Lactobacillus fermentum [18].
Кроме того, фаговая терапия потенциально может иметь положительное влияние на микробиоту человека и связанное с ним здоровье хозяина [105]. Бактериофаги — это вирусные частицы, которые естественным образом инфицируют бактерии с высокой специфичностью, и фаговая терапия заключается в использовании этих бактериофагов в качестве противомикробных агентов [106,107]. Некоторые группы в настоящее время исследуют их пригодность в качестве терапевтической стратегии против некоторых кишечных патогенов, например против AIEC, связанного с воспалительным заболеванием кишечника [108].
Наконец, бактерии (как непатогенные, так и патогенные) синтезируют небольшие диффузные сигнальные молекулы, называемые аутоиндукторами, чтобы они скоординированно контролировали экспрессию генов всего сообщества в ответ на изменения плотности клеток [109]. Этот процесс, называемый зондированием кворума, может быть универсальным или высокоспецифичным, позволяя бактериям общаться внутри и между видами. Следовательно, определение кворума может иметь большое влияние на состав микробных сообществ, а также участвует в регуляции экспрессии генов вирулентности многими патогенными бактериями [110].Следовательно, идентификация химических сигналов, рецепторов и генов-мишеней будет иметь важное значение для нашего понимания того, как взаимодействие бактерий и бактерий может быть использовано для предотвращения колонизации патогенными бактериями [100].
Необходимы дополнительные исследования для расшифровки сложной взаимосвязи между кишечной микробиотой и патогенными бактериями, которые в конечном итоге помогут определить и, возможно, спроектировать «здоровый» микробиом.
Благодарности
Эта статья посвящена нашему уважаемому наставнику, Арлетт Дарфей-Мишо, которая положила начало нашей научной карьере.Мы благодарны Эндрю Гевирцу и Паскалю Коссарту за критическую рецензию рукописи.
Вклад авторов
Н.Р. и B.C. написал рукопись.
Конкурирующие интересы
У нас нет конкурирующих интересов.
Финансирование
до н.э. является лауреатом премии за развитие карьеры Американского фонда Крона и колита (CCFA).
Список литературы
1. Round JL, Mazmanian SK.
2009 г.
Микробиота кишечника формирует иммунные реакции кишечника во время здоровья и болезни.Nat. Rev. Immunol.
9, 313–323. (10.1038 / nri2515) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 2. Флинт HJ, Скотт КП, Луи П., Дункан Ш.
2012 г.
Роль микробиоты кишечника в питании и здоровье. Nat. Преподобный Гастроэнтерол. Гепатол.
9, 577–589. (10.1038 / nrgastro.2012.156) [PubMed] [CrossRef] [Google Scholar] 5. Чоу Дж, Тан Х, Мазманян СК.
2011 г.
Патобионты микробиоты желудочно-кишечного тракта и воспалительных заболеваний. Curr. Opin. Иммунол.
23, 473–480. (10.1016 / j.coi.2011.07.010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6.Дюклузо Р., Рейльбо П.
1989 г.
Бактериальные взаимодействия в пищеварительном тракте. Rev. Sci. Tech. Выключенный. Int. Epiz. 8, 313–332. (10.20506 / rst.8.2.410) [CrossRef] [Google Scholar] 7. Териот CM, Янг В.Б.
2015 г.
Взаимодействие между микробиомом желудочно-кишечного тракта и Clostridium difficile . Анну. Rev. Microbiol.
69, 445–461. (10.1146 / annurev-micro-0-104115) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Осава Н., Мицухаси С.
1964 г.
Заражение мышей-нематод Shigella Flexneri 3a.Jpn. J. Exp. Med.
34, 77–80. [PubMed] [Google Scholar] 9. Фукуда С., То Х, Тейлор Т. Д., Оно Х, Хаттори М.
2012 г.
Бифидобактерии, продуцирующие ацетат, защищают хозяина от энтеропатогенной инфекции через переносчики углеводов. Кишечные микробы
3, 449–454. (10.4161 / gmic.21214) [PubMed] [CrossRef] [Google Scholar] 10. Fukuda S, et al.
2011 г.
Бифидобактерии могут защитить от энтеропатогенной инфекции за счет выработки ацетата. Природа
469, 543–547. (10.1038 / nature09646) [PubMed] [CrossRef] [Google Scholar] 11.Бонхофф М, Дрейк Б.Л., Миллер С.П.
1954 г.
Влияние стрептомицина на восприимчивость кишечного тракта к экспериментальной сальмонеллезной инфекции. Proc. Soc. Exp. Биол. Med.
86, 132–137. (10.3181 / 00379727-86-21030) [PubMed] [CrossRef] [Google Scholar] 12. Лоули Т.Д. и др.
2009 г.
Лечение антибиотиками мышей-носителей Clostridium difficile вызывает состояние суперседдера, опосредованную спорами передачу и тяжелое заболевание у хозяев с ослабленным иммунитетом. Заразить. Иммун.
77, 3661–3669. (10.1128 / IAI.00558-09) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14.Камада Н, Ким Ю.Г., Шам ХП, Валланс Б.А., Пуэнте Дж.Л., Мартенс Э.С., Нуньес Г.
2012 г.
Регулируемая вирулентность контролирует способность патогена конкурировать с кишечной микробиотой. Наука
336, 1325–1329. (10.1126 / science.1222195) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15. Gantois I, Ducatelle R, Pasmans F, Haesebrouck F, Hautefort I, Thompson A, Hinton JC, Van Immerseel F.
2006 г.
Бутират специфически подавляет экспрессию гена острова 1 патогенности Salmonella . Прил. Environ.Microbiol.
72, 946–949. (10.1128 / AEM.72.1.946-949.2006) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Шин Р., Сузуки М., Моришита Ю.
2002 г.
Влияние кишечных анаэробов и органических кислот на рост энтерогеморрагической инфекции Escherichia coli O157: H7. J. Med. Microbiol.
51, 201–206. (10.1099 / 0022-1317-51-3-201) [PubMed] [CrossRef] [Google Scholar] 17. Kommineni S, et al.
2015 г.
Продукция бактериоцина усиливает нишевую конкуренцию энтерококков в желудочно-кишечном тракте млекопитающих.Природа
526, 719–722. (10.1038 / nature15524) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 18. Rea MC, Sit CS, Clayton E, O’Connor PM, Whittal RM, Zheng J, Vederas JC, Ross RP, Hill C.
2010 г.
Турицин CD, посттрансляционно модифицированный бактериоцин с узким спектром активности против Clostridium difficile . Proc. Natl Acad. Sci. США
107, 9352–9357. (10.1073 / pnas.0
4107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 19. Шамбергер Г.П., Диез-Гонсалес Ф.
2002 г.Отбор недавно выделенных колициногенных штаммов Escherichia coli , ингибирующих Escherichia coli O157: H7. J. Food Prot.
65, 1381–1387. [PubMed] [Google Scholar] 20. Пинто А.Л., Фернандес М., Пинто С., Альбано Х., Кастильо Ф., Тейшейра П., Гиббс П.А.
2009 г.
Характеристика бактериоцинов против Listeria , выделенных из моллюсков: потенциальные противомикробные средства для контроля неферментированных морепродуктов. Int. J. Food Microbiol.
129, 50–58. (10.1016 / j.ijfoodmicro.2008.11.005) [PubMed] [CrossRef] [Google Scholar] 21.Чанос П., Уильямс ДР.
2011 г.
Anti- Listeria Бактерии, продуцирующие бактериоцин, из сырого овечьего молока в северной Греции. J. Appl. Microbiol.
110, 757–768. (10.1111 / j.1365-2672.2010.04932.x) [PubMed] [CrossRef] [Google Scholar] 22. Дония М.С., Цимерманчич П., Шульце С.Дж., Виланд Браун Л.С., Мартин Дж., Митрева М., Кларди Дж., Линингтон Р.Г., Фишбах М.А.
2014 г.
Систематический анализ кластеров биосинтетических генов в микробиоме человека показывает общее семейство антибиотиков. Клетка
158, 1402–1414. (10.1016 / j.cell.2014.08.032) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Уолш CJ, Guinane CM, Hill C, Росс RP, O’Toole PW, Коттер PD.
2015 г.
Идентификация in silico кластеров генов бактериоцина в желудочно-кишечном тракте на основе базы данных эталонных геномов проекта Human Microbiome Project. BMC Microbiol.
15, 183 (10.1186 / s12866-015-0515-4) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 25. Chassaing B, Koren O, Goodrich JK, Poole AC, Srinivasan S, Ley RE, Gewirtz AT.
2015 г.Пищевые эмульгаторы воздействуют на микробиоту кишечника мышей, вызывая колит и метаболический синдром. Природа
519, 92–96. (10.1038 / nature14232) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 26. Териот CM, Боуман А.А., Янг В.Б.
2016 г.
Вызванные антибиотиками изменения микробиоты кишечника изменяют вторичную продукцию желчных кислот и позволяют спорам Clostridium difficile прорастать и разрастаться в толстом кишечнике. мСфера
1, e00045-15. (10.1128 / mSphere.00045-15) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 27.Бриттон Р.А., Янг В.Б.
2014 г.
Роль кишечной микробиоты в устойчивости к колонизации Clostridium difficile . Гастроэнтерология
146, 1547–1553. (10.1053 / j.gastro.2014.01.059) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 28. Sorg JA, Sonenshein AL.
2010 г.
Подавление инициации прорастания спор Clostridium difficile с использованием аналогов хенодезоксихолевой кислоты, желчной кислоты. J. Bacteriol.
192, 4983–4990. (10.1128 / JB.00610-10) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 29.Buffie CG, et al.
2015 г.
Прецизионное восстановление микробиома восстанавливает опосредованную желчной кислотой устойчивость к Clostridium difficile . Природа
517, 205–208. (10.1038 / nature13828) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 30. Weingarden AR, Chen C, Bobr A, Yao D, Lu Y, Nelson VM, Sadowsky MJ, Khoruts A.
2014 г.
Трансплантация микробиоты восстанавливает нормальный состав фекальных желчных кислот при рецидивирующей инфекции Clostridium difficile . Являюсь. J. Physiol. Гастроинтест. Liver Physiol.306, G310 – G319. (10.1152 / ajpgi.00282.2013) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 31. Карлссон Дж., Пуцеп К., Чу Х., Кейс Р.Дж., Бевинс К.Л., Андерссон М.
2008 г.
Региональные вариации экспрессии антимикробного пептида клеток Панета в кишечном тракте мышей. BMC Immunol.
9, 37 (10.1186 / 1471-2172-9-37) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 32. Риос Д., Вуд М.Б., Ли Дж., Чассен Б., Гевиртц А.Т., Уильямс И.Р.
2015 г.
Отбор образцов антигена кишечными М-клетками является основным путем, инициирующим продукцию IgA слизистой оболочки для комменсальных кишечных бактерий.Mucosal Immunol. 9, 907–916. (10.1038 / mi.2015.121) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 33. Bevins CL, Salzman NH.
2011 г.
Клетки Панета, антимикробные пептиды и поддержание гомеостаза кишечника. Nat. Rev. Microbiol.
9, 356–368. (10.1038 / nrmicro2546) [PubMed] [CrossRef] [Google Scholar] 34. Cash HL, Whitham CV, Behrendt CL, Hooper LV.
2006 г.
Симбиотические бактерии направляют экспрессию кишечного бактерицидного лектина. Наука
313, 1126–1130. (10.1126 / science.1127119) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 35.Fransen F, et al.
2015 г.
Мыши BALB / c и C57BL / 6 различаются по содержанию полиреактивного IgA, что влияет на образование антиген-специфических IgA и разнообразие микробиоты. Иммунитет
43, 527–540. (10.1016 / j.immuni.2015.08.011) [PubMed] [CrossRef] [Google Scholar] 37. Мазманян СК, Лю СН, Цианабос А.О., Каспер ДЛ.
2005 г.
Иммуномодулирующая молекула симбиотических бактерий направляет созревание иммунной системы хозяина. Клетка
122, 107–118. (10.1016 / j.cell.2005.05.007) [PubMed] [CrossRef] [Google Scholar] 38. Иванов И.И., Фрутос Р.Д., Манель Н., Йошинага К., Рифкин Д.Б., Сартор РБ, Финлей Б.Б., Литтман Д.Р.2008 г.
Специфическая микробиота направляет дифференцировку Т-хелперных клеток, продуцирующих ИЛ-17, в слизистой оболочке тонкой кишки. Клеточный микроб-хозяин
4, 337–349. (10.1016 / j.chom.2008.09.009) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 40. Gaboriau-Routhiau V, et al.
2009 г.
Ключевая роль сегментированных нитчатых бактерий в скоординированном созревании ответов Т-хелперных клеток кишечника. Иммунитет
31, 677–689. (10.1016 / j.immuni.2009.08.020) [PubMed] [CrossRef] [Google Scholar] 41. Lecuyer E, et al.2014 г.
Сегментированные нитчатые бактерии используют вторичные и третичные лимфоидные ткани для индукции ответа кишечных IgA и специфических Т-хелперных 17 клеток. Иммунитет
40, 608–620. (10.1016 / j.immuni.2014.03.009) [PubMed] [CrossRef] [Google Scholar] 42. Ракофф-Нахум С., Паглино Дж., Эслами-Варзане Ф., Эдберг С., Меджитов Р.
2004 г.
Распознавание комменсальной микрофлоры толл-подобными рецепторами необходимо для гомеостаза кишечника. Клетка
118, 229–241. (10.1016 / j.cell.2004.07.002) [PubMed] [CrossRef] [Google Scholar] 43.Араки А. и др.
2005 г.
У мышей с дефицитом MyD88 развивается тяжелое воспаление кишечника при колите, вызванном декстрановым сульфатом натрия. J. Gastroenterol.
40, 16–23. (10.1007 / s00535-004-1492-9) [PubMed] [CrossRef] [Google Scholar] 44. Чжан Б. и др.
2014 г.
Вирусная инфекция. Профилактика и лечение ротавирусной инфекции посредством TLR5 / NLRC4-опосредованной продукции IL-22 и IL-18. Наука
346, 861–865. (10.1126 / science.1256999) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Атараши К. и др.
2013.
Индукция Treg рационально подобранной смесью штаммов Clostridia из микробиоты человека.Природа
500, 232–236. (10.1038 / nature12331) [PubMed] [CrossRef] [Google Scholar] 47. Ким СН, Пак Дж., Ким М.
2014 г.
Короткоцепочечные жирные кислоты кишечной микробиоты, Т-клетки и воспаление. Иммунная сеть
14, 277–288. (10.4110 / in.2014.14.6.277) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 48. Furusawa Y, et al.
2013.
Бутират комменсального микроба индуцирует дифференцировку регуляторных Т-клеток толстой кишки. Природа
504, 446–450. (10.1038 / nature12721) [PubMed] [CrossRef] [Google Scholar] 49.Смит П.М., Ховитт М.Р., Паников Н., Мишо М., Галлини К.А., Бохлули Ю.М., Гликман Дж. Н., Гарретт В.С.
2013.
Микробные метаболиты, короткоцепочечные жирные кислоты, регулируют гомеостаз Treg-клеток толстой кишки. Наука
341, 569–573. (10.1126 / science.1241165) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 50. Бейтс Дж. М., Акерлунд Дж., Миттдж Э., Гийемин К.
2007 г.
Щелочная фосфатаза кишечника выводит токсины из липополисахаридов и предотвращает воспаление у рыбок данио в ответ на кишечную микробиоту. Клеточный микроб-хозяин
2, 371–382.(10.1016 / j.chom.2007.10.010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Боймер С., Вульферинк М., Раабен В., Фихтер Д., Брэндс Р., Сейнен В.
2003 г.
Щелочная фосфатаза из кишечника теленка, новый терапевтический препарат для лечения заболеваний, опосредованных липополисахаридами (ЛПС), снижает токсичность ЛПС у мышей и поросят. J. Pharmacol. Exp. Ther.
307, 737–744. (10.1124 / jpet.103.056606) [PubMed] [CrossRef] [Google Scholar] 52. Кояма И., Мацунага Т., Харада Т., Хокари С., Комода Т.
2002 г.
Щелочные фосфатазы снижают токсичность липополисахаридов in vivo и in vitro посредством дефосфорилирования.Clin. Биохим.
35, 455–461. (10.1016 / S0009-9120 (02) 00330-2) [PubMed] [CrossRef] [Google Scholar] 53. Chassaing B, Gewirtz AT.
2016 г.
Спровоцировала ли агрессия микробиоты развитие эпидемии ожирения?
Биологические исследования
38, 122–128. (10.1002 / bies.201500116) [PubMed] [CrossRef] [Google Scholar] 54. Влодарска М., Уиллинг Б., Кини К.М., Менендес А., Бергстром К.С., Гилл Н., Рассел С.Л., Валланс Б.А., Финли Б.Б.
2011 г.
Лечение антибиотиками изменяет слой слизи толстой кишки и предрасполагает хозяина к обострению колита, вызванного Citrobacter rodentium .Заразить. Иммун.
79, 1536–1545. (10.1128 / IAI.01104-10) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 55. Виллемсен Л.Е., Кетсиер М.А., ван Девентер С.Дж., ван Тол Е.А.
2003 г.
Короткоцепочечные жирные кислоты стимулируют экспрессию муцина 2 в эпителии за счет различных эффектов на продукцию простагландинов E (1) и E (2) кишечными миофибробластами. Кишечник
52, 1442–1447. (10.1136 / gut.52.10.1442) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 56. Симотоёдомэ А, Мегуро С., Хасэ Т, Токимицу И, Саката Т.2000 г.
Короткоцепочечные жирные кислоты, но не лактат или сукцинат, стимулируют выделение слизи в толстой кишке крысы. Комп. Биохим. Physiol. Мол. Интегр. Physiol.
125, 525–531. (10.1016 / S1095-6433 (00) 00183-5) [PubMed] [CrossRef] [Google Scholar] 57. Камерон Э.А., Сперандио В.
2015 г.
Заклятые враги: сигнализация и интеграция питания во взаимодействиях патоген-микробиота-хозяин. Клеточный микроб-хозяин
18, 275–284. (10.1016 / j.chom.2015.08.007) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Феррейра Дж. А., Ву К. Дж., Грицковиан А. Дж., Були Д. М., Веймер Британская Колумбия, Зонненбург Дж. Л..2014 г.
Сукцинат, продуцируемый кишечной микробиотой, способствует инфицированию C. difficile после лечения антибиотиками или нарушения моторики. Клеточный микроб-хозяин
16, 770–777. (10.1016 / j.chom.2014.11.003) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 60. Кертис М.М., Ху З., Климко С., Нараянан С., Деберардинис Р., Сперандио В.
2014 г.
Комменсал кишечника Bacteroides thetaiotaomicron обостряет кишечную инфекцию за счет изменения метаболического ландшафта. Клеточный микроб-хозяин
16, 759–769.(10.1016 / j.chom.2014.11.005) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 61. Pham NT, Lawley TD.
2014 г.
Использование патогенами пищевой сети кишечника. Клеточный микроб-хозяин
16, 703–705. (10.1016 / j.chom.2014.11.012) [PubMed] [CrossRef] [Google Scholar] 62. Пачеко А.Р., Кертис М.М., Ричи Дж.М., Мунера Д., Уолдор М.К., Морейра К.Г., Сперандио В.
2012 г.
Чувствительность к фукозе регулирует бактериальную колонизацию кишечника. Природа
492, 113–117. (10.1038 / nature11623) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 63.Гиль Дж. Л., Сорг Дж. А., Соненшейн А. Л., Чжу Дж.
2010 г.
Метаболизм солей желчных кислот у мышей влияет на прорастание спор Clostridium difficile . PLoS ONE
5, e8740 (10.1371 / journal.pone.0008740) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 64. Майер Л., Бартель М., Стечер Б., Майер Р. Дж., Ганн Дж. С., Хардт В. Д..
2014 г.
Salmonella Штамм Typhimurium ATCC14028 требует h3-гидрогеназ для роста в кишечнике, но не в системных участках. PLoS ONE
9, e110187 (10.1371 / journal.pone.0110187) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 65.Bertin Y, Girardeau JP, Chaucheyras-Durand F, Lyan B, Pujos-Guillot E, Harel J, Martin C.
2011 г.
Энтерогеморрагический Escherichia coli получает конкурентное преимущество за счет использования этаноламина в качестве источника азота в содержимом кишечника крупного рогатого скота. Environ. Microbiol.
13, 365–377. (10.1111 / j.1462-2920.2010.02334.x) [PubMed] [CrossRef] [Google Scholar] 66. Кендалл М.М., Грубер С.К., Паркер К.Т., Сперандио В.
2012 г.
Этаноламин контролирует экспрессию генов, кодирующих компоненты, участвующие в межцерковной передаче сигналов и вирулентности в энтерогеморрагической Escherichia coli O157: H7.мБио
3, е00050-12. (10.1128 / mBio.00050-12) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 67. Thiennimitr P, et al.
2011 г.
Воспаление кишечника позволяет Salmonella использовать этаноламин для конкуренции с микробиотой. Proc. Natl Acad. Sci. США
108, 17 480–17 485. (10.1073 / pnas.1107857108) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 68. Joseph B, Przybilla K, Stuhler C, Schauer K, Slaghuis J, Fuchs TM, Goebel W.
2006 г.
Идентификация генов Listeria monocytogenes , участвующих во внутриклеточной репликации, путем профилирования экспрессии и скрининга мутантов.J. Bacteriol.
188, 556–568. (10.1128 / JB.188.2.556-568.2006) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 69. Эверард А. и др.
2013.
Перекрестное взаимодействие между Akkermansia muciniphila и кишечным эпителием контролирует ожирение, вызванное диетой. Proc. Natl Acad. Sci. США
110, 9066–9071. (10.1073 / pnas.1219451110) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 70. Schneeberger M, Everard A, Gomez-Valades AG, Matamoros S, Ramirez S, Delzenne NM, Gomis R, Claret M, Cani PD.
2015 г. Akkermansia muciniphila обратно коррелирует с началом воспаления, изменением метаболизма жировой ткани и метаболическими нарушениями во время ожирения у мышей. Sci. Rep.
5, 16643 (10.1038 / srep16643) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 71. Ганеш Б.П., Клопфляйш Р., Лох Г., Блаут М.
2013.
Commensal Akkermansia muciniphila обостряет воспаление кишечника у Salmonella Typhimurium-инфицированных гнотобиотических мышей. PLoS ONE
8, e74963 (10.1371 / journal.pone.0074963) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 72. Карвалью Ф.А. и др.
2012 г.
Временная неспособность управлять протеобактериями способствует хроническому воспалению кишечника у мышей с дефицитом TLR5. Клеточный микроб-хозяин
12, 139–152. (10.1016 / j.chom.2012.07.004) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 73. Chassaing B, Корен O, Карвалью FA, Ley RE, Gewirtz AT.
2014 г.
Патобионт AIEC вызывает хронический колит у восприимчивых хозяев, изменяя состав микробиоты. Кишечник
63, 1069–1080.(10.1136 / gutjnl-2013-304909) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 74. Vayssier-Taussat M, et al.
2014 г.
Сдвиг парадигмы с патогенов на патобиом: новые концепции в свете мета-омики. Фронт. Cell Infect. Microbiol.
4, 29 (10.3389 / fcimb.2014.00029) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 75. Камдар К. и др.
2016 г.
Генетические и метаболические сигналы во время острой кишечной бактериальной инфекции изменяют микробиоту и приводят к развитию хронического воспалительного заболевания.Клеточный микроб-хозяин
19, 21–31. (10.1016 / j.chom.2015.12.006) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 77. Корбель Дж.О., Дёркс Т., Йенсен Л.Дж., Перес-Иратхета К., Качановски С., Хупер С.Д., Андраде М.А., Борк П.
2005 г.
Систематическая ассоциация генов с фенотипами путем анализа генома и литературы. PLoS Biol.
3, e134 (10.1371 / journal.pbio.0030134) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 78. Fabich AJ, et al.
2008 г.
Сравнение углеродного питания патогенных и комменсальных штаммов Escherichia coli в кишечнике мышей.Заразить. Иммун.
76, 1143–1152. (10.1128 / IAI.01386-07) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 79. Ле Бугенек К., Шулер К.
2011 г.
Обмен сахара, дополнительный фактор вирулентности энтеробактерий. Int. J. Med. Microbiol.
301, 1–6. (10.1016 / j.ijmm.2010.04.021) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 80. Саха Р., Саха Н., Донофрио Р.С., Бестервельт LL.
2013.
Микробные сидерофоры: мини-обзор. J. Basic Microbiol.
53, 303–317. (10.1002 / jobm.201100552) [PubMed] [CrossRef] [Google Scholar] 81.Фишбах М.А., Линь Х., Лю Д.Р., Уолш К.Т.
2006 г.
Как патогенные бактерии избегают саботажа млекопитающих в битве за железо. Nat. Chem. Биол.
2, 132–138. (10.1038 / nchembio771) [PubMed] [CrossRef] [Google Scholar] 82. Сингх В., Йео Б.С., Сяо Икс, Кумар М., Бахман М., Боррегаард Н., Джо Б., Виджай-Кумар М.
2015 г.
Взаимодействие между энтеробактином, миелопероксидазой и липокалином 2 регулирует выживание E. coli в воспаленном кишечнике. Nat. Commun.
6, 7113 (10.1038 / ncomms8113) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 86.Лупп С., Робертсон М.Л., Викхэм М.Э., Секиров И., Чемпион О.Л., Гейнор Е.К., Финли ББ.
2007 г.
Опосредованное хозяином воспаление нарушает микробиоту кишечника и способствует чрезмерному росту энтеробактерий. Клеточный микроб-хозяин
2, 204 (10.1016 / j.chom.2007.08.002) [PubMed] [CrossRef] [Google Scholar] 87. Darfeuille-Michaud A, et al.
2004 г.
Высокая распространенность адгезивно-инвазивной инфекции Escherichia coli , связанной со слизистой оболочкой подвздошной кишки, при болезни Крона. Гастроэнтерология
127, 412–421. (10.1053 / j.gastro.2004.04.061) [PubMed] [CrossRef] [Google Scholar] 88. Шассен Б., Дарфёй-Мишо А.
2011 г.
Комменсальная микробиота и энтеропатогены в патогенезе воспалительных заболеваний кишечника. Гастроэнтерология
140, 1720–1728. (10.1053 / j.gastro.2011.01.054) [PubMed] [CrossRef] [Google Scholar] 89. Нэш Дж. Х. и др.
2010 г.
Последовательность генома адгезивно-инвазивной Escherichia coli и сравнительный геномный анализ с другими патотипами E. coli . BMC Genomics
11, 667 (10.1186 / 1471-2164-11-667) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 90.Miquel S, et al.
2010 г.
Полная последовательность генома ассоциированного с болезнью Крона адгезивно-инвазивного штамма E. coli LF82. PLoS ONE
5, e12714 (10.1371 / journal.pone.0012714) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 91. Wu L, et al.
2005 г.
Распознавание активации иммунной системы хозяина с помощью Pseudomonas aeruginosa . Наука
309, 774–777. (10.1126 / science.1112422) [PubMed] [CrossRef] [Google Scholar] 92. Унтервегер Д., Мията С.Т., Бахманн В., Брукс Т.М., Маллинс Т., Костюк Б., Провенцано Д., Пукацки С.2014 г.
Система секреции Vibrio cholerae типа VI использует различные эффекторные модули для внутривидовой конкуренции. Nat. Commun.
5, 3549 (10.1038 / ncomms4549) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 93. Макинтайр Д.Л., Мията СТ, Китаока М., Пукацки С.
2010 г.
Система секреции Vibrio cholerae типа VI проявляет антимикробные свойства. Proc. Natl Acad. Sci. США
107, 19 520–19 524. (10.1073 / pnas.1012931107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 94.Патанкар CV, Джоши Л.М.
1985 г.
Производство бактериоцина Salmonella . J. Postgrad. Med.
31, 46–51. [PubMed] [Google Scholar] 95. Соуза М.А., Мендес Э.Н., Аполлонио А.С., Фариас Лде М., Магалхаес П.П.
2010 г.
Продукция бактериоцина Shigella sonnei , выделенная из фекалий детей с острой диареей. APMIS
118, 125–135. (10.1111 / j.1600-0463.2009.02570.x) [PubMed] [CrossRef] [Google Scholar] 96. Горак В.
1994 г.
Семьдесят типов колицина Shigella sonnei и индикаторная система для их определения.Zentralbl. Бактериол.
281, 24–29. (10.1016 / S0934-8840 (11) 80633-X) [PubMed] [CrossRef] [Google Scholar] 97. Kaewklom S, Samosornsuk S, Pipatsatitpong D, Aunpad R.
2013.
Колицин типа 7 продуцируется большинством из Shigella sonnei , выделенных от тайских пациентов с диареей. Braz. J. Microbiol.
44, 731–736. (10.1590 / S1517-83822013000300010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 99. Падилья К., Лобос О., Бревис П., Абака П., Хуберт Э.
2006 г.
Опосредованная плазмидой продукция бактериоцина Shigella flexneri , выделенная из дизентерийной диареи, и их трансформация в Escherichia coli .Lett. Прил. Microbiol.
42, 300–303. (10.1111 / j.1472-765X.2005.01829.x) [PubMed] [CrossRef] [Google Scholar] 100. Белисарио Дж. Э., Наполитано М.
2015 г.
Микробиомы человека и их роль в дисбактериозе, распространенных заболеваниях и новых терапевтических подходах. Фронт. Microbiol.
6, 1050 (10.3389 / fmicb.2015.01050) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 101. van Nood E, et al.
2013.
Дуоденальная инфузия донорских фекалий при рецидиве Clostridium difficile . N. Engl. J. Med.
368, 407–415.(10.1056 / NEJMoa1205037) [PubMed] [CrossRef] [Google Scholar] 102. Коттер П.Д., Росс Р.П., Хилл К.
2013.
Бактериоцины — жизнеспособная альтернатива антибиотикам?
Nat. Rev. Microbiol.
11, 95–105. (10.1038 / nrmicro2937) [PubMed] [CrossRef] [Google Scholar] 103. Rea MC, et al.
2011 г.
Влияние противомикробных препаратов широкого и узкого спектра действия на Clostridium difficile и микробное разнообразие в модели дистального отдела толстой кишки. Proc. Natl Acad. Sci. США
108 (Дополнение 1), 4639–4644. (10.1073 / pnas.1001224107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 104.Корр С.К., Ли И, Ридель К.Ю., О’Тул П.В., Хилл С., Гахан К.Г.
2007 г.
Продукция бактериоцина как механизм противоинфекционной активности Lactobacillus salivarius UCC118. Proc. Natl Acad. Sci. США
104, 7617–7621. (10.1073 / pnas.0700440104) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
108. Цуй Дж., Джейкобс Дж., Браун Дж.
2014 г.
Бактериофаги как терапевтическая стратегия для нацеливания на прилипшую, инвазивную Escherichia coli , связанную с воспалительным заболеванием кишечника. Национальная конференция SACNAS, 16–18 октября, Лос-Анджелес, Калифорния .
109. Шаудер С, Басслер БЛ.
2001 г.
Языки бактерий. Genes Dev.
15, 1468–1480. (10.1101 / gad.899601) [PubMed] [CrossRef] [Google Scholar] 110. Резерфорд С.Т., Басслер Б.Л.
2012 г.
Определение бактериального кворума: его роль в вирулентности и возможности борьбы с ней. Харб Холодного источника. Перспектива. Med.
2, a012427 (10.1101 / cshperspect.a012427) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
кишечных патогенов
кишечных патогенов
Кишечные патогены
И.Агенты
II. Общие закономерности болезни
III. Эпидемиология
IV. Бактериальные кишечные возбудители — виды
болезни
A. Холера — прототипное токсигенное заболевание
B. Шигеллез — прототип инвазивный
болезньC. Прочие кишечные патогены
Кишечные патогены
Большое количество патогенов могут вызывать
кишечное заболевание.К ним относятся бактерии, вирусы, простейшие
и грибы
Кишечные патогены
Вирусы — ротавирус
Norwalk агент
Холерный вибрион
Шигелла
E.кишечная палочка
Campylobacter jejuni
Salmonella виды
Простейшие
В промышленно развитых странах основные причины
кишечных инфекций:
Вирусы — ротавирус, вызывающий
зимние эпидемии вг.
детей и агент Norwalk, который
связанныйс летними вспышками у детей и
взрослыеE.кишечная палочка
Campylobacter jejuni
Salmonella spp .
Во всем мире: холера и дизентерия являются основными
причины заболеваемости и смертности.
Общие закономерности заболевания :
Диарея может быть результатом токсичности или инвазии ,
симптомы возникают в результате размножения организмов и
вторжение кишечного эпителия и / или выработка токсинов
(Фигура
1, рисунок 2).Заболевание может варьироваться от легкой диареи (которая даже
хотя легкая форма может быть серьезной проблемой для младенца или недоедания
индивидуальный) к системной, фатальной сепсисе или токсемии
Эпидемиология
Они передаются фекально-оральным путем. В
патогены выводятся с калом, а затем распространяются известными
4 Fs: кал, пальцы, еда и мухи. Если возбудитель или его
токсин в основном передается с пищей, болезнь будет называться
пищевое отравление .Эти заболевания обычно отражают фекальные
загрязнение продуктов питания и воды и, следовательно, связано с плохим
санитарии, исключением являются пищевые отравления токсинного типа,
как ботулизм и S. aureus, при которых проглоченный токсин или
организмы могут происходить из окружающей среды, а не фекалий
загрязнение. Большинство случаев связано с зараженными продуктами питания.
или вода, или наличие здоровых носителей в сообществе.
Эти болезни могут быть эпидемическими или эндемичными .
Резервуар: Для многих кишечных патогенов,
резервуаром являются люди, но для других, таких как Salmonella
видов животных-хозяев может быть много.
Мы обсудим только некоторые из этих болезней,
в частности, вызванные кишечными бактериями. Эти
бактерии вызывают 5 основных паттернов болезней:
1. Энтеротоксигенный — (прототип В.
холера )Бактерии прикрепляются к тонкой кишке —
выделяют токсин — водянистыйдиарея
2. Дизентерия — (Shigella)
Инвазивные и размножение слизистой оболочки внутри
эпителиальные клеткитерминальный отдел подвздошной кишки и толстый кишечник
3. Разрушение границы кисти
без дальнейшего вторжения4. Поражение брыжеечной
лимфатические узлы или,5. Септицемия
Некоторые виды, такие как E.coli и сальмонелла
попадают в несколько из этих групп в зависимости от
отдельные штаммы:
E. coli 1,2,3,5
S. typhi 5, но S. энтеридит
1, 4Campylobacter 1,2, 4
Трудно идентифицировать эти патогены у многих
экземпляров — как отличить нормальную флору E.
coli и тот, который является причиной заболевания.Это часто
необходимо для определения наличия специфических факторов вирулентности
вместо того, чтобы просто идентифицировать бактерию
Дизентерия
Результаты бациллярной дизентерии (упоминание амебной)
от заражения любой шигеллой
4 вида: все патогены для человека
Shigella dysenteriae **
S. flexneri
С.boydii
с. sonnei *
Перечислены в порядке убывания степени серьезности
болезнь* наиболее распространен в США
** наименее распространен в США
Эпидемиология: узкий диапазон хозяев -человек
водохранилище,
Заражающая доза: 10-1000 организмов
чрезвычайно заразен / очень легко
спредможет распространяться фомитами, так как
необходимая доза настолько маламытье рук редко эффективно в
уничтожение организмовВысокая заболеваемость, за исключением эндемичных районов
где есть некоторое наращивание иммунитета.Очень трудно контролировать распространение болезней,
особенно в любом месте, где есть санитария.
«так себе» (детские сады, учреждения, армии,
большие сборища Радужные люди)Инкубационный период: 1-4 дня
Симптомы: Внезапное начало
Сильные спазмы в животе
лихорадка
диарея — часто с кровью и слизью
малый объем, частый
обычно не водянистый понос, как
холера, хотя иногда наблюдается водянистый понос из-за
к токсину шига, действующему на тонкий кишечник (токсин шига
выпущен в пути или нетипичная колонизация
тонкий кишечник)неврологический sxs: вялость, спутанность сознания
Патология: Колонизирует толстую кишку
эпителий
Изъязвление подвздошной и толстой кишки
эпителий, поражающий толстую кишку (всасывающий
функция)таким образом, см. Небольшой объем, кровянистый, слизистый
табуретыводянистый, объемный понос, вызванный:
маленькийкишка вовлечена ( секреторная
функция)Отличительные поражения: небольшие язвы толстой кишки
(маленькие кратеры)язв / абсцессов, покрытых псевдомембраной
, состоящий из мертвых бацилл
эпителиальные клетки,остатков фибрина и полиморфно-ядерных
лейкоциты.Размножение бактериальных клеток
приводит квыброс эндотоксина и метаболизма
побочные продуктыShigella вызывает сильное воспалительное
ответстимуляция хемотаксических факторов (через
эндотоксин и др.)приток PMNs лизис хозяина
клетки -> высвобождение интерлейкинов и др. дополнительных PMN
подходит к району-> воспалительная реакция, спазмы,
высокая температура….Бактерии не обнаруживаются за пределами пластинки
propriaимеют только ограниченное инвазивное
потенциалне вызывают сепсис
т.е. высокоинвазивный с точки зрения
проникает в эпителиальные клетки кишечника, но
не вторгаются системно — ограничено локализовано
вторжениеСамоограничивающееся заболевание
опасно для жизни у младенцев / маленьких
дети из-за обезвоживания или хронического недоедания
Патогенность: при попадании внутрь, организмы
должен
Пережить транзит через желудок
(кислотостойкий)Присоединить к эпителиальным клеткам толстой кишки
Вторгнуться в ячейки
Размножение в эпителиальных клетках
Распространение внутриклеточно и
межклеточноПримечание : Внутриклеточный паразит (
против.внутриклеточный возбудитель)
Факторы вирулентности:
(1.) Приверженность
2. Способность проникать в эпителиальный
ячейки3. Способность размножаться в эпителиальной
ячейки4. Возможность распространения на соседние
ячейки(5.) Токсины
() не очень хорошо определен, поскольку
вклад в вирулентность
Токсины:
В 1953 году Ван Хейниган сообщил об изоляции
и очистка от токсина из супернатантов культур S.shigae ( S. dysenteriae ). Это было классифицировано как
нейротоксин, Шига токсин , так как он вызывает паралич и
смерть мышей после инъекции. В естественных инфекциях , это
ведет себя больше как энтеротоксин и обладает энтеротоксической активностью
был отмечен в лигированных петлях подвздошной кишки кролика. (re: анализ холеры)
Однако шигеллы встречаются в больших
кишечник, на подвздошную кишку влияние относительно невелико.
Токсин также обладает активностью цитотоксина в
клетки культуры ткани.При нанесении на монослой клеток он лизирует
клетки
Токсин шига: подавляет синтез белка
в экстрактах клеток млекопитающих
ингибирование не требует NAD
в отличие от активности токсина дифтерии
(цель: рибосома — отщепляет аденин от 3 ‘
конец 28СТаким образом, компонент
рРНК рибосомы блокирует
аминоацил тРНК связывает и ингибирует пептид
удлинение)
Шига-подобный токсин (SLT)
Первоначально считалось, что токсин шига обнаружен только в S.dysenteriae , но более поздние исследования продемонстрировали
наличие близкородственного токсина, называемого шига-подобным токсином, в
культуры S. flexneri и S. sonnei :
O’Brien et al. изолированные и частично
очищенный SLT из S.
Генетика производства токсина шига:
Хромосомно закодировано в Shigella: stx
локус stx A stx B1 субъединица А — ферментативная активность
+ 5 субъединиц B — активность связывания
Наличие токсина способствует
фактор, но не существенный для вирулентности
Регламент:
Синтез токсина шига, репрессированного Fe
как дифтерийный и ботулинический токсины
Жизненный цикл шигелл в клетках-хозяевах (Рисунок 3)
Каждый из этих шагов / этапов абсолютно
необходимо для производства болезни
Приверженность: явно участвует в
первые шагиШигеллы, вероятно, попали через
М-клетки, а затем проникают через субэпителиальные пространстваПроникновение = Вторжение = Вход:
, по-видимому, является одним из самых важных
шаги ввызывает болезнь
Механизм: направленный фагоцитоз
по безпрофессиональный фагоцит
Лизис пузырька
Попав внутрь клетки, микроб должен
уметьразрушить фагосомный пузырек и получить
запись вцитозоль
Опосредовано контактным гемолизином
Внутриклеточное умножение:
Рост в кишечном эпителии
ячейка, которая не оборудована для уничтоженияЗащищено от гуморального иммунного ответа
компонентыЗащищено от макрофагов
Подвергается воздействию различных факторов окружающей среды
Распространение на соседние ячейки:
Эта способность требуется для производства.
болезниВключает индуцированную полимеризацию актина
от Shigellaповерхностный белок
См. Бактерии, связанные с клеткой-хозяином
выступы, которые выдавливаются в соседние клетки-хозяева
Генетика вирулентности
Большая (220 кБ) плазмида, необходимая для вирулентности
Плазмида вирулентности:
Семейство больших плазмид Shigella spp
Кодирует ряд белков, экспрессируемых на
поверхность шигелл, которые участвуют в:
прикрепление, индукция фагоцитоза, лизис
фагоцитарная вакуоль (контактный гемолизин) и распространяется на
соседние ячейки
Регламент температуры г.
кодируемые плазмидой факторы вирулентности
Выражается при 37 ° C (температура внутри хоста)
Не выражается при 30C
Используйте T D в качестве сигнала окружающей среды, чтобы предупредить микроб
расположениеНесколько хромосомных локусов
также требуется для вирулентности
Штаммы ETEC вызывают холеруподобные
синдром
Вирулентность этих штаммов связана с
производство токсинов, но они должны прилипать и
колонизировать тонкий кишечник — прикрепиться через специфических пилей или
гребешок
LT — Этот токсин связан с
холерный токсин86K белок, состоящий из 1 субъединицы и 5 b
субъединицыперекрестная антигенная реактивность между двумя
функционально то же — привязка к GM1,
стимулируют аденилатциклазу.Второй LT был изолирован
из штаммов свиней, родственных CT, но отличных от LT человекаE. coli LT обычно представляет собой плазмиду.
кодируется, в то время как CT является хромосомным
Другой класс токсинов кишечной палочки — это течка.
стабильные токсины :
STA — активен на различных животных
иСТБ — действует только на свиней
Это небольшие полипептиды — ~ 18 аминокислот.
— показывают некоторые вариации на амино-конце, но
карбокситерминус не отличается
ST быстро связывается с клетками и активирует
кишечный гуанилат циклаза
Повышенный уровень цГМФ вызывает мембрану
изменения, которые приводят к чистой секреции жидкости и электролитов
Гены
ST также являются плазмидой, кодируемой
Ген STA — это транспозон, фланкированный
инвертированные повторы IS1
ST и LT обычно обнаруживаются на одной плазмиде —
Штаммы LT +, ST + вызывают наиболее тяжелое заболевание
штаммов LT + / ST- и LT- / ST + также были
изолированные и патогенные
Энтеропатогенные E.coli (EPEC)
1940-х и 1950-х годов было отмечено, что E. coli
изолированные от случаев детской диареи попадали в определенные O: H
серотипы. Эти конкретные серогруппы редко встречались в
здоровые дети. Введен термин «энтеропатогенный» E.
кишечная палочка
Эти штаммы вызывают диарею у добровольцев, но
отсутствуют LT и ST и не связаны с дизентерией
вторжение. Эти штаммы колонизируют и вызывают разрушение кисти.
граница.
Хотя эти штаммы не вызывают LT или ST,
они вырабатывают по крайней мере один токсин, который может играть роль в заболевании:
Шига-подобный токсин (SLT)
Энтероинвазивный E. coli —
дизентерия, клинически выглядит как шигеллез
Эти штаммы способны к инвазии и
размножение в эпителиальных клетках толстой кишки.Плазмида размером 220 т.п.н. со значительной последовательностью
гомология S.обнаружена плазмида вирулентности flexneri
у этих штаммов
Учитывая беспорядочный характер кишечных
природа — неудивительно, что много обычных плазмид и общих
патогенные механизмы встречаются
Клонированные гены используются в качестве зондов для обнаружения
эти патогенные E. coli в культурах или клинических образцах
Salmonella видов также a
разнородная группа:
Энтеротоксигенные штаммы продуцируют
лабильный токсин, сходный по функциям и антигенности с холерой
токсин
С.тиф и паратифы —
представляют собой наиболее инвазивные кишечные возбудители, вызывающие тиф или
паратиф соответственно
S. typhi и paratyphi A являются
строго человеческие патогены ( paratyphi B имеют другие животные
резервуаров)
Брюшной тиф (Рисунок 4)
начинается с приема внутрь S. typhi
из зараженной пищи или воды организмы проникают в
слизистая оболочка кишечника, но при этом не вызывают кишечных симптомов
сцена.Получите доступ к регионарной лимфатической системе и распространите
системно.
В собственной пластинке неиммунного хозяина —
вызвать приток макрофагов. Те, что не проглочены
локально, стекать в мезентериальный лимфатический узел и может быть фагоцитозирован
или получить доступ к крови — отфильтрованной ретикулендотелием
клеток по всему телу — диссеминации . Бациллы
продолжают размножаться и остаются не убитыми макрофагами .
Это факультативных внутриклеточных возбудителей .
Инкубационный период 10-14 дней
после проглатывания —
появление симптомов:
Появление симптомов, связанных со вторым,
устойчивая бактериемия
Лихорадка, розовые пятна — вероятно, оба
проявления эндотоксемии, спленемегалии, боли в животе
и диарея
Как и многие внутриклеточные возбудители, S.тиф
вызывает более хроническое заболевание
Носители не редкость, и ~ 3% становятся хроническими.
носители — могут продолжать носить и сбросить организм
на всю жизнь — например, Брюшной тиф Мэри
S. typhi очень хорошо растет в желчи, может
сохраняются в желчном пузыре и желчных путях, а клетки
постоянно попадает в кишечник. Это лучшие
переносчики болезни.
Устойчивость к S.typhi относительно сложный
— задействован как гуморальный, так и клеточный иммунитет
Бактерии имеют капсулу, антиген Vi, а не
антифагоцитарные, но клетки Vi + более вирулентны. Может помочь защитить
ошибка, защищая антигены O от антител, которые могут быть
присутствует в крови
Антитела против Vi чаще встречаются в
хронические носители
Антигены O или H, ассоциированные с острым
случаях, H ab сохраняется, O Ab может перекрестно реагировать с другими энтеросолюбильными препаратами
Иммунитет может потребовать разработки
клеточный иммунитет, активированные макрофаги и Т-клетки, которые могут
предотвратить бактериемию у ранее инфицированных или хронически инфицированных
частные лица.
Самая распространенная Salmonella
инфекции сейчас S. энтеридит (тип 4 на диаграмме)
Короткий инкубационный период 8 — 48 ч. Как правило
следует за употреблением зараженной пищи, но может быть получен из
животных:
домашних черепах и других рептилий часто переносят
Сальмонелладомашняя птица, утки, индейки — 40%
здоровые индюки заражены
прямой контакт с животными может привести к
инфекция — чаще — пища заражена во время
переработка — яйца от зараженных кур, неправильно убитых
индейки и др.
Организмы проникают в эпителий и размножаются
внутри собственной пластинки, впадают в мезентериальные лимфатические узлы, но
редко становятся сепсисом, за исключением зараженных хозяев.
Взаимодействие кишечного эпителия с патогеном и местной микробиотой: трехстороннее взаимовлияние
Поверхности слизистой оболочки желудочно-кишечного тракта содержат огромное количество комменсальной микробиоты, которая эволюционировала вместе с хозяином, и, кроме того, демонстрирует одну из самых сложные отношения с хозяином.Эта взаимосвязь влияет на несколько важных аспектов биологии хозяина, включая синтез питательных веществ, защиту от инфекции и развитие иммунной системы. С другой стороны, несмотря на существование нескольких линий защитных механизмов слизистой оболочки, патогенные организмы, такие как Shigella и Salmonella, разработали сложные стратегии вирулентности для преодоления этих барьеров. Постоянный вызов со стороны этих патогенов и попытки хозяина противостоять им создают динамическое равновесие межклеточных и молекулярных перекрестных помех.Даже незначительные нарушения этого равновесия могут нанести вред хозяину, что приведет к тяжелой бактериальной инфекции или даже аутоиммунным заболеваниям, таким как воспалительное заболевание кишечника. Несколько экспериментальных модельных систем, включая стерильных мышей и мышей, получавших лечение антибиотиками, использовались различными исследователями для изучения этой сложной взаимосвязи. Хотя это только начало, это обещает стать захватывающей эрой в изучении взаимоотношений хозяина и микроба.
1. Введение
В кишечнике зрелого человека обитает огромное количество бактерий, называемых
комменсальная микрофлора или, в последнее время, «микробиота».» Это было
По оценкам, эта микробиота состоит из более чем 10 14 особей
бактерии, насчитывающие более 500 различных видов [1]. Примечательно, что состав
микробиота индивидуальна, и тип видов, обитающих в желудочно-кишечном тракте
(GI) тракт варьируется в зависимости от возраста, диеты и состояния здоровья организма-хозяина [2]. Фактически, общее количество микробов
в желудочно-кишечном тракте человека намного превышает (> 10–100 раз)
сумма всех наших соматических и половых клеток.Биологический результат этого огромного и
сложная популяция микробов заключается в том, что их гены (так называемый микробиом)
синтезируют примерно в 100 раз больше белков, чем соматические клетки своего хозяина [3].
Нет
Удивительно, но кишечник человека более густонаселен микроорганизмами.
чем любой другой орган, и это место, где они оказывают сильное влияние на человека
биология. Это потому, что кишечник
слизистая оболочка служит первичной границей между иммунной системой и внешним
окружающей среды, и, кроме того, играет центральную роль в комменсальной флоре хозяина
взаимодействия.Накапливающиеся данные указывают на то, что микробиота кишечника
способствует поддержанию энергетического обмена и иммунной функции хозяина.
Более поздние исследования показывают, что комменсальная микробиота играет важную роль.
роль в развитии множества состояний, включая ожирение [4, 5], диабет [6], неалкогольную жировую болезнь печени [7], воспалительное заболевание кишечника [8] и, возможно, рак [9]. К сожалению, огромная сложность
кишечной флоры вместе с ее очень сложными взаимодействиями с кишечной
эпителий делает его устойчивой к изучению системой.Хотя в основном
неисследованная, наша кишечная микробиота играет сложную и недооцененную основную
роль для нашего здоровья и благополучия. В этом обзоре мы обсудим новые
разработки в области, которые подчеркивают клеточную и молекулярную основу
перекрестные помехи между хозяином, комменсальной микробиотой и патогенными
бактерии как в здоровом, так и в больном желудочно-кишечном тракте.
2. Роль микробиоты в желудочно-кишечном тракте
микрофлора кишечного микроокружения как единица обеспечивает важные
защитные, метаболические и трофические функции.Резидентные бактерии служат центральным
линии устойчивости к колонизации экзогенными микробами и, таким образом, помогают в
предотвращение потенциального проникновения на слизистую кишечника поступающего
возбудитель. Эта защитная функция известна как барьерный эффект или колонизация.
сопротивление и выполняет ряд важных ролей. Например, приверженец
непатогенные бактерии часто могут предотвратить прикрепление и последующее проникновение
подозреваемые патогены в эпителиальные клетки, а также конкурируют за питательные вещества
доступность.Комменсальная микробиота
также помогает поддерживать гомеостаз питательных веществ в желудочно-кишечном тракте, вводя и потребляя все
Ресурсы. Например, диетическое
питательные вещества всасываются в кишечнике и вместе с различными непищевыми веществами.
соединения, вырабатываемые микробиотой, метаболизируются ферментами хозяина, такими как
цитохром P450 и конъюгированные ферменты в печени [10]. Образующиеся метаболиты, которые
полученные как от хозяина, так и от микробов, возвращаются в кишечник
желчь для дальнейшего метаболизма или выведения [11].Это взаимовыгодные отношения
помогает уменьшить нежелательное перепроизводство питательных веществ, которое потенциально может
поддерживать вторжение микробных конкурентов с потенциальным патогенным исходом
для хоста [12].
Довольно
примечательно, что отсутствие кишечных бактерий связано с уменьшением
обновление клеток слизистой оболочки, васкуляризация, толщина мышечной стенки, подвижность, исходный уровень
производство цитокинов, активность пищеварительных ферментов и опосредованные дефектными клетками
иммунитет [13].Действительно, сравнительные исследования в
стерильные и обычные животные установили, что кишечник
микрофлора необходима для развития и функционирования иммунной системы слизистых оболочек.
система в раннем детстве, процесс, который, как теперь известно, важен для
общий иммунитет у взрослых. Например, было хорошо установлено, что
количество интраэпителиальных Т-клеток и Т-клеток собственной пластинки ниже в стерильных
животных, эта особенность полностью меняется после восстановления нормальной флоры [14].Точно так же уровни секреторного IgA
в кишечнике стерильных животных, но заметно увеличивается при
кишечная колонизация комменсальной бактерии Bacteroides thetaiotamicron [15]. Кроме того, интимные отношения
между комменсальной микробиотой и кишечным эпителием участвуют в
формирование механизмов памяти системного иммунитета, например оральной толерантности.
Первоначально это было признано открытием, что системная реакция на
специфический патоген может быть устранен после приема антигена; этот эффект
продолжается в течение нескольких месяцев у традиционно колонизированных мышей, тогда как у
Системная невосприимчивость мышей без микробов сохраняется всего несколько дней [16].Следовательно, врожденная иммунная система
различает потенциальных патогенов из комменсальной микробиоты с помощью
индуцирование толерантности к микробным эпитопам. Это, в свою очередь, снижает реакцию на
часто встречающиеся пищевые продукты и другие антигены окружающей среды. Коллективно
эти примеры помогают проиллюстрировать важную концепцию того, что комменсальный
микробиота глубоко влияет на развитие иммунной системы слизистой оболочки кишечника.
системы и необходимы для предотвращения проникновения экзогенных патогенов.
Микрофлора кишечника также составляет
важный метаболический вклад за счет производства витамина К, фолиевой кислоты и короткоцепочечных
жирные кислоты (основной источник энергии для энтероцитов) и опосредуют распад
диетических канцерогенов [2, 17]. Возможно, основная метаболическая функция толстой кишки
микрофлора — это ферментация неперевариваемых углеводов. Эти
неперевариваемые углеводы включают крупные полисахариды (т. е. устойчивые
крахмалы, пектины, целлюлоза), некоторые олигосахариды, которые не перевариваются, как
а также неабсорбированные сахара и спирты.Первичная метаболическая конечная точка таких
ферментация — это образование короткоцепочечных жирных кислот (ацетат,
пропионат, бутират). Фундаментальная роль короткоцепочечных жирных кислот в
Физиология толстой кишки заключается в их трофическом воздействии на эпителий кишечника.
Следовательно, короткоцепочечные жирные кислоты, по-видимому, играют важную роль в
контроль пролиферации и дифференцировки эпителиальных клеток в толстой кишке.
Недавние исследования также показали влияние бутирата на кишечный барьер.
функция [18].Более того, было показано, что комменсальные бактерии могут модулировать ген
выражения в хозяине, чтобы создать устойчивую среду для
сами по себе, в то же время препятствуя росту других конкурентоспособных
бактерии в экосистеме кишечника [15].
Чтобы хозяин процветал и производил больше
кишечника, микробная экосистема кишечника должна быть функционально стабильной
время, несмотря на внутреннюю динамику сообщества. Составляющие бактерии
ожидается высокая степень функциональной избыточности между видами, поэтому
что потеря одной линии не влияет отрицательно на гомеостатический баланс
микросреды кишечника [19].Пока неясно, как селективный
давление, динамика микробного сообщества и кишечная микросреда
формируют геном и последующие функции членов микробиоты кишечника,
Есть несколько интересных новых разработок в этой области. Например, Gordon et al.
al. представили провокационную концепцию, что эволюция кишечника
микробиом также, вероятно, играет важную роль в формировании эволюции
люди [19]. Этот принцип основан на экспериментах в
которой эта группа исследователей секвенировала геномы двух обитающих в кишечнике
Bacteroidetes и сравнили их геномы с геномами других бактерий, которые
живут как внутри, так и вне человеческого тела.Примечательно, что они
обнаружили, что боковой перенос генов, мобильные генетические элементы и ген
усиление играет важную роль в влиянии на способность
Bacteroidetes, чтобы изменять свою клеточную поверхность, чувствовать окружающую среду и собирать урожай.
питательные ресурсы, присутствующие в дистальном отделе кишечника [19]. Важно отметить, что эти выводы лежат в основе
концептуальная основа, позволяющая предположить, что адаптация к экосистеме кишечника является
динамический процесс, включающий приобретение генов от других микроорганизмов,
и далее подчеркивает важность рассмотрения эволюции людей.
с точки зрения эволюции микробиома [19, 20].
3. Ограничение проникновения патогенов и комменсалов за пределы поверхности слизистой оболочки
хозяин защищен от потенциально вредных кишечных микроорганизмов
физические и химические барьеры, создаваемые кишечным эпителием,
в основном состоит из поглощающих энтероцитов ворсинок [21]. Апикальная поверхность энтероцитов
высокодифференцированные конструкции, состоящие из жестких, плотно упакованных
микроворсинки, мембраны которых содержат стебельчатые гликопротеиновые ферменты [22, 23].Кроме того, кончики микроворсинок энтероцитов
покрытый слоем толщиной 400–500 нм
сетка, известная как гликокаликс нитевидной границы кисти [24], состоит из сильно гликозилированных
трансмембранные муцины [25, 26]. Кишечный эпителиальный барьер также состоит из
энтероэндокринные клетки, бокаловидные клетки и клетки Панета. Микроскладчатые (M) клетки
также присутствуют в связанном с фолликулом эпителии, где они представляют собой
морфологически отличный тип эпителиальных клеток, основная функция которых
является переносчиком макромолекул, частиц и микроорганизмов
от просвета до подлежащей лимфоидной ткани [27, 28].Межклеточные соединительные комплексы, состоящие из
плотные соединения, адгезивные соединения и дезомосомы поддерживают целостность
эпителиальный барьер. Наиболее апикальные компоненты соединительного комплекса
плотные соединения эпителия, которые строго регулируются и служат для
создать полупроницаемый диффузионный барьер между отдельными клетками (рис. 1 (а)).
В совокупности эти особенности помогают кишечному эпителию действовать как
физический барьер для предотвращения доступа нежелательных бактерий к хозяину.
Кишечный эпителий также
обеспечивает уникальную поверхность, оснащенную множеством специализированных ячеек, которые
продуцируют слизь, антимикробные пептиды и антимикробные молекулы, которые
вместе образуют переднюю линию защиты от патогенных микроорганизмов (рис. 1 (а)). Слой слизи секретируется бокаловидными клетками, и этот слой покрывает
кишечный эпителий, чтобы создать физическую блокаду против нарушения
кишечные микробные возбудители. Например, было продемонстрировано, что
секретируемая слизь действует как барьер для Yersinia enterocolitica [29], ротавируса резуса [30] и Shigella.
flexneri [31].Комменсальная микробиота также была
установлено, что регулирует выработку кишечных муцинов, которые, следовательно,
подавляет прикрепление многих патогенных бактерий к кишечному эпителию.
клетки [32–34]. Клетки Панета
еще один важный тип клеток, которые участвуют в защите кишечника от
потенциально вредные болезнетворные бактерии. Эти клетки присутствуют в основании
склеп Либеркюн [35] и, как было показано, производил ряд
антимикробных пептидов.Кроме того, в желудочно-кишечном тракте
антимикробные пептиды эволюционно консервативны [36], и на сегодняшний день α -дефенсинов (HD), β -дефенсинов (hBD) и кателицидинов были
выявлены у человека [37]. Клетки Панета также производят ряд
антимикробные молекулы, включая лизоцим, фосфолипазу A 2 и
ангиогенин-4 (см. обзор [37]). Следовательно, это выводится многочисленными
исследования того, что клетки Панета способны контролировать бактериальную экосистему (Таблица
1).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ангиогенин-4 экспрессируется в основном в
тонкий кишечник, слепая и толстая кишка и действует на грамположительные бактерии [49, 50].Однако большинство антимикробных пептидов, экспрессируемых
эпителиальные клетки млекопитающих являются членами семейств пептидов, которые опосредуют
неокислительное уничтожение микробных клеток фагоцитами [50]. Эти амфипатические молекулы взаимодействуют с бактериальными мембранами и лизируют их [55]. Defensins
обычно обладают широким спектром антимикробной активности (Таблица 1). В
В частности, было показано, что дефенсин-5 кишечника человека убивает Listeria monocytogenes , E. coli, и Candida albicans [40].Дополнительные доказательства, подтверждающие
критическая роль дефенсинов in vivo
было продемонстрировано в исследовании с использованием трансгенных мышей с человеческим дефенсином-5; эти
мыши проявляли выраженную устойчивость к пероральному заражению вирулентным сероваром Salmonella enterica Typhimurium ( S. typhimurium ) [39]. В
эпителиальные клетки кишечника также экспрессируют другой класс антимикробных
пептид, кателицидины (LL-37 / Cap18), в которых домен кателина связан
к пептиду с антимикробной активностью [56].LL-37 выражается в
эпителиальные клетки, расположенные на поверхности и верхних криптах нормальной толстой кишки человека.
Хотя в более глубоких криптах толстой кишки или
в эпителиальных клетках тонкой кишки исследования на мышах определили
эти молекулы должны защищать от бактериальных патогенов [47]. Интересно, что выражение этих
факторов, в отличие от ангиогенинов, не индуцируется наличием патогенных
бактерии, а их секреция вызвана комменсальной микробиотой
и / или их производные.Недавнее добавление к постоянно растущему списку кишечных
противомикробное средство включает RegIII γ , который, как было показано, токсичен для
Грамположительные бактерии [52]. RegIII γ представляет собой лектин С-типа, который связывается с
углеводный фрагмент, составляющий стенку бактериальной клетки, петидогликан. Недавний
исследования также показали, что экспрессия RegIII γ сильно зависит от присутствия
микрофлора кишечника, поскольку у мышей без микробов экспрессия RegIII γ сильно подавлена [53] (Таблица 1).
Кишечный эпителий также обеспечивает
поверхность, на которой хозяин может ощущать микробную микросреду, чтобы
вызвать соответствующий защитный ответ, выпустив массив сигналов
молекулы (например, хемокины и цитокины). Эти молекулы затем запускают набор
лейкоциты, чтобы вызвать ранний воспалительный ответ. Как ни парадоксально, но
хотя постоянно подвергается воздействию грамположительных и грамотрицательных бактерий и
их продукты (т.е., липополисахарид (ЛПС), пептидогликан и липопротеин)
нормальная здоровая слизистая кишечника поддерживает механизм
гипореактивность к микробиоте просвета и их продуктам. Преувеличенный
воспалительные реакции в отсутствие патогенных бактерий иначе были бы
вредно [57, 58]. Соответственно, нормальный кишечный эпителиальный хозяин
защиты способны точно интерпретировать сложную микробную среду в
чтобы различать постоянно установленные комменсальные микробы и
эпизодические возбудители.
В основе этой стратегии
все эндогенные микробиоты обладают собственными сигнатурными молекулами, называемыми
молекулярные структуры, связанные с микробами [59]. Однако при заражении патогенным
организма, иммунный ответ хозяина активируется путем специфического распознавания
«Чужие» молекулярные структуры, известные как молекулярные структуры, связанные с патогенами.
Эпителиальные клетки способны ощущать микросреду в кишечнике с помощью
средства рецепторов распознавания образов (PRR), которые включают Toll-подобные рецепторы
(TLR) и белки нуклеотид-связывающего домена олигимеризации (NOD) [38, 60–63].TLR эволюционно консервативны и характеризуются
внеклеточный домен с богатыми лейцином повтора (LRR) (вовлеченный в лиганд
распознавание), а также внутриклеточный рецептор Toll / интерлейкин-1
домен (участвует в передаче провоспалительного сигнала) [60, 64–66]. Кроме того, два белка NOD (NOD1 и NOD2) функционируют как
внутриклеточные сенсоры бактериальных продуктов в индукции воспалительного
ответ [60, 64–67].
Эти
PRR распознают бактериальные факторы, такие как LPS, липопротеины, флагеллин,
неметилированная CpG ДНК и большое количество других специфических компонентов.Регуляция экспрессии и конкретного местоположения TLR и NOD в
кишечные эпителиальные клетки способствуют эффективному иммунному распознаванию
комменсальная микрофлора и поддерживает хрупкий баланс; позволяя базальный уровень
сигнальных событий, чтобы продолжить, в то же время сдерживая врожденные
иммунные ответы. Например, в здоровом кишечнике эпителиальные клетки экспрессируют
очень мало или отсутствует TLR2, TLR4 и CD14, и, как результат, сводит к минимуму
распознавание комменсальных ЛПС [68, 69].TLR5, который распознает бактериальный флагеллин, был
сообщается, что экспрессируется исключительно на базолатеральных поверхностях
эпителиальные клетки. Этот TLR идеально подходит для обнаружения своего лиганда,
транслоцированный флагеллин [70]. Кроме того, TLR3, TLR7, TLR8 и TLR9 являются
экспрессируется во внутриклеточных эндосомных компартментах [71]. Эти внутриклеточные PRR не будут
обычно встречаются люминальные комменсальные бактерии или бактерии, прикрепленные к апикальному
поверхность эпителиальных клеток кишечника, но они хорошо расположены для распознавания
патогенные бактерии, активно нарушающие эпителиальный барьер.Как
дополнительная мера, комменсальные бактерии обладают способностью вызывать
экспрессия кишечной щелочной фосфатазы, которая не только дефосфорилирует
пищевых липидов, но также дефосфорилирует ЛПС комменсальной флоры, что приводит к
в сниженной токсичности для млекопитающих [72].
Непатогенные микроорганизмы также могут быть
способен избирательно ослаблять путь NF-kB как механизм кишечной
иммунная толерантность. Neish et al. первоначально сообщалось, что колонизация человека
модельный эпителий кишечника с определенными штаммами непатогенных бактерий
может ослабить ответ клетки-хозяина на последующие провоспалительные проблемы
путем блокирования провоспалительного / антиапоптического пути NF- κ B [73].Этот эффект опосредуется ингибированием убиквитинирования I κ B- α , которое предотвращает регулируемое
I κ B- α деградация, NF- κ B ядерная транслокация и последующая
активация провоспалительных / антиапоптических генов. I κ B- α Убиквитинирование катализируется E3-убиквитинлигазой [74], которая регулируется посредством ковалентной модификации
cullin-1 убиквитин-подобным белком NEDD8 [75, 76]. Недавно было установлено, что взаимодействие
непатогенные бактерии с эпителиальными клетками приводят к быстрой потере
неддилированный Cul-1 и последующая репрессия пути NF- κ B [77].В совокупности этот набор наблюдений
подчеркивает способность кишечных бактериальных сообществ влиять на
эукариотических процессов и, возможно, более конкретно демонстрирует воспалительные
толерантность кишечного эпителия млекопитающих.
4. Как патогены преодолевают эпителиальный барьер
As
описанный выше, кишечный эпителий превратился в довольно грозную
крепость для защиты от микробного вторжения. Однако в процессе
коэволюция, потенциально вредные кишечные микроорганизмы развились противодействовать
стратегии захвата клеточных молекул и сигнальных путей хозяина
стать потенциально патогенным.В качестве первого шага в процессе заражения
определенные кишечные патогены нацелены на специфические структуры эпителиальных клеток, в том числе
гликопротеины и гликолипиды, которые служат рецепторами бактериальных
приложение [78]; таким образом, позволяя им использовать
лежащий в основе путь передачи сигнала. Другие стратегии вторжения
кишечные патогены, такие как S. typhimurium и Shigella flexneri , разработали сложную стратегию, которая
направляет проникновение кишечного патогена в эпителиальные клетки кишечника.Этот процесс требует экспрессии бактериальной системы секреции белков типа III (TTSS), функция которой заключается в доставке набора эффекторных белков в хозяйскую клетку [79–81]. Эти эффекторные белки кооптируют сигнал клетки-хозяина.
каскады трансдукции как умный способ подорвать нормальную клетку-хозяин
процессы, вызывая заметную перестановку хоста
цитоскелет. Этот механизм входа называется бактериальным опосредованным эндоцитозом.
проникновение бактерий и способствует проникновению возбудителя через эпителиальный барьер, поскольку
а также вызвать провоспалительный ответ [79–81].
последний шаг в этом процессе может быть достигнут путем прямого цитотоксического повреждения,
внутриклеточная миграция, нарушение плотных контактов эпителия или
косвенно, вызывая инфильтрацию нейтрофилов. Хотя несколько бактериальных
патогены смогли модулировать эпителиальные плотные контакты, чтобы
их собственное преимущество, прямое взаимодействие бактериальной вирулентности
фактор на составляющие белки плотного соединения был предложен
только в единичных случаях [82].Хорошо задокументировано, что ряд кишечных патогенов нарушает эпителий кишечника.
барьер и воздействие на TER или параклеточную проницаемость, чаще всего с
изменение расположения герметичного соединительного компонента
белки по механизмам, уникальным для разных патогенов [82]. Например, Clostridium difficile токсины A и B усиливают эпителиальный
проницаемость клеток за счет разрушения микрофиламентов актина внутри
перифункциональное кольцо [83], а энтеропатогенная Escherichia coli разрушает эпителиальный
барьер за счет фосфорилирования легких цепей миозина [84].Что касается S. typhimurium , модели инфекции in vitro имеют
выявили изменение проницаемости эпителия и потерю
барьерная функция, которая предполагает быстрые изменения как в плотном соединении
проницаемость и трансцеллюлярная проводимость [85, 86]. Недавние исследования также показывают, что эффекторный белок Salmonella SigD (также называемый SopB), который кодируется островом-1 патогенности Salmonella (SPI-1), способен вызывать снижение
функция эпителиального барьера, возможно, за счет активации PKC [87].Также эффекторные белки SopB, SopE,
SopE2 и SipA необходимы для разрушения эпителиального барьера и
изменить распределение по крайней мере некоторых белков плотных контактов [88, 89]. Такой
возмущения в компонентах плотного стыка приводят к усилению
бактериальная транслокация
и проникновение нейтрофилов через кишечный барьер. Следовательно
способность регулировать молекулярный состав плотных контактов
способствует патогенности S.typhimurium , способствуя его захвату и распределению в организме хозяина (рис. 1 (b)) [85].
S. flexneri имеет
особый способ патогенеза, который включает проникновение в эпителиальный слой толстой кишки.
клетки с базолатеральной поверхности [90], тем самым требуя ее
перемещение из просвета на нижележащую поверхность
эпителий. Это событие транслокации исторически было
объясняется захватом и транспортом М-клетками [91]. Однако с тех пор было установлено, что Shigellae также способны изменять компоненты
комплекс плотных соединений, позволяющий бактериям проходить через
парацеллюлярное пространство для достижения базолатеральной поверхности; событие, которое
также снижает барьерную функцию [92].Оказавшись на базолатеральной поверхности, Shigellae быстро вторгаются и
распространяются по эпителию, вызывая дальнейшее снижение
барьерная функция [92–94] за счет действия системы TTSS и
дополнительные белки, кодируемые большой плазмидой вирулентности [94–97].
кишечная
патогены вызывают у людей множество заболеваний, но одним неоспоримым симптомом является
проявление гастроэнтерита. Некоторые бактериальные кишечные инфекции
характеризуется нарушением нормального движения электролитов и воды
через эпителий, который преобразуется из состояния чистой абсорбции жидкости
к одной из чистых секреций жидкости [98].Секреторная диарея в результате
секреция эпителиального хлорида долгое время считалась защитой хозяина
механизм. Это основано на представлении о том, что повышенный уровень жидкости и электролита
движение в просвет кишечника помогает подавить прилипание патогенных организмов
путем «смывания» их с тела. Однако можно также утверждать, что
индукция диареи, вызванной патогенами, — это способ обеспечить передачу новым
хозяева, а значит, и патогенная пригодность [99]. Эти идеи не исключают друг друга.
секреторная диарея может быть полезной как для хозяина, так и для патогена.
Патогенные бактерии вызывают диарею
несколько механизмов. Холерные вибрионы находятся в просвете тонкой кишки и вырабатывают токсины, которые изменяют ионный
абсорбция и / или секреция [100, 101]. Другие бактерии, такие как Shigella и энтероинвазивная E. coli , вторгаются и
разрушают эпителий толстой кишки, что приводит к дизентерии [102]. Совсем недавно было показано, что патогенная кишечная палочка увеличивает
секреция хлорид-иона кишечным эпителием путем усиления экспрессии
рецептора нейропептида галанина 1 [103].Ротавирус, еще одна важная причина
диарея у младенцев, вызывает это состояние, активируя кишечную нервную систему.
система [104, 105].
Большой приток нейтрофилов (PMN) в
слизистая оболочка и просвет от подлежащей сосудистой сети является важной особенностью
кишечных бактериальных инфекций [105, 106]. При инфицировании эпителиальных клеток кишечными патогенами
таких как S. typhimurium и S. flexneri , синтезируется IL-8 и
секретируется базлатерально.Такой базолатеральный выброс IL-8 оставляет отпечаток субэпителиального матрикса.
с долгоживущими гаптотактическими градиентами, которые служат для нейтрофилов через
lamina propria в субэпителиальное положение [107]. Однако базолатеральное высвобождение ИЛ-8 ограничено.
недостаточно, чтобы вызвать миграцию нейтрофилов через кишечник
эпителий, предполагая, что производство других медиаторов воспаления,
высвобождение которого, вероятно, будет поляризовано апикально, важно для
выполнение этого шага в воспалительном пути [107, 108].В поддержку этого утверждения Kucharzik et al. недавно разработал
модель двойной трансгенной мыши со способностью индуцировать экспрессию человеческого IL-8
ограничивается кишечным эпителием [109]. Результаты этой трансгенной модели показали, что
хотя острой индукции IL-8 в кишечном эпителии достаточно для
запускают рекрутмент нейтрофилов в собственную пластинку, появляются дополнительные сигналы.
необходим для трансэпителиальной миграции нейтрофилов и повреждения слизистой оболочки.Действительно, недавние данные свидетельствуют о том, что эйкозаноид, гепоксилин A 3 ,
секретируется апикально и отвечает за последний этап нейтрофилов
трансэпителиальная миграция в просвет кишечника [110, 111]. Этот процесс
довольно сложные, поскольку отдельные сигнальные пути опосредуют инвазию S. typhimurium , индукцию секреции CXCL8 и
индукция секреции гепоксилина А 3 [111–113].
Способность серотипов Salmonella вызывать трансмиграцию ПМЯ in vitro коррелирует с их
способность вызывать диффузный энтерит (определяемый гистологически как трансэпителиальный
миграция нейтрофилов), но не брюшной тиф у человека [114].Более того, крупномасштабные трансэпителиальные
миграция вызывает снижение барьерной функции [115]. Исследования, изучающие механизм, лежащий в основе высвобождения HXA 3 во время
инфицирование S. typhimurium выявило участие S. typhimurium типа III секретируемого эффекторного белка SipA [116]. Модель S.
Эффекторный белок typhimurium , SipA, способствует каскаду передачи липидного сигнала
который рекрутирует фактор ADP-рибозилирования 6 фактор обмена гуаниновых нуклеотидов
(например, ARNO) к апикальной плазматической мембране.ARNO способствует ADP-рибозилированию
активация фактора 6 на апикальной мембране, который, в свою очередь, стимулирует
Рекрутирование и активность фосфолипазы D на этом сайте. Фосфолипаза D
продукт, фосфатидная кислота, метаболизируется фосфогидролазой в
диацилглицерин, который привлекает цитозольную протеинкиназу C (PKC) -альфа к
апикальная мембрана. Через процесс, который менее понятен, активирован
PKC-альфа фосфорилирует нижестоящие мишени, которые отвечают за
производство и апикальное высвобождение HXA 3 , который управляет трансэпителиальным
движение нейтрофилов [117].
5. Прототипические взаимодействия между патогенными бактериями и комменсальной микробиотой
Там
являются достаточными доказательствами, подтверждающими зарождающуюся концепцию того, что изменение
состав комменсальной микробиоты изменяет кишечник
микросреда, делающая эту нишу уязвимой для патогенного поражения. В этом
в разделе мы обсуждаем примеры, чтобы проиллюстрировать замечательные перекрестные помехи между
хозяина, его кишечной микробиоты и потенциальных патогенных бактерий.
Это
хорошо задокументировано, что S.
typhimurium вызывает системную инфекцию (брюшной тиф) у мышей при
у людей этот энтеральный возбудитель вызывает гастроэнтерит. Однако Barthel et al. обнаруженный
та предварительная обработка мышей C57BL / 6 стрептомицином, антибиотиком, убивающим
факультативные анаэробы с последующим инфицированием устойчивым к стрептомицину
штамм S. typhimurium вызывал устойчивый воспалительный ответ кишечника [118].Такой энтерит в первую очередь характеризуется воспалением.
в слепой кишке, а также имеет несколько типичных патологических
признаки острого , индуцированного сальмонеллой
гастроэнтерит у людей, включая инфильтрацию PMN и эпителиальных клеток
эрозия. Это интригующий результат, поскольку единственная разница между
нелеченные и получавшие стрептомицин мыши — это изменение комменсального
Флора; таким образом, демонстрируя, что присутствие микрофлоры играет важную роль.
защитная роль от патогенных захватчиков.Это исследование также подтверждает
давняя находка Барроу и Такера, которые обнаружили, что предварительное лечение
слепая кишка цыпленка с тремя разными штаммами E. coli значительно снизила инфицирование Salmonella по сравнению с необработанными животными [119]. Кроме того, Hudault et al. (2001)
определили, что присутствие одного вида E. coli в кишечнике может ограничить инфекцию S . typhimurium по сравнению с его стерильным
аналог [120].
Подробнее
недавно Stecher et al. использовал S.
typhimurium модель колита для исследования конкуренции между кишечными
патоген и микробиота хозяина [121]. Эта группа обнаружила, что воспалительные реакции, вызванные S. typhimurium , приводят к глубокому
нарушения в составе комменсальной микробиоты, определяемые
16S рРНК. Воспалительные реакции хозяина, вызванные S. typhimurium , не только изменили состав микробиоты, но и
подавлял его рост, тем самым преодолевая сопротивление колонизации.В противоположность,
авирулентный мутант Salmonella
дефект в инициировании воспаления не смог преодолеть колонизацию
сопротивление. Эти результаты поднимают интересный вопрос в том, что, возможно,
воспаление кишечника, вызванное S.
typhimurium может стать решающим событием для преодоления колонизации
сопротивление. В этом отношении запуск иммунной защиты хозяина может изменить
баланс между защитной микробиотой и патогеном в пользу
возбудитель.Идея о том, что микробиота кишечника может быть изменена путем вторжения
патогены также поддерживаются Lupp et al. кто нашел этот опосредованный хозяином
воспаление в ответ на инфекционный агент, вызвавший изменения в
толстой кишки, что привело не только к устранению подмножества
местная микробиота, но также привела к росту энтеробактерий
семья [122]. Более того, у детей, перенесших
лечение диареи, колебания микрофлоры кишечника не наблюдались
как при ротавирусной, так и при неротавирусной диарее [123].Этот фенотип был обратным, и
нормальная микрофлора восстановилась примерно через три месяца после болезни
эпизод. Другие исследования изучали роль кишечной микробиоты.
при передаче инфекционных заболеваний. В частности, Lawley et al. описать
модель, в которой постоянно инфицированные мыши 129X1 / SvJ представляют собой естественную модель
коробка передач. В этой модели только подгруппа мышей, называемых «супершеддерами», могла
избавляться от большого количества бактерий в фекалиях.В то время как иммуносупрессия
инфицированные мыши не индуцируют фенотип супершеддера, мыши, леченные антибиотиками
показали высокий фенотип супершеддера [124]. Вместе эти исследования показывают, что
кишечная микробиота играет решающую роль в борьбе с патогеном
инфекция, болезнь и даже заразность.
Там
также являются примерами, в которых представители комменсальной микрофлоры способны
вызвать болезнь. Это особенно хорошо видно на примере Enterococcus faecalis , известного представителя желудочно-кишечного тракта.
микробиота.В здоровом кишечнике эти бактерии ведут себя как обычные обитатели
кишечная экосистема. Однако у людей, получающих антибиотики
лечения или лиц с ослабленным иммунитетом, E. faecalis может колонизировать новые ниши кишечника.
микроокружение как определенная подгруппа этого вида устойчиво к антибиотикам.
(Рисунок 1 (c)). В таких скомпрометированных условиях E. faecalis может инфицировать и распространяться на другие участки хозяина, такие как
как кровоток, мочевыводящие пути и хирургические раны.Неудивительно, что
подгруппа населения, несущая гены устойчивости к антибиотикам, также имеет генетические
элементы, придающие инфекционность и вирулентность. Кроме того, последовательность генома
из E. faecalis штамм V583, наиболее
Возбудитель устойчивой к ванкомицину энтерококковой инфекции в Америке [125] был недавно зарегистрирован [126]. Недавние исследования определили, что более 25% генома E. faecalis наиболее вероятно
происходит из мобильной или чужеродной ДНК, что могло способствовать быстрому
приобретение и распространение устойчивых к лекарствам штаммов [126].Другой пример — это Clostridium difficle , a
Грамположительные бактерии, которые могут безвредно населять кишечник человека.
Однако некоторые люди, проходящие терапию антибиотиками, в результате
их измененная микрофлора кишечника, представленная инфекцией C. difficle , сопровождающейся тяжелым кишечным колитом
(Рисунок 1 (c)) [127].
Комменсал
бактерии, такие как Bacteroides fragilis ,
может также подавлять другие условно-патогенные члены кишечной микрофлоры от
вызывая болезнь [128]. Б.
fragilis — это грамотрицательная бактерия, обитающая в здоровом человеке.
кишечник. Обычно эта бактерия представляет собой поверхностную углеводную капсулу.
известный как полисахарид А (ПСА), который способствует многим полезным
деятельность, лежащая в основе иммунного развития хозяина, включая активацию
CD4 + Т-клеток и стимуляция врожденного иммунного ответа через TLR2
сигнализация. Мазманян и др. определил, что B.
fragilis защищает хозяина от Helicobacter
hepaticus -индуцированный колит у экспериментальных мышей.Однако у животных
содержащие штаммов B. fragilis , которые
не экспрессирует PSA, H. hepaticus Колонизация привела к заболеванию и индуцированной продукции провоспалительных цитокинов
иммунными клетками кишечника [128, 129]. Таким образом, у здоровых людей оказывается, что PSA из B. fragilis необходим для получения некоторых
полезная деятельность. Несмотря на это, было обнаружено, что ПСА усиливает действие
способность B. fragilis вызывать
заболевание у пациентов с нарушенной поверхностью слизистой оболочки, например
послеоперационные пациенты.Эта функция запускается при входе в подслизистую оболочку
бактерии, во время которых ПСА активирует CD4 + Т-клетки, что приводит к образованию абсцесса [130].
6. Роль бактерий в воспалительном заболевании кишечника
Последние данные, полученные в результате различных расследований
вовлекает аномальные микробные взаимодействия хозяина в патогенез
воспалительное заболевание кишечника (ВЗК). Фактически, IBD преимущественно возникают в
толстая кишка и дистальный отдел подвздошной кишки (т. е. места, которые содержат самые высокие концентрации
кишечных бактерий).Важная роль микробных агентов в
Патогенез ВЗК предполагают многочисленные недавние исследования, в которых делается вывод о том, что
бактериальная флора различается у пациентов с воспалительным заболеванием кишечника (ВЗК).
и здоровые люди. Более того, накапливающиеся данные свидетельствуют о том, что
состав и функция микробиоты у пациентов, страдающих ВЗК, ненормальны.
Девяносто девять
процент кишечной микробиоты здоровых людей состоит из видов
внутри четырех бактериальных отделов: Firmicutes , Bacteroidetes , Proeobacteia и Actinobacteria [131, 132].Исследование микробного разнообразия при активной ВЗК
широко обсуждаемая тема, представляющая интерес, и это область исследований, все еще находящаяся на стадии своего развития.
младенчество. У пациентов с ВЗК раннее возвращение свидетельствует о снижении
в количестве полезных бактерий, таких как Bifidobacterium и Lactobacillus spp., и увеличение количества патогенных бактерий, таких как Bacteroides и Escherichia coli [132–136]. Такой дисбактериоз вызывает нарушение баланса между
предполагаемые видызащитных бактерий по сравнению с вредными, и может способствовать
воспаление. Другие исследования показали снижение микробного
разнообразие, которое сопровождает увеличение количества Enterobacteriaceae,
в том числе E. coli , с уменьшенным количеством Firmicutes ,
и, в частности, уменьшение количества видов Clostridium . Какими бы убедительными ни были эти данные, до сих пор нет доказательств того, что
обозначить, является ли конкретный патоген ответственным за начало или рецидив ВЗК
[132].Кроме того, наиболее убедительные исследования
получены из животных моделей. Тем не менее, ряд организмов был
причастен к болезни Крона с Mycobacterium
paratuberculosis и E. coli [137].
Пациенты
с ВЗК имеют большее количество бактерий, связанных со слизистой оболочкой, чем у контрольных пациентов
[138], а генерализованный или местный дисбактериоз
наблюдается из-за наличия небольшого количества нормальных бактерий и высокого
количество необычных бактерий с уменьшением биоразнообразия.Состав
повышенное количество бактерий, прикрепленных к кишечному эпителию при ВЗК
пациенты из разных родов. Бактероиды
spp ., в частности, был идентифицирован как преобладающий представитель
эпителиальный слой, а в некоторых случаях располагался внутриклеточно [136]. Хотя это остается интригующим наблюдением, роль Bacteroides в ВЗК остается неясной.
Кроме того, отчетливо приросший или инвазивный E.
coli был обнаружен в слизи подвздошной кишки пациентов с болезнью Крона.
болезнь, и вовлечение новой потенциально патогенной группы приверженцев
инвазивный E.coli (AIEC) был
предложил [139]. Например, в исследованиях, направленных на
оценить преобладание штаммов E. coli , связанных со слизистой оболочкой подвздошной кишки пациентов с болезнью Крона, E. coli было выделено из 65%
хронические поражения и из 100% биоптатов ранних поражений. По сравнению,
Было выделено 3–6% бактерий E. coli .
образуют здоровую слизистую оболочку подвздошной кишки. E. coli также присутствовала ненормально (50–100% от общего количества
количество аэробов и анаэробов) при ранних и хронических поражениях подвздошной кишки при БК
пациенты [140, 141].Эти наблюдения были подтверждены в последующем исследовании в
адгезивный E. coli был обнаружен в
38% пациентов с активной болезнью Крона подвздошной кишки [133]. Это исследование также показало, что
количество E. coli in situ коррелировало с тяжестью заболевания, и что инвазивный E. coli также был ограничен
воспаленная слизистая оболочка. Интересно отметить, что выделенные штаммов E. coli были преимущественно новыми в филогенезе, проявляли патоген-подобные
поведение in vitro и выраженные факторы вирулентности [133].
Это
есть подозрение, что аномальная колонизация слизистой оболочки ложного слоя в значительной степени обусловлена
к повышенной экспрессии CEACAM6, рецептора адгезивно-инвазивной E. coli [142]. Однако пациенты с болезнью Крона также демонстрируют дефектные
механизмы уничтожения микробов, которые приводят к увеличению воздействия комменсалов
бактерии. Например, у пациентов с болезнью Крона антибактериальный
продукция пептидов, включая α -дефенсин 5 при заболевании подвздошной кишки и человеческий β -дефенсин 2 при колите Крона [143, 144].Это сопровождается функциональными нарушениями в
уничтожение Bacteroides vulgatus , E. coli и Enterococcus
faecalis [145]. Кроме того, полиморфизмы NOD2 в
Болезнь Крона также связана с избирательным снижением продукции α -дефенсина клетками Панета.
как при неполноценном удалении внутриклеточных патогенов эпителиальным эпителием толстой кишки.
клетки [146]. Таким образом, в сочетании с бракованными
функция антимикробного пептида при болезни Крона функциональные изменения
описанные выше, дают разумное обоснование значительного увеличения
слизисто-ассоциированные Enterobacteriaceae.Кроме того, в свете изменений в
состав люминальной микробиоты, пожалуй, неудивительно, что
Болезнь Крона имеет особенности, которые могут быть следствием микробного процесса.
Примером этого является отмеченная инфекция бляшек Пейера и лимфоидных
агрегатов, а также наличие язв, микроабсцессов, трещин, свищей, гранулем,
и лимфангит [137].
По мере накопления доказательств, позволяющих предположить, что
дисбактериоз у пациентов с ВЗК вызывает нарушение баланса между предполагаемыми
видызащитных и вредных бактерий, один потенциальный новый метод
вмешательство заключается в модуляции кишечной флоры. Действительно, нынешние
исследования показывают, что пробиотики могут предложить альтернативный или адъювантный подход
к традиционным методам лечения ВЗК за счет изменения микрофлоры кишечника и
в свою очередь, модулируя иммунную систему хозяина. Пробиотики — это живая пища.
добавки или компоненты бактерий, которые благотворно влияют на человека
здоровье. Действительно, пробиотическая активность была связана с Lactobacillus , Bifidobacteria , Streptococcus , Enterococcus , непатогенными E.coli и Saccharomyces bourlardii [147, 148].
Пробиотик
Добавки могут уравновесить местную микрофлору у пациентов с ВЗК. Растущий
литература поддерживает эту новую концепцию, которая предполагает, что
пробиотики обладают терапевтическим действием при язвенном колите, болезни Крона и
поучит [147, 148]. Обоснование использования пробиотиков для лечения
ВЗК подчеркивается предполагаемой патогенной ролью кишечной микрофлоры.
при этой болезни.Многочисленные исследования подтверждают мнение о том, что введение
пробиотики в желудочно-кишечный тракт могут изменять кишечную микрофлору у пациентов с ВЗК,
что, в свою очередь, оказывает сильное влияние на защитные механизмы кишечника, в том числе
(i) подавление роста патогенных микробов, (ii) увеличение плотности эпителиальных клеток
соединений и проницаемости, (iii) модулирование иммунного ответа
слизистая оболочка кишечника, (iv) увеличение секреции антимикробных продуктов и
(iv) устранение патогенных антигенов [149–151].Таким образом, такие широкие механистические эффекты пробиотиков могут
объясните наблюдаемые положительные эффекты.
Пробиотик
препараты в первую очередь основаны на различных молочнокислых бактериях
(лактобациллы, бифидобактерии и стрептококки), которые при здоровых
Условия являются нормальными и важными компонентами комменсальной микробиоты. В
кроме того, пробиотические смеси часто содержат некоторые непатогенные бактерии, которые
включают E. coli , энтерококки или
дрожжи ( Saccharomyces bourlardii ) [152].Штаммы пробиотиков также должны удовлетворять
важные критерии. Во-первых, пробиотики должны быть безопасными и протестированы для использования людьми [149, 152]. Кроме того, такие штаммы должны быть человеческого происхождения,
устойчивы к кислоте и желчи, выживают и метаболически активны в
просвет кишечника. Пробиотики также должны быть антагонистами по отношению к патогенным микроорганизмам.
бактерии, производящие антимикробные вещества, конкурируют в желудочно-кишечном тракте,
и способствовать снижению рН толстой кишки.
Многие
клинические испытания документально подтвердили, что пробиотики могут достигать и поддерживать
ремиссия у пациентов с язвенным колитом, а также профилактика и поддержание
ремиссия поучита.Тем не мение,
пробиотики кажутся неэффективными при болезни Крона [153]. Хотя контролируемые клинические испытания
по-прежнему требуется исследовать нерешенные вопросы, связанные с эффективностью, дозой,
продолжительность использования, состав для одного или нескольких занятий и одновременное использование
пробиотики, синбиотики или антибиотики, предварительные данные для
терапевтическое использование пробиотиков у отобранных пациентов с ВЗК легкой и средней степени тяжести
обнадеживают.
Благодарность
Настоящий отчет подготовлен при поддержке Национальных институтов здравоохранения, гранты DK56754 и
DK33506 на имя Б.А. Маккормик.
Инвазивные бактериальные патогены кишечника: вирулентность шигелл, плазмиды и потенциальные вакцины
- Деннис Дж. Копецко
- Филипп Дж. Сансонетти
- Луи С. Барон
- Сэмюэл Б.
3
Цитаты - 166
Загрузки
Abstract
Бактериальные заболевания желудочно-кишечного тракта обычно возникают по одному из трех общих механизмов.Первый механизм, называемый «интоксикация», возникает в результате бактериальной секреции экзотоксина, который часто предварительно образуется в пище до приема внутрь хозяином. Примером этого процесса является стафилококковое или клостридиальное пищевое отравление. Напротив, оставшиеся два процесса требуют живых и размножающихся возбудителей болезней. По «энтеротоксигенному» механизму, как обсуждается в другом месте этого тома, бактерии колонизируют тонкий кишечник, обычно тощую или двенадцатиперстную кишку. Эти бактерии размножаются на поверхности кишечника и вырабатывают энтеротоксин, который стимулирует отток жидкости и электролитов, что приводит к водянистой диарее.Типичными примерами служат энтеропатогенные Escherichia coli и Vibrio cholera. Наконец, третья группа организмов, называемая «инвазивными», действительно проникает через эпителиальную слизистую оболочку толстой кишки. Впоследствии эти организмы размножаются внутриклеточно и распространяются внутри или через слизистую оболочку. Этот последний механизм, классически типичный для Shigella и Salmonella, теперь считается используемым инвазивными штаммами 15. coli, Yersinia и, возможно, Campylobacter. В отличие от других инвазивных бактериальных заболеваний, таких как сальмонеллез, при которых инвазивные бактерии распространяются по всему хозяину, шигеллез — это заболевание, обычно ограничивающееся слизистой оболочкой кишечника.В то время как токсигенным организмам обычно требуется большая доза организмов, чтобы вызвать заболевание, предыдущие исследования показали, что всего десять вирулентных клеток Shigella могут вызывать заболевание у людей. Таким образом, эти особенности отличают токсигенный механизм кишечного заболевания от инвазивного (см. Обзоры 1, 2 ).
Ключевые слова
Штамм вакцины Группа несовместимости больших плазмид Вакцина против тифа Shigella Sonnei
Эти ключевые слова были добавлены машиной, а не авторами.Это экспериментальный процесс, и ключевые слова могут обновляться по мере улучшения алгоритма обучения.
Это предварительный просмотр содержимого подписки,
войдите в
, чтобы проверить доступ.
Предварительный просмотр
Невозможно отобразить предварительный просмотр. Скачать превью PDF.
Список литературы
1.
Формальный, С.Б., П. Гемски, Р.А. Джаннелла и А. Такеучи. 1976. Исследования патогенеза кишечных инфекций, вызываемых инвазивными бактериями, стр. 27–43.
В
: Острая диарея в детстве — Симпозиум Ciba, Vol. 42. Эльзевир / Северная Голландия.
Google Scholar
2.
Gemski, P. and S.B. Формальный. 1975. Шигеллез: инвазивная инфекция желудочно-кишечного тракта, стр. 165–169. В: Микробиология-1975, изд. Д. Шлессинджер, Американское общество микробиологии, Вашингтон, округ Колумбия
Google Scholar
3.
Копецко, Д.Дж., О. Вашингтон и С.Б. Формальный. 1980. Генетические и физические свидетельства плазмидного контроля
Shigella sonnei
формы I поверхностного антигена клетки.Заразить. Иммун. 29: 207–214.
PubMedGoogle Scholar
4.
Sansonetti, P., M. David, and M. Toucas. 1980. Корреляция между perte d’ADN плазмидным и пассажем вирулентной фазы I в avirulente фазы II chez
Shigella sonnei
. C.R. Acad. Sci. 290 (D): 879–882.
Google Scholar
5.
Formal, S.B., L.S. Барон, Д.Дж. Копецко, О. Вашингтон, К. Пауэлл и К.А. Жизнь. 1981. Создание потенциального бивалентного вакцинного штамма: введение
генов антигена формы I Shigella sonnei
в вакцинный штамм против брюшного тифа
galE Salmonella typhi
Ty21a.Заразить. Иммун.
31
: (в печати).
Google Scholar
6.
Кенн, Л., Б. Линдберг, К. Петерссон, Э. Катценелленбоген и Э. Романоваска. 1980. Структурные исследования 0-специфических боковых цепей липополисахарида
Shigella sonnei
фазы I. Carbohydrate Res.
78
. 119–126.
CrossRefGoogle Scholar
7.
Sereny, B. 1955. Экспериментальный
Shigella
конъюнктивит. Acta. Microbiol. Акад.Aci. Подвешенный.
2
: 293–296.
Google Scholar
8.
Johnson, D.A. и Н.С. Willetts. 1980. T
n2301
, конструкция транспозона, несущая всю область переноса плазмиды F. J. Bacteriol. 143: 1171–1178.
PubMedGoogle Scholar
9.
Mel, D.M., A.L. Terzin, and L. Vuksic. 1965. Исследования по вакцинации против бактериальной дизентерии. 3. Эффективная оральная иммунизация против
Shigella flexneri
2a в полевых испытаниях.Бык. Wld. Hlth. Орг.
32
: 647–655.
Google Scholar
10.
Germanier, R. and E. Furer. 1975. Выделение и характеристика
galE
мутанта Ty21a
Salmonella typhi
: штамм-кандидат для живой пероральной вакцины против брюшного тифа. J. Infect. Дис.
131
: 553–558.
PubMedCrossRefGoogle Scholar
11.
Wahdan, M.H., C. Serie, R. Germanier, A. Lackany, Y. Cerisier, N. Guerin, S. Sallam, P. Geoffroy, A.Садек Эль-Тантаиви и П. Гезри. 1980. Контролируемое полевое испытание живой пероральной брюшной тифозной вакцины Ty21a. Bu1 WHO
58
: 469–474.
Google Scholar
12.
Casse, F., C. Boucher, J.S. Жульо, М. Мишель и Ж. Денер. 1979. Идентификация и характеристика больших плазмид в
Rhizobium meliloti
с использованием электрофореза в агарозном геле.

 Khanna & LEH Raffals, The Microbiome in Crohn’s Disease. Role in Pathogenesis and Role of Microbiome Replacement Therapies, 2017
Khanna & LEH Raffals, The Microbiome in Crohn’s Disease. Role in Pathogenesis and Role of Microbiome Replacement Therapies, 2017
 Это перманентное воспаление обеспечивает пребывание иммунокомпетентных клеток в состоянии субактивации и, как следствие, — более быстрый и эффективный ответ на попадание агрессивной (патогенной) флоры. Во-вторых, под действием нормальной микрофлоры синтезируются «естественные» («нормальные») антитела, реагирующие на наиболее распространенные в природе антигенные детерминанты (паттерны). Это обеспечивает протективную функцию в отношении многих патогенов. И наконец, в-третьих, не вдаваясь в подробности, следует напомнить, что в кишечнике постоянно находится около 60-70% всех лимфоцитов человека, которые рециркулируют по всему организму. Контакт с микробами кишечника может приводить к активации различных клонов лимфоцитов. Это влияние сохраняется при попадании этих лимфоцитов в кровеносное русло. И в зависимости от того, какие свойства приобрели иммунные клетки, будет определяться их влияние на весь организм. Кроме того, системное действие могут оказывать и вырабатывающиеся в кишечнике под действием микрофлоры различные биологически активные вещества, прежде всего, цитокины. Итогом такого влияния может оказаться как иммуностимуляция, так и иммуносупрессия. Эти процессы могут лежать в основе развития различных заболеваний, в т.ч. и аутоиммунных.
Это перманентное воспаление обеспечивает пребывание иммунокомпетентных клеток в состоянии субактивации и, как следствие, — более быстрый и эффективный ответ на попадание агрессивной (патогенной) флоры. Во-вторых, под действием нормальной микрофлоры синтезируются «естественные» («нормальные») антитела, реагирующие на наиболее распространенные в природе антигенные детерминанты (паттерны). Это обеспечивает протективную функцию в отношении многих патогенов. И наконец, в-третьих, не вдаваясь в подробности, следует напомнить, что в кишечнике постоянно находится около 60-70% всех лимфоцитов человека, которые рециркулируют по всему организму. Контакт с микробами кишечника может приводить к активации различных клонов лимфоцитов. Это влияние сохраняется при попадании этих лимфоцитов в кровеносное русло. И в зависимости от того, какие свойства приобрели иммунные клетки, будет определяться их влияние на весь организм. Кроме того, системное действие могут оказывать и вырабатывающиеся в кишечнике под действием микрофлоры различные биологически активные вещества, прежде всего, цитокины. Итогом такого влияния может оказаться как иммуностимуляция, так и иммуносупрессия. Эти процессы могут лежать в основе развития различных заболеваний, в т.ч. и аутоиммунных. rhamnosus GG
rhamnosus GG longum BB536
longum BB536 Состав микробиоты тонкой кишки остается неизвестным. Во-вторых, при таком исследовании выделяют 8-12 видов микробов, в то время как их количество в кишечнике более 1000 (причем не учитывается содержание даже бактериодов, которые составляют более 50% массы всех кишечных микробов). В-третьих, для достоверной диагностики требуется собрать содержимое кишечника в стерильных условиях, транспортировать материал при определенной температуре и доставить его в лабораторию в течение 2 часов. Иначе результаты будут искажены.
Состав микробиоты тонкой кишки остается неизвестным. Во-вторых, при таком исследовании выделяют 8-12 видов микробов, в то время как их количество в кишечнике более 1000 (причем не учитывается содержание даже бактериодов, которые составляют более 50% массы всех кишечных микробов). В-третьих, для достоверной диагностики требуется собрать содержимое кишечника в стерильных условиях, транспортировать материал при определенной температуре и доставить его в лабораторию в течение 2 часов. Иначе результаты будут искажены.