Рак головы и шеи — профилактика, стадии, симптомы и методы лечения
Введение
Рак начинается, когда здоровые клетки изменяются и начинают неконтролируемо расти, образуя массу, называемую опухолью. Опухоль может быть раковой и доброкачественной. Раковая опухоль является злокачественной, то есть, может прорастать и распространяться на другие части тела. Доброкачественная опухоль может расти, но не распространяться на другие ткани.
Рак головы и шеи
Рак головы и шеи — это термин, используемый для описания ряда различных злокачественных опухолей, которые развиваются в области горла, гортани, носа, пазух и рта или в этих органах.
Большинство раковых заболеваний головы и шеи представляют собой плоскоклеточные карциномы. Этот вид онкологии начинается в клетках эпителия, который составляет тонкий слой поверхностной ткани. Непосредственно под эпителием, на некоторых участках головы и шеи имеется слой влажной ткани, называемый слизистой оболочкой. Если рак обнаружен только в плоскоклеточном слое, он называется карциномой in situ. Если рак разросся за пределы этого клеточного слоя и перешел в более глубокие ткани, он называется инвазивным плоскоклеточным раком.
Если рак разросся за пределы этого клеточного слоя и перешел в более глубокие ткани, он называется инвазивным плоскоклеточным раком.
Если рак головы и шеи начинается в слюнных железах, опухоль обычно классифицируется как аденокарцинома, аденоидная кистозная карцинома или мукоэпидермоидная карцинома.
Виды рака головы и шеи
Существует 5 основных видов рака головы и шеи, каждый из которых назван в соответствии с той частью тела, где он обнаружен.
- Рак гортани и гипофарингеальный рак. Гортань – составная часть голосового аппарата. Этот трубчатый орган на шее предназначен для дыхания, разговора и глотания. Он расположен в верхней части дыхательного горла, или трахеи. Гипофаринкс (пищевод) – нижний отдел горла, окруженный гортанью.
- Рак полости носа и околоносовых пазух. Носовая полость — это пространство позади носа, откуда воздух попадает в горло. Околоносовые пазухи — это заполненные воздухом области, окружающие носовую полость.

- Рак носоглотки. Носоглотка — это воздушная полость в верхней части глотки за носом.
- Рак ротовой полости и ротоглотки. Полость рта включает в себя рот и язык. Ротоглотка включает в себя середину горла, от миндалин до кончика голосового аппарата.
- Рак слюнных желез. Слюнная железа вырабатывает слюну. Слюна — жидкость, которая выделяется во рту для поддержания его влажности и содержит ферменты, расщепляющие пищу.
В области головы и шеи также могут быть локализованы другие виды онкопроцесса, но их диагностика и лечение сильно отличаются.
Факторы риска и профилактика онкологии головы
Фактор риска — все то, что увеличивает вероятность развития онкологии у человека. И хотя факторы риска зачастую влияют на развитие рака, большинство из них непосредственно его не вызывают. У некоторых людей с несколькими факторами риска, может никогда не развиться рак, а у других, не имеющих известных факторов риска, он, наоборот, возникнет. Знание своих факторов риска и обсуждение их со своим врачом поможет сделать более осознанный выбор образа жизни и медицинского обслуживания.
Знание своих факторов риска и обсуждение их со своим врачом поможет сделать более осознанный выбор образа жизни и медицинского обслуживания.
Существует 2 вещества, значительно увеличивающие риск развития рака головы и шеи:
- Табак. Под употреблением табака подразумевают: курение сигарет, сигар или трубок; жевательный или нюхательный табак. Это наиболее значимый фактор риска развития рака головы и шеи.
- Алкоголь. Злоупотребление алкогольными напитками повышает риск развития злокачественных новообразований. .
Совместное употребление алкоголя и табака увеличивает этот риск еще больше.
Факторы, которые могут повысить риск развития рака головы и шеи, включают также:
- Длительное пребывание на солнце. Это особенно касается рака в области губ, а также рака кожи головы и шеи.
- Вирус папилломы человека (ВПЧ). Половые отношения с человеком с ВПЧ является наиболее распространенным способом инфицирования ВПЧ.
 Существуют различные виды ВПЧ, называемые штаммами.
Существуют различные виды ВПЧ, называемые штаммами. - Вирус Эпштейна-Барра (EBV). Воздействие EBV (вирус, вызывающий мононуклеоз или «моно») играет весомую роль в развитии рака носоглотки.
- Пол. У мужчин в 2–3 раза чаще развивается рак головы и шеи. Тем не менее, уровень рака головы и шеи у женщин возрастает уже несколько десятилетий.
- Возраст. Люди в возрасте от 45 лет более подвержены риску онкопроцесса.
- Плохая гигиена полости рта и зубов.
- Экологические или профессиональные ингалянты. Вдыхание различных химических соединений (лакокрасочные материалы, асбест) может повысить риск развития опасного заболевания.
- Употребление марихуаны.
- Неправильное питание. Диета с низким содержанием витаминов А и В увеличивает риски.
- Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) и ларингофарингеальная рефлюксная болезнь (ЛЭРБ).
 Рефлюкс связан с ростом опухоли в данной области.
Рефлюкс связан с ростом опухоли в данной области. - Ослабленная иммунная система.
- Воздействие радиоактивного излучения. Напрямую связано с развитием онкопроцесса.
- Рака головы и шеи в анамнезе. Люди, у которых был однажды рак головы и шеи, имеют более высокий шанс развития другой злокачественной опухоли в будущем.
Профилактика
Отказ от табака — важнейшая составляющая профилактики.
- Отказ от употребления алкоголя и марихуаны.
- Регулярное применение солнцезащитного крема, в том числе бальзама для губ с достаточным солнцезащитным фактором (SPF)
- Снижение риска заражения ВПЧ путем вакцинации от ВПЧ или путем ограничения количества половых партнеров. Использование презерватива во время полового акта не может полностью защитить от ВПЧ.
- Поддержание надлежащего ухода за зубными протезами. Неудачно подобранные зубные протезы могут улавливать канцерогенные вещества из табака и алкоголя.
 Протезы следует снимать каждую ночь, чистить и тщательно промывать каждый день.
Протезы следует снимать каждую ночь, чистить и тщательно промывать каждый день.
Последующее наблюдение и контроль
Лечение людей, у которых диагностирован рак, не заканчивается после завершения активной терапии. Лечащий врач будет продолжать проверять, не произошел ли рецидив рака, контролировать всевозможные побочные эффекты и общее состояние здоровья. Это называется последующим наблюдением. Оно состоит из регулярных медицинских осмотров и проведения анализов.
Контроль рецидива
Одной из целей последующего наблюдения является контроль рецидива, то есть, повторного наступления болезни. Рак рецидивирует из-за того, что в организме могут остаться небольшие скопления злокачественных клеток. Со временем эти клетки могут увеличиваться до тех пор, пока они не появятся в результатах анализов или не вызовут соответствующие симптомы. Во время последующего наблюдения лечащий врач может предоставить вам персональную информацию о риске рецидива. Ваш врач задаст конкретные вопросы о вашем здоровье.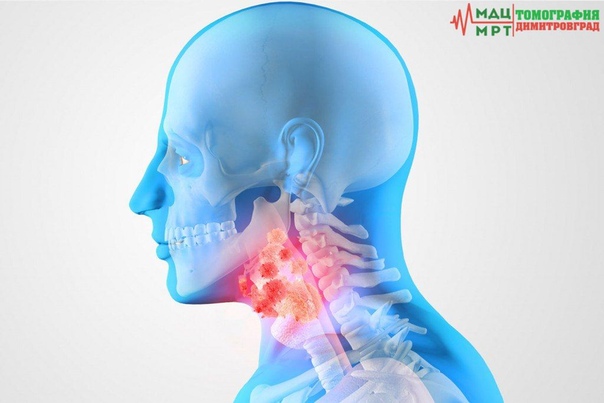 Может потребоваться сдать анализы крови или пройти визуальную диагностику в рамках регулярного последующего наблюдения. Рекомендации по последующему наблюдению зависят от нескольких факторов, включая тип и стадию первоначально диагностированного рака головы и шеи и проведенное лечение. Доктор также подскажет, какие признаки и симптомы контролировать.
Может потребоваться сдать анализы крови или пройти визуальную диагностику в рамках регулярного последующего наблюдения. Рекомендации по последующему наблюдению зависят от нескольких факторов, включая тип и стадию первоначально диагностированного рака головы и шеи и проведенное лечение. Доктор также подскажет, какие признаки и симптомы контролировать.
Контроль долгосрочных и отложенных побочных эффектов
Лечение злокачественных опухолей сопровождается различными побочными эффектами. Долгосрочные последствия сохраняются после периода терапии. Отложенные побочные эффекты могут развиться спустя месяцы или даже годы. К долгосрочным и отсроченным последствиям могут относиться физические и эмоциональные изменения.
Обсудите со своим врачом риск развития таких побочных эффектов в зависимости от типа рака, вашего индивидуального плана лечения и общего состояния здоровья. Если известно, что проводимое лечение может вызывать некоторые отложенные эффекты, вам может потребоваться пройти определенные дополнительные методы обследования. Например, если вы получали лучевую терапию, врач порекомендует вам регулярно сдавать кровь для проверки функции щитовидной железы. Врач может направить вас к специалисту для лечения отложенных эффектов.
Например, если вы получали лучевую терапию, врач порекомендует вам регулярно сдавать кровь для проверки функции щитовидной железы. Врач может направить вас к специалисту для лечения отложенных эффектов.
Реабилитация является основной частью последующего наблюдения после лечения рака головы и шеи. Пациентам может назначаться физиотерапия для поддержания двигательных функций и уровня движений, а также терапия речи и глотания для восстановления таких навыков, как разговор и прием пищи. Правильная оценка и лечение часто могут предотвратить долгосрочные проблемы с речью и глотанием. Некоторым пациентам может понадобиться освоить новые способы питания или другие способы приготовления пищи.
Больные могут выглядеть по-другому, чувствовать усталость и быть не в состоянии говорить или есть, как раньше. Многие люди испытывают депрессию. Группы поддержки помогают пациентам справиться с изменениями после лечения.
Ведение собственных медицинских записей
Вам с доктором предстоит совместно разработать индивидуальный план последующего наблюдения. Обязательно обсудите любые свои опасения по поводу собственного будущего физического или эмоционального здоровья.
Обязательно обсудите любые свои опасения по поводу собственного будущего физического или эмоционального здоровья.
Стадии
Стадия – это определение того, где расположен рак, распространен ли он, и куда, а также его влияние на другие части тела.
Врачи используют диагностические тесты для определения стадии рака; им может потребоваться информация, основанная на образцах ткани, полученных при операции, поэтому определение стадии может продолжаться до проведения всех анализов. Информация о стадии помогает врачу определить, какое лечение является оптимальным, и спрогнозировать возможность выздоровления.
Система классификации опухолей TNM
Один из способов определения стадии рака – этот система TNM. Врачи используют результаты диагностических тестов и сканирования для получения ответов на следующие вопросы:
- Опухоль (T): ее размеры и расположение?
- Лимфатические узлы (N): степень распространенности процесса на лимфатические узлы?
- Метастазы (M): распространённость рака на другие части тела?
Для определения стадии рака каждого пациента результаты объединяются. Стадия обеспечивает общий способ описания рака, чтобы врачи могли совместно планировать оптимальное лечение.
Стадия обеспечивает общий способ описания рака, чтобы врачи могли совместно планировать оптимальное лечение.
Рак головы и шеи: Симптомы и признаки
Пациенты с раком головы и шеи часто испытывают следующие симптомы или признаки. Иногда у больных с раком головы и шеи не наблюдают никаких нижеуказанных изменений. Или причиной симптома может быть неонкологическое заболевание.
- Незаживающие воспаление или рана
- Красное или белое пятно во рту
- Ком, шишка или масса в области головы или шеи, болезненное или безболезненное
- Длительно сохраняющаяся боль в горле
- Гнилостный запах изо рта, который не объясняется гигиеной
- Хрипота или осиплость голоса
- Частые носовые кровотечения и/или необычные выделения из носа
- Затруднение дыхания (в том числе и носового)
- Двоение в глазах
- Онемение в шее или слабость в затылочной области
- Боль или трудности с жеванием, проглатыванием даже маленьких кусочков пищи
- Боль в челюсти
- Кровянистые выделения в слюне или мокроте, слизи, которая выделяется в рот из дыхательных путей
- Расшатывание зубов
- Протезы, которые больше не подходят
- Необъяснимая потеря веса
- Усталость
- Боль в ушах или инфекция
Если вас беспокоят что-то из вышеперечисленного, следует обратиться к специалисту. Ваш врач, среди прочего, спросит, как долго и как часто вы испытываете симптом (симптомы). Эта беседа поможет в постановке правильного диагноза.
Ваш врач, среди прочего, спросит, как долго и как часто вы испытываете симптом (симптомы). Эта беседа поможет в постановке правильного диагноза.
Если диагностирован рак, облегчение симптомов остается важной частью онкологической помощи. Это может называться паллиативной или поддерживающей терапией. Она часто начинается вскоре после постановки диагноза и продолжается в течение всего лечения.
Методы лечения онкологии головы и шеи
Стандарты оказания медицинской помощи при онкологии головы и шеи – лучшие из современных методов лечения. В качестве одного из вариантов терапии врачи рекомендуют рассмотреть клинические исследования. С помощью клинических исследований проверяется новый подход к лечению. Специалисты хотят узнать, является ли новое лечение безопасным, эффективным. Клинические исследования являются вариантом для лечения и онкологической помощи на всех стадиях рака.
Онкологическая команда
Специалисты по раку головы и шеи обычно формируют междисциплинарную команду для лечения каждого пациента. В состав входят следующие специальности:
В состав входят следующие специальности:
- Химиотерапевт: лечение с помощью лекарств, среди которых химиотерапия, иммунотерапия и таргетная терапия.
- Радиолог-онколог: специализируется на лучевой терапии.
- Хирург-онколог: лечение с помощью операции.
- Реконструктивный / пластический хирург: восстановление повреждений, вызванных лечением опухоли
- Стоматолог-ортопед: восстановление тканей в ротовой полости.
- Отоларинголог: восстановление тканей уха, горла, носа.
- Стоматолог-онколог: опыт лечения пациентов с раком головы и шеи.
- Онкологическая медсестра: специализируется на уходе за больными раком.
- Физиотерапевт: восстановление двигательной активности, физических сил.
- Логопед: восстановление навыков речи, глотания после проведенных манипуляций.
- Аудиолог: лечение и контроль проблем слуха.

- Психолог/психиатр: занимаются эмоциональными, психологическими и поведенческими потребностями больного раком и семьи пациента.
- Социальный работник. предоставляет консультации пациентам, членам семьи и группам поддержки..
- Сертифицированный диетолог-нутриционист: помогает людям понять, как правильно питаться и что есть в соответствии с их конкретным состоянием.
Пациенту может потребоваться осмотр у нескольких специалистов до того, как план лечения будет полностью разработан.
Обзор лечения
Многие раковые заболевания головы и шеи можно вылечить, особенно если они обнаружены на ранней стадии. Устранение рака является основной целью лечения, но сохранение функции соседних нервов, органов и тканей не менее важно. Планируя лечение, врачи учитывают, как лечение может повлиять на качество жизни человека.
Основные варианты терапии – хирургическая, лучевая, таргетная, химиотерапия. Операция или лучевая терапия сами по себе или в сочетании могут быть частью плана лечения.
Варианты лечения и рекомендации зависят от нескольких факторов, включая тип и стадию рака, возможные побочные эффекты, личные предпочтения и общее состояние здоровья.
Хирургическое вмешательство
Цель хирургического вмешательства заключается в удалении раковой опухоли и части здоровых тканей во время операции. При раке головы и шеи используются следующие операции:
- Лазерные операции. Этот способ может использоваться для лечения опухоли на ранней стадии, особенно если она была обнаружена в гортани.
- Удаление. Это операция по удалению раковой опухоли и части окружающих ее здоровых тканей, известных как край.
- Лимфодиссекция, или шейная диссекция. Если врач подозревает распространение раковой опухоли, он может удалить лимфатические узлы на шее. Это может быть сделано одновременно с проведением удаления опухоли.
- Реконструктивная (пластическая) хирургия. Если для хирургического лечения рака требуется удаление важного участка ткани, например, удаление челюсти, кожи, глотки или языка, может потребоваться реконструктивная или пластическая операция для замены отсутствующей ткани.
 Эта операция помогает восстановить внешний вид человека и функциональность отдельных органов. Логопед потребоваться, чтобы заново научить больного глотать и общаться, используя новейшие методики.
Эта операция помогает восстановить внешний вид человека и функциональность отдельных органов. Логопед потребоваться, чтобы заново научить больного глотать и общаться, используя новейшие методики.
Исходя из расположения, размеров, вида рака, процесс лечения будет проходить поэтапно с проведением нескольких операций.. При невозможности полного устранения опухоли рекомендуются дополнительные процедуры. Если раковые клетки остаются после оперативного вмешательства, назначают другие виды онкологической помощи (радио-, химиотерапия) в сочетанном или изолированном виде.
Побочные эффекты хирургического вмешательства
Неблагоприятные последствия операции зависят от способа и места ее проведения. Больным следует обсудить все нюансы побочных эффектов проводимой терапии с лечащим врачом. Наиболее распространенные негативные последствия операций в области головы и шеи – проблемы с речевым аппаратом и процессом глотания, снижение слуха. Удаление лимфатических узлов сопровождается скованностью в плечах. Кроме того, может возникнуть лимфостаз. После проведения тотальной ларингэктомии, которая заключается в удалении гортани, у людей может снизиться функция щитовидной железы, которую необходимо контролировать, например, принимая препараты гормонов щитовидной железы.
Другой вероятный побочный эффект – это отек гортани, затрудняющий дыхание. В подобном случае в трахее инструментом выполняется временный канал для нормального дыхания (трахеостома).
Некоторые пациенты после операции сталкиваются с обезображиванием лица. Для запуска или поддержания важных функций организма (например, устранение дефекта трахеостомы)может быть рекомендована реконструктивная хирургия. Пациентам следует встретиться с различными членами медицинской команды для совместного принятия решения о лечении, понять процесс выздоровления. Программы, которые помогают пациентам приспосабливаться к изменениям своей внешности, могут пригодиться как до, так и после операции.
Лучевая терапия
Лучевая терапия (радиотерапия) — это применение ионизирующего излучения для лечения злокачественных новообразований. Схема лечения содержит в себе несколько циклов процедур, проводимых через определенные временные интервалы. Радиотерапия может назначаться как отдельно, так и совместно с хирургическим вмешательством.
Дистанционная лучевая терапия – наиболее оптимальный вариант. Подразумевает действие на опухоль излучения, исходящего из расположенного за пределами организма аппарата. Особый вид наружной дистанционной лучевой терапии — модулированная по интенсивности лучевая терапия (IMRT). IОна использует передовые технологии для точного направления лучей излучения на новообразование. IMRT значительно снижает вероятность поражения здоровых участков, минимизируя возможные негативные последствия.
Протонная терапия — разновидность наружной дистанционной лучевой терапии с применением протонов. Современная медицина практически не использует протонную терапию.
Брахитерапия – контактный метод радиотерапии с применением имплантов. По способу применения может быть ручной и автоматизированной.
Перед началом лечения пациенту необходимо посетить стоматолога-онколога для решения проблемы кариеса, так как радиотерапия может усугубить кариозный процесс. Также понадобятся рекомендации логопеда для дальнейшего восстановительного периода.
Другими неприятными последствиями радиотерапии могут стать покраснение, отек контактирующего с излучением участка кожи, потеря аппетита, стоматит (язвы на внутренней поверхности щек). Пациенты жалуются на сухость во рту, ломоту в костях, утомляемость. Большинство симптомов исчезают вскоре после окончания курса лечения. Если при лечении повреждены лимфатические узлы, может возникнуть отек мягких тканей (лимфадема).
Лучевая терапия может вызвать гипотиреоз, при котором щитовидная железа (расположенная на шее) замедляет выработку гормонов, отвечающих за бодрость и активность. В таком случае эндокринолог выписывает гормоно-заместительные препараты. Если радиотерапия проводится в области шеи, необходимо периодически контролировать функцию щитовидной железы.
Медикаментозная терапия
Системная терапия — это применение лекарственных препаратов для устранения онкопроцесса. Такие препараты вводятся в кровообращение для устранения раковых клеток. Схему системного лечения составляет химиотерапевт.
Обычные способы системного лечения – установка внутривенного (ВВ) катетера в вену или проглатывание (пероральный прием) препарата.
При раке головы и шеи применяются следующие виды медикаментозной терапии:
- Химиотерапия
- Таргетная терапия
- Иммунотерапия Схема медикаментозной терапии (количество препаратов) зависит от формы и тяжести онкопроцесса.
Химиотерапия
Применение препаратов, препятствующих развитию и делению опухолевых клеток называют химиотерапией.
Схема химиотерапии схожа с радиотерапией: несколько этапов за определенное количество времени. Количество принимаемых препаратов индивидуально и зависит от многих факторов.
Негативные последствия также сугубо индивидуальны. В первую очередь наблюдаются депрессивные состояния, выпадение волос, тошноту и рвоту.
Таргетная терапия
Каждая опухоль имеет свои особенности, мишени. Вид онкологического лечения, основанного на уничтожении целевых молекул (специфических генов) и ферментов, подпитывающих жизнедеятельность злокачественных клеток. Таргетная (целевая) терапия предотвращает гибель нормальных клеток и тканей, влияя только на таргетные молекулы.
Для выбора необходимого препарата врач проводит анализ на определение белковых фракций, генов новообразования. Ингибиторы EGFR. При раке головы и шеи может назначаться лечение, направленное на специфический опухолевый белок — рецептор эпидермального фактора роста (EGFR). Исследователи обнаружили, что препараты, которые блокируют EGFR, помогают остановить или замедлить рост некоторых видов рака головы и шеи.
Агностическая противоопухолевая терапия. Ларотрэктиниб (Витракви) — это сертифицированный препарат таргетной терапии, фокусирующийся на измененных генах NTRK. Ларотрэктиниб актуален для устранения метастазов, которые по разным причинам невозможно удалить оперативным вмешательством.
Иммунотерапия
Обязательный этап лечения, предназначенный для увеличения естественной сопротивляемости организма, укрепления иммунной системы. Используются вещества, вырабатываемые иммунными клетками или произведенные в лабораторных условиях.
Пембролизумаб (Кейтруда) и ниволумаб (Опдиво) – новейшие эффективные иммунопрепараты для лечения рецидивирующего или метастатического плоскоклеточного рака головы и шеи. Пембролизумаб может назначаться отдельно, если опухоль экспрессирует определенное количество белка PD-L1. Или же его можно использовать в сочетании с химиотерапией независимо от уровня PD-L1, экспрессируемого опухолью. Ниволумаб можно использовать, если рак продолжал расти или распространяться во время лечения химиотерапией на основе платины.
Разные виды иммунотерапии могут спровоцировать различные негативные последствия. К общим побочным эффектам относятся кожные реакции, гриппоподобные симптомы, диарея и изменение веса.
Физические, психологические социальные последствия онкологии
Пациенты, принимающие онкопомощь неизбежно сталкиваются с физическими, психологическими нагрузками, а также с социальными последствиями. Управляет всеми этими факторами поддерживающая терапия (другое название – паллиативная).
Поддерживающая терапия очень разнообразна, подразумевая под собой медикаментозное лечение, изменение в питании, психологическую разгрузку.
Метастатический рак головы и шеи
Если процесс распространяется за пределы пораженного органа, врачи называют это метастатическим раком. В таком случае важно проконсультироваться у врача, имеющего опыт лечения подобных случаев. У врачей существуют разные взгляды на оптимальный стандартный план лечения. В качества варианта лечения можно также рассмотреть клинические исследования.
План лечения метастатического рака может сочетать в себе все вышеперечисленные лечебные методики онкологии.
Ремиссия и возможность выздоровления
Ремиссия – это состояние, при котором злокачественные клетки в организме и соответствующая симптоматика отсутствуют. Ремиссию также называют «отсутствием признаков заболевания».
Ремиссия бывает временной или постоянной.
Если болезнь возвращается после первичного цикла терапии, она называется рецидивирующим раком. Заболевание может повторно проявиться в том же месте (местный рецидив), рядом (регионарный рецидив) или в другом месте (отдаленный рецидив). В подобном случае необходимо провести серию свежих анализов, чтобы понять полную картину общего состояния здоровья.
Если лечение не помогает
Рак головы и шеи, к сожалению, не всегда излечим. Такой вариант событий называется прогрессирующим или терминальным раком.
Подобный диагноз является большим стрессом для больного и его близких. Потому так важно откровенно беседовать с командой медицинской помощи, объясняя свои ощущения, тревожность. Специальная подготовка и опыт помогают команде медиков оказывать поддержку больным и членам их семей. Чрезвычайно важно обеспечить человеку физический комфорт, свободу от боли и психоэмоциональную помощь.
Опухоли головы и шеи
Рассказывает Геннадий Элькун,
оториноларинголог, врач высшей категории, профессор, д.м.н.
К опухолям головы и шеи относят опухоли рта, глотки, гортани, а также встречающиеся реже опухоли носа, синуса, придаточных пазух, слюнных желез и среднего уха – существует всего более 30 возможных мест локализации злокачественных образований органов головы и шеи.
Опухоли полости рта
Рак ротовой полости – один из наиболее частых типов злокачественных образований органов головы и шеи. Опухоль может быть локализована на губе, языке, под языком, внутренней стороне щеки, на твердом небе, на тканях позади зубов мудрости. При раке губы злокачественные образования чаще всего образуются на верхней губе. Наиболее частой локализацией опухоли в полости рта является нижняя стенка (дно полости рта) и боковая часть языка.
Рак глотки и гортани
Выделяют несколько разновидной рака глотки и гортани в зависимости от локализации и типа опухоли.
Рак носоглотки
Рак ротоглотки. Ротоглотка включает мягкое небо, основание (корень) языка, гланды, заднюю и боковые стенки гортани. Чаще всего рак ротоглотки развивается в гландах и корне языка.
Рак голосовых связок. Рак голосовых связок — второй по частоте вид злокачественных образований органов головы и шеи.
К редким видам опухолей головы и шеи относят:
Рак носовых пазух
Рак слюнных желез
Рак среднего уха
Лечение рака щитовидной железы отличается от лечения других опухолей головы и шеи.
Факторы риска
Основными факторами риска развития опухолей головы и шеи являются курение, употребление нюхательного и жевательного табака и злоупотребление алкоголем (3 из 4 случаев заболевания).
Повышенный риск развития опухолей головы и шеи также может быть связан с инфицированием вирусом папилломы человека ВПЧ 16. Чаще всего опухоли головы и шеи развиваются после 50 лет. Мужчины заболевают чаще, чем женщины.
Другие факторы риска:
Диета с высоким содержанием животных жиров.
Солнечное излучение – длительное пребывание на солнце может привести к развитию рака губы.
Длительное воздействие химических веществ – древесная пыль, кожевенная пыль и формальдегид, выделяемый МДФ, связаны с риском развития некоторых видов рака носоглотки и придаточных пазух носа.
Предраковые состояния полости рта, такие как лейкоплакия и эритроплакия, чаще всего связанные с курением.
Симптомы
Общие симптомы опухолей головы и шеи:
Язвочка(рана) в ротовой полости, которая не проходит в течение нескольких недель
Красные или белые пятна на слизистой оболочке ротовой полости или глотки, которые со временем не исчезают
Нарушения глотания, боль при глотании или пережевывании пищи
Изменения голоса
Постоянная боль в горле или боль в ухе с одной стороны
Припухлость на лице, во рту или на шее
Менее распространенные симптомы:
Выпадение зубов
Заложенность носа или носовые кровотечения
Боль или онемение лица и верней челюсти
Несмотря на то что эти симптомы могут указывать на другие заболевания, важно обратиться к врачу для уточнения диагноза, особенно если они наблюдаются в течение длительного времени.
При прогрессировании заболевания опухоли головы и шеи чаще всего распространяются на шейные лимфоузлы. Увеличение лимфоузлов обычно свидетельствует об инфекционном заболевании, а не о злокачественном процессе. Но если увеличение шейного лимфоузла наблюдается в течение 3-4 недель, необходимо обратиться к врачу!
Типы опухолей головы и шеи
Наиболее распространенным типом опухолей головы и шеи является плоскоклеточный рак. Большинство опухолей головы и шеи (9 из 10 случаев) образуются из клеток плоского эпителия, выстилающих поверхность ротовой полости, носа и носоглотки. Реже среди опухолей головы и шеи встречаются лимфомы, аденокарциномы и саркомы.
Диагностика
Диагностика и лечение опухолей головы и шеи должны проводиться в специализированной клинике при участии врачей нескольких специальностей: радиолога, онколога, оториноларинголога, хирурга. При необходимости могут быть привлечены офтальмологи, челюстно-лицевые хирурги, нейрохирурги.
Методы диагностики:
Ультразвуковое исследование шеи и шейных лимфоузлов
Эндоскопическое исследование (осмотр отделов полости носа, носоглотки, гортани).
Для окончательной постановки диагноза проводится биопсия.
Виды биопсии: инцизионная биопсия (иссечение части пораженной ткани), тонкоигольная пункционная биопсия.
Если по результатам биопсии подтверждается диагноз злокачественного образования, проводятся дальнейшие исследования с целью стадирования процесса: рентген, компьютерная и магнитно-резонансная томография, сцинтиграфия, ПЭТ/КТ.
Клиника оториноларингологии и хирургии головы и шеи ЕМС расположена в многопрофильном госпитале ЕМС, где круглосуточно работает лаборатория, отделения лучевой (УЗИ, рентген, КТ, МРТ) и радионуклидной (ОФЭКТ/КТ, ПЭТ/КТ) диагностики что позволяет в кратчайшие сроки установить правильный диагноз и назначить соответствующее лечение.
Лечение
В Институте онкологии Eвропейского медицинcкого центра (Москва) проводится комплексное лечение опухолей головы и шеи. Лечение рака гортани, носоглотки и других опухолей в области головы и шеи проводится с применением методов хирургического лечения, лучевой терапии, химиотерапии, а также сочетания нескольких методов. Каждый случай рассматривается на врачебном консилиуме для определения наиболее успешной тактики лечения.
Начальная стадия опухолей головы и шеи, как правило, предполагает проведение хирургического лечения. В Институте онкологии EMС проводится хирургическое лечение онкологических патологий органов области головы и шеи в полном объеме с применением самых современных методов, включая робот-ассистированную хирургию с использованием системы DA Vinci Si HD последнего поколения при злокачественных новообразованиях ротогортаноглотки (TORS), опухолях слюнных желез (подчелюстных, околоушных), а также проведение робот-ассистированных лимфодиссекций шеи (удаление пораженных лимфатических узлов на шее).
Операции проводит команда высококлассных хирургов, в том числе один из ведущих европейских специалистов в области хирургии головы и шеи профессор Жан Рене Милье, хирург-оториноларинголог, профессор, д.м.н. Геннадий Элькун. Робот-ассистированные операции позволяют добиться радикального лечения опухоли и при этом являются максимально щадящими для пациента. Специалисты EMС проводят успешные операции в том числе в самых сложных случаях.
Лучевая терапия опухолей головы и шеи проводится в Центре лучевой терапии EMC на линейных ускорителях последнего поколения. Применение самых современных методов лучевой терапии позволяет в ряде случаев провести излечение опухоли без операции.
Видео:
Удаление злокачественной опухоли костей лицевого черепа
Автор: Геннадий Элькун, оториноларинголог, врач высшей категории, профессор, д.м.н.
Злокачественные новообразования полости рта > Клинические протоколы МЗ РК
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «07» марта 2019 года
Протокол №57
Рак полости рта – злокачественная опухоль эпителиального генеза, поражающая органы входящие в полость ограниченной от слизистой губ до передних небных дужек. Рак органов полости рта развивается у мужчин в 5-7 раз чаще, в возрасте 60-70 лет. чаще развивается в переднем отделе дна полости рта и состовляет 20% всех видов плоскоклеточного рака полости рта. 3% приходятся на аденокарциномы малых слюнных желез. Среди клинико-анатомических форм преобладает язвенная. [1- 3]
Рак языка – занимает 1 место среди злокачественных опухолей полости рта. Чаще развивается в средней трети боковой поверхности(62-70%) случаев. И в корне языка. Значительно реже на нижней поверхности языка, редко- на дорсальной поверхности и кончике языка. [1-3]
Рак слизистой оболочки щеки –типичной локализацией служат углы рта, линия смыкания зубов, а фоновым процессом- лейкоплакия. Часто вовлекается слизистая оболочка альвеолярной части нижней челюсти, реже-альвеолярный отросток верхней челюсти или обеих челюстей, ретромалярная область. [1-3]
Рак слизистой оболочки твердого неба- плоскоклеточный рак в области неба встречается редко, в большинстве случаев здесь развиваются злокачественные опухоли из малых слюнных желез(аденокистозный рак, аденокарцинома, мукоэпидермоидный рак). [1-3]
Рак слизистой альвеолярного отростка верхней челюсти и альвеолярного отростка нижней челюсти- почти всегда имеют строение плоскоклеточного рака, примерно с одинаковой частотой встречаются в области верхней и нижней челюстей. Фактором развития рака чаще является травма съемным протезом и лейкоплакия. Регионарное метастазирование наблюдается примерно у 30% больных. [1-3] (УД — А).
ВВОДНАЯ ЧАСТЬ
Название протокола: Злокачественные новообразования полости рта
Код (ы) МКБ-10:
Боли при раке головы и шеи
Разновидности рака области головы и шеи
Опухоли головы и шеи могут поразить много органов – щитовидная железа, гортань, глотка, околоушные железы, содержимое орбиты глазного яблока. И каждая из локализаций имеет свои опухоли.
Лидирует плоскоклеточный рак полости рта, глотки, верхних отделов пищеварительного тракта. Второе по распространенности – злокачественные опухоли щитовидной железы. Достаточно распространена опухолевая патология кожи – меланома, плоскоклеточный рак, базально-клеточный рак, или более редкий – метатипический рак.
Сложной проблемой является запущенность наших больных. В Соединенных Штатах Америки пациент попадает к врачу, имея первую стадию рака в 50% случаев. В России же мы имеем уже 3-4 стадию опухолевого процесса у 70% обратившихся. Проблема – отсутствие междисциплинарного подхода в диагностике. Куда идет наш пациент? Он идет не к онкологу. Если болит что-то в ротовой полости, то пациент идет к стоматологу. Если у него проблемы со зрением, то пациент идет к офтальмологу. Если болит верхнечелюстная пазуха, гайморова пазуха, он пойдет к ЛОР-врачу. И здесь очень важна онкологическая настороженность этих специалистов. Но как можно говорить о хорошей подготовке у междисциплинарных специалистов, если в мединституте на это уделяют всего 2 недели?
Плоскоклеточный рак
Плоскоклеточный рак возникает из плоского эпителия. Это покровные эпителий, слизистая оболочка полости рта и верхних отделов пищеварительного тракта. Канцерогенез у него, как и при других опухолях. Можно выделить особенности в возникновении рака ротоглотки, где имеет большое значение инфицирование вирусом папилломы человека. Это так называемые ВПЧ-ассоциированные опухоли. Также в поражении носоглотки имеет значение наличие вируса Эпштейна-Барр.
Надо отметить, что прогноз лучше у пациента, у которого опухоль связана с ВПЧ. У этих пациентов выживаемость лучше, методы лечения менее агрессивны. Но здесь важна ранняя диагностика.
Базально-клеточный рак кожи
Легче бороться с начальными стадиями базально-клеточного рака кожи. Эта опухоль практически не метастазирует и, если начать её правильно лечить, то почти в 100% случаев пациента можно вылечить.
Симптомы рака области головы и шеи
Что должно настораживать? Первое – это боль в горле или полости рта, которая не проходит более 3 недель. Боль может быть острая, может неострая. Постоянная, ноющая.
При очень многих распространенных опухолях пациенты не жалуются на болевой синдром. Но может быть чувство дискомфорта, особенно – одностороннее. При ангине болят нёбные миндалины с двух сторон. А боль в одной из зон в течение 3-х недель односторонняя – повод идти к врачу. Если имеется постоянное ощущение постороннего тела, что-то мешает при глотании или при дыхании, ощущение дискомфорта, что-то мешает повернуть голову.
Заложенность носа длительная без признаков воспаления, ринита, гайморита. Когда имеется нарушение носового дыхания, которого раньше не было – это тоже повод идти к врачу.
Выделения кровянистые из полости носа должны тоже очень настораживать и являться поводом обращения к специалисту.
И самое главное, это наличие какой-то длительно незаживающей язвочки, даже небольшой, 5-10 мм, на языке, щеке, губе. Это тоже повод обратиться к доктору.
И немаловажный момент – появление объемных образований на шее, что может являться уже метастатическим поражением лимфоузлов шеи.
Имеются опухолевые поражения кожи, это отдельная нозология. Мы выделяем её, так как здесь требуется более серьезные приемы пластической хирургии. Как хирург, я считаю, что оптимальным методом лечения рака кожи является хирургический метод с хорошим пластическим замещением дефекта.
Клиника может быть разной – это может быть меланома, проявление язвочки на коже, или опухоль может выглядеть в форме жемчужины перламутрового цвета с четкими краями. Или это может быть плоскоклеточный рак, который похож на цветную капусту. Плоскоклеточный рак кожи может выглядеть так же, как плоскоклеточный рак полости рта – на языке или щеке. Бывают формы экзофитные, когда опухоль растет наружу, как гриб. И эндофитные , когда она внутри и её не видно.
Как быстро развивается рак головы и шеи
Это зависит от ряда факторов. От того, насколько опухоль «злая». Первый уровень по градации, это опухоли, которые больше похоже на ту ткань, из которой изначально появились. Они могут течь более длительно. Чем больше различие, тем опухоль хуже.
Имеет значение способность опухоли к метастазированию. Вот почему так опасна меланома. Саму опухоль убрать несложно. А вот её распространение через лимфу, через кровь – это уже существенная проблема.
Что касается головы и шеи, то здесь не такая большая площадь. Диаметр шеи у взрослого человека – 12-15 см, и на этом пространстве мы имеем жизненно важные сонные артерии, вены, глотку, пищевод, трахею, гортань. И тот период времени, когда поражаются рядом лежащие жизненно важные структуры, достаточно короткий.
Диагностика рака области головы и шеи
Первое – сбор анамнеза, выяснение жалоб. И очень тщательный, внимательный осмотр. Может быть визуальный осмотр, пальпация, изучение доступных для взгляда анатомических областей, таких, как полость рта.
Методы углубленного осмотра – непрямая или прямая ларингоскопия, фарингоскопия. Сейчас у нас все кабинеты оборудованы эндоскопическим инструментарием, где с помощью эндоскопа можем обследовать носоглотку, ротоглотку, гортань, гортаноглотку, пищевод.
Самое главное, что должен сделать онколог – подтвердить диагноз, то есть взять материал опухоли на исследование. Оно может быть цитологическим, когда изучаются клетки под микроскопом. Или гистологическим, когда изучают фрагмент ткани.
Есть более сложная диагностика – иммунноцитохимические или иммуногистохимические методы исследования. И здесь важно понимать, что забор материала для исследования может быть сделан и рукой врача, и с помощью биопсии эндоскопом, и под контролем ультразвука врачи тонкой иглой могут зайти в опухоль или лимфатическую зону, и взять ткань из опухоли. Они это видят на мониторе и делают очень точно. После этого отправляют материал на исследование.
Лечение рака области головы и шеи
Практически во всем мире тактика однозначна. Если мы говорим о плоскоклеточном раке полости рта, то это операция, а потом уже, при необходимости, проводится химиолучевая терапия.
Но в России накоплен огромный опыт и по консервативному лечению.
Почему это важно? Любой человек хочет быть функционально полноценным. Если мы говорим о гортани, то операция – калечащая. И если есть возможность пролечить без операции с помощью химиолучевой терапии, то, конечно, человек выберет то лечение, которое сохранит ему орган.
Существуют различные варианты сочетания химиотерапии и лучевой терапии. Может сначала проводиться химиотерапия, индукционная полихимиотерапия, когда проводится 3 курса, а затем, в зависимости от реакции опухоли, пациент может пойти либо на операцию, либо на лучевую терапию.
Началась эра таргетного лечения. Ее плюс в том, что не так много химиотерапических препаратов реально работают при плоскоклеточном раке органов головы и шеи, и они токсичны, особенно в сочетании с лучевой терапией. А таргетная терапия в сочетании с лучевой терапией реально снижает токсичность лечения.
Если говорить о раке ротоглотки с ВПЧ, то для этих пациентов предпочтительно использовать лучевую терапию в сочетании с таргетной. Мы говорим о препаратах Эрбитукс или Цетуксимаб.
Существует также проблема метастатического или распространенного рака головы и шеи, когда хирург уже не может ничего сделать. Это бывает при рецидивных опухолях, при изначально распространенных, или при метастатическом процессе, который уже хирургически контролироваться не может. И из-за ранее проведенной лучевой терапии в анамнезе, либо из-за обширности площади поражения, проведение лучевой терапии невозможно. Остается вариант химиотерапии. И применение таргетных препаратов, таких, как Цетуксимаб, показало очень высокую эффективность.
И могу сказать, что Цетуксимаб пациентами переносится вполне неплохо.
Метастазы при раке области головы и шеи
Прежде всего, метастазируют плоскоклеточный рак, рак щитовидной железы, злокачественные опухоли больших и малых слюнных желез, опухоли кожи (исключая базально-клеточный рак кожи). Метастазирование делится на два варианта. Оно может быть лимфогенным, через лимфатическую систему в лимфоузлы, находящиеся ближе всего к опухоли. И гематогенным, когда через кровь поражаются отдаленные органы и системы. Это может быть печень, легкие, кости скелета.
Одно из направлений развития онкологии головы и шеи – подход к операциям и лечению метастазов в лимфатические узлы шеи. Существует достаточно ясное понимание и схема лечения,. Известно, что от толщины опухоли зависит процент поражения лимфоузлов шеи. Чем толще опухоль в миллиметрах, тем выше вероятность поражения лимфатических узлов. За стандарт мы принимаем следующие значения: при плоскоклеточном раке в полости рта менее 2 мм мы не будем рекомендовать вмешательство на лимфоузлы, если не имеем иного подтверждения. А если опухоль до 4 мм, мы будем исследовать сторожевой лимфатический узел.
При этом вводится определенный препарат рядом с опухолью, и смотрится, в котором лимфоузле произошло его накопление. Для этого есть методика ОФЭКТ. Далее мы делаем маленький разрез, буквально 1.5-2 см, находим этот узел, и гамма-детектором измеряем концентрацию радиофармпрепарата, который в этом лимфатическом узле накопился. Это сторожевой узел, он первый, то есть лимфа от опухоли пришла именно в него. Этот узел удаляем и исследуем гистологическим путем, нет ли там метастазов. Если их нет, то мы ничего дальше не делаем.
Если есть поражения, то мы переходим к расширенной шейной лимфодиссекции. Эта технология может быть применима как для опухолей кожи и полости рта, так и для опухолей молочной железы.
А если мы видим, что опухоль более 4 мм, то мы будем рекомендовать профилактическое удаление лимфатических узлов.
Рецидивы после лечения опухолей головы и шеи
Рецидивы, как и при любой злокачественной опухоли есть. Мы очень тщательно отслеживаем эти ситуации. У них разная частота. В среднем, это от 15 до 35% для разных видов опухолей.
Но с внедрением методов реконструктивной хирургии, мы можем себе позволить более радикально и широко убрать опухоль. При этом частота рецидивов будет гораздо меньше.
И мы наших пациентов не бросаем, прослеживаем их на протяжении всей жизни. По нашим данным, 32% наших больных, даже при запущенной стадии, возвращаются к своей прежней работе. Это очень высокий процент.
Андрей Поляков
Онколог. Руководитель отделения опухолей головы и шеи МНИОИ им. П.А. Герцена (филиал НМИРЦ МЗ РФ). К.м.н., доцент
Первоисточник
Плоскоклеточный рак органов головы и шеи: причем здесь ВПЧ
Плоскоклеточный рак головы и шеи появляется в том числе и из-за вируса папилломы человека. Какие типы ВПЧ находят в таких опухолях, как его диагностируют и какие мутации присущи заболеванию, описывает патоморфолог Анастасия Муравцева.
Статистика и факторы риска
Плоскоклеточный рак органов головы и шеи (ПРГШ) составляет около 3 % всех злокачественных опухолей у мужчин и 1,5 % злокачественных опухолей у женщин. Не вызывал сомнений тот факт, что основным этиологическим фактором развития ПРГШ является курение и употребление алкоголя, особенно крепких спиртосодержащих напитков.
С начала 1980-х годов ученые начали обсуждать роль вируса папилломы человека (ВПЧ) в развитии ПРГШ, в основном рака гортани. Однако в последние годы больше внимания стало уделяться риску развития злокачественных опухолей ротоглотки на фоне ВПЧ-инфекции. Плоскоклеточный рак, ассоциированный с ВПЧ, наиболее часто поражает орофарингеальную область и диагностируется у пациентов моложе 50 лет. Частота выявления ВПЧ при опухолях этой локализации варьирует от 20 до 60 %, при этом в 80–90 % случаев диагностируется ВПЧ 16-го типа, в остальных случаях – ВПЧ 18-го типа. Оба подтипа вируса являются факторами высокого риска.
Диагностика
Основной метод диагностики ПРГШ – биопсия. Для постановки точного диагноза достаточно выполнения гистологического исследования со стандартной окраской препарата гематоксилином и эозином. Хотя гистологические признаки ВПЧ- ассоциированного и ВПЧ-негативного плоскоклеточного рака одинаковы, для проведения дальнейших исследований и разработки лечебных подходов необходимо разделять эти варианты опухолей.
Диагностика ВПЧ может быть основана на исследовании его специфической ДНК, содержащейся в ДНК опухолевой клетки, с помощью полимеразной цепной реакции (ПЦР), ферментного анализа или секвенирования. Другим, более простым способом выявления ВПЧ может быть иммуногистохимическое исследование, направленное на обнаружение продукта экспрессии гена p16, которым является белок ink4A. Повышение активности гена p16 INK4A является следствием того, что на фоне инфицирования ВПЧ высокого риска происходит подавление активности или полная инактивация генов-онкосупрессоров, таких как p53 и ген-супрессор ретинобластомы (Rbl). Участки вирусной ДНК (E6 и E7) специфически взаимодействуют с белками, кодируемыми этими двумя генами, в результате чего запускается неконтролируемая пролиферация клеток и подавляется апоптоз. Таким образом, иммуногистохимическое исследование с целью выявления гена p16 INK4A может оказаться высокоинформативным методом при наличии метастазов плоскоклеточного рака в лимфатические узлы шеи без выявленного первичного очага.
Генетический материал 2 подтипов ПРГШ (ВПЧ-ассоциированного и ВПЧ-негативного, связанного с курением и употреблением алкоголя) характеризуется различными результатами при секвенировании. При ВПЧ-ассоциированном ПРГШ наблюдается лишь небольшое количество мутаций. В основном это мутации гена PIK3CA, которые сопровождаются изменением функций клетки. При отсутствии ВПЧ-инфекции отмечается большая разнородность генетических мутаций, особенно затрагивающих гены-онкосупрессоры, такие как p53 или CDKN2A. Другие семейства сигнальных генов, активность которых регулируется тирозинкиназными рецепторами, также подвергаются мутациям, однако с меньшей частотой (в 5–8 % случаев).
Анализ результатов лечения показывает, что пациенты с ВПЧ-ассоциированным плоскоклеточным раком имеют лучший прогноз. При ВПЧ-ассоциированном ПРГШ наблюдается небольшое количество специфических мутаций гена PIK3CA, благодаря чему имеется возможность таргетной терапии, направленной на сигнальный путь PICK3CA/AKT/mTOR.
В ходе начальных исследований с использованием ингибиторов mTOR, таких как эверолимус и темсиролимус, были получены хорошие результаты. В случае ВПЧ-негативного плоскоклеточного рака основной мутацией является мутация гена, кодирующего белок p53. Этот ген является онкосупрессором, а мутация подавляет его активность. На данный момент исследуется эффект ингибиторов белка mdm2, который подавляет активность белка p53.
Список источников:
1. Squamous cell carcinoma of the head and neck: new avenues of treatment?// T. Braunschweig1 , A. Lewandrowski1 , D. Smeets1 , M.V. Bolotin2
2. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2858285/
3. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3028875/
Рак головы и шеи — Head and neck cancer
Рак возникает в области головы или шеи.
| Рак головы и шеи | |
|---|---|
| Обширный рак языка с окружающим красным плоским лишаем | |
| Специальность | Онкология , челюстно-лицевая хирургия |
| Симптомы | Шишка или боль, которые не заживают, боль в горле, которая не проходит, проблемы с глотанием, изменение голоса |
| Факторы риска | Алкоголь , табак , бетель-квид , вирус папилломы человека , радиационное воздействие , определенные воздействия на рабочем месте, вирус Эпштейна-Барра |
| Диагностический метод | Биопсия ткани |
| Профилактика | Не употреблять табак или алкоголь |
| лечение | Хирургия, лучевая терапия , химиотерапия , таргетная терапия |
| Частота | 5,5 миллиона (пострадало в течение 2015 года) |
| Летальные исходы | 379 000 (2015) |
Рак головы и шеи — это группа раковых заболеваний, которая начинается во рту, носу, горле, гортани , пазухах или слюнных железах . Симптомы рака головы и шеи могут включать не заживающую шишку или болезненность, не проходящую боль в горле, проблемы с глотанием или изменение голоса. Также может наблюдаться необычное кровотечение, отек лица или затрудненное дыхание.
Около 75% случаев рака головы и шеи вызвано употреблением алкоголя или табака , включая бездымный табак . Другие факторы риска включают бетель-квид , определенные типы вируса папилломы человека , радиационное воздействие , определенные воздействия на рабочем месте и вирус Эпштейна-Барра . Около 90% случаев рака головы и шеи представляют собой плоскоклеточный рак . Диагноз подтверждается биопсией тканей . Степень распространения может быть определена с помощью медицинских изображений и анализов крови .
Отказ от табака или алкоголя может снизить риск рака головы и шеи. Хотя скрининг среди населения в целом не представляется полезным, скрининг групп высокого риска путем обследования горла может быть полезным. Рак головы и шеи часто излечим, если его диагностировать на ранней стадии; однако, если диагноз поставлен поздно, результаты обычно плохие. Лечение может включать комбинацию хирургического вмешательства, лучевой терапии , химиотерапии и таргетной терапии . После лечения одного рака головы и шеи люди подвергаются более высокому риску развития второго рака.
В 2015 году от рака головы и шеи во всем мире пострадали более 5,5 миллиона человек (2,4 миллиона человек от рака ротовой полости, 1,7 миллиона человек в горле и 1,4 миллиона человек от рака гортани), и они стали причиной более 379 000 смертей (146 000 во рту, 127 400 горла, 105 900 рака гортани). Вместе они занимают седьмое место по частоте встречаемости рака и девятое место среди причин смерти от рака. В Соединенных Штатах около 1% людей страдают в какой-то момент своей жизни, причем мужчины страдают вдвое чаще, чем женщины. Обычный возраст постановки диагноза составляет от 55 до 65 лет. Средняя 5-летняя выживаемость после постановки диагноза в развитом мире составляет 42-64%.
Признаки и симптомы
Рак головы и шеи обычно начинается с симптомов, которые кажутся достаточно безобидными, таких как увеличенный лимфатический узел на внешней стороне шеи, боль в шее, боль в горле или хриплый голос . Однако в случае рака головы и шеи эти состояния могут сохраняться и стать хроническими. В горле или шее может быть комок или боль, которая не заживает и не проходит. Может быть затрудненное или болезненное глотание. Говорить может быть трудно. Также может быть стойкая боль в ухе .
Другие симптомы могут включать: уплотнение на губе, во рту или деснах, язвы или незаживающие язвы во рту, кровотечение изо рта или онемение, неприятный запах изо рта, обесцвеченные пятна, которые остаются во рту, болезненный язык и невнятность речи. если рак поражает язык. Также может быть заложенность носовых пазух, потеря веса и некоторое онемение или паралич лицевых мышц .
Пищевода
Рак пищевода — это рак, возникающий в пищеводе — пищевом тракте, который проходит между горлом и желудком. Симптомы часто включают затруднение глотания и потерю веса. Другие симптомы могут включать боль при глотании , хриплый голос , увеличение лимфатических узлов («желез») вокруг ключицы , сухой кашель и, возможно, кашель или рвоту кровью .
Рот
Плоскоклеточный рак ротовой полости.
Плоскоклеточный рак часто встречается в областях рта, включая внутреннюю губу, язык , дно рта , десны и твердое небо . Рак полости рта тесно связан с употреблением табака , особенно жевательного табака или макающего табака , а также сильного употребления алкоголя . Рак этой области, особенно языка, чаще лечится хирургическим путем, чем другие виды рака головы и шеи.
Операции по поводу рака полости рта включают:
Дефект обычно закрывается / исправляется с помощью трансплантатов другой части тела и / или кожи и / или ношения протеза .
Нос
Рак околоносовых пазух и полости носа поражает носовую полость и придаточные пазухи носа . Большинство этих видов рака представляют собой плоскоклеточные карциномы.
Носоглотка
Рак носоглотки возникает в носоглотке , области, в которой носовые полости и евстахиевы трубы соединяются с верхней частью глотки. В то время как некоторые виды рака носоглотки биологически схожи с обычными плоскоклеточными карциномами головы и шеи (HNSCC), «низкодифференцированная» карцинома носоглотки представляет собой лимфоэпителиому , которая отличается по своей эпидемиологии , биологии, клиническому поведению и лечению и рассматривается как отдельный болезнь многими специалистами.
Горло
Большинство видов рака ротоглотки представляют собой плоскоклеточные карциномы, которые начинаются в ротоглотке (глотке), средней части горла, которая включает мягкое небо , основание языка и миндалины . Плоскоклеточный рак миндалин в большей степени связан с инфекцией вируса папилломы человека, чем рак других областей головы и шеи. ВПЧ-положительный рак ротоглотки обычно имеет лучшие результаты, чем ВПЧ-отрицательное заболевание, с увеличением выживаемости на 54%, но это преимущество для рака, связанного с ВПЧ, применимо только к раку ротоглотки.
Люди с карциномой ротоглотки имеют высокий риск развития второго первичного рака головы и шеи.
Гипофаринкс
Гортаноглотки включают в себя грушевидные придаточные пазухи носа, заднюю стенку глотки, а также postcricoid области. Опухоли гипофаринкса часто находятся на поздней стадии диагностики и имеют наиболее неблагоприятный прогноз, как опухоли глотки. Они имеют тенденцию к раннему метастазированию из-за обширной лимфатической сети вокруг гортани .
Гортань
Рак гортани начинается в гортани или «голосовой коробке». Рак может возникать на самих голосовых складках (рак «голосовой щели») или на тканях выше и ниже настоящих связок («надгортанный» и «подсвязочный» рак соответственно). Рак гортани тесно связан с курением табака .
Операция может включать лазерное иссечение небольших поражений голосовых связок, частичную ларингэктомию (удаление части гортани) или полную ларингэктомию (удаление всей гортани). Если была удалена вся гортань, пациенту остается постоянная трахеостомия. Реабилитация голоса у таких пациентов может быть достигнута тремя важными способами — пищеводной речью, трахеоэзофагеальной пункцией или электроглоткой. Скорее всего, потребуется помощь интенсивного обучения и логопеда и / или электронное устройство.
Трахеи
Рак трахеи — это редкий вид рака, который обычно классифицируется как рак легких .
Большинство опухолей слюнных желез отличаются от обычных плоскоклеточных карцином головы и шеи по причине, гистопатологии , клинической картине и терапии. Другие необычные опухоли, возникающие в области головы и шеи, включают тератомы , аденокарциномы , аденоидно-кистозные карциномы и мукоэпидермоидные карциномы . Еще реже встречаются меланомы и лимфомы верхних отделов пищеварительного тракта.
Причины
Алкоголь и табак
Когда ДНК подвергается окислительному повреждению, два наиболее распространенных повреждения превращают гуанин в 8-гидроксигуанин или 2,6-диамино-4-гидрокси-5-формамидопиримидин.
Около 75% случаев вызваны употреблением алкоголя и табака .
Табакокурение — один из основных факторов риска рака головы и шеи. Основным канцерогенным соединением табачного дыма является акрилонитрил . Акрилонитрил, по-видимому, косвенно вызывает повреждение ДНК за счет увеличения окислительного стресса , что приводит к увеличению уровней 8-оксо-2′-дезоксигуанозина (8-оксо-dG) и формамидопиримидина в ДНК. (см. изображение). И 8-оксо-dG, и формамидопиримидин обладают мутагенными свойствами . ДНК-гликозилаза NEIL1 предотвращает мутагенез с помощью 8-оксо-dG и удаляет формамидопиримидины из ДНК.
Однако у курильщиков сигарет в течение всей жизни повышается риск рака головы и шеи, который в 5-25 раз выше, чем у населения в целом. Риск у бывшего курильщика заболеть раком головы и шеи начинает приближаться к риску в общей популяции через 15 лет после отказа от курения. Высокая распространенность употребления табака и алкоголя во всем мире и высокая ассоциация этих видов рака с этими веществами делает их идеальными целями для усиленной профилактики рака.
Бездымный табак — причина рака полости рта и ротоглотки . Курение сигар также является важным фактором риска рака полости рта.
Другие канцерогены окружающей среды, которые, как подозревают, могут быть потенциальными причинами рака головы и шеи, включают профессиональные воздействия, такие как очистка никелевой руды , воздействие текстильных волокон и обработка древесины. Употребление марихуаны , особенно в молодом возрасте, было связано с увеличением случаев плоскоклеточного рака по крайней мере в одном исследовании, в то время как другие исследования показывают, что использование марихуаны не связано с плоскоклеточным раком полости рта или со снижением плоскоклеточного рака. .
Диета
В одном исследовании чрезмерное потребление яиц, обработанного мяса и красного мяса было связано с повышенным риском рака головы и шеи, в то время как потребление сырых и вареных овощей казалось защитным.
Не было обнаружено, что витамин Е предотвращает развитие лейкоплакии , белых бляшек, которые являются предшественником карциномы слизистой оболочки у взрослых курильщиков. В другом исследовании изучалось сочетание витамина Е и бета-каротина у курильщиков с раком ротоглотки на ранней стадии и было обнаружено худший прогноз у потребителей витаминов.
Орех бетель
Жевание орехов бетеля связано с повышенным риском плоскоклеточного рака головы и шеи.
Инфекция
Вирус папилломы человека
Некоторые виды рака головы и шеи вызываются вирусом папилломы человека (ВПЧ). В частности, HPV16 является причинным фактором для некоторых плоскоклеточных карцином головы и шеи (HNSCC). Примерно 15-25% HNSCC содержат геномную ДНК ВПЧ, и ассоциация варьируется в зависимости от места опухоли, особенно ВПЧ-положительного рака ротоглотки , с наибольшим распределением в миндалинах , где ДНК ВПЧ обнаружена (от 45 до 67% ) случаев, реже в гортани (13–25%) и реже — в полости рта (12–18%) и гортани (3–7%).
По оценкам некоторых экспертов, хотя до 50% случаев рака миндалин могут быть инфицированы ВПЧ, только 50% из них могут быть вызваны ВПЧ (в отличие от обычных причин, вызываемых табаком и алкоголем ). Роль ВПЧ в оставшихся 25-30% пока не ясна. Оральный секс небезопасен и приводит к значительной части случаев рака головы и шеи, связанных с ВПЧ.
Положительный статус HPV16 связан с улучшенным прогнозом по сравнению с HPV-отрицательным OSCC.
ВПЧ может вызвать опухоль с помощью нескольких механизмов:
- Онкогенные белки E6 и E7.
- Нарушение генов-супрессоров опухолей .
- Амплификации ДНК высокого уровня, например, онкогенов .
- Создание альтернативных нефункциональных транскриптов.
- межхромосомные перестройки.
- Четкие паттерны метилирования и экспрессии генома хозяина, даже если вирус не интегрирован в геном хозяина.
Индукция рака может быть связана с экспрессией вирусных онкопротеинов, наиболее важных E6 и E7, или с другими механизмами, многие из которых управляются интеграцией, такими как генерация измененных транскриптов, нарушение супрессоров опухоли, высокие уровни амплификации ДНК, межхромосомные перестройки или изменения в паттернах метилирования ДНК, причем последние могут быть обнаружены, даже когда вирус идентифицирован в эписомах. E6 изолирует p53, способствуя деградации p53, в то время как pRb ингибирует E7. p53 предотвращает рост клеток, когда ДНК повреждается путем активации апоптоза, и p21, киназа, которая блокирует образование циклина D / Cdk4, избегая фосфорилирования pRb и тем самым предотвращая высвобождение E2F, является фактором транскрипции, необходимым для активации генов, участвующих в пролиферации клеток. pRb остается связанным с E2F, в то время как это действие фосфорилируется, предотвращая активацию пролиферации. Следовательно, E6 и E7 действуют синергетически, запуская прогрессирование клеточного цикла и, следовательно, неконтролируемую пролиферацию, инактивируя опухолевые супрессоры p53 и Rb.
Вирусная интеграция имеет тенденцию происходить в онкогенах или генах-супрессорах опухоли или рядом с ними, и именно по этой причине интеграция вируса может в значительной степени способствовать развитию характеристик опухоли.
Вирус Эпштейна-Барра
Инфекция, вызванная вирусом Эпштейна-Барра (EBV), связана с раком носоглотки . Рак носоглотки встречается эндемически в некоторых странах Средиземноморья и Азии, где титры антител к ВЭБ могут быть измерены для скрининга групп высокого риска. Рак носоглотки также связан с употреблением соленой рыбы, которая может содержать высокие уровни нитритов .
Гастроэзофагеальная рефлюксная болезнь
Наличие кислотного рефлюкса (гастроэзофагеальная рефлюксная болезнь [ГЭРБ]) или рефлюксной болезни гортани также может быть основным фактором. Кислоты желудка , протекающие по пищеводу, могут повредить его слизистую оболочку и повысить предрасположенность к раку горла.
Трансплантация гемопоэтических стволовых клеток
Пациенты после трансплантации гемопоэтических стволовых клеток (ТГСК) имеют более высокий риск развития плоскоклеточного рака полости рта. Рак полости рта после ТГСК может иметь более агрессивное поведение с худшим прогнозом по сравнению с раком полости рта у пациентов без ТГСК. Предполагается, что этот эффект связан с постоянным подавлением иммунитета на протяжении всей жизни и хронической оральной реакцией «трансплантат против хозяина» .
Другие возможные причины
Есть несколько факторов риска развития рака горла. К ним относятся курение или жевание табака или другие вещи, такие как гутха или паан , чрезмерное употребление алкоголя , плохое питание, приводящее к дефициту витаминов (хуже, если это вызвано сильным употреблением алкоголя), ослабленная иммунная система , воздействие асбеста , длительное воздействие дерева пыль или пары краски, воздействие химикатов нефтяной промышленности и возраст старше 55 лет. Другие факторы риска включают появление белых пятен или пятен во рту, известных как лейкоплакия , которая примерно в случаев перерастает в рак, и вдыхание или вдыхание кремнезема при резке бетона, камня или шлакоблоков, особенно в закрытых помещениях, таких как склад, гараж или подвал.
Диагностика
Человек обычно обращается к врачу с жалобами на один или несколько из вышеперечисленных симптомов . Пациенту, как правило, проводят пункционную биопсию этого поражения, и имеется гистопатологическая информация, и между онкологом-радиологом , онкологом-хирургом и онкологом будет проводиться многопрофильное обсуждение оптимальной стратегии лечения . Большинство (90%) случаев рака головы и шеи являются плоскоклеточными, называемыми «плоскоклеточными карциномами головы и шеи».
Гистопатология
Рак горла классифицируется в соответствии с его гистологией или клеточной структурой и обычно определяется по его локализации в полости рта и на шее. Это связано с тем, что появление рака в горле влияет на прогноз — некоторые виды рака горла более агрессивны, чем другие, в зависимости от их местоположения. Стадия, на которой диагностируется рак, также является критическим фактором в прогнозе рака горла. Руководства по лечению рекомендуют рутинное тестирование на наличие ВПЧ для всех плоскоклеточных опухолей ротоглотки.
Плоскоклеточная карцинома
Плоскоклеточный рак представляет собой рак из плоскоклеточной клетки — это разновидность эпителиальной клетки найдено в оба коже и слизистых оболочках . На его долю приходится более 90% всех случаев рака головы и шеи, в том числе более 90% рака горла. Плоскоклеточная карцинома чаще всего возникает у мужчин старше 40 лет, которые в анамнезе злоупотребляли алкоголем в сочетании с курением.
Онкомаркер Cyfra 21-1 может быть полезен при диагностике плоскоклеточного рака головы / шеи (SCCHN).
Аденокарцинома
Аденокарцинома — это рак эпителиальной ткани, имеющий железистые характеристики. Некоторые виды рака головы и шеи представляют собой аденокарциномы (кишечного или не кишечного клеточного типа).
Профилактика
Избегание признанных факторов риска (как описано выше) — это наиболее эффективная форма профилактики. Регулярные стоматологические осмотры могут выявить предраковые поражения в полости рта.
При ранней диагностике рак ротовой полости, головы и шеи легче поддается лечению, и шансы на выживание значительно возрастают. По состоянию на 2017 год не было известно, могут ли существующие вакцины против ВПЧ предотвратить рак головы и шеи.
Управление
Улучшения в диагностике и местном управлении, а также таргетная терапия привели к улучшению качества жизни и выживаемости людей с раком головы и шеи.
После постановки гистологического диагноза и определения степени опухоли выбор подходящего лечения для конкретного рака зависит от сложного набора переменных, включая локализацию опухоли, относительную заболеваемость различных вариантов лечения, сопутствующие проблемы со здоровьем, социальные и логистические факторы, предыдущие первичные опухоли и предпочтения человека. Планирование лечения обычно требует междисциплинарного подхода с участием хирургов-специалистов, медицинских и радиационных онкологов.
Хирургическая резекция и лучевая терапия являются основой лечения большинства видов рака головы и шеи и в большинстве случаев остаются стандартом лечения. При небольших первичных раковых опухолях без региональных метастазов (стадия I или II) используется только широкое хирургическое удаление или только лечебная лучевая терапия. Обычно используются более обширные первичные опухоли или опухоли с регионарными метастазами (стадия III или IV), запланированные комбинации пред- или послеоперационного облучения и полного хирургического удаления. В последнее время, когда историческая выживаемость и показатели контроля признаны менее чем удовлетворительными, особое внимание было уделено использованию различных режимов индукционной или сопутствующей химиотерапии.
Операция
Хирургическое лечение часто используется при большинстве видов рака головы и шеи. Обычно цель состоит в том, чтобы полностью удалить раковые клетки. Это может быть особенно сложно, если рак находится около гортани и может привести к тому, что человек не может говорить. Хирургическое вмешательство также часто используется для резекции (удаления) некоторых или всех шейных лимфатических узлов, чтобы предотвратить дальнейшее распространение болезни.
CO 2 -лазерная хирургия — еще одна форма лечения. Трансоральная лазерная микрохирургия позволяет хирургам удалять опухоли из голосового аппарата без внешних разрезов. Это также позволяет получить доступ к опухолям, недоступным с помощью роботизированной хирургии. Во время операции хирург и патолог работают вместе, чтобы оценить адекватность иссечения («состояние края»), минимизируя количество удаленных или поврежденных нормальных тканей. Этот метод помогает человеку после операции как можно больше говорить и глотать.
Лучевая терапия
Радиационная маска, применяемая при лечении рака горла
Лучевая терапия — самый распространенный вид лечения. Существуют различные формы лучевой терапии, включая трехмерную конформную лучевую терапию, лучевую терапию с модуляцией интенсивности, терапию пучком частиц и брахитерапию, которые обычно используются при лечении рака головы и шеи. Большинство людей с раком головы и шеи, проходящих лечение в США и Европе, получают лучевую терапию с модуляцией интенсивности с использованием фотонов высокой энергии. В более высоких дозах облучение головы и шеи связано с дисфункцией щитовидной железы и дисфункцией оси гипофиза . Лучевая терапия рака головы и шеи также может вызывать острые кожные реакции различной степени тяжести, которые можно лечить и контролировать с помощью кремов для местного применения или специальных пленок.
Химиотерапия
Химиотерапия при раке горла обычно не используется для лечения рака как такового. Вместо этого он используется для создания неблагоприятных условий для метастазов, чтобы они не распространялись в других частях тела. Типичные химиотерапевтические агенты представляют собой комбинацию паклитаксела и карбоплатина . Цетуксимаб также используется при лечении рака горла.
Docetaxel -На химиотерапия показала очень хороший отклик в местно — распространенным раком головы и шеи. Доцетаксел является единственным таксаном, одобренным FDA США для лечения рака головы и шеи, в комбинации с цисплатином и фторурацилом для индукционного лечения неоперабельной, местнораспространенной плоскоклеточной карциномы головы и шеи.
Хотя амифостин и не является конкретно химиотерапией, он часто вводится внутривенно в химиотерапевтических клиниках до сеансов лучевой терапии IMRT . Амифостин защищает десны и слюнные железы от воздействия радиации.
Нет никаких доказательств того, что эритропоэтин следует регулярно назначать вместе с лучевой терапией.
Фотодинамическая терапия
Фотодинамическая терапия может быть перспективной при лечении дисплазии слизистых оболочек и небольших опухолей головы и шеи. Амфинекс дает хорошие результаты в ранних клинических испытаниях для лечения запущенного рака головы и шеи.
Таргетная терапия
Таргетная терапия , согласно Национальному институту рака , — это «тип лечения, при котором используются лекарства или другие вещества, такие как моноклональные антитела, для выявления и атаки определенных раковых клеток без вреда для нормальных клеток». Некоторые виды таргетной терапии, применяемые при плоскоклеточном раке головы и шеи, включают цетуксимаб , бевацизумаб и эрлотиниб .
Данные самого высокого качества доступны по цетуксимабу с момента публикации в 2006 г. рандомизированного клинического исследования, сравнивающего лучевую терапию в сочетании с цетуксимабом и только лучевую терапию. Это исследование показало, что одновременное применение цетуксимаба и лучевой терапии улучшает выживаемость и контроль локорегиональных заболеваний по сравнению с одной лучевой терапией без значительного увеличения побочных эффектов , как можно было бы ожидать от одновременной химиолучевой терапии, которая в настоящее время является золотым стандартом лечения распространенного рака головы и шеи. Хотя это исследование имеет решающее значение, его интерпретация затруднена, поскольку лучевая терапия цетуксимабом напрямую не сравнивалась с химиолучевой терапией. С интересом ожидаются результаты текущих исследований по выяснению роли цетуксимаба при этом заболевании.
В другом исследовании оценивалось влияние добавления цетуксимаба к традиционной химиотерапии ( цисплатин ) по сравнению с одним цисплатином . Это исследование не выявило улучшения выживаемости или выживаемости без признаков заболевания при добавлении цетуксимаба к традиционной химиотерапии.
Однако другое исследование, завершившееся в марте 2007 года, показало, что выживаемость улучшилась.
В обзоре 2010 г. сделан вывод о том, что комбинацию цетуксимаба и платина / 5-фторурацила следует рассматривать в качестве действующей стандартной схемы лечения первого ряда.
Гендицина — это генная терапия , в которой аденовирус используется для доставки гена-супрессора опухоли р53 в клетки. Он был одобрен в Китае в 2003 году для лечения плоскоклеточного рака головы и шеи.
Сообщалось о мутационном профиле HPV + и HPV- рака головы и шеи, что дополнительно демонстрирует, что они являются принципиально разными заболеваниями.
Иммунотерапия
Иммунотерапия — это вид лечения, который активирует иммунную систему для борьбы с раком. Один из видов иммунотерапии, блокада иммунных контрольных точек, связывает и блокирует ингибирующие сигналы на иммунных клетках, чтобы высвободить их противораковую активность.
В 2016 году FDA предоставило ускоренное разрешение на применение пембролизумаба для лечения людей с рецидивирующим или метастатическим HNSCC с прогрессированием заболевания во время или после химиотерапии, содержащей платину. Позже в том же году FDA одобрило ниволумаб для лечения рецидивирующего или метастатического HNSCC с прогрессированием заболевания во время или после химиотерапии на основе платины. В 2019 году FDA одобрило пембролизумаб в качестве первой линии лечения метастатического или неоперабельного рецидива HNSCC.
Побочные эффекты лечения
В зависимости от применяемого лечения люди с раком головы и шеи могут испытывать следующие симптомы и побочные эффекты лечения:
Психосоциальный
Могут быть предложены программы поддержки эмоционального и социального благополучия людей, у которых был диагностирован рак головы и шеи. Нет четких доказательств эффективности этих вмешательств или какого-либо конкретного типа психосоциальной программы или продолжительности времени, которая была бы наиболее полезной для людей с раком головы и шеи.
Прогноз
Хотя на ранних стадиях рака головы и шеи (особенно рака гортани и полости рта) наблюдается высокий уровень излечения, до 50% людей с раком головы и шеи имеют запущенное заболевание. Показатели излечения снижаются в местно-распространенных случаях, вероятность излечения которых обратно пропорциональна размеру опухоли и даже больше — степени поражения регионарных узлов.
Консенсус-комиссии в Америке ( AJCC ) и Европе ( UICC ) установили системы стадирования плоскоклеточного рака головы и шеи . Эти системы стадий пытаются стандартизировать критерии клинических испытаний для исследовательских исследований и пытаются определить прогностические категории заболевания. Плоскоклеточный рак головы и шеи классифицируется согласно системе классификации TNM , где T — размер и конфигурация опухоли, N — наличие или отсутствие метастазов в лимфатических узлах, а M — наличие или отсутствие отдаленных метастазов. Характеристики T, N и M объединяются для определения «стадии» рака от I до IVB.
Проблема вторых праймериз
Преимущества выживания, обеспечиваемые новыми методами лечения, были подорваны значительным процентом людей, излечившихся от плоскоклеточного рака головы и шеи (HNSCC), у которых впоследствии развиваются вторые первичные опухоли . Частота вторичных первичных опухолей колеблется в исследованиях от 9% до 23% в возрасте 20 лет. Вторые первичные опухоли представляют собой главную угрозу для долгосрочного выживания после успешной терапии ранней стадии HNSCC. Их высокая заболеваемость является результатом того же канцерогенного воздействия, которое вызвало начальный первичный процесс, называемый полевой канцеризацией .
Пищеварительная система
Многие люди с раком головы и шеи также не могут нормально есть. Опухоль может нарушить способность человека глотать и есть, а рак горла может повлиять на пищеварительную систему . Проблемы с глотанием могут привести к тому, что человек захлебнется пищей на ранних стадиях пищеварения и будет мешать ее беспрепятственному перемещению вниз в пищевод и дальше.
Лечение рака горла также может быть вредным для пищеварительной системы и других систем организма. Лучевая терапия может вызвать тошноту и рвоту , что может лишить организм жизненно важных жидкостей (хотя при необходимости они могут быть получены внутривенно). Частая рвота может привести к дисбалансу электролитов, что имеет серьезные последствия для правильного функционирования сердца. Частая рвота также может нарушить баланс желудочных кислот, что отрицательно сказывается на пищеварительной системе, особенно на слизистой оболочке желудка и пищевода.
Некоторым людям может потребоваться энтеральное питание — метод, при котором питательные вещества добавляются непосредственно в желудок человека с помощью назогастрального зонда для кормления или гастростомического зонда . Необходимы дальнейшие исследования для определения наиболее эффективного метода энтерального питания, чтобы гарантировать, что люди, проходящие лучевую терапию или химиолучевое лечение, могут получать питание во время лечения.
Дыхательная система
В случае некоторых видов рака горла дыхательные пути во рту и за носом могут быть заблокированы комками или опухолью из-за открытых язв. Если рак горла находится около дна горла, он имеет высокую вероятность распространения в легкие и препятствует способности человека дышать ; это еще более вероятно, если человек курит, потому что он очень подвержен раку легких .
Душевное здоровье
Рак головы или шеи может повлиять на психическое состояние человека и иногда может привести к социальной изоляции. Может возникнуть психологический стресс и могут возникнуть такие чувства, как неуверенность и страх. Некоторые люди могут также иметь измененный внешний вид, различия в глотании или дыхании и остаточную боль, которую необходимо контролировать.
Другие
Как и любой другой рак , метастазирование поражает многие области тела, поскольку рак распространяется от клетки к клетке и от органа к органу. Например, если он распространяется на костный мозг , это препятствует выработке организмом достаточного количества красных кровяных телец и влияет на правильное функционирование белых кровяных телец и иммунной системы организма ; распространение в кровеносную систему предотвратит транспортировку кислорода ко всем клеткам тела; а рак горла может привести нервную систему в хаос, делая ее неспособной должным образом регулировать и контролировать тело.
Эпидемиология
Число новых случаев рака головы и шеи в США в 2006 г. составило 40 490, что составляет около 3% злокачественных новообразований у взрослых. В 2006 году от этой болезни умерло в общей сложности 11 170 человек. Ежегодно во всем мире заболеваемость превышает полмиллиона случаев. В Северной Америке и Европе опухоли обычно возникают из полости рта, ротоглотки или гортани, тогда как рак носоглотки чаще встречается в странах Средиземноморья и на Дальнем Востоке. В Юго-Восточном Китае и Тайване рак головы и шеи, особенно рак носоглотки , является наиболее частой причиной смерти молодых мужчин.
- В 2008 году в США было 22 900 случаев рака полости рта, 12 250 случаев рака гортани и 12 410 случаев рака глотки.
- По прогнозам, в 2002 году 7 400 американцев умрут от этого рака.
- Более 70% случаев рака горла при обнаружении находятся на поздней стадии.
- У мужчин на 89% больше шансов получить диагноз, чем у женщин, и они почти в два раза чаще умирают от этих видов рака.
- Афроамериканцы непропорционально часто страдают от рака головы и шеи, с более молодым возрастом заболеваемости, повышенной смертностью и более поздними стадиями заболевания на момент обращения. Заболеваемость раком гортани выше у афроамериканцев по сравнению с белым, азиатским и латиноамериканским населением. У афроамериканцев, страдающих раком головы и шеи, более низкая выживаемость при аналогичных опухолевых состояниях.
- Курение и употребление табака напрямую связаны со смертельным исходом от рака ротоглотки (горла).
- Риск развития рака головы и шеи увеличивается с возрастом, особенно после 50 лет. Большинство людей в возрасте от 50 до 70 лет.
Исследование
Иммунотерапия ингибиторами иммунных контрольных точек изучается при раке головы и шеи.
Ссылки
внешняя ссылка
Плоскоклеточная карцинома головы и шеи, ассоциированная с вирусом папилломы человека
Рак полости рта является одной из наиболее частых причин смертности и заболеваемости, при этом плоскоклеточный рак является шестой по частоте злокачественной опухолью в мире. Помимо табака и алкоголя, вирус папилломы человека (ВПЧ) связан с некоторыми видами рака головы и шеи. Как и при раке шейки матки, ВПЧ 16 и 18 типов являются причиной злокачественной трансформации. ВПЧ-положительные злокачественные опухоли головы и шеи обладают уникальными характеристиками, такими как возникновение в более молодой возрастной группе, отчетливые клинические и молекулярные особенности и лучший прогноз по сравнению с ВПЧ-негативными карциномами.Они также обладают потенциалом профилактики с помощью вакцинации. В настоящем обзоре подробно описаны основные особенности плоскоклеточного рака полости рта, ассоциированного с ВПЧ, его отличия от ВПЧ-отрицательного рака полости рта, диагностические особенности и недавние стратегии профилактики и лечения.
1. Введение
Рак полости рта был определен как «новообразование, затрагивающее ротовую полость, которое начинается у губы и заканчивается у передней стойки зева» [1]. Плоскоклеточная карцинома (ПКР) — наиболее частое злокачественное новообразование полости рта, на которое приходится более 90% случаев рака полости рта [2].Он определяется как «злокачественное эпителиальное новообразование, проявляющее плоскоклеточную дифференцировку, характеризующуюся образованием кератина и / или наличием межклеточных мостиков» [3]. Это шестая по частоте злокачественная опухоль в мире [2]. Вирус папилломы человека (ВПЧ) — самая распространенная вирусная инфекция, передаваемая половым путем [4]. Установлено, что ВПЧ является возбудителем рака шейки матки.
Недавние сообщения, которые обычно ассоциируются с доброкачественными поражениями кожи и полости рта, предполагают участие ВПЧ в раке полости рта и ротоглотки [5].
Структура ВПЧ . ВПЧ принадлежит к семейству Papillomaviridae и представляет собой небольшой ДНК-вирус без оболочки диаметром 52–55 нм. Геном состоит из двухцепочечной ДНК, связанной с клеточными гистонами и окруженной белковым капсидом [4]. Восемь открытых рамок считывания (ORF) имеют три функциональных компонента: раннюю (E) область, позднюю (L) область и длинную контрольную область (LCR). Ранняя область важна для репликации, клеточной трансформации и вирусной транскрипции; поздняя область формирует структурные белки (L1-L2), необходимые для сборки вириона; а длинная контрольная область необходима для репликации и транскрипции вирусной ДНК [4].
2. История
zur Hausen в 1970-х годах предположил, что рак шейки матки и заостренные кондиломы могут иметь общую вирусную этиологию, то есть ВПЧ 6–8 [6]. Syrjanen в 1983 году впервые предположил, что HPV является возбудителем рака головы и шеи из-за схожих клинических признаков травм полости рта и половых органов, а также сходства эпителия, сродства HPV к эпителиальным клеткам и его онкогенного потенциала [7].
3. Эпидемиология
Систематический обзор плоскоклеточного рака головы и шеи, ассоциированного с ВПЧ (HNSCC), выявил распространенность 25.9%. Распространенность была выше при плоскоклеточном раке ротоглотки (OPSCC) (35,6%) по сравнению с оральным (23,5%) и ларингеальным (24,0%) SCC [8]. Известно, что этническая принадлежность и географическое происхождение пациентов ответственны за различия в распространенности ВПЧ при HNSCC. Азиатские страны, особенно Япония, имеют самую высокую частоту в мире. Такая высокая распространенность ВПЧ у азиатских пациентов с раком полости рта означает, что вирусная инфекция может быть важным этиологическим агентом и наряду с диетическими привычками и вероятной генетической предрасположенностью может вызывать дополнительные мутации, ведущие к злокачественному новообразованию.Самая низкая распространенность ВПЧ-положительных HNSCC была в Африке [9]. Kulkarni et al. [10] в исследовании, проведенном в Карнатаке, Индия, обнаружили, что 96% случаев рака шейки матки были положительными на ВПЧ, 70,59% были положительными на OSCC и 84% в общей популяции. Их результаты показали более высокую распространенность ВПЧ 18 по сравнению с ВПЧ 16 среди населения в целом [10]. Elango et al. [11] с помощью ПЦР обнаружили, что 48% OSCC языка были положительными на ВПЧ 16.
4. Факторы риска
Рак ротоглотки, связанный с ВПЧ, имеет такие факторы риска, как большее количество половых партнеров, орально-генитальный секс и орально-анальный секс.Употребление марихуаны является независимым фактором риска ВПЧ-положительного HNSCC, и риск увеличивается с увеличением интенсивности, продолжительности и совокупного количества лет курения марихуаны.
Употребление марихуаны может играть роль в развитии рака ротоглотки (OPCs) из-за своего иммуномодулирующего действия. Каннабиноиды связываются с рецептором CB2 иммуномодулирующих клеток в ткани миндалин. Это вызывает снижение иммунного ответа, снижение устойчивости к вирусным инфекциям и снижение противоопухолевой активности [12]. Тоомбак, разновидность нюхательного табака, связан с раком полости рта в Судане.Они обнаружили, что 46% плоскоклеточных карцином полости рта были положительными на ВПЧ [13].
Herrero et al. [14] обнаружили, что ВПЧ реже выявляется у бывших курильщиков, нынешних курильщиков и тех, кто ест табак, по сравнению с некурящими и не курильщиками. Обнаружение ВПЧ также чаще встречается у субъектов, у которых более одного полового партнера на протяжении жизни, и у субъектов, имевших в анамнезе оральный секс. Связь ДНК ВПЧ с сексуальным поведением была сходной для рака полости рта и ротоглотки [14]. Ho et al. [15] обнаружили, что тип ВПЧ влияет на риск цервикальной интраэпителиальной неоплазии больше, чем вирусная нагрузка.
5. Конкордантные типы ВПЧ в слюне и шейке матки
Du et al. [16] исследовали распространенность ВПЧ в слюне и шейке матки у молодежи Швеции. Их результаты показали, что оральная инфекция чаще встречается у женщин с цервикальной инфекцией ВПЧ, хотя количество типов ВПЧ было меньше. Они также обнаружили, что оральные типы ВПЧ полностью соответствовали цервикальным типам ВПЧ, но обратное было неверно. ВПЧ 16 был самым распространенным типом. Однако в исследовании, проведенном на беременных женщинах, только у 1% была одновременная инфекция ВПЧ в полости рта и шейке матки, но ни один из случаев не имел подобного типа ВПЧ [17].Adamopoulou et al. [18] обнаружили, что у женщин с цервикальной инфекцией ВПЧ больше шансов получить бессимптомную инфекцию полости рта. Исследование, проведенное на ВИЧ-положительных женщинах, показало, что оральные инфекции ВПЧ встречаются реже, чем инфекции шейки матки, как у ВИЧ-положительных, так и у ВИЧ-отрицательных женщин [19]. Соответствие между оральным и цервикальным ВПЧ было низким [19]. В Малайзии низкая распространенность перорального HR-HPV наблюдалась у женщин с раком шейки матки [20].
6. Этиопатогенез
Онкогенный потенциал ВПЧ обусловлен его способностью включать E6 и E7 в геном хозяина, что приводит к инактивации генов супрессоров опухолей p53 и p16 [9].Белок Е6 ВПЧ может влиять на p53 двумя способами: он может связываться с ним, вызывая его деградацию, или он может ингибировать опосредованное p300 ацетилирование p53, что влияет на его функцию [21].
Dai et al. [22] обнаружили обратную связь между мутациями TP53 и HPV-положительным раком. Они также обнаружили, что мутации TP53 чаще встречаются у курильщиков по сравнению с некурящими, а ДНК ВПЧ 16 чаще встречается у некурящих по сравнению с курильщиками [22]. Опосредованный ВПЧ туморигенез был выше у людей со статусом Arg / Arg и Arg / Pro с кодоном 72 по сравнению с гомозиготами Pro / Pro, взятыми в качестве эталонного генотипа [21].E7 влияет на белок ретинобластомы, супрессор опухоли (pRb), предотвращает его связывание с фактором транскрипции E2F и, таким образом, предотвращает развитие клеточного цикла. Эта функциональная инактивация pRb приводит к увеличению белка-супрессора p16 p16INK4A. Большинство HPV-положительных HNSCC демонстрируют сверхэкспрессию p16 [6]. Связь ВПЧ и курения с канцерогенезом не ясна. Однако одно исследование показало, что инфекции ВПЧ низкого риска могут действовать вместе с табаком и алкоголем, которые являются известными причинами рака полости рта и ротоглотки [23].
Канцерогенное действие алкоголя, табака и других родственных канцерогенов может усиливаться инфекцией ВПЧ. Дефектный апоптоз, неоваскуляризация и бессмертие клеток также преимущественно связаны с инфекцией ВПЧ. Таким образом, канцерогенез, опосредованный ВПЧ, может быть интегрированным процессом из-за взаимодействия различных факторов. Это привело к гипотезе «синдрома обреченной слизистой оболочки», возникающего из-за вирусной инфекции и связанных с ней клеточных, а также генетических изменений [24].
7. Рак полости рта и ротоглотки
Международное агентство по изучению рака (IARC) провело многоцентровое исследование рака полости рта и ротоглотки по типу случай-контроль в девяти странах. Они обнаружили ДНК ВПЧ в ткани биопсии 3,9% случаев рака полости рта по сравнению с 18,3% случаев рака ротоглотки. ВПЧ 16 был наиболее распространенным типом (89,3%) [14]. Влияние табака и HPV вместе оценивали с использованием VLP L1 HPV16 и антител против HPV16 E6 и E7. Оказалось, что ВПЧ является фактором, способствующим развитию рака у курильщиков и тех, кто ест [14].ВПЧ 16 и 18 участвуют почти во всех ВПЧ-положительных формах рака [25].
8. Клинические аспекты
ВПЧ-положительный рак ротовой полости встречается в более молодой возрастной группе по сравнению с ВПЧ-отрицательным раком со средней разницей в возрасте 4–10 лет. Пациенты с ВПЧ-положительной реакцией также имеют более высокий доход и более продолжительное образование [26]. Соотношение мужчин и женщин составляет 5: 1. Рак, связанный с ВПЧ, обычно проявляется меньшими первичными опухолями, но более поздней узловой стадией [26]. Сообщалось о кистозных метастазах в шейные узлы, и иногда опухоль может проявляться как метастатическое узловое заболевание с неизвестной первичной [26].
9. Диагностика
Обычными методами, используемыми в диагностике ВПЧ, являются обнаружение вирусной ДНК с помощью полимеразной цепной реакции (ПЦР) или гибридизация in situ и определение p16 с помощью иммуногистохимии. Амплификация последовательностей ДНК-мишени с помощью ПЦР с последующей гибридизацией со специальными зондами является наиболее распространенным методом обнаружения и генотипирования ВПЧ [27].
В недавнем исследовании использовались вместе три метода для определения влияния ВПЧ на возникновение HNSCC. Они использовали комбинацию иммуногистохимии p16, консенсусной ПЦР HPVDNA и гибридизации in situ, чтобы лучше идентифицировать HNSCCs, вызванные HPV.Все HNSCC, которые были HPV-положительными с помощью ПЦР и / или ISH, также были положительными по p16 по иммуногистохимии (IHC), при этом IHC показала очень высокую чувствительность как единичный тест (100% как в OSCC, так и в OPSCC), но более низкую специфичность (74% в OSCC и 93% в OPSCC) [28].
Исследования показали, что положительность p16 может использоваться в качестве биомаркера опухолей, связанных с ВПЧ, а также в качестве прогностического фактора при HNSCC [8]. Чаудхари и др. [29] сравнили эффективность ПЦР и Hybrid Capture II при обнаружении ВПЧ.В OSMF было получено 86% согласованных результатов. Чувствительность и специфичность теста составляли 73,7% и 92,5% для HC II и ПЦР, соответственно, а в OSCC результаты имели совпадение 88,3% с чувствительностью и специфичностью 87,14% и 92,76% [30].
Антитела к ВПЧ могут быть обнаружены в сыворотке крови и являются мерой совокупного воздействия инфекции ВПЧ на человека [30]. Антитела против HPV16 L1 и E6 чаще обнаруживались при раке ротоглотки по сравнению с раком полости рта.Антитела против HPV16 E6 или E7 были обнаружены у 65% пациентов с HPV16-положительным раком ротоглотки. Таким образом, они могут быть использованы в качестве маркеров ВПЧ в отсутствие соответствующих цитологических или гистологических образцов [14]. Cameron et al. использовали слюну вместо сыворотки для определения антител к ВПЧ, преимущественно IgG, у ВИЧ-положительных людей. Слюна использовалась благодаря простоте сбора как в педиатрической, так и в гериатрической возрастных группах, неинвазивным методам сбора и сопоставимым результатам [30].Однако антител, полученных при пероральном заборе образцов, меньше, чем в сыворотке; поэтому ложноотрицательные результаты могут быть обычным явлением [30]. Schwartz et al. [31] обнаружили, что реакция антител к Е6 наблюдалась в семь раз чаще в случаях с ДНК ВПЧ 16.
ДНК ВПЧ в слущенных клетках и слюне обнаруживается хуже, чем в тканях. Иммунный ответ снижается у пациентов с ВИЧ, а уровень выявления ВПЧ выше. Adamopoulou et al. [32] обнаружили, что у ВИЧ-положительных людей частота инфицирования ВПЧ в три раза выше, что связано с увеличением интраэпителиальных новообразований шейки матки и полости рта [32].
10. Гистопатология
Патологические признаки ВПЧ-положительных опухолей отличаются от ВПЧ-отрицательных опухолей в следующем: (a) Они не связаны с дисплазией поверхности или кератинизацией. (B) Они демонстрируют дольчатый рост. (C) У них есть инфильтрирующие лимфоциты. (D) Базалоидные варианты распространены. ВПЧ-положительные опухоли обычно хорошо дифференцированы, а базалоидные опухоли имеют хороший прогноз [12].
11. Прогноз
Плоскоклеточная карцинома полости рта имеет высокие показатели смертности и заболеваемости, несмотря на огромное количество исследований в этой области [33].Более высокий уровень смертности и вторичные первичные опухоли чаще встречаются у курильщиков, пьющих алкоголь и жующих фунт [33]. Отказ от курения и употребления алкоголя имеет благоприятный прогноз для OSCC, а фрукты и овощи обладают защитным эффектом, особенно цитрусовые, свежие помидоры, зеленый перец и морковь [34]. Низкий социально-экономический статус и низкий уровень образования, задержка в диагностике и сопутствующие заболевания, такие как системные заболевания, могут повлиять на результаты OSCC. Богатая сосудистая и лимфатическая сеть, локальное распространение, стадия опухоли на момент выявления и метастазирование в шейный узел связаны с плохим прогнозом [33].Толщина опухоли более 5 мм тесно связана с скрытыми метастазами в лимфоузлы, и некоторые авторы считают, что это лучше, чем стадия TNM при определении прогноза. Экстракапсулярное распространение, периневральная инвазия, дифференцировка опухоли и ангиогенез показали свою роль в определении прогноза [33].
Среди молекулярных маркеров участвуют аберрации в хромосомах 3, 9, 11, 13 и 17 и гены-супрессоры опухоли, такие как p53 и pRb [33]. Цитокератин 8/18 является независимым фактором, связанным с плохим прогнозом, как и аномальное содержание ДНК [33, 34].Факторы, связанные с лечением, включают расслоение шейного узла и достижение безрезультатных границ [33]. Частота местных рецидивов составляет от 64 до 84% в случае положительных хирургических полей [34]. 5-летняя выживаемость на ранней стадии для пациентов, перенесших операцию, составляет 92%, лучевая терапия — 69%, комбинированная терапия — 71%. В запущенных случаях этот показатель изменяется до 74%, 37% и 51% соответственно [34]. Liang et al. [35] обнаружили, что среди различных биомаркеров E6 и E7 HPV16 в сыворотке были наиболее предсказуемыми при определении прогноза HNSCC.Они обнаружили, что пациенты с p16 + / E6- / E7- имели повышенный риск смерти. Пациенты, опухоли которых были ДНК-позитивными на ВПЧ16, но серонегативными по E6 и / или E7, не имели снижения общей смертности, но пациенты с серопозитивными E6 и / или E7 показали значительное снижение смертности независимо от статуса ДНК [35]. При ВПЧ-положительном заболевании употребление табака является независимым прогностическим фактором; улучшенный прогноз наблюдается у мужчин, но у женщин оценка выживаемости не меняется [26].
12. Питание и ВПЧ
Считается, что аскорбиновая кислота, β-каротин и α-токоферол обладают защитным действием.Ho et al. [15] обнаружили, что у ВПЧ-положительных лиц с пониженным содержанием аскорбиновой кислоты в плазме более 0,803 мг / дл был снижен риск цервикальной интраэпителиальной неоплазии (CIN) по сравнению с лицами с уровнем ниже 0,803 мг / дл. Аскорбиновая кислота предотвращает онкогенную трансформацию in vitro и подавляет репликацию ВИЧ в Т-лимфоцитах. Таким образом, его добавка может сыграть роль в профилактике [15]. Несколько исследований показали обратную связь между потреблением темно-зеленых и желтых овощей, b-каротина и витаминов C и E с риском CIN и рака.Джулиано и др. [36] показали, что потребление лютеина / зеаксантина, b-криптоксантина и витамина С с пищей может снизить риск стойкой инфекции HPV, специфичной для определенного типа. Потребление папайи, богатого источника пищевых каротиноидов, было связано со снижением риска хронической инфекции. Защитный эффект этих питательных веществ может быть связан с их антиоксидантной активностью. Они также могут быть вовлечены в снижение вирусной репликации и экспрессии [36].
13. Вакцинация
Одним из предлагаемых методов профилактики рака ротоглотки, связанного с ВПЧ, является вакцинация.В настоящее время доступны две вакцины: вакцина против ВПЧ 16/18 Церварикс и вакцина против ВПЧ 6/11/16/18 Гардасил [25]. Консультативный комитет CDC по практике иммунизации (ACIP) рекомендовал вакцинацию против ВПЧ для женщин и мужчин в возрасте от 11 до 12 лет, начиная с 9 лет, и бустерные дозы до 26 и 21 года для женщин и мужчин соответственно [25 ]. Для того, чтобы вакцинация сыграла роль в профилактике рака ротоглотки, защита должна длиться не менее двух десятилетий, и продолжающиеся исследования не показали уменьшения системных антител через 8 лет после вакцинации [25].
14. Ведение ВПЧ-положительного рака головы и шеи
Улучшение показателей выживаемости привело к исследованию снижения дозы облучения при ВПЧ-положительном раке головы и шеи [37]. Текущие испытания включают индукционную химиотерапию с облучением, адаптированным к ответу, альтернативы цисплатину, назначаемые одновременно с облучением, ограничение дозы облучения и использование минимально инвазивной хирургии [37]. Считается, что ВПЧ-положительные клетки более чувствительны к радиации по сравнению с ВПЧ-отрицательными клетками [37].
15. Заключение
ВПЧ-положительный рак головы и шеи, таким образом, отличается от ВПЧ-отрицательных опухолей по эпидемиологии, клиническим характеристикам, молекулярному профилю и ответу на терапию. В связи с этим идентификация ВПЧ-положительности важна во всех случаях для лучшего ведения пациента.
Резюме
Карциномы головы и шеи, связанные с вирусом папилломы человека, карциномы полости рта и ротоглотки имеют особенности, отличные от плоскоклеточных карцином, связанных с табаком и алкоголем.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Границы | Неоднородность иммунного ландшафта плоскоклеточной карциномы головы и шеи и ее влияние на иммунотерапию
- 1 Медицинский колледж Джорджии, Университет Огаста, Огаста, Джорджия, США
- 2 Департамент биохимии и молекулярной биологии, Онкологический центр Джорджии, Школа медицины, Университет Огаста, Огаста, Джорджия, США
- 3 Отделение отоларингологии, Онкологический центр Джорджии, Школа медицины, Университет Огаста, Огаста, Джорджия, США
Плоскоклеточный рак головы и шеи (HNSCC) — это высокоагрессивная многофакторная опухоль верхних отделов пищеварительного тракта, ежегодно поражающая более полумиллиона пациентов во всем мире.Алкоголь, табак и инфекция, вызванная вирусом папилломы человека (ВПЧ), являются хорошо известными причинными факторами для HNSCC. Текущие варианты лечения HNSCC включают хирургическое вмешательство, лучевую терапию, химиотерапию или комбинаторные препараты. За последнее десятилетие, несмотря на заметное улучшение клинических исходов многих типов опухолей, общая 5-летняя выживаемость HNSCCs оставалась ~ 40-50% в основном из-за недостаточной доступности эффективных терапевтических вариантов для пациентов с HNSCC с рецидивирующим заболеванием. Следовательно, существует острая и неудовлетворенная потребность в идентификации конкретных молекулярных сигнатур, которые лучше предсказывают клинические результаты, и маркеров, которые служат лучшими терапевтическими целями.Благодаря последним технологическим достижениям в области геномного и эпигенетического анализа наши знания о молекулярных характеристиках и классификации HNSCC значительно обогатились. Клинический и геномный метаанализ профиля экспрессии гена многокомпонентного HNSCC четко продемонстрировал, что HNSCC HPV + и HPV — происходят не только из тканей разных анатомических областей, но также имеют разные профили мутаций, молекулярные характеристики, иммунный ландшафт. , и клинический прогноз.Здесь мы кратко рассмотрим наше текущее понимание биологии, молекулярного профиля и иммунологического ландшафта HNSCC HPV + и HPV — с акцентом на разнообразии и гетерогенности клинико-патологических и терапевтических реакций HNSCC. После обзора последних достижений и конкретных проблем, связанных с эффективной иммунотерапией HNSCC, мы затем завершаем обсуждение необходимости дальнейшего углубления нашего понимания уникальных характеристик гетерогенности HNSCC и пластичности иммунного ландшафта.Расширение знаний об иммунологических характеристиках HNSCC HPV + и HPV — может улучшить терапевтическое нацеливание и стратегии иммунотерапии для различных подтипов HNSCC.
Введение
Плоскоклеточный рак головы и шеи (HNSCC) — это эпителиальные опухоли, происходящие из слизистой оболочки ротовой полости, ротоглотки, гортани или гипофаринкса. Согласно недавно опубликованному отчету GLOBOCAN 2018 (глобальная статистика рака) (Bray et al., 2018), ежегодно диагностируется более 800000 новых случаев HNSCC. В настоящее время большинство случаев рака головы и шеи имеют регионально распространенный характер с метастазами в лимфатические узлы на момент постановки диагноза. Пациентам часто предлагаются стандартные варианты лечения: хирургическое вмешательство, лучевая терапия, химиотерапия или комбинация этих вмешательств, но у 40-60% пролеченных пациентов возникают рецидивы и они не реагируют на последующие терапевтические вмешательства (Haddad and Shin, 2008; Tolstonog and Simon , 2017).Таким образом, несмотря на значительное улучшение общей выживаемости (ОВ) пациентов с другими типами опухолей, 5-летний показатель ОВ для HNSCC не сильно изменился за последнее десятилетие (Jemal et al., 2011; Torre et al., 2015; Bray et al., 2018). Классическими причинными факторами для ~ 80% HNSCC являются чрезмерное употребление табака и / или чрезмерное употребление алкоголя (Haddad and Shin, 2008; Leemans et al., 2018). В связи с недавним значительным увеличением числа инфекций вируса папилломы человека (ВПЧ) в западном мире со специфическим увеличением распространенности ВПЧ-положительных опухолей ротоглотки у некурящих, ВПЧ-инфекция стала еще одним канцерогенным фактором HNSCC (D ‘ Соуза и др., 2007; Castellsague et al., 2016). HNSCC представляют собой разнообразные и сложные заболевания, проявляющие высокий уровень меж- и внутриопухолевой гетерогенности, а также различия в терапевтическом ответе независимо от клинической стадии. Следовательно, лучшее понимание биологии HNSCC и идентификация конкретных маркеров или сигнатур для клинического прогноза и терапевтических целей будут неоценимы для адаптации передовых целевых вмешательств для улучшения результатов лечения HNSCC.
За последнее десятилетие огромные успехи в секвенировании следующего поколения (NGS) и анализе изменений в экспрессии / перестройке генов, включая число копий ДНК, соматические мутации и метилирование промоторов, привели к экспоненциальному увеличению геномной и эпигенетической информации. относительно молекулярной характеристики и ландшафта HNSCC (Hammerman et al., 2015; Leemans et al., 2018). Эти достижения, особенно в контексте канцерогенеза HNSCC, клинико-патологии и иммунотерапевтических вмешательств, позволили глубже понять разнообразный молекулярный механизм канцерогенеза HNSCC, уникальные характеристики и гетерогенность микросреды опухоли HNSCC (TME) и разнообразие клинических ответов. среди подтипов HNSCC (Hammerman et al., 2015; Tonella et al., 2017; Leemans et al., 2018). Эта информация, наряду с постоянным углубленным исследованием и переводом в целевые терапевтические стратегии, приведет к значительному улучшению клинических результатов.Здесь мы сначала кратко обсуждаем наше текущее понимание генетического ландшафта и молекулярных характеристик HNSCCs с акцентом на потенциальное влияние клеточных и иммунологических путей и гетерогенности, а затем обсуждаем основы иммунологии опухоли, противоопухолевый иммунитет и иммунный ландшафт. HNSCC TME. Затем мы завершаем обсуждение текущих и потенциальных новых стратегий против эффективных терапевтических мишеней в отношении высокогетерогенных и иммуносупрессивных HNSCC.
Геномный ландшафт и молекулярная классификация HNSCC
Традиционная классификация HNSCC и клиническое ведение в основном основаны на анатомическом расположении, фенотипе и клинических стадиях, включая наличие метастазов опухолевых узлов (TNM) и глубины инвазии опухоли (Brierley et al., 2016). Тем не менее, для большинства распространенных HNSCC с регионарными метастазами гистологические и клинические стадии не коррелируют с клиническими ответами или прогнозом (Ha
Frontiers | Экзосомы при плоскоклеточной карциноме головы и шеи
Введение
Рак головы и шеи (HNC) — одно из самых распространенных злокачественных новообразований во всем мире.Несмотря на постоянный прогресс в лечении HNC, 5-летняя общая выживаемость при поздних стадиях HNC остается низкой и составляет примерно 50% (1, 2). HNC часто развивается на поверхности слизистой оболочки рта, включая ротовую полость (язык, губу, щёк, десну и нёбо), ротоглотку, гортань и периоральный рак кожи (3). Более 90% HNCs представляют собой плоскоклеточный рак головы и шеи (HNSCC). Точная этиология HNSCC остается неясной; однако потребление табака и алкоголя является основными факторами риска HNSCC, как показали эпидемиологические исследования.Вирус папилломы человека слизистой оболочки (ВПЧ) также относится к субпопуляции HNSCC; ~ 25,9% HNSCC являются HPV-положительными, тогда как распространенность HPV при плоскоклеточном раке ротоглотки (SCC) составляет 34,1%, что выше, чем при оральном SCC (4).
Экзосомы, которые были впервые обнаружены в 1983 г., представляют собой зрелые мультивезикулярные тельца с двойной мембраной (MVB) размером 30–150 нм, происходящие из эндосомного пути (5). Экзосомы существуют во внеклеточном пространстве и в жидкостях, таких как кровь, моча и слюна (6).Экзосомы связаны со многими физиологическими аспектами заболевания посредством межклеточной коммуникации и передачи сигналов, что указывает на потенциальное клиническое применение экзосом в качестве биомаркеров и терапевтических мишеней. Экзосомы, происходящие из опухолей (TDE), содержат цитомембрану, белки, нуклеиновые кислоты, липиды и другие вещества из родительских опухолевых клеток (7). Более того, известно, что экзосомы участвуют почти во всех стадиях рака (8–11). Растет количество доказательств того, что TDE участвуют в развитии, прогрессировании и лечении рака, опосредуя межклеточную коммуникацию и передачу сигналов (12, 13).Биоактивные компоненты экзосом, происходящих из HNSCC, такие как микроРНК, факторы транскрипции и онкогенные белки, играют ключевую роль в опосредовании туморогенеза, перепрограммировании микроокружения опухоли, иммунной толерантности, стимулировании метастазирования и устойчивости к терапии. Например, внутриклеточный аннексин 1 (ANXA1) регулирует активность рецептора эпидермального фактора роста (EGFR) и изменяет высвобождение EGFR-содержащих TDE в HNC (14). Экзосомы, продуцируемые гипоксическими оральными SCC-клетками, доставляют вирусный miR-21 к нормоксическим клеткам, вызывая эпителиально-мезенхимальный переход (EMT), способствуя миграции и инвазии клеток (15).Другое исследование показало, что экзосомальный ядерный фактор-κB-активирующий киназу-ассоциированный белок 1 (NAP1), полученный из рака полости рта, способствует цитотоксичности естественных киллеров (NK) через активацию пути передачи сигнала фактора регуляции интерферона (IRF-3) в реципиентных клетках. (16). Кроме того, miR-34a-5p в экзосомах, происходящих из связанных с раком фибробластов (CAF) в SCC полости рта, стимулирует пролиферацию и метастазирование раковых клеток полости рта через сигнальный каскад AKT / гликоген-синтеазы-киназа-3β / β-катенин / улитка (17).Недавнее исследование продемонстрировало, что тромбоспондин 1, полученный из оральных экзосом SCC, также участвует в поляризации макрофагов на M1-подобные опухолевые макрофаги и способствует инвазии раковых клеток (18). Экзосомы, происходящие из HNSCC, содержащие EphrinB1, могут манипулировать микроокружением опухоли посредством индукции иннервации опухоли (19). Кроме того, Sento продемонстрировал, что оральные экзосомы, полученные из SCC, способствуют росту опухоли путем активации фосфатидилинозитол-3-киазы (PI3K) / AKT, митоген-активируемой протеинкиназы (MAPK) / киназы, регулируемой внеклеточными сигналами (ERK), и c-Jun N- терминальная киназа-1 / сигнальный преобразователь и активатор транскрипции (STAT) 2 путей (20).Новые данные подтверждают жизненно важную роль TDE в развитии, прогрессировании и лечении HNSCC.
В этом обзоре мы суммируем многие аспекты биологии и функций экзосом в HNSCC.
Биогенез, особенности и компоненты экзосом
Закладка внутрь и формирование MVB
Различные типы везикул, включая внеклеточные везикулы (EV), MVB и экзосомы, были описаны и часто помечены как взаимозаменяемые во многих предыдущих исследованиях.Хотя эти разные типы везикул имеют общие общие черты, они имеют разные морфологии, свойства, механизмы биогенеза и функциональные роли. Компоненты плазматической мембраны и окружающие цитозольные компоненты встраиваются в инвагинирующую мембрану, что приводит к образованию ранних эндосом (21). Экзосомы обычно образуются в результате отрастания внутрь от мембраны и затем высвобождаются во внеклеточное пространство посредством активации Ca 2+ -зависимых или Rab-GTPases (22).Вкратце, экзосомы образуются из ранних эндосом, созревают в MVB и затем секретируются во внеклеточное пространство после слияния с плазматической мембраной. Во-первых, экзосомы начинаются как ранние эндосомы, которые образуются в результате эндоцитоза плазматической мембраны. Биогенез экзосом и сортировка функционального груза точно регулируется определенными механизмами, включающими множество факторов. Наиболее часто описываемый путь биогенеза экзосом — это эндосомный сортировочный комплекс, необходимый для транспортного механизма (ESCRT).Четыре типа ESCRTs (ESCRT-0 – III) участвуют в регуляции образования MVB, зарастания везикул и сортировки белковых грузов (23). Механизм ESCRT запускается и секвестрируется убиквитинированными белками в доменах эндосомальной мембраны через субъединицы связывания убиквитина ESCRT-0 в эндосомальной мембране, затем взаимодействуя с комплексами ESCRT-I и ESCRT-II, вызывая деформацию мембраны в зачатках. Наконец, комплекс ESCRT-III отделяется от мембраны MVBs (23-25). Однако механизм, который управляет нагрузкой белкового груза в ESCRT-зависимые экзосомы, все еще неясен.
Клетки
также используют ESCRT-независимые пути, включая инсфингозин-1-фосфат, церамид, обогащенные тетраспанином микродомены и сфингомиелиназу, для продукции и высвобождения экзосом (26–28). Эти ESCRT-независимые механизмы могут участвовать в стимулировании индуцируемого доменом почкования, сортировки биоактивных молекул в экзосомы, сегрегации груза внутри эндосомальной мембраны и образования экзосом.
ESCRT-зависимые и независимые механизмы высвобождения экзосом основаны на клеточном происхождении.Кроме того, мембранные белки лизосом и поздних эндосом могут быть важны для биогенеза и секреции экзосом (29).
Регулируемая секреция и межклеточные взаимодействия
Секреция экзосом участвует в различных сигнальных путях. Например, ключевая регуляторная роль белков семейства RAB в перемещении внутриклеточных экзосом была продемонстрирована Colombo et al. (30). Другой отчет показал, что путь Wnt особенно важен для нарушения регуляции высвобождения экзосом в раковых клетках (31).Кроме того, секреция экзосом опосредуется связанными с экзоцитозом молекулярными моторами и белками цитоскелета (32). Спонтанная секреция экзосом обычно происходит в стабильном состоянии; однако известно, что некоторые условия стимулируют экзосомы. Действительно, известно, что внутренние сигналы клетки усиливают высвобождение высоких уровней TDE из раковых клеток посредством активации онкогенных сигнальных путей или регуляции механизмов слияния мембран (33). Кроме того, данные свидетельствуют о том, что условия микросреды усиливают высвобождение экзосом из раковых клеток (15, 34).Затем экзосомы высвобождаются во внеклеточную среду посредством экзоцитоза или разрушаются путем слияния с лизосомами. Как описано ранее, Rab GTPases являются важными регуляторами секреции экзосом. Более того, несколько исследований показали, что растворимые рецепторные комплексы белков прикрепления, чувствительных к N-этилмалеимиду, которые участвуют в слиянии мембран, могут влиять на секрецию экзосом (35–37).
В конечном счете, экзосомы интернализуются клетками-реципиентами посредством рецептор-опосредованного эндоцитоза, пиноцитоза, фагоцитоза или слияния с клеточной мембраной, что приводит к доставке молекулярных и генетических компонентов в клетки-реципиенты (30).Экзосомы нацелены на клетки-реципиенты после секреции во внеклеточное пространство и затем вызывают изменения в нижестоящих сигнальных путях. Специфичность реципиентных клеток-мишеней зависит от типа пар лиганд / рецептор, присутствующих в экзосомах и реципиентных клетках; и исследование дает дополнительную информацию о том, что гликаны играют ключевую роль в процессе поглощения экзосом (38). Схематическое изображение путей биогенеза и секреции экзосом показано на рисунке 1.
Рисунок 1 .Схематическое изображение биогенеза и компонентов экзосом, полученных из HNSCC. Инвагинация плазматической мембраны формирует ранние эндосомы с последующим отрастанием полезной нагрузки в эндосомальную мембрану с образованием мультивезикулярных эндосом (MVBs). Созревание поздней эндосомы через слияние с плазматической мембраной и высвобождение экзосом. Некоторые из поздних эндосом сливаются с лизосомами для деградации лизосом. Экзосомы, происходящие из HNSCC, содержат различные клеточные ингредиенты, такие как нуклеиновые кислоты, липиды и белки, которые действуют как ключевые молекулы передачи сигналов.
Характеристики и компоненты экзосом
Типичные экзосомы имеют особую двояковогнутую или чашеобразную форму и наблюдаются как сфероиды при просвечивающей электронной микроскопии (39). Содержимое экзосом богато нуклеиновыми кислотами, цитозольными / эндосомными белками и компонентами цитоскелета, которые обладают уникальной биологической активностью (40). Компоненты TDE отличаются от компонентов экзосом, высвобождаемых из здоровых клеток. TDE доставляют функциональный груз, включая онкогены и онкогенные белки, которые могут проявлять биологическую активность.Функциональные грузы, такие как груз белка, груз РНК и груз ДНК, TDE в микросреде опухоли играют важную роль в содействии прогрессированию рака и метастазированию (рис. 1) (33). Белковые грузы, включая различные онкопротеины, иммуномодулирующие молекулы и факторы роста, действуют как медиаторы онкогенеза. TDE также содержат множество нуклеиновых кислот, таких как микроРНК (miRNAs), мРНК, длинные некодирующие РНК и ДНК, которые доставляют генетическую информацию (41–43).
Многие исследователи проанализировали функции miRNAs в экзосомах, и в экзосомах были обнаружены различные специфические грузы miRNA и внеклеточные компоненты.Эти наблюдения подчеркивают специфичность экзосомальных miRNAs, различные сигнатуры miRNA экзосом и различные функции экзосомальных miRNAs. В серии экспериментов проанализирована функция miRNA в экзосомах с момента их первоначального описания (44). Сообщалось, что в экзосомах происходил отбор специфических грузов miRNA и внеклеточного экспорта (30). Эти наблюдения подчеркивают специфичность экзосомальных miRNAs, отдельные сигнатуры miRNA экзосом и различные функции экзосомальных miRNAs.Экзосомные miRNA связаны с множеством патологических активностей, включая туморогенез, инвазию, прогрессирование, ангиогенез, метастазирование и химиорезистентность. Однако не все экзосомальные miRNA участвуют в поддерживающих опухолевые механизмы механизмах. miRNA экзосом обладают высокой функциональностью и играют роль в межклеточной коммуникации и регуляции микроокружения опухоли, что указывает на то, что экзосомальные miRNA играют важную роль в диагностических и терапевтических приложениях.
Кроме того, экзосомы содержат церамиды, липиды, сфинголипиды, холестерин и глицерофосфолипиды.Поскольку экзосомы образуются в результате слияния эндоцитарных компартментов с плазматической мембраной, композиции белков, липидов и двойного липидного слоя можно использовать для идентификации экзосом. Наиболее часто идентифицируемыми маркерами являются ALIX и тетраспанины, такие как CD9, CD63, CD81 и CD82 (23).
Функции экзосом в HNSCC
Экзосомы были идентифицированы как биоактивные и информативные MVB наноразмеров, которые влияют на многие аспекты развития и прогрессирования HNSCC. Здесь мы обсуждаем недавние открытия механизмов, посредством которых происходящие из HNSCC экзосомы модулируют иммунный ответ, микроокружение опухоли, межклеточную коммуникацию и инвазию опухоли.Мы также описываем экзосомы как потенциальные биомаркеры и обсуждаем их применение в терапии рака и терапии резистентности.
Экзосомы как потенциальные биомаркеры
В клинических условиях было показано, что некоторые соответствующие биомаркеры влияют на лечение пациентов с HNSCC. Несколько отчетов показали, что жидкие биопсии, включая биопсии циркулирующей опухолевой ДНК, циркулирующих опухолевых клеток и экзосомальных миРНК, могут иметь потенциальное клиническое применение при HNC (45). Более того, статус HPV является прогностическим фактором при HNSCC; Пациенты с положительной реакцией на ВПЧ лучше реагируют на химиотерапию и лучевую терапию и более восприимчивы к иммунному надзору.Кроме того, miRNA являются независимыми прогностическими маркерами для пациентов с HPV-отрицательными HNSCC (46), а сверхэкспрессия EGFR связана с худшим прогнозом и исходами при HNSCC (47). Однако необходимы дальнейшие исследования для установления биомаркеров для определения стадии HNSCC и облегчения принятия терапевтических решений.
Экзосомы модулируют различные патологические активности, способствуя росту, инвазии и отдаленным метастазам раковых клеток. TDE также несут ценную геномную и протеомную информацию и могут предоставить информацию об изменениях геномных и протеомных профилей экзосом пациентов с раком в ответ на противораковую терапию (48).Такие протеомные и генетические компоненты хорошо защищены внутри липидного бислоя и могут быть сохранены без значительной потери функционального профилирования. Следовательно, экзосомы могут служить многообещающими маркерами для мониторинга прогрессирования рака и терапевтических реакций (49).
TDE могут быть получены из крови или слюны пациентов с HNSCC, что указывает на то, что TDE могут представлять собой неинвазивный, клинически значимый биомаркер прогрессирования рака и реакции на лечение в реальном времени (45, 50–53).Например, было показано, что количество экзосом в плазме является индикатором прогноза HNSCC. Gimzewski сообщил, что повышенное количество экзосом, размеры экзосом и межэксосомы были обнаружены в слюне пациентов с раком полости рта (54). Кроме того, пациенты с HNSCC с запущенной стадией заболевания и более короткой общей выживаемостью обычно обнаруживают повышенные уровни экзосом в плазме, что указывает на то, что экзосомы плазмы в HNSCC могут применяться для мониторинга прогрессирования опухоли (52, 54).Одно предыдущее исследование продемонстрировало, что сигнатуры TDE могут служить кандидатами в биомаркеры для ранней диагностики, мониторинга и наблюдения за ВПЧ-16 ротоглотки (55). Более того, неинвазивный метод, включающий инфракрасную спектроскопию с преобразованием Фурье экзосом слюны, показал высокую чувствительность и специфичность в диагностике рака полости рта (56).
Некодирующие РНК из экзосом плазмы были тщательно изучены как потенциальные биомаркеры при HNSCC, поскольку они происходят из целых опухолевых клеток и, следовательно, могут представлять собой цельноклеточные РНК (57, 58).В нескольких исследованиях сообщается, что раковые клетки могут избирательно упаковывать выбранные miRNAs в экзосомы, и эти избирательные экзосомальные miRNAs затем действуют как опухолевые супрессоры или онкогены в HNSCC (59–61). Кроме того, гипоксическая микросреда может стимулировать ротовой полости рта с образованием экзосом, богатых miR-21 , которые связаны с метастазами в лимфатические узлы (15). Сывороточная экзосомальная miR-21 и антисмысловая РНК гомеобоксового транскрипта ( HOTAIR ) также в значительной степени связаны с клиническими характеристиками ПКР гортани (59).В предыдущем исследовании было показано, что повышенные уровни CAF-производных экзосомальных miR-196a коррелируют с устойчивостью к цисплатину в HNSCC посредством нацеливания на циклин-зависимую киназу (CDK) N1B и ингибитор члена семейства роста 5 (ING5), что указывает на то, что это miRNA может служить многообещающим предиктором устойчивости к цисплатину и плохой выживаемости при HNSCC (60). Исследование Zhou с коллегами показало, что существуют значительные различия в экспрессии между экзосомальными miRNA и клеточными miRNA в SCC гортани (61).Кроме того, происходящие из рака ротовой полости экзосомы слюны miR-512-3p и miR-412-3p могут служить потенциальными биомаркерами (62). В другом примере Inazawa и его коллеги обнаружили, что экзосомальная miR-1246 индуцирует подвижность и инвазию клеток посредством прямого нацеливания, дифференциально экспрессируемого в нормальных и неопластических / MAPK-активирующих домен смерти 2D в оральном SCC (63). В совокупности эти результаты предполагают, что экзосомальные miRNA могут служить отличными диагностическими и прогностическими биомаркерами.
Анализ экзосомальных белков — новый инструмент для разработки экзосом в качестве потенциальных биомаркеров HNSCC. Более 80% HNSCC демонстрируют сверхэкспрессию EGFR в мембране, а гиперактивность EGFR играет важную роль в развитии туморогенеза и механизмах устойчивости к лекарствам, активируя различные сигнальные пути, включая PI3K / AKT, RAS / MEK / ERK и киназу Януса. (JAK) / STAT-пути в HNSCC. Недавнее исследование показало, что EGFR может секретироваться из клеток посредством транспорта экзосом и что эти EGFR-содержащие экзосомы обладают способностью регулировать аутокринную продукцию VEGF в эндотелиальных клетках (64).Экзосомный EGFR опосредует метастазирование и опухолевый иммунитет при раке легкого (65). ANXA1, опухолевый супрессор в HNSCC, регулирует активность EGFR и высвобождение экзосомального фосфо-EGFR, показывая, что экзосомальный EGFR и фосфо-EGFR могут быть прогностическими биомаркерами при HNSCC (14). Кроме того, уровни экзосомального EGFR и фосфо-EGFR снижаются после лечения цетуксимабом, что указывает на то, что экзосомы могут служить биомаркерами для мониторинга лечения цетуксимабом (66).
Анализ профилей белков экзосом показал, что характеристики и функции экзосом из HPV-положительных / -отрицательных HNC значительно различались.ВПЧ-положительные экзосомы имели низкие уровни p53 и не содержали циклин D1, но содержали p16, E6 / E7 и белок, ингибирующий Т-клетки PTPN11 (67). Недавнее исследование показало, что протеомный анализ внеклеточных везикул слюны может давать прогностические биомаркеры орального ПКР (68).
Микроокружение HNSCC является высоко иммунодепрессивным, и путь запрограммированной гибели клеток (PD) -1 / PD-лиганд 1 (PD-L1) играет важную роль в HNSCC. Высокие уровни PD-L1 связаны с плохими исходами при различных типах рака, включая HNSCC.Было обнаружено, что ингибиторы контрольных точек PD-1 безопасны и эффективны при резистентном к платине рецидивирующем или метастатическом HNSCC (69, 70). Кроме того, исследование Whiteside с коллегами показало, что экзосомы PD-L1 + в плазме связаны с подавлением иммунитета и прогрессированием заболевания. Кроме того, блокирование передачи сигналов экзосом PD-L1 + к Т-клеткам PD-1 + ослабляло иммуносупрессию у пациентов с HNSCC (71). В другом исследовании Феррис сообщил, что передача сигналов JAK2 / STAT1 участвует в EGFR-опосредованном уклонении от иммунитета в HNSCC и что методы лечения, направленные на этот сигнальный путь, могут быть полезными для блокирования активации PD-L1 в HNSCC (72).Более того, повышенные уровни белка теплового шока 90 в TDE, как сообщается, служат потенциальными биомаркерами клинической стадии и прогноза у пациентов с раком полости рта (73). Недавнее исследование показало, что экзосомы, полученные из плазмы, были связаны с прогрессированием заболевания HNSCC после разделения на фракции CD3 + и CD3 — (74). Кроме того, было показано, что происходящие из HNSCC экзосомы проявляют синергетические взаимодействия с инвадоподиями, что указывает на то, что экзосомы играют ключевую роль в содействии инвазии рака (35).TDE, индуцирующие репрограммирование транскриптома, могут вызывать связанные с раком патологии в HNSCC, включая ангиогенез, иммунорегуляцию и метастазирование; эти функциональные различия в HNSCC могут служить кандидатами в маркеры (75).
Растущее количество доказательств показывает, что характеристики TDE и экзосомальных компонентов (например, экзосомальных miRNA, экзосомных белков) могут служить потенциальными неинвазивными биомаркерами для обнаружения, мониторинга и лечения HNSCC (Рисунок 2). Однако методы выделения и разделения TDE сложны и требуют много времени, поэтому необходимы дополнительные исследования TDE как неинвазивных биомаркеров.
Рисунок 2 . Экзосомы, происходящие из HNSCC, действуют как биомаркеры. Скрининг экзосомальных биомаркеров для диагностики, прогноза или лечения HNSCC.
Роль в регуляции микросреды опухоли
Иммунные клетки
Микроокружение опухоли образовано стромальными клетками и связано со злокачественным прогрессированием (76). Более того, TDE играют важную роль в регуляции опухолевого микроокружения HNC (77). Иммунологическая активность экзосом связана со многими аспектами иммунной регуляции, включая презентацию антигена, активацию иммунной системы, иммунный надзор и подавление иммунитета.Проникающие в опухоль миелоидные супрессорные клетки (MDSC), ассоциированные с опухолью макрофаги (TAM) и регуляторные Т-клетки (Treg) являются известными медиаторами иммуносупрессивного микроокружения и ограничивают эффективность иммунотерапии при HNC (78). Экзосомы, содержащие иммуносупрессивные молекулы, могут способствовать иммуносупрессии при раке, что помогает раковым клеткам ускользать от иммунных ответов, тем самым способствуя онкогенезу (79, 80). Кроме того, было показано, что связанные с экзосомами биоактивные белки и РНК регулируют иммунную систему (81, 82).Экзосомы могут опосредовать подавление иммунитета посредством прямого / косвенного ингибирования функций Т-клеток и NK-клеток, а затем изменения количества или активности иммуносупрессорных клеток, включая MDSC, Treg и HLA-DR-клетки (83). Экзосомы также участвуют в различных растворимых факторах, таких как лиганды рецептора контрольной точки (PD-L1), ингибирующие цитокины (IL-10 и TGF-β1), лиганды рецептора смерти (FasL), эктоферменты и простагландин E2, ответственный за противоопухолевый иммунитет в микроокружение опухоли (84, 85).В лимфоцитах и NK-клетках экзосомы связаны со стадией заболевания и активностью у пациентов с HNC, что позволяет предположить, что экзосомы плазмы могут быть связаны с прогрессированием HNC (86). При раке передача сигналов экзосом может влиять на иммунную систему, ингибируя зрелость антигенпрезентирующих клеток и TDE, которые несут и переносят опухолевые антигены к антигенпрезентирующим клеткам, тем самым индуцируя иммунные ответы, зависимые от Т-клеток или NK-клеток (87). В аналогичном исследовании было обнаружено, что TDE, содержащие FasL и фактор некроза опухоли α, индуцируют апоптоз Т-клеток, тем самым создавая иммуносупрессивное микроокружение опухоли для поддержки прогрессирования опухоли (88).TDE, полученные из нескольких линий клеток HNCC, индуцируют супрессивный фенотип в Т-клетках CD8 + через галектин-1, что указывает на то, что полученные из опухоли иммуносупрессивные экзосомы могут быть потенциальными терапевтическими мишенями для предотвращения дисфункции Т-клеток и усиления противоопухолевых иммунных ответов (89). Как упоминалось ранее, уровни микровезикул FasL + , полученных из орального SCC, коррелируют с опухолевой нагрузкой, а микровезикулы FasL + участвуют в опосредовании апоптоза в активированных Т-лимфоцитах через рецепторные и митохондриальные пути (51).Недавнее исследование показало, что Treg-клетки CD4 + CD39 + продуцируют аденозин при воздействии экзосом CD39 + CD73 + из плазмы у пациентов с HNSCC, тем самым поддерживая ускользание от опухоли (90). Кроме того, недавнее исследование показало, что давление кислорода регулирует микроокружение опухоли путем изменения экзосомальных miRNAs, которые впоследствии регулируют ось miR-21, / фосфатаза и гомолог тензина (PTEN) / PD-L1 (91).
ВПЧ-положительные и -отрицательные экзосомы
Молекулярные и функциональные профили экзосом из HPV-положительных и -отрицательных HNSCC различаются.Раннее исследование продемонстрировало, что экзосомы, полученные из HNSCC, по-разному влияют на иммунную систему при HPV-положительных и -отрицательных HNSCC. Однако нет различий в супрессивных Т-клетках CD4 + и CD8 + между ВПЧ-положительными и -отрицательными экзосомами, хотя реакции дендритных клеток (ДК) человека, происходящих из моноцитов, и зрелых ДК на экзосомы различаются. ВПЧ-положительные экзосомы способствуют созреванию ДК, тогда как ВПЧ-отрицательные экзосомы подавляют созревание ДК. ВПЧ-отрицательные экзосомы подавляют экспрессию механизмов процессинга антигена, тогда как ВПЧ-положительные экзосомы — нет (67).ВПЧ-положительные экзосомы, которые способствуют созреванию ДК, также могут стимулировать противоопухолевые иммунные ответы, тем самым улучшая клинические исходы у пациентов с ВПЧ-положительными HNSCC (67). Было показано, что HPV использует экзосомы хозяина для межклеточной коммуникации и индуцирует экспрессию EGFR и передачу сигналов AKT в реципиентных клетках. Одно исследование показало, что экзосомальный NAP1, полученный из клеток рака полости рта, может способствовать активации NK-клеток за счет увеличения экспрессии и фосфорилирования IRF-3 (92).
Фибробласты
CAF особенно важны для регуляции прогрессирования опухоли.Мезенхимальные стволовые клетки, перепрограммированные TDE, опосредуют проангиогенную активность и превращают стромальные клетки в CAF; эти клетки являются основным компонентом микроокружения опухоли и играют ключевую роль в развитии опухоли (93). CAF, происходящие из HNC, изначально устойчивы к цисплатину. Действительно, исследование Zhang показало, что экзосомальный miR-196a , полученный из HNC, вызывает устойчивость к цисплатину путем нацеливания на CDKN1B и ING5, подчеркивая роль происходящего из CAF экзосомального miR-196a в стимулировании пролиферации клеток и ингибировании апоптоза клеток в HNC микросреда (60).Более того, высокая экспрессия ассоциированного с микрофибриллами белка 5 в экзосомах, происходящих из CAF, может способствовать пролиферации и метастазированию орального SCC через активацию сигнальных путей MAPK и AKT (94). Кроме того, было показано, что TDE доставляют кавеолин-1 в микроокружение опухоли, чтобы опосредовать EMT и CAF в SCC языка (95). В аналогичном исследовании было обнаружено, что происходящее из CAF экзосомальное miR-34a-5p связано с пролиферацией и метастазированием раковых клеток в полости рта (17).Таким образом, TDE становятся мощными медиаторами микроокружения опухоли в HNSCC (Рисунок 3).
Рисунок 3 . Макроскопическое изображение функций экзосом, полученных из HNSCC, в микроокружении опухоли. Экзосомы снижают иммунный надзор за опухолью, вмешиваясь в иммунную систему: (а) подавляют функции иммунных клеток; (б) подавляют активность Treg, MDSC; (c) интерференция дифференцирования постоянного тока; (г) Поляризация ТАМов. Экзосомы, происходящие из HNSCC, опосредуют метастазирование через стимуляцию пролиферации эндотелиальных клеток, EMT, CAF и способствуют ангиогенезу, а также перепрограммированию стромального компартмента.Экзосомы, полученные из HNSCC, также влияют на прогрессирование рака, способствуя росту раковых клеток, инвазивному поведению раковых клеток и развитию устойчивости к терапии.
Роль TDE в регулировании прогрессирования рака и метастазирования
Во многих исследованиях оценивалась роль TDE в инициации и прогрессировании рака. Многочисленные молекулы TDE участвуют в инициации и развитии раковых клеток или в микроокружении опухоли (96). Действительно, TDE могут трансформировать эпителиальные клетки в раковые клетки, тем самым инициируя туморогенез.Исследования показали, что TDE перепрограммируют функции реципиентных клеток и способствуют трансформации преметастатической ниши, способствуя метастазированию посредством межклеточной коммуникации или аутокринных сигналов. Кроме того, TDE способствуют прогрессированию опухоли путем доставки факторов, необходимых для поддержания роста опухоли, за счет использования аутокринной или юкстакринной передачи сигналов (97). Кроме того, многие исследования показали, что РНК из TDE может способствовать метастазированию (57). Перемещение молекул miRNA может вызывать туморогенез, прогрессирование опухоли и проникновение мРНК в клетки-реципиенты, что приводит к трансляции белка и метастазированию (44).EMT участвует в прогрессировании и метастазировании раковых клеток, а TDE доставляют функциональные комплексы путем слияния мембран с клетками-реципиентами и связывания рецепторов мембран реципиентных клеток для стимулирования EMT (98).
Экзосомы, полученные из гипоксических оральных SCC-клеток, способствуют миграции и инвазии клеток, доставляя miR-21 к нормоксическим клеткам HNSCC (15). Накашима провел исследование, показавшее, что miR-200c-3p обладает инвазивной способностью в микроокружении SCC ротовой полости человека (99).Более того, CAF вносят вклад в пролиферацию и метастазирование раковых клеток ротовой полости посредством опосредованной экзосомами передачи паракринных сигналов miR-34a-5p (17). Несколько исследований сообщили о гетерогенности передачи сигналов β трансформирующего фактора роста (TGF) в SCC полости рта. TGFβ, экспрессируемый на поверхности TDE, может дифференцировать фибробласты в миофибробласты, тем самым способствуя прогрессированию опухоли и метастазированию в SCC полости рта (100). Кроме того, экзосомы нацелены на разные органы посредством вариаций молекул интегрина, экспрессируемых на поверхности.Освободившиеся экзосомы могут быть доставлены в отдаленные органы для стимулирования онкогенной активности путем создания подходящего преметастатического микроокружения опухоли для миграции опухоли. Таким образом, TDE вносят вклад в развитие этой преметастатической ниши и индуцируют метастатический потенциал в реципиентных клетках. Недавнее исследование показало, что экзосомы могут транспортировать EGFR в печень, чтобы реконструировать ее микроокружение (101). TDE могут передавать онкогенный EGFR в эндотелиальные клетки, вызывая повышенную регуляцию фактора роста сосудистого эндотелия (VEGF) и аутокринного VEGF в эндотелиальных клетках, подвергшихся воздействию MV, связанных с раковыми клетками (64).Более того, MV, происходящие из раковых клеток полости рта, способствуют ангиогенезу эндотелиальных клеток посредством сигнального пути Shh / RhoA (102). Дополнительные эксперименты продемонстрировали, что экзосомальный miR-150 способствует онкогенезу за счет активации VEGF, а другое исследование показало, что экзосомы, полученные из HNSCC, стимулируют ангиогенез in vitro и in vivo посредством функционального репрограммирования эндотелиальных клеток (103). Эти исследования показывают, что экзосомальная miRNA может влиять на биологию эндотелиальных клеток; затем экзосомальная miRNA индуцирует ангиогенез в HNC посредством различных путей регуляции.
TDE модулируют иммунный ответ во взаимодействиях с микроокружением опухоли, участвующих в прогрессировании рака. Экзосомы, полученные из орального SCC, индуцировали поляризованные M1-подобные ТАМ и способствовали метастазированию опухоли (18). Экзосомы, высвобождаемые опухолью, содержащие потенциат EphrinB1, индуцируют аксоногенез, будут способствовать иннервации опухоли в HNSCC (19). А доставка экзосом с большим количеством miRNA-21 способствует ЕМТ-опосредованной М2-подобной поляризации ТАМ, что может способствовать опухолевой прогрессии HNSCC (104). Другое исследование продемонстрировало, что экзосомы, полученные из облученных клеток HNSCC, могут изменять движение раковых клеток и способствовать миграции клеток-реципиентов посредством передачи сигналов AKT (105).В дополнительной серии экспериментов экзосомы были задействованы в плазматической мембране инвадоподий, и нокдаун Rab27a снизил секрецию экзосом и переваривание внеклеточного матрикса, связанное с созреванием инвадоподий (35). Механизмы, с помощью которых TDE регулируют прогрессирование рака и метастазирование, показаны на рисунке 3.
Терапевтическое применение
Экзосомы — это наночастицы клеточного происхождения, которые обладают уникальными свойствами, такими как низкая иммуногенность, сильная способность преодолевать физиологические барьеры, хорошее биораспределение и биодоступность, а также пониженная иммуногенность.Таким образом, TDE могут играть важную роль в качестве потенциальных носителей противоопухолевых препаратов. Кроме того, экзосомы могут быть реконструированы с помощью своих родительских клеток или дополнены желаемой биологической активностью (106). Экзосомы были разработаны как многообещающие терапевтические агенты при лечении различных видов рака (107–109). Поскольку пациенты с метастатическим HNSCC имеют плохой прогноз и обычно плохо реагируют на традиционные методы лечения, эффективная адресная доставка обычных химиотерапевтических препаратов может быть облегчена с помощью инновационных подходов к разработке систем доставки лекарств, таких как экзосомы.
Экзосомы-носители лекарственного средства были выделены из различных типов клеток, включая клетки HEK-293, незрелые DC, макрофаги и раковые клетки. Различные терапевтические агенты, включая белки, малые интерферирующие РНК (миРНК), миРНК и таргетные лекарственные средства, могут быть включены в экзосомы посредством электропорации, химической трансфекции, модификации родительских клеток или прямой инкубации, тем самым повышая биологическую активность и достигая целевой доставки в пациенты. Онкологический центр Джеймса Грэма Брауна инициировал фазу I клинических испытаний для проверки терапевтического воздействия экзосом растений на HNC (NCT01668849).Было показано, что при различных типах рака экзосомы переносят миРНК и растворимые белки в качестве терапевтических молекул в клетки и ткани реципиента (107, 110). Гипоксическое микроокружение способствует образованию экзосом, обогащенных miR-21 , пероральным SCC зависимым от гипоксии фактора (HIF) -1a- и HIF-2a, и эти экзосомы, богатые miR-21 , затем опосредуют поведение миграции и вторжения. Восстановление экспрессии miR-21 в экзосомах, истощенных по HIF-1a- и HIF-2a, предотвращает миграцию и инвазию SCC полости рта (15).Более того, гипоксические TDEs опосредуют функцию MDSC через ось miR-21, / PTEN / PD-L1 в оральном SCC (91). Эти данные указывают на терапевтическую ценность ингибирования экзосом для перорального лечения ПКР.
Нанотела против EGFR
, закрепленные на внеклеточных везикулах с помощью гликозилфосфатидилинозитола, могут улучшить нацеливающую способность внеклеточных везикул, подчеркивая потенциальное применение этих внеклеточных везикул в качестве системы доставки лекарств и нового инструмента в опухолевых клетках, экспрессирующих EGFR (111).Гематоэнцефалический барьер не позволяет лекарствам попадать в мозг, что может снизить терапевтический эффект лечения рака мозга. Экзосомы, полученные из эндотелиальных клеток мозга, могут доставлять противораковые препараты через гематоэнцефалический барьер для лечения рака мозга. Кроме того, носители лекарств на основе экзосом могут обеспечивать проницаемость через гематоэнцефалический барьер, позволяя лекарству нацеливаться на раковые клетки (112).
Основные рациональные подходы к подавлению опосредованного экзосомами потенциала стимулирования опухоли сосредоточены на блокировании высвобождения экзосом и подавлении коммуникации опухолевых клеток с реципиентными клетками.Известно, что TDE в большом количестве секретируются раковыми клетками, что делает их потенциальными мишенями для противоопухолевой терапии. Прямое нацеливание на процесс высвобождения экзосом также изучается для лечения рака. Доставляемая экзосомами транзиторная миРНК поликистозного рецептора 2 (TRPP2) заметно подавляет экспрессию TRPP2 и ингибирует ЕМТ, предполагая, что экзосома-TRPP2 миРНК может быть эффективной генной терапией на основе РНК при лечении HNC (113). Invadopodia также усиливают секрецию экзосом; соответственно, подавление экспрессии invadopodia может подавлять биогенез и высвобождение TDE (114).Другой потенциальной стратегией нарушения регуляции экзосом является ингибирование поглощения экзосом. Лечение гепарином блокирует захват экзосом оральными клетками SCC, тем самым ослабляя индуцированное экзосомами прогрессирование рака, чтобы ингибировать рост и прогрессирование оральных клеток SCC (20). Однако использование этих реагентов для удаления экзосом в настоящее время ограничено исследовательским использованием только потому, что эти реагенты могут также вызывать нецелевые эффекты. Необходимы дальнейшие исследования для изучения трансляционного воздействия реагентов, нацеленных на экзосомы.
Благодаря потенциальному присутствию TDE и уникальных биомаркеров, связанных с этими пузырьками, TDE также могут применяться в качестве вакцинной иммунотерапии (115). Антигенпрезентирующие экзосомы из В-лимфоцитов и ДК, содержащие комплексы MHCI / II, могут стимулировать Т-клетки CD4 + и CD8 + в качестве терапевтических вакцин против ВПЧ (116). Кроме того, онкогены ВПЧ играют жизненно важную роль в канцерогенезе, индуцированном ВПЧ, а подавление эндогенной экспрессии Е6 / Е7 ВПЧ влияет как на содержание, так и на уровни MV, высвобождаемых из ВПЧ-положительных раковых клеток (117).Эти данные указывают на то, что ингибирование эндогенной экспрессии E6 / E7 HPV может иметь терапевтическое применение. Вакцины против ВПЧ на основе эндогенно сконструированных экзосом для HNC были оценены в нескольких клинических испытаниях фазы I (118). Однако необходимы дополнительные исследования, чтобы определить возможность и безопасность TDE в качестве противораковых вакцин. Одна из основных проблем при разработке этого подхода — создание масштабируемых воспроизводимых методов продукции экзосом. МСК могут найти применение в производстве экзосом в клинически применимых масштабах благодаря их способности продуцировать большие количества экзосом.
В совокупности эти исследования показывают, что стратегии, основанные на экзосомах, могут иметь много преимуществ по сравнению с обычными схемами приема лекарств; однако есть некоторые ограничения и проблемы при использовании экзосом. Во-первых, поскольку TDE содержат генетические компоненты из раковых клеток, раковые клетки могут не быть подходящими родительскими клетками для нацеливания на экзосомы в клинических применениях. Кроме того, эффективная загрузка экзосом без значительных изменений структуры и содержимого экзосомальных мембран может быть затруднена.В целом, эти отчеты показывают, что экзосомы могут функционировать как исключительные векторы доставки генов, которые являются безопасными, эффективными, органоспецифичными и неиммуногенными. Тем не менее, прежде чем станет возможным клиническое применение, необходимы значительные усилия.
Сопротивление противораковой терапии
Текущие варианты терапии HNSCC включают хирургическое вмешательство, лучевую терапию, химиотерапию, лечение анти-EGFR-антителами и иммунотерапию (119). Однако лекарственная устойчивость остается серьезным препятствием на пути к успешному лечению рака.Лекарственная устойчивость включает эндогенную лекарственную устойчивость, врожденную лекарственную устойчивость и приобретенную лекарственную устойчивость. Приобретенная лекарственная устойчивость — это процесс, посредством которого раковые клетки, подвергшиеся химиотерапии, радиации или таргетной терапии, демонстрируют перепрограммирование своего генома, чтобы приобрести устойчивость к терапии. Раковые клетки могут смягчать эффекты лучевой и химиотерапии с помощью различных механизмов (120, 121).
Учитывая важную роль экзосом в клеточной коммуникации и микроокружении опухоли, многие исследования показали, что экзосомы участвуют в устойчивости к противоопухолевой терапии.По одному механизму экзосомы изолируют цитотоксические препараты во внутриклеточных везикулах и впоследствии сводят на нет действие лекарств внутри клеток (122). Из-за природы экзосом как медиаторов межклеточной коммуникации в микроокружении опухоли, эти экзосомы играют важную роль в устойчивости к терапии, передавая различное содержимое, такое как миРНК, мРНК, ДНК и белки, чтобы вызвать внешнюю устойчивость к терапии (123). . Точно так же экзосомы также способствуют устойчивости к терапии за счет переноса мРНК, миРНК и других компонентов.Кроме того, TDE опосредуют резистентность к терапии по другому механизму, включая улучшенную репарацию ДНК, антиапоптотическую передачу сигналов или доставку транспортеров к чувствительным к лечению клеткам. Как медиаторы мезенхимальных стволовых клеток и EMT, экзосомы также способствуют резистентности к лечению, связанной с микроокружением опухоли (123).
Экзосомы, полученные из устойчивых к лекарствам раковых клеток, опосредуют устойчивость к лекарствам путем прямого перемещения лекарств из клеток (124). Путь AKT является часто мутирующим онкогенным путем в HNSCC и функционирует как ключевой регулятор радиационной устойчивости и главный драйвер клеточного движения и миграции (125).Экзосомы, полученные из облученных клеток HNSCC, запускают путь AKT, способствуя миграции и увеличивая хемотаксис в раковых клетках-реципиентах (105). Лучевая терапия может усиливать инвазивные и метастатические свойства HNSCC за счет высвобождения большого количества экзосом в гипоксической раковой ткани после лучевой терапии (126–128). У пациентов с меланомой, получающих терапию блокадой PD-1, уровень циркулирующего экзосомального PD-L1 коррелирует с опухолевой нагрузкой и ответом на терапию (129). Ось передачи сигналов иммунной контрольной точки PD-1 / PD-L1 демонстрирует замечательные ответы при резистентных к платине рецидивирующих или метастатических HNSCC; PD-L1-содержащие TDE, которые передают функциональный PD-L1 и ингибируют иммунные ответы, могут быть регуляторами и биомаркерами устойчивости к терапии блокадой PD-1.Кроме того, экзосомы, полученные из устойчивых к цисплатину клеток HNSCC, доставляют miR-21 к родительским клеткам и индуцируют устойчивость к цисплатину, что позволяет предположить, что эти экзосомы могут функционировать в основном посредством регуляции генов (130). TDE вовлечены в развитие лекарственной устойчивости HNSCC (Рисунок 3).
Будущее
TDE содержат многочисленные биоактивные клеточные молекулы и генетические характеристики, позволяющие им изменять функции клеток-реципиентов и микросреды опухоли.Соответственно, TDE играют важную регуляторную роль при раке. Действительно, TDE участвуют во многих аспектах передачи межклеточного вещества и сигнала, способствуя инициации, развитию, метастазированию, устойчивости к лечению и иммуносупрессии HNSCC. При HNSCC TDE могут служить потенциальными клиническими биомаркерами прогрессирования или ответа на терапию из-за их различного функционального содержания (белки, гены) и элементов родительских раковых клеток. Тем не менее, экзосомы еще не применялись для лечения HNSCC.Необходимы дальнейшие исследования, чтобы выяснить молекулярные механизмы, участвующие в высвобождении экзосом, и изучить клиническое применение этих везикул. Понимание того, как раковые клетки используют TDE для ускорения роста и прогрессирования рака, может привести к разработке новых методов лечения HNSCC. Следовательно, требуется много работы для разработки методов лечения HNSCC на основе экзосом.
Авторские взносы
CX, FS и NX: концепция обзора, дизайн обзора, интерпретация, подготовка рукописи и рецензирование рукописи.YZ, JL и QW: подготовка рукописи и обзор рукописи.
Финансирование
Это исследование финансировалось Исследовательским фондом Национальной комиссии по здравоохранению и планированию семьи и Проектом плана медицинской науки и технологий провинции Чжэцзян (№: KWJ-ZJ-1802).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Список литературы
1. Брей Ф., Ферлай Дж., Сурджоматарам И., Сигель Р.Л., Торре Л.А., Джемаль А. Глобальная статистика рака 2018 г .: оценки GLOBOCAN заболеваемости и смертности от 36 видов рака в 185 странах во всем мире. Рак J Clin . (2018) 68: 394–424. DOI: 10.3322 / caac.21492
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Анг К.К., Харрис Дж., Уилер Р., Вебер Р., Розенталь Д.И., Нгуен-Тан П.Ф. и др. Вирус папилломы человека и выживаемость пациентов с раком ротоглотки. N Engl J Med . (2010) 363: 24–35. DOI: 10.1056 / NEJMoa0912217
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Lydiatt WM, Patel SG, O’Sullivan B., Brandwein MS, Ridge JA, Migliacci JC, et al. Рак головы и шеи — основные изменения в восьмом издании руководства по стадированию рака Американского объединенного комитета по раку. Cancer J Clin. (2017) 67: 122–37. DOI: 10.3322 / caac.21389
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4.Kreimer AR, Clifford GM, Boyle P, Franceschi S. Типы вируса папилломы человека при плоскоклеточном раке головы и шеи во всем мире: систематический обзор. Биомарк эпидемиологии рака Предыдущая . (2005) 14: 467–75. DOI: 10.1158 / 1055-9965.EPI-04-0551
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Пан Б.Т., Джонстон Р.М. Судьба рецептора трансферрина во время созревания ретикулоцитов овцы in vitro : селективная экстернализация рецептора. Ячейка .(1983) 33: 967–78. DOI: 10.1016 / 0092-8674 (83)
-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Келлер С., Райдингер Дж., Рупп А.К., Янссен Дж. В., Альтевогт П. Экзосомы, полученные из жидкости организма, как новый шаблон для клинической диагностики. Дж. Перевод Мед. . (2011) 9:86. DOI: 10.1186 / 1479-5876-9-86
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Беккер А., Такур Б.К., Вайс Дж.М., Ким Х.С., Пейнадо Х., Лайден Д. Внеклеточные везикулы при раке: межклеточные медиаторы метастазирования. Раковые клетки . (2016) 30: 836–48. DOI: 10.1016 / j.ccell.2016.10.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Чжан Х.Г., Grizzle WE. Экзосомы: новый путь локальной и удаленной межклеточной коммуникации, который способствует росту и метастазированию неопластических поражений. Ам Дж. Патол . (2014) 184: 28–41. DOI: 10.1016 / j.ajpath.2013.09.027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14.Раульф Н., Лукарелли П., Таварадж С., Браун С., Висенсио Дж. М., Заутер Т. и др. Аннексин A1 регулирует активность EGFR и изменяет EGFR-содержащие опухолевые экзосомы при раке головы и шеи. евро J Рак . (2018) 102: 52–68. DOI: 10.1016 / j.ejca.2018.07.123
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Li L, Li C, Wang S, Wang Z, Jiang J, Wang W и др. Экзосомы, полученные из клеток гипоксической плоскоклеточной карциномы полости рта, доставляют miR-21 к нормоксическим клеткам, вызывая прометастатический фенотип. Рак Res . (2016) 76: 1770–80. DOI: 10.1158 / 0008-5472.CAN-15-1625
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Ван И, Цинь Икс, Чжу Х, Чен В., Чжан Дж, Чен В. Экзосомный NAP1, полученный из рака полости рта, усиливает цитотоксичность естественных клеток-киллеров через путь IRF-3. Оральный онкол . (2018) 76: 34–41. DOI: 10.1016 / j.oraloncology.2017.11.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Ли YY, Tao YW, Gao S, Li P, Zheng JM, Zhang SE и др.Связанные с раком фибробласты способствуют пролиферации и метастазированию раковых клеток ротовой полости через паракринную miR-34a-5p, опосредованную экзосомами. EBioMedicine . (2018) 36: 209–20. DOI: 10.1016 / j.ebiom.2018.09.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Xiao M, Zhang J, Chen W., Chen W. M1-подобные опухоль-ассоциированные макрофаги, активируемые переносимым экзосомами THBS1, способствуют злокачественной миграции в плоскоклеточной карциноме полости рта. J Exp Clin Cancer Res .(2018) 37: 143. DOI: 10.1186 / s13046-018-0815-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Сенто С., Сасабе Э., Ямамото Т. Применение стойкого лечения гепарином подавляет злокачественный потенциал клеток плоскоклеточной карциномы полости рта, индуцированный экзосомами, происходящими из опухолевых клеток. PLOS ONE . (2016) 11: e0148454. DOI: 10.1371 / journal.pone.0148454
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Abels ER, Breakefield XO.Введение во внеклеточные везикулы: биогенез, выбор груза РНК, содержание, высвобождение и захват. Cell Mol Neurobiol. (2016) 36: 301–12. DOI: 10.1007 / s10571-016-0366-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Коломбо М., Моита С., ван Ниль Г., Коваль Дж., Виньерон Дж., Бенарок П. и др. Анализ функций ESCRT в биогенезе, составе и секреции экзосом подчеркивает гетерогенность внеклеточных везикул. J Cell Sci .(2013) 126 (Pt 24): 5553–65. DOI: 10.1242 / jcs.128868
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Кацманн Д.Д., Бабст М., Эмр С.Д. Убиквитин-зависимая сортировка по мультивезикулярному пути тела требует функции консервативного комплекса сортировки эндосомных белков, ESCRT-I. Ячейка . (2001) 106: 145–55. DOI: 10.1016 / S0092-8674 (01) 00434-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Аирола М.В., Ханнун Я.А.Метаболизм сфинголипидов и нейтральные сфингомиелиназы. Handb Exp Pharmacol. (2013) 215: 57–76. DOI: 10.1007 / 978-3-7091-1368-4_3
CrossRef Полный текст | Google Scholar
28. Перес-Эрнандес Д., Гутьеррес-Васкес С., Хорхе I, Лопес-Мартин С., Урса А., Санчес-Мадрид Ф. и др. Внутриклеточный интерактом обогащенных тетраспанином микродоменов обнаруживает их функцию в качестве механизмов сортировки по отношению к экзосомам. J Biol Chem. (2013) 288: 11649–61. DOI: 10.1074 / JBC.M112.445304
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Zhu H, Guariglia S, Yu RY, Li W, Brancho D., Peinado H, et al. Мутация SIMPLE в зубе Шарко-Мари-1с изменяет образование экзосом. Mol Biol Cell. (2013) 24: 1619–37, S1–3. DOI: 10.1091 / mbc.e12-07-0544
CrossRef Полный текст | Google Scholar
30. Коломбо М., Рапосо Дж., Тери С. Биогенез, секреция и межклеточные взаимодействия экзосом и других внеклеточных везикул. Annu Rev Cell Dev Biol. (2014) 30: 255–89. DOI: 10.1146 / annurev-cellbio-101512-122326
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Экстром Э. Дж., Бергенфельц С., фон Бюлов В., Серифлер Ф., Карлемальм Э., Йонссон Г. и др. WNT5A вызывает высвобождение экзосом, содержащих проангиогенные и иммуносупрессивные факторы, из клеток злокачественной меланомы. Молочный рак . (2014) 13:88. DOI: 10.1186 / 1476-4598-13-88
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32.Власов А.В., Магдалено С., Сеттерквист Р., Конрад Р. Экзосомы: современные знания об их составе, биологических функциях, диагностических и терапевтических возможностях. Biochim Biophys Acta . (2012) 1820: 940–8. DOI: 10.1016 / j.bbagen.2012.03.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Бебельман М.П., Смит М.Дж., Пегтель Д.М., Баглио С.Р. Биогенез и функция внеклеточных везикул при раке. Pharmacol Ther. (2018) 188: 1–11. DOI: 10.1016 / j.pharmthera.2018.02.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Ван Т., Гилкс Д.М., Такано Н., Сян Л., Ло В., Бишоп С.Дж. и др. Факторы, индуцируемые гипоксией, и RAB22A опосредуют образование микровезикул, которые стимулируют инвазию и метастазирование рака груди. Proc Natl Acad Sci USA . (2014) 111: E3234–42. DOI: 10.1073 / pnas.1410041111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Хосино Д., Киркбрайд К.С., Костелло К., Кларк Е.С., Синха С., Грега-Ларсон Н. и др.Секреция экзосом усиливается инвадоподиями и приводит к инвазивному поведению. Сотовый представитель . (2013) 5: 1159–68. DOI: 10.1016 / j.celrep.2013.10.050
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Verweij FJ, Bebelman MP, Jimenez CR, Garcia-Vallejo JJ, Janssen H, Neefjes J, et al. Количественная оценка секреции экзосом отдельными клетками показывает модулирующую роль передачи сигналов GPCR. Дж. Ячейки Биол . (2018) 217: 1129–42. DOI: 10.1083 / jcb.201703206
CrossRef Полный текст | Google Scholar
37.Вэй И, Ван Д., Цзинь Ф., Биан З, Ли Л., Лян Х и др. Пируваткиназа типа M2 способствует высвобождению экзосом опухолевых клеток посредством фосфорилирования белка 23, связанного с синаптосомами. Nat Commun . (2017) 8: 14041. DOI: 10.1038 / ncomms14041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Уильямс К., Пазос Р., Ройо Ф., Гонсалес Э., Рура-Феррер М., Мартинес А. и др. Оценка роли поверхностных гликанов внеклеточных везикул на поглощение клетками. Научный сотрудник .(2019) 9: 11920. DOI: 10.1038 / s41598-019-48499-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Thery C, Boussac M, Veron P, Ricciardi-Castagnoli P, Raposo G, Garin J, et al. Протеомный анализ экзосом, происходящих из дендритных клеток: секретируемый субклеточный компартмент, отличный от апоптотических везикул. Дж Иммунол . (2001) 166: 7309–18. DOI: 10.4049 / jimmunol.166.12.7309
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41.Чжоу В., Фонг М.Ю., Мин И, Сомло Г., Лю Л., Паломарес М.Р. и др. MiR-105, секретируемая раком, разрушает сосудистые эндотелиальные барьеры, способствуя метастазированию. Раковые клетки . (2014) 25: 501–15. DOI: 10.1016 / j.ccr.2014.03.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Мело С.А., Сугимото Х., О’Коннелл Дж. Т., Като Н., Вильянуэва А., Видал А. и др. Раковые экзосомы осуществляют клеточно-независимый биогенез микроРНК и способствуют онкогенезу. Раковые клетки . (2014) 26: 707–21.DOI: 10.1016 / j.ccell.2014.09.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Валади Х., Экстром К., Боссиос А., Сьостранд М., Ли Дж. Дж., Лотвалл Дж. Опосредованный экзосомами перенос мРНК и микроРНК представляет собой новый механизм генетического обмена между клетками. Нат Клетки Биол . (2007) 9: 654–9. DOI: 10.1038 / ncb1596
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Hess J, Unger K, Maihoefer C, Schuttrumpf L, Wintergerst L, Heider T, et al.Сигнатура из пяти микроРНК предсказывает выживаемость и контроль болезни у пациентов с раком головы и шеи, отрицательных по ВПЧ-инфекции. Clin Cancer Res . (2019) 25: 1505–16. DOI: 10.1158 / 1078-0432.CCR-18-0776
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Принсипи С., Хуэй А.Б., Брюс Дж., Синха А., Лю Ф.Ф., Кислингер Т. Экзосомы и микровезикулы опухолевого происхождения при раке головы и шеи: значение для биологии опухоли и открытия биомаркеров. Протеомика .(2013) 13: 1608–23. DOI: 10.1002 / pmic.201200533
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Ким Дж. У., Вецковски Е., Тейлор Д. Д., Райхерт Т. Е., Уоткинс С., Уайтсайд Т.Л. Fas-лиганд-положительные мембранные везикулы, выделенные из сыворотки пациентов с раком полости рта, индуцируют апоптоз активированных Т-лимфоцитов. Clin Cancer Res . (2005) 11: 1010–20.
PubMed Аннотация | Google Scholar
52. Теодораки М.Н., Хоффманн Т.К., Джексон Е.К., Уайтсайд, Т.Л.Экзосомы в плазме HNSCC как суррогатные маркеры опухолевой прогрессии и иммунной компетентности. Клин Эксперимент Иммунол . (2018) 194: 67–78. DOI: 10.1111 / cei.13157
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Злотогорски-Гурвиц А., Даян Д., Чаушу Г., Сало Т., Веред М. Морфологические и молекулярные особенности экзосом, полученных из жидкости полости рта: пациенты с раком полости рта по сравнению со здоровыми людьми. J Cancer Res Clin Oncol . (2016) 142: 101–10. DOI: 10.1007 / s00432-015-2005-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54.Шарма С., Гиллеспи Б.М., Паланисами В., Гимзевски Ю.К. Количественный наноструктурный и биомолекулярный силовой спектроскопический анализ экзосом, полученных из слюны человека. Ленгмюр . (2011) 27: 14394–400. DOI: 10.1021 / la2038763
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Каннан А., Хертвек К.Л., Филли Дж. В., Уэллс Р. Б., Дасгупта С. Генетическая мутация и сигнатура экзосом рака ротоглотки, ассоциированного с вирусом папилломы человека. Научный сотрудник .(2017) 7: 46102. DOI: 10.1038 / srep46102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Злотогорски-Гурвиц А., Декель Б.З., Малонек Д., Яхалом Р., Веред М. Спектр экзосом слюны на основе FTIR в сочетании с компьютерным дискриминирующим анализом в диагностике рака полости рта. J Cancer Res Clin Oncol . (2019) 145: 685–94. DOI: 10.1007 / s00432-018-02827-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58.Рабиновиц Г., Боуден М., Флорес Л. М., Верселис С., Вергара В., Джо В. Ю. и др. Сравнительный анализ экспрессии микроРНК среди доброкачественных и злокачественных тканей языка и плазмы пациентов с раком языка. Передний Oncol . (2017) 7: 191. DOI: 10.3389 / fonc.2017.00191
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Ван Дж, Чжоу Й, Лу Дж, Сунь Й, Сяо Х, Лю М. и др. Комбинированное определение сывороточного экзосомального miR-21 и HOTAIR в качестве диагностических и прогностических биомаркеров плоскоклеточного рака гортани. Мед Онкол . (2014) 31: 148. DOI: 10.1007 / s12032-014-0148-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Цинь Х, Го Х, Ван Х, Чжу Х, Ян М., Ван Х и др. Экзосомная miR-196a, происходящая из связанных с раком фибробластов, придает устойчивость к цисплатину при раке головы и шеи посредством нацеливания на CDKN1B и ING5. Биология генома . (2019) 20:12. DOI: 10.1186 / s13059-018-1604-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61.Хуанг Q, Ян Дж., Чжэн Дж., Сюэ С, Го Й, Чжоу Л. Характеристика избирательного профиля экспрессии экзосомальной микроРНК, полученного из плоскоклеточного рака гортани, обнаруженного с помощью секвенирования следующего поколения. Компания Oncol Rep . (2018) 40: 2584–94. DOI: 10.3892 / or.2018.6672
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Гай С., Камусси Ф., Брокколетти Р., Гамбино А., Кабрас М., Молинаро Л. и др. MiRNA, ассоциированные с внеклеточными пузырьками слюны, как потенциальные биомаркеры плоскоклеточной карциномы полости рта. BMC Рак . (2018) 18: 439. DOI: 10.1186 / s12885-018-4364-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Саха С., Мурамацу Т., Уэда К., Инадзава Дж. Экзосомная микроРНК miR-1246 индуцирует подвижность и инвазию клеток посредством регуляции DENND2D в плоскоклеточной карциноме полости рта. Научный сотрудник . (2016) 6: 38750. DOI: 10.1038 / srep38750
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Аль-Недави К., Михан Б., Кербель Р.С., Эллисон А.С., Рак Дж.Эндотелиальная экспрессия аутокринного VEGF при захвате микровезикул опухолевого происхождения, содержащих онкогенный EGFR. Proc Natl Acad Sci USA . (2009) 106: 3794–9. DOI: 10.1073 / pnas.0804543106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Huang SH, Li Y, Zhang J, Rong J, Ye S. Экзосомы, содержащие рецептор эпидермального фактора роста, индуцируют опухолеспецифические регуляторные Т-клетки. Рак Инвест . (2013) 31: 330–5. DOI: 10.3109 / 07357907.2013.789905
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66.ван Доммелен С.М., ван дер Меель Р., ван Солинг В.В., Коимбра М., Вейдер П., Шиффелерс Р.М. Лечение цетуксимабом изменяет содержание внеклеточных везикул, высвобождаемых из опухолевых клеток. Наномедицина . (2016) 11: 881–90. DOI: 10.2217 / nnm-2015-0009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Людвиг С., Шарма П., Теодораки М.Н., Пьетровска М., Ернени С.С., Ланг С. и др. Молекулярные и функциональные профили экзосом из линий клеток рака головы и шеи HPV (+) и HPV (-). Передний Oncol . (2018) 8: 445. DOI: 10.3389 / fonc.2018.00445
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Винк Ф.В., Прадо Рибейро А.С., Рамос Домингес Р., Линг Л.И., Риано-Пачон Д.М., Ривера С. и др. Понимание иммунных ответов при раке полости рта посредством протеомного анализа слюны и внеклеточных пузырьков слюны. Научный сотрудник . (2015) 5: 16305. DOI: 10.1038 / srep16305
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69.Феррис Р.Л., Блюменшейн Дж. Мл., Файетт Дж., Гигей Дж., Колевас А.Д., Лиситра Л. и др. Ниволумаб при рецидивирующем плоскоклеточном раке головы и шеи. N Engl J Med. (2016) 375: 1856–67. DOI: 10.1056 / NEJMoa1602252
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Чоу LQM, Хаддад Р., Гупта С., Махипал А., Мехра Р., Тахара М. и др. Противоопухолевая активность пембролизумаба у пациентов с рецидивирующей и / или метастатической плоскоклеточной карциномой головы и шеи, не выбранных по биомаркеру: результаты в когорте расширения фазы Ib KEYNOTE-012. Дж Клин Онкол . (2016) 34: 3838–45. DOI: 10.1200 / JCO.2016.68.1478
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. Теодораки М.Н., Ернени С.С., Хоффманн Т.К., Гудинг В.Е., Уайтсайд, TL. Клиническое значение экзосом PD-L1 (+) в плазме больных раком головы и шеи. Clin Cancer Res. (2018) 24: 896–905. DOI: 10.1158 / 1078-0432.CCR-17-2664
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. Конча-Бенавенте Ф., Шривастава Р.М., Триведи С., Лей Й., Чандран У., Ситала Р.Р. и др.Идентификация внутренних и внешних путей клеток ниже EGFR и IFNgamma, которые индуцируют экспрессию PD-L1 при раке головы и шеи. Рак Res . (2016) 76: 1031–43. DOI: 10.1158 / 0008-5472.CAN-15-2001
PubMed Аннотация | CrossRef Полный текст |
Рак головы и шеи: введение
НА ЭТОЙ СТРАНИЦЕ: Вы найдете основную информацию об этом заболевании и частях тела, на которые оно может повлиять. Это первая страница Рака.Руководство Net по раку головы и шеи. Используйте меню для просмотра других страниц. Думайте об этом меню как о дорожной карте для этого полного руководства.
Рак начинается, когда здоровые клетки изменяются и выходят из-под контроля, образуя массу, называемую опухолью. Опухоль может быть злокачественной или доброкачественной. Раковая опухоль является злокачественной, то есть она может расти и распространяться на другие части тела. Доброкачественная опухоль означает, что опухоль может расти, но не распространяется.
О раке головы и шеи
«Рак головы и шеи» — это термин, используемый для описания ряда различных злокачественных опухолей, которые развиваются в или вокруг горла, гортани, носа, носовых пазух и рта.
Большинство видов рака головы и шеи представляют собой плоскоклеточные карциномы. Этот тип рака начинается с плоских плоскоклеточных клеток, которые составляют тонкий слой ткани на поверхности структур головы и шеи. Непосредственно под этой подкладкой, которая называется эпителием, в некоторых областях головы и шеи есть слой влажной ткани, называемой слизистой оболочкой. Если рак обнаружен только в плоском слое клеток, он называется карциномой in situ. Если рак вышел за пределы этого клеточного слоя и переместился в более глубокие ткани, это называется инвазивной плоскоклеточной карциномой.Если врачи не могут определить, где начался рак, это называется раком неизвестной первичной формы. Узнайте больше о плоскоклеточной карциноме неизвестного первичного звена головы и шеи.
Если рак головы и шеи начинается в слюнных железах (см. Ниже), опухоль обычно классифицируется как аденокарцинома, аденоидно-кистозная карцинома или мукоэпидермоидная карцинома.
Типы рака головы и шеи
Существует 5 основных типов рака головы и шеи, каждый из которых назван в соответствии с той частью тела, в которой он развивается.Для получения дополнительной информации о конкретном типе рака посетите руководство, посвященное этому типу рака головы и шеи, на этом же веб-сайте.
Рак гортани и гортани. Гортань обычно называют голосовым ящиком. Этот орган в форме трубки на шее важен для дыхания, разговора и глотания. Он расположен в верхней части трахеи или трахеи. Гипофаринкс еще называют глоткой. Это нижняя часть горла, окружающая гортань.Подробнее о раке гортани и гортани.
Рак полости носа и придаточных пазух носа. Носовая полость — это пространство сразу за носом, через которое воздух проходит к горлу. Придаточные пазухи — это заполненные воздухом области, окружающие полость носа. Узнайте больше о раке полости носа и придаточных пазух носа.
Рак носоглотки. Носоглотка — это воздушный проход в верхней части глотки за носом.Узнайте больше о раке носоглотки.
Рак полости рта и ротоглотки. Полость рта включает рот и язык. Ротоглотка включает середину глотки от миндалин до кончика голосового аппарата. Подробнее о раке полости рта и ротоглотки.
Рак слюнной железы. Слюнная железа вырабатывает слюну. Слюна — это жидкость, которая попадает в рот для поддержания его влажности и содержит ферменты, которые начинают расщеплять пищу.Подробнее о раке слюнных желез.
Другие типы рака также могут быть локализованы в области головы и шеи, но их диагностика и лечение сильно отличаются. Конкретная информация об опухолях головного мозга, раке пищевода, раке глаз, раке паращитовидной железы, саркоме и раке щитовидной железы доступна в других руководствах на сайте Cancer.Net.
Ищете больше введения?
Если вы хотите получить больше информации, изучите эти связанные элементы. Обратите внимание, что по этим ссылкам вы попадете в другие разделы Рака.Сеть:
Ответы ASCO Информационный бюллетень: Прочтите одностраничный информационный бюллетень, который предлагает введение в рак головы и шеи. Этот бесплатный информационный бюллетень доступен в формате PDF, поэтому его легко распечатать. Этот информационный бюллетень доступен также на румынском языке.
Блог Cancer.Net: Прочтите мнение эксперта ASCO о том, что пациенты с недавно диагностированным раком должны знать о раке головы и шеи.
Cancer.Net Обучающее видео для пациентов: Просмотрите короткое видео, подготовленное экспертом ASCO по раку головы и шеи, которое предоставляет основную информацию и области исследований.
Следующий раздел в этом руководстве — Статистика . Это помогает объяснить, у скольких людей диагностирован рак головы и шеи, а также общие показатели выживаемости. Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Рак горла, Рак головы и шеи
Врачи ежегодно диагностируют около 48000 новых случаев рака головы и шеи в США . Поскольку они могут влиять на то, как мы дышим, говорим, глотаем и смотрим, рак головы и шеи требует высокоточного лечения.
В онкологическом центре UPMC Hillman мы имеем обширный опыт как в стандартных, так и в новых методах лечения, включая минимально инвазивные методы лечения рака головы и шеи. Минимально инвазивная хирургия может уменьшить влияние рака головы и шеи на вашу повседневную жизнь.
Наши специалисты используют командный подход к решению многих аспектов лечения рака головы и шеи. И мы лечим вас и ваши уникальные потребности, а не только ваш рак.
У нас более 60 офисов в Пенсильвании, Огайо и западном Нью-Йорке.
Что такое рак головы и шеи?
Рак — это результат аномального роста клеток.
Около 90 процентов случаев рака головы и шеи формируются в плоскоклеточной карциноме.
Плоскоклеточная карцинома образуется из плоскоклеточных клеток, которые представляют собой клетки, выстилающие многие структуры тела, такие как:
- Горло
- Рот
- Нос
- Пазухи
Мы лечим следующие виды рака головы и шеи:
- Рак горла — рак гортани, носоглотки и метастатический плоскоклеточный рак шеи.
- Рак полости рта и глотки — полости рта, ротоглотки и слюнной железы.
- Рак носа и пазух — придаточные пазухи носа и носовая полость.
- Рецидивирующий или метастатический рак головы и шеи — рак, который рецидивировал в голову и шею или распространился по всему телу
- Рак щитовидной железы
Причины рака головы и шеи
Воздействие токсинов, таких как табак и алкоголь, является основной причиной большинства видов рака головы и шеи.
Вирус папилломы человека (ВПЧ), вызывающий рак шейки матки, также может вызывать рак головы и шеи, особенно те, которые начинаются в ротоглотке.
Риск рака головы и шеи
Факторы риска увеличивают вероятность заболевания раком. Иногда люди могут изменить свои привычки, чтобы снизить факторы риска.
Факторы, которые могут увеличить риск рака головы и шеи :
- Токсины — курение или жевание табака и употребление слишком большого количества алкоголя.
- Возраст — большинство случаев рака головы и шеи поражает людей от 50 лет и старше.
- Пол — мужчины подвержены большему риску, чем женщины.
- Радиация — облучение в детстве.
Почему выбирают UPMC для лечения рака головы и шеи?
Наши хирургические, медицинские и радиационные онкологи предоставляют всестороннюю, индивидуальную и заботливую помощь.
Мы — единственный в западной Пенсильвании комплексный онкологический центр, назначенный Национальным институтом рака.Это означает, что у вас есть доступ к клиническим испытаниям методов лечения рака головы и шеи, которые вы, возможно, не найдете в других местах.
Симптомы и диагностика рака головы и шеи
Люди с раком головы и шеи могут сначала не испытывать многих симптомов, но по мере роста рака симптомы могут возникать. Существуют различные факторы риска, повышающие вероятность заболевания раком.
Узнайте больше о симптомах и диагностике.
Программа лечения рака головы и шеи
Онкологический центр UPMC Hillman использует междисциплинарный подход к лечению рака головы и шеи, чтобы обеспечить полный комплекс услуг.
Узнайте больше о нашей лечебной программе.
Стадии базального и плоскоклеточного рака кожи
После того, как кому-то поставят диагноз «рак», врачи попытаются выяснить, распространился ли он, и если да, то как далеко.Этот процесс называется этапом . Стадия рака описывает, сколько рака находится в организме. Это помогает определить, насколько серьезен рак и как лучше его лечить.
Этап основывается на результатах физического осмотра, биопсии кожи (и любых других биопсий) и результатах визуализационных тестов, если они проводились. Эти экзамены и тесты описаны в разделе «Тесты на базальный и плоскоклеточный рак кожи».
Определение стадии базальноклеточного рака кожи редко требуется, потому что эти виды рака почти всегда излечиваются до того, как они распространятся на другие части тела.
Плоскоклеточный рак кожи с большей вероятностью распространится (хотя этот риск все еще невелик), поэтому определение стадии может быть более важным, особенно у людей с повышенным риском. Сюда входят люди с ослабленной иммунной системой, например, те, кому была сделана трансплантация органов, и люди, инфицированные ВИЧ, вирусом, вызывающим СПИД. Большинство плоскоклеточного рака кожи возникает в области головы и шеи и, как правило, имеет более высокий риск рецидива (возвращения) или распространения по сравнению с таковыми в других местах.
Как определяется этап?
Системой, наиболее часто используемой для определения стадий базальноклеточного и плоскоклеточного рака кожи, является Американская объединенная комиссия по раку (AJCC) TNM system . Самая последняя версия, действующая с 2018 года, применяется только к плоскоклеточному и базально-клеточному раку кожи области головы и шеи (губ, ушей, лица, кожи головы и шеи). Этап основан на 3 ключевых элементах информации:
- Размер t umor (T) , и если он проник глубже в близлежащие структуры или ткани, такие как кость
- Если рак распространился на близлежащие лимфатические узлы n odes (N)
- Если рак распространился ( м этастазирован) на отдаленные части тела (М)
Цифры или буквы после T, N и M предоставляют более подробную информацию о каждом из этих факторов.Более высокие числа означают, что рак продвинулся дальше.
После определения категорий T, N и M человека эта информация объединяется в процессе, называемом группировка стадий , чтобы назначить общую стадию. Самая ранняя стадия рака кожи — это стадия 0 (также называемая карциномой in situ, или CIS). Остальные стадии варьируются от I (1) до IV (4). Как правило, чем меньше число, тем меньше распространился рак. Более высокое число, например стадия IV, означает, что рак распространился еще больше.
Если у вас рак кожи в области головы и шеи, поговорите со своим врачом о вашей конкретной стадии. Стадия рака может быть сложной, поэтому попросите врача объяснить вам это так, как вы понимаете. Для получения дополнительной информации см. Стадия рака .
Другие факторы, которые могут повлиять на прогноз и варианты лечения
Стадия рака кожи может помочь понять, насколько серьезным может быть рак, включая вероятность его рецидива после лечения.Но важно учитывать и другие факторы. Некоторые из них включают:
- Расположение опухоли
- Как быстро растет опухоль
- Насколько четко очерчены границы опухоли
- Если опухоль вызывает симптомы, такие как боль или зуд
- Как раковые клетки выглядят под микроскопом
- Если раковые клетки проникли в мелкие нервы или кровеносные сосуды внутри и вокруг опухоли
- Если рак находится в месте, которое ранее лечили радиацией
- Если у человека ослабленная иммунная система
Ваш врач объяснит, может ли какой-либо из этих факторов повлиять на ваше лечение или прогноз.
.


 Существуют различные виды ВПЧ, называемые штаммами.
Существуют различные виды ВПЧ, называемые штаммами. Рефлюкс связан с ростом опухоли в данной области.
Рефлюкс связан с ростом опухоли в данной области. Протезы следует снимать каждую ночь, чистить и тщательно промывать каждый день.
Протезы следует снимать каждую ночь, чистить и тщательно промывать каждый день.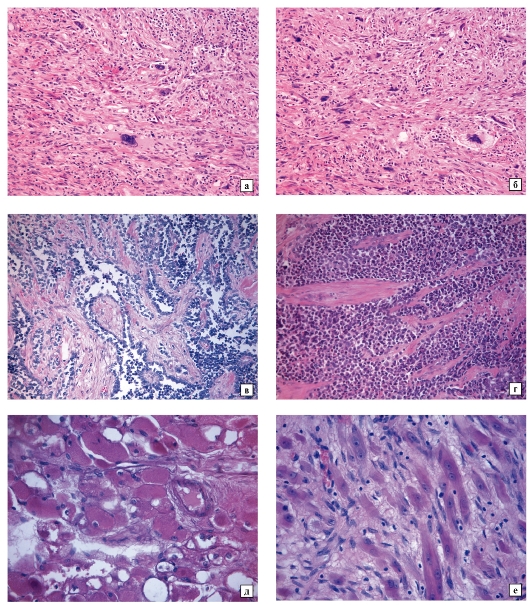
 Эта операция помогает восстановить внешний вид человека и функциональность отдельных органов. Логопед потребоваться, чтобы заново научить больного глотать и общаться, используя новейшие методики.
Эта операция помогает восстановить внешний вид человека и функциональность отдельных органов. Логопед потребоваться, чтобы заново научить больного глотать и общаться, используя новейшие методики.