Подкожное введение инъекций в Санкт-Петербурге
/
Подкожное введение лекарственного средства
Инъекции лекарств в организм проводят различными способами, и подкожное введение – один из них. При данном методе введения лекарственное средство попадает в подкожную клетчатку, откуда и происходит его всасывание в кровеносные сосуды.
Для введения препарата используется одноразовый шприц. Существуют лекарственные средства, которые вводятся только подкожно. В частности, при помощи подкожных инъекций вводят вакцины, гепарин и его производные и другие вещества, не имеющие местного раздражающего действия. В большой круг кровообращения вещество попадает быстрее, чем при пероральном приеме в виде таблеток или капсул. Подкожная инъекция практически безболезненна и хорошо переносится пациентами.
Стоимость
array(1) {
["STOIMOST"]=>
array(37) {
["ID"]=>
string(1) "1"
["TIMESTAMP_X"]=>
string(19) "2017-06-29 14:40:11"
["IBLOCK_ID"]=>
string(1) "2"
["NAME"]=>
string(18) "Стоимость"
["ACTIVE"]=>
string(1) "Y"
["SORT"]=>
string(3) "500"
["CODE"]=>
string(8) "STOIMOST"
["DEFAULT_VALUE"]=>
string(0) ""
["PROPERTY_TYPE"]=>
string(1) "N"
["ROW_COUNT"]=>
string(1) "1"
["COL_COUNT"]=>
string(2) "30"
["LIST_TYPE"]=>
string(1) "L"
["MULTIPLE"]=>
string(1) "N"
["XML_ID"]=>
NULL
["FILE_TYPE"]=>
string(0) ""
["MULTIPLE_CNT"]=>
string(1) "5"
["TMP_ID"]=>
NULL
["LINK_IBLOCK_ID"]=>
string(1) "0"
["WITH_DESCRIPTION"]=>
string(1) "N"
["SEARCHABLE"]=>
string(1) "N"
["FILTRABLE"]=>
string(1) "N"
["IS_REQUIRED"]=>
string(1) "N"
["VERSION"]=>
string(1) "1"
["USER_TYPE"]=>
NULL
["USER_TYPE_SETTINGS"]=>
NULL
["HINT"]=>
string(0) ""
["PROPERTY_VALUE_ID"]=>
string(2) "67"
["VALUE"]=>
string(3) "250"
["DESCRIPTION"]=>
string(0) ""
["VALUE_ENUM"]=>
NULL
["VALUE_XML_ID"]=>
NULL
["VALUE_SORT"]=>
NULL
["~VALUE"]=>
string(3) "250"
["~DESCRIPTION"]=>
string(0) ""
["~NAME"]=>
string(18) "Стоимость"
["~DEFAULT_VALUE"]=>
string(0) ""
["DISPLAY_VALUE"]=>
string(3) "250"
}
}
Скидки
Скидка болельщикам ФК «Зенит» до 10% (скидка зависит от типа дисконтной карты).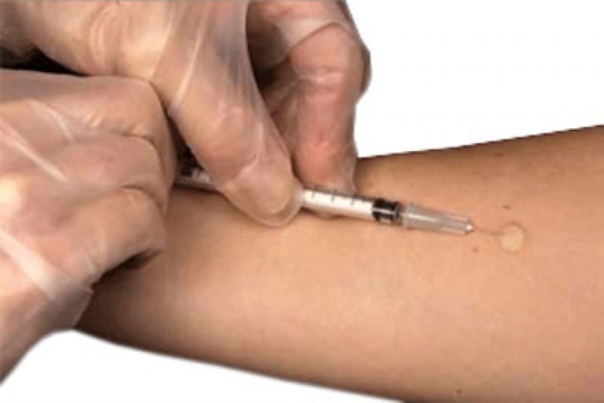
Внутрикожное и подкожное введение лекарственных средств. Проблемно-ситауционная задача
В процессе работы с модулем студент закрепит полученные знания по показаниям и противопоказаниям, выбору места введения, подготовке оснащения и правилам выполнения подкожной инъекции.
Тип:
Практический;
версия:
1.0.1.10
от 29.10.2009
Внимание! Для воспроизведения модуля
необходимо установить на компьютере
проигрыватель ресурсов.
Категория пользователей
Преподаватель, Обучаемый
Контактное время
0100
минут
Интерактивность
Высокая
Дисциплины
Тематика среднего профессионального образования
/ Сестринское дело
/ Основы сестринского дела
Статус
Завершенный вариант (готовый, окончательный)
Тип ИР сферы образования
Практический модуль
Язык
Русский
Ключевые слова
Инъекция
Автор
Издатель
Правообладатель
Чумакова Э.
 М.
М.
Франчайзариум ООО
ООО «Франчайзариум»
Федеральное агентство по образованию России Федеральный орган исполнительной власти
Федеральное агентство по образованию России
Россия, 115998, Москва, ул. Люсиновская, д. 51,
Характеристики информационного ресурса
Тип используемых данных:
text/xml, audio/mpeg, application/x-shockwave-flash, text/html, image/jpeg, image/png
Объем цифрового ИР
4 982 051 байт
Проигрыватель
OMS-player версии от 2. 0
0
Категория модифицируемости компьютерного ИР
открытый
Признак платности
бесплатный
Наличие ограничений по использованию
нет ограничений
Рубрикация
Ступени
образования
Среднее профессиональное образование
Целевое
назначение
Учебное
Тип
ресурса
Открытая образовательная модульная мультимедийная система (ОМС)
Классы общеобразовательной
школы
Уровень образовательного
стандарта
Федеральный
Характер
обучения
Внутривенное и подкожное введение лекарственных инъекций и препаратов в Перми. Запись на консультацию врача-специалиста +7 (342) 234-03-03
При лечении острых и хронических заболеваний парентеральное введение препаратов позволяет максимально быстро ввести необходимое лекарство в организм человека и создать необходимую концентрацию лекарственного средства для достижения терапевтического эффекта.
Это является основным преимуществом перед другими методами введения лекарственных препаратов в организм.
ВНУТРИМЫШЕЧНАЯ ИНЪЕКЦИЯ
Внутримышечная инъекция — это непосредственное введение в мышечную ткань лекарственных препаратов в небольших объемах. Мышечные ткани содержат развитую сеть кровеносных сосудов, по этому после выполнения инъекции происходит постепенное поступление введенного лекарственного препарата в организм через кровь.
Внутримышечное введение препарата позволяет поддерживать необходимую концентрацию лекарственного препарата в организме. Для выполнения внутримышечной инъекции обычно используется ягодичная область, по показаниям инъекции также могут выполнятся в другие крупные мышцы.
ВНУТРИВЕННАЯ ИНЪЕКЦИЯ
Внутривенная инъекция — это непосредственное введение раствора лекарственного препарата в вену. Венами называются кровеносные сосуды по которым кровь течет к сердцу. Внутривенное введении препарата, если сравнивать с внутримышечным введением, позволяет максимально быстро создать необходимую концентрации лекарственного препарата в крови и в органе на который нацелено медикаментозное воздействие.
Поскольку лекарственный препарат вводится непосредственно в кровь, время нахождения его в организме значительно меньше, чем при внутримышечном введении. Обычно внутривенное введение препарата выполняется в вены предплечья, либо в другие хорошо визуализируемые крупные вены.
Компания Рош (SIX: RO, ROG; OTCQX: RHHBY) объявила результаты двух исследований, которые показали, что фиксированная доза препарата Мабтера (ритуксимаб) – 1400 мг – может вводиться подкожно (ПК), что позволит пациентам проводить меньше времени в медицинских центрах для получения курса лечения данным препаратом. «Форма для подкожного введения Мабтеры обеспечивает пациентам эффективный и более удобный вариант введения препарата, что позволит совершить переворот в лечении B-клеточных злокачественных заболеваний, – сказал Хал Баррон, доктор медицины, главный медицинский директор и глава глобального подразделения по разработке лекарственных препаратов компании Рош. – Являясь лидером в области инновационных методов лечения онкологических заболеваний, компания Рош реализует широкую программу исследований экспериментальных лекарственных средств и новых способов их введения». Подкожная инъекция Мабтеры значительно сокращает сроки введения препарата — до 5 минут по сравнению с 2,5 часами (иногда до 4-6 часов) при внутривенном введении. Готовая к применению подкожная форма позволяет значительно сократить время на приготовление лекарственного средства и процедуру введения, что положительно повлияет на использование ресурсов медицинских учреждений благодаря существенной экономии времени персонала. Первичная конечная точка по сопоставимой эффективности (отсутствие меньшей эффективности) подкожной формы Мабтеры по сравнению с внутривенной была выбрана, чтобы гарантировать соответствие выбранной дозировки подкожной формы стандартной дозировке при внутривенном введении. В дополнение к этому, в исследовании SparkThera Ib фазы также была достигнута первичная конечная точка по сопоставимости фармакокинетических параметров Мабтеры (Ctrough) при подкожном и внутривенном введении в режиме поддерживающей терапии при фолликулярной лимфоме. В частности, при введении Мабтеры один раз в два месяца, минимальное отношение концентраций при подкожном/внутривенном введении было равно 1,24, а при введении Мабтеры раз в три месяца – 1,12. Об исследовании SABRINA (BO22334) SABRINA представляет собой двухэтапное международное исследование III фазы для изучения фармакокинетических параметров, эффективности и безопасности подкожной и внутривенной формы введения Мабтеры пациентам с фолликулярной лимфомой, получающим индукционную и поддерживающую терапию. На первом этапе (выбор оптимального режима дозирования) первичной конечной точкой являлись фармакокинетические параметры Мабтеры (Ctrough) при внутривенном и подкожном введении. Ранее не получавшие лечения пациенты с фолликулярной лимфомой были рандомизированы в группы для получения 375 мг/м2 Мабтеры внутривенно или фиксированной дозы 1400 мг Мабтеры подкожно, в обоих случаях в комбинации с химиотерапией по схеме CHOP или CVP. Пациенты, достигшие полного или частичного ответа после 8 циклов лечения, продолжали получать поддерживающую терапию Мабтерой с подкожным или внутривенным введением в соответствии с их первичной рандомизацией. Также при анализе эффективности по данным исследования SABRINA было продемонстрировано, что переход с внутривенного на подкожный способ введения может быть выполнен без потери эффективности: были показаны сходные результаты по частоте объективного ответа [84,4% ВВ и 90,5% ПК] и полного ответа [29,7% ВВ и 46% ПК], подтверждающие вывод о сопоставимой эффективности. Об исследовании SparkThera (BP22333) SPARKTHERA представляет собой двухэтапное международное исследование Ib фазы, в котором сравниваются лекарственные формы Мабтеры для ПК и ВВ введения с точки зрения фармакокинетических параметров и профиля безопасности при проведении поддерживающей терапии у пациентов с фолликулярной лимфомой. На первом этапе (выбор оптимального режима дозирования) была выбрана доза Мабтеры для подкожного введения, а на втором этапе фиксированная дозировка, составившая 1400 мг, изучалась в режиме поддерживающей терапии у пациентов, рандомизированных для получения подкожной или внутривенной формы. О препарате Мабтера в форме для подкожного введения В лекарственной форме для подкожного введения препарата Мабтера используется технология Enhanze™, разработанная компанией Halozyme Therapeutics Inc., которая позволяет вводить пациентам большие объемы лекарственного препарата подкожно. Принцип технологии заключается в обратимом разрушении гиалуроновых волокон, формирующих барьер между клетками подкожно-жировой клетчатки. С использованием этой технологии в Рош также разработана форма для подкожного введения препарата Герцептин (трастузумаб), в Европейское агентство по лекарственным средствам (ЕМА) подана заявка на включение подкожной формы Герцептина в перечень лекарственных форм Герцептина и разрешение его применения при HER2-положительном раке молочной железы. О препарате Мабтера Мабтера (ритуксимаб) является моноклональным антителом, которое специфически связывается с особым белком, антигеном CD20, на поверхности нормальных и злокачественных В-клеток. После связывания антитело мобилизует естественные механизмы иммунной защиты для уничтожения помеченных В-клеток. Антиген CD20 отсутствует на стволовых кроветворных клетках (предшественниках В-клеток) в костном мозге, поэтому здоровые В-клетки восстанавливаются после лечения, и их концентрация достигает нормального уровня в течение нескольких месяцев. Препарат Мабтера (Ритуксан), открытый компанией Biogen Idec, впервые получил разрешение в США в 1997 году для применения при рецидивирующих индолентных неходжкинских лимфомах и стал первым таргетным противоопухолевым препаратом, разрешенным Управлением по контролю качества продуктов питания и лекарственных средств США. В июне 1998 года препарат был разрешен к применению в Европе под торговой маркой Мабтера. За 15 лет эффективность и безопасность Мабтеры была доказана в более чем 300 исследованиях II/III фазы. Показания к применению Мабтеры в онкологии включают В-клеточные неходжкинские лимфомы и хронический лимфолейкоз. Продолжаются исследования применения данного препарата при других формах злокачественных лимфопролиферативных заболеваний. С начала применения Мабтеру получили более 3 миллионов пациентов, из них 2,7 миллиона – в связи со онкогематологическими заболеваниями. В США, Канаде и Японии препарат Мабтера известен под названием Ритуксан. Ритуксан распространяется в США совместно с компаниями Genentech и Biogen Idec, в остальных странах мира распространением Мабтеры занимается Ф.Хоффманн-Ля Рош Лтд, за исключением Японии, где препарат распространяют компании Chugai и Zenyaku Kogyo Co. Ltd. О компании Рош Компания Рош входит в число ведущих компаний мира в области фармацевтики и является лидером в области диагностики in vitro и гистологической диагностики онкологических заболеваний. Стратегия, направленная на развитие персонализированной медицины, позволяет компании Рош производить инновационные препараты и современные средства диагностики, которые спасают жизнь пациентам, значительно продлевают и улучшают качество их жизни. Являясь одним из ведущих производителей биотехнологических лекарственных препаратов, направленных на лечение онкологических заболеваний, тяжелых вирусных инфекций, аутоиммунных воспалительных заболеваний, нарушений центральной нервной системы и обмена веществ и пионером в области самоконтроля сахарного диабета, компания уделяет особое внимание вопросам сочетания эффективности своих препаратов и средств диагностики с удобством и безопасностью их использования для пациентов.
Все товарные знаки, использованные или упомянутые в данном пресс-релизе, защищены законом.
|
Манипуляции сестринского ухода
Главная/Прейскурант/Манипуляции сестринского ухода
| A11.01.002 | Подкожное введение лекарственных препаратов | 320 |
| A11.01.003 | Внутрикожное введение лекарственных препаратов (местная анестезия) | 540 |
| A11.02.002 | Внутримышечное введение лекарственных препаратов | 370 |
| A11.02.002.1 | Внутримышечное введение лекарственных препаратов (без лекарственных препаратов) | 290 |
| A11.04.003 | Диагностическая аспирация сустава (в плановом порядке) | 1180 |
| A11.04.004 | Внутрисуставное введение лекарственных препаратов (в плановом порядке) | 860 |
| A11.09.007.001 | Ингаляторное введение лекарственных препаратов через небулайзер (пульмикорт 0,25 мг/мл) | 360 |
| A11.09.007.001.1 | Ингаляторное введение лекарственных препаратов через небулайзер (беродуал) | 310 |
| A11.12.002 | Катетеризация кубитальной и других переферических вен | 1620 |
A11. 12.003 12.003 | Внутривенное введение лекарственных препаратов (без стоимости лекарственных средств) | 590 |
| A11.12.003.001 | Непрерывное внутривенное введение лекарственных препаратов | 950 |
| A11.28.007 | Катетеризация мочевого пузыря | 780 |
Обычная версия сайта
Настройки
Размер текстааа
Цвет фонааааа
Интервал между букваминормальныйувеличенныйбольшой
Шрифтбез засечекс засечками
Изображения
Подкожное введение противоопухолевых агентов
В последние годы много говорилось о развитии перорального противоопухолевого лечения с точки зрения практических аспектов и удобства для пациента по сравнению с внутривенным введением. Основными недостатками внутривенных инъекций являются риск инфицирования кровотока и необходимость в условиях стационара. По состоянию на январь 2014 года было доступно более 60 пероральных противоопухолевых средств, из них 22 ингибитора киназы были одобрены во всем мире с 2001 года (иматиниб).Меньше внимания уделялось возможности подкожного введения в качестве парентеральной альтернативы, вероятно, из-за цитотоксической природы этих агентов. Однако недавние одобрения (азацитидин, бортезомиб, омацетаксин, трастузумаб и в ближайшем будущем ритуксимаб) привели к возрождению интереса к этому способу введения.
Помимо аналогов лютеинизирующего гормона-рилизинг-гормона (терапия депривации андрогенов при раке простаты, эндокринная терапия при раке груди) и цитокинов (альдеслейкин / интерлейкин-2 и интерферон-альфа) при лечении карциномы почек и меланомы, очень мало (n = 8) противоопухолевые средства вводятся подкожно.Это связано с тем, что большинство из них являются раздражающими или пузырьковыми (известно, что , т.е. , вызывают локальное повреждение подкожных или подкожных тканей после случайной инфильтрации, также называемой экстравазацией) (1). Подкожная доставка, таким образом, применяется к невезикантным агентам. В настоящее время одобрены противоопухолевые препараты для подкожного введения: метотрексат, цитарабин, азацитидин, кладрибин, бортезомиб, омацетаксин, блеомицин и трастузумаб (Таблица I). Согласно официальной маркировке, азацитидин (в Европе) и омацетаксин вводятся только подкожно, тогда как другие можно вводить внутривенно или другими путями.Ритуксимаб для подкожного введения находится в стадии разработки в качестве парентеральной альтернативы внутривенной формы. С коммерческой точки зрения составы трастузумаба и ритуксимаба нацелены на противодействие следующему появлению внутривенных биологически подобных агентов (генерические версии этих дорогостоящих терапевтических белков, именуемые «биоаналогами»). Сообщалось также о подкожном введении алемтузумаба не по назначению. Насколько мне известно, ни одна общая статья не была посвящена подкожной доставке противоопухолевых агентов людям.Цель этого краткого обзора — представить то, что известно об использовании подкожных противоопухолевых агентов у людей (данные на животных исключены).
Подкожная доставка, таким образом, применяется к невезикантным агентам. В настоящее время одобрены противоопухолевые препараты для подкожного введения: метотрексат, цитарабин, азацитидин, кладрибин, бортезомиб, омацетаксин, блеомицин и трастузумаб (Таблица I). Согласно официальной маркировке, азацитидин (в Европе) и омацетаксин вводятся только подкожно, тогда как другие можно вводить внутривенно или другими путями.Ритуксимаб для подкожного введения находится в стадии разработки в качестве парентеральной альтернативы внутривенной формы. С коммерческой точки зрения составы трастузумаба и ритуксимаба нацелены на противодействие следующему появлению внутривенных биологически подобных агентов (генерические версии этих дорогостоящих терапевтических белков, именуемые «биоаналогами»). Сообщалось также о подкожном введении алемтузумаба не по назначению. Насколько мне известно, ни одна общая статья не была посвящена подкожной доставке противоопухолевых агентов людям.Цель этого краткого обзора — представить то, что известно об использовании подкожных противоопухолевых агентов у людей (данные на животных исключены).
Подкожная инъекция
Подкожная доставка осуществляется в подкожную клетчатку (под кожей), как правило, в виде короткой инъекции (несколько секунд или минут). Этот способ введения адаптирован для хронического лечения, представляет собой альтернативу для пациентов с плохим венозным доступом, ограничивает инфекционные проблемы, может применяться в амбулаторных условиях и позволяет самостоятельно вводить препарат образованным пациентам.Он более удобен для пациентов и медицинского персонала, требует меньше фармацевтической подготовки. В целом это может снизить затраты для системы здравоохранения. Однако объем инъекции должен быть ограничен (1-5 мл) по причинам боли, что требует использования концентрированных составов, а иногда и двух отдельных мест введения. Для макромолекул (антител, см. Ниже) для подкожного введения могут потребоваться вспомогательные вещества, облегчающие введение. Кроме того, продукт должен диффундировать во внеклеточном матриксе, чтобы попасть в кровь (фаза абсорбции).Даже если место инъекции находится очень близко к кровеносным сосудам, не все лекарства доставляются эффективно и систематически (, то есть , абсолютная биодоступность может быть менее 100% по сравнению с внутривенной инъекцией). Кроме того, может произойти задержка всасывания, и время до максимального эффекта (фармакодинамическая конечная точка) может быть больше по сравнению с внутривенным путем. Степень и скорость всасывания также могут варьироваться в зависимости от анатомической области подкожной инъекции (живот, плечо, бедро) (2).Что касается конкретных побочных эффектов, подкожное введение может привести к реакциям в месте инъекции, включая эритему и боль, и может быть более иммуногенным.
Кроме того, продукт должен диффундировать во внеклеточном матриксе, чтобы попасть в кровь (фаза абсорбции).Даже если место инъекции находится очень близко к кровеносным сосудам, не все лекарства доставляются эффективно и систематически (, то есть , абсолютная биодоступность может быть менее 100% по сравнению с внутривенной инъекцией). Кроме того, может произойти задержка всасывания, и время до максимального эффекта (фармакодинамическая конечная точка) может быть больше по сравнению с внутривенным путем. Степень и скорость всасывания также могут варьироваться в зависимости от анатомической области подкожной инъекции (живот, плечо, бедро) (2).Что касается конкретных побочных эффектов, подкожное введение может привести к реакциям в месте инъекции, включая эритему и боль, и может быть более иммуногенным.
Противораковые средства, вводимые подкожно
Метотрексат. Метотрексат — антифолатное средство, используемое при лечении различных видов рака. В онкологии в основном его вводят внутривенно из-за используемых высоких доз (, т.е. > 1 г / м 2 ). Можно использовать пероральный путь введения, но он ограничен нелинейным, неполным и непостоянным всасыванием (3).Следовательно, пероральная, а также подкожная или внутримышечная доставка метотрексата предназначена для
прерывистые, низкие дозы (20-30 мг). Эти дозировки редко используются в онкологии (поддержание ремиссии при остром лимфобластном лейкозе) и в основном применяются для лечения аутоиммунных заболеваний (ревматоидный артрит).
Таблица II.
Средние фармакокинетические характеристики противоопухолевых агентов, вводимых людям подкожно.
Метотрексат для подкожного введения был разработан как альтернатива пероральному введению, чтобы обойти вариабельность всасывания.Когда метотрексат (40 мг / м 2 ) вводили подкожно пяти детям с острым лимфобластным лейкозом на поддерживающей терапии, было обнаружено, что он полностью абсорбируется по сравнению с внутривенной дозой (4). Пики концентраций (C max ) были сопоставимы (7,4 мкМ против 11,4 мкМ для подкожного и внутривенного путей, соответственно) (Таблица II). Дети хорошо переносили подкожное введение (4). С тех пор в продажу поступили предварительно заполненные шприцы метотрексата (50 мг / мл), что упростило подкожную инъекцию.
Пики концентраций (C max ) были сопоставимы (7,4 мкМ против 11,4 мкМ для подкожного и внутривенного путей, соответственно) (Таблица II). Дети хорошо переносили подкожное введение (4). С тех пор в продажу поступили предварительно заполненные шприцы метотрексата (50 мг / мл), что упростило подкожную инъекцию.
Цитарабин. Цитарабин, или цитозинарабинозид, является аналогом пиримидинового нуклеозида цитидина. После внутриклеточного фосфорилирования до цитарабинтрифосфата он проявляет свое цитотоксическое действие, подавляя синтез ДНК. Это краеугольный препарат лечения острого миелолейкоза, который используется на разных этапах (индукция, консолидация, поддерживающая терапия) с различными схемами и широким диапазоном доз (от 100 мг / м 2 до 6 г / м 2 в сутки) (5).Цитарабин также активен при лечении острого лимфобластного лейкоза и неходжкинских лимфом. В высоких дозах цитарабин вводят венозной инфузией в течение 1-3 часов. Что касается низких доз (50-100 мг / м 2 на инъекцию, , т.е. малых объемов инъекции), подкожная инъекция рассматривалась как практическая альтернатива внутривенному пути для пациентов с острым миелогенным лейкозом, леченных во время индукции или реиндукции. фаза.
Клиническая фармакокинетика подкожного цитарабина недостаточна (Таблица II).После подкожной болюсной инъекции (100 мг / м 2 ) у пяти взрослых пациентов с острым миелогенным лейкозом цитарабин быстро всасывался (время достижения пика в плазме крови составляет около 0,5 ч на основании кривой зависимости концентрации в плазме от времени). Экспозиции (площади под кривой зависимости концентрации в плазме от времени или AUC) после подкожного и внутривенного введения были аналогичными (абсолютная биодоступность: 100%) (6). Подкожная инфузия (100 мг / м 2 в течение 12 часов) также была исследована у шести пациентов с острым миелогенным лейкозом, обеспечивая сопоставимую AUC по сравнению с 12-часовой венозной инфузией (7). В настоящее время цитарабин вводится подкожно путем болюсной инъекции в фазе индукции (или реиндукции) острого миелогенного лейкоза.
В настоящее время цитарабин вводится подкожно путем болюсной инъекции в фазе индукции (или реиндукции) острого миелогенного лейкоза.
Азацитидин . Азацитидин также является аналогом цитидина, одобренным в качестве единственного средства для лечения различных гематологических нарушений (некоторые миелодиспластические синдромы, хронический миеломоноцитарный лейкоз, острый миелогенный лейкоз). После превращения в азацитидинтрифосфат в опухолевых клетках азацитидин обращает аберрантное гиперметилирование ДНК (как так называемый агент гипометилирования), что приводит к повторной экспрессии замалчиваемых генов и дифференцировке клеток (8).В Европе азацитидин вводится только подкожно в дозе 75 мг / м 2 ежедневно в течение семи дней, каждые 28 дней в течение не менее шести месяцев лечения, тогда как в США его также можно вводить внутривенно. При дозе выше 100 мг (4 мл) требуется подкожная инъекция в два места двумя шприцами). Согласно вкладышу к упаковке, азацитидин вводится в предплечье, живот и бедро, и места инъекции необходимо менять, чтобы оптимизировать переносимость. Использование теплых компрессов после подкожной инъекции может уменьшить симптомы (8).Пероральная форма азацитидина находится в стадии разработки и может облегчить лечение.
Абсолютная биодоступность оценивалась у шести пациентов с миелодиспластическими синдромами, которые получали азацитидин в дозе 75 мг / м. 2 однократно, подкожно и внутривенно (9). После подкожной инъекции азацитидин быстро всасывался (время достижения пика в плазме: 0,5 ч). Пик в плазме был выше после внутривенной инъекции (2750 нг / мл против 750 нг / мл после подкожной инъекции).Период полураспада обоих был коротким (<1 ч), а системный клиренс был очень высоким (около 2,5 л / мин). Абсолютная биодоступность составила 89% (таблица II). Другое исследование, оценивающее относительную биодоступность перорального азацитидина у 42 пациентов с различными гематологическими нарушениями, обнаружило аналогичные фармакокинетические параметры по сравнению с подкожной инъекцией (10).
Кладрибин . Кладрибин или 2-хлордезокси-2’-аденозин представляет собой аналог пурина, используемый в качестве монотерапии у пациентов с волосатоклеточным лейкозом, очень редким гематологическим заболеванием.Это также пролекарство, которое должно фосфорилироваться в лейкозных клетках, чтобы быть цитотоксичным (11). Кладрибин можно вводить путем однократной непрерывной венозной инфузии (0,1 мг / кг / день) в течение семи дней. Он также доступен в виде подкожного препарата под другим товарным знаком и вводится в виде однократного курса из пяти ежедневных подкожных инъекций по 0,14 мг / кг, что соответствует объему инъекции 5 мл для взрослого с массой тела 70 кг.
Первоначальное фармакокинетическое определение показало короткий период полураспада в плазме и внутриклеточно, частично поддерживая использование непрерывной венозной инфузии.Переоценка фармакокинетического профиля кладрибина с помощью высокоэффективной жидкостной хроматографии подчеркнула более низкий клиренс и возможность прерывистого введения (12). Таким образом, подкожная инъекция была протестирована как более удобный способ введения. Кинетический профиль исследовали у 10 пациентов с хроническим лимфолейкозом или неходжкинской лимфомой, получавших кладрибин (0,14 мг / кг) внутривенно и подкожно (таблица II) (13). Абсолютная биодоступность составляла 102%, а пик концентрации был выше после подкожной инъекции (318 нМ), чем после внутривенной инфузии (169 нМ), из-за продолжительности перфузии (2 часа).Конечные периоды полураспада были сопоставимы (10-13 ч) (13). Клинически подкожная инъекция была аналогична непрерывному внутривенному введению и характеризовалась отсутствием местной токсичности (11).
Бортезомиб. Бортезомиб — атипичное противораковое средство, действующее как ингибитор протеасомы, ферментного комплекса, участвующего в деградации цитотоксических белков (14). Бортезомиб используется отдельно или в сочетании с другими агентами при лечении множественной миеломы (официальная маркировка в Европе) и лимфомы из клеток мантии с обременительным графиком приема (1. 3 мг / м 2 болюсной внутривенной инъекцией в дни 1, 4, 8, 11 21-дневного цикла, повторяя 6-8 циклов). Подкожное введение (тот же график) было протестировано как более практичный путь и сравнивалось с точки зрения активности (общая скорость ответа после четырех циклов) с внутривенным болюсом в рандомизированном исследовании фазы III не меньшей эффективности, включающем 222 пациента с миеломой (15). Подкожный бортезомиб был не хуже, чем внутривенный бортезомиб (общая частота ответа: 42% в обеих группах).Напротив, пациенты, получавшие подкожное лечение, демонстрировали меньшую периферическую нейротоксичность (все степени, 38% против 53%; p = 0,044). Однако у 6% пациентов наблюдались подкожные реакции в месте инъекции (15). Бортезомиб для подкожного введения был одобрен в 2012 году с той же формой для внутривенного введения 3,5 мг (порошок восстанавливается 1,4 мл физиологического раствора вместо 3,5 мл, что дает концентрированный раствор 2,5 мг / мл).
3 мг / м 2 болюсной внутривенной инъекцией в дни 1, 4, 8, 11 21-дневного цикла, повторяя 6-8 циклов). Подкожное введение (тот же график) было протестировано как более практичный путь и сравнивалось с точки зрения активности (общая скорость ответа после четырех циклов) с внутривенным болюсом в рандомизированном исследовании фазы III не меньшей эффективности, включающем 222 пациента с миеломой (15). Подкожный бортезомиб был не хуже, чем внутривенный бортезомиб (общая частота ответа: 42% в обеих группах).Напротив, пациенты, получавшие подкожное лечение, демонстрировали меньшую периферическую нейротоксичность (все степени, 38% против 53%; p = 0,044). Однако у 6% пациентов наблюдались подкожные реакции в месте инъекции (15). Бортезомиб для подкожного введения был одобрен в 2012 году с той же формой для внутривенного введения 3,5 мг (порошок восстанавливается 1,4 мл физиологического раствора вместо 3,5 мл, что дает концентрированный раствор 2,5 мг / мл).
Два сравнительных фармакокинетических исследования (n = 24; n = 31) были проведены, показав сопоставимые системные воздействия в течение 72 часов (биодоступность 100%) с небольшой задержкой всасывания после подкожной инъекции (время пика в плазме: 0.5 ч) (таблица II) (15, 16). Конечные периоды полураспада были сопоставимы после внутривенной и подкожной инъекции (около 65-95 часов) (16). Кроме того, фармакокинетика не зависела от места подкожной инъекции (15). Что касается азацитидина, места инъекции необходимо менять по причинам переносимости (бедро, живот), и рекомендуется использовать новую иглу для инъекции (не ту, что используется для аспирации раствора во флаконе). Ретроспективное исследование 15 японских пациентов с миеломой показало лучшую местную переносимость после инъекции в живот, чем в бедро (17).Реакции в месте инъекции от умеренной до тяжелой (степень 2) наблюдались у пяти пациентов в основном после введения в бедро. В целом, частота локализационных реакций 2 степени была ниже после инъекций в брюшную полость (1/91; 1,1%), чем после инъекций в бедро (6/65; 9,2%) (17). Одноцентровое исследование с участием 47 пациентов с миеломой показало, что 68% пациентов предпочли подкожное введение (18). Подкожный бортезомиб отдельно или в сочетании с пероральными противомиеломными средствами (иммуномодулирующими препаратами, такими как талидомид и его аналоги, кортикостероиды), таким образом, повышает удобство лечения пациентов с миеломой.
Одноцентровое исследование с участием 47 пациентов с миеломой показало, что 68% пациентов предпочли подкожное введение (18). Подкожный бортезомиб отдельно или в сочетании с пероральными противомиеломными средствами (иммуномодулирующими препаратами, такими как талидомид и его аналоги, кортикостероиды), таким образом, повышает удобство лечения пациентов с миеломой.
Омацетаксин. Омацетаксин (мепесукцинат) представляет собой полусинтетическую форму гомохаррингтонина, алкалоида, экстрагируемого из видов Cephalotaxus , который показал активность при лечении хронического миелоидного лейкоза (19). Омацетаксин ингибирует синтез белка и в настоящее время одобрен в США для лечения взрослых пациентов с хроническим миелолейкозом или хроническим миелолейкозом в ускоренной фазе с устойчивостью или непереносимостью двух или более ингибиторов тирозинкиназы. Омацетаксин доступен (по крайней мере, во Франции) через программу сострадательного использования.Лечение хронического миелоидного лейкоза в основном амбулаторное и включает пять пероральных ингибиторов киназ (иматиниб, дазатиниб, нилотиниб, босутиниб, понатиниб). Омацетаксин (1,25 мг / м 2 ) вводится подкожно два раза в день в течение двух недель (индукция) или в течение одной недели (поддерживающая терапия) каждый месяц. По данным двух исследований фазы II, медиана воздействия омацетаксина составляет 7,5 месяцев (диапазон: 0,03–38,6 месяцев) (20). Подкожный путь введения был выбран как непрерывный режим низких доз, чтобы ограничить сердечно-сосудистые побочные эффекты коротких внутривенных инъекций гомохаррингтонина (19).С прагматической точки зрения, подкожное введение должно выполняться профессионалами здравоохранения (без самостоятельного введения), и, по нашему опыту, пациенты госпитализируются во время цикла. Хотя этот способ введения менее удобен, чем пероральные ингибиторы тирозинкиназы, он также представляет собой альтернативное лечение для пациентов, не придерживающихся схемы лечения.
Фармакокинетика омацетаксина подкожно (1,25 мг / м 2 2 два раза в день) изучалась в дни 1 и 11 в течение 2-недельного цикла у 21 взрослого пациента с различными типами рака (Таблица II) (21).Фармакокинетические профили были сопоставимы в день 1 и день 11, за исключением пика в плазме, который был больше на 11 день (36,4 нг / мл против 25,1 нг / мл в день 1). Абсорбция была быстрой (время пика в плазме: 0,55 ч), а конечный период полувыведения составлял 7 часов. Биодоступность омацетаксина неизвестна, но, по оценкам, составляет около 70-90% на основании фармакокинетики внутривенного гомогаррингтонина (21).
Блеомицин. Блеомицин является основным противоопухолевым агентом, который используется в комбинации при лечении рака яичек и лимфом из половых клеток.Блеомицин действует путем расщепления ДНК и вводится в основном путем короткой внутривенной инъекции (22). Его также можно вводить путем венозной инфузии, внутримышечной инъекции и подкожной инфузии (вкладыш в упаковку). Использование блеомицина путем непрерывной подкожной инфузии мало документировано (23, 24). Фармакокинетическое исследование, сравнивающее подкожную и венозную инфузию в течение 24 часов у девяти пациентов с различными типами рака, показало сопоставимые воздействия (биодоступность около 90%) (таблица II) (23). В клинической практике подкожное введение блеомицина носит анекдотический характер.
Моноклональные антитела. Моноклональные антитела — терапевтический источник, используемый при лечении различных заболеваний. Из-за очень длительного периода полувыведения (2-3 недели) их вводят с перерывами либо путем внутривенной перфузии (требующей короткой госпитализации для управления потенциальными реакциями, связанными с инфузией), либо путем подкожной инъекции (амбулаторное лечение и возможное самостоятельное введение в больницу). дома). Подкожное введение моноклональных антител уже выполняется, например, при лечении ревматоидного артрита или болезни Крона адалимумабом, цертолизумабом, пеголом и голимумабом, а также при лечении астмы омализумабом.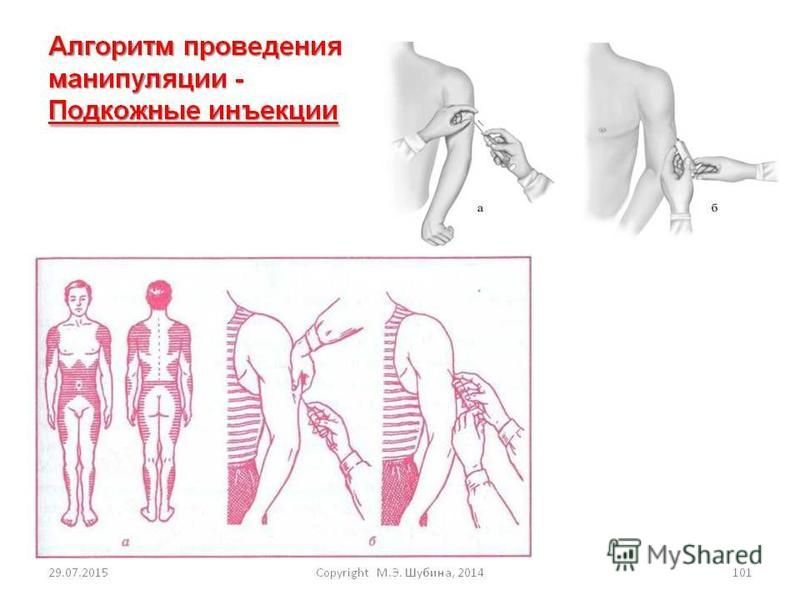 Механизмы абсорбции антител после подкожного введения подробно рассмотрены (25, 26). После подкожной инъекции моноклональные антитела, по-видимому, достигают крови через лимфатические сосуды с помощью промежуточного звена неонатального рецептора (FcRn), также участвующего в транспортировке через эпителиальные клетки и удалении иммуноглобулинов (25-27).
Механизмы абсорбции антител после подкожного введения подробно рассмотрены (25, 26). После подкожной инъекции моноклональные антитела, по-видимому, достигают крови через лимфатические сосуды с помощью промежуточного звена неонатального рецептора (FcRn), также участвующего в транспортировке через эпителиальные клетки и удалении иммуноглобулинов (25-27).
В онкологии моноклональные антитела используются с 1997 г. (ритуксимаб) (28). Их вводят в больнице путем венозной перфузии свыше 0.5–4 ч, в основном в дозировках в зависимости от размера тела. В 2013 году в Европе был одобрен препарат трастузумаба для подкожного введения, в ближайшем будущем за ним последует ритуксимаб.
Алемтузумаб . Первые попытки подкожной доставки моноклональных антител в онкологии были предприняты с алемтузумабом, антителом, нацеленным на лимфоциты через их мембранный антиген CD52 (29). Алемтузумаб (также известный как кампат-1H) долгое время (с конца 1980-х годов) исследовался как лимфолитическое средство при аутоиммунных заболеваниях, трансплантации и раке, как внутривенно, так и подкожно.Алемтузумаб был окончательно одобрен (2001) в качестве единственного средства для лечения хронического лимфолейкоза, вводимого внутривенно в фиксированной дозе 30 мг трижды в неделю на срок до 12 недель. График был установлен эмпирически и, к сожалению, не относится к длительному периоду полувыведения антитела (около трех недель) (27). Вместо того, чтобы исследовать менее частые введения (по аналогии с другими антителами), оптимизация графика была проведена за счет подкожной доставки. Два испытания фазы II (30 мг трижды в неделю, подкожно) у нелеченных (n = 41) или у предварительно получавших лечение пациентов с лимфолейкозом (n = 103) показали активность, по крайней мере сравнимую с активностью внутривенного (одобренного) пути у предварительно получавших лечение пациентов (общий ответ: 34%; медиана общей выживаемости: 19.1 мес) (29, 30). Ни одно рандомизированное исследование не сравнивало два режима введения. Кроме того, самостоятельное введение пациентом было сочтено возможным (29, 31). Фармакокинетика алемтузумаба, вводимого подкожно, мало документирована, а его абсолютная биодоступность неизвестна (таблица II). Учитывая медленное выведение, фармакокинетическая документация должна требовать введения однократной инъекции с очень большой продолжительностью отбора проб, чтобы охарактеризовать терминальную фазу выведения. Текущий график приема (три инъекции в неделю) исключает какие-либо кинетические исследования.Hale et al. сравнивал минимальные концентрации в крови пациентов, получавших внутривенное или подкожное лечение (30 мг трижды в неделю) (32). Максимальные минимальные концентрации были аналогичными (5,4 мкг / мл), но требуемая кумулятивная доза была выше после подкожных инъекций (551 мг, диапазон = 146-1106 мг по сравнению с 90 мг, диапазон = 13-316 мг), что подчеркивает медленный процесс абсорбции. . Другими словами, максимальные минимальные концентрации были получены на второй и шестой неделе лечения после внутривенного и подкожного введения соответственно.В 2012 году производитель отозвал алемтузумаб в Европе по коммерческим причинам, чтобы сосредоточиться на лечении рассеянного склероза (, то есть , чтобы избежать использования не по назначению для этого потенциально нового показания). Алемтузумаб остается доступным для лечения хронического лимфолейкоза через программу сострадательного использования и может вводиться подкожно в клинике.
Трастузумаб. Трастузумаб представляет собой моноклональное антитело, которое нацелено на трансмембранный рецептор HER2 (рецептор 2 эпидермального фактора роста человека), сверхэкспрессируемый при определенных типах рака (также называемых HER2-положительным) и связанный с плохим прогнозом без специфического (анти-HER2) лечения.Противоопухолевая активность проистекает из нескольких механизмов, которые включают зависимую от антител клеточную цитотоксичность, ингибирование расщепления эктодомена, индукцию апоптоза (33). Трастузумаб одобрен для лечения рака груди со сверхэкспрессией HER2 (15% рака груди) и лечения метастатического рака желудка со сверхэкспрессией HER2 (около 20% рака желудка) (33, 34). Трастузумаб вводят внутривенно (1 ч 30 мин для первой дозы и 30 мин для последующих перфузий) еженедельно или каждые три недели в дозе, скорректированной с учетом массы тела, которая включает ударную дозу при первом введении.Продолжительность лечения составляет один год при раннем раке груди (до и после операции) и варьируется при метастатическом заболевании (до неудовлетворительного ответа, неприемлемой токсичности или желания пациента), но может длиться более 10 лет у некоторых пациентов с раком груди. Трастузумаб назначают вместе с другими противоопухолевыми средствами или отдельно (поздняя фаза лечения рака груди на ранней стадии).
Более удобным способом применения трастузумаба было подкожное введение. В отличие от алемтузумаба, который вводится в низких дозах (30 мг), трастузумаб вводят в дозах от 100 до 600 мг, в зависимости от массы тела и частоты инъекций (еженедельно или три раза в неделю).При использовании внутривенного препарата эти еженедельные или трехнедельные дозы представляют собой объемы 5-30 мл восстановленного раствора, которые препятствуют подкожной доставке. Концентрированный препарат для подкожного введения с фиксированной дозой 600 мг (120 мг / мл) был разработан с интеграцией рекомбинантной гиалуронидазы человека (10000 МЕ), фермента, который временно разрушает внеклеточный матрикс и способствует абсорбции. Этот состав был одобрен в Европе (сентябрь 2013 г.) и предназначен для лечения рака груди ( i.е. не одобрен для лечения метастатического рака желудка). По сравнению с внутривенным введением трастузумаб вводится подкожно в фиксированной дозе (600 мг каждые три недели) без ударной дозы. Что касается внутривенного введения трастузумаба, следует отметить, что ни дозирование, основанное на массе тела, ни использование ударной дозы не имеют клинического значения (33).
Внутривенные и подкожные препараты сравнивались в многоцентровом рандомизированном исследовании, в котором участвовали 596 женщин с HER2-положительным раком молочной железы на ранней стадии (35).Трастузумаб вводили каждые три недели либо внутривенно (8 мг / кг, затем 6 мг / кг в соответствии с действующей маркировкой) или подкожно (фиксированная доза 600 мг, вводимая в бедро медсестрой в течение 5 минут) в течение восьми циклов до операции и для 10 циклов после операции (общая продолжительность лечения: один год). Оценивались эффективность, безопасность и фармакокинетика. Состав для подкожного введения был не хуже в отношении доли пациентов с противоопухолевым ответом (полный патологический ответ), оцененных до операции (внутривенное введение: 40.7%; подкожно: 45,4%) и до средней геометрической минимальной концентрации в крови, измеренной после семи циклов (внутривенно: 51,8 мкг / мл; подкожно: 69 мкг / мл). Однако по сравнению с внутривенным путем у большего числа пациентов в группе, получавшей подкожное лечение, наблюдались серьезные побочные эффекты (21% против 12%), особенно инфекции и инвазии (8,1% против 4,4%). Что касается местной переносимости, у 11,1% пациентов наблюдались реакции в месте инъекции (в основном 1 степени) после подкожного введения (35).В другом рандомизированном исследовании оценивалось предпочтение пациентом подкожной или внутривенной инъекции трастузумаба (36). Пациенты с ранним раком груди получали оба препарата от медицинского работника в клинике (без самостоятельного приема дома). Неудивительно, что среди 236 пациентов, подлежащих оценке, 91,5% предпочли подкожную инъекцию. Двумя основными причинами были экономия времени (из-за очень короткой продолжительности подкожной инъекции) и меньшая боль и дискомфорт (36).
Более подробные фармакокинетические данные были получены у здоровых мужчин-добровольцев (во избежание воздействия на здоровых женщин и риска развития антител к трастузумабу, которые могут повлиять на любое лечение в будущем) и пациентов с HER2-положительным раком молочной железы, получавших подкожное или внутривенное введение состав в виде разовой дозы (Таблица II) (37).Трастузумаб давали в дозе от 6 до 12 мг / кг в зависимости от массы тела. После подкожного введения трастузумаб всасывался медленно (время пика в плазме крови: 4-6 дней). Что касается терапевтической дозы (6 мг / кг), абсолютная биодоступность препарата для подкожного введения составила 84% (таблица II) (37). Таким образом, при рассмотрении вопроса о других моноклональных антителах (абсолютная биодоступность около 50-80%) трастузумаб с гиалуронидазой, по-видимому, хорошо всасывается после подкожной инъекции (2, 26).Конечные периоды полужизни были одинаковыми после внутривенной и подкожной инъекции (10 дней), что ниже 28,5 дней, о которых ранее сообщалось для внутривенного препарата, из-за другого компартментного кинетического анализа (37). Фармакокинетика трастузумаба, вводимого подкожно с помощью одноразового инъекционного устройства, допускающего самостоятельное введение (не одобрено) и с помощью шприца, сравнивалась у 119 рандомизированных здоровых добровольцев мужского пола (38). Фармакокинетические параметры были сходными для двух способов подкожного введения (таблица II).
Ожидаются результаты проспективного нерандомизированного исследования с двумя когортами (SafeHer, NCT01566721). Это исследование проверяет безопасность и переносимость подкожного трастузумаба (600 мг каждые три недели в течение одного года) у пациентов с ранним раком молочной железы посредством вспомогательного введения во флаконе или самостоятельного введения с помощью готового к использованию устройства для подкожных инъекций.
Введение химиотерапии — внутривенное, подкожное, пероральное
Как проводится химиотерапия?
Химиотерапевтические препараты можно вводить несколькими способами.
Метод введения любого химиотерапевтического агента и его дозировка определяются путем тщательного тестирования (клинических испытаний), проводимого до того, как лекарство станет коммерчески доступным для использования у пациентов.
В ходе клинических испытаний врачи и ученые устанавливают, как всасываются конкретные химиотерапевтические препараты и как они действуют в организме. Поскольку известно, что желудочный сок разрушает определенные химические вещества, иногда становится невозможным давать лекарство в виде таблеток. Другие типы лекарств более эффективно борются с раком, когда их вводят внутривенно (через иглу в вене).Некоторые лекарства можно вводить путем инъекции в мышцу, в то время как другие всасываются в организме при введении непосредственно в брюшную полость или мочевой пузырь.
Химиотерапевтические препараты для перорального применения (принимаемые через рот)
Химиотерапевтические препараты для перорального применения — это препараты, которые можно проглатывать. Доступные в таких формах, как таблетки, пилюли, капсулы и жидкость, они всасываются в желудке или под языком.
- Пероральные химиотерапевтические препараты, которые принимаются через рот, имеют защитное покрытие, которое растворяется пищеварительными соками, присутствующими в желудке.
- Когда желудочная кислота разрушает защитную оболочку, лекарство высвобождается и всасывается через слизистую оболочку желудка.
- Некоторые лекарства имеют специальное защитное покрытие, которое позволяет лекарству высвобождаться внутри системы через разные промежутки времени. Этот процесс, известный как пролонгированное высвобождение, допускает более длительную задержку между двумя последовательными дозами.
- Химиотерапевтические препараты, которые можно принимать, помещая их под язык, известны как сублингвальных химиотерапевтических препаратов .Они растворяются и быстро всасываются в организм. Это быстрый способ введения лекарств в организм. Некоторые лекарства, такие как лекарства от тошноты, особенно эффективны при таком приеме, поскольку они не теряются в случае рвоты пациента.
- Почему не все химиотерапевтические препараты доступны в пероральной форме? Некоторые препараты могут быть денатурированы желудочными кислотами; другие могут не всасываться через слизистую оболочку желудка или кишечника. Когда они не усваиваются организмом, они выводятся через стул или мочу, что делает их неэффективными.Другие химиотерапевтические препараты могут быть слишком агрессивными и могут повредить слизистую оболочку желудка.
- Некоторые химиотерапевтические препараты можно вводить как внутривенно, так и перорально. Медицинские работники принимают решение на основе эффективности препарата, удобства и предписанного режима.
Химиотерапевтическое лечение: подкожная инъекция
- Для подкожных инъекций (sub-q) используется небольшая игла, аналогичная той, которую используют диабетики для введения инсулина.
- При подкожном введении лекарства игла входит в пространство между кожей и мышцей.Не проникает в мышечный слой.
- Подкожные инъекции химиотерапии обычно используются для введения некоторых конкретных типов химиотерапевтических препаратов и модификаторов биологической реакции.
- Если показатели крови пациента ниже нормы, подкожные инъекции с меньшей вероятностью приведут к кровотечению по сравнению с внутримышечными инъекциями.
Внутримышечные инъекции химиотерапии
- Внутримышечные инъекции вводятся через кожу для достижения мышечного слоя.По сравнению с подкожной инъекцией используется игла большего размера, позволяющая проникнуть глубже.
- Лекарство всасывается быстрее, чем при пероральном приеме, но медленнее, чем при внутривенном, подкожном и сублингвальном способах введения.
- Внутримышечная инъекция обычно используется для введения лекарств от тошноты, поскольку она может обойти и без того расстройство желудка.
- Большинство химиотерапевтических препаратов нельзя вводить внутримышечно из-за агрессивности химических веществ.
- Врачи часто избегают внутримышечных инъекций при лечении пациентов с низким уровнем тромбоцитов, потому что кровотечение внутри мышцы может привести к осложнениям.
Связано: Продолжительность химиотерапии
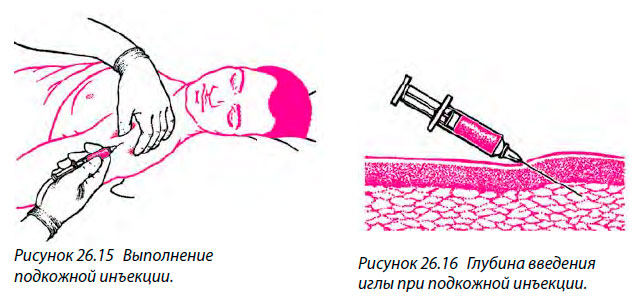
2.05 ПРОЦЕДУРА ВВЕДЕНИЯ ПОДКОЖНОЙ ИНЪЕКЦИИ
а. Следуйте процедурам, описанным в параграфе 2-3.
г. Выберите место инъекции и положение пациента.
(1) Наружная часть плеча (дельтовидная область плеча).Место инъекции (см. Рис. 2-8) находится на ширине руки вниз от верхней части плеча и на треть от края до внешней стороны руки. Пациент может сидеть или стоять, открыв выбранное вами плечо.
(a) Длина иглы, используемой для всех подкожных инъекций, составляет от 1/2 до 7/8 дюйма (калибр от 23 до 25).
(b) Объем лекарства от 0,5 до 1,0 миллилитра или меньше обычно вводят взрослому в дельтовидную область.
Рисунок 2-8.Дельтовидная область плеча, внешняя сторона плеча.
(2) Наружная сторона бедра (область широкой мышцы бедра). Место инъекции находится на ширине руки вниз от паха на внешней стороне бедра (см. Рис. 2-9). Пациент может сидеть или стоять. Выбранная вами верхняя часть ноги должна быть полностью обнажена. Максимальный объем лекарства 3,0 миллилитра может быть введен взрослому в область латеральной широкой мышцы бедра.
(3) Ягодицы. Третий участок, который можно использовать, — это подкожная клетчатка в области ягодиц.
Рисунок 2-9. Vastus lateralis area, внешняя сторона бедра.
г. Подготовьте место для инъекции.
Очистите пораженный участок антисептической подушечкой, круговыми движениями от центральной точки наружу примерно на два дюйма.
г. Снимите защитный кожух иглы.
Крышка иглы должна быть снята сразу. Любое вращательное движение или движение в сторону может погнуть иглу. Не касайтесь иглы. Положите колпачок иглы на чистую ровную поверхность.
эл.Стабилизируйте место инъекции.
Зажмите ткань на плече или бедре, в зависимости от того, что вы выбрали (см. Рис. 2-7).
(1) Осторожно зажмите кожу между большим и указательным пальцами, чтобы образовалась складка на коже, не касаясь места инъекции.
(2) Складка ткани помогает определить точный размер иглы. Измерьте расстояние от основания сгиба до вершины и выберите иглу, близкую к длине сгиба.
ф. Вставьте иглу.
(1) Удерживайте цилиндр шприца между большим и указательным пальцами скосом вверх.
(2) Вставьте иглу под углом 45 градусов к коже (см. Рисунок 2-7). Все подкожные инъекции вводятся под углом 45 градусов в жировую ткань под кожей.
(3) Вставьте иглу только на три четверти длины иглы, используя твердый, быстрый толчок вперед, чтобы минимизировать дискомфорт.
(4) Освободите кожу. Освободите защемленную кожу, стабилизируя цилиндр шприца.
г. Аспирируйте шприц.
См. Параграф 2-3n выше.
ч. Введите лекарство.
Медленно и равномерно вдавите поршень в цилиндр большим пальцем до тех пор, пока все лекарство не будет вытеснено. Лекарство следует вводить медленно. Быстрая инъекция окажет давление на ткань и вызовет боль.
и. Удалите иглу.
Поместите антисептическую подушечку немного выше места инъекции.
Быстро извлеките иглу под тем же углом 45 градусов, что и введенная, и опустите подушечку на место инъекции.
Дж. Массаж сайта.
После извлечения иглы осторожно помассируйте место инъекции антисептической подушечкой, если в инструкции по применению лекарств не указано иное.
(1) Мягкое давление на место инъекции поможет закрыть проколотую ткань и распределить лекарство так, чтобы оно легко абсорбировалось.
(2) Вы можете использовать ту же антисептическую подушечку, которая использовалась для подготовки места перед инъекцией.
к. Закройте место инъекции.
Наложите липкую повязку на место инъекции, чтобы защитить одежду в случае кровотечения и предотвратить заражение.
л. Выполните постинъекционный уход за пациентом.
См. Параграф 2-3u.
Внутримышечное и подкожное введение — UTS Pharmacology
Особенности подкожной и внутримышечной доставки лекарств
Вы ходили в тренажерный зал и весь год работали над достижением этого гламурного тела, но что-то не так, вы смотрите на тренажерный зал (или парк, если это ваша сцена) и замечаете, что вы самый маленький и самый бледный человек там. .Как любой рациональный человек, вы решаете покупать в Интернете «пептиды» и любые другие гормоны, которые могут дать вам преимущество перед началом лета, но вы не в восторге от предлагаемых вам вариантов. Вы решаете нанести визит к одному из тех врачей, которых рекомендовал один из многих чудовищ в вашем тренажерном зале, который уверяет вас, что их «рецепты» законны (а это так) и стоит ваших с трудом заработанных денег (а это не так). Три недели анализов крови и несколько тысяч долларов спустя вы сидите в гостиной перед связкой игл в холодильнике, сезонным запасом бактериостатической воды, пустым кошельком и сердитым супругом, требующим ответов.Но для этого вы сюда пришли?
Общие пути администрирования
Наше тело прекрасно справляется с защитой от посторонних предметов (ксенобиотиков). PH (кислотность) нашего желудка достаточен, чтобы денатурировать и сделать многие пероральные препараты бесполезными или менее эффективными. Даже если они выживают, они могут не попасть в желудок или кишечник, если они слишком заряжены, недостаточно липофильны или слишком велики. Мы можем пропустить многое, вводя лекарства непосредственно в нашу систему. Внутривенные (IV) инъекции по определению имеют 100% абсорбцию, поскольку они сразу попадают в кровоток, однако часто не подходят, поскольку они очень инвазивны, могут повредить кровеносные сосуды, если выполнено неправильно или если введенный препарат является едким, а также может не иметь желаемой продолжительности действия
Рисунок 1 Виды доставки лекарств
Подкожно (SC)
Sub означает под кожей, а под кожей означает кожу, поэтому этот метод доставки лекарства включает инъекцию лекарства в слой под кожей и над мышцами или жиром.Лекарство должно диффундировать либо в капилляры, либо в лимфатическую систему в зависимости от молекулярной массы лекарства. Хотя он мгновенно попадает в организм, процесс диффузии занимает больше времени и подходит для лекарств, которые не требуют немедленной пиковой концентрации, а вместо этого имеют длительное высвобождение, это большое преимущество перед пероральными лекарствами, поскольку они не подвергаются метаболизму при первом прохождении, а доза в результате ответ становится более предсказуемым. По сравнению с внутримышечным (IM), он не попадает в мышцы напрямую, он обычно безболезнен и очень прост в применении.Недостатки SC присущи его способу доставки, то есть вам нужно вводить его с помощью иглы, это может быть немного болезненно, и необходимы правильные методы обращения и хранения, чтобы гарантировать отсутствие инфекций. Но поскольку в 2015 году ультрафиолетовые солярии были запрещены, подкожные инъекции меланотана II — единственный способ сохранить лицо в тренажерном зале зимой.
Внутримышечно (IM)
После тщательного рассмотрения вы удалите из холодильника прописанный доктором Бьорк гормон роста человека, вы начинаете осознавать риск аллергической реакции, возникающей из-за этих препаратов, которые вводятся непосредственно в ваше тело, что заставляет вас спрашивать: «Подождите секунду, в течение некоторого времени». аллергическая реакция. Почему я ввожу EpiPen прямо в ногу, а не подкожно, и почему это не так ».Внутримышечные инъекции доставляют лекарство в богатую кровью красную мышцу, что обеспечивает более быструю доставку и распределение лекарства по сравнению с подкожными инъекциями. Это важно для эпипенов, которые содержат адреналин / эпиненфрин, который является естественным гормоном в нашем организме, подавляющим аллергическую реакцию. Проблема здесь в том, что
Рис.2 Места доставки ТЦ
Период полувыведения адреналина из плазмы составляет всего 2-3 минуты, и более медленная доставка может означать, что большая часть препарата денатурируется до того, как он успеет что-либо сделать, а в случае анафилактического шока это означает смерть.Поскольку вы вводите инъекцию непосредственно в мышцу, довольно часто возникают отек и покраснение, а также дренаж и боль в месте инъекции. Преимущество SC состоит в том, что им гораздо проще управлять самостоятельно и практически не требуется никакого обучения.
Внутримышечное быстрое против медленного высвобождения
Но почему одни внутримышечные препараты всасываются намного быстрее, чем другие? Почему адреналин так быстро проникает в мышцы и кровоток, но при этом антипсихотические препараты, такие как галоперидол, могут принимать антипсихотические препараты в течение недели? Большинство лекарств имеют врожденное предпочтение растворяться либо в масляном (липофильном) растворе, либо в водном (гидрофильном) растворе, стероиды, например, считаются липидами и нерастворимы в воде, вместо этого они абсорбируются непосредственно через фосфолипидные клеточные стенки и в место их нахождения. действие.Галоперидол имеет значение LogP, равное 4,3, что означает, что на каждую молекулу галоперидола, которая переходит в водную фазу (подумайте о плазме крови), примерно 20 тысяч остаются в масляной суспензии в месте инъекции. Поскольку галоперидол удаляется из плазмы крови, это означает, что большее количество лекарства из масляного внутримышечного кармана будет диффундировать в кровоток, создавая эффект замедленного высвобождения. Это звучит как сложная работа, много логарифмических значений, абсорбции, скорости распределения и побочных эффектов, которые никому не нужно обсуждать.Так что, может быть, вместо того, чтобы притворяться, что вы вспотеете на мачехе в спортзале ночью, когда никого нет рядом, совершите хорошую здоровую пробежку на солнце, получите этот витамин D и оставьте инъекции медицинским работникам и тем, кто в нем нуждается. .
Рис.3 Влияние logP на наркотики
Александр, Р., Паппачан, Дж., Смит, Г., и Тейлор, Б. (1995). Избегайте подкожного или внутримышечного введения адреналина. BMJ 311 : 1434-1435.
Дуглас, Дж.(2003). Адреналин и не опасные для жизни аллергические реакции: Адреналин внутримышечно безопасен. BMJ 327 : 226-с-227.
Дуглас Дж. (2003). Адреналин и не опасные для жизни аллергические реакции: Адреналин внутримышечно безопасен. BMJ 327 : 226-с-227.
Джостер, В. (2003). Высвобождение под контролем мелатонина ??? Neurim Pharmaceuticals. Наркотики в исследованиях и разработках 4 : 131-132.
Воан, Г., Мейсон, младший, А., и Рейтер, Р. (1986). Сывороточный мелатонин после однократной водной подкожной инъекции сирийским хомячкам.Нейроэндокринология 42 : 124-127.
(Посещали 4196 раз, сегодня 26 посещений)
Подкожные биопрепараты, технологии и системы доставки лекарств (3-е издание), 2020-2030 гг.
Нью-Йорк, 18 июня 2020 г. (GLOBE NEWSWIRE) — Reportlinker.com объявляет о выпуске отчета «Подкожные биопрепараты, технологии и системы доставки лекарств» (3-е издание), 2020-2030 »- https://www.reportlinker.com/p05483804/?utm_source=GNW
. Учитывая необходимость обхода желудочного метаболизма, биопрепараты в основном предназначены для введения парентерально.Фактически, большинство таких методов лечения разработаны для внутривенного введения и обычно применяются в клинических условиях (больницы / инфузионные центры). Однако этот сценарий требует больших затрат и, как известно, связан с проблемами, связанными с приверженностью к лечению. В этом контексте подкожный путь доставки лекарств предлагает ряд преимуществ, включая самолечение и варианты управления жизненным циклом. Хотя фармакокинетические профили препаратов для внутривенного и подкожного введения различаются, исследования показали, что конечные пользователи (пациенты и медицинские работники) предпочитают последние препараты, что дает возможность значительной экономии средств.
В настоящее время изучается возможность подкожной доставки для ряда клинических кандидатов на разных этапах разработки. Более того, несколько одобренных терапевтических продуктов, которые в настоящее время доступны в формах для внутривенного введения, также пересматриваются и оцениваются для подкожного введения. Однако есть определенные опасения, связанные с подкожным путем. Например, большинство терапевтических средств на основе белков, таких как моноклональные антитела, необходимо вводить в больших количествах, и было показано, что они приводят к получению высоковязких составов при изменении их состава для подкожной доставки.Для решения этой конкретной проблемы многие компании разработали / разрабатывают ряд новых технологических платформ для облегчения доставки вязких лекарственных форм. Подобные нововведения постепенно способствуют переходу к подкожному введению, в первую очередь из-за спроса на самоуправляемые терапевтические средства. Фактически, на рынке доступно несколько решений для самолечения, снабженных множеством удобных для пользователя функций; Примеры включают предварительно заполненные шприцы, шприцы-ручки, автоматические инъекторы, безыгольные инъекторы и носимые инъекторы большого объема.За последние несколько лет вышеупомянутые комбинированные лекарственные препараты и устройства получили широкое распространение, позволили существенно сократить расходы на здравоохранение (которые несут пациенты) и улучшили приверженность к терапии. В связи с этим ожидается, что рост числа хронических клинических состояний (которые характеризуются необходимостью частого приема лекарств) и продолжающиеся усилия разработчиков терапии / устройств, занятых в этой области, будут стимулировать рост рынка подкожных биопрепаратов в ближайшем будущем. годы.
ОБЪЕМ ОТЧЕТА
Отчет «Подкожные биопрепараты, технологии и системы доставки лекарств (3-е издание), 2020-2030 годы» содержит подробное исследование текущего рыночного ландшафта и будущего потенциала биопрепаратов, предназначенных для подкожного введения. Кроме того, в исследовании проводится углубленный анализ технологий приготовления и систем доставки лекарств (с упором на носимые инъекторы большого объема, автоинъекторы, ручные инъекторы, безыгольные инъекторы, системы восстановления лекарств, предварительно заполненные шприцы и имплантаты), которые обеспечивают подкожную доставку. биологических препаратов.Среди других элементов, отчет содержит следующее:
• Подробная оценка текущего рыночного ландшафта коммерчески доступных биопрепаратов и биопрепаратов клинической стадии, предназначенных для доставки подкожным путем, а также информация о году утверждения, фазе разработки, типе фармакологической молекулы, целевой терапевтической области, частоты дозирования, доступных лекарственных форм и основных участников.
• Тематическое исследование ведущих подкожных биопрепаратов (с точки зрения полученной выручки) с подробным описанием механизма действия, истории разработки, годовых продаж, технологической платформы (если доступна) и сравнение их внутривенных и подкожных препаратов (если применимо) .
• Оценка различных технологий подкожного введения вместе с информацией о разработчиках, типе фармакологической молекулы, пути введения, механизмах действия и основных преимуществах.
• Глубокое трехмерное сравнение разработчиков технологии подкожных рецептур, основанное на силе трубопроводов (количество лекарств, разработанных с использованием определенной технологии), мощности поставщика (количество лет опыта и размер компании) разработчика и основных преимуществах, предлагаемых их соответствующие технологии.Кроме того, исследование включает подробный сравнительный анализ разработчиков технологий из Северной Америки и Европы, подчеркивающий основные преимущества, предлагаемые их запатентованными технологиями, применимость к другим типам фармакологических молекул и другие возможные пути введения лекарств.
• Подробные профили ключевых разработчиков технологий с кратким обзором компании, ее технологического портфеля, портфеля продуктов, финансовой информации (если таковая имеется), последних разработок и информированного прогноза на будущее.
• Анализ сотрудничества и партнерских соглашений, подписанных разработчиками технологии подкожных рецептур с 2011 г .; он включает подробную информацию о сделках, которые были / сосредоточены на технологиях подкожной рецептуры, которые были проанализированы на основе года соглашения, типа соглашения, а также авансовых и промежуточных платежей.
• Углубленный обзор самых современных и популярных систем подкожной доставки лекарств, включая носимые инъекторы большого объема, автоинъекторы, ручные инъекторы, безыгольные инъекторы, системы восстановления лекарств, предварительно заполненные шприцы и имплантаты, с предоставлением информации об их разработчике (ах). ) и особенности устройства.Подробная информация о конкретных параметрах, полученных для различных категорий устройств, упоминается следующим образом:
• Носимые инъекторы большого объема: стадия разработки (коммерциализация и разработка), тип устройства (инфузионный насос и патч-насос), тип вводимой дозы (непрерывный и болюсный) ), объем / емкость хранения (в мл), режим инъекции (игла, игла / канюля и игла / катетер) и механизм действия (движущая сила).
• Автоинжекторы: удобство использования (одноразовые и многоразовые), тип первичного контейнера (шприц, картридж и др.), Объем / емкость хранения (в мл), тип дозы (фиксированная доза и переменная доза) и исполнительный механизм (автоматический, полу- автоматический и ручной).
• Инжекторы-ручки: удобство использования (одноразовые и многоразовые), объем / емкость хранения (в мл) и тип дозы (фиксированная доза и переменная доза).
• Безыгольные системы впрыска: стадия разработки (коммерциализация и разработка), объем / емкость хранения (в мл), удобство использования (одноразовые и многоразовые) и исполнительный механизм (пружинный, с газовым приводом и другие).
• Системы восстановления лекарств: удобство использования (одноразовые и многоразовые), тип устройства (двухкамерные системы и другие новые системы) и тип контейнера для лекарств (картридж, флаконы и др.).
• Предварительно заполненные шприцы: материал, из которого изготовлен цилиндр (стекло и пластик), количество камер цилиндра (однокамерная и двухкамерная), тип системы игл (фиксированная система игл, замок Люэра и конус Люэра) и объем / емкость хранения (в мл) .
• Имплантаты: стадия разработки (коммерческая и разрабатываемая), целевая терапевтическая область, материал имплантата (силикон, титан, полимеры и др.) И продолжительность лечения.
• Комплексный анализ конкурентоспособности подкожных носимых инъекторов большого объема, подкожных автоинъекторов, подкожных безыгольных инъекторов и предварительно заполненных шприцев с учетом возможностей поставщика и конкретной информации о продукте.
• Обсуждение связанных тенденций, ключевых движущих сил и проблем, которые могут повлиять на развитие отрасли, в рамках комплексной системы SWOT; он включает в себя анализ с помощью шарика Харви, подчеркивающий относительное влияние каждого параметра SWOT на общий рынок подкожных продуктов.
Одной из ключевых целей этого исследования было понять основные движущие силы роста и оценить существующий размер рынка и будущий потенциал роста рынка подкожных биопрепаратов, технологий и систем доставки лекарств.Основываясь на исторических тенденциях и информации, связанной с продажами подкожных биологических препаратов, мы предоставили обоснованную оценку вероятного развития рынка в краткосрочной, среднесрочной и долгосрочной перспективе на период 2020-2030 годов. В отчете также приводятся подробные сведения о вероятном распределении текущих и прогнозируемых возможностей по [A] фазе разработки (утвержденная, предварительная регистрация и фаза III и фаза II и фаза II / III)), типу фармакологической молекулы [B] (белки, пептиды (рекомбинантные), моноклональные антитела, продукты на основе других антител, клеточная / генная терапия и вакцины), [C] целевые терапевтические области (аутоиммунные нарушения, метаболические нарушения, нарушения крови, заболевания костей, онкологические нарушения, генетические нарушения, неврологические нарушения, респираторные расстройства и другие расстройства) и [D] ключевые географические регионы (Северная Америка, Европа, Азиатско-Тихоокеанский регион и остальной мир).В дополнение к прогнозу рынка подкожных биологических препаратов, мы также предоставили 10-летний прогноз для систем подкожной доставки, охватывающий рынок носимых инъекторов большого объема, автоинъекторов, предварительно заполненных шприцев, безыгольных инъекторов и систем восстановления лекарств. Кроме того, мы также спрогнозировали доходы, которые разработчики технологии подкожных рецептур могут получить за счет лицензионных соглашений; для этого мы предоставили представление о вероятных авансовых платежах и промежуточных платежах, которые будут получены в результате сделок, связанных с разработкой подкожных рецептур биопрепаратов.Чтобы учесть будущие неопределенности и повысить надежность нашей модели, мы предоставили три сценария прогноза, а именно консервативный, базовый и оптимистичный сценарии, представляющие различные направления роста отрасли.
На мнения и идеи, представленные в этом исследовании, повлияли обсуждения, проведенные с множеством заинтересованных сторон в этой области. В отчете представлены подробные стенограммы интервью, проведенных со следующими людьми:
• Дебора Биттерфилд (главный исполнительный директор и основатель Lindy Biosciences)
• Мэтью Янг (основатель и главный технический директор, Oval Medical Technologies)
• Стив Престрелски (главный научный сотрудник) и основатель, Xeris Pharmaceuticals), Хун Ци (вице-президент по разработке продуктов, Xeris Pharmaceuticals) и Скотт Коулман (старший.Scientist Formulation, Xeris Pharmaceuticals)
• Дэвид Дейли (главный исполнительный директор и соучредитель, DALI Medical Devices)
• Майкл Рейли (главный исполнительный директор и соучредитель, Excelse Bio)
• Пунам Р. Велагалети (соучредитель, i -novion)
• Майкл Хувен (главный исполнительный директор, Enable Injection)
• Фредерик Орс (главный исполнительный директор, Immunovaccine Technologies)
• Патрик Анкетиль (главный исполнительный директор, Portal Instruments)
• Менахем Цукер (вице-президент и главный научный сотрудник, Elcam Medical)
• Тиффани Х.Берк (директор по глобальным коммуникациям, West Pharmaceutical Services) и Грэм Рейнольдс (вице-президент и генеральный менеджер, Global Biologics, West Pharmaceutical Services)
• Дэвид Хёзе (руководитель отдела коммуникаций, MedinCell)
Все фактические данные были получены и проанализированы публично доступные информационные форумы и обсуждения первичных исследований. Финансовые показатели, упомянутые в этом отчете, приведены в долларах США, если не указано иное.
МЕТОДОЛОГИЯ ИССЛЕДОВАНИЙ
Данные, представленные в этом отчете, были собраны посредством вторичных и первичных исследований.Для всех наших проектов мы проводим интервью с экспертами в данной области (академические круги, промышленность, медицинская практика и другие ассоциации), чтобы узнать их мнение о новых тенденциях на рынке. Это в первую очередь полезно для нас, чтобы составить собственное мнение о том, как рынок будет развиваться в разных регионах и технологических сегментах. По возможности доступные данные были проверены на точность из нескольких источников информации.
Вторичные источники информации включают
• Годовые отчеты
• Презентации для инвесторов
• Документы SEC
• Отраслевые базы данных
• Пресс-релизы с веб-сайтов компаний
• Документы государственной политики
• Мнения отраслевых аналитиков
Пока основное внимание уделялось прогнозируя рынок на ближайшее десятилетие, в отчете также представлен наш независимый взгляд на различные технологические и некоммерческие тенденции, возникающие в отрасли.Это мнение основано исключительно на наших знаниях, исследованиях и понимании соответствующего рынка, собранных из различных вторичных и первичных источников информации.
ОПИСАНИЕ ГЛАВЫ
Глава 2 содержит краткое изложение выводов, полученных в ходе нашего исследования. Он предлагает общий взгляд на вероятную эволюцию рынка подкожных биопрепаратов, технологий и систем доставки лекарств в краткосрочной, среднесрочной и долгосрочной перспективе.
Глава 3 представляет собой общее введение в различные типы терапевтических молекул (биопрепараты и небольшие молекулы), сравнивая их характеристики, такие как размер молекулы, структура молекулы, иммуногенность и стабильность.В главе также освещаются различные типы продуктов биологического происхождения, которые в настоящее время разрабатываются различными заинтересованными сторонами в этой отрасли. Далее обсуждаются проблемы, связанные с парентеральным путем доставки лекарств, в частности, проблемы, связанные с традиционным внутривенным (инфузионным) путем. Кроме того, в этой главе обсуждаются различные способы введения, уделяя особое внимание подкожному способу введения, подчеркивая его преимущества и связанные с ними ограничения.
Глава 4 включает информацию о более чем 450 подкожных биологических препаратах-кандидатах, которые в настоящее время одобрены / разрабатываются. Он включает всесторонний анализ имеющихся на рынке биопрепаратов и биопрепаратов на клинической стадии, основанный на году утверждения, фазе разработки фармакологической молекулы, целевой терапевтической области, частоте дозирования, доступных лекарственных формах и основных участниках.
Глава 5 представляет собой сборник тематических исследований ведущих подкожных биопрепаратов с точки зрения годовых глобальных продаж.Каждое тематическое исследование включает в себя спецификации лекарств / терапии, их соответствующий механизм действия, историю разработки, годовые продажи, технологическую платформу (если доступна) и сравнение их внутривенных и подкожных составов (если применимо).
Глава 6 предоставляет список технологий подкожных рецептур, которые в настоящее время доступны / разрабатываются различными фирмами в этой области. В главе освещаются ключевые особенности каждой технологии и дается информация об их разработчиках.Он также включает анализ, основанный на типе фармакологической молекулы, пути введения, механизмах действия и основных преимуществах.
В главе 7 представлено трехмерное сравнение разработчиков технологии подкожных рецептур, основанное на силе трубопроводов (количество лекарств, разработанных с использованием определенной технологии), мощности поставщика (количество лет опыта и размер компании) разработчика и основных преимуществах. предлагаемые соответствующими технологиями. Он также включает сравнительный анализ разработчиков технологий, базирующихся в Северной Америке и Европе, подчеркивая преимущества их патентованных технологий, применимость к другим типам фармакологических молекул и другие возможные пути введения лекарств.
Глава 8 включает подробное описание профили ключевых разработчиков технологий с обзором компании, ее технологического портфеля, портфеля продуктов, финансовой информации (если таковая имеется), последних разработок и информированного прогноза на будущее.
Глава 9 содержит подробный анализ и обсуждение различных совместных действий и партнерств, связанных с технологиями подкожной рецептуры, которые были подписаны между игроками. Он включает краткое описание целей моделей партнерства (включая лицензионные соглашения, слияния / поглощения, разработку продуктов, сервисные альянсы, производство и другие), которые были приняты заинтересованными сторонами в этой области с 2011 года. Он состоит из схематическое изображение, показывающее игроков, которые создали максимальное количество союзов.Кроме того, мы представили карту мира сделок, заключенных в этой области, выделив те, которые были заключены на разных континентах и между ними.
Глава 10 содержит подробное обсуждение систем подкожной доставки с особым акцентом на носимых инъекторах большого объема, автоинъекторах, ручных инъекторах, безыгольных инъекторах, системах восстановления лекарств, предварительно заполненных шприцах и имплантатах. Он включает подробный анализ, основанный на конкретных параметрах для каждой категории устройств, а именно [A] носимых инъекторов большого объема, по стадиям разработки (коммерциализация и разработка), типу устройства (инфузионный насос и патч-насос), типу вводимой дозы ( непрерывный и болюсный), объем / емкость хранения (в мл), режим инъекции (игла, игла / канюля и игла / катетер) и механизм действия (движущая сила), [B] автоинъекторы, по удобству использования (одноразовые и многоразовые), тип первичного контейнера (шприц, картридж и др.), объем / емкость хранения (в мл), тип дозы (фиксированная доза и переменная доза) и исполнительный механизм (автоматический, полуавтоматический и ручной), шприц-ручки [C] по удобству использования (одноразовые и многоразовые), объему / емкости хранения (в мл) и типу дозы (фиксированная доза и переменная доза), [D] безыгольные инъекционные системы, по стадиям разработки (коммерциализация и разработка), объем / емкость хранения (в мл), удобство использования (одноразовые и r eusable) и исполнительный механизм (пружинный, с газовым приводом и др.), [E] системы восстановления лекарств, по удобству использования (одноразовые и многоразовые), типу устройства (двухкамерные системы и другие новые системы) и типу контейнера для лекарств ( картридж, флаконы и др.), [F] предварительно заполненные шприцы, материал изготовления цилиндра (стекло и пластик), количество камер цилиндра (однокамерные и двухкамерные), тип системы игл (система фиксированных игл, замок Люэра и конус Люэра) объем / емкость хранения (в мл) и [G] имплантаты, в зависимости от стадии разработки (коммерциализация и разработка), целевой терапевтической области, материала имплантата (силикон, титан, полимеры и др.) и продолжительности лечения.Поскольку носимые инъекторы большого объема, предварительно заполненные шприцы, безыгольные инъекторы и автоинжекторы представляют собой самые новые и передовые типы устройств, мы также предоставили комплексный анализ конкурентоспособности этих продуктов с учетом возможностей поставщика (на основе размера база сотрудников) и спецификации продукта.
Глава 11 предоставляет подробный анализ, охватывающий ключевые параметры и тенденции, которые могут повлиять на развитие отрасли, в рамках комплексной системы SWOT; он включает в себя анализ с помощью шарика Харви, подчеркивающий относительное влияние каждого параметра SWOT на общий рынок подкожных продуктов.
В главе 12 представлена информированная оценка текущих и будущих возможностей на рынке подкожных биопрепаратов, технологий и систем доставки лекарств, подчеркивающая вероятный рост рынка до 2030 года. Она также включает прогнозы будущих продаж различных подкожных биологических препаратов-кандидатов. которые в настоящее время оцениваются разными игроками. В главе представлена подробная сегментация рынка на основе фазы разработки (одобрено, предварительная регистрация и фаза III и фаза II и фаза II / III), типа фармакологической молекулы (белки, пептиды (рекомбинантные), моноклональные антитела, другие продукты на основе антител. , клеточная / генная терапия и вакцины), целевые терапевтические области (аутоиммунные нарушения, нарушения обмена веществ, нарушения крови, заболевания костей, онкологические нарушения, генетические нарушения, неврологические нарушения, респираторные нарушения и другие нарушения) и ключевые географические регионы (Северная Америка, Европа, Азиатско-Тихоокеанский регион и остальной мир).В дополнение к прогнозу рынка подкожных биологических препаратов, мы также предоставили 10-летний прогноз для систем подкожной доставки, охватывающий рынок носимых инъекторов большого объема, автоинъекторов, предварительно заполненных шприцев, безыгольных инъекторов, систем восстановления лекарств. Кроме того, мы также спрогнозировали доходы, которые разработчики технологии подкожных рецептур могут получить за счет лицензионных соглашений; для этого мы предоставили представление о вероятных авансовых платежах и промежуточных платежах, которые будут получены в результате сделок, связанных с разработкой подкожных рецептур биопрепаратов.
Глава 13 представляет собой краткое изложение всего отчета. В этой главе мы представили список основных выводов из отчета и выразили свое независимое мнение в отношении исследований и анализа, описанных в предыдущих главах.
Глава 14 представляет собой сборник стенограмм интервью, проведенных с ключевыми заинтересованными сторонами на этом рынке. В этой главе мы подробно рассказали о наших беседах с Деборой Биттерфилд (главный исполнительный директор и основатель Lindy Biosciences), Мэтью Янгом (основатель и технический директор, Oval Medical Technologies), Стивом Престрелски (научным директором и основателем Xeris). Pharmaceuticals), Хун Ци (вице-президент по разработке продуктов, Xeris Pharmaceuticals) и Скотт Коулман (старший.Scientist Formulation, Xeris Pharmaceuticals), Дэвид Дейли (главный исполнительный директор и соучредитель, DALI Medical Devices), Майкл Рейли (главный исполнительный директор и соучредитель, Excelse Bio), Пунам Р. Велагалети (соучредитель, i-novion) , Майкл Хувен (главный исполнительный директор, Enable Injection), Фредерик Орс (главный исполнительный директор, Immunovaccine Technologies), Патрик Анкетиль (главный исполнительный директор, Portal Instruments), Менахем Цукер (вице-президент и главный научный сотрудник, Elcam Medical), Тиффани Х.Берк (директор по глобальным коммуникациям, West Pharmaceutical Services) и Грэм Рейнольдс (вице-президент и генеральный менеджер, Global Biologics, West Pharmaceutical Services) и Дэвид Хёзе (руководитель отдела коммуникаций, MedinCell).
Глава 15 представляет собой приложение, в котором приведены табличные данные и числа для всех цифр, представленных в отчете.
Глава 16 представляет собой приложение, в котором приводится список компаний и организаций, упомянутых в отчете.
Читать отчет полностью: https: // www.reportlinker.com/p05483804/?utm_source=GNW
О Reportlinker
ReportLinker — это отмеченное наградами решение для исследования рынка. Reportlinker находит и систематизирует самые свежие отраслевые данные, чтобы вы могли мгновенно получать все необходимые исследования рынка в одном месте.
__________________________
Клэр: [email protected] США: (339) -368-6001 Intl: +1 339-368-6001
Подкожное введение ондансетрона Случай
Пациент
КК, 61-летняя женщина с раком толстой кишки, у которой нет сопутствующих заболеваний и аллергии на лекарства.Она является НКО из-за непроходимости кишечника, ей сделали колостому и поставили трубку ПЭГ для питания и приема лекарств.
Текущие лекарства:
- Амлодипин 5 мг таблетки VPT ежедневно PRN при АД> 130/90
- Лоразепам 0,5 мг таблетки VPT каждые 4 часа PRN тревога
- Морфин 20 мг / мл; 0,5 мл (10 мг) VPT каждые 4 часа PRN боль
- Дексаметазон 4 мг таблетка; 2 таблетки (8 мг) VPT каждое утро и день
- Ондансетрон 4 мг таблетка VPT каждые 4 часа при тошноте / рвоте
- Омепразол 20 мг в виде суспензии VPT ежедневно при диспепсии
Тошнота и рвота CC были облегчены с помощью таблеток Пегансетрона до недавнего времени, когда это стало трудноразрешимым.Междисциплинарная команда хосписа пришла к выводу, что непрерывная инфузия ондансетрона будет лучшим вмешательством при РС. Прогноз CC — недели, и у нее нет внутривенного (IV) доступа; поэтому настой назначается для подкожного введения в соответствии с рекомендациями местной аптеки для инфузий:
- Прекратить прием ондансетрона в таблетках
- Ввести ондансетрон 4 мг подкожно один раз в качестве нагрузочной дозы, затем ввести подкожно с постоянной скоростью 0.5 мг / час с болюсной дозой 0,25 мг каждые 30 минут по мере необходимости при тошноте / рвоте.
Хотя подкожный путь введения для ондансетрона 1 не соответствует инструкции, в литературе и экспертном заключении есть поддержка подкожного применения ондансетрона.
ОСНОВЫ ПОДКОЖНОГО МАРШРУТА
2
- Размещение: Канюля вставлена под углом 45 градусов в подкож. ткань верхней части груди, верхней части спины, живота, плеча или бедра
- Продолжительность: Обычно используется для краткосрочной терапии (<7 дней)
- Частота смены катетера: Каждые 72 часа в другое место
- Предел объема: В целом подкожная ткань может абсорбировать до 2–3 мл при периодическом введении (исключая промывание физиологическим раствором) или 2–3 мл / час при непрерывной инфузии.Некоторые протоколы поддерживают скорость до 5 мл / час при периодическом введении. 3
- Обслуживание: Промывайте 0,5 мл физиологического раствора (хлорид натрия 0,9%) после каждого приема лекарства. Гепарин не нужен.
РОЛЬ В БОЛЬНИЦЕ
Непрерывная подкожная инфузия (CSI, CSCI) и периодическая подкожная инъекция облегчают введение обезболивающих и препаратов для контроля симптомов и уже много лет используются в хосписах и паллиативной помощи.Внутривенный (IV) путь обычно является стандартом лечения, когда требуется парентеральный путь, однако этот путь может быть обременительным для пациентов и их семей, а также с возможностью установить и поддерживать доступ для внутривенного введения в определенных условиях оказания медицинской помощи, особенно в домашних условиях. может быть трудно, если не невозможно. Поэтому в хосписе следует чаще рассматривать подкожные и другие непероральные пути введения. Другие распространенные альтернативы введению лекарств включают местный, трансдермальный, ректальный и трансмукозальный пути. 3,4,5
Показания к применению CSI включают:
5
- Тяжелая дисфагия
- Поражения рта, горла и пищевода
- Кишечная непроходимость
- Глубокая слабость
- Плохая абсорбция
- Неприемлемо
- Неприемлемо
- количество пероральных лекарств или объемов сиропов, затрудняющих прием внутрь
- Пациент без сознания
- Неизлечимые симптомы, которые плохо контролируются пероральными методами
- Ректальный путь введения неприемлем.
Преимущества
- Менее инвазивный, чем внутривенный путь, и менее болезненный, чем внутримышечный путь
- Более низкий риск инфицирования, чем внутривенный путь 6
- Подходит для пациентов, которым требуются парентеральные препараты и у которых нет внутривенного доступа выполнимо
- Может использоваться как для прерывистой, так и для непрерывной инфузии
- Исследования показали, что инфузии SQ могут давать такие же уровни лекарств в плазме, что и внутривенные инфузии 7,8,9
Ограничения
- Кратковременность
- Частота смены катетера
- Максимальный объем, требующий использования высококонцентрированных растворов
- Утечка в месте инфузии
- Побочные реакции в месте инфузии
- Пневмоторакс (редко) при введении игл в область грудной стенки 5,10
- Раздражение кожи, включая зуд, жжение и боль
- Кровотечение
- Инфекция
- Многие парентеральные препараты не помечены для подкожного применения из-за раздражающих свойств
ПОДДЕРЖКА ЛИТЕРАТУРЫ ДЛЯ ИСПОЛЬЗОВАНИЯ ОБЩИХ ПРЕПАРАТОВ ВНЕОБРАЗИТЕЛЬНОЙ ИНФОРМАЦИИ (НЕ ВСЕ ВКЛЮЧЕНО 9204 прерывистый подкож.инъекции - Дексаметазон 5,11
- Дифенгидрамин 12
- Фентанил 2
- Галоперидол 5,6
- Гидроморфон 2,5,63
- Морфин 2,5,6
Через сплошную подрезку. инфузия
- Дексаметазон 3,4,5,11
- Фентанил 3,4,7
- Галоперидол 3,4,5
- Гидроморфон 3,4,5,7
- Кетамин 3,5
- Лоразепам 4
- Метадон 3,7
- Метоклопрамид 3,4
- Мидазолам 3,4,5
- Морфин 3,4,7
- Ондансет 3,13-15
- Фенобарбитал 4,16,17
Из-за сообщений о некрозе тканей при подкожном введении следует избегать приема следующих лекарств этим путем: 5
- Антибиотики
- Диазепам
- Хлорпромазин
- Прохлорперазин
Оценка фармацевта:
Ондансетрон не рекомендован для подкожного введения, потому что это лекарство представляет собой стерильный водный изотонический раствор, забуференный цитратом, который может вызывать аллергические или токсические реакции на кожу из-за его кислого pH.Однако в 1996 году Макарио и его коллеги опубликовали отчет о пациенте, который перенес этот путь и добился облегчения симптомов. Было высказано предположение, что более медленная скорость инфузии способствовала такому положительному результату. 13
В 2012 году Райхманн и Киркбрайд изучали непрерывную подкладку. прием метоклопрамида и ондансетрона для лечения тошноты и рвоты во время беременности. В результате получился непрерывный подкат. метоклопрамид переносился значительно хуже, чем непрерывная подкожная терапия.ондансетрон (31,8% против 4,4%; P <0,001), что указывает на более высокую переносимость лечения ондансетроном по сравнению с метоклопрамидом. 14
В опубликованном в 2014 году исследовании изучали переносимость и фармакокинетические свойства ондансетрона, вводимого подкожно с рекомбинантной человеческой гиалуронидазой Ph30 (rHuPh30) у здоровых добровольцев и мини-свиней. Они сравнили эффект этой терапии с внутримышечным, внутривенным и пероральным введением монотерапии ондансетроном. В результате системное воздействие ондансетрона после подкожного введения было аналогично внутримышечному и внутривенному введению и значительно превышало воздействие перорального введения.Комбинированная терапия ондансетроном и rHuPh30 также в целом хорошо переносилась. 15
Приказ для пациента CC гласит: «ондансетрон 4 мг подкожно однократно в качестве ударной дозы, затем вводится подкожно с постоянной скоростью 0,5 мг / час с болюсной дозой 0,25 мг каждые 30 минут, если это необходимо при тошноте / рвоте».
- Раствор ондансетрона для инъекций выпускается во флаконах по 2 мг / мл и пакетах с предварительно приготовленной смесью 32 мг / 50 мл с 5% -ной декстрозой
- Доза болюса (4 мг) дает объем 2 мл. даст примерно 0 часов в час.8 мл / час
- Прерывистые дозы «по мере необходимости» дадут 0,25 мг каждая, что дает 0,5 мг каждый час и составляет примерно 0,8 мл каждый час
- Объем начального болюса на 2 мл подходит для подкожного всасывания
- Потенциально Максимальный объем инфузии каждый час (непрерывная инфузия плюс дозы «по мере необходимости») составит 1,6 мл и считается подходящим для этого маршрута.катетер в тканях верхней части грудной клетки, верхней части спины, живота, плеча или бедра
- Меняйте катетер каждые 72 часа на другое место для предотвращения раздражения кожи и других осложнений
- Поддерживайте это место, промывая 5 мл физиологического раствора (хлорид натрия 0,9%) после каждого приема лекарства и / или смены пакета. Гепарин не нужен.
СКАЧАТЬ КОПИЮ ЭТОГО ПРИМЕРНОГО ИССЛЕДОВАНИЯ
Щелкните здесь, чтобы загрузить копию этого примера.
Для получения дополнительной информации по этой теме, пожалуйста, просмотрите эти ссылки:
- Клиническая фармакология [база данных онлайн]. Тампа, Флорида: Elsevier / Gold Standard, Inc .; 2017. По состоянию на ноябрь 2017 г. Ссылка на сайт
- Подкожные лекарства и паллиативная помощь: руководство для лиц, осуществляющих уход. Безопасный уход дома: обучение лиц, осуществляющих уход, паллиативной помощи. 3 rd 2016 апрель. Ссылка на сайт
- Оуэнс Д. Консультация междисциплинарной группы: Непрерывные подкожные инфузии. J Хоспис Паллиат Нурс. 2005 ноябрь / декабрь; 7 (6): 310.
- Херндон CM, Fike DS. Практика непрерывных подкожных инфузий в хосписах США. J Устранение болевых симптомов . 2001; 22: 1027–1034.
- Руководство NHS Lanarkshire по использованию подкожных препаратов в паллиативной помощи, 2011.PDF link
- Bartz L, et al. Подкожное введение лекарств в паллиативной помощи: результаты систематического обсервационного исследования. J Устранение болевых симптомов. Октябрь 2014 г .; 48 (4): 540-547.
- Weissman DE. Быстрые факты и концепции № 28: Подкожные инфузии опиоидов. 2015 май. Ссылка на сайт
- Nelson KA, et al. Перспективное перекрестное исследование внутривенного введения морфина для лечения хронической боли внутри пациента. J Устранение болевых симптомов. 1997; 13 {5): 262-267.
- Dickman A, et al. Непрерывные подкожные инфузии шприца в паллиативной помощи. Оксфорд, Англия: Издательство Оксфордского университета; 2005.
- Hutton N, et al. Подход хосписов и паллиативной медицины к уходу за педиатрическими пациентами В: Обучение врачей хосписам и паллиативной помощи: программа самообучения.3 rd Storey CP, ed, et al. 2008; Гленвью, Американская академия хосписной и паллиативной медицины.
- Использование составов дексаметазона в паллиативной помощи: ответ palliativedrugs.com на недавние изменения. Palliativedrugs.com. 2014 декабрь
- Chen A, et al. Безопасное применение дифенгидрамина подкожно в условиях стационара хосписа. Амер Дж. Хоспис Паллиат Мед . 2016. DOI: 10.1177 / 10496668160
- Macario A, et al. Улучшение результатов при хронической подкожной инфузии ондансетрона при трудноизлечимой тошноте и рвоте. Анестезия и анальгезия. июль 1996 г .; 83 (1): 194-195. Абстрактная ссылка
- Reichmann JP, Kirkbride MS. Обзор доказательств использования непрерывного подкожного введения метоклопрамида и ондансетрона для лечения тошноты и рвоты во время беременности. Manag Care. Май 2012; 21 (5): 44-7. Ссылка на статью
- Dychter SS, et al. Переносимость и фармакокинетические свойства ондансетрона, вводимого подкожно с рекомбинантной гиалуронидазой человека мини-свиньям и здоровым добровольцам. Clin Ther. 2014, 1 февраля; 36 (2): 211-24. Абстрактная ссылка
- Hosgood JR, et al. Оценка подкожного введения фенобарбитала у пациентов хосписа. Am J Hosp Palliat Care . 2016 Апрель; 33 (3): 209-13. Abstract link
- Phenobarbital In: Scottish Palliative Care Guidelines. 2014; По состоянию на ноябрь 2017 г. Ссылка на сайт
Третий метод приема лекарств
С резкими изменениями в оказании медицинской помощи и появлением новых методов диагностики и лечения оптометристы оказались в уникальном положении для оказания помощи системе органов, которая действительно имеет общесистемные последствия.Не только лечение, которое мы оказываем для глаза, может иметь системные разветвления, но и системные проблемы могут проявляться в глазу.
Большое количество офтальмологических состояний можно лечить с помощью местных и пероральных фармацевтических агентов. Но нам нужно иметь в виду, что, когда мы обсуждаем «актуальные» и «пероральные», мы не столько обсуждаем напрямую лекарства, сколько мы описываем пути доставки лекарств. Фактически, некоторые лекарства, такие как, например, стероиды, можно вводить разными способами.Мы знакомы с местным и пероральным применением стероидов, но многие из этих стероидов можно вводить путем инъекции, ингаляции и трансдермального введения.
Эта статья посвящена третьему наиболее распространенному способу приема лекарств, используемых для лечения заболеваний глаза и придаточного аппарата: инъекциям.
Причины уколов
Использование инъекций для ухода за глазами Диагностические инъекции
• Внутривенная флуоресцентная ангиография
• Внутривенная ангиография с индоцианином зеленым
• Внутривенное введение тенсилона при миастении.
• Внутрикожное тестирование на ТБ
Первичные терапевтические инъекции
• В / м антибиотики от гонореи
• Транслезионные стероиды от халязии
• Подкожные анестетики для периокулярной области
• В / м / подкожный ботулотоксин
• Интравитреальные инъекции при AMD
• Интравитреальные инъекции при отеке желтого пятна
• Адреналин подкожно, внутримышечно или внутривенно при анафилаксии
Вторичные и дополнительные инъекции
• Субконъюнктивальные стероиды при увеите
• Субтеноновые инъекции стероидов при увеите, плоском паразите, воспалении заднего полюса.
• Интравитреальные инъекции при AMD и макулярном отеке
Как и при использовании пероральных и местных лекарств, инъекционные препараты можно разделить на те, которые используются в диагностических целях, и те, которые используются в терапевтических целях.Из тех инъекционных препаратов, которые используются в терапевтических целях, их можно далее разделить на первичную лечебную терапию и дополнительную лечебную терапию. ( См. «Использование инъекций для ухода за глазами». )
При использовании пероральных и местных лекарств бремя надлежащего приема лекарств обычно ложится на плечи пациентов, и мы, как офтальмологи, часто слишком мало думаем о фактическом проведении лечения. Однако при использовании инъекционных препаратов для лечения глазных заболеваний ответственность за правильное введение инъекционных препаратов ложится непосредственно на плечи врача.Таким образом, любой офтальмолог, использующий инъекционные препараты, должен быть обучен соответствующим административным методам.
Кроме того, очевидно, что поставщик медицинских услуг должен быть знаком с самими лекарствами, включая дозировку, показания, противопоказания, побочные эффекты и ожидаемые результаты, а также справляться с осложнениями, возникающими в результате их приема.
Таким образом, абсолютно необходимо, чтобы офтальмологи, использующие инъекции, были обучены действительным методам введения инъекций, потому что существует множество типов инъекций, имеющих отношение к уходу за глазами.Кроме того, при назначении любых лекарств необходимо соблюдать законы штата о лицензировании. ( См. «Полномочия оптометристов по введению наркотиков путем инъекций» ниже )
Виды инъекций
Типы инъекций, используемых при заболеваниях глаза и придатков, включают внутримышечные, внутрикожные, подкожные, субконъюнктивальные и субтеноновые, интравитреальные, внутривенные и внутрикамерные инъекции.
Давайте рассмотрим каждый по очереди.
Внутримышечные инъекции
Когда мы думаем о внутримышечных (IM) инъекциях, мы склонны думать о значительных объемах лекарств, вводимых через большие длинные иглы в мышцы конечностей.Но этот тип внутримышечной инъекции имеет относительно ограниченное применение в офтальмологии.
Часто внутримышечные инъекции в условиях ухода за глазами используются для лечения системных инфекций с глазными проявлениями, таких как гонококковые инфекции, при которых типичное лечение состоит из внутримышечной инъекции роцефина (цефтриаксона, Roche). 1-3 Местами для введения этих внутримышечных инъекций являются дельтовидные и четырехглавые мышцы бедра, а также бедро. 3
Иногда внутримышечные инъекции используются для лечения реакций контактного дерматита глаз и придатков, как, например, в случае ядовитого плюща.
Ботокс используется не только в косметических целях, но и в терапевтических целях, таких как гемифациальный спазм (на фото здесь), блефароспазм и мигренозные головные боли.
В настоящее время одним из наиболее распространенных типов инъекций в лицо также технически является внутримышечная инъекция. Эти инъекции чаще всего используются дерматологами и пластическими хирургами в косметических целях. 4-6 Косметический ботокс (онаботулинумтоксин А, Allergan) для уменьшения межбровных и мимических морщин попадает в эту категорию. Ботулинический токсин прерывает нормальную передачу нервно-мышечного соединения, что приводит к параличу поперечно-полосатой мышцы, снабжаемой нервно-мышечным соединением (НМС).
В идеале Ботокс вводят непосредственно в нужную мышцу, делая это внутримышечно. Однако ботокс часто вводят в виде подкожной инъекции на лицо в ткань, лежащую над целевой мышцей, и диффузия нейротоксина в подлежащую мышцу дает желаемый эффект.
Хотя ботокс часто считается косметическим лечением, есть показания к его использованию в терапевтических целях, такие как блефароспазм, гемифациальные спазмы, нарушения глазных мышц и, в последнее время, мигрень. 5,7 Хотя фактический механизм уменьшения головной боли неизвестен, считается, что ботулотоксин блокирует ноциоцептивные нейропептиды, которые высвобождаются в ситуациях хронической боли.
Внутрикожные инъекции
Общий пример внутрикожной инъекции: Введение этой инъекции включает медленное введение скоса иглы под углом от 5 ° до 15 °.Скос иглы продвигается через эпидермис, прямо под поверхность кожи, так что скос полностью покрывается. Фото: CDC / Габриэль Бененсон
Этот тип инъекций имеет ограниченное применение при уходе за глазами. Поскольку внутрикожная ткань плохо васкуляризована, это хорошее место для наблюдения за локализованными реакциями иммунного типа, такими как те, которые возникают, когда тестирование очищенных производных белка (PPD) используется для определения воздействия туберкулина на человека.
Подкожные инъекции
Подкожная ткань находится под дермой и над мышечной тканью. Он состоит из соединительной ткани и жира и минимально васкуляризован. Он не плотно прилегает к поверхностным и нижележащим тканям и, как таковой, может удерживать большие объемы лекарств.
Инъекционные анестетики вводятся подкожно в периокулярные ткани. Они могут быть введены как местный тип инъекции (нацеленный на конкретную область, например, временную часть века), или как более региональная инъекция нервного блока, нацеленная на большую площадь.Они используются в основном для анестезии верхних и / или нижних век во время заживления ран, биопсии повреждений, удаления инородных тел века, электроэпиляции, удаления халязии и термического прижигания точек.
Подкожная клетчатка века, благодаря своим физическим характеристикам (способность удерживать большие объемы лекарств) и непосредственной близости к пластине предплюсны, делает ее идеальным тканевым резервуаром для стероидов при лечении халязии. Халазия — воспалительные процессы мейбомиевых желез.
Они могут возникать спонтанно из-за локального раздражения, но чаще всего развиваются после инфекционного процесса.
Подкожные инъекции используются для анестезии век при заживлении ран, биопсии пораженных участков, удалении инородных тел века, электроэпиляции, удалении халазии и термической прижигании точек.
Стероиды полезны при лечении халязии, но они противопоказаны при активных инфекционных процессах век.Поэтому, рассматривая инъекционный стероид для лечения ячменя на веках, убедитесь, что это на самом деле халязион, а не что-то еще.
С анатомической точки зрения, халазия развивается внутри мейбомиевой железы. Мейбомиевы железы расположены внутри пластинки предплюсны. Пластинка предплюсны состоит из рыхлой соединительной ткани и по своей природе является хрящевой.
Таким образом, он довольно плотный, и вставить тонкую иглу в ткань такой плотности сложно.Однако по мере развития халазии они неизменно увеличиваются в размерах по осям x, y и z.
Некоторые халазии могут «указывать» больше изнутри, чем снаружи, а некоторые наоборот. 8 В любом случае наиболее подходящим местом для введения стероида для инъекций остается подкожное пространство.
На конъюнктивальной стороне века конъюнктива предплюсны плотно прилегает к подлежащей пластине предплюсны, поэтому субконъюнктивальное пространство очень мало.Попытка ввести инъекционный стероид в это пространство в лучшем случае затруднена.
Халязион может «указывать» больше снаружи, чем внутри (или наоборот). Тем не менее, стероид вводится в подкожное пространство. Фото: Томас Дж. Стоккерманс, О. Д., доктор философии
Хотя халазия различается по размеру, продолжительности и твердости, инъекции стероидов обычно работают очень хорошо, если соблюдаются два условия: используется соответствующее количество и концентрация стероида и халазион недавнего происхождения (обычно менее четырех до полгода) и так еще относительно мягкая.По мере того как халязион со временем становится более компактным и внутри пораженной мейбомиевой железы образуется больше грануляционной ткани, она становится более плотной. Они медленнее реагируют на инъекции стероидов и могут потребовать второй инъекции. Старые халазии — особенно если они присутствуют более шести месяцев — могут не поддаваться лечению стероидами, и их необходимо надрезать и дренировать или удалить.
Наиболее эффективным стероидом для лечения халязии является Кеналог-40 (Bristol-Myers Squibb), который представляет собой ацетонид триамцинолона в концентрации 40 мг / см3.Кеналог-40 представляет собой густую вязкую суспензию белого цвета, которая плохо всасывается в системный кровоток. Он идеально подходит для лечения халязии по этой и ряду других причин. В то время как подкожное пространство века может вместить (относительно) больший объем инъекционных препаратов, то, что вводится в эту область, не должно быть чрезмерно большим. В зависимости от размера и продолжительности халязиона используется от 0,2 до 1,0 куб. См Kenalog-40.
Поскольку это вязкая суспензия, которая медленно всасывается, болюс лекарства имеет тенденцию оставаться в подкожном пространстве в течение длительного периода времени и постепенно снижает хроническую воспалительную реакцию, которая является основой стойкости халязиона.Таким образом, вполне нормально иметь возможность визуализировать триамцинолон, оставшийся под дермой и эпидермисом века в течение нескольких недель. Этот эффект может оставаться видимым в течение нескольких недель и происходит в первую очередь из-за плотности самого стероида, а также прозрачности тонкой кожи век. Иногда этот остаточный стероид ошибочно диагностируется как побочный эффект инъекционного триамцинолона: депигментация кожи. В любом случае пациента следует предупредить и проинформировать об этой возможности.
При выборе инъекционного стероида от ячменя на веках убедитесь, что это действительно халязион, а не что-то еще.
Некоторые халазии, особенно на начальных стадиях, очень мягкие, и пораженная мейбомиева железа не растянута полностью. Эта ситуация поддается прямой инъекции стероида внутрь очага поражения. Однако даже в этих ситуациях внутри мейбомиевой железы все еще не так много физического пространства для депонирования большого количества стероидов.Таким образом, не важно, чтобы инъекция производилась внутри очага поражения; Также действуют паралезионные инъекции.
С точки зрения безопасности, при инъекции стероидов в веко важно, чтобы кончик иглы двигался, а не оставался неподвижным в одном пространстве. Таким образом, возможно, что одна инъекция стероида, выполненная трансляцией поражения, может включать как внутриочаговую, так и паралезионную инъекцию.
Субконъюнктивальные и субтеноновые инъекции
Показания к этим видам инъекций часто совпадают; Хотя методы введения этих инъекций схожи по подходу, они принципиально различаются.
Как видно из названия, введенное лекарство в конечном итоге доставляется либо в субконъюнктивальное пространство, либо в субтеноновое пространство. Доступ к субконъюнктивальному пространству легче, чем к субтеноновому пространству. Кроме того, учитывая, что субконъюнктивальное пространство больше кпереди, чем субтеноновое пространство, субконъюнктивальные инъекции имеют более выраженный эффект в переднем сегменте, в то время как субтеноновые инъекции больше влияют на
Такой увеит
воспалительный хориоретинит, может потребоваться инъекция стероидов
в субтеноновое пространство или интравитреально.
задний сегмент. 8,9 В некоторых ситуациях введение субконъюнктивальной инъекции лидокаина подготавливает ткань для последующей субтеноновой инъекции. 9
Оба типа инъекций используются в основном для лечения воспалений. Хронический упорный передний увеит часто можно дополнительно лечить с помощью субконъюнктивальной инъекции стероида. 8,9 Важно отметить, что при рассмотрении вопроса о субконъюнктивальной инъекции стероида для облегчения контроля стойкого увеита пациент должен сначала продемонстрировать слабый или минимальный ответ на агрессивную местную терапию.
Другими словами, субконъюнктивальные инъекции стероидов не следует использовать, если только агрессивная местная терапия циклоплегиками и местными стероидами не справляется с воспалением переднего сегмента.
Кроме того, инъекции субконъюнктивальных стероидов не должны использоваться вместо местной терапии, а должны использоваться в качестве дополнительной терапии вместе с местными лекарствами. Инъекции Sub-Tenon используются для лечения воспалений заднего сегмента, хотя с появлением более безопасных систем доставки и лекарств также часто используются интравитреальные инъекции.
Интравитреальные инъекции
Общие расходные материалы, необходимые для инъекций • Шприцы, обычно от 1 до 3 куб.
• Иглы, обычно от 27ga до 30ga от 3/8 дюйма до 5/8 дюйма для
периокулярный, 23ga 1,5 дюйма для IM конечности (инсулин или
шприцев для туберкулеза подходят для периокулярных инъекций)
• Спиртовые салфетки
• Бинты пластыри
• Стерильные тампоны.
• Местные анестетики
• Актуальные капли и мази с антибиотиками.
• Ампулы или флаконы с лекарствами
• Щипцы
• Зеркало крышки
И последнее, но не менее важное: документ об осознанном согласии
Хотя эти инъекции не используются многими оптометристами, ретинологи регулярно используют их в современной практике.Интравитреальные инъекции используются для лечения заболеваний заднего сегмента, в основном, макулы. Поскольку стекловидное тело не имеет сосудов, всасывание препаратов, вводимых в стекловидное тело, обычно происходит медленно.
Ангиогенная возрастная дегенерация желтого пятна характеризуется повышенным накоплением жидкости в субретинальном и / или интраретинальном пространствах. Существует множество форм влажной AMD, но все они основаны на разрушении гематоэнцефалического барьера и развитии новых кровеносных сосудов, берущих начало в сосудистой оболочке.Терапия против VEGF нацелена на определенные факторы роста, ответственные за образование неоваскулярных мембран, которые подвержены утечке и кровотечению; это основа потери зрения у пациентов с ангиогенной AMD.
При введении в полость стекловидного тела агенты против VEGF находятся в непосредственной близости от неоваскулярных мембран и вызывают меньше системных побочных эффектов, чем при других путях введения. Луцентис (ранибизумаб, Genentech) и Авастин не по назначению (бевацизумаб, Genentech) являются яркими примерами препаратов против VEGF, которые вводятся путем интравитреальной инъекции.
Стероиды, такие как Кеналог, также вводятся интравитреально, хотя и по другим причинам. Было обнаружено, что отек желтого пятна — будь то диабетическая макулопатия, окклюзия вен или другие неангиогенные заболевания, при которых жидкость накапливается в центральном желтом пятне и угрожает зрению — отвечает на интравитреальное введение Kenalog (IVK). Хотя другие методы лечения часто используются в сочетании с терапией IVK (например, фокальным лазером), IVK остается жизнеспособным вариантом лечения во многих случаях дегенерации желтого пятна.
Диагностические инъекции
• Внутривенная флуоресцентная ангиография
• Внутривенная ангиография с индоцианином зеленым
• Внутривенное введение тенсилона при миастении.
• Внутрикожное тестирование на ТБ
Первичные терапевтические инъекции
• В / м антибиотики от гонореи
• Транслезионные стероиды от халязии
• Подкожные анестетики для периокулярной области
• В / м / подкожный ботулотоксин
• Интравитреальные инъекции при AMD
• Интравитреальные инъекции при отеке желтого пятна
• Адреналин подкожно, внутримышечно или внутривенно при анафилаксии
Вторичные и дополнительные инъекции
• Субконъюнктивальные стероиды при увеите
• Субтеноновые инъекции стероидов при увеите, плоском паразите, воспалении заднего полюса.
• Интравитреальные инъекции при AMD и макулярном отеке
воспалительный хориоретинит, может потребоваться инъекция стероидов
в субтеноновое пространство или интравитреально.
• Шприцы, обычно от 1 до 3 куб.
• Иглы, обычно от 27ga до 30ga от 3/8 дюйма до 5/8 дюйма для
периокулярный, 23ga 1,5 дюйма для IM конечности (инсулин или
шприцев для туберкулеза подходят для периокулярных инъекций)
• Спиртовые салфетки
• Бинты пластыри
• Стерильные тампоны.
• Местные анестетики
• Актуальные капли и мази с антибиотиками.
• Ампулы или флаконы с лекарствами
• Щипцы
• Зеркало крышки
И последнее, но не менее важное: документ об осознанном согласии
Внутривенные инъекции
Внутривенные (IV) инъекции обычно используются только в диагностических процедурах в контексте офтальмологической помощи. Флуоресцентная ангиография, ангиография с индоцианином зеленым и, реже, тестирование тенсилона (эдрофониум, Valeant Pharm.) Выполняются с внутривенным введением препаратов.
| Яркий пример внутривенного (IV) введения при уходе за глазами: флуоресцентная ангиография. |
Как преимущество, так и недостаток внутривенных инъекций заключается в почти мгновенном всасывании лекарства в сосудистую систему. Желаемые эффекты, такие как возможность оценить поток флуоресцеина через глаз, происходят быстро. Но нежелательные побочные эффекты также возникают быстро и более заметно, когда лекарства вводятся внутривенно.
Внутрикамерные инъекции
Эти инъекции обычно предназначены для процедур в операционной во время внутриглазных операций.Они не будут использоваться в повседневной клинической офтальмологии.
Инъекционный способ введения — это просто альтернативный способ доставки лекарства в организм. Инъекционные препараты могут использоваться в качестве основного и дополнительного лечения. В современной оптометрической практике необходимо знать их показания и способы использования.
Доктор Фанелли занимается частной практикой в Уилмингтоне, Северная Каролина, пишет колонку «Обзоры оптометрии» «Грандиозные раунды глаукомы» и читает лекции по глаукоме и другим клиническим темам.
1. Ison CA, Александр С.
Устойчивость к противомикробным препаратам Neisseria gonorrhoeae в Великобритании:
наблюдение и управление. Эксперт Rev Anti Infect Ther. 2011 г.
Октябрь; 9 (10): 867-76.
2. Караннанте А., Приньяно Дж., Кузини М. и др. Цефиксим и цефтриаксон
восприимчивость к Neisseria gonorrhoeae в Италии с 2006 по 2010 гг. Clin
Microbiol Infect. 2011 июн 28. doi: 10.1111 / j.1469-0691.2011.03619.x.
[Epub перед печатью]
3. Рой Ф.Х., Фраунфельдер Ф.В., Фраунфельдер Ф.Т. Течение Роя и Фраунфельдера
Глазная терапия.6-е изд. Филадельфия: Сондерс / Эльзевьер; 2008: 32-33.
4. Darlington AB. Феномен ботокса. Plast Surg Nurs. 2010 январь-март; 30 (1): 22-6.
5. Матарассо А., Шафер Д. Ботулинический нейротоксин типа A-ABO (Диспорт):
клинические показания и практическое руководство. Aesthet Surg J. 2009 Ноябрь; 29 (6
Дополнение): S72-9
6. Braccini F, Dohan Ehrenfest DM. Преимущества комбинированной терапии в
косметические препараты для лечения старения лица: ботулинический токсин,
филлеры и мезотерапия. Рев Ларингол Отол Ринол (Борд).2010; 131 (2): 89-95.
7. Блюменфельд А,
Зильберштейн С.Д., Додик Д.В. и др. Способ введения
onabotulinumtoxinA при хронической мигрени: безопасный, хорошо переносимый и
парадигма эффективного лечения, основанная на клинической программе PREEMPT.
Головная боль. Октябрь 2010; 50 (9): 1406-18.
8. Кански Дж., Боулинг Б. Клиническая офтальмология: систематический подход. 7-е изд. Филадельфия: Сондерс / Эльзевьер; 2011: 411-12.
9. Элерс Дж. П., Чираг П. С., Грегори Л. Ф. и др. Руководство Wills Eye: Офис
и отделение неотложной помощи. Диагностика и лечение глазных болезней.5-е изд.
Филадельфия: Липпинкотт Уильямс и Уилкинс; 2008: 422.
| Право оптометристов вводить наркотики путем инъекций | ||
| Государство | Использование инъекционных препаратов в диагностических и лечебных целях 1 [включая лечение анафилаксии] | Использование инъекционных наркотиков в настоящее время ограничивается лечением только анафилаксии |
| Аляска | ДА | |
| Алабама | ДА | |
| Аризона | ДА | |
| Арканзас | ДА | |
| Калифорния | ДА | |
| Колорадо | ДА | |
| Коннектикут | ДА | |
| D.С. | ДА | |
| Гавайи | ДА | |
| Айдахо | ДА | |
| Иллинойс | ДА | |
| Айова | ДА | |
| Кентукки | ДА | |
| Луизиана | ДА | |
| Мэн | ДА | |
| Мэриленд | ДА | |
| Миннесота | ДА | |
| Миссисипи | ДА | |
| Монтана | ДА | |
| Нью-Гэмпшир | ДА | |
| Нью-Джерси | ДА | |
| Нью-Мексико | ДА | |
| Северная Каролина | ДА | |
| Северная Дакота | ДА | |
| Огайо | ДА | |
| Оклахома | ДА | |
| Орегон | ДА | |
| Теннесси | ДА | |
| Техас | ДА | |
| Юта | ДА | |
| Вермонт | ДА | |
| Вирджиния | ДА | |
| Вашингтон | ДА | |
| Западная Вирджиния | ДА | |
| Висконсин | ДА | |
| ¹ Полномочия на введение инъекционных препаратов лекарства для диагностических и лечебных целей могут быть ограничены государством акт или правила оптометрии. | ||

 Результаты исследований продемонстрировали, что при подкожной инъекции концентрация Мабтеры в крови (фармакокинетические параметры; ФК) соответствовала аналогичному показателю при стандартном внутривенном введении (ВВ). Профили нежелательных явлений (НЯ) при подкожной инъекции Мабтеры и внутривенном введении Мабтеры были сопоставимы; реакции в месте введения препарата в большинстве случаев были легкой или умеренной степени тяжести. Полученные результаты были представлены на 54-й ежегодной конференции Американского гематологического общества (ASH) и стали основанием для оформления заявки на расширение ассортимента лекарственных форм. В настоящий момент заявка официально передана в Европейское агентство по лекарственным средствам (EMA).
Результаты исследований продемонстрировали, что при подкожной инъекции концентрация Мабтеры в крови (фармакокинетические параметры; ФК) соответствовала аналогичному показателю при стандартном внутривенном введении (ВВ). Профили нежелательных явлений (НЯ) при подкожной инъекции Мабтеры и внутривенном введении Мабтеры были сопоставимы; реакции в месте введения препарата в большинстве случаев были легкой или умеренной степени тяжести. Полученные результаты были представлены на 54-й ежегодной конференции Американского гематологического общества (ASH) и стали основанием для оформления заявки на расширение ассортимента лекарственных форм. В настоящий момент заявка официально передана в Европейское агентство по лекарственным средствам (EMA).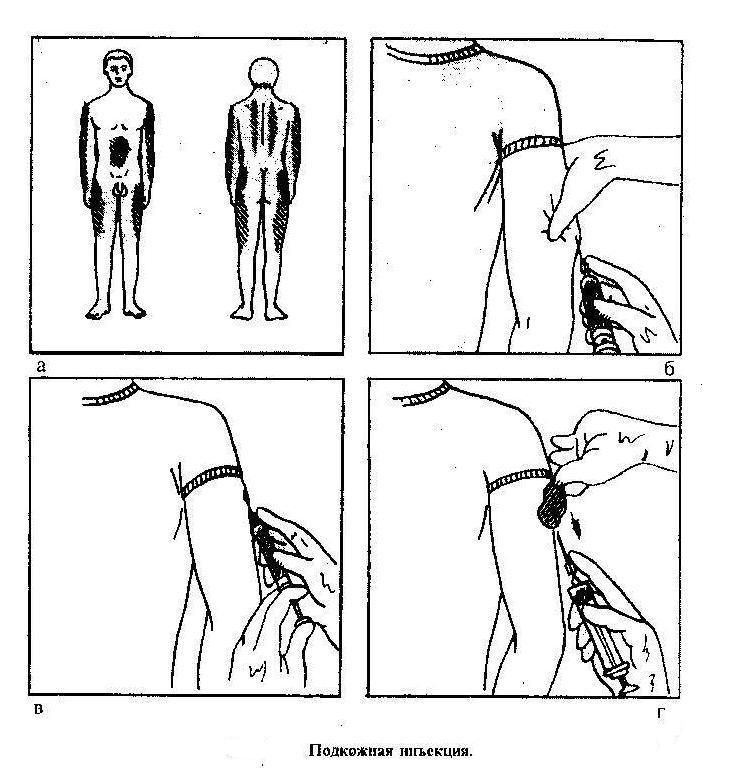 Исследование достигло своей первичной конечной точки: было доказано, что минимальная концентрация препарата в течение заданного временного интервала введения (Ctrough) при подкожной инъекции Мабтеры не уступала соответствующему показателю при внутривенном введении (134,6 против 83,1 мкг/мл, соотношение 1,62). Кроме того, анализ эффективности, оцениваемой по частоте ответа, показал, что переход от внутривенного к подкожному введению не повлиял на доказанную эффективность Мабтеры.
Исследование достигло своей первичной конечной точки: было доказано, что минимальная концентрация препарата в течение заданного временного интервала введения (Ctrough) при подкожной инъекции Мабтеры не уступала соответствующему показателю при внутривенном введении (134,6 против 83,1 мкг/мл, соотношение 1,62). Кроме того, анализ эффективности, оцениваемой по частоте ответа, показал, что переход от внутривенного к подкожному введению не повлиял на доказанную эффективность Мабтеры.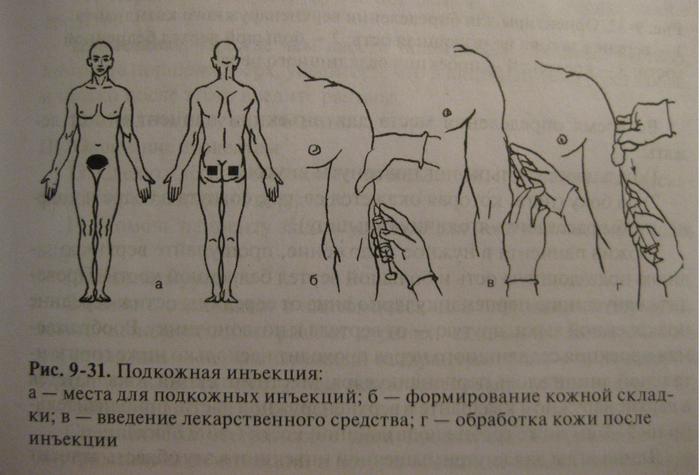 На втором этапе с первичной конечной точкой по эффективности в группы для подкожного и внутривенного введения Мабтеры будут рандомизированы дополнительные пациенты.
На втором этапе с первичной конечной точкой по эффективности в группы для подкожного и внутривенного введения Мабтеры будут рандомизированы дополнительные пациенты.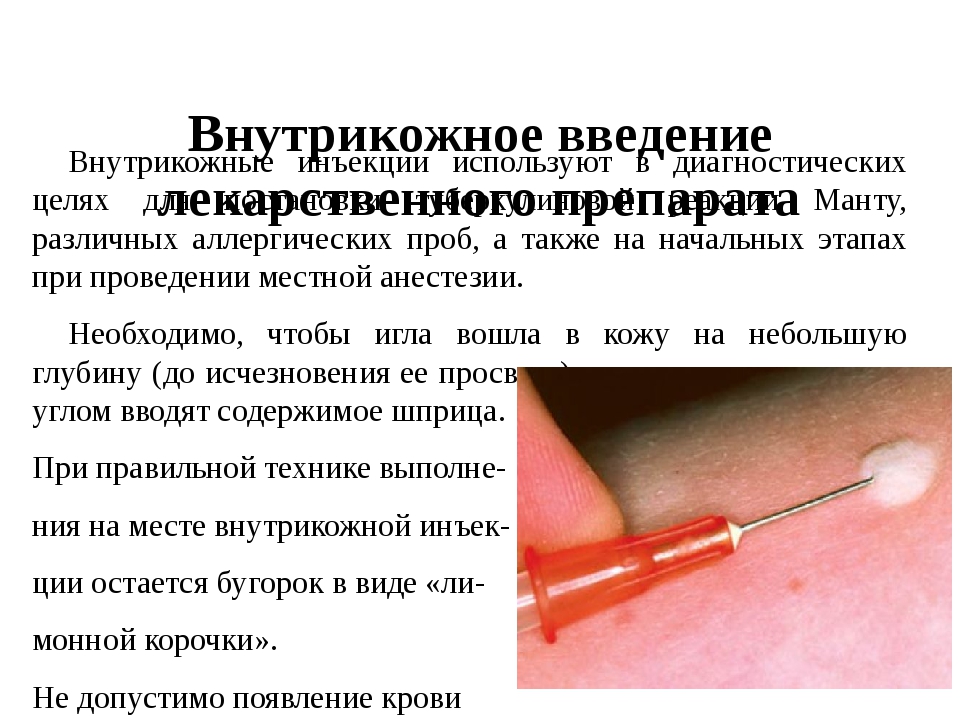
 Компания была основана в 1896 году в Базеле, Швейцария, и на сегодняшний день имеет представительства в 150 странах мира и штат сотрудников более 80 000 человек. Инвестиции в исследования и разработки в 2011 году составили более 8 миллиардов швейцарских франков, а объем продаж группы компаний Рош составил 42,5 миллиарда швейцарских франков. Компании Рош полностью принадлежит компания Genentech, США и контрольный пакет акций компании Chugai Pharmaceutical, Япония. Дополнительную информацию о компании Рош в России можно получить на сайте http://www.roche.ru/
Компания была основана в 1896 году в Базеле, Швейцария, и на сегодняшний день имеет представительства в 150 странах мира и штат сотрудников более 80 000 человек. Инвестиции в исследования и разработки в 2011 году составили более 8 миллиардов швейцарских франков, а объем продаж группы компаний Рош составил 42,5 миллиарда швейцарских франков. Компании Рош полностью принадлежит компания Genentech, США и контрольный пакет акций компании Chugai Pharmaceutical, Япония. Дополнительную информацию о компании Рош в России можно получить на сайте http://www.roche.ru/