Лаборатория ДНК-Диагностики — Бактериологические исследования
Бактериологические исследования МЦ «Лаборатория ДНК-Диагностики» выполняет в лицензированных бактериологических лабораториях:
- ФКУЗ «МСЧ МВД России по Алтайскому краю», г. Барнаул, ул. Юрина, 206К;
Ниже приведён перечень бактериологических исследований.
Материал для исследования отбирается в стерильные пробирки с транспортными средами Эймса или Кэри-Блэра, сохраняющими жизнеспособность микроорганизмов в процессе доставки биоматериала в бактериологическую лабораторию в течение нескольких суток.
Общие рекомендации по взятию биоматериала для бактериологических исследований.
- Посев из цервикального канала и влагалища на флору
- Посев из цервикального канала или влагалища на кандиды с определением чувствительности к противогрибковым препаратам
- Посев на флору (из глаз, ушей, носа, зева — 1 точка взятия)
- Посев (из глаз, ушей, носа, зева — 1 точка взятия) на кандиды с определением чувствительности к противогрибковым препаратам
- Посев из уретры у мужчин на флору
- Посев из уретры у мужчин на кандиды с определением чувствительности к противогрибковым препаратам
- Посев секрета предстательной железы на флору
- Посев мочи на уропатогенную флору
- Посев содержимого пустул на флору
- Посев из цервикального канала или уретры на Mycoplasma hominis и Ureaplasma
- Определение чувствительности Ureaplasma и Mycoplasma hominis к противомикробным препаратам
- Бактериологическое исследование мазка/соскоба из прямой кишки на дизентерийную группу и сальмонеллез
- Бактериологическое исследование отделяемого зева или носа на стафилококк с определением чувствительности
- Бактериологическое исследование отделяемого зева или носа на возбудителя дифтерии
- Бактериологическое исследование кала на условно-патогенную флору
Бактериологические исследования
Бактериологические исследования
=\Bitrix\Main\Config\Option::get(«slam. counters»,»META_STRING»,»»,SITE_ID)?>
counters»,»META_STRING»,»»,SITE_ID)?>
=\Bitrix\Main\Config\Option::get(«slam.counters»,»BODY_TOP_STRING»,»»,SITE_ID)?>
Фильтр по параметрам
550 ₽
Посев мочи
350 ₽
Микроскопическое исследование мазка со слизистой оболочки носа (эозинафилы)
550 ₽
биоматериал на грибы
600 ₽
посев на аэробную и факультативно-анаэробную флору из свища мышечной ткани
550 ₽
Посев на гемолитический стрептококк группы А
350 ₽
Посев на дифтерию (Corynebacterium diphtheriae)
600 ₽
посев на аэробную и факультативно-анаэробную флору из грудного молока
600 ₽
посев на аэробную и факультативно-анаэробную флору из зева
600 ₽
посев на аэробную и факультативно-анаэробную флору из носа
600 ₽
посев на аэробную и факультативно-анаэробную флору из половых органов
600 ₽
посев на аэробную и факультативно-анаэробную флору из ротоглотки
600 ₽
посев на аэробную и факультативно-анаэробную флору из уха
400 ₽
Посев на золотистый стафилококк (S. аureus) из зева/носа, качественный результат
аureus) из зева/носа, качественный результат
500 ₽
Посев на золотистый стафилококк (S. aureus) из зева/носа, количественный результат
600 ₽
посев на аэробную и факультативно-анаэробную флору с кожи
1000 ₽
Исследование микробиоценоза влагалища с определением чувствительности к антибиотикам
600 ₽
Посев на аэробную и факультативно-анаэробную флору из конъюктивы
600 ₽
Общий анализ мокроты
Запишитесь на прием к специалисту онлайн или по телефону >
=\Bitrix\Main\Config\Option::get(«slam. counters»,»BODY_FOTER_STRING»,»»,SITE_ID)?>
counters»,»BODY_FOTER_STRING»,»»,SITE_ID)?>
Инфант-Всеволожск. Многопрофильный медицинский центр во Всеволожске
Посевы — Инфант-Всеволожск. Многопрофильный медицинский центр во Всеволожске
(813) 70-43-554
(812) 600-10-03
7 дней в неделю с 8:30 до 20:30
Выберите клинику: Всеволожск, Октябрьский пр. 122пос. им. Морозова, ул. Мира 3Ленинский пр. 95пр. Сизова 25
Записаться к врачу
Наши клиники:
Отзывы пациентов
Пару дней назад, я приводила ребенка на комплексный медосмотр в Инфант. Осмотр врачей был максимально профессиональный, общение отличное, результаты соответствующие состоянию ребенка. Мне очень понравилось и моя дочь осталась довольна осмотром врачей. Стоит платить за такую медицину. Спасибо. С уважением, Елена Владимировна Миленина.
В нашей клинике проводятся следующие виды микробиологических исследований:
- Посев на флору с определением чувствительности к антибиотикам
- Посев на флору с определением чувствительности к фагам
- Посев на флору с определением чувствительности к антибиотикам и бактериофагам
- Посев на Mycoplasma species с определением титра и чувствительности к антибиотикам
- Посев на Ureaplasma species с определением титра и чувствительности к антибиотикам
- Посев Candida spp./дрожжеподобные грибы с подбором антимикотических препаратов
- Посев на Chlamydia trachomatis
- Посев на Chlamydia trachomatis с определением чувствительности к антибиотикам
- Посев на Trichomonas vaginalis
- Дисбактериоз кишечника с определением чувствительности к антибиотикам
- Посев на гемолитический стрептококк группы А
- Посев на дифтерию (Corynebacterium diphtheriae)
- Дисбактериоз кишечника с определением чувствительности к антибиотикам и бактериофагам
- Исследование кожи и ногтевых пластинок на поверхностные микозы
- Посев кала на патогенную флору (диз.
 группа и тифо-паратифозная группа)
группа и тифо-паратифозная группа) - Посев кала на условно-патогенную флору
- Посев на золотистый стафилококк (S. aureus)
- Посев на золотистый стафилококк (S. aureus) с определением чувствительности к антибиотикам
- Бактериологическое исследование клинического материала на анализаторе VITEK bioMerieux
- Дисбактериоз кишечника с определением чувствительности к фагам
- Дисбактериоз кишечника без определения чувствительности к антибиотикам и фагам
- Посев отделяемого раны на флору с определением чувствительности к антибиотикам
- Посев клинического материала на анаэробную флору с определением чувствительности к антибиотикам
- Исследование микробиоценоза влагалища с определением чувствительности к антибиотикам
- Получение уретрального отделяемого
- Получение урогенитального мазка
- Получение мазка из зева или носа
- Забор материала на исследование поверхностных микозов
Записаться на прием вы можете по телефонам:
8 (812) 600-10-03 — колл-центр
8 (963) 319-90-79 — Всеволожск
8 (963) 319-96-68 — пос. им. Морозова
8 (963) 319-90-57 — СПб, пр. Сизова, 25
Наверх
Медицинский центр
«Инфант»
Ленинградская область, г. Всеволожск,
Октябрьский пр. 122
Ленинградская область, поселок им. Морозова, ул. Мира 3
(812) 600-10-03, 8 (813)-70-43-554, ежедневно с 08:30 до 20:30
Мазок из зева и носа
Мазок из зева и носа – это лабораторное исследование содержимого носоглотки, которое позволяет определить возбудителя заболевания и назначить максимально эффективное лечение. В этом случае выполняется посев мазка с определением чувствительности микрофлоры к антибиотикам — антибиотикограмма. Кроме того, исследование мазка позволяет дифференцировать причину воспаления слизистой оболочки носоглотки: она может быть инфекционной или аллергической природы, и терапевтические методы в этих двух случаях будут принципиально отличаться. Нормальное содержимое взятого секрета – это слизь с ресничками мерцательного эпителия, содержащая нормальную микрофлору. Однако инфицирование содержимого патогенными бактериями или вирусами, снижение иммунитета вследствие различных причин приводят к развитию инфекционного или аллергического воспаления.
Кроме того, исследование мазка позволяет дифференцировать причину воспаления слизистой оболочки носоглотки: она может быть инфекционной или аллергической природы, и терапевтические методы в этих двух случаях будут принципиально отличаться. Нормальное содержимое взятого секрета – это слизь с ресничками мерцательного эпителия, содержащая нормальную микрофлору. Однако инфицирование содержимого патогенными бактериями или вирусами, снижение иммунитета вследствие различных причин приводят к развитию инфекционного или аллергического воспаления.
Когда нужно сдавать мазок из зева и носа?
Врач рекомендует сдать это исследование, если симптомы, присутствующие у конкретного пациента, могут развиваться при разных заболеваниях с целью дифференциальной диагностики, при длительно протекающих воспалительных процессах, устойчивых к проводимой терапии. Кроме того, рекомендуется сдать мазок на флору при частых рецидивах ринита, при длительном насморке для подбора лечения: антибиотики, противовирусные или антиаллергенные препараты.
Материал для исследования – секрет слизистой. Если количество лейкоцитов в нем превышает допустимые нормы – рассматриваются причины, по которым это происходит, так как такие показатели – иммунный ответ организма.
Расшифровка микроскопии мазка из зева и носа
Рассматривается наличие и количество следующих форменных элементов и соединений:
- Нейтрофилы больше нормы означают присутствие бактериальной инфекции;
- Лимфоциты могут изменять свое количество в зависимости от того, каким заболеванием страдает пациент;
- Макрофаги являются указанием на то, что организм вынужден бороться с попавшей в него инфекцией;
- Брадикинин и гистамин — их наличие свидетельствует о том, что у человека имеет место аллергический процесс;
- Эозинофилы – увеличение их количества также может являетьсяпроявлением аллергической реакции
Врач может направить пациента на взятие мазка из зева и носа, если последний жалуется на зуд носовых ходов, учащение дыхания или его затруднение, обильное выделение слизи из носовых ходов, частое чихание без признаков простуды.
Методы исследования мазка
Содержимое из зева и носа исследуется разными методами, в зависимости от того, какова цель его проведения: на стафилококк, на микрофлору и т.п. Может быть применен один из следующих методов:
- Бакпосев: применяется для определения рода и вида возбудителя.
- Исследование на чувствительность микрофлоры: необходимо для того, чтобы максимально эффективно подобрать антибиотик.
- ПЦР (полимеразная цепная реакция): применяется для максимально точного определения типа микрофлоры и вирусов.
- Тестирование на антигены: необходимо при выявлении причины аллергической реакции.
Окончательный выбор методики диагностики делает отоларинголог, направивший пациента в зависимости от клинической картины и предполагаемого заболевания. Если данных одного анализа недостаточно для достижения поставленной врачом цели, может быть взят дополнительный мазок, и проведен другой тип анализа.
Сдать мазок из носа и зева в клинике «Первый Доктор»
Чтобы добиться максимальных результатов лечения, наши специалисты уделяют внимание правильной диагностике. Мазок является самым достоверным анализом для выявления возбудителя инфекций верхних дыхательных путей.
Высокая квалификация сотрудников клиники, а также современный уровень лабораторного оборудования, используемого при проведении диагностики – это гарантия того, что результаты будут максимально точными, а назначенное лечение – максимально эффективным.
| Бак. посев кала на патогенные энтеробактерии (сальмонеллы, шигеллы) | 1 опред. | 545.00р. |
| Бак. посев раневого отделяемого на микрофлору с опред. антибиотикочув-ти | 1 опред. | 705.00р. |
Бак посев мат-ла из урогенит. тракта без микроскопии на м/флору с опред. антибиотикочувств. | 1 опред. | 495.00р. |
| Бак. посев из закрытых полостей (пунктаты, аспираты) на микрофлору с опред. антибиотикочув-ти | 1 опред. | 565.00р. |
| Бак. исслед. кала на дисбактериоз без определения чув-ти к антибиотикам/бактериофагам | 1 исслед. | 720.00р. |
| Бак посев из зева на микрофлору с опред . антибиотикочув-ти | 1 опред. | 545.00р. |
| Бак. посев на золотистый стафилококк (S. Aureus) | 1 опред. | 545.00р. |
| Бак. посев мокроты на микрофлору с опред. антибиотикочув-ти | 1 опред. | 915.00р. |
| Бактериологическое исследование молока | 1 опред. | 600.00р. |
| Бак. посев мочи на микрофлору с опред. антибиотикочув-ти. | 1 опред. | 445.00р. |
| Бак. посев из носа на микрофлору с опред. антибиотикочув-ти | 1 опред. | 545.00р. |
| Бак. посев смыва с кожи на микрофлору с опред. антибиотикочув-ти | 1 опред. | 545.00р. |
| Определение количества микоплазм и уреаплазм в одной пробе с антибиотикочувствительностью | 1 опред. | 1 050.00р. |
| Бак. посев мазка с конъюктивы одного глаза на микрофлору с опред. антибиотикочув-ти | 1 опред. | 620.00р. |
| Бактериологическое исследование материала и посев на грибы | 1 исслед. | 565.00р. |
| Бактериологическое исследование материала на BL | 1 исслед. | 545.00р. |
| Бак. посев сока предстательной железы на микрофлору с определением антибиотикочув-ти | 1 опред. | 545.00р. |
| Бак. посев из уха на микрофлору с опред. антибиотикочув-ти | 1 опред. | 790.00р. |
| Бак. исслед. кала на дисбактериоз с определением чув-ти к антибиотикам | 1 исслед. | 1 090.00р. |
| Бак. исслед. кала на дисбактериоз с определением чув-ти к бактериофагам | 1 исслед. | 780.00р. |
| Бак. исслед. кала на дисбактериоз с определением чув-ти к антибиотикам и бактериофагам | 1 исслед. | 1 090.00р. |
| Бак. посев мат-ла из урогенит. тракта с микроскопией на м/флору и чув-ть к антибиотикам | 1 опред. | 495.00р. |
| Бак. посев эякулята на микрофлору с определением чув-ти к антибиотикам | 1 опред. | 495.00р. |
| Микроценоз влагалища | 1 опред. | 935.00р. |
| Микологический посев (грибы) с опред. чув-ти к антимикотикам | 1 опред. | 565.00р. |
| Бак. посев кала на патогенные, энтеропатогенные кишечные палочки (детям до 2-х лет) | 1 опред. | 675.00р. |
| Бак. посев из закрытых полостей (пунктаты, аспираты) на облигатные анаэробы без антибиотикограммы | 1 опред. | 775.00р. |
| Посев крови на стерильность | 1 исслед. | 1 650.00р. |
| Бактериологическое исследование на бетта-гемолитический стрептококк | 1 исслед. | 820.00р. |
Бакпосев из зева и носа, цена, сдать анализ, результаты онлайн — Dila.ua
Общая характеристика
Исследование показано при подозрении на бактериальную природу ринитов, синуситов с целью подбора адекватной этиологической терапии.Риниты ассоциируются с пневмококковой, стафилококковой, стрептококковой инфекцией. Различие между инфекцией и колонизацией пациента нельзя выявить с помощью только культивирования. Нужно учитывать титры роста и клиническую картину. Выделяемые микроорганизмы: Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus spp., Коагулазонегативные стафилококки, Staphylococcus aureus, Enterobacteriaceae, Pseudomonas aeruginosa, Haemophilus influenzae, Moraxella catarrhalis, Candida spp., Corynebacterium spp., Neisseria spp.
Тип биоматериала и способы взятия:
| Тип БМ | В отделении МЛ «ДІЛА» | На дому | В ЛПЗ | Самостоятельно |
|---|---|---|---|---|
| Мазок из носа | В отделении МЛ «ДІЛА» | На дому | В ЛПЗ | Самостоятельно |
Правила подготовки пациента
Стандартные условия: В течение рабочего дня МЛ «ДІЛА». Материал принимается в любом отделении МЛ «ДІЛА». Важно:• На протяжении суток перед забором материала не применять препаратов местного значения. • Сдавать до или не раньше, чем через 14 дней после окончания курса антибактериальной, антимикотической терапии (если другое не определено лечащим врачом). • Парные посевы берутся разными тампонами и оформляются как 2 посева. Внимание: возможна доставка биоматериала в лабораторию в течение 48 часов при температуре +20-25°С в специальной транспортной пробирке (тампон с транспортной средой).
Материал принимается в любом отделении МЛ «ДІЛА». Важно:• На протяжении суток перед забором материала не применять препаратов местного значения. • Сдавать до или не раньше, чем через 14 дней после окончания курса антибактериальной, антимикотической терапии (если другое не определено лечащим врачом). • Парные посевы берутся разными тампонами и оформляются как 2 посева. Внимание: возможна доставка биоматериала в лабораторию в течение 48 часов при температуре +20-25°С в специальной транспортной пробирке (тампон с транспортной средой).
В лабораторном справочнике можно ознакомиться с подробным описанием исследования
Цена и сроки исследования:
Бактериологический посев + антибиотикограмма материала из носа
Цена (грн.)
355
Срок
5 дн.
| 99-84-810 | !Острые кишечные инфекции (диарея) — комплексное исследование: посев кала на патогенную микрофлору, посев кала на грибы рода Candida, токсины клостридий, антигены простейших,энтеропатогенные вирус | Кал | 2 — 5 р.д. | 5500.00 |
| 71-00-404 | !ПРОФИЛЬ! Посев материала верхних дыхательных путей на дифтерию (Corynebacterium diphtheriae) | Мазок со слизистых оболочек зева и носа | 2 — 4 р.д. | 590.00 |
| 49-84-106 | Аг патогенной кишечной палочки E. Coli O157:H7 Coli O157:H7 | Кал | 4 р.д. | 1900.00 |
| 78-61-001 | Бактериоскопическое исследование окрашенного мазка (по Граму) | Мазок на предметном стекле | 1 р.д. | 225.00 |
| 99-00-800 | Биоценоз влагалища (комплекс): микроскопия и посев мазка из влагалища на микрофлору (аэробы, микроаэрофилы, анаэробы, грибы) с определением чувствительности к АБ и антимикотическим препаратам | Мазок на предметном стекле; Мазок с заднего свода влагалища | 3 — 6 р.д. | 1400.00 |
| 79-53-003 | Дополнительная антибиотикограмма: чувствительность ESBL-штаммов | Выделенный микроорганизм(ы) | 1-2 р.д. | 370.00 |
| 79-53-001 | Дополнительная антибиотикограмма: чувствительность микроорганизмов к расширенному спектру антибиотиков | Выделенный микроорганизм(ы) | 1-2 р.д. | 680.00 |
| 79-53-002 | Дополнительная антибиотикограмма: чувствительность микроорганизмов к спектру антибиотиков по индивидуальному заказу | Выделенный микроорганизм(ы) | 1-2 р.д. | 390.00 |
| 79-55-005 | Идентификация выделенного микроорганизма (аэробы, анаэробы, грибы) | Выделенный микроорганизм(ы) | 1-2 р.д. | 250.00 |
| 99-84-811 | Исследование кала на наличие клостридий (комплексное исследование, включает посев кала на Clostridium difficile и выявление токсинов клостридий) | Кал | 2 — 5 р.д. | 1500.00 |
| 99-90-812 | Комплексное исследование (кожа, мягк.ткани) на грибы (включает посевы на плесневые, дрожжевые грибы) с определением чувcтвительности к антимикотическим препаратам | Мазок с кожи, мягких тканей | 4 — 7 р.д. | 1060.00 |
| 99-632-812 | Комплексное исследование (ухо лев) на грибы (включает посевы на плесневые, дрожжевые грибы) с определением чувcтвительности к антимикотическим препаратам | Мазок из левого уха | 4 — 7 р. д. д. | 1060.00 |
| 99-631-812 | Комплексное исследование (ухо прав) на грибы (включает посевы на плесневые, дрожжевые грибы) с определением чувcтвительности к антимикотическим препаратам | Мазок из правого уха | 4 — 7 р.д. | 1060.00 |
| 99-81-812 | Комплексное исследование НДП (мокрота, лаваж) на грибы (включает посевы на плесневые, дрожжевые грибы) с определением чувcтвительности к антимикотическим препаратам | Мокрота; Бронхоальвеолярный лаваж | 4-7 р.д. | 1060.00 |
| 79-54-007 | Определение чувствительности к антимикотическим препаратам выделенной культуры грибов | Выделенный микроорганизм(ы) | 2-3 р.д. | 1100.00 |
| 74-79-003 | Педиатрический посев крови (аэр, условно анаэр бакт. и грибы — флакон BactAlert PN) с определением чувствительности к антибиотикам и антимикотическим препаратам | Венозная кровь | 5 — 7 р. д. | 1050.00 |
| 72-634-002 | Посев (глаз лев) на Neisseria gonorrhoeae (гонококк) с определением чувcтвительности к антибиотикам | Мазок с конъюнктивы левого глаза | 3-5 р.д. | 740.00 |
| 75-634-001 | Посев (глаз лев) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Мазок с конъюнктивы левого глаза | 3 — 5 р.д. | 625.00 |
| 72-634-005 | Посев (глаз лев) на золотистый стафилококк (Staphylococcus aureus) с определением чувcтвительности к антибиотикам | Мазок с конъюнктивы левого глаза | 2 — 4 р.д. | 270.00 |
| 71-634-601 | Посев (глаз лев) на микрофлору с определением чувcтвительности к антибиотикам | Мазок с конъюнктивы левого глаза | 2 — 4 р.д. | 600.00 |
| 72-633-002 | Посев (глаз прав) на Neisseria gonorrhoeae (гонококк) с определением чувcтвительности к антибиотикам | Мазок с конъюнктивы правого глаза | 3-5 р./109/109.jpg) д. д. | 740.00 |
| 75-633-001 | Посев (глаз прав) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Мазок с конъюнктивы правого глаза | 3 — 5 р.д. | 625.00 |
| 72-633-005 | Посев (глаз прав) на золотистый стафилококк (Staphylococcus aureus) с определением чувcтвительности к антибиотикам | Мазок с конъюнктивы правого глаза | 2 — 4 р.д. | 270.00 |
| 71-633-601 | Посев (глаз прав) на микрофлору с определением чувcтвительности к антибиотикам | Мазок с конъюнктивы правого глаза | 2 — 4 р.д. | 600.00 |
| 72-442-001 | Посев (гнойн.отд) на анаэробы с определением чувcтвительности к антибиотикам | Гнойное отделяемое | 4 — 6 р.д. | 460.00 |
| 75-442-001 | Посев (гнойн.отд) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Гнойное отделяемое | 3 — 5 р.д. | 590.00 |
| 72-35-005 | Посев (гр.молоко) на золотистый стафилококк (Staphylococcus aureus) с определением чувcтвительности к антибиотикам | Грудное молоко | 2 — 4 р.д. | 270.00 |
| 71-966-403 | Посев (десн.карман) на Bordetella pertussis (коклюш) | Мазок из десневого кармана | 6 р.д. | 440.00 |
| 72-966-003 | Посев (десн.карман) на Neisseria meningitidis с определением чувcтвительности к антибиотикам | Мазок из десневого кармана | 3 — 5 р.д. | 400.00 |
| 72-966-001 | Посев (десн.карман) на анаэробы с определением чувcтвительности к антибиотикам | Мазок из десневого кармана | 2 — 6 р.д. | 480.00 |
| 72-966-006 | Посев (десн.карман) на бета-гемолитические стрептококки (Streptococcus) с определением чувcтвительности к антибиотикам | Мазок из десневого кармана | 2 — 4 р. д. д. | 480.00 |
| 75-966-001 | Посев (десн.карман) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Мазок из десневого кармана | 3 — 5 р.д. | 625.00 |
| 72-966-005 | Посев (десн.карман) на золотистый стафилококк (Staphylococcus aureus) с определением чувcтвительности к антибиотикам | Мазок из десневого кармана | 2 -4 р.д. | 270.00 |
| 71-966-401 | Посев (десн.карман) на микрофлору с определением чувcтвительности к антибиотикам | Мазок из десневого кармана | 2 — 4 р.д. | 700.00 |
| 72-37-001 | Посев (желчь) на анаэробные бактерии с определением чувствительности к антибиотикам | Желчь | 2 — 6 р.д. | 460.00 |
| 75-37-001 | Посев (желчь) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Желчь | 3 — 5 р.д. | 760.00 |
| 75-84-001 | Посев (кал) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Кал | 3 — 5 р.д. | 590.00 |
| 74-79-004 | Посев (ликвор, бж) на аэробные бактерии и грибы (флаконы BactAlert FA) с определением чувствительности к антибиотикам | Внутренние биологические жидкости | 5 — 7 р. д. | 1050.00 |
| 72-81-001 | Посев (мокрота) на анаэробы с определением чувcтвительности к антибиотикам | Мокрота | 2 — 6 р.д. | 460.00 |
| 75-81-001 | Посев (мокрота) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Мокрота | 3 — 5 р.д. | 625.00 |
| 73-85-003 | Посев (моча) на Ureaplasma spp. / Mycoplasma hominis с определением титра и чувствительности к антибиотикам | Моча разовая | 2 — 3 р. д. д. | 1200.00 |
| 73-85-001 | Посев (моча) на Ureaplasma spp. с определением титра и чувствительности к антибиотикам | Моча разовая | 2 — 3 р.д. | 1200.00 |
| 75-85-001 | Посев (моча) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Моча разовая | 3 — 5 р.д. | 680.00 |
| 72-85-005 | Посев (моча) на золотистый стафилококк (Staphylococcus aureus) с определением чувcтвительности к антибиотикам | Моча разовая | 2-3 р.д. | 448.00 |
| 71-85-200 | Посев (моча) на флору с определением чувствительности к антибиотикам | Моча разовая | 2 — 4 р.д. | 700.00 |
| 75-90-001 | Посев (мягк.ткани) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Мазок с кожи, мягких тканей | 3 — 5 р.д. | 760.00 |
| 71-90-603 | Посев (мягк.ткани) на микрофлору с определением чувcтвительности к антибиотикам | Мазок с кожи, мягких тканей | 2 — 4 р.д. | 760.00 |
| 72-41-001 | Посев (операц.мат) на анаэробы с определением чувcтвительности к антибиотикам | Операционный материал | 4 — 6 р.д. | 460.00 |
| 75-41-001 | Посев (операц.мат) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Операционный материал | 3 — 5 р.д. | 590.00 |
| 72-41-005 | Посев (операц.мат) на золотистый стафилококк (Staphylococcus aureus) с определением чувствительности к антибиотикам | Операционный материал | 2 — 4 р.д. | 270.00 |
| 72-41-008 | Посев (операц.мат) на клостридии (Clostridium difficile) | Операционный материал | 2 — 6 р.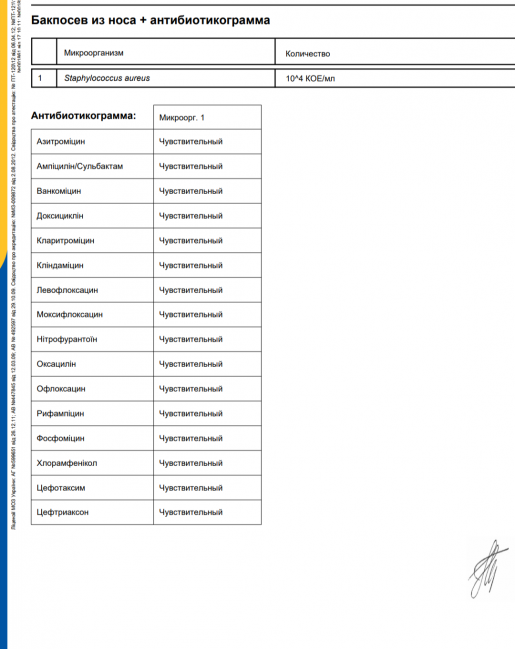 д. д. | 440.00 |
| 72-441-001 | Посев (отд.ран) на анаэробы с определением чувcтвительности к антибиотикам | Раневое отделяемое | 2 — 6 р.д. | 760.00 |
| 75-441-001 | Посев (отд.ран) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Раневое отделяемое | 3 — 5 р.д. | 590.00 |
| 72-47-001 | Посев (пунктат) на анаэробы с определением чувcтвительности к антибиотикам | Пунктат | 2 — 6 р.д. | 450.00 |
| 75-47-001 | Посев (пунктат) на грибы рода Candida с определением чувcтвительности к антимикотическим препаратам | Пунктат | 3 — 5 р.д. | 590.00 |
| 71-967-403 | Посев (рот.полость) на Bordetella pertussis (коклюш) | Мазок со слизистой оболочки полости рта | 6 р.д. | 440.00 |
| 72-967-003 | Посев (рот.полость) на Neisseria meningitidis с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки полости рта | 3 — 5 р.д. | 400.00 |
| 72-967-001 | Посев (рот.полость) на анаэробы с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки полости рта | 2 — 6 р.д. | 480.00 |
| 72-967-006 | Посев (рот.полость) на бета-гемолитичские стрептококки (Streptococcus) с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки полости рта | 2 — 4 р.д. | 480.00 |
| 75-967-001 | Посев (рот.полость) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Мазок со слизистой оболочки полости рта | 3 — 5 р.д. | 625.00 |
| 72-38-005 | Посев (секр.прост) на золотистый стафилококк (Staphylococcus aureus) с определением чувcтвительности к антибиотикам | Секрет предстательной железы | 2-3 р.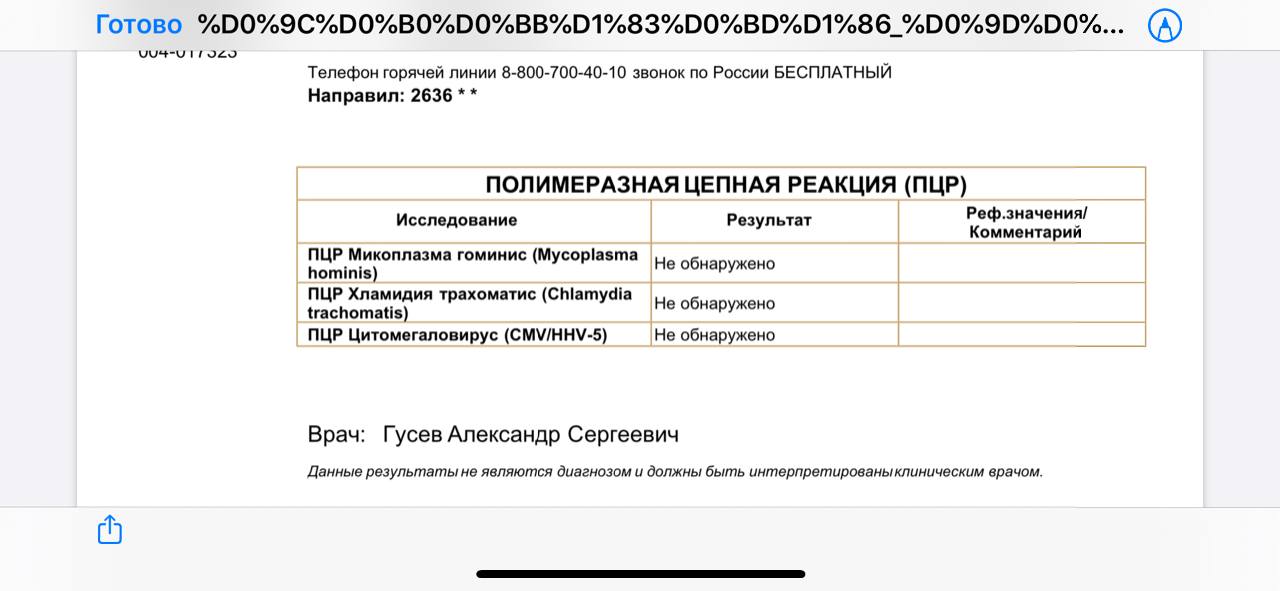 д. д. | 448.00 |
| 72-632-001 | Посев (ухо лев) на анаэробы с определением чувcтвительности к антибиотикам | Мазок из левого уха | 2 — 6 р.д. | 450.00 |
| 75-632-001 | Посев (ухо лев) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Мазок из левого уха | 3 — 5 р.д. | 650.00 |
| 72-632-005 | Посев (ухо лев) на золотистый стафилококк (Staphylococcus aureus) с определением чувcтвительности к антибиотикам | Мазок из левого уха | 2-3 р.д. | 448.00 |
| 72-631-001 | Посев (ухо прав) на анаэробы с определением чувcтвительности к антибиотикам | Мазок из правого уха | 2 — 6 р.д. | 450.00 |
| 75-631-001 | Посев (ухо прав) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Мазок из правого уха | 3 — 5 р.д. | 650.00 |
| 72-631-005 | Посев (ухо прав) на золотистый стафилококк (Staphylococcus aureus) с определением чувcтвительности к антибиотикам | Мазок из правого уха | 2-3 р.д. | 448.00 |
| 71-962-403 | Посев ВДП (зев) на Bordetella pertussis (коклюш) | Мазок со слизистой оболочки ротоглотки (зев) | 6 р.д. | 440.00 |
| 72-962-003 | Посев ВДП (зев) на Neisseria meningitidis с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки ротоглотки (зев) | 3 — 5 р.д. | 400.00 |
| 72-962-001 | Посев ВДП (зев) на анаэробы с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки ротоглотки (зев) | 2 — 6 р.д. | 480.00 |
| 72-962-006 | Посев ВДП (зев) на бета-гемолитические стрептококки (Streptococcus) с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки ротоглотки (зев) | 2 — 4 р. д. д. | 480.00 |
| 75-962-001 | Посев ВДП (зев) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Мазок со слизистой оболочки ротоглотки (зев) | 3 — 5 р.д. | 625.00 |
| 72-962-005 | Посев ВДП (зев) на золотистый стафилококк (Staphylococcus aureus) с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки ротоглотки (зев) | 2 — 4 р.д. | 270.00 |
| 71-962-401 | Посев ВДП (зев) на микрофлору с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки ротоглотки (зев) | 2 — 4 р.д. | 700.00 |
| 71-963-403 | Посев ВДП (миндал.) на Bordetella pertussis (коклюш) | Мазок с миндалин | 6 р.д. | 440.00 |
| 72-963-003 | Посев ВДП (миндал.) на Neisseria meningitidis с определением чувcтвительности к антибиотикам | Мазок с миндалин | 3 — 5 р.д. | 400.00 |
| 72-963-001 | Посев ВДП (миндал.) на анаэробы с определением чувcтвительности к антибиотикам, миндалины | Мазок с миндалин | 2- 6 р.д. | 480.00 |
| 72-963-006 | Посев ВДП (миндал.) на бета-гемолитические стрептококки (Streptococcus) с определением чувcтвительности к антибиотикам | Мазок с миндалин | 2 — 4 р.д. | 480.00 |
| 75-963-001 | Посев ВДП (миндал.) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Мазок с миндалин | 3 — 5 р.д. | 625.00 |
| 72-963-005 | Посев ВДП (миндал.) на золотистый стафилококк (Staphylococcus aureus) с определением чувcтвительности к антибиотикам | Мазок с миндалин | 2 — 4 р.д. | 270.00 |
| 71-963-401 | Посев ВДП (миндал.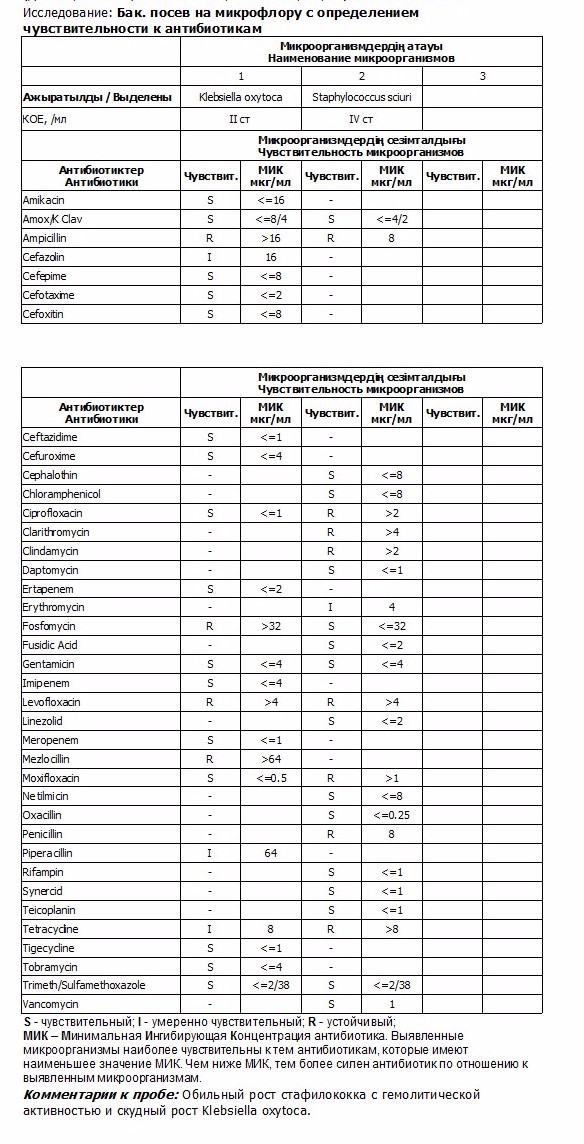 ) на микрофлору с определением чувcтвительности к антибиотикам ) на микрофлору с определением чувcтвительности к антибиотикам | Мазок с миндалин | 2 — 4 р.д. | 700.00 |
| 71-920-403 | Посев ВДП (н/г) на Bordetella pertussis (коклюш) | Мазок со слизистой оболочки носоглотки | 6 р.д. | 440.00 |
| 72-920-003 | Посев ВДП (н/г) на Neisseria meningitidis с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки носоглотки | 3 — 5 р.д. | 400.00 |
| 72-920-001 | Посев ВДП (н/г) на анаэробы с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки носоглотки | 2 — 6 р.д. | 480.00 |
| 72-920-006 | Посев ВДП (н/г) на бета-гемолитические стрептококки (Streptococcus) с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки носоглотки | 2 — 4 р.д. | 480.00 |
| 75-920-001 | Посев ВДП (н/г) на грибы рода Candida с определением чувствительности к антимикотическим препаратам, н/г | Мазок со слизистой оболочки носоглотки | 3 — 5 р.д. | 625.00 |
| 72-920-005 | Посев ВДП (н/г) на золотистый стафилококк (Staphylococcus aureus) с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки носоглотки | 2 — 4 р.д. | 270.00 |
| 71-920-401 | Посев ВДП (н/г) на микрофлору с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки носоглотки | 2 — 4 р.д. | 700.00 |
| 71-923-403 | Посев ВДП (нос) на Bordetella pertussis (коклюш) | Мазок со слизистой оболочки носа | 6 р.д. | 440.00 |
| 72-923-003 | Посев ВДП (нос) на Neisseria meningitidis с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки носа | 3 — 5 р.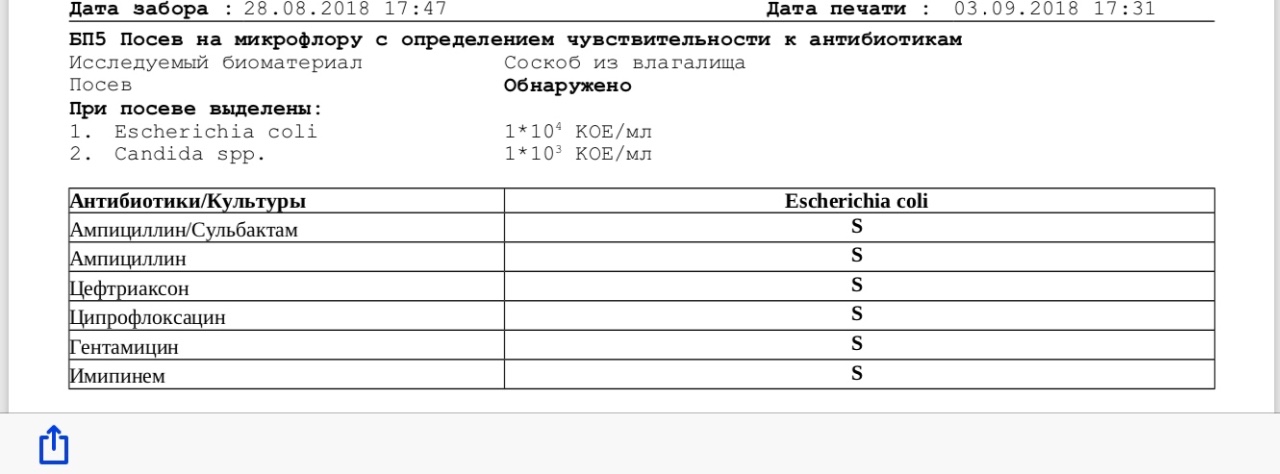 д. д. | 400.00 |
| 72-923-001 | Посев ВДП (нос) на анаэробы с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки носа | 2- 6 р.д. | 480.00 |
| 72-923-006 | Посев ВДП (нос) на бета-гемолитические стрептококки (Streptococcus) с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки носа | 2 — 4 р.д. | 480.00 |
| 75-923-001 | Посев ВДП (нос) на грибы рода Candida с определением чувствительности к антимикотическим препаратам | Мазок со слизистой оболочки носа | 3 — 5 р.д. | 625.00 |
| 72-923-005 | Посев ВДП (нос) на золотистый стафилококк (Staphylococcus aureus) с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки носа | 2 — 4 р.д. | 270.00 |
| 71-923-401 | Посев ВДП (нос) на микрофлору с определением чувcтвительности к антибиотикам | Мазок со слизистой оболочки носа | 2 — 4 р.д. | 700.00 |
| 71-92-402 | Посев ВДП (нос) путей на дифтерию (Corinebacterium diphtheriae) | Мазок со слизистой оболочки носа | 2 — 4 р.д. | 280.00 |
| 71-903-403 | Посев ВДП (пазухи) на Bordetella pertussis (коклюш) | Пунктат из околоносовых полостей (пазух) | 6 р.д. | 440.00 |
| 72-903-003 | Посев ВДП (пазухи) на Neisseria meningitidis с определением чувcтвительности к антибиотикам | Пунктат из околоносовых полостей (пазух) | 3 — 5 р.д. | 400.00 |
| 72-903-001 | Посев ВДП (пазухи) на анаэробы с определением чувcтвительности к антибиотикам | Пунктат из околоносовых полостей (пазух) | 2 — 6 р.д. | 480.00 |
| 72-903-006 | Посев ВДП (пазухи) на бета-гемолитические стрептококки (Streptococcus) с определением чувcтвительности к антибиотикам | Пунктат из околоносовых полостей (пазух) | 2 — 4 р.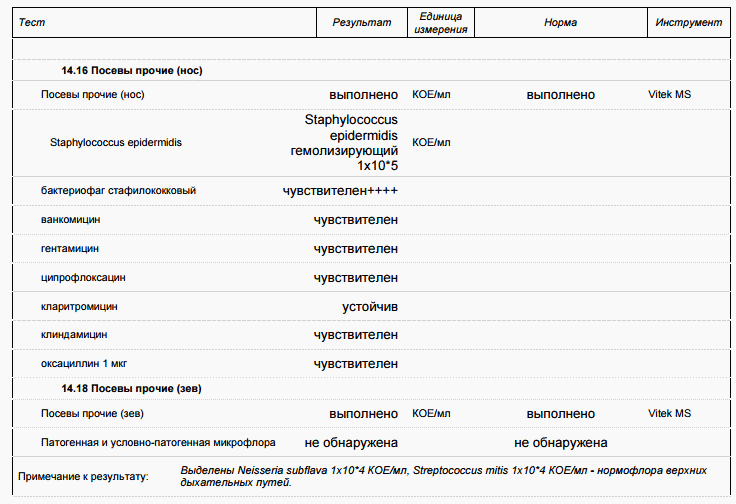 д. д. | 480.00 |
респираторная система человека | Описание, части, функции и факты
Нос — это внешний выступ внутреннего пространства, носовой полости. Он подразделяется на левый и правый канал тонкой медиальной хрящевой и костной стенкой, носовой перегородкой. Каждый канал открывается к лицу через ноздрю и в глотку через хоану. Дно полости носа образовано небом, которое также образует крышу полости рта. Сложная форма носовой полости обусловлена выступами костных гребней верхней, средней и нижней носовых раковин (или раковин) с боковой стенки.Проходы, образованные таким образом под каждым гребнем, называются верхним, средним и нижним носовыми ходами.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
С каждой стороны интраназальное пространство сообщается с рядом соседних заполненных воздухом полостей в черепе (придаточные пазухи носа), а также через носослезный канал со слезным аппаратом в углу глаза. Проток отводит слезную жидкость в носовую полость.Этот факт объясняет, почему во время плача может быстро нарушаться или даже затрудняться носовое дыхание: слезная жидкость не только выливается в слезы, но и заполняет носовую полость.
Придаточные пазухи носа представляют собой набор парных одиночных или множественных полостей переменного размера. Большая часть их развития происходит после рождения, и они достигают своего окончательного размера к 20 годам. Пазухи расположены в четырех разных костях черепа — верхней, лобной, решетчатой и клиновидной.Соответственно, их называют гайморовой пазухой, которая является самой большой полостью; лобная пазуха; решетчатые пазухи; и клиновидная пазуха, которая расположена в верхней задней стенке полости носа. Пазухи выполняют две основные функции: поскольку они наполнены воздухом, они помогают удерживать вес черепа в разумных пределах и служат резонансными камерами для человеческого голоса.
Полость носа и прилегающие к ней пространства выстланы слизистой оболочкой дыхательных путей. Обычно слизистая оболочка носа содержит секретирующие слизь железы и венозные сплетения; его верхний клеточный слой, эпителий, состоит в основном из клеток двух типов: реснитчатых и секретирующих. Этот структурный дизайн отражает особые вспомогательные функции носа и верхних дыхательных путей в целом по отношению к дыханию. Они очищают, увлажняют и согревают вдыхаемый воздух, подготавливая его к интимному контакту с нежными тканями зоны газообмена. Во время выдоха через нос воздух осушается и охлаждается, что позволяет экономить воду и энергию.
Обычно слизистая оболочка носа содержит секретирующие слизь железы и венозные сплетения; его верхний клеточный слой, эпителий, состоит в основном из клеток двух типов: реснитчатых и секретирующих. Этот структурный дизайн отражает особые вспомогательные функции носа и верхних дыхательных путей в целом по отношению к дыханию. Они очищают, увлажняют и согревают вдыхаемый воздух, подготавливая его к интимному контакту с нежными тканями зоны газообмена. Во время выдоха через нос воздух осушается и охлаждается, что позволяет экономить воду и энергию.
Две области носовой полости имеют разную выстилку. Преддверие носа покрыто кожей с короткими густыми волосками, называемыми вибриссами. На крыше носа обонятельная луковица с ее сенсорным эпителием проверяет качество вдыхаемого воздуха. Около двух десятков обонятельных нервов передают ощущение запаха от обонятельных клеток через костный свод носовой полости в центральную нервную систему.
Сравнительный анализ бактериальной микробиоты ноздри и ротоглотки человека
РЕФЕРАТ
Нос и горло являются важными местами колонизации патогенов, но микробиота обоих относительно не исследована с помощью культурально-независимых подходов.Мы исследовали бактериальную микробиоту ноздри и задней стенки ротоглотки семи здоровых взрослых с использованием двух культурально-независимых методов: микрочипа гена 16S рРНК (PhyloChip) и библиотеки клонов гена 16S рРНК. Хотя бактериальная микробиота ротоглотки была богаче, чем микробиота ноздри, микробиота ротоглотки варьировала среди участников меньше, чем микробиота ноздри. Несколько типов составили большинство бактерий, обнаруженных на каждом участке: Firmicutes и Actinobacteria в ноздре и Firmicutes , Proteobacteria и Bacteroidetes в ротоглотке.По сравнению с независимыми от посевов исследованиями микробиоты из других участков тела, микробиота ноздри и ротоглотки демонстрирует отличные паттерны распределения на уровне филумов, поддерживая колонизацию ниш в дискретных анатомических участках. В ноздре распределение Actinobacteria и Firmicutes напоминало распределение в коже, хотя Proteobacteria были гораздо менее распространены. Распределение Firmicutes , Proteobacteria и Bacteroidetes в ротоглотке было наиболее похоже на распределение в слюне, причем Proteobacteria больше, чем в дистальных отделах пищевода или рта.В то время как Firmicutes преобладали на обоих участках, отдельные семейства внутри этого типа численно доминировали в каждом. На обоих участках наблюдалась обратная корреляция между распространенностью Firmicutes и другого типа: в ротоглотке Firmicutes и Proteobacteria и в ноздре Firmicutes и Actinobacteria . В ноздре эта обратная корреляция существовала между семейством Firmicutes , Staphylococcaceae и семейством Actinobacteria , что предполагает потенциальный антагонизм между этими группами.
В ноздре распределение Actinobacteria и Firmicutes напоминало распределение в коже, хотя Proteobacteria были гораздо менее распространены. Распределение Firmicutes , Proteobacteria и Bacteroidetes в ротоглотке было наиболее похоже на распределение в слюне, причем Proteobacteria больше, чем в дистальных отделах пищевода или рта.В то время как Firmicutes преобладали на обоих участках, отдельные семейства внутри этого типа численно доминировали в каждом. На обоих участках наблюдалась обратная корреляция между распространенностью Firmicutes и другого типа: в ротоглотке Firmicutes и Proteobacteria и в ноздре Firmicutes и Actinobacteria . В ноздре эта обратная корреляция существовала между семейством Firmicutes , Staphylococcaceae и семейством Actinobacteria , что предполагает потенциальный антагонизм между этими группами.
ВАЖНОСТЬ Человеческий нос и горло, хотя и связаны, содержат отдельные ниши, которые являются важными местами колонизации патогенными бактериями. Для многих из этих патогенов колонизация увеличивает риск заражения. Большинство исследований микробиоты среды обитания носа и горла сосредоточено на переносе одного или нескольких патогенов. Мы предположили, что расширение знаний о составе сложных бактериальных сообществ, в которых обитают эти патогены, даст новое понимание того, почему некоторые люди становятся колонизированными патогенами, а другие — нет.Действительно, в микробиоте ноздрей участников наблюдалась обратная корреляция между распространенностью семейства Staphylococcaceae ( Firmicutes ), члены которого включают важные патогены, и семейств Corynebacteriaceae и Propionibacteriaceae (оба 17 Actinobacteriaceae). ), члены которой чаще являются доброкачественными комменсалами. Лучшее понимание конкурентной бактериальной колонизации повысит нашу способность определять предрасположенность к носительству патогенов на этих участках и последующий риск инфекции.
ВВЕДЕНИЕ
Самый внешний сегмент носа, ноздри или передние ноздри, являются переходной зоной от кожи к носовой полости. Подобно коже, ноздри содержат сальные железы, потовые железы и волосы и выстланы ороговевшим многослойным плоским эпителием, более похожим на кожу, чем на продуцирующий слизь мерцательный столбчатый эпителий носовой полости (1). Ноздри помогают фильтровать вдыхаемый воздух, который содержит небольшое количество чрезвычайно разнообразных микробов (2, 3).Кроме того, ноздри подвергаются воздействию микробов, присутствующих в дренаже из полости носа и носовых пазух. Горло, или глотку, можно разделить на три части. Как и полость носа, носоглотка (верхняя часть глотки за носом) выстлана мерцательным столбчатым эпителием. Ротоглотка, расположенная сразу за ртом, выстлана неороговевшим многослойным плоским эпителием, как и более дистальный отдел гортани. Ротоглотка постоянно подвергается воздействию как вдыхаемых, так и проглатываемых микробов, которые выводятся мукоцилиарными механизмами как из верхних, так и из нижних дыхательных путей, а также содержатся в слюне.Ноздря и ротоглотка — разные среды обитания. В то время как патоген Staphylococcus aureus колонизирует оба участка (1, 4–6), исследования, основанные на культивировании, показывают, что эти участки имеют несколько общих бактериальных резидентов. Это привело нас к изучению состава бактериального сообщества микробиоты этих двух местообитаний во взаимосвязи друг с другом.
Как упоминалось выше, большая часть знаний о микробиоте носа и горла была получена путем культивирования и сосредоточена на переносе патогенов.Известно, что в ноздрях обитают бактерии из родов Corynebacterium , Propionibacterium и Staphylococcus , включая важный патоген Staphylococcus aureus (1). В прилегающей носовой полости преобладают (по крайней мере, при культивировании) Corynebacterium spp. и Staphylococcus spp. (7). В ротоглотке обитают виды из родов Streptococcus , Haemophilus , Neisseria и в меньшей степени Staphylococcus и различные анаэробные бактерии (1). Это место носительства многих важных патогенов человека, включая Streptococcus pneumoniae , Streptococcus pyogenes , Haemophilus influenzae , Neisseria meningitidis , Moraxella catarrhalis , и Staphylococcus 1 . Три недавних исследования, не зависящих от культуры, посвящены микробиоте кожи или желудочно-кишечного тракта, включая ноздрю или горло (8–10), хотя ни одно из них не сравнивало микробиоту ноздри с микробиотой горла.
Это место носительства многих важных патогенов человека, включая Streptococcus pneumoniae , Streptococcus pyogenes , Haemophilus influenzae , Neisseria meningitidis , Moraxella catarrhalis , и Staphylococcus 1 . Три недавних исследования, не зависящих от культуры, посвящены микробиоте кожи или желудочно-кишечного тракта, включая ноздрю или горло (8–10), хотя ни одно из них не сравнивало микробиоту ноздри с микробиотой горла.
Недавнее применение независимого от культуры анализа ротовой полости здорового взрослого человека (11, 12), слюны (13), желудочно-кишечного тракта (8, 14-17), влагалища (18-20), наружного уха (21), и кожа (9, 10, 22-25) показали, что сотни типов бактерий колонизируют различные ниши человеческого тела. Эти исследования показывают, что ограниченное количество типов составляет большинство бактерий, присутствующих на каждом участке, с сохранением уровня филумов среди здоровых людей (26). Они также демонстрируют высокую степень межличностных различий в составе бактериального сообщества на уровне видов на каждом участке.
Более полное понимание микробиоты человека начинается с углубленных исследований бактериального сообщества, присутствующего в каждой нише. При идентификации присутствующих бактерий и определении их относительной численности такие исследования предоставляют фундаментальную информацию об аспектах микробиоты, которые коррелируют со здоровьем человека. Например, сообщается о корреляции между состоянием здоровья и составом микробиоты при ожирении (27, 28), болезни Крона (29, 30), пародонтите (31) или бактериальном вагинозе (32, 33).Такие исследования также служат основой для выявления бактерий, которые могут оказывать значительное влияние на общий состав и динамику сообщества. Конструирование и секвенирование библиотек клонов генов 16S рРНК из бесчисленных источников открыло огромное разнообразие бактерий. Однако из-за экономических ограничений библиотеки клонов не могут применяться для углубленного отбора проб микробных сообществ. Микромассивы гена 16S рРНК предлагают альтернативный подход. Один из таких микрочипов, PhyloChip (34, 35), содержит 500 000 зондов и может обнаруживать приблизительно 8 500 таксонов бактерий в одном эксперименте.В этом наборе таксон в широком смысле определяется как кластер последовательностей гена 16S рРНК с дивергенцией ≤3% (34). PhyloChip использовался для изучения профилей бактериальных сообществ из ряда различных типов образцов, включая образцы желудочно-кишечного тракта мышей (36) и человека (37–39). Сравнение библиотек клонов PhyloChip и 16S рРНК показывает, что этот массив на несколько порядков более чувствителен в отношении способности идентифицировать разнообразие, обнаруживая таксоны с низкой численностью (0,01% сообщества), даже когда в сообществе доминирует небольшое количество высокоразвитых людей. обильные микробы (2, 35).
Микромассивы гена 16S рРНК предлагают альтернативный подход. Один из таких микрочипов, PhyloChip (34, 35), содержит 500 000 зондов и может обнаруживать приблизительно 8 500 таксонов бактерий в одном эксперименте.В этом наборе таксон в широком смысле определяется как кластер последовательностей гена 16S рРНК с дивергенцией ≤3% (34). PhyloChip использовался для изучения профилей бактериальных сообществ из ряда различных типов образцов, включая образцы желудочно-кишечного тракта мышей (36) и человека (37–39). Сравнение библиотек клонов PhyloChip и 16S рРНК показывает, что этот массив на несколько порядков более чувствителен в отношении способности идентифицировать разнообразие, обнаруживая таксоны с низкой численностью (0,01% сообщества), даже когда в сообществе доминирует небольшое количество высокоразвитых людей. обильные микробы (2, 35).
Здесь мы описываем применение PhyloChip для профилирования бактериального состава образцов из ноздрей и ротоглотки от семи здоровых взрослых людей. Кроме того, мы сконструировали и секвенировали параллельные библиотеки клонов гена 16S рРНК из образцов первых четырех участников, чтобы определить наиболее распространенные бактерии путем секвенирования гена 16S рРНК, а также предоставить сравнительный метод.
РЕЗУЛЬТАТЫ
Сравнение на уровне филумов сообществ бактерий ноздрей и ротоглотки.Парные мазки с поверхности слизистой оболочки (по одному мазку с каждого участка) были взяты из ноздрей и задней стенки ротоглотки семи здоровых взрослых людей в возрасте от 26 до 45 лет, которые не принимали противомикробные препараты в течение предшествующих 2 месяцев, не были беременны и не были беременны. остро болен.
Таксономия, ранее определенная для PhyloChip, использовалась для классификации бактерий, обнаруженных с помощью обоих методов (40, 41). Анализы на микрочипах выявили в общей сложности 39 типов с обоих участков, 34 из которых расположены в ноздре, а 38 — в ротоглотке (см.рис.S1 в дополнительном материале). Анализ библиотеки клонов гена 16S рРНК образцов от четырех из семи участников выявил восемь типов, шесть из ноздрей и семь из ротоглотки (темные кружки на рис. S1 в дополнительном материале).
ФИГ. S1
Филогенетическое дерево бактериальной микробиоты ноздри и ротоглотки, показывающее типы, обнаруженные с использованием микрочипов гена 16S рРНК (надписи) и библиотек клонов (кружки). Черный тип, 10 типов присутствуют во всех образцах как из ноздри, так и из ротоглотки; черные кружки — пять типов, обнаруженных анализом библиотеки клонов на обоих сайтах; красный тип, дополнительные 11 типов присутствуют во всех образцах ротоглотки; красные кружки — два типа, обнаруживаемые библиотеками клонов только из ротоглотки; синий тип, дополнительный тип присутствует во всех ноздрях; синие кружки, в библиотеках клонов, тип обнаружен только из образцов из ноздрей; фиолетовый тип, 11 типов присутствуют в подмножестве образцов из ноздрей и ротоглотки; зеленый тип, пять типов присутствуют только в подмножестве образцов ротоглотки; водного типа, организмы присутствуют только в некоторых образцах ноздрей.Дерево было сгенерировано в ARB с Archaea в качестве внешней группы. Длина ответвлений отражает разнообразие, за исключением того, что ветви Firmicutes и Proteobacteria были укорочены, чтобы соответствовать. Скачать Рисунок S1, файл EPS, 0,32 МБ. Авторские права © 2010 Lemon et al.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-Noncommercial-ShareAlike 3.0 Unported, которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Усредненный образец распределения на уровне филумов для каждого участка показал, что и ноздрю, и ротоглоточная микробиота имеют распределение на уровне филумов, отличное от такового для других участков тела (26). В обоих сайтах на несколько типов приходилась как большая часть сигнала гибридизации от микрочипов, так и большая часть клонированных последовательностей гена 16S рРНК со сходными паттернами филогенетического распределения (рис. 1; см. Рис. S2A – C в дополнительном материале). , что предполагает хорошее соответствие между этими подходами к профилированию.Из образцов ноздрей это были Firmicutes и Actinobacteria (светло-голубой и темно-синий, соответственно, на рис. 1 и см. Рис. S2C в дополнительном материале). В ротоглотке наиболее распространенными типами были Firmicutes , Proteobacteria и Bacteroidetes (светло-голубой, бордовый и желтый, соответственно, на рис. 1 и рис. S2C). На основе микрочипов было оценено количество копий 16S рРНК на основе интенсивности флуоресценции каждого таксона, считающегося присутствующим, что позволяет рассчитать относительное соотношение каждого обнаруженного типа по отношению к общему количеству обнаруженных бактерий (2).Межличностные различия на уровне филума были очевидны, при этом относительная численность основных типов на каждом участке варьировалась в разных выборках.
FIG S2
Анализ библиотек клонов ноздрей и ротоглотки. (A) Филогенетическое дерево бактериальных таксонов, идентифицированных в библиотеках клонов гена 16S рРНК из ноздрей участников от 1 до 4 (719 клонов). (B) Филогенетическое дерево бактериальных таксонов, идентифицированных в библиотеках клонов гена 16S рРНК из ротоглоток участников от 1 до 4 (666 клонов).Деревья были созданы в ARB. (C) Относительное количество основных типов, обнаруженных библиотеками клонов гена 16S рРНК в ноздре и ротоглотке из образцов 1-4. (D) Анализ разрежения ≥97% (открытые символы) — и ≥99% (закрытые символы) -Группы сходства генов 16S рРНК, выделенных из библиотек клонов ноздрей (черные квадраты) и ротоглотки (серые круги). Скачать Рисунок S2, файл EPS, 1,26 МБ. Авторские права © 2010 Lemon et al.
Это статья в открытом доступе, распространяемая на условиях Creative Commons Attribution-Noncommercial-ShareAlike 3.0 Непортированная лицензия, которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
РИС. 1
Гистограмма, показывающая относительное распределение основных типов бактерий в образцах ноздрей и ротоглотки, обнаруженных с помощью PhyloChip. Мы использовали интенсивность гибридизации микроматрицы для оценки количества копий гена 16S рРНК для каждого таксона, обнаруженного на массиве, а затем суммировали их, чтобы оценить относительную распространенность каждого типа, чтобы сравнить сообщества всех участников.Каждая полоса, обозначенная образцом от 1 до 7, представляет 100% бактерий, обнаруженных в образце с помощью анализа микроматрицы. Столбцы, обозначенные AV 1-7, представляют средний состав сообщества, обнаруженный микрочипом для всех семи семи образцов участка. Столбцы, обозначенные AV 1-4, представляют средний состав сообщества, обнаруженный микрочипом из образцов 1-4. Столбцы, обозначенные CL 1-4, представляют собой среднее значение относительной численности типов в библиотеках клонов гена 16S рРНК из образцов 1-4.
Сравнение бактериальных сообществ ноздрей и ротоглотки на уровне семьи. Firmicutes На приходится большой процент бактерий, присутствующих как в ноздре, так и в ротоглотке; однако наиболее многочисленные семейства этого типа варьировались в зависимости от местонахождения. В ноздрях на Staphylococcaceae и Lachnospiraceae приходилась большая часть из Firmicutes , обнаруженных массивом, в то время как в ротоглотке большая часть сигнала была связана с Streptococcaceae , Lachnospiraceae и an Неклассифицированная группа Clostridia (рис.2). Точно так же в библиотеках клонов последовательности из семейства Staphylococcaceae были в большом количестве в образцах ноздрей, а последовательности из семейств Streptococcaceae и клостридиальных семейств Acidaminococcaceae и Lachnospiraceae были в изобилии в образцах ротоглотки (см. S3 в дополнительном материале).
FIG S3
Относительная численность наиболее распространенных семейств Firmicutes , обнаруженных библиотеками клонов гена 16S рРНК из образцов 1–4 по сравнению (A) с семействами Actinobacteria в ноздре и (B) с семействами Proteobacteria в ротоглотка.Для сравнения для каждого сайта показаны смежные графики, каждый с раскраской семейств из указанного типа. Скачать Рисунок S3, файл EPS, 0,45 МБ. Авторские права © 2010 Lemon et al.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-Noncommercial-ShareAlike 3.0 Unported, которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Рис. 2
Относительная численность наиболее распространенных семейств Firmicutes по сравнению с относительной численностью семейств Actinobacteria в образцах ноздрей (A) и по сравнению с относительной численностью семейств Proteobacteria в образцах ротоглотки (B), как обнаружено с помощью Анализ PhyloChip.Для сравнения для каждого сайта показаны смежные графики, на каждом из которых семейства из указанного типа окрашены, как указано. Мы использовали интенсивность гибридизации микроматрицы для оценки количества копий гена 16S рРНК для каждого таксона, обнаруженного на массиве, а затем суммировали их, чтобы оценить относительную численность каждого типа.
Обратная корреляция между Firmicutes и другим типом на обоих участках. Наблюдалась сильная обратная корреляция в относительной распространенности Actinobacteria и Firmicutes в сообществах ноздрей (рис.3A) (коэффициент корреляции Пирсона = -0,95, P <0,001). На более высоком уровне филогенетического разрешения эта обратная корреляция была очевидна между членами семейства Firmicutes Staphylococcaceae и Actinobacteria семейств Corynebacteriaceae и / или Propionibacteriaceae (рис. 3B) (коэффициент корреляции Спирмена = — 0,93, P <0,001). В отличие от сравнения на уровне филумов, последняя взаимосвязь не выглядела линейной, поскольку произошло резкое снижение распространенности Staphylococcaceae , когда совокупная распространенность семейств Actinobacteria превысила ~ 22% от всего сообщества (рис. .2). Эта очевидная нелинейность была причиной использования коэффициента корреляции Спирмена, а не коэффициента корреляции Пирсона. Кроме того, для сравнения на уровне семьи относительная распространенность каждого из них составляла log 10 , преобразованных до регрессионного анализа (рис. 3B). Аналогичная тенденция наблюдалась и в данных из библиотек клонов ноздрей.
Рис. 3
Обратная корреляция между относительной распространенностью представителей филума Firmicutes и другого типа на каждом участке.Пунктирными линиями обозначены 95% доверительные интервалы. (A) Линейная регрессия относительной распространенности (в процентах от всего сообщества) бактерий из типа Firmicutes и типа Actinobacteria в сообществах ноздрей. Коэффициент корреляции Пирсона = -0,95; P <0,001. r 2 = 0,91; P <0,001. (B) Линейная регрессия log 10 -трансформированных относительных распространений (в процентах от всего сообщества) семейства Firmicutes, , Staphylococcaceae, и семейства Actinobacteria, , семей , Corynebacteriaceae, и , Propionibacteriaceae, в сообществах ноздрей.Коэффициент корреляции Спирмена (нетрансформированных данных) = -0,93; P <0,001. r 2 = 0,69; P <0,05. (C) Линейная регрессия относительной распространенности (в процентах от всего сообщества) бактерий из типа Firmicutes и типа Proteobacteria в ротоглоточных сообществах. Коэффициент корреляции Пирсона = -0,994; P <0,001. r 2 = 0,99; П <0.001.
В ротоглоточных сообществах наблюдалась обратная корреляция в относительной распространенности Firmicutes и Proteobacteria (рис. 3C). Мы не смогли выявить потенциальные основы этой обратной корреляции на более тонком филогенетическом уровне.
Таксонов, связанных с ноздрями и ротоглоткой, обнаруженными с помощью микрочипа. На более тонком филогенетическом уровне анализ PhyloChip обнаружил в общей сложности 1325 таксонов бактерий со всех участков. В совокупности 911 бактериальных таксонов были обнаружены в образцах из ноздрей и 1066 были обнаружены в образцах ротоглотки (см. Таблицу S1 в дополнительном материале).Сравнение таксонов из обоих участков выявило 259 таксонов, уникальных для ноздри (выделено синим в таблице S1 в дополнительном материале) и 414 таксонов, уникальных для ротоглотки (выделено розовым цветом в таблице S1). Как показано на рис. 4A, большинство этих таксонов были обнаружены на очень низких уровнях. Как и все методы, у PhyloChip есть ограничения. Поскольку мы не пытались подтвердить идентификацию этих многих редких таксонов, общее количество обнаруженных таксонов может быть завышенным. На каждом участке наблюдалась высокая степень межличностных вариаций в составе сообщества на уровне таксона (см.рис.S4 в дополнительном материале).
ТАБЛИЦА S1
Таксоны, обнаруженные в образцах из ноздрей и ротоглотки с использованием PhyloChip. Таксоны, уникальные для ротоглотки, выделены розовым, а уникальные для ноздри — синим. Значение гибридизации показано для каждого таксона, который считался присутствующим. Таблица S1, файл PDF, 0,43 МБ. Авторские права © 2010 Lemon et al.
Это статья в открытом доступе, распространяемая на условиях Creative Commons Attribution-Noncommercial-ShareAlike 3.0 Непортированная лицензия, которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
FIG S4
Для визуализации большого количества данных, генерируемых микрочипом для каждого образца, интенсивность гибридизации, которая имеет логарифмическую связь с числом копий гена 16S рРНК (2), показана для каждого таксона, идентифицированного по крайней мере в 1 из 14 образцов. Обнаруженные 1325 таксонов расположены в алфавитном порядке по типам по осям x , и каждая вертикальная линия представляет таксон.Каждая строка от одного участника, с образцами ноздрей в левом столбце и образцами ротоглотки в правом столбце. Цветом выделены четыре основных типа. Скачать Рисунок S4, файл EPS, 2,80 МБ. Авторские права © 2010 Lemon et al.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-Noncommercial-ShareAlike 3.0 Unported, которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Рис. 4
Таксономическое разнообразие, обнаруженное микрочипом в образцах из ноздри и ротоглотки. (A) Общее количество таксонов, обнаруженных в каждом образце, и среднее количество (AV) таксонов, обнаруженных для каждого участка (темно-серые столбцы). Показано количество таксонов, обнаруженных в каждом образце и в среднем на участке (AV), каждый из которых составлял <0,05% от всего сообщества (светло-серые столбцы). Планки погрешностей представляют собой стандартные ошибки средних значений. (B) Количество таксонов, которые составляли 100% (темно-серые столбцы), 95% (белые столбцы) и 90% (светло-серые столбцы) от общего количества бактерий, обнаруженных микрочипом в каждом образце и в среднем на участке ( СРЕДНИЙ).Планки погрешностей представляют собой стандартные ошибки средних значений. (C) Индекс разнообразия Симпсона (1- D ) для каждого образца из ноздри (темно-серые столбцы) и ротоглотки (светло-серые столбцы), рассчитанный с использованием оценочного числа копий гена 16S рРНК, полученного из данных интенсивности гибридизации микрочипов. . Данные представлены в виде графика 1 — D , так что чем выше столбец, тем больше разнообразие.
Бактериальная микробиота ноздрей и ротоглотки на основе библиотек клонов гена 16S рРНК.Мы также исследовали микробиоту ноздри и ротоглотки у четырех из семи участников, отобранных с использованием библиотек клонов гена 16S рРНК. PhyloChip обнаруживает редкие таксоны, которые вряд ли будут обнаружены в библиотеках клонов стандартного размера, содержащих от 200 до 500 клонов на образец, при условии, что в массиве есть зонды для этих таксонов. Однако библиотеки клонов позволяют напрямую идентифицировать широко распространенные последовательности гена 16S рРНК, присутствующие в образце. В общей сложности от всех четырех взрослых мы проанализировали 719 клонов, происходящих из ноздрей, и 666 клонов, происходящих из ротоглотки.Мы обнаружили 36 таксонов (определяемых кластеризацией при 97% идентичности нуклеотидов) из ноздрей и 71 таксон из ротоглотки (см. Рис. S2A и B в дополнительном материале). При 97% значение Chao 1 (оценка богатства сообщества) для ноздрей составляло 50 таксонов (стандартное отклонение ± 7,2), а для ротоглотки — 120 таксонов (SD ± 17). 36 таксонов, присутствующих в образцах ноздрей, сгруппированы в пределах пяти бактериальных типов: Actinobacteria , Firmicutes , Proteobacteria , Bacteroidetes и Fusobacteria (в дополнение к хлоропластам [см.S2A в дополнительном материале]). 71 таксон, обнаруженный в образцах ротоглотки, сгруппирован в пределах семи бактериальных типов: Firmicutes , Proteobacteria , Bacteroidetes , Fusobacteria , Actinobacteria , TM7 и SR1 (см. Рис. S2B). Как указано выше, относительная численность каждого типа в каждом сайте была аналогична той, которая была обнаружена с помощью микрочипов (рис. 1 и см. Рис. S2C в дополнительном материале). Анализ разреженности показал, что при 97% кластеризации последовательностей объединенные библиотеки для каждого сайта начали насыщаться (см.рис.S2D). Лучше всего это объясняется большой долей редких таксонов, обнаруженных с помощью микроматрицы (каждый из которых присутствует на уровне <0,05% от расчетного общего числа копий гена 16S рРНК на основе сигналов гибридизации, как показано на рис. 4A), которые вряд ли появятся в пределах клонировать библиотеки размера, сконструированного для этого исследования.
Микробиота ротоглотки имеет большее богатство, чем микробиота ноздрей. Богатство (количество различных таксонов) и равномерность (относительное количество таксонов) отобранного сообщества часто рассчитываются для характеристики и сравнения отобранного сообщества с другими сообществами.Используя микроматрицу, количество таксонов в образце ноздрей (темно-серые полосы слева на рис. 4A и B) варьировалось от 125 до 778, в среднем 342,7 таксона на человека (стандартная ошибка среднего [SEM], 86,8). Количество таксонов в образце ротоглотки (темно-серые полосы справа на рис. 4A и B) варьировалось от 444 до 788, в среднем 561,7 таксонов на сообщество, отобранное в образце (SEM, 48). Бактериальная микробиота ротоглотки имела большее среднее количество таксонов на образец, чем микробиота ноздри (тест t , P <0.05). Библиотеки клонов также продемонстрировали большее разнообразие ротоглоточной микробиоты: в среднем 33 таксона на ротоглотку по сравнению с 15 таксонами на ноздрю (тест t , P <0,05) (см. Рис. S5A в дополнительном материале).
FIG S5
Таксономическое разнообразие, обнаруженное с помощью библиотек клонов гена 16S рРНК из образцов из ноздрей и ротоглотки с 1 по 4. (A) Общее количество таксонов, обнаруженных из каждого образца из ноздри (темно-серые столбцы) и каждого образца ротоглотки (светло-серые столбцы) ) и среднее количество (AV) таксонов, обнаруженных для каждого участка.*, среднее количество таксонов на ротоглотку статистически отличалось от количества таксонов на ноздрю ( t тест, P D ) для библиотеки клонов гена 16S рРНК из каждого образца ноздри (темно-серые столбцы) и каждого образца ротоглотки. (светло-серые полосы) и в среднем для каждого сайта (AV). Данные представлены в виде графика 1 — D , так что чем выше столбец, тем больше разнообразие. Планки погрешностей представляют собой стандартные ошибки средних значений. Скачать Рисунок S5, файл EPS, 0.65 МБ. Авторские права © 2010 Lemon et al.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-Noncommercial-ShareAlike 3.0 Unported, которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Микроматрица обнаружила большое количество таксонов в каждом образце, которые присутствовали на низких уровнях, каждый из которых составляет <0,05% от общего расчетного числа копий гена 16S рРНК, определенного по сигналу гибридизации (светло-серые столбцы на рис.4А). В образцах ноздрей в среднем 71% таксонов в каждом образце присутствовали при <0,05% каждый (SEM, 7,9%), а в ротоглотке в среднем 84% обнаруженных таксонов присутствовали при <0,05%. каждый (SEM, 3,8%).
Ровность сообществ варьировалась от человека к человеку, всего лишь 11 таксонов и целых 171 таксон составляли 95% от общего оценочного числа копий гена 16S рРНК, как определено по сигналам гибридизации для выбранных сообществ (белый стержни на рис.4Б). Среднее количество таксонов, представляющих 90% сообщества, обнаруженного с помощью микроматрицы (светло-серые столбцы на рис. 4B), было аналогично среднему количеству таксонов на сообщество, обнаруженных библиотеками клонов для каждого сайта (см. Рис. S5A в дополнительный материал).
Для оценки разнообразия (как богатства, так и равномерности) каждого сообщества мы использовали индекс разнообразия Симпсона ( D ) (рис. 4C; см. Рис. S5B в дополнительном материале). Индекс разнообразия Симпсона указывает на вероятность того, что любые две бактерии, обнаруженные в образце, относятся к одному и тому же виду (таксону) (42).Различия от человека к человеку в зависимости от того, обладают ли ноздри или ротоглотка большим разнообразием (большее значение 1 — D ), измеряемое индексом Симпсона, было указано как с помощью микроматрицы (рис. 4C), так и библиотеки клонов (см. Рис. .S5B в дополнительном материале) данные.
Межличностное сравнение микробиоты ноздри и ротоглотки. Чтобы изучить потенциальные отношения между отобранными сообществами без априорных ожиданий, мы использовали анализ соответствия (CoA).Этот анализ показал, что бактериальные сообщества, проанализированные с помощью микроматрицы, сгруппированы по участкам, а не по индивидуумам, при этом сообщества ноздрей и ротоглотки сгруппированы отдельно (рис. 5A и B). Ось соответствия 1 нанесена на обе оси 2 и 3, чтобы проиллюстрировать группировку между сайтами, а также взаимосвязь сообществ из одного и того же сайта. Этот анализ не показал, что ни ноздри, ни ротоглотка более тесно связаны между собой.
Чтобы лучше различить взаимосвязь между бактериальными сообществами из одного и того же участка, но у разных особей, мы выполнили кластерный анализ с использованием взвешенного UniFrac, который учитывает как филогенетические отношения, так и относительную численность таксонов в каждом сообществе (43).Каждая конечная ветвь дендрограммы представляет сообщество из одного образца, обнаруженного микрочипом (т.е. один человек, один сайт) (рис. 5C). Опять же, сообщества ноздрей и ротоглотки сгруппированы отдельно, что подтверждает вывод о том, что микробиота ноздрей одного человека больше похожа на микробиоту ноздри другого человека, чем на его / ее собственную микробиоту ротоглотки. Аналогичные результаты были получены с использованием невзвешенного UniFrac (данные не показаны). При сравнении пола или возраста внутри участка в анализах CoA и UniFrac не выявлено какой-либо заметной закономерности (данные не показаны).Сравнение взвешенных расстояний UniFrac во всех образцах из ноздрей и во всех образцах ротоглотки показало, что микробиота ротоглотки была менее разнообразной среди семи человек, чем микробиота ноздри (рис. 5D). Опять же, аналогичные результаты были получены с использованием невзвешенного UniFrac (данные не показаны). Не было обнаружено статистической разницы во взвешенных расстояниях Unifrac при сравнении сообществ между всеми 14 образцами, ноздрями и ротоглоткой, по сравнению между парной ноздрей и ротоглоточной микробиотой каждого человека (рис.5D).
FIG 5
Бактериальные сообщества сгруппированы по участкам, а не по индивидууму. (A и B) Анализ соответствия общего профиля гибридизации микроматрицы от каждого образца, выполненный в МэВ v4.4. Черные квадраты, ноздри; серые круги, ротоглотки. Для наглядности данные показаны в двух измерениях, при этом ось 1 нанесена на график относительно оси 2 (A) и оси 3 (B). Процент в скобках для каждой оси указывает процентное отклонение, которое объясняется этой осью. (C и D) Взвешенный анализ UniFrac общего профиля гибридизации микроматрицы из каждого образца.(C) Каждая конечная ветвь представляет собой общее бактериальное сообщество, обнаруженное в образце одного человека из указанного места. Все узлы были восстановлены на 100% методом складного ножа. (D) Расстояния UniFrac, измеренные в образцах микробиоты ноздри (w / in N), в образцах ротоглоточной микробиоты (w / in OP), между всеми образцами из ноздри и ротоглотки (между N и OP), а также между парной ноздрей и микробиота ротоглотки для каждого человека (по парным N и OP). *, статистически отличается от значений для других, как определено односторонним дисперсионным анализом с тестом Тьюки (установлено на 0.05) от парных значений UniFrac. Планки погрешностей представляют собой стандартные отклонения.
ОБСУЖДЕНИЕ
Мы использовали два различных метода на основе гена 16S рРНК, не зависящие от культуры, для исследования бактериального состава микробиоты, взятой из ноздрей и ротоглотки здорового взрослого человека. Количество участников в этом исследовании ( n = 7) было сопоставимо с таковыми в большинстве первоначальных независимых культуральных исследований микробиоты из разных участков тела (11, 15, 16, 19, 22, 24), хотя и невелико. по сравнению с сотнями и тысячами людей, включенных в эпидемиологические исследования.Каждая микробиота ноздри и ротоглотки имела отчетливую картину распределения на уровне филумов, которая была устойчивой для разных методов (рис. 1 и см. Рис. S2C в дополнительном материале). Подобно тому, что происходило на других участках тела, наблюдалась большая степень межличностных вариаций в составе сообществ на уровне таксона, наряду с некоторыми вариациями на уровне филума. Это говорит о том, что несколько видов могут быть способны выполнять отдельные и важные функции и что функциональная избыточность внутри сообществ может служить признаком стабильности сообщества и, возможно, биомаркером здоровья человека (28, 44).
Обратная корреляция между Firmicutes и Actinobacteria в микробиоте ноздри. В ноздре численное преобладание Actinobacteria и Firmicutes напоминало кожу; однако Proteobacteria встречались гораздо реже (10, 22, 24, 25). Распространенность Firmicutes и Actinobacteria была обратно коррелирована, и это было статистически значимым для семи образцов ноздрей.На уровне семьи эта обратная корреляция существовала между семейством Firmicutes Staphylococcaceae и семейством Actinobacteria Corynebacteriaceae и Propionibacteriaceae , предполагая возможный антагонизм между этими группами. Staphylococcaceae включают важные внебольничные и внутрибольничные патогены, например S . aureus и коагулазонегативные Staphylococcus spp.Наблюдаемая обратная корреляция поднимает интригующую возможность того, что сообщества ноздрей, в которых наиболее распространены Actinobacteria , могут защищать от носительства Staphylococcus spp., Включая патоген S . золотистый . В соответствии с этим, основываясь на культивировании носовых бактерий у 156 здоровых взрослых, Уэхара и его коллеги наблюдали более низкие показатели S . aureus носительство у лиц, колонизированных Corynebacterium (8.5%), чем у тех, у кого нет (44,6%), хотя Staphylococcus spp. кроме S . aureus были обнаружены при культивировании у всех особей (45). Еще одно исследование S , основанное на выращивании. aureus носительство в ноздре у 216 взрослых сообщает о схожих результатах (46). Существует множество возможных объяснений такой обратной корреляции — от вариаций факторов хозяина, таких как сайты прикрепления и субстраты, до различных форм бактериальной конкуренции, таких как конкуренция за общие сайты прикрепления и опосредованное низкими молекулами ингибирование.В будущем будет интересно выяснить молекулярные механизмы, которые управляют этой наблюдаемой обратной корреляцией.
Сравнение составов микробиоты ноздрей из исследований, не зависящих от культуры. Недавнее исследование микробиоты кожи с использованием библиотек клонов гена 16S рРНК включало образцы ноздрей (ноздрей) от 10 здоровых взрослых и обнаружило, что Actinobacteria были наиболее распространенными последовательностями с этого сайта ( 10). Мы предполагаем, что различия в методологии могут объяснить повышенную распространенность Firmicutes в наших образцах, например, несколько разные критерии исключения, сухие и влажные мазки, а также различия в протоколах подготовки ДНК и амплификации гена 16S рРНК.Кажется менее вероятным, что различия в характеристиках участников внесли свой вклад, поскольку оба опроса включали взрослых одинакового возраста, от 20 до 41 года (10) по сравнению с 26 до 45 лет, и оба опроса проводились в схожих географических точках (города на восточном побережье США). Соединенные Штаты). Другое недавнее исследование микробиоты из множества участков тела взрослого человека с использованием пиросеквенирования генов 16S рРНК со штрих-кодом также включало ноздри (9). Всем участникам, кроме одного, было от 30 до 35 лет, и все они жили в Боулдере, штат Колорадо, вместе с мужчинами и женщинами.В соответствии с представленными здесь результатами, это исследование выявило как Actinobacteria , так и Firmicutes как наиболее распространенные типы в образцах ноздрей. Как и в случае с результатами нашей библиотеки клонов, в бактериальных сообществах ноздрей численно доминировали представители Actinobacteria . Одно заметное отличие состоит в том, что Actinobacteria в подавляющем большинстве (> 60%) были из семейства Propionibacteriaceae (9), тогда как мы наблюдали большое количество как Corynebacteriaceae , так и Propionibacteriaceae среди Actinobacteria , обнаруженных с использованием обоих методы (рис.2 и см. Рис. S3 в дополнительном материале). Опять же, это могут быть объяснены методологические различия.
Бактериальный состав на уровне филума в ротоглотке отличается от такового в пищеводе и ротовой полости, но аналогичен таковому в слюне. Повышенное присутствие грамотрицательных бактерий, особенно из типа Proteobacteria , в ротоглотке по сравнению с их присутствие в ноздре согласуется с данными культивирования. По сравнению с другими человеческими сайтами, проанализированными независимыми от культуры методами, сигнал Proteobacteria из ротоглотки конкурирует только с сигналами от кожи (10, 22, 24–26) и слюны (13).В микробиоте дистального отдела пищевода численно преобладают Firmicutes и Bacteroidetes родов, подобных микробиоте ротоглотки, но с гораздо меньшим количеством Proteobacteria (16). В здоровом рту также обитает множество Firmicutes ; в одном исследовании Firmicutes были непропорциональны любому другому присутствующему типу (11, 26), а в другом паттерн распределения на уровне филумов был подобен таковому у слюны (12). Из ниш человеческого тела, проанализированных независимыми от культуры методами, результаты нашей библиотеки клонов из ротоглоточной микробиоты показали структуру состава на уровне филумов, наиболее похожую на структуру слюны.Состав типов в микробиоте слюны, обнаруженный библиотеками клонов гена 16S рРНК от 120 человек (с ~ 120 последовательностями гена 16S рРНК на человека), следующий: Firmicutes , ~ 37,8%; Proteobacteria , ~ 28%; Bacteroidetes , ~ 20%; Актинобактерии , ~ 7%; и другие — 7,2% (13). Недавнее исследование микробиоты кишечника с использованием пиросеквенирования с использованием штрих-кодовых меток для пулов ампликонов гена 16S рРНК включало глотку (8). Только ~ 5% последовательностей из их образцов горла (4.7% ± 3,4) кластера в филуме Proteobacteria , тогда как ~ 15% (14,5 ± 3,9) кластера в Actinobacteria (8). Различия в методах, вероятно, объясняют эти разные наблюдения. Другой возможный источник вариаций — различия в выборке популяций. Шесть участников исследования Андерссона и его коллег были старше и имели сопутствующие заболевания (трое в возрасте от 42 до 73 лет с язвой двенадцатиперстной кишки и трое из контрольной группы в возрасте от 70 до 75 лет с диспепсией) (8).Эти различия предполагают необходимость обследований здоровой микробиоты дыхательных путей у большего числа людей с широким возрастным диапазоном.
На уровне филума, как из ноздри, так и из ротоглотки, Firmicutes были обнаружены как большая часть всего сообщества с помощью микрочипов, чем с помощью библиотек клонов. Для обоих мы следовали одним и тем же протоколам, использовали одну и ту же смесь бактериальной ДНК и, в большинстве случаев, использовали один и тот же пул ампликонов. Наблюдаемые различия указывают на то, что микроматрица чрезмерно представила Firmicutes или что библиотеки клонов недостаточно представили их для этих сайтов.Относительные пропорции зондов на микроматрице для Firmicutes по сравнению с Bacteroidetes и Actinobacteria , возможно, способствовали различию в распространенности этих типов при обнаружении каждым методом. В качестве альтернативы, некоторые предполагают, что клонирование через Escherichia coli может привести к небольшому снижению обнаружения организмов, богатых AT, то есть Firmicutes , хотя, насколько нам известно, это никогда не демонстрировалось напрямую.Фактически, недавняя оценка недопредставленности морского биоразнообразия SAR11, основанная на методах, основанных на клонировании через E . coli (библиотеки фосмидных и бактериальных искусственных хромосом [BAC]) предполагает, что недопредставленность этой группы с низким содержанием GC с использованием этих методов вряд ли связана с ее богатством AT (47).
Комбинированные подходы, основанные на генах 16S рРНК, для изучения состава микробиоты. Все методы, основанные на генах 16S рРНК, вероятно, имеют определенные предубеждения и сильные стороны, хотя в целом от каждого ожидается схожий паттерн; Таким образом, комбинированный подход дает преимущества.В большинстве молекулярных анализов микробиоты человека до настоящего времени использовались библиотеки клонов гена 16S рРНК, и мы использовали как этот метод, так и PhyloChip для анализа образцов от первых четырех участников. Количество клонов на человека на сайт было таким же, как и в других библиотеках клонов сайтов человеческого тела (10, 13, 14, 16, 22, 24). Количество таксонов, идентифицированных PhyloChip, было намного больше, чем количество, идентифицированное из библиотек клонов гена 16S рРНК, и было, по крайней мере, сопоставимо с тем, что можно было ожидать при пиросеквенировании 454 гена 16S рРНК.Однако с помощью микроматрицы мы смогли проанализировать большее количество людей, чем это было возможно в то время, по стоимости, сопоставимой с пиросеквенированием. Хотя микроматрица не идентифицирует ранее незарегистрированные таксоны, комбинированный подход с микрочипами и библиотеками клонов гена 16S рРНК позволил идентифицировать преобладающих членов отобранных сообществ с помощью их последовательности гена 16S рРНК. Кроме того, общая картина гибридизации каждого чипа может использоваться в качестве «подписи» сообщества для анализа, сравнивающего сообщества (например,г., бета-разнообразие).
Как упоминалось в результатах, точное количество таксонов, обнаруженных микрочипом, лучше всего рассматривать как приблизительное. При этом и ноздря, и ротоглотка постоянно подвергаются воздействию большого количества бактерий окружающей среды через вдыхаемый воздух. Кроме того, ротоглотка подвергается воздействию микробов, присутствующих в продуктах питания и жидкостях. Таким образом, неудивительно, что большое количество бактерий, связанных с внешними источниками, было обнаружено на очень низких уровнях в образцах с каждого участка.Чтобы определить, являются ли какие-либо из этих редких таксонов долгосрочными резидентами этих участков, или они просто временно присутствуют, потребуется как больший набор данных, так и подтверждение наличия редких таксонов другими методами.
Бактериальная микробиота ноздри по сравнению с микробиотой ротоглотки. Анализ микробиоты, взятой из ноздри и ротоглотки, показал, что бактериальные сообщества сгруппированы по участкам, а не по индивидуумам, аналогично тому, что наблюдалось для других участков тела (9) .Наблюдаемые нами различия в значительной степени отражают различия в численности сигналов каждого таксона на каждом участке. Поскольку и ротоглотка, и ноздря получают дренаж из общих источников (носоглотка, пазухи и носовая полость), неудивительно, что обнаруженные таксоны сильно перекрываются. Тогда вариации могут возникать из разных источников; Бактерии в ротоглотку могут попадать через рот, слюну и глотать, тогда как ноздри фильтруют воздух, прежде чем он достигнет ротоглотки. Мы постулируем, что различия в составе бактериальной микробиоты на этих двух участках в значительной степени обусловлены различиями в окружающей среде ниши, такими как различия в субстрате и поверхности (например,g., кератин и кожный жир в ноздре), немного более низкая температура ноздрей и ожидаемые колебания pH между участками (не измеряемые в этом исследовании) (1).
На основании сравнения расстояний UniFrac во всех образцах из ноздри и ротоглотки, среди семи взятых в пробы взрослых, состав микробиоты ротоглотки был более консервативным, чем состав микробиоты ноздри (рис. 5D). Ранее было показано, что микробиота горла менее подвержена межличностным изменениям, чем микробиота желудка или фекалий (8).Чтобы определить, демонстрирует ли в целом ротоглоточная микробиота более межличностную композиционную консервацию, потребуются исследования, анализирующие бактериальные сообщества из ряда различных участков тела у большего числа людей. В отличие от гендерных различий в составе микробиоты кожи ладоней (23), мы не наблюдали каких-либо различий в составе микробиоты ноздрей или ротоглотки, которые коррелировали бы с полом среди выбранных людей, хотя размер нашей выборки мог повлиять на эту оценку.Это исследование микробиоты ноздри и ротоглотки семи здоровых взрослых людей способствует углублению понимания состава здоровой микробиоты человека и его межличностных вариаций. Такие опросы являются необходимой основой для будущих исследований, направленных на определение воздействия различных нарушений, например, антибиотиков, вакцин, инфекций, болезней и медицинских вмешательств, на экологию связанных с человеком микробных сообществ и взаимосвязь между здоровьем человека и составом микробиоты.
МАТЕРИАЛЫ И МЕТОДЫ
Набор участников. Мы набрали семь здоровых взрослых добровольцев, четырех мужчин и трех женщин в возрасте от 26 до 45 лет. После получения объяснения исследования и подробностей о сборе проб, все давали устное согласие перед участием. Критерии исключения для этого пилотного исследования были следующими: (i) использование любых противомикробных препаратов в течение последних 2 месяцев, (ii) беременность, (iii) любое интеркуррентное заболевание, и (iv) возраст менее 21 года или старше 65 лет. .Институциональный наблюдательный совет (IRB) Детской больницы Бостона передал оценку IRB Гарвардской медицинской школы, которая одобрила это исследование.
Сбор образцов и выделение ДНК. Отдельные мазки слизистой оболочки собирали из одной ноздри и с задней стенки ротоглотки каждого участника и быстро замораживали при -80 ° C (BBL CultureSwab; Becton, Dickinson and Co.). С задней стенки ротоглотки мазок мазали, не касаясь миндалин, язычка, языка или других структур полости рта.Для экстракции нуклеиновой кислоты верхнюю часть тампона в асептических условиях срезали в стерильную 2-мл пробирку с лизирующим матриксом B (MP Biomedicals), содержащую 600 мкл буфера RLT Plus (Qiagen) с 2-меркаптоэтанолом (Sigma-Aldrich, Inc.). После взбивания гранул (30 с при 5,5 м / с) геномную ДНК очищали из образцов супернатантов с использованием набора AllPrep DNA / RNA (Qiagen, 2005).
ПЦР-амплификация и очистка генов 16S рРНК. Чтобы минимизировать потенциальную ошибку амплификации при ПЦР, мы амплифицировали гены 16S рРНК из экстрактов ДНК с использованием температурного градиента (от 48 ° C до 56 ° C) в восьми повторных реакциях со специфичным для бактерий праймером 16S установите 27F (5′-AGAGTTTGATCCTGGCTCAG-3 ‘) и 1492R (5′-GGTTACCTTGTTACGACTT-3’) (48), как описано ранее (39).Для каждого образца амплифицированные продукты объединяли, очищали осаждением изопропанолом и количественно определяли гель-электрофорезом с использованием 2% E-геля с лестницей количественного анализа с низкой массой ДНК (Invitrogen Corp.).
Конструирование и анализ библиотеки клонов гена 16S рРНК. Для создания библиотек клонов для образцов ноздрей и ротоглотки от первых четырех участников пулы ампликонов лигировали и клонировали с использованием стандартного протокола из набора для клонирования TOPO TA для секвенирования (Invitrogen).Индивидуальные клонированные последовательности гена 16S рРНК сначала амплифицировали с использованием праймеров M13F и M13R (набор для клонирования TOPO TA для ручного секвенирования), а затем секвенировали с 5′-конца праймером 27F с использованием ABI3700 (Applied Biosystems, Inc.). После удаления последовательностей праймеров и векторов последовательности гена 16S рРНК были обрезаны путем удаления всех ведущих и замыкающих оснований, которые содержали неоднозначности и для которых достоверность составляла менее 25%, и хроматограмма каждой последовательности проверялась вручную на наличие оставшихся ошибок вызывающего основания с помощью Sequencher (Gene Codes Corp.). Последовательности с минимальной длиной 500 п.н. затем группировали на основании ≥97% идентичности последовательностей. Кластеризация 97% была сделана для облегчения сравнения с таксонами, обнаруженными PhyloChip, для которых таксон в широком смысле определяется как кластер последовательностей гена 16S рРНК с дивергенцией ≤3% (34). Последовательности выравнивали с помощью NAST на сайте Greengenes (40, 49). Предполагаемые химеры были идентифицированы с помощью ChimeraCheck в RDP и Bellerophon и исключены из набора данных (50). Сгруппированные клонированные последовательности гена 16S рРНК сравнивали с последовательностями в двух базах данных, NCBI и RDP, с использованием выравнивания последовательностей (BLAST) для выявления совпадений с наилучшими названиями.Последовательности, выровненные по NAST, вместе с лучшими совпадениями BLAST, полученными из двух баз данных для отдельных клонированных последовательностей, были импортированы в базу данных Greengenes с использованием программного пакета ARB (40, 51). Последовательности добавляли к универсальной дендрограмме ARB с использованием алгоритма экономичности ARB с фильтром по маске Лейна (48). Затем были извлечены клонированные последовательности и их ближайшая именованная эталонная последовательность (и) и собраны с использованием экономичности в деревья, показанные для библиотек клонов. В конечном итоге, было 141, 261, 176 и 141 клон из отдельных образцов ноздрей и 199, 217, 171 и 79 клонов из отдельных образцов ротоглотки, всего 719 последовательностей, происходящих из ноздрей, и 666 последовательностей, полученных из ротоглотки.
Гибридизация объединенных ампликонов ПЦР с PhyloChip. Мы добавили 250 нг объединенных ампликонов гена 16S рРНК из каждого образца смесью, содержащей известные концентрации контрольных ампликонов, чтобы обеспечить нормализацию межмассивных вариаций (2). Объединенную смесь для каждого образца затем фрагментировали, пометили биотином и гибридизовали с PhyloChip (версия G2; Affymetrix), как описано ранее (2, 34, 35). PhyloChips промывали, окрашивали и сканировали с использованием сканера GeneArray (Affymetrix), как описано ранее (34).Каждое сканирование регистрировали с использованием стандартного программного обеспечения Affymetrix (GeneChip Microarray Analysis Suite, версия 5.1), и данные массива обрабатывали, как описано ранее (2, 34, 35). На PhyloChip каждый таксон был представлен минимум 11 парами зондов, а некоторые были представлены до 55. Как описано ранее, таксон считался «присутствующим» в образце, когда количество положительных пар зондов делилось на общее количество пар зондов в наборе зондов было равно или больше 0.9 (34). Значения гибридизации (интенсивность флуоресценции) для каждого таксона рассчитывались как усеченное среднее (с максимальным и минимальным значениями, удаленными перед усреднением) (34). Значения гибридизации были преобразованы в оценочное число копий гена с использованием формулы, полученной из анализа латинского квадрата, как описано ранее (2).
Анализ данных PhyloChip. Все таксоны, обнаруженные PhyloChip во всех 14 образцах, были добавлены с использованием экономичности к существующему филогенетическому дереву, основанному на дереве парсимонии ARB, поставляемом с базой данных Greengenes ARB (выпуск за октябрь 2006 г.) (40).Для сравнения численно доминирующих типов для каждого участка тела были выполнены коэффициенты корреляции и линейная регрессия с использованием Sigma Plot 11. Мы провели взвешенный и невзвешенный анализ UniFrac с использованием дерева объединения соседей всех таксонов, представленных на PhyloChip, которые имеют 16S> 1200 п.н. Последовательности рРНК (40, 43, 52, 53; файл бактерий.6190.tree на http://greengenes.lbl.gov/Download/Taxonomic_Outlines/). Тест t на матрице расстояний UniFrac использовался, чтобы определить, значительно ли различались ли расстояния UniFrac в среднем для бактериальных сообществ, обнаруженных в двух участках тела.Чтобы определить, различались ли составы сообществ в группах ротоглотки и ноздри и между ними, мы использовали односторонний дисперсионный анализ (ANOVA) с тестом Тьюки (установленным на 0,05) для парных значений UniFrac.
Чтобы определить, как состав бактериального сообщества варьировался в разных образцах, мы также сравнили общие профили гибридизации для каждого образца, используя анализ соответствия (CoA) в МэВ v4.4 (54). Анализ проводился на основе данных интенсивности гибридизации, преобразованных в журнал 2 , для каждого образца с фильтром отсечки в процентах, установленным на 0.02%.
Номера доступа последовательностей гена 16S рРНК. Последовательности из библиотек клонов, сгруппированные с 99% идентичностью (53 из ноздрей и 109 из ротоглотки), были депонированы в базе данных NCBI под номерами доступа GenBank от HM172637 до HM172798.
БЛАГОДАРНОСТИ
Мы благодарим людей, принявших участие в этом исследовании. Мы также благодарим сотрудников лаборатории Колтера Даррена Хиггинса и сотрудников лаборатории Хиггинса за вдумчивые обсуждения. Мы благодарим Ребекку Дж. Кейс, Эрин А.Gontang и Hera C. Vlamakis за критический обзор рукописи. Мы благодарим Иветт М. Пичено, Тодда ДеСантиса и Гэри Андерсена за помощь в настройке процессинга PhyloChip в Гарварде.
H.K.S. была частично поддержана грантом сайта REU DBI-0552060 от Национального научного фонда. S.V.L. частично поддерживается Фондом Райнина. Часть этой работы была выполнена в Национальной лаборатории Лоуренса Беркли в рамках контракта № de-AC02-05Ch21231. Работа частично поддержана грантами GM58213 и GM082137 компании R.K.
СНОСКИ
- Получено 5 мая 2010 г.
- Принято 13 мая 2010 г.
- Опубликовано 22 июня 2010 г.
- Авторские права © 2010 Lemon et al.
Микробиом верхних дыхательных путей в условиях здоровья и болезней | BMC Biology
Костелло Е.К., Лаубер К.Л., Хамади М., Фирер Н., Гордон Дж. И., Найт Р. Изменчивость бактериального сообщества в средах обитания человеческого тела в пространстве и времени. Наука. 2009; 326: 1694–7. https: // doi.org / 10.1126 / science.1177486.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ллойд-Прайс Дж., Махуркар А., Рахнавард Дж., Крэбтри Дж., Орвис Дж., Холл А.Б. и др. Штаммы, функции и динамика в расширенном проекте микробиома человека. Природа. 2017; 550: 61. https://doi.org/10.1038/nature23889.
CAS
Статья
PubMed
PubMed Central
Google Scholar
de Steenhuijsen Piters WAA, Sanders EAM, Bogaert D. Роль местной микробной экосистемы в респираторном здоровье и болезнях. Philos Trans R Soc B Biol Sci. 2015; 370: 20140294. https://doi.org/10.1098/rstb.2014.0294.
CAS
Статья
Google Scholar
Диксон Р., Эрб-Даунворд Дж., Мартинес Ф., Хаффнагл Г. Микробиом и дыхательные пути. Общественный доступ HHS. 2017; 78: 481–504.
Google Scholar
Лайтхарт Б. Мини-обзор изменений концентрации, обнаруженных в популяциях бактерий в атмосфере на открытом воздухе. 2000. https://link.springer.com/content/pdf/10.1023%2FA%3A1007694618888.pdf. По состоянию на 22 октября 2018 г.
Google Scholar
Коупленд Э., Леонард К., Карни Р., Конг Дж., Форер М., Найду И. и др. Хронический риносинусит: потенциальная роль микробного дисбактериоза и рекомендации по участкам отбора проб. Front Cell Infect Microbiol.2018; 8: 57. https://doi.org/10.3389/fcimb.2018.00057.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Домингес-Белло М.Г., Костелло Е.К., Контрерас М., Магрис М., Идальго Г., Фирер Н. и др. Способ доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc Natl Acad Sci U S. A. 2010; 107: 11971–5. https://doi.org/10.1073/pnas.1002601107.
Артикул
PubMed
PubMed Central
Google Scholar
de Steenhuijsen Piters WAA, Huijskens EGW, Wyllie AL, Biesbroek G, Van Den Bergh MR, Veenhoven RH, et al. Дисбактериоз микробиоты верхних дыхательных путей у пожилых больных пневмонией. ISME J. 2016; 10: 97–108.
PubMed
Статья
CAS
Google Scholar
Уилан Ф.Дж., Вершур С.П., Стернс Дж.С., Росси Л., Луинстра К., Леб М. и др. Утрата топографии микробных сообществ верхних дыхательных путей у пожилых людей.Ann Am Thorac Soc. 2014; 11: 513–21.
PubMed
Статья
Google Scholar
Бассис К.М., Тан А.Л., Янг В.Б., Пиннонен М.А. Микробиота носовой полости здорового взрослого человека. Микробиом. 2014; 2: 27.
PubMed
PubMed Central
Статья
Google Scholar
Шилц М.Х., Росас-Салазар С., Товчигречко А., Ларкин Е.К., Торральба М., Акопов А. и др. Минимально инвазивный метод отбора проб выявляет различия в таксономическом богатстве носовых микробиомов у младенцев младшего возраста, связанные со способом родоразрешения.Microb Ecol. 2016; 71: 233–42.
PubMed
Статья
Google Scholar
Stearns JC, Davidson CJ, Mckeon S, Whelan FJ, Fontes ME, Schryvers AB, et al. Культуральные и молекулярные профили показывают сдвиги в бактериальных сообществах верхних дыхательных путей, которые происходят с возрастом. ISME J. 2015; 9: 1246–59. https://doi.org/10.1038/ismej.2014.250.
Артикул
PubMed
PubMed Central
Google Scholar
Koskinen K, Pausan MR, Perras AK, Bang MBC, Mora M, Schilhabel A, et al. Первые сведения о разнообразных археомах человека: специфическое обнаружение архей в желудочно-кишечном тракте. MBio. 2017; 8: 1–17.
Артикул
Google Scholar
Vayssier-Taussat M, Albina E, Citti C, Cosson J-F, Jacques M.-A, Lebrun M-H, et al. Сдвиг парадигмы с патогенов на патобиом: новые концепции в свете мета-омики. Front Cell Infect Microbiol.2014; 4: 29. https://doi.org/10.3389/fcimb.2014.00029.
Артикул
PubMed
PubMed Central
Google Scholar
Абреу Н.А., Нагалингам Н.А., Сонг Й., Рёдигер Ф.К., Плетчер С.Д., Голдберг А.Н. и др. Истощение разнообразия микробиома синуса и обогащение Corynebacterium tuberculostearicum опосредуют риносинусит. Sci Transl Med. 2012; 4: 151ra124. https://doi.org/10.1126/scitranslmed.3003783.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Коберн Б., Ван П.В., Диас Кабальеро Дж., Кларк С.Т., Брахма В., Дональдсон С. и др. Микробиота легких в зависимости от возраста и стадии заболевания при муковисцидозе. Научный доклад 2015; 5: 10241. https://doi.org/10.1038/srep10241.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Gevers D, Kugathasan S, Denson LA, Vázquez-Baeza Y, Van Treuren W., Ren B, et al. Микробиом, ранее не получавший лечения, при впервые возникшей болезни Крона. Клеточный микроб-хозяин.2014; 15: 382–92. https://doi.org/10.1016/j.chom.2014.02.005.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Хартстра А.В., Боутер КЭК, Бэкхед Ф., Ньивдорп М. Понимание роли микробиома в ожирении и диабете 2 типа. Уход за диабетом. 2015; 38: 159–65. https://doi.org/10.2337/dc14-0769.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Петерсен C, Раунд JL. Микрообзор «Определение дисбактериоза и его влияния на иммунитет и болезнь хозяина». Cell Microbiol. 2014. 16: 1024–33.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Hoggard M, Waldvogel-Thurlow S, Zoing M, Chang K, Radcliff FJ, Wagner Mackenzie B, et al. Воспалительные эндотипы и микробные ассоциации при хроническом риносинусите. Фронт Иммунол. 2018; 9: 2065. https://doi.org/10.3389 / fimmu.2018.02065.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Bernstein JA. Характеристика подтипов ринита. Am J Rhinol Allergy. 2013; 27: 457–60. https://doi.org/10.2500/ajra.2013.27.3983.
Артикул
PubMed
Google Scholar
Гинат ДТ. Постобработка изображений придаточных пазух носа после эндоскопической хирургии носовых пазух.Neuroimaging Clin N Am. 2015; 25: 653–65. https://doi.org/10.1016/J.NIC.2015.07.008.
Артикул
PubMed
Google Scholar
Принципи Н., Эспозито С. Орошение носа: неточно определенная медицинская процедура. Int J Environ Res Public Health. 2017; 14. https://doi.org/10.3390/ijerph24050516.
PubMed Central
Статья
PubMed
Google Scholar
Рамакришнан В.Р., Холт Дж., Нельсон Л.Ф., Ир Д., Робертсон К.Э., Франк Д.Н. Детерминанты носового микробиома: пилотное исследование эффектов интраназального применения лекарств. Аллергия на ринол (Провиденс). 2018; 9: 2152656718789519. https://doi.org/10.1177/2152656718789519.
Артикул
Google Scholar
Физел Л.М., Робертсон К.Э., Рамакришнан В.Р., Франк Д.Н. Сложность микробиома и золотистый стафилококк при хроническом риносинусите.Ларингоскоп. 2012; 122: 467–72. https://doi.org/10.1002/lary.22398.
Артикул
PubMed
PubMed Central
Google Scholar
Prevaes SMPJ, De Winter-De Groot KM, Janssens HM, De Steenhuijsen Piters WAA, Tramper-Stranders GA, Wyllie AL, et al. Развитие микробиоты носоглотки у младенцев с муковисцидозом. Am J Respir Crit Care Med. 2016; 193: 504–15.
CAS
PubMed
Статья
Google Scholar
Тео С.М., Мок Д., Фам К., Кусел М., Серральха М., Трой Н. и др. Микробиом носоглотки младенца влияет на тяжесть инфекции нижних дыхательных путей и риск развития астмы. Клеточный микроб-хозяин. 2015; 17: 704–15. https://doi.org/10.1016/j.chom.2015.03.008.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Smith TL, Litvack JR, Hwang PH, Loehrl TA, Mace JC, Fong KJ, et al. Детерминанты исходов хирургии носовых пазух: проспективное когортное исследование, проведенное в нескольких учреждениях.Otolaryngol Head Neck Surg. 2010. 142: 55–63. https://doi.org/10.1016/j.otohns.2009.10.009.
Артикул
PubMed
PubMed Central
Google Scholar
Лал Д., Кейм П., Делисл Дж., Баркер Б., Ранг М.А., Чиа Н. и др. Картирование и сравнение бактериальной микробиоты в полости носовых пазух здоровых людей, больных аллергическим ринитом и хроническим риносинуситом. Int Forum Allergy Rhinol. 2017; 7: 561–9. https://doi.org/10.1002/alr.21934.
Артикул
PubMed
Google Scholar
Luna PN, Hasegawa K, Ajami NJ, Espinola JA, Henke DM, Petrosino JF, et al. Связь между передними носовыми ходами и микробиотой носоглотки у младенцев, госпитализированных по поводу бронхиолита. Микробиом. 2018; 6: 1–14.
Артикул
Google Scholar
Чжоу Ю., Михиндукуласурия К.А., Гао Х., Ла Роса П.С., Уайли К.М., Мартин Дж.С. и др.Изучение классов бактериального сообщества в основных средах обитания человека. Genome Biol. 2014; 15: R66.
PubMed
PubMed Central
Статья
Google Scholar
Ян М., Памп С.Дж., Фукуяма Дж., Хван П.Х., Чо Ди-И, Холмс С. и др. Микроокружение носа и межвидовые взаимодействия влияют на сложность микробиоты носа и носительство S. aureus . Клеточный микроб-хозяин. 2013; 14: 631–40.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Sahin-Yilmaz A, Наклерио, РМ. Анатомия и физиология верхних дыхательных путей. Proc Am Thorac Soc. 2011; 8: 31–9. https://doi.org/10.1513/pats.201007-050RN.
Артикул
PubMed
Google Scholar
Джонс Н. Физиология и анатомия носа и придаточных пазух носа. Adv Drug Deliv Rev. 2001; 51: 5–19. https://doi.org/10.1016/S0169-409X(01)00172-7.
CAS
Статья
PubMed
Google Scholar
Геуркинк Н. Анатомия, физиология и функции носа. J Allergy Clin Immunol. 1983; 72: 123–8.
CAS
PubMed
Статья
Google Scholar
Хименес П.Н., Кох Дж., Томпсон Дж. А., Ксавье КБ, Кул Р. Х., Квакс В. Дж. Множественные сигнальные системы, регулирующие вирулентность синегнойной палочки. Am Soc Microbiol. 2012; 76: 46–65.
CAS
Google Scholar
Li Z, Наир СК. Определение кворума: как бактерии могут координировать деятельность и синхронизировать свою реакцию на внешние сигналы? Protein Sci. 2012; 21: 1403–17.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Патель Н.Н., Уоркман А.Д., Коэн Н.А. Роль вкусовых рецепторов как стражей врожденного иммунитета в верхних дыхательных путях. J Pathog. 2018; 2018: 9541987.
PubMed
PubMed Central
Статья
Google Scholar
Коэн Н. Мукоцилиарный клиренс носовых пазух при здоровье и болезнях. Ann Otol Rhinol Laryngol Suppl. 2006; 196: 20–6 www.ncbi.nlm.nih.gov/pubmed/17040014.
PubMed
Статья
PubMed Central
Google Scholar
Али М. Гистология слизистой оболочки носоглотки человека. J Anat. 1965; 99: 657–72 https://europepmc.org/backend/ptpmcrender.fcgi?accid=PMC1270703&blobtype=pdf. По состоянию на 5 ноября 2018 г.
CAS
PubMed
PubMed Central
Google Scholar
Белл GW, Джоши BB, Маклеод, Род-Айленд. Заболевание верхнечелюстной пазухи: диагностика и лечение. Бр Дент Дж. 2011; 210: 113–8. https://doi.org/10.1038/sj.bdj.2011.47.
CAS
Статья
PubMed
Google Scholar
Проктор Д.М., Релман Д.А., Секция D, Альто П. Ландшафтная экология и микробиота человеческого носа, рта и горла. Cell Hot Microbe. 2018; 21: 421–32.
Артикул
CAS
Google Scholar
Koskinen K, Reichert JL, Hoier S, Schachenreiter J, Duller S, Moissl-Eichinger C и др. Носовой микробиом отражает и потенциально формирует обонятельную функцию. Научный доклад 2018; 8: 1–11.
Артикул
CAS
Google Scholar
Шрофф К., Меслин К., Себра Дж. Комменсальные кишечные бактерии порождают самоограничивающийся гуморальный иммунный ответ слизистой оболочки, постоянно колонизируя кишечник. Заражение иммунной. 1995; 63: 3904–13.
CAS
PubMed
PubMed Central
Google Scholar
Casado B, Pannell LK, Iadarola P, Baraniuk JN. Идентификация белков слизистой оболочки носа человека с помощью протеомики. Протеомика. 2005; 5: 2949–59.
CAS
PubMed
Статья
Google Scholar
Ваннер А., Салате М., О’Риордан Т. Мукоцилиарный просвет в дыхательных путях. Am J Respir Crit Care Med. 1996; 154: 1868–902.
CAS
PubMed
Статья
Google Scholar
Schenck LP, Surette MG, Bowdish DME. Состав и иммунологическое значение микробиоты верхних дыхательных путей. FEBS Lett. 2016; 590: 3705–20.
CAS
PubMed
Статья
Google Scholar
Ooi EH, Wormald PJ, Tan LW. Врожденный иммунитет в придаточных пазухах носа: обзор носовых защитных сил хозяина. Am J Rhinol. 2008; 22: 13–9.
PubMed
Статья
Google Scholar
Дивайн Д.А., Марш П.Д., Мид Дж. Модуляция ответов хозяина оральными комменсальными бактериями. J Oral Microbiol. 2015; 7: 26941.
PubMed
Статья
CAS
Google Scholar
Иванов И., Хонда К. Кишечные комменсальные микробы как иммуномодуляторы. Клеточный микроб-хозяин. 2012; 12: 496–508.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Ганц Т. Противомикробные полипептиды в защите дыхательных путей хозяина. J Clin Invest. 2002; 109: 693–7.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Санчес Л., Кальво М., Брок Дж. Х. Биологическая роль лактоферрина. Болезнь Арка у ребенка. 1992. 67: 657–61.
CAS
Статья
Google Scholar
Klebanoff SJ. Миелопероксидаза: друг и враг.J Leukoc Biol. 2005. 77: 598–625.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Nauseef WM. Сборка НАДФН-оксидазы фагоцитов. Histochem Cell Biol. 2004. 122: 277–91.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Thomas EL, Aune TM. Лактопероксидаза, пероксид, тиоцианатная антимикробная система: корреляция окисления сульфгидрила с антимикробным действием.Заражение иммунной. 1978; 20: 456–63.
CAS
PubMed
PubMed Central
Google Scholar
Ли Р.Дж., Сюн Дж., Кофонов Дж. М., Чен Б., Лысенко А., Цзян П. и др. Полиморфизм вкусовых рецепторов T2R38 лежит в основе восприимчивости к инфекциям верхних дыхательных путей. J Clin Invest. 2012; 122: 4145–59.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Паркер Д., Принц А. Врожденный иммунитет респираторного эпителия. Am J Respir Cell Mol Biol. 2011; 45: 189–201.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Salathe М. Регуляция биения ресничек млекопитающих. Annu Rev Physiol. 2007; 69: 401–22.
CAS
PubMed
Статья
Google Scholar
Харабути Ю., Хамамото М., Ширасаки Х., Асакура К., Мацуяма Х., Катаура А.Специфический иммунный ответ аденоидов на респираторный антиген. Am J Otolaryngol. 1989; 10: 138–42.
CAS
PubMed
Статья
Google Scholar
Rynnel-Dagöö B. Иммунологическая функция аденоида. Пропорции Т- и В-клеток. Acta Otolaryngol. 1976; 82: 196–8.
PubMed
Статья
Google Scholar
Graeme-Cook F, Bhan AK, Harris NL.Иммуногистохимическая характеристика интраэпителиальных и субэпителиальных мононуклеарных клеток верхних дыхательных путей. Am J Pathol. 1993; 143: 1416–22.
CAS
PubMed
PubMed Central
Google Scholar
Brandtzaeg P. Роль J-цепи и секреторного компонента в опосредованном рецептором железом и печеночном транспорте иммуноглобуинов у человека. Scand J Immunol. 1985; 22: 111–46.
CAS
PubMed
Статья
Google Scholar
Van Kempen MJP, Rijkers GT, Van Cauwenberge PB. Иммунный ответ при аденоидах. Int Arch Allergy Immunol. 2000; 122: 8–19.
PubMed
Статья
Google Scholar
Тан X, Хори С., Осамура Р., Цуцуми Ю. Ретикулярный эпителий крипт и интраэпителиальные лимфоидные клетки в гиперпластической небной миндалине человека: иммуногистохимический анализ. Pathol Int. 1995; 45: 34–44.
CAS
PubMed
Статья
Google Scholar
des Rieux A, EGE R, Gullberg E, Préat V, Schneider Y-J, Artursson P. Транспорт наночастиц через in vitro модель эпителия, связанного с кишечным фолликулом человека. Eur J Pharm Sci. 2005. 25: 455–65.
PubMed
Статья
CAS
Google Scholar
Патель Н.Н., Кохански М.А., Майна И.В., Триантафиллоу В., Уоркман А.Д., Тонг С.К.Л. и др. Одиночные хемосенсорные клетки, продуцирующие интерлейкин-25 и врожденные лимфоидные клетки группы 2, обогащаются при хроническом риносинусите с полипами носа.Int Forum Allergy Rhinol. 2018; 8: 900–6.
Артикул
Google Scholar
Като А., Шлеймер Р.П. Помимо воспаления: эпителиальные клетки дыхательных путей находятся на стыке врожденного и адаптивного иммунитета. Curr Opin Immunol. 2007; 19: 711–20.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Ляо Б., Цао П, Цзэн М., Чжэнь З., Ван Х., Чжан И и др.Взаимодействие стромального лимфопоэтина тимуса, IL-33 и их рецепторов в эпителиальных клетках при эозинофильном хроническом риносинусите с полипами носа. Eur J Allergy Clin Immunol. 2015; 70: 1169–80.
CAS
Статья
Google Scholar
Фингер ТЕ, Бёттингер Б., Хансен А., Андерсон К.Т., Алимохаммади Х., Сильвер ВЛ. Одиночные хеморецепторные клетки в носовой полости служат часами дыхания. Proc Natl Acad Sci U S. A. 2003; 100: 8981–6.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Rivière S, Challet L, Fluegge D, Spehr M, Rodriguez I. Белки, подобные рецепторам формилового пептида, представляют собой новое семейство вомероназальных хемосенсоров. Природа. 2009; 459: 574–7.
PubMed
Статья
CAS
Google Scholar
Liberles SD, Horowitz LF, Kuang D, Contos JJ, Wilson KL, Siltberg-Liberles J, et al.Рецепторы формилового пептида являются кандидатами в хемосенсорные рецепторы вомероназального органа. Proc Natl Acad Sci U S. A. 2009; 106: 9842–7.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Алари Ю. Раздражающие свойства переносимых по воздуху материалов для верхних дыхательных путей. Arch Env Heal. 1966; 13: 433–49.
CAS
Статья
Google Scholar
Tizzano M, Gulbransen BD, Vandenbeuch A, Clapp TR, Herman JP, Sibhatu HM. Носовые хемосенсорные клетки используют сигналы горького вкуса для обнаружения раздражителей и бактериальных сигналов. Proc Natl Acad Sci U S. A. 2010; 107: 3210–5.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Джеппетти П., Матерацци С., Николетти П. Временный рецепторный потенциал ваниллоида 1: роль в воспалении и заболевании дыхательных путей. Eur J Pharmacol.2006; 533: 207–14.
CAS
PubMed
Статья
Google Scholar
Saunders CJ, Christensen M, Finger TE, Tizzano M. Холинергическая нейротрансмиссия связывает одиночные хемосенсорные клетки с воспалением носа. Proc Natl Acad Sci U S. A. 2014; 111: 6075–80.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Braham H, Cooper S, Anderson C, Tizzano M, Kingdom T, Finger T и др.Одиночные хемосенсорные клетки и передача сигналов рецептора горького вкуса в слизистой оболочке носовых пазух человека. Int Forum Allergy Rhinol. 2013; 3: 450–7.
Артикул
Google Scholar
Оскулати Ф., Кастеллуччи М., Синти С., Занканаро С. Одиночные хемосенсорные клетки и диффузная хемосенсорная система дыхательных путей. Eur J Histochem. 2007; 51 (Приложение 1): 65–72.
PubMed
Google Scholar
Чжан И, Хун М.А., Чандрашекар Дж., Мюллер К.Л., Кук Б., Ву Д. и др. Кодирование сладкого, горького и умами вкусов: разные рецепторные клетки имеют сходные сигнальные пути. Клетка. 2003; 112: 293–301.
CAS
PubMed
Статья
Google Scholar
Ивата С., Йошида Р., Ниномия Ю. Вкусовые трансдукции в клетках вкусовых рецепторов: основные вкусы и многое другое. Curr Pharm Des. 2014; 20: 2684–92.
CAS
PubMed
Статья
Google Scholar
Ли Р.Дж., Кофонов Д.М., Розен П.Л., Зиберт А.П., Чен Б., Дограмджи Л. и др. Рецепторы горького и сладкого вкуса регулируют врожденный иммунитет верхних дыхательных путей человека. J Clin Invest. 2014; 124: 1393–405.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Бейкер Э.Х., Джордж С., Джи К.М., Ходсон М., Филипс Б.Дж., Бейнс Д. и др. Гипергликемия и муковисцидоз изменяют концентрацию глюкозы в дыхательной жидкости, определяемую по конденсату из выдыхаемого воздуха.J Appl Physiol. 2007; 102: 1969–75.
CAS
PubMed
Статья
Google Scholar
Уоркман А.Д., Майна И.В., Брукс С.Г., Кохански М.А., Коварт Б.Дж., Мэнсфилд С. и др. Роль семейства 2 хинин-чувствительных вкусовых рецепторов в иммунной защите дыхательных путей и хроническом риносинусите. Фронт Иммунол. 2018; 9: 624.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Уоркман А.Д., Брукс С.Г., Кохански М.А., Бласетти М.Т., Коварт Б.Дж., Мэнсфилд С. и др. Тесты на горький и сладкий вкус отражают статус болезни при хроническом риносинусите. J Allergy Clin Immunol Pract. 2018; 6: 1078–80.
PubMed
Статья
Google Scholar
Ли Р.Дж., Харири Б.М., МакМахон Д.Б., Чен Б., Дограмджии Л., Адапа Н.Д. и др. Бактериальные D-аминокислоты подавляют врожденный иммунитет придаточных пазух носа через рецепторы сладкого вкуса в одиночных хемосенсорных клетках.Научная сигнализация. 2018; 10 (495): eaam7703.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Camarinha-Silva A, Wos-Oxley ML, Jáuregui R, Becker K, Pieper DH. Валидация T-RFLP как чувствительного и высокопроизводительного подхода для оценки паттернов бактериального разнообразия в передних отделах ноздрей человека. FEMS Microbiol Ecol. 2011; 79: 98–108.
Артикул
CAS
Google Scholar
Wos-Oxley ML, Plumeier I, Von Eiff C, Taudien S, Platzer M, Vilchez-Vargas R, et al. Попытка проникнуть в разнообразие и ассоциации внутри микробных сообществ передней части человеческого тела. ISME J. 2010; 4: 839–51. https://doi.org/10.1038/ismej.2010.15.
Артикул
PubMed
Google Scholar
Чарлсон Э.С., Чен Дж., Кастерс-Аллен Р., Биттингер К., Ли Х., Синха Р. и др. Нарушенные микробные сообщества в верхних дыхательных путях курильщиков сигарет.PLoS One. 2010; 5: 1–10.
Артикул
CAS
Google Scholar
Уилсон М. Микробные обитатели человека. Кембридж: Cambridge Univ. Нажмите; 2005. https://doi.org/10.1186/1471-2180-9-259.
Google Scholar
Camarinha-Silva A, Jáuregui R, Pieper DH, Wos-Oxley ML. Временная динамика бактериальных сообществ в передних отделах ноздрей человека. Environ Microbiol Rep.2012; 4: 126–32.
PubMed
Статья
Google Scholar
Frayman KB, Armstrong DS, Grimwood K, Ranganathan SC. Микробиота дыхательных путей при раннем муковисцидозе легких. Педиатр Пульмонол. 2017; 52: 1384–404.
PubMed
Статья
Google Scholar
Тео С.М., Мок Д., Фам К., Кусел М., Серральха М., Трой Н. и др. Микробиом дыхательных путей младенца в состоянии здоровья и болезни влияет на дальнейшее развитие астмы.Клеточный микроб-хозяин. 2015; 17: 704–15. https://doi.org/10.1016/j.chom.2015.03.008.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Бисбрук Г., Цивцивадзе Э., Сандерс ЕАМ, Монтижн Р., Винховен Р.Х., Кейсер БДЖФ и др. Ранний состав респираторной микробиоты определяет закономерности бактериальной сукцессии и здоровье органов дыхания у детей. Am J Respir Crit Care Med. 2014; 190: 1283–92.
PubMed
Статья
Google Scholar
Biesbroek G, Bosch AATM, Wang X, Keijser BJF, Veenhoven RH, Sanders EAM и др. Влияние грудного вскармливания на микробные сообщества носоглотки у младенцев. Am J Respir Crit Care Med. 2014; 190: 298–308.
PubMed
Статья
Google Scholar
Фон Линстоу М.Л., Шённинг К., Хоег А.М., Севелстед А., Виссинг Н.Х., Бисгаард Х. Колонизация дыхательных путей новорожденных связана с неприятными легочными симптомами у младенцев. Am J Respir Crit Care Med.2013; 188: 1041–2.
Артикул
Google Scholar
Мур Х., Джейкоби П., Тейлор А., Харнетт Дж., Боуман Дж. В. Райли Т. и др. Взаимодействие респираторных вирусов и патогенных бактерий в верхних дыхательных путях бессимптомных детей аборигенного и неаборигенного происхождения. Pediatr Infect Dis J. 2010; 29: 540–5.
PubMed
Статья
Google Scholar
van den Bergh MR, Biesbroek G, Rossen JWA, de Steenhuijsen Piters WAA, Bosch AATM, van Gils EJM, et al. Связи между патогенами в верхних дыхательных путях у маленьких детей: взаимодействие между вирусами и бактериями. PLoS One. 2012; 7: e47711. https://doi.org/10.1371/journal.pone.0047711.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Vissing NH, Chawes BLK, Bisgaard H. Повышенный риск пневмонии и бронхиолита после бактериальной колонизации дыхательных путей у новорожденных.Am J Respir Crit Care Med. 2013; 188: 1246–52.
PubMed
Статья
Google Scholar
Камаринья-Силва А., Хауреги Р., Чавес-Морено Д., Оксли АПА, Шаумбург Ф., Беккер К. и др. Сравнение бактериального сообщества передней части носа в двух отдельных популяциях человека с использованием секвенирования ампликона Illumina. Environ Microbiol. 2014; 16: 2939–52.
CAS
PubMed
Статья
Google Scholar
Zhou Y, Gao H, Mihindukulasuriya KA, Rosa PSL, Wylie KM, Vishnivetskaya T, et al. Биогеография экосистем здорового организма человека. Genome Biol. 2013; 14: R1. https://doi.org/10.1186/gb-2013-14-1-r1.
Артикул
PubMed
PubMed Central
Google Scholar
О Дж, Берд А.Л., Деминг С., Конлан С., Программа NCS, Kong HH и др. Биогеография и функция формы индивидуальности в метагеноме кожи человека. Природа.2014; 514: 59–64. https://doi.org/10.1038/nature13786.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Франчески С., Бонафе М., Валенсин С., Оливьери Ф., Де Лука М., Оттавиани Э. и др. Воспаление-старение: эволюционная перспектива старения иммунитета. Ann N Y Acad Sci. 2006; 908: 244–54. https://doi.org/10.1111/j.1749-6632.2000.tb06651.x.
Артикул
Google Scholar
Stämpfli MR, Anderson GP. Как сигаретный дым искажает иммунные реакции, способствуя развитию инфекций, заболеваний легких и рака. Nat Rev Immunol. 2009; 9: 377 EP.
Артикул
CAS
Google Scholar
Macgregor I. Влияние курения на экологию полости рта. Обзор литературы. Clin Prev Dent. 1989; 11: 3–7.
CAS
PubMed
Google Scholar
Yu G, Phillips S, Gail MH, Goedert JJ, Humphrys MS, Ravel J, et al.Влияние курения сигарет на микробиоту полости рта и носа. Микробиом. 2017; 5: 1–6. https://doi.org/10.1186/s40168-016-0226-6.
Артикул
Google Scholar
Мейсон Р. Биология альвеолярных клеток II типа. Респирология. 2006; 11 (Дополнение: S1): 2–5.
Google Scholar
Ратнер А.Ю., Лысенко Е.С., Пауль М.Н., Вайзер Дж. Синергетические провоспалительные реакции, вызванные полимикробной колонизацией эпителиальных поверхностей.Proc Natl Acad Sci U S. A. 2005; 102: 3429–34. https://doi.org/10.1073/pnas.0500599102.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Phipps JC, Aronoff DM, Curtis JL, Goel D, O’Brien E, Mancuso P. Воздействие сигаретного дыма ухудшает клиренс легочных бактерий и опосредованный комплементом фагоцитоз Streptococcus pneumoniae в альвеолярных макрофагах. Заражение иммунной. 2010; 78: 1214–20.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Castranova V, Huffman LJ, Judy DJ, Bylander JE, Lapp LN, Weber SL, et al. Повышение выработки оксида азота легочными клетками после воздействия кремнезема. Перспектива здоровья окружающей среды. 1998; 106 (Дополнение 5): 1165–9. https://doi.org/10.1289/ehp.98106s51165.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Чаудхури Н., Сабро И. Фундаментальные науки о врожденной иммунной системе и легких. Paediatr Respir Rev.2008; 9: 236–42. https://doi.org/10.1016/j.prrv.2008.03.002.
Артикул
PubMed
PubMed Central
Google Scholar
Bagaitkar J, Demuth DR, Daep CA, Renaud DE, Pierce DL, Scott DA. Табак активирует фимбриальные белки P. gingivalis, которые вызывают гипочувствительность TLR2. PLoS One. 2010; 5: e9323.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Garmendia J, Morey P, Bengoechea JA. Влияние воздействия сигаретного дыма на взаимодействия хозяина и бактериальных патогенов. Eur Respir J. 2012; 39: 467–77.
CAS
PubMed
Статья
Google Scholar
Goldstein-Daruech N, Cope EK, Zhao K-Q, Vukovic K, Kofonow JM, Doghramji L, et al. Табачный дым опосредует индукцию микробных биопленок придаточных пазух носа. PLoS One. 2011; 6: e15700.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Kulkarni R, Antala S, Wang A, Amaral FE, Rampersaud R, LaRussa SJ и др. Сигаретный дым увеличивает образование биопленок Staphylococcus aureus за счет окислительного стресса. Заражение иммунной. 2012; 80: 3804–11. https://doi.org/10.1128/IAI.00689-12.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Макихерн Е.К., Хванг Дж. Х., Сладевски К. М., Никатия С., Девиц С., Мэтью Д. П. и др. Анализ влияния сигаретного дыма на фенотипы вирулентности стафилококков.Заражение иммунной. 2015; 83: 2443–52.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Мутепе Н.Д., Кокеран Р., Стил Х.С., Терон А.Дж., Митчелл Т.Дж., Фельдман С. и др. Влияние конденсата сигаретного дыма на образование пневмококковой биопленки и пневмолизина. Eur Respir J. 2013; 41: 392. https://doi.org/10.1183/036.00213211.
CAS
Статья
PubMed
Google Scholar
Шен П., Уилан Ф.Дж., Шенк Л.П., МакГрат Дж.Дж.К., Вандерштокен Дж., Боудиш DME и др. Колонизация Streptococcus pneumoniae необходима для изменения носовой микробиоты у мышей, подвергшихся воздействию сигаретного дыма. Заражение иммунной. 2017; 85: 1–14.
Артикул
Google Scholar
Брук I, Гобер А.Е. Выявление потенциальных патогенов в носоглотке у здоровых детей и детей со склонностью к среднему отиту, а также их курящих и некурящих родителей. Анн Отол Ринол Ларингол.2005; 117: 727–30.
Артикул
Google Scholar
Гринберг Д., Гивон-Лави Н., Бройдес А., Бланкович И., Пелед Н., Даган Р. Вклад курения и воздействия табачного дыма на Streptococcus pneumoniae и Haemophilus influenzae носительство у детей и их матерей. Clin Infect Dis. 2006; 42: 897–903. https://doi.org/10.1086/500935.
Артикул
PubMed
Google Scholar
Sapkota AR, Berger S, Vogel TM. В бактериальном метагеноме сигарет много патогенов человека. Перспектива здоровья окружающей среды. 2009. 118: 351–6.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Брук I, Гобер А.Е. Влияние отказа от курения на микробную флору. Arch Otolaryngol Head Neck Surg. 2007. 133: 135–8. https://doi.org/10.1001/archotol.133.2.135.
Артикул
PubMed
Google Scholar
Гарсиа-Родригес Дж., Фреснадилло М. Динамика клонизации носоглотки потенциальными респираторными патогенами. J Antimicrob Chemother. 2002; 50 (Дополнение S2): 59–73.
PubMed
Статья
CAS
PubMed Central
Google Scholar
Ильес К., Поплавский Н.К., Купер РТ. Пассивное воздействие табачного дыма и бактериального менингита у детей. J Paediatr Child Health. 2001; 37: 388–91.
CAS
PubMed
Статья
Google Scholar
Моррис Б., Хеннебергер Р., Хубер Х, Мойсль-Эйхингер К. Микробная синтрофия: взаимодействие для общего блага. FEMS Microbiol Rev.2013; 37: 384-406.
CAS
PubMed
Статья
Google Scholar
Крисмер Б., Либеке М., Янек Д., Нега М., Раутенберг М., Хорниг Г. и др. Ограничение питательных веществ регулирует метаболизм Staphylococcus aureus и адаптацию ниши в носу человека. PLOS Pathog. 2014; 10: e1003862.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Феррарис Р., Яшарпур С., Ллойд К., Мирзаян Р., Даймонд Дж. Концентрации глюкозы в просвете кишечника при нормальных условиях. Am J Physiol. 1990; 259: G822–37.
CAS
PubMed
Google Scholar
Лорин М., Гаерлан П., Мандель И. Количественный состав носовых секретов у нормальных субъектов. J Lab Clin Med. 1972; 80: 275–81.
CAS
PubMed
Google Scholar
Vanthanouvong V, Roomans G. Методы определения состава носовой жидкости с помощью рентгеновского микроанализа. Microsc Res Tech. 2004; 63: 122–8.
CAS
PubMed
Статья
Google Scholar
Винкельманн Г. Микробный транспорт, опосредованный сидерофором. Biochem Soc Trans. 2002. 30: 691–6.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Ramsey MM, Freire MO, Gabrilska RA, Rumbaugh KP, Lemon KP. Staphylococcus aureus смещается в сторону комменсализма в ответ на виды Corynebacterium. Фронтальная микобиология. 2016; 7: 1–15.
Google Scholar
Штуббендик Р.М., Мэй Д.С., Шеврет М.Г., Темкин М.И., Вендт-Пиенковски Э., Кагнаццо Дж. И др. Конкуренция между носовыми бактериями предполагает роль сидерофор-опосредованных взаимодействий в формировании носовой микробиоты человека. Am Soc Microbiol.2019; 85 (10): e02406–18.
CAS
Google Scholar
Bomar L, Brugger SD, Yost BH, Davies SS, Lemon P. Corynebacterium accolens выделяет свободные от пневмококков жирные кислоты из ноздрей человека и триацилглицерины на поверхности кожи. MBio. 2016; 7: 1–13.
Артикул
CAS
Google Scholar
Wollenberg MS, Claesen J, Escapa IF, Aldridge KL, Fischbach MA, Lemon P.Копропорфирин III, продуцируемый пропионибактериями, вызывает агрегацию Staphylococcus aureus и образование биопленок. MBio. 2014; 5: 1–10.
Артикул
CAS
Google Scholar
Лимон К.П., Клепак-Церадж В., Шиффер Х.К., Броди Э.Л., Линч С.В., Колтер Р. Сравнительный анализ бактериальной микробиоты ноздри человека и ротоглотки. MBio. 2010; 1: 4–6.
Google Scholar
Франк Д. Н., Физел Л. М., Бессезен М. Т., Прайс CS, Янофф EN, Пейс Н. Р.. Микробиота носа человека и носительство Staphylococcus aureus . PLoS One. 2010; 5: e10598.
PubMed
PubMed Central
Статья
CAS
Google Scholar
von Eiff C, Becker K, Machka K, Stammer H, Peters G. Носовое носительство как источник бактериемии Staphylococcus aureus . N Engl J Med. 2001; 344: 11–6.
Артикул
Google Scholar
Wertheim HF, Vos MC, Ott A, van Belkum A, Voss A, Kluytmans JA, et al. Риск и исход нозокомиальной бактериемии Staphylococcus aureus у носителей через нос по сравнению с лицами, не являющимися носителями. Ланцет. 2004; 364: 703–5.
PubMed
Статья
Google Scholar
Консорциум HM. Структура, функции и разнообразие микробиома здорового человека. Природа. 2012; 486: 207–14. https://doi.org/10.1038/nature11234.
CAS
Статья
Google Scholar
Грайс Е.А., Конг Х.Х., Конлан С., Деминг С.Б., Дэвис Дж., Янг А.С. и др. Топографическое и временное разнообразие микробиома кожи человека. Наука. 2009; 324: 1190–2. https://doi.org/10.1126/science.1171700.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Kuehnert M, Kruszon-Moran D, Hill H, McQuillan G, McAllister S, Fosheim G, et al. Распространенность Staphylococcus aureus колонизация носа в США, 2001–2002 гг.J Infect Dis. 2006; 193: 172–9.
CAS
PubMed
Статья
Google Scholar
Gorwitz R, Kruszon-Moran D, McAllister S, MCQuillan G, McDougal L, Fosheim G, et al. Изменения в распространенности колонизации носа Staphylococcus aureus в США, 2001–2004 гг. J Infect Dis. 2008; 197: 1226–34.
PubMed
Статья
Google Scholar
Барбара Дж., Стангеллини В., Брэнди Дж., Кремон С., Ди Нардо Дж., Де Джорджио Р. и др. Взаимодействие между комменсальными бактериями и сенсомоторной функцией кишечника при здоровье и болезни. Am J Gastroenterol. 2005; 100: 2560–8.
CAS
PubMed
Статья
Google Scholar
Zipperer A, Konnerth MC, Laux C, Berscheid A, Janek D, Weidenmaier C, et al. Комменсалы человека, продуцирующие новый антибиотик, ухудшают колонизацию патогенов.Природа. 2016; 535: 511–6. https://doi.org/10.1038/nature18634.
CAS
Статья
PubMed
Google Scholar
Янек Д., Ципперер А., Кулик А., Крисмер Б., Пешель А. Высокая частота и разнообразие антимикробных действий, продуцируемых штаммами назального стафилококка против бактериальных конкурентов. PLOS Pathog. 2016; 12: e1005812.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Новик Р., Гейзингер Э. Определение кворума стафилококков. Анну Рев Жене. 2008; 42: 541–64.
CAS
PubMed
Статья
Google Scholar
Thoendel M, Horswill A. Идентификация Staphylococcus aureus остатков AgrD, необходимых для аутоиндуцирующего биосинтеза пептидов. J Biol Chem. 2009. 284: 21828–38.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Линдси Дж. А., Райли ТВ, Мил Б. Дж.. Staphylococcus aureus, но не Staphylococcus epidermidis , может получать железо из трансферрина. Микробиология. 1995; 141: 197–203.
CAS
PubMed
Статья
Google Scholar
Шаллер М., Лёвенштейн М., Борелли С., Якоб К., Фогезер М., Бургдорф В. и др. Индукция хемоаттрактивного провоспалительного цитокинового ответа после стимуляции кератиноцитов с помощью Propionibacterium acnes и копропорфирина III.Br J Dermatol. 2005. 153: 66–71.
CAS
PubMed
Статья
Google Scholar
Борелли С., Мерк К., Шаллер М., Якоб К., Фогезер М., Вайндл Г. и др. Производство порфирина in vivo P. acnes у нелеченных пациентов с акне и его регулирование лечением акне. Acta Derm Venereol. 2006; 86: 316–9.
CAS
PubMed
Статья
Google Scholar
Богерт Д., Де Гроот Р., Херманс ШИМ.Колонизация Streptococcus pneumoniae: ключ к пневмококковой инфекции. Lancet Infect Dis. 2004. 4: 144–54.
CAS
PubMed
Статья
Google Scholar
Nakatsuji T, Kao MC, Zhang L, Zouboulis CC, Gallo RL, Huang C.M. Жирные кислоты, не содержащие кожного сала, усиливают врожденную иммунную защиту себоцитов человека за счет усиления экспрессии β-дефенсина-2. J Invest Dermatol. 2010; 130: 985–94. https://doi.org/10.1038/jid.2009.384.
CAS
Статья
PubMed
Google Scholar
Ли Х, Андалиби А., Вебстер П., Мун С., Тойферт К., Кан С. и др. Антимикробная активность молекул врожденного иммунитета против Streptococcus pneumoniae, Moraxella catarrhalis и нетипируемых. BMC Infect Dis. 2004; 4: 1–12.
Артикул
Google Scholar
Манерт А., Блохс М., Паусан М.-Р., Мойсл-Эйхингер К. Археом человека: методологические ошибки и пробелы в знаниях. Emerg Top Life Sci. 2018; 2: 469–82. https://doi.org/10.1042 / ETLS20180037.
CAS
Статья
Google Scholar
Pausan MR, Csorba C, Singer G, Till H, Schoepf V, Santigli E, et al. Измерение археома: обнаружение и количественная оценка сигнатур архей в человеческом теле. bioRxiv. 2018: 334748. https://doi.org/10.1101/334748.
Sogodogo E, Fellag M, Loukil A, Nkamga V, Michel J, Dessi P, et al. Девять случаев метаногенных архей при рефрактерном синусите, возникающем клиническом заболевании.Front Public Heal. 2019; 7: 38.
Артикул
Google Scholar
Куи Л., Моррис А., Гедин Е. Человеческий микобиом в здоровье и болезнях. Genome Med. 2013; 5: 63. https://doi.org/10.1186/gm467.
Артикул
PubMed
PubMed Central
Google Scholar
Кортен И., Мика М., Кленя С., Кенингер Е., Мак И., Барбани М. Т. и др. Взаимодействие респираторных вирусов и микробиоты носа в течение первого года жизни у здоровых младенцев.мСфера. 2016; 1: e00312–6. https://doi.org/10.1128/mSphere.00312-16.
Артикул
PubMed
PubMed Central
Google Scholar
Jung WH, Croll D, Cho JH, Kim YR, Lee YW. Анализ микобиома преддверия носа у больных аллергическим ринитом. Микозы. 2015; 58: 167–72. https://doi.org/10.1111/myc.12296.
Артикул
PubMed
PubMed Central
Google Scholar
Попгеоргиев Н., Теммам С., Рауль Д., Деснуес С. Описание безмолвного вирома человека с акцентом на гигантские вирусы. Интервирология. 2013; 56: 395–412. https://doi.org/10.1159/000354561.
Артикул
PubMed
PubMed Central
Google Scholar
Van der Schans CP. Транспорт бронхиальной слизи. Respir Care. 2007; 52: 1150–6; обсуждение 1156–8. https://doi.org/10.1016/0952-8180(93)-S.
Артикул
PubMed
PubMed Central
Google Scholar
Heintz-Buschart A, Pandey U, Wicke T., Sixel-Döring F, Janzen A, Sittig-Wiegand E, et al. Микробиом носа и кишечника при болезни Паркинсона и идиопатическом расстройстве поведения во сне, связанном с быстрым движением глаз. Mov Disord. 2017; 33: 88–98.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Pail G, Huf W, Pjrek E, Winkler D, Willeit M, Praschak-Rieder N, et al. Световая терапия в лечении расстройств настроения.Нейропсихобиология. 2011; 64: 152–62. https://www.karger.com/. https://doi.org/10.1159/000328950.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Хоггард М., Бисвас К., Зоинг М., Вагнер Маккензи Б., Тейлор М.В., Дуглас Р.Г. Свидетельства дисбактериоза микробиоты при хроническом риносинусите. Int Forum Allergy Rhinol. 2017; 7: 230–9. https://doi.org/10.1002/alr.21871.
Артикул
PubMed
Google Scholar
Fokkens WJ, Lund VJ, Mullol J, Bachert C, Alobid I, Baroody F, et al. EPOS 2012: Европейский позиционный документ по риносинуситу и полипам носа 2012. Резюме для оториноларингологов. Ринол Дж. 2012; 50: 1–12. https://doi.org/10.4193/Rhino50E2.
Артикул
Google Scholar
Форман А., Джервис-Барди Дж., Вормолд П. Дж. Способствуют ли биопленки возникновению хронического риносинусита и противодействию ему? Ларингоскоп. 2011; 121: 1085–91.https://doi.org/10.1002/lary.21438.
Артикул
PubMed
Google Scholar
Шин С., Поникау Дж., Шерис Д., Конгдон Д., Фригас Е., Гомбургер Н. и др. Хронический риносинусит: усиленный иммунный ответ на повсеместно распространенные воздушно-капельные грибы. J Allergy Clin Immunol. 2004. 114: 1369–75.
CAS
PubMed
Статья
Google Scholar
Bachert C, Gevaert P, van Cauwenberge P.Энтеротоксины золотистого стафилококка: ключ к заболеванию дыхательных путей? Аллергия. 2002; 57: 480–7.
CAS
PubMed
Статья
Google Scholar
Махдавиния М., Кешаварзян А., Тобин М.К., Ландай А., Шлеймер Р.П. Комплексный обзор носового микробиома при хроническом риносинусите (ХРС). Clin Exp Allergy. 2016; 46: 21–41. https://doi.org/10.1111/cea.12666.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Коуп Е.К., Голдберг А.Н., Плетчер С.Д., Линч С.В. Композиционно и функционально различная микробиота носовых пазух у пациентов с хроническим риносинуситом имеет иммунологические и клинически разные последствия. Микробиом. 2017; 5: 53. https://doi.org/10.1186/s40168-017-0266-6.
Артикул
PubMed
PubMed Central
Google Scholar
Choi E-B, Hong S-W, Kim D-K, Jeon SG, Kim K-R, Cho S-H, et al. Уменьшение разнообразия носовой микробиоты и секретируемых ими внеклеточных пузырьков у пациентов с хроническим риносинуситом на основе метагеномного анализа.Аллергия. 2014; 69: 517–26. https://doi.org/10.1111/all.12374.
CAS
Статья
PubMed
Google Scholar
Вагнер Маккензи Б., Уэйт Д.В., Хоггард М., Дуглас Р.Г., Тейлор М.В., Бисвас К. Коллапс бактериального сообщества: метаанализ микробиоты носовых пазух при хроническом риносинусите. Environ Microbiol. 2017; 19: 381–92. https://doi.org/10.1111/1462-2920.13632.
CAS
Статья
PubMed
Google Scholar
Psaltis AJ, Wormald P-J. Терапия синоназального микробиома при СВК: критический подход. Curr Allergy Asthma Rep.2017; 17: 59. https://doi.org/10.1007/s11882-017-0726-x.
CAS
Статья
PubMed
Google Scholar
Dlugaszewska J, Leszczynska M, Lenkowski M, Tatarska A, Pastusiak T., Szyfter W. Патофизиологическая роль бактериальных биопленок при хроническом синусите. Eur Arch Otorhinolaryngol. 2016; 273: 1989–94.https://doi.org/10.1007/s00405-015-3650-5.
Артикул
PubMed
Google Scholar
Стивенсон М.Ф., Мфуна Л., Дауд С.Е., Уолкотт Р.Д., Барбо Дж., Пуассон М. и др. Молекулярная характеристика полимикробной флоры при хроническом риносинусите. J Otolaryngol Head Neck Surg. 2010; 39: 182–7 http://www.ncbi.nlm.nih.gov/pubmed/20211106. По состоянию на 16 октября 2018 г.
PubMed
Google Scholar
Рамакришнан В.Р., Хаузер Л.Дж., Физель Л.М., Ир Д., Робертсон К.Э., Франк Д.Н. Микробиота носовых пазух варьирует в зависимости от фенотипа хронического риносинусита и позволяет прогнозировать исход хирургического вмешательства. J Allergy Clin Immunol. 2015; 136: 334–42.e1. https://doi.org/10.1016/J.JACI.2015.02.008.
Артикул
PubMed
Google Scholar
Hirschberg A, Kiss M, Kadocsa E, Polyanka H, Szabo K, Razga Z, et al. Различные активации толл-подобных рецепторов и антимикробных пептидов при хроническом риносинусите с полипозом носа или без него.Eur Arch Otorhinolaryngol. 2016; 273: 1779–88. https://doi.org/10.1007/s00405-015-3816-1.
Артикул
PubMed
Google Scholar
Аврора Р., Чаттерджи Д., Хентцлеман Дж., Прасад Дж., Синдвани Р., Сэнфорд Т. Сравнение микробиомов здоровых добровольцев и пациентов с хроническим риносинуситом. JAMA Otolaryngol Neck Surg. 2013; 139: 1328. https://doi.org/10.1001/jamaoto.2013.5465.
Артикул
Google Scholar
Chalermwatanachai T, Vilchez-Vargas R, Holtappels G, Lacoere T, Jáuregui R, Kerckhof F-M и др. Хронический риносинусит с полипами носа характеризуется дисбактериозом микробиоты носа. Научный доклад 2018; 8: 7926. https://doi.org/10.1038/s41598-018-26327-2.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Брук I. Роль анаэробных бактерий при синусите. Анаэроб. 2006; 12: 5–12. https: // doi.org / 10.1016 / J.ANAEROBE.2005.08.002.
CAS
Статья
PubMed
Google Scholar
Кухар Х.Н., Таджудин Б.А., Махдавиния М., Хейлингоеттер А., Ганти А., Гаттузо П. и др. Относительное количество носовой микробиоты при хроническом риносинусите по данным структурной гистопатологии. Int Forum Allergy Rhinol. 2018. https://doi.org/10.1002/alr.22192.
Артикул
Google Scholar
Нараги М., Деруи А.Ф., Эбрахимхани М., Киани С., Дехпур А. Оксид азота: новая концепция в патогенезе хронического синусита B. Am J Otolaryngol. 2007. 28: 334–7.
CAS
PubMed
Статья
Google Scholar
Кэри Р.М., Уоркман А.Д., Хаттен К.М., Зиберт А.П., Брукс С.Г., Чен Б. и др. Вызванное денатонием уничтожение бактерий носовых пазух может играть роль в исходах хронического риносинусита. Int Forum Allergy Rhinol. 2017; 7: 699–704.
PubMed
PubMed Central
Статья
Google Scholar
Адаппа Н.Д., Трусдейл С.М., Уоркман А.Д., Дограмджи Л., Мэнсфилд С., Кеннеди Д.В. и др. Корреляция вкусового фенотипа T2R38 и образования биопленок in vitro у пациентов с неполипоидным хроническим риносинуситом. Int Forum Allergy Rhinol. 2017; 6: 783–91.
Артикул
Google Scholar
Белл Дж. С., Спенсер Дж. И., Йейтс Р. Л., Йи С. А., Джейкобс Б. М., ДеЛука Г. К..Приглашенный обзор: От носа до кишечника — роль микробиома в неврологических заболеваниях. Neuropathol Appl Neurobiol. 2018: нан 12520. https://doi.org/10.1111/nan.12520.
PubMed
Статья
Google Scholar
François A, Grebert D., Rhimi M, Mariadassou M, Naudon L, Rabot S, et al. Изменения обонятельного эпителия у беспроблемных мышей. Научный доклад 2016; 6: 24687. https://doi.org/10.1038/srep24687.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Braak H, Del Tredici K, Rüb U, Vos RAI, Jansen Steur ENH, Braak E. Стадия патологии головного мозга, связанной со спорадической болезнью Паркинсона. Neurobiol Aging. 2003. 24: 197–211. https://doi.org/10.1016/S0197-4580(02)00065-9.
Артикул
PubMed
Google Scholar
Braak H, Vos RAI, Bohl J, Del Tredici K. Иммунореактивные включения желудочного α-синуклеина в сплетениях Мейснера и Ауэрбаха в случаях, поставленных на стадию патологии головного мозга, связанной с болезнью Паркинсона.Neurosci Lett. 2006; 396: 67–72. https://doi.org/10.1016/j.neulet.2005.11.012.
CAS
Статья
PubMed
Google Scholar
Haehner A, Boesveldt S, Berendse HW, Mackay-Sim A, Fleischmann J, Silburn PA, et al. Распространенность потери обоняния при болезни Паркинсона — многоцентровое исследование. Park Relat Disord. 2009; 15: 490–4. https://doi.org/10.1016/j.parkreldis.2008.12.005.
CAS
Статья
Google Scholar
Béraud D, Maguire-Zeiss KA. Неправильно свернутый α-синуклеин и толл-подобные рецепторы: терапевтические мишени при болезни Паркинсона. Паркинсонизм, связанный с разладом. 2012; 18 (Приложение 1): 17–20. https://doi.org/10.1016/S1353-8020(11)70008-6.
Артикул
Google Scholar
Friedland RP. Механизмы молекулярной мимикрии с участием микробиоты в нейродегенерации. J. Alzheimer’s Dis. 2015; 45: 349–62.
CAS
Статья
Google Scholar
Хан Ф, Олокетуй, СФ. Перспективы нейродегенеративных заболеваний: микробиота носоглотки и кишечника. J Appl Microbiol. 2016; 122: 306–20.
PubMed
Статья
Google Scholar
Mulak A, Bonaz B. Ось микробиоты мозга и кишечника при болезни Паркинсона. Мир Дж. Гастроэнтерол. 2015; 21: 10609–20. https://doi.org/10.3748/wjg.v21.i37.10609.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Pereira PAB, Aho VTE, Paulin L, Pekkonen E, Auvinen P, Scheperjans F. Микробиота полости рта и носа при болезни Паркинсона. Park Relat Disord. 2017; 38: 61–7. https://doi.org/10.1016/j.parkreldis.2017.02.026.
Артикул
Google Scholar
Хоукс Ч., Дель Тредичи К., Браак Х. Болезнь Паркинсона: гипотеза двойного удара. Neuropathol Appl Neurobiol. 2007. 33: 599–614.
CAS
PubMed
Статья
Google Scholar
Boutin S, Graeber SY, Weitnauer M, Panitz J, Stahl M, Clausznitzer D, et al. Сравнение микробиомов из разных ниш верхних и нижних дыхательных путей у детей и подростков с муковисцидозом. PLoS One. 2015; 10: 1–19. https://doi.org/10.1371/journal.pone.0116029.
CAS
Статья
Google Scholar
Prevaes SMPJ, De Steenhuijsen Piters WAA, De Winter-De Groot KM, Janssens HM, Tramper-Stranders GA, Chu MLJN, et al.Соответствие микробиоты верхних и нижних дыхательных путей у младенцев с муковисцидозом. Eur Respir J. 2017; 49. https://doi.org/10.1183/13993003.02235-2016.
PubMed
Статья
Google Scholar
Бойл М. Муковисцидоз у взрослых. J Am Med Assoc. 2007; 298: 1787–93.
CAS
Статья
Google Scholar
Фодор А.А., Клем Э.Р., Гилпин Д.Ф., Эльборн Дж.С., Бушер Р.С., Танни М.М. и др.Микробиота дыхательных путей при муковисцидозе взрослых является стабильной с течением времени и по типу инфекции, а также очень устойчива к лечению антибиотиками при обострениях. PLoS One. 2012; 7: e45001.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Parkins MD, Floto RA. Возникающие бактериальные патогены и изменение представлений о бактериальном патогенезе при муковисцидозе. J Cyst Fibros. 2015; 14: 293–304. https://doi.org/10.1016/j.jcf.2015.03.012.
CAS
Статья
PubMed
Google Scholar
Трейси М., Коген Дж., Хоффман Л. Детский микробиом и легкие. Curr Opin Pediatr. 2015; 27: 348–55. https://doi.org/10.1097/MOP.0000000000000212.
Артикул
PubMed
PubMed Central
Google Scholar
Whiteson KL, Bailey B, Bergkessel M, Conrad D, Delhaes L, Felts B, et al.Верхние дыхательные пути как микробный источник легочных инфекций при муковисцидозе. Параллели из островной биогеографии. Am J Respir Crit Care Med. 2014; 189: 1309–15. https://doi.org/10.1164/rccm.201312-2129PP.
Артикул
PubMed
PubMed Central
Google Scholar
Бернс Дж. Л., Гибсон Р. Л., Макнамара С., Йим Д., Эмерсон Дж., Розенфельд М. и др. Продольная оценка Pseudomonas aeruginosa у детей раннего возраста с муковисцидозом.J Infect Dis. 2001; 183: 444–52.
CAS
PubMed
Статья
Google Scholar
Jelsbak L, Johansen HK, Frost A-L, Thøgersen R, Thomsen LE, Ciofu O, et al. Молекулярная эпидемиология и динамика популяций синегнойной палочки в легких больных муковисцидозом. Заражение иммунной. 2007; 75: 2214–24. https://doi.org/10.1128/IAI.01282-06.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Goss CH, Muhlebach MS. Обзор: золотистый стафилококк, и MRSA при муковисцидозе. J Cyst Fibros. 2011; 10: 298–306. https://doi.org/10.1016/j.jcf.2011.06.002.
CAS
Статья
PubMed
Google Scholar
Тидденс HAWM, Стик С.М., Дэвис С. Мультимодальный мониторинг муковисцидоза легких: роль компьютерной томографии грудной клетки. Педиатр Респир Ред. 2014; 15: 92–7. https://doi.org/10.1016/j.prrv.2013.05.003.
Артикул
PubMed
Google Scholar
Mellert TK, Getchell ML, Sparks L, Getchell TV. Характеристика иммунного барьера обонятельной слизистой оболочки человека. Otolaryngol Head Neck Surg. 1992; 106: 181–8.
CAS
PubMed
Статья
Google Scholar
Kimmelman CP. Клинический обзор обоняния. Am J Otolaryngol. 1993; 14: 227–39.https://doi.org/10.1016/0196-0709(93)-F.
CAS
Статья
PubMed
Google Scholar
Гренхэм С., Кларк Дж., Крайан Дж. Ф., Динан Т. Г.. Связь между мозгом, кишечником и микробами в условиях здоровья и болезней. Front Physiol. 2011; 2: 94. https://doi.org/10.3389/fphys.2011.00094.
Артикул
PubMed
PubMed Central
Google Scholar
Hughes DT, Sperandio V.Передача сигналов между царствами: общение между бактериями и их хозяевами. Nat Rev Microbiol. 2008; 6: 111–20. https://doi.org/10.1038/nrmicro1836.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Wilson MT, Hamilos DL. Микробиом носа и пазух в состоянии здоровья и болезни. Curr Allergy Asthma Rep.2014; 14: 485.
PubMed
Статья
CAS
Google Scholar
Wegener B-A, Croy I, Hähner A, Hummel T. Обонятельные тренировки с пожилыми людьми. Int J Geriatr Psychiatry. 2018; 33: 212–20. https://doi.org/10.1002/gps.4725.
Артикул
Google Scholar
Пекала К., Чандра Р.К., Тернер Дж. Х. Эффективность обонятельной тренировки у пациентов с потерей обоняния: систематический обзор и метаанализ. Int Forum Allergy Rhinol. 2016; 6: 299–307. https://doi.org/10.1002/alr.21669.
Артикул
PubMed
Google Scholar
Лю С.М., Прайс Л.Б., Хангейт Б.А., Абрахам А.Г., Ларсен Л.А., Кристенсен К. и др. Staphylococcus aureus и экология носового микробиома. Sci Adv. 2015; 1. https://doi.org/10.1126/sciadv.1400216.
PubMed
PubMed Central
Статья
Google Scholar
Рамакришнан В.Р., Хаузер Л.Дж., Франк Д.Н. Бактериальный микробиом придаточных пазух носа в условиях здоровья и болезней. Curr Opin Otolaryngol Head Neck Surg. 2016; 24: 20–5.https://doi.org/10.1097/MOO.0000000000000221.
Артикул
PubMed
PubMed Central
Google Scholar
Bosch AATM, Levin E, van Houten MA, Hasrat R, Kalkman G, Biesbroek G, et al. На развитие микробиоты верхних дыхательных путей в младенчестве влияет способ родоразрешения. EBioMedicine. 2016; 9: 336–45. https://doi.org/10.1016/j.ebiom.2016.05.031 M4 — Citavi.
Артикул
PubMed
PubMed Central
Google Scholar
Lécuyer H, Audibert J, Bobigny A, Eckert C, Jannière-Nartey C., Buu-Hoï A, et al. Dolosigranulum pigrum вызывает внутрибольничную пневмонию и сепсис. J Clin Microbiol. 2007; 45: 3474–5. https://doi.org/10.1128/JCM.01373-07.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Boesveldt S, Postma EM, Boak D, Welge-Luessen A, Schöpf V, Mainland JD, et al. Аносмия — клинический обзор. Chem Senses. 2017; 42: 513–23.
PubMed
PubMed Central
Статья
Google Scholar
Хаммель Т., Секингер Б., Вольф С.Р., Паули Э, Кобаль Г. Палочки «Sniffin»: обонятельные характеристики оцениваются путем комбинированного тестирования на определение запаха, различение запаха и обонятельный порог. 1997. https://academic.oup.com/chemse/article-abstract/22/1/39/383479. По состоянию на 11 января 2019 г.
Google Scholar
Джайн Р., Хоггард М., Бисвас К., Зоинг М., Цзян И., Дуглас Р. Изменения в бактериальном микробиоме пациентов с хроническим риносинуситом после эндоскопической хирургии носовых пазух. Int Forum Allergy Rhinol. 2017; 7: 7–15. https://doi.org/10.1002/alr.21849.
Артикул
PubMed
Google Scholar
Kern RC. Кандидатская диссертация: Хронический синусит и аносмия: патологические изменения обонятельной слизистой оболочки. Ларингоскоп. 2009; 110: 1071–7.
Артикул
Google Scholar
Hornung DE. Анатомия носа и обоняние. Adv Оториноларингол. 2006; 63: 1–22.
PubMed
PubMed Central
Google Scholar
Wiley. Руководство Берджи по систематике архей и бактерий. 2015.
Google Scholar
Mygind N, Nielsen LP, Hoffmann H-J, Shukla A, Blumberga G, Dahl R, et al.Механизм действия интраназальных кортикостероидов. J Allergy Clin Immunol. 2001; 108: S16–25. https://doi.org/10.1067/MAI.2001.115561.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Роджерс Г.Б., Шоу Д., Марш Р.Л., Кэрролл депутат, Серисье Д.Д., Брюс К.Д. Респираторная микробиота: решение клинических вопросов, информирование клинической практики. Грудная клетка. 2015; 70: 74–81. https://doi.org/10.1136/thoraxjnl-2014-205826.
Артикул
PubMed
Google Scholar
Ван Л-М, Цяо Х-Л, Ай Л, Чжай Дж-Дж, Ван Х-Х. Выделение устойчивых к противомикробным препаратам бактерий при инфекциях верхних дыхательных путей у пациентов. 3. Биотехнологии. 2016; 6: 166. https://doi.org/10.1007/s13205-016-0473-z.
Артикул
Google Scholar
Perl TM, Cullen JJ, Wenzel RP, Zimmerman MB, Pfaller MA, Sheppard D, et al. Мупироцин интраназально для профилактики послеоперационных инфекций Staphylococcus aureus . N Engl J Med.2002; 346: 1871–7. https://doi.org/10.1056/NEJMoa003069.
CAS
Статья
PubMed
Google Scholar
Bode LGM, Kluytmans JAJW, Wertheim HFL, Bogaers D, Vandenbroucke-Grauls CMJE, Roosendaal R, et al. Профилактика инфекций в области хирургического вмешательства у носителей инфекции Staphylococcus aureus . N Engl J Med. 2010; 362: 9–17. https://doi.org/10.1056/NEJMoa0808939.
CAS
Статья
PubMed
Google Scholar
Чой KJ, Jang DW, Эллисон MD, Франк-Ито DO. Характеристика профиля воздушного потока в послеоперационной верхнечелюстной пазухе с использованием компьютерного гидродинамического моделирования: пилотное исследование. Am J Rhinol Allergy. 2016; 30: 29–36. https://doi.org/10.2500/ajra.2016.30.4266.
Артикул
PubMed
PubMed Central
Google Scholar
Kennedy DW. Факторы прогноза, исходы и стадия хирургии решетчатой пазухи. Ларингоскоп. 1992; 102 (12 Pt 2 Suppl 57): 1–18 http: // www.ncbi.nlm.nih.gov/pubmed/1453856. По состоянию на 9 октября 2018 г.
CAS
PubMed
PubMed Central
Google Scholar
Hauser LJ, Ir D, Kingdom TT, Robertson CE, Frank DN, Ramakrishnan VR. Исследование репопуляции бактерий после хирургии носовых пазух и периоперационных антибиотиков. Int Forum Allergy Rhinol. 2016; 6: 34–40. https://doi.org/10.1002/alr.21630.
Артикул
PubMed
PubMed Central
Google Scholar
Джервис-Барди Дж., Форман А., Филд Дж., Вормальд П. Дж. Нарушение заживления слизистой оболочки и инфекция, связанная с Staphylococcus aureus , после эндоскопической хирургии носовых пазух. Am J Rhinol Allergy. 2009; 23: 549–52. https://doi.org/10.2500/ajra.2009.23.3366.
Артикул
PubMed
Google Scholar
Тан NC-W, Форман А., Ярделеза К., Дуглас Р., Тран Х., Вормальд П.Дж. Множественность Staphylococcus aureus при хроническом риносинусите: взаимосвязь между поверхностной биопленкой и внутриклеточным местом жительства.Ларингоскоп. 2012; 122: 1655–60. https://doi.org/10.1002/lary.23317.
Артикул
PubMed
Google Scholar
Plouin-Gaudon I, Clement S, Huggler E, Chaponnier C, François P, Lew D, et al. Внутриклеточная резидентность часто связана с рецидивирующим риносинуситом Staphylococcus aureus . Ринология. 2006; 44: 249–54 http://www.ncbi.nlm.nih.gov/pubmed/17216740. По состоянию на 9 октября 2018 г.
CAS
PubMed
Google Scholar
Джервис-Барди Дж., Форман А., Боас С., Валентин Р., Вормальд П. Дж. Каково происхождение золотистого стафилококка в ранней послеоперационной полости носовых пазух? Int Forum Allergy Rhinol. 2011; 1: 308–12. https://doi.org/10.1002/alr.20050.
Артикул
PubMed
Google Scholar
Bhattacharyya N, Gopal HV, Lee KH. Бактериальная инфекция после эндоскопической хирургии носовых пазух: контролируемое проспективное исследование. Ларингоскоп.2004. 114: 765–7. https://doi.org/10.1097/00005537-200404000-00032.
Артикул
PubMed
Google Scholar
Рама С., Баллентин Р., Хаймс А. Наука дыхания: практическое руководство. Honesdale: издательство Гималайского института; 1998.
Google Scholar
Bastier P-L, Lechot A, Bordenave L, Durand M, de Gabory L. Орошение носа: от эмпиризма к доказательной медицине.Обзор. Eur Ann Otorhinolaryngol Head Neck Dis. 2015; 132: 281–5. https://doi.org/10.1016/J.ANORL.2015.08.001.
Артикул
PubMed
Google Scholar
Georgitis JW. Гипертермия носа и простое орошение при хроническом рините: изменения медиаторов воспаления. Chest J. 1994; 106: 1487–92. https://doi.org/10.1378/CHEST.106.5.1487.
CAS
Статья
Google Scholar
Hauser LJ, Ir D, Kingdom TT, Robertson CE, Frank DN, Ramakrishnan VR. Оценка передачи бактерий в придаточные пазухи носа через орошение носовых пазух. Int Forum Allergy Rhinol. 2016; 6: 800–6. https://doi.org/10.1002/alr.21755.
Артикул
PubMed
Google Scholar
Сингхал Д., Форман А., Барди Дж. Дж., Вормальд П. Дж. Биопленки золотистого стафилококка. Ларингоскоп. 2011; 121: 1578–83. https://doi.org/10.1002/lary.21805.
Статья
PubMed
Google Scholar
Псалтис А.Дж., Форман А., Вормальд П.-Дж., Шлоссер Р.Дж. Загрязнение устройств для промывания носовых пазух: обзор доказательств и клиническая значимость. Am J Rhinol Allergy. 2012; 26: 201–3. https://doi.org/10.2500/ajra.2012.26.3747.
Артикул
PubMed
Google Scholar
Тиченор В.С., Терлоу Дж., МакНалти С., Браун-Эллиотт Б.А., Уоллес Р.Дж., Фолкинхэм Дж.Нетуберкулезные микобактерии в бытовой сантехнике как возможная причина хронического риносинусита. Emerg Infect Dis. 2012; 18: 1612–7. https://doi.org/10.3201/eid1810.120164.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Йодер Дж.С., Стрейф-Буржуа С., Рой С.Л., Мур Т.А., Висвесвара Г.С., Ратард Р.К. и др. Смертность от первичного амебного менингоэнцефалита, связанного с промыванием носовых пазух загрязненной водопроводной водой.Clin Infect Dis. 2012; 55: e79–85. https://doi.org/10.1093/cid/cis626.
Артикул
PubMed
PubMed Central
Google Scholar
Georas SN, Rezaee F. Функция эпителиального барьера: на переднем крае иммунологии астмы и аллергического воспаления дыхательных путей. J Allergy Clin Immunol. 2014; 134: 509–20.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Soyka MB, Wawrzyniak P, Eiwegger T., Holzmann D, Treis A, Wanke K, et al. Дефектный эпителиальный барьер при хроническом риносинусите: регуляция плотных контактов IFN-g и IL-4. Am Acad Allergy Asthma Immunol. 2012; 130: 1087–96.
CAS
Google Scholar
Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B и др. Консенсусное заявление Международной научной ассоциации пробиотиков и пребиотиков относительно области применения и надлежащего использования термина пробиотик.Нат Рев Гастроэнтерол Гепатол. 2014; 11: 506–14.
PubMed
Статья
Google Scholar
Мартенс К., Пугин Б., Де Бок И., Спакова И., Стилант Б., Сейс С.Ф. и др. Пробиотики для дыхательных путей: потенциал для улучшения эпителиального и иммунного гомеостаза. Аллергия. 2018. https://doi.org/10.1111/all.13495.
CAS
PubMed
Статья
Google Scholar
Cope EK, Lynch SV. Новые лекарственные средства на основе микробиома для лечения хронического риносинусита. Curr Allergy Asthma Rep.2015; 15: 504.
CAS
PubMed
Статья
Google Scholar
Мак Д., Арне С., Хайд Л., Вей С., Холлингсворт М. Внеклеточная секреция муцина MUC3 следует за прикреплением штаммов Lactobacillus к эпителиальным клеткам кишечника in vitro. Кишечник. 2003. 52: 827–33.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Рао Р., Самак Г. Защита и восстановление кишечного барьера пробиотиками: пищевые и клинические последствия. Curr Nutr Food Sci. 2013; 9: 99–107.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Сагар С., Вос А.П., Морган М.Э., Гарссен Дж., Георгиу Н.А., Бун Л. и др. Комбинация Bifidobacterium breve с неперевариваемыми олигосахаридами подавляет воспаление дыхательных путей на мышиной модели хронической астмы.Biochim Biophys Acta Mol Basis Dis. 1842; 2014: 573–83. https://doi.org/10.1016/j.bbadis.2014.01.005.
CAS
Статья
Google Scholar
Blaser M, Bork P, Fraser C, Knight R, Wang J. Исследованный микробиом: недавние открытия и будущие задачи. Nat Rev Microbiol. 2013; 11: 213–7.
CAS
PubMed
Статья
Google Scholar
Чжэн Дж., Гензле М.Г., Линь XB, Руан Л., Сунь М.Разнообразие и динамика бактериоцинов микробиома человека. Environ Microbiol. 2015; 17: 2133–43.
CAS
PubMed
Статья
Google Scholar
Lebeer S, Vanderleyden J, De Keersmaecker S. Взаимодействие с хозяином пробиотических бактериальных поверхностных молекул: сравнение с комменсалами и патогенами. Nat Rev Microbiol. 2010. 8: 171–84.
CAS
PubMed
Статья
Google Scholar
Shandilya UK, Jadhav S, Panwar V, Kansal V. Пробиотики: мощное иммуномодулирующее средство против аллергии. Пробиотики Antimicro Prot. 2011; 3: 151–8.
Артикул
Google Scholar
von der Weid T, Bulliard C, Schiffrin EJ. Индукция молочнокислой бактерией популяции CD4 ϩ Т-клеток с низкой пролиферативной способностью, которые продуцируют трансформирующий фактор роста бета и интерлейкин-10. Clin Diagn Lab Immunol. 2001; 8: 695–701.
PubMed
PubMed Central
Google Scholar
Pochard P, Gosset P, Grangette C, Andre C, Tonnel A, Pestel J, et al. Базовая и клиническая иммунология. Молочнокислые бактерии подавляют продукцию цитокинов Т H 2 мононуклеарными клетками пациентов с аллергией. J Allergy Clin Immunol. 2002; 110: 617–23.
CAS
PubMed
Статья
Google Scholar
Christensen HR, Frokiaer H, Pestka JJ.Лактобациллы по-разному модулируют экспрессию цитокинов и поверхностных маркеров созревания в дендритных клетках мышей. J Immunol. 2002; 168: 171–8.
CAS
PubMed
Статья
Google Scholar
Toh ZQ, Anzela A, Tang MLK, Licciardi PV. Пробиотическая терапия как новый подход к лечению аллергических заболеваний. Front Pharmacol. 2012; 3: 1–14.
Артикул
CAS
Google Scholar
Fujimura KE, Demoor T, Rauch M, Faruqi AA, Jang S, Johnson CC и др. Воздействие домашней пыли способствует обогащению кишечного микробиома Lactobacillus и иммунной защите дыхательных путей от аллергенов и вирусной инфекции. Proc Natl Acad Sci U S. A. 2014; 111: 805–10.
CAS
PubMed
Статья
Google Scholar
Квон Х., Ли С., Со Дж., Чае С., Хван Дж., Саху А. и др. Генерация регуляторных дендритных клеток и CD4 + Foxp3 + Т-клеток при введении пробиотиков подавляет иммунные нарушения.Proc Natl Acad Sci U S. A. 2010; 107: 159–64.
Артикул
Google Scholar
Jang S, Kim H, Kim Y, Kang M, Kwon J, Seo J, et al. Профилактика астмы с помощью Lactobacillus rhamnosus на мышиной модели. Allergy Asthma Immunol Res. 2012; 4: 150–6.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Маркетти Дж., Тинкати К., Сильвестри Дж.Микробная транслокация в патогенезе ВИЧ-инфекции и СПИДа. Clin Microbiol Rev.2013; 26: 2–18.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Cope EK, Lynch SV. Новые лекарственные средства на основе микробиома для лечения хронического риносинусита. Curr Allergy Asthma Rep.2015; 15: 9. https://doi.org/10.1007/s11882-014-0504-y.
CAS
Статья
Google Scholar
Спакова И., Петрова М.И., Фремау А., Полларис Л., Ванойрбек Дж., Сейс С. и др. Интраназальное введение пробиотика Lactobacillus rhamnosus GG предотвращает аллергическую астму, вызванную пыльцой березы, на мышиной модели. Аллергия. 2019; 74: 100–10.
CAS
PubMed
Статья
Google Scholar
Wu C, Chen P, Lee Y, Ko J, Lue K. Влияние иммуномодулирующих добавок с Lactobacillus rhamnosus на воспаление дыхательных путей на модели астмы у мышей.J Microbiol Immunol Infect. 2016; 49: 625–35. https://doi.org/10.1016/j.jmii.2014.08.001.
Артикул
PubMed
Google Scholar
Китц Р., Мартенс Ю., Цизенис Е., Энк П., Роуз М.А. Пробиотик E. faecalis — адъювантная терапия у детей с рецидивирующим риносинуситом. Cent Eur J Med. 2012; 7: 7–10.
Google Scholar
Пеллатон С., Наттен С., Тьерри А., Будуски С., Барбье Н., Бланшар С. и др.Внутрижелудочное и интраназальное введение Lactobacillus paracasei NCC2461 модулирует аллергические дыхательные пути. Int J Inflam. 2012; 2012: 686739.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Мартенсон А., Аболхалай М., Линдстедт М., Мартенсон А., Олофссон Т.С., Васкес А.В. и др. Клиническая эффективность местного микробиома молочнокислых бактерий при хроническом риносинусите: рандомизированное контролируемое исследование.Ларингоскоп Исследование Отоларингол. 2017; 2: 410–6.
PubMed
PubMed Central
Статья
Google Scholar
Vasquez A, Forsgren E, Fries I, Paxton RJ, Flaberg E, Szekely L, et al. Симбионты как основные модуляторы здоровья насекомых: молочнокислые бактерии и медоносные пчелы. PLoS One. 2012; 7: e33188.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Батлер Э, Ойен Р.Ф., Линдхольм К., Олфонссон Т.С., Нильсон Б., Васкес А. Пилотное исследование по изучению симбионтов молочнокислых бактерий медоносной пчелы в подавлении патогенов хронических ран у человека. Int World J. 2014; 13: 729–38.
Google Scholar
Olofsson TC, Vasquez A. Обнаружение и идентификация новой молочнокислой бактериальной флоры в медовом желудке медоносной пчелы Apis mellifera . Curr Microbiol.2008; 57: 356–63.
CAS
PubMed
Статья
Google Scholar
Олофссон Т.К., Батлер È, Маркович П., Линдхольм К., Ларссон Л., Васкес А. Симбионты молочнокислых бактерий у медоносных пчел — неизвестный ключ к противомикробной и терапевтической деятельности меда. Int World J. 2016; 13: 668–79.
Google Scholar
Кларк Дж, Ву Х, Джаясингхе Л., Патель А., Рид С., Бейли Х.Непрерывная идентификация оснований для секвенирования одномолекулярных нанопор ДНК. Nat Nanotechnol. 2009; 4: 265–70.
CAS
PubMed
Статья
Google Scholar
Ид Дж., Фер А., Грей Дж., Луонг К., Лайл Дж., Отто Дж. И др. Секвенирование ДНК в реальном времени по отдельным молекулам полимеразы. Наука. 2009. 323: 133–8.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Эрл Дж., Адаппа Н., Крол Дж., Бхат А., Балашов С., Эрлих Р. и др. Профилирование бактериального сообщества на уровне видов здорового микробиома придаточных пазух носа с использованием секвенирования полноразмерных генов 16S рРНК Pacific Biosciences. Микробиом. 2018; 6: 190.
PubMed
PubMed Central
Статья
Google Scholar
Дыхательная система | Свинья
Дыхательная система свиньи начинается от ноздрей, ведущих в два носовых прохода.Они содержат кости спинной и брюшной носовых раковин. (Рис.1-8). Брюшные носовые раковины состоят из четырех тонких основных костей, по две с каждой стороны, разделенных хрящевой перегородкой. Вы можете представить это как четыре бигуди, помещенные в нос. Дыхательные пути выстланы гладкой мембраной, называемой слизистой оболочкой, потому что она покрыта липкой слизью. Он также покрыт мелкими волосками, которые волнообразно движутся по поверхности слизистой. Они перемещают слизь из носа, бронхов и трахеи в горло, где она проглатывается.Воздух, вдыхаемый через нос, нагревается носовыми раковинами, которые из-за своей спиралевидной формы вызывают турбулентность. Это выбрасывает более крупные из мелких частиц, так что они прилипают к слизи и попадают в горло. Множество ветвей бронхов, уменьшаясь в диаметре, оказывают аналогичное влияние на более мелкие частицы. Затем слизистый подъемник переносит их в горло. Только самые мелкие частицы достигают альвеол, где альвеолярные макрофаги поглощают их и удаляют их.Изнутри носовые ходы открываются в глотку (глотку), которая является обычным проходом для пищи и воздуха. Пища проглатывается по пищеводу, а воздух всасывается в гортань в задней части глотки. Гортань (голосовой ящик) контролирует вдох и выдох. Он открывается в трахею, которая переходит в грудную клетку, где разделяется на два бронха. Бронхи разветвляются на более мелкие бронхи и продолжают разветвляться, постепенно уменьшаясь в размерах, становясь бронхиолами, которые заканчиваются очень маленькими воздушными мешочками, называемыми альвеолами.Кислород проходит из альвеол в кровоток, а углекислый газ выходит. Легкие разделены на семь долей, как показано на рис. 1-8.
Терминология
Абсцесс — Область пневмонии, содержащая гной, где инфекция изолирована от остальной легочной ткани фиброзной капсулой.
Actinobacillus pleuropneumoniae — Первоначально назывался haemophilus. Бактерия, вызывающая тяжелую геморрагическую и некротизирующую пневмонию с плевритом.
Альвеолярные макрофаги — Эти клетки, расположенные в альвеолах, поглощают бактерии и вирусы. Они уничтожаются некоторыми вирусами, например. вирус респираторно-репродуктивного синдрома свиней (PRRS).
Атрофический ринит — Ринит, вызванный токсигенными (производящими токсины) штаммами Pasteurella multocida , при котором носовые раковины безвозвратно теряют свои ткани (атрофируются). Теперь это называется прогрессирующим атрофическим ринитом, чтобы отличить его от непрогрессирующего атрофического ринита, вызванного Bordetella bronchiseptica (с добавлением других организмов) и / или загрязнителями окружающей среды, который менее серьезен и заживает, когда инфекция останавливается иммунной системой. отклик.
Бронхит — Воспаление бронхов или бронхиол в легких.
Консолидирующая пневмония — Легочная ткань разрушилась и стала твердой. Типичным примером является инфекция Mycoplasma hyopneumoniae (энзоотическая пневмония), которая вызывает воспаление передних долей легких.
Энзоотическая пневмония — Также называется микоплазменной пневмонией. Вызывается Mycoplasma hyopneumoniae, , которая вызывает консолидирующую пневмонию нижних отделов передних долей легких.
Болезнь Глессера — Вызывается Haemophilus parasuis . Это может вызвать тяжелую пневмонию и уплотнение с фибринозным плевритом.
Легочные черви — Маленькие нитевидные черви, вызывающие паразитарную пневмонию.
Некротическая пневмония — Некроз означает гибель тканей живого животного. Некротическая пневмония возникает, когда организм или его токсины убивают легочную ткань. Может возникнуть абсцесс. Типичный пример — пневмония, вызываемая Actinobacillus pleuropneumoniae .
Pasteurella — Бактерии, обитающие в верхних дыхательных путях. Они часто вызывают вторичные инфекции, например, после инфицирования Mycoplasma hyopneumoniae . Существует два общих вида: P. haemolytica и P. multocidia , последний из которых является обычным для свиней.
Плеврит — Также называется плевритом. Блестящие оболочки, покрывающие поверхность легких и внутреннюю часть грудной стенки, называются плеврой.Инфекция или воспаление этих поверхностей называется плевритом. Это вместе с перикардитом очень часто встречается у свиней и приводит к значительным потерям из-за осуждения на убое. Вирусы, такие как грипп, PRRS, чума свиней и бактерии Actinobacillus pleuropneumoniae , Haemophilus parasuis и Pasteurella multocidia , могут вызывать плеврит.
Пневмония — Воспаление любой части легочной ткани. Есть разные виды пневмонии.
Пиемическая пневмония — Множественные небольшие абсцессы, разбросанные по легким и перенесенные туда через кровоток. Типичный пример — пиемия от укуса хвоста. Тушу убивают на убой.
Частота дыхания — Она варьируется от 20-40 вдохов в минуту у поросят и растущих свиней до 15-20 вдохов в минуту у свиноматок.
Ринит — Описывает любую форму воспаления нежной слизистой оболочки носа. Некоторые агенты, такие как пыль и газы, могут вызывать это, но это не приводит к долгосрочному повреждению структуры носа.Чихание всегда возникает при рините.
Salmonella choleraesuis — бактерия, специфичная для свиней, вызывающая генерализованный сальмонеллез и пневмонию.
Свиной грипп (SI) — вирусная инфекция, которая вызывает четко обозначенные темно-пурпурно-красные поражения в легких.
Трахеит — Воспаление трахеи (дыхательного горла). Грипп может вызвать очень сильный «лающий» кашель.
Турбинные кости — Дорсальная и вентральная. Свитки кости внутри носовых ходов.Они нагревают и фильтруют воздух, проходящий через нос.
Дыхательный аппарат
Глава 4 Биопленки в здоровье и медицине
Раздел 8 Флора основных систем тела
Страница 5 Дыхательный аппарат
© Альфред Б. Каннингем, Джон Э. Леннокс и Рокфорд Дж. Росс, ред. 2001-2010
Дыхательный аппарат
Легочный аппарат человека, состоящий из носоглотки, трахеи, бронхиол и легких, является еще одной из тех систем, в которых проксимальные органы, легкие при нормальных условиях стерильны, а в дистальных частях — нос и рот. наиболее сильно колонизированные области тела.
Защитные механизмы дыхательных путей
Механизмы, которые позволяют организму совершить этот выдающийся подвиг, — это мукоциллярный эсклатор, фагоцитарные клетки (нейтрофилы и макрофаги) и антитела, продукты приобретенной иммунной системы. Отказ любого из этих защитных механизмов приводит к тяжелому, обычно летальному заболеванию. Важность этих механизмов у млекопитающих подтверждается способностью легких переносить и очищать до 1 x 10 5 аспирированных клеток в течение 20 минут (Morc et al.1009) — (у Вильсона).
Большинство вдыхаемых частиц отфильтровывается в носовых раковинах и носовых раковинах, которые образуют большую поверхность, покрытую слизью. До 70-80% частиц, попадающих в дыхательные пути, дальше не уходят. Однако более мелкие частицы, менее 1 мкм в диаметре, не удаляются в носу, вместо этого они удаляются с помощью механизма, называемого мукоциллярным эскалатором.
Мукоциллярный эскалатор — это замечательный механизм захвата и удаления частиц, который простирается от задней части носовой полости через трахею и носоглотку и воздухопроводящие бронхиолы к конечным бронхиолам.Механизм состоит из мерцательных эпителиальных клеток, выстилающих дыхательные пути, и множества секреторных клеток, которые производят водянистую перициллярную жидкость (серозные клетки), которая находится близко к эпителию, и более вязкую слизь (бокаловидные клетки), которая покрывает более жидкий слой. Между этими двумя слоями находится тонкий слой сурфактанта, который сам является секреторным продуктом других эпителиальных клеток (клеток Клары). Этот сложный слой устроен таким образом, что вязкая слизь может плавать и перемещаться по поверхности нижнего слоя перициллярной жидкости.Движение создается огромным количеством ресничек, связанных с мерцательными эпителиальными клетками, которые, когда они бьются, перемещают слой слизи вверх, от самых глубоких частей легких и к задней части сквозного отверстия, где слизь либо проглатывается, либо отхаркивается. http://www.colorado.edu/Outreach/BSI/k12activities/interactive/actidhpamucociler.html.
На практике, когда частицы, включая споры и бактерии, попадают в дыхательные пути во время ингаляции, они сталкиваются со слоем слизи, покрывающим респираторный эпителий.Реснички, биение которых происходит со скоростью несколько сотен движений в минуту, перемещают слой слизи со скоростью 5-20 мм в минуту (Wilson).
Учитывая эффективность этого механизма, кажется удивительным, что любые организмы могут прочно закрепиться. Ряд видов, населяющих дыхательные пути человека, включая важные условно-патогенные микроорганизмы, такие как Haemophilusinfluenzae, Strep.pneumoniae, Staph. aureus и Strep pyogenes продуцируют адгезины.Эти адгезины позволяют бактериям связываться со слоем слизи, покрывающей дыхательные пути, но почему они не выводятся быстро? Возможно, эти организмы способны изменять мукоциллярный эскалатор таким образом, чтобы препятствовать его нормальному функционированию (Уилсон).
Флора носоглотки, трахеи и бронхов
В нормальной резидентной флоре носоглотки преобладают грамположительные организмы, такие как α-гемолитические стрептококки (группа viridans, а иногда и S.pneumoniae ), коагулазо-положительные и отрицательные стафилококки ( S. aureus и S. eidermidis ), многие из которых являются условно-патогенными микроорганизмами у больных людей-хозяев. В дополнение к ним существует множество грамотрицательных организмов, населяющих носоглотку, в том числе виды Haemophilus, Neisseria и Moraxella, многие из которых также являются потенциальными патогенами. Другая группа организмов, растущих на поверхности слизистой оболочки дыхательных путей, — это молликуты, бактерии, лишенные клеточных стенок и предъявляющие очень высокие требования к питанию в окружающей среде.К ним относятся роды Ueraplasma и Mycoplasma, которые представляют собой очень маленькие организмы (0,2 мкм) и обладают очень маленькими молекулами ДНК (<600 кг оснований). Некоторые из этих необычных организмов (например, Mycoplasmafermentans ) известны как условно-патогенные микроорганизмы.
Средний отит и проблема некультивируемых образцов
Средний отит и средний отит с выпотом являются наиболее распространенными заболеваниями, при которых родители обращаются за медицинской помощью для своих детей.Это также наиболее распространенное состояние, при котором детям требуются антибиотики и хирургическое вмешательство, как правило, установка тимпаностомической трубки для отвода выпота из среднего уха. Любопытно, что хотя эти приступы боли в среднем ухе обычно проходят, по крайней мере временно, с помощью антибиотиков, предполагаемый организм, ответственный за инфекцию, часто невозможно культивировать из выпота, выделенного из уха во время операции. Почти 75% случаев ОМ не подлежат культивированию, то есть основные организмы, связанные с этим заболеванием Haemophilusinfluenzae, Moraxellacatarrhalis и Streptococcus pneumoniae , обычно не восстанавливаются, когда образцы помещают на питательную среду, предназначенную для выращивания этих организмов.Означает ли это, что многие случаи OM и OME вызваны какой-либо другой причиной?
В недавнем исследовании (Hall-Stoodley et al. 2006) небольшие образцы слизистой оболочки среднего уха были иссечены во время введения тимпаностомических трубок, также были получены контрольные образцы от субъектов с отрицательной реакцией на ОМ, перенесших операцию на кохлеарной имплантации. Эти образцы были окрашены флуоресцентными красителями и иммунофлуоресцентными красителями для FISH (флуоресцентная гипридизация in vitro) для исследования под конфокальной сканирующей лазерной микроскопией (CSLM).
Только 5 из 27 (19%) образцов выпота из исследуемой популяции можно было культивировать на патоген, но 46 из 50 образцов OM (92%), наблюдаемых с помощью CSLM с флуоресцентными красителями или с помощью методов FISH, специфичных для патогенов, были положительными на наличие биопленки. .
Это исследование раскрывает один из очень важных атрибутов биопленок, часто микроорганизмы, связанные с биопленками, не могут расти на средах, предназначенных для культивирования организмов, предположительно ответственных за инфекцию.Несмотря на то, что они не могут расти на среде, эти организмы обычно присутствуют и способны расти и вызывать патологию in situ .
Эти бактерии адаптировались к жизни в вашем носу — и это может быть хорошей новостью | Наука
Новый специфический для носа штамм полезных бактерий Lactobacillus использует волосовидные волокна, называемые фимбриями (стрелки), чтобы цепляться за поверхность носа.
Де Бок и др. ., Cell Reports
Аманда Хайдт
Подобно разрастающемуся городскому городу, определенные районы человеческого тела поддерживают различные сообщества микробов. И многие из них хорошие парни; Например, микробы в кишечнике помогают нам переваривать пищу, тогда как микробы на языке и коже могут защищать от вторжения патогенов.Теперь исследователи обнаружили полезные бактерии и в нашем носу. Этот «носовой микробиом» может защитить от хронического воспаления носовых пазух или даже аллергии.
Исследование является «важным шагом» к распознаванию защитных свойств бактерий в новой части тела, говорит Мария Марко, микробиолог из Калифорнийского университета в Дэвисе, которая не принимала участия в работе. «В прошлом была проделана некоторая работа, но это первое глубокое исследование».
Для проведения исследования исследователи во главе с Сарой Лебир, микробиологом из Университета Антверпена, исследовали бактерии в носу 100 здоровых людей.Затем ученые сравнили обнаруженные ими микробы с микробами сотен пациентов с хроническим воспалением носа и носовых пазух.
Из 30 наиболее распространенных типов микробов, обнаруженных командой, выделялась одна группа: противомикробные и противовоспалительные бактерии под названием Lactobacillus . Их было в 10 раз больше в носу здоровых людей, сегодня исследователи публикуют в Cell Reports .
Лактобациллы обычно процветают в бедных кислородом районах, поэтому Лебир был удивлен, увидев их в органе, продуваемом свежим воздухом.Но при более внимательном рассмотрении выяснилось, что особый штамм, обнаруженный ее командой в человеческих носах, имеет особые гены, называемые каталазами, которые безопасно нейтрализуют кислород, что является редкостью среди других лактобацилл. «Кажется, они адаптировались к этой среде», — говорит Лебир.
Под микроскопом исследователи также смогли увидеть крошечные волосовидные отростки, называемые фимбриями, которые прикрепляют бактерии к внутренней поверхности носа. Лебер считает, что микробы также могут использовать волосы для связывания с рецепторами на клетках кожи внутри носа, заставляя клетки закрываться, как люк.Чем меньше открытых клеток, тем сложнее проникнуть в них аллергенам и вредным бактериям.
Но одного наличия Lactobacillus у здоровых людей недостаточно, чтобы сказать, что он защищает от болезней, признает Лебер. Являются ли микробы защитными, также трудно проверить на животных моделях, таких как мыши, у которых очень разные носы.
И некоторые эксперты не уверены, что лактобациллы, обнаруженные командой, уникально адаптированы к человеческому носу.Во рту также обитают миллионы лактобацилл, отмечает Йенс Уолтер, микробиолог из Университетского колледжа Корка, и они могут попасть в нос при чихании. По словам Уолтера, результаты исследования — это «правильные первые шаги», но он хотел бы видеть больше исследований, чтобы подтвердить их новизну и потенциальные преимущества.
В конечном итоге Лебир надеется разработать терапевтические препараты с использованием назальных пробиотиков. Заболевания носовых пазух имеют немного методов лечения, а хронические состояния, которые необходимо постоянно лечить, повышают риск того, что бактерии станут устойчивыми к антибиотикам.По ее словам, внедрение полезных штаммов бактерий, лишенных генов устойчивости к антибиотикам, было бы решением с меньшим риском.
В качестве первого шага Лебир разработала назальный спрей, содержащий Lactobacillus микробов, выделенных ее командой. Лактобациллы благополучно колонизировали пациентов без каких-либо побочных эффектов.
Дыхание и сон — все начинается с языка !: Sopris Smiles: Общая семейная стоматология
Миофункциональная терапия
Отношения между мышцами лица, рта и горла должны работать в гармонии.Когда эти мышцы выполняют свою работу, они позволяют вам дышать, глотать, жевать, говорить и двигаться легко и безболезненно. Иногда для людей эти мышцы не всегда так легко работают вместе, миофункциональная терапия направлена на исправление любых мышечных расстройств на лице, шее, голове и рту с помощью повторяющейся терапии, основанной на физических упражнениях.
Для чего используется миофункциональная терапия?
Люди, страдающие орофациальными миофункциональными расстройствами (OMD), обычно имеют ослабленные или недоразвитые мышцы лица, рта и горла.Миофункциональная терапия направлена на укрепление и переобучение ротоглотки с помощью простых повторяющихся упражнений. Ротоглотка соединяет рот и горло, это в основном «трубка», выстланная мышечными тканями, которая помогает нам есть, говорить и дышать. Ротоглотка помогает держать дыхательные пути открытыми во время сна, если они слабые, это может нарушить поток воздуха, вызывая храп или апноэ во сне.
Язык играет БОЛЬШУЮ роль
Многие люди не осознают, что язык играет в нашем организме большую роль, чем мы думаем.Когда язык не функционирует должным образом, это может нарушить работу дыхательных путей. У человека могут быть две проблемы — это уздечка языка и / или укол языка. Уздечка языка — это физическая проблема, когда уздечка языка слишком тугая, слишком короткая и слишком ограниченная. Он изменяет диапазон движений, которые может выполнять язык. Для исправления уздечки языка обычно требуется операция, которая называется френэктомией. Выталкивание языка — это привычка, которую кто-то развивает, которая может начаться как нарушение дыхания через рот. Когда ваш язык находится у дна вашего рта, каждый раз, когда вы глотаете, он толкается вперед к вашим зубам.По сути, это плохая координация мышц, и это привычка, которую можно исправить. Эти две проблемы иногда идут рука об руку: если у вас уздечка языка, у вас также может развиться толкание языка. К счастью, с помощью миофункциональной терапии эти две проблемы можно решить и улучшить!
Вот некоторые признаки и привычки, которые могут быть у людей, у которых есть OMD:
- Шлифовка зубьев
- Дыхание через рот
- Сосание большого пальца
- Прикус гвоздя
- Укороченная верхняя губа
- Аномалии развития
- Слюни
- Нарушения сна
- Расстройство речи
- Проблемы с жеванием
- Проблемы с глотанием
- Боль в челюсти
Стоматологические проблемы с дыханием через рот
Если вы дышите через рот, бактерии отличаются от бактерий, если вы дышите через нос.У нас есть микробиом, флора бактерий, которая живет во рту. Существует баланс хороших и плохих бактерий, если мы дышим через рот, этот баланс нарушается. Тогда у нас больше шансов получить кариес, кариес или даже заболевание десен. Дыхание ртом сушит ваш рот, например, если вы спите, и ваш рот открыт и становится сухим, слюна не может выполнять свою функцию по очистке внутренней части вашего рта, когда он закрыт, и появляются кариес или проблемы с деснами.
Детский В.С. Взрослые
Орофациальные миофункциональные расстройства встречаются не только у взрослых, на самом деле многие из этих привычек начинаются в младенчестве и постепенно начинают влиять на вас по мере вашего роста. Когда мы видим ребенка с такими вредными привычками, мы хотим научить его иметь здоровые привычки, чтобы он мог правильно расти и развиваться. Их челюсть должна расширяться вперед, а лицо должно расширяться, они должны развить красивую широкую палитру с пространством для языка и для того, чтобы их зубы входили прямо. Дети, у которых эти привычки не закреплены, обычно вырастают во взрослых с более длинными узкими лицами, меньшим ртом, узкими дыхательными путями, у них с большей вероятностью разовьется боль в челюсти, лицевая боль, боль в шее, головные боли и даже апноэ во сне.Когда эти проблемы обнаруживаются в более молодом возрасте, мы можем обучить их выработке правильных привычек по мере их взросления.
Кто такой орофациальный миофункциональный терапевт?
Орофациальные миофункциональные терапевты обучены обучать своих пациентов самосознанию и обучать методам коррекции привычек для устранения оральных привычек и оптимизации оральных функций у детей и взрослых. Представьте физиотерапевта, но для вашего лица и рта наш терапевт обучает упражнениям, которые в основном вращаются вокруг языка и губ.Пациенты узнают новые связи между своим мозгом и языком, а также мышцами лица и рта. Миотерапевтам сначала необходимо определить, какая основная проблема с языком может быть уздкой языка или уколом языка. Эти упражнения действительно уникальны, и их даже весело выполнять! Наши планы лечения индивидуализированы с учетом конкретных потребностей каждого пациента.
5 ЦЕЛЕЙ миофункционального терапевта
- В состоянии покоя «манжетное уплотнение»
- Хотите, чтобы ваш язык касался неба
- Правильное жевание и правильное глотание
Это всего лишь краткое введение в основные концепции миофункциональной терапии, мы надеемся, что оно вызвало у вас интерес и пролило некоторый свет на эту тему.Если у вас есть вопросы или вы хотите получить консультацию, звоните в наш офис! Мы с нетерпением ждем возможности поговорить с вами!
.

 группа и тифо-паратифозная группа)
группа и тифо-паратифозная группа)