Микробиологическое исследование мокроты — Клиники Беларуси
Микробиологическое исследование мокроты
Мокрота — это секрет дыхательных путей (легких, бронхов, трахеи и гортани), который образуется при их повреждении различными микроорганизмами- возбудителями заболеваний, или под воздействием химических или физических факторов и выделяется при кашле. Мокрота образуется только при заболевании. У здоровых людей мокроты, как правило, нет.
Зачем исследовать мокроту? Какова цель микробиологического исследования мокроты?
Микробиологическое исследование мокроты проводится, чтобы выявить возбудителя заболевания и определить его чувствительность к антибактериальным лекарственным средствам. Другими словами, это нужно для выбора адекватной схемы лечения.
В каких случаях нужно провести микробиологическое исследование мокроты?
Такое исследование мокроты необходимо во всех случаях воспалительных заболеваний органов дыхания (пневмонии, бронхиты, трахеиты, легочные абсцессы и другие), которые сопровождаются отделением мокроты.
А также оно очень важно для пациентов с хроническими заболеваниями: муковисцидозом и хронической обструктивной болезнью легких (ХОБЛ). Ведь именно у таких людей бактериальный инфекционный процесс хронический, они длительно получают лечение по этому поводу, и крайне важно «попасть» с антибиотиком.
Все мы знаем, что плохого и хорошего антибиотика не бывает. Бывает те, которые действуют на конкретного возбудителя, и те, которые на него не действуют.
Надо ли как-то готовиться к микробиологическому исследованию мокроты? Как сдавать мокроту на бакпосев?
Микробиологическое исследование мокроты обязательно проводится до начала антибактериальной терапии.
Важно, чтобы ожидаемый результат не был «смазан» каким-либо лечением. Нам нужно выделить «наивного» ненапуганого возбудителя. И точно понять, как помочь человеку, какое лечение подобрать.
В случае неэффективности антибиотикотерапии, при затяжном течении воспалительного заболевания (например, пневмонии), при подозрении на суперинфекцию (повторное инфицирование пациента тем же или другим возбудителем заболевания), а также для контроля эффективности антибиотикотерапии могут проводиться повторные исследования.
Обычно проводят исследование утренней порции мокроты, скопившейся в течение ночи, поскольку эта порция наиболее богата микрофлорой.
Мокроту нужно собирать до завтрака. Обязательно нужно почистить зубы и тщательно прополоскать рот кипяченой водой.
Мокрота собирается в специальный стерильный контейнер с крышкой. И этот полученный образец нужно доставить в лабораторию немедленно,в крайнем случае, их можно хранить в холодильнике, но не дольше, чем 2 часа.
Как проводится микробиологическое исследование мокроты?
В лаборатории вначале проводят окраску полученного образца специальными красителями (окраска по Граму).
А затем уже проводится сама микроскопия.
Все исследование занимает около 1 часа.
Результат- это получение предваительного заключения о возбудителе, который содержится в мокроте.
Его узнают по «портрету». Но внешне некоторые микроорганизмы похожи, поэтому такой метод определения возбудителя и дает только лишь предварительное заключение.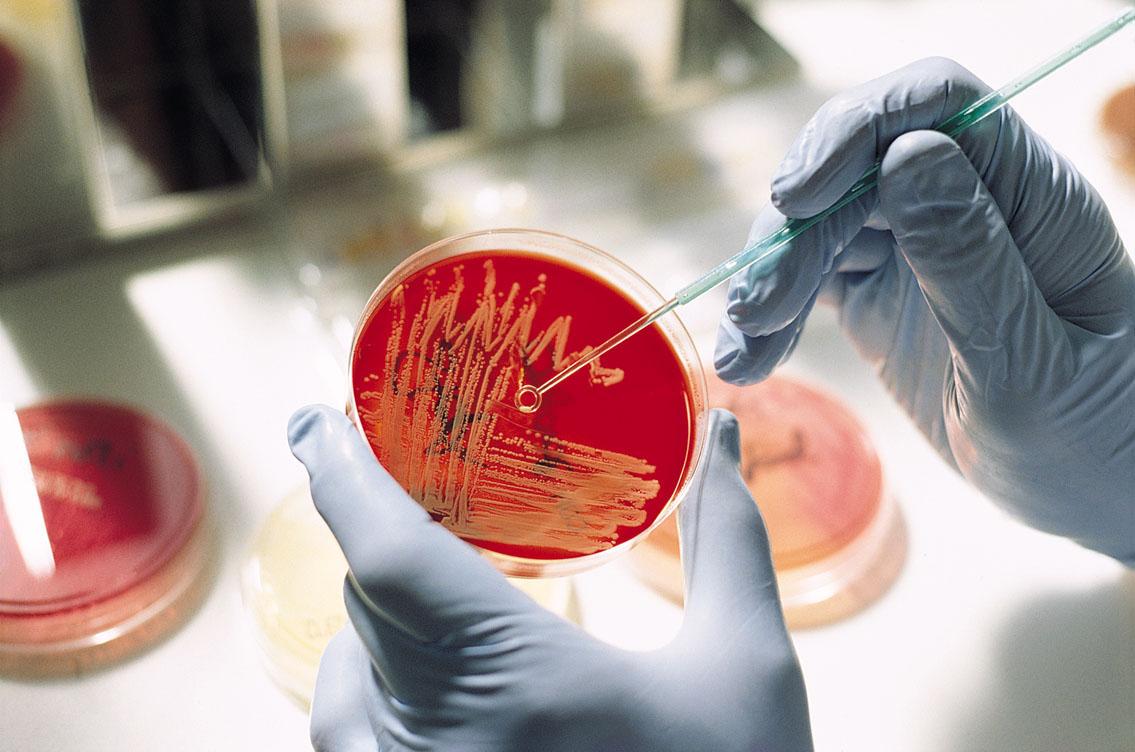
А для лечения этого недостаточно. Нужно точно знать, с каким микробом мы имеем дело.
Для этого и выполняется следующий этап — посев мокроты на специальные чашки Петри с определенными питательными средами. Засеянные чашки Петри помещают в термостат (прибор, в котором поддерживается оптимальная для роста бактерий температура).
Ежедневно контролируют наличие роста на этих питательных средах и его характер.
Оценивают количество выросших колоний.
Это очень важно, так как диагностически значимым является присутствие не менее 1 млн. бактерий в 1 мл мокроты.
Из выросших колоний выделяют чистые культуры бактерий, устанавливают вид бактерий с использованием классических лабораторных методов или автоматизированных систем.
И только после этого можно получить информацию о чувствительности выделенного микроба к антибактериальным лекарственным средствам.
На выполнение всех этапов исследования уходит порядка 3-7 дней.
Принцип здесь прост: чем больше бактерий было в доставленном образце, тем быстрее мы получим их рост, а, значит, и ответ.
Посев на флору и чувствительность к антибиотикам (с микроскопией нативного препарата)
Исследуемый материал
Мокрота, промывные воды бронхов или трахеи
Анализ мокроты на чувствительность к антибиотикам – это исследование, которое позволяет выявить патогенные микроорганизмы, вызывающие инфекционные заболевания бронхолегочной системы.
Для исследования необходим бак посев мокроты на микрофлору. Мокрота (патологический секрет) выделяется из трахей и бронхов во время кашля. Ее появление свидетельствует о заболеваниях дыхательных путей.
По своему составу мокрота неоднородна. В ней может содержаться слизь, серозная жидкость, гной, фибрин, кровь.
При помощи посева мокроты определяется возбудитель соответствующего заболевания и его чувствительность к антибиотикам. Это дает возможность назначить правильное лечение, предотвратив переход болезни в хроническую форму.
Когда назначают исследование
В обязательном порядке врач назначает анализ мокроты
- на туберкулез
- на бк
- при бронхите
- при пневмонии
- при бронхиальной астме
- при новообразованиях органов дыхания
- глистной, грибковой инвазии легких.
Также бактериологический анализ мокроты проводят при неясных процессах в грудной клетке по результатам рентгенологического обследования или аускультации.
В норме бак анализ мокроты может показывать наличие представителей нормальной микрофлоры. Однако, обнаружение лишь нормальной микрофлоры еще не означает отсутствие инфицирования.
Расшифровка и интерпретация результатов исследования проводится только лечащим врачом. Как правило, в мокроте присутствует микрофлора ротоглотки, поэтому результат посева интерпретируется с учетом общего стояния пациента и клинической картины.
Сбор мокроты
Чтобы результаты были более точными, нужно правильно собрать мокроту для анализа. Мокрота накапливается ночью, поэтому ее сбор проводиться утром до еды после полоскания рта кипяченой водой.
Мокрота накапливается ночью, поэтому ее сбор проводиться утром до еды после полоскания рта кипяченой водой.
Следует учесть, что мокроты образуется больше, и она лучше отходит, если перед исследованием употребить больше жидкости. Чтобы сдача мокроты на анализ прошла более эффективно, пациент должен сделать три глубоких вдоха и энергично откашляться.
Материал собирается в разовый стерильный ударостойкий контейнер с плотно закрывающейся крышкой.
Общий анализ мокроты дает макроскопическую оценку секрета (консистенция, цвет, наличие, характер примесей), а также его микроскопию. Микроскопия мокроты оценивает клеточный состав, наличие кристаллов, волокон, микрофлоры. Этот анализ не диагностирует специфические заболевания, например, туберкулез.
Для чего необходимо исследование
Исследование мокроты используется:
- при диагностике патологических процессов в дыхательных путях и легких;
- для оценки характера патологий;
- для наблюдения в динамике за состоянием пациента с хроническими заболеваниями;
- для оценки эффективности проводимого лечения.

Лаборатория ИНВИТРА проведет необходимые исследования, включая анализ мокроты на микрофлору в короткие сроки на современном оборудовании, позволяющем делать самые точные выводы.
Литература
- Беркоу Р. (Ред.). Руководство по медицине, т. I М. «Мир», 1997. 1045 с.
- Приказ МЗ СССР от 22 апреля 1985 г. № 535 Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений.
- Энциклопедия клинических лабораторных тестов под ред. Н.У. Тица. Издательство «Лабинформ» — М. — 1997 — 942 с.
- Nightingale C. et al./ Antimicrobial Pharmacodynamics in Theory And Clinical Practice/2006/ M.Dekker inc./ 550 ps.
Вопрос-ответ: лабораторная диагностика туберкулеза
Вопрос-ответ: лабораторная диагностика туберкулеза
В Чувашской Республике проходит акция «Белая ромашка», посвященная Всемирному дню борьбы с туберкулезом, которая продлится до 20 апреля. О существовании этого недуга люди знали с древнейших времен. И в настоящее время туберкулез продолжает оставаться ведущей инфекционной болезнью, уносящей жизни людей во всем мире. Для
О существовании этого недуга люди знали с древнейших времен. И в настоящее время туберкулез продолжает оставаться ведущей инфекционной болезнью, уносящей жизни людей во всем мире. Для
В распознавании и дифференциальной диагностике туберкулеза, а также в эффективности проводимого лечения очень важную роль играют лабораторные методы исследования. На наиболее распространенные вопросы о лабораторной диагностике туберкулеза отвечает заведующий бактериологической лабораторией Ольга Стебловская.
— Ольга Евгеньевна, расскажите, что такое МБТ?
Это туберкулёзные палочки — Микобактерии туберкулеза (МБТ).
— Где же находят эти туберкулёзные палочки?
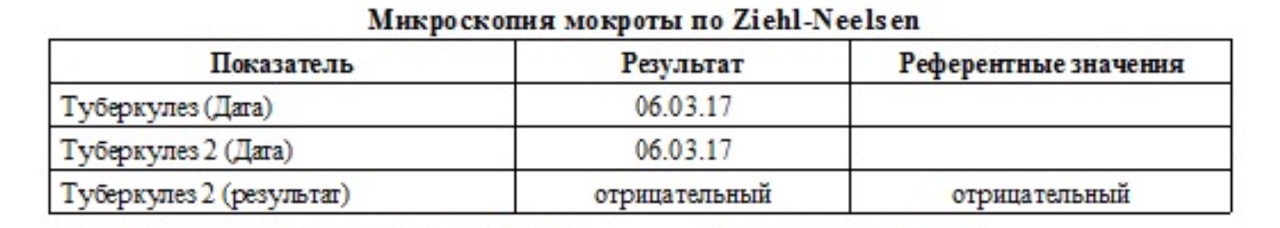
При туберкулезе легких Микобактерии туберкулеза (МБТ) чаще всего находят в мокроте. Как много туберкулезных палочек выделяет больной и как долго зависит от формы туберкулезного процесса. Часто и много выделяют МБТ больные инфильтративным и фиброзно-кавернозным туберкулезом, особенно, если есть полости распада. Реже и гораздо меньше выделяют МБТ больные очаговым и диссеминированным туберкулезом легких. Если мокроты у больного много, МБТ находят в большем количестве, а в скудной мокроте МБТ встречается реже и в виде единичных экземпляров.
Реже и гораздо меньше выделяют МБТ больные очаговым и диссеминированным туберкулезом легких. Если мокроты у больного много, МБТ находят в большем количестве, а в скудной мокроте МБТ встречается реже и в виде единичных экземпляров.
Второе место по эффективности выделения МБТ у больных, не выделяющих мокроту, занимают исследования промывных вод бронхов.
Также можно искать МБТ в плевральной жидкости при плеврите, в моче — при туберкулезе мочеполовых органов, и в других выделениях организма больного.
— Как обнаруживают туберкулёзные палочки в лаборатории?
Частота обнаружения МБТ зависит от способа исследования биоматериала:
1. Бактериоскопический метод — поиск МБТ на стекле под микроскопом. Среди бактериоскопических методов больше всего МБТ обнаруживает люминесцентная микроскопия, когда мазок окрашивают светящимися красителями и изучают в люминесцентном микроскопе. Бактериоскопическим методом МБТ обнаруживается чаще при обильном бактериовыделении- 100 000 МБТ в 1 мл материала.
2. Бактериологический способ — посев выделений больного на искусственные питательные среды и получение культуры МБТ с последующим изучением ее свойств. По частоте обнаружения МБТ посев материала на плотные или жидкие питательные среды занимает первое место. Для получения культуры МБТ достаточно всего 20-100 микробов в материале от больного.
При бактериологическом способе исследования удается не только выявить туберкулезные палочки, но и подсчитать их количество, а также изучить лекарственную чувствительность к противотуберкулезным препаратам и составить схему лечения больного.
Бактериологический метод (посев материала на специальные среды) обнаружения МБТ очень высокоточный, но имеет существенный недостаток: для получения культуры требуется 4-12 недель.
Применение жидких питательных сред и специального оборудования (бактериологических анализаторов) позволяет определить рост МБТ уже через 5дней.
3. Молекулярно-генетические методы (ПЦР) — поиск в биоматериале генетических маркеров МБТ. Метод ПЦР очень точен, позволяет проводить исследование небольшого количества материала и обнаружить 5-20 клеток МБТ. По оценкам специалистов метод ПЦР превосходит бактериоскопический и бактериологический методы, особенно при диагностике внелегочных форм туберкулеза.
Молекулярно-генетические методы (ПЦР) — поиск в биоматериале генетических маркеров МБТ. Метод ПЦР очень точен, позволяет проводить исследование небольшого количества материала и обнаружить 5-20 клеток МБТ. По оценкам специалистов метод ПЦР превосходит бактериоскопический и бактериологический методы, особенно при диагностике внелегочных форм туберкулеза.
В бактериологической лаборатории Республиканского противотуберкулезного диспансера представлен полный спектр методов для диагностики туберкулеза:
— бактериоскопические методы; классический посев и определение лекарственной чувствительности МБТ на плотных средах;
— ускоренная методика на жидких средах с применением бактериологического анализатора BACTEC MGIT 960;
— молекулярно-генетические методики: ПЦР В РЕАЛЬНОМ ВРЕМЕНИ и методика HAIN TEST.
Медицинский центр — Асклепий
Общий анализ мокроты
Исследуемый материал: мокрота
Сроки исполнения: 2 р. д.
д.
Подготовка к исследованию:
Мокроту собирают в стерильные широкогорлые пластиковые контейнеры вместимостью не менее 70 мл с завинчивающейся крышкой. Лучше всего собирать мокроту утром до приёма пищи. Перед тем, как выделить мокроту, пациент должен тщательно прополоскать рот и носоглотку кипячёной водой. Полоскание ротовой полости перед сбором мокроты уменьшает риск загрязнения пробы слюной. Чистить зубы перед выделением мокроты не рекомендуется. При чистке зубов могут быть микротравмы дёсен и в мокроту может попасть кровь из ротовой полости. Следует собирать только мокроту, отделяющуюся при кашле, а не при отхаркивании. Емкость с мокротой, как можно скорее доставляется в лабораторию.
Об исследовании:
Мокрота– выделяемый при кашле патологически изменённый трахеобронхиальный секрет с примесью слюны и секрета слизистой оболочки околоносовых пазух. Общеклиническое исследование мокроты включает описание её характера, общих свойств и микроскопическое исследование. ОБЩИЕ СВОЙСТВА: Количество мокроты обычно колеблется от 10 до 100 мл в сутки. Мало мокроты отделяется при острых бронхитах, пневмониях, застойных явлениях в лёгких, в начале приступа бронхиальной астмы. В конце приступа бронхиальной астмы количество выделяемой мокроты увеличивается. Большое количество мокроты (иногда до 0,5 л) может выделяться при отёке лёгких, а также при нагноительных процессах в лёгких при условии сообщения полости с бронхом (при абсцессе, бронхоэктатической болезни, гангрене лёгкого, при туберкулёзном процессе в лёгком, сопровождающемся распадом ткани). Цвет мокроты. Чаще мокрота бесцветная, присоединение гнойного компонента придаёт ей зеленоватый оттенок, что наблюдают при абсцессе лёгкого, гангрене лёгкого, бронхоэктатической болезни, актиномикозе лёгкого. При появлении в мокроте примеси свежей крови мокрота окрашивается в различные оттенки красного цвета (мокрота при кровохаркании у больных туберкулёзом, актиномикозом, раком лёгкого, абсцессом лёгкого, при инфаркте лёгкого, сердечной астме и отёке лёгких).
ОБЩИЕ СВОЙСТВА: Количество мокроты обычно колеблется от 10 до 100 мл в сутки. Мало мокроты отделяется при острых бронхитах, пневмониях, застойных явлениях в лёгких, в начале приступа бронхиальной астмы. В конце приступа бронхиальной астмы количество выделяемой мокроты увеличивается. Большое количество мокроты (иногда до 0,5 л) может выделяться при отёке лёгких, а также при нагноительных процессах в лёгких при условии сообщения полости с бронхом (при абсцессе, бронхоэктатической болезни, гангрене лёгкого, при туберкулёзном процессе в лёгком, сопровождающемся распадом ткани). Цвет мокроты. Чаще мокрота бесцветная, присоединение гнойного компонента придаёт ей зеленоватый оттенок, что наблюдают при абсцессе лёгкого, гангрене лёгкого, бронхоэктатической болезни, актиномикозе лёгкого. При появлении в мокроте примеси свежей крови мокрота окрашивается в различные оттенки красного цвета (мокрота при кровохаркании у больных туберкулёзом, актиномикозом, раком лёгкого, абсцессом лёгкого, при инфаркте лёгкого, сердечной астме и отёке лёгких). Мокрота ржавого цвета (при крупозной, очаговой и гриппозной пневмонии, при туберкулёзе лёгких с творожистым распадом, застое в лёгких, отёке лёгких, при лёгочной форме сибирской язвы) или мокрота коричневого цвета (при инфаркте лёгкого) указывает на содержание в ней не свежей крови, а продуктов её распада (гематин). Грязно-зелёный или жёлто-зелёный цвет может иметь мокрота, отделяющаяся при различных патологических процессах в лёгких, сочетающихся с наличием у больных желтухи. Жёлто-канареечный цвет мокроты иногда наблюдают при эозинофильных пневмониях. Отхождение мокроты цвета охры возможно при сидерозе лёгкого. Черноватая или сероватая мокрота бывает при примеси угольной пыли и у курильщиков. Мокроту могут окрашивать некоторые лекарственные препараты, например, рифампицин окрашивает отделяемое в красный цвет. Запах. Мокрота обычно не имеет запаха. Появлению запаха способствует нарушение оттока мокроты. Гнилостный запах она приобретает при абсцессе, гангрене лёгкого, при гнилостном бронхите в результате присоединения гнилостной инфекции, бронхоэктатической болезни, раке лёгкого, осложнившемся некрозом.
Мокрота ржавого цвета (при крупозной, очаговой и гриппозной пневмонии, при туберкулёзе лёгких с творожистым распадом, застое в лёгких, отёке лёгких, при лёгочной форме сибирской язвы) или мокрота коричневого цвета (при инфаркте лёгкого) указывает на содержание в ней не свежей крови, а продуктов её распада (гематин). Грязно-зелёный или жёлто-зелёный цвет может иметь мокрота, отделяющаяся при различных патологических процессах в лёгких, сочетающихся с наличием у больных желтухи. Жёлто-канареечный цвет мокроты иногда наблюдают при эозинофильных пневмониях. Отхождение мокроты цвета охры возможно при сидерозе лёгкого. Черноватая или сероватая мокрота бывает при примеси угольной пыли и у курильщиков. Мокроту могут окрашивать некоторые лекарственные препараты, например, рифампицин окрашивает отделяемое в красный цвет. Запах. Мокрота обычно не имеет запаха. Появлению запаха способствует нарушение оттока мокроты. Гнилостный запах она приобретает при абсцессе, гангрене лёгкого, при гнилостном бронхите в результате присоединения гнилостной инфекции, бронхоэктатической болезни, раке лёгкого, осложнившемся некрозом. Для вскрывшейся эхинококковой кисты характерен своеобразный фруктовый запах мокроты. Слоистость мокроты. Гнойная мокрота при стоянии обычно разделяется на 2 слоя, гнилостная — на 3 слоя (верхний пенистый, средний серозный, нижний гнойный). Особенно характерно появление трёхслойной мокроты для гангрены лёгкого, в то время как появление двухслойной мокроты обычно наблюдают при абсцессе лёгкого и бронхоэктатической болезни. Реакция. Мокрота обычно имеет щелочную или нейтральную реакцию. Разложившаяся мокрота приобретает кислую реакцию. Характер мокроты: Слизистая мокрота выделяется при остром и хроническом бронхите, астматическом бронхите, трахеите. Слизисто-гнойная мокрота характерна для абсцесса и гангрены лёгкого, гнойного бронхита, обострения хронического бронхита, стафилококковой пневмонии. ?Гнойно-слизистая мокрота характерна для бронхопневмонии. Гнойная мокрота возможна при бронхоэктазах, стафилококковой пневмонии, абсцессе, гангрене, актиномикозе лёгких. Серозная мокрота отделяется при отёке лёгкого.
Для вскрывшейся эхинококковой кисты характерен своеобразный фруктовый запах мокроты. Слоистость мокроты. Гнойная мокрота при стоянии обычно разделяется на 2 слоя, гнилостная — на 3 слоя (верхний пенистый, средний серозный, нижний гнойный). Особенно характерно появление трёхслойной мокроты для гангрены лёгкого, в то время как появление двухслойной мокроты обычно наблюдают при абсцессе лёгкого и бронхоэктатической болезни. Реакция. Мокрота обычно имеет щелочную или нейтральную реакцию. Разложившаяся мокрота приобретает кислую реакцию. Характер мокроты: Слизистая мокрота выделяется при остром и хроническом бронхите, астматическом бронхите, трахеите. Слизисто-гнойная мокрота характерна для абсцесса и гангрены лёгкого, гнойного бронхита, обострения хронического бронхита, стафилококковой пневмонии. ?Гнойно-слизистая мокрота характерна для бронхопневмонии. Гнойная мокрота возможна при бронхоэктазах, стафилококковой пневмонии, абсцессе, гангрене, актиномикозе лёгких. Серозная мокрота отделяется при отёке лёгкого. Серозно-гнойная мокрота возможна при абсцессе лёгкого. ?Кровянистая мокрота выделяется при инфаркте лёгких, новообразованиях, пневмонии (иногда), травме лёгкого, актиномикозе и сифилисе.. Также нужно помнить, что не всегда появление обильной примеси крови в мокроте обусловлено лёгочной патологией. Симулировать лёгочное кровотечение могут, например, желудочное или носовое кровотечения. МИКРОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕ: Микроскопическое исследование мокроты позволяет обнаружить слизь, клеточные элементы, волокнистые и кристаллические образования, грибы, бактерии и паразиты. Клетки Альвеолярные макрофаги— клетки ретикулогистиоцитарного происхождения. Большое количество макрофагов в мокроте выявляют при хронических процессах и на стадии разрешения острых процессов в бронхолёгочной системе. Альвеолярные макрофаги, содержащие гемосидерин («клетки сердечных пороков»), выявляют при инфаркте лёгкого, кровоизлиянии, застое в малом кругу кровообращения. Макрофаги с липидными каплями — признак обструктивного процесса в бронхах и бронхиолах.
Серозно-гнойная мокрота возможна при абсцессе лёгкого. ?Кровянистая мокрота выделяется при инфаркте лёгких, новообразованиях, пневмонии (иногда), травме лёгкого, актиномикозе и сифилисе.. Также нужно помнить, что не всегда появление обильной примеси крови в мокроте обусловлено лёгочной патологией. Симулировать лёгочное кровотечение могут, например, желудочное или носовое кровотечения. МИКРОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕ: Микроскопическое исследование мокроты позволяет обнаружить слизь, клеточные элементы, волокнистые и кристаллические образования, грибы, бактерии и паразиты. Клетки Альвеолярные макрофаги— клетки ретикулогистиоцитарного происхождения. Большое количество макрофагов в мокроте выявляют при хронических процессах и на стадии разрешения острых процессов в бронхолёгочной системе. Альвеолярные макрофаги, содержащие гемосидерин («клетки сердечных пороков»), выявляют при инфаркте лёгкого, кровоизлиянии, застое в малом кругу кровообращения. Макрофаги с липидными каплями — признак обструктивного процесса в бронхах и бронхиолах. Ксантомные клетки(жировые макрофаги) обнаруживают при абсцессе, актиномикозе, эхинококкозе лёгких. Клетки цилиндрического мерцательного эпителия— клетки слизистой оболочки гортани, трахеи и бронхов; их обнаруживают при бронхитах, трахеитах, бронхиальной астме, злокачественных новообразованиях лёгких. Плоский эпителий обнаруживают при попадании в мокроту слюны, он не имеет диагностического значения. Лейкоциты в том или ином количестве присутствуют в любой мокроте. Большое количество нейтрофилов выявляют в слизисто-гнойной и гнойной мокроте. Эозинофилами богата мокрота при бронхиальной астме, эозинофильной пневмонии, глистных поражениях лёгких, инфаркте лёгкого. Эозинофилы могут появиться в мокроте при туберкулёзе и раке лёгкого. Лимфоциты в большом количестве обнаруживают при коклюше и, реже, при туберкулёзе. Эритроциты.Обнаружение единичных эритроцитов в мокроте диагностического значения не имеет. При наличии свежей крови в мокроте определяют неизменённые эритроциты, если же с мокротой отходит кровь, находившаяся в дыхательных путях в течение длительного времени, обнаруживают выщелоченные эритроциты.
Ксантомные клетки(жировые макрофаги) обнаруживают при абсцессе, актиномикозе, эхинококкозе лёгких. Клетки цилиндрического мерцательного эпителия— клетки слизистой оболочки гортани, трахеи и бронхов; их обнаруживают при бронхитах, трахеитах, бронхиальной астме, злокачественных новообразованиях лёгких. Плоский эпителий обнаруживают при попадании в мокроту слюны, он не имеет диагностического значения. Лейкоциты в том или ином количестве присутствуют в любой мокроте. Большое количество нейтрофилов выявляют в слизисто-гнойной и гнойной мокроте. Эозинофилами богата мокрота при бронхиальной астме, эозинофильной пневмонии, глистных поражениях лёгких, инфаркте лёгкого. Эозинофилы могут появиться в мокроте при туберкулёзе и раке лёгкого. Лимфоциты в большом количестве обнаруживают при коклюше и, реже, при туберкулёзе. Эритроциты.Обнаружение единичных эритроцитов в мокроте диагностического значения не имеет. При наличии свежей крови в мокроте определяют неизменённые эритроциты, если же с мокротой отходит кровь, находившаяся в дыхательных путях в течение длительного времени, обнаруживают выщелоченные эритроциты. Клетки злокачественных опухолейобнаруживают при злокачественных новообразованиях. Волокна Эластические волокнапоявляются при распаде ткани лёгкого, который сопровождается разрушением эпителиального слоя и освобождением эластических волокон; их обнаруживают при туберкулёзе, абсцессе, эхинококкозе, новообразованиях в лёгких. Коралловидные волокна выявляют при хронических заболеваниях лёгких, таких как кавернозный туберкулёз. Обызвествлённые эластические волокна — эластические волокна, пропитанные солями кальция. Обнаружение их в мокроте характерно для распада туберкулёзного петрификата. Спирали, кристаллы Спирали Куршмана образуются при спастическом состоянии бронхов и наличии в них слизи. Во время кашлевого толчка вязкая слизь выбрасывается в просвет более крупного бронха, закручиваясь спиралью. Спирали Куршмана появляются при бронхиальной астме, бронхитах, опухолях лёгких, сдавливающих бронхи. Кристаллы Шарко-Лейдена— продукты распада эозинофилов. Обычно появляются в мокроте, содержащей эозинофилы; характерны для бронхиальной астмы, аллергических состояний, эозинофильных инфильтратов в лёгких, лёгочной двуустки.
Клетки злокачественных опухолейобнаруживают при злокачественных новообразованиях. Волокна Эластические волокнапоявляются при распаде ткани лёгкого, который сопровождается разрушением эпителиального слоя и освобождением эластических волокон; их обнаруживают при туберкулёзе, абсцессе, эхинококкозе, новообразованиях в лёгких. Коралловидные волокна выявляют при хронических заболеваниях лёгких, таких как кавернозный туберкулёз. Обызвествлённые эластические волокна — эластические волокна, пропитанные солями кальция. Обнаружение их в мокроте характерно для распада туберкулёзного петрификата. Спирали, кристаллы Спирали Куршмана образуются при спастическом состоянии бронхов и наличии в них слизи. Во время кашлевого толчка вязкая слизь выбрасывается в просвет более крупного бронха, закручиваясь спиралью. Спирали Куршмана появляются при бронхиальной астме, бронхитах, опухолях лёгких, сдавливающих бронхи. Кристаллы Шарко-Лейдена— продукты распада эозинофилов. Обычно появляются в мокроте, содержащей эозинофилы; характерны для бронхиальной астмы, аллергических состояний, эозинофильных инфильтратов в лёгких, лёгочной двуустки. Кристаллы ХСпоявляются при абсцессе, эхинококкозе лёгкого, новообразованиях в лёгких. Кристаллы гематоидина характерны для абсцесса и гангрены лёгкого. Друзы актиномицета выявляют при актиномикозе лёгких. Элементы эхинококка появляются при эхинококкозе лёгких. Пробки Дитриха— комочки желтовато-серого цвета, имеющие неприятный запах. Состоят из детрита, бактерий, жирных кислот, капелек жира. Они характерны для абсцесса лёгкого и бронхоэктатической болезни.Тетрада Эрлихасостоит из четырех элементов: обызвествлённого детрита, обызвествлённых эластических волокон, кристаллов ХС и микобактерий туберкулёза. Появляется при распаде обызвествлённого первичного туберкулёзного очага. Мицелий и почкующиеся клетки грибов появляются при грибковых поражениях бронхолёгочной системы. Пневмоцисты появляются при пневмоцистной пневмонии. Сферулы грибов выявляют при кокцидиоидомикозе лёгких. Личинки аскарид выявляют при аскаридозе. Личинки кишечной угрицы выявляются при стронгилоидозе. Яйца лёгочной двуустки выявляются при парагонимозе.
Кристаллы ХСпоявляются при абсцессе, эхинококкозе лёгкого, новообразованиях в лёгких. Кристаллы гематоидина характерны для абсцесса и гангрены лёгкого. Друзы актиномицета выявляют при актиномикозе лёгких. Элементы эхинококка появляются при эхинококкозе лёгких. Пробки Дитриха— комочки желтовато-серого цвета, имеющие неприятный запах. Состоят из детрита, бактерий, жирных кислот, капелек жира. Они характерны для абсцесса лёгкого и бронхоэктатической болезни.Тетрада Эрлихасостоит из четырех элементов: обызвествлённого детрита, обызвествлённых эластических волокон, кристаллов ХС и микобактерий туберкулёза. Появляется при распаде обызвествлённого первичного туберкулёзного очага. Мицелий и почкующиеся клетки грибов появляются при грибковых поражениях бронхолёгочной системы. Пневмоцисты появляются при пневмоцистной пневмонии. Сферулы грибов выявляют при кокцидиоидомикозе лёгких. Личинки аскарид выявляют при аскаридозе. Личинки кишечной угрицы выявляются при стронгилоидозе. Яйца лёгочной двуустки выявляются при парагонимозе. Результаты макроскопического, химического и микроскопического исследования мокроты позволяют сделать вывод о локализации и характере патологического процесса.
Результаты макроскопического, химического и микроскопического исследования мокроты позволяют сделать вывод о локализации и характере патологического процесса.
Новые возможности диагностики туберкулеза в пульмонологическом отделении стационара | Бородулина
1. Васильева И.А., Белиловский Е.М., Борисов С.Е., Стерликов С.А. Заболеваемость, смертность и распространенность как показатели бремени туберкулеза в регионах ВОЗ, странах мира и в Российской Федерации. Часть 1. Заболеваемость и распространенность туберкулеза. Туберкулез и болезни легких. 2017; 95 (6): 9–21. DOI: 10.21292/2075-1230-2017-95-6-9-21.
2. Павлунин А.В., Шарафутдинова М.А., Борисова С.Б. и др. Причины несвоевременного выявления и ошибки диагностики туберкулеза органов дыхания в общей лечебной сети. Туберкулез и социально-значимые заболевания. 2015; (2): 63–64.
3. Бородулина Е.А., Поваляева Л.В., Бородулина Э.В. и др. Проблема диагностики туберкулеза в практике врача-пульмонолога. Вестник современной клинической медицины. 2017; 10 (1): 89–93. DOI: 10.20969/VSKM.2017.10(1).89-93.
4. Поваляева Л.В., Бородулина Е.А., Бородулин Б.Е., Еремеев А.Е. Впервые выявленный туберкулез легких и способ его выявления. Туберкулез и болезни легких. 2011; 88 (5): 113–114.
5. Севастьянова Э.В., Пузанов В.А., Смирнова Т.Г. и др. Оценка комплекса микробиологических и молекулярно-генетических методов исследований для диагностики туберкулеза. Туберкулез и болезни легких. 2015; (1): 35–41.
6. Залуцкая О. М., Сагальчик Е.Р., Суркова Л.К. Руководство по лабораторной диагностике туберкулеза. Минск: 2013.
Минск: 2013.
7. Серегина В.А., Будрицкий А.М. Современные возможности диагностики туберкулеза легких. Вестник Ви теб ского государственного медицинского университета. 2016; 15 (4): 7–17.
8. Бородулина Э.В., Суслин С.А. Совершенствование организации диагностики туберкулеза в практике участкового терапевта. Бюллетень Национального научноисследовательского института общественного здоровья имени Н.А. Семашко. 2017; (4): 16–21.
9. Гуревич Л.Г., Скрягина Е.М., Залуцкая О.М. Диагностика и дифференциальная диагностика туберкулеза легких на различных уровнях оказания медицинской помощи. Туберкулез и болезни легких. 2014; 91 (1): 14–19.
10. Бородулина Е.А., Бородулин Б.Е., Поваляева Л.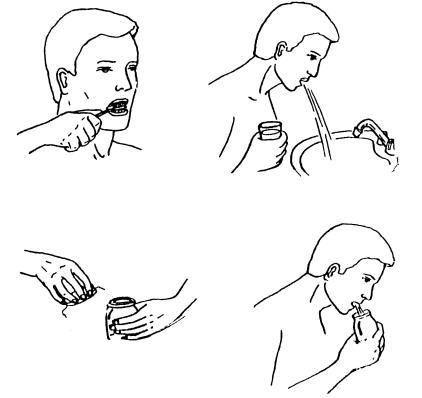 В. и др. Дифференциальная диагностика внебольничной пневмонии и инфильтративного туберкулеза легких Диаскинтестом®. Пульмонология. 2010; (3): 89–91.
В. и др. Дифференциальная диагностика внебольничной пневмонии и инфильтративного туберкулеза легких Диаскинтестом®. Пульмонология. 2010; (3): 89–91.
11. Родионова Ю.Д., Гусякова О.А., Лямин А.В. и др. Оценка влияния условий хранения мокроты на витальные свойства микобактерий туберкулеза. Туберкулез и болезни легких. 2017; 95 (1): 42–46. DOI: 10.21292/2075-1230-2017-95-1-42-46.
12. Корецкая Н.М., Наркевич А.Н. Биологические свойства возбудителя у больных туберкулезом легких при различных путях выявления заболевания. Бюллетень экспериментальной биологии и медицины. 2014; 158 (7): 78–81.
13. Разнатовская Е. Н., Ясинский Р. Н., Конакова О. В. и др. [Актуальность использования GenoType MTBDRplus для ранней диагностики мультирезистентных форм туберкулеза]. Запорожский медицинский журнал. 2017; (2): 210–216. DOI: 10.14739/2310-1210.2017.2.95741 (на украинском).
2017; (2): 210–216. DOI: 10.14739/2310-1210.2017.2.95741 (на украинском).
14. Ерохин В.В., Черноусова Л.Н. Значение молекулярногенетических исследований в модернизации фтизиатрии. Фтизиатрия и пульмонология. 2011; (2): 52–53.
15. Mansfeld M., Skrahina A., Shepherd L. et al. Major differences in organization and availability of health care and medicines for HIV/TB coinfected patients across Europe. HIV Med. 2015; 16 (9) 544–552. DOI: 10.1111/hiv.12256.
16. Бородулина Е., Уханова С., Ревина О., Пронина Е. Участковый врач-фтизиатр в условиях мегаполиса XXI века. Врач. 2016; (11): 25–27.
17. Слогоцкая Л.В., Богородская Е.М., Сенчихина О.Ю. и др. Формирование групп риска заболевания туберкулезом при различных иммунологических методах обследования детского населения. Российский педиатрический журнал. 2017; 20 (4): 207–213. DOI: 10.18821/1560-9561-2017-20-4-207-213.
Российский педиатрический журнал. 2017; 20 (4): 207–213. DOI: 10.18821/1560-9561-2017-20-4-207-213.
18. Slogotskaya L.V., Bogorodskaya Е., Ivanova D. et al. Sensitivity and specificity of new skin test with recombinant protein CFP10-ESAT6 in patients with tuberculosis and individuals with non- tuberculosis diseases. Eur. Respir. J. 2013; 42 (Suppl. 57): P1995.
19. Аксенова В.А., Барышникова Л.А., Долженко Е.Н., Кудлай Д.А. Актуальные вопросы массового обследования детского населения на туберкулез в современных условиях. Доктор.Ру. 2012; 8 (76): 27–29.
20. Слогоцкая Л.И., Литвинов В.И., Сельцовский П.П. и др. Применение кожной пробы с аллергеном туберкулезным рекомбинантным (Диаскинтест®) для диагностики туберкулезной инфекции у больных с ВИЧ инфекцией. Пульмонология. 2011; (1): 60–64. DOI: 10. 18093/0869-0189-2011-0-1-60-64.
Пульмонология. 2011; (1): 60–64. DOI: 10. 18093/0869-0189-2011-0-1-60-64.
21. Мамаев А.Н., Кудлай Д.А. Визуализация данных в презентациях, отчетах и исследованиях. М.: Практическая медицина; 2011.
КТ легких при туберкулезе — DocDoc.ru
Компьютерная томография (КТ) — это самый информативный способ исследования легких. С помощью КТ можно выявить практически любые изменения в бронхолегочной системе, в том числе туберкулез. К сожалению, КТ не может использоваться для скрининга заболевания (как флюорография) из-за высокой стоимости, поэтому его обычно назначают, если на ФЛГ или рентгенограмме есть патологические изменения.
КТ — это послойное сканирование легких при помощи рентгеновских лучей. Томограммы получаются намного более четкими, чем рентгенограммы, а послойные срезы позволяют получить объемное изображение и выявить даже небольшие по размеру изменения в легочной ткани. Это очень важно для диагностики туберкулеза на ранних стадиях.
Это очень важно для диагностики туберкулеза на ранних стадиях.
Показания для КТ легких при подозрении на туберкулез:
- инфильтративные тени на флюорограмме или рентгенограмме;
- положительные результаты пробы Манту или Диаскинтеста;
- положительный посев мокроты на туберкулезную палочку.
Диагноз туберкулеза легких выставляют только при положительном посеве мокроты. Если он отрицательный, а в легких обнаружены характерные очаги, речь идет о патологическом процессе другой этиологии. В этом случае назначается дополнительное обследование. Если лабораторное обследование дает положительные результаты, то нужно исключать внелегочные формы туберкулеза.
КТ используют не только для подтверждения диагноза туберкулеза легких и внутригрудных лимфоузлов, с ее помощью определяют локализацию и размеры патологических очагов, оценивают результаты лечения.
Если вас беспокоит какая-то проблема со здоровьем, запишитесь на диагностику. Успех лечения зависит от правильно поставленного диагноза.
Успех лечения зависит от правильно поставленного диагноза.
Что видно на КТ легких при туберкулезе?
В острой фазе туберкулеза легких на КТ видны очаги уплотнения легочной ткани (инфильтраты) рядом с бронхами и увеличенные измененные лимфатические узлы рядом с корнем пораженного легкого. При диссеминированной форме туберкулеза на КТ легких регистрируются множественные мелкие инфильтраты, преимущественно в верхних долях. Если обычная томограмма недостаточно информативна, используют контрастирование. Особенно хорошо КТ с контрастом «показывает» казеозный некроз.
После курса лечения количество и размеры очагов должны уменьшиться — с целью контроля эффективности терапии обычно назначают повторное КТ.
Данная статья размещена исключительно в познавательных целях, не заменяет приема у врача и не может быть использована для самодиагностики.
03 июня 2015
Анализ мокроты (на ВК методом флотации) — Анализ мокроты — Диагностика
Все анализы
Фото и иллюстрации
Туберкулезная палочка Источник: suite101. | Бактерии Коха Источник: oerafrica.org |
Общее описание
В случае туберкулеза легких имеет большое значение факт выделения больным в окружающую среду микобактерий туберкулеза. В зависимости от этого все формы делятся на открытые (с выделением) и закрытые (без выделения). При открытых формах лечебные и противоэпидемические мероприятия проводятся с большей интенсивностью.
В обычном мазке из мокроты больного туберкулезом далеко не всегда выявляются микобактерии. Для того чтобы выявить бактерии Коха в материале, содержащем малое их количество, применяется метод флотации, позволяющий создать в исследуемой среде область с высокой концентрацией микобактерий. Метод флотации основан на различной гидрофильности и несмешивании сред. При этом в хорошо гомогенизированный (распределенный) исследуемый материал добавляют углеводород, который связывает бактерии Коха и концентрирует их ближе к поверхности.
Аудитория риска
Аудитория риска
Исследование мокроты методом флотации для определения микобактерий туберкулеза применяется у больных туберкулезом легких или у пациентов с подозрением на туберкулез, у которых выделение микобактерий не было выявлено с помощью обычных бактериоскопических методов. Проводится анализ с целью уточнения наличия бактериовыделения.
Подготовка и проведение исследования
Подготовка и проведение исследования
Для проведения исследования методом флотации мокрота собирается больным в специальную емкость и в количестве 15-10 мл доставляется в лабораторию. В чистую стеклянную посуду выливается собранная мокрота, после чего к ней добавляется равное количество гидроксида натрия или калия 0,5%. Содержимое емкости тщательно перемешивают путем встряхивания. После достижения гомогенизации (однородности) исследуемого материала в него добавляется 100 мл дистиллированной воды, а также 0,5-1 мл бензина или ксилола. Полученный материал тщательно встряхивается на протяжении 10 минут и оставляется для отстаивания на протяжении 30-60 минут.
Полученный материал тщательно встряхивается на протяжении 10 минут и оставляется для отстаивания на протяжении 30-60 минут.
Мелкие капли углеводорода за счет несмешиваемости с водой и определенных гидрофобных качеств микробной стенки увлекают за собой микобактерии туберкулеза и концентрируют их в верхней части раствора. В этой области формируется так называемое флотационное кольцо, в котором концентрация бактерий Коха максимальна. После отстаивания исследуемого материала лаборант переносит на предметные стекла участки флотационного кольца, производит окрашивание по Цилю-Нильсену (в случае световой микроскопии) или с помощью флюорохромных методов (при люминесцентной микроскопии). Полученные препараты просматриваются в большом количестве полей зрения под микроскопом. Наибольшую эффективность показывает метод флотации в сочетании с люминесцентной микроскопией.
Методы исследования
Флотационный метод исследования мокроты подразумевает смешивание двух разнородных сред с последующим выделением и микроскопией порции лабораторного материала, в которой предполагается наибольшая вероятность скопления бактерий Коха.
Какие заболевания диагностирует
Какие заболевания диагностирует
Исследование мокроты с целью выявления бактерий Коха с помощью метода флотации применяется для диагностики открытых форм туберкулеза легких (с наличием выделения бактерий в окружающую среду).
Стандартный посев мокроты — Медицинская энциклопедия MedlinePlus
Стандартный посев мокроты — Медицинская энциклопедия MedlinePlus
Стандартный посев мокроты
Иллюстрации
Альтернативные имена
Вернуться к началу
Посев мокроты
Определение
Вернуться к началу
Обычный посев мокроты — это анализ секрета из легких и бронхов (трубок, по которым воздух попадает в легкие) для поиска бактерий, вызывающих инфекцию.
Как проводится тест
Вернуться к началу
Вы будете глубоко кашлять и выплюнете мокроту в стерильную чашку. Затем мокрота отправляется в лабораторию. Там он помещается в специальное вещество (среду) в условиях, позволяющих бактериям или грибам расти.
Затем мокрота отправляется в лабораторию. Там он помещается в специальное вещество (среду) в условиях, позволяющих бактериям или грибам расти.
Как подготовиться к экзамену
Вернуться к началу
Обильное питье воды и других жидкостей накануне исследования может помочь получить образец.
Как будет выглядеть тест
Вернуться к началу
Вам нужно будет кашлять. Иногда врач постучит пальцем по груди, чтобы отделить глубокую мокроту. Вы можете вдохнуть парообразный туман, чтобы облегчить откашливание образца.
Почему проводится тест
Вернуться к началу
Посев мокроты проводится с целью выявления бактерий, вызывающих инфекцию легких или дыхательных путей (бронхов).
Нормальные результаты
Вернуться к началу
Присутствие болезнетворных организмов в мокроте является нормальным явлением.
Что означают аномальные результаты
Вернуться к началу
Аномальные результаты будут зарегистрированы как положительный посев. Это означает, что обнаружен болезнетворный организм, который может помочь в диагностике:
Это означает, что обнаружен болезнетворный организм, который может помочь в диагностике:
Прочие условия, при которых может проводиться испытание:
Риски
Вернуться к началу
Этот метод получения пробы не несет никаких рисков.
Соображения
Вернуться к началу
Иногда окраска по Граму или окрашивание мокроты на КУБ, проведенное одновременно, может помочь в постановке диагноза.
Дата обновления:
12.11.2007
Автор обновления:
Арнольд Л. Лентнек, доктор медицины, отделение инфекционных заболеваний, больница Кеннестоун, Мариетта. Обзор предоставлен VeriMed Healthcare Network.
Информация, представленная в данном документе, не должна использоваться во время оказания неотложной медицинской помощи, а также для диагностики или лечения любого заболевания.Для диагностики и лечения любых заболеваний необходимо проконсультироваться с лицензированным врачом. Звоните 911 для всех случаев неотложной медицинской помощи. Ссылки на другие сайты предоставляются только для информации — они не означают поддержки этих сайтов. Copyright 1997-2009, A.D.A.M., Inc. Любое копирование или распространение информации, содержащейся в данном документе, строго запрещено.
Звоните 911 для всех случаев неотложной медицинской помощи. Ссылки на другие сайты предоставляются только для информации — они не означают поддержки этих сайтов. Copyright 1997-2009, A.D.A.M., Inc. Любое копирование или распространение информации, содержащейся в данном документе, строго запрещено.
Рекомендации по подходу, анализ мокроты, общий анализ крови
Reid LM. Уменьшение деления бронхов при бронхоэктазии. Торакс . 1950 Сентябрь 5 (3): 233-47. [Медлайн]. [Полный текст].
Tiddens HA. Компьютерная томография грудной клетки должна рассматриваться как рутинное исследование муковисцидоза. Педиатр Респир Ред. . 2006 Сентябрь 7 (3): 202-8. [Медлайн].
Young K, Aspestrand F, Kolbenstvedt A. КТ высокого разрешения и бронхография в оценке бронхоэктазов. Акта Радиол . 1991, ноябрь 32 (6): 439-41. [Медлайн].
[Медлайн].
Смит И. Е., Цветочный компакт-диск.Обзорная статья: визуализация при бронхоэктазах. Бр. Дж. Радиол . 1996 июл.69 (823): 589-93. [Медлайн].
Чалмерс Дж. Д., МакХью Б. Дж., Дочерти С., Гован Дж. Р., Хилл АТ. Дефицит витамина D связан с хронической бактериальной колонизацией и тяжестью бронхоэктазов. Торакс . 2013 Январь 68 (1): 39-47. [Медлайн]. [Полный текст].
Дэвис Г., Уилсон Р. Профилактическое лечение антибиотиками бронхоэктазов с помощью азитромицина. Торакс . 2004 июн. 59 (6): 540-1. [Медлайн]. [Полный текст].
Tagaya E, Tamaoki J, Kondo M, Nagai A. Влияние короткого курса терапии кларитромицином на выработку мокроты у пациентов с хронической гиперсекрецией дыхательных путей. Сундук . 2002 июл. 122 (1): 213-8. [Медлайн].
122 (1): 213-8. [Медлайн].
Ялчин Э., Кипер Н., Озчелик У., Догру Д., Фират П., Сахин А. Влияние кларитромицина на воспалительные параметры и клинические состояния у детей с бронхоэктазами. Дж Клин Фарм Тер . 2006 г. 31 (1): 49-55. [Медлайн].
Люс Дж. М.. Бронхоэктазия. Мюррей Дж. Ф., Надель Дж. А., ред. Учебник респираторной медицины . 2-е изд. Филадельфия, Пенсильвания: WB Saunders and Co; 1994. 1398-1417.
IP MS, Лам В.К. Бронхоэктазы и родственные нарушения. Респирология . 1996 Июнь 1 (2): 107-14. [Медлайн].
Kolbe J, Wells AU. Бронхоэктазия: запущенная причина респираторной заболеваемости и смертности. Респирология . 1996 декабрь 1 (4): 221-5. [Медлайн].
Коул П.Дж. Новый взгляд на патогенез и лечение стойкого бронхиального сепсиса: гипотеза «вязкого круга» и ее логические терапевтические коннотации. Дэвис Р.Дж. Стратегии ведения хронического бактериального сепсиса . Оксфорд: Фонд медицинских публикаций; 1984 г.1-20.
Пастер М., Хеллиуэлл С., Хоутон С. и др. Исследование причинных факторов у пациентов с бронхоэктазами. Am J Respir Crit Care Med . 2000. 162: 1277-1284.
Синглтон Р., Моррис А., Реддинг Г. и др. Бронхоэктазия у детей коренного населения Аляски: причины и клиническое течение. Педиатр Пульмонол . 2000 марта, 29 (3): 182-7. [Медлайн].
Чанг А., Гримвуд К., Малхолланд Е. и др.Бронхоэктазия у детей коренных народов в отдаленных австралийских общинах. Med J Aust . 2002. 117: 200-204.
и др.Бронхоэктазия у детей коренных народов в отдаленных австралийских общинах. Med J Aust . 2002. 117: 200-204.
Баркер А.Ф. Бронхоэктазия. N Engl J Med . 2002 May 2. 346 (18): 1383-93. [Медлайн].
Холмс А.Х., Тротман-Дикенсон Б., Эдвардс А., Пето Т., Луцци Г.А. Бронхоэктазы при ВИЧ-инфекции. QJ Med . 1992 ноябрь-декабрь. 85 (307-308): 875-82. [Медлайн].
Райх Дж. М., Джонсон RE.Комплексное заболевание легких, вызванное Mycobacterium avium, проявляющееся в виде изолированной язычковой или средней доли. Синдром леди Уиндермир. Сундук . 1992 июн. 101 (6): 1605-9. [Медлайн].
Koh WJ, Kwon OJ. Бронхоэктазы и нетуберкулезная микобактериальная легочная инфекция. Торакс . 2006 май. 61 (5): 458; Ответ автора 458. [Medline]. [Полный текст].
[Medline]. [Полный текст].
Викремасинге М., Озерович Л.Дж., Дэвис Г. и др. Нетуберкулезные микобактерии у больных бронхоэктазами. Торакс . 2005 Декабрь 60 (12): 1045-51. [Медлайн]. [Полный текст].
Angrill J, Augusti C., de Celis R, et al. Бактериальная колонизация у пациентов с бронхоэктазами: микробиологическая картина и факторы риска. Торакс . 2002. 57: 15-19.
King PT, Holdsworth SR, Freezer NJ, Villanueva E, Holmes PW. Контрольное микробиологическое исследование бронхоэктазов у взрослых. Респир Мед . 2007 августа 101 (8): 1633-8. [Медлайн].
Дэвис Дж., Уэллс А.Ю., Доффман С., Ватанабе С., Уилсон Р.Влияние синегнойной палочки на функцию легких у пациентов с бронхоэктазами. Евро Респир J . 2006 28 ноября (5): 974-9. [Медлайн].
[Медлайн].
Цанг К.В., Лам С.К., Лам В.К. и др. Высокая распространенность Helicobacter pylori при активной бронхоэктазии. Am J Respir Crit Care Med . 1998 Октябрь 158 (4): 1047-51. [Медлайн].
Цанг К.В., Лам В.К., Квок Э. и др. Helicobacter pylori и симптомы со стороны верхних отделов желудочно-кишечного тракта при бронхоэктазиях. Евро Респир J . 1999 г., 14 (6): 1345-50. [Медлайн].
Де Гроот М., Хитт Г., Фултон К. и др. Ретроспективный анализ риска аспирации и генетической предрасположенности у пациентов с бронхоэктазами с и без инфекции, вызванной нетуберкулезными микобактериями. Am J Respir Crit Care Med . 2003. 163: A763.
Национальные институты здравоохранения. Генетическое тестирование на муковисцидоз. Заявление конференции по развитию консенсуса Национального института здравоохранения о генетическом тестировании на муковисцидоз. Арк Интерн Мед. . 1999, 26 июля, 159 (14): 1529-39. [Медлайн].
Арк Интерн Мед. . 1999, 26 июля, 159 (14): 1529-39. [Медлайн].
Янкаскас Дж. Р., Маршалл BC, Суфиан Б., Саймон Р., Родман Д. Уход за взрослыми при муковисцидозе: консенсусный отчет конференции. Сундук . 2004 г., 125 января (1 доп.): 1С-39С. [Медлайн].
Керем Э., Кори М., Керем Б.С. и др. Связь между генотипом и фенотипом при муковисцидозе — анализ наиболее частой мутации (дельта F508). N Engl J Med . 1990 29 ноя.323 (22): 1517-22. [Медлайн].
Громан Дж.Д., Мейер М.Э., Уилмотт Р.В., Цейтлин П.Л., Cutting GR. Вариант фенотипа муковисцидоза при отсутствии мутаций CFTR. N Engl J Med . 2002 8 августа. 347 (6): 401-7. [Медлайн].
Drumm ML, Konstan MW, Schluchter MD, et al. Генетические модификаторы заболеваний легких при муковисцидозе. N Engl J Med . 2005 Октябрь 6. 353 (14): 1443-53. [Медлайн].
N Engl J Med . 2005 Октябрь 6. 353 (14): 1443-53. [Медлайн].
Li Z, Kosorok MR, Farrell PM, et al.Продольное развитие мукоидной инфекции Pseudomonas aeruginosa и прогрессирование заболевания легких у детей с муковисцидозом. ЯМА . 2005 2 февраля. 293 (5): 581-8. [Медлайн].
Handelsman DJ, Конвей AJ, Бойлан LM, Turtle JR. Синдром Юнга. Обструктивная азооспермия и хронические синопульмональные инфекции. N Engl J Med . 1984, 5 января. 310 (1): 3-9. [Медлайн].
Стерджесс Дж. М., Томпсон М. В., Чегледи-Надь Э, Тернер Дж.Генетические аспекты синдрома неподвижных ресничек. Ам Дж. Мед Генет . 1986 25 сентября (1): 149-60. [Медлайн].
Ноун П.Г., Ли М.В., Саннути А. и др. Первичная цилиарная дискинезия: диагностические и фенотипические особенности. Am J Respir Crit Care Med . 2004 15 февраля. 169 (4): 459-67. [Медлайн].
Am J Respir Crit Care Med . 2004 15 февраля. 169 (4): 459-67. [Медлайн].
Лиллингтон, Джорджия. Дискинетические реснички и синдром Картагенера. Бронхоэктазия с завихрением. Clin Rev Allergy Immunol . 2001 Август.21 (1): 65-9. [Медлайн].
Моррисси Б., Луи С. Аллергический бронхолегочный аспергиллез: развивающаяся проблема астмы. Гершвин М., Альбертсон Т., ред. Бронхиальная астма: Руководство для практического понимания и лечения . 5-е изд. Тотова, Нью-Джерси: Humana Press; 2006. 279-309.
Vendrell M, de Gracia J, Rodrigo MJ и др. Дефицит продукции антител с нормальным уровнем IgG при бронхоэктазах неясной этиологии. Сундук .2005, январь 127 (1): 197-204. [Медлайн].
Де Грасиа Дж., Родриго М.Дж., Морелл Ф. и др. Недостатки подкласса IgG, связанные с бронхоэктазами. Am J Respir Crit Care Med . 1996 Февраль 153 (2): 650-5. [Медлайн].
и др. Недостатки подкласса IgG, связанные с бронхоэктазами. Am J Respir Crit Care Med . 1996 Февраль 153 (2): 650-5. [Медлайн].
Thickett KM, Kumararatne DS, Banerjee AK, Dudley R, Stableforth DE. Общий вариабельный иммунный дефицит: респираторные проявления, легочная функция и результаты компьютерной томографии с высоким разрешением. QJM . 2002 окт.95 (10): 655-62. [Медлайн].
Notarangelo LD, Plebani A, Mazzolari E, Soresina A, Bondioni MP. Генетические причины бронхоэктазов: первичный иммунодефицит и легкие. Дыхание . 2007. 74 (3): 264-75. [Медлайн].
Stover DE, White DA, Romano PA, Gellene RA, Robeson WA. Спектр заболеваний легких, связанных с синдромом приобретенного иммунодефицита. Ам Дж. Мед. . 1985 марта 78 (3): 429-37. [Медлайн].
Джонс В.Ф., Ид Н.С., Франко С.М., Бадгетт Дж. Т., Бучино Дж. Дж. Семейные врожденные бронхоэктазы: синдром Вильямса-Кэмпбелла. Педиатр Пульмонол . 1993 16 октября (4): 263-7. [Медлайн].
Вудринг JH, Ховард RS 2-й, Рем SR. Врожденная трахеобронхомегалия (синдром Мунье-Куна): сообщение о 10 случаях и обзор литературы. Дж Визуализация грудной клетки . 1991 г., 6 (2): 1-10. [Медлайн].
Cordasco EM Jr, Beder S, Coltro A, Bavbek S, Gurses H, Mehta AC. Клинические особенности синдрома желтого ногтя. Клив Клин Дж. Мед . 1990 июль-авг. 57 (5): 472-6. [Медлайн].
Шин МС, Хо КДж. Бронхоэктатическая болезнь у пациентов с дефицитом альфа-1-антитрипсина. Редкое явление ?. Сундук . 1993 ноябрь 104 (5): 1384-6. [Медлайн].
Чан Э, Фельдман Н., Чмура К.Предрасполагают ли мутации гена альфа-1-антитрипсина к нетуберкулезной микобактериальной инфекции? Am J Respir Crit Care Med . 2004. 169: A132.
Парр Д.Г., Гость П.Г., Рейнольдс Дж. Х., Доусон Л. Дж., Стокли Р. А.. Распространенность и влияние бронхоэктазов при дефиците альфа1-антитрипсина. Am J Respir Crit Care Med . 2007 15 декабря. 176 (12): 1215-21. [Медлайн].
Кувелье А., Мюир Дж. Ф., Хеллот М. Ф., Бенхаму Д., Мартин Дж. П., Бенишоу Дж.Распределение аллелей альфа (1) -антитрипсина у пациентов с бронхоэктазами. Сундук . 2000 Февраль 117 (2): 415-9. [Медлайн].
2000 Февраль 117 (2): 415-9. [Медлайн].
Унитаз Walker. Легочные инфекции и ревматоидный артрит. QJ Med . 1967, апрель, 36 (142): 239-51. [Медлайн].
Перес Т., Реми-Жардин М., Кортет Б. Участие дыхательных путей при ревматоидном артрите: клинические, функциональные и результаты КТВР. Am J Respir Crit Care Med . 1998 Май. 157 (5 Pt 1): 1658-65.[Медлайн].
McMahon MJ, Swinson DR, Shettar S, Wolstenholme R, Chattopadhyay C, Smith P. Бронхоэктазия и ревматоидный артрит: клиническое исследование. Энн Рум Дис . 1993, ноябрь 52 (11): 776-9. [Медлайн].
Swinson DR, Symmons D, Suresh U, Jones M, Booth J. Снижение выживаемости у пациентов с сопутствующим ревматоидным артритом и бронхоэктазами. Br J Ревматол . 1997 июн. , 36 (6): 689-91. [Медлайн].
, 36 (6): 689-91. [Медлайн].
Робинсон Д.А., Мейер С.Ф.Первичный синдром Шегрена, связанный с рецидивирующими синопульмональными инфекциями и бронхоэктазами. Дж. Клин Иммунол . 1994 август 94 (2, часть 1): 263-4. [Медлайн].
Casserly IP, Fenlon HM, Breatnach E, Sant SM. Результаты компьютерной томографии с высоким разрешением при идиопатическом анкилозирующем спондилите — корреляция с клиническими данными, результатами исследования функции легких и простой рентгенографией. Br J Ревматол . 1997 июн. 36 (6): 677-82. [Медлайн].
Fenlon HM, Doran M, Sant SM, Breatnach E.КТ грудной клетки высокого разрешения при системной красной волчанке. AJR Ам Дж. Рентгенол . 1996 Февраль 166 (2): 301-7. [Медлайн].
Тилли-Леблон I, Валларт Б. , Леблон Д. и др. Поражение дыхательных путей при рецидивирующем полихондрите. Клинические, функциональные, эндоскопические и рентгенологические исследования. Медицина (Балтимор) . 1998 Май. 77 (3): 168-76. [Медлайн].
, Леблон Д. и др. Поражение дыхательных путей при рецидивирующем полихондрите. Клинические, функциональные, эндоскопические и рентгенологические исследования. Медицина (Балтимор) . 1998 Май. 77 (3): 168-76. [Медлайн].
Камю П., Колби ТВ. Легкое при воспалительном заболевании кишечника. Евро Респир J .2000 15 января (1): 5-10. [Медлайн].
Rockoff SD, Рохатги ПК. Необычные проявления грудного саркоидоза. AJR Ам Дж. Рентгенол . 1985 Mar.144 (3): 513-28. [Медлайн].
Вуд Дж. Р., Беллами Д., Чайлд АХ, Цитрон КМ. Заболевания легких у пациентов с синдромом Марфана. Торакс . 1984 Октябрь 39 (10): 780-4. [Медлайн]. [Полный текст].
Дрисколл Дж. А., Бхалла С., Лиапис Н., Ибричевич А., Броди С. Л..Аутосомно-доминантная поликистозная болезнь почек связана с повышенной распространенностью рентгенологических бронхоэктазов. Сундук . 2008 май. 133 (5): 1181-8. [Медлайн].
Сундук . 2008 май. 133 (5): 1181-8. [Медлайн].
Джавидан-Неджад C, Бхалла С. Бронхоэктазия. Радиол Клин Норт Ам . 2009 Март 47 (2): 289-306. [Медлайн].
Кеннеди Т.П., Вебер Диджей. Нетуберкулезные микобактерии. Недооцененная причина гериатрической болезни легких. Am J Respir Crit Care Med .1994 июн. 149 (6): 1654-8. [Медлайн].
Николаизик WH, Warner JO. Этиология хронической гнойной болезни легких. Арка Дис Детский . 1994 Февраль 70 (2): 141-2. [Медлайн]. [Полный текст].
Уоллес Р. Дж. Младший Mycobacterium avium комплексное заболевание легких и женщины. Теперь болезнь равных возможностей. Сундук . 1994 Январь 105 (1): 6-7. [Медлайн].
Исеман, доктор медицины, Бушман Д. Л., Акерсон Л.М. Экскаваторная грудная клетка и сколиоз.Грудные аномалии, связанные с заболеванием легких, вызванным комплексом Mycobacterium avium. Am Rev Respir Dis . 1991 Октябрь 144 (4): 914-6. [Медлайн].
Л., Акерсон Л.М. Экскаваторная грудная клетка и сколиоз.Грудные аномалии, связанные с заболеванием легких, вызванным комплексом Mycobacterium avium. Am Rev Respir Dis . 1991 Октябрь 144 (4): 914-6. [Медлайн].
Никотра МБ, Ривера М., Дейл А.М., Шеперд Р., Картер Р. Клиническая, патофизиологическая и микробиологическая характеристика бронхоэктазов в стареющей когорте. Сундук . 1995 Октябрь 108 (4): 955-61. [Медлайн].
Зейтц А.Е., Оливье К.Н., Штайнер С.А. и др. Тенденции и бремя госпитализаций, связанных с бронхоэктазами, в США, 1993-2006 гг. Сундук . 2010 Октябрь 138 (4): 944-9. [Медлайн]. [Полный текст].
Моррисси BM, Харпер RW. Бронхоэктазия: половые и гендерные аспекты. Clin Chest Med . 2004 июн.25 (2): 361-72. [Медлайн].
Эллис Д.А., Торнли П.Е., Уайтман А.Дж., Уокер М., Чалмерс Дж., Крофтон Дж.В.Современные взгляды на бронхоэктазы: клинические и социальные исследования и обзор факторов, влияющих на прогноз. Торакс . 1981, сентябрь, 36 (9): 659-64. [Медлайн]. [Полный текст].
Кейстинен Т, Сайнаджакангас О, Туупонен Т, Кивела SL. Бронхоэктатическая болезнь: орфанное заболевание с плохо изученным прогнозом. Евро Респир J . 1997 г., 10 (12): 2784-7. [Медлайн].
Saynajakangas O, Keistinen T, Tuuponen T, Kivela SL. Бронхоэктазы в Финляндии: тенденции в стационарном лечении. Респир Мед . 1997 августа 91 (7): 395-8. [Медлайн].
Онен З.П., Гулбай Б.Е., Сен Э. и др. Анализ факторов, влияющих на смертность больных бронхоэктазами. Респир Мед . 2007 июл.101 (7): 1390-7. [Медлайн].
Янечко Л.У детей с хроническим влажным кашлем, несмотря на прием антибиотиков, могут быть бронхоэктазы. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/822067. Доступ: 24 марта 2014 г.
Гоял В., Гримвуд К., Марчант Дж., Мастерс И.Б., Чанг А.Б. Предсказывает ли неудавшийся хронический влажный кашель на антибиотики бронхоэктаз? Арка Дис Детский . 2014 12 февраля [Medline].
King PT, Holdsworth SR, Freezer NJ, Villanueva E, Holmes PW. Характеристика начала и клинических проявлений бронхоэктазов у взрослых. Респир Мед . 2006 декабрь 100 (12): 2183-9. [Медлайн].
Flume PA, Янкаскас JR, Ebeling M, Hulsey T, Clark LL. Массивное кровохарканье при муковисцидозе. Сундук . 2005 августа 128 (2): 729-38. [Медлайн].
Prys-Picard CO, Niven R. Недержание мочи у пациентов с бронхоэктазами. Евро Респир J . 2006 г., 27 (4): 866-7. [Медлайн].
Hansell DM. Бронхоэктазия. Радиол Клин Норт Ам . 1998, январь, 36 (1): 107-28. [Медлайн].
[Медлайн].
Mannino DM, Davis KJ. Снижение функции легких и исходы у пожилого населения. Торакс . 2006 июн. 61 (6): 472-7. [Медлайн]. [Полный текст].
Martinez-Garcia MA, Soler-Cataluna JJ, Perpina-Tordera M, Roman-Sanchez P, Soriano J.Факторы, связанные со снижением функции легких у взрослых пациентов со стабильными бронхоэктазами без кистозного фиброза. Сундук . 2007 ноябрь 132 (5): 1565-72. [Медлайн].
Чанг С., Синглтон Р., Моррис П. и др. Пневмококковые вакцины для детей и взрослых с бронхоэктазами. Кокрановская база данных систематических обзоров . 2008. 3:
.
Чанг CC, Моррис PS, Чанг AB. Вакцина против гриппа для детей и взрослых с бронхоэктазами. Кокрановская база данных Syst Rev . 18 июля 2007 г. CD006218. [Медлайн].
[Медлайн].
Эванс Д. Д., Бара А. И., Гринстоун М. Длительные антибиотики при гнойных бронхоэктазах. Кокрановская база данных Syst Rev . 2003. (4): CD001392. [Медлайн].
Эванс Д. Д., Гринстоун М. Долгосрочные антибиотики при лечении бронхоэктазов, не связанных с МВ — улучшают ли они исход ?. Респир Мед . 2003 июл.97 (7): 851-8. [Медлайн].
Рубин БК.Антибиотики в аэрозольной форме для лечения бронхоэктазов без кистозного фиброза. J Аэрозоль Med Pulm Drug Deliv . 2008 21 марта (1): 71-6. [Медлайн].
Баркер А.Ф., Коуч Л., Фил С.Б. и др. Раствор тобрамицина для ингаляций снижает плотность мокроты синегнойной палочки при бронхоэктазах. Am J Respir Crit Care Med . 2000 августа 162 (2, часть 1): 481-5. [Медлайн].
Билтон Д., Хениг Н., Моррисси Б., Готфрид М. Добавление ингаляционного тобрамицина к ципрофлоксацину при острых обострениях инфекции Pseudomonas aeruginosa при бронхоэктазии у взрослых. Сундук . 2006 ноябрь 130 (5): 1503-10. [Медлайн].
Haciibrahimoglu G, Fazlioglu M, Olcmen A, Gurses A, Bedirhan MA. Хирургическое лечение бронхоэктазов у детей, вызванных инфекционным заболеванием. J Thorac Cardiovasc Surg . 2004 г., май. 127 (5): 1361-5. [Медлайн].
Drobnic ME, Sune P, Montoro JB, Ferrer A, Orriols R. Ингаляционный тобрамицин у пациентов с некистозным фиброзом с бронхоэктазами и хронической бронхиальной инфекцией, вызванной Pseudomonas aeruginosa. Энн Фармакотер . 2005, январь, 39 (1): 39-44. [Медлайн].
Scheinberg P, Shore E.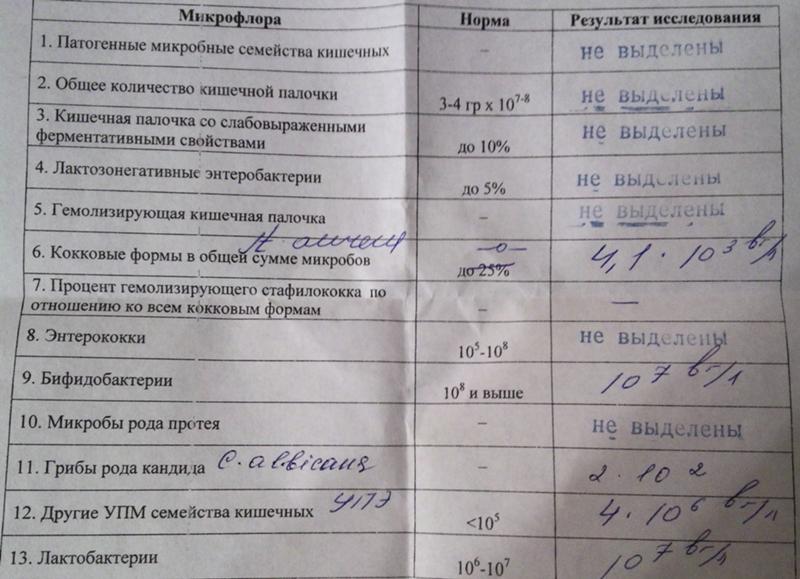 Пилотное исследование безопасности и эффективности ингаляционного раствора тобрамицина у пациентов с тяжелыми бронхоэктазами. Сундук . 2005 апр. 127 (4): 1420-6. [Медлайн].
Пилотное исследование безопасности и эффективности ингаляционного раствора тобрамицина у пациентов с тяжелыми бронхоэктазами. Сундук . 2005 апр. 127 (4): 1420-6. [Медлайн].
Lin H, Cheng H, Wang C и др. Вдыхаемый гентамицин снижает активность нейтрофилов дыхательных путей и секрецию слизи при бронхоэктазах. Am J Respir Crit Care Med .1999. 155: 2024-2029.
Штейнфорт Д.П., Штейнфорт С. Влияние длительного распыления колистина на функцию легких и качество жизни пациентов с хроническим бронхиальным сепсисом. Медицинский работник J . 2007 июл. 37 (7): 495-8. [Медлайн].
Мюррей М. П., Гован Дж. Р., Доэрти С. Дж. И др. Рандомизированное контролируемое исследование распыленного гентамицина при бронхоэктазиях без кистозного фиброза. Am J Respir Crit Care Med . 2011 15 февраля. 183 (4): 491-9.[Медлайн].
183 (4): 491-9.[Медлайн].
Паттерсон Дж. Э., Хьюитт О., Кент Л., Брэдбери И., Элборн Дж. С., Брэдли Дж. М.. Acapella в сравнении с «обычным очищением дыхательных путей» во время обострения бронхоэктазов: рандомизированное перекрестное исследование. Хрон Респир Дис . 2007. 4 (2): 67-74. [Медлайн].
Итон Т., Янг П., Цзэн И., Колбе Дж. Рандомизированная оценка острой эффективности, приемлемости и переносимости трепетания и активного цикла дыхания с постуральным дренажом и без него при бронхоэктазах без кистозного фиброза. Хрон Респир Дис . 2007. 4 (1): 23-30. [Медлайн].
Лангендерфер Б. Альтернативы перкуссии и постурального дренажа. Обзор методов очистки от слизи: перкуссионный и постуральный дренаж, аутогенный дренаж, положительное давление на выдохе, трепетный клапан, внутрилегочная перкуссионная вентиляция и высокочастотное сжатие грудной клетки с помощью ThAIRapy Vest. Дж Кардиопульм Ребил . 1998 июл-авг. 18 (4): 283-9. [Медлайн].
Дж Кардиопульм Ребил . 1998 июл-авг. 18 (4): 283-9. [Медлайн].
Mutalithas K, Watkin G, Willig B, Wardlaw A, Pavord ID, Birring SS.Улучшение состояния здоровья после физиотерапии бронхолегочной гигиены у пациентов с бронхоэктазами. Респир Мед . 2008 августа 102 (8): 1140-4. [Медлайн].
Дональдсон С.Х., Беннетт В.Д., Земан К.Л., Ноулз М.Р., Тарран Р., Бушер Р.С. Очистка слизи и функция легких при муковисцидозе с применением гипертонического раствора. N Engl J Med . 2006 19 января. 354 (3): 241-50. [Медлайн].
Элкинс М.Р., Робинсон М., Роуз Б.Р. и др.Контролируемое испытание длительного применения ингаляционного гипертонического раствора у пациентов с муковисцидозом. N Engl J Med . 2006 19 января. 354 (3): 229-40. [Медлайн].
Fuchs HJ, Borowitz DS, Christiansen DH и др. Эффект аэрозольной рекомбинантной человеческой ДНКазы на обострения респираторных симптомов и на функцию легких у пациентов с муковисцидозом.Группа изучения пульмозима. N Engl J Med . 1994 8 сентября. 331 (10): 637-42. [Медлайн].
Пауль К., Ритчел Э., Баллманн М. и др. Влияние лечения дорназой альфа на воспаление дыхательных путей у пациентов с муковисцидозом. Am J Respir Crit Care Med . 2004 15 марта. 169 (6): 719-25. [Медлайн].
О’Доннелл А.Е., Баркер А.Ф., Иловайт Дж.С., Фик РБ. Лечение идиопатических бронхоэктазов с помощью аэрозольной рекомбинантной человеческой ДНКазы I. Исследовательская группа rhDNase. Сундук . 1998 Май. 113 (5): 1329-34. [Медлайн].
Исследовательская группа rhDNase. Сундук . 1998 Май. 113 (5): 1329-34. [Медлайн].
Франко Ф, Шейх А., Гринстоун М. Агонисты бета-2 короткого действия для лечения бронхоэктазов. Кокрановская база данных Syst Rev . 2003. CD003572. [Медлайн].
Шейх А., Нолан Д., Гринстоун М. Бета-2-агонисты длительного действия для лечения бронхоэктазов. Кокрановская база данных Syst Rev . 2001. CD002155. [Медлайн].
Лассерсон Т., Холт К., Эванс Д., Гринстоун М.Антихолинергическая терапия бронхоэктазов. Кокрановская база данных Syst Rev . 2001. CD002163. [Медлайн].
Кольбе Дж., Уэллс А, Рам ФС. Ингаляционные стероиды при бронхоэктазиях. Кокрановская база данных Syst Rev . 2000. CD000996. [Медлайн].
Corless JA, Warburton CJ.Антагонисты лейкотриеновых рецепторов при бронхоэктазиях без кистозного фиброза. Кокрановская база данных Syst Rev . 2000. (4): CD002174. [Медлайн].
Капур Н., Петски Х.Л., Белл С., Колбе Дж., Чанг AB. Ингаляционные кортикостероиды при бронхоэктазах. Кокрановская база данных Syst Rev . 2018 16 мая. 5: CD000996. [Медлайн].
Цанг К.В., Тан К.С., Хо П.Л. и др. Ингаляционный флутиказон при бронхоэктазах: 12-месячное исследование. Торакс . 2005 Март.60 (3): 239-43. [Медлайн]. [Полный текст].
Martinez-Garcia MA, Perpina-Tordera M, Roman-Sanchez P, Soler-Cataluna JJ. Ингаляционные стероиды улучшают качество жизни пациентов со стабильными бронхоэктазами. Респир Мед . 2006 Сентябрь 100 (9): 1623-32. [Медлайн].
Ингаляционные стероиды улучшают качество жизни пациентов со стабильными бронхоэктазами. Респир Мед . 2006 Сентябрь 100 (9): 1623-32. [Медлайн].
Anwar GA, Bourke SC, Afolabi G, Middleton P, Ward C, Rutherford RM. Эффекты длительного приема низких доз азитромицина у пациентов с бронхоэктазами без МВ. Респир Мед .2008 октябрь 102 (10): 1494-6. [Медлайн].
Вонг С., Джаярам Л., Каралус Н., Итон Т., Тонг С., Хоккей Н. и др. Азитромицин для профилактики обострений при бронхоэктазиях без кистозного фиброза (EMBRACE): рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет . 2012 18 августа. 380 (9842): 660-7. [Медлайн].
Капур Н., Белл С., Кольбе Дж., Чанг А.Б. Ингаляционные стероиды при бронхоэктазиях. Кокрановская база данных Syst Rev . 2009 21 января. CD000996. [Медлайн].
CD000996. [Медлайн].
Corless JA, Warburton CJ. Хирургия против безоперационного лечения бронхоэктазов. Кокрановская база данных Syst Rev . 2000. (4): CD002180. [Медлайн].
Балканлы К., Генц О, Дакак М. и др. Хирургическое лечение бронхоэктазов: анализ и ближайшие результаты у 238 пациентов. евро J Cardiothorac Surg . 2003 24 ноября (5): 699-702. [Медлайн].
Агастиан Т, Дешам С., Трастек В.Ф., Аллен М.С., Пайролеро ПК.Хирургическое лечение бронхоэктазов. Энн Торак Хирургия . 1996 Oct.62 (4): 976-8; обсуждение 979-80. [Медлайн].
[Рекомендации] Polverino E, Goeminne PC, McDonnell MJ, et al. Рекомендации Европейского респираторного общества по лечению бронхоэктазов у взрослых. Евро Респир J . 2017 Сентябрь 50 (3): [Medline]. [Полный текст].
[Полный текст].
Диагностика инфекции легионеллой | Клинические инфекционные болезни
Абстрактные
Легионеллы, которые являются важной причиной пневмонии у людей, по-прежнему ошибочно называют экзотическими патогенами.Возможность диагностировать инфекцию Legionella ограничена неспецифическим характером клинических проявлений и недостатками диагностических тестов. Несмотря на недавние улучшения, существующие диагностические тесты на инфекцию Legionella либо не обладают чувствительностью для выявления всех клинически важных легионелл, либо не могут дать результаты в течение клинически приемлемого периода времени. Понимание местной эпидемиологии Legionella важно для принятия решения о том, проводить ли тест на инфекцию Legionella и какие диагностические тесты использовать.В большинстве случаев наилучшей диагностической комбинацией является использование теста на антиген в моче и посева мокроты. Полимеразная цепная реакция (ПЦР) — многообещающий инструмент, но стандартизированные методы анализа коммерчески недоступны. Дальнейшая работа должна быть сосредоточена на разработке тестов на антигены в моче, которые выявляют более широкий спектр патогенных легионелл, и на разработке стандартизированных тестов ПЦР.
Полимеразная цепная реакция (ПЦР) — многообещающий инструмент, но стандартизированные методы анализа коммерчески недоступны. Дальнейшая работа должна быть сосредоточена на разработке тестов на антигены в моче, которые выявляют более широкий спектр патогенных легионелл, и на разработке стандартизированных тестов ПЦР.
Болезнь легионеров продолжает иметь репутацию экзотической инфекции.Напротив, при систематическом поиске видов Legionella неизменно признаются одной из распространенных причин пневмонии. Однако вне рамок исследований подтвержденный диагноз легионеллеза встречается нечасто. Эта неспособность диагностировать болезнь легионеров в повседневной практике в значительной степени является результатом трех факторов: неспособности клинически и рентгенологически отличить болезнь легионеров от других причин пневмонии, невозможности заказать диагностические тесты на инфекцию Legionella и недостаток доступных диагностических средств. тесты.Болезнь легионеров более точно описывается как неуловимый диагноз, а не как экзотическая инфекция.
Хотя методы диагностики улучшились за 25 лет, прошедших с момента первого описания Legionella pneumophila , в настоящее время нет доступных тестов, позволяющих своевременно диагностировать болезнь легионеров с высокой степенью чувствительности и специфичности. Действительно, некоторые авторы оспаривают рутинный порядок проведения любых микробиологических тестов для пациентов с пневмонией, что подтверждается данными, свидетельствующими о том, что такие тесты не оказывают значительного влияния на выбор антибактериальной терапии и исход для пациентов [1, 2].Недавно Марри [3] заявил, что такой подход к диагностике болезней легионеров ошибочен. Отсутствие теста на инфекцию Legionella может задержать распознавание вспышек болезни легионеров, может пропустить изменения в эпидемиологии болезни (включая развитие устойчивости к противомикробным препаратам) и может помешать лицам потребовать компенсацию за инфекцию, приобретенную на рабочем месте. Что важно, можно выбрать подгруппу пациентов, для которых результаты диагностических тестов на инфекцию Legionella высоки и которым будет полезен конкретный диагноз.
В этом обзоре основное внимание уделяется текущим диагностическим тестам на инфекцию Legionella с особым акцентом на тесты, которые позволяют поставить диагноз в сроки, которые повлияют на начальное лечение инфекции. При рассмотрении различных диагностических тестов на инфекцию Legionella важно учитывать несколько факторов. Во-первых, для диагностики инфекции Legionella требуются специализированные тесты, и они должны быть специально запрошены врачом.Во-вторых, важно понимать разницу между выполнением теста в исследовательской лаборатории и тем, что реально может быть достигнуто в местной диагностической лаборатории. Были задокументированы значительные межлабораторные различия в способности культивировать легионеллы [4], и это также, вероятно, будет распространяться на другие тесты. В-третьих, интерпретация результатов диагностических тестов затруднена из-за отсутствия подходящего «золотого стандарта». Расчетные данные о чувствительности и специфичности зависят от разных стандартов сравнения.В-четвертых, на полезность диагностических тестов влияет местная эпидемиология Legionella . L. pneumophila серогруппы 1 является преобладающей причиной легионеллеза во многих, если не в большинстве, регионах мира, и заражение этим организмом легче диагностировать, чем инфицирование другими видами и серогруппами Legionella . В некоторых регионах более важны другие виды и серогруппы. Например, Legionella longbeachae является основной причиной легионеллеза в Австралии и Новой Зеландии [5], где это часто связано с воздействием почвенной смеси [6].Инфекция этим видом не будет обнаружена текущими тестами на антиген в моче и будет пропущена лабораториями, которые проводят серологические анализы только для L. pneumophila.
Культура
Диагностика культур требует специальных сред, адекватной обработки образцов и технических знаний (таблица 1). Для получения положительного результата требуется несколько дней, при этом большинство колоний Legionella обнаруживается в течение 3–5 дней. Стандартная среда, используемая для культивирования легионелл, представляет собой агар с забуференным угольным дрожжевым экстрактом (BCYE) с добавлением α-кетоглутарата с антимикробными агентами или без них.Эта среда обеспечивает железо и L-цистеин, которые необходимы для роста легионелл. Рост примерно видов Legionella (например, Legionella micdadei и Legionella bozemanii ) усиливается за счет добавления в агар BCYE альбумина бычьей сыворотки [7], а добавление индикаторных красителей в среду может помочь в идентификации. Питательные среды, содержащие цефамандол, будут подавлять рост видов Legionella , которые не продуцируют β-лактамазу, таких как L.micdadei и L. bozemanii [8].
Таблица 1
Диагностические тесты на инфекцию Legionella .
Таблица 1
Диагностические тесты на инфекцию Legionella .
Legionellae можно выделить из различных типов образцов, хотя выделения из нижних дыхательных путей (например, образцы мокроты и бронхоскопии) являются предпочтительными образцами. Основным ограничением посева мокроты является то, что менее половины пациентов с болезнью легионеров выделяют мокроту [9–12].Другие факторы влияют на чувствительность посева после получения образца мокроты. Legionella Бактерии могут плохо выжить в респираторном секрете, и эти образцы следует обрабатывать немедленно. У некоторых пациентов с болезнью легионеров выделяется относительно небольшая гнойная мокрота; эти образцы могут быть отклонены лабораториями, которые выбрасывают образцы мокроты, содержащие небольшое количество полиморфно-ядерных лейкоцитов [13]. Следовательно, критерии отклонения не должны применяться к образцам мокроты, отправленным для посева Legionella .Опыт лабораторного персонала также важен, и лаборатории, имеющие опыт культивирования Legionella , имеют больше шансов восстановить организм.
Оценочная чувствительность посевов мокроты колеблется от <10% до ∼80% и варьируется в зависимости от различных стандартов сравнения и отдельных лабораторий [9, 14–16]. На практике лучшие результаты могут быть достигнуты только лабораториями, особенно заинтересованными в инфекции Legionella , а чувствительность обычно составляет <50%, когда серологические результаты используются в качестве стандарта.Бронхоскопические образцы, вероятно, дают больший диагностический результат, чем образцы отхаркиваемой мокроты.
Legionella видов можно выделить из посевов крови, но урожай плох. Рост легионелл поддерживается обычными средами для культивирования крови, но может не активировать сигнал тревоги коммерческих аппаратов для культивирования крови [17]. Следовательно, необходимы слепые пересевы на твердые среды. В целом, посев крови низкий и вряд ли повлияет на клиническое ведение.
Окрашивание прямым флуоресцентным антителом (Dfa)
Окрашивание
DFA позволяет обнаруживать легионеллы в респираторных секретах и образцах тканей. Преимущество этого метода заключается в том, что он дает результат в течение 2–4 часов, но он технически сложен и должен выполняться опытным лабораторным персоналом. Сообщаемая чувствительность к окрашиванию DFA варьируется, постоянно ниже, чем у культуры, и менее точно известна для видов, отличных от L. pneumophila. Для секрета нижних дыхательных путей, чувствительность обычно находится в диапазоне 25–66%, при этом образцы жидкости бронхоальвеолярного лаважа имеют более высокий выход, чем образцы транстрахеальной жидкости или мокроты [15, 18, 19].Специфичность окрашивания DFA оценивается в ~ 94% [18], хотя этот тест, вероятно, будет менее специфичным для неопытных рук. Ложноположительные результаты могут быть получены из-за перекрестных реакций с другими бактериями, включая видов Bacteroides fragilis, видов Pseudomonas , видов Stenotrophomonas и видов Flavobacterium . Перекрестные реакции могут быть менее серьезной проблемой при использовании агентов DFA с моноклональными антителами. Проблемы с чувствительностью и специфичностью ограничили использование окрашивания DFA, и положительный результат DFA в отсутствие других подтверждающих доказательств в настоящее время обычно не считается достаточным для диагностики инфекции Legionella .
Обнаружение антигена в моче
Обнаружение растворимого антигена Legionella в образцах мочи — это быстрый метод, обеспечивающий раннюю диагностику инфекции Legionella и полезный инструмент для расследования вспышек болезни легионеров [20]. Коммерческие комплекты, в которых используются методологии RIA и EIA, доступны уже несколько лет и имеют схожие рабочие характеристики. Недавно был разработан иммунохроматографический анализ (NOW Legionella Urinary Antigen Test; Binax), который имеет такую же чувствительность и специфичность, что и EIA [21].Этот тест прост в выполнении и может дать результат в течение 15 минут.
Для обнаружения L. pneumophila серогруппы 1 тесты на антигены в моче имеют чувствительность в диапазоне 70–100% и специфичность, приближающуюся к 100% [22]. Чувствительность может быть увеличена на 20% за счет 25-кратной концентрации образцов мочи перед тестированием [23]. Основным недостатком этих тестов является их неспособность надежно обнаруживать организмы, отличные от L. pneumophila серогруппы 1.Были разработаны анализы широкого спектра, которые обнаруживают растворимые антигены из широкого разнообразия видов Legionella , но коммерчески недоступны. Биотест Legionella Urine Antigen EIA (Биотест) предназначен для обнаружения легионелл, отличных от L. pneumophila серогруппы 1, но он делает это менее надежно, чем обнаруживает L. pneumophila серогруппы 1 [24]. Ложноположительные результаты по антигену в моче наблюдались у пациентов с сывороточной болезнью [25].
Легионелла Антигенурия может быть обнаружена уже через 1 день после появления симптомов и сохраняется в течение нескольких дней или недель.В одном случае было документально подтверждено, что выведение антигена происходит в течение> 300 дней [26]. Растворимые антигены Legionella также были обнаружены в образцах, отличных от мочи, включая образцы мокроты, ткани легких, сыворотки и плевральной жидкости, хотя использование таких образцов не было полностью оценено.
Анализ мочи на антигены в настоящее время является признанным и ценным инструментом для диагностики болезни легионеров, особенно в регионах, где L. pneumophila серогруппы 1 является наиболее частой причиной болезни.В местах, где только меньшая часть инфекций вызывается L. pneumophila серогруппы 1, имеющиеся в настоящее время анализы антигена в моче вносят меньший вклад в существующие лабораторные тесты.
Серологические исследования
Серологическое тестирование на инфекцию Legionella является ценным эпидемиологическим инструментом, но мало влияет на принятие клинических решений из-за задержки во времени до получения результата. Антитела, вырабатываемые в ответ на инфекцию, обычно представляют собой смесь IgA, IgM и IgG, и тесты должны обнаруживать все типы для оптимальной чувствительности.Измерение специфических IgM является ненадежным маркером острой инфекции, потому что антитела IgM могут сохраняться в течение длительных периодов времени. Сероконверсия может занять несколько недель, что является серьезным ограничением серологического тестирования. В большинстве случаев 4-кратное увеличение титра антител обнаруживается в течение 3-4 недель, но в некоторых случаях это может занять более 10 недель [27]. Слишком раннее получение образцов сыворотки в фазе выздоровления, несомненно, приводит к множеству ложноотрицательных результатов и, вероятно, частично составляет 20–30% пациентов с болезнью легионеров, у которых предположительно не развивается детектируемый ответ антител [18].Однако очевидно, что у части людей с доказанной инфекцией Legionella не обнаруживается сероконверсия [15]. На практике следует поощрять клиницистов к получению образцов сыворотки в фазе выздоровления через 3 недели после начала заболевания для анализа параллельно с сывороткой, полученной во время острой фазы. Если по истечении этого периода сероконверсии не наблюдается и все еще есть подозрение на инфекцию Legionella , следует получить дополнительный образец фазы выздоровления.
Из различных доступных методов обнаружения антител непрямая иммунофлуоресценция является стандартным эталонным тестом. Диагностическим считается 4-кратное или большее увеличение обратного титра антител до ≥128. Титры реципрокных антител в острой фазе ≥256 при наличии пневмонии когда-то считались достаточными для предположительного диагноза, но это оказалось ненадежным [28], особенно с учетом высокой распространенности положительных антител против Legionella среди некоторых людей без клинические доказательства легионеллеза.Практически нет никакой роли в тестировании отдельных образцов сыворотки.
Еще одним недостатком серологического тестирования является невозможность точного обнаружения всех видов и серогрупп Legionella . Хотя сероконверсия к L. pneumophila серогруппы 1 обычно рассматривается как высокопрогнозирующая болезнь, чувствительность и специфичность сероконверсии к другим видам и серогруппам не подтверждены строго. Кроме того, образование перекрестно-реактивных антител среди членов семейства Legionellaceae может затруднить определение вида или серогруппы инфицирования.У некоторых пациентов с инфекцией, отличной от L. pneumophila серогруппы 1, будет сероконверсия до L. pneumophila серогруппы 1 [29]. И наоборот, идентификация на основе последовательностей продуктов ПЦР Legionella от пациентов, у которых была сероконверсия до видов Legionella , отличных от L. pneumophila , указывает на то, что некоторые из них, вероятно, были инфицированы L. pneumophila (неопубликованные наблюдения). Перекрестно-реактивные антитела также иногда обнаруживаются у пациентов с инфекциями, вызванными бактериями, отличными от Legionella , включая псевдомонады, микобактерии, видов Bacteroides и Campylobacter видов.Интересная перекрестная реакция происходит между L. bozemanii и Rickettsia typhi в результате общего антигена [30].
Амплификация нуклеиновой кислоты
Недавно методы обнаружения ДНК показали многообещающие возможности для быстрой диагностики инфекции Legionella . ПЦР позволяет специфически амплифицировать мельчайшие количества ДНК Legionella , обеспечивает результаты в короткие сроки и может обнаруживать инфекции, вызванные любыми видами и серогруппами Legionella .В настоящее время анализ Legionella PCR доступен только в ограниченном количестве лабораторий, которые используют различные собственные анализы.
ПЦР была успешно использована для обнаружения ДНК Legionella в различных экологических и клинических образцах. При тестировании образцов из нижних дыхательных путей, ПЦР неоднократно показывала, что чувствительность равна или выше, чем у культуры [31–33]. Действительно, ПЦР можно считать тестом выбора для пациентов, у которых выделяется мокрота. Роль ПЦР для тестирования других типов образцов менее ясна. Legionella ДНК может быть обнаружена в образцах мочи, сыворотки и лейкоцитов, полученных от пациентов с болезнью легионеров, с чувствительностью 30–86% [34–37]. Чувствительность ПЦР может возрасти при тестировании образцов, полученных на ранней стадии болезни, и при тестировании> 1 типа образцов от каждого пациента [34]. Мазки из горла также могут быть подходящим образцом для тестирования ПЦР, но это применение было оценено только в одном исследовании [38].
Необходима дальнейшая работа для создания стандартного метода ПЦР, который будет достаточно надежным для использования за пределами исследовательской лаборатории.Его применение к образцам, не связанным с респираторными заболеваниями, особенно привлекательно, поскольку это позволит обойти проблему пациентов, которые не производят образцы мокроты. Разработка оптимального метода ПЦР осложнялась периодическим заражением некоторых коммерческих наборов для экстракции ДНК ДНК Legionella [39]. Использование этих наборов для обработки образцов может привести к ложноположительным результатам и подчеркивает важность включения соответствующих контролей в каждый цикл анализа.
Стратегия тестирования
Поскольку болезнь легионеров невозможно клинически или рентгенологически отличить от других причин пневмонии, решение о тестировании на инфекцию Legionella может быть трудным и часто принимается беспорядочно.Важно знать местную эпидемиологию. Некоторые лаборатории в районах, где видов Legionella являются частой причиной пневмонии, решили регулярно культивировать все образцы мокроты, полученные от пациентов с пневмонией, на среду Legionella . Однако немногие лаборатории смогут оправдать дополнительные расходы, связанные с рутинным культивированием Legionella . В большинстве регионов частота заражения Legionella неизвестна, и решение о заказе диагностических тестов на инфекцию Legionella обычно ограничивается пациентами из группы риска, пациентами с тяжелой пневмонией и сценариями вспышек.Несомненно, можно выбрать группу пациентов, для которых результат диагностических тестов Legionella , вероятно, будет относительно высоким. В эту группу входят пожилые люди, курильщики, люди с ослабленным иммунитетом, пациенты с хроническими заболеваниями легких, пациенты, которые проживают в больницах с Legionella- колонизированными источниками воды, и люди, подвергшиеся воздействию почвенной смеси. Заболеваемость легионерами выше среди пациентов с тяжелой пневмонией, и все пациенты с пневмонией, поступающие в отделение интенсивной терапии, должны быть проверены на эту инфекцию.
В местах, где L. pneumophila серогруппы 1 является преобладающей причиной инфекции Legionella или во время вспышки инфекции L. pneumophila серогруппы 1, анализ мочи на антиген является особенно ценным диагностическим инструментом. Разработка коммерческого теста на антиген в моче, который также надежно выявляет другие патогены человека Legionella , станет большим достижением и, вероятно, сделает его диагностическим тестом выбора почти во всех условиях.В географических регионах, где легионеллы, отличные от L. pneumophila серогруппы 1, являются численно важными патогенами, современные тесты на антигены в моче все еще полезны, но не должны использоваться в качестве единственного диагностического инструмента. Если возможно, ПЦР Legionella в сочетании с тестированием на антиген в моче, вероятно, будет лучшей стратегией начального тестирования, которая обнаружит все виды Legionella и предоставит результаты в течение определенного периода времени, которые повлияют на клиническое ведение.
Если ПЦР недоступна, наилучшей комбинацией тестов является анализ мочи на антиген в сочетании с посевом образцов из нижних дыхательных путей.Культура остается важным диагностическим инструментом, но его относительно низкая чувствительность и зависимость от доступности образца из нижних дыхательных путей делают его неадекватным в качестве единственного диагностического теста. Хотя серологическое тестирование не влияет на начальное лечение, оно может быть полезным, если конкретный диагноз не поставлен во время острой фазы инфекции, но образцы как острой фазы, так и фазы выздоровления должны анализироваться параллельно. Во время предполагаемой вспышки болезни легионеров оправдан агрессивный подход к диагностике, который будет включать использование комбинации методов тестирования.
Легионелла видов может иногда вызывать лихорадку Понтиак, острое, лихорадочное, непневмоническое заболевание, характеризующееся высокой частотой приступов, коротким инкубационным периодом и быстрым выздоровлением. Диагноз лихорадки Понтиак обычно основывается на распознавании типичных клинических признаков во время вспышки болезни, и диагноз подтверждается серологическими исследованиями больных. Использование культуры в основном ограничивается тестированием проб окружающей среды для определения источника вспышки, хотя L.pneumophila серогруппы 1 была выделена из трахеального аспирата ребенка с лихорадкой Понтиак [40].
Выводы
Инфекция Legionella , несомненно, недооценена. Диагностика основана на использовании специализированных тестов, часто в сочетании. Анализы на антигены в моче, посев мокроты и ПЦР-анализ образцов нижних дыхательных путей являются наиболее важными диагностическими инструментами для выявления инфекции Legionella на ранней стадии болезни.Разработка анализов на антигены в моче, которые выявляют более широкий спектр патогенных легионелл, и разработка стандартизированных ПЦР-тестов будут основными достижениями в диагностике Legionella . Увеличение доступности и использования улучшенных диагностических тестов поможет лучше охарактеризовать эпидемиологию болезни легионеров, включая истинную заболеваемость и географические различия.
Благодарности
Я благодарен Стиву Чемберсу за полезные комментарии к статье в рукописи.
Список литературы
1,,,,,.
Первоначальные микробиологические исследования не повлияли на исход у взрослых, госпитализированных с внебольничной пневмонией
,
Am J Respir Crit Care Med
,
1999
, vol.
160
(стр.
346
—
8
) 2,,,,.
Низкая ценность первоначальных микробиологических исследований в лечении нетяжелой внебольничной пневмонии
,
Chest
,
2001
, vol.
119
(стр.
181
—
4
) 3.
Диагностика Legionellaceae как причины внебольничной пневмонии: «… сначала продолжайте лечение, а потом не утруждайтесь задавать вопросы» — плохая идея
,
Am J Med
,
2001
, vol.
110
(стр.
73
—
5
) 4.
Болезнь легионеров
,
Clin Infect Dis
,
1993
, т.
16
(стр.
741
—
9
) 5« и др.
Распространение видов и серогрупп Legionella , выделенных посевом у пациентов со спорадическим внебольничным легионеллезом: международное совместное исследование
,
J Infect Dis
,
2002
, vol.
186
(стр.
127
—
8
) 6,,.
Распространение Legionella longbeachae серогруппы 1 и других легионелл в горшечных почвах в Австралии
,
Appl Environ Microbiol
,
1990
, vol.
56
(стр.
2984
—
8
) 7,,,,.
Повышенное извлечение Legionella micdadei и Legionella bozemanii на забуференном агаре с угольным дрожжевым экстрактом с добавлением альбумина
,
J Clin Microbiol
,
1990
, vol.
28
(стр.
616
—
8
) 8,,,.
Рост 28 видов Legionella на селективных питательных средах: сравнительное исследование
,
J Clin Microbiol
,
1993
, vol.
31
(стр.
2764
—
8
) 9« и др.
Сравнительное исследование клинической картины Legionella pneumonia и других внебольничных пневмоний
,
Chest
,
1998
, vol.
113
(стр.
1195
—
200
) 10,,,.
Legionella видов внебольничная пневмония: обзор 56 госпитализированных взрослых пациентов
,
Chest
,
1996
, vol.
109
(стр.
1243
—
9
) 11,.
Болезнь легионеров: обзор 79 случаев внебольничной инфекции в Ноттингеме
,
Thorax
,
1986
, vol.
41
(стр.
635
—
40
) 12,,,,,.
Болезнь легионеров: клинические особенности эпидемии в Филадельфии
,
Ann Intern Med
,
1979
, vol.
90
(стр.
509
—
17
) 13,.
Опасность проверки гнойности мокроты в культуре Legionella видов
,
J Clin Microbiol
,
1994
, vol.
32
(стр.
209
—
10
) 14,,,,.
Легионелла, Chlamydia pneumoniae и Инфекция Mycoplasma у пациентов, госпитализированных в больницу Крайстчерча с пневмонией
,
N Z Med J
,
1999
, vol.
112
(стр.
222
—
4
) 15,,,,.
Диагностика болезни легионеров: обновление лабораторных методов с новым акцентом на культивирование
,
JAMA
,
1983
, т.
250
(стр.
1981
—
5
) 16« и др.
Микробная этиология острой пневмонии у госпитализированных пациентов
,
Chest
,
1992
, vol.
101
(стр.
1005
—
12
) 17,,,,.
Выделение Legionella pneumophila из крови с помощью системы BACTEC: проспективное исследование, дающее положительные результаты
,
J Clin Microbiol
,
1985
, vol.
22
(стр.
422
—
4
) 18,,.
Лабораторная диагностика болезни легионеров
,
Am Rev Respir Dis
,
1980
, vol.
121
(стр.
317
—
27
) 19,,.
Прямая иммунофлуоресценция в диагностике болезни легионеров
,
Chest
,
1981
, vol.
79
(стр.
566
—
70
) 20,,,,.
Быстрая диагностика болезни легионеров с помощью иммунохроматографического анализа на Legionella pneumophila антиген серогруппы 1 в моче во время вспышки в Нидерландах
,
J Clin Microbiol
,
2000
, vol.
38
(стр.
2738
—
9
) 21« и др.
Оценка быстрого иммунохроматографического анализа для обнаружения антигена Legionella в образцах мочи
,
Eur J Clin Microbiol Infect Dis
,
1999
, vol.
18
(стр.
896
—
8
) 22,.
Legionella Анализ мочи на антиген: потенциальное влияние на диагностику и антибиотикотерапию
,
Diagn Microbiol Infect Dis
,
1996
, vol.
24
(стр.
129
—
39
) 23« и др.
Сравнение иммуноферментного анализа (EIA) на антиген мочи Binax Legionella с анализом EIA на антиген мочи Biotest Legionella для обнаружения антигена Legionella как в концентрированных, так и в неконцентрированных образцах мочи
,
J Clin Microbiol
,
1998
, т.
36
(стр.
2718
—
22
) 24« и др.
Многоцентровая оценка мочевого антигена Biotest Legionella EIA
,
Clin Microbiol Infect
,
1998
, vol.
4
(стр.
359
—
65
) 25,,,,,.
Случай ложноположительных результатов теста на антиген в моче на Legionella pneumophila
,
Clin Infect Dis
,
1999
, vol.
29
(стр.
953
—
4
) 26,,.
Начало и продолжительность экскреции антигена с мочой при болезни легионеров
,
J Clin Microbiol
,
1984
, vol.
20
(стр.
605
—
7
) 27,,,,.
Отсроченная сероконверсия при болезни легионеров
,
Ланцет
,
1988
, т.
2
8609
стр.
513
28« и др.
Переоценка определения болезни легионеров: использование анализа мочевых антигенов
,
Clin Infect Dis
,
1995
, vol.
20
(стр.
1286
—
91
) 29,,,,,.
Реактивность сыворотки крови пациентов с подозрением на легионеллез против 29 антигенов Legionellaceae и Legionella -подобных организмов по данным непрямого иммунофлуоресцентного анализа
,
J Infect Dis
,
1983
, vol.
147
(стр.
23
—
31
) 30,,,,.
Вестерн-блот-анализ иммунного ответа на Legionella bozemanii антигены
,
J Clin Pathol
,
1991
, vol.
44
(стр.
932
—
5
) 31« и др.
Обнаружение Legionella spp. в жидкостях бронхоальвеолярного лаважа путем амплификации ДНК
,
J Clin Microbiol
,
1992
, vol.
30
(стр.
920
—
4
) 32,,,,.
Обнаружение видов Legionella в респираторных образцах с использованием ПЦР с подтверждением секвенирования
,
J Clin Microbiol
,
2000
, vol.
38
(стр.
1709
—
12
) 33,,,.
Иммуноферментный анализ для обнаружения ПЦР-амплифицированной ДНК легионелл в бронхоальвеолярной жидкости
,
J Clin Microbiol
,
1995
, vol.
33
(стр.
1247
—
52
) 34« и др.
Использование полимеразной цепной реакции для обнаружения ДНК Legionella в образцах мочи и сыворотки пациентов с пневмонией
,
Clin Infect Dis
,
1996
, vol.
23
(стр.
475
—
80
) 35« и др.
Обнаружение ДНК Legionella в образцах мочи человека и морской свинки с помощью полимеразной цепной реакции
,
Eur J Clin Microbiol Infect Dis
,
1995
, vol.
14
(стр.
25
—
33
) 36,,,,,.
Диагностическая значимость обнаружения ДНК Legionella в образцах мочи с помощью полимеразной цепной реакции
,
Eur J Clin Microbiol Infect Dis
,
1999
, vol.
18
(стр.
716
—
22
) 37,,,.
Обнаружение ДНК Legionella в периферических лейкоцитах, моче и плазме морских свинок с помощью полимеразной цепной реакции
,
Eur J Clin Microbiol Infect Dis
,
1999
, vol.
18
(стр.
445
—
7
) 38,,,,.
Диагностика Legionella pneumophila, Mycoplasma pneumoniae или Chlamydia pneumoniae инфекций нижних дыхательных путей с использованием полимеразной цепной реакции на одном образце мазка из горла
,
Diagn Microbiol Infect Dis
,
1996
, vol.
24
(стр.
7
—
14
) 39« и др. Наборы для экстракции ДНК
Qiagen для подготовки проб для ПЦР Legionella не подходят для диагностических целей
,
J Clin Microbiol
,
2002
, vol.
40
стр.
1126
40,,,,,.
Вспышка лихорадки Понтиак среди детей после использования гидромассажной ванны
,
Clin Infect Dis
,
1998
, vol.
26
(стр.
1374
—
8
)
© 2003 Американского общества инфекционистов.
Руководство по микробиологии | Клинические лаборатории UCSF
Перейдите по этой ссылке, чтобы увидеть обновленный график вирусных изолятов.
Отправьте запросы на культуру с указанием типа образца, запрошенной процедуры (процедур) и времени сбора.Укажите особые состояния пациента (например, иммунодефицит, трансплантат, муковисцидоз и т. Д.) И любую антимикробную терапию. Эта информация помогает правильно обработать образец и интерпретировать культуру. За идентификацию и тестирование на чувствительность взимается дополнительная плата.
Часы : Культуры готовятся и мазки, окрашенные по Граму, считываются круглосуточно, 7 дней в неделю. Предварительные результаты окрашивания статограмм из обычно стерильных участков и мазков на малярию выдаются гематологическими отделениями больниц.
ОБЩЕЕ:
Большинство образцов, отправленных для посева, должны храниться при комнатной температуре до тех пор, пока посланник не доставит их в лабораторию, однако заморозить мочу и собрать респираторные образцы неинвазивным способом. Не используйте , а не , охлаждайте посевы крови, мазки в транспортной среде с углем, спинномозговые, суставные и другие обычно стерильные биологические жидкости, ткани или образцы, уже засеянные в чашки или бульон. Такие культуры следует доставить в главные клинические лаборатории для немедленной обработки.
- Пометьте каждый образец, указав имя пациента, номер отделения, источник, дату и время.
- Руководство по сбору микробиологических образцов для операционных UCSF
ABSCESS: см. РАНУ
АМНИОТИЧЕСКАЯ ЖИДКОСТЬ:
- Сбор : Подайте жидкость в стерильную прозрачную пластиковую черную верхнюю трубку.
- Вирусы : Для CMV и HSV отправьте образцы жидкости для тестирования с помощью ПЦР.По поводу краснухи обратитесь в лабораторию.
АСИТИЧЕСКАЯ ЖИДКОСТЬ: см. ПЕРИТОНЕАЛЬНАЯ ЖИДКОСТЬ
КРОВИ:
- Бактерии (обычные) : Выход посевов крови у взрослых зависит от объема и увеличивается примерно на 3% на 1 мл посевной крови; 20% взрослых с бактериемией имеют менее 1 колониеобразующей единицы в 10 мл крови. Около 80% пациентов, у которых есть положительные посевы крови, являются положительными при первом взятии проб, 90% обнаруживаются при двух пробах и почти 99% при трех пробах; Оптимальный рутинный посев крови состоит из 2 или 3 наборов аэробных и анаэробных бутылей с 10 мл крови в каждой бутылке.Сделайте , а не , соберите более трех культур крови от одного пациента в течение 24 часов.
Участки, время сбора и необходимый объем крови
- Лучше не брать посевы крови в течение нескольких часов или дней после введения антибиотиков и, если возможно, избегать сбора образцов из постоянных внутрисосудистых катетеров или шунтов, которые часто имеют внешнее загрязнение, особенно у трехходовых запорных кранов, что затруднительно дезинфицировать.Чтобы избежать разбавления образца введенными жидкостями, отбирайте образцы дистальнее существующих внутривенных линий. Образцы для посева крови не следует отбирать из сосудистой линии, если: (1) не собираются образцы для теста дифференциального времени до положительного результата (DTTP) или (2) это специально разрешено врачом. Не следует использовать посев крови для оценки эффективности антибиотикотерапии.
- Специальная бактериальная культура : Для Brucella spp.собрать гемокультуры. Сообщите микробиологу о подозрении на этот организм, чтобы культуры можно было инкубировать в течение 14 дней.
- Грибы : Дрожжи, такие как Candida spp. и Cryptococcus spp. будет расти в обычных посевах крови и не требует отдельной грибковой культуры. Для культивирования липофильных дрожжей Malassezia и инвазивных плесневых грибов, включая Histoplasma , Fusarium и Scedosporium , также закажите «Культивирование грибов, кровь». Культура микобактерий : Посев крови на микобактерии непродуктивен, за исключением обнаружения комплекса Mycobacterium avium-intracellulare у ВИЧ-инфицированных пациентов. Заказать AFB Культура, Кровь.
- Культивирование микобактерий : Обычный посев крови на микобактерии непродуктивен, за исключением обнаружения комплекса Mycobacterium avium-intracellulare у ВИЧ-инфицированных пациентов. Отправьте две темно-зеленые (без геля) пробирки с гепарином натрия и укажите при заказе теста, что у пациента ослаблен иммунитет.
- Паразиты, включая малярию : Кровь, поступившая в верхнюю пробирку бледно-лилового цвета, исследуется с помощью окрашивания по Гимзе на паразитов, передающихся через кровь: Plasmodium , Trypanosoma , Babesia , висцеральный Leishmania и микрофилярии spp. Изучите историю болезни пациента на предмет возможной периодичности и оптимального времени взятия проб.
- Вирусы : ПЦР более чувствительна, чем вирусная культура для идентификации вирусов в образцах крови, и в первую очередь показана пациентам с ослабленным иммунитетом для диагностики виремии.Обнаружение ПЦР в крови чаще всего выполняется для CMV, EBV, BK, аденовируса, энтеровируса, HSV и HHV6. Отправьте кровь в пробирку с ЭДТА с лавандовым верхом для тестирования на вирусную ПЦР.
ТЕЛОВАЯ ЖИДКОСТЬ (например, суставная, перикардиальная, плевральная; см. Также АМНИОТИК, ЦЕРЕБРОСПИНАЛЬНАЯ или ПЕРИТОНЕАЛЬНАЯ ЖИДКОСТЬ):
- Сбор : Соберите 15–20 мл жидкости в стерильную прозрачную пластиковую верхнюю пробирку черного цвета.
КОСТНЫЙ МОЗГ:
- Сбор : Образцы костного мозга для посева можно собирать независимо или во время диагностической аспирации костного мозга и процедуры биопсии; запланируйте последнее заранее, позвонив в гематолог.
- Хотя культуры костного мозга могут быть полезны для выявления распространенных грибковых и микобактериальных заболеваний, они вряд ли помогут в идентификации обычных бактериальных заболеваний.
- Поместите образец в желтую верхнюю пробирку изолятора объемом 1,5 мл, полученную в отделе гематологии или микробиологии.
БРОНХОАЛЬНО-ВЕОЛЯРНЫЙ ЛАВАЖ и БИОПСИЯ ЛЕГКИХ:
| Культура / Тест | Больные СПИДом | Другой иммунодефицит / пациентов после трансплантации |
|---|---|---|
| Бактерии (обычные) | Обычный заказ | Обычный заказ |
Aspergillus | Заказ если указано | Заказ если указано |
Культура грибов с КОН | Заказ при подозрении на гистоплазмоз, кокцидиоидомикоз или другие мицелиальные грибы; параллельно исследовать гистологию и посев биопсии | Заказать при подозрении на грибки , кроме дрожжей и Aspergillus |
Микобактерии | Приказ при М.tuberculosis , MAIC или другие микобактерии | Заказ при подозрении |
Legionella | Заказ при подозрении (редко) | Обычный заказ |
Вирусов: | ||
| Респираторный | Заказ при подозрении | Заказ при подозрении |
CMV | Не указано | Количественная ПЦР крови для мониторинга или диагностики.Гистология биоптата может быть полезна при оценке заболевания. Посев на ЦМВ может быть положительным из-за бессимптомного носительства. |
Прочие, включая HSV и VZV | Заказ ПЦР при указании | Заказ ПЦР при указании |
Паразиты | Цитология Pneumocystis carinii (по анатомической патологии) | Заказ при подозрении |
НАКОНЕЧНИК КАТЕТЕРА:
- Сбор : Посев на кончик катетера не проводится.Посевы в месте катетера, полученные с помощью мазков, не позволяют прогнозировать катетерную инфекцию, но могут быть полезны для определения возбудителя, когда локализованная инфекция в месте очевидна и можно получить гнойный образец. Наконечники мочевого или перитонеального катетера не подходят для посева; вместо этого отправьте мочу или перитонеальную жидкость.
- Бактерии (стандарт) : Посев на кончик катетера больше не проводится. Запросить разность времени до положительного результата посевов крови из периферической вены и внутривенной линии крови, взятых с разницей в 15 минут.Если микроорганизмы растут в образце, взятом через линию, по крайней мере, на два часа раньше, чем в периферической крови, то линия считается источником инфекции.
- Fungi : Сообщите в лабораторию, если есть подозрение на инфекцию Malassezia furfur на образцах от пациентов с перееданием.
ЦЕРЕБРОСПИНАЛЬНАЯ ЖИДКОСТЬ:
- Сбор : Подача в стерильную пробирку для бактериального посева (используйте пробирку, входящую в комплект LP, или стерильную прозрачную пластиковую черную пробирку.
- Бактерии (обычные) : Из-за относительной хрупкости многих распространенных этиологических микроорганизмов при менингите жидкость следует немедленно доставить в лабораторию.
- Cryptococcus neoformans : Для диагностики дрожжевого и криптококкового менингита рекомендуются тесты на бактериальную культуру спинномозговой жидкости (дрожжи, включая Cryptococcus neoformans, хорошо растут на обычных бактериальных культурах), а также на криптококковый антиген в спинномозговой жидкости и сыворотке.
- Coccidioides immitis : Чувствительность культуры спинномозговой жидкости для Coccidiodes immitis ограничена. Серологический анализ сыворотки и / или спинномозговой жидкости на Coccidioides ( Coccidioides immitis Antibody, Immunodiffusion) более чувствителен, чем посев, и является рекомендуемым диагностическим тестом первой линии.
- Mycobacteria : CSF будет обрабатываться для культивирования AFB только после консультации с лабораторией.Мазки дают положительный результат в очень небольшом количестве спинномозговой жидкости с положительным посевом и проводятся только после уведомления микробиологической лаборатории о высоком уровне подозрительности. Для посева требуется более 2 мл спинномозговой жидкости. Выход культуры CSF AFB увеличивается с увеличением объема образца. Рекомендуемые объемы — не менее 6 мл для педиатрии и 15-20 мл для взрослых. Посев на микобактерии прозрачной бесклеточной спинномозговой жидкости непродуктивен, и его не следует заказывать.
- Паразиты (Naegleria, Acanthamoeba, Trypanosoma, Toxoplasma) : При подозрении на диагноз обратитесь в лабораторию и немедленно доставьте образец в лабораторию.Посев возможен только в том случае, если пациент не принимает антибиотики. Быстрая диагностика может быть возможна при исследовании пятна Гимзы.
- Вирусы (укажите конкретных искомых агентов):
- Арбовирус: Обратитесь в лабораторию для получения информации о сборе образцов для диагностики энцефалита, переносимого комарами. Запросы пересылаются в Лабораторию вирусных и риккетсиозных заболеваний Департамента здравоохранения Калифорнии и должны сопровождаться специальной формой направления, включающей соответствующую историю болезни.
- Цитомегаловирус: ПЦР на ЦМВ показана для диагностики причины полирадикулопатии или энцефалита, когда нейтрофильный лейкоцитоз спинномозговой жидкости не объясняется бактериальной инфекцией.
- Энтеровирус: ПЦР на энтеровирус проводят на спинномозговой жидкости.
- Herpes simplex: ДНК HSV с помощью ПЦР проводят на спинномозговой жидкости.
- Varicella-Zoster: Вирус VZV иногда вызывает энцефалит у здоровых людей, обычно в сочетании с поражениями кожи, и у ВИЧ-инфицированных пациентов.Пациентам с возможным заболеванием ЦНС предлагается ПЦР и серология ЦСЖ на VZV.
CERVIX / ENDOCERVIX: см. VAGINA / CERVIX
КОЛОНИЧЕСКИЕ и ДРУГИЕ КИШЕЧНИКИ (например, Дуоденальные) АСПИРАТЫ и БИОПСИИ (см. Также ЖЕЛУДОЧНЫЙ АСПИРАТ):
- Сбор : Отправляйте образцы аспирата или биопсии в пластиковый стаканчик с плотно закрывающейся крышкой. Ткань должна быть влажной, но не в транспортную среду.
Паразиты : Для Giardia , Strongyloides и других кишечных паразитов доставьте образец в лабораторию в течение 30 минут после сбора с понедельника по пятницу.Для Giardia определение антигена в стуле с помощью EIA более чувствительно и специфично, чем микроскопическое исследование. Проктоскопическое исследование E. histolytica проводится редко. Перед проведением ректороманоскопии у каждого пациента должна быть проведена серия как минимум из 3 стандартных исследований стула на паразитов. Аспират или соскобы из подозрительных поражений толстой кишки могут быть отправлены в фиксаторе SAF с 1 частью образца на 3 части SAF. Перед забором пробы проконсультируйтесь в лаборатории.Образцы биопсии поражений следует исследовать с помощью обычного гистопатологического исследования. Серология на E. histolytica весьма полезна, особенно при диагностике амебного абсцесса печени.
- Посев на вирус : Для CMV и простого герпеса поместите биопсию в UTM (флокированный тампон).
CONJUNCTIVAE: см. EYE
ДИАЛИЗНАЯ ЖИДКОСТЬ: см. ПЕРИТОНЕАЛЬНАЯ ЖИДКОСТЬ
ДРЕНАЖ: см. РАНУ
ГЛАЗ:
- Сбор : Соскобы конъюнктивы получают, собирают с помощью тампона и помещают в транспортную пробирку, соответствующую требуемому тесту: транспортная среда для бактериальной культуры, вирусная удерживающая среда для вирусов и среда UTM для Chlamydia (получена из Микробиология).
- Бактерии (стандарт) : Если вы отправляете посевы из обоих глаз, обязательно отметьте, какой образец взят из правого или левого глаза.
- Chlamydia trachomatis : Соскоб конъюнктивы необходим для диагностики хламидийного конъюнктивита.
- Паразиты : Отправьте соскобы роговицы на чашку с непитательным агаром для культуры Acanthamoeba . Для Loa Loa отправьте образец в отдел анатомической патологии.
- Вирусы : Отправьте флокированный мазок в UTM.
ГАСТРИЧЕСКИЕ АСПИРАТЫ и БИОПСИИ:
- Сбор : Образцы желудочного аспирата следует быстро доставить в лабораторию сразу после сбора и только в период с 06:30 до 19:00 для нейтрализации содержания антибактериальной кислоты.
- Бактерии (стандарт) : Образцы желудка будут культивированы на Helicobacter pylori , если это указано.Посев содержимого желудка, возможно, может быть полезным для диагностики неонатального сепсиса; стандартное лабораторное исследование этих образцов включает поиск стрептококков группы B и Listeria monocytogenes , а также менее распространенных патогенов. Посевы крови и амниотической жидкости более чувствительны и более специфичны для диагностики стрептококковой инфекции группы B, чем посев желудочного аспирата.
- Mycobacteria : Посев содержимого желудка обычно менее продуктивен, чем посев мокроты или других респираторных культур.Первый утренний желудочный аспират наиболее полезен для диагностики туберкулеза, когда у пациента нет возможности выделять мокроту.
ЖИДКОСТЬ ДЛЯ СОЕДИНЕНИЙ: см. ЖИДКОСТЬ КУЗОВА
ОБРАЗЦОВ НАСОФАРИНГЕЛЯ:
- Флокированный тампон в универсальной транспортной среде — это основной метод сбора образцов из носоглотки для тестирования на респираторные вирусы и ПЦР Bordetella pertussis.
НАЗОФАРИНГЕАЛЬНЫЙ МАТЧИК (СЛОЖЕННЫЙ МАТР):
- Сбор : Для сбора используйте флокированный тампон / универсальную транспортную среду.Введите тампон в ноздрю, осторожно вращая тампон внутрь до тех пор, пока сопротивление не будет встречено на уровне носовых раковин. Поверните тампон несколько раз против стенки носоглотки (примерно 10 секунд), а затем возьмите тампон. Поместите тампон в контейнер с универсальной транспортной средой. Разломайте конец тампона, чтобы можно было надежно закрепить верхнюю часть флакона. Обозначьте образец соответствующим образом и отправьте в лабораторию.
- Респираторные вирусы : Носоглоточные мазки в универсальной транспортной среде являются предпочтительным типом образцов для тестирования на респираторные вирусы.
НАСАЛЬНЫЙ АСПИРАТ или ПРОМЫВКА:
- Сбор : Образцы для ПЦР на вирус или ПЦР Bordetella pertussis следует собирать в течение 5–7 дней после начала заболевания и предпочтительно в течение первых 4 дней. Образцы, собранные через 7 дней, редко выявляют патогены.
Назальный аспират:
- Взрослые и дети старшего возраста: удобно расположить пациента в сидячем положении, шея слегка вытянута вверх.
- Младенцы и дети младшего возраста: сядьте на колени родителей лицом вперед, спиной к груди родителей.Родитель должен обнять ребенка одной рукой таким образом, чтобы удерживать его тело и руки.
- Новорожденные: плотно пеленайте для комфорта
- Для взрослых, детей и младенцев действуйте следующим образом:
- Прикрепите один конец отсасывающего катетера к ловушке для слизи (оба доступны в Службе материалов)
- Присоедините другой конец к настенному патрубку. НЕ используйте отсасывание через рот.
- Включите всасывание и отрегулируйте вакуумное давление до 40-60 мм рт.При извлечении катетера из носоглотки используйте большой палец для отсасывания.
- Слегка вытянув голову пациента, закапайте 1-2 мл стерильного физиологического раствора в ноздрю пациента.
- Осторожно введите трубку через наружную ноздрю в нософарник. ПРИМЕЧАНИЕ: глубина введения, необходимая для достижения задней части глотки, эквивалентна расстоянию между внешней ноздрей и наружным отверстием уха.
- Выполните аспирацию и, используя вращательное движение, аспирируйте материал при извлечении трубки под давлением 40-60 мм рт.ПРИМЕЧАНИЕ: катетер должен оставаться в носоглотке не более 10 секунд.
- При необходимости наберите материал в ловушку для образцов, используя стерильный физиологический раствор. Держите ловушку для образцов вертикально, чтобы секреты не попали во всасывающую трубку.
- Повторяйте процедуру до получения подходящего образца (2 мл).
- Предложите пациенту салфетки по мере необходимости.
- Отсоединить и выключить всасывающее устройство. Свяжите трубку или закройте слизистую ловушку крышкой, находящейся на дне ловушки.
Промывание носа:
- Взрослые и дети старшего возраста: расположите пациента в удобном сидячем положении, слегка вытянув шею.
- Перед процедурой попросите пациента высморкаться.
- С помощью стерильного шприца введите 3 мл стерильного физиологического раствора в одну ноздрю
- Если возможно, попросите пациента удерживать физиологический раствор в течение нескольких секунд.
- Поместите контейнер с образцом прямо под носом, слегка надавив на верхнюю губу.
- Наклоните головку вперед и дайте жидкости стечь в контейнер с образцом.
- Повторите процедуру для другой ноздри, собрав жидкость в тот же контейнер.
- Предложите пациенту салфетки.
- Младенцы и дети младшего возраста: сядьте на колени родителей лицом вперед, спиной к груди родителей. Родитель должен обнять ребенка одной рукой таким образом, чтобы удерживать его тело и руки.
- Наполните шприц с грушей 1–3 мл стерильного физиологического раствора, в зависимости от размера пациента, и закапайте физиологический раствор в одну ноздрю, наклонив голову назад.
- Ослабьте давление на колбу, чтобы аспирировать образец обратно в колбу.
- Поместите образец в контейнер для образцов.
- Повторите процедуру для другой ноздри, перенеся второй образец в тот же контейнер для образцов.
- Предложите салфетки по мере необходимости.
- Взрослые и дети старшего возраста: расположите пациента в удобном сидячем положении, слегка вытянув шею.
ПЕРИКАРДИАЛЬНАЯ ЖИДКОСТЬ: см. КОРПУСНАЯ ЖИДКОСТЬ
ПЕРИТОНЕАЛЬНАЯ ЖИДКОСТЬ (включая абдоминальные, асцитические и диализные жидкости):
- Бактерии (стандарт) : Сначала внесите по 10 мл в каждую из бутылей для аэробных и анаэробных культур крови у постели пациента для оптимального роста и восстановления организмов.Если получено <20 мл, разделите жидкость поровну между бутылками. Дополнительная жидкость может подаваться в стерильную пробирку, что позволяет выполнить окрашивание по Граму и быстрее идентифицировать бактерии, присутствующие в высоких концентрациях. Включает культуры для выделения аэробных и анаэробных бактерий, а также Candida .
- Другие организмы : Перенесите жидкость в стерильную пробирку. Закажите «Посев других грибов с пятном КОН», если рассматривается гистоплазмоз, и / или посев микобактерий, если туберкулез брюшины является диагностическим соображением.
ПЛЕВРАЛЬНАЯ ЖИДКОСТЬ: см. КОРПУСНАЯ ЖИДКОСТЬ
PUS (см. Также WOUND):
- Сбор : Отправляют в стерильную прозрачную пластмассовую верхнюю пробирку черного цвета. Образец ткани предпочтительнее образца гноя, но гной — лучший образец, чем мазки, помещенные в транспортную среду.
ПРЯМОЙ:
- Neisseria gonorrhoeae и Chlamydia trachomatis :
- Обнаружение нуклеиновых кислот — чувствительный метод диагностики CT / NG-инфекций, рекомендуемый для большинства пациентов.
- Инструкции по взятию образцов ДНК CT / NG
- Культура Chlamydia trachomatis обычно показана для оценки неэффективности клинического лечения, когда ДНК может сохраняться после лечения. Для посева требуется транспортировка ткани или мазка в специальной среде UTM, которую можно получить в микробиологической лаборатории.
- Культура Neisseria gonorrhoeae обычно показана для оценки неэффективности клинического лечения и получения изолята для тестирования чувствительности.Для посева требуется мазок в транспортной среде Эми с углем.
МАТЧА И ТРАХЕСТВЕННЫЙ АСПИРАТ:
- Сбор : Образцы собирают прямым отхаркиванием в чистый пластиковый стаканчик, закрытый крышкой, которая не протекает (чистый нестерильный контейнер является удовлетворительным). Индукция мокроты при необходимости должна проводиться с помощью респираторной терапии, обычно за день до сбора. Могут быть представлены ловушки Люкена.По возможности, пациенту следует промыть ротовую полость свежей водой, прежде чем пытаться откашливать образец мокроты.
- Бактерии (стандартный метод) : Окрашивание по Граму выполняется по прибытии в лабораторию. Образцы, демонстрирующие большое количество плоскоклеточных клеток как свидетельство контаминации глотки, не будут обрабатываться в дальнейшем, а отправителю будет предложено предоставить новый, должным образом собранный образец.
- Грибы : Закажите посев на Aspergillus при подозрении. Candida spp. часто загрязняют дыхательные пути и оцениваются только у пациентов с трансплантацией легких и у других пациентов, у которых обнаружено их большое количество и в чистой культуре. При подозрении на системную инфекцию Histoplasma, Coccidioides, Blastomyces или возбудителями мукормикоза следует заказать «Посев на грибок». Образцы, собранные с помощью более инвазивных процедур, таких как бронхиальный лаваж, лучше подходят для обнаружения этих организмов.Укажите подозреваемых агентов в поле «Предупреждение / инструкции» при заказе теста в Apex. КОН обычно включается в культуру грибов.
- Mycobacteria : Соберите 3 отдельных образца мокроты с 8–12-часовыми интервалами, включая как минимум один образец ранним утром. Образцы мокроты, собранные с интервалом менее 8 часов, объединяют и тестируют как один образец.
- Паразиты : Направьте образцы Pneumocystis carinii в Цитологию.Для других паразитов укажите искомый организм при заказе теста.
- Вирусы : SPUTUM не является подходящим образцом.
- Herpes simplex : Поскольку HSV часто выводится бессимптомно, мокрота является плохим образцом для диагностики пневмонита, вызванного HSV. См. Выше бронхоальвеолярный лаваж.
- Респираторные вирусы : Для аспиратов трахеи можно заказать ПЦР на панель респираторных вирусов.
КОЖА (см. Также РАНУ):
- Коллекция : Ткань, полученная при биопсии, часто является лучшим образцом для диагностики кожных инфекций, но аспирированный или дренированный гной, везикулярная жидкость или соскобы кожи могут быть полезны для диагностики некоторых инфекций.
- Бактерии (обычные) : При рожистом воспалении, импетиго и целлюлите мазки, взятые из поверхностных покрытых коркой и мокнущих поражений, если они есть, должны быть помещены в транспортную среду.Аспирация иглой центра или края пораженной области имеет ограниченную полезность при этих инфекциях. При паронихии, белоснежности, фолликулите и карбункулах сдавайте аспирированный гной или, что менее желательно, гнойный дренаж на тампоне в транспортной среде.
- Грибы : При язвенных и / или узловых грибковых инфекциях кожи (споротрихоз, бластомикоз или инфекции, вызванные Cryptococcus spp.), Отправьте биопсию кожи с края поражения параллельно с образцом, отправленным в дерматопатологию. для гистологического исследования.Заказ «Культура грибов с пятном КОН». При поверхностных микозах (например, Candida , Epidermophyton, Trichophyton или Microsporum spp.) Отправьте соскоб с кожи, волос или ногтей в чистую пробирку и закажите «Грибковая культура, дерматофиты с грибковым пятном KOH». Clinic можно засеять непосредственно на микобиотический агар и отправить в лабораторию только для посева, заказав «Грибковые культуры, дерматофиты (дерматологическая клиника)».
- Mycobacteria и Nocardia spp.: При изъязвлениях и / или узелковых поражениях кожи, вызванных кислотоустойчивыми микроорганизмами (например, Mycobacterium marinum, Nocardia asteroides ), отправьте биопсию кожи на микобактериальную культуру параллельно с образцом, представленным в дерматопатологию для гистологического исследования.
- Паразиты : Для Leishmania spp. Мазки аспиратов или сенсорных препаратов окрашивают Гимза и исследуют под микроскопом. Для диагностики филяриальной (онхоцеркальной) инфекции можно исследовать влажные образцы среза кожи с ягодиц, икр или области над лопаткой; этот тест бесполезен для диагностики кожных мигрирующих личинок.Ткани следует отправить в дерматопатологию для гистологического исследования на паразитов.
- Вирусы :
- Herpes simplex: Чтобы получить образец для культивирования, снимите везикулу и соберите содержимое жидкости и базальный клеточный слой с помощью хлопкового тампона. Поместите тампон в универсальную транспортную среду (UTM). Сушеные корки от старых поражений не подходят. Тампоны с деревянными стержнями могут содержать токсичные для вируса соединения.Чтобы получить образец, пригодный для прямого исследования с флуоресцентными антителами, соскоблите основание открытой везикулы стерильным лезвием скальпеля и перенесите полученные клетки на два чистых стеклянных предметных стекла, оставив на каждом предметном стекле по два пятна, каждое примерно по 1,5 см. в диаметре (размером с десять центов). Дайте предметным стеклам высохнуть на воздухе и отправьте их на окрашивание. См. Также ветряную оспу ниже.
- Varicella-zoster: Прямое определение антигена — наиболее эффективное средство обнаружения.Чтобы получить образец, пригодный для прямого исследования с флуоресцентными антителами, соскоблите основание открытой везикулы стерильным лезвием скальпеля и перенесите полученные клетки на два чистых стеклянных предметных стекла, оставив на каждом предметном стекле по два пятна, каждое примерно по 1,5 см. в диаметре (размером с десять центов). Дайте предметным стеклам высохнуть на воздухе и отправьте их на окрашивание.
ТАБЛИЦА:
- Сбор : Соберите свежий образец в чистый пластиковый стаканчик с непротекающей крышкой (нестерильный контейнер подойдет).Доставить в лабораторию менее чем за 1 час. Амбулаторные пациенты должны получить инструкции и контейнеры в лаборатории или на станциях амбулаторной флеботомии. Для образцов, требующих консерванта, метод консервации описан ниже с описанием испытания.
- Бактерии (обычные) : Свежий стул должен быть получен в микробиологическую лабораторию в течение 3 часов после сбора. Восстановление Shigella , вероятно, улучшится, если образец будет доставлен в лабораторию в течение 15 минут после сбора.Доступны флаконы, содержащие транспортную среду Кэри-Блера для бактериального посева образцов кала, которые нельзя доставить в лабораторию в течение 3 часов после прохождения. Заполняйте эти емкости только до красной линии. Образцы стула дают более высокую скорость восстановления кишечных патогенов, чем ректальные мазки. Двух образцов, собранных с интервалом в 24–48 часов, достаточно для выявления подавляющего большинства случаев; большее количество образцов требует консультации с лабораторией. Мазки следует сдавать в консерванте Кэри-Блэра.
- Нозокомиальное заражение возбудителями стула чрезвычайно редко. При подозрении на бактериальный энтерит при поступлении в больницу необходимо запросить посев кала; они не будут приниматься в плановом порядке пациентам, которые были госпитализированы более 3 дней. За исключениями обращайтесь в лабораторию.
- Образцы обычно культивируют на Salmonella, Shigella , Campylobacter spp. и E. coli O157, и проверены на токсин шига. Aeromonas, Edwardsiella, и Plesiomonas также можно выделить из обычного посева стула. Если есть подозрение на наличие Yersinia или вибрионов ( Vibrio cholerae или V. parahaemolyticus ), закажите культуру для этих возбудителей отдельно.
- Токсин Clostridium difficile : Отправьте свежий стул. Бессимптомное носительство является обычным явлением, поэтому обследование следует проводить только пациентам с симптомами. Отправляйте табуреты ТОЛЬКО от пациентов с диареей (> = 3 стула без формы за <= 24 часа, стул должен соответствовать форме контейнера).У пациентов с кишечной непроходимостью можно взять мазок из прямой кишки - укажите «кишечную непроходимость» в поле для комментариев при заказе теста. Повторные анализы в течение 1 недели без разрешения микробиологической лаборатории не допускаются. Для тестирования пациентов младше 1 года требуется одобрение Службы детских инфекционных болезней.
- Фекальные лейкоциты : С помощью палочки-аппликатора выберите образец диарейного стула, включая кровянистые или слизистые выделения, если они есть.Поскольку лейкоциты лизируются в старых образцах, образец следует доставить в лабораторию в течение 3 часов после сбора. Этому тесту не хватает чувствительности и специфичности для диагностики причины внутрибольничной диареи, и он проводится только у амбулаторных больных и у пациентов <72 часов после госпитализации.
- Жировые шарики, качественный мазок для : Отправьте несохраненный стул. Этот тест полезен только для пациентов старше 6 месяцев.
- Грибки : Тест не предлагался.
- Mycobacteria : Тест не предлагается.
- Паразиты («O&P») : Соберите 3 образца (не более одного за 24–48 часов), чтобы повысить вероятность положительного результата. Свежий стул необходимо получить в микробиологическую лабораторию в течение 1 часа после сбора. В качестве альтернативы отправляйте стул во флаконах с фиксатором SAF (ацетат натрия-уксусная кислота-формалин). Следуйте инструкциям, прилагаемым к флаконам. Заполняйте только красную линию. Пациенты не должны получать противомикробную терапию или контрастное вещество с барием в течение как минимум 7 дней до сбора образца.
- Cryptosporidium : Обычное обследование яиц и паразитов включает скрининговый тест на Cryptosporidium . Если стандартное обследование O&P отрицательно на Cryptosporidium и подозрение на инфекцию все еще сохраняется, закажите обследование на кокцидии, которое позволит выявить небольшое количество микроорганизмов.
- Giardia lamblia : Добавьте свежий стул или стул в фиксаторе SAF. Тест на антиген предпочтительнее исследования на яйца и паразиты, если Giardia является единственным кишечным паразитом при дифференциальной диагностике. Нозокомиальное заражение паразитами встречается даже реже, чем нозокомиальный шигеллез. Если есть подозрение на паразитарный энтерит, при поступлении в больницу следует запросить O&P обследование; они не будут приниматься в плановом порядке пациентам, которые были госпитализированы более 3 дней.За исключениями обращайтесь в лабораторию.
- Microsporidium : Заказывается отдельно от стандартного осмотра на яйца и паразиты.
- Острица : Соберите 3 лопаточки за 3 утра подряд. Соберите каждый образец ПЕРЕД дефекацией или купанием. Лопасти для забора крови можно приобрести в амбулаторных пунктах для флеботомии или в лаборатории. Если этих лопаток нет в наличии, для сбора можно использовать прозрачный прозрачный скотч (, а не Magic Mending tape) и наклеить липкой стороной вниз на чистое предметное стекло микроскопа.
- Вирусы : Возбудители вирусного гастроэнтерита, как правило, не культивируются, включая аденовирус 40 и 41, агент Norwalk и ротавирус .
- Enterovirus : ПЦР для энтеровирусов используется только для определения причины асептического менингита и / или вирусного сепсиса новорожденных. Поместите свежий, неконсервированный стул в стерильную емкость.
- Антиген ротавируса : Тест на антиген ротавируса с помощью EIA доступен для диагностики диарейных заболеваний у педиатрических пациентов.Отправляйте свежий стул в пластиковый стаканчик. Повторное тестирование можно проводить каждые 7 дней.
ГОРЛО:
- Бактерии (стандарт) : Отправьте дакроновый тампон в бумажной обертке. Если не требуется поиск конкретного организма или диагноза (например, дифтерия, гонорея, молочница), посевы из горла обычно обрабатываются только , чтобы исключить возможность стрептококкового фарингита группы А.
- Neisseria gonorrhoeae и Chlamydia trachomatis :
- Обнаружение нуклеиновых кислот — чувствительный метод диагностики CT / NG-инфекций, рекомендуемый для большинства пациентов.
- Инструкции по взятию образцов ДНК CT / NG
- Культура Chlamydia trachomatis обычно показана для оценки неэффективности клинического лечения, когда ДНК может сохраняться после лечения. Для посева требуется транспортировка ткани или мазка в специальной среде UTM, которую можно получить в микробиологической лаборатории.
- Культура Neisseria gonorrhoeae обычно показана для оценки неэффективности клинического лечения и получения изолята для тестирования чувствительности.Для посева требуется мазок в транспортной среде Эми с углем.
- Грибы : см. Бактерии (обычные) — укажите диагноз возможной молочницы.
- Вирусы : См. ОБРАЗЦЫ НАСОФАРИНГЕЛЯ для получения информации о надлежащем отборе образцов на респираторные вирусы.
ТКАНИ (см. Также РАНУ):
- Отправить в транспортном флаконе для анаэробов (имеется в операционных и в микробиологическом отделении) или в стерильном контейнере, если он слишком велик для размещения во флаконе для анаэробного транспорта.Не помещайте салфетки в транспортную среду Amies с углем
.
ТРАХЕАЛЬНЫЙ АСПИРАТ: см. МАТЕРИАЛ
УРЕТРА:
- Сбор : Протрите уретру начисто и предпочтительно собирайте образец через> 1 час после мочеиспускания
- Бактерии : «Молочить» уретру и собирать отделяемое. Если выделений нет, введите тампон на 2–4 см в уретру и вращайте в течение 15–30 секунд.Поместите тампон для сбора в транспортную среду Amies, содержащую древесный уголь, и отправьте его в лабораторию в течение 6 часов после сбора.
- Neisseria gonorrhoeae , Chlamydia trachomatis и Trichomonas vaginalis :
- Обнаружение нуклеиновых кислот — чувствительный метод диагностики CT / NG и инфекций Trhichomonas vaginalis, рекомендуемый для большинства пациентов.
- Инструкции по взятию образцов РНК CT / NG и Trichomonas vaginalis
- Культура Chlamydia trachomatis обычно показана для оценки неэффективности клинического лечения, когда ДНК может сохраняться после лечения.Для посева требуется транспортировка ткани или мазка в специальной среде UTM, которую можно получить в микробиологической лаборатории.
- Культура Neisseria gonorrhoeae обычно показана для оценки неэффективности клинического лечения и получения изолята для тестирования чувствительности. Для посева требуется мазок в транспортной среде Эми с углем.
МОЧА:
- Коллекция : Культура должна быть охлаждена незамедлительно , а , а не должна находиться у постели пациента при комнатной температуре.
- Чистая моча для посева собирается в чистый, сухой пластиковый стаканчик с непротекающей крышкой (нестерильные емкости разрешены):
- Самки :
- Попросить пациента:
- Вымыть руки водой с мылом
- Раздвинув половые губы, промойте всю область стерильной очищающей салфеткой из комплекта поставки; протирание спереди назад.
- Продолжайте раздвигать половые губы и начать мочиться прямо в унитаз.
- На полпути установите контейнер, а затем начните мочиться в контейнер. Не прикасайтесь контейнером к области гениталий
- Стакан наполнять не обязательно, достаточно наполовину.
- Попросите пациента вернуть образец в указанное место.
- Мужчины :
- Попросить пациента:
- Вымыть руки водой с мылом
- Оттяните крайнюю плоть, если имеется
- Полностью промойте головку полового члена («головку» полового члена) с помощью прилагаемой стерильной очищающей салфетки.
- Начало мочеиспускания прямо в унитаз
- Во время приготовления пара установите емкость, затем начните мочиться в емкость. Не прикасайтесь контейнером к области гениталий
- Стакан наполнять не обязательно, достаточно наполовину.
- Вернуть образец в указанное место.
- Попросить пациента:
- Попросить пациента:
- Мочу с постоянного катетера собирают путем аспирации мочи через порт катетера с помощью стерильной трубки Vacutainer с красной пробкой («простая, стерильная»).В качестве альтернативы, мочу можно собрать с помощью иглы и шприца и перенести в вакуумную трубку с красной пробкой (откройте верхнюю часть вакуумной трубки; нет необходимости проходить через резиновую диафрагму иглой). Не отправляйте мочу из длинной дренажной трубки или мешка для сбора.
- Первый сбор мочи сразу после введения катетера считается «прямой катетеризацией мочи». Мочу с прямого катетера собирают с помощью наборов для сбора катетера. Мочу помещают в чашку с завинчивающейся крышкой.
- Посевы на кончике катетера Фолея не подходят для диагностики инфекции мочевыводящих путей и не принимаются для обработки.
- Самки :
- Чистая моча для посева собирается в чистый, сухой пластиковый стаканчик с непротекающей крышкой (нестерильные емкости разрешены):
- Бактерии (стандартный метод) : Количественный посев проводится на всех образцах мочи. Окрашивание по Граму выполняется только по запросу. Одной культуры достаточно в клинической ситуации, требующей быстрого начала терапии. Нет необходимости сдавать повторные образцы ежедневно или с другими частыми интервалами.
- Сообщения о смешанной флоре половых органов с другими организмами в количестве> 1000 колониеобразующих единиц (КОЕ) / мл будут сопровождаться пометкой, такой как «Присутствует смешанная флора. Предлагать воспоминания, если это клинически показано». Смешанную флору обычно не выявляют, если образец не был должным образом взят из катетера или нефростомической трубки. Если культура дает один организм, организм будет идентифицирован. Если присутствуют два или более микроорганизмов, они будут идентифицированы в соответствии с алгоритмом, который учитывает клинические условия и общее количество бактерий в моче.Тесты на чувствительность обычно выполняются только в том случае, если> 10 000 КОЕ / мл обнаружено в средней части моче или если> 1000 КОЕ / мл присутствует в образцах, полученных с помощью катетера, уретеростомии или нефростомического дренажа. Врач, желающий провести другую процедуру с образцом, должен обратиться в лабораторию.
- Скрининговая культура : Скрининговую культуру можно запросить, нажав кнопки «Пропустить идентификатор» и «Пропустить чувствительность» в поле «Предупреждения / инструкции» при заказе посева мочи в Apex.Это менее дорогостоящая количественная культура, для которой идентификация видов и тестирование на чувствительность будут проводиться (за дополнительную плату) только по специальному запросу после того, как будут представлены результаты . Чашки с положительными скрининговыми культурами сохраняют в течение 7 дней. Этот тест особенно подходит для скрининга детей, беременных женщин, молодых женщин с первыми инфекциями мочевых путей, а также пациентов, которым проводят дренирование через катетер Фолея.
- Грибы : Закажите бактериальный посев при подозрении на грибковую инфекцию мочевыводящих путей.При подозрении на заражение другими грибковыми возбудителями проконсультируйтесь с лабораторией перед сдачей мочи.
- Mycobacteria : Лучший образец мочи — это первое утреннее мочеиспускание, то есть примерно 8-часовой образец, содержащийся в условиях, обычно свободных от других бактерий. Посев мочи в течение 24 часов не проводится, поскольку чрезмерный рост загрязняющих веществ является частой причиной неудачных результатов посева кислотоустойчивых культур. Образцы должны быть собраны методом «чистых мочеиспусканий» (см. Выше).Поскольку туберкулез мочевыводящих путей в нашей популяции пациентов встречается крайне редко, посев мочи на микобактерии требует консультации с лабораторией. Посевы обычно ограничиваются пациентами с положительными PPD, у которых обнаружена необъяснимая пиурия с отрицательными стандартными бактериальными культурами. Посев мочи не следует использовать для выявления случаев туберкулеза легких. Окрашивание мочи на КУБ обычно не проводится, поскольку моча редко бывает положительной, а непатогенные микобактерии морфологически сходны с M.tuberculosis часто присутствуют в мочеполовых путях.
- Паразиты : Мочу, собранную и объединенную между 1000 и 14 часами, можно исследовать на Schistosoma haematobium и (редко) микрофилярии.
- Вирусы :
- CMV: Посев мочи на CMV подходит только для новорожденных до 3 недель, чтобы попытаться зарегистрировать врожденную инфекцию, в отличие от инфекции, приобретенной во время родов, которая становится положительной через 3-4 недели после родов.Моча от пациентов старше 3 недель требует одобрения Службы инфекционных заболеваний или начальника отдела.
- Аденовирус, вирус BK (паповавирус), эпидемический паротит, корь, краснуха: Запросы на корь и краснуху требуют консультации с Департаментом общественного здравоохранения СФ. Закажите тест ДНК вируса BK Количественная ПЦР на вирус BK, который более чувствителен, чем культура.
VAGINA / CERVIX:
- Коллекция : Используйте зеркало без смазки (смазка может быть токсичной для интересующих клеток и микроорганизмов).Очистите шейку матки от выделений из влагалища и слизи.
- Бактерии : Соберите эндоцервикальный экссудат на дакроновый тампон вращательным движением. Поместите тампон в транспортную среду Amies, содержащую древесный уголь, и отправьте его в лабораторию в течение 6 часов после сбора.
- Если указан посев на потенциальные патогены, отличные от Neisseria gonorrhoeae , закажите Бактериальная культура и окраска по Граму, Genital и по возможности укажите, какие потенциальные патогены вызывают озабоченность.Возможные патогены включают бета-гемолитические стрептококки, Staphlococcus aureus, большое количество дрожжевых грибов и грамотрицательных палочек, а также видов Haemophilus и т. Д.
- Вагинально-ректальный посев беременных на стрептококки группы B следует заказывать как Streptococcus Group B Culture .
- Бактериальный вагиноз / вагинит : Закажите мазок из влагалища на бактериальный вагиноз / дрожжи и отправьте тонкие мазки вагинальных выделений на 2 предметных стекла или возьмите мазок в транспортной среде Эми с углем.Микроскопическое исследование мазка вагинального секрета, окрашенного по Граму, может выявить как «ключевые» клетки, соответствующие диагнозу бактериального вагиноза, так и дрожжевые грибки.
- Neisseria gonorrhoeae, Chlamydia trachomatis и Trichomonas vaginalis :
- Обнаружение нуклеиновых кислот — чувствительный метод диагностики инфекций CT / NG и Trichomonas vaginalis, рекомендуемый для большинства пациентов.
- Инструкции по взятию образцов РНК CT / NG и Trichomonas vaginalis
- Культура Chlamydia trachomatis обычно показана для оценки неэффективности клинического лечения, когда ДНК может сохраняться после лечения. Для посева требуется транспортировка ткани или мазка в специальной среде UTM, которую можно получить в микробиологической лаборатории.
- Культура Neisseria gonorrhoeae обычно показана для оценки неэффективности клинического лечения и получения изолята для тестирования чувствительности.Для посева требуется мазок в транспортной среде Эми с углем.
- Herpes simplex : Чтобы получить образец для посева, осторожно очистите поверхность интактного полового пузырька физиологическим раствором. Снимите крышу с пузырьков и соберите жидкое содержимое и слой базальных клеток с помощью хлопкового тампона. Поместите тампон в универсальную транспортную среду (UTM). Тампоны с деревянными стержнями могут содержать токсичные для вируса соединения. Чтобы получить образец, пригодный для прямого исследования с флуоресцентными антителами, соскоблите основание открытой везикулы стерильным лезвием скальпеля и перенесите полученные клетки на два чистых предметных стекла, оставив на каждом предметном стекле по два пятна, каждое примерно по 1.5 см. в диаметре (размером с десять центов). Дайте предметным стеклам высохнуть на воздухе и отправьте их на окрашивание.
- Стрептококк группы B : Для оптимальной чувствительности получите селективную бульонную среду от Microbiology. Возьмите мазки из нижней части влагалища и прямой кишки и отправьте мазки в среду в лабораторию. В качестве альтернативы отправьте мазки в транспортную среду Amies, содержащую древесный уголь.
- Trichomonas vaginalis: Отправьте мазок из влагалища или шейки матки APTIMA, см. Инструкции по взятию образцов ДНК CT / NG.
- Дрожжи : см. Бактериальный вагиноз выше. Вагинальный мазок на бактериальный вагиноз / дрожжевые грибки позволяет легко обнаружить клинически активную вагинальную дрожжевую инфекцию. Как правило, в культуре нет необходимости, если только не требуется изоляция организма для тестирования чувствительности в случае неэффективности лечения.
РАНА (включая абсцесс и дренаж; см. Также КОЖА и ТКАНИ):
- Сбор : Образец ткани предпочтительнее образца гноя, но гной лучше мазков, взятых в транспортной среде.
- Отправьте ткань во флаконе для транспортировки анаэробов (имеется в операционных и в микробиологическом отделении) или в стерильном контейнере, если он слишком велик, чтобы поместиться в флакон для транспортировки анаэробов. Не помещайте ткань в транспортную среду Amies с углем. Слейте жидкость в стерильную прозрачную пластиковую черную пробирку. Если ткани, гноя или жидкости недостаточно, отправьте по крайней мере два дакроновых мазка в транспортной среде Amies с древесным углем.
- Бактерии (стандарт) : Включает процедуры по выделению аэробных и анаэробных бактерий.Анаэробные культуры могут быть выполнены только из мазков, если мазки помещены в транспортную среду Эми с углем. Анаэробные посевы не производятся на образцах, таких как мазки от фурункулов, мазок с катетерного наконечника, целлюлит, пролежни, пустулы / гной, кожа, швы, язвы (но не из операционной) и кончики перитонеальных шунтов.
- Грибы :
- Candida and Aspergillus: Культуры на эти патогены следует особо запрашивать при подозрении на их присутствие в абсцессах и поверхностных ранах.Ткани и жидкости из обычно стерильных участков автоматически исследуются на наличие дрожжей и Aspergillus .
- Другие виды: При подозрении на наличие других грибов, образующих мицелий, оптимальным образцом является биопсия пораженной ткани. Посевы проводятся 30 дней. Мазки являются неприемлемыми образцами для культивирования мицелий-образующих организмов, особенно организмов, вызывающих мукормикоз, поскольку они часто не позволяют выявить патоген, обнаруженный в биоптатах и выращенный на их основе.
- Mycobacteria: Посев из ран на микобактерии указывается нечасто и не проводится из мазков. Если Nocardia spp. подозреваются, закажите культуру AFB и укажите «Ищите Nocardia».
- Паразиты : см. Кожа
- Вирусы : Запросить тестирование конкретных вирусов, представляющих клинический интерес.Ткани из инфицированных зон следует собирать в асептических условиях и перевозить в лабораторию в универсальной транспортной среде (UTM).
- Цитомегаловирус : Ткани можно культивировать на ЦМВ, но трудно различить выделение ЦМВ (носительство) и активное заболевание.
Сообщается обо всех организмах, присутствующих в обычно стерильных материалах, независимо от того, могут ли они быть контаминантами.О видах, которые, как известно, часто являются патогенными, можно сообщать из обычно нестерильных районов; однако, когда они присутствуют в небольшом количестве, они не обязательно являются клинически значимыми. Нормальная флора представлена в следующей таблице
.
ОРГАНИЗМЫ, СООТВЕТСТВУЮЩИЕ НОРМАЛЬНОЙ ФЛОРЕ
Культуры желудочно-кишечного тракта и прямой кишки
- различных грамотрицательных бактерий, кроме Salmonella, Shigella, Campylobacter, Aeromonas, Yersinia, Edwardsiella и Vibrio видов
- грамотрицательные палочки, не ферментирующие декстрозу, энтерококки
- энтерококки
- Эпидермальный стафилококк
- альфа-гемолитические и негемолитические стрептококки
- дифтероиды
- Золотистый стафилококк в малых количествах
- дрожжи в небольших количествах
- анаэробы в большом количестве
Генитальные культуры
- Любая из следующих сумм:
- Corynebacterium видов
- Lactobacillus видов
- альфа-гемолитические и негемолитические стрептококки
- непатогенные Neisseria видов
- Следующие смешанные и не преобладающие:
- Энтерококки
- Enterobacteriaceae и другие грамотрицательные палочки
- Эпидермальный стафилококк
- Золотистый стафилококк
- Gardnerella vaginalis
- Candida видов и другие дрожжи
- Анаэробы (слишком много видов, чтобы перечислить)
Ороназальные (оральные, назальные и глоточные) культуры
- Любая из следующих сумм:
- Corynebacterium виды
- непатогенные Neisseria видов
- альфа-гемолитические и негемолитические стрептококки
- Эпидермальный стафилококк
- анаэробов (слишком много видов, чтобы перечислить; различное количество видов Prevotella, видов, анаэробных кокков, видов Fusobacterium, и т. Д.)
- Меньшие количества следующего, когда они сопровождаются вышеуказанным:
- дрожжи
- Haemophilus видов
- пневмококки
- Золотистый стафилококк
- грамотрицательные стержни
- Neisseria meningitidis
Культуры кожи
- Staphylococcus epidermidis
- Staphylococcus aureus (в небольших количествах)
- видов микрококков
- непатогенный Neisseria
- альфа-гемолитические и негемолитические стрептококки
- Propionibacterium видов
- небольшое количество других организмов (например,g., Candida или Acinetobacter видов)
Тестирование на чувствительность выполняется методом разбавления микротитровального бульона, а в особых случаях — методом дисковой диффузии [Бауэра-Кирби]. Формы тестирования чувствительности и отчетов предоставляют как числовые, так и интерпретирующие отчеты о минимальной ингибирующей концентрации (МИК) каждого тестируемого препарата. МИК, самая низкая концентрация лекарственного средства, подавляющего рост организма in vitro , указывается в мг / л (мкг / мл).
Используются различные батареи лекарств. В таблицах на следующих страницах указаны препараты, указанные для конкретных типов организмов. Система постоянно корректируется в соответствии с новой информацией и текущими потребностями. Тестирование на чувствительность к другим лекарствам не проводится без консультации со Службой инфекционных заболеваний или Аптекой по инфекционным заболеваниям.
Тесты на чувствительность будут регулярно проводиться для любого организма, который считается потенциально значимым в лаборатории, если тест не был проведен на том же организме в течение 7 дней (4 дня для устойчивых к нафциллину Staphylococcus aureus, Pseudomonas aeruginosa, Citrobacter, Enterobacter, и Serratia spp.) . Чашки со значительными культурами хранятся в лаборатории в течение 7 дней после выпуска окончательного отчета. Таким образом, можно получить уязвимость после получения отчета.
Совместно с Комитетом по фармации и терапии и Службой инфекционных заболеваний отдел микробиологии клинических лабораторий разработал иерархическую схему отчетности о результатах тестов на чувствительность к противомикробным препаратам. Целью условной отчетности является сокращение использования более дорогих или токсичных противомикробных препаратов в тех случаях, когда они не нужны, и, таким образом, снижение огромных затрат на использование противомикробных препаратов в UCSF.
Результаты по чувствительности будут представлены для панели первичных лекарств, состоящей из стандартных, менее дорогих (часто генерических) и менее токсичных агентов. Если организмы устойчивы к этим основным лекарствам, будут сообщены дополнительные результаты для более дорогих, потенциально более токсичных лекарств второго выбора. Эта процедура соответствует общим принципам, установленным Институтом клинических и лабораторных стандартов, и рекомендована Консультативным подкомитетом UCSF по антибиотикам Комитета по фармации и терапии.
Таблицы лекарств были разработаны для стафилококков, стрептококков, энтерококков, энтеробактерий, Pseudomonas aeruginosa и других микроорганизмов и учитывают, получены ли изоляты из мочи или из других мест. Всегда указываются первичные препараты; О вторичных препаратах сообщается только в том случае, если обнаружена устойчивость к конкретному первичному препарату. Эти панели и вторичные препараты, о которых сообщается условно, описаны ниже:
| Первичные препараты | Вторичные препараты |
|---|---|
| Клиндамицин (подавлен в моче и спинномозговой жидкости; подавлен в группе S. epidermidis , если эритромицин-R и клиндамицин-S или -I) | |
| Эритромицин (подавленный в моче и спинномозговой жидкости) | |
| Нафциллин, в случае устойчивости: Для чувствительных к нафциллину изолятов нафциллин или цефазолин являются препаратами выбора. | Ванкомицин |
| Пенициллин (Если не сообщается, но рассматривается возможность лечения, обратитесь в отдел микробиологии.) | |
| Тетрациклин (подавлен в спинномозговой жидкости и крови) | |
| Триметоприм-сульфаметоксазол (подавлен в крови) |
Staphylococcus saprophyticus
- Регулярно не тестировался.Добавлено примечание: инфекции мочевыводящих путей, вызванные этим микроорганизмом, реагируют на противомикробные препараты, такие как нитрофурантоин, ТМП SMZ или фторхинолон в концентрациях, достигаемых в моче у пациентов с нормальной функцией почек. Обратитесь в лабораторию для тестирования чувствительности в случае неэффективности лечения или аллергии.
| Первичные препараты | Вторичные препараты |
|---|---|
| Ампициллин | |
| Ципрофлоксацин (только моча) | |
| Гентамицин, высокий уровень (подавляется в моче) | |
| Нитрофурантоин (только моча) | |
| Тетрациклин (только моча) | |
| Ванкомицин, Отчет о резистентности: | Тетрациклин (только нестерильные участки) Даптомицин (зарегистрировано по VRE из стерильных участков, кроме CSF) Линезолид (зарегистрировано по VRE из стерильных участков, включая CSF) |
| Первичные препараты |
|---|
| Клиндамицин |
| Эритромицин |
| Пенициллин |
| Первичные препараты |
|---|
| Клиндамицин |
Группа B Streptococcus (стерильные участки)
- Регулярно не тестировался.Добавлено примечание: (Этот вид повсеместно чувствителен к пенициллину. Тест на чувствительность показан только для пациентов с аллергией.)
| Первичные препараты |
|---|
| Цефотаксим |
| Цефтриаксон |
| Клиндамицин (подавлен в CSF) |
| Эритромицин (подавлен в CSF) |
| Левофлоксацин (подавлен в CSF) |
| Пенициллин |
| Ванкомицин |
Streptococcus pneumoniae
- сайтов, отличных от крови и спинномозговой жидкости) и выделить из нестерильных участков с пониженной чувствительностью к пенициллину:
| Первичные препараты | Вторичные препараты |
|---|---|
| Цефотаксим | |
| Цефтриаксон, отчет о промежуточной или резистентности: | Меропенем |
| Клиндамицин | |
| Эритромицин | |
| Левофлоксацин | |
| Пенициллин | |
| Тетрациклин | |
| Триметоприм-сульфаметоксазол | |
| Ванкомицин |
- Кровь или CSF:
| Первичные препараты | Вторичные препараты |
|---|---|
| Цефотаксим | |
| Цефтриаксон, отчет о промежуточной или резистентности: | Меропенем |
| Пенициллин | |
| Ванкомицин |
Коринебактерии
- Восприимчивость выполняется по запросу.
Neisseria meningitidis
- Чувствительность определяют на изолятах из стерильных центров.
Сообщается о следующих препаратах для профилактики контактов с менингококковой инфекцией, но не для лечения пациентов с инвазивным менингококком:
| Первичные препараты |
|---|
| Азитромицин |
| Ципрофлоксацин |
| Миноциклин |
| Рифампицин |
Haemophilus influenzae
- Восприимчивость выполняется по запросу.
Salmonella
Критерии определения чувствительности изолятов кала:
- младенцы <6 месяцев
- Salmonella typhi , S. paratyphi A, S. choleraesuis
Первичные препараты | Вторичные препараты |
Ампициллин (подавлен в CSF), , если промежуточный или устойчивый: | Ампициллин-сульбактам (подавлен в CSF) |
Цефтриаксон (подавляется при стуле, за исключением Salmonella typhi , S.paratyphi A, S. choleraesuis | |
Триметоприм-сульфаметоксазол | |
Ципрофлоксацин (подавлен в спинномозговой жидкости) | |
Левофлоксацин (подавлен CSF) |
Shigella / Plesiomonas / Edwardsiella tarda
Первичные препараты | Вторичные препараты |
Ампициллин (подавлен в CSF), , если промежуточный или устойчивый: | Ампициллин-сульбактам (подавлен в CSF) |
Цефтриаксон (подавляется при стуле) | |
Ципрофлоксацин (подавлен в спинномозговой жидкости) | |
Левофлоксацин (подавлен CSF) | |
Триметоприм-сульфаметоксазол |
Aeromonas
Первичные препараты |
Цефтриаксон (подавляется при стуле) |
Ципрофлоксацин (подавлен в спинномозговой жидкости) |
Левофлоксацин (подавлен в спинномозговой жидкости) |
Триметоприм-сульфаметоксазол |
Холерный вибрион
Первичные препараты |
Ампициллин |
Триметоприм-сульфаметоксазол |
Тетрациклин |
Vibrio spp., а не V. cholerae
Первичные препараты | Вторичные препараты |
Ампициллин (подавлен в CSF), , если промежуточный или устойчивый: | Ампициллин-сульбактам (подавлен в CSF) |
Цефтазидим (подавляется при стуле) | |
Ципрофлоксацин (подавлен в спинномозговой жидкости) | |
Левофлоксацин (подавлен в спинномозговой жидкости) | |
Триметоприм-сульфаметоксазол | |
Тетрациклин |
Campylobacter
Препарат сообщается только при наличии устойчивости
Первичные препараты |
Ципрофлоксацин |
Эритромицин |
| Первичные препараты | Вторичные препараты |
|---|---|
| Ампициллин-сульбактам (подавлен на CSF и Enterobacter spp.) | Ампициллин-сульбактам (подавлен на CSF и Enterobacter spp.) |
| Цефазолин (подавлен в CSF) | |
| Цефепим ( Enterobacter только spp.) | |
| Цефтриаксон (подавлен на Enterobacter spp.), Отчет о промежуточной или резистентности: | Цефепим и Эртапенем Если указывается Эртапенем-I или R, меропенем |
| Ципрофлоксацин (подавлен в CSF) | |
| Эртапенем (подавлен в CSF; Enterobacter spp.только), если отчет промежуточный или стойкий: | Меропенем |
| Гентамицин | |
| Левофлоксацин (подавлен в CSF) | |
| Нитрофурантоин (только моча) | |
| Пиперациллин-тазобактам (подавлен на CSF и Enterobacter spp. Со всех участков, кроме мочи) | |
| Тобрамицин | |
| Триметоприм-сульфаметоксазол |
| Первичные препараты | Вторичные препараты |
|---|---|
| Азтреонам (подавлен, если цефтазидим I или R) | |
| Цефтазидим, , если указано промежуточное или устойчивое состояние: | Цефепим и меропенем |
| Ципрофлоксацин (подавлен в CSF) | |
| Левофлоксацин (подавлен в CSF) | |
| Пиперациллин-тазобактам (подавлен в спинномозговой жидкости) | |
| Тобрамицин, , отчет о резистентности: | Амикацин |
Stenotrophomonas maltophilia
- Изоляция этого организма из нестерильных участков может представлять собой колонизацию.По вопросам лекарственной чувствительности обращайтесь в микробиологическую лабораторию. Для получения рекомендаций по эмпирической терапии обратитесь в аптеку ID. Чувствительность обычно определяется на стерильных участках и у пациентов с муковисцидозом:
| Первичные препараты |
|---|
| Цефтазидим |
| Миноциклин |
| Триметоприм-сульфаметоксазол |
| Первичные препараты | Вторичные препараты |
|---|---|
| Ампициллин-сульбактам (подавлен в CSF) | |
| Цефтриаксон, , если указано промежуточное или устойчивое состояние : | Цефепим и меропенем |
| Ципрофлоксацин (подавлен в CSF) | |
| Гентамицин | |
| Левофлоксацин (подавлен в CSF) | |
| Пиперациллин-тазобактам (подавлен в спинномозговой жидкости) | |
| Тобрамицин | |
| Триметоприм-сульфаметоксазол |
| Первичные препараты | Вторичные препараты |
|---|---|
| Азтреонам (подавлен, если цефтазидим I или R) | |
| Цефтазидим, , если указано промежуточное или устойчивое состояние: | Цефепим и меропенем |
| Ципрофлоксацин (подавлен в CSF) | |
| Гентамицин | |
| Левофлоксацин (подавлен в CSF) | |
| Пиперациллин-тазобактам (подавлен в спинномозговой жидкости) | |
| Тобрамицин | |
| Триметоприм-сульфаметоксазол |
| Первичные препараты |
|---|
| Цефтазидим |
| Меропенем |
| Миноциклин |
| Триметоприм-сульфаметоксазол |
Campylobacter
- Препарат сообщается только при наличии устойчивости
| Первичные препараты | |
|---|---|
| Амикацин | |
| Цефотаксим | |
| Цефтриаксон | |
| Ципрофлоксацин | |
| Имипенем | |
| Миноциклин | |
| Триметоприм-сульфаметоксазол |
| Первичные препараты |
|---|
| Амикацин |
| Цефокситин |
| Ципрофлоксацин |
| Кларитромицин |
| Доксициклин |
| Тобрамицин (сообщается только в том случае, если M.chelonae) |
| Триметоприм-сульфаметоксазол |
Если подходящий первичный или вторичный препарат недоступен, по запросу может быть проведено тестирование на соответствующие дополнительные противомикробные препараты. Проконсультируйтесь в лаборатории.
Результаты восприимчивости интерпретируются с использованием рекомендаций CLSI, основанных на значениях MIC или размерах зон Кирби-Бауэра. Интерпретация результатов теста на восприимчивость определяется следующим образом:
S- Восприимчивый : Противомикробный препарат подавляет организм в концентрации, легко достижимой в крови и моче при обычных дозировках.
I- Промежуточный (или неопределенный): Для достижения ингибирующей концентрации в сыворотке могут потребоваться более высокие дозы противомикробного препарата, чем обычно. Интерпретация I для антипсевдомонадных пенициллинов предполагает только то, что препарат не следует использовать в качестве отдельного агента, а следует применять в комбинации с аминогликозидом.
R- Устойчивый : Противомикробный препарат не подавляет организм даже в концентрациях, достижимых в сыворотке или моче при использовании высоких доз.
Актуальную информацию о совокупном проценте обычно изолированных видов бактерий, чувствительных к определенному уровню противомикробных препаратов, и о количестве штаммов в базе данных UCSF можно найти по адресу http://clinicalpharmacy.ucsf.edu/idmp/antibiogram_home.htm . Данные включают изоляты как внебольничных, так и внутрибольничных инфекций, которые соответствуют лабораторным критериям потенциальной клинической значимости (например, моча> = 100000 / мл, изоляты из обычно стерильных участков, таких как кровь, преобладающие организмы из раны и т. Д. .). Однако не все бактерии однозначно представляют собой клинически значимые инфекции (например, S. epidermidis ).
Синдромы и возможные | Назофаринкс * | Горло | Табурет | CSF | Моча | Прочие |
| Респираторный синдром | ||||||
| Вирус гриппа A, B | +++ (ПЦР) | |||||
| Парагрипп | ++ (ПЦР) | |||||
| Респираторно-синцитиальный вирус | ++++ (ПЦР) | |||||
| Аденовирус | ++ (ПЦР) | |||||
| Риновирус | +++ (ПЦР) | |||||
| Метапневмовирус | ++ (ПЦР) | |||||
| Корона (вкл.SARS) | ++ (ПЦР) | |||||
| Дерматологические заболевания и заболевание слизистых оболочек | ||||||
| Везикулярный | ||||||
| Простой герпес | везикула (C, FA) +++ | |||||
| Varicella zoster | везикула (FA) ++++ | |||||
| Энтеровирус (синдром кисти, стопы и рта) | везикула (ПЦР) ++ | |||||
| Экзантематический | ||||||
| Энтеровирус | плазма (ПЦР) +++ | |||||
| Корь | +++ (C, ПЦР) | ++ (C, ПЦР) | кровь (S) +++ | |||
| Краснуха | +++ (ПЦР) | +++ (ПЦР) | кровь +++ | |||
| Менингоэнцефалит | ||||||
| Арбовирус (например,Западный Нил) | +++ (ПЦР) | кровь (S) +++ | ||||
| Энтеровирус | +++ (ПЦР) | |||||
| Простой герпес | +++ (ПЦР) | |||||
| VZV | ++ (ПЦР, S) | |||||
| Желудочно-кишечный | ||||||
| Ротавирус | ++ (Ag, ПЦР) | |||||
| Норовирусы | ++ (ПЦР, Ag) | кровь (S) | ||||
| Врожденный и перинатальный | ||||||
| Цитомегаловирус | ++++ (К) | |||||
| Энтеровирус | кровь (ПЦР) +++ | |||||
| Вирус простого герпеса | ++ (К) | ++ (ПЦР) | везикула (FA, C) ++++ | |||
| ЦМВ-инфекция | ||||||
| Цитомегаловирус (CMV) | ++++ (К) | кровь (ПЦР) +++ | ||||
| Гепатит (A-E) | кровь (S, ПЦР) ++++ | |||||
| Гепатиты B и C | кровь (S, ПЦР) +++ | |||||
| СПИД | ||||||
| ВИЧ | кровь (S) ++++ | |||||
| Миокардит, перикардит и плевродиния | ||||||
| Коксаки Б | перикардиальная жидкость (ПЦР) + | |||||
Ag = обнаружение антигена
bDNA = разветвленная ДНК
C = культура
FA = флуоресцентное антитело
H = гистология
ПЦР = полимеразная цепная реакция
S = серология
++++ = вероятность положительности
«Индуцированная мокрота по сравнению с промыванием желудка для диагностики туберкулеза легких у детей» | BMC Infectious Diseases
Двадцать два пациента были госпитализированы с подозрением на ПТБ.Один был исключен за то, что не предоставил забор проб согласно протоколу. 11 пациентов (53%) были женщинами, средний возраст составлял 72 месяца (от 1 месяца до 14 лет). Семь (33%) были моложе 5 лет. 9 пациентов (43%) были из Испании и 12 (57%) из других стран: Южной Америки (7), Африки (4) и Восточной Европы (Украина) (1).
Семнадцати пациентам (80%) был поставлен клинический диагноз ЛТБ на основании положительной туберкулиновой кожной пробы и радиологических критериев.Четыре пациента были исключены, поскольку окончательный диагноз не был ПТБ и не были идентифицированы другие микроорганизмы. Во всех из них были проведены одинаковые диагностические тесты (3 GL и 3 IE). Наблюдение за детьми без противотуберкулезных препаратов было удовлетворительным.
Положительная туберкулиновая кожная проба считалась положительной, если реакция Манту была> 10 мм, независимо от наличия вакцинации БЦЖ в анамнезе или> 5 мм, и контакт был с хорошо известным источником туберкулеза. Из этих пациентов поводом для исследования было: 8 (47%) инфицированных ТБ (у 3 пациентов бессимптомно), у одного (5.9%) из-за обследования детей из эндемичной зоны и 8 (47%) из-за наличия симптомов. На момент постановки диагноза у 11 (65%) пациентов были клинические симптомы, наиболее частые, респираторные симптомы и лихорадка 5 (29,4%), отдельные респираторные симптомы 4 (23,5%) и конституциональные симптомы 2 (11,8%). У всех пациентов величина Манту была больше 5 мм, а медиана — 18,4 мм (диапазон 8–20). У одного пациента двухмесячного возраста туберкулиновая кожная проба стала положительной во время последующего наблюдения при контакте с туберкулезом с первоначально нормальными рентгенограммами грудной клетки, которые впоследствии стали патологическими.Шесть пациентов родились за границей. В 5 из них манту превышала 10 мм. У другого пациента размер Манту был 8 мм, но с патологической рентгенографией грудной клетки и микробиологическим выделением M. tuberculosis .
Рентгенограммы грудной клетки были выполнены во всех случаях: патологические у 12 (70%) пациентов (лимфаденопатия — наиболее частая находка), нормальные у 4 (23,5%) пациентов и неопределенные у 1 (5,9%). У 5 пациентов с нормальными или неопределенными рентгенограммами грудной клетки была выполнена КТ грудной клетки, и у всех она была патологической.Индексный случай был известен у 9 (53%) пациентов: отца (1), матери (2), дедушки (2) и дяди (4).
Тест на ВИЧ (иммуноферментный иммуноферментный анализ, ELISA) был проведен только у одного пациента с отрицательными результатами. У остальных пациентов был собран семейный анамнез всех домашних контактов, включая мать, и ни один из них не был инфицирован ВИЧ. Поскольку вертикальная передача является основным путем передачи ВИЧ, мы предположили, что они не были ВИЧ-инфицированными. Других факторов риска выявлено не было.
Анализ гамма-интерферона (тест QuantiFERON-TB Gold) был проведен с 4 пациентами (23,5%): 2 положительными, 1 отрицательными и 1 неопределенным.
У всех пациентов, включенных в исследование (21), ИИ была успешно выполнена. Ни один пациент не был слишком болен, чтобы пройти эту технику. Самой молодой пациенткой была 34-дневная девочка, у которой не было никаких побочных эффектов. У больного 9 лет с плевральным выпотом нежелательных явлений не выявлено. Только у двух пациентов 13 и 14 лет, соответственно, откашлялась спонтанная, без аспирации.
Всего было 63 образца ИБ. У первых 5 пациентов (январь 2007 г. — июнь 2008 г.) вторичные эффекты не были зарегистрированы, так как данные не собирались проспективно до июня 2008 г. Из 16 пациентов, у которых проявились потенциальные нежелательные эффекты ИИ (всего 48 процедур), серьезных побочных эффектов не было. реакции возникли во время или после процедуры; Наиболее частыми побочными эффектами были легкое носовое кровотечение в 8 процедурах (16,6%), тошнота в 3 (6,25%) и усиление кашля в 3 (6,25%). Только у одного ребенка была преходящая гипоксемия за 2 процедуры (наименьшая сатурация кислорода 87%), выздоровевшая спонтанно.Эпизодов бронхоспазма не было.
Микробиологическое подтверждение было зарегистрировано у 10 пациентов (58,8%) с помощью GL или IS. M. tuberculosis был идентифицирован из GL у 8 детей (47,1%) и IS у 7 (41,2%) (дополнительный файл 1: рисунок и таблица S1).
В таблице 1 отражены микробиологические результаты 10 пациентов с микробиологическим подтверждением. У пяти детей оба метода взятия проб оказались положительными. У двух пациентов микробиологическая диагностика была возможна только с помощью ИС (ПЦР), а у трех пациентов — только с помощью ГЛ.Коэффициент корреляции (индекс Каппа) для GL и IS составил 0,401.
Таблица 1
Пациенты с положительным результатом в GL и / или IE
Из общего количества образцов IS (51) от 17 пациентов с диагнозом ТБ посев был положительным у 13 (25,5%), а мазок — у 2 (3,9%). Из 51 образца желудочного аспирата культура была положительной в 17 (33,3%), а мазок — в 3 (5,9%). Тридцать пять клинических образцов (17 IS и 18 GL) от 13 пациентов были обработаны NAAT.Двадцать три образца (12 IS и 11 GL) были обработаны COBAS TaqMan MTB, 11 (4 IS и 7 GL) — GenoType ® MTBDRplus и один образец IS — Xpert® MTB / RIF. NAAT был положительным в 5 из 17 образцов IS (29,4%) и в 3 из 18 образцов GL (16,7%) (дополнительный файл 1: таблица S1).
В таблице 2 показаны кумулятивные выходы от IS и GL после последовательного отбора проб в течение 3 последовательных дней и комбинированный выход обоих методов.
Таблица 2
Совокупный доход от GL и IS и комбинированный доход от обоих методов
Диагностическая ценность трех последовательных GL составила 8/17 (47.1%), что эквивалентно одному образцу из GL и одному образцу из IS в тот же день (8/17) (47,1%).
Не было значимой статистической разницы между диагностическими показателями трех образцов GL и трех образцов IS (p 0,81), а также между тремя образцами GL и комбинацией обоих методов в течение трех последовательных дней (p 1).
Из семнадцати пациентов с диагнозом ПТБ 5 были в возрасте ≤ 5 лет (возраст: 2, 6, 8, 28 и 47 месяцев). У всех этих пациентов было микробиологическое подтверждение, за исключением 28-месячного ребенка.В двух случаях (у 2-месячного и 8-месячного младенцев) оба метода сбора образцов выделили M.tuberculosis .
Было два случая резистентности (один к изониазиду у ребенка из Испании, а другой — к рифампицину у ребенка-иммигранта). Случай устойчивости к рифампицину был обнаружен в культуре из ЗС (где микробиологические результаты всех образцов из ИС были отрицательными). Случай устойчивости к изониазиду выявлен в образцах культур ЗС. У этого пациента ПЦР и посев в трех образцах IS также были положительными.Первоначально исследование устойчивости проводилось в рамках 1-й IS (ПЦР), генотип MTBDR plus был отрицательным. Это, вслед за результатом культуры GL, было интерпретировано как несоответствие результатов. На образцах культуры IS исследование устойчивости не проводилось, поскольку оно уже проводилось в культуре из GL.
Микроскопический анализ и оценка качества индуцированной мокроты у детей с пневмонией — Gulla
Внебольничная пневмония (ВП) у детей, особенно в возрасте до пяти лет, чаще встречается в развивающихся странах с оценочной заболеваемостью около 0.026 эпизодов на год ребенка составляют 95% всех эпизодов пневмонии у детей раннего возраста во всем мире (1). Это основная причина смертности детей в возрасте до 5 лет. Вмешательства, такие как эмпирические антибиотики у детей с подозрением на пневмонию, привели к значительному снижению смертности от пневмонии (2). Всемирная организация здравоохранения предложила выявить пневмонию по учащенному дыханию и затрудненному дыханию и назначить антибиотики в странах с высокой детской смертностью (2).Этот подход вызвал опасения по поводу развития организмов, устойчивых к лекарствам. Замечено, что у большинства детей с нетяжелой пневмонией, диагностированной с использованием критериев ВОЗ, были нормальные рентгеновские снимки, что позволяет предположить, что у них, возможно, не было бактериальной пневмонии (3). Это было подтверждено рандомизированными контролируемыми испытаниями, в которых сравнивали антибиотики и плацебо при нетяжелой пневмонии, диагностированной по критериям ВОЗ; не показывает разницы в результатах (4,5). Эти наблюдения показывают, что введение антибиотиков может спасти жизнь детям с пневмонией, вызванной бактериями, но эмпирические антибиотики могут быть ответственны за развитие резистентных к лекарствам организмов и их неблагоприятные последствия.Поэтому важно определить возбудителей пневмонии и принять решение о применении антибиотиков.
Обычно используемые методы выявления этиологических микробиологических агентов при пневмонии: образцы из дыхательных путей для микроскопии и посева, идентификация антигенов в образцах респираторных органов и моче, серологические исследования на определенные агенты, посев крови, полимеразная цепная реакция (ПЦР) (6).
Процедура взятия образцов из дыхательных путей, особенно из нижних дыхательных путей, имеет огромное влияние на результаты микроскопии и посевов и их интерпретацию.Обычно используемые образцы включают мазки из зева, носоглоточные аспираты, смывы из носоглотки, мокроту, индуцированную мокроту, бронхоальвеолярный лаваж, взятие пробы щетки с бронхоскопической защитой и небронхоскопический лаваж. Посевы мазков из горла являются общепринятым методом диагностики бактериального фарингита (7). Носоглоточный аспират и смывы из носоглотки используются для выявления вирусных агентов и атипичных агентов (8). Бронхоскопический и небронхоскопический лаваж, а также взятие пробы с защищенной щеткой являются полезными образцами, но являются инвазивными и требуют экспертизы, поэтому показаны только в отдельных случаях.Исследование мокроты обычно используется для микробиологических исследований у взрослых с пневмонией. У детей образец мокроты, представляющий образец нижних дыхательных путей, получить трудно, поскольку в большинстве случаев он заражается колонизаторами горла и дыхательных путей. Индуцированная мокрота успешно используется у госпитализированных и амбулаторных детей с туберкулезом (9), а также для выявления пневмоцистных инфекций у детей с ослабленным иммунитетом и пневмонией (10). Имеется достаточно доказательств того, что индуцированная мокрота имеет хорошую корреляцию с микробными агентами нижних дыхательных путей (бактериальные агенты i.e., pseudomonas spp ., staphylococcus ) у детей с муковисцидозом (11). Тем не менее, количество исследований использования индуцированной мокроты у детей с ВП ограничено.
Важные этапы получения индуцированной мокроты включают: индукцию, сбор, оценку ее качества, обработку для идентификации микробных агентов с использованием нескольких методов. Индукция мокроты и сбор мокроты хорошо известны, поскольку они используются для диагностики туберкулеза у детей.Легко определить в мокроте микроорганизмы, не обнаруженные в ротоглотке, такие как Mycobacterium tuberculosis, атипичные агенты, PCP и т. Д. Однако это сложно для бактериальных агентов из-за высокой скорости колонизации обычными бактериальными агентами, которые также вызывают пневмонию у детей. Это особенно верно для мокроты (откашливаемой и индуцированной), что может привести к неправильному выводу о том, что колонизаторы верхних дыхательных путей являются возбудителями пневмонии.
Следовательно, образцы мокроты следует проверять на качество перед обработкой для культивирования.Проверка качества обычно включает подсчет количества плоских эпителиальных клеток (SEC) и полиморфно-ядерных клеток (PMN) в мазке, окрашенном по Граму.
Мюррей и др. исследовали отхаркиваемую мокроту грубо и под микроскопом, чтобы определить ее пригодность для бактериального посева. Среднее количество выделенных видов бактерий составило 2,7 из образцов с <10 SEC на поле, 2,4 из транстрахеальных аспиратов и более 4 из образцов с> 10 SEC на поле.Потенциальные бактериальные патогены были изолированы менее чем в 15% образцов, у которых было более 10 SEC на поле. Бактериальная флора образцов с менее чем 10 SEC на поле была аналогична таковой из транстрахеальных аспиратов (12). Musher et al. Исследовали окраску по Граму и посев образца мокроты у 105 пациентов с пневмококковой пневмонией, подтвержденной посевом крови. Они определили адекватный образец мокроты как ≥10 лейкоцитов для каждого SEC при увеличении 400 ×. Посев на эти образцы дал правильный диагноз в> 80% случаев пневмококковой пневмонии (13).Следовательно, наличие> 25 PMN и <10 SEC на поле с малым увеличением или ≥10 лейкоцитов для каждого SEC считается высококачественным образцом отхаркиваемой мокроты у взрослых (12,13). Образцы, содержащие относительно большое количество SEC и низкое количество PMN, считаются образцом плохого качества и представляют собой заражение флорой верхних дыхательных путей. Однако Mycobacterium tuberculosis, Legionella, большинство грибов и вирусов не продуцируют PMN в мокроте, и, следовательно, качество образца можно лучше измерить, оценив количество SEC на поле с малым увеличением (14).
Мушер и др. показал, что микроскопическое исследование образцов мокроты перед введением антибиотиков позволило поставить правильный диагноз более чем у 80% пациентов с пневмококковой пневмонией (13). Одно исследование, проведенное как на взрослых, так и на детях, с целью выявления респираторных патогенов с помощью технологии карт TaqMan, показало, что идентификация патогенных бактерии и вирусы лучше в мокроте высокого качества по сравнению с мазками из ротоглотки или носоглотки (15).Lahti et al. обследовал 101 ребенка в возрасте от 6 месяцев до 15 лет с ВП более 15 месяцев. 76 детей могли производить мокроту высокого качества, и возможные возбудители болезни могли быть идентифицированы у 90% детей, у которых была выделена мокрота высокого качества (16).
Около 75% взрослых с пневмонией могут производить мокроту достаточного качества и качества для микробиологической диагностики (17,18). Сообщалось, что у взрослых чувствительность исследования мокроты для выявления бактериальных патогенов превышает 75%.Однако следует помнить о предшествующем воздействии антибиотиков и заражении ротовыми и ротоглоточными бактериями (19). Обычно сбор мокроты у младенцев и детей может оказаться непрактичным по разным причинам. Часто дети склонны проглатывать образец мокроты, а не откашливать ее. По сравнению со взрослыми, высока вероятность заражения мокроты колонизирующими бактериями, такими как Streptococcus pneumoniae и Haemophilus influenzae во время сбора. Также известно, что распространенность носительства Streptococcus pneumoniae составляет 6–14% у взрослых по сравнению с 57–65% у детей в возрасте 5 лет, а распространенность носительства Haemophilus influenzae составляет 3% у взрослых по сравнению с 26% в детский возраст от 5 лет (20).
Безопасность индуцированной мокроты также необходимо учитывать у детей, особенно в возрасте до 5 лет. Обычно это делается у детей с тяжелой или очень тяжелой пневмонией, требующей госпитализации для выявления микроорганизма. Показано, что у детей старшего возраста в возрасте 6–16 лет с астмой индуцированная мокрота является неинвазивной и относительно безопасной процедурой, за исключением нескольких пациентов, у которых наблюдались умеренный бронхоспазм, тошнота, боль в горле, покалывание в ладонях и подошвах (21,22).Недавно в двух исследованиях, проведенных в Кении и Новой Каледонии, оценивалась безопасность индукции мокроты у детей младше 5 лет, поступивших с тяжелой или очень тяжелой пневмонией. Только у одного ребенка было побочное явление в виде судорог во время распыления гипертонического раствора (23,24). Следовательно, индуцированный отбор мокроты можно безопасно проводить у детей с тяжелой или очень тяжелой пневмонией.
Мердок и др. (25) исследовали 3772 индуцированных образца мокроты от детей в возрасте от 1 до 59 месяцев с тяжелой пневмонией, госпитализированных из семи стран Африки и Азии.Они намеревались получить индуцированную мокроту до начала приема антибиотиков и следовали стандартизированному протоколу во всех центрах, чтобы обеспечить единообразие во всех центрах. Две тысячи шестьсот восемь (69%) образцов мокроты содержали <10 СЕК на поле слабого увеличения, 2350 (62%) образцов имели> 25 ПМЯ на одно поле слабого увеличения и 1509 (40%) имели как <10 СЕК, так и> 25 PMN на поле малой мощности. Образцы с SEC <10 на LPF имели низкое количество ротоглоточной флоры и более высокую распространенность потенциальных возбудителей пневмонии, что делало SEC <10 на LPF в качестве маркера высокого качества мокроты.По мере увеличения количества СЕК распространенность Hemophilus influenzae , Streptococus pneumoniae и Moraxella catarrhalis в образцах мокроты снижалась. Однако распространенность грамотрицательных бактерий Staphylococcus aureus увеличивалась с увеличением количества СЕК. Количество ротоглоточной флоры увеличивалось с присутствием большего количества SEC, но четкой связи с количеством PMN не наблюдалось. Образцы мокроты с SEC <10 на LPF были связаны с более низкими шансами культивирования большего количества ротоглоточной флоры 0.23 (95% ДИ, 0,19–0,29), тогда как образцы с PMN> 25 на LPF были связаны с повышенными шансами культивирования большего количества ротоглоточной флоры 1,60 (95% ДИ, 1,34–1,91), однако величина эффекта была небольшой. Это исследование — одно из немногих, в котором пытались определить этиологические агенты пневмонии у детей. Есть несколько ограничений, в том числе отсутствие золотого стандарта для сравнения, влияние предшествующего использования антибиотиков на посев мокроты и возможные расхождения в отчетах о посевах мокроты и окрашивании по Граму в разных странах, где проводилось исследование.
Мокрота с <10 SEC и> 25 PMN на LPF долгое время считалась образцом высокого качества (12), однако предпосылка для большого количества PMN была проблемой, поскольку некоторые пневмонии однозначно не связаны с повышенным PMN (26). . Напротив, при оценке качества мокроты необходимо учитывать состояния, связанные с повышенным уровнем PMN в образце мокроты, такие как курение сигарет, такие загрязнители, как озоновые эндотоксины, стероидорезистентная астма (27).
Если индуцированная мокрота может быть использована для выявления этиологических агентов пневмонии у детей, это может стать большим шагом к рациональному использованию антибиотиков у детей. Необходимо продемонстрировать воспроизводимость результатов, полученных в исследовании Murdoch et al. (25), выполнив дополнительные исследования. Не менее важно обучить детских медсестер и педиатрических врачей правильно собирать мокроту и транспортировать ее в лабораторию. Помимо бактериального посева, существуют огромные возможности использования молекулярных технологий для выявления различных этиологических агентов в течение нескольких часов.
Благодарности
Нет.
Конфликт интересов: Авторы не заявляют о конфликте интересов.
Список литературы
- Rudan I, Tomaskovic L, Boschi-Pinto C, et al. Глобальная оценка заболеваемости клинической пневмонией среди детей в возрасте до пяти лет.Bull World Health Organ 2004; 82: 895-903. [PubMed]
- Sazawal S, Черный RE. Группа исследований по ведению пациентов с пневмонией. Влияние ведения случаев пневмонии на смертность новорожденных, младенцев и детей дошкольного возраста: метаанализ исследований на уровне сообщества. Lancet Infect Dis 2003; 3: 547-56. [Crossref] [PubMed]
- Хазир Т. Рентгенография грудной клетки у детей в возрасте 2-59 месяцев с диагнозом нетяжелая пневмония по определению Всемирной организации здравоохранения: описательное многоцентровое исследование в Пакистане.BMJ 2006; 333: 629-30. [Crossref] [PubMed]
- Agarwal G, Awasthi S, Kabra SK и др. Трехдневное против пятидневного лечения амоксициллином при нетяжелой пневмонии у детей раннего возраста: многоцентровое рандомизированное контролируемое исследование. BMJ 2004; 328: 791-6. [Crossref] [PubMed]
- Лодха Р., Кабра СК, Панди РМ. Антибиотики при внебольничной пневмонии у детей. Кокрановская база данных Syst Rev 2013; 6: CD004874. [PubMed]
- Мердок Д.Р., Дженнингс Л.С., Бхат Н., Андерсон Т.П.Новые достижения в быстрой диагностике респираторных инфекций. Infect Dis Clin North Am 2010; 24: 791-807. [Crossref] [PubMed]
- Фокс JW, Маркон MJ, Бонсу Б.К. Диагностика стрептококкового фарингита путем обнаружения Streptococcus pyogenes в образцах из задней глотки по сравнению с образцами из полости рта. J Clin Microbiol 2006; 44: 2593-4. [Crossref] [PubMed]
- Ginocchio CC, McAdam AJ. Современные передовые методы тестирования респираторных вирусов. J Clin Microbiol 2011; 49: S44-8.[Crossref]
- Zar HJ, Hanslo D, Apolles P и др. Индуцированная мокрота по сравнению с промыванием желудка для микробиологического подтверждения туберкулеза легких у младенцев и детей раннего возраста: проспективное исследование. Ланцет 2005; 365: 130-4. [Crossref] [PubMed]
- Das CK, Mirdha BR, Singh S, et al. Использование индуцированной мокроты для определения распространенности Pneumocystis jirovecii у детей с ослабленным иммунитетом и пневмонией. J Trop Pediatr 2014; 60: 216-22. [Crossref] [PubMed]
- Кабра С.К., Алок А., Капил А. и др.Может ли мазок из зева после физиотерапии заменить мокроту для выявления микробных патогенов у детей с муковисцидозом? Индийский журнал J Pediatr 2004; 71: 21-3. [Crossref] [PubMed]
- Мюррей PR, Вашингтон JA. Микроскопический и бацериологический анализ откашливаемой мокроты. Mayo Clin Proc 1975; 50: 339-44. [PubMed]
- Мушер Д.М., Монтойя Р., Ванахита А. Диагностическое значение микроскопического исследования мокроты и культур мокроты, окрашенных по Граму, у пациентов с бактериемической пневмококковой пневмонией.Clin Infect Dis 2004; 39: 165-9. [Crossref] [PubMed]
- Грант Л.Р., Хаммитт Л.Л., Мердок Д.Р. и др. Процедуры получения образцов мокроты у детей. Clin Infect Dis 2012; 54: S140-5. [Crossref] [PubMed]
- Wolff BJ, Bramley AM, Thurman KA, et al. Улучшенное обнаружение респираторных патогенов за счет использования высококачественной мокроты с помощью технологии карт памяти TaqMan. J Clin Microbiol 2016; 55: 110-21. [Crossref] [PubMed]
- Лахти Э, Пелтола В., Варис М. и др.Индуцированная мокрота в диагностике внебольничной пневмонии у детей. Торакс 2009; 64: 252-7. [Crossref] [PubMed]
- Лэнг Р., Слейтер В., Коулз С. и др. Внебольничная пневмония в Крайстчерче и Вайкато 1999-2000: микробиология и эпидемиология. N Z Med J 2001; 114: 488-92. [PubMed]
- Neill AM, Martin IR, Weir R, et al. Внебольничная пневмония: этиология и полезность критериев тяжести при поступлении. Торакс 1996; 51: 1010-16.[Crossref] [PubMed]
- Аневлавис С., Петроглоу Н., Цаварас А. и др. Проспективное исследование диагностической полезности окрашивания мокроты по Граму при пневмонии. Дж. Инфекция 2009; 59: 83-9. [Crossref] [PubMed]
- Абдуллахи О., Ньиро Дж., Лева П. и др. Описательная эпидемиология носоглоточного носительства Streptococcus pneumoniae и Haemophilus influenzae у детей и взрослых в округе Килифи, Kenya Pediatr Infect Dis J, 2008; 27: 59-64. [Crossref] [PubMed]
- Ковар Р.А., Спан Дж. Д., Мартин Р. Дж. И др.Безопасность и применение индуцированного анализа мокроты при детской астме. J Allergy Clin Immunol 2004; 114: 575-82. [Crossref] [PubMed]
- Lex C, Payne DNR, Zacharasiewicz A, et al. Индукция мокроты у детей с тяжелой астмой: безопасность, осуществимость и тип воспалительных клеток. Педиатр Пульмонол 2005; 39: 318-24. [Crossref] [PubMed]
- Хаммитт Л.Л., Казунгу С., Морпет С.К. и др. Предварительное исследование этиологии пневмонии среди госпитализированных детей в Кении.Clin Infect Dis 2012; 54: S190-9. [Crossref] [PubMed]
- Mermond S, Zurawski V, D’Ortenzio E, et al. Инфекции нижних дыхательных путей среди госпитализированных детей в Новой Каледонии: пилотное исследование для проекта исследования этиологии пневмонии в интересах здоровья детей. Clin Infect Dis 2012; 54: S180-9. [Crossref] [PubMed]
- Мердок Д. Р., Морпет С. К., Хаммитт Л. Л. и др. Микроскопический анализ и оценка качества индуцированной мокроты у детей с пневмонией в исследовании PERCH.Clin Infect Dis 2017; 64: S271-9. [Crossref] [PubMed]
- Ingram JG, Plouffe JF. Опасность скрининга гнойной мокроты в культуре видов Legionella. J Clin Microbiol 1994; 32: 209-10. [PubMed]
- Джаярам Л., Парамесваран К., Сирс М.Р. и др. Подсчет индуцированных клеток мокроты: их полезность в клинической практике. Eur Respir J 2000; 16: 150-8. [Crossref] [PubMed]
doi: 10.21037 / jlpm.2017.09.01
Цитируйте эту статью как: Gulla KM, Kabra SK.Микроскопический анализ и оценка качества индуцированной мокроты у детей с пневмонией. Журнал J Lab Precis Med 2017; 2: 76.
Сравнение двух молекулярных панелей для независимого культурального обнаружения патогенов нижних дыхательных путей
Авторы: А. Гадиколай , В. Синклер, Дж. Валлентин, Дж. Карлквист, Б. К. Лопансри; Intermountain Med. Ctr., Murray, UT
Раскрытие информации: А. Гадиколай: Нет. W. Sinclair: Нет. Дж. Валлентин: Нет. Дж. Карлквист: Нет. Б.К. Лопансри: C. Консультант; Себя; Люминекс. F. Следователь; Себя; Иммунэкспресс, OpGen.
Аннотация
Введение: Ведение пациентов с пневмонией часто носит эмпирический характер, поскольку для получения результатов традиционной культуры и определения чувствительности к противомикробным препаратам требуются дни. Растущая распространенность устойчивости к антибиотикам усилила потребность в быстром обнаружении патогенов и устойчивости. Две коммерчески доступные мультиплексные молекулярные панели (панель BioFire® FilmArray® Pneumonia [FAP] и панель Curetis Unyvero® нижних дыхательных путей [LRTP]) могут улучшить уход за пациентами за счет быстрого, независимого от культуры обнаружения патогенов и ключевых маркеров резистентности.
Цель: Основной целью данной оценки было оценить эффективность обеих панелей в образцах нижних дыхательных путей, отправленных в централизованную микробиологическую лабораторию.
Метод: С мая 2019 года по декабрь 2019 года мы протестировали 120 образцов (68 мокроты, 37 бронхоальвеолярных лаважей, 15 трахеальных аспиратов), отправленных в Центральную лабораторию Межгорья. Мы собрали удобный образец и провели тестирование согласно рекомендациям производителя.Респираторные культуры обрабатывались в лаборатории клинической микробиологии в соответствии с местными протоколами. Вирусные патогены были исключены из анализа.
Результаты: Три аспирата трахеи и одна мокрота дали неверный результат для FAP или LRTP и были исключены из анализа. Из 116 выполненных культур 52 образца были положительными на 68 патогенов, 16 образцов были положительными на непатогенные организмы, 12 образцов не имели роста и 36 образцов со смешанной респираторной флорой.LRTP и FAP идентифицировали 82 и 95 патогенов соответственно. Чувствительность / специфичность / PPV / NPV, основанная на положительности культуры в качестве эталона, для LRTP составляла 89% / 98% / 67% / 99,6%, а для FAP 95% / 98% / 62% / 99,8%. Из маркеров устойчивости, включенных в панели, были обнаружены mecA в обоих и tem в LRTP. По сравнению с культурой, FAP был положительным по MRSA в 8 образцах, два из которых были отрицательными по культуре и LRTP. LRTP был положительным на MRSA в 7 образцах, один из которых не был обнаружен культурой или FAP.Четыре образца, положительные на Haemophilus influenzae, показали устойчивость к нему с помощью LRTP.


 com
com