Послеоперационное кровотечение – причины и обработка
Кровотечение после хирургического вмешательства – серьезное осложнение, способное привести к летальному исходу. Поэтому такое состояние требует незамедлительной врачебной помощи.
Послеоперационное кровотечение может быть ранним или поздним. Ранняя кровопотеря возникает в первые несколько часов после хирургического вмешательства. Как правило, она развивается на фоне нарушения свертываемости крови, вследствие расстройства водно-электролитного баланса или действия наркотических препаратов. Поздние кровотечения беспокоят спустя несколько суток и даже недель и обычно обусловлены занесением инфекции в рану или расхождение швов. В любом случае жизни пациента угрожает опасность и требуется неотложная медицинская помощь.
Причины возникновения послеоперационных кровотечений
Спровоцировать развитие послеоперационного кровотечения могут следующие факторы:
- Аррозия кровеносного сосуда из-за начавшегося гнойного процесса.
 Такое осложнение возникает через некоторое время после проведения вмешательства.
Такое осложнение возникает через некоторое время после проведения вмешательства. - Расхождение швов, соскальзывание лигатуры с сосуда крупного диаметра. Наблюдается при неправильной технике наложения швов, использовании некачественного шовного материала.
- Нарушение свертываемости крови.
- Инфицирование.
Иногда развивается кровотечение из мелких сосудов, которые остались не прошитыми. Подобное возможно при снижении артериального давления во время операции, в результате чего сосуды спадаются.
Препарат для помощи при послеоперационном кровотечении
Профилактика осложнений кровотечений в послеоперационном периоде
При развитии послеоперационного кровотечения у пациентов снижается ОЦК и показатели гемоглобина. При этом могут наблюдаться следующие последствия:
- острая гипоксия, в результате которой происходит угнетение дыхательного центра, сердечно-сосудистой системы, которые могут привести к летальному исходу;
- воздушная эмболия – попадание воздуха в полость сердца, возникающее при нарушении целостности магистральных сосудов;
- гипокоагуляционное состояние – потеря большого количества тромбообразующих компонентов, что может привести к диапедезным кровотечениям в дальнейшем.
 Чтобы предупредить послеоперационное кровотечение, необходимо:
Чтобы предупредить послеоперационное кровотечение, необходимо: - контролировать показатели свертываемости крови;
- прошивать сосуды до наложения лигатур;
- проводить антибиотикотерапию;
- по показаниям осуществлять предоперационная трансфузия компонентов крови, введение витамина К.
При развитии послеоперационного кровотечения необходимо незамедлительно оказать помощь, так как подобное состояние способно привести к смерти пациента.
Послеоперационные кровотечения
Одним
из грозных осложнений раннего
послеоперационного периода после
резекции желудка является кровотечение
в просвет пищеварительного тракта и
особенно в свободную брюшную полость.
Кровотечение в просвет пищеварительного
тракта.Это осложнение может возникнуть
в результате ряда причин. Чаще его
источником являются нели-гированные в
области гастроэнтероанастомоза сосуды
желудка и кишки, реже — просмотренные
во время первой операции язвы кардиального
отдела желудка, особенно острые. Причиной
Причиной
кровотечения из культи желудка может
быть геморрагический гастрит. Однако
у некоторых больных кровотечение может
быть более массивным и более длительным.
Диагностика кровотечений облегчается,
если в культю желудка введен назогастральный
зонд. Общее состояние больного, частота
пульса и артериальное давление не всегда
могут в таких случаях отразить тяжесть
кровопотери. Если кровотечение из
сосудов в области анастомоза всегда
отмечается в первые же часы после
операции, то при других источниках
(просмотренные во время операции язвы,
геморрагический гастрит) кровотечение
может возникнуть через несколько дней
после оперативного вмешательства.Лечение
кровотечений в просвет пищеварительного
тракта зависит в первую очередь от
величины и темпов кровопотери. Лечение
всегда начинают с переливания крови и
гемостатической терапии. Постоянный
назогастральный зонд позволяет
контролировать степень кровотечения.
У большинства больных кровотечение,
особенно если источником его являются
сосуды в области анастомоза, останавливается
под влиянием консервативных мероприятий.
Однако, если угрожающее послеоперационное
кровотечение продолжается и для
поддержания на нормальном уровне объема
циркулирующей крови, пульса, артериального
давления требуются повторные
гемотрансфузии, показано оперативное
вмешательство.
Кровотечение
в брюшную полость.Источником
внутрибрюшного кровотечения могут
быть пересеченные сосуды большого и
малого сальника, особенно при перевязке
большой массы сальника одной лигатурой.
Кровотечение в брюшную полость может
также развиться при соскальзывании
лигатур с крупных сосудов, при надрыве
во время операции капсулы селезенки
или ее ткани. Следует обратить внимание
на возможность послеоперационного
кровотечения при стволовой или селективной
ваготомии из сосудов, сопровождающих
блуждающие нервы. Всегда необходимо
лигировать концы блуждающих нервов, а
при селективной ваготомии, скелетируя
малую кривизну желудка, проводить
тщательный гемостаз.
Лечение.
Подозрение на послеоперационное
внутрибрюшное кровотечение должно
служить основанием для немедленной
релапаротомии. Промедление с повторной
Промедление с повторной
операцией и проведение консервативных
мероприятий, направленных на остановку
кровотечения, в этих случаях крайне
опасны.
Послеоперационный панкреатит
Причины
возникновения послеоперационных
панкреатитов, как и вообще острых
панкреатитов, различны.
Многие
авторы считают, что это осложнение
развивается главным образом вследствие
травмы поджелудочной железы во время
оперативного вмешательства.
Действительно, при резекции желудка и
гастрэктомии на определенных этапах
операции поджелудочная железа может
быть травмирована. Так, при мобилизации
задней стенки двенадцатиперстной
кишки в случае язвы, пенетрирующей в
головку поджелудочной железы, реальна
опасность повреждения санториниева
протока . Послеоперационный панкреатит
нередко развивается на фоне хронического.
Большое значение придается застою
содержимого в приводящей петле,
дуоденостазу, нарушающим отток
панкреатического сока и способствующим
рефлюксу кишечного содержимого в протоки
поджелудочной железы. Причиной
Причиной
послеоперационного панкреатита могут
также быть нарушение кровоснабжения
поджелудочной железы при перевязке
желудочно-двенадцатиперстной артерии,
спленэктомии или в результате тромбэмболии
панкреатических сосудов. Диагностика.
Большое значение в диагностике
послеоперационного панкреатита следует
придавать стойкому нарушению эвакуации
из культи желудка, упорному парезу
кишечника, желтухе, нарастающей
интоксикации, тахикардии, гипертермии.
Диагноз подтверждается повышенным
содержанием панкреатических ферментов
в крови, гипердиастазурией, хотя нередко
послеоперационный панкреатит,
особенно панкреонекроз, может протекать
без повышения уровня амилазы в крови и
моче.
Лечение..
Для лечения больных с послеоперационным
панкреатитом мы рекомендуем комплекс
консервативных мероприятий, направленных
на угнетение секреторной активности
поджелудочной железы, инактивацию
ферментов и борьбу с ферментной токсемией,
на борьбу с шоком, нарушениями
водно-электролитного баланса, на
профилактику почечной и сердечно-сосудистой
недостаточности. Необходимо также
Необходимо также
проведение антибактериальной,
антиаллергической и антигистаминной
терапии. Вводят назогастральный зонд
для постоянной аспирации желудочного
содержимого.
Профилактика.
Помимо необходимости избегать грубых
манипуляций в области поджелудочной
железы, считаем важным подчеркнуть
следующее. Если до операции выявлен
дуоденостаз или во время оперативного
вмешательства обнаружено, что
двенадцатиперстная кишка резко расширена,
напряжена, то наиболее целесообразна
резекция желудка с Y-образным анастомозом
по Ру, надежно дренирующая двенадцатиперстную
кишку. При язвах, пенетри-рующих в
поджелудочную железу, особенно при
больших перифокальных инфильтратах,
во избежание травмы поджелудочной
железы в ряде случаев обоснованы отказ
от резекции желудка и выполнение другой,
менее травматич-ной, операции — резекции
для выключения, пилоропластики или
гастро-энтероанастомоза в сочетании с
ваготомией. При невозможности во время
операции избежать травмы поджелудочной
железы или при производстве вмешательства
на самой железе с первого же дня с
профилактической целью назначают
ингибиторы панкреатических ферментов.
При любой операции на желудке обязателен
динамический контроль за содержанием
амилазы в крови и моче.
кровоточит, сколько дней может, почему, кровь
На чтение 3 мин. Просмотров 19k.
Многие пациенты задаются вопросом, сколько дней может кровить операционная рана. При проведении полостных хирургических вмешательств рассекаются мягкие ткани, в результате чего образуется рана. После завершения манипуляций ее сшивают. Это ускоряет заживление тканей и препятствует проникновению инфекций. На этапе восстановления нередко возникают кровотечения. Кровит шов после операции по нескольким причинам, для выявления которых требуется осмотр врача.
Почему кровит шов после операции
Развитию кровотечения из послеоперационного шва способствуют следующие причины:
- инфицирование кожных покровов и жировой клетчатки;
- некроз окружающих рану тканей;
- повреждение подкожной клетчатки и мышц;
- неправильная установка дренажной трубки;
- использование некачественного шовного материала;
- ослабление организма вследствие перенесенной операции;
- ошибки, происходящие при выполнении вмешательства;
- нарушение функций иммунной системы;
- несоблюдение рекомендаций хирурга в раннем послеоперационном периоде;
- раннее введение физических нагрузок.

Факторы, из-за которых кровоточит шов, могут воздействовать как вместе, так и по отдельности. О появлении кровянистых выделений из операционной раны сообщают специалисту, делающему перевязку.
Сколько дней может кровить
Выделение небольшого количества крови в раннем послеоперационном периоде считается нормой. Шов может кровить 5-7 дней. Если время кровотечения увеличивается или появляются осложнения в виде нагноения, необходимо начинать лечение.
Что делать для остановки крови
При незначительных кровотечениях из швов используются лекарственные средства:
- Противовоспалительные гели. В отличие от мазей, не образуют жирной пленки, препятствующей поступлению кислорода. Вентиляция препятствует нагноению. Самым эффективным средством лечения послеоперационных осложнений считают гель Солкосерил. Его наносят на очищенную от загрязнений кожу перед наложением повязки.
- Антисептические и заживляющие порошки. Они впитывают влагу, оказывая подсушивающее действие.
 Заживление тканей ускоряется, выделение кровянистой жидкости прекращается. Порошок Банеоцин уничтожает патогенные микроорганизмы, считающиеся главной причиной возникновения послеоперационных осложнений. Средство нужно наносить на чистую кожу, поэтому рану перед процедурой очищают. Отмершие ткани и загрязнения удаляют с помощью смоченного перекисью водорода марлевого тампона. Шов просушивают стерильной салфеткой, после чего наносят порошок.
Заживление тканей ускоряется, выделение кровянистой жидкости прекращается. Порошок Банеоцин уничтожает патогенные микроорганизмы, считающиеся главной причиной возникновения послеоперационных осложнений. Средство нужно наносить на чистую кожу, поэтому рану перед процедурой очищают. Отмершие ткани и загрязнения удаляют с помощью смоченного перекисью водорода марлевого тампона. Шов просушивают стерильной салфеткой, после чего наносят порошок. - Антисептические растворы. Если шов после операции кровит больше недели, речь идет о повреждении сосудов. В таком случае в кровеносную систему может попасть инфекция. Кожу нужно обрабатывать зеленкой или раствором йода.
- Гемостатики (Викасол). Такие средства применяются при низкой свертываемости крови. Они быстро останавливают кровотечение. Таблетки рекомендуется принимать не более 5 дней.
- Антибиотики (Цефазолин). Внутримышечное введение препаратов помогает справиться с кровоточивостью и нагноением. Уничтожение бактерий способствует быстрому заживлению раны.

При выраженных кровотечениях применяются хирургические вмешательства:
- Удаление гематомы. Ткани раздвигают зажимами, кровяной сгусток удаляют методом выдавливания или вылущивания. В рану вводят дренажную трубку, обеспечивающую отток воспалительной жидкости.
- Повторная лапаротомия. Применяется при длительных или массивных кровотечениях, образовании глубоких гематом. В стерильных условиях с раны снимаются швы, мягкие ткани и сосуды проверяются на наличие повреждений. После удаления гематомы кровоточащие вены и артерии перевязывают. Завершается операция послойным сшиванием мягких тканей. Рану дренируют.
После операции пациента оставляют в стационаре на 3-4 дня. В это время вводят антибиотики, осуществляют физиопроцедуры, следят за заживлением раны.
В это время вводят антибиотики, осуществляют физиопроцедуры, следят за заживлением раны.
Читайте также:
Послеоперационное кровотечение — Здоровье прежде всего!
Послеоперационное кровотечение
Послеоперационное кровотечение в ткани сопровождается образованием гематомы под швами или промоканием повязки. Оно почти всегда прекращается самостоятельно в течение 1—2 суток. В случаях повышенной кровоточивости показано применение средств, ускоряющих свертывание крови (хлористый кальций, викасол и др.). Гематому следует пунктировать и отсосать кровь, а при неудаче — распустить несколько швов. Гораздо опаснее внутреннее послеоперационное кровотечение, особенно после операций на органах брюшной полости, когда симптомы кровотечения могут маскироваться местными и общими изменениями, вызванными операционной травмой. В таких случаях руководствуются гл. обр. лабораторными данными, говорящими о нарастающей анемии. Грозные последствия нарастающей кровопотери могут проявиться в разное время (от нескольких часов до нескольких дней). Диагностика облегчается при выделении крови из оперированного органа. После операции на желудке обильная, а главное повторная рвота свежей кровью, не поддающаяся консервативному лечению, вынуждает к релапаротомии, расшиванию анастомоза и перевязке кровоточащих сосудов. Релапаротомия показана и при симптомах послеоперационного кровотечения в брюшную полость. Меньшие трудности встречает распознавание послеоперационных кровотечений в грудную полость.
Диагностика облегчается при выделении крови из оперированного органа. После операции на желудке обильная, а главное повторная рвота свежей кровью, не поддающаяся консервативному лечению, вынуждает к релапаротомии, расшиванию анастомоза и перевязке кровоточащих сосудов. Релапаротомия показана и при симптомах послеоперационного кровотечения в брюшную полость. Меньшие трудности встречает распознавание послеоперационных кровотечений в грудную полость.
Кровотечение после огнестрельных ранений является одним из наиболее частых осложнений боевых травм. Осложненными кровотечениями считаются ранения, сопровождающиеся выраженной кровопотерей. Во время Великой Отечественной войны они встречались у 25% раненых и чаще всего были связаны с повреждением артерий, реже паренхиматозных органов и еще реже вен. На этапах медицинской эвакуации наблюдаются кровотечения гл. обр. из сосудов конечностей, т. к. подавляющее большинство раненых с кровотечением из других крупных сосудов погибало на поле боя. Как правило, кровотечения происходит из сосудов, поврежденных первично (в момент ранения), и только в 1 % случаев — из сосудов, пострадавших в дальнейшем течении раневого процесса. У меньшей части раненных в сосуды кровотечения начиналось тотчас вслед за ранением (сопутствующее или первичное кровотечения). У некоторых из них оно останавливалось самопроизвольно, но обычно вскоре возобновлялось уже в качестве вторичного (последующего) кровотечения. В подавляющем большинстве случаев сопутствующего ранению кровотечения не было вообще (75% раненных в сосуды) и наблюдались только кровотечения последующие, т. е. вторичные — ранние и поздние. Отсутствие или самопроизвольная остановка первичного кровотечения имеет место обычно в случаях, когда раневой канал проходит через большие массы мышц, узок, извилист и легко обтурируется тромбами. Реже происходит обтурация самого просвета раненого сосуда образующимся в нем «провизорным тромбом» (Н. И. Пирогов). При гладком течении раны и отсутствии последующих кровотечений процесс может закончиться образованием травматической аневризмы.
Как правило, кровотечения происходит из сосудов, поврежденных первично (в момент ранения), и только в 1 % случаев — из сосудов, пострадавших в дальнейшем течении раневого процесса. У меньшей части раненных в сосуды кровотечения начиналось тотчас вслед за ранением (сопутствующее или первичное кровотечения). У некоторых из них оно останавливалось самопроизвольно, но обычно вскоре возобновлялось уже в качестве вторичного (последующего) кровотечения. В подавляющем большинстве случаев сопутствующего ранению кровотечения не было вообще (75% раненных в сосуды) и наблюдались только кровотечения последующие, т. е. вторичные — ранние и поздние. Отсутствие или самопроизвольная остановка первичного кровотечения имеет место обычно в случаях, когда раневой канал проходит через большие массы мышц, узок, извилист и легко обтурируется тромбами. Реже происходит обтурация самого просвета раненого сосуда образующимся в нем «провизорным тромбом» (Н. И. Пирогов). При гладком течении раны и отсутствии последующих кровотечений процесс может закончиться образованием травматической аневризмы.
Видеоторакоскопия в лечении послеоперационных кровотечений и их осложнений при ранениях груди — Хирургия. Журнал им. Н.И. Пирогова — 2012-08
Вопросы тактики при свернувшемся гемотораксе (СГ) активно разрабатываются в НИИСП им. Н.В. Склифосовского в течение последних 10 лет [1-3, 6]. Ежегодно в институте хирургическое лечение получают от 440 до 520 пострадавших с проникающими ранениями груди. Послеоперационное кровотечение и СГ развивались в среднем у 1,8%, эмпиема плевры — у 1,3% пострадавших. Методом выбора в лечении этих осложнений за последние годы стала видеоторакоскопия (ВТС).
Цель исследования — определить источники и причины послеоперационного внутриплеврального кровотечения и сформулировать основные принципы эффективного использования ВТС в лечении послеоперационных кровотечений и их осложнений у пострадавших, перенесших различные хирургические вмешательства при ранении груди.
Материал и методы
За период с 2002 по 2011 г. ВТС была применена в лечении 50 пострадавших с различными осложнениями ранений груди. У 35 (70%) пациентов осложнения были связаны с внутриплевральным кровотечением. ВТС с остановкой продолжающегося кровотечения была произведена 6 пациентам, эвакуация СГ — 27, санация эмпиемы плевры, осложнившей течение СГ, — 2 пострадавшим. Мужчин было 32 (91,4%), женщин — 3 (8,6%), средний возраст пострадавших составил 31±8 лет. Колото-резаные ранения груди были у 94,4% пострадавших, огнестрельные ранения — у 2 (5,6%). Изолированные ранения груди имели место у 25 (69,4%) пострадавших, сочетанные — у 11 (30,6%). ВТС выполняли гемодинамически стабильным пациентам с тяжестью повреждений по ISS 9±3 (4-18). Статистический анализ проводили с применением U-теста Mann-Whitney и одностороннего дисперсионного анализа Kruskal-Wallis (Statistica 6).
ВТС была применена в лечении 50 пострадавших с различными осложнениями ранений груди. У 35 (70%) пациентов осложнения были связаны с внутриплевральным кровотечением. ВТС с остановкой продолжающегося кровотечения была произведена 6 пациентам, эвакуация СГ — 27, санация эмпиемы плевры, осложнившей течение СГ, — 2 пострадавшим. Мужчин было 32 (91,4%), женщин — 3 (8,6%), средний возраст пострадавших составил 31±8 лет. Колото-резаные ранения груди были у 94,4% пострадавших, огнестрельные ранения — у 2 (5,6%). Изолированные ранения груди имели место у 25 (69,4%) пострадавших, сочетанные — у 11 (30,6%). ВТС выполняли гемодинамически стабильным пациентам с тяжестью повреждений по ISS 9±3 (4-18). Статистический анализ проводили с применением U-теста Mann-Whitney и одностороннего дисперсионного анализа Kruskal-Wallis (Statistica 6).
Результаты и обсуждение
Из 6 больных с продолжающимся кровотечением 4 перенесли дренирование плевральной полости, 2 — атипичную торакотомию. Исходный гемоторакс у них составил в среднем 463±238 мл. Временной интервал от первичной операции до ВТС составил в среднем 16±12 ч (4-51 ч), средняя кровопотеря — 1360±392 мл (650-2000 мл), средний темп кровотечения — 110±53 мл/ч. Источником кровотечения после дренирования плевральной полости у 2 пострадавших была рана грудной стенки, у 2 — рана легкого, причем в 2 наблюдениях было выявлено по два источника кровотечения. После атипичной торакотомии у обоих пациентов было выявлено по два источника кровотечения — рана после торакотомии и рана легкого у одного и торакотомная рана и надрыв легочной связки у другого. Гладкое послеоперационное течение с продолжительностью лечения 8±2 сут отмечено у 4 из 6 пострадавших. Послеоперационные осложнения развились у 2 пострадавших. Один пациент был оперирован через 51 ч с кровотечением из раны грудной стенки и сквозной раны легкого с общей кровопотерей 2000 мл. К моменту ВТС имелось нагноение вокруг дренажной трубки (Klebsiella pneumoniae и Serratia spp.
Исходный гемоторакс у них составил в среднем 463±238 мл. Временной интервал от первичной операции до ВТС составил в среднем 16±12 ч (4-51 ч), средняя кровопотеря — 1360±392 мл (650-2000 мл), средний темп кровотечения — 110±53 мл/ч. Источником кровотечения после дренирования плевральной полости у 2 пострадавших была рана грудной стенки, у 2 — рана легкого, причем в 2 наблюдениях было выявлено по два источника кровотечения. После атипичной торакотомии у обоих пациентов было выявлено по два источника кровотечения — рана после торакотомии и рана легкого у одного и торакотомная рана и надрыв легочной связки у другого. Гладкое послеоперационное течение с продолжительностью лечения 8±2 сут отмечено у 4 из 6 пострадавших. Послеоперационные осложнения развились у 2 пострадавших. Один пациент был оперирован через 51 ч с кровотечением из раны грудной стенки и сквозной раны легкого с общей кровопотерей 2000 мл. К моменту ВТС имелось нагноение вокруг дренажной трубки (Klebsiella pneumoniae и Serratia spp. ), в связи с чем лечение после ВТС продолжалось 12 сут. У другого пациента после ВТС, ушивания глубокой резаной раны легкого, не выявленной и не ушитой при атипичной торакотомии, в послеоперационном периоде образовалась внутрилегочная гематома с нагноением, потребовавшая наружного дренирования. Длительность лечения после ВТС составила 41 сут.
), в связи с чем лечение после ВТС продолжалось 12 сут. У другого пациента после ВТС, ушивания глубокой резаной раны легкого, не выявленной и не ушитой при атипичной торакотомии, в послеоперационном периоде образовалась внутрилегочная гематома с нагноением, потребовавшая наружного дренирования. Длительность лечения после ВТС составила 41 сут.
СГ у 12 из 27 пациентов сформировался после дренирования плевральной полости, у 8 — после атипичной торакотомии, у 7 — после типичной торакотомии. Средний объем исходного гемоторакса у больных, перенесших дренирование, составил 241±108 мл, СГ — 842±246 мл; у пациентов, которым выполнена атипичная торакотомия, — соответственно 321±168 и 617±389 мл. Гемоторакс у пострадавших, перенесших типичную торакотомию, составил 271±147 мл, средний объем СГ — 686±159 мл. Временной интервал между операциями равнялся 8±4 сут (1-23 сут).
Как видно из табл. 1, кровотечение в послеоперационном периоде наиболее часто возникало после дренирования плевральной полости и первичной хирургической обработки раны.
Как следует из табл. 2, наиболее частой причиной развития СГ независимо от вида операции явилась неадекватная функция плеврального дренажа, установленного при первичной операции. У одного пациента, поступившего через 16 ч после ранения, дренаж не функционировал в связи с развившимся к этому времени СГ. У трети пострадавших причиной развития СГ было вторичное внутриплевральное кровотечение, возникшее после удаления дренажной трубки из плевральной полости. Таким образом, нарушения методики дренирования плевральной полости превалировали в качестве основных причин развития СГ.
В первые 3 сут после первичного вмешательства ВТС была выполнена 3 пациентам. Во время операции было констатировано отсутствие внутриплевральных сращений, отсутствие фибринозных наложений на легком и париетальной плевре. В плевральной полости были выявлены сгустки различной плотности. У одного пострадавшего, обратившегося через 40 ч после ранения с инфицированной раной груди (Staphylococcus aureus), ВТС и эвакуация СГ были выполнены через сутки после иссечения краев раны в связи с аррозионным кровотечением из нее. Средняя продолжительность лечения пациентов после ВТС без послеоперационных осложнений составила 8 и 13 сут, у пострадавшего с гнойным осложнением — 30 сут.
Средняя продолжительность лечения пациентов после ВТС без послеоперационных осложнений составила 8 и 13 сут, у пострадавшего с гнойным осложнением — 30 сут.
Через 4-6 сут после первичного вмешательства ВТС была произведена 9 пострадавшим. Рыхлые и умеренно плотные сращения были выявлены у 8 из них. Фибринозные наложения на плевре были обнаружены у 7 из 9 пациентов. Незначительное количество фибрина в виде отдельных тонких наслоений было у 2 из 3 больных, оперированных на 4-е сутки, у 1 из них имелись массивные фибринозные наложения и мутный геморрагический выпот. Сгустки различной давности в плевральной полости были выявлены в 7 наблюдениях, лизированная кровь без сгустков — в 2.
После ВТС осложнения диагностированы у 4 больных. Гидроторакс развился у 3 пострадавших, оперированных в сроки от 4 до 6 сут после первичного вмешательства. При ВТС у 2 из них отмечались значительное количество фибрина и мутный экссудат. Длительность их лечения после ВТС составила 19, 22 и 23 дня.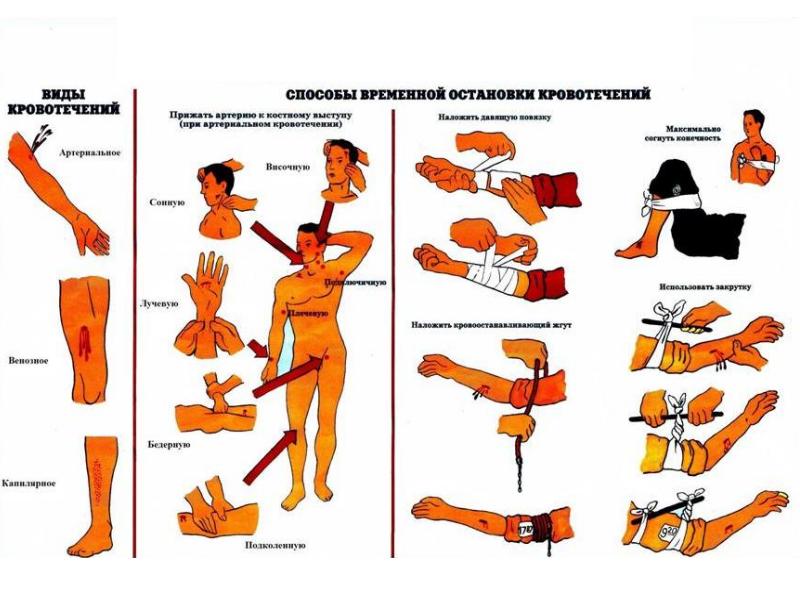 Нижнедолевая пневмония и стафилококковая бактериемия развились у больного, оперированного на 5-е сутки после первичного вмешательства, выполненного на фоне инфицированного свернувшегося гемоторакса (Pseudomonas aeruginosa) и значительных плотных фибринозных наложений на плевре. Длительность лечения после ВТС у этого больного составила 24 дня. Послеоперационный период у 5 пациентов с неосложненным течением после ВТС составил от 7 до 13 сут.
Нижнедолевая пневмония и стафилококковая бактериемия развились у больного, оперированного на 5-е сутки после первичного вмешательства, выполненного на фоне инфицированного свернувшегося гемоторакса (Pseudomonas aeruginosa) и значительных плотных фибринозных наложений на плевре. Длительность лечения после ВТС у этого больного составила 24 дня. Послеоперационный период у 5 пациентов с неосложненным течением после ВТС составил от 7 до 13 сут.
В сроки от 7 до 9 сут были оперированы 6 больных. Рыхлые плевральные сращения были выявлены у 1, умеренно плотные сращения — у 4, плотные — у 1 пострадавшего. Незначительное количество фибрина было обнаружено у 3 больных. Значительные фибринозные наложения на плевре и фибрин в виде сот имели место у 3 пострадавших. Лизированная кровь и сгустки в пропорции 2:1-5:1 были у всех больных. Не отмечено осложнений после ВТС у 2 из 6 пациентов, оперированных на 7-е и 9-е сутки после первичного вмешательства. Длительность их лечения составила соответственно 5 и 6 сут. Гидроторакс после ВТС развился у 2 пострадавших, оперированных на 7-е и 9-е сутки, длительность послеоперационного периода у них составила соответственно 13 и 17 сут. При этом у одного пациента из плеврального экссудата были выделены Enterococcus sp. и Pseudomonas aeruginosa, несмотря на это, гнойные осложнения у него не развились. Нагноение ран в месте стояния дренажных трубок в плевральной полости было выявлено у одного больного. Продолжающееся гнойное воспаление в плевральной полости после ВТС, пневмония и бактериемия, вызванные Staphylococcus epidermidis, имели место у другого пострадавшего. Лечение после ВТС в этих наблюдениях продолжалось соответственно 14 и 24 сут.
Гидроторакс после ВТС развился у 2 пострадавших, оперированных на 7-е и 9-е сутки, длительность послеоперационного периода у них составила соответственно 13 и 17 сут. При этом у одного пациента из плеврального экссудата были выделены Enterococcus sp. и Pseudomonas aeruginosa, несмотря на это, гнойные осложнения у него не развились. Нагноение ран в месте стояния дренажных трубок в плевральной полости было выявлено у одного больного. Продолжающееся гнойное воспаление в плевральной полости после ВТС, пневмония и бактериемия, вызванные Staphylococcus epidermidis, имели место у другого пострадавшего. Лечение после ВТС в этих наблюдениях продолжалось соответственно 14 и 24 сут.
Через 10-12 сут после первичной операции были оперированы 7 пострадавших. Рыхлые плевральные сращения были выявлены у 4, умеренно плотные — у 2, плотные — у 1 больного. Лизированная кровь без сгустков была обнаружена у одного пострадавшего. У 6 больных соотношение сгустков и жидкой части в СГ составило 1:2. У 6 пациентов имелись выраженные фибринозные наложения на париетальной и висцеральной плевре и фибрин в виде сот, разграничивавших плевральную полость. Неосложненный послеоперационный период после ВТС был у 2 пострадавших, оперированных на 10-е и 11-е сутки после первичного вмешательства, при этом у одного пациента из плеврального содержимого во время операции был выделен Staphylococcus aureus. Длительность послеоперационного периода после ВТС у них составила 12 и 13 сут. У 4 пациентов, оперированных на 11-е сутки после первичного вмешательства, развился гидроторакс. Инфицирование плеврального содержимого Escherichia coli и Streptococcus spp. отмечено у одного и Staphylococcus aureus — у другого пациента. Длительность послеоперационного лечения пациентов с гидротораксом после ВТС составила соответственно 13, 14, 20, 22 сут.
У 6 пациентов имелись выраженные фибринозные наложения на париетальной и висцеральной плевре и фибрин в виде сот, разграничивавших плевральную полость. Неосложненный послеоперационный период после ВТС был у 2 пострадавших, оперированных на 10-е и 11-е сутки после первичного вмешательства, при этом у одного пациента из плеврального содержимого во время операции был выделен Staphylococcus aureus. Длительность послеоперационного периода после ВТС у них составила 12 и 13 сут. У 4 пациентов, оперированных на 11-е сутки после первичного вмешательства, развился гидроторакс. Инфицирование плеврального содержимого Escherichia coli и Streptococcus spp. отмечено у одного и Staphylococcus aureus — у другого пациента. Длительность послеоперационного лечения пациентов с гидротораксом после ВТС составила соответственно 13, 14, 20, 22 сут.
Двое пострадавших были оперированы на 22-е и 23-и сутки. В плевральной полости имелись плотные сращения, массивные наложения фибрина на легком и грудной стенке. У одного больного были мелкие сгустки. Гидроторакс, сопровождавшийся гипертермией и потребовавший плевральной пункции, развился у одного пациента. Продолжительность его лечения после ВТС составила 47 сут, а пациента с неосложненным послеоперационным течением — 14 сут.
У одного больного были мелкие сгустки. Гидроторакс, сопровождавшийся гипертермией и потребовавший плевральной пункции, развился у одного пациента. Продолжительность его лечения после ВТС составила 47 сут, а пациента с неосложненным послеоперационным течением — 14 сут.
Острая эмпиема плевры осложнила СГ у 2 больных с сочетанными ранениями груди. У одного из них имелись торакоабдоминальные и люмборетроперитонеальные ранения с ранением обеих почек, печени. В течение первых суток после операции в связи с продолжающимся внутрибрюшным кровотечением из сосудистой ножки левой почки была выполнена релапаротомиия и левосторонняя нефрэктомия, тампонирование ложа удаленной почки. Кровопотеря составила более 4 л. В послеоперационном периоде было отмечено наличие гидроторакса слева и при двух плевральных пункциях была получена серозно-геморрагическая жидкость в объеме 100 и 300 мл. На 4-е сутки после поступления было выполнено дренирование левой плевральной полости. В связи с прекращением поступления экссудата на 9-е сутки дренажная трубка из плевральной полости была удалена, однако к 11-м суткам в левой плевральной полости, по данным КТ, имелось 900 мл содержимого, поэтому было произведено повторное дренирование плевральной полости. К этому времени послеоперационный период осложнился флегмоной забрюшинного пространства в области тампонирования ложа левой почки и развилась эмпиема левой плевральной полости. ВТС с плеврэктомией и декортикацией легкого была выполнена на 22-е сутки после ранения, но больной умер в первые сутки после этого вмешательства. Причиной смерти явились интоксикация и раневое истощение.
К этому времени послеоперационный период осложнился флегмоной забрюшинного пространства в области тампонирования ложа левой почки и развилась эмпиема левой плевральной полости. ВТС с плеврэктомией и декортикацией легкого была выполнена на 22-е сутки после ранения, но больной умер в первые сутки после этого вмешательства. Причиной смерти явились интоксикация и раневое истощение.
У другого пациента имелись ранение левой половины груди с ранением легкого и левостороннее люмборетроперитонеальное ранение с ранением левой почки, не проникающим в лоханку, а также напряженная забрюшинная гематома. Исходный гемоторакс был минимальным. В связи с «низким» ранением груди была выполнена атипичная торакотомия, выявлена и ушита рана легкого, произведены диафрагмотомия, ревизия забрюшинной гематомы, ушивание раны почки. Причиной вторичного внутриплеврального кровотечения и развития эмпиемы плевры объемом 500 мл была несостоятельность швов раны легкого с вторичным кровотечением. ВТС с санацией эмпиемы плевры была выполнена на 8-е сутки. Из содержимого плевральной полости были получены Acinetobacter spp. и грамотрицательная неферментирующая бактерия. Этот больной провел в стационаре после ВТС 27 сут.
Из содержимого плевральной полости были получены Acinetobacter spp. и грамотрицательная неферментирующая бактерия. Этот больной провел в стационаре после ВТС 27 сут.
Наиболее типичными клиническими признаками продолжающегося кровотечения низкой интенсивности (менее 200 мл/ч) [9] являются поступление крови или геморрагической жидкости по дренажу, постепенное снижение показателей артериального давления, нарастание тахикардии, боль в груди, нарушение механики дыхания. Поступление крови или геморрагической жидкости по дренажной трубке в большем, чем обычно, объеме должно быть показанием к оценке содержимого в полости плевры. Наш опыт показал, что ни в одном наблюдении продолжающегося умеренного кровотечения по дренажным трубкам не удалось эвакуировать всю кровь даже с применением аспирации. Аналогичные данные представили M. Muslim и соавт. [15]. Несмотря на небольшой темп кровотечения, средняя кровопотеря в этой группе больных превысила 1000 мл. Главными элементами мониторинга являются оценка темпа поступления крови по дренажу и определение уровня гемоглобина и гематокрита в содержимом плевральной полости, ультразвуковое исследование груди. В ходе ВТС у всех пациентов в плевральной полости отмечены свертки крови. Раннее применение ВТС позволило не только остановить кровотечение и произвести аппаратную реинфузию эритроцитного компонента, но и эвакуировать СГ, а также завершить операцию адекватным дренированием плевральной полости. Рандомизированные исследования, проведенные за рубежом, показали, что при наличии травматического гемоторакса выполнение ВТС без предварительного лечения больных дренированием плевральной полости значительно сокращало длительность стационарного лечения и снижало частоту послеоперационных осложнений [10, 11].
В ходе ВТС у всех пациентов в плевральной полости отмечены свертки крови. Раннее применение ВТС позволило не только остановить кровотечение и произвести аппаратную реинфузию эритроцитного компонента, но и эвакуировать СГ, а также завершить операцию адекватным дренированием плевральной полости. Рандомизированные исследования, проведенные за рубежом, показали, что при наличии травматического гемоторакса выполнение ВТС без предварительного лечения больных дренированием плевральной полости значительно сокращало длительность стационарного лечения и снижало частоту послеоперационных осложнений [10, 11].
Важным фактором, влияющим на эффективность выполнения ВТС и быструю реабилитацию пациентов, являются сроки, в которые выполняется эндохирургическое вмешательство после развития СГ. Как видно на рис. 1,Рисунок 1. Сроки выполнения ВТС у больных с СГ после проникающего ранения груди (n=27). из 27 больных с наличием СГ 12 (44,4%) ВТС была выполнена в первые 7 сут после первичной операции, 13 (48,1%) — позже 7 сут, 2 (7,4%) — позже 20 сут. По данным литературы, имеется взаимосвязь между сроками выполнения ВТС и длительностью последующего лечения. Так, по данным S. Milanchi и соавт. [13], больные, оперированные на 7-е сутки, провели в стационаре приблизительно 20 дней. В нашем исследовании пациенты в среднем были оперированы через 8±4 сут и находились в стационаре после ВТС 16±5 сут. Эффект применения ВТС при лечении СГ основан на малой травматичности хирургического доступа и сокращении периода восстановления за счет ранней активизации пациента [8]. По нашему мнению, оптимальный результат применения ВТС в лечении СГ достигается тогда, когда возможна быстрая и полная эвакуация плеврального содержимого. При наличии фибринозных наложений и невозможности их полного удаления возникает опасность развития дальнейших воспалительных или гнойных осложнений. Длительность лечения 11 (40,7%) больных без послеоперационных осложнений, оперированных в среднем через 8±4 сут, составила 10±3 дня. У 16 (59,3%) пациентов с различными послеоперационными осложнениями, которые были оперированы в среднем через 8±3 сут (p>0,05), длительность послеоперационного периода составила 20±4 сут (p<0,05).
По данным литературы, имеется взаимосвязь между сроками выполнения ВТС и длительностью последующего лечения. Так, по данным S. Milanchi и соавт. [13], больные, оперированные на 7-е сутки, провели в стационаре приблизительно 20 дней. В нашем исследовании пациенты в среднем были оперированы через 8±4 сут и находились в стационаре после ВТС 16±5 сут. Эффект применения ВТС при лечении СГ основан на малой травматичности хирургического доступа и сокращении периода восстановления за счет ранней активизации пациента [8]. По нашему мнению, оптимальный результат применения ВТС в лечении СГ достигается тогда, когда возможна быстрая и полная эвакуация плеврального содержимого. При наличии фибринозных наложений и невозможности их полного удаления возникает опасность развития дальнейших воспалительных или гнойных осложнений. Длительность лечения 11 (40,7%) больных без послеоперационных осложнений, оперированных в среднем через 8±4 сут, составила 10±3 дня. У 16 (59,3%) пациентов с различными послеоперационными осложнениями, которые были оперированы в среднем через 8±3 сут (p>0,05), длительность послеоперационного периода составила 20±4 сут (p<0,05). Несмотря на отсутствие достоверных различий в средних сроках от развития СГ до выполнения ВТС у пациентов с осложнениями и без осложнений, как видно на рис. 2,Рисунок 2. Осложнения после ВТС у больных с СГ, развившиеся в зависимости от сроков выполнения ВТС (n=27). прослеживается тенденция нарастания количества осложнений при позднем выполнении операции. Так в 1-6-е сутки ВТС была выполнена 18 пациентам, осложнения развились у 7 из них. Из 13 пациентов, оперированных на 7-12-е сутки, осложнения развились у 10. Данные литературы показывают, что у больных, перенесших ВТС позже 10 сут от развития СГ, количество послеоперационных осложнений, длительность дренирования плевры и продолжительность лечения были существенно больше, чем при выполнении операции в более ранние сроки [4, 7].
Несмотря на отсутствие достоверных различий в средних сроках от развития СГ до выполнения ВТС у пациентов с осложнениями и без осложнений, как видно на рис. 2,Рисунок 2. Осложнения после ВТС у больных с СГ, развившиеся в зависимости от сроков выполнения ВТС (n=27). прослеживается тенденция нарастания количества осложнений при позднем выполнении операции. Так в 1-6-е сутки ВТС была выполнена 18 пациентам, осложнения развились у 7 из них. Из 13 пациентов, оперированных на 7-12-е сутки, осложнения развились у 10. Данные литературы показывают, что у больных, перенесших ВТС позже 10 сут от развития СГ, количество послеоперационных осложнений, длительность дренирования плевры и продолжительность лечения были существенно больше, чем при выполнении операции в более ранние сроки [4, 7].
Недостаточное количество наблюдений не позволяет нам делать статистически значимое заключение. Тем не менее, как видно на рис. 2, операции, выполненные в первые 3 сут, сопровождаются наименьшим количеством осложнений. При выполнении ВТС в ранние сроки свертки крови могут быть легко фрагментированы и удалены. В связи с отсутствием фибринозных наложений и легочно-плевральных сращений снижается опасность ятрогенных повреждений легкого при установке первого торакопорта, а после ВТС удается легко расправить легкое, что снижает риск развития ателектазов, пневмонии и реактивного гидроторакса. Аналогичные данные публикуют и другие исследователи этой проблемы [14]. Наш опыт показывает, что с 4-х суток в плевральной полости формируется отграничительный спаечный процесс. Сгустки крови частично лизируются, частично трансформируются в фибрин, который покрывает висцеральную и париетальную плевру и фрагментирует плевральную полость в виде сот. Эвакуация такого остаточного гемоторакса традиционным дренированием плевральной полости не достигает цели, нередко приводит к инфицированию и развитию нагноения [1, 2, 17]. Следует отметить, что 3 пострадавшим с осложнениями после ВТС в промежутке между первичной операцией и ВТС выполнялось дренирование плевральной полости при наличии СГ.
При выполнении ВТС в ранние сроки свертки крови могут быть легко фрагментированы и удалены. В связи с отсутствием фибринозных наложений и легочно-плевральных сращений снижается опасность ятрогенных повреждений легкого при установке первого торакопорта, а после ВТС удается легко расправить легкое, что снижает риск развития ателектазов, пневмонии и реактивного гидроторакса. Аналогичные данные публикуют и другие исследователи этой проблемы [14]. Наш опыт показывает, что с 4-х суток в плевральной полости формируется отграничительный спаечный процесс. Сгустки крови частично лизируются, частично трансформируются в фибрин, который покрывает висцеральную и париетальную плевру и фрагментирует плевральную полость в виде сот. Эвакуация такого остаточного гемоторакса традиционным дренированием плевральной полости не достигает цели, нередко приводит к инфицированию и развитию нагноения [1, 2, 17]. Следует отметить, что 3 пострадавшим с осложнениями после ВТС в промежутке между первичной операцией и ВТС выполнялось дренирование плевральной полости при наличии СГ.
Выполнение ВТС в поздние сроки имеет ряд особенностей и сопровождается большим количеством осложнений и конверсий в торакотомию [16]. Это обусловлено выраженным спаечным процессом и инфильтративными изменениями, характерными как для инфицированного СГ, так и для эмпиемы плевры [5, 12, 18]. Наличие патогенной микрофлоры, полученной из плеврального содержимого в ходе ВТС, не у всех пострадавших приводило к развитию гнойных осложнений. Безусловно, ВТС с санацией плевральной полости в наших наблюдениях оказала терапевтическое действие и способствовала уменьшению длительности лечения. Проведенные нами исследования показали, что продолжительность лечения эмпиемы плевры с помощью дренирования и применения аспирационно-промывных методов составила 51±14 сут, в то время как длительность лечения инфицированного СГ и эмпиемы плевры после ВТС — 25±6 сут, гидроторакса — 19±4 сут.
Таким образом, источником послеоперационного кровотечения при проникающих ранениях груди у 25,9% пациентов были неустраненные повреждения грудной стенки и легкого, у 40,7% — технические ошибки при выполнении первичной операции. Развитие свернувшегося гемоторакса у 65,5% больных было связано с нарушением функции плеврального дренажа, у 31% — с нарушениями методики дренирования. У пострадавших с клинической картиной продолжающегося неинтенсивного внутриплеврального кровотечения применение видеоторакоскопии в первые часы после первичного вмешательства позволило остановить кровотечение и избежать развития свернувшегося гемоторакса. Наилучшие результаты при развитии этого осложнения достигнуты при выполнении видеоторакоскопии в пределах 3 сут от начала клинических проявлений внутриплеврального кровотечения. При инфицированном свернувшемся гемотораксе и эмпиеме плевры видеоторакоскопия позволяет сократить длительность лечения больных по сравнению с таковой при традиционных методах.
Развитие свернувшегося гемоторакса у 65,5% больных было связано с нарушением функции плеврального дренажа, у 31% — с нарушениями методики дренирования. У пострадавших с клинической картиной продолжающегося неинтенсивного внутриплеврального кровотечения применение видеоторакоскопии в первые часы после первичного вмешательства позволило остановить кровотечение и избежать развития свернувшегося гемоторакса. Наилучшие результаты при развитии этого осложнения достигнуты при выполнении видеоторакоскопии в пределах 3 сут от начала клинических проявлений внутриплеврального кровотечения. При инфицированном свернувшемся гемотораксе и эмпиеме плевры видеоторакоскопия позволяет сократить длительность лечения больных по сравнению с таковой при традиционных методах.
КРОВОТЕЧЕНИЕ ВО ВРЕМЯ ОПЕРАЦИИ — Med24info.com
Кровотечение во время операции может произойти по нескольким причинам. Самой частой среди них являются грубые, насильственные и резкие действия в ране при выделении подкожных вен. Следует помнить о том, что стенки варикозных вен легко рвутся не только от захвата их инструментами, но и от очистки их от окружающих тканей тупфером. Как лучше действовать во время вмешательства в паховой области, чтобы предупредить ранение подкожных вен, читайте в главе 6.
Следует помнить о том, что стенки варикозных вен легко рвутся не только от захвата их инструментами, но и от очистки их от окружающих тканей тупфером. Как лучше действовать во время вмешательства в паховой области, чтобы предупредить ранение подкожных вен, читайте в главе 6.
Второй причиной кровотечения является короткая культя вены, с которой легко соскальзывает лигатура. Если не удается создать культю длиной не менее 2 мм, то надежнее перевязать ее с прошиванием: лигатура подводится на игле под середину зажима на вене, а затем обвязывает его дважды.
Третья причина — неумение накладывать надежный узел на сосуд. Прежде чем оперировать больных с варикозной болезнью, научитесь вязать узлы. Нельзя доверять операции на варикозных венах неопытным хирургам без контроля профессинала.
Если же кровотечение началось, то не надо спешить, суетиться и безконтрольно накладывать зажимы. Особенно это опасно в паховой области, так как можно зажать или поранить бедренную вену.
Последовательность Ваших действий в ране не менст
- см длиной:
- опустите пальцы левой руки в рану (без салфетки !!) и постарайтесь прижать возможное место кровотечения;
- осушите кровь в ране салфеткой в правой руке;
- попросите ассистента максимально раздвинуть края раны;
- медленно отодвигайте свои пальцы в ране и осторожно приподнимайте один за другим, стараясь точно определить место кровоточащего сосуда;
- увидев источник кровотечения, опять прижмите его уже одним пальцем;
- возьмите в правую руку зажим и наложите его на место, откуда поступает кровь после того, как Вы приподняли палец левой руки.
После этого выделите кровоточащий сосуд и перевяжите культю его.
Если кровотечение произошло в ране длиной менее 3 см, ввести в нее палец можно, но параллельно что-либо сделать уже нельзя. Либо расширьте доступ (для паховой и подколенной областей это обязательно), либо затампони- руйте рану салфеткой и пусть ассистент сильно прижмет всю рану на несколько минут, пока Вы занимаетесь чем- либо другим. Как правило, кровотечение останавливается. Если эта мера оказывается недостаточной, то путем прижатия кожи вокруг раны на расстоянии определитесь с местонахождением источника кровотечения и в нужном направлении вводите зажим.
Как правило, кровотечение останавливается. Если эта мера оказывается недостаточной, то путем прижатия кожи вокруг раны на расстоянии определитесь с местонахождением источника кровотечения и в нужном направлении вводите зажим.
Постоперационные инструкции | Центр синуса Джонса Хопкинса
Чего ожидать после эндоскопической хирургии носовых пазух:
- Кровотечение: Кровянистые выделения в течение первых 3-5 дней после операции на носовых пазухах, особенно после промывания носовых пазух, являются нормальным явлением. Если после операции возникает устойчивое кровотечение, слегка наклоните голову назад и нежно дышите через нос. Вы можете промокнуть нос салфеткой, но избегайте сморкания. Если это не остановит кровотечение, можно использовать спрей Африн.Несколько спреев обычно останавливают кровотечение. Если Африн не может остановить устойчивое носовое кровотечение, вам следует позвонить в наш офис или к дежурному врачу (см.
 Контакты ниже).
Контакты ниже). - Боль: Вы должны ожидать некоторого давления в носу и пазухах и боли в течение первых нескольких дней после операции. Это может быть похоже на инфекцию носовых пазух или тупую боль в носовых пазухах. Сильнодействующий тайленол часто бывает всем, что нужно для облегчения послеоперационного дискомфорта. Вам следует избегать аспирина и НПВП, таких как мотрин, адвил и алев (см. Ниже).Если тайленола недостаточно для снятия боли, следует использовать послеоперационные обезболивающие, прописанные врачом.
- Усталость: В первую неделю после операции вы можете почувствовать сильную усталость. Это нормально, и большинство пациентов планируют взять отпуск по крайней мере на 1 неделю для восстановления. Каждый пациент индивидуален, и некоторые из них возвращаются к работе раньше.
- Заложенность носа и выделения: В первые несколько недель после операции у вас будет заложенность носа и выделения из носа.
 Ваш носовой ход и дыхание должны вернуться в норму через 2-3 недели после операции.
Ваш носовой ход и дыхание должны вернуться в норму через 2-3 недели после операции. - Послеоперационные визиты: У вас будет определенное количество послеоперационных посещений в зависимости от того, какую операцию вы перенесли. Во время этих посещений мы будем очищать ваш нос и пазухи от жидкости и крови, оставшихся после операции. Эти посещения очень важны для облегчения процесса заживления, поэтому важно, чтобы вы посещали все запланированные для вас посещения. Чистка вызывает некоторый дискомфорт, поэтому лучше всего за 45 минут до визита принять обезболивающее (описанное выше).
- Выдувание носа и напряжение: Вам следует избегать напряжения, подъема тяжестей (> 20 фунтов) и сморкания в течение как минимум 10 дней после операции. Напряжение или сморкание вскоре после операции может вызвать кровотечение. Вы можете возобновить 50% обычного режима физических упражнений через 1 неделю после операции и свой обычный распорядок через 2 недели после операции.

- Аспирин или нестероидные противовоспалительные (НПВП) препараты: Аспирин и НПВП, такие как мотрин, адвил и алев, следует прекратить за 2 недели до операции.Аспирин и такие НПВП могут вызвать кровотечение, и их следует избегать в течение 2 недель после операции.
- Стероидные назальные спреи: Если вы принимали назальные стероидные спреи до операции, вам следует избегать их использования в течение как минимум 2 недель после операции на носовых пазухах, чтобы позволить заживлению слизистой оболочки носа и пазух. Ваш врач скажет вам, когда можно будет возобновить прием этого лекарства.
- Назальный солевой спрей: Назальный солевой спрей можно использовать каждые 2-3 часа после операции и может сделать ваш нос более комфортным после операции.Эти спреи (Ayr, Ocean, Simple Saline) являются лекарствами, отпускаемыми без рецепта, и их можно купить в любой аптеке.
- Промывание носовых пазух: Вы начнете промывание носовых пазух с помощью наборов для промывания носовых пазух (NeilMed Sinus Rinse Kit) на следующий день после операции.
 Это нужно делать не реже двух раз в день. Ваш врач или медсестра покажут вам, как выполнять ирригацию. Поначалу они будут казаться странными, если вы не делали их раньше. Однако вскоре они станут довольно успокаивающими, поскольку очистят от мусора, оставшегося в пазухах после операции.Вы можете ожидать появления кровянистых выделений при орошении в первые несколько дней после операции. Эти орошения имеют решающее значение для успеха после операции на носовых пазухах!
Это нужно делать не реже двух раз в день. Ваш врач или медсестра покажут вам, как выполнять ирригацию. Поначалу они будут казаться странными, если вы не делали их раньше. Однако вскоре они станут довольно успокаивающими, поскольку очистят от мусора, оставшегося в пазухах после операции.Вы можете ожидать появления кровянистых выделений при орошении в первые несколько дней после операции. Эти орошения имеют решающее значение для успеха после операции на носовых пазухах!
- Лихорадка после дня операции выше 101 ° F
- Постоянные прозрачные водянистые выделения после первой недели операции
- Внезапные изменения зрения или отек глаз
- Сильная головная боль или скованность шеи
- Сильная диарея
- Устойчивый , обильное кровотечение из носа, которое не проходит после использования Afrin
Кому звонить после операции:
В течение дня вам следует звонить в клинику по телефону: 410-955-6070
В нерабочее время звонить по телефону: 410-955 -6242
Ибупрофен не увеличивает риск кровотечения после пластической хирургии
Пациентам часто рекомендуют не принимать ибупрофен и другие нестероидные противовоспалительные препараты (НПВП) до или после операции из-за повышенного риска кровотечения. Но имеющиеся данные свидетельствуют о том, что ибупрофен не увеличивает риск кровотечения после процедур пластической хирургии, согласно обзору исследования в апрельском выпуске Plastic and Reconstructive Surgery ®, официального медицинского журнала Американского общества пластических хирургов (ASPS). .
Но имеющиеся данные свидетельствуют о том, что ибупрофен не увеличивает риск кровотечения после процедур пластической хирургии, согласно обзору исследования в апрельском выпуске Plastic and Reconstructive Surgery ®, официального медицинского журнала Американского общества пластических хирургов (ASPS). .
«Ибупрофен — полезный препарат в хирургических условиях с множеством положительных эффектов», — пишут доктора. Брайан Келли, Джеффри Козлоу и его коллеги из Мичиганского университета. Они считают, что ибупрофен может обеспечить безопасный и эффективный контроль боли при некоторых процедурах пластической хирургии, избегая при этом более высоких рисков и затрат на некоторые другие обезболивающие.
Исследования пластической хирургии сообщают об отсутствии увеличения кровотечений при применении ибупрофена
Исследователи провели систематический обзор и метаанализ исследовательской литературы для выявления высококачественных исследований, сравнивающих ибупрофен с другими обезболивающими у пациентов, перенесших операции, связанные с пластической хирургией. Они нашли четыре исследования, в которых 443 пациента были случайным образом распределены по ибупрофену или другим лекарствам. Все исследования начинали с ибупрофена до или сразу после операции и продолжались не менее одной недели.
Они нашли четыре исследования, в которых 443 пациента были случайным образом распределены по ибупрофену или другим лекарствам. Все исследования начинали с ибупрофена до или сразу после операции и продолжались не менее одной недели.
Изучаемые процедуры: косметическая хирургия лица, хирургия рака груди, пластика грыжи, а также хирургия и реконструкция рака кожи. Во всех исследованиях использовалась одинаковая доза ибупрофена (400 мг каждые четыре часа). Сравнительные методы лечения включали ацетаминофен, парацетамол плюс кодеин или кеторолак, отпускаемый только по рецепту НПВП.
Согласно собранным данным, все исследуемые препараты обеспечивали хороший контроль боли. Только семь процентов пациентов, получавших ибупрофен, и 11 процентов пациентов, которым были назначены препараты сравнения, сообщили о неудовлетворенности своим обезболивающим.(Разница была незначительной.)
Ибупрофен и другие препараты также были похожи по риску кровотечения. Частота «хирургически значимого послеоперационного кровотечения» составила 3,5 процента при приеме ибупрофена и 4,1 процента при применении других методов лечения (также незначительно). Дальнейший анализ был сосредоточен на сравнении ибупрофена и парацетамола плюс кодеин — распространенного послеоперационного обезболивающего, которое использовалось в качестве сравнительного лечения в трех из четырех исследований. Опять же, не было значительной разницы в контроле боли или риске кровотечения.
«Кровотечение — серьезная проблема для пластических хирургов, и НПВП обычно используются с учетом этого», — пишут доктор Келли и соавторы. Несмотря на то, что ибупрофен является недорогим лекарством, широко доступным без рецепта (OTC), мало исследований оценивали его использование у пациентов с пластической хирургией.
Исследователи подчеркивают, что их исследование ограничивалось процедурами, при которых кровотечение и гематомы (скопления крови) легко обнаруживаются. Они также признают некоторые другие ключевые ограничения, особенно небольшое количество включенных исследований и пациентов.Однако они считают, что при пластических и дерматологических (кожных) операциях на небольших участках ибупрофен может обеспечить хороший контроль боли без увеличения риска кровотечения. Полученные данные согласуются с тем фактом, что, в отличие от некоторых других НПВП, ибупрофен оказывает лишь краткосрочное временное влияние на функцию тромбоцитов — клеток крови, которые играют ключевую роль.
Послеоперационный ибупрофен и риск кровотечения после тонзиллэктомии с или без Аденоидэктомия — Full Text View
Тонзиллэктомия с аденоидэктомией и без нее — одна из наиболее часто выполняемых хирургических процедур в педиатрии.Частота проведения аденотонзиллэктомии увеличилась за последние четыре десятилетия (1). Это в основном связано с повышением осведомленности о потенциальных неблагоприятных последствиях, которые нарушение дыхания во сне у детей (SDB) может иметь для развития и долгосрочного здоровья легких и сердечно-сосудистой системы. SDB превзошел рецидивирующий тонзиллит как наиболее частое показание для аденотонзиллэктомии у детей (2-5). За последнее десятилетие, согласно Национальному статистическому отчету CDC об амбулаторных хирургических вмешательствах в США, ежегодные показатели тонзиллэктомии, выполненной с аденоидэктомией и без нее, у детей в возрасте 15 лет и младше увеличились с 287000 до 530 000 (6, 7).Аденотонзиллэктомия — вторая по частоте процедура, выполняемая у детей в возрасте до 15 лет. Хотя в целом аденотонзиллэктомия считается безопасной процедурой, она сопряжена со значительными осложнениями и потенциально может вызвать осложнения, особенно в педиатрической популяции. Осложнения включают послеоперационное кровотечение, обезвоживание, боль, анестезиологические осложнения и риски для дыхательных путей, аспирацию и пост-обструктивный отек легких (8). У маленьких детей риск аденотонзиллэктомии более критичен из-за меньшего размера дыхательных путей и респираторного резерва, а также меньшего объема крови (5).
Послеоперационное кровотечение можно классифицировать как первичное событие, возникшее <24 часов после операции, или вторичное событие, возникшее> 24 часа после тонзиллэктомии. Кроме того, события могут быть дополнительно описаны с помощью предпринятых вмешательств, таких как посещение отделения неотложной помощи, госпитализация для наблюдения или возвращение в операционную для достижения гемостаза. Частота послеоперационных кровотечений, включая первичные и вторичные кровотечения, колеблется от 3,3 до 20%, в среднем 4,5% (9). Таким образом, ежегодно десятки тысяч детей сталкиваются с потенциально опасным для жизни послеоперационным кровотечением, часто требующим повторной госпитализации, введения анестетика и оперативного контроля кровотечения.
Послеоперационная боль вносит значительный вклад в заболеваемость после тонзиллэктомии. Хотя наркотики эффективны для контроля послеоперационной боли, они часто противопоказаны, особенно у детей с нарушенным дыханием во сне, из-за их потенциально неблагоприятных побочных эффектов на дыхание и центральную нервную систему (10). Нестероидные противовоспалительные средства (НПВП), которые блокируют воспаление и отек, вызванные простагландинами, являются привлекательным терапевтическим вариантом, поскольку они не приводят к угнетению дыхательной и центральной нервной системы и, следовательно, могут снизить риск послеоперационного угнетения дыхания, тошноты и рвоты. чрезмерная седация и задержка мочи.Было показано, что НПВС являются эффективными анальгетиками после тонзиллэктомии (11,12). Однако, поскольку их механизм действия может также препятствовать агрегации тромбоцитов и увеличивать время кровотечения, их использование сбалансировано с учетом повышенного риска послеоперационного кровотечения. Аспирин, который необратимо ингибирует циклооксигеназу, влияет на коагуляцию и кровотечение на срок до 10 дней, был связан с увеличением скорости кровотечения после тонзиллэктомии (13). Однако НПВП, не относящиеся к аспирину, демонстрируют обратимое ингибирование ЦОГ-1 и ЦОГ-2 и, следовательно, не оказывают такого же тяжелого длительного воздействия на кровотечение (14).Ибупрофен, производное пропионовой кислоты, широко используется при мышечно-скелетной боли, но исследования его использования для обезболивания после тонзиллэктомии ограничены.
В 2011 году Американская академия отоларингологии опубликовала Руководство по клинической практике, в котором излагаются научно обоснованные стратегии выбора и периоперационного ведения тонзиллэктомии у детей. В рамках рекомендации клиницистам разъяснять медицинским работникам важность послеоперационного обезболивания, Боуг и др. Выступили за использование ибупрофена в послеоперационном периоде, заявив, что «ибупрофен можно безопасно использовать для обезболивания после операции» (15), цитируя Кокрановский обзор 2005 года. НПВП и кровотечения после тонзиллэктомии в поддержку этого руководства (16).Кокрановский обзор недавно добавил к своему анализу дополнительные исследования, и результаты остались схожими. В самом последнем Кокрановском обзоре, опубликованном в 2010 г., оценивалась 15 рандомизированных испытаний, сравнивающих НПВП с другими анальгетиками или плацебо, и было установлено, что использование НПВП не повлияло существенно на количество эпизодов периоперационных кровотечений, требующих и не требующих хирургического вмешательства; в этом обзоре не проводилось различий между первичными и вторичными кровотечениями (17). Поскольку кровотечение после тонзиллэктомии является необычным явлением, требуется большое количество участников, чтобы обеспечить достаточное количество событий, чтобы дать значимый результат, поэтому большой размер выборки> 1000 детей в Кокрановском обзоре заслуживает восхищения.Однако размер выборки был недостаточным для сравнения риска кровотечения при применении каждого отдельного НПВП. Кроме того, НПВП назначали как перорально, так и парентерально, а также до операции, во время и после операции, а продолжительность послеоперационного применения анальгетиков различалась в разных исследованиях. Используемая хирургическая техника также не была единообразной между исследованиями. Мы полагаем, что из-за этих ограничений данных недостаточно для широкого внедрения рекомендации Академии о том, что ибупрофен можно безопасно использовать для обезболивания после тонзиллэктомии без более тщательно контролируемого проспективного исследования.
Несмотря на то, что в литературе есть много исследований, посвященных оценке использования НПВП после тонзиллэктомии, существует несколько рандомизированных проспективных исследований, оценивающих использование ибупрофена, и лишь несколько исследований имеют достаточную мощность для адекватной оценки риска послеоперационного кровотечения. Разработка и проведение исследования для конкретной оценки ибупрофена после детской тонзиллэктомии и частоты послеоперационных кровотечений, требующих возвращения в операционную для контроля, важны для педиатрического сообщества отоларингологов, особенно с учетом недавних клинических рекомендаций Американской академии отоларингологии.Результаты такого окончательного исследования, возможно, повлияют на десятки тысяч детей, подверженных риску пост-тонзиллэктомического кровотечения каждый год. Это повлияет на наши собственные стандарты ухода, а также на национальные и международные нормы.
Предварительные исследования:
В Массачусетском глазном и ушном госпитале нет прецедентов назначения ибупрофена детям после тонзиллэктомии с аденоидэктомией или без нее. Несмотря на то, что Американская академия отоларингологии поддерживает использование ибупрофена в послеоперационном периоде, детские отоларингологи в нашем учреждении все еще не решаются назначать ибупрофен в послеоперационном периоде без дополнительных исследований его использования.
В отделении детской отоларингологии Массачусетского глазного и ушного госпиталя есть прецедент успешного завершения рандомизированных контролируемых исследований, включающих аденотонзиллэктомию (19, 20). Имея в своем распоряжении главных исследователей, занимающихся клиническими исследованиями, а также медсестер-исследователей и координаторов, можно провести проспективное контролируемое клиническое исследование использования ибупрофена после тонзиллэктомии. Кроме того, Массачусетская глазная и ушная больница рассчитывает ежегодную частоту кровотечений после тонзиллэктомии, включая процент пациентов, возвращающихся в отделение неотложной помощи для оценки возможного послеоперационного кровотечения, а также процент пациентов, возвращающихся в операционную для контроля кровотечения. .Таким образом, существует прецедент сбора данных о послеоперационных кровотечениях, а также контролируемая частота кровотечений, с которой можно сравнивать частоту кровотечений в проспективном исследовании.

 Такое осложнение возникает через некоторое время после проведения вмешательства.
Такое осложнение возникает через некоторое время после проведения вмешательства. Чтобы предупредить послеоперационное кровотечение, необходимо:
Чтобы предупредить послеоперационное кровотечение, необходимо:
 Заживление тканей ускоряется, выделение кровянистой жидкости прекращается. Порошок Банеоцин уничтожает патогенные микроорганизмы, считающиеся главной причиной возникновения послеоперационных осложнений. Средство нужно наносить на чистую кожу, поэтому рану перед процедурой очищают. Отмершие ткани и загрязнения удаляют с помощью смоченного перекисью водорода марлевого тампона. Шов просушивают стерильной салфеткой, после чего наносят порошок.
Заживление тканей ускоряется, выделение кровянистой жидкости прекращается. Порошок Банеоцин уничтожает патогенные микроорганизмы, считающиеся главной причиной возникновения послеоперационных осложнений. Средство нужно наносить на чистую кожу, поэтому рану перед процедурой очищают. Отмершие ткани и загрязнения удаляют с помощью смоченного перекисью водорода марлевого тампона. Шов просушивают стерильной салфеткой, после чего наносят порошок.
 Контакты ниже).
Контакты ниже). Ваш носовой ход и дыхание должны вернуться в норму через 2-3 недели после операции.
Ваш носовой ход и дыхание должны вернуться в норму через 2-3 недели после операции.
 Это нужно делать не реже двух раз в день. Ваш врач или медсестра покажут вам, как выполнять ирригацию. Поначалу они будут казаться странными, если вы не делали их раньше. Однако вскоре они станут довольно успокаивающими, поскольку очистят от мусора, оставшегося в пазухах после операции.Вы можете ожидать появления кровянистых выделений при орошении в первые несколько дней после операции. Эти орошения имеют решающее значение для успеха после операции на носовых пазухах!
Это нужно делать не реже двух раз в день. Ваш врач или медсестра покажут вам, как выполнять ирригацию. Поначалу они будут казаться странными, если вы не делали их раньше. Однако вскоре они станут довольно успокаивающими, поскольку очистят от мусора, оставшегося в пазухах после операции.Вы можете ожидать появления кровянистых выделений при орошении в первые несколько дней после операции. Эти орошения имеют решающее значение для успеха после операции на носовых пазухах!