Предстерилизационная очистка инструментария многоразового использования, аппаратуры в соответствии с нормативными документами
Предстерилизационная очистка и стерилизация изделий медицинского назначения.
План.
1. Предстерилизационная очистка инструментария многоразового использования, аппаратуры в соответствии с нормативными документами.
2. Стерилизация: понятие, методы и режимы.
3. Устройство и функции ЦСО.
При проведении инвазивных ПМУ во всех отделениях и амбулаторно-поликлинических организациях используются стерильные изделия медицинского назначения, которые после обеззараживания при профилактической и очаговой дезинфекции подвергаются предстерилизационной очистке и стерилизации.
Все мероприятия по стерилизации проводятся согласно документов:
1. Постановление Главного государственного санитарного врача РФ от 18 мая 2010 г. N 58 «Об утверждении СанПиН 2.1.3.2630-10 «Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность».
2. «МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ДЕЗИНФЕКЦИИ, ПРЕДСТЕРИЛИЗАЦИОННОЙ ОЧИСТКЕ И СТЕРИЛИЗАЦИИ ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ. МУ-287-113» (УТВ. ДЕПАРТАМЕНТОМ ГОССАНЭПИДНАДЗОРА МИНЗДРАВА РФ ОТ 30.12.1998).
3. ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы».
ПСО и стерилизация проводятся в централизованных стерилизационных отделениях (далее ЦСО), а при их отсутствии в отделениях МО систематически во всех случаях при подготовке изделий к предстоящим медицинским манипуляциям, при которых эти изделия будут соприкасаться с кровью, раневой поверхностью, инъекционными препаратами или при которых имеется риск повреждения слизистых оболочек.
Цель ПСО — удаление с изделий медицинского назначения белковых, жировых, лекарственных, механических загрязнений, в том числе невидимых (крови, слизи), дезинфицирующих средств, детергентов, что обеспечивает эффективность последующей стерилизации, безопасное использование простерилизованных изделий и снижающий риск пирогенных реакций. ПСО осуществляется в качестве самостоятельного процесса после дезинфекции изделий или при совмещении с ней.
ПСО осуществляется в качестве самостоятельного процесса после дезинфекции изделий или при совмещении с ней.
ПСО проводят ручным и механизированным способами.
При ручной обработке замачивают, моют и ополаскивают изделия в ваннах, раковинах, бачках и других емкостях, которые должны иметь кран (шланг) для струйной подачи воды. Предстерилизационная очистка ручным способом должна осуществляться моющими растворами используя емкости из пластмасс, стекла или покрытых эмалью (без повреждений) в определенной последовательности.
Для механизированной ПСО используют специальные моечные и моечно-дезинфекционные (комбинированные) машины для мойки шприцев и игл, хирургических инструментов. Работа моечных машин основана на использовании одного из методов: струйного, ротационного, ершевания, ультразвукового с использованием поверхностно-активных веществ или других добавок. Методика проведения механизированной обработки зависит от типа используемого оборудования и должна соответствовать инструкции по эксплуатации.
Для ПСО, используются химические, физические средства, оборудование, аппаратура и материалы, разрешенные к применению в МО в установленном порядке в Российской Федерации, не оказывающие неблагоприятного воздействия на человека.
Разъемные изделия подвергают предстерилизационной очистке в разобранном виде.
После завершения ПСО проводится контроль качества предстерилизационной обработки — постановка контольных проб на наличие остаточных количеств щелочных компонентов моющего препарата, крови, жировых компонентов лекарственных средств.
Контролю подвергают 1% от одновременно обработанного инструментария одного наименования (но не менее 3-5 единиц). После завершения ПСО, при отрицательных контрольных пробах, изделия медицинского назначения подвергаются процессу стерилизации.
Стерилизация: понятие, методы и режимы.
Стерилизация обеспечивает полное высвобождение вещества или предмета от микроорганизмов.
Стерилизация — это процесс уничтожения всех видов микробной флоры (в том числе споровых микроорганизмов) и вирусов с помощью физических или химических воздействий.
Простейшим способом стерилизации является обжигание металлических и стеклянных предметов в пламени горелки. Выбор способа стерилизации зависит от целого ряда факторов, основным из которых является устойчивость предмета (изделия) к тому или иному воздействию.
Стерилизацию осуществляют физическими (паровой, воздушный, в среде нагретых шариков) и химическими (применение растворов химических средств, газовый) методами. Выбор адекватного метода стерилизации зависит от особенностей стерилизуемых изделий.
При стерилизации паровым, воздушным и газовым методами изделия, как правило, стерилизуют упакованными в стерилизационные упаковочные материалы; при паровом методе, кроме того, используют стерилизационные коробки без фильтров и с фильтрами.
Могут быть использованы только упаковочные материалы, разрешенные в установленном порядке к промышленному выпуску и применению (в случае импортных материалов — разрешенные к применению) в Российской Федерации.
При воздушном методе, а также в отдельных случаях при паровом и газовом методах, допускается стерилизация инструментов в неупакованном виде (в открытых лотках).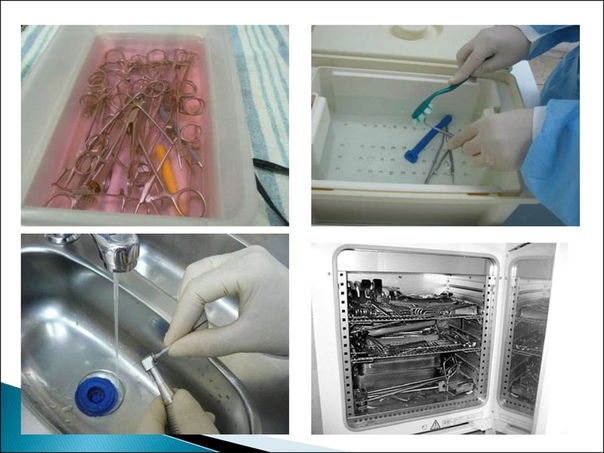
Стерилизационная очистка
Стерилизационная очистка — это этап, следующий после дезинфекции. Он производится для итогового устранения от остатков грязи разного происхождения. От качества и точности выполнения такой очистки зависит действенность и эффективность последующего этапа – стерилизации.
Стерилизационные очистительные работы — это совокупность мер, ориентированных на устранение загрязнений: белковых, жировых, механических. Медицинские инструменты при активном применении, постоянной обработке подвергаются коррозии. Их очищают химическими веществами для предотвращения возникновения коррозии. Даже поступившие, еще не применявшиеся для работы с пациентами, инструменты должны в обязательном порядке пройти через очистку. Это необходимо для того, чтобы удалить все ненужные производственные загрязнения. Съемные части изделия подлежат предстерилизационной очистке в разобранном виде. Такая чистка производится двумя способами: ручным или механическим. При использовании моечных технологий и иных средств необходимо тщательно изучить инструкцию по эксплуатации. Оба способа требуют использования моечных средств для повышения качества результата очистки.
При использовании моечных технологий и иных средств необходимо тщательно изучить инструкцию по эксплуатации. Оба способа требуют использования моечных средств для повышения качества результата очистки.
Очистка ручным способом проводится в определенной последовательности. Ручная обработка проходит без помощи технических устройств. Для ее проведения разработаны инструкции по последовательности выполнения дезинфекции. Инструменты заранее ополаскивают в чистой воде нескольких минут. Затем замачивают в моющем средстве. Время вымачивания — 15 минут, температура жидкости — 60°С. На сегодняшний день популярными считаются группы средств, позволяющие единовременно производить и дезинфекцию, и такую очистку. В качестве дезинфицирующего средства можно порекомендовать японское средство от компании Sarava. Оно обладает различными нужными для очистки свойствами: вирулицидность, бактерицидность, фунгицидность. Предстерилизацию проводят прохладно-теплым раствором, температура которого не менее 20º в течение 8часов. При чистке медицинских инструментов, гастроскопов, колоноскопов, бронхоскопов можно использовать щетку, ерш или ватно-марлевый тампон. Рекомендуется обязательно проводить повторное ополаскивание в чистой воде. Можно это делать достаточно быстро — 2-3 минуты. Завершается процесс предстерилизации просушкой медицинских инструментов, изделия горячим воздухом. Итог действий – полное исчезновение влаги на корпусе и поверхности.
При чистке медицинских инструментов, гастроскопов, колоноскопов, бронхоскопов можно использовать щетку, ерш или ватно-марлевый тампон. Рекомендуется обязательно проводить повторное ополаскивание в чистой воде. Можно это делать достаточно быстро — 2-3 минуты. Завершается процесс предстерилизации просушкой медицинских инструментов, изделия горячим воздухом. Итог действий – полное исчезновение влаги на корпусе и поверхности.
Механизированная обработка проходит с помощью специального оборудования или с применением ультразвука при использовании активных веществ. Механизированная очистка осуществляется в машинах специального назначения для медицинских игл, шприцов и иных приборов и инструментов. Работа таким способом осуществляется согласно инструкциям, с которыми знакомят заранее. Располагается текст инструкции рядом с механизмами обработки.
Для проведения очистительных действий не рекомендуется заменять перекись водорода на таблетки гидропирита. При близких качествах таблетки имеют высокую коррозийскую активность. Инструменты очень быстро теряют свою прочность и возможность использования в работе. Важно это знать для обработки инструментов с острыми режущими плоскостями. При отсутствии среди медицинских средств перекиси водорода, ее советуют заменить на перекиси марок А,Б. Такой состав переписи должен содержать концентрацию не меньше 28%.
Инструменты очень быстро теряют свою прочность и возможность использования в работе. Важно это знать для обработки инструментов с острыми режущими плоскостями. При отсутствии среди медицинских средств перекиси водорода, ее советуют заменить на перекиси марок А,Б. Такой состав переписи должен содержать концентрацию не меньше 28%.
Оба способа (ручной и механизированный) предполагают использования различных моющих составов, которые должны быть нетоксичными, достаточно эффективными и проверенными. Главное, они не должны нанести вред обрабатывающему предмету, изменять качество металла. Антимикробные свойства моющих составов и средств позволяют совместить предстерилизационную очистку с дезинфекцией. После проведения предстерилизационной обработки инструментов, гастроскопов, колоноскопов, бронхоскопов проходит подготовка и непосредственная стерилизация.
Контроль за качеством состояния инструментов проводится 1 раз в 7 дней. Такая очистка будет считаться эффективной, только если после проведения пробы не будут обнаружены и выделены остатки загрязнения и дезинфекционного средства. Для определения уровня очистки проводятся различные пробы. Азопирамовый анализ используют для проверки наличия остатков крови. С такой же целью используется Амидопированная проба. Обнаружение остатков использованных дезинфицирующих средств проводится через фенолфталеиновую пробу. Анализ с Суданом-3 необходим для обнаружения остатков жира. При обнаружении положительной пробы на кровь, жировые выделения или моющие средства, инструменты, гастроскопы, колоноскопы, бронхоскопы необходимо подвергнуть очистке повторно. Результат всех этапов контроля, вид пробы и тип анализа фиксируется в журнале.
Для определения уровня очистки проводятся различные пробы. Азопирамовый анализ используют для проверки наличия остатков крови. С такой же целью используется Амидопированная проба. Обнаружение остатков использованных дезинфицирующих средств проводится через фенолфталеиновую пробу. Анализ с Суданом-3 необходим для обнаружения остатков жира. При обнаружении положительной пробы на кровь, жировые выделения или моющие средства, инструменты, гастроскопы, колоноскопы, бронхоскопы необходимо подвергнуть очистке повторно. Результат всех этапов контроля, вид пробы и тип анализа фиксируется в журнале.
Поделитесь данным материалом в соцсетях:
|
Централизованное стерилизационное отделение — Федеральный центр нейрохирургии, г. Новосибирск
Централизованное стерилизационное отделение – это важнейшее структурное подразделение современного хирургического стационара, призванное:
- обеспечивать операционные и клинические отделения стерильными изделиями медицинского назначения;
- повышать эпидемическую безопасность пациентов и персонала;
- сокращать расходы на неспецифическую профилактику внутри больничных инфекций.

В нашем центре сосредоточены последние технические инновации и новые методики дезинфекции, предстерилизационной обработки и стерилизации медицинских изделий, которые позволяют предотвратить угрозу распространения внутрибольничных инфекций. Специалистами отделения реализован комплексный подход расчетов, технических заданий, проектирования, выполнения строительно-монтажных работ, подбора, поставки, запуска и обслуживания. Все оборудование представлено маркой «GETINGE»-шведского концерна, являющегося крупнейшим мировым производителем стерилизационного оборудования. Это не только стерилизаторы, паровые дезинфекционные камеры, но и ультразвуковые мойки, термозапаивающие машинки, системы хранения и транспортировки и многое другое, что позволяет выполнять работу на высоком профессиональном уровне, соблюдая все правила и нормы инфекционного контроля.
Современные концепции инфекционного контроля базируются на принципе барьера: строгого разделения на «грязную» и «чистую» зоны. Предварительная обработка изделий медицинского назначения в нашем центре производится в «грязной» зоне, с помощью ультразвуковых моющих ванн и современных дезинфекционно-моющих машин форвакуумного типа. Использованные инструменты распределяются на специальные сетки и лотки и загружаются в моющие машины на «грязной» стороне, а уже обработанные и продезинфицированные выгружаются в «чистой» зоне. Изолированность «грязной» и «чистой» зон исключает повторную контаминацию обработанных инструментов.
Предварительная обработка изделий медицинского назначения в нашем центре производится в «грязной» зоне, с помощью ультразвуковых моющих ванн и современных дезинфекционно-моющих машин форвакуумного типа. Использованные инструменты распределяются на специальные сетки и лотки и загружаются в моющие машины на «грязной» стороне, а уже обработанные и продезинфицированные выгружаются в «чистой» зоне. Изолированность «грязной» и «чистой» зон исключает повторную контаминацию обработанных инструментов.
Альтернативные программные комбинации гарантируют достижение требуемого качества очистки и дезинфекции в соответствии со всеми действующими стандартами.
Инструменты и изделия медицинского назначения, прошедшие дезинфекцию и предстерилизационную очистку, стерилизуются в автоклавах «GETINGE», что обеспечивает высокое качество стерилизации, точность выполнения заданного цикла, статус которого постоянно контролируется дисплеем. Двухдверный (проходной) вариант стерилизационной камеры позволяет загружать подготовленные инструменты на «чистой» стороне, а простерилизованные, на «стерильной», что исключает риск ошибок при большом обороте стерилизационных контейнеров.
Камерная дезинфекция является одним из существенных звеньев противомикробных мероприятий. Используется при выписке каждого больного из отделения и является обязательным мероприятием для обеззараживания хлопчатобумажных, шерстяных, суконных, кожаных вещей, матрацев, одеял, подушек, утиля, документов и книг. В нашем центре автоматический паровой дезинфектор оборудован горизонтально-скользящей дверцей проходного типа с загрузкой на уровне пола. Он сочетает высокую производительность с экономичностью, снабжен системой управления, облегчающей обслуживание аппарата.
Низкотемпературная стерилизационная система «СТЕРРАД» разработана для обеспечения современных высочайших стандартов стерилизации с использованием проверенных временем технологий. Этот способ стерилизации безопасен для инструментов, имеет самые минимальные ограничения по конструкции обрабатываемых предметов, это позволяет продлить срок использования медицинских инструментов и сократить расходы на их ремонт. Является наиболее эффективным благодаря своей высокой проникающей способности. Предназначен для быстрой и бережной стерилизации инструментов и оборудования, особенно высокотехнологичного, дорогостоящего инструментария: оптических устройств, эндоскопов, видеокамер, видеоскопов, инструментов для микрохирургии, электрических и электронных устройств, изделий из полимеров и прочее.
Является наиболее эффективным благодаря своей высокой проникающей способности. Предназначен для быстрой и бережной стерилизации инструментов и оборудования, особенно высокотехнологичного, дорогостоящего инструментария: оптических устройств, эндоскопов, видеокамер, видеоскопов, инструментов для микрохирургии, электрических и электронных устройств, изделий из полимеров и прочее.
По мере того, как эндоскопические манипуляции находят все более широкое применение, риск возникновения инфекций возрастает. Для решения этой проблемы в нашем центре используется автоматизированная машина для обработки эндоскопов «ENDOCLINS-NSX». Автоматизация процессов дезинфекции высокого уровня гарантирует высокий результат стандартов обработки. Интегрированная система выполняет обработку всех модификаций современных эндоскопов, имеет встроенную систему оповещения циклов, поддерживает стандартный процесс дезинфекции высокого уровня для охраны здоровья пациентов и персонала.
Новейшие технологии обработки инструментов, используемые в нашем центре, позволяют достичь наилучших результатов для пациентов, повысить продуктивность работы, уменьшить затраты.
Мы заботимся о безопасности пациентов!
Сестринский персонал централизованного стерилизационного отделения.
Предстерилизационная очистка медицинских изделий в Москве
Закажите услугу
Назначение предстерилизационной очистки
Перед процессом стерилизации многие изделия необходимо отмыть от механических загрязнений после производства (остатки песка при пескоструйной обработке, масляная пленка и др.). Для этого мы используем специальное оборудование: дезинфекционно-моечную машину проходного типа для чистых помещений INNOVA или УЗ-мойку ElmaSonic, — выбор оборудования зависит от типа загрязнений и подбора оптимального средства для очистки.
Параметры дезинфеционно-моечной машины гибко настраиваются, — это позволяет отмывать даже термочувствительные медицинские изделия и блистерную упаковку из полиэтилена высокой плотности при температуре 40С. Отмывка в режиме с пониженной температурой препятствует деформации блистера, использующегося для упаковки медицинских изделий.
Контроль качества
Контроль качества предстерилизационной очистки имеет очень важное значение, т.к. необходимо доказать, что медицинское изделие после отмывки не содержит загрязнений и пригодно для использования по назначению.
Для подтверждения качества, по окончании цикла мы выдаем клиенту протокол контроля качества, где фиксируются данные процесса: данные чек-листа из автоматической дезинфекционно-моечной машины, температурный режим при отмывке медицинских изделий и компонентов, продолжительность цикла, моющие средства, результаты проб на остаточное присутствие моющего средства и загрязнений (проба с Суданом III, фенолфталеиновая проба).
Проведение процесса предстерилизационной очистки и валидация
Несмотря на то, что данный процесс кажется рутинным, мы зачастую сталкиваемся с задачами разработки технологии очистки медицинских изделий от производственных загрязнений и подбором специальных методов и средств очистки. При разработке метода нужно учитывать не только то, какие загрязнения присутствуют на медицинском изделии, но и материал, из которого оно состоит: подбор средств и температурного режима нужно произвести так, чтобы на выходе мы получили очищенное медицинское изделие, не потерявшее в течение процесса отмывки своих физико-химических свойств и не ставшее пирогенным.
Именно поэтому, многие наши клиенты заказывают у нас услугу валидации процесса предстерилизационной очистки, — они хотят быть уверены в том, что после отмывки медицинское изделие очищено от всех загрязнений и не изменило своих свойств.
Для валидации процесса, в загрузку помещаются изделия вместе с датчиками. При выгрузке продукции, данные с датчиков снимаются и документируются. Параллельно проводится ряд тестов и лабораторных испытаний, подтверждающих, что процесс отмывки происходит с повторяемым качеством. Все результаты фиксируются в протоколах и в последствии выдаются клиенту.
Стоимость
Расчет стоимости по запросу
Заказать услугу
Спасибо, Ваша заявка отправлена!
Мы свяжемся с вами в ближайшее время.
Подготовка инструментов к стерилизации | Стоматология сегодня
Многие местные центры по уходу за домом предлагают короткие курсы по различным темам ремонта и модернизации. Одним из популярных предложений является внутренняя покраска стен, пола и потолка. Присутствующие удивляются, когда вместо краски и кисти им дают ведро с мыльной водой и губку. Для того, чтобы в итоге был положительный результат, вначале требуется правильная подготовка. Поверхности необходимо отремонтировать, отшлифовать, тщательно очистить, а затем полностью промыть.Краска должна напрямую контактировать с поверхностями. Наличие масел, грязи, клея или пятен может отрицательно повлиять на качество картины. Подготовка поверхности — залог успешной покраски.
Правильная очистка — важный шаг в подготовке инструментов к стерилизации. Очистка удаляет прилипшие материалы, которые могут помешать стерилизации. Подготовка инструмента включает 5 последовательных групп действий: у врача и транспортировка, выдержка (предварительное замачивание), очистка, контроль коррозии / сушка / смазка и упаковка. 1-3
КАТЕГОРИИ ПУНКТОВ ПОМОЩИ ПАЦИЕНТАМ
| Таблица 1. Категории предметов ухода за пациентами. * | |||
| |||
* Изменено по ссылкам с 1 по 4. |
Центры по контролю и профилактике заболеваний (CDC) классифицировали предметы ухода за пациентами как критические, полукритические и некритические в зависимости от потенциального риска инфицирования пациента во время использования. Система основана на классификации, впервые предложенной Сполдингом в 1968 г. (Таблица 1).CDC рекомендует сначала очистить критические и полукритические предметы, а затем стерилизовать их нагреванием. 1,4
Полукритические предметы, чувствительные к нагреванию, должны, как минимум, очищаться и обрабатываться дезинфицирующими средствами высокого уровня. Некритические предметы очищаются и обрабатываются дезинфицирующим средством низкого уровня, когда не видно крови. Когда видна кровь, следует использовать дезинфицирующие средства среднего уровня. 1,2
КРЕСЛО И ТРАНСПОРТИРОВКА
Операционная подготовка следующего пациента не может начаться до тех пор, пока все зараженные предметы не будут безопасно удалены, выброшены или обработаны.Удаление зараженных предметов ухода за пациентом из операционной следует выполнять осторожно, чтобы не допустить контакта с микроорганизмами. Контакт с неповрежденной кожей рук, слизистыми оболочками глаз, носа или рта, а также чрескожные травмы острыми инструментами создают риск передачи заболевания. Инструменты, транспортируемые в зону обработки инструментов, должны содержаться во избежание травм. Локализация может быть определена как кассеты для инструментов или клетки, в которых предметы ухода за зубами очищаются, стерилизуются и хранятся до момента использования.Острые инструменты не следует приносить открыто в зону обработки инструментов. Чрескожные травмы могут возникнуть у другого стоматологического медицинского персонала (DHCP) или пациентов в коридорах, ведущих к зоне обработки инструментов.
УДЕРЖАНИЕ / ПРЕДВАРИТЕЛЬНАЯ ЗАЩИТА
Если DHCP не может начать процедуру обработки инструментов сразу после транспортировки предметов ухода за зубами в зону обработки инструментов, предметы должны быть помещены в раствор для хранения в устойчивом к проколам контейнере для процесс предварительной очистки.Это облегчает процесс очистки, предотвращая высыхание материала пациента на инструментах. Очистка становится проще и требует меньше времени. Удерживающий раствор может быть дезинфицирующим / детергентным или ферментативным очистителем. Использование стерилизующего / дезинфицирующего средства высокого уровня (например, глутарового альдегида) не считается целесообразным и поэтому не рекомендуется. Некоторые кассеты из пластика / смолы нельзя помещать в удерживающий раствор. Всегда консультируйтесь и следуйте рекомендациям производителя кассеты.Кроме того, имейте в виду, что некоторые инструменты могут подвергнуться коррозии, если их оставить в растворе для хранения более чем на несколько часов. При использовании моечной машины предварительная очистка не требуется. Загрязненные инструменты можно поместить прямо в моечную машину и держать там до начала цикла промывки.
ОЧИСТКА
Очистка загрязненных стоматологических инструментов необходима при любых процедурах стерилизации. Очистка снижает бионагрузку (микроорганизмы, кровь, слюна, твердые ткани ротовой полости и стоматологические материалы).Бионагрузка может изолировать или защитить микроорганизмы от стерилизующих агентов. Очистить стоматологические инструменты можно двумя способами: механическим (ультразвуковая очистка, моечные / моечно-дезинфекционные устройства) и вручную. 1-3
Ультразвуковая очистка
Ультразвуковая очистка по сравнению с ручной очисткой снижает прямой контакт с загрязненными инструментами и, таким образом, снижает вероятность порезов и колотых ран. Ультразвук из-за своего кавитационного действия (генерируются миллиарды взрывающихся пузырьков, которые создают турбулентность очистки, которая удаляет и разрушает мусор), как правило, более действенна и действенна, чем ручная очистка.Например, офисный персонал может правильно очистить больше инструментов за определенный период времени. Почти все инструменты можно очищать ультразвуком. Одним из основных исключений является большинство стоматологических наконечников, которые обычно необходимо чистить вручную. Как незакрепленные инструменты, так и инструменты в кассетах можно очищать ультразвуком. Всегда проверяйте инструкции производителя по очистке. 2,3,5
| Таблица 2. Выбор ультразвукового очистителя. * • Приобретите устройство, отвечающее потребностям практики (например, достаточно большое, чтобы вмещать от 15 до 20 незакрепленных инструментов одновременно, или приспособленное для одновременной очистки нескольких кассет, уложенных друг на друга). * Изменено из ссылок 2, 3, 5 и 6. |
Ультразвуковые очистители бывают разных размеров, от круглых единиц размером с пинту до многолитровых, прямоугольной формы, которые можно использовать на столешнице или встраивать в стойку (таблица 2).
Таблица 3. Рекомендации по использованию ультразвукового очистителя. * • Используйте соответствующие средства индивидуальной защиты — перчатки, маски, защитные очки и медицинский халат. * Изменено из ссылок 2 и 6. |
Незакрепленные инструменты и инструменты, удерживаемые в кассетах, должны быть подвешены в растворе, но не на дне камеры устройства (Таблица 3). Размещение инструментов непосредственно на полу устройства приведет к плохой очистке, а чрезмерное раскачивание может повредить устройство и инструменты. Использование подвесной корзины или стойки позволит позиционировать инструменты или кассеты для оптимальной очистки.Крышка должна быть на месте всякий раз, когда прибор работает.
Камера устройства должна быть заполнена (обычно в пределах 0,5–1 дюйма от верха) раствором моющего средства, предназначенным для использования в ультразвуковом очистителе. Хотя эти моющие средства более дорогие, чем те, которые используются в домашних условиях, в долгосрочной перспективе они более экономичны. Ультразвуковые моющие средства имеют рабочий уровень pH, который не повредит металлы инструментов и способен вызывать кавитацию в течение длительного времени.
Функцию ультразвукового очистителя легко проверить, используя процесс, называемый тестом алюминиевой фольги.Сначала отрежьте кусок легкой фольги примерно на дюйм короче, чем длина камеры. Фольга должна быть примерно на дюйм длиннее, чем глубина камеры. Поместите лист фольги как можно вертикально в заполненную камеру, не касаясь сторон. Нижняя часть фольги должна быть не менее чем на дюйм выше пола устройства. Дайте устройству поработать 30 секунд. Снимите фольгу и обратите внимание на наличие небольших углублений (неровностей) или даже отверстий в фольге или на ней. Галька должна быть равномерно распределена по поверхности фольги.Если есть участки размером более полдюйма без гальки, возможно, устройство нуждается в ремонте. Производитель конкретных устройств может проводить испытания алюминиевой фольги, аналогичные только что описанным. В таких случаях пользователи должны следовать этим указаниям. 2,5,6
Мойки для инструментов
Другой метод механической очистки инструментов — это моечные машины (иногда называемые «моечно-дезинфицирующими машинами»). Эти устройства использовались в больницах и более крупных клиниках и стали доступны для стоматологических кабинетов.
Мойка чистит инструменты струей горячей воды с моющим средством с последующим ополаскиванием под высоким давлением. Шайбы должны изготавливаться специально для использования с медицинскими / стоматологическими инструментами. Не следует использовать те, которые предназначены для домашнего использования.
Шайбы обычно имеют большие размеры и обычно подходят для многих кассет для инструментов (и отдельных инструментов). Обычный цикл очистки включает несколько этапов стирки и полоскания, на выполнение которых часто уходит до часа. Эксплуатация моечных машин, включая подбор мойки
решения, как правило, хорошо описывается производителями.
Ручная очистка
| Таблица 4. Рекомендации по ручной чистке. * • Всегда используйте средства индивидуальной защиты, такие как рабочие перчатки, маски, защитные очки и халат. * Изменено из ссылок 2 и 5. |
Ручная чистка инструментов — это традиционный метод очистки и относительно эффективный метод удаления мусора (Таблица 4). Однако чистка опасна и не так эффективна, как механические методы чистки.
В случае сильно прилипающих материалов для правильной очистки некоторых инструментов может потребоваться очистка руками. Однако регулярная ручная очистка всех инструментов перед стерилизацией не рекомендуется.Чистка рук требует прямого контакта с загрязненными инструментами, что увеличивает вероятность профессионального воздействия даже при использовании рабочих перчаток. Сегодня механические очистители очень эффективны, поэтому нет необходимости чистить инструменты вручную перед помещением в ультразвуковой очиститель или устройство для мытья инструментов. 2,3,5 Кроме того, персонал может выполнять другие задачи по переработке инструментов во время ультразвуковой или машинной очистки.
После очистки инструменты должны выглядеть чистыми (без мусора).Однако их следует рассматривать как все еще загрязненные микробами (нестерильные). Это означает, что при обращении с этими предметами необходимо использовать средства индивидуальной защиты. Воздействие нестерильных (хотя и чистых) инструментов через слизистую оболочку или чрескожное вмешательство является серьезным вопросом. Стоматологические кабинеты должны подготовить официальную письменную политику в отношении процедур после контакта. Все сотрудники офиса должны знать, что представляет собой облучение и какие конкретные шаги необходимо предпринять в случае аварии. 2
КОНТРОЛЬ КОРРОЗИИ / СУШКА / СМАЗКА
После очистки инструменты и кассеты для инструментов следует хорошо промыть. Некоторые устройства для очистки (например, машины для мойки инструментов) имеют автоматические циклы ополаскивания. После ополаскивания инструменты и кассеты следует дать стечь и, в идеале, полностью высохнуть. Встряхивание инструментов и кассет может ускорить этот процесс. Однако следует соблюдать осторожность, чтобы не повредить инструменты. Сушку инструментов вручную с использованием каких-либо полотенцесушителей необходимо производить осторожно.Некоторым инструментам (например, навесным) для правильной работы требуется смазка.
Несмотря на то, что инструменты были очищены, они не стерильны. При обращении с ними необходимо использовать соответствующие средства индивидуальной защиты. Сюда входят рабочие перчатки, защитные очки и халаты.
Теперь можно определить физическую целостность инструментов. Поврежденные предметы можно удалить и заменить. Углеродистая сталь подвержена ржавлению и потускнению при обработке в паровом автоклаве.Углеродистая сталь часто используется в стоматологических борах, на режущих / очищающих кромках некоторых инструментов (например, ортодонтических плоскогубцев, скалеров и топоров) и на поверхностях захвата щипцов.
Растворы, ингибирующие коррозию (например, содержащие нитрит натрия), можно распылять на инструменты перед обработкой в паровом автоклаве. Такие растворы также можно использовать в качестве инструментальных соусов («молока»). Обычный результат — уменьшение коррозии инструмента. Альтернативой использованию ингибитора ржавчины может быть тщательная сушка очищенных инструментов и их обработка либо в сушильном шкафу, либо в стерилизаторе паров ненасыщенных химикатов. 1-5
УПАКОВКА
Цель стерилизации — это больше, чем просто стерилизация инструментов между пациентами; он доставляет стерильные инструменты к креслу каждый раз, когда они будут использоваться. Правильная очистка важна, но не менее важна и сохранение стерильности инструментов после их обработки в стерилизаторе. Упаковка инструментов перед обработкой поможет защитить их от загрязнения при хранении или транспортировке в кресле для использования.Неупакованные инструменты не имеют практического срока хранения. Инструменты, обрабатываемые без защитной упаковки, могут быть легко загрязнены после обработки. 2
Упаковка является не только защитной, но и организационным инструментом. Упаковка помещает инструменты в функциональные наборы или группы. Химические мониторы также могут быть включены в упаковочные материалы. Кроме того, биологические мониторы легко помещаются и удерживаются в пакетах, пакетах, лотках или кассетах. 2
| Таблица 5.Упаковочные материалы, подходящие для различных типов стерилизации. * | ||||||||||||
| ||||||||||||
| * Изменено по ссылкам с 1 по 6. ** Условия не включают время разогрева или охлаждения; используйте тестирование спор для обеспечения стерилизации. # Лучше всего покупать стерильные жидкости для промывания для клинического использования. & Обработка в закрытых контейнерах должна проверяться тестированием на споры. @ Алюминиевая фольга легко рвется и рвется. |
Следует использовать только те упаковочные материалы, которые предназначены для использования в стерилизаторах. Упаковка считается медицинским устройством и поэтому ее эффективность и действенность регулируется Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов.Кроме того, упаковка должна соответствовать типу используемого стерилизатора (Таблица 5). Неправильная упаковка может замедлить стерилизацию, разрушиться во время обработки или даже высвободить токсичные химические вещества при нагревании.
Одной из форм упаковки, которая становится все более популярной, является кассета для инструментов. Кассеты сокращают непосредственное обращение с загрязненными инструментами и удерживают инструменты вместе в течение всего процесса стерилизации (очистки, ополаскивания, сушки и упаковки). Кассеты легко помещаются в моечные машины для инструментов, которые часто бывают большими и вмещают от 5 до 10 за один цикл.Кроме того, после стерилизации кассеты легко хранить штабелями. Кассеты также можно пропускать через ультразвуковые очистители. Однако необходимо использовать блоки подходящего размера. Кассеты изготавливаются из различных материалов (нержавеющая сталь, алюминий и пластик / смола) и выдерживают стерилизацию паром, химическими парами и сухим жаром. 2
ЗАКЛЮЧЕНИЕ
Организация по процедурам безопасности и асептики (OSAP) — это стоматологический ресурс по инфекционному контролю и безопасности.OSAP недавно опубликовала книгу о руководящих принципах CDC — от политики к практике: OSAP’s Guide to the Guidelines. Книга предназначена для поддержки усилий стоматологов, направленных на лучшее понимание рекомендаций и определение эффективных и действенных методов соблюдения, включая подготовку инструментов к стерилизации. Информация для заказа доступна на osap.org или по телефону (410) 571-0003.
Ссылки
1. Кон В.Г., Коллинз А.С., Кливленд Дж. Л. и др .; Центры по контролю и профилактике заболеваний.Руководство по инфекционному контролю в стоматологических учреждениях, 2003 г. MMWR . 2003; 52 (РР-17): 1-61.
2. Миллер CH, Паленик CJ. Инфекционный контроль и обращение с опасными материалами для стоматологической бригады . 3-е изд. Сент-Луис, Миссури: Эльзевьер Мосби; 2005: 191-250.
3. Организация по безопасности и асептическим процедурам. От политики к практике: Руководство OSAP к руководящим принципам. Аннаполис, Мэриленд: OSAP; 2004: 45-62.
4. Сполдинг Э. Химическая дезинфекция медицинских и хирургических материалов.В: Лоуренс CA, Блок SS. Дезинфекция, стерилизация и консервация . Филадельфия, Пенсильвания: Lea & Febiger; 1968: 517-531.
5. Паленик CJ. Стерилизация стоматологических инструментов: шестиэтапный процесс. J Contemp Dent Pract . 2001; 2: 84-96.
6. Jorgensen G, Palenik CJ. Стерилизация инструментов. Дент Оборудование и материалы . 2004; 9: 69-71.
Г-жа Йоргенсен работала ассистентом-ортодонтом, ассистентом главного врача и тренером в большой группе.В настоящее время она работает полный рабочий день инструктором по клиническим процедурам и ассистирует стоматолога в Portland Community College в Портленде, штат Орегон. Она является утвержденным докладчиком по патогенам, передающимся с кровью в Национальной ассоциации стоматологических лабораторий (NADL), и является членом Dental Assisting. Национальный совет, комитет по созданию тестов для экзаменов по инфекционному контролю (ICE). С ней можно связаться по телефону (503) 977-4036 или Этот адрес электронной почты защищен от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Др.Паленик за последние 25 лет занимал ряд академических и административных должностей в Школе стоматологии Университета Индианы. В их число входят профессор микробиологии полости рта, директор по здоровью и безопасности людей, директор центральной службы стерилизации и председатель комитетов по инфекционному контролю и управлению опасными материалами. В настоящее время он является директором по исследованиям и службам инфекционного контроля. Доктор Паленик опубликовал 125 статей, более 290 монографий, 3 книги и 7 глав в книгах, большинство из которых связано с инфекционным контролем и безопасностью и здоровьем человека.Кроме того, он провел более 100 курсов повышения квалификации в США и 8 зарубежных странах. Все вопросы следует направлять в OSAP по адресу Этот адрес электронной почты защищен от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Стерилизация женщин: этические вопросы и соображения
Этическое консультирование включает три основных аспекта: 1) содержание представленной информации, 2) процесс передачи информации и 3) саморефлексию. со стороны акушера-гинеколога.Содержание должно включать самую последнюю информацию о процедурах стерилизации и альтернативах (см. Также Практический бюллетень № 121, Обратимая контрацепция длительного действия: имплантаты и внутриматочные средства , и Практический бюллетень № 133, Преимущества и риски стерилизации ). Процесс консультирования не должен быть осуждающим, и врачи должны распознавать пациентов как людей с различными желаниями и приоритетами. Наконец, акушеры-гинекологи должны стремиться избегать привнесения в клиническую встречу сознательных или бессознательных предубеждений в отношении пола, расы и класса в отношении того, кто должен стать матерью.
Консультации
Акушеры-гинекологи несут этическую ответственность за то, чтобы все пациенты понимали риски и преимущества стерилизации (включая возникающие неконтрастные преимущества, такие как возможное снижение риска рака), и что стерилизацию следует рассматривать как постоянную, хотя и со случайными неудачами. и риск сопутствующей внематочной беременности 33. Обратимые методы контрацепции длительного действия должны рассматриваться как дополнительные возможности для женщин, которые завершили деторождение или никогда не желают забеременеть 34 35.Акушеры-гинекологи также должны информировать пациенток о том, что стерилизация мужского партнера имеет более высокую эффективность и более низкий риск, чем женская стерилизация. Факторы риска для последующего обращения за хирургическим вмешательством следует обсудить, особенно молодой возраст и трудности в браке или отношениях, или другие важные факторы жизненного стресса во время запроса. Выбор между различными методами, в конечном счете, зависит от предпочтений пациента, и выбор метода контрацепции должен определяться собственными приоритетами и жизненным контекстом женщины.Следует уважать четко сформулированное желание женщины постоянно предотвращать будущую беременность. Когда женщины выбирают стерилизацию, потому что их партнеры-мужчины не желают рассматривать вазэктомию, решение о стерилизации, хотя и автономное, может быть результатом представлений о мужественности или других гендерных норм о том, кто несет ответственность за планирование семьи. Хотя акушеры-гинекологи могут чувствовать себя некомфортно из-за того, что они увековечивают несправедливые гендерные нормы, выполняя женскую стерилизацию в таких ситуациях, это допустимо с этической точки зрения и в конечном итоге может представлять собой решение, оптимальное для женщины с учетом ее конкретных обстоятельств.
Акушеры-гинекологи также должны знать и иметь возможность обсуждать соответствующие законы или постановления, которые могут ограничивать положения о стерилизации, такие как требования к минимальному возрасту и периоду ожидания программы Medicaid. Кроме того, акушеры-гинекологи должны знать, что некоторые пациенты могут иметь страховое покрытие, ограниченное беременностью и ближайшим послеродовым периодом, и могут иметь ограниченный доступ к стерилизации или другим вариантам контрацепции за пределами этого окна 14.
Таким образом, при консультировании пациентов следует уделять особое внимание консультированию пациентов. постоянство стерилизации и включать информацию об обратимых альтернативах, особенно методах LARC, которые так же эффективны, как и постоянная стерилизация.В соответствующих случаях следует обсудить стерилизацию партнера-мужчины во время предстерилизационного консультирования пациента как вариант с меньшим риском и большей эффективностью, чем стерилизация у женщин. При необходимости следует обсудить юридические или нормативные ограничения стерилизации.
Процесс консультирования
Процесс консультирования также имеет этические последствия. Целью консультирования по стерилизации — и консультирования в целом — является принятие ориентированного на пациента подхода, при котором принятие решений разделяется между пациентом и опекуном.Следует избегать патернализма, при котором врач игнорирует автономию пациента, чтобы «защитить» ее от последствий ее собственного принятия решений.
За последние несколько десятилетий в здравоохранении произошел переход от модели «врач знает лучше» к модели, в которой пациент находится в центре внимания и рассматривается как соучастник и партнер при принятии решений в области здравоохранения 36. Этот переход к коллективному подходу жизненно важен для обеспечения автономии пациента в принятии медицинских решений.Однако, когда пациенты рассматривают такое необратимое решение, как стерилизация, врач нередко испытывает защитный импульс, чтобы помочь пациенту избежать того, что называется «сожалением о стерилизации». Например, врачи могут колебаться в отношении предоставления запрошенной стерилизации молодым женщинам, зная, что для большинства людей полное когнитивное созревание — включая способность включать долгосрочные цели в комплексный процесс принятия решений — достигается лишь к середине 20-х годов 37 Когда молодые женщины, цветные женщины, незамужние женщины и женщины, испытывающие серьезные жизненные стрессоры, обращаются с просьбой о стерилизации, может возникнуть защитный импульс из-за знания того, что женщины из этих демографических групп непропорционально стремятся к обратной информации в более позднем возрасте.Кроме того, поскольку материнство остается прочно укоренившейся частью социокультурного определения женщины в современной американской жизни, выполнение просьб о стерилизации у нерожавших женщин может показаться трудным. В этих ситуациях, как и при любом консультировании по поводу стерилизации, важно рассматривать методы LARC как одинаково эффективные и обратимые варианты.
Однако врачи должны осознавать, что пациенты обладают большим опытом в своей жизни и в том, что для них важно и значимо.Хотя исключить весь риск сожаления невозможно, отказ в стерилизации тем, кто ее просит, происходит за счет ограничения способности женщин полностью выражать свою независимость в отношении того, когда и следует ли забеременеть и родить. Устранение риска сожаления путем ограничения автономии пациента, как правило, считается специалистами по биоэтике хуже, чем позволить пациенту сделать, возможно, ошибочный выбор. Невозможно избавиться от сожаления, поскольку сам факт того, что он является полностью автономным человеком, обладающим способностью принимать решения, несет в себе риск сожаления о принятии решения.Это явление получило название «степень риска» 38. Когда способность принимать решения ограничена врачом или учреждением, риск сожаления может быть уменьшен; однако отмена полномочий на принятие решений считается более вредным, чем сожаление о принятии решений. 38. В случае сомнений в целесообразности проведения запрошенной стерилизации рекомендуется, чтобы врач ошибся в сторону уважения автономии принятия решений и репродуктивной автономии пациента.
Некоторые акушеры-гинекологи отказываются выполнять процедуры стерилизации из-за своих личных религиозных убеждений или моральных ценностей.В таких случаях врач должен предоставить альтернативную форму контрацепции, которая в равной степени приемлема для пациента, или направить пациента к другому поставщику гинекологической помощи, как это должно быть в случае, когда заявление совести препятствует оказанию помощи 39. Автономия женщины, которая стремится к стерилизации, ее всегда следует уважать, даже несмотря на возражения на ее просьбу, основанные на совести.
И наоборот, принуждение или принуждение женщины каким-либо образом к стерилизации, которую она не желает или о которой она не уверена или не знает, всегда неприемлемо.Принуждение и насильственная стерилизация в прошлом принимали ряд форм, включая отказ от оказания другой медицинской помощи для стимулирования стерилизации, угрозы задействовать систему защиты детей, если женщина не дает согласия на стерилизацию, или выполнение стерилизации без ведома пациента в ходе курса. другого хирургического лечения. Эти и любые другие методы принудительной или принудительной стерилизации неэтичны и никогда не должны выполняться.
Иногда на просьбу женщины о стерилизации могут повлиять внешние факторы.Например, женщина может потребовать стерилизацию из-за давления со стороны партнера или из-за того, что у нее нет страхового покрытия или ресурсов для обратимых вариантов, которые она предпочла бы. И снова тщательный диалог имеет первостепенное значение, и необходимо четко обозначить весь спектр желаний женщины, связанного с построением семьи в долгосрочной перспективе. Если единственная причина для продолжения стерилизации связана с такими факторами, как давление со стороны партнера, врачи должны усердно работать над решением проблем репродуктивного принуждения, включая потенциальные проблемы безопасности.Если финансовые ограничения приводят к запросу на стерилизацию, врачи должны работать с пациентами, чтобы найти недорогие обратимые варианты, если эти методы действительно приемлемы для пациента.
При условии, что консультирование следовало изложенным здесь принципам, этически приемлемо выполнение стерилизации во время аборта, родов или другой репродуктивной помощи. Тем не менее, такие запросы следует обсудить до первичной процедуры или мероприятия, в то время, когда пациент может принять взвешенное решение, проанализировать риски и преимущества стерилизации, подумать об альтернативных методах контрацепции и составить планы действий на случай непредвиденных обстоятельств. акушерские или неонатальные осложнения или другие непредвиденные события.Следует избегать стерилизации, если решение о стерилизации принимается во время родов или другой неотложной помощи или когда острые события (например, разрыв матки) вызывают опасения, что деторождение в будущем нежелательно или небезопасно. Хотя могут быть редкие случаи, когда стерилизация оправдана, в таких ситуациях врачи обычно должны предложить методы LARC и вернуться к вопросу стерилизации позже. И наоборот, если запланированную стерилизацию планируется провести во время кесарева сечения или сразу после родов, и есть неожиданные неонатальные осложнения, для которых план действий в чрезвычайных обстоятельствах не был обсужден заранее, решение следует пересмотреть и предложить метод LARC в качестве альтернативы. возможная альтернатива.
Таким образом, акушеры-гинекологи должны предоставлять консультации перед стерилизацией, которые включают обсуждение репродуктивных желаний женщины и ставят ее желания в центр внимания. Даже с учетом риска сожаления, этически допустимо выполнение запрошенной стерилизации первородящих женщин и молодых женщин, которые не хотят иметь детей. Запрос на стерилизацию молодой женщины без детей не должен автоматически вызывать консультацию по психическому здоровью. Хотя вполне понятно, что врачи не хотят вызывать у женщин сожаления о стерилизации, им также следует избегать патернализма.
Консультирование и саморефлексия — пол, раса, класс и материнство
Исследования в области социальных наук показывают, что раса и социальный класс влияют на представления о том, кто должна быть матерью и какие качества делают «хорошей матерью». По этой причине акушеры-гинекологи должны учитывать роль предвзятости в рекомендациях по консультированию и уходу и избегать действий, основанных на предубеждениях в отношении расы, этнической принадлежности, социально-экономического статуса, сексуальной ориентации и материнства, которые могут, несмотря на лучшие намерения, повлиять на интерпретацию пациентов. запросы и влияние на оказание помощи.В случае стерилизации риски действовать в соответствии со стереотипами или рассматривать женщин исключительно с точки зрения их «демографии» двояки: в желаемой стерилизации может быть отказано, потому что женщина принадлежит к демографической группе, которая непропорционально ищет обратную информацию, исторически подвергалась виктимизации, или что, по мнению врача, следует иметь детей. Нежелательная стерилизация может быть проведена ненадлежащим образом из-за принадлежности к категории, для которой преобладают стереотипы «неконтролируемой фертильности» 40.Ориентированный на пациента подход, который фокусируется на репродуктивных желаниях отдельной женщины, может смягчить некоторые из потенциально негативных последствий более широкого социального климата расового и классового неравенства, в котором осуществляется медицинская помощь.
Растения | Бесплатный полнотекстовый | AgNO3 стерилизует зерна ячменя (Hordeum vulgare) без подавления прорастания — необходимый инструмент для исследования микробиома растений
1. Введение
Семена населены разнообразным набором жизнеспособных микроорганизмов, которые могут повлиять на последующее развитие растений [1].Чтобы определить влияние конкретных, специально введенных микроорганизмов на рост растений, необходимо удалить неидентифицированные переносимые семенами микроорганизмы. Переносимые семенами микроорганизмы располагаются на поверхности семян (эпифиты) или внутри семян (эндофиты) [2]. Эндофитные бактерии были обнаружены в зародышах и эндосперме семян [3,4,5], и они принадлежат в первую очередь к типам Proteobacteria, Actinobacteria, Firmicutes и, в меньшей степени, Bacteroidetes [1,6,7,8]. Это преобладание типов Proteobacteria, Actinobacteria и Firmicutes в качестве эндофитов зерна также было показано специально для ячменя [9,10].Эндофиты грибов в основном принадлежат к любому из двух классов Dothideomycetes и Tremellomycetes [2]. Было предложено несколько путей передачи эндофитных бактерий. Эндофиты могут передаваться семенам от матери через сосудистую систему или от отца через гамету [5]. Жизнеспособные бактерии, переносимые опрыскиванием цветков родительских растений, были обнаружены внутри зародыша семян [11], что привело авторов к предположению, что воздух или контакт с насекомыми могут быть путём проникновения эндофитов семян.Berg и Raaijmakers [5] предполагают, что у диких видов растений прохождение через кишечник животных может повлиять на микробиом семян, в то время как эпифиты семян культурных растений могут переноситься во время хранения после сбора урожая [12]. Эти факторы могут быть специфичными для растений [5], что также было подтверждено специально для ячменя. Два независимых исследования зерновых эндофитов ячменя выявили различия в относительной численности бактерий у разных сортов ячменя [9,10]. Кроме того, авторы одного из исследований [9] подчеркнули, что они обнаружили, что Xanthomonas является наиболее распространенным родом для одного сорта, тогда как во втором исследовании он отсутствовал как эндофит зерна [10].Следовательно, становится очевидным, что без анализа ничего не известно о микробиоме семян конкретных видов растений или даже сортов [13]. Было показано, что эндофиты семян могут влиять на прорастание, рост проростков и устойчивость к патогенам [14,15], а в двух отдельных исследованиях были обнаружены доказательства, свидетельствующие о том, что переносимые из семян микроорганизмы могут перемещаться в микробиом проростков и ризосферы [8,16]. Таким образом, микробиом семян неизвестен для большинства растений, и он может влиять на состав микробиома растений и ризосферы, что требует удаления микробиома семян (внутри и на поверхности) перед значимым изучением взаимодействия между растениями и микроорганизмами.Исследования с арабидопсисом могут обойти эти проблемы, используя стерильные семена, которые легко доступны. Однако для большинства растений семена, которые являются стерильными или гнотобиотическими (все организмы идентифицированы), недоступны, и исследователи должны полагаться на стерилизацию семян. Поэтому очень важен быстрый и надежный протокол стерилизации. Обычно применяемые химические агенты для стерилизации семян включают гипохлорит натрия (Arabidopsis thaliana [17,18], Triticum aestivum [19], Gossypium [20], Hordeum vulgare [21]), газообразный хлор (Cotton, [20]), хлорид ртути (Triticum aestivum [19], Stevia rebaudiana [22]), перекиси водорода (Cotton [20], Hordeum vulgare [23,24,25]), газообразного оксида пропилена (Triticum aestivum [19]) и нитрата серебра (Triticum aestivum [19] ], Hordeum vulgare [26,27]).Методы физической стерилизации семян включают гамма-облучение (Hordeum vulgare [28]) и нагревание (Hordeum vulgare [29], различные виды [30]). Однако для большинства химических агентов нет единого мнения о наилучшем протоколе в отношении продолжительности воздействия, концентрации и обработки до и после стерилизации, и очевидно, что эффективность протокола может различаться даже для разных сортов одного и того же виды [20]. В настоящее время ни один протокол не является золотым стандартом стерилизации семян, и, насколько нам известно, ни одно исследование не предоставило метод стерилизации семян за пределами поверхности, а также показало, что последующее прорастание и рост растений не пострадали.Это препятствует прогрессу в исследованиях взаимодействия растений и микробов. В этом исследовании мы стремились найти наиболее эффективный протокол стерилизации зерна для экспериментов по взаимодействию растений и микроорганизмов в контролируемых условиях. Мы использовали четыре критерия для оценки эффективности протокола: 1. Высокая доля зерен без культивируемых жизнеспособных микроорганизмов, 2. Высокий процент прорастания, 3. Отсутствие остаточного стерилизующего эффекта после завершения протокола и 4. Отсутствие влияния стерилизации на последующий рост растений.Сначала мы протестировали три стерилизующих агента (NaClO, H 2 O 2 и AgNO 3 ) и продолжили оптимизировать протокол с наиболее многообещающим агентом, то есть AgNO 3 . Затем мы приступили к тестированию диапазона концентраций AgNO 3 наряду с обработками до и после стерилизации. Мы предположили, что AgNO 3 убивает как эпифиты, так и эндофиты, поскольку AgNO 3 проникает через семенную оболочку Xanthium glabratum в такой же степени, как вода во время набухания семян [31].Мы предположили, что замачивание зерна в течение 20 часов в качестве предстерилизационной обработки смягчит поверхность зерна и, таким образом, сделает ее более проницаемой для жидкостей, а присутствие воды активирует спящие микроорганизмы и сделает их более восприимчивыми к стерилизации. Наконец, мы предположили, что промывание растворенным NaCl после воздействия AgNO 3 остановит процесс стерилизации за счет удаления ионов Ag + и связывания ионов Ag + с ионами Cl — с образованием твердого AgCl, который не убивают микроорганизмы.
3. Обсуждение
В этой статье мы описываем метод, который приводит к 100% стерильности почти для всех зерен (98% ± 2) с использованием AgNO 3 . Этот эффект может сохраняться даже в течение 21 дня роста растений в условиях, благоприятствующих росту микробов (среды PDA и TSA).
Успешный протокол стерилизации зерна должен давать 100% стерильные зерна, не влияя на последующий рост растений. Кроме того, важно, чтобы антимикробный эффект прекращался после того, как биоцид выполнил свою задачу.Это особенно верно, если зерна будут впоследствии использоваться для экспериментов с участием микроорганизмов, например, для манипулирования микробиомом зерна, растений или ризосферы.
Промывка зерен NaCl способствовала удалению Ag, поскольку ионы Ag + легко реагируют с ионами Cl — с образованием твердого кристаллического AgCl [32]. Твердый AgCl не обладает антимикробными свойствами. Осадки в наших промывочных растворах NaCl были видимыми, поэтому при промывании зерен в NaCl оставалось значительно меньшее количество остаточного серебра, чем просто воды.Это соответствовало снижению Ag в 42 раза при максимальной концентрации AgNO 3 для сухих зерен. В отличие от зерен, промытых только водой, количество остаточного Ag оставалось постоянным для всех концентраций AgNO 3 , несмотря на 200-кратное увеличение для зерен, промытых в NaCl, что указывает на то, что растворы NaCl обеспечивали достаточную доступность Cl — . Процент зерен, которые были на 100% стерильными при промывании сухих зерен в NaCl, был низким (1–6%), независимо от концентрации AgNO 3 , эффективность сравнима с эффективностью зерен, подвергшихся воздействию воды без какого-либо AgNO 3 (стерильность 0%).Это не может быть объяснено отсутствием антимикробного потенциала AgNO 3 , поскольку 92% сухих зерен, промытых водой вместо NaCl, не содержали бактерий или грибков. Однако, похоже, это подтверждает нашу гипотезу о том, что NaCl обеспечил захват ионов Ag + для стерилизации после начала промывки, как сообщалось ранее [19,32], несмотря на то, что в зернах осталось больше остаточного серебра, чем в контроле. Возможно, что при таких низких концентрациях Ag больше не действовал или что все ионы Ag + были связаны в твердом кристаллическом AgCl, тем самым дезактивируя стерилизующий эффект Ag + .
Остаточный Ag был одинаковым для замоченных и сухих зерен при промывании в NaCl. Эти низкие количества остаточного Ag оказались неэффективными при стерилизации после того, как произошло промывание, как указывалось выше, и, следовательно, высокая стерильность замоченных зерен, промытых в NaCl, по сравнению с почти отсутствующей стерильностью сухих зерен, должна быть отнесена на счет обработки перед стерилизацией. т.е. замачивание, а не из-за длительного действия небольшого количества остаточного Ag. Хотя мы можем сделать вывод, что количество остаточного Ag, оставшегося на зернах, промытых в NaCl, не повлияло на количество стерильных зерен, мы не можем полностью исключить возможность того, что небольшое остаточное количество могло повлиять на рост и функционирование микроорганизмов.Поэтому мы очень поощряем дальнейшие исследования, которые могут выяснить, оказывают ли такие количества Ag после воздействия ионов Cl — какое-либо влияние на микроорганизмы, поскольку это может повлиять на исследования, в которых новые микроорганизмы вводятся в систему.
Мы предположили, что замачивание зерен в воде усилит антимикробный эффект AgNO 3 , что, как мы подтвердили, верно для зерен, промытых в NaCl после стерилизации (рис. 3). Есть две возможные теории, относящиеся к впитыванию, которые могли бы это объяснить.Набухание — это строго физический процесс, при котором зерно впитывает воду, чтобы начать прорастание. Следовательно, твердая поверхность зерна размягчается [33], начинается дыхание и метаболическая активность [34], а экссудаты, включая углерод и питательные вещества, выходят из зерна через разрывы на поверхности [14]. Во время воздействия AgNO 3 пропитанные зерна уже должны были инициировать впитывание [33]. Для сухих зерен пропитывание началось бы в течение 15 минут погружения в AgNO 3 , но поглощение жидкостей, таких как ddH 2 O с ионами Ag + , все еще было бы низким на этом раннем этапе процесса [ 34].Во время впитывания проникновение AgNO 3 через семенную оболочку Xanthium glabratum равнялось проникновению воды [31], демонстрируя его способность достигать эндофитных микроорганизмов вместе с эпифитами. Поэтому повышенная проницаемость из-за впитывания может быть возможной теорией, объясняющей, почему замачивание может способствовать антимикробному эффекту AgNO 3 . AgNO 3 является биоцидным из-за антимикробных свойств свободных ионов Ag + , тогда как чистое твердое серебро и AgCl не обладают антимикробными свойствами [32].AgNO 3 классифицируется как дезинфицирующее средство [32], что означает, что это биоцид широкого действия, который при достаточно высокой концентрации убивает бактерии, грибы, вирусы и простейшие посредством нарушения нескольких механизмов, в отличие от только одного конкретного механизм [32,35]. Нарушение дыхательной цепи [32,36] — один из метаболических процессов, пролиферация которых подавляется [35]. Во-вторых, в бактериальной клетке Ag + может реагировать с тиоловыми группами структурных и ферментативных белков, тем самым инактивируя трансмембранный энергетический метаболизм и транспорт электролитов [32,35].В-третьих, Ag + может предотвращать репликацию ДНК [32,37]. Поскольку противомикробный эффект AgNO 3 связан с метаболическими процессами, это объясняет, почему AgNO 3 более эффективен в отношении активных микроорганизмов и меньше влияет на спящие микроорганизмы [32]. Распространенной стратегией обойти проблему толерантности из-за покоя является для создания условий, которые подталкивают организмы к метаболически активной стадии [38]. Увеличивается размножение микробов и активируются метаболические процессы во время и после набухания из-за увеличения доступности питательных веществ и воды [14,39].Вторая возможная теория усиления антимикробного эффекта AgNO 3 из-за замачивания заключается в том, что во время замачивания спящие микроорганизмы становятся более активными и, следовательно, более восприимчивыми к стрессу. Оба пути повышения эффективности воздействия влаги были предложены ранее, чтобы объяснить усиление антимикробного эффекта этилена и оксида пропилена при увеличении относительной влажности зерен ячменя [40]. Оптимальный протокол стерилизации убьет все микроорганизмы внутри и внутри зерна без любое негативное воздействие на зерно и его последующее развитие.Чтобы проверить наличие каких-либо нарушений реакции на AgNO 3 , мы оценили процент всхожести, который был определен как проростки с побегами длиной более 5 см и корнями. При промывании в NaCl всхожесть оставалась высокой, несмотря на повышение концентрации AgNO 3 . Фактически, всхожесть составляла 92% и 96% при 10% (мас. / Мас.) AgNO 3 для сухих и замоченных зерен, соответственно, по сравнению с контрольными обработками, промытыми только в воде, где всхожесть составляла 95% и 92%, соответственно для сухих и замоченных зерен. замоченные зерна.Напротив, сухие зерна, промытые только водой, показали снижение процента прорастания. Мы наблюдали аналогичные тенденции в различии всхожести между 7 и 21 днем. Зерна, промытые в NaCl, не различались по проценту прорастания между двумя точками времени, тогда как зерна, промытые только в стерильном ddH 2 O, показали замедленную реакцию прорастания. Наш эксперимент по выращиванию растений, в котором зерна подвергались жесткой стерилизации, аналогичным образом показал задержку прорастания (3 дня). Ранее сообщалось о задержке развития из-за AgNO 3 [41,42] наряду с сообщениями о снижении биомассы и эпигенетических изменениях [43,44].Может быть трудно отличить прямые эффекты стерилизации от косвенных эффектов, вызванных отсутствием эндофитов, поскольку они также могут влиять на развитие растений [11,13,14]. По крайней мере, некоторые из эпигенетических изменений, вызванных Ag + , были связаны с ответами растений на микроорганизмы [43], и в этих исследованиях не учитывался нейтрализующий эффект ионов Cl — . Поскольку NaCl устраняет негативное влияние AgNO 3 на прорастание, и мы не наблюдаем снижения биомассы растений, кажется, что ингибирующее влияние AgNO 3 на развитие растений не является постоянным, а скорее временным ингибированием растений, которое сохраняется только пока сохраняется стерилизующая сила Ag + .На накопление биомассы не повлияла стерилизация с самой жесткой комбинацией процедур до и после стерилизации и концентрацией AgNO 3 с учетом 3-дневной задержки прорастания. Это еще один показатель того, что AgNO 3 является эффективным стерилизующим агентом, который не оказывает отрицательного воздействия на биомассу растений, если NaCl используется в качестве постстерилизационной обработки. Мы не можем исключить возможность того, что при определенных условиях Ag + может воздействовать на растения способами, которые мы не исследовали.Мера предосторожности для экспериментов, исследующих механизмы растений, которые мы не рассмотрели, может заключаться в том, чтобы подвергать все виды обработки одному и тому же протоколу стерилизации. В общем, представляется сложной задачей найти стерилизующий агент, который убивает все микроорганизмы, но оставляет зерно невредимым. Другие обычно используемые стерилизующие агенты (гипохлорит натрия, газообразный хлор, хлорид ртути, перекись водорода, газообразный пропиленоксид, нитрат серебра и гамма-облучение) привели к изменению всхожести семян [19,20,26,28].Кроме того, предыдущие отчеты не выходят за рамки 10 дней. Тем не менее, наши данные показали, что стерильность, измеряемая как полное отсутствие бактерий и грибков на поверхности растения (зерно, побег, корень) или на питательной среде (PDA или TSA), значительно снизилась в течение времени, прошедшего между 7 и 1 днями. 21. Таким образом, требуется больше времени, чем 7 дней, чтобы обнаружить и идентифицировать все эндофитные зерновые микроорганизмы, которые могут перемещаться из внутренней ткани зерна или проростков и колонизироваться в других местах. Эндофиты семян обладают способностью перемещаться в почву и становятся важными игроками в микробиоме ризосферы [8,16].Микроорганизмы в основном размножаются в корне и корешке, в отличие от участков семян с меньшим развитием растений [14]. Это говорит о том, что по крайней мере некоторые микроорганизмы нуждаются в растении для процветания, и может объяснить, почему некоторым микроорганизмам нужно больше времени, прежде чем начать рост вне семян. Следовательно, необходим как минимум 21 день, чтобы достоверно установить, сработал ли протокол стерилизации. Мы не можем исключить возможность того, что процент стерильных зерен уменьшился, если эксперимент длился более 21 дня.Медленнорастущие микроорганизмы или микроорганизмы, которые требовали условий выращивания, отличных от предоставленных нами (например, почвы), могли присутствовать, но остаться незамеченными, поскольку мы использовали метод, зависящий от культивирования. Следовательно, мы не можем исключить возможность того, что остались некоторые устойчивые к Ag + микроорганизмы, которые при различных условиях роста были бы жизнеспособными. Следует отметить, что антимикробный эффект ионов Ag + бактериостатический в низких концентрациях, но в высоких концентрациях он бактерицидный, поскольку нарушение трансмембранного энергетического обмена необратимо [35].Ag + обладает способностью достигать внутренних отделений и тканей семян [31], и мы рекомендуем стерилизовать очень высокой концентрацией AgNO 3 . Таким образом, возможность присутствия в зернах остаточных жизнеспособных микроорганизмов потребует от них устойчивости к Ag + . Сообщалось о резистентности к Ag + , хотя и для ограниченного числа микроорганизмов [35]. Тем не менее, мы поощряем будущие исследования, которые расширят наши знания, используя независимую от выращивания оценку стерильности зерна после стерилизации, поскольку мы считаем, что стерильность зерна является важным инструментом для дальнейшего понимания взаимодействия между растениями и микроорганизмами.
Обычная практика стерилизации без изменения агента, времени воздействия, концентрации и обработки до и после стерилизации может расширить наши знания о том, как переносимые семенами микроорганизмы влияют на взаимодействие растений, почвы и микробиома. Здесь мы предполагаем, что AgNO 3 является эффективным стерилизующим агентом с усиленным эффектом, когда зерна предварительно замачивают в течение 20 часов с последующей стерилизацией в 10% (мас. / Мас.) AgNO 3 и промыванием 1% (мас. / Мас.) w) NaCl после каждого из трех промываний в стерильном ddH 2 O.Этот протокол приводит к 100% стерильности 97% зерен, поддерживает высокую скорость прорастания (96%), и 98% проросших зерен были 100% стерильными после 21 дня инкубации, в то время как количество остаточного Ag на зернах оставалось низким ( 12,79 ± 3,82 мкг Ag на 1 г зерна). Этот метод показал отсутствие задержки прорастания между 7 и 21 днем, поскольку максимальный потенциал прорастания был достигнут к 7-му дню, и биомасса растений не пострадала.
4. Материалы и методы
Мы провели оценку AgNO 3 как агента для стерилизации зерна без вреда для последующего роста растений в четыре этапа.См. Рисунок 6 для иллюстрации временной шкалы и Раздел 4.2, Раздел 4.3, Раздел 4.4 и Раздел 4.5 для получения подробной информации, относящейся к четырем шагам.
4.1. Сбор и отбор зерна
Мы использовали необработанные зерна ярового ячменя (Hordeum vulgare cv. Evergreen, Nordic Seed Galten, Дания), стандартный сельскохозяйственный продукт, который, вероятно, подвергался воздействию широкого спектра почвенных микроорганизмов в поле и во время хранения. но не подвергался какой-либо стерилизации против микробного заражения.Использовали только неповрежденные зерна массой 55 ± 5 мг.
4.2. Выбор стерилизующего агента
Первоначально мы проверили эффективность трех различных стерилизующих агентов (NaClO, H 2 O 2 и AgNO 3 ). Мы протестировали NaClO, как это было предложено Спикманом и Крюгером [19]. Зерна ячменя замачивали в водопроводной воде на 20 часов, подвергали воздействию 9% (мас. / Мас.) NaClO в течение 30 минут и трижды промывали в стерильном ddH 2 O в течение 5 минут. Чтобы проверить H 2 O 2, , мы следовали Барампураму, Аллену и Краснянски [20].Зерна замачивали в 1% (мас. / Мас.) Мыльной воде (Vel Ultra, Colgate-Palmolive Company, Virum, Дания) в течение 20 минут, трижды промывали в стерильном ddH 2 O в течение 5 минут, подвергали воздействию 3% ( w / w) H 2 O 2 в течение 7 часов и трижды промывали в стерильной ddH 2 O в течение 5 минут. Для AgNO 3 зерна подвергались воздействию 1% (мас. / Мас.) В течение 5 мин и трижды промывались в стерильной ddH 2 O в течение 5 мин [25]. В качестве контроля для трех стерилизующих агентов обработка заключалась в замачивании зерен в водопроводной воде в течение 7 часов с последующими тремя полосканиями в стерильном ddH 2 O в течение 5 минут и в обработке, при которой зерна не обрабатывались до инкубации.Для каждой из 5 различных обработок 30 семян подвергали воздействию, а затем помещали на чашки, содержащие PDA, приготовленный из 39 г порошка PDA (Sigma) на L ddH 2 О. На каждую чашку было 10 семян, т. Е. Каждая обработка состояла из 3 тарелки. Мы проверили стерильность через 6 дней инкубации в темноте при 15 ° C, как описано в разделе 4.3.
4.3. Влияние AgNO
3 на стерильность и прорастание
Чтобы найти оптимальный протокол стерилизации зерна с помощью AgNO 3 , мы протестировали 6 различных концентраций AgNO 3 в ddH 2 O: 0%, 0.05%, 0,2%, 1,0%, 3,0% и 10,0% (мас. / Мас.) В сочетании с обработкой до и после стерилизации. Для каждой комбинации обработки 120 зерен ячменя встряхивали при 150 об / мин в 50 мл раствора AgNO 3 в течение 15 мин. Перед обработкой AgNO 3 половину зерен вымачивали в воде на 20 ч перед воздействием AgNO 3 . Другая половина не получала предстерилизационной обработки. После воздействия AgNO 3 зерна промывали трижды по 5 мин в стерильном ddH 2 O на роторном шейкере.В качестве обработки после стерилизации половину зерен ополаскивали в стерильном 1% (мас. / Мас.) Растворе NaCl в течение 5 минут после каждого полоскания в стерильном ddH 2 О. См. Таблицу 1 для схематического обзора экспериментальной установки.
После стерилизации зерна инкубировали в темноте при 15 ° C на двух разных средах для выращивания в чашках Петри, запечатанных парафильмом. Для стимуляции роста бактерий мы использовали TSA: 0,3 г порошка триптического соевого бульона (Becton Dickinson, Franklin Lakes, Нью-Джерси, США), 15 г агара (Merck, Дармштадт, Германия) и 100 мкг мл -1 циклогексимида (Sigma, Санкт-ПетербургЛуис, США) на L ddH 2 О. Для стимуляции роста грибков мы использовали КПК, приготовленный из 39 г порошка КПК (Sigma) на L ddH 2 О. Для каждой из 22 комбинаций лечения мы установили 10 чашки Петри TSA и 10 PDA, каждая из которых содержит 5 зерен, в результате получается 50 реплик зерен на среду, вложенных в чашку Петри.
Зерна оценивали на стерильность и всхожесть через 7 и 21 день. Мы также отметили параметры развития корней и побегов (наличие побега и корня, длину побега и количество корней) для каждого отдельного зерна.Мы считали, что зерна проросли, если выросли побеги длиной более 5 см и появились корни через 21 день. Меньшее развитие, чем это, оценивалось как незрелое, так как развитие проростков должно было развиваться дальше, чем это было за 21-дневный промежуток времени.
Мы использовали рассекающий микроскоп (Olympus SZX16) для визуального обнаружения и подсчета любых грибковых или бактериальных присутствий на поверхности зерна, побега и корня, а также на питательной среде, где находилось растение. При необходимости подозреваемые микроорганизмы переносили на предметное стекло и исследовали под световым микроскопом (Olympus BX50 при увеличении 100 × –1000 ×).
Мы преобразовали данные подсчета в двоичную переменную отсутствия / присутствия. Зерно оценивали как стерильное только тогда, когда бактерии и грибки на зерне, растении и в непосредственной близости от него в чашке Петри полностью отсутствовали. Оценка на 7-й день помогала отслеживать прогресс, но результаты для выбора оптимального протокола стерилизации были основаны на окончательной оценке на 21-й день, поскольку цель заключалась не только в стерилизации поверхности, но и в удалении всех эндофитов, способных перемещаться наружу. завода и его окрестностей.
4.4. Остатки серебра в зернах и на них.
зерен обрабатывали, как на этапе 2 (раздел 4.3), по 40 зерен в каждой комбинации обработки. После обработки мы измерили концентрацию Ag в трех повторностях по 0,5 г зерен, высушенных до постоянного веса (около 10 зерен). Зерна добавляли в тефлоновые сосуды MARSXpress (CEM, Северная Каролина, США) и суспендировали в 10 мл 32,5% (об. / Об.) HNO 3 . Материал переваривали в микроволновой печи MARS 6 (CEM, Северная Каролина, США) с использованием программы для растительных материалов (мощность: 1030–1800, время нарастания: 20–25 минут, время выдержки: 10 минут, температура: 200 ° C. ).Содержание Ag измеряли с помощью атомно-абсорбционной спектроскопии (PinAAcle 900T, PerkinElmer, Массачусетс, США) с пламенем этилена при 328,1 нм.
4.5. Выращивание растений из стерилизованных зерен
Для оценки роста растений из стерилизованных зерен, прошедших самый строгий протокол стерилизации (сухие семена, 3% (вес.) AgNO 3 , промытые в стерильном ddH 2 O) без микробного загрязнения, мы приготовили микрокосмы в пробирках Falcon (50 мл, Greiner Bio-One, кат. № 227 261), крышки которых были модифицированы двумя отверстиями.Здесь были вставлены короткие пластиковые трубы (диаметром 7 мм и 4,5 мм) — большая для завода и меньшая для водоснабжения. Искусственная питательная среда, состоящая из прокаленного (550 ° C в течение 6 часов) песка (тип кварцевого песка: № 2, размер частиц: 0,71–1,22 мм, Dansand A / S) и вермикулита в соотношении 1: 1 (об. / Об.) смесь. Все компоненты микрокосма были автоклавированы, и вся работа проводилась в стерильных условиях.
Мы прорастили 150 нестерилизованных зерен и 150 зерен, стерилизованных в 3% (мас. / Мас.) AgNO 3 и промытых в стерильной ddH 2 O, как описано в разделе 4.3, в темноте при 15 ° C на среде КПК. Результаты этапов 2 и 3 (Раздел 4.2, Раздел 4.3 и Раздел 4.4) показали, что зерна, получавшие 3% (мас. / Мас.) AgNO 3 без предварительного замачивания и обработки после стерилизации NaCl, имели задержку прорастания, уменьшенное количество проросшие зерна и наибольшая концентрация остатков Ag. Таким образом, эта концентрация была выбрана для этапа 4, на котором наблюдали за развитием проростков в ответ на стерилизацию AgNO 3 .
Впоследствии мы поместили 60 проросших, стерилизованных и 60 проросших, нестерилизованных зерен по отдельности в пробирки Falcon, и обе пластиковые трубки в крышке были закрыты стерилизованной ватой.Ватку в большей трубке при необходимости реорганизовывали вокруг растущего саженца, чтобы микрокосмы оставались герметичными, не препятствуя росту растений. Сеянцы, которые никогда не появлялись над пластиковой трубкой, отбрасывали.
Пробирки Falcon помещали в камеру для выращивания (14/10 часов свет / темнота при 18 ° C). Раствор, содержащий все основные питательные вещества, был приготовлен по ранее описанному рецепту [45], хотя 600 мкМ KHCO 3 и 300 мкМ NH 4 KNO 3 заменили 600 мкМ KNO 3 .Растения проверяли каждые второй-третий день, и количество добавляемого питательного раствора основывалось на расчетной относительной скорости роста 0,09 дня -1 , рассчитанной на основе более ранних экспериментов, и предположении, что потребность в азоте составляет 5% от сухой массы растения. . Питательные растворы перед использованием автоклавировали. Добавляли стерильный ddH 2 O, чтобы поддерживать постоянную подачу воды на уровне 15 мл.
Дата появления всходов над пластиковой трубкой была записана, и растения были собраны через 25 дней после этой даты.Всходы и корни сушили до постоянного веса при 50 ° C и регистрировали сухой вес.
4.6. Статистика
Для этапа 1, выбора стерилизующего агента (рис. 6), мы проверили различия в стерильности и всхожести между обработками, используя тест отношения правдоподобия для основного эффекта обработки с последующим тестом Тьюки на средних квадратах. На этапе 2, влияние AgNO 3 на стерильность и всхожесть (рис. 6), мы проанализировали всхожесть, стерильность зерна (включая проросшие и непроросшие зерна) и стерильность проросших зерен с использованием трех отдельных обобщенных линейных смешанных моделей (биномиально распределенных). ).Здесь пре-стерилизационная обработка, пост-стерилизационная обработка и питательная среда были фиксированными, категориальными, бинарными переменными, а концентрация AgNO 3 — фиксированной, непрерывной переменной. Для всех трех моделей мы преобразовали переменную концентрацию AgNO 3 , используя как линейный, так и квадратичный член («прорастание»: sqrt (AgNO 3 ) + AgNO 3 , «стерильность» и «стерильность проросших зерен»: журнал (AgNO 3 ) + AgNO 3 2 ). Мы сделали это, чтобы оптимизировать соответствие моделей и учесть немонотонные отношения с AgNO 3 .Мы удалили 0% (мас. / Мас.) Концентрацию AgNO 3 из двух моделей для стерильности. При этой концентрации ни одно зерно не было стерильным на 100%, что привело к идеальному разделению, и модели включали логарифмические преобразования. Поскольку пять зерен были вложены в одну чашку Петри, нормальность случайного эффекта чашки Петри была подтверждена для всех трех переменных ответа. Все модели диагностики, тесты отношения правдоподобия, средние по методу наименьших квадратов и тесты Тьюки проводились на насыщенных моделях с взаимодействиями.Степень соответствия трех моделей проверялась отдельно на основе кумулятивной суммы остатков с использованием пакета R «gof» [46]. Используемый порог значимости для P-значений для тестов «Колмогорова – Смирнова» и «Крамера фон Мизеса» составил 0,05 на основе 10 000 симуляций. Модель проросших зерен была полностью проверена, а модели стерильности и стерильности проросших зерен были проверены без серьезных отклонений; хотя некоторые P-значения были ниже 0,05. Мы повторно провели тесты совокупной суммы остатков отдельно для четырех комбинаций до- и постстерилизационной обработки.Затем были проверены все модели, за исключением комбинации обработки сухих зерен, промытых в NaCl. Это лечение оказало минимальное влияние на стерильность, поэтому мы считали модели пригодными для нашего анализа. Разница в стерильности и всхожести между 7-м и 21-м днями анализировалась отдельно для каждой комбинации среды и обработки до и после стерилизации, где переменная AgNO 3 трансформировалась, когда это необходимо, чтобы соответствовать модели, которая была подтверждена ее совокупная сумма остатков, как описано выше.Что касается стерильности, некоторые концентрации AgNO 3 имели идеальное разделение, где наблюдения были либо все 1, либо все 0 как для 7-го, так и для 21-го дня, что делало регрессионное моделирование устаревшим. Мы исключили эти данные из анализа и посчитали, что они не отличаются. При других концентрациях AgNO 3 только одна временная точка имела идеальное разделение, тогда как другая имела вариацию. Затем данные без идеального разделения были подогнаны, как описано выше, и данные с идеальным разделением были подогнаны как регрессионная модель с использованием метода уменьшения смещения Ферта (пакет R «logistf») и AgNO 3 в качестве факторной переменной.Всякий раз, когда моделирование было разделено на две части, это показано на связанных рисунках (рис. S1 и S3). На этапе 3, остатки Ag в зернах и на них (рис. 6), концентрацию Ag, оставшуюся на зернах, анализировали с помощью трехфакторного дисперсионного анализа ANOVA с обработками до и после стерилизации в качестве фиксированных, категориальных, бинарных переменных. Концентрация AgNO 3 обрабатывалась как фиксированная категориальная переменная с шестью концентрациями (0, 0,05, 0,2, 1, 3 и 10). Невозможно было проверить подходящую модель с AgNO 3 в качестве непрерывной переменной.Переменная ответа, концентрация Ag, была преобразована логарифмически. Модель запускалась со значительным трехсторонним взаимодействием.
Для всех данных из шагов 2–3 был проведен тест отношения правдоподобия для проверки взаимодействий наивысшего порядка. Средние значения наименьших квадратов (lsmeans) использовались для оценки предсказанных вероятностей с обратным преобразованием (± SE). Для поиска различий между комбинациями лечения с поправкой на множественные сравнения использовался критерий Тьюки по среднему значению наименьших квадратов.
Для этапа 4, рост растений из стерилизованных зерен, был использован t-тест после подтверждения с помощью теста Бартлетта того, что две независимые группы имеют равные дисперсии для разницы между нестерилизованным и стерилизованным зерном в i) сухом весе и ii) дней между пересадкой и появлением всходов.
Все тесты были основаны на уровне достоверности 0,95 и пороге значимости 0,05. Все анализы выполнялись в R (версия 3.3.1 3 (2016-06-21)) с использованием пакетов «lme4», «gof», «logistf» и «lsmeans».
Часто задаваемые вопросы — новый антивирусный автоклав класса B
1. В чем преимущество автоклава класса B?
Автоклавы
класса B, также называемые паровыми стерилизаторами предварительного вакуума, используют пар под давлением для стерилизации загрязненных предметов.Для соответствия классу B более 99% воздуха из камеры необходимо удалить перед стадиями нагрева и стерилизации. Для справки: гравитационные автоклавы удаляют от 90 до 95% воздуха. Поэтому автоклавы класса B более продвинуты, чем автоклавы класса N, в которых в качестве метода вытеснения воздуха используется сила тяжести.
2. Почему необходимо удаление воздуха перед стерилизацией?
Удаление воздуха имеет решающее значение для улучшения проникновения пара. Со временем стоматологические и медицинские инструменты стали более сложными, и возникла необходимость подтверждать проникновение пара в самые глубокие и сложные части инструментов для проверки стерилизации.
Это довольно просто:
- Если есть воздух, то нет пара
- Если нет пара, значит нет стерилизации
Представьте себе очень длинную и узкую трубку, которую нужно стерилизовать в автоклаве. Пар, стерилизующий агент, не может проникнуть через длинную, полую и узкую трубку или завернутые инструменты.
99% воздуха в камере удаляется, что обеспечивает полное проникновение пара. Без критического этапа предварительного вакуумирования воздуха процесс стерилизации был бы нарушен.
3. Удаляется ли воздух из автоклава перед этапом стерилизации?
До сих пор только высокотехнологичные лабораторные автоклавы обрабатывали воздух, удаляемый из автоклава на этапе предстерилизации. Хотя обработка воздуха, выпущенного из автоклава в окружающую среду на стадии предварительного вакуумирования, не требуется по закону, компания Tuttnauer добавила дополнительные меры безопасности к своим стоматологическим и медицинским автоклавам, предоставив уникальное решение, которое обеспечивает дополнительный уровень защиты окружающей среды в клинике.Автоклавы Tuttnauer Elara и HSG теперь доступны с циклом, который решает проблему удаления загрязненного предвакуумного воздуха.
4. Как работает этот цикл?
Цель автоклава — обеспечить стерилизацию микроорганизмов к концу цикла. В стандартном автоклаве класса B не учитываются условия окружающей среды. Здесь происходит цикл защиты от вирусов.
Преимущество этого цикла заключается в том, что на этапе перед стерилизацией в камере создаются условия дезактивации для вирусов, поэтому после запуска обычного цикла воздух, который будет выходить на этапе удаления воздуха, будет очищенным воздухом с ограниченным риском. к окружающему.
5. В чем преимущество?
Автоклав класса B с новым циклом защиты от вирусов, обрабатывает воздух в камере автоклава перед этапом предварительного удаления воздуха . Это гарантирует, что любой вредоносный вирус, включая коронавирус, будет уничтожен до того, как они попадут обратно в окружающую среду, на этапе удаления воздуха.
Этот инновационный цикл был разработан в связи со вспышкой коронавируса. В периоды пандемий необходимо минимизировать риск заражения, особенно в клиниках и медицинских учреждениях.Этот автоклав — идеальное решение.
6. Где я могу узнать больше об автоклаве и цикле коронавируса?
Есть несколько вариантов:
- Загрузить брошюру по автоклаву
- Свяжитесь с торговым представителем Tuttnauer
консервирование продуктов питания | Определение, значение и методы
Бактерии и грибы (дрожжи и плесень) являются основными типами микроорганизмов, вызывающих порчу пищевых продуктов и пищевые болезни.Пищевые продукты могут быть заражены микроорганизмами в любое время во время сбора урожая, хранения, обработки, распределения, обработки или приготовления. Основными источниками микробного заражения являются почва, воздух, корм для животных, шкуры и кишечники животных, поверхности растений, сточные воды и оборудование или посуда для пищевой промышленности.
Бактерии — это одноклеточные организмы, которые имеют простую внутреннюю структуру по сравнению с клетками других организмов. Увеличение количества бактерий в популяции микробиологи обычно называют ростом бактерий.Этот рост является результатом деления одной бактериальной клетки на две идентичные бактериальные клетки, процесса, называемого бинарным делением. В оптимальных условиях роста бактериальная клетка может делиться примерно каждые 20 минут. Таким образом, одна клетка может произвести почти 70 миллиардов клеток за 12 часов. Факторы, влияющие на рост бактерий, включают доступность питательных веществ, влажность, pH, уровень кислорода, а также наличие или отсутствие ингибирующих веществ (например, антибиотиков).
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишись сейчас
Пищевые потребности большинства бактерий — это химические элементы, такие как углерод, водород, кислород, азот, фосфор, сера, магний, калий, натрий, кальций и железо. Бактерии получают эти элементы, используя газы из атмосферы и метаболизируя определенные компоненты пищи, такие как углеводы и белки.
Температура и pH играют важную роль в контроле скорости роста бактерий. Бактерии можно разделить на три группы в зависимости от их температурных требований для оптимального роста: термофилы (55–75 ° C или 130–170 ° F), мезофилы (20–45 ° C или 70–115 ° F) или психротрофы. (10–20 ° C или 50–70 ° F).Кроме того, большинство бактерий лучше всего растут в нейтральной среде (pH равен 7).
Бактериям также требуется определенное количество доступной воды для своего роста. Доступность воды выражается как активность воды и определяется отношением давления пара воды в пище к давлению пара чистой воды при определенной температуре. Следовательно, водная активность любого пищевого продукта всегда имеет значение от 0 до 1, где 0 означает отсутствие воды, а 1 — чистую воду.Большинство бактерий не растут в продуктах с активностью воды ниже 0,91, хотя некоторые галофильные бактерии (которые способны переносить высокие концентрации соли) могут расти в продуктах с активностью воды ниже 0,75. Рост можно контролировать, снижая активность воды — либо добавляя растворенные вещества, такие как сахар, глицерин и соль, либо удаляя воду путем обезвоживания.
Потребность в кислороде для оптимального роста у разных бактерий значительно различается. Некоторым бактериям для роста необходим свободный кислород, и они называются облигатными аэробами, тогда как другие бактерии отравляются кислородом и называются облигатными анаэробами.Факультативные анаэробы — это бактерии, которые могут расти как в присутствии кислорода, так и в его отсутствие. Помимо концентрации кислорода, потенциал восстановления кислорода в питательной среде влияет на рост бактерий. Потенциал восстановления кислорода является относительной мерой окислительной или восстановительной способности питательной среды.
Когда бактерии заражают пищевой субстрат, требуется некоторое время, прежде чем они начнут расти. Эта лаг-фаза — это период, когда бактерии приспосабливаются к окружающей среде.За фазой запаздывания следует логарифмическая фаза, в которой численность населения растет логарифмическим образом. По мере роста населения бактерии потребляют доступные питательные вещества и производят отходы. Когда запас питательных веществ истощается, скорость роста переходит в стационарную фазу, в которой количество жизнеспособных бактериальных клеток остается неизменным. Во время стационарной фазы скорость роста бактериальных клеток равна скорости их гибели. Когда скорость гибели клеток становится больше, чем скорость роста клеток, популяция входит в фазу убыли.
Популяция бактерий выражается либо на грамм, либо на квадратный сантиметр площади поверхности. Общая бактериальная популяция редко превышает 10 10 клеток на грамм. Популяция менее 10 6 клеток на грамм не вызывает заметной порчи, за исключением сырого молока. Популяции от 10 6 до 10 7 клеток на грамм вызывают порчу некоторых пищевых продуктов; например, они могут создавать неприятный запах в мясе в вакуумной упаковке. Популяции, содержащие от 10 7 до 10 8 клеток на грамм, вызывают неприятный запах в мясе и некоторых овощах.При уровнях выше 5 × 10 7 клеток на грамм большинство пищевых продуктов демонстрируют ту или иную форму порчи.
Когда условия для роста бактериальных клеток неблагоприятны (например, низкие или высокие температуры или низкое содержание влаги), несколько видов бактерий могут продуцировать устойчивые клетки, называемые эндоспорами. Эндоспоры обладают высокой устойчивостью к нагреванию, химическим веществам, высыханию (высыханию) и ультрафиолетовому излучению. Эндоспоры могут оставаться бездействующими в течение длительного времени. Когда условия становятся благоприятными для роста (например,g., размораживание мяса), эндоспоры прорастают и производят жизнеспособные клетки, которые могут начать экспоненциальный рост.
(PDF) Предстерилизационная очистка многоразовых инструментов в общей стоматологической практике
© 2007 Nature Publishing Group
RESEARCH
6 BRITISH DENTAL JOURNAL
использовать соответствующие материалы и рабочие условия,
необходимы. Использование щеток с проволочной щетиной и мочалок для чистки стоматологических инструментов
не рекомендуется, так как они могут привести к повреждению поверхности инструментов, которое вызовет коррозию
и ухудшит последующую обработку и функциональность.
33
Прочие чистящие средства должны быть одноразовыми или
подлежать тщательной очистке после использования. Очистка устройств с просветом
, например наконечников аспиратора, затруднена из-за доступа
для очистки и осмотра; эти типы устройств
могут быть легко и экономично заменены одноразовыми альтернативами
.
Ультразвуковые ванны были широко доступны в операционных
и часто использовались в сочетании с ручной очисткой.
Еще раз был широкий диапазон рабочих процедур для
этих. Только в 20% хирургических вмешательств жидкость в ультразвуковой ванне менялась в конце каждого клинического сеанса, хотя в конце каждого рабочего дня из ультразвуковой ванны опорожнялось незначительно больше (63%). . Рекомендуется опорожнять ультразвуковые ванны
не реже одного раза в четыре часа или чаще
, если они сильно загрязнены.
34
Химические вещества, используемые в ультразвуковых ваннах
, обычно были щелочными, нейтральными, ферментативными или моющими средствами собственной марки
производителя, каждое из которых допустимо при условии, что
они соответствуют инструкциям производителя прибора.
Использование жидкости для мытья посуды и дезинфицирующих средств не рекомендуется, так как эти составы не прошли валидацию для хирургических инструментов
, а в случае дезинфицирующих растворов
их использование может привести к фиксации белка в инструментах. В заказе
для обеспечения эффективности процесса очистки важны регулярные испытания
на функциональность ультразвуковых ванн. Однако в
редко можно было найти периодические испытания ультразвукового генератора
или выполняемые тесты эффективности очистки.
22,23
Сложно оценить эффективность процесса очистки
без доказательства
того, что ультразвуковой аппарат действительно работает.
Все очищенные устройства следует проверять на наличие мусора после очистки и перед стерилизацией. Из-за большого количества небольших инструментов
сложной формы в стоматологии рекомендуется использовать увеличительное стекло с подсветкой
. Предыдущие исследования
показали, что стоматологические инструменты
часто загрязняются после обработки.
5,6,8,9
В то время как большинство хирургических
требовали осмотра своих инструментов после очистки, только 1%
имели лупу для осмотра инструментов.
Общий контроль процесса дезактивации
должен осуществляться определенным лицом в рамках практики с использованием принципов обеспечения качества
. Этот человек должен обладать очевидной компетенцией
для управления этим процессом в стоматологической практике.Записанные процедуры
должны определять, документировать и контролировать все этапы очистки
, должны быть легко доступны для персонала, осуществляющего очистку, и должны быть в курсе последних событий. Несмотря на то, что
, многие практики имели доступ к информационному листу BDA A12,
24
, этот документ
содержит мало подробных процедур и
гарантии качества, чтобы помочь персоналу провести эффективную очистку стоматологических инструментов
.
В заключение, многие процедуры, используемые для очистки многоразовых стоматологических инструментов в общей стоматологической практике
, не соответствуют существующим руководствам и увеличивают риск передачи инфекции. Это вызывает особую озабоченность,
, поскольку очистка является ключевым этапом в процессе стерилизации, а в
снижается риск дальнейшей передачи vCJD. Там, где возможно
, практикующим врачам следует изучить множество доступных им вариантов
для обработки стоматологических инструментов.В некоторых случаях
это может включать использование централизованных средств воспроизводства
35
или одноразовых инструментов. Другие варианты
могут включать компромисс с локальной обработкой дорогих
устройств, таких как стоматологические наконечники, и централизованной обработкой других инструментов. Если местная переработка стоматологических инструментов будет продолжаться в общей стоматологической практике, очевидно, что потребуется большая работа
, чтобы помочь стоматологической бригаде улучшить процесс очистки
стоматологических инструментов.Это должно принять форму
программ обучения и подготовки, а также разработку
более четкого процесса управления с использованием принципов обеспечения качества. Результаты этого исследования также имеют серьезные финансовые последствия для стоматологической практики, не в последнюю очередь в обеспечении
специальных зон дезактивации и автоматизированных дезинфицирующих машин
. Это также представляет собой возможность для улучшения,
, особенно с учетом планирования новых стоматологических установок.Однако, если
возможность должна быть полностью реализована, существует требование
для достаточной инфраструктуры для поддержки практикующих врачей в реализации улучшений местной дезактивации,
29
для
пример экспертной оценки новостройки, ввод в эксплуатацию и испытание
дезактивационного оборудования. Практическое руководство
, помогающее практикующим врачам соответствовать различным нормативным требованиям,
правил по очистке стоматологических инструментов имеет важное значение для достижения прогресса
в этой очень важной области клинической практики.
Это исследование было поддержано грантом Управления здравоохранения Шотландии
.
на обучение членов исследовательской группы профинансировала NHS Education for Scotland. Авторы благодарят г-на Рэя Уоткинса, главного стоматолога
в Шотландии, и доктора Джима Ренни, декана стоматологического отделения
в Шотландии за поддержку исследования, членов исследовательских групп
и практикующих стоматологов и медсестер, согласившихся быть обследованным.
1. Динакаран С., Каярка В. Обломки обработанных офтальмологических инструментов: причина
для беспокойства. Eye 2002; 16: 281-284.
2. Рамакришна Б. С. Безопасность техники: стандарты инфекционного контроля в эндос-
экз. J Gastroenterol Hepatol 2002; 17: 361-368.
3. Кибрия С. М., Керр К. Г., Дэйв Дж., Гоф М. Дж., Гомер-Ванниасинкам С., Мавор А. И. Д.
Бактериальная колонизация допплеровских зондов в хирургических отделениях сосудов. Eur J Vasc
Endovasc Surg 2002; 23: 241-243.
4. Голдер М., Чан С. Л. Х., О’Ши С., Корбетт К., Кристи И. Ф., Френч Г. Потенциальный риск
перекрестной инфекции при периферическом венозном доступе из-за заражения
жгутов. Lancet 2000; 355: 44.
5. Лоу А. Х., Бэг Дж., Берк Ф. Дж. Т., Маккензи Д., МакХью С. Исследование крови
, заражение полосок матрикса Сиквленда. Br Dent J 2001; 192: 43-45.
6. Смит А., Диксон М., Эйткен Дж., Багг Дж. Зараженные стоматологические инструменты. J Hosp
Infect 2002; 51: 233-235.
7. Weightman N C, Lines L D. Проблемы с дезактивацией стоматологической руки —
штук и другого интраорального стоматологического оборудования в больницах. J Hosp Infect
2004; 56: 1-5.
8. Смит А. Дж., Леттерс С., Ланге А., Перретт Д., МакХью С., Бэг Дж. Уровни остаточного белка
на повторно обработанных стоматологических инструментах. J Hosp Infect 2005; 61: 237-241.
9. Letters S, Smith AJ, McHugh S, Bagg J. Исследование визуального заражения и заражения крови на обработанных эндодонтических файлах из общей стоматологической практики.Br Dent J
2005; 199: 522-525.
10. Отдел экономики, статистики и операционных исследований Департамента здравоохранения.
Оценка рисков вБКЯ и стоматологии. Лондон: The Stationery Office, 2003.
(www.doh.gov.uk/cjd/dentistryrisk/index.htm).
11. Отдел экономики, статистики и операционных исследований Департамента здравоохранения.
Оценка риска передачи вБКЯ хирургическим путем: промежуточный обзор. Лондон:
The Stationery Office, 2005.
12. Фрош Ф., Джойс Р., Джонсон А. Ятрогенная вБКЯ от хирургических инструментов. Br Med
J 2001; 322: 1558-1559.
13. Фаверо М. С., Бонд В. В. Химическая дезинфекция медицинских и хирургических материалов.
In Block S S (ed) Дезинфекция, стерилизация и консервация. 5-е изд. С. 881-917.
Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс, 2001.
14. Паркер Х. Четвертый, Джонсон Р. Б. Эффективность оксида этилена для стерилизации
стоматологических наконечников.J Dent 1995; 23: 113-115.
15. Альфа М. Дж., Олсон Н., Дегань П., Хизон Р. Новые технологии низкотемпературной стерилизации
: микробиоцидная активность и клиническая эффективность. В Rutula W A (ed)
Дезинфекция, стерилизация и антисептика в здравоохранении. С. 67-78. Champlain, NY:
Polyscience Publications, 1998.
16. Рутула В.А., Вебер Д. Дж. Клиническая эффективность низкотемпературной стерилизации
технологий. Инфекционный контроль Hosp Epidemiol
1998; 19: 798-804.
17. Закон о здоровье и безопасности на рабочем месте 1974 года. Лондон: HMSO, 1974.
18. Закон о защите прав потребителей 1998 года (ответственность за продукцию). Лондон: HMSO, 1998.
Циклы паровой стерилизации: гравитационные и вакуумные циклы
Паровая стерилизация основывается на трех (3) параметрах для уничтожения микробов и организмов: время, температура и давление. И этими параметрами можно управлять в различных рецептах цикла для стерилизации различных типов загрузок. Однако требование к циклу для каждого типа загрузки — например, красных пакетов, носителей, стеклянной посуды, клеток, подстилки для животных и наконечников пипеток — может значительно различаться.
В то время как подавляющее большинство обычных лабораторных загрузок можно стерилизовать с помощью одного из следующих трех (3) основных циклов: гравитация, вакуум (или Prevac) и жидкости; Важно убедиться, что ваш стерилизатор предлагает циклы, подходящие для ВСЕХ требований к загрузке.
В этой статье мы исследуем первые два основных цикла стерилизации паром: гравитацию и вакуум.
| Основные циклы | Описание | Типичное приложение или тип загрузки |
|---|---|---|
| Гравитация | Самый простой цикл стерилизации.Пар вытесняет воздух в камере под действием силы тяжести (т. Е. Без механической помощи) через сливное отверстие. | Посуда, неупакованные товары, отходы, посуда, мешки. |
| Предвакуум и / или поствакуум | Воздух механически удаляется из камеры и загружается посредством серии импульсов вакуума и давления. Это позволяет пару проникать в пористые области груза, которые иначе не могли бы быть достигнуты с помощью простого перемещения под действием силы тяжести. | Упакованные товары, пакеты, подстилки для клеток для животных, клетки, пористые материалы, красные мешки. |
Затем, в будущих статьях, мы обсудим дополнительные типы циклов, такие как жидкости, избыточное давление воздуха и множество других, более сложных типов циклов для специальных применений.
Откройте для себя 12 лучших циклов паровой стерилизации здесь>
Чтобы получить обзор паровой стерилизации, посмотрите наше видео здесь:
Гравитационный цикл
Традиционный «Гравитационный цикл» является наиболее распространенным и простым цикл стерилизации паром.Во время гравитационного цикла пар перекачивается в камеру, содержащую окружающий воздух. Поскольку пар имеет меньшую плотность, чем воздух, он поднимается к верху камеры и в конечном итоге вытесняет весь воздух. Когда пар заполняет камеру, воздух вытесняется через дренажное отверстие. Выталкивая воздух наружу, пар может напрямую контактировать с загрузкой и начать ее стерилизацию.
В конце цикла пар выпускается через дренажное отверстие. Однако груз может быть горячим и, возможно, влажным.Чтобы решить эту проблему, гравитационные автоклавы могут быть оснащены функцией вакуумирования после цикла, чтобы облегчить сушку загрузки. Если стерилизатор оборудован этой функцией, он работает в обычном гравитационном цикле, и после того, как загрузка стерилизована, вакуум вытягивает пар и конденсат через дренажное отверстие. Чем дольше вакуумная система работает во время фазы сушки, тем холоднее и суше будут товары после извлечения из камеры.
Гравитационные циклы обычно используются с такими грузами, как стеклянная посуда, биологически опасные отходы (отходы из красных мешков), вентилируемые контейнеры и некоторые типы неупакованных инструментов.
Цикл вакуумирования
Существуют определенные типы применений, в которых воздух нелегко вытесняется из камеры. Вытеснение воздуха под действием силы тяжести (как описано выше) не так эффективно для пористых грузов или частично вентилируемых контейнеров. Например, при стерилизации таких предметов, как клетки с подстилкой для животных, упакованные товары, хирургические пакеты и т. Д., Лучше всего использовать цикл вакуумирования (также называемый циклом Prevac).
Стерилизатор, сконфигурированный для работы в режиме вакуумирования, будет оборудован вакуумной системой.Типичный цикл вакуумирования начинается с серии чередующихся нагнетаний пара и откачки вакуума (также называемых импульсами) для динамического удаления воздуха из камеры. Создание вакуума для удаления окружающего воздуха из камеры позволяет пару всасываться в области, куда в противном случае ему было бы трудно проникнуть. Отсутствие воздуха в камере позволяет «пару проникать в загрузку почти мгновенно», что приводит к более надежной стерилизации и сокращению времени цикла стерилизации (Perkins 124).
После завершения стерилизации можно запрограммировать постцикловый вакуум для улучшения и ускорения процесса сушки. В объединенных стерилизаторах есть два варианта вакуумных систем: водяной эжектор с дополнительным подкачивающим насосом, а также жидкостный кольцевой вакуумный насос.
Общие вакуумные системы
Гравитационные и вакуумные циклы — это наиболее часто используемые циклы паровой стерилизации, так как они подходят для самых разных типов загрузки автоклавов. Однако некоторые нагрузки (например, шприцы, контактные линзы, определенные типы носителей и т. Д.)) требуют специальных конфигураций цикла, например, с линейным изменением давления или температуры. К счастью, современные современные контроллеры могут управлять параметрами стерилизации, чтобы приспособиться к этим нагрузкам.
В CSS мы понимаем, что многим нашим клиентам нужна помощь в определении и создании правильного цикла стерилизации для их типа загрузки. Таким образом, мы надеемся, что эта статья поможет, и мы рекомендуем вам вернуться к нашей следующей серии статей в блоге, где мы сначала представим цикл жидкости, а затем сосредоточимся на изучении расширенных циклов стерилизации и их применения.

